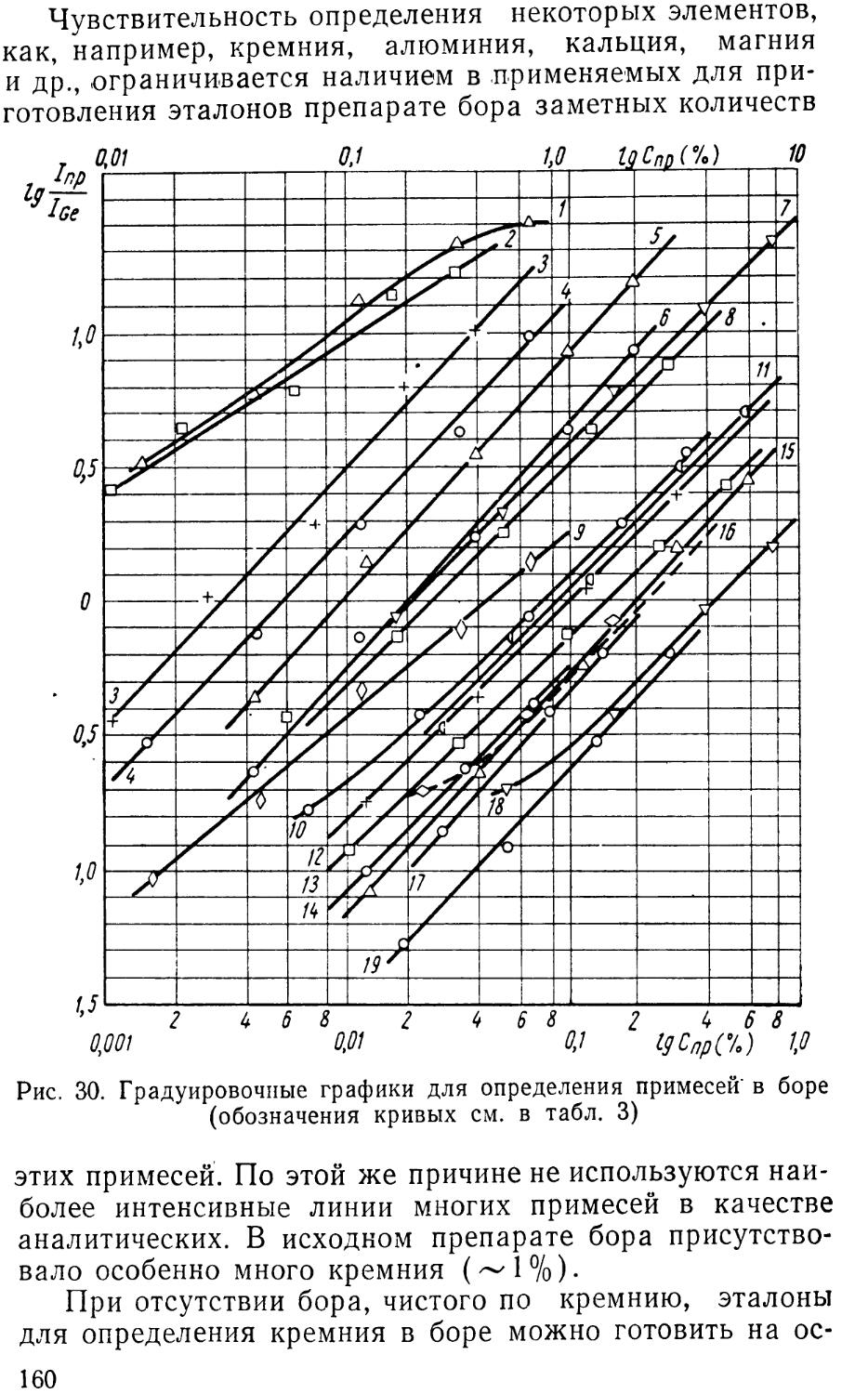
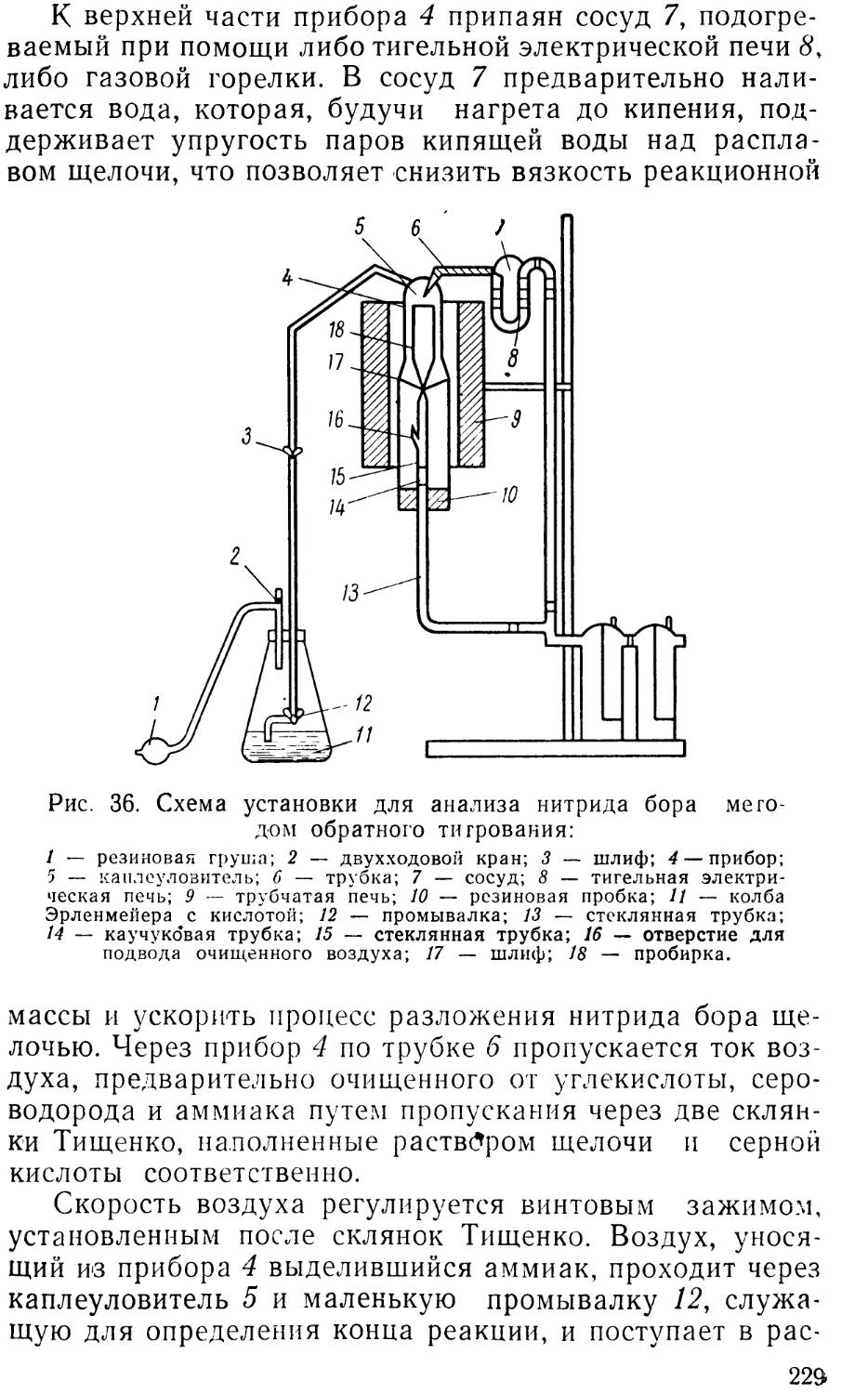
Author: Васильева М.Г. Лалыкина В.М.
Tags: аналитическая химия неорганическая химия ядерная техника ракетная техника
Year: 1965
Text
М. Г. ВАСИЛЬЕВА, В. М. ЛАЛЫКИНА, Н. А. МАХАРАШВИЛИ, А. Л.ЧЖОЛОВА, В. М. СОЙФЕР, Н. Г. ЦКИРИЯ
АНАЛИЗ БОРА И ЕГО НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Под редакцией д-ра хим. наук Е. Е. БАРОНИ
АТОМИЗДАТ
МОСКВА 1965
УДК 543.06 : 546.27
I
М. Г. Васильева, В. М. Лалыкина, Н. А. Махарашвили, А. Л. Соколова, В. М. Сойфер, Н. Г. Цкирия
АНАЛИЗ БОРА И ЕГО НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Тематический план 1965 г. № 39
Редактор Е. И. П апга 5 ен.к о в а Художественный редактор А. С. ександров Переплет художника Ю. К. М о с е е в а
Техн, редактор С. М. П о п о в a z $>рректор 3. А. Авдюшева
Сдано в набор 2/1V 1965 г«. Подписано в печать 4/VIII 1965 г.
Бумага 84 X 108’/з2- Физич. печ. л. 8,38. Привел, и. л. 13,99. Уч.-изд. л. 14,29 Заказ изд. 1281 Тираж 2750 экз. Т-10721 Цена 81 коп. Заказ тип. 1195
. Атомиздат, Москва, Центр, ул. Кирова, 18
Экспериментальная типография ВНИИПП Государственного комитета Ссвета Министров СССР по печати
Москва И-51, Цветной бульвар, 30.
Отпечатано с готового набора в тип. Изд-ва ДОСААФ. Зак. 92
^^^^Вг£&Т'\
^^^MSSSb -
Предисловие
^^ИКЦи~ ’'
Ийр Быстрое развитие ядерной и ракетной техники послу-ИШило стимулом для развития химии многих элементов, Кз том числе и бора.
К Специфичность свойств элементарного бора и его К^оединений в зависимости от кристаллической структур Ыьт и изотопного состава вызывают все больший интерес Ир химиков-исследователей и технологов.
Ир В связи с этим ощущается потребность в руководстве Ирр проведению анализов бора и его соединений. За по-||йледнее время опубликовано много оригинальных работ йи несколько сборников, посвященных бору и его соеди-нйгёйиям. Например: Г. Буз и Д. Мартин «Химия трехфто^ К^цстого бора и его производных». М., Изд-во иностр. 1й$йт., 1955; А. В. Топчиев и др. «Фтористый бор и его |Кродинения как катализаторы в органической химии».
Изд-во АН СССР, 1956; Киффер и Шварцкопф |||«Твердые сплавы». М., Металлургиздат, 1957; Г. В. Сам-^жРйОв и др. «Бор, его соединения и сплавы». Киев, Изд-во
УССР, 1960; Г. В. Самсонов и др. «Анализ тугоплав-соединений». М., Металлургиздат, 1962 (подробно из-|^^кены методы анализа карбидов и нитрида бора и бо-металлов); А. А. Немодрук и 3. К. Каралова ^^Аналитическая химия бора». М., «Наука», 1964.
| Однако аналитическая химия бора все еще представ-лена в разрозненных методиках, применяемых для решения, отдельных задач. Поэтому каждому занимающе
3
муся вопросами анализа бора приходится проводить трудоемкую работу по подбору необходимой литератур ры и уточнению применяемых методов.
Предлагаемая книга представляет собой попытку обобщить основные литературные материалы и изложить методы анализа бора и его соединений, проверенные практически. Теоретические основы даны лишь в той ме-* ре, в какой это необходимо для понимания основ метода анализа.
ГЛАВА I
МЕТОДЫ ОПРЕДЕЛЕНИЯ БОРНОЙ КИСЛОТЫ
1. Введение
Обнаружение бора в различных соединениях и анализ элементарного бора сводятся в основном к переведению бора в борную кислоту и определению последней объемным, весовым, колориметрическим и другими методами.
Борная кислота Н3ВО3—слабая неорганическая кислота, представляющая собой бесцветные кристаллы в виде чешуек. Как трехосновная кислота она диссоциирует ступенчато:
Н3ВО3 £ Н* + Н2ВО?, Н2ВОГХН+ + НВО2з", НВО^“ z н+ + BOh-
Соответствующие константы диссоциации 0,1 М раствора борной кислоты и более разбавленных растворов при комнатной температуре равны: = 6-10“10; К2 =
= 2* 10-13; Кз = 2-10~14. С повышением концентрации раствора борной кислоты константа диссоциации возрастает вследствие образования более сильных полиборных кислот [1]. Например, при 18° в 0,25 (0,5; 0,75) М растворе константа диссоциации становится равной 26 (119; 408) • 10“10 соответственно. В растворах с концентрацией Н3ВО3 выше 0,5 М кислый характер обусловлен в основном образованием тетраборной кислоты Н2В4О7. В разбавленных растворах (концентрация борной кислоты ниже 0,1 А1) константа диссоциации не зависит от концентрации.
При нагревании до 70° борная кислота заметно обезвоживается, переходя в метаборную кислоту НВО2.
5
Растворимость борной кислоты в 100 мл воды составляет, г:
При 0°.......... 2,66
» 20°..........4,9
» 100°.........39,7
Соли борной кислоты — бораты — являются производными метаборной (НВО2) или тетраборной (Н2В4О7) кислоты. Преобладающее большинство солей метаборной и тетраборной кислот трудно растворимо в воде. Исключение составляют соли щелочных металлов.
Весовые методы определения борной кислоты не получили распространения. Недостатком этих методов является длительность выполнения анализа и незначительная точность определения. Удовлетворительные результаты получаются при небольших концентрациях бора (3—4%). В литературе подробно описываются различные варианты этого метода с поглощением борной кислоты окисью кальция [2] и окисью магния [3]. Л. А. Май и И. И. Юрданов [4] предлагают весовой метод определения борной кислоты без предварительного отделения ее от мешающих примесей отгонкой в виде борнометило-вого эфира. Способ заключается в насыщении анализируемого раствора при строго определенной температуре борной кислотой с добавлением некоторого избыточного количества ее. После окончания насыщения остаток борной кислоты высушивают и взвешивают. Концентрацию борной кислоты в исследуемом растворе вычисляют по формуле
Г / / \ О 1000 / TV7X
£н8ВО3 (г/Л) у
где S — растворимость борной кислоты в 100 мл воды при данной температуре, г; V—объем анализируемого раствора, мл\ т — количество добавленной борной кислоты, г; W— вес остатка борной кислоты, г.
Точность метода ±10% (отн.).
Описан также весовой метод определения бора после осаждения его в виде труднорастворимой бариевой соли комплексной борновинной кислоты Ba5B2Ci2H8O24 X X Н2О [5, 6] и метод перевода борной кислоты в HBF4 с последующим осаждением нитроном [7, 8].
Колориметрические методы определения борной кислоты широко применяются при определении микроколи-6
честв бора в различных соединениях. Подробно колори-» метрические методы анализа изложены в гл. II.
При содержании бора более 0,1%, как правило, применяют объемный метод определения борной кислоты, который может осуществляться как визуальным титрованием с применением соответствующих индикаторов, так и потенциометрическим [1, 9—13], амперометрическим [14, 15], кулонометрическим [16] и кондуктометрическим [17] титрованием. Чаще других электрохимических определений борной кислоты применяют потенциометрическое титрование. Титрование это может осуществляться также в неводных средах [18] и с использованием токов высокой частоты [19].
Необходимым условием любого способа титрования является применение многоатомных спиртов для образования комплексных борных кислот с более высокой константой диссоциации, чем у борной кислоты. Преимущество потенциометрического титрования перед визуальным заключается в том, что титрование можно проводить в окрашенных и очень разбавленных растворах [13]. Кроме того, титрование строго до одного и того же значения pH позволяет устранить влияние ряда слабых кислот и оснований, которые титруются в интервале pH 4—9.
Применяя потенциометрическое титрование, можно оп-» ределять бор в присутствии таких примесей, как цинк, кадмий, кобальт, никель, мышьяк (в виде As3*), алюминий (например, при определении бора в сталях и ферроборе) [20, 21]. Потенциометрическое титрование рекомендуется при определении бора в сталях и сплавах [22].
Из других электрохимических методов определения борной кислоты описаны поляриметрический [23—25] и полярографический [26, 27]. Поляриметрический метод определения борной кислоты основан на измерении угла вращения плоскости поляризации света, проходящего через раствор маннита или другого многоатомного спирта, содержащий соли борной кислоты.
Полярографический метод определения кислот, константа диссоциации которых меньше 10-8—10~7 (для борной кислоты 10“11— 10-10), затруднен [28].
В литературе [29] описан способ определения борной кислоты, основанный на ее свойстве взаимодействовать
7
с метиловым спиртом в присутствии иод-пиридинового раствора по уравнению
Н3ВО3 + ЗСН3ОН =- В (ОСН3)3 + ЗН2О или
Н3ВО3 + 3J, + 3SO2 4- 6СН3ОН = 6HJ + 3HSO4CH3 + + В (ОСН3)3.
Метод применяется для определения борной кислоты в присутствии метилбората.
Газоволюмометрический метод определения борной кислоты [30] основан на образовании маннитоборной кислоты, взаимодействующей с углекислым кальцием с выделением эквивалентного количества углекислого газа, измеряемого специальной бюреткой. Метод оригинален по принципу, но преимуществ перед изложенными выше методами не имеет.
В последнее время широкое распространение получил новый ядерно-физический метод определения бора по нейтронному поглощению [31—33]. Эффективность использования методов нейтронного поглощения для количественного определения содержания бора обусловлена тем, что сечение захвата медленных нейтронов атомами бора составляет 755 бархатом, в то время как у других элементов оно меньше, а иногда не превышает долей или единиц барна [34]. Принцип метода заключается в том, что при просвечивании потоком медленных нейтронов образца, содержащего бор, наблюдается ослабление потока, по величине пропорциональное содержанию бора. Поскольку коэффициент ослабления потока нейтронов данным элементом обусловливается особенностями строения его ядра, а не электронных оболочек, результаты анализа не зависят от химической связи атома в молекуле; поэтому возможен анализ как твердых, так и жидких проб любого соединения бора, в том числе и борной кислоты [35].
Метод количественного определения бора с использованием наведенной искусственной радиоактивности [27, 36] основан на облучении продукта, содержащего бор, нейтронами и регистрации наведенной активности. Другие радиоактивные элементы, которые образуются в результате ядерной реакции с медленными нейтронами,
8
имеют или большой, или малый период полураспада и при анализе бора не дают заметной активности [27]. Определению бора таким методом мешают большие количества хлора и водорода.
2. Объемные методы определения борной кислоты
Визуальное титрование
Борная кислота титруется только как одноосновная 'кислота (рис. 1), а такие соли, как Na2B4O7, На2НВОз
Рис. 1. Кривая потенциометрического титрования 0,25 М раствора борной кислоты едким натром при температуре 16° С (индикатор— тропеолин 0).
или ИазВОз, при нейтрализации не образуются. Реакция нейтрализации протекает по уравнению
Н3ВО3 + NaOH -> NaBO2 + 2Н2О.
Прямое титрование борной кислоты с применением в качестве индикатора тропеолина 0 (pH 11 —13) или нитрамина неточно, так как борная кислота очень слабая (Ki = 6-10-10) и в эквивалентной точке pH = 11,2. Переход окраски нечеткий.
Для повышения кислотности растворов борной кислоты используют маннит, глицерин, фруктозу, инвертный сахар, глюкозу, пропиленгликоль, глюконат кальция и другие многоатомные спирты и полиоксисоединения [37—40].
Многоатомные спирты образуют с борной кислотой комплексные кислоты: маннитоборную
Н[ВО2(С6Н8(ОН)6)2],
9
глицериноборную
Н[ВО2(С3Н5(ОНз)2]
и др. Допускается существование трех видов комплексов [41, 42]:
В некоторых работах утверждается, что наиболее вероятно существование в растворе комплексов типа III:
Образование комплексов типов I, II и других незначительно и не принимается во внимание [38, 41, 43]. Реакция борной кислоты с образованием комплексов идет по схеме
10
Координационное число бора в этих комплексных кислотах равно 4, связь аналогична связи бора в молекуле
HBF4 [1]:
^Комплексные кислоты более сильны, чем сама борная -кислота, что видно из приводимых ниже констант диссоциации:
к
Н3ВО3..........................6-Ю-'0
Н][ВО2 (С3Н5(ОН)3)2].........3-10—7
Н [ВО2vC3H8(ОН),)»]..........6-Ю"6
На рис. 2 показаны кривые титрования борной кислоты
и комплексов борной и маннитом [1].
Активность борной кислоты может быть повышена и добавлением ней-
кислоты с глицерином, эритритом
Рис. 2. Кривые титрования 0,1 М раствора борной кислоты 0,2 н. раствором едкого натра в присутствии 4 молей многоатомного спирта на каждый моль борной
кислоты (индикатор —
фенолфталеин):
1 — борная кислота; 2 — борная кислота 4- глицерин;
3 — борная кислота + эритрит; 4 — борная кислота 4- маннит.
Эквивалентная
тральных солей [1, 44], таких, как NaCl, LiCl, ВаС12, SrCl2 и СаС12. Из этих солей особенно сильное влияние на повышение кислотности растворов борной кислоты оказывает СаС12. В литературе описан метод определения борной кислоты с использованием СаС12 в качестве активирующего вещества [44]. Действие указанных сое-
11
динений объясняется увеличением концентрации борной кислоты вследствие связывания воды добавленными катионами и образованием аутокомплексов борной кислоты.
Для повышения кислотности растворов борной кислоты наиболее часто используют маннит. Глюкоза при определении борной кислоты дает заниженные результаты [45]. Очищенный глицерин приходится добавлять в значительном количестве (на 80—100 мл раствора 40— 50 мл глицерина), поэтому объем жидкости увеличивается и точка перехода получается очень нечеткой. То же самое, но в меньшей мере относится к свежеприготовленным растворам инвертного сахара. При применении хлоридов натрия, лития и кальция точность анализа недостаточна. Удобнее всего применение маннита, так как объем титруемой жидкости не увеличивается и окраска фенолфталеина резко изменяется при одной капле избыточно добавляемого раствора едкого натра [45]. Влияние маннита на ход титрования борной кислоты рассматривается в нескольких работах [1, 46, 47]. Оптимальной концентрацией маннита можно считать 1 г на 10 мл 0,1 н. раствора борной кислоты.
Поскольку кислотность комплексов борной кислоты с многоатомными спиртами снижается с повышением температуры и разбавлением раствора, титрование борной кислоты следует вести в холодном растворе при возможно малом объеме.
При нейтрализации сильных кислот или оснований перед титрованием борной кислоты индикатором служит метиловый оранжевый или метиловый красный. Применение последнего предпочтительнее, так как он более устойчив в окислительных средах. Нейтрализацию сильных кислот можно проводить и по Штоку — Джонсу:
5J- + JOr + 6Н+ ЗН9О + 3J •
Метод этот не имеет преимуществ перед нейтрализацией щелочью и требует предосторожности при добавлении маннита в начале титрования борной кислоты, так как избыточно добавленное количество маннита приводит к появлению характерного для выделившегося иода окрашивания раствора, которое мешает титрованию.
Индикатором при титровании борной кислоты служит фенолфталеин, так как эквивалентная точка при отно-
12
шении маннита к борной кислоте, равном 4:1, лежит при pH 7—10 (см. рис. 2).
Некоторые авторы рекомендуют в отдельных случаях применять п-нитрофенол (например, при титровании в среде метилового спирта) [2], бромфеноловый синий [48], а-нитрофенол [49] и смешанные индикаторы следующих составов: метиловый красный + бромкрезоловый зеленый + фенолфталеин + тимолфталеин [50]; фенолфталеин + нафтоловый зеленый [51]; метиловый оранжевый + метиловый голубой [1] и др. Применение указанных индикаторов связано с попытками обеспечить большую резкость индикаторного перехода. По мнению авторов, применение в качестве индикаторов метилового красного (при нейтрализации сильных кислот) и фенолфталеина (при нейтрализации борманнитовой кислоты) дает четкий переход окраски раствора в точке эквивалентности.
Определение борной кислоты в смеси с сильными кис-. лотами и основаниями подробно рассмотрено Вибер-гом [1].
В настоящее время общепринятый вариант объемного определения борной кислоты состоит в том, что ана-? лизируемый раствор, не содержащий СО2, точно нейтра-г лизуют по метиловому красному едким натром, затем до-. бавляют маннит (инвертный сахар, глицерин) и титруют едким натром до появления розовой окраски фенолфталеина, не исчезающей от повторного прибавления ман-~ нита (инвертного сахара, глицерина). Метод титрования ; борной кислоты растворами щелочей, содержащими маннит [52], преимуществ перед изложенным выше не имеет. Необходимым условием титрования борной кислоты является отсутствие СО2, а также ионов аммония, фтора и катионов гидролизующихся металлов.
[ Ход определения борной кислоты в нейтральных, кис-/ лых и щелочных растворах приводится ниже.
± Ход анализа. Раствор, содержащий борную кис-| лоту, нейтрализуют по метиловому красному 0,1 н. рас-f твором едкого натра (или соляной кислоты), прибавляют ^одну-две капли 0,1 н. раствора НС1 и вновь нейтрализу-£ ют. К нейтральному раствору прибавляют приблизи-тельно 1 г маннита или 3 мл 50%-ного инвертного сахара (появляющаяся красная окраска метилового красного исчезает при последующем прибавлении щелочи) и тит-
13
руют 0,1 н. раствором едкого натра в присутствии 10— 15 капель фенолфталеина до появления розовой окраски. Прибавляют маннит и, если розовая окраска исчезнет, титруют щелочью до появления устойчивой розовой окраски, не исчезающей при последующем прибавлении маннита. Параллельно
проводят «холостой» опыт. Кривая титрования борной кислоты приведена на рис. 3.
Титр едкого натра устанавливают по борному ангидриду, по дважды перекристаллизова иной борной кислоте или по соляной кислоте; 1 мл точно 0,1 н. раствора едкого натра соответствует:
0,001081 г бора; 0,00348 г борного ангидрида; 0,006181 г борной кис-
fl 4 8 12 16 26 Z4 ЛОТЫ.
ojhM. ростера мн, мл П р и о п р е д е л ен и и м а -
Рис. 3. Кривая потенциометри- ЛЫХ количеств бора ческого титрования смеси НС1 + (0,02—1 мг) используют
4- Н3ВО3. микробюретку и титрова-
ние ведут 0,01 н. раствором едкого натра. Наименьшее определяемое этим методом содержание бора составляет 0,02 мг при концентрации раствора не ниже 0,0004%. При титровании 30— 40 мг бора в 0.3 М растворе борной кислоты ошибка определения составляет ± 0,1 мг бора.
Потенциометрический метод определения борной кислоты
Потенциометрическое титрование строго до одного и того же значения pH дает возможность определять борную кислоту в присутствии некоторых веществ, мешающих визуальному титрованию борной кислоты.
Титрованию борной кислоты от значения pH = 5,8 не мешает присутствие цинка, никеля, кадмия, кобальта, марганца, аммонийных солей, арсенитов и арсенатов (если As2C>5 не более 10 мг), а также малых количеств 14
Fкремневой (до 50 мг), фосфорной (до 10 мг Р2О5) и оло-^вянной кислот. В больших количествах фосфорные и (мышьяковые кислоты от добавления маннита частично (повышают активность и тем самым вызывают ошибки при визуальном титровании. При потенциометрическом титровании в присутствии Р2О5 лучше устанавливать gpH равным не 5,8, а 4,9. При титровании малых коли-рчеств борной кислоты рекомендуется устанавливать •|рН = 6 [20, 41]. Утверждается, что фосфат-ионы можно (не удалять (а также СО2). При содержании Р2О5 больше 10 мг ее отделяют в виде фосфата серебра. Сурьму отделяют в виде гидрата трехокиси нагреванием щелочного раствора.
Присутствие слабых органических кислот, константа диссоциации которых больше 10-5 или меньше 10~10, не мешает титрованию при условии, что они не образуют соединений с борной кислотой. Алюминий, железо, свинец необходимо удалять с 8-оксихинолином [12].
П. Я. Яковлев и Г. В. Козина [20] рекомендуют при потенциометрическом титровании борной кислоты связывать алюминий в цитратный комплекс, а железо, никель, хром, марганец и другие элементы осаждать в виде гидроокисей 20%-ным раствором едкого натра. Основы метода потенциометрического титрования изложены в соответствующей литературе [3, 53].
Потенциометрическое титрование борной кислоты выполнялось на приборе ЛП-5 со стеклянным и насыщенным каломельным электродами.
Прибор ЛП-5 (рис. 4) состоит из потенциометра, усилителя, сухого элемента З-СЛ-ЗО. питающего потенциометрическую цепь, нормального элемента и электродного устройства. Основные части прибора показаны на рис. 5, где —измерительный реохорд; /?2—реостат температурной компенсации; при измерениях устанавливается на значение, соответствующее температуре испытуемого (раствора; — реостат «Установка нуля» для введения ^поправки на асимметрию стеклянного электрода при [Измерении pH; для поворота реостата ручка устанавливается в вертикальное положение; R^— реостат для (настройки потенциометрической цепи по нормальному Элементу; R$— реостат для настройки усилителя; К—• ^снопка в центре ручки измерительного реохорда; нажимается только при проведении измерений; при проведе-
нии титрования кнопка фиксируется во включенном положении, что достигается нажатием и поворотом ее по часовой стрелке; G — гальванометр с чувствительностью О,'13* 10-6 а на деление шкалы; Ui — ключ, переключающий потенциометрическую схему на измерение в милли-
Рис. 4. Общий вид потенциометра ЛП-5.
вольтах (положительных — для кислой среды, отрицательных— для щелочной среды) и в единицах pH; и2 — ключ, предназначенный для включения в потенциометрическую цепь сухого элемента (индекс Р), для включения потенциометрической цепи на настройку по нормальному элементу (индекс НЭ) и для выключения сухого элемента из потенциометрической цепи (индекс «Выкл.»); Кл — гнездо для подключения каломельного 16
электрода; Ст — гнездо для подключения стеклянного электрода.
К прибору прилагается комплект электродов, которые для работы не требуют дополнительных операций по их зарядке. При работе электроды закрепляются в специальные штативы Ш, размещенные в левом боковом отсеке футляра.
Рис. 5. Схема прибора ЛП-5.
Во время измерений необходимо следить, чтобы сосудик каломельного электрода был заполнен насыщенным раствором хлористого калия, уровень которого должен быть выше уровня испытуемого раствора. При надобности следует доливать раствор хлористого калия. Резиновую пробочку, закрывающую сосудик каломельного электрода, при измерениях надо открывать.
Перед измерением стеклянный электрод должен в течение 1—2 ч выдерживаться в дистиллированной воде или, при ежедневном использовании, храниться в ней постоянно. Дистиллированную воду необходимо периодически менять. Во время измерений надо следить за тем, •Чтобы жидкость внутри стеклянного электрода заполняла шарик электрода, в противном случае электрод следует встряхнуть.
Подготовка к работе. Для подготовки -прибора к работе следует:
;1) соединить прибор с сетью переменного тока 127— 220 в, для чего колодку 1 (см. рис. 5) вставить в гнездо
Анализ бора I •e’EYгцу- 7 А I 17
(127—220 в), а вилку 2, находящуюся на другом конце шнура,— в штепсельную розетку с напряжением 127— 220 в; выключатель В переключить на индекс «Вкл.» (при этом индикаторная лампочка должна зажечься); до производства измерения необходимо дать лампам прогреться в течение 5—10 мин-,
2) установить в штативы бокового отсека электроды;
3) перед измерением тщательно промыть сосуды и электроды дистиллированной водой и ополоснуть их исследуемым раствором;
4) для опускания электродов в испытуемый раствор нажать штифт держателя электродов на большом штативе или отвернуть винт держателя малого штатива; при этом кончик каломельного и шарик стеклянного электродов должны быть погружены в раствор;
5) подключить электроды к прибору; в гнездо Ст вставить наконечник шнура стеклянного, а в гнездо-Кл— наконечник шнура каломельного электродов.
Настройка прибора. Настройка прибора заключается в настройке усилителя и потенциометрической цепи по нормальному элементу. Перед включением прибора в сеть необходимо разарретировать гальванометр и корректором (при помощи отвертки) привести стрелку к нулю.
Для настройки усилителя надо через 5—10 мин после включения прибора в сеть при помощи реостата R$ установить стрелку гальванометра в нулевое положение.
Для настройки потенциометрической цепи необходимо:
1) ключ и2 поставить в положение Р, благодаря чему сухой элемент будет включен в потенциометрическую цепь;
2) ключ и\ — на индекс pH; температурный компенсатор следует установить на значение, соответствующее температуре испытуемого раствора;
3) настроить потенциометрическую цепь по нормальному элементу, для чего ключ и2 переключить, держать в положении НЭ, одновременно при помощи реостата Rt установить стрелку гальванометра в нулевое положение.
Настройка считается правильной в том случае, когда при переключении ключа и2 из положения Р в положение НЭ стрелка' гальванометра сохраняет одно и то Же нулевое положение. Если она отклоняется от нулевого 18.
положения, производят дополнительную настройку: при положении ключа на Р — реостатом /?5, а при положении на НЭ — реостатом /?4.
Во всех случаях изменения положения температурного компенсатора или переключения ключа щ на другой индекс производят настройку потенциометрической цепи по нормальному элементу. При настройке прибора "следует обратить внимание на кнопку К реохорда: она не должна быть заперта.
Измерение pH стеклянным электродом. Перед измерением необходимо откорректировать шкалу pH по буферному раствору для устранения ошибки потенциала асимметрии стеклянного электрода. Для этого наливают в стаканчик буферный раствор с точно известным pH и опускают каломельный и стеклянный электроды в этот раствор. Желательно, чтобы величина pH буферного раствора была близка к величине pH анализируемого раствора в точке эквивалентности и чтобы температура буферного раствора была близка к температуре испытуемого раствора. При потенциометрическом титровании борной кислоты от значения pH = 6,9 (установленного до прибавления маннита) до pH = 6,9 (после прибавления маннита) корректировку шкалы pH можно проводить по буферному раствору с pH = 7,94 при температуре 18° (см. п. 4).
Ключ щ устанавливают в положение pH, а реостат температурной компенсации Rz—на величину температуры буферного раствора; настраивают прибор, как указано выше. Затем, вращая ручку реохорда устанавливают его на известную величину pH буферного раствора (7,94). Нажав кнопку К, вращают реостат /?з до установки стрелки гальванометра на нуль. Затем выливают буферный раствор, тщательно промывают стаканчик и электроды дистиллированной водой, ополаскивают их испытуемым раствором, наливают испытуемый раствор в стаканчик и опускают в него электроды. После этого устанавливают реостат температурной компенсации на температуру анализируемого раствора, включают магнитную мешалку и, нажав кнопку К, нейтрализуют раствор до значения pH = 6,9 (т. е. до возвращения стрелки гальванометра к нулю), приливая сначала 0,5 н. раствор NaOH (или НС1), а затем 0,02 н. раствор NaOH (или НС1).
2* 19
К точно нейтрализованному раствору прибавляют маннит и продолжают титрование до возвращения pH раствора снова к 6,9. Титр раствора едкого натра устанавливают потенциометрическим титрованием стандартного раствора, приготовленного из дважды перекристаллизованной борной кислоты.
Допустимое отклонение среднего арифметического двух параллельных результатов от действительного содержания бора в металле или сплаве не должно превышать ±0,02% (абс.) при содержании бора 0,1—1,0% и ±0,03% при содержании бора 1,0—2,0% [54].
Амперометрическое титрование
Амперометрическим, или полярографическим, титрованием [14, 53, 55] называется метод определения эквивалентной точки посредством измерения силы диффузионного тока, которая изменяется в зависимости от кон
центрации восстанавливаемого вещества в растворе.
Для кривых амперометрического титрования характерна максимальная крутизна в точке эквивалентности.
Схема установки для амперометрического титрования с капельным ртутным электродом приведена на рис. 6.
Титрование может быть осуществлено на установке, имею-
Рис. 6. Схема установки для амперометрического титрования с капельным ртутным электродом:
1 — выносной анод; 2 — мешалка; 3 — электролизер; 4 — капельный электрод; 5 — бюретка; 6 — гальванометр; 7 — вольтметр.
щей в качестве катода платиновую проволоку, а внешнего анода — насыщенный каломельный элек-трод [14].
Проволока (длиной 8—10 мм, диаметром 0,5 мм) впаяна в стекл’янную трубку с загнутым концом.
20
Для измерения силы тока применяется микроамперметр чувствительностью 0,5*10-6 а]мм. Обычно для амперометрического титрования выбирают потенциал, соответствующий средней области волны диффузионного тока. Полученная вольт-амперная кривая (рис. 7) дает основание принять его равным 0,55 в по отношению к насыщенному каломельному электроду. Вольт-амперные
Рис. 7. Вольт-амперная кривая анодной поляризации в 0,001 н. растворе NaOH.
кривые, снятые для растворов с более низкой и более высокой концентрациями щелочи, имели ту же конфигурацию, и величина потенциалов оставалась той же. (На вольт-амперной кривой ясно выражены два потенциала восстановления кислорода — при 0,3 и 0,6 в по отношению к насыщенному каломельному электроду.) Кривые амперометрического титрования борной кислоты показаны на рис. 8.
Ход анализа. 50 мл раствора, свободного от СО2 (-10 мг бора), помещают в стаканчик для титрования. Включают схему, прикладывают потенциал 0,55 в и выжидают до установления стрелки микроамперметра на нуле. Жидкость перемешивают при помощи
21
магнитной мешалки. Добавляют по каплям 0,1 н. раствор едкого натра. Моменту нейтрализации сильной кислоты соответствует резкий скачок потенциала. После нейтрализации сильных кислот (соляной, серной, азотной) в раствор добавляют ~ 1 г маннита (стрелка микроамперметра возвращается в первоначальное положение) и продолжают титрование. По полученным дан-
Рис. 8. Кривые амперометрического титрования борной кислоты едким натром. Взято раствора для титрования:
1 — 25 мл\ 2 — 50 мл\ 3 — 100 мл.
ным строят кривую титрования и определяют объем щелочи, пошедшей на титрование.
Поправки на разбавление вводить нет необходимости. Титр едкого натра устанавливают по дважды перекристаллизованной борной кислоте.
3. Методы отделения борной кислоты от мешающих примесей
Объемному определению борной кислоты титрованием щелочью мешает большинство тяжелых металлов, которые при титровании гидролизуются, приводя к завышенным результатам, или адсорбируют борную кислоту на выпадающих гидроокисях, вызывая занижение данных. Присутствие слабых кислот также должно быть исключено, так как часть из них титруется в заданном интервале pH, а часть мешает определению эквивалентной точки, создавая неясность перехода с цветным индикатором.
К мешающим примесям относятся: СО2, NH+ , Н2РО7 , F-, Fe3+, Fe2+, Al3+, Zn2+, Pb2+, Ni2+, 22
Co2+, Cu2+, Ag+, TiO2+, Mo02+ , Zr4+, Ta5+,
Cr3+, W6+, V5+, Hg2+, Re7+, As5+, Sb5+, SiO2.
Германий и теллур (Ge4+, Te6+) обязательно должны отсутствовать, так как с маннитом они также образуют одноосновные комплексные кислоты.
Как указывалось выше, существуют методы определения бора на фоне сопутствующих элементов. Так, потенциометрическим титрованием при фиксированном значении pH удается определить бор в присутствии цинка, никеля, кадмия, кобальта, марганца, аммонийных солей, арсенитов и арсенатов, кремневой, фосфорной и оловянной кислот [12] (см. п. 1).
Сильно гидролизующиеся соли (железа, алюминия и др.) мешают потенциометрическому титрованию, и необходимо либо удалять их, либо применять маскирование путем перевода в соответствующее комплексное соединение. Последним способом можно устранить влияние больших количеств алюминия, связывая его в прочный комплекс с лимонной кислотой [20, 21]. Известен способ маскирования многих мешающих катионов (Fe3+, Со2+, Ni2+, Mn2+, Zn2+, Cu2+, Pb2+, Al3+, Cd2+, Са2+, Mg2+, Ва2+) добавлением комплексона III [56—58]. На таком же принципе основан метод титрования борной кислоты в присутствии редкоземельных элементов [59], титана, циркония и хрома [60].
В отдельных случаях возможно определение борной кислоты в уксуснокислом растворе [61] и растворе, содержащем соли железа, алюминия и никеля [62, 63]. При определении борной кислоты в растворах никеля авторы работы [62] для повышения кислотности растворов борной кислоты применяют инвертный сахар и фруктозу, полагая, что последние образуют с борной кислотой более сильные комплексные кислоты, чем маннит или глицерин. Титрование этих кислот заканчивается при значениях pH более низких, чем pH гидролиза Ni2+. В качестве индикатора можно применять крезоловый красный, феноловый красный и метиловый красный.
Методы отделения веществ, мешающих определению борной кислоты, сводятся в основном к осаждению, отгонке, экстракции, электролизу, ионному обмену и т. д.
Метод отделения примесей с применением электролиза [58, 64] не нашел распространения из-за необходимости дополнительного отделения некоторых металлов, не
выделяющихся на ртутном катоде (Ti, V, Zr и др.), и токсичности ртути.
В литературе описан пирогидролитический метод отделения бора для его определения в цирконии, циркалое и других материалах [65, 66]. Метод состоит в разложении анализируемого материала, помещенного в платиновой или никелевой лодочке в середину никелевой трубки, парами воды при высокой температуре. Разложение пробы и отгонка борной кислоты с водяным паром продолжаются 1,5 ч при 1100°. При 1300° достаточно пропускать пар в течение 30 мин. Иногда применяют способы отгонки бора в виде борнометилового эфира (например, в случае разделения бора и кремния при определении бора в кремнии).
Известным способом извлечения борной кислоты из различных видов борсодержащего сырья является экстракция. В качестве экстрагирующих агентов для этой цели применяют различные органические растворители, в частности диэтиловый эфир, амиловый спирт, метиловый спирт, бензол, ацетон и т. п. [2, 67, 68]. Данные по растворимости борной кислоты в различных спиртах и эфирах опубликованы в соответствующей литературе [69]. Ниже приведена растворимость борной кислоты (в %) в некоторых органических растворителях (при 20°):
Метиловый спирт.................20,68
Этилацетат .....................1,00
Метилэтилкетон..................0,70
Ацетон .........................0,57
Метилбутилкетон ................ 0,23
Анилин..........................0,15
Изоамиловый спирт ..............2,39*
Сивушное масло..................2,46*
* При 25°.
Практическое применение нашли экстракционные методы определения борной кислоты, основанные на переводе последней в ион BF7, образовании соли MBF4 (где М — подходящий органический катион) и экстрагировании этой соли.
Последний способ наиболее часто применяется при колориметрических определениях бора. Известны, например, экстракция бензолом соединения HBF< с метиловым фиолетовым [70J. кристаллическим фиолетовым [68], 24
бриллиантовым зеленым [71, 72], экстракция дихлорэтаном комплексного соединения BF7" с метиленовым голубым или с азуром [73—75], экстракция ацетоном при определении малых количеств бора в кремниевых соединениях [76], экстракция диэтиловым эфиром [77] и т. д. При сравнении различных органических растворителей лучшим для экстракции HBF4 оказался дихлорметан. Ход анализа при экстрагировании иона ВРГ описан в гл. II.
Универсальным методом отделения борной кислоты от мешающих примесей следует считать отгонку бора в виде борнометилового эфира при 65° по реакции
Н3ВО3 + ЗСН3ОН -> (СН3О)3В + зн.о.
Принцип классического метода определения бора в виде борнометилового эфира [2] заложен еще работами Муассака [78], который пользовался его весовым вариантом. Этому же методу посвящены работы Вейнтрауба [79] и Кролля [80]. Более точным является вариант, разработанный Чэпином [81]. В наиболее простом варианте метод этот описан Ю. Н. Книпович [3]. Отделение бора дистилляцией рекомендуется для определения главным образом его микроколичеств в минеральных удобрениях и растительных материалах [82—84], при анализе различных стекол и эмалей [1], в сложнолегированных сталях [85]. Большинство колориметрических определений бора * требует предварительной дистилляции борнометилового эфира. Для полноты определения микроколичеств бора дистилляцию эфира проводят два-три раза большим количеством метилового спирта [54].
В качестве обезвоживающих средств применяют сер-. ную или фосфорную кислоту или соли кальция. Для ускорения отгонки бора в виде борнометилового эфира и . полного удаления его из аппаратуры предложен прибор, в котором через анализируемый раствор пропускают инертный газ [86]. Для более полной дистилляции эфира в литературе последнего времени рекомендуется прибавлять хлористый цинк [87]. Аппаратура для отгонки борнометилового эфира должна быть выполнена из не содержащего бор стекла.
Омыление борнометилового эфира проводят щелочью
(СН3О)3В + NaOH 4- Н2о -> NaBO2 + ЗСН3ОН.
25
Однако связывание бора посредством едкого натра не дает хороших результатов вследствие частичного гидролиза образовавшегося метабората натрия до борной кислоты, которая улетучивается при отгонке СНзОН. Для омыления эфира рекомендуется применять Са(ОН)г, что обеспечивает связывание всего бора в нелетучий Са(ВОг)2 [88]. Исследовалось влияние на реакцию омыления эфира температуры испарения дистиллятов, получаемых -после отгонки бора в виде борнометило-вого эфира. Установлено, что испарение следует проводить при температуре 55° [89].
Метод отгонки борнометилового эфира применяется в отсутствие веществ, которые при отгонке будут попадать в дистиллят вместе с борной кислотой. К таким веществам относятся углекислота и карбонаты, аммонийные соли, сернистая и азотная кислоты, фториды, органические соединения и др. Примеси двуокиси силикатов, фосфорной кислоты и фосфатов, а также гидроокисей металлов (например, алюминия и железа) иногда усложняют метод, требуя предварительного их отделения [1]. Отделение бора отгонкой в виде борнометилового эфира требует большой затраты времени.
Наиболее простой и быстрый метод — это осаждение катионов металлов щелочами и карбонатами: карбонатом натрия [90], карбонатом кальция [91, 92], карбонатом бария [93, 94], гидратом окиси натрия [20, 60, 95, 96] и гидратом окиси бария [97, 98]. Подробный обзор различных способов отделения мешающих примесей осаждением приведен в соответствующей литературе [1, 12, 99].
Основным недостатком методов осаждения является опасность соосаждения борной кислоты с осадками гидроокисей и карбонатов. Как правило, необходимо многократное переосаждение гидроокисей. При использовании карбоната кальция возможны потери бора из-за соосаждения бората кальция [92]. Проверка метода отделения металлов от бора с помощью гидроокиси бария, карбоната кальция и карбоната бария показала, что наиболее полное отделение происходит при осаждении карбонатом бария [100]. Карбонат бария рекомендуется применять для отделения титана, циркония, ниобия, тантала, хрома и вольфрама [94]. В присутствии ионов железа или кальция возможно количественное осаждение ванадия и
26
|.. молибдена [94]. Применение углекислого бария для t -осаждения примесей, мешающих титрованию бора, опи-L сано в гл. IV и V.
| Гидроокись натрия применяется для отделения Fe3+, I Ni2+, Cr3+, Ti4+, Mn2+ в сталях и ферросплавах. Соосаж-I дение бора устраняется осаждением этих катионов в | сильнощелочной среде. При pH 7—10 еще наблюдается * соосаждение бора [21]. Метод осаждения едким натром применяется при определении бора в боридах титана, циркония и хрома [60]. Определяя микроколичества бо-I ра, осаждение металлов щелочами необходимо прово-( дить в кварцевой посуде, поскольку стеклянная посуда всегда содержит бор. Так как борная кислота соосаж-• дается вследствие образования аморфных или гелеподобных осадков, внимания заслуживает способ осаждения металлов с оксихинолинатом натрия [12]. При использо-; вании 8-оксихинолина для осаждения металлов получа-, ются кристаллические хорошо фильтрующиеся осадки.
Метод применяется для осаждения цинка, свинца, алю-; миния, железа, никеля. Известен способ отделения нике-У ля, ванадия и молибдена экстрагированием их диэтилди-I тиокарбаматных комплексов хлороформом [94].
г В последние годы большое распространение при оп-| ределении бора получили методы хроматографического разделения металлов [41, 101 —119]. Исследование адсор-бируемости борной кислоты на катионо- и анионообмен-? них смолах [41, 108, 115, 116] показало, что по эфектив-* ности поглощения бора отечественные аниониты типа АН и АВ располагаются в ряд: АВ-16 > АН-9 > > АН2ФГ > АН-1 [115]. Амберлит IRA-400 в ОН“-форме ’ адсорбирует бор при pH > 2 [108], в С1“-форме — при ? pH > 5. Слабоосновной диаион А в ОН_-форме адсорби-? рует бор в кислой области с максимумом при pH 3—4, в С1“-форме — при pH > 6. Количественная адсорбция борной кислоты затруднена и не нашла распространения.
Различные типы ионообменных смол используются для удержания таких катионов, как Ni2+, Со2+, NH+ , Zn2+, Al3+, Fe3+, Fe2+, Cu2+ и др. Описаны способы отделения NH~4, Zn2+, Ni2+, Fe3+, Al3+ и других катионов на ионообменных смолах амберлит IR-120 и дауэкс-50 [101, 102, 120]. Рекомендуется при использовании амберлита пропускать раствор, содержащий борную кислоту, через две последовательно соединенные друг с другом колонки 27
с амберлитом IR-120 (Н+-форма) и амберлитом 1RA-400. Отделение мешающих элементов возможно при pH < 4. При отделении мешающих примесей на колонке с ионитом дауэкс-50 [101] рекомендуется подключать последовательно к колонке с катионообменной смолой колонку с анионообменной смолой.
Применение отечественных Н+-катионитов для отделения мешающих примесей при определении бора в электролитах подробно описано в соответствующей литературе [103, 113, 114, 118]. Для определения бора в свинцовом борофтористоводородном электролите применялись сульфоуголь и эспатит-1. Получены удовлетворительные результаты при отделении Pb2+, Cu2+, Fe2+. В никелевом электролите для адсорбции никеля применяли сульфоуголь К и ионообменную смолу СВС [118]. Описано применение катионитов КУ-2 и СДВ-3. Метод проверен на серии проб.
Для сравнения пробы анализировались также обычным методом с отделением мешающих примесей карбонатом бария в присутствии избытка хлорида бария. Выяснилось, что применение катионита позволяет добиться более точных и воспроизводимых результатов, чем отделение примесей карбонатом бария [НО].
Разработаны методы ионообменного определения бора в природных водах и его концентрирования [115]. Способ состоит в следующем: заполняют колонку высотой 20 см и диаметром 16 мм ионообменной смолой КУ-2, КУ-1 или СВС-1 в количестве 10 г, заливают дистиллированной водой и оставляют на 24 ч для набухания смолы; 50 мл анализируемой воды пропускают со скоростью 1 мл/мин и промывают колонку 0,005—0,1 н. раствором НС1 (тремя порциями по 25 мл со скоростью 5 мл!мин). Метод позволяет количественно определять более 25 мг NH+ Са2+, Mg2+, Fe2+, Fe3+, Al3+, Ni2+, Cu2+, TiO2+ или МоОг+.
Для отделения анионов исследовалось применение анионитов АН-1, АН2ФГ, АН-9, АВ-16. При пропускании 50 мл анализируемого раствора с pH ~ 2 через колонку, наполненную анионитом АН-1 в ОН~-форме, со скоростью 1 мл!мин бор полностью проходил через колонку, а анионы сильных кислот (СГ, БОГ”, NO? , Н2РО4 ) и частично кремнекислота поглощались смолой.
28
Б Авторами проводилось отделение борной кислоты ог Е кальция, магния, меди, железа, алюминия на колонке с Е катионитом КУ-1. Отделение примесей — количественное, В метод прост и может быть применен для отделения ме-Е шающих титрованию борной кислоты примесей и для Е концентрирования примесей с целью их определения.
Б Для отделения борной кислоты от мешающих приме-1> сей и для концентрации примесей при определении пос-f ледних в элементарном боре следует рекомендовать Г катионит КУ-2, поскольку он значительно дешевле и, « что наиболее важно, обладает более высокой химической г стойкостью к кислотам, щелочам и окислителям (1 н. I HNO3), чем катионит КУ-1.
F Критический обзор методов отделения кремнекисло-5 ты с применением дистилляции и экстракции приведен в соответствующей литературе [69]. Описаны условия экс-тракции субмикрограммовых количеств борной кислоты из смеси с кремневой кислотой, содержавшейся в коли-честве нескольких граммов. Описан перфоратор для г экстракции борной кислоты с метанол-изопропиловым ;; эфиром [69]. Описано также отделение кремния в виде геля [12].
Фтор (при содержании более 5%) отделяют в виде | CaF2[l]. .
: Соли аммония удаляют отгонкой из щелочного рас-
твора. Для удаления углекислого газа раствор подкис- ляют соляной кислотой и кипятят с обратным холодиль-ником во избежание потерь борной кислоты с водяными парами.
По данным П. Чижевского [121], летучесть борной - кислоты с водяным паром значительна. Однако Ш. К. Ашратова [122] считает нецелесообразным приме-' нение обратного холодильника при освобождении борной ' кислоты от углекислого газа кипячением. Ю. М. Кост-рикин и В. А. Коровин [123] показали, что борная кислота летуча с водяным паром и процесс этот подчиняется закону распределения = const, где Сп и Св — концен-св
трация борной кислоты соответственно в паре и воде, выраженная, например, в миллиграммах на килограмм. Постоянная величина этого отношения при атмосферном давлении близка к 0,005. Вычислено, что при обычных аналитических условиях кипячения растворов борной
29
кислоты улетучиванием ее с паром можно пренебречь [например, если принять, что 0,2—0,3 мг раствора кипятят 10—15 мин и при этом испаряется не более 0,05 мг жидкости, то потери составят не более 0,16—0,20% (отн.)]. Но при выпаривании разбавленных растворов борной кислоты досуха потерями борной кислоты вследствие улетучивания ее с паром пренебрегать нельзя [123].
Фельдман [124] установил, что при упаривании при температуре 75° до малого объема водных растворов борной кислоты и растворов, содержащих азотную, серную, хлорную кислоты, потери бора составляют меньше 3%. При упаривании растворов борной кислоты в соляной кислоте потери бора значительны и особенно велики при выпаривании досуха (~75%).
В условиях определения бора в элементарном боре, карбиде бора и боргалоидных соединениях пренебрегать летучестью борной кислоты с водяными парами не следует, поскольку кипячение растворов с целью удаления углекислого газа проводят в солянокислом растворе и в малом объеме.
Отделение железа (III), никеля, хрома, титана и марганца 20%-ным раствором едкого натра [20]
Необходим ые реактивы
1. Соляная кислота (1:1).
2. Перекись водорода, 3%-ный водный раствор.
3. Едкий натр, 20%-ный раствор.
4. Лимонная кислота, 5%-ный раствор.
5. Метиловый оранжевый, 0,1 %-ный водный раствор.
Ход анализа. В коническую колбу емкостью 250 мл помещают 1 г стали или сплава, закрывают колбу резиновой пробкой со вставленным в нее обратным водяным холодильником и приливают 30 мл НС1 (1:1). После полного разложения навески раствор окисляют 10—20 мл 3%-ного раствора перекиси водорода и кипятят 10 мин. При неполном разложении образца остаток, который может содержать нерастворимые соединения бора, отфильтровывают, сплавляют с карбонатом натрия в платиновом тигле и 'после выщелачивания сплава разбавленной соляной кислотой соединяют с основным раствором.
за
Жидкость переносят в мерную колбу емкостью 500 мл и разбавляют дистиллированной водой до 350—400 мл-, приливают 20%-ный раствор едкого натра до осаждения гидроокисей металлов и добавляют избыток в 10—15 мл. Щелочной раствор разбавляют дистиллированной водой до метки, перемешивают и отфильтровывают половину раствора в мерную колбу емкостью 250 мл, из которой переносят в коническую колбу емкостью 500 мл. Если раствор стали или сплава содержит алюминий, в колбу приливают 5%-ный раствор лимонной кислоты; при содержании алюминия до 10% достаточно прилить 5— 6 мл, при большем содержании алюминия (10—20%) — 10—12 мл. Осторожно подкисляют раствор разбавленной (1:1) соляной кислотой до изменения окраски метилового оранжевого. Для удаления углекислого газа раствор кипятят в течение 5 мин, охлаждают в проточной воде, переносят в стакан емкостью 400 мл и титруют.
Отделение цинка, свинца, алюминия, железа и никеля в виде оксихинолятов [12]
Необходимые реактивы
1. о-Оксихинолят натрия, 0,25 М. раствор.
2. Бромкрезоловый пурпуровый, 0,1%-ный спиртовой раствор.
3. Хлористый магний, 1 М. раствор.
4. Активированный уголь.
5. Метиловый красный, 0,1%-ный спиртовой раствор.
Присутствие избытка о-оксихинолина действует как буфер. Для получения более резкой окраски индикатора в точке эквивалентности избыток о-оксихинолина должен быть удален (особенно он мешает при использовании индикаторов, область перехода которых лежит ниже pH = 6). Кроме того, голубая окраска о-оксихинолина мешает видеть окраску самого индикатора. Для удаления избытка о-оксихинолина применяются активированный уголь и хлористый магний.
Ход анализа. Нейтральный или слабокислый раствор (объем ~50 мл) нагревают до 60° и добавляют небольшой избыток о-оксихинолята натрия. После осаждения взвеси (просветления) испытывают раствор на щелочную реакцию с бромкрезоловым пурпуровым. Если
31
оксихинолят натрия присутствует в избытке, то голубой раствор окрашивается в фиолетово-голубой цвет. Для полноты осаждения нагревают еще 5 мин. К анализируемому раствору прибавляют 5 мл 1 М раствора хлористого магния и нагревают 5 мин. Затем фильтруют раствор на воронке Бюхнера и промывают осадок дистиллированной водой комнатной температуры. Фильтрат слабо подкисляют по метиловому красному и добавляют 0,5 г активированного угля. Через 5 мин раствор фильтруют и промывают водой. В бесцветном фильтрате определяют борную кислоту одним из известных способов.
Отделение кремния в виде геля [12]
Присутствие более 50 мг SiO2 мешает титрованию борной кислоты. Было установлено, что адсорбция борной кислоты сильно зависит от концентрации ионов водорода, Так, из 100 мл раствора, содержащего 129 мг В2О3, гель двуокиси кремния (225 мг SiO2) при различных значениях pH адсорбирует следующие количества В2О3, мг:
рН=9 рН=7 рН=5 рН=3
18,1
12,5
7,0
1,3
Ход анализа. Щелочной раствор боросиликатов, объем которых не больше 10—15 мл, перемешивают (стеклянной палочкой) с 3 г хлорида аммония. При этом кремнекислота выпадает в виде геля. Раствор через 5 мин нейтрализуют соляной кислотой (6 н.) и подкисляют еще 10 каплями. Пробу нагревают до кипения и оставляют на 10 мин на кипящей водяной бане. Раствор фильтруют через двойной фильтр на воронке Бюхнера и промывают горячей 0,01 н. НС1. Фильтрат нейтрализуют и прибавляют едкий натр в таком количестве, чтобы раствор оставался щелочным после полного выделения аммиака. Для предотвращения разъедания стекла добавляют 5 мл 1 М хлористого магния. После удаления СО2 кипячением подкисленного раствора нейтрализуют соляную кислоту и титруют борную кислоту потенциометрически от pH = 5,8 до pH = 5,8.
32
Отделение аммония, кальция, магния, железа (II и III), алюминия, никеля, меди (II), титанатов и молибдатов при помощи катионита КУ-2
Катионит КУ-2 относится к монофункциональным сильнокислотным катионитам полимеризационного типа [125].
Зависимость статистической обменной емкости (в мг-экв1г) от pH следующая:
pH- 3..............4,7
pH— 5..............4,75
pH- 7..............4,75
pH-13..............5,02
По литературным данным [126, 127], никель, кобальт железо и медь хорошо поглощаются из растворов pH = = 1,5 и выше, а железо и свинец адсорбируются из еще более кислых растворов. Цинк поглощается в интервале pH 2—5. Избыток кислоты нейтрализуют свободным от СО2 4%-ным раствором едкого натра до появления мути (или по метиловому красному), которую растворяют, добавляя несколько капель 5%-ной НС1 [110].
Общий вид установки показан на рис. 9. Установка состоит из колонки высотой 40 см и диаметром 30 мм и термостата (тип ТС-15). Катионитовая колонка изготовлена из полиэтилена и снабжена стеклянной рубашкой, через которую подается горячая вода (45—50°). Трубка опирается на пористое стекло.
Подготовка катионита. Примерно 40 г катионита КУ-2 помещают в стакан, заливают 4 н. НС1 и оставляют на ночь. Промывают набухшую смолу два-три раза дистиллированной водой и загружают в колонку. Включают термостат, доводят температуру в колонке до 50° и промывают колонку дистиллированной водой до отсутствия реакции на ион хлора.
Ход анализа. Включают термостат и через 40— 45 мин (температура при этом достигает 50°) пропускают 50—100 мл раствора со скоростью 1 мл!мин. Затем промывают колонку дистиллированной водой, пропуская последнюю со скоростью 1 мл!мин, двумя порциями по 30 мл. В объединенном фильтрате определяют борную кислоту.
Для регенерации катионита колонку промывают 2—5%-ной НС1, приливая последнюю двумя порциями по
3 Анализ бора 33
Рис. 9. Общий вид установки для отделения примесей с применением катионитов.
[ 25 мл. Затем промывают колонку водой до отрицатель-
u ной реакции на ион хлора.
t Метод позволяет отделять более 100 мг каждого из следующих катионов: NH^,Ca2+, Mg2+, Fe2+, Fe3+, Al3+, Ni2+, Cu2+, TiO2+, MoO2+ [115].
4. Приготовление реактивов
Инвертный сахар. Приготовляется двумя способами: а) 600 г сахарозы (ГОСТ 5833—51) растворяют в 600 мл свежепрокипяченной дистиллированной воды и осторожно нагревают до растворения. Кипятить не следует, так как инвертный сахар при этом окрашивается в желтый цвет, что мешает титрованию. Затем раствор осторожно нагревают почти до кипения, прибавляют 5 мл 3 н. НС1, сильно взбалтывают 1—2 мин и приливают 300 мл воды. После охлаждения к полученному раствору прибавляют две-три капли раствора метилового красного и нейтрализуют 0,1 н. раствором едкого натра до желто-оранжевой (апельсиновой) окраски;
б) растворяют примерно 3 кг кристаллического сахара в 1 л дистиллированной воды и кипятят раствор несколько минут до просветления, лучше всего в большом стакане. Затем удаляют нагреватель, быстро добавляют 25 мл 3 н. H2SO4, перемешивают пол минуты, доливают 1,5 л дистиллированной воды, к которой добавлено 25 мл 3 н. едкого натра, свободного от углекислоты, перемешивают и охлаждают. Раствор имеет концентрацию примерно 55% и должен быть нейтрализован по метиловому красному.
Глицерин. Глицерин содержит жирные кислоты, поэтому. его надо предварительно обработать следующим образом: к 500 мл глицерина прибавляют 50 мл воды, 5 мл раствора фенолфталеина и затем 0,5 н. раствора едкого натра до появления розовой окраски индикатора. Если раствор при стоянии обесцвечивается, то перед употреблением его снова обрабатывают 0,1 н. раствором щелочи.
Борный ангидрид. Установление титра едкого натра по борному ангидриду. В платиновую чашку насыпают 2 г борной кислоты и сплавляют ее в муфельной печи при 700—800° в течение 15—20 мин, затем осторожно, чтобы не попала в чашку вода, касаются дном чашки поверхности холодной воды. По охлаждении масса растрески-3* 35
вается и отстает от стенок чашки. Кусочки бесцветной стекловидной массы борного ангидрида помещают в сухой чистый бюкс с хорошо пришлифованной крышкой и хранят в эксикаторе.
В бюксе с пришлифованной крышкой взвешивают точно 1,7410 г свежеприготовленного борного ангидрида, количественно переносят в химический стакан емкостью 300—400 мл и растворяют в 200—250 мл дистиллированной воды. Раствор охлаждают и переносят в мерную колбу емкостью 500 мл, доливают до метки дистиллированной водой и хорошо перемешивают. Дистиллированную воду предварительно кипятят в течение 10—15 мин, 1 мл приготовленного раствора борной кислоты отвечает 1 мл точно 0,1 н. раствора щелочи.
В коническую колбу емкостью 250 мл отмеряют пипеткой 25 мл приготовленного раствора борной кислоты, приливают 50—60 мл дистиллированной воды (прокипяченной), две-три капли раствора метилового красного и нейтрализуют раствор 0,1 н. раствором щелочи. Дальнейшее титрование борной кислоты проводят в тех же условиях, как и при определении бора по описанному выше методу.
Коэффициент нормальности щелочи вычисляют по формуле
где Vi — объем борной кислоты, взятой на титрование, мл; V2— объем 0,1 н. раствора щелочи, израсходованной на титрование борной кислоты, мл.
Примечание. В случае изотопного бора титр едкого натра или гидроокиси бария по бору изменяется в зависимости от процента обогащения бора.
Для нормального бора (18,8% В10) титр 0,1 н. NaOH или Ва(ОН)2 равен 0,001081 и вычисляется по реакциям,
Ва(ОН)2 + 2Н3ВОз = Ва(ВО2)2 + 4Н2О, НзВОз 4- NaOH = NaBO2 4- 2Н2О.
Для изотопного бора, например с обогащением 81,4% В10, расчет проводится следующим образом:
8М-.0+18.6 П _10J8f..
100
где 10,186 — средний молекулярный вес бора.
36
Следовательно, 0,0010186 — титр 0,1 н. раствора едкого натра или гидроокиси бария по бору.
Ниже приводятся данные по изменению титра щелочи в зависимости от процента обогащения бора по В10 (табл. 1).
Таблица 1
Изменение титра едкого натра или едкого бария в зависимости от процента обогащения бора по изотопу В10
Обогащение бора по В10, % Титр 0,1 н. щелочи по бору, г!мл Обогащение бора по В10, % Титр 0,1 н. щелочи по бору, г!мл
75,0 0,0010250 80,5 0,0010195
75,5 0,0010245 81,0 0,0010190
76,0 0,0010240 81,5 0,0010185
76,5 0,0010235 82,0 0,0010180
77,0 0,0010230 82,5 0,0010175
77,5 0,0010225 83 0 0,0010170
78,0 0,0010220 83,5 0,0010165
78,5 0,0010215 84,0 0,0010160
79,0 0,0010210 84,5 0,0010155
79,5 0,0010205 85,0 0.0010150
80 0 0,0010200 85,5 0,0010145
Боратный буфер с pH = 7,94 (18°). К 5,5 мл 0,05 Л1 раствора Na2B4O7-ЮН2О (19,072 г/л) прибавляют 4,5 мл 0,1 н. НС1.
0-Оксихинолят натрия, 0,25 М раствор. 7,5 г о-оксихинолина растворяют при сл.збом нагревании в 50 мл 1 н. едкого натра. Разбавляют раствор дистиллированной водой до 250 мл. В течение 10 дней раствор прозрачен. Появляющееся небольшое голубое окрашивание не мешает.
Литература
1. Wiberg Е. Analyse der Borverbindungen, Handbuch der ana-lytischen Chemie, Teil III, Bd. Ill, 1942.
2. Виллебранд В. и др. Практическое руководство по неорганическому анализу. М., Госхимиздат, 1957.
3. Анализ минерального сырья. Сб. методов хим. анализа. Под ред. Ю. Н. Книпович и Ю. В. Морачевского. Л., Госхимиздат, 1956.
4. М а й Л. А., Юр да нов И. И. «Заводск. лаборатория», 21, 162 (1955).
5. Ishibashi М. et al. Rec. Oceanogr. Works Japan, 2, 127 (1955).
6. W а к a m a t s u 5h., В u n s e к i К. «Бунсэги кагаку», Japan Analyst, 9, No. 1, 22 (I960).
7. Z u с c n e s i C. A., de Ford D. D. Analyt. Chem., 29, No. 8, 1169 (1957).
8. Лерман Э. И. «Об. тр. Весе. н.-и. ин-та Гознака», 1, 243 (1957).
9. de Ford D. D. et al. Analyt. Chem., 33, 471 (1961).
10. В 1 u m e n t h a 1 H., Fall W. Analyt. Chem., 25, No. 7, 1120 (1953).
11. Taylor D. S. J. Assoc. Offic. Agric. Chemists, 33, 132 (195G).
12. Schaffer H., S i e v e r t s A. Z. analyt. Chem., 121, 172 (1941).
13. Csapo F. et al. Z. analyt. Chem., 151, 273 (1956).
14. Б о г о в и н а В. И., Селиванов В. Т. «Заводск. лаборатория», 24, 1200 (1958).
15. Swann W. В. et al. Analyt. chim. acta, 22, 76 (1960).
16. И ин ум a X., Йо см ори Т. «Бунсэги кагаку», Japan Analyst, 9, No. 10, 826 (1960).
17. Якушева 3. П., Ян Шо-сян Г. В. «Ж. прикл. химии», 35, 2199 (1962).
18. Moss М. L. et al. Analyt. Chem., 20, 784 (1948).
19. M a s a i c h i г о N., Kam ur a Y. «Якугаку дзасси», J. Pharmac. Soc. Japan, 71, 1194 (1951).
20. Яковлев П. Я., Козина Г. В. «Заводск. лаборатория», 26, 1342 (1960).
21. Яковлев П. Я-, Козина Г. В. Новые методы испытаний металлов. «Тр. Центр, н.-и. ин-та черной металлургии», 24 (1962).
22. Яковлев П. Я., Козина Г. В. «Заводск. лаборатория», 29, 920 (1963).
23. de Ford D. D. et al. Analyt. Chem., 33, No. 3, 471 (1961).
24. К о d a m a K-, Shiie H. «Бунсэги кагаку», Japan Analyst, 9, No. 8, 685 (1960); цит. по «Реф. ж. хим.», 7Д116 (1961).
25. Kodama К., Shiie H. Analyt. Chem., 34, No. 1, 106 (1962).
26. Крюкова T. А. и др. Полярографический анализ. М., Гос-химиздат, 1959.
27. R е у п о 1 d s G. F., Terry Е. A. J. Polarogr. Soc., 7, No. 1, 2 (1961).
28. Коршунов И. А., Кузнецова 3. Б. «Ж. аналит. химии», 6, 96 (1951).
29. С т р и ж е в с к и й И. И. «Заводск. лаборатория», 25, 146
(1959).
30. Берг Л. Г., Аношина Н. П. «Изв. Казанск. фил. АН СССР, сер. хим. н.», 6, 205 (1961).
31. Христианов В. К., Панов Г. И. «Ж. аналит. химии», 12, 362 (1957).
32. Лобанов Е. М. и др. «Докл. АН УзССР», 3, 13 (1962).
33. Martelly L., Sue Р. Bull, chim., 1—2, 103 (1946).
34. Малышева Н. Т. и др. «Ж. аналиг. химии», 18, 1367 (1963).
35. Я к у б о в и ч А. Л., Зайцев Е. И. «Заводск. лаборатория», 28, 819 (1962).
36. Fiti М. et al. Studii si cercetari fiz. Avad. RPR, 11, No. 2, 423 (1960).
37. van Z i e m p t J. A. M. Z. anorgan. und allgem. Chem<, 111, 151 (1920).
38. M a g n a n i n i G. Z. phys. Chem., 6, 58 (1890).
38
39. S c i а г г a J. J., Z a p a t о с к у J. A. J. Amer. Pharmac. Assoc. Scient. Ed., 44, 370 (1955).
40. Лит я ну, Моциу. Studii si cercetari chim. Acad. RPR. Fil., Cluj, 8, No. 3/4, 243 (4957).
41. Ma тер OB a E. А., Рож а иска я T. И. «Ж. неорган. химии». 6, 177 (1961).
42. Н е г m a n s Р. Н. Z. anorgan. und allgem. Chem., 142, 83
(1925).
43. Schaffer H. Z. anorgan. und allgem. Chem., 247, 96 (1941).
44. Schaffer H., Sieverts A. Z. anorgan. und allgem. Chem., 246, 149 (1941).
45. Михеева В. И. и др. «Ж. неорган. химии», 11, 1249 (1957).
46. Hollander М., Rieman W. Industr. and Engng Chem., Analyt. Ed., 17, 602 (1945).
47. Antikainen P. Ann. Acad. Sci. Fenicae, Ser. A, 11, 8 (1954).
48. Vicci M. Chimica, 8, No. 2, 1 (1953).
49. Strecker W., Kannappel E. Z. analyt. Chem., 61, 378 (1922).
50. Blumenthal H. Analyt. Chem., 23, 192 (1951).
51. Lasienwicz K. Chem. analyt., 7, No. 5, 931 (1962).
52. Hahn J. Z. Analyt. Chem., 33, 316 (1961).
53. Юинг Г. Вт Инструментальные методы химического анализа. М., Госхимиздат, 1960.
54. Яковлев П. Я. и др. Анализ материалов металлургического
производства. М., Металлургиздат, 1961.
55. Ф а й н б е р г С. Ю. Анализ руд цветных металлов. М., Металлургиздат, 1953.
56. Хииро Кадзуо. Bull. Gevt. Industr. Res. Inst., Osaka, 13, No.^3, 198 (1962); цит. по «Реф. ж. хим.», 13Г111 (1963).
57. Pribil R., Wiinsch L. Chem. listy, 45, 337 (1951).
58. Tereshko J. Analyt. Chem., 35, 157 (1963).
59. Кугай Л. H., Назар чу к T. Н. «Ж. аналит. химии», 16, 205 (1961).
60. Щербаков В. Г. и др. «Тр. Семинара по жаростойким материалам. АН УССР». Бюлл. № 6, 1961.
61. Kiihne S., Hagen L. Z. analyt. Chem., 123, 187 (1942).
62. Rackett G. H. Metal Finish, 61, No. 4, 52 (1963).
63. Щ и г о л ь М. В., Бурчи некая Н. В. «Ж. аналит. химии», 11, 106 (1956).
Industr. and Engng
Chem.,
18, 607
64. Т s с h i s с h е w s k i N. (1926).
65. Wiederkehr V. R., Go ward G. W. Analyt. Chem., 31, 2102 (1959).
66. Williams J. P. et al. Analyt. Chem., 31, 1560 (1959).
67. Николаев А. В., К у p н а к о в а А. Г. Бор. В кн. «Тр. Конф, по химии бора и его соединений». М., Госхимиздат, 1958.
68. Б л ю м И. А. и др. «Заводск. лаборатория», 27, 644 (1961).
69. Pohl F. A. Z. analyt. Chem., 157, 12 (1957).
70. Полуэктов Н. С. и др. «Ж. аналит. химии», 13, 396 (1958).
71. Марченко П. В. «Заводск. лаборатория», 27, 801 (1961).
72. Бабко А. К.. Марченко П. В. «Заводск. лаборатория», 26, 1202 (1960).
73. Pasztor L. et al. Analyt. Chem., 32, 277 (1960).
74. Pasztor L., Bode D. Analyt. Chem., 32, 1530 (1960).
75. Кар а л ов a 3. К., Нем одр у к А. А. «Ж. аналит. химии», 18, 615 (1963).
76. Lechner A. et al. Acta chim. Acad, scient. hung., 28, 231 (1961).
77. Ross W. et al. Analyt. Chem., 29, 810 (1957).
78. Moi ss an H. C. R. Acad. Sci., Paris, 116, 1087 (1893).
79. Weintraub E. Trans. Amer. Electrochem. Soc., 16, 165 (1904).
80. Kroll W. Z. anorgan. und allgem. Chem., 20, 212 (1899); 21, 169 (1899).
81. Chapin W. H. J. Chem. Soc., London, 30, 1691 (1926).
82. Roth H., Beck W. Z. analyt. Chem., 141, 404 (1954).
83. Buchmann C. Holzforschung, 15, No. 6, 178 (1961).
84. Методы определения микроэлементов. M.— Л., Изд-во АН
СССР, 1950.
85. Гото Хидэхиро, Такэяма Сюр о. Нихон киндзаку гак-кайаи, J. Japan, Inst. Metals, 25, No. 9, 588 (1961).
86. Миямото Масатоси. «Бунсэги кагаку», Japan Analyst, 12, No. 2, 115 (1963); цит. по «Реф. ж. хим.», 20Г76 (1963).
87. S z а к а с s О. et al. Ann. Univ, scient. Budapest., sec. chim..
2, 625 (1960).
88. R a b, Jr. Sb. Vysake Skely zemed
89. В о г г о n d a 1 e J. et al. Analyst,
90. Foote F. J. Industr. and Engng (1932).
Brno, A, No. 1, 27 (1960).
86, No. 1024, 489 (1961).
Chem., Analyt. Ed., 4, 39
91. Wherry E. T. J. Amer. Chem. Soc., 30, 1687 (1908).
92. Мухина 3. С., Алёшин А. Ф. «Заводск. лаборатория», 11,
23 (1945).
93. В 1 u m e n t h a 1 H. Analyt. Chem., 23, 992 (1951).
94. Пилипенко A. T., К У гай Л. Н. «Укр. хим. ж.», 25, 786 (1959).
95. Scott W. W. Industr. and Engng Chem., Analyt. Ed., 4, 306 (1932).
96. Методы определения и анализа редких элементов. Сб. статей. Под ред. А. П. Виноградова и Д. И. Рябчикова. М., Изд-во АН СССР, 1961, стр. 485.
97. Mylius W. Chemiker-Ztg., 57, 173, 194 (1933).
98. Сабинина Л. В., Стюнкель Т. В. «Заводск. лаборатория», 13, 752 (1947).
99. Gmelins Handbuch der anorgan. Chemie, 143, 308 (1925).
100. Самсонов Г. В. и др. Анализ тугоплавких соединений. М., Металлургиздат. 1962.
101. Lang К. Z. analyt. Chem., 163, No. 4, 241 (1958).
102. Brunisholz G., Bannet J. Helv. chim. acta, 34, No. 7, 2074 (1951).
103. Лазарев А. И. «Заводск. лаборатория», 18, 666 (1952).
104. Calkins R., Stenger V. A. Analyt. Chem., 28, No. 3, 399 (1956).
105. Newstead E. F., Gulbierz J. E. Analyt. Chem., 27, 1673 (1957).
106. Дегтяренко Я. А. «Укр. хим. ж.», 22, 813 (1956).
107. Викторова М. Е., Котова А. В. «Тр. Ин-та нефти АН КазССР», 4, 171 (1961).
108. Satori Muto. Bull. chem. Soc. Japan, 30, 881 (1957).
40
109. Hug А. К. M. et al. J. Indian Chem. Soc., Industr. and News Ed., 20, 127 (1957).
ПО. Янковский В. В., Янковская Л. В. «Заводск. лаборатория», 24, 538 (1958).
111. Дегтяренко Я. А. «Заводск. лаборатория», 28, 427 (1962).
112. Norwitz G., Со dell С. М. Analyt. chim. acta, 11, 233 (1954).
113. Дегтяренко Я. А. «Заводск. лаборатория», 18, 1187 (1952).
114. За нь ко А. А., Дегтяренко Я. А. «Заводск. лаборатория», 18, 49 (1952).
115. Эр иста в и Д. И. и др. «Тр. Груз, политехи, ин-та», 5 (85), 3 (1962).
116. Эр иста в и Д. И., Броучек Ф. И. «Тр. Груз, политехи, ин-та», 5 (85), 17 (1962).
117. Броучек Ф. И. «Тр. Груз, политехи, ин-та», 5 (85), 27 (1962).
118. Лазарев А. И. «Заводск. лаборатория», 18, 51 (1952).
119. J. Iron and Steel Inst., 189, 227 (1958).
120. Schutz E. Mitt. Geb. Lebensmitteluntersuch. und Hyg., Bern, 44, 213 (1953).
121. T s c h i s c h e w s k i P. Acta phys. Nat., 12, 120 (1884).
122. Ашратова Ш. К- «Заводск. лаборатория», 26, 59 (1960).
123. Кострикин Ю. М., Коровин В. А. «Заводск. лаборатория», 26, 60 (1960).
124. Feldman С. Analyt. Chem., 33, 1916 (1961).
125. Салдадзе К. М. и др. Ионообменные высокомолекулярные соединения. М., Госхимиздат, 1960.
126. Лурье Ю. Ю., Филиппова Н. А. «Заводск. лаборатория», 13, 5 (1947).
127. Лурье Ю. Ю., Филиппова Н. А, «Заводск. лаборатория», 14, 2 (1948).
ГЛАВА II
КАЧЕСТВЕННЫЕ РЕАКЦИИ
И ОПРЕДЕЛЕНИЕ МАЛЫХ КОЛИЧЕСТВ БОРА
1. Качественное обнаружение бора
При качественном обнаружении бора могут быть использованы методы, пригодные для определения малых количеств бора (см. п. 2 настоящей главы). Но наиболее часто применяемые методы — это проба на окрашивание пламени и реакции с кармином, куркумином и хинализарином.
Определение бора по окрашиванию пламени [1]
Летучие соединения бора окрашивают бесцветное пламя в зеленый цвет. Это свойство используют при качественном обнаружении бора. Определению мешают ионы Си2+ и Ва2+, поэтому они должны быть предварительно удалены. Чувствительность метода ±0,2%.
Испытание в пламени становится более чувствительным, если применять его к борным эфирам (особенно метиловому), которые образуются при действии спирта на борную кислоту или бораты в присутствии серной кислоты по реакции
зсн3оц+ н3во3 =зн2о + В (ОСН3)3.
Для обнаружения бора по окрашиванию пламени борнометиловым эфиром поступают следующим образом: сухое измельченное испытуемое вещество помещают в фарфоровую чашку, прибавляют туда немного метилового спирта и концентрированной серной кислоты, смесь перемешивают стеклянной палочкой и зажигают. В присутствии соединений борной кислоты края пламени окрашиваются образующимся борнометиловым эфиром в зеленый цвет.
42
Определение бора в присутствии солей меди (II) и бария [1]
Следующее видоизменение опыта дает возможность обнаружить бор в присутствии солей меди и бария; ис
пытуемое вещество с метиловым спиртом и концентрированной серной кислотой нагревают в пробирке до ки-
пения, затем пробирку плотно закрывают пробкой, через которую проходят две стеклянные трубки: одна короткая (/) и другая длинная (2), доходящая почти до дна пробирки (рис. 10); через трубку 2 продувают воздух, который, проходя через жидкость, увлекает с собой пары борнометилового эфира и выходит через трубку 1. Последнюю вводят в бесцветное пламя горелки, которое и окрашивается борноме-тиловым эфиром в зеленый цвет. Пробирку следует нагревать на водяной или песчаной бане.
Определение бора
в виде фторида бора [1]
Рис. 10. Прибор для качественного определения бора в присутствии меди (II) и бария.
Некоторые природные соединения бора не разлагаются серной кислотой. Для анализа таких соединений пользуются реакцией образования фторида бора: сухое испытуе
мое вещество смешивают с четырьмя частями KHSO4 и одной частью CaF2. Смесь помещают в ушко платиновой проволоки и вносят в бесцветное пламя, которое окрашивается в зеленый цвет вследствие образования летучего фторида бора BF3 по реакциям:
6CaF2 4- 12KHSO4 - 6K2SO4 + 6CaSO4 + 12HF
2KHSO4 = H2O + K2S2O7
K2S2O7 - K2SO4 + SO3 Na2B4O7 + SO3 = Na2SO4 + 2B,O3 2B2O3 + 12HF = 6H2O + 4BF3
6CaF2 + Na2B4O7 + 14KHSO4 = 7H2O+ 7K2SO4+Na2SO4+ + 6CaSO4 + 4BF3
43
Определение бора с куркумовой бумагой"[2]
Проба с куркумовой бумагой дает возможность открывать бор, например, в минералах. Для испытания пользуются дистиллятом, полученным по способу, описанному в гл. I.
Метод определения с куркумовой бумагой заключается в следующем: раствор солей бора, находящийся в плоской чашке (из не содержащего бор стекла), подкисляют соляной кислотой, вводят в него кусок куркумовой бумаги и испаряют досуха в эксикаторе. В отсутствие мешающих элементов, например титана, и при не слишком высоком содержании соляной кислоты в растворе бор окрашивает желтую куркумовую бумагу в красно-бурый цвет. Если на окрашенную борной кислотой куркумовую бумагу подействовать щелочью, то красно-бурый цвет изменится в синевато- или зеленовато-черный; при действии щелочью на не окрашенную борной кислотой куркумовую бумагу она буреет.
Приготовление куркумовой бумаги [1]. Корень куркумы измельчают и несколько раз обрабатывают водой. Раствор выбрасывают, а нерастворимый осадок настаивают в теплом месте с шестикратным (по весу) количеством разбавленного (1:1) этилового спирта. Нерастворимый осадок отфильтровывают, а желтым фильтратом пропитывают полоски не очень плотной фильтровальной бумаги и высушивают их в темноте. Куркумовую бумагу следует хранить в банках с притертой пробкой, оклеенных черной бумагой, так как от действия света куркумовая бумага бледнеет.
Определение бора при помощи раствора куркумина [3]
Растворы куркумина используют, например, при определении бора в обработанной древесине. В этом случае на зачищенную поверхность древесины, обработанной борной кислотой или бурой для предохранения от вредителя, наносят две капли спиртового раствора куркумина и после их испарения две капли раствора соляной кислоты (30 мл 95%-ного спирта и 20 мл 30 %-ной НС1), насыщенного салициловой кислотой; при содержании Н3ВО3 менее 0,1% наблюдается красно-коричневое пятно; при~0,2% —однородное ярко-красное; при~0,8% — интенсивное темно-каштановое. Окрашивание сухой древесины наблюдается через 5 мин, сырой — через 30 мин.
44
Определение бора с кармином [4]
Растворами кармина при качественном определении бора пользуются очень часто. Например, для определения бора в породах и минералах в полевых условиях используют сернокислый раствор кармина. В этом случае около 10 мг пробы, растертой в пудру, смешивают с Na2CO3 в отношении 1 :3 и в платиновом тигле вносят в пламя спиртовки. Плав помещают в пробирку с каплей воды, прибавляют две-три капли серной кислоты и 2 мл сернокислого раствора кармина (0,01 г кармина растворяют в 200 мл концентрированной серной кислоты). Спустя 3—5 мин в присутствии десятых, сотых и тысячных долей процента бора раствор окрашивается в синий, фиолетово-голубой или розовато-сиреневый цвет соответственно.
Чувствительность реакции 0,025 мг бора в 25 мл раствора.
Обнаружение бора в силикатных рудах методом растирания [5]
Для обнаружения бора в силикатных рудах применяется цветная реакция с хинализарином.
Анализируемую пробу (8—40 мг) тонко измельчают, прибавляют небольшое количество хинализарина и растирают в течение 30 сек, К растертой смеси прибавляют одну каплю серной кислоты. При содержании борного ангидрида во взятой навеске 6 мкг или больше смесь окрашивается в голубовато-синий цвет. При меньшем содержании борного ангидрида окраска появляется только после нагревания смеси.
Реакция обнаружения борного ангидрида методом растирания более надежна, чем та же реакция, проводимая после предварительного сплавления пробы с карбонатом натрия.
2. Определение малых количеств^ бора в различных неорганических соединениях
Из-за способности сильно поглощать нейтроны бор является чрезвычайно вредной примесью в ядерном топливе и конструкционных материалах для реакторов. Кро-
45
ме того, в малых количествах бор присутствует как легирующая добавка в различных коррозионностойких и жаропрочных сплавах, а также применяется в пиротехнике и ракетной технике в качестве высокотеплопроизводительной добавки. Все это послужило причиной появления большого числа работ, посвященных определению малых количеств бора в различных материалах [6—47]. Не меньшее число работ посвящено определению бора в почвах, растениях и удобрениях.
Среди предложенных методов определения бора имеются объемные, колориметрические, физико-химические и физические методы.
Объемное определение рекомендуется в том случае, когда содержание бора более 0,1%; оно может осуществляться как визуальным способом, так и с применением электрохимических методов индикации.
При визуальном титровании следует особое внимание уделять присутствию мешающих определению примесей. Вопрос о мешающих примесях рассмотрен в гл. I, и там же изложены способы их отделения.
Применение электрохимических методов титрования, и в частности потенциометрического, имеет немало преимуществ по сравнению с визуальным. Потенциометрическое титрование дает возможность проводить титрование очень разбавленных растворов, содержащих 0,01 — 0,1 мкг (10~8— 10-3 %) бора. При таком содержании бора расход 0,01 н. щелочи составляет 0,0001—0,001 мл (при условии, что 1 мл 0,01 н. щелочи соответствует 108 мкг бора) [48]. Визуальное титрование в таких разбавленных растворах неприменимо. Основы методов потенциометрического и амперометрического титрования изложены в гл. I. Там же приведена соответствующая литература.
В описанном в гл. I способе титрования борной кислоты фиксированное pH принято 6,9. Авторы работы [48] рекомендуют при титровании малых количеств бора устанавливать pH = 6, так как в результате серии опытов с фиксированными значениями pH 5; 5,5; 6; 6;5; 7 наиболее благоприятные результаты титрования получены при pH = 6. При более высоком значении pH нейтрализуется часть борной кислоты, которая, таким образом, не вступает во взаимодействие с маннитом. При низких значениях pH кислотность раствора, вызываемая образо-46
ванием маннитоборной кислоты, может получаться неизмеримо малой. Последние обстоятельства имеют немаловажное значение для определения микрограммовых количеств бора.
При определении бора в удобрениях также рекомендуется устанавливать pH = 6 [49]. Ход определения бора методом потенциометрического титрования см. в гл. 1.
Из описанных в литературе методов определения малых содержаний бора особого внимания заслуживают колориметрические методы. При колориметрических (фотометрических, спектрофотометрических) методах анализа используют свойство борной кислоты образовывать окрашенные соединения с различными органическими реагентами. При всех реакциях на борную кислоту образуется ее сложный эфир с шестичленным внутрикомплексным циклом [50]. Атомы углерода этих циклов могут входить в состав как ароматических, так и алифатических соединений.
Чаще других соединений для колориметрического определения бора применяются производные антрахинона (ализарин, хинализарин, кислый ализариновый синий ББ, кармин и др.). В настоящее время известны цветные реакции более 60 производных антрахинона с борной кислотой в среде концентрированной серной кислоты [1 — 5, 48, 49, 51—59]. У всех этих соединений оксигруппа находится в пара-положении к СО-группе [50]. Все реакции, основанные на применении оксиантрахинонов, проводят в сернокислых растворах. Только те оксиантрахиноны дают в нейтральных и слабощелочных растворах цветные реакции с борной кислотой, которые в своей молекуле содержат не менее двух гидроксильных групп в о-поло-жении друг к другу. Образующиеся внутрикомплексные соединения, в которых бор связывается с молекулой оксиантрахинона путем замещения водорода в двух гидроксильных группах, обладают малой прочностью [59].
В среде концентрированной серной кислоты с борной кислотой реагируют также и другие органические соединения, содержащие гидроксильную группу по соседству с карбонильной, например резацетофенон [60], хромотроп 2В [61] и др. Общим для всех отмеченных реактивов является их участие в образовании шестичленных
'47
внутрикомплексных циклов, замыкаемых бором,
В отличие от цветных реакций, выполняемых в среде концентрированной серной кислоты, известны способы определения бора реактивами, взаимодействующими в этанольной или водной среде.
К первому типу относится куркумин, один из наиболее часто применяемых реактивов на борную кислоту [51, 62—81]. Куркумин с борной кислотой образует комплекс следующей структуры:
О—С—СН-СН—С6Н3 (ОСН3) (ОН)
/ II
(НО)2В сн
Чо-С—СН=СН—С6Н3 (ОСН3) (ОН).
Определение бора в водных или слабоуксусных растворах с применением азо- и иминопроизводных Н- и /(-кислоты описано в соответствующей литературе [82, 83]. Описан способ определения бора в водных растворах с применением //-азометина [84J, фталеинового фиолетового [85, 86] и в слабоуксусной кислой среде с //-резорцином [82]. Соединения, служащие реактивами для фотометрического определения бора в водных или слабоуксуснокислых растворах, содержат две гидроксильные группы в смежных пери- и ортоположении к азо- или азометино-вой группе [82]:
SO3H
SO3H 27-резорцин
48
—он
он
I so3H азометин
Из других органических реагентов чаще всего используются карминовая кислота [87—90], хинализарин [89, 92—101], бензоин [102—106] и др.
Как правило, колориметрическому определению бора мешают присутствие окислителей (нитраты, хроматы, перекись водорода), разрушающих красители, фтор-ион, образующий комплексное соединение с бором [91], а также некоторые элементы, такие, как железо, никель, марганец, медь, хром, кобальт, алюминий, ванадий, титан, молибден, цирконий, олово, мышьяк. Влияние окислителей устраняют восстановлением их гидразином, фтор-ион связывают добавлением двуокиси кремния. В литературе имеется обзор методов определения бора с применением дистилляции, ионного обмена, электролиза с ртутным катодом и определения в видимой и УФ-области спектра с применением флуорометрии, спектроскопии, полярографии и амперометрического титрования в урановых материалах, полупроводниках, сталях и цветных сплавах [107, 108]. Подробно методы отделения мешающих примесей изложены в п. 2 гл. I.
Лучшим способом отделения от мешающих примесей и одновременного концентрирования малых количеств бора следует признать отгонку борнометилового эфира (температура кипения 65° С) и экстракцию иона BF7 в виде соли MBF4, где М — подходящий органический катион (см. п. 2 гл. I).
Разработаны методы колориметрического определения бора и без отделения мешающих компонентов. Так, рекомендован метод определения бора в железе и низ-’ колегированных сталях в присутствии никеля (до 10 мг), I марганца, меди, хрома, кобальта (до 2 мг), алюминия, ' ванадия, титана, молибдена, циркония (до 1 мг), олова и мышьяка (до 0,1 мг). Железо в этом случае восста-
4 Анализ бора , . 4$
навливают сернистой кислотой до Fe2+ [109]. Относительная ошибка не выше 6%.
Известен метод определения 0,01—0,1% бора в низколегированных сталях с применением хинализарина без отделения сопутствующих компонентов [110]. Относительная ошибка определения меньше 5,6%. В углеродистых и хромоникелевых сталях в присутствии фосфорной кислоты можно определять бор с кармином без предварительного отделения [111]. Часто для маскирования присутствующих компонентов применяется комплексон [85, 112]. Указанные методы не всегда надежны.
При выборе реактива следует помнить, что нет универсального способа, который можно было бы рекомендовать для всех многочисленных случаев определения ‘ микроколичеств бора. В каждом конкретном случае выявляются преимущества того или иного реактива. Так, при экстракционно-фотометрическом определении бора в тетрафториде урана авторы работы [113] рекомендуют применять метиленовый голубой, несмотря на то, что при определении бора в окиси бериллия лучшие результаты эти же авторы получили с бриллиантовым зеленым [114]. В данном конкретном случае это связано с тем, что в условиях экстрагирования тетрафторобората бриллиантового зеленого (pH ~ 4) уран гидролизуется и мешает экстракции.
Значительная часть исследовательских работ посвящена изучению влияния различных факторов на чувствительность реакций борной кислоты с кармином, хинализарином, диантримидом и куркумином.
Найдено, что оптимальной концентрацией кармина является 0,02%-ный раствор, максимальная чувствительность измерения достигается в среде 92%-ной серной кислоты (по объему) и оптимальное время для появления окраски больше или равно 3 ч [115]. Изменение температуры практически на окраску не влияет. При увеличении концентрации хлора, меди, хрома, никеля, титана окраска появляется с меньшей скоростью. Содержание HNO3 должно быть минимальным. Для разрушения HNO2 рекомендуют применять тиомочевину. Чувствительность метода определения бора с кармином составляет 0,025 мг борного ангидрида в 25 мл.
Для меньших содержаний бора лучше применять хинализарин [91], Определения с хинализарином проводят 5Q
визуально-колориметрическим методом, так как фотоко-лориметрический метод менее чувствителен [116]. Чувствительность метода с хинализарином 0,003—0,1% бора.
Наиболее чувствительный реактив из числа красителей— это диантримид (1,1-иминодиантрахинон). Он приблизительно в три раза чувствительнее карминовой кислоты [109] и в шесть раз — хинализарина при условии фотоколориметрического выполнения анализа [116]. Оптимальные условия проведения реакции с диантримидом следующие [109]: концентрация диантримида 0,4 мг/мл\ концентрация серной кислоты 93—95%; концентрация бора 0,3—1 мкг/мл; продолжительность нагревания 1,0—1,5 ч при 100° и 4—5 ч при 80°; длина волны 620 ммк.
Куркумин — самый чувствительный реактив на борную кислоту. Преимущество куркумина в том, что в отличие от оксиантрахинонов, реагирующих в сернокислой среде, реакции с куркумином протекают в водной среде.
При сравнении четырех методов колориметрического определения бора, основанных на его реакциях с диантримидом, кармином, виктория фиолетовым и куркумином, найдено, что последний — наиболее быстрый, простой и чувствительный [117]. Метод с применением куркумина дает возможность определять 0,1—10 мг/л бора. Определению мешают нитраты в концентрации выше 20 мг)л (в пересчете на азот). Для повышения чувствительности и устойчивости окраски с куркумином рекомендуется н-пропанол [67].
Чувствительность метода определения бора с применением куркумина при анализе различных материалов составляет (%) [76]:
Металлического циркония.........4-10””3 — 8Л0“2
Органических соединений............. >Ы0~5
Графита......................... >2-10—6
Растворов NH4OH................. >2-10””7
Металлических бериллия и магния . >5-1 О’”6
Нержавеющей стали............... >3 10~4
Двуокиси урана ... ....... >5-10““6
Диураната аммония ....... >2-10~5
Растворов UO2(NO3)2 . .......... >210~6
Сплавов циркония ......... >Ы0“’5
Метод предусматривает предварительную отгонку борнометилового эфира, 4* ' 51
Наиболее эффективными ускорителями появления окраски с куркумином являются щавелевая и салициловая кислоты; с щавелевой кислотой можно обнаружить 0,002 мкг бора (1 : 10 000 000) [118].
Из физико-химических методов определения малых количеств бора наиболее часто используется спектральный метод анализа. В литературе имеется большое число работ [119—138], посвященных определению бора в различных материалах спектральным методом, обладающим по сравнению с другими методами анализа рядом преимуществ. Спектральный метод анализа позволяет применять небольшую навеску, одновременно определять несколько примесей без их разделения, обладает достаточно высокой чувствительностью (1-10-4 — 1-10-3 %) и т. д. [139]. Чувствительность спектрального метода можно повысить различными приемами: увеличением количества сжигаемой пробы, химическим или физическим обогащением пробы, тщательным подбором условий возбуждения и регистрации спектров, использованием искусственной атмосферы для снятия фона в спектре и др.
Одни авторы [119, 123, 127—129, 133, 135, 139] для повышения чувствительности определения бора спектральным методом предварительно обогащают пробу; другие [121, 122, 130, 131] определение бора ведут в атмосфере инертного газа; третьи [121, 124, 134, 139] увеличивают эффективность возбуждения атомов, применяя добавки веществ, снижающих температуру возбуждения, или же используя полый катод.
Для повышения чувствительности определения бора до 10“4— 1О~5о/о некоторые авторы прибегают к полному отделению искомого элемента маннитом [127, 129] либо другими способами [123, 133]. Авторы работы [120] предлагают метод двойной дуги, который позволяет определять 10-8—Ю“9о/о бора в графите после предварительного озоления 10—100 г его до количества, равного 1 г. Карбид бора в графите они переводят в летучее соединение — трехфтористый бор — путем добавления смеси A1F3 + NaF (1’1). Источники возбуждения — дуга постоянного тока 120 в\ искровой ток 15'а, дуговой— 12 а.
Приводимый далее метод [131] спектрального определения бора в кремнии разработан на образцах кремния высокой чистоты. Результаты спектрального анализа сравнимы с результатами колориметрического метода 52
определения бора с куркумином, проводимого авторами книги и описанного в настоящей главе. Меняя условия возбуждения и регистрации спектров, авторы добились относительного снижения интенсивности фона и ровы-шения чувствительности обнаружения элементов в ре-
зультате увеличения разности Зл+ф — Зф. Все при-
меси, как установлено, выгорают за очень короткое время в конце полного испарения всей навески. Использование этого явления обогащения позволяет существенно увеличить чувствительность обнаружения примесей в чистых веществах путем фотографирования спектра последней стадии горения дуги.
Полосы SiO, возникающие при горении дуги в воздухе, особенно ин-
Рис. 11. Прибор для определения бора в токе азота:
1 — винты для центрирования электродов; 2 — металлическое кольцо; 3 — резиновые плотно пригнанные пробки; 4 — отросток для подачи в баллон азота; 5 — прозрачное кварцевое окно для выхода излучения; 6 — поджигающий электрод; 7 — крючок для отвода электрода; 8 — вакуумный шланг; 9 — отросток для откачки воздуха.
тенсивны в той области спектра, в которой расположены аналитические линии бора. Для устранения молекулярного спектра SiO определение бора проводят в специальном кварцевом баллоне в потоке азота (рис. 11).
Методы фотометрии пламени оказались малопригодными для определения небольших количеств бора, так как некоторые элементы (щелочные, щелочноземельные, медь) влияют на окраску пламени, вызванную присутствием бора, и должны быть удалены из раствора.
53
Физические методы определения малых количеств бора не получили большого распространения, так как они требуют специальной аппаратуры. Подробно о физических методах анализа см. в гл. I.
Объемное определение бора в сталях и сплавах
При определении бора в сталях способ переведения образца в раствор и отделения мешающих компонентов избирается в зависимости от состава стали. Например, рекомендуют растворять сталь в серной кислоте при добавлении перекиси водорода и после кипячения с обратным холодильником отделять сопутствующие элементы электролизом на ртутном катоде [140].
Критическая оценка методов определения бора в стали приводится в соответствующей литературе [101]. Для образцов стали с содержанием бора не менее 0,2% рекомендуется спектрофотометрический метод, с содержанием бора более 0,2—5%—алкалиметрическое титрование с потенциометрической индикацией. Подробное описание хода анализа при растворении некоторых образцов стали и сплавов приведено в специальной литературе [141].
Анализ углеродистых сталей
Способ потенциометрического титрования изложен в гл. I.
При визуальном титровании борной кислоты в анализе углеродистых сталей [141] избыток минеральной кислоты, а также мешающее влияние алюминия, ванадия и вольфрама устраняют добавлением смеси солей иодида и йодата калия; выделившийся при этом иод оттитровы-вают раствором тиосульфата. После нейтрализации испытуемого раствора производят титрование борной кислоты в присутствии глицерина или маннита едким натром.
Необходимые реактивы
1. Кислота соляная, 0,1 н., 2%-ный и 1:1 растворы.
2. Едкий натр, 0,1 н. и 20%-ный растворы.
3. Глицерин или маннит.
4. Перекись водорода, 3%-ный раствор.
5. Углекислый кальций.
6. Фенолфталеин, 0,1%-ный спиртовой раствор.
54
7. n-Нитрофенол,
8. Йодноватокислый калий, 2%-ный раствор.
9. Йодистый калий, 5%-ный раствор.
10. Крахмал, 1%-ный раствор.
11. Тиосульфат натрия, 0,1 н. раствор.
12. Хлористый барий.
13. Углекислый калий.
14. Кислота азотная, уд. в. 1,4.
15. Метиловый оранжевый, 0,1%-ный водный раствор.
16. Метиловый красный, 0,1%-ный спиртовой раствор.
Ход анализа. Навеску стали в количестве 0,3—1 г (в зависимости от содержания бора) растворяют в 15— 40 мл соляной кислоты (1:1). Растворение ведут в колбе с воздушным холодильником длиной 50—60 см. После растворения металла приливают по каплям 3%-ный раствор перекиси водорода. Раствор кипятят, охлаждают, прибавляют свежепрокипяченной дистиллированной воды и нейтрализуют избыток кислоты 20%-ным раствором едкого натра до слабокислой реакции. Затем при перемешивании вносят в раствор малыми порциями тонко-измельченный углекислый кальций до полной нейтрализации кислоты (обычно 10—15 г) и избыток 0,3 г.
Раствор с осадком (хрома, никеля, железа, титана, циркония) кипятят в течение 10 мин, затем охлаждают и фильтруют через воронку Бюхнера. Осадок промывают малыми порциями дистиллированной воды.
Фильтрат переносят в колбу емкостью 500 мл, добавляют одну каплю раствора фенолфталеина или /г-нитро-фенола и нейтрализуют соляной кислотой. Для удаления СО2 раствор подкисляют соляной кислотой и кипятят с воздушным холодильником в течение 30 мин. После охлаждения раствор точно нейтрализуют по метиловому красному, добавляют 1 мл фенолфталеина, 10 мл глицерина (или 1 г маннита) и титруют 0.5 н. раствором едкого натра до появления розовой окраски, не исчезающей от последующего прибавления 10 мл глицерина. Параллельно по всем стадиям анализа проводят «холостой» опыт.
Содержание бора вычисляют по формуле
q (%) -°»001081 m-Vo)-ioo в п
65
где 0,001081—титр 0,1 н. раствора едкого натра, выраженный в граммах бора, г)мл; К — коэффициент нормальности 0,1 н. раствора едкого натра; — объем 0,1 н. раствора едкого натра, израсходованного на титрование, мл; Vo — объем 0,1 н. раствора едкого натра, израсходованного на титрование «холостого» опыта, мл; п — навеска, г.
Анализ сталей, содержащих алюминий, вольфрам и ванадий
Навеску стали в количестве 0,5 г растворяют в 25 мл соляной кислоты (1:1) с добавлением 10 мл 3%-ного раствора перекиси водорода. Растворение и нагревание проводят с обратным холодильником до полного разложения перекиси водорода.
После охлаждения выпавшую вольфрамовую кислоту отфильтровывают и осадок промывают 2%-ным раствором соляной кислоты. Кислый раствор переливают в мерную колбу емкостью 250 мл, содержащую 40 мл 20 %-кого раствора едкого натра, нагревают с целью коагуляции осадка и после охлаждения доводят дистиллированной водой до метки.
Раствор фильтруют через сухой складчатый фильтр и, отобрав 150—200 мл, нейтрализуют соляной кислотой (1:1) по лакмусу, затем прибавляют раствор 0,1 н. соляной кислоты до кислой реакции по лакмусу и после нейтрализации приливают 0,5 мл избытка. После кипячения в течение 30 мин с воздушным холодильником в охлажденный раствор приливают 5 мл смеси 2%-ного раствора йодата калия и 5%-ного раствора иодида калия. Выделившийся иод через несколько минут оттитровывают 0,1 н. раствором тиосульфата натрия. Определение бора заканчивают титрованием едким натром в присутствии маннита.
Анализ жаропрочных сплавов
Навеску сплава в количестве 0,25—1 г (в зависимости от содержания бора) помещают в колбу с обратным холодильником и растворяют в 20 мл соляной .кислоты (1:1) при нагревании. После растворения стружки прибавляют 2—3 мл азотной кислоты и продолжают кипячение до удаления окислов азота. Если стружка плохо 56
растворяется в соляной кислоте, можно добавлять азотную кислоту.
После растворения стружки раствор охлаждают (не удаляя обратного холодильника), переносят в мерную колбу емкостью 500 мл, добавляют 7—10 г хлорида бария и тщательно перемешивают до растворения соли. Полученный раствор нейтрализуют содой, добавляя ее небольшими порциями до полной нейтрализации кислоты и выпадения осадка. Колбу с осадком и раствором нагревают до кипения, охлаждают и доводят объем жидкости до метки водой. Затем раствор тщательно перемешивают и фильтруют в мерную колбу емкостью 250 мл. Щелочной раствор в объеме 250 мл переливают в коническую колбу емкостью 500 мл, подкисляют соляной кислотой по метиловому оранжевому и кипятят с воздушным холодильником в течение 15—20 мин для удаления углекислого газа. Кислый раствор охлаждают, нейтрализуют соляную кислоту 10%-ным раствором едкого натра по метиловому оранжевому. В нейтральный раствор добавляют 1 мл раствора фенолфталеина, 0,5—0,7 г маннита, растворенного в 10 мл воды, и титруют 0,1 н. раствором едкого натра до появления розовой окраски, не исчезающей при последующем прибавлении маннита.
Анализ алюминиевых сплавов
Бор в небольших количествах добавляют к алюминиевым сплавам в экспериментальных целях. В процессах плавки он вступает в соединения с алюминием и другими компонентами сплава, образуя бориды (MgB2, А1В2, А1В12 и др.), но не исключена возможность, что бор остается в элементарном виде.
При растворении сплава в кислотах легко образуются летучие водородистые соединения бора, в виде которых он может быть потерян с парами во время кипячения раствора. Во избежание этого необходимо применять обратный холодильник для улавливания паров. При растворении сплава в щелочах опасаться потерь бора не следует.
Объемный метод рекомендуется при содержании бора более 0,2%. В этом случае обязательно очень тщательное отделение основы сплава — алюминия.
Ход анализа. Навеску алюминиевого сплава в количестве 1 г (когда содержание бора более 5%, навеску
берут 0,5 г) растворяют в 35—40 мл смеси кислот в конической колбе емкостью 500 мл, снабженной пробкой с воздушным холодильником. Растворение ведут сначала на холоду, а после прекращения бурной реакции — при нагревании.
После окончания растворения колбу немного охлаждают, промывают холодильник три-четыре раза водой и удаляют его. Полученный раствор кипятят 1—2 мин и фильтруют через простой бумажный фильтр в мерную колбу емкостью 500 мл. Если на фильтре окажется нерастворимый остаток, то фильтр вместе с последним переносят в железный тигель, заливают 5 мл 25%-ного раствора едкого натра и нагревают до полного растворения осадка, что обычно происходит очень быстро.
Полученный щелочной раствор разбавляют водой и отфильтровывают через маленький бумажный или ватный фильтр, собирая раствор в ту же мерную колбу, и тщательно промывают, фильтр пять-шесть раз небольшими порциями воды.
К объединенным фильтратам приливают 70 мл 20%-ного раствора хлористого бария, 10—15 капель метилового красного и осторожно нейтрализуют сухой безводной содой до изменения окраски индикатора, после чего прибавляют небольшой избыток соды. Затем добавляют дистиллированную воду до метки, перемешивают и оставляют отстаиваться на 5—6 ч, после чего фильтруют через плотный фильтр 250 мл раствора в сухую мерную колбу.
Отобранную аликвотную часть раствора переносят в коническую колбу емкостью 500 мл, подкисляют соляной кислотой и кипятят 20 мин с обратным холодильником для удаления углекислого газа. Определение заканчивают титрованием с маннитом (см. выше).
3. Объемное определение бора в фосфатных и комплексных удобрениях
Объемный метод применяется при содержании бора более 0,1% [142].
Необходимые реактивы
1. Метанол чистый.
2. Серная кислота, не содержащая бора.
3. Суспензия гидроокиси кальция.
4. Едкий натр, 0,01; 0,02 и 0,5 н. растворы.
5. Фенолфталеин, 0,1%-ный спиртовой раствор.
6. Бромкрезоловый пурпуровый, 0,1%-ный метанольный раствор.
Ход анализа. Навеску мелко растертой в агатовой ступке пробы фосфорного удобрения в количестве 1—2 г помещают в реакционную колбу и прибавляют 4 мл воды
Рис. 12. Прибор для дистилляции борнометилового эфира:
1 — испаритель метанола; 2 — реакционная колба из кварца; 3 — обратный холодильник; 4 — змеевиковый холодильник,
и 45 мл метанола. Для анализа минеральных удобрений отвешенную пробу в количестве 1—2 г смешивают в платиновой чашке с таким же количеством гидроокиси кальция и нагревают в муфельной печи при температуре 600° в течение 30 мин. Охлажденный остаток после прокаливания смывают 4 мл воды и 45 мл этанола в реакционную колбу.
Для отгонки борнометилового эфира применяют установку, показанную на рис. 12. Закрывают кран соединительной трубки, которая ведет к испарителю метанола /, пропускают холодную воду в обратный холодильник 3 и после установки термометра и воронки осторожно до-
59
бавляют через последнюю в реакционную колбу по каплям 4 мл серной кислоты (уд. в. 1,84). Чтобы избежать перегрева в месте капания серной кислоты, колбу одновременно слегка встряхивают. Если температура поднимается выше 50°, то добавление серной кислоты прекращают и прибавляют ее после того, как раствор охладится. Затем подставляют под змеевиковый холодильник 4 мерную колбу емкостью 50 мл, в которой находится 10 мл 0,5 н. раствора едкого натра для омыления борнометилового эфира, куда добавляют две-три капли фенолфталеина, после чего пропускают через установку пары метанола; одновременно из обратного холодильника спускают холодную воду. Нагрев бани испарителя метанола регулируют так, чтобы смесь борнометиловый эфир — метанол поступала из холодильника быстрыми каплями. Температура при этом не должна подниматься выше 75°. Во время дистилляции встряхивают колбу. После 10-минутной дистилляции охлажденный до комнатной температуры раствор доводят дистиллированной водой до метки, что необходимо в том случае, когда бор должен определяться в аликвотных частях дистиллята.
Для титрования применяют весь дистиллят, который переливают в две колбы Эрленмейера емкостью 100 мл каждая, и испаряют метанол на водяной бане при пропускании очищенного воздуха. После добавления 5— 10 мл воды титруют вначале щелочь до нейтральной точки по метиловому красному 0,5 н. раствором соляной кислоты, затем подкисляют 0,5 н. соляной кислотой (приблизительно 0,3 мл), кипятят 30 мин для удаления углекислого газа и очень точно нейтрализуют еще горячий раствор 0,02 или 0,01 н. раствором едкого натра.
Колбу с титруемым раствором закрывают пробкой, снабженной трубкой с натронной известью, раствор охлаждают под струей воды и добавляют к нему 3 мл холодного насыщенного раствора маннита. После трехминутного стояния добавляют четыре капли индикатора бромкрезолового пурпурового и титруют 0,02 или 0,01 н. раствором едкого натра до перехода окраски в краснофиолетовый цвет. 1 мл 0,01 н. раствора едкого натра соответствует 0,1081 мг бора.
Для анализа проб, содержащих большие количества бора (концентраты и минералы бора), следует брать меньшие навески или более концентрированную щелочь
6Ю
(1 н.) и из 100 мл дистиллята отбирать для титрования аликвотную часть. Минералы бора лучше сплавлять с содой.
4. Определение бора в сталях и сплавах колориметрическим методом с хинализарином
Колориметрические методы определения бора с применением хинализарина [141], растворенного в концентрированной серной кислоте (83% по объему), широко применяются в практике массовых анализов и рекомендуются при содержании бора 0,0005% и более.
Метод основан на образовании в сернокислой среде окрашенного внутрикомплексного соединения борной кислоты с хинализарином.
В зависимости от содержания бора цвет раствора изменяется от малинового до голубого. Определение производят визуально.
Необходимые реактивы
1. Кислота серная, уд. в. 1,84—1,825.
2. Углекислый натрий.
3. Гидразин сернокислый, 5%-ный раствор.
4. Хинализарин, 0,01%-ный раствор.
5. Борная кислота, стандартный раствор.
Приготовление шкалы для колориметрирования. Навеску 13,2 г стали, не содержащей бора, но одинакового состава с испытуемой сталью, растворяют в 100 мл серной кислоты (1 :4). Нерастворимый остаток отфильтровывают и промывают водой. Раствор переливают в мерную колбу емкостью 250 мл и дополняют до метки водой. (Осторожно! Серную кислоту приливают к воде, охлаждая колбу в струе холодной воды.)
Отбирают в пробирки по 15 мл полученного раствора, добавляют пипеткой в каждую пробирку 0,03; 0,05; 0,06; 0,07; 0,1; 0,2; 0,5; 1 и 2 мл раствора борной кислоты с титром 0,001081 г бора в 1 мл. Каждую пробирку доливают водой до 20 мл, перемешивают и получают шкалу растворов, содержащих от 0,0005 до 0,02% бора. Для количественного колориметрического определения бора отбирают пробы по 2 мл в цилиндры с притертой пробкой. К каждой пробе добавляют две капли насыщенного раствора сульфита натрия или гидразинсульфата и 20 мл серной кислоты (уд. в. 1,84). Непрерывно охлаждая раствор
61
струей холодной воды, приливают серную кислоту. К охлажденному раствору добавляют 1 мл раствора хинализарина и перемешивают содержимое пробирки, предварительно закрыв ее притертой пробкой. Через 15 мин сравнивают окрашенные стандартные растворы с испытуемым.
При выполнении серийных анализов рекомендуется приливать хинализарин одновременно в стандартные и испытуемые растворы.
Ход анализа стали. Навеску стали в количестве 1 г помещают в коническую колбу емкостью 100— 150 мл с воздушным холодильником длиной 70—75 см и приливают 8 мл серной кислоты (1 :4). Колбу опускают в холодную баню. После растворения металла раствор охлаждают и фильтруют в пробирку емкостью 30 мл через маленький фильтр. Осадок промывают два раза 5%-ным раствором серной кислоты (по 1 мл в каждый прием) и три раза горячей водой порциями по 2 мл. Весь объем после промывания не должен превышать 14— 15 мл. Осадок вместе с фильтром высушивают на воздухе.
В сухой фильтр насыпают 0,1 г безводного углекислого натрия, тщательно смешивают с остатком на фильтре, после чего помещают фильтр в платиновый тигель. Бумагу фильтра осторожно озоляют, а затем, добавив еще 0,3 г углекислого натрия, оплавляют при возможно низкой температуре до получения однородной массы.
После охлаждения в тигель вливают по каплям 1—2 мл серной кислоты (1:3) и полученный раствор приливают к основному фильтрату. Тигель промывают водой. После полного выщелачивания общий объем в пробирке должен составлять 20 мл. Тщательно перемешав содержимое пробирки, отбирают 2 мл отстоявшегося испытуемого раствора в сухой колориметрический цилиндр, добавляют две капли гидразинсульфата (для восстановления хрома, марганца, железа), 20 мл серной кислоты (уд. в. 1,84) при охлаждении и снова перемешивают.
В охлажденный раствор приливают 1 мл раствора хинализарина. Количество бора в испытуемой пробе вычисляют путем сравнения полученной окраски с окраской в цилиндрах, содержащих стандартные растворы бора,
62
5. Колориметрическое определение бора в фосфатных и комплексных удобрениях, в растениях и почвах с применением антримида
Определение бора с антримидом [142] проводят при содержании бора не менее 0,1 %. Борная кислота с антримидом образует окрашенное соединение голубого цвета.
Необходимые реактивы
1. Метанол чистый.
2. Серная кислота, не содержащая бора.
3. Едкий натр, 0,01; 0,02 и 0,5 н. растворы.
4. Суспензия гидроокиси кальция, 0,1 н. раствор.
5. Фенолфталеин, 0,1%-ный метанольный раствор.
6. Бромкрезоловый пурпуровый, 0,1%-ный метанольный раствор.
7. Антримид, стандартный раствор.
Определение бора в фосфатных и комплексных удобрениях
Пробу обрабатывают так, как описано выше, проводят дистилляцию борнометилового эфира. Для колориметрического определения используют аликвотную часть дистиллята. При навеске пробы 1 г, содержание бора в которой больше 0,01%» дистиллят (50 мл) переносят в мерную колбу емкостью 100 мл и доливают до метки метанолом. Для анализа отбирают соответствующее количество.
Для омыления борнометилового эфира используют 10 мл 0,1 н. суспензии гидроокиси кальция. В отличие от объемного метода раствор индикатора не применяется. Конец дистилляции определяют по индикаторной бумаге. Если среда все еще щелочная, то прибавляют немного твердой гидроокиси кальция (это бывает редко, например в случае неполного удаления углекислого газа).
Для колориметрического определения отбирают соответствующее количество дистиллята (2, 3, 5 или 10 мл раствора) и вносят его в реакционную кварцевую посуду емкостью 15—20 мл. Раствор выпаривают на водяной бане досуха. После этого почвенные соли растворяют в 2 мл серной кислоты, приливая последнюю медленно по стенкам при вращении реакционного стакана, прибавляют 2 мл раствора антримида и перемешивают содержимое стакана (лучше всего пропусканием врздуха
63
через капилляр е тонким острием). Для развития окраски вносят стакан с раствором в сушильный шкаф на 3 ч, затем содержимое стакана после охлаждения выливают в мерную колбу емкостью 10 мл, смывают концентрированной серной кислотой и доводят этой кислотой до метки. Стандартным раствором служит раствор, содержа-
Содержаниев,п1
Рис. 13. Интенсивность окраски раствора комплекса борная кислота — антримид (10 1лл раствора антри-мида, кювета объемом 1 си3) в зависимости от содержания бора
щий 5 мл 0,01%-ного раствора антримида в серной кислоте и 2 мл концентрированной серной кислоты, который обрабатывается одинаково с анализируемым раствором. Измерение проводят на фотоколориметре типа ФМ в кювете объемом 1 см3.
Содержание бора в пробе определяют по расчетной кривой, построенной для стандартных растворов в координатах интенсивность окраски — концентрация (рис, 13),
Оределение бора в растениях
Для получения средней пробы берут навеску в количестве I—2 г и затем определяют содержание бора в аликвотной части метанол-борнометилового дистиллята.
Во избежание потерь бора при озолении 1—2 г сухой или свежеизмельченной пробы для выщелачивания оставляют на ночь в платиновой чашке с 10—20 мл 0,1 н. суспензии гидроокиси кальция. При меньшей навеске количество гидроокиси кальция соответственно уменьшают. После выпаривания на водяной бане пробу озоляют на слабом огне горелки и затем прокаливают в муфельной печи при температуре 600° в течение 10 мин. Дальнейший анализ проводят так же, как описано выше для анализа борсодержащих комплексных удобрений.
64
Определение бора в почвах
Навеску тонкоизмельченной в агатовой ступке воздушно-сухой почвы, просеянной через сито с отверстием 2 мм, в количестве 0,5 г отвешивают в платиновый тигель, смешивают с 1 г сухой и не содержащей бора содой и покрывают еще 0,5 г соды. Тигель, внесенный в холодный муфель, нагревают постепенно до 875° и выдерживают при этой температуре 30 мин. После охлаждения на светлый расплав наливают 3 мл воды. При нагревании тигля на слабом пламени кусочки плава отстают от дна тигля.
С помощью кварцевой палочки переносят плав в реакционную колбу, смывая тигель дистиллированной водой. Затем реакционную колбу нагревают для растворения оставшихся кусочков плава на слабом пламени. В зависимости от состава почвы получают при этом более или менее мутный раствор. Маленькие твердые частицы растворяются позднее при подкислении серной кислотой. Охлаждают раствор в колбе до комнатной температуры и присоединяют колбу к аппаратуре (см. рис. 12), не подключая испаритель метанола. После того как подставлена холодная баня под колбу, наполняют обратный холодильник 3 водой. Для подкисления раствора и удаления углекислого газа добавляют (при закрытом кране в испаритель метанола) из капельной воронки осторожно 20 мл серной кислоты при встряхивании колбы. Температура при этом не должна подниматься выше 40°. Таким же образом вносят в колбу 45 мл метанола. Для удаления оставшейся окиси углерода проводят через аппаратуру, начиная от трубки испарителя метанола, слабый ток воздуха в течение 3 мин.
Для последующей дистилляции спускают воду из обратного холодильника, удаляют охлаждающую баню из-под реакционной колбы и открывают испаритель метанола. Дистиллят собирают в колбу емкостью 100 мл, в которую вносят 0,1 н. раствор суспензии гидроокиси кальция. Затем полностью дистиллируют. Во время дистилляции нагревают реакционную колбу пламенем горелки Шпара, чтобы отделенная студенистообразная кремневая кислота оставалась постоянно в движении и не могла осесть и чтобы не повышался объем жидкости в реакционной колбе. Незадолго до того как дистиллят достигнет метки колбы, ее удаляют, и после остывания до комнатной тем
5 Анализ бора
65
пературы доводят объем раствора до метки метанолом. Далее поступают так, как описано для анализа борсодержащих удобрений.
6. Колориметрическое определение бора в металлическом алюминии
с применением ацетилхинализарина
Точность определения бора с ацетилхинализарином [143] приблизительно в два раза выше, чем с применением хинализарина.
Для образцов с содержанием бора 1 • 10-4 % и выше ошибка определения составляет 10%.
Необходимые реактивы
1. Серная кислота, уд. в. 1,84.
2. Хинализарин.
3. Уксусная кислота, ледяная.
4. Метиловый спирт.
5. Тетраборат натрия (бура).
Ход анализа. В кварцевую колбу емкостью 25— 50 мл вносят 0,25 г порошка или стружки анализируемого вещества, прибавляют 0,5 мл воды и 5 мл серной кислоты (уд. в. 1,84). Через 1—3 мин в зависимости от степени измельчения пробы начинается бурная реакция. После ее окончания содержимое колбы нагревают до появления белых паров. После охлаждения жидкость вместе с осадком переносят в кварцевую центрифужную пробирку с притертой пробкой емкостью 12 мл с меткой, отвечающей объему 10 мл (или в такую же пробирку из стекла, не содержащего бора). Колбу споласкивают 2,5 мл серной кислоты и сливают в центрифужную пробирку, в которую вводят 2 мл раствора ацетилхинализарина. В центрифужную пробирку добавляют серную кислоту до общего объема 10 мл, хорошо перемешивают и центрифугируют до полного отделения взвешенных частичек сульфата алюминия. Верхний прозрачный слой сливают в кювету с толщиной слоя 10 мм и на спектрофотометре измеряют оптическую плотность при 620 ммк, применяя воду в качестве раствора сравнения. Содержание бора находят по калибровочному графику.
Построение калибровочной кривой. При построении калибровочной кривой поступают точно так же, как описывалось ранее, с той лишь разницей, что
66
вместо анализируемого образца алюминия применяют пробу, не содержащую бора. В случае отсутствия такой пробы можно пользоваться любыми образцами металлического алюминия, из которого предварительно отделен бор отгонкой в виде борнометилового эфира. Для этого в колбу после растворения навески в серной кислоте вводят 10 мл воды, раствор охлаждают, прибавляют к нему 5 мл метилового спирта и хорошо перемешивают. Затем упаривают на кипящей водяной бане в течение 10— 15 мин и под конец на газовой горелке до появления белых паров. После охлаждения снова прибавляют 5 мл метилового спирта и вновь упаривают до появления белых паров. К остатку прибавляют определенный объем (0,05; 0,1; 0,2; 0,3; 0,4 и 0,5 мл) стандартного раствора буры, содержащего 10 мкг/мл бора, снова упаривают до появления белого дыма и переносят в центрифужную пробирку. Далее поступают так, как описывалось выше. Полученные значения оптической плотности используют для построения калибровочного графика.
Вместо измерения оптической плотности растворов на спектрофотометре возможно определение бора по шкале стандартов. В этом случае тщательное отделение сульфата алюминия необязательно. При хранении стандартных растворов в кварцевых пробирках с притертыми пробками и в темноте шкала пригодна для работы в течение двух месяцев.
7. Определение бора в борсуперфосфатах с применением кармина [144]
Необходимые реактивы
1. Карминовая кислота, 0,1%-ный раствор в серной кислоте, уд. в. 1,84.
2. Серная кислота, 20%-ный раствор.
3. Стандартный раствор борной кислоты, 25 мкг!мл бора (0,1425 г Н3ВО3 растворяют в 1 л 20%-ной H2SO4).
4. Хлористое железо, 10%-ный раствор.
5. Углекислый кальций.
Ход анализа. 5г пробы помещают в колбу емкостью 500 мл, добавляют 250 мл дистиллированной воды и взбалтывают в течение 30 мин. Затем добавляют 60 мл 10%-ного раствора хлористого железа, 5 г углекислого кальция и вновь взбалтывают в течение 10 мин.
5*
67
Раствор фильтруют в колбу емкостью 500 мл и доливают до метки дистиллированной водой. Из полученного раствора отбирают в колбу емкостью 100 мл пипеткой: а) 20 мл—для пробы с содержанием бора 2%; б) 10 мл— для пробы с содержанием бора 4%; в) 1,5 мл — для пробы с содержанием бора 6%. Доливают до метки 20 %-ной серной кислотой и хорошо перемешивают.
В цилиндр емкостью 50 мл вносят 20 мл 0,01%-ного раствора карминовой кислоты и раствор из 100-жл колбы в количестве: а) 2,5 мл — для пробы, содержащей 2% бора; б) 3 мл — для пробы, содержащей 4% бора; в) 2 мл — для пробы, содержащей 6% бора. Доливают при помощи пипетки 20%-ной серной кислотой до объема 23 мл, перемешивают в течение 1 мин и оставляют стоять на 1 ч. Раствор фотометрируют в кювете с толщиной слоя 2 см. В качестве раствора сравнения применяют раствор, состоящий из 20 мл карминовой кислоты и 3 мл 20%-ной серной кислоты. Содержание бора вычисляютпо предварительно построенной расчетной кривой.
Построение калибровочной кривой. В цилиндры емкостью 50 мл вносят 20 мл 0,01%-ного раствора карминовой кислоты и стандартные растворы бора, содержащие 0; 5; 10; 15; 20; 25 мкг. Приливают в цилиндры пипеткой 20%-ную серную кислоту до объема 25 мл, хорошо перемешивают, оставляют стоять в течение 1 ч и затем колориметрируют.
Точность метода ±10% (отн.).
8. Определение бора в тетрафториде урана с метиленовым голубым
Метод основан на экстракции бора дихлорэтаном в виде тетрафторобората метиленового голубого [113].
Необходимые реактивы
1. Углекислый аммоний, 10%-ный раствор.
2. Углекислый натрий, 2%-ный раствор.
3. Перекись водорода, 30%-ный раствор.
4. Серная кислота, 5 и. раствор.
5. Фтористоводородная кислота, 4%-ный раствор.
6. Метиленовый голубой, 0,002 М раствор.
7. Дихлорэтан.
8. Стандартный раствор борной кислоты, содержащий 10 мкг)мл бора.
68
Ход анализа. Помещают 0,1—0,25 г тетрафторида урана в платиновую чашку, добавляют 10 мл водного раствора, содержащего 10% (NH4)2 СО3 и 20% Na2CO3, и при нагревании на водяной бане (70—80°) при перемешивании вводят постепенно 10 капель 30%-ной перекиси водорода. В случае сильного вспенивания раствора чашку на время снимают с водяной бани. По окончании разложения (примерно 5 мин) содержимое чашки продолжают нагревать на слабокипящей бане в течение 10 мин [для полного разрушения (NH4)2CO3 и ЩО2], следя за тем, чтобы объем оставшегося раствора составлял около 3 мл. После охлаждения раствора к нему осторожно добавляют 3 мл 5 н. серной кислоты и 4%-ный раствор фтористоводородной кислоты (Змл при навеске тетрафторида 0,1 г и 2 мл при навеске 0,25 г). Платиновую чашку с разложенным образцом закрывают другой платиновой чашкой, наполненной холодной водой (для предупреждения быстрого испарения раствора), и ставят на кипящую водяную баню на 15 мин (для образования тетрафторобората).
Охлажденный раствор переносят в полиэтиленовый цилиндр (высота 22 см, внутренний диаметр 1,5 см), доводят объем водной фазы до 15 мл бидистиллятом, прибавляют 1,2 мл 0,002 М раствора метиленового голубого и перемешивают. Далее вводят 5 мл дихлорэтана, закрывают цилиндр пробкой и энергично встряхивают 2 мин. После разделения фаз сухой пипеткой отбирают дихлорэтановый экстракт, находящийся в нижней части цилиндра, переносят в центрифужную пробирку и центрифугируют 5 мин при 5000 об!мин. Полученным после центрифугирования раствором при помощи пипетки заполняют кювету с толщиной слоя 3 мм и измеряют оптическую плотность относительно воды на фотоколориметре ФЭК-Н-57 с красным светофильтром и эффективной длиной волны 656 ммк.
Содержание бора находят по калибровочной кривой, построенной в координатах оптическая плотность — содержание бора (мкг).
Построение калибровочной кривой. К Ю мл раствора карбонатной смеси прибавляют различные количества бора (в пределах 0—4 мкг) в виде раствора борной кислоты, 10 капель 30%-ной перекиси водорода и далее поступают в соответствии с описанным
69
выше методом, за исключением того, что количество добавляемой 4%-ной фтористоводородной кислоты увеличивают до 3,5 мл.
Чувствительность метода 8- 10~5%.
При определении 8*10~5 — 4«<10~3% бора ошибка составляет ±5% (отн.).
9. Определение бора в стали с бриллиантовым зеленым
Для определения бора использована реакция образования комплекса аниона тетраборной кислоты с красителем бриллиантовым зеленым и экстрагирования его бензолом [145]. Окраску ослабляют металлы, образующие устойчивые фторидные комплексы, в частности железо, алюминий, титан, цирконий. Влияние этих элементов можно устранить повышением концентрации фтористого аммония (концентрация фтористого аммония должна быть не более 0,8 г-экв/л).
Необходимые реактивы
1. Серная кислота (1 :4).
2. Перекись водорода, 30%-ный раствор.
3. Фтористый аммоний, 2М раствор.
4. Бриллиантовый зеленый, 0,5%-ный раствор.
5. Уротропин, 40%-ный раствор.
6. Бензол.
7. Стандартный раствор борной кислоты, содержащий 10 мкг)мл бора.
Ход анализа. Навеоку стали в количестве 0,5 г растворяют при слабом нагревании в 12 мл серной кислоты (1 :4). Растворение ведут в кварцевой колбе с обратным холодильником.
После полного разложения навески и охлаждения жидкости добавляют 0,5—2 мл 30 %-ной перекиси водорода (в зависимости от содержания углерода) для окисления карбидов. Жидкость в том же приборе кипятят 30 мин. После охлаждения холодильник промывают 10— 12 мл бидистиллята. Раствор переносят в мерную колбу емкостью 25 мл и доводят до метки водой.
Для определения бора отбирают 5 мл раствора в сосуд из материала, устойчивого к воздействию плавиковой кислоты. Вводят 2 мл 2 М раствора фтористого аммония, который хранят в парафинированной склянке.
70
Спустя 30 мин добавляют одну-две капли 0,5%-ного раствора бриллиантового зеленого, который одновременно служит индикатором для установления pH. Кислоту нейтрализуют 40%-ным раствором уротропина (насыщенный раствор), прибавляя его малыми порциями до изменения окраски из желтой в голубовато-зеленую.
Нейтрализованный раствор переносят в делительную воронку, добавляют 0,5—1 мл ( в зависимости от предполагаемого содержания бора) 0,5%-ного водного раствора бриллиантового зеленого и точно 5 мл бензола. Смесь взбалтывают 1—2 мин и после расслаивания тщательно отделяют водный слой, сливая вместе с ним 0,5—1 мл бензольного экстракта. Оставшийся бензольный слой переносят в сухую пробирку и дают постоять до исчезновения мути. Затем измеряют интенсивность окраски на фотоколориметре ФЭК-Н-57 в кювете с толщиной слоя 0,5 см, пользуясь светофильтром с эффективной длиной волны 610 ммк. Содержание бора рассчитывают по калибровочной кривой.
Построение калибровочной кривой. Для построения калибровочной кривой в качестве фона пользуются раствором стали, близкой по составу к анализируемой, но не содержащей бора. Навеску растворяют, как описано выше. Перед добавлением фтористого аммония вводят определенное количество стандартного раствора с известным содержанием бора. В зависимости от ожидаемого содержания бора в испытуемом образце стали строят калибровочную кривую с интервалами концентраций 0,1—0,5 или 0,5—2,0 мкг бора в 5 мл. Количество 0,5%-ного раствора красителя, вводимого для определения, в первом случае равно 0,5 мл, во втором — 1 мл.
Чувствительность реакции 0,5 мкг бора в 5 мл бензольного экстракта.
Точность метода ±10% (отн.).
Реакция более чувствительна, чем с метиловым фиолетовым.
10. Определение бора в различных видах минерального сырья с кристаллическим фиолетовым
Метод основан на экстракции бензолом фторидного комплекса бора с кристаллическим фиолетовым [146].
71
Результаты определения равноценны результатам, получаемым методом с использованием метилового фиолетового, но применение кристаллического фиолетового значительно сокращает длительность отстаивания (просветления) экстракта.
1 мкг бора равноценен 10 мкг тантала, 17 г ртути или 20 мкг рения.
Необходимые реактивы
;1. Углекислый калий-натрий.
2. Серная кислота, 4 н. раствор.
3. Фтористый натрий.
4. Бензол.
5. Кристаллический фиолетовый, 1%-ный водный раствор.
6. Стандартный раствор борной кислоты, содержащий 10 мкг/мл бора.
Ход анализа. Для определения общего бора навеску пробы в количестве не более 0,15—0,25 г (содержание бора в навеске не должно превышать 10 мг) сплавляют в платиновом тигле с 3 г КЫаСОз. При анализе некоторых материалов с низким содержанием крем-некислоты (железные, марганцевые руды) для обеспечения лучшего сплавления следует перемешать навеску с 0,05—0,07 г хорошо измельченной кремнекислоты. Навеску плавня берут на технических весах с погрешностью не более ±0,02 г. Тигель с плавнем помещают в фарфоровый стакан емкостью 300 мл, в который предварительно наливают 50 мл воды и 20 мл 4 н. серной кислоты (из этого количества кислоты расходуется: на нейтрализацию плавня 11,5 мл, на нейтрализацию фтористого натрия— 2,0 мл, на создание избыточной кислотности — 6,5 мл. После растворения плава (можно вести при нагревании) вынимают тигель, ополаскивают его и вносят в стакан 2 г фтористого натрия, взвешенного на технических весах с погрешностью не более ±0,1 г. Закрывают стакан часовым стеклом или фарфоровой чашкой и кипятят в течение 10—15 мин.
Для определения кислоторастворимого бора навеску пробы не более 0,25 г помещают в фарфоровый стакан •емкостью 300 мл, вливают 70 мл воды и прибавляют из бюретки 4 мл 4 н. серной кислоты, закрывают стакан и кипятят 10 мин. Затем вносят 1 г фтористого натрия, снова нагревают до кипения и кипятят 5—7 мин.
72
Дальнейший ход анализа в обоих вариантах одинаков. После охлаждения раствор переводят в мерную колбу емкостью 250 мл, доводят до метки и сразу же (чтобы избежать извлечения бора из стекла раствором) переливают обратно в фарфоровый стакан.
При анализе проб с содержанием не более 0,05% отбирают 25 мл раствора в делительную воронку, в которую налито 25 мл бензола. Сразу же прибавляют 0,5 мл 1%-ного раствора кристаллического фиолетового и экстрагируют в течение 30 сек. После расслоения жидкостей сливают экстракт в сухой стакан емкостью 50— 100 мл и оставляют, закрыв часовым стеклом, на 40— 60 мин до полного просветления раствора. Переливают раствор в кюветы длиной 50 мм и измеряют оптическую плотность на фотоколориметре ФЭК-М с зеленым светофильтром или на фотоколориметре ФЭК-Н-57 со светофильтром № 6, применяя в качестве нулевого раствора чистый бензол. Параллельно ведут «холостой» опыт.
При анализе проб со средним содержанием бора более 0,05% отбирают 2,5 мл основного раствора в пробирку с притертой пробкой емкостью 30—40 мл, в которую предварительно наливают 15 мл бензола. Сразу же прибавляют 0,5 мл 1%-ного раствора кристаллического фиолетового, экстрагируют, осторожно в несколько приемов сливают экстракт в сухой стакан и далее поступают, как описано выше. Измерение проводят в кюветах длиной 30 мм.
Если в аликвотной части, равной 2,5 мл, оптическая плотность раствора выходит за пределы калибровочной кривой, повторяют определение из меньшей аликвотной части. Для этого смешивают в сухом фарфоровом стакане в нужном соотношении объемы раствора пробы и раствора «холостого» опыта и отбирают 2,5 мл.
Величина коэффициента распределения соединения фторидного комплекса бора с метиловым фиолетовым между бензолом и водой зависит от температуры. Содержание соединения в бензоле увеличивается приблизительно на 1% при повышении температуры растворов на Г. Поэтому необходимо стабилизировать температуру экстрагента, выдерживая его перед применением в термостате при температуре около 20°.
Построение калибровочной кривой. При построении калибровочных кривых для определе
73
ния общего бора в фарфоровые стаканы вводят различные объемы стандартного раствора бора, по 50 мл воды, по 20 мл 4 н. серной кислоты, вносят по 3 г KNaCOa, по 2 г NaF, кипятят растворы 5 мин и поступают, как указано выше.
При построении кривых для определения кислоторастворимого бора в фарфоровые стаканы вводят различные объемы стандартного раствора бора, по 70 мл воды, по 4 мл 4 н. серной кислоты, по 1 г NaF, кипятят 5 мин и поступают, как описано выше.
Для определения бора в воде анализируемую воду (не более 100 мл) помещают в фарфоровый стакан. Если взято меньше, доводят объем водой до 100 мл, прибавляют 4 мл 4 н. серной кислоты, 1 г NaF, кипятят 5 мин и поступают, как описано при определении бора в минеральном сырье.
Минимальное, доступное определению данным методом содержание бора составляет 0,002%. Точность метода ±10% (отн.).
11. Определение бора в кремнии и тетраиодиде кремния с применением куркумина
При определении бора в кремнии и тетраиодиде кремния авторы настоящей работы использовали свойство борной кислоты образовывать с куркумином в присутствии щавелевой кислоты красный осадок, который при растворении в спирте дает раствор красно-оранжевого цвета. Интенсивность окраски раствора пропорциональна содержанию бора. Конечное определение бора проводят фотометрически, применяя фильтр № 10 (зеленый).
Чувствительность метода 10~7—1 г/г навески. Ошибка метода ±15—20% (отн.).
Необходимые реактивы
1. Натр едкий, 5%-ный раствор.
2. Метиловый спирт, очищенный.
3. Этиловый спирт, 98%-ный, не содержащий бора.
4. Соляная кислота, 6 н., свежеприготовленная.
5. Щавелевая кислота, перекристаллизованная.
6. «Кварцевая вода» ( бидистиллят, перегнанный в кварцевой аппаратуре).
7. Карбид кремния, обработанный кислотой.
8. Куркуминово-спиртовой раствор.
74
9. Серная кислота, не содержащая бора.
<10. Стандартный раствор бора.
11. Азотнокислая ртуть.
Построение калибровочной кривой. Для построения калибровочной кривой берут стандартные растворы, содержащие бор в количестве 0; 0,25; 0,5; 1; 2,5: 5; 10 мкг и доводят до 1 мл водой, добавляют по 25 мл не содержащего бор метилового спирта, по 1 мл серной кислоты и по нескольку кристаллов карбида кремния и отгоняют в течение 40 мин борнометиловый эфир. Дальнейшую обработку см. в описании хода анализа.
Определение бора в кремнии
Ход анализа. Навеску ОД г тонко измельченного кремния помещают в платиновую чашку, добавляют 6 мл 5%-ното едкого натра и медленно растворяют при нагревании. После растворения навески чашку переносят на горячую водяную баню (химический стакан емкостью 300 мл). Если остается нерастворимый остаток, добавляют четыре раза по 2—3 мл воды и выпаривают. \ У
Сухой остаток растворяют ZA в 5 мл воды и затем добавляют г 4 25 мл метилового спирта, хо- / \
рошо перемешивают плекси- / \
гласовой палочкой и деканти- / \
руют на фильтре ватмана. / \
К осадку (в чашке) приливают '------' L
1 мл едкого натра и 4 мл воды, ’
нагревают на водяной бане ДО Рис. 14. Схема перегонного растворения, затем добавляют аппарата.
25 мл метилового спирта и
фильтруют на том же фильтре. Фильтр промывают 20 мл метилового спирта.
Фильтрат выпаривают на водяной бане досуха, сухой остаток растворяют в 1 мл воды (хорошо вращать чашку), затем приливают 25 мл метилового спирта и 1 мл серной кислоты. Полученный раствор переносят в перегонный аппарат (рис. 14). Отгонку борнометилового эфи
75
ра проводят на электроплитке (при температуре 170°. Бор-нометиловый эфир улавливают в кварцевой чашке емкостью 100 мл, содержащей 2 мл 5%-ного раствора едкого натра и 8 мл метилового спирта. Выводная трубка перегонного аппарата расположена на расстоянии 1 мм от дна чашки, что обеспечивается поддержанием уровня воды в водяной бане (химический стакан емкостью 600 мл), причем чашка плавает на воде. Продолжительность перегонки 40 мин.
Для удаления метилового спирта чашку переносят на водяную баню (стакан емкостью 700 мл), нагретую до 55—60°. Раствор выпаривают досуха и после охлаждения осадок растворяют в 1 мл соляной кислоты (1:1). После растворения осадка приливают 2 мл куркум ин а, тщательно перемешивают в течение 2—3 мин и ставят на водяную баню (стакан емкостью 600 мл). При температуре 55° (температуру выдерживают точно) выпаривают раствор досуха. После этого чашку быстро вынимают, охлаждают и приливают 15 мл 98%-ного спирта; чашку вращают в течение 3 мин для лучшего экстрагирования, затем раствор выливают в кювету объемом 5 мл для фо-тометрирования. Применяется фильтр № 10, зеленый.
Определение бора в тетраиодиде кремния
Ход анализа. Навеску азотнокислой ртути в количестве 3 г помещают в кварцевую чашку емкостью 100 мл, добавляют 5 мл воды и взбалтывают. Через час в чашку вносят 2,5 г тонкоизмельченного тетраиодида кремния. Полученный красный осадок должен отстаиваться не менее 2 ч.
Осадок переносят в кварцевый перегонный аппарат (см. рис. 14), добавляют 25 мл метилового спирта и 1 мл серной кислоты. Образующийся борнометиловый эфир отгоняют. Приемником служит кварцевая чашка емкостью 100 мл, содержащая 2 мл едкого натра и 10 мл метилового спирта. Перегонка длится 40 мин.
После перегонки чашку ставят на водяную баню (химический стакан емкостью 600 мл), нагретую до 60°. К раствору добавляют 1 мл 6 н. соляной кислоты и выпаривают. Затем вводят 2 мл раствора куркумина и вновь выпаривают при температуре 55°, которая строго выдерживается. После испарения остаток охлаждают и к нему
76
приливают 15 мл этилового спирта. Раствор перемешивают путем вращения чашки в течение 3 мин. Фотомет-рируют раствор на фотоколориметре типа ФМ при зеленом светофильтре № 10.
12. Капельный метод определения микроколичеств бора в кремнии
Метод основан на изменении окраски раствора куркумина в кислой среде из желтой в красную в «присутствии бора [147] (если красный цвет вызван присутствием бора, то при добавлении щелочи цвет меняется на зеленый).
Определение проводят на фильтровальной бумаге, пропитанной 1%-ной спиртовой настойкой куркумина. Метод позволяет определять 0,05 мкг бора в 0,05 мл раствора. Высокая чувствительность достигается концентрированием испытуемого раствора на поверхности бумаги за счет нанесения на нее парафиновых колец (парафиновые кольца наносят на фильтровальную бумагу, пропитанную куркумином, при помощи нагретой стеклянной трубки с внутренним диаметром 1 см и наружным 2 см).
Ввиду того что анализируемый раствор (0,5 или 1 мл) трудно полностью перенести на бумагу при помощи этой методики, бор в кремнии определяется только до содержания 2 • 10-6 г/г навески. Для увеличения чувствительности определения бора в кремнии рекомендуется: увеличение диаметра кольца; увеличение объема анализируемого раствора, наносимого на бумагу (от 0,01 мл до 0,5 мл); увеличение навески кремния.
Необходимые реактивы
1. Натр едкий, 5 и 10%-ные растворы.
2. Серная кислота, 1 н. и концентрированный растворы.
3. Метиловый спирт, очищенный.
4. Соляная кислота, 1:1.
5. Щавелевая кислота, насыщенный раствор.
6. Борная кислота, стандартный раствор.
Ход анализа. Навеску кремния в количестве 0,1—4 г в виде тонкоизмельченного порошка растворяют в 5—10 мл 10%-кого раствора едкого натра на водяной бане. Полученный раствор выпаривают досуха. К сухому остатку добавляют 2 мл 1 н. серной кислоты, охлаж
77
дают льдом, осторожно приливают 3 мл концентрированной серной кислоты и 40 мл очищенного метилового спирта. Полученную смесь переносят в перегонную колбу (см. рис. 14) для отгонки борнометилового эфира. При навеске от 0,1 до 0,25 г кремния бор отделяют от кремния метиловым спиртом без перегонки.
Омыление эфира проводят в чашке (приемник) смесью 1 мл 5%-ного едкого натра и 8 мл метилового спирта. После окончания отгонки метилового спирта раствор в чашке выпаривают досуха на водяной бане. Охлажденный осадок растворяют в 5—10 каплях соляной кислоты (1:1) и добавляют несколько капель насыщенного раствора щавелевой кислоты. Общий объем раствора не должен превышать 1 мл.
Полученный раствор (0,01—0,05 мл) наносит непосредственно из микробюревки, конец которой оттянут в тонкий капилляр, на фильтровальную бумагу во внутреннюю часть парафинового кольца и высушивают в эксикаторе над хлористым кальцием. Окраску сравнивают с одновременно приготовленной шкалой стандартных растворов.
Приготовление шкалы стандартов. В маленькую кварцевую чашку помещают 1 мл раствора борной кислоты определенной концентрации (от 1 до 10 мкг), добавляют 1 мл 5%-ного раствора едкого натра и 5 мл метилового спирта. Содержимое чашки выпаривают досуха на водяной бане, сухой остаток растворяют в соляной кислоте.
13. Колориметрическое определение бора с //-резорцином [82]
В уксуснокислых растворах окраска реактива в присутствии борной кислоты меняется от желтой к розовой.
Необходимые реактивы
1. Я-резорцин, 0,04%-ный раствор.
2. Уксусная кислота, 1 н. раствор.
3. Стандартный раствор борной кислоты, 10 мкг!мл.
Ход анализа. Нейтральный раствор, содержащий 1—60 мкг бора, помещают в мерную колбу емкостью 50 мл, прибавляют 4 мл раствора реактива и 5 мл 1 н. раствора уксусной кислоты. Объем раствора доводят до 'метки дистиллированной водой. Через 4—6 ч прово
78
дят 'колориметрирование раствора на фотоколориметре ФМ-1 в кювете объемом 50 мл при длине волны 530 ммк. Точность метода ± 10% (отн.).
14. Определение бора спектральным методом [131]
Определение бора проводят при помощи спектрографа ИСП-22 с одним конденсором освещения щели. Ширина щели составляет 15 мк. Электроды угольные: анод с кратером груби,ной 3 мм, диаметром 4 мм; катод за-
Рис. 15. Градуировочный график для определения бора в кремнии.
острен. Источник возбуждения — дуга постоянного тока, напряжение 220 в, сила тока 5 а.
При анализе используются фотопластинки, тип II. Время экспозиции 2,5 мин.
Ход анализа. Электроды предварительно обжигаются в дуге постоянного тока на воздухе в течение 1 мин. Кратер анода заполняется порошком металлического кремния, и дуга зажигается в токе азота. Спектры регистрируются на фотопластинках после 5-секундного обжига электродов с пробой. Градуировочный график для аналитической пары В 2497,73 A/Si 2563,67 А представлен на рис. 15. Наименьшая обнаруживаемая концентрация бора равна (1,5—2)-10~4%. Вероятная ошибка составляет ±15% (отн.).
Эталоны, содержащие бор, были изготовлены разбавлением сплава Si — В спектрально чистым кремнием.
79
Точки, полученные для этих эталонов и для опытных партий кремния, проанализированных химическим методом, хорошо укладываются на одном градуировочном графике.
Рис. 16. Градуировочные графики для определения бора: о о
t В2497.7А „ B2496.8A
/ — ; 2 •
. ° . ° Si2506,9A Si2506,9A
При больших (концентрациях бора (0,5—50%) в крем* нии бор определяется следующим (способом. Исследуемый порошок разбавляется графитовым порошком и сжигается в дуге постоянного тока. В этом случае дуга током азота не обдувается, так как из-за малого содержания кремния и бора в анализируемой навеске мешающие полосы ВО и SiO исчезают.
80
Из графиков, приведенных на рис. 16, определяется 100тв
а =------у где и msi — весовые части бора и крем-
mSi
ния 'соответственно.
Содержание бора вычисляется по формуле
100а
100 +а
15. Приготовление реактивов
Приготовление реактивов едкого натра, тиосульфата натрия, фенолфталеина /и метилового оранжевого описывается в работе [88]. Способ подготовки глицеринапри-веден в гл. I.
Метиловый спирт, не содержащий бора. К 400 мл метилового спирта добавляют 4 мл 5%-ного едкого натра, несколько кристаллов SiC и перегоняют.
Этиловый спирт, абсолютный. 96%-ный спирт кипятят с обратным холодильником в течение 3 ч с металлическим кальцием и затем отгоняют. Расход металлического кальция 8—40 г на 100 мл спирта.
Серная кислота, не содержащая бора. К 2 мл серной кислоты приливают 20 мл (метилового спирта и упаривают до появления белых паров.
Хинализарин, 0,01%-ный раствор. 0,01 г хинализарина растворяют в 100 мл концентрированной серной кислоты (уд. в. 1,84). Раствор хранят в склянке с притертой пробкой.
Стандартный раствор борной кислоты. Борную кислоту сплавляют в платиновой чашке, затем касаются дном чашки поверхности холод,ной воды. Плав при этом растрескивается, и его переносят в бюкс.
Отвешивают 0,8705 г плава и растворяют в мерной колбе емкостью 250 мл (в свежепрокиляченной и охлажденной воде. После растворения плава колбу дополняют водой до метки. 1 мл полученного -раствора соответствует 0,00108 г бора.
Из колбы отбирают пипеткой 25 мл раствора и разбавляют водой до (метки в мерной колбе емкостью 250 мл. 1 мл полученного раствора соответствует 0,000108 г бора.
Антримид, стандартный раствор. Растворяют 100 мг диантрихинонил-1-амина в 25 мл серной кислоты (уд. в.
6 Анализ бора
81
1,84) . Для приготовления рабочего раствора разбавляют стандартный раствор серной кислотой в соотношении 1 :20.
Ацетилхинализарин. 50 мг хинализарина растворяют в 500 мл 1серной кислоты и прибавляют 100 мл ледяной уксусной кислоты.
Литература
1. Петрашень В. И. Качественный химический анализ. М.— Л., Госхимиздат, 1948.
2. Гиллебранд В. Ф. и др. Практическое руководство по неорганическому анализу. М., Госхимиздат, 4957.
3. McMullen М. J. Analyst, 78, 442 (1953).
4. Д а н и л о в а В. В. «Тр. ин-та геол, рудных месторожд., пет-рогр., минералог, и геохим. АН СССР», 64, 98 (1961).
5. О ж и г о в Е. П. и др. «Ж. аналит. химии», 16, 315 (1961).
6, Г о р в и ц А. М. «Бюл. Всес. ин-та минерал, сырья», 2, 21 (1958).
7. de Leo V. Rev. Metall., 58, 605 (1961).
8. Langmyhr F. J., S k а а г О. В. Analyt. chim. acta, 25, 262 (1961).
9. Марченко П. В. «Заводск. лаборатория», 27, 801 (1961).
10. Pasztor L. C., Bode D. J. Analyt. Chem., 32, 1530 (I960).
11. Ийнума X., Йо симор и Т. «Бунсэки кагаку», Japan Analyst, 10, 826 (1960).
12. О n i s h i J и г о s h i et al. Bull. Chem. Soc. Japan, 33, 830 (I960).
13. Takeuchi T., Yoshimori T. «Бунсэки кагаку», Japan Analyst, 9, 780 (1960).
14. Г о p д и e в с к и й А. В., Устюгов Г. П. «Химия и химич^ технол.», 4, 366 (1961).
15. Починок X. М. «Наук, пращ Укр. наук-досл. in-ту физюл. рослин», 21, 85 (1960).
16. Pasztor L. С., Bode J. D. Analyt. chim. acta, 24, 467 (1961).
17. Akira Murat a, Fumio Yamauchi. J. Chem. Soc. Japan, Pure Chem. Sec., 79, 1454 (1958).
18. Eberle A. R., Zerner M. W. Analyt. Chem., 32, 146 (1960).
19. Гуркина T. В., Д p об а ченко А. В. Сб. «Методы люминесцентного анализа». Минск, Изд-во АН БССР, 1960.
20. Голубцова Р. Б. «Ж. аналит. химии», 15, 481 (1960).
21. Ожигов Е. П. и др. «Ж. аналит. химии», 16, 315 (1961).
22. Pasztor L. С. et al. Analyt. Chem., 32, 277 (1960).
23, Grob R. L., Yoe J. H. Analyt. chim. acta, 14, 253 (1956).
24. Spicer G. S., Strickland J. D. H. Analyt. Chem., 18, 23Г (1958).
25. Borchert O. Taianta, London, 2, 387 (1959).
26. William L. K. Analyt. Chem., 33, 738 (1961).
27. Б а б к и н M. П., С e ч а н P. Д. «Изв. высш. учеб, заведений.
. Химия и хим. технол.», 5, 847 (1962).
28. Си б адзуки То си о. «Бунсэки кагаку», Japan Analyst, 12,.
385 (1963); цит. по «Реф. ж. хим.», 22Г26 (1963).
82
I
29. Щербов Д. П., Коржова Р. Н. «Тр. Казахск. н.-и. ин-та минерал, сырья», вып. 2, 217 (1960).
30. Ере-мин Ю. Г., Романов П Н. «Заводск. лаборатория», 29г 420 (1963).
31. Ska аг О. В. Analyt. chini. acta, 28, 200 (1963).
32. R о s е 11 i R. Chim. analyt;, 44, 208 (1962).
33. Hiiro К a z u o. Bull. Gevt. Industr. Res. Inst., Osaka, 13, 1921
. (1962); цит. по «Реф. ж. хим.», 13Г109 (1963).
34. Leone R. et al. Metallurgia ital., 54, 333 (1962).
35. Hirro К a z u o. J. Chem. Soc. Japan, Pure Chem. Sec., 83, 715 (1962); цит. по «Реф. ж. хим.», 6Г99 (1963).
36. Наган Мисао. J. Sci. Soil. Manufct. Japan, 33, 47 (1962); цит. по «Реф. ж. хим.», 9Г119 (1963).
37, Hiiro К a z и о. Bull. Govt. Industr. Res. Inst., Osaka, 13, 34 (1962); цит. по «Реф. ж. хим.», 10Г121 (1963).
38. LiidemannK. F., ZimmermanR. Neue Hiitte, 8, 21 (1963).
39. Hiiro Kazuo. Bull. Chem. Soc. Japan, 35, 1097 (1962); цит.
по «Реф. ж. хим.», 10Г121 (1963).
40. Hayes M. R., Metcalfe J. Product. Group. U. K. Atomic Energy, Author, Rpt. 391 (S), (9) pp. ill (1962).
41. Kocher J. Bull. Soc. chim. France, 6, 1247 (1962).
42. S r i v a s t a v a R. et al. Analyt. Chem., 34, 209 (1962).
43. Mannier D. et al. Helv. chim. acta, 46, 1047 (1963).
44. Kazuo H. Japan Analyst, 11, 223 (1962).
45. Kazuo H. Japan Analyst, 11, 337 (1962).
46. Lechner L., Ferenczy Z. Nehezvegyipari Kutato Intezet Kozlemenyei, 2, 253 (1963).
47. L e c h n e r L. et. al. Nehdzvegyipari Kutato Intezet Kozlemeny-ci, 2, 259 (1963).
48. CsapoJ. et al. Z. analyt. Chem., 151, 273 (1956).
49. Lang K. Z. analyt. Chem., 163, 247 (1958).
50. Кореям ан И. M. «Ж. аналит. химии», 2, 153 (1947)).
51. Elwell N. Т., W о о d D. F. Analyst, 88, 475 (1963).
52. В о v а 1 i n i Е. et al. Ann. chimica, 49, 1046 (1959).
53. M a e c k W. J. et al. Analyt. Chem., 35, 62 (1963).
54. Rab F. Collect. Czechosl. Chem. Comm., 24, 3654 (1959).
55. Koichi E m i. et al. J. Chem. Soc. Japan. Pure Chem. Sec.,
78, 1299 (1957).
56. Ruggieri R. Analyt. chim. acta, 25, 145 (1961).
57. Г о p д и e в с к и й А. В., Устюгов Г. П. «Изв. высш. учеб, заведений. Химия и хим. технол.», 4, 366 (1961).
58. Rab R. Sbor. Vysokd skoly zemed. a Lesn. fak. Brne, A 2, 223 (1960).
59. Назарчук T. H. «Укр. хим. ж.», 28, 233 (1962).
60. Neelakantam К., Row Z. Chem. Abstrs, 6589 (1943)\
61. Комаровский А. Полуэктов Н. «Ж. прикл. химии», 7, 831 (1934).
62. J о h n s о n Е. A. et al. Organic Chemical Reagents. Essex, Hopkins and Williams, 1958.
63. Spicer D. S., Strickland J. D. H. Analyt. chim. acta, 18, 231, 523 (1958).
64. Мори M. и др. «Нагоя когё гидзюцу сикэнсе хококу», 10, 83 (1961).
65. В о г г о w d а 1 е J. et al. Analyst, 84, 426 (1959).
6* -83
66. Pagane C., Schneidemann В. Analyst., 85, 909 (1960).
67. Lechner A., Ferenczy Z. Acta chim. Acad, scient. hung., 28, 223 (1961).
68. Lechner A. et al. Acta chim. Acad, scient. hung., 28, 231 (1961).
69. Ek er ton D., VI am is J. Analyt. Chem., 33, 1098 (1961).
70. Schneer A. et al. Z. analyt. Chem., 182, 178 (1961).
71. Coursier J. et al. Analyt. chim. acta, 13, 379 (1955).
72. Product. Group, U. K. Atomic Energy, Author, Rpt. 409 (S), (10), pp. ill (1963).
73. Product. Group, U. K. Atomic Energy, Author, Rpt. 362 (S), (7), pp. ill (1962).
74. Ми я м ото Масатоси. «Бунсэки кагаку», Japan Analyst, 12, 233 (1963); цит. по «Реф. ж. хим.», 22Г90 (1963).
75. Миямото Масатоси. «Бунсэки кагаку», Japan Analyst, 11, 535 (1962); цит. по «Реф. ж. хим.», 5Г97 (1963).
76. Н а у е s М. R., Metcalfe J. Analyst, 87, 956 (1962).
77. Greenhalgh R. Analyst, 87, 970 (1962).
78. Monnier D. et al. Helv. chim. acta, 7, J856 (1961).
79. L u k e C. L. Z. analyt. Chem., 151, 310 (1956).
80. Kar K. A. Metals and Alloys, 9, 175 (1938).
81. Мухина 3. С., Алешин А. Ф. «Заводск. лаборатория», 11, 23 (1945).
82. Гр изо В. А., Полуэктова Е. Н. «Ж. аналит. химии», 13, 434 (1958).
83. Capelle R. Analyt. chim. acta, 24, 555 (1961).
84. Capelle R. Analyt. chim. acta, 25, 59 (1961).
85. Patrovsky V. Taianta, London, 10, 175 (1963).
86. Patrovsky V. Geol. Prftzkum, 4, 247 (1962).
87. Я к о в л е в П. Я. и др. Анализ материалов металлургического производства. М., Металлургиздат (1961).
88. Lang К. Z. analyt. Chem., 163, 247 (1958).
89. Зоркин Ф. П. «Ж. прикл. химии», 9, 1505 (1936).
90. Александров Г. П., Цвик С. М. «Заводск. лаборатория», 16, 1396 (1950).
91. Анализ минерального сырья. Сб. методов хим. анализа. Под ред. Ю. Н. Книпович и Ю. В. Морачевского. Л., Госхимиздат, 1956.
92. Scharrer К. Z. analyt. Chem., 128, 437 (1948).
93. Hiiro К a z и о. «Бунсэки кагаку», Japan Analyst, 11, 571 (1962); цит. по «Реф. ж. хим.», ЗГ97 (1963).
94. Bardzicka В., Krauze A. Chem. analit., 5, 791 (1960).
95. В u с i е w i с z J. et al. Prace Inst, odlewn., 9, 264 (1959).
96. Б а й Ю й - в э н ь. «Касюэ тунбао», 2, 58 (1960).
97. Johnson E. A., T о о g о о d M. J. Analyst, 79, 493 (1954).
98. Синякова С. И. Методы определения микроэлементов. М.— Л., Изд-во АН СССР, 1950.
99. Rudolph G. A., Flickinger L. С. Steel, 112, 14 (1943).
100. Jones А. Н. Analyt. Chem., 29, 1101 (1957).
101. Kysil В., Vo ho г a J. Collect. Czechosl. Chem. Commun., 24, 3893 (1959).
102. Sommer L. Chem. listy, 51, 2032 (1957).
103. White С. E., Hoffmann D. E. Analyt. Chem., 29, 1105 (1957).
104. White С. E. et al. Analyt. Chem., 19, 802 (1947).
84
105. Elliot G., Radley J. A. Analyst, 86, 62 (1961).
106. Hiiro К a z u o. Bull. Govt. Industr. Res. Inst., Osaka, 13, 124 (1962); цит. по «Реф. ж. хим.», 11Г143 (1963).
107. Takeuchi Tsugio, Suzuki Masami. «Бунсэки кагаку», Japan Analyst, 9, 639 (1960); цит. по «Реф. ж. хим.», 7Д115 (1961).
108. R a b F. Chem. listy, 55, 765 (1961).
109. Danielsson L. Taianta, London, 3, 203 (1959).
110. Jones A. H. Analyt. Chem., 29, 1101 (1957).
111. Мартынче.нко И. У., Бондаренко А. М. «Ж. аналит. химии», 12, 495 (1957).
112. Hiiro Kazuo. J. Chem. Soc. Japan, Pure Chem. Sec., 83, 711 (1962); цит. по «Реф. ж. хим.», 5Г96 (1963).
113. Кара лов a 3. К., Нем одр ук А. А. «Ж. аналит. химии», 18, 615 (1963).
114. К а р а л о в а 3. К., Н е м о д р у к А. А. «Ж. аналит. химии», 17, 985 (1962).
1115. Higgs D. G. Analyst, 85, 897 (1960).
116. Химические реактивы и препараты. М., Госхимиздат, 1961.
117. Lishka Raymond. J. Amer. Water Works Assoc., 53, 1517 (1961).
118. M у т о. «Бунсэки кагаку», Japan Analyst, 4, 572 (1955); цит. no «Реф. ж. хим.», 2 (1957).
119. Wiberg E. Handbuch der analyt. Chem., Teil III, Bd. Ill, 1942.
120. Shaw D. M. et al. Spectrochim. acta, 4, 233 (1950).
121. Feldmann C., Eilenburg J. V. Analyt. Chem., 27, 1714 (1955).
122. Garton F. M. Spectrochim. acta, 9, 297 (1957)\
123. Paterson J. E., Grimes W. F. Analyt. Chem., 30, 1900 (1958).
124. Janda J., Schroll E. Mikrochim. acta (Wien), No. 2—3, 389 (1959).
125. Яковлев П. Я. и др. Анализ материалов металлургического производства. М., Металлургиздат, 1961, стр. 277.
126. Риш М. А., Приев Я. М. «Тр. ин-та каракулеводства, М-во с. х. УзССР», 11, 281 (1961).
127. Василевская Л С. и др. «Заводск. лаборатория», 28, 674 (1962).
128. Пчелинцева А. Ф. и др. «Заводск. лаборатория», 28, 677 (1962).
129. С ем о в М. П. «Заводск. лаборатория», 29, 1450 (1963).
130. Штейнберг А. Н. «Тр. ин-та металлургии АН СССР», 11, 229 (1962).
131. Швангирадзе Р. Р., Мозговая Т. А. «Ж. аналит. химии», 12, 708 (1957).
132. Кузовлев И. А., Гусарский В. В. «Заводск. лаборатория», 28, 1076 (1962).
133. Andreson R. F. Appl. Spectroscopy, 14, 123 (1960).
134. В г a n d s t е i n М. et. al. Microchim. acta, No. 5—6, 935 (1960).
135. Simozaki Z. et al. Electr. Comm. Lab. Techn. J., 11, 765 (1962); цит. по «Реф. ж. хим.», 14Г146 (1963).
136. H i r a n о S. et al. J. Chem. Soc. Japan, Industr. Chem. Sec., 62, 622 (1959); цит. по «Реф. ж. хим.», 13107 (1960).
137. Jedlewsk A. Chem. analit., 7, 381 (1962).
85
138. Gianni F., Potenza F. Analyt. chim. acta, 25, 90 (1961).
139. Нед л ер В. В., Аракельян Н. А. «Заводск. лаборатория», 28, 672 (1962).
140. Суслен никова В. М., Киселева Е. К. Руководство по приготовлению титрованных растворов. Л., Госхимиздат, 1962.
141. Мухина 3. С. и др. Методы анализа металлов и сплавов. М., Оборонгиз, 1959.
142. Roth Н., Beck W. Z. analyt. Chem., 141, 404 (1954).
143. Немодрук А. А. и др. «Заводск. лаборатория», 28, 406 (1962).
144. Niele Н. Z. analyt. Chem., 151, 270 (1956).
145. Бабко А. К., Марченко П. В. «Заводск. лаборатория», 26, 1202 (1960).
146. Б л ю м И. А. и др. «Заводск. лаборатория», 27, 644 (1961).
147. Соколова А. Л.. Махарашвили Н. А. «Ж. аналит. химии», 14, 745 (1959).
ГЛАВА III
АНАЛИЗ ЭЛЕМЕНТАРНОГО БОРА
1. Введение
Большой интерес, проявляемый к беру и его соединениям, объясняется широкой областью его применения. Основное применение бор находит в производстве жароупорных и химически стойких боридов и сплавов, а также в качестве легирующей добавки в различных коррозионностойких и жаропрочных сплавах [1].
Легкий изотоп бора В10 является сильным поглотителем тепловых нейтронов. Сечение захвата медленных нейтронов атомами В10 составляет 755 бархатом, в то время как у других элементов оно значительно меньше, а иногда не превышает долей или единиц барна [2]. Этим обстоятельством объясняется использование бора, а также его карбида, нитрида и других соединений в реакто-ростроении в качестве замедлителя ядерных процессов (регулирующих стержней) или в качестве материалов, защищающих от нейтронного излучения.
При захвате изотопом В10 нейтрона происходит реакция В10(az, a) Li7, которая используется для регистрации нейтронов при помощи борных счетчиков и борных камер, наполненных газообразным BF3 или покрытых слоем бора на металлической подложке.
Тяжелый изотоп бора В11 обладает очень небольшим сечением захвата нейтронов и практически прозрачен для них.
В полупроводниковой и ракетной технике бор также находит широкое применение [1].
Аморфный бор — это порошок коричневого (что, вероятно, связано с наличием субокислов), черного, серо-коричневого или желтого цвета. Такое многообразие окрасок зависит от способа получения боря и связанного с этим наличия тех или иных примесей.
87
Кристаллический бор— черного цвета или явно металлического вида. Первое относится к мелкокристаллическому бору, второе характерно для бора крупнокристаллического.
Некоторые авторы считают, что наиболее чистые образцы как аморфного, так и кристаллического бора обладают черным цветом [1]. В то же время рафинированный муассановский бор, содержание основного компонента в котором составляет 99,5%, имеет явно выраженный серый цвет с металлическим блеском.
Физические параметры бора следующие:
Удельный вес бора: аморфного . . . кристаллического
Температура: плавления . . . кипения . . . .
2,3 [3]
3,3 [3]; 2,35 [1]
2300° [3]; 2075° [1]
2500—2550° [1,3]
Химические свойства бора обусловлены его положением в периодической системе элементов. Находясь в третьей группе таблицы Менделеева, бор имеет три электрона на внешней орбите, для него не характерна тенденция к дальнейшему присоединению электронов, и во всех соединениях бор трехвалентен.
Характерной особенностью бора является его способность проявлять как металлические, так и металлоидные свойства. Так, бор образует кислоты и их ангидриды и наряду с этим карбиды, бориды и т. п.
Химические свойства бора в значительной мере зависят от степени его кристалличности. Так, аморфный бор, обладая активной поверхностью, адсорбирует значительное количество газов и влаги, окисляется на воздухе, более реакционноспособен, чем бор кристаллический, энергичнее взаимодействует с окислителями, обнаруживает некоторую растворимость в концентрированных щелочах. При температуре около 800° аморфный бор сгорает ослепительно ярким пламенем.
Кристаллический бор более инертен к химическим воздействиям, не окисляется при обычной температуре, жаростоек. При повышении температуры кристаллический бор становится более активным, вытесняет элементы из таких стойких окисных соединений, как Р2О5, SiO2, СО2 и др. [3].
88
Однако при всех различиях в химическом поведении обе модификации бора сохраняют одну и ту же характерную способность — образовывать кислоты. Бор — ярко выраженный кислотообразователь, и именно на этом свойстве бора основаны все методики его определения.
Как правило, при анализе элементарного бора его переводят в борную кислоту, которую определяют объемным методом без предварительной отгонки бор|Нометило-вого эфира. Такое ускоренное определение бора предлагалось уже в работах Джонса [4]. Метод этот значительно усовершенствован Штоком [5] и Крюллем (6].
Универсальным методом переведения бора в растворимое состояние можно считать метод сплавления с карбонатами щелочных металлов [7—11], но ввиду повышенного 'износа платиновых тиглей сплавления следует избегать, особенно если присутствуют примеси калия, натрия и углерода.
Бор переводят в борную кислоту окислением каким-либо способом, описанным в литературе. Одним из таких способов является нитрозный [9]. Метод этот предусматривает значительное число операций, а это всегда связано с потерями бора. Продолжительность анализа 3— 4 ч.
На возможность растворения бора и некоторых боридов в смеси азотной кислоты и перекиси водорода указывали еще Муассан [12] и Крюлль [6]. На этой основе разработан метод окисления бора смесью пергидроля и азотной кислоты [13].
При применении ускоренного метода определения бора путем окисления азотной кислотой пробу обрабатывают азотной кислотой (1:1) дю удаления бурых паров-окиолов азота, нейтрализуют по n-нитрофенолу и титруют борную кислоту по фенолфталеину в присутствии глицерина [14].
Перйодатный и йодатный методы определения элементарного бора предполагают окисление бора и переведение его в раствор совместно с растворимыми боридами при помощи кислого раствора перйодата или йодата калия [15].
Предложенный М. Г. Васильевой и А. Л. Соколовой [16] персульфатный метод определения элементарного бора, не уступая перйодатному в точности результатов, является более простым и менее продолжительным. При
89^
применении этого метода необходимо обращать особое внимание на чистоту используемого персульфата, иначе поправка на глухой опыт значительна и нет резкости перехода окраски 'индикатора в эквивалентной точке.
Все методы определения элементарного бора, основанные на титровании образующейся при окислении бора борной кислоты, дают содержание общего бора, т. е. бора элементарного и связанного в виде боридов и боратов. Однако некоторые свойства бора, в частности химическая активность, обусловливаются не общим содержанием бора, а содержанием бора, способного окисляться. Поэтому важным фактором является определение активного бора по количеству израсходованного окислителя.
Еще Муассан [17] указывал на возможность полного окисления бора растворами перманганата калия. Попытки количественного определения бора при помощи перманганата калия описаны в работах Вейнтрауба [18] и Каленберга [19]. Но применение перманганата калия, окислительно-восстановительный потенциал которого достаточно высок (потенциал системы МпО^" /Мп2+ равен 1,52 в), затруднено ввиду неустойчивости его растворов. Кроме того, при использовании перманганата калия наблюдаются побочные реакции образования окислителя разной валентности.
Использование бихромата калия <в качестве окислителя бора оказалось невозможным, так как окислительно-восстановительный потенциал системы СггО^/Сг3*, равный 1,3 в, недостаточен для быстрого и количественного окисления бора. Реакция протекает медленно. Повышение температуры в реакционной смеси мало способствует ускорению реакции [20].
Активный бор можно определять перйодатным методом [15] в том его варианте, когда раствором тиосульфата титруют иод, выделенный из растворов KJ и KJO3, эквивалентным количеством борной кислоты.
Из всех методов определения активного бора подробно следует остановиться на цериметрическом методе [21], основанном на окислении бора раствором сульфата четырехвалентного церия. Окислительно-восстановительный потенциал системы Се4+/Се3+ равен 1,44 в в 2 н. серной кислоте. Большим преимуществом этого окислило
теля является то, что его превращение в трехвалентный одрий протекает прямолинейно, без промежуточных ступеней, и реакция Се4+ + е Се3+ обратима, ори этом растворы очень устойчивы.
Применение метода определения активного бора требует отсутствия других восстановителей.
Для получения сравнительных данных по определению элементарного бора различными методами авторы провели определение бора периметрическим, персуль-фатным, перйодатным и азотнокислотным методами. Как видно из табл. 2, результаты определения бора тремя последними методами практически совпадают, в то время как периметрический метод всегда дает заниженные результаты. Сплавление остатка, не растворимого в сернокислом церии, с углекислым калием-натрием повышает содержание бора до действительного значения.
Таблица 2
Результаты определения бора (в %) периметрическим, персульфатным, перйодатным и азотнокислотным методами
Проба с с Периметрический метод Персульфатный метод Метод окисления азотной кислотой Перйодатный метод
растворимый бор после сплавления общий бор растворимый бор после сплавле- ния общий бор общий бор общий бор
I 1 96,17 96,17 100,0 — 100,0 100,9
’2 96,71 3,20 99,91 100,0 — 100,0 99,9
3 96,81 2,45 99,26 99,9 99,9 м — 99,9
4 89,80 4,64 94,44 92,75 1,65 94,4 — — 93,7
5 90,53 4,35 94,88 93,37 1,43 94,8 93,8
II 6 90,35 -—- 92,60 1,90 94,5 «' 1 - 94,1
7 89,63 —- — —— - 93,5
8 75,35 — 97,47 - - 97,47 — 1 97,1
III 9 76,99 — —1 94,14 — 94,14 94,23 —-
IV 10 77,55 — 97,87 — 97,87 97,87 —
I. Бор аморфный, полученный пиролизом диборана. Спектральным анализом найдено:51 — 0,001 %; Mg— 0,0001%; Си, Fe, Al — нет.
f 'Л] II. Бор аморфный, полученный магний-термическим методом. К ачественно спектральным методом найдено: Mg — очень много; Si — много; Мп, А1, Си, Ni, Fe — следы.
III. Бор, полученный электролизом из расплавленных солей KBF4, KF и KCL
IV. Бор аморфный, полученный пиролизом диборана.
91
По мнению авторов, в нерастворимом остатке находятся не только бориды, но и часть нерастворимого бора. К этому выводу приводит тот факт, что в боре с содержанием основного элемента около 98% периметрическим методом определено около 78% бора (см. табл. 2), т. е. при содержании .примесей около 2% до баланса не достает 20% бора, который должен находиться в связанном состоянии (в виде каких-либо боридов). Подобное положение наблюдается и при определении бора с содержанием основного элемента 99,9—100%. В этом случае периметрическим методом получены результаты, на 4% ниже .действительного содержания (см. табл. 2). Поскольку сумма примесей в таком боре не превышает 0,1%, бор в количестве 4% не может быть связан в виде боридов и остается предположить, что не растворилась часть элементарного бора.
Растворимость электролитического бора в сернокислом церии можно несколько повысить, увеличивая степень измельчения пробы; для аморфного бора такая возможность исключена.
При наличии в пробе примесей калия, углерода и суб-окислов результаты параллельных определений бора периметрическим методом имеют плохую сходимость.
Авторы книги считают, что при оценке активного бора периметрическим методом можно пользоваться только как ориентировочным, а окончательный вывод о содержании бора, не связанного в виде боридов и боратов, следует делать только после определения примесей.
Таким образом, определение общего бора рекомен дуется проводить азотным или персульфатным методом с визуальным титрованием образующейся при окислении борной кислоты *.
* Авторы использовали в нескольких случаях потенциометрическое титрование, так как анализировались пробы, для которых при визуальном титровании наблюдается нечеткий переход окраски индикатора в точке эквивалентности. Причина нечеткого перехода окраски индикатора пока не выяснена.
При потенциометрическом титровании раствор, содержащий борную кислоту, предварительно нейтрализовали по метиловому красному, затем проводили точную нейтрализацию потенциометрическим способом и титровали борную кислоту от pH = 6,9 до рН = = 6,9, как описано в гл. I. Титр едкого натра был установлен по дважды перекристаллизованной борной кислоте или, что лучше, по стандартному образцу бора.
92
Состав и содержание примесей в элементарном боре зависят от способа получения бора.
Согласно литературным данным, существуют следующие (методы получения бора:
1. Металлотермический метод (восстановление борного ангидрида). Основные примеси: кремний, железо, алюминий, кальций, 'магний.
В зависимости от металла-восстановителя в качестве примесей могут присутствовать калий, натрий, магний.
2. Электрохимический метод. Основные примеси: кремний, алюминий, железо, кальций, магний, углерод, калий.
В зависимости от материала катода и анода в качестве примесей могут присутствовать никель, молибден, вольфрам, тантал, цирконий, хром, углерод.
3. Восстановление галогенидов бора водородом. Основными примесями являются аппаратурные загрязнения: кремний, железо, алюминий, медь, никель, магний.
4. Восстановление галогенидов бора металлами. Основные примеси: калий, натрий, магний и др., а также аппаратурные загрязнения (кремний, железо, алюминий, медь, никель, магний).
5. Термическая диссоциация галогенидов бора на накаленной металлической нити. Основные примеси: кремний, железо, алюминий, кальций, магний. Материал нити: молибден, вольфрам, тантал.
6. Крекинг бороводородов, в частности пиролиз диборана. Метод приобретает все большее значение, так как получаемый бор обладает высокой степенью чистоты. Примеси: аппаратурные загрязнения (кремний, магний, кальций, углерод).
7. Термическое разложение борорганических соединений. Основные примеси: аппаратурные загрязнения и углерод.
В книге рассмотрены методы определения примесей, относящихся к натрий-термическому (восстановление трехфтористого бора металлическим натрием) и электролитическому (путем электролиза из расплава солей KBF4, КС1, KF) методам получения элементарного бора.
В боре, полученном, натрий-термическим методом, необходимо определять кремний, железо, алюминий, кальций, магний, натрий, серу, фтор, влагу, адсорбированные газы, кислород. Натрий, сера, фтор—примеси техноло-
93
гического порядка. Кремний, железо, алюминий, кальций, магний — аппаратурные и реактивные загрязнения. Сера (присутствует по той причине, что исходный трехфтористый бор часто содержит в качестве примеси значительные количества двуокиси серы.
В боре, полученном электролитическим .методом, необходимо определять никель, калий, углерод, медь, железо, алюминий, кальций, магний, кремний, влагу и кислород. Никель, калий, углерод, медь —примеси технологического порядка. Железо, алюминий, кальций, магний, кремний — аппаратурные и реактивные загрязнения. Никель попадает в пробу как материал катода, графит — как материал анода. Калий разряжается на катоде наряду с бором, образуя бориды калия, которые не растворяются в ооляной кислоте. Медь определяют в том случае, если в качестве исходного вещества использовался диметилэфират трехфтористого бора (например, при получении изотопного бора), содержащий в качестве основной примеси медь.
Количественному определению примесных элементов обычно предшествует качественный спектральный анализ. По количественному определению примесей спектральным методом опубликовано несколько работ [22, 23]. В работе [22] описан метод спектрографического обнаружения примесей в остатке после предварительного разложения образца элементарного бора медленным и быстрым хлорированием в кварцевой трубке при температуре 725°.
При спектрографическом определении в боре примесей кальция, алюминия, кремния, железа, меди, магния, олова, хрома, марганца, свинца, титана [24] элементарный бор предварительно окисляют смесью азотной кислоты с перекисью водорода. Анализируемые и эталонные образцы смешивают с графитом и окисью никеля. Спектры возбуждают в дуге переменного тока между графитовыми электродами. Метод пригоден для определения примесей при концентрациях только выше 0,02%.
В работе [25] описан химико-спектральный метод определения в элементарном боре примесей марганца, молибдена, вольфрама, тантала при концентрациях 5 X X 10-5% (вольфрама, тантала) и 1*10~6% (марганца, молибдена) из навески бора в 4 г. Метод основан на концентрирований примесей путем окисления бора азот-» 94
ной кислотой до борной кислоты с последующей обработкой фтористоводородной кислотой и отгонкой бора в виде трехфтористого бора.
Предлагаемый ниже (см. п. 12) прямой спектрографический .метод [26] определения примесей в элементарном боре разработан .на образцах бора, «полученных натрий-термическим методом и методом разложения бромида бора на молибденовой ленте. Результаты анализа, полученные спектрографическим методом, сравнивались с результатами химического метода анализа, разработанного авторами.
Методы химического анализа примесей в элементарном боре в литературе не описаны. Необходимо было разработать способы определения отдельных элементов, принимая во внимание то обстоятельство, что присутствие борной кислоты (борная кислота образуется при переведении бора в раствор путем обработки окислителем) мешает определению некоторых элементов. Так, при определении кремния бор адсорбируется осадком кремневой кислоты и улетучивается с последней в виде BF3 при обработке фтористоводородной кислотой, вследствие чего получаются завышенные результаты для кремния {27]. Железо и алюминий не удается полностью выделить из растворов, содержащих борную кислоту, даже трехкратным осаждением их аммиаком [27]. Определению кальция и магния весовым (методом присутствие борной кислоты не мешает.
В литературе описано использование хлорирования для разложения пробы и удаления бора в виде ВС13 [22]. Более простой способ отделения бора — путем отгонки борнометилового эфира после предварительного растворения навески бора в каком-либо окислителе. Способ не требует дополнительной аппаратуры, можно пользоваться навесками любой величины.
Переведение бора в раствор авторы осуществляли обработкой навески бора азотной кислотой в присутствии нескольких миллилитров пергидроля или только азотной кислотой.
Поскольку необходимость определения кремния исключает возможность удаления бора в виде BF3 обработкой пробы фтористоводородной кислотой, авторы удаляли бор в виде борноэтилового эфира. Замена метилового спирта этиловым несколько увеличивает продолжитель-
на
ность обработки пробы, но обеспечивает безопасность работы с самим реактивом. В остатке после отгонки эфира определяли примеси кремния, железа, алюминия, никеля, кальция, магния способами, описанными в соответствующей литературе [11, 27—29]. Систематический ход анализа предусматривал последовательное определение кремния, железа, алюминия, никеля, кальция, магния из одной навески и калия, натрия, углерода, серы из отдельных навесок. Возможность определения в элементарном боре углерода абсорбционно-газообъемньгм методом, серы — методом сжигания, калия и натрия — методом фотометрии пламени, кремния — весовым методом, никеля, железа, алюминия, кальция, магния — объемными методами была проверена практически.
Так как отгонка борнометилового эфира значительно увеличивает продолжительность анализа, представляло интерес изучение возможности определения указанных примесей без отделения борной кислоты. В результате проведенных разработок был предложен ускоренный метод определения кремния, железа, .алюминия, никеля, кальция, магния в элементарном боре без удаления борной кислоты. Определение примесей этим методом подробно изложено ниже.
Далее был разработан способ колориметрического о.гь ределения примесей. Применение колориметрических методов анализа бора дает возможность определять примеси из малых навесок, что существенно при анализе изотопного бора, так как уменьшается расход дорогостоящего продукта на анализ. Кроме того, потребность в руководстве по колориметрическому определению примесей в элементарном боре назрела в связи с необходимостью аналитического контроля продукта высокой степени чистоты. Подробно способ колориметрического определения примесей изложен далее.
Как правило, до полного баланса бора, полученного натрий-термическим методом, не хватает от 5 до 12%; ввиду того что аморфный бор является мелкодисперсным порошком с большой активной поверхностью, остальными примесями могут быть окись бора, водород, азот, адсорбированные газы. Содержание адсорбированных газов определяют методом вакуумной откачки [30—32].
Схема установки для определения адсорбированных газов показана на рис. 17. Принцип определения сле-
96
Рис. 17. Схема прибора для определения адсорбционной способности аморфного бора:
1 — кварцевая адсорбционная трубка; 2 — спираль; 3 — катетометр; 4 — кварцевая чашка; 5 — манометр; 6, 7 — дозаторы.
дующий: в кварцевую чашку 4 берут навеску бора в количестве 0,2—0,3 г и подвешиватот чаинку на спирали 2, которая вставляется в кварцевую адсорбционную трубку /. Из установки откачивается газ сначала при комнатной температуре, а затем при температуре 300° до давления 2-Ю-5 мм рт. ст. Затем прибор охлаждается до комнатной температуры (22°), устанавливается нулевая точка и пускается сухой азот через дозатор 6. Начальное и конечное давление азота измеряется манометром 5, изменение <• длины спирали — катетометром 3 или окулярным микрометром. После установления равновесия, т. е. момента, ко-t гда вес образца больше не из-к меняется, из прибора откачи-; вается азот сначала при ком-натной температуре, а затем £ при 300° до давления £ 2-10—5 мм рт. ст. и определяет-: ся положение спирали 2.
Определение борного ангид-рида в боре проводят кипяче-I нием навески в дистиллирован-ной воде и титрованием образующейся при этом борной t кислоты: визуально — в слу-< чае анализа электролитическо-
L го бора и потенциометрически — при анализе аморфного | бора, образующего в нейтральной среде коллоидные рас-творьц
I Для коагуляции коллоидного бора можно использо-k вать соляную кислоту (1 мл концентрированной НС1 до-L статочно для коагуляции раствора, содержащего 20 мг | аморфного бора в 100 мл воды). При наличии в боре бо-f ридов, растворимых в соляной кислоте, результаты по н определению В2О3 будут завышены.
: Содержание борного ангидрида в элементарном боре
обычно не превышает 0,1—0,2%; значительные количества кислорода, обнаруживаемого в боре, обусловлены,
7 Анализ бора
97
по-видимому, присутствием не борного ангидрида, а суб-окислов.
По некоторым литературным данным, возможно наличие в боре его субокислов общего состава: ВпО™(п = = 4-^-7; т— 1ч-5) [1]. Существование В7О, В4О2 не доказано, а ВО, В2О2 образуются лишь в специальных условиях, например при высоких температурах при нагревании борного ангидрида или при гидролизе некоторых боридов или низших галоидных соединений бора.
Соответствующие субокислам бора кислоты либо совсем неизвестны, либо изучены еще недостаточно И, 33].
Субокислы—очень устойчивые химические соединения, которые не растворяются в воде [21], кислотах и других реагентах [34].
Авторы книги проверили возможность определения кислорода, связанного в субокислы, способом, описанным в литературе применительно к определению кислорода в окислах циркония и бора [35, 36]. Метод основан на обработке пробы парами однохлористой серы в потоке азота при температуре 500—4000°. При этом металл связывается в хлорид, ia кислород — в сернистый ангидрид, который после удаления избыточных паров однохлористой серы сухой сернистой ртутью определяется иодометрически. Минимальные количества кислорода, которые можно определить этим методом, ограничиваются величиной поправки, определяемой в «холостом» опыте и зависящей от объема паров однохлористой серы, прошедших через слой сернистой ртути, а также от температуры сжигания навески. Так, при определении кислорода в 20 мг Fe2O3 или А12О3 поправка составила 0,024 и 0,16 мг кислорода соответственно, т. е. величина поправки «холостого» опыта, равная. 0,2 мг кислорода, от навески 20 мг составляет 1%. Так как содержание кислорода в боре колеблется в пределах 0—2% для бора электролитического и еще выше для бора натрий-термического, то навеска бора должна быть не менее 0,04—0,05 г.
Навеска бора в указанном количестве помещалась в две фарфоровые лодочки (с целью увеличения поверхности соприкосновения бора с S2C12) и подвергалась обработке парами однохлористой серы. Полного разложения пробы в условиях, описанных для определения кис-98
лор'ОДа в окислах некоторых металлов, для элементарно* го бора не наблюдалось *.
При определении кислорода в (металлах из больших .навесок авторы работ [35, 36] указывали на необходимость ускорения взаимодействия с однохлористой серой путем нагревания последней до кипения на спиртовой горелке. Нами было обнаружено, что нагревание приводит к быстрому испарению S2C12, в результате чего резко повышается величина поправки «холостого» опыта, так как наблюдается проскок однохлористой серы за фильтры. При этом фильтры быстро забиваются конденсирующейся серой и выходят из строя. Увеличение продолжительности сжигания (до 5—6 ч) при условии медленного пропускания однохлористой серы не дало положительных результатов, поскольку хотя и наблюдалось взаимодействие бора с однохлористой серой, но величина поправки «холостого» опыта при этом значительно превышала предполагаемое содержание кислорода. Таким образом, указанный метод не может быть рекомендован для определения кислорода в элементарном боре.
Оценка возможности определения газов в металлах по группам периодической системы элементов приведена в соответствующей литературе [37]. Для определения кислорода в боре рекомендовано вакуум-плавление. Метод основан на возможности восстановления кислородных соединений бора углеродом и замере образующейся при этом окиси углерода. При необходимости определения в боре водорода и азота преимущество также остается за методом вакуум-плавления [37, 38]. Определение водорода основано на термическом разложении водородных соединений в вакууме при температуре 2000°. Аппаратура для анализа газов в металлах методом вакуум-плавления приведена в соответствующей литературе [37, 39].
Для характеристики качества элементарного бора кроме химического анализа производятся физические определения (величин частиц, удельной поверхности, удельного веса, насыпного веса и т. in.
* Авторы работ [35, 36] испытали взаимодействие паров однохлористой серы с окисла ми AI2O3, MgO, ТЮ2, ZrOj, ВеО, Сг20з и В2О3 (навески по 10 мг). Из перечисленных окислов труднее всех реагировал В20з, который полностью вступал в реакцию лишь при длительном нагревании до 900—1000°.
99
Замер величины частиц аморфного и кристаллического бора производят на оптическом горизонтальнохм (микроскопе МИМ-8 или на электронном микроскопе. Оптическая схема микроскопа, конструкция основных узлов прибора, правила работы с микроскопом, а также вопросы препарирования порошкообразных объектов подробно описаны в соответствующей литературе [40, 41].
Насыпной вес — вес единицы объема свободно насыпанного порошка — определяют на волюмометре, который состоит из воронки с ситом и кожуха с несколькими наклонными стеклами, пересыпаясь по которым, порошок попадает в тигелек с измеренными объемом и весом. Избыток порошка снимается с тигелька стальной линейкой, после чего он взвешивается, и насыпной вес порошка определяется путем деления веса порошка в граммах на объем тигля в кубических сантиметрах [42].
Определение удельного веса и удельной поверхности приводятся ниже.
2. Отбор пробы, измельчение, усреднение [27, 43—48]
Эти операции имеют большое значение, так как от них зависит соответствие результатов анализа действительному составу анализируемого вещества. При неправильном проведении их самый тщательный и точно выполненный анализ теряет свою ценность.
Техника взятия средней пробы в отдельных случаях может различаться, но общий принцип заключается в том, что средняя проба должна составляться из большого числа небольших порций вещества, взятых из различных мест исследуемой партии.
Для аморфного бора первичную среднюю пробу отбирают плексигласовой трубкой (диаметром 5—7 мм, длиной 60—80 мм) по всей толще пробы. Дальнейшее усреднение проводят перекатыванием порошка по стенкам бюкса. Квартование не проводится из-за большой адсорбционной способности аморфного бора, в результате чего он увлажняется и частично окисляется.
Пробу кристаллического бора отбирают из нескольких участков исходного материала, измельчают в железной ступке, пропускают через сито размером 300 меш, обрабатывают горячей соляной кислотой (1:1) для переведения в раствор железа и промывают водой до от-
100
к
рицательной -реакции на ионы Fe3+ и С1". Отмытый бо-р сушат в сушильном шкафу при температуре 105—110° до постоянного веса *.
Работая с навесками бора 20—30 мг, необходимо уделять большое внимание однородности (пробы. Одно-родность пробы достигается, если раз-мер частиц не превышает 0,02 мм. (Если анализируемый материал состоит из частиц с разной твердостью или с разным удельным весом, то измельчение необходимо доводить до ~1 мк.)
Зная величину навески, можно рассчитать необходимую степень измельчения анализируемого материала. Зависимость между степенью измельчения -и минимальной величиной навески выражается формулой Алимарина [44] (10П— P)a3-d-10~5
£
Л2Р
Рис. 18. Общий вид вакуум-ступки в рабочем состоянии.
р-где S — навеска, г; Р — содержание р определяемого компонента, %; а — £ удельный вес частицы; d — диаметр F наиболее крупной частицы, см\ л — от-fc носительная ошибка определения, if При значительной окисляемости I продукта, связанной с большой сте-пенью -измельчения, рекомендуется проводить измельчение в вакуум-ступ-k ке (рис. 18 и 19). Пестик и рабочая по-| верхность ступки изготовлены из стали К марки У-8, остальные части — из стаяли 1Х18Н9Т.
g.' Измельчаемый (материал помещают
Е рой BHHTaiMiH присоединяют крышку. Затем ступку поме-I щают в металлический куда заливают жидкий
I----------
[
ступку, к кото-
в
кожух, выложенный асбестом, азот, так как в охлажденном со-
приготовлена большая партия проб.
* Указан-ным способом
Небольшое количество борной кислоты, обнаруженное в фильтрате, по-видимому, обусловлено присутствием боридов, растворимых в соляной кислоте. Окисление бора незначительное.
101
стоянии материал становится более хрупким и легче поддается измельчению. Отводную трубку ступки присоединяют к форвакуумному насосу и приступают к измельчению пробы.
После измельчения просеивают пробу через сито размером 300 меш, отмывают пробу соляной кислотой от железа, .высушивают и усредняют.
Рис. 19. Вакуум-ступка в разобранном виде.
Следует заметить, что явления, происходящие при значительном измельчении проб, интересны сами по себе. Полагают, что при таком измельчении проб имеет место не только увеличение дисперсности, но и глубокое изменение структуры частиц. Это явление сходно с эффектом разупорядочения кристаллической решетки графика, приближающим ее к структуре аморфных модификаций углерода [45].
Способность к разупрочнению решетки связана с природой самого вещества. Эффект, наблюдаемый у бора, при тех же условиях не был замечен на карбиде бора и других веществах. Для полного разъяснения этого явления в настоящее время нет достаточных данных [45].
Отобранную измельченную часть пробы рекомендуется хранить в стеклянных банках с притертыми пробками или в бюксах.
3. Определение влаги [46—48]
Аморфный бор, обладая большой поверхностью, адсорбирует значительное количество влаги, определение 102
Рис. 20. Общий вид установки для определения влаги.
которой проводят под вакуумом *. При малой пробе Используют аппаратуру, показанную на рисч 20 и 21.
Ход анализа. Пробирку 12 с навеской бора помещают в трубку 3, закрывают через шлиф колбой 10, пускают воду в обратный холодильник 4 и включают электроплитку 1.
Рис. 21. Схема установки для определения влаги:
1 — электроплитка; 2 — колба с кипящим толуолом; 3 — трубка для высушиваемого вещества; 4 — обратный холодильник для охлаждения паров толуола; 5 — ловушка, охлаждаемая жидким воздухом; 6 — вакуумный кран для пуска воздуха в масляный насос; 7 — масляный насос ВН-461; 8 — ртутный манометр; 9 — вакуумный кран для пуска воздуха в аппаратуру через колонку с силикагелем; 10 — колба с активированным силикагелем для поглощения паров влаги; И — колонка с силикагелем для сушки воздуха при впуске в аппаратуру; 12 — пробирка для взятия пробы.
Перед включением масляного насоса 7 закрывают краны 6 и 9 и откачивают воздух из системы 2, 3. Затем, медленно открыв кран 9, начинают откачивать воздух при разрежении 5 мм рт. ст., контролируемом ртутным манометром 8. Откачивание проводится в течение 2,5 ч.
Выключают электроплитку /ив течение 20—25 мин при наличии вакуума дают пробе охладиться, после чего закрывают кран 9, открывают кран 6 для впуска воздуха в насос через ловушку 5.
Для взятия высушенного вещества осторожно открывают кран 9 и впускают сухой воздух, прошедший через
* При наличии адсорбированных газов метод дает несколько завышенные результаты.
104
колонку 11 с силикагелем. Затем отсоединяют колбу 10. Пробирку с высушенным бором вынимают шпателем, закрывают крышкой и выдерживают в эксикаторе, находящемся в весовой комнате. Высушивание проводят до постоянного веса.
Содержание влаги вычисляют по формуле
-100,
<?2 —<71
где q\ — вес бюкса, г; д2 — вес бюкса с навеской бора до высушивания, г; д3 — вес бюкса с навеской бора после высушивания, г.
В кристаллическом боре влагу определяют высушиванием навески бора в сушильном шкафу при температуре 105—110° в течение 2 ч в бюксе с крышкой, которую приоткрывают во время сушки.
После охлаждения в эксикаторе в течение 1 ч при комнатной температуре бюкс взвешивают. Высушивание навески проводят до постоянного веса. Содержание влаги рассчитывают по приведенной выше формуле.
Способ одновременного определения влаги и проведения анализа бора более правильный, чем определение бора в предварительно высушенной пробе.
4. Определение активного бора цериметрическим методом
Определение бора цериметрическим методом [21] основано на окислении его сернокислым церием.
Реакция протекает по уравнению
2В + 6Се (SO4)2 + 6Н2О - 2Н3ВО3 + ЗСе2 (SO4)3 + 3H2SO4.
Необходимые реактивы
1. Сернокислый церий, окисный или окись церия.
2. Соль Мора, 0,1 н. раствор.
3. Фенилантраниловая кислота, 0,2%-ный раствор в 2%-ном растворе двууглекислого натрия.
4. Серная кислота, 2 н. раствор.
5. Углекислый натрий.
Ход анализа. Навеску бора в количестве 0,02 г в виде тонкоизмельченного порошка помещают в колбу Эрленмейера емкостью 250 мл, добавляют 25—50 мл 0,3 н. раствора сернокислого церия (Се4+) в 1—2 н. сер
105
ной кислоте. Колбу с раствором оставляют на 2—3 ч на предварительно разогретой и затем выключенной песчаной бане. После охлаждения раствора избыток окислителя оттитровывают 0,1 н. раствором соли Мора в присутствии двух-трех капель 0,2%-ного раствора фенилантраниловой кислоты.
Содержание бора вычисляют по формуле
<>„(%)= , ° п
где V — объем раствора сернокислого церия, мл; Vi — объем раствора соли Мора, израсходованного на титрование избытка сернокислого церия, мл; с — количество миллилитров сернокислого церия, эквивалентное 1 мл раствора соли Мора; D — нормальность раствора сернокислого церия; п — навеска бора, г; 0,36067 — пересчет-ный коэффициент.
Точность метода ±1% (отн.).
Примечание. Содержание бора удобнее вычислять по формуле
(V — 0,001081-/С-100
QB (% )=-----1:,
п
где 0,001081 —титр 0,3 н. раствора сернокислого церия, выраженный в граммах бора, г!мл; К — коэффициент нормальности раствора сернокислого церия.
5. Перйодатный и йодатный методы определения элементарного бора [15]
Метод основан на окислении бора и некоторых боридов кислым раствором перйодата или йодата калия и титровании образующейся при этом борной кислоты после нейтрализации раствора по способу Штока — Джонса.
Реакции протекают по уравнениям
3KJO4 + 2В - 3KJO3 + В2О3;
KJO3 + 2В = KJ + В2О3;
KJO3 + 5KJ + 6НС1 = 6КС1 + 3J2 + ЗН2О.
Необходимые реактивы
1. Иоднокислый или иодноватокислый калий.
2. Йодистый калий.
106
3. Тиосульфат натрия, концентрированный и 0,1 н. растворы.
4. Гидроокись бария, 0,1 н. раствор.
5. Соляная кислота, концентрированный и 0,1 н. растворы.
6. Фенолфталеин, 1%-ный спиртовой раствор.
7. Маннит.
Ход анализа. В колбу из кварца помещают 0,5 г KJO3 или KJO4, прибавляют 10 мл дистиллированной воды и 1 мл концентрированной соляной кислоты. Содержимое колбы взбалтывают до растворения солей, затем помещают в колбу навеску бора в количестве 0,02 г. Навеску растворяют при нагревании с обратным холодильником в течение 30—45 мин.
Раствор охлаждают, а нерастворимый остаток отфильтровывают, промывают несколько раз водой. Затем промывают холодильник водой, собирая промывные воды в колбу с раствором (выделившийся иод часто приходится отделять от стенок холодильника стеклянной палочкой).
В фильтрат добавляют 5 мл 0,1 н. раствора соляной кислоты, примерно 0,1 г KJ, необходимого для уничтожения избытка перйодата или йодата калия. Для удаления выделившегося иода применяют сначала насыщенный раствор тиосульфата натрия, а затем точно оттит-ровывают 0,1 н. раствором тиосульфата натрия. Эту операцию повторяют до прекращения выделения иода после прибавления йодистого калия.
Избыток минеральной кислоты связывают прибавлением необходимого количества йодата калия и йодистого калия. Выделившийся иод вновь оттитровывают 0,1 н. раствором тиосульфата натрия. Эту процедуру также повторяют до прекращения выделения иода после прибавления KJO3 и KJ.
В нейтральный раствор добавляют 10—15 капель 1%-ного спиртового раствора фенолфталеина, около 1 г маннита и титруют раствором гидроокиси бария до появления розовой окраски, не исчезающей от последующего прибавления маннита.
Содержание бора вычисляют по формуле
<2В(%) =
0,001081— Уо)-100
107
где 0,001081 —титр раствора гидроокиси бария, выраженный в граммах бора, г! мл; К — коэффициент нормальности раствора гидроокиси бария; V}— объем раствора гидроокиси бария, израсходованного на титрование, мл; Vo — объем раствора гидроокиси бария, израсходованного на титрование «холостого» опыта, мл; п — навеска бора, г.
Нерастворимый остаток с фильтром помещают в платиновый тигель и осторожно озоляют. Затем в тигель добавляют KNaCOs и сплавляют остаток на горелке. Полученный плав после охлаждения тигля выщелачивают горячей водой, нейтрализуют соляной кислотой (1:1), добавляют две-три капли избытка соляной кислоты и кипятят раствор с обратным холодильником для удаления углекислоты. Раствор охлаждают, холодильник промывают дистиллированной водой и в фильтрате после нейтрализации избытка минеральной кислоты по Illi оку — Джонсу определяют содержание бора, как описано выше.
Суммируя содержание бора в фильтрате после растворения навески в перйодате и содержание бора в фильтрате после выщелачивания, определяют общее содержание бора.
Точность метода ±0,5% (отн.).
6. Персульфатный метод определения элементарного бора
Метод основан на окислении бора и некоторых боридов смесью персульфата калия и перекиси водорода [16]. Реакции протекают по уравнениям:
K2S2O8 + Н2О2 - 2KHSO5;
2В + 2KHSO5 + ЗН2О2 - 2Н3ВО3 + K2SO4 +
4- H2SO4 + О2.
Необходимые реактивы
1. Надсернокислый калий, 1,3%-ный раствор.
2. Перекись водорода, 3%-ный раствор.
3. Едкий натр, 0,1 н. раствор.
4. Метиловый красный, 0,1%-ный спиртовой раствор.
5. Фенолфталеин, 1%-ный спиртовой раствор.
6. Маннит.
108
Ход анализа. Навеску бора в количестве 0,02 г помещают в колбу Эрленмейера из прозрачною кварка емкостью 250 мл, прибавляют 10 мл 3%-кого раствора перекиси водорода и 20 мл 1,3%-ного раствора персульфата калия. Раствор кипятят с обратным холодильником 30—45 мин.
После охлаждения раствора холодильник промывают два-три раза дистиллированной водой. Нерастворимый остаток отфильтровывают через беззольный фильтр и несколько раз промывают водой. К фильтрату добавляют две-три капли раствора метилового красного и •нейтрализуют раствор вначале 30%-ным и 0,5 н. растворами едкого натра. Затем добавляют несколько капель 0,1 н. соляной кислоты и точно нейтрализуют раствор 0,1 н, раствором едкого натра. К нейтральному раствору добавляют 10—15 капель фенолфталеина, около 0,2 г маннита и раствор титруют 0,1 н. раствором едкого натра до появления розовой окраски, не исчезающей от последующего прибавления маннита.
Содержание бора вычисляют по формуле
<2В(%Ю
0,001081 K(Vi — Ур) • 100 п
где 0,001081 —титр 0,1 н. раствора едкого натра, выраженный в граммах бора, г!мл\ К — коэффициент нормальности раствора едкого натра; Vi—объем 0,1 н. раствора едкого натра, израсходованного на титрование, мл\ Vo —объем 0,1 н. раствора едкого натра, израсходованного на титрование «холостого» опыта, мл\ п— навеска, г.
Нерастворимый остаток сплавляют в платиновом тигле с KNaCOs,. выщелачивают горячей водой, подкисленной соляной кислотой (1 : 1), и кипятят с обратным холодильником в течение 45—60 мин. После удаления углекислоты раствор охлаждают, холодильник смывают водой, раствор нейтрализуют сначала 30%-ным, затем 0,5 н. растворами едкого натра, добавляют несколько капель 0,1 н. соляной кислоты и точно нейтрализуют 0,1 н. раствором едкого натра., К нейтральному раствору добавляют 10—15 капель фенолфталеина, маннит и титруют, как описано выше.
109
Суммируя содержание бора в фильтрате после растворения навески и в фильтрате после выщелачивания’ плава, определяют содержание общего бора.
Точность метода ±0,5% (отн.).
7. Определение элементарного бора методом окисления азотной кислотой
Сущность метода [14] состоит в окислении бора до борной кислоты и титровании последней в присутствии маннита.
Необходимые реактивы
1. Едкий натр, 0,1; 0,5 н. и 30%-ный растворы.
2. Соляная кислота, 0,1 н. раствор.
3. Фенолфталеин, 1%-ный спиртовой раствор.
4. Метиловый красный, 0,1%-ный спиртовой раствор.
5. Маннит.
Ход анализа. Навеску бора в количестве 0,02 г помещают в колбу Эрленмейера из прозрачного кварца емкостью 250 жл, ставят на электроплитку, соединяют колбу с обратным холодильником .и приливают 10 мл азотной кислоты (1 : 1). Стенки колбы охлаждают, применяя для этой цели ветошь, смоченную водой. После прекращения выделения бурых паров удаляют ветошь и включают электроплитку. Растворение пробы ведут при умеренном кипячении в течение 30 мин. Раствор охлаждают до комнатной температуры, промывают холодильник дистиллированной водой, добавляют в раствор две-три капли метилового красного и нейтрализуют сначала 30%-ным и 0,5 н. растворами едкого натра, затем добавляют несколько капель 0,1 н. соляной кислоты и точно нейтрализуют 0,1 н. раствором едкого натра. К нейтральному раствору прибавляют 10—15 капель фенолфталеина, около 0,2 г маннита и титруют до появления розовой окраски, не исчезающей от последующего прибавления маннита.
Содержание бора вычисляют по формуле, приведенной выше.
При наличии нерастворимого остатка сплавление ведут, как описано в персульфатом методе определения элементарного бора (см. п. 5).
Точность метода ±0,5% (отн.).
ПО
8. Определение углерода
Методы определения углерода в тугоплавких соединениях основаны на сжигании образца с соответствующим плавнем в токе кислорода при температуре 1250°. Количество образовавшейся двуокиси углерода измеряют различными способами: при помощи эвдиометров, шкала которых рассчитана на содержание 1,5; 0,5 и 0,25% углерода, либо объемным баритовым, кондуктометрическим или потенциометрическим анализом. Вопросы определения углерода в различных тугоплавких соединениях и материалах металлургического производства подробно рассмотрены в литературе [11, 49—52].
Авторы настоящей книги определяли углерод в боре абсорбционно-газообъемным методом из навески 0,05— 0,06 г способом, описанным в гл. V. Применялся эвдиометр с градуировкой 1,5%. Этим методом определялся углерод в количествах от 0,2 до 2%. Допустимые расхождения двух параллельных определений не превышали 0,05—0,1% (абс.).
Для определения малых количеств углерода (менее 0,1%) в большинстве случаев применяют объемный баритовый метод, кондуктометрический, потенциометрический и абсорбционно-газообъемный методы с использованием микроэвдиометра.
Среди физических и физико-химических методов определения углерода заслуживает внимания метод вымораживания [53]. Сущность метода состоит в следующем: двуокись углерода замораживают в капилляре жидким кислородом, затем кислород откачивают диффузионным насосом и дают двуокиси углерода испариться в небольшом сосуде, объем которого известен; на основании создающегося давления вычисляют содержание углерода в навеске образца. Этим способом можно определять 0,5—1 мкг углерода. Плавень при этом проходит особую очистку. Точность определения 0,0005% углерода. Для массовых анализов метод не может быть рекомендован.
Баритовый метод [49—51] считается очень точным и применяется как стандартный для определения углерода в сталях, ферросплавах и других материалах с содержанием 0,1—0,45% углерода [51]. Этот же метод может быть использован для определения углерода в боре.
111
Для титрования избытка Ва(ОН)2 рекомендуется не соляная кислота, которая может растворять чрезвычайно мелкодисперсный осадок углекислого бария, а янтарная кислота, не растворяющая ВаСО3. Результаты получаются более устойчивые [50]. При определении углерода баритовым методом пользуются титром, установленным по стандартному образцу № 126, содержащему 0,013% углерода. Титрованный раствор янтарной кислоты готовят растворением 2,95 г х. ч. реактива в 5 л дистиллированной воды.
В литературе рекомендуется для понижения растворимости ВаСОз вводить этанол [52], а избыток бария титровать комплексоном III по эриохрому черному Т. Метод применим для определения менее 0,05% углерода. По утверждению авторов работы [52], этот метод точнее и проще кислотно-основного титрования, так как позволяет применять более щелочные растворы для поглощения углекислого газа, в которых связывание его протекает более полно.
Широкое распространение для определения малых количеств углерода (0,001—0,1%) получил кондуктометрический метод [51]., Метод дает хорошо воспроизводимые результаты и позволяет определять микроколичества углерода из навесок 0,1 и 0,05 г. Кондуктометрическим титрованием можно определить менее 85 мкг СО2 в пробе [54].
Определение двуокиси углерода по уменьшению электропроводности Ва(ОН)2 можно проводить не кондуктометрическим, а высокочастотным методом [55]. При макроопределении расхождение между параллельными анализами не превышает 1%, при (микроопределении — 5%.
Применение потенциометрического метода с использованием потенциометра П-4 в соединении с ламповым усилителем ЛУ-2 дает возможность определять 8— 10 мкг углерода, что при расчете на навеску 1 г соответствует 0,0008—0,001 % углерода [56]. При определении 5—150 мкг ошибка не превышает 0,001—0,004% (абс.).
Для определения 1 • 10~3% углерода в элементарном боре рекомендуется абсорбционно-газообъемный метод с применением микроэвдиометра со шкалой от 0 до 0.25% углерода [50] или усовершенствованный объемный баритовый метод [50]. Использование этих методов дает 112
возможность переходить от макроопределении к микроопределениям, незначительно изменяя аппаратуру.
Для определения углерода при помощи микроэвдиометра используют аппаратуру, описанную в гл. V и примененную для определения 0,1—2% углерода в боре. При этом эвдиометр со шкалой на 1,5% заменяют микроэвдиометром со шкалой от 0 до 0,25% и вместо однотрубчатой печи для сжигания навески применяют двухтрубчатую печь. Примеси органических соединений, находящихся в кислороде, сгорают в первой трубке, и СО2 улавливается в поглотителях *. В качестве плавня используется окись меди, прокаленная при температуре 850° в муфельной печи в течение 3—4 ч, Содержание углерода в плавне не более 0,001—0,002%.
Вода в микроэвдиометре должна быть заменена раствором, подкисленным серной кислотой, с удельным весом более единицы, Для этой цели может быть применен 20%-ный раствор сернокислой меди, имеющий удельный вес 1,20. Эта замена позволяет удобно и уверенно производить уравнивание менисков жидкости в эвдиометре и уравнительной склянке [50].
Для определения углерода при помоши микроэвдиометра необходимо так отрегулировать поступление кислорода в фарфоровую трубку для сжигания и в эвдиометр, чтобы последний заполнялся газовой смесью не ранее чем через 10—45 мин. Ход определения и расчет при применении абсорбционно-газообъемного метода см. в гл. V. Эвдиометр со шкалой 0—0,25% углерода дает возможность производить отсчеты с точностью до 0,001%. Допустимые отклонения среднего арифметического двух параллельных результатов от действительного содержания не должны превышать следующих величин:
Содержание углерода, % 0.001—0,005 0,005—0,01 0,01—0,05 0,05—0,1 0,1—0,2
Отклонение, % (абс.)
±0,001 ±0,002 ±0,003 ±0,005
±0,01
* Склянка Дрекселя, наполненная 5%-.ным раствором едкого бария, служит для поглощения СО2, содержащегося в кислороде. Склянка с концентрированной серной кислотой применяется для поглощения воды.
8 Анализ бора ИЗ
Установка для определения углерода баритовым методом аналогична описанной в абсорбционно-газообъемном методе (см. гл. V), кроме прибора для поглощения углекислого газа. При выходе газов из печи вместо эвдиометра подключают поглотительный аппарат, состоящий из 10-шариковой трубки (рис. 22).
При применении объемного баритового метода нет необходимости ограничивать объем кислорода для сжигания образца, что очень удобно при анализе трудно или медленно сгораемых материа-лов. Минимально определяе- . - ’ Г мое количество углерода — около 10 мкг. Переход к мень-
Рис. 22. Схема поглоти тельного аппарата.
шим количествам ограничен величиной поправки в «холостом» опыте, которая становится соизмеримой с определяемым количеством углерода.
Ход анализа,/ Поглотительный сосуд наполняют 20 мл стандартного раствора гидроокиси бария. Разогревают печь до температуры 1250° и пропу£кают кислород в течение 5 мин, чтобы вытеснить из прибора весь воздух. Скорость пропускания кислорода должна быть такой, чтобы можно было пересчитать пузырьки газа в сосудах очистительной системы. Через 10—15 мин открывают пробку поглотительного сосуда [50, 51] и, не прекращая подачи кислорода, тут же титруют избыток раствора едкого бария раствором янтарной кислоты до исчезновения розовой окраски фенолфталеина.
Для проверки точности титрования к раствору в резервуаре прибавляют одну-две капли раствора едкого бария; появление розового окрашивания указывает на правильно проведенное титрование.
Содержание углерода вычисляют по формуле
П /оп_
V с х 70 ) “ -------------- ,
п
Т — титр 0,01 н. раствора Ва(ОН)2, выраженный в граммах углерода, г/мл\ V — объем раствора Ва(ОН)2,
114
взятого на титрование, мл; V\ — объем раствора янтарной кислоты, израсходованного на титрование избытка Ва(ОН)2, мл; с — количество миллилитров Ва(ОН)2, соответствующее 1 мл янтарной кислоты; b — величина поправки «холостого» опыта; К — коэффициент нормальности Ва(ОН)2; п — навеска, г.
9. Определение серы
Свойства сульфидов бора изучены очень мало [1]. Способы определения серы в элементарном боре не описаны в литературе.
Нами проверена возможность определения серы методом отгонки в виде сероводорода (по Шульте [11, 47]) и методом сжигания пробы в токе кислорода [11, 47, 49]. Как показали результаты опытов, при растворении пробы в соляной кислоте (по Шульте) образования сероводорода не наблюдается. Таким образом, сера в элементарном боре присутствует либо в виде сульфидов, не разлагаемых соляной кислотой, либо в виде других соединений. Определение серы в элементарном боре рекомендуется проводить методом сжигания из навески 0,1—0,15 а.
Вопросы определения малых количеств серы (1 • 10-4%) подробно рассмотрены в соответствующей литературе [50]. Наибольшего внимания заслуживала проверка методов определения серы, почти не требующих применения особо чистых реактивов. К ним в первую очередь относятся методы, основанные на сжигании навески в токе кислорода с последующим улавливанием и определением выделяющегося сернистого газа. Рекомендуется для определения серы в железе, чугуне и хроме применять сернокислый парафенилендиамин. Чувствительность метода 1,5*10"4% серы. Определение серы в боре указанным методом авторы книги не проводили. По-видимому, применение сернокислого диме-тилпарафенилендиамина для определения серы в боре не должно вызывать затруднений.
10. Определение калия инатрия
Наиболее хорошо изученным и распространенным методом определения калия в различных материалах следует считать хлорплатинатный [11, 27]. Недостатком метода является высокая стоимость реагента.
8* 115
Дипикриламинатный метод [11] получил малое распространение из-за опасности работы с реагентом; перхлоратный метод [11, 27, 46, 57] имеет ряд недостатков, связанных, в частности, с некоторой растворимостью перхлората.
Из других методов наиболее часто применяется ко-бальтинитритный метод [11, 27, 58—60]. В зависимости от величины исходной пробы и содержания в ней калия, а следовательно, от количества полученного осадка гексакобальтинитрита калия-натрия определение заканчивается весовым [43], объемным [27, 59] или колориметрическим [58, 61] методом. Метод недостаточно точный, что связано с непостоянством состава осадка в зависимости от состава исходной пробы и условий осаждения. Применительно к бору весовой и объемный методы определения калия в виде кобальтинитрита натрия положительных результатов не дали. В работе других авторов [62] показано, что при определении калия в виде K2Na[Co(NO2)6] осадок стехиометрического состава не может быть получен, так как он представляет собой смешанные кристаллы, в решетке которых калий и натрий легко замещают друг друга.
В последнее время широкое распространение получил способ определения калия с тетрафенилборатом натрия [Г1, 63—69]. Сравнительное изучение известных методов определения калия осаждением с помощью тетрафенилбората натрия показало [66], что оптимальными условиями осаждения являются: pH 4,2—4,4 (подкисление раствора 10%-ной СН3СООН по метиловому красному); комнатная температура; продолжительность выдерживания раствора с осадком перед фильтрованием 10 мин; промывная жидкость — насыщенный раствор тетрафенилбората калия. Установлено также [67], что тетрафенилборат натрия осаждает количественно калий при концентрации последнего 10 мкг!мл в случае, если анализ заканчивается цериметрическим титрованием зетрафенилборат-иона. Ошибка определения колеблется от нескольких процентов до 30%. В случае растворения КВ(С6Н5)4 в ацетоце и фотометрирования окраски, образуемой бором с} карминовой кислотой [68], ошибка определения составляет меньше 6%.
Наиболее быстрым и приемлемым методом для определения калия и натрия по сравнению с другими, опи-116
санными в литературе 'методами является метод фотометрии пламени [69, 70]. Щелочные металлы легче других возбуждаются в пламени, и техника фотометрии отличается сравнительной простотой, быстротой определения, хорошей воспроизводимостью результатов, несложностью аппаратуры и достаточно высокой точностью [69, 70]. Применение пламенной фотометрии для определения калия и натрия позволяет обойтись без удаления борной кислоты. Авторами книги была проверена возможность определения калия и натрия в боре указанным 'методом и найдены условия проведения анализа применительно к бору, полученному электролитическим и натрий-термическим методами.
Достаточно точным химическим методом определения натрия следует считать способ осаждения его в виде соли (UO2)3ZnNa(СН3СОО)9 • 6Н2О [11, 27, 49]. Присутствующие в боре примеси осаждению натрия этим методом не мешают.
Определение калия и натрия методом фотометрии пламени [68, 70]
Принцип метода фотометрии пламени следующий: анализируемый раствор посредством сжатого воздуха или кислорода распыляется в мелкую взвесь-аэрозоль и
Рис. 23. Стеклянная горелка с распылителем:
/ — трубка для подачи анализируемого раствора; 2 — трубка для подачи сжатого воздуха; 3 — распылитель; 4 — камера; 5 — сток избыточного раствора; 6 — трубка для подачи горючего газа; 7 — горелка.
в таком виде попадает в горелку (рис. 23), работающую на горючем газе (ацетилене, светильном газе и т. п.). Если в растворе присутствуют легко возбуждаемые элементы, то возникает характерное излучение, и пламя
117
окрашивается. Так, соль натрия окрашивает пламя в желтый цвет, соль калия — в сиреневый и т. д.
Излучение пламени проходит через светофильтры или спектроскоп-монохроматор, который пропускает излучение определяемого элемента и задерживает излучение других элементов, попадает на фотоэлемент, преобразующий световую энергию в электрическую. Полученный ток измеряется гальванометром высокой чувствительности. Величина фототока пропорциональна интенсивности излучения, которая, в свою очередь, зависит от концентрации определяемого элемента в растворе.
Общий вид и схема установки для фотометрии пламени показаны на рис. 24 и 25.
Необходимая аппаратура. Для проведения анализа по методу фотометрии пламени предложено несколько приборов.
1. Спектрограф. В кассетной части помещают пластинку со щелью, через которую проходит лишь излучение с длиной волны определяемого элемента. За щелью в светонепроницаемой коробке устанавливают фотоэлемент.
2. Спектроскоп-монохроматор. Через его выходную щель можно выделить излучение света любой длины волны при помощи барабана, поворачивающего призму монохроматора.
3. Фильтровые фотометры. Выделение нужного излучения производится при помощи светофильтров, окрашенных стекол, пленок или каких-либо иных сред.
Наиболее прост и удобен в работе спектрофотометр, собранный из монохроматора, фотоумножителя и гальванометра. Так как при анализе элементарного бора на содержание примесей методом фотометрии пламени определяют только калий и натрий, то для этого удобнее всего применять фильтровые фотометры ввиду простоты их устройства и дешевизны.
Для питания фотоумножителей нужен ток высокого напряжения (700—2000 в). Выводы фотоумножителя подаются через регулятор чувствительности на зеркальный гальванометр. J
Для определения калия используется фотоумножитель типа ФЭУ-22 с кислородно-цезиевым катодом. Натрий определяют при помощи фотоумножителя типа ФЭУ-19 или ФЭУ-17 с сурьмяно-цезиевым катодом. Ме-
118
Рис. 24. Общий вид установки для фотометрии пламени.
Рис. 25. Схема установки для фотометрии пламени:
1 — анализируемый раствор; 2 — распылитель; 3 — трубка для подачи сжатого воздуха; 4 — сток избыточного раствора; 5 — трубка для подачи горючего газа; 6 — горелка; 7 — пламя; 8 — светофильтр; 9 — фотоэлемент; 10 — зеркальный гальванометр; 11 — осветитель;
12 — шкала гальванометра.
нее чувствителен, но все же достаточно пригоден для определения натрия ФЭУ-22.
Необходимые реактивы
1. Хлористый натрий.
2. Хлористый калий.
3. Соляная кислота, 0,5-н. раствор.
4. Азотная кислота, концентрированная.
5. Пергидроль.
Приготовление стандартных растворов. Для приготовления исходного стандартного раствора навеску хлористого натрия (0,6353 г) или хлористого калия (0,4767 г) растворяют в дистиллированной воде в мерной колбе емкостью 250 мл. Стандартный раствор содержит 1 мг!мл натрия или калия.
Стандартные растворы готовят с содержанием 0; 2,5; 5; 10 мкг!мл натрия или калия при содержании их в пробе до 3%. Таким образом, шкала стандартных растворов следующая:
Момер раствора..........* .... 1
Объем исходного стандартного раствора (100 мкг/мл), мл.............. 0,25
Содержание калия или натрия, мкг 2,5
Объем дистиллированной воды, мл 9,75
2 3
0,5 1
5 10
9,5 9,0
Подготовка пробы к анализу. Навеску пробы в количестве 0,5 г помещают в платиновую чашку (или кварцевую), добавляют постепенно 10 мл азотной кислоты (1:2) и примерно такое же количество пергидроля. После прекращения бурной реакции чашку помещают на песчаную баню и выпаривают ее содержимое досуха. Сухой остаток смывают водой и вновь выпаривают досуха, после чего сухой остаток растворяют в воде и фильтруют два раза. Раствор переносят в мерную колбу емкостью 25 мл и разбавляют водой до метки.
Ход анализа. Подают свежий воздух в распылитель (давление распыляющего газа — воздуха — выбирают в пределах 0,7—1,0 атм) и горючий газ в горелку и зажигают пламя. (В случае применения спектрофотометра после включения последнего и подачи питания на фотоумножитель устанавливают ширину входной и выходной щелей 0,1 мм и затем зажигают горелку.)
Регулируют пламя таким образом, чтобы оно было постоянным (конус пламени должен быть вытянутым и неколеблющимся). Для юстировки положения горелки
120
ее передвигают поперек оптической оси прибора, вводя в пламя раствор соли калия. Наблюдают фототок по шкале гальванометра. Горелку закрепляют в положении, при котором наблюдается максимальный отсчет. Затем определяемую спектральную линию наводят точно на выходную щель. Для этого, пользуясь шкалой на барабане монохроматора, устанавливают барабан на нужную длину волны света (длина волны калия равна 766,0—• 769,6 ммк). Затем в пламя вводят раствор соли калия
Рис. 26. Графический расчет при работе по методу ограничивающих растворов.
Рис. 27. Графический расчет при работе по методу добавок.
(например, в концентрации 20; 60; 100 мкг/мл), медленно поворачивают барабан монохроматора и находят положение, при котором отсчет по гальванометру будет максимальным. После этого устанавливают указатель гальванометра на нуль.
Анализируемый раствор вводят в распылитель и фо-тометрируют, проводя отсчет, когда указатель гальвано-метра*остановится. Прекращают подачу раствора в пламя и, когда указатель гальванометра возвратится в исходное положение, проверяют нулевую точку.
При переходе к анализу следующего раствора ополаскивают распылитель дистиллированной водой в течение 3—4 сек. Повторяют отсчет в обратном порядке (т. е. от больших концентраций к меньшим) и берут среднее из двух отсчетов. Те же операции повторяют для стандартных растворов, один из которых дает меньший, а другой больший отсчет, чем раствор пробы.
Концентрацию калия в пробе определяют графическим путем (рис. 26); здесь ось абсцисс соответствует
121
концентрации, ось ординат — показаниям гальванометра.
На график наносят точки, соответствующие стандартным растворам, и соединяют их прямой линией АВ. На оси ординат откладывают отрезок ОС, соответствующий отсчету гальванометра для раствора пробы, и проводят через точку С линию CD параллельно оси абсцисс. Опустив из точки D перпендикуляр на ось абсцисс, определяют расстояние ОС, которое и является концентрацией раствора по графику.
При наличии серии проб, сильно отличающихся по составу (для которых пришлось бы готовить различные по содержанию добавочных веществ стандартные растворы), часто пользуются методом добавок. Здесь стандартом является добавка определяемого элемента, которая находится в тех же условиях, что и анализируемое вещество в пробе. Скачала раствор пробы готовят несколько более концентрированным по сравнению с тем, который будет'фотометрироваться (например, в два раза). Далее три одинаковые порции его, например по 5 мл, разливают в стаканчики. Ко второй и третьей порциям прибавляют определяемый элемент в таком количестве, чтобы конечные концентрации добавок составляли 5 и 10 мкг! мл, и разбавляют водой до объема 10 мл. Фотометрируют все три раствора, определяют в одном из них величину фона для поправки отсчетов гальванометра. Содержание элемента в пробе находят методом интерполирования.
Концентрацию определяемого элемента находят графическим путем (рис. 27): откладывают по оси ординат отрезок-ОД, равный отсчету гальванометра для раствора пробы, и строят точки В и С, соответствующие? отсчетам гальванометра для растворов с добавками 5 и 10 мкг/мл элемента. Проводят через точки Л, В, С прямую линию и продолжают ее до пересечения с осью абсцисс в точке D. Величина OD и есть искомая концентрация раствора пробы. Точки Л, В, С должны лежать на прямой линии, если существует прямо пропорциональная зависимость между интенсивностью излучения и концентрацией.
При определении по методу добавок необходимо установить величину фона вблизи аналитической линии и определить поправку для отсчетов гальванометра.
122
Метод особенно пригоден для определения следов элементов в присутствии больших количеств посторон-Ж них веществ при малой величине пробы.
Содержание калия в пробе определяют по формуле
£ QK(%) = ^^-ioo =
F n-10-2 «
# где a — концентрация определяемого элемента, найден-fe ная графическим путем, мкг/мл-, п — навеска бора, г.
Чувствительность определения калия в этих усло-Ц* виях составляет 0,001 мкг!мл. Чувствительность опре-деления натрия очень высока, однако она ограничи-вается концентрацией следов натрия, находящегося в ^воздухе.
В Влияние посторонних металлов меньше всего сказы-Ц-.чвается при использовании пламени светильного газа.
& Тетрафенилборатный метсд определения калия [11]
| Тетрафенилборат натрия в нейтральных и слабо-gt кислых растворах образует с ионом калия осадок тет-Р рафенилбората калия КВ(СбН5)4. Осаждение калия Й. можно производить в кислых растворах (pH около 1) в ft присутствии любых количеств натрия, магния и каль-Ц ция. Осаждение калия может быть также выполнено в К щелочной среде (pH 8—9) в присутствии комплексона КIII, образующего с кальцием и магнием комплексы, не Ц осаждающиеся тетрафенилборатом.
ft Приготовление необходимых реактивов см. п. 14 на-fe стоящей главы.
|Ход анализа в кислой среде. В анализи-уемый раствор добавляют соляную кислоту (1:1), тобы кислотность раствора была приблизительно 0,1 н. ^атем на холоду добавляют избыток 3%-ного водного аствора NaB(C6Hs)4. Раствор перемешивают для уско-ения выпадения осадка. Осадок выпадает в виде круп-ых бесцветных кристаллов. Через 10—15 мин после саждения осадок фильтруют через стеклянный фильтр-игель № 3 с пористым дном и промывают несколько аз насыщенным раствором КВ(СбН5)4. Чистой водой ромывать осадок нельзя, так как растворимость тет-афенилбората калия в 100 мл воды составляет 0,578 мг ри 20°.
123
Тигель с промытым осадком высушивают при 120— 130°. Выше этой температуры осадок разлагается.
Переводной множитель на калий равен 0,1091.
Точность определения ±5—10% (отн.).
Ход анализа в щелочной среде. К 200 лм раствора добавляют одну-две капли 1%-ного раствора фенолфталеина, 250 мг сухого комплексона III для связывания в комплекс кальция и магния, по каплям 0,1 н. раствор едкого натра до красной окраски фенолфталеина (pH 8—8,5) и затем 10 мл 3%-ного водного раствора NaB(C6H5)4.
Осадок тетрафенилбората калия отделяют и несколько раз промывают промывной жидкостью, затем высушивают при 120° до постоянного веса.
Точность определения ±5—10% (отн.).
Определение натрия (объемный и весовой методы) [49]
Натрий осаждают, добавляя уранилацетат, из нейтральной или слабоуксусной среды в виде труднорастворимого соединения желтого цвета состава NaZn(UO2)3(CH3COO)9 • 6Н2О. Затем шестивалентный уран, входящий в состав соединения, восстанавливают до четырехвалентного металлическим алюминием в сернокислом растворе. Определение заканчивают титрованием перманганатом калия восстановленных соединений урана.
Реакция протекает по следующим уравнениям:
NaCl + Zn (СН3СОО)2 + 3UO2 (СН3СОО)2 4г СН3СООН -- NaZn (UO2)3 (СН3СОО)9 + НС1;
2NaZn (UO2)3 (СН3СОО)9 + 9H2SO4 - 6UO2SO4 + + Na2SO4 + 2ZnSO4 + 18CH3COOH;
UO2SO4 + H2SO4 + H2 =-- 2H2O 4- U (SO4)2 — реакция вос
становления;
U (SO4)2 + О + НД= UO2SO4 4- H2SO4 — реакция окисления.
124
Необходимые реактивы
Л. Этиловый спирт, абсолютный.
2. Диэтиловый эфир, обезвоженный.
3. Уксуснокислый уранил.
4. Уксуснокислый цинк.
5. Уксусная кислота, ледяная.
6. Хлористый натрий, 0,1 н. раствор.
7. Серная кислота (1 : 5).
8. Марганцовокислый калий, 0,1 н. раствор.
Ход анализа. Навеску бора в количестве 0,05— 0,06 г помещают в платиновый тигель или чашку и обрабатывают азотной кислотой (1:2) с добавлением перекиси водорода. После посветления раствора его упаривают досуха. Сухой остаток обрабатывают 10 мл цинк-уранилацетата и 3 мл этилового спирта. Для ускорения осаждения раствор тщательно перемешивают плексигласовой палочкой (особенно в случае малых количеств натрия) и оставляют стоять не менее часа (на ночь оставлять нельзя). Осадок фильтруют через пористый стеклянный фильтр № 4, отсасывают водоструйным насосом, промывают промывной жидкостью три раза (по 2 мл), смывая при этом стенки тигля и каждый раз хорошо отсасывая раствор, затем промывают два раза эфиром (по 2 мл) и отсасывают раствор до удаления запаха эфира.
При весовом методе определения натрия далее поступают следующим образом: тигель вытирают снаружи слегка влажной тканью и помещают в эксикатор на 10—15 мин, после чего взвешивают. Высушивание и взвешивание повторяют до установления постоянного веса.
Содержание натрия вычисляют по формуле
^Na (%)
(« — 6)-0,01495-100
где 0,01495 — пересчетный коэффициент на натрий; а — вес осадка, г; b — вес осадка для «холостого» опыта, г; п — навеска, г.
Точность метода ±0,01 — 0,02% (абс.).
При объемном методе определения натрия поступают следующим образом: осадок с тигля смывают горячей водой в стакан емкостью 500 мл, тигель помещают в другой стакан, заливают 30 мл серной кислоты (1 : 5)
125
и кипятят 2—3 мин. Затем тигель вынимают из стакана, смывают водой, раствор сливают в первый стакан, добавляют несколько капель 0,1 н. раствора перманганата калия до светло-розовой окраски, помещают в этот же раствор спираль из алюминиевой проволоки и кийятят его в течение 1 ч для восстановления шестивалентного урана до четырехвалентного (окраска раствора приобретает темно-зеленый цвет). При этом раствора остается приблизительно 30 мл.
Не удаляя спирали, быстро охлаждают раствор в токе воды, удаляют спираль, хорошо ополаскивают дистиллированной водой и титруют раствором перманганата калия. Параллельно ведут «холостой» опыт.
Содержание натрия вычисляют по формуле
(%) -.
I •»
где Т — титр раствора перманганата калия, выраженный в граммах натрия (1 мл 0,1 н. раствора перманганата калия соответствует 0,000384 г натрия), г)мл\ V — объем раствора перманганата калия, израсходованного на титрование пробы, мл; Vo — объем раствора перманганата калия, израсходованного на титрование «холостого» опыта, мл; К — коэффициент нормальности раствора перманганата калия; п — навеска, г. ""
Метод позволяет определять натрий в количествах 0,005—0,1% из навески 0,5—4 г.
Точность метода при содержании натрия 0,005— 0,03% составляет ±0,003% (абс.), при содержании натрия 0,04—0,1% равна ±0,01—0,02% (абс.).
Примечание. Этим же способом проводится определение натрия, находящегося в виде растворимых соединений. В этом случае обрабатывают пробу следующим образом: навеску бора в количестве 0,1 г помещают в стакан емкостью 100 мл и добавляют 10 мл концентрированной соляной кислоты. Содержимое стакана выпаривают досуха, добавляют 20 мл дистиллированной воды и 4 мл уксусной кислоты (для коагуляции коллоидного бора). Раствор фильтруют через плотный фильтр, осадок на фильтре промывают небольшим количеством дистиллированной воды, подкисленной уксусной кислотой (1—2 мл 98%-ной уксусной кислоты на 100 мл воды). Фильтрат переносят в стакан емкостью 50 мл и выпаривают досуха. Затем добавляют 1 мл дистиллированной воды, 10 мл цинкуранилацетата и 3 мл спирта. Раствор тщательно перемешивают и определение натрия проводят, как описано выше, 126
11. Определение кремния, железа, алюминия, никеля, кальция, магния без удаления борной кислоты
Наиболее перспективным методом определения примесей является комплексонометрический [29, 71, 72], который дает возможность определять несколько элементов из одной навески, что сокращает продолжительность анализа и уменьшает расход пробы на анализ. Для определения примесей в элементарном боре был выбран комплексон III.
Присутствие борной кислоты может создавать помехи при комплексонометрическом титровании определяемого элемента, так как известно, что борная кислота способна образовывать с некоторыми элементами комплексы. Прочность этих комплексов должна быть меньше прочности комплекса элемента с комплексоном III. В противном случае применение комплексонометрического титрования окажется невозможным. Проверка на растворах чистых солей, к которым была добавлена борная кислота, показала, что борная кислота не мешает титрованию железа, алюминия, магния и никеля комплексоном III.
Ход определения в таком случае следующий: пробу бора растворяют в азотной кислоте и выделяют кремне-кислоту. Раствор делят на две аликвотные части, в одной из которых определяют железо и алюминий, а в другой— никель, кальций и магний после предварительного выделения одного из этих элементов. Поскольку комплексонометрическому титрованию магния по эрпохрому черному Т мешает присутствие следов железа, предполагается предварительное осаждение магния в виде магнийаммонийфосфата.
Таким образом, комплексонометрическое титрование никеля и кальция проводят из одного раствора, учитывая, что в растворе присутствуют также ионы железа и алюминия. (Железо и алюминий очень удобно маскировать триэтаноламином. Маскирование с этим реактивом особенно благоприятно при последующем титровании с мурексидом). Установлено, что в условиях титрования никеля хорошо титруется кальций и, таким образом, при титровании по мурексиду определяется сумма никеля и кальция. Так как при титровании каль
127
ция единственно надежным маскирующим средством для никеля является KCN (Яд!), целесообразно выбрать следующий путь определения: из одной аликвотной части раствора определяют сумму кальция и никеля, а из другой — только никель после маскирования кальция фтористым натрием.
На искусственных смесях проверка описанного хода анализа дает положительные результаты, но при переходе к анализу элементарного бора в случае титрования никеля и магния комплексоном III наблюдается нечеткий переход окраски индикатора в эквивалентной точке. Удаление борной кислоты положения не меняет. Поэтому для получения надежных результатов рекомендуется предварительно выделять никель в виде диметилглиок-симата никеля, кальций — в виде оксалата кальция, магний — в виде магнийаммонийфосфата с последующим объемным определением перечисленных элементов. Так как присутствие фосфатов затрудняет комплексоно-метрическое титрование магния, объемное определение магния осуществляют растворением осадка в соляной кислоте с последующим титрованием избытка соляной кислоты едким натром.
Определение кальция в оксалате кальция титрованием перманганатом дает более надежные результаты, чем комплексонометрическое титрование по мурексиду* так как переход окраски в эквивалентной точке отчетли-4 вый и титрование можно проводить разбавленным раствором перманганата.
Никель определяют титрованием комплексоном III по мурексиду после растворения осадка диметилглиок-симата никеля в соляной кислоте.
Последовательное титрование железа и алюминия в присутствии борной кислоты не вызывает затруднений, переход индикатора в эквивалентной точке достаточно резкий.
Как указывалось ранее, определению кремния борная кислот^ мешает, так как адсорбция последней приводит к завышенным результатам по кремнию. Было установлено, что при содержании кремния 0,1 — 1 % и навеске пробы 0,5 г заметной адсорбции не наблюдается и после промывания осадка он не содержит борной кислоты.
Рассматриваемый далее способ определения в боре примесей кремния, железа, алюминия, никеля, кальция
128
и магния был проверен путем добавок определяемых элементов к бору. Результаты сравнивались с данными анализов, полученных спектральным методом и методом определения примесей после удаления борной кислоты. Авторы книги пользовались общепринятыми методами определения кремния, железа, алюминия, никеля, кальция и магния в различных материалах [11, 27— 29, 46, 47, 49, 71—73], предварительно уточнив их и применив для анализа элементарного бора.
Определение кремния
Метод основан на способности кремния в результате гидролиза количественно выделяться в осадок в виде малорастворимой кремневой кислоты, которую обезвоживают выпариванием. Нерастворимый гидрат окиси кремния прокаливанием переводят в SiC>2 и взвешивают.
Уравнение реакции
H4SiO4 -> H2SiO3 + Н2О -> SiO2-xH2O.
Необходимые реактивы
1. Азотная кислота, 1 : 2.
2. Соляная кислота, концентрированная и 0,1 н. раствор.
Ход анализа. Навеску бора в количестве 0,5 г помещают в стакан емкостью 250 мл и добавляют постепенно 20—25 мл азотной кислоты (1 :2). После прекращения буркой реакции раствор нагревают на песчаной бане до его посветлекия. Нерастворимый остаток отфильтровывают и сплавляют в платиновом тигле с углекислым калием-натрием. Раствор после выщелачивания плава соединяют с раствором после растворения пробы в азотной кислоте и выпаривают досуха, после чего обрабатывают осадок три раза по 10 мл соляной кислотой, каждый раз выпаривая досуха. К сухому остатку прибавляют 25 мл 0,1 н. соляной кислоты и 50 мл горячей дистиллированной воды. Раствор перемешивают, нагревают 5—10 мин и горячим фильтруют через беззольный фильтр средней плотности. Осадок на фильтре промывают горячей водой до отрицательной реакции на ион хлора. Фильтр с осадком кремневой кислоты переносят во взвешенный платиновый тигель и осторожно озоляют, не давая бумаге вспыхнуть. Осадок
9 Анализ Сора 129
прокаливают при температуре 1000° в течение 40— 50 мин, затем взвешивают и вновь прокаливают до постоянного веса.
Содержание кремния вычисляют по формуле
Qsi(%) =
а-0,469-100
п
где а — вес тигля с прокаленным осадком двуокиси кремния, г; 0,469 — коэффициент пересчета с двуокиси кремния на кремний, г; п — навеска, г.
Точность определения ±10% (отн.).
Фильтрат после отделения кремнекислоты делят на две аликвотные части (100 и 150 мл), в одной из которых определяют железо и алюминий, а в другой — никель, кальций и магний.
Определение железа
Метод основан на образовании комплексных соединений Fe3+ с комплексоном III. Реакция протекает по схеме
М3+ + H2Enta2~ - MEnta- + 2Н+
В качестве индикатора применяют сульфосалицилат натрия. В начале титрования индикатор связывается в красно-фиолетовый комплекс с ионами железа. В конце титрования концентрация’ ионов железа резко падает, поэтому наблюдается цвет свободного индикатора (желтый).
Необходимые реактивы
1. Комплексон III, 0,05 и 0,005 М растворы.
2. Соляная кислота, 1 н. раствор.
3. Сульфосалицилат натрия, 10%-ный раствор.
Ход анализа. К аликвотной части раствора (100 мл) после отделения кремнекислоты прибавляют 6 мл 1 н. соляной кислоты, нагревают раствор до 50— 60°, прибавляют 1 мл 10%-ного раствора сульфосалицилата натрия и медленно титруют 0,05 М раствором комплексона III до исчезновения красно-фиолетовой окраски сульфосалицилата железа; 1 мл 0,05 М раствора комплексона III соответствует 0,002792 г железа.
Содержание железа вычисляют по формуле
QFe(%) = ^2-,
п.
130
где Т — титр комплексона III, выраженный в граммах железа, г! мл; V — объем раствора комплексона III, израсходованного на титрование, мл; п — навеска пробы, содержащаяся в аликвотной части раствора, г.
Точность определения ±5—10% (отн.).
Определение алюминия
Метод основан на образовании комплексного соединения алюминия с комплексоном III. Титрование раствО’ ра проводят в присутствии пиридина по эриохрому черному Т.
Необходимые реактивы
1. Комплексон III, 0,05 или 0,005 М раствор.
2. Хлористый цинк, 0,05 или 0,005 М раствор.
3. Пиридин.
4. Эриохром черный Т, 0,5%-ный спиртовой раствор.
Ход анализа. В раствор после титрования железа вводят точно отмеренный объем 0,05 М раствора комплексона III в количестве, превышающем эквивалентное по алюминию на 2—10 мл, прибавляют три — пять капель индикатора эриохрома черного Т, 3—5 мл пиридина и титруют хлористым цинком до перехода окраски раствора из синей в сине-фиолетовую. Отдельно устанавливают соотношение между растворами комплексона III и хлористого цинка; 1 мл 0,05 М раствора комплексона III соответствует 0,001349 г алюминия.
Содержание алюминия вычисляют по формуле
п
где Т — титр раствора комплексона III, выраженный в граммах алюминия, г/мл; V — объем раствора комплексона III, добавленного в пробу, мл; Vi — объем раствора хлористого цинка, израсходованного на титрование избытка комплексона III, мл; с — количество миллилитров комплексона III, соответствующее 1 мл раствора хлористого цинка; п — навеска пробы, содержащаяся в аликвотной части раствора, мл.
Точность определения ±5—40% (отн.).
Определение никеля
Метод основан на осаждении никеля в виде диметил-глиоксимата никеля с последующим растворением осадка в соляной кислоте и комплексонометрическом титровании никеля по мурексиду.
9*
131
Реакция осаждения выражается уравнением н3с—с—с—сн3
NiCl2 + 2 || || + 2NH4OH =
HON NOH
Необходимые реактивы
1. Диметилглиоксим, 1%-ный спиртовой раствор.
2. Соляная кислота, 9 н. раствор.
3. Комплексон III, 0,05 или 0,005 М раствор.
4. Аммиак, 25%-ный водный раствор.
5. Мурексид, смесь с хлористым натрием (1:99).
Ход анализа. Аликвотную часть раствора (150 мл) нагревают до кипения, прибавляют одну-две капли 0,1%-ного раствора метилового оранжевого и по каплям аммиак до перехода окраски раствора в жел-» тый цвет, после чего добавляют еще две-три капли аммиака. Раствор ставят на горячую песчаную баню на 10—15 мин. Затем осадок гидроокисей железа и алюминия отфильтровывают и промывают горячей водой два-три раза.
Раствор после отделения железа и алюминия нагревают до 70—80°, прибавляют 1 мл аммиака и 10 мл 1%-ного спиртового раствора диметилглиоксима. Осадок отфильтровывают через 2 ч. (При содержании никеля более 0,3% фильтровать можно через 15 мин. При содержании никеля 0,1—0,2% можно прибавлять к раствору перед осаждением диметилглиоксимата точно отмеренное количество никеля, например 1 мл раствора, содержащего 0,005 г никеля. В этом случае фильтровать раствор можно через 15 мин.)
Осадок на фильтре промывают горячей водой и затем растворяют на фильтре в 20 мл 9 н. соляной кисло
132
ты. Раствор выпаривают досуха, к сухому остатку добавляют 50 мл дистиллированной воды, мурексид, 10 мл аммиака и титруют никель комплексоном III до перехода окраски раствора из желто-кирпичной в фиолетовую; 1 мл 0,05 М раствора комплексона III соответствует 0,002934 г никеля.
Содержание никеля вычисляют по формуле
где Т — титр комплексона III, выраженный в граммах никеля, г/мл; V — объем раствора комплексона III, израсходованного на титрование, мл; п — навеска пробы, содержащаяся в аликвотной части раствора, г.
Точность определения ±5% (отн.).
Определение кальция
Метод основан на осаждении кальция в виде оксалата кальция, растворении осадка и титровании оксалата перманганатом калия.
Реакции протекают по уравнениям
Са2+ + С2О2" + Н2О -> СаС2О4 • Н2О;
5Н„С„О4 4- 2КМпО4 + 3H,SO4 = K,SO4 +
+ 2MnSO4 + 10CO2 -b 8H2O.
Необходимые реактивы
1. Соляная кислота, концентрированный раствор.
2. Аммоний щавелевокислый, насыщенный раствор.
3. Аммиак, 25%-ный водный раствор.
4. Перманганат калия, 0,1 и 0,01 н. растворы.
5. Серная кислота, 10%-ный раствор.
6. Метиловый оранжевый, 0,1%-ный водный раствор.
Ход анализа. Раствор после отделения никеля упаривают до объема 60—70 мл, подкисляют соляной кислотой по метиловому оранжевому, нагревают до 70— 80° и приливают к нему 3—5 мл насыщенного раствора щавелевокислого аммония. Затем к раствору добавляют по каплям аммиак до слабого запаха аммиака. Раствор с осадком кипятят в течение 10—15 мин, охлаждают и через 2 ч фильтруют через бумажную массу. Осадок промывают водой до отсутствия помутнения с AgNOj.
133
Затем осадок на фильтре растворяют в 50 мл 10%-ной серной кислоты (63 мл серной кислоты уд. веса 1,84 + + 937 мл воды), приливают 50 мл горячей воды, нагревают раствор до 70—80° и титруют перманганатом калия до появления розовой окраски. К оттитрованному раствору присоединяют бумажную массу с фильтра, промывают воронку водой и продолжают титрование до появления розовой окраски раствора; ’1 мл 0,01 н. раствора КМпО4 соответствует 0,0002007 г кальция.
Содержание кальция вычисляют по формуле
TI//G100
где Т — титр раствора перманганата калия, выраженный в граммах кальция, г/мл\ V — объем раствора перманганата калия, израсходованного на титрование, мл\ К — коэффициент нормальности комплексона III; п — навеска пробы, содержащаяся в аликвотной части раствора, е:
Точность определения ±10% (отн.).
Определение магния
Метод заключается в осаждении магния в виде маг-нийаммонийфосфата с последующим растворением осадка в соляной кислоте и титровании избытка кислоты едким натром. Реакции протекают по уравнениям
Mg2+ + NH+ + РО34“ + 6Н2О - MgNH4PO4- 6Н2О;
MgNH4PO4 + 2НС1 - MgCl2 + NH4H2PO4.
Необходимые реактивы
1. Аммиак, 25%-ный водный раствор.
2. Фосфорнокислый аммоний, двузамещенный, 10%-ный раствор.
3. Соляная кислота, концентрированная и 0,1-н. раствор.
4. Едкий натр, 0,1 н. раствор.
5. Метиловый оранжевый, 0,1%-ный водный раствор.
Ход анализа. В растворе после отделения кальция осаждают магний в виде магнийаммонийфосфата, для чего к раствору прибавляют 5 мл концентрированной соляной кислоты и 10 мл двузамещенного фосфата аммония. Затем медленно добавляют при перемешива
134
нии 20—30 мл (около !/з объема) аммиака, перемешивают еще 1—2 мин и оставляют в холодном месте на 12 ч (на ночь).
Раствор фильтруют через плотный фильтр (синяя лента), осадок промывают 10—15 раз 25%-ным раство-4 ром аммиака. Фильтр высушивают, помещают в стакан, в котором проводилось осаждение, приливают 5—10 мл (в зависимости от содержания магния) 0,1 н. соляной кислоты. Разрывают фильтр стеклянной палочкой, омывают стенки стакана водой, доводят объем раствора до 100—150 мл дистиллированной водой, прибавляют две- три капли метилового оранжевого и титруют избыток кислоты 0,1 н. раствором едкого натра до желтой окраски; 1 мл 0,1 н. соляной кислоты соответствует 0,001216 г магния. Содержание магния вычисляют по формуле
, /о/\- ^(Vi-V2.)^100
Mg /о) - -------
где Т — титр раствора соляной кислоты, выраженный в граммах магния, г!мл\ Vi — объем раствора соляной кислоты, прибавленной к пробе, мл\ V2— объем раствора едкого натра, израсходованного на титрование избытка соляной кислоты, мл\ с — количество миллилитров кислоты, соответствующее 1 мл щелочи; К—коэффициент нормальности раствора кислоты; п — навеска пробы, содержащейся в аликвотной части раствора, г.
Если в анализе употребляется точно 0,1 н. соляная кислота, а щелочь имеет коэффициент нормальности К, то формула принимает следующий вид:
QMg(°/o) =
(У\ — УгК)0,001216-100 п
Точность метода ±10% (отн.).
Примечание. Определение указанных выше примесей можно проводить и из отдельных навесок. В этом случае перед определением железа и алюминия раствор необходимо выпарить досуха, затем растворить сухой остаток в 100 мл дистиллированной воды, прибавить 15—20 мл 1 н. раствора соляной кислоты, сульфосалицилат натрия и титровать, как описано выше. При содержании железа более 1% осаждают гидроокиси прибавлением аммиака до первого помутнения раствора, затем прибавляют одну-две капли концентрированной соляной кислоты до посветления раствора, 15—20 мл 1 н. раствора соляной кислоты, еульфосалицилат натрия и поступают, как описано выше.
135
При определении никеля, кальция и магния из отдельных навесок необходимо предварительно отделить гидроокиси железа и алюминия осаждением их аммиаком или перевести железо и алюминий в комплекс с винной или лимонной кислотой.
12. Колориметрическое определение меди, никеля, железа, алюминия, кальция, магния и кремния
Основы колориметрического анализа изложены в соответствующей литературе [49, 74, 75 и др.]. В боре колориметрическим методом определяют медь, никель, железо, алюминий, кальций, магний и кремний.
Определение меди, никеля и железа
Для колориметрического определения меди предложено большое количество реактивов. Наиболее часто рекомендуются дитизон [11, 50, 74—76] и диэтилдитио-карбамикат натрия [11, 74—81]. Дитизон — более чувствительный реактив. Колориметрическому определению меди с дитизоном мешают большие количества железа, а также ртуть и серебро. Последние два элемента в элементарном боре не присутствуют. Определению меди с диэтилдитиокарбаминатом мешают марганец, никель, кобальт и большие количества железа.
Применение дитиофосфата никеля, пиридино-родани-да, бензоимоксима и ферроцианида для колориметрического определения меди описано в соответствующей литературе [46, 49].
Среди других методов определения меди можно указать способ, основанный на сравнении интенсивностей синей окраски медноаммиачных комплексных соединений и стандартных растворов [48, 49, 82], а также способы определения меди с такими реактивами, как 2,2'-ди-хиколин [83], неокупроин [84], рубеановодородная кислота [85] и др. Все указанные методы значительно уступают методам определения с дитизоном и диэтилдитиокарбаминатом как по чувствительности, так и по точности определения.
Авторами книги была проверена возможность определения меди в боре путем экстракции комплекса меди с диэтилдитиокарбаминатом из аммиачноцитратного буферного раствора [80], а также путем экстракции комплекса меди с дитизоном из слабокислого раствора [74, 75].
136
При содержании меди, никеля и железа 0,1—0,05%’ рекомендуется эти элементы определять из навески 0,02 г путем последовательной экстракции из аммиачно-цитраткого буферного раствора. В этом случае нет не-f обходимости удалять борную кислоту. При колоримет-? рировании раствора на универсальном фотометре ФМ-1 ' в кювете объемом 10 мл с синим светофильтром № 7 надежные результаты получаются, когда меди содержится от 5 до 50 мкг, что составляет 0,02—0,2%. При содержании меди от 1 до 5 мкг, что соответствует 0,004—0,02%, колориметрирование проводят визуальным способом. Увеличив навеску до 0,2 г, можно определить 0,002— 0,02% меди колориметрированием на фотометре ФМ-1 и 0,0004—0,002% —визуальным колориметрированием. Поскольку при анализе изотопного бора увеличение навески нежелательно, так как ведет к расходу дорогостоящего продукта, а также вызывает необходимость дополнительных операций по удалению борной кислоты (при содержании борной кислоты более 0,05 г)мл она выпадает в осадок), при содержании меди менее 0,01% рекомендуется дитизоновый метод. Для одинаковых навесок этот метод более чувствителен, чем метод с ди-. этилдитиокарбамикатом, и дает возможность определять 0,05—0,5 мкг меди в хлороформном слое величиной 0,5 мл. При навеске 0,02 г можно определить 0,0002— 0,002% меди. Увеличение навески до 0,2 г дает возможность определять 0,00002—0,0002% меди. Для определения меди с дитизоном необходимо предварительное удаление борной кислоты. Подробный ход анализа изложен ниже.
Методы колориметрического определения никеля описаны в соответствующей литературе [11, 27, 46, 50, 74, 75, 86]. Наиболее часто определение никеля проводят колориметрированием винно-красного комплексного соединения никеля с диметилглиоксимом. Мешающие элементы (Fe, Сг, Си и др.) связывают в комплексы лимоннокислым аммонием в слабоаммиачной среде, вследствие чего они, за исключением меди, не экстрагируются хлороформом. При последовательной экстракции меди, никеля и железа из аммиачноцитратного буферного раствора [82] операция разрушения комплекса меди с диметилглиоксимом не применяется. Метод последовательной экстракции меди, никеля, железа рекомендуется 137
при содержании никеля 0,1% и более. Навеска в этом случае составляет 0,02 г. Надежные результаты получаются при колориметрировании 5—50 мкг никеля, что составляет 0,02—0,2%. При больших содержаниях колориметрирование проводят из аликвотной части раствора, при меньших переходят к способу визуального колориметрирования из малых объемов. Метод визуального колориметрирования никеля позволяет определять до 0,1 мкг, что от навесок 0,02 и 0,2 г составляет 0,0005 и 0,00005% соответственно. Подробный ход определения никеля изложен ниже.
Сведения о реактивах, обычно применяющихся для колориметрического определения железа, приведены в соответствующей литературе [74, 75]. Чаще других реактивов применяется сульфосалициловая кислота [49— 51, 74, 86—88], о-фенактролин [50, 75, 89, 90], роданид [74, 75] и др.
Наиболее чувствительным и специфическим методом определения железа является колориметрический метод с применением о-фенантролина. Определению железа с о-фенантролином сильно мешает присутствие никеля [50, 75]. Концентрация никеля не должна превышать 2 мкг/мл. Так как в элементарном боре, полученном электролитическим методом, никель является основной примесью, этот метод не может быть рекомендован для определения железа в боре.
При содержании железа 0,1% и более применяют способ определения его с а-нитрозо-р-нафтолом экстракцией железа из аммиачноцитратного буферного раствора. Надежные результаты получаются при колориметрировании 5—50 мкг железа, что составляет 0,02—0,2%. При больших содержаниях железо определяют из аликвотной части раствора, при меньших содержаниях — колориметрическим методом с применением роданида. Последним методом можно определить I—5 мкг железа, что при навеске 0,02 г составляет 0,005—0,02%.
а) Последовательное экстракционно-фотометрическое определение меди, никеля и железа.
Необходимые реактивы
1. Раствор диэтилдитиокарбамината свинца в хлороформе: водный раствор, содержащий 0,2 г диэтилдитиокарбамината натрия, 0,2 г нитрата свинца и 1 г тартрата калия-натрия, нейтрализуют аммиаком по феноловому 138
/ красному и встряхивают с хлороформом. После промы-- вания двумя порциями воды экстракт фильтруют и раз-бавляют хлороформом до 1 л.
п: 2. Бромная вода: «кварцевую» воду насыщают бро-
П МОМ.
р 3. Диметилглиоксим, 1%-ный спиртовой раствор.
% 4. Аммиачноцитратный буферный раствор: 4%-ный
раствор трехзамещенного цитрата натрия, содержащий • в литре 5 мл 0,1%-ного раствора фенолового красного < й нейтрализованный аммиаком по этому индикатору; применяется аммиак 1 : 20; pH = 7,5 ± 0,5.
5. «Кварцевая» вода, полученная перегонкой в кварцевой установке.
6. Соляная кислота, 6—7 и 0,5 н.: соляную кислоту получают перегонкой без нагревания, для чего в эксика-г тор наливают концентрированную соляную кислоту, а на фарфоровую сетку помещают кварцевую чашку с бидистиллятом, перегнанным в кварцевом аппарате.
7. Едкий натр, 30%-ный и 0,1 н. растворы, приготовленные на «кварцевой» воде.
8. Аскорбиновая кислота, 10%-ный водный раствор.
9. а-Нитрозо-р-нафтол, 1 г/л с прибавлением на литр раствора 120 мл 0,1 н. раствора едкого кали.
10. Изоамиловый спирт.
11. Хлороформ.
12. Феноловый красный, 0,1%-ный водный раствор.
13. Стандартный раствор меди, содержащий 1 мг меди в 1 мл раствора: навеску невыветрившихся прозрачных кристаллов сернокислой меди CuSO4-5H2O в количестве 1,964 г растворяют в 500 мл воды, подкисленной серной кислотой.
14. Стандартный раствор никеля, содержащий 1 мг никеля в 1 мл раствора: навеску NiSO4*7H2O в количестве 0,4786 г растворяют в 50 мл воды, добавляют 2 мл 1 н. серной кислоты и разбавляют до 100 мл.
15. Стандартный раствор железа, содержащий 1 мг железа в 1 мл раствора: навеску Fe2(SO4)3 • 2Н2О в количестве 0,3902 г растворяют в 100 мл воды, подкисленной серной кислотой.
16. Азотная кислота, перегнанная в кварцевой установке.
Определение меди. Ход анализа. Навеску бора в количестве 0,02—0,2 г помещают в кварцевую чашку
139
и растворяют в 15—20 мл HNO3 (1 :2), прибавляя последнюю небольшими порциями во избежание разбрызгивания. После прекращения выделения бурых паров раствор выпаривают досуха на песчаной бане, прибавляют 1 мл концентрированной соляной кислоты и вновь выпаривают досуха. К сухому остатку (при навеске бора 0,2 г необходимо остаток дважды обработать этиловым спиртом, прибавляя последний по 5 мл и каждый раз выпаривая досуха), приливают 5 мл дистиллированной воды, три капли серной кислоты уд. веса 1,84 и 5 мл ам-миачноцитратного буферного раствора. Экстрагируют медь раствором диэтилдитиокарбамината свинца в хлороформе три раза, приливая каждый раз по 1 мл экстрагента, собирают экстракты в колориметрический стаканчик с меткой на 10 мл, доводят до метки хлороформом и колориметрируют в кювете с толщиной слоя 10 мл с синим светофильтром № 7 на ФМ-1. При содержании меди менее 10 мкг колориметрируют визуально.
Содержание меди находят по калибровочному графику, который строят, проводя экстракцию определенных количеств меди из аммиачноцитратного буферного раствора.
Шкала стандартных растворов следующая: Содержание меди, мкг.......... 10 20 30
Стандартный раствор меди (10 мкг /мл), мл ............................. 1 2 3
Серная кислота (уд. в. 1,84), капли 3 3 3
Аммиачноцитратный буферный раствор, мл ....................... 5 5 5
Экстракцию и разведение раствора до объема 10 мл проводят, как это описано выше для растворов пробы. При визуальном колориметрировании стандарты готовят с интервалами в 1 мкг от 1 до 5 мкг.
Чувствительность метода при применении фотометра ФМ-1 составляет 5—50 мкг в 10 мл. Чувствительность метода при визуальном колориметрировании 1—10 мкг в 10 мл. Точность определения ±10% (отн.). Метод позволяет определять из навески 0,2 г визуальным колориметрированием 4*10-4—2*10-3% меди.
Определение никеля. К раствору после отделения меди прибавляют, если необходимо, одну-две капли аммиака (1 :20) до появления фиолетовой окраски индикатора (pH более 8,0), 1 мл диметилглиоксима и через 15 мин экстрагируют комплекс двухвалентного никеля 140
' с диметилглиоксимом тремя порциями хлороформа по 5 мл каждая. Объединенные экстракты встряхивают с тремя порциями 0,5 н. соляной кислоты по 5 мл каж-—дая.
К полученному солянокислому раствору, помещенному в мерную колбу емкостью 50 мл, прибавляют 10— 20 капель (до желтой окраски раствора) бромной воды, 2 мл 25%-ного раствора аммиака и 1 мл 1%-ного раствора диметилглиоксима. Разбавляют раствор водой до метки и через 15 мин измеряют оптическую плотность с синим светофильтром № 7 в кювете емкостью 50 мл.
Содержание никеля находят по калибровочному графику, который строят, прибавляя определенные количества никеля к 15 мл 0,5 к. соляной кислоты с последующим введением бромной воды, аммиака и диметилглиоксима.
Шкала стандартных растворов следующая:
Содержание никеля, мкг ... 10 15 20 25 30
Стандартный раствор никеля (10 мкг/мл), мл.................. 1 1,5 2 2,5 3
Соляная кислота, 0,5 н. раствор, мл..................... 15 15 15 15 15
Бромная вода, капли .... 10—20 10—20 10—20 10—20 10—20
Аммиак, 25%-ный раствор, мл 2 2 2 2 2
Диметилглиоксим. 1 % -ный спиртовой раствор, мл . . . 1 1 1 1 1
Чувствительность метода при применении фотометра ФМ-1 составляет 5—50 мкг в 50 мл раствора. Точность определения ±10% (отн.). Метод позволяет определять из навески 0,2 г визуальным колориметрированием 5 • 10-4—5 • 10-3% никеля.
Определение железа. К раствору после отделения никеля прибавляют 5 мл 10%-ного раствора аскорбиновой кислоты, осторожно нейтрализуют по феноловому красному аммиаком (1 :20), приливают 5 мл а-нитрозо-(3-нафтола и разбавляют водой приблизительно до 100 мл. Через 45 мин производят двукратную экстракцию изоамиловым спиртом (по 10 мл) комплекса двухвалентного железа с а-нитрозо-(3-нафтолом. Объединенные экстракты разбавляют изоамиловым спиртом в мерной колбе емкостью 25 мл и измеряют оптическую плотность с красным светофильтром № 2 в кювете емкостью 10 мл.
141
Содержание железа находят по калибровочному графику, который строят, проводя экстракцию определенных количеств железа аммиачноцитратного буферного раствора.
Шкала стандартных растворов следующая:
Содержание железа, мкг ......... 10 15 20 25 30
Стандартный раствор железа (10 мкг/мл). мл 1 1,5 2,0 2,5 3,0 Аммиачноцитратный буферный раствор, мл............................... 5 5 5 5 5
Аскорбиновая кислота, 10%-ный водный
раствор, мл.................... 5 5 5 5 5
а-Нитрозо-р-нафтол [после нейтрализации
раствора аммиаком (1:20) по фенолово-
му красному], мл......, .... 5 5 5 5 5
Экстракцию и разведение раствора до объема 25 мл проводят, как это описано выше для растворов пробы.
Чувствительность метода при применении фотометра ФМ-1 составляет 5—50 мкг железа в 25 мл раствора. Точность определения ±10% (отн.). Метод позволяет определять из навески 0,2 г 2,5 • 10-3—2,5 • 10-2% железа.
б) Определение меди с дитизоном. Метод основан на образовании дитизоната меди, окрашивающего хлороформный слой в фиолетово-красный цвет. В зависимости от содержания меди цвет хлороформного слоя изменяется от зеленого (в отсутствие меди) через различные оттенки серо-фиолетового до красно-фиолетового при избытке меди.
Присутствующие в элементарном боре примеси определению меди с дитизоном не мешают.
Необходимые реактивы
1. Азотная кислота (1:2), очищенная перегонкой в кварцевом аппарате.
2. Кислота соляная, 0,5 н. раствор: готовится соответствующим разбавлением кислоты, полученной путем перегонки'без нагревания (см. п. а).
3. Дитизон, 0,01%-ный раствор в хлороформе марки «для наркоза»; из этого раствора перед употреблением готовят рабочий раствор разбавлением хлороформом вдвое.
4. Вода, дважды перегнанная в кварцевом приборе.
5. Стандартный раствор меди, содержащий 1 мг в 1 мл раствора: 1,964 г невыветрившихся прозрачных кристаллов сернокислой меди CliSO4-5H2O растворяют в 500 мл 0,1 н. соляной кислоты; в день употребления
142
f готовят рабочий раствор с содержанием меди 1 мкг]мл t соответствующим разбавлением стандартного раствора. | Ход анализа. Навеску бора в количестве 0,02— 0,2 г растворяют в азотной кислоте (1:2) и выпаривают •Y с соляной кислотой, как описано при последовательном '7 определении меди, никеля и железа. Сухой остаток рас-| творяют в воде, дважды обрабатывают этиловым спир-том, приливая последний по 5 мл и каждый раз выпари-S вая досуха. Остаток растворяют в 0,1 мл соляной кисло-ты, добавляют 0,25 мл воды, раствор переносят в коло-риметрическую пробирку (высота 8—10 см, внутренний £ диаметр 5—6 мм) и споласкивают тигель 0,25 мл воды, к. которую вливают в ту же пробирку. Добавляют 0,5 мл g' 0,005%-ного раствора дитизона, закрывают пробирку 7 пробкой и взбалтывают I мин. Дают разделиться слоям и окраску нижнего хлороформного слоя сравнивают с < окраской одновременно приготовленных стандартов.
Приготовление стандартов. В колори-- метрические пробирки отмеривают стандартный раствор меди в количестве 0,00; 0,05; 0,10; 0,20; 0,30 мкг меди. Добавляют воды до 0,5 мл, приливают по 0,1 мл соляной кислоты, 0,5 мл 0,005%-ного раствора дитизона. Закрывают пробирки пробками и взбалтывают 1 мин. Дают слоям разделиться и приступают к колориметрированию. При колориметрировании сравнение ведут не по интенсивности, а по оттенкам окрасок. Через все стадии анализа необходимо проводить «холостой» опыт.
Чувствительность метода составляет 0,05—0,5 мкг в 0,5 мл хлороформного слоя. Точность определения ±20% (отн.). Метод позволяет из навески 0,2 г определить 2,5* 10-5—2,5*10-4% меди.
в) Определение никеля с диметилглиоксимом. Метод основан на образовании в присутствии окислителя винно-красного комплекса никеля с диметилглиоксимом.
Необходимые реактивы
1. Азотная кислота (1 :2), полученная перегонкой в кварцевом аппарате.
2. Соляная кислота, полученная перегонкой без нагревания (см. п. а), 0,5 н. раствор.
3. Аммиак, 25%-ный водный раствор: получают насыщением «кварцевой» воды газообразным аммиаком.
4. Аммиак разбавленный: готовят стократным разбавлением концентрированного аммиака.
143
5. Натрий лимоннокислый, 10%-ный раствор: раствор очищают путем добавления к 200 мл его 5 мл 1%-ного раствора диметилглиоксима и взбалтывания в течение 2 мин с 10 мл хлороформа; дают слоям разделиться и отбрасывают хлороформный слой.
6. Диметилглиоксим, 1%-ный спиртовой раствор.
7. Хлороформ перегнанный.
8. Бромная вода, насыщенная, свежеприготовленная.
9. Раствор никеля, содержащий 1 мг никеля в 1 мл раствора: 0,4786 г невыветрившихся кристаллов сернокислого никеля NiSO4*7H2O растворяют в 50 мл воды, добавляют 2 мл 1 н. серной кислоты и разбавляют в мерной колбе до 100 мл; стандартный раствор с содержанием никеля 2 мкг в 1 мл готовят в день употребления разбавлением основного раствора.
Ход анализа. Растворяют пробу и отгоняют бор-нометиловый эфир, как это описано выше при определении меди. К сухому остатку добавляют 0,5 мл азотной кислоты и 3 мл воды, слегка нагревают и переносят раствор в маленькую делительную воронку емкостью 25 мл. Чашку споласкивают двумя порциями воды по 3 мл, которые сливают в воронку. К раствору в делительной воронке добавляют по 2 мл лимоннокислого натрия, концентрированного аммиака и раствора диметилглиоксима, перемешивают и оставляют стоять 15 мин. Затем вливают в воронку 6 мл хлороформа и взбалтывают в течение 1 мин. Дают разделиться слоям и хлороформ сливают в другую делительную воронку, где взбалтывают его в течение 1 мин с 5 мл разбавленного аммиака. Хлороформ сливают в третью делительную воронку, добавляют 2 мл 0,5 н. соляной кислоты и взбалтывают в течение 1 мин. Хлороформ сливают в стаканчик, а кислую вытяжку помещают в кварцевую чашку. Хлороформную вытяжку возвращают в воронку и повторяют обработку соляной кислотой. Соединенные кислые вытяжки выпаривают на водяной бане досуха, к остатку добавляют одну каплю азотной и три капли соляной кислот и вновь выпаривают досуха. Сухой остаток переносят в маленькую колориметрическую пробирку с помощью 0.6 мл воды, которую приливают в два приема. Затем в пробирку добавляют по 0,1 мл концентрированного аммиака, раствора диметилглиоксима и бромной воды, перемешивая после каждого добавления, и через 15 мин 144
сравнивают с одновременно приготовленными стандартами..
Приготовление стандартов. В колориметрические пробирки отбирают раствор никеля в количестве 0,0; 0,2; 0,4; 0,6; 0,8; 1,0 мкг. Приливают воду до объема 0,6 мл и добавляют по 0,1 мл аммиака, раствора диметилглиоксима и бромной воды, перемешивая после каждого добавления. Через 15 мин шкала готова для колориметрирования. Через все стадии анализа проводят «холостой» опыт.
Чувствительность определения составляет 0,1 мкг в 1 мл раствора. Точность метода ±20% (отн.). Метод позволяет из навески 0,2 г определить 5* 10-5—5* 10~4% никеля.
г) Определение железа с роданидом калия. Метод основан на экстракции изоамиловым спиртом окрашенного комплекса железа с роданидом. Примеси, присутствующие в элементарном боре, определению железа этим методом не мешают.
Необходимые реактивы
1. Соляная кислота, 1 н. раствор, полученный перегонкой без нагревания (см. п.а).
2. Роданистый калий, 50%-ный водный раствор.
3. Изоамиловый спирт.
4. Вода — бидистиллят, очищенный перегонкой в кварцевом аппарате.
5. Стандартный раствор железа, содержащий 1 мг железа в 1 мл: 0,864 г прозрачных невыветрившихся кристаллов, железоаммонийных квасцов FeNH^SO^X X 12Н2О растворяют в мерной колбе в 100 мл 0,5 н. серной кислоты; стандартный раствор с содержанием железа 5 мкг в 1 мл готовят в день употребления соответствующим разбавлением основного раствора.
Ход анализа. Навеску пробы в количестве 0,02— 0,2 г растворяют в азотной кислоте (1 :2) способом, описанным выше (см. п. а). Сухой остаток после удаления боркоэтилового эфира смывают 5 мл 1 н. раствора соляной кислоты в колориметрическую пробирку, добавляют 1 мл раствора роданистого калия и 3 мл изоамилового спирта, перемешивая раствор после прибавления каждого реактива. Раствор взбалтывают в течение 15 мин и дают слоям разделиться, после чего колориметрируют раствор, сравнивая окраску верхнего спиртового слоя
10 Анализ бора
145
с окраской спиртовых слоев одновременно приготовленных стандартных растворов.
Приготовление стандартных растворов. В колориметрические пробирки отбирают стандартный раствор железа в количестве 0, 1,2, 3, 4, 5 мкг, приливают 5 мл 1 н. раствора соляной кислоты и 3 мл изоамилового спирта. После взбалтывания раствора в течение 15 мин и разделения слоев приступают к колориметрированию. Через все стадии анализа проводят «холостой» опыт.
Чувствительность метода 1 мкг в 3 мл спиртового слоя. Точность определения ±20% (отн.).
Метод позволяет из навески 0,2 г определить 5* 10~4% железа.
Определение алюминия
Для колориметрического определения алюминия в различных материалах используются методы, основанные на образовании окрашенных комплексных соединений алюминия с различными органическими реагентами. Чаще других реагентов применяются алюминон [И, 50, 51, 75, 91] и стильбазо* [49, 81, 92—98].
Стильбазо— наиболее чувствительный реактив на ионы алюминия. Определению алюминия со стильбазо не мешает до 0,1 мг железа в 5 мл раствора после восстановления его аскорбиновой кислотой. Присутствие двухвалентных и щелочных металлов не мешает [81], содержание меди до 50 мкг не оказывает влияния на результаты определения алюминия.
Авторы для определения алюминия в элементарном боре применяли стильбазо. Присутствие бора несколько
* Стильбазо — диаммонийная соль стильбен-2,2'-диоульфокисло-та-4,4'-бис- (азо-1) -3,4-диоксибензола
146
| занижает результаты анализа, и необходимо отделять Jr бор в виде борноэтилового эфира. Определение алюми-ния проводили методом сравнения со стандартными рас-t творами, так как колориметрическое титрование затруд-| нительно из-за недостаточно быстрого развития окраски алюминия со стильбазо. Алюминий реагирует со стиль-
% базо при pH 5,2—5,6.
: Необходимые реактивы
; 1. Азотная кислота, перегнанная в кварцевом при-
li боре.
%. 2. Аскорбиновая кислота, 10%-ный водный раствор.
3. Соляная кислота, полученная насыщением бидистиллята хлористым водородом (см. п. а).
4. Ацетатная буферная смесь pH = 5,4: смесь 29 мл 0,2 М раствора уксусной кислоты (1,2 мл ледяной уксусной кислоты доводят до 100 мл водой) и 171 мл 0,2 М С раствора уксуснокислого натрия (1,64 г уксуснокислого " натрия в 100 мл воды).
5. Стильбазо, 0,025 %-ный водный раствор.
6. Раствор алюминия, содержащий 1 мг алюминия в 1 мл: 17,6 г невыветрившихся кристаллов KA1(SO4) X X 12Н2О растворяют в 1 л 0,1 н. соляной кислоты; раствор с содержанием 10 мкг!мл алюминия готовят соответствующим разбавлением раствора.
7. Подкисленная вода: 0,6 мл соляной кислоты (уд. в. 1,12) в 1л воды.
' Ход анализа. Навеску бора в количестве 0,02— „ 0,2 г растворяют в азотной кислоте (1:2) способом, описанным выше (см. п. а). Сухой остаток после удале- ния борноэтилового эфира смывают 3 мл воды в колориметрический стаканчик. К раствору прибавляют 0,2 мл 10%-ного раствора аскорбиновой кислоты, 0,3 мл раствора стильбазо и 3 мл буферной смеси с pH = 5,4 > и разбавляют раствор водой до метки 10 мл. Окраску раствора сравнивают с окраской одновременно приготовленных стандартных растворов.
Приготовление стандартных растворов. В колориметрические стаканчики,с меткой 10 мл отмеряют стандартный раствор алюминия в количест-. ве 1, 2,..., 10 мкг. Прибавляют к раствору 0,2 мл < 10%-ного раствора аскорбиновой кислоты, 0,3 мл буферной смеси с pH = 5,4 и разбавляют раствор водой до метки 10 мл.
Ю*
147
Чувствительность определения составляет 1 —10 мкг в 10 мл раствора. Точность определения ±10% (отн.). Метод позволяет из навески 0,2 г определять 5-10~4—5Х X Ю-3% алюминия.
Определение кальция
Обычно кальций определяют косвенными колориметрическими методами, например по аниону труднорастворимой кальциевой соли, в виде которой его предварительно выделяют в осадок. Способы колориметрического определения кальция изложены в соответствующей литературе [75]. Наиболее часто применяемые методы основаны на осаждении кальция в виде оксалата [75, 99] или фосфата [75, 100]. Последующее колориметрирование проводят, используя свойство оксалатов легко восстанавливать окрашенные вещества, или путем колориметрирования молибденовой сини.
Определение кальция можно заканчивать и путем применения комплексонометрических индикаторов, например титрованием комплексоном III по эриохрому черному Т после растворения оксалата в соляной кислоте [99]. При соблюдении соответствующих условий этими методами можно определить менее 50 мкг кальция.
Реактивы, используемые в качестве индикаторов при комплексонометрическом титровании кальция, находят все большее применение при прямом фотометрическом определении последнего. Часто для этого применяют му-рексид [86, 101—103], кислотный хром синий К [104], кислотный хром темно-синий [105] и др.
Применение мурексида дает возможность определять до 1 мкг кальция путем сравнения испытуемых растворов со шкалой эталонов от 1 до 10 мкг с интервалом в 1 мкг в 5—10 мл раствора. При определении кальция от 0,5 до 10 мкг с интервалом в мкг в 10—15 мл раствора с кислотным хромом синим в условиях, рекомендованных для мурексида (pH~ 12), удается получить более контрастную шкалу эталонов [104].
Почти все элементы, присутствующие в элементарном боре в качестве примеси, мешают определению кальция с указанными реактивами. Влияние магния удается исключить колориметрированием при pH = 12. Медь, никель, железо можно отделить экстракцией их дитизонатов [104] 148
или диэтилдитиокарбаматных комплексов [86]. Для маскирования железа и алюминия можно применять также 1%-ный раствор триэтаноламина и 0,5%-ный раствор фтористого натрия.
При определении кальция в боре с мурексидом, кислотным хромом синим К, кислотным хромом темно-синим было установлено, что присутствие борной кислоты вызывает небольшое ослабление окраски растворов, поэтому перед колориметрическим определением кальция с этими реактивами необходимо предварительно удалять борную кислоту выпариванием с этиловым спиртом.
При колориметрическом определении кальция с мурексидом мешающее влияние никеля удается устранить только цианидом. Рекомендуемые [86, 104] способы отделения никеля, железа, алюминия, меди приводят к уменьшению контрастности шкалы. Недостатком метода определения кальция с мурексидом является также малая устойчивость растворов реактива (не более 8 ч). Колориметрирование необходимо проводить в течение 5 мин.
Кальцион ИРЕА [106] также не является специфическим реактивом на кальций. Определению кальция мешают элементы, гидролизующиеся в этих условиях. Для устранения влияния мешающих элементов применяют маскирование с триэтаноламином или экстракцию ди-этилдитиокарбаминатов. Применение кальциона позволяет определять до 1 мкг кальция. Результаты определения сильно зависят от солевой концентрации фотометри-руемых растворов.
В качестве реактива для колориметрического определения кальция в элементарном боре можно рекомендовать хлоранилат натрия. Метод основан на осаждении кальция хлоранилатом натрия, растворении осадка в минеральной кислоте и колориметрировании хлораниловой кислоты [108]. Колориметрирование же по остатку хлораниловой кислоты, не вошедшей в реакцию [109], не обладает высокой чувствительностью и точностью. Синтез реактива очень прост (см. п. 14). Растворы хлорани-лата натрия устойчивы: 0,05%-ный раствор хлоранилата при хранении в темноте в течение 10 суток титра не меняет. Хлоранилат кальция очень мало растворим в воде; насыщенный водный раствор его лишь слабо окрашен в фиолетовый цвет. При осаждении заметных количеств кальция (более 100 мкг) из нейтральных растворов их
149
объем (1 —10 мл) не сказывается на полноте выпадения хлоранилата кальция [108]. При определении 10—100 мкг кальция осаждение следует вести из 1 мл раствора 0,5%-ным раствором хлоранилата натрия; 1 мл реактива достаточно для осаждения приблизительно 520 мкг кальция. Определение кальция в боре рекомендуется проводить методом колориметрического титрования с использованием титрованных растворов хлоранилата натрия.
При определении более 100 мкг кальция из навески 0,02 г и объема раствора 10 мл борную кислоту можно не удалять, так как присутствие последней не мешает определению кальция. При малых количествах кальция, осаждаемых из раствора объемом 1 мл, борную кислоту необходимо предварительно удалять выпариванием с этиловым спиртом. Магний, натрий и калий определению кальция этим методом не мешают [108].
Авторами проверена возможность определения кальция с хлоранилатом натрия в присутствии железа, алюминия, никеля. Установлено, что при содержании кальция менее 50 мкг осаждению его в виде хлоранилата не мешают алюминий, железо и никель, присутствующие в количествах до 100 мкг. При содержании кальция более 50 мкг железо и алюминий мешают во всех соотношениях с кальцием (начиная от 1 : 1).
При определении кальция с хлоранилатом натрия реакции протекают по уравнениям
C6O4GI2Na2 4- СаС12 -> С3О4С12 Са + 2NaCl;
СвО4С12Са + 2HNO3 -> С6О4С12Н2 + Са (NO3)2.
Необходимые реактивы
1. Азотная кислота, дважды перегнанная в кварцевой установке, концентрированная и 1 н. раствор.
2. Бидистиллят, перегнанный в кварцевой установке.
3. Соляная кислота, 6—7 н., полученная перегонкой без нагревания (см. п. а).
4. Хлоранилат натрия, 0,5%-ный водный раствор (см. п. 14).
5. Хлоранилат натрия, 0,05%-ный водный раствор (для титрования); готовится из 0,5%-ного раствора разбавлением в 10 раз; титр проверяют осаждением 10— 20 мкг кальция из стандартного раствора и титрованием раствора способом, описанным для анализа пробы.
150
6. Промывная жидкость — насыщенный раствор хлоранилата кальция (см. п. 14).
7. Стандартный раствор кальция (1 мг кальция в 1 мл): навеску 5,891 г Са (МОз)2 • 4Н2О растворяют в 1 л воды; стандартный раствор с содержанием кальция 100 мкг!мл готовят соответствующим разбавлением основного раствора.
Ход анализа. Навеску бора в количестве 0,02— 0,2 г растворяют в азотной кислоте (1:2) способом, описанным выше (см. п. а данной главы). Сухой остаток после удаления борноэтилового эфира растворяют в 1 мл воды, прибавляют 1 мл 0,5%-ного раствора хлоранилата натрия и оставляют стоять 30 мин. Затем раствор фильтруют через фильтр-тигель № 4, промывают три раза по 1 мл промывной жидкости. Меняют приемник и растворяют осадок на тигле в 1,5 мл 1 н. азотной кислоты, приливая последнюю небольшими порциями. Промывают тигель пять раз дистиллированной водой, добавляя каждый раз по 1 мл. Переносят раствор в стаканчик для титрования и доводят водой до метки 10 мл. В контрольный стаканчик прибавляют 1,5 мл 1 н. азотной кислоты и 8 мл воды. Затем из микробюретки прибавляют по каплям титрованный 0,05%-ный раствор хлоранилата натрия, сравнивая каждый раз окраску раствора с окраской раствора пробы. В конце титрования объемы растворов уравнивают (разница за счет не совсем точно уравненных растворов настолько мала, что ею можно пренебречь).
Содержание кальция вычисляют по формуле
100,
где Т — титр хлоранилата натрия, выраженный в граммах кальция, г 1мл; V2 — объем раствора хлоранилата натрия, израсходованного на титрование пробы, мл; Vo — объем раствора хлоранилата натрия, израсходованного на титрование «холостого» опыта, мл; п — навеска пробы, г.
Чувствительность метода составляет 1 —100 мкг в 10 мл раствора. Точность метода ±10% (отн.). Метод позволяет из навески 0,2 г определять 5 • 10~4 — 5 • 10“2% кальция.
151
Определение магния
Большинство цветных реакций на магний основано на способности гидроокиси магния адсорбировать различные азокрасители. Характерными реагентами для магния являются азо- и диазосоедикения, имеющие окси-и нитрогруппы в орто- или параположениях к азогруппе [НО]. К таким реактивам на магний относятся эриохром сине-черный Б [111 —113], пикраминазо [НО] и др. Кроме того, имеются вещества, не содержащие указанных групп, например титановый желтый |[74, 75]. Непрямые методы определения магния описаны в сответствующей литературе [74, 75, 114].
Авторами книги проверена возможность определения магния в элементарном боре с применением эриохрома сине-черного Б, пикраминазо и титанового желтого. Большинство элементов, присутствующих в элементарном боре в виде примесей (Ni, Fe, Al), мешают определению магния.
По увеличению чувствительности при определении магния в одних и тех же условиях указанные реактивы располагаются в следующий ряд: пикраминазо, титановый желтый, эриохром сине-черный Б. Для устранения влияния мешающих элементов рекомендуется экстракция железа этилацетатом в виде диэтилдитиокарбамика-та [111], осаждение железа и никеля диэтилдитиокарбаминатом натрия [НО], экстракция оксихинолятов хлороформом и т. д.
При определении магния с эриохромом сине-черным Б, а также с пикраминазо окраска раствора пробы после обработки соответствующим образом и выполнения реакции на магний имеет меньшую интенсивность, чем окраска стандартных растворов с таким же содержанием магния. Кроме того, окраска растворов пробы в этом случае имеет оттенки, несколько отличные от окраски стандартных растворов. Стандартные растворы также необходимо обрабатывать диэтилдитиокарбаминатом или оксихинолином и проводить экстракцию способом, принятым для пробы. Сходимость результатов анализа неудовлетворительна. Так как эриохром сине-черный Б обладает индикаторными свойствами, результаты определения сильно зависят от pH раствора. Присутствие борной кислоты должно быть исключено, так как она скижа-
152
ет интенсивность окраски и, кроме того, затрудняет установление определенного pH раствора.
В качестве реактива на магний при определении его в боре был выбран титановый желтый *. Метод очень . чувствителен (2 мкг в 10 мл конечного объема при визуальном колориметрировании), легко выполним и его х можно применять в присутствии относительно больших количеств кальция (Са : Mg до 200: 1) [74, 75]. Удаление борной кислоты необходимо только при ее содержании, превышающем величину растворимости во взятом объеме..
Титановый желтый в щелочном растворе окрашен в желтый цвет; в присутствии гидроокиси магния образуется соединение адсорбционного характера и окраска раствора из желтой переходит в оранжевую или кирпично-красную, в зависимости от содержания магния [74].
Необходимые реактивы
1. Титановый желтый, 0,05 %-ный свежеприготовленный водный раствор.
2. Гидроксиламин солянокислый, 5%-ный водный раствор.
3. Едкий натр, 1 н. раствор.
4. 8-Ожсихинолин, 1%-ный раствор в хлороформе.
5. Хлороформ.
6. Вода — бидистиллят, дважды перегнанный в квар-’ цевом аппарате.
7. Азотная кислота (1:2), дважды перегнанная в кварцевом аппарате.
8. Соляная кислота, 5—6 н. раствор, полученный перегонкой без нагревания (см. п. а).
9. Раствор магния, содержащий 1 мг магния в 1 мл раствора: навеску 0,1 г металлического магния растворяют в 1 мл 6 н. соляной кислоты и разбавляют водой в меркой колбе до 100 мл\ стандартный раствор с содер-жанием магния 10 мкг]мл готовят соответствующим раз-I бавлением основного раствора.
Ход анализа. Навеску бора в количестве 0,05 г г растворяют в 10—15 мл азотной кислоты (1 : 2), как описано выше (см. п. а). Сухой остаток после выпаривания с соляной кислотой растворяют в 3—4 мл воды, нейтрализуют по индикаторной бумаге 0,1 н. едким натром и 0,1 н.
* Титановый желтый — натриевая соль 2,2/-дисульфо-4,4'-ди-[6-метилбензтиазолил-2]-диазоаминобензола.
153
соляной кислотой до pH = 7 и приливают два раза по 1 мл раствора 8-оксихинолина в хлороформе,каждый раз тщательно взбалтывая раствор. При этом экстрагируются железо, алюминий, никель. Раствор промывают 1 мл хлороформа и затем фильтруют в колориметрический стаканчик. Прибавляют 0,5 мл 5%-ного раствора гидроксиламина солянокислого, 0,2 мл 0,05%-ного раствора титанового желтого и 2 мл 1 н. едкого натра. Раствор разбавляют до 10 мл водой и фотометрируют на ФМ-1 в кювете емкостью 10 мл со светофильтром № 10.
Содержание магния находят по калибровочному графику, который строят путем фотометрирования стандарт
ных растворов.
Шкала стандартных растворов следующая:
Содержание магния, мкг . . . . Стандартный раствор магния (10 мкг/мл), мл................
Г идроксиламин солянокислый, 5%-ный раствор, мл . . . .
Титановый желтый, 0,05%-ный раствор, мл ..................
Едкий натр, 1 н. раствор, мл
10 20 30 40 50
1 2 3 4 5
0,5 0,5 0,5 0,5 0,5
0,2 0,2 0,2 0,2 0,2
2 2 2 2 2
Экстракцию и разведение раствора до объема 10 мл проводят, как это описано выше для растворов пробы.
Чувствительность метода 5—100 мкг в 10 мл объема. Точность определения ±10% (отн.). Метод позволяет из навески 0,2 г определять 2,5* 10"3—5* 10“2% магния.
Определение кремния
Малые количества кремния в различных материалах определяют по реакции образования желтоокрашенного кремнемолибденового комплекса H4[Si(Mo30io)_4]x~* Н2О или синей кремнемолибденовой гетерополикислоты
Н8
zMo2O6 \Мо2О7)б_
Ряд работ посвящен изучению условий образования и определения кремнекислоты [115—118]. Данные исследования показали, что в пределах pH среды 1,9—3,0 величина светопоглощекия растворов синей кремнемолибденовой гетерополикислоты достигает максимального значения. Определение успешно проводится при комнатной 154
температуре [119]. Величина светопоглощения растворов синей кремнемолибдековой гетерополикислоты, содержащей 1—2 мкг кремния в 5 мл, возрастает в течение первых 60 мин на 1—2% и затем остается практически без изменения [119]. Действие закона Бугера — Ламберта — Бэра распространяется на область концентраций кремния 0—1 мкг в 5 мл раствора. Чувствительность спектрофотометрического определения кремния составляет 0,03 мкг, а точность определения при этой концентрации ±0,01 мкг [119].
Изучался обратный переход одной формы кремнекислоты в другую (а± Р Д у) в зависимости от концентрации минеральных кислот и температуры [116, 120].
Проведенные исследования показали, что для колориметрического определения любых концентраций кремния наиболее пригодна кислотность 0,02—2 н.; при этом следует избегать кипения раствора и, вообще, длительного нагревания. Растворение навески лучше проводить при комнатной температуре в азотной кислоте [116]. Чувствительность определения кремния в 50 мл по желтому комплексу 0,025 мг, по синему—0,005 мг [74]. В качестве восстановителей можно применять двухлористое олово [74, 121—124], соль Мора [50, 125—132], аскорбиновую кислоту [124, 131], тиомочевику [116, 133], 1-амино-2-наф-тол-4-сульфокислоту [134] и др. Присутствующие в боре примеси железа, алюминия, никеля определению кремния в виде желтого и синего комплексов не мешают *.
Колориметрическое определение синей кремнемолибденовой гетерополикислоты проводят при содержании кремния менее 5 мкг и желтоокрашенного кренемолибде-нового комплекса при содержании кремния более 5 мкг.
Необходимые реактивы
1. Азотная кислота (1 :2), дважды перегнанная в платиновом аппарате.
2. Едкий натр, 1 н. раствор; хранится в полиэтиленовой или парафинированной посуде.
3. Серная кислота, х. ч. или ч. д. а.
4. Молибденовокислый аммоний, 10%-ный свежеприготовленный раствор.
* Железо и алюминий не мешают определению кремния, если концентрация кремневой кислоты не выше 1 мг в 100 мл раствора. Никель не мешает определению кремния при содержании 3 мг никеля в 100 мл раствора.
155
5. Двухлористое олово, 0,5%-ный свежеприготовленный раствор в 2 н. соляной кислоте.
6. Соляная кислота, полученная насыщением бидистиллята газообразным хлористым водородом (см. п. а) в сосуде из полиэтилена или плексигласа.
7. Изоамиловый спирт, перегнанный в стеклянном приборе на шлифах.
8. Вода — бидистиллят, перегнанный в кварцевом приборе.
9. Раствор кремнекислого натрия, содержащий 0,1 мг кремния в 1 мл раствора: 0,0214 г SiO2 сплавляют в платиновом тигле с KNaCOs, выщелачивают водой и разбавляют до объема 100 мл\ стандартный раствор с содержанием кремния 10 мкг!мл готовят соответствующим разбавлением основного раствора.
Ход анализа. Навеску бора в количестве 0,05 г растворяют в платиновой чашке в 10—15 мл азотной кислоты (1:2), которую прибавляют малыми порциями во избежание разбрызгивания раствора. Раствор выпаривают досуха, прибавляют два раза по 5 мл этилового спирта и каждый раз вновь выпаривают. К охлажденному остатку приливают 0,5 мл 10 н. серной кислоты и перекосят раствор в колориметрическую пробирку, смывая стенки платиновой чашки 2,5 мл воды. Затем добавляют в пробирку 0,2 мл 10%-ного раствора молибдата аммония. Пробирку с раствором помещают в стакан с кипящей водой на 5 мин. После охлаждения приливают 1 мл 10 н. серной кислоты, перемешивают и добавляют 0,2 мл свежеприготовленного 0,5%-ного раствора двухлористого олова в 2 н. соляной кислоте. Перемешивают, прибавляют 2 мл изоамилового спирта и пять раз встряхивают пробирку. После разделения жидкостей сравнивают окраску спиртового слоя с окраской спиртовых слоев одновременно приготовленных стандартных растворов.
Приготовление стандартных растворов. Отбирают в платиновые чашки стандартные растворы кремния в количествах от 0 до 4 мкг с интервалами в 0,5 мкг. Растворы выпаривают досуха, прибавляют 1 мл HNO3 (1 :2), выпаривают досуха, добавляют 1,5 мл 1 н. раствора едкого натра и вновь выпаривают. К охлажденному остатку приливают 0,5 мл 10 н. серной кислоты и далее поступают так, как это описано для пробью 156
Чувствительность метода 0,5—5 мкг в объеме 2 мл. Точность метода ±20%. Метод позволяет из навески 0,2 г определять 2,5-10~4—2,5* 10-3% кремния.
При содержании кремния более 5 мкг колориметри-ро)вание проводят по окраске желтого кремнемолибденового комплекса. Пробу в этом случае обрабатывают способом, описанным выше. Стандартные растворы готовят с содержанием кремния от 5 до 50 мкг с интервалом 5 мкг. После удаления борной кислоты в виде борноэти-лового эфира и обработки сухого остатка едким натром и серной кислотой переносят раствор пробы и стандартные растворы в колориметрические стаканчики, смывая стенки платиновых чашек 3 мл воды, прибавляют по 0,5 мл 10%-ного раствора молибдата аммония и после доведения объема до 10 мл помещают растворы в кипящую водяную баню (стакан) на 5 мин. После охлаждения раствора приступают к колориметрированию.
Чувствительность определения составляет 5—50 мкг кремния в 10 мл. Точность метода ± 10% (отн.). Метод позволяет из навески 0,2 г определять 2,5 • Ю-3 — 2,5 X X 10-2% кремния.
13. Определение примесей спектральным методом [26]
Необходимая аппаратура и материалы
1. Спектрограф ИСП-22.
2. Электроды угольные; межэлектродное расстояние 4 мм.
3. Источник возбуждения — дуга постоянного тока, сила тока 14 а.
4. Ширина щели 0,01 мм.
5. Время экспозиции 60 сек.
6. Фотопластинки спектральные, тип II.
Условия возбуждения и регистрации спектра. Количественное определение примесей в боре осложняется тем, что в дуге, горящей в атмосфере воздуха, бор соеди-
157
Рис. 28. Приспособление для создания вокруг электродов равномерного потока азота:
К — катод; А — анод.
Рис. 29. Спектрограммы, полученные при сжигании препарата бора в атмосфере воздуха (1) и в токе азота (2).
няется с кислородом, давая линейчато-полосатый спектр молекулы ВО. В области спектра, где расположены аналитические линии большинства примесей, молекулярный спектр ВО затрудняет измерение интенсивностей спектральных линий, снижает точность и воспроизводимость определений. Обдувая область дуги потоком азота, удалось в значительной степени ослабить линейчато-полосатый спектр ВО.
Приспособление для создания вокруг электродов равномерного потока азота изображено на рис. 28. Аналогичное приспособление применено ранее для снижения интенсивности полос в токе углекислого газа [23]. На рис. 29 приведены спектры, полученные при сжигании препарата бора в атмосфере воздуха и в токе азота при одинаковых условиях.
Для построения градуировочных графиков к анализируемым и эталонным образцам в качестве элемента сравнения добавляли германий. Предварительно был приготовлен исходный эталон добавлением к бору смеси примесных элементов. Серия рабочих эталонов получена последовательным разбавлением исходного эталона порошком бора до нужных концентраций примесей. Эталоны и анализируемые пробы перемешивали в соотношении 1:1 с графитовым порошком, содержащим 5% германия.
Построение градуировочных графиков. Для построения градуировочных графиков спектры каждого эталонного образца регистрировали по четыре раза на четырех фотопластинках. По средним значениям относительных интенсивностей
строили градуировочные графики в координатах
1g - 1g с„р,
'Ge
где /пр и Спр— соответственно интенсивность излучения и концентрация примесей в боре.
Аналитические пары линий, интервалы определяемых концентраций и средние относительные ошибки определений приведены в табл. 3, а градуировочные графики — на рис. 30. В последней графе табл. 3 указано, к каким элементам откосятся графики 1—19 на рис. 30. Большие относительные ошибки (30—40%) наблюдаются для элементов в том случае, когда в качестве аналитических выбраны линии ионизованных атомов. Этого следовало ожидать, так как все линии сравнения принадлежат нейтральным атомам германия.
Таблица 3
Аналитические пары линий, интервалы концентраций и средние относительные ошибки определений примесей в боре спектральным методом
Определяемый элемент Аналитическая пара линий Определяемый интервал концентраций, вес. % Средняя ошибка, + % (отн.) Номер графика на рис. 30
Со Coll 2378,6/Ge 2379,1 0,02 —0,8 20 15
Sn SnI 2421,7/Ge 2379,1 0,02 —0,5 13 19
Si Sil 2435,2/Ge 2417,7 1,0 —5,0 13 13*
Al All 2568/Ge 2379,1 0,02 —0,2 12 17
Mg Mgl 2776,7/Ge 2793,9 0,01 —0,2 9 14
Mg Mgll 2802,7/Ge 2793,9 0,001—0,08 32 1
Pb Pbl 2833,1/Ge 2829 0,004—0 1 18 9
Sn SnI 2840/Ge 2829 0,006—0,4 11 8
Sb SbI 2877,9/Ge 2829 0,01 —0,6 18 12
Cr CrII 2677,2/Ge 2829 0,01 —0,5 43 7
Mn Mn 2933,1/Ge 2829 0,004—0,3 35 6
Mn Mn II 2949,2/Ge 2829 0,004—0,3 40 5
Fe Fel 2973,1/Ge 2829 0,01 —0,8 17 И
Ni Nil 3003,6/Ge 2829 0,01 —0,5 17 3*
Cr CrI 3005/Ge 2829 0,01 —0,5 21 18
Bi Bi I 3067,7/Ge 2829 0,002—0,1 13 4
Cd Cdl 3261 /Ge 2829 0,01 —0,4 9 10
Cu Cui 3274/Ge 2829 0,001—0,04 21 2
Zn Znl 3282,3/Ge 2829 0,02 —0,4 15 16
* Построены по верхней шкале концентраций.
159
Чувствительность определения некоторых элементов, как, например, кремния, алюминия, кальция, магния и др., ограничивается наличием в применяемых для приготовления эталонов препарате бора заметных количеств
Рис. 30. Градуировочные графики для определения примесей' в боре (обозначения кривых см. в табл. 3)
этих примесей. По этой же причине не используются наиболее интенсивные линии многих примесей в качестве аналитических. В исходном препарате бора присутствовало особенно много кремния (~1°/о).
При отсутствии бора, чистого по кремнию, эталоны для определения кремния в боре можно готовить на ос-160
нове углерода, аналогично приготовлению их на основе бора. Отношение /si/Zoe в углероде будет то же самое, что и в боре. Результаты определений, полученных на осцове построенного графика, удовлетворительно согласуются с химическими (например, для кремния; табл. 4).
Таблица 4
Содержание кремния в боре (вес. %), определенное спектральным методом на основе построенного графика и химическим методом
Химический анализ .... 3,5 2,0 0,61 0,61 0,44 0,40
Спектральный метод . . . 3,1 2,6 0,64 0,53 0,45 0,44
14. Определение удельной поверхности порошков бора
Для определения удельной поверхности порошков бора используется способ определения удельной поверхности порошков и пористых тел [135, 136].
Под внешней удельной поверхностью порошкообразных материалов подразумевается суммарная поверхность частиц, содержащихся в единице объема или единице веса тела.
Полная удельная поверхность включает поверхность пор, в том числе тупиковых пор, если они имеются.
От удельной поверхности зависят некоторые свойства дисперсной системы: механические свойства, теплопроводность, звукопроницаемость, оптические свойства и т. п.
Величина удельной поверхности дисперсных тел оказывает существенное влияние на адсорбционные свойства тела. Она определяет взаимодействие дисперсного тела с внешней средой в некоторых процессах: капиллярной пропитке, растворении, в химических реакциях и т. д.
Поскольку адсорбционное равновесие определяется полной удельной поверхностью, адсорбционно-статические методы ведут к определению полной, или «статической», поверхности. Методы, основанные на таких кинетических явлениях, как скорость фильтрационных процессов, кинетика адсорбции в диффузионной области и
П Анализ бора 161
т. д., ведут к определению внешней, или «кинетической», удельной поверхности.
Среди методов оценки удельной поверхности порошков и пористых тел наиболее прост и доступен метод измерения по фильтрации разреженного воздуха при молекулярном, или кнудсеновском, режиме течения. Этот метод хорошо разработан теоретически и практически легко осуществим. В основе его лежит формула
S== Л / 2 Ъ’р
13 у xMRT Qx
где S — удельная поверхность; М —
молекулярный вес воздуха; R — универсальная газовая постоянная; Г — температура опыта; б — пористость тела; р — перепад давления на образце при фильтрации; Q — число молей воздуха, протекающих через 1 см2 пористой перегородки; х — толщина слоя, через который идет фильтрация.
Величина б определяется из уравнения
где р2 — насыпной вес испытуемого образца; pi — плотность частиц.
Для экспериментального определения удельной поверхности по данной формуле в лаборатории поверхностных явлений Института физической химии АН СССР разработан специальный оригинальный прибор (рис. 31) [136]. Принцип действия его заключается в следующем: воздух, проходя с определенной скоростью через реометр /, попадает в прибор и, непрерывно от-качиваясь форвакуумным насосом, фильтруется через пористый образец 10, Таким путем создается разрежение воздуха, измеряемое ртутным вакуумметром 9. Перепад давления определяется дифференциальным манометром 2.
Удельная поверхность измеряется при наличии молекулярного, или кнудсеновского, режима течения разреженного воздуха, условия существования которого определяются экспериментально.
Если измерять перепад давления р = h2 — h} на образце в зависимости от давления над образцом Л2 при разрежении воздуха /ij (или в зависимости от среднего 162
Л. л. \ л
давления —-*-< I, то можно установить, что в области * /
молекулярного течения перепад давления на образце не зависит от Л2 (или от среднего давления) при одной и той же достаточно малой скорости течения воздуха. Режим течения воздуха создается определенной скоростью прохождения его в приборе. Необходимо знать пре-
Рис. 31. Принципиальная схема прибора для определения удельной поверхности порошков:
/ — реометр; 2 — дифференциальный манометр; 3 — капилляр; 4 — трубка реометра со шкалой; 5 — трубка манометра со шкалой; 6. 7. 8 — краны; 9 — вакуумметр; 10 — кювета с образцом.
дельные значения скорости течения воздуха, при которых сохраняется молекулярное течение воздуха.
Экспериментально установлено, что в области моле кулярного течения существует прямолинейная зависимость между давлением на образце и высотой (толщиной) образца. Отсюда очевидно, что практически можно использовать для опытов образцы только малой толщины (например, для порошка при S = 50 м2)г толщина слоя х = 0,2 см), так как при большой толщине перепад давления слишком высок.
Как показали многочисленные опыты, проведенные в лаборатории поверхностных явлений Института фи-
11* 163
зической химии АН СССР, и их проверка другими методами, наиболее правильные значения удельной поверхности получаются при пористости б = 0,5. Большая пористость для порошков обычно является результатом образования агрегатов, разделенных сравнительно широкими каналами, снижающими сопротивление течению воздуха. В этих условиях формула становится неприме-* нимой и значения удельной поверхности получаются заниженными.
Прибор широко используется в практике исследовательской работы. Этим прибором определяется удельная поверхность различных сорбентов, катализаторов и других материалов.
15. Приготовление реактивов
Приготовление растворов гидроокиси бария, перманганата калия, едкого натра, тиосульфата натрия, фенолфталеина и метилового красного описано в соответствующей литературе [137].
Раствор сернокислого церия. Окись церия в количестве 100 г помещают в фарфоровую чашку емкостью 1000 мл, прибавляют 250 мл серной кислоты (1:1) и нагревают при температуре 120—130° до тех пор, пока нерастворившаяся масса не примет ярко-желтого цвета. После этого прекращают нагревание, осторожно прибавляют небольшими порциями дистиллированную воду, размешивают, переливают в стакан и прибавляют воды до 1 л. Раствор нагревают при 70—80° в течение 1 ч. Не-растворившийся осадок отфильтровывают и устанавливают титр раствора по соли Мора.
Примечание. При наличии соли сернокислого церия навеску ее растворяют в 2 н. серной кислоте: 99,69 г соли помещ ют в мерную колбу емкостью 1 л и доводя! до метки 2 н. серной кислотой.
Регенерация сернокислого церия [138]. После накопления достаточного количества отходов, содержащих церий, приступают к его регенерации. Для этого прибавляют к раствору избыток насыщенного раствора щавелевой кислоты для осаждения Се2(С2О4)зХ X ЭНгО. Раствор тщательно перемешивают стеклянной палочкой.
После осаждения осадка большую часть жидкости сливают, а осадок переносят на фильтр в воронку Бюх-164
нера. Осадок на фильтре промывают 0,1 н. раствором соляной кислоты и несколько раз водой, а затем ацетоном или спиртом.
Высушенный на воздухе осадок переносят в мелкую испарительную чашку и нагревают желтым пламенем горелки Меккера для превращения щавелевокислого церия в окись церия. Масса вскоре приобретает темносерый цвет, но нагрев при помешивании продолжают до появления серого цвета окиси церия. Эта операция занимает 10—15 мин. Высокая температура ведет к образованию нерастворимой окиси церия. В обычных условиях восстанавливается не менее 95% церия. Из окиси церия готовят сернокислый церий способом, описанным выше.
Растроо фенилантпанчлорнй кислоты (о-дифенил-аминкарбоновой кислоты), 0,2%-ный. Навеску в количестве 0,2 г фенилантраниловой кислоты растворяют в 100 мл 2%-ного раствора двууглекислого натрия.
Индикатор эриохром черный Т, специальный ЕТ-00. 0,5 г индикатора и 3 г солянокислого гидроксиламина растворяют в 100 мл спирта (этилового или метилового). Раствор хранится 10—12 дней в склянке из темного стекла.
Сульфосалицилат натрия. 10 г сульфосалициловой кислоты растворяют в 60 мл дистиллированной воды и прибавляют 35—36 мл 2 н. щелочи. Раствор должен иметь по метиловому красному кислую реакцию.
Промывная жидкость для определения натрия. 0,5 г тройного ацетата NaZn(UO2)3(CH3COO)9’6H2O растворяют в 500 мл 95 %-нот'о или абсолютного этилового спирта. Раствор фильтруют непосредственно перед употпеблением.
Раствор цинкуранилацетата. К 90 мл дистиллированной воды прибавляют 2,7 мл ледяной уксусной кислоты, 10 г уранилацстата и 2,78 г ацетата цинка. Раствор подогревают до растворения солей, затем охлаждают и добавляют в него 2 мл 0,1 н. раствора хлористого натрия. Раствор оставляют стоять сутки, затем осадок отфильтровывают на фильтре-тигле № 4 или № 3.
Регенерация уранилацетата. Лабораторные отходы, содержащие соединения урана, обрабатывают раствооом аммиака с добавкой небольшого количества хлористого аммония. Выпавший темно-желтый
165
осадок пироураната аммония (NH^UjOy сушат, тонко измельчают и малыми порциями нагревают на металлической бане, постоянно перемешивая, при температуре 250—260° в течение 30 ч до получения однородного оранжево-желтого порошка UO3.
К 500 мл 80 %-ной уксусной кислоты, нагретой до 75—80°, добавляют понемногу 85 г UO3. Раствор фильтруют и упаривают на водяной бане при температуре 75—80° до образования кристаллической пленки (испаряется около 150 мл воды), охлаждают до 15—20°, выделившиеся кристаллы отсасывают, промывают 30 мл воды, перекристаллизовывают и сушат при комнатной температуре.
Тетрафенилборат натрия [139]. К раствору фенил-магнийбромида, полученного из 9,6 г магния, 60 г бром-бензола в 200 мл абсолютного эфира, охлаждаемому водой, медленно прибавляют при энергичном перемешивании 8,8 г молекулярного соединения тр<ч»Л1Г ристого бора с эфиром (т. кип. 125—129°), растворенного в 30 мл абсолютного эфира; реакцию проводят в 0,5 л трехгор-лой колбе, снабженной обратным холодильником, капельной воронкой и механической мешалкой. Все соединения колбы лучше осуществлять на шлифах. Фенил-магнийбромид должен быть в избытке. Реакционную смесь нагревают в течение 2 ч на водяной бане. Затем в вакууме отгоняют эфир, нагревая на водяной бане до кипения и поддерживая эту температуру 15—20 мин. Реакционную колбу охлаждают водой и затем поибав-ляют 400—500 мл воды. Если температура поднимается, колбу вновь охлаждают водой. Выпадает осадок фтористого магния и всплывает некоторое количество маслообразного вещества, которое скоро застывает, если реакционную массу вылить в плоскую чашку.
Для осаждения магния прибавляют 45 г углекислого натрия, растворенного в небольшом количестве воды, охлажденной до комнатной температуры. Для лучшей фильтрации осадка и обесцвечивания раствора прибавляют активированный уголь и фильтруют. Осадок трудно промывается, поэтому его снимают с фильтра, размешивают в 400 мл воды и еще раз фильтруют. Оба фильтрата объединяют и насыщают хлористым натрием. Выпадает белый объемистый осадок тетрафенилбората натрия, который отфильтровывают, промывают насы-
166
щепным раствором хлористого натрия и высушивают в вакуум-эксикаторе над хлористым кальцием. Выход — 30 г сырого продукта. Последний экстрагируют в течение 4—6 ч абсолютным эфиром в аппарате Сокслета для удаления мешающих определению калия примесей: После экстракции получается 26—28 г продукта, содержащего 45—50% тетрафенилбората натрия, что составляет 55—60% теоретического, считая на трехфтористый бор. - л
Раствор тетрафенилбората натрия, 3%-ный, и промывная жидкость. Для приготовления раствора тетра-фенитбората натрия в 100 мл воды растворяют 7 г препарата, содержащего около 50% №В(СбН5)4. Раствор оставляют на ночь, затем к нему для коагуляции нерастворимого осадка добавляют 0,5 г гидроокиси алюминия. Осадок отфильтровывают. 1 мл такого раствора осаждает около 3 мг калия.
Для приготовления промывной жидкости к раствору хлористого калия или сульфата калия прибавляют раствор тетрафенилбората натрия. Осадок отфильтровывают и тщательно промывают водой. Полученный осадок взбалтывают с достаточным объемом дистиллированной воды, оставляют стоять на несколько часов, добавляют к нему 0,5—1 г гидроокиси алюминия и фильтруют. Фильтрат служит промывной жидкостью.
Хлоранилат натрия и промывная жидкость. Для синтеза хлоранилата натрия 30 г фенола растворяют в царской водке (400 мл}. Чтобы реакция не была очень бурной, фенол растворяют сначала в 300 мл соляной кислоты, а затем прибавляют 100 мл азотной кислоты и ставят нагревать на водяную баню. Кипятят в течение 10— 12 ч. Затем прибавляют 120 мл соляной кислоты и 40 мл азотной кислоты и кипятят еще, после чего отфильтровывают. Осадок растворяют в смеси ледяной уксусной кислоты и спирта (1:3). Полученный хлоранил (кристаллы желтого цвета) отфильтровывают и высушивают (выход 33%). Затем хлоранил кипятят с 1 н. едким натром, получают хлоранилат натрия (порошок коричневого цвета), который отфильтровывают и сушат (при промывке спиртом).
Для приготовления промывной жидкости (насыщенного раствора хлоранилата кальция) 30 г раствора соли кальция, содержащего 1 мг кальция в 1 мл раствора,
167
разбавляют водой до 10 мл и прибавляют 10 мл 0,5%-ного хлоранилата натрия.
Через 30 мин отфильтровывают осадок через фильтр-тигель № 4 и промывают шесть-семь раз водой. Промы,-тый осадок взмучивают в 500 мл воды и оставляют стоять в течение суток для насыщения, после чего отфильтровывают (раствор бледно-сиреневого цвета).
Литература
1. Самсонов Г. В. и др.. Бор, его соединения и сплавы. Киев, Изд-во АН УССР, 1960.
2. Малышева Н. Г. и др. «Ж. аналит. химии», 18, 1367 (1963).
3. М у р а ч Н. Н. Справочник металлурга по цветным металлам.
Т. 1. М., Металлургиздат, 1953, стр. 1038.
4. J о n е s L. С. Z. anorgan. und allgem. Chem., 20, 212 (1899); 21 169 (1899).
5. Stock C. R. Compt. rend. Acad. sci.. Paris, 130, 516 (1900).
6. Kroll W. Z. anorgan. und all^em. Chem 102. 1 (1918).
7. Blumenthal H. Analyt. Chem., 23, 992 (1951).
8. Blumenthal H. Powder metal Bull., 6, 80 (1951).
9. Михеева В. И. и др. «Ж. неорган. химии», 11, 1249 (1957).
10. Gmelins Handbuch der anorganischen Chemie. Bor. Erg. Band., 1954.
11. Анализ минерального сырья. Сб. методов хим. анализа. Под пед. Ю. Н. Книпович и Ю. В. Морачевского. Л., Госхимиздат, 1956.
12. Moissan Н- Ann. chimie, 7, 428 (1895).
13. Котляр Е. Е., Назар чу к Т. Н. «Ж. аналит. химии», 15, 207 (1960).
14. «Бэйцузин даоюэ сюэбао (цзыжань кэсюэ)», 4, 491 (1958); цит. по «Реф. ж. хим.», 15. № 53155 (1959).
15. Марковский Л. Я., Капутовская Т. В. «Заводск. лаборатория», 24, 1065 (1958).
16. Васильева М. Г., Соколова А. Л. «Ж. аналит. химии», 7, 530 (1962).
17. Moissan Н. Ann. chimie, 7, 296 (1895).
18. Weintraub Е. Trans. Amer. Electrochem. Soc., 16, 165 (1904). 19. Kahlenberg A. Trans. Amer. Electrochem. Soc., 47, 29 (1925). 20. 3 а б и я к о В. И. Материалы диссертационной работы, Уральский н.-и. хим. ин-т, 1951.
21. Забияко В. И. «Тр. Уральского н.-и. хим. ин-та», Вып. 1, 222 (1954).
22. Winslow Е., L i е b h a f s к у Н. J. Amer. Chem. Soc., 64, 2725 (1942).
23. Акимов А. И. «Оптика и спектроскопия», 1, 434 (1956).
24. Lader S. Appl. Spectroscopy, 12, 85 (1958).
25. Тарасевич Н. И., Железнова А. А. «Ж. аналит. химии», 18, 1345 (1963).
26. Ш в а н г и р а д з е Р. К. и др. «Ж. аналит. химии», 17, 94 (1962).
27. Г и л л е б р а н д В. Ф. и др. Практическое руководство по неорганическому анализу. М., Госхимиздат, 1957.
168
28. К о л ь т г о ф И. М., С е н д е л Е. Б. Количественный анализ. М.—Л., Госхимиздат, 1948.
29. Комплексонометрия. Сб. статей. Перев. с англ. М., Госхимиздат, 1958.
30. М а к-Б е н Д. М. Сорбция газов твердыми телами. Перев. с англ. М.— Л., ОНТИ, 1934.
31. Брунауер С. Адсорбция газов и паров. Т. 1. М., Изд-во иностр, лит., 1948.
32. Беринг Б. П., С е р п и н с к и й В. В. «Докл. АН СССР», 55, 741 (1947).
33. Холлидей А., Мес сей А. «Успехи химии», 33, 233 (1964).
34. «Тр. Уральского н.-и. хим. ин-та», вып. 5, 1959, стр. 166.
35. Клейнер К. Е., Маркова Л. В. «Укр. хим. ж.», 23, 236 (1957).
36. Клейнер К. Е. «Укр. хим. ж», 22, 809 (1956).
37. Т у р о в ц е в а 3. М. Анализ газов в металлах. «Тр. Комис, по аналит химии АН СССР», 10 (1960).
38. Kern R. Phys. Kondens. Mater., 1, 105 (1963).
39. T у p о в ц e в a 3. М., Кунин Л. Л. Анализ газов в металлах. М.—Л., Изд-во АН СССР, 1959.
40. Левин Е. Е. Микроскопическое исследование металлов. М.— Л., Машгиз, 1955.
41. Лукьянович В. М. Электронная микроскопия в физико-хи-мических исследованиях. М., Изд-во АН СССР, 1960.
42. Бальшин М. Ю. Порошковая металлургия. М., Машгиз, 1948.
43. К о р е н м а н И. М. Количественный микрохимический анализ. М.—Л., Госхимиздат, 1949.
44. Али мар ин И. П. «Заводск. лаборатория», 9, 365 (1940).
45. Цо м а я К. П., Ш в а н г и р а д зе Р. Р. Физика металлов и металловедение. Т. 10, вып. 5. Свердловск, Металлургиздат, 1960.
46. Ф а й н б е р г С. Ф. Анализ руд цветных металлов. М., Металлургиздат, 1953.
47. Дымов А. М. Технический анализ металлов. М., Металлургиздат, 1949
48. Берлин А. Я. Техника лабораторной работы в органической химии. М., Госхимиздат, 1952.
49. Мухина 3. С. и др. Методы анализа металлов и сплавов. М., Оборонгиз, 1959.
50. Яковлев П. Я. и др. Анализ материалов металлургического производства М., Металлургиздат, 1961.
51. Самсонов Г. В. и др. Анализ тугоплавких соединений. М., Металлургиздат, 1962.
52. К а ва х а та Macao и др. «Бунсэки кагаку». Japan Analyst, 11, 192 (1962); цит.. по «Реф. ж. хим.», ЗГ122 (1963).
53. Friedrich К. Mirkochim. acta, 4, 674 (1963).
54. Povolny М. Rostl. Vyroba, 8, 781 (1962).
55. Bruins E. H. Analyt. Chem., 35, 934 (1963).
56. Быковская Ю. И. «Ж. аналит. химии», 17, 607 (1962).
57. Т и х о н о в В. Н., Г р а н к и н а М. Я. «Ж. аналит. химии», 17, 917 (1962).
58. К и м X е н Н а к и др. «Ж. аналит. химии», 1, 54 (1962).
59. Кри венцов М. И. В сб. «Современные метолы анализа природных вод», вып. 15. М., Изд-во АН СССР, 1962.
60. Piller R. Z. analyt. Chem., 157, 7 (1957).
169
61. Dupuis Th. Compt. rend. Acad, sci., Paris, 237, 256 (1953).
62. Belcher R., Robinson J. W. Analyt. chim. acta, 27, 568 (1962)
63. Huka Milan Valny Z d e n ё k. Sklar a Keramik, 12, 7, 21 (1962).
64. ? ысс И. Г., Нилу Э. Л. «Тр. Днепропетр. металлург, ин-та», вып. 44, 197 (1961).
65. Муренкова А. А., Вечер А. А. «Хим. пром-сть», 5, 68 '1962).
6Ь. Русакова Г. Г. «Ж. аналит. химии», 18, 154 (1963).
67. Янсон Э. Ю., Иевиньш А. Ф. «Уч. зап. Рижского политехи, ин-та», 6, 57 (1962).
68. В oval ini Е., Gasini A. Ann. chimica, 52, 482 (1962).
69. Полуэктов Н. С. Экспрессные методы анализа при помощи фотометрии пламени в цветной металлургии. М., Металлург-издат, 1958.
70. Полуэктов Н. С. Методы анализа по фотометрии пламени. М.. Госхимиздат, 1959.
71. Пршибил Р. Комплексоны в химическом анализе. М., Изд-во иностр, лит., 1955.
72. Пршибил Р. Комплексоны в химическом анализе. М., Изд-во иностр, лит., 1960.
73. Лен дель Г. и др. Анализ черных металлов. М.— Л., Госхимиздат, 1934.
74. Б а б к с А К., П и л и п е н к о А. Т. Колориметрический анализ. М.— Л.. Госхимиздат, 1951.
75. Сен дел Е. Б. Колориметрическое определение следов металлов. М.— Л., Госхимиздат, 1949.
76. К о в а л е н к о П Н. В сб. «Технология покрытий металлов и методы контроля производства». Ростов-на-Дону, Ростовск. ун-т, 1962, стр. 155.
77. С h i г a A. Rev. chim. (RPR), 13, 494 (1962).
78. Юаса Теру «Бунсэки кагаку», Japan Analyst, 11, 359 (1962).
79. Л исецкая Г. С. и др. «Заводск. лаборатория», 29 156 (1963).
80. Б л а н к А. Б. и др. «Ж. аналит. химии», 16, 715 (1961).
81. К у з н е ц о в В. И. и др. «Заводск. лаборатория», 16, 787 (1950).
82. Macher К., Nadziakiewicz Н. Chem. anali., 7, 599 (1962).
83. Steele Т. W., Н у d е A. J. J. S. Inst Mining and Metallurgy, 62, 12, Part. 2 764 (1962).
84. И с и x a p а Йос и кор o, Kora Моритака. «Бунсэки кагаку», Japan Analyst, 11, 246 (1962)
85. Б о г д а с a p о в К. Н. «Уч. зап. Ростовск.-на-Дону ун-та», 60, 105 (1959).
86. Л и с е ц к а я Г. С. и др. «Заводск. лаборатория». 29, 156 (1963).
87. Кузнецов В. И. «Заводск. лаборатория», 3, 278 (1946).
88. Иоффе В. П. «Сб. тр. Гос. н.-и. ин-та цветн. мет», № 19, 736 (1962).
89. J а с k s о n Н., Р h i 1 1 i р s D. S. Analyst, 87, 712 (1962).
90. Fennel T. R. F., W e b b J. R. Taianta, London, 9, 795 (1962).
91. Конкин В. Д. «Заводск. лаборатория», 20, 414 (1954).
92. L a n d i М. F., В г a i с о v i с h L. Metallurgia ital., 54, 389 (1962).
170
93. Назаренко В. А., Бирюк Е. А. Современные методы анализа в металлургии. М., Металлургиздат, 1955.
94. Агинская Н. А., П е т р а ш е н ь В. И. «Тр. Новочерк. политехи ин-та», 72, 13 (1958).
95. Багдад а ров К. Н. и др. Труды совещания работников вузов и заводских лабораторий Юго-Востока СССР по физико-химическим методам контроля производства. Изд-во Ростове к.-на-Дону ун-та, 1959, стр. 170.
96. Бухаров И. Н. и др. В сб. «Методы получения и измерения радиоактивных препаратов». М., Атомиздят, 1960.
97. Молот Л. А и др. «Тр. Комис, по аналит. химии АН СССР», 11, 231 (1960).
98. W е t 1 е s е и С. U., О m a ng S. Н. Analyt. chim. acta, 24, 294 (1961).
99. Kacl К. et al. Casoplekaru ceskych, 93, 629 (1954).
100. Ринькис Г. Я. «Тр. Ин-та биол. АН Латв. ССР», 21, 191 (1961).
101. Беленький Б. Г., С е в е р и н е ц Л. Я. «Ж. аналит. химии», 18 954 (1963).
102. Williams М. В., Moser J. Н. Analyt. Chem., 25, 1414 (1953).
103. С о г s u с h Т. Т, Posner А. М. Nature 176, 268 (1955).
104. Горюшина В. Г., Арчакова Т. А. «Заводск. лаборатория», 28 796 (1962).
105. Богданова И. В. «Ж. аналит. химии», 16, 677 (1961).
106. Основные указания по аналитическому применению реактива на кальций—кальциона ИРЕА. М., 1960 (Всес. н.-и. ин-т хим. реактивов).
107. Barreto A. Rev. quim. industr., 14, 18 (1945); Chem. Abstr., 40. 4974 (1946).
108. Назаренко В. А., Бирюк E. А. «Заводск. лаборатория», 18, 1425 (1952).
109. Tyner E. Ch. Analyt. Chem., 20, 76 (1948).
ПО. Гусев С. И. и др. «Ж. аналит. химии», 16, 674 (1961).
111. Назаренко В. А., Бирюк Е. А. «Заводск. лаборатория», 21, 20 (1955).
112. Marczenko Z, К a s i и г а К. Chem. anal it., 7, 775 (1962).
113. Пей ве Я., Пакалн Г. «Изв. АН Латв. ССР», 3. 59 (1962).
114. Бабко А. К., Л у тохин а Н. В. «Ж. аналит. химии», 17, 922 (1962)
115. Willstatter R. et al. Chem. Вег, 61. 2280 (1928).
116. Никитина Е. И. «Заводск. лаборатория», 24, 398 (1958).
117. Spillner F. Mitt. Verein. Grosskesselbesitzer, 80, 366 (1962).
118. Богдасаров К. Н.. За и кин а Т. И. В сб. «Технология покрытий металлов и методы контроля производства». Изд-во Рос-товск.-на-Дону ун-та, 1962, стр. 180.
119. Цап М. Л. «Заводск. лаборатория», 21, 281 (195>).
120. Егорова Е. Н. «Изв. АН СССР. Отд. хим. наук», № 1, 16 (1954).
121. В rad so n J. A. et al. Analyt. Chem, 20, 504 (1948).
122. Кикс C. Analyt. Chem., 25, 148 (1953).
123. Назаренко В. А., Флянтикова Г. В. «Заводск. лаборатория», 24, 663 (1958).
124. Andersson Z. Н. Arkiv Kemi, 19, 223 (1962).
171
125. С а пир А. Д. «Заводск. лаборатория», 19, 1035 (1953).
126. Wolk Т. Arch. Eisenhiittenwesen, 25, 333 (1954).
127. Тананаев Н. В., Дубова М. И. «Заводск. лаборатория», 18. 22 (1952).
128. Носков Ф. Н.. Соколова В. М. «Заводск. лаборатория», 18. 176 (1952).
129. Алексеенко И. С. «Заводск. лаборатория», 18, 178 (1952).
130. Boiric С.. Platzer R. Acta chim. Acad, scient. hung., 33, 267 (1962).
131. Harrison F H. Metallurgy, 66. вып. 300, 398 (1962).
132. Усатенко Ю. И., Орлова Ю. Я. «Заводск. лаборатория», 15. II (1949).
133. Мальцев В. Ф., Лукьяненко Л. П. В сб. «Производство труб». Вып. 7. Харьков, Металлургиздат, 1962, стр. Г2.
134. Loren zini L. et al. Metallurgia, ital., 54, 387 (1962).
135. ДерягинБ В. и др. «Ж. прикл химии», 29. 46 (1956).
136. Дерягин Б. В. и др. «Вестн. АН СССР», 2, 80 (1963).
137. Сусленникова В. М.. Киселева Е. К. Руководство по приготовлению титрованных растворов. Л., Госхимиздат, 1962.
138. DukeF. R, Stone К. G. Industr. and Engng Chem. Analyt. Ed., 16, 721 (1944).
139. Иевиньш А. Ф., ГудриниецеЭ. Ю. «Ж. аналит. химии», 2, 271 (1954).
ГЛАВА IV
АНАЛИЗ БОРИДОВ
1. Введение
Бориды относятся к металлоподобным тугоплавким соединениям и имеют большое внешнее и внутреннее сходство с металлами и интерметаллидами.
Большинство металлоподобных соединений образуются металлами переходных групп. Связь в таких соединениях осуществляется валентными электронами и электронами внутренних уровней. Поэтому металлоподобные соединения очень прочны, обладают большой твердостью, тугоплавкостью, химической стойкостью, высокими значениями энергий кристаллических решеток, при образовании их из элементов выделяются большие количества тепла, они характеризуются высокой электро- и теплопроводностью, а некоторые из них и сверхпроводимостью [1, 2].
Наиболее изучены бориды щелочноземельных, редкоземельных и переходных металлов. Бориды щелочных металлов в чистом виде до сих пор не получены. Они образуются в количестве 2—6% при производстве аморфного бора методом восстановления окиси бора металлическим калием или натрием [3] и при электролизе расплавленных солей [4, 5]. При анализе элементарного бора, полученного электролитическим методом из расплава солей фтористого калия, хлористого калия и тетрафторобората калия, и бора, полученного восстановлением трехфтористого бора металлическим натрием, нами обнаружено 1—3% калия в первом и до 2% натрия во втором.
В результате реакции сплавов медь — магний и медь — кальций с бурой при температуре 1500° образуется борид меди с содержанием бора 4% [6], которому приписывается состав С11В22 [2].
173
Некоторые физические свойства отдельных боридов приведены в табл. 5 [1].
Таблица 5
Физические свойства некоторых боридов тугоплавких металлов
Борид Молекулярный вес Удельный вес, г!см* Теплота образования, ккал моль Температура плавления, °C Т еплопроводно^ ть при 20° С, у 10* кал см сек град Микротвердость, кг/мм* Удельное электросопротивление, мкомсм
TiBa 69 54 4.45 70 0 2950 58 3370 14,4
ZrB2 1 2 86 5 8 78,0 £040 58 2250 16 6
HiB2 200 2 10 5 3250 —• 20)0 8.8
\в2 72.59 4 6 1 24С0 *— 2800 19 0
NlBa 114 55 6 0 36,0 3000 40 2600 34,0
Т аВ2 202 52 11 7 52 0 3’00 26 2500 37.4
Ci В2 73 65 5 6 30 0 2200 53.4 2 00 84.0
МооВ5 246 00 8 0 50 0 2 00 61.0 2350 18 0
W.,B5 42. 94 и.о 25—45 2300 76,0 2660 43.0
ВаВб 202 28 4.25 1 2270 —— 3000 ЗС6 0
SrBe 152 55 3.42 -1 2235 — 2900 191.8
СаВв 104,92 2,45 2235 2740 123,5
Основные способы получения боридов следующие:
1. Синтез из элементов спеканием смесей порошков металла и бора в атмосфере аргона при 1300—2000°.
2. Осаждение из газовой фазы при восстановлении летучих галоидных соединений бора и металла водородом.
3. Взаимодействие окиси металла с карбидом бора или смеси окислов металла и бора с углеродом.
4. Электролиз расплавленных смесей боратов щелочных и щелочноземельных металлов с окислами тугоплавких металлов.
5. Металлотермическое восстановление смеси окислов металла и бора.
6. Восстановление окислов металла бором [2].
В зависимости от способа и условий получения боридов состав их может быть различным: М4В, М3В, М3В2, М3В4, М2В, М2В5, МВ, МВ2, МВ4, МВб. Один и тот же металл может давать ряд из указанных соединений. Вследствие наличия у бора одного неспаренного 2о-электрона 174
на внешней орбите атомы бора способны к прочной ковалентной связи как в собственных кристаллах, так и в соединениях с другими элементами, что обусловливает разнообразные и сложные кристаллические структуры боридов. Вопросы изучения фазового состава боридов, их структуры, а также определения микротвердости, эмиссионных свойств, электросопротивления и другие подробно освещены в соответствующей литературе [2,7—24].
Первое систематическое исследование химической стойкости боридов переходных металлов проведено в работе [25], где изучалось действие на порошки боридов со-: ляной, азотной, серной, фосфорной, хлорной, плавиковой J и щавелевой кислот, а также смесей кислот с добавками I различных окислителей. Результаты, полученные в этом . исследовании, приводятся в табл. 6 [1, 25].
На основании данных о химической стойкости бори-дов переходных металлов [1, 2, 25—30] можно сделать ’ -следующие выводы. Наиболее легко бориды металлов J IV, V и VI групп растворяются смесями серной (уд. в. 1,84) и азотной (уд. в. 1,4), а также азотной и плавиковой кислот. Бориды ле! ко разлагаются в серной кислоте с добавками сульфата калия и надсернокислого калия, при спекании с окисью кальция, окисью магния или углекислым барием и при сплавлении со щелочами и карбонатами щелочных металлов. В щелочных растворах бориды переходных металлов количественно разлагаются, особенно при нагревании. Исключение представляет борид хрома состава СгВ2, который практически не разлагается в щелочных растворах.
Бориды щелочноземельных металлов СаВб, SrBe, ВаВ6 по своим химическим свойствам очень похожи друг на друга. Они легко разлагаются при нагревании серной кислотой (уд. в. 1,84) и растворами азотной кислоты. Окислители (PbO2, KNO3) быстро разлагают эти бориды при температуре красного каления; они разлагаются также при сплавлении с карбонатом калия, едким кали или кислым сульфатом калия. При температуре красного каления бориды щелочноземельных металлов взаимодействуют с хлором и серой, а при температуре 250° и под давлением они разлагаются водой [1]. С боридами кальция, стронция и бария медленно реагируют галоило-; водородные кислоты, а также смесь КС1О3 и НО [31]. Растворы галоидоводородных кислот и разбавленной
J75
Таблица 6,
Растворимость боридов переходных металлов в различных средах
Борид НС) (УД. в. 1.19) H,SP4 (Уд. в. 1.84) н,рэ4 (уд в. 1.7) HNO, (УД. в. 1.4) нсю4 HF (кони.) Н,с,о4 (насыщ. рас твоР) Смесь кислот + окислитель Смесь кислот Нарекая водка
TiB, Н н. р. н. р. 1 н — Р р н. р.
ZrB2 Н X. р. • Р ——» —• — Р р Р
VB2 Р р р Р р р оч. уст. х. р. X. р. X. р.
NbB2 н —- Н —" — н н н
ТаВ2 н н. р. н. р. н — — —— —— - — н
Cr3B2 оч. уст. оч. уст. ——— н X. р. оч. уст. —— —— ——
СгВ н н II XI 1 н н — X. р. X. р. — —
СгВ2 X. р •——• — X 1 —• — — •—
Мо2В н X. р. — X. р. —— — - — ——* —— —
МоВ н. р. — - — — - — — х. р. X. р. —
Мо2В3 .—- — ' х. р. —— —— — X. р. х. р. X. р.
WB н — ~~ - — — - ' " X. р. X. р. х. р.
Примечание. х. р. — хорошо растворим; р — растворим; н. р. — незначительно растворим; н — нерастворим; оч. уст — совершенно нерастворим;------данные о растворимости отсутствуют.
серной кислоты на бориды щелочноземельных металлов не действуют совершенно. Аммиак не действует на эти бориды даже при температуре размягчения стекла. Отдельные бориды щелочноземельных металлов взаимодействуют с концентрированной хлорной кислотой [1] и с фтором [31, 32].
Бориды редкоземельных элементов — химически до- вольно устойчивые соединения. Они не разлагаются соляной (уд. в. 1,19), плавиковой и разбавленной серной кислотами, а также растворами щелочей [33]. Исключе-1 ние составляет гексаборид церия, который разлагается ; смесью едкого натра и пергидроля [34]. Серная кисло-' та (уд. в. 1,84) разлагает бориды редкоземельных эле-[ ментов только при нагревании. В азотной кислот^ (кон-Ь центрированной и разбавленной) эти бориды разлагают-ся полностью. Замечено, что при загрязнении боридов \ редкоземельных элементов карбидами или углеродом их ; необходимо сплавлять с карбонатом калия-натрия. Можно также разложить бориды редкоземельных элементов действием кислот-окислителей и при сплавлении с пере-i кисью натрия, щелочами и содой. Данные о растворимо-< сти боридов редкоземельных элементов в кислотах и их смесях приведены в табл. 7.
Таблица 7
Растворимость боридов редкоземельных элементов в кислотах и смесях кислот, %
Бори д HNO3 (1 : 1) Царская водка (1 : 1) H2SO4 + 5 капель HNO3 НС1 (1 : 1) H2so4 (1 : 1)
VB„ Полное раст- Полное раст- Полное раст- 77—78 71—72
LaB6 ворение при ворение на ворение при 93—94 89—92
СеВ6 слабом нагре- холоду или при слабом нагре- 84—86 83—84
PrBe вании в тече- слабом нагре- вании в тече- 90—94 27—30
NdBe ние 5 мин вании в тече- ние 5 мин 87—88 78
SmB6 ние 5 мин 79—80 77
GdBe 91—93 87
Бориды элементов группы железа (Fe, Со, Ni) растворяются в концентрированной серкой кислоте при нагревании, в азотной кислоте и царской водке, а так^ке в смеси серной и соляной кислот в присутствии окислителей [2, 6].
12 Анализ бора
177
Бориды элементов группы платины хорошо растворяются в царской водке, медленно — в серной кислоте при нагревании [2].
Элементы седьмой группы периодической системы (Мп, Re) также способны образовывать с бором различные бориды. Бориды марганца [33] разлагаются не только кислотами, ко даже холодной и особенно горячей водой. Борид марганца МпВ растворим в перйодате и йодате калия [2]. В практике работы с боридами рения ReB2, Re2B5 и смешанными боридами рения и редкоземельных элементов нами установлено, что они нацело разлагаются в азотной кислоте (1:1), при сплавлении с углекислым калием-натрием и при спекании с углекислым барием.
Анализ боридов основан на переведении их в раствор при помощи окислителей, чаще всего азотной кислоты [35, 36], расплавленных карбонатов, щелочей, перекиси натрия [5] и карбонатио-нитратных смесей [37]. Для боридов легких металлов (Са, Sr, Ba, Mg, Be) может быть рекомендован перйодатный и йодатный методы [38], а также метод растворения в азотной кислоте [1].
Универсальный метод для анализа боридов разработан Блюменталем [39—41]. Метод основан на сплавлении в платиновом тигле боридов с 10-кратным избытком карбонатов калия-натрия с добавкой 0,1—0,2 г нитрата натрия. Блюменталь разработал метод анализа большей части боридов в трех вариантах: 1) сплавление с бисульфатом калия в кварцевом тигле для анализа боридов железа, циркония и титана: 2) сплавление со смесью карбоната и нитрата натрия для анализа боридов алюминия, кальция, магния, хрома, марганца, ванадия, молибдена, тория, вольфрама; 3) сплавление со смесью карбоната и нитрата калия для анализа боридов ниобия и тантала.
Для анализа боридов (в том числе -и боридов тантала, ниобия, вольфрама, лантана, циркония, титана) разработаны экспресс-методы, основанные на сплавлении с избытком перекиси натрия или едкого натра в железном или никелевом тигле [42, 43].
После переведения боридов в растворимое состояние металлы отделяются от раствора осаждением щелочью, содой, гидроокисью бария [44—46]. Осадок затем отфильтровывают, а в фильтрате определяют борную кислоту путем титрования ее раствором едкого натра в при-
178
сутствии маннита и фенолфталеина [1, 2]. В некоторых боридах определение бора можно проводить без предварительного отделения металла [1, 34]. Нами предложен метод анализа боридов рения и смешанных боридов рения и редкоземельных элементов без отделения рения. А. Т. Пилипенко и Л. Н. Кугай для отделения от бора никеля, молибдена и ванадия применили экстракцию их диэтилдитиокарбаминатных комплексов хлороформом [47].
На основании литературных данных о растворении бора [35, 46, 48, 49] и некоторых боридов [50] в различных окислителях была исследована возможность определения свободного бора в некоторых тугоплавких соединениях [51] и разработан метод определения общего и свободного бора в карбиде бора, нитриде бора, боридах циркония, гафния, тантала и хрома [1].
2. Анализ боридов редкоземельных элементов
В боридах .редкоземельных элементов определяют содержание металла, общего бора и общего углерода.
Определение редкоземельных элементов
Для определения редкоземельных элементов применяют объемный метод титрования раствором комплексона III с индикатором арсеназо [34, 52—54].
Необходимые реактивы
1. Аммиак (1 : I).
2. Пиридин.
3. Комплексон III, 0,025 М раствор.
4. Арсеназо, 0,5%-ный водный раствор.
5. Азотная кислота (1:1).
Ход анализа. Навеску 0,2 г гексаборида редкоземельного элемента растворяют при слабом нагревании в колбе с обратным холодильником в 10—20 мл азотной кислоты. Полученный раствор переносят в мерную колбу емкостью 250 мл и доводят водой до метки. 50 мл раствора переносят в коническую колбу емкостью 300 мл, j\q-бавляют три — пять капель пиридина, нейтрализуют избыток кислоты аммиаком при pH 6—7 по универсальной индикаторной бумажке, прибавляют две-три капли рас-12* 179
гвора арсеназо и титруют редкоземельный элемент 0,025 М раствором комплексона III до перехода фиолетовой окраски в розовую.
Содержание редкоземельного элемента вычисляют по формуле
TV-250-100 п-50
где Т — титр раствора комплексона III, выраженный в граммах редкоземельного элемента, г!мл; V — объем раствора комплексона III, израсходованного на титрование, мл; п — навеска борида редкоземельного элемента^. Точность определения ±1% (отн.).
Определение общего бора
Для определения бора в боридах редкоземельных элементов применяют объемный метод без отделения последних [34]. Редкоземельный элемент связывают комплексоном III в комплексное соединение и определяют бор объемным методом в присутствии комплексоната редкоземельного элемента.
Необходимые реактивы
1. Едкий натр, 0,1 н. раствор.
2. Метиловый красный, 0,1%-ный спиртовой раствор.
3. Фенолфталеин, 1%-ный спиртовой раствор.
4. Маннит.
Ход анализа. 50 мл раствора, полученного как указано выше, переносят в коническую колбу емкостью 300 мл, добавляют точное количество 0,025 М раствора комплексона III, необходимое для связывания редкоземельного элемента, которое находят по методу, описанному выше. Полученный раствор нейтрализуют по метиловому красному сначала 10%-ным, а затем 0,1 н. раствором едкого натра. К раствору добавляют маннит, несколько капель фенолфталеина и титруют 0,1 н. раствором едкого натра до появления розовой окраски раствора, не исчезающей при добавлении новой порции маннита.
Содержание бора вычисляют по формуле
<2В(%) =
TV 100 • 250
п -50
180
где Т — титр 0,1 н. раствора едкого натра, выраженный в граммах бора, г! мл; V — объем 0,1 н. раствора едкого натра, израсходованного на титрование, мл; п — навеска, г.
Если гексаборид редкоземельного элемента растворяется в азотной кислоте неполностью, навеску в 0,05 г сплавляют со смесью карбонатов калия и натрия, плав выщелачивают соляной кислотой (1:1), раствор переносят в мерную колбу емкостью 100 мл. Содержание редкоземельного элемента определяют, как описано выше. Содержание бора определяют после кипячения раствора с обратным холодильником для удаления СО2 методом, описанным выше.
Определение общего углерода
Содержание общего углерода в боридах редкоземельных элементов определяют абсорбционно-газообъемным методом, сжигая навеску (0,05—0,1 г) в токе кислорода с плавнем — окисью меди, как указано при определении: общего углерода в карбиде бора (см. гл. V, п. 1).
3. Анализ борида тантала |1]
В бориде тантала определяют содержание бора и тантала.
Определение бора
Определение бора проводят аналогично определению бора в бориде молибдена [1]. Следует отметить, что после спекания навески, выщелачивания спека горячей водой и добавления соляной кислоты тантал необходимо отделять осаждением карбонатом бария.
Определение тантала
Ход анализа. Навеску 0,1 г борида тантала сплавляют с 1 —1,5 г перекиси натрия в никелевом тигле. Плав выщелачивают водой, гидроокись никеля растворяют в серной кислоте. Из сернокислого раствора осаждают тантал избытком аммиака в присутствии хло
рида аммония. Гидроокись тантала отфильтровывают, промывают разбавленным раствором аммиака (1:20) и растворяют в горячей серной кислоте (1 :4). Фильтр с осадком хорошо промывают водой. Фильтрат разбавляют водой до 150 мл и осаждают тантал 6%-ным раствором купферона при температуре 10—15°, добавляя его небольшими порциями и постоянно перемешивая раствор. Купферонат тантала выпадает не сразу. Поэтому раствору необходимо дать постоять в течение часа после добавления 15—20 мл купферона. Осадок купфероната тантала отфильтровывают, промывают водой, подкисленной серной кислотой, сушат, прокаливают и взвешивают. Весовая форма — ТагОб.
Содержание тантала вычисляют по формуле
<?Та(%)
а-0.8189-100
п
где а — вес осадка пятиокиси тантала, е; 0,8189 — пере-счетный коэффициент с пятиокиси тантала на тантал; п — навеска, г.
Точность метода ±0,1% (отн.).
4. Анализ борида хрома [1]
В бориде хрома определяют содержание общего и свободного бора, хрома и общего углерода.
Определение общего бора
Определение общего бора проводят аналогично его определению в бориде титана [1].
Определение хрома
Хром определяют объемным методом. Борид хрома растворяют в серной кислоте с добавлением азотной кислоты. Хром окисляют до шестивалентного состояния персульфатом аммония, применяя в качестве катализатора нитрат серебра:
Сг2 (SO4)3 + 3 (NH4)2S2O8 + 8Н2О = 2Н2СгО4 +
+ 6NH4HSO4 + 3H2SOd.
В качестве катализатора можно применять также сульфаты кобальта и никеля.
182
Шестивалентный хром титруют раствром соли Мора: 2Н2СгО4 + 6FeSO4 + 6H2SO4 - Cr2 (SOt)3 +
+ 3Fe2 (SO4)3 + 8H2O.
В качестве индикатора применяют фенилантранило-вую кислоту.
Точность метода ±0,5—1 % (отн.).
Необходимые реактивы
1. Перекись натрия.
2. Азотнокислое серебро, 1%-ный раствор.
3. Персульфат аммония, 20%-ный раствор.
4. Стандартный раствор соли Мора.
5. Фенилантраниловая кислота.
6. Серная кислота (1:1).
Ход анализа. Навеску 0,1 г борида хрома растворяют в 50 мл серкой кислоты (1:4) в стакане емкостью 250 мл, накрытом часовым стеклом. После прекращения растворения осторожно добавляют 2—3 мл азотной кислоты, нагревают до выделения паров серной кислоты, давая им выделяться в течение 2--3 мин (длительное выделение паров серной кислоты приводит к выпадению нерастворимых солей хрома). Раствор охлаждают, разбавляют водой до 200 мл, нагревают и переносят в колбу емкостью 500 мл. Прибавляют 5 мл раствора нитрата серебра, 20—25 мл раствора персульфата аммония, нагревают до кипячения и кипятят до полного разложения персульфата аммония. Затем раствор охлаждают и титруют раствором соли Мора в присутствии фенилантраниловой кислоты.
Содержание хрома вычисляют по формуле
где Т — титр раствора соли Мора, выраженный в граммах хрома, г!мл; V — объем раствора соли Мора, израсходованного на титрование, мл; п— навеска, г.
Определение свободного бора
Определение свободного бора в бориде хрома основано на различной растворимости борида и свободного бора в соляной кислоте (1 :1).
183
Ход анализа. Навеску 0,5—1,0 г борида хрома растворяют при нагревании в колбе с обратным холодильником в 50 мл соляной кислоты (1:1) в течение часа. Нерастворимый остаток, состоящий из карбида бора и свободного бора, отфильтровывают и промывают соляной кислотой (1 :20). Осадок с фильтром помещают в колбу и приливают смесь, состоящую из 30 мл перекиси водорода (1:3) и пяти капель азотной кислоты. Растворение ведут при нагревании с обратным холодильником в течение 30—40 мин. Остаток карбида бора отфильтровывают и в фильтрате определяют содержание свободного бора. Фильтрат нейтрализуют раствором едкого натра по метиловому красному и определяют бор, как описано при определении бора в бориде циркония [1].
Определение общего углерода
Содержание общего углерода в бориде хрома определяют абсорбционно-газообъемным методом, сжигая навеску 0,5—1,0 г борида в токе кислорода при температуре 1100—1200° с плавнем — окисью меди.
5. Анализ борида никеля [1]
Определение никеля
Никель определяют объемным комплексонометрическим методом.
Необходимые реактивы
1. Комплексон III, 0,05 М раствор.
2. Буферный раствор, pH = 11.
3. Мурексид.
Ход анализа. Навеску 0,5 г борида никеля растворяют при нагревании в 20—30 мл азотной кислоты (1:1) с добавлением нескольких капель соляной кислоты. Раствор охлаждают, разбавляют водой, переносят в мерную колбу емкостью 250 мл и доводят водой до метки. 25 мл полученного раствора перекосят в коническую колбу емкостью 250 мл; разбавляют до 80 мл водой, нейтрализуют раствором аммиака до образования аммиаката никеля, добавляют 30—50 мл буферного раствора, разбавляют водой до 150 мл и на кончике шпателя вносят сухую смесь мурексида с хлоридом натрия. Титруют раствор 0,05 М раствором комплексона III до перехода желтой окраски раствора в фиолетовую.
184
Содержание никеля вычисляют по формуле
<U%) I I»
где Т — титр 0,05 М раствора комплексона 111, выраженный в граммах никеля, г/мл; V — объем 0,05 М раствора комплексона III, израсходованного на титрование, мл; п — навеска, соответствующая взятой части раствора, г.
Точность метода ±1% (отн.)
Определение бора
Содержание бора в бориде никеля определяют объемным методом титрования раствором едкого натра в присутствии маннита. Никель связывают в комплексное соединение комплексоном III.
Ход анализа. 50 ли раствора, полученного как описано выше, переносят в колбу для титрования, приливают точно необходимое для связывания никеля количество миллилитров комплексона III, нейтрализуют раствор сначала 10%-ным, а затем 0,1 н. раствором едкого натра по метиловому красному и титруют борную кислоту 0,1 н. раствором едкого натра в присутствии маннита и фенолфталеина до появления розовой окраски раствора, не исчезающей при добавлении новой порции маннита.
6. Анализ борида меди
Определение меди
Медь определяют электролитически, путем выделения ее на платиновом сетчатом катоде Винклера из кислого раствора [55, 56].
Необходимые реактивы и аппаратура
1. Азотная кислота (1:1).
2. Серная кислота, уд. в. 1,84.
3. Спирт, 96%-ный.
4. Электролизная установка.
5. Платиновые электроды: сетчатый катод Винклера и спираль.
Ход анализа. Навеску 0,1 г борида меди растворяют при нагревании в колбе с обратным холодильником в 10—15 мл азотной кислоты. Полученный раствор пере
185
носят в мерную колбу емкостью 100 мл и доводят водой до метки. 50 мл раствора переносят в стакан емкостью 250 мл, добавляют 0,5—1 мл серной кислоты, доводят объем до 100—150 мл, подогревают до 60° и подвергают раствор электролизу при силе тока 1,5—2 а и напряжении 3—4 в в течение 40—50 мин, перемешивая электролит магнитной мешалкой. Полноту выделения меди проверяют путем более глубокого погружения катода в электролит. Если в течение 5 мин вновь погруженная в электролит поверхность катода не покроется медью, электролиз считают законченным. Не прекращая подачу тока, электроды поднимают над электролитом, обмывают водой и выключают ток. Катод отсоединяют, промывают спиртом, высушивают при температуре 60° в течение 5 мин и после охлаждения взвешивают. По разности в весе катода (до электролиза и после) определяют количество выделившейся меди.
Содержание меди вычисляют по формуле
г I и
где а — количество выделившейся меди, г; I объем испытуемого раствора, мл-, V — объем израсходованного на анализ, мл-, п— навеска, Точность метода ±0,1% (отн.).
Определение бора
Бор определяют объемным методом после меди электролизом.
Ход анализа. Раствор после электролиза переносят в коническую колбу емкостью 300 мл, кипятят с обратным холодильником в течение 30 мин для удаления углекислого газа. После охлаждения раствор нейтрализуют сначала 10%-ным, а затем 0,1 н. раствором едкого натра по метиловому красному и титруют борную кислоту, как описано выше.
7. Анализ борида железа (ферробора)
Определение железа
Железо определяют методом коплексонометрического титрования в аликвотном объеме [57].
Необходимые реактивы
1. Серная кислота, 1 н. раствор.
— общий раствора,
отделения
186
2. Перекись водорода, 30%-ный раствор,
3. Аммиак, 25 %-ный раствор.
4. Соляная кислота, уд. в. 1,19 и 1 н. раствор.
5. Сульфосалициловокислый натрий.
6. Комплексон III, 0,05 М раствор.
Ход анализа. 0,1—0,2 г борида железа растворяют в смеси 10 мл серной кислоты и 5 мл перекиси водорода при нагревании с обратным холодильником. Полученный раствор переносят в мерную колбу емкостью 250 мл и доводят водой до метки. 50 мл раствора выпаривают досуха. Сухой остаток растворяют в 50—70 мл горячей воды. К раствору по каплям прибавляют аммиак до появления мути гидроокиси железа.
Осадок гидроокиси растворяют, вводя по каплям соляную кислоту до посветления раствора. К раствору прибавляют 15—20 мл 1 н. раствора соляной кислоты, нагревают до 60—70°. Раствор титруют по сульфосалицилату натрия комплексоном III, как описано в гл. V, п. 1.
Определение бора
Бор определяют объемным методом после отделения железа [58].
Необходимые реактивы
1. Едкий натр, 20%-ный и 0,1 н. растворы.
2. Соляная кислота, уд. в. 1,19 и 0,1 н. раствор.
3. Метиловый красный, 0,1%-ный раствор.
4. Фенолфталеин, 1%-ный спиртовой раствор.
5. Маннит.
Ход анализа. К 50 лл раствора прибавляют 20 %-ный раствор едкого натра до выпадения гидроокиси железа и избыток в 5—10 мл. Раствор фильтруют, осадок на фильтре растворяют соляной кислотой, в растворе вновь осаждают железо 20%-ным раствором едкого натра и фильтруют. Фильтраты объединяют, нейтрализуют соляной кислотой по метиловому красному, прибавляют несколько капель избытка НС1 и кипятят с обратным холодильником для удаления углекислого газа. Затем раствор нейтрализуют едким натром и Нитруют борную кислоту в присутствии маннита и фенолфталеина, как описано выше.
187
8. Анализ борида марганца
Определение марганца
Марганец определяют персульфатко-серебряным методом [55] по реакциям
2MnSO4 + 5 (NH4)2S2O8 + 8Н2О - 5 (NH4)2SO4 + г 7H2SO4 + 2HMnO4.
Окислителем двухвалентного марганца до семивалентного служит двуокись серебра, образующаяся при реакции
2Ag ’ 4- S„O2- + 2Н О1 Ag2O2 + 2SO2- + 4H+.
Семивалентный марганец титруют 0,1 н. раствором соли Мора по реакции
10FeSO4 + 2НМпО4 + 7H2SO4 - 5Fe2 (SO4)3 +
+ 2MnSO4 + 8H2O.
Необходимые реактивы
1. Серная кислота, уд. в. 1,84 и 1 : 1.
2. Перекись водорода, 30%-кый раствор.
3. Ортофосфоркая кислота, уд. в. 1,7.
4. Азотнокислое серебро, 2%-ный раствор.
5. Персульфат аммония.
6. Соль Мора, 0,1 к. раствор.
7. Фенилантракиловая кислота, 0,2%-кый раствор в 2 %-ном растворе двууглекислого натрия.
Ход анализа. Навеску 0,1—0,2 г борида марганца растворяют в смеси 10 мл серной кислоты (1:1) и 5 мл перекиси водорода при нагревании с обратным холодильником. Полученный раствор переносят в мерную колбу емкостью 250 мл и доводят водой до метки. К 50 мл раствора прибавляют 5—6 мл концентрированной серной кислоты, 5 мл ортофосфорной кислоты, разбавляют водой до 200 мл и нагревают до 60—70°. Одновременно в коническую колбу емкостью 1 л приливают 5 мл раствора азотнокислого серебра, 30 мл серной кислоты (1:1) и 5 мл ортофосфорной кислоты. Разбавляют раствор до 200 мл и нагревают до 60—70°. Затем в колбу с раствором серебра добавляют 3—5 г персульфата аммония и вводят небольшими порциями нагретый анализируемый раствор. После вливания каждой порции содержимое колбы взбалтывают и ждут, пока раствор из 188
красноватого не станет ярко-фиолетовым. Полученный раствор кипятят в течение 10—12 мин для разрушения избытка персульфата аммония, охлаждают под краном и титруют 0,1 н. раствором соли Мора до бледно-розовой окраски раствора. Затем прибавляют пять капель раствора фенилантраниловой кислоты и продолжают титрование до перехода окраски в светло-зеленую.
Содержание марганца вычисляют по формуле
, 7V-250-100
QMnU)- 50/г
где Т — титр 0,1 н. раствора соли Мора, выраженный в граммах марганца, г/мл; V — объем раствора соли Мора, израсходованного на титрование, мл; п — навеска борида марганца, г.
Точность метода ±1% (отн.).
Определение бора
Бор определяют объемным методом после отделения марганца осаждением его едким натром, как описано при определении бора в бориде железа (см. п. 6 настоящей главы).
9. Анализ борида рения
В бориде рения определяют рений, бор и углерод.
Определение рения
В литературе число работ по аналитической химии рения и его соединений ограниченно [54, 59—63]. Рений в боридах определяют колориметрическим методом с ди-метилглиоксимом в присутствии восстановителя — двухлористого олова [54].
Необходимые реактивы
1. Азотная кислота (1:1).
2. Соляная кислота, уд. в. 1,19 и 2 н. раствор.
3. Диметилглиоксим, 1%-ный спиртовой раствор.
4. Двухлористое олово, 2%-ный раствор в 2 н. растворе соляной кислоты.
5. Стандартный раствор рения, 0,1 мг рения в 1 мл. Ход анализа. Навеску 0,05 г борида рения растворяют в 10 мл азотной кислоты при кипячении с обрат-
189
ным холодильником. Нерастворимый остаток сплавляю^ с карбонатом калия-натрия, выщелачивают соляной кислотой и раствор соединяют с фильтратом. Объединенный раствор .перекосят в мерную колбу емкостью 100—200 мл и доводят водой до метки.
5—10 мл раствора выпаривают досуха в фарфоровой чашке. Сухой остаток обрабатывают 2—3 мл концентрированной соляной кислоты и выпаривают досуха на водяной бане, повторяя эту операцию два-три раза. К сухому остатку добавляют 10—15 мл 2 н. раствора соляной кислоты, чашку накрывают часовым стеклом и нагревают на водяной бане в течение 10—15 мин. Раствор переносят в мерную колбу емкостью 100 мл и доводят водой до метки.
2—5 мл полученного раствора (в аликвотной части раствора должно содержаться 0,05—0,5 мг Re) переносят в пробирку для колориметрирования емкостью 25 мл, добавляют 5 мл 2 н. раствора соляной кислоты, 2 мл ди-метилглиоксима и 3 мл раствора двухлористого олова. Одновременно готовят шкалу стандартов, в той же последовательности вводя стандартный раствор рения с интервалом 0,1—0,2 мл и реактивы, и доливают 2 н. раствором соляной кислоты до объема, равного объему испытуемого раствора. Через 30—40 мин сравнивают полученные окраски.
Содержание рения вычисляют по формуле
где Т — титр стандартного раствора, выраженный в граммах рения, г/мл; V — объем стандартного раствора рения, равнозначного по окраске испытуемому раствору; мл; п — навеска, отнесенная к аликвотной части раствора, взятой на колориметрирование, г.
Точность определения ±1—2% (отн.).
Определение бора
Бор определяют из аликвотного объема, равного 50— 100 мл, после кипячения раствора с обратным холодильником в течение 30 мин объемным методом, как описано выше.
В случае, когда большое количество рения затрудняет нейтрализацию перед титрованием борной кислоты, 190
рений отделяют осаждением карбонатом бария, и бор определяют, как описано при определении бора в анализе борида вольфрама [1].
Определение углерода
Углерод в боридах рения определяют абсорбционногазообъемным методом, сжигая навеску в 0,05—0,1 г в токе кислорода с плавнем — окисью меди.
10. Анализ смешанных боридов рения и редкоземельного элемента
В смешанных боридах рения и редкоземельного элемента определяют содержание рения, редкоземельного элемента, бора и углерода.
Определение рения
Содержание рения определяют колориметрическим методом с диметилглиоксимом после растворения навески в 0,1—0,2 г, как описано при определении рения в бориде рения (см. п. 8).
Определение редкоземельного элемента
Содержание редкоземельного элемента определяют комплексонометрическим титрованием, как описано в начале данной главы.
Определение бора
Бор определяют объемным методом, как описано при определении бора в боридах редкоземельных элементов (см. начало данной главы).
Определение углерода
Углерод определяют абсорбционно-газообъемным методом, описанным при определении углерода в карбиде бора (см. гл. V).
Результаты анализов гексаборидов редкоземельных элементов, борида рения и смешанных боридов приводятся в табл. 8 *.
* При загрязнении боридов редкоземельных элементов, рения и их смешанных боридов железом последнее определяют методом комплексонометрического титрования, как описано при определении натертого железа в карбиде бора (см. гл. V, п. 1).
191
Таблица 8
Результаты анализа боридов редкоземельных элементов, рения и их смешанных боридов
Борид Содержание, %
РЗЭ бора углерода железа 1 суммарное 1
расчетное получен ное расчетное полученное
ЕиВ8 71,54 71,77 28,46 28,52 * . . 100,29
EuB6 70,70 68.35 29,30 30,22 1,75 — 100,32
Re2B5 87,30 87,00 12,70 12,40 Не определялось • 99,40
(Eu, Re) В 19,7 62,8 22,90 (Ей) 61,00 (Re) 17,5 16,61 — —' — 100,54
(Eu, Re) В 19,7 62,8 22,50 (Eu) 61,00 (Re) 17,5 15,60 Не определялось 99,10
11. Приготовление реактивов
Буферный раствор, pH = 11. Смешивают 1 М растворы аммиака и уксусной кислоты в соотношении 97,6:2,4 (по объему).
Стандартный раствор железоаммонийных квасцов. Навеску квасцов в 48,22 г растворяют в серной кислоте (1 :20) и доводят этой кислотой до объема 1 л. 1 мл полученного раствора соответствует 0,002395 г Ti. Титр раствора устанавливают по стандартному образцу ферротитана.
Стандартный раствор соли Мора. 39,2 г (NH4)2SO4 X X FeSO4-6H2O растворяют в 1 л серной кислоты (1 :20). Титр раствора устанавливают по стандартному образцу феррованадия.
Стандартный раствор рения (0,1лгг/лгл Re). 0,05 г металлического рения растворяют при нагревании в 10 мл азотной кислоты (1:1) с обратным холодильником. Раствор выпаривают досуха, обрабатывают остаток два-три раза 2—3 мл соляной кислоты (2 н. раствором), выпаривая каждый раз досуха. К сухому остатку прибавляют 10—15 мл 2 н. раствора соляной кислоты, переносят раствор в мерную колбу емкостью 500 мл и доводят водой до метки.
192
Приготовление 0,05 М раствора комплексона III и раствора мурексида подробно описано в литературе [64].
Литература
1. Самсонов Г. В. и др. Анализ тугоплавких соединений. М., Металлургиздат, 1962.
2. С а м с о н о в Г. В. и др. Бор, его соединения и сплавы. Киев, Изд-во АН УССР, 1960.
3. Самсонов Г. В, Портной К. И. Сплавы на основе тугоплавких соединений. М., Оборонгиз, 1961.
4. Марковский Л. Я., Кондрашов Ю. А. «Ж. неорган. химии», 2, 34 (1957).
5. Winslow Е., Liebhafsky Н. J. Amer. Chem. Soc., 64, 2725 (1942).
6. Li hl F., Feischl O. Metallurgia, 8, 11 (1954).
7. К i e s s 1 i n g R. Fortschr. chem. Forsch., 3, 41 (1954).
8. Самсонов Г. В. «Ж. физ. химии», 30, 2057 (1956).
9. Самсонов Г. В. «Докл. АН СССР», 113, 1299 (1957).
10. Марковский Л. Я., Кондрашов Ю. А. «Ж. неорган. химии», 2, 34 (1957).
11. Самсонов Г. В. «Ж. техн, физ.», 26, 716 (1956).
12. Самсонов Г. В. и др. «Радиотехника и электроника», 2, 632 (1957).
13. С а м с о н о в Г. В., Н е ш п о р В. С. «Электроника», 3, 148 (1959).
14. Самсонов Г. В., Н е ш п о р В. С. В сб. «Зопросы порошковой металлургии и прочности материалов», вып. 7. Киев, Изд-во АН УССР, 1959.
15. Самсонов Г. В., Н е ш п о р В. С. «Сб. научн. тр. Моск, ин-та цветн. мет. и золота и ВНИТО металлургов», № 31, М., Металлургиздат, 1958, стр. 361.
16. Самсонов Г. В. и др. «Докл. АН УССР», 8, 838 (1958).
17. Самсонов Г. В., Нешпор В. С. В сб. «Зопросы порошковой металлургии и прочности материалов», вып. 8. Киев, Изд-во АН УССР, 1960.
18. Самсонов Г. В., Цейтина Н. Я. «Физика металлов и металловедение», 1, 303 (1955).
19. Самсонов Г. В. «Докл. АН СССР», 93, 859 (1953).
20. Самсонов Г. В. «Докл. АН СССР», 86, 329 (1952).
21. Самсонов Г. В., Нешпор В. С. «Докл. АН СССР», 104, 405
(1955).
22. Нешпор В. С., Самсонов Г. В. «Физика металлов и металловедение». 4, 181 (1957).
23. Самсонов Г. В. и др. «Физика металлов и металловедение», 8, 622 (1959).
24. С а м с о н о в Г. В. «Ж. физ. химии», 30, 2057 (1956).
25. М о д ы л е в с к а я Д. К., Самсонов Г. В. «Укр. хим. ж.», 25, 55 (1960).
26. М е е р с о н Г. А., Самсонов Г. В. «Изв. Сектора физ.-хим. анализа. ИОНХ АН СССР», 22, 82 (1953).
27. М о i ss a n Н. Compt. rend. Acad, sci., Paris, 120, 290 (1895).
28. A n d r i e u x L., Marion A. Compt. rend. Acad, sci., Paris, 236, 805 (1953).
13 Анализ бора
193
29. Andri eux L. Rev. Metallurgies 45. No. 49, 159 (1948).
30. Ewerhart J. W. Mater, and Methods, 40, 90 (1954).
31. Moissan H., Williams P. Compt. rend. Acad, sci., Paris, 125, 629 (1897).
32. Gmelins Handbuch der anorgan. Chemie, 8 Aufl., 1931, System No. 29, 187.
33. Andrieux L. Ann. chimie, 12, 422 (1929).
34. Кугай Л. H., Назар чу к T. Н. «Ж. аналит. химии», 16, 205 (1961).
35. Moissan Н. Ann. chimie. 6, 296 (1895).
36. Binet duJassoneix A. Ann. chim. phys., 7, 161 (1909).
37. Weintraub E. Trans. Electrochem. Soc., 16, 165 (1909).
38. Марковский Л. Я., Капутовская Г. В. «Заводск. лаборатория», 24, 1065 (1958).
39. Blumenthal Н. Powder Metallurgy Bull., 6, 48 (1951).
40. Blumenthal H. Powder Metallurgy Bull., 6, 80 (1951).
41. Blumenthal H. Analyt. Chem., 23, (1951).
42. Кугай Л. H. Определение бора в боридах титана, циркония, ванадия, ниобия, тантала и вольфрама. Информационное письмо Ин-та металлокерамики и спец, сплавов АН УССР. Вып. 59 (1957).
43. Кугай Л. Н. Определение бора в боридах никеля. Информационное письмо Ин-та металлокерамики и спец, сплавов АН УССР. Вып. 61 (1958).
44. Сабинина Л. В., С т ю н к е л ь Т. В. «Заводск. лаборатория», 13, 752 (1947).
45. П и л и п е н к о А. Т., Кугай Л. Н. «Укр. хим. ж.», 25, 786 (1959).
46. К го 11 W. Z. anorgan. und allgem. Chem., 1, 102 (1918).
47. Пилипенко A. T., Кугай Л. Н. «Заводск. лаборатория», 24, 10 (1958).
48. 3 а б и я к о В. И. «Тр. Уральского н.-и. хим. ин-та», 1, 222 (1954).
49. М и хеева В. И. и др. «Ж. неорган. химии», 2, 1248 (1957).
50. Марковский Л. Я., Капутовская Г. В. «Ж. неорган. химии», 3, 2 (1958).
51. К о т л я р Е. Е., Н а з а р ч у к Т. Н. «Ж. аналит. химии», 15, 207 (1960).
52. Fritz J. S. et al. Analyt. Chem., 30, 1111 (1958).
53. К у т e й н и к о в А. Ф., Бродская В. М. «Заводск. лаборатория», 28, 792 (1962).
54. Методы определения и анализа редких элементов. Сб. статей. Под ред. А. П. Виноградова и Д. И. Рябчикова. М., Изд-во АН СССР, 1961.
55. Анализ минерального сырья. Сб. методов хим. анализа. Под ред. Ю. Н Книпович и Ю. В. Морачевского. Л., Госхимиздат, 1956, стр 468.
56. Б а б к о А. К., Пятницкий И. В. Количественный анализ. М., «Высшая школа», 1962, стр. 189.
57. IstvSn R. Р. Koh5sz. lapek, 93, 426 (1960).
58. Яковлев П. Я., Козина Г. В. «Заводск. лаборатория»? 26, 1342 (1960).
194
69. Лебедев К. В. Рений. М., Металлургиздат, 1960.
60. Лазарев А. И., Родзаевский В. В. «Ж. аналит. химии», 16, 243 (1961).
61. Рений. В кн. «Труды Всесоюзного совещания по проблеме рения, 26—27 мая 1958 г.». М., Изд-во АН СССР, 1961.
62. Шеллер В Р., П о у э л л А. Р Анализ минералов и руд редких элементов. М., Госгеолтехиздат, 1962.
63 Рябчиков Д. И., Борисова Л. В. «Ж. аналит. химии», 18, 851 (1963).
64. Сусленникова В. М. Киселева Е. К. Руководство по приготовлению титрованных растворов. Л., Госхимиздат, 1962.
Глава V
АНАЛИЗ НЕКОТОРЫХ СОЕДИНЕНИЙ БОРА
Определение бора в любом из возможных его соединений сводится в основном к определению борной кислоты. Различие состоит лишь в способе разложения продукта и переведении бора в борную кислоту.
Ниже приводятся методы анализа некоторых соединений бора.
1. Анализ карбидов бора
Карбиды бора благодаря таким ценным свойствам, как высокая твердость (близкая к твердости алмаза), тугоплавкость, химическая инертность и другие, находят все большее применение в технике. Они обладают также хорошо выраженными полупроводниковыми свойствами, которые используются в технике при создании высокотемпературных полупроводниковых материалов [1].
Основные физико-химические свойства двух карбидов бора — В4С и В6>5С — следующие:
Плотность, г/см3...........
Температура плавления, °C Температура кипения, °C . . Микротвердость, кг/мм3 . .
в«с В6,5С
2 524-0 01 2,44
2550 (235Э) 2450
3550 —
4950 5600—5800
Карбидам бора приписывается различный химический состав, начиная от ВС до В(зС [2]. В зависимости от условий реакции получения карбида бора возможно образование карбида определенного состава, смеси карбидов, смеси карбидов бора с бором, твердого раствора бора в карбиде бора и твердого раствора углерода в карбиде бора с замещением соответствующего числа атомов 196
бора или углерода в решетке карбида бора. Из результа-тов рентгеновского анализа следует, что уже сплав, содержащий 5,11 вес. % углерода, имеет решетку, отличную от решетки бора [2]. Такой широкий интервал изменчивости фазового состава затрудняет определение состава проб карбида бора на основании анализа по компонентам, и большое значение приобретает рентгеноструктурный анализ.
Основным звеном системы В — С считается В4С или В12С3.
Для различных форм карбидов состав основных ком понентов следующий (%):
в с
В4С............ 78,29 21,71
В„С............84,4 15 6
В6 5С . . 85,42 . 14,58
Химическое поведение карбидов бора характеризуется большой стойкостью против воздействия многих химических реагентов, в том числе даже таких, как элементарный хлор и кислород при температуре выше 1000°. Сера при температуре размягчения стекла, а также бром и иод на карбид бора не действуют.
Стойкость карбида бора по отношению к агрессивным средам затрудняет его анализ, связанный с переведением карбида бора в растворимое состояние.
На карбид бора в продолжение длительного времени не действуют концентрированные и разбавленные кислоты и их смеси как на холоду, так и при температурах кипения [3], за исключением смесей серной и азотной, а также плавиковой и азотной кислот, которые, однако, действуют очень слабо [4—6]. Карбид бора стоек против действия разбавленных и концентрированных растворов щелочей, нагретых до кипения и холодных, а также смесей щелочей с окислителями [7, 8]. Данные по растворимости карбида бора в различных агрессивных средах приведены в табл. 9—11 [7, 8].
Следует отметить, что отношение карбида бора к окислителям различно в зависимости от фазового состава карбида. Например, карбид бора В4С окисляется при воздействии на него кипящей смеси серной и азотной кислот в условиях, когда получающиеся пары NO окисляются до N2O4 и возвращаются в реакционную смесь.
Таблица 9
Устойчивость карбида бора по отношению к окислителям
Окислитель
Время
ВОЗДСЙк 'T-ВИЯ, ч
Царская водка 4-HNO3 (уд. в. 1,4) ... .
Хромовая смесь. 30%-ная Н2О2 + H2SO4 (уд.
в. 1,84)................................
Н2О2 + 0 01 г KNOS........................ 42
2 мл H2SO4 (уд. в. 1,84)4-0,6 мл HNO3 (уд. в. 1,4)............................... 6
Результат воздействия
Не разла-гается
То же
» »
Разлагается полностью
Таблица 10
Растворимость карбида бора в концентрированных кислотах и их смесях (состав карбида бора: 76,9% В общего, 21,4% С общего)
Кислота Время воздействия, ч Температура, °C Н ерастворимый остаток, % Содержание в кислотной вытяжке, %
железа алюминия бора в пересчете на В4С
НС1 24 20 98,0 Не определялось отот Не определялось
H2SO4 24 20 98,0 в » в в
[HNO3 24 20 97,0 в в в в
НС1О4 24 20 98,0 в в — в в
НС1 1 115 98,0 в в —— в в
H2SO4 1 280 98,0 1,10 — в в
HNOj 1 120 97,0 0,33 ——от в в
НС1О4 1 120 98,0 0,19 —• в в
HF 4- H2SO4 2 280 91,5 0,35 в в
HF 4- HNO3 2 116 90,8 0,30 в в
H2SO4 4- HNO3 4 130 91,2 0,63 1,1 7,20
HC1 4- HC1O4. 4 116 97,5 0,43 1.0 1,22
198
Таблица 11
Растворимость карбида бора в водных растворах щелочи (состав карбида бора см. в табл. 10)
Концентрация раствора щелочи, % Температура, •C Время воздействия, ч Нерастворимый остаток. %
5 (NaOH) 20 40 98.3
25 (NaOH) 20 40 99.2
12 (NaOH) 20 40 99,0
12(NaOH) 100 2 99.0
6 (NaOH) 20 40 98,6
6 (NaOH) 100 j 2 98,5
3 (NaOH) 20 40 98,8
1 (NaOH) 20 40 99,0
1 (NaOH) 100 1 99,0
1 (NaOH) 100 2 98,5
10 (NaOH + H2O2) 100 1 98 0
10 (NaOH + Brs) j 100 I 99,65
На этом основывается метод определения бора в карбиде бора кислотным разложением, разработанный И. Г. Шафраном и М. В. Павловой [9, 10]. Эта же методика уточнялась Г. В. Самсоновым и О. И. Колчиной [11]. Однако для карбидов, приближающихся к составу В13С, окисление кипящей смесью серной и азотной кислот не наблюдается. Это избирательное отношение различных типов карбида бора к окислителям исключает применение универсального окислителя, и общепринятым методом анализа карбида бора является сплавление его с карбонатами щелочных металлов при температуре 800— 900°. Образующаяся при разложении пробы борная кислота определяется титрованием с маннитом.
А. И. Миклашевский [5] предлагает метод полного анализа карбида бора, основанный на разложении его сплавлением с содой и селитрой. Для осаждения алюминия и железа Миклашевский применял углекислый кальций, но лучшие результаты получаются при осаждении примесей углекислым барием [12].
Ввиду того что наличие свободного углерода в карбиде бора приводит к порче платинового тигля, сплавление карбида бора рекомендуется проводить в железных или никелевых тиглях с перекисью натрия [13] или спекание с ВаСОз[14]. Процессы, происходящие при спекании, подробно изложены в литературе [15].
199
При анализе карбида бора, обогащенного по В10 или В11, следует применять карбонатное сплавление в платиновом тигле. В последнем случае бор можно определять из малых навесок карбида бора, что существенно при анализе изотопных материалов, поскольку уменьшается расход дорогостоящего продукта на анализ.
Определение свободного бора в карбиде бора основывается на разном отношении к окислителям карбита бора и бора свободного (не связанного в карбид). Для определения последнего можно использовать известные методы определения элементарного бора, например нитроз-ный, окисление бора смесью йодата и перйодата калия, смесью пергидроля и азотной кислоты, персульфатный. О них подробно говорится в гл. III. В этом случае пренебрегают наличием незначительного количества боридов тугоплавких металлов, которые не менее стойки по отношению к агрессивным средам, чем карбид бора.
Так как в периметрическом методе содержание бора определяют не по количеству борной кислоты, образующейся при окислении пробы, а по количеству израсходованного окислителя, применение этого метода для определения свободного бора ограничено в некоторых случаях. Например, при наличии в карбиде бора свободного углерода церий расходуется и на окисление углерода по реакции
С + 2Се (SO4), + 2Н2О - СЭ> + Се, (S9t)3 + H2SO, + Н/
Подобного типа реакции использовались для прямого сжигания углерода мокрым путем [1, 8].
Естественно, что в присутствии каких-либо металлов-восстановителей результаты анализа по содержанию свободного бора в карбиде бора будут завышены. Кроме того, наряду с этим наблюдается частичное растворение самого карбида.
Бопее точными являются методы определения свободного бора путем непосредственного титрования образующейся при растворении бона борной кислоты.
Е. Е. Котляр и Т. Н. Назарчук разработали методику определения свободного бора в карбиде бора, основанную на растворении свободного бора в присутствии перекиси водорода и небольшого количества азотной кислоты [16]. Применение персульфатного метода определения элемен
200
тарного бора [17] для определения свободного бора в карбиде бора дает аналогичные результаты (табл. 12).
Таблица 12
Результаты определения свсбодисго бсра в карбиде бора различными методами
Номер пробы Содержание <во одного бора, %
Персульфатный метод Сбоаботка ( ме< ью пергидроля и азотной ки< лоты Цериме’рический метод
1 0.95 1,10 Не обнаружено
1 0,84 0,85 » »
о 0 60 0 75 3 05
0 66 0 63 3,11
о 1.13 1,20 12,84
О 0,98 1,17 13,03
А о го 0,38 20, €4
4 0,40 0,43 21 08
0 63 0,66 8,10
О 0,59 0,66 7,54
Для определения свободной борной кислоты карбид бора обрабатывают при кипячении дистиллированной водой. Миклашевский рекомендует для этой цели соляную кислоту [5].
Методы определения общего углерода основаны на сжигании образца с определенным плавнем в токе кислорода при температуре 1200—1250°. Существует множество литературных данных по определению углерода в различных материалах [8, 18, 19]. Методы эти с некоторыми изменениями могут быть использованы для опое-деления общего углерода в карбиде бора с весовым [20— 23] или объемным [19, 20, 24, 25] определением образующегося при этом углекислого газа. Опубликованы также работы по применению кондуктометрического [25—29] и потенциометрического [30—34] методов определения углерода в различных материалах. Электрохимические методы чаще используют при определении малых количеств углерода. Кондуктометрический метод подробно изложен в литературе [14]. Метод потенциометрического титрования описан в гл. I.
201
Проверялись абсорбционно-газообъемный и абсорбционно-весовой методы применительно к анализу карбида бора. Проанализирована большая серия проб. Оба метода дают надежные и воспроизводимые результаты. Абсорбционно-газообъемный метод следует предпочесть, так как он менее продолжителен, чем абсорбционно-весовой.
В качестве плавня применяют медь, свинец или их окислы [20].
Действие плавней объясняют по-разному. Так, полагают, что плавни, сгорая в кислороде, вызывают местное повышение температуры, облегчающее сгорание навески; легкоплавкие металлы (свинец, олово) сплавляются с материалом навески и образуют легко сгорающие соединения или сплавы; окислы действуют как окислители, отдавая кислород навеске быстрее, чем при применении одного газообразного кислорода; другие плавни действуют не только как переносчики кислорода, но и как катализаторы (медь и окись свинца).
Из всех методов определения общего углерода наибольшее распространение получил волюмометрический метод, так как при применении этого метода значительно сокращается продолжительность анализа. И. Г. Шафран и Р. Р. Владимирская [21] рекомендуют определять углерод в карбиде бора газообъемным методом из навески 0,05 г.
В литературе опубликовано несколько методов определения свободного углерода в карбиде бора, но ни один из них не дает достаточно надежных результатов.
К химическим относятся методы определения свободного углерода, основанные на способности углерода адсорбировать различные красители (бромтпмолэвый синий, метиленовый голубой и др.). В работе Н М. Поповой и Л. В. Заславской [35] приведены результаты изучения адсорбции красителей карбидными осадками.
Описанный в литературе [1, 8, 36] метод определения свободного углерода путем окисления его до СОг хромовой смесью по реакциям:
ЗС + 4СгО3 4- 6H2SO4 = ЗСО2 + 2Сг2 (SOJ3 + 6Н2О;
ЗС + 2К2Сг2О7 + 8H2SO4 = 2K2SO4 + 2Cr2 (SO4)3 +
+ 3CO2 + 8H2O
не нашел широкого применения ввиду трудоемкости ме* тода и недостаточной надежности результатов анализа.
202
Для окисления могут использоваться следующие окислители и их смеси: Н2О2, СгОз, H2SO4, KJO3 + Н3РО4,
+ KJO3, H2SO4 + НС1О4 + КгСг2О7, СгОз + + H2SO4 + Н3РО4, KMnO4 + H2SO4. Углекислый газ, образующийся при окислении свободного углерода, например смесью 25 мл серной кислоты (2 : 1), 0,5 г бихромата калия и 0,1 г хромового ангидрида, рекомендуют поглощать 0,1 н. раствором Ва(ОН)2, избыток которого оттит-ровывают 0,1 н. раствором соляной кислоты [36]. Методы эти отличаются недостаточной точностью.
Физические методы определения свободного углерода основаны на разных магнитных свойствах свободного углерода и карбида бора [8], на различии их удельных весов, на несмачиваемости углерода полярными жидкостями и смачиваемости карбида бора [37], на способности углерода образовывать суспензии при добавке различных органических веществ. По методу С. М. Гутмана пепти-затором суспензии графита служит таннин [38]. При встряхивании осадка, содержащего карбиды бора и свободный углерод, с раствором таннина после отстаивания образуются два слоя: нижний — содержащий карбиды, и верхний — суспензию свободного углерода.
Более приемлем способ определения свободного углерода, предложенный А. И. Миклашевским для определения свободного углерода в карбиде кремния [39]. На основе этого метода Г. А. Меерсон и Г. В. Самсонов разработали метод определения свободного углерода в карбиде бора [40]. Метод основан на различии в скорости и характере окисления карбида бора и углерода кислородом или хромовой смесью. Свободный углерод определяют расчетным или графическим путем. Так как скорость
I \
окисления карбида бора постоянна 1~= л ), где с — содержание углерода, г, то в области постоянных точек кривая переходит в прямую линию, характеризующую окисление самого графита (рис. 32). Расчетная формула следующая:
__ ___ Де ,
^своб ^Общ
где сОбщ — суммарное количество выгоревшего углерода к моменту времени t.
203
Расчет содержания свободного углерода в карбиде бора, имеющем сумму содержаний В 4- С =100%» можно производить по формуле [1]
^своб ^сбщ 0,28сз,
где Собщ — общее содержание углерода, %;
св —содержание бора в порошке карбида, %.
Рис. 32. Определение свободного углерода графическим методом.
Конечно, в этом случае складываются ошибки, имевшие место при определении общего бора. Поэтому следует предпочесть непосредственное определение углерода.
Состав примесей в карбиде бора зависит от способа его получения. В карбиде бора определяют в основном следующие примеси: железо, натертое из металлической ступки при измельчении пробы, железо общее, алюминий, кальций, магний и кремний.
При горячем прессовании карбида бора без защиты пресс-формы аргоном возможно образование нитрида бора. Нитрид бора об
разуется и при получении карбида бора из аморфного бора, полученного натрий-термическим способом. Содержание нитрида бора достигает в этом случае 4—5%. Определение азота проводят по методу Дюма, описанному в данной главе (см. п. 2). Кроме того, в таких карбидах замечено присутствие серы (примесь, попадающая из исходного материала — трехфтористого бора).
При анализе карбида бора, изготовленного из бора, обогащенного изотопом В10, титр щелочи в зависимости от процента обогащения рассчитывают так же, как это описано в гл. I.
При анализе карбида бора, полученного методом прямого синтеза из элементов с использованием бора раз-
204
личного изотопного состава, молекулярный вес бора в карбиде или коэффициент распределения изотопного и неизотопного бора в карбиде бора определяется масс-спектрометрически после перевода карбида бора в трехфтористый бор.
Отбор пробы, ее измельчение и усреднение
Техника отбора пробы для порошкообразного карбида бора та же, что и для кристаллического. При анализе карбида бора, полученного в виде твердого монолитного стержня, последний разбивают под прессом или молотком. Полученный таким образом крупнокристаллический материал усредняют методом многократного квартования до тех пор, пока проба не составит 0,5—1 г. Отобранную пробу измельчают и усредняют, как это описано в гл. III для кристаллического бора. Для измельчения карбида бора можно рекомендовать вакуум-сгупку. Предусмотренное охлаждение ступки облегчает измельчение карбида, так как в этих условиях он становится более хрупким.
На анализ поступает проба с величиной частиц 270— 320 меш.
Определение общего бора
а) Сплавление с карбонатами.
Необходимые реактивы
1. Углекислый калий-натрий.
2. Соляная кислота, 0,1 и. и I : I растворы.
3. Едкий натр, 0,1 н., 0,5 н., 30%-ный растворы.
4. Маннит.
5. Метиловый красный, 0,1%-ный спиртовой раствор.
6. Фенолфталеин, 1%-ный спиртовой раствор.
Ход анализа. Навеску карбида бора 0,02— 0,03 г помещают в платиновый тигель и пепемешиваютсЗгуг-лекислого калия-натрия. Смесь сверху засыпают еще 1—2 г углекислого калия-натрия. Тигель закрывают крышкой и осторожно нагревают на слабом огне горелки в течение 15—20 мин. Затем пламя увеличивают и продолжают сплавление в течение 40—50 мин. Если сплавление проводить аккуратно, то крышка тигля остается чистой. После охлаждения тигля плав выщелачивают го-
205
рячей водой и раствор переносят в колбу Эрленмейера, снабженную шлифом для присоединения к холодильнику, и раствор кипятят в течение 45—60 мин для удаления углекислого газа.
После охлаждения раствора холодильник смывают несколько раз дистиллированной водой и раствор нейтрализуют сначала 30%-ным едким натром, затем 0,5 н. раствором едкого натра. Прибавляют несколько капель 0,1 н. соляной кислоты и нейтрализуют раствор 0,1 н. едким натром. К нейтральному раствору прибавляют 10— 15 капель фенолфталеина, примерно 1 г маннита и титруют до появления розовой окраски, не исчезающей от последующего прибавления маннита.
Содержание бора вычисляют по формуле
Q (о/о) = 0,00Ю8^(У1 — У»)-100 в л
где 0,001081 —титр 0,1 н. раствора едкого натра в пересчете на бор, г; К — коэффициент нормальности раствора; Vi — объем 0,1 н. раствора едкого натра, израсходованного на титрование, мл; Vo — объем 0,1 н. раствора едкого натра, израсходованного на титрование «холостого» опыта, мл; п — навеска, г.
Точность метода ±0,5% (отн.).
б) Сплавление с едким натром и перекисью натрия [15]. Сущность метода заключается в переведении бора в борную кислоту сплавлением, отделении ее от мешающих элементов и последующем титровании борной кислоты 0,1 н. раствором щелочи в присутствии маннита или инвертного сахара по фенолфталеину.
Необходимые реактивы
1. Едкий натр, 0,1 н., 20%-ный растворы и твердый.
2. Перекись натрия.
3. Соляная кислота. 1:1.
4. Углекислый барий.
5. Инвертный сахар, 50%-ный нейтральный раствор, или маннит.
Ход анализа. Навеску 0,02 г тонко измельченного карбида бора сплавляют в железном тигле со смесью 1 г едкого натра и 1 г перекиси натра таким образом: в железный тигель помещают 1 г едкого натра и ставят на электроплитку до расплавления щелочи. После охлаж-206
денйя плава туда же помещают навеску карбида бора и снова расплавляют на плитке. Плав с навеской охлаждают, добавляют 1 г перекиси натрия и снова ставят на электроплитку. Когда плав станет совершенно прозрачным и однородным, тигель помещают в муфель при температуре 700—800° на 5—10 мин, Плав выщелачивают водой и добавляют соляную кислоту до растворения гидроокиси железа. К раствору прибавляют несколько капель индикатора метилового красного и нейтрализуют избыток кислоты 20%-ным раствором едкого натра до появления мути Ее(ОН)з, которую растворяют в капле соляной кислоты (1:1). Раствор разбавляют водой до 100 мл и небольшими порциями добавляют сухой углекислый барий. Раствор с осадком кипятят и выдерживают 10—15 мин при температуре 80—90° до просветления, затем фильтруют в коническую колбу емкостью 600— 700 мл, осадок на фильтре промывают пять-шесть раз горячей водой до отрицательной реакции на ион хлора (реакция с AgNOa).
К фильтрату добавляют соляную кислоту до перехода окраски индикатора от желтой к красной и еще избыток в две-три капли. Раствор кипятят с обратным холодильником в течение 15—20 мин для удаления углекислого газа. Быстро охлаждают, нейтрализуют по метиловому красному вначале 20%-ным, а затем 0,1 н. раствором едкого натра до перехода окраски раствора в желтый цвет, добавляют 40 мл раствора инвертного сахара и титруют по фенолфталеину до появления устойчивой розовой окраски, не исчезающей от последующего прибавления инвертного сахара. Одновременно с образцом карбида бора по всем стадиям проводят «холостой» опыт.
Содержание бора вычисляют по формуле
71
где Т — титр 0.1 н. раствора едкого натра по борной кислоте; Vi — объем 0,1 н. раствора едкого натра, израсходованного на титрование, мл; — объем 0,1 н. раствора едкого натра, израсходованного на титрование «холостого» опыта, мл; п — навеска, г.
Точность метода ±1% (отн.).
в) Спекание с окисью кальция или углекислого бария [14]. Спекание карбида бора с окисью кальция или угле.
207
кислого бария проводят в никелевых, железных или фарфоровых тиглях. Лучшими для спекания с окисью кальция следует считать неглазурованные фарфоровые тигли; для спекания с углекислым барием — никелевые тигли. Полученный спек хорошо отстает от стенок тигля и может быть удален простым высыпанием.
Необходимые реактивы
1. Окись кальция или углекислый барий.
2. Соляная кислота, 1:1.
3. Едкий натр, 0,1 н. и 20%-ный растворы.
4. Маннит.
5. Метиловый красный, 0,1%-ный раствор.
6. Фенолфталеин, 1%-ный спиртовой раствор.
Ход анализа. Перемешивают на часовом стекле 0,1—0,15 г тонкоизмельченного карбида бора с десятикратным количеством окиси кальция или углекислого бария. Хорошо «смывают» стекло новой порцией окиси кальция или углекислого бария в тигель.
Тигель помещают в муфельную печь и спекают смесь при температуре 950—1000° в течение 1 —1,5 ч. Спек после охлаждения высыпают в стакан, тигель обмывают горячей водой, осадок в стакане растворяют в соляной кислоте (1 : 1), к раствору добавляют несколько капель индикатора метилового красного и нейтрализуют 20%-ным раствором едкого натра до перехода окраски раствора в желтый цвет. К полученному нейтральному раствору прибавляют по каплям соляную кислоту до перехода окраски раствора в красный цвет. Для осаждения примесей прибавляют небольшое количество сухого углекислого бария до изменения окраски раствора от красной к желтой, нагревают до кипения, отфильтровывают осадок и хорошо промывают горячей водой. Раствор кипятят в течение 10 мин для удаления углекислого газа. В фильтрате определяют бор титрованием щелочью в присутствии маннита или инвертного сахара.
Содержание бора вычисляют по формуле, приведенной выше. Точность метода ± 1 % (отн.).
Определение борного ангидрида [15]
Навеску 0,5—1 г карбида бора обрабатывают при кипячении 100 мл дистиллированной воды в течение 1 ч. Раствор охлаждают, отфильтровывают неразложивший-208
ся карбид бора и хорошо промывают фильтр горячей водой. Фильтрат и промывные воды собирают вместе, охлаждают и титруют борную кислоту в присутствии маннита или инвертного сахара, как описано выше.
Определение свободного бора (суммы ВСВоб'+ В203) [16]
Метод основан на различной способности к окислению свободного бора и бора, связанного в карбид.
Необходимые реактивы
1. Пергидроль, 1 :2.
2. Азотная кислота, концентрированная.
3. Едкий натр, 20%-ный и 0,1 н. растворы.
4. Соляная кислота, 1:1.
5. Маннит.
6. Метиловый красный, 0,1%-ный спиртовой раствор.
7. Фенолфталеин, 1%-ный спиртовой раствор.
Ход анализа. Навеску 0,1—1 г карбида бора (в зависимости от содержания свободного бора) обрабатывают в конической колбе емкостью 200—250 мл с пришлифованным обратным холодильником смесью 45— 75 мл пергидроля (1:2) с 10 каплями концентрированной азотной кислоты. Раствор в колбе медленно нагревают до кипения и кипятят 40—45 мин. При больших количествах свободного бора во время кипячения прибавляют еще 3—5 мл пергидроля. При содержании свободного бора до 5% достаточно 15 мл пергидроля (1 :2).
После окончания растворения свободного бора раствор кипятят еще 10 мин, а затем охлаждают, промывают холодильник дистиллированной водой и отфильтровывают нерастворимый остаток (карбид бора). Осадок промывают несколько раз водой и два-три раза 1%-ным раствором едкого натра. Слабокислый фильтрат кипятят с обратным холодильником для удаления углекислого газа.
Раствор охлаждают, нейтрализуют 20%-ным раствором едкого натра по метиловому красному, прибавляют одну-две капли соляной кислоты (1:1), снова нейтрализуют 0,1 н. раствором едкого натра, добавляя его по каплям из бюретки. В нейтральный раствор вводят маннит (или 10 мл 50%-ного нейтрального раствора инвертного сахара) и титруют по фенолфталеину до неисчезающей 14 Анализ бор? 209
розовой окраски. Одновременно по всем стадиям анализа проводят «холостой» опыт.
Содержание бора вычисляют по формуле, приведенной выше. Точность метода ±1% (отн.).
Определение общего углерода [18]
Термин «Общее содержание углерода» обозначает весь углерод, независимо от состояния, в котором он находится.
Определение углерода проводят объемным и весовым методами.
а) Абсорбционно-газообъемный метод. Метод основан на сжигании навески карбида бора в токе кислорода, в результате чего весь углерод окисляется в двуокись углерода и вместе с избыточным кислородом собирается в газоизмерительной бюретке (эвдиометре). После измерения объема смесь газов перекачивают в специальный поглотительный сосуд, наполненный концентрированным (30%-ным) раствором едкого кали, в котором происходит поглощение углекислого газа по реакций
СО, + 2КОН = К,СО3 + Н,О.
Остаток газа (кислород) переводят при помощи уравнительной склянки обратно в бюретку и измеряют его объем. Разность между первым и вторым отсчетами соответствует количеству (объему) поглощенного углекислого газа.
Обычно шкала бюретки (эвдиометра) градуируется так, чтобы объем поглощенного углекислого газа соответствовал (в показаниях шкалы) процентному содержанию углерода в анализируемой пробе при соответствующей величине навески.
Точность метода при содержании углерода 0,1% и более составляет ±0,5—1,0% (отн.).
Схема установки для определения углерода абсорб-ционно-газообменным методом изображена на рис. 33.
Аппаратура. 1. Печь трубчатая Марса 6, горизонтальная, длиной 200 мм, обеспечивающая нагрев до температуры не менее 1250°. Рекомендуется применять печи с силитовыми стержнями. Такие печи позволяют получать температуру 1350—1400°. Можно применять также печи с нихромовой обмоткой. Для измерения темпера-210
туры в середину печи вводят платино-платинородиевую термопару. Силу тока контролируют амперметром.
2. Реостат для регулирования температуры в печи.
3. Поглотительные сосуды 2 и 3 для очистки кислорода. Сосуд 2 содержит 4%-ный раствор марганцевокислого калия в 40%-ном растворе едкого кали; сосуд 3— натронную известь (внизу) и стеклянную вату (вверху).
Рис. 33. Прибор для определения углерода абсорбционно-газообъемным методом:
1 — баллон с кислородом; 2, 3 — поглотительные сосуды для очистки кис-юрода; 4 —- кран, регулирующий скорость подачи кислорода; 5 — фарфоровая трубка; 6 — печь Марса; 7 — соединительная трубка; 8 — трубка со стеклянной ватой; 9 — змеевик; 10 — газоизмерительная бюретка; 11 — поплавок; 12 — трехходовой кран; 13 — поплавок; 14 — поглотительное устройство; 15 — уравнительная склянка; 16 — термопара.
Перед змеевиком помещается стеклянная трубка 8 длиной 10 см и диаметром 3 см, наполненная стеклянной ватой для улавливания механических примесей, образующихся при сгорании пробы и уносимых кислородом.
4. Аппарат Вюрца — Штролейна (волюмометр) имеет следующие детали: змеевиковый холодильник 9 для охлаждения поступающей из печи газовой смеси СОг + Ог, трехходовой кран 12, через который газовая смесь из печи и холодильника 9 поступает в газоизмерительную бюретку 10, в которой производится измерение объема поступающей газовой смеси.
14*
211
Бюретка представляет собой узкий цилиндрический сосуд емкостью 250 мл с двойными стенками, пространство между которыми заполнено водой, чтобы температура газа в бюретке меньше подвергалась воздействию окружающей среды. Термометр, укрепленный в расширенной части бюретки, предназначен для измерения температуры газовой смеси.
В верхней части бюретки имеется пустотелый поплавок 11, поднимающийся при заполнении бюретки жидкостью и запирающий верхнее отверстие. К узкой части бю ретки прикреплена подвижная шкала, при помощи которой измеряют объем газов. Шкала соответствует только той бюретке, к которой она прилагается, перенос ее на другую бюретку недопустим. Деления шкалы соответствуют процентному содержанию углерода при указанной на шкале навеске. Бюретки обычно калибруют при температуре 16° и атмосферном давлении 760 мм рт. ст., поэтому для иных условий вводят поправку.
Для определения углерода в карбидах бора из навесок 0,1—0,2 г и выше аппарат Вюрца — Штролейна должен быть снабжен эвдиометром с делением 0—4%. Поправки на давление и температуру приведены в табл. 13.
На нижний стеклянный отвод бюретки надевают каучуковую трубку, соединяющую бюретку с уравнительной склянкой 15, наполненной водой, подкисленной серной кислотой с несколькими каплями метилового оранжевого. При помощи склянки 15 производится перекачивание газовой смеси из бюретки в поглотительное устройство 14. Оно состоит из двух сообщающихся сосудов, соединенных стеклянной трубкой. В верхней части одного из них, соединяющегося с бюреткой, находится автоматический поплавок 13. Каждый из сосудов поглотительного устройства наполнен 35%-ным раствором едкого кали.
5. Баллон с кислородом 1.
6. Трубка фарфоровая или кварцевая 5 длиной 600 мм с внутренним диаметром 18—20 мм. Длина трубки должна быть такой, чтобы концы ее выступали из печи не менее чем на 175 мм с каждой стороны.
Запыленную трубку перед употреблением прожигают по всей длине или очищают при помощи ерша из мягкой проволоки. Для испытания трубки на герметичность ее закрывают пробкой с одного конца, а другой конец соединяют с кислородным баллоном. Затем пропускают 212
Поправки на давление и температуру к показаниям эвдиометра
Таблица 13
Темпера- Давление, мм рт. ст.
тура, °C 730 735 740 745 750 755 760 765 770 775 780
10 j-HSk * 0.986 0,993 1.000 1,007 1,014 1,020 1,027 1,034 1,041 1,048 1,055
11 0.982 0 989 0,995 1,002 1,009 1,016 1,023 1,030 1.037 1,013 1,050
12 0.978 0 984 0.991 0,998 1,005 1,012 1,019 1.025 1 032 1,039 1,015
13 0.973 0,980 0.987 0,993 1,000 1,007 1,014 1.021 1.028 1,034 1,041
14 0.969 0.976 0,983 0,989 0,996 1,003 1.0 0 1 016 1,023 1,030 1,037
15 0.966 0,972 0,978 0.984 0 992 0 998 1.005 1 011 1,018 1,025 1,032
16 0.965 0.968 0.974 0 980 0.987 0.993 1,003 1,007 1,014 1,021 1,027
17 0.950 0.963 0 969 0,976 0,982 0.989 0,996 1,002 1.009 1,016 1,022
18 0.951 0.958 0.964 0.971 0.978 0,985 0 991 0 997 1,001 1.011 1,018
19 0.946 0.954 0,960 0.966 0.973 0.980 0.986 0,993 1,000 1,007 1,013
20 0.942 0.949 0.955 0.961 0 968 0.975 0.982 0.988 0 995 1,002 1,008
21 0.937 0,944 0.950 0,957 0,961 0.971 0.977 0.983 0 990 0 997 1.003
22 0.932 0.940 0.946 0.953 0.959 0.965 0.972 0.978 0 985 0.992 0,998
23 0.928 0.935 0,941 0 948 0.954 0.961 0.967 0.973 0.980 0 987 0,993
24 0.923 0.930 0.936 0,943 0 949 0'956 0.962 0,968 0.975 0.982 0,988
25 0.918 0.925 0,931 0.937 0.944 0 951 0,957 0.963 0,970 0.977 0,983
26 0 013 0.920 0,926 0.933 0.939 0 945 0,952 0.958 0,965 0 971 0.978
27 0.908 0.915 0,921 0,927 0.934 0 940 0,947 0.953 0,960 0.966 0.973
28 0,903 0.909 0,916 0,922 0.929 0 935 0.942 0,948 0.955 0.961 0.967
29 0.898 0.904 0.9U 0 917 0.924 0 930 0.936 0.943 0,949 0.956 0.962
30 0.893 0.899 0,905 0.911 0.918 0.924 0.931 0.937 0.944 0.950 0.950
31 0.877 0.894 0,900 0,906 0.913 0 919 0 926 0,932 0.937 0.945 0.961
32 0,882 0,888 0,895 0.901 0,907 0,914 0.920 0,926 0,933 0.939 0.945
33 0.876 0.883 0.889 0,806 0.902 0,908 0 914 0 921 0 927 0 934 0.940
34 0,871 0,877 0,883 0,890 0 896 0.902 0.908 0,915 0.921 0.928 0,934
35 0,865 0,872 0,878 0,884 0,890 0,897 0,903 0,909 0,916 0,922 0,928
кислород. При хорошей герметичности ток кислорода прекращается через 3—5 мин. Трубку закрывают с обеих сторон хорошо подогнанными резиновыми пробками, в отверстие которых вставлены стеклянные или латунные трубки 7.
7. Лодочки фарфоровые неглазурованные или шамотовые.
В зависимости от величины навески анализируемой пробы применяются лодочки следующих размеров (мм)\
Длина Ширина Высота
№ 1 .............. 67 7 8
№ 2 .............. 72 9 9
Перед употреблением лодочки прокаливают в токе кислорода при той же температуре, при которой производят сжигание. Прокаленные лодочки хранят в эксикаторе, крышка которого не должна смазываться вазелином.
8. Крючок для вдвигания и извлечения лодочек из грубки изготовляют из толстой медной (не латунной) жароупорной или малоуглеродистой железной проволоки круглого сечения. Применяют также крючки из кварцевых стержней.
Аппарат должен находиться в помещении, не имеющем значительных температурных колебаний. Изменение температуры газа, находящегося в системе аппарата (в бюретке), на 1° влечет за собой колебания в результатах анализа на ±0,05%.
Необходимые реактивы
1. Едкое кали, 40%-ный раствор.
2. Перманганат калия, 4%-ный раствор в 40 %-ном растворе едкого кали.
3. Серная кислота, уд. в. 1,84.
4. Метиловый оранжевый, 0,1%-ный водный раствор.
5. Плавни — металлическая медь, свинец или их окис-лы. Все плавни перед употреблением должны быть проверены на содержание углерода.
Ход анализа. Навеску 0,06 г карбида бора помещают в заранее прокаленную лодочку и добавляют в качестве плавня окись меди (или окись свинца) в виде порошка в 10—15-кратном количестве, после чего содержимое лодочки тщательно перемешивают проволочкой непосредственно в лодочке. Чтобы предохранить трубку для сжигания от быстрой порчи, рекомендуется лодочку с навеской помещать в маленькую кварцевую трубку и 214
уже вместе с последней вводить в трубку для сжигания. При попадании плава на стенки маленькой трубки ее легко заменить новой.
Лодочку с навеской вводят в середину трубки для сжигания после того, как печь нагрета до 1100—1200°.
Введя лодочку в середину трубки для сжигания, быстро закрывают последнюю пробкой и через 1—2 мин (за это время лодочка и навеска примут температуру печи) начинают пропускать ток кислорода со скоростью трех пузырьков в секунду. Скорость пропускания кислорода регулируют таким образом, чтобы жидкость в эвдиометре опустилась почти до нуля за 1—2 мин. Затем при помощи трехходового крана 12 отключают систему поглощения от печи и прекращают подачу кислорода. Не вынимая лодочку из печи, проводят поглощение и замер объема углекислого газа. Для этого, держа в правой руке склянку 15, устанавливают уровень жидкости в бюретке на нуле, затем левой рукой поворачивают кран 12 так, чтобы бюретка 10 соединилась с поглотительным устройством 14. Смесь углекислого газа и избыточного кислорода перегоняют в поглотительный аппарат, поднимая и опуская склянку. Эту операцию повторяют три раза, после чего перегоняют газ из поглотительного устройства в эвдиометр. При этом необходимо следить за тем, чтобы поплавок 13 поднялся и закрыл отверстие, не оставив в растворе пузырьков газа.
При помощи уравнительной склянки 15 устанавливают объемы жидкостей в бюретке 10 и самой склянке на одинаковом уровне. По уменьшению объема в бюретке определяют количество поглощенного углекислого газа.
Трехходовым краном 12 соединяют эвдиометр с атмосферой и заполняют его раствором, опуская уравнительную склянку. Вновь соединяют печь с поглотительной системой, пропускают кислород и повторяют замер поглощенного углекислого газа. Операцию эту повторяют до тех пор, пока объем поглощенного углекислого газа не окажется равным нулю.
Благодаря калибровке бюретки 10 (одно деление соответствует 0,05% углерода при навеске 1 г) можно сразу определить процентное содержание углерода, сделав поправку на температуру и барометрическое давление по табл. 13.
21 5
Содержание углерода вычисляют по формуле
Q (<%) = Kgi + g»+ ,.- • •+g4)-rf]K ' с п
где tzi, ^2,...» ап — показания газоизмерительной бюретки после первого, второго, третьего и т. д. сжигания; d — показания шкалы для «холостого» опыта; К — поправочный коэффициент на давление и температуру, по табл. 13; п — навеска, г.
Примечания: 1. Перед началом работы надо проверить все соединения и краны установки на герметичность и привести аппарат в рабочее состояние.
2. Перед началом работы необходимо сжечь две-три навески стали-нормали, чтобы убедиться в правильности работы прибора.
3. Газоизмерительную бюретку необходимо содержать в чистоте, время от времени промывая ее теплой хромовой смесью.
4. Необходимо не реже одного раза в месяц менять раствор едкого кали в поглотительном устройстве, а также менять слой ваты.
5. При определении углерода в образцах, содержащих более 0,1% серы, включают между трубкой для сжигания и аппаратом-поглотителем промывную склянку, наполненную смесью для поглощения SO2 и SO3. Смесь готовят растворением 35 г хромового ангидрида в 100 мл воды. К полученному раствору прибавляют 500 мл серной кислоты уд. в. 1,84.
Определение свободного углерода
Для определения свободного углерода в карбиде бора
используется та же аппаратура, что и для определения общего углерода.
Метод основан на различии в скорости и характере окисления карбида бора и углерода кислородом. Окисление смеси В4С + С можно рассматривать как суммарный процесс окисления свободного углерода и собственно карбида. Скорость окисления карбида бора является величиной постоянной, т. е. — = К. Окисление же сво-
М
бодного углерода идет быстрее, чем окисление карбида. Сжигание ведется до тех пор, пока не будет достигнуто постоянство — . Содержание свободного углерода опре
деляют расчетным путем.
Ход анализа. Навеску карбида бора в количестве 0,2—0,5 г (в зависимости от содержания свободного углерода), измельченную до крупности 350—400 меш, по
216
мешают в фар оровую лодочку и загружают в печь Марса при температуре 1000°. Отмечают время и начинают сжигание в токе кислорода. По истечении выбранного интервала времени, т. е. 5 или 10 мин, прекращают доступ кислорода и отключают поглотительную систему от печи трехходовым краном. Углекислый газ поглощается. Замеряют объем газа, освобожденного от углекислоты. Выпускают этот газ наружу, соединяют систему с печью и снова пропускают кислород в течение выбранного интервала времени. Расчет результатов производится для каждой порции газа отдельно. Сжигают навеску
Дс
до достижения постоянного значения—, повторяющего
ся три — пять раз.
Содержание свободного углерода вычисляют по формуле
__ __ Дг .
^своб ^общ д . ^9
где Собщ — суммарное количество выгоревшего углерода к моменту времени t.
Определение примесей в карбиде бора
Для определения примесей в карбиде бора навеску последнего сплавляют в платиновом тигле с углекислым калием-натрием, плав выщелачивают, раствор подкисляют соляной кислотой и кипятят для удаления углекислого газа. Определение железа, алюминия, кальция, магния, никеля, меди, кремния проводят весовым, комплексонометрическим или колориметрическим методом (см. гл. III).
Определение натертого железа. Для определения натертого железа, попадающего в пробу при измельчении карбида бора в металлической ступке, навеску карбида бора обрабатывают соляной кислотой при кипячении и в фильтрате определяют железо комплексонометрическим методом.
Необходимые реактивы
1. Соляная кислота, 6 н. раствор.
2. Азотная кислота, концентрированная.
3. Аммиак, 25%-ный и 1 н. водные растворы.
4. Комплексон III, 0,005 М раствор.
217
5. Сульфосалициловокислый натрий, 10%-ный раствор.
Ход анализа. Навеску карбида бора в количестве 0,05—0,1 г обрабатывают в колбе Эрленмейера емкостью 250 мл соляной кислотой (6 н.) в количестве 50 мл и кипятят на электроплитке в течение 10—15 мин до полного извлечения железа. Фильтруют через плотный фильтр. Осадок на фильтре промывают несколько раз горячей водой до отрицательной реакции на ион железа по роданистому калию или аммонию. В фильтрат приливают 0,5 мл концентрированной азотной кислоты для окисления всего железа до трехвалентного состояния и кипятят раствор в течение 5 мин. Затем осторожно добавляют аммиак до помутнения раствора, приливают 10 мл 1 н. соляной кислоты и доводят объем раствора до 100 мл дистиллированной водой. Раствор вновь нагревают до 60—70°, прибавляют в него 1 мл 10%-ного раствора сульфосалицилата натрия и титруют комплексоном III до исчезновения лиловой окраски сульфосалицилата железа. 1 мл 0,05 М раствора комплексона III соответствует 0,002792 г железа.
Содержание натертого железа вычисляют по формуле
п
где Т — титр раствора комплексона III по железу; V — объем раствора комплексона III, израсходованного на титрование, мл\ п — навеска, г.
Точность метода ±0,2% (отн.).
2. Анализ нитрида бора
Нитрид бора представляет собой талькообразный порошок белого цвета состава BN с теоретическим содержанием бора 43,6% [1]. В литературе имеются также указания на существование нитридов бора других составов: B3N, B(N3)3 и B3N3 [2].
Вследствие сходства кристаллической структуры и некоторых физических свойств нитрида бора и графита первый называется «белым графитом». При высоком давлении нитрид бора переходит в кристаллическую модификацию, называемую боразоном [1].
218
Нитрид бора является хорошим огнеупорным (температура плавления 2500°) [41], полупроводниковым [1] и смазочным [1] материалом.
Нитрид бора — устойчивое соединение по отношению к воздействию различных химических реагентов. Растворы кислот и щелочей, а также водород, хлор и иод на него не действуют [42—44]. Однако при температуре красного каления нитрид бора реагирует с хлором, образуя треххлористый бор [44, 45]. В атмосфере азота он устойчив до температуры 2500—3000° [44]. Сухим кислородом и двуокисью углерода нитрид бора окисляется при температуре 700—800° с образованием окиси бора и азота [1]. При нагревании на воздухе в струе сероводорода нитрид бора не изменяется.
концентрированная серная кислота разлагает нитрид бора очень медленно с образованием сульфата аммония. Полное разложение наступает после 6—10-часового кипения [44, 45]. Пары воды разлагают нитрид бора с образованием аммиака и борной кислоты [45—47]. Б. В. Некрасов [42] считает, что разложение нитрида бора под действием паров боды происходит при температуре красного каления, а И. Г. Шафран [46] указывает на то. что нитрид бора разлагается с образованием аммиака при кипячении в воде. При кипячении со щелочами при температуре красного каления нитрид бора также разлагается с выделением аммиака [2]. Коррозионная стойкость нитрида бора в различных средах приведена в табл. 14.
Таблица 14
Коррозионная стойкость нитрида бора в различных средах
Коррозионная среда Убыль в весе, мг/см* Уменьшение прочности, °.,
Серная кислота, концентрированная . . . Нет Нет
Серная кислота, 20%-ная 10,7 60
Едкий натр, 20%-ный 8,9 70
Фосфорная кислота, концентрированная 1,3 23
Фтористоводородная кислота, концентри-
рованная 17,5 55
Азотная кислота, концентрированная . . 18,9 82
II р и м е ч а и и е. Испытание проводилось на изделиях и ; нитрида бора.
219
В зависимости от способа получения нитрида бора [41, 42] состав и содержание примесей в нем будут различными. Наиболее характерными составными компонентами нитрида бора являются бор общий и свободный, азот и углерод.
Определение бора основано на переведении его в борную кислоту. При определении общего бора в виде борной кислоты последнюю отделяют от мешающих элементов одним из описанных в литературе методов [9, 48] и титруют щелочью в присутствии маннита по фенолфталеину [48].
Для определения свободного бора в нитриде бора его окисляют смесью пергидроля и азотной кислоты [16] и борную кислоту, образующуюся в результате окисления свободного бора, титруют упомянутым выше методом [9, 48].
Большинство методов определения азота в нитриде бора предусматривает длительную операцию отделения его в виде аммиака из щелочного раствора от остальных компонентов анализируемого образца [15, 46, 48].
Определение азота в нитриде бора, полученном при температуре 1600°, осуществляют по методу Кьельдаля [15]. В образцах нитрида бора, полученных при температурах 1600—1800°, Е. Е. Котляр и Л. Н. Кугай [48] рекомендуют определять азот по методу Дюма.
В литературе описан метод анализа нитрида бора [47], основанный на разложении нитрида бора со щелочами в железной трубке при температуре 400—450° с образованием аммиака. Последний улавливается 0,1 н. раствором соляной кислоты. Обратным титрованием поглотительного раствора определяют аммиак, по количеству которого рассчитывают процентное содержание азота.
Изменив аппаратурную часть метода Шталера и Эльберта [47], И. Г. Шафран [46] разработал новый метод определения азота в нитриде бора. Этот метод был видоизменен Косогоровым и Ширсом [49]. По их методике нитрид бора сплавляют с гидратом лития, содержащим две молекулы воды, при температуре 500—550°. Образующийся в описанных методиках [46, 47, 49] аммиак поглощают 2—4%-ным раствором борной кислоты и титруют 0,25 н. раствором соляной кислоты по метиловому оранжевому [49].
220
В одной из последних работ по определению азота в нитридах бора и кремния применялось сплавление с гидратом окиси лития при температуре 800° [50].
Для определения небольших количеств азота (0,01— 1%) в тугоплавких материалах А. X. Клибус и Т. Н. На-зарчук [51] предлагают тимолгипобромитную реакцию на азот, исключающую отгонку аммиака. При действии тимола и гипобромита натрия на аммиак в щелочной среде образуется окрашенное соединение, экстрагируемое органическими растворителями, причем окраска водного слоя, возможное выпадение осадка в водном слое [52] и присутствие большинства катионов и анионов [53] не мешают реакции образования окрашенного соединения.
Содержание примеси углерода в нитриде бора определяют газообъемным методом в аппарате Вюрца — Штролейна после сжигания навески с плавнем [48].
Составные компоненты нитрида бора определяют из отдельных навесок по описанным ниже методикам. Среднюю пробу отбирают методом квартования. Определение влаги в нитриде бора рекомендуется проводить под вакуумом, так как при температуре 80—100° во влажной среде нитрид бора частично разлагается [45]. При массовых анализах нитрида бора определение влаги проводят в термостате при температуре 80—100°.
Разложение навески нитрида бора осуществляется одним из описанных в литературе методов [14, 46. 48, 54], в зависимости от определяемого элемента.
Определение общего бора
Метод состоит в переведении бора в борную кислоту, отделении ее от мешающих элементов осаждением углекислым барием и титровании 0,1 н. раствором щелочи в присутствии маннита по фенолфталеину [9, 48].
Необходимые реактивы
1. Едкий натр, 0,1 н. и 20%-ный растворы и твердый.
2. Перекись натрия.
3. Соляная кислота, 1:1.
4. Углекислый барий.
5. Маннит.
Ход анализа. Навеску нитрида бора в количестве 0,1 г сплавляют в железном тигле со смесью щелочи и перекиси натрия. Сплавление проводят следующим об
221
разом: 1 г едкого натра помещают в железный тигель и расплавляют на электроплитке. После охлаждения плава в тигель помещают навеску нитрида бора и эту смесь снова расплавляют на электроплитке. Плав с навеской охлаждают, наклоняя тигель так, чтобы между стенкой тигля и плавом образовалось свободное пространство. В это пространство вносят перекись натрия в количестве 1 г, и тигель снова ставят на электроплитку. Когда плав становится совершенно прозрачным и однородным, тигель помещают в муфель при температуре 500—600° и сплавляют в течение 5—10 мин. Плав выщелачивают в воде и добавляют соляную кислоту (1:1) в количестве 20—30 мл до растворения гидроокиси железа. Избыток соляной кислоты нейтрализуют 20%-ным раствором едкого натра до выпадения легкой мути гидроокиси железа, которую растворяют несколькими каплями соляной кислоты (1:1). Раствор разбавляют водой до 100 мл и прибавляют углекислый барий небольшими порциями до выпадения основных солей железа, алюминия и др.
Раствор с осадком кипятят и выдерживают 10—15 мин при температуре 80—90° до просветления раствора и фильтруют в колбу Эрленмейера емкостью 500—750 мл. Осадок промывают три-четыре раза горячей водой и растворяют на фильтре соляной кислотой (1:1) в тот же стакан, где проводили осаждение углекислым барием. В полученном растворе проводят осаждение углекислым барием, как описано выше. Осадок отфильтровывают и промывают водой. Оба фильтрата собирают вместе, добавляют НС1 (1:1) до перехода окраски индикатора метилового красного от желтой к красной, еще 2—3 мл НС1 (1:1) и кипятят с обратным холодильником в течение 10—15 мин для удаления углекислого газа. Раствор быстро охлаждают и нейтрализуют по метиловому красному сначала 20%-ным, а затем 0,1 н. раствором едкого натра. Борную кислоту титруют в присутствии маннита по фенолфталеину до возникновения устойчивой розовой окраски, не исчезающей при последующем прибавлении маннита.
Одновременно с образцом по всем стадиям анализа проводят «холостой» опыт.
Содержание бора вычисляют по формуле
п 'пхч Г (Vi-Vo)-100
п
где Т—татр 0,1 н. раствора едкого натра, выраженный в граммах бора, г!мл\ Vi — объем 0,1 н. раствора едкого натра, израсходованного на титрование пробы, мл\ Vo — объем 0,1 н. раствора едкого натра, израсходованного на титрование «холостого» опыта, мл\ п — навеска, г.
Точность метода ±1% (отн.).
Второй вариант метода определения общего бора в нитриде бора заключается в разложении навески нитрида бора сплавлением с 10—15-кратным количеством соды в платиновом тигле. Полученный сплав выщелачивают на холоду 10—15 мл соляной кислоты (1:1) и с полученным кислым раствором дальше поступают так, как указано в методике определения общего бора в карбиде бора (см. настоящую главу).
Точность метода ±0,5% (отн.)
Определение свободного бора
Метод определения свободного бора основан на том, что нитрид бора не разлагается смесью перекиси водорода с азотной кислотой, тогда как свободный бор полностью растворяется в этой смеси. Окончательное определение бора проводится ускоренным объемным методом [16].
Необходимые реактивы.
1. Перекись водорода, 1 :3.
2. Азотная кислота, уд. в. 1,34.
3. Едкий натр, 0,1 н. и 20%-ный растворы.
4. Соляная кислота, 1:1.
5. Маннит.
6. Метиловый красный, 0,1%-ный спиртовой раствор.
Ход анализа. Навеску нитрида бора в количестве 0,1—0,5 г (в зависимости от содержания свободного бора) растворяют в конической колбе емкостью 200—250 мл с пришлифованным шариковым холодильником в смеси 15—45 мл перекиси водорода (1:3) и 10 капель азотной кислоты. Нагревают медленно до кипения и кипятят в течение 40—50 мин. При больших количествах свободного бора во время кипения прибавляют еще 3—5 мл перекиси водорода. При содержании свободного бора до 5% достаточно 15 мл перекиси водорода. После окончания реакции раствор кипятят еще 10 мин с целью разложения перекиси водорода, охлаждают, промывают холодильник водой и отфильтровывают нерастворимый оста-
223
ток (карбид бора, нитрид бора). Осадок промывают несколько раз холодной водой и два-три раза 1%-ным раствором едкого натра. Слабокислый раствор кипятят с обратным холодильником в течение 5—10 мин для удаления углекислого газа. Быстро охлаждают, нейтрализуют по метиловому красному 20%-ным раствором едкого натра, прибавляют одну-две капли НС1 (1:1) и снова нейтрализуют уже 0,1 н. раствором едкого натра. К нейтральному раствору прибавляют маннит и титруют по фенолфталеину до устойчивой розовой окраски, не исчезающей от последующего прибавления маннита. Одновременно проводят по всем стадиям анализа «холостой» опыт.
Содержание свободного бора вычисляют по формуле
° п
Обозначения те же, что и в предыдущей формуле. Точность метода ± 1 % (отн.)
Определение азота методом Кьельдаля
Сущность метода определения азота по Кьельдалю [15, 48] заключается в том, что навеска нитрида бора разлагается серной кислотой с выделением аммиака, который определяется объемным или колориметрическим методом.
Необходимые реактивы.
1. Серная кислота, 0,1 н. и концентрированный растворы.
2. Едкий натр, 0,1 н. и 40%-ный растворы.
3. Сернокислый калий.
4. Метиловый красный, 0,1%-ный спиртовой раствор. Ход анализа. Навеску нитрида бора в количестве 0,1—0,2 г нагревают с 10—15 мл концентрированной серной кислоты в конической колбе емкостью 50—100 мл с запорным клапаном. Если нитрид бора не разлагается серной кислотой, применяют метод «мокрого сплавления». Для этого прибавляют к раствору 5—7 г соли K2SO4 и продолжают нагревание до полного разложения навески. Раствор разбавляют водой и переносят в дистилляционную колбу, в которой находится. 50—70 мл 40%-ного раствора едкого натра и три-четыре кусочка 224
гранулированного цинка. Щелочной раствор подвергают дистилляции для отгонки аммиака. Прибор для отгонки аммиака изображен на рис. 34.
Отгон, содержащий аммиак, собирают в коническую колбу емкостью 300 мл, в которой находятся 25 мл 0,1 н.
раствора серной кислоты и две капли метилового красного. Дистилляцию считают законченной после того, как объем отгона станет равным 150— 200 мл. Избыток серной кислоты титруют 0,1 н. раствором едкого натра. Параллельно по всем стадиям анализа проводят «холостой» опыт.
Содержание азота вычисляют по формуле
<?N(%) -
T[V\—V2c —(V3 —V4c)l-100 ' ?
П 4k
где Т — титр 0,1 н. раствора / \
серной кислоты, выраженный /ДА
в граммах азота, г/мл; Vi— j
объем титрованного раствора
серной КИСЛОТЫ, мл; V2— объ- Рис. 34. Схема прибора для ем 0,1 н. раствора едкого нат- отгонки аммиака, ра, израсходованного на тит-
рование избытка серной кислоты, мл; V3 — объем 0,1 н. раствора серной кислоты, использованного в «холостом» опыте, мл; У4 — объем 0,1 н. раствора едкого натра, израсходованного на титрование серной кислоты в «холостом» опыте, мл; с — соотношение между объемами 0,1 н. растворов серной кислоты и едкого натра при их взаимном титровании; п — навеска, г.
Точность метода ±1% (отн.).
Определение азота методом Дюма
Метод заключается в том, что навеска нитрида бора разлагается путем окисного сплавления в потоке двуокиси углерода с последующим определением объема выде-
15 Анализ бора
225
ляющегося при этом молекулярного азота [15]. Схема установки для определения азота по методу Дюма приведена на рис. 35.
Необходимые реактивы
1. Порошкообразная смесь для сплавления, состоящая из хромата свинца и окиси свинца, прокаленной при температуре 600°. Смесь составляется в соотношении компонентов 1:1.
Рис. 35. Схема установки для определения азота по методу Дюма: 1 — азотометр; 2 — трубчатая печь с кварцевой трубкой для очистки азота; 3 — печь Марса для сжигания навески; 4, 5 — гальванометры; б, 7 — термопары; 8 — аппарат Киппа; 9 — реостат.
2. Порошкообразная медь, полученная восстановлением окиси меди в потоке водорода при нагревании.
3. Едкое кали, 40%-ный раствор.
Ход анализа. Навеску нитрида бора в количестве 0,1—0,2 г помещают в фарфоровую лодочку и смешивают с десятикратным количеством смеси для сплавления. Лодочку с навеской переносят в трубку холодной печи Марса, закрывают и продувают систему двуокисью углерода до тех пор, пока уровень щелочи в азотометре не станет постоянным. Скорость прохождения пузырьков газа в азотометре регулируется специальным краном. Размер пузырьков должен быть минимальным. Затем нагревают печь до температуры 1000—1200°. Сплавление проводят в токе углекислого газа до тех пор, пока щелочь в азотометре не достигнет постоянного уровня. Количество непоглощенного газа отвечает объему выделенного*
226
Давление водяного пара при температуре 15—35°, мм рт. ст.
Таблица 15
Температура, °C
Температура, °C 0,0 0 , 1 0,2 0,3 0,4 0,5 0,6 0,7 *0,8 0,9
15 12,788 12,870 12,953 13,037 13,121 13,205 13,299 13,375 13,461 13,547
16 13’634 13'721 13,809 13,898 13,987 14,076 14,166 14,256 14,347 14,438
17 14,530 14,622 14,715 14,809 14,903 14,997 15,092 15,188 15,284 15,380
18 15’477 15,575 15,673 15,772 15,871 15,971 16,071 16.171 16,272 16,374
19 16,477 16,581 16,685 16,789 16,894 16,999 17,105 17,212 17,319 17,427
20 17\535 17,644 17>53 17,863 17,974 18,085 18,197 18,309 18,422 18,536
21 18,650 18,765 18,880 18,996 19,113 19,231 19,349 19,468 19,587 19,707
22 23 19,’827 21,068 19,948 21,196 20,070 21,324 20,193 21,453 20,316 21,583 20,340 21,714 20,565 21,845 20.690 21,977. 20,815 22,110 20,941 22,243
24 22,377 22,512 22,648 22,785 22,922 23,060 23,198 23,337 23,476 23,616
25 23756 23,’897 24,039 24,182 24,326 24,471 24,617 24,764 24,912 25,060
26 25\209 25,359 25,509 25,660 25,812 25,964 26,117 26,271 26,426 26.582
27 26,739 26,897 27,055 27,214 27,374 27,535 27,696 27,853 28,021 28,185
28 28,340 28,514 28,680 28,847 29,015 29,184 29,354 29,525 29,697 29,870
29 30^043 30,217 30,392 30,568 30.745 30,923 31,102 31,281 31,464 31,642
30 31,824 32,007 32,1-91 32,376 32,561 32,747 32,934 33,122 33,312 33,503
31 33\695 33,888 34,082 34,276 34,471 34,667 34,864 35,062 35,261 35,462
32 35,663 35,865 36,068 36,272 36,477 36,683 36,891 37,099 37,308 37,518
33 37\729 37,942 38,155 38,369 38,584 38,801 39,018 39,237 39,457 39,677
34 39,898 40,121 40,344 40,569 40,796 41,023 41,251 41,480 41,710 41,941
35 42,175 42,409 42,644 42,880 43,117 43,355 43,595 43,836 44,078 44,320
азота. Параллельно через весь ход анализа проводят «холостой» опыт.
Содержание азота в пробе вычисляют по формуле
п У(Р-Г) 0,04493
°' (273 + /)и
где V — объем выделившегося азота, мл; Р — барометрическое давление, мм рт. ст.; W — давление водяного пара, мм рт. ст. (значение находят по табл. 15); t — температура, °C; п — навеска, г.
Точность метода ±0,5—1,0% (отн.).
Определение азота методом обратного титрования
Метод заключается в разложении нитрида бора нагреванием со щелочью, поглощении выделившегося при реакции аммиака раствором 0,1 н. серной кислоты и последующем оттитровывании избытка последней. По количеству аммиака рассчитывается процентное содержание азота в нитриде бора [46, 47].
Необходимые реактивы
1. Едкий натр, 0,1 и. раствор и твердый.
2. Серная кислота, 0,1 н. раствор.
3. Фенолфталеин, 1%-ный спиртовой раствор.
4. Метиловый красный, 0,1%-ный спиртовой раствор.
Аппаратура. Установка для проведения анализа нитрида бора приведена на рис. 36. Прибор изготовляется из стекла пирекс. Верхняя часть прибора 4 помещена в электрическую трубчатую печь 9, в которой поддерживается температура 300°. В верхнюю часть прибора 4 вставляется на шлифе 17 стеклянная пробирка 18 с навеской нитрида бора и щелочью. Шлиф 17 припаян к стеклянной трубке 15, связанной с резиновой пробкой 10, которая закрепляется на выступающей из печи 9 нижней части прибора 4. Через пробку 10 продета стеклянная трубка 13, которая связана с трубкой 15 отрезком каучуковой трубки 14 для гибкости системы.
Трубка 15 имеет отверстие 16, через которое поступает предварительно очищенный воздух, создающий небольшое сверхдавление в зазоре между шлифом 17 и пробкой 10 (в нижней части прибора 4). Это позволяет избежать потерь аммиака в процессе анализа через неплотности в шлифе 17.
228
К верхней части прибора 4 припаян сосуд 7, подогреваемый при помощи либо тигельной электрической печи 8, либо газовой горелки. В сосуд 7 предварительно наливается вода, которая, будучи нагрета до кипения, поддерживает упругость паров кипящей воды над расплавом щелочи, что позволяет снизить вязкость реакционной
Рис. 36. Схема установки для анализа нитрида бора методом обратного титрования:
/ — резиновая груша; 2 — двухходовой кран; 3 — шлиф; 4 — прибор; 5 — каплеуловитель; б — трубка; 7 — сосуд; 8 — тигельная электрическая лечь; 9 — трубчатая печь; 10 — резиновая пробка; И — колба Эрленмейера с кислотой; 12 — промывалка; 13 — стеклянная трубка; 14 — каучуковая трубка; 15 — стеклянная трубка; 16 — отверстие для подвода очищенного воздуха; 17 — шлиф; 18 — пробирка.
массы и ускорить процесс разложения нитрида бора щелочью. Через прибор 4 по трубке 6 пропускается ток воздуха, предварительно очищенного от углекислоты, сероводорода и аммиака путем пропускания через две склянки Тищенко, наполненные раствором щелочи и серной кислоты соответственно.
Скорость воздуха регулируется винтовым зажимом, установленным после склянок Тищенко. Воздух, уносящий из прибора 4 выделившийся аммиак, проходит через каплеуловитель 5 и маленькую промывалку 12, служащую для определения конца реакции, и поступает в рас-
229
гвор кислоты, налитой в колбу Эрленмейера 11, в которой поглощается аммиак.
Колба 11 связана с резиновой грушей 1 и двухходовым краном 2, что позволяет при определении конца реакции создавать в колбе И давление воздуха, необходимое для нагнетания новой порции кислого раствора в промывалку 12. Для удобства промывки и сборки прибора предусмотрен шлиф 3.
Ход анализа. Пробу нитрида бора тщательно растирают в агатовой ступке. Навеску нитрида бора в количестве 0,2 г высыпают в стеклянную пробирку 18, дно и стенки которой предварительно покрываются толстым слоем застывшего расплава щелочи. Величина навески определяется по разности в весе бюкса с нитридом бора и без нитрида бора (после высыпания из бюкса навески). В пробирку с навеской нитрида бора насыпают 0,5 г измельченной щелочи, которую тщательно перемешивают тонкой стеклянной палочкой, оставляемой внутри пробирки. Сверху смеси помещают слой щелочи 4—5 мм. В колбу Эрленмейера 11 наливают 50 жл 0,1 н. раствора H2SO4, добавляют две-три капли фенолфталеина, наполняют сосуд 7 водой и нагревают печь 9 до температуры 300°.
Прибор необходимо предварительно собрать и испытать на герметичность. Для этого в собранный без пробирки прибор пускают воздух и закрывают кран 2. При этом воздух не должен проходить через склянки Тищенко (каучук перед склянками Тищенко предварительно протыкают иглой, создавая таким образом предупредительный клапан для выпуска воздуха). Открывают кран 2 и регулируют зажимом скорость воздуха с таким расчетом, чтобы через колбу 11 проходило 100—120 мл воздуха в минуту, затем вынимают шлиф 3 и охлаждают. Устанавливают в шлифе 17 пробирку с навеской нитрида бора, быстро вставляют в прибор 4, помещенный в нагретую до 300° печь, и тщательно закрепляют пробку 10. Через 15 мин нагревают в сосуде 7 воду до кипения, затем нагнетают в промыяалку 12 0,1 н. раствор H2SO4 и наблюдают, не обесцветится ли раствор. Эту операцию повторяют через каждые 5 мин, каждый раз замеряя объем H2SO4 в миллилитрах.
Если в течение 15 мин раствор в промывалке 12 не обесцвечивается, разложение нитрида бора можно считать законченным.
230
Отделяют при помощи шлифа 3 колбу 11 от прибора 4. Промывают трубку водой через шлиф 3 в колбу 11, добавляют в раствор колбы 11 две-три капли метилового красного и титруют избыток кислоты 0,1 н. раствором едкого натра.
Содержание азота в нитриде бора вычисляют по формуле
п (50^1 24,28
yNc°) - 10/г
где /G— нормальность раствора серной кислоты; Кч— нормальность раствора едкого натра; V — объем 0,1 н. раствора едкого натра, израсходованного на оттитровы-вание избытка кислоты (обратное титрование), мл; п — навеска, г.
Точность метода ± 1 % (отн.).
Определение азота сплавлением с гидроокисью лития
Метод заключается в разложении нитрида бора нагреванием с гидроокисью лития, поглощении выделяющегося по реакции аммиака раствором борной кислоты и оттитровывании аммиака 0,1 н. раствором соляной кислоты.
Необходимые реактивы
1. Гидроокись лития.
2. Борная кислота, 2%-ный раствор.
3. Серная кислота, уд. в. 1,84.
4. Соляная кислота, 0,1 н. раствор.
5. Метиловый оранжевый, 0,1%-ный водный раствор.
Ход анализа. Навеску нитрида бора в количестве 0,03—0,15 г помещают в фарфоровую лодочку, на дно которой предварительно насыпают гидроокись лития, и сверху покрывают гидроокисью лития. Общее количество гидроокиси лития должно составлять 2—3 г. Лодочку с содержимым помещают в фарфоровую трубку диаметром 20 мм и длиной 50—70 см, вставленную в трубчатую печь. К одному концу фарфоровой трубки присоединяют два поглотительных сосуда, содержащих по 20 мл 2%-ной Н3ВО3, а к другому концу — поглотительный сосуд с 20 мл H2SO4 (уд. в. 1,84). Печь нагревают в течение 15 мин до 750—800° и одновременно через всю систему водоструйным насосом просасывают ток воздуха со скорос
231
тью 65—70 пузырьков в минуту, увлекающих за собой пары образовавшегося аммиака и выделившейся воды; которые поглощаются раствором борной кислоты.
Через 30 мин после достижения температуры 800° выделение аммиака прекращается, раствор из поглотительных сосудов количественно переносят в коническую колбу и оттитровывают аммиак 0,1 н. раствором НС1 с индикатором метиловым оранжевым.
Содержание азота вычисляют по формуле
QN(%) = ^,
п
где Т — количество азота, соответствующее 1 мл 0,1 н. соляной кислоты, г; V — объем 0,1 н. раствора соляной кислоты, израсходованной на титрование, мл\ п— навеска нитрида бора, г.
Точность метода ±0,5% (отн.).
Приготовление необходимых реактивов см. в соответствующей литературе [55].
3. Анализ фосфида бора
Фосфид бора является химически стойким соединением. Он практически не растворяется в концентрированных азотной, соляной, серной, 40 %-ной фтористоводородной кислотах и в их смесях, в смеси азотной кислоты и перекиси водорода, в 20 и 60 %-ном растворах едкого натра, смеси едкого натра и бромной воды, смеси серной кислоты и сульфата калия [15].
Для анализа фосфида бора предложено сплавление со щелочными окислительными смесями [56]. При сплавлении возможна потеря фосфора в виде фосфина.
Изучена возможность количественного перевода фосфида бора в раствор кипячением со смесью азотной кислоты и стократным по отношению к навеске количеством азотнокислого натрия [57].
Необходимые реактивы
1. Азотнокислый натрий.
2. Азотная кислота, уд. в. 1,2.
3. Азотнокислое серебро, 0,1 М раствор.
4. Углекислый натрий.
5. Едкий натр, 0,1 н. раствор.
6. Метиловый красный, 0,1%-ный спиртовой раствор.
7. Фенолфталеин, 0,1%-ный спиртовой раствор.
8. Маннит.
9. Азотнокислый аммоний, 35%-ный раствор.
10. Аммиак, 25%-ный раствор.
11. Молибденовокислый аммоний (см. приготовление реактивов).
12. Азотнокислый калий, 2%-ный раствор.
Ход анализа. Навеску пробы в количестве 0,1 г помещают в кварцевую колбу с обратным холодильником, добавляют 50 мл воды, 10 г NaNO3 и в несколько приемов 75 мл HNO3 (уд. в. 1,2). К обратному холодильнику подключают поглотительный сосуд, содержащий 25 мл 0,1 М AgNO3 и медленно нагревают раствор. После растворения продукта отсоединяют поглотительный сосуд, прозрачную жидкость охлаждают и переносят в мерную колбу емкостью 250 мл. Нерастворившийся остаток сплавляют с Na2CO3 + NaNO3, плав выщелачивают, раствор добавляют в колбу и доводят объем до метки водой. Из аликвотного объема, содержащего не более 10 мг Р2О3, определяют бор потенциометрическим титрованием (см. гл. I). Титровать следует до pH = 4,9.
Определение фосфора [58]
Объемный метод определения фосфора основан на растворении осадка титрованным раствором едкого натра и оттитровывании избытка щелочи раствором кислоты. Уравнение реакции:
(NH4)3PO4.12А1оОз + 23NaOH - NaNH4HPO4 -|-
+ (NH4)2MoO4 J- 11 Na2MoO4 + 11H2O.
Азотнокислый раствор выпаривают до объема 40 — 50 ли, прибавляют 30 мл 35%-ного раствора NH4NO3> нейтрализуют аммиаком и добавляют 1—2 мл концентрированной HNO3. Раствор нагревают до 50—60° и приливают 40—80 мл горячего раствора (NH4)2MoO4. Оставляют осадок стоять на 3—4 ч и затем отфильтровывают через бумажную массу. Промывают осадок холодным нейтральным 2%-ным раствором нитрата калия до нейтральной реакции по метиловому красному.
Осадок вместе с бумажной массой переносят в стакан, прибавляют 20—30 мл свежепрокипяченной дистиллированной воды, две-три капли раствора фенолфталеина и титрованный раствор 0,1—0,2 н. едкого натра до
233-
розового окрашивания раствора и еще 3—5 мл избытка. Раствор тщательно перемешивают и оттитровывают избыток едкого натра 0,1 н. раствором азотной кислоты в присутствии фенолфталеина.
Содержание фосфора вычисляют по формуле
п — V2/<2) 0.00135 100
Ч'р \ /о / ,
г п
где Vi — объем раствора едкого натра, израсходованного на титрование, мл\ V2—объем раствора азотной кислоты, израсходованной на титрование избытка едкого натра, мл\ Ki — коэффициент нормальности раствора едкого натра; К2 — коэффициент нормальности раствора азотной кислоты; 0,00135 — титр 0,1 н. раствора едкого натра, выраженный в граммах фосфора, г/мл; п — навеска, г.
Точность метода ±4% (отн.).
4. Приготовление реактивов
Молибденовокислый аммоний [59]. Навеску в количестве 80 г растертого в фарфоровой ступке молибдата аммония растворяют в разбавленном аммиаке (130 мл 25%-ного аммиака и 670 мл воды). Затем готовят разбавленную азотную кислоту (445 мл HNO3 уд. в. 1,4 и 755 мл воды) и, охладив, вливают в нее (а не наоборот) небольшими порциями при постоянном перемешивании раствор молибдата аммония. До употребления молибденовый реактив должен стоять в темноте в течение 8— 10 дней.
5. Анализ соединения бор — кремний
Муассан и Шток [2, 60] указали на существование двух химических соединений кремния с бором — B3Si и B6Si. Химически силициды бора весьма устойчивы. Так, концентрированная серная кислота разлагает их только при кипячении. При кипячении в дымящей серной кислоте растворяется только B6Si (в количестве 80—90% от его содержания в смеси с B3Si). Расплавленные щелочи легче разлагают B3Si, чем B6Si [2, 60] *.
Методы анализа силицида бора в литературе не описаны. Для определения бора в силициде может быть ис-
* Цит. по литературному источнику [2].
234
•пользован метод спектрального анализа, описанный в гл. II применительно к определению бора в кремнии.
Химические методы анализа основаны на сплавлении силицида бора с различными плавнями. При больших содержаниях кремния для переведения его в раствор применяют сплавление с такими веществами, как карбонаты натрия и калия, едкий натр, перекись водорода, свинцовый глет, смесь окиси свинца и борного ангидрида, сплав карбоната калия и борного ангидрида [15]. Лучшим методом переведения кремния в раствор является сплавление силицида бора с едким натром в никелевых (или железных) тиглях. Выщелачивание плава производят в .приблизительно 10%-ном растворе серной или соляной кислоты [15].
При одновременном определении кремния и бора переведение силицида бора в раствор удобнее осуществлять сплавлением навески в количестве 0,02 г в платиновом тигле с шестикратным количеством KNaCOs. В этом случае *в раствор не попадают элементы, мешающие визуальному титрованию борной кислоты (материал тиглей — Ni, Fe, Al и т. п.). Присутствие кремния в количествах, не превышающих 50 мг SiO2, титрованию борной кислоты не мешает [61].
Выщелачивание плава проводят горячей водой и после кипячения подкисленного раствора для удаления уг* лекислого газа борную кислоту определяют титрованием с маннитом.
Для определения кремния [58] соответствующую аликвотную часть раствора подкисляют соляной кислотой и выпаривают почти досуха. Затем для удаления бора прибавляют 10—20 мл метилового или этилового спирта и вновь выпаривают. Добавление спирта и выпаривание следует повторить три-четыре раза, смачивая каждый раз остаток соляной кислотой. Далее кремневую кислоту определяют обычными методами (двукратным выпариванием или осаждение желатином).
Литература
1. Самсонов Г. В., Портной К. И. Сплавы на основе тугоплавких соединений. М., Оборонгиз, 1961.
2. С а м с о н о в Г В. и др. Бор, его соединения и сплавы. Киев, Изд-во АН УССР, 1960.
3. Ridhway R. Trans. Amer. Electrochem. Soc.. 66. 117 (1934).
235
4. Назар чу к Т. Н. «Ж. неорган. химии», 4, 2665 (1959).
5. Миклашевский А. И. «Заводск. лаборатория», 7, 168 (1938).
6. Шафран И. Г. «Ж. прикл. химии», 2, 56 (1938).
7. Н а з а р ч у к Т. Н. «Бюл. Ин-та металлокерамики и спец, сплавов АН УССР», № 6, 30 (1961).
8. Лендель Г. и др. Анализ черных металлов. М. — Л., Госхимиздат, 1934.
9. Ш а ф р а н И. Г., Павлова М. В. «Заводск. лаборатория», 7, 1245 (1938).
10. Ш а ф р а н И. Г. «Заводск. лаборатория», 7, 561 (1938).
11. Самсонов Г. В., Копнина О. И. «Заводск. лаборатория», 2, 269 (1953).
12. Blumenthal Н. Analyt. Chem., 23, 192 (1951).
13. Пилипенко А. Т., Кугай Л. Н. «Укр. хим. ж.», 35, 786 (1959).
14. М о д ы л е в с к а я К. Д. и др. «Заводск. лаборатория», 27, 1345 (1961).
15. Самсонов Г. В. и др. Анализ тугоплавких соединений, М., Металлургиздат, 1962.
16. К о т л я р Е. Е., Н а з а р ч у к Т. Н. «Ж. аналит. химии», 15, 207 (1960).
17. Васильева М. Г., Соколова А. Л. «Ж. аналит. химии», 7, 530 (1962).
18. Мухина 3. С. и др. Методы анализа металлов и сплавов. М., Оборонгиз, 1959.
19. Гиллебранд В. Ф. и др. Практическое руководство по неорганическому анализу. М., Госхимиздат, 1957.
20. Дымов А. М. Технический анализ. М., Металлургиздат, 1944.
21. Шафран И. Г., Владимирская Р. Р. «Заводск. лаборатория», 7, 269 (1938).
22. Б е р л л-Л у н г е. Химико-технические методы исследования.
Т. 2. ГОНТИ —НКТП СССР, 1938, стр. 2.
23. Бабаев М. В. «Заводск. лаборатория», 16, 221 (1950).
24. Унифицированные методы анализа ферросплавов. Сб. статей. М, Изд-во АН СССР, 1944.
25. Caim J. R., Maxwell L. С. Industr. and Engng Chem., 11, 852 (1919).
26. Брунс Б. и др. «Ж. аналит. химии», 2, 294 (1947).
27. В е n n е t Е. Z. et al. Analyt. Chem., 22, 445 (1950).
28. Halle C. N., Halle M. N. Analyt. Chem., 23, 724 (1951).
29. Ponolny Milan. Dostl. Vyroba, 8, 781 (1962).
30. О el sen W. et al. Arch. Eisenhiittenwesen, 22, 225 (1951).
31. О el sen W. et al. Angew. Chemie, 63, 557 (1951).
32. Wuterhink A. Microchim. acta, 5, 509 (1954).
33. Fischer W. et al. Metallhiittenwesen, 8, 529 (1955).
34. Быковская Ю. И. «Ж. аналит. химии». 17, 607 (1962).
35. П о п о в а Н. М., Заславская Л. В. «Заводск. лаборатория», 21, 1285 (1955).
36. К i t a h а г a S a b u г е et al. Repts Scient. Res. Inst., 34, 339 (1958).
37. К л я ч к о Ю. А., Шапиро М. М. «Заводск. лаборатория», 14, 549 (1948).
38. Гутман С. М. «Заводск. лаборатория», 13, 1403 (1947).
236
39. Миклашевский А. И. Карборунд, химический анализ и его свойства. ГОНТИ — НКТП СССР, 1938.
40. Меер сон Г. А., Самсонов Г. В. «Заводск. лаборатория», 16, 1423 (1950).
41. Брауэр Г. Руководство по препаративной органической химии. М., Изд-во иностр, лит., 1956.
42. Некрасов Б. В. Курс общей химии. М., Госхимиздат, 1954
43. F г i е d г i с h Е., S i 11 i g L. Z anorgan. und allgem. Chem., 143, 308 (1925).
44. Pascal P. Traite chim. mineric., 5, 607 (1932).
45. M e 11 о r J. W. Compressed Tretease Inorg. Theoret. Chem.. 5, 882 (1925).
46. Шафран И. Г. «Ж. прикл. химии», 13, 1885 (1940).
47. Stabler A., Elbert J. Chem. Вег., 46, 2060 (1913).
48. Котляр Е. Е., Кугай Л. Н. Информационное письмо № 219. Киев, Изд-во АН УССР, 1960.
49. Cosegrave J. D., Shears Е. С. Analyst, 85, 448 (1960).
50. С я в ц и л л о С. В. и др. «Заводск. лаборатория», 29, 806 (1963).
51. Клибус А. X., Назар чу к Т. Н. «Ж. аналит. химии», 16, 1 (1961).
52. Lapin L. N., Н е i n W. О. Z. analyt. Chem., 98, 236 (1934).
53 Л а п и н Л. Н. «Тр. Комис, по аналит. химии АН СССР», 5(8), 77 (1959).
54. Лютая М. Д. и др. «Ж. неорган. химии», 6, 2738 (1961).
55. Сусленникова В. М., Киселева Е. К. Руководство по приготовлению титрованных растворов. Л., Госхимиздат, 1962.
56. W i 11 i a m s F. V., Ku eh r w ein R. A. J. Amer. Chem. Soc.. 82, 1330 (1960).
57. Сентюрина H. H. и др. «Заводск. лаборатория», 29, 1057 (1963).
58. Анализ минерального сырья. Сб. методов хим. анализа. Под ред. Ю. Н. Книпович и Ю. В. Морачевского. Л., Госхимиздат, 1956.
59. Ф а й н б е р г С. IO Анализ руд цветных металлов. М., Метал-лургиздат, 1953.
60. М о i s s a n A., Stock A. Compt. rend. Acad, sci., Paris, 131, 139 (1950); см. также Евстропьев К. С., Торопов К. А. Химия кремния и физическая химия силикатов. М., Промстрой-издат, 1950, стр. 223.
61. Schafer Н., Sieverts A. Z. analyt. Chem., 121, 172 (1941).
Глава VI
АНАЛИЗ ГАЛОИДНЫХ СОЕДИНЕНИЙ БОРА
1. Введение
Бор с галогенами образует соединения общей формулы ВпГт; наиболее распространенные из них ВГ3 (п = = 1, т = 3).
Все галогениды бора представляют собой бесцветные вещества, дымящие на воздухе вследствие гидролиза [1]
вг3 + ЗН2О - н3во3 + знг.
Взаимодействие трехфтористого бора с водой протекает по схеме [2—4]
4BF3 + ЗН2О - 3HBF4 + Н3ВО3.
Наряду с этим трехфтористый бор при пропускании его в воду образует гидраты BF3*H2O и BF3*2H2O [2]. Основные физико-химические свойства галогенидов бора приводятся в табл. 16.
Таблица 16
Основные физико-химические свойства галогенидов бора
Свойства BF, ВС1, ВВг8 BJ,
Агрегатное состояние при нормальных условиях Плотность, г/см? . . Температура, °C: кипения .... плавления . . . Газ 3,065 (г/л) —101 —127 Газ 3,97 + 13 — 107,3 Жидкость 2.811 +91,12 —46 Твердое вещество 3,3 (расплавленного) +209,5 +49
238
Для галогенидов бора характерны реакции образования комплексных соединений с молекулами органических и неорганических веществ. Известны комплексные соединения с серной кислотой, ее солями, азотной кислотой, аммонием, эфирами и другими неорганическими и органическими соединениями [2, 5].
Координационная способность галогенидов бора с уменьшением объема их молекул (от трехиодистого бора к трехфтористому бору) заметно возрастает. У трехфтористого бора она наибольшая, в отличие от своих аналогов он образует комплексное молекулярное содинение с фтористым водородом — борофтористоводородную кислоту HBF4 [1, 2, 5]. Трехфтористый бор, являясь ярко выраженным акцептором электронов, отличается высокой ; каталитической активностью и находит все большее применение как катализатор при синтезах в органической химии [6—8].
В последние годы трехфтористый и треххлористый бор используются для разделения изотопов бора. При действии на треххлористый и трехбромистый бор водорода или различных видов электрических разрядов [5] образуется элементарный бор. Трехиодистый бор ввиду трудности его синтеза пока не нашел практического применения.
Анализ галогенидов бора основан на их гидролизе с последующим определением бора в виде борной кислоты, галогенидов и примесей описанными в литературе методами. Содержание отдельных компонентов пробы определяют из аликвотных объемов.
2. Отбор проб г
В литературе вопрос отбора проб трехфтористого бора и других галоидных соединений бора освещен недостаточно. Вуз и Мартин [6] разработали метод отбора проб трехфтористого бора и сконструировали для этой цели аппаратуру. Этот метод не лишен недостатков, так как требует большой навески и потому недостаточно точен, f Авторы настоящей книги используют вакуумную установку, позволяющую отбирать для анализа пробы трехфтористого бора из баллонов.
Общий вид и схема установки приведены на рис. 37 : и 38.
23 &
Треххлористый и трехбромистый бор отбирают в стеклянные ампулы и по разности весов пустой ампулы и ампулы с пробой определяют навеску.
Рис. 37. Общий вид установки для отбора проб BF3.
Таким же образом отбирают навеску трехиодистого бора, предварительно расплавив последний. Отбор проб трехиодистого и трехбромистого бора рекомендуется вести в технологической установке непосредственно.
240
Вакуумная установка для отбора проб трехфтористо-го бора снабжена микровентилями, мановакуумметром (типа АМ-1 150X1; типа АМ-1 150x60), стеклянным ртутным манометром, при помощи которых точно контролируется количество отобранного продукта. К установке через штуцер 11 присоединяют пустую стеклянную ампулу, к участку до крана 3 — баллон 8 с продуктом. Сушат установку нагреванием ее горелкой. Затем, открыв микровентили 1—4, откачивают установку форвакуумным
Рис. 38. Схема установки для отбора проб BF3:
/, 2, 5, 4 — сильфонные микровентили; 5 - ртутный манометр; 6 — мано вакуумметр; 7 — ловушка для конденсации продукта; 8 — баллон с про дуктом; 9 — капиллярный ртутный манометр; 10 — ампула или платиновая колба для отбора продукта; 11 — съемный штуцер.
насосом до разрежения 10-1—10-2 мм рт. ст., после чего закрывают все краны. В таком виде установка готова для отбора проб.
При отборе проб открывают краны 2, 3, 4, оставляя ; закрытым кран 1. Затем открывают вентиль баллона 8 и t. запускают в установку продукт до тех пор, пока давле-; ние в установке не станет равным 1—2 атм (по маномет-• ру 5). После этого вентиль баллона закрывают и записывают показания ртутного манометра 9 (давление продукта). Закрывают краны 2 и 1.
В платиновую колбу емкостью 300 мл наливают 100— ; 150 мл воды, колбу взвешивают и помещают ее в жид- кий воздух для замораживания. Платиновую колбу закрывают пробкой из тефлона, имеющей внутри сквозное отверстие с резьбой, которое закрывается тефлоновой крышкой. Для обеспечения герметичности поверх колбы и пробки надевается эластичная резиновая трубка. От-
16 Анализ бора 241
винчивают тефлоновую крышку в пробке, вынимают пробку из колбы и подсоединяют последнюю к системе через штуцер 11. Открывают кран /, откачивают в тече* ние 1—2 мин систему, закрывают кран 1 и открывают кран 2. Поглощение продукта ведут до тех пор, пока уровень ртути в ртутном манометре 9 не станет постоянным. Записывают показания манометра 9 (давление отбора пробы)* Перекрыв кран 2, отъединяют колбу, закрывают ее пробкой и оставляют стоять до тех пор, пока температура раствора в колбе не станет равной комнатной. Колбу взвешивают и по разности в весе ее до и после поглощения трехфтористого бора определяют отобранную навеску (так называемую «практическую» навеску). К системе через штуцер 11 присоединяют ампулу 10 и, открыв все краны, откачивают остатки продукта из системы в ловушку, помещенную в жидкий воздух. Затем из ловушки продукт выпускают.
Испытуемый раствор из платиновой колбы переносят в мерную колбу емкостью 500 мл. Платиновую колбу тщательно смывают несколько раз водой, объем раствора доводят до метки. Из аликвотных объемов определяют содержание основных и примесных компонентов в пробе (раствор следует хранить в платиновом сосуде).
Отбор проб трехфтористого бора для определения в нем основных компонентов производится следующим образом: к системе через штуцер 11 присоединяют несколько пустых ампул с общим отводом. Откачивают систему до 10~2—10~3 мм рт. ст., после чего открывают кран 2 и запускают продукт в ампулы. Затем, перекрыв кран 2, каждую ампулу отпаивают и передают на анализ. Ампулу с продуктом взвешивают и содержимое ее переводят в раствор при помощи специально сконструированной «бомбы» (рис. 39). «Бомба» изготавливается из латуни, внутренняя часть, где производится растворение продукта, — из тефлона, так что взаимодействие продуктов реакции со стенками «бомбы» исключено.
В «бомбу» наливают 50—100 мл воды, помещают туда ампулу с продуктом и «бомбу» закрывают. Тефлоновые уплотнения обеспечивают необходимую герметичность «бомбы». Бойком из тефлона разбивают ампулу и тщательно взбалтывают раствор в «бомбе». Затем «бомбу» вскрывают, раствор переносят в мерную колбу емкостью 100—150 мл9 тщательно смывают стенки «бом-
242
фЫ» и осколки ампулы водой в ту же колбу. Объем раствора доводят до метки и из аликвотных объемов его Определяют содержание основных компонентов пробы.
)сколки амгТулы сушат, осторожно снимают с фильтра и □вешйвают. По разности в весе ампулы с продуктом и фстсй ампулы (осколков) определяют навеску*.
Отбор пробы значительно упрощается при условии применения установки, состоящей из баллона BF3, колбы для разложения из нержавеющей стали, футерованной тефлоном, и стеклянного манометра, заполненного октойлом. Ход отбора в этом случае следующий: колбу для разложения заполняют 100— 120 мл дистиллированной ’ воды,
Рис. 39. «Бомба» для переведения в раствор проб галогенидов бора: •’ а — общий вид; б — детали «бомбы»; в — ключи к «бомбе».
закрывают крышкой и взвешивают с точностью до 0,Ьлсг.
^Подсоединяют колбу к баллону и отбирают пробу BF3 в течение 3—4 мин при изменении давления в манометре
от 10 до 15 мм рт. ст. Колбу с продуктом ставят в весо-;вой комнате на 1—1,5 ч до достижения комнатной темпе-
ратуры и взвешивают. Полученный раствор переносят в ' мерную колбу емкостью 500 мл и доводят водой до метки.
♦ При анализе трехфтористого бора можно воспользоваться «теоретической» навеской отобранного продукта, получаемой рас-четным^путем. В этом случае отбору проб трехфтористого бора предшествует калибровка установки. Для этого к системе вместо ампулы или платиновой колбы присоединяют пустой сосуд известного объема. Откачивают систему, запускают в нее анализируемый про-дукт и рассчитывают объем установки по закону Бойля — Мариотта. Затем, приведя объем, занимаемый установкой, к условиям от-
16* 243
3. Анализ трехфтористого Сора
Прямого химического метода определения трехфтористого бора не существует. Дэви [6] пропускал трехфтористый бор через металлический калий и определял количества элементарного бора и фтористого калия. Трехфтористый бор количественно реагирует с фтористым ацетилом [9, 10], цианистым водородом, пятиокисью фосфора и другими веществами [2], образуя осадки.
Степень чистоты трехфтористого бора определяют масс-спектрометрическим методом анализа, позволяющим также определять его изотопный состав [11, 12].
Химический анализ трехфтористого бора производится на основе взаимодействия его с водой, в результате которого образуется борофтористоводородная кислота.
Борофтористоводородная кислота — сильная кислота, диссоциирующая как одноосновная. Щелочью эта кислота не титруется, так как в растворе к ней примешиваются продукты гидролиза ВРГ-иона, легко титруемые щелочью [2, 13—15].
Степень гидролиза ВР4~-иона, протекающего по схеме [2]
BF? + Н2О = ВРзОБГ + HF, незначительна и возрастает с разбавлением раствора и повышением температуры [8, 15]. Поэтому для определения ВРГ-иона необходимо либо разложить его при нагревании [2, 16, 17], либо определить весовым методом [18—20].
Попытки разложения ВРГ-иона щелочью не дали положительных результатов, так как этот процесс идет очень медленно [13]. Длительностью разложения ВРГ-иона отличается и метод американских авторов [21] . Полнее ВРГ -ион разлагается в смеси с твердыми солями магния, кальция бария и окислами металлов [22].
бора пробы .и рассчитав объем отобраиной пробы Vиск» ВЫЧИСЛЯЮТ «теоретическую» навеску по формуле
^теор — dV иск, где d — удельный вес продукта в зависимости от изотопного состава и температуры, г/слс3; V — объем отобранного для анализа продукта, мл.
Расхождение между навесками «практической» и «теоретической» составляет ±1—2% (отн.).
244
Наиболее быстрым и полным является способ разложения ВРГ-иона при каталитическом воздействии ионов водорода и кальция, описанный в работах И. Г. Рысса и др. [2, 16, 23—25]. Ионы фтора при этом быстро и полностью связываются в осадок по уравнению [2, 16]
BF4“ + 2Са2+ + ЗН2О - НзВОз + 2CaF2 + ЗН+.
Если раствор, содержащий ВРГ ионы, кипятить с раствором хлористого кальция в течение часа с обратным холодильником, то образовавшиеся ионы водорода можно оттитровать щелочью по метиловому красному, а после прибавления маннита оттитровать по фенолфталеину и образовавшуюся борную кислоту [16, 21, 24, 26]. Титрование по метиловому красному или метиловому оранжевому позволяет определить и количество фтора в пробе тогда, когда трехфтористый бор не содержит кислотообразующих примесей или когда учтены поправки расхода щелочи на титрование последних [26].
В зависимости от состава и содержания примесей в трехфтористом боре на титрование по метиловому красному или метиловому оранжевому после кипячения с хлористым кальцием и на титрование по фенолфталеину после прибавления маннита будут израсходованы различные объемы щелочи (V] и V? соответственно). В отсутствие примесей соотношение V\lV2 = 3; если трехфто-ристый бор загрязнен примесями, то соотношение V|/V2 будет больше или меньше 3. В первом случае продукт содержит в качестве примеси в основном тетоафтопид кремния, во втором—триоксифторид бора (BOF)3 [23].
Для количественного определения фтора в ВЕ7-ионе И. Г. Рысс [17] предложил разложение последнего проводить в присутствии веществ, катализирующих реакцию гидролиза BFF -иона и удаляющих с необходимой скоростью из реакции ионы водорода, избыток которых может вызвать растворение осадка фтористого кальция. Если раствор, содержащий ВЕГ-ионы, кипятить в течение часа в присутствии хлористого кальция, йодистого калия, хлорноватокислого калия и метаванадата калия, последний из которых каталитически связывает водородные ионы по схеме [2, 17].
С1ОГ + 6J- + 6Н+ = Cl- + 3J2 + ЗН2О,
245
то образуется осадок фтористого кальция, который служит весовой формой для определения фтора [26]. Чтобы избежать частичного гидролиза осадка фтористого кальция вследствие адсорбции влаги с отщеплением фтористого водорода и образованием соли CaOHF [27], некоторые авторы предлагают нагревать фтористый кальций с уксусной кислотой [27, 28].'
Количественному определению фтора с использованием реакции образования гидроксотрифторборатов мешают эквимолярные количества анионов серной, азотной и соляной кислот и анионов слабых кислот [29].
Наиболее вероятными примесями в трехфтористом боре, полученном различными методами, являются растворимые [HF, SiF4, SO2, SO3 и (ВОР)з] и нерастворимые (воздух) в воде примеси.
Вопрос образования примеси триоксифторида бора в процессе получения трехфтористого бора очень интересен. Некоторые авторы [2, 23] указывают на существование триоксифторида бора в трехфтористом боре, другие [301, однако, не упоминают об этой примеси в процессе получения трехфтористого бора. Баумгартен и Брунс [31] отмечают, что триоксифторид бора образуется при условиях, близких к условиям получения трехфтористого бора. Оксифториду бора (ВОР)з приписывается формула циклического тримера
О
FBZ \f
[О 0 bZ F
В литературе имеются также сведения о том, что подобные оксисоединения образуются и при получении треххлористого и трехбромистого бора [5, 32, 33]. Данные по определению содержания триоксифтористого бора в литературе отсутствуют.
В практике при анализе трехфтористого бора часто встречаются пробы, в которых соотношение V/|V2 меньше 3, что, согласно Рыссу [23], говорит о наличии примеси оксифторида бора. Учитывая присутствие оксифтори-246
да бора в трехфтористом боре, нами выведены формулы для вычисления его содержания в трехфтористом боре, которые приводятся ниже.
Анализ трехфтористого бора начинают с определения содержания в нем воздуха и двуокиси серы. Содержание воздуха определяют газообъемным методом [21], содержание двуокиси серы — иодометрически [21, 26, 34, 35].
Классическим методом определения трехокиси серы является весовой метод [36, 37]. Немалыми преимуществами по сравнению с ним обладает объемный комплексонометрический метод определения трехокиси серы и серы в виде SO|~ [38—43]. Нами рекомендован комплексонометрический метод определения серы в трехфтористом боре, приводимый ниже.
Существование фтористого водорода в свободном виде в водном растворе трехфтористого бора маловероятно. Поэтому определение содержания фтористого водорода в трехфтористом боре сводится к определению четырехфтористого кремния, образующегося в результате взаимодействия фтористого водорода со стенками сосуда [23].
В литературе [44, 45] описан метод определения тетрафторида кремния в смеси трифторид бора — тетрафтэ-рид кремния с точностью 0,2% путем избирательного вымораживания. Для определения тетрафторида кремния можно использовать количественное отделение его от фтористого водорода адсорбцией на бифториде натрия NaHF2 в интервале температур 80—250° [46]. В отдельных пробах трехфтористого бора тетрафторид кремния можно определять классическим весовым методом в виде SiO2 [25, 27, 30, 36, 37, 39]. Применение колориметрического [36] и весового [47] методов определения кремнемолибденового комплекса к определению содержания тетрафторида кремния в трехфтористом боре затруднительно. Свайнхерт и др. [21] для определения тетрафторида кремния рекомендуют метод титрования соли кремнефтористоводородной кислоты едким натром, уточненный нами.
Определение газов, не растворимых в вгдэ
Определяют емкость стеклянной трубки, снабженной кранами с обоих концов для отбора газа. Трубку сушат продуванием сухого воздуха и оставляют ее наполненной
247
воздухом при закрытых кранах. После продувания трубки, присоединенной к установке, трехфтористым бором открывают вентиль баллона и краны трубки и в течение 15 мин пропускают через трубку газ. Затем последовательно закрывают верхний и нижний краны баллона и анализируют газ в трубке. Для этого один конец трубки присоединяют к уравнительной груше емкостью 500 мл, содержащей 400 мл раствора хлорида натрия (300 г растворяют в 1 л воды). Второй конец трубки присоединяют к газовой бюретке, также наполненной раствором хлорида натрия. Следят за тем, чтобы в соединительных трубках не было пузырьков газа. Добавление к раствору хлорида натрия небольшого количества смачивающего средства («ультравет») помогает удалению небольших пузырьков газа со стенок соединительных трубок. Укрепляют трубку для отбора газа в вертикальном положении и переводят раствор из уравнительной груши в бюретку, быстро вначале и медленно под конец, чтобы толчком раствора не разбить стекло. Когда поглощение закончится, переводят нерастворенный газ в бюретку и записывают объем газа и температуру бюретки.
Нерастворенный газ принимается за воздух. Объем газа над раствором соли определяют с поправкой на влажность и температуру для сопоставления его с газом в трубке для отбора, находящемся в тех же условиях.
Содержание воздуха вычисляют по формулам, приведенным ниже:
v1 = v
L р
273-\-t'
273 +Г
где V) — объем воздуха в трубке, мл; У2 — объем воздуха в бюретке, . мл; Р — барометрическое давление, мм рт. ст.; р — упругость паров воды над 23%-ным раствором хлористого натрия при температуре t", мм рт. ст.; f — температура трубки при ее заполнении; t" — температура бюретки при измерении объема.
При малом содержании воздуха барометрическое давление на результаты расчета влияет незначительно.
В табл. 17 приведены приближенные значения факто-[р__р 273 4 t' I
----‘ото--77 для Давления от 720 до 760 мм рт. ст. р 273 I' J
248
Таблица 17
Приближенные значения фактора | Р 273+ *' "I L р 273 +1" J
Температура трубки при ее заполнении Г, °C Температура бюретки t”, °C
10 20 30 40
10 0,99 0,95 1 । 0 92 0 85
20 1,02 0,98 0.94 0 88
30 1,06 ; 1.01 0 97 0 91
40 1,10 ; 1,05 1,00 0,94
! (
Вес воздуха, г = Ln X ’ всзд
____________Объем воздуха в трубке, мл_______________ (Объем трубки, мл) — (Объем воздуха в трубке, мл)
Г Вес BF3. г , Вес SO2. г , Вес SiF4, г “ х *т" и- ,
Ln;BF,) ^N(SO2) ^-N<SiF<)
где Ln — плотность соответствующего газа при 0° и 760 мм рт. ст.
Подставив значения плотностей, получают:
Вес воздуха, г = 1,29 х
Объем воздуха в трубке, мл
X —-------------------- X
(Объем трубки, мл) — (Объем воздуха в трубке, мл)
X ((Вес BF3, г-0,325) 4-(BecSO2, г-0,34) 4-
4-(Вес SiFt, г-0,21)|;
Содержание воздуха, о/о = -<в<* воздуха, гМОО-.
Истинный вес образца, г
Определение двуокиси серы
Двуокись серы определяют иодометрически [21, 26, 34, 36]. Раствор иодида-иодата в кислой среде восстанавли< вается до элементарного иода, часть которого при взаи-17 Анализ бора 249
модействии с двуокисью серы переходит в иод-ион по схеме:
KJO8 + 5KJ 4- 6НС1 = 3J2 4- 6КС1 4- ЗН2О;
H2SO8 4- J2 4- Н2О = 2Ш 4- H2SO4.
Избыток выделившегося иода оттитровывают 0,1 н. раствором тиосульфата натрия по реакции
J2 4- 2Na2S2O8 = 2NaJ 4- Na2S4Oe.
Необходимые реактивы
1. Иодисто-иодноватокислый калий, 0,1 н. раствор.
2. Йодистый калий.
3. Серноватистокислый натрий, 0,1 н. раствор.
4. Углекислый натрий.
5. Крахмал, 1%-ный раствор.
Ход анализа. К 5 мл раствора иодида-иодата калия приливают 25 мл воды и 10 мл испытуемого раствора. Выделенный иод титруют 0,1 н. раствором тиосульфата натрия до светло-желтой окраски, прибавляют 1 мл раствора крахмала и продолжают титровать раствором тиосульфата натрия до обесцвечивания раствора.
Содержание двуокиси серы вычисляют по формуле п /ом_loo Vso, * /«)---------------»
где 0,0032— титр 0,1 н. раствора тиосульфата натрия, выраженный в граммах двуокиси серы, г/мл-, V,— объем раствора иодида-иодата калия, израсходованного на анализ, мл; У2 — объем раствора тиосульфата натрия, израсходованного на титрование, мл; Ко — общий объем испытуемого раствора, мл; К. — коэффициент нормальности 0,1 н. раствора тиосульфата натрия; V — объем испытуемого раствора, израсходованного на анализ, мл; с — соотношение объемов 0,1 н. растворов иодида-иодата калия и тиосульфата натрия; п — навеска трехфтористого бора, г.
Содержание серы в виде ее двуокиси определяют по формуле
о /0/х_ QsSoJ%) -----2---•
Точность определения двуокиси серы объемным методом ± 1 % (отн.) [36, 37].
250
Определение серы комппексенометрическнл методом
Метод позволяет определять общее содержание серы путем титрования избыточного количества ионов бария комплексоном III в присутствии комплексоната магния по схеме [38, 39, 40—43]:
ВаС12 + SQ2- = BaSO4 + 2С1~;
ВаС1а + ИД2- = BaY2- + 2НС1.
Необходимые реактивы
I. Аммиак, 25%-ный раствор.
2. Соляная кислота, 0,5 н. раствор.
3. Перекись водорода, 30%-ный раствор.
4. Хлористый барий, 0,1 и. раствор.
5. Буферный раствор, pH 7—8.
6. Хлористый аммоний.
7. Хлористый магний, 10%-ный раствор.
8. Эриохром черный Т.
9. Этиловый спирт, 96%-ный.
10. Комплексон III, 0,05 М и 10%-ный растворы.
Ход анализа. 5—10 мл испытуемого раствора разбавляют 50 мл воды, нейтрализуют аммиаком (1:1) (количество аммиака, необходимого для нейтрализации взятой на анализ части испытуемого раствора, определяют заранее), прибавляют 0,5 мл 0,5 н. раствора соляной кислоты, 2,5 мл перекиси водорода, 10 мл 0,1 н. хлористого бария и кипятят в течение 5—10 мин. После охлаждения раствора прибавляют к нему 10 мл буферного раствора, пять капель раствора эриохрома черного Т и титруют 0,05 М раствором комплексона III до ярко-синей ; окраски раствора.
| Общее содержание серы вычисляют по формуле
л 0 00 6(У,-1М1% 100
Vso6ux < /о)------------------»
Vn
: где 0,0016 — титр 0,05 М раствора комплексона III, вы-' раженный в граммах серы, г!мл-, К,— объем 0,1 н. рас-твора хлористого бария, израсходованного на анализ, мл-, £ Кг— объем 0,05 М раствора комплексона III, израсходо-\ ванного на титрование избытка хлористого бария, мл, i Ко — общий объем испытуемого раствора, мл-, К — объем ' испытуемого раствора, израсходованного на анализ, мл\
251
с — соотношение объемов 0,1 н. раствора хлористого бария и 0,05 М раствора комплексона III; п.— навеска трехфтористого бора. г.
Содержание двуокиси и трехокиси серы вычисляют по следующим формулам:
Qso„ — 2QsSo/> @sso, ~ Ф’обш ^sso2> ^so» = 2°.Qsso>, где —общее содержание серы, %; <?sso. —содержание серы в ее двуокиси, %; Qsgo, —содержание серы в ее трехокиси, %; QSOj—содержание трехокиси серы, %; 2 и 2,5 — пересчетные коэффициенты.
Точность определения ±1% (отн.).
Определение тетрафторида кремния
Метод определения тетрафторида кремния основан на титровании соли кремнефтористоводородной кислоты, образующейся в результате реакций [6, 21, 26, 48]:
3SiF4 + ЗН2О = 2H,SiFe 4- H2SiO3;
2H2SiF6 + H.SiO, + 6NaF = 3Na,SiFe + 3H2O.
Необходимые реактивы
1. Фтористый натрий.
2. Соляная кислота, 0,5 и 0,1 н. растворы.
3. Этиловый спирт, 96%-ный.
4. Едкий натр, 0,5 и 0,1 н. растворы.
5. Фенолфталеин, 0,1%-ный спиртовой раствор.
Ход а н а л и з а. В платиновую чашку помещают I г фтористого натрия, добавляют 10—20 мл испытуемого раствора, 5 мл 0,5 н. раствора соляной кислоты, 5 мл воды, ставят на водяную баню и, помешивая палочкой из плексигласа, после растворения фтористого натрия выпаривают досуха. Прибавляют 20 мл этилового спирта и 10 мл воды. Растворяют остаток при помешивании, прибавляют пять капель фенолфталеина и дают раствору стоять в течение 5—10 мин. Титруют 0,5 н. раствором едкого натра до появления ярко-розовой окраски, не исчезающей в течение 30 мин. Уточняют точку нейтрализации, для чего по каплям прибавляют 0,1 н. раствор соляной кислоты до исчезновения розовой окраски. Затем добавляют по каплям 0,1 н. раствор едкого натра до появления розовой окраски, устойчивой в течение 15 сек,. 252
Этим титрованием пренебрегают, так как оно проводится для нейтрализации кислого NaHFj, образующегося в результате взаимодействия соляной, борной и тетрафторборной кислот с фтористым натрием.
Содержимое чашки переносят в колбу Эрленмейера емкостью 250 мл, чашку смывают горячей водой, свободной от углекислоты, и доводят объем до 100 мл этой'же водой (удобнее брать заранее отмеренный объем воды в количестве 100 мл). Растворяют осадок при нагревании почти до кипения (до появления первого пузырька), прибавляют 10 капель фенолфталеина и титруют 0,1 н. раствором едкого натра до появления розовой окраски раствора, устойчивой в течение 15 сек. Параллельно ведут «холостой» опыт с 5 мл воды.
Содержание тетрафторида кремния вычисляют по формуле
п zn/. 0,0026 -V2) KV0 100
Vn
где 0,0026 — титр 0,1 н. раствора едкого натра, выраженный в граммах тетрафторида кремния, г)мл; К. — коэффициент нормальности 0,1 н. раствора едкого натра; Vi — объем 0,1 н. раствора едкого натра, израсходованного на титрование, мл; У2— объем 0,1 н. раствора едкого натра, израсходованного на титрование «холостой» пробы, мл; Vo — общий объем испытуемого раствора, мл; V — объем испытуемого раствора, израсходованного на анализ, мл; п—навеска трехфтористого бора, г.
Точность объемного определения тетрафторида кремния ±1% (отн.).г
Определение бэра и фтора объемным методом
Бор в трехфтористом боре определяют объемным методом в виде борной кислоты, которая количественно титруется в присутствии маннита по фенолфталеину [35—37].
Трехфтористый бор при взаимодействии с водой наряду с борной кислотой образует борфтористоводородную кислоту [2], анион которой BF7 разлагается с образованием борной кислоты и ионов водорода по реакциям [2, 16, 17, 21]:
4BF3 -Ь ЗН,0 = Н3ВО3 4- 3HBF4;
BF7 4- 2Са2+ 4- ЗН2О = Н3ВО3 4- 2CaF2 4- ЗН+.
18 Анализ бора 253
По методу нейтрализации образующейся сильной кислоты раствором едкого натра определяют содержание фтора в трехфтористом боре.
Необходимые реактивы
1. Едкий натр, 0,1 и 0,5 н. растворы.
2. Хлористый кальций, 25%-ный раствор.
3. Маннит.
4. Фенолфталеин, 0,1%-ный спиртовой раствор.
5. Метиловый красный, 0,1%-ный раствор.
Ход анализа. К 5 мл испытуемого раствора прибавляют 10—15 мл раствора хлористого кальция, нейтрализованного по метиловому красному, и нейтрализуют 0,5 н. раствором едкого натра. Объем (1) едкого натра, израсходованного на нейтрализацию, записывают. Кипятят пробу в течение часа с обратным холодильником. Охлаждают раствор до комнатной температуры, смывают холодильник дистиллированной водой и нейтрализуют раствор сначала 0,5 н„ а затем 0,1 н. раствором едкого натра. Объемы 0.5 и 0,1 н. растворов едкого натра (2), израсходованного на нейтрализацию, также записывают. По сумме объемов (1+2) едкого натра, израсходованного на нейтрализацию, определяют содержание фтора по приведенной ниже формуле.
К раствору прибавляют маннит, 5—10 капель фенолфталеина и титруют 0,1 н. раствором едкого натра до появления розовой окраски раствора, не исчезающей от последующего прибавления маннита.
Содержание бора и фтора определяют по формулам:
/оМ_ Т’МЛУо-ЮО.
обиЛ /о) ---,
О.ОЭЮК^.'-У'По-ЮО (%) =ь--------;
Qfbf, (%) = Qfo6iu (%) - Qfsif< (%);
6.25nQsV
= Vo ’
где T — титр 0,1 н. раствора едкого натра, выраженный в граммах бора с учетом коэффициента обогащения трехфтористого бора изотопом В10, г/мл-, К—коэффициент нормальности 0,1 н. раствора едкого натра; Vi — объем 0,1 н. раствора едкого натра, израсходованного на титро-254
вание, мл; Vo — общий объем испытуемого раствора, мл; V — объем испытуемого раствора, израсходованного на анализ, мл; п — навеска, г; 0,0019 — титр 0,1 н. раствора едкого натра, выраженный в граммах фтора, г/мм; V, — объем 0,1 н. раствора едкого натра, израсходованного на нейтрализацию (объемы 1 +2), мл; V' — объем 0,1 н. раствора едкого натра, израсходованного на нейтрализацию серной кислоты, образовавшейся из окислов серы, мл; 6,25 — пересчетный коэффициент; Qs — общее содержание серы в испытуемом растворе, %; Qfo6u( — общее содержание фтора, %; QfBFs — содержание фтора в трехфтористом боре, %; QfS[F4 — содержание фтора в тетрафториде кремния, %.
Определив соотношение объемов раствора едкого натра, израсходованного на нейтрализацию и титрование, и содержание бора и фтора, находят содержание триоксифторида бора и трехфтористого бора. Представив оксифторид бора в виде BF3 • В2О3, где соотношение В : О :
: F = 1 : 1,48: 1,76, и определив содержание бора без учета его в В20з (по уравнению Qb(%) = 0,19 QfBFs), вычисляют содержание оксифторида бора и трехфтористого бора с помощью пересчетных коэффициентов 1; 1,48 и 1,76.
Определение фтора весовым методом
Фтор вдовым методом определяют в виде фторида кальция, образующегося в результате разложения иона BF4- путем кипячения его с хлористым кальцием, йодистым калием, хлорноватокислым калием и метаванадатом калия [2, 16, 21, 23].
Необходим ые реактивы
1. Метаванадат калия, 0,1 М раствор.
2. Хлорноватокислый калий (КСЮз).
3. Йодистый калий.
4. Хлористый кальций, 25%-ный раствор.
5. Раствор А, представляющий собой 0,5—1 М раствор по хлористому кальцию, 0,04 М по хлорноватокислому калию и 0,24 М по иодистому калию.
Ход а н а л и з а. К 50 мл раствора А приливают 5 мл испытуемого раствора, 0,15 мл 0,1 М раствора метаванадата калия и кипятят в течение часа в стакане емко-18* 255
стью 500 мл, поддерживая объем раствора постоянным путем периодического добавления воды. Фильтруют теплый раствор, осадок промывают горячей водой, насыщенной фтористым кальцием, сушат, прокаливают и взвешивают. Содержание фтора вычисляют по формуле
,п/, 0.4872а1/о-100
общ'7"' уп 1
где 0,4872 — пересчетный коэффициент с фтористого кальция на фтор; а— вес осадка фтористого кальция, г; Vo — общий объем испытуемого раствора, мл; V — объем испытуемого раствора, израсходованного на анализ, мл; п — навеска, г.
Точность весового определения фтора ±0,5% (отн.). На практике фтор в трехфтористом боре определяют чаще по методу нейтрализации.
4. Анализ треххлористого бора
Единственным методом анализа треххлористого и трехбромистого бора является их гидролиз с образованием кислот, содержание которых определяют описанными в литературе методами (5, 32, 33, 36, 49].
При синтезе треххлористого бора последний загрязняется такими примесями, как хлор, тетрахлорид кремния, фосген и хлориды металлов [5].
Бор определяют в виде борной кислоты (см. п. 3 настоящей главы) и по результатам этого определения вычисляют содержание треххлористого бора по приведенной ниже формуле. Контролем чистоты треххлористого бора может также служить определение общего хлора, осуществляемого методом Фольгарда [34, 35, 37, 48] или методом нейтрализации сильной кислоты.
Свободный хлор в треххлористом боре определяют иодометрически [50].
Определению фосгена в литературе посвящено несколько работ [51—57]. Но все эти методы позволяют определять фосген лишь при отсутствии хлора, хлористого водорода и других примесей. В присутствии перечисленных примесей фосген определяют методом [52], основанным на взаимодействии фосгена с гексаметиленимином и последующем титровании избытка гексаметиленимина после отгонки его с водой из щелочного раствора.
256
Используя свойство фосгена [58] разлагаться нацело при 800° на хлор и окись углерода, определение фосгена можно осуществить следующим образом. Известное количество треххлористого бора пропустить через нагретую до 800° трубку, выделившийся хлор поглотить раствором йодистого калия, избыток иода оттитровать раствором тиосульфата натрия и вычислить общее содержание элементарного хлора, а по разности последнего со свободным хлором — содержание хлора в фосгене. Анализ технического треххлористого бора на содержание фосгена [59] показал, что расхождение между параллельными пробами не превышает 0,2%.
При определении тетрахлорида кремния в треххлористом боре авторы настоящей книги используют объемный метод определения тетрафторида бора, описанный в данной главе.
Определение бора
Бор определяют в виде борной кислоты (см. п. 3 настоящей главы), исключив добавление хлористого кальция к раствору и кипячение.
Вычисляют содержание треххлористого бора по формуле
П /0/\_ 0.01172ЛТгУ0-100 Vbci,v/o)~ Vn .
где 0,01172 — количество треххлористого бора, соответствующее 1 мл 0,1 н. раствора едкого натра, г/мл‘, К — коэффициент нормальности 0,1 н. раствора едкого натра; Vi — объем 0,1 н. раствора едкого натра, израсходованного на титрование борной кислоты, мл; Vo — общий объем испытуемого раствора, мл; V — объем испытуемого раствора, израсходованного на анализ, мл; п — навеска, г.
Определение свободного хлора
Определение свободного хлора основано на выделении хлором свободного иода из йодистого калия и оттитровывании последнего 0,1 н. раствором тиосульфата натрия по реакциям [50]:
J- + 3CI2 + ЗН8О = JO3- + 6С1- 4- 6Н+;
257
J07 + 5J- + 6Н+ = 3 J2 + ЗН2О;
J2 4" 2N32S2O3 = 2NaJ 4“ Na2S,jOg.
Необходимые реактивы
1. йодистый калий, 10%-ный раствор.
2. Серноватистокислый натрий, 0,1 н. раствор.
3. Едкий натр, 0,1 и 0,5 н. растворы.
4. Соляная кислота, 0,1 н. раствор.
5. Крахмал, 1%-ный водный раствор.
Ход анализа. К 10 мл раствора йодистого калия приливают 30—40 мл воды и 10 мл испытуемого раствора. Выделившийся иод титруют 0,1 н. раствором тиосульфата натрия до бледно-желтой окраски раствора, прибавляют 1 мл раствора крахмала и продолжают титрова-вание до обесцвечивания раствора.
Содержание свободного хлора * вычисляют по формуле
п _ 0,00355/0/^.100
где 0,00355 — титр 0,1 н. раствора тиосульфата натрия, выраженный в граммах хлора, г!мл; К—коэффиииент нормальности 0,1 н. раствора тиосульфата натрия; Vj — объем 0,1 н. раствора тиосульфата натрия, израсходованного на титрование выделившегося иода, мл; Уо — общий объем испытуемого раствора, мл; V — объем испытуемого раствора, израсходованного на анализ, мл; п— навеска треххлористого бора, г.
Точность определения ±1% (отн.).
Определение тётрахлорида кремния
Содержание тетрахлорида кремния определяют методом, описанным в п. 3 данной главы, и вычисляют по формуле
П fo/\- O,00478K(V1-V4Vo100
VsiciJ/o)- Vn
* Если после определения -свободного хлора раствор нейтрализовать по метиловому красному сначала 0,5 н., а затем 0,1 н. раствором соляной кислоты и 0,1 н. раствором едкого натра, то, прибавив маннит и фенолфталеин, можно оттитровать борную кислоту, как описано в п. 3 данной главы.
258
где 0,00478 — титр 0,1 н. раствора едкого натра, выраженный в граммах тетрахлорида кремния, г/мл; К.— коэффициент нормальности 0,1 н. раствора едкого натра; Vi —!• объем 0,1 н. раствора едкого натра, израсходованного \На титрование испытуемого раствора, мл; V2— объем 0,1 н. раствора едкого натра, израсходованного на титрование «холостого» опыта, мл; Vo — общий объем испытуемого раствора, мл; V — объем испытуемого раствора, израсходованного на анализ, мл; п—навеска треххлористого бора, г.
Определение общего хлора
Определение общего хлора осуществляется по методу Фольгарда, в котором избыток раствора азотнокислого серебра титруют раствором роданистого аммония в присутствии железоаммонийных квасцов как индикатора по реакциям [35]:
Cl- + AgNO3 = AgCl + NO7;
AgNO3 + NH4CNS = AgCNS 4- NH+'+ NO;
Необходимые реактивы
1. Азотнокислое серебро, 0,1 н. раствор.
2. Железоаммонийные квасцы, насыщенный раствор.
3. Роданистый аммоний, 0,1 н. раствор.
Ход анализа. К 10 мл испытуемого раствора приливают 20 мл 0,1 н. раствора азотнокислого серебра и 1—2 мл раствора железоаммонийных квасцов. Избыток ионов серебра оттитровывают 0,1 н. раствором роданистого аммония до появления оранжево-красной окраски-раствора, не исчезающей при сильном перемешивании.
Содержание общего хлора вычисляют по формуле
Qa(o/O) = п.ООЗббХ^-^УоЮО t
где 0,00355 — титр 0,1 н. раствора роданистого аммония, выраженный в граммах хлора, г/мл; К — коэффициент нормальности раствора роданистого аммония; Vi — объем 0,1 н. раствора азотнокислого серебра, израсходованного на анализ, мл; И2— объем 0,1 н. раствора роданистого аммония, израсходованного на титрование, мл; Vo — общий объем испытуемого раствора, мл; V—объем испытуемого раствора, израсходованного на анализ, мл; п— навеска треххлористого бора, г.
Точность метода ± 1 % (отн.).
5. Анализ трехбромистого бора
Примесями бромида бора могут быть элементарный бром, четырехбромистый кремний и бромиды различных металлов [5]. /
В последние годы получил развитие метод невидного титрования [60], рекомендуемый авторами работы [61] для кондуктометрического титрования органических оснований трехбромистым бором в неводном растворителе. Реакцию взаимодействия между органическим основанием и трехбромистым бором, растворенным в неводном растворителе (нитробензоле, тиониле хлористом и тиофосфориле хлористом), можно рекомендовать для определения трехбромистого бора, поскольку эта реакция протекает стехиометрически [61]:
//\ S\ //\ //\
+ * + ]
W
NO2 N N NO2
ВВг3 ВВг8
Сложность определения состоит в том, что необходимо применять безводные хорошо очищенные препараты (трехбромистый бор, пиридин, нитробензол) и проводить титрование в сухой инертной атмосфере, что трудно осуществить в случае анализа технического трехбромистого бора.
Содержание составных компонентов трехбромистого бора определяют описанными ранее методами: бор— объемным методом (см. настоящую главу); бром — методом Фольгарда или методом нейтрализации сильной кислоты; бром свободный — иодометрически, как описано при определении свободного хлора.
Содержание трехбромистого бора, брома общего и свободного вычисляют по формулам:
л /оМ_ 0.0251 W„-100 .
УввгЛ/о) ’>
П ,0/._ 0.008^ (V,'-V2)V0.100
/о)------------—----------;
260
\ О 008K2V? Vft100
<?»„(%) =-------
где о\о251 —титр 0,1 н. раствора едкого натра, выраженный ц граммах трехбромистого бора, г/мл; К—коэффициент нормальности раствора едкого натра; Vi — объем 0,1 н. раствора едкого натра, израсходованного на титрование борной кислоты, мл; Vo — общий объем испытуемого раствора, мл-, V — объем испытуемого раствора, израсходованного на анализ, мл; п—навеска трехбромистого бора, г; 0,008 — титр раствора роданистого аммония выраженный в граммах брома, г!мл; К\ — коэффициент нормальности раствора роданистого аммония; V,' — объем 0,1 н. раствора азотнокислого серебра, израсходованного на анализ, мл; V2 — объем 0,1 н. раствора роданистого аммония, израсходованного на титрование, мл; 0,008 — титр 0,1 н. раствора тиосульфата натрия, выраженный в граммах бора, г/мл; К2— коэффициент нормальности раствора тиосульфата натрия; У[ — объем 0,1 н. раствора тиосульфата натрия, израсходованного на титрование иода, мл.
6. Приготовление реактивов
Приготовление 0,1 н. растворов азотнокислого серебра, тиосульфата натрия, роданистого аммония, хлористого бария подробно описано в соответствующей литературе [62].
Иодид-иодат калия, 0,1 н. раствор. 3,567 г иодид-иода-та калия и 40 г иодида калия растворяют в воде и доводят объем до 1 л. Титр устанавливают по 0,1 н. раствору тиосульфата натрия [36]. Для этого к 10 мл раствора иодид-иодата калия приливают 10 мл 0,1 н. раствора соляной кислоты и титруют 0,1 н. раствором тиосульфата натрия до бледно-желтой окраски раствора, прибавляют 1—2 мл раствора крахмала и продолжают титрование до обесцвечивания раствора. Коэффициент нормальности раствора иодид-иодата калия вычисляют по формуле
где Ki — коэффициент нормальности 0,1 н. раствора тиосульфата натрия; Vi— объем 0,1 н. раствора тиосульфа-
261
та натрия, израсходованного на титрование, мл; V— объем 0,1 н. раствора иодид-иодата калия, израсходованного на титрование, мл.
Раствор А. 2,45 г хлорноватокислого калия, 19,92 г йодистого калия и 250 мл 25%-ного раствора хлористого кальпия смешивают, растворяют в воде и доводят объем до 500 мл [2, 26].
Буферный раствор, pH 7—8. 8,28 г хлористого аммония растворяют в ИЗ мл концентрированного аммиака и разбавляют водой до 900 мл. Затем 10 мл 10%-ного раствора хлористого магния разбавляют 40 мл воды, прибавляют 10 мл буферного раствора, пять капель индикатора и титруют приблизительно 10%-ным раствором комплексона III до ярко-синей окраски раствора. Оттитрованный раствор прибавляют ко всему количеству буферного раствора и доводят его объем до 1 л.
Литература
1. Некрасов Б. В. Kvpc общей химии. М., Госхимиздат, 1954.
2. Р ы с с И. Г. Химия фтора и его неорганических соединений. М., Госхимиздат, 1956.
3. Фтор и его соединения. Перев. с англ. Под ред. Саймонса. М., Изд-во иностр, лит., 1953.
4. Никитина Е. А. «Успехи химии», 15, 707 (1946).
5. С а м с о н о в Г. В. и др. Бор, его соединения и сплавы. Киев, Изд-во АН УССР, 1960.
6. Б у з Г., Мартин Д. Химия трехсЬтористого бора и его производных. М., Изд-во иностр лит., 1955.
7. Топчиев А. В., Паушкин Я. М. «Успехи химии», 16, 664 (1947).
8. Топчиев А. В., Завгородний С. В. Фтористый бор и его соединения как катализаторы в органической химии. М., Изд-во АН СССР 1956
9 М i 1 Ге г N. Nature, 158, 950 (1946).
10. McKeura F. Е. Nucleonics 9, No. 8, 24 (1951); No. 9, 40 (1951).
11. Melton С. E. et al. Analyt. Chem., 28, 1049 (1956).
12. Th ode H. G. et al. J. Amer. Chem. Soc., 70. 3008 (1948).
13. Рысс И. Г. и др. «Ж. физ. химии», 22, 1322 (1948).
14 Рысс И. Г. «Докл. АН СССР», 52, 421 (1946).
15. Рысс И. Г., Слуцкая М. М. «Докл. АН СССР», 57, 689 (1947).
16. Рысс И. Г. «Ж. общ. хим», 16, 531 (1946).
17. Рысс И. Г. «Заводск. лаборатория», 12, 651 (1946).
18. Lange W. Вег., 59, 2432 (1926).
19. Б е р к о в и ч В. Л., К у л я ш о в а Ю. В. «Ж. прикл. химии», 10, 192 (1937).
20. Shaare Н. G., Wagner W. Z. analyt. Chem., 146, 326 (1955). 262
21. Swinehart C. et al. Analyt Chem., 19, 28 (1947).
22. F\bi с с И. Г., Полякова E. M. «Ж. общ. химии», 18, 286 (1948).
23. P ы с с И. Г., Полякова Е. М. «Ж. общ. химии», 19, 1956 (1949).
24. Рысс И. Г. «Ж. неорган. химии», 2, 2716 (1957).
25. Рысс И. Г., Писа ржевская Н. П. «Докл. АН СССР», 87, 995 (1952).
26. Соколова А. Л. и др. Сборник методик по проведению полного химического анализа трехфтористого бора, элементарного бора и промывных вод бора (в печати).
27. Ballcze Н. Hod os М. Z. analyt. Chem., 168, 161 (1959).
28. С i с а г a A. et al. Ind. usoara, 5, 255 (1953).
29. Гольд и нов А. Л. и др. «Ж. аналит. химии», 13, 583 (1958).
30. Hell riegel W. Вег., 70, 689 (1937).
31. Baumgarten Р., Bruns W. Вег., 72, 1753 (1939).
32. И в а н о в-Э мин Б. Н. и др. «Ж. неорган. химии», 34, 2378 (1961).
33. Креч Э. И., Захарченко Н. Е. «Ж. прикл. химии», 13, 846 (1940).
34. Т а н а н а е в Н. А. Объемный анализ. Свердловск — Москва. ГОНТИ —НКИТ, СССР, 1939.
35. К о л ь т г о ф И. М., С е н д е л Е. Е. Количественный анализ. М., Госхимиздат, 1948.
36. Анализ минерального сырья. Сб. методов хим. анализа. Под ред. Ю. Н. Книпович и Ю. В. Морачевского. Л., Госхимиздат, 1956.
37. Г и л л е б р а н д В. Ф. и др. Практическое руководство по неорганическому анализу. М., Госхимиздат, 1957.
38. Пршибил Р. Комплексоны в химическом анализе. М., Изд-во иностр, лит., 1960.
39. Пршибил Р. Комплексоны в химическом анализе. М., Изд-во иностр, лит., 1955.
40. М я к и н а Н. Б. «Почвоведение», 8, 96 (1960).
41. Ashbrook A., Ritsey G. Analyst, 86, 740 (1962).
42. Kalman F. Bdr-es cipotechn., 11, 20 (1961).
43. Ceausescu D. Studii si cercetari stinnt. Acad. RPR, Basa Timisoara, Ser. Stiinte Cheim., 5, 77 (1958).
44. G i 1 k e у W. K. et al. Industr. and Engng Chem., Analyt. Ed., 8, 150 (1936).
45. Gilliam O. R. et al. Phys. Rev., 75, 1014 (1949).
46 • P ы с с И. Г., Я т л о в В. С. Авт. свид. 30268, 3692.
47. Armand М., Berth cux J. Analyt. chim. acta, 8, 510 (1953).
48. Кольтгоф И. М., Стенгер В. А. Объемный анализ. М., Госхимиздат, 1952.
49 S с h u е 1 е W. et al. Analyt. Chem., 28, 505 (1956),
50. Кольтгоф И. М. и др. Объемный анализ. М., Госхимиздат, 1961.
51. Berolzheimer D. D. Industr. and Engng Chem., 11, 263 (1919).
52. Терентьев А. П. и др. «Ж. аналит. химии», 16, 743 (1961).
53. Методы качественных и количественных определений отравляющих веществ армий империалистических стран. М., Оборонгиз, 1955.
263
54. Ohlweiler О. A. et al. Chim. analyt, 41, 94 (1959).
55. M a t u s z а к M. P. Industr. and Engng Chem., Analyt. Ed., 6, 457 (1934).
56. J a n t W. P. et al. Industr. and Engng Chem., Analyt. Ed., 8, 20 (1936).
57. Olsen J. O., Ferguson G. E. Industr. and Engng Chem., Analyt. Ed., 3, 189 (1931).
58. Ч и ч и б а б и н А. Е. Основные начала органической химии. Т. 1. М. — Л., Госхимиздат, 1953, стр. 733.
59. Антонов И. С. и др. «Завод, лаборатория», 7, 809 (1963).
60. Ш а н т и Р. Палит и др. Неводное титрование. М., Госхимиздат, 1958.
61. Hazel J. F., McNabb W. М. Analyt. chim. acta, 15, 187 (1956).
62. С у с л e н н и к о в а В. М., Киселева Е. К. Руководство по приготовлению титрованных растворов. Л., Госхимиздат, 1962.
ОГЛАВЛЕНИЕ
Предисловие .......................................... 3
Глава I. Методы определения борной кислоты.............. 5
1. Введение ................................... 5
2. Объемные методы определения борной кислоты ..... 9
Визуальное титрование ............................. 9
Потенциометрический метод определения борной кислоты ......................................... 14
Амперометрическое титрование ..................... 20
3. Методы отделения борной кислоты от мешающих примесей ....................................... 22
Отделение железа (111), никеля, хрома, титана и марганца 20%-ным раствором едкого натра ......... 30
Отделение цинка, свинца, алюминия, железа и никеля в виде оксихинолятов ............................ 31
Отделение кремния в виде геля .................... 32
Отделение аммония, кальция, магния, железа (II и III), алюминия, никеля, меди (II), титанатов и молибдатов при помощи катионита КУ-2........................ 33
4. Приготовление реактивов ....................... 35
Литература .................................... 37
Глава II. Качественные реакции и определение малых количеств бора ........................................ 42
1. Качественное обнаружение бора .................. 42
Определение бора по окрашиванию пламени ......... 42
Определение бора в присутствий солей меди (II) и бария ...................................... 43
Определение бора в виде фторида бора ............. 43
Определение бора с куркумовой бумагой ............ 44
Определение бора при помощи раствора куркумина ... 44
Определение бора с кармином ...................... 45
Обнаружение бора в силикатных рудах методом растирания ...................................... <5
2. Определение малых количеств бора в различных неорганических соединениях ......................... 45
Объемное определение бора* в сталях и сплавах..... 54
Анализ углеродистых сталей ...................... 54
265
Анализ сталей, содержащих алюминий, вольфрам «и ванадий ........................................... 56
Анализ жаропрочных сплавов ........................ 56
Анализ алюминиевых сплавов ........................ 57
3. Объемное определение бора в фосфатных и комплексных удобрениях .................................... 58
4. Определение бора в сталях и сплавах колориметрическим методом с хинализарином .................... 61
5. Колориметрическое определение бора в фосфатных и комплексных удобрениях, в растениях и почвах с применением антримида ................................ 63
Определение бора в фосфатных и комплексных удобрениях ........................................ 63
Определение бора в растениях ..................... 64
Определение бора в почвах ........................ 65
6. Колориметрическое определение бора в металлическом алюминии с применением аиетилхинализарина ......... 66
7. Определение бора в борсуперфосфатах с применением кармина ........................................... 67
8. Определение бора в тетрафториде урана с метиленовым голубым...................................... 68
9. Определение бора в стали с бриллиантовым зеленым 70
10. Определение бора в различных видах минерального сырья с кристаллическим фиолетовым ................. 71
И. Определение бора в кремнии и тетраиодиде кремния с применением куркумина............................. 74
Определение бора в кремнии ........................ 75
Определение бора в тетраиодиде кремния ............ 76
12. Капельный метод определения микроколичеств бора в кремнии ........................................ 77
13. Колориметрическое определение бора с Я-резорцином 78
14. Определение бора спектральным методом .......... 79
15. Приготовление реактивов ........................ 81
Литература ......................................... 82
Глава III. Анализ элементарного бора...................... 87
I. Введение ........................................ 87
2. Отбор пробы, измельчение, усреднение .......... 100
3. Определение влаги.............................. 102
4. Определение активного бора цериметрическим методом ................................................105
5. Перйодатный и йодатный методы определения элементарного бора .................................. 106
6. Персульфатный метод определения элементарного бора 108
7. Определение элементарного бора методом окисления азотной кислотой ................................ ИО
8. Определение углерода ........................... 1И
9. Определение серы .............................. 115
10. Определение калия и натрия .................... 115
Определение калия и натрия методом фотометрии пламени ....................................... 117
Тетрафенилборатный метод определения калия ....... 123
Определение натрия (объемный и весовой методы) ... 124
266
11. Определение кремния, железа, алюминия, никеля, кальция, магния без удаления борной кислоты ......... 127
Определение кремния ............................. 129
Определение железа .............................. 130
Определение алюминия ............................ 131
Определение никеля .............................. 131
Определение кальция ............................. 133
Определение магния .............................. 134
12. Колориметрическое определение меди, никеля, железа, алюминия, кальция, магния и кремния ................ 136
Определение меди, никеля и железа ................ 136
Определение алюминия ........................... 146
Определение кальция ............................ 148
Определение магния ............................. 152
Определение кремния ............................ 154
13. Определение примесей спектральным методом .... 157
14. Определение удельной поверхности порошков бора ... 161
15. Приготовление реактивов ....................... 164
Литература ........................................ 168
Глава IV. Анализ боридов
173
1. Введение ................................ ... 173
2. Анализ боридов редкоземельных элементов .........
Определение редкоземельных элементов ...............
Определение общего бора ............................
Определение общего углерода ........................
3. Анализ борида тантала ...........................
Определение бора ...................................
Определение тантала ................................
4. Анализ борида хрома .............................
Определение общего бора ............................
Определение хрома ..................................
Определение свободного бора ........................
Определение общего углерода ........................
5. Анализ борида никеля ............................
Определение никеля .................................
Определение бора ...................................
6. Анализ борида меди ..............................
Определение меди ..................................
Определение бора ..................................
7. Анализ борида железа (ферробора) ................
Определение железа ..............................•
Определение бора ..................................
8. Анализ борида марганца .........................
Определение марганца ..............................
Определение бора ..................................
9. Анализ борида рения.............................
Определение рения .................................
Определение бора ..................................
Определение углерода ..............................
10. Анализ смешанных боридов рения и редкоземельного элемента ...........................................
Определение рения .................................
179
179
180
181
181
181
181
182
182
182
183
184
184
184
185
185
185
185
186
186
187
188
188
189
189
189
190
191
191
191
267
АНАЛИЗ БОРА
И ЕГО НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ