Author: Дурнов Л.А. Голдобенко Г.В.
Tags: онкология медицина педиатрия
ISBN: 5-225-04639-9
Year: 2002
Text
Д.А.Дурнов, Г.В.Голдобенко
ДЕТСКАЯ
ОНКОЛОГИЯ
Учебная
литература
для студентов
медицинских
вузов
Учебная литература
для студентов медицинских вузов
Л.А.Дурнов, Г.В.Голдобенко
ДЕТСКАЯ
ОНКОЛОГИЯ
Издание второе,
переработанное и дополненное
Допущен Департаментом образовательных
медицинских учреждений и кадровой политики
Министерства здравоохранения Российской
Федерации в качестве учебника для студентов
медицинских вузов
Москва
'Медицина1
2002
Дурнов Л. А., Голдобенко Г. В.
Д84 Детская онкология: Учебник. — 2-е изд., перераб. и
доп. — М.: Медицина, 2002. — 608 с.: ил.: [2] л. ил. (Учеб,
лит. Для студентов медицинских вузов) ISBN 5-225-04639-9
Второе издание учебника (первое вышло в 1997 г.) расширено и переработано с учетом последних достижений медицины в организации лечебного процесса в стационаре и детской поликлинике. Подробно освещены важнейшие разделы детской онкологии, клиника, диагностика (с
учетом новейших методов исследования), лечение и профилактика злокачественных и ряда доброкачественных опухолей у детей. Представлены современные схемы проведения химиотерапии. Большое внимание
уделено психологии общения врача и больного.
Для студентов медицинских вузов.
ББК 55.6
ISBN 5-225-04639-9 © Л. А. Дурнов,
Г. В. Голдобенко, 2002
Все права авторов защищены. Ни одна часть этого издания не может быть занесена в память компьютера либо воспроизведена любым способом без предварительного письменного разрешения издателя.
АВТОРСКИЙ КОЛЛЕКТИВ
ДУРНОВ
Лев Абрамович
ГОЛДОБЕНКО
Генрих Витальевич
АКСЕЛЬ
Евгения Мильевна
БЕЛКИНА
Белла Моисеевна
БОЙЧЕНКО
Елена Игоревна
БОНДАРЬ
Игорь Витальевич
ГОРДИНА
Галина Андреевна
ИВАНОВА
Надежда Михайловна
КИСЕЛЕВ
Александр Владимирович
КОШЕЧКИНА
Наталья Анатольевна
МАХОНОВА
Лидия Алексеевна
МАЛКОВА
Светлана Александровна
НЕЧУШКИНА
Инесса Викторовна
ПАШКОВ
Юрий Викторович
академик РАМН, заслуженный деятель
науки РФ, директор НИИ ДО РОНЦ
им. Н.Н.Блохина РАМН
заслуженный деятель науки РФ,
профессор
д.м.н., ведущий научный сотрудник
РОНЦ им. Н.Н.Блохина РАМН
д.м.н., ведущий научный сотрудник
НИИ ДО РОНЦ им. Н.Н.Блохина
РАМН
к.м.н., доцент кафедры детской
онкологии РМАПО
главный детский онколог М3 РФ,
зам. директора НИИ ДО РОНЦ им.
Н.Н.Блохина РАМН
д.м.н., ведущий научный сотрудник
НИИ ДО РОНЦ им. Н.Н.Блохина
РАМН
к.м.н., ведущий научный сотрудник
НИИ ДО РОНЦ им. Н.Н.Блохина
РАМН
д.м.н., зав. отделением химиотерапии
злокачественных лимфом НИИ ДО
РОНЦ им. Н.Н.Блохина РАМН
профессор, руководитель отдела
лучевой диагностики НИИ ДО РОНЦ
им. Н.Н.Блохина РАМН
профессор, ведущий научный
сотрудник НИИ ДО РОНЦ
им. Н.Н.Блохина РАМН
профессор, зав. отделением
химиотерапии лейкозов НИИ ДО
РОНЦ им. Н.Н.Блохина РАМН
ученый секретарь НИИ ДО РОНЦ
им. Н.Н.Блохина РАМН
профессор, ведущий научный
сотрудник НИИ ДО РОНЦ
им. Н.Н.Блохина РАМН
3
ПОЛЯКОВ
Владимир Георгиевич
ПЫХОВ
Михаил Иванович
САЛТАНОВ
Александр Иосифович
СУСУЛЕВА
Наталья Александровна
ЧЕРВОНОБАБ
Юрий Владимирович
ЧЕРНОВА
Наталья Владимировна
П1АРОЕВ
Тимур Ахмедович
профессор, зам. директора НИИ ДО
РОНЦ им. Н.Н.Блохина РАМН
д.м.н., декан педиатрического
факультета РМАПО
член-корр. РАМН, профессор,
зав. отделением анестезиологии,
реанимации и интенсивной терапии
НИИ ДО РОНЦ им. Н.Н.Блохина
РАМН
к.м.н., доцент кафедры детской
онкологии РМАПО
к.м.н., ведущий научный сотрудник
НИИ ДО РОНЦ им. Н.Н.Блохина
РАМН
к.м.н., старший научный сотрудник
НИИ ДО РОНЦ им. Н.Н.Блохина
РАМН
профессор кафедры детской онкологии
РМАПО
ОГЛАВЛЕНИЕ
Авторский коллектив 3
Предисловие к первому изданию 8
Предисловие ко второму изданию 10
Часть I. ОБЩАЯ ОНКОЛОГИЯ 11
Глава 1. Особенности детской онкологии. — Л. А. Дурнов 11
1.1. История детской онкологии 11
1.2. Эпидемиология опухолей у детей 13
1.3. Этиология опухолей у детей 16
1.4. Генетика опухолей у детей 18
1.5. Структура злокачественных новообразований у детей 20
1.6. Особенности лечения опухолей у детей 24
1.7. Особенности обезболивания и интенсивной терапии у детей. —
А. И. Салтанов 28
Глава 2. Статистика злокачественных новообразований у детей. —
Е. М. Аксель, И. В. Бондарь 78
Глава 3. Основные принципы диагностики злокачественных опухолей у детей. — Ю. В. Пашков 92
3.1. Общие методы обследования ребенка 96
3.2. Лучевая диагностика. — М. И. Пыхов, Н. А. Кошечкина. ... 104
3.3. Морфологические методы исследования 127
Глава 4. Общие принципы лечения опухолей у детей. —
Ю. В. Пашков 130
4.1. Хирургическое лечение 133
4.2. Лучевая терапия 136
4.3. Лекарственное лечение 139
Глава 5. Организация онкологической помощи детям России. —
И. В. Бондарь 145
Глава 6. Деонтология и реабилитация. — Л. А. Дурнов 162
Часть II. ЧАСТНАЯ ОНКОЛОГИЯ 172
Глава 7. Лейкозы у детей. — С. А. Майкова 172
7.1. Острый лейкоз 172
7.2. Хронический миелолейкоз 183
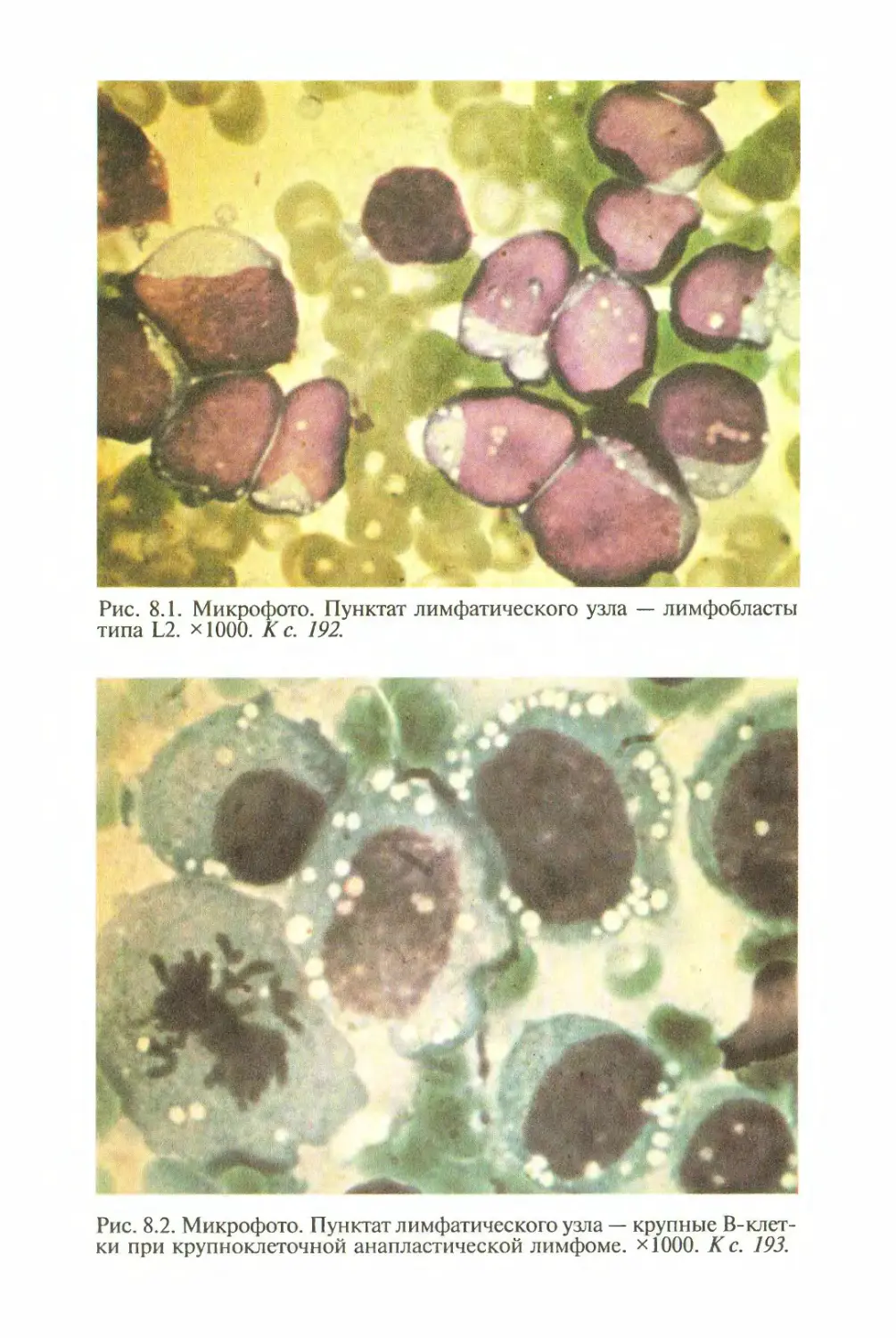
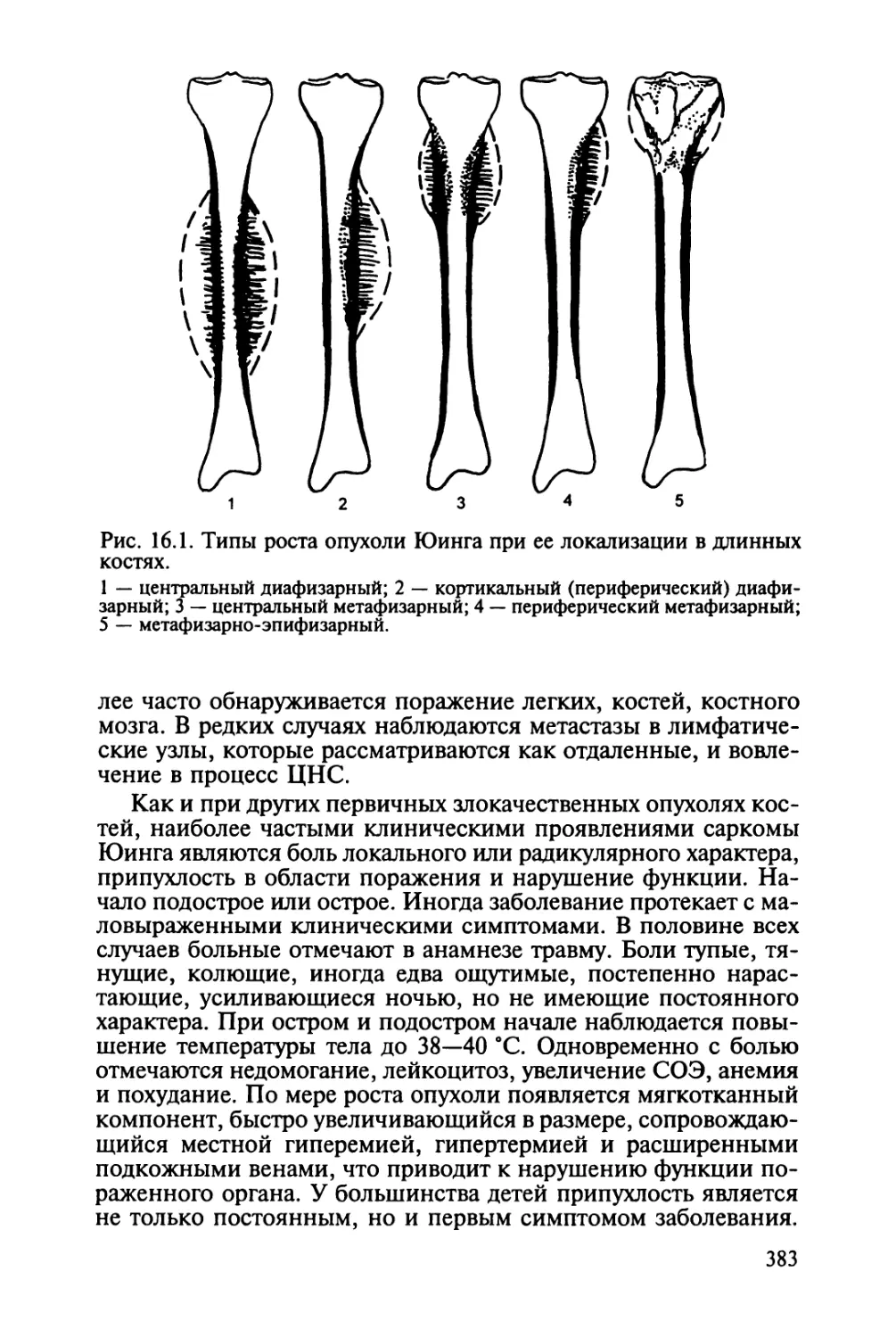
Глава 8. Неходжкинские лимфомы. — А. В. Киселев 189
5
Глава 9. Болезнь Ходжкина (лимфогранулематоз). —
Г. А. Гордина, Л. А. Махонова 222
Глава 10. Гистиоцитарные опухоли у детей. — Л. А. Махонова . . 237
10.1. Диагностика и дифференциальная диагностика реактивных
и опухолевых гистиоцитарных заболеваний у детей 237
10.2. Лангергансово-клеточный гистиоцитоз (Х-гистиоцитоз). . 243
10.3. Злокачественный гистиоцитоз (гистиоцитарная саркома) 249
Глава 11. Опухоли головы и шеи. — В. Г. Поляков 255
11.1. Рак щитовидной железы 255
11.2. Опухоли слюнных желез 271
11.3. Недифференцированный рак носоглотки 280
11.4. Эстезионейробластома 288
Глава 12. Опухоли головного мозга. — Г. В. Голдобенко 294
Глава 13. Нефробластома. — Л. А. Дурнов, Г. В. Голдобенко .... 312
Глава 14. Нейробластома. — Г. В. Голдобенко, Л. А. Дурнов 327
Глава 15. Опухоли мягких тканей. — Т. А. Шароев 341
15.1. Рабдомиосаркома ^44
Глава 16. Злокачественные опухоли костей. — Н. М. Иванова,
Ю. В. Пашков 370
16.1. Остеогенная саркома. Н. М. Иванова, Ю. В. Пашков. . . 370
16.2. Саркома Юинга. — Н. М. Иванова 381
Глава 17. Опухоли половых органов у детей. — И. В. Нечушкина 398
Глава 18. Ретинобластома. — Г. В. Голдобенко, Л. А. Дурнов,
Б. М. Белкина, В. Г. Поляков 413
Глава 19. Меланома у детей. — Н. В. Чернова 429
Глава 20. Злокачественные эпителиальные опухоли у детей. —
И. В. Бондарь 439
20.1. Гепатоцеллюлярный рак 439
20.2. Опухоли желудочно-кишечного тракта 445
20.3. Опухоли почки 447
20.4. Аденокарциномы коры надпочечника 448
20.5. Рак молочной железы 449
20.6. Опухоли кожи 450
Глава 21. Доброкачественные опухоли у детей. — И. В. Бондарь 452
21.1. Опухоли и опухолевидные образования костей 452
21.2. Доброкачественные опухоли кожи и ее придатков 455
Глава 22. Фармакоэкономика в детской онкологии. —
Ю. В. Червонобаб 466
6
КВАЛИФИКАЦИОННЫЕ ТЕСТЫ ПО ДЕТСКОЙ ОНКОЛОГИИ. —
Ю. В. Пашков, Н. А. Сусулева, Т. А. Шароев, Е. И. Бойченко,
Л. А. Дурнов 475
Раздел 1. Основы социальной гигиены и организация онкологической помощи детям 475
Раздел 2. Хирургическая анатомия и оперативная хирургия . . 487
Раздел 3. Морфология опухолей 494
Раздел 4. Основы теоретической и экспериментальной онкологии 502
Раздел 5. Методы диагностики 508
Раздел 6. Общие принципы лечения злокачественных опухолей 514
Р а з д е л 7. Опухоли головы и шеи 523
Р а з д е л 8. Опухоли глаза и орбиты 534
Р а з д е л 9. Опухоли органов грудной клетки 539
Раздел 10. Опухоли органов брюшной полости 553
Раздел 11. Забрюшинные внеорганные опухоли 559
Раздел 12. Опухоли половых органов у детей 565
Раздел 13. Опухоли мочеполовой системы 571
Раздел 14. Опухоли кожи 579
Раздел 15. Опухоли опорно-двигательного аппарата 582
Раздел 16. Опухоли кроветворной и лимфатической ткани . . . 591
Эталоны ответов 603
ПРЕДИСЛОВИЕ
к первому изданию
Онкология — наука об опухолях; детская онкология — наука
об опухолях у детей. От злокачественных новообразований в
мире ежегодно умирают 6 млн человек, из них около 200 000 детей. В результате резкого снижения смертности и заболеваемости многими детскими инфекциями и другими болезнями на
передний план вышли заболевания, которые раньше мало привлекали внимание врачей. К ним относятся прежде всего злокачественные опухоли, которые в настоящее время занимают
второе место среди причин детской смертности. Накапливаются наблюдения, указывающие на рост заболеваемости некоторыми злокачественными новообразованиями у детей. Своеобразие и особенности опухолевого процесса в детском возрасте
привели к тому, что на стыке онкологии и педиатрии появилась
новая научная и практическая дисциплина — детская (педиатрическая) онкология.
Несмотря на относительно небольшую частоту возникновения злокачественных опухолей и возможность полного излечения пациентов, смертность от них у детей остается высокой.
Связано это с тем, что, к сожалению, большинство детей поступают для лечения в далеко зашедших стадиях заболевания,
когда проведение специфической терапии представляет значительные трудности. Основная причина этого обусловлена слабой онкологической настороженностью по отношению к ребенку и, в частности, недостаточными знаниями в области детской онкологии.
Детский врач (да и врач любой специальности) редко сталкивается с больным ребенком, пораженным злокачественной
опухолью. За всю врачебную практику обычный врач-педиатр
встречает не более 8 детей с опухолью. Отсюда ошибки в диагностике и тем более в терапии.
Успехи в детской онкологии связаны с организацией онкологической помощи, с повышением знаний в области детской
онкологии, диагностики и лечения опухолей у детей. От этого
в конечном счете зависит жизнь ребенка. Опыт работы детских
специализированных онкологических отделений наглядно показывает, что результаты лечения опухолей у детей зависят от
своевременной диагностики, которая определяется онкологической настороженностью детского врача и своевременной гос-
8
питализацией детей в специализированное учреждение. Так,
например, комплексная терапия нефробластомы в детских онкологических отделениях позволяет достигнуть выздоровления
у 90 % детей, в неспециализированных отделениях — в 20 %. Если бы дети поступали для лечения своевременно, то уже сейчас
разработанные схемы лечения позволяли бы спасать более 70 %
из них, а при некоторых новообразованиях (например, при ре-
тинобластоме, лимфогранулематозе) и 100 % больных детей.
Лечение детей со злокачественными опухолями сегодня направлено не только на спасение их жизни, но и на то, чтобы помочь выздоровевшим прожить полноценную жизнь. Этого
можно добиться, внушая детям через родителей и близких желание вести здоровый образ жизни, контролируя при этом провоцирующие факторы и поддерживая ресурсы ребенка, семьи и
общества.
Решить эти проблемы можно, лишь вооружив врачей знаниями в области детской онкологии.
Настоящий учебник состоит из общей и специальной частей. В общей части изложены основные сведения об особенностях, статистике, диагностике и лечении злокачественных новообразований у детей, вопросы деонтологии и организации
онкологической помощи. В специальной части описаны диагностика и лечение наиболее распространенных новообразований в детском возрасте. Редкие опухоли освещены в специальной главе.
В основу учебника положен 30-летний опыт работы авторов
в области детской онкологии. Учебник написан сотрудниками
научно-исследовательского института детской онкологии и гематологии Онкологического научного центра им. Н.Н. Блохина
Российской академии медицинских наук и Кафедры детской
онкологии Российской медицинской академии последипломного образования.
Мы считаем, что этот учебник будет полезен не только студентам последних курсов, но и начинающим врачам.
Это первый в нашей стране учебник по детской онкологии,
поэтому мы рассчитываем получить ваши замечания и предложения по содержанию и построению его с тем, чтобы совершенствовать начатый нами труд.
Руководитель Департамента
образовательных медицинских учреждений
и кадровой политики
Министерства здравоохранения РФ
член-корреспондент РАМН
Н.Н. Володин
ПРЕДИСЛОВИЕ
ко второму изданию
Детская онкология является наглядным примером того, как
при активном использовании современных точных наук и естествознания можно добиться хороших результатов за короткий
промежуток времени.
Детская онкология как научная и практическая дисциплина
насчитывает всего не более 40 лет. Первые детские онкологические отделения стали создаваться лишь в 60-х годах XX столетия, тогда же стали публиковаться и многие статьи, посвященные опухолям у детей. Именно поэтому первый учебник по
детской онкологии появился только в 1997 г. Необходимость
его издания диктовалась прежде всего сравнительно небольшим числом этих тяжелых заболеваний, в результате чего практический врач нечасто встречается с такими больными, не может накопить достаточного опыта в распознавании опухолей у
детей, поэтому так велико число детей, поступающих на лечение в далеко зашедших стадиях опухолевого процесса.
Вместе с тем современные возможности детской онкологии
при использовании комплексного лечения в большинстве случаев позволяют добиться полного излечения. Сочетание полихимиотерапии с лучевым и лекарственным, а также другими методами лечения спасает 80 % заболевших детей.
Во втором издании учебника авторы учли не только стремительное развитие детской онкологии, но и замечания, которые
были сделаны после выхода первой книги, за что мы очень благодарны нашим читателям. Надеемся получить замечания и советы и к настоящему изданию учебника.
В этом издании уделено больше внимания распознаванию
опухолей у детей, а также детально освещена современная химиотерапия, которая становится ведущим методом лечения
злокачественных опухолей у детей. Мы надеемся, что учебник
станет нужным пособием не только для студентов, но и для врачей разных специальностей.
Авторы выражают искреннюю благодарность фирме "Novartis"
за помощь в издании учебника.
Директор НИИ детской онкологии
ОНЦ им. Н.Н. Блохина,
акад. РАМН
Л.А. Дурнов
10
Часть!. ОБЩАЯ ОНКОЛОГИЯ
Глава 1 | ОСОБЕННОСТИ ДЕТСКОЙ ОНКОЛОГИИ
1.1. История детской онкологии
Остеогенная саркома, а также опухоль Юинга, столь часто
встречающиеся у детей и подростков, были, по-видимому, обнаружены при изучении останков древних египтян в Некрополе, расположенном вблизи Гизы, на берегу Нила, недалеко от
Каира. Исследования показали, что опухоли были у людей,
живших 5000 лет назад (2715 г. до н.э.), но привлекать к себе
внимание опухоли у детей стали лишь с конца XIX в., а начало
истории детской онкологии следует считать с конца 40-х годов
прошлого столетия.
После второй мировой войны, когда мир стал оправляться от
болезней, голода и разрухи, силы врачей были брошены на ликвидацию эпидемий, распространенных детских инфекций, которые уносили десятки тысяч жизней. В результате были достигнуты большие успехи: почти ликвидирована смертность от
полиомиелита, дифтерии, скарлатины, туберкулезного менингита и многих других детских болезней. В экономически развитых странах на передний план стали выходить заболевания, на
которые раньше обращали недостаточно внимания, и к этому
времени начали появляться публикации о злокачественных
опухолях у детей. К 1975 г. смертность от злокачественных опухолей детей от 1 года до 16 лет вышла на 2-е место. Эти данные
привлекли пристальное внимание общества.
С 60-х годов XX столетия начали организовываться детские
онкологические отделения. Так, в США педиатрическая онкология стала создаваться как подспециальность сразу же после
окончания второй мировой войны. До этого в США дети с опухолями лечились у педиатров и терапевтов при участии хирургов и радиологов. Уже в это время проводилось комбинированное лечение опухолей у детей.
Первая попытка лучевого лечения опухоли у ребенка (и успешная) была осуществлена A. Friendlender в 1915 г.
Внедрение лекарственного лечения имеет свою историю. Использование во время войны химического оружия, в частности применение
во время первой мировой войны немецкой армией иприта, так же как
и во время второй мировой войны, обратило на себя внимание ряда исследователей. Поражение ипритом вызвало большое число инфекций
в связи с подавлением гемопоэза.
На аутопсии погибших солдат находили выраженную аплазию кроветворения. Сидней Фарбер, детский патологоанатом в Бостонском
детском госпитале, используя эти факты (уже были проведены исследования на животных и взрослых людях), применил производные ип¬
11
рита при детском лейкозе. В 1948 г. он с сотрудниками сообщил о быстрых ремиссиях при применении химиотерапии при лейкозе у детей,
а затем и при других опухолях детского возраста.
К 1954 г. было показано успешное применение гормональных препаратов при различных новообразованиях у детей, а в
устных сообщениях того времени Фарбер докладывал о применении актиномицина-Д, который показал высокую активность
при опухоли почки (нефробластоме).
В то же время в нашей стране была опубликована первая монография, посвященная злокачественным новообразованиям у
детей: "Злокачественные опухоли почек у детей". Ее автором
была К. А. Москачева, много сделавшая для становления детской онкологии в нашей стране.
20 января 1962 г. было организовано первое в нашей стране
детское онкологическое отделение на базе 1-й Детской городской клинической больницы им. Морозова в Москве. Надо
сказать, что в архиве этой больницы хранились истории болезни детей, которым еще в 1905 г. Т. П. Краснобаев поставил диагноз остеогенной саркомы. Там же в 1951 г. был открыт первый в стране кабинет для лечения опухолей у детей.
В декабре 1966 г. директор Ленинградского института онкологии им. Н. Н. Петрова А. И. Раков объявил о создании в составе института отделения детской онкологии. В 1968 г. в
Санкт-Петербурге при активном участии заведующего этим отделением Г. А. Федореева был проведен симпозиум по детской
онкологии, посвященный вопросам онкологической помощи
детям. Г. А. Федореев отдал много сил для организации онкологической помощи детям не только в Санкт-Петербурге, но и
по всей стране. В то же время в 1967 г. было открыто отделение
детской онкологии в Московской области.
В 80-х годах прошлого столетия в США началось активное
изучение различных аспектов опухолей у детей, разрабатывались программы комбинированного и комплексного лечения.
Было создано несколько национальных программ, которые
осуществлялись различными группами специалистов. Многие
из них становились интернациональными. Такая группа под руководством D. D. Angio образовала Международный комитет
по изучению нефробластомы. Официальное признание детской
онкологии, а также программы обучения педиатров, онкологов
и гематологов по этой специальности в США впервые состоялось лишь в 1987 г. В 1981 г. было создано Американское общество педиатрической гематологии и онкологии, а также
"Американский журнал педиатрической онкологии".
В нашей стране в 1965 г. была организована проблемная комиссия по детской онкологии при Научном совете по злокачественным новообразованиям при АМН СССР (теперь РАМН).
Проблемная комиссия осуществляла координацию исследований
в области детской онкологии (сначала в СССР, затем в России).
12
В 1967 г. небольшая группа педиатров, хирургов, патологоанатомов и других специалистов встретилась в педиатрическом
отделении онкологического Института Gustav-Ruossy в Париже
для организации педиатрического онкологического клуба. Два
года спустя в Мадриде клуб бьш преобразован в Международное
общество онкологов-педиатров (SIOP). На первом этапе общество имело большей частью клиническую ориентацию, способствуя активному развитию клинического изучения и лечения таких опухолей, как медуллобластома, нефробластома, рабдомиосаркома. В последние годы в повестке ежегодных собраний
SIOP рассматриваются фундаментальные научные исследования в области детской онкологии. Членами SIOP являются и
отечественные онкологи. В 1976 г. был создан Комитет по раку
у детей при Международном противораковом союзе, в который
вошел и представитель нашей страны Л. А. Дурнов. В 1978 г.
создана проблемная комиссия по детской онкологии при СЭВ.
Она стала изучать различные вопросы детской онкологии, волнующие детских онкологов стран Восточной Европы.
В эти же годы в нашей стране параллельно проводились такие же исследования. Было организовано 18 детских онкологических отделений в различных регионах бывшего Советского
Союза. Ими руководили детские онкологи, которые обучались
в созданном на базе детских отделений Онкологического научного центра РАМН в 1990 г. Научно-исследовательском институте детской онкологии (НИИ ДО РОНЦ РАМН). После распада СССР в России осталось 9 детских онкологических отделений, которые объединены Комитетом по раку у детей при
Всесоюзном (теперь Всероссийском) научном обществе онкологов, созданном в 1988 г.
В 1990 г. впервые организован курс детской онкологии при
Центральном институте усовершенствования врачей (ЦОЛИУВ),
а с 1993 г. он преобразован в кафедру детской онкологии при
Российской медицинской академии последипломного образования (бывший ЦОЛИУВ). С 1993 г. стал издаваться журнал
"Детская онкология".
В 1996 г. в мировой компьютерной сети "Интернет" создан
"Клуб детских онкологов".
История детской онкологии только начинается — впереди
длинный и нелегкий путь борьбы за детские жизни.
1.2. Эпидемиология опухолей у детей
Эпидемиология в детской онкологии в меньшей степени (в
отличие от взрослых) рассматривает связь возникновения опухолей с географическими и другими факторами внешней среды.
Может быть, это связано с не совсем достоверной статистикой,
но, скорее всего, с относительной редкостью их — ведь на целый
13
регион с миллионным населением приходится всего 42 ребенка
со злокачественной опухолью. Даже в такой большой стране,
как США, ежегодно заболевают не более 8000 детей, а в странах
Европы ежегодно около 21 000. Другая причина связана с тем,
что на маленьких детей внешняя среда, географические, климатические условия действуют опосредованно через их матерей, поэтому эпидемиология опухолей у детей — это эпидемиология их родителей.
Профессиональные вредности, вредные привычки, различные физические и химические воздействия прежде всего и главным образом влияют на родителей, а через них на детей.
Ведущие детские онкологи разных стран под эпидемиологией опухолей у детей во всех своих работах подразумевают связь
злокачественных новообразований с акушерской патологией, с
вирусными инфекциями во время беременности у матери, с
вакцинацией матерей во время беременности, врожденными и
семейными факторами, полом и возрастом, пороками развития.
Например, ведущий ученый в области эпидемиологии A. Miller в большом обзоре, который он называет "эпидемиологическим", дает эпидемиологическую оценку связи между злокачественными опухолями и врожденными дефектами. Он условно
делит опухоли у детей на 3 группы. В 1-ю группу входят лейкоз,
нефробластома, рак печени и надпочечников, нейробластома.
Эти опухоли нередко сочетаются с различными врожденными
пороками. Для острого лейкоза характерно сочетание с болезнью Дауна, а для остальных опухолей этой группы (кроме нейробластомы) — с гемигипертрофией. При нейробластоме нередко возникает аниридия (врожденное отсутствие радужной
оболочки). Вторую группу составляют опухоли мозга. Они чаще
всего сочетаются с пороками развития ЦНС (некоторая склонность к возникновению глиом отмечается у больных узелковым
склерозом и нейрофиброматозом). В 3-ю группу входят опухоли
гениталий, которые также часто встречаются одновременно с
пороками развития. Далее автор указывает, что лимфомы чаще
всего сочетаются с врожденной агаммаглобулинемией, опухоли
костей — с множественными экзостозами, энхондромами, несовершенным остеогенезом.
В ряде исследований указывается, что в странах с умеренным
климатом первое место в детском возрасте занимают лейкозы, а
в тропическом климате — лимфомы. R. Miller исследовал географическое распределение лейкозов и лимфом у детей — его удивили случаи группового возникновения этих заболеваний в одной
и той же школе, в одном квартале, что пока трудно объяснить.
Известно, что лимфосаркомы особенно часто встречаются в
Японии, лимфогранулематоз — у детей в тропических зонах
Африки.
Манчестерский канцер-регистр (Англия), давно и плодотворно работающий в области детской онкологии, указывает,
14
что злокачественные опухоли чаще встречаются у мальчиков.
Частота опухолей у детей варьирует в разных странах и социально-экономических группах населения. Так, лейкозы типичны для детей из наиболее обеспеченных слоев населения, а у
цветных они весьма редки в силу низкого уровня жизни и неустановленных этнических факторов. Роль факторов внешней
среды в этиологии опухолей у детей, судя по данным регистра,
вероятно, гораздо меньше, чем для взрослых; тем не менее она
требует глубокого изучения.
В последние годы появляется все больше работ по эпидемиологии опухолей у детей, приближающихся к таковым в общей онкологии. Определенный интерес представляют данные,
приводимые различными авторами.
• Острый лимфобластный лейкоз. Заболеваемость более высока в Китае, Японии, США, Англии, Европе; более низкая — на Ближнем Востоке и в Африке.
• Острый миелобластный лейкоз. Самый высокий индекс
заболеваемости в Шанхае, Японии, Новой Зеландии, относительно низкий — в США и Европе.
• Лимфогранулематоз. Самые высокие индексы заболеваемости в подростковом и юношеском возрасте отмечены в
индустриальных странах Запада, а общие высокие индексы — в США, Латинской Америке, Африке, Израиле.
• Неходжкинские лимфомы. Самый высокий индекс в Африке (за счет лимфомы Беркитга); в Японии он в 2 раза
ниже, чем в других странах.
• Опухоли ЦНС. Более высокий индекс в США (белые дети), Германии, Швеции, более низкий — в Азии и Африке.
• Нейробластома. Более высокий индекс заболеваемости в Северной Америке, Европе, Израиле, Австралии; более низкий — в Африке, Центральной и Южной Америке, Азии.
• Ретинобластома. Колебания индекса заболеваемости небольшие. По сравнению со странами Европы и Америки
более часты случаи ретинобластомы в Корее; более высок
индекс заболеваемости в Индии и Африке.
• Нефробластома. Самый высокий индекс заболеваемости
в США (у чернокожих детей), в Финляндии, некоторых
районах Франции; более низкий он для Азии.
• Саркомы костей. Более высокий индекс заболеваемости для
детей Испании, испанского населения США; более низкий — для Азии (остеогенная саркома). Для саркомы Юинга
более высокий индекс для белых детей США, Новой Зеландии, Австралии, а очень низкий — для Японии и Китая.
• Саркомы мягких тканей. Наиболее высокий индекс заболеваемости характерен для Испании, США (белое и испанское население), более низкий — для детского населения
Азии (включая Японию, Китай, Индию, Филиппины).
15
1.3. Этиология опухолей у детей
Для объяснения происхождения опухолей у детей используются теории, которые приняты в общей онкологии. Но имеются гипотезы, характерные для детской онкологии. Одной из них
является теория Конгейма, предложенная еще в 70-х годах XIX
столетия. Согласно этой теории, опухоли происходят из перси-
стирующих эмбриональных зачатков, возникших из-за нарушения эмбриогенеза. Во время внутриутробного развития плода
происходит смещение эмбриональных зачатков тканей. Не использованные при строительстве организма, эти эктопированные клетки могут длительное время не проявлять себя. При
присоединении внутренних и внешних раздражителей эти зачатки могут дать опухолевый рост.
Противоречат теории Конгейма определенные факторы:
преимущественное развитие опухолей в пожилом возрасте, а не
у детей; преобладание новообразований в органах, где нет особых
сложностей формирования в период эмбрионального развития.
Так, опухоли у взрослых сравнительно редко возникают из жаберных дуг, эмбриональных протоков, а чаще — из эпителия желудочно-кишечного тракта. В то же время наиболее распространенные опухоли у детей (нефробластомы, нейробластомы, медуллобластомы, гепатобластомы, ретинобластомы) развиваются
в течение эмбрионального или раннего постнатального периода
из незрелых органов и тканей. Теория Конгейма объясняет также
сочетание опухоли с пороками развития, преобладающими у детей в возрасте до 4 лет, преимущественный соединительнотканный генез новообразований и отсутствие предопухолевых
заболеваний. Важны также экспериментальные подтверждения, указывающие на возможность "спонтанной” малигниза-
ции эктопированных эмбриональных клеток. Эта же теория может объяснить происхождение многих доброкачественных опухолей у детей (опухолевидных врожденных аномалий тканевого
развития, состоящих из местных тканей и тканей, чужеродных
для данной локализации) — гамартом.
Согласно теории Фишер-Вазельса, сформулированной в 20-х
годах прошлого столетия, придается наибольшее значение в возникновении опухолевого роста условиям, при которых ткань в
течение длительного срока получает мощные физиологические
или патологические импульсы к росту. Они могут возникать
вследствие повторной гибели или регенерации тканей (частое
воздействие рентгеновских лучей) либо под влиянием быстрого
роста тканей в определенные возрастные периоды.
Теории Конгейма и Фишер-Вазельса в ряде случаев согласуются: можно предположить, что ранняя детерминация неиспользованных зародышевых зачатков при наличии определенных реализующих факторов приводит к развитию из них опухолей.
16
Высказывается мысль о вирусной природе рака у детей. Так,
в связи с эндемическим распространением африканской лимфомы (лимфомы Беркитга) в основном у детей в возрасте 4—8 лет
получено много данных, свидетельствующих о причастности вируса к возникновению этого новообразования. Вирусную теорию пытаются использовать и для объяснения некоторых других
системных новообразований, в частности лейкозов. Указывается
также на большую возможность горизонтальной передачи при
лимфогранулематозе, что может свидетельствовать об инфекционной природе этого новообразования.
Большой интерес представляет теория иммунологического
контроля. Согласно этой теории, у практически здорового человека заложена возможность злокачественного превращения
клеток, которая сдерживается защитными силами организма.
Эта теория находит свое подтверждение в том, что у детей с поломками иммунной системы чаще возникают злокачественные
опухоли. Эта теория, которая также именуется концепцией иммунологического надзора, имеет не только сторонников, но и
многих противников, которые утверждают, что она не объясняет происхождения большинства опухолей у детей.
Наиболее интересна для детской онкологии теория происхождения опухолей, связанная с трансплацентарным бластомо-
генезом. Согласно этой теории, большинство новообразований
у детей возникает путем прохождения канцерогенных веществ
через плаценту. Через плаценту проходят почти все лекарственные препараты, применяемые в акушерской практике. В эксперименте доказана проходимость плаценты для стронция-98,
который вызывал остеосаркомы у родившихся крысят при парентеральном питании матери.
Есть работы, основанные на большом статистическом материале, указывающие на трансплацентарное воздействие табака,
алкоголя на потомство. Так, у курящих женщин дети заболевают в 2 раза чаще, чем у некурящих. Трансплацентарно действуют некоторые препараты, применяемые в сельском хозяйстве
(пестициды). В связи с этим необходима тщательная проверка
всех веществ и препаратов, с которыми контактирует беременная женщина.
Трагический эксперимент был поставлен жизнью. В США с
1966 по 1973 г. было зарегистрировано 170 случаев рака влагалища у девочек и девушек 15—20 лет, матери которых во время
беременности принимали синтетические препараты (стильб-
эстрол, диэтилстильбэстрол). Всего же таких наблюдений более 500.
К концу прошлого столетия предложено, судя по данным
литературы, четырнадцать гипотез о происхождении опухолей
у детей.
Какие же факторы могут быть использованы для построения
теории происхождения опухолей у детей?
17
1. Врожденный характер большинства опухолей в раннем
детском возрасте.
2. Связь злокачественных опухолей с пороками развития.
3. Наследственный характер некоторых опухолей у детей.
4. Иммунологическая некомпетентность при некоторых опухолях у детей.
5. Спонтанная регрессия некоторых опухолей у детей. Так,
нейробластома является новообразованием, при котором намного чаще, чем при других опухолях, происходит регрессия.
Особенно важно, что на вскрьггии нейробластому обнаруживают
в 200 раз чаще, чем ее клинические проявления в последующем.
Указанные особенности течения опухолевого процесса объясняются рядом причин: иммунологическими, реакцией организма на операционную травму, гормональными факторами, инфекцией и др. Спонтанная регрессия нейробластомы чаще происходит у детей раннего возраста, что объясняют пассивным
иммунитетом, и поэтому прогноз этого заболевания у детей
младшего возраста значительно лучше.
6. Трансплацентарный бластомогенез.
7. Облучение во время беременности и опухоль у плода.
Многочисленные статистические исследования указывают, что
риск возникновения опухолей у детей становится более высоким, если мать во время беременности подвергалась рентгеновскому облучению (это может быть обычное рентгеновское обследование). Риск при этом выше, чем чаще проводилось облучение.
8. Возраст матери и опухоль у ребенка. Наблюдениями за
детьми со злокачественными опухолями установлено, что в
62 % случаев матери этих детей на момент беременности были
старше 30 лет. Фактор возраста особенно значителен для матерей старше 40 лет. Связывают это с увеличением спонтанных
мутаций в герминогенных клетках, с перезреванием яйцеклетки.
Считается также, что определенную роль играет возраст отца.
1.4. Генетика опухолей у детей
Известно около 100 генетически обусловленных синдромов,
которые предрасполагают к развитию необластических процессов в детском возрасте. Доказано, что в этиологии ряда врожденных опухолей у детей основную роль играют генетические
факторы. Это в первую очередь характерно для ретинобластомы
и нефробластомы. Так, наследственный характер ретинобластомы подтверждают следующие факты: при семейных случаях
имеется двустороннее поражение и заболевание наследуется
половиной потомства независимо от пола.
Для спонтанной билатеральной ретинобластомы также характерно наследование у 50 % потомства. Односторонняя спо¬
18
радическая ретинобластома наследуется у 8—25 % детей. Рети-
нобластома развивается у родственников больного, хотя родители здоровы.
Развитие наиболее распространенных эмбриональных опухолей связано со структурными изменениями хромосомного
аппарата, в частности с делецией (утратой) определенных участков хромосомы, в результате которой включается действие
супрессорных тканеспецифических механизмов и, возможно,
активируются определенные онкогены.
Наиболее фундаментальным открытием в этой области следует считать картирование супрессорных генов при ретинобла-
стоме, нефробластоме и нейробластоме. Ген нейробластомы
расположен в хромосоме 1, нефробластомы — в хромосоме 11,
ретинобластомы — в хромосоме 13. Указанные мутационные
изменения могут происходить как в герминальных (половых)
клетках (тогда они считаются наследственными и передаются
потомству по аутосомно-доминантному типу), так и в соматических клетках ребенка (в этих случаях опухоль не наследуется).
Для трансформации мутантной клетки в раковую необходимо
наличие еще одного фактора, чаще мутационного в этой же
клетке. Вероятность второго события определяет пенетрант-
ность (вероятность проявления) опухоли.
Итогом медико-генетического консультирования является
выделение двух групп — с высоким и низким риском возникновения опухоли с соответствующими рекомендациями родителям
и необходимостью диспансеризации детей, если они принадлежат к группе с высоким риском. Полученные данные позволили
создать методологическую основу медико-генетического консультирования в детской онкологии.
Генетические исследования в детской онкологии позволяют
прийти к следующим выводам.
• Эмбриональные опухоли представляют гетерогенную группу. Примерно 40 % из них следует отнести к генетически
детерминированным аутосомно-доминантным состояниям, при которых происходит мутация в герминальных
клетках. У 60 % детей развитие опухоли обусловлено мутацией в соматических клетках и потомкам не передается.
• Критериями принадлежности индивидуума к генетически
детерминированной группе являются двусторонность, по-
лифокусность процесса и наличие в семье еще одного пораженного. На долю таких детей приходится от 12 до 25 %
в зависимости от вида опухоли. Риск повторных случаев
в семьях таких больных достигает 30—45 %.
• Односторонние спорадические опухоли представляют существенную трудность для медико-генетического консультирования, так как они могут быть обусловлены мутациями как в герминальных, так и в соматических клетках. Для
19
дифференцировки этих явлений используются различные
подходы: фенотипическая идентификация, поиски биохимических маркеров и групп сцепления.
• Установлен ряд биохимических маркеров, которые являются надежными тестами для диагностики делеционных вариантов нефробластомы и ретинобластомы. К ним относятся
активность кеталазы эритроцитов, активность ЛДГ-А, уровень гемоглобиновых фракций для больных с нефробла-
стомой; активность эстеразы — для больных с ретинобла-
стомой. При крупных делециях наиболее надежным тестом
следует считать исследования кариотипа больного ребенка.
Медико-генетическое консультирование является также основой для создания системы профилактики злокачественных
новообразований путем диспансеризации детей, имеющих высокий риск развития опухоли. При этом следует ставить следующие задачи.
1. Предупреждение развития заболевания (при высоком риске
рекомендуется воздержаться от деторождения).
2. Профилактика далеко зашедших стадий заболевания путем выделения групп детей с повышенной угрозой возникновения злокачественных опухолей. При этом группы риска могут
формироваться на основе различных критериев. У 30 % детей с
опухолями различной локализации диагностируются пороки
развития и синдромальные состояния. Механизм сочетания
опухолей с синдромами и пороками развития различен. В одних
случаях считается, что гены этих состояний и ген опухоли расположены в непосредственной близости друг от друга и делегируют одновременно; в других — малигнизация связана с дефектом репарации ДНК.
Наиболее информативными следует считать группы риска,
сформированные на основе генеалогических данных о семье
больного. Риск повторной малигнизации в этих семьях достигает 30—45 %.
Предотвратить рождение больного ребенка можно с помощью вероятностного прогноза (при риске выше 25 % рекомендуется воздержаться от деторождения). Более эффективным
следует считать использование внутриутробной диагностики.
1.5. Структура злокачественных новообразований у детей
Обращает на себя внимание необычная структура опухолей
в детском возрасте. Рак (опухоли эпителиальной природы), составляющий у взрослых подавляющее большинство случаев, у
детей встречается значительно реже, не чаще чем в 5—6 %, тогда как саркома — почти в 84 % наблюдений. В возрасте до
1 года у детей преобладают эмбриональные опухоли ("истинные
опухоли детства"); они составляют до 85 % всех злокачествен -
20
ных новообразований в этот период. Если не принимать во
внимание ранний возраст, то около половины всех опухолей у
детей занимают гемобластозы (острый лейкоз, злокачественные
лимфомы).
Значительный удельный вес приходится на опухоли ЦНС.
Очень часто встречаются опухоли почек, симпатической нервной системы, опухоли костей (у подростков). Структура заболеваемости опухолями у детей представляет как бы обратную
картину заболеваемости новообразованиями у взрослых.
Для практического врача важны главным образом особенности опухолей у детей, связанные с диагностикой и лечением.
Они в основном сводятся к следующему.
• Трудности, связанные с получением анамнеза у детей
младшего возраста, отсутствием или невнятностью жалоб. Сведения, получаемые от родителей и родственников или других
людей, ухаживающих за ребенком, далеко не равноценны сведениям, полученным от самого больного. Нередко эта информация "уводит" от диагноза, создает неверную картину заболевания в силу различных качеств рассказчика, его отношения к
больному, эмоционального состояния. Близкие ребенка стараются навязать свою точку зрения врачу. Это часто происходит
из-за страха перед диагнозом рака. Не сознавая всего, они в ряде случаев стремятся описать симптомы болезни часто уже наблюдавшиеся у ребенка. Другие родители, наоборот, стараются
обнаружить рак на ранней стадии и ищут симптомы, характерные для злокачественной опухоли. В редких случаях (при явлениях канцерофобиии) родители ребенка даже придумывают
симптомы, которые им кажутся типичными для рака.
В связи с этим врач вынужден активно "искать” признаки болезни, предполагать возможные жалобы больного. Здесь важно
обратить внимание на поведение ребенка. Изменение внешнего
вида и поведения ребенка особенно хорошо видно врачу, постоянно наблюдающему ребенка. В связи с этим желательно
иметь контакт с лечащим врачом больного, если обследует его
другой врач.
Необходимо исходить из того, что у детей преобладает определенная локализация наиболее распространенных опухолей:
забрюшинное пространство, средостение, подмышечные, паховые, шейные и надключичные лимфатические узлы, мягкие
ткани конечностей. К сожалению, при обследовании маленького ребенка приходится ориентироваться на его поведение,
внешний вид, положение тела, ставить диагноз, исходя из предположений, так как отсутствие конкретных жалоб со стороны
ребенка, их неясность, нелокализованность, если они есть,
крайне затрудняют диагностику. Особенно затруднительна диагностика опухолей головного мозга.
У более старших детей приходится учитывать при сборе
анамнеза стремление ребенка скрыть некоторые симптомы бо¬
21
лезни из-за боязни боли при обследовании, нежелания госпитализации. В более редких случаях следует исключить аграва-
цию с целью вызвать жалость или в связи с другими мотивами.
Принимая во внимание изложенное выше, врач должен
стремиться в большей степени к объективному обследованию,
что особенно важно в детской онкологии, но никогда не сбрасывать со счетов даже крупицы знания, полученного при сборе
анамнеза.
• Относительно малое число визуально наблюдаемых опухолей. В отличие от взрослых, у которых много визуально
наблюдаемых форм опухолей (рак молочной железы, рак
пищевода, желудка, прямой кишки, ротоглотки, кожи),
доступных простому или эндоскопическому осмотру, у детей такие опухоли крайне редки. У девочек, например,
крайне редки опухоли шейки матки, позволяющие у женщин ставить диагноз при простом осмотре с последующим
цитологическим исследованием. Однако и ряд опухолей у
детей (лейкозы, злокачественные лимфомы) могут являться объектом визуального наблюдения. Увеличение лимфатических узлов разной локализации при этих новообразованиях должно привлечь внимание врача. Обязательны их
цитологическое и гистологическое исследования, позволяющие во многих случаях своевременно поставить диагноз. Визуально можно также наблюдать припухлость в области конечности при опухолях мягких тканей и костей.
Здесь наряду с рентгеновским исследованием показана
пункционная биопсия с целью получения цитологических данных.
• Наиболее распространенные опухоли у детей расположены в труднодоступных областях. К сожалению, часто
встречающиеся опухоли, особенно у самых маленьких детей, располагаются в труднодоступных для прямого исследования областях: череп — опухоли ЦНС; средостение —
нейробластома, опухоли вилочковой железы, злокачественные лимфомы; забрюшинное пространство — неф-
робластома, нейробластома, тератоидные опухоли. Опухоли, расположенные в этих областях, могут расти длительное время, не вызывая субъективных ощущений, не
приводя к видимым объективным изменениям (разумеется, речь не идет о тех случаях, когда, например, опухоль
мозга затрагивает жизненно важные центры). В некоторых случаях опухоли могут вызывать боли или неприятные ощущения, сдавливая нервы или сосуды, но обычно
они растут, раздвигая окружающие органы и ткани, тем
более что анатомо-физиологические данные детского организма позволяют это. Постепенно опухоли, расположенные в труднодоступных областях, увеличиваются в
22
размерах и обнаруживаются, когда становятся очень
большими. Нередко их находит мать ребенка при одевании или купании. В других случаях сама первичная опухоль не выявляется, а обращают на себя внимание метастазы. Последние очень характерны для нейробластомы,
которая дает о себе знать появлением визуально наблюдаемых метастазов (глазница, мягкие ткани, кости черепа).
Очень трудны для диагностики опухоли мозга, так как их
проявление (головокружение, головные боли, тошнота,
изменения со стороны зрения и другие) объективно регистрируются с трудом, а расспросить ребенка, особенно маленького, как мы уже писали, сложно. Здесь необходимы
ультразвуковое исследование, компьютерная и магнитно-
резонансная томография.
• Диагностика опухолей в детском возрасте затруднена и
тем, что большинство опухолей у детей скрывается под
различными "масками". Практически любое заболевание
в детском возрасте, особенно раннем, да и некоторые физиологические процессы, могут своими проявлениями
напоминать опухоль, так же как опухоль может приниматься за физиологический процесс или какое-либо неонкологическое заболевание. Положение усугубляется
тем, что довольно часто наряду с опухолью одновременно
протекают и другие заболевания, происходят физиологические процессы, которые могут прикрывать опухоль
(прорезывание зубов, половое созревание и т. д.). Необходимо помнить о нередком сочетании опухоли с пороками
развития, которые своей манифестацией могут также
"прикрывать" ее. К сожалению, часто врач останавливается на диагнозе широко известных в детском возрасте
болезней, которые он хорошо знает еще со студенческой
скамьи. Поэтому столь важна онкологическая настороженность по отношению к ребенку. Во всех случаях врач,
осматривающий ребенка, в первую очередь должен думать о злокачественном новообразовании и исключить
или диагностировать его.
• Преобладание общих симптомов над местными. Клиническая картина большинства опухолей у детей нередко кажется одинаковой, так как на передний план выходят общие симптомы. В подавляющем большинстве случаев для
всех злокачественных новообразований характерны бледность кожных покровов разной степени выраженности, в
той или иной мере похудание (или остановка в прибавке
массы тела), изменение в поведении, быстрая утомляемость, нарушения со стороны желудочно-кишечного тракта (тошнота, рвота, запор, понос, боли), субфебрильная
температура, анемия, повышение СОЭ. В общем, врач
часто наблюдает клиническую картину, характерную для
23
любой детской болезни, для любой детской инфекции.
Мало присущи опухолям бросающиеся в глаза симптомы,
которые символичны для опухоли, появляющиеся обычно
в разгаре заболевания. Врач должен помнить о типичных
злокачественных новообразованиях у детей и при обнаружении общих симптомов исследовать наиболее часто
встречающиеся локализации опухолей в детском возрасте.
• Необходимость анестезиологического обеспечения. Почти во всех случаях диагностических исследований необходимо анестезиологическое обеспечение, особенно у маленьких детей. Только обезболивание диагностической
процедуры, исключение неприятных ощущений позволяют получить качественную информацию, не говоря уже о
сохранении контакта с обследуемым ребенком. Обезболивание во многих случаях необходимо не только для того,
чтобы избавить ребенка от страха, неприятных ощущений
и боли, но и для его "обездвиживания". Чтобы максимально использовать время анестезии, следует сочетать там,
где это возможно, несколько процедур одновременно (например, пальпацию, ректальное пальцевое исследование,
пункцию костного мозга, пункционную биопсию и т. д.).
Только полное исключение неприятных ощущений, страха,
тревоги и боли у ребенка позволит провести полноценное
исследование, а в дальнейшем лечение.
1.6. Особенности лечения опухолей у детей
Особенности терапии злокачественных опухолей у детей во
многом зависят от специфичности опухолевого процесса, которая накладывается на анатомо-физиологическое своеобразие,
свойственное детскому организму. В основном они сводятся к
следующему.
1. Нарушение анатомо-топографических взаимоотношений
У плода, после рождения ребенка или в раннем детском возрасте, когда еще до конца не сложились правильные взаимоотношения органов, связочный аппарат не укрепился, клетчатка
нежна и очень эластична, опухоль при своем росте нарушает
обычное расположение органов, привычное для хирурга. При
многих опухолях требуется изменение обычных, ранее разработанных методов оперативного вмешательства. Можно наблюдать различное нестандартное, иногда парадоксальное расположение органов: опухоль почки (разумеется, вместе с почкой)
может находиться в малом тазе или на уровне проекции верхней
границы печени. Здоровая почка может быть смещена нейробластомой в малый таз или на противоположную сторону. Наблюдается также смещение печени, которое у взрослых трудно
24
представить. Печень может быть сдвинута опухолью и так высоко поднимать диафрагму, что будет казаться расположенной
в грудной полости, при этом она разворачивается так, что трудно определить ее части. Но особенно часто в силу своей подвижности в раннем детском возрасте смещаются почки. Так,
нефробластома и нейробластома по мере роста разворачивают
почку вокруг оси, сдвигая ее в стороны, вверх и вниз, крайне
затрудняя дифференциальную диагностику и хирургическое
вмешательство.
В некоторых случаях взаимоотношения органов настолько
изменены, что трудно установить, где находится новообразование: в брюшной полости или забрюшинном пространстве. Поэтому столь важно провести детальное дооперационное обследование, позволяющее хирургу предвидеть возможные сложности во время оперативного вмешательства.
2. Сочетание опухоли с врожденными пороками развития
Нередко затрудняет оперативное вмешательство и сочетание
опухолей с различными пороками развития, особенно с пороками мочеполовой системы. Не говоря уже о том, что хирургу
бывает трудно разобраться в связи порока с почкой (или другим
элементом мочеполовой системы), приходится не только удалять опухоль, но там, где это возможно, проводить коррекцию
порока.
Вместе с тем сочетание ряда пороков с опухолью, особенно
на фоне топографоанатомических нарушений, затрудняет не
только ориентировку хирурга и вносит дополнительные трудности в оперативное вмешательство, но иногда делает невозможным радикальное удаление новообразования. Наличие порока зачастую затрудняет оценку эффективности проведенного
лечения, особенно в тех случаях, когда порок не удается корригировать.
И в этих случаях необходима детальная топическая доопе-
рационная диагностика, позволяющая хирургу лучше ориентироваться во время операции.
3. Большие операции у маленьких детей
Маленьким детям нередко приходится проводить "большие
операции", что желательно делать при больших, трудноудали-
мых опухолях, расположенных в черепе, средостении, забрю-
шинном пространстве. При этом часто новообразования поражают детей в возрасте до 3 лет. Приходится также выполнять
сложные комбинированные оперативные вмешательства, особенно в тех случаях, когда опухоль прорастает в соседние органы и ткани. У ряда детей удаляют опухоль почки с селезенкой,
почку с надпочечником, опухоль почки с хвостом поджелудочной железы, с частью кишки и другими органами и тканями.
Наиболее сложными, связанными с грозными осложнениями яв¬
25
ляются операции на печени (особенно правосторонняя гемиге-
патэктомия). В некоторых случаях приходится выполнять операции в два этапа (например, на легких — сначала на одном, затем на другом), что нередко бывает при наличии метастазов. Не
так редки повторные операции, и они обычно очень сложны,
когда речь идет о рецидиве опухоли.
Хирург, оперируя маленького ребенка с опухолью, должен
учитывать и чисто онкологические проблемы: оперативное
вмешательство по возможности должно быть радикальным.
4. Высокая чувствительность злокачественных опухолей у детей к ионизирующему излучению
При лучевой терапии врач должен учитывать более высокую
и разнообразную чувствительность к облучению как опухоли,
так и организма ребенка. Большинство наиболее распространенных новообразований у детей (лейкоз, нефробластома, рети-
нобластома, нейробластома, лимфосаркома, лимфогранулематоз) высокочувствительны к радиации. Даже рабдомиосаркома и
другие опухоли мягких тканей, которые у взрослых радиорези-
стентны, у детей поддаются лучевому воздействию. При ряде
опухолей у детей можно достигнуть ремиссии, а иногда и полного излечения с помощью одной только лучевой терапии.
Обычно же она является эффективным компонентом комплексного лечения.
5. Лучевая терапия, побочные эффекты и последствия
Облучение детей, особенно в раннем детском возрасте, может вызывать серьезные последствия, если не учитывать тот
факт, что радиолог имеет дело с бурно растущим и в то же время
лабильным, не до конца сформированным организмом. Уже в
процессе лечения возможно угнетение кроветворения. Лечение
может сопровождаться тошнотой, рвотой, резким падением аппетита, в связи с чем иногда приходится его прекращать. У детей, особенно маленьких, по сравнению со взрослыми лимфо-
пения возникает значительно раньше и при меньших суммарных дозах. В редких случаях в зонах облучения по поводу
опухоли через некоторое время может возникнуть другая опухоль, например остеогенная саркома после лечения ретинобла-
стомы. Серьезные осложнения возникают в тех случаях, когда
в область облучения попадают зоны роста костей, что приводит
к деформации и укорочению конечности. Возможны атрофии
мышц, молочной железы, зубов, сколиозы, асимметрии конечностей и тела.
Побочных эффектов и последствий лучевой терапии можно
избежать или значительно их уменьшить при хорошей технике
и продуманном режиме облучения, причем даже тех, которые
пока неизбежны (недостаточная активность гонад, катаракта).
26
6. Высокая чувствительность злокачественных новообразований к противоопухолевым препаратам
Почти все злокачественные новообразования у детей высокочувствительны к различным противоопухолевым препаратам.
Наиболее распространенные опухоли в детском возрасте в отличие от таковых у взрослых прекрасно реагируют на применение полихимиотерапии, которая поистине произвела революцию в детской онкологии. Лекарственное лечение применяется
как монотерапия, а также в качестве активного компонента лучевого лечения. Химиотерапия особенно эффективна при ге-
мобластозах, и у детей в отличие от взрослых ее применение
весьма результативно и при солидных опухолях.
7. Защитная лекарственная терапия ребенка с опухолью
При проведении лекарственной противоопухолевой терапии
возможны быстрые, непредсказуемые изменения показателей
крови, нарушения со стороны нервной системы, а также возникновение побочных эффектов и осложнений. Особенно это
следует учитывать в тех случаях, когда одновременно применяется много препаратов. Необходимо четко рассчитывать дозы
препаратов при использовании одновременно нескольких методов и проводить адекватную симптоматическую терапию.
При соблюдении этого правила побочные эффекты и осложнения можно свести к минимуму.
8. Особенности оценки результатов лечения
Одной из особенностей детской онкологии является возможность более быстрой оценки результатов лечения. Замечено, что подавляющее большинство детей, проживших без метастазов и рецидивов 2 года, становятся практически здоровыми. На основе большого статистического материала создана
определенная единица времени, названная "период риска"; она
определяет период времени, в который могут возникнуть рецидивы или метастазы опухоли. По поводу этого периода шла дискуссия, которая не закончилась и в настоящее время. Одни авторы считают, что этот период у детей должен исчисляться полутора годами, другие настаивают на 3-летнем периоде. Однако
большинство детских онкологов считают достаточным 2-лет-
ний период, позволяющий считать ребенка выздоровевшим в
отличие от 5-летнего срока у взрослых. Однако наблюдение за
ребенком педиатр (или детский онколог, что лучше) должен
вести до тех пор, пока он не перейдет к врачу-онкологу, лечащему взрослых.
Почти у 6 % детей, излеченных от злокачественной опухоли,
возникают через некоторое время вторичные опухоли. Появление этих опухолей связывают с облучением, химиотерапией, а
также с генетическими нарушениями. Помнить об этом необ¬
27
ходимо, поэтому, как было сказано выше, леченный в детстве
по поводу злокачественной опухоли больной должен находиться в "группе риска" под наблюдением онколога, который лечит
взрослых пациентов.
* * *
Выше приведены далеко не все особенности детской онкологии. Знание их необходимо врачу для распознавания и лечения злокачественных новообразований у детей. Это знание входит в понятие онкологической настороженности по отношению
к ребенку, позволяет целенаправленно обследовать его, найти
оптимальные методы и режимы лечения, выбирая наиболее рациональные пути.
1.7. Особенности обезболивания и интенсивной терапии у детей
Оценка состояния ребенка и предоперационная подготовка.
Оценка общесоматического статуса у детей со злокачественными
опухолями опирается на современные представления об анатомо-физиологических особенностях детского возраста, характеризующегося в целом интенсивным ростом ребенка с прогрессирующим увеличением массы и поверхности тела, анатомической
и функциональной незрелостью органов и систем организма, что
обусловливает их уязвимость в отношении воздействия различных патогенетических факторов.
Несовершенство нервной системы, заключающееся в функциональной и морфологической незрелости коры большого мозга, обусловливает развитие преимущественно генерализованных
и стереотипных реакций в ответ на боль, гипоксию, охлаждение
и другие стрессоры. Подобной универсальной реакцией организма грудного ребенка на различные патогенетические воздействия являются судорожные состояния. Они возникают и в
ответ на недостаток кислорода при пневмониях, интоксикациях,
гипертермическом синдроме. В стереотипную реакцию, как
правило, входят и нарушение дыхания, а также водно-электролитные расстройства, включающие различные "порочные круги"
вследствие незрелости и уязвимости (особенно в раннем детском возрасте) мембранного аппарата клетки, гидродинамики,
терморегуляции и других важных систем организма.
Быстрота развития генерализованной реакции у грудного ребенка не исключает позитивного ответа организма на эффективное и главное своевременное лечебное воздействие. Наоборот,
по сравнению с детьми более старшего возраста и взрослыми
"ответ" на правильную лечебную тактику незамедлителен, что
позволяет в большинстве случаев быстро ликвидировать различные функциональные расстройства. При неверной тактике
28
лечения особая острота стереотипной реакции у маленького ребенка может быстро привести к дистрессу и истощению механизмов компенсации, запас которых ограничен. Наиболее слабыми с точки зрения адаптивности и устойчивости систем являются система внешнего дыхания, кровообращения, водноэлектролитного и эндокринного гомеостаза.
Слабая сопротивляемость системы дыхания у грудного ребенка обусловлена относительной узостью верхних дыхательных путей, преимущественно диафрагмальным дыханием, повышенной выработкой трахеобронхиального секрета, высокой
потребностью организма в кислороде и связанным с этим та-
хипноэ. При некоторых не только внутригрудных, но и забрю-
шинных новообразованиях (нейробластома, нефробластома) у
маленьких детей значительно ухудшаются условия для адекватного внешнего дыхания.
Опухоли заднего средостения, наиболее часто встречающиеся у детей в возрасте до 1 года, сдавливают ткань легких и смещают средостение, нередко деформируя скелет грудной клетки.
Забрюшинные опухоли, достигая в отдельных случаях огромных
размеров (описаны опухоли массой до 5—6 кг), резко поднимают диафрагму и создают выраженную компрессию органов грудной клетки. Метеоризм у таких детей всегда сопровождается
значительной дыхательной недостаточностью. При сдавлении
органов грудной клетки опухолью нарушается дренажная функция бронхов, появляются очаги ателектазов, возможно присоединение пневмонии, значительно ухудшающей состояние больного и прогноз заболевания.
В такой ситуации при подготовке ребенка к операции учитывают недостаток кислорода, возможность слабой сопротивляемости инфекции, что требует обстоятельного обследования,
включающего исследование газового состава крови и иммунологического статуса. Показаны ингаляции, включающие растворы гидрокарбоната натрия, а при бронхиальной констрикции —
эуфиллина и преднизолона, при вязкой мокроте — протеолитические ферменты. Полезным приемом является дыхание под
постоянным положительным давлением (ДППД) — метод, который впервые применили Огеогу и соавт. (1971) у новорожденных. Этот прием хорошо расправляет легкие и повышает
парциальное давление кислорода в крови. Для осуществления
ДППД используют пластиковую камеру или полиэтиленовый
мешок, которые соединяют с источником кислорода и банкой
Боброва. При превышении давления кислорода и выдыхаемого
воздуха под камерой (мешком) 5—10 см вод.ст. (490—980 Па)
газ пузырьками выделяется через жидкость банки Боброва в атмосферу. Метод можно выполнять в различных вариантах — с
маской наркозного аппарата, интубационной трубкой, носовыми катетерами и др. В настоящее время используют ларингеальную маску и воздуховоды с раздуваемой манжетой типа СОРА.
29
В особо тяжелых случаях гипоксемии в некоторых клиниках
применяют метод гипербарической оксигенации (ГБО), который может быть успешно использован и для предоперационной
подготовки.
При профилактике усугубления расстройств внешнего дыхания необходимо избегать аллергизации ребенка, гипертермии,
охлаждения, психоэмоционального срыва и других неблагоприятных ситуаций, резко повышающих потребление кислорода.
Поэтому предоперационный период должен проходить в условиях надлежащего контроля за состоянием ребенка с использованием комплекса медикаментозных средств и физических методов ухода, повышающих возможности компенсации функции
внешнего дыхания. Присоединение респираторной инфекции у
детей, о которой упомянуто выше, можно предупредить с помощью различных средств повышения неспецифической сопротивляемости, а также методом направленной иммунокоррекции (Т-активин, интерфероны, препараты для коррекции гуморального иммунитета — пентаглобин, интерглобин и др.).
При развитии респираторной инфекции показана незамедлительная антибиотикотерапия в комплексе средств по повышению сопротивляемости, из которых важнейшими являются
аскорбиновая кислота (20—30 мг/кг) и витамины группы В.
В раннем детском возрасте сердечно-сосудистая система более сформирована, чем система дыхания, однако вазомоторная
регуляция далеко не совершенна. Для этого периода развития ребенка характерны централизация кровообращения и относительно высокое удельное периферическое сопротивление. Клинически значимые изменения сосудистого тонуса в грудном возрасте,
по нашим данным, бывают лишь при опухолях, продуцирующих катехоламины и вызывающих симптомы катехоламиновой
недостаточности. Подробнее о предоперационной подготовке
таких больных будет сказано ниже.
Известно, что объем внеклеточного (экстрацеллюлярного)
пространства у детей значительно выше, чем у взрослых. Этот
факт, а также недостаточная способность почек концентрировать мочу и выводить натрий у маленького ребенка, приводит
к тому, что уровень фильтрации в 2 раза ниже, чем у взрослого
человека, в то время как способность выводить натрий (в расчете на 1 м2 поверхности тела) составляет 1/з от таковой у
взрослого человека, поэтому грудные дети склонны к задержке
натрия, воды и хлора, что создает условия для образования отеков. Гидрофильность ткани головного мозга обусловливает развитие отека и набухания мозга при различных интоксикациях
и других патологических состояниях, сопровождающихся нарушением осмолярности крови. Невозможность адекватно выводить натрий, хлор и воду восполняется способностью маленького ребенка к компенсаторному увеличению экстраренальных
потерь (рвота, понос, перспирация), которые возникают в ответ
30
на любое чрезвычайное воздействие инфекционного или токсического характера. Небольшая емкость мочевого пузыря может приводить к его переполнению мочой и резкому снижению
диуреза, поэтому во время операций у грудных детей необходимо производить катетеризацию мочевого пузыря.
При нефробластоме у детей в возрасте до 4 лет, несмотря на
объективное снижение секреторной и экскреторной функции
пораженной почки, наблюдающееся более чем у половины детей с этой патологией, общий объем диуреза не нарушается, что
свидетельствует о достаточной компенсации за счет здоровой
почки.
Этот эффект не исчезает и в послеоперационном периоде после удаления больной почки. Нарушения функции почек чаще
наблюдаются при двустороннем поражении почек нефробласто-
мой, при нефробластоме подковообразной почки, а также при
новообразованиях мочевого пузыря.
При необходимости выполнения оперативного вмешательства у ребенка с клиникой острой почечной недостаточности
проводят экстренную подготовку, включающую все элементы
посиндромной терапии, а при необходимости — гемодиализ.
Недостаточность функции коры надпочечников чаще возникает у детей, леченных глюкокортикоидами. Как правило, до
операции при нефробластоме с поражением надпочечника и
нейробластоме надпочечника функция надпочечников не страдает. При кортикостероме чаще наблюдается гиперфункция коры надпочечников, что можно проследить по клиническим признакам (синдром Кушинга) и лабораторным исследованиям (повышение активности кортизола и кортикостерона, нарушение
соотношения оксикортико- и кетостероидов в моче). Возможность развития острой недостаточности коры надпочечников
может возникнуть после удаления надпочечника в ходе оперативного вмешательства при тяжелом течении операционного и
послеоперационного периодов, однако в целом система надпочечников у детей с солидными новообразованиями вполне надежна. Для улучшения способности к адаптации в период операции и в послеоперационном периоде показана подготовка
адаптогенами (дибазол, элеутерококк).
Особое место следует отвести осложнениям опухолевого процесса (разрыв опухоли, внутреннее кровотечение, перитонит в
результате прорастания опухоли желудочно-кишечного тракта в
брюшную полость и др.). В данном случае предоперационная
подготовка складывается из элементов реанимации и посиндромной терапии.
При рассмотрении вопросов предоперационной подготовки
следует учитывать не только особенности раннего детского возраста и характер локальной патологии. Опухолевый процесс у
грудного ребенка в той или иной степени сопровождается развитием и прогрессированием общей симптоматики, не завися-
31
щей от локализации новообразования, иначе говоря — "общим
опухолевым симптомокомплексом".
"Общий опухолевый симптомокомплекс" проявляется вялостью, постепенно переходящей в адинамию, субфебрилитетом,
снижением аппетита, потерей тургора подкожного жирового слоя
и мышечной массы. Масса опухоли компенсирует потерю массы
тела, поэтому при взвешивании может произойти ошибка в оценке общего состояния ребенка. Опухолевая прогрессия довольно
быстро приводит к анемии, а в далеко зашедших стадиях — к выраженным и плохо корригируемым сдвигам в гемограмме —
тромбоцито- и лейкопении, резкому увеличению СОЭ, лимфо-
пении. На фоне нарастания анемии происходят сдвиги в биохимическом составе крови: нарастает гипогликемия, увеличивается содержание в сыворотке мочевины и остаточного азота, повышается уровень аланиновой и аспарагиновой трансаминаз,
щелочной фосфатазы и особенно лактатдегидрогеназы (ЛДГ).
Следует отметить важность наблюдения за динамикой изменения уровня ЛДГ на этапах лечения ребенка, так как установлено, что в послеоперационном периоде и при эффективных результатах специфической терапии (лекарственной, лучевой)
имеется отчетливая тенденция к снижению уровня ЛДГ в крови.
Уменьшение уровня общего белка в сыворотке крови, а также снижение содержания альбумина при нарастании процентного содержания глобулинов в основном за счет а-2- и р-фрак-
ций у детей более старших возрастных групп возникают при
значительном увеличении размеров новообразования и при генерализации опухолевого процесса. В возрасте до 1 года нарушения белкового обмена, выражающиеся в гипопротеинемии и
гипоальбуминемии, могут возникнуть на ранних стадиях развития опухоли и протекать значительно выраженнее. Это объясняется, с одной стороны, физиологическими особенностями
белкового обмена у грудных детей, с другой — влиянием злокачественной опухоли на обмен протеинов и углеводов, патологические изменения которого тем выраженнее, чем меньше
возраст заболевшего ребенка.
Физиология белкового обмена у новорожденных и грудных
детей характеризуется положительным балансом азота в отличие от взрослых людей, у которых в норме имеется азотистое
равновесие. Только при условии преобладания анаболических
процессов в метаболизме протеинов над катаболическими создается возможность для роста и развития грудного ребенка.
Лишь у детей первых дней периода новорожденное™ и у недоношенных временно может быть нейтральный и даже отрицательный баланс азота. Грудной ребенок в отличие от более старших детей не может ограничиваться минимальными или средними количествами белка, а требует для своего нормального
развития оптимального количества, соответствующего суточным потребностям. Утилизации белков в раннем детском воз-
32
рас re значительно способствует адекватное введение углеводов
нобъеме 140—180 ккална 1 г белка. Суточное количество азота,
выделяемое с мочой, у детей в возрасте до 1 года выше, чем у
• юнее старших детей, и составляет в среднем 350—450 мг/кг в
сутки. У грудных детей общего азота мочи выделяется за счет
мочснины на 10 % меньше, чем у взрослых людей. Чем меньше
ребенок, тем больше моча содержит мочевой кислоты. При
низком диурезе возможно развитие мочекислого инфаркта почек. У грудных детей больше азота с мочой выделяется также за
счет аммиака, что объясняется неполным превращением последнего в мочевину. Характерно и меньшее выведение с мочой
креатинина. Это связано с относительно меньшей мышечной
массой у детей раннего возраста. Аминный азот в составе общего азота мочи занимает больший процент, чем у детей старшею возраста и у взрослых людей.
Опухоль в процессе своего роста поглощает значительные количества белка, которые ребенок получает с пищей. При постепенном увеличении размеров новообразования и биологически
активных быстрорастущих опухолях происходит нарастание дефицита азота; для поддержания жизнедеятельности органов,
имеющих первостепенное значение (мозг, сердце, печень, почки), начинают преобладать катаболические процессы, ведущие
к саморазрушению собственных белков организма. В первую
очередь страдает лимфатическая система; при этом происходит
разрушение периферического лимфоидного аппарата и как
следствие этого — нарастание иммунодефицита. У детей грудного возраста под влиянием опухолевого процесса более резко
снижается уровень иммуноглобулинов в крови, особенно IgM
и IgG, синтез которых происходит преимущественно в селезенке и лимфатических узлах. Поскольку иммуноглобулин класса
IgM содержит основную массу антител против полисахаридных
ан тигенов, О-антигенов грамотрицательных бактерий и других,
становится понятным снижение резистентности к инфекции у
грудных детей со злокачественными опухолями. Хорошо известно, что в первые полгода жизни ребенка синтез IgG находится на низком уровне, что является подтверждением незрелости иммунологической системы у грудных детей. Поставщиками азота являются также мышцы и кожа. Это объясняет
относительно быстрое истощение мышечного слоя, тургора кожи при росте злокачественной опухоли у маленького ребенка.
Особенности углеводного обмена у детей раннего возраста
характеризуются высокой усвояемостью углеводов (98—99 %).
')то объясняет относительно низкий уровень сахара в крови у
детей в возрасте до 1 года по сравнению с детьми более старшего возраста. Натощак в крови здоровых грудных детей количество глюкозы колеблется в пределах 3,3—4,9 ммоль/л. Большая часть всосавшихся гексоз превращается в гликоген, что
обусловлено сравнительно активной работой инсулярного ап¬
33
парата. Чем моложе ребенок, тем слабее выражена пищевая гипергликемия; характер глюкозотолерантного теста в норме мало отличается от такового у взрослого, однако выносливость к
углеводной нагрузке у грудного ребенка выше.
Гликолиз у маленьких детей протекает более интенсивно,
чем у детей старшего возраста. Количество лактата в крови детей 1-го года жизни на 30 % выше, чем у взрослого человека.
Известно, что гликолиз наиболее резко выражен в тканях, растущих особенно интенсивно, — эмбриональных тканях, опухолевых клетках.
Согласно теории В. С. Шапота об опухоли как "ловушке"
глюкозы, незрелая ткань опухоли поглощает огромные количества глюкозы, отбирая ее у организма. Таким образом, при росте опухоли ее способность конкурировать с организмом за источники энергии и азот увеличивается и достигает максимума
либо при достижении огромных размеров, либо при генерализации процесса. Чем меньше масса тела ребенка, тем больше
отношение массы опухоли к массе тела и тем энергичнее новообразование конкурирует с организмом за источники энергии.
При анализе глюкозотолерантных тестов у детей с нефро-
бластомой была установлена повышенная толерантность к углеводной нагрузке при очень низком среднем уровне глюкозы
в крови натощак (2,2—3,8 ммоль/100 мл), а также отсутствие
гипогликемической фазы, следующей в норме за гиперглике-
мической. Выявлено нормальное функционирование инсулярного аппарата, о чем свидетельствуют данные адекватного выделения в кровь инсулина.
Таким образом, высокий уровень обменных процессов в организме детей раннего возраста, потребность в преобладании
анаболических процессов как основных факторов роста и развития ребенка, необходимость в полноценном усвоении относительно больших количеств энергии и азота — все эти физиологические особенности растущего организма вступают в противоречие с энергетическими запросами растущей опухоли,
постепенно (а в раннем детском возрасте относительно быстро)
истощающей резервы организма ребенка.
Коррекция нарушений белкового и углеводного обмена в
предоперационном периоде — сложная задача, так как инфузия
белков и глюкозы может привести к дальнейшему прогрессированию опухолевого процесса. Поэтому длительное применение инфузий по программе вспомогательного парентерального
питания без одновременного проведения лекарственной или
лучевой терапии нежелательно. Короткий курс инфузионной
терапии (2—3 дня) позволяет значительно улучшить состояние
ребенка перед операцией. Инфузионная терапия включает применение глюкозы в 10 % растворе (2—3 г на 1 кг сухого вещества
глюкозы в сутки) с инсулином (1 ЕД на 4 г глюкозы), витаминами (кокарбоксилаза, Bl, В2), калием (не более 2 ммоль/кг в
34
сутки). При интоксикации показано введение гемодеза (детям
моложе 6 мес — по 50 мл, старше 6 мес — по 100 мл в сутки).
С целью коррекции отрицательного баланса азота в инфузионную смесь следует включать аминокислотные смеси (Вамин и
др.) по 7—10 мл/кг.
Работами иностранных авторов доказано, что у детей с неф-
робластомой, саркомой Юинга, опухолями печени, мягких тканей, ЦНС, нейробластомой, ретинобластомой, лейкозами и другими злокачественными опухолями дефицит белкового питания
колеблется в пределах 6—50 %. Наибольшее значение в его возникновении имеют распространенность и продолжительность
существования опухоли, интенсивность противоопухолевого лечения, в том числе цитотоксической терапии, осложнения со
стороны желудочно-кишечного тракта при отсутствии в про-
фамме лечения введения кортикостероидов и стимуляторов аппетита, вмешательства на органах брюшной полости и осложнения основного заболевания со стороны этих органов, а также
психологическая депрессия, негативное отношение к мероприятиям поддерживающей терапии (последнее относится к детям
старшего возраста). В результате белкового дефицита на 30 %
сокращается жизненная емкость легких, нарушается секреторная и моторная функция органов пищеварения, атрофируется
мышечная ткань, повышается риск развития пептических язв и
жировой дегенерации печени.
Адекватная коррекция нарушений белкового питания у детей со злокачественными новообразованиями с помощью питания через рот стала возможна сравнительно недавно, с появлением разнообразных сбалансированных смесей для энтерального питания (Нутрилан, Нутризон, Нутродрип и др.).
Неплохие результаты может дать так называемое дополнительное парентеральное питание, в том числе с введением 2,5—3 г
аминокислот на 1 кг массы тела в течение не менее 21—28 дней.
Эффективность инфузионной терапии в плане предоперационной подготовки значительно увеличивается при назначении
анаболических стероидов продленного действия (нероболил, ре-
таболил) в возрастных дозировках (детям моложе 6 мес —
0,1 мл, старше 6 мес — 0,2 мл). Анаболические стероиды можно назначить в процессе предоперационной химиотерапии или
же за 3—4 дня до операции. В последнем случае максимум действия нероболила или ретаболила проявляется в 1—3-и сутки
послеоперационного периода, наиболее ответственные с точки
зрения операционного риска.
В педиатрии показаниями для введения анаболических стероидов являются гипотрофия, задержка роста, а также различные патологические процессы в стадии реабилитации. Анаболические стероиды способствуют снижению потерь азота с мочой не только в послеоперационном периоде, но и в процессе
предоперационной химиотерапии, стабилизируют уровень про-
35
теинемии и альбуминемии, снижают объем гемотрансфузии,
необходимый для восстановления гемограммы при ее нарушениях под влиянием химиотерапии. Ретаболил у детей с нефро-
бластомой улучшает показатели глюкозотолерантного теста и
углеводный обмен в послеоперационном периоде. Улучшаются
показатели белкового и электролитного обмена, быстрее восстанавливается нормальный уровень IgM и IgG.
Грудные дети хорошо переносят прием экстракта (15—20 капель) из корней элеутерококка колючего (ЭКЭК). Препарат назначают 3 раза в день за 20 мин до приема пищи. ЭКЭК обладает не только адаптогенным эффектом — он улучшает усвояемость глюкозы здоровыми клетками организма, способствует
нормализации гемограммы и перистальтики кишечника.
Использование 10 % раствора альбумина имеет клиническое
значение при гипопротеинемии; раствор следует вводить с заместительными целями. Дети раннего возраста хуже переносят
инфузию этого препарата. Кроме того, для метаболизма 1 г альбумина с целью получения анаболического эффекта требуется
не менее 500 ккал; период полураспада альбумина составляет
60 сут, поэтому в качестве компонента парентерального питания его применять не следует. Нативную плазму дети грудного
возраста переносят лучше, чем введение альбумина. Ее применение оправдано не только при гипо- и диспротеинемии, но и
при необходимости проведения заместительного парентерального питания, так как плазма является источником незаменимых жирных кислот. Однако как источник азота плазма малопригодна, так как период полураспада белков плазмы весьма
длителен и для их катаболизма требуется большое количество
глюкозы как энергетического материала (на 100 мл плазмы
400 мл 10 % раствора глюкозы).
Большое значение в эффективности инфузионно-анаболической предоперационной подготовки имеют витамины, которые
назначают с учетом суточной потребности грудного ребенка.
При некоторых новообразованиях исходное состояние ребенка утяжеляется присоединением симптомов, характерных
для той или иной опухоли. Прежде всего это относится к нейробластомам, течение которых у детей в возрасте до 1 года чаще
сопровождается симптомами катехоламиновой интоксикации —
артериальной гипертензией интермиттирующего характера, побледнением кожных покровов, потливостью, похолоданием конечностей с асимметрией кожной температуры и тонуса сосудов; в тяжелых случаях катехоламиновой интоксикации возникают диспепсические нарушения и алопеция.
Эффективным методом борьбы с указанным синдромом является введение дроперидола (детям до 6 мес — 0,5 мл, старше
6 мес — до 1 мл) за 1—2 ч до ожидаемого катехоламинового
криза, что устанавливается при анализе карты интенсивного
ухода и наблюдения за тяжелобольными. Препараты рауволь-
36
фии, сульфат магния и спазмолитики должного эффекта при
развитии катехоламинового криза, как правило, не дают. Реже
с лечебной целью применяют альфа-адренолитики (фентол-
амин, режитин), используемые в основном для проведения
дифференциальной диагностики с феохромоцитомой.
При нефробластоме у детей грудного возраста чаще, чем в более старшем возрасте, возможно развитие артериальной гипертензии, имеющей постоянный характер. Описана резко выраженная гипертензия при артериальном давлении 180—220 мм рт.ст.
как при одностороннем, так и при двустороннем поражении
почек; гипертензия при нефробластоме плохо поддается действию дроперидола и устраняется лишь оперативным вмешательством.
У детей грудного возраста с указанными новообразованиями
чаще встречается латентная форма гипертонии, которая нередко
просматривается врачами. Выраженное повышение артериального давления может возникнуть при плаче и возбуждении ребенка, а обнаруживается, как правило, лишь в операционной после проведения премедикации недостаточной эффективности.
Обезболивание и седация при диагностических исследованиях.
Незрелость нервной системы у грудного ребенка не означает отсутствия психических эмоций, которые, как хорошо известно,
устанавливаются значительно раньше, чем членораздельная речь.
Отрицательные эмоции ребенок выражает очень бурно, а известно, что крик или безудержный плач приводит к гипоксии либо
значительно ее усугубляет. Кроме того, резкие отрицательные
эмоции могут перерасти в стресс со всеми его клинико-функциональными и гормонально-метаболическими проявлениями.
В связи с этим главный принцип обследования в детской онкологической клинике — фармакологическая седация и надежное обезболивание всех манипуляций, сопряженных с появлением болевого синдрома.
Методы и средства анестезии должны соответствовать анатомо-физиологическим особенностям организма ребенка, учитывать особенности основной и сопутствующей патологии, не
представляя дополнительной опасности для больного.
К средствам седации относят препараты различных фармакологических групп, способные успокоить больного, понизить
избыточные рефлексы, полностью купировать страх перед манипуляцией или перед окружающей обстановкой, внушающей
тревогу.
В медицине седацией пользуются весьма широко — примером может служить так называемая премедикация, которую назначают больному перед наркозом. К задачам премедикации
относят снижение чувства страха, умеренную гипорефлексию,
снижение порогов воздействия средств наркоза на ЦНС и ней-
ромышечную систему. Помимо седативных средств, в премеди-
кацию вводят парасимпатолитики и десенсибилизирующие ве¬
37
щества. На основе известных с давних пор схем премедикации
врачи начали изучать и внедрять в практику различные комбинации препаратов с целью создания продолжительного седативного эффекта.
Для получения адекватного эффекта седации необходимо
знать специфику самой процедуры, т. е. иметь сведения о ее
продолжительности, возможности появления ноцицептивного
(болевого) фактора, положении больного на манипуляционном
столе и другие.
У детей в возрасте от 6 мес до 6 лет легче добиться снотворного
(гипнотического) эффекта, чем удовлетворительной седации.
В более старшем возрасте дети, получив седативные препараты,
могут идти на сотрудничество с медицинским работником, выполняющем диагностическую или лечебную процедуру.
За рубежом весьма широко обсуждается проблема разлучения
ребенка с родителями и присутствия родителей на процедуре.
При этом исходят главным образом из того, может ли присутствие родителей помочь проведению манипуляции. Если ребенок засыпает, то, как правило, родители покидают помещение,
где происходит процедура.
У детей более старшего возраста много зависит от индивидуальных особенностей психики и уже складывающейся личности. Считают, что большинство детей старше 6 лет уже доверяют взрослым. Дети в какой-то степени уже информированы
о строении своего тела, отклонениях от нормы, заболевании,
что имеет значение для удачного проведения процедуры, так
как ребенок начинает понимать ее пользу для своего здоровья.
Однако могут возникать и психотические реакции в связи с
осознанием ребенком вредности для здоровья наркоза и процедуры. В стационарах информация от ребенка к ребенку передается очень быстро, неизбежно приводя к нежелательным
последствиям. Дело врача или родителей — максимально нивелировать искаженную информацию, успокоить ребенка и вселить в него уверенность в безопасности предстоящей манипуляции. Этому способствуют и общий режим лечебного учреждения, и уровень манипуляционного (и анестезиологического)
пособия, не допускающий возникновения осложнений.
Путь введения средств седации или базисного наркоза имеет
большое значение, особенно при повторных процедурах. По
степени дискомфорта, испытываемого ребенком, способы введения препаратов распределяются следующим образом: 1) внутривенное введение; 2) внутримышечная инъекция; 3) ректальное введение; 4) интраназальное и 5) пероральное введение.
Внутривенное введение с целью седации не оправдано по
двум причинам. Первая — это неизбежное стрессорное состояние ребенка и закрепление в его сознании этого эпизода, что
крайне неблагоприятно для последующих процедур (в случаях,
когда имеется постоянный доступ — катетеризирована подклю¬
38
чичная вена — этот фактор отпадает). Второй серьезной причиной ограничения венозного доступа к введению средств седа-
ции является возможное побочное действие препарата, прежде
всего в виде респираторной депрессии, что требует обязательного мониторинга дыхания или (это более эффективно) уровня
сатурации кислорода (SpC>2).
Внутримышечное введение также негативно воспринимается
детьми, и если речь идет о курсовой процедуре (лучевая терапия),
лучше найти другой, безболезненный путь введения. Некоторые препараты (например, бензодиазепины) могут плохо всасываться из мышц в кровоток, что извращает фармакокинетику
препарата и значительно снижает эффект. Это может быть при
плохой микроциркуляции, гипотермии и изменениях pH, когда
может произойти кристаллизация препарата.
При приеме препарата через рот следует учитывать ряд важных моментов: а) избегать горьких и концентрированных растворов; б) не назначать прием препарата через рот после еды:
препарат растворяется в желудочном содержимом и значительно медленнее всасывается; кроме того, возможен рвотный рефлекс, немедленный или отсроченный, что значительно хуже.
Горький препарат второй раз ребенок в рот не возьмет, поэтому
лучший способ — это разведение расчетной дозы в 5 % сиропе.
Концентрированный раствор может дать не только рвоту, но и
диарею (в результате высокой осмолярности раствора). Многие
анестезиологи до сих пор настроены против перорального
приема лекарств с целью седации, считая, что попадание препарата в желудок вызывает немедленную секрецию желудочного сока, а это может стать опасным в связи с возможной регур-
I итацией и последующей аспирацией содержимого. В последние годы к этому относятся с меньшим опасением, особенно
если больному нужна только седация, а не наркоз с введением
миорелаксантов и интубацией трахеи.
При ректальном введении следует учитывать два важных
фактора: 1) добавлять обволакивающие вещества в раствор, обладающий раздражающим действием (например, хлоралгидрат);
2) не вводить через катетер препарат, метаболизирующийся в печени, слишком глубоко — за пределы прямой кишки во избежание попадания препарата в портальную систему и быстрой элиминации.
Исторически одними из первых средств для осуществления
снотворного или седативного эффекта, помимо опиатов, явились производные барбитуровой кислоты — барбитураты.
Основополагающие работы Waters о барбитуратах, применяемых с целью базис-наркоза и седации, были опубликованы в
30-х годах XX в.
Хотя барбитураты при внутривенном введении оказывают депрессивное влияние на респираторную и сердечно-сосудистую
системы, их широко используют при диагностических и лечеб¬
39
ных процедурах. При других путях введения они, как правило,
не дают указанных выше побочных эффектов. Барбитураты
считают хорошими антиконвульсантами. К отрицательным качествам барбитуратов относят гипералгию, которая может развиться при использовании небольших доз барбитуратов. При
ряде заболеваний (порфирия) они противопоказаны.
Используют барбитураты короткого и ультракороткого действия.
Пентобарбитал и секобарбитал — короткодействующие барбитураты; в дозе 3—5 мг/кг внутримышечно или внутрь создают хорошую седацию длительностью 1—2 ч. Оральный путь
приема препаратов предпочтительнее, так как после внутримышечной инъекции продолжительное время сохраняется боль.
Барбитурат ультракороткого действия тиопентал натрия выпускается рядом зарубежных фирм в виде свечей и назначается
с целью седации в дозе 30 мг/кг. Сон у 2/з детей длится 15 мин.
К недостаткам тиопентала натрия причисляют относительно
длительный период полувыведения (9 ± 6,1 ч). Введенная доза
полностью устраняется из плазмы в течение 24—48 ч.
Другой барбитурат ультракороткого действия метогекситал
имеет меньший период полувыведения (3,9 ±2,1 ч). Для осуществления сна или глубокой седации метогекситал применяют
в дозе 20—30 мг/кг ректально. Раствор для введения готовят
следующим образом: 500 мг кристаллического метогекситала
растворяют в 5 мл дистиллированной воды — получается 10 %
раствор препарата. Растворенный препарат набирается в
шприц, к нему подсоединяют катетер, вводимый в прямую
кишку. Необходимо набрать в шприц воздух, вдувание которого через шприц после введения лекарства позволяет более равномерно его распределить по стенкам прямой кишки. После
введения 20 мг/кг препарата дети засыпают в течение 15 мин.
Для проведения безболезненной манипуляции или сеанса лучевой терапии достаточна доза 20 мг/кг. При введении 30 мг/кг
обеспечивается возможность венепункции или подобной по
степени болевого воздействия манипуляции. Ректальное введение препарата обеспечивает хорошие результаты у детей от
6 мес до 6 лет. Авторы методики считают, что ректальное введение может (или должно) производиться в присутствии родителей, большинство из которых предпочитают эту методику,
так как введение препарата не связано с болью и во сне ребенка
легко забрать у родителей.
Аналогично методике применения метогекситала можно
вводить и гексенал — барбитурат ультракороткого действия. Он
используется главным образом для вводного наркоза внутривенно, однако накоплен богатейший опыт его применения для
седации (в реанимации для синхронизации больного с аппаратом ИВЛ и других целей). С целью обеспечения фармакологического сна или седации гексенал вводят внутримышечно или
40
ректально. При внутримышечном введении используют дозу
10 мг/кг препарата в 10 % растворе, а ректально — в тех же дозировках, что и метогекситал (20—30 мг/кг). В настоящее время
эти методы введения гексенала используют достаточно редко,
как правило, при отсутствии более современных альтернативных препаратов, однако о возможности создания длительного
и глубокого седативного эффекта или глубокого фармакологического сна с помощью гексенала следует помнить. Напомним,
что тиопентал натрия ректально вводят только в свечах (!).
К применяемым небарбитуровымпрепаратам относятся хлоралгидрат и триклофос — средства для энтерального применения. Они используются для седации в педиатрии, хотя относятся к противосудорожным средствам. Оба обладают продолжительным началом и длительным периодом действия. Период
полувыведения их метаболита трихлорэтанола превышает 8 ч.
Хлоралгидрат чаще используется для седации не анестезиологами, а врачами рентгенологических и других диагностических кабинетов, так как, по мнению анестезиологов, этот препарат не обеспечивает глубокого медикаментозного сна. Хлоралгидрат имеет неприятный вкус, раздражает кожу, слизистые
оболочки и желудочно-кишечный тракт. Доза для орального
применения колеблется между 50 и 70 мг/кг, и эффект наиболее выражен, если прием препарата осуществлен за 90—120 мин
до исследования. В последние годы было выяснено образование некоторых токсических метаболитов хлоралгидрата, в связи
с чем его выпуск во многих странах приостановлен.
Триклофос, назначаемый в дозе 70 мг/кг, в меньшей степени раздражает слизистые оболочки. После приема препарата
внутрь максимальный эффект наступает через 90—120 мин. Депрессии дыхания и сердечно-сосудистой системы препарат не
вызывает.
Оксибутират натрия, относящийся кноотропам, по химическому строению и фармакологическим свойствам близок к
гамма-аминомасляной кислоте (ГАМК). Рецепторы в ЦНС, через которые реализуются эффекты многих психофармакологических средств, в том числе бензодиазепинов, называют ГАМК-
рецепторами (или GABA-рецепторами). Оксибутират натрия
как ноотропный препарат вызывает антигипоксический, седативный и центральный миорелаксирующий эффект; он потенцирует действие анальгетиков, обладает противошоковым и ан-
тисудорожным действием. Благоприятно воздействует на сетчатку глаза.
Для создания снотворного или глубокого седативного эффекта у детей оксибутират натрия назначают внутрь в дозе 120—
150 мг/кг в 5 % растворе глюкозы или в 5 % сиропе. Вводят оксибутират натрия и внутримышечно (100—120 мг/кг). Сон
длится до 2—3 ч. Внутривенно препарат применяют либо с целью вводного наркоза, либо как средство для лечения отека мозга.
41
Препараты, относящиеся ктранквилизаторам, включают бензодиазепины, фенотиазины и бутирофеноны. Они
уменьшают тревогу и создают различной степени седативный
эффект.
Бензодиазепины (БД) широко используют для седации у детей.
Они оказывают успокаивающее действие, ослабляют чувство
тревоги, вызывают амнезию. Низкие дозы создают дремотное
состояние без депрессии дыхательной и сердечно-сосудистой
систем. После применения БД тошноты и рвоты не возникает.
Диазепам (седуксен, реланиум, сибазон) — один из наиболее
распространенных препаратов, используемых с целью седации,
хотя он весьма ограниченно применяется у новорожденных и
грудных детей. Диазепам метаболизирует в печени и имеет продолжительный период полувыведения (до 40 ч у взрослых). При
нарушениях функции печени период полувыведения значительно увеличивается. Это происходит и при еще незрелой
функции печени у новорожденных и грудных детей. По эффективности пути введения диазепама распределяются так: внутривенный — оральный — ректальный — внутримышечный.
Ректальное введение (1 мг/кг) более эффективно, чем применение диазепама в свечах. Пик концентрации препарата после
ректального введения раствора диазепама отмечается через
20 мин. Средняя доза для орального применения — 0,1—0,3 мг/кг,
хотя она может быть и повышена до 0,5 мг/кг.
Лоразепам (лорафен, мерлит) применяют старшим детям (по
данным фирмы-производителя, детям старше 12 лет в таблети-
рованной форме и с 18 лет — в виде инъекций). Доза для седации (премедикации) составляет 0,05 мг/кг. Максимальная доза
4 мг. Преимущества перед диазепамом — меньшее раздражение
в месте инъекции и более эффективная амнезия. По сравнению
с диазепамом начало и период действия более продолжительные. Однако специалисты оценивают этот препарат по основным качествам значительно ниже диазепама.
Мидазолам — короткодействующий, водорастворимый бен-
зодиазепин с периодом полувыведения около 2—3 ч. Он наиболее часто используется у детей с целью седации, так как превосходит по быстроте действия и элиминации другие БД. Его
вводят внутривенно, внутримышечно, ректально, интраназаль-
но и орально. Он не вызывает раздражения тканей. Пик плазменной концентрации мидазолама после интраназального введения — 10 мин, после ректального — 16 мин, орального —
около 50 мин.
Ввиду того что печень активно метаболизирует мидазолам,
дозы препарата при энтеральных путях введения выше, чем при
парентеральных. Для адекватной седации рекомендуют следующие дозы мидазолама: при внутривенном и внутримышечном
введении — 0,1—0,2 мг/кг; назальном — 0,2 мг/кг; оральном —
0,5—0,75 мг/кг; ректальном — 1 мг/кг.
42
Фенотиазины реже бензодиазепинов применяются у детей с
целью седации, однако они занимают серьезное место в преме-
дикации и в настоящее время.
Прометазин (дипразин, пипольфен) наиболее часто из фено-
I Пл атовых производных включают в схемы премедикации и седи ци и. Он относится к так называемым большим транквилизаторам; по химическому строению и фармакологическим свойствам близок к аминазину (последний в настоящее время с
целью седации почти не применяют).
Ирометазин оказывает выраженное влияние на ЦНС, окалывая седативно-транквилизирующее воздействие; он усиливает действие анальгетиков, снотворных средств, снижает температуру тела. Влияние на сосудистую систему может проявиться
в развитии ортостатического коллапса (при резком переводе
Пильного из горизонтального в вертикальное положение). На
сердце и респираторную систему практически не действует.
Ирометазин является мощным антигистаминным средством
(блокатором Hi-рецепторов), обладает противорвотной активностью и антихолинергическими свойствами. Рекомендуемые
дозы прометазина — 0,5—1 мг/кг внутрь. Эффект начинается
через 20 мин и длится 4—6 ч. Прием препарата может сопровождаться сухостью и местной анестезией тканей ротовой полости. При внутримышечной инъекции возможно развитие инфильтратов. Разовая доза для детей может быть вычислена по
формуле:
РДц = РДв/МТ • ДФ,
|дс РДц — разовая доза детская; РДв — разовая доза взрослого;
МТ — масса тела в кг; ДФ — дозис-фактор Харнака (до 1 года) — 1,8; (1—3 года) — 1,6; (4—8 лет) — 1,4; (9—15 лет) — 1,2.
Принцип рассчитывать дозу по дозис-фактору Харнака, исходя из дозы взрослого (ДФ = 1), является универсальным и
удобным, особенно в неотложных обстоятельствах, когда под
рукой нет рецептурного справочника.
Бутирофеноны используются для седации в основном в виде
дроперидола — мощного нейролептика, создающего эффект так
называемой минерализации (безразличия к окружающему). Дро-
нсридол также относят к классу "больших транквилизаторов". Он
является альфа-адренолитическим препаратом, что следует учитывать, оценивая вегетативные проявления и общее состояние
больного. В небольших дозах препарат дает хороший противо-
рвотный эффект. Это важно у детей с заболеваниями глазного яб-
иока или орбиты, особенно при опухолях. Вводят 50—75 мкг/кг
дроперидола внутривенно в составе премедикации. После внутривенного и внутримышечного введения 100—150 мкг/кг дроперидола его действие начинается через 3—10 мин; пик действия — через 30 мин. Седативно-транквилизирующий эффект
дроперидола может продолжаться 2—4 ч, в ряде случаев — зна¬
43
чительно дольше (до 12 ч). Поскольку дроперидол значительно
потенцирует действие других препаратов, при комбинации с
ними дозу следует уменьшить. При назначении дроперидола
следует учитывать степень гиповолемии и возможность появления экстрапирамидных расстройств.
Кетамин (кеталар, калипсол, кетанест) относится к средствам для наркоза. Он обладает и наркотизирующим (анестезирующим), и анальгетическим действием. Воздействие на ЦНС
характеризуется как диссоциативное. Суть диссоциативной
анестезии в том, что препарат угнетает ассоциативную зону и
подкорковые образования таламуса. В связи с этим эффектом
кетамин способен создавать картину, несвойственную другим
внутривенным анестетикам: нередко отмечают кратковременное, но выраженное повышение двигательной активности, возможны резкое повышение мышечной спастичности, появление
галлюцинаторного синдрома как при введении в анестезию, так
и после ее окончания. Однако эти побочные явления связаны
с двумя основными факторами: скоростью введения препарата
и применением профилактических мероприятий. При медленном (лучше — инфузионном) введении побочные явления значительно нивелируются. К профилактическим мерам следует
отнести применение специфических и неспецифических протекторов кетамина.
Специфическими протекторами являются препараты бензо-
диазепинового ряда (БД), среди которых наиболее часто анестезиологи используют диазепам или мидазолам. Назначение
одного из этих препаратов перед введением кетамина обеспечивает спокойное введение в анестезию без указанных побочных эффектов. Неспецифические протекторы — это препараты,
предварительное введение которых также предупреждает или
снижает выраженность побочных эффектов кетамина. К ним
можно отнести нейролептики (дроперидол) и барбитураты. Было замечено, что после введения гексенала или тиопентала кетамин не вызывает описанных выше побочных эффектов.
Следует отметить, что при внутримышечном и других путях
введения (кроме внутривенного) побочные эффекты кетамина
почти не проявляются, особенно у детей. Дети вообще значительно лучше переносят кетамин, чем взрослые.
С целью седации используют, как правило, внутримышечный путь введения. Доза 6—8 мг/кг создает анестезию (на фоне
фармакологического сна) через 6—10 мин, которая длится в
среднем 30—40 мин.
Кетамин по праву можно назвать одним из основных анестетиков в педиатрии, способных решить самые разнообразные
задачи. Учитывая, что он обладает выраженным анальгетическим эффектом, его можно использовать при выполнении различных болезненных манипуляций. Однако он вполне надежен
и при процедурах, не сопровождающихся болевым синдромом.
44
Таблица 1.1. Препараты для премедикации [Letty М.Р. et al., 1993]
Препарат
Путь введения
Доза (мг/кг)
Метогекситал (10 %)
Ректальный,
20-30
Бензодиазепины:
внутримышечный
10
диазепам
Оральный
0,1-0,5
мид азолам
Оральный
0,4-0,75
Интраназальный
0,2
Ректальный
0
1
о
Внутримышечный
0,08
Кетамин
Оральный
3-6
Интраназальный
3
Ректальный
6-10
Анальгетики:
Внутримышечный
2-10
фентанил
Оральный
15—20 мкг/кг
морфин
Внутримышечный
0,1-0,3
суфентанил
Интраназальный
1—3 мкг/кг
В табл. 1.1 представлены дозы различных препаратов, применяемых в педиатрии для создания седативного и снотворного
эффектов.
В проблеме седации при лучевой терапии у детей, страдающих
злокачественными опухолями, возникает много сложностей.
К сожалению, в настоящее время этому вопросу придают недостаточно серьезное значение, так как в доступной литературе отсутствуют работы, систематизирующие чей-либо опыт в этой
области.
На основании своего опыта мы можем выделить ряд проблем, которые необходимо изучать в дальнейшем.
• Седация у больных с болевым синдромом
При болевом синдроме проблема создания удовлетворительной седации при лучевой терапии осложняется не
только у маленьких, но и у более взрослых детей. Актуальный вопрос — какой анальгетик вводить в схему седации. Если больной получает наркотический анальгетик,
то необходимо его включать в комбинацию препаратов,
но иметь в виду, что он потенцирует действие седативных
препаратов, с одной стороны, однако способен при длительном болевом синдроме повысить резистентность к
седативным средствам — с другой.
45
• Седация при лучевой терапии у маленьких детей
Эта проблема особенно остро стоит при многосеансных
курсах. Маленькие дети отличаются не только особенностями психики, но и более высокой толерантностью к седативным препаратам. В силу особенностей фармакокинетики препаратов у маленьких детей (особенно до 3 мес)
ожидаемая эффективность многих проверенных схем может не оправдаться. Отсутствие должного эффекта (например, после введения ребенку оксибутирата натрия)
ставит вопрос о дополнительном введении либо этого,
либо другого седативного средства. Тут же возникает вопрос, какой путь избрать для введения дополнительного
препарата и в какой дозе.
Мы неоднократно сталкивались со случаями очень высокой толерантности к мидазоламу, реланиуму, оксибути-
рату натрия и даже к кетамину у маленьких детей. Конечно, в таких случаях следует отдать предпочтение наиболее
сильному препарату, но применение последнего требует
мониторинга. В связи с этим встает и другой, не менее
важный вопрос — проблема безопасности пациента.
• Проблема безопасности пациента
Разработанная в анестезиологии передовых стран за последнее десятилетие концепция безопасности больного
декларирует применение кардиореспираторного мониторинга при применении препаратов, способных вызвать
депрессию дыхания и сердечно-сосудистой системы. Современный монитор, который обязательно находится в
операционной и палатах интенсивной терапии, должен
соответствовать так называемому гарвардскому стандарту: неинвазивное определение артериального давления
(NIBP), насыщение крови кислородом (SpC>2), частота
сердечных сокращений по плетизмограмме или ЭКГ.
Многие диагностические исследования (КТ, пункции под
КТ, МРТ) у детей в зарубежных клиниках проводят не
только в условиях полного мониторинга по указанному
стандарту, но и с применением общей анестезии (препараты для наркоза, миорелаксанты, искусственная вентиляция легких), так как, по мнению анестезиологов, только такой вид анестезиологического обеспечения может
гарантировать безопасность больного, находящегося в
помещении, отделенном от персонала.
Анестезиологическое пособие, кроме того, должно строго
соответствовать тем требованиям, которые предъявляются процедурой.
Так, при кратковременных исследованиях (пункция костного мозга, пункционная биопсия опухоли, введение химиопре-
46
Маратов в спинномозговой канал) адекватным методом является
злкисно-кислородный наркоз, осуществляемый подачей через
маску наркозного аппарата смеси закиси азота и кислорода
( 1:1) без премедикации. Опыт показал, что закись азота у не-
а гропинизированных детей вызывает незначительную саливацию; при повышенной саливации и симптомах сдавления легких новообразованием для премедикации обязательно вводят
атропин (0,1 мл подкожно). Использование для премедикации
иромедола, дроперидола или седуксена при кратковременных
манипуляциях (от 2 до 5 мин) не оправдано, так как в после-
иаркозный период у детей сохраняются сонливость, депрессия,
что исключает возможность активного поведения ребенка в течение дня.
При частом применении закиси азота у ребенка может возникнуть резистентность к анестетику. В таких случаях показана
нрсмедикация промедолом или дроперидолом; последний особенно показан в случаях повышения рвотного рефлекса. При
использовании промедола и дроперидола включение в преме-
дикацию атропина строго обязательно.
При пальпации живота в условиях тотальной миорелаксации
также целесообразно применение закиси азота с кислородом.
1’елаксант деполяризующего типа (листенон, миорелаксин, ди-
шлин) вводят в дозе 1—1,5 мг на 1 кг массы тела после индукции, осуществляемой подачей закиси азота и кислорода (3:1)
через маску наркозного аппарата. В этих случаях для премеди-
кации обязательно назначение атропина. Искусственная вентиляция легких (ИВЛ) осуществляется мешком или мехом наркозного аппарата по полуоткрытому типу при общем газотоке
нс менее 2—3-минутных объемов дыхания ребенка. Промедол
и другие средства премедикации (нейролептики, транквилизаторы) показаны в исключительных случаях — при резкой негативной реакции ребенка и при болевом синдроме.
Следует помнить, что недопустимо непосредственно перед
или же сразу после введения миорелаксантов деполяризующего
действия вводить циклофосфан или антибиотики аминоглико-
зидового ряда, так как они резко пролонгируют и потенцируют
действие деполяризующих релаксантов и способны вызвать
длительное апноэ у маленького ребенка.
Преимущества изложенной методики анестезии перед другими заключаются в следующем: 1) методика технически проста
и безопасна; 2) ингаляция закиси азота с кислородом позволяет
пунктировать вену для введения миорелаксанта безболезненно;
.1) апноэ, развивающееся после введения миорелаксантов в указанных дозах на фоне закисно-кислородного наркоза и премедикации, содержащей только атропин, не превышает 3—5 мин,
чего вполне достаточно для проведения тщательной пальпации
живота и выполнения комплекса исследований; 4) полное восстановление активности больного наступает через 7—10 мин
47
после введения миорелаксанта без признаков остаточной сонливости, угнетения мышечной активности. Быстрое восстановление исходной активности позволяет широко использовать
данный метод анестезии в амбулаторных условиях.
Особое значение имеет общая анестезия, применяемая при
ангиографических исследованиях у грудного ребенка, так как с
помощью данного метода диагностируется большинство злокачественных опухолей в детском возрасте.
Анестезия кетамином (кеталаром) является на сегодняшний
день наиболее эффективной при ангиографических исследованиях, включая аортографию у грудных детей. После премеди-
кации атропином, диазепамом (мидазоламом) и/или дропери-
долом (в тех случаях, когда психомоторные реакции ребенка
повышены) внутримышечно вводят кетамин (кеталар) в дозе
8—10 мг/кг. Длительность анестезии при аортографии после
однократной инъекции — 30—40 мин; поддерживать анестезию
рациональным дополнительным введением кетамина внутривенно (в дозе 1,5—2 мг/кг). Препарат увеличивает артериальное
давление, но не вызывает спазма бедренной артерии, поэтому
условия для ее пункции благоприятные. После внутримышечного введения первоначальной дозы кетамина (кеталара) возможно в единичных случаях угнетение дыхания, которое необходимо контролировать визуально или (лучше) с помощью
пульсоксиметра.
К преимуществам анестезии кетамином следует отнести активность рефлексов с гортани и глотки, отсутствие западания
языка и челюсти, быстрое пробуждение без выраженных явлений посленаркозной депрессии. Анестезия кетамином (кеталаром) противопоказана больным с выраженной артериальной
гипертензией и при склонности к судорожным состояниям.
Анестезия кетамином (кеталаром) в настоящее время является
средством выбора при рентгенографии черепа, компьютерной
томографии, лучевой терапии у детей в возрасте до 1 года. Отсутствие токсического эффекта при его применении делает кетамин предпочтительным анестетиком, особенно при повторных
анестезиях. Необходимость полного обездвиживания маленького
ребенка требует выключения сознания, что удается при назначении внутримышечной инъекции кетамина (кеталара) в дозе
8—10 мг/кг.
Однако сложность проблемы обезболивания при повторных
диагностических исследованиях или лечебных процедурах заключается в том, что уже со 2-го дня применения кетамина или другого препарата начинает прослеживаться устойчивость к нему.
Ранний детский возраст можно с уверенностью охарактеризовать как возраст повышенной устойчивости к транквилизаторам
(седуксен, триоксазин), нейролептикам (дроперидол) и некоторым общим анестетикам, каким является кетамин. Иногда уже
на 3-й день лечебной процедуры (лучевая терапия) приходится
48
увеличивать дозу кетамина до 12—14 мг/кг для достижения эффекта. В то же время у детей грудного возраста повышена чув-
1'гпи гельность к наркотическим анальгетикам (промедол, фен-
пшил) и фенотиазиновым производным. Это обстоятельство
ниосит известные трудности в решение проблемы достижения
снотворного или мощного седативного эффекта у грудных де-
юй при проведении серии рентгенологических исследований
(снимок черепа в разных проекциях, серия снимков скелета для
выявления метастатического поражения), а также при ежедневном проведении лучевой терапии. Для этой цели применение
морфина адекватно только при выраженном сопутствующем
Полевом синдроме, однако это требует постоянного монитор-
ного наблюдения за состоянием функции внешнего дыхания у
маленького ребенка.
Устойчивость к транквилизаторам, нейролептикам и кетамину (кеталару) увеличивается с каждым днем их применения,
поэтому целесообразно пользоваться различными схемами или
препаратами: например, в 1-й день использовать комбинацию
дроперидола и седуксена, во 2-й день — оксибутират натрия
(100 мг/кг), в 3-й — кетамин (кеталар) или даже гексенал рек-
тльно или внутримышечно. Проблема создания нетоксичного
и эффективного метода анестезии у детей раннего возраста еще
не до конца разработана и имеет в первую очередь организационный характер.
11еобходимо закрепление анестезиолога на ежедневном рабочем месте в отделении лучевой терапии и в клинических отделениях, целесообразно организовать систему мониторного
наблюдения за состоянием больного в отделениях лучевой терапии, радиохирургии, кабинетах ангиографии и других спе-
циализированных подразделениях, где необходимо дистанционное наблюдение за состоянием ребенка в процессе анестезии.
Общая анестезия при оперативных вмешательствах. Компоненты общей анестезии у детей. Терминологически анестезию
при оперативных вмешательствах подразделяют на общую, проводниковую и местную.
Главным требованием к анестезии как у взрослых, так и у детей является ее адекватность. Под адекватностью анестезии
понимают:
• соответствие ее эффективности характеру, выраженности
и длительности операционной травмы;
• учет требований к ней в соответствии с возрастом пациента, сопутствующей патологией, тяжестью исходного состояния, особенностями нейровегетативного статуса и т. д.
Адекватность анестезии обеспечивается с помощью управления различными компонентами анестезиологического пособия.
()сновные компоненты современной общей анестезии реализуют следующие эффекты: 1) торможение психического воспри¬
49
ятия (гипноз, глубокая седация); 2) блокаду болевой (афферентной) импульсации (аналгезия); 3) торможение вегетативных реакций (гипорефлексия); 4) выключение двигательной
активности (миорелаксация или миоплегия).
В связи с этим выдвинуто понятие так называемого идеального анестетика, что определяет основные направления и тенденции в развитии фармакологии.
Анестезиологи, работающие в педиатрии, учитывают особенности организма ребенка, влияющие на фармакодинамику
и фармакокинетику компонентов анестезии. Из них наиболее
важные:
• снижение связывающей способности белков;
• увеличенный объем распределения;
• снижение доли жировой и мышечной массы.
В связи с этим начальные дозировки и интервалы между повторными введениями у детей часто значительно отличаются от
таковых у взрослых пациентов.
Средства ингаляционной анестезии. Ингаляционный (в англоязычной литературе — volatile, "летучий") анестетик из испарителя наркозного аппарата в процессе вентиляции поступает
в альвеолы и из них — в кровоток. Из крови анестетик распространяется во все ткани, в основном концентрируясь в мозге,
печени, почках и сердце. В мышцах и особенно в жировой ткани концентрация анестетика растет очень медленно и значительно отстает от ее нарастания в легких.
У большинства ингаляционных анестетиков роль метаболической трансформации невелика (20 % у галотана), поэтому между величиной вдыхаемой концентрации и концентрации в
тканях имеется определенная взаимосвязь (прямо пропорциональная при наркозе закисью азота).
Глубина анестезии в основном зависит от напряжения анестетика в мозге, что непосредственно связано с его напряжением в
крови. Последнее зависит от объема альвеолярной вентиляции и
величины сердечного выброса (так, снижение альвеолярной вентиляции и увеличение сердечного выброса увеличивают длительность периода индукции). Особое значение имеет растворимость анестетика в крови. Высокую растворимость имеют
мало используемые в настоящее время диэтиловый эфир, ме-
токсифлуран, хлороформ и трихлорэтилен; низкую — современные анестетики (изофлуран, севофлюран и др.).
Подача анестетика может проводиться через маску или
эндотрахеальную трубку. Ингаляционные анестетики
могут быть использованы в виде нереверсивного (выдох в
атмосферу) и реверсивного (выдох частично в наркозный
аппарат, частично в атмосферу) контуров. В реверсивном контуре имеется система поглощения выдыхаемой углекислоты.
50
В педиатрической анестезиологии чаще используют нереверсивный контур, который имеет целый ряд недостатков, в частности потерю больным тепла, загрязнение атмосферы операционной, большой расход наркозных газов. В последние годы
в связи с появлением нового поколения наркозно-дыхательной
техники и мониторинга все более широко начинает использоваться метод реверсивного контура по системе низкопоточной
анестезии (low flow anaesthesia). Общий газоток при этом составляет величину менее 1 л/мин.
Общая анестезия ингаляционными анестетиками у детей используется значительно чаще, чем у взрослых пациентов. Это
связано прежде всего с широким применением масочных анестезий у детей. Наиболее популярным анестетиком в России
является галотан (фторотан), который обычно применяется в
сочетании с закисью азота.
Детям необходима большая концентрация ингаляционного
анестетика (около 30 %), чем взрослым, что, по-видимому, связано с быстрым увеличением альвеолярной концентрации анестетика вследствие высокого отношения между альвеолярной
вентиляцией и функциональной остаточной емкостью. Также
имеют значение высокий сердечный индекс и относительно
высокая его пропорция в мозговом кровотоке. Это приводит к
тому, что у детей введение в анестезию и выход из нее при прочих равных условиях происходят быстрее, чем у взрослых. Вместе с тем возможно и очень быстрое развитие кардиодепрессив-
ного эффекта, особенно у новорожденных.
Галотан (фторотан, наркотан, флюотан) — самый распространенный на сегодняшний день ингаляционный анестетик в
России. У детей вызывает постепенную потерю сознания (в течение 1—2 мин); препарат не раздражает слизистые оболочки
дыхательных путей. При дальнейшей его экспозиции и увеличении вдыхаемой концентрации до 2,4—4 об.% через 3—4 мин
от начала ингаляции наступает полная потеря сознания. Галотан
обладает относительно низкими анальгетическими свойствами,
поэтому его обычно комбинируют с закисью азота или наркотическими анальгетиками. Галотан оказывает бронхолитическое
действие, в связи с чем показан для анестезии у детей с бронхиальной астмой. К негативным свойствам галотана относят повышение чувствительности к катехоламинам (их введение в ходе
анестезии галотаном противопоказано). Обладает кардиоде-
прессивным действием (угнетает инотропную способность миокарда, особенно в высоких концентрациях), снижает периферическое сосудистое сопротивление и артериальное давление. Галотан заметно увеличивает мозговой кровоток, в связи с чем его
применение не рекомендуется детям с повышенным внутричерепным давлением. Он также не показан при патологии печени.
У энфлурана (этрана) растворимость кровь/газ немного ниже,
чем у галотана, поэтому индукция и выход из анестезии проис¬
51
ходят несколько быстрее. В отличие от галотана энфлуран обладает анальгетическими свойствами. Депрессивное действие
на дыхание и сердечную мышцу выражено, но чувствительность к катехоламинам значительно ниже, чем у галотана. Вызывает тахикардию, увеличение мозгового кровотока и внутричерепного давления, токсическое воздействие на печень и
почки. Имеются данные об эпилептиформной активности эн-
флурана.
Изофлуран (форан) еще менее растворим, чем энфлуран.
Чрезвычайно низкий метаболизм (около 0,2 %) делает анестезию более управляемой, а индукцию и восстановление — более
быстрыми, чем у галотана. Обладает анальгетическим действием. В отличие от галотана и энфлурана изофлуран не оказывает
существенного влияния на миокард в средних концентрациях.
Изофлуран снижает артериальное давление вследствие вазодилатации, за счет чего немного увеличивает частоту сердечных
сокращений, не сенсибилизирует миокард к катехоламинам.
Меньше, чем галотан и энфлуран, влияет на перфузию мозга и
внутричерепное давление. К недостаткам изофлурана следует
отнести увеличение при индукции секреции дыхательных путей, кашля и достаточно частые (более 20 %) случаи ларинго-
спазма у детей.
Севофлюран и дезфлюран — ингаляционные анестетики последнего поколения, еще не нашедшие широкого применения
в России.
Закись азота — бесцветный газ тяжелее воздуха, с характерным запахом и сладковатым вкусом, не взрывоопасен, хотя
поддерживает горение. Поставляется в жидком виде в баллонах
(1 кг жидкой закиси азота образует 500 л газа). В организме не
метаболизирует. Обладает неплохими анальгетическими свойствами, но очень слабый анестетик, поэтому используется как
компонент ингаляционной или внутривенной анестезии. Используется в концентрациях не более 3:1 по отношению к кислороду (более высокие концентрации чреваты развитием ги-
поксемии). Кардиальная и респираторная депрессия, влияние
на церебральный кровоток минимальны. Длительное применение закиси азота может привести к развитию миелодепрессии
и агранулоцитоза.
Компоненты внутривенной анестезии. К ним предъявляют
следующие требования: 1) быстрота наступления эффекта;
2) незатруднительное внутривенное введение (низкая вязкость)
и безболезненность инъекции; 3) минимальная кардиореспира-
торная депрессия; 4) отсутствие побочных явлений; 5) возможность проведения режима титрования; 6) быстрое и полное восстановление пациента после анестезии.
Используют эти средства как в комбинации с ингаляционными, так и без них — последний способ получил название тотальной внутривенной анестезии (ТВА). Именно при этом спо¬
52
собе анестезии удается полностью избежать отрицательного
воздействия на организм персонала операционной.
Гипнотики обеспечивают выключение сознания пациента.
Они, как правило, хорошо растворяются в липидах, быстро
проходя через гематоэнцефалический барьер.
В педиатрической анестезиологии широко используют барбитураты, кетамин, бензодиазепины и пропофол. Все эти средства по-разному оказывают влияние на дыхание, внутричерепное давление и гемодинамику.
Барбитураты. Наиболее широко используемыми для общей
анестезии барбитуратами являются тиопентал натрия и гексе-
нал, которые большей частью применяют для индукции у
взрослых пациентов и значительно реже у детей.
Тиопентал натрия у детей используют в основном для индукции внутривенно в дозе 5—6 мг/кг, в возрасте до 1 года 5—
8 мг/кг, у новорожденных 3—4 мг/кг. Потеря сознания наступает через 20—30 с и продолжается 3—5 мин. Для поддержания
эффекта требуются дозы 0,5—2 мг/кг. У детей используют 1 %
раствор, а у более старших — 2 %. Как и большинство других
гипнотиков, тиопентал натрия не имеет анальгетических
свойств, хотя он и снижает порог болевой чувствительности.
У детей тиопентал метаболизирует в 2 раза быстрее, чем у
взрослых. Период полувыведения препарата составляет 10—
12 ч, что в основном зависит от функции печени, так как с мочой выделяется очень небольшое количество. Обладает умеренной способностью связывания с белками, особенно альбуминами (свободная фракция составляет 15—25 %). Препарат токсичен при подкожном или внутриартериальном введении,
обладает гистамин-эффектом, вызывает депрессию дыхания,
вплоть до апноэ. Обладает слабым вазодилатирующим эффектом и вызывает депрессию миокарда, активирует парасимпатическую (вагусную) систему. Отрицательные гемодинамические
эффекты особенно выражены при гиповолемии. Тиопентал повышает рефлексы с глотки, может вызвать кашель, икоту, ла-
ринго- и бронхоспазм. У некоторых больных имеется толерантность к тиопенталу, причем у детей она бывает реже, чем у
взрослых. Премедикация промедолом у детей позволяет приблизительно на 1/з уменьшить индукционную дозу.
Гексенал по своим свойствам мало отличается от тиопентала.
Препарат легко растворим в воде, причем хранить такой раствор можно не более часа. У детей его вводят внутривенно в виде 1 % раствора (у взрослых 2—5 %) в дозах, аналогичных тиопенталу. Период полувыведения гексенала около 5 ч, влияние
на дыхание и гемодинамику аналогично тиопенталу, хотя вагусное действие выражено в меньшей степени. Реже регистрируются случаи ларинго- и бронхоспазма, поэтому его чаще используют для индукции.
53
Доза тиопентала и гексенала для индукции у детей старшего
возраста (как и у взрослых) составляет 4—5 мг/кг при внутривенном введении. В отличие от тиопентала гексенал можно вводить внутримышечно (в/м) и ректально. При в/м введении доза
гексенала составляет 8—10 мг/кг (при этом индукция наркотического сна наступает через 10—15 мин). При ректальном введении гексенал используют в дозировке 20—30 мг/кг. Сон наступает через 15—20 мин и длится не менее 40—60 мин (с последующей длительной депрессией сознания, требующей
контроля). В наши дни к этому методу прибегают редко и лишь
в случаях отсутствия возможности использовать более современные методики.
Кетамин — дериват фенциклидина. При его введении сохраняются гортанный, глоточный и кашлевой рефлексы. У детей
используется широко как для индукции, так и для поддержания
анестезии. Очень удобен для индукции в виде внутримышечных
инъекций: доза для детей до 1 года — 10—13 мг/кг, до 6 лет —
8—10 мг/кг, более старших — 6—8 мг/кг. После в/м введения
эффект наступает через 4—5 мин и длится 16—20 мин. Дозы
для в/в введения составляют 2 мг/кг; эффект развивается в течение 30—40 с и длится около 5 мин. Для поддержания анестезии используется в основном в виде постоянной инфузии со
скоростью 0,5—3 мг/кг в час. Введение кетамина сопровождается повышением артериального давления и частоты сердечных
сокращений на 20—30 %, что определяется его адренергической активностью. Последняя обеспечивает бронходилатирую-
щий эффект. Лишь 2 % раствор кетамина выделяется с мочой в
неизмененном виде, остальная (подавляющая) часть метаболизи-
рует. Кетамин обладает высокой растворимостью в жирах (в 5—
10 раз выше, чем у тиопентала), что обеспечивает его быстрое
проникновение в ЦНС. В результате быстрого перераспределения из мозга в другие ткани кетамин обеспечивает достаточно
быстрое пробуждение.
При быстром введении может вызвать респираторную депрессию, спонтанные движения, повышение мышечного тонуса, внутричерепного и внутриглазного давления.
У взрослых и детей старшего возраста введение препарата
(чаще внутривенное) без предварительной защиты бензодиазе-
пиновыми (БД) производными (диазепам, мидазолам) может
вызвать неприятные сновидения и галлюцинации. Для купирования побочных явлений применяют не только БД, но и пирацетам. У 1/з детей в послеоперационный период возникает рвота.
В отличие от взрослых дети значительно лучше переносят
кетамин, в связи с чем показания для его использования в педиатрической анестезиологии достаточно широки.
При самостоятельной анестезии кетамин широко используется при проведении болезненных манипуляций, катетеризации центральной вены и перевязках, малых хирургических вме¬
54
шательствах. Как компонент анестезии показан при индукции
и для поддержания в составе комбинированной анестезии.
Противопоказаниями для введения кетамина являются патология ЦНС, связанная с внутричерепной гипертензией, артериальная гипертензия, эпилепсия, психические заболевания,
гиперфункция щитовидной железы.
Оксибутират натрия у детей используется для индукции и
поддержания анестезии. Для индукции его назначают в/в в дозе
около 100 мг/кг (эффект развивается через 10—15 мин),
внутрь в 5 % растворе глюкозы в дозе 150 мг/кг или в/м (120—
130 мг/кг) — в этих случаях эффект проявляется через 30 мин
и длится около 1,5—2 ч. Для индукции оксибутират обычно используют в комбинации с другими препаратами, в частности с
бензодиазепинами, промедолом или барбитуратами, а для поддержания анестезии — с ингаляционными анестетиками. Кар-
диодепрессивное действие практически отсутствует.
Оксибутират натрия легко включается в метаболизм, а после
распада выводится из организма в виде углекислого газа. Небольшие количества (3—5 %) выделяются с мочой. После внутривенного введения максимальная концентрация в крови достигается через 15 мин, при приеме через рот этот срок удлиняется почти до 1,5 ч.
Может вызывать появление спонтанных движений, значительное повышение периферического сосудистого сопротивления и некоторое повышение АД. Иногда наблюдаются угнетение
дыхания, рвота (особенно при приеме внутрь), двигательное и
речевое возбуждение при окончании действия, при длительном
введении — гипокалиемия.
Бензодиазепины (БД) широко применяются в анестезиологии. Их действие опосредовано увеличением ингибирующего
эффекта гамма-аминомасляной кислоты на нейрональную передачу. Биотрансформация происходит в печени.
Наиболее широко распространен в анестезиологической
практике диазепам. Он оказывает успокаивающее, седативное,
снотворное, противосудорожное и мышечно-релаксирующее
действие, усиливает действие наркотических, анальгетических,
нейролептических средств. У детей в отличие от взрослых не
вызывает психической депрессии. Используется в педиатрической анестезиологии для премедикации (обычно в/м в дозе
0,2—0,4 мг/кг), а также внутривенно как компонент анестезии
для индукции (0,2—0,3 мг/кг) и поддержания анестезии в виде
болюсов или постоянной инфузии.
При приеме через рот хорошо адсорбируется из кишечника
(пик концентрации в плазме достигается через 60 мин). С белками плазмы связывается около 98 %. Относится к числу медленно выделяющихся препаратов из организма (период полу-
выведения составляет от 21 до 37 ч), в связи с чем его считают
плохоуправляемым препаратом.
55
При парентеральном введении у взрослых больных с гипо-
волемией диазепам может вызвать умеренную артериальную гипотонию. У детей снижение АД наблюдается гораздо реже — при
сочетанном приеме с тиопенталом, фентанилом или пропофолом. Нарушения дыхательной функции могут быть связаны с
мышечной гипотонией центрального генеза, особенно при сочетанном введении с опиоидами. При внутривенном введении
могут наблюдаться боли по ходу вены, которые снимаются
предварительным введением лидокаина.
Мидазолам значительно более управляем, чем диазепам, в
связи с чем находит все более широкое применение в анестезиологии. Помимо снотворного, седативного, противосудорожного и релаксирующего действия, вызывает антероградную амнезию. Применяется для премедикации у детей: 1) через рот (в
нашей стране используют ампульную форму, хотя выпускаются
специальные сладкие сиропы) в дозе 0,75 мг/кг для детей от
1 года до 6 лет и 0,4 мг/кг от 6 до 12 лет, действие его проявляется через 10—15 мин; 2) внутримышечно в дозе 0,2—0,3 мг/кг;
3) per rectum в ампулу прямой кишки в дозе 0,5—0,7 мг/кг (эффект наступает через 7—8 мин); 4) интраназально в каплях детям до 5 лет в дозе 0,2 мг/кг (в этом случае эффект наступает в
течение 5 мин, приближаясь к внутривенному). После премедикации мидазоламом ребенок может быть легко отсоединен от
родителей. Широко используется как компонент анестезии для
индукции (в/в 0,15—0,3 мг/кг) и поддержания анестезии в виде
постоянной инфузии в режиме титрования со скоростью от
0,1 до 0,6 мг/кг в час и ее прекращением за 15 мин до конца
операции.
Период полувыведения мидазолама (1,5—4 ч) в 20 раз короче,
чем у диазепама. При приеме через рот около 50 % мидазолама
подвергается печеночному метаболизму. При интраназальном
введении за счет отсутствия первичного печеночного метаболизма эффект приближается к внутривенному, в связи с чем дозу
необходимо снизить.
Мидазолам незначительно влияет на гемодинамику, угнетение дыхания возможно при быстром введении препарата. Аллергические реакции крайне редки. В последние годы в зарубежной литературе можно встретить указания на икоту после
применения мидазолама.
Мидазолам хорошо сочетается с различными препаратами
(дроперидол, опиоиды, кетамин). Его специфический антагонист флумазенш (анексат) вводится взрослым в нагрузочной дозе
0,2 мг/кг и затем по 0,1 мг каждую минуту до пробуждения.
Пропофол (диприван) — 2,6-диизопропилфенол, короткодействующий гипнотик с очень быстрым действием. Выпускается
в виде 1 % раствора в 10 % эмульсии соевого масла (интралипид).
У детей применяется с 1985 г. Пропофол вызывает быструю (в
течение 30—40 с) потерю сознания (у взрослых в дозе 2 мг/кг
56
продолжительность около 4 мин) с последующим быстрым восстановлением. При индукции анестезии у детей его дозировки
значительно выше, чем у взрослых: рекомендуемая доза для
взрослых составляет 2—2,5 мг/кг, для детей младшего возраста —
4—5 мг/кг.
Ряд авторов не рекомендуют назначать пропофол детям до
3 лет, хотя имеется значительный опыт его применения у детей
раннего возраста.
Для поддержания анестезии рекомендуется постоянная инфузия с начальной скоростью у детей около 15 мг/кг в час. Далее существуют различные инфузионные режимы. Отличительной чертой пропофола является очень быстрое восстановление после окончания его введения с быстрой активацией
моторных функций по сравнению с барбитуратами. Хорошо
сочетается с опиатами, кетамином, мидазоламом и другими
препаратами.
Пропофол подавляет гортанно-глоточные рефлексы, что позволяет успешно использовать введение ларингеальной маски,
снижает внутричерепное давление и давление спинномозговой
жидкости, обладает противорвотным действием, практически
не обладает гистамин-эффектом.
К побочным эффектам пропофола относят боли в месте инъекции, которые могут быть предупреждены одновременным
введением лигнокаина (1 мг на 1 мл пропофола). Пропофол у
большинства детей вызывает депрессию дыхания. При его введении наблюдаются дозозависимая артериальная гипотония
вследствие снижения сосудистого сопротивления, повышение
вагусного тонуса и брадикардия. Могут наблюдаться возбуждение, спонтанные двигательные реакции.
В схемах тотальной внутривенной и сбалансированной анестезии широко применяют дроперидол — нейролептик бутиро-
фенонового ряда. Дроперидол обладает выраженным седативным эффектом. Хорошо сочетается с анальгетиками, кетамином
и бензодиазепиновыми производными. Обладает выраженным
противорвотным действием, оказывает а-адренолитический
эффект (это может быть выгодным для предотвращения спазма
в системе микроциркуляции в ходе оперативных вмешательств), предотвращает эффект катехоламинов (антистрессовый и противошоковый эффекты), обладает местноанальгетическим и антиаритмическим действием. Используется у детей
для премедикации внутримышечно за 30—40 мин до операции
в дозе 1—5 мг/кг; для индукции используется в/в в дозе 0,2—
0,5 мг/кг, обычно вместе с фентанилом (так называемая нейро-
лептаналгезия, НЛА); эффект проявляется через 2—3 мин. При
необходимости вводят повторно для поддержания анестезии в
дозах 0,05—0,07 мг/кг.
Побочные эффекты — экстрапирамидные расстройства, выраженная гипотензия у больных с гиповолемией.
57
Наркотические анальгетики включают в себя алкалоиды опия (опиаты) и синтетические соединения, обладающие опиатоподобными свойствами (опиоиды). В организме
наркотические анальгетики связываются с опиодными рецепторами, которые структурно и функционально подразделяются
на ц (мю), Д (дельта), эе (каппа) и ст (сигма). Самыми активными
и эффективными болеутоляющими средствами являются агонисты ц-рецепторов. К ним относятся морфин, фентанил, про-
мед ол, новые синтетические опиоиды — альфентанил, суфен-
танил и ремифентанил (в России пока не зарегистрированы).
Помимо высокой антиноцицептивной активности, эти препараты вызывают ряд побочных явлений, среди которых
эйфория, угнетение дыхательного центра, эмезис (тошнота,
рвота) и другие симптомы торможения активности ЖКТ, психическая и физическая зависимость при их длительном применении.
По действию на опиатные рецепторы современные наркотические анальгетики подразделяются на 4 группы: полные агонисты (они вызывают максимально возможную аналгезию), частичные агонисты (слабее активируют рецепторы), антагонисты
(связываются с рецепторами, но не активируют их) и агонисты/
антагонисты (активируют одну группу и блокируют другую).
Наркотические анальгетики используются для премедикации,
индукции и поддержания анестезии, а также послеоперационной
аналгезии. При этом, если агонисты используются для всех этих
целей, частичные агонисты применяются в основном для послеоперационной аналгезии, а антагонисты — как антидоты при
передозировке агонистов.
Морфин — классический наркотический анальгетик. Его
анальгетическая сила принята за единицу. Разрешен для использования у детей всех возрастных групп. Дозы для индукции
у детей внутривенно 0,05—0,2 мг/кг, для поддержания — 0,05—
0,2 мг/кг внутривенно каждые 3—4 ч. Используется и эпиду-
рально. Разрушается в печени; при патологии почек могут накапливаться метаболиты морфина. Среди многочисленных побочных эффектов морфина следует особо выделить респираторную депрессию, повышение внутричерепного давления, спазм
сфинктеров, тошноту и рвоту, возможность освобождения гистамина при внутривенном введении. У новорожденных отмечена повышенная чувствительность к морфину.
Тримеперидин (промедол) — синтетический опиоид, который
широко используется в педиатрической анестезиологии и для
премедикации (0,1 мг/год жизни внутримышечно), и как
анальгетический компонент общей анестезии при операциях
(0,2—0,4 мг/кг через 40—50 мин внутривенно), и с целью послеоперационной аналгезии (в дозах 1 мг/год жизни, но не более 10 мг внутримышечно). После внутривенного введения период полувыведения промедола составляет 3—4 ч. По сравне¬
58
нию с морфином промедол обладает меньшей анальгетической
силой и менее выраженными побочными явлениями.
Фентанил — синтетический наркотический анальгетик, широко используемый в педиатрии. По анальгетической активности превышает морфин в 100 раз. Незначительно изменяет АД,
не вызывает освобождения гистамина. Используется у детей:
для премедикации — внутримышечно за 30—40 мин до операции
0,002 мг/кг, для индукции — внутривенно 0,002—0,01 мг/кг. После внутривенного введения (со скоростью 1 мл/мин) эффект
достигает максимума через 2—3 мин. Для поддержания аналгезии
во время операции вводят 0,001—0,004 мг/кг каждые 20 мин бо-
люсно или в виде инфузии. Применяется в комбинации с дро-
перидолом (нейролептаналгезия) и бензодиазепинами (атарал-
гезия), причем в этих случаях увеличивается длительность эффективной аналгезии (до 40 мин).
За счет высокой жирорастворимости фентанил накапливается в жировых депо, в связи с чем его период полувыведения
из организма может достигать 3—4 ч. При превышении рациональных дозировок это может сказаться на своевременном восстановлении самостоятельного дыхания после операции (при
угнетении дыхания используют антагонисты опиоидных рецепторов налорфин или налоксон; в последние годы с этой целью
применяют агонисты-антагонисты — налбуфин, буторфанол
тартрат и др.).
Помимо центральной депрессии дыхания, к побочным эффектам фентанила относят выраженную ригидность мышц и
грудной клетки (особенно после быстрого внутривенного введения), брадикардию, повышение ВЧД, миоз, спазм сфинктеров, кашель при быстром в/в введении.
Пиритрамид (дипидолор) близок по активности к морфину.
Доза для индукции у детей составляет 0,2—0,3 мг/кг внутривенно, для поддержания — 0,1—0,2 мг/кг каждые 60 мин. При послеоперационном обезболивании вводится в дозе 0,05—0,2 мг/кг
через 4—6 ч. Обладает умеренным седативным эффектом.
Практически не оказывает воздействия на гемодинамику. При
внутримышечном введении период полувыведения составляет
4—10 ч. Метаболизирует в печени. Побочные эффекты проявляются в виде тошноты и рвоты, спазма сфинктеров, повышения внутричерепного давления. Угнетение дыхания возможно
при использовании больших доз.
Из препаратов группы агонистов-антагонистов опиоидных рецепторов в России используют бупренорфин (морфин, темгезик),
налбуфин (нубаин), буторфанол (морадол, стадол, бефорал) и пентазоцин (фортрал, лексир). Анальгетическая потенция этих препаратов недостаточна для использования их в качестве основного анальгетика, поэтому они в основном применяются для послеоперационного обезболивания. В силу антагонистического
воздействия на ц-рецепторы эти препараты применяют для ин¬
59
версии побочных эффектов опиатов и прежде всего для купирования депрессии дыхания. Они позволяют снять побочные
эффекты, но сохранить обезболивание. Вместе с тем пентазоцин как у взрослых, так и у детей может быть использован в
конце фентаниловой анестезии, когда он позволяет быстро купировать явления респираторной депрессии и сохраняет анальгетический компонент. У детей он вводится для этого внутривенно в дозе 0,5—1,0 мг/кг.
Миорелаксанты. Миорелаксанты (МР) являются неотъемлемым компонентом современной комбинированной анестезии,
обеспечивающим расслабление поперечнополосатой мускулатуры. Они используются для интубации трахеи, предотвращения рефлекторной активности мускулатуры и облегчения ИВЛ.
Миорелаксанты по длительности действия подразделяют на
препараты ультракороткого действия — менее 5—7 мин, короткого действия — менее 20 мин, средней длительности — менее
40 мин и длительного действия — более 40 мин. В зависимости
от механизма действия МР можно разделить на две группы —
деполяризующие и недеполяризующие.
Деполяризующие миорелаксанты обладают ультракоротким
действием, в основном это препараты суксаметония (листенон,
дитилин и миорелаксин). Нейромышечный блок, вызванный
этими препаратами, имеет следующие характерные особенности.
Внутривенное введение вызывает полную нейромышечную
блокаду в течение 30—40 с, в связи с чем эти препараты остаются незаменимыми для срочной интубации трахеи. Длительность нейромышечной блокады обычно 4—6 мин, поэтому они
используются или только для эндотрахеальной интубации с последующим переходом на недеполяризующие препараты, или
при проведении коротких процедур (например, бронхоскопия
под общей анестезией), когда для удлинения миоплегии может
применяться их дробное введение.
К побочным эффектам деполяризующих МР можно отнести
появление после их введения мышечных подергиваний (фибрилляции), длящихся, как правило, не более 30—40 с. Последствиями этого являются посленаркозные мышечные боли. У
взрослых и детей с развитой мускулатурой это бывает чаще. В
момент мышечных фибрилляций в кровь выходит калий, что
может быть небезопасно для работы сердца. Для предотвращения этого неблагоприятного эффекта рекомендуют проводить
прекураризацию — введение небольших доз недеполяризующих миорелаксантов (МР).
Деполяризующие МР повышают внутриглазное давление,
поэтому они должны использоваться с осторожностью у больных с глаукомой, а пациентам с проникающими ранениями
глаза их применять не рекомендуется. Введение деполяризующих МР может вызвать брадикардию и спровоцировать наступление синдрома злокачественной гипертермии.
60
Суксаметоний по химическому строению может рассматриваться как удвоенная молекула ацетилхолина (АХ). Используют
его в виде 1—2 % раствора из расчета 1—2 мг/кг массы внутривенно. В качестве альтернативы можно вводить препарат под
язык; в этом случае блок развивается через 60—75 с.
Недеполяризующие миорелаксанты. К недеполяризующим
МР относятся препараты короткого, среднего и длительного
действия. В настоящее время чаще всего используются препараты стероидного и изохинолинового ряда. Недеполяризующие
МР имеют следующие особенности:
• по сравнению с деполяризующими МР более медленное
начало действия (даже у препаратов короткого действия)
без явлений мышечных фибрилляций;
• эффект деполяризующих МР прекращается под влиянием
антихолинэстеразных препаратов;
• длительность элиминации у большинства недеполяризующих МР зависит от функции почек и печени, хотя кумуляция препарата возможна при повторном введении
большинства МР даже у больных с нормальной функцией
этих органов;
• большинство недеполяризующих МР обладает гистамин-
эффектом;
• удлинение блока при использовании ингаляционных анестетиков различается в зависимости от типа препарата:
применение галотана вызывает удлинение блока на 20 %,
изофлурана и энфлурана — на 30 %.
Тубокурарин хлорид (тубокурарин, тубарин) — производное
изохинолинов, естественный алкалоид. Это первый миорелак-
сант, использованный в клинике. Препарат длительного действия (35—45 мин), поэтому повторные дозы уменьшают в 2—
4 раза по сравнению с первоначальными, так что релаксация
продлевается еще на 35—45 мин.
К побочным эффектам относят выраженный гистамин-эффект, способный привести к развитию ларинго- и бронхоспазма, снижение артериального давления, тахикардию. Препарат
обладает выраженной способностью к кумуляции.
Панкурониум бромид (павулон), как и пипекурониум бромид
(ардуан), являются стероидными соединениями, не обладающими гормональной активностью. Они относятся к нейромы-
шечным блокаторам (НМБ) длительного действия; релаксация
мышц продолжается 40—50 мин. При повторном введении дозу
снижают в 3—4 раза: с увеличением дозы и кратности введения
увеличивается кумуляция препарата. К достоинствам препаратов относят малую вероятность гистамин-эффекта, уменьшение внутриглазного давления. Побочные эффекты в большей
степени свойственны панкурониуму: это некоторое повышение
АД и ЧСС (иногда отмечается выраженная тахикардия).
61
Векурониум бромид (норкурон) — стероидное соединение, МР
средней продолжительности. В дозе 0,08—0,1 мг/кг позволяет
провести интубацию трахеи в течение 2 мин и вызывает блок
длительностью 20—35 мин; при повторном введении — до
60 мин. Кумулируется достаточно редко, чаще у больных с нарушением функции печени и/или почек. Обладает низким гистамин-эффектом, хотя в редких случаях вызывает истинные
анафилактические реакции.
Атракуриум бенсилат (тракриум) — МР средней продолжительности действия из группы производных изохинолинового
ряда. Внутривенное введение тракриума в дозах 0,3—0,6 мг/кг
позволяет выполнить интубацию трахеи через 1,5—2 мин. Длительность действия 20—35 мин. При фракционном введении
последующие дозы снижают в 3—4 раза, при этом повторные
болюсные дозы продлевают мышечную релаксацию на 15—
35 мин. Целесообразно инфузионное введение атракуриума со
скоростью 0,4—0,5 мг/кг в час. Период восстановления занимает 35 мин. Не оказывает отрицательного воздействия на гемодинамику, не кумулируется. За счет уникальной способности
к спонтанной биодеградации (элиминация Хофмана) атракуриум обладает предсказуемостью эффекта. К недостаткам препарата относят гистамин-эффект одного из его метаболитов (лау-
донозина). Из-за возможности спонтанной биодеградации хранить атракуриум необходимо только в холодильнике при
температуре от 2 до 8 °С. Нельзя смешивать атракуриум в одном шприце с тиопенталом и щелочными растворами.
Мивакуриум хлорид (мивакрон) — единственный недеполяризующий МР короткого действия, производное изохинолинового
ряда. В дозах 0,2—0,25 мг/кг интубация трахеи возможна через
1,5—2 мин. Длительность блока в 2—2,5 раза больше, чем у сук-
саметония. Может вводиться в виде инфузии. У детей начальная
скорость инфузии составляет 14 мг/кг в минуту. Мивакуриум
имеет исключительные параметры восстановления блока (в
2,5 раза короче векурониума и в 2 раза — атракуриума); почти
полное (95 %) восстановление нейромышечной проводимости
происходит у детей через 15 мин. Препарат не кумулируется,
минимально влияет на показатели кровообращения. Гистамин-
эффект выражен слабо и проявляется в виде кратковременного
покраснения кожи лица и груди. У больных с почечной и печеночной недостаточностью следует снизить начальную скорость
инфузии без существенного снижения общей дозы. Мивакуриум
является релаксантом выбора при коротких процедурах (в частности, при эндоскопической хирургии), в однодневных стационарах, при операциях с непредсказуемой продолжительностью и
при необходимости быстрого восстановления нейромышечного
блока.
Цисатракуриум (нимбекс) — недеполяризующий НМБ, является одним из десяти стереоизомеров атракуриума. Начало дей¬
62
ствия, длительность и восстановление блока аналогичны атра-
куриуму. После введения в дозах 0,10 и 0,15 мг/кг интубация
трахеи может быть проведена в течение около 2 мин, длительность блока около 45 мин, и время восстановления около
30 мин. Для поддержания блока скорость инфузии составляет
1—2 мг/кг в минуту. У детей при введении цисатракуриума начало, длительность и восстановление блока короче по сравнению со взрослыми. Следует отметить отсутствие изменений в
системе кровообращения и (что особенно важно) отсутствие
гистамин-эффекга. Как и атракуриум, он подвергается органонезависимой элиминации Хофмана. Обладая всеми положительными качествами атракуриума (отсутствие кумуляции, органонезависимая элиминация, отсутствие активных метаболитов), с
учетом отсутствия гистамин-эффекга цисатракуриум является
более безопасным НМБ средней длительности действия, который
может быть широко использован в различных областях анестезиологии-реаниматологии.
Проводниковая (регионарная) анестезия. Спинномозговая анестезия. Спинномозговая анестезия (СА) заключается в инъекции раствора местного анестетика в субарахноидальное пространство спинного мозга. СА не оказывает клинически значимого влияния на дыхательный объем, частоту дыхания, минутную вентиляцию, парциальное давление СО2 в альвеолярном
воздухе, РаСС>2 и РаС^. Потребность в О2 сокращается на 10 %,
продукция СО2 уменьшается на 20 % за счет снижения активности метаболических процессов в мышцах.
Спинномозговая анестезия используется при оперативных
вмешательствах на нижних конечностях, тазобедренном суставе, промежности, а также органах, расположенных ниже диафрагмы, особенно в ситуациях, когда по тем или иным причинам нежелательно проведение других методов обезболивания.
Относительными противопоказаниями могут быть сердечная недостаточность, гиповолемия, септические состояния, кахексия, повышенная возбудимость нервной системы, частые
головные боли в анамнезе, ИБС.
Абсолютными противопоказаниями являются воспалительные процессы в месте пункции, некорригированная гиповолемия, тяжелая анемия, психические заболевания, искривления
позвоночника, аллергия к местным анестетикам, увеличенное
внутричерепное давление.
Пункцию субарахноидального пространства в педиатрической анестезиологии проводят чаще срединным доступом на
уровне Ljjj—Ljv или Lpy—Ly. Это связано с анатомическими
особенностями спинного мозга и позвоночника ребенка. К моменту рождения плода его спинной мозг оканчивается на уровне Lju, а к годовалому возрасту этот уровень поднимается до Lj.
Твердая мозговая оболочка у новорожденных детей обнаруживается на уровне Sjy, и к году этот уровень достигает Sjj—Sfij.
63
Осложнения при СА: боль в спине, головная боль, задержка
мочи, менингит, повреждение сосудов, нерва.
Эпидуральная анестезия способна вызывать все три вида
блокады — сенсорную, моторную и вегетативную. Необходимый уровень анестезии достигается подбором анестетика, его
концентрации и дозы. Основные показания для спинномозговой анестезии распространяются и на эпидуральную. Помимо
того, установка катетера в эпидуральное пространство обеспечивает дополнительное преимущество — возможность проведения анестезии при длительных операциях и в послеоперационном периоде. На эпидуральную анестезию распространяются
все противопоказания к спинномозговой анестезии. Ввиду расположения в эпидуральном пространстве сплетений вен, лишенных клапанов, необходимо соблюдать особые меры предосторожности из-за риска кровотечения. Риск кровотечения велик при лечении антиагрегантами или мини-дозами гепарина.
Эпидуральная пункция может выполняться на уровне всех
четырех отделов позвоночника: шейном, грудном, поясничном,
крестцовом.
Точная доза местного анестетика при эпидуральной анестезии зависит от многих факторов, но в среднем она составляет
1—2 мл раствора анестетика на каждый сегмент спинного мозга, который необходимо блокировать. Доза анестетика колеблется в рекомендуемых пределах, потому что действие препарата внутри эпидурального пространства носит не вполне предсказуемый характер. Предполагается, что при эпидуральной
анестезии у местного анестетика есть две анатомические точки
приложения:
• эпидуральные нервные корешки и спинномозговые узлы,
куда препарат поступает после диффузии через межпозвоночные отверстия;
• субарахноидальное пространство, куда препарат поступает
либо путем диффузии через твердую мозговую оболочку,
либо через эпидуральный лимфатический ствол.
Уровень введения иглы в эпидуральное пространства
в зависимости от области операции
Область операции
Уровень пункции
Легкие, трахея, бронхи (грудная клетка)
Желудок, печень, ПЖЖ
Тощая и подвздошная кишка
Слепая и восходящая толстая кишка
Нисходящая толстая и сигмовидная кишка
Прямая кишка, промежность
Почки и мочеточники
Матка
Предстательная железа, мочевой пузырь
Нижние конечности
Thu—Thiv
Thv-Thvn
Tbvu-Thix
64
Катетеризация эпидурального пространства позволяет вводить расчетную дозу дробно, в несколько приемов. Эффективность эпидуральной анестезии оценивают отдельно по каждой
модальности, симпатическую блокаду — по кожной температуре,
двигательную — по шкале Бромэджа. Шкала Бромэджа определяет возможность полного сгибания в коленном суставе как
"отсутствие блокады", возможность полного сгибания в коленном суставе и неспособность поднять выпрямленную ногу —
как "частичную блокаду", неспособность согнуть ногу в колене
при сохраненном сгибании стопы — как "почти полную блокаду" и отсутствие движений в нижней конечности — как "полную
блокаду".
Доза бупивакаина (0,25 % раствора) составляет 0,5 мл (тест),
основная 0,5—0,75 мл/кг. Объем вводимого раствора анестетика рассчитывают, ориентируясь на место стояния катетера и необходимый уровень аналгезии по формуле: V раствора (мл/сег-
мент) = 1/10 • п (возраст в годах). Повторные дозы обычно составляют половину вводимой вначале. При продленной аналгезии в
послеоперационном периоде в раствор добавляют промедол в дозе 0,1—0,2 мг/кг, морфин в дозе 0,05—0,1 мг/кг.
Зоны иннервации
• Органы грудной клетки и грудная клетка — ТЬц—ТЬуц
• Верхний этаж брюшной полости — Thy—Thyi
• Нижний этаж брюшной полости — ТЬуш—Thx
• Почки — Thyin
• Промежность — Sj—Sy
Позвонок ТЬуц легко обнаружить, проведя горизонтальную
линию через нижние углы лопаток.
Каудальная анестезия. Каудальное пространство — это крестцовый отдел эпидурального пространства. Доступ к нему осуществляется через крестцовую щель — срединно расположенный костный дефект в самой нижней части крестца. Крестцовая
щель прикрыта не костью, а плотной крестцово-копчиковой
связкой, соответствующей надостистой и межостистой связке в
поясничном, грудном и шейном отделах позвоночника. Крестцово-копчиковая связка плотно прилегает к желтой, так что
различия в плотности между двумя этими связками при проведении иглы не определяются (в отличие от других отделов позвоночника).
Каудальная анестезия показана при хирургических вмешательствах, процедурах на промежности и крестцовой области.
Каудальная анестезия особенно хорошо подходит для операций
вблизи заднепроходного отверстия, потому что их часто выполняют в положении больного на животе, и мощную сенсорную
блокаду крестцовых дерматомов можно обеспечить без избыточного краниального распространения анестетика. У детей кау¬
65
дальную анестезию проводить проще, потому что крестцовая
щель легко пальпируется, а крестцово-копчиковая связка не
подверглась кальцинозу и дегенеративным изменениям.
Противопоказания к каудальной анестезии такие же, как и
к другим видам блокады. Близость перианальной области требует исключить инфекцию кожи и подкожного жирового слоя:
даже подозрение на инфекцию является абсолютным противопоказанием к каудальной анестезии. Пролежни в области крестца также являются противопоказанием из-за риска распространения инфекции на центральную нервную систему. Выраженное ожирение затрудняет идентификацию крестцовой щели
и крестцово-копчиковой связки, являясь поэтому относительным противопоказанием. У 5—10 % людей крестцовая щель отсутствует, и у них каудальная анестезия невозможна.
Осложнения аналогичны тем, которые встречаются при эпидуральной и спинномозговой анестезии. Важно тщательно соблюдать асептику, так как инфекции могут повлечь за собой
очень тяжелые осложнения.
Дозировка. Объем вводимого раствора (промедол + адреналин + местный анестетик) подбирается в зависимости от
уровня необходимой блокады.
• промедол 0,1—0,2 мг/кг;
• адреналин 1:200 000 — 0,5 мл/10 мл вводимого раствора;
• бупивакаин 0,25 % — 0,3—1,25 мл/кг.
Выбор метода общей анестезии. Оперативные вмешательства
выделяют по степени травматичности и шокогенности. Под
травматачностью подразумевают объем удаляемых тканей и
способ, которым производится выделение новоообразования, —
острый, тупой, комбинированный.
Шокогенность операции определяет главным образом локализация операционной травмы; наиболее шокогенны вмешательства, сопровождающиеся травмой нервных корешков и
сплетений.
В детской онкологии по травматичности ведущее место занимают операции по поводу опухолей печени, забрюшинного
пространства, нефробластом, опухолей заднего средостения,
брюшной полости. Среди вмешательств при этах локализациях
опухоли наиболее шокогенны операции, сопровождаемые повреждением органов и тканей, иннервируемых системой чревного нерва. Именно при таких вмешательствах наблюдается
наибольшее число прессорно-депрессорных реакций, в разной
степени предупреждаемых современными схемами комбинированной анестезии.
Приводим принципиальные схемы общей анестезии, используемые при операциях по поводу опухолей различной локализации.
66
• Масочный наркоз галотаном (фторотаном). После преме-
дикации, включающей анальгетик (промедол), больному
в операционной проводят преоксигенацию в течение 2—
3 мин, после чего через маску наркозного аппарата подают смесь закиси азота и кислорода (3:1, 2:1). Через несколько вдохов указанной смеси начинают постепенно
увеличивать концентрацию фторотана, доводя ее до 2—
2,5 об.%. После осуществления индукции анестезии последнюю поддерживают при концентрации фторотана во
вдыхаемой смеси в границах 1—1,5 МАК (0,75—1 об.%).
В конце вмешательства постепенно снижают концентрацию фторотана до 0 и завершают наркоз постоксигенацией, отключая закись азота. Включение промедола в
премедикацию оправдано слабой анальгетической (анти-
ноцицептивной) потенцией фторотана.
Указанный вид обезболивания весьма популярен в детских хирургических клиниках, он позволяет выполнять
аппендэктомии, грыжесечение и многие другие малотравматичные операции. В детской онкологии используется
при удалении опухолей, расположенных на поверхности
тела, биопсиях лимфатических узлов, опухолей костей и
мягких тканей.
• Самостоятельный наркоз кетамином. Этот препарат, хорошо переносимый детьми, наиболее широко применяется при оперативных вмешательствах в детской онкологии. Хороший седативный (и гипнотический) эффект
создает кетамин при внутримышечном введении (6—
8 мг/кг, у маленьких детей до 10—12 мг/кг). Дозировка в
этом диапазоне позволяет привезти ребенка в операционную спящим, провести катетеризацию периферической
или центральной вены: катетеризировать эпидуральное
пространство (эпидуральная анестезия) или произвести
пункцию субарахноидального пространства с введением
раствора местного анестетика (спинномозговая анестезия).
После осуществления венозного доступа кетаминовый
наркоз легко поддерживать, вводя его внутривенно по показаниям в дозах 1—2 мг/кг. Учитывая тенденцию к ги-
пердинамии после введения кетамина, следует в премедикацию вводить препараты бензодиазепинового (диазепам, мидазолам) и бутирофенонового (дроперидол) ряда.
Данный вид анестезии адекватен при тех же вмешательствах, что были указаны при описании предыдущей методики.
• В последние годы отработана методика комбинированного
наркоза кетамином и мидазоламом. Премедикация проводится за 15—20 мин до операции следующими препаратами: промедол 2 % — 0,05—0,08 мл/год жизни (0,2—
0,3 мг/кг), атропин 0,1 % — 0,1 мл/год жизни (0,05 мг/кг),
67
Инфузионно-трансфузионная терапия при операциях. Содержание воды в организме ребенка выше (70—75 % от массы тела), чем у взрослых (60—65 %). Если принять, что она составляет 70 % от массы тела, то 5 % приходится на плазму, 15 % на
тканевую жидкость и 50 % на внутриклеточную жидкость.
Объем циркулирующей крови (ОЦК), внутрисосудистый
объем поддерживаются онкотическим (коллоидно-осмотическим — КОД) давлением белков плазмы крови. Основным белком плазмы является альбумин, он обеспечивает 80 % коллоидного осмотического давления плазмы. Перепад этого давления
между циркулирующей плазмой и интерстициальной жидкостью предотвращает отток циркулирующей жидкости в интерстициальное пространство.
Задачи инфузионно-трансфузионной терапии при оперативных вмешательствах следующие:
• поддержание нормоволемии и стабильности гемодинамики;
• поддержание оптимального уровня гематокрита;
• улучшение микроциркуляции и реологических свойств
крови;
• эффективная доставка кислорода;
• поддержание адекватного градиента между КОД плазмы
и давлением заклинивания легочных капилляров.
Препараты для инфузионно-трансфузионной терапии должны восстанавливать гемодинамическое равновесие, длительно
находиться в кровеносном русле, легко метаболизировать, не
накапливаться в тканях, хорошо переноситься, минимально
влиять на иммунную систему.
Во время оперативного вмешательства снижение ОЦК происходит за счет не только кровопотери, но и потерь жидкости
с дыханием и при испарении из раны (перспирация). При небольших по объему и травматичное™ операциях без кровопотери у детей возможно применение кристаллоидных растворов —
Рингера и изотонического раствора хлорида натрия. Применение 5 % раствора глюкозы в этих целях менее целесообразно,
так как отсутствие натрия ("осмотического каркаса" внеклеточного пространства) не способно удержать воду. Волемический
коэффициент кристаллоидных растворов низкий: 1000 мл инфузии позволяет увеличить ОЦК только на 150—200 мл. Вместе
с тем использование больших объемов кристаллоидов ведет к
снижению КОД, что способствует выходу жидкости в интер-
стиций и формированию отеков. Отек нарушает доставку кислорода к тканям, и в этом плане определенную опасность
представляет увеличение объема внесосудистой воды в легких,
что может привести к респираторной дисфункции.
Коллоидные растворы, содержащие крупные молекулы, не
преодолевающие капиллярную мембрану, позволяют значи¬
70
тельно снизить объем переливаемой жидкости, необходимой
для стабилизации ОЦК. Поддерживая длительное время ОЦК,
коллоидные растворы в то же время препятствуют перегрузке
организма жидкостью.
Коллоидны ерастворы подразделяют на натуральные
(плазма, альбумин) и синтетические (декстраны, препараты желатина, препараты гидроксиэтилкрахмала).
Плазма (свежезамороженная) применяется не столько в целях поддержания ОЦК, сколько для профилактики синдрома
ДВС. Однако переливание плазмы может усиливать активность
каскадов системной воспалительной реакции и увеличивать
риск полиорганной недостаточности у тяжелых больных. Гемореологический эффект плазмы ограниченный, а риск развития
анафилактоидных реакций высокий.
Альбумин считается онкотическим средством, так как на 60—
80 % поддерживает КОД. Альбумин способен к динамическому
перераспределению между сосудистым и внесосудистым водными секторами, вследствие чего волемический эффект 5 %
альбумина ниже, чем у декстранов и ГЭК. Длительность внутрисосудистой циркуляции альбумина также ниже (1,5—4 ч).
При тяжелых патологических состояниях альбумин проходит
через капиллярную мембрану в ткани и тем самым увеличивает
способность к отекам. Появление альбумина в интерстиции
легких резко ухудшает их функциональную способность за счет
скопления жидкости. По сравнению с синтетическими эффективными коллоидами альбумин в настоящее время не считается
препаратом выбора для поддержания ОЦК.
Декстраны (полиглюкин, реополиглюкин) обеспечивают
увеличение ОЦК за счет высокой способности связывать воду.
Высокомолекулярные декстраны (50 000 дальтон и выше) более
длительно поддерживают ОЦК по сравнению с низкомолекулярными. Имеются данные о неблагоприятном воздействии
декстранов на почечные канальцы и на систему гемокоагуляции
(возможность кровотечения при использовании высоких доз).
Применение декстранов сопряжено с возможностью анафилактических реакций, в связи с чем предварительно вводят небольшие объемы декстранов (этот метод называется "неполной антигенной ингибицией") для ослабления возможной аллергической реакции.
Препараты желатина получают методом гидролиза коллагена крупного рогатого скота. Они применяются с 1915 г., хотя
технология изготовления претерпела за прошедшие годы значительные изменения. В России используются зарубежный
препарат гелофузин (4 % раствор сукцинированного желатина)
и отечественный — желатиноль. Молекулярная масса препаратов в среднем 35 000 дальтон, однако в его составе имеется низкомолекулярная фракция, которая плохо удерживает воду,
вследствие чего плазмозамещающее действие кратковременно.
71
Применение препаратов желатина сопряжено с возможностью
анафилактических реакций. Описаны геморрагические осложнения.
Гидроксиэтилкрахмал (ГЭК) обладает высокой способностью
связывать воду. Длительность плазмозамещающего эффекта зависит от молекулярной массы: низкомолекулярный ГЭК удерживает воду в кровяном русле 8—12 ч, высокомолекулярный —
12—24 ч. Оптимальным препаратом считают 6 % ГЭК с молекулярной массой 450 000 дальтон. Переливание больших количеств (более 20 мл/кг) высокомолекулярного ГЭК может приводить к ухудшению функции тромбоцитов. Препараты ГЭК
положительно влияют на реологические свойства крови.
Определение показаний для введения растворов кристаллоидов, коллоидных плазмозамещающих препаратов, а также
эритроцитарной массы, концентрата тромбоцитов и свежезамороженной плазмы проводят на основе оценки потери ОЦК и лабораторных показателей (гемоглобин, гематокрит, показатели
свертываемости плазмы и др.). Инфузионные растворы вводят в
дозе 5—10—20 мл/кг в час, при выраженной кровопотере — до
30 мл/кг.
Переливание крови (эритромассы, эритровзвеси) осуществляется только для предотвращения анемизации при кровопотере. Уровень гематокрита выше 30 % в детской анестезиологической практике считается показателем, при котором возмещение эритроцитов не показано.
Интенсивная терапия в послеоперационном периоде. Задачи
интенсивной терапии в послеоперационном периоде следует разделить на общие и специализированные. К общим относят послеоперационное обезболивание, антибактериальную и инфузионную терапию, профилактику и лечение гипертермии и ряд других. Специализированные задачи вытекают из особенностей
самого оперативного вмешательства: дренирование плевральной
полости после торакальных вмешательств, уход за трахеостомой
после некоторых операций по поводу опухолей шеи (ларингэк-
томия), торможение секреции поджелудочной железы после
операций типа гастропанкреатодуоденальной резекции и др.
Одной из задач общего характера после большинства операций в детской онкологии является профилактика "вторичного
синдрома повреждения", обозначаемого в современной литературе как системная воспалительная реакция.
В послеоперационном периоде у детей моложе 1 года особенно отчетливо прослеживаются три основных "критических"
этапа.
Первыйкритическийэтап — это первые 2—3 ч после
операции, в течение которых нормализуется температура тела,
нивелируются остаточные явления, связанные с применением
миорелаксантов, фентанила, анестетиков; нормализуется объем
циркулирующей крови и ее компонентов, выравнивается ки¬
72
слотно-основной баланс. Это наиболее ответственный период,
который необходимо тщательно контролировать с помощью
информативных, физиологичных и технически простых методов, позволяющих своевременно изменить тактику ведения
больного.
Большую помощь оказывает мониторный контроль за динамикой комплекса QRS, частотой и глубиной дыхания. Показано
динамическое наблюдение за сосудистым тонусом с помощью
периферической и центральной реографии или фотоплетизмографии. Изменения тонуса сосудов всегда опережают изменения
центрального объема крови и могут служить надежным сигналом
появления прессорно-депрессорных реакций кровообращения,
сигналом развития шока. Указанные методы контроля уровня
волемии, безусловно, обогащаются данными измерения центрального венозного давления и объема циркулирующей крови.
Гиповолемия на первом критическом этапе может развиться
в результате первичного (продолженного) или вторичного кровотечения. В первом случае назначают заместительную терапию в комплексе с гемостатическими средствами (глюконат
кальция, викасол, дицинон и др.), поддерживаемыми препаратами, предупреждающими развитие синдрома ДВС (свежезамороженная плазма, тромбоциты). При угрозе фибринолитического кровотечения назначают эпсилон-аминокапроновую кислоту и другие ингибиторы протеолиза (контрикал, тразилол,
гордокс).
Своевременно не распознанная гиповолемия может привести к нестабильной гемодинамике, особенно при присоединении провоцирующих факторов — послеоперационного болевого синдрома на фоне озноба, возбуждения ребенка и других
причин.
При гиповолемии показано введение коллоидных плазмозаме-
нителей (см. выше). Чаще гиповолемия сопровождается умеренным гипертензивным синдромом на фоне тахикардии, реже —
при резком нарушении функции коры надпочечников по гипотоническому типу.
Некомпенсированный метаболический ацидоз на первом критическом этапе усугубляет расстройства гемодинамики. Как правило, в течение первых 2—3 ч послеоперационного периода удается провести компенсацию метаболического ацидоза (если он
развился) с помощью простых средств (гидрокарбонат натрия).
При прогрессирующем снижении функции внешнего дыхания на фоне повышения рСС>2 (артериализированной крови)
или EtC02 (в выдыхаемом воздухе), а также при снижении сатурации кислорода в крови (SpC>2) рассматривается вопрос о
проведении ребенку продленной искусственной вентиляции
легких (ИВЛ). Однако мы являемся сторонниками полноценного выведения больного из состояния посленаркозной депрессии с полным восстановлением самостоятельного дыхания и
73
сознания. Для этого нужны время, терпение и правильная тактика восстановления жизненно важных функций после оперативных вмешательств.
Для нормализации функции внешнего дыхания необходимы
обеспечение адекватного послеоперационного обезболивания,
поддержание полной проходимости верхних дыхательных путей, профилактика пневмонии. В первые сутки поддерживают
достаточную оксигенацию с помощью системы увлажнения кислорода, специальных систем (мешок Мартина), ингаляций с
эуфиллином, преднизолоном, содой. Назначают антибиотики с
учетом тропности к органам в профилактических дозах.
Адекватное послеоперационное обезболивание достигается
продленной эпидуральной анестезией.
Обезболивание у детей, перенесших сравнительно нетяжелые вмешательства, можно проводить смесью анальгина (0,5—
2 мл 25 % раствора в зависимости от возраста), пипольфена или
супрастина (1 мг/кг) и седуксена (2,5 мг) внутримышечно каждые 4 ч в течение 1-х суток. Со 2-х суток болевой синдром, как
правило, нивелируется. С положительной стороны зарекомендовала себя аналгезия, проводимая с помощью трамадола (тра-
мала) и нефопама (оксадола).
Особая травматичность некоторых вмешательств у грудных
детей (по поводу опухолей печени, брюшной и грудной полостей, забрюшинной и забрюшинно-пресакральной областей)
создает условия для тяжелого течения так называемого вто-
рогокритическогоэтапа первых суток послеоперационного периода, или "вторичного синдрома поврежде-
н и я". Вторичный синдром повреждения развивается постепенно
сразу же после операции и достигает отчетливой клинической
выраженности через 8—10 ч после операции.
Этот синдром, обусловленный резорбтивными процессами
из зоны операционного повреждения и эндогенной интоксикацией продуктами тканевого распада, характеризуется повышением температуры тела, одышкой и тахикардией, увеличением
артериального давления. Стрессорный характер синдрома подтверждается увеличением содержания в крови адреналина и серотонина, а также гликемией и повышением уровня гормонов
гипофизарно-надпочечниковой системы — АКТГ, СТГ и кортизола. Клиническая выраженность вторичного синдрома повреждения значительно ослабляется профилактическим назначением дроперидола, который следует ввести через 5—6 ч после
операции внутримышечно в дозе 0,2 мг/кг.
Снижение остроты вторичного синдрома повреждения и нормализация показателей гомеостаза в ближайший период после
операции во многом обязаны рациональной инфузионной терапии. Правильная тактика инфузий позволяет снизить риск
ухудшения состояния ребенка на третьем критическом
этапе, т. е. через 20—22 ч после операции, когда на вторич¬
74
ный синдром повреждения может наслоиться парез кишечника
и привести к выраженным электролитным расстройствам.
Необходимым компонентом инфузионной терапии в ближайшем послеоперационном периоде является реополиглюкин
(или препараты ГЭК), назначаемый с целью улучшения реологических свойств крови. В целях детоксикации используют по-
ливинилпирралидон (гемодез), хотя имеются и противники его
применения из-за относительно высокого содержания натрия в
этом препарате (в 100 мл препарата гемодеза содержится
9,6 ммоль Na).
Важным методическим приемом в создании нейтрального
водного баланса в первые сутки послеоперационного периода
является так называемая "ночная пауза” инфузионной терапии.
Паузу создают от 0.00—1.00 ч ночи до 6.00—7.00 утра; весь назначенный на сутки объем жидкости следует перелить за 10—
12 ч, что удается при относительно невысокой средней скорости инфузии — 100 мл/ч. Приведенные параметры инфузионной терапии позволяют поддерживать осмолярность крови в
нормальных границах (270—280 мосмоль/л), стабилизировать
нейтральный водный баланс, предупреждать развитие таких
грозных осложнений, как отек или набухание мозга.
Калий (2,7 ммоль/кг) следует вводить со 2-х суток послеоперационного периода, если во время операции осуществлялась
гемотрансфузия. Его целесообразно переливать капельно в растворе 10—20 % глюкозы с инсулином (1 ЕД на 3—4 г сухого вещества глюкозы) при концентрации 750 мг на 100 мл глюкозы.
Приведенные суточные дозировки калия соответствуют суточным потребностям и полностью корригируют изменения концентрационных коэффициентов (K/Na плазмы и мочи).
С целью ослабления катаболических процессов и увеличения синтеза белка в период послеоперационного стресса показано введение азота. Гидролизаты белка хуже переносятся детьми грудного возраста, чем аминокислотные смеси, поэтому их
необходимо разводить 10 % раствором глюкозы и обязательно
назначать десенсибилизирующую терапию (глюконат кальция,
антигистаминные средства). Некоторые аминокислотные смеси (альвезин, стерамин, аминофузин) изготовлены на 10 % растворе сорбитола. Гидролизаты и аминокислотные смеси обеспечивают введение 300—350 г/кг азота, т. е. приблизительно такого же количества азота, которое теряется с суточной мочой
грудного ребенка после тяжелых операций. Как было сказано в
разделе о предоперационной подготовке, введение ретаболила
до операции значительно улучшает усвоение глюкозы и азота в
лечение 1—3 сут послеоперационного периода.
С целью восполнения недостатка незаменимых жирных кислот можно с 3-х суток переливать жировые эмульсии в небольшом объеме (7—10 мл/кг). Однако дети грудного возраста относительно неплохо переносят лишь инфузию интралипида
75
(Швеция) и гораздо хуже — других жировых эмульсий. Иногда
прибегают к переливанию нативной плазмы, которая содержит
необходимый спектр незаменимых жирных кислот, хотя к плазме как компоненту искусственного питания в настоящее время
относятся негативно.
В 1-е сутки в течение 10—12 ч после операции у детей еще
сохраняется гипергликемия, что свидетельствует о нарушении
утилизации глюкозы. Как правило, гипергликемия соответствует увеличению уровня пирувата в крови. С целью лучшей усвояемости глюкозы показаны введение 100—150 мг кокарбок-
силазы в сутки (с глюкозой) и увеличение соотношения глю-
коза/инсулин в пользу последнего (1 ЕД/инсулина 3 г или даже
2 г сухого вещества глюкозы) при контроле за гликемией.
О значении кокарбоксилазы в интенсивной терапии послеоперационного периода у грудных детей следует сказать особо.
Известно, что кокарбоксилаза —это фосфорное производное
тиамина (витамин Bj) — дифосфотиамин, которое в виде про-
стетической группы входит в состав карбоксилазы — фермента,
осуществляющего декарбоксилирование пирувата и других аль-
фа-кетокислот. Если учесть, что нервная система значительную
часть энергии черпает из углеводов, то становится ясным значение для ее жизнедеятельности блокады механизма утилизации глюкозы на уровне пирувата, который, так же как и лактат,
накапливаясь в крови, является токсичным метаболитом по отношению к нервной ткани. Увеличение уровня пирувата в крови в 1-е сутки у детей полностью соответствует картине интоксикации и "судорожной готовности", которая особенно часто
наблюдается у детей раннего возраста.
Несомненно, показано введение и витамина В2 (рибофлавина), коэнзима так называемых флавиновых ферментов—первичных акцепторов водорода. Суточная потребность в рибофлавине
у детей раннего возраста составляет 1,2 мг/кг. При назначении
витамина В3 необходимо учитывать, что его введение в организм
повышает потребность в аминокислотах. Не менее важно физиологическое значение для детского организма никотинамида, являющегося составной частью никотинамидадениндинуклеотида
(НАД), который в свою очередь является одной из основных частей окислительно-восстановительной системы, первичным акцептором водорода в реакциях дегидрирования. При недостатке
никотинамида (никотиновой кислоты, витамина РР) усиливается его образование из триптофана, поэтому при включении в
инфузионную терапию аминокислотных смесей (содержащих
триптофан) потребность в никотинамиде снижается.
Под влиянием этого витамина быстрее нивелируется дис-
протеинемия, которая развивается в послеоперационном периоде и характеризуется снижением уровня альбуминов и увеличением уровня глобулинов, в основном за счет а-2- и р-гло-
булинов. Суточная потребность в никотиновой кислоте у
76
ребенка грудного возраста составляет 10 мг. Усиление распада
триптофана с образованием никотиновой кислоты и серотонина происходит в присутствии витамина Bg (пиридоксина). Недостаток пиридоксина в организме сопровождается повышением возбудимости коры полушарий большого мозга с проявлениями в виде эпилептиформных приступов и характерных
изменений на ЭЭГ. Пиридоксин рационально включать в инфузионную терапию еще и потому, что он усиливает анаболическое воздействие аминокислот, вводимых в организм, так как
активно участвует в процессах трансаминирования, декарбок-
силирования и метилирования. Суточная потребность в пири-
доксине — 1 мг/кг. Практикой установлено, что для полноценного использования глюкозы и аминокислот в инфузионной
терапии показано применение по крайней мере двух из трех
указанных витаминов (лучшие результаты можно получить при
использовании рибофлавина и пиридоксина в комбинации с
аминокислотными смесями).
Благотворное действие аскорбиновой кислоты общеизвестно. Особенно важно то, что она усиливает функциональные
свойства коры надпочечников, восстанавливает основное вещество соединительной ткани, участвует в окислительно-восстановительных реакциях (восстановление окисленных форм
ферментов), предохраняет адреналин от окисления, нормализует обмен тирозина и фенилаланина, улучшает фагоцитарные
свойства крови и регенераторные процессы. Мы назначаем аскорбиновую кислоту детям грудного возраста в дозе 20—30 мг/кг.
После вмешательств по поводу опухолей брюшной полости
и забрюшинного пространства практически у всех детей наступает парез кишечника, который достигает своего полного клинического развития на протяжении 2 сут послеоперационного
периода. Эпидуральная анестезия лидокаином или бупивакаи-
ном в значительной степени снижает остроту проявлений пареза кишечника, но полностью не решает эту проблему.
В лечении и профилактике пареза кишечника большое значение следует придавать концентрационным коэффициентам
K/Na в плазме, эритроцитах и моче, а также оценке показателей, которые характеризуют преобладание симпатикотониче-
ских влияний на органы в ближайшем послеоперационном периоде над парасимпатикотоническими. Не случайно первые 3—
4 дня послеоперационного периода можно назвать периодом
преобладания симпатико-адреналовой системы. Стимуляция
прозерином (по 0,1—0,2 мл внутримышечно троекратно через
30 мин) или убретидом (0,1— 0,5 мл внутримышечно однократно в сутки), как правило, дает положительный эффект, однако
введение этих препаратов нужно осуществлять на фоне действия
либо эпидуральной анестезии местными анестетиками, либо
глюкозоновокаиновой смеси (0,25 % раствор новокаина пополам с 10 % раствором глюкозы).
77
Глава 2
СТАТИСТИКА ЗЛОКАЧЕСТВЕННЫХ
НОВООБРАЗОВАНИЙ У ДЕТЕЙ
Научно обоснованное планирование и успешное управление
онкологической службой, оценка эффективности реализуемых
ею противораковых мероприятий, а также решение многих других научных и практических задач невозможно без четко налаженной системы учета и своевременно поступающей для анализа достоверной информации. Это положение приобретает
особенно важное значение для онкопедиатрии, которая переживает в настоящее время свое организационное становление.
Система учета. На всех больных, проживающих в районе обслуживания онкологических учреждений, осуществляющих
учет и диспансеризацию больных злокачественными новообразованиями и преинвазивным раком (независимо от их локализации), заполняется "Контрольная карта диспансерного наблюдения (онко)” (форма № 030-6/у). Источниками сведений для
заполнения контрольных карт являются "Извещение”, "Выписка из медицинской карты стационарного больного злокачественным новообразованием" (форма № 027-1/у), "Медицинская
карта амбулаторного больного" (форма № 025/у), "Выписка из
протокола врачебной конференции по разбору причин выявления больного с запущенной формой злокачественного новообразования" (форма № 027-2/у). На основании контрольных
карт составляется "Отчет о больных злокачественными новообразованиями" (форма № 35). Содержащаяся в нем информация
используется для расчета показателей состояния онкопедиат-
рической помощи (табл. 2.1).
Таблица 2.1. Показатели онкопеднатрнческой помощи в России
Показатель
Морфологическая верификация диагноза, %
Выявляемость на профосмотрах, %
Распределение I—II
вновь выявленных Ц1
больных по jy
стадиям процесса
Не установлена
Летальность на 1-м году с момента
установления диагноза, %
На 100 новых больных приходится
умерших
Россия
Москва
1995 г.
1999 г.
1995 г.
1999 г.
78,0
85,5
91,1
94,5
4,2
3,4
0,0
3,3
24,4
25,6
20,3
22,1
14,3
13,4
19,3
13,8
8,0
10,2
8,4
11,0
53,3
50,8
52,0
53,0
21,4
19,0
22,9
14,8
45
40
37
29
78
Учет заболеваний злокачественными новообразованиями (ЗН)
детей осуществляется на основе "Извещения о больном с впервые в жизни установленным диагнозом рака или другого злокачественного новообразования" (форма № 090/у). "Извещение"
заполняется всеми врачами общей и специализированной лечебно-профилактической сети Минздрава РФ и других ведомств
на каждый случай впервые в жизни диагностированного заболевания злокачественным новообразованием и преинвазивным
раком независимо от обстоятельств выявления. Сюда входят:
а) самостоятельное обращение за медицинской помощью;
б) периодический профилактический осмотр и диспансеризация
детского населения или хронических больных; в) медицинское
освидетельствование; г) обследование в стационаре; д) операция;
е) патологоанатомическое вскрьггие (посмертно выявленное заболевание); ж) сверка сведений об умерших онкологических
больных с данными статистических управлений, если выясняется, что при жизни заболевание диагностировано, но не учтено
(посмертно учтенное заболевание). При первично-множественных опухолях "Извещение" составляется раздельно на каждую из них с указанием вверху документа "вторая (третья) локализация". Руководители городских и сельских лечебно-профилактических учреждений общей сети, а также расположенных на
их базе отделений (кабинетов) детской онкологии обеспечивают своевременную пересылку "Извещений" (в 3-дневный срок)
в онкологическое учреждение, обслуживающее онкологических
больных данной территории, при децентрализованной системе
учета и в республиканский (краевой, областной) диспансер —
при централизованной. С целью обеспечения наиболее полной
информированности о заболеваниях злокачественными новообразованиями главные врачи онкологических диспансеров организуют: а) ежемесячные сверки сведений об умерших онкологических больных, состоявших при жизни на учете, со свидетельствами о смерти в статуправлениях, выявляя при этом
неучтенных онкологических больных, умерших не только от основного заболевания, но и от других причин; б) не менее 2 раз
в году сверку учтенных диспансером больных с онкологическими больными, выписанными из лечебно-профилактических учреждений общей сети (по статистическим картам выбывших из
стационара, форма № 066/у), обращая особое внимание на гематологические, нейрохирургические, урологические и другие
специализированные отделения (учреждения); в) контроль за
поступлением "Извещений" из учреждений других ведомств. На
основании информации, содержащейся в "Извещениях", составляется "Отчет о заболеваниях злокачественными новообразованиями" (форма № 7). Больные с преинвазивным раком в
этот отчет не включаются.
Сложившаяся в течение многих лет государственная система
регистрации онкологических заболеваний в России представ¬
79
ляет собой оптимальный вариант по сравнению с используемыми в мировой практике. Анализ первичной медицинской
документации на неучтенных детей показал, что практически
у всех из них диагноз был поставлен при жизни, но по тем или
иным причинам в диспансер не было послано "Извещение".
Первичное выявление заболевания на секции как результат несовершенства диагностики является редким событием. Основная причина прижизненного недоучета больных злокачественными новообразованиями — это несоблюдение онкологами и
врачами общей лечебной сети заключенных в систему учета
требований. Поэтому повышение качества и полноты информации об онкологических больных связано не столько с необходимостью совершенствования самой системы учета, сколько
с организационными проблемами. При их решении и создании
АСУ на базе современных компьютеров организаторы онкологической помощи получат возможность принимать решение
оперативно на условиях наиболее полной информированности.
В связи с относительной редкостью злокачественных новообразований у детей многие практические и научные вопросы
не могут быть корректно оценены на уровне отдельных административных территорий. Отсюда настоятельная необходимость создания всероссийского детского канцер-регистра.
Состояние онкологической помощи. Показатели состояния
онкопедиатрической помощи, рассчитанные на основании официальных отчетных данных (форма № 35), приведены в табл. 2.2.
За счет большой доли гемобластозов в структуре заболеваемости детей показатель морфологического подтверждения диагноза у них относительно высок — 85,5 %, в Москве — на 9 %
выше (94,5 %), но по ряду территорий не превысил 50 % (Марий Эл, Хакасия). В 19 регионах диагноз был верифицирован у
всех больных. Онкологические заболевания на профилактических осмотрах в детских коллективах выявляются очень редко.
В 1999 г. на 100 детей с впервые в жизни установленным диагнозом злокачественного новообразования приходилось лишь 3
заболевания, распознанных на профосмотрах.
Сопоставление распределения впервые выявленных заболеваний детей злокачественными новообразованиями по степени
распространения процесса со взрослыми больными невозможно
из-за высокой доли нестадируемых заболеваний среди детей. Однако, несмотря на это, все больные распределены по стадиям в
Курской, Саратовской, Кемеровской, Читинской, Камчатской
областях, республиках Карачаево-Черкесия и Ингушетия. Поэтому и доля больных с I—II стадиями заболевания оказалась
здесь очень высокой. В среднем по России опухоли на ранних
стадиях (I—И) в 1999 г. зарегистрированы у 25,6 % детей (в Москве — 22,1 %). Значительно выше показатель был в Кемеровской (51,7 %), Рязанской (45,5 %), Нижегородской (44,4 %),
80
Таблица 2.2. Показатели онкопедиатрической помощи в России
Россия
Москва
Показатель
Закончили
специаль-
ное лечение
Абсолютное число
на 100 новых больных
в том числе с использованием
методов:
хирургичес¬
кого
лучевого
лекарствен¬
ного
комбинированного или
комплексного
химиолуче-
вого
Находились под
наблюдением на
конец года (из
них 5 лет и более)
абсолютное число
на 100 тыс.
населения
абсолютное число
%
Индекс накопления контингентов
Летальность контингентов
Кумулятивный показатель
1995 г.
1999 г.
1995 г.
1999 г.
1832
1733
165
196
63
62
82
78
18,0
21,3
17,0
27,0
5,9
4,1
0,0
0,0
43,9
39,4
22,4
31,2
20,7
26,2
20,6
27,0
11,5
9,0
40,0
14,9
10 675
12 223
988
942
33,3
35,9
64,4
58,1
2939
4203
406
341
27,5
34,4
41,1
46,5
3,7
4,4
4,9
5,6
12,6
9,1
7,7
5,2
0,47
0,52
0,42
0,53
Саратовской (42,3 %) и Камчатской (50 %) областях, республиках Татарстан (48,5 %) и Карачаево-Черкесия (50 %).
Большие различия между числом заболеваний, не имеющих
стадийности, и количеством больных с неустановленной стадией заболевания по ряду территорий позволяют предположить,
что здесь "скрывается" и некоторое число больных с распространенным процессом. Величина доли умерших детей до
1 года с момента установления диагноза, во многом определяемая качеством лечения, в определенной мере зависит и от численности в этой группе заболеваний с высокой летальностью.
Поэтому оба показателя не отражают реальной запущенности
заболевания, сопоставимой с данными у взрослых больных, и
характеризуют многие стороны онкопедиатрической помощи.
При среднереспубликанском показателе запущенности
10,2 % доля больных с IV стадией достигает 25 % в Адыгее, Калмыкии, Ленинградской, Курской областях; 26,7 % — в Курганской; 35 % — в Томской и 33 % — в Читинской областях;
30 % — в республике Марий Эл; 26,2 % — в Приморском крае.
Из вновь выявленных больных на 1-м году с момента установления диагноза умирают 19 % (в Москве — около 15 %). Не
81
было в 1999 г. таких больных в Хакасии, Мордовии, Тамбовской и Камчатской областях. Однако показатель превышал
42 % в Коми (42,9 %), Владимирской (66,7 %) области, Чувашии (50 %).
На 100 вновь выявленных больных в России приходится
40 умерших (в Москве — 29). Значительно выше это соотношение в Тюменской (83), Костромской (77), Воронежской (62),
Пермской (66) областях, республиках Марий Эл (78), Бурятии
(93), Алтае и Карачаево-Черкесии (по 75). Показатель выше 100
(Курская область) обусловлен в основном погрешностями учета.
В России 1,7 тыс. детей (или 62 на 100 вновь выявленных
больных) закончили специальное лечение (в Москве 70 на
100 вновь выявленных). Соответственно структуре заболеваемости основным методом лечения был лекарственный (самостоятельный или в сочетании с другими).
Чем выше эффективность лечения и соответственно ниже
летальность, тем интенсивнее идет накопление контингентов.
На конец 1999 г. в России на учете состояли 12,2 тыс. детей (в
1995 г. — 9,7 тыс.), или 0,6 % в общем числе наблюдаемых контингентов. Число больных, наблюдавшихся 5 лет и более, достигало 4,2 тыс. (34,4 %).
Важным показателем, характеризующим состояние онкологической помощи, является выживаемость больных.
В течение последних 20 лет имеются определенные успехи в
раннем выявлении и лечении детей со злокачественными новообразованиями, которые привели к значительному росту их
выживаемости, особенно при остром лимфолейкозе (с 53 % в
1974—1976 гг. до 80 % в 1989—1994 гг.), раке почки (74 и 93 %),
опухолях центральной нервной системы (54 и 63 %), лимфогранулематозе (79 и 92 %). Для всех злокачественных новообразований показатель, по данным Европейского регистра, увеличился с 56 до 75 % заболевших.
Известные среднеевропейские показатели 5- и 10-летней относительной выживаемости больных злокачественными новообразованиями (ЗН) детей, зарегистрированные Европейским
канцер-регистром, следующие: минимальные значения отмечены при ЗН костей (45 %) и головного мозга (51 %), на уровне
60—75 % находятся ЗН носоглотки, яичника, почки, лейкозы;
80—90 % составляют опухоли яичка и лимфогранулематоз.
Больные со злокачественными новообразованиями головного мозга выживают в течение 5 лет в Польше (17 %), Эстонии
(24 %); выживаемость при этой форме злокачественных новообразований достигает 80 % в Швейцарии и Нидерландах. При
лейкозах минимальные показатели отмечены также в Эстонии
(17 %) и Польше (27 %), максимальные — в Германии (70 %).
На уровне 50—55 % 5-летняя выживаемость больных лейкозами в странах Северной Европы (в Дании, Финляндии), а также
в Нидерландах, Шотландии, Англии, Франции и Италии.
82
Заболеваемость. В 1999 г. число заболевших и умерших от
рака детей продолжало снижаться и составило 2,9 тыс. и
1,5 тыс. соответственно. Первое место в структуре заболеваемости (46 %) и смертности (46 %) детей занимают гемобласто-
зы, далее следуют опухоли ЦНС (18,3 %), костей и мягких тканей (11,4 %), почек (6,3 %). Среди гемобластозов наиболее часто встречаются лимфолейкозы, лимфо- и ретикулосаркомы,
лимфогранулематоз.
За 1990—1999 гг. увеличилась доля больных злокачественными новообразованиями костей и суставных хрящей, яичника,
печени, ЦНС и рака щитовидной железы, снизилась — яичка,
почки и гемобластозов.
Максимальная заболеваемость и смертность отмечается у
лиц обоего пола в 0—4 года. В этой возрастной группе пик заболеваемости выражен при раке печени, мягких тканей, яичка,
почки, лейкозах. Наибольшие показатели заболеваемости в 5—
9 лет были при злокачественных новообразованиях ЦНС, в
10—14 лет —при лимфогранулематозе, злокачественных новообразованиях костей и суставных хрящей, яичника, щитовидной железы, полости рта.
В 1999 г. наиболее высокая заболеваемость (стандартизованный показатель) детей злокачественными новообразованиями
наблюдалась в Северо-Западном (15,6) районе. Максимальная
заболеваемость злокачественными новообразованиями костей
и суставных хрящей (0,8!) — в Волго-Вятском, ЦНС (2,3), мягких тканей (1) — в Северном, почки (1,3) — в Центральном и
Волго-Вятском районах. Высокие среднегодовые показатели
заболеваемости злокачественными новообразованиями отмечались в Санкт-Петербурге (16,2), Москве (14,3), Свердловской
(15,9), Рязанской (13,6) и Брянской (13,3) областях, раком почки — в Свердловской (1,6) и Брянской (1,4) областях, ЦНС —
в Липецкой области (3,2), Санкт-Петербурге (3,7) и Москве (3),
костей и мягких тканей — в Адыгее, Орловской и Сахалинской
(по 1,2), гемобластозами — в Ленинградской, Астраханской и
Рязанской областях (по 7,1) (табл. 2.3).
Значительно выше, чем в среднем по России, заболеваемость раком в США, Дании, Финляндии, Норвегии, Швеции и
Новой Зеландии (15,0—15,6).
Заболеваемость злокачественными новообразованиями детей имеет свои особенности как в России, так и в различных
странах мира. Максимальная заболеваемость злокачественными новообразованиями детей отмечается в Швеции, Норвегии,
Дании, Финляндии (15,4), в США (у белых детей), а также в
Новой Зеландии (15—15,6). Сравнительно низкая заболеваемость ЗН в Алжире, Мали и Индии.
Первое место в структуре заболеваемости злокачественными
новообразованиями детей занимают гемобластозы (46 %). Мальчики поражались чаще девочек лимфогранулематозом, лимфо-
83
Таблица 2.3. Среднегодовые стандартизованные показатели заболеваемости ЗН детского населения республик,
краев и областей России (1995—1999 гг.)
Экономический район,
Все
В том числе
город, республика, край,
область
злокачественные
новообразования
(140-208)
кости и мягкие
ткани (170, 171)
почки (189)
ЦНС (191, 192)
гемобластозы
(200-208)
Северный
Республика Карелия
8,1 (64-65)
0,29 (66)
0,12 (75-76)
2,5 (7)
4,6 (49-52)
Республика Коми
11,7 (22)
0,16 (73)
0,63 (47-78)
2,0 (16-20)
5,1 (31-33)
Архангельская область
12,9(11)
0,43 (51-52)
0,90 (23)
2,0 (16-20)
5,9 (19)
Вологодская область
11,9 (20)
0,55 (28-35)
0,59 (51)
3,2 (2)
4,9 (39-43)
Мурманская область
10,2 (37-40)
0,82 (15-16)
1,0 (14-17)
0,89 (68)
4,2 (58)
Северо-Западный
Санкт-Петербург
16,2 (1)
0,73 (20)
1,3 (3-7)
3,7 (1)
7,1 (1-3)
Ленинградская область
5,4 (76)
0,46 (43-45)
0,45 (59-60)
0,65 (74)
2,5 (74)
Новгородская область
9,8 (45)
0,24 (69-70)
0,39 (63)
1,6 (36-41)
6,2 (16)
Псковская область
11,0 (27-28)
0,42 (53)
1,2 (8-10)
1,1 (61-66)
6,4 (13-14)
Центральный
Брянская область
13,3 (7-9)
0,84 (13)
1,4(2)
1,9 (21-26)
4,9 (39-43)
Владимирская область
10,1 (41-43)
0,38 (56-57)
0,94 (21)
1,9 (21-26)
5,8 (20-21)
Ивановская область
9,4 (47)
0,37 (58-59)
0,32 (67-69)
1,4 (47-53)
3,6 (63-65)
Тверская область
10,2 (37-40)
0,56 (27)
0,78 (32)
1,6 (36-41)
5,0 (34-38)
Калужская область
12,2 (19)
0,53 (37)
0,53 (56-57)
2,3 (10-12)
6,6 (11-12)
Костромская область
10,9 (29-30)
0,31 (64-65)
1,0 (14-17)
2,0 (16-20)
5,5 (24-26)
Москва
14,3 (3)
0,52 (38-39)
0,84 (28)
3,0 (3)
6,4 (13-14)
Продолжение
Экономический район,
Все
В том числе
город, республика, край,
область
злокачественные
новообразования
(140-208)
кости и мягкие
ткани (170, 171)
почки (189)
ЦНС (191, 192)
гемобластозы
(200-208)
Московская область
9,7 (46)
0,50 (41)
1,1 (11-13)
0,71 (72)
4,9 (39-43)
Орловская область
12,6 (14-16)
1,2 (1-2)
1,2 (8-10)
1,7 (31-35)
5,2 (30)
Рязанская область
13,6 (4)
0,86 (12)
1,3 (3-7)
1,7 (31-35)
7,1 (1-3)
Смоленская область
12,5 (17)
0,90 (8)
0,98 (18)
1,2 (58-60)
6,7 (6-10)
Тульская область
10,1 (41-43)
0,38 (56-57)
1,3 (3-7)
1,7 (31-35)
4,7 (47-48)
Ярославская область
12,7 (12-13)
0,81 (17-18)
0,54 (54-55)
1,2 (58-60)
6,7 (6-10)
Волго-Вятский
Республика Марий Эл
6,7 (73)
0,19 (71-72)
0,49 (58)
1,5 (42-46)
2,6 (71-73)
Республика Мордовия
9,1 (51-54)
0,45 (46-49)
0,71 (40)
0,84 (70)
4,6 (49-52)
Чувашская республика
5,8 (75)
0,64 (25)
0,38 (64)
1,32 (54-57)
2,4 (49-52)
Нижегородская область
13,3 (7-9)
0,97 (6-7)
1,1 (11-13)
1,7 (31-35)
4,9 (39-43)
Кировская область
10,8 (31-32)
0,87 (11)
0,83 (29-31)
2,1 (14-15)
4,5 (53-54)
Центрально-Черноземный
Белгородская область
10,5 (34)
0,55 (28-35)
0,95 (19-20)
1,3 (54-57)
5,5 (24-26)
Воронежская область
8,9 (56)
0,48 (42)
0,83 (29-31)
1,3 (54-57)
4,8 (44-46)
Курская область
8,0 (66-67)
0,44 (50)
0,64 (46)
1,5 (42-46)
2,9 (69)
Липецкая область
13,5 (5-6)
0,69 (22-23)
1,0 (14-17)
2,6 (6)
6,8 (4-5)
Тамбовская область
8,1 (64-65)
0,88 (9-10)
М (П-13)
1,4 (47-53)
3,8 (61)
оо
1У»
оо
ON
Продолжение
Экономический район,
Все
В том числе
город, республика, край,
область
злокачественные
новообразования
(140-208)
кости и мягкие
ткани (170, 171)
почки (189)
ЦНС (191, 192)
гемобластозы
(200-208)
Поволжский
Республика Калмыкия
8,4 (62)
0,00 (74-78)
0,73 (38)
1,8 (27-30)
3,5 (66)
Республика Татарстан
13,3 (7-9)
0,45 (46-49)
0,74 (37)
1,9 (21-26)
5,8 (20-21)
Астраханская область
13,1 (10)
0,88 (9-10)
1,3 (3-7)
1,3 (54-57)
7,1 (1-3)
Волгоградская область
12,7 (12-13)
0,83 (14)
0,87 (24-26)
2,3 (10-12)
6,6 (11-12)
Самарская область
П,5 (24)
0,52 (38-39)
0,95 (19-20)
2,8 (5)
5,0 (34-38)
Пензенская область
12,6 (14-16)
0,78 (19)
1,3 (3-7)
1,9 (21-26)
6,7 (6-10)
Саратовская область
8,7 (57-59)
0,45 (46-49)
0,53 (56-57)
1,5 (42-46)
3,6 (63-65)
Ульяновская область
10,2 (37-40)
0,31 (64-65)
0,70 (41)
1,6 (36-41)
5,3 (29)
Северо-Кавказский
Кабардино-Балкария
7,8 (68)
0,37 (58-59)
0,22 (71)
0,67 (73)
4,5 (53-54)
Карачаево-Черкесия
9,2 (49-50)
0,81 (17-18)
0,45 (59-60)
2,0 (16-20)
2,4 (75-76)
Республика Адыгея
7,0 (72)
U О)
0,40 (62)
0,58 (77)
2,6 (71-73)
Республика Дагестан
7,7 (69-70)
0,32 (61-63)
0,44 (61)
1,1 (61-66)
4,3 (56-57)
Республика Северная
Осетия
8,2 (63)
0,71 (21)
0,12 (75-76)
0,57 (76)
5,5 (24-26)
WV А 11/1
Краснодарский край
11,6 (23)
0,82 (15-16)
0,77 (33-35)
1,4 (47-53)
6,1 (17-18)
Ставропольский край
9,1 (51-54)
0,41 (54-55)
0,60 (50)
2,1 (14-15)
3,7 (62)
Ростовская область
8,0 (66-67)
0,41 (54-55)
0,18 (72)
1,1 (61-66)
4,8 (44-46)
Продолжение
Экономический район,
Все
В том числе
город, республика, край,
область
злокачественные
новообразования
(140-208)
кости и мягкие
ткани (170, 171)
почки (189)
ЦНС (191, 192)
гемобластозы
(200-208)
Уральский
Республика Башкор-
П,8 (21)
0,55 (28-35)
0,77 (33-35)
2,0 (16-20)
5,6
(22-23)
тостан
Удмуртская Республика
9,2 (49-50)
0,43 (51-52)
0,30 (70)
0,87 (69)
5,0
(34-38)
Свердловская область
15,9 (2)
1,0 (4-5)
1,6(1)
2,9 (4)
6,7
(6-10)
Курганская область
12,3 (18)
0,63 (26)
0,67 (43-44)
1,4 (47-53)
6,8
(4-5)
Оренбургская область
11,4 (25)
0,45 (46-49)
0,66 (45)
2,3 (10-12)
5,6
(22-23)
Пермская область
7,7 (69-70)
0,19 (71-72)
0,55 (53)
1,1 (61-66)
3,4
(67-68)
Челябинская область
10,0 (44)
0,46 (43-45)
0,87 (24-26)
1,8 (27-30)
4,3
(56-57)
Западно-Сибирский
Республика Алтай
8,6 (60-61)
0,55 (28-35)
0,00 (77-78)
1,9 (21-26)
5,1
(31-33)
Алтайский край
9,1 (51-54)
0,46 (43-45)
0,32 (67-69)
1,5 (42-46)
4,4
(55)
Кемеровская область
8,7 (57-59)
0,66 (24)
0,13 (74)
0,58 (75)
6,1
(17-18)
Новосибирская область
13,5 (5-6)
0,51 (40)
1,0 (14-17)
2,4 (8-9)
6,7
(6-10)
Омская область
10,4 (35-36)
0,69 (22-23)
0,17 (73)
0,95 (67)
5,4
(27-28)
Томская область
10,1 (41-43)
0,55 (28-35)
0,67 (43-44)
1,1 (61-66)
5,0
(34-38)
Тюменская область
9,1 (51-54)
0,55 (28-35)
0,35 (66)
1,4 (47-53)
4,6
(49-52)
Восточно-Сибирский
Республика Бурятия
7,1 (71)
0,32 (61-63)
1,2 (8-10)
1,8 (27-30)
2,8
(70)
оо
оо
Продолжение
Экономический район,
Все
В том числе
город, республика, край,
область
злокачественные
новообразования
(140-208)
кости и мягкие
ткани (170, 171)
почки (189)
ЦНС (191, 192)
гемобластозы
(200-208)
Республика Тува
6,2 (74)
0,00 (74-78)
0,72 (39)
1,6 (36-41)
1,9 (77)
Республика Хакасия
9,0 (55)
0,97 (6-7)
0,91 (22)
1,4 (47-53)
3,6 (63-65)
Красноярский край
9,3 (48)
0,54 (36)
0,87 (24-26)
1,9 (21-26)
4,0 (59-60)
Иркутская область
8,6 (60-61)
0,55 (28-35)
0,54 (54-55)
1,5 (42-46)
4,7 (47-48)
Читинская область
Дальневосточный
8,7 (57-59)
0,32 (61-63)
0,32 (67-69)
0,73 (71)
5,4 (27-28)
Республика Саха (Якутия)
11,0 (27-28)
1,0 (4-5)
0,83 (29-31)
2,2 (13)
4,0 (59-60)
Приморский край
11,3 (26)
0,35 (60)
0,77 (33-35)
1,8 (27-30)
5,0 (34-38)
Хабаровский край
10,8 (31-32)
0,28 (67)
0,69 (42)
1,6 (36-41)
4,9 (39-43)
Амурская область
10,4 (35-36)
0,27 (68)
0,37 (65)
1,2 (58-60)
4,8 (44-46)
Камчатская область
10,9 (29-30)
0,00 (74-78)
0,57 (52)
2,4 (8-9)
4,6 (49-52)
Магаданская область
5,2 (77)
0,00 (74-78)
0,61 (49)
1,1 (61-66)
2,6 (71-73)
Сахалинская область
10,2 (37-40)
1,2 (1-2)
0,63 (47-48)
1,4 (47-53)
3,4 (67-68)
Калининградская
область
12,6 (14-16)
0,24 (69-70)
0,85 (27)
1,6 (36-41)
6,3 (15)
В целом по России:
10,7
0,55
0,75
1,7
5,1
и ретикулосаркомами, острым миелолейкозом. Пик заболеваемости лейкозами приходится на 0—4 года, лимфо- и ретикулосаркомами — на 5—9 лет, лимфогранулематозом — на 10—
14 лет. Значительно выше среднероссийской (5,2) заболеваемость гемобластозами в Санкт-Петербурге (10,2), Астраханской
(9,8) и Камчатской (8,6) областях.
Почка — сравнительно частая локализация ЗН у детей. Наиболее высокая заболеваемость отмечается в странах Северной
Европы, Канаде (1). На уровне 0,6—0,9 заболеваемость в Англии, Шотландии, России, Словакии. Одинаково часто встречается рак почки у белого и черного населения США (0,9—1,0).
Менее 0,4 заболеваемость в Индии, Алжире и Японии. Наиболее высока заболеваемость этой формой рака в возрасте 0—
4 года у детей обоего пола. Среди регионов России максимальная заболеваемость раком почки выявлена в Псковской (3,4),
Тульской (3,1), Кировской (2,9), Магаданской (2,6) областях,
республике Калмыкия (4,1).
В структуре заболеваемости детей злокачественные новообразования ЦНС занимают 2-е место (см. рис. 2.2). Максимальных размеров показатели достигают в Швеции, Дании, Финляндии (5—5,1 %ооо). Низка заболеваемость в России (2), Бразилии
и Индии (по 1,5). Значительно выше среднероссийской заболеваемость опухолями ЦНС в Томской (4,5), Вологодской (4,3),
Пензенской и Калининградской (по 3,1) областях, Хабаровском
(3,4) и Ставропольском (3,1) крае, в Москве (3,6).
Наиболее высока заболеваемость злокачественными новообразованиями костей на Кубе, в Бразилии, среди белого населения в США, России, Канаде, Италии и Испании (0,6—0,7).
Максимальные показатели отмечаются в 10—14 лет. Меланомой кожи дети сравнительно часто заболевают в Норвегии
(0,30) и Австралии (0,38), в 5 раз реже — в России (0,06). На
уровне 0,31—0,34 (на 100 тыс. детей) заболеваемость раком печени в Мали, Китае, Сингапуре и Норвегии. Низка заболеваемость в Алжире, Бразилии, Польше и Франции (0,06—0,09); в
России она составляет 0,18. Наиболее часто дети поражаются в
возрасте 0—4 года. Заболеваемость выше у мальчиков (0,24),
чем у девочек (0,15).
В 1999 г. в России умерли 36 тыс. детей (0—14 лет), из которых 24,7 % от несчастных случаев и 24,2 % — от состояний,
возникающих в перинатальном периоде. На долю новообразований в структуре смертности детского населения приходится
лишь 5,5 % (6-е место). Однако уже в 5—14 лет они прочно занимают 2-е место у лиц обоего пола. В России, США рак является 2-й (после несчастных случаев) причиной смерти детей
от 1 года до 14 лет. Далее следует смерть от врожденных аномалий (пороков развития) (8,9 %), болезней органов дыхания,
нервной системы и органов чувств (по 8,5 %), инфекционных
заболеваний (3,8 %).
89
Таблица 2.4. Возрастно-половые показатели смертности
Возраст, годы
Причина смерти
0-
-4
5-
-9
10-
-14
м
Д
м
д
м
д
Врожденные аномалии
92,8 81,4
3,6
3,3
2,3
1,6
(1)
(4)
(4)
Несчастные случаи
58,0 44,8
36,7
19,8
40,9
16,0
(3)
0)
(1)
Болезни органов дыхания
59,8 49,2
2,8
2,1
1,6
1,2
(2)
(5)
(5)
Новообразования
8,6 7,7
6,3
4,4
5,6
4,3
(6)
(2)
(2)
Болезни нервной системы и
13,7 10,3
5,8
4,5
4,2
3,2
органов чувств
(5)
(3)
(3)
Инфекционные болезни
31,2 23,5
1,3
1,5
1,0
0,7
(4)
(6)
(6)
В табл. 2.4 представлены возрастно-половые показатели
смертности детей в зависимости от основных классов болезней
и их ранги. В 0—4 года 1-е ранговое место занимают врожденные аномалии (пороки развития), которые затем перемещаются
на 4-е место. На 2-м месте — болезни органов дыхания, переходящие в 5—14 лет на 5-е место, на 3-м — несчастные случаи,
поднимающиеся в следующих возрастных группах на лидирующее 1-е место; новообразования с 6-го ранга в 0—4 года поднимаются на 2-е место.
Пик смертности детей от злокачественных новообразований
приходится на возрастную группу 0—4 года в основном за счет
опухолей мочевых органов, органов пищеварения и дыхания. В
возрасте 10—14 лет дети чаще умирают от злокачественных новообразований костей и мягких тканей.
В 1999 г. 1,5 тыс. детей умерли от рака (в 1990 г. — 2,3 тыс.),
из них 610 (42 %) — от гемобластозов, 55 (3,8 %) — от рака почки,
352 (24,3 %) — от опухолей центральной нервной системы, 329
(12,1 %) — от злокачественных новообразований костей и мягких тканей.
Информативно (в определенном смысле) сравнение соотношений показателей смертности и заболеваемости. По мнению
многих авторов, соотношение числа умерших и заболевших является индикатором тяжести заболевания ("груз заболевания").
Чем ближе значение к единице, тем хуже прогноз для данной
локализации. Отношение числа умерших от рака детей к забо¬
90
левшим в 1999 г. в России составило от 0,2—0,5 при всех злокачественных новообразованиях, а также гемобластозах, при
меланоме кожи, раке яичка, мочевого пузыря, почки до 0,7—
0,9 при злокачественных новообразованиях органов пищеварения (в том числе печени) и ЦНС.
Стандартизованные показатели смертности наиболее высоки в Волго-Вятском (6,6), Северном и Центрально-Черноземном (по 6,3) районах, при раке губы, полости рта и глотки — в
Восточно-Сибирском и Дальневосточном (по 0,23), органов
пищеварения — в Уральском (0,19), при лимфомах — в Северо-
Западном (0,71) районах.
В ранжированном ряду среднегодовых показателей смертности первые 3 места занимают Астраханская, Волгоградская и
Пензенская (7,8—8,7 %ооо) области, при раке губы, полости рта
и глотки — Калужская область, Кабардино-Балкария и Бурятия
(0,28—0,51 %ооо), при раке мочевых органов — республики Хакасия, Тыва и Оренбургская область (0,9—1,1 %ооо), при лимфомах — Кабардино-Балкария, Карачаево-Черкесия и Адыгея
(1,4—2,1 %ооо), при лейкозах — Астраханская и Тамбовская области, Тыва (3,0—3,2 %ооо).
Смертность детей от злокачественных новообразований во
многих странах, включая Россию, стабилизировалась или несколько снижается.
Среди причин инвалидности первое место занимают болезни нервной системы и органов чувств, второе — психические
расстройства, затем врожденные аномалии, болезни органов
дыхания, костно-мышечной системы и соединительной ткани,
эндокринные заболевания, болезни мочеполовой системы,
травмы и отравления, а также болезни органов пищеварения.
Среди детей-инвалидов вследствие злокачественных новообразований у 44,9 % причиной инвалидности являются гемобла-
стозы — от 36,3 % в 0—4 года до 47,8 % в 5—9 лет.
На 10 000 детского населения приходится 141 инвалид, от
91 в 0—4 года до 166 в 10—14 лет. Новообразования чаще распространены среди инвалидов в возрасте 10—14 лет (6 на
10 000 против 2 в 0—4 года).
Средняя продолжительность жизни детей увеличивается с
возрастом при всех формах опухолей. Больные гемобластозами
живут в несколько раз дольше, чем больные злокачественными
новообразованиями костей и мягких тканей.
Частота, структура и особенности распространения злокачественных новообразований в различных популяциях и на отдельных территориях России, как видно из представленных данных, не остаются стабильными. Анализ происходящих перемен
и использование его результатов в целях управления, перспективного планирования и оценки эффективности проводимых
лечебно-профилактических мероприятий способствует совершенствованию онкологической помощи детскому населению.
91
Глава 3
ОСНОВНЫЕ ПРИНЦИПЫ
ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ
ОПУХОЛЕЙ У ДЕТЕЙ
Результаты лечения злокачественных новообразований у детей
находятся в прямой зависимости от стадии опухолевого процесса, т. е. от сроков установления диагноза. Диагностирование
заболевания в поздней стадии, когда налицо выраженные симптомы распространенного процесса, в подавляющем большинстве случаев бесполезно для больного, так как, несмотря на
применение всех возможных методов терапии, излечение ребенка маловероятно.
Своевременная диагностика опухоли основана на выявлении
слабовыраженных, порой неясных симптомов, которые не приводят к заметному ухудшению состояния ребенка и часто игнорируются родителями и врачами, не имеющими онкологической
настороженности. Дополнительные трудности связаны с тем,
что многие часто встречающиеся новообразования у детей имеют скрытую локализацию (опухоли центральной нервной системы, забрюшинного пространства, средостения и др.).
В целях улучшения своевременной диагностики новообразований предусмотрено осуществить:
• своевременную диагностику злокачественных опухолей в
амбулаторно-поликлинических учреждениях по месту
первичной обращаемости больных путем повышения онкологической настороженности врачей этих учреждений,
рационального применения современных инструментальных и лабораторных методов;
• обязательное проведение всестороннего обследования
для выявления предопухолевых и опухолевых заболеваний у больных, находящихся на лечении в стационарах
лечебно-профилактических учреждений;
• направление больных злокачественными новообразованиями в онкологические и другие специализированные
учреждения, имеющие оборудование и условия для лучевого, комбинированного и комплексного лечения.
Современное клиническое обследование детей — это процесс, начинающийся с расспроса родителей и ребенка (если это
возможно), осмотра последнего, включающий в себя применение целого ряда специальных методик. Различают 3 группы методов обследования — общие, частные и специальные.
В общие входят расспрос ребенка или родителей (с особым
вниманием к семейному анамнезу), физикальное исследование
органов и систем (при необходимости пальпация органов
брюшной полости и малого таза под наркозом), взвешивание и
определение роста ребенка, измерение температуры тела, арте¬
92
риального давления, общий анализ крови с оценкой функции
костного мозга, общий анализ мочи, оценка функционального
состояния печени и почек.
Эти данные имеют значение не только для установления
правильного диагноза заболевания, но они также необходимы
для последующей оценки изменений функции отдельных органов и тканей, развивающихся вследствие проведенного противоопухолевого лечения.
К частным относят методы, которые применяются в обязательном порядке в диагностике у детей, больных данной формой
злокачественной опухоли, независимо от ее патологической
природы, распространенности и наличия осложнений, например, физикальное исследование пораженной области, исследование регионарных лимфатических узлов и рентгенография пораженного отдела скелета при опухолях костей.
Специальные методы исследования применяются лишь у некоторых больных с определенной локализацией опухоли, т. е.
при наличии особых показаний, например, радиоизотопная диагностика, ангиография мозга, электроэнцефалография при диагностике опухолей головного мозга.
Общие методы исследования позволяют заподозрить наличие злокачественного процесса у ребенка и дать основание врачу использовать частные и специальные методы, необходимые
для раннего распознавания опухоли и определения степени ее
распространенности.
При этом врач должен понимать, что злокачественные опухоли у детей, особенно раннего возраста, в течение длительного
периода протекают скрытно. Поэтому нельзя просто ждать проявления болезни, а следует активно искать признаки опухолевого заболевания.
Во многих случаях диагностический этап может быть завершен использованием частных методов обследования.
Диагностика новообразований у детей осуществляется трехэтапно: участковый педиатр и специалисты детской районной
поликлиники, детский терапевтический или хирургический
стационар и специализированное детское онкологическое (гематологическое) отделение. На каждом из этих этапов решаются свои задачи. В условиях поликлиники необходимо заподозрить наличие опухолевого процесса и немедленно госпитализировать ребенка. В специализированном стационаре следует в
короткие сроки подтвердить или отвергнуть онкологический
диагноз, а при подтверждении его перевести больного в детское
онкологическое отделение. В последнем уточняются локализация, морфологический вид и стадия новообразования, без чего
невозможна современная адекватная терапия.
Принципы обследования больного ребенка в онкопедиатрии
существенно не отличаются от таковых в педиатрии, но учитывают особенности роста и развития опухолевого процесса.
93
При сборе анамнеза необходимо выяснить детально особенности развития ребенка от рождения до момента обследования.
Учитывая врожденный характер большинства опухолей, можно
обнаружить у ряда больных сопутствующие пороки и асимметрию развития, стигмы. Во многих случаях за 1—3 мес, а иногда
и больший срок до появления несомненных признаков заболевания, выявляются симптомы так называемого общего опухолевого симптомокомплекса. Такие признаки, как вялость, сонливость, беспокойный сон, повышенная раздражительность,
ухудшение аппетита, рвота, похудание, нарушение стула, а также повышение температуры без явных других проявлений определенного заболевания, нередко бывают первыми симптомами
злокачественного процесса. Необходимо обращать внимание
также на "беспричинные" боли в конечностях, кровоизлияния и
другие симптомы. В каждом случае врач должен объяснить их
происхождение, что требует детального обследования ребенка в
поликлинике, а затем, при неясном диагнозе, — в стационаре.
Особенности диагностики опухолей у детей связаны с рядом
факторов:
• невозможностью получения анамнеза от пациента (у детей раннего возраста), отсутствием жалоб. Поэтому приходится прибегать к расспросу родителей и ближайших
родственников, а эти сведения далеко не равноценны
данным, полученным от больного;
• относительно малым числом визуально обнаруживаемых
опухолей. У детей встречаются как казуистика рак молочной железы, рак шейки матки, рак пищевода и желудка
(которые доступны эндоскопическому исследованию).
Из визуально наблюдаемых опухолей можно указать на
врожденный лейкоз (увеличение лимфатических узлов и
лейкемоиды на коже), рабдомиосаркомы влагалища и
опухоли мягких тканей;
• расположением наиболее часто встречающихся опухолей
у детей в труднодоступных для исследования областях: черепной коробке (опухоли ЦНС), забрюшинном пространстве (нефробластома, нейробластома). Опухоли, локализующиеся в этих областях, нередко растут медленно, не
вызывая видимых объективных изменений. Раздвигая окружающие ткани и органы, новообразования постепенно
увеличиваются в размере и часто обнаруживаются лишь
тогда, когда достигнут значительной величины или, как
это нередко бывает при нефробластоме, дадут метастазы
в отдаленные органы. Обнаружение опухолей ЦНС у детей особенно затруднено, так как опухоли мозга обычно
начинают проявляться субъективными ощущениями (головокружение, тошнота, нарушения зрения, головные
боли), о которых дети раннего возраста не могут сооб¬
94
щить окружающим. Не менее трудно и раннее распознавание опухолей, расположенных в забрюшинном пространстве. Если врач устанавливает диагноз на стадии заболевания, когда опухоль еще не достигла больших
размеров, то мы считаем, что диагноз поставлен своевременно, но это вовсе не значит, что он поставлен на ранней,
начальной стадии заболевания. Кроме того, для установления точного диагноза при забрюшинном расположении
опухоли нередко приходится прибегать к относительно
сложным методам исследования (аортография, радиоизотопная диагностика, лимфография, компьютерная томография). Однако и эти сложные методы исследования отнюдь не всегда позволяют поставить диагноз на самом
раннем этапе развития опухоли; новообразование должно
достигнуть определенных размеров, чтобы быть зафиксированным;
• множеством "масок", под которыми скрываются злокачественные опухоли. Практически любое заболевание в
раннем детском возрасте, да и некоторые физиологические состояния, могут своими проявлениями быть похожими на опухолевый процесс, и наоборот. Положение
усугубляется тем, что наряду с опухолью нередко протекают другие заболевания и процессы (прорезывание зубов, рахит). Необходимо вспомнить и тот факт, что опухоли часто сочетаются с пороками развития, которые могут маскировать новообразование;
• необходимостью применения почти во всех случаях анестезиологического пособия при диагностических исследованиях. Это делается не только для того, чтобы избавить ребенка от неприятных ощущений, но и для того,
чтобы добиться его "обездвиживания". Учитывая это, рекомендуется во время дачи наркоза или при других методах обезболивания проводить не одну, а несколько процедур, требующих иммобилизации больного.
Диагностика новообразований у детей является комплексной
с учетом данных клинических, лабораторных, радиологических
(рентгенологических, радиоизотопных), морфологических и некоторых других методов исследования (эхотомография, термография и др.). Указанные методы по возможности проводятся
одновременно с анализом полученных данных. Разумеется, последовательность проведения и удельный вес различных видов
и методов обследования ребенка существенно разнятся в зависимости от вида, локализации, стадии, гормональной активности новообразований. Вместе с тем имеется ряд общих положений диагностики новообразований вне зависимости от их особенностей и локализаций.
95
\ Общие методы обследования ребенка
Анамнез. Правильный расспрос родителей и родственников
ребенка во многом способствует решению диагностической задачи. Собирая общий или отдаленный анамнез, надо выявить
следующие факты: бытовые и профессиональные вредности, с
которыми могли встречаться родители до зачатия ребенка, случаи злокачественных новообразований в их семьях. Иногда это
может оказаться существенным: так, например, при ретино-
бластоме указание на то, что в семье были случаи такого заболевания, диктует врачу необходимость консультации обследуемого ребенка у офтальмолога. Исследования показали достоверную зависимость: чем старше мать, тем больше возможность
возникновения опухоли у ребенка. Врач должен расспросить
мать о разных факторах, которые тем или иным образом могли
воздействовать на нее во время беременности (прием лекарственных препаратов без назначения врача, алкоголя, курение,
контакты с некоторыми пестицидами, канцерогенными веществами). Обязательно должны быть собраны сведения об облучении матери во время беременности. Должны быть зафиксированы заболевания, которые возникали во время беременности. Необходимо выяснить и течение родов, что может прояснить
некоторые моменты и помочь в дифференциальной диагностике.
Например, когда родители, взволнованные обнаружением опухоли в области шеи у ребенка, приходят к врачу, то в подавляющем большинстве их можно успокоить. Во время родов при
ягодичном предлежании плода возможны разрывы грудиноключично-сосцевидной мышцы с образованием гематомы.
В результате родовой травмы может произойти отслойка
надкостницы в теменной области, которая в некоторых случаях
может симулировать опухоль. Необходимо помнить, что в родильном доме при осмотре могут быть выявлены сосудистые и
пигментные, дермоидные и тератоидные опухоли. Крестцово-
копчиковые тератомы обычно обнаруживаются уже при рождении и должны стать особым объектом наблюдения.
Очень часто увеличение живота у маленького ребенка принимается за рахит. Перенесенные ребенком заболевания тоже
могут помочь в диагностике и дифференциальной диагностике.
Тромбофлебит пупочных вен может объяснить развившуюся в
дальнейшем гепатомегалию и спленомегалию, гемолитическую
болезнь — желтуху.
Врачу, обследующему маленького ребенка, следует помнить о
ряде заболеваний новорожденных, таких как токсическая эритема, сепсис, воспаление грудных желез, стоматит.
Физические методы исследования. Уже первый взгляд на ребенка со злокачественной опухолью может сказать врачу многое.
Ребенок малоподвижен, безучастен (реже — крайне беспокоен),
у него "задумчивый", устремленный в одну точку взгляд. В не¬
96
которых случаях можно наблюдать одышку, раздувание крыльев носа, цианоз. Кожа ребенка серовато-белая, иногда с желтушным оттенком. На коже могут отмечаться кровоизлияния,
кровоподтеки (лейкоз, поздние стадии нейробластомы). Отмечается похудание в той или иной степени. Могут наблюдаться
экзофтальм (нейробластома, гистиоцитоз X, саркомы орбиты),
экхимозы (нейробластома, лейкоз), на коже — различные припухлости. В некоторых случаях они могут приобретать определенную окраску. Чаще всего встречаются сосудистые опухоли —
гемангиомы, столь распространенные в детском возрасте. Нужно
помнить, что наряду с кожными ангиомами могут наблюдаться
и гемангиомы печени.
Уплотнения, прощупываемые на коже, могут быть следствием лейкемической инфильтрации (лейкемоиды), уплотнения (в
виде "бугров"), прощупываемые в области черепа, — результатом
травмы во время родов, а также метастазами нейробластомы.
Степень выраженности подкожного жирового слоя у ребенка также должна интересовать врача. Похудание, снижение
плотности тканей, выраженные в той или иной степени, почти
всегда сопровождают злокачественную опухоль у ребенка. При
этом, если у детей старшего возраста похудание выражено не
очень резко, то у маленьких детей можно наблюдать и явления
кахексии. Следует также помнить, что масса тела ребенка за
счет роста опухоли может не уменьшаться.
Осмотр шеи позволяет видеть увеличение лимфатических узлов. Как мы указывали, у маленьких детей лимфогранулематоз и
другие злокачественные лимфомы встречаются как казуистика,
увеличение же лимфатических узлов у них может встречаться при
лейкозе или нейробластоме. Нужно помнить о кровоизлияниях
в кивательную мышцу, о лимфаденитах неопухолевой природы.
При осмотре грудной клетки нужно обратить внимание на ее
форму. При некоторых забрюшинных опухолях и опухолях печени можно наблюдать ее деформацию. Иногда в нижних ее отделах при опухолях забрюшинного пространства и печени бывает выражен подкожный венозный рисунок. Родителей грудных детей нередко волнует увеличение молочных желез, в связи
с чем они обращаются к онкологу. Увеличение молочных желез
у маленьких детей следует относить к физиологическим причинам (нужно помнить при этом о мастите новорожденных). При
осмотре живота иногда отмечается его равномерное увеличение, которое часто принимают за рахитическое (при этом часто
отмечается умеренная сплено- и гепатомегалия). При дряблой
брюшной стенке опухоли значительно изменяют конфигурацию живота. Может наблюдаться выбухание правой или левой
половины живота (при нефробластоме, реже — при нейробластоме). Справа деформация всегда более заметна; по-видимому,
это связано с тем, что в деформации участвует и печень. Увеличивается и объем живота. Педиатр часто встречается с уве-
97
личением живота при рахите (в связи с чем этот диагноз столь
часто ставят при опухолях брюшной полости и забрюшинного
пространства). Наряду с увеличением живота, его объема при
опухоли нередко можно видеть выраженный сосудистый рисунок, особенно в его верхней части.
Осмотр поясничной области может указать на сколиоз, вызванный опухолью забрюшинного пространства, выбухание в
виде "пирожка" слева или справа от позвоночника (что бывает
при нейробластоме и реже — при нефробластоме).
В подавляющем большинстве случаев первым этапом диагностики является исследование первичного очага поражения.
При этом необходимо установить локализацию, местное распространение и морфологический характер опухоли с учетом
частоты тех или иных новообразований и заболеваний, включая
пороки развития определенных органов и тканей у детей. Например, при выявлении "опухоли" в животе необходимо учитывать, что новообразования органов и тканей забрюшинного
пространства встречаются у детей в 10—15 раз чаще, чем внут-
рибрюшинные опухоли. Вместе с тем у детей до 1 года пороки
развития почек встречаются значительно чаще, чем нефробла-
стомы. Указанные закономерности делают целесообразным
проведение на первом этапе обследования детей с опухолевыми
образованиями в животе экскреторной урографии, которая является важнейшим методом установочной диагностики патологии в забрюшинном пространстве. Важнейшую информацию
дают также ультразвуковая и компьютерная томографии. Пальпация живота является основным информативным методом
клинического обследования.
В случаях, когда вызывают сомнения результаты обычной
пальпации при небольших размерах опухоли или локализации
процесса в верхних отделах живота и пресакральной области,
следует применять пальпацию с использованием миорелаксан-
тов деполяризующего типа действия без интубации трахеи по
следующей методике: после премедикации (атропина сульфат в
дозе 0,1 мг на год жизни ребенка) на фоне выключенного сознания, что достигается ингаляцией смеси закиси азота с кислородом в соотношении 3:1 — 4:1, внутривенно вводят миорелак-
сант (листенон, миорелаксин) в дозе 1,5—2 мг/кг массы. Релаксация наступает через 15—30 с и продолжается 2—4 мин, что
вполне достаточно для проведения тщательной пальпации живота, ректального исследования. Под действием релаксантов
происходит не только расслабление мышц брюшного пресса,
но и выключение самостоятельного дыхания. В период апноэ
производят непрерывную вентиляцию легких маской наркозного аппарата. По окончании манипуляции необходимо убедиться в полном восстановлении самостоятельного дыхания.
Для профилактики возможных осложнений следует иметь наготове комплект для экстренной интубации трахеи и электро-
98
отсасыватель. При указанной поднаркозной манипуляции
можно одновременно осуществить катетеризацию подключичной вены (для проведения парентерального питания, химиотерапии, инфузионной терапии), костномозговую пункцию, аспирационную или трепанобиопсию.
Опухоль чаще определяется в верхней половине живота,
справа или слева от позвоночника, иногда по средней линии.
Консистенция опухоли разная и зависит от ее характера; при
нефробластоме плотноэластическая, при нейробластоме —
твердая, с бугристой поверхностью. Границы более четкие при
нефробластоме, менее — при нейробластоме; соответственно
меняется и подвижность. В связи с тем что у детей связочный
аппарат не сформировался, опухоли нередко значительно
смещают печень и селезенку. Поэтому в детском возрасте,
особенно в раннем, часто при забрюшинно расположенных
опухолях ставится диагноз гепатомегалии, спленомегалии,
опухоли печени, кисты селезенки, гепатолиенального синдрома, рахита.
Необходимо отметить, что поэтапное и целенаправленное
применение существующих методов исследования позволяет
уточнить размеры и локализацию новообразования, провести
дифференциальный диагноз, проследить этапы развития опухолевого процесса, осуществить динамическое наблюдение за
больным.
Исследование крови. Анемия почти всегда сопровождает
злокачественные новообразования у детей; степень ее выраженности обычно связана с течением опухолевого процесса, но
зависит также и от характера новообразования. Она может быть
резко выражена уже в начале заболевания при лейкозе, нейробластоме и слабо — при нефробластоме, рабдомиосаркоме. В
далеко зашедших стадиях при любых злокачественных новообразованиях она выражена значительно.
В той или иной степени при злокачественных опухолях увеличена СОЭ. Она повышена у всех больных и иногда достигает
высоких цифр. При злокачественных опухолях у детей отмечен
гипертромбоцитоз. Каких-либо закономерностей в показателях
белой крови при опухолях у детей, за исключением лейкоза, не
установлено. Может наблюдаться как умеренная лейкопения,
так и умеренный лейкоцитоз.
При лейкозе у детей одним из основных критериев заболевания являются показатели белой крови. При гемобластозах обнаруживаются преимущественно незрелые патологические формы гемоцитобластов. При миелобластозе в периферической крови имеются незрелые патологические формы — миелобласты,
содержащие в цитоплазме азурофильную зернистость. В периферической крови может быть пониженное, нормальное и резко
повышенное число лейкоцитов.
99
Большое значение придается пункции костного мозга. Пунктируются грудина, подвздошная кость, редко пяточная и большеберцовая.
При остром лейкозе в костномозговом пункгате обычно находят повышенное содержание недифференцированных клеток —
ретикулярных гемоцитобластов — от 20 % до почти полного
(особенно при врожденном лейкозе) замещения костного мозга
гемоцитобластами. Они часто деформированы, имеют причудливое ядро, широкий ободок протоплазмы, фигуры митоза и
амитоза.
При исследовании костного мозга при нейробластомах также нередко (более 30 %) обнаруживают очень сходные с лимфоцитами незрелые клетки. У этих клеток имеется слившаяся
цитоплазма, так как они располагаются группами из четырех и
более клеток, иногда (и при лейкозе) они вытесняют весь нормальный костный мозг, заменяя его метастатической инфильтрацией (в таких случаях нейробластому крайне сложно отдифференцировать от лейкоза). В некоторых случаях в костном
мозге можно увидеть розетки, характерные для нейробластомы,
а если число опухолевых клеток значительное, то можно обнаружить четкие цитоплазматические образования, сходные с
нейрофибриллами. В костном мозге можно обнаружить ксан-
томатозные и бластоматозные клетки (при некоторых формах
гистиоцитоза X).
Установлено, что следует считать постоянной активизацию
свертывающей системы крови при развитии злокачественных
опухолей в детском организме. Эта тенденция проявляется в
повышении толерантности плазмы к гепарину, увеличении
концентрации фибриногена, появлении склонного к агрегации
патологического фибриногена В. Фибринолитическая активность у обследованных больных, наоборот, снижается. Под действием адекватной химиотерапии показатели имеют тенденцию
к нормализации.
При злокачественных опухолях печени у детей выделены
3 группы биохимических изменений, которые могут с большой
долей вероятности свидетельствовать о наличии злокачественного процесса. Первая группа изменений, подтверждающих
злокачественный процесс, характеризуется повышением концентрации а-1- и р-глобулинов, фибриногена, снижением фибринолитической активности крови, гиперхолестеринемией, ги-
пертромбоцитозом.
Вторая группа изменений связана с интенсивной реакцией
печени на катаболизм белка: гипоальбуминемия, повышение
концентрации фосфора в крови, гиперкалиемия, увеличение
активности трансаминаз, суточной экскреции электролитов и
общего азота с мочой. К симптомам третьей группы относят ги-
пербилирубинемию, указывающую на застойные явления в печени.
100
Из этих изменений к специфическим для первичной злокачественной гепатомы у детей относятся повышение концентрации а-1-глобулинов (74 % больных) и гиперхолестеринемия
(79 % больных).
На основании лабораторных, клинических экспериментальных исследований установлена роль тестостерона и простаглан-
динов серии Е в патогенетических механизмах роста и метаста-
зирования остеогенной саркомы.
У преобладающего большинства больных остеогенной саркомой обнаружена гиперандрогенемия, которая не зависит от
пола, возраста, стадии пубертатного периода, степени полового
развития, фазы менструального цикла. Определение рецепторов
половых стероидных гормонов позволяет выделить злокачественные новообразования скелета, чувствительные к эндокринному лечению, при этом уровень и частота выявления рецепторов зависят от возраста больных и их пола, морфологического
строения, степени анаплазии и лечебного патоморфоза опухоли,
вида проводимой предоперационной химио- или химиолучевой
терапии. Наличие в цитозольной фракции остеогенной саркомы
рецепторов андрогенов является неблагоприятным фактором в
прогнозе заболевания. Обнаружено, что синтез эйкозаноидов в
злокачественных новообразованиях костей скелета выше по
сравнению с доброкачественными и опухолеподобными поражениями; он зависит от возраста больных, вида пораженной
кости, морфологического строения опухоли и степени выраженности ее лечебного патоморфоза, предоперационной терапии.
Определение уровня простагландинов серии Е в остеогенных саркомах нелеченых и леченных до операции больных может быть использовано в оценке метастатического потенциала
опухоли, независимо от вида проводимой терапии в послеоперационном периоде.
Показано, что различные морфологические варианты опухолей костей отличаются содержанием липидосвязанных сиа-
ловых кислот, уровень которых положительно коррелирует со
степенью дифференцировки опухоли и длительностью безмета-
статического периода, а также особенностями фракционного
состава ганглиозидов, позволяющими однозначно дифференцировать их от опухолей другого типа.
У преобладающего большинства больных остеогенной саркомой обнаруживается гиперандрогенемия, которая не зависит
от пола, возраста, фазы менструального цикла, пубертатного
периода, степени полового развития.
Исследование спинномозговой жидкости показано при подозрении на прорастание или метастазирование опухоли в головной мозг, а также при первичных опухолях ЦНС. Изменение
состава спинномозговой жидкости при злокачественных опухолях бывает довольно часто. Почти всегда повышено содержание белка, в основном за счет альбуминов. Следует помнить,
101
что у маленьких детей количество белка и сочетание его между
альбуминовой и глобулиновой фракциями меняется с возрастом, и это надо учитывать в процессе исследования. Исследование спинномозговой жидкости позволяет диагностировать
метастатическое поражение ЦНС, в первую очередь спинного
мозга при нейробластоме и нефробластоме. Оно косвенно указывает на эти опухоли и на лейкемическую инфильтрацию при
лейкозе. Увеличение количества белка, при том что плеоцитоз,
как правило, отсутствует (белково-клеточная диссоциация), характерно для опухолей головного мозга. Обнаружение бластных
клеток в спинномозговой жидкости делает диагноз окончательно ясным.
В настоящее время в арсенал диагностических средств детской онкологии прочно вошла реакция Абелева — Татаринова,
реакция на а-фетопротеин (АФП). Продукция АФП характерна
для двух типов злокачественных опухолей: герминальных тератобластом и гепатоцеллюлярной карциномы. При других опухолях либо вовсе не наблюдается повышения уровня АФП, либо наблюдается лишь незначительное увеличение концентрации этого белка.
Такое увеличение чаще всего встречается при метастатических опухолях печени, особенно при карциномах желудочно-
кишечного тракта с метастазами в печень. Эта реакция может
быть использована не только для диагностики и дифференциальной диагностики указанных злокачественных опухолей, но
также для оценки эффективности проведенного лечения и изучения динамики опухолевого процесса.
Однако к реакции Абелева — Татаринова у детей в возрасте
до 1 года следует относиться критически и оценивать ее данные
с учетом ряда факторов. У них эта реакция может быть положительной не только при тератобластомах и гепатобластомах,
но и при любых других заболеваниях. В диагностике следует
учитывать только высокие положительные цифры, полученные
при определении АФП методом преципитации в геле. В таких
случаях можно предполагать, что у ребенка имеется тератобластома или злокачественная опухоль печени.
Динамика АФП при хирургическом лечении рака печени является важным диагностическим тестом. Уровень АФП резко
падает после удаления опухоли и вновь повышается при рецидиве или метастазировании. Случаи успешных операций гепа-
тоцеллюлярного рака у детей, к тому же исследованных на
АФП, стали довольно частыми.
Для установления диагноза злокачественной герминогенной
опухоли крестцово-копчиковой области достаточно определять
уровень АФП, который при наличии данного новообразования
очень высок. При адекватной терапии наступает нормализация
его показателей; в случае неэффективного лечения уровень
АФП повышается задолго до очевидного роста опухоли.
102
Показано, что общая активность фермента лактатдегидроге-
назы (ЛДГ) в сыворотке крови больных нейробластомой повышается до 77 % и снижается в короткий период времени после
удаления опухоли. В связи с этим определение в сыворотке
больных ЛДГ может существенно расширить диагностические
и прогностические возможности. Кроме того, независимо от
степени повышения исходного уровня ЛДГ, при достижении
полной или частичной ремиссии, а также при стабилизации
опухолевого процесса наблюдается статистически достоверное
снижение активности фермента. Прогрессирование заболевания сопровождается значительным увеличением активности
ЛДГ в сыворотке крови детей с нейробластомой.
Исследование мочи. Необходимо помнить, что сбор мочи у
детей имеет свои особенности и от того, как она будет собрана,
во многом зависит правильная оценка показателей (а иногда
могут возникнуть и диагностические ошибки). Для однократного сбора мочи у мальчиков фудного возраста используют маленький пузырек или пробирку, которые можно прикрепить
липким пластырем или бинтом к бедру или лобку. Этот метод
применим для суточного сбора мочи, но в таких случаях приходится постоянно следить за ребенком. Исследование мочи
дает представление и о специфических изменениях. Так, микрогематурия может сопровождать нефробластому, олигурия наблюдается при лейкозе, некоторых опухолях урогенитального
синуса (рабдомиосаркома влагалища, мочевого пузыря, предстательной железы).
Особое значение приобретает исследование экскреции катехоламинов в моче.
Нейробластома — эмбриональная опухоль, происходящая из
клеток нервного фебешка. В зависимости от степени диффе-
ренцировки клеток различают ганглионеврому, ганглионейро-
бластому, симпатобластому и симпатогониому. Три последних
вида опухолей объединяют под названием "нейробластома",
степенью дифференцировки которой в конечном итоге определяется дальнейшее течение заболевания.
Общими признаками опухолей, происходящих из клеток
нервного фебешка, являются синтез и секреция катехоламинов
(КА), дофамина (ДА), адреналина (А), норадреналина (Н). Исследования КА, их предшественников и метаболитов в моче могут служить информацией о нарушениях, которые происходят
в процессе роста опухолей, исходящих из клеток нервного фебешка. Использование суточной мочи для определения в ней
уровня и соотношения КА является важным этапом в диагностике нейробластом еще и потому, что за сутки она накапливает
продукты деятельности опухолевых клеток и нормальной функции мозгового слоя надпочечников и симпатических ганглиев.
Нейробластома, как правило, сопровождается повышением
как секреции, так и экскреции КА и их метаболитов — гомо¬
103
ванилиновой кислоты (ГВК) и ванилилминдальной кислоты
(ВМК). Имеются данные о том, что степень зрелости опухоли
в основном коррелирует с прогнозом заболевания.
Оценка непосредственной эффективности химиолучевой терапии нейробластом имеет важное значение для решения вопроса о целесообразности продолжения применяемой комбинированной терапии или ее изменения. Кроме того, нейробластоме присуща высокая агрессивность с метастазированием в
кости, костный мозг, забрюшинные лимфатические узлы, протекающая скрытно, без выраженных клинических проявлений.
Доклиническое выявление метастазов с использованием маркеров представляет возможность своевременно начать лечение.
В связи с этим длительное динамическое наблюдение за больным от начала заболевания, в процессе лечения и в стадии ремиссии с использованием указанного выше скрининга маркеров нейробластомы дает возможность провести анализ его диагностической и прогностической значимости, а также оценить
эффективность проводимого лечения или в случаях его неэффективности назначить другие комбинации.
3.2. Лучевая диагностика
Визуализация в медицине Ифает центральную роль. От точности диагностической информации во многом зависит результат лечения. Методы получения диагностической информации
основаны на следующих физических явлениях:
• Рентгенологические исследования (РИ) — рентгеновские
лучи поглощаются тканями.
• Магнитно-резонансная томография (МРТ) — радиочастотное излучение возникает при возбуждении непарных
ядер атомов в магнитном поле.
• Радионуклидная диагностика (РНД) — радиоактивные
изотопы, концентрируясь в определенных тканях, испускают гамма-излучение.
• Ультразвуковое исследование (УЗИ) — высокочастотные
лучи направленных ультразвуковых волн отражаются в
направлении датчика.
• Термография (ТГ) — инфракрасные волны самопроизвольно испускаются тканями.
4- Традиционная рентгенодиагностика является одним из основных источников получения информации о функциональном и морфологическом состоянии внутренних органов и
систем ребенка и включает рентгеноскопические, рентгенографические и томографические исследования.
•Ф- Рентгенологические методы исследования включают:
• Рентгенографию с использованием экрана с пленкой или
кассетой.
104
• Флюороскопию или просвечивание с усилителем изображения и телевизионной видеокамерой.
• Компьютерную томографию (КТ)— компьютеризированный метод аксиальной визуализации.
•Ф- Внедрение в клиническую практику рентгеновской компьютерной томографии, основанной на принципе регистрации
ослабленного узко коллимированного пучка рентгеновских
лучей, проходящих через тело больного, значительно увеличило возможности рентгенологического метода в изучении
различных органов и тканей. Высокая чувствительность детекторов и обработка полученной цифровой информации
ЭВМ по специальному алгоритму позволили получать одновременно четкое изображение разных по плотности структур
и дифференцировать ткани с малым коэффициентом контрастности, что сделало возможным визуализировать внутреннюю структуру таких паренхиматозных органов, как печень, почки, поджелудочная железа, а также судить о состоянии головного, спинного мозга и других органов и тканей.
<• Наряду с рентгенологическими методами исследования важнейшим методом визуализации внутренних органов и тканей в настоящее время является ультразвуковое исследование. Использование приборов, работающих в режиме реального времени, позволяет визуализировать внутренние
органы в двухмерном изображении и оценивать их анатомическое и функциональное состояние, что широко раздвигает
рамки диагностических возможностей клинициста в определении характера и распространенности опухолевого процесса. Высокая информативность метода основана на отражении ультразвука от границы между различными тканями,
разность в акустической сопротивляемости которых превышает 1 %. Неоспоримым преимуществом метода является
отсутствие отрицательных биологических влияний на организм ребенка.
•Ф- Разновидностью УЗИ является возможность фиксации движения (в частности, крови, мочи и т. д.), основанная на эффекте Допплера. Существуют методики непрерывной, импульсной допплерометрии, цветовое допплеровское картирование (ЦДК). С 1993 г. внедряется новая ультразвуковая
технология визуализации кровотока — Color Doppler Energy
Imaging — энергетическая допплерография (ЭД). Преимуществом метода является высокая чувствительность, позволяющая визуализировать сосуды мелкого калибра и регистрировать медленные потоки. Использование ЦДК, а также
ЭД повышает возможности УЗИ в дифференциальной диагностике первичнокостных опухолей, опухолей мягких тканей, опухолей нейроэктодермальной природы. Изучение диагностических возможностей УЗИ в сравнении с другими
диагностическими мероприятиями позволяет считать его од¬
105
ним из первых и обязательных в комплексе диагностических
исследований, а также незаменимым при оценке эффективности проводимой терапии.
<• Радионуклидные методы диагностики (РНД), получившие
широкое применение в онкологии, основаны на принципе
регистрации и измерения излучений от введенных в организм радиофармацевтических препаратов (РФП). Радионуклиды и меченые соединения при их введении пациенту
включаются в биологические процессы организма. Регистрация излучения с помощью специальной аппаратуры
позволяет количественно оценить функциональную активность исследуемого объекта и обеспечивает его визуализацию.
Радионуклидная диагностика включает:
• Гамма-сцинтиграфию, которая выполняется в одно-,
двух- или трех проекциях.
• Позитронную эмиссионную томографию (ПЭТ). Наиболее передовая технология с использованием клинического циклотрона, радиохимического комплекса и позитронного эмиссионного томографа. На циклотроне нарабатываются ультракороткоживущие (от 2 мин до 2 ч)
позитронизлучающие радионуклиды (18F, 11С, 13N,
150). Радиохимический комплекс осуществляет синтез и
контроль качества нарабатываемых РФП. Позитронные
томографы имеют кольцевую детекторную систему, что
позволяет получать информацию в трехмерном пространстве с одновременным сканированием всего тела
пациента.
• Радиоиммунологический анализ — метод определения
концентрации различных биологических веществ (гормонов, опухолевых маркеров) в сыворотке крови с помощью
специальных веществ на основе меченых моноклональных антител. Опухолевыми маркерами являются антигены злокачественных опухолей, которые находятся на поверхности опухолевых клеток и частично попадают в
кровь. Повышение концентрации опухолевого маркера в
сыворотке крови больного свидетельствует о прогрессировании опухолевого процесса.
Радионуклидный метод диагностики позволяет изучать состояние обмена веществ, функции органов и систем, получать
анатомо-топографическое изображение органов и тканей, что
является особенно важным, так как в ряде случаев функциональные нарушения наступают значительно раньше анатомоморфологических изменений.
106
В настоящее время для изучения состояния лимфатических
узлов при системных заболеваниях крови широко используется
радионуклидный метод исследования с применением радиоактивных коллоидов — нитратного комплекса галлия — 6'Ga. Повышенное включение цитрата °7Ga в ткани при их поражении
объясняется изменением клеточного состава и биохимической
активности в зоне поражения. Наиболее оптимальное соотношение между показателями накопления 67Ga в опухоли и тканевым фоном наступает через 48 ч. Несмотря на то что нитратный комплекс 67Ga не является специфическим препаратом,
сканирование с его помощью позволяет уточнить наличие и
локализацию активных очагов поражения и контролировать
эффект проводимого лечения. Для выявления патологических
очагов в скелете используются остеотропные препараты, среди
которых наибольшее признание получили фосфатные соединения, редуцированные оловом и меченные 99тТс (полифосфат, пирофосфат, трифосфат). Эти препараты обладают высокой тропностью к костной ткани, не токсичны и имеют оптимальную энергию для получения качественных сцинтиграмм
скелета.
<■ Магнитно-резонансная томография (МРТ) — самая молодая
из радиологических методик. Магнитно-резонансные томографы могут создать изображения сечения любой части тела,
при этом ионизирующее излучение не используется, а воздух
или кости не являются помехой при визуализации.
В МРТ используется свойство ядра водорода являться магнитным диполем со слабовыраженными полюсами. В сильном
магнитном поле МР-томографа ядра водорода ориентируются
согласно направлению внешнего магнитного поля, при этом
магнитные оси каждого протона вращаются вокруг направления внешнего магнитного поля. Это специфическое вращательное движение называется прецессией, а его частота — резонансной частотой или частотой Лармора. При пропускании коротких электромагнитных радиочастотных импульсов вдоль оси
тела пациента, а также при совпадении частоты радиоволн с
ларморовской частотой протонов наблюдается явление магнитного резонанса. МР-изображения характеризуются различиями
в магнитных свойствах тканей, что определяется плотностью
протонов в этих тканях и методикой их исследования.
Диагностические возможности МРТ велики, во многом превосходят возможности КТ и УЗИ и в настоящее время активно
изучаются. К противопоказаниям использования МРТ следует
отнести наличие любого ферромагнитного объекта в зоне исследования (ферромагнитные клипсы на сосудах, ферромагнитные эндопротезы, ферромагнитные инородные тела), наличие кардиостимуляторов, первые 3 мес беременности.
107
Общим принципом диагностики злокачественных опухолей
у детей является комплексное использование клинического,
морфологического, эндоскопического, лабораторных и лучевых методов, включающих традиционное рентгенологическое
исследование, ангиографическое исследование, рентгенологическую компьютерную томографию, а также ультразвуковую
томографию, радионуклидное исследование, магнитно-резонансную томографию. Большая информативность методов лучевой диагностики злокачественных опухолей требует применения строго необходимой последовательности оптимально
эффективных методик, обусловленной природой патологического очага, его локализацией, степенью распространения, характером проводимой терапии, ее ритмом и продолжительностью.
Опухоли костей. В комплексной лучевой диагностике новообразований скелета рентгенологический метод сохраняет ведущее положение и определяет последовательность и
объем уточняющих исследований. Структура опухолей костей
представлена на рис. 3.1; 3.2.
Методически правильное проведение квалифицированного
рентгенологического исследования (РИ) обычно позволяет не
только установить наличие или отсутствие опухолевого поражения кости, но и достоверно судить о его доброкачественности или злокачественности. Рентгенологическое исследование
костей является обязательным при болях неясного характера.
Необходимо помнить, что при локализации процесса в костях
таза, ребрах, позвоночнике нередко основным симптомом становятся иррадиирующие боли не только в костях и суставах, но
и в грудной и брюшной полости. Это приводит к диагностическим ошибкам, так как рентгенологическому исследованию
подвергается не первичный очаг, а "болевая зона". В диагностически трудных случаях, а именно при выраженных болях в костях и нормальной рентгенологической картине, показаны повторные снимки с короткими интервалами (2—3 нед), позволяющие судить о динамике процесса.
Рентгенограммы выполняются в двух стандартных взаимно
перпендикулярных проекциях с захватом смежных (с предполагаемым участком поражения) отделов кости. Иногда обзорные
снимки целесообразно дополнять прицельными снимками, томограммами. Применение радионуклидного исследования показано при выраженной болезненности и нормальной рентгенологической картине, при подозрении на злокачественную
опухоль или метастатическое поражение, для уточнения местного распространения опухолевого процесса, для суждения об
эффективности проводимого лечения, а также для выявления
рецидива заболевания. КТ помогает установить внутрикостное
и внекостное распространение опухоли, выявить вовлечение
прилежащих органов и тканей в опухолевый процесс. Учитывая
108
Рис. 3.1. Структура опухолей
костей у детей.
I — доброкачественные опухоли
(62 %); II — злокачественные опухоли
(30 %); III — метастатическое поражение костей (8 %).
Рис. 3.2. Структура злокачественных опухолей костей у детей.
I — остеогенная саркома (64 %); II —
хондросаркома (2 %); III — другие
опухоли (0,5 %); IV — саркома Юинга
(27 %); V — фибросаркома (0,5 %).
возможности различных методов лучевой диагностики, план исследования больных должен строиться по определенной схеме.
При первично-костных и метастатических опухолях костей
у детей используют следующие диагностические методы: рентгенография зоны поражения в стандартных прямой, боковой и
косых проекциях, УЗИ, КТ, РИД, пункционная биопсия опухоли, открытая биопсия по показаниям. Все эти методы, являясь не конкурирующими, а дополняющими друг друга, позволяют в короткие сроки и с наименьшими материальными и временными затратами установить топику и распространенность
опухолевого процесса.
При первичных злокачественных опухолях трубчатых костей
(наиболее частые опухоли — остеогенная саркома и саркома
Юинга) осуществляется рентгенография в стандартных прямой
и боковой проекциях. При поражении ребер, костей таза, позвонков (первичные — чаще саркома Юинга и другие круглоклеточные саркомы, гистиоцитоз X, злокачественные лимфомы;
вторичные — метастазы нейробластомы) проводится полипо-
зиционное рентгенологическое исследование в прямой, боковой, правой и левой косой проекциях. Оценка распространенности процесса, состояние внекостного компонента опухоли,
изменения в процессе терапии доступны УЗИ, которое незаменимо в динамическом наблюдении. Исследование костей свода
черепа (гистиоцитоз X, метастазы), как правило, ограничивается рентгенографией в двух стандартных проекциях.
Поражение костей основания черепа, лицевого скелета (рабдомиосаркома, лимфосаркома, другие опухоли орбиты, ЛОР-
органов, метастазы) предусматривает проведение РИ с использованием специальных укладок, обязательной КТ для уверен¬
109
ного суждения о распространенности процесса, а также комплекса РНД, УЗИ и эндоскопического исследования в динамике. Исследования очага поражения необходимо выполнять до и
после курсов противоопухолевой терапии, а также после радикального удаления опухоли не менее одного раза в месяц для
выявления рецидива, уточнения состояния культи, эндопротеза
в первые 6 мес.
При диссеминированных процессах в скелете (метастазы, ге-
мобластозы) первоначальное исследование всего скелета (рентгенологическое, радиоизотопное исследование) рекомендуется
только при нейробластоме и гистиоцитозе X, что связано с высоким процентом поражения костной ткани при этих заболеваниях, а также нередким отсутствием при этом клинических проявлений и ложноотрицательными результатами как при рентгенологическом, так и при радионуклидном исследовании.
Метастатическое поражение скелета при злокачественных
опухолях у детей наиболее типично для нейробластомы и костных сарком. Для нейробластомы характерно раннее (до и в
первые 6 мес после выявления опухоли) множественное поражение скелета, сочетающееся с метастазами других локализаций. При этом определяется преимущественное поражение
бедренных костей, костей таза, черепа, позвоночника. Высока
частота патологических переломов, особенно компрессионных
переломов тел позвонков. Поражение эпифизов трубчатых костей происходит очень редко. Для нейробластомы типичными
являются мелкоочаговая деструкция, высокая частота периостальной реакции, расхождение краев швов при распространенных метастазах в кости свода черепа, поражение оболочек
мозга.
Костные метастазы саркомы Юинга наблюдаются нередко;
в ряде случаев отмечены изолированное поражение скелета и
сочетание его с метастазами в легкие. При этом на рентгенограммах выявляются участки мелкоочаговой деструкции, местами сливающиеся между собой, без выраженной периостальной реакции. Наиболее частые локализации метастазов саркомы Юинга — позвоночник, кости таза и черепа.
Рентгенологическая семиотика метастатического поражения
соответствует проявлениям первичной опухоли. Треть метастатической остеогенной саркомы составляет поражение той же
кости проксимальнее первичной опухоли в непосредственной
близости от нее или в ближайшем отделе смежной кости при
трансартикулярном распространении. В этих случаях при рентгенологическом исследовании определяются изолированные
небольшие остеобластические метастазы, как правило, выявляемые с первичной опухолью, что диктует необходимость
рентгенологического исследования пораженного отдела конечности на всем протяжении с обязательным захватом смежных
суставов.
110
При острых лейкозах у детей наиболее часто выявляются зоны субхондрального разрежения структуры костной ткани в
длинных трубчатых костях, что является отображением нормального костеобразования и роста в местах лейкемической
инфильтрации костного мозга. С развитием лейкозного процесса наблюдается увеличение ширины просветления в субхондральных зонах. В период ремиссии выраженность их уменьшается вплоть до полного исчезновения и появляется вновь
при обострении заболевания. Специфические изменения наиболее ярко проявляются в костях, образующих коленные суставы, дистальных метафизах костей предплечий. В редких случаях выявляется мелкоочаговая деструкция костей скелета, обусловленная лейкемической инфильтрацией костномозговых
пространств опухолевой гиперплазией костного мозга в виде
единичных или множественных мелкоочаговых литических зон
как в губчатых, так и в плоских и смешанных костях. Кроме деструктивных изменений, выявляются рентгенологические признаки реактивного остеопластического процесса в виде эндостальной остеосклеротической реакции, а также в виде реактивного костеобразования — периостальных напластований в
области диафизов длинных трубчатых костей.
Характерным признаком острого лейкоза у детей является
системный диффузный остеопороз, при котором отмечаются
общее разрежение структуры костной ткани, истончение кортикального слоя вплоть до полного исчезновения на отдельных
участках, возникновение системной бревиспондилии при поражении позвоночника. Тела позвонков уплощаются, замыкатель-
ные пластинки прогибаются и приобретают вид двояковогнутых
линз — "рыбьих позвонков". Могут возникать компрессионные
переломы. Высота межпозвонковых пространств увеличивается.
Лангергансово-клеточный гистиоцитоз. При солитарной эозинофильной гранулеме наиболее часто поражаются плоские
кости; второе место по частоте занимают трубчатые кости.
Изменения костей при гистиоцитозе X имеют типичную
картину: это очаги деструкции костной ткани неправильной округлой формы с четкими, неровными, подчеркнутыми контурами, сливающиеся между собой, без периостальной реакции и
с выраженным мягкотканным компонентом. Преимущественно поражаются плоские (лобная и теменная) кости свода черепа, таз и трубчатые кости, из них наиболее часто — бедренные.
Однако в ряде случаев дифференциальная диагностика со
злокачественными опухолями, метастазами, воспалительными
заболеваниями крайне сложна. Использование прицельной
трепанобиопсии при рентгенологическом исследовании, а также радиоизотопное исследование скелета способствуют установлению точного диагноза. Обладая высокой чувствительностью, радионуклидный метод исследования указывает на область поражения, на распространенность процесса, позволяет
111
выявить относительно ранние фазы развития патологического
процесса в костной ткани и лимфатической системе.
При локализации в длинных трубчатых костях характерным
является поражение в области диафиза; эпифизарная локализация является крайне редкой. Фиксируется крупноочаговая деструкция с четкими контурами, выраженной периостальной реакцией, с деформацией кости, с выраженным мягкотканным компонентом. При поражении губчатых костей процесс у большей
части больных локализуется в позвоночнике. При рентгенологическом исследовании этих детей преимущественно выявляется снижение высоты тела позвонка. В ряде случаев наблюдаются
очаги деструкции, округлые, единичные, расположенные эксцентрично, средних размеров, нередко ячеистого характера.
При злокачественном гистиоцитозе чаще поражаются кости
таза и черепа. Рентгенологические признаки полиморфны. Типична мелкоочаговая деструкция костной ткани без четких
контуров, а также крупно- и среднеочаговые изменения с четким отграничением от окружающей костной ткани, без периостальной реакции и мягкотканного компонента.
Вовлечение в опухолевый процесс скелета при лимфогранулематозе (ЛГМ) чаще происходит путем лимфогематогенного
метастазирования и реже — путем непосредственного прорастания опухоли в прилежащие костные структуры. Поражение позвоночника, костей таза, ребер, грудины, бедренных и плечевых
костей, лопаток, ключиц является типичной локализацией специфического процесса; остальные отделы скелета поражаются
крайне редко. При непосредственном переходе опухолевого
процесса с мягких тканей выявляется краевая деструкция костей
без выраженной периостальной реакции. При метастатическом
поражении обнаруживаются очаги деструкции, чаще в губчатом
веществе кости. Форма и размеры деструкции варьируют в широких пределах и могут иметь четкие контуры или стертые границы, скрывающие истинную величину пораженного участка.
Изменения структуры костной ткани в виде очагов склеротического уплотнения, как четко отграниченных от окружающей
костной ткани, так и диффузных, также являются типичным
проявлением специфического поражения при ЛГМ у детей. Для
литического поражения плоских костей характерны грубая деформация кости за счет вздутия, крупноячеистая структура.
При поражении костей таза изменения чаще локализуются в
области крестцово-подвздошных сочленений и крыльях подвздошных костей в виде сочетания литических и остеосклеро-
тических зон. В позвоночнике могут наблюдаться очаги деструкции или остеосклероза, локализующиеся в телах, суставных
отростках, дужках позвонков одного или нескольких отделов.
Эхографическая картина внекостного компонента злокачественных опухолей костей характеризуется наличием объемного образования, широко прилежащего к кости, имеющего гете¬
112
рогенную структуру и зоны пониженной эхоплотности по периферии, а также гиперэхогенные участки вблизи кости.
Опухолевые поражения лимфатических узлов. Ультразвуковая картина метастатического поражения лимфатических узлов
характеризуется их увеличением, нечеткостью контуров, истончением капсулы, образованием конгломератов, низкой интенсивностью отражений. Следует отметить, что при ультразвуковом исследовании в 30 % случаев обнаруживаются измененные
лимфатические узлы, невыявляемые, как правило, при клиническом осмотре, например глубокие паховые. Под влиянием
проводимой специфической терапии отмечаются уменьшение
размеров лимфатических узлов, уплотнение и увеличение толщины капсулы, неравномерное снижение коэффициента поглощения ультразвуковых волн. Таким образом, УЗИ является
высокоинформативным методом диагностики поражения периферических лимфатических узлов у детей, что позволяет рекомендовать его широкое применение в плане диагностики и
оценки эффективности проводимой терапии, а также дифференциальной диагностики специфических и неспецифических
процессов.
Опухоли мягких тканей. Локализация и морфологическая
структура опухолей мягких тканей представлены на рис. 3.3, 3.4.
Наиболее характерным для ультразвуковой картины мягкотканных злокачественных опухолей конечностей, туловища, го-
Рис. 3.3. Локализация опухолей мягких тканей у детей.
I — голова—шея (31 %); II —
живот (7 %); III — конечности (32 %); ГУ — туловище
(16 %); V — мочеполовая
система (14 %).
Рис. 3.4. Морфологическая характеристика опухолей мягких тканей у
детей.
I — рабдомиосаркома (67 %); II — синовиальная саркома (17 %); III — ангиосаркома (3 %); IV — другие (8 %); V — злокачественная шваннома (1 %); VI —
гемангиоперицитома (1 %); VII — дерматофибросаркома (3 %).
113
ловы и шеи является выявление объемных образований неправильной округлой формы с бугристыми контурами, неоднородной структуры, широко прилежащих к костным структурам.
Чаще всего они имеют нечеткий контур, реже — четкую плотную капсулу. В большинстве случаев структура образований неоднородна, пониженной эхоплотности, с неоднородными гиперэхогенными зонами неправильной формы без четких контуров.
В редких случаях определяются анэхогенные участки неправильной округлой формы. Размеры опухолевых узлов колеблются в широких пределах — от 1 до 15. Кроме исследования первичного опухолевого узла, необходимо оценить состояние прилежащих органов и тканей. У ряда больных при локализации
опухоли в области конечностей обнаруживается поражение рядом лежащей костной ткани в виде деструкции, слоистости,
прерывистости, шероховатости коркового слоя кости.
Рабдомиосаркома — наиболее частая опухоль мягких
тканей, которая может локализоваться в области головы и шеи,
урогенитального тракта, туловища и конечностей. Более половины наблюдений рабдомиосаркомы головы и шеи относится к
так называемой параменингеальной локализации, занимающей
полость носа, околоносовые пазухи, носоглотку, крылонебную
и подвисочную ямки, среднее ухо. Околоушно-жевательная область, ротоглотка, гортань, язык, другие мягкие ткани головы и
шеи и орбита поражаются рабдомиосаркомой почти поровну.
Дифференциальная диагностика поражений мягких тканей
головы и шеи проводится с реже встречающимися мезенхимальными опухолями — нейробластомой, назоорофарингеальной
злокачественной лимфомой (поражение вальдейерова кольца —
10 %, поражение челюстей — 3 % от общего числа лимфосар-
ком), лимфогранулематозом. Поражение лимфоидной ткани
глоточного кольца при лимфосаркоме наблюдается в 7 % случаев. Использование традиционных методов рентгенодиагностики и КТ позволяет судить о распространенности опухолевого
процесса. У большей части больных наблюдается сужение просвета носоглотки более чем на 2/з за счет выбухания задней и/
или одной из боковых стенок носо- и/или ротоглотки. Деструктивные костные изменения встречаются крайне редко; более
типичными являются деформация и истончение прилежащих
костных структур. Особое место занимают органные опухоли —
ретинобластома, рак щитовидной и слюнной желез.
Первичная диагностика опухолей головы и шеи осуществляется при помощи УЗИ, РНД, термографического и эндоскопического методов. КТ уточняет форму, размеры, локализацию
опухоли, степень распространенности процесса на окружающие ткани, сосуды, скелет, в полость черепа и позвоночный канал (в наблюдениях нейробластомы типа "гантели"). В последнем случае с помощью традиционного РИ шейного отдела позвоночника в нескольких проекциях по косвенным признакам
114
Рис. 3.5. Структура злокачественных опухолей средостения у детей.
I — гемобластозы (61 %); II — солидные опухоли (31 %); III — метастатическое
поражение (8 %).
можно успешно диагностировать расположение части опухоли
в позвоночном канале.
Средостение. Средостение является частой локализацией
злокачественных опухолевых процессов у детей (рис. 3.5). Основным в выявлении поражения средостения является рентгенологическое исследование (РИ). Оно включает рентгенографию грудной клетки в стандартных прямой, боковой, правой и
левой косой проекциях, что позволяет уточнить локализацию
новообразования и состояние прилежащих органов и тканей.
Суперэкспонированный снимок выполняется для оценки изменений в скелете грудной клетки и выявления включений в патологическом образовании. Симультанная томография выполняется для уточнения состояния внутригрудных лимфатических
узлов, трахеи и крупных бронхов. Исследование пищевода с
контрастным веществом и рентгеноскопия позволяют судить о
взаимоотношении органов и тканей средостения, а также о наличии передаточной пульсации, изменении формы, размеров,
положения новообразования в зависимости от фазы дыхания.
КТ позволяет в большинстве случаев отказаться от применения инвазивных методик исследования, поскольку с ее помощью можно оценить не только исходную локализации опухоли, но и наличие включений, состояние прилежащих органов
и тканей, плотность патологического образования. Важную
роль в дифференциальной диагностике новообразований средостения играет радионуклидное исследование с цитратом 67Ga. С
помощью УЗИ имеется реальная возможность точного определения локализации и распространенности опухолевого процесса
в переднем средостении, оценки состояния и "участия" вилоч-
ковой железы в патологическом процессе. Эхографически можно выявить клинически скрытое поражение внутригрудных
лимфатических узлов, своевременно определить рецидив заболевания, участвовать в объективной оценке применяемых схем
терапии у детей со злокачественными лимфомами. Пораженная
115
Рис. 3.6. Структура поражения средостения при гемобластозах у детей.
I — лимфогранулематоз (60 %); II — не-
ходжкинские лимфомы (30 %); III —
гистиоцитарные опухоли (8 %); IV —
лейкозы (2 %).
вилочковая железа при ультразвуковом исследовании увеличена в размерах, диффузно изменена (эхоструктура неоднородна, эхоплотность снижена, капсула уплотнена, бугриста),
нередко "впаяна" в конгломерат увеличенных лимфатических
узлов. При медиастинальной форме лимфосаркомы, кроме увеличения внутригрудных лимфатических узлов, у многих больных отмечается поражение вилочковой железы. У большей части больных поражение средостения обусловлено гемобластоза-
ми, реже наблюдаются солидные опухоли и кисты;
метастатическое поражение средостения встречается в редких
случаях.
Поражение средостения при гемобластозах у детей (рис. 3.6)
почти в 2/з случаев обусловлено лимфогранулематозом, реже —
лимфосаркомой, при этом типичным является сочетанное поражение внутригрудных лимфатических узлов, вилочковой железы, плевры. В редких случаях поражение средостения наблюдается при гистиоцитарных опухолях и лейкозах.
Поражение органов грудной полости при ЛГМ наблюдается
более чем у половины больных, первично-медиастинальная локализация — у 12 %. Изолированное поражение внутригрудных
лимфатических узлов встречается в значительном числе наблюдений, реже — в сочетании с поражением легочной ткани, плевры.
Рентгенологическая картина разнообразна и зависит от степени
увеличения лимфатических узлов, состояния легких, плевры,
вилочковой железы. Чаще встречается поражение паратрахеаль-
ных и трахеобронхиальных групп лимфатических узлов. Значительно реже в опухолевый процесс вовлекаются бронхопульмональные и загрудинные лимфатические узлы. Изолированное
поражение паратрахеальных, а также бронхопульмональных
лимфатических узлов наблюдается в редких случаях. Поражение
легочной ткани, как правило, выявляется в виде единичных или
множественных шаровидных теней размером до 3—4 см, преимущественно в средних и нижних отделах легких. В опухолевых узлах могут возникать полости распада. Поражение легочной ткани в виде инфильтративных или интерстициальных изменений встречается в более редких случаях. Вовлечение в
процесс вилочковой железы не типично для ЛГМ, однако имеются единичные случаи ее изолированного поражения. Поражение плевры также не является типичным для ЛГМ.
116
При медиастинальной форме лимфосаркомы у детей изолированное поражение органов фудной полости наблюдается у 1/4
больных, при этом поражение медиастинальных лимфатических
узлов, плевры, вилочковой железы всфечается с одинаковой частотой; изолированного поражения легочной ткани не наблюдается. У преобладающей части больных отмечается сочетанное поражение различных органов и тканей фудной полости, при этом
наиболее типичным является сочетанное поражение внутрифуд-
ных лимфатических узлов, вилочковой железы и плевры. В целом
поражение внутршрудных лимфатических узлов имеет место у
81 % больных, плевры — у 66 %, вилочковой железы — у 57 %, легочной ткани — у 10 %. При поражении внутрифудных лимфатических узлов; наиболее типичным является поражение всех
фупп узлов; нередко поражаются медиастинальные лимфатические узлы. Крайне редко поражаются только бронхопульмональные лимфатические узлы. Поражение плевры у половины детей
выявляется в виде одно- или двустороннего плеврита, у других —
в виде единичных или множественных узлов на плевре (костальной, медиастинальной или базальной); у ряда больных встречается
сочетанное поражение плевры. При поражении вилочковой железы, как правило, отмечается поражение обеих долей. Вовлечение
легочной ткани характеризуется опухолевой инфильтрацией прилежащих отделов при увеличении медиастинальных и бронхопульмональных лимфатических узлов, а также вилочковой железы.
Эхофафическая картина лимфопролиферативных заболеваний характеризуется наличием множественных увеличенных
лимфатических узлов средостения, близко расположенных друг
к другу, с четко выраженной утолщенной капсулой (что более
типично для ЛГМ), а также в виде объемных образований с бугристыми контурами, чаще однородной сфуктуры, пониженной
эхоплотности, что более характерно для лимфосаркомы.
Среди солидных опухолей наиболее часто встречаются опухоли средостения нейрогенной природы (рис. 3.7). Значительно
реже диагностируются другие солидные опухоли, такие как тератомы, кисты, тимомы, ме-
зенхимомы, липомы, недиф¬
ференцированные саркомы,
Рис. 3.7. Структура солидных
опухолей и кист средостения у
детей.
IX
VHI с
VIII
VII
II - кисты (7,8 %); III—
ные опухоли (6,6 %); IV
стые опухоли (3 %); V -
(1,8 %); VI — недиффере
ные саркомы (1,8 %); VII
I — нейрогенные опухоли (76 %);
II — кисты (7,8 %); III — тератоген-
»i (7,8 %); III — тератоген-
>ли (6,6 %); IV — сосуди-
:оли (3 %); V — тимомы
:оли (76 %):
onyxi
(1,8 %); VI
VI — недифференцирован-
сомы (1,8 %); VII — липомы
VIII — мезенхимомы
IX — десмокд (0,6 %).
иффер<
%); VII
мезенхимомы
II
117
Опухоли заднего средостения с успехом диагностируются с
помощью РИ, включающего полипозиционную рентгенотрафию
грудной клетки. При необходимости прицельно исследуются
прилежащие к опухоли отделы скелета — ребра, позвоночник в
оптимальных для изучения проекциях, с использованием супер-
экспонированных рентгенограмм и снимков с увеличением изображения. Локализацию, характер, распространенность процесса
при опухолях больших размеров помогает определить КТ.
Оценка лечения нейробластомы заднего средостения производится при помощи контрольного рентгенологического исследования. Как правило, на рентгенограммах нейробластома располагается на протяжении 5—7 позвонков в реберно-позвоночном углу, имеет овальную форму и четкие контуры, почти в 30 %
наблюдений содержит мелкоочаговые известковой плотности
включения. Более чем в половине наблюдений отмечены смещение и незначительное сдавление пищевода, у 1/з больных —
трахеи. Помощь в диагностике заболевания оказывают характерные для опухолей заднего средостения увеличение межреберных промежутков, смещение, ротация, деформация и истончение задних отрезков ребер на уровне поражения. Наиболее
трудны для диагностики внеорганные нейробластомы смешанной локализации (средостение и забрюшинное пространство),
расположенные над почками. Экскреторная урография, как
правило, представляет ложноотрицательные результаты. Помогают диагностике участки обызвествлений опухоли и симптом
"усов" (тень подчеркнутой и смещенной латерально медиастинальной плевры) на уровне поражения при анализе обзорных
снимков брюшной полости. Методом выбора в этих случаях является КТ.
УЗИ наиболее эффективна в выявлении опухолей данной
локализации. УЗ-картина нейрогенных опухолей средостения
характеризуется наличием гетерогенного объемного образования, расположенного пре- и паравертебрально, пониженной
эхоплотности, как правило, четко отграниченного от окружающих тканей, с мелкоточечными гиперэхогенными включениями и зонами повышенной эхоплотности без четких контуров.
Абдоминальные опухоли у детей. Структура опухолевых заболеваний абдоминальной области у детей кардинально отличается от структуры опухолевых заболеваний абдоминальной
области у взрослых (рис. 3.8). Эпителиальные раковые опухоли,
Рис. 3.8. Структура абдоминальных опухолей у детей.
I — злокачественные лимфомы
(60 %); II — солидные опухоли (40 %).
118
характерные для взрослого контингента, являются крайней
редкостью для больных в возрасте до 15 лет.
При абдоминальной форме лимфосаркомы у детей используют следующие диагностические мероприятия: обзорная рентгенография брюшной полости, исследование желудочно-кишечного тракта с бариевой взвесью, экскреторная урография,
УЗИ, КТ, РИД с цитратом 67Ga, эндоскопические исследования (лапароскопия, колоноскопия, эзофагогастроскопия), диагностическая лапаротомия (при необходимости экстренного установления диагноза, при наличии клиники "острого живота").
Все эти методы, являясь не конкурирующими, а дополняющими друг друга, позволяют в короткие сроки и с наименьшими
материальными и временными затратами установить топику и
распространенность опухолевого процесса.
Изучение диагностических возможностей УЗИ в сравнении с
другими диагностическими мероприятиями позволяет считать
его первым и обязательным в комплексе диагностических исследований для выявления специфического поражения органов
брюшной полости и забрюшинного пространства у детей.
При абдоминальной форме лимфосаркомы наиболее часто
поражаются лимфатические узлы брюшной полости и кишечная трубка, реже — лимфатические узлы и кишечная трубка одновременно. Следует отметить, что частота поражения отдельных участков кишечной трубки различна: чаще вовлекаются в
процесс слепая и терминальные отделы подвздошной кишки
(рис. 3.9).
Первичное поражение желудка у детей является редкостью.
Рентгенологическая картина лимфосаркомы желудка характеризуется утолщением складок слизистой оболочки, хаотической направленностью, ригидностью стенки на участке поражения, нарушением перистальтики и эвакуаторной функции.
Для ультразвуковой картины типичны неравномерное утолще-
Рис. 3.9. Поражение желудочно-кишечного тракта при
НХЛ у детей.
I — подвздошная кишка (77 %);
II — слепая кишка (41 %); III —
илеоцекальный угол (30 %); IV —
восходящий отдел толстой кишки
(13 %); V — поперечно-ободочная
кишка (4 %); VI — нисходящий
отдел толстой кишки (1 %); VII —
сигмовидная кишка (3 %); VIII —
прямая кишка (4 %); IX — желудочек (7 %); X — двенадцатиперстная кишка (6 %); XI — тощая
кишка (11 %).
IX
IV in
119
ние стенок желудка от 1 до 3—5 см, потеря нормальной слоистости стенки, деформация полости желудка.
Рентгенологическая картина поражения петель кишок характеризуется большой протяженностью (10—25 см и более), неравномерным сужением кишки, неровностью и нечеткостью контуров, наличием дефектов наполнения неправильной формы, выходом контрастного вещества за контуры просвета кишки при
ее изъязвлении. Пораженная часть кишки окружена "пустотой",
прилежащие петли кишок раздвинуты опухолевым конгломератом. При УЗИ в брюшной полости выявляется неоднородный
опухолевый узел с неровными, бугристыми контурами, в центре
которого определяется неравномерно суженный просвет кишки,
не участвующий в перистальтике.
Поражение лимфатических узлов брюшной полости без вовлечения в процесс кишечной трубки характеризуется смещением, раздвиганием петель кишок ("симптом пустоты"), сглаженностью контуров прилежащих петель кишок. При УЗИ выявляются отдельные опухолевые узлы пониженной эхоплотности,
округлой формы, от 2 до 10 см, смещаемые при исследовании.
Опухолевый процесс наиболее часто локализуется в подвздошной кишке, в слепой кишке и терминальном отделе подвздошной кишки, других отделах толстой кишки. Значительно реже
поражаются остальные отделы кишечной трубки — желудок,
двенадцатиперстная кишка, тощая кишка. У большей части
больных при абдоминальной форме лимфосаркомы определяется наличие свободной жидкости в брюшной полости. В ряде
случаев опухолевый процесс распространяется на органы грудной полости в виде поражения плевры, плевры и лимфатических узлов, лимфатических узлов.
Следует подчеркнуть, что при изолированном поражении
кишечной трубки вовлечения в процесс органов грудной полости не отмечается.
Структура солидных абдоминальных опухолей представлена
на рис. 3.10.
Нефробластома — наиболее распространенная солидная абдоминальная злокачественная опухоль, которая поражает в основном одну почку, но иногда обе почки; очень редко встречается внепочечная ее локализация. Нефробластома отличается
высокой частотой метастазирования. Большая часть метастазов
Рис. 3.10. Структура солидных абдоминальных опухолей у детей.
I — опухоли почек (51 %); II — забрюшинные
внеорганные опухоли (20 %); III — опухоли
печени (11 %); IV — опухоли надпочечников;
V — опухоли внутренних половых органов
(4,8 %); VI — прочие (4,2 %).
120
диагностируется в течение первых 1,5 лет. Часто наблюдается
метастатическое поражение органов грудной и брюшной полости, забрюшинного пространства, реже — скелета. Для установления диагноза, определения степени распространенности
процесса в наблюдениях подвижной опухоли (80 см2) необходимы и достаточны УЗИ и КТ брюшной полости, радионуклидное
исследование почек, забрюшинных лимфатических узлов, рентгенологическое исследование грудной клетки в четырех проекциях. При выявлении неподвижной опухоли (более 80 см2) в
случаях трудностей диагностики показана ангиография. Наиболее сложными для диагностики являются опухоли верхнемедиальных отделов почки, имитирующие картину забрюшинной
нейробластомы.
Наиболее эффективна в диагностике нефробластомы абдоминальная ангиография, включающая аортографию. Характер
патологической васкуляризации, источники кровоснабжения,
выявляемые при артериальной ангиографии, определяют опухолевый процесс и распространенность нефробластомы. Ангиография является наиболее информативным (93 %) методом
лучевой диагностики при подозрении на двустороннюю неф-
робластому, при опухоли аномальной (в том числе подковообразной) почки, в случаях нефробластомы одной почки в сочетании с неопухолевым заболеванием контралатеральной почки.
УЗИ — основной метод диагностики и динамического наблюдения при нефробластоме, необходимый для оценки эффективности лечения первичной и метастатической опухоли в комплексе с РКТ. Характерным ультразвуковым признаком опухолей почек у детей является наличие патологического объемного
образования неоднородной структуры с беспорядочными отражениями различной интенсивности, состоящего из одного
(70 %) или нескольких (30 %) опухолевых узлов, пониженной
или повышенной плотности, с зонами кистозной дегенерации
в 25 % случаев.
При выявлении саркоматозных вариантов нефробластомы,
характеризующихся частым метастазированием в кости, необходимо радионуклидное и рентгенологическое исследование
скелета.
Опухоли печени. Среди первичных злокачественных опухолей
печени наиболее часты гепатобластомы и гепатоцеллюлярный
рак. В выявлении этих опухолей методом скрининга используют
ультразвуковую диагностику. При обнаружении солидного образования в печени для сокращения диагностического процесса
целесообразна пункция тонкой иглой под контролем УЗИ; при
наличии злокачественных клеток в пунктате следует произвести
ангиографию для определения операбельности. По результатам
гепатографии можно достаточно точно судить о количестве,
размерах и исходной локализации опухоли, инфильтративности
роста, диагностировать наличие капсулы и некрозов, оценить
121
распространенность процесса в печени, определить его выход
за пределы капсулы.
При подозрении на гематогенные метастазы в печень следует
выполнить радионуклидное исследование, УЗИ, КТ, МРТ, а
при сомнительных результатах этих методов — ангиографию.
Для исключения непосредственного врастания абдоминальной
опухоли в печень наиболее информативна ангиография.
Ультразвуковая картина первичного опухолевого поражения
печени у детей (гепатобластома, гепатоцеллюлярный рак) характеризуется наличием одного или нескольких опухолевых узлов,
сливающихся между собой, с неровными, нечеткими контурами, неоднородной структуры, чаще с отражениями большей интенсивности, реже — меньшей интенсивности по сравнению с
паренхимой печени. В ряде случаев четко дифференцируется
граница между опухолевым узлом и неизмененной тканью печени. Чем меньше размеры опухолевого узла, тем труднее выявляется разница между паренхимой печени и опухолью. Наличие
зон кальцинации является типичным для злокачественных опухолей у детей. Метастатическое поражение печени, характерное
для солидных опухолей и лимфопролиферативных заболеваний,
как правило, характеризуется множественными зонами неправильной формы пониженной эхоплотности без четких контуров.
Метастатическое поражение забрюшинных лимфатических
узлов наиболее часто наблюдается при опухолях половых желез,
редких у детей опухолях почек (почечно-клеточный рак, аденокарциномы, саркома), при органных и внеорганных нейробластомах, реже — при нефробластомах и опухоли печени. Наиболее
чувствительна при выявлении увеличения забрюшинных лимфатических узлов КТ; при этом следует отметить низкую специфичность этого метода, так же как ангиографии и УЗИ.
При УЗИ поражения забрюшинных лимфатических узлов
характеризуются следующими признаками: наличием объемных образований неправильной формы с неровным четким
контуром, с неоднородной внутренней структурой низкой интенсивности. Метастатические опухолевые узлы в зависимости
от их объема и локализации могут вызывать деформацию и смещение сосудов, смещение и ротацию почек, гидронефроз, смещение и сдавление поджелудочной железы, желтуху.
Нейробластома составляет 7—10 % всех солидных опухолей
у детей. Большинство из них (60—86 %) приходится на злокачественные новообразования симпатических нервных ганглиев —
нейробластомы и ганглионейробластомы.
Значительно реже в забрюшинном пространстве у детей
встречаются доброкачественные опухоли нервных ганглиев
(ганглионевромы), внеорганные тератоидные опухоли, опухоли
жировой, мышечной, соединительной ткани, лимфатических и
кровеносных сосудов, параганглиев, периферических нервов и
их оболочек. Среди новообразований надпочечников, на долю
122
которых у детей приходится около 7 % всех солидных опухолей,
также большинство составляют нейробластомы (НБ) и ганглио-
нейробластомы (ГНБ). Заболеваемость, диагностика и лечение
надпочечниковых и внеорганных забрюшинных нейробластом
и ганглионейробластом в силу сходства их гистогенеза и локализации часто рассматриваются вместе, для чего используется
собирательный термин — забрюшинная нейробластома или за-
брюшинная симпатобластома.
При подозрении на забрюшинную опухоль в медицинских
учреждениях широкого профиля обычно производят только
экскреторную урографию и эхографию, что дает возможность
поставить предположительный диагноз. В специализированных
детских онкологических клиниках широко применяются и другие методы лучевой диагностики (КТ, МРТ, РИД с технецием
и мета-йод-бензил гуанидином, ангиография, рентгенография
грудной полости и костей скелета для выявления метастазов),
а также лабораторные методы (определение уровня суточной
экскреции катехоламинов и количественная оценка плазменных маркеров опухоли — нейронспецифической энолазы, ганг-
лиосайдов, ферритина, цитологическое исследование пунктата
опухоли, костного мозга и метастатических очагов). Локализации нейробластомы представлены на рис. 3.11.
Уровень расположения опухоли вдоль позвоночника и свойственный нейробластоме инфильтративный рост определяют
комплекс диагностических мероприятий, направленных не
только на выявление локализации опухоли, но и на уточнение
распространенности патологического процесса при планировании оперативного или лучевого лечения. Встречаются различные локализации нейробластомы. Среди них наиболее часты
опухоли забрюшинного пространства и опухоли заднего средостения. Опухоли, расположенные вдоль шейных позвонков и
встречающиеся не столь часто, представляют наименьшие трудности для диагностики из-за доступности морфологического
Рис. 3.11. Локализация нейрогенных опухолей у детей.
I — средостение (22 %); II — за-
брюшинное пространство (40 %);
III — смешанная локализация
(4 %); IV — надпочечники (20 %);
V — пресакральные (10 %); VI —
шея (4 %).
VI
123
исследования. Наблюдение за изменением опухоли подобной
локализации в процессе консервативного лечения возможно
осуществить с помощью УЗИ. При планировании оперативного
лечения необходимы КТ и АГ, которые позволяют также оценить вовлечение в опухолевый процесс магистральных сосудов,
прилежащих органов и тканей.
При дифференцировании с жировыми забрюшинными опухолями несомненное преимущество у КТ.
Наибольшее число внеорганных нейробластом расположено
на уровне почек, и в зависимости от двустороннего или одностороннего расположения дает веретенообразную или полуовальную тень, нередко с обызвествлениями, прилежащую к
позвоночнику. Часто вдоль наружного контура опухоли выявляется тень отодвинутой и ротированной почки. При расположении наибольшего поперечника новообразования выше ворот
почки последняя смещается не только латерально, но и вверх
или вниз соответственно.
Таким образом, наиболее типичные при экскреторной уро-
1рафии признаки нейробластомы — латеральное смещение чашечно-лоханочной системы и мочеточников. Опухолевые сосуды из системы поясничных артерий, высокая частота вовлечения магистральных сосудов (врастание в стенку нижней
полой вены в 12 раз, а аорты — в 3 раза чаще, чем при других
опухолях) характерны для ангиографической картины забрю-
шинной нейробластомы. Расширение, смещение надпочечниковых артерий, питающих новообразование, смещение вниз
почечных артерий отличают опухоль надпочечника.
Для выявления нейробластомы надпочечника (20 % всех за-
брюшинных опухолей), особенно при дифференцировании подобной опухоли больших размеров от нефробластомы верхнего
полюса почки, показана ангиография.
Пресакральные нейробластомы встречаются гораздо реже
(10 %), занимают обычно полость малого таза, смещают вперед
и деформируют мочевой пузырь и прямую кишку, сдавливают и
оттесняют латерально мочеточники. Забрюшинная нейробластома наиболее агрессивна, чаще поражает окружающие органы
и ткани, чаще метастазирует в забрюшинные лимфатические
узлы и отдаленные органы. При определении распространенности забрюшинных внеорганных опухолей на диафрагму, надпочечник, скелет наиболее информативна КТ. При выявлении
распространенности забрюшинной нейробластомы на почки,
забрюшинные лимфатические узлы, магистральные сосуды диагностические возможности ангиографии и КТ равны. Поражение (непосредственное врастание) печени, селезенки, поджелудочной железы, брыжейки, брюшины успешнее выявляет ангиография. Оценка эффективности лечения забрюшинной
нейробластомы может быть проведена по данным повторных
экскреторных урографий (нормализация положения почек, мо-
124
источников, мочевого пузыря), УЗИ (усиление эхогенности,
уменьшение размеров), КТ (увеличение кальцинации и уплотнение капсулы опухоли).
Особую разновидность нейрогенных новообразований составляют опухоли в виде песочных часов, интрапаравертебраль-
ные нейробластомы (ИПВН), которые встречаются в 9 % случаев. Рентгенография и томография позвоночника в таких случаях выявляют изменения 2—4 смежных позвонков, вызванные
расположением части опухоли в позвоночном канале: асимметрия формы, размеров, положения корней дужек позвонка, увеличение расстояния между корнями дужек, поперечными отростками смежных позвонков, расширение позвоночного канала,
деформация тел позвонков, поперечных и суставных отростков,
головок ребер. КТ незаменима в диагностике ИПВН, так как
позволяет не только дать точную оценку паравертебральной
части опухоли, но и информацию о состоянии спинного мозга
и интравертебральной части опухоли. Следует отметить, что
трудности дифференциальной диагностики нейробластом всех
перечисленных локализаций помогают преодолеть исследования содержания катехоламинов в суточной моче, изучение состояния костного мозга, радионуклидные исследования печени,
лимфатической системы, скелета.
Помимо пресакральной нейробластомы, первичного и метастатического поражения тазового кольца, злокачественное поражение таза и промежности включает урогенитальные новообразования и внеорганные опухоли мягких тканей, преимущественно тератоидные, герминогенные, рабдомиосаркомы.
Злокачественные тератоидные опухоли составляют 2—5 %
всех новообразований у детей, поражают мягкие ткани крестцово-копчиковой и пресакральной области (различают наружную, внутреннюю и сочетанную локализации), значительно реже — яичник, влагалище, яичко. Локализация тератоидных
опухолей представлена на рис. 3.12.
Для уточнения размеров, локализации, распространенности
опухолевого процесса, выявления наиболее частых метастазов используют рентгенологическое исследование органов грудной полости и таза (характерные плотные включения, изменения
крестцово-копчикового отде-
Рис. 3.12. Локализация тератоидных опухолей у детей.
I — крестцово-копчиковая локализация (33 %); II — пресакральная локализация (6 %); III — яичники (32 %);
IV — яичники (7 %); V — забрюшин-
ное пространство (13 %); VI — средостение (4 %); VII — другие локализа-
125
ла позвоночника), УЗИ мягких тканей крестцово-копчиковой и
ягодичной области, брюшной полости, забрюшинного пространства, полости таза (смещение и деформация мочевого пузыря,
вторичные изменения верхних мочевых путей из-за нарушения
оттока мочи, метастазы в печень и забрюшинные лимфатические
узлы). Для решения вопроса о возможности оперативного лечения показаны КТ и ангиография.
На опухоли мочевого пузыря приходится 0,8 % всех злокачественных опухолей детского возраста. Опухоли мочевого пузыря у детей в 95 % случаев обусловлены рабдомиосаркомами.
Использование УЗИ позволяет судить о характере и распространенности поражения, а также о вторичных изменениях
верхних мочевыводящих путей (одно-, двусторонний гидронефроз). Для ультразвуковой картины опухолевого поражения
характерно наличие неравномерного утолщения слизистой
оболочки до 1—3 см, а также экзофитной опухоли, локализующейся в области шейки, боковых, передней и задней стенок мочевого пузыря. В редких случаях опухоль имеет внепузырный
рост и визуализируется в виде бугристого узла паренхиматозной
плотности, широко прилежащего к стенке мочевого пузыря,
вызывая его смещение и деформацию.
Опухоли яичка. Опухоли яичка относятся к редким опухолям
у детей и составляют 1,5 % от всех злокачественных солидных
опухолей. Опухоли яичка по гистологическому варианту у детей
представлены герминогенными опухолями — семиномой, эмбриональной карциномой инфантильного типа, тератокарцино-
мой, зрелой тератомой. К негерминогенным опухолям относятся
эмбриональная рабдомиосаркома, лейдигома, нейрофиброма,
лейомиосаркома, а также гемобластозы с поражением яичка.
УЗИ является высокоинформативным методом диагностики
злокачественных опухолей яичка. Типичной УЗ-картиной злокачественных опухолей яичка являются увеличение размеров
яичка, неправильная форма опухолевого узла, четкие, неровные контуры, беспорядочная внутренняя структура, низкая или
различная интенсивность отражения.
Злокачественные опухоли половых органов у девочек в 86 %
случаев локализуются в яичниках, в 10 % — во влагалище и
шейке матки, в 3 % — в теле матки; в редких случаях опухоль
обнаруживается в наружном отверстии мочеиспускательного
канала и вульве. По морфологической характеристике наиболее
часто встречаются герминогенные опухоли яичников и опухоли
стромы полового тяжа. Эпителиальные опухоли (рак яичников)
не характерны для детского возраста.
Ультразвуковая картина опухолей яичников характеризуется
наличием опухолевого узла с четкими, ровными контурами неоднородной структуры, с зонами без отражений, чередующимися с участками паренхиматозной плотности; в большей части
случаев опухоль имеет большие размеры, заполняет малый таз и
126
нижние отделы брюшной полости, вызывая деформацию и смещение прилежащих органов и тканей. Опухоли матки и влагалища визуализируются в виде узлов паренхиматозной плотности.
Ретинобластома — наиболее частая внутриглазная злокачественная опухоль, встречающаяся преимущественно в раннем детском возрасте. УЗИ является информативным методом диагностики, позволяющим определить локализацию и степень проми-
ненции опухоли, судить о динамике роста и регрессии опухоли.
УЗ-картина характеризуется наличием объемного образования на сетчатке глаза с нечеткими, неровными, бугристыми
контурами неоднородной структуры, с гиперэхогенными включениями. У большей части детей наблюдается отслойка сетчатки
различной степени выраженности. При УЗИ различают две формы ретинобластомы — твердую и кистозную. Твердые формы
имеют четкие контуры, соприкасающиеся с изображением оболочек глаза; они более характерны для ранней стадии ретинобластомы. Рост опухоли, некротические изменения вызывают в
ряде случаев отделение опухолевого узла от сетчатки. Кистозные формы имеют неоднородную структуру, нечеткие контуры,
не соприкасаются с оболочками. Кистозные формы характерны
для созревшей ретинобластомы.
Многолетний опыт работы детской клиники доказывает
объективную сложность работы врача—онколога—педиатра,
обусловленную скудной картиной начальных проявлений опухолевого процесса, выраженными симптомами сопутствующих
соматических заболеваний, быстрыми темпами роста опухолей
(например, среднее время удвоения нефробластомы составляет
17 дней), что подчеркивает важность выбора оптимального набора методик для получения уточненной диагностической информации. Широкие кооперативные исследования, сочетающие получение изображения опухолей и морфологическую верификацию, основанные на применении современных методов
визуализации, являются одной из важнейших задач развития
лучевой диагностики.
3.3. Морфологические методы исследования
Особое место в диагностике опухолей у детей занимают морфологические методы.
Детям все пункционные исследования проводят под ингаляционным масочным наркозом закисью азота с кислородом, что,
с одной стороны, значительно облегчает проведение этой процедуры для больного ребенка, а с другой — дает оптимальную
возможность для технического выполнения и получения клеточного аспирата.
Успех проводимой современной комплексной терапии злокачественных опухолей в основном зависит от раннего их выявления.
127
Глава 4
ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ
ОПУХОЛЕЙ У ДЕТЕЙ
На протяжении многих десятилетий хирурги разрабатывали
сложнейшие онкологические операции, и именно онкология
дала наиболее значительную почву для развития современной
хирургии. В настоящее время общепризнано, что терапия злокачественных опухолей включает в себя, помимо хирургического, лучевой и лекарственный методы. В последние годы активно
разрабатываются вопросы иммунотерапии при ряде злокачественных новообразований. Таким образом, современная терапия опухолей — исключительно сложное дело, требующее не
только специальных знаний, но и необходимых дорогостоящих
аппаратов лучевой терапии, разнообразных химиотерапевтических и других цитостатических препаратов. Последовательность и необходимость применения перечисленных методов
специального лечения злокачественных новообразований зависят от морфологической структуры, распространенности и чувствительности их к тому или иному методу терапии.
Особенности, связанные с лечением, следующие:
а) нарушения топографоанатомических взаимоотношений
при многих опухолях, требующих хирургического вмешательства. После рождения или в раннем детском возрасте, когда еще
не до конца сложились правильные взаимоотношения органов,
а связочный аппарат не укрепился, клетчатка нежна и весьма
эластична, опухоль при своем росте нарушает обычное расположение органов, привычное для хирурга. Можно наблюдать
различные варианты расположения пораженных опухолью органов. Нередко опухоль почки может располагаться в малом тазе или здоровая почка может быть смещена нейробластомой в
малый таз. Наблюдаются такие смещения печени, которые у
взрослого трудно представить: печень может так высоко поднимать диафрагму, что кажется расположенной в грудной полости; развернута так, что трудно определить ее части. Особенно часто в силу своей большой подвижности у детей смещаются
обе почки. Нейробластома, достигая больших размеров, резко
смещает почку (или почки), ротируя их вокруг поперечной и
продольной осей, крайне затрудняя диагностику;
б) сочетание с различными пороками развития (особенно с
пороками развития мочеполовой системы) затрудняет хирургическое вмешательство. Приходится не только удалять опухоль,
но и производить коррекцию порока. Вместе с тем сочетание
порока и опухоли затрудняет ориентировку хирурга, вносит дополнительные трудности в оперативное вмешательство, а иногда делает невозможным радикальное удаление опухоли;
в) большие операции у маленьких детей, которые нередко
проводятся при крупных, трудноудалимых опухолях, располо¬
130
женных в забрюшинном пространстве, черепе, комбинированные оперативные вмешательства (удаление опухоли почки с селезенкой, удаление опухоли почки с хвостом поджелудочной
железы, с резекцией кишечника и т. д.). Особенно объемны у
детей раннего возраста операции на печени (нередко гемигепат-
эктомии). При этом хирург должен учитывать стоящие перед
ним чисто онкологические проблемы; оперативное вмешательство должно быть радикальным;
г) опасность в связи с кровопотерей, даже незначительной.
Маленькие дети чрезвычайно чувствительны к потере крови, и
даже адекватное ее замещение помогает не всегда, особенно
при большой кровопотере. При удалении опухолей забрюшин-
ного пространства нередко обнаруживаются большие патологические, расширенные вены, поэтому потеря крови в той или
иной степени неизбежна. Положение усугубляется тем, что при
опухолях (особенно при нейробластомах) смещаются магистральные сосуды: нижняя полая вена, воротная вена, аорта, почечные сосуды. В связи со сдавлением опухолью органов и тканей сосуды гипертрофированы, диаметр вен достигает больших
размеров, ткани сильно кровоточат, иногда наблюдается диа-
педезное кровотечение. Необходимо учитывать, что у детей со
злокачественными новообразованиями еще до операции имеется выраженная анемия и незначительная кровопотеря, особенно у детей раннего возраста, может привести к гибели;
д) трудности управления гомеостазом у ребенка со злокачественной опухолью. Установлено, что у ослабленного интоксикацией и предыдущим лечением (лекарственным, лучевым)
детского организма коррекция дестабилизации, вызванной опухолевым процессом, крайне сложна. У ребенка со злокачественной опухолью возникает ряд паранеопластических синдромов —
нейроэндокринный (раздражительность, повышенная утомляемость, нарушение сна; полиневропатия, нейромиозит, иногда
энцефаломиелопатия; снижение суточной экскреции с мочой
17-КС, увеличение экскреции с мочой дофамина и ДОФА,
уменьшение количества норадреналина, повышение суточной
экскреции с мочой 5-оксииндолилуксусной кислоты); метаболический (прогрессирующее уменьшение массы тела, уменьшение
содержания в сыворотке крови аспарагиновой и аланиновой
трансаминаз, лабильность гликемии, повышение лакгатгидроге-
назы и альдолазы в сыворотке крови; повышение в сыворотке
крови общего холестерина; гипокалиемия, гипонатриемия, гипо-
кальциемия, метаболический ацидоз); иммунологический
(уменьшение числа лимфоцитов в периферической крови, снижение реакции бластгрансформации Т-лимфоцитов, увеличение
лейкоцитарного индекса интоксикации; снижение резистентности организма к инфекциям); гематологический (уменьшение
числа эритроцитов, понижение содержания гемоглобина, ани-
зоцитоз, пойкилоцитоз; нейтрофилез, лимфопения, гиповоле-
131
мия; увеличение клеток ретикулоэндотелиальной системы, нарушение процессов созревания клеток гранулоцитарного и
эритроидного ростков; снижение толерантности плазмы к гепарину, повышение содержания фибриногена плазмы, снижение фибринолитической активности плазмы; ускорение СОЭ,
поражение внутренних органов (тахикардия, аритмия, повышение артериального давления; снижение функциональной активности желудка и поджелудочной железы; изменение размеров и консистенции печени, гиперхолестеринемия и гиперби-
лирубинемия, повышение активности трансаминаз; снижение
функции почек концентрировать и разводить мочу, альбуминурия, цилиндрурия, гематурия, пиурия); общесоматический (общая слабость, бледность кожных покровов, повышение температуры тела и др.). Перечислены далеко не все признаки, сопровождающие в той или иной степени злокачественную
опухоль, но и изложенное показывает, насколько сложна коррекция гомеостаза у ребенка;
е) высокая чувствительность злокачественных опухолей у детей к ионизирующему излучению. Большинство новообразований у детей (лейкоз, нефробластома, нейробластома, ретинобла-
стома) в отличие от опухолей у взрослых чрезвычайно чувствительно к лучевому лечению. При некоторых злокачественных
новообразованиях у детей можно достигнуть излечения с помощью одной лучевой терапии, в других случаях она является компонентом комплексной терапии, но при этом следует учитывать
повреждающее действие ионизирующего излучения;
ж) повреждающее действие ионизирующего воздействия
особенно выражено у детей раннего возраста. Облучение может
вызвать у детей серьезные последствия, так как радиолог имеет
дело с быстро растущим и в то же время не до конца сформированным, лабильным организмом. Уже в процессе лечения у
некоторых больных детей появляется резкое угнетение кроветворения, которое может сопровождаться рвотой, резким снижением аппетита, в связи с чем иногда приходится прерывать
лечение. У детей по сравнению со взрослыми лейкопения, лим-
фопения возникают значительно раньше. У некоторых детей в
отдаленные сроки после лучевого лечения возникали лейкозы,
злокачественные опухоли на месте лечения;
з) высокая чувствительность большинства опухолей у детей
к лекарственной терапии. Наиболее распространенные опухоли
у детей в отличие от взрослых быстро и значительно поддаются
современным методам химиотерапии. Лекарственное лечение
применяется в качестве самостоятельного метода, но чаще как
активный компонент комплексной терапии;
и) возможность более быстрой оценки результатов лечения
при большинстве опухолей у детей. Большинство исследователей считают, что для оценки результатов лечения достаточно
2-летнего периода.
132
4.1. Хирургическое лечение
Ведущим методом лечения опухолей у детей, обеспечивающим в большинстве случаев радикальное удаление опухоли, является хирургический. При некоторых опухолях у детей в возрасте до 1 года достаточно только хирургического вмешательства, чтобы добиться полного выздоровления, например, при
опухолях почек. Однако хирургическое лечение у детей сопряжено с большими трудностями, связанными не только с незрелостью анатомо-физиологических функций, но и с нарушением
гомеостаза. В связи с этим возникает необходимость коррекции
гомеостаза и терапии паранеопластических синдромов.
После обследования больного ребенка, выявления характера
и выраженности паранеопластических процессов (особенно
учитывая токсико-дистрофическое состояние, сопровождающее
опухолевый процесс) назначают восстановительную терапию.
При хронической кортикоидной недостаточности применяют
глюкокортикоиды (преднизолон, гидрокортизон, кортизон),
анаболические гормоны (ретаболил, неробол), при катехолами-
новой интоксикации — допегит, дроперидол.
Обменные нарушения в зависимости от звеньев, которые нарушены, с успехом корригируются анаболическими гормонами,
аминокислотными (аминазол, мориамин, альвезин) и белковыми
препаратами, гемотрансфузиями при нарушении белкового обмена. При расстройствах углеводного обмена назначают инсулин, растворы глюкозы, электролитов, витамины.
Переливания крови, плазмы, альбумин, протеин, хлорид калия, глюкозу, витамины применяют при нарушениях водно-минерального обмена. При метаболическом ацидозе вводят раствор
бикарбоната. Иммунологические изменения частично корригируются также переливанием крови, лейкоцитарной массы, интерферона, спленина, вакцины БЦЖ (в ряде случаев используется имплантация фетальной вил очковой железы). Анемия, столь
нередкая у детей, компенсируется переливанием крови, эритроцитарной массы, белковых препаратов, глюкозы, введением витаминов группы С, В, анаболических гормонов. Лейкопения устраняется с помощью переливания крови, лейкоцитарной массы,
лейкогена, пентоксила, витаминов группы В, преднизолона.
При сопутствующих поражениях других органов и систем:
артериальной гипертензии, миокардиодистрофии, нефропатии,
кишечном дисбактериозе — соответственно назначают препараты раувольфии, дроперидол, оксигенотерапию, кокарбоксилазу,
хлорид калия, сосудорасширяющие средства, диуретики, мек-
саформ, мексазу. Эта восстановительная терапия проводится на
протяжении 5—7 дней и в большинстве случаев дает положительный эффект. Только в редких случаях при злокачественных
опухолях у детей врач сталкивается с необходимостью проведения экстренной операции. Наиболее часто такая ситуация воз¬
133
никает при разрывах нефробластом, перфорациях кишечника
при лимфосаркомах, тератомах.
Хирургическое лечение злокачественных опухолей у детей
сочетает принципы детской хирургии с постулатами онкологии.
Многие оперативные вмешательства, разработанные в детской
хирургии, взяты на вооружение детскими онкологами. К ним,
в частности, относятся необходимость максимального щажения
тканей, минимальная кровопотеря, возможное сокращение
времени операции. Вместе с тем имеются существенные особенности, связанные с наличием опухоли, как правило, значительных размеров, резко изменяющей обычные топографоанатомические взаимоотношения органов и тканей в области операции. Даже первичные (не говоря о повторных) оперативные
вмешательства обычно сопровождаются не только значительной кровопотерей, но и серьезной операционной травмой, оказывающей существенное влияние на течение послеоперационного периода. Речь идет в первую очередь об операциях по поводу наиболее часто встречающихся новообразований ЦНС,
забрюшинного пространства (нефробластомы, нейробластомы),
а также опухолей печени. Но и при операциях по поводу новообразований других локализаций нередко встречаются значительные технические трудности.
Запущенность опухолевого процесса у большинства детей
при поступлении в стационар, создающая ситуацию первичной
неоперабельности или условной операбельности, является одной из причин широкого применения в предоперационном периоде химио- и лучевой терапии. В связи с этим хирургический
метод применяется в качестве первого этапа комплексного лечения лишь в тех случаях, когда опухоли резистентны к этим
видам лечения (гепатобластомы, частично тератобластомы).
Применение консервативных методов терапии позволяет значительно сократить число расширенных оперативных вмешательств, когда опухоль тесно связана с прилежащими органами
и приходится производить резекцию или удаление этих органов
(печень, селезенка, кишечник и др.). Однако самое большое
значение предоперационных методов лучевой и лекарственной
терапии заключается в возможности перевести во многих случаях неоперабельную опухоль в операбельную.
Особую сложность представляют хирургические вмешательства у детей первого года жизни. Операция у ребенка в возрасте
нескольких месяцев по правилам онкологии должна быть выполнена радикально — так называемые большие операции у маленьких детей. Операционное поле, которым располагает хирург, крайне ограничено не только размерами тела маленького
пациента, но и величиной опухоли. Во многих случаях новообразование по отношению к размеру тела ребенка больше, чем
у детей старшего возраста и взрослых. При операциях в брюшной полости и забрюшинном пространстве у детей до 1 года не¬
134
редко возникают ситуации, когда величина опухоли крайне затрудняет ее выделение единым блоком. Поэтому приходится
проводить операции, противоречащие принципам абластики.
('ледует учитывать, что многие опухоли у грудных детей кис-
гозно перерождаются и может произойти перфорация этих
кист, что нередко приводит к генерализации процесса. Учиты-
ная это, необходимо как можно более осторожно манипулиро-
нать с опухолью и стараться защитить брюшную полость от попадания в нее содержимого кист и опухолевых масс. Абластику
при операциях у маленьких детей трудно претворить в жизнь, но
максимально стремиться к этому необходимо. При кистозных
опухолях, при опасности разрыва допустимо пунктировать ее
для уменьшения размеров.
У маленьких детей не всегда следует стремиться к крайнему
радикализму при удалении опухолей. Исключение составляют
резистентные к химиолучевому лечению гепатобластомы и тератобластомы. Наличие же эффективных средств лекарственной и лучевой терапии позволяет даже при распространенных
опухолях у детей (нейробластома, нефробластома, рабдомиосаркома и некоторые другие) надеяться на успех и при нерадикально проведенных операциях.
В настоящее время для большинства локализаций опухолей
у детей разработаны принципиальные схемы оперативного вмешательства, однако почти каждая операция даже по поводу часто встречающихся новообразований, например почки, внепо-
чечных опухолей, является нестандартной. Оперативные доступы при злокачественных новообразованиях у детей учитывают
топографоанатомические особенности вмешательства, которое
отличается рядом особенностей.
• По правилам онкологии операция должна быть выполнена радикально. Вместе с тем нередко имеются объективные причины, препятствующие осуществлению этого
важнейшего принципа, в основном у детей младшего возраста, у которых встречается, как уже было указано выше,
большинство новообразований "скрытой" локализации.
• Операционное поле, которым располагает хирург, крайне
ограничено не только размерами тела больного, но и размерами опухоли. До операции хирург должен иметь четкое представление о местном распространении опухоли,
в частности о ее соотношении с прилежащими органами
и тканями, а главное — с магистральными сосудами. Эту
информацию дает комплексное обследование, включающее современные методы — компьютерную и ультразвуковую томографию, ангиографию.
• В процессе оперативного вмешательства необходима
тщательная ревизия органов и тканей, лимфатических узлов и при малейших подозрениях на их опухолевое пора¬
135
жение — морфологическая верификация (биопсия или
аспирационная биопсия с цитологическим исследованием пунктата). Полученные данные имеют принципиально
важное значение для уточнения стадии процесса и последующей специальной терапии.
• При пред- и интраоперационной оценке операбельности
новообразования и риска оперативного вмешательства необходимо учитывать возможности химиолучевой терапии
злокачественных новообразований у детей. В частности,
это относится к нефробластомам, нейробластомам, рабдомиосаркомам. В случае исключительно высокого риска
вмешательства из-за огромных размеров опухоли, вовлечения в процесс жизненно важных органов, магистральных сосудов, тяжести состояния пациента, невозможности
обеспечения адекватного анестезиологического пособия и
других факторов целесообразно ограничиться биопсией.
При подозрении на системный характер опухолевого процесса (лимфатических узлов средостения, забрюшинных
и внутрибрюшинных лимфатических узлов, шеи и т. д.)
необходимо срочное гистологическое исследование с отказом от ненужной "радикальной" операции.
• При невозможности осуществления радикального удаления первичной опухоли ее оставшаяся часть и пораженные лимфатические узлы должны быть отмечены металлическими клипсами, чтобы в послеоперационном периоде можно было провести целенаправленное облучение.
• Выполняя пробную или диагностическую лапаротомию,
хирург должен быть готов к большому оперативному вмешательству, что необходимо иметь в виду при подготовке
не только больного, но и самого хирурга к операции.
4.2. Лучевая терапия
Лучевое лечение является одним из важнейших компонентов комплексного лечения злокачественных опухолей в онкопедиатрии. Специфика детского организма и развитие опухолевого процесса определяют и ряд особенностей проведения
лучевой терапии у детей.
Лучевой метод как самостоятельный в плане радикального
лечения в детской онкологической практике используется редко, так как радикальное лечение требует использования больших доз излучения на опухолевой очаг, что представляет на сегодняшний день ряд сложностей ввиду высокой радиочувствительности детского организма, особенно в первые месяцы и
годы постнатального развития.
В комплексном лечении лучевой метод применяется в следующих формах.
136
1. Предоперационное облучение, направленное на снижение
жизнеспособности опухолевых клеток, уменьшение размеров
опухоли.
2. Послеоперационное облучение, направленное на уничтожение опухолевых клеток, возможно, оставшихся не удаленными при операции или при нерадикальном удалении опухоли.
3. Сочетание лучевой терапии с химиотерапией и хирургическим методом.
Особенности гистогенеза злокачественных опухолей у детей
в значительной степени обусловливают возможности лучевой
терапии. Подавляющее большинство новообразований — низкодифференцированные, что определяет их высокую радиочувствительность. Последняя наблюдается особенно при нефроб-
ластоме, нейробластоме, лимфосаркоме, рабдомиосаркоме, саркоме Юинга, лимфогранулематозе. Вместе с тем одна и та же по
морфологическому строению опухоль у разных больных на необходимую очаговую дозу реагирует неодинаково, что зависит
от характера ее роста, размеров, длительности существования,
сопутствующих заболеваний и общей реактивности организма.
Особенности лучевой терапии у детей определяются и клинико-дозиметрическими параметрами метода. Так, из детской
практики полностью исключена методика ортовольтной рентгенотерапии, при которой максимум поглощенной дозы приходится на поверхностные слои кожи, реагирующей на облучение развитием лучевых реакций, вплоть до влажного эпидер-
мита, что не позволяет подвести к опухоли необходимую дозу
излучения.
Общеизвестное требование максимальной концентрации терапевтической дозы в опухолевом очаге и минимальное лучевое
повреждение окружающих опухоль нормальных структур имеют особое значение в лучевой терапии детей. Современные ме-
гавольтные установки с использованием источников гамма-излучения, тормозного и электронного излучения линейных ускорителей и бетатронов в определенной мере обеспечивают
указанные выше требования. Однако облучаемые ткани, как
правило, включают определенный объем нормальных органов
и тканей, толерантность которых к излучению невысока и составляет 50—75 % дозы, необходимой для стойкой резорбции
опухоли. В этих условиях необходимо строго индивидуализировать разовые и суммарные поглощенные дозы, шире применять средства, формирующие дозные поля (решетки, клиновидные фильтры, блоки), использовать способы фармакологической и гипоксической защиты нормальных тканей, что
позволяет предотвратить или уменьшить непосредственные побочные эффекты и развитие лучевых повреждений.
Проведение лучевой терапии у маленьких детей затруднено в
связи с необходимостью обездвиживания пациента. Облучение
в таких случаях проводится во время сна, как естественного, так
137
и вызванного применением седативных средств в возрастной
дозировке (хлоралгидрат, димедрол, седуксен, дроперидол).
Учитывая высокую чувствительность к радиации детей, особенно младшего возраста, большой объем облучаемых тканей,
исходную тяжесть состояния ребенка, следует тщательно следить за возможными побочными эффектами. Облучение нередко сопровождается рвотой как при облучении живота, так и
других областей, являясь симптомом общей лучевой реакции.
Проявлением местного побочного эффекта могут быть диспепсические расстройства, особенно у детей младшего возраста.
Наконец, нередко наблюдаются другие побочные действия общего характера (тошнота, потеря аппетита, нарушение сна, усиление токсикоза) и изменения показателей крови (лейкопения,
анемия). При достижении значительной суммарной очаговой
дозы возможны выраженные местные кожные реакции.
Для предупреждения и лечения подобных проявлений лучевой терапии необходим комплекс мероприятий. При планировании разовых, суммарных очаговых доз и режима облучения,
проводимого на фоне химиотерапии, необходимо учитывать
возможность потенцирования некоторых побочных эффектов
химиопрепаратами. Так, актиномицин "D", адриамицин усиливают поражение кожи и слизистых оболочек; циклофосфан в
сочетании с облучением нередко приводит к возникновению
цистита, а адриамицин при облучении средостения усиливает
кардиотоксичность. Для предупреждения или лечения местных
лучевых реакций необходимы тщательный уход за кожей в области облучения, смазывание облепиховым маслом, рыбьим
жиром, линиментом алоэ.
Профилактика лучевых повреждений является важным звеном
комплексного лечения детей со злокачественными опухолями.
Многолетние клинические и физиологические исследования позволили обнаружить у ряда детей длительно существующие функциональные и органические пострадиационные нарушения, проявляющиеся в разные возрастные периоды изменением тех или иных органов и систем, которые находятся в
процессе морфологического и функционального созревания и
формирования.
Лучевые повреждения могут быть общими и местными.
К нарушениям общего характера относятся астеноневротиче-
ские явления (головная боль, возбуждение, бессонница и др.),
эндокринные (запоздалое половое созревание, ожирение и др.).
Местно характерны повреждения в зонах облучения: разной
степени трофические изменения кожи, подкожного жирового
слоя и мягких тканей, вплоть до формирования лучевого фиброза, облитерация лимфатических сосудов с развитием лимфо-
стаза; выпадение волос, телеангиэктазии. Со стороны скелета
могут отмечаться замедление роста и деформации костей, частично за счет преждевременного замыкания эпифизарных зон,
138
ведущие к укорочению конечности, асимметрия отдельных участков тела, остеопороз и патологические переломы. Возможны
также поздние лучевые повреждения внутренних органов и тканей: очаговый пневмосклероз, миокардиодистрофия, катаракта
и др. Тяжелым последствием лучевой терапии является развитие
второго злокачественного новообразования в зоне облучения.
Описанные особенности лучевой терапии у детей определяют следующие требования:
• всегда точно знать морфологическое строение (гистогенез) опухоли и степень ее распространенности;
• облучение проводить с оптимальных полей с индивидуальным расчетом разовой и суммарной поглощенной дозы в опухолевом очаге и за его пределами;
• в процессе лучевого лечения проводить постоянный контроль за показателями периферической крови и динамикой опухолевого процесса;
• лучевое лечение проводить на фоне общеукрепляющей
терапии и профилактики лучевых повреждений.
4.3. Лекарственное лечение
Лекарственное лечение злокачественных опухолей у детей
является относительно новым, но очень перспективным направлением комплексной терапии, что связано с высокой чувствительностью большинства новообразований у детей к противоопухолевым препаратам. Лишь менее 9 % из них не реагирует
положительно на это лечение. Разнообразие злокачественных
опухолей практически исключает возможность создания препарата, одинаково эффективного для всех новообразований. В
связи с этим проводится широкий поиск препаратов различного
механизма действия, что имеет важнейшее значение для комбинированной химиотерапии опухолевых заболеваний.
Все препараты, используемые в настоящее время в химиотерапии опухолей, делятся на две группы — гормональные и
собственно химиотерапевтические синтетического и природного происхождения. Первые используются для лечения новообразований, сохранивших способность тканей, в которых они
развиваются, реагировать на гормоны, в норме регулирующие
их рост. К ним относятся андрогены, эстрогены, прогестероны,
кортикостереоиды.
Терапевтический эффект большинства химиопрепаратов
связан с подавлением ими различных этапов обмена нуклеиновых кислот в опухолевых клетках. Препарат может непосредственно взаимодействовать с нуклеиновыми кислотами, нарушая
их способность нормально функционировать, и может взаимодействовать с ферментами, ответственными за биосинтез и
функционирование нуклеиновых кислот.
139
В зависимости от структуры и происхождения выделяют
5 групп химиопрепаратов.
Алкилирующие препараты, способные реагировать с нуклеофильными центрами, нарушая синтез ДНК и в меньшей степени РНК, в результате чего наступают изменения структуры де-
зоксирибонуклеопротеидов, и клетки становятся нежизнеспособными. В эту группу входят эмбихин, новэмбихин, допан,
циклофосфан, сарколизин, фторбензотэф и др.
Антиметаболиты, т. е. вещества, сходные по химической
структуре с витаминами, которые включаются вместо них в
процессы обмена, действуя при этом как конкурентные ингибиторы важных метаболических процессов. Так, фолиевая кислота принимает участие в синтезе пуринов и пиримидинов и
соответственно в синтезе нуклеотидов. Антифолиевые препараты, аналоги пурина и пиримидинов, имеют, таким образом,
большое значение в химиотерапии. Такие препараты из этой
группы, как метотрексат, 6-меркаптопурин, 5-фторурацил,
фторафур, цитозинарабинозид, относятся к числу лучших из
известных противоопухолевых средств.
Противоопухолевые антибиотики (дакгиномицин, хризома-
лин, аурантин, брунеомицин, рубомицин, карминомицин, мито-
цин С, стрептонигрин, блеомицин, адриамицин), состоящие из
различных аминокислот, соединенных с хромоформной группой, нашли широкое применение в лечении многих системных
и солидных новообразований у детей.
Препараты растительного происхождения (винкристин, винб-
ластин) являются митотическими ядами, блокирующими митозы
клеток.
Прочие противоопухолевые препараты с неуточненным механизмом действия (аспарагиназа, имидазол-карбоксамид (ДТ1С),
хлодитан (орто-пара-ДДЦ), прокарбазин (натулан), производные нитрозомочевины (BCL, CCL).
Выбор препарата обычно основывается на знании его эффективности при том или другом морфологическом виде опухоли. Некоторые из противоопухолевых агентов метаболически
инертны, пока они не активированы нормальной тканью организма. Применение циклофосфана не дает местного эффекта,
так как он метаболически инертен до тех пор, пока не метабо-
лизируется в печени.
Одним из существенных ограничений при применении химиотерапии является устойчивость в некоторых анатомических
регионах злокачественных клеток, где концентрация препаратов недостаточна для достижения их гибели.
Так, большинство противоопухолевых препаратов не проникает через гематоэнцефалический барьер, что является причиной последующего развития нейролейкоза. Для его профилактики применяют эндолюмбальное введение метотрексата и лучевую терапию.
140
Таким образом, до начала химиотерапии необходимо комплексное обследование больного для выяснения состояния ряда органов и систем, в частности костномозгового кроветворения, печени, почек и др.
В настоящее время в детской онкологии в большинстве случаев химиопрепараты применяют внутривенно (системная химиотерапия). В ряде случаев химиопрепараты вводят эндолюм-
бально. В последние годы при лечении ряда злокачественных
опухолей широкое применение получила регионарная (в частности, внутриартериальная) химиотерапия, проводимая с помощью современных инфузаторов. Этот метод с успехом применяется при саркомах мягких тканей и костей. Проводятся исследования по использованию этого метода при раках печени и
нефробластомах.
Метод основан на гипотезе создания в очаге поражения высокой и постоянной концентрации лекарственного препарата с
одновременным снижением токсического действия лекарственного агента.
В настоящее время общепризнано, что наибольший эффект
следует ожидать от полихимиотерапии. Обычно в комбинацию
включают препараты, в той или иной степени активные при
данной опухоли. Теоретически целесообразно включение препаратов: 1) обладающих разным механизмом действия, т. е.
имеющих разные точки приложения на обмен опухолевых клеток; 2) действующих на разные фазы клеточного цикла, на чем
основан принцип синхронизации клеточной популяции (применение препарата, блокирующего определенную фазу клеточного цикла для обеспечения последующего максимального воздействия через определенный промежуток времени другого
препарата, действующего в этой фазе); 3) оказывающих различное побочное действие с тем, чтобы избежать суммации токсических эффектов; 4) обладающих различной быстротой действия с тем, чтобы более медленно действующий закрепил ремиссию, достигнутую быстродействующим препаратом.
Лекарственная противоопухолевая терапия применяется как
самостоятельно, так и в комбинации с хирургическим и лучевым методами лечения.
Предоперационная химиотерапия предполагает выполнение
грех основных задач:
• уменьшение размеров опухоли для создания благоприятных условий при операции и абластики;
• определение биологической чувствительности опухоли к
химиопрепаратам;
• профилактика потенциально имеющихся метастазов в
доклинической стадии и лечение имеющихся отдаленных
метастазов.
141
Это важно для решения вопроса о целесообразности применения данной комбинации препаратов в послеоперационном
периоде с целью профилактики рецидивов и метастазов.
Профилактическая и поддерживающая химиотерапия показала свою целесообразность при многих новообразованиях у детей — нефробластоме, нейробластоме, рабдомиосаркоме, не говоря уже о системных поражениях (лимфосаркома, лимфогранулематоз, лейкоз). При назначении профилактической
химиотерапии необходимо руководствоваться степенью лечебного (лекарственного) патоморфоза в удаленной или подвергшейся биопсии опухоли после проведения предоперационной
химиотерапии. При наличии III—IV степени патоморфоза профилактическое лечение проводят по той же схеме; при I—II степени необходимо провести замену химиопрепаратов.
Наконец, при диссеминированных новообразованиях химиотерапия является ведущим, а в большинстве случаев и единственным методом лечения.
При оценке эффективности химиотерапии учитывают рекомендации, предложенные ВОЗ в 1977 г.:
а) полный эффект. Исчезновение всех опухолевых образований, определяемое дважды в течение срока не менее 4 нед;
б) частичный эффект. Уменьшение всех измеряемых опухолей не менее чем на 50 %, определяемое дважды в срок не менее
4 нед. При этом не должно обнаруживаться появление новых
опухолевых очагов;
в) без эффекта. К этой категории относятся те больные, у которых отмечается уменьшение опухолей менее чем на 50 % или
увеличение их менее чем на 25 %. При этом не должно констатироваться появление новых опухолевых очагов;
г) прогрессирование. Увеличение размеров опухолей на 25 %
или больше, появление новых опухолевых очагов. Уменьшение
опухоли менее чем на 50 % не оценивается как улучшение, а
увеличение ее менее чем на 25 % не рассматривается как ухудшение.
Продолжительность общего эффекта отсчитывается от даты
начала лечения до даты первого наблюдения прогрессирования
болезни. Продолжительность полного объективного эффекта
измеряется от даты, когда этот полный эффект впервые зарегистрирован, до даты, когда отмечены первые признаки прогрессирования заболевания. Для частичного эффекта отсчет ведется от начала лечения.
При проведении химиотерапии часто наблюдаются различные проявления токсичности препаратов, т. е. изменение нормальной биологической деятельности живой клетки в патологическом направлении. Оказывая подавляющее действие на
быстро размножающиеся клетки злокачественной опухоли,
препараты воздействуют и на такие нормальные клетки и их
142
ткани, как кроветворные органы, слизистая оболочка кишечника, нервная ткань. Отмечены токсические воздействия многих препаратов на определенные органы и ткани. Так, препараты винкоалкалоидов воздействуют на нервную ткань, антра-
циклины — на сердечную мышцу. Комбинируя препараты с
различными токсическими воздействиями, можно получить дополнительный эффект воздействия на опухолевые клетки, не
усиливая побочные эффекты химиотерапии.
Различают немедленные побочные реакции, возникающие в
1-е сутки введения препаратов (тошнота, рвота), ранние, развивающиеся в пределах 1-й недели и представленные разнообразными токсическими явлениями со стороны кроветворения,
нервной системы, печени, почек, и поздние побочные реакции,
аналогичные ранним, но наблюдающиеся в более поздние сроки в процессе дальнейшего лечения. Нередко последние являются результатом кумуляции длительно применяющихся препаратов.
При выраженности побочных проявлений химиотерапию
прерывают, а в ряде случаев и прекращают. Наиболее частой
причиной прерывания лечения являются нарушения кроветворения, характеризующиеся уменьшением числа лейкоцитов и
тромбоцитов. Проведение лекарственного лечения с учетом возможных побочных эффектов и своевременным принятием профилактических мер может предупредить возникновение серьезных осложнений.
Комплексное и комбинированное лечение. Даже короткое перечисление методов лечения, применяемых в детской онкологии, показывает, какой значительный арсенал терапевтических
средств имеется в настоящее время в руках детского онколога.
В последние десятилетия разработаны наиболее эффективные
программы комплексного лечения многих злокачественных новообразований, учитывающие возможности хирургического,
лучевого и лекарственного методов. Комбинации их и удельный вес каждого из них существенно колеблются в зависимости
от морфологического вида, распространенности опухоли, ее
чувствительности к химиолучевой терапии и, наконец, от возраста больного ребенка.
В течение последних двух десятилетий произошли существенные сдвиги в детской онкологии в виде совершенствования
методов диагностики и комплексного лечения злокачественных
новообразований у детей.
Наиболее значительные результаты в лечении многих злокачественных новообразований в локализованной стадии получены в последнее десятилетие (1970—1980). Достигнутые успехи
объясняются главным образом большим вниманием многих исследователей к проблеме детской онкологии, интенсивной разработкой и внедрением в практику новых методов диагностики,
химиолучевой терапии.
143
В настоящее время с учетом неудовлетворительных результатов лечения ряда нозологических форм злокачественных заболеваний у детей, таких как забрюшинная нейробластома (5-
летняя выживаемость не более 20 %), тератобластомы (5-летняя
выживаемость не более 15 %), для улучшения результатов лечения стала применяться так называемая высокодозная полихимиотерапия. Этот вид лечения проводится одновременно с
трансплантацией костного мозга и дает обнадеживающие предварительные результаты. Однако оно должно проводиться только в специализированных отделениях на базе детских онкоге-
матологических учреждений.
Вместе с тем необходимо подчеркнуть, что чем своевременнее диагностирована опухоль, тем больше шансов добиться выздоровления ребенка даже при применении менее агрессивной
терапии.
Глава 5
ОРГАНИЗАЦИЯ ОНКОЛОГИЧЕСКОЙ
ПОМОЩИ ДЕТЯМ РОССИИ
Специализированная помощь детям с онкологическими заболеваниями начала организовываться в нашей стране (в бывшем
СССР) в 60-х годах прошлого века. Подробное описание истории развития детской онкологии представлено в главе 1.
Значительное развитие специализированной детской онкологической службы в России отмечено в последнее десятилетие
в связи с созданием сети крупных детских онкогематологиче-
ских центров с материальной и финансовой помощью КЕР
(Германия).
В большинстве административных, областных, краевых и
республиканских центров открыты детские онкологические
кабинеты, которые должны осуществлять сбор статистических
данных, первичную диагностику, диспансерное наблюдение и
амбулаторную химиотерапию детям со злокачественными
новообразованиями, организационно-методическую работу с
педиатрическими и неонкологическими специализированными детскими поликлиническими и стационарными отделениями.
В регионах, где нет детских онкологических кабинетов и отделений, помощь детям со злокачественными новообразованиями оказывают различные специалисты детских больниц или
онкологических диспансеров для взрослого населения, что, к
сожалению, не всегда дает положительные результаты.
В 1994 г. в стране насчитывалось 15 детских онкологических
отделений, а там, где их нет, лечением этого контингента занимаются территориальные онкологические диспансеры и частично гематологические, нейрохирургические и урологические
подразделения учреждений общей лечебной сети.
К этому времени в России были развернуты финансируемые
Министерством здравоохранения Российской Федерации 833
койки для детей, больных злокачественными опухолями, или
0,25 на 10 000 детского населения. Кроме того, с учетом других
источников финансирования общее число коек достигло 942
(0,28 на 10 000 детского населения). Таким образом, обеспеченность детскими онкологическими койками превысила соответствующий показатель для взрослых в 3,7 раза.
Однако до настоящего времени онкологическая служба в педиатрии в отличие от государственной системы онкологической помощи взрослым организационно несовершенна, что отчасти объяснимо молодостью науки "детской онкологии" и относительной редкостью этой патологии в детском возрасте.
В 1976 г. ВОЗ сообщила, что в 23 экономически развитых
странах смертность детей в результате злокачественных новообразований вышла на 2-е место, уступая лишь смертности детей от несчастных случаев. В настоящее время в Российской
145
Федерации смертность у детей с онкологическими заболеваниями конкурирует со смертностью от травматических повреждений и зачастую выходит на 1 -е место.
Показатели заболеваемости детей со злокачественными новообразованиями в нашей стране примерно одинаковы во всех
регионах и составляют, по данным ряда регионов (Москва, Московская область — Балашиха, Санкт-Петербург, Нижний Новгород, Ставрополь, Ростов-на-Дону, Волгоград, Кемерово, Челябинск), 13—15 на 100 тыс. детского населения. Эти цифры
существенно выше, чем официальные данные онкологических
диспансеров регионов, где детская онкологическая служба отсутствует (6—7 детей на 100 тыс. детского населения). Число
ежегодно регистрируемых детей со злокачественными опухолями увеличилось за последнее десятилетие на 20 % и достигло
4,45 тыс.
Таблица5.1. Обеспеченность детскими онкологическими койками
в Российской Федерации на 2000 г.
Округа
Российской
Федерации
Город
Детское
население
Коечный фонд
Центральный
Москва
7442,6
280
Балашиха
(Московская
область)
30
Калуга
15
Воронеж
40
Северо-
Западный
Санкт-Петербург
3106,8
110
Приволжский
Нижний Новгород
6400,7
60
Волгоград
85
Южный
Ростов-на-Дону
3200,3
60
Уральский
Екатеринбург
4848,7
60
Пермь
30
Челябинск
40
Сибирский
Новосибирск
6037,9
60
Кемерово
40
Новокузнецк
40
Омск
40
Дальневосточ¬
Хабаровск
2080,9
40
ный
Владивосток
40
Всего...
1070
146
Ежегодно в стране первично выявляются следующие онкологические заболевания: лейкозы — 1370, лимфосаркомы —
350, лимфогранулематоз — 310, нефробластомы — 770, нейробластомы — 770, саркомы мягких тканей и костей — по 770, ре-
тинобластомы, опухоли ЛОР-органов — по 110, опухоли головного мозга — 1980 и прочие опухоли — 220 случаев. В Российской Федерации к настоящему времени имеется 1070 коек для
детей с онкологическими заболеваниями (табл. 5.1).
В отличие от онкологической помощи взрослым, в которой
для борьбы со злокачественными новообразованиями создано
несколько научно-исследовательских институтов и огромная
сеть онкологических диспансеров, а в медицинских институтах
и на медицинских факультетах организованы кафедры онкологии, в педиатрической онкологической службе имеется лишь
один научно-исследовательский институт (Институт детской
онкологии и гематологии Российского онкологического научного центра РАМН) и ни одной кафедры в медицинских институтах.
С 1990 г. по настоящее время Минздравом РФ, органами исполнительной власти, региональными отделениями здравоохранения и головным НИИ Детской онкологии и гематологии
РОНЦ им. Н. Н. Блохина РАМН проведена организация межрегиональных, региональных, краевых, областных и городских
центров детской онкологии на базах многопрофильных детских
больниц и онкологических диспансеров (Приказ М3 РФ
№ 270 от 12.09.97 г.), внедрены в практику работы международные протоколы лечения детей с онкологическими заболеваниями (стандарты детской онкологической помощи). Под контроль поставлены около 70 % онкологических больных детей.
Вместе с тем не решены вопросы разделения федеральных и
региональных программ финансирования лечения и социального обеспечения детей с онкологическими заболеваниями,
обеспечения необходимым оборудованием, реактивами, лекарствами и сопровождающими материалами современных технологий лечения детей и подростков со злокачественными новообразованиями. Также не решены вопросы подготовки и переподготовки врачей, медицинских сестер и лаборантского
состава, работающих по новым технологиям в центрах (отделениях) детской онкологии.
Для проведения разумной децентрализации детской онкологической помощи в России с созданием крупных межтерриториальных центров Министерством здравоохранения РФ совместно со специалистами головного НИИ и кафедрой детской онкологии РМАПО планируются лицензирование имеющихся отделений и сертификация сотрудников, работающих с
детьми, больными онкологическими заболеваниями. Не исключено, что может возникнуть необходимость в перепрофи-
лировании/сокращении некоторого количества коек на терри¬
147
ториях. НИИ детской онкологии РОНЦ им. Н. Н. Блохина
РАМН совместно с благотворительным обществом КЕР (Германия), региональными отделениями и центрами детской онкологии и гематологии (Волгоград, Нижний Новгород, Кемерово, Пермь, Челябинск, Балашиха, Ростов-на-Дону и др.)
проводит большую научно-практическую работу по следующим направлениям:
• разработка научно обоснованных методов организации
онкологической помощи детям;
• изучение эпидемиологии солидных опухолей и гемобла-
стозов у детей;
• изучение особенностей клинического течения злокачественных новообразований у детей (солидные опухоли и ге-
мобластозы);
• оценка эффективности различных методов диагностики
солидных опухолей и гемобластозов в детском возрасте;
• разработка новых и совершенствование существующих методов профилактики и лечения (хирургического, лучевого
и лекарственного) новообразований в детском возрасте;
• разработка методов медико-генетического консультирования детей с солидными опухолями и гемобластозами, а
также их семей;
• разработка принципов комплексной реабилитации детей
со злокачественными новообразованиями (солидные опухоли и гемобластозы);
• изучение структуры онкологической заболеваемости детей из зон, загрязненных радионуклидами;
• диагностика и изучение лимфаденопатий у детей из зон,
загрязненных радионуклидами;
• обследование при дисплазиях гемопоэза детей из зон, загрязненных радионуклидами;
• разработка принципов мониторинга и раннего выявления
онкологических заболеваний у детей из зон, загрязненных
радионуклидами;
• выявление онкологических проблем подросткового периода;
• разработка принципов паллиативной детской онкологии
и хосписов.
Создание сети межтерриториальных центров с головным учреждением позволит улучшить качество статистики и оказания
помощи детям с онкологической патологией, а также решит вопросы разделения федеральных и региональных программ финансирования лечения, улучшения его качества и социального
обеспечения детей с онкологическими заболеваниями.
Многолетний опыт создания и функционирования детской
онкологической службы в регионах России (Московская область, Нижний Новгород, Волгоград, Кемерово и др.) показал,
148
что наиболее целесообразной и эффективной является централизованная помощь детям со злокачественными новообразованиями. Она состоит из нескольких звеньев, каждое из которых
выполняет свои функциональные задачи. Это, по сути своей, и
является стандартами оказания детской онкологической помощи в Российской Федерации, а именно:
А. Общая или специализированная неонкологическая педиатрическая служба:
• педиатрическое поликлиническое отделение
(установочный диагноз, общее педиатрическое обследование, госпитализация);
• неонкологический педиатрический (или
специализированный — гематологический,
хирургический, урологический, ортопедо-
травматологический, офтальмологический
и др.) стационар (стационарное дообследование с
установлением диагноза и консультацией детского онколога, перевод в детское онкологическое отделение, а при
его отсутствии — в онкодиспансер; проведение профилактических или поддерживающих курсов химиотерапии
по рекомендации детского онколога).
Б. Специализированная детская онкологическая служба:
• поликлиническое детское онкологическое
отделение (кабинет) (организационно-методическая работа с получением достоверных статистических
данных о заболеваемости и смертности детей с онкопатологией, ее структуре, частоте и причинах поздней диагностики новообразований; диагностический и дифференциально-диагностический процесс; амбулаторная специальная терапия; диспансерное наблюдение; комплексная
реабилитация);
• специализированный детский онкологический стационар (педиатрический) (комплексное обследование с установлением вида и распространенности опухолевого процесса; проведение программной комплексной терапии; организационно-методическая работа в прикрепленном регионе; комплексная
реабилитация; диспансерное наблюдение).
Перечисленные звенья существуют в полном или частичном
составе практически во всех регионах России, но необходимы их
тесная связь и преемственность для того, чтобы они функционировали как единое целое в детской онкологической службе
региона. Только при выполнении этих условий возможно осуществление главной задачи — своевременной диагностики злокачественного новообразования с последующим адекватным
лечением больного ребенка. К сожалению, почти у 50 % детей
149
злокачественное новообразование распознается в распространенной стадии процесса, что требует не только более тяжелого
и сложного лечения, но и ухудшает прогноз заболевания.
Структура детской онкологической службы России имеет
3 уровня.
• Первый уровень — специалисты Управлений охраны здоровья матери и ребенка, санаторно-курортной помощи и
реабилитации Минздрава РФ и головной институт —
НИИ детской онкологии и гематологии РОНЦ
им. Н. Н. Блохина РАМН.
• Второй уровень — крупные межрегиональные центры
детской онкологии.
• Третий уровень — отделения онкологии и гематологии/
онкологии многопрофильных республиканских, краевых
и областных больниц и онкологических диспансеров.
Коечный фонд службы детской онкологии должен быть соотнесен с показателями онкологической заболеваемости (15 на
100 000 детского населения до 15 лет). При этом необходимо
учитывать заболеваемость подростков 15—18 лет и длительность и кратность стационарной терапии у одного ребенка.
Важное место в этой сети занимает консультативный детский онкологический кабинет в детской поликлинике общей лечебной сети. В его функции входит организационно-методическая работа с получением достоверных статистических данных о
заболеваемости и смертности детей со злокачественными новообразованиями, ее структуре, запущенности, причинах; диагностический и дифференциально-диагностический процесс;
специальная амбулаторная терапия; диспансерное наблюдение;
реабилитация.
Там, где учетом детей занимаются специализированные детские онкологические кабинеты (Москва), он значительно более
полный. К сожалению, пока таких кабинетов еще мало и поэтому учет осуществляется областными и городскими онкологическими диспансерами (а как мы уже указывали, при этом
недоучет составляет до 50 % больных).
В Санкт-Петербурге также создан детский раковый регистр
и показана ненадежность существующей (формальной) системы
учета детей со злокачественными новообразованиями на основе
получаемой документации из различных детских стационаров и
поликлиник. Недоучет числа заболевших в целом за 1990—
1997 гг. составил в Санкт-Петербурге около 50 %. Существенное колебание показателей заболеваемости и смертности в различных регионах России, низкий официальный общий показатель заболеваемости детей злокачественными новообразованиями в России (около 9,0 на 100 тыс. детского населения)
также в основном связаны с недоучетом. Так, общее число первичных официально регистрируемых детей с онкологической
150
патологией в России составляет около 3000, хотя с учетом численности детского населения и предполагаемом среднем показателе 15,0 на 100 тыс. таких больных должно быть около 6000.
Редкость злокачественных новообразований у детей придает
особую значимость достоверности статистических показателей
заболеваемости и смертности больных в этом возрасте. Как показывает опыт работы, правильность статистики теснейшим
образом связана с уровнем организации детской онкологической службы в регионах России.
В 1997 г. в России заболевание ребенка злокачественным
новообразованием регистрировалось в среднем каждые 2,8 ч, а
из 10 000 новорожденных в этом году 14 рискуют заболеть в
детском возрасте. В 2000 г. каждые сутки регистрировалось
10 новых заболеваний у детей. Уже эти несколько цифр свидетельствуют о важности оценки состояния детской онкологической помощи.
На конец 1999 г. в России на учете состояли 9418 детей, или
примерно 0,5 % от общего числа наблюдаемых больных. Пять и
более лет наблюдались 24 % детей. Летальность достигла 18 %.
Специальное исследование заболеваемости злокачественными
новообразованиями детей на Дальнем Востоке показало, что
ежегодно заболевают 13 детей на 100 тыс., но, судя по всему,
это неполные данные, так как существуют трудности учета на
этих территориях. Исходя из этих сведений, можно предположить, что один из 450 детей, достигших 15 лет, заболеет злокачественной опухолью.
К этому следует добавить, что в России различными доброкачественными опухолями (главным образом гемангиомы,
лимфангиомы, пигментные невусы) ежегодно заболевают до
650 детей на 100 000.
Эти данные соответствуют сведениям из других стран. Так,
в США заболеваемость детей до 15 лет злокачественными опухолями составляет 14 на 100 000. По данным Национального
института рака США, заболевает один из 330 американцев в
возрасте до 20 лет.
Первое место в структуре заболеваемости детей занимают ге-
мобластозы (52,8 %), затем опухоли центральной нервной системы (13,2 %), почек (7,6 %), костей (5,8 %) и мягких тканей
(4,1 %). Наиболее часто среди гемобластозов встречаются острый лимфолейкоз (36,2 %), неходжкинские лимфомы (24,7 %),
лимфогранулематоз (16,4 %) и другие острые лейкозы (16,4 %).
Мальчики заболевают в 1,3 раза чаще, чем девочки, особенно
при злокачественных новообразованиях печени (в 1,9 раза) и
глотки (в 2,3 раза). Рак щитовидной железы поражает в 1,8 раза
чаще девочек.
В возрасте 0—4 года дети чаще заболевают низкодифференцированными злокачественными новообразованиями (рак печени, почек, яичка и острый лейкоз). Максимальные показате¬
151
ли заболеваемости в возрасте 10—14 лет отмечаются для злокачественных новообразований полости рта, глотки, костей,
мягких тканей, яичника, меланомы кожи.
Среди солидных злокачественных опухолей различных органов и тканей наиболее часто диагностируются опухоли центральной нервной системы (около 20 %), реже — почек (неф-
робластома) — 8 %, костей и мягких тканей (7 %), глаз (3,5 %).
Крайне редко встречаются типичные опухоли взрослых — рак
желудка, кишечника, молочной железы и др.
Из гемобластозов существенно преобладает острый лейкоз,
как правило, лимфобластный (65 %) по сравнению с миелоид-
ным (2 %), и очень редко (в отличие от взрослых) встречаются
хронические формы лейкозов (3 %). Среди поражений лимфатических узлов часто встречаются лимфосаркома (неходжкин-
ская лимфома) (около 20 %) и лимфогранулематоз (болезнь
Ходжкина — 10 %).
Наиболее высокая заболеваемость детей зарегистрирована в
Дальневосточном (13,2), Уральском (12,8) и Центральном (11,1)
округах. Максимальная заболеваемость гемобластозами выявлена в Дальневосточном (10) и Северном (5,8), злокачественными новообразованиями почек — в Центральном (2,4) и Дальневосточном (1,4), центральной нервной системы — в Волго-
Вятском и Уральском (по 1,6), костей — в Северо-западном
(0,68) и Южном (0,62) округах.
Из 10 000 новорожденных мальчиков рискуют заболеть в
детском возрасте 15, девочек — 12. Наиболее высока вероятность заболеть в возрасте 0—14 лет гемобластозами — 0,085 и
0,059 % соответственно для мальчиков и девочек, злокачественными новообразованиями костей и мягких тканей — 0,014 и
0,013 %.
Расхождения между официальными и фактическими данными значительно затрудняют практическую и научную деятельность в детской онкологии. Первая причина недоучета состоит
в том, что врачи общей лечебной сети не оформляют документы
на ребенка о выявлении онкологического заболевания; вторая —
часть детей направляют в другие города, а по месту жительства
сведения о диагнозе не сообщают; третья — составляются извещения, где выставляется как основной диагноз непосредственная причина смерти (воспаление легких, отек мозга и т. д.),
а не основное заболевание — злокачественная опухоль; четвертая — несовершенство контроля и способов передачи статистической информации.
Эпидемиологические исследования в детской онкологии
фактически не проводятся, вернее за эпидемиологию в детской
онкологии ошибочно принимают другие параметры, например
связь злокачественных опухолей с врожденными пороками.
Вместе с тем настоящие исследования в этой области могли
бы дать очень многое, учитывая более краткий латентный пе¬
152
риод развития опухолей у детей, зависимость от течения беременности и связь с различными наследственными факторами.
Как было указано в главе 2, на всех первично заболевших детей заполняется "Контрольная карта диспансерного наблюдения (онко)" (форма № 030-6/у). Источником сведений для заполнения контрольных карт являются "Извещение", "Выписка
из медицинской карты стационарного больного со злокачественным новообразованием" (форма № 027-1/у), "Медицинская
карта амбулаторного больного" (форма № 025/у), "Выписка из
протокола врачебной конференции по разбору причин выявления больного с запущенной формой злокачественного новообразования" (форма № 027-2/у). На основании контрольных
карт составляется "Отчет о больных злокачественными новообразованиями" (форма № 35). Одним из источников получения
информации является "Врачебное свидетельство о смерти", которое необходимо сверять с органами записи актов гражданского состояния (ЗАГС).
К сожалению (это в большей степени связано с тем, что онкологическая служба помощи детям только создается), многие
общие педиатрические и специализированные стационары не
оформляют и не направляют документацию для первичной регистрации больных детей в онкологических диспансерах, а
также информацию о состоянии здоровья ребенка на конец
года.
Важность правильного методологического подхода к учету и
регистрации детей с впервые установленным диагнозом злокачественной опухоли доказана опытом организации детской онкологической службы в Москве. Так, до 1970 г., когда учет детей с опухолями осуществлялся городским диспансером на основе получаемой документации из различных детских
стационаров и поликлиник, показатель заболеваемости составлял невероятно низкую цифру (несопоставимую с зарубежными данными) — 6,0—8,0 на 100 000 детского населения.
В 1971—1976 гг. резко активизировалась работа по созданию
в Москве детской онкологической службы, но отсутствовала
сверка документов, получаемых онкологическим диспансером
по первичному выявлению больных злокачественными заболеваниями детей и истинного их числа в больницах и учреждениях
города (нейрохирургических, офтальмологических, гематологических и других). Показатель заболеваемости злокачественными новообразованиями вырос до 8,0—10,0 на 100 000 детского населения.
С 1976 г. на базе НИИ детской онкологии и гематологии
РОНЦ РАМН работает городской консультативный кабинет
Онкологического клинического диспансера Москвы, врачами которого, кроме диагностики и лечения, осуществляются контроль
за регистрацией вновь выявленных онкологических заболеваний
у детей и пополнение детского ракового регистра.
153
В результате организации онкологической педиатрической
службы в Москве и правильного учета выяснены показатели заболеваемости, более приближенные к истинным, в среднем
12,0—14,5 на 100 000 детского населения.
В последние годы (с 1994 г.) в Москве организована сеть детских онкологических кабинетов в административных округах,
что приблизило специализированную службу к общепедиатрической. Таким образом, достигаются возможность получения консультации у детского онколога в любых сомнительных случаях,
осуществление амбулаторного лечения и паллиативной помощи на дому, диспансеризация и организация реабилитации после окончания лечения.
Важнейшим критерием организации онкологической помощи
является показатель морфологического подтверждения диагноза.
К сожалению, явно недостаточно число патоморфологов, специализирующихся в области детской онкологии, поэтому столь
высок процент неправильно установленных диагнозов (до 15).
Морфологическое подтверждение диагноза у детей сравнительно высокое (83,3 %), что объясняется большим удельным
весом гемобластозов в структуре заболеваемости. С этим же
связан и большой процент (52,2) заболеваний с неустановленной стадией. Ранние стадии заболевания у детей отмечаются реже, чем у взрослых (21,4 против 35,2 %), что во многом определяется и малой эффективностью профилактических осмотров
в детских коллективах (0,9 % против 8,4 % среди взрослых).
На 100 вновь выявленных заболеваний приходится 9—10 запущенных. Летальность до года с момента установления диагноза в 2,7 раза превышает эти цифры, что связано не только с
агрессивным течением некоторых форм заболеваний у детей, но
и с ошибочной оценкой степени распространенности процесса.
В среднем по России в 1999 г. у 76,6 % детей диагноз выявлен в далеко зашедших стадиях заболевания. На I—II стадии болезни диагноз был установлен лишь у 23,4 % детей.
Пик смертности детей от злокачественных новообразований
приходится на возрастную группу 0—4 года в основном за счет
опухолей губы, полости рта и глотки и гемобластозов. Максимальная смертность наблюдается в 5—9 лет от рака желудочно-
кишечного тракта и органов дыхания.
Величина доли умерших до года детей с момента установления диагноза во многом определяется качеством лечения и зависит от численности в этой группе заболеваний с высокой летальностью. Поэтому оба показателя не отражают реальной запущенности, сопоставимой с данными по взрослым больным,
что характеризует сложности онкологической помощи детям.
Внедрение в детскую онкологию достижений диагностики и
лечения, накопление опыта позволили значительно улучшить
результаты лечения. Все больше детей становятся практически
здоровыми, и поэтому больший контингент детей должен на-
154
холиться под диспансерным наблюдением. Сроки активного
наблюдения, комплексного контрольного обследования и проведение (при необходимости) противорецидивного лечения зависят от характера и течения опухолевого процесса.
В детском возрасте при солидных опухолях специальная терапия продолжается обычно 2 года, при злокачественных лимфомах — 3 года, при лейкозах — 5 лет. Эти сроки условны и могут меняться в связи с изменениями схем лечения. В эти периоды больного осматривают через 1,5—2 мес. В последующем
периодичность обследования увеличивается до 3—6—12 мес.
Формально диспансерное наблюдение за больным со злокачественной опухолью ведется до 15-летнего возраста, однако при
рецидивировании опухолевого процесса нередко возникает вопрос о продолжении лечения в детском отделении и в старшем
возрасте. В последние годы ставится вопрос о включении в контингент пациентов детской онкологии подростков, юношей и
девушек до 18—21 года.
Сравнительно небольшая абсолютная заболеваемость детей
со злокачественными новообразованиями является объективной причиной для создания самостоятельных, далеко отстоящих одно от другого детских онкологических отделений на 50—
60 коек. При этом учитывается, что больных детей должны госпитализировать в отделение неоднократно для контрольного
обследования и проведения необходимого лечения.
В последние годы создаются отделения для реабилитации
детей после лечения по поводу злокачественных опухолей.
Реабилитационные мероприятия у детей с опухолями с успехом могут проводиться и в общих реабилитационных учреждениях.
Внедрение современных технологий диагностики и лечения
онкологической патологии детского возраста в странах СНГ
совпало по времени с дезинтеграцией Советского Союза, что
является свидетельством несоответствия существовавшей системы в обеспечении современной помощи этому контингенту
больных.
К настоящему времени накоплен определенный положительный опыт внедрения современных американских и европейских программ во многие клиники для лечения большинства солидных злокачественных опухолей (нефробластома, нейробластома, рабдомиосаркома, саркома Юинга и др.), а также
злокачественных заболеваний крови и лимфоидной ткани (острых не-В-лимфобластных лейкозов, неходжкинских лимфом,
болезни Ходжкина и др.). Однако их диагностика и лечение
весьма далеки от желаемого и усложнены постоянным финансовым дефицитом, влекущим за собой отсутствие адекватного
количества современных фармакологических средств, медицинского оборудования и обученного персонала. Это в свою
очередь делает невозможным реализацию и строгое соблюдение
155
протоколов лечения, тормозя продвижение современных высокоэффективных технологий.
Практически каждый, кто проводит работу по налаживанию
современного программного лечения, сталкивается со следующими проблемами: организацией адекватной ранней диагностики, приобретением опыта в проведении агрессивной полихимиотерапии с профилактикой и лечением осложнений, оптимальным использованием хирургического и радиационного
методов в комплексном лечении, профилактикой внутрибольничных инфекций (гепатитов В и С), герпетической и грибковых инфекций, созданием условий наблюдения за больными в
процессе проведения поддерживающего лечения и после его завершения, реабилитацией ранней (в процессе лечения) и отдаленной (по окончанию лечения), психологической помощью
больным и их семьям.
Решение этих проблем ложится на детских онкологов, что
заставляет увеличивать рамки их компетенции, превращая их
во врачей с энциклопедическим объемом знаний, а также в
психологов и социальных работников.
Внедрение современных технологий диагностики и лечения
онкологически больных детей произвело революцию в мировой
медицинской практике и вывело значительную часть этих болезней из категории фатальных. Смертность детей от лейкозов
снизилась до 25 %, от солидных опухолей — в среднем до 35 %,
от других гемобластозов — до 40 %. Однако достижение таких результатов возможно только при применении всего комплекса диагностических и лечебных мероприятий, стоимость которых
очень велика. Она включает стоимость применяемых в высоких
дозах дорогих противоопухолевых химиопрепаратов (почти исключительно зарубежного производства), противомикробных,
противовирусных средств и противогрибковых антибиотиков последнего поколения, компонентов крови и иммуноглобулинов.
В качестве примера можно привести следующие цифры: лечение одного ребенка с онкологическим заболеванием стоит
около 10 тыс. долларов США; на одну пересадку костного мозга
необходимо истратить не менее 50 тыс. долларов США (суммы
указаны без учета оплаты труда медицинского персонала).
За последние 5 лет в ведущих федеральных детских онкологических центрах при участии зарубежных клиник и международных благотворительных организаций удалось подготовить
квалифицированных специалистов, способных осуществлять
современное высокоэффективное лечение этих больных в полном объеме на всех его этапах (диагностика, лечение, реабилитация). Препятствием этому являются отсутствие разработанной
системы оказания помощи детям с онкологическими заболеваниями; низкое финансирование из федерального и регионального бюджета, не обеспечивающее современного уровня лечения. Не до конца решены вопросы систематической подготов¬
156
ки и переподготовки врачей, медицинских сестер и лаборантов,
работающих по современным технологиям в центрах (отделениях) детской онкологии, их информационного обеспечения;
отставание научно-практических разработок от аналогичных
исследований западных стран; отсутствие достоверных статистических данных о заболеваемости, результативности терапии
и смертности для этого контингента детей и подростков.
Актуальность поднятых проблем требует скорейшего принятия комплекса государственных мер, утверждения их как Федеральной целевой программы "Онкология" и ее раздела "Детская онкология".
Реализация программы должна стать итогом завершения организационного этапа в создании службы детской и подростковой онкологии. Цель программы в государственном целевом
финансировании системы специализированной медицинской
помощи и обеспечении всех ее звеньев современными технологиями диагностики и лечения для снижения смертности, ин-
валидизации и повышения качества жизни детей и подростков,
больных онкологическими заболеваниями.
Задачи этой программы в целом были обсуждены и сформулированы в резолюциях Всероссийского рабочего совещания
детских онкологов (Москва, ноябрь, 1995 г.), Всероссийского
съезда онкологов (Ростов-на-Дону, октябрь, 1995 г.), I Всероссийского съезда детских онкологов и гематологов (Москва,
1997 г.).
К ним относятся:
• обеспечение федерального финансирования (с определением долевого участия регионов) современных технологий
диагностики, лечения и реабилитации детей и подростков
с гематологическими и онкологическими заболеваниями;
• организация регистра детей и подростков с гематологическими и онкологическими заболеваниями;
• разработка и внедрение стандартизированных кооперированных протоколов диагностики, лечения и реабилитации распространенных болезней крови и онкологических
заболеваний у детей и подростков;
• улучшение системы подготовки медицинских кадров, работающих в области онкологии детей и подростков, повышение их квалификации;
• научное обеспечение предлагаемых программ медицинской помощи детям и подросткам с онкологическими заболеваниями;
• информационное обеспечение медицинских работников
и населения по вопросам эффективного лечения и прогноза лейкоза, рака и других злокачественных заболеваний у детей и подростков.
157
На первый взгляд, проблема диагностики в детской онкологии решена. Современные методы исследования, включая ультразвуковую, компьютерную и магнитно-резонансную диагностику, лабораторные, иммунологические тесты (например, реакцию на альфа-фетопротеин, исследования катехоламинов и
др.), позволяют диагностировать опухоль у ребенка.
Добиться таких результатов дает возможность комплексное
использование клинического, морфологического, эндоскопического, лабораторных и лучевых методов, включающих традиционное рентгенологическое исследование.
Однако, к сожалению, не менее чем 50 % (а в некоторых регионах 75 %) детей поступают на лечение, имея далеко зашедшие стадии опухолевого процесса. Связано это с пониженной
онкологической настороженностью по отношению к ребенку, а
иногда и полным ее отсутствием. По данным исследователей из
НИИ онкологии им. Н. Н. Петрова (Санкт-Петербург), лишь к
одному из 20 педиатров в течение года обращается ребенок со
злокачественной опухолью.
По нашим данным, в среднем рядовой педиатр за свою врачебную деятельность встречает не более 9 детей с онкологическим заболеванием.
При анализе позднего поступления детей со злокачественными опухолями выясняется, что в этом в основном виноваты
врачи (65 %), значительно реже — родители (17 %) и лишь в
18 % случаев имеют место объективные трудности диагностики,
причем в специализированном учреждении они разрешимы.
Проблема своевременной диагностики опухолей у детей во
многом связана с решением задачи повышения знаний врачей
общей лечебной, педиатрической сети в области детской онкологии.
Достижением детской онкологии являются результаты лечения. В среднем, учитывая все стадии опухолевого процесса, в
том числе и далеко зашедшие, 5-летняя выживаемость (т. е.
практическое выздоровление) при лимфобластном лейкозе составляет 65 %, при лимфогранулематозе — 75 %, при лимфо-
саркоме — 50 %, при нефробластоме — 60 %, при остеогенной
саркоме — 45 % случаев.
Основными методами лечения детей являются лекарственный (41 %), хирургический (22 %), комбинированный и комплексный (18 %).
При своевременном начале лечения, т. е. в I—II стадии, результаты лечения значительно улучшаются: при лимфобластном лейкозе до 80 %, при лимфогранулематозе до 95 %, при
лимфосаркоме до 65 % и выше, при нефробластоме до 90 %,
при ретинобластоме до 100 %.
Конечно, такие данные достигнуты лишь в высокоспециализированных детских онкологических отделениях, но они показывают современные возможности детской онкологии.
158
Революцию в детской онкологии произвела химиотерапия.
И меется ряд важных особенностей терапии у детей в отличие от
лечения взрослых с онкологической патологией. Прежде всего
>то тенденция к росту и развитию детского организма, которая
должна определять тактику и стратегию лечения.
Химиопрепараты, как и лучевая терапия, воздействуют на
нуклеиновые кислоты клеток опухоли. Но плохо то, что оба метода имеют одну точку приложения — хромосомальный аппарат
клетки, в результате чего страдают и нуклеиновые кислоты здоровых клеток. С этим связывают и отсроченную малигнизацию.
Гак, отмечается, что при лимфогранулематозе риск появления
лейкоза увеличивается при сочетании лучевой и лекарственной
терапии, хотя достоверно это не доказано. Однако выявлено,
что у детей, перенесших агрессивное комплексное лечение,
многие неонкологические попутные заболевания протекают в
крайне тяжелой форме.
Детский и подростковый организм — растущий, и это всегда
необходимо учитывать, и в первую очередь — при назначении
лучевой терапии, тем более что она является важнейшим компонентом комплексного лечения опухолей у детей и используется почти в 70 % случаев. Ионизирующее излучение наиболее
часто применяется у детей с опухолями центральной нервной
системы, гемобластозами, саркомами мягких тканей и костей,
нейро- и нефробластомами. Так, например, при использовании
пред- или послеоперационного облучения детей с нефробла-
стомой III стадии местные рецидивы встречаются в 2 раза реже,
чем без него. Кроме того, после предоперационного лучевого
воздействия частота разрыва опухоли во время операции снижается до 4 % (без облучения она достигает 33 %). У детей с
острым лейкозом, которым проведено облучение головного
мозга, развитие нейролейкоза наблюдается редко (4 %) в отличие от больных, получивших только лекарственную терапию
(25 %). При неходжкинских лимфомах, протекающих с поражением медиастинальных лимфатических узлов, число длительно живущих и выздоровевших детей значительно выше в
гой группе, в которой, кроме лекарственного лечения, проводили еще и облучение средостения (соответственно 66 и 18 %).
Вместе с тем при использовании лучевой терапии в детском
возрасте возникают значительные проблемы, обусловленные
радиопоражаемостью здоровых растущих тканей и органов ребенка. Лучевое воздействие может повреждать эпифизы костей,
что в дальнейшем приводит к замедлению, а в ряде случаев и к
остановке роста. При облучении брюшной полости могут быть
затронуты гонады, что в дальнейшем не исключает нарушения
полового развития. Возможно повреждение внутренних органов и эндокринной системы, что приводит к гипотиреоидизму,
нарушению функций почек, пульмонитам и другим осложнениям.
159
Но всего этого можно избежать при правильном и адекватном проведении лучевой терапии.
В связи с этим особое значение приобретает поиск возможностей повышения селективности действия радиации, т. е. преимущественного разрушения опухоли без повреждения нормальных тканей и органов ребенка.
Необходимо обращать особое внимание на соотношение общей интегральной дозы и поглощенной очаговой дозы. Процент облучаемой поверхности и объема туловища ребенка в
возрасте от 2 до 5 лет может достигать соответственно 24 и 48,
в то время как у взрослых не более 7.
Для проведения лучевой терапии должны использоваться
только аппараты, генерирующие высокоэнергетические излучения (линейные ускорители). К сожалению, в большинстве
вновь открытых детских онкологических и гематологических
отделений их нет, что недопустимо, как и то, что очень мало
специально подготовленных терапевтов-педиатров, проводящих лучевую терапию.
Следует подчеркнуть, что при топометрическом планировании необходимо точное клиническое и инструментальное обоснование объема тканей, подлежащих облучению. Использование для предлучевой подготовки стимуляторов, компьютерной
и/или ультразвуковой томографии позволяет уменьшить ошибку в выборе облучаемой мишени и в величине дозы на 20—30 %.
В последние годы в терапию опухолей у детей введена и
трансплантация костного мозга. Она позволяет излечивать детей, которых без этого вида терапии спасти было невозможно.
Это относится в первую очередь к лейкозам и лимфосаркомам,
а также к IV стадии нефробластомы, нейробластомы, саркомы
Юинга и некоторым другим опухолям. Трансплантация костного мозга позволяет провести наиболее агрессивное лекарственное лечение.
Однако усиление агрессивности комбинированного и комплексного лечения, применяемого в детской онкологии, ставит
новые проблемы, прежде всего это различной степени отдаленные последствия комплексного лечения. Серьезные последствия, такие как возникновение вторых опухолей, генетические
нарушения, кардиологические осложнения, пульмониты, наблюдаются почти у 14 % излеченных пациентов.
Побочные эффекты и осложнения во многом связаны с по-
лихимиотерапевтическим лекарственным лечением. Возможные ранние и отдаленные осложнения химиотерапии в основном сводятся к следующим состояниям: угнетению гемопоэза
(вплоть до панцитопении); алопеции; тошноте, рвоте, потере
аппетита (встречается у 50 % детей); мукозитам, диарее, кардиотоксичности (10 %). Имеется ряд других осложнений, зависящих от применяемого препарата (аллергические реакции,
панкреатиты, стоматиты и др.).
160
В детской клинике особенно важно точное ведение дозового
и курсового режима, который должен варьировать не только в
связи с возрастом ребенка. При этом особое внимание приходится уделять учету взаимного влияния при сочетаниях различных методов лечения.
Появление в последние годы большого количества излеченных больных вызвало к жизни еще одну проблему детской онкологии — психосоциальную реабилитацию. В той или иной степени реакции детей со злокачественными опухолями изменены.
Это провоцируется как наличием опухолевого процесса, вызывающего ряд неприятных ощущений (в том числе и боль), так и
отношением окружающих, которое улавливается чутким и настороженным восприятием больного ребенка. В некоторых случаях
наличие видимых внешних (алопеция, деформация лица и конечностей, ампутации и др.) или внутренних (расстройства со
стороны желудочно-кишечного тракта, боль в животе, тошнота и
др.) признаков опухолевого заболевания или последствий его лечения могут приводить к угнетенному состоянию, депрессии, а в
дальнейшем обусловить и психические отклонения.
Врачи, работающие в области детской онкологии, должны
обладать знаниями и навыками хорошего психотерапевта. Ибо
только при правильно построенных отношениях между больным ребенком, его родителями и врачом возможно достижение
хороших результатов. Это особенно необходимо потому, что лечение длительное, нередко растягивается на годы и часто приходится на самый ранимый детский возраст.
Реабилитация в детской онкологии должна начинаться при
первой встрече врача с ребенком и его родителями. Быть рядом
с ними, помочь преодолеть трудности, войти в окружающую
действительность — главные задачи детского онколога. Для
этого созданы реабилитационные отделения.
Глава 6 I ДЕОНТОЛОГИЯ И РЕАБИЛИТАЦИЯ
Вопросы врачебной деонтологии, сущность которой вытекает
из сложной психологической ситуации, которая создается для
врача, для больного злокачественным заболеванием, родителей
и родственников заболевшего ребенка, занимают особое место
в детской онкологической практике. В основе успешного решения данной проблемы ведущая роль принадлежит педиатру-
онкологу, его личности, профессиональной осведомленности
как в области онкологии, так и, безусловно, педиатрии в целом.
Высокая преданность и верность своему делу, чувство долга, не
утрачивающегося за годы работы с онкологическими больными, — те необходимые качества, которые способствуют практической реализации основных принципов врачебной этики.
Врач и больной ребенок, с одной стороны, и то непомерное
горе, внезапно постигающее родителей, теряющих любимого,
иногда единственного ребенка, — с другой. Врач должен понимать всю драматичность возникшей ситуации, в которой поведение ребенка, принимающего по-детски все — и хорошее, и
плохое, его переживания, исходящие не только из внешних воздействий, но и обусловленные в какой-то мере внутренними
изменениями, которые вызываются течением злокачественного
процесса.
Улыбка ребенка, больного онкологическим заболеванием, —
это не только свидетельство приближающегося улучшения в состоянии, но и бессловесное выражение взаимного контакта, который установился между маленьким пациентом и лечащим
врачом. И в том, как быстро будет налажен такой контакт, решающее значение принадлежит врачу.
Особенно тягостными для ребенка любого возраста являются
первые дни пребывания в стационаре. Сознание того, что ребенок болен чем-то серьезным (особенно у детей школьного возраста), страх перед предстоящими обследованиями, значительно
усиливающийся при общении со своими сверстниками, длительное время находящимися в клинике и хорошо осведомленными о всех лечебных и диагностических методах (стернальная
и спинномозговая пункции, трепанобиопсия,-пункционные
биопсии, внутривенные введения и т. д.) — вот те некоторые
внешние факторы, "давящие" на психику ребенка, делающие его
замкнутым, ушедшим в свои размышления и переживания.
Кроме того, смена привычной для ребенка любого возраста
домашней обстановки на больничную, разлука с родителями и
близкими друзьями накладывают определенный отпечаток на
поведение больного ребенка. В такой ситуации нельзя ни на
минуту забывать, что ребенок — не миниатюрный взрослый, а
сложное существо, требующее к себе сугубо тонкого и предельно индивидуального подхода.
162
Ничто не вызывает негативизм к врачу, как грубый обман
(обещание выписать домой через несколько дней, не проводить
сложных и порой болезненных исследований и т. д.), безразличное отношение, приуменьшающее личность ребенка. В этом отношении с детьми раннего возраста бывает даже проще. Способность быстро переключаться, "недооценка” окружающей обстановки, заботливое и внимательное отношение окружающих
позволяют малышу быстро отвлечься (но не забыть ее!) от только что вызвавшей боль манипуляции. Безусловно, физическая
травма, нанесенная ребенку при проведении того или иного исследования или лечебной процедуры, будет тем меньше, чем выше квалификация и практическая подготовка врача.
В некоторых случаях с маленькими пациентами приходится
идти на вынужденный обман с тем, чтобы провести необходимое исследование. Но и в данной ситуации не может быть шаблона (при проведении повторных исследований), так как ребенок хорошо помнит встречавшуюся ранее обстановку в процедурном кабинете, подготовку и проведение исследования, даже
занимаемое положение врача, готовящегося к той или иной манипуляции.
Максимально щадящая тактика врача в такой ситуации, особенно если проведенная лечебная процедура принесла значительное облегчение и уменьшила страдания ребенка, позволяет
стереть ту грань страха, которая возникает у малыша при пере-
ступании порога процедурного кабинета. В практике детского
врача-онколога было немало случаев, когда дети с нейролейкозом сами просили сделать им повторные спинномозговые
пункции при усилении гипертензивного синдрома и возобновлении мучительных головных болей.
С пациентами школьного возраста, подростками врачебная
тактика существенно меняется. Ребенок школьного возраста,
поступивший в клинику, "загруженный" своими мыслями и переживаниями, сразу же получает поток информации от своих
сверстников, испытавших на себе все "тяготы" процедурного
кабинета. Порой врач не располагает достаточным временем
для постепенной психологической подготовки школьника к
предстоящему исследованию. Необходимость максимально быстрой постановки диагноза, решение экстренных вопросов терапевтической тактики не позволяют откладывать проведение
необходимых исследований на несколько дней. В такой ситуации умелое, успокаивающее и обнадеживающее слово, насыщенное логическим содержанием о необходимости проведения
той или иной процедуры, является решающим в преодолении
страха. Принцип "влияния личности" врача является очень важным в налаживании полного контакта со старшими детьми. Если ребенок полностью доверяет врачу, то он согласится на любую процедуру с уверенностью в том, что она необходима для
скорейшего выздоровления.
163
Значительные сложности встречаются при многократном
поступлении больного ребенка в клинику. Тяжесть состояния
больного, связанная с прогрессированием основного заболевания, значительная "усталость" от проведенных ранее процедур,
сознание и еще большая боязнь (по сравнению с первичными
исследованиями) повторных исследований диктуют необходимость проведения тщательной "психологической асептики" у
таких пациентов. Личный авторитет врача у таких пациентов,
еще больше закрепляющийся при систематических беседах с
ними на самые различные темы (не касающиеся, естественно,
обсуждения болезни ребенка), углубляет то взаимное доверие,
которое создается между врачом и годами наблюдающимся
подростком. Мы были свидетелями, как лечащий врач и школьник, длительно страдавший лимфогранулематозом, играли партию в шахматы "на стернальную пункцию", необходимость проведения которой крайне тяготила ребенка. Проиграв партию,
мальчик, ни одной минуты не колеблясь, пошел в процедурный
кабинет. Безусловно, приведенный пример может, на первый
взгляд, показаться сомнительным в этическом плане (пункция
все равно была бы сделана, а в данной ситуации врач, имеющий
безусловные преимущества в практике игры, заранее знающий
исход партии, обыгрывает подростка). Тем не менее сам факт
такого взаимодоверяющего подхода во многом характеризует
глубину отношений, которые сложились между врачом и пациентом.
Слово врача, пользующегося авторитетом у ребенка, имеет
очень большое значение. Это особенно видно на клинических
обходах. Умение врача пользоваться словом, вселяющим уверенность в скорейшем выздоровлении, является наилучшим
эмоциональным стимулом для ребенка. В то же время нечаянно
высказанное сомнение в присутствии ребенка, неуверенность
интонации, растерянность могут нанести непоправимый ущерб
взаимоотношениям ребенка и лечащего врача.
Врачу, длительно работающему с онкологическими больными, не раз приходилось поражаться мужеству его маленьких пациентов. Глаз ребенка не пропускает ничего, он замечает все.
Перевод соседа по палате в изолированную комнату внешне не
отражается на ребенке. Он продолжает играть и улыбаться, но
он хорошо знает, что его товарищу стало хуже, в связи с чем его
пришлось изолировать. С какой материнской трогательностью
и заботой дети относятся к своим товарищам, которые в силу
ряда обстоятельств находятся на постельном режиме!
Детская онкологическая клиника полна трагедий, которые
могут случиться в любую минуту. Порой бывает, что трагедия
разыгрывается внезапно, на глазах многих детей. Но ни в одном
случае нам не приходилось (и не было для этого повода) объяснять подростку причину невозвратного отсутствия его товарища среди детей клиники. Такое мужество детей, как ничто
164
другое, помогает сохранять жизненный тонус, является тем стимулом к работе, который необходим врачу-онкологу.
Следующий, не менее важный раздел деонтологии — это
взаимоотношения врача и родителей больного ребенка. Любая
его болезнь является "терзанием души" для родителей, не говоря
уже об онкологическом заболевании. В связи с этим к родителям
заболевшего ребенка надо относиться особенно бережно. Нам
нередко приходилось встречаться с родителями, получившими
прямой, неутешительный ответ врачей некоторых медицинских
учреждений на вопрос об окончательном диагнозе и прогнозе болезни их ребенка. Вся драма болезни превращается для родителей в "кромешный ад”. В такой ситуации мы видим перед собой
людей, уже потерявших веру в выздоровление ребенка. К сожалению, как нередко еще бывает, постоянное чувство возможной
потери любимого ребенка, сохраняющееся порой в сознании
родителей долгие годы, наносит непоправимый вред не только
самим родителям, но и заболевшему, близким родственникам и,
конечно, врачам клиники. В данном случае необходимая для
врача активная помощь в борьбе за жизнь ребенка наталкивается на пассивное ожидание внушенной безысходности.
Независимо от уровня интеллектуального развития, степени
осведомленности в той или иной области медицинских знаний,
родителей с первых дней пребывания ребенка в клинике интересует только один вопрос: окончательный диагноз и откровенное мнение врача в отношении прогноза заболевания. Наиболее ответственной является первая встреча врача с родителями
больного ребенка. Нет надобности говорить о том, что врач заранее должен находиться в "полной готовности" к предстоящей
беседе. Такт врача, его умение правильно, в нужном направлении вести разговор с родителями, не допуская поспешных заключений (хотя окончательный диагноз врачу уже известен),
создают тот благоприятный фон, на котором основываются
взаимоотношения.
В памяти встают многие случаи гипердиагностики. Когда диагноз острого лейкоза как приговор ребенку и родителям произнесен кем-то вслух или выдано направление на госпитализацию
в специализированную онкогематологическую клинику с таким
диагнозом, полностью деморализующим родителей, сложность
первой встречи с родителями особенно остро ощутима. Нам известны многочисленные случаи, когда диагноз острого лейкоза
был поставлен ошибочно. В такой ситуации только полное выздоровление ребенка (инфекционный мононуклеоз, лейкемоид-
ные реакции и т. д.) может быть той частицей компенсации
всего пережитого родителями за дни (кажущиеся годами), необходимые для выяснения окончательного диагноза. И если после состоявшейся первой встречи врача с родителями один из основных принципов гуманности — надежда на лучшее — будет соблюден, в этом несомненная заслуга врача.
165
Последующие встречи также не менее сложны, так как они
затрагивают вопросы предстоящих методов исследования и лечения. Термины "стернальная пункция”, "люмбальная пункция",
"пункционная биопсия" и т. д. ассоциируются у многих родителей с вмешательствами, наносящими еще больший вред и так
тяжелобольному ребенку. Терпеливое разъяснение необходимости проведения данных исследований (без которых, естественно, не может обойтись современная онкологическая клиника)
всегда дает положительный результат.
Вопросы прогноза заболевания, как правило, все чаще обсуждаются уже в процессе проводимого лечения. В этом отношении время оказывает значительную помощь врачу. В процессе
проведения современной полихимиотерапии при острых лейкозах в большинстве случаев отмечается довольно быстрый положительный клинический эффект, хотя гематологические показатели продолжают отражать остроту лейкемического процесса. Объяснение родителям в доступной форме этих
положений позволяет им надеяться, что проводимая терапия
является эффективной, а прогноз заболевания — благоприятным. Значительным подкреплением появившейся у родителей
надежды на благоприятный ближайший исход заболевания также служат клинические примеры из опыта лечения больных с
подобным заболеванием. Ссылка на возможное появление новых, еще более эффективных противоопухолевых препаратов,
усовершенствование тактики лечения, успехи, достигнутые за
последние годы в лечении таких больных, позволяют добиться
осознания родителями необходимости набраться терпения и
продолжать активную борьбу за жизнь ребенка.
Несмотря на видимые успехи в лечении, у родителей нередко остаются сомнения в правильности постановки диагноза и
проводимой терапии. Они предпринимают попытки организовать повторные консультации, консилиумы, разборы и т. д. Задача врача высокой квалификации, тонко понимающего специфику своей профессии, а значит, лишенного самолюбивых
предубеждений, — всецело содействовать этому вполне объяснимому желанию родителей. Такие консилиумы способствуют
еще большему повышению авторитета лечащего врача.
Период выписки ребенка домой является очень ответственным в онкологической клинике. Ведь по существу почти такая
же активная терапия должна продолжаться и в домашних условиях, где роль лечащего врача во многом ложится на плечи родителей. Если в такой ситуации в каждом из родителей врач видит частицу себя, то значит он с полной уверенностью может
рассчитывать на строгое соблюдение всех рекомендаций по
дальнейшей терапии.
Период пребывания ребенка в клинике (а он бывает достаточно продолжительным), невольно способствует тому, что
среди родителей также устанавливаются определенные взаим-
166
иые контакты. Если в самом начале они касаются обсуждения
состояния детей, лечения, проводимых дополнительных исследований, то в последующем круг вопросов, обсуждаемых ими,
значительно расширяется. Такая связь сохраняется и после выписки детей из стационара и поддерживается письмами, телефонными разговорами и личными встречами. Все то, что кто-
нибудь из родителей узнает о "новом" лечении (от родственников и знакомых, из научно-популярной литературы, передач по
радио и телевидению и т. д.), очень быстро становится общим
достоянием. При этом невольно возникают мысли о том, правильно ли лечили их ребенка, достаточно ли современными методами, а почему к их ребенку была применена данная схема
лечения, а не другая и т. д. Весь этот поток вопросов обрушивается на врача на первом же амбулаторном приеме, в первом
письме или телефонном разговоре. Несомненно, каждый заданный вопрос требует исчерпывающего ответа. Однако, на
наш взгляд, нет ничего более убедительного, чем наглядный
пример. В этом отношении огромное значение имеет правильный подбор больных, приглашенных на контрольный осмотр в
поликлинику. Родители недавно выписавшегося ребенка непременно должны попасть на прием вместе с "долгожителем".
Эмоциональный психологический заряд, полученный на таком
приеме, послужит наглядной иллюстрацией современных возможностей в области лечения, а также критическому пересмотру возникших сомнений.
К сожалению, тесная взаимосвязь между родителями имеет
и отрицательные стороны. Часто бывает, что родители раньше
врачей узнают о трагическом исходе заболевания. Однако правильно построенная работа с родителями способствует тому,
что это крайне тяжелое известие воспринимается ими чаще вне
связи с их собственным ребенком. Вера в то, что именно их ребенок попадет в число выздоравливающих, и, кроме того, уверенность в том, что в лечении этих заболеваний произойдет
дальнейший прогресс, является защитным барьером, охранительным торможением в восприятии полученного известия.
Как известно, у части детей в различные сроки наступает
обострение заболевания, что вносит новые, еще большие трудности во взаимоотношения с родителями. Эти трудности обусловливаются тем, что с наступлением обострения заболевания
у родителей теряется то главное, что приобреталось с таким
большим трудом, — надежда на полное исцеление ребенка.
В этот период, как никогда, все действия врача должны подчиняться принципу гуманизма. Соблюдение этого принципа в течение всего периода болезни, каким бы продолжительным он
ни был, позволит родителям умершего ребенка осознать, что
они со своей стороны, а лечащий врач со своей, сделали все, что
в их силах в тяжелейшей борьбе за максимальное продление
жизни больного ребенка.
167
Современные методы лечения злокачественных опухолей у
детей позволяют добиться выздоровления большинства детей.
Однако это тяжелый и длительный путь, даже при применении
самых современных программ лечения, где базисным методом
является использование комбинаций химиотерапевтических
препаратов. Реальное достижение конечной цели — полного
излечения ребенка от онкологических заболеваний — во многом обусловлено прочностью и надежностью связей своеобразного треугольника, вершиной которого является больной ребенок, а его углами — высококвалифицированный врач — детский онколог, с одной стороны, и родители и родственники
ребенка — с другой.
Реабилитация детей в онкологии также имеет свои особенности. Они обусловлены тем, что восстановительное лечение
направлено на пациента, который еще не занимается профессиональной деятельностью, не несет материальной ответственности, не сформирован до конца как личность. Ребенок и
подросток — это развивающийся, растущий организм с не-
сформированными анатомическими и физиологическими функциями.
В психологическом плане пациент не имеет жизненного
опыта; мировоззрение его еще не устоялось, так же как и отношение к окружающему; психика крайне ранима. В наш век
акселерации вступают в противоречие достаточно рано развивающиеся анатомические и физиологические функции, хотя
далеко не зрелые, с еще менее зрелой психикой. Ребенок во
многом зависит от окружающих, прежде всего от родителей.
Все это должно учитываться при проведении реабилитационных мероприятий.
Дети с большой степенью переживания относятся к своему
внешнему виду и внутреннему состоянию. Наличие видимых и
значительных внутренних повреждений может явиться причиной психических расстройств и даже серьезных психических заболеваний.
Реабилитация тесно сплетается с деонтологией. Хорошие
взаимоотношения врача, больного ребенка, его родителей создают лучшие условия для реабилитации. Весь опыт детских онкологов учит, что достижение хороших результатов лечения зависит не только от терапевтических мероприятий, но и от взаимоотношений ребенка с врачом, умения последнего внушить
надежду ребенку и его родителям.
Принципы реабилитации применительно к ребенку, страдающему злокачественной опухолью, можно сформулировать
следующим образом.
1. Начинать реабилитацию следует при постановке диагноза,
ибо психическое воздействие врача должно быть эффективно
уже при первых встречах с ребенком и его родителями.
168
2. Проводить реабилитационные мероприятия необходимо
постоянно, обеспечивая их непрерывность и в тех случаях, когда ребенок находится вне больничного учреждения.
3. Реабилитация должна быть комплексной и направленной
как на восстановление анатомических и физиологических
функций, так и на психику ребенка и его родителей. С этой целью для работы должны быть привлечены специалисты различного профиля (психологи, методисты лечебной физкультуры,
педагоги, воспитатели и др.).
4. Важно обеспечить сочетание индивидуального и коллективного в системе реабилитационных мероприятий. При этом
доля того или иного компонента зависит от личности больного
ребенка (и его родителей).
5. Возвращение в коллектив больного ребенка должно быть
подготовлено. Педагоги должны быть осведомлены о болезни
ребенка и снабжены рекомендациями по обращению с ним.
В любом случае нельзя выделять в коллективе ребенка с опухолью, подчеркивая его особое положение среди здоровых детей. Обязанности педагога и воспитателя — максимально обеспечить нормальное отношение к нему со стороны окружающих.
Реабилитация в детской онкологии должна быть рассчитана
на значительно больший срок. В отличие от взрослых у ребенка
впереди большая жизнь, в которой он должен приобрести профессию, обзавестись семьей, воспитать детей, т. е. быть полноценным человеком. Задача врача и цель проводимых им реабилитационных мероприятий — вывести ребенка в полнокровную
жизнь, убрав как можно больше препятствий на его трудном и
долгом пути.
В процессе лечения врач должен выбрать наиболее рациональные методы, которые при прочих равных условиях могут
дать минимальные осложнения и побочные эффекты. Изучение
программ лечения злокачественных опухолей у детей в настоящее время направлено на поиски таких методов. Следует указывать, что многие калечащие операции, которые проводятся у
взрослых, в детском возрасте в ряде случаев не являются необходимыми в связи с высокой чувствительностью большинства
новообразований у детей к лучевой и лекарственной терапии.
Психическая реабилитация, как мы уже указывали, взаимосвязана с деонтологией и начинается с момента установления
диагноза злокачественной опухоли. Уже в этот период ребенок
(речь, конечно, идет о детях школьного возраста) должен быть
готов ко многим испытаниям, но в то же время верить в свое
выздоровление. Задача врача существенно облегчается тем, что
ребенок и подросток более внушаемы и оптимистичны, чем
взрослые. Однако следует учитывать, что дети обладают меньшей волей, жизненным опытом, чем взрослые, и за них приходится решать многие вопросы. Дети не должны ощущать даже
малейшей неполноценности. Необходимо вселить в них уве¬
169
ренность в том, что они ничем не отличаются от сверстников
и могут прожить жизнь так же, как и их товарищи. Кстати, опыт
детских онкологов учит тому, что правильная ориентация ребенка и подростка позволяют ему не обращать внимания на некоторые анатомические и физиологические утраты.
Ни в коем случае нельзя выделять больного ребенка в семье,
где имеются другие дети; внимание семьи должно быть равным
для всех — больных и здоровых. В этом состоит искусство воспитателя, родителя и врача.
Выписывая ребенка из стационара, врач должен провести
беседу с родителями, а лучше и с педагогами школы или детского сада, чтобы при наличии определенных дефектов, вызванных болезнью и лечением (ампутация, энуклеация, алопеция
и т. д.), педагоги нашли наиболее разумную манеру поведения и
обращения со школьником или ребенком младшего возраста.
"Незаметность" этого отношения и есть наиболее ощутимая помощь ребенку. Поведением окружающих должна руководить не
жалость, а разумная поддержка. В процессе лечения дети должны периодически прерывать учебу, посещение детского сада, отрываться от семьи и дома. В таких случаях необходимо обеспечить преподавание на дому или в больнице; это дает им дополнительные силы в борьбе за жизнь. Но и в больничном
коллективе при помощи воспитателей, педагогов, психологов и
в первую очередь врачей и медицинских сестер необходимо создать такую обстановку, чтобы ребенок как можно меньше ощущал свою оторванность от семьи, школы, товарищей.
Следует указать на важность так называемой косметической
реабилитации. Многие дети, получающие лучевое и лекарственное лечение, лысеют. Обычно они это очень тяжело переживают, особенно девочки. Необходимо убедить ребенка в том, что
это явление временное (еще лучше привести в пример детей, у
которых волосы восстановились). Во многих случаях депрессию,
которая нередко возникает у облысевших девочек старшего возраста, можно устранить временным использованием париков.
Дети весьма болезненно (иногда сильнее, чем взрослые,
вплоть до явлений дисморфизма) относятся ко всем дефектам
на лице, возникающим после различных операций по поводу
опухолей, расположенных в области головы и шеи (резекция
челюсти, энуклеация). В таких случаях необходимо как можно
раньше провести протезирование, современные методы которого позволяют получить хорошие косметические результаты.
Психическая реабилитация тесно смыкается не только с деонтологией, но и с физической реабилитацией. Необходимо
учитывать, что детский онколог имеет дело с растущим организмом, поэтому по возможности следует выбирать методы операций и оперативных доступов, учитывающие это обстоятельство.
Так, операция замещения удаленной кости эндопротезом у
детей до 10 лет затруднительна, так как интенсивный рост здо¬
170
ровой конечности приводит к значительной разнице в их длине, выраженному уродству и невозможности пользоваться эн-
допротезированной конечностью. Правда, сейчас разработан
специальный эндопротез, раздвигающийся по мере необходимости, но он еще недостаточно совершенен, поэтому эндопротезирование детям до 10 лет пока не рекомендуется. Лучше всего проводить его, когда заканчивается интенсивный рост.
Сложность протезирования детей, кроме того, усугубляется
тем, что протезы приходится менять несколько раз по мере роста пациента, однако оставлять детей без протеза нельзя, так как
он необходим не только для физической реабилитации, но в
значительной мере для психической. При этом хорошо выполненное протезирование служит благоприятным психологическим фактором и для окружающих детей. Они видят, что у товарища по палате имеется протез, которым он легко и с успехом
пользуется, и с меньшей боязнью идут на подобную операцию.
Необходимо постоянно помнить, что наиболее убедительным
для ребенка является наглядный пример.
В системе реабилитационных мероприятий важной составной частью является лечебная физкультура, которая применяется не только в случае утраты детьми конечности, но и для всех
пациентов, лечившихся по поводу злокачественной опухоли.
В специализированных клиниках детской онкологии (да и не
только в них) для этого должны быть созданы все условия. Занятия лечебной физкультурой, улучшая общее состояние ребенка, предупреждают развитие многих осложнений болезни и
лечения и исправляют последствия различных видов терапии
(сколиоз, деформация грудной клетки и т. д.). Дозированная
лечебная физкультура должна проводиться еще до начала интенсивного лечения, в послеоперационном периоде (дыхательные упражнения, массаж и другие процедуры) и являться обязательным мероприятием в течение длительного времени.
Выздоровевшие дети, достигшие репродуктивного возраста,
ставят перед врачом вопросы о возможности иметь в будущем
ребенка. В задачу реабилитации входит и эта проблема. Для
профилактики лучевой кастрации необходима не только рациональная методика облучения, но и хирургическая защита яичников (с этой целью яичники оперативным путем перемещаются и метятся танталовыми скрепками), что позволяет провести щадящее лучевое лечение.
Излеченные дети способны в дальнейшем не только к половой жизни, но и к рождению нормального потомства.
Реабилитация в детской онкологии приобретает все большее
значение в связи с увеличивающимся числом выздоровевших
детей.
Ч а с т ь II. ЧАСТНАЯ ОНКОЛОГИЯ
Глава 7 | ЛЕЙКОЗЫ У ДЕТЕЙ
Лейкозы у детей занимают ведущее место в структуре онкологических заболеваний детского возраста и составляют 30—35 % всех
злокачественных заболеваний, из которых на острый лимфобластный лейкоз (ОЛЛ) приходится 80 %, на острый миелобластный
лейкоз (ОМЛ) — 15—17 %. Доля хронического миелолейкоза
(ХМЛ) незначительна: всего 3—5 %. Частота острого лейкоза
(ОЛ) у детей до 15 лет составляет 4,1 ± 0,4 случаев на 100 000
детского населения с соотношением мальчики/девочки — 1:3.
7.1. Острый лейкоз
Острый лейкоз — это злокачественные опухоли, возникающие из кроветворных клеток и, как правило, поражающие костный мозг. При остром лейкозе субстрат опухоли представлен
незрелыми бластными клетками с нежной структурой ядерного
хроматина.
Морфологически заболевание представлено бластными клетками, которые могут быть охарактеризованы цитохимически,
иммунологическими поверхностными маркерами и с помощью
цитогенетических методов.
Согласно клоновой теории, рост лейкозной популяции происходит из одной клетки, и скорость роста зависит от доли активно пролиферирующих клеток, их генерационного времени,
числа клеток с ограниченной продолжительностью жизни, скорости потери клеток. Когда лейкозная популяция достигает определенной массы, происходит торможение дифференцировки
нормальных стволовых клеток и резко падает их нормальная
продукция. Клинические симптомы ОЛ у детей обусловлены
степенью инфильтрации костного мозга бластными клетками и
экстрамедуллярным распространением процесса.
В течении ОЛ выделяют следующие периоды: предлейкоз-
ный, острый, ремиссии, рецидив и терминальный.
Предл ейкозный период практически не диагностируется, поскольку специфические симптомы отсутствуют.
Острый периоду большинства детей имеет бурное начало и характеризуется полиморфизмом клинических симптомов, которые обусловлены процессами гиперплазии опухолевой ткани (бластная трансформация костного мозга, увеличение лимфатических узлов, паренхиматозных органов и др.) и
подавлением нормального кроветворения (анемия, гранулоци-
топения, тромбоцитопения).
Наиболее ранними являются симптомы общей интоксикации, анорексия без значительной потери массы тела, боли в
172
костях и суставах. Типичные признаки ОЛ у детей — увеличение печени, селезенки и лимфатических узлов, чаще шейных,
подмышечных и паховых. Одновременное увеличение лимфатических узлов в подчелюстной, околоушной и окологлазнич-
ной области характеризует симптомокомплекс Микулича.
Кожные покровы и видимые слизистые оболочки у большинства больных отличаются бледностью. Характерным признаком является геморрагический синдром, выражающийся
полиморфными кровоизлияниями (от петехий до кровоизлияний крупных размеров) на коже и кровотечений со слизистых
оболочек (носовые, желудочно-кишечные, почечные).
К редким проявлениям ОЛ относятся изменения на коже и
в подкожном жировом слое в виде лейкемидов, некротические
поражения кожи и слизистой оболочки ротовой полости ("гингивит", "стоматит” — от катарального до язвенно-некротического) и кишечника (энтеропатия). Развитие их связано с лейкоз-
ной инфильтрацией слизистых оболочек тканей и сосудов, наличием кровоизлияний и присоединением инфекций.
При ОЛЛ у детей возможно вовлечение в процесс центральной нервной системы (ЦНС), половых органов, глаз и легких.
Клинические симптомы поражения перечисленных органов
более характерны для рецидивов заболевания. Появление их в
начальном периоде острого лейкоза служит плохим прогностическим признаком.
Изменения в легких клинически протекают под "маской"
бронхита или мелкоочаговой "пневмонии". Рентгенологически
выявляются диффузные изменения в интерстиции легких в виде
мелкоочаговых теней.
Поражение ЦНС (нейролейкоз) характеризуется лейкозным
"менингитом", "менингоэнцефалитом" или "энцефалитом".
Общими для всех клинических форм являются общемозговые
и менингеальные симптомы: ригидность мышц затылка, симптом Кернига, реже — симптом Брудзинского, судороги клони-
ко-тонического характера. Характерны для нейролейкоза поражения черепных нервов. Наиболее часто вовлекаются в процесс
VII, XII, III, IV и VI нервы. Лейкозное поражение гипоталамической области ствола мозга протекает в виде диэнцефального
синдрома (жажда, полиурия, ожирение, гипертермия).
Вовлечение в лейкозный процесс половых органов определяется пальпаторно по увеличению и уплотнению яичек, семенных канатиков у мальчиков и яичников у девочек.
Если для ОЛЛ более характерно увеличение размеров лимфатических узлов и паренхиматозных органов, то ведущими
клиническими проявлениями острого миелобластного лейкоза
являются анемический и геморрагический синдромы.
Под ремиссией ОЛ подразумевается стадия заболевания,
когда в результате проведенного лечения отсутствуют клинические симптомы заболевания и существующими методами не
173
обнаруживаются бластные клетки в пунктате костного мозга и
других органах; при этом нормальное кроветворение поддерживается на достаточном для жизнедеятельности пациента уровне.
Для терминального периода заболевания типичны
не столько органные изменения, сколько выраженное угнетение нормального кроветворения: нарастают гранулоцитопения
со вторичными инфекционными осложнениями, тромбоцито-
пения с возможностью спонтанных кровотечений, и одновременно с возрастающей прогрессией увеличивается количество
бластных элементов костного мозга и периферической крови.
Перечисленные синдромы являются ведущими в причинах
смерти детей, больных острым лейкозом.
Рецвдив ОЛ — это новый этап развития опухоли, когда в состоянии ремиссии вновь появляются клетки опухоли как в костном мозге, так и вне его (чаще в ЦНС — нейролейкоз, в половых органах и т. д.).
Диагностика ОЛ основывается на данных цитологического
исследования клеток периферической крови и костного мозга.
Основными являются значительное увеличение бластных клеток в костномозговом пунктате и появление их в анализах периферической крови. Для подтверждения диагноза ОЛ необходимо проведение комплексного обследования, главным в котором является морфологический метод.
В анализах периферической крови обычно наблюдается снижение гемоглобина, количества эритроцитов, тромбоцитов.
В зависимости от лейкоцитоза различают случаи с нормальным, сниженным (10 • Ю^л и менее) и повышенным (20 • 109/л
и более, вплоть до 1 • 109/л) количеством лейкоцитов. Повышенное количество лейкоцитов (>10 • 109/л) определяется приблизительно у 1/2 больных, а >50 • 109/л — у 1/5 пациентов. Абсолютным показателем заболевания является появление бластных клеток, количество которых может варьировать (от 1—2 до
90 % и более). Однако могут быть случаи с отсутствием бластных клеток в периферической крови.
В костномозговом пунктате, который производят из подвздошной кости или грудины, а у детей раннего возраста (до
1 года) из пяточной кости, количество бластных клеток может
колебаться в пределах 50—100 %, имеется нарушение нормальных клеточных соотношений, а также уменьшение или отсутствие мегакариоцитов.
Диагноз острого лейкоза может быть установлен при минимальном количестве бластов — 25 %. Однако возможны варианты с малопроцентным содержанием патологических клеток
(20—30 %). Если в этих случаях диагноз вызывает сомнения, то
необходимы трепанобиопсия и гистологическое исследование
костного мозга. Более тонкая идентификация бластов проводится на основании иммунофенотипирования и цитогенетического исследования.
174
Пункция лимфатических узлов при их увеличении, а также
пункция опухолевых образований, если они имеются, является
обязательной для получения цитологического подтверждения
диагноза заболевания.
При рентгенологическом исследовании костной системы часто
выявляется остеопороз в трубчатых костях и позвоночнике. При
остром лейкозе у детей изменения в скелете могут быть в вице
поперечных полос разряжения в метафизах, деструктивно-очаговых поражений, общего диффузного разрежения костной
структуры и периостозов, системной бревиспондилии. Кроме
того, при рентгенологическом исследовании грудной клетки может быть выявлено расширение средостения за счет увеличенных внутригрудных лимфатических узлов, когда следует проводить дифференциальный диагноз с неходжкинской лимфомой.
Спинномозговая пункция позволяет диагностировать поражение нервной системы даже при отсутствии клинической симптоматики. При увеличении количества клеточных элементов
следует думать о нейролейкозе; чаще всего при этом увеличивается и уровень белка. Однако возможны случаи, когда клинически имеются неврологические симптомы, а в спинномозговой жидкости нет изменений цитоза. При этом следует обращать внимание на увеличение количества белка. С помощью
новых методов стало возможным обнаружение в цереброспинальной жидкости даже минимального числа лимфобластов.
С целью диагностики поражения нервной системы проводят
также рентгеновскую компьютерную томографию (КТ), электроэнцефалографию (ЭЭГ), эхоэнцефалографию, МРТ.
Другие лабораторные исследования могут регистрировать
последствия инфильтрации различных органов лейкозными
клетками и продукты их разрушения. Повышение уровня мочевой кислоты может быть результатом нарушения пуринового
обмена при диагностике заболевания или в начальной стадии
химиотерапии. Гиперурикемия может привести к почечной недостаточности. Одновременно может наблюдаться повышение
в сыворотке крови уровня электролитов (кальция, калия, фосфора), ЛДГ, особенно у больных с высоким лейкоцитозом в периферической крови, а также выраженной лимфаденопатией и
гепатоспленомегалией.
В 1976 г. франко-американо-британская (FAB) группа сотрудничества предприняла попытку уточнить морфологическую классификацию острого лейкоза и предложила критерии
для выделения типов опухолевых клеток на основании цито-
морфологических и цитохимических исследований. Исходя из
современных представлений о кроветворении, острые лейкозы
делят на лейкозы лимфоидного и миелоидного происхождения.
Острый лимфобластный лейкоз. По морфологическим критериям бластных клеток острый лимфобластный лейкоз имеет
3 типа клеток — LI, L2, L3.
175
Около 85 % детей с ОЛЛ имеют преимущественно тип клеток L1,14 % — L2 и 1 % — L3. Лимфобласты типа L3 имеют поверхностные иммуноглобулины и другие маркеры В-клеток.
Вместе с тем не обнаружено корреляции между морфологическими типами клеток L1 и L2 и иммунологическими маркерами на поверхности клеток. Учитывая, что у многих больных
встречается смешанная популяция лимфобластов, выделяются
случаи с типами L1/L2 и L2/L1.
Лейкозные лимфобласты дают отрицательную реакцию на
пероксидазу и хлорацетатэстеразу, не содержат липидов. Для
лимфобластов характерно гранулярное распределение материала в ШИК-реакции в виде пурпурных гранул по периферии цитоплазмы. Высокая активность кислой фосфатазы в лимфобластах среди детей с острым лимфобластным лейкозом встречается в 20—30 % случаев.
Острый недифференцируемый вариант острого лейкоза характеризуется отрицательными цитохимическими реакциями.
Властные клетки крови и костного мозга при этом варианте заболевания должны подлежать иммунологическому и цитохимическому типированию.
Благодаря использованию иммунологических методов исследования выявляется гетерогенность ОЛЛ в пределах морфологически однородных популяций лейкозных клеток.
Внедрение гибридомной технологии и получение панели диагностических моноклональных антител к дифференцировоч-
ным антигенам гемопоэтических клеток позволило типировать
властные клетки больных ОЛЛ по многим маркерным характеристикам в совокупности с цитохимическими и морфологическими характеристиками.
В настоящее время с точки зрения биологических основ возникновения ОЛЛ принято выделение Т-клеточного и не Т-кле-
точного (В-линейного) иммунологических подвариантов ОЛЛ с
дальнейшим углублением иммунологической классификации в
пределах каждого из этих типов. Приблизительно 80—85 % острых лимфобластных лейкозов у детей принадлежит к В-линии,
остальные к Т-линии.
Количество дифференцировочных антигенов Т- и В-лим-
фоцитов исчисляется десятками, и практически к каждому из
них получено по нескольку МКА, различающихся специфичностью. Систематизация МКА осуществляется в соответствии
с кластерами дифференцировки (CD) лейкоцитарных антигенов.
Иммунофенотипическими маркерами ОЛЛ являются В-кле-
точные антигены (CD19, CD22, CD23, CD37), Т-клеточные антигены (CDla, CD3, CD4, CD5, CD7, CD8) и антигены различных линий (HLA-DR, CD38, CD10, CD34 и др.). Около 90 %
случаев острого лимфобластного лейкоза экспрессирует CD 10 —
"общий", или "common", антиген.
176
Наиболее многочисленная подгруппа ОЛЛ у детей (60—
НО %) представлена лейкозами из В-линейных предшественников. Выделяются рго-В пре-пре-В (ранний пре-В-клеточный,
common), пре-В и В-клеточный подварианты.
Различные морфологические варианты ОЛЛ характеризуются
специфическими хромосомными аномалиями. Современные цитогенетические технологии позволили установить хромосомные
нарушения приблизительно в 90 % случаев ОЛЛ. Гипердиплоид-
пость (более 50 хромосом) чаще наблюдается при пре-пре-В-
клеточном варианте ОЛЛ и является наиболее благоприятной в
прогностическом отношении. У больных с В-клеточным 11 выявляется псевдодиплоидный кариотип, что ассоциируется с
плохим прогнозом. Наличие редких хромосомных нарушений:
( (9;22), t (4; ОЛЛ) и др. — прогностически неблагоприятно.
Сравнительный анализ особенностей клинико-гематологических, иммунологических и цитогенетических данных при ОЛЛ
выявил гетерогенность этого заболевания, что послужило основанием для дифференцированного подхода к лечению ОЛЛ с
помощью изучения прогностического значения различных параметров, таких как клинические, гематологические, цитологические и других.
Неблагоприятным считается увеличение числа лейкоцитов
(более 50—100 • 109/л) и бластоза в периферической крови.
Имеются данные о влиянии возраста на прогноз ОЛЛ у детей.
Прогноз заболевания в возрасте до 1 года абсолютно неблагоприятен. Выживаемость больных старше 10 лет также меньше
по сравнению с более младшей группой.
Другие характеристики больных, такие как пол, раса, выраженное увеличение селезенки, печени и периферических лимфатических узлов, лимфатических узлов средостения, а также
первоначальный уровень гемоглобина, количества тромбоцитов
и сывороточных иммуноглобулинов, предлагаются как вероятные признаки, которые могут иметь значение в прогнозе болезни, однако их прогностическая значимость еще не определена.
Придается значение для неблагоприятного исхода массе
опухоли с поражением ЦНС и наличием других экстрамедуллярных очагов лейкозной инфильтрации.
При идентификации факторов прогноза ОЛЛ у детей стало
очевидно, что при этом заболевании могут быть выделены прогностические или стадийные группы с помощью характеристик, значительно и независимо влияющих на прогноз. В этом
имелась необходимость для создания отдельных терапевтических протоколов лечения. Больные с хорошим прогнозом должны получать стандартную терапию со сведением до минимума
риска вторичных эффектов. В более интенсивном лечении нуждаются больные с плохим прогнозом.
Большинство исследователей считают, что ранний ответ на
терапию (по данным костного мозга на 15-й день лечения) яв¬
177
ляется благоприятным прогностическим признаком для длительной выживаемости больных.
Франко-американо-британская группа исследователей использовала гепатоспленомегалию с первичным лейкоцитозом
(бластозом) для определения индекса фактора риска, который
явился основой для стратификации больных острым лимфобластным лейкозом по прогностическим факторам. Критерии
для групп риска при ОЛЛ, согласно терапевтическому протоколу BFM-90, следующие.
Группа стандартного риска устанавливается, если: 1) риск-
фактор (RF) <0,8; 2) количество бластов в периферической
крови на 8-й день лечения не превышает 1000 в 1 мкл (после 7-
дневного приема преднизолона); 3) отсутствует пре-Т/т-имму-
нофенотип лейкоза (если у пациента не проводилось иммуно-
фенотипического исследования бластов, но имеется медиастинальная опухоль, то пациент в любом случае исключается из
стандартной группы риска); 4) не имеется первичного поражения ЦНС; 5) отсутствуют транслокации t (9;22) или/и BCR-
ABL-рекомбинации; 6) установлена полная ремиссия на 33-й
день лечения. Для отнесения больного в группу стандартного
риска необходимо соблюдение всех 6 критериев.
Группа среднего риска соответствует следующим критериям:
1) RF >0,8; 2) количество бластов в периферической крови на
8-й день лечения (после 7-дневной преднизолоновой профазы)
не превышает 1000 в 1 мкл; 3) отсутствуют транслокации t
(9;22) или/и BCR-ABL-рекомбинации; 4) полная ремиссия на
33-й день лечения. Для отнесения больного в группу среднего
риска необходимо наличие у него всех 4 критериев.
Группа высокого риска отличается следующими признаками:
1) наличием бластов в периферической крови на 8-й день лечения после 7-дневной преднизолоновой профазы более 1000 в
1 мкл; 2) наличием транслокации t (9;22) или/и BCR-ABL-рекомбинации; 3) отсутствием полной ремиссии на 33-й день лечения. Присутствие хотя бы одного из перечисленных выше
критериев относит пациента в группу высокого риска.
Лечение острого лимфобластного лейкоза.
Начиная с 1960 г. терапевтические возможности в онкологии
основывались на остром лимфобластном лейкозе у детей как
уникальной модели генерализованной опухоли. В результате
были отработаны и внедрены в клиническую практику наиболее эффективные химиопрепараты и их комбинации, разработаны стратегия и тактика лечения различных лейкозов.
В настоящее время очевидно, что длительность индуцированной ремиссии при ОЛЛ во многом обусловливается строгим
соблюдением принципов этапного лечения заболевания: адекватной терапии индукции, интенсификации-консолидации ремиссии, направленной на элиминацию резидуальных бластных
клеток, химио- и химиолучевой профилактики нейролейкоза,
178
противорецидивного (поддерживающего) лечения, предполагающего наличие в организме остаточных очагов лейкозной инфильтрации. Для больных с высоким риском существенным
компонентом лечения являются периодические курсы интенсификации и реиндукции.
Значительно улучшились результаты лечения детей с ОЛЛ
при применении так называемой тотальной терапии, заключающейся в использовании комбинации химиопрепаратов для достижения ремиссии, осуществлении мер, направленных на профилактику нейролейкоза (химиолучевая терапия), и длительном
противорецидивном (поддерживающем) лечении в периоде ремиссии [Aur R. J.A., 1979]. Благодаря "тотальной терапии" американскими авторами была объявлена перспектива достижения
50 % выживаемости детей с ОЛЛ более 5 лет.
Анализ результатов лечения ОЛЛ у детей в России и за рубежом свидетельствует о повсеместной унификации схем индуктивной терапии.
В индукции ремиссии базисными препаратами являются
преднизолон, винкристин, антациклиновые антибиотики и L-ac-
парагиназа.
Достижение ремиссии в результате индукционного курса характеризуется отсутствием клинических признаков заболевания, нормоклеточностью пунктата костного мозга с количеством бластов менее 5 % при отсутствии их в периферической
крови и количестве гранулоцитов 0,5 • 109/л и тромбоцитов
100,0 • 109/л. Имеет значение также отсутствие признаков лей-
козного поражения ЦНС или других экстрамедуллярных проявлений.
Концепция профилактики поражения ЦНС при ОЛЛ у детей
основывается на наличии там "убежища" для лейкозных клеток,
неопределяемых в момент диагностики заболевания и при проведении системной химиотерапии.
Для профилактики нейролейкоза традиционно используются
эндолюмбальное введение метотрексата и гамма-терапия на область головного мозга (в дозе 12—18 Гр). В настоящее время
имеются попытки снижения доз лучевой терапии до полной ее
отмены у больных стандартного и даже среднего риска. Это связано с появлением отдаленных последствий этого вида лечения.
В некоторых программах терапии применяется "triple''-терапия
(эндолюмбальное введение трех препаратов — метотрексата,
цитозин-арабинозида и гидрокортизона).
Концепция интенсификации-консолидации заключается в
дальнейшей редукции популяции лейкозных клеток, достигнутой в период индукции ремиссии. Для этого применяются либо
препараты, с помощью которых была достигнута ремиссия, либо комбинация химиопрепаратов, не использованная в период
индукции и способная довести до минимума развитие перекрестной резистентности.
179
Цель поддерживающего лечения — максимальная редукция
лейкозного клона. Наличие резидуальной (остаточной) лейкемии документируется в некоторых случаях биопсийным материалом.
Существует несколько гипотез объяснения существования
лейкемических клеток в периоде ремиссии: развития биохимической лекарственной резистентности, наличия физиологических или фармакологических "убежищ" (ЦНС, яички и др.),
поддержания популяции лейкозных клеток в фазе GO, менее
чувствительных к химиотерапии, и др.
Наиболее часто для поддержания ремиссии используются 6-
меркаптопурин и метотрексат. Длительность поддерживающей
терапии до конца не определена (2—3 года). Риск возникновения рецидива (особенно тестикулярного) у мальчиков ориентирует большинство авторов проводить им лечение не менее 3—
3,5 лет. Интерес представляют данные по эффективности применения поддерживающего лечения в течение 2 лет по программе BFM.
Большинство современных протоколов лечения ОЛЛ у детей
(BFM, DFCI, POG, CCSG, UKALL, Dutch ALL-VI и др.), применяемых в США, Германии, Великобритании и Голландии,
использует интенсивную полихимиотерапию с обязательным
включением профилактики нейролейкоза. Применение программного лечения позволило увеличить долгосрочную выживаемость до 70—80 %. Высокую эффективность показали программы, разработанные немецкими авторами ОЛЛ-BFM
(BFM-83, BFM-87, BFM-90), которые получили широкое распространение в Европе и России.
Лечение рецидивов как ОЛЛ, так и ОМЛ проводится интенсивными программами химиотерапии с применением повышенных доз препаратов. В последние годы все больше внедряется аллогенная и аутотрансплантация костного мозга и гемопоэтических стволовых клеток.
Острый миелоидный лейкоз. В основе классификации FAB
ОМЛ лежит морфологическая и цитохимическая характеристика опухолевых клеток:
• МО — недифференцированный вариант;
• Ml — миелобластный лейкоз без созревания;
• М2 — миелобластный лейкоз с созреванием;
• М3 — гипергранулярный промиелоцитарный вариант;
• M3v — микро- и гипогранулярный промиелоцитарный
вариант;
• М4 — миеломонобластный вариант;
• М5 — монобластный вариант;
• Мб — эритролейкоз с >50 % эритробластов и <30 % или
>30 % бластных клеток;
• М7 — мегакариобластный вариант.
180
Иммунофенотипическое исследование является методом,
дополняющим стандартную морфоцитохимическую диагностику
и позволяющим уточнять варианты ОМЛ.
Иммунологические маркеры ОМЛ можно условно разделить
на следующие группы: общемиелоидные, стадиеспецифичные
и линиеспецифичные.
Наиболее распространенными и широко применяемыми для
подтверждения миелоидной (гранулоцитарной и моноцитар-
ной) природы лейкоза являются антигены кластеров CD 13 и
CD33, несколько реже используется CDw65. Оценка этих трех
маркеров позволяет подтвердить миелоидную природу бласт-
ных клеток в 98 % случаев ОМЛ у детей.
Стадиеспецифичные маркеры ОМЛ — это антигены, которые появляются или исчезают по мере дифференцировки мие-
лоидных клеток. Наиболее известными являются антигены
CD34, CD lib, CD14, CD15.
К линиеспецифичным маркерам, используемым в иммунодиагностике ОМЛ у детей, относятся в первую очередь антигены, на основании экспрессии которых диагностируются эрит-
роидный и мегакариобластный варианты ОМЛ.
Факторы прогноза у больных с ОМЛ менее изучены, чем у
больных с ОЛЛ. Было проведено большое количество универсальных и многофакторных статистических исследований, с
помощью которых появилась возможность применения рационального лечения.
Учитывая гетерогенность ОМЛ, морфологический FAB-ва-
риант является основным фактором прогноза.
В группе больных, имевших FAB-M1 морфологический вариант, к высокому риску были отнесены больные с минимальной клеточной дифференцировкой (без палочек Ауэра).
В группе пациентов, имевших FAB-M2 морфологический
вариант, большую роль в развитии рецидива играют уровень
лейкоцитов и достижение ремиссии позднее чем через 10 нед
после начала лечения.
У пациентов с морфологическим вариантом FAB-M3 и инициальной патологией системы свертывания заболевание часто
заканчивалось смертью в связи с выраженным геморрагическим синдромом в первой фазе лечения. Тем не менее у этих пациентов отмечается более длительная безрецидивная выживаемость при условии, если достигается полная ремиссия и удается
справиться с нарушением коагуляции.
Среди пациентов с морфологическим вариантом FAB-M4
есть группа больных с содержанием атипичных эозинофилов в
пунктате костного мозга более 3 %, у которых отмечается лучший прогноз, чем у группы пациентов без эозинофилов.
Морфологический вариант FAB-M5 является прогностически неблагоприятным. Высокий риск и ранняя смертность при
181
варианте М5 особенно часто встречаются у больных с высоким
лейкоцитозом и экстрамедуллярным органным поражением.
При морфологическом варианте М5 часто встречаются хромосомные аберрации 11-й пары: t (9; 11) и t (11;23), что также является косвенным прогностически плохим признаком.
В литературе нет единства мнений относительно роли им-
мунофенотипирования в оценке возможностей прогноза заболевания и индивидуализации полихимиотерапии.
Обнаружена связь иммунофенотипа с кариотипом клеток
ОМЛ и описаны воспроизводимые иммуноцитогенетические
характеристики для некоторых FAB-вариантов: М2 с палочками Ауэра, М3, М4 с эозинофилией. Наличие хромосомных
аберраций, типичных для этих вариантов: t (8;21), t (15; 17), inv
(16), — связано с более длительной выживаемостью, что во
многом определяется ответом на индуктивную терапию. Для t
(8;21) характерна экспрессия CD13 или CD34 при отсутствии
маркеров моноцитарной линии (CD 14 или CD4). Типичная для
варианта М3 транслокация (15; 17) связана с иммунофенотипом
HLA-DR-, CD34-, CD14- и CD13+. При варианте М4 с эозинофилией inv (16) отмечается коэкспрессия моноцитарного
маркера CD14 (или CD2) с антигенами CD34 или CD13.
Лечение острого миелоидного лейкоза. При
проведении индуктивного и консолидирующего курсов
химиотерапии необходима максимальная интенсификация,
что приводит к наиболее быстрому достижению полных ремиссий.
Следствием такой терапии является аплазия костного мозга,
во время которой резко возрастает риск возникновения инфекционных и геморрагических осложнений, в связи с чем больные нуждаются в массивном сопроводительном лечении, включающем в себя заместительную, антибактериальную и дезин-
токсикационную инфузионную терапию с ежедневной
коррекцией электролитов и белка.
Основными препаратами, входящими в используемые программы полихимиотерапии, являются сочетания цитозинара-
бинозида и антрациклиновых антибиотиков. До 80-х годов использовались схемы "DAT" и "7+3”. С середины 80-х в программном лечении стал использоваться этопозид, что привело
к более высокому числу достижения полных ремиссий и увеличению безрецидивной выживаемости.
Наиболее эффективными программами лечения, включающими этопозид, являются программы BFM-83, BFM-87.
Индукция ремиссии состоит из цитозинарабинозида, дауно-
рубицина, этопозида, а консолидации — из винкристина, дау-
норубицина, цитозинарабинозида, 6-тиогуанина, преднизоло-
на, циклофосфамида с последующей поддерживающей терапией (цитозинарабинозид, 6-тиогуанин, адриамицин). Поданным
исследования BFM-83, 6-летняя бессобытийная выживаемость
182
составила 47 % по сравнению с BFM-78 (ДАТ), где она равнялась 38 %.
В последнее время появились работы о применении миток-
сантрона для лечения ОМЛ у детей, особенно у больных с плохим прогнозом (М5, М7, М2 с лейкоцитозом более 50 • 109/л) и
при рецидиве заболевания. Наиболее эффективной терапией
оказалось сочетание высоких доз цитозара, митоксантрона и
этопозида. Данная терапия приводит к выраженной миелоде-
прессии, без которой невозможно достичь полной ремиссии
при ОМЛ, особенно у больных с неблагоприятным прогнозом
и рецидивами.
Использование факторов роста (интерлейкин-3, G-CSF,
GM-CSF) у больных ОМЛ является важным в научном отношении, и ответ связан с биологической характеристикой лей-
козных клеток. Это исследование даст возможность применения перечисленных ростовых факторов у детей с ОМЛ.
Направление, связанное с использованием дифференцирующих агентов, таких как изомеры ретиноевой кислоты, достигло
наибольшего результата при терапии острого промиелоцитарно-
го лейкоза. При хромосомной аберрации t (15; 17), соответствующей М3 FAB, точка разрыва хромосомы 17 вовлекает ген,
соответствующий ядерному рецептору альфа-ретиноевой кислоты, что позволяет восстановить пораженный ген при лечении промиелоцитарного лейкоза ретиноевой кислотой и избежать геморрагических осложнений. Количество полных ремиссий при применении изомеров ретиноевой кислоты колеблется
от 87 до 98 %.
Для достижения более длительных ремиссий при ОМЛ как
альтернативный метод применяется аллогенная (Ал-ТКМ) и
аутологичная (Ау-ТКМ) трансплантация костного мозга.
АлТКМ от HLA-идентичного сиблинга в настоящее время проводится у больных ОМЛ во многих гематологических центрах,
но роль ее при этом заболевании до сих пор дискутируется.
Применение Ал-ТКМ позволяет достичь более длительной
безрецидивной выживаемости больных по сравнению с продолжительной циклической поддерживающей терапией. Следовательно, проведение Ал-ТКМ показано больным с неблагоприятным прогнозом и наличием HLA-идентичного сиблинга, а
Ау-ТКМ следует проводить в первую ремиссию больным с неблагоприятным прогнозом и отсутствием HLA-идентичного
сиблинга.
7.2. Хронический миелолейкоз
Хронический миелолейкоз (ХМЛ) — клоновое миелопроли-
феративное заболевание, возникающее из ранних предшественников миелопоэза, морфологическим субстратом которого
183
являются преимущественно созревающие и зрелые фанулоциты,
в основном нейтрофилы.
С помощью цитогенетических методов Р. С. Nowell и
D. A. Hungerford в 1960 г. впервые выявили специфический
хромосомный маркер для хронического миелолейкоза — делению приблизительно половины длинного плеча 22-й пары, который транслоцирован на длинное плечо хромосомы 9— t (9;22).
Измененная хромосома была названа филадельфийской (Ph') в
честь города в США, где она была впервые найдена. Ph’-xpo-
мосома в кариотипе клеток крови и костного мозга обнаруживается у 85—95 % взрослых больных. Помимо филадельфийской хромосомы, могут наблюдаться и другие хромосомные
аномалии.
По современным представлениям, ХМЛ возникает в результате соматической мутации в стволовой гемопоэтической клетке, приводящей к образованию хромосомного маркера — Ph'-
хромосомы и гена Ьсг-аЫ, продуцирующего белок р-210, обладающий тирозинкиназной активностью, которая и обусловливает характерный для хронического миелолейкоза нарастающий
лейкоцитоз.
У детей данные исследований также подтверждают наличие
двух цитогенетических вариантов заболевания — с филадельфийской хромосомой в кариотипе и без нее. Выявление Ph '-хромосомы определяет "взрослый", или Ph'-положительный, вариант заболевания у детей; в остальных случаях это ювенильный,
или Ph'-отрицательный, вариант хронического миелолейкоза.
Последний вариант встречается редко.
Течение ХМЛ у взрослых и детей носит профессирующий
характер, и в динамике принято выделять 3 фазы в зависимости
от степени зрелости клеточного состава опухоли: хроническую
фазу, переходную фазу (акселерации) и бластный криз.
Клинико-гематологические характеристики хронической
фазы "взрослого" варианта ХМЛ у детей мало отличаются от таковых у взрослых. Они всфечаются в любом возрасте и имеют
определенную симптоматику в зависимости от стадии болезни.
Наиболее частые проявления ХМЛ — спленомегалия и гиперлейкоцитоз. В связи с постепенно нарастающей интоксикацией дети старшего возраста начинают отмечать общую слабость, утомляемость, повышение температуры тела, похудание.
Могут развиться потеря аппетита, боли в животе и костях.
Пальпируется плотная селезенка — от 2 до 10—12 см ниже края
реберной дуги; печень увеличена меньше и определяется на 2—
5 см из-под реберного края.
Для периферической крови характерен нейфофильный гиперлейкоцитоз (до 500 • 109/л) с преобладанием незрелых клеток
фанулоцитарного ряда (промиелоцитов и миелоцитов, метамиелоцитов, единичных миелобластов), увеличением палочкоядерных и сегментоядерных нейтрофилов, а также базофилов и
184
эозинофилов ("базофильно-эозинофильная" ассоциация); СОЭ
увеличена.
Почти у всех больных детей отмечается умеренная нормо-
хромная анемия. Количество тромбоцитов у большинства больных нормальное; у некоторых выявляется гипертромбоцитоз.
В пунктате костного мозга имеется выраженное увеличение
миелокариоцитов за счет пролиферирующего пула клеток гра-
нулоцитарного ряда с увеличением базофилов и эозинофилов.
На более поздних стадиях болезни наблюдается угнетение эри-
тронормобластического и мегакариоцитарного ростков кроветворения.
В последние годы все большее значение в комплексной диагностике ХМЛ приобретают такие исследования, как определение активности щелочной фосфатазы нейтрофилов и уровня
фетального гемоглобина. Так, активность щелочной фосфатазы
нейтрофилов резко снижена или равна нулю в хронической фазе заболевания, что является важным диагностическим признаком в атипичных и сложных случаях ХМЛ, а также на ранних
этапах его развития.
Переход в острую фазу заболевания (бластный криз) с увеличением содержания бластных клеток обычно происходит в
процессе развития болезни. Обычно принято считать пограничным для определения бластного криза увеличение бластных
клеток в периферической крови и/или в костномозговом пунктате более 20 %.
В "переходном" периоде (фазе акселерации) между хронической фазой и властным кризом в анализах периферической крови наблюдаются нарастание количества незрелых гранулоцитов
(чаще промиелоцитов), базофилов, повышение лейкоцитов, несмотря на увеличение дозы химиопрепаратов. Отмечаются снижение эритроцитов и гемоглобина, тромбоцитопения.
Клинико-гематологическая картина бластного криза зависит от цитологического типа бластных клеток и не отличается
от острого лейкоза.
В настоящее время принято типирование опухолевых клеток
при властном кризе ХМЛ по принципам, аналогичным острому
лейкозу, т. е. с использованием морфологического, цитохимического и иммунологического методов исследования.
Для Ph'-отрицательного (ювенильного) варианта ХМЛ характерно скоротечное развитие болезни. Часто заболевание начинается остро: с болей в животе, быстрого нарастания геморрагического синдрома, симптомов интоксикации. При этом варианте, который чаще наблюдается у детей раннего возраста,
отмечается более выраженная клиническая симптоматика.
В анализах периферической крови при Ph'-отрицательном
ХМЛ чаще наблюдаются выраженная анемия и снижение количества гемоглобина и тромбоцитов, чем у детей с Ph'-положительным вариантом заболевания. При сравнении анализов
185
периферической крови больных с Ph'-положительным и Ph'-
отрицательным вариантами ХМЛ отмечаются следующие особенности: в первом случае наблюдается увеличение количества
миелоцитов и метамиелоцитов, а в последнем имеется увеличение более молодых клеток гранулоцитарного ряда — промиелоцитов и миелобластов.
Среди хронических миелолейкозов особо выделяется хронический миеломоноцитарный лейкоз [Nilmeyer С. М. et al.,
1997]. При этом варианте, помимо увеличения незрелых клеток
гранулоцитарного ряда, имеется также пролиферация клеток
моноцитарного ряда с появлением атипичных моноцитоидных
элементов в крови и костном мозге при относительно небольшом содержании бластных клеток миелоидного типа.
При цитогенетическом исследовании кариотипа клеток этих
детей, как правило, не выявляется филадельфийская хромосома; редки и другие аномалии кариотипа. Наиболее часто встречается моносомия 7, трисомия 8 и делеция короткой ножки
хромосомы 12 (чаще, чем транслокация).
По классификации ВОЗ (1976), это заболевание является
атипичной формой Ph'-отрицательного варианта ХМЛ. В соответствии с ФАБ-классификацией (1982) хронический миеломоноцитарный лейкоз относится к группе миелодисплазий. До
настоящего времени вопрос о месте этого заболевания в системе гемобластозов дискутируется. В попытке решения большинства имеющих место противоречий специально созданная Международная рабочая группа по ювенильному миеломоноци-
тарному лейкозу предложила обозначить это заболевание как
ювенильный миеломоноцитарный лейкоз (ЮММЛ).
В последние годы разрабатываются прогностические факторы в течении ХМЛ. Наиболее важными для прогноза заболевания являются данные цитогенетического исследования. Так,
отмечено, что взрослые больные с Ph'-положительным вариантом заболевания живут дольше.
Из гематологических показателей определенное прогностическое значение имеют лейкоцитоз и абсолютное количество
незрелых гранулоцитов. При увеличении этих показателей продолжительность жизни больных сокращается. Значительная
тромбоцитопения (ниже 100 • 109/л) ухудшает выживаемость.
Влияет на прогноз болезни количество бластных клеток и
базофилов. Существует мнение, что увеличение базофилов более чем на 20 % является достоверным предвестником бластно-
го криза. Эти показатели дают право некоторым авторам провести параллель между властными клетками и базофилами в
плане прогностической значимости.
В настоящее время наиболее достоверным прогностическим
фактором у больных ХМЛ считается ответ на первоначальное
лечение препаратами а-интерферона. В случае получения гематологического ответа больные живут дольше, и наибольшая вы¬
186
живаемость при ХМЛ наблюдается при наступлении цитогенетической ремиссии.
Лечение хронического миелолейкоза. При
ХМЛ задачей лечения является максимально возможное увеличение продолжительности жизни больных, которая, как правило, коррелирует с длительностью развернутой (хронической)
стадии заболевания, поскольку продолжительность фазы акселерации (переходной стадии) и терминальной стадии болезни
(за редким исключением) исчисляется месяцами.
В 1953 г. для лечения ХМЛ был предложен миелосан (бу-
сульфан), остававшийся основным препаратом для терапии
данного заболевания в течение 40 лет.
Развитие миелофиброза, фиброза легочной ткани и гипо-
кортицизма при длительном применении миелосана значительно ухудшает течение болезни и результаты трансплантации костного мозга (ТКМ), если таковая предпринимается после этого лечения.
Гидроксимочевина стала применяться для лечения ХМЛ с
60-х годов прошлого столетия, и к середине 80-х годов стало
очевидно, что она не вызывает перечисленных выше побочных
явлений, обусловленных миелосаном. Терапия гидроксимоче-
виной улучшает выживаемость больных, а также не ухудшает
результатов ТКМ, если она осуществляется после курса лечения данным препаратом.
К сожалению, ни миелосан, ни гидроксимочевина не приводят к длительному и выраженному подавлению содержащих
филадельфийскую хромосому клеток и значительному увеличению продолжительности жизни больных ХМЛ, не говоря уже о
выздоровлении.
В настоящее время доказано, что так же, как и для взрослых,
единственным методом полного излечения ХМЛ у детей является аллогенная трансплантация костного мозга (АлТКМ), которая должна быть проведена в течение 6 мес после установления диагноза, если идентифицирован совместимый сиблинг,
т. е. родной брат или сестра, и в течение года при наличии совместимого неродственного донора.
Однако возможности применения миелотрансплантации ограничены в связи с отсутствием родственного донора у 70 %
больных и с необходимостью длительного поиска HLA-совмес-
тимого донора.
В настоящее время препараты интерферона (интрон А, ро-
ферон и др.) являются терапией выбора у больных ХМЛ, не
подлежащих ТКМ.
Критериями эффективности терапии ХМЛ препаратами интерферона (ИФ) являются гематологическая и цитогенетическая ремиссии. Гематологическая ремиссия оценивается по количеству лейкоцитов и спленомегалии, а цитогенетическая —
по проценту РЬ+-клеток в костномозговом пунктате (0 % —
187
полная ремиссия, 35 % — частичная, 35—95 % — малая, 100 % —
отсутствует).
Так, комбинация препаратов ИФ с гидроксимочевиной позволяет достичь более быстрой нормализации гематологических показателей, а комбинация с малыми дозами цитозара может увеличить количество больных с большим цитогенетическим ответом, так как цитозар сам обладает способностью
супрессировать пролиферацию Ph+-клеток, а препараты интерферона потенцируют его действие.
Подтверждением патогенетической обоснованности использования интерферонотерапии при ХМЛ являются случаи, при
которых достигалась полная элиминация опухолевого клона.
Процент полных гематологических ремиссий и большого цитогенетического ответа был наиболее высоким у больных, начавших лечение ИФ в ранней хронической фазе (менее 12 мес с
момента установления диагноза).
Доказана важная роль препаратов интерферона в посттрансплантационном периоде у больных высокого риска или у больных с ранним цитогенетическим рецидивом.
В последнее время при лечении ХМЛ изучается эффективность ряда лекарственных препаратов: гомохаррингтонина, ази-
дотимидина, децитабина, топотекана, трансретиноевой кислоты (ATRA). Большое внимание приковано к апробации нового
препарата STI 571 (гливек) с принципиально новым механизмом воздействия на патогенетические механизмы развития
ХМЛ. Препарат ингибирует фермент тирозинкиназу на клеточном уровне, подавляя пролиферацию и вызывая апоптоз Ph’-
положительных лейкозных клеток. У взрослых больных с ХМЛ
препарат показал свою высокую эффективность.
До сих пор четко не определено значение спленэктомии в
комплексном лечении ХМЛ. Имеется мнение, что ее роль сводится к устранению абдоминального дискомфорта и тем самым
облегчается течение заболевания, что не отражается на его продолжительности. В отдельных случаях удаление селезенки способствует снятию явлений гиперспленизма и купированию аутоиммунных нарушений. В то же время допустима и вероятность
дополнительной клональной селекции более злокачественных
клеток в этом органе.
В современном лечении ХМЛ может использоваться лейко-
форез, способный при проведении 1—6 процедур уменьшить
содержание патологических клеток в 20 раз. Показанием к его
назначению является наличие гиперлейкоцитоза и/или выраженной интоксикации. Лейкофорез и спленэктомия обычно
сочетаются с полихимиотерапией.
Глава 8 НЕХОДЖКИНСКИЕ ЛИМФОМЫ
Неходжкинские лимфомы (НХЛ) у детей составляют 7—8 % от
числа всех опухолевых заболеваний и наиболее часто диагностируются в возрасте 5—9 лет; мальчики болеют в 2—3 раза чаще девочек.
Для НХЛ детского возраста характерна высокая пролиферативная активность незрелых опухолевых клеток со склонностью к диффузному росту, ранней диссеминации, поражению
костного мозга и центральной нервной системы (ЦНС).
Эпидемиологические исследования, позволившие выявить
определенное увеличение случаев заболевания НХЛ, дали основание предположить возможную вирусную природу некоторых форм НХЛ. Наиболее ярким доказательством вирусной
этиологии лимфом является наличие связи между вирусом Эпштейна — Барр (EBV) и лимфомой Беркитта, в основном африканского варианта. Лимфома Беркитта имеет ряд отличий от
спорадических случаев заболевания, встречающихся в других
регионах мира. В развитии эндемической лимфомы Беркитта
имеют значение и климатические факторы, например повышенная солнечная радиация в зоне Центральной Африки; но
ведущим фактором является индуцирующая роль вируса Эпштейна — Барр, который обнаруживается у 95 % заболевших
детей и только у 10—20 % — при спорадической лимфоме Беркитта. Имеется предположение о возникновении под влиянием
EBV неудержимой пролиферации пораженных В-клеток. Особенно большое значение придается малярии, при которой Т-
клетки теряют свою супрессивную функцию.
Наибольший интерес представляет связь Т-лимфомы с вирусом HTL-1, который встречается у населения южного побережья Японии и в некоторых других регионах земного шара.
Однако проблема ретровирусов находится в стадии изучения.
Под воздействием вирусов в Т- и В-клетках возникают хромосомные транслокации и развитие опухолевого роста. Транслокации локализуются в генах. При В-клеточных лимфомах
классическая транслокация t (8; 14) вовлекает локус 24 длинного
плеча хромосомы 14, где расположен ген синтеза тяжелых цепей Ig. На хромосомах 2 и 22 локализованы гены легких цепей.
Нарушение локусов хромосом 14, 2 и 22 сопровождается развитием В-клеточной опухоли. Описаны транслокации хромосом при Т-клеточной лимфоме — t (10; 14), t (11; 14), t (14; 14) и
при крупноклеточной Ki-лимфоме — t (2;5).
Большое значение в этиологии и патогенезе НХЛ у детей
придается нарушениям клеточного и гуморального иммунитета.
Существует причинная взаимосвязь между иммунодефицитны-
ми состояниями и развитием лимфом. Частота злокачественных опухолей у больных с иммунодефицитным состоянием в
10 000 раз превышает таковую в общей популяции, аналогич¬
189
ной по возрасту. Атаксия-телеангиэктазия, синдромы Вискотга —
Олдрича, Блума, агаммаглобулинемия и др. ассоциируются с
повышенной частотой возникновения лимфом. Повышенный
риск развития опухоли отмечается среди реципиентов аллогенных почечных трансплантантов. Атрофия или отсутствие ви-
лочковой железы, проявления аутоиммунизации и особенно
наличие структурных хромосомных изменений в лимфоидных
клетках способствуют развитию опухолевого роста.
В литературе имеются сообщения о семейных случаях заболевания лимфомой. Лимфопролиферативные заболевания часто сопровождаются цитогенетическими нарушениями, и наиболее часто обнаруживаются изменения в 14-й, а также в 8-й,
3-й, 11-й и 7-й парах хромосом в виде количественных и структурных изменений, а также транслокации длинного плеча хромосомы 11 на хромосому 14 и трисомию хромосом 3 и 18.
Избыточное лучевое воздействие может повысить риск развития НХЛ у детей.
НХЛ у детей отличаются от лимфом взрослых диффузным
характером роста, высоким потенциалом пролиферации, быстротой генерализации и диссеминации процесса с поражением
костного мозга и ЦНС, а также частотой первично-генерализованных форм заболевания, что необходимо учитывать при составлении программ лечения.
Морфоиммунологическая классификация неходжкинских лимфом. Существует большое число морфологических классификаций НХЛ. В настоящее время используется около 10 классификаций НХЛ, которые постоянно улучшаются и дополняются,
благодаря современным иммунологическим и цитогенетическим исследованиям опухолевой ткани и клетки. С учетом того,
что НХЛ является опухолью, поражающей иммунную систему,
с помощью морфологических исследований и применения моноклональных антител произошло разделение лимфом на В- и
Т-клеточные варианты заболевания.
Основной функцией В-лимфоцитов является способность
синтезировать и продуцировать иммуноглобулины. Развитие В-
лимфоцитов происходит в костном мозге до стадии незрелых
клеток, затем клетки (в зависимости от созревания) мигрируют
в периферические лимфоидные ткани, в основном в пейеровы
бляшки (групповые лимфатические фолликулы) толстого кишечника.
Развитие Т-лимфоцитов после созревания в костном мозге
происходит в вилочковой железе до зрелых клеток.
Дифференцировка клеток лимфоидного ряда имеет место
при участии антигенов в периферических лимфатических узлах
и тканях.
Rappaport разделяет лимфому на Беркитг-тип и не-Беркитт-
тип. В классификации Lukes и Collins лимфому Беркитга относят к В-клеточному варианту, а лимфому со складчатым ядром —
190
к Т-клеточному варианту. Lukes и Collins выделяют еще крупноклеточные варианты злокачественных лимфом, которые берут свое начало из крупных фолликулярных центров лимфатических узлов.
В новой Kiel-классификации лимфома Беркитта отграничена от лимфобластных вариантов, уточнена функциональная активность В-клеточных форм заболевания, связанных с выработкой иммуноглобулинов, а Т-клеточные варианты — с продукцией лимфокинов. Имеется разделение лимфом на низко- и
нысокозлокачественные формы.
На основании комплексного изучения результатов различных классификаций была создана классификация лимфом —
Working Formulation (WF) — в США; ее отличия от Kiel-клас-
сификации представлены в табл. 8.1.
В 1994 г. международной Европейско-Американской группой по изучению лимфом была предложена классификация новообразования лимфоидной системы с учетом клеточной принадлежности опухоли.
Принципиально новым явилось разделение опухолей на две
самостоятельные группы: Т- и В-клеточные опухоли.
В свою очередь в зависимости от степени иммунологической
дифференцировки в каждой группе выделено два типа опухолевого процесса.
I — опухоли из клеток-предшественников: В- и Т-лимфо-
бластная лимфома.
II — опухоли из периферических В- или Т-клеточных эле¬
ментов, которые в зависимости от морфофункциональных и генетических особенностей разделены на
рубрики.
Г а б л и ц а 8.1. Морфологическая характеристика В- и Т-клеточных
вариантов НХЛ по классификации WF и Kiel
В-клеточные варианты
Т-клеточные варианты
Kiel
WF
Kiel
WF
Лимфобластная Лимфобластная Лимфобластная
нескладчатая
Лимфома Мелкоклеточная
Беркитта нерасщепленная
Центробластная Диффузная Периферическая
крупноклеточная Т-клеточная
нерасщепленная
Крупноклеточ- Нет аналога
пая анаплазированная лимфома
Крупноклеточная анаплазированная лимфома
Лимфобластная
складчатая
Крупноклеточ¬
ная
иммунобластная
полиморфная
Нет аналога
191
В этой классификации термин "лимфобластная лимфома"
(Т- или В-клеточная) закреплен только за опухолями, субстратом которых являются клетки-предшественники Т- или В-кле-
точных линий, т. е. пролиферирующие клетки антигеннезависи-
мых стадий. Подчеркивается отсутствие морфологических различий между Т- и В-клетками-предшественниками, выделение
которых возможно лишь при иммунологическом исследовании
моноклональными антителами ранних предшественников.
В детском возрасте наиболее часто встречаются следующие
лимфомы:
• В-клеточные лимфомы:
1. В-лимфобластная лимфома. Лимфобластная — в
классификации Раппопорта, лимфобластная В-клеточная — в
Кильской классификации, недифференцируемая — в классификации Lukes—Collins, лимфобластная — в классификации
Working Formulation.
Цитологическим субстратом являются лимфобласты (типа
L2) с округлыми, реже извитыми ядрами, нежным строением
хроматина, без четких нуклеол, с довольно скудной, умеренно
базофильной цитоплазмой. В препаратах часты фигуры митоза,
что свидетельствует о высокой пролиферативной активности
(рис. 8.1, см. цв. вкл.).
Иммунологически опухолевые лимфобласты характеризуются
отсутствием поверхностных иммуноглобулинов и экспрессией
TdT, CD19, CD79a, CD22, HLA-DR, реже - CD20, CD10, CD34
с возможной в ряде случаев коэкспрессией CD13 или CD33.
Четких генетических изменений не выявлено. Возможна
транслокация t (1; 19), t (9;22) или (11;13).
Дети болеют чаще, чем взрослые. 80 % всех ОЛЛ и около
20 % НХЛ представлены этой формой.
2. Лимфомы из периферических В-клеток.Диффузная крупноклеточная В-клеточная лимфома.
Гистиоцитарная диффузная (Rappaport), центробластная, В-
иммунобластная, крупноклеточная анапластическая В-клеточ-
ная (Кильская классификация), с расщепленными и нерасще-
пленными ядрами, В-иммунобластная (классификация Lukes—
Collins), диффузная крупноклеточная с расщепленными ядрами (Working Formulation).
В этой рубрике объединено несколько клеточных типов опухолей:
А. Субстрат лимфомы представлен крупными клетками с округлыми ядрами, содержащими выраженные нуклеолы, с базофильной цитоплазмой. Клетки по морфологии схожи с цен-
тробластами и иммунобластами.
Б. Субстрат лимфомы представлен крупными, резко анаплазированными элементами с округлыми или многодольчатыми
ядрами и резко базофильной цитоплазмой.
192
Рис. 8.1. Микрофото. Пунктат лимфатического узла — лимфобласты
типа L2. хЮОО. К с. 192.
Рис. 8.2. Микрофото. Пунктат лимфатического узла — крупные В-клет-
ки при крупноклеточной анапластической лимфоме. хЮОО. Кс- 193.
Рис. 8.3. Микрофото. Пункгат лимфатического узла — опухолевые клетки типа L3. + макрофаги. х800. к с. 193.
Рис. 8.5. Микрофото. Пунктат лимфатического узла в мягких тканях —
крупные элементы Ki+1, CD30 при крупноклеточной анапластической лимфоме. К с. 195.
Рис. 8.4. Микрофото. Пунктат лимфатического узла — лимфобласты
типа L1. х 1000. К с. 194.
Рис. 10.2. Микрофото. Пункгат лимфатического узла — анаплазированные крупные клетки, многоядерные клетки с эритрофагией, митозы при
злокачественном гистиоцитозе. х800. К с. 242.
В. Субстрат лимфомы обогащен Т-лимфоцитами и гистиоцитами, создающими подобие Т-клеточной лимфомы или лимфогранулематоза в стадии лимфоидной пролиферации.
Иммунологическая характеристика: более 50 % опухолевых
элементов содержит поверхностные и цитоплазматические иммуноглобулины. Экспрессируют В-ассоциированные антигены: CD19, CD20, CD22, CD79a, часть клеток — CD45, CD10.
Не выявлено четкой корреляции между морфологическим
типом опухолевых элементов и их иммунологической характеристикой.
При цитогенетических исследованиях более чем в 30 % случаев обнаружена реаранжировка BCL-гена.
Крупноклеточные В-лимфомы являются агрессивными опухолями. Развиваются как в лимфоидной ткани, так и экстрано-
дально.
В классификации как самостоятельный подтип крупноклеточной В-лимфомы выделена первичная медиастинальная (тимусная) В-клеточная лимфома. В старых классификациях эта
форма не отражена.
Морфологическим субстратом лимфомы являются крупные
клетки с вариабельным строением ядер, часто многодольчатых,
со скудной цитоплазмой. Иногда клетки схожи с клетками Березовского — Штернберга, что приводит к частым диагностическим ошибкам (рис. 8.2, см. цв. вкл.).
Опухолевые элементы иммунологически характеризуются
экспрессией В-клеточно-ассоциированных антигенов — CD 19,
CD20, CD22, CD79a и чаще — отсутствием иммуноглобулинов.
• Лимфома Беркитта:
недифференцированная лимфома, лимфома типа Беркитта
(по классификации Rappaport), лимфома Беркитта (Кильская
классификация), мелкая нерасщепленно-клеточная (классификация Lukes—Collins), мелкая нерасщепленно-клеточная Бер-
китт-типа (классификация Working Formulation).
Цитологическая картина опухолевого субстрата мономорф-
ная, представлена клетками среднего размера с округлыми ядрами, умеренной базофильной цитоплазмой, содержащей, как
правило, липидные вакуоли. Типичным является присутствие
функционально активных макрофагов, создающих картину
"звездного неба".
Эта лимфома обладает высокой пролиферативной активностью. Значительно выражен апоптоз. Цитологический тип клеток — L3 (рис. 8.3, см. цв. вкл.).
Иммунологически выявляются поверхностные иммуноглобулины класса М, экспрессируются В-ассоциированные антигены — CD19, CD20, CD22, CD79a, CD10. К типичной "африканской" лимфоме Беркитта относятся только те случаи забо¬
193
левания, когда выявляются генетические изменения —
транслокация с-шус хромосомы 8 к иммуноглобулину области
тяжелой цепи хромосомы 14 — t (8; 14), реже — 2t (2;8) или 22t
(8;22).
При эндемичной "африканской" и неэндемичной лимфоме
Беркигга отмечены различные точки разрыва тяжелой цепи иммуноглобулина хромосомы 14.
• Лимфома высокой степени злокачественности, беркитго-
подобная:
недифференцируемая (по классификации Rappaport), из
мелких нерасщепленных клеток (классификация Lukes—Collins), из мелких нерасщепленных клеток, неберкитта (классификация Working Formulation).
У взрослых больных этот тип лимфомы является как бы промежуточным между крупноклеточными В-лимфомами с цен-
тробластными или иммунобластными отличительными чертами и типичной лимфомой Беркигга. В детском возрасте морфологический субстрат этого типа опухоли практически
идентичен типичной лимфоме Беркитта.
Иммунологически характеризуется наличием поверхностных и цитоплазматических иммуноглобулинов и экспрессией
В-ассоциированных антигенов — CD19, CD20, CD22, CD79a и
обычно — отсутствием CD 10.
Генетические особенности: в 30 % случаев выявляется реаранжировка гена BCL-2.
• Т-клеточные лимфомы:
1. Опухоли из предшественников Т-клеток:
Т-лимфобластная лимфома. В старых классификациях
этот тип лимфомы выделялся как слабодифференцированный
диффузный лимфоцитарный (по классификации Rappaport), Т-
лимфобластный (Кильская классификация), Т-лимфоцитар-
ный с извитыми ядрами (классификация Lukes—Collins) и лимфобластный с извитыми и неизвитыми ядрами (Working Formulation).
Как уже указывалось, морфологических отличий клеток-
предшественников Т- и В-линий нет. Необходимо обязательное иммунологическое тестирование для верификации типа
опухолевого процесса. Однако, как показывает наш опыт, клеточные элементы при этом типе более мелкие по размерам или
имеют складчатые ядра и соответствуют типу лимфобластов L1,
по FAB-классификации (рис. 8.4, см. цв. вкл.).
Иммунологически характерны экспрессия CD7, CD3 TdT и
нестабильное присутствие CD2, CD5, CD 1а.
Отмечается вариабельность цитогенетических отклонений.
В детском возрасте Т-клеточные опухоли из клеток-предше-
ственников составляют около 40 % всех лимфом.
194
2. Лимфомы из периферических Т-клеток.
Анапластическая крупноклеточная лимфома CD30+, Т- или В-
клеточный тип.
Критерием для объединения этой весьма полиморфной как
по морфологическим характеристикам, так и по клиническим
проявлениям группы заболеваний считается высокая экспрессия Ki-1 -антигена CD30+.
В старых классификациях этот тип лимфом был выделен как
гистиоцитарный диффузный, недифференцируемый (по классификации Rappaport), крупноклеточный анапластический
(Кильская классификация), Т-иммунобластный (классификация Lukes—Collins), недифференцируемый крупноклеточный,
иммунобластный (Working Formulation).
Кроме того, существуют и другие наименования — злокачественный гистиоцитоз, синусоидальная крупноклеточная лимфома, атипичный гистиоцитоз.
Субстрат лимфомы представлен крупными, весьма плеоморфными клеточными элементами с уродливыми ядрами, довольно обильной, чаще светлой цитоплазмой. Могут встречаться
многоядерные формы, схожие с клетками Штернберга, что
приводит к диагностическим ошибкам (рис. 8.5, см. цв. вкл.).
Иммунологически опухолевые элементы характеризуются
высокой экспрессией CD30, наличием CD45, CD25, CD15,
CD3, ЕМА-эпителиального мембранного антигена, а также
других Т-клеточно-ассоциированных антигенов — CD43,
CD45RO. Кроме того, в ряде случаев экспрессируется КР-1
(панмакрофагальный антиген) и выявляется лизоцим.
Генетические исследования выявили реаранжированный
TCR в 50—60 % случаев.
В классификации как самостоятельная рубрика выделена
анапластическая крупноклеточная ходжкиноподобная форма
лимфомы.
Причиной выделения этой формы в отдельную рубрику послужили особенности роста лимфомы, а именно: наличие сливающихся полос опухолевых клеток и склерозирующих тяжей,
создающих архитектонику лимфатического узла, схожего с вариантом нодулярного склероза лимфогранулематоза (болезни
Ходжкина).
Цитологически и иммунологически опухолевые клетки аналогичны элементам крупноклеточной анапластической Т-лим-
фомы.
Таким образом, иммунологические и цитогенетические исследования, проводившиеся параллельно с углубленным морфологическим изучением лимфом, внесли некоторую ясность в
распознавание различных нозологических форм Т- и В-опухо-
лей лимфатической системы и дали возможность более объективного выделения их в самостоятельные формы лимфом.
195
Авторы уточненной классификации считают, что если новые
схемы лечения, направленные непосредственно против антигенных или генетических отличительных черт заболевания,
окажутся эффективными, то это подтвердит необходимость выделения и углубленного изучения различных нозологических
типов лимфом.
Клиника. Клинические симптомы НХЛ у детей проявляются
в зависимости от первичной локализации и распространения
опухолевого роста, а также признаками интоксикации.
Выраженность различных локализаций НХЛ у детей тесно
связана с гистологическим и иммунологическим вариантом
опухоли.
Почти 50 % НХЛ первично развиваются в лимфатических
узлах брюшной полости, средостения и периферических лимфатических узлах. В остальных случаях лимфома возникает экс-
транодально и может поражать желудочно-кишечный тракт,
миндалины, мягкие ткани, кожу, кости и пр.
Целесообразно выделение следующих основных локализаций НХЛ:
• брюшная полость с первичным поражением кишечника
или лимфатических узлов (30—40 %);
• лимфатические узлы средостения и поражение вилочко-
вой железы (20—30 %);
• периферические лимфатические узлы (12—20 %);
• глоточное (вальдейерово) кольцо (12 %);
• прочие локализации (мягкие ткани, кожа, печень, почки,
яичко, молочные железы и т. д.).
Клиническая картина НХЛ брюшной полости
зависит от локализации первичного очага. Выделяют две формы — поражение мезентериальных и забрюшинных лимфатических узлов и поражение желудочно-кишечного тракта (чаще
всего опухоль локализуется в области илеоцекального отдела).
Заболевание длительное время существует бессимптомно. Могут отмечаться редкие неинтенсивные боли в животе, похудание, тошнота, рвота, потеря аппетита. В дальнейшем боли усиливаются, увеличивается живот за счет асцита, нарастает похудание. Нередко увеличиваются печень и селезенка. При
пальпации в животе определяется крупнобугристая, плотная
опухоль (рис. 8.6).
Как уже отмечалось, при поражении кишечника процесс
чаще всего локализуется в области илеоцекального отдела, реже — в восходящем отделе ободочной кишки. Возможны вздутие живота, задержка стула вследствие кишечной непроходимости, вызванной инвагинацией кишки в результате опухолевого роста.
196
Рис. 8.6. Поражение брюшной полости у ребенка с
НХЛ. Кахексия.
Поражение забрю-
шинных лимфатических
узлов при НХЛ встречается редко и требует
дифференциальной диагностики с нейробластомой и рабдомиосаркомой. Морфологическим субстратом при
абдоминальных локали¬
зациях чаще всего являются В-лимфоциты.
Частота поражения
костного мозга при этих
лимфомах достигает
25 %, а ЦНС - 10 %.
На втором месте по
частоте поражения НХЛ
стоит переднее
средостение с вовлечением внут-
ригрудных лимфатических узлов и вилочковой
железы. Данная локализация при НХЛ составляет от 13 до
30 % от общего числа заболевших. По данным НИИ ДОиГ
РОНЦ им. Н. Н. Блохина РАМН, вовлечение в процесс средостения было диагностировано в 19 % случаев.
Заболевание вначале протекает бессимптомно и может быть
обнаружено случайно во время профилактического обследования.
Однако большинство больных обращаются к врачу с развернутой клиникой заболевания: наличием компрессионного синдрома и симптомов дыхательной недостаточности; при этом
средняя длительность заболевания обычно не превышает 3 мес.
У больных рано появляются кашель, одышка, затрудненное
дыхание. На передней грудной стенке выражена венозная сеть.
Возникает синдром "верхней полой вены" с резким нарушением
дыхания, отеком и цианозом лица, шеи, верхней половины
грудной клетки. Компрессионный синдром встречается у большинства (73,2 %) детей, симптомы дыхательной недостаточности — у 55 % больных. У каждого 5-го больного к моменту диагностики заболевания имеется выраженная деформация передней грудной стенки за счет растущей опухоли средостения.
Основным методом диагностики поражения средостения
при НХЛ у детей является рентгенологический, проводящийся
197
Рис. 8.7. Рентгенотрамма грудной клетки — увеличение внутригрудных
лимфатических узлов при неходжкинской лимфоме.
наряду с томографическим исследованием органов грудной
клетки (рис. 8.7). При этом выявляется расширение тени средостения за счет увеличенных внутригрудных лимфатических
узлов и вилочковой железы. Ретростернальное пространство затемнено. Наиболее часто наблюдается увеличение лимфатических узлов передней группы и вилочковой железы. Реже встречается увеличение трахеобронхиальных, бронхопульмональных
лимфатических узлов и корней легких.
Поражение средостения у детей с НХЛ характеризуется быстрым ростом и наличием большой массы опухоли, у 91,5 % детей превышающей 10 см со средним медиастинально-торакальным индексом более 0,5.
Вовлечение плевры и наличие плеврального выпота наблюдаются почти у 2/з больных. Плеврит, как правило, односторонний, тотальный или субтотальный, геморрагического или
серозного характера. Пункция плевральной полости с исследованием плевральной жидкости является источником опухолевых клеток для цитологической и иммунологической диагностики НХЛ.
Опухолевые узлы на плевре выявляются относительно редко.
Вовлечение перикарда диагностируется еще реже и зависит от
локализации и характеристики опухолевого роста в средостении.
198
Рис. 8.8. Больной с неходжкинской лимфомой — поражение лимфатических узлов шейно-подчелюстной области с обеих сторон.
Морфологическим субстратом при НХЛ средостения в большинстве случаев являются Т-лимфоциты. Согласно Working
Formulation, опухоль часто классифицируется как лимфобластная конволютная злокачественная лимфома. Для этого варианта опухоли характерна высокая частота поражения костного
мозга (30—50 %), оболочек головного и спинного мозга, гонад.
Данная лимфома быстро поддается лечению, однако вследствие
высокой пролиферативной активности опухолевых клеток может наступить ранний рецидив заболевания.
В 10—15 % случаев НХЛ средостения может быть В-клеточ-
ной природы. При этом обычно поражение лимфоидной ткани
средостения сочетается с вовлечением вилочковой железы. Быстро развивается компрессионный синдром. Часто имеются
экстранодальный рост, поражение печени, желудочно-кишечного тракта, яичников, ЦНС. Это наиболее агрессивно текущая
форма среди В-клеточных лимфом.
Поражение периферических лимфатических узлов при НХЛ
может быть локальным или генерализованным. Наиболее часто
199
Рис. 8.9. Поражение глоточного
(вальдейерова) кольца у больного с неходжкинской лимфомой.
в процесс вовлекаются лимфатические узлы шеи, подчелюстной области (рис.
8.8) и реже — подмышечные и паховые.
Лимфатические узлы
плотные, безболезненные,
не спаянные с окружающими тканями, часто сливаются в конгломераты. У ряда
больных отмечается первичное генерализованное
поражение периферических
лимфатических узлов с наличием увеличенных селезенки и печени.
При данной локализации
опухолевые клетки представлены как Т-, так и В-лимфоцитами. Поражение костного
мозга (20 %) и оболочек головного мозга (10 %) встречается реже, чем при медиастинальных и абдоминальных НХЛ.
Поражение глоточного (вальдейерова) кольца (рис. 8.9)
встречается в 9 % случаев и сопровождается "заложенностью"
носа, изменением дыхания, ощущением инородного тела при
глотании. Отмечаются увеличение миндалин, свисание опухоли
из носоглотки, которая нередко закрывает вход в ротоглотку,
гнилостный запах изо рта. Опухоль синюшного цвета, бугристая. Иногда лимфома прорастает в полость носа и распространяется в назальные синусы, основание черепа, орбиту со сдавлением зрительных и других черепных нервов.
При поражении носоглотки часто обнаруживаются увеличенные шейные и подчелюстные лимфатические узлы. Вовлечение костного мозга и ЦНС диагностируются реже, чем при
других локализациях НХЛ.
Поражение мягких тканей часто локализуется на волосистой
части головы в виде припухлости плотной консистенции
(рис. 8.10), а также на передней брюшной стенке, спине
(рис. 8.11). Очень редко НХЛ может возникать в молочных железах (рис. 8.12), яичке, яичниках.
Вовлечение в процесс ЦНС может встречаться при любой локализации НХЛ и представлено инфильтрацией мозговых оболочек, черепных нервов, внутричерепной опухолью с наличием
головной боли, нарушения зрения, слуха, парезов и параличей.
200
Рис. 8.10. Поражение мягких
тканей волосистой части головы у ребенка с НХЛ.
НХЛ с поражением кожи проявляется в виде папулезных и узловатых образований величиной от
горошины до грецкого
ореха, плотной консистенции, синюшно-красного
цвета с возможным изъязвлением на поверхности.
Первичное поражение
костей встречается редко.
При этом поражаются
кости таза, лопатки, трубчатые кости с наличием
участков разрежения костной структуры различных размеров, а также ос-
салгий.
Клиническая классификация, принятая в Arm-Arbor и применяемая для лимфогранулематоза, при стадировании НХЛ у
детей малоприемлема. В настоящее время наибольшее распространение получила классификация S. Murphy (1980), согласно
которой выделяют 4 клинические стадии НХЛ у детей:
I стадия — одна экстранодальная или нодальная опухоль
без локального распространения (кроме медиастинального, абдоминального, эпидурального поражения).
II стадия— одна экстранодальная опухоль + поражение регионарных лимфатических узлов;
— поражение двух и более групп лимфатических
узлов по одну сторону диафрагмы;
— две одиночные экстранодальные опухоли ± поражение регионарных лимфатических узлов по
одну сторону диафрагмы;
— первичная опухоль ЖКТ (илеоцекальный отдел) ±
± поражение мезентериальных лимфатических
узлов:
• IIR — резецированная (опухоль макроскопически полностью удалена);
• IINR — нерезецированная (опухоль макроскопически не полностью удалена).
За исключением медиастинальной и эпидуральной локализаций
201
Рис. 8.11. Больной с неход-
жкинской лимфомой — поражение мягких тканей спины.
Рис. 8.12. Больная с неходжкинской лимфомой — поражение обеих
молочных желез.
202
III стадия—две одиночные экстранодальные опухоли по обе
стороны диафрагмы;
— две и более групп лимфатических узлов выше и
ниже диафрагмы;
— все первичные внутригрудные опухоли;
— все распространенные внутрибрюшные опухоли,
нерезектабельные;
— все параспинальные и эпидуральные опухоли
независимо от других зон поражения.
IV стадия— любая из перечисленных выше с исходным поражением ЦНС и/или костного мозга (менее 25 %) и/или с
мультифокальным поражением скелета.
В анализах периферической крови у больных с I—II стадиями НХЛ изменений не отмечается; при III—IV стадиях часто
наблюдается анемия, при поражении костного мозга — умеренная тромбоцитопения, увеличение числа лейкоцитов, грануло-
цитов и иногда — властных клеток.
При биохимическом исследовании крови у больных с распространенным процессом характерно повышение уровня лакгатде-
гидрогеназы (ЛДГ) и реже — гаптоглобина и церулоплазмина.
V больных HXJI могут наблюдаться симптомы интоксикации (снижение массы тела более чем на 10 %, лихорадка выше
37,5—38 °С, потливость); при их наличии к клинической стадии
прибавляется символ "Б", а при отсутствии — "А".
Симптомами биологической активности процесса считаются:
1) повышение уровня ЛДГ выше 500 ЕД/л;
2) повышение уровня церулоплазмина в сыворотке крови
выше 200 ЕД/л.
Наличие этих симптомов обозначается символом "б”, а отсутствие — "а".
Диагностические исследования необходимо проводить до
начала специального лечения.
К обязательным исследованиям относятся пункция и биопсия опухолевого образования, пораженных лимфатических узлов или очагов экстранодального поражения с осуществлением
комплексного морфологического и иммунологического исследования опухолевых элементов и ткани для выяснения варианта
Т- или В-лимфомы.
Комплексное обследование проводится для уточнения локализации опухоли, распространения опухолевого роста, выявления поражения различных органов и клинической стадии заболевания с проведением следующих обязательных и дополнительных методов исследования.
Обязательные исследования
• Полное физикальное обследование.
203
• Клинический анализ крови.
• Биохимический анализ крови: ЛДГ,мочевая кислота, печеночные ферменты, креатинин, мочевина, белок.
• Исследование клеточного и гуморального иммунитета.
• Рентгенография органов грудной клетки в 2 проекциях.
• УЗИ органов брюшной полости, таза и грудной клетки.
• Радиоизотопное исследование лимфатической системы с
галлием-67.
• Пункция костного мозга (трепанобиопсия).
• Спинномозговая пункция.
• Консультация отоларинголога, невропатолога, окулиста.
• Цитологическое исследование.
• Иммунологическое исследование.
• Цитогенетическое исследование.
Дополнительные исследования
1. При поражении ЦНС: ЭХО-ЭГ, КТ, МРТ головы.
2. При поражении костей: МРТ, сканирование костей с тех-
нецием-99, прицельная рентгенография.
3. При поражении ЖКТ: эзофагогастродуоденоскопия, ко-
лоноскопия с биопсией.
4. При поражении органов грудной клетки: рентгенотомо-
графия, УЗИ, КТ.
5. При поражении яичек: УЗИ.
Комплексное обследование больных должно проводиться в
максимально короткие сроки для уточнения Т- или В-лимфо-
мы, определения клинической стадии заболевания и соответствующей группы риска, т. е. прогноза.
Важными факторами являются наличие бластных клеток в
костном мозге и цереброспинальной жидкости, а также показатели ЛДГ в сыворотке крови.
Дифференциальная диагностика различных вариантов НХЛ.
При лимфобластных лимфомахв большинстве случаев
опухолевые клетки имеют Т-тип различной степени зрелости и
только в 10—15 % случаев выявляются не-Т-клетки с фенотипом ранних пре-В-клеток (CD19+, 1а+ Са11а+) и пре-В-клеток
(CD19+, Ia+Calla+CLgM+).
В большинстве случаев НХЛ имеют не В-клеточную, а Т-
клеточную характеристику, а бластные клетки — L1 и
L2 морфологию.
Наиболее часто данный вариант НХЛ локализуется в средостении, поражая лимфатические узлы и вилочковую железу.
Поражение брюшной полости бывает редким и не сопровождается вовлечением илеоцекального отдела, характеризуется
увеличением лимфатических узлов, гепатоспленомегалией с
быстрым вовлечением в процесс костного мозга.
204
В отличие от других вариантов при Т-клеточной опухоли
наиболее часто наблюдается поражение костного мозга и ЦНС.
При беркиттоподобных, В-клеточных, вариантах лимфомы наиболее часто поражается брюшная полость (кишечная трубка и лимфатические узлы), а на втором
месте по частоте — глоточное (вальдейерово) кольцо и периферические лимфатические узлы.
Частым и наиболее благоприятным при этом варианте является поражение илеоцекального отдела. Характерным является
вовлечение в процесс челюстей и других костей лицевого скелета. Поражение костного мозга диагностируется редко.
Лимфобласты при данном варианте по морфологическим
характеристикам ^относятся к типам L3 FAB-классификации, а
по иммунологическим — к В-клеткам (CD19+, CD20+, CD22+,
Slg+, Ig+, Calla+).
Морфологически лимфобласты мелкие по размеру, ядро с
2—5 ядрышками и резкая базофилия цитоплазмы с вакуолизацией. Такие опухолевые клетки с наличием макрофагов создают картину "звездного неба".
Беркитгоподобная лимфома у детей составляет 90 % В-клеточных вариантов лимфом. Очень редко встречается неберкит-
топодобная В-лимфома из клеток герминативных центров лимфоидных фолликулов с теми же клиническими проявлениями.
Особым вариантом НХЛ являются крупноклеточные анапластические лимфомы, которые у детей встречаются в 15—
18 % случаев. Эта группа лимфом различна по морфологической и иммунологической характеристикам и наиболее сложна
для диагностики.
Большинство крупноклеточных лимфом имеет В-клеточное,
реже — Т-клеточное происхождение, однако необходимы дальнейшие иммунологические исследования для уточнения иммунологической характеристики этого варианта лимфом.
Так, с помощью моноклональных антител из группы крупноклеточных анапластических лимфом выделен особый тип
клеток — Ki-1+ (CD30+). Большинство опухолей из этой группы ранее относилось к злокачественному гистиоцитозу или
лимфогранулематозу (саркоме Ходжкина).
Ki-1-антиген был выделен в 1985 г. на отдельных клетках Березовского — Штернберга при лимфогранулематозе. Его присутствие не характерно для клеток моноцитарно-макрофагаль-
ной системы. Однако при Ki-1-лимфоме все 100 % опухолевых
клеток CD30 (Ki-1) положительные.
Морфологически такие опухолевые клетки представлены
крупными анаплазированными элементами и схожи с опухолевыми клетками при злокачественном гистиоцитозе.
Проведенные нами комплексные морфологические исследования опухолевых клеток у 60 больных указали на крупно¬
205
клеточную анапластическую лимфому или злокачественный
гистиоцитоз.
Цитологические исследования выявили два типа опухолевых
клеток: 1) крупные клетки округлой или овальной формы с явлениями полиморфизма, базофилии цитоплазмы, наличием
нуклеол или их отсутствием, нежно-петлистым хроматином ядра, умеренно выраженными признаками атипии; 2) очень крупные опухолевые клетки с резко выраженными признаками атипии, ядром округлой или полигональной формы и плотной
структурой ядерного хроматина.
При иммунологическом типировании опухолевых клеток отмечено три варианта: 1) экспрессия только CD30+; 2) CD30+,
CD19+ и CD30+, CD22; 3) CD30+, CD68+, CD10+,
МАС387 и т. д.
При этом цитоиммунологические параллели не были выявлены. Обнаружение почти во всех опухолевых клетках CD 30+
указывало на крупноклеточную анапластическую Ki-1-лимфому, а выявление СБЗО-антигена в отдельных клетках в сочетании с CD 19+ и CD22+ — на В-крупноклеточную анапластическую лимфому; сочетание CD68+, CD14+ и др. свидетельствовало о злокачественном гистиоцитозе.
Морфологически клетки К-1-лимфомы могут быть схожи с
клетками при злокачественном гистиоцитозе даже по данным
электронной микроскопии. Однако при злокачественном гистиоцитозе в отличие от экспрессии К-1-антигена (CD30+) при крупноклеточной анапластической лимфоме обнаруживают в клетках маркеры CD68+, CDlla, CD14+, эритрофагоциты; имеется
положительная реакция клеток на неспецифическую эстеразу,
ингибируемую NaF. Все эти признаки отсутствуют при крупноклеточной анапластической Ki-1-лимфоме.
Кроме Ki-1-лимфомы, различают самостоятельные варианты
крупноклеточных лимфом. Клетки крупных размеров с признаками анаплазии типа иммунобластов. В опухолевой ткани часто
присутствуют макрофаги. Большинство крупноклеточных лимфом имеет В-клеточную природу.
Определенное число крупноклеточных лимфом имеет и гис-
тиоцитарное происхождение и носит название «злокачественный гистиоцитоз».
Клинические симптомы крупноклеточных анапластических
лимфом часто имеют одинаковые характеристики, но отличаются от обычных вариантов НХЛ. Их отличительной особенностью является более частое поражение кожи, мягких тканей,
костной системы и периферических лимфатических узлов с
проявлением у всех больных симптомов интоксикации и особенно лихорадки; нередко наблюдаются распад опухолевой ткани,
изъязвление. Однако может также встречаться поражение средостения и лимфатических узлов брюшной полости, редко —
костного мозга и ЦНС.
206
Такая клиническая картина заболевания с проявлениями
симптомов интоксикации имеет сходство со злокачественным
гистиоцитозом. Поэтому для дифференциального диагноза
крупноклеточных анапластических лимфом и злокачественного гистиоцитоза необходимо проведение иммунологических исследований опухолевых клеток с выявлением маркеров, характерных для данной опухоли. Это является обязательным при
выборе программ лечения.
Клинико-морфологические характеристики вариантов НХЛ
у детей представлены в табл. 8.2.
Дифференциальная диагностика НХЛ с лимфогранулематозом (ЛГМ) проводится с учетом характерной морфологии опу-
Таб л и ца 8.2. Клинико-морфологические характеристики вариантов
НХЛ у детей
Вариант лимфомы
Показатель
не-В-клеточная
В-клеточная
крупноклеточная
анаплазированная
Типичная
локализация
Тимус
Лимфатические
узлы средостения
Мезентериальные лимфатические узлы
Любая
Цитоморфология (FAB)
L1
L2
Неклассифици-
руемая
L3
Неклассифици-
руемая
Неклассифици-
руемая
Гистология
(WF)
Лимфобластная
Иммунобластная
Недифференци¬
руемая
Беркиттоподоб-
ная
Иммунобластная
из больших клеток фолликулярных центров
Из крупных
анаплазированных клеток
Иммунология
Т-клеточные
Маркеры
CALLA
(CD10±)
пре-В (Clg+;
sig-)
SlgG+
Ki-1 (CD30)
Цитогенетика
t(8;14)(g24;gl 1)
t(H;i4)
t(8; 14)(g24;g32)
t(2;8); t(8;22)
t(2;5)
207
холевой ткани после выполнения пункции и биопсии опухоли.
Типичным субстратом опухоли при ЛГМ являются опухолевые
клетки Березовского—Штернберга и клетки Ходжкина, которые различаются размером, характеристикой ядра, цитоплазмы
и особенно большими размерами нуклеолы в ядре клетки. В зависимости от стадии заболевания в опухолевой ткани могут наблюдаться лимфоидное преобладание, смешанно-клеточная
пролиферация, нодулярный склероз и лимфоидное истощение.
Течение заболевания при ЛГМ более медленное, с наиболее
частым поражением периферических лимфатических узлов средостения и реже — лимфатических узлов брюшной полости и селезенки. Поражения органные — легких, костей, кишечника —
наблюдаются реже и ассоциируются с IV стадией заболевания.
На основании изучения прогностических факторов больные
с НХЛ распределяются по группам риска. При В-клеточной
опухоли, кроме стадии заболевания, учитываются результаты
операции: полное или неполное удаление опухоли с оценкой ее
массы и уровня ЛДГ.
Группы риска НХЛ у детей:
В-клеточные НХЛ:
R1 — стадия I—IIR; первичная опухоль макроскопически
полностью удалена.
R2 — стадия IINR—III; первичная опухоль не удалена или
удалена не полностью:
• только экстраабдоминальное поражение;
• интраабдоминальная локализация при показателях
ЛДГ, не превышающих удвоенные нормальные значения до начала ПХТ после первичной операции.
R3 — стадия IINR, III, IV; первичная опухоль не удалена
или удалена не полностью и имеет место хотя бы один из нижеперечисленных признаков:
• при абдоминальном поражении увеличение ЛДГ
более чем в 2 раза от возрастной нормы перед началом ПХТ после первичной операции;
• поражение ЦНС;
• поражение костного мозга;
• мультифокальное поражение костей;
• В-ОЛЛ (>25 % бластов в костном мозге).
Не-В-клеточные НХЛ:
I и II стадии относятся к группе стандартного риска.
III и IV стадии относятся к группе среднего риска.
Ki-лимфомы:
К1 —больные с I и IIR стадиями, по классификации
S. Murphy;
К2 — больные с IINR и III стадиями;
КЗ — больные с IV стадией.
208
НХЛ детского возраста в значительной степени отличаются
от лимфом, возникающих у взрослых больных, прежде всего
тем, что у взрослых опухоли развиваются из более зрелых предшественников Т- и В-лимфоцитов. У детей более 95 % НХЛ составляют высокозлокачественные варианты с диффузным характером роста. Характерной особенностью НХЛ у детей является быстрая генерализация процесса с вовлечением в процесс
костного мозга и ЦНС, а также преобладание экстранодальных
локализаций. НХЛ детского возраста имеют очень высокий пролиферативный потенциал, поэтому большинство больных поступают в клинику с распространенными стадиями заболевания.
Таким образом, даже локализованные стадии следует рассматривать как первично-генерализованные, что должно отражаться на выборе программы лечения.
Биологические особенности НХЛ у детей учитываются при
разработке всей программы терапии, благодаря чему повышается эффективность лечения.
Лечение. Современные программы лечения НХЛ у детей основаны на индивидуальном подходе с учетом различных морфологических и клинических вариантов заболевания. Высокая
митотическая активность клеток определяет хорошую чувствительность к терапии НХЛ у детей.
С целью выбора лечения НХЛ можно подразделить на ряд
клинических групп, которые принципиально формируются по
гистологическим критериям, несмотря на все расширяющиеся
познания в области иммунобиологии лимфом. При наличии
нескольких клинически эквивалентных классификаций рабочая
классификация (Working Formulation) дает полезное подразделение лимфом на опухоли низкой, промежуточной и высокой
степени злокачественности. Агрессивные лимфомы, которые
бывают промежуточной и высокой степени злокачественности,
требуют применения интенсивных химиотерапевтических режимов, которые могут значительно различаться по интенсивности доз, набору противоопухолевых препаратов и необходимости профилактики поражения ЦНС. По мере улучшения лечения
и понимания природы этих заболеваний значение прогностических факторов, таких как масса опухоли и гистология, будет
уменьшаться.
В отличие от больных с лимфомами низкой степени злокачественности у пациентов, страдающих опухолями промежуточной и высокой степени злокачественности, прогноз заболевания
бывает плохим в случае применения неинтенсивной химиотерапии типа CVP (циклофосфан, винкристин, преднизолон) или
монохимиотерапии. Так, при использовании режима CVP полные ремиссии достигаются в 25—30 % случаев, при этом у большинства больных впоследствии развивается рецидив, заканчивающийся смертельным исходом. Стало очевидным, что отсутствие полной первичной ремиссии или возникновение рецидива
209
ассоциируются с быстрым прогрессированием болезни и смертью. К сожалению, несмотря на разработку высокоэффективных
химиотерапевтических режимов, способных вызывать длительные ремиссии, не существует действительно эффективных комбинаций для рецидивных больных (10—20 % длительных повторных ремиссий).
Следует иметь в виду, что химиотерапевтические режимы с
одинаковой эквивалентностью достижения полных ремиссий
не обязательно будут ассоциироваться с одинаковой частотой
рецидивов. Так, при сравнении комбинации С-МОРР (цикло-
фосфамид, метотрексат, винкристин, прокарбазин, преднизо-
лон) и ВАСОР (блеомицин, доксорубицин, циклофосфамид,
винкристин, преднизолон) оказалось, что полные ремиссии
были достигнуты в 49 и 51 % случаев. При этом рецидивы впоследствии были выявлены соответственно у 52 и 32 % больных.
Многие клинические успехи ранее достигались за счет добавления или замены препаратов, а также изменения доз и режимов.
Так, добавление доксорубицина к комбинации CVP с изменением доз и режима введения препаратов привело к появлению схемы CHOP, которая оказалась значительно эффективнее предыдущего режима в отношении выживаемости больных. Однако
дальнейшие модификации, такие как СНОР-блеомицин и
ВАСОР, существенно не улучшили результатов, полученных при
использовании комбинации CHOP, вероятно, потому, что добавление доксорубицина являлось наиболее важным фактором.
Несмотря на имеющиеся успехи, основная проблема химиотерапевтических режимов первого поколения заключалась в
низком проценте излечения пациентов. Поэтому для повышения эффективности при разработке комбинаций второго поколения стали использовать большее количество неперекрестнорезистентных препаратов, назначаемых короткими чередующимися циклами.
Появление режимов третьего поколения позволило лишь несколько повысить процент полных ремиссий, так как режимы
принципиально создавались по упомянутому выше варианту.
Исключение составил режим МАСОР-В. Прежде всего препараты вводили каждую неделю за счет чередования агентов, обладающих и не обладающих миелосупрессивным эффектом.
Все лечение заканчивалось в течение 12 нед по сравнению с
16—40 нед при применении других химиотерапевтических режимов. Способность достижения полной эрадикации опухоли
за столь короткий период времени дала повод предположить,
что использование эффективных препаратов, вводимых в высокоинтенсивном дозовом режиме, является важным моментом
лечения. При этом в случае химиочувствительных опухолей
длительное применение терапии, вероятно, нецелесообразно.
Принципы создания режима МАСОР-В послужили основой
для разработки будущих лекарственных комбинаций.
210
Интенсивные химиотерапевтические режимы третьего поколения могут применяться у больных с распространенными лимфомами промежуточной и высокой степени злокачественности.
В ряде случаев, когда предполагается, что больной не перенесет
интенсивной терапии, можно воспользоваться менее интенсивными режимами типа CHOP.
При этом, однако, следует помнить о снижении вероятности
достижения полной ремиссии.
Лимфомы высокой степени злокачественности могут иметь
различную клеточную природу, что сказывается на клинической
картине, чувствительности к химиотерапии и прогнозе. Следует
помнить, что стадирование и определение понятия лимфобластной лимфомы варьируют в широких пределах в зависимости
от медицинского учреждения, что затрудняет сравнение клинических исследований. В некоторых случаях лимфобластную лимфому отличают от Т-клеточного острого лимфобластного лейкоза по наличию менее 25 % бластных клеток в миелограмме. Другие исследователи таких различий не делают.
Этот факт важно иметь в виду при интерпретации результатов химиотерапии, так как прогноз у больных со значительным
поражением костного мозга может быть хуже при проведении
одинаковой химиотерапии.
У больных лимфобластными лимфомами могут возникать состояния, требующие срочного вмешательства. Так, у детей с
большими опухолями средостения может возникнуть синдром
верхней полой вены в виде диспноэ, дисфагии, сердечной аритмии и тампонады сердца. При этом имеется высокий риск анестезиологических осложнений, сердечной недостаточности и
кровотечения из расширенных сосудов средостения. У этой группы больных часто встречается плевральный выпот и иногда —
выпот в перикарде. В обоих случаях может потребоваться экстренная помощь.
Нужно учитывать, что эффект лучевой терапии при наличии
синдрома верхней полой вены неоднозначен, принимая во внимание тот факт, что облучение не дает прогностических преимуществ, но усиливает токсичность антрациклинов. Лишь в
редких случаях при малой эффективности химиотерапии может
быть показано облучение средостения. У отдельных больных
при угрожающих ситуациях можно использовать комбинированную химиолучевую терапию. При этом доза лучевой терапии
должна составлять 120 сГр.
Вовлечение в процесс ЦНС к моменту диагностики также
может потребовать срочного добавления лучевой терапии к общей программе лечения, так как одна химиотерапия не позволит излечить больного.
Пациентам с поражением черепных нервов или с внутримозговым процессом показано применение дозы 3000 сГр. Большинству больных с параплегией также рекомендуется лучевая
211
терапия, однако параспинальные опухоли чувствительны к химиотерапии и облучение не имеет преимуществ перед одной
химиотерапией. Тем не менее в случае выраженного парапареза
многие онкологи предпочитают комбинированную химиолуче-
вую терапию, учитывая потенциальные неврологические осложнения при возможной недостаточной эффективности одной химиотерапии.
Несмотря на эти проблемы, можно получать хорошие результаты у детей с НХЛ высокой степени злокачественности.
Анализ результатов лечения показал, что лимфобластные лимфомы лучше реагируют на интенсивные режимы, разработанные для терапии лейкоза, в то время как нелимфобластные опухоли — на лимфомные режимы, основными компонентами которых являются алкилирующие агенты. Клинический протокол
LSA2L2, разработанный N. Wollner, включает в себя
10 препаратов, таких как циклофосфамид, винкристин, дауно-
мицин, цитозин арабинозид, L-аспарагиназу, преднизон и др.;
он был основан на принципах лечения острого лимфобластного
лейкоза (ОЛЛ). После проведения интенсивной индукции и
консолидации больные находились на поддерживающем лечении в течение 1 года. Длительная безрецидивная выживаемость
у этой группы больных составила 73 %. У больных с локальным
процессом выживаемость достигала 90 %. Аналогичные результаты были получены у больных лимфобластной лимфомой при
использовании лейкозоподобного протокола АРО, включающего адриамицин, преднизон и винкристин.
С другой стороны, результаты лечения детей с нелимфобластными лимфомами при применении протокола LSA2L2 были
значительно хуже: 2-летняя выживаемость составила лишь
26 %. Другое исследование показало, что комбинации А-СОР
(доксорубицин, циклофосфамид, винкристин, преднизон), режим 77-04 (циклофосфамид, доксорубицин, винкристин, метотрексат, преднизон), разработанный в Национальном онкологическом институте США, и LSA2L2 обладают одинаковой
эффективностью как при лимфобластных, так и при нелимфобластных лимфомах у детей.
Анализ указанных выше сведений позволил сделать вывод о
том, что наиболее важными препаратами для лечения больных
лимфобластными и нелимфобластными лимфомами высокой
степени злокачественности являются циклофосфамид, антра-
циклины, винкристин и преднизон.
Кроме того, принимая во внимание высокую частоту рецидивов в ЦНС у больных лимфомами высокой степени злокачественности, считается обязательным проведение профилактики
поражения ЦНС у этой категории больных. Этого можно добиться путем прямого введения метотрексата или цитозин ара-
бинозида в ЦНС, а также системного использования высоких
доз метотрексата. В настоящее время не доказано, что крани¬
212
альное облучение эффективнее химиотерапии для профилактики поражения ЦНС, а принимая во внимание потенциальные
побочные эффекты лучевой терапии, включая интеллектуальные функции, от применения ее следует по возможности воздерживаться.
Разработка в Германии терапевтической программы BFM
(Берлин — Франкфурт — Мюнстер) привела к достижению у
78 % больных с III—IV стадиями лимфобластной лимфомы
длительной выживаемости. Усовершенствование этой программы в зависимости от клеточной принадлежности лимфомы позволило еще более улучшить результаты терапии.
Наиболее эффективным лечением неходжкинской лимфомы у детей в настоящее время является полихимиотерапия
(ПХТ). Применяемые противоопухолевые препараты, их дозы
и длительность лечения зависят от стадии заболевания и характеристики прогноза, т. е. групп риска. Программы лечения в
виде индукции, консолидации и поддерживающей терапии различаются при В- и не-В-клеточной (Т-клеточной) лимфоме.
Основные принципы лечения НХЛ у детей включают следующие положения:
1. Программы лечения зависят от иммунологического исследования (Т-клеточная, В-клеточная, Ki-1-лимфома).
2. При I и II стадиях заболевания применяется менее интенсивная химиотерапия, при этом длительная выживаемость
больных составляет 85 %.
3. При всех морфологических и иммунологических вариантах НХЛ у детей обязательна профилактика поражения ЦНС.
4. При проведении интенсивной программной химиотерапии НХЛ у детей лучевая терапия не показана.
Для программ лечения Т-клеточных (не-В-клеточных) лимфом характерными являются:
1. Длительный, непрерывный (в течение 2 лет) курс лечения.
2. Основные препараты — винкристин, антрациклиновые антибиотики, L-аспарагиназа, антиметаболиты (6-меркаптопурин,
метотрексат).
3. Различия в программе лечения зависят только от стадии
заболевания.
4. Поддерживающая терапия проводится в течение 1,5 лет.
5. Для профилактики и лечения поражения ЦНС применяют
эндолюмбальную химиотерапию и облучение головного мозга.
Для программ лечения В-клеточных лимфом характерными
являются:
1. Короткие курсы высокодозной химиотерапии с продолжительностью лечения до 6 мес.
2. Основные препараты: метотрексат в высоких дозах (от
1 до 5 г/м2 на введение), циклофосфан (ифосфамид), цитозар,
вепезид, адриабластин.
213
3. Отсутствие поддерживающей химиотерапии.
4. Тактика химиотерапии зависит от массы опухоли, объема
хирургического вмешательства и уровня сывороточной ЛДГ.
5. Профилактику и лечение поражения ЦНС осуществляют
интратекальным введением химиопрепаратов без облучения головного мозга.
Оперативные вмешательства при НХЛ у детей.
Диагностика и лечение НХЛ у детей представляет определенные сложности для хирурга. Оперативные вмешательства важны
для уточнения характера опухолевого процесса, его распространенности, определения возможности удаления опухоли, а также
в ряде случаев для контроля за эффективностью лечения посредством исследования резидуального образования. Следует подчеркнуть, что объем операции должен быть согласован с онкогематологом.
Хирургический метод оказывает положительное действие у
больных с локализованным процессом, особенно при поражении илеоцекального отдела кишечника при угрозе или возникшем осложнении (перфорация, кровотечение), и заключается в
резекции илеоцекального угла или правосторонней гемиколэк-
томии. При полностью удаленной НХЛ у больного имеются
большие шансы на выздоровление при меньшей интенсивности и продолжительности лечения. С другой стороны, важно
иметь в виду, что выполнение неоправданно тяжелых и обширных оперативных вмешательств может привести к отсрочке химиотерапии, что будет способствовать генерализации процесса
и ухудшению прогноза заболевания.
В случае предполагаемой радикальной операции хирург должен:
1) выполнить операцию таким образом, чтобы имелась возможность своевременно начать химиотерапию;
2) убедиться в том, что опухоль не прорастает жизненно важные органы; при этом необходимо помнить, что хирургическое
удаление больших участков кишки, почек, матки, яичников, селезенки, легкого и пр. является серьезной ошибкой, так как
специфическая инфильтрация этих органов, как правило, подвергается обратному развитию на фоне химиотерапии;
3) быть уверенным в том, что риск операции не чрезмерен
и через 3—5 дней ребенок сможет начать лечение;
4) иметь информацию, что у больного нет поражения костного мозга и/или ЦНС — в противном случае показана лишь
биопсия опухоли.
В случае полного удаления опухоли проводят тщательную
ревизию брюшной полости и удаляют лимфатические узлы более 1 см в диаметре. Операция считается нерадикальной, если
не удалось удалить регионарные или отдаленные лимфатиче¬
214
ские узлы более 1 см в диаметре при макроскопически резецированной опухоли.
В ряде случаев для принятия решения об объеме оперативного вмешательства у больных НХЛ и с целью проведения дифференциальной диагностики с другими новообразованиями ин-
траоперационно выполняются отпечатки на стекле со срочным
цитологическим исследованием опухолевых клеток.
При выполнении биопсии хирург обязан:
1) вместе с онкогематологом определить, какие лимфатические узлы выбрать для биопсии. Типичной ошибкой является
удаление наиболее легкодоступного образования, в то время
как пораженные узлы могут располагаться более глубоко;
2) взять достаточное количество материала для необходимых
исследований; целесообразно удалять не менее двух лимфатических узлов (вместе с капсулой) размером более 1,5 см в диаметре и плотных на ощупь; для выполнения отпечатков узел
разрезают вдоль, при этом плоскость разреза должна проходить
через ворота лимфатического узла;
3) бережно относиться к биоптату, помня, что разрушенные
ткани непригодны для исследования;
4) путем тщательной ревизии определить объем и распространенность опухолевого процесса.
У больных с локализацией НХЛ в средостении торакотомию
или медиастинотомию выполняют лишь при отсутствии увеличенных периферических лимфатических узлов, плеврального
выпота или поражения костного мозга. При этом операция заключается в биопсии, так как хирургический метод не является
лечебной процедурой при лимфомах средостения.
Повторная операция показана больным с локальной НХЛ,
сохраняющейся после проведения индуктивной химиотерапии
для дифференциальной гистологической диагностики между
резидуальной опухолью и фиброзными изменениями. При обнаружении небольшой резидуальной опухоли и отсутствии поражения костного мозга и ЦНС ее по возможности удаляют.
Тактика лечения крупноклеточных анапластических лимфом зависит от стадии заболевания и группы риска и в основном совпадает с таковой при В-клеточных НХЛ.
Тактика сопроводительной терапии при лечении не-В- и В-клеточных НХЛ у детей. В настоящее время разработан целый комплекс мер, позволяющих
уменьшить частоту и тяжесть побочных реакций и осложнений
во время проведения химиотерапии НХЛ у детей.
Принципы сопроводительной терапии:
• обеспечение надежного долгосрочного центрального венозного доступа с помощью туннелизируемых катетеров;
• обеспечение возможности адекватной заместительной терапии тромбоконцентратами для поддержания уровня
215
тромбоцитов >20 000/мкл, а при появлении абдоминальной симптоматики или пневмонии — >50 000/мкл;
• проведение селективной оральной деконтаминации, включающей антибиотики, антимикотики, а также профилактику мукозита с первых дней циторедуктивной фазы;
• для лечения инфекционных осложнений в период ней-
тропении — применение цефалоспоринов III генерации с
антипсевдомонадной активностью (фортум, цефобид,
цефтриаксон) и/или В-лактамных пенициллинов с ами-
ногликозидами, метронидазола, амфотерицина-В;
• проведение парентерального питания (частичного или
полного) при невозможности продолжить полноценное
энтеральное, при потере массы тела >10 %, подозрении
на нейтропенический энтероколит.
В начале лечения главную опасность представляют синдром
лизиса опухоли и развитие мочекислой нефропатии с острой
почечной недостаточностью. Главным условием предупреждения развития токсических реакций, вызванных этим синдромом, является применение массивной инфузионной терапии в
дозе 3000 мл/м2 в сутки (125 мл/м2 в час) в составе: 5 % глюкоза — 1500 мл/м2 в сутки; 0,9 % NaCl — 1320 мл/м2 в сутки;
4 % NaHC03 - 180 мл/м2.
Диурез стимулируется введением лазикса. В профилактике
мочекислой нефропатии важную роль играет назначение алло-
пуринола в дозе 300 мг/м2 в 3 приема в сутки (10 мг/кг), в первые 3—8 дней лечения.
Тромбоконцентрат переливается для поддержания количества
тромбоцитов на уровне 50 • 109/л, позволяющем избежать кровотечения (особенно в случаях высокого бластного лейкоцитоза).
Эритроцитная масса переливается для поддержания гема-
токрита на уровне 30 %, исключая случаи с инициальным гиперлейкоцитозом, когда трансфузия эритроцитной массы может
резко повысить риск церебрального лейкостаза.
Инфекционные осложнения могут появиться на любом этапе лечения, однако наиболее опасны при развитии агранулоцитоза в периферической крови (с количеством гранулоцитов ниже 500/м3).
При развитии агранулоцитоза в периферической крови необходимы изоляция ребенка и проведение соответствующей терапии.
Иммунология, иммунотерапия и иммунокоррекция при НXЛ. Известно, что НХЛ является опухолью иммунной системы. Проведенные исследования иммунной системы позволили обнаружить у больных детей существенные нарушения Т- и В-клеточного звена иммунитета, которые
еще более усугубляются у больных после применения интенсивной химиотерапии. При обследовании детей с НХЛ до начала химиотерапии было обнаружено, что содержание Т-лим-
216
фоцитов было снижено у 76,8 % больных, а функциональная
активность лимфоцитов была подавлена в 2,5 раза у 90,2 %
больных НХЛ по сравнению с группой здоровых детей. Кроме
того, у 71,3 % больных отмечено снижение содержания В-лим-
фоцитов периферической крови, а также уровня иммуноглобулинов А и М классов соответственно в 96,3 и 87,4 % случаев.
В результате изучения у больных НХЛ синтеза интерферона
отмечено нарушение способности мононуклеаров периферической крови вырабатывать гамма- и альфа-интерферон, что проявляется в виде синдрома недостаточности интерферона, ведущего к нарушениям иммунного ответа. При изучении прогностического значения способности мононуклеаров периферической
крови вырабатывать гамма-интерферон на течение НХЛ выяснилось, что эта способность была снижена в 2 раза у больных,
умерших в течение первого года от начала заболевания в связи
с прогрессированием процесса, по сравнению с детьми, у которых в последующем имелось безрецидивное течение НХЛ более 1 года, а титр выработки гамма-интерферона у них составил
253,24 ЕД/мл.
В настоящее время доказано, что интерферон обладает антивирусным, антипролиферативным, противоопухолевым и ан-
тиметастатическим действием.
С целью улучшения выживаемости детей, больных НХЛ и
находившихся в полной ремиссии, показана интерферонотера-
пия и иммунокоррекция препаратом тактивин, что приводит к
повышению 2- и 5-летней выживаемости больных, получавших
такое лечение.
При сравнении различных препаратов выяснилось, что наилучшие показатели 2- и 5-летней безрецидивной выживаемости
были у больных, получавших реаферон в сочетании с тактиви-
ном, а наихудшие — у больных, получивших только человеческий лейкоцитарный интерферон.
Учитывая эти данные, нужно считать оправданным применение у детей, больных НХЛ, под контролем иммунного статуса
различных иммуномодуляторов (тактивин, имунофан; витамины группы А — бета-каротин; витамин С), а также гамма- и альфа-интерферона.
Контроль за состоянием иммунитета и выработки интерферона, а также применение иммуностимуляторов будут способствовать уменьшению частоты инфекционных осложнений, рецидивов заболевания и повышению выживаемости больных.
Рецидивы при НХЛ у детей. Несмотря на несомненные успехи в лечении НХЛ у детей, в ряде случаев возникает рецидив
заболевания, требующий особых подходов к терапии этого
серьезного осложнения, которое ассоциируется с неблагоприятным прогнозом.
Перед началом лечения рецидива НХЛ необходимо точно
установить его существование. Некоторые состояния могут си¬
217
мулировать наличие лимфомы. Так, большие проблемы могут
возникнуть у больных с крупными абдоминальными опухолями
или опухолями средостения в момент диагностики. После проведения противоопухолевой терапии эти новообразования могут сократиться в размерах, но не исчезнуть полностью. При
повторной биопсии очень часто выявляют фиброзные или жировые изменения без наличия жизнеспособной ткани. Однако
такие явления чаще всего обнаруживаются у пациентов с нодулярной лимфомой, в которой коллагеновое вещество не изменяется под воздействием лечения. Лучевая терапия в случае ее
применения у больных с резидуальным процессом может еще
более усложнить ситуацию, приводя к усилению фиброза, особенно в легочной ткани, прилегающей к средостению.
Другая проблема может быть связана с плевральным выпотом. Необходимо тщательное исследование плевральной жидкости у больных с негативными цитологическими данными в
отношении злокачественного процесса. В этих случаях целесообразно изучить поверхностные маркеры, применить проточную цитометрию и в ряде случаев использовать цитогенетические методы. При этом следует помнить, что констриктивный
перикардит как осложнение лучевой терапии может симулировать злокачественный процесс. Однако в этом случае жидкость
будет иметь характеристики транссудата.
При подозрении на рецидив лимфомы необходимо предпринять попытку биопсии резидуальной опухоли. При этом можно
выполнить эксцизионную биопсию или, при локализации процесса в брюшной полости, игловую аспирационную биопсию.
При лечении НХЛ по различным интенсивным программам
рецидивы возникают не часто: при В-НХЛ — у 9,5 %, а при
Т-НХЛ — у 16 % больных. У детей с В-клеточной НХЛ большинство рецидивов выявляется в первые 6—8 мес, а после года
вероятность их выявления практически равна нулю. При Т-кле-
точной НХЛ наиболее часто рецидивы диагностируются в первые 2 года, затем частота их с каждым годом уменьшается.
Обычно рецидив возникает не в области первйчного очага,
а в костном мозге или ЦНС. При этом возможно изолированное поражение головного мозга.
Несмотря на высокую чувствительность лимфомы Беркитта
к химио- и лучевой терапии, прогноз у рецидивных больных до
последнего времени был неудовлетворительным и длительная
выживаемость почти не отмечалась. Успехи появились лишь с
момента применения высокодозной химиотерапии в сочетании
с трансплантацией аутологичного костного мозга (АуТКМ).
После того как была показана взаимосвязь дозы и эффекта,
появились подтверждающие это мнение исследования с использованием различных химиотерапевтических режимов. При
этом наблюдался высокий непосредственный эффект у больных с рецидивом заболевания. Последующие длительные ре¬
218
миссии и вероятное полное выздоровление ряда больных подтвердили эффективность такого подхода у больных лимфомой
Беркитга. Тем не менее остается ряд нерешенных проблем, связанных с показаниями и техникой АуТКМ при лимфоме Беркитга. К ним относятся вопросы: 1) каков оптимальный химиотерапевтический режим и нужно ли добавлять тотальное облучение тела (ТОТ); 2) каким больным показана АуТКМ и можно
ли ее проводить в период первой полной ремиссии.
В настоящее время существуют различные высокодозные
химиотерапевтические режимы, используемые в сочетании с
АуТКМ. Первоначально предложенный режим ВАСТ (карму-
стин, цитарабин, циклофосфамид, тиогуанин) был впоследствии
интенсифицирован за счет тройного увеличения дозы BCNU.
Режим BEAM (этопозид, мелфалан) был разработан с целью
снижения токсичности комбинации ВАСТ. Применение тотального облучения тела (ТОТ) до настоящего времени ставится
под сомнение. Место ТОТ в процессе подготовительного режима у больных с лейкозом не вызывает сомнений у большинства
исследователей, но не у всех, так как некоторые виды интенсивной терапии не приводят к санации костного мозга. Однако
при лимфоме Беркитга ТОТ не является необходимым, так как
приживление трансплантата не проблема при АуТКМ.
Существуют и другие подготовительные режимы, используемые при лимфоме Беркитга в сочетании с ТОТ или без него:
циклофосфамид + кармустин; циклофосфамид; циклофосфамид + доксорубицин + винбластин + цитарабин + метотрексат
и др.
Кроме того, добавление ТОТ усиливает токсичность за счет
увеличения частоты интерстициального пульмонита и энцефалопатии, а у маленьких детей необходимо помнить об отдаленных последствиях.
В настоящее время на основании имеющегося опыта можно
сделать заключение о том, что около 20 % детей с лимфомой
Беркитга являются потенциальными кандидатами для высоко-
дозной химиотерапии в сочетании с АуТКМ. К ним относятся:
• больные с частичным эффектом после первичного лечения;
• дети с рецидивом, чувствительным к химиотерапии;
• пациенты с поражением ЦНС в момент диагностики, особенно с вовлечением в процесс более 25 % костного мозга.
Больные с рецидивом лимфобластной лимфомы также являются кандидатами для трансплантации костного мозга при
наличии чувствительности к химиотерапии. У большинства
больных, получавших циклофосфамид в сочетании с ТОТ, выживаемость лучше, чем у пациентов, которым проводилась
только химиотерапия во время рецидива. Стратегия лечения у
этой категории больных должна быть такой же, как у больных
219
с лейкозом, и при достижении ремиссии и наличии совместимого донора — АлТКМ.
При В-клеточной лимфоме возможно достижение второй
ремиссии, однако, как правило, она бывает короткой, а вероятность излечения не превышает 5 %.
После завершения интенсивной программы лечения в течение 1,5—6 мес (в зависимости от группы риска) дети с В-клеточной НХЛ не получают дополнительной поддерживающей
терапии. Контроль в динамике заключается в клинической
оценке, анализах крови (клинический и биохимический) с обязательным исследованием ЛДГ, УЗИ очагов первичного поражения. При необходимости проводится детальное обследование, аналогичное первичному.
После завершения всей интенсивной программы лечения,
проводящейся в течение 4,5—6,5 мес в зависимости от группы
риска и облучения головного мозга, дети с Т-клеточной НХЛ
получают поддерживающую терапию в течение 24 мес, включая
первоначальное лечение. Динамический контроль осуществляется по тем же принципам, как и при В-клеточной НХЛ.
После окончания интенсивной терапии в течение 4—6 мес в
зависимости от группы риска больные с крупноклеточной анапластической лимфомой (ККАЛ) не получают поддерживающего лечения. Однако в настоящее время изучается вопрос о
применении у больных с ККАЛ поддерживающего лечения,
особенно с III и IV стадиями заболевания. Динамический контроль включает клиническую оценку, клинический и биохимический (ЛДГ) анализы крови, УЗИ брюшной полости и рентгенографию грудной клетки.
Несмотря на всевозможные усилия, направленные на снижение токсичности терапии, режимы ее остаются достаточно
агрессивными, что может сопровождаться непосредственными
и отдаленными осложнениями. Для их профилактики и лечения используется сопроводительная терапия, которая не менее
важна, чем сама цитостатическая терапия. Основные принципы
сопроводительной терапии дают возможность не только перенести интенсивное лечение, но в основном предупредить поздние осложнения, что в итоге обеспечивает качество жизни онкологических больных. Отдаленные осложнения могут быть
связаны с нарушением функций различных органов и систем,
а также с развитием вторых опухолей.
Как результат применения алкилирующих препаратов и ионизирующего излучения возможны нарушения со стороны
ЦНС, эндокринной системы, сердца и легких, печени и почек.
Применение антрациклинов, особенно в комбинации с цикло-
фосфаном, метотрексатом и облучением средостения и позвоночника, способствует возникновению осложнений со стороны
сердца. Кумулятивная доза антрациклиновых антибиотиков,
превышающая 450 мг/м2, может привести к появлению серьез¬
220
ных и порой необратимых изменений в сердечной мышце, требующих в ряде случаев пересадки органа.
Вторые опухоли развиваются у 4 и более процентов больных
в сроки от 4 до 10 лет после завершения лечения. Как правило,
возникают нелимфобластные лейкозы, хотя возможны и другие
опухолевые заболевания. В последние годы появились сообщения о развитии вторых опухолей в более ранние сроки (через
15—20 мес) при лечении эпиподофилотоксинами (вепезид, те-
нипозид) с увеличением среди них доли ОЛЛ.
Это следует иметь в виду при наблюдении за детьми, перенесшими лечение по поводу НХЛ. В связи с этим нельзя ставить вопрос о формальном снятии с учета этой категории больных — они должны находиться под наблюдением врача в течение длительного периода времени.
Выявленные нарушения со стороны различных органов и
систем должны лечиться соответствующими специалистами совместно с онкологом. В реабилитационный курс целесообразно
включать санаторно-курортное лечение по специализированным программам.
Многие больные, излеченные от НХЛ, нуждаются в психологической реабилитации, медико-генетическом консультировании по вопросам семьи и брака, а также в социологической
помощи при выборе специальности.
Глава 9
БОЛЕЗНЬ ХОДЖКИНА
(ЛИМФОГРАНУЛЕМАТОЗ)
Болезнь Ходжкина является опухолевым заболеванием лимфоидной ткани с образованием гранулем, клеточный состав которых представлен гигантскими опухолевыми клетками и реактивными элементами воспаления.
Впервые заболевание описано английским патологоанатомом Томасом Ходжкиным в 1932 г. Описание гистологической
картины опухолевых клеток было сделано С. Я. Березовским
(1890), позже — К. Штернбергом (1898) и Д. Ридом (1902). В отечественной литературе гигантские опухолевые клетки принято
называть клетками Березовского — Штернберга (БШ).
Основой морфологической характеристики болезни Ходжкина
являются клетки БШ. Это крупные клетки до 20 микрон (мкм) в
диаметре, содержащие 1 или 2 ядра, в которых имеются крупные нуклеолы. Цитоплазма обильная, базофильная или слабо-
оксифильная, иногда вакуолизированная. Предстадиями этих
клеток являются клетки Ходжкина меньшего размера с наличием
одного ядра, морфологически схожие с иммунобластами.
Установлено, что клетки БШ являются опухолевым клоном,
происходящим из В-лимфоцитов лимфоидных герминативных
центров. С другой стороны, эти клетки могут иметь характеристики Т-лимфоцитов и интердигитирующих ретикулярных клеток. Многолинейное происхождение клеток БШ можно объяснить гибридомой в результате слияния различных клеточных линий, вызванных вирусом Эпштейна—Барр или другими агентами.
Цитогенетические исследования выявили неожиданную
частоту В-клеточных транслокаций (14:18) и bcL-2 гена при болезни Ходжкина.
Интересной особенностью болезни Ходжкина является относительно редкое (около 1 %) обнаружение злокачественных
клеток БШ в исследуемом материале при наличии выраженного реактивного инфильтрата лимфоцитами, макрофагами, гранул оцитами, эозинофилами.
Гистологическая классификация болезни Ходжкина. В основу
морфологической классификации болезни Ходжкина положены обнаружение клеток БШ и гистологическая характеристика
пораженной ткани. В зависимости от последней различают 4
гистологических варианта болезни Ходжкина.
1. Лимфоцитарное преобладание (нодулярное
и диффузное).
2. Нодулярный склероз.
3. Смешанно-клеточный вариант.
4. Лимфоидное истощение.
Различают нодулярный и классический варианты лимфоцитарного преобладания. Нодулярный вариант лимфоцитарного
222
преобладания характеризуется преобладанием лимфоцитов и
гистиоцитов: CD20+ (В-лимфоцитарный маркер), CD15—.
Классические клетки БШ (CD15+) встречаются редко, как и
вирус Эпштейна — Барр. Часто обнаруживается прогрессивная
трансформация герминативных центров лимфатических узлов.
У больных с данным типом гистологического варианта наблюдается длительный анамнез; довольно часто он диагностируется
у детей, преимущественно у мальчиков, поражая в основном
один регион лимфатических узлов без вовлечения средостения.
Классический вариант лимфоцитарного преобладания представлен преобладанием лимфоцитов, на фоне которых обнаруживаются CD 15+ клетки БШ. Клиническое течение болезни
Ходжкина напоминает таковое у больных со смешанно-клеточным вариантом.
Смешанно-клеточный вариант — CD 15+ (клетки БШ) выявляется часто на фоне большого количества нормальных реактивных клеток (лимфоцитов, плазматических клеток, эозинофилов,
гистиоцитов). Этот вариант можно спутать с периферической Т-
клеточной лимфомой, генерализованными стациями заболевания.
Нодулярный склероз — этот вариант отличается наличием
коллагеновых волокон, разделяющих лимфатические узлы на
дольки, которые содержат разновидность клеток БШ — лакунарные клетки. Этот вариант часто наблюдается у детей, поражает наддиафрагмальные лимфатические узлы и имеет определенный характер распространения.
Лимфоцитарное истощение диагностируется редко, трудно
дифференцируется от неходжкинской лимфомы, особенно от
крупноклеточной анапластической лимфомы. Югетки БШ и
плеоморфные клетки обнаруживаются часто относительно фоновых лимфоцитов. Этот вариант характеризуется поздней диагностикой и плохим прогнозом.
Вариант лимфоцитарного преобладания относительно часто
(13 %) встречается у детей до 10 лет, в то время как вариант лимфоцитарного истощения диагностируется исключительно редко.
Вариант нодулярного склероза у детей обнаруживается независимо от возраста, однако чаще выявляется у подростков (77 %)
по сравнению с детьми более младшего возраста (44 %). С другой
стороны, смешанно-клеточный вариант чаще диагностируется у
младших детей (33 %) по сравнению с подростками (11 %).
В настоящее время доказана роль цитокинов, секретируемых
клетками Ходжкина, с которыми связаны клинические проявления болезни, такие как лихорадка, ночной пот, иммунодефицит,
потеря массы тела, лейкоцитарно-эозинофильная инфильтрация
и др. Количество цитокинов превышает 12, включая интерлейкин-1, интерлейкин-6 и туморнекротический фактор. Интерлей-
кин-5, возможно, ответствен за эозинофилию у больных со смешанно-клеточным вариантом заболевания, а трансформирующий
фактор-В — фактор роста — за фиброз при нодулярном склерозе.
223
Эпидемиология. В структуре онкологических заболеваний у
детей болезнь Ходжкина составляет 5—7 %, а среди злокачественных лимфом — 35—40 % случаев.
Отмечается значительное преобладание мальчиков в соотношении 3:1. У детей пубертатного возраста наблюдается выравнивание этого соотношения, нередко девочки болеют чаще.
У детей раннего возраста болезнь Ходжкина встречается редко и выявляется преимущественно в подростковом возрасте.
Предположения об инфекционной природе заболевания не
нашли серьезного подтверждения. Тем не менее доказана роль
вируса Эпштейна — Барр в патогенезе болезни Ходжкина. Интересно отметить, что экспрессия ДНК1-вируса Эпштейна —
Барр зависит от возраста больных. Она определяется у 75 % пациентов в возрасте до 10 лет.
Существует генетическая предрасположенность к болезни
Ходжкина. Так, у сиблингов частота возникновения заболевания в 2—5 раз выше, а у однополых сиблингов — в 9 раз выше.
В литературе имеются сообщения о диагностике болезни Ходжкина у родителей и детей. У монозиготных близнецов риск
возникновения заболевания в 99 раз выше, чем у дизиготных
близнецов.
Состояние иммунной системы играет важную роль в возникновении болезни Ходжкина. У детей с болезнью Ходжкина определяется дефицит клеточного иммунитета, который включает
относительное снижение Т-клеток и повышенную чувствительность эффекторных Т-клеток к супрессорным моноцитам и
Т-супрессорным клеткам. Следует отметить влияние радиации на
длительное нарушение гомеостаза Т-клеточной популяции.
У больных с врожденными и приобретенными формами иммунодефицита не отмечено повышения частоты болезни Ходжкина.
Клиника и диагностика болезни Ходжкина. Клиническая картина болезни Ходжкина характеризуется наличием интоксикации (лихорадка более 38 “С, потливость в ночные часы, снижение аппетита и массы тела, зуд кожи), которая встречается почти
у 1/3 больных и почти всегда при генерализованных стадиях заболевания.
В периферической крови, как правило, имеется нейтро-
фильный лейкоцитоз, у ряда больных — эозинофилия, часто
увеличена СОЭ.
Болезнь Ходжкина является заболеванием, поражающим
различные органы и системы ребенка. У большинства детей заболевание диагностируется в наддиафрагмальных областях.
Основным клиническим проявлением болезни Ходжкина является увеличение лимфатических узлов. Увеличение периферических лимфатических узлов регистрируется у 60—80 % больных. Наиболее часто отмечается увеличение шейно-надключичных лимфатических узлов в проекции кивательных мышц, реже —
подмышечных, паховых, бедренных. Лимфатические узлы плот-
224
Рис. 9.1. Больной с болезнью
Ходжкина. Поражение шейных и надключичных лимфатических узлов слева.
ной консистенции, безболезненные, не спаяны
между собой, образуют
конгломераты различных
размеров (рис. 9.1).
Частота поражения
внутригрудных лимфатических узлов колеблется
от 40 до 75 %. По данным
НИИ детской онкологии
и гематологии РОНЦ,
увеличение лимфатических узлов средостения
наблюдается у 41 %, а
среди детей подросткового возраста — у 60—76 %
пациентов.
По мнению большинства исследователей, поражение внутригрудных лимфатических узлов приводит к ухудшению прогноза заболевания, особенно при массивном поражении.
Симптомы поражения внутригрудных лимфатических узлов
разнообразны и зависят от локализации процесса, степени
сдавления или прорастания жизненно важных структур и органов средостения.
При поражении медиастинальных лимфатических узлов возможно развитие компрессии верхней полой вены, трахеи, или
сдавление легких увеличенными бронхопульмональными лимфатическими узлами, реже — сдавление спинного мозга с развитием параличей. Почти у 20 % детей наблюдается синдром
сдавления верхней полой вены, наличие которого представляет
трудности для выполнения диагностической операции. Деформация грудной клетки за счет сдавления образующих ее костей
опухолью встречается редко.
Наиболее часто у детей с болезнью Ходжкина отмечается увеличение паратрахеальных, трахеобронхиальных, бронхопульмональных, реже — передней группы и бифуркационных лимфатических узлов. Увеличение вилочковой железы регистрируется
у каждого пятого больного.
Поражение легких при болезни Ходжкина встречается в 20 %
случаев заболевания (чаще у подростков) и характеризуется инфильтративными или очаговыми изменениями в легких (рис. 9.2).
225
Опухолевая инфильтрация плевры наблюдается в 4—6 %
случаев, выпот в плевральных полостях накапливается редко и
в основном имеет одностороннюю локализацию.
Вовлечение в процесс перикарда с наличием в нем выпота
также может иметь место преимущественно у детей старшего
возраста при поражении внутригрудных лимфатических узлов.
Поражение диафрагмы отмечается крайне редко, обычно в
случаях генерализации заболевания и не превышает 2,5 % случаев.
У 1/з больных с поражением внутригрудных лимфатических
узлов клиническая симптоматика отсутствует, и расширение
тени средостения выявляется случайно при профилактическом
рентгенологическом исследовании (рис. 9.3).
Изолированное поражение средостения или поддиафрагмальных лимфатических узлов составляет менее 5 % случаев.
При локализации процесса ниже уровня диафрагмы течение
заболевания может осложняться компрессией мочеточников
увеличенными лимфатическими узлами с развитием гидронефроза или кишечника с проявлениями синдрома нарушенного
всасывания, а при увеличении лимфатических узлов ворот печени — с развитием желтухи.
Увеличение печени и селезенки при болезни Ходжкина
встречается довольно часто, но не всегда оно свидетельствует о
поражении этих органов. Так, вовлечение в процесс печени регистрируется у 5—10 % больных и коррелирует с неблагоприятным прогнозом заболевания. Поражение селезенки наблюдается у 1/з пациентов, обычно при генерализованных формах заболевания.
Поражение костей позвоночника, ребер, таза, длинных
трубчатых костей встречается у 10—15 % пациентов.
Вовлечение в процесс костного мозга, кожи, миндалин,
нервной системы, почек наблюдается редко и является проявлением диссеминации заболевания.
Диагностика и дифференциальная диагностика болезни Ходжкина. Морфологическая верификация диагноза и варианта заболевания осуществляется с помощью пункции и биопсии опухолевого образования пораженных лимфатических узлов с изучением морфологии и иммунологии опухолевой ткани.
В диагностике болезни Ходжкина важным является уточнение гистологического варианта заболевания с помощью биопсии опухолевой ткани.
Современная диагностика болезни Ходжкина основывается
на комплексном обследовании больного с включением рентгенологического, радиоизотопного и ультразвукового методов
исследования и проводится с целью уточнения степени распространения процесса на различные органы и структуры, т. е. стадии заболевания, до начала лечения больного.
226
Рис. 9.2. Рентгенограмма грудной клетки — поражение легочной ткани.
Рис. 9.3. Рентгенограмма грудной клетки — поражение лимфатических
узлов средостения.
227
Объем обязательных методов исследования:
• клинический анализ крови;
• биохимический анализ крови (с исследованием белка, мочевой кислоты, щелочной фосфатазы, печеночных ферментов, гаптоглобина, церулоплазмина);
• пункция и биопсия увеличенных лимфатических узлов с
морфологическим и иммунологическим исследованиями
пунктата или биоптата опухолевой ткани;
• рентгенография в двух проекциях (прямой и боковой) и
томография органов грудной клетки;
• ультразвуковое исследование (УЗИ) периферических
лимфатических узлов, средостения, брюшной полости и
забрюшинного пространства;
• сканирование лимфатической ткани с цитратом галлия-67;
• сканирование костей с технецием-99;
• компьютерная томография (КТ) органов грудной клетки
или брюшной полости, которая позволяет дать более точную
информацию о локализации первичной опухоли, структуре,
форме, размерах, о взаимоотношении ее с окружающими
тканями и органами и увеличивает диагностическую точность поражения.
Комплексное обследование должно быть проведено в относительно короткое время. Использование рентгенологического,
ультразвукового, радиоизотопного методов исследования, изучение морфологии пунктата и биоптата опухолевой ткани и клинического течения заболевания позволяет оценить степень распространения процесса до заболевания (стадию заболевания).
Для оценки стадии заболевания используется клиническая
классификация, принятая в Ann-Arbor в 1971 г. для злокачественных лимфом, согласно которой выделено 4 стадии заболевания.
Клиническая классификация
I стадия— поражение одной группы лимфатических узлов
(I) или одного экстралимфатического органа или ткани (IE).
II стадия— поражение двух или более групп лимфатических
узлов по одну сторону диафрагмы (II) или вовлечение одного
экстралимфатического органа или ткани и одной или более
групп лимфатических узлов по одну сторону диафрагмы (НЕ).
III стадия— поражение двух и более групп лимфатических
узлов по обе стороны диафрагмы (III) или с вовлечением селезенки (Шс) или вовлечение экстралимфатического органа (ткани) и одной и более групп лимфатических узлов по обе стороны
диафрагмы (ШЕ).
228
IV стадия— диссеминированное многофокусное поражение
одного или нескольких внелимфатических органов (ткани) —
печени, легких, костей, костного мозга и др. в сочетании или
без поражения лимфатических узлов; при этом символом "Е"
обозначается поражение экстранодальных (внелимфатических)
областей.
Кроме того, при уточнении стадии заболевания необходимо
учитывать наличие (Б) или отсутствие (А) симптомов интоксикации и наличие (б) или отсутствие (а) биологической активности процесса.
Симптомы интоксикации включают наличие лихорадки более 38 °С в течение недели, профузный ночной пот, потерю
массы тела более 10 % за последние 6 мес, зуд кожи. Эти симптомы чаще коррелируют с генерализованными (III и IV) стадиями заболевания, наблюдаются у 50—80 % больных и имеют
важное прогностическое значение.
Маркерами "биологической активности" заболевания являются повышенные уровни церулоплазмина (более 185 ЕД/л),
гаптоглобина (более 1,5 г/л), СОЭ (более 30 мм/ч), фибриногена (более 300 ЕД/л в сыворотке крови); эти изменения наблюдаются при генерализованном процессе.
На совещании в Cotswald эта классификация была пересмотрена с учетом новых предложений. В классификации, принятой
в Апп-АгЬог, не учитывалась масса опухоли (размеры или число
пораженных зон) или специфика поражения. По этой причине
была предложена подклассификация системы стадирования,
особенно для больных с выраженной медиастинальной аденопатией, у которых опухоль в средостении превышала 1/з поперечного размера грудной клетки на уровне купола диафрагмы
на стандартной заднепередней рентгенограмме (IIIA подстадия).
У больных этой группы имелся повышенный риск рецидива заболевания после одной лучевой терапии. У пациентов с патологической III стадией заболевания, у которых выявлено поражение селезенки, лимфатических узлов ворот селезенки, печени
или celiac (Ш1 подстадия), прогноз более благоприятный, чем у
больных с поражением парааортальных, подвздошных или мезентериальных лимфатических узлов (III2 подстадия).
V детей преобладают I—II стадии, причем II стадия болезни
Ходжкина встречается у 40—50 % детей, независимо от их возраста. Генерализованные стадии и симптомы интоксикации чаще наблюдаются у подростков.
Клиническая стадия (CS) устанавливается по данным комплексного обследования, патологическая стадия (PS) — по данным лапаротомии.
Клиническое стадирование болезни Ходжкина проводится с
учетом детального анализа клинических симптомов, признаков
сердечно-легочной и органной дисфункции с регистрацией локализации и размеров всех пальпируемых лимфатических уз¬
229
лов, исследования глоточного (вальдейерова) кольца и др. Учитываются показатели периферической крови, функций почек и
печени. Кроме того, исследуются сывороточные маркеры, такие как CD8- и СБЗО-антигенные уровни, которые наряду с повышенной СОЭ могут ассоциироваться с худшим прогнозом и
служить показателем активности процесса. Больным с общими
симптомами или III—IV стадиями заболевания нужно проводить биопсию костного мозга. С помощью рентгенографии органов грудной клетки и КТ уточняется состояние внутригруд-
ных лимфатических узлов (включая корни легких и сердечнодиафрагмальный угол), паренхимы легких, перикарда, плевры
и грудной стенки. Выявленные изменения могут служить основанием для применения более активной терапии.
В последние два десятилетия пересмотрена роль эксплоративной лапаротомии со спленэктомией как диагностической и
лечебной процедуры.
Во многих исследовательских центрах проведено специальное изучение роли эксплоративной лапаротомии при болезни
Ходжкина у детей. Эксплоративная лапаротомия включала
спленэктомию и краевую биопсию печени, множественную
биопсию лимфатических узлов, а при наличии процесса в области таза — оофоропексию у девочек.
После лапаротомии у детей наблюдалось увеличение частоты и тяжести инфекционных, особенно вирусных, заболеваний.
Имеются сообщения о высокой частоте сепсиса после спленэк-
томии, особенно у детей до 5 лет. Риск инфекции в большей
степени зависит от интенсивности химиотерапии после спле-
нэктомии. Кроме того, могут наблюдаться осложнения в виде
непроходимости кишечника и мочеточников. Также в литературе имеются сообщения об увеличении частоты вторых опухолей у этих больных.
Современные возможности комплексной диагностики, включающей такие методы, как ультразвуковое и радиоизотопное исследования лимфатической системы, позволяют уточнить степень вовлечения различных структур и органов брюшной полости и забрюшинного пространства до лечения и при динамическом
наблюдении за течением заболевания.
Решение о выполнении эксплоративной лапаротомии должно быть тщательно взвешенным с учетом влияния полученной
информации на лечебную тактику. Поэтому выбор терапии диктует объем обследования для установления стадии заболевания.
Так, у больных с III и IV клиническими стадиями хирургическое стадирование не изменит агрессивную химиотерапию,
поэтому следует использовать клиническое стадирование.
Таким образом, лапаротомия со спленэктомией не может
быть рутинной процедурой. Лапаротомия может быть выполнена
в случаях, если ее результаты будут влиять на тактику лечения.
Так, показанием для выполнения эксплоративной лапаротомии
230
со спленэктомией может явиться сохранность симптомов поражения селезенки с явлениями гиперспленизма после окончания индуктивной химиотерапии.
Прогностические факторы. По мере совершенствования лечения болезни Ходжкина менялось прогностическое значение
различных факторов. Однако некоторые из них продолжают
влиять на успех и выбор терапии. Эти факторы взаимозависимы,
например стадия, масса опухоли и биологическая активность заболевания.
Стадия заболевания остается наиболее важным прогностическим фактором. У больных с распространенными стадиями, особенно с IV, прогноз заболевания хуже, чем у пациентов с ранними стадиями.
Масса опухоли отражает число пораженных зон. Больные с медиастинальной лимфаденопатией имеют повышенный
риск развития рецидива. Эффективность комбинированной терапии у больных со II стадией и массивным поражением средостения выше, чем при применении одной лучевой терапии. У пациентов с множественными очагами поражения (более 4 зон)
прогноз хуже. Особенно плохой прогноз у больных с ГУ стадией
и множественными органными поражениями.
Общие симптомы отражают биологическую активность
процесса при болезни Ходжкина и сопровождаются худшим
прогнозом. Наличие у пациентов лихорадки и профузного ночного пота определяет наихудший прогноз.
Лабораторные показатели: повышение СОЭ, сывороточного ферритина, антигена CD8 и снижение гемоблобина,
альбумина — ассоциируются с худшим прогнозом. Эти показатели отражают биологию и массу опухоли.
Больным с наличием общих симптомов или III и ГУ стадиями
заболевания должна выполняться биопсия костного мозга.
Гистологический вариант также влияет на прогноз
заболевания. У больных с I—II стадиями и смешанно-клеточным вариантом имеется риск возникновения поддиафрагмальных
рецидивов. У больных с лимфоцитарным истощением прогноз
плохой.
Возраст детей является также важным прогностическим
фактором. По данным университета Стэнфорда, 5- и 10-летняя
выживаемость детей до 10-летнего возраста составляет 94 и 92 %
соответственно по сравнению с 93 и 86 % среди подростков
(11—16 лет) и 84 и 73 % — у взрослых. Лучшую выживаемость
у детей младшего возраста можно объяснить высокой частотой
лимфоидного преобладания и смешанно-клеточного варианта,
меньшей частотой генерализованных стадий и общих симптомов.
Дети в возрасте до 4 лет имеют хороший прогноз.
Таким образом, к неблагоприятным факторам прогноза при
болезни Ходжкина у детей относятся:
1. Пубертатный и препубертатный возраст.
231
2. Гистологические варианты — лимфоидное истощение, нодулярный склероз.
3. Поражение внутригрудных лимфатических узлов.
4. IV стадия заболевания.
5. Наличие симптомов интоксикации и биологической активности процесса.
6. Массивность поражения:
• размеры лимфатических узлов более 5 см в диаметре;
• поражение 5 и более групп лимфатических узлов;
• медиастинально-торакальный индекс (МТИ), равный
0,5 и более.
В соответствии с установленной стадией заболевания и выявленными прогностическими факторами до начала лечения определяют группу риска. Выделяют 3 группы прогностического
риска: благоприятный (1), стандартный (2), неблагоприятный (3).
К 1-й группе риска относятся больные с I—II Аа и Аб стадиями, не имеющие неблагоприятных факторов прогноза.
Ко 2-й группе риска относятся больные с II Аа и Аб стадиями
с наличием одного или более неблагоприятных факторов прогноза и с III Аа и Аб стадиями и отсутствием неблагоприятных
прогностических факторов.
К 3-й группе риска относятся больные с III Аа и III Аб стадиями и неблагоприятными прогностическими факторами, а
также со II Бб, III Бб стадиями.
Наиболее высокий риск имеют больные с IV стадией заболевания с вовлечением в процесс легких, плевры, перикарда, печени, костей.
Лечение. В прошлом успехи в лечении локализованных I и И
стадий болезни Ходжкина у взрослых и детей были достигнуты
при применении лучевой терапии. В настоящее время лучевая
терапия у детей утратила полностью самостоятельное значение
и применяется исключительно с консолидирующей целью после
окончания химиотерапии, при этом предпочтение отдается излучению высоких энергий, генерируемых циклическими и линейными ускорителями.
Лечение болезни Ходжкина у детей на современном этапе
включает химио- и лучевые методы, причем ведущее место занимает химиотерапия. Достижение высокой эффективности
лечения и снижение непосредственных и отдаленных последствий терапии является ведущим принципом в лечении данного
заболевания.
Начало химиотерапии болезни Ходжкина относится к
1948 г., когда Wintrobe и Huguley, а в 1950 г. Л. Ф. Ларионовым
был применен мустарген и обнаружена высокая эффективность
этого препарата.
В дальнейшем в лечении болезни Ходжкина использовались
другие противоопухолевые препараты: алкилирующие агенты —
232
циклофосфан, допан, хлорбутин (лейкеран), ифосфамид, препараты растительного происхождения — винбластин, винкри-
стин (онковин), синтетические препараты — прокарбазин (нату-
лан), дакарбазин (ДТ1С), имидазол-карбоксамид, проспидин,
производные нитрозомочевины — CCNU (ломустин, белустин),
нидран (ACNU), нитрозометилмочевина, противоопухолевые
антибиотики — адриамицин, фарморубицин, карминомицин, за-
ведос (идарубицин), флеомицины — блеомицин, блеомицетин,
эпиподофиллотоксины — этопозид (VP-16-213, вепезид), тени-
позид (VM-26), соединения платины — цисплатин, карбоплатин.
Наиболее эффективными оказались комбинации препаратов
МОРР (мустарген + онковин + прокарбазин + преднизолон),
CVPP (циклофосфан + винбластин + прокарбазин + преднизолон), СОРР (циклофосфан + онковин + прокарбазин + преднизолон), DOPP (допан + онковин + прокарбазин + преднизолон), ABVD (адриамицин + блеомицин + винбластин + имидазол-карбоксамид), ОРРА (винкристин + прокарбазин +
+ преднизолон + адриамицин).
Программы химиотерапии, применяемые у детей с болезнью Ходжкина
Препараты
Доза и режим введения
МОРР
Мехлорэтамин (нитроген мус-
тард)
6 мг/м2, внутривенно 1-й и 8-й дни
Винкристин (онковин)
1,4 мг/м2, 1-й и 8-й дни
Прокарбазин
100 мг/м2, внутрь 1—14-й день
Преднизолон
40 мг/м2, внутрь 1—14-й день
Циклы повторяются ежемесячно
ABVD
Доксорубицин (адриамицин)
25 мг/м2, внутривенно 1-й и 15-й дни
Блеомицин
10 мг/м2, внутривенно 1-й и 15-й дни
Винбластин
6 мг/м2, внутривенно 1-й и 15-й дни
Дакарбазин
375 мг/м2, внутривенно 1-й и 15-й
дни
MOPP/ABVD
3 цикла МОРР чередуется с 3 циклами ABVD
CVPP
Хлорамбуцил
6 мг/м2, внутрь 1-й и 14-й дни
Винбластин
6 мг/м2, внутривенно 1-й и 8-й дни
Прокарбазин
100 мг/м2, внутрь 1—14-й день
Преднизолон
40 мг/м2, внутрь 1—14-й день
233
Продолжение
Препараты
Доза и режим введения
СОРР
Циклофосфамид
600 мг/м2, внутривенно 1-й и 8-й дни
Винкристин
1,5 мг/м2, внутривенно 1-й и 8-й дни
Прокарбазин
100 мг/м2, внутрь 1—14-й день
Преднизолон
ОРРА
40 мг/м2, внутрь 1—14-й день
Винкристин
1,5 мг/м2, внутривенно 1-й, 8-й и 15-й
дни
Прокарбазин
100 мг/м2, внутрь 1—15-й день
Преднизолон
60 мг/м2, внутрь 1—15-й день
Доксорубицин
Циклы повторяют ежемесячно
40 мг/м2, внутривенно 1—15-й день
В настоящее время не существует идеального единственного
метода лечения детей с болезнью Ходжкина.
У детей лечение сопровождается значительно ббльшим числом побочных эффектов и осложнений, чем у взрослых. Применение облучения может привести к глубоким изменениям со
стороны костно-мышечной системы, задержке роста костей,
атрофии мышц в зоне облучения, поэтому назначение детям с
ранними стадиями болезни Ходжкина высоких доз облучения
как монотерапии неоправданно из-за возможных осложнений.
Кроме того, могут возникнуть осложнения со стороны гонад,
вызванные применением химиотерапии.
В последние годы возникла необходимость в уменьшении
интенсивности химиотерапии, доз и объема лучевой терапии.
Сокращены общая продолжительность химиотерапии и объем
лучевой терапии до 26—30 Гр.
Выбор объема и интенсивность химиотерапии определяются
оценкой неблагоприятных факторов, выявленных в результате
комплексного обследования больных и влияющих на прогноз
заболевания (группа риска).
Обязательным условием эффективности лечения является
соблюдение режима цикловой химиотерапии: 2-недельные курсы чередуются с 2-недельными интервалами в лечении.
Лечение может быть прервано при присоединении инфекционных заболеваний (ветряная оспа, ОРВИ, herpes zoster, сепсис и др.) или при развитии тяжелых осложнений. Лечение проводится при удовлетворительном состоянии больного и отсутствии гипоплазии кроветворения (при числе лейкоцитов более
2,0 • 109/л, гранулоцитов более 0,5 • 109/л, тромбоцитов более
100 • 107л).
234
С целью консолидации ремиссии после окончания цикловой химиотерапии по показаниям проводят облучение зон поражения.
Разовая очаговая доза (РОД) колеблется от 1,7 до 2 Гр в
день. Суммарная очаговая доза (СОД) облучения в зависимости
от программ лечения — в пределах от 20 до 35 Гр.
Реццдивы болезни Ходжкина и их лечение. Несмотря на достигнутые успехи в лечении болезни Ходжкина у детей, после
внедрения в практику комбинированной химиолучевой терапии частота рецидивов заболевания составляет от 6 до 38 %.
Большинство рецидивов возникает в первые 3 года после
окончания лечения, причем более половины из них приходится
на первый год.
Различают ранние и поздние рецидивы. Ранний рецидив характеризуется появлением признаков заболевания в течение
первого года, а поздний — в более поздние сроки (более 12 мес)
после достижения ремиссии.
Выявление локальных и диссеминированных рецидивов наблюдается примерно с одинаковой частотой.
Возникновение рецидивов болезни Ходжкина у детей чаще
связано с неадекватностью терапии ввиду недооценки стадии
заболевания и факторов риска (группы риска) или нарушением
режима и доз химиотерапии и лучевой терапии по различным
причинам.
Морфологическое подтверждение рецидива заболевания является обязательным условием в каждом отдельном случае.
Проведение комплексного обследования больного с уточнением зон поражения, неблагоприятных прогностических факторов, состояния иммунологической активности является необходимым для выбора объема терапии.
Выбор лечебной тактики при рецидиве заболевания основывается на детальной оценке клинической картины рецидива,
сроков его возникновения, ранее проведенного лечения, факторов прогноза.
В лечении рецидивов болезни Ходжкина также используется
комбинированная химиолучевая терапия. Интенсивность и
длительность химиотерапии рецидивов зависят от степени распространения процесса и группы риска больного. У больных с
рецидивом заболевания применяются схемы химиотерапии,
включающие препараты 2-го ряда: производные нитрозомоче-
вины, вепезид, дакарбазин, флеомицины, имидазол-карбоксамид и др. Выбор схем химиотерапии во многом зависит от локализации поражения. Так, при вовлечении в процесс легочной
ткани используются схемы химиотерапии с добавлением препаратов мочевины (CCNU, BCNU и др.), при вовлечении печени — противоопухолевые антибиотики, при поражении лимфатических узлов — проспидин, вепезид, имидазол-карбоксамид.
К наиболее широко применяемым схемам химиотерапии при
235
болезни Ходжкина у детей следует отнести СЕР, IEP, ABVD,
Dexa-BEAM и др.
В случаях непрерывно-рецидивирующего течения болезни
Ходжкина показано применение высокодозной химиотерапии
с трансплантацией аутологичного костного мозга или периферических стволовых клеток.
При достижении полного эффекта после применения 3—6
курсов противорецидивной химиотерапии в зависимости от характеристики рецидива проводится консолидирующая лучевая
терапия на зоны поражения.
По данным различных исследователей, выживаемость детей
с болезнью Ходжкина составляет 93—100 %. Высокий процент
излечения детей определяет необходимость динамического наблюдения и оценки качества жизни.
Многие исследователи указывают на неблагоприятное влияние комбинированного химиолучевого лечения на репродуктивную функцию лиц, перенесших в детстве болезнь Ходжкина.
У них наблюдается увеличение частоты бесплодия, потомства с
врожденными аномалиями развития. Поэтому важным является вопрос прогнозирования здорового потомства в семьях, в которых один из родителей получал лечение по поводу болезни
Ходжкина.
Наблюдение за бывшими пациентами в НИИ ДОиГ РОНЦ
РАМН за 20-летний период показало, что 18-летнего возраста
и старше достигли 258 пациентов, из них 53 имеют семью и 84 —
потомство. Дети, рожденные от родителей, один из которых получал лечение по поводу болезни Ходжкина, родились здоровыми. Беременность и роды у женщин, рожавших в длительной
(более 5 лет) полной ремиссии, не отягощали прогноза заболевания; они не желательны в ранние сроки становления ремиссии (2—3 года). Комбинированное лечение болезни Ходжкина
в детском возрасте не оказывает существенного влияния на репродуктивную функцию и умственные способности бывших
пациентов.
Глава 10 | ГИСТИОЦИТАРНЫЕ ОПУХОЛИ У ДЕТЕЙ
Гистиоцитозы представляют разнообразную группу заболеваний, для которых является характерным пролиферативный процесс в системе мононуклеарных фагоцитов (СМФ). В зависимости от степени зрелости и дифференцировки гистиоцитарных
элементов существуют различные формы заболевания, имеющие особенности клиники, прогноза и лечения. Клеточные элементы системы мононуклеарных фагоцитов принимают участие
в иммунном ответе против инфекционных и чужеродных антигенов с развитием гистиоцитарных пролиферативных синдромов реактивного или опухолевого характера.
10.1. Диагностика и дифференциальная диагностика
реактивных и опухолевых гистиоцитарных заболеваний
у детей
Клетки системы мононуклеарных фагоцитов (СМФ) происходят из промоноцитов костного мозга, которые являются источниками двух функционально различных клеточных линий.
Первая клеточная линия (истинно макрофагальная) включает
моноциты периферической крови и их производные — тканевые макрофаги (гистиоциты). К ним относятся перитонеальные,
плевральные, альвеолярные макрофаги, остеокласты, клетки
Купфера, гистиоциты соединительной ткани и другие.
Вторая клеточная линия (антигенпрезентативная) включает в
себя популяцию дендритических клеток, которые в процессе филогенеза утратили макрофагальную функцию. Антигенпрезента-
тивные клетки делятся на 3 класса: дендритические ретикулярные клетки (ДРК), интердигитирующие ретикулярные клетки
(ИРК) и клетки Лангерганса (КЛ).
Дендритические клетки интимно связаны с Т-зонами и с В-
клетками лимфатических органов. Любая патология, рассматриваемая в гистиоцитарных синдромах, является результатом
реактивной или опухолевой пролиферации одной из этих двух
линий клеток. Таким образом, клеточные элементы СМФ составляют важную защитную систему организма человека против инфекционных и чужеродных антигенов и являются важным клеточным компонентом иммунного ответа.
Клинические и патологические проявления одного из наиболее часто встречающихся заболеваний СМФ — лангер-
гансово-клеточного гистиоцитоза (ЛКГ) ранее
были описаны как эозинофильная гранулема, болезнь Хенда —
Шюллера — Крисчена, болезнь Абта — Леттерера — Зиве. Прогноз больных с этими заболеваниями варьировал от благоприятного до фатального. Lichtenstein в 1953 г. впервые различил
общие клинические и патологические черты этих 3 синдромов
237
и присвоил им название "Гистиоцитоз X". После обнаружения
Neselof и соавт. (1973) того факта, что пораженные клетки при
гистиоцитозе X являлись дендритическими клетками, название
данного заболевания было изменено большинством исследователей на ”ЛКГ', или "гистиоцитоз из клеток Лангерганса".
В 1987 г. рабочей группой Гистиоцитарного общества было
рекомендовано все гистиоцитарные синдромы у детей разделить на 3 группы. При этом ЛКГ составил I класс. Гистиоци-
тозы из мононуклеарных фагоцитов, иных чем клетки Лангерганса, вошли во II класс. В III класс были включены злокачественные формы гистиоцитозов. Диагноз при этом
основывается на специфических гистогенетических критериях.
Классификация основных реактивных и опухолевых гистиоцитозов представлена в табл. 10.1.
Диагностика лангергансово-клеточного гистиоцитоза основывается на обнаружении специфических дендритических клеток, называемых клетками Лангерганса (рис. 10.1). Они характеризуются эозинофильной цитоплазмой, бледными, дольчатыми,
иногда бобовидными, неправильной формы ядрами, содержащими мелкодисперсный хроматин, маленькие ядрышки. Связанный с пролиферацией клеток гранулематозный комплекс составляют лимфоциты, фагоцитирующие гистиоциты, эозинофи-
лы, нейтрофилы. В некоторых случаях гистологическая картина
Рис. 10.1. Микрофото. Пунктат мягкотканного образования — клетки
Лангерганса (белые отростчатые эпидермоциты), эозинофилы. х600.
238
Таблица 10.1. Классификация основных гистиоцитозов у детей
Синдромы
Характеристика
больных
Поражаемые
органы
Гистопатии
лкг
Дети раннего
Класс I
Кости, легкие,
Дендритические клет¬
возраста, реже
печень, лимфатические
ки: гранулы Бирбека,
подростки и
CDla+
СГМЛА
взрослые узлы, кожа,
селезенка,
костный мозг
Класс II
Старшие дети, Лимфатичес-
Гистиоцитоз синусов
взрослые
кая ткань,
лимфатических узлов
ВАГФС
В любом воз-
реже экстра-
нодальные
поражения
Костный
с плазмоцитозом, лим-
фофагоцитозом:
CDla(-), S-100(+)
Инфильтраты из гис¬
расте, связано
мозг, селезен¬
тиоцитов с эритрофа¬
с вирусной
ка, печень
гоцитозом и лимфо¬
сглг
или другой
инфекцией,
часто у лиц с
иммуносупрессией
Грудные дети,
Костный
цитов
Инфильтраты из гис¬
наследуется
мозг, селезен¬
тиоцитов с эритрофа¬
аутосомно-
ка, печень,
ЦНС
гоцитозом и лимфо¬
рецессивно
цитов
онлл
Класс III
Дети до Шлет, Костный
Монобласты в пери¬
(FAB-M5)
взрослые стар¬
мозг, кровь,
ферической крови,
ше 40 лет
кожа, десна
более 30 % в костном
Злокачествен¬
Старшие дети
Лимфатичес¬
мозге, CDllc+,
CD13+, CD14+,
CD21+, CD33+
Атипичные гистиоци¬
ный гистио-
и молодые
кие узлы, пе¬
ты, промежуточные
цитоз
люди
чень, селезен¬
между монобластами
Истинно гис-
Взрослые
ка, кости,
костный мозг,
ЖКТ
Лимфатичес¬
и фиксированными
тканевыми макрофагами, различная экспрессия антигенов,
CD30 ± Ki-l(-)
Атипичные фиксиро¬
тиоцитарная
кие узлы, кос¬
ванные гистиоциты,
лимфома (гис-
ти, кожа, ЖКТ
фенотип часто
тиоцитарная
саркома)
CDllc+, CD14+
239
инфильтратов включает крупные, плеоморфные макрофаги.
Клетки Лангерганса иммуногистохимически могут быть идентифицированы по экспрессии CDla-антигена (ОКТ-6) или
ультраструктурно — по выявлению гранул Бирбека. К сожалению, до настоящего времени не представляется возможным
считать клетки Лангерганса нормальными или патологическими, опухолевыми.
Существует несколько теорий, объясняющих этиологию
ЛКГ. Согласно одной, это патология иммунной регуляции, так
как в большинстве случаев заболеваний выявляется тот или
иной иммунный дефект. Согласно другой, ЛКГ является результатом цитокиномедиаторной активации, приводящей к ответной пролиферации дендритических клеток. Нельзя исключить также, что заболевание может быть следствием вирусной
инфекции, причем в качестве инфекционного агента выступают ретровирусы. Клинико-рентгенологические и лабораторные
данные, оценивая характеристики клинического течения и результаты лечения больных, не исключают патогенетический и
опухолевый процесс.
В отличие от лангергансово-клеточного гистиоцитоза гис-
тиоцитозы, входящие во II класс, происходят из других клеток,
отличающихся от дендритических клеток Лангерганса. Наиболее часто встречается синусовый гистиоцитоз с массивной лимфаденопатией (СГМЛА).
Впервые он описан как отдельная нозологическая форма в
1978 г. Rosali и Dorfman. Заболевание характеризуется болезненным увеличением шейных лимфатических узлов. Другие
группы лимфатических узлов, лимфоидная ткань носоглотки и
экстранодальные локализации (кожа, реже кости) вовлекаются
в процесс приблизительно у 30—40 % больных. Клинические
симптомы могут персистировать в течение ряда лет.
Патогистологически СГМЛА проявляется пролиферацией
плазматических клеток, макрофагов с признаками фагоцитоза
лимфоцитов. Эти данные наводят на мысль о том, что нарушения иммунного ответа с выраженными изменениями лимфоидной ткани могут быть центральным звеном патогенеза СГМЛА.
Гистиоцитозы S-100 — позитивные, не экспрессируют CDla-
антиген. Ультраструктурные исследования выявили неланген-
гарсово-клеточную природу гистиоцитов, так как наблюдаются
спонтанные ремиссии заболевания и не отмечается поражений
жизненно важных органов.
Различные исследователи при этой форме заболевания применяли лучевую терапию, химиотерапию (винкристин, цикло-
фосфан и др.) с кратковременными улучшениями. Мы успешно
использовали а-интерферон — реаферон длительными повторными курсами по 3—6 млн внутримышечно до 1—2 мес. Возможны и спонтанные ремиссии заболевания. Прогноз заболевания в основном хороший.
240
Ко II классу гистиоцитозаотносится также вирусассоци-
ированный гемафагоцитарный синдром (ВАГФС),
который является генерализованным ответом организма на вирусную инфекцию у больных с различными иммунодефицит-
ными состояниями. Синдром описан Rissdal в 1979 г. у группы
больных с врожденными иммунодефицитными состояниями
(болезнь Чедиака — Хигаси, Х-сцепленный лимфопролиферативный синдром и др.). У больных с ВАГФС имеет место пролиферация реактивных гистиоцитов с признаками эритрофагоцитоза в костном мозге, селезенке, печени, лимфатических узлах, ЦНС, других органах.
Клинические проявления в виде лихорадки, печеночной недостаточности, панцитопении, выраженной коагулопатии
(ДВС-синдром) являются нежелательными, так как часто ведут
к смерти больного. Предполагается, что этиологическими факторами могут быть не только вирусы, но и паразиты, грибы,
бактериальные агенты. Вирусы, наиболее часто приводящие к
развитию ВАГФС, относятся к семейству герпетических (EDV),
а также цитомегаловирусов, вирусов кори, парагриппа, аденовирусов. Заболевание имеет плохой прогноз.
Семейный гемофагоцитарный лимфогистио-
цитоз (СГЛГ), так же как и ВАГФС, является быстро прогрессирующим фатальным заболеванием, наследуемым по ау-
тосомно-рецессивному типу; характеризуется пролиферацией
активированных макрофагов. Болеют дети грудного возраста,
независимо от пола. Инфильтрация гистиоцитами с признаками эритрофагоцитоза в костном мозге. Заболевание сопровождается лихорадкой, гепатоспленомегалией и панцитопенией.
Диагностическими критериями этого симптомокомплекса являются поражение костного мозга, лимфатических узлов, селезенки, печени, мозговых оболочек (плеоцитоз), триглицериде-
мия. СГЛТ отличается от ВАГФС отсутствием связи с инфекцией и наличием наследственного фактора. Имеется попытка
лечить заболевание с помощью полихимиотерапии с частичным эффектом.
По данным литературы последних лет, оба заболевания
(ВАГФС и СГЛТ) являются следствиями нарушения продукции
и контроля цитокинов, в частности тумор-некробиотического
фактора.
Во II класс гистиоцитозов входят и некоторые другие, так называемые реактивные синдромы: болезни накопления (болезни
Помпе, Гоше, Нимана — Пика, I тип ганглиозидоза, болезнь
Фабри, ювенильная ксантогранулема), некоторые пролиферативные синдромы (болезнь "трансплантант против хозяина"),
бериллиоз и др.
КIII классу гистиоцитарных синдромов относят злокачественные опухолевые гистиоцитозы. Термин "злокачественный гистиоцитоз" был предложен в 1966 г. Н. Rappa-
241
port. По гистологической классификации злокачественных новообразований кроветворной и лимфоидной тканей ВОЗ,
злокачественный гистиоцитоз отнесен к группе "острых лейкемий и родственных заболеваний", а гистиоцитоз из клеток Лан-
герганса (Х-гистиоцитоз) выделен в группу "хронической моно-
цитарной лейкемии и системных гистиоцитарных заболевший".
Клинико-морфологическая характеристика злокачественного
гистиоцитоза и гистиоцитоза из клеток Лангерганса различны.
Неодинаковы также результаты лечения и прогноз заболевания.
Ряд авторов рассматривают злокачественные гистиоцитозы
как макрофагальные опухоли и относят их к лейкозам, называя
при этом макрофагальными лейкозами. Выделение данной опухолевой пролиферации в качестве гистиоцитарного варианта
ретикулосаркомы или лимфомы и тем более одной из форм
лейкоза едва ли является современным.
Термин "злокачественный гистиоцитоз" указывает на клинико-морфологическое отличие от гистиоцитоза из клеток
Лангерганса. Диагноз устанавливается на основании морфологического исследования опухолевой ткани с помощью комплексной диагностики, включающей цитологический, иммуно-
гистохимический, цитохимический, гистологический и субмикроскопический методы. Цитологическая характеристика
опухолевых клеток представлена клеточным полиморфизмом.
И. И. Матвеева выделила три типа опухолевых клеток.
1. Округлые клетки (размером от 17,25 до 31 мкм) с базо-
фильной цитоплазмой, часто с ее вакуолизацией, не содержащей, как правило, включений. Хроматин ядра имеет нежнопетлистое строение, нуклеолы не всегда четко просматриваются.
Ядерно-цитоплазматическое отношение довольно высокое.
Часты митозы. Подобные клетки составляют от 10 до 59 % элементов опухоли.
2. Клетки крупные (диаметром от 21 до 36 мкм), несколько
вытянутой формы, ядро несколько эксцентрично расположено,
цитоплазма слабобазофильна, без фагоцитарной активности,
выражена ее вакуолизация, иногда содержится азурофильная
зернистость. Ядро круглое, с нежным рисунком хроматина,
нуклеолы четкие или отсутствуют, ядерно-цитоплазматическое
отношение значительно увеличено. В пунктате такие клетки составляют от 28 до 80 %.
3. Клетки, схожие со II типом, но обладающие фагоцитарной
активностью; характерным является наличие эритрофагии. В
пунктате они составляют от 4 до 34 % (рис. 10.2, см. цв. вкл.).
При цитохимическом исследовании все элементы не содержат миелопероксидазы, ШИК-реакция варьирует от негативной
до умеренно выраженной, активность неспецифической эстеразы
высокая или умеренная, активность кислой фосфатазы очень высокая. При ультраструкгурном исследовании в опухолевых клетках отсутствуют гранулы Бирбека, отмечается эритрофагоцитоз.
242
Пораженным клеткам присущи большое количество лизосом,
фагосом, выраженный пластинчатый комплекс (аппарат Гольджи), что отличает их от клеток Лангерганса. При иммунологическом исследовании отмечена положительная экспрессия антигенов CD68+, CD14+, CDllc+ и иногда небольшое число
клеток в сочетании с антигенами и CD30+.
При дифференциальной диагностике злокачественного гис-
тиоцитоза от синусового гистиоцитоза с массивной лимфаде-
нией, лангергансово-клеточного гистиоцитоза и других реактивных гистиоцитозов, помимо макроскопических признаков,
необходимо использовать детали ультраструктуры опухолевых
клеток: отсутствие гранул Бирбека и в меньшей степени выраженный фагоцитоз позволяют исключить лангергансово-кле-
точный гистиоцитоз и другие гистиоцитозы.
10.2. Лангергансово-клеточный гистиоцитоз (Х-гистиоцитоз)
Клиническая картина ЛКГ полиморфна и варьирует от генерализованного поражения различных систем организма до единичных и бессимптомных очагов поражения костей. У детей
раннего возраста заболевание может начинаться с проявлений
лихорадки, нарушения аппетита, сна, беспокойства.
Кости чаще вовлекаются в процесс у детей старшего возраста
в виде единичных или множественных очагов костной деструкции. Наиболее часто поражаются кости черепа (рис. 10.3), тазовые, бедренные кости, позвонки, ребра, нижняя челюсть.
Практически не отмечается патологии в костях кисти и стопы.
Поражение костей может быть бессимптомно или сопровождаться болевым синдромом и припухлостью окружающих мягких тканей. В зависимости от локализации патологического
очага наблюдаются следующие симптомы: экзофтальм, "мастоидит", "рецидивирующий отит", снижение слуха, расшатывание зубов, "гипертрофический гингивит", патологические переломы, компрессия тел позвонков.
Рентгенологическая картина характеризуется литическими
очагами с четкими контурами, овальной или неправильной
формы, отграниченными от других отделов кости зоной склероза. В фазе репарации через 4—6 мес появляется трабекуляриза-
ция и наблюдается уменьшение размеров дефекта. Для подтверждения характера поражения можно использовать радиоизотопное сканирование скелета и (по показаниям) компьютерную
томографию, особенно при подозрении на вовлечение в процесс
головного мозга, орбиты, пирамиды височной кости, сосцевидного отростка и позвонков.
Кожа, как правило, поражается у детей раннего возраста. У
новорожденных эта патология известна как болезнь Хашимо-
то—Притскера. Кожные изменения полиморфны, и больные
длительно наблюдаются с диагнозами себорейного дерматита,
243
Рис. 10.3. Рентгенограмма черепа. Множественные очаги деструкции
костей черепа при лангергансово-клеточном гистиоцитозе. Боковой
(а) и прямой (б) снимки.
244
экземы, пиодермии. Чаще всего сыпь отмечается на волосистой
части головы, коже туловища. Типичная сыпь папулезная, белесовато- или красно-коричневого цвета, нередко кожные элементы покрыты корочкой или сопровождаются изъязвлением.
Кожные изменения наиболее часто являются составной частью
генерализованной формы заболевания и первыми симптомами
ЛКГ (рис. 10.4).
Поражение слизистых оболочек полости рта проявляется
стоматитом, гиперплазией десен.
Лимфатические узлы наиболее часто вовлекаются в процесс у
подростков. Лимфаденопатия может быть изолированной (чаще
шейные и паховые лимфатические узлы) или распространенной.
Легкие поражаются в любом возрасте, что проявляется в виде
кашля, одышки. Часто больные имеют лишь общие симптомы —
лихорадку, слабость, снижение массы тела. Ранние изменения
на рентгенограммах показывают деформацию и усиление легочного рисунка, в последующем — микроузловые инфильтративные тени. Реакция со стороны внутригрудных лимфатических узлов наблюдается нечасто.
Отмечается увеличение печени. Гепатомегалия может быть
следствием как специфического поражения, так и обструкции
увеличенными лимфатическими узлами области vena porta.
Рис. 10.4. Больной с лангергансово-клеточным гистиоцитозом — себорейный дерматит, экзема; экзофтальм при поражении черепа, орбиты.
245
Специфическое поражение печени проявляется гипербилиру-
бинемией, асцитом, нарушениями коагуляции крови, что является плохим прогностическим фактором.
Поражение селезенки также ухудшает прогноз заболевания;
оно часто встречается у детей раннего возраста и нередко сопровождается симптомами гиперспленизма.
Изменения костного мозга характеризуются цитопенией периферической крови. Наличие клеток Лангерганса в пунктате
костного мозга клинически проявляется лихорадкой, сплено-
мегалией, поражением кожи, несахарным диабетом и тромбо-
цитопенией. Нарушения со стороны костного мозга подтверждаются пунктатом костного мозга и трепанобиопсией.
Поражение желудочно-кишечного тракта проявляется симптомами мальабсорбции, тошнотой, энтеропатией. Чаще в процесс вовлекаются подвздошная кишка, а также желудок, толстая кишка.
Среди эндокринопатий наиболее часто встречаются симптомы несахарного диабета и низкорослость. Они являются следствием частичного или полного гипопитуитаризма, что обусловлено недостаточной трофической стимуляцией гипотала-
мо-гипофизарной области или ингибицией гипоталамических
рилизинг-факторов. Галакторея, гипогонадизм и пангипопи-
туитаризм описываются намного реже. Поражение щитовидной железы при ЛКГ встречается редко; в литературе имеется
описание лишь 11 случаев. Мы наблюдали поражение щитовидной железы у 2 из 186 больных ЛКГ за период с 1976 по
1994 г. Одна больная — девочка 3 лет, другой пациент — мальчик 7 лет. Поражение щитовидной железы у них было изолированным в течение заболевания и сопровождалось ее увеличением до И—III степени. При ультразвуковом исследовании выявлена неоднородность структуры железы. Сцинтиграфия с
радиоактивным 311 выявила увеличение долей щитовидной
железы и отсутствие накопления радиофармакологического
препарата в пораженной доле. Радиоиммунологическое исследование гормонального профиля показало гипотиреоидизм.
При цитологическом исследовании пунктата щитовидной железы выявлена пролиферация гистиоцитов, макрофагов с примесью эозинофилов.
При гистологическом исследовании с помощью гемитирео-
идэктомии в ткани щитовидной железы выявлена диффузная
пролиферация зрелых гистиоцитов. При электронно-микроскопическом исследовании в гистиоцитах обнаружены гранулы
Бирбека, что подтвердило диагноз ЛКГ с поражением щитовидной железы у обоих детей. При полном клиническом обследовании каких-либо других локализаций поражения не было выявлено.
Больным в течение 6 мес была проведена химиотерапия
винкристином, циклофосфаном и преднизолоном (схема СОР)
246
и ежедневно назначался тироксин. В течении заболевания у
больных наблюдается ремиссия (соответственно 126 и 56 мес).
Вовлечение центральной нервной системы проявляется в
виде очаговых поражений коры полушарий большого мозга,
диэнцефальных и мозжечковых нарушений. Для диагностики
этих локализаций необходимо проводить компьютерную томографию в сочетании с эхоэнцефалографическими исследованиями.
Таким образом, окончательный диагноз ЛКГ формируется
на основании морфологического исследования пораженной
ткани с проведением электронно-микроскопического исследования при обнаружении в гистиоцитах гранул Бирбека, а при
иммунологическом исследовании — экспрессии CD 1а.
Важной является оценка поражения различных систем и органов с характеристикой их функциональной активности. Для
прогноза заболевания большое значение имеет число вовлеченных в процесс органов и систем. В связи с этим у больных ЛКГ
выделяют две формы.
1. Локализованный ЛКГ, который включает:
• локализованное поражение костей (наличие одного
или нескольких очагов в пределах одной кости);
• изолированное поражение кожи;
• локализованное поражение лимфатических узлов (до 4
лимфоузлов одной группы).
2. Диссеминированный ЛКГ, в который входят:
• группа А — полиочаговое поражение костей без изменения или с поражением прилежащих мягких тканей;
• группа В — поражение мягких тканей без поражения
или с поражением костей; вовлечение в процесс висцеральных органов без органной дисфункции;
• группа С — наличие органной дисфункции по критериям
М. Е. Lahey (1975); при этом дисфункция печени характеризуется одним или более из следующих признаков:
— общий белок ниже 55 г/л;
— альбумин ниже 25 мкмоль/л;
— отеки и/или асцит;
— билирубин свыше 20 мкмоль/л при отсутствии признаков гемолиза.
Дисфункция кроветворения проявляется наличием одного
или более из следующих признаков:
— гемоглобин ниже 100 г/л при отсутствии дефицита
железа;
— лейкоциты ниже 4,0 • 109/л;
— нейтрофилы ниже 1,5 • 10^/л;
— тромбоциты ниже 100* 1 (г/л.
247
Дисфункция легких характеризуется наличием тахипноэ и/
или диспноэ, цианоза, кашля, пневмоторакса, плеврального экссудата (не являющегося результатом наслоившейся инфекции).
С учетом прогноза заболевания предложено деление его на
стадии со следующими клиническими признаками ЛКГ.
I стадия — локализованное поражение в одной кости;
II стадия — распространенное поражение костной системы
с наличием (или без него) симптомов "несахарного диабета",
экзофтальма, гнойного отита;
III стадия — поражение лимфатических узлов с вовлечением в
процесс селезенки, с поражением (или без него) костной системы;
IV стадия — диффузное или диссеминированное поражение
различных органов и систем (кожи, легких, печейи, костного
мозга, кишечники и др.) с (или без него) совместным поражением лимфатических узлов, селезенки, костной системы.
В каждой стадии выделяются подстадии: "А" — отсутствие
общих симптомов; "В" — наличие общих симптомов.
При этом более благоприятный прогноз наблюдается при поражении костной системы; он ухудшается при поражении лимфатических узлов, селезенки и особенно легких и других органов.
Возраст больного обратно пропорционален тяжести прогноза
больных ЛКГ. Больные с дисфункциями гемопоэза, печени и
легких имеют только 50—70 % выживаемость в течение 5 лет.
Тактика лечения больных с ЛКГ зависит от форм заболевания — локализованная или генерализованная — диссеминированная.
Лечение. При локализованных очагах поражения костей возможно применение местно лучевой терапии с суммарной дозой
на очаг 6—10 Гр.
При полиочаговом поражении костной системы необходимо
проведение химиотерапии препаратами винбластином, цикло-
фосфаном, преднизолоном. При генерализованных формах заболевания проводится системная, цикловая полихимиотерапия. С этой целью Международное гистиоцитарное общество с
1990 г. начало изучение ЛКГ у детей с генерализованными формами заболевания. Проводятся изучение и сравнение двух программ лечения ЛКГ — DAL-HX-83 и DAL-HX-90.
В протоколы программы DAL-HX-83 включены препараты
вепезид (этопозид), винбластин и преднизолон в индукции ремиссии и поддерживающее лечение с назначением винбластина,
преднизолона и вепезида 1 раз в 3 нед. Кроме того, в зависимости от тяжести прогноза и органных дисфункций (в схеме "С")
показано применение метотрексата в дозе 500 мг/м. Однако использование последнего в настоящее время пересматривается.
С 1990 г. предложена программа лечения ЛКГ, включающая
повышенные дозы метилпреднизолона (30 мг/кг массы) в течение 3 сут в сочетании с винбластином; такие циклы (до 8) по¬
248
вторяются через 3 нед. Регрессия заболевания при этом начиналась через 6—12 нед приблизительно у 50 % больных. Однако
необходимы дальнейшие наблюдения для сравнения этих двух
программ лечения. Новые программы включают также использование а-интерферона и циклоспорина А, а также применение
различных иммуномодуляторов.
10.3. Злокачественный гистиоцитоз (гистиоцитарная саркома)
Диагноз злокачественного гистиоцитоза основан на цитологическом исследовании пунктатов опухоли и костного мозга с
обязательным гистологическим исследованием пораженных
лимфатических узлов, опухолевых инфильтратов в мягких тканях, кожи и других органов. Кроме оценки морфологической
характеристики опухолевых элементов, для диагностики истинного злокачественного гистиоцитоза используются критерии по
иммунофенотип ированию.
1. Опухолевые клетки не экспрессируют Т- или В-ассоции-
рованные антигены.
2. Опухолевые клетки экспрессируют миеломоноцитарные
антигены, включающие:
A. Миеломоноцитарные антигены CDllb, CDllc, CD14,
CD15, лизоцим;
B. Моноцитарно-макрофагальные элементы СВ366, СВ686,
МАС-387, a-1-антигрипсин, a-1-антихимотрипсин;
C. Антитела, ассоциированные с другими линиями, которые
проявляют активность с клетками моноцитарно-мак-
рофагальной линии HLA-DR, CD43, CD45RO, CD45
(LCA), CD74.
При исследовании генома выявляется отсутствие генов ре-
анжировки В-иммуноглобулиновых и Т-клеточных антигенных
рецепторов.
При проведении морфологического и иммунологического исследования необходимо проводить дифференциальную диагностику злокачественного гистиоцитоза с крупноклеточной анапластической лимфомой (ККАЛ) и Ki-1-лимфомой (КАЛ).
В отличие от злокачественного гистиоцитоза для ККАЛ характерна экспрессия антигенов на клетках CD15, CD 19, CD22 и
реже — CD2, CD3, CD7, для КАЛ — CD30+.
При морфологическом исследовании выявлено, что выраженные нуклеолы менее характерны для клеток при злокачественном гистиоцитозе, а эритрофагия, фагоцитоз и базофилия менее
выражены в клетках при крупноклеточной анапластической
лимфоме.
Таким образом, учитывая, что клинические симптомы при
злокачественном гистиоцитозе и крупноклеточных анапластических лимфомах имеют сходство, для диагностики этих опу¬
249
холей на современном этапе необходимо проведение комплексных морфологических и иммунологических исследований опухолевой ткани и клеток.
Клиническая картина. Злокачественный гистиоцитоз характеризуется выраженными симптомами интоксикации в виде лихорадки и потери массы тела. Основные симптомы — лимфаде-
нопатия, поражение костной системы, реже печени, селезенки,
легких, плевры, кожи, почек, костного мозга, желудочно-кишечного тракта.
Первичной локализацией поражения у большинства больных
являются лимфатические узлы шейно-надключичной, паховоподвздошной областей, реже подмышечных, медиастинальных,
брыжеечных. Отличительной особенностью поражения лимфатических узлов является инфильтрация мягких тканей с распадом
и образованием изъязвлений на поверхности. Второй по частоте
первичной локализацией поражения является костная система.
При рентгенологическом исследовании выявляются мелкоочаговые деструктивные изменения в плоских и трубчатых костях,
напоминающие метастазы опухоли; крупноочаговые, с нечеткими
контурами, сливные очаги деструкции и множественные очаги
деструкции с четкими контурами, схожие с изменениями при
миеломной болезни. Реже первичной локализацией опухоли являются кожа и подкожно-жировой слой, мягкие ткани (например, орбиты, молочной железы, конечностей и пр.).
Лихорадка наблюдается практически у каждого больного и
имеет разнообразный характер: она может быть фебрильной или
гектической, постоянной или периодической.
В клиническом течении заболевания у больных в короткие
сроки наступают генерализация и диссеминация опухолевого
роста с выраженностью симптомов интоксикации, похудания и
поражением различных органов и систем. В период генерализации возможны изменения в легких в виде очаговой или множественной инфильтрации интерстиция.
Для злокачественного гистиоцитоза более характерно поражение глубоких слоев кожи и подкожно-жирового слоя с образованием инфильтратов в виде узловатых образований синюшного
цвета с распадом и изъязвлением в центре. Возможно выявление
инфильтратов в молочных железах. Поражение костного мозга
носит характер метастазирования по мере генерализации опухолевого роста, а не наоборот. По мере прогрессирования заболевания у больных нарастают проявления общей интоксикации в
виде лихорадки с размахами температуры до 39—40 °С, озноба,
похудания. Особенности течения заболевания с дальнейшим
метастазированием в различные органы дают право характеризовать его как гистиоцитарную саркому.
Клинические стадии злокачественного гистиоцитоза (гис-
тиоцитарной саркомы) укладываются в классификацию неход-
жкинскихлимфом S. Murphy. Поданной классификации, боль¬
250
шинство больных при постановке диагноза имеют III—IV клиническую стадию заболевания.
При дифференциальной диагностике злокачественного гисгио-
цитоза и лангергансово-клеточного гистиоцитоза, помимо микроскопических признаков, используют детали ультраструктуры
опухолевых клеток, а именно: отсутствие гранул Бирбека и значительно меньше выраженный фагоцитоз позволяют исключить
ЛКГ. Высокая степень дифференцировки всех составляющих
пролиферат клеток, фагоцитоз лимфоидных, плазматических
клеток, сегментоядерных лейкоцитов (а не эритроцитов) являются характерными чертами синусового гистиоцитоза с массивной лимфаденопатией. Отсутствие десмосом, пучков тоно-
филаментов позволяет отвергать недифференцированный рак,
меланосом и промеланосом — меланому (метастаз), миофила-
ментов — рабдомиосаркому и т. д.
Наиболее часто приходится дифференцировать злокачественный гистиоцитоз от крупноклеточной анапластической
лимфомы (ККАЛ) и Ю-1 -лимфомы (КАЛ), учитывая определенное сходство клинических симптомов злокачественного
гистиоцитоза, КАЛ и ККАЛ.
При этом у больных указанными заболеваниями наиболее
часто наблюдается поражение лимфатических узлов, кожи и
подкожно-жирового слоя с выраженностью симптомов интоксикации, особенно лихорадки. Диагноз помогают уточнить результаты иммунологического исследования опухолевых клеток
и электронной микроскопии.
Особенности клинических проявлений, выявление в проли-
фератах гистиоцитарных клеток различной степени зрелости с
преобладанием бластных форм позволяют считать эти состояния гистиоцитарными опухолями с определенной морфологической остротой процесса, т. е. острым гистиоцитозом. Наличие у большинства больных в начале заболевания первичной
локализации опухоли с дальнейшим метастазированием в различные органы и системы дает право характеризовать заболевание как гистиоцитарную саркому.
Основные клинические симптомы у детей со злокачественным
гистиоцитозом в период развернутых клинических проявлений
заболевания
• брюшной полости
Поражение костей:
• длинных трубчатых
• плоских
• позвонков
Поражение печени
Поражение селезенки
Поражение плевры
Поражение легких
1. Симптомы интоксикации
2. Анемический синдром 4.
3. Увеличение лимфатических узлов:
• шейно-надключичных
• подмышечных ,
• пахово-бедренных ^
• средостения
• забрюшинного про- 7.
странства 8.
251
9. Поражение костного мозга
10. Поражение миндалин
11. Поражение почки
12. Поражение ЖКТ
13. Поражение ЦНС
14. Поражение мягких тканей:
• конечностей
• туловища
• орбиты
• головы
• молочных желез
• полости рта и десен
15. Поражение кожи и подкожно-жирового слоя:
• геморрагии
• папулы
• узловые элементы
• сочетанные
16. Желтуха
Для постановки диагноза злокачественного гистиоцитоза
предложен п л а н обследования бол ьн ых, включающий
обязательные мероприятия.
1. Общее обследование'.
сбор анамнеза (уточнение интоксикации);
общий осмотр;
общий анализ крови;
цитологическое исследование костного мозга;
рентгенография органов грудной клетки;
УЗТ брюшной полости и забрюшинного пространства;
рентгенография скелета;
цитратом
сканирование лимфатической системы с
2. Морфологическая диагностика:
• цитологическое и цитохимическое исследование ткани
опухоли;
• гистологическое исследование ткани опухоли с электронной микроскопией;
• иммунофенотипирование опухоли.
3. Биологическое исследование:
• биохимический анализ крови (определение общего белка и его фракций, уровня билирубина, гаптоглобина,
церулоплазмина, ЛДГ, ЩФ, АЛТ, ACT, фибриногена);
• исследование иммунного статуса.
Дифференциально-диагностические критерии злокачественного гистиоцитоза представлены в табл. 10.2.
Злокачественный гистиоцитоз необходимо дифференцировать от ЛКГ, лимфогранулематоза, лимфосаркомы.
При дифференциальной диагностике злокачественного гистиоцитоза от лангергансово-клеточного гистиоцитоза, крупноклеточных анапластических лимфом, кроме микроскопических
признаков, необходимо использовать ультраструктуры опухолевых клеток и комплекс иммунологических исследований.
Лечение злокачественного гистиоцитоза основывается на
системной цикловой интенсивной полихимиотерапии с применением повышенных доз метотрексата и цитозара. Курсы хи¬
252
миотерапии включают также винкаалкалоиды, глюкокортикоиды, циклофосфамид, этопозид, антрациклиновые антибиотики,
меркаптопурин и интратекальное введение метотрексата в сочетании с цитозаром и преднизолоном. В последние годы во
многих клиниках Европы для лечения злокачественного гис-
тиоцитоза и других крупноклеточных лимфом используются
Таблица 10.2. Дифференциально-диагностические критерии
злокачественного гистиоцитоза (ЗГ), злокачественных лимфом и
гистиоцитоза из клеток Лангерганса (ЛКГ) у детей
Клинические симптомы
и признаки
ЗГ
ЛКГ
лгм
Неходж-
кинские
лимфомы
Пол (соотношение м:д)
2:1
1:1,2
3,5:1
3,4:1
Средний возраст (лет)
10,5
ДоЗ
12,6
4-6
Симптомы
интоксикации (%)
96,5
48/79
34
62
Увеличение лимфатических узлов (%)
36,2
100
94
шейно-надключич¬
ных
36,1
—
60-80
66
подмышечных
22,5
—
6-20
36
пахово-бедренных
25,3
—
6-12
—
средостения
14,1
—
30-40
17,5
забрюшинного
пространства
15,5
—
3-47
10,5
брюшной полости
1.4
—
—
10,5
Поражение органов и систем (%)
Кости
35,2
72,9
Менее 1
Менее 1
Печень
26,8
19,7
2,5
10
Селезенка
18,3
21,9
30
4
Плевра
25,3
Нехарак¬
терно
30-40
17,5
Легкие
15,5
18,1
10-20
Нехарак¬
терно
Костный мозг
14,4
2
Нехарак¬
терно
22-27
Почки
7,0
Нехарак¬
терно
То же
2
ЖКТ
4,2
Нехарак¬
терно
40
ЦНС
4,2
Менее 1
И II
1-1,5
Мягкие ткани
36,6
31,5
Нехарак¬
терно
Кожа
35,2
24,7
4
253
протоколы лечения крупноклеточных анапластических лимфом, например германский протокол CCAL-NHL-BFM-90. Основу терапии составляет использование указанных выше препаратов в виде сжатого курса интенсивной химиотерапии "блоками". В данном случае химиотерапия проводится только при
строгом соблюдении сопроводительного лечения (адекватная
инфузионная терапия, деконтаминация кишечника, антибактериальная терапия, трансфузия компонентов крови и пр.).
Различие в программе BFM-90 зависит от степени риска,
т. е. клинической стадии заболевания. При I—II стадии назначают 3 цикла лечения, при III—IV — 6 циклов с увеличением дозы
метотрексата до 1—5 г/м2 в виде 24—36-часовой инфузии вместо
500 мг/м2 при I—II стадии. Помимо этого, в блоке А применяют
ифосфамид в дозе 800 мг/м2 с MESNA ежедневно в течение
5 сут, вепезид (VB-16) 100 мг/м2 — 4-й и 5-й дни и цитозар по
150 мг/м2 2 раза в сутки, 4-й и 5-й дни, а также дексаметазон —
10 мг/м2 ежедневно по 5 дней. В блоке В, кроме метотрексата в
дозе 500 мг/м2 и дексаметазона по 10 мг/м , назначают цикло-
фосфан по 200 мг/м2 с MESNA ежедневно 5 дней, адри-
абластин по 25 мг/м2 — 4-й и 5-й дни. В блоках АА и ВВ все
препараты применяют в тех же дозах, за исключением метотрексата 1—5 г/м , и в 1-е сутки вводят винкристин в дозе 1,5 мг/м2.
Несмотря на плохой прогноз злокачественного гистиоцитоза
у детей, даже при III—IV стадии заболевания получены положительные результаты.
Кроме данной программы, при злокачественном гистиоцито-
зе (III—IV стадия) используют протокол DAL-HX-90 с назначением в индукции вепезида (65 мг/м2 в 1—5-й день и 150 мг/м2 в
18-й; 25-й; 32-й; 39-й дни), винбластина в дозе 6 мг/м2 с ад-
риамицином 40 мг/м2 в 15-й; 22-й; 29-й; 36-й дни внутривенно,
капельно и преднизолона внутрь в дозе 40—60 мг/м2. Поддерживающую терапию проводят курсами реиндукции: преднизо-
лон в дозе 40 мг/м2 (1—5-й день), винбластин — 6 мг/м2 (1-й
день), вепезид — 150 мг/м2 внутривенно, капельно (5-й день) и
метотрексат — 1 г/м2 внутривенно, капельно с лейковорином
(1-й день). Курсы реиндукций проводят через 3 нед до 54 нед.
Возможно чередование курсов реиндукции по 5 дней с назначением вместо винбластина винкристина в дозе 1,5 мг/м2 в 1-й
день, адриабластина в дозе 40 мг/м2 в 1-й день, метотрексата в
той же дозе с лейковорином, но на 5-й день. При этом ежедневно назначается 6-меркаптопурин в дозе 60—80 мг/м2 внутрь.
Два протокола нуждаются еще в сопоставлении и в сравнении результатов лечения.
Таким образом, гистиоцитозы у детей представляют собой
широкий спектр заболеваний, различающихся между собой не
только по клиническому течению и степени зрелости пролиферирующих элементов системы мононуклеарных фагоцитов, но
и по подходам к лечению и прогнозу.
254
Глава 11 | ОПУХОЛИ ГОЛОВЫ И ШЕИ
11.1. Рак щитовидной железы
В последние годы проблема рака щитовидной железы становится все более актуальной, что обусловлено истинным его ростом.
Это заболевание, встречающееся значительно реже, чем у
взрослых, составляет тем не менее от 1 до 3 % от общего количества и до 8—15 % злокачественных солидных опухолей головы и шеи в детском возрасте.
Название Thyroid (щит) греческое. Железа была названа
Warton в 1646 г. из-за особенностей ее формы или из-за того,
что она прикрывала гортань. Щитовидная железа состоит из
двух боковых долей и промежуточной или перешейка, который
располагается в области И—IV колец трахеи и иногда доходит
до щитовидного хряща.
Кровоснабжение щитовидной железы осуществляется верхними и нижними парными щитовидными артериями. Иногда
имеется дополнительная непарная артерия, отходящая от дуги
аорты или безымянной артерии. По кровоснабжению щитовидная железа занимает первое место в человеческом организме.
На 10 г щитовидной железы приходится 56 мл крови в 1 мин,
на такое же количество ткани почки — 15 мл. Иннервация щитовидной железы осуществляется симпатическими и парасимпатическими волокнами от шейного симпатического ствола и
его узлов и блуждающего нерва.
Снаружи щитовидная железа покрыта фиброзной капсулой,
от которой отходят тонкие прослойки, разделяющие железу на
дольки. Дольки состоят из фолликулов, выстланных однослойным кубическим эпителием. В полости фолликула находится
секрет — коллоид, состоящий в основном из тиреоглобулина,
в молекулу которого входят йодтирозины и йодтиронины. Между фолликулами располагается соединительная ткань, которая
составляет строму щитовидной железы. За последние годы получены новые данные о строении щитовидной железы, о ее
многогранной функциональной деятельности, которая разделена между различными группами клеток. Непрерывный рост информации о строении и функции органов и тканей, о гисто- и
морфогенезе возникающих из них опухолей заставляют постоянно усовершенствовать классификации, построенные на клиническом, гистологическом и гистогенетическом принципах.
Для клинициста идеальным вариантом классификации заболеваний щитовидной железы являлась бы такая, которая учитывала прежде всего распространенность опухолевого поражения, гистологические варианты и гистогенез. Все существующие ныне классификации, не удовлетворяя полностью эти три
основных принципа, тем не менее оказывают большую помощь
в клинической практике.
255
Международная гистологическая классификация
I. Эпителиальные опухоли
А. Доброкачественные:
1) фолликулярная аденома
2) прочие
Б. Злокачественные:
1) фолликулярный рак
2) папиллярный рак
3) плоскоклеточный рак
4) недифференцированный рак
а) веретеноклеточная форма
б) гигантоклеточная форма
в) мелкоклеточная форма
5) медуллярный рак
II. Неэпителиальные опухоли
А. Доброкачественные
Б. Злокачественные
1) фибросаркома
2) прочие
III. Смешанные опухоли
1. Карциносаркома
2. Злокачественная гемангиоэндотелиома
3. Злокачественные лимфомы
4. Тератомы
IV. Вторичные опухоли
V. Неклассифицируемые опухоли
VI. Опухолеподобные поражения
Отечественная клиническая классификация по стадиям
I стадия — одиночная опухоль, не прорастающая в капсулу, не вызывающая деформации или ограничение смещаемости
железы. Регионарные метастазы не определяются.
II а стадия — одиночная опухоль, вызывающая деформацию
железы, или множественные опухоли без признаков прорастания капсулы железы. Смещаемость железы не нарушена. Регионарные метастазы не определяются.
Пб стадия — опухоль той же или меньшей степени распространенности при наличии смещаемых регионарных метастазов
на стороне поражения.
Ша стадия — одиночная опухоль или множественные опухоли, прорастающие в капсулу щитовидной железы. Смещаемость железы ограничена. Могут отмечаться сдавление трахеи,
256
пищевода, парез или паралич возвратных нервов. Регионарные
метастазы не определяются.
Шб стадия — опухоль той же или меньшей степени местного распространения с двусторонними смещаемыми, одно- или
двусторонними ограниченно смещаемыми или контралатеральными регионарными метастазами.
IVa стадия — опухоль прорастает в окружающие анатомические структуры и органы. Щитовидная железа не смещается.
Регионарные метастазы не определяются.
IV6 стадия — опухоль той же степени местного распространения с любыми вариантами регионарного метастазирования,
или опухоль меньшей степени местного распространения с не-
смещаемыми регионарными метастазами, или опухоль любой
степени местного распространения с клинически определяемыми отдаленными метастазами.
Международная классификация по системе TNM
I — первичная опухоль
Tis — преинвазивная карцинома (carcinoma in situ)
ТО — первичная опухоль не определяется
Т1 — одиночный узел в одной доле без деформации железы или с деформацией и без ограничения сме-
щаемости
Т2 — множественные узлы в одной доле без деформации
железы или с деформацией и без ограничения сме-
щаемости
ТЗ — опухоль, поражающая обе доли без деформации
железы или с деформацией и без ограничения подвижности, либо одиночный узел в перешейке
Т4 — опухоль распространяется за пределы капсулы железы
ТХ — недостаточно данных для оценки первичной опухоли
N — регионарные метастазы
N0 — нет признаков поражения регионарных лимфатиче¬
ских узлов
N1 — определяются пораженные смещаемые гомолате-
ральные лимфатические узлы
N2 — определяются пораженные смещаемые лимфатические узлы на противоположной стороне, по
средней линии или с обеих сторон
N3 — определяются пораженные несмещаемые лимфатические узлы
NX — недостаточно данных для оценки регионарных лимфатических узлов
257
М — отдаленные метастазы
МО — нет признаков отдаленных метастазов
Ml — имеются отдаленные метастазы
MX — недостаточно данных для определения отдаленных
метастазов.
В последние годы мы используем Международную классификацию рака щитовидной железы по TNM (American Join
Committee, 1993), которую рекомендуем применять для стади-
рования рака щитовидной железы.
Т — распространение первичной опухоли
ТХ — недостаточно данных д ля оценки первичной опухоли
ТО — первичная опухоль не определяется
Т1 — опухоль <1 см в наибольшем измерении, ограниченная тканью щитовидной железы
Т2 — опухоль >\ см, но <4 см в наибольшем измерении,
ограниченная тканью щитовидной железы
ТЗ — опухоль более 4 см в наибольшем измерении, ограниченная тканью щитовидной железы
Т4 — опухоль любого размера, распространяющаяся за
пределы капсулы щитовидной железы.
Все категории подразделяются на:
а) солитарную опухоль
б) многофокусную опухоль (классификация по наибольшему
узлу).
N — наличие или отсутствие регионарных метастазов
(лимфатические узлы шеи и верхнего средостения)
NX — недостаточно данных для оценки регионарных
лимфатических узлов
N0 — нет регионарных метастазов
N1 — имеется поражение регионарных лимфатических
узлов метастазами
Nla — поражены лимфатические узлы на стороне опухоли
Nib — поражены лимфатические узлы шеи с обеих сторон, срединные или на противоположной стороне
либо медиастинальные лимфатические узлы
М — наличие или отсутствие отдаленных метастазов
pTNM — является гистологическим подтверждением рака
щитовидной железы.
Исследователями опровергнуты мнения о едином гистогенезе опухолей щитовидной железы, связанных только с фолликулярными А-клетками, вырабатывающими тироксин при низкой активности сукцинатдегидрогеназы (СДГ). Опухоли второй
группы клеток — Ашкенази (Гюртля) или В-клетки, напротив,
258
характеризуются высокой метаболической активностью. Опухоли третьей группы часто генетически связаны с парафолликуляр-
ными или с С-клетками, обеспечивающими продукцию кальци-
тонина и характеризующимися наличием в строме и клетках рака
амилоида с высокой активностью неспецифической эстеразы и
низкой СДГ.
Дифференцированные и недифференцированные формы рака
щитовидной железы из А-клеток представляют 2 большие группы
новообразований. Первая характеризуется медленным развитием
болезни, хорошим прогнозом и встречается наиболее часто;
вторая — высокой степенью злокачественности и плохим прогнозом; встречается значительно реже.
Клетки В (Ашкенази) характеризуются высокой активностью
окислительно-восстановительных ферментов, большинства
гидролитических ферментов и неспецифической эстеразы, что
можно рассматривать как проявление интенсивной метаболической деятельности. Правильная гистогенетическая диагностика возможна за счет исследования СДГ, которая при других
видах опухолей остается низкой. Длительность развития заболевания из В-клеток меньше, чем из А-клеток. Различают 3 варианта В-клеток, которые влияют на особенности течения заболевания.
Парафолликулярные С- и В-клетки принадлежат к единой
клеточной системе (АПУД), объединяющей различные по происхождению клетки, но обладающие некоторыми общими
свойствами и участвующие в синтезе полипептидных гормонов
или накоплении биогенных аминов.
Из фолликулярных клеток и клеток Ашкенази могут развиваться папиллярная и фолликулярная аденокарциномы и недифференцированный рак (рис. 11.1; 11.2). Из парафолликуляр-
ных клеток развивается солидный рак, в строме которого содержится амилоид, поэтому его называют медуллярным (рис. 11.3).
В детском возрасте в основном встречается рак щитовидной
железы из А-клеток. По нашим данным, в 75 % случаев это папиллярный рак со всеми своими морфологическими разновидностями (папиллярный рак типичного строения, фолликулярный вариант папиллярного рака, диффузный склерозированный
вариант папиллярного рака и диффузный фолликулярный вариант папиллярного рака), который развивается достаточно медленно. Отмечается преобладание девочек над мальчиками в соотношении 6:1. В 32 % наблюдений диагностируется фолликулярный рак, обладающий несколько более активным течением;
при этом соотношение девочек и мальчиков составляет 2,5:1.
При смешанной гистологической форме (папиллярно-фолликулярной), составляющей 22 %, количество девочек также
втрое выше.
Рак из В-клеток, как и медуллярный рак, встречается крайне
редко и составляет в сумме 2 % наблюдений. Медуллярный рак
259
Рис. 11.1. Папиллярный рак
щитовидной железы.
Рис. 11.2. Фолликулярный рак щитовидной железы.
260
Рис. 11.3. Медуллярный рак щитовидной железы.
развивается как спорадически, так и в виде семейного эндокринного синдрома.
Недифференцированные формы рака являются казуистическими в детском возрасте и описаны в виде единичных наблюдений, как и некоторые другие неэпителиальные злокачественные опухоли щитовидной железы (тератома, лимфосаркома,
ангиосаркома и др.).
Рак щитовидной железы встречается значительно чаще у девочек в среднем соотношении 3,6:1. Основной возраст больных
на момент заболевания составляет 8—14 лет. В то же время имеются наблюдения возникновения рака щитовидной железы у
детей до 3 лет жизни, что составляет около 3 % наблюдений.
Наибольшее количество детей заболевает в возрасте 11—14 лет,
т. е. в пубертатный период, при этом соотношение девочек и
мальчиков составляет 4,6:1. В последние годы наряду с общим
ростом заболеваемости отмечается значительное увеличение
количества детей младшего возраста, что мы склонны объяснять влиянием экологических факторов, в частности йодной
недостаточностью, повышением уровня радиации, канцерогенных веществ, провоцирующим действием предшествовавшего
облучения области головы и шеи при различных заболеваниях,
назначением антитиреоидных препаратов и т. д.
Высокая дифференциация опухолевых клеток при раке щитовидной железы у детей обусловливает относительно медленное
261
его развитие и течение. В отличие от взрослых у детей значительно реже рак развивается на фоне предшествовавшего зоба.
Клиническая картина. Начальные признаки не патогномо-
ничны. Основным симптомом рака щитовидной железы у детей
является появление асимметрии и деформации в области щитовидной железы, определяемые визуально. Впоследствии могут развиться ощущения дискомфорта и инородного тела при
глотании пищи, неудобства при поворотах головы и чувство
стеснения одеждой в области шеи.
При пальпаторном исследовании щитовидной железы, как
правило, на фоне ее увеличения отмечается наличие небольшого
безболезненного узелка, который имеет тенденцию к росту и
уплотнению. В начальном периоде заболевания образование
имеет плотноэластическую консистенцию и легко смещается
при глотании. Обычно бывает трудно пальпаторно выявить узлы небольших размеров, особенно при их первоначальной локализации в задних отделах щитовидной железы. Зачастую ребенок лечится у педиатров или детских хирургов по поводу
предполагаемых шейных лимфаденитов различной этиологии,
и только спустя длительный период времени, составляющий
порою 2 года и более, устанавливают диагноз первичного ракового поражения щитовидной железы и метастатического поражения шейных лимфатических узлов. В то же время существуют
варианты клинического течения, когда опухоль имеет быстрый
и агрессивный рост с выходом за капсулу щитовидной железы,
с инфильтрацией, прорастанием окружающих тканей и обширным метастазированием.
Наличие увеличенных регионарных лимфатических узлов является вторым по частоте симптомом рака щитовидной железы.
Наиболее часто поражаются шейные лимфатические узлы, расположенные по ходу сосудисто-нервного пучка. При этом пальпируются увеличенные, плотные, иногда легко, а в поздних
случаях плохо смещаемые отдельные узлы, цепочка или конгломерат, образованные слившимися метастазами.
В некоторых случаях при длительном течении заболевания у
детей появляется затруднение дыхания, что обусловлено врастанием опухоли в трахею, ее смещением и сдавлением с уменьшением просвета непосредственно раковой опухолью щитовидной железы или ее метастазами. Особенно показательна такая
клиническая картина при поражении метастазами паратрахе-
альных лимфатических узлов, уходящих загрудинно в верхнее
средостение. В других наблюдениях развившаяся дыхательная
недостаточность может быть связана с метастатическим поражением легочной ткани при диссеминации процесса. Этими же
причинами, а также прорастанием опухоли возвратного нерва
вызваны изменения голоса — от его осиплости до афонии.
Болевые ощущения в области пораженной щитовидной железы и метастатических узлов являются довольно редкими в
262
детском возрасте и бывают при врастании опухоли в трахею или
вовлечении в процесс нервных проводящих путей шеи. В ряде
наблюдений отмечается болевой синдром, что обусловлено
диссеминацией процесса с поражением костной системы.
Наименее характерными являются общие признаки опухолевого заболевания, так называемый общий опухолевый симпто-
мокомплекс, включающий в себя вялость, слабость, адинамию,
отсутствие аппетита и другие признаки опухолевой интоксикации. В большинстве случаев, несмотря даже на обширные поражения ткани щитовидной железы, последняя функционирует
достаточно активно и дети находятся в эутиреоидном состоянии.
Метастатическое поражение регионарных лимфатических
узлов шеи отмечается в 84 % наблюдений, в 54 % из них регионарные метастазы визуально определялись раньше, чем изменения в щитовидной железе, причем двустороннее поражение
лимфатических узлов регистрируется у 66 % всех больных с метастазами. Наиболее часто вовлекаются в процесс глубокие
яремные лимфатические узлы, расположенные вдоль сосудистонервного пучка шеи. Поражение этой группы лимфатических
узлов выявляется у 98 % больных. Отмечается частое метастази-
рование в паратрахеальные лимфатические узлы — 27,5 %; акцессорные и лимфатические узлы латерального треугольника
шеи вовлекаются в процесс у 21,1 и 23,7 % больных соответственно. Относительно редко рак щитовидной железы метастази-
рует в надключичные лимфатические узлы, еще реже — в лимфатические узлы верхнего средостения.
Отдаленные метастазы выявляются у 20—22 % детей. У большинства из них обнаруживается метастатическое поражение
легких, реже костей. Чаще всего имеется сочетанное поражение
регионарных лимфатических узлов легких. Иногда поражение
легких является рентгенологической находкой при обследовании ребенка по поводу простудных заболеваний.
Особый интерес представляют дети с так называемым скрытым раком щитовидной железы, когда имеется небольших размеров опухолевое поражение железы, не выявляемое возможными доступными методами исследований, а первым клиническим
признаком служит "хроническая шейная лимфаденопатия".
В таких ситуациях крайне необходимо знать, что причиной подобных "лимфаденопатий" может быть рак щитовидной железы,
и направить свои усилия на своевременную его диагностику.
В последние годы рак щитовидной железы приобретает более
агрессивное течение, развивается у детей более младшего возраста, что особенно заметно на примерах больных, поступающих для лечения из зон, загрязненных радионуклидами после
аварии на Чернобыльской АЭС.
К сожалению, отсутствие характерных клинических признаков
рака щитовидной железы и достаточных знаний у детских специалистов в области детской онкологии приводит к весьма пе¬
263
чальным последствиям. Большинство детей попадают к детскому
онкологу в момент развернутых клинических проявлений, когда
уже имеется значительное поражение самой щитовидной железы,
лимфатического коллектора шеи и отдаленных органов.
Анализ анамнестических данных показывает, что от появления первых симптомов заболевания до установления диагноза
проходит от 1 мес до 2,5 лет, причем у 56 % больных диагноз
устанавливается спустя 1,5—2 года. В 17 % наблюдений детям
с увеличенными шейными лимфатическими узлами ставится
диагноз хронического тонзиллита с лимфаденитом и проводится физиотерапевтическое лечение.
В связи с этим необходимы усиление профилактической работы в детских учреждениях, повышение онкологической настороженности врачей педиатрической сети, систематический
контроль за детьми в группах "риска", в которые отнесены дети
из эндемичных по йоду районов, с гипотиреозом, гиперплазиями щитовидной железы, узловым зобом, проживающие и проживавшие в районах с неблагоприятной радиационной обстановкой, дети ликвидаторов аварий на АЭС.
Для диагностики рака щитовидной железы необходимо использовать комплекс мероприятий, включающий в себя сбор
анамнестических данных, способный выявить больных, проживавших в зонах с недостаточностью йода; имевших родителей
или ближайших родственников, оперированных или наблюдавшихся по поводу новообразований щитовидной железы; больных, которым в раннем детском возрасте проводилась лучевая
терапия на область головы и шеи по поводу доброкачественных
или воспалительных заболеваний; детей из районов с неблагоприятной радиационной обстановкой.
Важными моментами диагностики являются осмотр и пальпация щитовидной железы и зон регионарного метастазирова-
ния, позволяющая обнаружить деформации, асимметрии, узло-
образование, увеличение пораженных лимфатических узлов. Из
клинических признаков, помогающих диагностике рака щитовидной железы, можно отметить увеличение объема щитовидной
железы, уплотнение узла, ограничение смещаемости железы, в то
же время отмеченные симптомы могут быть и при тиреоидитах,
аденомах и т. д.
Лучевые методы диагностики включают в себя ультразвуковое исследование органов шеи, рентгенографию органов шеи и
грудной клетки, сцинтиграфию щитовидной железы с 99тТс, по
показаниям — рентгенографию области шеи, костей скелета,
прямую тиреоидолимфографию, ангиографию, компьютерную
томографию шеи и верхнего средостения.
Эхографические исследования, которые широко используются в последние годы, имеют неоценимое значение в диагностике патологии щитовидной железы у детей, в первую очередь
как скрининговое неинвазивное исследование, позволяющее
264
заподозрить объемный процесс. Извращение эхографического
сигнала, наличие гипоэхогенных участков в увеличенных лимфатических узлах шеи позволяют заподозрить не банальное течение лимфаденопатии (рис. 11.4).
По ультразвуковому исследованию авторы классифицируют 3
типа поражения лимфатических узлов — солидное, кистозное и
Рис. 11.4. Ультразвуковая томография (а, в). Рак щитовидной железы.
Щитовидная железа увеличена за счет обеих долей, больше правой доли.
Тиреоидная ткань обычной эхогенности, в области перешейка несколько неоднородная. В верхнем полюсе правой доли определяется овальное
образование размерами 18 • 15 • 14 мм без капсулы, пониженной эхогенности, неоднородной структуры, с довольно ровными контурами.
265
смешанное. Солидные образования могут быть часто доброкачественными, однако имеется высокий шанс их малигнизации;
кистозные — не всегда доброкачественные, но в большей степени, чем плотные образования. Особенно необходимо проводить
ультразвуковое исследование при непальпируемых, небольших
узлах, расположенных в задних отделах щитовидной железы. При
этом разрешающая способность метода является достаточно высокой, что позволяет рекомендовать его широкое применение.
При рентгенологическом исследовании органов шеи у 10 %
детей отмечается смещение или сужение трахеи. Помимо рентгенографии трахеи, необходима оценка состояния верхнего отдела пищевода, который может быть сдавлен, смещен или поражен врастающей в него опухолью щитовидной железы. Основным методом выявления метастатического поражения легких
является рентгенологическое исследование грудной клетки. Параллельно возможно выявление вовлеченных в процесс медиастинальных лимфатических узлов.
Радиоизотопное сканирование не является достоверным методом диагностики, так как не устанавливает природу поражения. Тем не менее этот метод является необходимым в комплексной диагностике, так как позволяет более правильно определить
тактику хирургического вмешательства. Для радиоизотопного
исследования щитовидной железы у детей используется корот-
коживущий изотоп технеция 99тТс. Пораженная ткань хуже накапливает изотоп, что на сканограмме выявляется в виде "холодного" узла. Проводимые радиоизотопные исследования с
99тТс показывают, что для злокачественной опухоли наиболее
характерно наличие "холодного" узла, который
определяется в 91 % наблюдений при раковых
-iM! поражениях (рис. 11.5).
В некоторых случаях "теплые" и "горячие" узлы в
щитовидной железе могут
иметь злокачественную
природу. Кроме того, радиоизотопное исследова-
Рис. 11.5. Радиоизотопное
исследование щитовидной
железы. Правая доля щитовидной железы увеличена в
размерах. В области, соответствующей локализации
опухоли в правой доле, накопление изотопа отсутствует — "холодный" узел.
ЛЩгГ.
ж
266
ние является весьма ценным при обследовании нерадикально
оперированных детей и выявлении отдаленных метастазов в
легких и костях. Метастазы и рецидивы медуллярного рака могут быть выявлены с помощью 201Та (таллий), который успешно применяется для исследования органов с высокой степенью
кровоснабжения, поэтому он концентрируется в щитовидной
железе и в опухоли.
Ряду больных проводится прямая тиреоидолимфография,
позволяющая по дефектам накопления контрастного вещества
определить размеры и расположение опухоли в щитовидной
железе. Тиреоидолимфография заключается в инъекции водорастворимых или высокодисперсных масляных веществ, таких
как верографин и сверхжидкий липиодол. Больной находится в
положении на спине с валиком под лопатками. Контраст вводится в пальпаторно не измененную ткань щитовидной железы
по 1,5—2 мл в каждую долю, и проводится рентгенологическое
исследование в прямой и боковой проекциях сразу после введения препарата при водорастворимых контрастных веществах
или через 24 ч при введении масляных растворов. Метод позволяет выявить нарушения контрастирования доли железы, прерывистость и неровность границ наполнения, соответствующих
опухолевому узлу. Непораженные лимфатические узлы хорошо
контрастируются, пораженные — полностью блокируются.
В некоторых случаях для определения степени распространенности опухоли, особенно при загрудинном расположении
щитовидной железы и поражении верхних загрудинных лимфатических узлов, приходится прибегать к проведению ангиографического исследования. Для контрастирования щитовидной
железы используется пункция бедренной артерии, в дальнейшем проведение селективной или общей артериографии в зависимости от задач исследования. Артериография позволяет также
выявить связь опухоли или ее метастазов с магистральными сосудами шеи. Наиболее характерными признаками опухолевого
поражения являются смещение, сужение просвета сосудов, их
ампутация.
В далеко зашедших стадиях заболевания при инфильтративном росте опухоли и ее метастазов используется компьютерная
томография органов шеи и верхнего средостения, что позволяет
уточнить распространенность опухолевого поражения и метастазов, синтопию органов, более точно определиться с планируемой
хирургической тактикой. При компьютерной томографии возможно дифференцировать мышечную и жировую ткани, крупные сосуды шеи, хрящи трахеи и гортани, костные структуры,
что является весьма ценным в предоперационной диагностике.
При нарушении фонации, затруднениях дыхания в процессе
диагностики больных целесообразно проведение ларингоскопии, обнаруживающей в ряде случаев вовлечение в процесс возвратного нерва или повреждение его во время предыдущих опе¬
267
раций, врастание опухоли в стенку трахеи. С развитием методов
эндоскопической диагностики исследование гортани перестало
быть большой проблемой для пациентов младшего возраста.
Только в небольшом количестве наблюдений приходится прибегать к поднаркозной фиброларингоскопии из-за боязни или
негативного отношения ребенка к манипуляциям.
Для диагностики опухолевых заболеваний и оценки функционального состояния щитовидной железы применяются ра-
диоиммунные методы определения маркеров и уровня тиреоидных гормонов. Уровень тиреоглобулина может быть повышен у больных с папиллярным и фолликулярным раком, но
остается в норме при анапластическом и медуллярном. Не указывает на доброкачественное или злокачественное поражение
лимфатических узлов, но может быть показателем малигниза-
ции при многоузловом зобе.
Повышение уровня тиреоглобулина может быть использовано при наблюдении за детьми, подвергшимися облучению и находящимися в группе риска по развитию заболевания щитовидной железы, а также перенесшими хирургические вмешательства по поводу рака. После проведения тиреоидэктомии по
поводу папиллярного или фолликулярного рака отмечается
нормализация уровня тиреоглобулина, при появлении рецидива и метастазов он вновь повышается. Раково-эмбриональный
антиген может быть повышен у пациентов с медуллярным раком, но более точным является определение уровня кальцито-
нина — специфического опухолевого маркера. Критическая
оценка метода радиоиммунной диагностики может быть проведена только при значительном накоплении лабораторных данных и проведении сравнительного анализа с неопухолевой патологией щитовидной железы.
Обязательным методом диагностики является подтверждение злокачественности процесса с помощью тонкоигольной аспирационной биопсии (ТАБ) с последующим цитологическим
исследованием аспирата. Цитологическое исследование в руках
опытного цитолога и онколога может дать максимум информации при минимальных затруднениях, так как требует только наличия инъекционной иглы, сухого, притертого 20-граммового
шприца и нескольких стекол. Дети старшего возраста легко переносят манипуляцию без применения анестезии, для детей
младшего возраста и негативно относящихся к процедурам детей используется кислородно-закисный наркоз. При небольших опухолях или опухолях, расположенных в глубоких отделах
щитовидной железы, ТАБ проводится под ультразвуковым контролем, что гарантирует адекватный забор материала. По данным этого исследования, злокачественное поражение щитовидной железы возможно распознать в 95—97 % случаев, а в 77 %
наблюдений определить морфологическую разновидность рака.
Так же обязательно цитологическое исследование увеличенных
268
шейных лимфатических узлов. В редких случаях приходится
прибегать к открытой биопсии, чаще всего регионарных метастазов, реже — непосредственно щитовидной железы.
Дифференциальную диагностику рака щитовидной железы
необходимо проводить в первую очередь с доброкачественными
новообразованиями, такими как аденома и узловой зоб. При
этих заболеваниях щитовидная железа имеет более гладкие, ровные контуры, эластическую консистенцию. Появление участка
уплотнения, деформация щитовидной железы должны вызвать
подозрение на малигнизацию процесса. Необходимо также дифференцировать рак щитовидной железы от острых и хронических тиреоидитов. Для острых тиреоидитов характерно острое
начало с повышением температуры, возможным болевым синдромом в области щитовидной железы и шеи; для хронических
динамика развития заболевания не столь активна, щитовидная
железа безболезненна, диффузно увеличена, уплотнена.
Значительно реже в щитовидной железе у детей развиваются
специфические струмиты, такие как туберкулез, актиномикоз,
эхинококк. Регионарные метастазы рака щитовидной железы
чаще всего принимают за банальные лимфаденопатии, туберкулез, срединные и боковые кисты шеи, лимфогранулематоз и др.
Решающее значение в дифференциальной диагностике имеет
цитологическое исследование, при неудачах — верификация диагноза после срочного интраоперационного или планового морфологического исследования. Вспомогательным методом диагностики при аутоиммунном тиреоидите Хашимото может быть
радиоиммунное исследование гормонов щитовидной железы.
Лечение. Основным методом лечения рака щитовидной железы у детей является хирургический. Подход к решению вопроса
об объеме хирургического вмешательства зависит от стадии заболевания, локализации и количества узлов в щитовидной железе, темпов роста и гистологического строения новообразования.
Все операции при раке щитовидной железы проводятся экст-
ракапсулярно. Минимальным объемом вмешательства следует
считать гемитиреоидэктомию (ГТ). При проведении операции
необходим широкий доступ для адекватной ревизии всей щитовидной железы и зон регионарного метастазирования. Обязательно контролируется ход возвратного нерва до его вступления в гортань. Верхний гортанный нерв может быть поврежден
при высоком расположении верхнего полюса щитовидной железы во время перевязки верхней щитовидной артерии. В таком
случае в послеоперационном периоде имеются проблемы с глотанием жидкой пищи из-за потери чувствительности в области
надгортанника.
В прежние годы мы использовали отечественную классификацию для стадирования рака щитовидной железы и, будучи
сторонниками сохранных операций, более выгодных для ребенка в функциональном отношении, в отделении опухолей голо¬
269
вы и шеи НИИ ДО РОНЦ РАМН проводили по возможности
щадящие операции при достижении максимальной абластики.
Так, всем детям с I стадией заболевания выполнялась гемити-
реоидэктомия. Опухоль располагается в одной из долей щитовидной железы, и ее размеры обычно не превышают 1,5 см.
У большинства больных со II стадией рака щитовидной железы объем проводимых оперативных вмешательств был шире,
что связано с большим распространением опухоли и наличием
регионарных метастазов. Большинству пациентов проводилась
гемитиреоидэктомия с резекцией перешейка (ГТРП) щитовидной железы, а также ГТРП и фасциально-футлярное иссечение
лимфатических узлов и клетчатки (ФФИЛК) шеи на стороне
поражения.
При III стадии хирургическое лечение проводилось в объеме
субтотальной резекции щитовидной железы с ФФИЛК с одной
или с обеих сторон шеи. При наличии отдаленных метастазов
всем больным выполнялась тиреоидэктомия с последующим
лечением радиоактивным йодом.
В последние годы отмечена тенденция к более активному течению рака щитовидной железы у детей, особенно проживавших и проживающих в регионах, загрязненных радионуклидами
после аварии на ЧАЭС. В связи с этим, а также после оценки
причин повторных операций мы пришли к выводу о целесообразности более агрессивного хирургического лечения. Органосохранные операции проводятся только больным с высокодифференцированными формами рака щитовидной железы, имеющими стадию по TNM TlaNOMO. Во всех остальных случаям
осуществляется тиреоидэктомия с последующей радиойодабла-
цией и супрессивной гормональной терапией левотироксином.
Кроме того, необходимо проводить иссечение центральной
(преларингеальной, претрахеальной и паратрахеальной) клетчатки шеи, при гистологическом исследовании которой у 10—
20 % больных могут быть обнаружены скрытые метастазы.
В связи со значительной распространенностью опухолевых поражений операции только на щитовидной железе были выполнены у 29 % больных. Во всех остальных случаях была необходимость в проведении иссечения лимфатических узлов и клетчатки шеи с одной или обеих сторон. Мы используем
модификацию ФФИЛК шеи, разработанную в стенах Онкологического научного центра РАМН, позволяющую избежать удаления кивательной мышцы, внутренней яремной вены, подчелюстной слюнной железы, резекции добавочного нерва, которые проводятся при классическом исполнении операции
Крайла или ее модификациях в виде радикальной шейной диссекции. Естественно, функциональные результаты при ФФИЛК
шеи значительно лучше при одинаковом проценте достижения
радикальности вмешательства. Сохранение внутренней яремной
вены позволяет избежать нарушений мозгового кровообраще¬
270
ния и отека лица, добавочный нерв обеспечивает полный объем
движений верхнего плечевого пояса, кивательная мышца защищает обнаженный после операции сосудисто-нервный пучок.
В послеоперационном периоде детям назначают тиреоидные
гормоны с целью гормональной коррекции, а также для подавления продукции тиреотропного гормона гипофиза, стимулирующего опухолевый рост.
В практике отделения опухолей головы и шеи НИИ ДО
РОНЦ РАМН хирургическое лечение у 25 % больных было повторным после первично проведенных оперативных вмешательств в других лечебных учреждениях. Большинство повторных
операций является технически трудновыполнимыми и влечет за
собой большое количество послеоперационных осложнений.
Причинами реопераций, как правило, служат неадекватность
первоначальных вмешательств, появление новых метастазов
или локальных рецидивов.
Среди осложнений оперативного лечения отмечаются повреждение внутренней яремной вены, повреждение возвратного
нерва, временный послеоперационный гипопаратиреоз, постоянный гипопаратиреоз, повреждение трахеи и пневмоторакс.
Всем детям с IV стадией заболевания требуется проведение
комбинированного лечения, включающего операцию (радикальную или нерадикальную) и лечение радиоактивным йодом. Радиоактивный йод назначают из расчета 50—100 мКи с интервалом в 3—6 мес. Максимальная суммарная доза составляет 200—
500 мКи.
Результаты лечения рака щитовидной железы зависят от стадии заболевания и адекватности лечения. Оценка 5-летней выживаемости больных указывает на благоприятный прогноз при
раке щитовидной железы I—II стадии заболевания; при III стадии живы 85,7 % оперированных детей, при IV стадии — 71 %
больных.
11.2. Опухоли слюнных желез
Опухоли слюнных желез у детей встречаются относительно редко и представлены преимущественно доброкачественными поражениями. По данным различных исследователей, они составляют от 3 до 5 % всех новообразований челюстно-лицевой области. Среди злокачественных опухолей головы и шеи
злокачественные поражения слюнных желез составляют не более 2 %. Наиболее часто (80—85 %) опухоль развивается в околоушной слюнной железе, реже в поднижнечелюстной или малых слюнных железах.
Слюнные железы делятся на малые и большие. Первые расположены в толще слизистой оболочки полости рта и делятся
на губные, щечные, молярные, язычные и небные железы.
Большие слюнные железы (околоушная и поднижнечелюстная)
271
парные, располагаются за пределами полости рта, открываясь
в нее протоками.
Серозные железы выделяют жидкость, богатую белком, слизистые — слизь, смешанные — смешанный секрет. Большие
слюнные железы, как и малые, выделяют серозный, слизистый
или смешанный секрет. Смесь секрета всех слюнных желез называют слюной.
Околоушная слюнная железа является железой серозного типа.
Имеет выводной проток, который прободает жевательную мышцу и открывается в полости рта на уровне второго верхнего коренного зуба. Кровоснабжается из поверхностной височной артерии, иннервация осуществляется из ушно-височного нерва,
постганглионарных волокон, симпатического шейного ствола.
Важной анатомической особенностью для хирургов является
то, что через околоушную слюнную железу проходит лицевой
нерв, обусловливая основные трудности при вмешательствах на
этом органе.
Поднижнечелюстная слюнная железа открывает проток в
области уздечки языка. Кровоснабжается от лицевой артерии,
иннервируется из лицевого нерва и симпатического сплетения.
Наиболее часто поражаются опухолью большие слюнные
железы, реже небные и щечные.
Для практической работы онкологи используют Международную гистологическую классификацию, предложенную ВОЗ
(серия № 7).
Международная гистологическая классификация
I. Эпителиальные опухоли
A. Аденома
1. Полиморфная аденома
2. Мономорфная аденома:
а) аденолимфома,
б) оксифильная аденома, другие типы
Б. Мукоэпидермоидная опухоль
B. Ацинозно-клеточная опухоль
Г. Карциномы
1. Аденокистозная карцинома (цилиндрома)
2. Аденокарцинома
3. Эпидермоидная карцинома
4. Недифференцированная карцинома
5. Карцинома в полиморфной аденоме (злокачественная опухоль)
II. Неэпителиальные опухоли
А. Доброкачественные
1. Гемангиома
272
2. Гемангиоперицитома
3. Неврилеммома
4. Нейрофиброма
5. Липома
Б. Злокачественные
1. Ангиогенная саркома
2. Рабдомиосаркома
3. Веретеноклеточная саркома (без уточнения гистогенеза)
III. Неклассифицированные опухоли
IV. Сходные опухолеподобные поражения:
1) доброкачественное лимфоэпителиальное поражение;
2) сиалоз;
3) онкоцитоз.
Общепринятой классификации опухолей слюнных желез не
существует до настоящего времени, поэтому в практической работе мы используем апробированную в отделении опухолей головы и шеи ОНЦ РАМН схему распределения опухолей по стадиям (для эпителиальных образований).
• I стадия (Т1) — опухоль размером (в наибольшем измерении) до 2 см, располагается в паренхиме железы и не
распространяется на капсулу. Кожа над опухолью немного возвышается или этих изменений нет. Симптомы поражения лицевого нерва отсутствуют.
• II стадия (Т2) — опухоль размером от 2 до 3 см, при осмотре совершенно отчетливо выступает в околоушной области. Капсула железы вовлечена в процесс. Выявляются
симптомы легкого пареза отдельных мимических мышц.
• III стадия (ТЗ) — опухоль поражает большую часть околоушной железы и прорастает в одну из окружающих анатомических структур (кожа, нижняя челюсть, сосцевидный отросток, наружный слуховой проход, жевательная
мышца и т. д.). Определяются симптомы поражения лицевого нерва.
• IV стадия (Т4) — опухоль на значительном протяжении
прорастает в несколько окружающих анатомических
структур. Паралич мимической мускулатуры на стороне
расположения опухоли.
Степень распространения регионарных и отдаленных метастазов обозначается по общим для головы и шеи принципам
(см. главу "Рак щитовидной железы").
В детском возрасте встречаются в основном эпителиальные
злокачественные опухоли (мукоэпидермоидная опухоль, ацинозно-клеточная опухоль и карциномы, чаще аденокарцинома
и цилиндрома). Опухоли мезенхимального происхождения (ан-
273
Рис. 11.6. Рецидив рака
правой околоушной слюнной железы.
гио-, рабдомио- и веретеноклеточная саркома)
бывает трудно расценить как происходящие
из ткани слюнной железы в связи с тем, что
к моменту установления диагноза в процесс
уже вовлечена целиком
околоушно- жевательная область (рис. 11.6).
Доброкачественные
новообразования представлены преимущественно полиморфной и
мономорфной аденомами, среди неэпителиальных опухолей
преобладают гемангиомы, реже встречаются опухоли, исходящие из нервных тканей и лимфангиомы.
Смешанные опухоли встречаются чаще в возрасте 10—14 лет,
гемангиомы и другие доброкачественные образования неэпителиальной природы — в младшем детском возрасте, что указывает на дисэмбриональное их происхождение. Злокачественные
опухоли мезенхимального строения являются уделом детей 4—
7-летнего возраста. А злокачественные эпителиальные новообразования развиваются, как и смешанные опухоли (рис. 11.7), в
более старшем возрасте.
По данным литературы и собственным наблюдениям, не выявлено корреляции между поражением слюнных желез и полом
ребенка. Как доброкачественные, так и злокачественные новообразования развиваются примерно одинаково в обеих половых
группах. Некоторые авторы считают, что опухоли слюнных желез несколько чаще (60—66 %) развиваются у девочек.
Клиническая картина опухолей слюнных желез зависит от их
локализации, распространенности и морфологического вида.
Как правило, развитие доброкачественных и даже злокачественных опухолей слюнных желез отличается довольно медленным клиническим течением. В связи с этим возможны ошибки
в правильной интерпретации диагноза со стороны педиатров,
детских стоматологов и других специалистов детского возраста.
Новообразования слюнных желез могут быть расположены поверхностно или в глубоких отделах слюнной железы.
Чаще других развиваются смешанные опухоли, преимущественно в околоушной слюнной железе. Поражение всегда одно-
274
Рис. 11.7. Цитограмма смешанной опухоли слюнной железы.
стороннее. Дети или ближайшие родственники замечают наличие безболезненного узлового образования, когда оно достигает
1—2 см. Опухоль относительно подвижна, кожа над ней не изменена, консистенция плотноэластическая.
Первоначально почти во всех случаях наличие объемного
процесса расценивается как околоушный лимфаденит или неспецифический паротит, и дети получают противовоспалительную терапию и физиотерапевтическое лечение. При увеличении
объема образования и его уплотнении возникают подозрения на
наличие опухолевого поражения. Таким образом, несмотря на
относительную доступность для диагностики околоушных и
поднижнечелюстных слюнных желез, далеко не всегда диагноз
бывает своевременным.
На основании данных отделения опухолей головы и шеи
НИИ ДО РОНЦ РАМН, от первых признаков заболевания до
установления правильного диагноза проходит от 1 до 18 мес.
Иногда размеры смешанной опухоли долго остаются без изменений, иногда опухоль может достигнуть значительных размеров.
Мономорфные аденомы чаще всего локализуются в толще
железы. Отличить мономорфную аденому от смешанной опухоли по клиническому течению практически невозможно.
Окончательную ясность может внести только гистологическое
исследование.
275
Среди злокачественных новообразований слюнных желез в
детском возрасте встречается мукоэпидермоидный рак, обладающий своеобразным клиническим течением. По данным некоторых авторов, опухоль в большей степени встречается у девочек и чаще поражает поднижнечелюстную слюнную железу.
С учетом наших наблюдений, мы можем быть солидарными с
первым утверждением и не согласиться со вторым, так как мукоэпидермоидный рак чаще развивался в околоушных слюнных
железах. Течение мукоэпидермоидного рака зависит от степени
дифференцировки опухолевых клеток. В отличие от смешанных
опухолей отмечаются инфильтрация кожи, ограничение сме-
щаемости, выраженная плотность новообразований, иногда болевой синдром. У ряда больных за месяц до появления визуально или пальпаторно определяемой опухоли отмечаются явления
дискомфорта в околоушно-жевательной области. В ряде наблюдений опухоль достигает значительных размеров и обладает инфильтративным ростом.
Мукоэпидермоидный рак обладает тенденцией к метастази-
рованию в регионарные лимфатические узлы. Необходимо отметить, что мукоэпидермоидные формы рака имеют выраженную тенденцию к рецидивированию, несмотря на проведение
радикальных операций.
Ацинозно-клеточные опухоли слюнных желез наблюдаются
крайне редко в детском возрасте. По клиническому течению
практически невозможно отдифференцировать этот вариант
новообразования от смешанной опухоли, аденокарциномы или
аденокистозной карциномы (цилиндромы), которые также редко встречаются у детей.
В отличие от других злокачественных новообразований аденокарцинома и цилиндрома чаще поражают малые слюнные
железы. Выявляемость этих новообразований довольно ранняя,
так как пациенты обращают внимание прежде всего на чувство
дискомфорта в полости рта при приеме пищи и разговоре. Визуально практически невозможно отдифференцировать наличие добро- или злокачественности процесса. Несмотря на более
раннее выявление цилиндром и аденокарцином, прогноз при
этих видах новообразований считается менее благоприятным,
чем при мукоэпидермоидном раке, так как в 5—10 % наблюдений отмечаются регионарные и отдаленные метастазы.
Опухоли поднижнечелюстной слюнной железы обладают
аналогичным клиническим течением, но в отличие от опухолей
околоушной железы значительно чаще принимаются за воспалительные изменения, сиалоадениты и банальные лимфадениты.
Для диагностики новообразований слюнных желез необходимо использовать комплекс диагностических мероприятий:
осмотр и пальпацию, ультразвуковое и цитологическое исследования, рентгенографию с контрастированием (сиалография),
276
в ряде случаев необходимо использовать компьютерную томографию, особенно при значительной распространенности опухолевого процесса, при поражении глоточного отростка околоушной слюнной железы. Цитологическое исследование не всегда
бывает легким, поэтому для уточнения морфологии новообразований приходится прибегать к открытой биопсии.
Осмотр и пальпация позволяют выявить болезненность,
определить смещаемость опухоли и кожи над ней, состояние
регионарных лимфатических узлов, лицевого нерва, полости
рта.
Эхография околоушно-жевательной области, подчелюстного
треугольника и других отделов шеи обнаруживает не только наличие объемного образования, указывает его размеры и отношение с окружающими тканями, но определяет структуру и плотность, что может служить важным моментом в дифференциальной диагностике. Под контролем ультразвукового датчика более
уверенно можно провести аспирационную пункцию подозрительных участков слюнной железы (рис. 11.8).
Сиалография проводится путем введения в протоки слюнных желез контрастного вещества с последующим рентгенологическим исследованием. Метод дает возможность определить
состояние слюнных протоков, их сдавление, оттеснение, дефекты наполнения, разрушения паренхимы слюнной железы и
Рис. 11.8. Эхография околоушной слюнной железы. В правой околоушной области выявляется округлая, неоднородная, преимущественно
изоэхогенная зона, довольно четко отграниченная от окружающих
тканей размером 2,4 • 2,3 • 2,2 см.
277
слюнных протоков. Кроме того, появляется возможность судить о синтопии слюнной железы.
Компьютерная томография используется редко, обычно при
запущенных стадиях заболевания, и позволяет выяснить отношения слюнной железы и опухоли, ее распространенность, наличие смещения крупных сосудов, оценить парафарингеальный
компонент, особенно при опухоли глоточного отростка околоушной слюнной железы, определиться с тактикой хирургического вмешательства.
Аспирационная пункция с последующим цитологическим
исследованием во многих случаях позволяет установить злокачественность опухоли, однако отсутствие в пунктате указаний на
наличие злокачественных клеток зачастую не является абсолютно достоверным. В связи с этим бывают необходимы проведение
открытой биопсии, морфологическое исследование, после чего
определяется оптимальная тактика хирургического или другого
вида лечения.
Дифференциальную диагностику опухолей слюнных желез
необходимо проводить с кистами, воспалительными процессами,
актиномикозом, туберкулезом, неспецифическими лимфадено-
патиями. Нельзя также упускать из виду возможность метасти-
ческого поражения околоушных, подчелюстных и верхних югулярных лимфатических узлов при других злокачественных новообразованиях, в первую очередь при раке носоглотки и
ретинобл астоме.
Лечение. Большинство злокачественных опухолей слюнных
желез проявляет резистентность к лучевой терапии и к химиотерапии, в связи с чем основным методом их лечения является
оперативный.
При смешанных и других доброкачественных опухолях околоушной слюнной железы разработаны различные виды хирургических вмешательств, основанных на локализации и распространенности опухолевого поражения. При небольших размерах новообразований и при поверхностном их расположении
производится резекция слюнной железы. При более глубокой
локализации и более обширном поражении целесообразно проведение субтотальной резекции в плоскости ветвей лицевого
нерва. В случаях рецидивов и при опухолях больших размеров
проводится паротидэктомия, при этом отмечаются существенно более значительные трудности при выделении ветвей лицевого нерва.
В некоторых случаях производится резекция глоточного отростка околоушной слюнной железы. При этом используется
подчелюстной разрез кожи, тупым путем выделяется опухоль от
глоточной стенки, основания черепа, окружающих тканей, вывихивается в рану и производится резекция.
Удаление доброкачественных опухолей поднижнечелюстной
и малых слюнных желез представляет значительно меньшие
278
трудности для хирурга. Поднижнечелюстную слюнную железу
удаляют в фасциальном футляре подчелюстного треугольника,
малые слюнные железы — в зависимости от локализации и степени распространенности.
Для лечения злокачественных новообразований чаще используют комбинированный метод с применением на первом
этапе дистанционной гамма-терапии. Суммарная очаговая доза
на опухоль составляет 30—40 Гр. При небольших новообразованиях возможно проведение резекции или субтотальной резекции околоушной слюнной железы. При опухолях больших
размеров необходимо проведение паротидэктомии. При возможности лицевой нерв сохраняется. В случае вовлечения лицевого нерва в опухолевый процесс приходится выполнять его
резекцию.
В послеоперационном периоде в зависимости от патологоанатомических находок возможно дополнительное облучение
послеоперационного ложа опухоли до общей суммарной дозы
50-55 Гр.
Злокачественные опухоли поднижнечелюстных и малых
слюнных желез лечат, исходя из тех же принципов.
При наличии метастатического поражения регионарных
лимфатических узлов проводят также комбинированное лечение
с включением в зону облучения регионарного коллектора шеи и
с последующим фасциально-футлярным иссечением лимфатических узлов и клетчатки шеи на стороне поражения.
При неоперабельных новообразованиях проводят дистанционную гамма-терапию, а также системную полихимиотерапию с
использованием таких препаратов, как адриамицин, платидиам,
блеомицин, метотрексат и др. Результаты подобной терапии
нельзя назвать удовлетворительными.
Отдаленные результаты лечения при доброкачественных
опухолях слюнных желез хорошие. Все радикально оперированные дети живы.
В ряде случаев возникают рецидивы заболевания, приводящие к более обширным и травматичным операциям с менее
удовлетворительными функциональными и косметическими
результатами.
Прогноз при злокачественных опухолях у детей также относительно благоприятный. Несмотря на рецидивы мукоэпидермоидной опухоли околоушной слюнной железы и повторные
хирургические вмешательства, все оперированные дети живы в
сроки от 3 до 10 лет. Хуже прогноз и результаты при карциномах слюнных железы, зависящие в основном от стадии заболевания к моменту установления диагноза и лечения. Перспективами для больных являются как можно-более раннее выявление
злокачественной опухоли, своевременность и адекватность хирургического вмешательства.
279
11.3. Недифференцированный рак носоглотки
Больные со злокачественными опухолями носоглотки составляют от 1 до 3 % от общего числа детей со злокачественными новообразованиями, до 10—12 % от детей со злокачественными опухолями головы и шеи и около 25 % от всех опухолевых заболеваний ЛОР-органов.
В 1921 г. Schmincke описал опухоль, состоящую из ретикулярной ткани, аналогичной лимфатическим узлам, и эпителиального ретикулума покрова носоглотки в сочетании с лимфоидными элементами, которая была названа "лимфоэпителиома".
Позднее во всех гистологических классификациях эта опухоль
стала называться "недифференцированным раком, или недифференцированной карциномой носоглоточного типа".
Среди причин возникновения недифференцированного рака
преобладают такие, как влияние экологических факторов — ионизирующее излучение, использование гербицидов и пестицидов, продукты химических и других производств, лекарственные препараты, обладающие тератогенным и канцерогенным
эффектом; не отрицаются также наличие иммунодефицита и
генетические факторы, на что указывают наблюдения развития
раковых опухолей носоглотки в кругу одной семьи. В районах
Юго-Восточной Азии, в частности в Китае, Индонезии, на Филиппинах, отмечается очень высокая заболеваемость недифференцированным раком носоглотки как у взрослых, так и у детей, составляющая до одной трети всех злокачественных новообразований. Одной из причин, обусловливающих такую
высокую частоту недифференцированного рака носоглотки,
многие исследователи связывают с наличием герпесоподобного
вируса Эпштейна — Барр (ВЭБ), антитела к которому определяются в 100 % случаев этого типа рака именно носоглоточной
локализации. Титр антител к ВЭБ у больных раком носоглотки
в 4 раза выше, чем у здоровых, и в 3 раза выше по сравнению
с раком других локализаций.
Анатомо-топографические особенности носоглотки предопределяют варианты клинического течения заболевания, такие
как распространение опухоли в близлежащие структуры с развитием соответствующей симптоматики.
Выраженная биологическая активность низкодифференцированного рака носоглотки у детей объясняет агрессивность течения с развитием как регионарных, так и отдаленных метастазов.
Метастатическое поражение регионарных лимфатических узлов при недифференцированном раке носоглотки отмечается
более чем в 90 % наблюдений с преимущественной локализацией в верхних отделах шеи. Отдаленные метастазы могут развиваться в легких, костях, мягких тканях, печени и других органах.
280
Для практической работы наибольшее признание в онкологических учреждениях получила Международная гистологическая классификация опухолей носоглотки.
Злокачественные опухоли
Эпителиальные опухоли
1. Рак носоглотки:
а) плоскоклеточный ороговевающий рак;
б) плоскоклеточный неороговевающий рак;
в) недифференцированный рак (носоглоточного типа).
2. Аденокарцинома.
3. Аденокистозная карцинома.
4. Прочие.
Международная классификация по системе TNM*
Т1 — опухоль ограничена одной стороной
Т2 — опухоль распространяется на обе стороны
ТЗ — опухоль распространяется в носовую полость и (или)
ротоглотку
Т4 — опухоль распространяется на основание черепа и (или)
захватывает черепные нервы
ТХ — определить распространенность первичной опухоли
невозможно.
Отечественная клиническая классификация по стадиям
• I стадия — небольшая опухоль или язва на одной из стенок носоглотки. Метастазы в регионарных лимфатических узлах не определяются.
• II стадия — опухоль занимает не более двух стенок носоглотки либо не более половины ее просвета при преимущественно экзофитной форме роста. Определяются единичные односторонние метастазы в верхней группе шейных лимфатических узлов.
• III стадия — опухоль заполняет всю носоглотку, не выходя за ее пределы; опухоль любого размера, распространяющаяся в ротоглотку и задние отделы полости
"■Символы N и М используются, как при других злокачественных
опухолях головы и шеи (см. "Рак щитовидной железы").
281
носа. Имеются односторонние или двусторонние подвижные метастазы.
• IV стадия — опухоль распространяется в полость черепа
с (или без них) деструкцией костей, поражением черепных нервов, в полость уха, околоносовые пазухи, крылонебную ямку, глазницу, определяются односторонние
или двусторонние фиксированные метастазы на шее, отдаленные метастазы.
Недифференцированный рак занимает основное место
(97 %) среди злокачественных эпителиальных новообразований
носоглотки и развивается в основном у детей 10—15-летнего
возраста, значительно чаще у мальчиков (рис. 11.9). Плоскоклеточная форма рака встречается в виде казуистических наблюдений. Часто встречающиеся воспалительные процессы в
носоглотке у детей (ринофарингиты, аденоидиты) имеют
сходную симптоматику со злокачественными новообразованиями, не носящими патогномоничных признаков при первичной локализации в носоглотке. Кроме того, большое количество
лимфаденопатий различной этиологии с локализацией на шее
приводит к еще большим трудностям в диагностике и дифференциальной диагностике опухолевых поражений. Следствием этого является их высокая запущенность.
Клиническая картина. 6
некоторых случаях начальный период заболевания
протекает как острое респираторное заболевание с
насморком, кашлем, подъемом температуры и последующим субфебрилитетом.
Возможно, что респираторное заболевание является
как бы пусковым моментом
для возникновения новообразования. В других случаях на фоне полного здоровья, исподволь появляются местные признаки
опухолевого поражения —
затруднение носового дыхания, выделения из по-
Рис. 11.9. Рак носоглотки с
метастазами в лимфатические
узлы шеи справа.
282
лости носа, гнусавость, в дальнейшем — головные боли, носовые кровотечения, снижение слуха, деформации в области ротоглотки, лица и шеи, затруднение дыхания, черепно-мозговые
и офтальмологические расстройства.
Ведущими местными симптомами при раке носоглотки являются различной степени выраженности расстройства носового дыхания, выявляемые у всех детей. В большинстве случаев
отмечается двустороннее затруднение носового дыхания, что
указывает на значительный объем опухоли в носоглотке. В связи с неправильной интерпретацией клинических данных детям
проводятся неадекватная противовоспалительная, антибактериальная терапия и физиотерапия. В некоторых случаях прибегают к удалению "аденоидов". Все это приводит к значительной запущенности опухолевого поражения.
Для недифференцированного рака носоглотки характерно
быстрое, агрессивное течение с инфильтрирующим ростом и
вовлечением в процесс окружающих анатомических структур.
С ростом опухоли появляются слизистые и гнойные выделения
из носа, а с присоединением вторичной инфекции и в далеко
зашедших стадиях заболевания — ихорозный запах, примесь
крови и некротические массы. Изъязвление и распад опухоли
вызывают периодические спонтанные носовые кровотечения.
При передней риноскопии в задних и верхних отделах полости
носа можно обнаружить опухолевые массы. Появляется деформация в области наружного носа, проекции околоносовых пазух.
Рост опухоли в ротоглотку вызывает смещение кпереди и
асимметрию мягкого неба, гнусавый оттенок голоса, при больших размерах — затруднение дыхания.
При первичной локализации опухоли на боковой стенке носоглотки часто уже в раннем периоде отмечается снижение слуха на стороне поражения, обусловленное отсутствием вентиляции среднего уха через евстахиеву трубу, закрытую опухолевыми массами. Отоскопическая картина соответствует при этом
хроническому тубоотиту.
Обладая выраженным местно-деструирующим ростом, недифференцированные раки носоглотки в ряде случаев вызывают разрушение костей основания черепа, при этом выявляются
поражение нескольких пар черепных нервов с соответствующей
симптоматикой, головные боли в результате гипертензивного
синдрома.
Выраженная опухолевая активность недифференцированного рака носоглотки проявляется не только местными симптомами, но и наличием регионарных и отдаленных метастазов.
Регионарное метастазирование имеет, как правило, двусто-
роннний характер, хотя прежде всего поражаются лимфатические узлы шеи на стороне опухоли. Потенцией к метастазиро-
ванию обладает около 90 % недифференцированных форм рака,
причем в 70—75 % случаев вовлекаются регионарные шейные
283
лимфатические узлы, а в 20—25 % имеется обширное сочетанное метастазирование с поражением регионарных лимфатических узлов, легких, печени, костей, мягких тканей. В большинстве случаев метастазы появляются в течение первого месяца
заболевания.
С учетом объективных трудностей диагностики и поздней
обращаемости больные редко поступают в специализированные отделения в I и II стадиях заболевания, что отрицательно
сказывается на прогнозе заболевания. Более 95 % детей до начала противоопухолевой терапии имеют III и IV стадии заболевания. Даже при своевременном обращении к врачу с уже выраженными клиническими симптомами диагноз подтверждается только у 15—20 % больных; остальные пациенты получают
неадекватное лечение.
По высказыванию ряда авторов, носоглотку считают "слепой"
зоной, крайне трудной для первичной диагностики, обозрения и
манипуляций, тем более что до настоящего времени для осмотра
носоглотки и задних отделов полости носа пользуются обычной
и задней риноскопией. В некоторых случаях применяется пальцевое исследование или боковая рентгеншрафия носоглотки.
Среди дополнительных методов диагностики необходимо
выделить исследование зон регионарного метастазирования с
помощью эхографии, а также радиоизотопное исследование с
цитратным комплексом 67Ga. Окончательное подтверждение
диагноза осуществляется в результате цитологического и гистологического исследований пунктатов или биоптатов опухоли.
Используя перечисленные методы диагностики, не всегда
можно поставить правильный диагноз, о чем свидетельствует
большой процент ошибок (до 90 %), допускаемых врачами при
обследовании детей с новообразованиями носоглотки. Для
своевременной и правильной диагностики недифференцированного рака носоглотки прежде всего необходимо помнить о
существовании этого заболевания у детей.
Оценка анамнестических данных с выявлением жалоб на общую утомляемость, сонливость, снижение аппетита, изменения
в поведении, головные боли, субфебрилитет и другие симптомы
общего характера помогают правильно оценить общее состояние
ребенка.
При осмотре следует обращать внимание на различного рода
асимметрии, деформации в области лица, черепа и шеи, которые могут свидетельствовать о наличии опухолевого поражения
носоглотки и зон регионарного метастазирования. Всем больным необходимо проведение тщательного инструментального
отоларингологического осмотра, пальцевое обследование рото-
и носоглотки.
Важнейшее значение имеют рентгенологические методы диагностики. Стандартные рентгенологические укладки (боковой
снимок носоглотки, прямой снимок придаточных пазух носа),
284
а также обзорная краниография в аксиальной и полуаксиальной
проекциях позволяют в большинстве случаев получить достаточный объем информации. В более сложных случаях необходимо применение рентгеновской томографии и компьютерной
томографии, являющейся наиболее ценной и информативной
из всех рентгенологических методов диагностики.
При традиционном методе рентгенологического исследования (боковая, аксиальная и полуаксиальная краниография)
удается выявить инфильтративный рост опухоли, объем мягкотканного компонента, его распространенность, заинтересованность пограничных с носоглоткой структур, деструкцию
костей лицевого скелета и черепа.
В последние годы все большее признание приобретает компьютерная томография, которая имеет большие преимущества
перед обычной рентгенографией, так как обладает значительно
более высокой информативностью при выявлении небольших
новообразований, особенно при проникновении их в крылонебную и подвисочную ямки. КТ точно определяет их распространенность, характер и направление роста, деструкцию костных
структур, внутричерепной рост опухоли и т. д. Процент выявления поражений окружающих органов и тканей при сопоставлении данных компьютерной томографии и ренгенологического
исследования выше в несколько раз, что позволяет определить
более конкретную и рациональную тактику лечения.
Крайне ценным и важным методом диагностики является
эндоскопическое исследование носоглотки или эпифарингоскопия. С развитием эндоскопической световолоконной оптики этот метод приобретает все большее значение. При эндоскопическом исследовании уже по внешнему виду можно довольно
точно высказаться о том или ином опухолевом процессе в носоглотке. Так, при недифференцированном раке носоглотки в
большинстве наблюдений отмечается экзофитная форма роста
опухоли, в части случаев с изъязвлением поверхности; реже
встречается эндофитный или смешанный рост рака. В большинстве наблюдений поверхность опухоли бугристая, тусклая,
розово-красного цвета, с выраженным сосудистым рисунком,
консистенция от мягко- до плотноэластической; при изъязвлениях опухоль покрыта фибринозно-некротическим налетом,
при биопсии легко кровоточит.
Опухоль чаще всего локализуется на боковых стенках носоглотки, инфильтрируя и распространяясь по ним в ротоглотку
и даже в гортаноглотку; реже поражается изолированно купол
носоглотки.
При росте новообразования кпереди опухолевые массы определяются при эндоскопическом осмотре в полости носа. Эндоскопия позволяет детально исследовать все стенки носоглотки, выявить направление роста опухоли и, что самое ценное,
провести прицельную биопсию для морфологического подтвер-
285
11.4. Эстезионейробластома
Среди злокачественных новообразований верхних дыхательных путей эстезионейробластома выделяется не только относительной редкостью, но и особенностями морфологического
строения и клинического течения.
Название опухоли происходит от греческого esthesio — ощущаю. В литературе это новообразование описывается также под
названием нейроэпителиомы обонятельного нерва или ольфакторной нейробластомы в связи с тем, что опухоль исходит из
обонятельного нейроэпителия и имеет недифференцированные
нейроэктодермальные структуры. По морфологическому строению выделяют в основном 3 типа обонятельной нейробластомы:
собственно эстезионейробластому, эстезионейроцитому и эсте-
зионейроэпителиому. При микроскопии отмечаются типичные
признаки нейрогенной опухоли, такие как формирование розеток и наличие мембран с гранулами, похожих на опухоли
АПУД-системы.
Впервые опухоль была описана Berger и Luc в 1924 г., и с тех
пор в мировой литературе приводится большое количество наблюдений у взрослых, преимущественно в возрасте 20—40 лет.
В отечественной литературе эстезионейробластома впервые
описана в 1966 г. В. В. Быстровой. В 1979 г. впервые опубликовано сообщение о 4 случаях эстезионейробластомы у детей,
которые наблюдали И. Л. Кручинина и В. Г. Поляков.
Встречаясь в основном у взрослых, эстезионейробластома
значительно меньше изучена в детском возрасте. Известно, что
опухоль развивается одинаково часто у детей обоего пола, преимущественно в возрасте после 10 лет.
На начальных этапах эстезионейробластома локализуется
обычно в верхних отделах полости носа. Обладая агрессивным
местно-деструирующим ростом, опухоль распространяется и заполняет всю половину полости носа, прорастает в околоносовые
пазухи, основание и полость черепа, орбиту (рис. 11.10; 11.11).
Из публикаций в мировой литературе следует, что эстезиобла-
стома вызывает обширное регионарное и отдаленное метастази-
рование. В детском возрасте относительно редко наблюдаются
метастазы в регионарные лимфатические узлы и еще реже отдаленные метастазы. Зоной регионарного поражения являются заглоточные верхние глубокие шейные, околоушные и поднижне-
челюстные лимфатические узлы. При отдаленном метастазиро-
вании поражаются плевра, легкие, кости, костный мозг, печень.
Клиническая картина. Как и при других морфологических
формах злокачественных новообразований этой локализации,
при эстезионейробластоме очень редко развивается общий опухолевый симптомокомплекс. Особенности анатомо-топографического строения полости носа у детей: узость носовых ходов,
288
Рис. 11.10. Эстезионейробластома левой половины полости носа с распространением в левую верхнечелюстную пазуху, клетки решетчатого
лабиринта, орбиту.
Рис. 11.11. Томограмма больного с эстезионейробластомой левой половины полости носа.
небольшое воздушное пространство — проявляются обычно
прогрессирующим расстройством носового дыхания вплоть до
аносмии. При этом могут быть вначале слизистые, потом слизисто-гнойные выделения из полости носа, в дальнейшем клинические проявления зависят от направления роста опухоли, ее
распространения на окружающие ткани, особенностей метаста-
зирования.
Рост опухоли через клетки решетчатого лабиринта в сторону
орбиты вызывает ограничение движений глазного яблока кнутри и кнутри—книзу, приводит к смещению глазного яблока
кнаружи и появлению мягкотканного компонента в проекции
медиального угла глаза.
Рост новообразования в задних отделах полости носа и распространение в орбиту вызывают экзофтальм, диплопию и другие патологические офтальмологические симптомы.
Распространение кпереди характеризуется появлением опухолевой массы в верхнем, а потом и в общем носовом ходе. Макроскопически опухоль обычно красновато-синюшного цвета,
плотноэластической консистенции, бугристая. Носовая перего-
289
родка может быть значительно смещена в противоположную сторону, что вызывает затруднение дыхания на здоровой стороне.
При деструкции латеральной стенки полости носа опухоль
распространяется в верхнечелюстную пазуху; появляется припухлость в проекции "собачьей ямки”, скуловой области, мягких тканей щеки, альвеолярного края верхней челюсти — стоматологические проявления.
Обладая выраженным инфильтрирующим ростом, эстезионейробластома может проникать в основание и полость черепа
с развитием симптомов внутричерепной гипертензии, упорных
головных болей, прогрессивным ухудшением общего состояния,
с вовлечением в процесс ряда черепных нервов.
Болевые признаки появляются, как правило, на поздних стадиях развития опухоли (чаще при росте в область крылонебной
ямки) и являются иррадиирующими.
Диагностика трудна, особенно на ранних этапах, когда новообразование принимается за воспалительный процесс, аденоиды, инородное тело и полипы полости носа. В связи с этим
детям проводится длительная неадекватная терапия, включающая обычно физиотерапию.
Как правило, развитие опухоли в полости носа сопровождается гиперсекрецией тягучей слизи, затрудняющей детальный
осмотр. Поэтому необходимо санировать общий носовой ход с
помощью электроаспиратора и после этого приступать к проведению исследования.
При передней риноскопии в верхних и задних отделах полости носа удается обнаружить опухолевую массу. При инструментальной пальпации ощущается плотноэластическая опухоль, иногда кровоточащая после проведения манипуляции.
Кровотечение, однако, легко останавливается рыхлой передней
тампонадой. Риноэпифарингоскопический осмотр, являющийся оптимальным у детей, позволяет визуализировать процесс и
проводить прицельную биопсию, избавляющую ребенка от повторных неприятных процедур.
Рентгенологическое исследование придаточных пазух носа и
носоглотки в обычных стандартных укладках часто бывает достаточно информативным для установления факта опухоли, но
для определения степени и границ ее распространенности необходимо использовать дополнительные проекции. Наиболее
информативными диагностическими методами для опухолей
полости носа и околоносовых пазух являются на настоящем
этапе КТ и МРТ.
В комплексе диагностических мероприятий необходимо
участие офтальмолога и невропатолога, что обусловлено описанным выше клиническим течением эстезионейробластомы.
Главными в установлении и подтверждении диагноза, как и
для любой онкологической патологии, являются морфологические методы диагностики. Цитологические методы исследова¬
290
ния при этом виде новообразования бывают информативными
и 50—70 % случаев. Окончательно подтверждает диагноз гистологическое заключение, проведенное после биопсии опухоли.
Комплексная диагностика позволяет определить степень
распространенности и установить стадию процесса на основании
Международной классификации для опухолей полости носа. Она
включает следующие стадии.
• I стадия. Опухоль ограничена одной стенкой полости
носа, носовой раковиной без перехода на смежные анатомические области и без деструкции костной стенки.
Метастазы не определяются.
• II стадия:
а) опухоль, переходящая на другую стенку полости носа,
вызывающая очаговую деструкцию костной основы стенки,
но не выходящая за пределы полости; регионарные метастазы не определяются;
б) опухоль той же стадии распространенности или меньшего распространения, но с одиночным метастазом на
стороне поражения.
• III стадия:
а) опухоль, распространяющаяся на смежные анатомические области, выходящая за пределы костных стенок или
переходящая на другую половину полости носа; регионарные и отдаленные метастазы не определяются;
б) опухоль той же стадии распространенности или меньшего местного поражения, но с множественными метастазами на стороне опухоли или двусторонними.
• IV стадия:
а) опухоль, прорастающая основание черепа, носоглотку
или кожу лица с обширной деструкцией костей, но без регионарных или отдаленных метастазов;
б) опухоль любой стадии распространенности с несмещае-
мыми регионарными или с отдаленными метастазами.
Дифференциальная диагностика должна проводиться с неопухолевой патологией детского возраста, такой как аденоиды,
полипы полости носа, гипертрофии носовых раковин, инородные тела, вызывающей сходную клиническую симптоматику.
К доброкачественным новообразованиям, от которых следует
дифференцировать эстезионейробластому, относится юношеская ангиофиброма носоглотки, при которой расстройства носового дыхания нарастают медленнее и проявляются обычно с двух
сторон. Кроме того, при ангиофиброме носоглотки имеются
обильные рецидивирующие носовые кровотечения. Следует учитывать пол и возраст больных, так как ангиофибромы развиваются в пубертатном периоде у мальчиков.
291
При осмотре и пальцевом исследовании носоглотки опухоль
определяется в виде тугоэластической массы округлой формы,
визуально — розово-красного цвета с большим количеством
кровеносных сосудов. Реже приходится дифференцировать эстезионейробластому от фибромы, хондромы и специфических
гранулем, которые также могут развиваться в полости носа.
Наличие злокачественных клеток в цитологическом исследовании предполагает дифференциальную диагностику с системными заболеваниями, в первую очередь с лимфосаркомой,
а также с рабдомиосаркомой и недифференцированным раком.
Окончательно верифицирует диагноз в таких случаях гистологическое исследование.
Лечение. Анализ литературных данных о возможных методах
и перспективах лечения эстезионейробластомы показывает неоднозначность мнений как о комбинированной, так и о комплексной терапии. Отмечены как достаточно высокая радиорезистентность новообразования, так и высокая его чувствительность и устойчивость эффекта от лучевой терапии. Так же
неоднозначны мнения и по поводу чувствительности опухоли к
химиопрепаратам, хотя в ряде наблюдений при местнораспространенных опухолях отмечается выраженный эффект при применении полихимиотерапии.
В случае операбельности эстезионейробластомы проводят
радикальное ее электрохирургическое иссечение. В последнее
время разработаны агрессивные расширенные операции типа
кранифациальных резекций, особенно при параменингеальном
росте опухоли. Однако проведение подобных операций есть не
что иное, как безысходность ситуации, особой надежды при отсутствии эффекта от консервативной терапии подобная тактика
не вызывает.
Опыт мировой литературы и наш собственный опыт заставляют придерживаться следующей тактики при лечении эстезионейробластомы у детей.
На первом этапе проводится 4 курса полихимиотерапии с
включением винкристина, циклофосфана, антрациклиновых антибиотиков. Винкристин вводят из расчета 1 мг/м2 в 1-й, 8-й,
15-й дни внутривенно; циклофосфан 500 мг/м2 в 1-й, 8-й, 15-й
дни внутривенно; адриамицин 30 мг/м2 в 1-й, 8-й дни. Курсы
повторяют через 3 нед. По достижении хорошего эффекта проводят электрохирургическое иссечение опухоли полости носа с
подходом по Муру. Радикальное удаление определяет дальнейшую тактику.
Полихимиотерапию проводят через каждые 3—4 нед, всего
8—10 курсов. При нерадикальном удалении назначают лучевую
терапию на ложе опухоли разовой дозой 2 Гр до суммарной
очаговой дозы (СОД) 50—55 Гр. В случае устойчивости новообразования к первой линии полихимиотерапии, что определяется после проведения 2 курсов лечения, необходимо сменить
292
схему лекарственного лечения. Целесообразно назначение препаратов платины — 80 мг/м2 в 1-й день внутривенно в комбинации с адриамицином — 20 мг/м2 в 1-й, 2-й, 3-й дни внутривенно
и этопозидом — 100 мг/м2 с 1-го по 5-й день внутривенно.
При незначительной эффективности лекарственного лечения необходимо решить вопрос о дистанционной гамма-терапии, которая проводится в предоперационном периоде (СОД
30 Гр), после чего решается вопрос о хирургическом вмешательстве. При его возможности гамма-терапия проводится и в
послеоперационном периоде (СОД облучения доводится до
50—55 Гр). При невозможности хирургического вмешательства
лучевая терапия продолжается как самостоятельный метод до
указанной суммарной очаговой дозы.
При наличии регионарных метастазов одномоментно с удалением основного очага проводят фасциально-футлярное иссечение лимфатических узлов и клетчатки шеи на стороне поражения с предварительным или послеоперационным их облучением.
В настоящее время разрабатываются новые, более эффективные комбинации полихимиотерапии, внедряются современные источники облучения с мультифракционным временным
распределением дозы, что позволяет надеяться на значительное
улучшение прогноза при проведении комплексного лечения эстезионейробластомы у детей.
Глава 12 I ОПУХОЛИ ГОЛОВНОГО МОЗГА
Опухоли головного мозга у детей до 15 лет отличаются от таковых у взрослых рядом характерных для них признаков, касающихся не только морфологической природы, структуры и
их локализации, но также симптоматологии, клинического течения и исходов. Морфологическое развитие центральной
нервной системы (ЦНС) у детей заканчивается к концу 2-го
года их жизни. Однако в головном мозге продолжается развитие моторной и сенсорной координации, идет становление
интеллектуальных способностей. Это влияет на тип и степень
неврологических и нейропсихических нарушений, которые
могут наблюдаться после лечения опухолей ЦНС в детском
возрасте.
Эпидемиология. Опухоли центральной нервной системы по
частоте развития занимают второе место среди злокачественных новообразований детского возраста, уступая только лимфомам и лейкозам, и составляют 14—20 %. Ежегодно в России
заболевают 1,4 на 100 000 детей в возрасте до 16 лет, что составляет примерно 450 новых случаев в году.
При установлении диагноза заболевания 15 % необластом
головного мозга встречается у младенцев в возрасте до 2 лет,
30 % — у детей в возрасте от 2 до 5 лет, 30 % — от 5 до 10 лет
и 25 % — от 11 до 18 лет. Наиболее часто опухоли локализуются
субтенториально, в задней черепной ямке. Необходимо отметить, что до 1 года неоплазмы наиболее часто располагаются
супратенториально.
Чаще опухоли развиваются из червя и гемисферы мозжечка.
В силу анатомо-физиологических особенностей детского организма и, в частности, способности к высокой компенсации
функций ЦНС в раннем возрасте к моменту появления клинических признаков заболевания новообразования этой локализации достигают больших размеров, распространяясь в полость
IV желудочка. В самом желудочке опухоли обычно исходят из
эпендимы либо субэпендимарно, реже из сосудистого сплетения.
Среди опухолей задней черепной ямки преобладают доброкачественные, чаще астроцитомы, реже ангиоретикуломы мозжечка.
Опухоли ствола мозга составляют 15—20 % от всех интракраниальных объемных образований детского возраста. Здесь встречаются первичные и вторичные новообразования. Последние возникают вследствие инфильтративного роста бластом из IV желудочка и червя мозжечка.
Супратенториальные опухоли локализуются над мозжечковым наметом. К ним относятся опухоли III желудочка, подкорковых структур, боковых желудочков, шишковидной железы и
полушарий большого мозга. Чаще это опухоли нейроэктодермального ряда (глиомы), но встречаются также краниофарингиомы, аденомы гипофиза и реже опухоли менингососудистого
294
происхождения. Выявляемые у больных в возрасте от 11 мес до
15 лет злокачественные опухоли полушарий большого мозга по
гистологической структуре в большинстве случаев нейроэктодермальные, в них преобладали опухоли эпендимарного ряда,
реже — менингососудистые новообразования.
По данных многих авторов, у детей преобладают две формы
опухолей: астроцитомы и медуллобластомы. Практически одинаково часто встречаются злокачественные глиомы, глиомы
ствола мозга, эпендимомы и краниофарингиомы.
Одной из особенностей развития бластом в головном мозге
является их расположение. Это относится к опухолям червя
мозжечка, ствола мозга, III и IV желудочков, хиазмально-селлярной области и шишковидной железы. Полагают, что такая
локализация бластом связана с диеэмбриогенезом, который в
свою очередь может быть одной из причин развития неопластического процесса. В детском возрасте наблюдаются опухоли
из эмбриональных зачатков.
Другой особенностью развития злокачественных опухолей
головного мозга является отсутствие гематогенного и лимфо-
генного метастазирования. Распространение опухоли идет в основном по оболочкам головного мозга, ликворным путям и реже непосредственно в полушария большого мозга. Небольшая
вероятность метастазирования наблюдается при медуллобластомах, герминомах и анапластических эпендимомах. Для детей
характерно поражение обширных зон мозга. Эти опухоли
склонны к кистообразованию и часто подвергаются распаду.
Нередко в тканях опухоли образуются петрификаты.
Клиническая картина. Симптоматология опухолей головного
мозга у детей характеризуется, как и у взрослых, сочетанием общемозговых и очаговых симптомов.
Сравнительно малый объем черепа и тесное расположение
жизненно важных структур мозга приводят к быстрому развитию тяжелой клинической картины, отягощенной гипертензивным синдромом отека мозга и нередко выраженными психическими расстройствами. У ряда больных могут наблюдаться нарушения двигательных функций. Обычно первыми симптомами
заболевания являются рвота, головная боль, иногда головокружение. В начальном периоде заболевания трудно определить появление застойных сосков при опухолях мозга, а также первичную атрофию зрительных нервов с битемпоральной гемианопсией, развивающихся у детей при краниофарингиомах.
Появление тех или иных симптомов во многом определяется
также локализацией первичной опухоли. Так, например, при
медуллобластоме задней черепной ямки, которую наблюдали
М. Г. Ротарь и соавт. (1992) у детей до 15 лет, ведущим в клинической картине заболевания был резко выраженный гипер-
тензивно-гидроцефальный синдром. В неврологическом статусе
отмечались нарушение походки, статики, диффузная мышечная
295
гипотония в верхних и нижних конечностях, горизонтальный
нистагм; парез VI черепного нерва с обеих сторон. При офтальмологическом осмотре на глазном дне выявлялись застойные
соски зрительных нервов. На рентгенограммах черепа обнаруживались гипертензивные изменения. В момент поступления в
стационар у детей отмечалось также наличие симптомов интоксикации: слабость, вялость, адинамия, снижение аппетита,
бледность кожных покровов.
В диагностике опухолей ЦНС, кроме данных обычного клинического обследования и рентгенографии костей черепа,
большое значение имеют данные КТ и МРТ, радиоизотопного
исследования. Комплексное обследование больного, кроме установления диагноза, позволяет получить максимально возможное представление о локализации и распространенности
патологического процесса.
Принципы лечения больных с опухолями ЦНС. Основным
методом терапии детей с опухолями головного мозга является
операция. Однако, к сожалению, эти новообразования нередко оказываются радикально неудалимыми не только вследствие их распространенности, но и из-за опасности повреждения жизненно важных структур мозга. В этих случаях производится лишь частичное удаление новообразования или только
биопсия, в дальнейшем — проведение дополнительно лучевого
или химиолучевого лечения.
Несмотря на все сложности оперативного вмешательства на
головном мозге, у нейрохирургов существует тенденция к максимальному удалению опухоли любой локализации у детей всех
возрастов. Использование микрохирургии с применением лазерной и ультразвуковой техники повысило возможности полного
удаления опухолей. А. Н. Коновалов и соавт. (1992) указывают,
что исследования последних лет, выполненные в ряде ведущих
нейрохирургических клиник мира, показали реальную возможность радикального удаления опухолей ствола мозга, которые совсем недавно считались неоперабельными. Авторы прооперировали 120 больных, из которых в 70 % случаев были пациенты моложе 16 лет. Субтотальное удаление опухоли было произведено в
67 % наблюдений. Достаточный уровень реабилитации спустя
6 мес после операции достигнут у 50—60 % больных.
Детям с новообразованиями задней черепной ямки при тяжелой клинической картине заболевания с выраженной окклюзионной гидроцефалией и в случаях неоперабельных опухолей, сопровождающихся тяжелой гидроцефалией, на первом этапе производится операция шунтирования с помощью дренажных систем;
чаще это вентрикулоатриостомия и вентрикулоперитоностомия.
Необходимо подчеркнуть, что при первичных новообразованиях ЦНС предпочтительным на первом этапе является любой
вид оперативного вмешательства с последующим лучевым, лекарственным или химиолучевым лечением.
296
Лучевая терапия. Остается несомненным, что лучевая
терапия находит широкое применение при опухолях головного
мозга, что обусловлено следующими причинами.
Во-первых, опухоли ЦНС редко оперируются радикально и
в большинстве случаев оперативное вмешательство ограничивается частичной резекцией бластомы или только взятием биопсийного материала. В этих случаях послеоперационная лучевая терапия остается практически единственным лечебным
средством.
Во-вторых, опубликованные данные об эффективности лечения больных опухолями головного мозга свидетельствуют о
значительном повышении числа длительно живущих детей, у
которых в качестве лечебного средства использовались ионизирующие излучения как в сочетании с оперативным вмешательством, так и с противоопухолевой лекарственной терапией.
Хотя по мере накопления знаний об отдаленных последствиях
облучения у детей, особенно в комбинации с противоопухолевыми препаратами, возникло много сомнений в использовании
конвенциальных курсов лучевого лечения. Продолжается поиск рационального временного распределения дозы в зависимости от опухоли и возраста ребенка, объема облучения головного мозга, т. е. факторов, оказывающих решающее влияние на
поздние лучевые повреждения ЦНС. Последние иногда могут
привести к серьезным осложнениям вплоть до некроза тканей
мозга, который может появиться в период от нескольких месяцев до нескольких лет после окончания облучения.
В основе лучевой патологии, развивающейся в тканях головного мозга, кроме непосредственного действия ионизирующих
излучений на нервные элементы, важную роль играет повреждение кровеносных сосудов, особенно это имеет место при поздних лучевых осложнениях. Изменения в сосудах в виде гибели
микрососудов наиболее часто встречаются при проведении облучения у ребенка в возрасте до 3 лет. У детей, которым проводилось облучение всего головного мозга в суммарных дозах ниже 20 Гр при разовой очаговой дозе 1,5—2 Гр 5 раз в неделю,
могут повреждаться капилляры с последующим развитием микрообызвествлений. Также необходимо отметить, что терапевтическое облучение головного мозга у очень маленьких детей, т. е.
до завершения миелинизации и полного развития мозга, может
привести к недоразвитию мозга и дисфункции нервной системы, поэтому некоторые исследователи полагают, что радиотерапия не должна проводиться у детей в возрасте до 2 лет.
При планировании лучевого лечения больным с опухолями
ЦНС чрезвычайно важно определить рациональный объем облучения. Для этой цели необходимо использовать данные, полученные во время операции, пред- и послеоперационной компьютерной томографии, гамма-энцефалографии, магниторезонансного
исследования, ангиографии, пневмоцистографии, радиоизотоп¬
297
ных исследований ликворных пространств. При этом нужно
учитывать, что наиболее радиочувствительными структурами
головного мозга являются ствол мозга, гипофиз, диэнцефаль-
ная область, а также хрусталик глаза. Можно полностью согласиться с мнением С. А. Раевской и соавт. (1992), считающих,
что критичность перечисленных структур в ряде случаев относительна, так как нередко опухоли непосредственно исходят из
этих образований (опухоли ствола, гипофиза, глиомы зрительных нервов и т. д.) или они тесно прилежат к ним, что не позволяет избежать их облучения в довольно высоких дозах. В подобных ситуациях возникает необходимость оценки степени
риска повреждения указанных зон ЦНС и опасности в связи с
ростом опухоли. Считаем, что в подобных ситуациях оправданным является использование высоких доз ионизирующих излучений: ведь риск для жизни ребенка значительно выше от прогрессирования опухоли, чем от возможного развития лучевых
повреждений.
Оптимальными сроками между операцией и облучением являются 12—20 дней. Детям младшего возраста и имеющим психические изменения в течение 2—4 дней проводят адаптацию к
процессу облучения. Беспокойным пациентам ежедневно до
облучения делают премедикацию.
При выборе величины разовой дозы необходимость исходит
из того, что из-за высокой чувствительности формирующихся
тканей ребенка использование обычных разовых доз (1,8—2 Гр)
вызывает гибель значительной части клеток, ответственных за
рост и развитие данного органа, что приводит к неблагоприятным отсроченным эффектам. Поэтому снижения лучевых повреждений можно достичь применением при облучении головного мозга небольших разовых очаговых доз. В большинстве
опубликованных работ рекомендуются дозы порядка 1,2—
1,5 Гр у детей до 4 лет и более высокие в старшем возрасте
(1,8—2 Гр). Однако при этом не учитывается, что опухоль способна ускорить процесс регенерации, что может послужить
причиной неудач лучевой терапии при чрезмерно растянутом
курсе облучения. Таким образом, выгодное для растущих тканей ребенка уменьшение разовой дозы приведет к увеличению
времени лучевого лечения, что неблагоприятно скажется на излечении опухоли.
Выход из этого положения, вероятно, нужно искать в отказе
от классического фракционирования очаговой дозы. В частности, его можно заменить гиперфракционированием, т. е. делением суточной дозы на небольшие разовые дозы (0,8—1 Гр),
подводимые с интервалом 4—6 ч. В пользу последнего говорят
следующие доводы.
1. Временной интервал способствует интенсификации процессов реоксигенации в опухоли вследствие гибели и вымывания части ее клеток и перераспределению клеток в их цикле
298
жизнедеятельности, что может привести к облучению их в наиболее радиочувствительных фазах.
2. Временной интервал между наибольшими разовыми дозами необходим для процессов репарации сублетальных и потенциально летальных повреждений в клетках. При этом в нормальных тканях эти процессы протекают значительно быстрее,
особенно у детей. Поэтому каждая последующая фракция имеет
определенные терапевтические преимущества, которые возрастают с числом подводимых фракций.
Однако при опухолях ЦНС из-за особенностей тканей головного мозга ряд авторов полагают, что эта методика подведения дозы малоприемлема, так как интервал между фракциями недостаточен для их восстановления от радиационного повреждения. Для них требуется, по-видимому, интервал даже
больший, чем 24 ч. Это положение допустимо для глиальных
тканей, но если считать, что в основе повреждений тканей головного мозга лежат изменения, возникающие в кровеносных
сосудах, то гиперфракционирование может оказаться полезным
методом облучения детей с новообразованиями ЦНС.
Необходимо подчеркнуть, что радиочувствительность отдельных опухолей ЦНС весьма различна.
Высокую радиочувствительность имеют медуллобластомы и
анапластические эпендимомы. Эти же опухоли имеют и более
злокачественное течение. Среди доброкачественных бластом
определенной радиочувствительностью обладают эпендимомы,
аденомы гипофиза.
Медуллобластома. Медуллобластома — одна из наиболее часто встречающихся опухолей ЦНС нейроэктодермального происхождения, имеющая склонность к инфильтративному росту и
метастазированию в спинной мозг.
Локализуется преимущественно в области задней черепной
ямки и составляет в детском возрасте (средний возраст 10 лет)
15—20 % от всех новообразований головного мозга. У детей она
поражает в основном зону червя мозжечка и может прорастать в
просвет IV желудочка и распространяться по субарахноидальным
пространствам головного и спинного мозга. Заболевание характеризуется быстрым нарастанием общемозговых и локальных
симптомов, выраженностью внутричерепной гипертензии, сочетанием признаков поражения мозжечка и ствола мозга. Длительность заболевания у большей части детей не превышает 6 мес.
Основные принципы лечения. Первичное оперативное удаление опухоли обычно оказывается радикальным более чем у 70 % больных. При этом операционная смертность не
превышает 2 %. Наибольшие послеоперационные осложнения
могут развиваться после операции на неоплазмах, распространяющихся на IV желудочек. Они включают в себя дисфункцию
дыхания и глотания, атаксию. Бульбарные и мозжечковые симптомы у большинства больных обратимы.
299
Лучевая терапия занимает центральное место в комплексном
лечении детей с медуллобластомой. Впервые она была использована вскоре после описания этой опухоли [Gushing, 1930;
Culter et al., 1936].
Это новообразование обладает определенной чувствительностью к противоопухолевой лекарственной терапии. Определенный успех был достигнут при лечении рецидивных опухолей
такими препаратами, как циклофосфамид, винкристин, карбо-
платин и производные нитрозомочевины. Бьшо показано, что
предоперационная химиотерапия может привести к частичной
или полной регрессии опухоли.
Использование ломустина и винкристина повышает эффективность лечения первичных больных медуллобластомой,
имеющих неблагоприятные прогностические признаки (возраст
от 2 до 5 лет, неполное удаление опухоли, несомненные признаки наличия метастазов в спинном мозге).
О положительном влиянии полихимиотерапии (эмбихин,
винкристин, прокарбазин, преднизолон; схемы МОРР) на результаты лучевого лечения указывают многие авторы. Allen и со-
авт. (1986) обобщили данные о 508 детях, у которых проводилось
лечение по поводу медуллобластомы. Было показано, что безре-
цидивная продолжительность жизни при наблюдении 4,5 года
увеличивается на 10—15 % у детей, которым проводилась дополнительная химиотерапия. Особенно значим этот показатель
у больных с неблагоприятной формой медуллобластомы.
Заслуживает внимания неоадъювантная химиотерапия, которая начинает применяться при лечении опухолей мозга у детей. Изучается схема полихимиотерапии, в которую включены
следующие препараты: карбоплатин 175 мг/м2 внутривенно 1—
3-й день; этопозид 100 мг/м2 внутривенно 1—3-й день; винкристин 1,5 мг/м2 внутривенно 1-й день. Проводится два полных
курса перед началом тотального облучения ЦНС у больных медуллобластомой. Указывается, что такое лечение переносится
хорошо и нет сложности при проведении лучевой терапии после указанного курса неоадъювантного лечения.
Многолетние исследования, выполненные в Институте нейрохирургии им. Н. Н. Бурденко, позволили сделать выводы о
неоднородности группы опухолей, объединенных одним общим названием "медуллобластома", и об этапности метастатического процесса при этих опухолях.
Анализ клинического течения и результатов комбинированного лечения больных с медуллобластомой позволил выделить
две основные группы новообразований.
Irpynna — с благоприятным течением, когда отсутствуют
признаки спинального метастазирования к моменту операции;
опухоль располагается в пределах червя мозжечка; наблюдается
определенная очередность метастатического поражения различных зон ЦНС: в течение 1-го года обнаруживается спиналь¬
300
ное метастазирование, значительно позже (через 1,5 года) —
супратенториальное. Полагают, что детям этой группы после
радикального удаления опухоли необходимо немедленное облучение задней черепной ямки и всего длинника спинного
мозга и только через 6 мес — облучение полушарий большого
мозга.
II группа — с неблагоприятным течением, куда входят
больные с нерадикально удаленными опухолями, для которых
характерны врастание в полость IV желудочка, инфильтрация
структур ствола мозга и наличие признаков спинального мета-
стазирования уже к моменту операции, появление супратенториальных метастазов в течение первых месяцев после оперативного вмешательства. Этой группе больных сразу после операции
показаны тотальное облучение ЦНС и проведение полихимиотерапии.
Методика проведения лучевой терапии. Как полагают большинство авторов, тотальное облучение необходимо проводить
у всех детей с медуллобластомой. Недостаточно полное лучевое
воздействие на субарахноидальное пространство ведет к развитию рецидивов в нейроаксиллярной и субфронтальных зонах.
Облучение с использованием тормозного излучения ускорителя проводится в фиксированном положении ребенка (лучше
на спине или животе). В зону лучевого воздействия включают
все менингеальные оболочки с защитой глаза. Используют
обычно два боковых противолежащих поля. Особое внимание
должно уделяться стыковке нижних границ полей черепа и
верхней границы вертебрального поля. При этом тщательно
рассчитывают зазор между ними, чтобы достичь равномерного
облучения головного и спинного мозга. Голову ребенка фиксируют в специальном подголовнике с максимальным передним
отведением подбородка для уменьшения лучевой нагрузки на
нижнюю челюсть. Точности воспроизведения условий облучения помогает изготовление специальных индивидуальных масок из пластического материала. Нижняя граница вертебрального поля должна быть на уровне позвонка SII.
При краниоспинальном облучении можно также руководствоваться следующими рекомендациями, предложенными Р. А. Пархоменко (1994).
1. Оптимальная ширина поля краниального облучения равна
максимальному диаметру головы либо превышает его на 0,5 см
в обе стороны.
2. Блоки, экранирующие ткани лица, должны располагаться
на 1 см от lamina eribrosa и по крайней мере на 1,5 см от средней
черепной ямки.
3. Для экранирования нормальных тканей необходимо изготовление индивидуальных защитных блоков.
4. Ширина поля облучения спинного мозга и его оболочек
должна, как правило, составлять 5—6 см.
301
Величина дозы. Медуллобластома относится к радиочувствительным неоплазмам. Высокая частота местного излечения
опухоли задней черепной ямки может быть достигнута при дозах излучения, лежащих в пределах лучевой толерантности тканей головного мозга.
Большинство авторов полагают, что дозы должны быть в
пределах 50—55 Гр на заднюю черепную ямку и 45—50 Гр на
эту же зону у детей моложе 3 лет.
При краниоспинальном облучении рекомендуется доза на
головной и спинной мозг в пределах 30—35 Гр (разовая доза
1,6 Гр, 5 раз в неделю) с последующим облучением только задней черепной ямки, т. е. опухолевого ложа, без лучевого воздействия на все основание головного мозга до суммарной дозы
50-55 Гр.
У маленьких детей и у больных, у которых нет клинических,
рентгенологических и цитологических признаков метастатического поражения спинного мозга, доза может быть ограничена
25 Гр (разовая очаговая доза 1,6 Гр, 5 раз в неделю).
Однако ряд авторов, сравнив результаты лечения двух групп
детей, получивших дозы 24 и 36 Гр на спинной и головной
мозг, считают, что после подведения низких доз увеличивается
число рецидивов опухоли. Поэтому они рекомендуют использовать дозы в пределах 30—36 Гр.
Разовая очаговая доза при краниоспинальном облучении
варьирует от 1,5 до 1,8 Гр; при облучении задней черепной ямки она чаще лежит в пределах 1,8 Гр.
Как мы указывали, небольшие разовые дозы, особенно у детей,
способствуют сохранению нормальных тканей от лучевых повреждений. Исходя из этого был предложен оригинальный метод
облучения при опухолях, требующих тотального облучения головного мозга и не имеющих признаков метастазирования. Ежедневный сеанс облучения проводится с изменением объема лечебной мишени ("поле в поле”): вначале весь головной мозг облучают дозой 1—1,2 Гр, а затем лучевому воздействию
подвергается только ложе опухоли, и разовая доза на эту зону
увеличивается до 1,6—1,8 Гр (т. е. на 0,6—0,8 Гр). Таким образом, удается подвести необходимую дозу на весь головной мозг
(элективное облучение) и на первичную опухоль (ложе), не удлиняя продолжительности курса лучевого лечения. Например,
если тотальное облучение головного мозга проводится разовой
дозой 1,2 Гр, то на 32 фракции удается подвести общую дозу
38 Гр (эквивалентную по биологическому эффекту дозе 30 Гр,
подведенных разовой дозой по 1,6 Гр 5 раз в неделю), одновременно доза на ложе опухоли за это число фракций достигает
54,4 Гр, подведенных по 1,7 Гр. Имеющиеся данные о влиянии
курса облучения на эффективность лучевого лечения показали,
что 5 лет живут 37 % больных при расширенном курсе и 62 % —
при непрерывном.
302
Результаты лечения. В большинстве сообщений о результатах лечения больных с медуллобластомой указывается, что 5 лет
живут 55—60 % и 10 лет — 45 % пациентов, причем произошло
заметное улучшение показателей длительности жизни больных
медуллобластомой за 15 лет, начиная с 60-х годов, примерно на
18—20 %. В большинстве исследований подчеркивается, что ре-
цидивирование заболевания происходит в основном в первые
2—3 года после лечения, хотя не исключается более позднее
прогрессирование болезни. Рецидивы заболевания возникают в
основном в задней черепной ямке.
Нейрокраниальные метастазы за пределами задней черепной ямки встречаются в 20—30 % случаев, располагаясь супра-
тенториально и в спинном мозге. Около 8 % составляют метастазы в кости и костный мозг.
Эпеццимома. Эпендимома — это опухоль, которая развивается из клеток, выстилающих стенки мозговых желудочков и
центрального канала позвоночника. У детей в 90 % случаев это
интракраниальные опухоли, из которых 60—70 % развиваются в
задней черепной ямке, наиболее часто в ГУ желудочке. В 10 %
случаев эпендимомы встречаются в спинном мозге. Они могут
заполнять полностью полость желудочков. В 25—50 % случаев
наблюдается инвазия ствола головного мозга, а у 50 % этих детей
бластома может распространяться через большое затылочное отверстие до уровня позвонка (Q или Сц). Нередко эта опухоль
метастазирует по желудочковой системе и оболочкам спинного
мозга. Супратенториальные эпендимомы локализуются преимущественно в париетальных и фронтальных долях мозга.
Клинические данные показывают, что имеется определенная
связь между степенью злокачественности опухоли и результатами лечения. Практически в 75 % случаев встречаются дифференцированные формы эпендимом и только в 25 % — анапластические. Последние отличаются агрессивным ростом и имеют
высокую склонность к метастазированию в спинной мозг.
Эпендимобластома — редкая опухоль маленьких детей,
обычно она субтенториальная.
Основные принципы лечения. Радикальное удаление эпендимомы IV желудочка технически часто невозможно
из-за того, что неоплазма нередко прорастает в мозжечок и
ствол мозга. Полная резекция опухоли этой локализации возможна только у 30—50 % детей.
Не меньшие сложности возникают при оперативном удалении
супратенториальных эпендимом из-за локализации и размера.
Лучевая терапия оказывает заметное влияние на число длительно живущих больных. Эпендимома и эпендимобластома
обладают умеренной радиочувствительностью, но они более
чувствительны, чем глиобластомы. Обычно при этих опухолях
проводят послеоперационное облучение. При наличии признаков метастатического поражения спинного мозга или желудоч¬
303
ковой системы показано облучение этих областей. Определенной эффективностью при этих новообразованиях обладают
противоопухолевые препараты. К ним прежде всего можно отнести алкилирующие агенты (циклофосфамид, цисплатин, кар-
боплатин и препараты нитрозомочевины). Использование цик-
лофосфамида или его комбинации с винкристином, СДЦР и
VP-16 или МОРР в предоперационном периоде позволяет добиться объективного и иногда стойкого эффекта.
Donek и соавт. (1991) наблюдали 5 больных с рецидивной
эпендимомой, которым проводилась полихимиотерапия с использованием платины в комбинации с винкристином и это-
позидом. У 1 из них было отмечено объективное улучшение,
которое продолжалось в среднем 12 мес. В целом, как показали
проспективные исследования по адъювантной химиотерапии,
не было отмечено улучшения показателей 5-летней выживаемости у больных эпендимомой при ее использовании.
Методика проведения лучевой терапии. Выбор объема тканей
ЦНС, подлежащих облучению при эпендимомах, зависит от их
локализации и степени злокачественности опухоли. Отмечено,
что после локального облучения, т. е. зоны развития бластомы,
частота рецидивов заболевания несколько выше (статистически
не достоверно), чем после облучения всего черепа или краниоспинальной области. Сводные сведения разных авторов позволяют сделать заключение, что краниоспинальные метастазы
встречаются в 12 % случаев. Однако при дифференцированных
эпендимомах они в основном развиваются при появлении рецидива первичной опухоли. У 80 % больных эти метастазы
встречаются при наличии эпендимомы высокой степени злокачественности, локализующейся в ГУ желудочке.
При облучении опухоли ГУ желудочка, кроме облучения зоны
ее расположения, необходимо включение в зону лучевого воздействия части спинного мозга до уровня верхнего края Сщ.
Современные лучевые методы диагностики позволяют с
большой точностью определить объем первичной опухоли.
Вследствие этого возможен экономный выбор мишени облучения: опухоль и 2—3 см тканей, прилежащих к ней.
При анапластических эпендимомах ГУ желудочка, а также
при наличии клинических, рентгенологических признаков и
положительных данных цитологического исследования цереброспинальной жидкости при других формах необластом показано проведение полного краниоспинального облучения.
Величина дозы. Большинство авторов полагают, что суммарная очаговая доза должна лежать на уровне толерантности тканей ЦНС: 54 Гр (подведенных разовой дозой 1,8 Гр 5 дней в неделю) у детей старше 2—3 лет.
Salazar и соавт. (1983), наблюдая за больными эпендимомой
ГУ желудочка, отметили, что местная эррадикация опухоли наблюдалась в 70 % случаев после облучения в дозах 45 Гр и выше.
304
При краниоспинальном облучении суммарные дозы на головной и спинной мозг должны быть в пределах 35—40 Гр.
Результаты лечения. Суммируя данные, приведенные различными исследователями, можно отметить, что после лечения
детей с внутричерепными эпендимомами 5 лет живут от 15 до
60 % больных.
Bloom и соавт. (1990) сообщили, что 30 % детей живут
15 лет.
Наихудшие результаты лечения наблюдаются среди детей
младше 2 лет с опухолями черепной ямки. Только 15 % детей
живут 5 лет. В группе детей старше 3—5 лет этот показатель равен 40—60 %.
Большое влияние на результаты лечения оказывает степень
злокачественности неоплазмы. При эпендимомах с низкой степенью злокачественности 5 лет живут 70 % детей, а при бласто-
мах с высокой степенью злокачественности только 29 %.
Глиома ствола головного мозга. Опухоли ствола мозга встречаются как у взрослых, так и у детей. Пик заболеваемости у последних приходится на возраст 3—9 лет. Они составляют 7—
10 % всех внутричерепных неоплазм у детей. Морфологические
данные о строении этих новообразований недостаточно полны.
Однако полагают, что многие опухоли этой зоны представлены
астроцитомами низкой степени злокачественности. Нередко
встречаются и глиобластомы.
Основные принципы лечения. Возможности хирургического лечения опухолей ствола мозга весьма ограничены, хотя только оперативное удаление необластомы ведет к стабилизации заболевания с малой вероятностью ее прогрессирования в течение 5—7 лет. Однако для многих заболевших детей
основным методом лечения является лучевая терапия. Симптоматическое улучшение после ее проведения наблюдается в 75 %
случаев, но большинство больных умирают в ранние сроки после окончания облучения.
Методика проведения лучевой терапии. Глиомы моста мозга
обладают инфильтрирующим ростом, нередко вовлекая в опухолевый процесс средний мозг (четверохолмие) и мозжечок.
Это необходимо помнить, выбирая объем тканей, подлежащих
облучению. Поэтому в него включается мозговой ствол от четверохолмия до уровня позвонка Cj. Рационально использование противолежащих полей и излучений высоких энергий.
Локальное облучение может быть рекомендовано для опухолей среднего мозга. При этом в мишень включается первичная
опухоль с 1—2 см прилежащих тканей.
Субарахноидальное метастазирование встречается у 15—20 %
детей с глиомами ствола мозга. Наиболее характерным для данных опухолей является местное прогрессирование заболевания.
Величина дозы. Рядом исследователей было показано, что
только 20—30 % детей с глиомами ствола мозга имеют относи¬
305
тельно хороший прогноз после облучения суммарной дозой
50—55 Гр. Низкий процент достижения местной деструкции
опухоли заставил искать новые пути временного подведения
дозы, что привело к использованию гиперфракционирования.
Так, Edwards и соавт. (1989), облучая опухоль в дозе 1 Гр 2 раза
в день до суммарной дозы 72 Гр, отметили, что 2 года прожили
30 % детей, а среди больных с диффузной опухолью среднее
время выживаемости равнялось одному году.
Высокодозное облучение, которое стало возможным при
использовании гиперфракционирования, оказалось более
эффективным при местно ограниченных опухолях ствола
мозга, особенно при диффузных инфильтрирующих бластомах
по сравнению с облучением, осуществляемым обычным курсом.
Результаты лечения. В результате проведенного курса лучевой терапии у 70—80 % детей достигается положительный симптоматический эффект. Freeman и соавт. (1991) отметили, что
на компьютерных томограммах после облучения с использованием гиперфракционирования у 1/з больных достигается заметное уменьшение объема опухоли.
Супратенториальные глиомы. Астроцитомы составляют
большинство опухолей этой группы детей. Существует 3 формы
астроцитом.
1. Плотные, фибриллярные, не очень богатые сосудами, достаточно хорошо ограничены; обладают низкой радиочувствительностью.
2. Опухоли, содержащие большое количество клеточных
элементов с развитой сосудистой сетью, склонные к кистозной
дегенерации. Они доброкачественные, но часто рецидивируют.
Радиочувствительность их несколько выше, чем у фибриллярных опухолей.
3. Анапластические астроцитомы имеют агрессивный инфильтративный рост, рецидивируют, умеренно радиочувствительны.
Основные принципы лечения. Хирургическое удаление опухолей низкой степени злокачественности, локализующихся в полушариях большого мозга, является основным
методом лечения, ведущим к достижению безрецидивной длительной жизни у значительной части детей.
В ряде работ, опубликованных с 1950 г., указывается, что
полное удаление этих опухолей возможно у 50 % детей.
Лучевая терапия показана только при неполном удалении
опухоли у детей старше 3 лет.
Астроцитома мозжечка. Астроцитомы мозжечка — это биологически доброкачественные опухоли, составляющие 15 %
всех неоплазм ЦНС у детей. Они редко встречаются у младенцев и часты у детей в возрасте от 2 до 5 лет. Большинство этих
неоплазм растет медленно и имеет четкие границы.
306
Первыми клиническими симптомами заболевания являются
атаксия и повышение внутричерепного давления вследствие блокирования IV желудочка. На компьютерных томограммах в 50 %
случаев обнаруживаются кисты, которые чаще всего единичные, с пристеночной опухолью.
Гистологически 80—85 % опухолей классифицируется как
пилоцистозный или юношеский тип астроцитомы. Оставшиеся
15 % описываются как диффузные астроцитомы.
Основные принципы лечения. Полное хирургическое удаление опухоли является основным методом лечения
большинства больных с астроцитомой мозжечка. Выполнение
его возможно у 75—80 % детей.
Лучевое лечение не имеет показаний к применению после
радикальных операций. Однако ряд авторов указывают на необходимость проведения послеоперационного облучения в случаях нерадикального удаления опухоли. Также оно показано при
астроцитомах, инфильтрирующих ствол мозга, и бластомах,
имеющих несомненные признаки биологической злокачественности, т. е. при опухолях 3-й формы.
Методика проведения лучевой терапии. При проведении послеоперационной лучевой терапии в зону облучения включается только задняя черепная ямка. При этом рекомендуется подведение суммарной очаговой дозы в пределах 50—54 Гр (разовая доза 1,8 Гр подводится 5 раз в неделю, ежедневно).
Результаты лечения. В последних работах, посвященных проблемам лечения больных с астроцитомой мозжечка, указывается,
что 90—95 % детей живут 20—25 лет после выполнения радикальных оперативных вмешательств.
Кроме того, отмечено, что даже после неполного удаления
этой опухоли 5 лет живут 80 % больных и 65—80 % — от 10 до
20 лет. Последнее указывает на возможность выполнения неполных резекций с последующими оперативными вмешательствами
при рецидивах опухолей.
Краниофарингиома — это биологически доброкачественная
опухоль, развивающаяся из эпителиальных клеток зоны турецкого седла. Она обычно состоит из большой массы плотной
опухолевой ткани и кистозных полостей. Бластоматозные ткани инкрустированы солями извести. Кисты содержат жидкость,
богатую кристаллами холестерина.
Эти опухоли составляют 7 % всех внутричерепных новообразований у детей. Они встречаются в любом возрасте, но в
50 % случаев у людей до 20 лет; пик заболеваемости приходится
на возраст от 8 до 14 лет.
Преобладающими симптомами являются нарушение зрения,
повышение внутричерепного давления. Гипофизарно-гипоталамическая дисфункция определяется у 30—70 % детей при постановке первичного диагноза. При этом регистрируется дефицит гормона роста или тиреоидстимулирующего гормона. Ино¬
307
гда имеются признаки диабета или нарушения содержания
гонадотропина.
Основные принципы лечения. Для медленно растущих опухолей, располагающихся по средней линии, основным методом успешного лечения является их резекция. В настоящее время в связи с успехами микрохирургии она может
быть выполнена у большинства детей. По данным разных авторов, полное удаление опухоли возможно у 50—80 % больных.
В ряде сообщений имеются данные о хороших результатах
лечения, которое ограничивалось аспирацией содержимого
кисты с помощью обычной декомпрессивной операции или неполной резекцией опухоли с последующим облучением.
Необходимо отметить, что местные рецидивы краниофарингиомы после радикального их удаления наблюдаются редко. Однако нежелательные осложнения, возникающие во время или
после оперативного вмешательства, еще значительны. Так, послеоперационная смертность достигает 2—5 % случаев, и значительные функциональные нарушения встречаются у 10 % детей.
Анализ эффективности консервативного лечения показывает,
что выраженность функциональных нарушений после такой терапии находится в прямой зависимости от объема выполненной операции.
После неполного хирургического удаления бластомы без послеоперационной лучевой терапии наблюдается быстрое восстановление роста опухоли. У этих больных в 70 % случаев регистрируются рецидивы в течение 3 лет после нерадикальных
операций.
Методика проведения лучевой терапии. При краниофарингиомах в зону облучения включается вся опухоль, границы которой определяют до операции. Однако если во время операции
удаляется значительный компонент кисты, то место расположения стенок ее в объем не включается.
Обычно для проведения облучения используются мегавольт-
ные излучения, генерируемые гамма-аппаратами или линейными ускорителями. Лучшее дозное поле наблюдается при облучении фотонами с энергией 6—10 МэВ с использованием противолежащих латеральных полей.
Наилучшие результаты консервативного лечения больных с
краниофарингиомой были получены после использования суммарных доз 50—55 Гр по сравнению с детьми, у которых дозы
были ниже 50 Гр. Обычно разовая доза лежит в пределах 1,8—
2 Гр, которая подводится 5 раз в неделю, ежедневно.
Опухоли эпифизарной зоны и внутричерепные герминоклеточ-
ные неоплазмы. Новообразования области шишковидной железы
представляют собой своеобразную гистологическую группу неоплазм. Преобладают герминоклеточные опухоли, особенно герминомы, которые развиваются чаще у мальчиков во втором десятилетии их жизни. При росте этих опухолей наблюдается по¬
308
вышение внутричерепного давления из-за сдавления водопровода
мозга. Иногда при опухолях шишковидной железы и задних отделов III желудочка наблюдается вертикальный паралич взора, а
также могут быть ускорение или замедление полового созревания, задержка роста.
До 25—35 % герминоклеточных бластом шишковидной железы метастазирует в III желудочек или спинной мозг.
В группу паренхиматозных опухолей шишковидной железы
включают примитивную пинеобластому, которая чаще встречается у маленьких детей, и пинеоцитому, развивающуюся в основном у взрослых. Супраселлярные герминоклеточные опухоли, которые ранее обозначались как эктопические пинеаломы,
встречаются реже, чем опухоли аналогичного строения зоны
шишковидной железы. Первые неоплазмы возникают преимущественно в первом и втором десятилетиях жизни человека.
При их развитии у детей появляются признаки диабета и раннего полового созревания. Супраселлярные герминоклеточные
бластомы, кроме гермином, встречаются очень редко.
При диагностике опухолей шишковидной железы определенную роль играет определение маркеров в сыворотке крови
и цереброспинальной жидкости (бета-человеческий хорион —
гонадотропин, бета-HCG).
Общие принципы лечения. При неоплазмах зоны
шишковидной железы и супраселлярных герминомах в ряду лечебных средств первое место занимает лучевая терапия. Это
обусловлено трудностями оперативных вмешательств, сопровождающимися значительным числом операционной смертности
и осложнений из-за анатомических особенностей зоны локализации опухоли, где имеется большое количество венозных
сплетений.
В работах последних лет показано, что операционная смертность не наблюдается у детей при выполнении открытой или
стереотаксической биопсии.
Из-за сложностей получения тканей опухоли для морфологического подтверждения диагноза в ряде клиник с целью установления природы опухоли используют показатель радиочувствительности бластомы, которая определяется по скорости
уменьшения объема опухоли во время облучения. Последний
рассчитывается с помощью современных методов лучевой диагностики (КТ или МРТ). Если после подведения к опухоли дозы в 20 Гр имеется значительное ее уменьшение, то считают,
что эта бластома является герминомой или другой высокорадиочувствительной опухолью. В этих случаях лучевое лечение
продолжается с увеличением объема мишени до облучения всего головного мозга или даже вместе со спинным мозгом. Новообразования, которые минимально уменьшились после указанной дозы, относят к радиорезистентным формам, при которых желательно выполнение резекции или продолжение только
309
локального облучения с подведением высоких очаговых доз, рекомендуемых при облучении глиом.
И все же полагают, что при опухолях зоны шишковидной
железы желательно выполнение биопсии, так как знание морфологического строения этих опухолей определяет план лучевой терапии или необходимость применения дополнительной
химиотерапии.
Неоплазмы супраселлярной зоны обычно подвергаются первичному оперативному вмешательству с целью их полного удаления или (при невозможности выполнения этого) взятия материала для морфологического исследования.
Противоопухолевое лекарственное лечение довольно эффективно у больных герминогенными опухолями. При этом результаты его бывают значительными при использовании схем,
содержащих циклофосфамид и цисплатин. Имеются сообщения об успешном использовании после операции циклофосфа-
мида или его комбинации с цисплатиной, винкристином и блео-
мицином. При этом при послеоперационном облучении подводятся более низкие дозы.
Методика проведения лучевой терапии. До настоящего времени обсуждается вопрос об объеме мишени облучения при
опухолях зоны шишковидной железы. И все же можно считать
установленным, что при пинеоцитомах и глиомах, диагноз которых подтвержден морфологическим исследованием, достаточно локального облучения первичной опухоли. При пинеобластомах и герминоклеточных бластомах, кроме гермином из-за
склонности этих опухолей к метастазированию, требуется облучение головного и спинного мозга.
При герминомах желательно облучение всего головного мозга
с подведением начальных доз в пределах 20—40 Гр. Основанием для этого положения является то, что у 25—40 % детей опухоль может распространяться в зону III желудочка. По мнению
Deamaley и соавт. (1990), тотальное облучение головного мозга
предупреждает развитие рецидивов у 15—20 % больных. После
завершения краниального лучевого воздействия рекомендуется
дальнейшее облучение только опухоли и 1—2 см прилежащих
нормальных тканей.
Облучение спинного мозга при герминомах проводится
только тогда, когда имеются неоспоримые данные о наличии в
этой области метастазов.
Герминомы шишковидной железы, по данным разных авторов, метастазируют нейроаксиально в 10—50 % случаев. При
этом метастатическое поражение спинного мозга встречается у
0—25 % детей.
Таким образом, можно отметить, что при морфологически
подтвержденных герминомах шишковидной железы вряд ли
оправдано использование краниоспинального облучения. Оно
всегда показано больным с распространенной внутричерепной
310
опухолью при наличии нескольких бластоматозных очагов или
при операционном разрыве опухоли и признаками метастатического поражения спинного мозга.
Величина дозы. Несмотря на радиочувствительность внутричерепных гермином, для достижения стойкого и полного излечения первичной опухоли доза должна быть 50 Гр и более. По данным ряда авторов, полная регрессия неоплазмы была получена у
50—60 % детей после подведения дозы 40 Гр и у 85—90 % — после облучения в дозе 50 Гр и более.
При нейроаксиллярном облучении доза облучения спинного
мозга должна ограничиваться 20—25 Гр при отсутствии признаков его метастатического поражения и 30—35 Гр при наличии
опухолевых клеток в спинномозговой жидкости.
Больным с герминоклеточными неоплазмами, кроме гермином, или с пинеобластомами показано проведение облучения
краниоспинальной зоны в дозах 36—40 Гр. Суммарная доза на
первичную опухоль должна быть на уровне 54 Гр. Такая же доза
должна подводиться и к глиомам.
Результаты лечения. Общая 5-летняя выживаемость у больных с опухолями зоны шишковидной железы составляет 75 %.
При внутричерепных герминомах этот период времени проживают 85—100 % детей. При других видах герминоклеточных
опухолей результаты лечения менее благоприятны, и длительное время после лечения живут только 5—35 % больных.
Примитивные нейроэктодермальные опухоли. В 1973 г. Hart и
Erie описали примитивную нейроэктодермальную опухоль как
высокозлокачественную недифференцированную супратенториальную бластому, которая поражает детей раннего возраста.
Эта опухоль обычно больших размеров, с четкими границами,
с наличием кист и кровоизлияний. Неоплазма состоит из примитивных клеток нейроэктодермального происхождения. Эта
опухоль часто метастазирует по нейроаксиальной зоне и может
быть множественной при установлении диагноза.
При лечении больных с примитивной нейроэктодермальной
опухолью после хирургического удаления бластомы обязательно последующее проведение химиолучевой терапии. Доза на
первичную опухоль должна быть на уровне 55 Гр.
Исход заболевания в основном плохой. Год после лечения
живут 10—15 % детей.
Глава 13 НЕФРОБЛАСТОМА
В 1899 г. Вильмс в своей монографии дал обзор литературы по
опухолям почек у детей. С этого времени эти новообразования
стали известны как опухоли Вильмса. Многие годы указанная
бластома служила моделью при изучении проблем детской онкологии в целом. К настоящему времени одной из проблем, относящихся к этой опухоли, является поиск оптимального лечения,
необходимого для полного излечения больного с минимальным
риском нарушения комфортности его последующей жизни.
Эпидемиология, гистология, генетика. Опухоль Вильмса, или
нефробластома, происходит из развивающихся тканей почек,
метанефрогенетического ростка. Это высокозлокачественная эмбриональная опухоль. Она является наиболее частым злокачественным новообразованием мочеполового тракта у детей и составляет 7,8 случаев на миллион детей в возрасте от 1 года до 14 лет.
Средний показатель в таких странах, как Финляндия, Швеция,
США, Австралия, Италия, Голландия и Великобритания, равняется 7,3. При этом наибольшее значение его было зарегистрировано в Финляндии (9,5) и наименьшее в Великобритании
(5,1).
По данным Института детской онкологии РОНЦ им. Н. Н.
Блохина РАМН, нефробластома встречается у 20 % детей с солидными новообразованиями (исключая опухоли ЦНС). Наиболее часто она встречается у детей до 5 лет (75 %) и в некоторых случаях может быть врожденной.
Частота нефробластомы среди мальчиков и девочек примерно одинакова.
Нефробластомы нередко сочетаются с врожденными аномалиями. Точная частота пороков развития неизвестна, так как
многие беременности с аномальными зародышами заканчиваются спонтанными абортами, а многие дети с большими аномалиями умирают, не достигнув возраста, когда могут проявляться клинические симптомы нефробластомы. Lemerle (1976)
выявил врожденные пороки развития у детей с нефробластомой
в 13 % случаев. Nakissa и соавт. (1989) описали 38 % аномалий
мочеполового тракта среди 133 больных.
Как считают некоторые авторы, ряд аномалий тесно связан
с нефробластомой [De Kraker, 1992]. К ним относят спорадическую аниридию, гемигипертрофию и почечные аномалии.
Сотрудниками клиники Института детской онкологии ОНЦ
РАМН была произведена попытка выяснения влияния на заболеваемость семейного онкологического анамнеза и возраста родителей. Было установлено, что чем старше возраст матери, тем
больше шансов родить ребенка с нефробластомой. Так, в 62 %
случаев матери этих детей в момент беременности были старше
30 лет, отцы — в 48,6 % случаев. В связи с этим возраст родителей должен рассматриваться как "фактор риска".
312
Имеются определенные данные о повышенном риске развития опухоли Вильмса у детей, чьи отцы работают на химических
предприятиях.
Макроскопически нефробластома представляется обычно
солитарной опухолью, хорошо отграниченной от тканей нормальной почки. Она может встречаться в любой части пораженного органа.
При больших размерах она вызывает деформацию полостей
почки. В ряде случаев опухоль инкапсулирована и в ней встречаются зоны некроза с образованием полостей, иногда с массивными кровоизлияниями. При так называемых мультикистоз-
ных формах нефробластомы на поверхности разреза выявляются
множественные тонкостенные кисты. Возможна инвазия окружающих опухоль тканей — почечной вены, нижней полой вены
и даже почечной лоханки и мочеточника. В 7—10 % случаев поражаются метастазами регионарные лимфатические узлы, прежде всего парааортальные, расположенные между нижней мезентериальной артерией и диафрагмой.
Прорастание кровеносных сосудов способствует стремительному метастазированию, которое может наблюдаться и без
этого. Наиболее часто гематогенные метастазы развиваются в
легких, печени, реже — в костях и ЦНС.
С морфологической точки зрения нефробластома представляет собой смесь эпителиальных и стромальных элементов в
различных пропорциях. Гистологическая картина разнообразна, но всегда имеются клетки двух типов: эпителиальные и соединительнотканные. Поданным В. Н. Суховой (1974), морфологическим критерием нефробластомы является обязательное
присутствие в почке недифференцированной опухолевой ткани
или нефрогенных структур, находящихся на разных уровнях
развития. Эпителиальные и соединительнотканные элементы
могут встречаться в различных сочетаниях, иметь разную степень дифференцировки и даже быть настолько недифференцированными, что порой трудно определить их гистогенез. Кроме
основных типов клеток, в опухоли всегда представлена в различной степени фиброзная строма с большим количеством
мелких сосудов типа капилляров и более крупных артериальных стволов. Иногда наблюдается выраженный ангиоматоз.
Около 30 % составляют ткани других типов: гладкие и поперечнополосатые мышечные волокна, хрящевая ткань, кость, нервные стволы и др.
В последние годы выделяют три группы нефробластом —
благоприятную, нормальную и неблагоприятную. К первым относят мультикистозные, тубулярные и фиброаденоматозные
формы опухоли, а к последним — новообразования со значительными очагами клеточного атипизма (анаплазией), светлоклеточную саркому и рабдоидную форму опухоли. Бластомы с
неблагоприятным гистологическим строением встречаются
313
примерно в 12 % случаев [Haas et al., 1981]. Светлоклеточная
саркома состоит из клеток с плохо окрашивающейся цитоплазмой и нечеткими краями. Они инфильтрируют паренхиму и
имеют склонность к метастазированию в кости. Злокачественные рабдоидные опухоли почки являются наиболее неблагоприятными неоплазмами почек у детей. Они состоят из клеток
с богатой ацидофильной цитоплазмой и имеют склонность к
отдаленному метастазированию, особенно в головной мозг
[Weeks et al., 1989].
Клиническое течение заболевания. Клинически опухоль
Вильмса у внешне здорового ребенка обнаруживается матерью
или педиатром во время обычного диспансерного наблюдения.
Гладкая, иногда с неровной поверхностью, плотная, безболезненная опухоль в брюшной полости часто является первым
признаком заболевания. Макрогематурия встречается более
чем в 25 % случаев заболевания. Она развивается тогда, когда
опухоль прорастает в чашечную систему почки. Такие опухоли
возникают в зонах, прилежащих к лоханке, диагностируются в
ранних стадиях своего развития. Другие симптомы неспецифичны, и к ним относят желудочно-кишечные расстройства,
общее недомогание, лихорадку, боль в животе и повышение артериального давления.
При сборе анамнеза особое внимание уделяется особенностям течения беременности и лекарственным средствам, которые применяла в это время мать ребенка, перенесенным инфекциям, заболеваемостью злокачественными новообразованиями в семье, наличию врожденных аномалий.
При дифференциальной диагностике необходимо в основном исключить другие опухоли и заболевания почек, такие, как
нейробластома, гидронефроз, поликистоз и внутрибрюшинные
опухоли (гепатомегалия, спленомегалия).
При обзорной рентгенографии брюшной полости можно выявить наличие кальцификатов, которые встречаются в 60—70 %
случаев нейробластом и только в 15 % — при нефробластоме.
Экскреторная урография с использованием быстрого введения большого количества контрастного вещества для получения отчетливой нефрограммы в ранней стадии исследования,
рентгенография в прямой, боковой и двух косых проекциях и
выполнение отсроченных снимков при экскреторных нарушениях позволяют в 82 % случаев нефробластомы определить локализацию и характер патологического процесса по типичной
деформации и смещению полостей почки [Волкова Л. Д.,
1991]. Ультразвуковая томография имеет особенно большое
значение при диагностике в тех случаях (10 %), когда почка не
дает отображения на пиелограммах.
Внедрение компьютерной томографии привело к снижению
роли инвазивной артериографии при обследовании больного с
нефробластомой. Абдоминальная компьютерная томография по¬
314
зволяет четко определить границы опухоли как в почке, так и
за ее пределами, выявить пораженные метастазами лимфатические узлы, метастазы в печень и помогает составить представление о состоянии противолежащей почки. Сопоставление диагностических возможностей компьютерной томографии с
ультразвуковой показывает большую значимость первой [Reiman et al., 1986].
Рентгеновская компьютерная томография, по мнению
Л. Д. Волковой (1991), — высокоточный метод, дающий возможность получить четкое изображение опухолевого узла, точную количественную информацию о его размерах, плотности,
структуре, выявить топографические взаимоотношения с другими органами, что в конечном итоге помогает определить стадию заболевания и провести оценку эффективности лечения.
Чувствительность этого метода в диагностике опухоли почки у
детей достигает 92 %.
При обследовании ребенка необходимо также рентгенографическое изучение органов грудной клетки из-за возможного
метастатического поражения легких. Для обнаружения этих метастазов используют рентгенографию в прямой, боковой и в
двух косых проекциях. Для выяснения распространенности метастатических изменений и выявления небольших по размеру
метастазов, которые не обнаруживаются на обычных рентгенограммах, проводят компьютерную томографию. Williams и со-
авт. (1988) обнаружили у 11 из 124 детей на компьютерных томограммах метастазы нефробластомы, которые не определялись на рентгенограммах.
Необходимо выполнение полного исследования мочи и крови.
У больных с нефробластомой может наблюдаться анемия, обусловленная гематурией. Обычным является изучение уровней
содержания азота и креатинина в сыворотке крови и функциональных тестов печени. Для исключения нейробластомы необходимо исследование катехоламинов в моче.
Редкие клинические признаки. При нефробластоме иногда
могут наблюдаться повышение артериального давления и его
восстановление до нормальных показателей после удаления пораженной нефробластомой почки.
Опухоль Вильмса может встречаться в комбинации с двумя
формами нефротического синдрома — гломерулосклерозом и
Драш-синдромом.
Стадирование. В начале прошлого столетия только 8 % детей
выживали после одного хирургического лечения. Оперативная
смертность достигала 23 %. Вероятно, излеченные больные —
это пациенты, которые имели начальные стадии заболевания. К
настоящему времени твердо установлено, что стадия заболевания
является важным прогностическим фактором и на ее основе
создается план рационального лечения. В США и Европе используется классификация стадий нефробластомы.
315
В последние годы Международным противораковым союзом
была предложена классификация стадий нефробластом (TNM),
основанная на следующих компонентах:
• Т — распространенность первичной опухоли;
• N — состояние регионарных лимфатических узлов;
• М — наличие или отсутствие отдаленных метастазов.
Она используется и как дооперационная клиническая классификация, и как послеоперационная патогистологическая
классификация. Более того, TNM-классификацию можно использовать для формирования групп больных с различными
стадиями.
TNM-классификация (1987)
Т — первичная опухоль
ТХ — недостаточно данных для оценки первичной опухоли
ТО — нет признаков первичной опухоли
Т1 — односторонняя опухоль в зоне* до 80 см2 (включая
почку)
Т2 — односторонняя опухоль в зоне более чем 80 см^
(включая почку)
ТЗ — разорвавшаяся перед лечением односторонняя опухоль
Т4 — двусторонняя опухоль
N — регионарные лимфатические узлы
NX — недостаточно данных для оценки состояния лимфатических узлов
N0 — метастазов в регионарных лимфатических узлах нет
N1 — метастазы в регионарных лимфатических узлах
М — отдаленные метастазы
MX — недостаточно данных для оценки отдаленных метастазов
МО — метастазов нет
Ml — есть отдаленные метастазы
PTNM—патогистологическая классификация
РТ — первичная опухоль
рТХ — недостаточно данных для оценки первичной опухоли
рТО — нет признаков первичной опухоли
рТ1 — внутрипочечная, полностью инкапсулированная
опухоль, удалена радикально
♦Зона рассчитывается в вертикальном и горизонтальном измерениях на рентгенограммах опухоли почки.
316
рТ2 — опухоль прорастает капсулу или почечную паренхиму; удалена радикально
рТЗ — опухоль прорастает капсулу или почечную паренхиму
(включается прорыв почечной капсулы и/или опухоль микроскопически определяется на наружной
стороне капсулы; опухоль микроскопически проникает, инфильтрирует или тромбирует почечные сосуды за пределами почки; инфильтрирует почечную
лоханку и/или мочеточник, тазовую клетчатку; экс-
цизия неполная или операционный разрыв капсулы
рТЗа — микроскопически остаточная опухоль, ограниченная опухолевым ложем
рТЗб — макроскопически остаточная опухоль или злокачественный асцит
рТЗв — пробная операция
PN — регионарные лимфатические узлы
pNX — недостаточно данных для оценки состояния лимфатических узлов
pNO — метастазов в регионарных лимфатических узлах нет
pN 1 — метастазы в регионарных лимфатических узлах
pNla — регионарные метастазы полностью удалены
pN16 — регионарные метастазы удалены не полностью
РМ — отдаленные метастазы
РТ-категории соответствуют М-категориям
Прогностические факторы. Эти факторы весьма разнообразны.
К ним относят опухолевую инвазию почечной вены, возраст ребенка, гистологическое строение нефробластомы, стадию заболевания, разрыв опухоли до или во время операции. Изучалось
их влияние на развитие рецидива заболевания. Выявлено, что
наиболее значимы гистологическое строение опухоли (благоприятное или неблагоприятное), наличие метастазов в лимфатических узлах и диссеминация опухоли.
D'Angio и соавт. (1981) и Farewall и соавт. (1981), отдавая
должное прогностическому влиянию разрыва опухоли, указывают, что этот фактор имеет меньшее значение, чем полагали
ранее, если это осложнение произошло локализованно в боковой зоне. Они же продемонстрировали значимость для прогноза такого фактора, как метастатическое поражение лимфатических узлов. Так, из 326 детей с нефробластомой без метастазов
в лимфатические узлы, имеющей благоприятное гистологическое строение, 2 года прожили 88 % больных, в то время как из
67 детей с аналогичной опухолью, но с метастазами в лимфатические узлы этот же срок прожили 56 % пациентов.
Число длительно живущих детей снижается с прогрессированием стадии заболевания от I к III.
Принципы лечения больных с нефробластомой. В настоящее
время общепризнана комплексная терапия детей, больных неф-
317
робластомой, включающая оперативное удаление опухоли, лучевое и интенсивное лекарственное лечение. Вопрос о доопе-
рационной терапии остается дискутабельным. Детские онкологи США считают ее нецелесообразной без морфологического
подтверждения диагноза, операционного установления стадии
заболевания, хотя, как утверждает D'Angio (1981), при современных диагностических возможностях некорректный клинический диагноз, установленный до операции, встречается чрезвычайно редко (около 5 %). Эта проблема широко изучается в
Европе.
В первых клинических исследованиях, проведенных Международным обществом детских онкологов (SIOP), было показано, что предоперационное облучение облегчает выполнение радикальной операции и уменьшает частоту разрыва опухоли. Последнее избавляет от необходимости проведения облучения
всей брюшной полости, что было необходимо после до- или
операционных разрывов нефробластомы. В последующих исследованиях был отмечен аналогичный эффект после проведения предоперационной химиотерапии.
Корректный выбор тактики лечения детей с нефробласто-
мой в основном зависит от стадии заболевания и морфологического строения опухоли. Новообразования благоприятного гистологического строения хорошо поддаются лучевому и лекарственному лечению. Однако из-за возможных поздних лучевых
повреждений, которые могут развиваться при длительном периоде жизни больного, в современных схемах комбинированного
лечения этих опухолей радиотерапия играет минимальную роль
по сравнению с химиотерапией. В частности, у детей, имеющих
опухоль, ограниченную почкой, она вообще не применяется,
что позволяет избежать назначения лучевого лечения почти у
половины заболевших детей.
Нефробластомы неблагоприятного гистологического строения
относительно устойчивы к обоим видам лечения, и поэтому они
подвергаются агрессивным методам мультимодальной терапии.
Оперативное лечение. Основные принципы хирургического лечения больных с нефробластомой изложены в работах
отечественных и зарубежных ученых [Дурнов Л. А., 1967; Лебедев В. И., 1990; Putnam et al., 1983; Thomas, 1992]. Кратко они
формулируются следующим образом.
• Наиболее целесообразным является трансперитонеальный доступ, при котором возможно произвести тщательную ревизию органов брюшной полости (печени, лимфатических узлов забрюшинного пространства и второй
почки) и при необходимости выполнить биопсию.
• Тщательное и нетравматическое удаление опухоли с принятием всех мер для предупреждения разрыва новообразования.
318
• Удаление нефробластомы с предварительной перевязкой
почечной вены.
• Обязательная резекция парааортальных лимфатических
узлов.
• Маркировка ложа опухоли в зоне сомнительного радикального удаления ее рентгеноконтрастными клипсами
для уточненного планирования зон облучения.
Химиотерапия. При лекарственном лечении больных
нефробластомой с успехом используют винкристин, актиноми-
цин-D, адриамицин, ифосфамид, циклофосфан и другие препараты. В настоящее время в клинической практике применяют сочетания таких препаратов, как дактиномицин, циклофосфан, винкристин и адриамицин.
Для предварительного лечения предлагается следующая схема:
винкристин — 1,5 мг/м2 внутривенно в 1-й, 8-й, 15-й дни
(максимальная разовая доза 2 мг):
дактиномицин — 1000 мкг/м2 внутривенно капельно 1-й
день (растворить в 400 мл 0,9 % изотонического раствора натрия хлорида).
Если к 15-му дню не наблюдается значительного объективного уменьшения опухоли (более чем на 50 %), то вместе с
третьим введением винкристина внутривенно вводят 40 мг/м2
адриамицина.
De Kraker (1992) приводит две схемы предоперационной химиотерапии, которые включены в исследование SIOP-9.
Как указывает автор, пролонгированная интенсивная предоперационная химиотерапия привела к увеличению числа больных, у которых после операции была установлена I стадия заболевания вместо IV стадии, которая определялась первоначально. Кроме того, уменьшилось число детей, у которых в
дальнейшем выявлялись отдаленные метастазы.
Было показано, что при нефробластомах I стадии с благоприятным гистологическим строением необходимо использовать
короткий курс дооперационной химиотерапии двумя препаратами — дактиномицином и винкристином. В группах больных
со II стадией (при метастазах в регионарных лимфатических узлах) и с III стадией дополнительное введение адриамицина снижает частоту рецидивов заболевания.
Вследствие этого во многих европейских странах до операции лекарственное лечение проводится двумя препаратами, а
схемы послеоперационной химиотерапии определяются в зависимости от стадии заболевания и гистологического строения
нефробластомы. Так, при I стадии (включая анапластические
опухоли) послеоперационное лечение осуществляется коротким
курсом с использованием двух препаратов; при II стадии (без
поражения регионарных лимфатических узлов метастазами)
можно применять трехкомпонентное лекарственное лечение в
319
течение 28 нед; при II стадии с метастатическим поражением
регионарных лимфатических узлов и III стадии химиотерапия
может быть аналогичной проводимой при II стадии, но она
должна дополняться лучевой терапией (15 Гр + локальное облучение небольшими полями зон нерадикального удаления
опухоли — 10—15 Гр).
В Институте детской онкологии РОНЦ РАМН послеоперационную химиотерапию назначают в зависимости от отсутствия (группа А) или наличия одного или более неблагоприятного
фактора (группа Б). К последним относятся неблагоприятная
гистологическая форма нефробластомы, наличие метастазов ее
в регионарных лимфатических узлах, инвазия сосудов, опухолевые тромбы в них, разрыв капсулы опухоли, имплантаты опухоли по брюшине, неэффективный курс предоперационной химиотерапии.
Послеоперационное лекарственное лечение в группе А проводится по следующей схеме:
I курс:
• винкристин 1,5 мг/м2 внутривенно в 1-й, 8-й, 15-й дни;
• дактиномицин 1000 мкг/м2 внутривенно в инфузии в 1-й
день (при сочетании с лучевой терапией дозу дактиноми-
цина снижают до 750 мкг/м2).
II курс (спустя 3 нед после завершения первого):
• винкристин 1,5 мг/м2 внутривенно в 1-й, 8-й дни;
• дактиномицин 1000 мкг/м2 внутривенно в инфузии в 1-й
день.
Следующие курсы проводят в том же режиме (аналогично
второму) с интервалами в первые 6 мес — 3 нед (всего 6 курсов); в последующие 6 мес — 6 нед (всего 3 курса). Общая длительность этой терапии 1 год.
В группе Б схема лечения несколько видоизменяется:
• винкристин и дактиномицин вводятся в режиме, аналогичном группе А;
• адриамицин 40 мг/м2 на 15-й день в первом курсе; в 8-й
день в последующих курсах.
Интервалы между курсами, число курсов и общая длительность послеооперационной химиотерапии аналогичны таковым в группе А.
Больным, у которых отмечена недостаточная эффективность
химиотерапии или прогрессирование при начальном использовании указанных схем, применяют программу VAB-6:
• винбластин 4 мг/м2 внутривенно в 1-й день;
• циклофосфан 600 мг/м2 внутривенно в 1-й день;
• дактиномицин 1000 мг/м2 внутривенно инфузией в 1-й
День;
• блеомицин 6 мг/м2 внутривенно в 1-й, 2-й и 3-й дни;
320
• платидиам 100—120 мг/м2 внутривенно инфузией в 4-й
день.
Сот и соавт. (1992), проанализировав данные 365 детей в
возрасте до 12 мес, показали, что при нефробластоме, имеющей
благоприятное гистологическое строение и без метастазов при
установлении первичного диагноза, можно получить превосходные результаты при использовании двухкомпонентной химиотерапии (послеоперационной) в дозах, уменьшенных на 50 %.
При этом у всех детей не было зарегистрировано ни одного случая смерти из-за токсичности химиопрепаратов и сопутствующих инфекционных заболеваний. Из 199 новорожденных с
нефробластомой I стадии 4 года прожили 96 % пациентов, из 38
маленьких детей со II стадией — 95 % и из 19 с III стадией —
90 %, причем эти результаты оказались практически одинаковыми с полученными у более старших детей, перенесших химиолечение в полных дозах. Так, из 498 детей с I стадией неф-
робластомы 4 года прожили 92 % больных, со II стадией — 94 %
из 342 детей, с III стадией — 91 % из 373 пациентов. Хотелось
бы подчеркнуть, что все дети имели нефробластому, имеющую
благоприятное гистологическое строение.
Лучевая терапия. Этот вид лечения за последние годы
претерпел заметные изменения. Еще в 50-е годы он был единственным средством, дополняющим радикальность оперативного лечения. Эта комбинация позволила улучшить результаты
хирургического лечения с 20 до 50—57 %.
Интересные сведения приводит Klapproth (1969), который
обобщил результаты эффективности лечения больных с нефробластомой на этапе сочетания хирургии и лучевой терапии.
Он изучил данные 1222 больных, из которых более 5 лет прожили 20,9 % детей после одной нефрэктомии; 27,2 % — после
операции и послеоперационного облучения и 26,2 % — после
предоперационного лучевого воздействия. Эти факты показывают, что ионизирующие излучения, применяемые на разных
этапах комбинированного лечения, улучшают результаты оперативного вмешательства на 6—7 %. При этом предоперационное облучение использовалось в основном у детей с первично
большими опухолями с целью уменьшения их размеров, и дозы
облучения были невелики.
По-видимому, эффективность лечения повышается за счет
уменьшения числа местных рецидивов и в меньшей степени за
счет уменьшения операционной диссеминации опухолевых клеток, которые могут быть причиной развития определенной доли
отдаленных метастазов. Следовательно, совместное применение
пред- и послеоперационной лучевой терапии должно более значимо увеличивать эффективность комбинированного лечения
больных с нефробластомой за счет включения всех положительных механизмов, направленных на увеличение радикальности
оперативных вмешательств (предупреждение развития местно-
321
регионарных рецидивов и разрыва опухоли во время операции,
снижение опасности развития отдаленных метастазов).
Это предположение подтвердилось в исследованиях ряда авторов, которые указали на увеличение числа больных, переживших 5 лет, до 50—57 %.
Однако, несмотря на положительные моменты лучевой терапии, в последние годы роль ее в комбинированном лечении
значительно уменьшилась, что объясняется появлением новых
эффективных противоопухолевых препаратов и их сочетаний и
теми осложнениями, которые развиваются у маленьких детей в
результате воздействия ионизирующих излучений на нормальные растущие ткани.
Многолетние кооперативные исследования, проведенные в
США и Европе, позволили сформулировать современные показания к применению лучевой терапии. В качестве примера
можно привести рекомендации американских исследователей
по использованию ионизирующих излучений при лечении детей с нефробластомой (NWTS-4).
В приведенных рекомендациях следует обратить особое внимание на правильный выбор времени начала послеоперационного облучения. Больные, у которых оно осуществлялось через
10 дней и более после операции, имели значимо больший риск
появления местного рецидива заболевания по сравнению с
детьми, у которых лучевое воздействие начиналось в более ранние сроки.
Thomas и соавт. (1984) сообщили данные по частоте местного рецидива в зависимости от сроков начала послеоперационной лучевой терапии (у 8 % детей из 99, если этот период был
более 10 дней, и у 0,8 % из 251 больного, если срок был более
короткий).
Во время предоперационного облучения в зону лучевого воздействия включается пораженная почка с ее сосудами и лимфатическими узлами. Верхняя граница располагается на уровне купола диафрагмы, нижняя — на уровне нижней мезентериальной
артерии, внутренняя — за средней линией, по противоположному краю позвоночного столба. В общем лечебную мишень составляют опухоль или ее ложе, почка или ее ложе с 2—3 см от
ее края.
Аналогичные границы "мишени" обозначаются и в послеоперационный период, за исключением того, что облучается не
почка, а ее ложе.
При необходимости дополнительного локального облучения
ложа опухоли вследствие наличия остаточной опухоли, неблагоприятного ее гистологического строения поля выбирают с таким расчетом, при котором исключается облучение позвоночника.
При облучении всей брюшной полости необходимо тщательно защищать тазобедренные суставы для предупреждения
322
нарушения роста костей, что в отдаленные сроки может привести к соскальзыванию головок бедра. Это осложнение встречается даже при дозах ниже 20 Гр [Silverman et al., 1981].
Выбор адекватного объема облучения не только ведет к
уменьшению числа отдаленных осложнений, но и отчетливо
влияет на исход заболевания. Как сообщили Thomas и соавт.
(1984), после проведенного или многофакторного анализа использование ограниченных по размеру полей облучения ведет
к увеличению числа рецидивов опухоли.
Лучевая терапия осуществляется на дистанционных мега-
вольтных аппаратах (гамма-терапевтических установках типа
"Рокус", линейных ускорителях, генерирующих фотоны с энергией 4—6 МэВ) с использованием двух противолежащих
встречных полей (переднего и заднего). Для уменьшения лучевой нагрузки на критические органы можно использовать свинцовые блоки, которые помещаются на 0,5 см внутрь от края
светового поля.
При выборе суммарной очаговой дозы можно считать, что
при комплексном современном лечении детей с нефробласто-
мой необходимо подведение относительно невысоких доз ионизирующего излучения.
В ситуациях, при которых имеется необходимость облучения
всей брюшной полости, в настоящее время рекомендуется облучение в дозе 10 Гр, рассчитанной на среднюю фронтальную
плоскость; разовая очаговая доза составляет 1,5—1,8 Гр, подводимых 5 раз в неделю [Thomas, 1992].
В Институте детской онкологии РОНЦ РАМН до настоящего времени при облучении брюшной полости использовались
дозы 20—24 Гр, которые подводились с помощью гиперфракционирования, при котором суточная доза 2 Гр делилась на две
фракции по 1 Гр с интервалом 4 ч. Отмечена хорошая переносимость такого курса лучевой терапии без каких-либо выраженных острых реакций со стороны кишечника.
В ряде случаев, в частности при неполном удалении опухолевого очага, необходимо локальное облучение в дозе 20 Гр,
подводимой по 1,5—1,8 Гр 5 раз в неделю, а при анапластических нефробластомах величина очаговой дозы колеблется в зависимости от возраста от 12 до 28 Гр.
При больших остаточных бластомах, плохо реагирующих на
полихимиотерапию, рекомендуется дозу на опухоль увеличивать до 40—45 Гр. Аналогичный подход к выбору дозы должен
быть и при опухолях, имеющих неблагоприятное гистологическое строение.
В исследованиях D'Angio и соавт. (1981) было показано, что
у маленьких (до 12 мес) детей с нефробластомой I—II стадии с
благоприятным гистологическим строением лучевую терапию
необходимо исключить, так как она не оказывает влияния на
результаты комбинированного лечения, основными компонен¬
323
тами которого являются операция и двухкомпонентная химиотерапия. Далее было отмечено, что при III стадии нефробла-
стомы, имеющей благоприятное гистологическое строение,
уменьшение очаговой дозы от 20 Гр до 10 Гр (по 1,8 Гр) несет
риск увеличения частоты возникновения рецидивов после проведения двухкомпонентной химиотерапии (дактиномицин +
винкристин). Этого отрицательного эффекта не наблюдается,
если к двум лекарственным препаратам добавить адриамицин.
Вследствие этого было сделано заключение о том, что в указанных клинических ситуациях предпочтительны проведение трехкомпонентной химиотерапии и облучение ложа опухоли в дозе
10 Гр. При таком лечебном подходе снижается число поздних
лучевых повреждений и повышается возможность излечения
клинически невыявляемых отдаленных метастазов.
И все же ряд авторов из-за кардиотоксичности адриамицина
предпочитают проводить двухкомпонентную химиотерапию и
облучение ложа опухоли в дозе 20 Гр за 11 фракций.
Облучение легких. Проблема лечения больных с неф-
робластомой, имеющих метастазы в легкие, куда чаще всего она
и метастазирует, остается актуальной. В настоящее время обсуждаются вопросы совершенствования комплексного лечения
этих детей с использованием хирургического удаления метастазов. Последний метод был изучен у 211 детей с нефробластомой
I—II стадий, у которых после успешного лечения первичной
опухоли были обнаружены метастазы в легких. Выявлено, что
результаты химиолучевой терапии аналогичны результатам хирургического лечения, при котором производилась резекция
солитарных опухолевых отсевов. Однако, как полагают исследователи, оперативное вмешательство иногда необходимо для
гистологического подтверждения наличия метастазов. Это связано с тем, что из 29 больных, у которых наличие метастазов
подтверждалось данными компьютерной томографии, 6 были
прооперированы, и только в 4 случаях морфологи подтвердили
наличие опухолевых метастазов. Рецидивы заболевания были отмечены у 5 % больных после химиолучевого лечения и у 11 % —
после полихимиотерапии.
Как отмечает De Kraker (1992), хотя имеется опасность нарушения роста грудной клетки и гипоплазии молочной железы у
девочек, необходимо тотальное облучение легких после химиотерапии при наличии сомнений в полной регрессии метастазов
на рентгенограммах или при множественных неоперабельных
метастазах, оставшихся после окончания трехкомпонентной химиотерапии.
При этом все легкое рекомендуется облучать в дозе 12 Гр за
8 фракций (по 1,5 Гр). В Институте детской онкологии РОНЦ
РАМН при облучении легких использовали методику гиперфракционирования. Облучение проводили на гамма-терапевтической установке типа "Рокус" и на линейном ускорителе фо¬
324
тонами 4—6 МэВ с двух встречных полей (переднего и заднего)
с обязательным включением всей мишени в 80 % изодозную
кривую и защитой позвоночного столба свинцовыми блоками.
Суточная доза 2—2,4 Гр дробилась на два сеанса по 1—1,2 Гр и
с 4-часовым интервалом между последними; курс — 7 дней, всего
14 фракций; облучение проводят 5 раз в неделю. При наличии
метастазов дополнительно проводили локальное облучение по
той же схеме подведения дозы. Как показал анализ полученных
данных, полная регрессия остаточных метастазов была у 53 %
детей. Можно отметить, что эффективность химиолучевого лечения была выше у детей с односторонним изолированным поражением легких и меньшим числом метастазов, а также при
более длительном интервале между окончанием первичного лечения и выявлением метастазов. Результаты исследования показали, что при одновременном проведении лекарственного и
лучевого лечения получен худший эффект, чем при химиотерапии, предшествовавшей облучению.
Анализ данных также показал, что после одного крупнопольного облучения ни у одного больного не наблюдалось
рентгенологических признаков изменений со стороны нормальных легочных тканей.
Двусторонняя нефробластома. У 5 % детей с нефробластомой
во время установления диагноза обнаруживается поражение
обеих почек. Каждый больной с синхронной двусторонней опухолью нуждается в индивидуальном подходе к лечению. При
этом тактика зависит от распространенности процесса в каждой
почке.
При удовлетворительной функции почек современная полихимиотерапия играет важнейшую роль в достижении регрессии
опухоли, достаточной для ее экономного удаления. Кроме того,
успешное ее проведение может оказать существенное влияние
на применение лучевого лечения. В начале комплексного лечения возможно использование двухкомпонентной химиотерапии
(дактиномицином и винкристином), а в случае малой ее эффективности необходимо назначение других химиопрепаратов.
При показаниях облучение почки проводится в дозе не выше
16 Гр по 1,6—1,8 Гр 5 раз в неделю. Повышение этой дозы несет опасность развития лучевого нефрита в единственной почке
ребенка. Наш опыт лечения детей с двусторонней нефробластомой показывает, что эти дозы излучения практически не
влияют на функцию оставшейся неудаленной почки.
Послеоперационное облучение зоны удаленной почки проводится в том же объеме и в тех же дозах, которые были описаны при лечении односторонней опухоли.
Результаты лечения. Число излеченных больных нефробластомой составляет около 90 % [Лебедев В. И., 1990; D’Angio et al.,
1989]. Поэтому изучение поздних нарушений, обусловленных
проведенным лечением, имеет большое практическое значение,
325
так как они могут оказывать существенное влияние на последующую жизнь бывшего больного.
В исследовании Dubousset (1980) было показано, что из 59
успешно леченных пациентов по поводу нефробластомы между
1950 и 1963 гг. у 63 % имелся кифоз и у 40 % сколиоз. Для предупреждения этих деформаций рекомендуются симметричное
облучение позвоночника и проведение ранних мероприятий по
его укреплению. Heaston и соавт. (1979) показали, что изменения скелета после использования мегавольтных излучений также часты, но менее выражены по сравнению с нарушениями,
вызванными ортовольтными излучениями. Thomas и соавт.
(1983) подтвердили высокую частоту развития сколиозов (у
14 из 26 больных), но с минимальными функциональными нарушениями.
Поздние нарушения функции почек могут встречаться даже
через 10 лет после окончания лечения. К ним относятся протеинурия, обусловленная гломерулосклерозом, повышение сывороточного креатинина (несмотря на компенсаторную гипертрофию противоположной почки) и артериального давления.
Последнее чаще наблюдается у больных, которым проводилось
облучение всей брюшной полости.
По данным Breslow и соавт. (1988), облученные больные имеют несколько больший риск заболеть второй опухолью. В его
группах детей вторые новообразования составили 10,8 % у подвергшихся лучевому воздействию и 5 % у необлученных больных.
Li и соавт. (1983) выявили 10 новых опухолей среди 478 детей с нефробластомой, леченных в течение 44 лет. При этом у
9 из 10 больных они располагались в зоне полей облучения.
Число вторичных новообразований увеличивается в группах
больных, живущих более 10 лет после окончания лечения.
Глава 14 I НЕЙРОБЛАСТОМА
Нейробластома — это злокачественная опухоль, которую впервые описал в 1865 г. Вирхов, назвав ее "глиомой". В 1910 г.
Wright доказал, что развивается она из эмбриональных нейро-
бластов симпатической нервной системы, и дал ей настоящее
название. Это наиболее частая экстракраниальная солидная
бластома, встречающаяся у детей и составляющая 14 % всех новообразований детского возраста [Дурнов Л. А. и др., 1986; Putnam et al., 1983, и др.].
Несмотря на определенные успехи в лечении детей с этим
заболеванием, все еще имеется много проблем, особенно при
наличии отдаленных метастазов у детей старше 1 года. Последние уже при установлении первичного диагноза встречаются в
70 % случаев. Thomas и соавт. (1984) отметили, что из 119 больных, поступивших в клинику, только 32 (26,8 %) имели I или
II стадию заболевания. И все же повышение знаний о биологической природе заболевания, появление новых методов диагностики и разработка эффективной мультимодальной терапии позволяют надеяться на дальнейший прогресс в терапии
нейробластом.
Эпидемиология. Ежегодно нейробластомой заболевают 6—8
детей на 1 млн детского населения до 15 лет (средний возраст —
2 года). Это наиболее частая злокачественная опухоль раннего
детства; иногда она выявляется при рождении и может увязываться с врожденными дефектами. Большинство опухолей локализуется в забрюшинном пространстве, преимущественно в
надпочечниках, реже — в средостении и на шее. По сводным
данным 7 сообщений, объединяющих 1310 больных, нейробластомы выявлены в надпочечнике у 32 % детей, в паравертебральном забрюшинном пространстве — у 28 %, в заднем
средостении — у 15 %, в зоне таза — у 5,6 % и на шее — у 2 %
детей.
Число неустановленных зон первичного развития опухоли
было в 17 % случаев. Нейробластома имеет тенденцию к мета-
стазированию в определенные зоны, такие, как кости, костный
мозг, лимфатические узлы. Редко отсевы опухоли встречаются
в коже и печени; как исключение, поражается головной мозг.
Нейробластомы раннего детского возраста обладают удивительной способностью, а именно способностью к спонтанному
созреванию в ганглионеврому. Интересно, что нейробластома
нередко случайно, при микроскопическом исследовании, обнаруживается у маленьких детей, умерших от неопухолевых заболеваний. Это свидетельствует о том, что ряд этих бластом протекает бессимптомно и спонтанно регрессирует.
Заслуживает внимания исследование клинико-генетических
аспектов нейробластом. В литературе описаны случаи возникновения множественных нейробластом различной локализации
327
у двух братьев [Robertson, Lee, 1975]. Была сделана попытка
объяснить семейные случаи нейробластом, медуллобластом и
глиом с точки зрения гипотезы о двух мутациях. Предполагается, что в некоторых случаях одна мутация наследуется, а вторая появляется в соматической клетке; в других случаях обе мутации происходят в одной соматической клетке [Knudson,
Meadows, 1977].
Исследователи, активно работающие в области эпидемиологии опухолей у детей, сообщают, что увеличенный риск заболевания раком коррелирует с врожденными уродствами и врожденной иммунологической недостаточностью.
Так, Edmonsen и соавт. (1968) приводят данные литературы
о 26 наблюдениях нейробластом с различными дефектами развития, а также собственное наблюдение над 6-месячным мальчиком, у которого при синдактилии были аномалии ребер и
нейробластома.
Клиническое течение. Первоначальные симптомы нейробластомы не имеют специфичности и могут имитировать различные педиатрические заболевания. Это объясняется, во-первых,
возможностью поражения опухолью и метастазами нескольких
зон организма ребенка, а также метаболическими нарушениями, обусловленными ростом этих опухолевых очагов. Растущая
инфильтрирующая опухоль, располагающаяся на шее, в грудной клетке, брюшной и тазовых полостях, может, прорастая и
сдавливая окружающие ее структуры, давать соответствующий
симптомокомплекс. При локализации в области головы и шеи
первыми симптомами могут быть появление пальпируемых
опухолевых узлов и развитие синдрома Горнера. Развиваясь в
грудной клетке, опухоль может стать причиной нарушения дыхания, дисфагии, сдавления вен. Первым сигналом наличия
опухоли в брюшной полости может быть наличие в ней пальпируемых опухолевых масс, в то время как новообразования таза могут проявляться нарушением акта дефекации и мочеиспускания. Нейробластомы, прорастающие через межвертебральные отверстия со сдавлением спинного мозга (опухоли в виде
"гантели"), вызывают характерные неврологические симптомы,
к которым можно отнести такие, как вялый паралич конечностей и/или нарушение мочеиспускания с напряженным мочевым пузырем.
Клинические симптомы, обусловленные метастазами, также
весьма многообразны. У новорожденных первым признаком
развития метастазов является быстрое увеличение печени, иногда сопровождающееся образованием на коже узлов голубоватого цвета и поражением костного мозга.
У детей более старшего возраста развитие метастазов может
вызвать боли в костях и увеличение лимфатических узлов. Иногда заболевание имеет признаки, характерные для лейкоза, т. е.
у детей развиваются анемия и кровоизлияния на слизистых
328
оболочках и коже, что обусловливается панцитопенией, вызванной поражением костного мозга клетками нейробластомы.
Метаболические изменения, развивающиеся в результате
роста опухоли, ведут к появлению ряда общих симптомов. Так,
в результате повышения уровня катехоламинов и иногда вазоактивных интестинальных пептидов (VIP) у детей могут
появляться приступы потливости и бледности кожных покровов, сопровождающиеся жидким стулом и гипертензией. Эти
симптомы могут возникать независимо от локализации бласто-
мы, и их интенсивность снижается при успешном лечении
больного.
Диагностика. Важным тестом в диагностике и дифференциальной диагностике нейробластом является определение суточной экскреции с мочой катехоламинов, их предшественников и
метаболитов (ванилилминдальной и гомованилиновой кислот).
У детей с нейробластомой в отличие от других опухолей наблюдается резкое повышение экскреции указанных веществ почти
в 85 % случаев. Кроме того, в крови или моче больного определяются и другие опухолевые маркеры: нейроноспецифическая энолаза, ферритин и ганглиосайды.
Их определение является не только ценным диагностическим тестом, но и может помочь в объективизации данных и
динамике опухолевого процесса после лечения.
Катехоламины. В 1959 г. впервые было показано, что у
детей с ганглионейромой повышается уровень содержания ва-
нилилминдальной кислоты. В настоящее время известно, что
клетки нейробластомы секретируют в большом количестве катехоламины в дополнение к метаболитам. Помимо повышения
абсолютных величин содержания в моче катехоламинов, наблюдается преимущественное увеличение экскреции "незрелых” фракций — дофамина и ДОФА. Соответственно значительно возрастает экскреция метаболитов катехоламиновой ва-
нилилминдальной и гомованилиновой кислот.
Хорошее понимание синтеза и метаболизма катехоламинов
имеет большое значение для клинических целей как при установлении диагноза, так и в ходе лечения больного и последующего наблюдения за ним. В последние 20 лет определение уровня в моче ванилилминдальной и гомованилиновой кислот стало
рутинным методом для указанных целей. Однако некоторые вопросы, касающиеся значимости этого теста, еще продолжают
обсуждаться.
Так, например, некоторые исследователи предлагают использование определения катехоламинов с целью "массового”
скрининга [Sawada et al., 1973].
В Японии обследовали более полумиллиона младенцев. В
результате было выявлено 25 детей с бессимптомно текущей
нейробластомой; в 92 % из них наблюдаются длительные сроки
без рецидива заболевания [Woods, Tuchman, 1987].
329
В США и Европе также наметилась тенденция к проведению
аналогичной программы. Однако имеются и определенные недостатки этого метода, связанные с тем, что благодаря скринингу определяются также дети с новообразованиями, которые
могли бы спонтанно регрессировать [Nischi et al., 1987].
Спорным остается вопрос о прогностическом значении уровней ванилилминдальной и гомованилиновой кислот у детей с
нейробластомой. В ранних сообщениях указывалось, что высокий их уровень обязательно ассоциируется с плохим прогнозом,
в то время как в более поздних работах не было найдено значимой связи с прогнозом [Siegel et al., 1980; Ninane et al., 1986].
Gahr, Hunneman (1987) исследовали уровни содержания ка-
техоламиновых метаболитов в плазме и моче у 84 детей с первичной нейробластомой и у 15 — с рецидивом. Авторами было
показано, что определение их содержания в плазме может успешно использоваться при длительном наблюдении за детьми
после лечения. Подчеркивается, что у некоторых детей при
нормальном содержании катехоламинов в моче наблюдался повышенный уровень их в плазме.
Нейроноспецифическая энолаза. Энолаза — это
гликолитический фермент, который в виде двух форм содержится в тканях головного мозга и нейроэндокринных тканях.
Оба вида энолаз, обозначенных аа и уу, являются биологически
и иммунологически самостоятельными субъединицами. Гамма-
энолаза находится в нейронах и поэтому называется нейроноспецифической энолазой (НСЭ). У детей с нейробластомой наблюдаются высокие уровни содержания НСЭ в сыворотке крови, но такие же показатели встречаются и при других формах
злокачественных новообразований, таких, как нефробластома,
саркома Юинга, лимфома, саркомы мягких тканей и острые
лейкозы [Короткевич Е. А. и др., 1995].
В связи с этим определение НСЭ при диагностике должно
оцениваться с большой долей осторожности. Однако этот тест
имеет определенное прогностическое значение. В частности,
низкие уровни содержания НСЭ увязываются с хорошим прогнозом, а у детей с диссеминированной формой заболевания,
т. е. прогностически неблагоприятной, отмечают высокие
уровни содержания сывороточной.
Интересно, что у больных с нейробластомой в стадии IVS,
имеющей хороший прогноз, обычно наблюдались более низкие
уровни НСЭ по сравнению с детьми, имевшими IV стадию заболевания при равных размерах первичной опухоли. Это подтверждает мнение о том, что нейробластома стадии IVS имеет
биологические характеристики, отличающиеся от характеристик аналогичной опухоли в других стадиях болезни.
Ферритин. У детей с нейробластомой наблюдается повышение уровня ферритина, который снижается в процессе лечения и нормализуется в период ремиссии. Полагают, что повы¬
330
шение содержания ферритина в сыворотке крови происходит
по следующим причинам: из-за повышения количества неиспользуемого железа, обусловленного анемией; из-за увеличения синтеза ферритина нейробластоматозными клетками с последующей секрецией в плазму [Напп et al., 1986].
Отмечается, что количество этого маркера почти не увеличивается у детей с нейробластомой I и II стадий, но оно заметно
изменяется у больных с III и IV стадиями заболевания. Evans и
соавт. (1987) выделили три группы больных, имевших различный прогноз течения заболевания:
• хороший, при нормальном содержании ферритина в сыворотке и возрасте ребенка менее 2 лет; в этой группе
прожили 93 % детей;
• умеренный, при нормальном уровне ферритина и возрасте ребенка 2 года и старше; 2 года без признаков заболевания наблюдались 58 % больных;
• плохой, при повышенном содержании ферритина; 2-лет-
няя продолжительность жизни у этих детей отмечена в
19 % случаев.
Ганглиосайды. Ганглиосайды — это мембранно-связанные гликолипиды, присутствующие в плазме большинства больных с нейробластомой. При наличии активно растущей опухоли
концентрация дисиалоганглиосайда возрастает в 50 раз по сравнению с нормальным уровнем. Отмечено, что при успешном
лечении уровень этого маркера быстро снижается и вновь может увеличиться при появлении рецидива. Кроме того, было зарегистрировано, что количество циркулирующего маркера не
повышается у детей с ганглионейромой.
Кроме клинического и лабораторного обследования ребенка, обязательно выполнение костномозговой пункции или тре-
панобиопсии грудины и крыла подвздошной кости. Полученные аспираты или биоптаты изучаются цитологически, иммунологически или с помощью проточной цитометрии. Отмечено,
что при этом они должны быть получены не менее чем из 4 зон.
Лучевые методы исследования являются одними из решающих
в клинической диагностике.
Ультразвуковое исследование должно всегда выполняться
первым при подозрении или наличии опухоли в брюшной или
тазовой полостях. Повторная эхография, компьютерная томография проводятся перед решением вопроса о первичном или
отсроченном оперативном вмешательстве. Данные, полученные при этом, помогают уточнить локализацию, распространенность опухоли и ее связь с интра- и экстраперитонеальными
структурами тазовой и брюшной полостей, а также выявить наличие в ней мелких кальцинатов, которые не определяются
обычной рентгенографией. Возможно также выполнение абдоминальной аортографии, нижней венокавографии, которые мо¬
331
гут помочь в уточненной диагностике распространенности за-
брюшинных нейробластом.
Заключительным этапом клинической диагностики заболевания является аспирационная биопсия с цитологическим, иммунологическим исследованием пунктата. Кроме того, аспираты могут быть изучены с помощью проточной цитометрии.
При диагностике отдаленных метастазов нейробластомы необходимо, кроме костного мозга, тщательное исследование
костей скелета, которые часто ими поражаются, особенно у детей в возрасте 2 лет и старше. При стандартной рентгенографии, выполненной во время первичной диагностики, костные
метастазы выявляются в 50—60 % случаев. Проведение радиоизотопного исследования с использованием радиоактивного
технеция (99тТс) повышает этот показатель до 80 %. В последние годы для диагностики нейробластом предложено проведение радиоизотопного исследования с применением метайодо-
бензилгванидина, аналога гванетидина, меченного 1311. Сканирование, проведенное после введения этого препарата,
позволяет выявить первичную остаточную и рецидивную опухоль, наличие метастатического поражения костного мозга,
костей, лимфатических узлов и мягких тканей. В обзорном сообщении, содержащем данные о 550 больных с нейробластомой, было показано, что более чем 90 % этих опухолей способно накапливать 131I-MJBG [Gelfand, Hoefenagel, 1988].
При динамическом наблюдении за детьми после лечения необходимо уделять пристальное внимание поиску метастатического поражения костного мозга и костей, используя сцинти-
графию с метайодобензилгванидином, аспирационную и тре-
панобиопсию. Для этих целей используется также МРТ.
Следует отметить, что за последние 10 лет в связи с развитием УЗИ, КТ, МРТ и радиоизотопной сцинтиграфии значительно повысились точность диагностики заболевания, определения его стадии и возможности эффективного наблюдения за
детьми после лечения.
Стадирование нейробластомы. В литературе опубликовано
довольно большое число систем стадирования этого заболевания. Из них до 1988 г. наиболее популярной была классификация, предложенная в США группой по изучению рака у детей
[CCSG, Evans et al., 1971]. В 1988 г. привлекла внимание модифицированная система стадирования нейробластомы, разработанная JNSS [Brodeur et al., 1988]. Предложенная в 1987 г. Международным противораковым союзом классификация TNM
была в 1997 г. исключена из нового издания этой классификации из-за неодинакового подхода к указанной опухоли различными исследовательскими группами. Интересная и простая
классификация опубликована С. Hurvits в 1995 г.
Необходимо отметить, что в настоящее время большинство
исследователей придерживаются классификации Brodeur и со-
332
авт. (1988), полагая, что единый подход к определению стадии
заболевания позволит осуществлять корректный анализ результатов лечения детей с нейробластомой, проводимого в различных лечебных центрах.
Международная классификация стадий нейробластомы
[Brodeur et al., 1988]
Стадия
Характеристика стадии
I
Локализованная опухоль, находящаяся в области первоначального развития; новообразование полностью удалено с (или без) микроскопических признаков его остатков; макроскопически подтвержденное отсутствие поражения лимфатических узлов по обе стороны позвоночника
IIA
Односторонняя опухоль с удалением большей ее части;
микроскопически — поражения лимфатических узлов
нет с обеих сторон
ив
Односторонняя опухоль, удаленная полностью или большая ее часть; микроскопически — имеется поражение
односторонних лимфатических узлов
III
Опухоль распространяется на противоположную сторону
с (или без) метастатического поражения регионарных
лимфатических узлов; односторонняя опухоль с метастазами в противолежащих лимфатических узлах; срединная опухоль с метастазами в лимфатических узлах с
обеих сторон
IV
Диссеминированная опухоль с метастазами в отдаленных
лимфатических узлах, костях скелета, легких и других
органах
IVS
Локализованная первичная опухоль, определяется в стадии I и II с метастазами в печень, кожу и/или костный
мозг
Классификация стадийности нейробластомы [Hurvits С., 1995]
Стадия
Распространенность заболевания
I
Локализованная опухоль, хирургически полностью удалена
п
Регионарное заболевание, одностороннее
ш
Опухоль распространяется за среднюю линию
IV
Генерализованное заболевание
rvs
Опухоль I или II стадии с метастазами в печень, кожу
и/или костный мозг без радиографических признаков
поражения костей у очень маленьких детей
Патоморфологическая классификация. Неоплазмы развиваются из симпатических ганглиев. Различают три типа опухолей,
отличающихся друг от друга степенью дифференциации.
333
Ганглионеврома состоит из зрелых ганглионарных клеток и
относится по своей природе к доброкачественным опухолям.
Она часто обызвествляется. Kemshead и соавт. (1985) полагают,
что все ганглионевромы — это зрелые нейробластомы. В литературе описаны случаи спонтанного или лечебного созревания
нейробластомы до ганглионевромы.
Ганглионейробластома — это промежуточная форма неоплазмы, лежащая между ганглионевромой и нейробластомой.
Зрелые ганглионарные клетки и недифференцированные нейробластомы встречаются в различных отделах опухоли в разных
пропорциях.
Нейробластома является недифференцированной формой
неоплазмы, состоящей из мелких круглых клеток с темно-пятнистыми ядрами. Часто могут встречаться розетки и характерные нейрофибриллы. В опухоли обнаруживаются геморрагии и
участки кальцификации.
Прогностические факторы
Эти показатели получены в результате выявления достоверной связи между продолжительностью жизни больных после
лечения с возрастом, стадией и биологическими параметрами
опухоли. Используя многофакторный анализ, исследователи
определили, что комбинация таких признаков, как возраст, стадия, уровень сывороточного ферритина и морфологического
строения нейробластом, позволяет выделить три группы детей
с различным прогнозом (табл. 14.1).
Табли ца 14.1. Прогностические факторы, влияющие на течение
нейробластомы
Факторы
Прогноз
благоприятный
промежуточный
неблагоприятный
Возраст (годы)
<1
1-2
>2
Стадия (INSS)
I, На, IVS
Нб, некоторые
III
Некоторые III,
IV
Первичная
локализация
Средостение
Таз, шея
Ретроперито-
неально
Г истологическое
Ганглионейро¬
Дифференциро¬
Недифферен¬
строение
бластома
ванная нейробластома
цированная
нейробластома
Уровни
ферритина
Норма
—
Повышенный
Уровни NSE
(пд-мл)
<20
20-100
>100
Плоидность
Гипердиплоид
—
Диплоид
Хромосомы I
Норма
—
Нарушение
334
• благоприятную, в которой более 80 % больных живут более 2 лет;
• промежуточную;
• неблагоприятную, в которой только около 20 % детей наблюдаются 2 года.
Возраст при установлении заболевания является единственным важным прогностическим фактором. Так, у детей до 1 года
течение заболевания всегда благоприятное. Далее значимыми
признаками, влияющими на прогноз, являются стадия и первичная локализация нейробластомы.
Прогноз у больных со стадией I и IVS, определенной согласно Международной классификации INSS, значительно более
благоприятный по сравнению с детьми, имеющими другие стадии заболевания. Так, при I и IVS стадиях нейробластомы более
5 лет живут соответственно 90 % и более 80 % детей после лечения, в то время как при стадиях ИА и В, III и IV этот показатель равняется 70—80, 40—70 и 60 % в возрасте до 1 года,
20 % в возрасте более 1 года и 10 % — в возрасте 2 и более лет.
При этом хотелось бы отметить, что 80 % детей поступают в
специализированную клинику в III—IV стадии заболевания.
Ретроперитонеальная и, в частности, нейробластома надпочечника дает худший прогноз, а опухоль, локализующаяся в
средостении — наилучший по сравнению с другими локализациями новообразования. Морфологические признаки дифференциации в первичной опухоли являются прогностически благоприятным фактором, так же как и бластомы гипердиплоидного типа.
Принципы лечения больных нейробластомой. Несмотря на то
что нейробластома интенсивно изучается клиницистами и экспериментаторами уже более 100 лет, лечение этого заболевания
остается важной проблемой детской онкологии. Выбор стратегии лечения по крайней мере зависит от двух факторов:
— прогностических признаков, выявленных у детей во время
установления диагноза заболевания;
— реакции опухоли на лечение.
Отвечая на эти вопросы, химиотерапевт, хирург и радиолог
могут определить рациональную тактику лечения ребенка с
нейробластомой, которая должна быть интенсивной в случае
наличия отрицательных прогностических признаков у больного
и менее агрессивной — при хорошем прогнозе. К сожалению,
нейробластома до настоящего времени остается плохо предсказуемой опухолью.
Химиотерапия. Ninane (1992) приводит следующие схемы противоопухолевого лекарственного лечения детей с нейробластомой (табл. 14.2).
При монохимиотерапии больных с нейробластомой, проводившейся обычными дозами, значимо эффективными оказа-
335
Таблица 14.2. Химиотерапия больных с нейробластомой
Препарат
Конвенциальная
химиотерапия, схемы
Высокодозные режимы
с пересадкой костного
мозга, схемы
1
2
3
4
5
1
2
3
4
Винкристин
+
+
+
+
+
—
—
+
—
Циклофосфамид
+
—
+
+
+
—
—
—
—
Доксорубицин
—
—
+
—
+
—
—
—
+
Цисплатин
—
—
+
+
+
—
—
—
+
Мелфалан
—
—
—
—
—
+
+
+
+
VM-26/VP-16
+
+
—
+
+
—
+
—
+
Карбоплатин
+
BCNU
лись 7 препаратов — винкристин, циклофосфамид, цисплатин,
доксорубицин, вепезид (VP-16), тенипозид (VM-26) и мелфа-
лан. Позднее была показана противоопухолевая активность
ифосфамида и карбоплатина при нейробластоме.
До 1980 г. ряд химиотерапевтических режимов состоял из
винкристина и циклофосфамида с адриамицином или без него.
Результаты лечения с использованием этих схем оказались разочаровывающими для детей старше 1 года с местнораспространенной опухолью, так как 2 года переживали только 10 % детей. Добавление цисплатина, вепезида и тенипозида привело к
повышению начального противоопухолевого эффекта, но мало
сказалось на отдаленных результатах.
В последние годы для повышения результатов химиотерапии
были предложены высокодозные схемы лечения с пересадкой
костного мозга [Ninane, 1992]. Некоторые результаты их использования приведены в табл. 14.3.
Анализируя данные, приведенные в табл. 14.3, можно отметить следующее.
1. Использование высоких доз мелфалана в виде единственного препарата позволяло получить результаты, по своему эффекту мало отличающиеся от результатов, которые наблюдались после интенсивной полихимиотерапии или комбинации
ее с тотальным облучением.
2. Смертность из-за токсичности проводимого лечения была
наименьшей в группе больных, которым вводили только высокие дозы мелфалана.
Необходимо отметить, что указанное лечение проводилось в
виде консолидирующей терапии у детей с распространенными
формами заболевания. Было показано, что больные с полной
или значительной регрессией опухоли после начальной химио-
336
Таблица 14.3. Результаты высокодозной химиотерапии с пересадкой
костного мозга детей с нейробластомами
Показатель
Кооперированные исследования (авторы)
Pritchard et al.
(1986)
Philip et al.
(1987)
Martmann
et al. (1985)
Ditngio с( ill,
(1985)
Число детей
30
37
26
47
Стадия
III—IV
IV
III—IV
IV
Статус
Полная и
Полная и
To же + час¬
То же
опухоли
значительная
значительная
тичная рег¬
регрессия
регрессия
рессия
Рандомизи-
Да
Нет
Нет
Нет
рованное ис-
следование
Интенсивная
Высокие
Тотальное
Высокие
Тотальное
химиотера¬
дозы мелфа-
облучение,
дозы мелфа-
облучение +
пия
лана
винкристин
лана (15) то
+ высокие
и высокие
же + кармус-
дозы мелфа-
дозы мелфа-
тин и тени-
лана
лана
позид
Костный
Транспла¬
35-аутоло-
Транспланта¬
26-аутоло-
мозг
нтация
гичный;
ция аллоген¬
гичный;
(пересадка)
аутологично¬
2-
ного и ауто¬
21-аллоген¬
го костного
аллогенный
логичного
ный
мозга
костный
костного
мозг
мозга
Число боль¬
54%
44 %
?
25 %
ных, пере¬
живших
2 года
Смерть из-за
2
7
3
15
токсичности
лечения
терапии имели лучшие показатели 2-летней продолжительности жизни по сравнению с теми, у которых опухоль мало реагировала на начальное лечение.
Интересные данные о многолетнем наблюдении за больными
с нейробластомой, подвергшимися интенсивной химиотерапии,
были представлены Philip и соавт. (1990) и Dini и соавт. (1990).
Первые исследователи наблюдали (в среднем 55 мес) 62
больных с нейробластомой IV стадии, возраст которых был более 1 года. Дети всей группы получали интенсивную консолидирующую химиотерапию с пересадкой костного мозга. Два года
без прогрессирования заболевания прожили 40 % детей, 5 лет —
25 % и 13 % — 7 лет. Однако в группе больных с полной регрессией метастазов 2 и 7 лет прожили 37 % детей. Dini и соавт.
337
(1990) привели данные о 34 больных с IV стадией и рецидивами
нейробластомы в возрасте старше 1 года. После интенсивной
консолидирующей химиотерапии с пересадкой костного мозга
4 года без прогрессирования заболевания прожили 29 % больных.
Оперативное лечение. Оперативное лечение широко
используется для радикального удаления ограниченной первичной опухоли. Кроме того, в последние годы оперативному
вмешательству подвергаются больные с местнораспространенными или метастатическими нейробластомами. После начальной химиотерапии нередко возникает возможность радикального удаления первичной опухоли и метастазов вследствие их
значительной регрессии. В ряде случаев прибегают и к повторным оперативным вмешательствам, если первичная операция
оказалась нерадикальной, но затем опухоль уменьшилась после
проведения дополнительной химиотерапии.
Лучевая терапия. В настоящее время в связи с прогрессивным развитием противоопухолевой лекарственной терапии
роль традиционного лучевого лечения больных с нейробластомой уменьшилась. Это связано еще и с тем, что эта опухоль в
основном поражает маленьких детей, облучение которых несет
опасность отдаленных лучевых повреждений.
Все же в некоторых клинических ситуациях имеются показания к ее применению. Во-первых, лучевое лечение может
быть проведено при нерадикальном оперативном удалении
первичной опухоли и малой эффективности химиотерапии, во-
вторых, при наличии местнораспространенной неоперабельной
первичной или метастатической опухоли, не реагирующей на
современные курсы химиотерапии.
Величина дозы излучения прежде всего зависит от возраста
ребенка и величины остаточной опухоли. По мнению ТегеЬ,
TefFt, при облучении ребенка до 1 года адекватной дозой могут
быть 10 Гр, подведенных в течение 2 нед (по 1 Гр за фракцию).
Jacobson (1984), поддерживая эту точку зрения, рекомендует дозу в 12 Гр за 2 нед.
У детей более старшего возраста суммарная доза ионизирующего излучения на опухоль должна быть увеличена. Например,
у детей от 1 года до 2 лет — до 15 Гр за 2 нед (по 1,5 Гр ежедневно 5 раз в неделю). В возрасте старше 3 лет доза может достигать 30—45 Гр при разовой очаговой дозе от 1,5 до 2 Гр 5 раз
в неделю [Jacobson, 1984; Scognamillo, 1987, и др.].
Нередко после подведения указанных доз опухоль либо полностью регрессирует, либо значительно уменьшается в размерах. В последнем случае становится возможным оперативное
удаление остатков нейробластомы. Симптоматический эффект
может быть достигнут после однократного облучения в дозе
5 Гр, но в случаях относительно удовлетворительного состояния ребенка лучше использовать курс облучения с разовой дозой 3 Гр, подводимых за 5 фракций.
338
При лучевом лечении необходимо захватывать всю опухоль
или ее ложе с 2 см прилежащих тканей.
Полагаем, что вопрос о применении лучевой терапии больных
с нейробластомой должен решаться в каждом случае индивидуально. При этом необходимо учитывать возможный непосредственный эффект на растущую опухоль. Например, даже при больших нерезектабельных опухолях бывает достаточно подвести дозу излучения в 10—15 Гр за 2—3 нед (1 Гр ежедневно), чтобы
добиться эффекта за счет спонтанного их созревания.
Методика мегавольтного облучения больных с нейробластомой определяется прежде всего локализацией опухолевого процесса, размерами и распространенностью новообразования.
Практически большинство нейробластом находится в брюшной и
грудной полостях. Это диктует необходимость использования в
основном двухпольного облучения — двух встречных противолежащих полей.
При опухолях заднего средостения с использованием фотонов или электронов в зону облучения необходимо включать всю
опухолевую массу и грудные позвонки на всю их ширину для
предупреждения деформации позвоночника. По достижении
верхнего предела лучевой толерантности спинного мозга необходима его защита. При этом нужно помнить, что толерантность его меняется с возрастом. Также необходима тщательная
защита плечевых суставов. При нейробластомах в настоящее
время облучение всей брюшной полости используется редко,
так как у больных с III стадией заболевания обычно применяют
агрессивную полихимиотерапию.
При облучении тазовой области пристальное внимание
уделяется защите тазобедренных суставов. У девочек необходимо по возможности выводить из зоны действия прямого
пучка ионизирующего излучения яичники путем оперативного
их перемещения. Последнее предохраняет ребенка от стерилизации и сохраняет его гормональную функцию [Gaetini et al.,
1988].
В последние годы для лечения детей с нейробластомой предлагается использовать внутреннее облучение с помощью метай-
одобензилгванидина (mJBG), меченного радиоактивным 1311,
который избирательно накапливается в нейробластоме. Опубликованы первые результаты такого вида лучевой терапии. Было показано, что 50 % больных с ГУ стадией заболевания и хи-
миорезистентной формой опухоли положительно отреагировали на введение mJBG (131I) [Ninane, 1992]. Mastrangelo и соавт.
(1989) привели данные о 10-месячном ребенке с нейробластомой III стадии, который жив без признаков болезни 18 мес после установления диагноза и лечился только с помощью внутреннего облучения.
339
Некоторые схемы лечения детей с нейробластомой в зависимости от стадии заболевания.
Стадия I. Выполнение радикального оперативного удаления опухоли бывает достаточным для излечения больного.
Тем не менее эти дети нуждаются в динамическом наблюдении,
так как возможны рецидивы заболевания или отдаленные метастазы.
Стадия ИА. При этой стадии нейробластомы излечения
больного, так же как и при I стадии, можно достичь с помощью
оперативного удаления опухоли.
Два исследования показали, что без признаков рецидива
прошли 100 % детей, как получавших послеоперационное лечение, так и не получавших его [Ninane et al., 1982; Hayes et al.,
1983]. Исключение составила "гантелеподобная" форма паравертебральной нейробластомы, при которой необходимо проведение адекватного химиолучевого лечения.
Стадия НВ. При этой стадии заболевания лечение должно начинаться с химиотерапии с последующим оперативным
вмешательством. Трудно однозначно сказать, есть ли необходимость ее применения у детей до 6 мес, так как течение заболевания в этом возрасте достоверно благоприятно.
Стадия III (опухоль нерезектабельна) истадияГ/. Лечение детей с этими стадиями заболевания — весьма трудная задача, и решается она в основном, исходя из опыта конкретного
специализированного отделения детской онкологии. Однако
можно указать на два основных принципа к подходу терапии.
1. Необходима агрессивная тактика хирургического лечения
при III стадии заболевания.
2. Дети с IV стадией в возрасте старше 1 года нуждаются в
интенсивной высокодозной химиотерапии с пересадкой костного мозга.
Стадия IVS. В основном при этой стадии заболевания
проводится химиотерапия (несколько курсов циклофосфамида
и винкристина) до и после оперативного вмешательства, выполняемого для удаления первичной опухоли.
Глава 15 I ОПУХОЛИ МЯГКИХ ТКАНЕЙ
Злокачественные опухоли мягких тканей достаточно часто
встречаются у детей. В структуре злокачественных новообразований саркомы мягких тканей занимают 4-е место, уступая гемобластозам, опухолям ЦНС и новообразованиям забрюшин-
ной области. Они составляют 8 % от общего числа злокачественных новообразований детского возраста. У новорожденных
и детей моложе 1 года этот вид опухолей наблюдается примерно
в 12 % случаев.
Существующие в настоящее время гистологические классификации злокачественных опухолей мягких тканей различаются между собой прежде всего потому, что отсутствует единое
мнение о том, какие тканевые образования включать в понятие
"мягкие ткани”.
Под мягкими тканями головы, шеи, туловища и конечностей следует понимать все анатомические образования, располагающиеся между костями скелета и кожей.
Согласно определению ВОЗ, "мягкими тканями обозначаются все неэпителиальные внескелетные ткани, за исключением ретикулоэндотелиальной системы, глии и тканей, поддерживающих специфические органы и внутренности".
К ним также относят, по мнению А. В. Смольянникова,
нейроэктодермальные ткани периферической и автономной
(вегетативной) нервной системы, параганглии. Мягкие ткани
возникают из производных мезодермы, миотома, части энтодермы, образующих мезенхиму, поперечнополосатые мышцы и
производные нейроэктодермы.
По мнению А. И. Ракова и Е. А. Чехариной, так называемые
мягкие ткани представляют собой неравномерное по объему
сочетание совершенно разнородных по своему происхождению, структуре и функции тканевых компонентов, обладающих
различными бластоматозными потенциями. Поэтому искусственное объединение возникающих из них новообразований допустимо лишь в клинико-анатомическом смысле и принимается
весьма условно. Из входящих в состав мягких тканей элементов
следует иметь в виду различные производные мезенхимы, поперечнополосатую мускулатуру и оболочки периферических нервов. Поэтому уже a priori следует допустить возможность развития из них разнообразных опухолей, обусловленную различием исходных тканевых структур. Следует отрицать включение
в понятие мягкие ткани кожи с ее дериватами и лимфатических
узлов, считая это ошибкой в гистогенетическом отношении. Те
же авторы возражают против отнесения некоторыми исследователями в группу мягких тканей новообразований забрюшин-
ного пространства и внутренних органов.
341
Между тем мнение подавляющего большинства авторов на
природу сарком мягких тканей у детей единодушно: практически все новообразования мягких тканей у детей мезенхимального происхождения.
Ниже приведена гистологическая классификация опухолей
мягких тканей, опубликованная центром ВОЗ в 1969 г. (табл.
15.1).
Опухоли мягких тканей представляют значительные трудности для морфологической верификации, определения гистогенеза и степени злокачественности. Это может быть обусловлено
тем, что опухолевые клетки, происходящие из разных дериватов мезенхимы, приобретают большое морфологическое сходство, а высокая степень катаплазии часто приводит к тому, что
они могут полностью утратить способность построения специфических структур (например, фасциальных), по которым можно было бы судить о происхождении клеток.
Международным противораковым союзом в иллюстрированном руководстве по TNM/pTNM классификации злокачественных опухолей приводится морфологическая классификация злокачественных опухолей мягких тканей (ICD-0 С38.1,2,
С47-49).
Правилом классификации должно быть гистологическое
подтверждение диагноза, позволяющее определить гистологический тип опухоли и степень злокачественности.
В классификации использованы следующие анатомические
области.
1. Соединительная ткань, подкожная и другие мягкие ткани,
периферические нервы (С47, С49).
2. Забрюшинное пространство (С48).
3. Средостение (С38.1.2).
В раздел гистологические типы опухолей, согласно ICD-0
морфологической рубрикации, включены следующие гистоло¬
гические типы злокачественных опухолей:
Альвеолярная мягкотканная саркома 9581/3
Ангиосаркома 9120/3
Эпителиоидная саркома 8804/3
Внескелетная хондросаркома 9220/3
Внескелетная остеосаркома 9180/3
Фибросаркома 8810/3
Лейомиосаркома 8890/3
Липосаркома 8850/3
Злокачественная фиброзная гистиоцитома 8830/3
Злокачественная гемангиоперицитома 9150/3
Злокачественная мезенхимома 8990/3
Злокачественная шваннома 9560/3
Рабдомиосаркома 8900/3
Синовиальная саркома 9040/3
Саркома без дополнительной характеристики (БДХ) 8800/3
342
Таблица 15.1. Гистологическая классификация опухолей мягких
тканей (приводится с некоторыми сокращениями)
Исходная ткань
Доброкачественные опухоли
Злокачественные
опухоли
Фиброзная ткань
Твердая фиброма
Выбухающая дер-
матофибросаркома
Мягкая фиброма
Дерматофиброма (гистиоцитома, склерозирующая гемангиома)
Эластофиброма (спины)
Фиброматозы
Фибросаркома
Жировая ткань
Липома
Липосаркома,
преимущественно:
Интрамуральная (инфильтри-
хорошо диффе¬
рующая липома)
ренцированная
Гибернома
миксоидная (эмбриональная)
Миелолипома
Фетальная липома
Диффузный липоматоз
круглоклеточная
Гладкие мышцы
Лейомиома
Ангиомиома (васкулярная
миома)
Эпителиоидная лейомиома
(причудливая лейомиома,
лейомиобластома)
Лейомиосаркома
Поперечнополосатые мышцы
Рабдомиома
Рабдомиосаркома
Кровеносные
Гемангиома (доброкачествен¬
Злокачественная
сосуды
ная гемангиоэндотелиома)
гемангиоэндотелиома (гемангио-
саркома)
Капиллярная (ювенильная)
Злокачественная
ангиома
Рацемозная ангиома
Интрамускулярная ангиома
Системный гемангиоматоз
Доброкачественная гемангиоперицитома
Гломангиома
гемангиоперици¬
тома
Лимфатические
Лимфангиома: капиллярная,
Злокачественная
сосуды
кавернозная, кистозная (гиг-
лимфангиоэндо-
рома)
Лимфангиомимома
Системный лимфангиоматоз
телиома (лимфан-
гиосаркома)
Синовиальная Доброкачественная
Синовиальная
ткань
синовиома
саркома
343
В представленную классификацию не включены следующие
гистологические типы опухолей: саркома Капоши, дермато-
фибросаркома, фибросаркома высокой степени дифференци-
ровки G1 (десмоидная опухоль) и саркомы, развивающиеся из
твердой мозговой оболочки, головного мозга, паренхиматозных
и полых внутренних органов.
Существует группа сарком мягких тканей, гистогенез которых не выяснен: это светлоклеточная, альвеолярная, синовиальная, эпителиоидная, хордоидная (экстраоссальная миксоид-
ная хондросаркома) и мелкокруглоклеточная (экстраоссальная
саркома Юинга).
Е. Masliah (1986) предложил унифицированную гипотезу
гистогенеза мягкотканных сарком неясной природы. Основываясь на обычном определении гистогенеза по сходству со зрелыми нормальными или эмбриональными тканями, некоторые
исследователи пытались найти их источники развития в области сухожильно-синовиальных зон. Но ни гистологические, ни
ультраструктурные, ни иммуногистохимические методы не помогли выявить с достаточной степенью достоверности клетки-
родоначальники этих сарком. Впервые эти саркомы были объединены в общую группу под термином сухожильно-влагалищных сарком в 1977 г. Возможно, предшественником опухолей
этой группы служат дериваты эктомезенхимы, относящиеся к
сухожилиям, апоневрозам, синовиям и менискам, называемые
хондроидной тканью или псевдохрящом, способным к плюро-
потентной трансформации в микроскопически нефункциональной ткани или опухоли. Подобные филогенетические остатки описаны у позвоночных, как и опухоли из них. Возможно, что эти саркомы происходят из полигенетически зрелых
остатков, а не являются продуктом реактивации эмбриологических зачатков, как предполагает концепция Конгейма.
15.1. Рабдомиосаркома
Из различных морфологических вариантов сарком мягких
тканей наиболее часто встречается рабдомиосаркома (РМС), на
долю которой приходится, по единодушному мнению многочисленных авторов, около половины сарком мягких тканей у детей.
По данным НИИ детской онкологии и гематологии РОНЦ
им. Н. Н. Блохина РАМН (НИИ ДО), РМС занимает около
38 % сарком мягких тканей у детей, реже встречаются ангио-
генные злокачественные опухоли (около 22 %) и синовиальные
(19 %). Остальные виды новообразований мягких тканей, такие, как лейомиосаркома, фибросаркома, липосаркома и др.,
диагностируются значительно реже.
Рабдомиосаркома развивается из поперечнополосатой мускулатуры или эмбриональных зачатков мышечной ткани. Она
344
состоит из миобластов, находящихся на разных этапах клеточной дифференцировки, в цитоплазме которых обнаруживаются
миофибриллы.
Вопросам гистогенеза и эмбриогенеза РМС посвящено определенное количество исследовательских работ. Проблема происхождения этого вида опухоли детально изучалась Ю. Б. Вахтиным и И. Н. Швембергом. Авторы считают, что существует
три основные теории происхождения РМС, дающие рациональное объяснение постоянному обнаружению в подобных
опухолях не только клеток миогенного типа, в различной степени проявляющих способность к цитодифференцировке, но и
клеток соединительнотканного типа, синтезирующих коллаген
и другие свойственные соединительной ткани белки, а также
клеток, имеющих ярко выраженное морфологическое сходство
с клетками эмбриональной мезенхимы.
По мнению Ю. Б. Вахтина и И. Н. Швемберга, с точки зрения теории дизонтогенетического происхождения РМС смешанный характер опухолей скелетных мышц обусловлен малиг-
низацией эмбриональных остатков, сохранивших плюропотент-
ность. По существу эта теория основывается на общеизвестных
представлениях Конгейма о развитии опухолей из эмбриональных остатков и дистопий. Однако сегодня имеются многочисленные экспериментальные факты, под давлением которых теория дизонтогенетического происхождения опухолей различных
органов и тканей оттесняется на задний план. К числу таких фактов нужно отнести прежде всего успешную индукцию у взрослых
животных опухолей, развитие которых связывалось исключительно с малигнизацией дремлющих эмбриональных остатков.
Хотя в настоящее время нет оснований считать, что большинство
РМС имеет дизонтогенетическое происхождение, для отдельных
видов опухолей, в состав которых входят клеточные или синцитиальные структуры, свойственные скелетным мышцам, отрицать возможность подобного происхождения довольно трудно. Это прежде всего относится к эктопическим РМС и к участкам РМС, обнаруживаемых в тератоидных опухолях.
Говоря об эмбриональном происхождении эктопических
РМС, можно с известной долей вероятности в качестве источников развития поперечнополосатых мышечных волокон,
встречающихся в таких опухолях, назвать следующие эмбриональные клеточные элементы: дистопические клетки миотомов,
мезенхимные клетки, детерминированные в направлении развития скелетных мышц, омнипотентные клетки герминативного
зачатка, нефрогенные, а возможно также, нейроэктодермальные клеточные элементы. Во всех этих случаях предполагается,
что источником развития эктопических РМС являются клетки,
обособившиеся от участия в нормальном онтогенезе на одной
из стадий эмбрионального развития, но до достижения ими
зрелого, дифференцированного состояния. Принято считать,
345
что эктопические PMC возникают из отщепившихся зачатков
мышечной ткани и являются дизонтогенетическими новообразованиями — гамартобластомами поперечной мышечной ткани.
РМС в скелетных мышцах развиваются из клеточных элементов самой мышечной ткани — миобластов, соединительнотканных клеток и клеток мезенхимного типа, сохранившихся в
эндомизии и адвентиции сосудов.
Морфологическая характеристика РМС впервые была представлена R. С. Нот, Н. Т. Enterline в 1958 г. и стала основой для
выделения вариантов рабдомиосарком в Международной классификации опухолей мягких тканей у детей (ВОЗ, Женева, 1969).
Как было изложено выше, в Международной классификации опухолей мягких тканей ВОЗ выделяют 4 типа РМС: эмбриональный (включая ботриоидный), альвеолярный, плеоморфный и смешанный. В последние годы в литературе стали
выделять еще два других типа РМС: юингоподобный и недифференцированную мезенхимальную саркому.
Эмбриональная рабдомиосаркома может встречаться в участках, где нет поперечнополосатых мышц; она, вероятно, связана с дисэмбриоплазиями и является наиболее распространенным типом опухоли в детском возрасте. Среди эмбриональных РМС выделяют миксоидный, круглоклеточный и
пучковый варианты опухоли, что зависит от преобладания тех
или иных клеток и волокон в анализируемых микроскопических участках.
Альвеолярная рабдомиосаркома характеризуется
наличием псевдожелезистых и псевдоальвеолярных структур,
возникающих в связи с наличием в опухоли соединительнотканных прослоек, которые окаймлены опухолевыми клетками.
Плеоморфная рабдомиосаркома имеет наиболее
пестрый вид: мелкие, округлые, овальные или веретенообразные клетки в различных соотношениях с гигантскими многоядерными элементами.
По данным литературы, наблюдается следующая частота
различных вариантов РМС: эмбриональный (включая ботриоидный) — 70 %, альвеолярный — 16 %, юингоподобный — 7 %,
недифференцированная мезенхиальная саркома — 6 %, плеоморфный тип — 1 % случаев.
По данным НИИ ДОГ, выявлены различные типы РМС: эмбриональный (включая ботриоидный) — 73 %, альвеолярный —
9.3 %, смешанный — 2 %, юингоподобный вариант — 1,4 %. У
14.3 % детей вариант опухоли уточнить не удается. Таким образом, у детей наиболее частым является эмбриональный вариант РМС.
В настоящее время все больший интерес вызывает роль генетических исследований в проблеме сарком мягких тканей.
Это касается прежде всего вопросов происхождения данного
вида новообразований. Так, С. S. Cooper, М. Straffon (1991)
346
представили данные о наследственной предрасположенности к
некоторым опухолям мягких тканей, как доброкачественым,
так и злокачественным: липомам, лейомиоматозам, фиброма-
тозам, рабдомиосаркоме и ряду других новообразований. Анализ цитогенетических данных, полученных при изучении опухолей мягких тканей, позволил вьмвить специфические перестройки хромосом, характерные для определенных типов
опухолей мягких тканей.
Кроме того, было уделено пристальное внимание амплификации генов, опухолевым супрессорным генам при развитии
новообразований мягких тканей.
Различные в гистогенетическом отношении саркомы мягких
тканей имеют свои излюбленные локализации. Так, РМС чаще
поражают область головы и шеи и мочеполовую систему, в то
время как синовиальные саркомы и фибросаркомы чаще локализуются в области туловища и конечностей.
Установлена различная частота рабдомиосарком мягких тканей в зависимости от их локализации. По мнению большинства
авторов, чаще всего (от 40 до 50 %) РМС локализуются в области головы и шеи, при этом наиболее часто поражаются орбита и ЛОР-органы. РМС орбиты составляет, по данным различных исследователей, от 9 до 37 % случаев. Заболеваемость
РМС ЛОР-органов варьирует от 40 до 60 % среди других злокачественных новообразований этой локализации. В области
туловища и конечностей РМС наблюдается в 25—37 % случаев,
причем нижние конечности поражаются в 2,6 раза чаще, чем
верхние.
Частота поражения различных частей тела при РМС, по данным НИИ ДОГ, представлена ниже.
Частота поражений различных частей тела
при рабдомиосаркоме у детей
Локализация
Частота поражения, %
Голова и шея
35
Конечности
25
Мочеполовая система
20
Туловище
10
Другие локализации
10
Следует отметить, что в зависимости от локализации первичной злокачественной опухоли различают две прогностические группы:
1-я группа — с благоприятной локализацией: орбита, пара-
тестикулярная зона, поверхностные области головы и шеи, влагалище, вульва, матка;
347
2-я группа — с неблагоприятной локализацией: туловище,
конечности, мочевой пузырь, простата, забрю-
шинная область, брюшная и грудная полости,
глубоко расположенные опухоли головы и шеи.
Рабдомиосаркомы диагностируются чаще (80 %) у детей до
5 лет, приблизительно одинаково часто у мальчиков и девочек,
в то время как синовиальные саркомы и фибросаркомы чаще
встречаются у детей в возрасте от 5 до 14 лет.
Клиническая картина. Клинические проявления рабдомиосаркомы у детей определяют главным образом локализацией
процесса и стадией заболевания. Одним из самых ранних симптомов болезни, а иногда и первым случайно обнаруженным
симптомом заболевания является опухоль. Однако, помимо местной симптоматики, практически у всех детей имеется общая
симптоматика — так называемый общий опухолевый
симптомокомплекс, развивающийся независимо от локализации новообразования.
В процессе роста опухоль вызывает компрессию той области,
где она расположена. Так, забрюшинные новообразования больших размеров нередко сдавливают нижнюю полую вену, что
приводит к появлению пастозности в области передней брюшной стенки и образованию выраженной подкожной венозной
сети на поверхности живота. При локализации опухоли в области грудной полости нередко наблюдается сдавление органов
средостения, что вызывает нарушение функции внешнего дыхания. При компрессии мочевыводящих путей отмечаются дизури-
ческие явления, азотемия. Бурно растущая первичная или метастатическая опухоль, инфильтрируя окружающие органы и ткани, вызывает появление местных симптомов, а иногда приводит
и к тяжелым, жизненно опасным осложнениям — разрыву опухоли, сопровождающемуся перитонитом, кровотечением, и т. д.
Наиболее важными симптомами опухолевого симптомоком-
плекса у детей являются вялость, снижение аппетита и массы
тела.
Вялость при далеко зашедшем процессе, переходящая в
адинамию, развивается достаточно быстро, уже на ранних стадиях злокачественного процесса. Синдром гиподинамии охватывает не только эмоциональную сферу, но и мышечную систему, которая утрачивает силу и двигательную активность как
за счет снижения мышечной массы, так и за счет потери калия.
Мышцы при общей адаптационной реакции одними из первых
подвергаются катаболизму, используя аминокислоты в межорганном обмене с целью поддержания функционального и морфологического гомеостаза мозга, печени, почек, миокарда, костного мозга и других органов, имеющих первостепенное значение для жизнедеятельности.
Снижение аппетита, в той или иной степени выраженное у всех детей, больных злокачественными опухолями,
348
входит в противоречие с повышенными запросами детского организма в средствах энергообеспечения. По данным литературы, гипорексия и анорексия возникают в результате торможения активности так называемого "центра аппетита" в гипоталамусе под влиянием определенных соединений, выделяемых
опухолевой клеткой в процессе ее метаболизма. Выраженная
анорексия при И—III стадии процесса наблюдается у 8—10 %
больных.
Снижение массы тела представляет собой закономерное следствие метаболических процессов в результате системного воздействия злокачественного новообразования. Взвешивание детей не всегда отражает действительную динамику изменения массы тела, так как результат взвешивания почти
всегда искажается массой самого новообразования. В большей
степени объективными критериями снижения трофики являются постепенная атрофия мышечной системы, истончение кожи и подкожно-жирового слоя, потеря тургора кожи.
Однако именно знание общего опухолевого симптомоком-
плекса в его разнообразных проявлениях позволяет улучшить
результаты ранней диагностики злокачественных опухолей у
детей в тех случаях, когда при первичном осмотре больного врачу не удается распознать новообразование с помощью обычных
клинических методов обследования. Иными словами, появление симптомов опухолевого симптомокомплекса (или опухолевого синдрома) заставляет врача подумать о наличии у больного
злокачественного новообразования, даже если клинически опухоль и не визуализируется.
Клиническая картина рабдомиосаркомы у детей определяется
главным образом локализацией процесса и стадией заболевания.
Рабдомиосаркома туловища и конечностей. Туловище и конечности являются достаточно частой локализацией РМС и, по
данным НИИ ДОГ, могут конкурировать с частотой этого вида
опухоли в области головы и шеи (по 35 %), хотя, по данным некоторых авторов, наиболее часто поражаются органы мочеполовой системы (51,4 %). При анализе причин запущенности
процесса при саркомах мягких тканей, проведенном в НИИ
ДОГ, было установлено, что подавляющее большинство ошибок были врачебными (85 %).
Следует подчеркнуть, что РМС туловища и конечностей относится к группе новообразований с прогностически неблагоприятным течением, особенно если речь идет о распространенных формах заболевания — III—IV стадии.
Первым и важнейшим признаком заболевания является наличие опухоли, которая при наружном осмотре определяется
как объемистая, чаще односторонняя припухлость округлой или
овальной формы. Образование располагается в толще мышц,
имеет нередко четкие границы, хотя на самом деле границы
опухоли чаще только кажутся четкими, создавая впечатление
349
инкапсулированное™. Но в основном вследствие обширной
инфильтрации окружающих тканей границы новообразования
представляются расплывчатыми, нечеткими, поддаются лишь
приблизительному определению. При попытке смещения новообразования отмечается, что опухоль легче сдвигается в поперечном направлении, в обе стороны. В продольном направлении новообразование практически не смещается. Если опухолевый узел располагается глубоко, то он может врастать в
предлежащую кость, и тогда он становится совершенно неподвижным.
Поверхность опухоли пальпаторно чаще определяется как
гладкая, но она может быть и бугристой. В этом смысле имеет
значение глубина расположения опухоли: при глубоко расположенных новообразованиях поверхность опухолевых узлов
выглядит, как правило, гладкой; поверхностные узлы определяются как бугристые.
Кожа над опухолью в большинстве случаев бывает неизмененной. Когда опухоль достигнет больших размеров, кожа над новообразованием может истончаться, приобретать багрово-синюшный оттенок. Наконец, может наступить момент, когда опухоль прорастает кожу и выходит на ее поверхность в виде
опухолевых масс, иногда с изъязвлением, нередко кровоточащих.
Опухоль чаще бывает безболезненной и не вызывает каких-
либо серьезных нарушений, особенно в начальных стадиях заболевания. По мере роста новообразования или при расположении опухоли в дистальных отделах конечностей появляются
болезненные ощущения, которые могут нарастать с ростом образования, что связано со сдавлением или прорастанием нервных стволов. Обычно незначительная болезненность определяется при пальпации опухоли, иногда над новообразованием при
пальпации определяется зона гиперестезии кожи. При прорастании опухоли в близлежащую кость или оболочки суставов появляется стойкая местная болезненность.
Температура над опухолью обычно незначительно повышена, что более четко определяется при сравнительной пальпации
симметричных участков конечностей или туловища. Измерение
температуры новообразования является важным диагностическим признаком активности злокачественного процесса и является обязательным в звене диагностических мероприятий.
Консистенция опухолевых узлов при рабдомиосаркоме бывает
обычно плотной или плотноэластической; иногда при больших
опухолях вследствие образования зон распада могут прощупываться участки флюктуации, которые нередко ошибочно принимаются врачами за гнойно-воспалительный процесс, что
приводит в дальнейшем к неоправданным хирургическим действиям (вскрытие и дренирование "абсцесса").
Рабдомиосаркомы области головы и шеи наряду с симптомами, изложенными выше, могут иметь некоторые признаки, спе¬
350
цифичные для данной локализации опухоли. При локализации
опухоли в области орбиты наблюдается припухлость, которая
определяется уже на ранних стадиях опухолевого процесса. Одновременно с припухлостью появляется экзофтальм, который
нередко обнаруживается как первый симптом заболевания,
причем чаще экзофтальм замечают родители ребенка, что является основанием для первичного обращения к врачу. По мере
роста новообразования оно может постепенно заполнить полость
орбиты, прорастать в глазное яблоко, вызывая вначале снижение, а потом и полную потерю зрения ребенка.
При локализации рабдомиосаркомы в области носоглотки,
полости носа, околоносовых пазух и крылонебной ямки одним из
первых симптомов является нарушение носового дыхания, сопровождающееся обычно слизисто-гнойным отделяемым с неприятным и даже зловонным запахом. У таких больных часто
ощущается неприятный запах изо рта. Вследствие обтурации
носовой полости появляется "гнусавость" голоса. Боли у детей
возникают в случаях поражения костей, или при заполнении
опухолью гайморовых верхнечелюстных (гайморовых) пазух,
или при прорастании новообразования в полость черепа через
клетки решетчатого лабиринта. Тогда же возможно появление
симптомов внутричерепной гипертензии. Рабдомиосаркому
носоглотки часто сопровождает серозный отит с соответствующей клинической симптоматикой.
При локализации опухоли в области среднего уха или сосцевидного отростка одними из первых проявлений заболевания
являются боли в ухе, которые могут быть весьма интенсивными. При увеличении размеров новообразования оно может обтурировать слуховой проход, приводя к потере слуха. Экзофитный рост опухоли вскоре выявляется при визуальном осмотре:
опухоль становится видна из наружного слухового хода. Рост
рабдомиосаркомы сопровождается появлением припухлости в
заушной области. Иногда наблюдается паралич лицевого нерва.
В процессе роста образования появляются выделения из слухового прохода, слизисто-гнойные, с неприятным гнилостным
запахом, сопровождающим распад опухоли.
При локализации новообразования в области языка, ротоглотки, гортани у больного рано появляются симптомы, связанные с нарушением глотания, что приводит к затруднению
приема пищи; при росте опухоли нарушается дыхательная функция. Особенности кровоснабжения указанных зон приводят к
ранней и бурной диссеминации патологического процесса —
появлению метастазов.
Рабдомиосаркома влагалища чаще встречается у девочек
младшего возраста (до 5 лет). На начальных стадиях заболевание имеет симптомы, которые трактуются как вульвит, вагинит,
остроконечные кондиломы, полипы. Чаще всего первыми симптомами болезни являются выделения из половых путей раз¬
351
личного характера (белесоватые, желтоватого цвета, с примесью гноя, иногда с неприятным запахом, кровянистые). По мере роста опухоли и обтурации уретры появляются симптомы
затрудненного мочеиспускания, дизурические явления. Больных беспокоит зуд в области влагалища, позднее присоединяются боли в области наружных половых органов. При осмотре
наружных половых органов родители ребенка иногда обнаруживают новообразование розового или красного цвета, иногда
множественные, чаще небольших размеров, заставляющие обратиться к врачу.
Рабдомиосаркома мочевого пузыря является одной из самых
тяжелых в прогностическом отношении локализаций. Чаще
опухоль поражает мальчиков в возрасте до 5 лет. Новообразование в области мочевого пузыря имеет свои излюбленные локализации: шейка мочевого пузыря, область треугольника Литгля.
Особенностью рабдомиосаркомы мочевого пузыря является
локализация, недоступная визуальной оценке. Поэтому так высока "запущенность" процесса именно при этом виде опухоли.
Возникая под слизистой оболочкой, опухоль отличается быстрым экзофитным ростом с прорастанием стенки пузыря, предстательной железы, околопузырной клетчатки.
Ранними симптомами заболевания являются дизурические
явления, которые имеют тенденцию к быстрому нарастанию. У
больных появляются частые позывы к мочеиспусканию, вплоть
до императивных позывов и тенезмов без мочеиспускания или
с мочеиспусканием небольшими порциями. Вскоре возникает
гематурия, которая иногда становится профузной, с большим
количеством сгустков крови. Пиурия является следствием присоединения вторичной инфекции. При появлении пиурии отмечается нарастание дизурических явлений, мочеиспускание
становится болезненным. Наконец наступает частичная, а иногда и полная, острая задержка мочи, возникающая вследствие
обтурации опухолью области шейки мочевого пузыря, причем
даже при небольших размерах новообразования; по мере роста
его в просвет мочевого пузыря и расположение в области шейки
может наступить острая полная задержка мочи. Иногда острая
задержка мочи является первым симптомом, заставляющим родителей обратиться к врачу.
Таких детей госпитализируют в стационары в экстренном
порядке, чаще всего с подозрением на камень мочевого пузыря.
Рабдомиосаркома яичка встречается довольно редко. Новообразование чаще всего проявляется возникновением уплотнения в области ткани органа, чаще безболезненного. При этом
наблюдается одностороннее увеличение яичка. По мере роста
опухоли увеличиваются размеры яичка, которое становится
плотным. При пальпации определяется неровность контуров,
отсутствует четкость границы между новоообразованием и яичком. При выходе опухоли за пределы капсулы отмечаются ин¬
352
фильтрация окружающих тканей, отечность мошонки, области
семенного канатика, надлобковой области. Наиболее часто рабдомиосаркома яичка принимается за гидроцеле, доброкачественные образования типа гонотиды или фибромы.
Рабдомиосаркомы грудной и брюшной полостей, забрюшинно-
го пространства и малого таза встречаются значительно реже,
чем опухоли этого вида, расположенные в области головы и
шеи, туловища, конечностей и мочеполовой системы. Если при
рабдомиосаркоме туловища и конечностей на первый план выделяются местные симптомы заболевания, то при новообразованиях, расположенных в грудной и брюшной полости, забрю-
шинном пространстве и малом тазе, превалируют симптомы
общего порядка — общий опухолевый симптомокомплекс.
При локализации рабдомиосаркомы в грудной полости местные симптомы заболевания связаны с прорастанием опухоли
в окружающие ее органы и ткани или сдавлением магистральных сосудов (синдром верхней полой вены: нарастающая
одышка, акроцианоз, головокружение и т. д.).
При расположении рабдомиосаркомы в брюшной полости
или забрюшинном пространстве местные симптомы болезни
обусловлены чаще всего сдавлением магистральных сосудов
(нижняя полая вена, мезентериальные сосуды, аорта). При росте опухоли могут возникнуть симптомы частичной, а иногда и
полной непроходимости кишечника вследствие поражения кишечной трубки. При прорастании стенки кишечника возможно
появление болевого синдрома, диспепсических явлений. Из-за
присутствия примеси крови кал пациента окрашивается в темный или даже черный цвет (мелена).
Клинические классификации рабдомиосаркомы. Для оценки
степени распространенности опухолевого процесса были предложены различные клинические классификации злокачественных новообразований мягких тканей, позволяющие в конечном
итоге составить адекватный план терапии при злокачественной
опухоли. Распространенность злокачественного новообразования соответствует той или иной стадии клинической классификации.
В 1968 г. Даниель-Бек предложил клиническую классификацию, согласно которой злокачественные опухоли мягких тканей по стадиям распределялись следующим образом:
I стадия — опухоль менее 5 см в наибольшем своем размере, с четкими границами, подвижная, без вовлечения кожи и
костей;
II стадия — опухоль более 5 см в наибольшем своем размере, с относительно четкими контурами, ограниченно подвижная, без вовлечения кожи и костей;
III стадия — опухоль любых размеров, со вторичными изменениями кожи, вплоть до ее изъязвления, или с деструкцией
кости, неподвижная. Могут быть симптомы сдавления сосудов
353
и нервных образований конечности: а) без регионарных метастазов; б) с регионарными метастазами;
IV стадия — опухоли обширные, изъязвленные, широко
инфильтрирующие окружающие ткани с большим разрушением
прилежащих костей, или опухоль любых размеров с отдаленными метастазами и кожной диссеминацией.
Приведенная классификация достаточно полно отражает
возможные варианты течения первичных опухолей мягких тканей, а также характеризует выраженность их местного и инфильтративного роста, способность опухоли к гематогенному и
лимфогенному метастазированию.
Рабочая классификация злокачественных опухолей мягких
тканей, предложенная И. Т. Кныш и И. М. Кострыба (1972),
также включает 4 стадии.
I стадия — опухоль диаметром до 5 см, не выходящая за
границы анатомического образования, из которого она исходит, подвижная, без регионарных и отдаленных метастазов;
II стадия — опухоль, прорастающая в соседние ткани, но
не выходящая за границы мышечно-фасциального футляра,
диаметром до 10 см, подвижная, без регионарных и отдаленных
метастазов;
III стадия — опухоль, прорастающая в соседние ткани,
диаметром более 10 см, спаянная с окружающими тканями, с
наличием регионарных (редко), но без отдаленных метастазов;
IV стадия — опухоль любых размеров, подвижная или неподвижная, с отдаленными метастазами — единичными или
множественными.
Представленная классификация имеет ряд недостатков, связанных главным образом с нечеткостью разграничения стадий
сарком мягких тканей, особенно начиная с момента выявления
регионарных и отдаленных метастазов.
Безусловный интерес представляет, на наш взгляд, клиническая классификация, предложенная А. А. Клименковым
(1971), в основу которой положена Международная классификация опухолей по системе TNM (Т —опухоль, N — регионарные метастазы, М — отдаленные метастазы). Классификация
опухолей по системе TNM достаточно полно отражает возможные варианты сочетаний первичной опухоли с регионарными и
отдаленными метастазами. Особенно четко раскрываются III и
IV стадии опухолевого процесса, что имеет несомненные преимущества перед классификацией опухолей по стадиям.
Символы TNM в классификации А. А. Клименкова расшифровываются следующим образом:
Т1 — опухоль менее 5 см в наибольшем своем размере, с
четкими границами, подвижная, без вовлечения кожи
и костей;
354
Т2 — опухоль более 5 см в наибольшем своем размере, с относительно четкими границами, ограниченно подвижная, без вовлечения кожи и костей;
ТЗ — опухоль любых размеров с нечеткими контурами, неподвижная, прорастающая кожу;
Т4 — опухоль любых размеров с изъязвлением кожи или прорастающая в кость. Могут быть симптомы сдавления
сосудисто-нервных образований конечности;
N0— метастазы в регионарные лимфатические узлы клинически не определяются;
N1— пальпируется единичный, подвижный лимфатический
узел более 2 см в диаметре или группа подвижных лимфатических узлов;
N3— пальпируется неподвижный опухолевый узел или
конгломерат неподвижных метастатических узлов;
МО— отдаленные метастазы клинически не выявляются;
Ml — солитарные отдаленные метастазы;
М2— множественные отдаленные метастазы.
В настоящее время предпочтение отдается использованию
для установления клинической стадии заболевания Международной классификации TNM, четвертое издание (1987), которая
была предложена для опухолей у взрослых, но с рекомендациями Международного союза онкологов-педиатров (S.I.O.P.). По
этой классификации к опухолям детского возраста относятся
нефробластома, нейробластома и саркомы мягких тканей.
Югассификация преимущественно применяется при РМС у
детей (ICD-0 М 8900/3), но может использоваться и при других
саркомах мягких тканей. Необходимо гистологическое подтверждение диагноза. Для оценки категории Т, N и М применяются следующие методы:
Т-категории — физикальный осмотр и методы визуализации, применяемые приданной локализации;
N-категории— физикальный осмотр и необходимые методы
визуализации;
М-категории— физикальный осмотр и методы визуализации
(при рабдомиосаркоме рекомендуется производить исследование костного мозга).
Дополнительные методы могут использоваться с целью повышения точности стадирования до начала лечения.
Регионарные лимфатические узлы поражаются в зависимости от локализации первичной опухоли:
• голова и шея — шейные и надключичные лимфатические
узлы;
• брюшная полость и таз — поддиафрагмальные, внутри-
брюшные и пахово-подвздошные лимфатические узлы;
355
Представленные pTNM-категории были сгруппированы в
следующие стадии (табл. 15.3).
Таблица 15.3. Стации заболевания согласно pTNM-классификации
Стадия
Классификация
I
РТ1
pNO
pMO
п
рТ1
pNla
pMO
рТ2
pNO, pNla
pMO
ш
рТЗа
pNO, pNla
pMO
шь
рТЗЬ
Любая pN
pMO
рТЗс
Любая pN
pMO
Любая рТ
pNlb
pMO
IV
Любая рТ
Любая pN
pMl
Следует отметить также, что при всех локализациях опухолей категории Ml и рМ1 могут быть дополнены в зависимости
от локализации метастазов:
• легкое PU •
• кости OSS •
• печень НЕР •
• головной мозг BRA •
• лимфатические узлы LY •
костный мозг MAR
плевра PLE
брюшина PER
кожа SKI
другие органы ОТН
Любая классификация представляет собой только основу
для работы, которая должна учитывать не только гистологическую характеристику опухоли, но сопоставлять ее с клиническими проявлениями болезни и результатами детального обследования. Это особенно важно в детской онкологии, где критерии
злокачественности бывают относительными. Именно поэтому
необходимо постоянно сопоставлять данные клинического, лабораторного, других общих и специальных методов диагностики и гистологического исследования, нередко прибегая к повторному гистологическому анализу.
Предложенная выше Международная классификация по
системе TNM достаточно громоздкая, во всяком случае такой
она представляется на первый взгляд. Но пока она единственная, с помощью которой детские онкологи разных стран могут
сравнивать и анализировать свои результаты и, что главное, сопоставлять их между собой. Это является непременным условием того, чтобы проблема диагностики и лечения РМС у детей
приблизилась к своему разрешению.
Диагностика рабдомиосаркомы. Диагностика рабдомиосаркомы у детей должна быть комплексной, с учетом данных клинического, инструментального, лабораторного, рентгенологического, радионуклидного, ультразвукового и морфологического
методов. Применение обычных методов физикального иссле¬
358
дования позволяет с большей долей вероятности исключить
или подтвердить опухолевый процесс, иногда предположить даже вид новообразования. При этом определяются размеры опухоли, ее консистенция, степень вовлечения в процесс окружающих тканей, наличие регионарных метастазов. При наружных
локализациях новообразований диагностика обычно не представляет больших трудностей.
Между тем Ниньо Кастельянос и соавт. (1986), приводя наблюдение за 172 больными с саркомами мягких тканей, отмечают, что при первичном обращении в районную поликлинику
правильный диагноз был поставлен только у половины больных. Остальные находились под наблюдением и получали лечение по поводу предполагаемой мышечной грыжи, гематомы,
воспалительных инфильтратов и т. д., т. е. соответствующую
неадекватную терапию.
Клинические наблюдения показывают, что при первичном
обращении к врачу диагноз злокачественной опухоли мягких
тканей ставится только 6,6 % пациентов. Наиболее часто ошибочно диагностируют доброкачественные опухоли (атерома,
гигрома, невринома, липома, фиброма и др.). Почти столь же
часто заболевание воспринимается как различного рода воспалительные изменения (артрит, бурсит, остеомиелит, туберкулезный гонит, хронический воспалительный процесс, лимфаденит). Кроме того, выставляются диагнозы и посттравматических изменений (осумкованная гематома, оссифицирующий
миозит, повреждение связок и др.).
Совершенно очевидно, что причиной ошибочной диагностики являются не только объективные трудности, но и отсутствие у врачей онкологической настороженности, незнание
клинических особенностей РМС у детей, неумение определить
необходимый набор диагностических средств.
Клинические симптомы РМС мягких тканей не отличаются
специфичностью и в значительном проценте случаев могут напоминать различные заболевания, в том числе и неопухолевые.
В связи с этим приобретают большое значение дополнительные
методы исследования, которые позволяют выявить признаки
опухолевого процесса, уточнить природу новообразования.
Рентгенологическое исследование при РМС
играет определенную роль и выполняется в основном при обследовании больных в условиях районной поликлиники. Между тем этот метод позволяет обнаружить тень опухоли, ее контуры, примерные размеры, наличие включений в новообразовании. В 19 % случаев наблюдаются вторичные изменения со
стороны прилежащей кости (периостальная реакция, остеопороз, краевая деструкция).
Обязательным является рентгенологическое исследование
легких у больных РМС в силу частоты гематогенного метаста-
зирования в легкие.
359
Важное место в ряду диагностических мероприятий занимает ангиографическое исследование. Метод контрастирования сосудов — вазография позволяет определить (или
уточнить) локализацию РМС, ее размеры, степень распространенности, взаимоотношения опухоли и окружающих тканей,
степень вовлечения в опухолевый процесс магистральных сосудов, что особенно важно при планировании хирургического
вмешательства.
Мы рекомендуем выполнять ангиографию всем больным перед хирургическим вмешательством, если имеются данные, полученные при других методах исследования больного, косвенно
указывающие на заинтересованность магистральных сосудов и
новообразование.
Одними из важнейших методов диагностики РМС являются
ультразвуковая томография (УЗТ) и компьютерная томография (КТ). Значение УЗТ в выявлении
сарком мягких тканей, и в частности РМС, трудно переоценить.
Данный метод исследования абсолютно атравматичен для больного ребенка с точки зрения физического и психического воздействия. УЗТ не вызывает никаких побочных реакций и осложнений, достаточно проста в обращении, обладает высокой
информативностью и относительно невысокой стоимостью.
УЗТ позволяет выполнять многочисленные исследования у одного пациента, что так важно для динамического наблюдения
за течением патологического процесса. Показаниями для УЗТ
мягких тканей являются:
• пальпируемое уплотнение или боли в мягких тканях опорнодвигательного аппарата;
• исследование зоны послеоперационного рубца у больных, прооперированных по поводу опухолей мягких тканей, с целью
раннего выявления рецидивов новообразования;
• установление размеров мягкотканного компонента костных опухолей;
• оценка динамики процесса в ходе консервативного химиолу-
чевого лечения сарком мягких тканей;
• выбор оптимального места для аспирационной биопсии патологического процесса в мягких тканях конечностей и туловища, грудной и брюшной полостей, малом тазе, забрю-
шинном пространстве;
• оценка степени местного распространения (соотношение с
магистральными сосудами, окружающими опухоль органами
и тканями) и выявление отдаленных лимфогенных и гематогенных метастазов.
Ультразвуковая диагностика сарком мягких тканей и других
патологических состояний основывается на анализе следующих
признаков: эхогенности и эхоструктуры образования; характера
контуров патологического очага (четкие, нечеткие, бугристые,
360
полицикличные); наличия дорсального ослабления поглощения ультразвука или акустической тени; усиления отражения
ультразвука от заднего контура образования или затухания отраженного ультразвукового сигнала; взаимоотношений с окружающими тканями (инфильтрация или оттеснение межмышечных прослоек, фасции, кожи, разрушение кортикального слоя
и т. д.) и магистральными сосудами (оттеснение, сдавление,
инвазия в просвет сосуда).
После окончания исследования первичного новообразования необходимо провести исследования регионарных групп
лимфатических узлов, которые изучаются на продольных и поперечных срезах. Затем следует оценить состояние печени, органов и тканей, в которые чаще всего метастазирует РМС.
Особенно высокую информативность дает указанный метод
исследования при опухолях, расположенных в области конечностей и туловища, тканях головы и шеи. Ложноотрицательные
результаты регистрируются чаще в случаях небольших размеров
лимфатических узлов при подозрении на их вторичное поражение. В основном метод УЗТ демонстрирует высокие разрешающие возможности при диагностике первичных и метастатических сарком мягких тканей, в том числе и РМС у детей.
Важным методом диагностики РМС является компьютерная
томография (КТ). Метод КТ применяется не только при диагностике РМС у детей, но и при дифференциальной диагностике
злокачественных и доброкачественных новообразований мягких
тканей.
Несомненными достоинствами метода КТ при диагностике
РМС и других опухолей мягких тканей, являются:
• возможность определения границ новообразования',
• оценка степени распространенности опухоли в окружающие
органы и ткани',
• изучение структуры самой опухоли, ее плотности',
• определение наличия зон некроза и кровоизлияний;
• выявление соотношения капсулы и опухолевой массы;
• оценка степени инвазии новообразования в окружающие
ткани и органы;
• регистрация пораженных метастазами лимфатических узлов.
Во время КТ-исследования врач имеет возможность выполнить прицельную аспирационную пункцию или биопсию для
уточнения морфологической природы новообразования. Наш
опыт выполнения диагностических пункций под контролем
компьютерного томографа демонстрирует высокую информативность метода. Возможность контроля расположения биопсийной иглы в массе опухоли позволяет избежать осложнений, связанных с ранением крупных сосудов, полых и паренхиматозных органов.
361
Кроме того, получая изображение опухоли в виде срезов,
имеется возможность выбрать оптимальный участок известной
плотности, что повышает эффективность производимой аспирационной пункции или биопсии.
КТ-исследование применяется не только как средство диагностики первичных и вторичных РМС у детей, но и как метод
контроля за эффективностью противоопухолевой терапии.
Выполнение КТ-исследования у одного ребенка в динамике
до начала специального лечения и после его окончания позволяет зарегистрировать эффект от проведенной терапии. Речь
идет не только о возможности наблюдения за сокращением массы опухоли (в случае положительного результата) или за ее увеличением (при отсутствии эффекта от специальной терапии), но
и о возможности наблюдения за изменением структуры самой
опухоли под воздействием противоопухолевых средств. Даже
при стабилизации размеров новообразования метод КТ позволяет визуализировать резорбцию компактного вещества опухоли, появление кистозных полостей на месте плотного вещества
новообразования, что является признаками лечебного патомор-
фоза, степень выраженности которого может быть очень высокой. В дальнейшем данные КТ подтверждаются результатами
оперативных находок и последующим морфологическим изучением удаленного опухолевого материала.
Важное место в диагностике РМС различных локализаций
отводится радионуклидному исследованию, позволяющему обнаружить первичный опухолевый очаг, уточнить его
размеры, местную распространенность и выявить метастазы.
При выполнении исследования применялись следующие радиофармпрепараты (РФП): 67Оа-цитрат и 99тТс.
Сцинтигоафия поражений мягких тканей конечностей и туловища с 99тТс-пертехнетатом позволяет выявить первичный
и/или метастатический очаг РМС, определить его размеры и
форму. Чувствительность радионуклидной диагностики составила до 90 %, специфичность — 82,5 %.
При выявлении первичного и вторичного поражения костей
и мягких тканей мы согласны с авторами, считающими, что
предпочтение следует отдавать методу радионуклидной диагностики по сравнению с рентгенографией.
Концентрация РФП в опухоли прямо пропорциональна степени злокачественности и не зависит от размеров новообразования. В метастазах, устойчивых к химиопрепаратам, накопление РФП не изменяется. Проведенное исследование позволяет
сделать заключение, что сцинтиграфия 67Оа-цитратом играет
дополнительную роль в обследовании больных с саркомами
мягких тканей, позволяет идентифицировать скрытые опухоли,
а также рецидивы и отдаленные метастазы после лечения.
Следует отметить, что некоторые морфологические варианты РМС имеют свои специфические локализации метастазиро-
362
вания. Речь идет об альвеолярном типе РМС. Исследования по
изучению метастазирования данного типа опухоли в НИИ ДО
показали, что "излюбленной" локализацией гематогенного дис-
семинирования альвеолярной РМС является позвоночник. Вот
почему мы рекомендуем в схему обследования больных с подозрением на РМС в обязательном порядке включать радионуклидное исследование скелета, а в случаях диагностирования
альвеолярного варианта РМС особое внимание обращать на исследование позвоночника.
Радионуклидные исследования могут применяться и как методы контроля над эффективностью противоопухолевой терапии.
Несмотря на высокую информативность перечисленных методов исследования, решающее значение при установлении диагноза имеют морфологические методы.
Наиболее доступным и простым в техническом отношении
является метод цитологического исследования пунктата из новообразования. Для этой цели производится аспирационная
пункция из опухоли.
Мы рекомендуем выполнять пункцию тонкой иглой. При
опухолях, расположенных в области конечностей и туловища,
для этой цели вполне пригоден одноразовый шприц с иглой,
имеющей хороший угол заточки, позволяющей выполнить исследование с минимальной болезненностью для пациента.
Морфологические признаки клеток злокачественных новообразований в цитологическом препарате не отличаются от обнаруживаемых при гистологическом исследовании, но благодаря
разобщенности клеток в мазках их значительно легче рассмотреть. Хорошо сделанный мазок всегда тоньше гистологического
препарата. Клетки в нем лежат раздельно и часто меняют форму.
Поэтому клеточный полиморфизм в мазке выявляется ярче,
чем в гистологических препаратах. Вот почему врач — детский
онколог должен уметь делать тонкий и качественный мазок для
последующего цитологического исследования в лаборатории.
В случаях получения отрицательного результата при цитологическом исследовании пунктата из опухоли, когда данный диагноз вызывает сомнения, необходимо проведение открытой
биопсии новообразования.
Анализ результатов различных методов диагностики, выполненный в НИИ ДО, позволил разработать два принципиальных
подхода при обследовании ребенка с подозрением на РМС: 1)
обследование больного с подозрением на РМС в неспециализированной районной поликлинике; 2) обследование больного
с подозрением на РМС в специализированной онкологической
поликлинике и/или стационаре.
Рекомендуемый объем обследования ребенка с подозрением
на РМС в условиях неспециализированной районной поликлиники включает следующие мероприятия.
363
Методы диагностики:
• клинические (физикалъные методы);
• рентгенологические;
• ультразвуковая томография;
• морфологические (цитологическое исследование пунктатов
и/или отпечатков с поверхности опухоли; гистологическое
исследование биопсийного материала (трепанобиопсия или
открытая биопсия опухоли).
Рекомендуемый объем обследования ребенка с подозрением
на РМС в условиях специализированной онкологической поликлиники и/или стационара включает более широкие мероприятия.
Методы диагностики:
• клинические (физикалъные методы);
• рентгенологические;
• радионуклидные;
• ультразвуковая томография;
• компьютерная томография;
• магнитно-резонансная томография;
• иммунологические (иммуногистохимия);
• морфологические (исследование материала, полученного методом пункционной или открытой биопсии; световая и
электронная микроскопия; цитологическая диагностика).
Лечение рабдомиосаркомы у детей. Для лечения РМС у детей
применяются все существующие современные методы терапии
злокачественных опухолей, которые используются и у взрослых
(хирургический, лучевой и лекарственный), но с учетом возрастных особенностей организма ребенка и своеобразия злокачественных новообразований детского возраста.
Лечение больных с рабдомиосаркомой определяется в зависимости от радикальности выполненного оперативного вмешательства, оцененной морфологическим исследованием удаленных во время операции тканей. Мы выделяем 4 клинические
группы, на которые разделяются дети, больные рабдомиосаркомой, в зависимости от распространенности первичной опухоли, степени радикализма хирургического вмешательства и
наличия регионарных и отдаленных метастазов.
В I клиническую группу входят больные, у которых возможно радикальное удаление первичного новообразования. II и III
группы представлены пациентами, у которых оперативное лечение выполнено с микро- и/или с макроскопическими остатками первичной опухоли, причем группа На представлена пациентами, у которых возможно удаление первичной опухоли с
микроскопическими остатками без метастазов в регионарных
лимфатических узлах, а в группу НЬ вошли пациенты, у кото¬
364
рых первичная опухоль удалена полностью или с микроскопическими остатками, но имеются метастазы в удаленных регионарных лимфатических узлах. IV клиническую группу составили дети, у которых к моменту установления диагноза уже
имелись отдаленные метастазы.
В схемах полихимиотерапии применяются следующие лекарственные препараты: винкристин, дактиномицин, цикло-
фосфамид, адриабластин, вепезид, цисплатин. При опухолях,
расположенных в параменингеальных областях, помимо перечисленных препаратов, для интратекального введения используются также метотрексат и цитозин-арабинозид.
Лучевое лечение рекомендуется применять в основном после повторных оперативных вмешательств, и у детей I клинической группы оно не проводится. Лучевая терапия назначается
больным, у которых зарегистрированы микро- и/или макроскопические остатки новообразования после выполненного хирургического этапа лечения (клинические группы На и lib, III).
В зону лучевого воздействия включается вся опухоль (размеры которой устанавливаются до начала лечения) с прилежащими нормальными тканями в пределах 4—5 см от края.
Для улучшения результатов хирургического лечения с целью
повышения резектабельности в случаях, когда предоперационная полихимиотерапия была неэффективна, в нашей клинике
проводится регионарная химиотерапия — внутриартериальная
перфузия, иногда в сочетании с предоперационной лучевой терапией.
Одной из важнейших задач, стоящих перед методом лучевого лечения, является подведение к опухоли оптимальной дозы
облучения с минимальным воздействием на окружающие новообразование здоровые ткани. Методом, наиболее полно
удовлетворяющим это требование, является внутритканевой
метод облучения, при котором радиоактивный препарат вводится непосредственно в опухоль.
Метод показан для лечения опухолей, имеющих небольшие
размеры. Особенностью метода является то, что внутритканевое введение препаратов является хирургической операцией,
требующей оказания анестезиологического пособия, соблюдения правил асептики и антисептики.
Если опухоль располагается глубоко в тканях, то ее удаляют
с последующим введением радиоактивного препарата в ложе
или просто обнажают. Препараты вводят в операционной с соблюдением правил защиты от излучений.
Расположение закрытых препаратов контролируют с помощью рентгенографии. После внутритканевого введения радиоактивных препаратов больных помещают в специальные так
называемые активные палаты (так как больные сами становятся
источниками излучения), где должны находиться до извлечения закрытых препаратов, а при введении открытых радиоак¬
365
тивных препаратов — в течение времени, равного 4—5 периодам полураспада.
Внутритканевая лучевая терапия проводится радиоактивными иглами и гранулами, источниками излучения в которых являются 60Со, 22Ra и 137Cs.
Иглы изготовлены в форме цилиндра с острым концом, во
внутреннюю часть их вставлен штифт из 60Со. Гранулы представляют собой цилиндрики или отрезки тонкой проволоки.
Применяются они в нейлоновых трубочках.
Внутритканевое введение игл является травматичной процедурой. Кроме того, за счет высокой дозы вокруг иглы образуется
некротический канал, из-за которого часто препарат смещается,
а иногда при неудовлетворительной тампонаде и выпадает.
Использование нейлоновых трубочек для прошивания опухолей позволило избежать указанных недостатков. Нейлоновые
нитки в опухоли чаще располагаются в виде треугольника, овала или круга. Для внутритканевой гамма-терапии применяются
и гранулы радиоактивного золота 198Аи, которые покрыты слоем платины в 1 мк, так как радиоактивное золото на 95 % является бета-излучателем. С помощью троакаров, специальных
игл и пистолетов гранулы золота вводят в опухоль.
Методика внутритканевой гамма-терапии путем последовательного введения радиоактивных препаратов до настоящего
времени не получила широкого распространения, хотя и считается перспективной.
При данном методе после введения в ткань опухоли спаренных полых игл или гибких полых трубок (имплантатов) и контроля за их положением эти аппликаторы заполняются радиоактивными препаратами 60Со, гранулами радиоактивного золота (198Аи) или иридия (1921г).
Внутритканевая бета-терапия проводится коллоидными системами, которые нетоксичны и не вступают в обменные процессы, а также с помощью рассасывающихся нитей и пленок,
содержащих радиоактивные вещества. При этом используются
изотопы с энергией бета-частиц 1,5—2 МэВ или претерпевающие к-захват ("Y, 198Au, 32Р).
Дозное поле от рассасывающихся нитей образуется в виде
цилиндра, а при применении пленок энергия распределяется в
одной плоскости. Для бета-излучения характерен высокий градиент мощности дозы на периферии облучаемого объема. Поэтому внутритканевая бета-терапия показана при саркомах
мягких тканей и их рецидивах, меланомах кожи, метастазах
опухолей в кожу и лимфатические узлы.
При радиохирургическом методе после удаления опухоли облучают ложе или хирургическим путем достигают опухоли и в
нее внедряют радиоактивные вещества. Следовательно, данный
метод является разновидностью внутритканевого метода лучевой
терапии. Радиоактивные вещества, применяющиеся при этом
366
методе, обладают бета- и гамма-излучением и имеют форму
нейлоновых трубочек, гранул 198Аи, танталовой проволоки,
игл, коллоидных растворов и рассасывающихся нитей.
Метод внутритканевого облучения пока редко применяется
при лечении злокачественных опухолей у детей, главным образом из-за его достаточно высокой стоимости. Поэтому публикаций, посвященных радиохирургическому методу лечения в
педиатрической онкологии, в мировой литературе крайне мало.
Внутритканевое облучение — брахитерапия является альтернативным методом дистанционному облучению. Применение
внутритканевого облучения позволяет подвести в опухоль высокую дозу с минимальным повреждением здоровых тканей.
В НИИ ДО и отделении радиохирургии НИИ клинической
онкологии РОНЦ им. Н. Н. Блохина РАМН метод радиохирургии при лечении солидных злокачественных опухолей применяется с 1983 г. Эффективность внутритканевой лучевой терапии заключается:
• в непрерывности и локальности облучения;
• в создании высокой очаговой дозы с равномерным облучением всей зоны облучаемого объема;
• в минимальном воздействии на окружающие здоровые
ткани и критические органы.
Радиохирургический метод позволяет производить органосохраняющие операции с удовлетворительными функциональными и отдаленными лечебными результатами.
Современное лечение РМС проводится на основании протоколов лечения данного вида опухоли. В НИИ ДО для лечения
PMC (I—III стадия) с 1993 г. применяется протокол, разработанный Международным союзом педиатров-онкологов
(S.I.O.P-89). Согласно протоколу лечения, больные разделяются на группы в зависимости от локализации опухоли, клинической и патологической стадии болезни (учитывается радикальность выполненного хирургического вмешательства).
Так, в группу А включаются пациенты с локализованной
стадией (ст. I; Т1, N0, МО; рТ1, N0, МО). Лечение начинается
с оперативного удаления новообразования. Спустя неделю после операции детям назначается полихимиотерапия по следующему плану (схема VA): винкристин внутривенно, 1,5 мг/м2 в
1-й, 8-й, 15-й, 22-й дни; дактиномицин внутривенно (15—30-
минутная инфузия препарата в изотоническом растворе натрия
хлорида) в 1-й и 22-й дни. Затем после трехнедельного перерыва повторяют курс лечения двумя препаратами по той же схеме.
На этом лечение заканчивается, и далее за больным осуществляется динамическое наблюдение.
В группу В входят больные со II и III стадиями заболевания,
с локализованными опухолями, но удаленными не полностью,
с микро- или макроскопическими остатками или те больные,
367
у которых вмешательство было ограничено только биопсией
новообразования, а также пациенты с регионарными метастазами. Опухоль локализуется в прогностически благоприятных зонах: паратестикулярной области, vagina, орбите, непа-
раменингеальных областях головы и шеи (Т1, N0, МО, рТЗ, а,
Ь, с).
В эту же группу включены пациенты, у которых опухоль распространяется на соседние ткани, хотя клинически и ограничена, но возможно радикальное удаление новообразования (Т2,
N0, МО; рТ2). Кроме того, в данную группу входят пациенты с
РМС неблагоприятных локализаций (области туловища и конечностей, мочевой пузырь, простата, забрюшинная зона,
брюшная и грудная полости, глубоко расположенные опухоли
головы и шеи).
Больные, включенные в группу В, получают полихимиотерапию по схеме IVA: винкристин внутривенно, 1,5 мг/м2 в 1-й,
8-й, 15-й дни; дактиномицин внутривенно, 1,5 мг/м2 в 1-й
день; ифосфамид 3 г/м2 в 1-й, 2-й, 3-й дни. Ифосфамид вводят
внутривенно капельно в изотоническом растворе натрия хлорида в течение 3 ч. Введение ифосфамида сопровождается гипергидратацией (до 2—3 л/м2) и обязательным назначением
уромитексана (mesna).
После окончания 1-го курса полихимиотерапии по схеме IVA
происходит оценка эффективности лекарственной терапии.
В случае стабилизации размеров опухоли или полной или частичной регрессии новообразования проводится повторный
курс полихимиотерапии тремя препаратами (IVA) по той же
схеме. Если после 1-го курса химиотерапии зарегистрировано
прогрессирование заболевания, то переходят к лечению по 2-й
линии лекарственной терапии.
При наличии эффекта в виде сокращения размеров опухоли
или стабилизации размеров новообразования проводят 2-й курс
полихимиотерапии по схеме IVA.
Затем осуществляется оценка эффекта от проведенного лечения. При регистрации частичной регрессии (ЧР) более 50 %
проводятся еще 2 курса химиотерапии по схеме IVA, после чего
оценивается эффективность химиотерапии. В случае достижения полной ремиссии лечение прекращается, и в дальнейшем
за пациентом устанавливается динамическое наблюдение.
Если после проведенных 4 курсов химиотерапии (IVA) достигнута лишь частичная ремиссия, то рассматривается вопрос
о возможностях выполнения хирургического удаления опухоли.
При выполнении радикальной операции (что подтверждается
гистологическим анализом зоны резекции) специальное лечение прекращается и за больным осуществляется динамический
контроль.
Наличие резидуальной опухоли после нерадикально выполненной операции является показанием для назначения больно¬
368
му лучевого лечения на остаточную опухоль. СОД лучевой терапии должна быть не менее 40 Гр (40—50 Гр).
В случае невозможности выполнения хирургического вмешательства после 4 курсов лекарственного лечения рассматривается вопрос о лучевом лечении и переходе на вторую линию
химиотерапии.
Если после проведенных начальных курсов полихимиотерапии у больного зарегистрирован эффект в виде сокращения
опухоли менее чем на 50 %, рассматривается вопрос о выполнении хирургического этапа лечения — удаления РМС. При
возможности радикального удаления опухоли после операции
пациенту проводится еще 2 курса полихимиотерапии по схеме
IVA, после чего лечение прекращают.
При наличии резидуальной опухоли после операции больного переводят на 2-ю линию химиотерапии.
В случае невозможности выполнения оперативного вмешательства больного также переводят на 2-ю линию химиотерапии.
Лечение IV стадии РМС, а также рецидивов заболевания
требует применения у больных высокодозной полихимиотерапии, что сопровождается развитием тяжелых реакций и осложнений со стороны различных органов и систем пациента. Для
предупреждения и лечения таких осложнений необходимо использование современных медицинских технологий, в том числе пересадки периферических стволовых клеток или костного
мозга. Такого рода лечение должно выполняться в специально
созданных для этой цели отделениях высокодозной химиотерапии и трансплантации костного мозга.
Глава 16 I ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ КОСТЕЙ
Опухоли костей составляют около 10 % всех злокачественных
новообразований у детей, которые встречаются преимущественно во втором десятилетии их жизни. В европейских странах,
таких как Франция, Германия, Италия и Великобритания, с населением 60—80 млн ежегодно выявляется 200 случаев заболевания.
Саркомы костей отличаются крайне агрессивным течением
и во многих случаях плохо поддаются различным методам лечения, нередко требуют проведения тяжелых лечащих хирургических вмешательств типа ампутаций и экзартикуляций конечностей. Кроме того, ряд некоторых злокачественных опухолей
костей поражает преимущественно лица детского, юношеского
и молодого возраста.
Важно отметить, что от 50 до 70 % всех наблюдений злокачественных опухолей костей приходится на долю остеогенной
саркомы — основной нозологической (у детей) единицы в этой
группе новообразований.
Второе место по частоте после остеогенной саркомы среди
злокачественных опухолей костей у детей занимает саркома
Юинга — 25 % случаев.
16.1. Остеогенная саркома
Остеосаркома — злокачественная опухоль, которая гистогенетически связана с примитивной мезенхимой или камбиальным резервом, обладающим потенцией к костеобразованию.
В ней происходит прямое превращение опухолевой соединительной ткани в кость и остеоид. Ежегодно регистрируется 2—
3 случая заболевания на 1 млн населения. Остеогенная саркома
может встречаться в любом возрасте, однако в 60 % случаев
приходится на второе десятилетие жизни. Мальчики болеют ею
чаще девочек, при этом возраст заболевших девочек несколько
ниже, чем мальчиков, что указывает на взаимосвязь между ускоренным ростом костей и развитием этих неоплазм. Более того,
больные с остеосаркомой обычно выше ростом по сравнению
со своими сверстниками.
Наиболее типичной локализацией опухоли являются мета-
физарные зоны быстрорастущих костей у подростков: нижний
метафиз бедренной, верхний метадиафиз большеберцовой и
плечевой костей. Реже опухоль поражает проксимальный отдел
малоберцовой кости, позвонки, нижнюю челюсть кости черепа.
Предполагают, что остеогенная саркома является злокачественной трансформацией быстро пролиферирующих костно-
формирующих клеток, которая происходит вследствие случай¬
370
ного или индуцированного воздействия вирусных, химических
или физических агентов.
Остеогенная саркома является основной нозологической
формой среди первичных злокачественных опухолей костей у
детей и подростков. Термин "остеогенная саркома" был предложен в 1920 г. Юингом, который объединил под этим названием большую группу костных опухолей. В дальнейшем были
выделены самостоятельные нозологические формы — параос-
тальная саркома, хондросаркома и фибросаркома.
В отечественной литературе в настоящее время используется
термин "остеогенная саркома". При этом имеется в виду злокачественная костная опухоль, возникшая из клеток, способных
к костеобразованию на уровне остеоида либо примитивных костных балок с дифференцировкой вплоть до остеоцитов. Вместе
с тем в опухоли встречаются хрящеподобные структуры (хонд-
ропластический остеогенез).
При изучении детской смертности от злокачественных новообразований было отмечено прогрессивное повышение
смертности при остеогенной саркоме в период первых двух десятилетий жизни. После окончания периода роста частота заболеваний остеогенной саркомой резко падает.
В норме процессы роста костей и остеогенеза протекают
строго синхронно. Любое нарушение такой синхронности в период развития кости может привести к патологическому состоянию или к адаптивному отклонению нормального гистогенеза. При этом необходимо иметь в виду, что все локальные регулирующие аппараты, в том числе и сосудистые структуры,
выполняют лишь опосредующую роль общекоррелирующих
влияний со стороны нервной и эндокринной систем.
В препубертатном и пубертатном периоде (при нарастании
гормональной активности) начинается особенно интенсивная
пролиферация росткового хряща, требующая синхронного увеличения оссификации. Поэтому любые сосудистые нарушения
в зоне метафизов или в системе питающих артерий, обеспечивающих 4/5 кровоснабжения метафизов, могут вызвать состояние гиповаскуляризации в зоне роста, что в свою очередь создает брадитрофные условия обмена в этих участках длинных
трубчатых костей. К подобным условиям наиболее адаптированной структурой оказывается хрящ как ткань, не нуждающаяся в интенсивном кровоснабжении, так как обменные процессы в ней происходят замедленно — путем диффузии.
Сложившиеся в результате нарушения кровоснабжения условия обмена могут поддерживать и даже стимулировать пер-
систенцию и пролиферацию хрящевых клеток эпифизарной
пластинки (зоны роста). Одновременно при снижении кровоснабжения более или менее глубоко подавляется процесс начальной оссификации и перестройки первичной костной спон-
гиомы в области метафиза. Участки такой провизорной кости
371
смещаются в процессе роста кости в диафизальном направлении и могут оказаться в несоответствующих анатомо-физиологических зонах, различающихся структурной и функциональной зрелостью. Эти зоны могут служить субстратом для возникновения дисплазий, а при прогрессировании явиться основой
формирования опухолевого зачатка.
Мы представляем описание микроскопического строения
остеогенной саркомы, исходя из разделения ее на морфологические варианты — остеопластический (остеосклеротический),
остеолитический и смешанный.
Остеопластическая остеогенная саркома. К этому варианту
относятся опухоли с выраженным неопластическим остеогенезом в виде атипичных костных балок, часто образующих сплошные поля. Опухолевые клетки отличаются резким атипизмом и
отсутствием правильной архитектоники. В зоне внекостного
компонента участки интенсивного костеобразования могут чередоваться с менее плотными клеточными структурами.
Остеолитическая остеогенная саркома. При этом структурном
варианте процессы опухолевого остеогенеза в новообразовании
выражены значительно меньше. В опухоли преобладают явления деструкции (лизиса) за счет лакунарной резорбции. Ткань
опухоли представлена клеточными элементами с различной степенью атипии, полиморфизма и митотической активности.
Основным диагностическим критерием остеогенной саркомы остается наличие признаков опухолевого (неопластического)
костеобразования. Наличие опухолевого остеогенеза принято
считать достоверным признаком принадлежности опухоли к остеогенной саркоме.
В телеангиоэктатических формах опухолевое костеобразование происходит в соединительнотканных прослойках, ограничивающих сосудистые полости.
Несколько особое положение занимает так называемая остеоидная саркома, которая по рентгенологической картине относится к остеолитическому варианту, а микроскопически характеризуется относительно высокой продукцией межуточного
вещества.
Смешанный вариант остеогенной саркомы — один из наиболее часто встречающихся вариантов, который сочетает в себе
признаки обеих вышеописанных форм. В саркомах этого варианта совершенно четко представлен неопластический остеогенез.
Костные структуры варьируют от необызвествленного остеоида
до атипичной костной ткани. Смешанный вариант является самым частым и наиболее типичным примером остеогенной саркомы. Иногда хрящевой компонент представлен очень обильно,
что создает большие трудности при дифференциальной диагностике.
Клиническая картина. Клинические проявления остеогенной саркомы у детей не имеют характерных только для остео¬
372
генной саркомы признаков. Классическая триада: боль, припухлость и нарушение функции — свойственна не только опухолевому поражению, но и многим заболеваниям опорнодвигательного аппарата неопухолевой природы. Клинические
проявления остеогенной саркомы во многом определяются локализацией опухоли, ее размерами и степенью распространенности на окружающие ткани.
По клиническому течению можно выделить два вида остеогенной саркомы: стремительное развитие опухоли с нарастанием
болевого синдрома, нарушением функции пораженной конечности и быстрым летальным исходом и медленное развитие опухолевого процесса. Для детей и подростков характерен первый
вид клинического течения заболевания. У большинства больных первым симптомом заболевания является боль, которая
появляется на фоне полного здоровья и совсем неожиданно.
Однако более чем в 50 % наблюдений в анамнезе имеется указание на травму именно того участка, в области которого в дальнейшем появляется опухоль. Боль при остеогенной саркоме
обусловлена сдавлением надкостницы и окружающих тканей.
Срок с момента травмы до появления заболевания варьирует в
довольно широких пределах, но все же основная масса родителей
связывают появление первых симптомов заболевания с травмой. Для проявления остеогенной саркомы характерны постоянные и самостоятельные боли в покое, интенсивность которых
прогрессирует очень быстро; появляются "ночные" боли. Наиболее интенсивные боли наблюдаются при поражении костей
голени, что определяется анатомическими особенностями этой
области (наличие парных костей, меньший объем окружающих
мягких тканей). Болевые ощущения имеют характер тупой, ноющей боли. В этот период общее состояние ребенка остается удовлетворительным; иногда в вечернее время возникает субфебрильная температура.
Важным клиническим симптомом служит появление опухоли, которая у детей очень быстро возникает вслед за болью. В подавляющем большинстве случаев опухоль выявляется в течение
месяца от начала появления боли. Как первый признак заболевания безболезненная опухоль встречается значительно реже,
чем болевые ощущения. По мере роста опухоли появляется болезненность опухоли при пальпации, возникает отечность мягких тканей, кожи, отмечается синюшность кожных покровов
вследствие венозного застоя. Кожные покровы становятся напряженными, и появляется расширенная поверхностная венозная сеть. Одновременно с появлением и ростом опухоли нарушается функция конечности, что проявляется в виде хромоты
и сгибательной контрактуры в ближайшем от опухоли суставе.
В этот момент состояние ребенка заметно ухудшается, отмечается подъем температуры до 38—39 °С, что, по-видимому, связано с распадом ткани опухоли.
373
Общие симптомы в виде недомогания, постоянной гипертермии, слабости, похудания, нарушения сна наблюдаются, как
правило, в поздних стадиях заболевания.
Все исследователи подчеркивают преимущественное поражение остеогенной саркомой длинных трубчатых костей.
В пределах длинных трубчатых костей наиболее часто встречающейся локализацией остеогенной саркомы является область
метафизов. Диафизы костей поражаются значительно реже.
Локализация остеогенной саркомы в плоских костях наиболее характерна для детей до 4—5 лет.
О чрезвычайно быстром росте остеогенной саркомы и об
очень высокой ее злокачественности свидетельствует тот факт,
что у большинства больных срок обращения к врачу от начала
клинических проявлений заболевания составляет в среднем
3,5 мес. Из них более чем у 15 % детей, впервые поступивших
для обследования, выявляются метастазы в легкие.
Остеогенная саркома — чрезвычайно злокачественная опухоль, склонная к быстрому гематогенному метастазированию.
Наиболее часто метастазы обнаруживаются в легких и до конца
1-го года от начала заболевания выявляются у подавляющего
числа больных. Крайне редко, но возможно метастазирование
остеогенной саркомы в регионарные лимфатические узлы и
другие кости.
Одним из наиболее патогномоничных рентгенологических
признаков остеогенной саркомы принято считать наличие остеофитов, возникающих на границе наружного дефекта компактного
слоя кости и внекостного компонента опухоли, который имеет вид
характерного "козырька" ("козырек", или треугольник "Кодмэна").
Другим рентгенологическим симптомом, который свидетельствует о распространении опухоли за пределы кости, являются так называемые спикулы, тонкие игольчатые обызвествления, направленные перпендикулярно длиннику кости. При
остеопластическом варианте они бывают различной длины и
отходят от коркового слоя в виде "языков пламени".
Распространение опухолевого процесса на окружающие ткани приводит к образованию внекостного компонента, в котором определяются поля оссификации различных размеров. Эти
участки, как правило, наблюдаются при остеопластическом и
смешанном вариантах остеогенной саркомы. В единичных наблюдениях при остеогенной саркоме на некотором удалении от
основного массива опухоли обнаруживается симптом "шаровидных уплотнений".
Определенное диагностическое значение при учете других
косвенных рентгенологических признаков у больных до 20 лет
имеет "симптом частичного расширения метаэпифизарной хрящевой зоны".
Остеолитический вариант остеогенной саркомы проявляется
очагами деструкции различных размеров с нечеткими, неров¬
374
ными контурами. Реактивные изменения надкостницы характеризуются вначале однослойным, а в дальнейшем многослойным периоститом. Опухоль истончает, а затем полностью разрушает кортикальный слой и реактивно измененную надкостницу,
выходит за пределы кости, инфильтрирует мышцы, сосуды и
нервы. При этом по краям опухоли образуется разрушенный
надкостницей характерный периостальный козырек.
При остеопластическом варианте остеогенной саркомы на
первый план выступают остеопластические процессы. Начальным признаком этой разновидности является появление патологических очагов различного размера аморфно-пятнистого
или сливного характера.
Трепанобиопсия, по нашему мнению, удобный и вполне надежный способ получения материала для исследования. Этот
метод практически бескровен, малотравматичен, прост и позволяет получить участок ткани опухоли, достаточный как для
цитологического, так и для гистологического исследования.
Оба метода требуют определенного опыта и тщательной подготовки с поедварительным изучением рентгенологической картины для того, чтобы проникнуть инструментом в нужном направлении на необходимую глубину.
Наиболее эффективной в диагностическом плане является
открытая, или инцизионная, биопсия, которая позволяет получить материал под визуальным контролем. Открытая биопсия
должна проводиться в сложных дифференциально-диагностических случаях, при сомнительных диагнозах трепанобиопсии
и с учетом объема предполагаемого оперативного вмешательства.
Все виды диагностических манипуляций и операций должны проводиться после предварительной разметки участка биопсии под контролем рентгеноскопии.
В отношении радиоизотопного метода исследования для диагностики единого мнения нет. Мы считаем, что сканирование
костей имеет большое значение при установлении уровня резекции кости при планировании сохранной операции, так как
позволяет выявить зоны изменений, которые могут еще недостаточно четко регистрироваться рентгенологически. Сканирование костей можно рекомендовать в качестве дополнительного диагностического метода, а также для динамического наблюдения за больным после оперативного лечения для выявления
рецидива опухоли.
Дифференциальная диагностика. Ранняя своевременная диагностика костных сарком представляет очень большие трудности. Об этом говорит тот факт, что почти 70 % больных до обращения к онкологу имели различные диагнозы, включающие
остеомиелит, миозит, невралгию, туберкулез, различные травматические повреждения. Большинство детей в связи с этим
получали неадекватное настоящему диагнозу лечение.
375
Дифференциальная диагностика является не менее сложной
задачей. Диагноз должен устанавливаться на основании комплексного исследования.
Большие трудности возникают нередко при дифференциальной диагностике остеогенной саркомы и саркомы Юинга. В
отличие от остеогенной саркомы саркома Юинга в подавляющем большинстве случаев поражает диафизы трубчатых костей.
Очень часто раньше болевого синдрома появляется опухоль.
Нередко началу заболевания при саркоме Юинга предшествует
гипертермия с появлением припухлости, что может симулировать воспалительный процесс и на ранних стадиях остеогенной
саркомы не наблюдается. На рентгенограмме при саркоме
Юинга полностью разрыхлен корковый слой кости, который
резко утолщен; отмечается значительное расширение костномозгового канала. Однако в ряде случаев только морфологическое исследование может способствовать установлению правильного диагноза.
Параостальная саркома локализуется в длинных трубчатых
костях, однако сильных болей не вызывает и проявляется в основном наличием опухолей. Обращает на себя внимание несоответствие обширности рентгенологических изменений скудости клинической картины. На рентгенограмме отмечается муфтообразное окутывание кости плотными напластованиями.
Типичные для остеогенной саркомы спикулы и "козырьки" отсутствуют. Опухоль, располагаясь снаружи кости, не вызывает
вначале реакции надкостницы и ее разрушения.
Заболевания воспалительного характера в большей степени
стимулируют саркому Юинга, чем остеогенную саркому. Очень
трудно установить диагноз остеогенной саркомы плоских костей,
особенно у детей младшего возраста. Однако на рентгенограммах прорыв очага воспаления за эпифизарный хрящ и каплевидное поражение эпифиза свидетельствуют в пользу воспалительного процесса. Следует отметить, что начальные проявления остеогенной саркомы никогда не сопровождаются общими
симптомами.
Известно, что результаты лечения больных детей с остеогенной саркомой находятся в зависимости от таких факторов, как
вид лечения, пол, возраст, размер опухоли, рентгеноморфологический вариант, степень лечебного патоморфоза в ткани опухоли после предоперационной терапии.
При определении степени лечебного патоморфоза в лаборатории патологической анатомии опухолей опорно-двигательного аппарата РОНЦ РАМН используются схемы Е. Н. Федоровой (1982).
• I степень — незначительное или полное отсутствие эффекта химиолучевой терапии.
376
• II степень повреждения — частичный ответ опухоли на
химиолучевое лечение. Отмечается очаговое "исчезновение" паренхимы опухоли до 50 %; в сохранившихся клетках опухоли явления дистрофии, появляются лечебные
формы. Однако в некоторых гистологических препаратах
имеются участки жизнеспособной опухолевой ткани.
• III степень повреждения — более 90 % опухолевой паренхимы некротизировано. Встречаются локусы жизнеспособной опухолевой ткани в отдельных гистологических препаратах.
• IV степень повреждения — полное отсутствие жизнеспособных опухолевых клеток при исследовании большого
числа срезов.
К благоприятным (статистически достоверным) факторам
следует отнести наличие III—IV степени лечебного патоморфоза
в опухолевой ткани и размеры опухоли до 10 см. Такие факторы,
как пол, возраст, также имеют определенное значение, однако,
по нашим данным, их значение оказалось статистически недостоверным.
Характеристика комплекса лечебных мероприятий. Несмотря
на большой клинический опыт лечения остеогенной саркомы у
взрослых и детей, не существует единой точки зрения на применение тех или иных методов лечения. В настоящее время при
лечении злокачественных новообразований костей применяют
три основных метода (хирургический, лучевой и лекарственный) и их комбинации.
Хирургический метод лечения остеогенной саркомы признан в настоящее время основным, применяется самостоятельно или в комплексе лечебных мероприятий и разделяется на
два основных способа оперативного вмешательства: калечащие
(ампутации и экзартикуляции) и сохранные операции. Ампутации и экзартикуляции в настоящее время являются основным методом лечения злокачественных новообразований костей у детей или важной составной частью комплексного лечения.
Главным моментом при выполнении этих операций является
выбор уровня ампутации, который устанавливается в зависимости от локализации, протяженности новообразования и задач предстоящего протезирования. С последней точки зрения,
ампутация по возможности должна быть произведена на функционально выгодном уровне и выполнена в техническом отношении так, чтобы получить выносливую, безболезненную культю. Основной принцип ампутаций и экзартикуляций при злокачественных опухолях костей — это проведение их за
пределами пораженной кости. Исключением из этого правила
следует считать новообразования, расположенные в дистальном отделе бедренной кости. В настоящее время большинство
377
хирургов-онкологов в этих случаях проводят подвертельную
ампутацию бедра.
Методика ампутаций и экзартикуляции у детей при остеогенной саркоме не отличается от операций у взрослых и методик, проводимых по другим показаниям.
Следует отметить, что результаты "чисто" хирургического
метода лечения остеогенной саркомы остаются неудовлетворительными. По данным большинства авторов, 5-летняя выживаемость у взрослых больных после радикального хирургического лечения колеблется от 7 до 16,2%, ау детей — от 3,3 до
5,7 % случаев.
Улучшение результатов лечения послужило поводом для
дальнейшей разработки органосохраняющих операций на конечностях. Большинство авторов считают, что при наличии
достаточно эффективных химиолучевых средств проведение
сохранных операций на конечностях у детей оправдано и целесообразно. Кроме того, при сохранении конечности родители
более охотно соглашаются на такие операции.
Большое число осложнений, неудовлетворительная функция конечности после операции и длительная иммобилизация
заставили отказаться от трансплантации больших сегментов аллокости. В доступной литературе имеется относительно небольшое число работ, посвященных использованию эндопротезов у
детей с остеогенной саркомой. Авторы отмечают положительные стороны нового метода по сравнению с аллопластикой. В
настоящее время используются эндопротезы из металла, керамики и других искусственных материалов. При этом авторы отмечают удовлетворительные, а в ряде случаев хорошие функциональные результаты с достаточным объемом движений в коленном суставе.
Применение только лучевой терапии у больных с остеогенной саркомой (даже в очень высоких дозах) привело к еще более
скромным результатам по сравнению с "чисто” хирургическим
лечением. Попытки комбинированного предоперационного облучения (в дозах 100—160 Гр) с немедленной ампутацией также
не увенчались успехом: не уменьшилась частота метастазирова-
ния, не увеличилась выживаемость.
Высокие дозы облучения (60—90 Гр) вызывают тяжелые лучевые повреждения. Ряд радиологов предлагают при остеогенной саркоме проводить облучение опухоли в дозе 6—12 Гр в течение 1—2 дней с последующей ампутацией конечности через
2—3 дня после окончания лучевой терапии. В. А. Бизер считает,
что лечение остеогенной саркомы должно состоять из двух этапов. На первом этапе — радикальный курс лучевой терапии
(50—100 Гр); вторым этапом лечения должна быть радикальная
операция, проводимая спустя 3—6 мес после окончания лучевой терапии. Такая тактика позволяет избежать необоснованно
калечащих операций у детей.
378
Морфологические изменения в ткани опухоли начинают появляться после облучения в дозе от 15 Гр, затем степень повреждения усиливается при облучении до дозы 50 Гр, а при возрастании дозы от 50 Гр 100 Гр степень повреждения практически не меняется.
Лучевая терапия опухолей костей у детей является далеко не
безопасным методом лечения. Помимо угнетающего действия
на кроветворение при неправильной методике лечения, она
приводит к тяжелейшим дистрофическим повреждениям мягких тканей и костей, подвергшихся облучению. Особенно опасно
ее применение, когда еще не окончен процесс роста костей.
Таким образом, применение лучевой терапии как самостоятельного метода лечения остеогенной саркомы не дает обнадеживающих результатов и может быть рекомендовано только как
составная часть комплексного или паллиативного лечения.
К настоящему времени при лечении остеогенной саркомы
прошли клиническую апробацию практически все химиотерапевтические препараты и их комбинации. Применение цикло-
фосфана сарколизина, винкристина, 5-фторурацила, метотрексата в отдельности не дало выраженного эффекта. Использование новых препаратов и их комбинаций изменило возможности
лечения остеогенной саркомы. Рядом авторов была установлена
чувствительность остеогенной саркомы к адриамицину и метотрексату; отмечена эффективность в лечении опухоли и ее метастазов. Это послужило основанием для включения адриамицина
и метотрексата в схемы комбинированной химиотерапии.
В последние годы в клинической практике в качестве предоперационного лечения применяются внутриартериальные инфузии диметилдихлорплатина (цисплатина); эффективность этого лечения при остеогенной саркоме составляет от 18 до 62 %.
Ряд авторов проводят предоперационное лечение цисплати-
ном и достигают операбельности в плане проведения сохранных
операций в 60 % случаев.
С учетом возможности проявления метастазов в более поздние сроки (от 16 до 26 мес) необходимо проводить обязательную
послеоперационную химиотерапию.
Следует также отметить, что сохранные операции с применением эндопротезирования являются наиболее перспективными
в сочетании с другими видами противоопухолевого лечения.
Рассмотрев результаты лечения детей с учетом различных
факторов, нам удалось установить, что выживаемость (5-летний
период без метастазов) у больных, получивших только хирургическое лечение, составила 12 %. В группе больных, получивших
хирургическое и лекарственное послеоперационное лечение, —
18 %; у больных, получивших комплексное лечение (химиотерапия до операции, облучение опухоли до операции, операция,
послеоперационная химиотерапия), — 37 %; у больных, получивших до и после операции препараты платины, — 65 %.
379
мосомной транслокации t (11 ;22)(ql2; q24) или ее варианта t
(21;22), повреждающей ген EWS. Кроме того, саркома Юинга
и ПНЭО характеризуются неразличимыми постоянными структурами с экспрессией протоонкогена: уровни c-myc, c-myb/raf-1
выявляются одинаково у обеих опухолей.
Иммуногистохимическое исследование с помощью авидин-,
биотинпероксидазной техники позволяет обнаружить те или
иные маркеры нейродифференцировки: нейронспецифическую
энолазу, CD56 (Leu 7), протеин S-100, глиальный фибриллярный кислый протеин, синаптофизин, GD2, белки нейрофила-
ментов. Еще одним высокоспецифичным признаком саркомы
Юинга является экспрессия продукта псевдоаутосомного гена
MIC2p (Е2, CD99), выявляющегося более чем в 90—95 % случаев этого заболевания. Экспрессия данного белка крайне редко наблюдается при других негемопоэтических опухолях, а его
диагностика проводится с помощью специфичных моноклональных антител НВА71, RFB-1, 12Е7, 013.
Таким образом, общая характерная хромосомная транслокация и одинаковые нейральные характеристики некоторых клеточных линий саркомы Юинга и примитивной нейроэктодермальной опухоли свидетельствуют в пользу предположения, что
эти две опухоли сходны и представляют собой разные стадии
дифференцировки одного злокачественного типа.
Клиническая картина. Саркома Юинга поражает все кости
скелета, однако несколько чаще она развивается в длинных
трубчатых костях конечностей. В последних СЮ первично локализуется в диафизе, метафизе или эпифизе с последующим
быстрым прогрессированием по длиннику кости (рис. 16.1).
Наиболее типичной локализацией СЮ длинных трубчатых
костей является диафиз, откуда опухоль распространяется одинаково к центру и периферии кости и отчетливо отличается от
локализации опухоли в метафизе, характерной для остеогенной
саркомы. Через зону роста и суставной хрящ опухоль обычно не
распространяется.
В большинстве случаев первичный очаг располагается в бедренной кости и костях верхней конечности, реже — в большеберцовой и малоберцовой костях. Второй, наиболее типичной
локализацией являются кости таза, реже встречается локализация первичного очага в костях осевого скелета (позвонки, кости черепа), ребрах, лопатке, ключице. Нередко очаги поражения обнаруживаются почти одновременно в нескольких костях.
В отличие от остеогенной саркомы более часто поражаются
плоские кости скелета.
Саркома Юинга у детей характеризуется более злокачественным течением, чем у взрослых больных; она быстро растет и рано метастазирует. Наличие метастазов при первичном обращении диагностируется у 22—38 % пациентов. Метастазирование
в основном происходит гематогенным путем, при этом наибо-
382
12 3 4 5
Рис. 16.1. Типы роста опухоли Юинга при ее локализации в длинных
костях.
1 — центральный диафизарный; 2 — кортикальный (периферический) диафи-
зарный; 3 — центральный метафизарный; 4 — периферический метафизарный;
5 — метафизарно-эпифизарный.
лее часто обнаруживается поражение легких, костей, костного
мозга. В редких случаях наблюдаются метастазы в лимфатические узлы, которые рассматриваются как отдаленные, и вовлечение в процесс ЦНС.
Как и при других первичных злокачественных опухолях костей, наиболее частыми клиническими проявлениями саркомы
Юинга являются боль локального или радикулярного характера,
припухлость в области поражения и нарушение функции. Начало подострое или острое. Иногда заболевание протекает с ма-
ловыраженными клиническими симптомами. В половине всех
случаев больные отмечают в анамнезе травму. Боли тупые, тянущие, колющие, иногда едва ощутимые, постепенно нарастающие, усиливающиеся ночью, но не имеющие постоянного
характера. При остром и подостром начале наблюдается повышение температуры тела до 38—40 °С. Одновременно с болью
отмечаются недомогание, лейкоцитоз, увеличение СОЭ, анемия
и похудание. По мере роста опухоли появляется мягкотканный
компонент, быстро увеличивающийся в размере, сопровождающийся местной гиперемией, гипертермией и расширенными
подкожными венами, что приводит к нарушению функции пораженного органа. У большинства детей припухлость является
не только постоянным, но и первым симптомом заболевания.
383
рукция коркового слоя и образуется мягкотканный компонент;
• IV вариант протекает с умеренным вздутием кости, деструкцией ячеистого характера, разрушением коркового слоя
и мягкотканным компонентом.
При поражении ребра саркомой Юинга мягкотканный компонент, как правило, приобретает сферическую форму. Опухоль
инфильтрирует плевру и осложняет процесс плевритом. Все это
затрудняет диагностику деструктивных изменений ребра.
Традиционная рентгенография первичного очага должна
быть дополнена ультразвуковым исследованием, КТ и/или
МРТ с вычислением объема опухоли с целью определения прогностической группы риска. Радионуклидное исследование костной системы проводится для определения протяженности
первичной опухоли и выявления метастатических очагов в других костях скелета. Рентгенографию легких в двух проекциях
для выявления метастатического поражения легких рекомендуется дополнить КТ. При обнаружении образования, исходящего из грудной стенки и растущего в грудную полость, помимо
полипозиционного рентгенологического исследования, следует
производить суперэкспонированные снимки и томографию.
Если после такого исследования неясна локализация опухоли,
то необходимо сканирование скелета для определения вовлечения в процесс ребер.
Ультразвуковое исследование, ангиография, КТ, МРТ и радиоизотопное сканирование дают важную дополнительную информацию для уточнения истинного интрамедуллярного и мягкотканного распространения опухолевого процесса и решения
вопроса о сохранной операции, а также с целью динамического
контроля.
Лабораторные анализы обнаруживают умеренно повышенную СОЭ, незначительную анемию и лейкоцитоз. Повышение
уровня сывороточной ЛДГ коррелирует с объемом первичной
опухоли и неблагоприятным прогнозом.
Даже в типичных случаях клинико-рентгенологический диагноз саркомы Юинга должен быть обязательно подтвержден
морфологическим исследованием. Для этого производится тре-
панобиопсия с последующим гистологическим и цитологическим исследованием. При сомнительном морфологическом заключении необходима открытая биопсия для верификации диагноза. Пункцию костного мозга для исключения поражения
костного мозга необходимо проводить из нескольких мест.
Необходимо отметить, что принципиальным для оценки прогностической группы риска является расчет объема опухоли
до начала лечения. Расчет эллипсоидных опухолей (большой
объем мягкотканного компонента) производится по формуле:
а • b • с • 0,52, для цилиндрических опухолей длинных труб¬
386
чатых костей с небольшим мягкотканным компонентом —
а • b • с • 0,785.
Патоморфология. Опухоль, развиваясь в костномозговом канале, распространяется на костную ткань, оттесняя и разрушая
надкостницу, и поражает мягкие ткани. Внутрикостный компонент обычно твердой консистенции, в то время как внекост-
ный компонент мягкотканный, с участками кровоизлияний и
кистозной дегенерации. Гистологически саркома Юинга характеризуется бесструктурными массами мелких гиперхроматических клеток без заметных цитоплазматических включений, выявляемых на светооптическом уровне. Дополнительные исследования позволяют обнаружить наличие гликогена в 90 % клеток,
однако данный признак не является патогномоничным. Имму-
ногистохимическое исследование с помощью авидин-, биотин-
пероксидазной техники позволяет обнаружить те или иные маркеры нейродифференцировки: нейронспецифическую энолазу,
CD56(Leu7), протеин S-100, глиальный фибриллярный кислый
протеин, синаптофизин, GD2, белки нейрофиламентов.
В настоящее время отсутствуют четкие критерии дифференциальной диагностики между СЮ и примитивной нейроэктодермальной опухолью (ПНЭО). Однако обнаружение 2 или более
маркеров нейродифференцировки, наличие Homer-Wright розеток и/или признаков нейродифференцировки, выявленных при
электронной микроскопии, позволяет поставить диагноз примитивной нейроэктодермальной опухоли. Таким образом, показано, что СЮ и ПНЭО являются гистологически схожими мелкокруглоклеточными опухолями, имеющими единую хромосомную
транслокацию t (11;22), однако ПНЭО имеет гистологические и
иммуногистохимические черты нейральной дифференцировки.
Проведение всех звеньев иммуногистохимических и генетических исследований оправдано высокой специфичностью данных
методов и необходимо для дифференциальной диагностики опухолей семейства саркомы Юинга и других мелкокруглоклеточных сарком, таких как альвеолярная рабдомиосаркома, нейробластома, лимфосаркома, мелкоклеточная остеогенная саркома.
Цитогенетические исследования. Наиболее частой генетической
аберрацией при саркоме Юинга является транслокация t (11 ;22)
(q24; ql2) с повреждением соответственно генов EWS и FLY1,
которая встречается в 80—85 % случаев. Эта транслокация — одна из первых хромосомных аберраций, которая была клонирована и охарактеризована на молекулярном уровне. Результатом
транслокации является слияние генов EWS и FLY1. Ген EWS
кодирует РНК-связанный протеин, тогда как FLY1 — ДНК-свя-
занный протеин, относящийся к EWS-семейству факторов
транскрипции. Образованный химерный EWS—FLY1 онкопротеин содержит EWS-трансактиваторный домен и FLY1 ДНК-
связанный домен. Следовательно, EFY1 определяет ДНК-свя-
занную специфичность EWS-FLY1 онкопротеина, а N-конце¬
387
вая порция EWS обусловливает нарушение регуляции и последовательности активации генов, в норме отвечающих на FLY1
(или близкие ему белки семейства ETS), что является одним из
важнейших патогенетических механизмов развития саркомы
Юинга. Химерный EWS—FLY1 онкопротеин, по-видимому, является промотором экспрессии различных генов, принимающих
участие в неопластической трансформации. Некоторые авторы
объясняют роль EWS—FLY1 онкопротеина как нарушение регуляции транскрипции, тогда как другие предполагают его участие в ингибировании апоптоза.
Определение цитогенетических и молекулярных нарушений
используется при дифференциальной диагностике мелкокруглоклеточных сарком. Выявление транслокации t (11;22) возможно методами RTPCR (обратной транскрипционной полимеразной цепной реакции), флюоресцентной гибридизации in situ, ка-
риотипирования, что является отчетливым дифференциальнодиагностическим критерием СЮ/ПНЭО. Например, наличие t
(11;22) позволяет отдифференцировать СЮ, продуцирующую
костные или хрящевые элементы, от схожих с ней мелкоклеточной остеогенной саркомы и мезенхимальной хондросаркомы. В
ряде исследований показана зависимость варианта онкопротеина EWS—FLY1 и клинического течения болезни. EWS—FLY1 типа 1 (результат слияния экзона 7 гена EWS и экзона 6 гена FLY1)
является наиболее часто встречающимся и определяется в 65 %
случаев.
Остальные 35 % СЮ содержат широкий спектр различных
транскрипционных композиций участков EWS и FLY1. В указанных исследованиях было показано, что EWS—FLY1 типа 1 коррелирует с благоприятным прогнозом и в основном встречается у
пациентов, имеющих локализованное заболевание.
Реже встречается транслокация t (21;22), приводящая к образованию онкопротеина EWS—ERG. Наличие вторичных хромосомных аберраций, таких как трисомия +8, +12, +2, +5, +9,
+ 15; появление дополнительного материала в длинном или коротком плече хромосомы могут играть роль в прогрессировании
саркомы Юинга.
Еще одним высокоспецифичным признаком саркомы Юинга
является экспрессия продукта псевдоаутосомного гена М1С2р
(Е2, CD99), выявляющегося более чем в 90—95 % случаев этого
заболевания. Экспрессия данного белка крайне редко наблюдается при других негемопоэтических опухолях, а его диагностика проводится с помощью специфичных моноклональных
антител НВА71, RFB-1, 12Е7, 013.
Дифференциальная диагностика. Наибольшее значение в
дифференциальной диагностике опухоли Юинга имеет остеомиелит, реже диафизарный туберкулез. По клиническим и лабораторным данным опухоль Юинга иногда неотличима от гематогенного остеомиелита. Общими признаками являются ост¬
388
рое или подострое начало, высокая температура тела, местные
изменения в виде болей, нарушения функции пораженного органа, покраснения и припухлости, лейкоцитоз и увеличение
СОЭ. Дифференциальный диагноз должен проводиться с учетом сроков заболевания по фазам течения патологического
процесса. Деструктивные изменения в кости и выраженные периостальные реакции, выявленные в ранний период заболевания, свидетельствуют о наличии опухоли.
Большое значение в первые недели клинического проявления заболевания имеют обнаруженные рентгенологически изменения мягких тканей.
При опухоли Юинга мягкотканный компонент более или
менее четко отграничен межмышечными прослойками, а при
остеомиелите мягкие ткани инфильтрированы, поэтому межмышечные прослойки не дифференцируются и занимают большую протяженность. Наличие некрозов к концу первого-второго месяца от начала заболевания, а в более поздние сроки —
секвестров свидетельствует об остеомиелите. Наличие спикул
облегчает распознавание опухоли Юинга (табл. 16.1).
При относительно медленном течении и ремиссиях опухоли
Юинга из-за появления в ней реактивных процессов возникает
клинико-рентгенологическая картина, сходная с остеомиелитом
Гарре и диафизарным туберкулезом (табл. 16.2).
Различные варианты течения саркомы Юинга также следует
дифференцировать главным образом с другими злокачественными новообразованиями. Так, I и II варианты течения опухоли
Юинга рентгенологически необходимо дифференцировать с
остеогенной саркомой, хондросаркомой (не содержащая известковые включения); III вариант — с остеогенной склерозирующей саркомой; IV вариант — с ячеистым вариантом хондросаркомы и гемангиоэндотелиомой, миеломой и гигантоклеточной опухолью.
При гистологическом исследовании саркому Юинга следует
дифференцировать с другими мелкоклеточными саркомами, такими как эмбриональная рабдомиосаркома, нейробластома, мелкоклеточная остеогенная саркома и злокачественная лимфома.
Иммуногистохимическое исследование может быть решающим
в дифференциальном диагнозе СЮ с другими мелкокруглоклеточными опухолями.
Принципы лечения больных. До появления новых эффективных противоопухолевых лекарственных препаратов и рациональных схем полихимиотерапии более 90 % детей умирали в
течение 2—5 лет после установления диагноза заболевания от
метастазов в легкие и/или кости. Первым методом лечения, доказавшим свою эффективность при саркоме Юинга, был метод
локальной лучевой терапии. Однако пациенты, подвергшиеся
только данному методу воздействия, менее чем в 10 % случаев
переживали 2-летний срок.
389
Таблица 16.1. Дифференциальная рентгенодиагностика опухоли
Юинга и острого гематогенного остеомиелита
Нозологические единицы
Признаки
саркома Юинга в фазе
прогрессирования
опухолевого процесса
острый гематогенный
остеомиелит
Локализация
Изменения структуры пораженного
участка кости
Периостальные
реакции
Спикулы
Изменения в мягких тканях пораженного сегмента
конечности
Диафиз с распространением на метафизы;
метафиз с последующим распространением
на диафиз. Ростковая
зона временно препятствует распространению опухоли на эпифиз
Потеря четкости внутреннего контура коркового слоя с возникновением очагов деструкции без образования
некроза и секвестрации
Как правило, возникают линейные, многослойные, разорванные
и козырьковые периос-
тозы
Наблюдаются в 20—
30 % случаев
Локальная припухлость
с максимальным увеличением размеров на
уровне наиболее выраженной деструкции
Метафиз с распространением процесса на
диафиз и через ростковую зону на эпифиз
Очаги деструкции быстро сливаются с образованием обширных
участков остеолиза с
некрозами и формирующимися секвестрами
Всегда возникают линейные, многослойные
и разорванные периоститы
Отсутствуют
Распространенное увеличение размеров мягких тканей, которое
предшествует деструктивному процессу
За последние 15 лет применение химиотерапии в сочетании
с локальным контролем (хирургическое вмешательство и/или
облучение) позволило более чем 2/з больным пережить 5-лет-
ний рубеж.
Эффективность лечения оценивается по стандартным критериям ВОЗ для костных опухолей: полный эффект может быть
установлен лишь после тотальной резекции опухолевого очага,
при морфологически подтвержденном лечебном патоморфозе
опухоли IV степени (т. е. при отсутствии жизнеспособной опухолевой ткани) и отсутствии отдаленных метастазов; частичный
клинический эффект — редукция более 50 % опухолевой массы
по сравнению с первоначально диагностированным объемом
продолжительностью не менее 2 нед, отсутствие новых опухолевых очагов; стабилизация заболевания — редукция менее
390
Таблица 16.2. Дифференциальная рентгенодиагностика опухоли
Юинга с диафизарным туберкулезом и остеомиелитом Гарре
Нозологические единицы
Признаки
саркома Юинга в
фазе относительной
ремиссии
диафизарный
туберкулез
остеомиелит
Гарре
Локализация
Метафиз, мета-
диафиз, диафиз
Диафиз
Диафиз
Характерно
Разнообразная
Деструкция, раз¬
Деструктивный
тика деструк-
деструкция губча-
рушающая кость
процесс слабо
ции
той кости, а также
коркового слоя
и ассимилированные периостальные наслоения
выражен либо
отсутствует
Остеосклероз
Умеренный
Умеренно
выражен
Выражен
Периосталь¬
Ассимилирую¬
Ассимилирован¬
Ассимилиро¬
ная реакция
щиеся периостозы
ные и ассимилирующиеся периоститы
ванные периоститы
Спикулы
Наблюдаются в
20-30 %
Отсутствуют
Отсутствуют
Толщина
Временно сущест¬
Размеры увеличе¬
Постоянно
кости
вующее увеличение размеров
ны по типу
“вздутия”
выраженное
утолщение
кости
Изменения в
мягких
тканях
Локально увеличены в размерах с
повышением их
интенсивности
Не изменены
Некоторое повышение интенсивности
50 % или увеличение более 25 % от первоначального объема
опухоли для всех известных очагов; прогрессия заболевания —
увеличение более 25 % от первоначального объема поражения
или появление новых метастазов.
Оперативное лечение. Локальный контроль может
быть достигнут с помощью хирургического вмешательства или
лучевой терапии.
Радикальное удаление первичной опухоли с минимальными
косметическими и функциональными нарушениями, выполненное после неоадъювантной химиотерапии, в большинстве
случаев обеспечивает стойкое излечение саркомы Юинга. Особые сложности имеются при опухолях тазовых костей. Только
в редких случаях в этой зоне встречаются первичные операбельные опухоли. Большинство из них имеет большие размеры с
инвазией мягких тканей и проникновением в полость таза и является неоперабельными.
391
Предоперационная лучевая терапия не увеличивает число
осложнений в послеоперационном периоде и в некоторых случаях необходима с целью снижения размеров, васкуляризации
опухоли и предотвращения интраоперационного разрыва опухоли. По данным ряда авторов, наиболее эффективно проведение операции в первые 10 нед от начала лечения с целью снижения риска отдаленного метастазирования.
В последние годы принципиально изменились подходы к
оперативному вмешательству по сравнению с ранее принятыми традиционными установками, когда операции выполнялись только по индивидуальным показаниям (рецидивы, патологические переломы, наличие кровотечения) у 10—20 % больных.
В настоящее время все больные должны подвергаться хирургическому лечению, за исключением неоперабельных локализаций (кости таза, позвоночник). Во время операции должен
осуществляться так называемый принцип абластики — широкая резекция пораженной кости вместе с окружающими нормальными мышцами во всех направлениях, т. е. единым мы-
шечно-фасциально-футлярным блоком с обязательным удалением всех мест предыдущих биопсий.
При наличии патологического перелома конечности, кровотечения в месте первичного очага поражения вследствие распада
новообразования показано удаление опухоли в объеме ампутации или экзартикуляции конечности на первом этапе лечения
(до проведения индуктивной химиотерапии). При возможности
радикального удаления первичного опухолевого очага с сохранением функции пораженного органа операция должна быть
выполнена на первом этапе лечения. При невозможности проведения органосохранной операции на первом этапе лечения ее
нужно осуществить после 3-го курса индуктивной химиотерапии
при локализованном процессе и после 4-го или 5-го курса — при
прогностических неблагоприятных вариантах СЮ/ПНЭО. Необходимо подчеркнуть, что во всех случаях химиотерапия начинается через 24 ч после проведения операции.
После удаления опухоли определяют степень лечебного па-
томорфоза по Huvos с выявлением жизнеспособных опухолевых клеток в гистотопографических срезах:
• I степень — незначительное или полное отсутствие эффекта;
• II степень — от 50 до 95 % ткани опухоли некротизировано;
• III степень — более 95 % опухоли некротизировано,
встречаются лишь небольшие фокусы жизнеспособной
опухолевой ткани;
• IV степень — отсутствие жизнеспособной опухолевой
ткани.
392
Лучевая терапия. Лучевое лечение широко использовалось из-за высокой радиочувствительности саркомы Юинга с
целью излечения первичной опухоли. Высокий процент локальных рецидивов после облучения стало толчком к успешному использованию полихимиотерапии и расширению показаний к
оперативному вмешательству.
Эффективность радиологического контроля зависит от адекватности дозы лучевой терапии (ЛТ) и выбранного объема облучения.
В настоящее время в большинстве международных протоколов (EICESS92, EICESS99, CCG и др.) и в клинике НИИ ДО
РОНЦ РАМН принят дифференциальный подход к лучевой терапии в зависимости от эффективности неоадъювантной химиотерапии (XT) и хирургического этапа лечения. При полном
радикальном удалении опухоли ЛТ не проводится; при микроскопически обнаруживаемой остаточной опухоли после ее удаления облучение осуществляется в суммарной очаговой дозе
(СОД) 35—45 Гр; при макроскопически остаточной опухоли и
неоперабельных локализациях — 50—55 Гр. Не используются
более высокие дозы ЛТ (60 Гр и выше) в связи с высоким риском инвалидизации пациентов из-за развития поздних лучевых
осложнений и увеличением риска появления вторичных опухолей (остеогенная саркома) в облученной кости.
Объем облучения жизненно важных органов не должен превышать следующих уровней:
• спинной мозг — не более 30 Гр;
• сердце — не более 18 Гр на менее чем 50 % объема органа;
• печень — не более 18 Гр на менее чем 50 % поверхности
органа;
• почки — одна из двух почек не должна подвергаться облучению;
• тонкий кишечник — не более 30 Гр.
При локализованных формах СЮ/ПНЭО в случае выполнения оперативного вмешательства на первом этапе лечения лучевую терапию проводят после 1-го курса химиотерапии; при выполнении операции после проведения 3 курсов химиотерапии
4-й курс проводят в послеоперационном периоде с последующим
облучением. В случае микроскопически определяемой остаточной опухоли ЛТ назначают в СОД 30 Гр в режиме стандартного
фракционирования (разовая очаговая доза — РОД 2 Гр). При
макроскопически остаточной опухоли и неоперабельных локализациях ЛТ проводят после 3-го, 4-го или 5-го курсов химиотерапии в соответствии со стандартными принципами: объем
облучаемой зоны должен включать всю область распространения опухоли на момент постановки диагноза + 2 см вокруг пораженного участка. Облучение проводят в режиме гиперфрак¬
393
ционирования в дозе 1,5 Гр 2 раза в день с интервалом 6 ч, 5 дней
в неделю; СОД 50 Гр.
Крупнопольное облучение легких также доказало свою эффективность в профилактике рецидивов, повысив 4-летнюю
выживаемость у больных с изолированным метастатическим
поражением легких с 13 до 53 % случаев [Jurgens Н., 1998]. Облучению подвергаются также и все выявленные метастатические очаги (СОД 30—36 Гр).
Крупнопольное облучение легких проводят после 2-го курса
полихимиотерапии в режиме стандартного фракционирования —
РОД 1,2 Гр, СОД 12 Гр. При сохранении очагов в легких после
6-го курса полихимиотерапии дополнительно производится локальное облучение очагов — СОД 12 Гр. Суммарная площадь облучения легочных метастазов не должна превышать 25 % от общей поверхности легких.
Все костные метастазы должны облучаться в объеме, установленном при первичной диагностике до начала специального
лечения. Облучение костных метастазов производится после
5-го курса полихимиотерапии параллельно облучению основного очага. Не подвергаются облучению костные поражения,
определявшиеся только по данным сцинтиграфии и исчезнувшие после 2-го курса химиотерапии. Облучение при поражении
более 50 % миелопролиферативных зон требует дополнительной консультации радиолога. Облучение проводят в режиме
стандартного фракционирования — РОД 1,5 Гр в день, СОД
30 Гр.
При наличии изолированного метастаза в кости черепа облучают все кости черепа (СОД 24 Гр) с последующим локальным облучением метастатического очага — СОД 6,6 Гр. Метастазы в ЦНС облучают после 2-го курса химиотерапии в СОД
30 Гр. Регионарные и другие метастазы должны подвергаться
облучению в объеме начального поражения с захватом 2 см от
зоны нормальных тканей в режиме стандартного фракционирования (РОД 1,5 Гр, СОД 30 Гр).
Необходимо отметить, что суммарная площадь облучения не
должна превышать 30 % поверхности тела (не более 50 % миелопролиферативных зон). Если необходимо облучать большую
площадь, то преимущество имеют опухолевые очаги, плохо регрессировавшие на индуктивной терапии. Очаги же, не выявляемые доступными диагностическими методами к моменту начала
ЛТ, не облучают. Вопрос об их облучении решается индивидуально после консультации с радиологом. Программа облучения
пациентов, имеющих другие метастатические поражения, составляется индивидуально.
Химиотерапия. Сочетание адъювантной химиотерапии,
лучевой терапии и расширение хирургического подхода улучшили прогноз для пациентов с саркомой Юинга и примитивной нейроэктодермальной опухолью.
394
В настоящее время в большинстве протоколов для лечения
неблагоприятных в прогностическом отношении СЮ/ПНЭО
используют альтернирующие курсы VAC, VAdrC, IE (ифосфа-
мид + вепезид). Существующие программы лечения больных с
СЮ/ПНЭО из групп высокого риска включают высокоэффективные лекарственные препараты с обязательным увеличением
дозовой интенсивности и уменьшением интервалов между курсами полихимиотерапии (ПХТ). Эффективность замены цик-
лофосфана на ифосфамид в курсовой дозе 9 г/м2 (курс VAIA)
у больных с первично-диагностированной СЮ/ПНЭО в протоколе ЕТ-2 (UK) позволила добиться достоверного увеличения
бессобытийной 6-летней выживаемости по сравнению с предыдущим ЕТ-1 исследованием с 34 до 51%. В исследовании
CESS-86 показано увеличение 5-летней бессобытийной выживаемости у больных с локализованными нерезектабельными
СЮ/ПНЭО с 44 до 58 % по сравнению с предыдущим исследованием CESS-81 при применении к ним дифференцированного подхода и интенсивного облучения. В этой группе больных
высокого риска (тазовая и другая центральная локализация)
циклофосфан был заменен на ифосфамид в комбинации с ад-
риамицином, винкристином, актиномицином. Общая длительность лечения — 12 курсов с облучением после 6 курсов ПХТ
в СОД 60 Гр.
Более чем 65 % детей с первично-локализованным процессом имеют долговременную безрецидивную выживаемость при
проведении современных программ лечения. Однако пациенты
с наличием метастазов на момент постановки диагноза и больные с локализованной формой заболевания с неблагоприятной
локализацией опухоли (кости таза, кости осевого скелета) или
имеющие объем новообразования более 100 см2 образуют группу с очень плохим прогнозом, безрецидивная выживаемость в
которой составляет 21—42 %.
В предварительных исследованиях была выявлена эффективность химиотерапевтических протоколов, включающих вы-
сокодозную химиотерапию (ВХТ) в самостоятельном варианте
или в комбинации с тотальным облучением тела для пациентов
с прогностически неблагоприятными формами СЮ. С начала
80-х годов была доказана эффективность высоких доз мелфа-
лана в сочетании с аутотрансплантацией стволовых клеток у
больных с СЮ/ПНЭО с крайне неблагоприятным прогнозом
на стандартную ПХТ. За период с 1978 по 1999 г. в 89 европейских центрах проведено 192 ВХТ с трансплантацией гемопоэтических клеток пациентам с СЮ. Многофакторный анализ
лечения больных группы высокого риска СЮ/ПНЭО с применением ВХТ в Европе показал высокую эффективность данного
метода.
В 1997 г. в НИИ ДО РОНЦ РАМН был создан протокол ES-
IPO-97 для пациентов группы высокого риска, состоящий из
395
индуктивной химиотерапии в соответствии с протоколом
CCG—7951; локальной терапии в виде хирургического удаления опухоли и/или облучения; фазы консолидации в виде ВХТ
с последующей трансплантацией гемопоэтических стволовых
клеток или стандартной химиотерапии для пациентов, подвергшихся радикальному хирургическому вмешательству локализованной опухоли.
Индуктивная фаза протокола включает 5 курсов ПХТ в альтернирующем режиме — 1-й, 3-й и 5-й курсы по схеме: винкри-
стин, 1,5 мг/м2 в 1-й, 8-й, 15-й дни, адриамицин, 37,5 мг/м2 в
1-й, 2-й дни в виде 24-часовой инфузии, циклофосфан, 2,1 г/м2 в
1-й, 2-й дни (блок А); 2-й и 4-й курсы ПХТ по схеме: ифосфа-
мид, 2,4 г/м2 в 1—5-й день, этопозид, 100 мг/м2 в 1—5-й день
(блок В). Интервал между курсами составляет 21 день; критерием начала очередного курса ПХТ является восстановление уровня лейкоцитов >1,5 • 10ул и тромбоцитов >75 • 109/л. Забор периферических стволовых клеток и эксфузию костного мозга для
обеспечения проведения ВХТ производят минимум после 2
курсов индуктивной ПХТ при условии санации костного мозга.
Пациенты с метастатическим поражением легких подвергаются
крупнопольному облучению легких в СОД 12 Гр после 2-го
курса индуктивной ПХТ. Лучевая терапия на область первичного поражения проводится в СОД 50—55 Гр, на область метастатических очагов — в СОД 30—36 Гр. В некоторых случаях
при наличии множественных костных поражений часть метастатических очагов облучают после проведения ВХТ. Схема
ВХТ: бисульфан — 16 мг/кг на курс, мелфалан — 140 мг/м2 на
курс, тиофосфамид — 600 мг/м2 на курс с последующей трансплантацией аутологичных гемопоэтических стволовых клеток.
Для пациентов с саркомой Юинга/примитивная нейроэктодермальная опухоль группы стандартного риска (отсутствие регионарных и отдаленных метастазов, объем опухоли менее
150 мм3, отсутствие патологического перелома или прорастания
опухоли в магистральные сосуды) рекомендовано проведение
10 курсов ПХТ в альтернирующем режиме. Каждый курс нужно
начинать на 21-й день от начала предыдущего или при восстановлении абсолютного числа лейкоцитов >2 • 109/л, тромбоцитов >7,5 • 1012/л (но не позднее 25-го дня). Уровень креатинина
сыворотки крови не должен превышать 2-кратного нормального
уровня и 1,5-кратного перед назначением ифосфамида.
Схема полихимиотерапии для детей со стандартным риском
СЮ/ПНЭО
Блок VAC
• винкристин — 1,5 мг/м2 (максимальная доза) в 1-, 8-, 15-й
день, в/в струйно;
396
• циклофосфан — 1400 мг/м2 в 1-й и 2-й день внутривенно
капельно за 1 ч в 200 мл 0,9 % раствора NaCl (курсовая
доза 2,8 г/м2);
• Месна — 1600 мг/м2 в 1-й и 2-й дни внутривенно. Первые
400 мг/м2 за 4 ч капельно в 0,9 % растворе NaCl (начать
вместе с циклофосфаном), затем внутривенно капельно в
течение суток или по 300 мг/м2 через каждые 3 ч внутривенно струйно или внутрь;
• доксорубицин — 25 мг/м2 в 1-й и 2-й дни внутривенно капельно в виде 4-часовой инфузии (курсовая доза 50 мг/м2).
Блок IE
• ифосфамид — 3 г/м2 в 1—3-й день внутривенно капельно в
200 мл 0,9 % раствора NaCl за 1 ч (курсовая доза 9,0 г/м2).
Месна — 3000 мг/м2 в 1—3-й день внутривенно. Первые
800 мг/м2 за 4 ч капельно в 0,9 % растворе NaCl (начать
параллельно с ифосфамидом), затем внутривенно капельно в течение суток или по 600 мг/м2 через каждые 3 ч
внутривенно струйно или внутрь;
• этопозид — 150 мг/м2 в 1—3-й день внутривенно капельно
1-часовая инфузия (концентрация вепезида: 0,2—0,4 мг/мл
разводят в 0,9 % растворе NaCl или 5 % растворе глюкозы;
курсовая доза 450 мг/м2).
При отсутствии ифосфамида он может быть заменен на циклофосфан (БЛОК СЕ) в эквитоксической дозе (циклофосфан —
750 мг/м2 в 1—3-й день внутривенно капельно в 200 мл 0,9 %
раствора NaCl за 1 ч (курсовая доза 2,25 г/м2) с аналогичным
применением месны.
Биотерапия. Пилотное исследование, проведенное с целью воздействия на минимальную резидуальную болезнь с помощью каскадных реакций, развивающихся на экзогенное введение интерлейкина-2, после проведения ВХТ и трансплантации костного мозга (ТКМ), позволило снизить процент
рецидивов.
Прогностические факторы. В ходе проведения основных исследовательских протоколов были выявлены следующие прогностические факторы: наличие метастазов на момент
постановки диагноза, локализация первичного очага поражения в костях таза и осевого скелета по сравнению с поражением
костей конечностей, возраст старше 15 лет, объем опухоли более
100 см2 или поражение >8 см по длиннику трубчатой кости, повышение уровня сывороточной ЛДГ, наличие патологического
перелома.
Значимыми прогностическими факторами являются метастазы, дозовая интенсивность химиотерапии, выраженность лечебного патоморфоза.
397
Глава 17 | ОПУХОЛИ ПОЛОВЫХ ОРГАНОВ У ДЕТЕЙ
Злокачественные опухоли половых органов составляют от 3 до
4 % от числа злокачественных новообразований детского возраста. Большинство опухолей половых органов у детей сочетается с пороками развития.
Эмбриогенез мочеполовой системы человека очень сложен.
Развитие мочевой и половой систем идет неразрывно и совместно путем деления эмбрионального урогенитального гребня на
медиальную (генитальную) и латеральную (нефрогенную) части. На ранней стадии эмбрион обладает потенцией развития
как в мужскую, так и в женскую особь. Генетический пол эмбриона детерминируется при оплодотворении и зависит от генотипа зиготы (XX или XY). Он определяет становление гонадного пола (формирование мужских или женских половых желез), а гонадный пол — становление фенотипического пола.
Половая дифференцировка может быть нарушена на любом
этапе. Расстройства могут быть вызваны изменением числа хромосом, мозаицизмом (часть клеток имеет нормальный кариотип, другая — нарушенный), аберрациями половых хромосом
(изменение структуры хромосомы: разрывы, делеции, транслокации), мутациями генов, участвующих в становлении гонадного и фенотипического пола, а также негенетическими причинами (прием различных медикаментов во время беременности
и т. д.). Примордиальные герминогенные клетки формируются
из эндодермы желточного мешка на 4—6-й неделе внутриутробного развития и начинают мигрировать в развивающийся эмбрион, а именно в урогенитальный гребень. Внутренние половые органы дифференцируются на 10—12-й неделе внутриутробного развития. В процессе своего развития половые органы
все более изолируются от мочевой системы и смещаются в малый таз. Установлено, что дифференцировка половых желез
справа и слева происходит независимо. Яичники не принимают
участия в дифференцировке парамезонефральных (мюллеро-
вых) протоков, а также в формировании наружных гениталий. У
зародышей женского пола мезонефральные (вольфовы) протоки
дегенерируют, а парамезонефральные формируют маточные
трубы, тело и шейку матки, а также часть влагалища. С 12-й по
20-ю неделю внутриутробного развития формируются наружные половые органы. У плода женского пола дифференцировка
наружных гениталий происходит независимо от состояния гонад
вследствие автономной тенденции к развитию по женскому типу.
Превращение половых тяжей в яички определяется геном SRY
(sex-determining region Y), локализованным на Y-хромосоме. К
9-й неделе эмбриогенеза клетки Сертоли начинают секретиро-
вать фактор регрессии парамезонефральных протоков, а клетки
Лейдига — тестостерон. Под действием тестостерона из мезо-
398
нефрального протока формируются придаток яичка, семявыно-
сящий проток, семенной пузырек и семявыбрасывающий проток. Тестостерон не диффундирует на противоположную сторону зародыша и поэтому действует только на ближний к яичку
мезонефральный проток. Если рядом с этим протоком находится
яичник или если яичко не секретирует тестостерон, то проток
дегенерирует. Неполноценность эмбрионального яичка (дисге-
незия) в этом периоде способствует нарушению половой диф-
ференцировки. Дисгенетичные яички не обеспечивают регрессию парамезонефральных протоков, что способствует развитию
дериватов этих протоков (матки, маточных труб и верхней трети
влагалища) и бисексуальных наружных гениталий.
У больных, в гонадах которых есть линия клеток, содержащих Y-хромосому, повышена частота опухолей половых желез.
Для пациентов, у которых наружные половые органы скорее
мужские или сомнительные, повышен риск развития опухоли
гонады. Чаще развиваются опухоли половых желез у больных с
чистой XY-дисгенезией гонад, наследуемой рецессивно-сцеп-
ленно с Х-хромосомой. Наилучшая тактика в отношении интер-
сексульных нарушений — профилактическое удаление расположенных внутриабдоминально половых желез или их остатков
у больных, у которых обнаруживают Y-хромосому, или если
имеются основания полагать, что она есть. К этой группе относятся больные с синдромом Тернера, у которых есть хотя бы
минимальные признаки вирилизации, и с чистой XY-дисгене-
зией гонад. При чистой XY-дисгенезии гонад описаны опухоли,
возникшие у больных в возрасте 7 лет, поэтому больным этой
группы следует удалять гонады, как только поставлен диагноз. К
сожалению, не все эндокринологи разделяют эту точку зрения.
Перечень патологических состояний, при которых наблюдаются опухоли яичек и яичников, следующий:
• смешанная дисгенезия гонад (XO/XY);
• чистая дисгенезия гонад;
• синдром тестикулярной феминизации;
• истинный гермафродитизм;
• крипторхизм;
• семейные опухоли яичек;
• рак яичника, доминантная форма;
• андробластома (опухоль, содержащая как клетки Лейдига,
так и клетки Сертоли) — рак щитовидной железы;
• синдром семейного рака;
• синдромы, включающие рак яичника:
а) Пейтца — Егерса;
б) Гарднера;
в) базально-клеточного невуса;
г) атаксия-телеангиэкгазия;
д) Штейна—Левенталя.
399
Таким образом, нарушения, возникающие во время беременности у эмбриона и плода, приводят к развитию не только пороков (неопущение яичка, неполное или полное удвоение органов — почки, мочеточников, матки и влагалища и т. д.), но и
опухолей мочеполовой сферы (опухоли яичников, яичка, влагалища). Единый эмбриогенез половой гонады через стадию индифферентной гонады ведет к развитию опухолей, одинаковых
по морфологической структуре как у мальчиков, так и у девочек.
Злокачественные опухоли половых органов у девочек наблюдаются преимущественно в яичниках (86 %); в 10 % случаев —
во влагалище и шейке матки. Очень редко они локализуются в
вульве. Поражение тела матки не характерно для детского возраста.
Злокачественные опухоли половых органов у девочек встречаются в любом возрасте — от периода новорожденное™ до
15 лет. Однако имеются определенные закономерности в структуре заболеваемости в зависимости от возраста. До 5 лет чаще
отмечено поражение влагалища и шейки матки, а в старшем возрасте (особенно в периоде полового созревания) — яичников.
Международная классификация опухолей яичников названа
гистологической, но при этом она согласуется с клинико-био-
лошческими характеристиками опухолей и применима в клинической практике (ВОЗ, 1973). Приводим ее в сокращенном
варианте:
I. Эпителиальные опухоли
II. Опухоли стромы полового тяжа
А. Гранулезостромально-клеточные опухоли
Б. Андробластомы: опухоли из клеток Серголи и Лейцита
Г. Неклассифицируемые опухоли стромы полового тяжа
III. Липидно-клеточные опухоли
IV. Герминогенные опухоли
V. Гонадобластома
VI. Опухоли мягких тканей, неспецифичные для яичника
VII. Неклассифицированные опухоли
VIII. Вторичные (метастатические) опухоли
В этой классификации гонадобластома выделена особо не
только в связи с клиническими проявлениями, но и как опухоль, наиболее часто сочетающаяся с пороками половой диф-
ференцировки. Ряд авторов считают, что гонадобластома встречается исключительно в дисгенетичных гонадах мужчин с кариотипом 46, XY или у индивидуумов с мозаичным кариотипом,
у которых в дисгенетичной гонаде есть клеточная линия, содержащая Y-хромосому, поэтому данную гонаду следует классифицировать как яичко. Однако более правильно будет считать,
что гонадобластома — это опухоль дисгенетичной гонады и может быть как у индивидуумов с кариотипом 46, XY, так и 46,
XX. Учитывая, что дисгенетичная гонада с кариотипом 46, XY
400
расположена не физиологично в забрюшинном пространстве,
риск опухолевого перерождения ее выше, чем у гонады с кариотипом 46, XX. Очень часто данная опухоль определяется
вместе с дисгерминомой, поэтому при обследовании больных,
у которых установлено наличие гонадобластомы или дисгерми-
номы, необходимо выявление кариотипа для определения лечебной тактики.
Из всех морфологических типов наиболее часто встречаются
герминогенные опухоли яичников (до 80 %) и опухоли стромы
полового тяжа (до 13 %). Эпителиальные опухоли, или истинные раки яичников, не характерны для детского возраста и составляют 7 %. Это наиболее важное отличие в структуре заболеваемости детей от взрослых, где преобладает рак яичников.
Герминогенные опухоли — новообразования, типичные для
детского возраста, составляют до 3 % всех злокачественных
опухолей у детей. Эти опухоли чрезвычайно разнообразны по
своему морфологическому строению, клиническому течению и
прогнозу.
Герминогенные опухоли встречаются в 2 раза чаще у девочек. Имеется 2 пика заболеваемости герминогенными опухолями в детском возрасте: у детей до 2 лет со снижением к 6 годам
и в возрасте 13—14 лет. Пик заболеваемости герминогенными
опухолями подростков 13—14 лет обусловлен в основном поражением яичников.
Наиболее часто герминогенные опухоли выявляются в яичниках, яичках и крестцово-копчиковой области. Не исключено
поражение забрюшинного пространства, средостения и влагалища. Как правило, это те области, где наиболее часто бывают
пороки развития.
Вопросы морфологической классификации и гистогенеза гер-
миногенных опухолей тесно взаимосвязаны. Предложена следующая морфологическая классификация герминогенных опухолей гонадной и экстрагонадной локализации (ВОЗ, 1985).
I. Опухоли одного гистологического типа:
1. Герминома (семинома, дисгерминома) классическая
2. Сперматоцитная семинома (только в яичке)
3. Эмбриональный рак
4. Опухоль желточного мешка (эндодермального синуса)
5. Полиэмбриома
6. Хориокарцинома
7. Тератома:
A. зрелая,
B. незрелая,
C. со злокачественной трансформацией (только в яичнике),
Д. с односторонней направленностью дифференциров-
ки (струма яичника, карциноид)
401
II. Опухоли более чем одного гистологического типа в различных комбинациях.
Отмечено, что чаще у детей встречаются зрелые и незрелые
тератомы, затем опухоли желточного мешка и герминогенные
опухоли сложного строения. При сопоставлении морфологического строения опухоли и ее локализации отмечены некоторые
закономерности. В яичниках чаще всего встречаются герминогенные опухоли сложного строения, тератомы и дисгерминомы.
При локализации опухолевого поражения в яичке на первом
месте стоит опухоль желточного мешка, затем тератомы, герминогенные опухоли сложного строения и т. д. Во влагалище
чаще встречается опухоль желточного мешка.
В клинической картине новообразований яичника ведущими
симптомами являются боли в животе, увеличение размеров живота и наличие "уплотнения" в брюшной полости. У ряда больных
могут быть признаки преждевременного полового созревания
или отсутствие признаков полового развития. Нередко больных
с опухолями яичника госпитализируют в хирургические стационары с картиной "острого живота", которая обусловлена перекру-
том ножки опухоли или ее разрывом. Только при диссеминации
процесса появляются симптомы интоксикации: вялость, бледность кожных покровов, снижение аппетита, похудание и т. д.
Диагностика и дифференциальная диагностика опухолей яичников включает в себя тщательно собранный анамнез, общеклиническое обследование, пальпацию образования, осмотр per rectum, пальпацию органов брюшной полости с миорелаксантами,
рентгенологическое исследование органов грудной клетки, экскреторную урографию, ультразвуковое исследование области
поражения. В неясных случаях для уточнения локализации поражения или распространенности процесса показаны компьютерная томография, ангиография, ирригоскопия, цистоскопия
и т. д. В процессе обследования необходимо обращать внимание на зоны метастазирования: лимфатические узлы, легкие,
печень, кости.
При подозрении на герминогенную опухоль любой локализации необходима постановка реакции на альфа-фетопротеин
(АФП): АФП — а-глобулин сыворотки эмбриона и плода. После рождения отмечается быстрое снижение титра АФП. Стойкое и интенсивное возобновление продукции АФП характерно
для герминогенных опухолей. Кроме того, для хориокарцино-
мы характерно увеличение титра хорионического гормона (ХГ).
Проведение указанных реакций позволяет уточнить не только
диагноз, но и следить за эффективностью проводимого лечения, так как уровни АФП и ХГ в сыворотке коррелируют с объемом опухолевых масс.
Данные комплексного обследования позволяют установить
стадию опухолевого процесса.
402
T1 — поражение ограничено яичниками:
Т1а — один яичник, капсула интактна,
Т1б — оба яичника, капсула интактна,
Tie — разрыв капсулы, опухоль на поверхности, злокачественные клетки в асцитической жидкости или смыве
из брюшной полости.
Т2 — распространение в таз:
Т2а — матка, трубы,
Т2б — другие ткани таза,
Т2с — злокачественные клетки в асцитической жидкости
или смыве из брюшной полости.
ТЗ — внутрибрюшинные метастазы за пределами таза и/
или метастазы в регионарных лимфатических узлах:
ТЗа — микроскопически определяемые внутрибрюшинные
метастазы,
ТЗб— макроскопически определяемые внутрибрюшинные
метастазы до 2 см,
ТЗс — внутрибрюшинные метастазы более 2 см и/или метастазы в регионарные лимфатические узлы.
Т4 — отдаленные метастазы (исключая внутрибрюшинные).
Приме чан ие. Метастазы в капсулу печени классифицируются как
ТЗ — стадия III, метастазы в паренхиме печени — как Ml — стадия IV;
позитивные цитологические находки в плевральной жидкости как Ml —
стадия IV.
Прогноз у больных с опухолью яичников определяется возможностью радикального удаления опухоли.
Лечение. Как правило, при опухолях яичников можно выполнить оперативное вмешательство на первом этапе лечения.
Оперативное лечение заключается в удалении придатков матки на стороне поражения и резекции большого сальника,
так как на большом клиническом материале установлено, что
поражение злокачественной опухолью яичника носит односторонний характер. В случае развития опухолевого поражения одного яичника на фоне дисгенезии гонад необходимо удаление
другого, так как риск поражения другой гонады резко возрастает.
Необходимо подчеркнуть, что при истинном раке яичников,
который у детей бывает очень редко, необходима операция в
объеме ампутации или экстирпации матки с придатками с обеих сторон и резекцией большого сальника. Очень высока роль
срочного гистологического исследования удаленной опухоли
для решения вопроса об объеме оперативного вмешательства,
особенно если определяется повышенный уровень СА-125.
Срочное гистологическое исследование показано и в том случае, когда не определяются опухолевые маркеры: АФП, ХГ. Не
установлено сочетание герминогенной опухоли и рака яичников или опухолей стромы полового тяжа и т. д., поэтому опре¬
403
деление указанных маркеров отвергает возможность наличия
рака яичника.
Химиотерапия является обязательным компонентом в
лечении герминогенных опухолей. Для лечения герминогенных
опухолей яичников мы рекомендуем схему VAB-6 в.
• Винбластин — 4 мг/м2 внутривенно в 1-й день
• Циклофосфан — 600 мг/м2 внутривенно в 1-й день
• Дактиномицин — 1 мг/м2 внутривенно капельно в 1-й
день
• Блеомицин — 15 мг/м2 внутривенно в 1-й, 2-й, 3-й дни
• Цисплатин — 100 мг/м2 внутривенно капельно в 4-й день
Интервалы между курсами 3—4 нед. Проводится 6 курсов
указанной химиотерапии. С целью уменьшения легочной токсичности блеомицина предложены другие модификации.
• Винбластин — 3 мг/м2 внутривенно в 1-й, 2-й дни
• Блеомицин — 10 мг/м2 внутривенно в 1-й, 2-й, 3-й дни
• Цисплатин — 20 мг/м2 внутривенно в 4-й, 5-й, 6-й, 7-й,
8-й дни
или
• Блеомицин — 15 мг/м2 внутривенно или внутримышечно
1 раз в неделю № 12
• Этопозид — 100 мг/м2 внутривенно в 1-й, 2-й, 3-й, 4-й,
5-й дни
• Цисплатин — 20 мг/м2 внутривенно в 1-й, 2-й, 3-й, 4-й,
5-й дни или
• Этопозид — 100 мг/м2 внутривенно в 1-й, 2-й, 3-й дни
• Ифосфамид — 1500 мг/м2 внутривенно в 1-й, 2-й, 3-й, 4-й,
5-й дни с уромитексаном в стандартном режиме.
Курсы химиотерапии следует проводить с интервалом 3 нед.
Основные мероприятия профилактики осложнений: инфузионная терапия до 2500—3000 мл/м2 и контроль диуреза, при необходимости его коррекция лазиксом. Конечно, все дети, получающие химиотерапию, подвержены инфекционным осложнениям, поэтому крайне важны соблюдение гигиенических
мероприятий, своевременное лечение стоматитов, инфекций
и т. д.
При дисгерминоме показана следующая схема химиотерапии, которая может быть использована и при лечении других
герминогенных опухолей.
• Винкристин — 1,5 мг/м2 внутривенно в 1-й день
• Этопозид — 100 мг/м2 внутривенно в 1-й, 2-й, 3-й дни
• Цисплатин — 20 мг/м2 внутривенно в 1-й, 2-й, 3-й дни.
Курсы проводят с интервалом 3 нед; количество курсов — 6.
Можно проводить лечение и по другим схемам.
• Вепезид — 100 мг/м2 внутривенно в 1-й, 2-й, 3-й дни
404
• Платина — 30 мг/м2 внутривенно в 1-й, 2-й, 3-й дни
• Фарморубицин — 30 мг/м2 внутривенно в 1-й день
или
• Вепезид — 100 мг/м2 внутривенно в 1-й, 2-й, 3-й дни
• Платина — 100 мг/м2 внутривенно в 1-й день
• Циклофосфан — 500 мг/м2 внутривенно в 1-й день.
При лечении детей группы повышенного риска (огромные
опухоли, состояние после экстренных операций по поводу разрыва или перекрута ножки опухоли, нерадикально выполненные операции) рекомендуем чередование режимов VAB-6 и следующего:
• Этопозид — 100 мг/м2 внутривенно в 1-й, 2-й, 3-й, 4-й,
5-й день
• Цисплатин — 20 мг/м2 внутривенно в 1-й, 2-й, 3-й, 4-й,
5-й дни.
Интервалы между курсами 3 нед. Каждый режим препаратов
вводится до 4 раз; следовательно, общее количество курсов — 8.
Применяется также схема.
• Винбластин — 3 мг/м2 внутривенно в 1-й, 2-й дни
• Дактиномицин — 0,5 мг/м2 внутривенно в 1-й, 2-й, 3-й
Дни
• Циклофосфан — 800 мг/м2 внутривенно в 3-й день.
При назначении химиотерапии редких опухолей яичника необходимо индивидуально подбирать схему химиотерапии и
своевременно в случае отсутствия эффекта от лечения ее менять,
однако приведенные выше схемы химиотерапии вполне применимы в данном случае. Возможно также использование схемы
химиотерапии.
• Винбластин — 4 мг/м2 внутривенно в 1-й день
• Дактиномицин — 300 мкг/м2 внутривенно в 1-й, 2-й, 3-й
Дни
• Циклофосфан — 200 мг/м2 внутривенно в 1-й, 2-й, 3-й
дни
или
• Этопозид — 100 мг/м2 внутривенно в 1-й, 2-й, 3-й, 4-й,
5-й дни
• Цисплатин — 20 мг/м2 внутривенно в 1-й, 2-й, 3-й, 4-й,
5-й дни.
Интервалы между курсами не менее 3 нед, количество курсов не менее 6; при определении опухолевых маркеров не менее
4 курсов после получения нормальных показателей маркеров.
Лучевая терапия при опухолях яичников практически
не применяется, за исключением дисгерминомы яичников. В
случаях нерадикальной операции или при лечении метастазов
следует проводить лучевую терапию на очаг поражения в СОД
30—45 Гр. Дисгерминома высокочувствительна к лучевому ле¬
405
чению, что позволяет получить хорошие результаты даже при
распространенном опухолевом процессе. Результаты лечения
полностью определяются своевременностью начала лечения и
радикальностью оперативного вмешательства.
Опухоли влагалища и шейки матки рассматриваются вместе,
так как, как правило, у детей определяется один гистологический
тип опухоли — рабдомиосаркома, которая обладает способностью мультицентрического роста. При поражении мочеполового тракта чаще диагностируется ботриоидный вариант эмбриональной рабдомиосаркомы. Наиболее часто рабдомиосаркома
влагалища и шейки матки встречается у девочек до 3 лет.
Клиническая картина. Вначале опухоль имеет вид
полипа, который можно обнаружить только при вагиноскопии.
При дальнейшем росте опухоли за счет травмы или недостаточного кровоснабжения и распада опухоли появляются кровянистые или гноевидно-кровянистые выделения из влагалища. Нередко по мере роста опухолевые массы выпадают из влагалища.
Могут быть проявления цистита и расстройства мочеиспускания, обусловленные сдавлением опухолью мочевого пузыря,
уретры или инфильтрацией стенки мочевого пузыря. Опухоль
отличается способностью к рецидивированию, а метастазирует
в более поздние сроки; как правило, на фоне уже имеющегося
рецидива заболевания.
Диагностика опухолевого поражения влагалища и шейки матки не сложна — достаточно произвести ректальное исследование, вагиноскопию с биопсией опухоли. После биопсии
выраженных кровянистых выделений не бывает. В момент первичного осмотра из-за больших размеров опухоли не всегда возможно установить локализацию поражения, она уточняется в
процессе лечения после сокращения размеров образования.
Классификация опухолей шейки матки, влагалища применима только к раку. Она учитывает глубину опухолевой инвазии. Рабдомиосаркома — опухоль, растущая из-под слизистого
слоя, чаще имеет вид опухолевой грозди, может состоять из нескольких изолированных опухолевых узлов. Более приемлема в
данном случае Международная классификация сарком мягких
тканей (у детей).
Т1 — опухоль ограничена органом, удаление возможно:
Т1а < 5 см,
Т1б > 5 см.
Т2 — распространение на соседние органы/ткани, удаление возможно:
Т2а < 5 см,
Т2б > 5 см.
ТЗ-, Т4-категории не определяются, однако возможно частичное удаление; резидуальная опухоль определяется микроскопически или макроскопически. Региональные лимфатиче¬
406
ские узлы: для верхних 2/3 влагалища —лимфатические узлы
таза, для нижней трети — паховые лимфатические узлы с обеих
сторон.
Лечение. После гистологической верификации диагноза
применяют химиотерапию. В процессе лечения определяют
чувствительность опухоли к химиотерапии и уточняют локализацию поражения. Химиотерапию проводят по схеме.
• Винкристин — 1,5 мг/м2 внутривенно в 1-й день
• Дактиномицин — 1,5 мг/м2 в 1-й день
• Ифосфамид — 3 г/м2 внутривенно в 1-й, 2-й, 3-й дни с
уромитексаном в стандартном режиме.
Интервалы между курсами 3 нед. В случае ранней диагностики указанное лечение может дать хорошие результаты. В
случае рецидивов рабдомиосаркомы лечение проводится в другом режиме.
• Винкристин — 2 мг/м2 внутривенно в 1-й, 8-й, 15-й дни
• Циклофосфан — 200 мг/м2 внутривенно в 1-й, 8-й, 15-й
дни
• Дактиномицин — 200 мкгДг внутривенно во 2-й, 5-й, 9-й,
12-й, 16-й дни.
После проведения 1—2 курсов химиотерапии и иссечения
оставшихся опухолевых масс решается вопрос о плане лучевого
лечения. При поражении влагалища невозможно выполнение
радикального оперативного вмешательства, поэтому огромное
значение имеет в этом случае лучевое лечение, а именно внут-
риполостная лучевая терапия, которая позволяет подвести значительные дозы (до СОД 50—60 Гр). Подведение такой дозы
лучевой терапии возможно при радиохирургическом варианте
лечения. При поражении шейки матки выполняется операция
в объеме экстирпации матки с верхней третью влагалища и маточными трубами. После операции так же, как и при поражении влагалища, необходимо продолжение специальной терапии в виде внутриполостного облучения культи влагалища и 6—
8 курсов химиотерапии по приведенной выше схеме.
Герминогенные опухоли во влагалище чаще представлены опухолью желточного мешка. Характерной особенностью этих опухолей является кровоточивость, более выраженная, чем при
рабдомиосаркоме влагалища.
Необходимо подчеркнуть, что у детей с опухолями влагалища речь идет о сохранении жизни ребенка. К сожалению, у этой
категории больных детей не гарантировано качество их жизни.
Требуются дальнейшие научные поиски для решения данного
вопроса.
Опухоли яичка относительно редко встречаются у мальчиков
и составляют до 1 % среди солидных злокачественных опухолей.
Чаще всего страдают дети до 3 лет.
407
При изучении катамнеза больных детей установлено значительное увеличение риска опухоли яичка при туберкулезе у матери во время беременности. Относительный риск опухолей
яичка отмечен у мальчиков, матери которых больны эпилепсией или имели мертворожденных в анамнезе. Матери мальчиков
с опухолью яичка страдали более часто выраженными токсикозами. К предрасполагающим факторам относят также различные врожденные аномалии и пороки развития (гипоплазия или
атрофия яичка, крипторхизм, эктопия яичка). Имеет значение
и травма, а также, возможно, семейная предрасположенность.
По данным ряда авторов, частота злокачественного перерождения неопущенного яичка в 10—15 раз выше, чем яичек, нормально опустившихся в мошонку. Риск можно несколько
уменьшить с помощью орхипексии, сделанной до 5 лет жизни.
Некоторые клиницисты считают, что яички, не опущенные к
периоду полового созревания, следует удалять. Не исключено,
что семейная неоплазия яичек может быть результатом семейного крипторхизма, хотя последний, кроме как при интерсексуальных состояниях, не описан.
Необходимо подчеркнуть, что среди опухолей яичка преобладают злокачественные: опухоль желточного мешка и эмбриональный рак, эмбриональная рабдомиосаркома, незрелая тератома, зрелая тератома, затем более редко встречающиеся опухоли — злокачественные опухоли стромы полового тяжа,
семиномы, лейдигомы, нейрофибромы, лейомиосаркомы. Семи-
номы в отличие от взрослых у детей встречаются крайне редко.
При опухоли яичка, как правило, ведущими симптомами являются плотное безболезненное образование и увеличение размеров яичка. Иногда опухоль является находкой во время операции
по поводу водянки яичка. Общие симптомы интоксикации появляются только при диссеминации опухолевого процесса.
Диагностика опухолей яичка заключается в обычном осмотре-пальпации; при сомнении показана аспирационная биопсия, которая после цитологического изучения пунктата позволяет в 85 % случаев установить злокачественность процесса.
Метастазирование происходит в забрюшинные лимфатические
узлы. Для установления распространенности процесса необходимы рентгенография легких, экскреторная урография, ультразвуковое исследование мошонки, паховой области на стороне поражения, малого таза, забрюшинного пространства, печени; при необходимости — КТ. В качестве диагностического фактора, а также
для контроля за лечением показано определение титра АФП, ХГ.
Клиническая Международная классификация дает возможность определить распространенность процесса.
Т1 — опухоль ограничена телом яичка;
Т2 — опухоль распространяется на белочную оболочку яичка
или придаток;
408
ТЗ — опухоль распространяется на семенной канатик;
Т4 — опухоль распространяется на мошонку.
Однако определить тактику лечения удобно по классификации (Royal Marsden Hospital):
• I стадия — нет признаков метастазирования, первичная
опухоль не поражает семенной канатик или
мошонку;
• II стадия — имеются метастазы в забрюшинные лимфа¬
тические узлы;
• III стадия — в процесс вовлекаются лимфатические узлы
выше диафрагмы;
• IV стадия — имеются нелимфогенные метастазы в лег¬
кие, печень, головной мозг, кости.
Прогностическое значение при опухолях яичка имеют стадия болезни и морфологическая структура опухоли, а при распространенном процессе — число и размеры пораженных лимфатических узлов и/или метастазов в легкие.
При лечении опухолей яичка используют хирургический
метод, лучевую терапию и химиотерапию в плане комбинированного или комплексного лечения.
Оперативное лечение первичного очага заключается в орх-
фуникулэктомии с перевязкой семенного канатика на уровне
внутреннего отверстия пахового канала. Билатеральная лимфаденэктомия забрюшинных лимфатических узлов у детей не
улучшает результатов лечения и поэтому не производится.
При локализованной стадии после удаления рабдомиосаркомы яичка показано проведение химиотерапии по схеме.
• Винкристин — 1,5 мг/м2 внутривенно в 1-й день
• Дактиномицин — 1,5 мг/м2 внутривенно в 1-й день
• Ифосфамид — 3 г/м2 внутривенно в 1-й, 2-й, 3-й дни с
уромитексаном в стандартном режиме.
Интервалы между курсами 3 нед. С таким интервалом между
курсами можно проводить лечение по следующим схемам.
• Винкристин — 1,5 мг/м2 внутривенно в 1-й, 8-й, 15-й
Дни
• Циклофосфан — 500 мг/м7 внутривенно в 1-й, 8-й, 15-й
Дни
• Платидиам — 60 мг/м7 внутривенно в 1-й, 8-й дни
или
• Винкристин — 1,5 мг/м2 внутривенно в 1-й день
• Адриамицин — 30 мг/м2 внутривенно в 1 -й день
• Циклофосфан — 800 мг/м2 внутривенно во 2-й день
• Платидиам — 100 мг/м7 внутривенно в 4-й день
или
409
Винбластин — 4 мг/м2 внутривенно в 1-й день
Цисплатин — 20 мг/м2 внутривенно в 1-й, 2-й, 3-й, 4-й,
5-й дни
Ифосфамид — 1,2 г/м2 внутривенно в 1-й, 2-й, 3-й, 4-й,
5-й дни
Месна (уромитексан) — 1200 мг/м2 внутривенно струйно
до ифосфамида, затем 1200 мг/м2 ежедневно инфузией с
1-го по 5-й дни.
При выявлении поражения забрюшинных лимфатических
узлов облучение тазовых и парааортальных лимфатических узлов в комплексе с химиотерапией может вызвать длительную
ремиссию.
При поражении метастазами легких возможно получить определенные успехи от применения химиотерапии и тотального
облучения легких в СОД 15 Гр и дополнительного локального
облучения в СОД 30 Гр.
Прогноз значительно благоприятнее у детей до 1 года, у
которых чаще диагностируются локализованные формы опухоли яичка. Результаты лечения полностью определяются своевременностью начала лечения и радикальностью оперативного
вмешательства.
Таким образом, существуют определенные единые закономерности в возникновении опухолей половых органов у детей:
половые клетки дают развитие герминогенным опухолям, а
клетки стромы — стромально-клеточным, мягкотканным опухолям и т. д., поэтому необходимо соблюдать единые принципы в обследовании и лечении таких детей.
• При сборе анамнеза болезни у ребенка обратить внимание на течение беременности у матери, наличие в анамнезе
у родственников наследственных синдромов, пороков развития, частоту прерывания беременности, особенно на
ранних сроках, или рождение мертворожденных с уродствами.
• Наличие у больного ребенка признаков нарушения половой дифференцировки или пороков развития любой локализации.
• Во время обследования детей с опухолевой патологией гениталий необходимо обследование мочевыводящей системы с целью обнаружения сопутствующего порока развития,
что необходимо учитывать при планировании лечения.
• Консультация врача-генетика обязательна для всех детей
с опухолями половых органов.
• Всем детям, у которых установлено наличие гонадобла-
стомы, андробластомы, дисгерминомы и т. д., показаны
определение пола и решение вопроса об удалении оставшейся гонады.
410
• Нужно учитывать, что герминогенные опухоли гонад у детей сохраняют способность секретировать эмбриональные белки, которые становятся опухолевыми маркерами
для этой группы детей.
• Необходимо определять опухолевые маркеры (АФП,
РЭА, ХГ и т. д.).
• Определение опухолевых маркеров должно осуществляться и в процессе лечения, так как это служит контролем
за течением опухолевого процесса: появление повышенного титра говорит о прогрессировании процесса, даже
если по данным объективного обследования опухолевые
массы не обнаружены;
• Основной объем лечения — удаление гонады на стороне
поражения вместе с маточной трубой или семенным канатиком (у девочек резекция большого сальника) и химиотерапия, так как опухолевое поражение носит односторонний характер. Однако при дисгенезии гонад необходимо удалять гонады с обеих сторон, так как риск
развития опухоли в непораженной гонаде крайне высок.
Все герминогенные опухоли высокочувствительны к химиотерапии, поэтому даже при распространенном опухолевом процессе или после нерадикального удаления опухоли возможно получить хорошие результаты лечения.
• При прогрессировании процесса (иногда установленного
только по данным повышения титра опухолевых маркеров)
своевременная смена химиопрепаратов может дать хорошие результаты лечения.
• После получения нормальных титров опухолевых маркеров нужно проводить до 4 курсов химиотерапии, затем решать вопрос о прекращении специальной терапии.
• Решать вопросы о повторной операции по удалению остаточной опухоли лучше всего после 2 курсов химиотерапии на фоне нормального титра опухолевого маркера.
• Необходимо иметь в виду, что по результатам морфологического исследования удаленных остаточных опухолей
среди некротически измененных тканей определяются
единичные жизнеспособные клетки, которые в данный
момент не вызывают повышения титра опухолевых маркеров, но несвоевременное прекращение лечения ведет к
росту опухолевых масс.
• В ряде случаев возможно решение вопроса о лучевой терапии метастазов или остаточной опухоли, так как герминогенные опухоли (особенно дисгерминомы) чувствительны к лучевой терапии.
• После прекращения специальной терапии необходимо
тщательное наблюдение в течение 1-го года с интервалами
3 мес с определением титра опухолевых маркеров; посте¬
411
пенно интервалы между исследованиями после 1-го года
увеличиваются.
• Обязательный объем обследования при профилактических
осмотрах: пальпация органов брюшной полости и малого
таза, рентгенологическое исследование легких, УЗИ органов малого таза, забрюшинного пространства, печени.
При проведении химиотерапии, особенно если опухоли неоперабельны на первом этапе, необходимо адекватно оценить
резервные возможности ребенка, так как опухолевые конгломераты в малом тазе препятствуют нормальной выделительной
функции почек, следовательно, замедлено выведение химиопрепаратов или их компонентов из организма ребенка. Это может вызвать выраженный токсический эффект от стандартных
доз химиопрепаратов, поэтому в таких случаях необходимо
снизить стандартные дозы на 25—30 %. При уменьшении размеров опухоли производится своевременная коррекция дозы до
нормальных значений. Чаще всего гонады поражаются гермино-
генными опухолями, которые высокочувствительны к химиотерапии, поэтому возможно развитие синдрома лизиса опухоли с
угрозой развития мочекислой нефропатии, что еще больше затруднит выделительную функцию почек. Детям, получающим
лечение по поводу опухолей половых органов, нужно, кроме
исследования общих анализов крови и мочи (1 раз в 2—3 дня),
производить биохимическое исследование крови, чтобы своевременно отметить изменение со стороны показателей мочевины,
креатинина, концентрации электролитов. Основными мероприятиями по предотвращению данного осложнения являются
инфузионная терапия до 2500—3000 мл/м2 и контроль диуреза,
при необходимости его коррекция лазиксом. Как было указано
выше, все дети, получающие химиотерапию, являются угрожаемыми по развитию инфекционных осложнений, поэтому крайне важны соблюдение гигиенических мероприятий, своевременное лечение осложнений химиотерапии.
Глава 18 РЕТИНОБЛАСТОМА
Ретинобластома — наиболее частая внутриглазная злокачественная опухоль, встречающаяся преимущественно в раннем детском возрасте. Она выявляется в двух вариантах: генетический,
или врожденный, вариант (около 40 %), который обычно муль-
тифокален, и спорадический вариант, чаще характеризующийся
наличием одного опухолевого очага в глазу. Больные с генетическими формами ретинобластомы имеют повышенную предрасположенность к развитию у них других видов злокачественных новообразований.
При этой опухоли, ограниченной глазом, имеются наибольшие шансы на выздоровление по сравнению с другими новообразованиями в детском возрасте. Прогноз заболевания резко
ухудшается при выходе ретинобластомы за пределы глазного
яблока. Отсюда очевидно, какое большое значение имеет раннее выявление этого заболевания.
Эпидемиология. Ретинобластома встречается у одного из
20 000 новорожденных и составляет 2,5—4,5 % всех злокачественных опухолей у детей до 15 лет. По данным Москвы, удельный вес в структуре солидных новообразований у детей составляет 7,5 % [Белкина Б. М., 1993]. Нет различия в частоте заболевших мальчиков и девочек. В 70—75 % случаев это
заболевание диагностируется в возрасте до 3 лет и менее чем в
5 % случаев — у детей старше 5 лет. Пик заболеваемости у детей
с односторонней опухолью приходится на 24—29 мес и на первые
12 мес — при двустороннем поражении. В Москве (по данным
1993 г.) в год выявляется 3—13 новых случаев ретинобластомы.
В Великобритании за этот же период времени — 40—50 заболевших детей, из которых у 1/з имеется одностороннее поражение.
По данным НИИ детской онкологии РОНЦ РАМН, односторонний процесс наблюдался в 62 % случаев, двусторонний —
в 38 %. Частота поражения правого и левого глаза практически
одинаковая: 50,7 и 49,3 %. При двусторонней опухоли синхронное развитие заболевания в обоих глазах отмечено в 88,9 %, ме-
тахронное — в 11,1 % (в среднем через 1,5 года).
Этиология и патогенез. Этиология ретинобластомы все еще
неизвестна. К факторам риска развития спорадической врожденной опухоли можно отнести немолодой возраст матери и отца [Derkinderen et al., 1990], длительную работу отца в металлургии [Bunin et al., 1990]. Односторонние ретинобластомы
обычно развиваются в результате соматических мутаций, поражающих только ретинальные клетки. Двусторонние новообразования чаще являются следствием мутаций хромосом половых
клеток. Наследственные формы ретинобластомы наблюдаются
примерно у 40—50 % больных. У здоровых родителей, имеющих одного ребенка с ретинобластомой, вероятность развития
413
опухоли у последующих детей составляет 6 %. В тех случаях, когда в семье больны несколько детей, риск развития бластомы у
последующих детей возрастает до 50 %.
У родителей, перенесших в детстве ретинобластому, рождается более половины детей с этой опухолью.
Морфологическое строение и клиническое течение заболевания.
Последние исследования показали, что ретинобластома является
опухолью нейроэпителиального происхождения, которую можно
рассматривать как одну из примитивных нейроэктодермальных
бластом детского возраста. Вероятно, она происходит из ретинопредшествующих клеток, и поэтому клетки опухоли имеют некоторое структурное подобие ретинофоторецепторных и амак-
ринных клеток. Строма в опухоли отсутствует. В зависимости
от степени дифференциации опухолевых клеток различают ретинобластому (встречающуюся чаще) и ретиноцитому. Более злокачественной из них является первая, недифференцированная
форма. При ней клетки опухоли группируются вокруг сосудов,
образуя так называемые псевдорозетки. Ретиноцитома, дифференцированная форма опухоли, состоит из более дифференцированных клеток, из которых образуются истинные розетки
Флекснера — Винтерштейнера. Возможно смешанное строение
опухоли.
Ретинобластома характеризуется быстрым ростом и вследствие недостаточного кровоснабжения некротизируется. В очагах
некроза откладываются соли кальция, образуя характерные для
больших опухолей кальцификаты. Классически различают два
вида макроскопического роста опухоли — эндофитный, при котором опухоль растет в направлении центра глаза, разрушая
внутренние слои сетчатки и стекловидное тело, и экзофитный,
или стелящийся, при котором опухоль инфильтрирует преимущественно наружные слои сетчатки, распространяясь в сторону
субретинального пространства. Большие опухоли с экзофитным ростом могут вызвать отслоение сетчатки с последующим
накоплением субретинального транссудата. Оба вида роста опухоли не имеют значимого прогностического значения.
Редко, в 1 —2 % случаев, у детей старшего возраста может наблюдаться инфильтративная форма ретинобластомы, характеризующаяся диффузным утолщением сетчатки, скоплением
экссудата в передних отделах стекловидного тела, ранним проявлением псевдогипопиона и передних спаек.
Клинические проявления заболевания разнообразны и зависят
от размера опухоли, места ее локализации и типа роста. Вначале
опухоль располагается в пределах сетчатки. Затем, по мере роста,
нарушает стекловидную пластинку, распространяется на сосудистую оболочку и стекловидное тело. Вследствие эндофитного
роста бластомы формируется проминирующий в стекловидное
тело узел серовато-беловатого цвета круглой или овальной формы. Узлы ретинобластомы могут быть единичными или множе¬
414
ственными. Острота зрения при локализации опухоли в центральных отделах глазного дна рано и резко снижается, появляется косоглазие.
В случаях расположения опухоли на периферии зрение резко
снижается по мере ее распространения в центральную зону
глазного дна.
Опухоль, увеличиваясь в размерах, может заполнить всю полость глазного яблока, прорастать в сосудистую оболочку. В результате разрушения и прорастания трабекулярного аппарата
глаза нарушается отток внутриглазной жидкости и повышается
внутриглазное давление. Появляются боли в глазу, застойная
инфекция, отек роговицы, наблюдаются расширение зрачка и
отсутствие его реакции на свет. У детей младшего возраста под
влиянием повышенного офтальмотонуса глазное яблоко, как
правило, увеличивается. При обширных дистрофических изменениях и некрозе ткани опухоли нередко развивается воспалительный процесс (иридоциклит, увеит). Вследствие отека орбитальной клетчатки может возникнуть экзофтальм. При росте
опухоли за пределы глазного яблока, в глазницу, этот симптом
появляется раньше и быстро нарастает. Возможны разрушение
костных стенок глазницы и проникновение опухоли в околоносовые пазухи.
При распространении ретинобластомы по зрительному нерву
в полость черепа (в субарахноидальное пространство) наблюдаются мозговые симптомы (головная боль, тошнота, рвота). Прорастание опухоли через стенку глазного яблока приводит к формированию экстрабульбарного узла. При распространении опухоли кпереди возможно появление очагов некроза роговицы.
Ретинобластома характеризуется лимфогенным и гематогенным метастазированием. В первом случае метастазы появляются
в околоушных, подчелюстных и шейных лимфатических узлах,
а во втором — в костях черепа, трубчатых костях нижних конечностей и печени. В редких случаях можно наблюдать спонтанную регрессию ретинобластомы, что связывают с иммунологическими факторами и нарушением кровообращения в опухоли.
Диагноз и стадия заболевания. Диагностика ретинобластомы
нередко представляет большие трудности. При этом требуется
внимательное изучение данных анамнеза, офтальмологического
осмотра, лабораторно-инструментального исследования. Первые
клинические признаки, характеризующие ретинобластому, следующие:
• лейкокория — беловато-желтоватое свечение зрачка
вследствие отражения света от поверхности опухоли;
• расширение зрачка, ослабление его прямой реакции на свет;
• косоглазие.
Лейкокория, косоглазие, нарушение зрения наблюдаются в
39 % и 40 % случаев при одно- и двусторонней ретинобластоме.
415
В случае наличия указанных симптомов необходим тщательный осмотр глазного дна ребенка (тонометрия, биомикроскопия
и т. д.). Прямую и обратную офтальмоскопию, проводимую для
установления внутриглазного распространения заболевания,
рекомендуется выполнять под общей анестезией с полным расширением зрачков. Локализацию и размер всех опухолевых образований необходимо документировать рисунком или фотографией. Наличие кальцификатов в ретинобластоме хорошо
определяется с помощью компьютерной томографии (КТ).
На КТ признаки кальцификации обнаруживаются в 83 %
случаев. Компьютерная томография является перспективным
методом исследования не только для установления первичного
диагноза, но и для оценки расположения и структуры опухоли,
ее распространенности за пределы глазного яблока в прилежащие области. Этот метод диагностики имеет высокую информативность для контроля эффективности проводимого лечения.
Магнитно-резонансная томография (МРТ) также помогает
определить распространенность заболевания и может быть
единственным средством диагностики внутричерепного роста
бластомы.
Одним из информативных методов диагностики является
ультразвуковая томография, позволяющая получить данные о
динамике роста опухоли, определить степень ее проминенции.
Совпадение данных офтальмоскопии и ультразвуковой томографии составляет 96 %. Этот метод ценен и для установления
раннего рецидива опухоли в орбите после энуклеации глаза.
Необходимо помнить, что эхографически невозможно выявить
новообразование, проминирующее в стекловидное тело менее
чем на 0,5—0,6 мм. Роль ультразвуковой томографии значительно возрастает при помутнении оптических сред глаза, обусловленном развитием осложнений в процессе лечения из-за
невозможности офтальмоскопического контроля.
Радиоизотопное исследование помогает в диагностике рети-
нобластомы и ее метастазов в печень, кости и головной мозг.
Таким образом, можно отметить, что ввиду трудности диагностики ретинобластомы и наличия противопоказаний к выполнению интраокулярной биопсии (так как она несет опасность диссеминации опухолевых клеток внутри глаза) в первую
очередь необходимо обязательное применение таких дополнительных методов обследования, как компьютерная, магнитно-
резонансная и ультразвуковая томография. При наличии признаков распространения опухоли на оптический нерв необходимо цитологическое изучение цереброспинальной жидкости.
Кроме того, у всех детей с цитогенетической целью нужно исследовать кровь.
Проведение указанных диагностических мероприятий позволяет уточнить распространенность опухолевого процесса и,
следовательно, установить стадию заболевания. Имеющиеся к
416
настоящему времени системы классификаций стадии ретино-
бластомы имеют определенные достоинства и недостатки.
Представленная в табл. 18.1 классификация была увязана с
прогнозом о возможном сохранении глаза, пораженного рети-
нобластомой, и не имела в своей основе связи с продолжительностью жизни больных.
В 1979 г. Stannad и соавт. предложили систему определения
стадий, основанную на морфологических данных, полученных
после оперативного удаления глаза, и клинической картине,
позволяющей использовать ее при планировании лечения
(табл. 18.2).
Начиная с 1987 г. используется постадийная классификация
TNM, предложенная Международным противораковым союзом, в которой характеризуются как первичная опухоль, так и
регионарное и отдаленное метастазирование. Степень поражения органа зрения опухолью оценивается на основании данных
Таблица 18.1. Классификация стадий ретинобластомы
[Reese, Ellsworth, 1963]
Группа
Характеристика
I
Очень благоприятная
а. Солитарная опухоль, менее чем 4 диска в диаметре
(1 диск, диаметр = 1,5 мм) в размере у или позади
экватора
б. Множественные опухоли, но не более 4 диаметров
диска в размере, все у или позади экватора
и
Благоприятная
а. Солитарная опухоль от 4 до 10 диаметров диска в
размере у или позади экватора
б. Множественные опухоли от 4 до 10 диаметров диска в
размере позади экватора
ш
Сомнительная
а. Любая опухоль впереди экватора
б. Солитарная опухоль больше 10 диаметров диска в
размере, позади экватора
IV
Неблагоприятная
а. Множественные опухоли, некоторые больше чем 10
диаметров диска
б. Любое поражение, распространяющееся на артериолы
ora serrata
V
Очень неблагоприятная
а. Массивная опухоль, занимающая более половины сетчатки
б. Обсеменение стекловидного тела
417
комплексного клинического обследования и результатов гистологического исследования бластомы после удаления глаза. Состояние каждого глаза оценивается отдельно.
Таблица 18.2. Классификация стадий ретинобластомы
[Stannad et al., 1979]
Стадия
Характеристика
I Опухоли, которые могут лечиться консервативно
II Новообразования, подлежащие удалению путем энуклеации, но еще ограниченные глазом и орбитой
Подразделения, полученные на основании морфологического изучения энуклеированного глаза:
N0 — нет инвазии зрительного нерва
N1 — инвазия опухоли до или после перехода в решетчатую пластинку
N2 — инвазия зрительного нерва за решетчатую пластинку, но линия резекции без микроскопических
признаков наличия опухоли
N3 — резекция по линии, имеющей признаки
опухолевых клеток
СО — нет инвазии хориоидальной оболочки
С1 — поверхностная инвазия хориоидальной оболочки
или цилиарного тела до половины толщины
С2 — инвазия хориоидальной оболочки на всю ее толщину
СЗ — инвазия склеры
С4 — опухоль выходит за пределы склеры
III Ретинобластома распространяется за пределы орбиты,
нет отдаленных метастазов
G1 — метастазы в околоушных лимфатических узлах
G2 — поражены другие группы лимфатических узлов
В1 — имеются данные, указывающие на метастатическое поражение головного мозга или имеются злокачественные клетки в спинномозговой жидкости
В2 — клинически выявляется злокачественный менингит
ВЗ — рецидив заболевания в интракраниальной зоне
IV Ретинобластома с отдаленными метастазами
Ml — метастазы в костный мозг
М2 — метастатическое поражение костей
М3 — метастазы в печень
М4 — множественные метастазы в органы
TNM — клиническая классификация
Степень вовлечения сетчатки выражают в процентах
Т —первичная опухоль
ТХ — недостаточно данных для оценки первичной опухоли.
418
ТО — нет признаков первичной опухоли.
Т1 — опухоль занимает 25 % или меньше глазного дна.
Т2 — опухоль занимает более 25 % сетчатки, но не более 50 %.
ТЗ — опухоль занимает более 50 % и/или выходит за пределы сетчатки, но располагается внутри глаза.
ТЗа — опухоль занимает более 50 % и/или имеются злокачественные клетки в стекловидном теле.
ТЗб — вовлечен диск зрительного нерва.
ТЗс — вовлечена передняя камера, наличие или отсутствие
распространения опухоли на увеальный тракт.
Т4 — опухоль с экстраокулярным ростом.
Т4а — прорастание в ретробульбарный зрительный нерв.
Т4б—другое экстраокулярное распространение.
Другие обозначения для Т-категорий
m —для обозначения множественной опухоли, например
Т2(гп).
f —для обозначения случаев с семейным анамнезом,
d —для обозначения диффузного вовлечения сетчатки.
N — регионарные лимфатические узлы
NX — отсутствие минимальных данных для оценки состояния лимфатических узлов.
N0 — метастазов в регионарных лимфатических узлах нет.
N1 — метастазы в регионарных лимфатических узлах.
М —отдаленные метастазы
MX — недостаточно данных для оценки отдаленных метастазов.
МО — метастазов нет.
Ml —имеются отдаленные метастазы.
Клиническая группировка по стадиям
IA стадия — T1N0M0
IB стадия — N2N0M0
ИВ стадия — T3N0M0
ПС стадия — T3cN0M0
IIIA стадия—T4aN0M0
ШВ стадия — T46N0M0
IV стадия — любое TN1M0, любое — TNM1.
В случаях двустороннего поражения стадия классифицируется по состоянию хуже видящего глаза.
PTNM — гистоморфологическая классификация
(после операции)
РТ — первичная опухоль
рТХ — степень инвазии не может быть установлена.
419
рТО — опухоль отсутствует при гистологическом исследовании.
рТ1—2 —соответствует Т1 и Т2.
рТЗ — соответствует ТЗ.
рТЗа — соответствует ТЗа.
рТЗЬ — прорастание опухоли в зрительный нерв до решетчатой пластинки.
рТЗс — прорастание опухоли в переднюю камеру с распространением на сосудистую оболочку или интраск-
леральная инвазия.
рТ4 —соответствует Т4.
рТ4а — опухоль расположена за решетчатой пластинкой, но
не доходит до уровня резекции зрительного нерва.
рТ4Ь — опухоль распространяется до уровня резекции или
иное экстраокулярное распространение.
pN —соответствует N.
рМ — соответствует М.
Уточненная диагностика стадии ретинобластомы чрезвычайно важна, так как она определяет тактику последующего лечения больного ребенка.
Принципы лечения больных с ретинобластомой. Оценивая в
целом стратегию лечения больных с ретинобластомой, идеальной можно считать такую терапию, при которой достигается
излечение ребенка с сохранением зрения. В последние годы
наибольшее значение приобрел комплексный метод лечения
детей с ретинобластомой, включающий хирургическое вмешательство, лучевую, лекарственную терапию, фото- и лазеркоа-
гуляцию. При этом методика лечения и комплекс применяемых
лечебных воздействий зависят от стадии заболевания. При двусторонней ретинобластоме каждый глаз лечат в зависимости от
степени его поражения опухолью.
Консервативное лечение проводят в основном на начальных
стадиях заболевания при односторонней ретинобластоме.
Консервативную органосохраняющую терапию, включая лучевую и криотерапию, а также фотокоагуляцию используют как
первичное лечение маленьких или средних по размеру ретино-
бластом, располагающихся за пределами макулярной и перипа-
пиллярной областей. Два последних метода могут также применяться для разрушения остаточной опухоли после дистанционной лучевой терапии. При бластомах менее 4 мм в диаметре,
локализующихся позади экватора, можно использовать непрямую фотокоагуляцию, а при аналогичных опухолях, лежащих
впереди экватора, лучше применять криотерапию. При этом
новообразование не должно быть более 7 мм.
Лучевая терапия. Ретинобластома — высокорадиочувствительная опухоль, а сетчатка относительно радиорезистент-
на, что создает благоприятные условия для успешного лучевого
420
ее излечения. Впервые для терапии ретинобластомы в 1903 г.
были использованы рентгеновские лучи с хорошим результатом. В 1931 г. для этой цели начато использование аппликаторов с радиоактивным источником в виде капсул с радоном [Foster, Moore, 1931]. В дальнейшем этот метод контактной лучевой
терапии продолжал совершенствоваться. Он находит применение и в настоящее время при лечении детей с одним или двумя
узлами опухоли небольших размеров (до 10 мм). В качестве источников излучения при изготовлении аппликаторов используют радиоактивный кобальт (60Со), йод (1251) и рутений (106Ru).
Применение радиоактивного кобальта имеет свои достоинства
и недостатки. При контактном облучении из-за относительно
высокой энергии гамма-излучения этого источника (1,27 МэВ)
невозможно исключить из зоны лучевого воздействия костные
стенки орбиты, хотя при этом достигается относительно благоприятное дозное поле в зоне опухоли и имеется возможность
длительного многократного использования аппликатора из-за
длительного периода полураспада 60Со (2,7 года).
Радиоактивные источники типа 1251, имеющего мягкое а-из-
лучение, или 106Ru, излучающего р-лучи, позволяют избежать
высоких лучевых нагрузок на окружающие ткани, но из-за короткого периода их полураспада требуется постоянное их обновление. Всегда необходим набор аппликаторов разных размеров, имеющих внутренний определенный радиус кривизны,
чтобы можно было подобрать аппликатор, соответствующий
кривизне глаза.
Под общей анестезией операцию начинают с открытия
конъюнктивы, ослабления прямых мышц и поворота глаз. Через зрачок освещают глазное яблоко. В результате этого маркируется тень, которую отбрасывает опухоль на склеру, изготавливается или подбирается аппликатор с неактивной пластинкой. Его помещают над опухолью, фиксируют; неактивную
пластинку замещают радиоактивной. Глаз возвращают в обычное положение. После подведения необходимой дозы (40—
50 Гр) к верхушке опухоли процедуру повторяют для удаления
аппликатора. Необходимо помнить, что доза на поверхности
основания опухоли, прилежащей к радиоактивному препарату,
может достигать 300 Гр, что приводит к окклюзии сосудов, и
поэтому аппликаторы не должны использоваться вблизи оптического диска или макулы. Иногда одновременно можно использовать два аппликатора, но при этом не должно быть наложения радиационных полей. Вероятно, контактное облучение рационально также использовать как дополнительное
воздействие на остаточную опухоль после дистанционного облучения ("буст").
Дистанционная лучевая терапия показана в следующих клинических случаях: при наличии опухоли в диаметре более
10 мм; при множественных опухолевых очагах размером менее
421
10 мм в диаметре, но не подлежащих контактному облучению
из-за невозможности создания рационального дозного поля;
при наличии отслойки сетчатки и опухолевых отсевов в стекловидном теле и в случаях, когда опухоль лежит в 3 мм от оптического диска и макулы.
На основании опыта НИИ ДО РОНЦ РАМН была предложена схема лечения детей с ретинобластомой в зависимости от
одно- или двустороннего поражения и стадии заболевания
[Белкина Б. М., 1993], где также даны рекомендации по показаниям к применению дистанционной лучевой терапии. Согласно им, она должна использоваться в качестве консервативного метода лечения одновременно с противоопухолевой химиотерапией при односторонней опухоли в стадии T12N0M0,
ТЗа, bNOMO (при отрицательном эффекте — энуклеация глаза).
Послеоперационное облучение необходимо осуществлять при
бластоме T3cN0M0, и наконец, предоперационное воздействие
рекомендуется проводить при опухоли Т4 с экстрабульбарным
ростом после проведения полихимиотерапии.
По мнению авторов, при органосохранном лечении суммарная очаговая доза должна быть в пределах 40—50 Гр [Ellsworth,
1977]. Как показывает наш опыт, величина этой дозы в 40 Гр
бывает достаточной при опухоли Т1 и Т2 и достигает 50—55 Гр
при ТЗа, b стадиях.
Кроме того, при проведении послеоперационного облучения суммарная очаговая доза 40 Гр (по 1,8—2 Гр 5 раз в неделю) подводится после удаления опухоли в пределах здоровых
тканей и 50 Гр — в случаях врастания опухоли в зрительный
нерв. Дозу необходимо рассчитывать на глубине 2 см с задней
стороны глаза.
Представляется перспективным при облучении ретинобла-
стомы для снижения повреждающего действия излучения на
нормальные ткани использовать гиперфракционирование, т. е.
деление суточной дозы 2 Гр на две фракции по 1 Гр с интервалом 4 ч. Однако использование этой методики представляет
большие трудности, обусловленные необходимостью использования искусственного сна у маленьких детей, которых чаще
всего поражает это новообразование.
Проведение облучения опухолей глаза требует формирования такого дозного поля, при котором достигалось бы максимальное снижение дозы ионизирующего излучения на здоровый глаз, головной мозг, хрусталик. Tapley (1984) предложил,
используя тормозное излучение ускорителя, облучать опухоль
через одно височное поле, a Skeggs, Williams (1966) при гамма-
терапии рекомендовали одно переднее поле. По нашему мнению, предложенные методы облучения имеют ряд недостатков:
из-за особенностей дозного распределения в первом случае
значительному облучению подвергается противолежащий глаз,
а во втором — все ткани глазного яблока, включая хрусталик.
422
Поэтому последняя методика облучения приемлема только для
послеоперационной лучевой терапии.
В практике НИИ РОНЦ РАМН при дистанционной терапии
облучение ретинобластомы осуществляется с использованием
двух тангенциальных полей, расположенных под углом 90° друг
к другу. При этом для формирования равномерного дозного поля с уменьшением ширины полутеней используются специальные свинцовые коллиматоры. Наиболее предпочтительно фотонное излучение с энергией 6—18 МэВ. Интересна методика
с использованием быстрых электронов с энергией 13 МэВ. Облучение пораженного глаза проводится с одного переднего поля, в центре которого помещается специальный металлический
цилиндр для защиты хрусталика; необходима сознательная или
искусственная фиксация взгляда на цилиндре.
В объем облучения включается вся задняя часть орбиты, начиная от хрусталика. При формировании дозного поля нужно
обязательно иметь основные размеры внутренней структуры
глаза, особенно расстояние между хрусталиком и роговой оболочкой. Для их определения используется ультразвуковая или
компьютерная томография. Для детей с опухолями, расположенными в задних отделах, облучение проводится с защитой
хрусталика [Schipper, 1983; Harmett et al., 1987]. При этом допускается экранирование также передней камеры глаза. Желательно использование контактных линз, которые подгоняются
к роговице ребенка и обеспечивают фиксацию глаза в необходимой точке, в которой выполняются все необходимые предлу-
чевые измерения.
При двустороннем поражении глаз опухолью используют два
височных поля размером 5 • 5 см, также, если возможно, с применением защитных коллиматоров при дистанционном облучении или открытые поля при использовании тормозного высокоэнергетического излучения и быстрых электронов. При этом
обеспечивается равномерное облучение обеих бластом.
Ряд авторов, оценивая тактические вопросы лечения больных
с ретинобластомой, полагают, что при двусторонней опухоли
наиболее пораженный глаз необходимо энуклеировать, а менее
пораженный — подвергнуть консервативной терапии. Считая
данный постулат до определенной степени верным, полагаем,
что к выбору рациональной методики комплексного лечения
необходимо подходить в зависимости от степени поражения каждого глаза. Основанием для этого послужило следующее: во-
первых, ретинобластома обладает относительной радиочувствительностью, что позволяет надеяться на ее разрушение с использованием ионизирующих излучений; во-вторых, радиопоражае-
мость опухолей, объем которых незначительно отличается друг
от друга и лежит в пределах сетчатки, труднопрогнозируема. В
связи с этим имеется опасность начального хирургического удаления более радиочувствительного новообразования, несмотря
423
на его клинически большую распространенность, и, наконец, в
случае малой чувствительности одной из опухолей всегда имеется возможность ее оперативного удаления, причем в более аб-
ластичных условиях. В подтверждение наших предположений у
33 % больных в сроки до 6 мес после лечения отмечалось полное исчезновение опухоли, причем в глазных яблоках с большим опухолевым процессом. Таким образом, предварительное
удаление более пораженного глаза привело бы к тому, что у
больного осталась бы опухоль, вероятность лучевого излечения
которой была бы минимальной.
Показанием к консервативному лечению двусторонних ре-
тинобластом является наличие в каждом глазу опухолей в стадии Tl, Т2, N3a, bNOMO. При стадии ТЗс в одном из пораженных глаз или клинически определенном экстрабульбарном росте опухоли на первом этапе необходима энуклеация наиболее
пораженного глаза [Белкина Б. М., 1993].
Эффективность лучевого лечения оценивается спустя 4 нед
после его завершения. При этом различают два типа регрессии
ретинобластомы: первый тип — опухоль в виде "прессованного
творога" с включением кальцинатов и второй — бластома в виде
"рыбьего мяса", которая аваскулярна, гомогенна с атрофическим пигментом в основании [Kingston et al., 1992]. Знание различных форм регрессии опухоли имеет большое значение для
офтальмологического наблюдения за ребенком.
Поздние осложнения после облучения проявляются в основном развитием катаракты, приблизительно через 18 мес,
сморщиванием век и сухостью глазного яблока. Последнее затрудняет использование контактных линз после удаления катаракты.
Оперативное лечение. Удаление глаза производится
при наличии ретинобластомы, поражающей зрительный нерв,
при экстрасклеральном ее распространении, при опухоли, занимающей более половины площади сетчатки, а также при наличии осложнений, развившихся в результате роста бластомы —
вторичной глаукомы, вторичного увеита, гемофтальма, полной
утраты зрения. И наконец, энуклеация показана при неудачах
консервативного лечения. Это операционное вмешательство технически довольно сложно, особенно у очень маленьких детей.
При его выполнении необходимо удаление как можно большей
части зрительного нерва. При патогистологическом изучении
удаленных тканей особое внимание уделяется определению наличия опухолевого поражения зрительного нерва, его протяженности, вовлечения в опухолевый процесс решетчатой пластинки и радикальности выполненной резекции. Это определяется тем, что все эти факторы оказывают влияние на
послеоперационное лечение.
Кроме того, необходимо иметь данные о наличии опухолевых клеток в субарахноидальном пространстве или в паренхиме
424
нерва, о степени инвазии хориоидальной оболочки. Прорастание последней более чем на половину ее толщины несет повышенный риск гематогенного метастазирования и возможность
опухолевого поражения зрительного нерва.
Химиотерапия. Роль адъювантной терапии больных с
ретинобластомой с использованием противоопухолевых лекарственных препаратов до настоящего времени остается спорной.
Данные кооперативных исследований, проведенных в США,
показали, что адъювантная химиотерапия детей с односторонней опухолью не улучшает результатов оперативного или консервативного лечения. Однако авторы полагают, что необходимо выделять группу детей, имеющих риск отдаленного метастазирования, так как именно в этой группе был отмечен
положительный эффект противоопухолевой лекарственной терапии.
В эту группу можно отнести больных, у которых бластома
поражает зрительный нерв протяженностью менее 5 см и опухоль полностью удаляется при энуклеации [Rubin et al., 1985];
у которых имеются значительная инвазия хориоидальной оболочки и поражение решетчатой пластинки [Melartney et al.,
1988]; у которых разрез при операции прошел по опухолевой
ткани, инфильтрирующей зрительный нерв [Kopelman et al.,
1987].
Роль химиотерапии при экстраокулярном росте ретинобла-
стомы не обсуждается, и это связано с недостатком данных об
эффективности отдельных лекарственных препаратов. И все же
в некоторых сообщениях имеются указания на хорошее терапевтическое действие циклофосфамида. Положительная реакция опухоли была отмечена при его применении у 4 % больных
[Lonsdate et al., 1968]. Ragab и соавт. (1975) наблюдали 6 детей
с ретинобластомой, лечившихся доксорубицином (адриамици-
ном). У 1 ребенка была достигнута полная регрессия опухоли,
а у 4 реакции ее на препарат не было. Pratt и соавт. (1985) отметили хороший эффект у детей, получавших лечение цикло-
фосфамидом и ифосфамидом. Они же показали, что наилучший результат наблюдается при комбинации таких препаратов,
как циклофосфамид и винкристин.
Kingston и соавт. (1987) получили ремиссию у детей с экст-
раокулярным ростом опухоли при использовании полихимиотерапии, содержащей платину.
Противоопухолевое лекарственное лечение играет определенную роль при терапии детей с рецидивными новообразованиями [Goble et al., 1990], а также при наличии интракраниального распространения опухоли. Она может иметь значение при
начальном лечении ретинобластомы в стадии Т4 с экстрабуль-
барным ростом.
Kingston и соавт. (1992) предлагают руководствоваться следующими показаниями к применению химиотерапии.
425
Показания к химиотерапии больных с ретинобластомой
[Kingston et al., 1992]
• Экстраокулярное заболевание:
а) рецидив в орбите;
б) отдаленные метастазы;
в) эктопическая интракраниальная ретинобластома.
• Большие ретинобластомы с выраженной инвазией
хориоидальной оболочки, распространением за
решетчатую пластинку и наличием опухолевых тканей в
области разреза зрительного нерва при энуклеации.
• Как дополнительное лечение в спасении глаза после
неполной регрессии опухоли, полученной в результате
проведения лучевой терапии.
• Первоначальная терапия перед облучением детей с местнораспространенной двусторонней ретинобластомой.
Обычно используют комбинацию препаратов [Белкина Б. М.,
1992]:
• винкристин — 1 мг/м2 внутривенно в 1-й, 8-й, 15-й, 22-й
и 29-й дни;
• циклофосфан — 300 мг/м2 внутривенно в 1-й, 8-й, 15-й,
22-й и 29-й дни;
• адриамицин — 20 мг/м2 внутривенно в 8-й и 22-й дни.
При проведении поддерживающих курсов лекарственного
лечения препараты вводят в 1-й, 8-й, 15-й дни (винкристин и
циклофосфан); адриамицин — в 8-й и 22-й дни. Интервал между курсами составляет 4 нед в первые 6 мес, в последующие
6 мес — 6—8 нед и до 12 нед в третьем полугодии. Длительность
лечения до 1,5 лет.
Кроме указанных препаратов, при ретинобластоме применяют ифосфамид, вепезид, платидиам.
Альтернативной схемой полихимиотерапии, используемой
при остаточной опухоли, прогрессировании или продолженном
росте при интраокулярном распространении, являются вепезид — 100 мг/м2 — 1-й, 2-й, 3-й, 4-й, 5-й дни внутривенно
капельно, карбоплатин — 360 мг/м2 — 1-й день внутривенно
капельно.
Прогноз. Трехлетняя продолжительность жизни для детей с
ретинобластомой в Великобритании составляет около 90 %
[Sanders et al., 1988].
По данным НИИ ОНЦ РАМН, 5 лет прожили с односторонним процессом после консервативного и оперативного лечения
82 и 93 % больных, а при двустороннем — 83 и 84 % соответственно. По мнению Kingston и соавт. (1992), которое мы также
426
поддерживаем, детей с односторонней ретинобластомой, переживших 5 лет после установления диагноза, можно считать выздоровевшими. Это положение не относится к детям с двусторонней ретинобластомой, которые могут умирать в более отдаленные
сроки от эктопических интракраниальных ретинобластом (24 %)
и вторых опухолей (22 %).
Анализ литературных и собственных данных показывает, что
больные с ретинобластомой как с одно-, так и с двусторонней
локализацией умирают в основном от отдаленных метастазов (в
97 % случаев при первой форме опухоли и в 50 % — при второй). Плохие результаты лечения наблюдаются у детей с наличием опухолевых клеток на месте разреза зрительного нерва,
выполняемого при энуклеации, и при наличии значительной
инвазии хориоидальной оболочки [Stannard et al., 1979, 1985).
Многофакторный анализ, выполненный Kingston и соавт.
(1992) при изучении данных о 330 детях, показал, что последний фактор имеет отрицательное прогностическое значение
только при значительной инвазии зрительного нерва. Было показано, что 5 лет переживают только 31 % детей, у которых опухоль распространяется за решетчатую пластинку и с выраженной инвазией хориоидальной оболочки, и 25 % — при сочетании последнего фактора с наличием опухолевых элементов по
линии разреза зрительного нерва.
Прогноз относительно сохранения зрения во многом зависит от размера и локализации ретинобластомы в глазном яблоке. Опухоль, поражающая макулу, всегда ведет к снижению остроты центрального зрения, что является причиной ухудшения
зрения.
Осложнения лечения. Риск развития катаракты зависит как
от дозы излучения, так и от техники проведения облучения. У
детей, получивших 40 Гр на весь глаз, значительное помутнение
хрусталика обычно развивается через 18—24 мес после окончания курса лучевого лечения.
Радиационное поражение слезных желез может привести к
снижению или к полному прекращению секреции слезной жидкости, что делает глаз уязвимым для множества внешних воздействий, которые приводят к грубым, подчас необратимым изменениям в переднем отделе глазного яблока — развитию ксероза (высыхание, дистрофия, помутнение, распад) и потере
зрения, так как слезные и бокаловидные железы, расположенные в конъюнктиве, не обеспечивают непрерывного и достаточного увлажнения и удаления флоры, инородных тел. При
этом нарушается питание роговицы.
Правильное проведение облучения с защитой хрусталика и
передних отделов глаза позволяет во многих случаях успешно
предупредить как развитие катаракты, так и синдрома "сухого
глаза". Так, по данным НИИ ДО РОНЦ РАМН, лучевая катаракта развилась только в 19 % случаев. Среднее время возник¬
427
новения лучевой катаракты было 42,5 мес. Только 13,2 % всех
катаракт потребовали оперативного вмешательства (экстракция
катаракты в связи с ее полным созреванием). Во всех остальных
случаях она имела стационарное течение, практически не прогрессировала и существенно не влияла на зрительные функции
при нецентральной ее локализации на сетчатке.
Повреждение кровеносных сосудов сетчатки является весьма серьезным осложнением, но оно встречается только в глазных яблоках, подвергшихся повторному облучению по поводу
рецидива опухоли. Имеется мнение, что проведение химиотерапии вместе с лучевым лечением ведет к повышению риска радиационных повреждений глаза. Может наблюдаться нарушение роста костей орбиты как после энуклеации, так и после лучевой терапии. Это может привести к асимметрии орбит.
Глава 19 | МЕЛАНОМА У ДЕТЕЙ
Меланома — одна из наиболее злокачественных опухолей человека, встречающаяся в любом возрасте; частота ее у детей составляет до 0,3 % по отношению ко всем злокачественным новообразованиям кожи и сотые доли процента от пигментных
невусов и других опухолей кожи. Опухоль нейроэктодермальной природы. Встречается во всех возрастных группах, наиболее часто наблюдается в возрасте от 4 до 6 лет и от 11 до 15 лет.
Частота заболевания не зависит от пола. Опухоль локализуется
по всему кожному покрову, одинаково часто в правой и левой
половине туловища. Частой локализацией являются конечности, почти в равной степени верхние и нижние, голова — шея
и туловище.
Меланома кожи как у взрослых, так и у детей может располагаться в любом участке тела. В литературе имеются сообщения о редких формах — меланоме слизистых, акральной — лен-
тигиозной меланоме, растущей из врожденного невоклеточного
невуса. Описаны единичные наблюдения редкой локализации
меланомы у детей, например меланомы сосудистой оболочки
глаза, пигментной опухоли верхней челюсти и гортани, меланомы наружного и среднего уха. Внутриглазные меланомы у детей
встречаются редко.
Этиология и патогенез. Меланома кожи в детском возрасте
является опухолью со сложным и невыявленным этиопатоге-
незом.
В 70 % случаев меланома развивается на фоне врожденных
пигментных невусов. Большое значение уделяют травме невуса
(хронической или одномоментной). Прогноз для больных с меланомой кожи, возникшей на фоне крупного врожденного невуса, чрезвычайно неблагоприятен (приблизительно 65 % больных умирают от диссеминации процесса). Эти больные составляют группу "риска"; они должны находиться под тщательным
динамическим наблюдением.
Все большую актуальность приобретает выяснение наследственных факторов в происхождении злокачественных новообразований, в частности меланомы кожи. Описаны случаи возникновения меланомы в одной семье.
Имеются мнения, что меланома кожи входит в синдром "семейного рака I типа". В литературе дискутируется вопрос о более
частом возникновении опухолей по линии матери, чем отца, в
семейных случаях. Авторы объясняют этот феномен возможной
цитоплазматической передачей. Считается, что существует одна форма наследуемой меланомы, хотя не исключается гетерогенность. Семейные случаи меланомы составляют примерно
10 % от всей группы меланом спорадических; опухоли мульти-
фокальны, и средний возраст их появления ниже, чем спорадических.
429
Предполагают аутосомно-доминантный тип наследования
этой патологии, хотя точных данных по сегрегации этого признака в семьях не имеется.
Важную роль в возникновении меланомы отводят избыточной солнечной инсоляции.
В структуре невуса меланоцит и меланобласт являются участниками злокачественной трансформации. Главным свойством
верхнего слоя кожи (эпидермиса) является образование кератина и меланина. Известно, что меланома отличается от других
злокачественных опухолей своей биохимической неспецифич-
ностью — образованием соединений, называемых меланогенами,
которые экскретируются в увеличенных количествах меланом-
ными больными в присутствии фермента тиразиназы. Мелано-
гены — это предшественники пигмента меланина, образующиеся в результате окислительной полимеризации тирозина на
белковой матрице в специализированных цитоплазматических
органеллах — меланосомах или менопротеиновых гранулах ме-
ланоцитов. Известно, что при малигнизации меланоцитов активность тирозиназы возрастает, вследствие чего ускоряется
превращение тирозина до ДОФА и меланина внутри клеток.
Промежуточные продукты обмена могут появляться в крови, а
затем в моче; тогда проявляется меланурия.
Физиологической функцией меланина в организме является
функция защитного экрана, поглощающего УФ и видимые лучи
солнечного света и тем самым пассивно ослабляющего их действие на биологические ткани. Таким образом, генетически обусловленную пигментацию кожи можно рассматривать как естественную защитную реакцию организма на повреждающее действие света или других физических либо химических факторов
внешней среды. При повреждении меланоцитов различными
факторами внешней среды происходит развитие патогенетических процессов свободнорадикального окисления. В этом процессе окисленные продукты тирозина накапливаются и действуют на клетки токсично, возможно и канцерогенно. Считается,
что нормальные меланоциты имеют защитный механизм против токсичных субстанций, образовавшихся в процессе окисления тирозина в меланин. Одним из компонентов защитной
системы является система антиоксидантной защиты клетки.
Однако эта система лабильна и легко разрушается в клетке, и
тогда тирозин, ДОФА и его производные, накапливаясь, разрушают меланоциты, что соответствует появлению ранних признаков заболевания, составляющих его симптомокомплекс, называемый "синдромом злокачественного перерождения”.
Этиология возникновения меланомы у детей до сих пор остается неясной, в связи с чем стоит задача ранней диагностики,
т. е. выявления меланомы среди пигментных невусов.
Диагностика. Важное значение, оказывающее влияние на
повышение эффективности лечения больных детей с меланомой
430
кожи, имеет совершенствование методов диагностики этого заболевания. Трудности диагностики и дифференциальной диагностики меланомы кожи у детей возникают в связи с разнообразием клинической картины, а также сходством этой опухоли
с многочисленными доброкачественными и злокачественными
опухолями кожи. Диагностика меланомы кожи у детей должна
быть комплексной и включать, как правило, выявление жалоб
больного, клиническую оценку анамнестических данных, осмотр больного, использование дополнительных методов исследования (радиоизотопный, термографический, цитологический
при опухолях с изъязвленной и кровоточащей поверхностью и
др.). Решающую роль при установке диагноза меланомы играет
гистологическое исследование опухоли после ее иссечения.
Комплексной диагностикой опухолей у детей решаются 3
основные задачи: выявление опухоли; уточнение ее величины,
локализации и распространенности процесса; уточнение стадии заболевания.
Для опухолей наружной локализации основным методом диагностики является осмотр ребенка. Диагностическим критерием, способствующим выявлению меланомы на ранних стадиях,
является местная симптоматика.
При подозрении на меланому кожи для уточнения диагноза
используют ряд дополнительных методов исследования (радиоизотопный, определение меланурии, термографический, морфологические и другие методы).
Радиофосфорную пробу (фосфорный тест), или контрастную p-радиометрию первичного очага опухоли, применяют
обычно до начала лечения. Считается, что этот метод помогает
уточнить характер исследуемого новообразования и выявить
степень воспалительных явлений. Сущность его состоит в сравнительном подсчете накопления фосфора в подозрительном
пигментном элементе и симметричной точке здоровой кожи
противоположной стороны тела. Оценку пробы производят по
показателям относительного накопления и по времени нахождения изотопа в опухоли. Для меланомы кожи характерны показатель относительного накопления изотопа более 200 % и
медленное выведение последнего из опухоли. Фосфорный тест
может быть применен как дополнительный метод дифференциальной диагностики меланомы кожи у детей в трудных клинических случаях.
Для диагностики меланомы кожи применятся термографический метод исследования, основанный на разнице температур
кожи, окружающей опухоль, и самой опухоли. Высокое термообразование при меланоме связано с интенсивным метаболизмом пигментных клеток. В результате исследования термографическим методом получаются термограммы. На наличие меланомы указывает "горячий очаг” в области новообразования.
Может выявиться "холодный очаг”, который соответствует эк¬
431
зофитной части видимой опухоли, окруженной "теплым ореолом". У больных с меланомой кожи термогенная активность в
опухолевом очаге составляет 1,9—3 °С. В группе детей с пигментными новообразованиями она не превышает в большинстве случаев 1—1,5 °С; при воспалении в невусе — до 2 °С. Термографический метод оказался информативным, он может
быть использован как самостоятельно, так и в комплексной диагностике меланомы кожи у детей, а также при контрольном
наблюдении за больными в амбулаторных условиях. Несомненным достоинством является безопасность метода, что особенно
важно в детской практике.
К недостаткам данного метода применительно к диагностике следует отнести то, что с его помощью не всегда можно
разграничить меланому и другие опухоли кожи и мягких тканей.
Морфологические методы диагностики занимают одно из
ведущих мест в диагностике и дифференциальной диагностике
меланомы кожи у детей. При помощи цитологического метода
исследования можно подтвердить или опровергнуть наличие
меланомы, определить ее распространенность. Этот метод применяется в случае изъязвления поверхности опухоли (мазки, отпечатки), а также в пунктатах лимфатических узлов.
Мы придерживаемся общепризнанного мнения о том, что
первичную опухоль не следует пунктировать и нарушать ее целостность (в возникновении меланомы кожи у детей могут
иметь значение травмы поверхности некоторых пигментных
невусов, в частности обширных).
Цитологическая картина меланомы характеризуется присутствием в опухоли полиморфных клеток с выраженным атипиз-
мом. Преобладает эпителиальный тип клеток. Кроме того, видны гистиоидные полуразрушенные элементы с наличием пигмента, гранулы которого располагаются как внутри клетки, так
и внеклеточно. Наряду с этим встречаются клетки саркоматозного типа.
При исследовании цитологического материала из метастатических узлов меланомы клеточная картина чаще повторяет таковую при первичной опухоли.
Совокупность всех клинических симптомов, а также последовательное проведение дополнительных методов диагностики
позволяют с большей долей вероятности заподозрить меланому.
Однако диагноз ставится окончательно только после гистологического исследования опухоли, после ее иссечения с учетом
клинических данных и данных дополнительных методов исследования.
Хотя ведущая роль в диагностике принадлежит гистологическому исследованию, оно подтверждает диагноз только в 70 %
случаев. Общий процент ошибочного первичного диагноза меланомы варьирует от 2 до 6,3 %, и его следует считать низким.
432
Многие исследователи на собственном материале отмечают, что
ошибки диагноза связаны как с завышением тяжести процесса,
так и с его недооценкой, т. е. гипер- и гиподиагностикой.
Гистологическая картина меланомы кожи у детей аналогична таковой у взрослых. Опухоль состоит из полиморфных клеток — эпителиоподобных, веретенообразных, невусоподобных.
Эпителиоподобные клетки образуют ячейки и солидные поля,
веретеноподобные складываются в тяжи. Пигмента в опухоли
может быть различное количество. Преобладает лимфоидная
инфильтрация, однако встречаются также очаговая и плазмо-
цитарная. У детей преобладает узловая форма роста меланомы,
что, возможно, связано с анатомо-морфологическим строением
кожи у детей.
Гистологическими критериями, наиболее важными для постановки диагноза меланомы, являются наличие клеточной
атипии, выраженный клеточный полиморфизм, изменения в
ядре и ядрышках, гигантские клетки, наличие митотических
фигур, инвазия в верхние слои эпидермиса, воспалительная реакция и глубина инвазии.
По клеточному составу меланому подразделяют на четыре
основных типа: эпителиальный, веретеноклеточный, смешанный и невоклеточный (мелкоклеточный). Морфологически ма-
лигнизация невуса проявляется ростом меланоцитов, проникновением их в эпидермис; как правило, в окружности пигментного очага возникает лимфоцитарный инфильтрат.
На основании достаточного изучения симптомологии меланомы кожи у детей в ряде случаев установление правильного
диагноза возможно при минимальном объеме диагностических
исследований, что позволяет в кратчайшие сроки проводить
оперативные вмешательства.
Меланому кожи часто приходится дифференцировать с другими новообразованиями, как с доброкачественными, так и со
злокачественными. В данном случае к доброкачественным процессам относятся ювенильная меланома, невус Якимото или
монгольские пятна, себорейная бородавка, нейрофиброматоз
(болезнь Реклингхаузена), опухоли сосудистого происхождения
(капиллярная и склеродермальная гемангиома), эпидермаль-
мые кисты; к злокачественным —злокачественная гистиоцитома, эмбриональная рабдомиосаркома, рак кожи (из придатков
кожи и сальных желез).
Клиническая картина меланомы кожи у детей вариабельна.
Местные ранние признаки заболевания составляют локальный
симптомокомплекс:
• быстрый рост опухоли;
• изменение цвета (иногда до черного);
• разрастание одного из участков ранее спокойного невуса;
433
• асимметрия, покалывание, жжение, возвышение над поверхностью кожи, появление папилломатозных выростов,
трещин;
• кровоточивость (даже однократная);
• изъязвление поверхности опухоли;
• выпадение волос на пораженном участке при волосатом
пигментном невусе (чаще на фоне обширного пигментного невуса);
• появление венчика воспаления вокруг опухоли. Ранние
симптомы заболевания составляют синдром активации
невуса, или синдром злокачественного перерождения.
Прогрессирующему росту могут подвергаться как врожденные
пигментные невусы, так и появившиеся на неизмененной коже.
Развитие заболевания бывает бурным, но иногда оно имеет
волнообразный характер. При этом темпы роста бывают разные.
Иногда рост их как бы прекращается, а между тем появляется заметное увеличение регионарных лимфатических узлов. В некоторых случаях росту пигментного образования предшествует
усиление его пигментации. Также может наблюдаться и бурное
течение опухолевого процесса с быстрым появлением метастазов
и прогрессированием заболевания.
Поздние признаки заболевания — появление сателлитов, увеличение регионарных лимфатических узлов, выраженные симптомы интоксикации в стадии диссеминации.
Рассматривая разнообразие клинической картины меланомы
кожи, необходимо остановиться на особенностях метастазиро-
вания этой опухоли у детей. К ним можно отнести преобладание
лимфогенного пути метастазирования, появление метастаза в
течение 1-го года жизни от начала заболевания.
Отмечено, что метастазирование в лимфатические узлы не
зависит от размеров первичной опухоли, тогда как метастазы в
кожу возникают при больших размерах первичной опухоли
(обычно более 5 см в диаметре).
Переходя к вопросу о возможностях лечения меланом и прогнозе заболевания, необходимо остановиться на вопросе о
классификации этого заболевания.
Наряду с классификацией ВОЗ на практике чаще приходится
использовать клиническую классификацию. Выделяют 3 формы
заболевания.
• локальная;
• местнораспространенная;
• диссеминированная.
Удачной является классификация меланом, предложенная
Т. Fitzpatrick и соавт. (1999).
Важно отметить, что особенностью меланомы у детей является в большинстве случаев преобладание узловой формы роста.
434
Классификация меланом, Т. Fitzpatrick и соавт. (1999)
Меланома
Широко распространен- Поверхностно распространенные формы
ные формы
Узловая меланома
Лентиго
Редкие формы Акральная лентигиозная
Меланома слизистых оболочек
Растущая из врожденного невоклеточного
невуса
Растущая из диспластического невуса
Крайне редкая форма Десмопластическая
Предшественники меланомы
Врожденный невоклеточный невус (гигантский)
Диспластический невус (гигантский или мелкий)
Злокачественное лентиго
Известную роль в прогнозе данного заболевания играет местная распространенность опухоли. Кларк выделил 5 уровней
инвазии в зависимости от анатомического строения кожи.
• I — опухоль находится в эпителии над базальной мем¬
браной;
• II — опухоль распространяется до росткового слоя дер¬
мы (прорывает базальную мембрану), основная
масса ее в сосочковом слое дермы;
• III — опухоль проникает глубже, но не выходит за пре¬
делы дермы (клетки опухоли собираются в ретикулярном слое дермы);
• IV — опухоль выходит за пределы дермы (на уровне по¬
товых желез);
• V — инвазия подкожно-жирового слоя.
Бреслоу увеличил информативность уровней инвазии по
Кларку, измеряя также толщину опухоли в миллиметрах.
Лечение. Одной из биологических особенностей меланомы
является высокая резистентность ее к химиотерапевтическому
и лучевому воздействию.
В то время как вопросы химиотерапии у взрослых разрабатываются давно, лекарственное лечение у детей стало применяться лишь в последние десятилетия. Именно поэтому до настоящего времени ведущим в лечении меланом кожи у детей является хирургический метод.
При выборе тактики лечения необходим индивидуальный
подход в каждом конкретном случае с учетом формы заболева-
435
ния, локализации опухоли, уровня инвазии по Кларку и толщины опухоли по Бреслоу, размера опухоли и характера поверхности.
Основным методом лечения как локальных, так и распространенных форм заболевания является хирургический. При
локальных формах заболевания можно ограничиться оперативным вмешательством (иссечение опухоли в пределах здоровых
тканей до фасции).
Выживаемость больных при небольших первичных опухолях, толщина которых не более 2 мм, приближается к 80 %.
При генерализованных формах меланомы основным методом лечения является лекарственный. Применяются монохимиотерапия и полихимиотерапия. Препаратами, которые наиболее часто применяются при лечении меланомы в различных
Таблица 19.1. Схемы химиотерапии, применяемые
при диссеминированных формах меланомы кожи
Наименование
препарата
Доза и режим введения
Интервал между
курсами
химиотерапии
Дакарбазин
200—300 мг/м2 внутривенно с 1-го
по 5-й день
3—4 нед
Сии Ну
80 мг/м2 внутривенно в 1-й день
Цисплатин
30 мг/м2 внутривенно в 3-й, 4-й,
6 нед
5-й и 6-й дни
Винкристин
1,4 мг/м2 внутривенно в 1-й
и 8-й дни
Нидран
1—2 мг/м2 внутривенно в 1-й день
Цисплатин
100 мг/м2 внутривенно в 1-й день
6 нед
Винкристин
1,4 мг/м2 внутривенно в 1-й
и 8-й дни
Дакарбазин
200—300 мг/м2 внутривенно
с 1-го по 5-й день
3 нед
Цисплатин
80 мг/м2 внутривенно в 1-й день
Нидран
1 мг/м2 внутривенно в 1-й день
Дакарбазин
250 мг/м2 внутривенно с 1-го
3 нед
по 3-й день
Цисплатин
100 мг/м2 внутривенно в 3-й день
Примечание. Иммунотерапия интроном А или рофероном А в режиме
3 млн ЕД/м2 подкожно через день проводится длительно, как адъювантная, а
в случае эффекта химиотерапии — для увеличения длительности ремиссии.
436
комбинациях, являются дакарбазин (ДТИК), араноза, проспи-
дин, производные нитрозомочевины и производные платины (цис-
платин, карбоплатин и платин).
Эффективность полихимиотерапии на 25—35 % выше, чем
при монохимиотерапии. Схемы и режимы проведения химиотерапии различны.
Особенностями течения меланомы кожи у детей являются
узловая форма роста, лимфогенный путь метастазирования, появление рецидивов и метастазов, чаще в 1-й год после окончания лечения (иссечения опухоли).
Методы лечения локальных и распространенных форм заболевания следующие.
1. Хирургический (иссечение первичной опухоли).
2. Хирургический + криодеструкция (при подкожных метастазах).
3. Криодеструкция как самостоятельный метод (при подкожных метастазах).
4. Электроэксцизия.
5. Иммунотерапия (после иссечения первичного очага) —
находится в стадии изучения.
6. Лучевая терапия (возможно ее применение при рецидивном
характере — облучение рубца после иссечения рецидива и облучение метастазов; при сомнении в радикальности операции).
При диссеминированной форме заболевания (лимфогенном
и гематогенном метастазировании) применяется химиотерапия
(табл. 19.1).
Несмотря на существующий прогресс в методах диагностики
и лечения злокачественных опухолей, до настоящего времени,
по данным ВОЗ, не менее 40—50 % больных умирают от прогрессирования болезни в первые 5 лет от начала лечения. Терапевтические возможности лекарственного лечения меланомы
кожи у детей полностью не раскрыты.
Комбинации химиопрепаратов, применяемые при лечении детей
с диссеминированной формой меланомы кожи
Винкристин
Дактиномицин
Проспидин
Винбластин
Блеомицин
Проспидин
Дакарбазин (ДТИК) + иммунотерапия
(между курсами лечения)
CCNU
Винкристин
Платидиам
Примечание. Препараты применяются в возрастных дозировках из расчета на 1 м2 поверхности тела ребенка.
437
Прогноз заболевания. Установлено, что при III уровне инвазии по Кларку и опухоли менее 0,76 мм больные имеют благоприятный прогноз заболевания. У детей более благоприятный
прогноз при адекватно проведенном лечении выявлен при локальной форме заболевания, при I—III уровне инвазии по Кларку и толщине опухоли по Бреслоу менее 1,5 мм при малых размерах образования и при локализации опухоли на конечностях.
Таким образом, вопросы ранней диагностики на этапе иммунологических и морфологических исследований при злокачественных меланомах кожи у детей продолжают развиваться и
совершенствоваться. В этой связи проблемы современной адекватной терапии этого редкого вида злокачественного опухолевого поражения продолжают изучаться и совершенствоваться.
Глава 20
ЗЛОКАЧЕСТВЕННЫЕ ЭПИТЕЛИАЛЬНЫЕ
ОПУХОЛИ У ДЕТЕЙ
20.1. Гепатоцеллюлярный рак
Первичные опухоли печени у детей наблюдаются редко; они
включают от 0,5 до 2 % случаев в детском возрасте и занимают
по частоте 10-е место. Ежегодная частота выявления злокачественных опухолей печени составляет 1,6 на 100 000 детей как
в РФ, так и зарубежом.
Большинство злокачественных опухолей печени относится к
двум большим морфологическим категориям — гепатобластоме
и гепатоцеллюлярному раку; 57 % опухолей печени у детей являются злокачественными.
Эпидемиология и этиология. Частота выявления гепатоцел-
люлярного рака у детей — 0,05—0,16 на 1000 больных злокачественными заболеваниями.
Среди детей с опухолями печени преобладают мальчики в
соотношении 2:1. Наиболее часто гепатобластома встречается у
детей младше 5 лет, а в 25 % случаев опухоли печени у детей обнаруживаются в первые 12 мес жизни. Гепатокарцинома встречается в основном в старшем возрасте, после 5 лет, особенно
часто в 10—15 лет.
Все большее внимание при изучении этиологии опухолей
печени у детей уделяют трансплацентарному бластомогенезу;
имеются примеры перинатального переноса австралийского
антигена с последующим развитием (через 6—7 лет) гепатоцел-
люлярной карциномы.
Имеются указания на заболевания и врожденные пороки
развития, которые могут приводить к злокачественным опухолям печени или сочетаться с ними. К ним относятся дефицит
а-антитрипсина, цирроз печени, синдром Фанкони, тирозину-
рия, атрезия желчевыводящих ходов, врожденный гепатит, га-
лактоземия.
Состояние матери во время беременности; употребление беременной женщиной напитков, содержащих алкалоиды; прием
лекарств, влияющих на ферментную активность печеночных
клеток могут способствовать возникновению рака печени у детей, родившихся от этой беременности.
Описаны случаи гепатоцеллюлярной карциномы и у детей с
лимфобластным лейкозом, которые ежедневно принимали метотрексат. Имеются также указания на связи между гепатоцеллюлярной карциномой и нейрофиброматозом, семейным поли-
позом, облучением матери во время беременности.
Патологическая анатомия. Микроскопически гепатоцеллю-
лярная карцинома отличается от гепатобластомы наличием крупных клеток, превосходящих своими размерами нормальный ге-
439
патоцит, а также наличием трабекул, значительным полиморфизмом ядер и отсутствием очагов гематопоэза.
На момент диагностики опухоль часто бывает глубоко инвазивной или мультицентричной, что делает возможным выполнение радикальных удалений опухолей менее чем у 30 % больных.
Следует отметить, что гепатоцеллюлярный рак имеет отличительные ультраструктурные особенности, которые позволяют
дифференцировать ее с другими опухолями. Наиболее характерными особенностями являются наличие крупных круглых
центрально расположенных ядер, выпуклых ядрышек, избыток
крупных митохондрий и частое возникновение микроворсинок
на плазменной мембране.
Стадии заболевания. Вопрос о стадийности опухолевого процесса при гепатоцеллюлярном раке остается довольно сложным, что связано как со скрытостью течения заболевания, так
и с топографоанатомическими особенностями строения этого
органа.
Используется модифицированная классификация Children's
Cancer Study Group and Southwest Oncology Group. Данная система основана на степени распространения опухолевого процесса и объеме возможной хирургической резекции:
• I стадия — возможна полная резекция опухоли по¬
средством клиновидной лобэктомии или
расширенной лобэктомии в качестве инициального лечения (поражение одного или
нескольких сегментов);
• ИА стадия — возможна полная резекция опухоли после
ипидеальной лучевой и/или химиотерапии
(несколько сегментов);
• IIБ стадия — процесс захватывает только одну долю пе¬
чени (все сегменты);
• III стадия — поражение обеих долей печени;
• IIIБ стадия — поражение регионарных лимфатических
узлов;
• IV стадия — отдаленные метастазы независимо от рас¬
пространенности опухолевого поражения.
Клиническая картина. Симптоматология гепатоцеллюлярной
карциномы тесно связана с распространенностью опухолевого
процесса и в значительной степени зависит от длительности заболевания, т. е. времени от момента появления первых признаков заболевания до морфологического подтверждения диагноза.
Около 80 % от числа выявленных детей поступают в поздних
стадиях с выраженной развернутой генерализованной клинической картиной заболевания.
В ранних стадиях заболевания у детей появляется целый ряд
общих симптомов: периодические летучие боли в животе, тошнота, рвота, анорексия, потеря массы тела. Указанные симптомы
440
только косвенно могут указывать на наличие опухолевого процесса и составляют так называемый опухолевый симптомоком-
плекс, присущий как опухолям печени, так и другим локализациям неопластического процесса.
К сожалению, в общеврачебной сети эти признаки часто остаются без внимания. Тогда первым симптомом, который заставляет заподозрить заболевание, является обнаруживаемая в
животе опухоль.
К числу наиболее часто встречающихся ранних признаков
рака печени можно отнести периодические боли в животе; увеличение окружности живота; периодические подъемы температуры, анорексию, похудание, повышение СОЭ, а также слабость,
периодическую рвоту и "беспричинное" беспокойство ребенка.
Значительно реже у детей отмечается острое начало процесса,
видимо, связанное как с растяжением лиссоновой капсулы, так
и с синдромом "абдоминального рака". В этих случаях заболевание симулировало явления "острого живота". Однако встречается это у детей достаточно редко.
Клинико-анамнестическая диагностика. Трудности клинического распознавания опухолей печени связаны с их длительным
бессимптомным течением, когда опухоль растет без каких-либо
регистрируемых изменений в организме.
Брюшная полость, в которой пальпируется опухоль, в силу
своих анатомических особенностей дает достаточный запас
пространства, и даже при значительных размерах новообразование может не вызывать сдавления прилежащих органов и тканей.
Кроме того, существенной особенностью течения опухолей в
детском возрасте является отсутствие субъективного компонента,
т. е. ребенок не может оценить и передать свои ощущения. При
пальпации в печени удается выявить опухолевые узлы только
значительных размеров, выходящие за пределы органа, вызывающие его деформацию. Узлы меньших размеров и располагающиеся внутриорганно определить пальпаторно даже с применением миорелаксантов практически невозможно.
Пальпация далеко не всегда позволяет установить орган, из
которого исходит опухоль (почка, надпочечник, желудок и др.),
но само обнаружение опухоли в животе дает возможность наметить план дальнейшего обследования ребенка, подобрать
требуемые дифференциально-диагностические приемы.
Лабораторно-биохимическое исследование. Лабораторные
исследования обнаруживают характерную для гепатоцеллюляр-
ной карциномы слабую нормохромную нормоцитарную анемию,
увеличение СОЭ, повышение уровня фибриногена и фибринолитической активности.
Функциональные пробы печени при распознавании ранних
стадий опухолевого поражения имеют лишь относительное значение и не обладают высокой диагностической точностью.
441
Иммунологическая диагностика. Наиболее ценным лабораторным тестом как для диагностики, так и для контроля за прогрессированием опухолевого процесса является реакция Абелева — Татаринова. Это серологический тест на эмбриональный
альфа-фетопротеин (АФП).
Продуцирование АФП гепатоцеллюлярными карциномами,
гепатобластомами и тератобластомами широко используется в
диагностике и оценке лечения этих форм опухолей.
К другим диагностическим тестам относится серологическая
оценка наличия антигена вируса гепатита В — австралийского
антигена.
В настоящее время мы считаем, что дети с наличием антигена
вируса гепатита В должны выделяться в отдельную диспансерную группу и подвергаться более частому и углубленному обследованию в отличие от остального детского контингента.
Рентгенорадиологические, ультразвуковые и инвазивные методы диагностики. Одним из наиболее доступных методов исследования печени является радионуклидная гепатосцинтигра-
фия. Диагностическая чувствительность этого метода колеблется
от 39 до 89 %, но специфичность крайне низка.
На сканограммах в большинстве случаев невозможно определить природу выявленных изменений в печени. Сходную картину могут давать доброкачественные и злокачественные опухоли, метастазы и гиперплазии, кисты, абсцессы и паразитарные заболевания.
В последнее десятилетие для диагностики опухолей печени
активно используется УЗИ. Ультразвуковая томография (УЗТ)
особенно ценна для выявления образований в увеличенной печени и для дифференцировки солидных опухолей от кистозных.
Однако и гепатобластома, и гепатоцеллюлярный рак имеют
диффузные гиперэхогенные участки, что затрудняет дифференциальную диагностику.
Доброкачественные опухоли слабоэхогенны, а гемангиомы и
другие сосудистые опухоли содержат участки различной эхоген-
ности.
Ультразвуковой метод — самый щадящий и наиболее дешевый метод инструментальной диагностики. Он достаточно информативен, его чувствительность колеблется от 50 до 85 %.
С помощью ультразвукового метода довольно часто можно выявить образования в печени, но трудно определить исходную
локализацию — сегмент печени, хотя долевую принадлежность
образования можно установить с высокой точностью.
Определенные сложности возникают при определении распространенности опухолевого процесса как внутри печени, так
и на окружающие ткани и органы. К достоинствам метода следует отнести и неинвазивность, что выгодно отличает ультразвуковой метод от ангиографии и рентгеновской компьютерной
томографии с внутривенным усилением. Сочетание ультразву¬
442
кового исследования с пункционной аспирационной биопсией
усиливает его эффективность и специфичность.
Метод успешно используется для определения динамики
опухоли в процессе ее предоперационного химиотерапевтического лечения.
На большинство вопросов, связанных с распространенностью
опухолевого поражения печени, может ответить аксиальная
рентгеновская компьютерная томография (КТ). Кроме того, КТ
имеет особую ценность для определения степени распространенности, анатомических границ опухоли и возможности ее резекции. КТ-сканирование имеет особое значение для диагностики опухолей левой доли печени, когда ангиографическая диагностика часто затруднена или полностью исключена.
С помощью метода КТ достаточно достоверно дифференцируются кистозные и солидные образования в печени. Используемая в данной методике денситометрия легко различает жировые, газовые и известковые включения. На компьютерных
томограммах хорошо видна капсула образования, по которой
определяются опухолевая инфильтрация и степень инвазии.
Следует отметить, что гепатоцеллюлярный рак характеризуется более низким разжижением в сравнении с гепатобласто-
мой и окружающей тканью; в редких случаях плотность бывает
одинаковой. Кроме того, обилие известковых включений характерно для гепатоцеллюлярного рака.
Посредством КТ-сканирования может быть определено состояние регионарных лимфатических узлов ворот печени, что
также необходимо для выбора тактики лечения больного.
В последнее время широко применяется сочетание КТ с
пункционной аспирационной биопсией, которую можно выполнить прицельно в любую долю опухоли от 2 до 3 см независимо от глубины залегания. Можно выбрать оптимальный путь
прохождения иглы вдали от "опасных" зон. Эта комбинация двух
методов исследования имеет высокую специфичность, так как
сочетает лучшие диагностические возможности каждого из них.
Компьютерная томография позволяет определить распространенность опухолевого процесса на окружающие органы и
ткани, достаточно хорошо визуализировать сосуды как внутри
печени, так и в области ворот, а также нижнюю полую вену и
аорту. Однако в определении гистологической принадлежности
злокачественной опухоли печени КТ имеет малую диагностическую ценность.
КТ-исследования значительно затруднены у детей до 1 года,
у которых из-за отсутствия подкожного жирового слоя трудно
определить границы между отдельными тканями и образованиями. Получение качественного изображения на томограммах
также затруднено из-за физиологического пневматоза кишечника и подвижности детей. Трудно отличить множественные
милиарные поражения печени от диффузных неопухолевых
443
процессов, часто встречающихся в детском возрасте. Не всегда
визуализируется переход опухоли печени на окружающие ткани
и/или органы, если участок мал и не попал в "срез". Кроме того,
лучевая нагрузка при КТ не меньше, чем при обычной рентгенографии, а при использовании внутривенного усиления или
пункционной биопсии метод уже нельзя назвать неинвазивным.
Одними из наиболее точных методов исследования, позволяющих осмотреть поверхность печени и взять материал из интересующего участка для гистологического и цитологического
анализов, являются лапароскопия и чрескожная аспирационная биопсия печени. Однако лапароскопия имеет ряд существенных недостатков. Так, во время лапароскопии остаются недоступными для визуального контроля верхние и задние отделы
печени и очаговые изменения в глубине органа. Кроме того,
малый объем брюшной полости у детей, четкое присутствие
спаечного процесса, как врожденного характера, так и ятрогенного, приводят к трудностям и частым ошибкам при лапароскопической диагностике.
Аспирационная биопсия позволяет получить цитологический материал и в 76,5 % случаев решить вопрос о наличии опухолевого процесса в печени.
К сожалению, возможности аспирационной биопсии ограничиваются только определением наличия и характера опухоли, ее
гистологической формы. Определять распространенность опухолевого процесса внутри печени и за ее пределами пункционным методом нецелесообразно. Вместе с тем не всегда имеется
уверенность в том, что игла попадет в патологически измененные ткани. Диагностическое значение имеют только положительные результаты пункции, а отрицательные данные не исключают опухолевого поражения печени; очаги, расположенные в верхних отделах толщи паренхимы печени под куполом
диафрагмы, затрудняют исследование. Кроме того, использование этого метода не дает гарантии повреждения соседних органов или крупных сосудов с последующими осложнениями.
Если вопросы диагностики так и не решены или решены неоднозначно, то применяют ангиографию. Среди инвазивных
этот метод наиболее информативен, выполняется путем рентгеноконтрастного исследования сосудов пораженного органа.
Известно, что при обычном рентгенологическом исследовании печени ткань ее гомогенная, так как этот орган лишен естественной контрастности, а также нет существенной разницы
между самой печенью и окружающими тканями. В связи с этим
рентгенологическое исследование печени становится возможным лишь при создании искусственной контрастности очагов
и тканей, расположенных вне и в самой печени. Это может быть
достигнуто контрастированием трубчатых систем печени.
Информативность ангиографии в выявлении патологических изменений в печени равна 95,2 %.
444
Таким образом, используя ангиографию при подозрении на
неопластический процесс в печени, мы можем не только подтвердить или опровергнуть наше предположение, но и четко локализовать анатомическую область поражения (доля, сегмент),
выяснить характер поражения (доброкачественное, злокачественное) и определить гистологический вариант опухоли, т. е.
добиться скорейшего начала лечения.
Лечение. Основным методом лечения является хирургический в объеме гемигепатэктомии. В настоящее время ведутся
исследования полихимиотерапевтического и лучевого лечения,
однако их результаты пока неоднозначны.
20.2. Опухоли желудочно-кишечного тракта
Злокачественные эпителиальные (раковые) опухоли желудочно-кишечного тракта встречаются у детей значительно реже, чем у взрослых, и составляют от 0,8 до 6 % всех солидных
опухолей детского возраста и 1 % опухолей с наиболее неблагоприятным исходом.
В большинстве случаев рак пищеварительного тракта у детей
имеет неблагоприятный прогноз, поскольку диагностируется
чаще случайно, в далеко зашедшей стадии, что объяснимо отсутствием онкологической настороженности педиатров в выявлении данных опухолей.
Только разработка ранней диагностики опухолей и выявление контингента больных с предраковыми состояниями сможет
значительно увеличить показатели выживаемости.
Эпидемиология и этиология. Эпидемиологические исследования показали, что географические факторы играют роль в
развитии карцином органов, подвергающихся прямому действию канцерогенов из окружающей среды, как, например, рак
желудка и толстой кишки. Тем не менее выявить, какие канцерогены сами по себе ответственны за развитие рака желудка и
кишечника у взрослых, а тем более у детей, пока не удалось.
Известно лишь одно предраковое состояние толстого кишечника генетического происхождения — семейный полипоз
кишечника, передающийся по доминантному типу.
Рассматривая карциномы "пищеварительной трубки”, необходимо учитывать, что этот вид рака является наиболее частым
в нижних слоях социально-экономических групп населения.
Мальчики почти в 2 раза чаще девочек подвержены раку желудочно-кишечного тракта.
Патологическая анатомия. От 75 до 95 % злокачественных новообразований желудочно-кишечного тракта — аденокарциномы.
Патоморфология всех видов рака желудочно-кишечного
тракта у детей практически одинакова и не отличается от таковой у взрослых.
445
Наиболее часто встречается метастазирование по лимфатическим путям, но оно зависит от локализации опухоли и ее гистологического строения.
Гематогенное метастазирование в основном происходит в
печень, однако метастазы в печени могут появиться и лимфогенным путем. Метастазы в печени чаще множественные, появляются в основном в правой доле. Метастазирование в другие
органы наблюдается реже.
Достаточно часто встречаются имплантационные метастазы
по брюшине и диссеминация опухолевых узлов по брыжейке и
петлям кишечника.
Стадии заболевания. На основании оценок соотношения
дифференцированных и недифференцированных клеток и степени инвазивности опухоли в стенку пораженного органа при
аденокарциномах наиболее подходит классификация TNM.
Клиническая картина. В начальных стадиях рак желудочно-
кишечного тракта отличается отсутствием патогномоничных
признаков.
Важнейшие симптомы начальных стадий опухолевого заболевания можно разделить на 3 основные группы.
• 1-я группа. Нарушения, проявляющиеся смутным беспокойством, легким ухудшением самочувствия, потерей
массы тела и аппетита, слабостью, недомоганием, быстрой утомляемостью. Специфических признаков поражения желудочно-кишечного тракта нет.
• 2-я группа. Клиника болезни соответствует всему комплексу хорошо известных типичных и нетипичных симптомов банальных заболеваний "пищеварительной трубки",
присущих детям старшего возраста. Поэтому нередко в
начале заболевания диагностируются хронические холециститы, гастриты, энтероколиты, иногда язвенная болезнь
желудка, и больному назначаются соответствующая диета,
лечение. Первоначально такое лечение бывает успешным,
что успокаивает родителей ребенка и дезориентирует лечащего врача.
• 3-я группа. Проявляются специфические д ля пораженного
органа симптомы с потерей аппетита, расстройствами пищеварения: поносом, запором, изжогой, отрыжкой, вздутием живота, тошнотой, рвотой (от простого срыгивания
только что проглоченной пищей до рвоты застойными
массами, часто с примесью крови), кишечным кровотечением разной интенсивности.
Диагностика. В ранних стадиях развития рака желудочно-
кишечного тракта анамнестические данные и результаты объективного обследования очень скудны и неспецифичны.
Не все родители придают одинаковое значение расстройствам функций желудка и кишечника, если они слабо выраже¬
446
ны. Только путем скрупулезного обследования можно выявить
небольшие изменения пораженного органа, вызванные опухолевым процессом, поэтому даже на незначительные жалобы и
нарушения нужно обращать особое внимание. Уже сочетания
трех признаков: потери аппетита, беспричинной слабости и похудания больного — достаточно для того, чтобы назначить ребенку соответствующее обследование.
При подозрении на опухоль кишечника необходимо тщательно пальпировать область живота в различных положениях
больного ребенка на спине, на левом и правом боку, стоя. При
опухолях, расположенных низко в ректосигмоидной зоне, необходимо применять ректальное пальцевое исследование, позволяющее выявить не только саму опухоль, но и ее отношение
к матке, мочевому пузырю.
Ведущее место в диагностике опухолей желудочно-кишечного тракта занимают рентгенологические и эндоскопические
исследования.
С помощью этих методик удается выявить изменения, характерные для предрака и перехода его в рак в том периоде, когда еще нет инфильтрации мышечной оболочки и появляется
она только на поверхности слизистой оболочки в виде отдельного бугорка или полипа.
Лечение. При карциномах желудочно-кишечного тракта радикальная резекция служит методом выбора и дает надежду на
полное выздоровление. Применяемая в последнее время полихимиотерапия не приносит желаемых результатов и требует
дальнейшего изучения.
20.3. Опухоли почки
Одной из наиболее редких эпителиальных опухолей почки
является почечно-клеточная карцинома (светлоклеточная карцинома, почечно-клеточная аденокарцинома). Впервые опухоль описана и изучена Grawitz в 1886 г.
Эпидемиология и этиология. Частота рака почки у детей колеблется в пределах 0,3—3,8 %. Заболевание чаще встречается
в возрасте старше 9 лет и, как правило, поражает только одну
почку.
Этиологические предпосылки рака почки у детей неизвестны. В настоящее время в различных литературных источниках
высказываются гипотезы о связи светлоклеточной карциномы
с озлокачествлением кист почки, развивающихся при болезни
Гиппеля—Ландау (наследственном ангиоматозе сетчатки и мозжечка), некрозом почечных сосочков вследствие приема фенацетина.
Патологическая анатомия. Патоморфологи относят светлоклеточную карциному к железистым опухолям (аденокарцино¬
447
мам). Микроскопически опухолевая ткань напоминает почечные канальцы.
Почечно-клеточная аденокарцинома метастазирует преимущественно гематогенным путем в легкие, печень, кости, контралатеральную почку. Нередко наблюдается и лимфогенный
путь метастазирования, прежде всего в регионарные лимфатические узлы.
Стадии заболевания. Сочетание классификации TNM и критерия инвазии вен обеспечивает наиболее точное определение
распространенности процесса.
Клиническая картина почечно-клеточного рака состоит из
общих и местных симптомов. Общие симптомы характерны для
всех локализаций опухолей у детей и обозначаются общим опухолевым симптомокомплексом.
К местным симптомам относится классическая триада: гематурия, боль и пальпируемая опухоль.
Отмечается паранеопластический синдром, характерный для
почечно-клеточной карциномы у детей. Это дисфункция печени, устраняющаяся после удаления первичной опухоли, и синдромы, проявляющиеся вследствие эктолической продукции
различных гормонов, включая паратгормон (гиперкальциемия),
эритропоэтин (кальциемия), гонадотропин (гинекомастия) и др.
Следует также отметить, что дети с почечно-клеточной карциномой обычно старше, чем с опухолью Вильмса; средний
возраст их составляет 11 лет.
Диагностика. В диагностике рака почки у детей ведущая роль
принадлежит рентгенологическому исследованию. Высокой
разрешающей способностью обладает ангиография, в частности абдоминальная аортография.
Лечение. Полное удаление опухоли может привести к излечению больного, но прогноз неблагоприятный из-за послеоперационных рецидивов. Опухоль радиочувствительна.
20.4. Аденокарциномы коры надпочечника
Рак коры надпочечника — редкое новообразование как у
взрослых, так и у детей. Определяемая частота этого заболевания
составляет 0,5 % всех детских злокачественных новообразований и встречается в соотношении 1 на 500 000 детей.
Все формы рака коры надпочечника у детей можно разделить по клиническому течению на две большие группы: гормонально-активные опухоли сравнительно небольших размеров и
гормонально-неактивные опухоли, но значительных размеров.
Эпидемиология и этиология. Адреналокортикальные карциномы связаны с другими дефектами развития, такими, как гемигипертрофии, аномалии мочевыделетельной системы, синдром Beckwith — Wiedemann. У больных с кортикальной кар¬
448
циномой надпочечника часто имеется еще одна первичная
опухоль, например, головного мозга, опухоль Вильмса; может
наблюдаться синдром Кушинга, особенно у детей до 5 лет.
Патологическая анатомия. Микроскопически в опухолях
можно обнаружить любые типы клеток, характерные для аденомы; они отличаются значительной вариабельностью гистологического строения. Наблюдается и атипия ядер, хотя эти признаки не являются надежными критериями злокачественности.
Клиническая картина адренокортикальной карциномы зависит от характера гормональной секреции опухолью. Наиболее
частой эндокринной манифестацией является синдром Кушинга, связанный с избытком продукции глюкокортикоидов.
Дифференцировать надпочечниковую форму синдрома Кушинга от гипофизарной относительно просто, поскольку опухоль надпочечника идентифицируется на ультразвуковой или
компьютерной томографии; кроме того, в плазме крови увеличивается концентрация кортизола, в связи с чем подавляется выработка гипофизом АКТГ, концентрация которого падает.
Диагностика. Повышение содержания различных гормонов
надпочечников и их метаболитов, а также нарушение нормальных механизмов регуляции гормонов позволяют предположить
у ребенка наличие злокачественной опухоли.
Для выявления стороны поражения, степени злокачественности и распространенности опухолевого процесса применяют
аспирационную биопсию, экскреторную урографию, ультразвуковую и компьютерную томографию, ангиографию.
Лечение. Наилучший эффект достигается при радикальном
удалении опухоли. Иногда после операции назначают лучевую
терапию и полихимиотерапию.
Прогноз неблагоприятный, излечение достигается максимум
в 30 % случаев.
20.5. Рак молочной железы
Злокачественные эпителиальные опухоли молочной железы
в детском возрасте исключительно редки и составляют 0,046 %
от всех злокачественных новообразований в детском возрасте.
Эпидемиология и этиология. Рак молочной железы в детском
возрасте чаще всего проявляется в препубертатном и пубертатном возрасте, что можно объяснить гормональной перестройкой
организма ребенка, не исключая и наследственное семейное
предрасположение.
Пятилетняя выживаемость детей, больных раком молочной
железы, лучше, чем у взрослых, так как у ребенка меньший объем ткани молочной железы и, следовательно, опухоль выявляется на более ранней стадии.
449
Патологическая анатомия. Макро- и микроскопическая картина эпителиальных опухолей молочных желез у детей мало чем
отличается от таковой у взрослых.
Метастазирование рака молочной железы происходит по
лимфатическим путям и кровеносным сосудам, отдаленные гематогенные метастазы у детей встречаются достаточно редко.
Лимфогенные метастазы в регионарные лимфатические узлы
развиваются позднее, чем у взрослых.
В настоящее время не существует разработанной специально
для детского возраста клинической классификации рака молочной железы. Редкие случаи его диагностирования вполне укладываются в разработанные для взрослых клинические классификации.
Клинические проявления и диагностика. Клинические проявления рака молочной железы у детей аналогичны взрослым.
Диагноз опухоли молочной железы у ребенка особых затруднений не вызывает, так как железа небольшая и опухоль хорошо контурируется. Чаще всего железа плотная, болезненная
при пальпации; редко обнаруживаются кровянистые выделения
из соска.
При проведении дифференциальной диагностики следует
помнить о псевдогипертрофии молочных желез (обычно двусторонней) у полных девочек, о гипертрофии желез в препу-
бертатном периоде и преждевременном половом созревании.
Сходность ранних симптомов злокачественных и доброкачественных опухолей молочных желез заставляет онкологов проводить между ними дифференциальную диагностику.
Наиболее доступной и информативной в этом случае является
пункционная биопсия с последующим цитологическим исследованием.
Лечение. Вопросы лечения рака молочной железы в детском
возрасте до настоящего времени нельзя считать разработанными.
В связи с малыми группами больных лучевая терапия и химиотерапия не разработаны.
Методом выбора остается радикальная операция, чаще расширенная секторальная резекция. После такой операции прогноз благоприятный, хотя и могут быть местные рецидивы.
20.6. Опухоли кожи
Рак кожи у детей встречается редко — до 0,6 % случаев от
всех опухолей кожи у детей.
Эпидемиология и этиология. Основным этиологическим
фактором в развитии рака кожи как у детей, так и у взрослых является ультрафиолетовое излучение, за которым по частоте следуют химические канцерогены, ионизирующее излучение и им-
мунодефицитные, иммунодепрессивные состояния, в основном
450
пигментная ксеродерма, являющаяся облигатным предраком
кожи.
Эпидемиологические данные из различных географических
зон показали увеличение плоскоклеточной и базально-клеточной карциномы у белого населения вблизи экватора.
Патологическая анатомия и стадирование. По гистологическому строению различают две формы рака кожи: базальноклеточный (базалиома) и плоскоклеточный (спинолиома) рак.
Используемая в онкопедиатрии классификация клинического стадирования рака кожи аналогична таковой у взрослых.
Клиническая картина. Клинические проявления различных
гистологических форм рака разнятся. Базально-клеточный рак
в большинстве случаев локализуется на лице. Клинически он
характеризуется появлением узелка плотной консистенции,
сливающегося с кожей или выступающего над ее поверхностью.
Кожа над образованием тонкая, атрофичная. В дальнейшем рядом с узелком появляются новые образования такого же рода,
которые сливаются с первым, образуя валик — "нитку жемчуга".
Опухоль развивается медленно, при этом отсутствуют какие-
либо реактивные изменения и состояние больных кажется
удовлетворительным.
Базально-клеточный рак растет медленно и распространяется
на окружающие и подлежащие ткани, мышцы, хрящи и кости.
Однако когда он поражает слизистые оболочки, то ведет себя
более агрессивно, чем плоскоклеточный рак, глубоко проникая
в окружающие ткани.
Метастазы при базально-клеточной форме рака, как правило, не возникают, за исключением случаев, когда рак развивается в непосредственной близости от лимфатического узла, который вовлекается в процесс.
Плоскоклеточный рак локализуется преимущественно на
коже лица, ушных раковинах, верхних и нижних конечностях,
наружных половых органах. В детском возрасте он возникает
обычно на фоне пигментной ксеродермы.
Плоскоклеточный рак более быстро развивается и чаще ме-
тастазирует. Наиболее агрессивны опухоли, локализующиеся
на туловище, конечностях и волосистой части головы. Отдаленное метастазирование наступает поздно и отмечается довольно
редко.
Диагностика. Подтверждение и уточнение диагноза при раке
кожи достигается с биопсии.
Окончательный диагноз ракового поражения кожи, особенно в ранней стадии заболевания, устанавливается патоморфологом, а не клиницистом. Поэтому всякие манипуляции с опухолями и язвами неясной природы возможны только после того, как произведена биопсия и определен диагноз.
Лечение. Основными методами являются иссечение опухоли
и лучевая терапия.
451
Глава 21
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ
У ДЕТЕЙ
21.1. Опухоли и опухолевидные образования костей
Ряд доброкачественных процессов в костях должен быть распознан и отдифференцирован от злокачественных опухолей,
что предупреждает последствия неоправданного лечения. Некоторые из них могут возникать как реакция на травму, но в ряде случаев ее невозможно установить, другие — гамартому или
истинное разрастание интактной ткани in situ. Другие же процессы, менее изученные, считаются доброкачественными с возможным злокачественным перерождением.
Остеоидная остеома встречается с умеренной частотой у подростков, особенно у мальчиков. Она обычно проявляется в бедренной или большеберцовой кости, реже — в позвоночнике,
плечевой кости или фалангах.
Кардинальным клиническим симптомом является
боль, вначале тупая и усиливающаяся при осевых нагрузках, чаще ночная, успокаивающаяся после приема ацетилсалициловой
кислоты. Через несколько недель или месяцев боль начинает
усиливаться и локализоваться, но местные признаки воспаления
отсутствуют. Диагностическую ценность имеют рентгенограммы,
на которых можно видеть четко очерченный очаг остеоидной
ткани, окруженный склерозированной костью. Иногда можно
выявить кальцификацию остеоида.
Лечение хирургическое: опухоль должна быть полностью
удалена, чтобы предупредить развитие рецидивов. Сходные признаки отмечаются при остеобластоме, но они крупнее и в ней
менее выражен остеосклероз. Она чаще, чем остеоидная остеома,
локализуется в позвоночнике.
Фиброзные (доброкачественные) кортикальные дефекты локализуются эксцентрично и происходят главным образом из
надкостницы, разрушая слой кости извне. Они встречаются у
53 % мальчиков и 31 % девочек, чаще всего в возрасте 4—8 лет,
могут персистировать до подросткового и даже более позднего
возраста. Место локализации дефекта всегда в метафизах длинных трубчатых костей, обычно рядом с коленным суставом.
Рентгенографические признаки их характерны. Эти поражения,
как правило, не сопровождаются симптоматикой и исчезают
спонтанно. Распознавать их необходимо, так как они могут быть
приняты за злокачественную опухоль.
Неоссифицирующая фиброма, или фиброксантома, часто
встречается у детей старших возрастных групп или подростков
и может быть связана с фиброзным кортикальным дефектом.
Почти в половине случаев обнаруживается случайно при рентгенографии. Симптомы обычно отсутствуют, но иногда больного может беспокоить постоянная боль в кости. Первым призна¬
452
ком может служить ее патологический перелом. На ногах кости
поражаются чаще.
Рентгенографическая картина их разреженного бахромчатого
повреждения настолько характерна, что не требуется биопсии.
Лечение не проводится. Спонтанное излечение может наступить через несколько месяцев или лет. Выскабливание или
другие вмешательства необходимы при истончении или переломе
кости.
Остеохондрома (хрящевой экзостоз) — единичное повреждение, соответствующее таковому при остеохондроматозе (наследственный множественный экзостоз). Она может появиться
в любой кости, формирующейся на основе хряща, особенно на
концах большеберцовой или бедренной, ближе к коленному
суставу. Расти начинает в детском или раннем подростковом периоде и заканчивает при закрытии прилежащих эпифизарных
пластинок, когда происходит оссификация хряща. У больного
может быть обнаружено новообразование или появляется боль
при переломе.
Рентгенографические признаки характерны. Некоторые новообразования имеют ножку. Спонтанная реактивация роста
наступает редко, иногда после перелома. В таких случаях следует заподозрить злокачественную опухоль и произвести ее
биопсию. С профилактической целью ее необходимо удалить,
особенно если она сопровождается какой бы то ни было симптоматикой.
Энхондрома относится к солитарным опухолям, соответствующим таковым при множественном энхондроматозе (болезнь Олье). Она встречается реже остеохондромы, чаще в пястных, плюсневых и фаланговых костях. Это деформирующее
образование клинически проявляется патологическими переломами. На рентгенограммах можно видеть округлой формы
очаги разреженной кости с истончением и частичным разрушением кортикального слоя и вкраплениями кальцинатов. Процессы в костях кистей и стоп доброкачественные; в длинных
трубчатых костях, их диафизах или мембранозных костях могут
перейти в злокачественные. Гистологически их трудно отличить от злокачественных опухолей.
Лечение заключается в вылущивании заведомо доброкачественных новообразований или широком иссечении подозрительных на злокачественность.
Солитарная (однокамерная) киста представляет собой пограничное состояние между дисплазией и истинной опухолью.
Она определяется рядом с эпифизарной пластинкой, мигрирует
в сторону диафизов при росте костей. В полости однокамерной
или многокамерной кисты содержится жидкость или кровь.
Природа кист неизвестна. Их связывали с травматическими гематомами. Симптомы отсутствуют или минимальны. Кисты могут заявить о себе патологическим переломом.
453
На рентгенограмме видна область разрежения, не пересекающего эпифизарную пластинку. Эти изменения могут разрешиться спонтанно.
При локализации кист в костях руки лечения не требуется;
в костях ноги они должны быть вылущены или иссечены, чтобы
предупредить возможный перелом.
Десмонды. Десмоиды иногда неправильно диагностируются
как фибросаркома. Однако они являются биологически доброкачественными и поддаются консервативной хирургии.
Некоторые из этих опухолей, так же как и фиброзная гамартома, детский пальцевой фиброматоз и фиброматоз colli, присущи детям младшего и среднего детского возраста.
Липобластома и доброкачественные липобластоматозы. Это
редкие, но характерные для детей опухоли, которые в 88 % случаев встречаются в возрасте до 3 лет. Особенно в этой возрастной
группе доброкачественную липобластому необходимо дифференцировать от злокачественных миксойдных опухолей или хорошо дифференцированных липосарком.
Клинически они представлены как изолированные, хорошо
очерченные образования (липобластома) или болезненные при
пальпации и инфильтративные образования (липобластоматоз),
в 70 % случаев располагающиеся на конечностях. Вероятно, ли-
побластоматозные образования представляют собой аномальный рост эмбриональных тканей после рождения и состоят из
эмбриональных липобластов с различной степенью дифферен-
цировки и плексиформных капилляров в свободной миксоид-
ной строме с отчетливым дольчатым делением адипозной ткани.
Лечение. Местное иссечение может сопровождаться рецидивом, в основном появляющимся в течение 12 мес, однако никогда не наблюдается метастазирования.
Гемангиоперицитома. Эти опухоли, впервые описанные в
1949 г. Стаутом, преимущественно доброкачественного характера. Однако в некоторых случаях они имеют тенденцию к местному рецидивированию и метастазированию.
Наиболее частой локализацией являются нижние конечности, таз и забрюшинное пространство.
Широкая местная эксцизия рекомендована для избежания
рецидива.
Гемангиоперицитома у новорожденных отличается от гемангиоперицитомы у детей до 12 мес и является преимущественно
конгенитальной. Поражение обычно исходит из слюнной железы, или мягких тканей головы и шеи, или нижних конечностей.
Несмотря на возможную очевидность гистологической злокачественности, местные рецидивы и/или метастазы не наблюдаются после радикальной хирургии. Гемангиоперицитома новорожденных должна быть дифференцирована от системного ге-
мангиоэндотелиоматоза и лимфангиомы.
454
Ангиосаркома. Ангиосаркома является опухолью, клетки которой напоминают нормальные эпителиальные клетки. В отличие от других опухолей мягких тканей ангиосаркомы в основном обнаруживаются в поверхностных мягких тканях или коже.
В серии из 101 наблюдения кожных ангиосарком, отмеченных
в США (Институт патологии вооруженных сил), 11 были диагностированы у больных до 11-летнего возраста. Клинически
эти опухоли представлены как заполненные кровью кожные узлы, инфильтрирующие кожу, с тенденцией к изъязвлению.
Лимфангиосаркома развивается при хронически измененной лимфоэдематозной ткани.
Лечение. Показано радикальное широкое иссечение опухоли, однако рецидив и метастазы в легкие встречаются часто.
Ангиосаркома (глубокая) чаще возникает на конечностях
или в брюшной полости; большие опухоли могут иногда осложняться нарушением коагуляции крови.
21.2. Доброкачественные опухоли кожи и ее придатков
Невусами называют врожденные или появившиеся во вне-
утробном периоде (приобретенные) образования различной окраски, в основе развития которых лежат изменения эмбрионального характера. Они содержат невусные клетки; этот признак является основным.
Невусы относят к доброкачественным опухолям кожи, однако в отдельных случаях из невусов могут возникнуть злокачественные опухоли.
Врожденные пигментные невусы обычно медленно растут с
ростом организма, и в отдельных случаях к пубертатному возрасту рост их прекращается. Обычно невусы, достигнув определенной величины, в дальнейшем остаются без изменения.
У больных с врожденными невусами относительно редко наблюдается развитие из них злокачественных опухолей; около
90 % населения имеют врожденные пигментные и непигментные пятна, однако количество меланом невелико. С другой стороны, невусы, появившиеся во внеутробном периоде, наблюдаются редко, но из них значительно чаще возникают злокачественные опухоли. Этому способствует в первую очередь травма,
поэтому с целью профилактики необходимо предохранять "родимые пятна” от повреждений.
Рост, воспаление, инфильтрация невуса должны побудить
больного обратиться к врачу и привлечь внимание последнего.
Имеются указания на роль наследственности и предрасположения к невусам.
Образование невусов на коже сочетается иногда с пороками
развития внутренних органов, нервной системы, костей, зубов,
общими дистрофиями и эндокринными расстройствами; такие
случаи рассматриваются как невоидные синдромы и болезни. У
455
Детей невусы и невоидные синдромы являются частым заболеванием. На коже каждого человека имеется до 20—30 изменений невоидного характера.
Подразделяет невусы на бородавчатые, пигментные, органные и системные.
Используется следующая классификация невусов и невоид-
ных болезней у детей:
• сосудистые;
• ангиомные;
• пигментные;
• гиперкератотические;
• аденоматозные;
• цистоматозные или атероматозные;
• фиброматозные;
• невоидные болезни и синдромы.
Пигментные невусы у детей развиваются обычно в возрасте
5—10 лет. Они представляют собой пятна или уплотненные образования различной величины и формы бурого, коричневого
или черного цвета. Эти образования имеют консистенцию нормальной кожи или несколько уплотнены; возникают в результате отложения пигмента (меланина) и размножения клеток,
содержащих пигмент.
Невусные клетки, обнаруживаемые в пигментных невусах,
представляют собой круглые образования с большим ядром,
имеющие сходство с эпителиоидными, содержат пигмент и располагаются непосредственно под эпидермисом или в соединительной ткани дермы.
Высказываются предположения, что невусные клетки происходят из эпителия или из соединительной ткани. В настоящее
время преобладает взгляд о связи невусов с меланоцитами —
пигментообразующими клетками базального слоя, имеющими
неврогенное происхождение и возникающими из элементов
влагалища нервов. Этот взгляд в известной мере объясняет сочетание невусов кожи с пороками развития нервной системы.
Врожденные пигментные невусы встречаются, помимо кожи,
в склере, в центральной нервной системе. Пигментные невусы
имеют различную величину и иногда распространяются на большие участки кожи. Иногда пятна невуса располагаются по ходу
Нерва (naevus linearis). Поверхность невуса может быть гладкой,
Шероховатой или бородавчатой (naevus verrucosus). Нередко на
Пигментных родимых пятнах наблюдается рост волос (naevus pi-
losus). Волосяной невус может занимать большие участки кожи,
Которая в подобных случаях значительно пигментирована и покрыта волосами.
Пигментные невусы могут возникать и на слизистой оболочке рта.
456
Прогноз пигментных невусов различен. В очень редких
случаях они могут исчезнуть самопроизвольно. Развитие из них
злокачественной меланомы наблюдается редко. Наиболее опасными в смысле перерождения являются гладкие плоские неверрукозные пигментные невусы без волос. Представляют большую опасность пигментные невусы, располагающиеся на нижних конечностях. Внеутробные невусы чаще перерождаются в
злокачественные опухоли, чем внутриутробные. Малигнизация
пигментных невусов происходит чаще в результате травмирования их (порезы, расчесывание, прижигания), а иногда в результате эндокринных факторов (половое созревание).
Признаками злокачественного перерождения пигментных
невусов являются увеличение в размерах пигментного пятна,
уплотнение и усиление его окраски, а иногда уменьшение пигментации, появление на поверхности плотных узелков (сателлитов) или пигментных пятен вокруг невуса, увеличение регионарных лимфатических узлов.
В большинстве случаев они не требуют вмешательств. Удаление рекомендуется при расположении невусов на местах, подвергающихся постоянному раздражению, или с косметической
целью, или, безусловно, в случаях начинающейся малигниза-
ции. В подобных случаях рекомендуется хирургическое иссечение или электроэксцизия с достаточным захватом здоровой ткани как в ширину на 1—2 см, так и в глубину. Целесообразно также применение короткофокусной рентгенотерапии до 5—6 Гр.
Небольшие невусы с подозрением на злокачественное перерождение следует подвергнуть сначала короткофокусной рентгенотерапии; в дальнейшем, после стихания реактивных явлений, удалить остатки опухоли хирургическим путем (иссечение)
или электроэксцизией. Для более крупных опухолей применяются радиотерапия (7—8 Гр), радикальное удаление опухоли и
регионарных лимфатических узлов.
При локализации пигментных пятен на лице применяют
криотерапию с экспозицией замораживания 45—90 с.
Лентиго представляет собой пятно, резко очерченное, плоское или слегка возвышающееся над уровнем окружающей кожи, желто-коричневого или темно-коричневого цвета. Эти пятна могут быть одиночными или рассеянными; чаще они наблюдаются на лице в юношеском возрасте. Развитие обычно
доброкачественное.
Голубой невус (naevus cocrulens) — образование округлых
очертаний, слегка возвышающееся над уровнем кожи, величиной с чечевицу или больше, голубого или черного цвета. Консистенция обычно мягкая. Голубые невусы чаще располагаются
на лице и верхних конечностях.
Гистологически голубой невус состоит из меланобластов веретенообразной формы с отростками, расположенными группами в средней и нижней частях дермы. Голубые невусы ветре-
457
чаются часто, они обычно доброкачественные. Вопрос о связи
голубого невуса с меланомой спорен. Большинство авторов
рассматривают голубые невусы как доброкачественные новообразования, редко переходящие в злокачественные меланомы.
Голубой невус при спокойном течении лечению не подлежит. При появлении признаков малигнизации лечение проводится так же, как при злокачественных меланомах.
Ангиоматозные, или сосудистые, невусы часто наблюдаются
у детей грудного и более старшего возраста. Хотя происхождение их не выяснено, тем не менее некоторые факты могут указывать на их связь с нервной системой (расположение по ходу
нервных стволов, сочетание с болезнью Реклингхаузена и с гемангиомами мозга). Сосудистые невусы, как правило, бывают
плоскими.
Плоские сосудистые невусы представляют собой пятна как
бы разлитого вина (naevus flammens, n.vinosus), располагающиеся на лице или на других участках кожи и слизистых оболочек.
Пятна полностью не исчезают при надавливании, а лишь бледнеют при этом; существуют от рождения, не увеличиваясь в
дальнейшем. Пятна имеют величину монеты, ладони, иногда
занимают половину лица, цвет их от бледно-красного до темно-
фиолетового. Обычно они не возвышаются над поверхностью
кожи, но иногда сочетаются с гемангиомами. Врожденные сосудистые невусы самостоятельно никогда не исчезают.
Разновидностью плоского сосудистого невуса является
звездчатая гемангиома (angioma stellatum), имеющая вид небольшого красного узелка с отходящими от него сосудистыми
веточками.
При лечении плоских ограниченных сосудистых невусов применяется криодеструкция, в ряде случаев хирургическое иссечение, а при больших по размерам невусах необходима кожная
пластика.
Болезнь Ращцо — Ослера — врожденное заболевание, характеризующееся наличием множественных телеангиэктазий и гемангиом на коже и слизистых оболочках. Весьма типичными для
этого заболевания являются кровотечения из носа, рта, желудка.
Заболевание начинается в раннем детстве с кровотечениями
изо рта и носа. В дальнейшем появляются гемангиомы, особенно на слизистой оболочке рта, на лице, кистях рук. Гемангиомы
могут возникать и во внутренних органах (кишечник, бронхи и
др.). Повторные кровотечения изо рта, носа вызывают вторичную анемию.
Лечение сводится к удалению отдельных гемангиом, назначению витаминов С и К, препаратов кальция. При повторных кровотечениях необходимо проведение гемотрансфузий.
Бородавчатый невус (naevus verrucosus) представляет собой
одиночные или множественные бляшки буроватого цвета, по¬
458
крытые наслоениями роговых масс. Иногда на поверхности невуса появляются сосочковые разрастания.
Невусы могут развиваться из желез кожи, чаще — из сальных
желез. В последних случаях они представляют собой бляшку,
состоящую из скопления узелков величиной от булавочной головки до чечевицы, желтого или коричневато-красного цвета.
Бляшка локализуется на волосистой части головы, на щеках,
нередко симметрично. Поверхность бляшки неровная, покрыта
бороздками; на ней имеется рост волос, консистенция мягкая.
Бляшка напоминает бородавчато-пигментный невус.
При гистологическом исследовании он представляет собой
скопление увеличенных в размерах сальных желез: имеется па-
пилломатоз, гиперкератоз, рудиментарные волосяные фолликулы, расширение кровеносных сосудов.
В области невуса сальных желез может возникнуть базальноклеточный или (реже) спиноцеллюлярный рак.
Аденома сальных желез (adenoma sebaceum) характеризуется
симметричными высыпаниями на лице в области щек, носа и
подбородка полушаровидных узелков величиной с булавочную
головку и больше. Цвет их от желтоватого до темно-красного.
Эти высыпания могут быть обнаружены уже при рождении,
но чаще они появляются к периоду полового созревания и существуют длительно, не имея склонности к обратному развитию.
Кроме описанных высыпаний, наблюдаются и другие нево-
идные образования — околоногтевые фибромы.
При сочетании с туберозным склерозом указанное заболевание получило название болезни Прингла — Бурневиля.
Различают несколько типов аденомы сальных желез:
• тип Бальцера, при котором наблюдаются увеличение и
гипертрофия сальных желез, — белый вариант;
• тип Прингла (с выраженным развитием сосудов) — красная разновидность;
• тип Галлопо — Лереда с преобладанием фиброзной ткани
плотной консистенции.
В качестве лечебных мероприятий применяются диатермокоагуляция, электролиз или замораживание снегом угольной
кислоты.
Цилиндрома (опухоль Шпиглера) — невоидное образование,
характеризующееся множественными круглыми плотными
опухолями от булавочной головки до нескольких сантиметров
в диаметре, располагающимися группами. Частая локализация
цилиндромы — волосистая часть головы, нос, щеки, подбородок. Возникает в детском возрасте, чаще до 10 лет, обладает
медленным ростом.
Цилиндрома может подвергаться слизистому и гиалиновому
перерождению.
459
Нейрофиброматоз, нейриноматоз — болезнь Реклингхаузена,
описанная им в 1882 г. Это заболевание характеризуется в основном наличием пигментных пятен, опухолей кожи и нервных
стволов.
Этиология и патогенез этого заболевания до настоящего времени остаются невыясненными. Высказываются мнения в
пользу эндокринной теории происхождения этого заболевания.
Большинство же авторов придерживаются дизонтогенетиче-
ской теории, рассматривающей развитие нейрофиброматоза
как результат врожденного поражения общего для кожи и нервной системы зародышевого листка — эктодермы. Травма может
играть роль стимулирующего фактора, оказывающего раздражающее действие на эмбриональные клетки — невроциты.
Нейрофибромы развиваются из незрелых шванновских (лем-
моцитов) или эндоневральных клеток мезодермального происхождения. Ряд авторов считают, что нейрофиброматоз следует
отнести к невусам.
Возможность наследственной передачи заболевания и семейный нейрофиброматоз, наблюдаемый иногда в трех и более
поколениях, также в известной степени говорят в пользу порока
развития экто- и мезодермы.
Пигментные пятна кожи возникают в результате скопления
меланина в базальном слое эпидермиса. Они обнаруживаются
при рождении или появляются позднее и могут быть единственным признаком этого заболевания. Пятна имеют различный вид:
мелкие, рассеянные, напоминающие веснушки, более крупные
типа пигментных невусов и более обширные пигментации.
Цвет их обычно коричневый разных оттенков, от желтовато-коричневого до темно-коричневого; обширные пятна, захватывающие значительные участки кожи, имеют цвет кофе с молоком. По мере роста организма число пятен увеличивается; в пожилом возрасте оно может уменьшаться.
Обычной локализацией этих пятен является кожа туловища,
лица и шеи.
Опухоли кожи представляют собой полушаровидные узлы
размером от горошины до куриного яйца и больше, мягкой
консистенции. Они располагаются на различных участках в
разном количестве (от десятков до нескольких сотен), имеют
цвет нормальной кожи, желтоватый или коричневатый.
В начале возникновения они едва возвышаются над поверхностью кожи, затем выступают больше, напоминая грыжу, так
как при надавливании на них они как бы вправляются в кожу.
В дальнейшем опухоли напоминают мягкую фиброму и нередко
расположены на ножке. Наряду с описанными мягкими кожными опухолями наблюдаются и более глубокие плотные новообразования, расположенные в подкожном жировом слое.
Одной из разновидностей нейрофиброматоза является своеобразный элифантиазис в виде избытка кожи наподобие склад¬
460
ки, свешивающейся вниз, в толще которой прощупываются
утолщенные, как шнуры, нервы (cutis laxa).
Опухоли могут возникать в полости рта: на языке, деснах,
глотке. В редких случаях при прощупывании опухоли наблюдается легкая болезненность.
При гистологическом исследовании их отмечаются значительное развитие соединительной ткани, разрастание соединительной оболочки нервов, многочисленные звездчатые и веретенообразные клетки, фрагменты амиелиновых нервов.
Описаны случаи злокачественного перерождения этих опухолей. В 12—16 % случаев нейрофиброматоз может перерождаться в саркому; это наблюдается чаще и при глубоко расположенных опухолях; кожные опухоли перерождаются редко.
У больных нейрофиброматозом выявляются опухоли периферических нервных стволов в виде веретенообразных утолщений
подкожных нервов предплечий, боковых поверхностей туловища, шеи, бедер. Эти поражения могут протекать безболезненно,
однако в отдельных случаях в области разветвления нервов наблюдаются парестезии, анестезия, гиперестезия. Ощупывание
опухолей слегка болезненно. При нейрофиброматозе нередко
могут иметь место явления физического и психического недоразвития: больные невысокого роста, со слаборазвитой мускулатурой, инфантильны; иногда при этом отмечаются сопутствующие врожденные дефекты (асимметрия лица, гипертрихоз,
spina bifida, синдактилия и др.). Со стороны психики наблюдаются снижение интеллекта, вялость, апатия, расстройство речи,
заикание.
Нейрофиброматоз может сочетаться с сосудистыми невусами, аномалиями внутренних органов, зубов, аденомой сальных
желез Прингла; иногда имеются фибромы, глиомы.
Помимо выраженных форм нейрофиброматоза, нередко обнаруживаются стертые формы, где выражен лишь один признак
этого заболевания. У детей в этих случаях чаще наблюдаются
только пигментные пятна.
Нейрофиброматоз возникает в раннем детстве, обладает
длительным доброкачественным течением; очень редко отмечается регресс одного и основных признаков этого заболевания.
Дифференциальный диагноз проводится с болезнью Дерку-
ма, распространенным цистоцеркозом, фибромами, пигментными невусами.
Ввиду большого количества опухолей при нейрофиброматозе удаление их хирургическим путем затруднено. Иссечение
опухолей производится при злокачественном их перерождении
или по косметическим соображениям, а также при давлении
опухоли на ближайшие органы и ткани.
Имеются данные о благоприятном действии впрыскиваний
фибролизина в ткань опухоли.
461
Пигментная ксеродерма — редко встречающееся заболевание, описанное впервые в 1870 г. Капози. Развивается в первые
годы жизни и в дальнейшем может переродиться в злокачественное новообразование. Заболевание нередко наблюдается у
членов одной семьи.
В патогенезе пигментной ксеродермы имеет значение врожденная повышенная чувствительность к солнечным лучам.
Высыпания появляются на открытых участках кожного покрова (лицо, тыльные поверхности кистей) в весеннее и летнее
время. Сначала возникают красные, несколько отечные пятна
без резких границ. После исчезновения солнечной эритемы остаются различной величины пигментные пятна желтовато-коричневого цвета; некоторые из них напоминают веснушки. В
дальнейшем кожа становится сухой; наряду с пигментированными участками появляются белые атрофические участки, телеангиэктазии и кератозы. С течением времени количество
пигментных пятен увеличивается, атрофические участки имеют
наклонность к сморщиванию, что приводит (при локализации
пигментной ксеродермы на лице) к атрезии ротового отверстия
и вывороту век с развитием конъюнктивита и светобоязни. Кожа лица приобретает пестрый вид. На этом фоне из кератозов
возникают бородавчатые разрастания, превращающиеся в спи-
ноцеллюлярный или базоцеллюлярный рак, реже развивается
меланома или саркома. Переходу в злокачественные новообразования способствуют солнечное и ультрафиолетовое облучение.
Течение болезни длительное, прогрессирующее. В большинстве случаев больные умирают в возрасте 15—20 лет; однако известны случаи, когда они доживали до старости и умирали от
других причин.
Гистологическая картина в начальной стадии нехарактерна:
гиперкератоз, атрофия мальпигиева слоя, в базальном слое увеличение количества меланина, в дерме — периваскулярная инфильтрация. В более поздней стадии процесса развивается
акантоз, усиливается пигментация, появляются признаки клеточной атипии; в соединительной ткани — дегенеративные изменения коллагеновых и эластических волокон; при наличии
злокачественного перерождения — картина опухоли.
В начальной стадии заболевания назначают общеукрепляющее лечение, полноценное питание, препараты железа, витамины (А, С, В12). Имеются сообщения о благоприятном действии резохина, кортизона. Рекомендуется защищать кожу открытых участков тела светозащитными мазями: 5 % мазь с
салолом, хинином; 15—20 % мазь с парааминобензойной кислотой. Возникающие бородавчатые разрастания и кератомы удаляют хирургическим методом, электроэксцизией. В случаях
злокачественного перерождения целесообразно применение
близкофокусной рентгенотерапии.
462
Верруциформная эпвдермодисплазия Левавдовского — Лютца —
редкое заболевание. Впервые было описано Левандовским и
Лютцем в 1922 г.
В детстве на коже кистей (на тыльных поверхностях), на плечах, стопах появляются высыпания плоских, несколько возвышающихся образований, напоминающих плоские бородавки. В
результате слияния этих высыпаний возникают лихенифициро-
ванные бляшки. Активное их распространение и наклонность
к слиянию отличают эпидермодисплазию от бородавок.
Левандовский и Лютц рассматривают эпидермодисплазию
как своеобразное высыпание бородавок, однако эти высыпания в отличие от бородавок самопроизвольно не исчезают.
Важным обстоятельством является возможность перерождения
эпидермодисплазии в спино- или базально-клеточную карциному, что, по мнению ряда авторов, наблюдается в 15—18 %
случаев.
Гистологически при эпидермодисплазии отмечаются гиперкератоз, гранулез, акантоз, вакуолизация клеток зернистого и
рогового слоев.
Лечение состоит в назначении поливитаминов и удалении
наиболее выраженных высыпаний. При злокачественном перерождении — соответствующая терапия.
К доброкачественным мезодермальным опухолям относятся
фибромы, келоид, липомы, лейомиомы, рабдомиомы.
Фиброма кожи обычно наблюдается у взрослых и редко — у
детей. Это плотные единичные или множественные мелкие узелки величиной от просяного зерна до горошины, цвета нормальной кожи или красновато-желтоватого. Располагаются на нижних и верхних конечностях, на животе. Течение их длительное.
Гистологически фиброма состоит из фибробластов и коллагеновой ткани, локализуется в дерме, помимо фибробластов,
иногда имеется много гистиоцитов (гистиоцитома).
Лечение хирургическое — иссечение опухоли.
Келоцд возникает в результате чрезмерного развития фиброзной ткани на месте травматических повреждений (раны,
ожоги, гнойные воспаления), не является истинной опухолью
и рассматривается с дифференциально-диагностическими целями. У детей нередко наблюдаются самопроизвольные келоиды на неизмененной коже.
Возникновение келоидов связывают с эндокринными расстройствами и системным поражением соединительной ткани
кожи. По внешнему виду келоиды похожи на фибромы, они
могут иметь любую локализацию. Величина их различна. Сначала возникает маленькая опухоль, размером с чечевицу, которая постепенно увеличивается, очертания округлые или линейные; от основной опухоли отходят отростки, напоминающие
клешни рака. Поверхность келоидов гладкая, беловато-розового цвета, консистенция плотная.
463
Течение келоидов длительное, хроническое. Они увеличиваются до определенного предела, в дальнейшем остаются без изменения. Самопроизвольное обратное развитие их наблюдается редко.
При гистологическом исследовании развившийся келоид
состоит из плотных пучков коллагеновых волокон, подвергшихся гиалинизации; в них располагаются голые ядра клеток,
эластические волокна, сосудов мало, эпидермис истончен.
Хирургическое иссечение нередко ведет к рецидивам, поэтому
после удаления рекомендуется введение кортизона. Применение
рентгенотерапии и лучей Букки в ряде случаев оказывается успешным. Назначают также инъекцию кортизона, большие дозы
витамина А (по 210 капель 3 раза в день), длительное лечение витаминами РР, В2, С и препаратами, содержащими железо.
В ряде случаев при свежих келоидах отмечался успех от инъекций гиалуронцдазы, стекловидного тела, экстракта алоэ. В
последнее время имеются наблюдения о благоприятном эффекте от внутримышечного введения пирогенала.
Липома — доброкачественная опухоль, развивающаяся в подкожном жировом слое и состоящая из жировой ткани. Располагается обычно на туловище в виде одиночных или множественных узлов мягкой консистенции, покрытых кожей нормальной
окраски. Опухоли находятся в капсуле, не спаяны с кожей.
Течение их медленное. Иногда липомы болезненны при
ощупывании, сочетаются с невралгическими болями (болезнь
Деркума). При гистологическом исследовании липома состоит
из скоплений зрелых жировых клеток, окруженных соединительнотканной оболочкой.
Лечение липом только хирургическое.
Лейомиома — доброкачественная опухоль, развивающаяся из
гладких мышечных волокон в дерме или подкожном жировом
слое. В детском возрасте встречается редко, вначале в виде маленьких узелков цвета нормальной кожи. Узелки медленно увеличиваются до размеров горошины, приобретая синюшный оттенок. Они плотной консистенции, болезненны при давлении и
охлаждении кожи. Различают множественные лейомиомы, возникающие в дерме из мышц, поднимающих волос; дартоидные
лейомиомы больших размеров, развивающиеся из мышц кожи
мошонки и грудных сосков, и подкожные лейомиомы обычно
одиночные, возникающие из гладких мышц стенок сосудов.
Гистологически лейомиома состоит из переплетающихся пучков гладкомышечных волокон с небольшим количеством сосудов.
При наличии болей необходимо хирургическое иссечение
крупных опухолей; для удаления мелких лейомиом возможно
применение электрокоагуляции или углекислого снега.
Рабдомиома — редкая доброкачественная опухоль из поперечнополосатых мышц. Развивается обычно у взрослых на языке, в скелетных мышцах и в коже, иногда сочетается с рабдо-
миомой сердечной мышцы.
464
Атерома — киста сальной железы, располагается на волосистой части головы, на шее или других участках кожи.
Величина атером различна: от горошины до яйца и более,
форма полушаровидная, консистенция плотная. Атерома вследствие расположения в толще дермы подвижна, обладает медленным ростом, иногда в результате инфицирования гноеродными
микробами нагнаивается. Гистологически атерома состоит из
скопления жира, перерожденных клеток эпителия, окруженных
соединительнотканной оболочкой.
Лечение — удаление опухоли хирургическим путем.
Кератоакантома, сально-железистый моллюск, — доброкачественная опухоль, впервые описанная Дюпоном в 1930 г.
Этиология ее не выяснена. Кератоакантома встречается у
лиц, имеющих контакт с углеводородами и продуктами каменного угля, а также у лиц, находящихся под влиянием длительных солнечных облучений. Возникает чаще у взрослых старше
50 лет, но наблюдаются кератоакантомы и в детском возрасте.
Заболевание начинается с появления безболезненных узелковых элементов, как правило одиночных, полушаровидной
формы, цвета нормальной кожи, напоминающих вначале плоские бородавки. Они локализуются на лице, тыльных поверхностях кистей, т. е. на местах, чаще подвергающихся воздействию экзогенных раздражителей. Величина опухолей может достигать 2—3 см в диаметре. В центре опухоли — кратеровидное
вдавление, заполненное роговыми массами, легко удаляемыми;
регионарные лимфатические узлы не увеличены.
Опухоль склонна к самопроизвольному разрешению, которое наступает через 3—4 мес после возникновения с оставлением атрофического рубца. В отдельных случаях возможно развитие из кератоакантомы спиноцеллюлярной эпителиомы.
Гистологическая картина довольно типична: кратеровидное
углубление в центре опухоли заполнено шаровидными роговыми
массами; в эпидермисе —явления резко выраженного акантоза;
межсосочковые эпителиальные выступы глубоко проникают в
дерму, но атипического роста не наблюдается; деформация отдельных клеток базального и шиловидного слоев, митозы, явления дискератоза. В дерме небольшой отек, очаговые инфильтраты из лимфоцитов, плазмоцитов, гистиоцитов, иногда
эозинофилов. В стадии обратного развития наблюдаются гигантские клетки инородного тела.
Дифференцировать кератоакантому следует с базоцеллюляр-
ной, спиноцеллюлярной эпителиомой и заразительным моллюском.
С учетом возможности злокачественного перерождения опухоли рекомендуется хирургическое удаление ее с последующим
гистологическим исследованием; можно также произвести кю-
ретаж с прижиганием дна, электрокоагуляцию, рентгенотерапию. Рецидивы наблюдаются редко.
465
Глава 22
ФАРМАКОЭКОНОМИКА
В ДЕТСКОЙ ОНКОЛОГИИ
Современное здравоохранения уже давно основывается на экономике. Экономика здравоохранения — наука, задачей которой
является определение наиболее эффективного использования
ресурсов и средств здравоохранения.
Фармакоэкономика — это отрасль экономики здравоохранения, изучающая клинические и экономические преимущества
лекарственных препаратов и схем лекарственной терапии. В
последнее десятилетие произошло смещение научных приоритетов с вопросов разработки и внедрения новых технологий
предоставления медицинских услуг, ориентированных преимущественно на минимизацию затрат, на определение эффективности и оптимального расходования средств (оценка затраты —
эффективность). Происходит переоценка старых методов лечения в сравнении с новыми терапевтическими подходами, причем не только с точки зрения их действенности и безопасности,
но и их эффективности и экономичности.
Высокая стоимость диагностики и лечения, профилактических и реабилитационных мероприятий, длительная, часто необратимая, утрата больными трудоспособности, значительные
затраты на социальное обеспечение и страхование влекут за собой большие финансовые и экономические потери. Из всех затрат на здравоохранение в России только 6—7 % идет на лечение злокачественных новообразований, притом что за 1996 г. в
стране зарегистрировано 423 050 новых случаев рака.
Экономическая оценка представляет собой комплекс методик, предназначенных для решения вопросов, связанных с распределением ресурсов; она дает информацию как о преимуществах того или иного метода лечения, так и о затратах, необходимых для получения этих преимуществ.
Опыт системы здравоохранения ведущих, экономически
развитых стран (США, Великобритании, Канады, Австралии,
Германии), несмотря на различия в их организации, свидетельствует о том, что на современном этапе терапию можно строить
не только на данных об эффективности, переносимости и безопасности, но и с учетом фармакоэкономического анализа. Это
приводит к снижению затрат на лекарства без уменьшения эффективности лечения.
Фармакоэкономика занимается исследованиями с целью
оценки поведения людей, компаний и рынка в связи с применением фармакоэкономических процессов и программ, направленных на изучение затрат (вложений) и последствий (результат) такого применения. В течение последних лет наметился
интенсивный рост научных исследований по изучению экономической эффективности лекарственных средств. Определились основные области применения фармакоэкономики.
466
1. Организация здравоохранения (определение бюджетных
затрат при формировании бюджета здравоохранения в условиях
конкретной финансово-экономической ситуации).
2. Рынок фармацевтических препаратов.
3. Практическое здравоохранение (формирование лекарственного формуляра и т.д.).
4. Клинические испытания новых лекарственных препаратов.
В настоящее время используются 5 основных видов фарма-
коэкономической оценки1.
• Анализ "стоимость болезни" (COI — cost of illness).
• Анализ "минимизации затрат" (СМА — cost—minimization
analysis).
• Анализ "затраты — эффективность" (СЕА — cost-effectiveness analysis).
• Анализ "затраты — полезность (утилитарность)" (CUA —
cost—utility analysis).
• Анализ "затраты — выгода (польза)" (СВА — cost—benefit
analysis).
Конкретный выбор между представленными видами экономической оценки зависит от целей и задач исследования, заказчика, для которого выполняется данное исследование, характера исследуемой медицинской технологии и способа ее
оценки.
В значительной части экономических исследований в медицине, проводимых в нашей стране, особенно в рамках работ по
обязательному медицинскому страхованию, производятся расчеты стоимости болезни. Этот анализ базируется на учете затрат, понесенных медицинским учреждением при проведении
диагностики и лечения определенного заболевания. При сопоставлении стоимости болезни у нескольких пациентов лечебного
учреждения с одной и той же нозологической формой можно
рассчитать среднюю стоимость лечения каждой конкретной болезни в конкретном медицинском учреждении. При этом результаты оказываемой медицинской помощи в расчет не принимаются. Полученные данные не создают условий для управления качеством оказываемой медицинской помощи.
Анализ минимизации затрат используется для подтверждения предпочтения более дешевому методу лечения. Метод "минимизации затрат" позволяет сопоставлять альтернативные технологии, выбирая при этом наиболее дешевые. Однако такой
подход мало применим в практической деятельности, так как
достаточно редко можно встретить альтернативные технологии,
обладающие одинаковым клиническим эффектом и различаю-
*В скобках даны англоязычные аббревиатуры и их расшифровка.
467
щиеся исключительно стоимостью. Метод "минимизации затрат" не учитывает результаты применения медицинских технологий. С точки зрения экономической оценки качества медицинской помощи этот метод имеет ограниченное применение,
однако дает возможность оценивать некоторые экономические
показатели фармакотерапии. Одним из наиболее часто употребляемых экономических исследований является анализ "затраты — эффективность". Если двумя или более медицинскими
вмешательствами различной степени эффективности преследуется одна и та же лечебная цель,то в этих случаях наиболее целесообразно выполнять анализ по критерию "затраты — эффективность". Анализ такого рода дает возможность учитывать и
соотносить как расходы, так и полученные результаты (эффективность) лечебных мероприятий. В качестве единиц эффективности чаще всего используются годы сохраненной жизни
или предотвращенные случаи смерти. Если в результате расчетов оказывается, что какой-либо вариант не только более эффективный, но и обходится дешевле, то его можно расценивать
как "доминирующая альтернатива".
Некоторые исследователи рассматривают анализ "затраты —
полезность" как частный случай анализа "затраты — эффективность". При этом варианте учитывается не столько достижение
тех или иных клинических эффектов, сколько мнение самого
пациента о достигнутых результатах с точки зрения их полезности, переносимости лечения, его безопасности и т.д. Пациент вправе выбирать, какой результат предпочтительнее: сомнительный эффект терапии или паллиативное лечение, направленное на уменьшение болезненных реакций.
Анализ "затраты — выгода (польза)”. При расчете по этому
способу как прямые медицинские затраты, так и результаты
проведенного лечения оцениваются в денежных единицах. Одним из способов такой оценки является опрос пациентов с целью выяснения суммы, которую они могли бы заплатить (гипотетически) для того, чтобы избежать определенного риска
смерти (оценка "готовности платить"). Результатом анализа "затраты — выгода" является определение прямой выгоды (в деньгах) от применения технологии или лекарства по сравнению с
альтернативным методом. Этот метод в фармакоэкономических
исследованиях в настоящее время используется редко из-за недостаточно разработанной методики расчетов.
Целью большинства методов лечения онкологических заболеваний является продление и обеспечение более высокого качества жизни, что довольно трудно измерить количественно.
Однако именно такой конечный результат представляет наибольший интерес в стратегии здравоохранения, особенно в области онкологии.
С точки зрения бюджета, наиболее предпочтительным является показатель стоимости болезни, стремящийся к нулю. По¬
468
этому в основе фармакоэкономического анализа всегда должны
быть заложены не столько собственно экономические выкладки, сколько качественная оценка достигаемых результатов —
экономический анализ качества лечения.
Фармакоэкономическая оценка должна быть основана на
ясных вариантах и проводиться на основе надежных клинических и эпидемиологических данных, чтобы ее можно было использовать в определении стратегии финансирования здравоохранения. Необходимо оценивать как "входы", т.е. затрачиваемые ресурсы, так и "выходы" — улучшение здоровья — для всех
вариантов заболевания.
"Входы", или затраты, включают в себя прямые издержки
(лекарственные препараты, диагностические процедуры, консультации, госпитализацию и т.п.), косвенные издержки (например, производственные потери, связанные с заболеванием
или лечением) и нематериальные затраты (боли, страдания,
связанные с лечением). "Выходы” измеряют как сопутствующие
экономические выгоды (экономия прямых, косвенных и нематериальных издержек), либо в единицах полезности (например,
число лет жизни с повышением качества жизни). "Выход" можно непосредственно измерить в денежном выражении, используя фармакоэкономические методы: "затраты — эффективность” и "затраты — полезность".
Метод "затраты — эффективность" используют при сравнении двух медицинских вмешательств при одинаковых показаниях. Конечные результаты измеряют как в денежных единицах, так и в продлении сроков жизни, числе успешно излеченных больных, длительности ремиссии и т.д. При этом можно
рассчитать прирост расходов в расчете на единицу прироста результатов лечения для здоровья, в частности для увеличения
продолжительности жизни.
Метод "затраты — полезность" применяют в тех исследованиях, когда проводимое лечение скорее связано с улучшением
качества жизни, а не с ее продлением, или когда измеряют
единственный конечный результат, для того чтобы сравнить
медицинские вмешательства при различных показаниях. Полученные годы жизни корректируют с помощью сравнений, определяющих предпочтение того или иного метода и отражающих относительное значение, которое человек придает разным
состояниям здоровья.
Фармакоэкономический анализ позволяет определить, какие лекарственные средства следует преимущественно использовать в лечебном учреждении, выявить лучший препарат для
данного пациента, найти наиболее выгодное лекарственное
средство для производителя.
Одним из новых критериев, характеризующих эффективность проведенного лечения, является качество жизни (КЖ).
Качество жизни ребенка — это интегральная характеристика
469
физиологического, психологического, эмоционального и социального функционирования здорового или больного ребенка,
основанная на его и его родителей субъективном восприятии.
Понятие "качество жизни" поясняет, как то или иное лицо чувствует себя и справляется с повседневными делами. Определение качества жизни больного является важной частью для измерения результатов лечения, поскольку указывает на эффективность лечения именно с точки зрения как самого больного,
так и его ближайшего окружения.
Согласно определению ВОЗ, "здоровье — это полное физическое, социальное и психологическое благополучие человека, а
не просто отсутствие заболевания". Одно из преимуществ определения качества жизни состоит в том, что с его помощью можно получить дополнительную информацию о клинической эффективности лечения. Особенно это касается онкологии:
многие медицинские мероприятия пока еще не способны привести к полному излечению или существенно улучшить продолжительность жизни, но могут значительно повысить качество жизни больного и помочь справиться с повседневными заботами.
Оценка качества жизни в онкологии является одним из важнейших критериев эффективности лечения наряду с определением общей и безрецидивной выживаемости и ответом на противоопухолевую терапию. На совместной конференции Национального института рака и Американского общества клинической
онкологии в 1990 г. было принято решение считать качество жизни вторым по значимости критерием оценки результатов противоопухолевой терапии после выживаемости и более важным,
чем первичный опухолевый ответ и безрецидивная выживаемость. По мнению многих зарубежных онкологов, изучение качества жизни является важнейшим компонентом многоцентровых рандомизированных клинических исследований. Качество
жизни становится основным критерием эффективности лечения в тех ситуациях, когда не установлены достоверные различия в выживаемости между группами больных, включенных в
протокол исследования. Именно на основании результатов
оценки качества жизни следует делать выбор необходимой программы лечения.
Для изменения качества жизни онкологических больных
разработан целый ряд стандартных методик в виде специальных
анкет-вопросников и шкал оценок, которые заполняются, как
правило, самими больными детьми или их родителями.
Выбор варианта анкеты как метода определения КЖ не
столь прост и должен отвечать четко сформулированным целям
и задачам планируемого клинического исследования. Не существует какого-либо одного совершенного метода, пригодного
для всех клинических ситуаций. Например, если речь идет о
том, чтобы получить данные о КЖ, служащие дополнительным
470
мерилом эффективности, то целесообразно использовать вопросники для оценки общего состояния здоровья. Эта оценка,
даваемая самим пациентом, субъективна, поэтому при разработке вопросников необходимо тщательно взвесить как содержательную часть вопроса, так и его стилистические особенности, позволяющие улучшить восприятие вопроса, оценить точность ответов на вопросы. В связи с этим наряду с косвенными
вопросами в анкете должны быть сформулированы прямые вопросы, позволяющие провести количественную оценку функциональных возможностей.
На этапе разработки вопросника необходимо провести исследование, в котором одной и той же группе пациентов предлагают одни и те же вопросы с интервалом в 3—4 нед. Цель подобного исследования — сравнение вариантов ответов двух вопросников. Удовлетворительным считается та формулировка,
при которой по-разному отвечают во время первого и второго
опросов не более 20 % опрашиваемых.
В международной практике разработаны и используются вопросники по КЖ, однако прямой перенос их в отечественное
здравоохранение связан как с трудностями из-за неточностей
перевода, так и отсутствием в нашей стране определенных общепринятых позиций оказания медицинской и социальной помощи, различий в менталитете, культурных и религиозных особенностей и 01раничений. Процесс адаптации международно
признанных вопросников имеет свои требования, в частности,
перевод должен заверяться несколькими независимыми экс-
пертами-переводчиками, носителями каждого языка (как языка, с которого переводится, так и на который переводится вопросник).
При выборе вопросника необходимо учитывать возможность применения его в фармакоэкономическом исследовании:
результаты должны быть представлены в виде единого итогового балла от 0 до 1. В таких вопросниках каждому вопросу и соответственно варианту ответа присваивается ранговая величина
и рассчитывается совокупность рангов. Качество жизни оценивается величиной от 0 до 1, при этом 0 — это смерть, а 1 — состояние полного физического и психического комфорта.
Одним из методов оценки КЖ является определение приобретенных в результате лечения лет качественной жизни (QALY —
quality abjusted life year). Расчет QALY производится следующим
образом: каждый год предстоящей жизни больного умножается
на ожидаемое КЖ, представленное в виде баллов от 0 до 1. Если
больному предстоит прожить 15 лет, при этом из них 10 лет с
КЖ 1 и 5 лет — с КЖ, оцененным как 0,5, то QALY будет равно:
(10 • 1,0) + (5 • 0,5) = 12,5. Другими словами, несмотря на то что
реально ожидается, что пациент проживет 15 лет, ценность этого срока с учетом КЖ снижается до 12,5 лет, т.е. соответствует
12,5 годам качественной жизни.
471
Методика QALY является универсальной и используется при
оценке любой медицинской технологии практически во всех
отраслях медицины.
Оценка КЖ, получаемая в результате медицинских вмешательств, является достаточно сложной процедурой, и исследования занимают, как правило, несколько лет. В России изучение КЖ проводится последние несколько лет и лишь в немногочисленных центрах. Необходимо четко усвоить, что оценка
КЖ должна проводиться согласно международным методологическим правилам, анкеты-вопросники обязаны проходить
международную экспертизу.
Целесообразно выделять сферы и субсферы, характеризующие КЖ онкологических больных.
Сферы КЖ
Физическая
Психологическая
Уровень
независимости
Социальные
отношения
Субсферы КЖ
Боль, потливость, одышка, кожный зуд,
лихорадка, аппетит
Самочувствие, настроение, самооценка
Работоспособность, зависимость
от лечения
Домашняя среда, обстановка
Особое значение исследования КЖ имеют для детской онкологии, главной целью которой является улучшение КЖ ребенка за счет современных методик лечения, реабилитационных и профилактических мероприятий, создания правильного
отношения ребенка к его здоровью и формированию у него
индивидуальной психологической защиты в условиях развившегося заболевания. Лечащий врач всегда обязан учитывать
характер маленького пациента, его переживания, личное
мнение и отношение к болезни, лечению, семье, окружающим
детям.
В течение своей болезни почти все дети испытывают боли,
обусловленные как самим заболеванием, так и инвазивными
процедурами, лечением или психической травмой. Испытывая
страх перед болью, дети начинают бояться больницы, медицинского персонала, диагностических и лечебных процедур. Качество жизни является ведущим ориентиром в проведении комплекса методов паллиативного лечения, позволяет осуществлять постоянный контроль за состоянием ребенка и вносить
коррективы в терапию.
Важнейшей проблемой паллиативной онкологии является
возможность контролировать боль. Известно, что свыше 70 %
больных с метастатическими формами рака страдают от выраженного болевого синдрома. Считается, что боль можно кон¬
472
тролировать у 80—90 % больных, однако реально в 50—80 %
случаев обезболивающий эффект недостаточен. Боль приводит
к серьезным отрицательным изменениям в состоянии больного
и существенно ухудшает его КЖ.
В последние годы достигнуты хорошие результаты в лечении
ряда онкологических заболеваний как у детей, так и взрослых.
Особенно это относится к болезни Ходжкина (БХ), при которой можно добиться излечения более 90 % больных в ранних
стадиях опухолевого процесса. Для этой категории пациентов
необходимо проведение длительного динамического изучения
КЖ на протяжении практически всей их дальнейшей жизни с
целью выявления ранних и поздних осложнений как самой болезни, так и побочных явлений от проведенного лечения. Изучение различных аспектов КЖ пациентов с БХ в процессе лечения через 5 и 10 лет после его завершения позволяет оценить
характер, частоту и виды осложнений, выявить особенности
реабилитации и адаптации к нормальной жизни, помочь в составлении группы риска, способствовать определению прогноза течения болезни.
В настоящее время еще четко не определены сроки, по истечению которых безрецидивное течение БХ можно считать истинным выздоровлением. Именно поэтому необходимо тщательное и регулярное наблюдение и полноценное обследование
больных после завершения всей терапевтической программы,
цель которого — не пропустить возврата болезни и сохранить
жизнь и здоровье пациента.
Учитывая особенности детского и юношеского возраста,
очень важной является проблема адаптации получающего или
уже завершившего лечение подростка или молодого человека к
окружающему его обществу и среде. У этих пациентов впереди
большая жизнь и жизненные планы: получить образование и
профессию, обзавестись семьей, родить и воспитать детей, т.е.
быть полноценным человеком. Подростки весьма болезненно,
порой сильнее, чем маленькие дети или взрослые, относятся ко
всем дефектам, связанным с проводимым лечением; облысение, различные послеоперационные рубцы, чрезмерное ожирение, гормональные изменения, нарушение менструального
цикла и т.п. могут привести к существенным изменениям в психике, вызвать депрессию и нарушения как в эмоциональной,
так и физиологической сфере. Особенно болезненно молодые
люди переживают нарушение функции гонад, которое является
одним из наиболее частых побочных эффектов химиотерапии и
облучения.
Многие выздоровевшие спрашивают врача о возможности
иметь детей в будущем, как отразится болезнь и проведенное
лечение на протекание беременности, родов и в дальнейшем на
ребенке.
473
На наш взгляд, одним из критериев выздоровления и полноты реабилитации больных, излеченных от БХ, является восстановление детородной функции, возможность беременеть и
рожать детей.
Учитывая данные 30-летнего наблюдения в РОНЦ им.
Н.Н.Блохина РАМН за 2300 больными БХ (включая более 600
пациентов моложе 16 лет), мы настоятельно рекомендуем всем
молодым женщинам, ранее получавшим противоопухолевое лечение, не беременеть в течение первых 3 лет после завершения
всей терапевтической программы и обязательно пройти тщательное контрольное обследование перед принятием ответственного решения.
С 1999 г. в России активно работает "Межнациональный
центр по исследованию качества жизни", возглавляемый профессором А.А.Новиковым. Сотрудники центра разрабатывают
и внедряют в отечественное здравоохранение концепции и методологии оценки КЖ пациентов с различными заболеваниями, прежде всего онкологического профиля, координируют национальные программы и осуществляют связь с ведущими центрами США и Европы.
КВАЛИФИКАЦИОННЫЕ ТЕСТЫ
ПО ДЕТСКОЙ ОНКОЛОГИИ
Тестовая программа составлена в соответствии с квалификационными
требованиями к специалисту — детскому онкологу и содержанием
унифицированной программы последипломного обучения по детской
онкологии.
Тестовая программа содержит современные представления, касающиеся ряда разделов специальности. В достаточном объеме освещены
современные методы лечения.
Раздел 1
ОСНОВЫ СОЦИАЛЬНОЙ ГИГИЕНЫ И ОРГАНИЗАЦИЯ
ОНКОЛОГИЧЕСКОЙ ПОМОЩИ ДЕТЯМ
001. Назовите статьи "Основ законодательства РФ об охране здоровья
граждан", регламентирующие права детей на охрану здоровья:
1. статья 22 "Права семьи";
2. статья 23 "Права беременных женщин и матерей";
3. статья 24 "Права несовершеннолетних";
4. все перечисленное правильно.
002. В формировании общественного здоровья определяющую роль
играют:
1. генетические факторы;
2. природно-климатические факторы;
3. уровень и образ жизни населения;
4. уровень, качество и доступность медицинской помощи.
003. Факторы, влияющие на общественное здоровье:
A) социально-экономические;
Б) природно-климатические;
B) биологические;
Г) психоэмоциональные (поведенческие);
1. все ответы правильны;
2. правильны ответы Б, В;
3. правильны ответы 1, Б;
4. все ответы правильны, кроме А;
5. все ответы правильные, кроме Г.
004. Рождаемость — это:
1. частота деторождений в той или иной совокупности населения;
2. структура исходов беременности на той или иной территории;
3. число родов за определенный временной интервал.
005. Суммарный коэффициент рождаемости означает:
1. среднее число детей у одной женщины;
2. среднее число девочек у одной женщины;
3. среднее число девочек у одной женщины с учетом вероятности
ее смерти.
006. Тенденция показателей рождаемости в России за последние пять
лет — это:
1. снижение;
475
2. увеличение;
3. стабилизация.
007. Воспроизводство в России в последние годы является:
1. простым;
2. суженным;
3. расширенным.
008. Для расчета общего показателя рождаемости необходимо иметь:
1. число живорожденных и среднегодовую численность населения;
2. число родов и численность женского населения;
3. число родившихся живыми и мертвыми и среднегодовую численность населения.
009. Основными показателями естественного движения населения являются:
1. рождаемость, смертность;
2. смертность, заболеваемость;
3. инвалидность, смертность.
010. Уровень рождаемости (на 1000) населения в нашей стране в настоящее время находится в пределах:
1. до 10;
2. от 10 до 15;
3. от 15 до 20.
011. Уровень общей смертности (на 1000) населения в нашей стране в
настоящее время находится в пределах:
1. от 5 до 10;
2. от 11 до 15;
3. от 16 до 20.
012. Связь между уровнями рождаемости и младенческой смертностью:
1. связи нет;
2. прямая;
3. обратная.
013. Показатель младенческой смертности рассчитывается:
1. на 100 родившихся;
2. на 1000 родившихся;
3. на 10 000 родившихся.
014. Критерии живорожденности, принятые в России:
1. срок беременности 28 нед и больше, рост (длина тела) не менее
35 см, а масса не менее 1000 г, признаки жизни (дыхание);
2. продолжительность беременности 20 нед и больше, дыхание,
сердцебиение, пульсация пуповины, произвольные движения
мускулатуры;
3. вне зависимости от продолжительности беременности, причем
плод после отделения дышит и проявляет другие признаки жизни, такие как сердцебиение, пульсация пуповины, произвольные движения мускулатуры, независимо от того, перерезана ли
пуповина и отделилась ли плацента.
015. Поздняя неонатальная смертность — это:
1. смертность детей в период 7—28-го дня жизни;
2. смертность детей на 2-й неделе жизни;
3. смертность детей от 0-го до 7-го дня жизни.
016. Ранняя неонатальная смертность — это:
1. смертность детей в 1-е сутки жизни;
2. смертность детей в период 168 ч после рождения.
476
017. Документы, предоставляемые учреждениями здравоохранения в
органы ЗАГСа для регистрации смерти ребенка:
1. свидетельство о перинатальной смерти;
2. врачебное свидетельство о смерти;
3. справка фельдшера;
4. история болезни;
5. протокол патологоанатомического (судебно-медицинского)
вскрытия.
018. Основная причина смерти — это:
1. основное заболевание, приведшее к летальному исходу;
2. заболевание, непосредственно приведшее к смерти;
3. ведущий синдром, явившийся непосредственной причиной
смерти.
019. При расчете показателя младенческой смертности учитывается:
1. место смерти;
2. место жительства матери;
3. место жительства отца;
4. место жительства ребенка.
020. Между уровнем младенческой смертности и больничной летальностью среди детей до 1 года имеется взаимосвязь:
1. прямая;
2. косвенная;
3. не существует.
021. Различия в расчете показателей смертности и летальности:
1. никаких;
2. летальность в %, смертность в %о (на тысячу).
022. Различия в анализе показателей смертности и летальности:
1. летальность — больничный показатель, смертность — территориальный;
2. смертность — больничный показатель, летальность — территориальный.
023. На основании какого документа формируется государственная
статистика младенческой смертности:
1. справка врача;
2. врачебное свидетельство о смерти;
3. история болезни;
4. на основании записей актов гражданского состояния.
024. Сущность термина "заболеваемость". Выберите один наиболее
правильный ответ:
1. вновь выявляемые заболевания в данном году;
2. все заболевания, зарегистрированные в данном году;
3. заболевания, выявленные при целевых медицинских осмотрах;
4. заболевания, выявленные при периодических медицинских осмотрах.
025. Сущность термина "болезненность". Выберите один наиболее
правильный ответ:
1. вновь выявляемые заболевания в данном году;
2. все заболевания, зарегистрированные в данном году;
3. заболевания, выявленные при целевых медицинских осмотрах;
4. заболевания, выявленные при периодических медицинских осмотрах.
026. Основные методы изучения заболеваемости в РФ:
А) по данным обращаемости;
477
Б) по данным медицинских осмотров;
В) по данным о причинах смерти;
Г) по данным опроса (интервью);
Д) по данным контрольных карт диспансерного наблюдения;
1. правильны ответы А, Б;
2. правильны ответы Б, Г, Д;
3. правильны ответы А, Б, В;
4. правильны ответы А, В, Д.
027. При статистической разработке заболеваемости населения врачи
руководствуются:
1. приказами М3 РФ;
2. методическими рекомендациями М3 РФ и регионального уровня;
3. руководством по социальной гигиене и организации здравоохранения;
4. Международной классификацией болезней, травм и причин
смерти.
028. Существуют следующие типы патологии населения:
A) социальный;
Б) инфекционный;
B) неэпидемический;
Г) экологический;
1. правильны ответы А, Б;
2. правильны ответы А, В;
3. правильны ответы Б, В;
4. все ответы правильны.
029. Методика расчета показателя первичной заболеваемости:
число вновь возникших заболеваний в данном году
1. — -1000;
среднегодовая численность населения ’
2.
3.
4.
число всех имеющихся у населения заболеваний
в данном году
среднегодовая численность населения
число заболеваний, выявленных у населения
на определенный момент
средняя численность осмотренных
число заболеваний определенной нозологии
число всех зарегистрированных
• 1000;
•1000;
• 1000.
030. Методика расчета показателя распространенности заболеваний у
населения:
число вновь возникших заболеваний в данном году
среднегодовая численность населения
1000;
число всех имеющихся у населения заболеваний
в данном году
среднегодовая численность населения
число заболеваний, выявленных у населения
на определенный момент
средняя численность осмотренных
• 1000;
1000;
478
число заболевании определенной нозологии
4. -1000.
число всех зарегистрированных
031. Максимальный уровень общей заболеваемости у детей РФ регистрируется в возрасте:
1. до 1 года;
2. 1—2 года;
3. 3—4 года;
4. 5—6 лет;
5. 7—9 лет;
6. 10—14 лет.
032. Измерителем объема потребности населения в амбулаторно-поликлинической помощи являются:
1. нормы загрузки врачей, работающих в поликлинике;
2. функция врачебной должности;
3. среднее число посещений поликлиники на одного жителя в год.
033. Качество профилактической работы в детской поликлинике определяется:
1. числом профилактических посещений на одного ребенка в год;
2. полнотой и своевременностью проведения профилактических
мероприятий;
3. изменением показателей здоровья детей.
034. Эффективность профилактической работы в детской поликлинике
определяется:
1. полнотой и своевременностью проведения профилактических
мероприятий;
2. динамикой показателей здоровья детей;
3. показателем охвата детей профилактическими прививками.
035. К декретированным возрастным группам при проведении профилактических осмотров детей относятся:
1. 2 года, 3 года, 8 лет, 13 лет;
2. 1 год, 3 года, 5 лет, 7 лет, 10 лет, 15 лет;
3. 4 года, 6 лет, 10 лет, 12 лет.
036. Дети и подростки с различными отклонениями в состоянии здоровья функционального характера, а также имеющие сниженную
сопротивляемость к острым и хроническим заболеваниям относятся к:
1. 1-й группе здоровья;
2. 2-й группе здоровья;
3. 3-й группе здоровья;
4. 4-й группе здоровья.
037. Дети и подростки, больные хроническими заболеваниями в состоянии субкомпенсации со сниженными функциональными возможностями, относятся к:
1. 1-й группе здоровья;
2. 2-й группе здоровья;
3. 3-й группе здоровья;
4. 4-й группе здоровья;
5. 5-й группе здоровья.
038. Дети и подростки с хроническими заболеваниями в состоянии
компенсации, с сохранением функциональных возможностей организма относятся к:
1. 1-й группе здоровья;
479
2. 2-й группе здоровья;
3. 3-й группе здоровья;
4. 4-й группе здоровья;
5. 5-й группе здоровья.
039. Часто болеющий ребенок определяется количеством заболеваний
в год:
1. от 0 до 3 раз в год;
2. от 4 до 7 раз в год;
3. от 8 и более раз в год.
040. В структуре смертности среди детей в экономически развитых
странах, по данным ВОЗ, на первом месте стоит смерть от:
1. злокачественных опухолей;
2. несчастных случаев;
3. инфекционных заболеваний;
4. сердечно-сосудистых заболеваний.
041. Среди причин детской смертности в экономически развитых странах, по данным ВОЗ, злокачественные новообразования занимают:
1. первое место;
2. второе место;
3. третье место;
4. четвертое место.
042. В структуре смертности взрослого населения в экономически развитых странах, по данным ВОЗ, злокачественные новообразования
занимают:
1. первое место;
2. второе место;
3. третье место;
4. четвертое место.
043. В структуре смертности детей в возрасте до 14 лет в России злокачественные новообразования занимают:
1. первое—второе место;
2. третье место;
3. четвертое место;
4. пятое место;
5. шестое место.
044. Заболеваемость злокачественными новообразованиями у детей в
экономически развитых странах составляет в среднем на 100 000
детского населения:
1. 8—10 детей;
2. 10—12 детей;
3. 14—15 детей;
4. 17—18 детей;
5. 19—20 детей.
045. Ежегодно заболевают доброкачественными опухолями на 100 000
детского населения:
1. до 350 детей;
2. до 450 детей;
3. до 550 детей;
4. до 650 детей;
5. до 750 детей.
046. К особенностям онкопедиатрии относятся:
1. врожденный характер большинства опухолей;
2. связь опухолей и пороков развития;
480
3. преобладание саркоматозных опухолей;
4. связь опухолей с трансплацентарным воздействием;
5. все перечисленное.
047. Международная классификация болезней — это:
1. перечень наименований болезней в определенном порядке;
2. перечень диагнозов в определенном порядке;
3. перечень симптомов, синдромов и отдельных состояний, расположенных по определенному принципу;
4. система рубрик, в которые отдельные патологические состояния
включены в соответствии с определенными установочными
критериями;
5. перечень наименований болезней, диагнозов и синдромов, расположенных в определенном порядке.
048. В морфологии солидных опухолей у детей преобладают:
1. рак;
2. саркома;
3. нет четкого различия.
049. В детском возрасте из солидных злокачественных опухолей чаще
всего встречаются:
1. саркомы мягких тканей;
2. опухоли почек;
3. нейробластома;
4. опухоли ЦНС;
5. опухоли костей.
050. В структуре онкогематологических заболеваний у детей первое место занимает:
1. лейкоз;
2. лимфогранулематоз;
3. лимфосаркома.
051. Какие злокачественные опухоли относятся к "истинным детским
опухолям"?
1. Тератобластома, ретинобластома, нейробластома, рабдомиосаркома.
2. Саркома Юинга, синовиальная саркома, хронический лимфо-
лейкоз, лимфосаркома.
3. Саркома Юинга, тератобластома, ретинобластома, нейробластома.
4. Тератобластома, ретинобластома, нейробластома, лимфосаркома.
052. У детей в возрасте до 5 лет преобладают следующие злокачественные опухоли:
1. остеогенная саркома и синовиальная саркома;
2. рак щитовидной железы;
3. нейробластома и нефробластома;
4. все ответы правильные;
5. правильного ответа нет.
053. У детей старше 12 лет преобладают опухоли:
1. нейробластома;
2. нефробластома;
3. остеогенная саркома;
4. тератобластома;
5. ретинобластома.
481
054. Особенностью диагностики злокачественных опухолей у детей является:
1. невозможность получения в большинстве случаев анамнеза от
самого пациента;
2. малое число опухолей, доступных визуальной оценке;
3. расположение опухолей в труднодоступных для диагностики
местах;
4. необходимость применения почти во всех случаях анестезиологического пособия;
5. все перечисленное.
055. Основной причиной запущенности онкологических больных в детском возрасте являются:
1. поздняя обращаемость;
2. недооценка и неправильная трактовка клинических и лабораторных данных врачами общей лечебной сети, отсутствие онкологической настороженности;
3. скрытое течение болезни;
4. наличие многочисленных "масок”, за которыми скрывается опухоль;
5. все ответы правильны.
056. С какого времени можно считать ребенка излеченным от злокачественной солидной опухоли, если с момента окончания противоопухолевого лечения прошли?
1. 1 год
2. 3 года
3. 5 лет
4. 7 лет
5. 10 лет.
057. Когда следует начинать реабилитацию ребенка, больного злокачественной опухолью?
1. С момента постановки диагноза.
2. В процессе проведения специальной терапии.
3. После окончания специальной терапии.
4. Спустя 2 года после окончания специального лечения.
058. Какие виды реабилитации применительны к больному ребенку?
1. Физическая реабилитация.
2. Психологическая реабилитация.
3. Социальная реабилитация.
4. Все перечисленное.
059. Проблемами реабилитации больного ребенка занимается главным
образом:
1. педиатр-онколог;
2. психолог;
3. методист по лечебной физкультуре;
4. педагог;
5. все перечисленные.
060. Следует ли родителей ребенка информировать о плане специального лечения, этапах терапии, о возможных реакциях и осложнениях, сопровождающих противоопухолевое лечение?
1. Следует говорить все.
2. Не следует.
3. Не обязательно.
4. Следует говорить не все.
482
061. В каких случаях и кому медицинская помощь оказывается без согласия граждан или их представителей?
1. Несовершеннолетним детям.
2. При несчастных случаях, травмах, отравлениях.
3. Лицам, страдающим онкологическими заболеваниями и нарушениями обмена веществ.
4. Лицам, страдающим тяжелыми психическими расстройствами, с
заболеваниями, представляющими опасность для окружающих.
062. Льготы на бесплатные медикаменты имеют:
1. все детское население;
2. дети дошкольного возраста;
3. дети до 3 лет и дети до 6 лет из многодетных семей;
4. инвалиды с детства;
5. подростки от 10 до 18 лет.
063. Что такое медицинское страхование?
1. Оплата медицинских услуг через страховую организацию.
2. Форма социальной защиты интересов населения в области охраны здоровья.
3. Оплата лечения и лекарств за счет накопленных средств.
4. Медицинское обслуживание населения за счет страховой организации.
064. Медицинское страхование — это:
1. метод организации медицинской помощи;
2. принцип организации;
3. вид деятельности;
4. раздел социальной гигиены и организации здравоохранения
как науки.
065. Какую ответственность несет медицинский работник, причинивший ущерб пациенту, не связанный с небрежным отношением
медработника к профессиональным обязанностям?
1. Освобождение от ответственности.
2. Уголовную ответственность.
3. Гражданско-правовую ответственность.
066. Кто несет ответственность за вред, причиненный здоровью пациента, при оказании медицинской помощи?
1. Медицинский работник.
2. Медицинское учреждение.
3. Органы управления здравоохранения.
067. Основные виды медицинского страхования:
A) обязательное медицинское страхование;
Б) социальное страхование;
B) добровольное медицинское страхование;
1. правильны ответы А, В;
2. правилен ответ Б;
3. правильные ответы А, Б;
4. все ответы правильны.
068. Субъектами обязательного медицинского страхования являются:
1. страховая организация;
2. фонд медицинского страхования;
3. гражданин;
4. территориальный орган управления здравоохранением;
5. медицинское учреждение.
483
069. Медицинскую помощь в системе обязательного медицинского
страхования оказывают:
1. государственные медицинские учреждения;
2. некоммерческие медицинские учреждения, имеющие лицензию;
3. медицинские учреждения с любой формой собственности;
4. медицинские учреждения с любой формой собственности,
имеющие лицензии.
070. Медицинские учреждения, выполняющие программы медицинского страхования, имеют право оказывать помощь вне системы
медицинского страхования:
1. да;
2. нет.
071. Отношения между медицинскими учреждениями и*СМО строятся
на основании:
1. договора страхования;
2. договора на предоставление лечебно-профилактической помощи
по ОМС;
3. договора финансирования.
072. Ребенок, имеющий страховой полис ОМС РФ, может получить
медицинскую помощь:
1. в территориальной детской поликлинике;
2. в любой поликлинике населенного пункта;
3. в любой детской поликлинике РФ.
073. Страхователем неработающего населения в системе ОМС является:
1. государство;
2. работодатель;
3. вышестоящий орган управления здравоохранением;
4. лечебное учреждение.
074. При невозможности оказать застрахованную помощь в объеме, предусмотренном договором с ОМС, медицинское учреждение:
A) организует помощь в другом учреждении;
Б) уведомляет СМО о невозможности оказать требуемую помощь;
B) обязано обеспечить требуемую помощь в другом учреждении
за счет средств, полученных от страховщика;
1. правильно А;
2. правильно В;
3. правильны ответы Б, В;
4. все ответы правильны.
075. Способы оплаты амбулаторно-поликлинической помощи в системе
обязательного страхования:
1. финансирование по схеме расходов;
2. среднедушевой норматив;
3. за пролеченного больного;
4. оплата законченных случаев;
5. оплата отдельных медицинских услуг.
076. Гарантированный объем медицинской помощи детям и подросткам в системе ОМС:
A) оказание медицинской помощи при острых заболеваниях;
Б) оказание профилактической, лечебно-диагностической и оздоровительной помощи участковым педиатром;
B) оказание медицинской помощи во вспомогательных и специализированных кабинетах;
484
Г) диспансерные осмотры;
1. правильны ответы А, Б, В;
2. правильны ответы Б, В, Г;
3. правильны ответы А, В, Г;
4. все ответы правильны.
077. Наиболее эффективные формы экономического стимулирования
труда медицинских работников:
1. оплата за работу сверх ставки;
2. оплата за расширение зоны обслуживания;
3. оплата за сложность и напряженность;
4. оплата по КТУ в коллективном порядке за объем и качество выполненной работы;
5. оплата за совмещение профессий.
078. Когда меняется стадия заболевания?
1. После операции.
2. После окончания специального лечения.
3. После получения гистологического анализа.
4. Не меняется.
079. Патологическая стадия заболевания выставляется:
1. после окончания обследования больного;
2. после получения цитологического анализа;
3. после получения гистологического анализа;
4. после операции;
5. правильно 1 и 2;
6. правильно 3 и 4.
080. Может ли изменяться клиническая группа больного?
1. Может.
2. Не может, устанавливается один раз.
3. Может, но только в пределах одной группы заболеваний: злокачественные или доброкачественные.
081. При обследовании больного в условиях поликлиники заподозрена
злокачественная опухоль. Для постановки окончательного диагноза пациент госпитализирован в стационар. Какую клиническую
группу Вы поставите больному при поступлении в отделение?
1. 1а.
2. Нб.
3. Н/О.
4. II.
082. Ребенок наблюдается в поликлинике по поводу полипоза желудка.
Какую клиническую группу Вы установите у пациента?
1. 1а.
2. 16.
3. Д/О.
4. Н/О.
5. II.
083. Больной, получивший комбинированное лечение в стационаре по
поводу II стадии нефробластомы, выписан из отделения без признаков рецидива и метастазов опухоли. Поставьте клиническую
группу пациента на момент выписки из стационара:
1. 1а;
2. 16;
3. II;
4. III;
485
5. IV.
084. Несмотря на длительное специальное лечение, у больного зарегистрировано прогрессирование основного заболевания — нейробластомы. Пациент признан инкурабельным.Определите клиническую группу пациента:
1. 1а;
2. 16;
3. II;
4. III;
5. IV.
085. Ребенок обследуется в поликлинике по поводу увеличения подмышечных лимфатических узлов. Цитологическое исследование
пунктата из лимфатического узла не позволяет исключить злокачественную лимфому. Произведена биопсия лимфатического узла.
Диагноз: вирусный лимфаденит. Определите клиническую группу
пациента:
1. 1а;
2. 16;
3. Н/О;
4. Д/О;
5. II.
086. Больной обследуется в поликлинике по поводу подозрения на саркому мягких тканей голени. Выполненная биопсия опухоли позволила диагностировать рабдомиосаркому (данные гистологического анализа). Данных, указывающих на метастазы, не получено.
Определите клиническую группу пациента:
1. 1а;
2. 16;
3. II;
4. III;
5. IV.
087. Ребенку с метастазами правосторонней нефробластомы в легкие
проведено комплексное лечение. При выписке данных, указывающих на наличие первичной опухоли и метастазов, нет. Определите клиническую группу пациента при выписке:
1. 1а;
2. 16;
3. II;
4. III;
5. IV.
088. Больной госпитализирован в стационар для обследования с подозрением на лимфогранулематоз, поражение шейных лимфатических узлов. Планировалась их биопсия, но из-за начавшегося
карантина в отделении по ветряной оспе ребенок был выписан из
стационара на период карантина. Определите клиническую группу
пациента при выписке:
1. 1а;
2. 16;
3. Н/О;
4. II.
089. Больной госпитализирован в стационар для оперативного лечения
по поводу опухоли подвздошной кишки. Во время операции обнаружены множественные метастазы в лимфатические узлы, в печень.
486
Первичная опухоль прорастала в поджелудочную железу. Случай
признан иноперабельным. Больному наложен обходной анастомоз ввиду опасности развития непроходимости кишечника — паллиативная операция. Определите клиническую группу пациента:
1. 1а;
2. II;
3. III;
4. IV.
090. Ребенку проведено комбинированное лечение по поводу нефроб-
ластомы левой почки, II стадия заболевания. При выписке выставлена III клиническая группа. Спустя 6 мес ребенок госпитализирован в отделение с множественными метастазами опухоли в
легкие, печень. Проводимое специальное лечение успеха не имело, и больной скончался от прогрессирования заболевания. Определите клиническую группу:
1. 1а;
2. II;
3. III;
4. IV.
091. Ребенку проведено комбинированное лечение по поводу нефроб-
ластомы левой почки, II стадия заболевания. При выписке выставлена III клиническая группа. Спустя 6 мес ребенок госпитализирован в отделение с множественными метастазами опухоли в
легкие, печень. Проводимое специальное лечение успеха не имело,
и больной скончался от прогрессирования заболевания. Поставьте стадию болезни после смерти пациента:
1. I;
2. II;
3. III;
4. IV.
Раздел 2
ХИРУРГИЧЕСКАЯ АНАТОМИЯ И ОПЕРАТИВНАЯ ХИРУРГИЯ
001. Хирургическая анатомия — это:
1. раздел хирургии, изучающий и разрабатывающий отдельные
хирургические доступы и приемы;
2. раздел анатомии, изучающий строение тела человека применительно к запросам хирургии, главным образом с целью оперативных доступов и приемов;
3. анатомия, изучающая строение, форму и взаимоотношение органов по областям тела;
4. раздел анатомии, изучающий пространственное расположение
органов и анатомических образований;
5. правильно 2 и 3.
002. Оперативная хирургия — это:
1. раздел хирургии, изучающий основы патологии и общие принципы применения оперативных методов лечения;
2. раздел хирургии, изучающий отдельные хирургические доступы;
487
3. раздел хирургии, разрабатывающий и изучающий оперативные
приемы;
4. раздел хирургии, разрабатывающий оперативные методы восстановления анатомической целостности, формы и функции
поврежденных органов и тканей;
5. правильно 2 и 3.
003. Оперативный прием — это:
1. совокупность действий хирурга при разделении тканей для обнажения органа, являющегося основным объектом хирургического вмешательства;
2. совокупность действий хирурга на органах и тканях, являющихся основным объектом вмешательства;
3. решающий этап хирургического вмешательства;
4. правильно только 2 и 3;
5. все ответы правильны.
004. К расширенной операции следует относить:
1. удаление опухоли в пределах здоровых тканей;
2. удаление опухоли в пределах здоровых тканей вместе с регионарными лимфатическими узлами;
3. удаление опухоли в пределах здоровых тканей совместно с регионарными лимфатическими узлами и всеми доступными
лимфатическими узлами в зоне операции;
4. удаление опухоли вместе с регионарными лимфатическими узлами и резекцией или удалением соседнего органа, пораженного опухолью;
5. правильного ответа нет.
005. К комбинированной операции следует относить:
1. удаление опухоли с регионарным лимфатическим барьером;
2. удаление опухоли с регионарным лимфатическим барьером и
всеми доступными лимфатическими узлами в зоне операции;
3. удаление опухоли с регионарными лимфатическими узлами с
резекцией или удалением соседнего органа, вовлеченного в
процесс;
4. удаление опухоли с регионарными лимфатическими узлами с
одновременной операцией по поводу другого заболевания;
5. все ответы правильны.
006. Типичной операцией при высокодифференцированном раке щитовидной железы I—II стадии является:
1. энуклеация опухоли;
2. резекция доли;
3. гемитиреоидэктомия с перешейком;
4. субтотальная резекция железы.
007. Типичная операция при раке щитовидной железы III стадии:
1. энуклеация узла;
2. гемитиреоидэктомия с перешейком;
3. субтотальная резекция железы;
4. гемитиреоидэктомия с перешейком с футлярно-фасциальным
иссечением лимфатических узлов и клетчатки шеи.
008. Внутренняя грудная артерия (внутренняя артерия молочной железы) — ветвь:
1. подключичной артерии;
2. общей сонной;
3. нижней щитовидной артерии;
488
4. позвоночной артерии.
009. Верхняя доля правого легкого состоит из:
1. 2 сегментов;
2. 3 сегментов;
3. 4 сегментов;
4. 5 сегментов.
010. Грудной лимфатический проток проникает из брюшной полости
в грудную через:
1. пищеводное отверстие диафрагмы;
2. аортальное отверстие;
3. между ножками диафрагмы.
011. Трансстернальный оперативный доступ наиболее часто применяется при локализации опухоли в:
1. переднем средостении;
2. трахее;
3. пищеводе;
4. заднем средостении;
5. легком.
012. Средостение разделяется на следующие отделы:
1. верхнее, среднее (центральное), нижнее;
2. переднее, заднее;
3. правильны все ответы.
013. Повторные хирургические вмешательства оправданы при рецидивах опухолей средостения:
1. ганглионевромы;
2. фибросаркомы;
3. лимфогранулематоза;
4. лимфангиомы;
5. симпатобластомы;
6. только 1, 2, 3.
014. В верхнем средостении располагаются:
1. дуга аорты;
2. три ветви дуги аорты;
3. трахея;
4. главные бронхи;
5. нижний полюс вилочковой железы.
015. Печень покрыта брюшиной:
1. со всех сторон;
2. со всех сторон, за исключением ворот печени;
3. со всех сторон, за исключением дорсальной поверхности, прилежащей к диафрагме;
4. со всех сторон, за исключением ворот печени и дорсальной поверхности, прилежащей к диафрагме;
5. правильного ответа нет.
016. Кровоснабжение печени осуществляется за счет:
1. печеночных артерий;
2. печеночных вен;
3. воротной вены.
017. В печени по портальной системе выделяется:
1. 10 сегментов;
2. 8 сегментов;
3. 7 сегментов.
489
018. Портальная вена расположена в печеночной двенадцатиперстной
связке:
1. между желчным протоком и печеночной артерией;
2. между желчным протоком, печеночной артерией и кзади от них;
3. между желчным протоком, печеночной артерией и кпереди от
них;
4. правильного ответа нет.
019. Радикальной операцией при раке печени I—II стадии считается:
1. клиновидная резекция органа;
2. сегментарная резекция;
3. гемигепатэктомия;
4. энуклеация опухоли.
020. Возможные операции при доброкачественных опухолях печени:
1. энуклеация опухоли;
2. клиновидная резекция печени;
3. гемигепатэктомия;
4. сегментарная резекция печени;
5. все ответы правильны.
021. Короткие вены желудка проходят в составе:
1. желудочно-ободочной связки;
2. желудочно-селезеночной связки;
3. печеночно-желудочной связки.
022. Селезеночная артерия берет начало от:
1. чревного ствола;
2. от аорты;
3. от верхней брыжеечной артерии;
4. правильного ответа нет.
023. Селезеночная вена впадает в:
1. нижнюю полую вену;
2. верхнюю брыжеечную вену;
3. воротную вену;
4. правильного ответа нет.
024. Левая желудочная артерия отходит от:
1. печеночной артерии;
2. селезеночной артерии;
3. общей печеночной артерии;
4. аорты;
5. чревного ствола.
025. Правая печеночная артерия отходит от:
1. собственно печеночной артерии;
2. общей печеночной артерии;
3. чревного ствола;
4. аорты.
026. Левая желудочная артерия проходит в составе:
1. желудочно-ободочной связки;
2. желудочно-селезеночной связки;
3. печеночно-желудочной связки.
027. Кровоснабжение ободочной кишки осуществляется из системы:
1. верхней брыжеечной артерии;
2. нижней брыжеечной артерии;
3. все ответы правильны.
490
028. Отток крови от восходящего отдела ободочной кишки осуществляется:
1. в систему верхней брыжеечной вены;
2. в систему нижней брыжеечной вены;
3. и в ту, и в другую;
4. ни в ту, ни в другую.
029. Отток крови от нисходящего отдела ободочной кишки осуществляется:
1. в систему верхней брыжеечной вены;
2. в систему нижней брыжеечной вены;
3. и в ту, и в другую;
4. ни в ту, ни в другую.
030. При кровоснабжении ободочной кишки:
1. ветви верхней брыжеечной артерии обязательно анастомозиру-
ют с ветвями нижней брыжеечной артерии;
2. ветви верхней брыжеечной артерии анастомозируют с ветвями
нижней брыжеечной артерии не всегда;
3. во всех случаях нет сосудистых анастомозов между ветвями
верхней и нижней брыжеечных артерий;
4. все три варианта возможны.
031. Типичные операции при опухолях правой половины ободочной
кишки у детей:
1. правосторонняя гемиколэктомия;
2. резекция илеоцекального угла;
3. резекция печеночного угла;
4. правильно 1 и 2;
5. все ответы правильны.
032. В воронко-тазовой связке проходят:
1. мошоночные артерия и вены;
2. яичниковые артерия и вены;
3. пузырные артерия и вены;
4. срамные артерия и вены.
033. "Брыжейкой" матки является:
1. круглая связка;
2. широкая связка;
3. воронко-тазовая связка.
034. Яичники кровоснабжаются из следующих артерий:
1. внутренней подвздошной;
2. маточной;
3. яичниковой;
4. наружной подвздошной.
035. Маточная артерия является ветвью:
1. внутренней подвздошной артерии;
2. наружной подвздошной артерии;
3. общей подвздошной артерии;
4. яичниковой артерии.
036. К связочному аппарату яичника относятся все перечисленные
связки, кроме:
1. собственной связки;
2. связки, подвешивающей яичник;
3. брыжейки;
4. круглой связки.
491
037. Все органы, расположенные в тазе, покрыты брюшиной, кроме:
1. матки;
2. маточных труб;
3. яичника;
4. мочевого пузыря.
038. Мочеточники у ребра матки расположены:
1. под маточной артерией;
2. над маточной артерией.
039. Типичная операция при злокачественной опухоли яичника у детей:
1. клиновидная резекция органа;
2. экстирпация матки с придатками;
3. овариэктомия с резекцией большого сальника.
040. В почечной ножке почечная артерия располагается:
1. выше и кпереди от почечной вены;
2. ниже и кзади от почечной лоханки;
3. ниже и кпереди от почечной вены.
041. Правая почечная артерия проходит:
1. позади нижней полой вены;
2. впереди нижней полой вены;
3. возможны оба варианта.
042. Левая почечная вена проходит:
1. впереди аорты;
2. позади аорты;
3. возможны оба варианта.
043. Мочеточники располагаются:
1. позади и кнутри от восходящего и нисходящего отделов ободочной кишки;
2. позади и кнаружи от восходящего и нисходящего отделов ободочной кишки;
3. спереди и кнутри от восходящего и нисходящего отделов ободочной кишки;
4. спереди и кнаружи от восходящего и нисходящего отделов ободочной кишки.
044. Типичная операция при нефробластоме II—III стадии:
1. трансперитонеальная нефруретерэктомия;
2. резекция почки;
3. энуклеация опухоли.
045. Возможные операции при нефробластоме I—II стадии:
1. резекция органа;
2. трансперитонеальная нефруретерэктомия;
3. энуклеация опухоли;
4. правильно только 1 и 2;
5. все ответы правильны.
046. Хирургическая тактика при нефробластоме V стадии:
1. нефрэктомия + резекция почки;
2. резекция почки + нефрэктомия.
047. Объем оперативного вмешательства при опухолях поджелудочной
железы у детей:
1. резекция поджелудочной железы;
2. внутреннее дренирование;
3. марсуниализация.
492
048. Возможные оперативные вмешательства при кистах поджелудочной железы:
1. внутреннее дренирование;
2. резекция поджелудочной железы;
3. марсуниализация.
049. Надпочечниковые артерии не отходят от:
1. нижней диафрагмальной артерии;
2. от аорты;
3. от чревного ствола;
4. от почечной артерии.
050. Мочеточники расположены:
1. позади подвздошных сосудов;
2. кпереди от подвздошных сосудов;
3. возможны оба варианта.
051. К сохранным операциям при злокачественных опухолях костей
относятся:
1. ампутация конечности;
2. сегментарная резекция кости с замещением трансплантатом;
3. экзартикуляция конечности;
4. клиновидная резекция кости.
052. Выбор уровня ампутации зависит от:
1. локализации опухоли;
2. протяженности опухоли;
3. степени вовлечения мягких тканей и сосудов;
4. от задач предстоящего протезирования.
053. Основной принцип сегментарной резекции кости:
1. широкое удаление опухоли;
2. широкое удаление опухоли в пределах не пораженной опухолевым процессом костной ткани;
3. широкое удаление опухоли с удалением регионарных лимфатических узлов;
4. сегментарная резекция при опухолевом процессе не производится.
054. При хирургическом лечении сарком костей соблюдаются следующие принципы:
1. радикальный характер операции;
2. абластичность оперативного вмешательства;
3. возможность дальнейшего протезирования;
4. все ответы правильны;
5. все ответы правильны, кроме 3.
055. Интраоперационная оценка распространенности опухолевого
процесса должна основываться:
1. только на визуальных данных;
2. только на основании пальпаторных данных;
3. на основании срочного цитологического исследования;
4. на основании сочетания перечисленных методов диагностики.
056. Абсолютно достоверная интраоперационная диагностика распространенности опухолевого процесса возможна:
1. на основании срочного цитологического исследования материала, взятого во время операции;
2. на основании срочного гистологического исследования биопсийного материала, взятого во время операции;
493
3. на основании комплексного обследования (пальпация, осмотр,
срочное гистологическое исследование);
4. нет абсолютно достоверных методов.
Раздел 3
МОРФОЛОГИЯ ОПУХОЛЕЙ
001. Паренхиму новообразования составляют:
1. собственно опухолевые клетки;
2. соединительная ткань;
3. кровеносные и лимфатические сосуды;
4. нервные и клеточные элементы стромы.
002. Строма опухоли:
1. является необходимой поддерживающей структурой;
2. обеспечивает подведение к опухолевым клеткам питательных
веществ и кислорода;
3. обеспечивает удаление продуктов метаболизма опухолевых клеток;
4. в ряде случаев не является обязательным компонентом новообразования;
5. все правильно, кроме 4.
003. Вновь образованные сосуды злокачественных опухолей:
1. редко приближаются по строению к нормальным венам и артериям;
2. могут быть представлены в виде каналов, выстланных эндотелием;
3. на уровне капилляров могут быть выстланы самими опухолевыми клетками;
4. все ответы правильны;
5. правильны ответы 1 и 3.
004. Клеточные мембраны стромы опухоли могут быть представлены:
1. лимфоцитами и нейтрофилами;
2. эозинофилами;
3. плазматическими клетками;
4. макрофагами и гигантскими клетками инородных тел;
5. всеми перечисленными типами клеток.
005. В тератоме могут развиться производные:
1. эктодермы;
2. мезодермы;
3. эндодермы;
4. все ответы правильны;
5. правильны ответы 1 и 2.
006. Рак in situ отличается от микроинвазивного тем, что:
1. инфильтрирует и разрушает базальную мембрану;
2. инфильтрирует ткани в пределах слизистой оболочки;
3. инфильтрирует и слизистую и подслизистую оболочки органа;
4. не распространяется глубже базальной мембраны и не разрушает ее.
007. Рак in situ, по Международной классификации TNM, относится:
1. к раку;
2. к предраку;
494
3. к доброкачественным опухолям;
4. отношение не определено.
008. К опухолеподобным процессам относятся:
1. гиперпластический полип;
2. аденоматозный полип;
3. аденопапилломатозный полип;
4. папилломатозный полип;
5. ни один из перечисленных.
009. К опухолям с местно-деструирующим ростом относятся:
1. десмоид;
2. фиброаденома;
3. миома;
4. липома.
010. Низкодифференцированные опухоли желудочно-кишечного тракта обладают преимущественно:
1. инфильтративным ростом;
2. экзофитным ростом;
3. смешанным ростом;
4. все перечисленные типы встречаются с одинаковой частотой.
011. К доброкачественным опухолям молочных желез относятся:
1. диффузная фиброзно-кистозная мастопатия;
2. узловая фиброзно-кистозная мастопатия;
3. фиброаденома;
4. все перечисленные;
5. ни одна из перечисленных.
012. Особенностями роста фиброаденомы железы являются:
1. экспансивный рост;
2. инфильтрирующий с метастазами;
3. инфильтрирующий без метастазов;
4. все ответы правильны.
013. Для папилломы мочевого пузыря характерны:
1. наклонность к рецидивам;
2. множественность поражений;
3. частое озлокачествление;
4. все ответы правильны;
5. правильны ответы 1 и 2.
014. К опухолевым процессам яичников относятся:
1. фолликулярная киста;
2. фиброма яичников;
3. кистома яичников;
4. дермоидная киста.
015. К истинным опухолям яичников относятся:
1. фолликулярная киста;
2. киста желтого тела;
3. параовариальная киста;
4. пилиоэпителиальная киста.
016. К новообразованиям АПУД-системы относятся:
1. рак большой слюнной железы;
2. медуллярный рак щитовидной железы;
3. бронхиогенный рак;
4. менингиома;
5. хордома.
495
3. на клиническом и, когда возможно, гистопатологическом определении распространения заболевания при установленном
морфологическом диагнозе.
036. Установленная степень распространения опухолевого процесса по
системе TNM и (pTNM):
1. должна оставаться без изменении в медицинской документации;
2. может быть изменена после специального лечения при выявлении в процессе наблюдения за больным метастаза в регионарные лимфатические узлы;
3. может быть изменена только при выявлении отдаленных метастазов при динамическом наблюдении.
037. При наличии сомнений в правильности определения категории
TNM рекомендуется:
1. выбрать более распространенную;
2. выбрать менее распространенную;
3. продолжить обследование больного.
038. В случае множественных синхронных злокачественных опухолей
в одном непарном органе классификация строится на основе
оценки:
1. каждой опухоли отдельно;
2. опухоли с наивысшей категорией Т (например, Т4, а не ТЗ);
3. опухоли с наименьшей категорией Т.
039. При наличии синхронных билатеральных опухолей парных органов:
1. каждая опухоль классифицируется отдельно;
2. классифицируется опухоль с наивысшей категорией Т;
3. классифицируется опухоль с наименьшей категорией Т.
040. В клинической классификации TNM символ "Т" может быть
представлен в следующем сочетании:
1. ТХ;
2. ТО;
3. Tis;
4. ТО;
5. все ответы правильные.
041. Сочетание "ТО” обозначает:
1. оценить размеры и местное распространение опухоли невозможно;
2. первичная опухоль не определяется;
3. преинвазивную карциному.
042. Сочетание "Tis” обозначает:
1. оценить размеры и местное распространение опухоли невозможно;
2. первичная опухоль не определяется;
3. преинвазивную карциному.
043. Сочетание "ТХ" означает:
1. оценить размеры и местное распространение опухоли невозможно;
2. первичная опухоль не определяется;
3. преинвазивную карциному.
044. В клинической классификации TNM символ "N" может быть
представлен всеми следующими вариантами, кроме:
1. NX;
2. N0;
498
3. N2;
4. Nis.
045. Сочетание NX обозначает:
1. недостаточно данных для оценки регионарных лимфатических
узлов;
2. нет признаков метастатического поражения регионарных лимфатических узлов;
3. одну из степеней поражения метастазами регионарных лимфатических узлов.
046. Сочетание N0 обозначает:
1. недостаточно данных для оценки регионарных лимфатических
узлов;
2. нет признаков метастатического поражения регионарных лимфатических узлов;
3. одну из степеней поражения метастазами регионарных лимфатических узлов.
047. Прямое распространение первичной опухоли на регионарные
лимфатические узлы классифицируется как:
1. N0;
2. NX;
3. N1-3;
4. Ml.
048. Символ ИМ0М в клинической классификации обозначает:
1. недостаточно данных для определения отдаленных метастазов;
2. нет признаков отдаленных метастазов;
3. имеются отдаленные метастазы.
049. Символ "MX” в клинической классификации TNM обозначает:
1. недостаточно данных для определения отдаленных метастазов;
2. нет признаков отдаленных метастазов;
3. имеются отдаленные метастазы.
050. Подразделение основных категорий классификации TNM по типу
Tla, Т1б или N2a, N26 применимо:
1. для обозначения тяжести клинических проявлений;
2. для характеристики отклонений в биохимических анализах;
3. для большей детализации при определении распространенности опухолевого процесса;
4. не применяется никогда.
051. Подтвержденная гистологически распространенность первичной
опухоли (при исследовании удаленного во время операции препарата) должна быть обозначена:
1. рТ1;
2. уТ1;
3. чТ1;
4. все ответы правильны.
052. Символ "pNO" означает:
1. регионарные лимфатические узлы не могут быть оценены;
2. при гистологическом исследовании регионарных лимфатических узлов метастазы не выявлены;
3. регионарные лимфатические узлы гистологическому исследованию не подвергались;
4. нет правильного ответа.
499
053. Символ "рМХ" обозначает:
1. наличие отдаленных метастазов не может быть определено
микроскопически;
2. при микроскопическом исследовании отдаленные метастазы
отсутствуют;
3. при микроскопическом исследовании подтверждено наличие
отдаленных метастазов.
054. Для обозначения гистологической дифференцировки в классификации TNM применяется символ:
1. С;
2. G;
3. R;
4. у;
5. ч.
055. Степень гистологической дифференцировки опухоли может быть:
1. высокой;
2. средней;
3. низкой;
4. все ответы верные.
056. Высокая степень дифференцировки опухоли обозначается символом:
1. G1;
2. G2;
3. G3;
4. G4.
057. Низкой степени дифференцировки опухоли соответствует символ:
1. G1;
2. G2;
3. G3;
4. G4.
058. Карцинома in situ в классификации TNM соответствует:
1. I стадии;
2. II стадии;
3. III стадии;
4. IV стадии;
5. 0 стадии.
059. Наблюдения с наличием отдаленных метастазов в классификации
TNM относятся к:
1. I стадии;
2. II стадии;
3. III стадии;
4. IV стадии;
5. 0 стадии.
060. Группировка наблюдений по стадиям в классификации TNM:
1. идентична стадированию заболеваний в отечественной классификации;
2. в большей мере соответствует распределению больных по клиническим группам;
3. присуща только для системы TNM;
4. все ответы правильны.
500
061. К лимфатическим структурам (в соответствии с классификацией
Ann Arbor) относятся:
1. лимфатические узлы, селезенка, тимус;
2. лимфатический аппарат глоточного (вальдейерова) кольца;
3. аппендикс;
4. пейеровы бляшки;
5. все перечисленные выше структуры.
062. В морфологии солидных опухолей детского возраста преобладают:
1. рак;
2. саркома;
3. нет четкого различия.
063. Наименее зрелая нейрогенная опухоль у детей:
1. ганглионеврома;
2. ганглионейробластома;
3. симпатогониома;
4. симпатобластома.
064. Наиболее зрелая нейрогенная опухоль у детей:
1. ганглионеврома;
2. ганглионейробластома;
3. симпатогониома;
4. симпатобластома.
065. Основным морфологическим критерием для постановки диагноза
лимфогранулематоза является:
1. стертый рисунок строения лимфатического узла;
2. наличие клеток Березовского — Штернберга;
3. наличие клеток Ходжкина;
4. наличие клеток Пирогова — Лангерганса.
066. Какие из перечисленных заболеваний можно отнести к предраковым?
1. Фиброаденому молочной железы.
2. Гастрит с пониженной кислотностью.
3. Полипоз кишечника.
4. Фибродесмоидную опухоль.
5. Все перечисленные формы.
067. В лимфоидную систему человека входят:
1. вил очковая железа;
2. пейеровы бляшки;
3. костный мозг;
4. селезенка;
5. грудной лимфатический проток;
6. все перечисленное.
068. Наибольшее количество Т-клеток (лимфоцитов) вырабатывается в:
1. костном мозге;
2. вилочковой железе;
3. в лимфатических узлах.
069. Наибольшее количество В-клеток (лимфоцитов) вырабатывается в:
1. селезенке;
2. костном мозге;
3. пейеровых бляшках.
501
Раздел 4
ОСНОВЫ ТЕОРЕТИЧЕСКОЙ И ЭКСПЕРИМЕНТАЛЬНОЙ
ОНКОЛОГИИ
001. Носителем генетической информации клетки человека в основном является:
1. РНК;
2. АТФ;
3. ДНК;
4. правильно только 1 и 2;
5. все ответы правильны.
002. Носитель генетической информации находится:
1. в клеточной мембране;
2. в цитоплазме;
3. в ядре;
4. правильно 1 и 2;
5. во всех структурах клетки.
003. Гормональная регуляция роста опухоли в организме чаще всего
осуществляется:
1. непосредственным воздействием на генетический аппарат;
2. непосредственным воздействием на цитоплазму;
3. воздействием на гормональные рецепторы в клеточной мембране;
4. правильны ответы 1 и 2;
5. все ответы правильны.
004. Основными биохимическими процессами в опухолевой клетке являются:
1. фотосинтез;
2. анаэробный гликолиз;
3. окислительно-восстановительные процессы;
4. правильного ответа нет;
5. все ответы правильны.
005. В доброкачественных опухолях дифференцировка клеток:
1. не нарушена;
2. нарушена умеренно;
3. нарушена выраженно;
4. возможны все варианты.
006. Одним из основных свойств клеток злокачественных новообразований является:
1. неконтролируемый рост;
2. контролируемый рост;
3. обязательное укорочение клеточного цикла;
4. обязательное удлинение клеточного цикла.
007. Злокачественные опухоли могут быть вызваны воздействием:
1. полициклических ароматических углеводородов;
2. ионизирующего излучения;
3. ретровирусов;
4. правильно 1 и 2;
5. все ответы правильны.
008. Наибольшей канцерогенной активностью обладают:
1. жиры;
2. углеводы;
3. витамины группы А и В;
502
4. полициклические ароматические углеводороды;
5. белки.
009. Ионизирующее излучение обладает канцерогенным действием
при воздействии:
1. в малых дозах;
2. в больших дозах;
3. не обладает канцерогенным действием;
4. не доказано.
010. Необходимым элементом вирусного канцерогенеза является:
1. размножение вируса в клетке;
2. гибель клетки;
3. интеграция ДНК- или РНК-вируса с ДНК-клетки;
4. изменение иммунологического статуса;
5. все ответы правильны.
011. Основная сущность злокачественных опухолей заключается в:
1. нарушении биохимических процессов в цитоплазме;
2. нарушении взаимодействия структур ядра и цитоплазмы;
3. повреждении генетического аппарата клетки;
4. правильны ответы 1 и 2;
5. правильного ответа нет.
012. В результате воздействия одного химического канцерогена возникают опухоли:
1. только одного гистологического типа;
2. тип опухоли зависит от типа клеток, подвергаемых воздействию
канцерогена;
3. тип опухоли зависит от факторов развития (эмбриогенез, половое созревание);
4. правильны ответы 2 и 3;
5. правильного ответа нет.
013. Доброкачественным опухолям присущи:
1. инфильтративный рост;
2. экспансивный рост;
3. нарушение дифференцировки клеток;
4. правильны ответы 2 и 3;
5. правильны все ответы.
014. Обязательными свойствами только злокачественных опухолей являются:
1. инфильтративный рост;
2. метастазирование;
3. экспансивный рост;
4. все ответы правильны;
5. правильны ответы 1 и 2.
015. Определение гормональных рецепторов важно:
1. для типирования гистологической природы опухолей;
2. для определения уровня гормонов в организме;
3. для определения целесообразности гормонотерапии;
4. правильны ответы 1 и 2;
5. все ответы правильны.
016. Возникновению опухолей способствует:
1. снижение показателей клеточного иммунитета;
2. состояние иммунитета не влияет на возникновение опухолей;
3. влияние иммунитета на возникновение опухолей спорно.
503
017. Опухоли могут вызываться:
1. химическими агентами;
2. физическими агентами;
3. биологическими агентами;
4. все ответы правильны;
5. правильны ответы 1 и 2.
018. К химическим канцерогенным веществам относятся следующие
классы соединений:
1. полициклические ароматические углеводороды и гетероциклические соединения;
2. ароматические азотсоединения и аминосоединения;
3. нитрозосоединения;
4. металлы, металлоиды, неорганические соли;
5. все перечисленные.
019. Канцерогенными для человека производственными процессами
являются:
1. работа с асбестом, сажей, производство резины;
2. работа с мышьяком, никелем, хромом и их соединениями;
3. работа в деревообрабатывающей и мебельной промышленности;
4. правильны ответы 1 и 2;
5. все ответы правильны.
020. К физическим канцерогенным факторам относятся:
1. ионизирующая радиация;
2. ультрафиолетовые лучи;
3. вибрация;
4. повышенное атмосферное давление;
5. правильны ответы 1 и 2.
021. Длительная и интенсивная инсоляция может привести к возникновению:
1. рака кожи;
2. рака легкого;
3. рака желудка;
4. нет правильного ответа.
022. Наиболее устойчива к онкогенному действию ультрафиолетового
излучения кожа:
1. не содержащая пигмента;
2. содержащая незначительное количество пигмента;
3. сильно пигментированная;
4. содержание пигмента не оказывает влияния.
023. Дробление общей дозы при радиоактивном (ионизирующем) облучении:
1. снижает онкогенный эффект;
2. повышает онкогенный эффект;
3. не оказывает какого-либо влияния на онкогенный эффект.
024. Дробление общей дозы при действии химических канцерогенов:
1. увеличивает онкогенный эффект;
2. не оказывает какого-либо влияния;
3. снижает онкогенный эффект.
025. Онкогенные вирусы:
1. являются инфекционными;
2. не являются инфекционными;
3. нет сведений об инфекционных свойствах.
504
026. Онкогенные вирусы передаются главным образом:
1. горизонтально, от особи к особи;
2. вертикально, через наследственный аппарат;
3. механизм передачи неизвестен.
027. Онкогенными являются:
1. только РНК-вирусы;
2. только ДНК-вирусы;
3. и те, и другие;
4. ни те, ни другие.
028. Трансформация клеток-мишеней в опухолевые под воздействием
онкогенных вирусов:
1. не сопровождается гибелью клеток;
2. сопровождается гибелью клеток;
3. в равной мере возможны оба варианта — 1-й и 2-й.
029. Необходимым условием превращения нормальной клетки в опухолевую в условиях вирусного канцерогенеза является:
1. локализация вируса в цитоплазме клетки;
2. интеграция ДНК- и РНК-вируса в ДНК-клетки;
3. возможны оба механизма.
030. Определенное отношение к возникновению лимфомы Беркитта и
рака носоглотки у человека имеет:
1. аденовирус;
2. вирус Эпштейна — Барр (возбудитель инфекционного моно-
нуклеоза);
3. Papova-вирус;
4. вирус из группы вирусов оспы.
031. К наследственно детерминированным могут быть отнесены опухоли:
1. рабдомиосаркома;
2. ретинобластома;
3. острый лимфобластный лейкоз;
4. лимфосаркома;
5. все ответы правильны.
032. Выраженную связь с наследственным характером опухоли в структуре злокачественных новообразований детского возраста имеют:
1. ретинобластомы;
2. пигментная ксеродерма;
3. лимфогранулематоз;
4. билатеральные нефробластомы;
5. тератобластомы.
033. Аденовирусы вызывают у человека развитие:
1. папиллом;
2. опухоли ротоглотки;
3. контагиозного моллюска;
4. воспалительных заболеваний дыхательных путей.
034. Современная схема вирусного канцерогенеза включает:
1. проникновение вируса в клетку и физическую интеграцию его
с клеточной ДНК;
2. функционирование интегрированного вирусного генома с образованием специфических м-РНК и онкобелков;
3. онкобелки воздействуют на функции клеток, приводят ее к
опухолевой трансформации;
4. все ответы правильны.
505
035. Биологические свойства, присущие только опухолевым клеткам:
1. топоингибиция;
2. субстратная зависимость размножения;
3. иммортализация (бессмертие);
4. зависимость размножения клеток от факторов роста;
5. все ответы правильны.
036. Впервые предложил теорию трансплацентарного бластомогенеза:
1. Конгейм;
2. Фишер—Вазельс;
3. Пеллер;
4. Кнудсон.
037. Критериями принадлежности индивидуума к генетически детерминированной группе является:
1. билатеральность;
2. полифокусность;
3. наличие в семье еще одного пораженного;
4. все перечисленное.
038. Для того чтобы опухоль наследовалась, должны произойти мутационные изменения в:
1. герминогенных клетках;
2. соматических клетках;
3. тех и других клетках.
039. Каков риск возникновения повторных злокачественных опухолей
в семьях, где имеется ребенок, относящийся к генетически детерминированной группе?
1. 5-10 %;
2. 15-25 %;
3. 30-45 %;
4. 50-65 %.
040. Какие из перечисленных синдромов и пороков развития представляют повышенный риск для возникновения опухолей у детей?
1. Аниридия.
2. Гемигипертрофия.
3. Пороки развития мочеполовой системы.
4. Синдром Гарднера.
5. Анемия Фанкони.
6. Все перечисленное.
041. Генетические нарушения (повреждения) нормальной клетки, предрасполагающие ее к опухолевой трансформации, могут быть реализованы в виде:
1. генных мутаций;
2. хромосомных аберраций;
3. изменений в количестве копий генов;
4. изменений в количестве хромосом;
5. все ответы правильны.
042. Современную концепцию онкогенов, утверждающую, что возникновение клеток со специфически измененным генотипом происходит в результате индуцируемых канцерогенами точечных мутаций, подтверждают известные данные о том, что:
1. практически все канцерогенные вещества (или агенты) обладают мутагенным эффектом;
2. подавляющее большинство мутагенных веществ обладает канцерогенной активностью;
506
3. оба ответа правильны;
4. нет правильного ответа.
043. Контакт организма с безусловно канцерогенными агентами и повреждения, производимые ими в геноме:
1. во всех случаях приводят к возникновению злокачественных
опухолей;
2. далеко не всегда приводят к возникновению злокачественных
опухолей;
3. никогда не приводят к возникновению злокачественных опухолей.
044. Возможность сохранения нормального генотипа клетки, несмотря
на постоянное воздействие канцерогенных факторов, обусловлена
в первую очередь:
1. наличием в клетке системы репарации повреждений ДНК;
2. чрезвычайной устойчивостью ДНК любой клетки к воздействию канцерогенов;
3. наличием системы генов-супрессоров;
4. правильны ответы 1 и 2.
045. Более эффективную систему репарации ДНК имеют клетки:
1. человека;
2. крысы;
3. мыши;
4. различия отсутствуют.
046. Протоонкогены клетки существуют в виде:
1. лишней хромосомы;
2. участка клеточной мембраны;
3. небольшой области нуклеотидных последовательностей ДНК.
047. Онкоген является:
1. активным гомологом протоонкогена;
2. небольшой нуклеотидной последовательностью, расположенной в ДНК рядом с протоонкогеном;
3. оба ответа правильны;
4. правильного ответа нет.
048. Онкогены обнаружены в геномах:
1. простейших одноклеточных организмов;
2. вирусов;
3. растений;
4. животных;
5. во всех перечисленных геномах.
049. Эффективность пролиферации (деления клеток) зависит от:
1. факторов роста (ФР);
2. числа рецепторов ФР;
3. и того, и другого;
4. ни того, ни другого.
050. Независимость пролиферации раковых клеток от факторов роста
и рецепторов ростовых факторов может быть обусловлена:
1. активацией синтеза белков, аутологичных фактору (ам) роста, —
"аутокринная активация";
2. образованием поврежденных (видоизмененных) рецепторов;
3. возбуждением пострецепторных путей переноса сигналов;
4. всем перечисленным;
5. правильны ответы 2 и 3.
507
051. Онкобелки, продуцируемые клеткой вследствие активации протоонкогена, могут быть гомологичными:
1. ростовому фактору тромбоцитов (РФТ);
2. трансферрину (фактору роста гемопоэтических клеток);
3. гастрину (фактору роста некоторых эпителиальных клеток);
4. эпидермальному фактору роста;
5. всему перечисленному.
052. Взаимосвязь развития опухоли и иммунологического статуса основывается на следующих положениях:
1. наличие на поверхности опухолевых клеток антигенов, распознаваемых иммунной системой хозяина, которая в ряде случаев
элиминирует опухолевые клетки или длительное время сдерживает их рост;
2. высокая вероятность развития злокачественных опухолей у
больных с первичными иммунодефицитами;
3. индукция иммунной недостаточности (тимэктомия) сопровождается учащением возникновения новообразований;
4. все ответы правильны.
053. Угнетение или снижение иммунной реактивности отмечено при:
1. воздействии на организм канцерогенных агентов;
2. прогрессировании опухолевого роста;
3. старении организма;
4. всех перечисленных факторах;
5. нет правильного ответа.
054. Отличительными чертами системы естественной (неспецифической) резистентности организма от специфического противоопухолевого иммунитета являются:
1. иммунный неспецифический характер распознавания опухолевых клеток;
2. готовность к немедленной реакции, не требующей предварительной иммунизации ("спонтанная" цитотоксичность);
3. отсутствие иммунной памяти;
4. правильны ответы 1 и 2;
5. все ответы правильны.
055. К эффекторам системы естественной противоопухолевой резистентности относятся:
1. активированные макрофаги;
2. естественные киллеры и цитостатические клетки, естественные
антитела;
3. гуморальные факторы (фактор некроза опухоли, интерфероны,
интерлейкины и др.);
4. все перечисленное;
5. правильны ответы 1 и 2.
Раздел 5
МЕТОДЫ ДИАГНОСТИКИ
001. К достоинствам метода УЗТ относятся:
1. неинвазивный характер исследования;
2. безвредность;
3. отсутствие противопоказаний;
508
4. высокая информативность;
5. все ответы правильны.
002. Термографический метод наиболее информативен при обследовании больных с опухолями:
1. легких;
2. кожи;
3. мягких тканей органов брюшной полости;
4. щитовидной железы;
5. правильны ответы 2, 3, 4.
003. К эндоскопическим методам исследования относятся:
1. лапароскопия;
2. торакоскопия;
3. рентгеноскопия;
4. капилляроскопия;
5. правильны ответы 1 и 2.
004. Применение рентгенотелевидения:
1. уменьшает лучевую нагрузку на рентгенолога;
2. уменьшает лучевую нагрузку на пациента;
3. увеличивает лучевую нагрузку;
4. повышает качество рентгенограмм;
5. правильны ответы 1 и 2.
005. Компьютерная томография может помочь поставить:
1. морфологический диагноз;
2. топический диагноз;
3. клинический диагноз;
4. все ответы правильны.
006. Наиболее информативное исследование при опухолях щитовидной железы:
1. ангиография;
2. цитологическое исследование;
3. термография;
4. радиоизотопное сканирование;
5. все ответы правильны.
007. Наиболее информативное исследование при опухолях печени:
1. компьютерная томография;
2. артериография;
3. венография;
4. ультразвуковая томография;
5. все ответы правильны.
008. Наиболее информативный метод исследования при опухолях средостения:
1. полипозиционная рентгенография;
2. ангиография;
3. компьютерная томография;
4. торакоскопия;
5. все ответы правильны.
009. Наиболее информативный метод исследования при нефробластоме:
1. ангиография;
2. компьютерная томография;
3. ультразвуковая томография;
4. выделительная урография;
5. правильны ответы 1 и 2.
509
010. Наиболее информативный метод исследования при нефробластоме
V стадии:
1. компьютерная томография;
2. артериография;
3. выделительная урография;
4. ультразвуковая томография.
011. Наиболее информативный метод исследования при опухолях костей:
1. радиоизотопное сканирование;
2. ангиография;
3. рентгенография;
4. пункционная биопсия.
012. Выбрать частный метод исследования:
1. рентгенография грудной клетки;
2. выделительная урография;
3. ангиография мозга;
4. биохимическое исследование крови.
013. Выбрать специальный метод исследования:
1. пальпация органов брюшной полости с релаксантами;
2. сканирование лимфатических узлов средостения;
3. целиакография;
4. исследование костного мозга.
014. Инструментальными методами, позволяющими дифференцировать магистральные сосуды без их контрастирования, являются:
1. ультразвуковая томография;
2. ангиография;
3. компьютерная томография;
4. рентгенография.
015. Уровень катехоламинов может быть определен в:
1. моче;
2. крови;
3. слюне;
4. спинномозговой жидкости.
016. Уровень стероидных гормонов определяется в:
1. моче;
2. крови;
3. ткани опухоли;
4. правильны ответы 1 и 2;
5. все ответы правильны.
017. При злокачественных опухолях у детей чаще всего наблюдается:
1. гипокоагуляция;
2. гиперкоагуляция;
3. нормокоагуляция.
018. Для механической желтухи в первую очередь характерно резкое
повышение активности:
1. ACT;
2. АЛТ;
3. щелочной фосфотазы;
4. ЛДГ.
019. Для механической желтухи характерно повышение:
1. концентрации только прямого билирубина;
2. концентрации только непрямого билирубина;
3. прямого и непрямого билирубина;
4. сначала прямого, а затем непрямого билирубина.
510
020. Ангиография обладает наименьшей информативностью в диагностике:
1. опухолей печени;
2. опухолей почек;
3. забрюшинных опухолей;
4. опухолей желудочно-кишечного тракта.
021. Абсолютным показанием для проведения общей аортографии является:
1. наличие опухоли брюшной полости;
2. подозрение на рецидив опухоли;
3. наличие так называемой немой почки.
022. Проведение обшей аортографии является методом выбора в диагностике:
1. билатеральной нефробластомы;
2. нейробластомы забрюшинного пространства;
3. опухоли яичника.
023. Венография нижней полой вены является обязательной при:
1. забрюшинной нейробластоме III стадии;
2. правосторонней нефробластоме.
3. в том и другом случае.
024. Наиболее информативным в диагностике метастазов в печень является:
1. лапароскопия;
2. ангиография;
3. биохимическое исследование крови;
4. сканирование печени.
025. Повышение уровня фибриногена в сыворотке крови характерно
для:
1. нефробластомы;
2. нейробластомы;
3. сарком мягких тканей;
4. всех злокачественных опухолей.
026. Гипертромбоцитоз является характерным для:
1. всех злокачественных опухолей;
2. опухолей ЦНС;
3. системных злокачественных заболеваний.
027. Повышение уровня экскреции катехоламинов является характерным для:
1. заболеваний почек;
2. нейробластом;
3. лимфопролиферативных процессов.
028. Повышение уровня щелочной фосфотазы характерно для:
1. злокачественных солидных опухолей;
2. лимфопролиферативных процессов;
3. не является специфичным при онкологической патологии.
029. Флебография в диагностике забрюшинных неорганных опухолей
показана при:
1. всех локализациях;
2. правосторонних опухолях;
3. срединном расположении;
4. левосторонней локализации;
5. правосторонней и срединной локализации.
511
030. На поперечных срезах грудной клетки при рентгеновской компьютерной томографии нельзя:
1. точно локализовать опухоль;
2. рассчитать ее размер;
3. оценить плотность;
4. определить доброкачественный или злокачественный характер.
031. Рентгенологическое томографическое исследование органов грудной полости позволяет:
1. определить точную локализацию и распространенность процесса;
2. изучить состояние трахеи и бронхов;
3. изучить состояние сегментарных бронхов;
4. уточнить состояние лимфатических узлов средостения и корней легких;
5. все ответы правильны.
032. Реакция Абелева — Татаринова имеет важное диагностическое
значение при:
1. нефробластоме;
2. нейробластоме;
3. тератобластоме.
033. У детей в возрасте до 1 года наличие эмбриоспецифического гамма-глобулина в сыворотке крови является:
1. нормой;
2. подозрением на наличие опухоли;
3. симптомом нарушения белкового обмена.
034. Появление альфа-фетопротеина в сыворотке крови указывает на:
1. наличие рака печени;
2. тератобластомы;
3. гепатита;
4. правильны ответы 1 и 2;
5. все ответы правильны.
035. Повышение уровня катехоламинов в моче возможно:
1. при наличии нейрогенной опухоли;
2. при наличии опухоли ЦНС;
3. после употребления большого количества цитрусовых и шоколада;
4. правильны ответы 1 и 3;
5. все ответы правильны.
036. Наиболее часто применяемыми методами введения газа в переднее средостение являются:
1. парастернальный;
2. ретроманубриальный;
3. паравертебральный;
4. субоксифоидальный;
5. правильны ответы 1 и 2.
037. Показаниями для проведения сиалографии являются:
1. аденома слюнной железы;
2. рак слюнной железы;
3. хронический сиалоаденит;
4. все ответы правильны.
038. Ангиография является наиболее информативным методом в диагностике:
1. хемодектом шеи;
512
2. метастазов в лимфатические узлы шеи;
3. рака слюнных желез.
039. К инвазивным методам рентгенологического исследования относятся:
1. компьютерная томография;
2. ирригоскопия;
3. ангиография.
040. К неинвазивным методам рентгенологического исследования относятся:
1. аортография;
2. лимфография;
3. компьютерная томография;
4. илеокавография;
5. веноазигография.
041. К специальным методам рентгенологического исследования относятся:
1. рентгенография грудной клетки;
2. гистерография;
3. рентгенография костей скелета;
4. обзорная рентгенография брюшной полости.
042. К рентгенологическим методам исследования мочевых путей относятся:
1. гистерография;
2. экскреторная урография;
3. холецистография;
4. бронхография.
043. К непрямым методам диагностики лимфатических узлов относятся:
1. лимфография;
2. илеокаваграфия;
3. рентгеновская компьютерная томография;
4. ультразвуковая томография;
5. все, кроме 1.
044. Ангиография наиболее информативна при диагностике:
1. опухолей матки;
2. опухолей почки;
3. опухолей желудка;
4. опухолей легких.
045. Радиоизотопные исследования в клинической онкологии используются для:
1. выявления первичной опухоли;
2. определения распространенности новообразования;
3. оценки функционального состояния некоторых органов;
4. все ответы правильны.
046. Опухоль характеризуется:
1. повышенным накоплением изотопа в опухоли;
2. пониженным накоплением изотопа в опухоли;
3. нарушением распространения изотопа по сосудам;
4. правильны ответы 1 и 2;
5. все ответы правильны.
047. Радиоактивный йод применяют для диагностики:
1. опухолей поджелудочной железы;
2. желудка;
3. щитовидной железы;
513
4. правильны ответы 1 и 3;
5. все ответы правильны.
048. Для диагностики метастатического поражения костей чаще всего
используется:
1. радиоактивный фосфор;
2. радиоактивный стронций;
3. радиоактивный кобальт;
4. радиоактивный йод.
049. Радиоиммунологическое исследование уровня АФП может быть
использовано для:
1. установления диагноза;
2. динамического наблюдения;
3. уточнения степени распространенности опухоли;
4. правильны ответы 1 и 2;
5. все ответы правильны.
050. Аспирационный (пункционный) метод исследования наиболее
информативен в цитологической диагностике опухолей:
1. эпителиальных;
2. мезенхимальных;
3. нейрогенных;
4. дизэмбриональных.
051. Наиболее чувствительна реакция определения альфа-фетопротеина
у больных в возрасте:
1. до 1 года;
2. от 2 до 5 лет;
3. от 6 до 10 лет;
4. старше 10 лет.
052. У больных с нейробластомой повышение суточной экскреции с
мочой катехоламинов наблюдается у:
1. 85 % пациентов;
2. 50 % пациентов;
3. 25 % пациентов.
053. Какие из фракций катехоламинов преимущественно увеличиваются при злокачественных нейрогенных опухолях?
1. Адреналин.
2. Норадреналин.
3. Дофамин.
4. ДОФА.
Раздел 6
ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ
ОПУХОЛЕЙ
001. Особенности, связанные с лечением детей со злокачественными
опухолями:
1. нарушение топографоанатомических соотношений при многих
опухолях в связи с их врожденным характером;
2. большие оперативные вмешательства у маленьких детей;
3. высокая чувствительность большинства опухолей у детей к ионизирующему излучению и химиопрепаратам;
514
4. повреждающее действие ионизирующего излучения на зоны
роста и репродуктивную функцию;
5. все перечисленное.
002. Абсолютным противопоказанием к оперативному лечению являются:
1. возраст ребенка;
2. сопутствующие заболевания (сахарный диабет, порок сердца,
пороки развития);
3. отягощенный аллергический анамнез;
4. запущенность опухолевого процесса.
003. Особенностью оперативных вмешательств у детей раннего возраста с онкологическими заболеваниями являются:
1. большой объем оперативного вмешательства;
2. трудность в управлении гомеостазом;
3. повышенная чувствительность к кровопотере;
4. все перечисленное.
004. Термину "операбельность" соответствует:
1. состояние больного, позволяющее выполнить операцию;
2. состояние больного, позволяющее выполнить радикальную
операцию;
3. распространенность опухоли, позволяющая выполнить радикальную операцию.
005. К понятию "резектабельность" относятся:
1. локализация и распространенность новообразования, позволяющая выполнить радикальную операцию;
2. возможность выполнить резекцию органа;
3. состояние больного, позволяющее выполнить операцию.
006. На отдаленные результаты лечения злокачественных опухолей у
детей наибольшее влияние оказывают:
1. гистологическая структура опухоли;
2. наличие отдаленных метастазов;
3. наличие регионарных метастазов;
4. возраст больного.
007. Факторы, влияющие на объем операции:
1. стадия заболевания;
2. возраст ребенка;
3. гистологическая структура опухоли;
4. все ответы правильны.
008. Виды оперативного лечения при злокачественных опухолях костей:
1. краевая резекция;
2. экскохлеация;
3. широкая сегментарная резекция;
4. ампутация конечности;
5. правильны ответы 3 и 4.
009. В каком возрасте при солидных опухолях I—II стадии проводится
только хирургическое лечение?
1. До 1 года.
2. До 5 лет.
3. Всегда проводится только комплексное лечение.
4. Независимо от возраста.
010. При солидных опухолях забрюшинного пространства II стадии
проводится лечение:
1. только хирургическое;
2. комбинированное;
3. индивидуально подобранное.
515
011. При каких солидных злокачественных опухолях допустимо нерадикальное удаление опухоли:
1. При нефробластоме.
2. При нейробластоме.
3. При опухолях мягких тканей.
4. При опухолях костей.
012. Лучевая терапия в лечении злокачественных опухолей используется:
1. как самостоятельный метод;
2. в комбинации с хирургическим методом;
3. в комбинации с химиотерапией;
4. все ответы правильны.
013. Основная задача радикальной лучевой терапии:
1. подведение максимально возможной дозы;
2. снижение биологической активности опухолевых клеток;
3. вызов гибели наиболее чувствительных опухолевых клеток;
4. достижение частичной регрессии опухоли;
5. достижение полной регрессии.
014. Паллиативная лучевая терапия решает следующие задачи:
1. подведение максимально возможной дозы излучения;
2. вызов гибели наиболее чувствительного пула опухолевых клеток;
3. получение торможения роста опухоли;
4. получение частичной регрессии опухоли.
015. Наиболее резистентной к лучевой терапии является:
1. плоскоклеточный неороговевающий рак;
2. семинома;
3. опухоль Юинга;
4. остеогенная саркома.
016. Ниболее радиорезистентной опухолью является:
1. плоскоклеточный неороговевающий рак;
2. семинома;
3. опухоль Юинга;
4. остеогенная саркома;
5. все перечисленные.
017. Расщепленный курс лучевой терапии применяют для:
1. повышения радиочувствительности опухоли;
2. защиты нормальных тканей;
3. снижения числа рецидивов;
4. повышения дозы облучения.
018. Послеоперационная лучевая терапия может быть проведена в следующих случаях:
1. при нерадикальности операции;
2. при выявлении во время операции регионарных метастазов;
3. при неабластичности операции;
4. правильны ответы 1 и 2;
5. все ответы правильны.
019. На радиочувствительность оказывают влияние:
1. напряжение кислорода в опухоли;
2. дифференцировка опухолевых клеток;
3. гипертермия опухоли;
4. все ответы правильны.
020. Используются следующие факторы модификации радиочувствительности опухоли:
1. локальная гипертермия;
516
2. искусственная гипергликемия;
3. гипербарическая оксигенация;
4. искусственная локальная гипоксия;
5. все ответы правильны.
021. Абсолютным противопоказанием к лучевому лечению является:
1. пожилой возраст;
2. молодой возраст;
3. активный туберкулез;
4. все перечисленные факторы;
5. ни один из перечисленных факторов.
022. В практике лучевой терапии пока не применяются:
1. дистанционное облучение;
2. внутиполостное облучение;
3. внутритканевое облучение;
4. внутреннее облучение;
5. нейтронзахватная терапия.
023. Сочетанная лучевая терапия означает:
1. применение двух способов облучения или двух видов излучения;
2. расщепление курса лучевой терапии;
3. облучение с радиомодификаторами;
4. облучение в сочетании с химиотерапией;
5. правильного ответа нет.
024. Единицей измерения экспозиционной дозы излучения является:
1. грэй;
2. рад;
3. кюри;
4. рентген.
025. Единицей измерения поглощенной дозы излучения является:
1. грэй;
2. кюри;
3. рентген;
4. все ответы правильны;
5. правильного ответа нет.
026. К лучевым реакциям относятся:
1. фиброз;
2. лучевая язва;
3. эритема кожи;
4. лучевой рак.
027. На чистоту местных лучевых реакций не влияют:
1. пожилой возраст;
2. аллергические заболевания;
3. сахарный диабет;
4. тиреотоксикоз;
5. правильного ответа нет.
028. Для профилактики и лечения лучевых реакций слизистых оболочек применяют:
1. антисептические растворы;
2. витаминизированные растворы;
3. метилурацил;
4. все перечисленное;
5. ничего из перечисленного.
029. Для профилактики и лечения общих лучевых реакций применяют:
1. антигистаминные препараты;
517
2. витамины;
3. седативные средства;
4. правильны ответы 1 и 2;
5. все ответы правильны.
030. При передозировке винкристина необходимо использовать:
1. аминазин;
2. сердечные гликозиды;
3. промедол.
031. Механизм действия алкилирующих препаратов проявляется в:
1. реакции алкилирования молекул ДНК;
2. нарушении синтеза пуринов и тимидиновой кислоты;
3. подавлении синтеза нуклеиновых кислот на уровне ДНК-мат-
рицы;
4. денатурации тубулина — белка микротрубочек;
5. образовании сшивок молекул ДНК.
032. Механизм действия противоопухолевых антибиотиков проявляется в:
1. реакции алкилирования молекул ДНК;
2. нарушении синтеза пуринов и тимидиновой кислоты;
3. подавлении синтеза нуклеиновых кислот на уровне ДНК-мат-
рицы;
4. денатурации тубулина — белка микротрубочек;
5. образовании сшивок молекул ДНК.
033. Механизм действия антиметаболитов проявляется в:
1. реакции алкилирования молекул ДНК;
2. нарушении синтеза пуринов и тимидиновой кислоты;
3. подавлении синтеза нуклеиновых кислот на уровне ДНК-мат-
рицы;
4. денатурации тубулина — белка микротрубочек;
5. образовании сшивок молекул ДНК.
034. Механизм действия препаратов растительного происхождения
(например, таксола) проявляется в:
1. реакции алкилирования молекул ДНК;
2. нарушении синтеза пуринов и тимидиновой кислоты;
3. подавлении синтеза нуклеиновых кислот на уровне ДНК-мат-
рицы;
4. денатурации тубулина — белка микротрубочек;
5. образовании сшивок молекул ДНК.
035. Механизм действия производных платины проявляется в:
1. реакции алкилирования молекул ДНК;
2. нарушении синтеза пуринов и тимидиновой кислоты;
3. подавлении синтеза нуклеиновых кислот на уровне ДНК-мат-
рицы;
4. денатурации тубулина — белка микротрубочек;
5. образовании сшивок молекул ДНК.
036. Эффективная предоперационная химиотерапия в ряде случаев
может привести к:
1. уменьшению объема опухоли;
2. переводу больного в операбельное состояние;
3. возможному сокращению объема оперативного вмешательства;
4. всему перечисленному;
5. правильных ответов нет.
518
037. Высокочувствительными к цитостатикам являются:
1. ретинобластома;
2. герминогенные опухоли;
3. остеогенная саркома;
4. саркома Юинга;
5. правильны ответы 1, 2, 4.
038. Наиболее уязвима для цитостатиков опухолевая клетка, находящаяся в фазе:
1. М;
2. G1;
3. S;
4. G2;
5. G.
039. К цитостатикам с преимущественно фазово-неспецифическим действием относятся:
1. адриамицин;
2. платидиам;
3. метотрексат;
4. алкилирующие агенты;
5. все перечисленные препараты.
040. К алкилирующим препаратам относятся:
1. ифосфамид;
2. эмбихин;
3. вепезид;
4. Тио-ТЭФ;
5. все перечисленные препараты, кроме 3.
041. К противоопухолевым антибиотикам относятся:
1. адриамицин;
2. митрамицин;
3. стрептозотоцин;
4. проспидин;
5. правильны ответы 1 и 2.
042. К антиметаболитам относятся:
1. фторурацил;
2. цитозар;
3. хлодитан;
4. цитембена;
5. правильны ответы все, кроме 3.
043. Противопоказанием для назначения антрациклинов является:
1. диссеминация опухолевого процесса;
2. сердечно-сосудистая недостаточность;
3. повышение температуры тела до 37,5 °С;
4. отсутствие одной почки.
044. Противопоказанием для применения ифосфамида является:
1. геморрагический цистит;
2. инфаркт в анамнезе;
3. повышение трансаминаз в 2 раза;
4. аллергия в анамнезе.
045. Целью I фазы клинического лечения противоопухолевым препаратом является:
1. определение допустимой для человека разовой и суммарной дозы цитостатика и спектра токсичности;
2. изучение противоопухолевой активности цитостатика при разных видах опухоли;
519
3. сравнительное изучение с другими цитостатиками;
4. изучение различных сочетаний с другими цитостатиками.
046. Целью II фазы клинического лечения противоопухолевым препаратом является:
1. определение максимально переносимой дозы цитостатика, изучение противоопухолевой активности цитостатика и ее спектра
при "сигнальных опухолях" — десяти наиболее часто встречающихся опухолей человека;
2. сравнительное изучение с другими цитостатиками;
3. изучение различных сочетаний с другими цитостатиками.
047. Целью III фазы клинического лечения противоопухолевым препаратом является:
1. определение максимально переносимой дозы цитостатика;
2. изучение противоопухолевой активности цитостатика и ее
спектра при "сигнальных опухолях";
3. сравнительное изучение с другими цитостатиками;
4. изучение различных сочетаний с другими цитостатиками.
048. При лечении опухолевых плевритов и асцитов наиболее эффективным способом введения химиопрепаратов является:
1. системная химиотерапия;
2. региональная химиотерапия;
3. локальная химиотерапия;
4. все методы одинаково эффективны.
049. Согласно рекомендации ВОЗ, под полным эффектом (полной ремиссией) понимают:
1. полную резорбцию опухоли;
2. полную резорбцию опухоли сроком не менее чем на 1 мес;
3. полную резорбцию опухоли сроком не менее чем на 2 мес;
4. уменьшение опухоли и улучшение состояния больного.
050. Согласно рекомендации ВОЗ, под частичным эффектом (частичной ремиссией) понимают:
1. уменьшение опухоли, улучшение состояния больного;
2. уменьшение размеров опухоли >50%;
3. уменьшение размеров опухоли >50 % сроком не менее чем на
2 мес.
051. Статистически значимое увеличение жизни больных с диссеминированным опухолевым процессом достигается при:
1. получении полного эффекта;
2. получении эффекта <50 %;
3. получении субъективного эффекта;
4. правильны ответы 1 и 2.
052. Под термином "неоадъювантная химиотерапия" понимают:
1. послеоперационную химиотерапию;
2. профилактическую химиотерапию;
3. оценку эффективности предоперационной химиотерапии по
степени лекарственного патоморфоза;
4. предоперационную химиотерапию.
053. К побочным реакциям химиотерапии относятся:
1. тошнота и рвота;
2. гипертермия;
3. агранулоцитоз;
4. нефротоксичность;
5. правильны ответы 1 и 2.
520
054. К осложнениям химиотерапии относятся:
1. диарея;
2. анорексия;
3. стоматит;
4. цистит;
5. правильны ответы 1, 3 и 4.
055. При передозировке винкристина возникает:
1. тахикардия;
2. гипертермия;
3. гиперкинезы.
056. Основным осложнением при передозировке адриамицина является:
1. нарушение проводимости в миокарде;
2. почечная недостаточность;
3. алопеция.
057. Основным осложнением при химиотерапии препаратами платины
является:
1. нефротоксичность;
2. геморрагический цистит;
3. ототоксичность.
058. При опухолях забрюшинного пространства III стадии проводится:
1. только хирургическое лечение;
2. только химиотерапия;
3. комплексное лечение.
059. К средствам неспецифической иммунотерапии относятся:
1. БЦЖ;
2. зимозан, летинол;
3. витамины;
4. все перечисленные.
060. К средствам специфической иммунотерапии относятся:
1. ауто- или аллогенная опухолевая клетка, отработанная тем
или иным способом с сохранением антигенной структуры клеток;
2. цитокины: интерфероны, интерлейкины;
3. препараты тимуса;
4. все перечисленное;
5. ничего из перечисленного.
061. Термин "симптоматическая терапия" означает:
1. терапию, направленную на устранение наиболее тягостных
проявлений заболевания, связанных с новообразованиями специфической терапии;
2. терапию, направленную на уменьшение первичных опухолей;
3. терапию, направленную на уменьшение отдаленных метастазов;
4. правильного ответа нет.
062. Наиболее частым возбудителем инфекционных осложнений у онкологических больных в последние годы является:
1. грамотрицательная флора;
2. грамположительная флора;
3. грибковая флора;
4. анаэробы;
5. правильны все ответы.
521
063. Для терапии кандцдамикозной инфекции (C.albicans) эффективны:
1. амфотерицин В;
2. флуконазол;
3. интраконазол;
4. все перечисленные агенты.
064. Для лечения вирусной инфекции (herpes Zoster) используются:
1. цефалоспорины;
2. бисептол;
3. пенициллины;
4. препараты альфа-интерферона;
5. противовирусные препараты (зовиракс, ацикловир, валтрекс,
фоскарнет).
065. Что понимают под активной иммунотерапией?
1. Лечение, под влиянием которого сам организм вырабатывает
тканевые антитела.
2. Вид терапии, когда иммунные лимфоциты и другие факторы
гуморального иммунитета вводятся в организм больного.
3. Правильного ответа нет.
066. Активная неспецифическая иммунотерапия используется для
проведения:
1. иммунореабилитации;
2. иммунопрофилактики рецидивов и метастазов;
3. иммунотерапии в далеко зашедших стадиях (в сочетании с лучевой и химиотерапией);
4. все перечисленное.
067. Какие из перечисленных препаратов являются неспецифическими стимуляторами иммунитета?
1. БЦЖ.
2. Тимозин.
3. Т-активин.
4. Интерферон.
5. Все перечисленные.
068. Действие интерферона на злокачественные клетки:
1. специфически защищает клетки от воздействия нуклеиновых
кислот;
2. специфически защищает клетки от воздействия чужеродных
белков;
3. все перечисленное.
069. Какие из перечисленных препаратов являются иммуномодуляторами?
1. Декарис.
2. Спленин.
3. Зимозан.
4. Все перечисленные.
070. Какие из перечисленных осложнений может вызывать иммунотерапия?
1. Зуд.
2. Увеличение лимфатических узлов.
3. Спленомегалию.
4. Гепатомегалию.
5. Озноб, лихорадку.
6. Все перечисленное.
522
Раздел 7
ОПУХОЛИ ГОЛОВЫ И ШЕИ
001. В каком возрасте наиболее часто встречаются опухоли головного
мозга?
1. До года.
2. От 2 до 10 лет.
3. Старше 10 лет.
002. Преимущественная локализация опухолей мозга у детей — это:
1. поражение мозжечка;
2. поражение других структур, расположенных в задней черепной
ямке, включая ствол мозга и IV желудочек;
3. надседловидная область;
4. полушария большого мозга;
5. желудочки мозга, кроме IV.
003. К опухолям надседловидной области относятся:
1. краниофарингеома;
2. глиомы зрительного пути;
3. опухоли гипоталамуса;
4. все ответы правильны.
004. По гистологическому строению, согласно современной классификации, принятой ВОЗ, выделяют:
1. глиальные опухоли;
2. нейрональные опухоли;
3. примитивные нейроэктодермальные опухоли;
4. опухоли эпифиза;
5. все ответы правильны.
005. Опухоли мозга у детей являются гетерогенными по клеточной популяции:
1. утверждение верно;
2. утверждение не верно.
006. Деление опухолей мозга у детей по гистологической структуре на
доброкачественные и злокачественные является условным:
1. утверждение верно;
2. утверждение не верно.
007. Укажите признаки, характеризующие перерождение доброкачественной опухоли мозга в злокачественную:
1. инфильтративный рост;
2. метастазирование;
3. нейротоксическое действие;
4. геморрагический синдром;
5. все ответы правильны;
6. правильны ответы 1 и 2.
008. Доброкачественным опухолям мозга более свойственны следующие признаки:
1. кистообразование;
2. инфильтративный рост;
3. васкуляризация опухоли и повышение проницаемости сосудов;
4. геморрагический синдром;
5. клиника острого менингита.
523
009. Злокачественным опухолям мозга более свойственны следующие
признаки:
1. кистообразование;
2. инфильтративный рост;
3. васкуляризация опухоли и повышение проницаемости сосудов;
4. геморрагический синдром;
5. клиника острого менингита.
010. Наиболее часто встречающаяся форма злокачественных опухолей
головного мозга у детей — это:
1. астроцитома;
2. медуллобластома;
3. эпендимома;
4. краниофарингиома.
011. Главной особенностью опухолей мозга у детей является:
1. длительный бессимптомный или малосимптомный период;
2. раннее развитие очаговой неврологической симптоматики;
3. частое и раннее нарушение психики.
012. Длительное бессимптомное течение опухолей головного мозга у
детей объясняется следующими причинами:
1. костной декомпрессией — расхождением внутричерепных
швов;
2. медленными темпами роста опухолей;
3. локализацией опухоли.
013. Последовательность расхождения швов следующая: а — затылочный; б — лобный; в — венечный; г — сагиттальный:
1. а, б, в, г;
2. г, в, б, а;
3. б, в, г, а.
014. При врожденной водянке головного мозга и внутричерепных
травмах края швов:
1. ровные;
2. зубчатые.
015. При опухолях ЦНС края швов:
1. ровные;
2. зубчатые.
016. Прогрессирующая гидроцефалия характеризуется следующими
признаками:
1. гидроцефалическим видом головы;
2. расширением поверхностных сосудов (венозная сеть) в височных областях и вокруг глаз;
3. гидроцефальным, дребезжащим звуком при перкуссии в области венечного шва;
4. усилением пальцевых вдавлений на краниограммах;
5. костными изменениями черепа;
6. все ответы правильны.
017. Ранними симптомами опухолей головного мозга у детей наиболее
часто являются:
1. общемозговые симптомы;
2. очаговые неврологические симптомы;
3. 1 и 2.
018. Наиболее частыми и ранними общемозговыми симптомами опухолей мозга у детей являются:
1. головная боль;
524
2. рвота;
3. застойные диски зрительных нервов;
4. судороги;
5. головокружение;
6. вынужденное положение головы и туловища;
7. изменения на краниограммах;
8. изменения цереброспинальной жидкости;
9. менингеальные симптомы;
10. правильны ответы 2, 3.
019. Для опухолей мозга у детей характерны:
1. дислокационные очаговые неврологические симптомы (симптомы на расстоянии);
2. рассеянные очаговые неврологические симптомы;
3. диссеминированные очаговые неврологические симптомы;
4. все ответы правильны.
020. Для медуллобластомы характерно метастазирование:
1. в другие области нервной системы;
2. системное метастазирование;
3. метастазирование в лимфатические узлы, легкие, кости.
021. Медуллобластома является высокочувствительной опухолью к:
1. лучевой терапии;
2. химиотерапии;
3. правильны ответы 1 и 2;
4. правильного ответа нет.
022. Медуллобластома локализуется в следующих отделах головного
мозга:
1. задней черепной ямке;
2. турецком седле;
3. полушариях большого мозга.
023. Опухоль менее 3 см в диаметре, расположенная в крыше IV желудочка, черве или полушарии мозжечка, относится к:
1. Т1;
2. Т2;
3. ТЗа;
4. ТЗв;
5. Т4.
024. Опухоль более 3 см в диаметре. Поражает одну близлежащую
структуру или частично заполняет IV желудочек и относится к:
1. Т1;
2. Т2;
3. ТЗа;
4. ТЗв;
5. Т4.
025. Опухоль поражает 2 прилежащие структуры или заполняет IV желудочек с распространением в водопровод мозга или в отверстие
Мажанди и/или Люшка и относится к:
1. Т1;
2. Т2;
3. ТЗа;
4. ТЗв;
5. Т4.
026. Опухоль растет из дна IV желудочка, заполняет его и относится к:
1. Т1;
525
2. Т2;
3. ТЗа;
4. ТЗв;
5. Т4.
027. Опухоль распространяется далее через водопровод мозга, поражает
средний мозг и III желудочек и относится к:
1. Т1;
2. Т2;
3. ТЗа;
4. ТЗв;
5. Т4.
028. При отсутствии признаков метастазирования субарахноидальных
и гематогенных метастазов устанавливается:
1. МО;
2. Ml;
3. М2;
4. М3;
5. М4.
029. При обнаружении опухолевых клеток в цереброспинальной жидкости устанавливается:
1. МО;
2. Ml;
3. М2;
4. М3;
5. М4.
030. При выявлении узла в мозжечке или субарахноидальном пространстве или в III и боковых желудочках мозга устанавливается:
1. МО;
2. Ml;
3. М2;
4. М3;
5. М4.
031. При выявлении опухолевых узлов в спинальном субарахноидальном пространстве устанавливается:
1. МО;
2. Ml;
3. М2;
4. М3;
5. М4.
032. Выявление внемозговых метастазов позволяет установить:
1. МО;
2. Ml;
3. М2;
4. М3;
5. М4.
033. В большинстве случаев преобладают следующие варианты опухоли мозга:
1. Т1-Т2;
2. ТЗ-Т4.
034. Классификация радикальности удаления медуллобластомы предусматривает:
1. тотальное удаление;
2. почти тотальное удаление;
526
3. субтотальное удаление;
4. частичное удаление;
5. биопсию опухоли.
035. Под тотальным удалением опухоли головного мозга понимают:
1. удаление опухоли в пределах видимых здоровых тканей;
2. удалено более 90 % опухоли, но имеются остатки ее.
036. Под почти тотальным удалением опухоли головного мозга понимают:
1. опухоль удалена в пределах видимых здоровых тканей;
2. удалено более 90 % опухоли, но имеются ее остатки;
3. удалено 51—90 % опухоли.
037. Под субтотальным удалением опухоли головного мозга понимают:
1. удалено более 90 % опухоли, но имеются ее остатки;
2. удалено 51—90 % опухоли;
3. удалено 11—50 % опухоли.
038. Под частичным удалением опухоли головного мозга понимают:
1. удалено более 90 % опухоли, но имеются ее остатки;
2. удалено 51—90 % опухоли;
3. удалено 11—50 % опухоли.
039. Основными критериями прогноза при опухолях мозга у детей являются:
1. возраст больного;
2. радикальность удаленной опухоли;
3. стадия опухолевого процесса;
4. вид примененного лечения;
5. правильны ответы 1 и 2.
040. При лечении медуллобластомы на современном этапе наиболее
эффективным является:
1. хирургическое лечение;
2. хирургическое лечение + лучевая терапия;
3. хирургическое лечение + химиотерапия;
4. хирургическое лечение + химиотерапия + лучевая терапия.
041. В раннем послеоперационном периоде лечения опухолей головного мозга наблюдаются следующие осложнения:
1. мозжечковые нарушения;
2. мутизм;
3. бульбарные и псевдобульбарные параличи;
4. гидроцефалия;
5. все ответы правильны.
042. Для лечения медуллобластом наиболее часто используют следующие
химиопрепараты:
1. ифосфамид;
2. вепезид;
3. препараты платины;
4. натулан;
5. метотрексат;
6. препараты нитрозомочевины;
7. все ответы правильны.
043. Особенностями проведения химиотерапии при лечении медуллобластомы являются:
1. мероприятия, направленные на снижение внутричерепной гипертензии;
2. постепенная эскалация доз химиопрепаратов;
3. постоянное введение антиэметических средств.
527
044. Проведение лучевой терапии при медуллобластомах у детей до
3 лет ограничено:
1. недоразвитием мозга с дисфункцией нервной системы;
2. психическими расстройствами;
3. эндокринопатиями;
4. эпилептическим синдромом;
5. все ответы правильны.
045. При проведении комплексного лечения медуллобластом удается
достигнуть:
1. 90 % от полного эффекта;
2. 80 % от полного эффекта;
3. 60—50 % от полного эффекта.
046. Длительная безрецидивная выживаемость детей с медуллобластомами, леченных по современным лечебным программам, составляет:
1. 70 %;
2. 60 %;
3. 40-50 %.
047. Преимущественным методом лечения астроцитомы является:
1. хирургический метод;
2. операция + химиотерапия;
3. операция + лучевая терапия;
4. операция + химиотерапия = лучевая терапия;
5. химиотерапия в сочетании или без лучевого лечения.
048. Выживаемость при хирургическом лечении астроцитом составляет:
1. 90 %;
2. 70-80 %;
3. 50 %.
049. Для краниофарингиомы характерны следующие признаки:
1. отставание роста;
2. прогрессирующая слепота;
3. внутричерепная гипертензия;
4. все ответы правильны.
050. При каких стадиях опухолевого процесса околоушной слюнной
железы отмечается поражение лицевого нерва?
1. I стадия.
2. II стадия.
3. III стадия.
4. IV стадия.
5. Правильны все ответы, кроме 1.
051. Ведущий симптом при раке носоглотки:
1. наличие опухоли;
2. расстройство носового дыхания;
3. боль.
052. Какой метод лечения никогда не применяется при раке носоглотки?
1. Хирургический.
2. Химиотерапия.
3. Лучевая терапия.
053. Рак щитовидной железы чаще встречается у:
1. девочек;
2. мальчиков;
3. нет четкого различия.
054. Рак щитовидной железы чаще встречается у детей в возрасте:
1. до 1 года;
528
2. 2-5 лет;
3. 7—10 лет;
4. 12—15 лет.
055. На возникновения рака щитовидной железы оказывают влияние
следующие факторы:
1. повышенная активность тиреотропного гормона гипофиза;
2. пониженная функция щитовидной железы;
3. узловые формы зоба;
4. предшествующее облучение;
5. все перечисленное.
056. Какие из перечисленных заболеваний предшествуют развитию рака
щитовидной железы?
1. Узловой зоб.
2. Диффузная гиперплазия тиреоидной паренхимы.
3. Узловатая гиперплазия.
4. Доброкачественные опухоли (аденома).
5. Все перечисленное.
057. Факторами, способствующими развитию рака щитовидной железы
в очагах эндемического зоба, считают:
1. длительное существование узлового и диффузно-узлового зоба;
2. предшествующие заболеванию нарушения функции эндокринной системы (дисгормональные заболевания);
3. дефицит некоторых микроэлементов в окружающей среде;
4. все перечисленное;
5. правильного ответа нет.
058. Дефицит каких из перечисленных микроэлементов способствует
развитию рака щитовидной железы?
1. Йода.
2. Меди.
3. Кобальта.
4. Всех перечисленных микроэлементов.
5. Правильного ответа нет.
059. Период между облучением и возникновением рака щитовидной
железы составляет в среднем:
1. 1—3 года;
2. 5—10 лет;
3. 12—15 лет;
4. 20—30 лет.
060. Можно ли считать, что частота случаев радиогенного рака щитовидной железы тем выше, чем моложе ребенок?
1. Можно.
2. Нельзя.
3. Не имеет значения.
061. Какие преимущественно гистологические формы рака щитовидной железы индуцированы малыми дозами ионизирующего облучения?
1. Папиллярный рак.
2. Фолликулярный рак.
3. Недифференцированные формы.
4. Все перечисленные.
062. Наиболее часто встречаются следующие формы рака щитовидной
железы у детей:
1. папиллярный рак;
529
2. фолликулярный рак;
3. смешанная форма.
063. Какие гистологические формы рака щитовидной железы преобладают у детей и юношей?
1. Папиллярный рак.
2. Фолликулярный рак.
3. Медуллярный рак.
4. Анапластический рак.
064. Какие из перечисленных форм рака щитовидной железы являются
благоприятными с точки зрения прогноза при адекватно проведенном лечении?
1. Фолликулярный рак.
2. Папиллярный рак.
3. Медуллярный рак.
4. Анапластический рак.
5. Правильны ответы 1 и 2.
065. Какому виду рака щитовидной железы свойственны следующие
характеристики: медленно растущая опухоль, чаще не имеет капсулы или частично инкапсулирована, метастазирует главным образом в регионарные лимфатические узлы?
1. Фолликулярному раку.
2. Папиллярному раку.
3. Медуллярному раку.
4. Анаплазированному раку.
066. Какому виду рака щитовидной железы свойственны следующие
характеристики: медленно растущая опухоль, чаще заключенная в
капсулу, имеющая тенденцию к инфильтрации капсулы, сосудов,
окружающих железу тканей, метастазирует преимущественно ге-
матогенно в легкие, кости?
1. Папиллярному раку.
2. Фолликулярному раку.
3. Медуллярному раку.
4. Анапластическому раку.
067. В детском и юношеском возрасте преобладает рак щитовидной
железы:
1. с низкой степенью злокачественности;
2. с высокой степенью злокачественности;
3. все ответы правильны.
068. Течение и прогноз рака щитовидной железы зависят от:
1. возраста ребенка;
2. гистологического вида опухоли;
3. пола пациента;
4. всего перечисленного.
069. Наиболее характерный симптом рака щитовидной железы:
1. боль;
2. затрудненное дыхание;
3. наличие пальпируемой опухоли;
4. общий опухолевый симптомокомплекс.
070. Наиболее частыми симптомами рака щитовидной железы у детей
являются:
1. затрудненное дыхание;
2. охриплость голоса;
3. асимметрия шеи;
530
4. болевые ощущения;
5. повышение температуры тела.
071. При раке щитовидной железы у детей определяются эндокринные
нарушения в виде:
1. снижения андрогенной функции коры надпочечников;
2. нарушения метаболизма кортикостероидов (глюкокортикоидов);
3. все ответы правильны;
4. нет правильного ответа.
072. Наиболее информативный метод диагностики рака щитовидной
железы у детей:
1. УЗТ;
2. КТ;
3. аспирационная биопсия опухоли;
4. радиоизотопное исследование.
073. Решающим методом диагностики рака щитовидной железы является:
1. физикальное обследование;
2. радионуклидные исследования;
3. УЗИ;
4. рентгенологическое исследование (пневмотиреография),
5. тонкоигольная пункционная аспирационная биопсия.
074. Под термином "скрытый рак" подразумевают опухолевый узел в
щитовидной железе размерами:
1. до 0,5 см;
2. до 1 см;
3. до 1,5 см;
4. до 2 см.
075. Какой из перечисленных методов диагностики наиболее информативен при скрининге так называемых бессимптомных (скрытых)
форм рака щитовидной железы у детей?
1. Физикальное обследование.
2. Радионуклидные исследования.
3. УЗИ.
4. Компьютерная томография.
076. Ультрасонографическими признаками рака щитовидной железы
чаще всего являются:
1. наличие гипоэхогенных участков;
2. отсутствие четких границ между участками с измененной эхо-
структурой и окружающей их паренхимой;
3. расположение измененных участков, как правило, в боковых
долях железы;
4. все перечисленное.
077. Повышение уровня кальцитонина является важным специфическим тестом при диагностике рака щитовидной железы:
1. папиллярного;
2. фолликулярного;
3. медуллярного;
4. анапластического;
5. все перечисленное.
078. Для медуллярного рака щитовидной железы характерно повышение уровня:
1. тироксина;
531
2. трийодтиронина;
3. кальцитонина;
4. все перечисленное;
5. правильного ответа нет.
079. Радиофармпрепаратами, которые, как правило, накапливает рак
щитовидной железы, являются:
1. радиоактивный йод (1321);
2. технеций ([99тТс1-пертехнетат);
3. селенметионин ([^Se]-метионин);
4. радиоактивный фосфор (32Р);
5. правильны ответы 3 и 4.
080. При сканировании щитовидной железы с радиоактивным йодом
в зоне раковой опухоли наблюдается преимущественно участок в
виде:
1. дефекта накопления;
2. повышенного накопления РФП;
3. отсутствия различия между патологической и нормальной тканью.
081. Метод радионуклидного исследования позволяет:
1. уточнить локализацию поражения;
2. установить наличие и распространенность метастазов;
3. выработать наиболее эффективный план терапии;
4. все перечисленное.
082. Наиболее частая локализация метастазов рака щитовидной железы:
1. легкие;
2. регионарные лимфатические узлы;
3. кости;
4. печень.
083. Причинами поздней диагностики рака щитовидной железы являются:
1. бессимптомное течение пролиферирующих форм рака;
2. недостаточная осведомленность педиатров о данном заболевании;
3. отсутствие у педиатров онкологической настороженности;
4. развитие рака на фоне доброкачественного зоба;
5. все перечисленное.
084. Ведущим методом лечения рака щитовидной железы является:
1. хирургический;
2. лекарственный;
3. лучевой.
085. Наиболее часто используемый метод лечения злокачественных
опухолей щитовидной железы:
1. хирургический;
2. лучевая терапия + хирургический;
3. лучевая терапия + хирургический + химиотерапия.
086. Минимальной операцией при наличии высокодифференцированного рака щитовидной железы является:
1. вылущивание узла опухоли;
2. резекция опухолевого узла в пределах здоровой ткани железы;
3. удаление доли железы;
4. гемитиреоидэктомия с перешейком.
087. Объем оперативного вмешательства при медуллярном раке щитовидной железы:
1. экономное удаление опухоли;
532
2. резекция доли железы;
3. гемитиреоидэктомия с перешейком;
4. субтотальная тиреоидэктомия;
5. тиреоидэктомия.
088. Объем хирургического вмешательства при раке щитовидной железы у детей с метастазами в лимфатические узлы шеи:
1. удаление первичной опухоли + удаление метастатических лимфатических узлов на шее;
2. удаление первичной опухоли + фасциально-футлярное иссечение клетчатки шеи с лимфатическими узлами;
3. удаление первичной опухоли + операция Крайля.
089. При отдаленных гематогенных метастазах объем хирургического
вмешательства:
1. гемитиреоидэктомия;
2. гемитиреоидэктомия с перешейком;
3. субтотальная тиреоидэктомия;
4. тиреоидэктомия.
090. Под субтотальной тиреоидэктомией понимают:
1. полное удаление одной доли щитовидной железы с перешейком;
2. полное удаление одной доли железы с перешейком и резекцию
патологических участков в другой доле;
3. полное удаление одной доли железы с перешейком с оставлением 2—3 г ткани железы в области задненаружной поверхности другой доли.
091. Объем оперативного вмешательства у ребенка со II стадией рака
щитовидной железы:
1. гемитиреоидэктомия;
2. гемитериоидэктомия с резекцией перешейка с футлярно-фасциальным иссечением лимфатических узлов и клетчатки шеи
на стороне поражения;
3. субтотальная резекция щитовидной железы.
092. При каких стадиях рака щитовидной железы показано лучевое лечение в различных модификациях?
1. I—II стадия.
2. III стадия.
3. IV стадия.
4. Правильны ответы 2 и 3.
5. Все ответы правильны.
093. Какой метод диагностики предпочтителен для суждения о степени
радикальности хирургического вмешательства после тиреоидэкто-
мии?
1. УЗИ.
2. Компьютерная томография.
3. Радионуклидные исследования.
094. При каком минимальном процентном содержании резидуальной
ткани щитовидной железы следует рассмотреть вопрос о повторном хирургическом вмешательстве, если больному запланировано
лечение радиоактивным йодом?
1. 10 %.
2. 15 %.
3. 20 %.
4. 25 %.
533
Раздел 8
ОПУХОЛИ ГЛАЗА И ОРБИТЫ
001. В структуре опухолей у детей удельный вес ретинобластомы составляет:
1. 1 %;
2. 3 %;
3. 5 %;
4. 7 %.
002. Основное число случаев заболеваемости ретинобластомой приходится на возрастную группу:
1. дети до 3 лет;
2. с 2 до 7 лет;
3. с 10 до 15 лет.
003. Ретинобластома является опухолью:
1. наследственной;
2. приобретенной;
3. врожденной;
4. правильны ответы 1 и 3.
004. Частота наследственных форм ретинобластомы составляет:
1. 60-70 %;
2. 5-10 %;
3. 40-50 %.
005. В пользу того, что ретинобластома — генетически обусловленная
опухоль, свидетельствуют:
1. семейные случаи ретинобластомы, которые носят двусторонний характер, и наследование наблюдается у 50 % потомства
независимо от пола;
2. спорадические случаи билатеральной ретинобластомы характеризуются наследованием в 50 % случаев;
3. при односторонней спорадической ретинобластоме наследование составляет от 8 до 25 % случаев;
4. отмечаются случаи ретинобластомы у родственников больного,
хотя родители здоровы;
5. все перечисленное.
006. Наиболее принятой теорией, объясняющей происхождение ретинобластомы у детей, является:
1. теория Конгейма;
2. теория Фишера — Вазельса;
3. теория Пелл ера;
4. теория Кнудсона.
007. Двустороннее поражение глаз при ретинобластоме наблюдается:
1. в 5—10 % случаев;
2. в 20—40 % случаев;
3. в 50 % случаев.
008. Морфологически ретинобластома является опухолью, происходящей из:
1. примитивных мезенхимальных клеток;
2. эмбриональных нейробластов симпатической нервной системы;
534
3. ретинопредшествующих клеток;
4. другой вариант.
009. Ретинобластома происходит из:
1. волокон зрительного нерва;
2. стекловидного тела;
3. нервных элементов оптически деятельной части сетчатки;
4. мягких тканей орбиты.
010. В клинических проявлениях ретинобластомы различают следующие виды макроскопического роста опухоли:
1. эндофитный;
2. экзофитный;
3. инфильтративный;
4. все ответы правильны.
011. По строению различают ретинобластому:
1. с большим количеством розеток;
2. смешанный вариант;
3. псевдорозеточную форму;
4. все ответы правильны.
012. Наиболее благоприятным по течению являются следующие варианты опухолей:
1. смешанный;
2. с большим количеством розеток;
3. псевдорозеточный.
013. В клиническом течении ретинобластомы возможны следующие
проявления:
1. повышение внутриглазного давления;
2. гнойное отделяемое в конъюнктивальном мешке;
3. расширение зрачка;
4. все ответы правильны;
5. правильны ответ 1 и 3.
014. При распространении ретинобластомы в ЦНС отмечаются:
1. косоглазие;
2. тошнота, рвота;
3. изменение в цереброспинальной жидкости;
4. правильны ответы 2 и 3;
5. все ответы правильны.
015. Для какой стадии ретинобластомы характерен "симптом кошачьего глаза"?
1. I.
2. II.
3. III.
4. IV.
016. Для II стадии ретинобластомы характерны:
1. воспалительные изменения;
2. псевдовоспалительные изменения;
3. широкий зрачок, прилегание опухоли к хрусталику;
4. глаукома;
5. все перечисленное.
017. При всех стадиях ретинобластомы может наблюдаться:
1. экзофтальм;
2. глаукома;
3. отслойка сетчатки;
4. страбизм;
535
5. свечение зрачка.
018. Наиболее часто ретинобластома метастазирует в:
1. регионарные лимфатические узлы;
2. кости;
3. костный мозг;
4. все перечисленное.
019. Ретинобластома чаще всего метастазирует гематогенным путем в:
1. кости черепа;
2. легкие;
3. печень;
4. все ответы правильны;
5. правильны ответы 1 и 3.
020. Дифференциальная диагностика ретинобластомы проводится со
следующими заболеваниями:
1. ретинит Коатса;
2. ангиоматоз сетчатки;
3. фиброплазия;
4. все ответы правильны.
021. К основным методам диагностики ретинобластомы относятся:
1. офтальмоскопия;
2. компьютерная томография;
3. спинномозговая пункция;
4. все ответы правильны;
5. правильны ответы 1 и 2.
022. Для постановки диагноза ретинобластомы и установления стадии
болезни необходимы следующие методы исследования:
1. офтальмоскопический, рентгенологический;
2. УЗИ и компьютерная томография;
3. морфологический;
4. радионуклидный;
5. все перечисленные.
023. Термография с углеводной нагрузкой позволяет судить:
1. о наличии метастазов в других органах;
2. об активности процесса;
3. все ответы правильны.
024. Изотопные методы диагностики позволяют:
1. диагностировать ретинобластому;
2. судить об активности процесса;
3. выявить метастазы;
4. правильны ответы 1 и 3;
5. все ответы правильны.
025. Категория опухоли ТЗ устанавливается в случаях:
1. опухоль занимает более 50 % сетчатки, и/или когда имеются
злокачественные клетки в стекловидном теле;
2. вовлечен диск зрительного нерва;
3. опухоль занимает более 50 % сетчатки и/или выходит за пределы сетчатки, но располагается внутри глаза.
026. Категория опухоли Т4а устанавливается, когда обнаруживается:
1. вовлечение диска зрительного нерва;
2. прорастание в ретробульбарный зрительный нерв;
536
3. опухоль занимает более 50 % сетчатки и/или выходит за пределы сетчатки, но располагается внутри глаза.
027. В классификации pTNM категория рТ4а характеризуется:
1. прорастанием опухоли в переднюю камеру с распространением
на сосудистую оболочку или интрасклеральной инвазией;
2. расположением опухоли за решетчатой пластинкой, но она не
доходит до уровня резекции зрительного нерва;
3. другим экстраокулярным распространением.
028. К преимуществам лечения ретинобластомы относится:
1. комплексный метод лечения;
2. проведение ПХТ;
3. проведение хирургического лечения.
029. При I, II стадиях ретинобластомы лечение начинают с:
1. хирургического;
2. ПХТ;
3. лучевой терапии;
4. правильны ответы 2 и 3;
5. все ответы правильны.
030. При каких стадиях ретинобластомы возможно выполнение органосохраняющего лечения?
1. I.
2. II.
3. III.
4. IV.
5. Правильны ответы 1 и 2.
031. При III стадии ретинобластомы больному проводится лечение:
1. хирургическое;
2. комбинированное;
3. комплексное.
032. При проведении полихимиотерапии при IV стадии ретинобластомы
применяют:
1. усиленную схему химиотерапии;
2. другие схемы химиотерапии;
3. ту же схему, что и при I—II стадии заболевания.
033. При проведении химиотерапии при IV стадии ретинобластомы
применяют следующие препараты:
1. вепезид;
2. натулан;
3. дактиномицин;
4. другие средства.
034. Для усиления результатов полихимиотерапии при IV стадии ретинобластомы применяют:
1. метотрексат;
2. адриамицин;
3. дактиномицин.
035. При степени вовлечения сетчатки Т1—Т2 проводят лучевую терапию в суммарной очаговой зоне:
1. 30 Гр;
2. 50 Гр;
3. 60 Гр.
036. При степени вовлечения сетчатки Т4 послеоперационную лучевую терапию проводят в суммарной очаговой дозе:
1. 50 Гр;
537
2. 40 Гр;
3. 30 Гр.
037. Послеоперационная лучевая терапия при Т4:
1. проводится;
2. не проводится.
038. При Т4 предоперационная лучевая терапия проводится в суммарной очаговой дозе:
1. 50 Гр;
2. 40 Гр;
3. 30 Гр.
039. Показанием к консервативному лечению двусторонних ретино-
бластом является наличие в каждом глазу опухолей:
1. ТЗс;
2. Т1;
3. Т2;
4. другие варианты;
5. правильны ответы 2 и 3.
040. У больного диагностирована двусторонняя ретинобластома. Правый глаз — III стадия, левый глаз — II стадия.Какая тактика терапии показана в данном случае?
1. Двусторонняя энуклеация.
2. Консервативное лечение обоих глаз.
3. Энуклеация правого глаза, консервативное лечение левого глаза.
041. К осложнениям лечения ретинобластом относятся:
1. лучевая катаракта;
2. конъюнктивит;
3. лучевое поражение слезных желез;
4. правильны ответы 1 и 3;
5. все ответы правильны.
042. При органосохранном лечении терапия продолжается в течение:
1. 6 мес;
2. 2 лет;
3. 1 года.
043. Частота наблюдений в течение 1-го года после окончания лечения:
1. 1 раз в 3 мес;
2. 1 раз в 6 мес;
3. 1 раз в год.
044. Пятилетняя выживаемость с односторонним процессом после
консервативного и оперативного лечения составляет соответственно:
1. 30 и 40 %;
2. 20 и 30 %;
3. 80 и 90 %.
045. Пятилетняя выживаемость с двусторонним процессом после консервативного и оперативного лечения соответственно:
1. 40 и 50 %;
2. 80 и 90 %;
3. 83 и 84 %.
538
Раздел 9
ОПУХОЛИ ОРГАНОВ ГРУДНОЙ КЛЕТКИ
001. Энтерогенные кисты средостения сходны по строению со стенкой:
1. стенкой пищевода;
2. стенкой желудка;
3. стенкой тонкой кишки;
4. все ответы правильны.
002. Для энтерогенных кист (энтерокистом) средостения характерна
локализация в:
1. переднем средостении;
2. центральном средостении;
3. заднем средостении;
4. кардиодиафрагмальном углу.
003. Целомические кисты перикарда могут:
1. сообщаться с полостью перикарда;
2. быть связанными с перикардом плоскостными сращениями;
3. не иметь связи с перикардом;
4. правильны ответы 1 и 2;
5. все ответы правильны.
004. Стенка бронхогенной кисты может быть представлена:
1. многорядным цилиндрическим эпителием;
2. соединительной тканью, содержащей слизистые железы;
3. гиалиновым хрящом;
4. гладкими мышцами;
5. все ответы правильны.
005. Бронхогенные кисты локализуются преимущественно:
1. в реберно-позвоночном углу;
2. в реберно-диафрагмальном углу;
3. в кардиодиафрагмальном углу;
4. в нижних отделах заднего средостения;
5. в верхних отделах средостения.
006. Осложненное течение кист средостения определяет:
1. нагноение кисты;
2. прорыв кисты в трахею;
3. пенетрация язв слизистой оболочки кисты в пищевод, аорту;
4. нарушение кожных покровов грудной клетки и формирование
свища;
5. все ответы правильны.
007. Свойством изменять свою конфигурацию в фазе максимального
вдоха и максимального выдоха, выявляемым при рентгеноскопии,
обладают следующие новообразования средостения:
1. тератомы;
2. тимомы;
3. большие однокамерные перикардиальные кисты;
4. липомы;
5. менингоцеле.
008. Активная хирургическая тактика у больных с доброкачественными
опухолями средостения оправдана в связи с:
1. возможностью малигнизации;
2. развитием компрессионного синдрома;
3. возможностью развития опасных для жизни осложнений;
4. правильны ответы 2 и 3.
539
009. При лечении доброкачественных опухолей средостения применяют:
1. хирургический метод;
2. лучевую терапию;
3. химиотерапию.
010. Для лимфосаркомы средостения характерны:
1. медленный рост;
2. бурный рост;
3. частое развитие медиастинального компрессионного синдрома;
4. редкое возникновение этого синдрома;
5. правильны ответы 2 и 3.
011. Для поражения средостения при злокачественных лимфомах у детей
характерны следующие рентгенологические признаки:
A) поражение всех групп внугригрудных лимфатических узлов;
Б) наличие обызвествлений;
B) увеличение только бронхопульмональных лимфатических узлов;
Г) затемнение ретростернального пространства;
Д) увеличение только медиастинальных лимфатических узлов;
1. правильно все перечисленное;
2. правильно А, Г и Д;
3. правильно А, Б и Д;
4. правильно Б, В и Г.
012. Наиболее часто изолированное поражение лимфатических узлов
средостение наблюдается при:
1. лимфогранулематозе;
2. лимфосаркоме;
3. ретикулосаркоме;
4. плазмоцитоме.
013. Внутригрудной рак щитовидной железы локализуется:
1. только загрудинно;
2. в любом отделе средостения;
3. все ответы правильны.
014. Внегонадная семинома средостения встречается:
1. исключительно у женщин;
2. исключительно у мужчин;
3. у тех и других.
015. Компрессионный медиастинальный синдром характеризуется следующими клиническими признаками:
1. синдромом сдавления верхней полой вены;
2. синдромом сдавления нервных стволов;
3. синдромом сдавления сердца и крупных артериальных стволов;
4. синдромом сдавления трахеи и крупных бронхов.
016. Для опухолей вил очковой железы характерны:
1. локализация в заднем средостении;
2. локализация в переднем средостении;
3. изменения в скелете грудной клетки;
4. наличие обызвествлений;
5. все перечисленное.
017. Дифференциальный диагноз тимомы наиболее часто следует проводить с:
1. лимфогранулематозом;
2. невриномой;
3. энтерогенной кистой;
4. тератомой;
5. правильны ответы 1 и 4.
540
018. Дифференциальный диагноз опухолей средостения необходимо
проводить с:
1. новообразованиями легких и плевры;
2. аневризмой аорты и сердца;
3. релаксацией диафрагмы и новообразованиями грудной стенки;
4. все ответы правильны.
019. Для уточнения диагноза при опухолевом поражении средостения
применяются:
1. рентгенография грудной клетки;
2. компьютерная томография;
3. рентгеновская томография;
4. ультразвуковая томография;
5. все ответы правильны.
020. Преимущественная локализация нейрогенных опухолей в средостении:
1. заднее средостение;
2. переднее средостение;
3. корень легкого;
4. реберно-диафрагмальный синус;
5. вилочковая железа.
021. Рентгенологические признаки нейрогенной опухоли заднего средостения:
1. локализация в реберно-позвоночном углу;
2. расширение межреберных пространств на стороне опухоли;
3. истончение и узурация ребер в области опухоли;
4. все ответы правильны.
022. Выбрать наиболее информативный метод диагностики нейрогенной опухоли заднего средостения из предложенных:
1. полипозиционная рентгенография;
2. бронхоскопия;
3. пневмомедиастинография;
4. ангиография.
023. Для нейрогенных опухолей заднего средостения у детей наиболее
характерны:
A) локализация в реберно-позвоночном углу;
Б) наличие обызвествлений;
B) деструкция в прилегающих отделах скелета грудной клетки;
Г) деформация ребер;
Д) увеличение внутригрудных лимфатических узлов;
1. все ответы правильны;
2. правильно А, Б и Г;
3. правильно В, Г и Д;
4. правильно А, В и Д.
024. Какой опухоли средостения свойственны атрофия ребер и расширение межреберных промежутков, выявленные рентгенографией?
1. Лимфогранулематозу.
2. Лимфосаркоме.
3. Нейробластоме.
4. Тимоме.
025. К нейрогенным опухолям средостения, исходящим из оболочек
нервов, относятся:
1. ганглионеврома;
2. феохромоцитома;
541
3. невринома;
4. нейрофиброма;
5. правильны ответы 3 и 4.
026. Нейрогенные опухоли в абсолютном большинстве локализуются в:
1. реберно-позвоночном углу;
2. центральном средостении;
3. верхних отделах переднего средостения;
4. переднем средостении на уровне основания сердца.
027. Нейрогенные опухоли в процессе своего развития могут:
1. малигнизировать;
2. созревать, т. е.превращаться из злокачественной в доброкачественную;
3. распространяться из средостения на шею;
4. проникать в спинномозговой канал;
5. все ответы правильны.
028. Выявление петрификатов в опухоли средостения при рентгенологическом исследовании является патогномоничным для:
1. злокачественной лимфомы;
2. тимомы;
3. нейрогенной опухоли;
4. зрелой тератомы.
029. Рентгенологическим признаком распространения нейрогенной
опухоли средостения в спинномозговой канал является:
1. интимное прилежание тела опухоли к телам позвонков;
2. истончение ребер;
3. узурация ребер;
4. расширение межреберных промежутков;
5. увеличение диаметра межпозвоночного отверстия.
030. Для нейрогенных опухолей заднего средостения у детей наиболее
характерны:
1. локализация в реберно-позвоночном углу;
2. утолщение ребер;
3. деструкция ребер, деформация позвонков;
4. плеврит.
031. Дифференциальный диагноз нейрогенной опухоли средостения
проводят с:
1. бронхогенной кистой;
2. тимомой;
3. лимфосаркомой средостения;
4. лимфогранулематозом с поражением внутригрудных лимфатических узлов;
5. со всеми перечисленными заболеваниями.
032. Зрелые тератомы средостения располагаются:
1. преимущественно в переднем средостении;
2. в заднем средостении;
3. одинаково в переднем и заднем.
033. Общим для строения зрелых тератом средостения является обязательное наличие в них элементов:
1. нервной ткани;
2. кожи;
3. эндодермы;
4. мезодермы;
5. все ответы правильные.
542
034. Тератобластомы (незрелые тератомы) средостения могут метнет
зировать в:
1. лимфатические узлы средостения;
2. плевру и легкие;
3. печень;
4. кости;
5. все ответы правильны.
035. Выявление костных включений в виде зубов или фаланг пальцси
в опухоли средостения при рентгенологическом исследовании является патогномоничным симптомом для:
1. тимомы;
2. зрелой тератомы;
3. злокачественной лимфомы;
4. энтерокистомы.
036. Реакция на АФП может быть положительной при:
1. тимоме;
2. хемодектоме;
3. зрелой тератоме;
4. тератобластоме.
037. Для тератогенных опухолей средостения характерны следующие
рентгенологические признаки:
1. локализация в реберно-позвоночном углу;
2. наличие обызвествлений в опухоли;
3. расположение в нижних и средних отделах переднего средостения;
4. все ответы правильны;
5. правильны ответы 2 и 3.
038. Для уточнения опухолевого процесса в средостении у детей могут
применяться:
1. рентгенография в прямой и боковой проекциях;
2. компьютерная томография;
3. рентгеновская томография;
4. ультразвуковая томография;
5. все ответы правильны.
039. Трансторакальная пункционная биопсия противопоказана при:
1. подозрении на аневризму аорты;
2. подозрении на кисту переднего средостения;
3. тимоме;
4. лимфогранулематозе;
5. правильны ответы 1 и 2.
040. К специальным инструментальным методам рентгенологического
исследования, применяемым при новообразованиях средостения,
относятся:
1. рентгеноскопия и рентгенография;
2. рентгеновская томография;
3. пневмомедиастинография;
4. рентгенологическое исследование на фоне пневмоторакса;
5. правильны ответы 3 и 4.
041. Диагностический пневмомедиастинум может применяться при локализации опухоли:
1. в передних отделах верхнего средостения;
2. в задних отделах верхнего средостения;
3. в средних отделах средостения;
4. в нижних отделах средостения.
543
3. дисгерминомы яичника;
4. рака щитовидной железы.
059. Выбор метода лечения метастазов в легкие в наименьшей степени
зависит от:
1. локализации первичной опухоли;
2. количества метастазов;
3. локализации метастазов;
4. характера предшествующего лечения первичной опухоли;
5. правильны ответы 2 и 3.
060. Хирургический метод лечения метастазов в легкие имеет преимущества перед другими при:
1. нефробластоме;
2. нейробластоме;
3. саркоме Юинга;
4. остеогенной саркоме.
061. При хирургическом методе лечения метастазов в легкие могут
быть выполнены:
1. клиновидная резекция;
2. сегментэктомия;
3. лобэктомия;
4. пульмонэктомия;
5. все ответы правильны.
062. При единичных солитарных метастазах могут применяться:
1. хирургический метод;
2. химиотерапия;
3. лучевая терапия;
4. все ответы правильны.
063. При выборе метода лечения при метастазах саркомы Юинга следует отдать предпочтение:
1. хирургическому методу;
2. химиотерапии;
3. лучевой терапии;
4. правильны ответы 2 и 3;
5. все ответы правильны.
064. При лечении метастазов остеогенной саркомы следует отдать
предпочтение следующим методам:
1. хирургическому;
2. химиотерапии;
3. хирургическому методу + химиотерапии;
4. лучевой терапии.
065. Кроме хирургических методов, при лечении доброкачественных
опухолей легких могут применяться:
1. лучевая терапия;
2. химиотерапия;
3. комбинированная терапия;
4. правильного ответа нет.
066. К методам морфологической верификации диагноза при опухолях
плевры относятся:
1. цитологическое исследование плевральной жидкости;
2. аспирационная или пункционная биопсия;
3. торакоскопия с биопсией;
4. открытая биопсия;
5. все ответы правильны.
546
067. Цитологическое исследование плевральной жидкости при опухолевом поражении плевры позволяет установить диагноз у:
1. 10 % больных;
2. 20—25 % больных;
3. 50 % больных.
068. Чрескожная биопсия плевры при наличии плеврита:
1. более информативна, чем цитологическое исследование жидкости;
2. менее информативна, чем цитологическое исследование жидкости;
3. существенной разницы нет.
069. Чрескожная биопсия плевры применяется:
1. у всех больных с плевральным выпотом;
2. при наличии опухолевого компонента;
3. во всех случаях.
070. Больным с доброкачественной мезотелиомой плевры рекомендуется:
1. хирургическое лечение;
2. лучевое лечение;
3. химиотерапия.
071. Наиболее часто при лечении злокачественной мезотелиомы плевры
применяется:
1. хирургический метод;
2. химиотерапия;
3. лучевая терапия;
4. иммунотерапия;
5. правильны ответы 2 и 3.
072. Метастазы в легкие чаще наблюдаются при:
1. нефробластоме;
2. нейробластоме;
3. тератобластоме.
073. Для лимфосарком средостения характерны:
1. медленный рост;
2. бурный рост опухоли;
3. поражение лимфоретикулярной системы;
4. частое развитие компрессионного синдрома;
5. редкое развитие этого синдрома;
6. правильны ответы 2, 3, 4.
074. Тератобластомы средостения могут метастазировать в:
Т. лимфатические узлы средостения;
2. плевру и легкие;
3. печень;
4. кости;
5. во все перечисленные органы.
075. Ангиографические методы в диагностике новообразований средостения имеют важное значение для:
1. оценки резектабельности;
2. оценки объема предполагаемой операции;
3. определения возможных технических осложнений во время
операции;
4. все ответы правильные.
547
076. Прескаленная биопсия лимфатических узлов при новообразованиях средостения должна проводиться при:
1. подозрении на изолированное поражение лимфатических узлов;
2. подозрении на злокачественную опухоль средостения;
3. наличии пальпируемых увеличенных лимфатических узлов;
4. отрицательных результатах аспирационной и пункционной
биопсии.
077. Диагностическая парастернальная медиастинотомия наименее
эффективна при локализациях:
1. в верхних отделах средостения;
2. в нижних отделах средостения;
3. паратрахеально;
4. в зоне бифуркации трахеи;
5. в заднем средостении.
078. У больных с новообразованиями средостения с диагностической
целью не может применяться:
1. трахеобронхоскопия;
2. эзофагоскопия;
3. медиастиноскопия;
4. торакоскопия;
5. правильного ответа нет.
079. Морфологическая верификация диагноза до начала лечения необходима у большинства больных с опухолью средостения, если
метод лечения следующий:
1. хирургический;
2. лучевой;
3. химиотерапия;
4. правильны ответы 2 и 3.
080. Оптимальная последовательность применения методов диагностики у больных с опухолью средостения:
1. аспирационная биопсия — трепанобиопсия — торакотомия;
2. трепанобиопсия — медиастинотомия — торакотомия;
3. медиастинотомия — торакотомия;
4. торакотомия.
081. Наилучшие отдаленные результаты лечения злокачественных ти-
мом получены при:
1. хирургическом лечении;
2. лучевом лечении;
3. химиотерапии;
4. комбинированном лечении (операция + лучевая терапия).
082. Химиотерапия чаще всего может быть самостоятельным методом
лечения при:
1. эпителиальной тимоме;
2. гранулематозной тимоме;
3. лейомиоме;
4. нейробластоме.
083. Наиболее информативным методом выявления метастазов в паренхиме легкого является:
1. рентгеноскопия;
2. рентгенография + томография;
3. рентгеновская компьютерная томография;
4. сканирование легких;
5. УЗТ.
548
084. Метод тотального облучения легких при лечении множественных
метастазов:
1. способствует улучшению результатов лечения;
2. не оказывает влияния на результаты лечения;
3. ухудшает результаты лечения.
085. Дифференциальный диагноз злокачественной мезотелиомы плевры необходимо проводить с:
1. доброкачественными опухолями плевры;
2. метастатическим поражением плевры;
3. опухолями легких грудной стенки, диафрагмы, средостения;
4. плевритом;
5. все ответы правильны.
086. К доброкачественным опухолям молочной железы относятся:
1. узловая фиброзно-кистозная мастопатия;
2. диффузная мастопатия;
3. фиброаденома.
087. Склерозирующий аденоз относится к:
1. доброкачественным дисплазиям;
2. воспалительным процессам;
3. злокачественным новообразованиям.
088. Основным методом лечения доброкачественных опухолей является:
1. хирургический;
2. лучевой;
3. гормональный;
4. лекарственный.
089. На фоне листовидной фиброаденомы могут развиться:
1. рак молочной железы;
2. фибросаркома;
3. внутрипротоковые папилломы.
090. В молочной железе "болезнь Педжета" относится к:
1. доброкачественным дисплазиям;
2. раку кожи;
3. внутрипротоковому раку.
091. В молочной железе может развиться:
1. фибросаркома;
2. ангиосаркома;
3. гематосаркома;
4. все ответы правильны.
092. Рак молочной железы развивается из:
1. лимфатических узлов;
2. кровеносных сосудов;
3. гладкой или поперечнополосатой мускулатуры;
4. железистого эпителия протоков;
5. незрелой соединительной ткани.
093. В качестве факультативного предрака молочной железы наиболее
опасны:
1. болезнь Минца;
2. узловая форма мастопатии;
3. цистаденома;
4. все перечисленное.
094. К диффузной форме рака молочной железы относится:
1. маститоподобный рак молочной железы;
2. Рак Педжета молочной железы;
549
3. рак добавочной доли молочной железы;
4. рак (in situ).
095. Для маститоподобного рака клинически характерно:
1. наличие опухолевидного узла с четкими границами;
2. наличие симптома "площадки";
3. наличие симптома "лимонной корки" и гиперемии кожи;
4. отсутствие увеличенных лимфатических узлов.
096. Рак молочной железы может иметь следующие клинические формы:
1. узловую;
2. диффузную;
3. экземоподобные изменения ареолы и соска;
4. все ответы правильны.
097. Симптом "лимонной корки" и отек ареолы:
1. увеличивает стадию заболевания и влияет на выработку плана
лечения;
2. не увеличивает стадию заболевания;
3. не влияет на выработку плана лечения;
4. влияет на общее состояние больной.
098. Рак молочной железы следует дифференцировать с:
1. узловой мастопатией;
2. гемобластозами;
3. маститом;
4. туберкулезом;
5. все ответы правильны.
099. Рак молочной железы может метастазировать в:
1. легкие;
2. кости;
3. печень;
4. головной мозг;
5. все ответы правильны.
100. Для рака молочной железы регионарными являются все перечисленные лимфатические узлы, кроме:
1. подмышечных;
2. подключичных;
3. парастернальных;
4. подчелюстных.
101. Рак молочной железы может метастазировать только:
1. гематогенно;
2. лимфогенно;
3. имплантационно;
4. гематогенно и лимфогенно;
5. всеми перечисленными путями.
102. Для диагностики рака молочной железы наиболее достоверным
методом исследования является:
1. маммография;
2. пункция с последующим цитологическим исследованием пунк-
тата;
3. термография;
4. ультразвуковое исследование.
103. Наиболее информативным методом ранней диагностики рака молочной железы является:
1. пальпация;
2. маммография;
550
3. ультразвуковая томография;
4. термография;
5. радионуклидная диагностика с 32Р.
104. Для ранней диагностики рака молочной железы наиболее информативна:
1. маммография;
2. флюорография;
3. пункционная биопсия;
4. секторальная резекция;
5. пальпация.
105. Для массовой диагностики патологии молочной железы применяются:
1. термография;
2. маммография;
3. флюорография;
4. пункционная биопсия;
5. пальпация.
106. Для выявления метастаза рака молочной железы в кости применяется:
1. рентгенологическое исследование;
2. изотопное исследование;
3. исследование рецепторов стероидных гормонов;
4. правильны ответы 1 и 2;
5. правильны ответы 2 и 3.
107. Для выявления метастазов рака молочной железы в печень применяется:
1. ультразвуковое исследование;
2. биохимическое исследование;
3. сканирование печени;
4. ангиография;
5. все перечисленное.
108. При раке молочной железы у мужчин встречаются все гистологические формы рака, известные у женщин:
1. правильно;
2. неправильно;
3. все формы, кроме рака Педжета.
109. Основным видом лечения внутрипротоковых папиллом является:
1. хирургический;
2. лучевой;
3. гормональный;
4. лекарственный.
110. У больной в верхненаружном квадранте молочной железы пальпируется опухоль размером 2x3 см, подвижная, плотная, с четкими
контурами, безболезненная. Кожные симптомы отрицательные.
Выделений из соска нет. Подмышечные лимфатические узлы не
увеличены. Появление опухоли отмечено месяц назад. Наиболее
вероятный диагноз:
1. диффузная мастопатия;
2. рак молочной железы;
3. болезнь Минца;
4. фиброаденома;
5. узловая мастопатия.
551
111. В левой молочной железе пальпируется безболезненное опухолевидное образование 2x3 см. Положительный симптом "площадки",
сосок деформирован, ареола отечна. Выделений из соска нет. Регионарные лимфатические узлы не пальпируются. Наиболее вероятный диагноз:
1. фиброаденома;
2. узловая мастопатия;
3. липома;
4. рак молочной железы;
5. болезнь Минца.
112. У мальчика 13 лет выявлено увеличение обеих молочных желез.
Узловых образований не выявляется. Наиболее целесообразным в
данном случае является:
1. обследование у уролога, эндокринолога, терапевта;
2. маммография;
3. пункция молочных желез с последующим цитологическим исследованием пунктата;
4. назначение гормонотерапии.
113. К андрогенным препаратам относятся:
1. медротестостерон-пропионат;
2. пролотестом;
3. тестостерон-пропионат;
4. омнадрен;
5. все ответы правильны.
114. Показанием к эндокринной терапии при раке молочной железы
является:
1. наличие рецепторов стероидных гормонов в опухоли;
2. первично распространенный рак молочной железы;
3. все стадии первичного рака молочной железы;
4. все ответы правильны;
5. правильны ответы 1 и 2.
115. Наружное облучение гипофиза дает наибольший эффект при метастазах в:
1. кости скелета;
2. печень;
3. лимфатические узлы;
4. легкие.
116. При отечно-инфильтративной форме рака молочной железы наиболее целесообразным является:
1. только хирургическое лечение;
2. только лучевая терапия;
3. только химиотерапия;
4. комбинированное лечение;
5. комплексное лечение.
117. Для выбора гормонотерапии при раке молочной железы оптимальным является следующее сочетание стероидных гормонов:
1. РЭ+ и РП+;
2. РА+ и РГ+;
3. РГ+ и РП+;
4. РА- и РЭ-;
5. РЭ- и РП-.
118. Для выключения функции яичников применяется:
1. хирургическая овариэктомия;
552
2. лучевая кастрация;
3. аналог природного ЛГРГ (золадекс);
4. все ответы правильны.
119. Золадекс вводится:
1. внутрь;
2. внутривенно;
3. внутримышечно;
4. в подкожный жировой слой передней брюшной стенки.
120. К препаратам из группы антиэстрогенов относятся:
1. нольваденс;
2. преднизолон;
3. мамомид;
4. пролотестон.
121. Наиболее эффективным препаратом при лечении рака молочной
железы при монотерапии является:
1. адриамицин, новантрон;
2. таксол;
3. метотрексат;
4. 5-фторурацил;
5. правильны ответы 1 и 2.
122. Наиболее часто применяемыми схемами адъювантной химиотерапии при раке молочной железы являются:
1. CMF;
2. FAK;
3. CMEFAV;
4. CAF.
123. К ингибиторам ароматазы относятся:
1. тамоксифен;
2. аримидекс;
3. мамомид;
4. нольваденс;
5. правильны ответы 1 и 4;
6. правильны ответы 2 и 3.
124. Послеоперационная химиотерапия целесообразна после радикального хирургического лечения при раке молочной железы в стадии:
1. I;
2. II;
3. III;
4. правильны ответы 1 и 2.
Раздел 10
ОПУХОЛИ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ
001. Среди доброкачественных опухолей печени у детей первое место
занимает:
1. аденома;
2. тератома;
3. кавернозная гемангиома;
4. гамартома.
553
2. очаги повышенной плотности;
3. правильного ответа нет.
023. При диагностике опухоли печени у детей противопоказаны следующие исследования:
1. аспирационная биопсия;
2. пункционная биопсия слепым методом;
3. лапароскопия с биопсией;
4. правильны ответы 1 и 2.
024. Ребенку 1 год. В правой половине живота определяется плотная,
неподвижная опухоль, уходящая в подреберье. Нижняя граница
опухоли до пупочной линии, левая переходит влево за среднюю
линию живота. Реакция Абелева — Татаринова положительная.
На урограммах отмечено смещение собирательной системы правой почки книзу и латерально. Какие методы исследования нужно
провести для уточнения диагноза?
1) Сканирование печени.
2) Аспирационную биопсию опухоли.
3) Определение экскреции катехоламинов.
4) Аортографию.
5) Диагностическую лапаротомию.
6) Исследование желудочно-кишечного тракта с барием.
1. 1,3,4.
2. 2, 3, 6.
3. 2.
4. 1,4,6.
025. Ребенку 1 год. Опухоль располагается в левом подреберье, мягкоэластичной консистенции, ограниченно подвижная. В области
правой лопатки и левой ягодицы капиллярные гемангиомы. Кожные покровы бледные. При аускультации над опухолью прослушивается систолический шум. Предположительный диагноз:
1. гепатобластома;
2. эхинококк;
3. гликогеновая болезнь;
4. кавернозная гемангиома;
5. нефробластома.
026. Ребенку 1 год. Опухоль располагается в правом подреберье, мягкоэластичной консистенции, ограниченно подвижная. В области
правой лопатки и на левой ягодице кавернозные гемангиомы. При
аускультации над опухолью прослушивается систолический шум.
Предположительный диагноз:
1. опухоль Вильмса;
2. кавернозная гемангиома печени;
3. гепатобластома.
027. Какие методы лечения используются при злокачественных эпителиальных опухолях желудочно-кишечного тракта у детей?
1. Химиотерапия.
2. Лучевая терапия.
3. Оперативное лечение.
4. Комбинированные методы.
028. Методом выбора при лечении первичного рака печени является:
1. хирургический метод;
2. системная химиотерапия;
3. регионарная химиотерапия;
4. лучевая терапия.
556
029. При злокачественных новообразованиях печени III стадии показано следующее лечение.
1. оперативное;
2. химиотерапия;
3. лучевая терапия.
030. Низкие цифры резектабельности обусловлены:
1. поздней диагностикой;
2. высоким процентом интра- и послеоперационных осложнений;
3. высокой послеоперационной летальностью;
4. недостаточной подготовкой хирургов и онкологов.
031. При проведении химиотерапии по поводу злокачественных опухолей печени целесообразно применять:
1. системную химиотерапию;
2. регионарную химиотерапию;
3. химиоэмболизацию печеночных артерий.
032. Противопоказанием для оперативного лечения рака печени является:
1. поражение обеих долей печени;
2. рак на фоне цирроза;
3. печеночная недостаточность;
4. наличие желтухи;
5. все ответы правильны.
033. Вторичное поражение печени как единственное проявление заболевания встречается:
1. часто;
2. редко;
3. никогда не встречается.
034. Объем оперативного вмешательства при злокачественных гепатомах:
1. энуклеация;
2. атипичная резекция;
3. гемигепатэктомия.
035. Ребенку 13 лет. При обследовании (проведена аортография, имеется положительная реакция Абелева — Татаринова) установлен
диагноз: злокачественная опухоль левой доли печени с внутриор-
ганными метастазами в правую долю. Ваша лечебная тактика:
1. резекция правой доли и гемигепатэктомия слева;
2. химиотерапия;
3. дистанционная гамма-терапия;
4. только симптоматическое лечение.
036. Ребенку 10 лет. Произведена клиновидная резекция правой доли
печени по поводу гепатокарциномы. Опухоль размером 2x2 см.
Может ли такая операция считаться радикальной?
1. Да.
2. Нет.
037. У ребенка имеется злокачественная опухоль левой доли печени с
внутриорганными метастазами в правую. Вид лечения:
1. резекция правой доли с левосторонней гемигепатэкгомией;
2. химиоэмболизация печеночной артерии;
3. дистанционная гамма-терапия.
038. Ребенку 10 лет. Произведена клиновидная резекция правой доли
печени по поводу гепатоцеллюлярного рака. Опухоль размером
2x3 см. Операция радикальная?
1. Да.
2. Нет.
557
039. Метастатическое поражение печени происходит:
1. гематогенным путем по воротной вене;
2. лимфогенно ретроградно;
3. лимфогенно ортоградно;
4. гематогенно по нижней полой вене.
040. Метастатическое поражение печени чаще наблюдается при:
1. нефробластоме;
2. нейробластоме;
3. опухолях костей;
4. опухолях мягких тканей.
041. Метастатическое поражение печени в отличие от первичной опухоли характеризуется:
1. множественными очагами поражения;
2. единичным очагом;
3. солитарным очагом.
042. При вторичном поражении печени метастазы первичной опухоли
в регионарных лимфатических узлах должны быть:
1. во всех случаях;
2. обнаруживаются редко;
3. в преобладающем большинстве наблюдений.
043. В настоящее время наилучшие результаты лечения метастатических опухолей получены при:
1. хирургическом лечении;
2. химиотерапии;
3. лучевой терапии.
044. Перфорации кишечной стенки при лимфосаркоме толстой кишки
способствуют:
1. повышенное давление в просвете кишки;
2. распад опухоли;
3. трофические нарушения в стенке кишки;
4. травматизация стенки кишки;
5. все перечисленные.
045. При правосторонней гемиколэктомии по поводу лимфосаркомы
печеночного изгиба ободочной кишки подвздошно-толстокишечная
артерия перевязывается:
1. во всех случаях;
2. не перевязывается;
3. единой тактики нет.
046. В начальном периоде заболевания при первичном раке печени:
1. отсутствуют патогномоничные симптомы заболевания и нарушение функции печени;
2. отсутствует клиническая симптоматика, но имеются нарушения функции печени;
3. имеются клинические симптомы, связанные с нарушением
функции печени.
047. Опухоли печени больших размеров чаще диагностируются по данным:
1. УЗТ;
2. КТ;
3. ангиографии;
4. сканирования.
558
048. Попытка выполнения радикальной операции при первичном раке
печени нецелесообразна в случаях:
1. поражения обеих долей;
2. рака на фоне цирроза;
3. наличия печеночной недостаточности;
4. наличия желтухи;
5. во всех перечисленных случаях.
Раздел 11
ЗАБРЮШИННЫЕ ВНЕОРГАННЫЕ ОПУХОЛИ
001. Опухоли симпатической нервной системы у детей в структуре солидных опухолей у детей составляют:
1. до 10 % всех новообразований;
2. до 25 % "
3. до 50 % "
4. до 75 % "
002. Наиболее часто нейрогенные опухоли встречаются у детей в возрасте:
1. до 1 года;
2. 2—4 года;
3. 5—8 лет;
4. 9—15 лет.
003. Наиболее частая локализация нейробластомы у детей:
1. забрюшинное пространство;
2. средостение;
3. область шеи;
4. малый таз.
004. Наименее зрелая нейрогенная опухоль:
1. симпатогониома;
2. симпатобластома;
3. ганглионейробластома.
005. Наиболее зрелая нейрогенная опухоль:
1. симпатогониома;
2. ганглионеврома;
3. симпатобластома;
4. ганглионейробластома.
006. Забрюшинной нейробластоме свойственны:
1. быстрый рост;
2. раннее метастазирование;
3. выход за пределы капсулы с прорастанием окружающих органов и тканей;
4. все перечисленное;
5. правильного ответа нет.
007. Нейробластома метастазирует в:
1. костный мозг, кости;
2. лимфатические узлы;
3. легкие;
4. печень;
5. все перечисленное.
559
008. Наиболее часто нейрогенные забрюшинные опухоли у детей пальпируются в:
1. верхних отделах живота;
2. полости малого таза;
3. нижних отделах живота;
4. подвздошных областях.
009. Наиболее частые признаки, наблюдающиеся при нейробластоме у
детей:
1. гиперемия кожи, наличие а-фетопротеина в сыворотке крови,
артериальная гипертония.
2. бледность кожи, артериальная гипертония, повышение экскреции катехоламинов и их метаболитов в моче;
3. бледность кожи, гематурия, увеличение показателей ами-
нотрансфераз в сыворотке крови.
010. При пальпации забрюшинная нейрогенная опухоль:
1. неподвижная, бугристая, переходит среднюю линию живота;
2. подвижная, гладкая, пальпируется в нижних отделах живота;
3. умеренно подвижная, плотноэластическая, не переходит среднюю линию живота;
4. умеренно подвижная, мелкобугристая, эластической консистенции, пальпируется в эпигастральной области.
011. Признак, патогномоничный для нейробластомы у детей:
1. высокий уровень эмбрионального а-фетопротеина;
2. высокий уровень катехоламинов в моче;
3. высокий уровень глюкозы в крови;
4. "сосудистые звездочки" на коже;
5. макрогематурия.
012. Артериальная гипертония при нейробластоме у детей наблюдается:
1. во всех случаях;
2. в 30 % случаев;
3. в 50 % случаев;
4. в 70 % случаев.
013. Основным методом установочной диагностики при забрюшинных
нейробластомах являются:
1. аортография;
2. УЗИ;
3. радионуклидные исследования;
4. определение экскреции катехоламинов в моче;
5. исследование костного мозга.
014. Повышение экскреции катехоламинов и их метаболитов наблюдается при нейробластоме:
1. во всех случаях;
2. в 30 % случаев;
3. в 50 % случаев;
4. в 70 % случаев.
015. Каким опухолям у детей свойственно поражение по типу "песочных часов"?
1. Нефробластоме.
2. Нейробластоме.
3. Гепатобластоме.
4. Дисгерминоме яичника.
016. При какой опухоли детского возраста при рентгенологическом исследовании могут быть обнаружены кальцификаты в виде мелко¬
560
точечных хлопьев, расположенных в центральных отделах новообразования?
1. При нефробластоме.
2. При нейробластоме.
3. При рабдомиосаркоме.
4. При гепатобластоме.
017. Морфологическое подтверждение диагноза до операции при за-
брюшинной нейробластоме может быть получено:
1. путем пункции опухоли под контролем УЗИ;
2. при пункции опухоли под контролем компьютерной томографии;
3. при пункции или биопсии во время лапароскопии;
4. при пункции опухоли во время пальпации с применением мышечных релаксантов;
5. при всех перечисленных методах диагностики.
018. Цитологическое исследование пункционного материала при за-
брюшинных неорганных опухолях до начала специального лечения выполняется для определения:
1. гистогенеза опухоли;
2. злокачественности или доброкачественности процесса;
3. исключения воспалительного заболевания;
4. всего перечисленного выше.
019. Нужно ли иметь морфологическое (цитологическое) подтверждение
диагноза у больного с подозрением на нейрогенную опухоль до операции, если новообразование имеет локализованный вид и размеры опухоли составляют до 10 см в диаметре?
1. Нужно обязательно.
2. Нужно стараться получить морфологическое подтверждение.
3. Не нужно.
020. Кальцификаты в нейрогенных опухолях при рентгенологическом
обследовании выявляются в:
1. 20 % случаев;
2. 40 % случаев;
3. 60 % случаев;
4. более чем в 70% случаев.
021. Для постановки диагноза и определения стадии болезни при нейробластоме забрюшинного пространства необходимы следующие
исследования:
1. миелограммы; экскреции мочи на катехоламины;
2. УЗИ и компьютерная томография;
3. сцинтиграфия скелета;
4. цитологическое исследование пунктата из опухоли или биопсия;
5. все перечисленное.
022. Наиболее часто дифференциальный диагноз при забрюшинных неорганных нейрогенных опухолях следует проводить с патологией:
1. почек;
2. надпочечников;
3. поражением забрюшинных лимфатических узлов;
4. со всем перечисленным.
023. Для определения тактики оперативного лечения при нейробластоме
забрюшинного пространства у детей решающим методом диагностики является:
1. сцинтиграфия скелета;
2. УЗИ;
561
3. компьютерная томография;
4. абдоминальная аортография и венография;
5. экскреторная урография.
024. Операбельность при забрюшиннной неорганной нейробластоме
зависит прежде всего от:
1. локализации опухоли;
2. гистологической структуры;
3. размеров опухоли;
4. связи опухоли с окружающими органами и тканями;
5. 2-го и 3-го пунктов;
6. 1-го и 3-го пунктов.
025. При операциях по поводу забрюшинных опухолей чаще применяется доступ:
1. чрезбрюшинный (срединная лапаротомия);
2. люмботомия;
3. параректальный;
4. брюшно-промежностный;
5. все доступы используются одинаково часто.
026. Лечебная тактика при нейробластоме в виде "песочных часов":
1. химиотерапия + лучевая терапия;
2. удаление забрюшинной опухоли + химиотерапия;
3. удаление забрюшинной опухоли + химиотерапия + лучевая терапия;
4. химиотерапия + ламинэктомия + удаление забрюшинной опухоли.
027. У больных с I стадией нейробластомы (Т1, N0, МО) в возрасте до
1 года применяются методы лечения:
1. только хирургический;
2. комбинированный;
3. комплексный;
4. используются все перечисленные методы терапии.
028. У больных со II стадией нейробластомы (Т2, N0, МО) лечение начинают с:
1. хирургического удаления опухоли;
2. предоперационной химиотерапии;
3. предоперационной лучевой терапии;
4. предоперационной химиолучевой терапии.
029. Лучевое лечение при нейробластоме применяется:
1. до операции при больших размерах новообразования;
2. при наличии послеоперационной резидуальной опухоли, определяющейся микроскопически;
3. при наличии макроскопически определяющейся резидуальной
опухоли;
4. только 2 и 3;
5. во всех перечисленных случаях.
030. У ребенка 2 лет стали возникать боли при дефекации, склонность
к запору, дизурические явления. Постепенно появилось недержание
кала. При пальцевом исследовании прямой кишки определяется
опухоль позади прямой кишки, плотная, неподвижная. Реакция
определения а-фетопротеина резко положительная. Ваш диагноз?
1. Рабдомиосаркома мочевого пузыря.
2. Тератобластома.
3. Нейробластома малого таза.
562
031. Роль лучевой терапии при лечении тератобластомы у детей:
1. самостоятельный метод;
2. метод комбинированного лечения;
3. метод комплексного лечения.
032. Выберите метод лечения зрелых тератом:
1. хирургический;
2. операция + химиотерапия;
3. операция + лучевая терапия;
4. комплексное лечение.
033. Больному, у которого пальпируется опухоль в левой половине живота, произведена экскреторная урография. На урограммах наблюдается латеральное смещение нижнего полюса и мочеточника.
На боковых снимках отмечено смещение почки и мочеточника
кпереди. О какой опухоли следует думать прежде всего?
1. Опухоль почки.
2. Опухоль надпочечника.
3. Забрюшинная внепочечная опухоль из симпатических ганглиев.
034. У ребенка при пальпации живота определяется опухоль в нижненаружном квадранте слева. При внутривенных урограммах наблюдается расширение лоханки, чашечек левой почки и верхнего отдела мочеточника. О какой опухоли идет речь?
1. Левосторонняя нефробластома.
2. Забрюшинная нейрогенная опухоль.
3. Правильного ответа нет.
035. Отсутствие функции почки при экскреторной урографии ("немая
почка") более характерно для:
1. нефробластомы;
2. нейрогенной забрюшинной опухоли;
3. забрюшинной тератомы;
4. всего перечисленного.
036. Для злокачественных нейрогенных опухолей характерно поражение следующих отделов скелета:
1. метафизов длинных трубчатых костей;
2. костей черепа;
3. ребер;
4. позвонков;
5. всего перечисленного.
037. При нейробластоме чаще поражаются:
1. метафизы длинных трубчатых костей;
2. эпифизы длинных трубчатых костей;
3. мелкие кости кистей и стоп.
038. Метастазы в легкие чаще наблюдаются при:
1. нефробластоме;
2. нейробластоме;
3. тератобластоме.
039. У больного живот увеличен, асимметричен за счет выбухания
вправо и вперед. При пальпации определяется опухолевидное образование, неподвижное, мелкобугристое, переходящее через
среднюю линию живота влево, плотной консистенции. Кожные
покровы бледные; резко снижен аппетит. Часто наблюдается тошнота, бывает рвота без видимых причин. Для какой опухоли более
характерны перечисленные симптомы?
1. Нефробластомы.
563
2. Нейробластомы.
3. Тератобластомы.
040. У больного имеется опухоль забрюшинного пространства слева. При
общей абдоминальной аортографии определяется тень опухоли, равномерно пронизанная слабо выраженной сетью патологических, извитых и перекрещивающихся между собой сосудов. Лакунарных
скоплений контраста в опухоли не выявлено. Кровоснабжение опухоли осуществляется в основном за счет поясничных артерий.
Просвет аорты и левой почечной артерии сужен. Для какой опухоли характерны перечисленные ангиографические признаки?
1. Нефробластомы.
2. Нейробластомы из надпочечника.
3. Нейробластомы из симпатических ганглиев.
4. Правильного ответа нет.
041. У ребенка 2 лет наблюдаются значительное ухудшение самочувствия, резкое снижение аппетита, появление тошноты и рвоты без
видимых причин, бледность кожных покровов, быстрое нарастание гиподинамии. При пальпации живота определяется неподвижная мелкобугристая опухоль слева, переходящая через среднюю линию живота. Экскреторная урография обнаруживает незначительную деформацию почечной системы, смещение почки и
мочеточника латерально. При рентгенографии черепа выявлены
множественные очаги деструкции вблизи швов. Исследование мочи на катехоламины обнаруживает увеличение незрелых фракций
катехоламинов. Ваш диагноз?
1. Нефробластома.
2. Лимфосаркома абдоминальной локализации.
3. Нейрогенная забрюшинная опухоль.
4. Опухоль яичника.
042. У ребенка 2 лет диагностирована забрюшинная правосторонняя
нейробластома, III стадия заболевания с поражением паракаваль-
ных лимфатических узлов (ТЗ, N1, МО). Поданным УЗИ, возможно прорастание опухоли в головку поджелудочной железы, печень. На КТ участка в проекции опухоли нижняя полая вена не
визуализируется. Выберите стратегию терапии пациента:
1. операция — химиотерапия;
2. операция — химиотерапия — дистанционное облучение;
3. химиотерапия — операция — химиотерапия — лучевая терапия;
4. предоперационное облучение — операция — химиотерапия —
лучевая терапия.
043. У ребенка 1,5 лет диагностирована симпатобластома забрюшинного пространства, I стадия заболевания (Т1, N0, МО). На первом
этапе лечения выполнено хирургическое вмешательство: радикальное удаление опухоли. После операции N-myc-антиген отрицательный. Выберите тактику послеоперационной терапии:
1. химиотерапия;
2. облучение ложа удаленной опухоли;
3. динамическое наблюдение за больным;
4. 1 и 2.
044. У больного диагностирована III стадия забрюшинной нейробластомы. Выберите химиопрепараты, которые показаны для лечения данной стадии заболевания:
1. винкристин;
564
2. циклофосфан;
3. адриабластин;
4. вепезид;
5. карбоплатин;
6. все перечисленные.
045. У ребенка в возрасте 7 мес диагностирована забрюшинная нейробластома с поражением костного мозга. Выберите химиопрепараты для лечения пациента:
1. винкристин;
2. циклофосфан;
3. адриабластин;
4. вепезид;
5. карбоплатин;
6. все перечисленные.
Раздел 12
ОПУХОЛИ ПОЛОВЫХ ОРГАНОВ У ДЕТЕЙ
001. Наиболее часто встречающиеся опухоли яичников:
1. герминогенные;
2. рак;
3. опухоли стромы полового тяжа.
002. К наиболее часто встречающимся злокачественным опухолям
яичников относятся:
1. эпителиальные;
2. стромы полового тяжа;
3. герминогенные;
4. метастатические.
003. Среди опухолей яичников у детей до 15 лет преобладают:
1. опухоли стромы полового тяжа;
2. эпителиальные опухоли;
3. герминогенные опухоли.
004. Удельный вес герминогенных опухолей в структуре опухолей яичников составляет:
1. около 80%;
2. 50 %;
3. 20 %;
4. 10 %;
5. менее 5 %.
005. Среди герминогенных опухолей яичников у детей наиболее часто
встречаются:
1. тератобластомы;
2. эмбриональный рак;
3. опухоли желточного мешка.
006. У детей чаще встречаются:
1. лейомиосаркома;
2. рабдомиосаркома;
3. карциносаркома;
4. эндометриальная саркома.
565
2. гранулезоклеточной опухоли;
3. серозной цистаденокарциномы;
4. андробластомы.
027. Какой опухоли яичников свойственны явления: псевдогермафродитизма, инфантилизма, пороков развития половых органов?
1. Дисгерминоме.
2. Тератобластоме.
3. Хориокарциноме.
4. Гонадобластоме.
028. Для каких видов злокачественных опухолей яичников имеет важное диагностическое значение реакция Абелева — Татаринова?
1. Тератобластомы.
2. Хориокарциномы.
3. Дисгерминомы.
4. Гонадобластомы.
029. Определение уровня хорионического гонадотропина имеет важное
диагностическое значение для диагностики опухолей яичника:
1. тератобластомы;
2. дисгерминомы;
3. андробластомы;
4. гонадобластомы;
5. хориокарциномы.
030. Необходимый метод диагностики при подозрении на злокачественную опухоль яичников;
1. реакция Абелева — Татаринова;
2. реакция на раковый эмбриональный антиген;
3. определение титра хорионического гонадотропина.
031. Основной метод диагностики злокачественных опухолей яичников у детей:
1. выделительная урография;
2. пальпация живота с миорелаксантами и вагиноскопией;
3. ультразвуковая томография.
032. Обязательные методы рентгенологического исследования при подозрении на опухоль яичников:
1. УЗИ;
2. исследование желудочно-кишечного тракта;
3. ангиография;
4. компьютерная томография.
033. Для диагностики злокачественной опухоли яичников решающим
методом является:
1. ультразвуковое исследование;
2. компьютерная томография;
3. лапароскопия;
4. гистологическое исследование.
034. Дифференциальную диагностику опухолей яичников следует проводить с:
1. миомой матки;
2. опухолью брыжейки;
3. опухолью большого сальника;
4. забрюшинными опухолями;
5. всем перечисленным.
568
035. При лечении доброкачественных опухолей яичников целесообразнее использовать методы лечения:
1. хирургический;
2. операцию + химиотерапию;
3. химиотерапию;
4. операцию + облучение.
036. Объем оперативного вмешательства при злокачественной опухоли
яичника:
1. клиновидная резекция опухоли;
2. экстирпация матки с придатками;
3. удаление опухоли с резекцией большого сальника.
037. Оптимальный доступ при опухолях яичников:
1. срединный;
2. разрез Пфанненштиля;
3. нижнесрединный.
038. Наиболее часто применяемые схемы химиотерапии при рабдомиосаркомах половых органов у детей:
1. VAB-6;
2. винкристин + дактиномицин + циклофосфан + адриамицин;
3. вепезид.
039. Наиболее рациональная схема химиотерапии при злокачественных тератоидных опухолях яичников:
1. VAB-6;
2. винкристин + циклофосфан + дактиномицин;
3. адриамицин + платидиам.
040. Схемы полихимиотерапии, чаще применяемые при дисгерминоме
яичников у детей:
1. винбластин + цисплатин + блеомицин;
2. вепезид + ифосфамид + цисплатин;
3. вепезид + ифосфамид;
4. карбоплатин + блеомицин + вепезид;
5. все перечисленное.
041. Дисгерминома яичников наиболее чувствительна к:
1. рубомицину;
2. ТиоТЭФу;
3. циклофосфану;
4. дактиномицину;
5. метотрексату.
042. У ребенка установлен диагноз тератобластомы яичника. Ваша лечебная тактика:
1. только операция;
2. операция + химиотерапия;
3. только химиотерапия.
043. Больной 16 лет по поводу перекрута ножки опухоли правого яичника произведено удаление правых придатков матки. Гистологически — чистая дисгерминома. Дальнейшая тактика предусматривает:
1. релапаротомию с удалением матки и левых придатков;
2. облучение + химиотерапию;
3. химиотерапию;
4. наблюдение;
5. правильны ответы 1 и 2.
044. Больной 15 лет в экстренном порядке произведено удаление левых придатков по поводу перекрута ножки опухоли; диаметр опу¬
569
холи 5 см. Гистологически —* дисгерминома с участками тератобластомы. В дальнейшем следует выполнить:
1. релапаротомию с удалением матки и правых придатков;
2. облучение + химиотерапию;
3. монохимиотерапию;
4. наблюдение.
045. Наиболее радиорезистентная опухоль яичников:
1. дисгерминома;
2. рак яичника;
3. тератобластома.
046. Злокачественные опухоли влагалища чаще всего встречаются в
возрасте:
1. до 5 лет;
2. от 6 до 30 лет;
3. от 30 до 50 лет;
4. старше 50 лет;
5. правильны ответы 1 и 4.
047. В возрасте до 5 лет чаще встречаются:
1. плоскоклеточный рак;
2. светлоклеточная аденокарцинома;
3. ботриоидная рабдомиосаркома;
4. низкодифференцированный рак.
048. В старших возрастных группах среди злокачественных опухолей
влагалища чаще всего встречаются:
1. светлоклеточный рак;
2. ботриоидная рабдомиосаркома;
3. плоскоклеточный рак;
4. низкодифференцированный рак;
5. правильны ответы 3 и 4.
049. Решающим в диагностике опухолей вульвы является:
1. гинекологический осмотр;
2. цитологическое исследование;
3. гистологическое исследование;
4. радиоизотопное;
5. термография.
050. При лечении доброкачественных опухолей вульвы целесообразнее
использовать:
1. хирургический метод;
2. лучевой метод;
3. криодеструкцию;
4. правильны ответы 1 и 3.
051. Оптимальная тактика при рабдомиосаркоме влагалища:
1. химиотерапия + операция;
2. операция + гамма-терапия;
3. химиотерапия + гамма-терапия;
4. химиотерапия + операция + внутриполостное облучение.
052. Объем оперативного вмешательства при рабдомиосаркоме влагалища:
1. иссечение опухоли;
2. экстирпация матки с придатками;
3. биопсия опухоли + химиотерапия.
570
053. При злокачественных опухолях шейки матки у детей объем one
ративного вмешательства должен включать:
1. экстирпацию матки с трубами и верхней частью влагалища;
2. конизацию шейки матки;
3. пангистерэктомию.
054. Каким опухолям яичников свойственны явления гирсутизма?
1. Тератобластоме.
2. Дисгерминоме.
3. Опухолям стромы полового тяжа.
4. Заражению яичника при злокачественной лимфоме.
Раздел 13
ОПУХОЛИ МОЧЕПОЛОВОЙ СИСТЕМЫ
001. Частота нефробластом среди других злокачественных солидных
опухолей детского возраста составляет:
1. до 10 %;
2. 20-30 %;
3. 30-50 %;
4. свыше 50 %.
002. Метод лечения локализованной формы рабдомиосаркомы мочевого пузыря у детей:
1. химиотерапия + гамма-терапия 4- операция;
2. химиотерапия + операция;
3. операция + гамма-терапия.
003. Нефробластома наиболее часто встречается в возрасте:
1. до 1 года;
2. от 2 до 5 лет;
3. от 6 до 9 лет;
4. 10—15 лет;
5. старше 15 лет.
004. Нефробластома может сочетаться с различными пороками развития:
1. часто;
2. крайне редко;
3. не сочетается.
005. Какие из перечисленных пороков мочеполовой системы являются
предопухолевыми для нефробластомы?
1. Поликистоз.
2. Гипоспадия.
3. Подковообразная почка.
4. Аномалии развития лоханок.
5. Все перечисленное.
006. Какие из перечисленных факторов играют роль в развитии нефробластомы у детей?
1. Возраст родителей старше 35 лет.
2. Наличие профессиональных вредностей у родителей.
3. Наличие злокачественных опухолей в семье.
4. Неблагоприятная экологическая среда.
5. Все перечисленное.
571
007. Наиболее часто встречающийся морфологический вариант неф-
робластомы:
1. типичный;
2. тубулярный;
3. кистозный;
4. фетальный;
5. саркоматозный.
008. Наиболее благоприятный прогноз у больных со следующим морфологическим вариантом нефробластомы:
1. анапластическим;
2. тубулярным;
3. кистозным;
4. саркоматозным;
5. с преобладанием неэпителиального компонента.
009. Наименее благоприятный прогноз у больных со следующим морфологическим вариантом нефробластомы:
1. анапластическим;
2. тубулярным;
3. кистозным;
4. саркоматозным;
5. с преобладанием неэпителиального компонента.
010. Значение морфологического варианта нефробластомы:
1. определяет выбор лечебной тактики;
2. влияет на прогноз заболевания;
3. не определяет выбор лечебной тактики;
4. правильны ответы 1 и 2;
5. нет правильного ответа.
011. Как часто встречается метастазирование при нефробластоме?
1. Часто.
2. Редко.
3. Не встречается.
012. При каком морфологическом варианте нефробластомы у детей
метастазов практически не бывает?
1. Типичном.
2. Мезобластической нефроме.
3. Тубулярном.
4. Саркоматозном.
5. Кистозном.
013. При нефробластоме метастазирование наиболее часто наблюдается в:
1. легких;
2. печени;
3. лимфатических узлах;
4. редко костях;
5. все ответы правильны.
014. Метастазы нефробластомы появляются в:
1. ранние сроки;
2. поздние сроки;
3. не появляются.
015. Для нефробластомы характерны следующие варианты метастази-
рования в легкие:
1. единичный метастаз;
2. множественные метастазы;
3. появление единичных метастазов с дальнейшим постепенным
увеличением их размеров и числа.
572
016. Причинами запущенности при нефробластоме являются:
1. ранний возраст ребенка;
2. отсутствие онкологической настороженности у педиатров;
3. недооценка клинических проявлений заболевания;
4. правильны ответы 2 и 3;
5. правильны ответы 1 и 3.
017. Характеристика нефробластомы при пальпации опухоли:
1) поверхность гладкая, реже крупнобугристая;
2) поверхность мелкобугристая;
3) малоподвижная;
4) неподвижная;
5) консистенция эластическая;
6) консистенция плотная.
1. Правильны ответы 2, 4, 6;
2. правильны ответы 1, 3, 5;
3. все ответы правильны.
018. Для опухолей почек у детей характерны следующие рентгенологические признаки:
1) деформация чашечно-лоханочной системы;
2) увеличение размеров почки;
3) смещение почки без деформации чашечно-лоханочной системы;
4) смещение одного из полюсов почки без деформации чашечнолоханочной системы;
5) смещение и деформация чашечно-лоханочной системы;
6) "немая" почка.
1. Все ответы правильны;
2. правильны ответы 1, 2, 6;
3. правильны ответы 1, 2, 5;
4. правильны ответы 3, 4, 6.
019. Ранними клиническими признаками нефробластомы являются:
1) небольшая бледность кожных покровов;
2) отсутствие аппетита;
3) гематурия;
4) анемия;
5) субфебрилитет.
1. Все ответы правильны;
2. правильны ответы 1, 2, 4;
3. правильны ответы 2, 4, 5;
4. правильны ответы 1, 3, 5.
020. Поздними клиническими признаками нефробластомы являются:
1. бледность кожных покровов;
2. наличие пальпируемой опухоли в животе;
3. вялость, выраженная слабость;
4. отсутствие аппетита;
5. все ответы правильны.
021. Необходимые рентгенологические исследования при подозрении
на опухоль брюшной полости или забрюшинного пространства:
1) рентгенография грудной клетки;
2) томография средостения;
3) цистография;
4) ультразвуковая томография;
5) холеграфия;
6) исследование желудочно-кишечного тракта с бариевой взвесью.
573
2. гипертонический криз со смертельным исходом;
3. правильного ответа нет;
4. правильны ответы 1 и 2.
038. Наибольшую диагностическую ценность при обследовании ребенка с подозрением на феохромоцитому имеют следующие исследования:
1. пальпация органов живота с миорелаксантами;
2. УЗИ и компьютерная томография;
3. ангиография;
4. исследование мочи на катехоламины;
5. суточное измерение АД;
6. правильны ответы 4 и 5.
039. Наиболее частыми причинами артериальной гипертензии у детей
являются:
1. патология почек (острый и хронический нефрит, сужение почечных артерий, гидронефроз, поликистоз);
2. патология сердечно-сосудистой системы (коарктация аорты,
аортальная недостаточность);
3. эссенциальная гипертония;
4. опухоли коры надпочечников;
5. адреногенитальный синдром;
6. феохромоцитома.
040. Рекомендуемый оптимальный план лечения больного с феохро-
моцитомой:
1. радикальное хирургическое удаление опухоли;
2. 1 + лучевое лечение;
3. 1 + химиотерапия;
4. комплексное лечение.
041. Рак коры надпочечников чаще встречается у детей в возрасте:
1. до 1 года;
2. от 2 до 5 лет;
3. от 7 до 10 лет;
4. от 12 до 15 лет.
042. Раком коры надпочечников чаще болеют:
1. мальчики;
2. девочки;
3. одинаково часто 1 и 2.
043. У девочек, больных раком коры надпочечников, могут наблюдаться:
1. резко выраженные гетеросексуальные признаки;
2. раннее половое созревание по женскому типу;
3. 1 и 2;
4. правильного ответа нет.
044. У мальчиков, больных раком коры надпочечников, наблюдаются
признаки:
1. преждевременное половое созревание по мужскому типу;
2. преждевременное половое созревание по женскому типу;
3. нарушения обмена;
4. 1 и 3;
5. 2 и 3;
6. 1 и 2.
045. При раке коры надпочечников чаще наблюдается:
1. повышенное АД;
2. пониженное АД;
3. нормальное АД.
576
046. Для какой опухоли детского возраста характерны перечисленные
симптомы: грубый голос, увеличение наружных половых органов,
усиленный рост волос на лице и туловище по мужскому типу,
ожирение, артериальная гипертония?
1. Нейробластомы.
2. Феохромоцитомы.
3. Рака коры надпочечника.
4. Дисгерминомы.
047. Выберите наиболее информативные методы диагностики при обследовании ребенка с подозрением на рак коры надпочечников:
1. определение в моче 17-кетостероидов;
2. исследование мочи на катехоламины;
3. адренолитическая проба;
4. УЗИ и компьютерная томография;
5. абдоминальная аортография;
6. 1, 4, 5;
7. 2, 3, 5.
048. Рекомендуемый оптимальный план лечения больного раком коры
надпочечников:
1. радикальное хирургическое удаление опухоли;
2. 1 + лучевое лечение;
3. 1 + химиотерапия;
4. комплексное лечение.
049. Наиболее часто встречающиеся морфологические формы злокачественных опухолей мочевого пузыря у детей:
1. рак мочевого пузыря;
2. рабдомиосаркома мочевого пузыря;
3. папилломатоз.
050. Наиболее часто встречающаяся локализация злокачественных опухолей мочевого пузыря:
1. дно;
2. тело;
3. треугольник;
4. устье мочеточников.
051. Ранние клинические проявления злокачественной опухоли мочевого
пузыря у детей:
1. острая задержка мочи;
2. изменения в моче (лейкоциты, эритроциты);
3. боль в животе;
4. пальпируемая опухоль.
052. Основной метод, подтверждающий диагноз злокачественной опухоли мочевого пузыря у детей:
1. цистоскопия с биопсией;
2. цистография;
3. лапароскопия.
053. Какие проявления наиболее характерны для злокачественной опухоли мочевого пузыря?
1. Раннее метастазирование (в пределах 6 мес).
2. Наличие восходящей инфекции.
3. Почечная недостаточность.
054. Метод лечения локализованной формы рабдомиосаркомы мочевого
пузыря у детей:
1. химиотерапия + гамма-терапия + операция;
577
2. химиотерапия + операция;
3. операция + гамма-терапия.
055. При рабдомиосаркоме мочевого пузыря I стадии противоопухолевое лечение начинают с:
1. хирургического удаления опухоли;
2. химиотерапии;
3. лучевого лечения.
056. При рабдомиосаркоме мочевого пузыря размерами 6 см, растущей
в просвет мочевого пузыря и располагающейся в области боковой
стенки органа, объемом операции будет:
1. экономное удаление опухоли;
2. резекция мочевого пузыря в пределах здоровых тканей;
3. экстирпация мочевого пузыря;
4. все ответы неправильны.
057. Удельный вес опухолей яичка по отношению ко всем новообразованиям детского возраста составляет:
1. не более 1 %;
2. до 3 %;
3. до 5 %;
4. до 10 %.
058. Опухоли яичка чаще встречаются у детей в возрасте:
1. до 1 года;
2. до 3 лет;
3. до 7 лет;
4. до 10 лет.
059. Среди врожденных аномалий яичка предрасполагающими для
возникновения опухоли являются:
1. гипоплазия яичка;
2. атрофия яичка;
3. крипторхизм;
4. эктопия яичка;
5. все перечисленное.
060. Среди злокачественных опухолей яичка чаще встречается:
1. эмбриональная карцинома;
2. рабдомиосаркома;
3. семинома;
4. лейомиосаркома;
5. злокачественная опухоль гонадной стромы.
061. Реакция Абелева — Татаринова имеет диагностическое значение
при следующих разновидностях опухолей яичек у детей:
1. тератобластоме (опухоль желточного мешка);
2. семиноме;
3. эмбриональной рабдомиосаркоме;
4. всех перечисленных.
062. Решающим методом диагностики при опухолях яичка является:
1. УЗИ;
2. компьютерная томография;
3. определение эмбрионального а-фетопротеина;
4. морфологический анализ пунктата из опухоли.
063. При динамическом контроле за ребенком, которому выполнена
орхофуникулэктомия по поводу тератобластомы яичка, рекомендуется проведение реакции Абелева — Татаринова (до начала ле¬
578
чения реакция на а-фетопротеин была резко положительной) с
интервалом:
1. 1 раз в 2 нед в течение 2 лет;
2. 1 раз в 1 мес в течение 2 лет;
3. 1 раз в 2 мес в течение 2 лет;
4. 1 раз в 3 мес в течение 2 лет.
064. Рекомендуемый объем оперативного вмешательства у ребенка с
тератобластомой яичка:
1. резекция яичка;
2. удаление пораженного яичка;
3. орхофуникулэктомия с высокой перевязкой семенного канатика;
4. 3 + лимфаденэктомия.
065. У ребенка в возрасте до 1 года диагностирована тератобластома
яичка. Метастазы не выявлены. Рекомендуется лечение:
1. орхофуникулэктомия с высокой перевязкой семенного канатика;
2. 1 + послеоперационная химиотерапия;
3. 1 + послеоперационная лучевая терапия;
4. комплексное лечение.
066. Билатеральная лимфаденэктомия забрюшинных лимфатических
узлов при опухолях яичка у детей:
1. улучшает отдаленные результаты лечения;
2. не улучшает отдаленных результатов лечения;
3. улучшает отдаленные результаты лечения у детей в возрасте до
1 года.
067. Задача: у больного после обследования в стационаре диагностирована II стадия нефробластомы (T2N0M0). Произведено хирургическое вмешательство. При исследовании всей удаленной около-
почечной клетчатки были выявлены микрометастазы. Какова дальнейшая тактика терапии больного?
1. Продолжить ПХТ, как при лечении II стадии заболевания.
2. Продолжить ПХТ, как при III стадии заболевания.
3. 2 + лучевая терапия на ложе удаленной опухоли.
4. Провести курсы высокодозной ПХТ.
068. Стратегию терапии нефробластомы определяют:
1. стадия заболевания;
2. возраст ребенка;
3. наличие сопутствующих заболеваний;
4. все перечисленное.
Раздел 14
ОПУХОЛИ КОЖИ
001. К меланомонеопасным невусам относятся:
1. голубой невус;
2. внутридермальный невус;
3. пограничный пигментный невус;
4. гигантский пигментный невус.
002. К меланомоопасным невусам следует отнести:
1. веррукозный невус;
2. фиброэпителиальный невус;
3. невус Ота.
579
003. Меланома кожи относится к опухолям:
1. нейроэктодермальной природы;
2. эктодермальной природы;
3. мезенхимальной природы;
4. дисэмбриональной природы.
004. Ведущим методом диагностики меланомы кожи является:
1. радиофосфорная проба;
2. лучевая мел анурия;
3. термография;
4. морфологический метод.
005. Клинически заподозрить наличие меланомы кожи можно по следующим признакам:
1. гиперпигментация;
2. асимметрии невоидного образования;
3. бурный темп роста опухоли;
4. выпадение волос при волосатом невусе;
5. все ответы правильны.
006. Наличие дочерних пигментных включений на коже вокруг меланомы указывает на:
1. местную распространенность процесса;
2. наличие дополнительных новообразований;
3. рецидив меланомы;
4. диссеминацию процесса.
007. Наличие инфильтрации меланомы до ретикулярного слоя кожи
указывает на степень инвазии по Clark:
1. I;
2. II;
3. Ill,
4. IV;
5. V.
008. Поражение сосочкового слоя кожи при меланоме соответствует
степени инвазии по Clark:
1. I;
2. II;
3. Ill;
4. IV;
5. V.
009. Поражение базального слоя кожи при меланоме соответствует
степени инвазии по Clark:
1. I;
2. И;
3. III;
4. IV;
5. V.
010. Субъективные жалобы при меланоме кожи у детей включают:
1. боль и зуд в области появившегося новообразования;
2. наличие опухоли кожи черного цвета, возвышающейся над поверхностью кожи;
3. покраснение, боль и припухлость на коже, повышение температуры тела;
4. опухолевое образование плоское, красного цвета, кровоточащее, при травмировании не растет.
580
011. Объективные данные осмотра при меланоме кожи у детей:
1. наличие плотноватого опухолевидного образования под кожей,
кожа не изменена;
2. наличие эластичной опухоли ярко-красного цвета, бледнеющей при надавливании, с бородавчатыми элементами, оволосением;
3. плоское пятно коричневого цвета с бородавчатыми элементами,
оволосением;
4. наличие образования черного цвета, плотного, с глянцевой поверхностью или темно-коричневого цвета узлоподобного образования, возвышающегося над поверхностью кожи с участками
изъязвления.
012. При меланоме кожи у детей выявляются следующие изменения:
1. анемия, увеличение СОЭ, лейкоцитоз;
2. положительная реакция на а-фетопротеин;
3. повышение экскреции катехоламинов с мочой;
4. повышение трансаминаз;
5. правильного ответа нет.
013. С какими заболеваниями кожи проводится дифференциальный
диагноз при подозрении на меланому кожи у детей?
1. Гемангиомой.
2. Пигментной ксеродермой.
3. Плоскоклеточным раком кожи.
4. Пигментным невусом.
5. Со всеми перечисленными.
014. Метастазы меланомы возможны в следующие органы:
1. печень;
2. легкие;
3. лимфатические узлы;
4. кожу и подкожный жировой слой;
5. все ответы правильны.
015. При лечении меланомы кожи у детей применяют:
1. химиотерапию;
2. кератолитические жидкости и мази;
3. оперативное лечение;
4. лучевую терапию;
5. криодеструкцию;
6. правильны ответы 1, 3, 5.
016. Ведущим методом лечения меланомы кожи является:
1. хирургический;
2. лучевая терапия;
3. комбинированный;
4. электрокоагуляция.
017. Хирургический метод лечения меланомы кожи у детей включает:
1. частичное иссечение опухолевой ткани с гистологическим исследованием;
2. глубокое иссечение кожи с опухолью с захватом подкожной
клетчатки до фасции;
3. иссечение опухоли с регионарными лимфатическими узлами.
018. Дополнительными методами лечения меланомы кожи у детей являются:
1. облучение опухоли и прилежащих участков кожи;
581
2. полихимиотерапия с учетом стадии процесса и степени инвазии;
3. гормонотерапия и противовоспалительная терапия.
019. При наличии меланомы кожи лица размерами до 0,5 см в области
носогубной складки наиболее целесообразным является применение:
1. хирургического метода;
2. лучевой терапии;
3. криодеструкции;
4. химиотерапии.
020. При хирургическом лечении меланомы кожи туловища и конечностей от краев опухоли следует отступить:
1. на 0,5 см;
2. на 1,5 см;
3. на 3,5 см;
4. на 5,0 см и более.
021. При хирургическом лечении меланомы кожи лица от краев опухоли следует отступить:
1. на 0,5 см;
2. на 1,5 см;
3. на 3,5 см;
4. на 5,0 см.
022. Наиболее рациональной программой лечения меланомы кожи ГУ
степени инвазии по Кларку является:
1. радикальная операция с последующим наблюдением;
2. радикальная операция + полихимиотерапия в течение 1 года;
3. радикальная операция с последующей химиотерапией в течение 1,5 лет;
4. лучевая терапия с последующей биопсией опухоли и монохимиотерапией.
023. Наихудшей в плане прогноза можно считать локализацию меланомы на:
1. коже;
2. голове;
3. верхних конечностях;
4. туловище;
5. нижних конечностях.
024. У ребенка пигментный невус поясничной области. Размер невуса
5 • 3 • 0,1 см.Определите клиническую группу пациента:
1. 1а;
2. 16;
3. Д/О;
4. Н/О;
5. II.
Раздел 15
ОПУХОЛИ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА
001. Для доброкачественных опухолей костей у детей характерны следующие рентгенологические признаки:
а) выраженный мягкотканный компонент;
582
б) мелкоочаговая деструкция;
в) периостальная реакция в виде "спикул";
г) наличие ’’козырька Кодмэна";
д) вздутие надкостницы;
е) четкие контуры участка деструкции;
ж) истончение коркового слоя.
1. Все ответы правильны;
2. правильны три последних признака;
3. правильны четыре первых признака;
4. правильны признаки б, г, е, ж.
002. Остеогенная саркома наиболее часто встречается в возрасте:
1. до 2 лет;
2. от 2 до 10 лет;
3. старше 10 лет.
003. Наиболее характерный возрастной период для остеогенной саркомы:
1. от 0 до 5 лет;
2. от 6 до 11 лет;
3. от 12 до 20 лет.
004. Наиболее характерными клиническими проявлениями остеогенной саркомы у детей являются:
1. боль при ходьбе;
2. "ночные боли";
3. повышение температуры тела.
005. Основные клинические симптомы остеогенной саркомы проявляются в следующей последовательности:
а) нарушение функции конечности;
б) припухлость;
в) боль;
г) повышение температуры тела;
д) расширенная венозная сеть над опухолью.
1. а, б, в, г, д;
2. в, б, а, г, д;
3. б, в, а, г, д.
006. Остеогенной саркомой поражаются чаще всего:
1. длинные трубчатые кости;
2. плоские кости;
3. кости черепа;
4. кости таза.
007. Преимущественная локализация остеогенной саркомы:
1. дистальный отдел бедренной кости;
2. проксимальный отдел бедренной кости;
3. дистальный отдел плечевой кости.
008. Типичной локализацией остеогенной саркомы является:
1. диафиз трубчатой кости;
2. метаэпифизарная зона кости;
3. плоские кости.
009. Остеогенная саркома метастазирует в:
1. паховые лимфатические узлы;
2. плоские кости;
3. легкие;
4. кости.
583
010. Метастазы в легкие при остеогенной саркоме наиболее часто выявляются:
1. к концу 1-го полугодия с момента установления диагноза;
2. к концу 1-го года;
3. к концу 2-го года.
011. Наиболее характерными рентгенологическими признаками при
остеогенной саркоме являются:
1. слоистый периостит;
2. "козырек Кодмена";
3. спикулы;
4. правильны ответы 1 и 2;
5. все ответы правильны.
012. Для метастатического поражения костей у детей характерны следующие рентгенологические признаки:
а) поражение одной кости;
б) литические очаги, окруженные склеротическим ободком;
в) множественное поражение скелета;
г) мелкоочаговая деструкция;
д) участки деструкции без четких контуров.
1. Все ответы правильны;
2. правильны только 3 последних признака;
3. правильны только 3 первых признака;
4. правильны ответы б, г, д.
013. Какой из методов позволяет достоверно установить диагноз остеогенной саркомы?
1. Рентгенография.
2. Ангиография.
3. Компьютерная томография.
4. Морфологическое исследование.
014. Остеогенную саркому следует дифференцировать с:
1. саркомой Юинга;
2. острым гематогенным остеомиелитом;
3. артритом;
4. посттравматическими изменениями;
5. со всеми перечисленными.
015. Основным методом лечения остеогенной саркомы является:
1. хирургический;
2. лучевой;
3. химиотерапия;
4. химиотерапия + операция.
016. У больного 6 лет диагностирована остеогенная саркома дистального метадиафиза бедренной кости.Какой объем оперативного
вмешательства может быть выполнен?
1. Подвертельная ампутация бедра.
2. Экзартикуляция бедра.
3. Обратная пластика.
4. Резекция с эндопротезированием.
5. Правильны ответы 1 и 3.
017. Больная 14 лет, рост 175 см; диагноз: остеогенная саркома проксимального метафиза бедренной кости. Мягкотканный компонент слабо выражен. Рентгенологическая протяженность 7 см.
Какой объем оперативного вмешательства возможен?
1. Экзартикуляция бедра.
584
2. Резекция бедренной кости с эндопротезированием.
3. Экскохлеация опухоли.
018. Больной 12 лет; диагноз: остеогенная саркома дистального мета-
диафиза большеберцовой кости. На каком уровне следует делать
ампутацию?
1. На границе верхней и средней трети большеберцовой кости.
2. На границе средней и нижней трети бедра.
3. Экзартикуляцию в коленном суставе.
019. Ребенок 10 лет; диагноз: остеогенная саркома дистального мета-
диафиза бедра.До начала специального лечения произошел патологический перелом. Лечебная тактика:
1. иммобилизация + химиотерапия;
2. иммобилизация + лучевая терапия;
3. подвертельная ампутация бедра + химиотерапия;
4. операция остеосинтеза + химиотерапия.
020. Больная 13 лет; диагноз: остеогенная саркома дистального метадиа-
физа бедренной кости.Мягкотканный компонент слабо выражен.
Рентгенологическая протяженность 10 см.Метастазы в легкие.Ваша лечебная тактика:
1. химиотерапия + подвертельная ампутация бедра;
2. химиотерапия + резекция бедра с эндопротезированием;
3. симптоматическая терапия.
021. В структуре опухолей у детей саркомы мягких тканей занимают:
1. 3-е место;
2. 4-е место;
3. 5-е место;
4. 6-е место.
022. У детей старше 1 года удельный вес сарком мягких тканей по отношению к другим опухолям составляет:
1. 3 %;
2. 5 %;
3. 8 %;
4. 12 %.
023. У детей до 1 года удельный вес сарком мягких тканей составляет:
1. 12 %;
2. 15 %;
3. 20 %;
4. 25 %.
024. Среди сарком мягких тканей чаще встречается:
1. ангиосаркома;
2. синовиальная саркома;
3. рабдомиосаркома.
025. Рабдомиосаркома среди сарком мягких тканей составляет:
1. до 30 %;
2. до 40 %;
3. до 50 %;
4. до 60 %.
026. Среди морфологических вариантов рабдомиосаркомы преобладает:
1. эмбриональный;
2. альвеолярный;
3. плеоморфный;
4. юингоподобный;
5. недифференцированный.
585
027. Чаще всего рабдомиосаркомы локализуются в области:
1. головы и шеи;
2. конечностей;
3. туловища;
4. мочеполовой системы.
028. Прогностически благоприятной локализацией рабдомиосаркомы
из перечисленных являются:
а) орбита;
б) паратестикулярная зона;
в) влагалище;
г) конечности;
д) мочевой пузырь.
1. Все перечисленные;
2. только а, б, в;
3. только а и б;
4. только а.
029. Прогностически неблагоприятной локализацией рабдомиосаркомы
из перечисленных являются:
а) конечности;
б) туловище;
в) брюшная и грудная полости;
г) поверхностные области головы и шеи.
1. Только два первых;
2. только а;
3. только а, б, в;
4. все перечисленные.
030. Рабдомиосаркома встречается чаще у детей в возрасте:
1. до 5 лет;
2. от 5 до 10 лет;
3. от 10 до 15 лет.
031. Синовиальная саркома и фибросаркомы встречаются чаще у детей
в возрасте:
1. до 5 лет;
2. от 5 до 10 лет;
3. от 5 до 14 лет.
032. В Международной классификации TNM категории ТЗ соответствует:
1. опухоль, прорастающая окружающие органы и/или ткани более
5 см;
2. опухоль, прорастающая окружающие органы и/или ткани менее 5 см;
3. наличие более одной опухоли (мультицентрический рост);
4. правильного ответа нет.
033. Причинами ошибочной диагностики при саркомах мягких тканей
у детей являются:
1. отсутствие у врачей онкологической настороженности;
2. незнание клинических проявлений сарком мягких тканей;
3. неумение определения необходимого набора диагностических
средств;
4. объективные трудности диагностики;
5. все перечисленные.
034. К группе параменингеальных относят опухоли, локализующиеся
в следующих областях:
1. полость носа и околоносовые пазухи, крылонебная ямка;
586
2. среднее ухо и височная область;
3. носоглотка;
4. орбита;
5. все перечисленные.
035. К группе непараменингеальных относят опухоли, локализующиеся
в следующих областях:
1. околоушно-жевательная;
2. ротоглотка;
3. мягкие ткани лица, шеи, волосистой части головы;
4. гортань и язык;
5. все перечисленные.
036. При рабдомиосаркоме влагалища ранними симптомами являются:
1. выделения из половых путей;
2. затрудненное мочеиспускание;
3. дизурические явления;
4. все перечисленные.
037. В начальных проявлениях рабдомиосаркома влагалища чаще принимается за:
1. вульвит;
2. вагинит;
3. остроконечные кондиломы;
4. полипы влагалища;
5. все перечисленное.
038. Начальными проявлениями рабдомиосаркомы среднего уха являются:
1. боли в ухе;
2. обтурация слухового прохода со снижением слуха;
3. припухлость в заушной области;
4. все перечисленное.
039. Для рабдомиосаркомы носоглотки ранними симптомами являются:
а) "гнусавость" голоса;
б) боли;
в) нарушение носового дыхания;
г) отделяемое из носа.
1. Все перечисленное;
2. только а;
3. только виг;
4. только в;
5. только г.
040. Рабдомиосаркома мочевого пузыря чаще локализуется в области:
1. дна пузыря;
2. задних стенок;
3. боковых стенок;
4. треугольника Литтла.
041. Ранними симптомами для рабдомиосаркомы мочевого пузыря являются:
1. гематурия;
2. пиурия;
3. дизурические явления;
4. болезненность при мочеиспускании;
5. острая задержка мочи.
587
2. местно-распространенные опухоли, когда хирургическое удаление новообразования сомнительно (стадии по pTNM Ша и II-
1Ь);
3. профилактическое облучение;
4. правильны ответы 1 и 2;
5. все перечисленное.
057. У больного рабдомиосаркома конечности.После операции проведено внутритканевое облучение ложа удаленной опухоли в СОД
30 Гр. Рекомендуется в дальнейшем:
1. химиотерапия;
2. дистанционное облучение в СОД 20—30 Гр;
3. 1 и 2;
4. лечение прекратить.
058. Наилучшие отдаленные результаты при лечении сарком мягких
тканей у детей зарегистрированы после проведения следующего
лечения:
1. радикально выполненной операции;
2. комбинированного (хирургическое + лучевая терапия);
3. комбинированного (хирургическое + химиотерапия);
4. комплексного;
5. зависят от стадии опухолевого процесса и адекватности выбранного специального лечения.
059. При I и II стадиях рабдомиосаркомы адекватным считается следующий объем терапии:
1. только хирургическое вмешательство;
2. комбинированное лечение (хирургическое + химиотерапия);
3. комбинированное лечение (хирургическое + лучевая терапия);
4. комплексное лечение.
060. При проведении химиотерапии при I стадии сарком мягких тканей чаще всего применяются следующие противоопухолевые препараты и их сочетания:
а) винкристин;
б) дактиномицин;
в) адриабластин;
г) вепезид;
д) препараты платины;
1. а + б;
2. г + д;
3. а + г + д;
4. а + б + д.
061. Выберите комбинацию химиопрепаратов для лечения первично
распространенной рабдомиосаркомы (рТ2; рТЗ а, Ь, с):
1. винкристин + дактиномицин + ифосфамид;
2. винкристин + адриабластин + дактиномицин;
3. винбластин + циклофосфан + метотрексат;
4. вепезид + карбоплатин + VM 26.
062. Имеется ли различие при выборе тактики химиотерапии у больных параменингеальными опухолями до 3 лет и старше 3 лет:
1. детям до 3 лет проводят более интенсивную химиотерапию;
2. детям до 3 лет проводят менее интенсивную химиотерапию;
3. различия нет.
063. Задача: у больного имеется саркома мягких тканей внутренней поверхности средней трети левого бедра. Размеры новообразования
590
4*4*Зсм.При выполнении хирургического вмешательства опухоль имела интимную связь с бедренной артерией.Удалена часть
опухоли.Объем резидуальной опухоли составляет 10 %.Установи-
те категорию рТ заболевания:
1. рТЗа;
2. рТЗЬ;
3. рТЗс.
064. Задача: больной поступил в стационар с рецидивом саркомы мягких тканей предплечья. Размеры рецидива 2 см в диаметре.Метастазов нет.Рекомендуемая стратегия терапии:
1. ПХТ;
2. хирургическое лечение;
3. хирургическое лечение + ПХТ;
4. операция в радиохирургическом варианте + дистанционное облучение + ПХТ;
5. хирургическое лечение + дистанционное облучение.
Раздел 16
ОПУХОЛИ КРОВЕТВОРНОЙ И ЛИМФАТИЧЕСКОЙ ТКАНИ
001. Лейкоз — системное заболевание крови, характеризующееся:
1. прогрессирующей клеточной гиперплазией в органах кроветворения с резким преобладанием пролиферативных изменений
над процессами нормальной дифференцировки клеток крови;
2. метабластическим разрастанием различных патологических
(анаплазированных) элементов;
3. и тем и другим;
4. правильного ответа нет.
002. Гемобластозы — опухоли кроветворной системы включают:
1. лейкозы;
2. лимфосаркомы;
3. лимфогранулематоз;
4. все перечисленное;
003. Системным поражением всей кроветворной ткани, или ее основных
компонентов, сопровождающимся характерным изменением периферической крови, является:
1. лейкоз;
2. гематосаркома;
3. нет правильного ответа;
4. все ответы правильны.
004. Общим с опухолями свойством лейкозов является:
1. неуклонное прогрессирующее течение;
2. постоянство прогрессии;
3. возможность получения лечебного эффекта от однотипных
препаратов;
4. возможность получения одним и тем же канцерогеном истинной опухоли и лейкоза;
5. все перечисленное.
005. Факторы, способствующие развитию лейкозов:
1. ионизирующая радиация;
2. химические агенты (химические профессиональные яды);
591
3. эндогенные химические соединения (индольные соединения,
класс стероидов — половые гормоны, желчные кислоты);
4. вирусные агенты;
5. конституциональные особенности;
6. все перечисленное.
006. Лейкозы у детей наиболее часто наблюдались в случаях:
1. родители были немолодыми в период зачатия ребенка;
2. родители были очень молодыми (ранние браки) в период зачатия ребенка;
3. возраст родителей не имеет значения;
4. имеет значение только возраст матери;
5. имеет значение только возраст отца.
007. Наиболее часто лейкозы у детей наблюдались при родителях,
имевших вредные привычки (прием алкоголя, курение):
1. связь не установлена;
2. прямая зависимость от длительности и выраженности вредных
привычек у обоих родителей;
3. связь установлена в случае вредных привычек у одного из родителей;
4. связь установлена в случае вредных привычек только у матери.
008. Чаще лейкозы у детей отмечались при родителях, имеющих определенные профессиональные вредности (водители автотранспорта,
работа в текстильной промышленности и др.):
1. связь не установлена;
2. слабая зависимость;
3. отчетливая зависимость.
009. У детей с лейкозами наблюдаются врожденные хромосомные аномалии:
1. трисомия в группе G;
2. мозаицизм 46/47;
3. анэуплоидия;
4. транслокации;
5. все перечисленное.
010. Хромосомные аномалии у детей с острым лейкозом встречаются:
1. часто;
2. редко.
011. Редкие хромосомные изменения при лейкозах:
1. t (4;11);
2. t (9;22);
3. все перечисленное.
012. Среди всех новообразований детского возраста лейкозы занимают:
1. первое место;
2. второе место;
3. третье место;
4. одно из последних мест.
013. Сколько детей заболевают острым лейкозом в СНГ ежегодно?
1. 1—2 тыс.
2. 3—5 тыс.
3. 6—8 тыс.
014. Какой процент приходится на острый лейкоз среди гемобластозов
у детей?
1. 10 %.
2. 30 %.
3. 50 %.
592
015. Какой процент приходится на острый лимфобластный лейкоз среди всей популяции больных лейкозом детей?
1. До 6 %.
2. До 50 %.
3. До 80 %.
016. Наиболее частый вид лейкозов у детей:
1. острый лимфобластный лейкоз;
2. острый нелимфобластный лейкоз;
3. хронический миелолейкоз;
4. хронический лимфолейкоз.
017. Субстрат опухоли при остром лейкозе:
1. незрелые, бластные клетки;
2. зрелые, дифференцированные клетки;
3. все ответы правильны;
4. правильного ответа нет.
018. Субстрат опухоли при хроническом лейкозе:
1. незрелые, бластные клетки;
2. зрелые, дифференцированные клетки;
3. все ответы правильны;
4. правильного ответа нет.
019. Случаи врожденных лейкозов у детей, зарегистрированные:
1. в возрасте до 1 года;
2. сразу после рождения (первые месяцы жизни);
3. до 3 лет.
020. В структуре врожденных лейкозов преобладает:
1. острый лимфобластный лейкоз;
2. хронический миелолейкоз;
3. острый нелимфобластный лейкоз;
4. нет различий в вариантах лейкоза.
021. Какой вариант лейкоза чаще встречается у детей в возрасте старше
5 лет?
1. Острый миелобластный.
2. Острый лимфобластный.
3. Хронический миелолейкоз.
022. Какой из вариантов лейкоза не встречается у детей?
1. Острый миелобластный.
2. Острый лимфобластный.
3. Хронический миелолейкоз.
4. Хронический лимфолейкоз.
023. Дети какого возраста чаще болеют острым лейкозом?
1. 1 года — 2 лет;
2. 3—5 лет;
3. 6—Шлет;
4. И—15 лет.
024. Кто чаще болеет острым лейкозом?
1. Мальчики.
2. Девочки.
025. В каком возрасте прогноз течения острого лимфобластного лейкоза наиболее благоприятный?
1. 6 мес.
2. 7 лет.
3. 12 лет.
4. 14 лет.
593
026. Нелимфобластные лейкозы у детей встречаются:
1. с той же частотой, как и у взрослых;
2. значительно реже, чем у взрослых.
027. Выберите наиболее частый морфологический вариант нелимфобластного лейкоза по FAB-классификации, встречающийся в детском возрасте:
1. МО.
2. Ml.
3. М2.
4. М3.
5. М4.
6. М5.
028. Какие изменения в анализе периферической крови наиболее часто встречаются в начале заболевания острым лимфобластным лейкозом?
а) Анемия.
б) Тромбоцитопения.
в) Увеличение СОЭ.
г) Лейкопения.
д) Лейкоцитоз.
е) Лимфоцитоз.
ж) Бластоз.
1. а, б, в, д, ж.
2. а, б, в, е.
3. а, б, в, г, е.
029. Система или орган, которому присуще наиболее частое поражение при остром лейкозе:
а) яичко;
б) нервная система;
в) глаза;
г) кожа;
д) мочевыводящая система;
е) пищеварительная система;
ж) дыхательная система.
1. а, б;
2. а, б, в, г;
3. все ответы правильны.
030. Наличие бластов в периферической крови при остром лейкозе:
1. обязательный признак;
2. не обязательный признак.
031. Какие методы диагностики позволяют провести точную диффе-
ренцировку лейкозов?
1. Клинические.
2. Морфологические.
3. Цитохимические.
4. Иммунологические.
032. При какой форме лейкоза более выражен геморрагический синдром?
1. При остром лимфобластном.
2. При остром миелобластном.
033. При каком морфологическом варианте нелимфобластного лейкоза
по FAB-классификации у детей выражены интоксикация, анемиче¬
594
ский, геморрагический синдромы, флебиты, тромбоэмболии, развитие ДВС синдрома?
1. МО.
2. Ml.
3. М2.
4. М3.
5. М4.
6. М5.
034. При каком цитозе цереброспинальной жидкости, исключая бла-
стные клетки, можно думать о нейролейкозе?
1. До 5 клеток.
2. Более 5 клеток.
3. Более 10 клеток.
035. Для профилактики нейролейкоза в современных программах лечения облучение головного мозга используется:
1. во всех случаях;
2. не используется;
3. по показаниям.
036. С целью профилактики нейролейкоза у детей наиболее часто используются следующие препараты для эндолюмбального введения:
а) цитозар;
б) винкристин;
в) метотрексат;
г) преднизолон;
д) гидрокортизон.
1. Все, кроме б;
2. в;
3. а, в.
037. Выберите прогностические критерии, используемые для определения активности острого лимфобластного лейкоза у детей при
лечении по программе BFM:
а) размеры лимфатических узлов;
б) размеры селезенки;
в) размеры печени;
г) выраженность анемии;
д) возраст;
е) лейкоцитоз свыше 50 тыс. в 1 мл3;
ж) бластоз периферической крови.
1. а, б, в, д, ж;
2. б, в, д, е, ж;
3. б, в, ж;
4. все перечисленное.
038. В какой период при остром лимфобластном лейкозе у детей наиболее целесообразна трансплантация костного мозга?
1. Первая ремиссия.
2. Рецидив.
3. Вторая ремиссия.
039. Выберите препараты, показавшие наибольшую эффективность в
лечении нелимфобластных лейкозов у детей:
1. винкристин, метотрексат, рубомицин, циклофосфан, преднизолон;
2. цитозар, рубомицин, вепезид;
3. тиогуанин, цитозар, циклофосфан.
595
040. Какова особенность сопроводительной терапии при программном
лечении МЗ-варианта нелимфобластного лейкоза у детей?
1. Применение заместительной терапии, введение гепарина, ингибиторов протеаз, свежезамороженной плазмы.
2. Антибактериальная, противовирусная терапия.
041. Какова особенность сопроводительной терапии при программном
лечении М5-варианта нелимфобластного лейкоза у детей?
1. Применение заместительной терапии, введение гепарина, ингибиторов протеаз, свежезамороженной плазмы.
2. Антибактериальная, противовирусная терапия.
042. Для какого возраста характерен ювенильный вариант (без филадельфийской хромосомы) хронического миелолейкоза?
1. 0—3 года.
2. 4—7 лет.
3. 8—11 лет.
4. 12—15 лет.
043. Назовите наиболее характерные клинические проявления хронического миелолейкоза:
1. спленомегалия;
2. гиперлейкоцитоз;
3. нарастающая интоксикация — общая слабость, утомляемость,
потеря массы тела, лихорадка;
4. все перечисленные.
044. Перечислите клинические особенности ювенильного хронического
миелолейкоза:
1. скоротечное развитие заболевания;
2. частое начало с острых болей в животе;
3. быстрое нарастание геморрагического синдрома;
4. увеличение периферических лимфатических узлов;
5. все перечисленные.
045. Выберете ранние предвестники наступления бластного криза при
хроническом миелолейкозе у детей:
1. увеличение размеров селезенки;
2. увеличение размеров печени;
3. увеличение размеров лимфатических узлов;
4. индекс удвоения лейкоцитов;
5. нарастание анемии;
6. правильны ответы 1 и 4.
046. Какое лечение считается принципиально эффективным при хроническом миелолейкозе у детей?
1. Применение химиотерапии.
2. Химиотерапия в сочетании с препаратами интерферона.
3. Аллогенная трансплантация костного мозга.
047. Возрастной пик заболевания детей лимфосаркомой:
1. до 1 года;
2. 5—9 лет;
3. 10—15 лет.
048. Субстрат опухоли при лимфосаркоме содержит:
1. зрелые малые лимфоциты (В-лимфоциты);
2. стволовые клетки;
3. лимфобласты;
4. атипичные мононуклеары;
5. атипичные лимфобласты.
596
049. Лимфосаркома поражает чаще:
1. мальчиков;
2. девочек;
3. достоверного различия нет.
050. Классификация лимфосаркомы по типу роста опухоли:
1. нодулярная и диффузная;
2. невластные и властные;
3. инфильтративный.
051. У детей встречается только следующий тип роста лимфосаркомы:
1. диффузный;
2. нодулярный.
052. По характеру опухолевых клеток у детей наиболее часто встречается:
1. лимфовластная лимфосаркома;
2. иммунобластная лимфосаркома;
3. пролимфоцитарная лимфосаркома.
053. Самый частый морфологический вариант лимфосаркомы у детей:
1. пролимфоцитарный;
2. опухоль Беркитта;
3. иммунобластный;
4. лимфобластный.
054. При лимфосаркоме у детей наиболее часто поражаются следующие
группы периферических лимфатических узлов:
1. шейные;
2. паховые;
3. подвздошные;
4. подмышечные;
5. правильны ответы 1 и 5.
055. Самая частая первичная локализация лимфосаркомы у детей в общей популяции больных:
1. периферические лимфатические узлы;
2. глоточное кольцо;
3. мягкие ткани;
4. брюшная полость;
5. средостение.
056. Самая частая первичная локализация лимфосаркомы у детей в
возрасте до 3 лет:
1. периферические лимфатические узлы;
2. глоточное кольцо;
3. мягкие ткани;
4. брюшная полость;
5. средостение.
057. При какой первичной локализации лимфосаркомы у детей чаще
наблюдается поражение костного мозга?
1. Мягкие ткани.
2. Периферические лимфатические узлы.
3. Средостение.
4. Илеоцекальная область.
5. При всех, кроме пункта 4.
058. При лимфосаркоме у детей наиболее часто поражаются следующие отделы желудочно-кишечного тракта:
1. тонкий кишечник;
2. прямая и сигмовидная кишки;
597
3. илеоцекальный угол;
4. восходящий отдел ободочной кишки;
5. желудок.
059. Общие симптомы интоксикации при лимфосаркоме у детей:
1. не выражены;
2. ярко выражены;
3. зависят от стадии.
060. Характерно ли появление зуда при лимфосаркоме в качестве симптома общей интоксикации?
1. Да.
2. Нет.
3. Иногда.
4. В большинстве случаев.
061. Препараты, наиболее часто используемые при лечении лимфосар-
комы у детей:
а) винкристин;
б) 5-фторурацил;
в) циклофосфан;
г) проспидин;
д) платидиам;
е) рубомицин;
ж) блеомицин;
з) преднизолон;
и) адриабластин.
1. а, б, е, з, и;
2. кроме б, г, д;
3. кроме б, г.
062. Вид поражения ЦНС при лимфосаркоме:
1. по типу нейролейкоза;
2. опухолевое поражение ЦНС с опухолевой инфильтрацией;
3. правильны ответы 1 и 2.
063. Частота лимфогранулематоза у детей:
1. одна из самых редких форм гемобластозов;
2. уступает по частоте только лимфобластным лейкозам;
3. самая частая форма гемобластозов.
064. Лимфогранулематоз у детей характеризуется:
1. быстрым течением с частой генерализацией;
2. медленным течением;
3. редкой генерализацией.
4. таким же темпом течения, как и у взрослых.
065. Наиболее часто лимфогранулематоз встречается у детей в возрасте:
1. до 3 лет;
2. от 4 до 6 лет;
3. от 6 до 8 лет;
4. старше 10 лет;
5. правильны ответы 2 и 4.
066. Среди детей, страдающих лимфогранулематозом, преобладают:
1. мальчики;
2. девочки;
3. достоверного различия нет.
067. Различают следующие морфологические варианты лимфогранулематоза у детей:
1. лимфоидное преобладание;
598
2. смешанно-клеточный;
3. лимфоидное истощение;
4. нодулярный склероз;
5. все ответы правильны.
068. Морфологический вариант лимфоидного истощения лимфогранулематоза может указывать на:
1. плохой прогноз;
2. хороший прогноз;
3. не влияет на прогноз.
069. При лимфогранулематозе у детей прогноз особенно неблагоприятен
в возрасте:
1. от 2 до 6 лет;
2. от 8 до 10 лет;
3. до 12 лет;
4. старше 12 лет.
070. При лимфогранулематозе у детей наиболее часто поражаются:
1. шейные лимфатические узлы;
2. югулярные лимфатические узлы;
3. лимфатические узлы средостения;
4. забрюшинные и паховые лимфатические узлы;
5. локтевые лимфатические узлы.
071. При лимфогранулематозе у детей младшей возрастной группы первичное поражение лимфатических узлов средостения встречается:
1. часто;
2. редко;
3. крайне редко;
4. не встречается.
072. При лимфогранулематозе у детей старшей возрастной группы первичное поражение лимфатических узлов средостения встречается:
1. часто;
2. редко;
3. крайне редко;
4. не встречается.
073. К симптомам общей интоксикации, которые учитываются при установлении стадии лимфогранулематоза, относятся:
а) необъяснимая лихорадка свыше 38 °С;
б) ночной проливной пот со сменой белья;
в) прогрессирующая потеря массы тела;
г) выраженный кожный зуд;
д) слабость;
е) анорексия;
ж) адинамия;
з) изменения сна.
1. Правильны ответы а, б, в.
2. Правильны ответы г, д, е.
3. Правильны ответы ж, з.
074. IV стадия лимфогранулематоза у детей может быть установлена при:
1. изолированном поражении селезенки;
2. изолированном поражении печени или костей;
3. поражении органов с поражением лимфатических узлов или без
него;
4. правильны ответы 1 и 2;
5. правильны ответы 2 и 3.
599
075. При лимфогранулематозе у детей дифференциальный диагноз чаще
всего проводят со следующими заболеваниями:
а) сифилитическим лимфаденитом;
б) туберкулезным и банальным лимфаденитом;
в) грибковым поражением лимфатических узлов;
г) болезнью кошачьей царапины;
д) бруцеллезом и туляремией.
1. а, б, в, г;
2. б, в, г;
3. б, в, г, д.
076. Основным морфологическим критерием для постановки диагноза
лимфогранулематоза является:
1. стертый рисунок строения лимфатического узла;
2. наличие клеток Березовского — Штернберга;
3. наличие клеток Ходжкина;
4. наличие клеток Пирогова — Лангерганса.
077. Современное лечение лимфогранулематоза у детей включает:
1. индуктивную полихимиотерапию, консолидирующую лучевую
терапию зон первичного поражения, реиндуктивную химиотерапию;
2. индуктивную полихимиотерапию, консолидирующую лучевую
терапию по "радикальной программе", реиндуктивную химиотерапию;
3. индуктивную полихимиотерапию, консолидирующую лучевую
терапию зон первичного поражения.
078. Наиболее частые симптомы при остром лейкозе в костной системе
на рентгенограммах:
1. просветления в трубчатых костях;
2. уплотнение костной структуры;
3. патологические переломы;
4. симптомы, напоминающие воспалительный процесс;
5. утолщение массы коркового вещества кости.
079. Какой из указанных анализов необходим при диагностике лейкоза:
а) клинический анализ периферической крови;
б) подсчет числа ретикулоцитов;
в) подсчет числа тромбоцитов;
г) определение уровня иммуноглобулинов;
д) определение числа Т- и В-лимфоцитов;
е) морфологическое исследование костного мозга.
1. а, б, в, е.
2. б, в, г, д.
3. а, г, д.
4. а, б, г.
080. При подозрении на острый лейкоз для подтверждения диагноза
необходимо:
1. определить число ретикулоцитов;
2. провести исследование костного мозга;
3. провести биопсию лимфатического узла;
4. определить процентное содержание лейкоцитов;
5. провести биопсию селезенки.
600
081. При дифференциальной диагностике мононуклеоза с острым лейкозом наиболее эффективным исследованием является:
1. цитологическое исследование лимфатического узла с подсчетом форменных элементов;
2. исследование периферической крови;
3. исследование костного мозга;
4. иммуноэлектрофорез.
082. 7-летнюю девочку лихорадит 10 дней.Выявлены генерализованное увеличение лимфатических узлов, гепатоспленомегалия, подкожные кровоизлияния и кровоизлияния в слизистой оболочке
полости рта, воспалительный процесс в ротоглотке. Кроме обычных анализов, прежде всего необходимо сделать:
1. пункцию костного мозга;
2. биопсию лимфатического узла;
3. реакцию Пауля—Бурнетта;
4. биопсию селезенки;
5. биопсию печени.
083. У 7-летней девочки, здоровой до данного момента, внезапно без
какой-либо травмы появились на коже синяки и кровоподтеки.
Назовите наиболее вероятный диагноз:
1. острый лимфобластный лейкоз;
2. болезнь Шенлейна—Геноха;
3. идиопатическая тромбоцитопения;
4. гемофилия;
5. ни одно из указанных.
084. Год назад у 5-летнего ребенка был поставлен диагноз острого лимфобластного лейкоза.В течение нескольких дней ребенка лихорадит, он жалуется на недомогание, головную боль и нарушение зрения.Появились судороги.Анализ крови и костного мозга показал
сохранение гематологической ремиссии.Какой из приведенных
ниже диагнозов наиболее правдоподобен:
1. пищевое отравление;
2. внутричерепное кровоизлияние;
3. гнойный цереброспинальный менингит;
4. поражение ЦНС при лейкозе;
5. вирусный менингит.
085. 3-летняя девочка с острым лимфобластным лейкозом получает
поддерживающее лечение 6-меркаптопурином и метотрексатом.
Число лейкоцитов в анализе периферической крови — 3 • 109/л.
Следует:
1. снизить наполовину дозу обоих препаратов;
2. снизить наполовину дозу метотрексата;
3. временно отменить оба препарата;
4. временно отменить одно лекарство;
5. оставить полную дозу препаратов.
086. Увеличение времени протромбина, гиперфибриногенемия, повышенная концентрация продуктов деградации фибрина, положительный протромбиновый и этаноловый тест, тромбоцитопения
особенно характерны для:
1. острого лимфобластного лейкоза;
2. острого промиелоцитарного лейкоза;
3. хронического миелолейкоза;
4. хронического лимфолейкоза;
5. ни для одного из указанных процессов.
601
087. Профилактическое облучение ЦНС применяется при:
1. лимфогранулематозе;
2. остром лимфобластном лейкозе;
3. нейробластоме;
4. лангергансоклеточном гистиоцитозе;
5. опухоли Вильмса.
088. Какой из приведенных симптомов не типичен для лимфогранулематоза?
1. Увеличение селезенки.
2. Увеличение лимфатических узлов.
3. Ложный зуд.
4. Повышение температуры.
5. Значительный лейкоцитоз с лимфоцитозом.
089. При дифференциальной диагностике лимфогранулематоза с хроническим неспецифическим воспалением лимфатических узлов
решающее значение имеет:
1. исследование периферической крови;
2. результат морфологического исследования лимфатического узла;
3. протеинограмма;
4. уровень щелочной фосфатазы крови;
5. ни одно из указанных исследований.
090. Лангергансоклеточный гистиоцитоз — это:
1. генетически обусловленное заболевание, связанное с хромосомой X;
2. комплекс разрастаний в РЭС-системе;
3. паразитарное заболевание;
4. ни одно из указанных.
ЭТАЛОНЫ ОТВЕТОВ
Раздел 1
ОСНОВЫ СОЦИАЛЬНОЙ ГИГИЕНЫ И ОРГАНИЗАЦИИ
ОНКОЛОГИЧЕСКОЙ ПОМОЩИ ДЕТЯМ
001 -
4
2,
033 —
2
050 —
1
3
5
002 —
3
3
034-
2
051 —
1
065-
3
076-
4
003-
1
018 —
1
035 —
2
052 —
3
066-
3
077-
4
004-
3
019 —
4
036-
2
053-
3
067-
1
078-
4
005-
1
020-
2
037-
4
054-
5
068-
1,
079-
4
006-
1
021 -
2
038-
3
055-
2
2,
080-
1
007-
2
022-
1
039-
2
056-
2
3,
081 -
1
008-
1
023-
4
040-
2
057-
1
5
082-
2
009-
1
024-
1
041 —
2
058 —
4
069-
4
083 —
4
010 —
1
025-
2
042-
3
059 —
5
070-
1
084-
5
011 —
2
026-
3
043-
5
060-
1
071 -
2
085 —
3
012 —
2
027-
4
044-
3
061 —
4
072-
3
086 —
3
013 —
2
028-
3
045-
4
062-
3,
073-
3
087-
4
014 —
3
029-
1
046-
5
4
074-
3
088-
1
015 —
1
030-
2
047-
4
063-
2
075-
1,
089-
4
016 —
2
031 —
3
048-
2
064-
1,
2,
090-
4
017-
1,
032-
3
049-
4
2,
3,
091 -
2
Раздел 2
ХИРУРГИЧЕСКАЯ АНАТОМИЯ И ОПЕРАТИВНАЯ ХИРУРГИЯ
001-
-5
012 -
-3
019 -
-3
029-
-2
040-
- 1
049-
-3
002-
- 5
013 -
-6
020-
- 1,
030 -
- 1
041 -
- 1
050 -
-2
003 -
-4
014 -
- 1,
2
031 -
-4
042-
- 1
051 -
-2
004-
-3
2,
021 -
-2
032-
-2
043-
- 1
052-
- 1
005-
-3
3
022-
- 1
033 -
-2
044-
- 1
053 -
-2
006-
- 1
015 -
-4
023-
-3
034-
-3
045-
-4
054-
-4
007-
-2
016-
- 1,
024-
-5
035 -
- 1
046-
-2
055 -
-4
008 -
- 1
2,
025 -
- 1
036-
-4
047-
- 1
056-
-3
009 -
-2
3
026-
-2
037-
-3
048-
- 1,
010 -
- 2
017 -
-2
027-
-3
038-
- 1
2,
011-
- 1
018-
-2
028-
- 1
039-
- 3
3
Раздел 3
МОРФОЛОГИЯ ОПУХОЛЕЙ
001 -
-1
012 -
- 1
020-
-2
031 -
- 1
042-
- 3
053 -
- 1
064-
- 1
002-
-5
013 -
- 1
021 -
- 3
032 -
- 1
043-
- 1
054-
-2
065-
-2
003-
-4
014 -
-4
022-
- 5
033-
-4
044-
-4
055-
-4
066-
-5
004-
-5
015 -
-4
023-
-3
034-
-2
045-
- 1
056 -
- 1
067-
- 6
005 -
-4
016 -
-2
024-
-4
035 -
-3
046-
-2
057 -
-4
068-
-2
006-
-4
017 -
-5
025 -
- 1
036-
- 1
047-
-3
058 -
-5
069-
- 3
007-
- 1
018 -
- 1
026-
-3
037-
-3
048-
-2
059-
-4
008-
- 1
019-
- 1,
027-
-3
038 -
-2
049-
- 1
060 -
-3
009-
- 1
2,
028-
-1
039-
- 1
050-
- 3
061 -
-5
010 -
- 1
3,
029-
-5
040-
-5
051 -
- 1
062-
-2
011-
-3
4
030-
- 1
041-
- 2
052-
-2
063-
-3
603
Раздел 4
ОСНОВЫ ТЕОРЕТИЧЕСКОЙ И ЭКСПЕРИМЕНТАЛЬНОЙ ОНКОЛОГИИ
001 - 3
002- 3
003- 3
004- 2
005- 1
006- 1
007- 5
008- 4
001- 5
002- 5
003- 5
004- 1
005- 4
006- 2
007- 2
008- 3
009- 1
010- 3
011- 3
012- 4
013- 2
014- 5
015- 3
016- 1
5
009- 5
010- 2
011- 4
012- 2
013- 3
014- 1
015- 1
016- 4
6
017- 4
018- 5
019- 5
020- 5
021 - 1
022- 3
023- 1
024- 1
017- 2
018- 3
019- 4
020- 4
021- 3
022- 1
023- 3
024- 2
025- 2
026- 2
027- 3
028- 1
029- 2
030- 2
031- 2
032- 1
025- 4
026- 1
027- 2
028- 3
029- 5
030- 4
031 - 5
032-3
033- 4
034- 4
035- 3
036- 4
037- 4
038- 1
039- 3
040 -6
033- 2
034- 5
035- 4
036- 5
037- 4
038 -1
039- 3
040- 3
041- 5
042- 3
043- 2
044 -4
045- 1
046- 3
047- 1
048- 5
041-2
042 -2
043-5
044 -2
045-4
046 -4
047- 3
048- 2
049- 3
050- 4
051 - 5
052- 4
053- 4
054- 5
055- 4
049 -4
050- 1
051 - 1
052-1
053 - 3,
4
Раздел
ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Раздел
МЕТОДЫ ДИАГНОСТИКИ
001 -
5
011 —
2
021 —
3
031 -
1
041 -
5
051 —
1
060 —
1
002-
4
012 —
4
022-
4
032-
3
042-
5
052-
4
061 —
1
003 —
4
013 —
5
023 —
1
033 —
2
043-
2
053 —
5
062-
5
004-
2
014 —
3
024-
3
034-
4
044-
1
054 —
5
063-
4
005-
1
015 —
4
025 —
1
035 —
5
045-
1
055 —
3
064-
5
006-
1
016 —
4
026 —
3
036-
4
046-
2
056 —
1
065 —
1
007 —
4
017 —
4
027-
5
037 —
5
047-
3
057 —
1,
066 —
4
008-
5
018 —
5
028 —
4
038 —
3
048-
3
3
067-
5
009-
1
019 —
4
029 —
5
039-
4
049-
2
058 —
2
068 —
1
010-
2
020-
5
030-
3
040-
5
050-
2
059-
1
069-
1
070-6
Раздел 7
ОПУХОЛИ ГОЛОВЫ И ШЕИ
001 -
- 2
010 —
2
022-
- 1
034-
- 1,
042-
-7
054-
- 1
002-
- 1
011
1
023-
- 1
2,
043-
- 1
055 -
-4
003 -
-4
012 -
1
024-
- 2
3,
044-
-5
056-
-5
004-
- 5
013 —
2
025-
- 3
4,
045-
- 1
057 -
-5
005 -
- 1
014 —
1
026-
- 4
5
046-
- 1
058 -
-4
006 -
- 1
015 —
2
027-
- 5
035-
- 1
047-
- 1
059 -
-4
007-
-6
016 —
6
028-
- 1
036-
-2
048 -
- 1
060 -
-2
008 -
- 1,
017 —
1
029-
- 2
037-
-2
049-
-4
061 -
- 1
5
018 —
10
030-
- 3
038-
-3
050-
-4
062-
- 1
009-
-2,
019 —
4
031 -
-4
039-
-5
051 -
- 5
063 -
- 1
3,
020-
1
032-
- 5
040-
-4
052 -
- 1
064-
- 1
4
021 -
3
033-
- 2
041 -
- 5
053-
- 1
065-
-5
604
066 -2 072- 3 078-3
067 - 2 073- 3 079-4
068 - 1 074- 5 080-5
069-2 075- 2 081 -1
070 - 3 076- 3 082-4
071 - 3 077-4 083-2
Раздел 8
ОПУХОЛИ ГЛАЗА И ОРБИТЫ
001 - 2 008- 3 015-1
002- 1 009- 3 016-5
003- 4 010-4 017-4
004- 3 011-4 018-4
005- 5 012- 2 019-5
006- 4 013-4 020-4
007- 2 014-4 021-5
084 - 5 090-4
085 - 1 091 -3
086 - 2 092-2
087 - 4 093-4
088 - 5 094-3
089 - 2 095-1
043- 1
044 -3
045-3
022- 5
023- 2
024- 4
025- 3
026- 2
027- 2
028- 1
029- 4
030- 5
031 - 3
032-3
033 -4
034-1
035 -2
036- 1
037- 1
038- 3
039- 5
040 -3
041- 4
042- 2
Раздел 9
ОПУХОЛИ ОРГАНОВ ГРУДНОЙ КЛЕТКИ
001 -
>4
022-
- 1
043-
- 3
064-
- 3
084-
- 1
103 -
-2
002-
- 3
023-
-2
044-
-6
065 -
-4
085 -
-5
104 -
- 1
003-
-4
024-
- 3
045-
- 3
066 -
-5
086-
-3
105 -
-2
004-
-5
025-
- 5
046-
-5
067-
-3
087-
- 1
106 -
-4
005-
-5
026-
- 1
047-
-3
068 -
-2
088 -
- 1
107 -
-5
006-
-5
027-
-5
048-
-4
069-
-2
089 -
-1,
108 -
- 1
007-
- 3
028-
-3
049-
- 1
070-
- 1
2,
109 -
- 1
008-
-4
029-
-5
050 -
- 3
071 -
-5
3
110 -
-4
009-
- 1
030 -
- 1
051 -
-4
072-
- 1
090-
-3
111-
-4
010 -
-5
031 -
- 5
052 -
-5
073 -
-6
091 -
-4
112-
- 1
011 -
- 2
032-
- 1
053 -
- 3
074-
-5
092-
-4
113-
-5
012 -
- 1
033 -
- 5
054-
-4
075 -
-4
093 -
-4
114-
-5
013 -
-3
034-
-5
055 -
-4
076-
-4
094-
- 1
115 -
- 1
014 -
-2
035-
- 2
056 -
-4
077-
-4,
095 -
-4
116 -
-5
015 -
- 1
036 -
-4
057-
-4
5
096-
-4
117 -
- 1
016 -
-2
037-
-5
058 -
-2
078 -
-5
097-
- 1
118 -
-4
017 -
-5
038 -
- 5
059 -
- 5
079-
-4
098 -
-5
119 -
-4
018 -
-4
039-
- 5
060-
-4
080-
- 1
099-
-5
120 -
- 1
019 -
- 5
040-
- 4
061 -
- 5
081 -
-4
100 -
-4
121 -
-5
020-
- 1
041 -
- 1
062-
-4
082 -
-4
101 -
- 5
122 -
- 1
021-
-4
042-
- 1
063-
-4
083 -
- 3
102-
-2
123-
- 6
124-3
Раздел 10
ОПУХОЛИ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ
001 —
3
008-
4
015 —
4
022-
1
029 —
2
036-
2
043-
1
002 —
3
009-
1
016 —
1
023-
4
030-
4
037-
2
044-
5
003 —
5
010 —
4
017 —
2
024-
1
031 -
3
038 —
2
045-
1
004-
1
011 —
1
018 —
5
025 —
4
032-
5
039 —
1
046-
1
005-
2
012 —
5
019 —
3
026-
2
033 —
2
040-
1
047-
3
006-
1
013 —
1
020-
5
027-
3
034-
3
041 -
1
048-
5
007-
1
014-
4
021-
1
028-
1
035-
2
042-
3
605
Раздел 11
ЗАБРЮШИННЫЕ ВНЕОРГАННЫЕ ОПУХОЛИ
001- 1 008- 1 015- 2 022-4 029-4 036 —
002- 2 009- 2 016- 2 023-4 030-2 037 —
003- 1 010- 1 017- 5 024-4 031-2 038 —
004- 1 011- 2 018-4 025- 1 032- 1 039-
005- 2 012- 2 019- 3 026-4 033- 3 040-
006- 4 013- 2 020- 1 027- 1 034-2
007- 5 014-4 021 - 5 028- 1 035- 1 041 —
5 042-3
2 043-3
1 044 -6
2 045-6
2,
3
3
Раздел 12
ОПУХОЛИ ПОЛОВЫХ ОРГАНОВ У ДЕТЕЙ
001 -
- 1
009-
-1
017 -
- 1
025-
-5
033-
-4
041 -
- 3
049-
-3
002-
- 1
010 -
-4
018 -
- 3
026-
-3
034-
-5
042-
- 2
050-
- 1
003-
- 3
011-
- 1
019 -
-4
027-
- 1
035 -
- 1
043-
- 3
051 -
-4
004-
- 1
012 -
- 3
020-
- 3
028-
- 1
036 -
-3
044-
- 3
052 -
- 1
005-
- 3
013 -
-4
021 -
- 1
029-
-5
037 -
- 1
045-
- 1
053-
- 1
006-
-2
014 -
-5
022-
- 3
030-
- 1
038 -
-2
046-
-5
054-
- 3
007-
-5
015 -
- 3
023 -
- 3
031 -
-3
039 -
- 1
047-
- 3
008-
-2
016-
-3
024-
-2
032-
- 1
040-
- 1
048-
-5
Раздел 13
ОПУХОЛИ МОЧЕПОЛОВОЙ СИСТЕМЫ
001 -
- 1
011 -
- 1
021 -
- 3
031 -
-4
041 -
- 2
051 -
-2
061 -
- 1
002-
-2
012 -
-2
022-
-4
032-
- 3
042-
-2
052 -
- 1
062-
-4
003-
-2
013 -
-5
023-
-6
033-
-6
043-
-3
053-
-2
063-
-4
004-
- 1
014 -
-2
024-
-5
034-
-2
044-
-4
054-
- 2
064-
- 3
005-
-5
015 -
-3
025-
-2
035 -
-8
045-
- 1
055-
- 1
065-
- 1
006-
- 3
016 -
-4
026-
-3
036-
-6
046-
-3
056 -
-2
066 -
- 2
007-
- 1
017 -
- 2
027-
- 3
037-
-4
047-
-6
057-
- 1
067-
- 3
008 -
- 2
018-
- 2
028-
-4
038-
-6
048-
- 1
058 -
-2
068-
-4
009-
-4
019 -
-2
029-
-6
039 -
-6
049-
-2
059-
-5
010-
-4
020-
- 5
030-
- 1
040-
- 1
050-
- 3
060-
- 1
Раздел 14
ОПУХОЛИ КОЖИ
001 - 2 005-5
002 - 3 006-4
003 - 1 007-3
004 - 4 008-2
009- 4 013- 5 017- 2 021 -2
010- 2 014- 5 018-2 022-2
011- 4 015- 6 019- 3 023-4
012- 5 016- 1 020- 2 024-2
Раздел 15
ОПУХОЛИ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА
001 - 2 003- 3 005- 2 007- 1 009- 3 011
002- 3 004- 2 006- 1 008-2 010- 1 012
5 013-4
2 014-5
606
015- 4 023- 1 031 - 3 039- 3 047- 1 055- 4 063 —
016- 5 024- 3 032-4 040-4 048- 3 056-4 064-
017- 2 025- 2 033- 5 041 - 3 049- 1 057-3
018 - 2 026- 1 034- 5 042 - 2 050- 3 058-5
019- 3 027- 1 035- 5 043- 2 051 -4 059-2
020 - 2 028- 2 036- 1 044 - 4 052-4 060-1
021 - 2 029- 3 037- 5 045- 2 053- 4 061 -1
022 - 3 030- 1 038- 1 046 - 5 054- 5 062-1
Раздел 16
ОПУХОЛИ КРОВЕТВОРНОЙ И ЛИМФАТИЧЕСКОЙ ТКАНИ
001 -
- 3
014 -
- 3
027-
- 3
040-
- 1
053-
-4
066 -
- 1
079-
002-
-4
015 -
-3
028-
-2
041 -
-2
054-
- 1
067-
-5
080-
003 -
- 1
016 -
- 1
029-
- 1
042-
- 1
055 -
-4
068 -
- 1
081 —
004-
-5
017 -
- 1
030 -
-2
043-
-4
056 -
- 5
069-
-4
082 —
005-
-6
018 -
-2
031 -
-4
044-
-5
057-
- 5
070-
- 1
083 —
006-
- 1
019 -
- 1
032-
-2
045-
-6
058 -
-3
071 -
-4
084 —
007-
-2
020-
-2
033 -
-4
046-
- 3
059-
- 1
072-
- 1
085 —
008-
-3
021 -
-2
034-
-3
047-
-2
060-
-2
073 -
- 1
086 —
009-
-5
022-
-4
035 -
-3
048-
-5
061 -
-3
074-
-5
087-
010 -
- 1
023-
-2
036-
-2
049-
- 1
062-
- 3
075-
-2
088 —
011-
- 4
024-
- 1
037-
- 3
050 -
- 1
063 -
- 2
076-
- 2
089 —
012 -
-2
025-
-2
038-
-3
051 -
- 1
064-
-4
077-
-3
090-
013-
- 3
026-
-2
039-
-2
052-
- 1
065-
- 5
078-
- 1
2
4
1
2
3
1
1
4
5
2
2
5
2
2
Учебник
Лев Абрамович Дурнов,
Генрих Витальевич Голдобенко
ДЕТСКАЯ ОНКОЛОГИЯ
Зав. редакцией Т.П. Осокина
Научный редактор Э.М. Попова
Художественный редактор С.М. Лымина
Технический редактор В.Г. Александрова
Корректор Л.П. Колокольцева
ЛР № 010215 от 29.04.97. Сдано в набор 12.04.2002.
Подписано к печати 10.06.2002. Формат бумаги 60x90 У16.
Бумага офсетная №1. Гарнитура Таймс. Печать офсетная.
Усл.печ.л. 38,25. Усл.кр.-отг. 39,0.
Уч.-изд. л. 42,77. Тираж 3000 экз. Заказ № 0205180.
Ордена Трудового Красного Знамени издательство
“Медицина".
101990, Москва, Петроверигский пер., 6/8.
Отпечатано в полном соответствии
с качеством предоставленного оригинал-макета
в ОАО «Ярославский полиграфкомбинат»
150049, Ярославль, ул. Свободы, 97.
|UI !к.1
ISBN S-aES-04b3B-fl
785225
346392
9