Author: Левин Ю.М.
Tags: различные формы заболеваний, методы их лечения, применения лекарственных средств медицина реаниматология
Year: 1975
Text
ОСНОВЫ РЕАНИМАТОЛОГИИ
В книге освещены общие закономерности процессов,
развивающихся в организме при умирании и в восстановительном
периоде после оживления. Рассмотрены вопросы о нарушении
функции дыхания, сердечно-сосудистой, центральной нервной
и эндокринной систем, функции печени, почек и др.
Изложены принципы лечения терминальных состояний, вызванных
различными причинами. Обосновано понятие о новой
нозологической единице — постреанимационной болезни.
Особое внимание уделено прогнозу восстановления
функций организма и диагнозу «смерти мозга».
ОСНОВЫ РЕАНИМАТОЛОГИИ
Издание второе, переработанное
и дополненное
Под редакцией
члена-корреспондента АМН СССР
В. А. НЕГОВСКОГО
МОСКВА «МЕДИЦИНА». 1975
УДК 616-036.882-08
РЕФЕРАТ
Второе, существенно переработанное издание книги «Основы реаниматологии»
под редакцией члена-корреспондента АМН СССР, лауреата Государственных премий
СССР профессора В. А. Неговского обобщает опыт мировой и отечественной науки в
области теоретической и клинической реаниматологии*
В книге рассмотрен ряд вопросов, которые не были освещены в первом издании;
зключены 6 новых глав; 9 глав, входящих в первое издание, полностью переработа-
ны и 5 глав дополнены новыми данными. В книге представлены основные вопросы
патофизиологии сердечно-сосудистой системы, дыхания, центральной нервной системы,
печени, почек, эндокринной системы, нарушения микроциркуляции и обмена веществ в
процессе умирания организма и в восстановительном периоде после клинической смер-
ти. В книге широко освещены вопросы клиники и терапии терминальных состояний,
вызванных патологией сердечно-сосудистой системы, острой дыхательной недостаточ-
ностью, кровопотерей, травмой, акушерско-гинекологической патологией, острыми эк-
зогенными отравлениями, утоплением, электротравмой, аллергическими реакциями;
списаны патогенез, клиника и терапия постреанимационной болезни, морфологические
изменения головного мозга и внутренних органов при терминальных состояниях.
В книге рассмотрены вопросы анестезии; функционального состояния системы
гемостаза у больных, находящихся в терминальных состояниях; прогноз восстановле-
ния функций организма и диагноз «смерти мозга»; организация работы в отделении
реанимации общего профиля и выездных реанимационных бригад; приводятся мето-
дические указания по обучению доврачебным методам реанимации.
Книга рассчитана на врачей разных специальностей, работающих в области реа-
ниматологии, а также на студентов-медиков.
ОСНОВЫ РЕАНИМАТОЛОГИИ
Редактор Ю. М. Левин
X} дожественный редактор Л. С. Бирюкова Техн, редактор В. С Артамонова
Оформление художника В. С. Сергеевой Корректор М. П. Молокова
Сдано в набор 27/IX 1974 г. Подписано к печати 13/Н 1975 г. Формат бумаги 70X90!/ie
22,5 печ. л. (условных 26,33 п. л.) 27,91 уч.-изд. л. Тираж 25 000 экз. Т-00970 МН-71.
Цена 2 р. 04 к.
Издательство «Медицина». Москва, Петроверигский пер., 6/8
Заказ 1266 Московская типография № Ц Союзполиграфпрома при Государственном
комитете Совета Министров СССР по делам издательств, полиграфии и книжной
торговли. Москва, 113105, Нагатинская, 1.
© Москва. «Медицина». 1975
0 5050°-122 87-75
039@1)—75
ПРЕДИСЛОВИЕ
Все возрастающее внимание к вопросам теоретической и клинической
реаниматологии, а также благожелательный интерес к книге «Основы
реаниматологии», проявленный со стороны врачей различных специаль-
ностей, побудили нас подготовить второе издание этой книги. Со времени
выхода в свет первого издания прошло 9 лет и, естественно, в новое
издание мы включили накопленные за эти годы данные, дополняющие,
а в некоторых случаях и частично изменяющие высказанную ранее точку
зрения на тот или иной вопрос. В книге рассматривается ряд новых
проблем, которым не могло быть уделено внимание в прежнем издании.
В настоящее время уже ни у кого не вызывает сомнения, что край-
ние стадии шока и массивная кровопотеря, особенно по мере их раз-
вития, приобретают черты, типичные для терминальных состояний. Эти
формы патологических процессов имеют большой удельный вес в ста-
тистике терминальных состояний. В этой связи вопросам патологии,
профилактики и терапии терминальных состояний, вызванных шоком и
кровопотерей, 'посвящен ряд (глав.
В книге впервые поставлен вопрос о постреанимационной болезни
(«болезни оживленного человека») как новой нозологической единице,
о ее сущности, механизмах возникновения и принципах лечения. Нару-
шения функций центральной нервной системы в клинической картине
постреанимационной болезни имеют особое значение. Именно они опре-
деляют полноценность человека после оживления и, следовательно, целе-
сообразность реанимации. В настоящее время формируется крайне важ-
ная глава реаниматологии, которую можно назвать неврологией терми-
нальных состояний. Необходимость развития этого направления в
реаниматологии вообще и, в частности, для лечения постреанимацион-
ной болезни трудно переоценить. Эти вопросы, а также одна из наиболее
актуальных проблем современной науки об оживлении организма —
проблема «смерти мозга», подвергаются поэтому более детальному
рассмотрению во втором издании книги. Обосновано понятие «смерть
мозга» и изложены пути диагноза этого состояния.
По-новому рассматривается патология обмена веществ при гипоксии
в терминальных состояниях и обсуждаются вновь выделенные типы
гипоксии. Представлены также новые результаты исследования кислот-
но-щелочного равновесия после длительных сроков клинической смерти
и при оживлении с помощью искусственного кровообращения.
Естественно, что в книге расширен и дополнен такой «традиционный»
раздел реаниматологии как остановка сердца. 'Кардиологическая смерть,
как известно, занимает сейчас первое место в общей статистике леталь-
ности.
В руководстве впервые описано применение электронаркоза при
электротерапии аритмий сердца. В главе, касающейся патофизиологии
и терапии терминальных состояний в акушерско-гинекологической кли-
нике, специально рассматривается вопрос о лечении эклампсии — есте-
ственно с позиций реаниматологии, так как смертность от экламспсии
довольно велика. Значительный новый материал представлен по вопросу
об организации реанимационной службы.
Пройдет некоторое время, возникнут новые наблюдения и факты и
материалы этой книги потребуют дополнений и изменений. Вместе с тем,
хочется надеяться, что на нынешнем этапе развития реаниматологии,
к счастью бурного и стремительного, наш труд принесет определенную
пользу тем, кого живо интересуют -проблемы современной теоретической
и клинической реаниматологии.
Член-корреспондент АМН СССР
В. А. Неговский
РЕАНИМАТОЛОГИЯ
И ЕЕ ЗАДАЧИ
Технический и культурный прогресс, достигнутый за последние де-
сятилетия, создал предпосылки для возникновения многих новых наук
и обособления ряда специальных дисциплин из общей медицинской
науки, в том числе и реаниматологии — науки об оживлении организма
(от лат. «re»— вновь, «animare — оживлять), патогенезе, профилактике
и лечении терминальных состояний, под которыми понимают состояния,
пограничные между жизнью и смертью. Становление реаниматологии
как самостоятельной области в медицине относится к настоящему време-
ни, но своими корнями она уходит в глубокую древность.
В XVIII ;и XIX веках появляются первые теоретические исследова-
ния, послужившие основой для осмысленного изучения процессов угаса-
ния и восстановления жизненных функций организма. Особая заслуга
в этом принадлежит русским естествоиспытателям — П. Посникову,
Е. Мухину, С. Г. Зыбелину, А. Филомафитскому, а в более позднее вре-
мя— их преемникам: А. А. Кулябко, Н. П. Кравкову, Ф. А. Андрееву,
С. И. Чечулину, С. С. Брюхоненко, И. Р. Петрову и др., в последние
годы — Г. Н. Андрееву, Г. Ш. Васадзе, А. А. Вишневскому, Г. Л. Любану,
Б. В. Петровскому, В. П. Радушкевичу, Н. Н. Сиротинину, С. А. Хачат-
ряну, Г. Н. Цыбуляку, А. М. Чернуху, Ю. Н. Шанину и др. Большой вклад
в развитие реаниматологии вносят <и многие зарубежные ученые, в том
числе Acuado Matorras, Aronski, Саев, Сага, Ciocatto, Стоянов, Damia,
Gordth, Hillman, Holmdahl, Huguenard, Jude, Kaminski, Kovach, Laborit,
Larcan, Lourant, Мандов, Manni, Mazzoni, Meyer, Milhaud, Mollaret, Nor-
lander, Safar, Stephenson, Strahl, White, Yurczyk и др. С 1936 года в этом
направлении ведутся исследования коллективом сотрудников Лаборато-
рии экспериментальной физиологии по оживлению организма АМН СССР
(руководитель В. А. Неговский).
В XX веке и особенно в «последние три-четыре десятилетия с новых
теоретических позиций ведутся всесторонние исследования .процессов,
которые протекают в организме во время терминальных состояний. Изу-
чение этих крайних этапов жизни теоретически подтвердило мысль о
том, что процессы умирания обратимы, когда погибает еще жизнеспо-
собный организм, и о том, что возможно предупредить, а в показанных
случаях и лечить состояния агонии и клинической смерти. Тп.:, за срав-
нительно короткий исторический промежуток времени был пройден путь
от эмпирических попыток оживления до становления реаниматологии
как новой теоретической науки, выводы которой ,могут быть использова-
ны и уже используются в клинических условиях. (В Советском Союзе
этому в значительной мере способствовали исследования, проводившие-
ся как на патофизиологических кафедрах, так и в хирургических, тера-
певтических и акушероко-гинекологических клиниках медицинских инсти-
тутов. Возникшая и подготовленная всем ходом развития отечественного
естествознания, молодая наука реаниматология является одновременно
и главой теоретической дисциплины — патологической физиологии.
Реаниматология изучает комплекс патологических процессов, возни-
кающих в организме в пограничных со смертью состояниях (особо тя-
желые формы типоксии, а также процессы, развивающиеся в постреани-
мационных состояниях). К основным вопросам, изучаемым реанимато-
логией, относятся исследования наблюдающихся в организме при
угасании и восстановлении жизненных функций общих закономерностей,
присущих всем видам умирания, и специфических для данного патоло-
гического процесса, приведшего к смерти; разработка наиболее совер-
шенных методов реанимации и последующего лечения больных в тост-
реанимационном («восстановительном») периоде. Выявление в эволю-
ционном аспекте биологической сущности переходного периода от жизни
к смерти и от смерти к жизни также является одной из важных проблем
реаниматологии.
Не зная законов существования организма на крайних этапах его
жизни, не учитывая патогенетических и этиологических факторов, при-
ведших организм к умиранию, нельзя помочь умирающему больному так
же, как нельзя излечить любое тяжелое заболевание, не зная его этио-
логии и 'патогенеза. Мы не можем в настоящее время .полагаться только
на эмпирический опыт, накопленный .практической медициной за долгие
годы, предшествовавшие ;первым -попыткам создания научно обоснован-
ной теории науки об оживлении. Появление реаниматологии как науки
отвечало насущным потребностям жизни.
В научной литературе, особенно зарубежной, встречается смешение
двух понятий: реаниматологии и реанимации. Реанимация — это непо-
средственно процесс оживления организма при проведении специальных
реанимационных мероприятий. (К ним в .первую очередь относятся искус-
ственное дыхание, массаж сердца, электрическая дефибрилляция сердца
и др. Реаниматология — это теоретическая дисциплина, научные выводы
которой используются лри реанимации в клинике.
В клинике проблемой реанимации в настоящее время занимаются
фактически врачи всех специальностей: терапевты, хирурги, анестезио-
логи, акушеры-гинекологи, педиатры, врачи скорой и неотложной -помо-
щи, медицинские работники горноспасательных станций, пунктов спасе-
ния утопающж.
Возникшая на стыке интересов таких экспериментальных и клиниче-
ских дисциплин, как патофизиология, хирургия, терапия (в частности,
неотложная), анестезиология, акушерство и гинекология, наука об ожив-
лении организма развивается среди этих дисциплин как равная, однако
присущим ей 'путем, заимствуя и обобщая опыт смежных с ней медицин-
ских дисциплин и в свою очередь обогащая их. Координированное взаи-
модействие врачей, находящихся у постели умирающего больного,—
залог успешной борьбы за его жизнь. Невозможно представить себе
работу реаниматолога без привлечения в нужный момент хирурга,
анестезиолога, акушера-гинеколога, терапевта для проведения всех не-
обходимых лечебных мероприятий соответственно основному патологи-
ческому процессу, приведшему к умиранию. Однако в последние критиче-
ские минуты, -когда речь идет о возвращении к жизни больного из
состояния, граничащего с биологической смертью, решающее слово не-
сомненно остается за реаниматологом. Именно реаниматолог, хорошо
знающий все особенности переходного периода от жизни к смерти (при
всех видах умирания), владеющий не только практическими методами
реанимации, но и усвоивший теоретические принципы, на основе которых
разрабатывались эти методы, может наиболее успешно справиться с за-
дачей восстановления угасающих или уже угасших -жизненных функций.
Трудно переоценить значение реаниматологии и практической реани-
мации в общей программе народного здравоохранения в нашей стране.
Подтверждением этого значения служит то большое внимание, которое
уделяют органы здравоохранения созданию реанимационных центров в
лечебных учреждениях, широкой .пропаганде и внедрению методов реани-
мации не только в крупных городах, но и в отдаленных районах и в
сельских местностях нашей страны и, наконец, всемерная помощь и со-
действие проведению исследовательских работ, посвященных проблемам
реаниматологии, в научных учреждениях нашей страны. Все это несом-
ненно является залогом успешного решения многих доставленных перед
реаниматологией задач.
Значение гипоксии в развитии терминальных состояний. К терми-
нальным состояниям относят все стадии умирания и начальные стадии
постреанимационного периода. Умирание может быть следствием разви-
тия любого заболевания или тяжелой травмы, каждое из которых имеет
свою нозологическую специфику. Процесс умирания наряду с особенно-
стями, зависящими от вида патологии, имеет общие закономерности,
характерные только для терминального состояния как своеобразной па-
тологической формы. Умирание в этом смысле представляет собой про-
цесс прогрессирующего угнетения жизненных функций организма и
распада систем, обеспечивающих гомеостаз; наиболее существенным в
процессе умирания является то, что он не может быть приостановлен
собственными силами организма и без помощи извне неизбежно приво-
дит к смерти. Общим патофизиологическим фактором, определяющим
развитие умирания, независимо от причины последнего всегда является
та или иная форма гипоксии. При этом если начало умирания может
быть вызвано какой-то из форм гипоксии в чистом виде, например гипок-
сической или цитотоксической, то при развитии умирания гипоксия при-
обретает смешанный характер с преобладанием циркуляторных наруше-
ний.^ Весьма часто гипоксическая гипоксия с самого начала осложнена
гиперкапнией.
Течение процесса умирания и последовательность угасания функций
основных органов и систем в значительной степени зависят от того,
какое из двух основных «ворот смерти» древних авторов — дыхание или
сердце, раньше поражает патогенный фактор. При первичном поражении
сердца в процессе умирания раньше выявляются .признаки сердечной
недостаточности, в выраженных случаях началом умирания является
остановка сердца или резкое ослабление его деятельности и лишь затем
развивается дыхательная недостаточность и 'поражение мозга. Во всех
остальных случаях, когда причина умирания первично не затрагивает
сердечную деятельность, гипоксия, вызывающая умирание, является
следствием той или иной недостаточности дыхания — внешнего или внут-
реннего. (В этом случае терминальная патология сердца выявляется по-
сле развертывания -картины угасания функций центральной нервной
системы, причем в некоторых случаях, как, например, при механической
асфиксии, сердечная деятельность может угаснуть после угасания дру-
гих основных жизненных функций организма, в частности после исчез-
новения самостоятельного дыхания. Подобное соотношение в состоянии
дыхания и сердечно-сосудистой системы имеет место, в частности, при
первичном поражении мозга. В последнем случае, когда умирание «вхо-
дит» через третьи «ворота смерти» — через мозг, обычно раньше разру-
шается механизм внешнего дыхания и лишь вторично страдает деятель-
ность сердечно-сосудистой системы. Исключением является лишь нейро-
генная остановка сердца.
Независимо от причин умирания .прогрессирующее кислородное
голодание раньше или позднее 'поражает все системы, органы и ткани
организма, вызывая в последних сложный комплекс патологических и
комленсаторно-приспособительных изменений. При этом если на началь-
ных этапах умирания преобладают вторые, то по мере углубления пато-
логического процесса решающее значение приобретают первые. Компен-
саторно-приспособительные реакции, направленные на обеспечение
адекватного кровообращения и оксигенации центральной нервной систе-
мы и сердца за счет всех остальных систем, обеспечиваются главным
образом деятельностью самой центральной нервной и эндокринной си-
стем и в меньшей мере тканевыми механизмами. /Выраженность компен-
саторных реакций зависит от тяжести первичной гипоксии и быстроты
ее развития. Так, при внезапной остановке сердца 'компенсаторные ре-
акции практически не реализуются 'вообще, при кровопотере, особенно
длительной, они успевают развиться в полной мере, в частности, наряду
с централизацией кровообращения обычно имеет место выброс в кровь
больших количеств глюкозы и опустошение гликогеновых депо.
В начальных фазах умирания одним из компенсаторно-приспособи-
тельных факторов, направленных на сохранение центральной нервной
системы, является повышение деятельности дыхательного и сосудодви-
гательного центра за счет гуморальных и рефлекторных воздействий.
Последние возникают вследствие стимуляции рецепторов дуги аорты и
каротидного синуса. 'В результате происходит учащение и углубление
дыхания, учащение сердцебиений, увеличение минутного объема сердца,
повышение артериального давления, сужение периферических сосудов и
сосудов брюшной лолости. Рефлекторная стимуляция вегетативных
центров и ретикулярной формации ствола мозга приводит к временному
увеличению церебрального кровоснабжения (централизация кровоснаб-
жения).
Длительное действие компенсаторных механизмов, не поддержанное
своевременно соответствующими реанимационными мероприятиями,
приводит к появлению дополнительных вредных факторов, которые не-
редко более опасны, чем исходный процесс, требующий компенсации.
В этих случаях при относительной сохранности мозга в конечном счете
развивается тяжелейшая гипоксия других тканей и органов с возникно-
вением регионарных нарушений гемодинамики, в частности микроцир-
куляции, развитием тяжелого метаболического ацидоза (который иногда
может сопровождаться газовым алкалозом) и грубыми нарушениями
функций и структуры паренхиматозных органов — печени, почек, сердца,
кишечника.
После исчерпания возможностей комленсации системных последствий
общего кислородного голодания быстро прогрессирует гипоксия мозга.
Кислородное голодание мозга приводит вначале к развитию некоторых
местных тканевых -компенсаторных реакций. Основными механизмами,
определяющими их развитие, является прогрессирующий переход мозга
от дыхания к анаэробному гликолизу с развитием внутри- и внеклеточ-
ного лактацидоза. Переход к гликолизу — древней форме выработки
энергии в живых тканях имеет защитно-приспособительное значение, так
как обеспечивает сохранение важнейших в жизненном отношении функ-
ций iM03ra ;в течение некоторого дополнительного времени и задерживает
наступление смерти. Сопутствующий гликолизу ацидоз вызывает расши-
рение артериол мозга, что также способствует сохранению кровоснабже-
ния мозга в критических условиях.
Однако в условиях гликолиза в мозге быстро исчерпываются нич-
тожные запасы гликогена и глюкозы, выработка богатых энергией фос-
форных соединений — АТФ, креатинфосфата ладает и количество их в
мозге быстро уменьшается, запасы креатинфосфата исчерпываются осо-
бенно быстро (М. С. Гаевская, 1963). Прямым результатом углубляю-
щегося ацидоза ткани мозга является наступающий вслед за компенса-
торным расширением артериол их парез и ларалич, который при общей
сердечно-сосудистой недостаточности осложняется паралитическим рас-
ширением венул. Ацидоз вызывает, кроме того, набухание перикапил-
лярной глии, способствует агрегации форменных элементов крови, ста-
зам и закупорке мелких сосудов, что приводит таким образом к нару-
шениям микроциркуляции и возникновению в :мозге вторичных очагов
ишемии. Существуют данные о том, что действие ацидоза на мозг ока-
зывается особенно выраженным при сохранении во время ишемии крови
в сосудах мозга (Neely, Youmans, 1963). Наряду с нарушениями угле-
водно-фосфорного обмена и, вероятно, вследствие этих нарушений
возникают также нарушения жирового обмена мозга, которые приводят
к появлению в мозге высокотоксических продуктов, действие которых
может оказаться лричиной развития ряда необратимых изменений эле-
ментов мозговой ткани (Е. Ф. Лунец, 1971; Bazan, 1970).
В результате первичной и вторичной -гипоксии мозга и связанного
с ней энергетического дефицита нарушается деятельность натриево-ка-
лиевого насоса, обеспечивающего поляризацию клеточных мембран,
деполяризация которых влечет за собой функциональный паралич ней-
ронов. Глубина гипоксической гипоксии, при которой нарушаются функ-
ции мозга, определяется напряжением кислорода, необходимым для
дыхания митохондрцй. Критический уровень рО2, ниже которого дыхание
изолированных митохондрий нарушается, равен 1—3 мм рт. ст. Для того
чтобы обеспечить такое налряжение кислорода ткани, рОг в капиллярах
должно быть не менее 10 мм рт. ст. (McMillan, Siezjo, 1971). Обычно же
при циркуляторной 'Гипоксии критический уровень напряжения кислоро-
да оказывается более высоким. Так, Opitz и Schneider A950), Hirsch
с соавторами A961), Schaertein A961), Thews A963) и др. как в экспе-
рименте, так и в клинике показали, что функции .мозга начинают нару-
шаться при рОг оттекающей от мозга венозной крови, равном 19—17 мм
рт. ст.; при 12—10 .мм рт. ст. все функции мозга угнетаются и возникает
непосредственная угроза жизни («порог смерти»; Hirsch, Schneider,
1968). Если кислородное снабжение не восстанавливается, смерть стано-
вится неизбежной.
Основными этапами умирания являются преагональное состояние,
терминальная пауза, агония, клиническая и биологическая смерть.
Преагональное состояние — этап умирания, характеризующийся рез-
ким снижением уровн-я артериального давления, сначала тахикардией
и тахипноэ, затем брадикардией и брадипноэ, прогрессирующим угнете-
нием сознания, электрической активности мозга и стволовых рефлексов
и нарастанием глубины кислородного голодания всех органов и тканей.
С лреагональным состоянием в известной степени может быть отождест-
влена четвертая стадия торпвдного шока.
Преаганальное состояние заканчивается терминальной паузой -в дыха-
нии, с .которой обычно совпадает резкое замедление пульса вплоть до вре-
менной асистолии.
Агония—предшествующий смерти этап ^м-иршия, который характе-
ризуется последней вспышкой жизнедеятельности. В период агонии
функции высших отделов мозга выключены, регуляция физиологических
функций осуществляется бульбарными центрами и носит примитивный,
неупорядоченный характер. Наблюдающаяся во время агонии внезапная
активация стволовых образований приводит к некоторому повышению
артериального давления, кратковременному восстановлению синусовой
автоматии, повышению эффективности сердечных сокращений и усиле-
нию дыхания, которое, однако, имеет патологический характер и неспо-
собно обеспечить необходимый газообмен. В некоторых случаях при
агонии усиливается электрическая активность мозга, а иногда восстанав-
ливается условнорефлекторная деятельность у животных и сознание у
человека. Агональная вспышка жизнедеятельности весьма кратковремен-
на и заканчивается полным угнетением всех жизненных функций, т. е.
клинической смертью. При умирании наркотизированного организма,
особенно в условиях действия барбитуратов, агония может быть .плохо
выражена или полностью отсутствовать.
Клиническая смерть — обратимый этап умирания, переходный период
между жизнью и смертью, это состояние, которое переживает организм
в течение нескольких минут после прекращения кровообращения и ды-
хания, когда полностью исчезают все внешние проявления жизнедеятель-
ности, но даже в наиболее ранимых гипоксией тканях еще не наступили
необратимые изменения. Во время .клинической смерти в организме
происходит постепенное угасание обменных процессов. Продолжитель-
ность клинической смерти определяется временем, -которое переживает
кора головного мозга в отсутствие кровообращения и дыхания. В какой-
то степени деструкция клеток наступает с самого начала клинической
смерти, однако даже после 5—6-минутной клинической смерти повреж-
дения значительной части клеток коры головного мозга еще обратимы,
что делает возможным полноценное оживление организма. Этому спо-
собствует также высокая пластичность центральной нервной системы,
в силу которой функции погибших клеток берут на себя другие клетки,
сохранившие свою жизнедеятельность.
Мировая клиническая практика подтверждает, что в обычных усло-
виях срок клинической смерти у человека не превышает 3—4, максимум
5—6 мин, у животных он иногда доходит до 10—12 .мин. Однако это
положение несколько схематично, так как длительность клинической
смерти в каждом случае зависит от ряда .причин: вида, условий и про-
должительности умирания, возраста умирающего, степени активности
и возбуждения его во время умирания и др. С помощью искусственной
гипотермии длительность 'клинической смерти может быть удлинена до
2 ч при температуре тела 10—8°iC (В. А. Неговский, В. И. Соболева,
1963). Наступающая вслед за клинической биологическая смерть пред-
ставляет собой необратимое состояние, когда оживление организма как
целого уже невозможно.
Общая последовательность угасания жизненных функций организма
при умирании, как упоминалось выше, в известной мере варьирует в
зависимости от его причины и быстроты развития. Однако эти вариации
касаются обычно соотношений в угасании функций сердечно-сосудистой
и центральной нервной систем, подчиняясь в пределах каждой из этих
систем в основном одним и тем же закономерностям и при разных видах
умирания отличаясь главным образом стремительностью изменений и
выраженностью, длительностью перечисленных выше стадий умирания.
Закономерности угасания функций нервной системы определяются
степенью чувствительности к гипоксии разных отделов нервной системы
и последовательностью выключения в процессе умирания тех или иных
ее функций. Вегетативная нервная система (ее бульбарные и спинальные
центры, -периферические ганглии и волокна) обладает относительной
резистентностью по сравнению с цереброспинальной системой. В послед-
ней особенно чувствительными и легко ранимыми оказываются филоге-
нетически более молодые и высокоорганизованные образования цент-
ральной неровной системы ('новая кора больших полушарий и кора полу-
шарий мозжеч/ка).
Угнетение функций коры головного мозга под действием гипоксии
клинически проявляется различными формами расстройства сознания
(возбуждение, эйфория, оглушенность, сопор, кома). Быстрое развитие
значительной гипоксии при остром прекращении церебрального крово-
обращения, внезапной остановке сердца и др. вызывает почти мгновен-
ное выключение сознания. При более медленном развитии гипоксии,
в частности при кровопотере в начале умирания, может иметь меото
рефлекторно вызываемая активация центральной нервной системы, кото-
рая проявляется на электроэнцефалограмме C3Г) десинхронизацией
биопотенциалов. В этот период больные еще в сознании, но могут быть
недостаточно ориентированы. Реакция активации центральной нервной
системы и защитно-приспособительных механизмов организма направле-
на на компенсацию возникающих функциональных нарушений и сохра-
нение высших отделов мозга. Позднее происходит постепенное угнетение
сначала коры, а затем подкорковых отделов мозга с углублением рас-
стройств высшей нервной деятельности от легких форм нарушения со-
знания и дезориентировки в окружающем до глубокой комы.
Под влиянием дальнейшего развития гипоксии снижаются, а затем
исчезают реакции зрачков на свет, роговичные и сухожильные рефлексы;
постепенно развивается паралитический мидриаз, возникают тонические
пароксизмы типа горметонических судорог или децеребрационной ригид-
ности; появляются нарушения функций тазовых органов — непроизволь-
ное мочеиспускание и дефекация; температура тела снижается на
1—2°iC. На ЗЭГ в процессе умирания отмечается замещение а-активности
высокоамплитудной медленной активностью в ритмах 0- и А-диапазона.
Электроэнцефалографически 'прогрессирующее под влиянием гипоксии
угнетение функций коры и субкортикальных образований характеризует-
ся сначала снижением частоты и амплитуды биопотенциалов, а затем и
полным угнетением электрической активности мозга.
В период атонального возбуждения структур мозгового ствола на
фоне «биоэлектрического молчания» коры и субкортикальных образова-
ний нередко наблюдается усиление электрической активности каудаль-
ного отдела ствола мозга, особенно его сетевидной формации. Упомяну-
тое выше кратковременное атональное восстановление биоэлектрической
активности коры головного мозга и даже сознания, а у животных —
примитивной условнорефлекторной деятельности происходит в резуль-
тате возбуждения сетевидной формации и вегетативных центров продол-
говатого мозга при сохранной сердечной деятельности и некотором
повышении артериального давления. Однако динамическое влияние
факторов умирания в конечном счете приводит к угасанию процессов
бульбарной регуляции и подавлению компенсаторно-приспособительных
механизмов центральной нервной системы.
Вслед за угасанием функций высших отделов центральной нервной
системы прекращается дыхание. В течение всего 'процесса умирания ды-
хание отражает функциональное состояние разных уровней центральной
нервной системы, которые принимают участие в его регуляции. В начале
умирания, например от кровопотери и от некоторых других причин, воз-
буждение дыхательного центра усиливается в первую очередь за счет
упоминавшихся выше рефлексов с сосудистых рефлексогенных зон. Ды-
хание в этот период учащается и углубляется, усиливается электриче-
12
екая активность инспираторных мышц, в акт дыхания включаются допол-
нительные дыхательные мышцы (мышцы шеи, дна лолости рта, языка,
плечевого пояса) и экспираторные мышцы (мышцы передней брюшной
стенки, внутренние межреберные мышцы) — выдох становится актив-
ным. По мере углубления гипоксии деятельность дыхательного центра
угнетается, дыхание замедляется, урежается и становится более поверх-
ностным, уменьшается электрическая активность всех дыхательных
мышц. В этой фазе могут развиваться различные виды 'периодического
дыхания, основной причиной которых является гипоксическое поражение
центральных механизмов регуляции дыхания. (В конце преагонального
периода исчезает активность мышц выдоха, так как деятельность экспи-
раторного центра, который осуществляет более тонкую регуляцию дыха-
ния, чем инспираторный центр (в процессе фило- и онтогенеза он разви-
вался позже), при умирании угасает раньше.
После выключения всех уровней регуляции, лежащих выше .продол-
говатого мозга, наступает так называемая терминальная пауза,
продолжительность которой составляет от нескольких секунд до 3—4 мин.
Терминальная лауза, или первичное аноксическое апноэ, является след-
ствием временного 'повышения тонуса центра блуждающего нерва
(Binet, Strumza, 1954). Под влиянием усиливающейся гипоксии тормо-
зящий вагусныи рефлекс исчезает и дыхательный центр восстанавливает
активность — начинается период агонии.
В начале агонии дыхание редкое, с небольшой амплитудой дыха-
тельных движений, а затем глубина его увеличивается, дыхание при-
обретает характер «gasping» с очень коротким вдохом и последующим
быстрым и полным выдохом. Нарушаются реципрокные отношения меж-
ду инспираторным и экспираторным центром; в акте вдоха участвуют все
дыхательные мышцы, причем мышцы выдоха сокращаются одновре-
менно с мышцами вдоха и дополнительными дыхательными мышцами,
в результате чего внешнее дыхание несмотря на кажущуюся интенсив-
ность становится неэффективным. Во время агонии дыхательный центр
не реагирует на афферентные импульсы, идущие со стороны рецепторов
легких и верхних дыхательных путей. J3 этот период возбуждение ирра-
диирует из инспираторного центра на мотонейроны дыхательных и дру-
гих скелетных мышц, вследствие чего в фазе вдоха можно зарегистри-
ровать электрическую активность практически всех мышц туловища и
конечностей.
При длительном умирании (более 20 мин) в конце агонии нормаль-
ный тетаничеокий характер сокращения дыхательных мышц переходит
в клонической (А. М. Гурвич, 1962—1966). Частота клонических сокра-
щений мышц соответствует частоте колебаний во вспышках, регистри-
руемых в этот период в сетевидной формации продолговатого мозга.
При углублении агонии наступает момент, когда лри полном исчезнове-
нии дыхательных движений и электрической активности дыхательных
мышц сохраняются лишь упомянутые ритмические вспышки электриче-
ской активности в сетевидной формации, и эти вспышки на электроме-
дуллограмме являются последним регистрируемым отражением деятель-
ности дыхательного центра лродолговатого мозга.
13
Прекращение сердечной деятельности наступает более или менее по-
степенно, через развитие асистолии, или внезапно. В последнем случае
остановка сердца чаще всего обусловлена фибрилляцией желудочков.
Процесс угасания функций сердца независимо от обусловивших его
причин имеет ряд специфических черт. Необходимо, в частности, отме-
тить наличие многообразных путей компенсации нарушений той или
иной функции, вследствие чего сердце в условиях прогрессирующей пато-
логии оказывается способным в течение известного периода обеспечи-
вать адекватную величину минутного объема. С точки зрения гемодина-
мики в целом и, следовательно, поддержания жизнедеятельности орга-
низма определяющим является лишь один фактор — эффективность
сокращения желудочков (при наличии достаточного венозного возврата
крови). В силу этого термины «остановка сердца» и «смерть сердца»
нередко .приобретают характер однозначных. Однако такая идентифика-
ция понятий сугубо утилитарна и не вскрывает патофизиологической
сущности явлений. Под «остановкой сердца» следует понимать резкое
угнетение или полное прекращение сердечных сокращений (асистолия)
или такое нарушение сократительного акта, которое приводит к очень
быстрому прекращению кровообращения (фибрилляция желудочков).
О «смерти сердца» можно говорить лишь после необратимого угасания
всех его функций.
Угасание отдельных функций сердца и деятельности всех его отделов
протекает не одновременно. Этот принципиальный факт был обнаружен
в опытах А. А. 'Кулябко A902) и Langendorf. Так, из трех основных
функций сердца раньше других угасает сократимость. В экспериментах
на изолированном сердце животных и человека было установлено, что
вначале прекращают свою деятельность желудочки — левый раньше
правого, а затем в той же последовательности и предсердия. Последними
прекращают сокращения участки миокарда, расположенные в области
впадения полых вен в правое предсердие.
Своеобразно протекает угасание сократительной функции миокарда
при фибрилляции сердца. Проведенные в Лаборатории эксперименталь-
ной физиологии по оживлению организма АМН СССР исследования по-
казали, что при воздействии на сердце собак переменного тока A27 В)
фибриллярные сокращения миокарда возникают как в предсердиях, так
и в желудочках. В предсердиях, однако, вскоре наступает спонтанная
дефибрилляция, в то время как в желудочках сердца фибрилляция про-
должается вплоть до полного угасания механических и биоэлектрических
проявлений их жизнедеятельности. При непосредственном наблюдении
последние слабые сокращения отдельных групп волокон миокарда же-
лудочков можно обнаружить даже на 10—12-й минуте умирания. Пред-
сердия же в течение этого периода чаще всего продолжают ритмично
сокращаться, сохраняя свои функции на несколько минут дольше, чем
желудочки сердца.
Сокращения миокарда, как правило, приостанавливаются значитель-
но раньше процесса 'генерации и проведения возбуждения. Электриче-
ские явления в сердце иногда удается обнаружить даже спустя
30—60 мин после его остановки (Л. И. Фогельсон, 1957). При этом, есте-
14
ственно, резко меняется форма потенциалов, что свидетельствует о глу-
боких нарушениях функций возбудимости и проводимости. Однако на
ранних этапах клинической смерти A—3 мин) при быстром умирании
от обескровливания у собак нередко еще регистрируются малоизменен-
ные комплексы синусового происхождения (Н. Л. Гурвич и др., 1971).
Характерным для желудочковых комплексов на этом этапе умирания
является резкое укорочение электрической систолы, что указывает, по-
видимому, на ограничение распространения процесса возбуждения пре-
делами проводящей системы. Современные исследования подтверждают
в целом правоту Pick A924), считавшего, что primum moricus в сердце
является переход от проводниковой системы к миокарду и ultimum
moricus — вся проводниковая система в целом.
Для понимания механизмов угасания деятельности сердца значи-
тельный интерес представляет .последовательность нарушения функции
проводимости по мере нарастания .гипоксии миокарда. Наиболее изучен-
ной в указанном отношении является экспериментальная модель умира-
ния от кровопотери. Различными авторами (А. И. Макарычев и
Н. -В. Семенов, 1942; В. А. Неговский, 1943—.I960; Н. Л. Гурвич, 1971)
было установлено, что при остром обескровливании собак непосредст-
венно перед наступлением клинической смерти наблюдается урежение
синусовой автоматии, синоаурикулярная блокада, периодически наблю-
дается атрио-вентрикулярный ритм, попеременная блокада ножек пучка
Гиса. При сохранившейся деятельности синусового узла различная сте-
пень атрио-вентрикулярной блокады обычно наблюдается после прекра-
щения сокращений сердца. Спустя 3 мин после прекращения сокращений
сердца, как правило, прекращается и деятельность синусового узла, во-
дителем ритма становится центр II или III порядка. Вид желудочковых
комплексов резко меняется, теряется дифференцировка между их на-
чальной и конечной частями, и постепенно они превращаются вначале в
дву-, а затем в монофазные отклонения.
Восстановление работы сердца — первый этап оживления. При ожив-
лении организма путем применения массажа сердца, искусственного
дыхания и артериального нагнетания крови восстановление биоэлектри-
ческой активности сердца протекает в общих чертах в обратном лорядке
по сравнению с периодом умирания. При устранении гипоксии миокарда
во время оживления вначале восстанавливаются функции автоматии,
возбудимости и проводимости, что находит отражение на ЭКГ, которая
быстро трансформируется, приближаясь по своему виду к исходной.
Эффективные сокращения сердца восстанавливаются несколько позже.
Вполне естественно, что чем длительнее и тяжелее была гипоксия, тем
медленнее восстанавливаются функции сердца и тем выраженнее их
нарушения на начальных этапах реанимации. Закономерной является
несравненно более быстрая динамика восстановления функций (автома-
тии, возбудимости, сократимости) при оживлении, чем динамика их
угасания при умирании. Так, даже после 10 мин клинической смерти,
вызванной кровопотерей, начальная часть желудочкового комплекса
(QRS) нормализуется уже к концу 1-й минуты оживления, патологиче-
ские же изменения конечной части (реполяризация миокарда) могут
15
сохраняться в течение суток. При оживлении фибриллирующего сердца
также наблюдается быстрое усиление его биоэлектрической активности,
выражающееся в увеличении амплитуды и частоты фибриллярных осцил-
ляции на ЭКГ. Однако спонтанная дефибрилляция наблюдается чрезвы-
чайно редко, и для нормализации сердечного ритма обычно .прибегают к
электрической дефибрилляции. Темп и характер восстановления функ-
ций сердца во многом определяются и методом оживления — наружным
или прямым массажем сердца в сочетании с артериальным или внутри-
венным нагнетанием крови, экстракорпоральным кровообращением.
Анализ динамики угасания и восстановления функций сердца позво-
ляет высказать мысль о том, что онто- и .филогенетически более старые
образования обладают и большей стойкостью к гипоксии. В первую оче-
редь это касается синусового узла, -который у человека формируется,
как известно, в период от 3—5-го мес внутриутробного развития, в то
время -как атрио-вентрикулярный проводящий пучок развивается значи-
тельно раньше — между 7-й и 9-й нед. Можно полагать, что указанная
закономерность связана со спецификой обмена в различных частях про-
водящей системы сердца.
Следует отметить, что биоэлектрическая активность сердца человека,
которое оживляли спустя много часов после смерти, на первых этапах
оживления по своей примитивности была близка к биопотенциалам, ге-
нерируемым сердцем головоногих моллюсков, в котором отсутствуют
нервные элементы. В процессе дальнейшего восстановления обнаружи-
лось также сходство и с биотоками земноводных \и лти'Ц. «Посмертное
восстановление», так же как и эволюционное развитие биоэлектрических
процессов в миокарде, проходит закономерный путь от проявления коле-
баний потенциалов в их простейшей форме до сложных компонентов в
нормальной ЭКГ человека» (С. В. Андреев, 1949).
Вслед за возобновлением сердечной деятельности, а в ряде случаев
и до ее возобновления, если методы оживления создают достаточную
циркуляцию крови и газообмен при неработающем сердце (экстракор-
поральное кровообращение, иногда массаж сердца), происходит посте-
пенное восстановление функций центральной нервной системы. Динами-
ка их восстановления определяется отсутствием или наличием морфо-
логических изменений и их распространенностью в различных отделах
головного мозга, функциональными соотношениями пострадавших от
аноксии структур и характером патофизиологических факторов, дейст-
вующих на головной мозг в восстановительном периоде.
Следует отметить, что в постреанимационном периоде наряду с
процессами восстановления в ткани мозга могут возникать новые пато-
логические изменения.
Известно несколько причин их появления. Одной из них оказываются
новые волны нарушений микроциркуляции, появляющиеся вследствие
вымывания из всех тканей большого количества токсических продуктов
неполного окисления и изменений свертываемости крови.
Другим важнейшим осложнением кислородного голодания мозга
является отек мозга, ухудшающий циркуляцию крови в мозге и диффу-
зию кислорода из капилляров к нейронам. До недавнего времени он счи-
тался почти обязательным осложнением гипоксии любой природы и
основной причиной наблюдающихся в связи с перенесенной общей ише-
мией мозга неврологических осложнений. Установлено, что основной
причиной неврологических нарушений, развертывающихся в связи с вре-
менным полным прекращением кровообращения, являются изменения
функций мозга вследствие первичной ишемии, вызванного ею ацидоза
и вторичных нарушений микроциркуляции. Установлено далее, что даже
при развитии в мозге необратимых изменений отек мозга может появить-
ся спустя многие часы A5—24 ч) после первичного воздействия, когда
судьба мозга уже решена; отек мозга в этом случае выражен мало, охва-
тывает наиболее пострадавшие отделы мозга (кору больших полушарий)
и, по-видимому, лишь сопутствует некробиотическим процессам в нервной
ткани (И. С. Новодержкина, 1970). Естественно, что, появившись, отек
мозга ухудшает состояние мозга, затрудняя диффузию кислорода от
капилляров к нервным элементам и вызывая новые нарушения крово-
снабжения мозга, которые, однако, могут иметь второстепенное значение
для исхода постишемического процесса.
Вместе с тем в определенных условиях, например в случаях, когда
гипоксию осложняют гиперкапния, артериальная гипотензия, наруше-
ния венозного оттока, тяжелый отек мозга может развиться и после
сравнительно кратковременной остановки кровообращения или даже в
ее отсутствие (Bakay, Lee, 1965). Отек в этих случаях выражен значи-
тельно, охватывает весь мозг и может вызывать смещения мозга и свя-
занные с этим тяжелые нарушения витальных функций. Существенный
вклад в патологические изменения мозга, по-видимому, вносит отек моз-
га также при множественной эмболии мозговых сосудов (Tzonos, 1969).
Из сказанного следует, что хотя отек мозга может играть весьма
важную роль в патологическом изменении мозга при терминальных
состояниях, связь между гипоксией мозга и его отеком неоднозначна,
в связи с чем наличие отека, его степень и значение в имеющемся пато-
логическом процессе должны оцениваться в каждом случае отдельно и
дифференцированно.
К патофизиологическим факторам, воздействующим на мозг в пост-
реанимационном периоде, относятся также нарушения гомеостаза, воз-
никающие как вследствие прямого действия гипоксии на внутренние
органы, так и в результате исчезновения регулирующих и интегрирую-
щих влияний центральной нервной системы. Извращение последних
возникает как следствие нарушений межцентральных отношений в моз-
ге, выражением чего являются, в частности, судороги.
В связи со сказанным очевидно, что гибель тканевых элементов мозга
может иметь место не только во время умирания и в период остановки
кровообращения и дыхания (клиническая смерть), но и в постреанима-
ционном периоде. Как показывают эксперименты с обменным перелива-
нием больших количеств крови (Л. Г. Шикунова и др., 1969), патогенные
факторы, устраняемые этим воздействием, оказывают свое основное
влияние на мозг в течение первых 30—60 мин постреанимационного пе-
риода, так как обмен крови спустя час после возобновления кровообра-
щения и газообмена заметно не влияет на течение восстановительного
2 Заказ No 1266 17
периода. Процессы, протекающие в организме в последующие несколько
суток, также небезразличны для состояния мозга даже при сохранении
удовлетворительной гемодинамики и газообмена. Точная природа этих
патологических процессов неизвестна. Однако как в эксперименте
(А. М. Гурвич, 1966), так и в клинике (Plum e. а., 1962) установлено, что*
в интервале между 2-ми и 5-ми сутками (около 3-х суток), а иногда и
позже при восстановлении после аноксии самой различной природы мо-
жет наступить существенное ухудшение неврологического статуса, не-
редко оканчивающееся гибелью.
Восстановление функций центральной нервной системы происходит
в основном по функциональным связям отдельных систем, звенья кото-
рых располагаются на разных анатомических уровнях. Обычно раньше-
всего начинают функционировать филогенетически более древние, не-
жизненно необходимые для существования вида функциональные си-
стемы. Первым в центральной нервной системе, если последняя не была
угнетена наркотиками, особенно барбитуратами, восстанавливается ды-
хательный центр.
Восстановление самостоятельного дыхания после клинической смер-
ти зависит прежде всего от возобновления адекватного кровообращения
в области продолговатого мозга и полноценной вентиляции легких. На?
более поздних этапах после оживления для восстановления нормальной
регуляции дыхания определенную роль играет рефлекторная стимуля-
ция дыхания, которая осуществляется за счет рефлекса Геринга —
Брейера и спинномозговых дыхательных рефлексов.
Появление первого вдоха, свидетельствующее о наличии возбужде-
ний в продолговатом мозге, оказывает большое стимулирующее влия-
ние на восстановление высших отделов центральной нервной системы
(В. А. Неговский, 1943). Рано появившееся самостоятельное дыхание
способствует более стойкому и полному восстановлению всех остальных
физиологических функций и оказывается эффективным фактором для
обеспечения устойчивого сосудистого тонуса.
При оживлении изменения дыхания, имевшие место при умирании,,
как бы повторяются в обратном порядке. На фоне искусственного дыха-
ния появляются начальные вдохи, амплитуда которых постепенно уве-
личивается и появляется дыхание агонального типа, когда дыхательные
движения имеют большую амплитуду и носят судорожный характер. За
этой фазой следует фаза альтернирующего дыхания, при котором наряду
с судорожными вдохами отмечаются вдохи более спокойные, меньшей
амплитуды. Наконец, альтернирующее дыхание сменяется фазой «вста-
вочных вдохов», когда на фоне нормального дыхания сохраняются более
глубокие вдохи. Последние постепенно становятся все более и более ред-
кими, и дыхание приобретает нормальный характер. Перечисленные
фазы отражают изменения функционального состояния дыхательнога
центра и восстановление корригирующих влияний на него со стороны
расположенных выше отделов центральной нервной системы.
Первым при оживлении начинает функционировать инспираторный
центр. Деятельность экспираторного центра восстанавливается позднее,,
и время восстановления активного выдоха, как иравило, «совладает с вос-
18
становлением роговичных рефлексов, или, другими словами, с восста-
новлением отделов ствола мозга, расположенных на границе между
продолговатым мозгом и варолиевым мостом. Исследование электриче-
ской активности разных групп дыхательных мышц в восстановительном
периоде после клинической смерти позволило установить, что момент
выключения из акта дыхания дополнительных дыхательных мышц яв-
ляется объективным критерием полноты восстановления функции внеш-
него дыхания (С. В. Толова, 1971).
После восстановления функций бульбарного дыхательного центра
происходит постепенное восстановление других бульбарных и спиналь-
ных центров. Затем восстановительный процесс охватывает вышележа-
щие отделы ствола, межуточный мозг и подкорковые ядра. Постепенно
исчезает паралитический мидриаз, восстанавливаются роговичный и
конъюнктивальный рефлексы, мышечный тонус, реакция зрачков на
свет.
■Восстановление межуточного мозга проявляется повышением темпе-
ратуры тела до нормальной или субфебрильной, начинается постепенное
восстановление электрической активности мозта, постепенно уменьшает-
ся глубина комы.
Позже всех других отделов головного мозга восстанавливаются
функции коры. Иногда они восстанавливаются через минуты, иногда —
через десятки минут, иногда — через часы и дни. При определенных си-
туациях функции коры больших полушарий могут совершенно не вос-
становиться.
При благоприятном течении оживления и восстановления функций
коры головного мозга неврологические осложнения регрессируют. Наибо-
лее 'быстро исчезают признаки поражения пирамидных путей. Восста-
новление высшей нервной деятельности происходит значительно медлен-
нее. Расстройства зрения и координации движений, нарушения сложных
форм чувствительности и особенно дефекты памяти могут сохраняться
на весьма длительное время. Восстановление деятельности коры голов-
ного мозга приводит к нормализации функций всех подкорковых и ство-
ловых образований.
Процесс восстановления функций коры головного мозга протекает в
определенной последовательности, напоминающей периоды развития
высшей нервной деятельности ребенка. На наиболее раннем этапе вос-
становления корковых функций, о чем свидетельствуют первые признаки
появления сознания — открывание глаз на громкий окрик, выполнение
элементарных инструкций и др., кора головного мозга еще очень легко
истощается, вследствие чего у больного быстро наступает состояние
заторможенности и сонливости. В этот период наблюдаются рефлексы
орального автоматизма, сосательные, жевательные и чмокающие движе-
ния, хватательный рефлекс. Контроль сфинктеров мочевого пузыря и
прямой кишки отсутствует. Установление элементарного словесного кон-
такта с больным позволяет выявить расстройства речи: элементы сенсор-
ной и амнестической афазий, парафазии, персеверации и др. Память на
прошлые и близкие события практически отсутствует. Больной дезориен-
тирован во времени и пространстве. При относительно быстром вдосста-
2* .19
новлении речевых функций можно обнаружить у этих больных грубые
расстройства гнозиса и праксиса. Характерным также является период
своеобразной эмоциональной расторможенности: негативизм, неадекват-
ная возбудимость, агрессивность, нарушение критики, склонность к
плоским шуткам и другие проявления неосмысленного нецелесообразно-
го поведения.
Однако в тех случаях, когда восстановление функций коры головного
мозга затягивается на длительные сроки или не происходит вообще,
в клинической картине на фоне глубокого коматозного состояния, гипер-
рефлексии, наличия защитных и патологических рефлексов появляются
признаки возбуждения, приводящего к тяжелым осложнениям гипота-
ламо-диэнцефальной области: гипертермия, тахикардия, тахипноэ и
целый ряд других явлений, свидетельствующих о глубоких нарушениях
корково-подкорковых отношений.
В зависимости от сроков клинической смерти и патофизиологических
факторов, действующих в постреанимационном периоде, процесс восста-
новления функций центральной нервной системы и высшей нервной дея-
тельности может приостановиться на любой фазе регресса неврологиче-
ских нарушений. Поэтому одной из основных задач оживления организ-
ма является сохранение коры головного мозга в процессе умирания,
предотвращение необратимых нарушений ее в период клинической смер-
ти и как можно более быстрое восстановление ее функций в постреани-
мационном периоде.
Постреанимационная болезнь. Все сказанное выше делает очевидным,
что оживленный организм находится в особом патологическом состоя-
нии, которое предлагается называть постреанимационной болезнью и
рассматривать как самостоятельную нозологическую форму. Именно с
существованием постреанимационной болезни связан установленный
сейчас факт формирования необратимости не только во время клиниче-
ской смерти, но и после оживления.
Основные патологические изменения органов и систем, характери-
зующие постреанимационную болезнь, заключаются в следующем.
Нарушения состояния миокарда, коронарного кровообращения и
системы, проводящей возбуждение, создают предпосылки для снижения
минутного объема сердца, которое может иметь место в течение дли-
тельного времени даже на фоне достаточно высокого системного арте-
риального давления. Нарушения структуры дыхательного акта и ком-
пенсаторное перенапряжение аппарата внешнего дыхания создают
предпосылки для развития недостаточности вентиляции легких и вторич-
ной гипоксической гипоксии, сочетающейся с гиперкапнией. Недостаточ-
ность функций печени и почек, особенно характерная для постреанима-
ционного периода после длительной гиповолемии и гипотензии, приводит
к углублению нарушений в регуляции обмена веществ и, в частности,
электролитного баланса. Эти нарушения охватывают все виды обмена,
как углеводного, так и жирового и белкового, выражающиеся сначала
в метаболическом ацидозе, а в более позднем периоде — в сочетании
метаболического алкалоза с гипоксическим состоянием тканей
(Е. С. Золотокрылина). Важное значение, по-видимому, имеет отравле-
29
ние токсинами бактериального происхождения. Указанные нарушения
осложняются изменениями свертывающей системы крови и распростра-
ненными нарушениями микроциркуляции. Тяжесть постреанимационной
болезни связана также с разрушением системы поддержания гомеостаза
вследствие патологических сдвигов в эндокринных органах и выключе-
нии или изменении его нервно-вегетативной регуляции.
Совокупность упомянутых нарушений приводит к тому, что в пост-
реанимационном периоде наряду с восстановлением может иметь место
возникновение новых патологических изменений. Постреанимационные
процессы имеют особое значение для мозга, в котором в этот период мо-
гут возникать новые изменения, складывающиеся с первичными ишеми-
ческими повреждениями и углубляющие последние. Именно с этими про-
цессами связана возможность вторичного развития комы и смерть боль-
ных с первоначальным быстрым и успешным восстановлением функций
мозга. .
Многие из описанных выше патологических изменений могут быть
предотвращены или смягчены путем соответствующих лечебных меро-
приятий, что составляет резерв в продлении сроков остановки кровообра-
щения, после которых возможно полноценное восстановление организма
как целого. Доля экстрацереб^альных патофизиологических факторов в
развитии необратимых изменений могга при умирании составляет не
менее чем 25—30% от действия всех факторов, вызывающих необрати-
мые изменения при умирании (A.M. Гурвич и др., 1972). Наиболее важ-
ным в лечении постреанимационной болезни является: обеспечение адек-
ватной циркуляции и газообмена, коррекция всех видов нарушения ме-
таболизма, защита мозга от дальнейшего действия гипоксии и отека его,
викарирование важнейших патологически измененных органов и систем.
Своеобразным разделом в ведении оживленного больного является
своевременная оценка глубины возникших при умирании повреждений
и степени их обратимости, т. е. прогноз вероятной полноты конечного
восстановления.
Таким образом, постреанимационная болезнь может быть выделена
в самостоятельную нозологическую единицу, так как она имеет свою
этиологию и патогенез и требует своеобразного лечения с помощью про-
ведения комплекса мероприятий, отличных от применяемых при других
заболеваниях, если последние не приводят к развитию терминального
состояния (В. А. Неговокий, 1972).
ЗАКЛЮЧЕНИЕ
Развитие реаниматологии и внедрение реанимации в практику ставит
все новые и новые вопросы, от быстроты и качества ответа на которые
зависят жизни десятков и сотен тысяч людей.
В развитии терминальных состояний огромную роль играют расстрой-
ства дыхания — первичные и вторичные. Для понимания патогенеза
дыхательной недостаточности и ее эффективного лечения необходимо
изучение общего и регионарного легочного кровообращения, многообраз-
ных показателей легочной вентиляции, нарушений эластических и аэро-
21
динамических свойств легких. В дальнейшем совершенствовании нуж-
дается и дыхательная аппаратура.
Одной из центральных проблем современной реаниматологии являет-
ся детальное исследование процесса угасания функции сердечно-сосуди-
стой системы при умирании организма и характера восстановления
гемодинамики при оживлении, взаимосвязь между отдельными звеньями
системы кровообращения и их роль в формировании компенсаторных
механизмов, направленных на поддержание гомеостаза. Необходимо,
в частности, целенаправленное и многостороннее изучение центральной
гемодинамики, регионарного органного кровотока и микроциркуляции
(на уровне концевых сосудистых образований). Необходимо также даль-
нейшее изучение свертывающей и противосвертывающей системы крови
как фактора, сопутствующего нарушениям гемодинамики и микроцир-
куляции.
Важнейшей задачей является исследование патофизиологии мозга в
постреанимационном периоде, экстра- и интрацеребральных механизмов,
определяющих гибель или восстановление ткани мозга, выявление ре-
зервов устойчивости мозга к тбтальной ишемии. Изучение этих вопросов
привело бы к существенному удлинению сроков ишемии мозга, совмести-
мых с полным восстановлением его функций. Особое место занимает
изучение различных аспектов мозгового кровообращения и метаболизма.
В данном случае от биохимии следует ждать важнейших сведений о
механизмах, обусловливающих функциональное состояние мозга в пе-
риод клинической смерти.
Следует продолжить изучение роли эндокринной системы в патоло-
гии терминальных состояний. Для выяснения первичных эндокринных
нарушений и разработки принципов их коррекции представляется важ-
ным исследовать характер реакции желез внутренней секреции и меж-
эндокринных взаимоотношений, важно также исследовать нарушения
их центральной нервной регуляции, расстройства в системе доставки
гормонов к «органам-мишеням» и чувствительность последних к гормо-
нальным воздействиям. Разработка этих процессов позволит подойти
к решению проблемы управления защитно-компенсаторными и восста-
новительными процессами в терминальных состояниях.
Одной из важнейших и неотложных задач является углубленное ис-
следование постреанимационной болезни как особой нозологической
единицы и разработка ее рациональной терапии. Проблема терапии на-
рушений, специфических для постреанимационной болезни, требует изу-
чения обмена веществ, ферментных систем окислительного и гликолити-
ческого цикла. Успешное лечение постреанимационной болезни тесно
связано и в значительной степени обусловлено ликвидацией скапливаю-
щихся в тканях биологически активных веществ, восстановлением и нор-
мализацией функций ряда желез эндокринной системы, иммунных ре-
акций.
Помимо исследований изменений по органам и системам, необходимо
гораздо более тщательно изучать патологию умирания и оживления в
зависимости от причин, вызвавших терминальное состояние. Требует
дальнейшего изучения специфика патологии терапии терминальных со-
22
стояний, вызванных травматическим шоком, утоплением, многими инток-
сикациями. Необходима постановка широких специальных исследований
особенностей умирания и оживления при электротравме (в настоящее
время в нашей стране почти никто не занимается данной проблемой при
зсей важности этого патологического состояния), при инфарктах мио-
карда, травматическом шоке, утоплении, облучении и др.
Гораздо более обширной должна быть программа исследований по
применению в реанимации искусственного кровообращения, гомо- и гете-
ротропных органов и др.
По-видимому, чрезвычайно перспективным будет управляемое элек-
тронно-вычислительной машиной (ЭВМ) ведение восстановительного
периода по непрерывной сигнализации от физиологических систем боль-
шого, с дифференцированными программами, выработанными на осно-
вании накопления знаний по реаниматологии.
Не только с теоретической, но и с практической точки зрения чрез-
вычайно важно развертывать исследования по многим вопросам реани-
матологии в эволюционно-биологическом аспекте.
Мы стоим в начале длинного и трудного пути. Великое множество
трудностей предстоит еще преодолеть тем, кто посвятил себя служению
науке по борьбе со смертью. Но тем дороже нам каждая завоеванная
ступень и тем ближе цель, которую поставила перед собой гуманная и
"благородная наука — реаниматология.
II
УГАСАНИЕ
И ВОССТАНОВЛЕНИЕ
ФУНКЦИЙ СЕРДЦА
Различные виды остановки сердца и их патогенез. Различают два
вида прекращения сердечной деятельности: 1) асистолию и 2) фибрил-
ляцию желудочков.
Под асистолией понимают полное прекращение сокращений желу-
дочков. Произойти она может внезапно (рефлекторно), при сохранив-
шемся тонусе миокарда, и постепенно — при развитии его атонии. Чаще-
всего остановка сердца происходит в диастоле и очень редко — в систоле.
Под фибрилляцией желудочков понимают некоординированные со-
кращения мышечных волокон сердца. При сохранившемся тонусе мио-
карда наблюдаются энергичные фибриллярные сокращения, а при ато-
нии — вялые.
Рациональная классификация видов остановки сердца может быть
построена на основе учета степени и характера нарушения проводи-
мости, поскольку эта функция в основном и определяет степень коорди-
нированности работы сердца.
Первая группа нарушений проводимости сердца
представляет собой нарушение проведения возбуждений между различ-
ными отделами сердца при сохранении возбудимости и сократимости
миокарда внутри каждого отдела сердца. К этой группе относят: а) аси-
столию всего сердца в результате нарушений и полной блокады прово-
димости между синусовым узлом и предсердиями; б) асистолию желу-
дочков вследствие полной поперечной блокады; ib) резко выражен-
ную желудочковую брадикардию (менее 30 сокращений в минуту) при-
неполной блокаде проводимости между предсердиями и желудочка-
ми или при наличии редкой автоматам идиовентрикулярного (проис-
хождения.
Асистолия всего сердца может наступить под влиянием рефлектор-
ного раздражения блуждающих нервов при резко повышенном их тонусе
во время наркоза и операции, а также при других патологических усло-
виях, при которых влияние гипоксии сочетается с другими неблагопри-
ятными факторами, способствующими резкому повышению тонуса блуж-
дающих нервов (при утоплении, удушении, отравлении барбитуратами
и т. п.).
24
Асистолия желудочков и резко выраженная желудочковая бради-
кардия могут наступить от тех же причин я при тех же условиях, при
которых наступает полная асистолия сердца, а также при наличии более
стойких морфологических изменений в проводящей ткани желудочков,,
например при болезни Адамса—Стокса (см. главу X).
Вторая группа нарушений проводимости сердца
представляет собой нарушение проведения возбуждения внутри прово-
дящей системы желудочков, в результате чего нарушается координиро-
ванность сокращений миокарда желудочков. К этой группе относят:
а) фибрилляцию и трепетание желудочков и б) пароксизмальную тахи-
кардию, связанную с нарушением внутрижелудочковой или внутрипред-
сердной проводимости.
Фибрилляция и трепетание желудочков поддерживаются круговой
циркуляцией возбуждения по проводящей системе, в результате чего от-
дельные группы мышечных волокон миокарда сокращаются разрозненно'
и разновременно и эффективная работа сердца прекращается. Фибрил-
ляция желудочков может наступить от тех же причин, от которых про-
исходит остановка сердца в состоянии асистолии, а также при заболева-
ниях сердца — спазме венечных сосудов, инфаркте миокарда.
Пароксизмальная тахикардия желудочкового и наджелудочкового
происхождения связана с нарушением проводимости и круговой цирку-
ляцией возбуждения. Хотя при этом координация сокращений миокарда
не нарушена, но при высокой частоте сокращения желудочков могут-
стать недостаточно эффективными для поддержания необходимого
уровня артериального давления.
Третья группа нарушений проводимости сердца
представляет собой наиболее глубокое нарушение проводимости, рас-
пространяющееся на все конечные разветвления проводящей системы
внутри миокарда. Последний теряет при этом способность отвечать не-
только на импульсы, поступающие из очагов автоматии (которые могут
при этом регистрироваться на электрокардиограмме еще в течение мно-
гих минут после прекращений эффективных сокращений сердца), но п
на искусственные механические или электрические раздражения. Это»
состояние сердца, при котором полностью теряется возбудимость и со-
кратимость, характеризуется потерей мышечного тонуса — атонией мио-
карда.
Атония миокарда является последней стадией любого вида оста-
новки сердца в случае, если своевременно не приняты меры для восста-
новления кровообращения.
Классификация видов прекращения эффективной работы по степени
нарушения проводимости облегчает ориентировку в вопросах терапии.
Во всех случаях отсутствия работы сердца, помимо проведения обяза-
тельных мер по устранению гипоксии и восстановлению кровообращения-
в организме (искусственное дыхание, прямой и наружный массаж серд-
ца, нагнетание крови в артерию), в каждом случае может еще требо-
ваться специфическая помощь, которая определяется патогенезом оста-
новки сердца (электростимуляция при болезни Адамса — Стокса;.
устранение фибрилляции и пароксизмальной тахикардии с помощью?
25*
дефибриллятора; введение адреналина, хлорида' кальция при атонии
миокарда и др.).
Этиология и патогенез прекращения сердечной деятельности. Основ-
ными причинами прекращения сердечной деятельности являются гипок-
сия, гиперкапния и метаболический ацидоз различной этиологии. Это
связано с тем, что изменения газового состава крови и сдвиги кислотно-
щелочного равновесия в кислую сторону нарушают обменные процессы
в миокарде и приводят к нарушениям возбудимости, проводимости и
снижению сократительной способности сердца. По данным Bigelow,
Heimbeker, Trusler A957), снижение насыщения крови кислородом даже
до 80—90% при длительных и травматичных операциях может привести
к серьезным нарушениям деятельности сердечно-сосудистой системы
вплоть до развития асистолии.
Большую роль в,патогенезе остановки сердца играют нарушения элек-
тролитного баланса и прежде всего изменения концентрации ионов К+
и Са++. Расстройства сердечной деятельности зависят не только от абсо-
лютных показателей содержания этих катионов, но и от-их. соотношения,
быстроты нарастания (Концентрации и клеточно-внеклеточного градиента.
Быстрое нарастание концентрации К+ в плазме и обеднение им клеток
чаще приводят к фибрилляции желудочков сердца, а постепенное уве-
личение— к асистолии. При остановке сердца на фоне гиперкалиемии
исчезает как электрическая активность сердца, так и его способность к
«сокращениям. При уменьшении концентрации Са++ миокард теряет
«способность к сокращению при сохранившейся электрической актив-
ности сердца C. Асканаса, 1972). По данным Lee, Richman, Visscher
A956), полная потеря сократительной способности сердца наблюдается
при уменьшении концентрации Са++ до 5% от нормальной.
Не меньшее значение в этих состояниях имеет снижение фермента-
тивной активности миозина, который катализирует расщепление адено-
зинтрифосфорной кислоты с освобождением энергии, необходимой для
мышечных сокращений (В. А. Энгельгардт, М. Н. Любимова, 1942),
и истощение энергетических ресурсов — гликогена (Becker, 1952; Hosier,
1954).
Асистолия. Внезапная остановка сердца может произойти при таких
манипуляциях, как экстирпация зуба, тонзиллэктомия, паранефральная
блокада, бронхоскопия (В. А. Неговский, 1972; Thomeret, 1951; Becker,
1952; Dale, 1952). Нередко внезапная остановка сердца бывает связанна
с проведением наркоза. Это осложнение может развиться при применении
любого анестетического агента на любом этапе операции. Однако чаще
всего она наблюдается при вводном наркозе, во время интубации и
экстубации, при изменении положения тела больного, при резком сни-
жении рСОг в крови на фоне выраженного дыхательного ацидоза
(Е. Н. Мешалкин, В. П. Смольников, 1963; 3. Асканаса, 1972). У боль-
ных, находящихся под действием мышечных релаксантов, остановка
сердца может наступить при введении антибиотиков. Вводный наркоз
тиопенталом натрия особенно опасен у лиц с заболеваниями сердца,
с неустойчивым сосудистым тонусом, а также при заболевании печени
и обширных ожогах.
26
К внезапной остановке сердца различной этиологии предрасположе-
ны больные с лабильной нервной системой, эндокринными нарушения-
ми, тяжелой интоксикацией, анемией и резким истощением.
Развитию внезапной остановки сердца — асистолии в ряде случаев
предшествуют нарушения сердечного ритма — брадикардия. При аси-
столии отмечается резкое снижение артериального давления с быстрым
исчезновением пульса на магистральных сосудах и потеря сознания. На
ЭКГ при прекращении сердечной деятельности исчезают желудочковые
комплексы, но миокард в первые минуты остановки сердца сохраняет
тонус.
В основе патогенеза внезапной асистолии часто лежит нервно-
рефлекторная реакция вагусного происхождения, приводящая к тормо-
жению активности синусового узла.
Обычно у здоровых людей рефлекторное торможение сердечной
деятельности кратковременное и устраняется самопроизвольно. Однако
при гипоксии, гиперкапнии, нарушениях метаболизма рефлекторная
остановка сердца может затянуться и стать опасной для жизни. Возмож-
ность возникновения рефлекторной остановки сердца в этих условиях
увеличивается в связи с повышением чувствительности миокарда к ац§-
тилхолину, снижением активности холинэстеразы в крови и угнетением
функции проводимости. Рефлекторная остановка сердца может возник-
нуть в результате раздражения миокарда и других органов, иннервируе-
мых блуждающим нервом, как через его центр, так и посредством
аксон-рефлексов (Reid, Stephenson, Hinton, 1952), а также и при раз-
дражении веточек тройничного нерва при иррадиации импульсов из
центра этого нерва в центр блуждающего нерва (А. Н. Рыжих, 1928).
Чаще всего внезапная остановка сердца возникает у больных в пре-
клонном возрасте, с заболеваниями сердечно-сосоудистой системы, когда
имеются нарушения автоматии и проводимости сердца (Л. В. Асеев,
1952; Bost, 1952; Ma, Hsia, 1954; Sadove, Julian, 1958), а также у детей
раннего возраста в связи с физиологическим повышением чувствитель-
ности сердца к импульсам, идущим по блуждающему нерву (Stephenson,
Reid, Hinton, 1954), и у взрослых, страдающих ваготонией.
При постепенном угасании сердечной деятельности наблюдаются
прогрессирующее понижение артериального давления, тахикардия, арит-
мия и в ряде случаев повышение венозного давления. Нередко остановке
сердца предшествует период длительной артериальной гипотензии. При
таком виде угасания сердечной деятельности обычно развивается атония
миокарда, но на ЭКГ в первые минуты прекращения кровообращения,
л иногда и дольше регистрируются видоизмененные желудочковые ком-
плексы. В основе патогенеза постепенного угасания сердечной деятель-
ности лежат нарушения метаболизма, которые приводят к депрессии
миокарда и недостаточности сократительной функции сердца. Экспери-
ментальными исследованиями установлено, что нарушения окислитель-
ных процессов в миокарде могут возникать не только при его ишемии
(Edwards e. а., 1954), но и при достаточном кровотоке в венечных сосу-
дах, когда возникает стресс (Hackel, Goodale, 1955). Понижение произ-
водительности сердечной мышцы наступает вследствие нарушения вы-
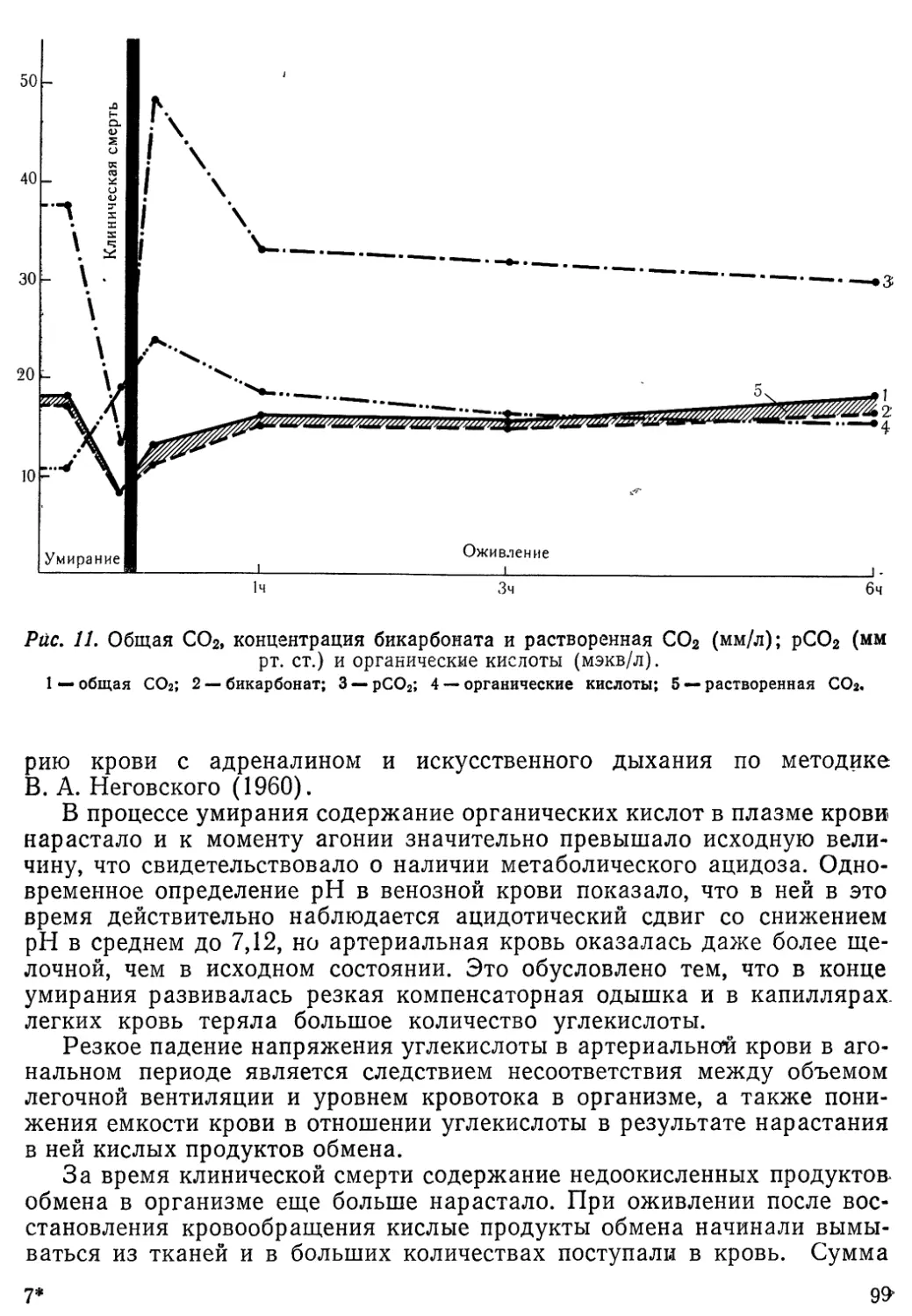
27
работки энергии и ее использования (Bing, 1955; Olso, Schwartz, 1951)v
Это грозное осложнение наблюдается при угасании сердечной деятель-
ности от травматического шока, кровопотери, асфиксии различной этио-
логии, во время передозировки наркотических агентов и т. д. Сроки*
прекращения сердечной деятельности при указанных патологических
процессах во многом зависят от состояния компенсаторных возможно-
стей организма и сердечно-сосудистой системы в первую очередь. Боль-
ные с различными заболеваниями сердца более подвержены опасности
остановки сердца даже при относительной артериальной гипотонии и.1
гипоксии (Eckenkoff, 1955).
Фибрилляция сердца. Явление фибрилляции сердца связано с нару-
шением способности сердечной мышцы совершать координированные-
сокращения: вместо одновременных сокращений и расслаблений всего*
миокарда отдельные мышечные пучки сокращаются разрозненно и раз-
новременно. Фибриллярные сокращения не способны поддерживать
полезную работу сердца как насоса, нагнетающего кровь в сосуды.
В случае фибрилляции предсердий кровообращение поддерживается за
счет работы желудочков; наступает лишь нарушение их ритма (мерца-
тельная аритмия) вследствие нерегулярного поступления возбуждения'
от непрерывно возбужденных предсердий. В случае же наступления
фибрилляции желудочков .кровообращение сразу же прекращается и,.
если не принять меры к устранению фибрилляции, организм быстро ло-
гибает.
Фибрилляция желудочков часто развивается внезапно. Отличать со-
стояние фибрилляции от асистолии сердца можно по данным электро-
кардиограммы или во время операции — путем непосредственного на-
блюдения за сердцем. Фибрилляция желудочков сопровождается появ-
лением на электрокардиограмме характерных фибриллярных осцилляции
неравномерной амплитуды с частотой 400—600 кол/мин.
При осмотре миокарда можно видеть, как по его поверхности «про-
бегают» быстрые сокращения отдельных мышечных пучков. На началь-
ном этапе фибрилляции — до наступления более глубокой гипоксии вся
поверхность желудочков находится в состоянии быстрых и частых коле-
баний («мелькания» или «мерцания»). Ощупывание миокарда в этом
состоянии вызывает своеобразное ощущение «червеобразных движе-
ний»; интенсивность этих движений также зависит от степени гипоксии*
миокарда. Все эти внешние проявления фибрилляции нашли свое отра-
жение в различных названиях данного феномена: «мерцания», «мелька-
ния», «червеобразные сокращения», «ундуляции» и т. д.
Предоставленные сами себе, фибриллярные сокращения желудочков-
постепенно замедляются, становятся все более слабыми. По мере нара
стания гипоксии все более и более значительные участки миокарда при-
ходят в состояние покоя. Через несколько минут могут полностью пре-
кратиться видимые движения по поверхности миокарда и только на*
ощупь можно обнаружить слабые сокращения в более глубоких слоях
сердечной мышцы. На ЭКГ можно видеть, как по мере ослабления фиб-
риллярных сокращений замедляется ритм и снижается амплитуда фиб-
риллярных осцилляции вплоть до полного их исчезновения.
28
Для объяснения механизма нарушения координированности сокра-
щений сердца при фибрилляции предлагались две теории: 1) гетеротоп-
*иой автоматии и 2) кольцевого ритма. Первая из этих теорий берет свое
начало с того времени, когда фибрилляция рассматривалась как «пере-
возбуждение» сердца. Согласно другой теории, нарушение координиро-
ванное™ сокращений связано с нарушением проведения возбуждения.
Такое нарушение может привести к тОхМу, что возбуждения будут непре-
рывно циркулировать по миокарду (вернее, по проводящей системе!)
того или иного отдела сердца. Беспрерывная циркуляция возбуждения
в частом ритме приводит к неусвоению ритма и нарушению координиро-
ванности сокращений.
Предвестниками наступления фибрилляции желудочков являются
различные нарушения ритма сердца. Наиболее часто при этом
появляются одиночные, а затем и групповые экстрасистолы. Не мень-
шую опасность представляет замедление ритма, связанное с развитием
-синусово-предсердной или предсердно-желудочковой блокады, что слу-
жит признаком резкого ухудшения проводимости. Еще более' грозным
предвестником нарушения координированности сокращений миокарда
является нарушение внутрижелудочковой проводимости, а именно появ-
ление блокады ножек пучка Гиса и конечных их разветвлений в миокар-
де желудочков.
Предварительной стадией фибрилляции является трепетание.
При этом состоянии сокращения миокарда имеют характер перисталь-
тики и частота возбуждений примерно вдвое меньше, чем при фибрилля-
ции C00 раз в минуту).
Пароксизмальная тахикардия, трепетание, фибрилляция являются
-переходными стадиями одного процесса и могут быть устранены одним
ш тем же воздействием — электрической дефибрилляцией сердца.
На основании данного факта следует считать, что все эти виды наруше-
ния ритма сердца поддерживаются одним и тем же механизмом, а именно
круговой циркуляцией возбуждения по сердцу вследствие
нарушения проводимости внутри того или иного его отдела. Предполо-
жение же о возникновении гетеротопной автоматии при фибрилляции
находится в противоречии с фактом возможности прекращения фибрил-
ляции электрическим раздражением. При испытании такого раздраже-
ния на нормально сокращающемся сердце наблюдается возбуждение и
сокращение сердца и никогда не наблюдается подавление автоматии.
Как указывалось ранее, фибрилляция желудочков может наступить
под влиянием различных неблагоприятных воздействий на сердце как
экзо-, так и эндогенного происхождения: 1) гипоксии, 2) гиперкапнии,
3) извращения и повышения рефлекторной возбудимости сердца, 4) от-
равления, 5) различных раздражений сердца (электрическое, механи-
ческое, температурное) и 6) наличия патологических изменений сердца
больного. Опасность наступления фибрилляции желудочков возрастает
при одновременном сочетании нескольких факторов, что часто встре-
чается как при операциях, так и при заболеваниях сердечно-сосудистой
системы. В практике реанимации фибрилляция желудочков нередко по-
является в качестве осложнения во время массажа сердца в результате
механического его раздражения при наличии гиперкапнии и гипоксии
миокарда.
В хирургической практике опасность нарушения работы
сердца зависит от характера оперативного вмешательства и особенно-
стей анестезиологического прсобия и возникающих осложнений.
Роль гипоксии в возникновении фибрилляции заключается в том, что
сердце в этом состоянии становится особо уязвимым, в результате чего
даже слабое механическое и рефлекторное раздражение может служить
причиной возникновения экстрасистолии и фибрилляции. Иногда доста-
точно прикосновения пинцетом к эпикарду, чтобы возникла фибрилля-
ция желудочков.
Роль наркоза иллюстрируется примером печального опыта первых
лет применения хлороформа, сопровождавшегося частыми случаями
внезапной смерти больных. Большое значение имеет в этом отношении
рефлекторное возбуждение и выделение адреналина в начале наркоза.
Из современных средств, применяемых для наркоза, фибрилляцию же-
лудочков могут вызвать циклопропан (карбон-тетрахлорид), фторотан,
хлорэтил.
В терапевтической практике в значительной части случаев
внезапной смерти не удается обнаружить каких-либо морфологических
изменений миокарда. Практика реанимации последних лет также пока-
зала, что при внезапном прекращении работы сердца наиболее часта*
обнаруживается фибрилляция желудочков. Опасность возникновения
фибрилляции желудочков при инфаркте миокарда особенно велика при
появлении аритмии. Асистолическая остановка сердца при инфаркте,
по-видимому, имеет место при более обширном повреждении ткани.
В случае же небольших морфологических изменений внезапное прекра-
щение работы сердца должно быть .поставлено в связь с наступлением
фибрилляции желудочков.
Развитие фибрилляции желудочков наблюдается во время приступов-
болезни Адамса—Стокса после кратковременного периода асистолии.
Хотя у этих больных часто наблюдается спонтанное прекращение фиб-
рилляции, такой благополучный исход бывает не всегда, и больные иног-
да погибают во время приступа, если им не оказывают своевременную-
помощь.
Описаны случаи внезапной смерти больных после длительных при-
емов препаратов наперстянки, хинидина, новокаинамида. Эти лекарства,
обычно назначаемые при тахисистолической форме мерцательной арит-
мии для предохранения желудочков от чрезмерно частого возбуждения,
способны в то же время ухудшить внутрижелудочковую проводимость
и служить причиной нарушения координированности сокращения мио-
карда.
Возникновение фибрилляции сердца под действием электриче-
ского тока представляет собой наиболее изученное и закономерное
явление в этой области патологии сердца. Нарушение координирован-
ности сокращения миокарда наступает в этом случае при превышении
частоты предельного ритма, который способен воспроизводить мио-
кард, — 5—6 раз в секунду.
30
Для возникновения фибрилляции желудочков в эксперименте не тре-
буется раздражать весь миокард: электроды могут быть расположены
на любом участке его поверхности. Важно, чтобы сила раздражения
превышала пороговую величину для получения эффекта возбуждения
в состоянии относительной рефрактерности миокарда в «уязвимую фазу»
цикла сердца (совпадает с вершиной зубца Т на ЭКГ).
Наступление фибрилляции желудочков в результате действия тока
на весь организм при электротравме также обусловлено непосредствен-
ным раздражающим действием тока на сердечную мышцу. Здесь, одна-
ко, имеется ряд превходящих (Обстоятельств: затруднение дыхания, по-
вышение артериального давления, рефлекторные влияния, которые могут
повысить предрасположенность сердца к фибрилляции в случае более
длительного действия тока. Данные опытов на животных, размер, вес
тела и сердца которых близки к размерам, весу тела и сердца человека,
позволили установить, что опасность наступления фибрилляции желу-
дочков от действия переменного тока осветительной сети возникает при
силе тока не ниже 100 мА. Более сильный ток A—5А) способен вызвать
фибрилляцию даже в случае весьма кратковременного воздействия —
менее продолжительности одной систолы. Опасный эффект кратковре-
менного воздействия сильного тока на сердце связан с возможностью-
попадания раздражения в момент окончания возбуждения желудочков—
в так называемую «уязвимую фазу» сердечного цикла. Раздражение
миокарда в это время застает его волокна в состоянии различной возбу-
димости. Одни волокна способны ответить на внешнее раздражение и
приходят в состояние возбуждения. Другие волокна, не окончившие к
этому моменту процесс предыдущего возбуждения, не реагируют на ис-
кусственный стимул непосредственно. Однако позднее и эти волокна
включаются в преждевременное экстрасистолическое возбуждение в
ответ на раздражение, поступающее к ним от соседних волокон. Этим
создается состояние разновременного возбуждения отдельных волокон
миокарда, которое в дальнейшем поддерживается путем круговой пере-
дачи возбуждения с одних волокон на другие.
•Возникновение фибрилляции желудочков при утоплении в прес-
ной воде в значительной мере связано с повышением количества калия
в -крови в результате гемолиза, вызванного разведением крови водой.
При утоплении в морской воде, не сопровождающемся гемолизом, фиб-
рилляции желудочков не наблюдается (см. главу XVI).
Охлаждение организма ниже 26—25° может привести к на-
ступлению фибрилляции желудочков. Такое «явление наблюдается в
эксперименте и клинике. У собак и обезьян, подвергшихся охлаждению
в ледяной ванне под нембуталовым наркозом, закономерно наступала
фибрилляция желудочков при достижении температуры тела 23—21°С
(В. А. Неговский, В. И. Соболева, 1960). Особенно часто фибрилляция
наступает при операциях на сердце в условиях глубокой гипотермии.
В нарушении деятельности сердца при гипотермии большую роль играет
ухудшение оксигенации крови. Опасность наступления фибрилляции же-
лудочков можно уменьшить, если во время охлаждения проводить искус-
ственное дыхание 'кислородом.
31
Фибрилляция желудочков может иногда наступить при диагности-
ческих процедурах, сопровождающихся механическими и хими-
ческими раздражениями сердца и других рефлексогенных зон (катетери-
зация сердца, бронхоскопия, ангиография). При катетеризации сердца
представляет опасность момент введения зонда в полость желудочков
и его прикосновения к чувствительной поверхности межжелудочковой
перегородки. Предупреждающим сигналом служит появление желудоч-
ковых экстрасистол.
Наряду с механическими раздражениями наступлению фибрилляции
благоприятствуют химические воздействия на сосудистые стенки контра-
стных веществ (диотраст и др.), применяемых для ангиографии.
Переливание крови в больших количествах также может выз-
вать фибрилляцию желудочков. Cooley, Christey A963) при перелива-
нии крови наблюдали 3,4% случаев фибрилляции. Развитие фибрилля-
ции в данном случае связано с нарушением соотношения Са"Н-/К+
в крови в.результате осаждения ионов кальция цитратной кровью, при-
меняемой для переливания (Firt, Hejhal, 1957). По Cooley и Christey,
возможно уменьшить опасность нарушения работы сердца путем перели-
вания суспензии эритроцитов, разведенных в кровезаменяющем раство-
ре, вместо цитратной крови.
Стадии фибрилляции желудочков
(изменения вида фибриллярных осцилляции на ЭКГ
в зависимости от степени гипоксии сердца)
Фибрилляция желудочков проявляется на электрокардиограмме в
•виде частых, непрерывных фибриллярных осцилляции, вид которых ме-
няется по мере нарастания гипоксии сердца. При фибрилляции, вызван-
ной электротравмой у здоровой взрослой собаки, вначале регистриру-
ются изоморфные, ритмичные синусоидальные осцилляции с частотой
10—12 в секунду. Через несколько секунд они начинают чередоваться с
осцилляциями другого вида — аритмичного полиморфного. Анализ ха-
рактера чередования этих двух видов осцилляции в зависимости от сте-
пени гипоксии сердца дал основание подразделить процесс развития
-фибрилляции желудочков на следующие пять стадий (Н. Л. Гурвич и
В. Я. Табак, 1964).
Первая стадия характеризуется правильным ритмом и относительно
высокой частотой фибриллярных осцилляции в течение нескольких се-
тсунд. Амплитуда их остается постоянной, а затем периодически начи-
нает убывать и возрастать, образуя характерные фигуры «веретен», пе-
ремежающихся несколькими низкоамплитудными аритмичными колеба-
ниями. Эти промежутки постепенно возрастают (с 0,2 до 0,7 с) при
относительно постоянной длительности веретен (IV2—2 с). К концу этой
стадии, продолжающейся 20—30 с, частота ритмичных осцилляции (ос-
новной ритм фибрилляции) замедляется до 8—9 раз в секунду (рис. 1).
Вторая стадия определяется по исчезновению фигур ветерен, увели-
чению длительности периодов аритмии и беспорядочному характеру
чередования ритмичных и аритмичных фибриллярных осцилляции. Бес-
'32
Рас. 1. ЭКГ фибрилляции желудочков у собаки (опыт 3/Х
1962 г.).
а — 15 с после начала фибрилляции — первая стадия; б — 50 с —вто-
рая стадия; в — 2 мин 10 с — третья стадия; г — 4 мин 30 с — четвертая
стадия; д — 7 мин — пятая стадия. II стандартное отведение, ско-
рость — 25 мм/с, усиление 1 см — 1 мВ.
порядочной становится группировка ритмичных осцилляции; они то про-
должаются подряд несколько секунд, то появляются в числе 2—3 в виде
буквы «М» или «W». К концу этой стадии основной ритм фибриллярных
осцилляции замедляется до 7—8 в секунду; лериоды аритмии становятся
более продолжительными и придают Э-КГ хаотический вид. Продолжи-
тельность второй стадии 20—40 с.
Третья стадия характеризуется отсутствием частых ритмичных осил-
ляций и появлением на ЭКГ групп более или менее изоморфных мед-
ленных (около 6 в секунду) колебаний, свойственных состоянию трепе-
тания желудочков. Переход групп трепетания в аритмичные осцилляции
имеет характерный вид: комплексы трепетания начинают постепенно
раздваиваться и переходят в синусоподобные осцилляции удвоенной
частоты. Эта стадия продолжается 2—3 мин.
3 Заказ № 1266
Четвертая стадия по данным ЭКГ представляет собой непосредствен-
ное продолжение третьей. Основанием для их подразделения служит
лишь значительное снижение амплитуды осцилляции — ниже 0,5 мВ
(вместо 1—1,5 мВ в предшествующие стадии). (В начале этой стадии еще
регистрируются группы трепетания и отмечается феномен удвоения ча-
стоты. Постепенно эти упорядоченные колебания на ЭКГ исчезают и
последняя приобретает полностью хаотический вид. Длительность чет-
вертой стадии 2—3 мин.
Пятая стадия характеризуется полной аритмичностью фибриллярных
осцилляции и низкой их амплитудой @,1—0,2 м(В). Лишь изредка мож,г
но увидеть на ЭКГ группу из 2—3 синусоидоподобных осцилляции.
Часто на фоне низких осцилляции желудочков можно обнаружить пред-
сердные зубцы («Р.») в правильном и довольно частом — 90—120 в ми-
нуту— ритме. Спустя 10—16 мин наблюдения фибриллярные осцилля-
ции угасают. В единичных случаях они наблюдаются дольше.
Полное угасание -биоэлектрической активности сердца при фибрил-
ляции желудочков наступает через 20—30 мин после ее начала.
Описанные изменения вида фибриллярных осцилляции желудочков
на ЭКГ имеют важное практическое значение для -проведения реанима-
ционных 'мероприятий. В течение первых двух стадий следует быстро
проводить электрическую дефибрилляцию, в результате которой можно
ожидать немедленного восстановления эффективной работы сердца.
Дефибрилляция, проведенная позднее (после наступления атонии мио-
карда), требует дополнительных мероприятий по устранению гипоксии
сердца. До дефибрилляции целесообразно провести мероприятия по
уменьшению гипоксии сердца (об этом можно судить по учащению фиб-
риллярных осцилляции и увеличению их амплитуды) и затем приступить
к дефибрилляции.
Диагностика остановки сердца. Основными клиническими признака-
ми остановки сердца и прекращения в организме кровообращения явля-
ются отсутствие сознания, пульса на магистральных сосудах и самостоя-
тельного дыхания, резкое расширение зрачков (без введения атропина!),
быстрое нарастание бледности или цианоза кожных покровов. В ряде
случаев отмечается появление клонических и тонических судорог. При
наличии указанного комплекса симптомов нет надобности выслушивать
сердце, измерять артериальное давление, записывать ЭКГ и т. д., по-
скольку этим удлиняются сроки отсутствия кровообращения в организ-
ме. Регистрация ЭКГ показана во время проведения реанимационных
мероприятий с целью дифференцирования причин прекращения крово-
обращения в организме (асистолия или фибрилляция желудочков)
и определения эффективности проводимой терапии. 'В последние годы
благодаря кардиомониторам появилась возможность вести постоянное
наблюдение за состоянием сердца.
Лечение асистолии. Основными терапевтическими мероприятиями при
клинической смерти являются массаж сердца и искусственная вентиля-
ция легких. Артериальное нагнетание крови, интракардиальные инъек-
ции адреналина, электростимуляция сердца являются дополнительными
средствами, повышающими эффективность массажа сердца. Массаж
34
сердца считается производительным в тех случаях, когда артериальное
давление поддерживается на уровне не ниже 60—70 мм рт, ст., пальпи-
руется пульс, хотя бы на сонных артериях, наблюдается сужение зрач-
ков и порозовение кожных покровов. Если с помощью массажа удается
поддерживать артериальное давление на указанном уровне, даже при
отсутствии сердечной деятельности могут восстановиться самостоятель-
ное дыхание и глазные рефлексы. Однако для более полного представ-
ления о состоянии кровообращения в организме, а следовательно, о про-
изводительности массажа сердца желательно иметь сведения о состоянии
биоэлектрической активности сердца и высших отделов головного мозга.
При поддержании в организме достаточного кровообращения по мере
уменьшения гипоксии отмечается восстановление синусового ритма и
нормализация желудочковых комплексов. На ЭЭГ при эффективном
массаже в случаях внезапной остановки сердца уже в первые минуты
обнаруживается восстановление электрической активности коры голов-
ного мозга (А. М. Гурвич, 1964). Однако при длительном массаже серд-
ца эффективность его ухудшается.
По данным О. Н. Булановой, И. О. Закс A961), даже при достаточно
высоком артериальном давлении с 15-й минуты массажа снижается со-
держание кислорода в артериальной крови и уменьшаются щелочные
резервы, к 30-й минуте эти изменения выявляются особенно резко.
В настоящее время отдается предпочтение наружному массажу серд-
ца. Методика его проведения подробно описана в главе XX. Преимуще-
ства наружного массажа сердца перед прямым заключаются в техниче-
ской простоте и доступности. Начинать его можно не только при асисто-
лии, но и при очень слабой, неэффективной сердечной деятельности.
Постреанимационный период протекает значительно легче, чем после
прямого массажа сердца. Однако проведение наружного массажа приво-
дит к быстрому утомлению реаниматора. В последнее десятилетие были
созданы специальные аппараты для наружного массажа сердца
(Dottor e. а., 1961; Nachlas e. a., 1962;'Baily e. а., 1964; Gunter, 1965;
Tombascia, 1966).
В нашей стране аппарат для механического наружного массажа
сердца сконструирован В. Л. Ивановым A971). Этот аппарат
работает, получая питание как от сети переменного тока напряжением
ПО, 127, 220 В, так и от сети постоянного тока низкого напряжения
(бортовая электросеть автомашины, самолета). Вмонтированные в аппа-
рат электроды позволяют проводить дефибрилляцию во время массажа
сердца. Адекватные размеры, форма контактной головки, производящей
надавливание на грудину, исключают возможность переломов ребер,
отрыва грудины и повреждений печени.
Противопоказаниями к проведению наружного массажа сердца яв-
ляются тяжелые травматические повреждения грудной клетки с множе-
ственным переломом ребер, кифосколиозы, резко выраженная ригид-
ность грудной стенки.
В случаях прекращения сердечной деятельности при указанной
патологии, а также при операциях на органах грудной полости методом*
выбора является прямой массаж сердца. Этот вид массажа показан т
3* 3S
тогда, когда наружный массаж сердца мало производителен и не создает
в организме кровообращения, достаточного для поддержания деятель-
ности жизненно важных органов. В ряде случаев прямой массаж сердца
способствует восстановлению сердечной деятельности тогда, когда на-
ружный оказывается неэффективным. Так, из 26 больных у 15, у которых
остановка сердца наступила во время наркоза вследствие тяжелой трав-
мы и 'Кровопотери, прямой массаж сердца, начатый после безуспешного
наружного, способствовал восстановлению эффективной сердечной дея-
тельности. У 7 из них восстановились функции центральной нервной
системы (iB. А. Неговский, 1966).
Прямой массаж сердца. Для проведения прямого массажа сердца
грудную полость вскрывают разрезом в четвертом или пятом межребер-
ных промежутках, отступя на 1,5—2 см от левого края грудины до сред-
ней подмышечной линии. Первоначально массаж сердца целесообразно
проводить без вскрытия перикарда. Имеющаяся в перикардиальной со-
рочке жидкость является как бы буфером и предотвращает травмирую-
щее действие массажа на миокард. /Кроме того, на вскрытие перикарда
затрачивается время, удлиняется срок клинической смерти и увеличи-
вается возможность развития фибрилляции желудочков. Вскрытие пери-
карда показано лишь при тампонаде сердца и резком его расширении,
а также тогда, когда массаж сердца через невскрытый перикард не дает
положительных результатов. При проведении массажа сердце сжимают
между четырьмя пальцами с одной стороны и большим пальцем с дру-
гой, периодически несколько изменяя их расположение. Во избежание
повреждения миокарда сердце следует массировать ладонными поверх-
ностями пальцев.
Массаж можно осуществлять и путем прижатия сердца к грудине.
Для этого одна рука захватывает сердце сзади <и прижимает его к груди-
не, которая снаружи фиксируется другой рукой. По сравнению с первым
видом массажа этот метод менее эффективен, так как при нем полости
сердца недостаточно хорошо опорожняются от крови. У детей массаж
сердца целесообразно проводить тремя пальцами. Введение в полость
грудной клетки кисти может оказаться травматичным.
Массаж сердца должен проводиться в ритме 60—70 сдавливаний в
минуту. После каждого расслабления сердца необходимо делать кратко-
временную паузу с тем, чтобы дать возможность желудочкам сердца
наполниться кровью. При медленном сдавливании сердца внутрижелу-
дочковое давление повышается медленно и выброс крови в сосуды бы-
вает недостаточным.
При грубом или неправильном проведении массажа сердца могут
произойти обширные повреждения миокарда вплоть до перфорации его
стенки К На вскрытии у больных, которым проводился массаж сердца,
могут быть обнаружены точечные кровоизлияния под эпи- и эндокардом.
Эти изменения скорее являются следствием перенесенной гипоксии, а не
травмирующего действия массажа. Подобные изменения, по данным
1 Это осложнение требует быстрого ушивания перфорационного отверстия с после-
дующим проведением массажа сердца.
36
Hosier A954), не оказывают существенного влияния на сердечную дея-
тельность. Опасным осложнением массажа сердца является фибрил-
ляция желудочков. В этих случаях дефибрилляцию следует про-
водить только после снижения степени гипоксии и повышения тонуса ми-
окарда.
Дефибрилляция сердца. Проблема дефибрилляции сердца — пробле-
ма спасения жизни многих тысяч людей, в том числе молодых и здоро-
вых, у которых нарушение деятельности сердца было вызвано случай-
ной причиной: электротравмой, повышенной чувствительностью к нарко-
зу во время операции, утоплением и т. п. Устранением фибрилляции
желудочков удается спасти жизнь многим больным, у которых фибрил-
ляция наступила при инфаркте мжжарда.
Большая частота внезапной смерти от фибрилляции желудочков
больных инфарктом миокарда обусловливает чрезвычайную актуаль-
ность вопросов своевременного проведения реанимационных мероприя-
тий. Успешная реанимация возможна лишь при организации специали-
зированной помощи на всех этапах лечения больных инфарктом миокар-
да. В частности, в специализированных стационарах должны быть
оборудованы палаты интенсивной терапии, оснащенные всем необходи-
мым для проведения реанимации. Поскольку фибрилляция желудочков
имеет склонность к рецидивам, больные должны находиться под посто-
янным мониторным наблюдением. Непрерывный электрокардиографиче-
ский контроль может быть прекращен только при отсутствии аритмии
в течение 4—5 сут, прошедших с момента возникновения последнего
приступа фибрилляции желудочков (Е. И. Чазов и др., 1972).
Впервые дефибрилляция сердца человека была осуществлена в 1947 г.
хирургом Beck переменным током. С этого времени методику открытой
дефибрилляции сердца стали применять в операционной, а в единичных
случаях и вне операционной. В 1956 г. стали проводить и наружную
дефибрилляцию сердца переменным напряжением 440—720 В (Zoll,
Linenthal, Gibson, Paul, Norman).
Возможность применения электрических разрядов для дефибрилля-
ции сердца была показана Prevost и Battelli еще в 1900 г. Однако при
несовершенной технике того времени (разряд малой емкости через ис-
кровой промежуток) приходилось применять крайне высокое напря-
жение— до 20 кВ на обнаженном сердце (!). При этих условиях эф-
фект дефибрилляции сопровождался остановкой сердца в диастоле, что
дало основание рассматривать прекращение фибрилляции как след-
ствие временной потери возбудимости сердца под действием сильного
тока.
Изучение закономерностей электрической дефибрилляции сердца
(Н. Л. Гурвич, 1940, 1957) позволило, однако, установить, что этот
эффект связан не с тормозящим, а с возбуждающим действием электри-
ческого раздражения, в результате которого прекращается .круговая
циркуляция возбуждения. В соответствии с этим принципом была ра-
ционализирована методика дефибрилляции сердца, Было показано, что
разряд конденсатора целесообразно производить через катушку индук-
тивности, наличие которой устраняет начальную высоковольтную часть
37
разрядного тока, увеличивая в
то же время продолжитель-
ность разряда. Этим значитель-
но повышается эффективность
разряда и устраняется возмож-
ность вредного действия чрез-
мерно сильного тока на сердце.
Применяемый в клиниках
Советского Союза наиболее
эффективный импульсный де-
фибриллятор (типа ИД-66) ге-
нерирует одиночный электриче-
ский импульс продолжитель-
ностью до 8 мс («полезное вре-
Рис. 2. Импульс ДКИ-01 при разряде с напря- мя пяяттпяжрния сеппия)
жением 5000 В через эталон сопротивления ?1Я>> Раздражения сердца;.
40 Ом. Каждое деление по горизонтали 2 мс, Импульс получается путем раз-
по вертикали — 5 А. ряда конденсатора емкостью
20 мкФ через индуктивность
0,3 Гн. При возможности разряда конденсатора до 5—6 кВ (наличие ин-
дуктивности в цепи снижает напряжение на объекте в 3—4 раза по
сравнению с напряжением заряда конденсатора!) импульсный дефибрил-
лятор обладает достаточной мощностью для наружной дефибрилляции
сердца у любого больного.
Преимущества разряда через индуктивность были подтверждены в
1953 г. McKay, Leeds. В 1967 г. В. Peleska в Праге сконструировал аппа-
рат ПРЕМА-1 -по типу советского дефибриллятора ИД-1-ВЭИ. При поль-
зовании аппаратом ПРЕМА-1 следует, однако, заменить имеющуюся в
этом аппарате катушку индуктивности с железным сердечником на
другую катушку с той же индуктивностью @,3 Гн) без сердечника (на-
личие железного сердечника в катуитке не обеспечивает сохранения
номинальной величины индуктивности при той силе тока — 20—26 А, ко-
торая требуется для дефибрилляции сердца). В последнем выпуске
чехословацкого аппарата (ЛРЕМА-З) эта ошибка исправлена и катушка
индуктивности не имеет сердечника. То же следует отметить и в отно-
шении аппарата, сконструированного Lown в США. При емкости
16 мкФ в аппарате имеется индуктивность менее 0,1 Гн, которая не
обеспечивает достаточной длительности импульса. Другим недостатком
аппарата Lown, присущим всем дефибрилляторам зарубежных фирм,
является градуировка в ватт-секундах (по энергии разряда) вместо
градуировки по напряжению, которая позволяет более точно определять
необходимую мощность импульса у того или иного больного.
Учитывая возможность повреждения сердца при той величине тока,
которая необходима для дефибрилляции, даже при наиболее оптималь-
ной форме импульса, генерируемого отечественным дефибриллятором
ИД-1-ВЭИ B5—35А), мы совместно с ВНИКРЭМ М. М. Пр.1 в послед-
1 Всесоюзный научно-исследовательский и конструкторский институт радиоэлек-
тронной медицинской аппаратуры Министерства медицинской промышленности СССР.
38
нее время разработали новую 'модель импульсного дефибриллятора —
ДИ-03 (ДКИ-01), которая генерирует импульс двухфазной формы
(рис. 2). Большая эффективность такого имлульса достигается в резуль-
тате суммации раздражающего эффекта обеих фаз тока, т. е. за счет
изменения направления тока, а ,не за счет его усиления. Дан-
ные клиники и эксперимента показали, что таким путем можно значи-
тельно снизить величину дефибриллирующего тока и, следовательно,
устранить опасность повреждения сердца.
Зарубежные конструкторы пошли по другому лути усовершенствова-
ния дефибриллятора — обеспечения генерации импульса достаточной
мощности D00 Дж) при наименьших габаритах аппарата. Такое «усо-
вершенствование» обычно достигается за счет уменьшения индуктив-
ности, в результате чего импульс приобретает форму апериодического
разряда. (О недостатках такого вида дефибриллятора см. ниже).
Общие закономерности
электрической дефибрилляции сердца
Электрическая дефибрилляция сердца -является следствием синхро-
низации возбуждения во всех его элементах под влиянием сильного
тока и в соответствии с этим подчиняется известным закономерностям
реакции возбудимых тканей на электрическое раздражение-
1. Для достижения дефибрилляции требуется определенная величи-
на тока, воздействующего на сердце, которая может быть охарактеризо-
вана как пороговая
2. Эффективность раздражения определяется его силой, продолжи-
тельностью, крутизной возрастания и убывания тока.
3. Минимальная величина дефибриллирующего тока («реобаза»)
достигается при продолжительности импульса 7—<10 м/с — «полезном
времени» раздражения сердца. Более продолжительное воздействие тока
не повышает эффективности воздействия и может лишь повредить
сердце.
4. Длительность раздражения, которая меньше «полезного времени»,
требует увеличения силы тока. Взаимосвязь время — сила раздражения
напоминает таковую же при раздражении сердца в диастоле.
5. Своеобразной особенностью электрической дефибрилляции сердца
является возрастание пороговой величины тока для некоторых видов
импульса — апериодического разряда, полусинусоидного— при увеличе-
нии их продолжительности за пределы «полезного времени» раздраже-
ния сердца. Это явление связано с падением градиента заднего фронта
указанных импульсов при большой продолжительности. Ведущее значе-
ние заднего фронта импульса в феномене дефибрилляции сердца под-
тверждается возможностью компенсации падения градиента соответстг
вующим увеличением силы тока.
Снижение эффективности апериодического разряда три увеличении
его продолжительности за пределы «полезного времени» указывает на
преобладающее значение заднего фронта импульса (иными словами, его
анэлектротонического эффекта) в феномене электрической дефибрилля-
39
ции сердца. Такая возможность объясняется данными об извращении
закона Пфлюгера (о возникновении возбуждения на катоде) и повыше-
нии реактивности под анодом при раздражении сердца в состоянии его
рефрактерности (Brooks, Hoffman, 1966; Decker, 1970). Значение этих
данных для понимания механизма электрической дефибрилляции сердца
несомненно, если учесть тот факт, что во время фибрилляции значитель-
ная (если не подавляющая) часть волокон миокарда и проводящей си-
стемы находятся в состоянии большей или меньшей рефрактерности.
Пренебрежение значением формы импульса и сведение эффекта де-
фибрилляции сердца исключительно к количеству энергии, выраженному
в ватт-секундах, имело своим результатом конструкции и распростране-
ние за рубежом «портативных» дефибрилляторов, генерирующих им-
пульс до 400 Дж, но имеющий вид апериодического разряда. Такой
импульс требует значительно большего тока для достижения эффекта,
что наносит вред сердцу, и более того, он может оказаться совершенно
неэффективным при более значительном сопротивлении в цепи из-за
падения крутизны заднего фронта.
Основные правила применения импульсного дефибриллятора типа
ИД-1-ВЭИ и ДИ-03 в клинике
а) Положение электродов.
Импульсный дефибриллятор снабжен электродами для дефибрилля-
ции сердца при вскрытой и интактной грудной клетке. И в том и в дру-
гом случае один электрод, имеющий вид плоского диска диаметром
15 см, подкладывают под левую лопатку больного. Другой электрод
7,5 см, поддерживаемый за изолирующую рукоятку, прижимают к перед-
ней поверхности сердца или же при наружной дефибрилляции —к по-
верхности грудной клетки несколько выше и правее области верхушеч-
ного толчка. В последних выпусках дефибриллятора предусмотрены для
наружной дефибрилляции сердца два одинаковых электрода с изоли-
рующими рукоятками. Один электрод прижимают к передней поверх-
ности грудной клетки над рукояткой грудины, а другой — к области верх-
хушки сердца.
При наружной дефибрилляции необходимо очень плотно прижать
электроды к телу с силой в 10 кг. Поверхность электродов смазывают
электропроводной пастой или же обертывают марлей, смоченной соле-
вым раствором. Особенно тщательно надо следить за равномерным кон-
тактом всей поверхности электродов с сердцем при открытой дефибрил-
ляции. Нарушение этого условия может привести к ожогу поверхности
миокарда краем электрода при отсутствии эффекта дефибрилляции
вследствие плохого контакта на других участках поверхности сердца.
б) Ориентировочные величины напряжения на конденсаторе при
дефибрилляции сердца импульсным дефибриллятором ИД-ЬВЭИ.
Большой клинический опыт применения импульсного дефибриллято-
ра позволяет рекомендовать следующие ориентировочные величины на-
пряжения для дефибрилляции сердца в зависимости от возраста и тело-
сложения больного (табл. 1).
Первая попытка дефибрилляции должна быть проведена с наимень-
шим напряжением, которое предположительно может быть достаточ-
40
Таблица 1
Возраст и телосложение больного
У взрослых:
при астеническом телосложении
при среднем телосложении
при более значительном объеме грудной клетки и у
упитанных больных.
при гипертрофии сердца
У детей:
до 1 года
1—3 лет
4—7 »
8—12 »
12—16 »
Величина дефибриллирующего
напряжения в вольтах
при интактной
грудной клетке
3000—4000
3500—4500
4500—5500
4500—5500
500—1000
1000—1500
1250—2000
2000—2500
2500—3500
при вскрытой
грудной клетке
1500—1750
1500—1750
1500—2000
2000—2500
300—500
500—700
500—1000
750—1250
1000—1500
ным; в случае отсутствия эффекта нужно повторить дефибрилляцию,
увеличив напряжение на 10—15%. Одиночный импульс пороговой силы
(для дефибрилляции) не обладает выраженным вредным влиянием и
поэтому целесообразнее идти на риск необходимости повторного воздей-
ствия, чем применять чрезмерно сильный ток, который может нанести
вред сердцу.
Последовательность мероприятий по восстановлению работы сердца
при наличии фибрилляции желудочков. При наступлении фибрилляции
желудочков следует стремиться по возможности быстрее — до наступле-
ния глубокой гипоксии — дефибриллировать сердце. При отсутствии
выраженной гипоксии одна лишь дефибрилляция способна привести к
восстановлению эффективной деятельности сердца. Длительность этого
срока различна в зависимости от предшествующего состояния сердца.
При нормальной гемодинамике до наступления фибрилляции работоспо-
собность миокарда может быть сохранена даже через 1—17г мин после
прекращения кровотока. В случае же нарушения гемодинамики задолго
до наступления фибрилляции (например, осложненный наркоз, неудо-
влетворительное дыхание и (Кровопотеря во время операции) даже
быстро проведенная дефибрилляция может иметь своим результатом
лишь слабые, малоэффективные сокращения сердца. В таких случаях,
а также при отсутствии дефибриллятора следует немедленно приступить
к проведению массажа сердца и искусственного дыхания (желательно
кислородом) для устранения гипоксии и восстановления работоспособ-
ности сердца. Этим путем можно сохранить жизнеспособность организ-
ма до доставки дефибриллятора.
О степени восстановления работоспособности миокарда и своевре-
менности дефибрилляции можно судить по виду фибриллярных осцилля-
ции на электрокардиограмме. При низкой их амплитуде, редком ритме
и резко выраженной аритмичности (что соответствует III стадии фиб-
рилляции) дефибрилляция не приводит к появлению эффективных со-
кращений сердца. После устранения гипоксии с 'помощью массажа уве-
личивается амплитуда осцилляции и они становятся более ритмичными
и частыми. При таком виде фибриллярных осцилляции можно ожидать
появления эффективных сокращений сердца непосредственно после де-
фибрилляции. Повысить эффективность массажа сердца можно путем
введения адреналина и нагнетания крови в артерию.
Следует отметить, что устранение гипоксии способствует повышению
работоспособности миокарда. В соответствии с этим снижается порого-
вая сила тока для дефибрилляции сердца.
Тактика и результаты лечения остановки сердца, вызванной различ-
ными причинами. Результаты лечения остановки сердца во многом за-
висят от причин прекращения сердечной деятельности, а также от сроков
клинической смерти, характера проводимого лечения и его продолжи-
тельности.
Внезапная остановка сердца значительно легче поддается лечению,
чем постепенное угасание сердечной деятельности с развитием атонии
миокарда.
Исход оживления во многом определяется сроками клинической
смерти. Чем раньше начаты лечебные мероприятия, тем меньше процент
летальных исходов. По данным Stephenson, Reid, Hinton A954, 1969),
94% из всех выживших больных перенесли клиническую смерть не более
4 мин и только у 6% остановка сердца продолжалась 6—6 мин. Следует
заметить, что предельные сроки клинической смерти довольно широко
варьируют. Когда развитию асистолии предшествует длительный период
гипотензии, лечение оказывается часто неэффективным даж'е после
1—3 мин клинической смерти. При внезапной остановке сердца даже
после 8—9-минутного прекращения кровообращения в организме (в не-
которых случаях) можно еще ожидать стойких положительных резуль-
татов.
При внезапной остановке сердца, когда тонус миокарда сохранен,
часто бывает достаточно провести несколько нажатий на грудную клет-
ку. Если же, несмотря на проведение наружного массажа сердца в те-
чение 1—2 мин, пульс на магистральных сосудах не пальпируется и
зрачки остаются широкими, показаны внутриартериальные или интра-
кардиальные введения адреналина или хлорида кальция. Обычно сер-
дечная деятельность восстанавливается в течение короткого промежутка
времени E—10 мин). Более длительное отсутствие восстановления сер-
дечной деятельности в этих случаях может быть обусловлено двумя
основными причинами: фибрилляцией желудочков и недостаточно совер-
шенным кровообращением в организме, создаваемым массажем сердца.
Фибрилляция желудочков в процессе проведения массажа сердца
при кратковременном прекращении кровообращения в организме возни-
кает чрезвычайно редко. Значительно чаще она является первопричиной
внезапной остановки сердца. Отдифференцировать внезапно развившую-
ся асистолию от фибрилляции желудочков лри невскрытой грудной по-
лости можно только на основании данных ЗКГ. Тем не менее возникно-
вение перед остановкой сердца резко выраженной тахикардии, особенно
42
с появлением экстрасистол, позволяет думать о фибрилляции желудоч-
ков сердца, а брадикардии— о рефлекторной остановке сердца. При до-
статочно хорошей продуктивности массажа сердца проводить его можно
в течение длительного времени (несколько часов). Недостаточность
кровообращения яри проведении наружного массажа сердца может
быть связана с развитием атонии миокарда при неправильном его прове-
дении и у больных с сердечно-сосудистой недостаточностью. Непрямой
массаж сердца следует продолжать до тех пор, пока имеются признаки
его эффективности. Если эти признаки не появляются в течение 3—4 мин
после начала наружного массажа, следует переходить на прямой транс-
торакальный массаж сердца (Н. М. Рябова, 1964).
При клинической смерти, связанной с массивной кровопотерей, пер-
воочередной задачей является восполнение объема циркулирующей кро-
ви. Поэтому в комплекс реанимационных мероприятий наряду с масса-
жем сердца и искусственной вентиляцией легких должна обязательно
входить гемотрансфузионная терапия. Однако вопрос о наиболее ра-
циональном пути введения крови до сих пор дискутируется. По млению
Воуап A955), Callord с соавторами A967), при применении наружного
массажа сердца имеет значение не путь, а скорость восполнения крово-
потери. По мнению Kirimli, Safar A965), применение наружного масса-
жа сердца в сочетании с внутривенным нагнетанием крови равноценно
артериальному нагнетанию крови.
Работы, выполненные в нашей лаборатории, показали преимущества
проведения наружного массажа сердца с артериальным нагнетанием
крови по сравнению с внутривенным. При проведении наружного масса-
жа сердца в сочетании с внутривенным нагнетанием крови у собак после
3—5 мин клинической смерти, вызванной «кровопусканием, артериальное
давление начинает повышаться в конце первой минуты оживления, как
правило, развивается трудно устранимая фибрилляция желудочков и
сердечная деятельность восстанавливается на 3—4-й минуте оживления,
а в ряде случаев и позже, когда кровопотеря возмещена на 75—100%.
При проведении наружного массажа сердца с артериальным нагнетани-
ем крови с такой же скоростью артериальное давление начинает повы-
шаться в первые 10—15 с оживления, фибрилляция желудочков возни-
кает в исключительно редких случаях и легко устраняется, сердечная
деятельность восстанавливается в конце 1-й—в начале 2-й минуты
реанимации при восполнении кровоштери на 30—42%. Более раннее
возобновление эффективного кровообращения в организме при проведе-
нии наружного массажа сердца с артериальным нагнетанием крови
создавало и более благоприятные условия для восстановления жизнен-
ных функций организма. Проведенные в этом же направлении исследова-
ния В. Л. Иванова A971) показали, что при внутривенном нагнетании
крови для осуществления кровотока требуется большее восполнение
кровопотери, чем при артериальном нагнетании, так как малый крут
кровообращения имеет большую емкость. Учитывая, что решающая роль
в конечном исходе оживления принадлежит тому методу, который с са-
мого начала обеспечивает перфузию кровью мозга и сердца, мы не
можем согласиться с мнением сторонников внутривенных трансфузий.
43
В связи с изложенным можно считать, что внутривенное переливание
крови имеет смысл проводить лишь в начале лечения остановки сердца,
во время обнажения артерии, а также при небольшой или восполненной
кровопотере, когда артериальное нагнетание крови по каким-либо при-
чинам провести не удается. Неостановленное кровотечение не является
противопоказанием к лечению остановки сердца при условии одновре-
менного проведения необходимых оперативных вмешательств. Отдель-
ные клинические наблюдения дают основания полагать, что при прове-
дении наружного массажа сердца в сочетании с артериальным нагнета-
нием крови даже в состоянии клинической смерти возможно произвести
хирургическое вмешательство и вернуть больных к жизни.
Для улучшения кровообращения в жизненно важных органах имеет
смысл привести больного в положение Тренделенбурга и пережать аорту
на 10—20 мин. Более длительное 'пережатие аорты может вызвать деге-
неративные изменения в паренхиматозных органах.
При длительном периоде умирания, когда наступает истощение ком-
пенсаторных возможностей организма и срок клинической смерти резко
сокращается, непрямой массаж сердца с артериальным нагнетанием
крови следует начинать еще в агональном периоде, а при отсутствии
положительных результатов в 'первую же минуту клинической смерти
приступать к прямому массажу в сочетании с комплексом других тера-
певтических мероприятий, повышающих его эффективность. Высокую
эффективность вспомогательного массажа сердца при резком ослабле-
нии сердечной деятельности при операциях на органах грудной полости
отмечали многие авторы, в частности А. Н. Бакулев A969), Б. В. Пет-
ровский A961), Cole A952). В неотложной хирургии и акушерской прак-
тике мы также получили наилучшие результаты при проведении наруж-
ного массажа сердца в стадии агонии.
При остановке сердца во время хирургических вмешательств боль-
шое влияние на исход лечения клинической смерти оказывает не только
характер умирания, но и вид, глубина и продолжительность наркоза.
Так, при остановке сердца вследствие быстрого внутривенного введения
тиопентала натрия или в начале ингаляции эфира при клинической смер-
ти не свыше 3 мин сердечная деятельность легко восстанавливается при
наружном массаже сердца. При более длительных сраках клинической
смерти необходимо сочетать наружный массаж сердца с артериальным
нагнетанием крови и интракардиальными введениями адреналина. Осо-
бенно трудно поддается лечению остановка сердца, наступившая во вре-
мя глубокого и длительного однакомпонентного наркоза. При таком виде
умирания даже комплексное применение всех лечебных мероприятий,
как правило, оказывается неэффективным.
Следует заметить, что независимо от причин прекращения сердечной
деятельности эффективность лечения этого осложнения снижается по
мере увеличения сроков проведения массажа сердца вследствие про-
грессирующего углубления гипоксии и ацидоза в тканях в результате
значительного замедления скорости кровотока. Эксперименты на соба-
ках показали, что после 2 мин остановки сердца от электротравмы про-
ведение в течение 60 мин ма'ссажа сердца с искусственным дыханием
44
воздухом способствует стойкому восстановлению всех функций организ-
ма. При удлинении массажа до 120 мин все животные погибают от
острой недостаточности сердца или дегенеративных изменений в парен-
химатозных органах без признаков восстановления функций высших
отделов центральной нервной системы. Лучшие результаты были полу-
чены при повышении парциального давления кислорода в крови путем
проведения искусственной вентиляции легких чистым кислородом.
Восстановление сердечной деятельности является первым этапом ле-
чения клинической смерти. У больных, выведенных из состояния кли-
нической смерти, в течение длительного времени сохраняется гипоксия
тканей, метаболический ацидоз и тяжелая интоксикация недоокислен-
ными продуктами обмена. Кроме того, не меньшее значение имеют и
другие нарушения метаболизма (гипопротеинемия, нарушения электро-
литного равновесия и т. д.) и свертывающей системы крови. Коррекция
указанных нарушений или лечение «болезни оживленного организма»
является непременным условием успешной реанимации.
Схема ведения восстановительного периода после клинической
смерти
1. Следует продолжать искусственную вентиляцию легких (ИВЛ)
(см. главу XI) до полного восстановления сознания больного и досто-
верно установленного адекватного самостоятельного дыхания. Раннее
прекращение ИВЛ — самая частая ошибка при оживлении и одна из са-
мых частых причин неудач реанимации.
2. После восстановления кровообращения необходимо немедленно
начинать устранение нарушения метаболического ацидоза, желательно
под динамическим контролем за кислотно-щелочным равновесием. По-
казано внутривенное введение гидрокарбоната натрия.
3. Для нормализации микроциркуляции показано раннее применение
антикоагулянтов прямого действия (см. главу III и XIV).
4. Для уменьшения повреждающего действия гипоксии и ацидоза на
мозг показано сразу после восстановления сердечной деятельности ох-
лаждение головы больного со снижением температуры, измеряемой в
наружном слуховом проходе (до 30—32°С). Гипотермия особенно необ-
ходима после длительных сроков клинической смерти E—6 мин и бо-
лее) и длительной реанимации, когда сердечная деятельность восстанав-
ливается через 10—15 мин массажа сердца. Прекращать охлаждение
можно только после появления признаков положительной неврологиче-
ской и электроэнцефалографической динамики через 2—3 сут).
5. Для предотвращения развития гипоксического отека мозга необ-
ходимо наряду с ИВЛ под контролем за ликворным давлением приме-
нять большие дозы кортикостероидов E00—600 мг кортизона или
100—120 мг преднизолона в сутки), концентрированные растворы белка,
аскорбиновую кислоту. Так называемую дегидратационную терапию
(мочевина, маннитол, салуретики) следует проводить с максимальной
осторожностью.
6. Абсолютно необходима тщательная коррекция нарушений водно-
электролитного баланса, белкового и углеводного обмена, профилактика
инфекционных осложнений (см. главу XII).
Ill
РЕГИОНАРНОЕ КРОВООБРАЩЕНИЕ
И МИКРОЦИРКУЛЯЦИЯ ПРИ ТЕРМИНАЛЬНЫХ
состояниях
Изучение закономерностей циркуляции крови в разных органах и
тканях при различных условиях жизнедеятельности организма состав-
ляет проблему регионарного кровообращения.
Во время шока, кровопотери, агонии изменения регионарного крово-
тока носят в основном приспособительный характер. Они направлены
на сохранение циркуляции крови в одних органах (наиболее жизненно
важных) за счет ее уменьшения в других. Однако во многих случаях
регионарные сдвиги скоро перестают быть адекватными. Недостаточ-
ность местного кровоснабжения приводит к образованию новых патоло-
гических сдвигов. Возникшие нарушения циркуляции и обмена веществ
могут оказаться необратимыми и способствовать возникновению необра-
тимых изменений в других областях.
Регуляция регионарного кровообращения включает многообразное
взаимодействие нервного и гуморального контроля. Нервный контроль
осуществляется на самых различных уровнях нервной системы. Гормо-
нальные факторы и накапливающиеся в тканях продукты обмена, поми-
мо непосредственного действия на сосуды, участвуют в осуществлении
нервных стимулов, усиливая или чаще противодействуя им. В разных
циркуляторных отделах, а иногда и в зонах чувствительность к накап-
ливающимся гуморальным продуктам различна, что наряду с другими
факторами обусловливает различие сосудистых реакций.
Капилляры, мельчайшие артериолы и венулы в силу непосредствен-
ного участия в процессах обмена находятся в большей зависимости от
гуморальных и метаболических агентов, чем более крупные сосуды.
В последних преобладает влияние нервной регуляции.
Для определения регионарного кровотока в настоящее время исполь-
зуются непосредственное измерение количества притекающей или отте-
кающей крови, резистография, термометрия, плетизмография, введение
радиоактивных веществ, красителей и другие методы, позволяющие
определять объемный кровоток в единицу времени. Большую ценность
представляет одновременное измерение кровообращения в разных обла-
стях с учетом сердечного выброса. Этот метод позволяет более точно
судить о регионарном перераспределении крови.
При всей важности перечисленных показателей они не могут харак-
теризовать многие тонкие сдвиги периферического кровообращения.
46
Такая ограниченность в определенной мере компенсируется изучением
микроциркуляции крови и состояния капилляров, в первую очередь ме-
тодами прижизненной микроскопии. Такие гистофизиологические на-
блюдения позволяют судить о непосредственной реакции прекапилляр-
ных сфинктеров и мышечных венул, активности вазомоции, нарушении
продвижения крови через капилляры, количестве функционирующих
капилляров, соотношении клеточного и плазменного состава крови и
других многочисленных факторах, которые составляют понятие «микро-
циркуляция».
Современные экспериментальные методы дают возможность уловить
и фиксировать изменения микроциркуляции во многих, даже малопро-
зрачных, органах и тканях.
В литературе существует много теорий, объясняющих нарушения ре-
гионарного кровообращения и микроциркуляции крови при тяжелом
шоке и коллапсе. К наиболее обоснованным можно отнести следующие:
1. Нарушение функций центральной нервной системы.
2. Нарушение нарвно-звдсжршшой регуляции.
3. Нарушение нервно-сосудистой регуляции.
4. Нарушение микроциркуляторного ложа.
5. Нарушение сопротивления периферических сосудов.
6. Уменьшение возврата крови в периферических сосудах.
7. Секвестрация крови в периферических сосудах.
8. Внутрисосудистое свертывание крови.
9. Агрегация форменных элементов крови.
10. Жировая эмболия.
11. Экстравазация крови.
12. Высвобождение катехоламинов.
13. Высвобождение вазотоксических веществ.
14. Высвобождение миодепрессорного фактора.
15. Бактериальная токсемия.
16. Недостаточность ретикулоэндотелиальной системы.
17. Нарушение обмена веществ.
18. Первичное нарушение кровообращения в одной из областей (моз-
говой, портальной, почечной и др.).
Большинство этих теорий построено на данных, полученных при ис-
пользовании экспериментальных моделей, отличающихся от тех, кото-
рые приняты в экспериментальной реаниматологии. Многие из установ-
ленных положений имеют общее значение, в том числе для понимания
нарушений, происходящих при умирании и оживлении после клиниче-
ской смерти. В то же время нельзя не учитывать, что выявление спе-
цифических закономерностей требует специального анализа с учетом
конкретных этиологических факторов, характера и динамики угасания
жизнедеятельности, осуществляемых терапевтических мероприятий
и т. д. Изучение этого вопроса на моделях умирания и оживления после
клинической смерти по существу только начинается. Имеются лишь еди-
ничные литературные данные. Поэтому в этой части приходится руко-
водствоваться в основном результатами исследований, проведенных
нами и нашими сотрудниками.
Нарушения микроциркуляции
При шоке и кровопотере наблюдаются две фазы изменения микро-
циркуляции. Первая состоит из так называемых компенсаторно-приспо-
собительных реакций. К ним относятся повышение чувствительности
артериол к адреналину, ограничение кровотока «центральными» кана-
лами, усиление вазомоции: увеличение частоты и амплитуды переме-
жающихся сокращений метартериол и прекапиллярных сфинктеров,
рост напряженности периодов констрикции. Следует подчеркнуть услов-
ность определения первой фазы как компенсаторно-приспособительной.
Компенсация в основном направлена на увеличение притока крови к
сердцу (венозного возврата крови) и поддержание центрального крово-
обращения. Осуществляется она за счет дефицита капиллярной перфу-
зии, что может приводить к развитию тканевых ишемических нарушений
еще при достаточно высоких показателях общего кровообращения. Вто-
рая фаза включает нарастающий застой крови на венозной стороне ка-
пилляра, падение венозного оттока, секвестрацию крови в ранее
запустевших капиллярах.
В начальном периоде в более крупных сосудах выражена констрик-
ция, в прекапиллярах — вазомоция. Последняя способствует капилляр-
ному кровотоку; вазоконстрикция его ослабляет. Важную роль при
кровопотере и шоке приобретают артерио-венозные анастомозы. Во вре-
мя спазма прекапиллярных сфинктеров кровь, минуя капилляры, через
анастомозы приходит в вены. С одной стороны, это благоприятствует
притоку крови к сердцу, а с другой — усиливает местную ишемию.
В динамике прогрессирующего шока или коллапса появляется застой
на венозной стороне капилляра. Одним из ведущих механизмов этого
явления считается нарушение симпатической регуляции, приводящее к
ослаблению тонуса прекапиллярных сфинктеров при его сохранении в
посткапил'лярных отделах (Symposium, 1970, и др.). В этом периоде
вазомоция может приобретать отрицательную роль, так как способству-
ет поступлению крови в капилляры, отток из которых затруднен. Такое
явление приводит к накоплению крови в капиллярах, уменьшению ее
количества в активной циркуляции, прогрессирующему сокращению
числа функционирующих капилляров. В части мелких сосудов кровоток
замедляется, в других — становится пульсирующим, маятникообразным
или даже обратным.
В начальных стадиях агонии происходит перемещение воды из тка-
ней в кровь (вследствие запустевания капилляров, падения скорости
кровотока и других факторов). Такому движению воды противодейству-
ет сохраняющаяся значительная разница тканевого и внутрисосудистого
онкотического давления. Восстановление объема циркулирующей крови
при кроврпотере благодаря мобилизации тканевой жидкости может быть
весьма значительным. Во время периода декомпенсации вода начинает
покидать капилляры. Этому способствует рост гидростатического давле-
ния, нарушение транспорта натрия, изменение физико-химических
свойств коллагеновых волокон, тканевой ацидоз и некоторые другие
метаболические сдаипи (Hollenberg e. а., 1970; Driicker, 1971, « др.)-
48
Повышенная экстравазация жидкости считается важным фактором про-
грессирующего падения количества крови в активной циркуляции, агре-
гации клеток крови, нарушения микроциркуляции и необратимости.
Наряду с экстравазациеи жидкости необходимо учитывать се секвестра-
цию в сосудах вместе с эритроцитами и отдельно от них.
Секвестрация крови зависит от увеличения вязкости, нарушения ста-
бильности суспензии форменных элементов крови в капиллярах и пре-
каниллярах, появления хилезных образований и т. д. Увеличение вяз-
кости крови предопределяется снижением скорости кровотока, потерей
воды и другими факторами. Большое значение придается затруднению
оттока крови из капилляров. В результате всего этого потоки эритро-
цитов и плазмы разделяются. Скорость движения последней начинает
опережать скорость движения эритроцитов.
С развитием стаза в капиллярах меняется соотношение жидкой части
и форменных элементов крови. Многие сократившиеся сосуды почти
целиком заполнены плазмой. В других накапливаются эритроциты. Осу-
ществлению микроциркуляции крови препятствует внутрисосудистое
свертывание крови, агрегация эритроцитов, лейкоцитов и тромбоцитов,
укрупнение хиломикронов и образование крупных капель жира. Внутри-
сосудистое свертывание крови предопределяется нарушением состояния
свертывающей и аитисвертывающей систем (Ю. М. Левин и др.,
1963—1973; А. М. Чернух, Ю. М. Штыхно, 1974; Crowell, Guyton, 1952;
Hardaway e. a., 1963).
Механизм агрегации эритроцитов в первую очередь связан с замед-
лением кровотока, вследствие чего уменьшается устойчивость их состоя-
ния в плазме. Стимулируют этот процесс потеря внутрисосудистой воды,
увеличение вязкости, нарушения состояния некоторых ингредиентов
крови, набухание эритроцитов, изменение сопротивления сосудов и т. д.
Решающую роль играет ацидоз. Некоторые авторы считают, что он «за-
пускает» процесс агрегации эритроцитов, склеивание тромбоцитов.
В результате проведения мероприятий, способствующих снижению
вязкости крови, а также за счет наличия выделяемого селезенкой анти-
тромбоцитарного фактора ослабляется агрегация эритроцитов, восста-
навливается микроциркуляция кровь. Сходные механизмы предопределя-
ют и агрегацию лейкоцитов. В некоторых органах, например в легких,
она оказывается выраженной в большей степени и проявляется раньше,
чем агрегация эритроцитов. Определенную роль в нарушении капилляр-
ного кровотока может играть закрытие последних не только агрегатами
лейкоцитов, по и отдельными лейкоцитами.
Липемия и жировая эмболия, не связанные с механической травмой,
уже давно описаны при шоке, кровопотере, гипоксии, терминальных со-
стояниях. Они сопутствуют агрегации форменных элементов крози и,
вероятно, способствуют ей. При терминальных состояниях, в зависи-
мости от тяжести стресса, в крови возрастает содержание р-липопро-
теидов, фосфолипидов, нейтральных жиров, холестерина и продуктов
жирового обмена. В мобилизации жиров участвуют гормоны гипофиза,
щитовидной железы, надпочечников, гепарин (активирующий выход
липопротеид-липазы), падение в плазме уровня альбуминов, характер-
4 Заказ № 1263 49
ное для тяжелых расстройств кровообращения. Во время кровопотери
в крови появляется ингибитор, подавляющий липолитическую актив-
ность почек, а также ингибиторы липопротеид-липазы. Весьма вероятно,
что липемию при терминальных состояниях можно связать с затрудне-
нием элиминации жира из крови вследствие падения капиллярного
кровообращения, блокады ретикулоэндотелиальной системы, угнетения
окислительно-восстановительных процессов и т. д. Определенную роль
играет увеличение поступления жира из грудного лимфатического про-
тока. Укрупнение хиломикронов и образование жировых капель, препят-
ствующих микроциркуляции, могут происходить и без значительного
увеличения содержания жира в крови.
Определенную роль в нарушении капиллярного кровообращения
играет набухание эндотелиальных клеток, суживающих просвет мелких
сосудов, а также «закупоривание» части сосудов отдельными оторвав-
шимися от сосудистой стенки отечными клетками эндотелия (Ames e. а.,
1968, и др.). Все эти разные по своей природе явления приводят к оди-
наковому патогенетическому эффекту-—образованию в периферических
сосудах множественных рассеянных ишемических очагов.
Нарушения
регионарного кровообращения
Микроциркуляторные сдвиги неразрывно связаны с нарушениями
регионарного кровообращения. Расстройства микроциркуляции имеют
выраженные регионарные особенности. Своеобразно проявляются они
в сердце, скелетных мышцах, печени и других органах.
Имеются четкие доказательства, что важнейшая роль в нарушении
регионарного кровообращения и микроциркуляции принадлежит паде-
нию сердечного выброса крови (Ю. М. Левин, 1964, 1970, 1973; Weale,
1963; Rothe, 1970, и др.). При шоке и кровопотере ударный и минутный
объем крови падает обычно раньше, чем снижается артериальное дав-
ление, и оказывается ниже по сравнению с нормой в 17г—3 раза. Умень-
шение притока крови включает всю цепь как общих, так и регионарных
приспособительных и патологических реакций.
Первыми реагируют нервно-рефлекторные механизмы. Их влияние
проявляется в сокращении артерий, вен, артериол и венул. Выражен-
ность этой реакции в разных отделах сосудистого русла неодинакова,
что способствует регионарному перераспределению сердечного выброса.
Иногда неврогенная вазоконстрикция может оказаться настолько зна-
чительной, что некоторые органы и ткани временно лишаются крови
при еще достаточном уровне аортального давления. Перераспределению
крови способствуют неравнозначное (в разных органах и тканях) на-
копление катехоламинов и других вазоактивных веществ, особенности
регионарного строения сосудов, структуры и функции органа.
При длительной гипотензии сокращение периферических сосудов ос-
лабевает даже тогда, когда нервный сосудистый тонус не меняется.
Ослабление происходит в результате антагонистического действия
i(b основном на сфинктеры артериол) накапливающихся в ишемизиро-
50
ванных тканях вазодилятаторов. Данные об их участии в декомпенса-
ции периферического кровообращения при шоке и кровопотере явились
важным шагом в понимании механизмов развития необратимости. Боль-
шинство этих веществ действуют преимущественно в зоне их образова-
ния. Некоторые из них проникают в кровь и перемещаются в отдален-
ные участки сосудистого русла. Для проявления действия этих веществ
на сосуды решающую роль играет не только их концентрация, но и со-
отношение количества тех или иных медиаторов, а также состояние
нервной регуляции. Действие вазодилятаторных метаболитов преобла-
дает в конечных стадиях шока или кровопотери.
Из большого числа выявленных вазотоксических веществ важная
роль отводится ферритину (Shorr e. а., 1961, и др.)- Было показано, что
в нормальной печени при достаточном содержании кислорода неактив-
ный ферритин содержатся в виде дисульфида с трехвалентным железом.
Во время тяжелой гипоксии ферритин восстанавливается до сульфгид-
рильной формы, а его железо становится двухвалентным. Последнее
легко диссоциирует и проникает п кровь. При сравнительно небольших
количествах поступившего в кровь двухвалентного железа оно связы-
вается белками плазмы. Когда возможности последних истощаются,
проявляется угнетающее сосудистый тонус действие двухвалентного
железа.
В результате гипоксического повреждения внутриклеточных мембран
в кровь попадает большое количество лизосомальиых ферментов, син-
тез которых происходит в основном в поджелудочной железе. Помимо
самостоятельного вазотоксического действия, они участвуют в образова-
нии пептидов, угнетающих сократительную функиию миокарда (Leter,.
Martin, 1970, и др.). Показано, что основным путем поступления этих
пептидов в кровь является лимфа. Удаление лимфы из устья грудного
протока улучшало течение восстановительного периода у собак, пере-
несших смертельную гипотензию.
Ишемизированный кишечник выделяет в кровь вазодепрессорное ве-
щество метаболического происхождения (Gergeli e. а., 1971, и др.|.
Предварительное удаление части кишечника или предупреждение попа-
дания продуцируемых в его стенках во время геморрагической гипотен-
зии токсических факторов способствует отдалению или даже предотвра-
щению некоторых расстройств микроциркуляции крови, увеличению
числа выживших животных.
В расстройствах периферического кровообращения при длительной
гипотензии участвуют бактерии и особенно их токсины (Drucker, 1974,'
и др.). Проникнув через физиологические барьеры во время шока или
коллапса, они плохо инактивируются, что связано с ослаблением функ-
ции ретикулоэндотелиальной системы, парализуют периферическую-
циркуляцию. Механизм их действия выяснен недостаточно. Есть данные
о том, что он опосредован через нервную систему, через потенцирование'
действия катехоламинов, осуществляется прямым влиянием на гладкие
мышцы сосудов и т. т. •• -
Существенную роль в расстройствах регионарного кровообращения
и мйкроциркуляции играют нарушения «венопрессорного механизма»
4* 51
(Hollenberg e. a., 1970, и др.). В это понятие включаются факторы, дей-
ствующие дистально по отношению - к капиллярам и способствующие
центрипеталыюму движению крови. Возникающее при шоке и длитель-
ной гипотензии нарушение вепопрессорного механизма вызывает паде-
ние притока крови к сердцу, уменьшение ее количества в активной цир-
куляции. Кровь накапливается в венах и усугубляет затруднение оттока
из капилляров.
Изменения регионарного
кровообращения и микроциркуляции в периоде
умирания
Коронарный кровоток. Если во многих органах компенса-
ция гипоксии возможна за счет усиленного потребления кислорода из
крови, торможения функций органа и, следовательно, уменьшения энер-
гетических затрат и т. д., то для сердца эти пути неосуществимы, так
как артерио-венозная разница по кислороду и в норме максимальна, а
торможение функций сердца связано с остановкой общей циркуляции
и гибелью организма. Поэтому приспособление скорости и объема коро-
нарного кровотока к трофическим потребностям миокарда является ос-
новным средством непрерывного восполнения энергетических затрат
миокарда.
Уменьшение коронарного кровотока при развитии шока или после
кровопотери наступает позже и выражено меньше, чем падение потока
в других областях. Более того, та часть сердечного выброса крови, кото-
рая попадает в венечные сосуды (коронарная фракция сердечного вы-
броса), неуклонно возрастает. Это связано с тем, что сопротивление
потоку в сосудах сердца оказывается меньшим, чем во многих других
областях. Возникающее перераспределение крови считается одним из
существенных проявлений механизма компенсации. Благодаря ему сни-
жение коронарного потока происходит лишь тогда, когда компенсация
оказывается исчерпанной. Основным патогенетическим фактором при
этом является нарастающее падение сердечного выброса и аортального
давления. В последующем недостаточный коронарный поток может стать
ведущим звеном порочного круга и привести (через нарушение обмена
в сердечной мышце) к еще большему падению ударного и минутного
объема крови (Б. И. Словиков, 1966, и др.).
Во время смертельной кровопотери коронарный поток уменьшается
позже (в процентном отношении меньше), чем сердечный выброс. В пе-
риод агонии или клинической смерти самые слабые сокращения сердца
сопровождаются некоторым продвижением крови по венечным сосудам
(Е. М. Березовская, 1969).
Мозговое кровообращение отличается своеобразными ме-
ханизмами компенсации, которые предохраняют мозг от внезапных из-
менений артериального давления. При острой кровопотере наступает
спазм регионарных артерий мозга. Он сочетается с выраженными пери-
стальтическими сокращениями мозговых артерий. В начальных стадиях
это способствует поддержанию внутримозгового кровообращения
52
(Г. И. Мчедлишвили, 1960). В дальнейшем спазм, если он сохраняется,
приобретает отрицательное значение, так как препятствует кровотоку,
В агональном периоде острой кровопотери остановка мозгового потока
крови происходит поздно, при очень низком артериальном давлении,
Однако угнетение потребления свободного кислорода в мозге наступает
еще до того, как прекращается мозговой кровоток (Б. И. Словиков,
1962). Микроскопия мягкой мозговой оболочки агонирующего животного
выявила неравномерное замедление кровотока в разных сосудах, пере-
стройку соотношения плазмы и эритроцитов, а в период стаза — их агре-
гацию A0. М. Левин, 1965, и др.).
Брыжеечный и печеночный кровоток при тяжелых рас-
стройствах циркуляции резко меняется (Lillehei e. а., 1962, и др.)» Выра-
женная специфика этих изменений связана с регионарными анатомиче-
скими особенностями. Кровь в этой области проходит через две сети
капилляров: кишечную и печеночную. Градиент порто-кавальиого давле-
ния очень мал. Поэтому даже небольшое изменение сопротивления сосу-
дов печени может вызвать затруднение кровотока, скопление крови
в брыжеечном русле. Последнее, как известно, отличается большой вме-
стимостью. Выключение из активной циркуляции части крови, количест-
во которой при шоке или кровопотере и без того уменьшено, может
оказаться грозным осложнением.
Вся эта картина четко выявляется в экспериментах на животных
(собаки, кошки и др.)» обладающих развитой системой сфинктеров в со-
судах печени A0. М. Левин, 1963, 1964; С. А. Селезнев, 1965, и др.).
В ряде случаев такое явление наблюдается и у человека, хотя у людей
сфинктерная система печеночных сосудов развита слабее.
Закономерно встречающиеся после тяжелого шока и кровопотери
некротические изменения в слизистой оболочке кишечника свидетельст-
вуют о выраженных регионарных нарушениях микроцнркуляции и тро-
фики.
Почечный кровоток во время шока или кровопотери обусловливает
не только функцию этого органа, но и продуцирование важных для об-
щей гемодинамики веществ. Кроме того, забирая около 25% всего сер-
дечного выброса, он в большей степени влияет на перераспределение
крови в других органах и тканях.
Чаще всего в начальных стадиях кровопотери почечный кровоток
снижается мало. Почечная фракция сердечного выброса не меняется или
даже возрастает. Это объясняется меньшим ростом сопротивления сосу-
дов почек по сравнению с другими органами и тканями. При дальней-
шем падении почечного кровотока сопротивление сосудов почки возрас-
тает. Происходит снижение почечной фракции сердечного выброса.
Такая реакция особенно прогрессирует, когда артериальное давление
падает ниже 50—60 мм рт. ст. В агональном периоде кровоток через
почки резко сокращается, что свидетельствует о значительном сопротив-
лении почечных сосудов.
На кровоток почек влияют имеющиеся в ней артерио-вспозные анасто-
мозы. Шунтируя кровь из артерий в вены, они усугубляют гипоксию,
особенно коркового слоя почек. Истинное малокровие почек при общих
53
расстройствах циркуляции может оказаться больше, чем зарегистриро-
ванное прямым методом количество протекающей крови.
Скелетные мышцы содержат около 70% всех сосудов организма. Они
обладают колоссальной вместимостью к широким диапазоном измене-
ния тонуса. Даже легкие сдвиги состояния этой части Периферического
сосудистого русла вызывают перемещение больших масс крови, измене-
ние общего кровообращения.
Кровоток в скелетных мышцах при шоке и кровопотере меняется не-
лостоянно. При резком снижении сердечного выброса он круто падает.
Сопротивление сосудов может усиливаться настолько, что поток времен-
но прерывается. При продленной гипотензии сопротивление потоку сла-
беет. Фракция сердечного выброса, приходящаяся на долю скелетных
мышц, возрастает (Ю. М. Левин, 1965; Б. И. Словиков, 1966, и др.).
Изменения регионарного
кровообращения и микроциркуляции в периоде
оживления
Оживление после клинической смерти приводит в разных случаях
к неодинаковому восстановлению сердечного выброса. Даже при одина-
ковых показателях общего артериального давления сердечный выброс
у разных животных может отличаться в 2—3 раза.
В экспериментах, связанных с более длительным умиранием и исто-
щением компенсаторных приспособлений, минутный объем крови после
временного увеличения значительно снижается. Такое снижение обычно
предшествует падению уровня общего артериального давления. При бла-
гоприятном течении восстановительного периода сердечный выброс срав-
нительно быстро нормализуется. В некоторых случаях он длительно
остается повышенным, но в последующем часто происходит значитель-
ное ослабление сердечной деятельности. Оно, очевидно, связано с исто-
щением и без того уменьшенных трофических ресурсов миокарда вовремя
усиленной работы сердца. Практическую важность контроля за ударным
и минутным объемом сердца трудно переоценить. Эти показатели одни-
ми из первых сигнализируют о начавшихся сдвигах общего кровообра-
щения, предупреждают о возможности декомпенсаций, проявлением ко-
торой является падение артериального давления.
Коронарный кровоток после оживления резко и быстро возрастает.
Он превышает исходный в 11/г—2 раза и, несмотря на колебания арте-
риального давления, характерные для восстановительного периода, мо-
жет долго оставаться повышенным. В случаях осложнения восстанови-
тельного периода и значительного уменьшения сердечного выброса
коронарный кровоток снижается. При этом вне зависимости от этапа
оживления и восстановления нервной регуляции сохраняется обычная
тенденция компенсации коронарного кровотока за счет других органов.
Чрезвычайно существенными представляются нам данные о пони-
женном содержании свободного кислорода в мышце сердца в начальном
периоде оживления после клинической смерти. Оно свидетельствует
о том, что даже повышенный кровоток не в состоянии удовлетворить резко
54
возросших метаболических потребностей миокарда. Изредка в периоде
оживления отмечается спонтанное падение коронарного кровотока при
условии более или менее благоприятного состояния общих показателей
гемодинамики. Механизм такого явления неясен. Однако оно, несомнен-
но, может оказаться причиной последующего падения сократительной
способности миокарда и сердечного выброса.
Кровообращение мозга в период оживления зависит от целого ряда
факторов. В результате повышенного сопротивления регионарных арте-
рий приток крови в течение 5—10 мин после восстановления общего
артериального давления оказывается пониженным даже в случаях бла-
гоприятного течения реанимации. При оживлении после клинической
смерти, которой предшествовала длительная гипотензия, резко возрас-
тает ликворное давление. Оно затрудняет отток крови из головного моз-
га, приводит к повышению внутричерепного венозного давления, что
в свою очередь может явиться причиной замедления мозгового кровото-
ка, разрывов капилляров, точечных кровоизлияний и других нарушений.
В периоде восстановления жизнедеятельности в коре и в других отделах
мозга сохраняется большое число нефуикционирующих капилляров.
Кровообращение в некоторых рассеянных участках может не восстанав-
ливаться до часа и дольше. Возобновление кровотока в таких областях
происходит в разное время после оживления. Существенно, что когда на
одном участке регистрируется отсутствие циркуляции, в соседнем крово-
ток и напряжение кислорода могут находиться на высоких цифрах.
Механизм выявленного нарушения связан с закрытием мелких сосудов.
Оно является одной из основных причин образования гнездных морфоло-
гических деструкции в головном мозге после тяжелой ишемии. В послед-
ние годы этому феномену уделено большое внимание в плане объяснения
механизмов необратимости (Ames е. а., 1968, и др.). Разработка лечеб-
ных мероприятий, направленных на предупреждение и устранение дан-
ного явления, должна иметь большое практическое значение.
Портальный кровоток при оживлении меняется непостоянно. В слу-
чаях благоприятного течения восстановительного периода в воротной
вене быстро устанавливается высокий объемный кровоток. Он может
превышать исходный в 1 7г—2 раза. Колебания артериального давления,
свойственные начальному периоду оживления, нерезко отражаются на
этом потоке. В менее благоприятных случаях, когда устанавливается по-
ниженное артериальное давление, портальный потек оказывается пони-
женным. Существенно, что и в первом, и во втором случае портальное
давление остается повышенным. Сказанное свидетельствует о выражен-
ной активации сосудистых сфинктеров печени, затруднении продвижения
крови через печеночные сосуды. При благоприятном течении восстано-
вительного периода через 40—90 мин происходит нормализация указан-
ных сдвигов.
В слизистой оболочке кишечника, кишечной стенке и в печени дли-
тельное время сохраняются диссеминированные участки, лишенные кро-
вообращения. Образующиеся после длительной гипотеизии в кишечнике
некротические язвы являются источником токсемии, могут приводить
к кровотечениям.
55
Кровоток в почках первые 30—40 мин после оживления обычно ос-
лаблен. Даже устойчивое повышение артериального давления не всегда
нормализует его. В эгом отношении положительное действие может ока-
зать новокаин, введенный паранефралыю или внутривенно.
Изучение кровотока в мелких сосудах почки во время восстанови-
тельного периода оживления после клинической смерти показывает воз-
можность длительного закрытия части из них, как это наблюдается
в сосудах головного мозга и других органов. Учитывая сходство картины
регресса этих изменений, а также положительное действие антикоагу-
лянтов, можно думать о близком механизме этого явления.
Кровоток в скелетных мышцах при оживлении варьирует в очень ши-
роких пределах. Можно выделить четыре основных типа: 1) стабилиза-
цию кровотока на цифрах, близких к норме; 2) резкое падение объем-
ного кровотока; 3) усиление кровотока; 4) смешанный тип, включающий
случаи изменения потока в короткий промежуток времени.
Перечисленные варианты связаны с состоянием общей гемодинамики
и регионарных сосудистых констрикторных механизмов. Естественно, что
значительное увеличение кровотока через скелетные мышцы может при-
водить к невыгодному для более чувствительных к гипоксии органов
регионарному перераспределению сердечного выброса крови.
Особое внимание вызывает выраженное непостоянство изменения со-
противления сосудов этой области.
Во время агонии и после оживления организма, перенесшего клини-
ческую смерть, в разных органах и тканях происходят специфические
сосудистые сдвиги. С одной стороны, они носят компенсаторно-приспо-
собительный характер, а с другой — создают условия для развития но-
вых расстройств. Знание механизмов возникновения этих расстройств
должно способствовать разработке мероприятий по их устранению, что
имеет первостепенное практическое значение.
Часто бывает, что успешно оживленный человек в дальнейшем по-
гибает. Изучение регионарного кровообращения и микроциркуляции
показало, что это иногда происходит не в результате необратимых рас-
стройств, возникших во время агонии и клинической смерти, а в резуль-
тате нарушений, проявившихся после оживления, когда уже восстанови-
лась работа сердца и самостоятельное дыхание. Большая часть таких
сдвигов в течение некоторого времени устранима. Однако, если не при-
нять соответствующих мер, нормализация может оказаться невоз-
можной. Следует выделить основные практически важные нарушения,
характерные для разных сосудистых зон.
Резкое понижение сердечного выброса значительно ухудшает течение
восстановительного периода. Это определяется уменьшением общего ко-
личества крови, отрицательными моментами защитной вазоконстрикции,
перераспределением крови, истощением компенсации, развитием гипок-
сии и т. д. *
Значительное повышение сердечного выброса в период оживления
также не может считаться адекватным, так как оно приводит к истоще-
нию и без того уменьшенных ресурсов сердца, последующему падению
его деятельности.
56
Требуют внимания случаи, свидетельствующие о возможности
тайного» уменьшения коронарного крозотока. Естественно, что это бла-
годаря прямой зависимости обмена миокарда от регионарного потока
может вызвать морфологические и функциональные нарушения. Однако
даже повышенный коронарный поток не всегда способен удовлетворить
возросшие потребности миокарда в кислороде. Поэтому одной из перво-
степенных задач восстановительного периода надо считать создание мак-
симально благоприятных условий для обмена миокарда.
Имеющиеся в период оживления после клинической смерти наруше-
ния циркуляции в мелких сосудах мозга, почек, печени, кишечника и
других органов увеличивают продолжительность гипоксии в соответст-
вующих зонах. Очевидно, что с этим явлением связаны многие локаль-
ные расстройства (вплоть до некротических), появляющиеся на разных
этапах восстановительного периода. Благоприятное действие аптикоагу-
лянтов позволяет их использовать как эффективные терапевтические
средства. Получены некоторые другие обнадеживающие результаты.
Скопление крови в портальном русле, уменьшение ее количества в ак-
тивной циркуляции, выключение части мелких сосудов из кровотока,
гипоксия печени и кишечника и т. д. — все это на каком-то из этапов
может предопределить необратимые циркуляторные расстройства.
Понижение почечного кровотока в восстановительном периоде прово-
цирует многочисленные нарушения — проявление почечно-печеночного
синдрома и т. д.
Важно учитывать непостоянство изменений сопротивления сосудов
скелетных мышц. Поиски путей регуляции кровотока в них могут дать
хороший практический результат.
Изучение микроциркуляции и регионарного кровообращения орга-
низма, перенесшего терминальное состояние, позволило выявить меха-
низмы, играющие важную роль в развитии необратимости. Нет сомнения
в том, что это направление, рожденное потребностями практики, внесет
вклад в науку об оживлении организма.
IV
УГАСАНИЕ
И ВОССТАНОВЛЕНИЕ ФУНКЦИЙ
ВНЕШНЕГО ДЫХАНИЯ
Нарушения внешнего дыхания приводят к расстройствам газообмена
в легких, которые могут проявляться в виде трех основных синдромов:
гипоксии, гиперкапнии и гипокапнии.
В артериальной крови в норме содержится 95—98% НЬО2, напряже-
ние О2 (рО2) равно 100 мм рт. ст., напряжение СОг (рСО2) равно 35—
45 мм рт. ст.
Синдром гипоксии. Если в артериальной крови содержание НЬОг
менее 95%, то это состояние называют гипоксемией. Гипоксемия являет-
ся частным проявлением общего синдрома гипоксии т. е. дефицита кис-
лорода в организме. Кислородное голодание, как известно, может быть
обусловлено нарушениями газообмена в легких, нарушением транспорта
кислорода кровью или утилизации его тканями (см. главу VI).
В клинике различают три стадии развития гипоксии.
Первая стадия — умеренная гипоксия. Больные беспокойны, эйфо-
ричны, реже сопливы (Сага, Poisvert, I962; Monsallier, 1963). Наблюда-
ется легкий цианоз, дыхание учащено, раздуваются крылья носа, пульс
частый, артериальное давление умеренно повышено. В артериальной
крови содержится 89—85% НЬО2, рО2— 70—55 мм рт. ст. (А. М. Чар-
ный, 1947).
Вторая стадия — глубокая гипоксия. Больные резко возбуждены.
Цианоз, дыхание учащено, в акте вдоха участвуют дополнительные ды-
хательные мышцы, пульс очень частый, артериальное давление повыше-
но. В этой стадии могут наступить судороги и кома. В артериальной кро-
ви 87—74% НЬО2, рО2 —55—40 мм рт. ст. (А. М. Чарный).
Третья стадия — гипоксическая кома. Больные без сознания, рефлек-
сов нет. Резкий цианоз, ритм дыхания нарушен, может наблюдаться
периодическое дыхание, артериальное давление резко падает, сердечная
деятельность нарушается и наступает смерть. В артериальной крови
40—30% НЬО2, рО2 —40—20 мм рт. ст. (А. М. Черный).
Синдром гиперкапнии — в организме повышено содержание углекис-
лоты, рСО2 в артериальной крови выше 40 мм рт. ст. При гиперкапнии
развивается газовый или дыхательный ацидоз, которым может быть
компенсированным и некомпенсированным (см. главу VI). В клинике
различают три стадии развития гиперкапнии.
58
Первая стадия — умеренная гиперкапния. Больные находятся в со-
стоянии эйфории, плохо спят. Кожные покровы гиперемированы, умерен-
но увеличено потоотделение, дыхание учащено, бронхиальная секреция
усилена, пульс частый, артериальное давление повышено.
Вторая стадия — глубокая гиперкапния. Больные резко возбуждены,
агрессивны. Кожные покровы с цианотичным оттенком, обильное пото-
отделение. Углекислота в норме является естественным возбудителем
для клеток дыхательного центра. Однако повышение содержания угле-
кислоты в артериальной крови приводит к угнетению дыхательного
центра, вследствие чего дыхание становится редким и поверхностным,
нарушается ритм дыхания. Бронхиальная секреция резко усилена, пульс
выше 160 ударов в минуту, артериальное давление повышено, увеличена
кровоточивость тканей, уменьшено мочеобразование. .
Третья стадия — ацидотическая кома. У больных отсутствуют созна-
ние и рефлексы. Кожные покровы цианотичны, артериальное давление
резко понижено. Кома развивается постепенно и смерть наступает от ос-
тановки дыхания или прекращения деятельности сердца.
Синдром гипокапнии — в артериальной крови уменьшено содержание
углекислоты, напряжение углекислоты менее 40 мм рт. ст. Гипокапния
развивается при повышении альвеолярной вентиляции, что часто проис-
ходит при нарушении центральной регуляции дыхания и при гипоксии
различного происхождения. Гипокапния и сама по себе может привести
к гипоксии вследствие затруднения диссоциации оксигемоглобина.
При значительной гипокапнии больные вялы, сонливы, апатичны.
Кожные покровы бледные и сухие, артериальное давление понижено,
пульс частый, реакция мочи щелочная вследствие усиления выделения
почками бикарбонатов. При гипокапнии развивается газовый алкало?,
который может привести к спазму сосудов мозга (Whittenberger, Sar-
noff, 1950).
Вследствие снижения содержания ионов кальция в крови при нара-
стании газового алкалоза развивается судорожный синдром — тре-
мор мимической мускулатуры, атетоз пальцев, повышение тонуса ды-
хательной мускулатуры (Н. Е. Буров, и др., 1963; Monsaliier, 1962,
и др.). Затем наступает алкалотическая кома, которая быстро приводит
к смерти.
Нарушение газообмена в начальных стадиях компенсируется орга-
низмом. Отметим следующие основные компенсаторные реакции.
1. Учащение дыхания, которое приводит к увеличению альвеолярной
вентиляции. Следует, однако, помнить, что альвеолярная вентиляция
возрастает только при умеренном учащении дыхания. Очень частое, а сле-
довательно, поверхностное дыхание приводит к уменьшению альвеоляр-
ной вентиляции даже при сохранении минутного объема дыхания (МОД)
на том же уровне.
Углубление дыхания может привести к увеличению МОД, но альвео-
лярная вентиляция при этом возрастает не всегда (Comroe, 1962, и др.).
При снижении проходимости бронхов вследствие усиленной работы
дыхательных мышц может повыситься рСОг артериальной крови и аль-
веолярного воздуха (Riley, 1965).
59
2. Усиление сердечной деятельности. В начальной стадии гипоксии
и гиперкапиии увеличивается сердечный выброс и возрастает скорость
кровотока, что приводит к временному улучшению газообмена.
3. Изменения периферической циркуляции. В ответ на первоначаль-
ное накопление углекислоты при развивающейся недостаточности внеш-
него дыхания происходит повышение тонуса периферических сосудов,
что на известном этапе приводит к повышению артериального давления
и увеличению скорости кровотока. Однако при углублении гипоксии
и ацидоза тонус периферических сосудов падает, сосуды расширяются,
происходит депонирование крови в капиллярах. Создаются условия для
развития отека тканей, в частности мозга и легких.
4. Почечный механизм компенсации вступает в действие при газовом
ацидозе и направлен на выведение из организма недоокисленных про-
дуктов обмена и анионов угольной кислоты. Одновременно в организме
задерживается натрий и, следовательно, вода, развивается олигурия,
что может быть крайне опасно для организма (Jousset, 1958; Maurath,
Franke, 19C3). Указанные компенсаторные механизмы играют положи-
тельную роль только до определенного предела. При углублении патоло-
гического процесса они истощаются и наступает декомпенсация основных
жизненных функций.
Патофизиологические закономерности угасания внешнего дыхания
в процессе развития терминального состояния и характер его восстанов-
ления в периоде после оживления в настоящее время достаточно подроб-
но изучены в экспериментах на животных (В. А. Неговский, 1943, 1954;
И. Р. Петров, 1949; Е. М. Смиренская, 1967; С. В. Толова, 1965, 1967,
и др.)- У больных, выведенных из терминального состояния, в основном
исследуются вентиляционные показатели в сочетании с показателями
кислотно-щелочного равновесия, которые, безусловно, дают много све-
дений для оценки функции внешнего дыхания, однако не всегда позво-
ляют решить вопрос о наличии дыхательной недостаточности (см. гла-
ву XI). Усиленная активность дыхательных мышц даже при удовлетво-
рительных показателях газового состава крови может являться
признаком дыхательной недостаточности, так как легочная вентиляция
достигается «дорогой ценой» сильного возбуждения дыхательного цент-
ра, приводящего в конечном счете к полному его истощению (Л. Л. Шик,
1956, 1958, 1960).
Важное значение имеет исследование электрической активности ды-
хательных мышц — электромиограммы (ЭМГ), которое, помимо оценки
аппарата внешнего дыхания, дает возможность косвенно судить о функ-
циональном состоянии инспираторного и экспираторного центров в раз-
ных условиях жизнедеятельности организма.
Мы остановимся более подробно на динамике изменения внешнего ды-
хания, в том числе структуры дыхательного акта, в процессе развития
терминального состояния у собак, вызванного массивной кровопотерей,
и в восстановительном периоде после клинической смерти. Под структу-
рой дыхательного акта мы понимаем соотношение в деятельности раз-
ных групп дыхательных мышц: инспираторных, экспираторных и допол-
нительных.
60
щш^—гш,4ш*^
Рис. «3. Изменения структуры дыхательного акта в процессе умирания от крово-
потери.
А—Ж — ЭМГ — масштаб усиления 50 мкВ: масштаб времени (обозначен на 3-ей кривой свер-
ху) — ! с. а—ж — пневмограммы — отметка времени 5 с. Сверху вниз на отрезках ЭМГ : ЭМГ
диафрагмы, ЭМГ поперечной мышцы живота, ЭМГ перстне-щитовидной мышцы А(а) — до
кроволотерп, Б(б) — 1-я, В(в) — 5-я, Г(г) — 11-я, Д(д) — 19-я, Е(е) — 22-н мин от начала кро-
Bonoiepn, Ж(ж) — последний агональный вдох на 22-й мин ог начала кровопотерн.
Изменение внешнего дыхания в процессе умирания. При нарастании
гипоксии в процессе умирания от кровопотсри внешнее дыхание претер-
певает изменения, которые можно разделить на следующие этапы:
1) учащение и углубление дыхания, 2) замедление дыхания с наруше-
нием его ритма, 3) терминальная пауза в дыхании, 4) атональное дыха-
ние, за которым следует полное угнетение дыхания (В. Кеинон, 1943;
В. А. Неговский, 1943, I960; Meyer, I957, и др.). Учащение дыхания в пер-
вые минуты кровопотери обусловлено возбуждением дыхательного цен-
тра импульсами от барорецепторов сосудистых рефлексогенных зон и
импульсами, приходящими в дыхательный центр по блуждающим нервам
(М. Е. Маршак, 1961; С. В. Толова, 1967; С. Heymans, D. Cordier, 1940;
Comroe, 1954; Katzaros, Loescke, 1964, 1965, и др.).
В начале кровопотеои увеличивается амплитуда колебаний биотоков
всех групп дыхательных мышц, в акт дыхания включаются экспиратор-
ные мышцы (внутренние межреберные, мышцы передней брюшной стен-
ки), дополнительные дыхательные мышцы шеи, дна полости рта, горта-
ни (рис. 3, А, Б). Усиленная деятельность дыхательных мышц в фазу
учащения дыхания приводит к значительному увеличению МОД. В этот
период увеличивается растяжение легочной ткани, сопротивление дыха-
тельных путей уменьшается в среднем до 80% исходного, функциональ-
ная остаточная емкость снижается до 86% (Cahil, Byrne, 1964).
При продолжающейся кровопотере дыхание постепенно замедляется!
уменьшается его глубина. Характерным признаком наступающей деком-
пенсации дыхания является расстройство ритма, появление периодическо-
го дыхания, которое типично не только для состояний, связанных с кро-
вопотерсй, но и для любого вида кислородного голодания (И. Р. Петров,
1949; Н. Н. Сиротинин, 1959; Hoff, Breckenridge, 1954).
61
При потере 25% объема крови в течение 20 мин в легких появляются
гиперемия, отек и точечные кровоизлияния. Причиной их может быть
застой в малом круге кровообращения (И. Р. Петров, Г. Ш. Васадзе,
1966). Угнетение дыхательного центра при неостановленной кровопотере
приводит к уменьшению объема легочной вентиляции. Альвеолярная»
вентиляция, как уже отмечалось, зависит от частоты дыхания, дыхатель-
ного объема и объема мертвого пространства, которое в свою очередь
состоит из анатомического и физиологического мертвого пространства.
Анатомическое мертвое пространство составляют верхние дыхательные
пути, физиологическое мертвое пространство—не функционирующие
в тот или иной момент отделы легочной ткани. При кровопогере физио-
логическое мертвое пространство может увеличиваться и за счет того,
что с уменьшением скорости кровообращения в легких часть капилляров
запустевает и перфузия легких соответственно уменьшается (Gerst, Rat-
tenborg, 1959; Brooks, Willians, Manley e. a., 1963).
В фазе замедления дыхания амплитуда колебании биотоков дыха-
тельных мышц остается выше исходной и только в колце фазы замедле-
ния дыхания — перед терминальной паузой степень возбуждения дыха-
тельного центра понижается, электрическая активность инспираторных
и дополнительных дыхательных мышц уменьшается, а экспираторных —
исчезает (рис. 3, В—Г).
Природа терминальной паузы, или первичного аноксического апноэ,
изучена недостаточно. Во время терминальной паузы, которая продол-
жается от нескольких секунд до 3—4 мин, чаще всего наблюдается бра-
дикардия, атрио-вентрикулярный ритм на ЭКГ, указывающие на воз-
буждение парасимпатической нервной системы. Ряд авторов считают,
что терминальная пауза в дыхании развивается в результате повышения
тонуса центра блуждающего нерва (И. А. Аршавский, 1965, Binet,
Strumza, I954). Зависимость между длительностью апноэ и рО2 в арте-
риальной крови, при котором оно наступает, не установлена. Под влия-
нием усиливающейся гипоксии тормозящий вагусиый рефлекс исчезает,
активность дыхательного центра восстанавливается и начинается аго-
нальное дыхание.
Агональное дыхание бывает двух видов: во-первых, дыхание типа
«gasping» с большой амплитудой дыхательных движений с коротким
максимальным вдохом и быстрым и полным выдохом, частотой 2—6 ды-
ханий в минуту и, во-вторых, слабое, редкое поверхностное дыхание
с малой амплитудой дыхательных движений, которое, как правило, раз-
вивается при продолжительном преагональном периоде. Первые аго-
нальные вдохи слабые, затем глубина их увеличивается, доходит до мак-
симума, после чего, постепенно ослабевая, дыхание прекращается.
Во время агонии, протекающей при очень низком артериальном дав-
лении, угасших глазных рефлексах и электрической активности голов-
ного мозга, в первых атональных вдохах участвуют мышцы вдоха и до-
полнительные дыхательные мышцы, экспираторные мышцы в акте
дыхания участия не принимают. В последующих атональных вдохах экс-
пираторные мышцы сокращаются в фазу вдоха вследствие нарушения
реципрокных отношений между инспираторным и экспираторным цент-
62
ром (рис. 3, Е). Если во время короткой агони;и артериальное давление
повышается, в связи с чем восстанавливаются роговичные рефлексы, а
на электроэнцефалограмме вновь появляются полиморфные Д-волны,
другими словами, если организм как бы возвращается к преагопальному
периоду, то рецинрокные отношения между центром вдоха и выдоха
восстанавливаются и экспираторные мышцы сокращаются в фазе выдо-
ха. При длительном умирании электрическая активность в выдыхатель-
ных мышцах исчезает перед терминальной паузой и на протяжении всего
периода агонии эти мышцы неактивны.
В периоде агонии амплитуда колебаний биотоков дыхательных мышц
в несколько раз превышает исходную, что объясняется сильным возбуж-
дением дыхательного центра. Импульсы из дыхательного центра в этот
период иррадиируют не только на экспираторный центр, но и на двига-
тельные нейроны других скелетных мышц, вследствие чего на крайних
стадиях умирания в акте вдоха участвуют и мышцы шеи, туловища, ко-
нечностей.
При длительном умирании в конце агонии изменяется характер со-
кращения дыхательных мышц — слитное тетаническое сокращение раз-
бивается на ряд клонических разрядов, воспроизводящих ритм колеба-
ний во вспышках электрической активности в сетевидной формации
продолговатого мозга. При углублении агонии наступает момент, когда
вспышки в сетевидиой формации сохраняются, а признаки активности
дыхательного центра по пневмограмме и электромиограмме дыхатель-
ных мышц полностью исчезают и вспышки на электрограмме продолго-
ватого мозга (электромедуллограмма) являются последним отражением
деятельности дыхательного центра (А. М. Гурвич, 1965).
Атональное дыхание формируется за счет автономных механизмов
продолговатого мозга и не зависит от влияния вышележащих отделов
центральной нервной системы (В. А. Неговский, 1943; И. А. Аршавский,
1966; С. В. Толова, 1971; Hukuhara, Nakayama, 1959). Причиной появле-
ния атонального дыхания при терминальных состояниях является не
только гипоксическое выключение центрального контроля над дыхатель-
ным центром продолговатого мозга, но и та или иная степень гипоксиче-
ского повреждения аппаратов ствола мозга (А. М. Гурвич, 1965; С. В. То-
лова, 1971).
Дыхательный центр во время агонии не реагирует на афферентные
импульсы, идущие со стороны рецепторов легких и верхних дыхательных
путей, и перевязка афферентных нервов (блуждающих и языкоглоточ-
ных) или раздражение их центральных отрезков не оказывает влияния
на ритм, частоту дыхания и на электрическую активность дыхательных
мышц. В конце агонии первыми из акта дыхания выключаются экспира-
торные мышцы (рис. 3, Ж), затем в 60% случаев прекращается одновре-
менно диафрагмальное и реберное дыхание и в 40% случаев сначала
исчезает реберное, затем диафрагмальное дыхание. Мышцы шеи в 60%
случаев выключаются из акта вдоха одновременно с диафрагмой и в 40%
случаев — после нее.
Эффективность внешнего дыхания во время агонии очень низкая.
Минутная легочная вентиляция составляет только 15% исходной, что
63
может быть объяснено тем, что мышцы выдоха (мышцы передней брюш-
ной стенки), сокращаясь одновременно с мышцами вдоха, препятствуют
движению диафрагмы, которая является главной мышцей вдоха и, по
данным Wade A954), обеспечивает 3Д дыхательного объема.
Развитие и характер расстройств дыхательных движений при острой
кровопотере в известной степени зависят от исходного функционального
состояния центральной нервной системы. Так, кровопотеря на фоне глу-
бокого наркоза (эфирного, амитал-натриевого и др.) не вызывает ком-
пенсаторного возбуждения дыхательного центра (Т. Н. Гроздова, 1954;
С. П. Мельничук, 1955; Я. М. Бритван, 1963, и др.). Введение новокаина
при кровопотере также тормозит компенсаторные реакции организма
(А. А. Подшивалов, 1958). При умирании от гипоксии под гексеналовым
и тиопепталовым наркозом атональное дыхание отсутствует (В. Б. Мал-
кип, 1955; А. М. Гурв'ич, 1965) и «смерть наступает без предупрежде-
ния»— «Death without warning» (Beecher, Moyer, 1941).
Умирание от кровопотери на фойе возбуждения цетральной нервной
системы вызывает более интенсивную и продолжительную одышку, и
остановка дыхания, например, на фоне фенаминового возбуждения на-
ступает раньше, чем у иптактных до кровопотери животных (С. П. Мель-
ничук, 1955). Кроме того, И. Р. Петров и Г. Ш. Васадзе A966) также
отмечали, что на фоне очень частого дыхания животные погибают зна-
чительно раньше, чем при отсутствии одышки.
При умирании от механической асфиксии отсутствует фаза учащения
дыхания и возбуждение дыхательного центра выражается только в уве-
личении амплитуды колебаний биотоков дыхательных мышц. Вследствие
быстрого (через 2 мин) почти полного исчезновения кислорода в артери-
альной крови значительно быстрее, чем при умирании от кровопотери,
исчезает электрическая активность в экспираторных мышцах. В 85%
случаев отсутствует терминальная пауза в дыхании. Агоиалыюе дыха-
ние при умирании от механической асфиксии развивается на фоне высо-
кого артериального давления и продолжается в 2 раза меньше, чем при
умирании от массивной кровопотери. При внезапной остановке крово-
обращения деятельность дыхательного центра угасает в первые 3—4 мин.
Изменения внешнего дыхания в восстановительном периоде после
клинической смерти. Во время клинической смерти дыхательный центр
находится в состоянии глубокого угнетения. Бульбарные центры обла-
дают высокой устойчивостью к гипоксии и деятельность дыхательного
центра может быть восстановлена даже после 30 мин полного прекраще-
ния кровообращения в мозге (С. Heymans, 1953).
Для восстановления дыхания при выведении организма из терми-
нального состояния необходимо прежде всего возобновление кровообра-
щения в области продолговатого мозга. Сроки восстановления дыхания
зависят от продолжительности умирания и от длительности клинической
смерти, При быстром умирании E—8 мин) и короткой клинической
смерти A —! V2 мин) деятельность дыхательного центра можно восстано-
рить путем массажа сердца или внутриартериального нагнетания крови
без применения искусственного дыхания. При более длительном умира-
нии н клинической смерти свыше 2 мин наряду с мероприятиями по вос-
64
становлению сердечной деятельности для восстановления газообмена
в легких необходимо проводить искусственное дыхание, которое следует
начинать как можно раньше. О методах искусственного дыхания см. гла-
ву XI. Применение фармакологических стимуляторов дыхания (аналеп-
тики) при оживлении после тяжелой гипоксии чаще приносит вред, чем
пользу, вследствие истощающего их действия на клетки дыхательного
центра (В А. Неговский, 1960). Применение углекислоты и карбогена
в начале оживления задерживает появление самостоятельного дыхания
(Е. М. Смиренская, 1952).
В последние годы с целью реанимации применяют аппараты искус-
ственного кровообращения (АИК), которые в первые же минуты перфу-
зии создают адекватное кровоснабжение оксигенированной кровью го-
ловного мозга и сердца. Полное искусственное кровообращение как
цельной кровью, так и кровью, разведенной плазмозамеиителями, при
объемной скорости перфузии не менее 100 мл/кг/мин позволяет быстро
восстановить и стойко нормализовать деятельность дыхательного центра
и без применения искусственного дыхания (С. В. Толова, А. А. Божьев,
А. К. Сидора, 1970).
Раннее восстановление дыхания имеет большое значение для после-
дующего прогноза оживления (см. главу XVIII). После 5-минутной кли-
нической смерти от кровопотери при оживлении комплексным методом
самостоятельное дыхание восстанавливается в первые 4 мин, после 8-ми-
нутной клинической смерти — через 7—12 мин от начала мероприятий
по оживлению (В. А. Неговский, 1943). Нормализация дыхания при
оживлении происходит в основном в обратном порядке, через те же эта-
пы, через которые протекает его угасание в периоде умирания.
После относительно коротких сроков клинической смерти C—5 мин),
вызванной массивной кровопотерей, наблюдаются следующие фазы в из-
менении внешнего дыхания: 1) фаза начальных вдохов — слабое, редкое
A—3 в минуту), поверхностное дыхание; 2) фаза дыхания атонального
типа — глубокое, редкое C—6 в минуту) судорожное дыхание типа
«gasping» с большой амплитудой дыхательных движений, иногда с за-
держкой в фазе вдоха (апнейстическое дыхание); 5) фаза альтернирую-
щего дыхания — наряду с судорожными вдохами появляются вдохи с
меньшей амплитудой дыхательных движений, частота дыхания увеличи-
вается; 4) фаза «вставочных» вдохов — дыхание становится более час-
тым и ритмичным, амплитуда дыхательных движений уменьшается, на
фоне ритмичного дыхания наблюдаются редкие, глубокие «вставочные»
вдохи, которые постепенно исчезают и дыхание нормализуется.
После восстановления кровообращения первым в дыхательной систе-
ме начинает функционировать инспираторный центр. В акте вдоха уча-
ствуют мышцы вдоха (диафрагма, наружные межреберные мышцы),
дополнительные дыхательные мышцы, в некоторых случаях и экспиратор-
ные мышцы сокращаются в фазу вдоха. Диафрагдта и мышцы шеи вклю-
чаются в акт дыхания одновременно, в 73% наблюдений диафрагмальное
дыхание начинается одновременно с реберным и в 27%—раньше него.
Сокращение мышц вдоха в фазу начальных вдохов очень слабое и вдохи
напоминают глотательные движения. По ЭМГ дыхательных мышц в вос-
5 Заказ № 1266 65
Г Д
A , Б В j Г
Е
Д
, 1
Рис. 4. Типы нормализации структуры дыхательного акта в восстановительном периоде
i после клинической смерти.
Сверху вниз на отрезках ЭМГ: 1 —ЭМГ диафрагмы; 2 —ЭМГ наружной косой мышцы живота;
3 —ЭМГ мррпне-щ|мп»млной мышцы I — псриыП тип нормализации аруктуры дыхагетьного акта
после 3-мин>тной клинической смерти от кровопотери А — 3-я, Б — 6-я, В — 8-я, Г— 10-я, Д — 88-яр
мин после начала оживления 11 — второй тип нормализации структуры дыхательного акта после
7-минутной клинической смерти от кривопотсрн А — 8-я, Б — 11-я, В — 12-я, Г — 15-я, Д — 17-я, Е —
24-я мин после начала оживления ill —трешй тип нормализации структуры дыха1ельного акта
после 7-минутиой клинической смерти от кроиопотери Дыхание восстановилось на 36-й мин после-
начала оживления. А-—41-я, Б —47-я, В — 62-я мин после начала оживления. Масштаб усиления
50 мкв, масштаб времени 1 с.
становительном периоде после клинической смерти выделено три типа
нормализации структуры дыхательного акта (рис. 4).
При первом типе, который наблюдается после коротких сроков кли-
нической смерти C—5 мин), при восстановлении дыхания в первые4 мин
от начала оживления на ЭМГ дыхательных мышц появляются вспышки
в фазу вдоха в инспираториых и дополнительных дыхательных мышцах
(рис. 4, 1, А). В экспираторных мышцах электрическая активность появ-
ляется позднее [в опытах на собаках в среднем через 11,8±1,2 мин
(М±т) от начала оживления] в самом начале вдоха (рис. 4, 1, Б), затем
в конце дыхательной паузы (рис.4,1, В, Г), постепенно как бы «сдвигает-
ся» в сторону предыдущего вдоха, занимая, наконец, весь период выдоха
и дыхательной паузы, реципрокные отношения между центрами вдоха
и выдоха восстанавливаются (рис. 4, 1, Д). В дополнительных дыхатель-
ных мышцах по мере нормализации дыхания активность в фазе вдоха
постепенно уменьшается и исчезает.
Второй и третий типы нормализации структуры дыхательного акта
наблюдаются после более продолжительных сроков клинической смерти
G—8 мин), когда дыхание появляется в среднем через 13,0±2,4 мин от
начала проведения мероприятий по оживлению.
При втором типе во время первых (или последующих) вдохов экспи-
раторные мышцы сокращаются одновременно с иисппраторпыми и до-
полнительными дыхательными мышцами па протяжении всего вдоха,
как и в периоде агонии при умирании (рис. 4, II, А). Затем в мышцах
выдоха появляется активность в конце дыхательной паузы и наблюдает-
ся та же динамика биотоков, что и при первом типе (рис. 4, II, Б—Е).
При третьем типе активность инспираторных и дополнительных ды-
хательных мышц появляется в фазе вдоха одновременно, как и при пер-
вых двух типах (рис. 4, III—А). В экспираторных мышцах в отличие от
двух предыдущих типов электрическая активность восстанавливается
сразу па протяжении всего выдоха и дыхательной паузы (в среднем
через 21,0±4,3 мин от начала оживления) (рис. 4, III, Б—В).
В восстановительном периоде после клинической смерти, вызванной
механической асфиксией, внезапной остановкой кровообращения, утоп-
лением, наблюдается та же динамика изменений внешнего дыхания и
структуры дыхательного акта по ЭМГ дыхательных мышц, что и после
клинической смерти от острой кровопотери.
На начальных стадиях оживления характер сокращения мышц, уча-
ствующих в дыхании, клонический. Сохранение клонуса на ЭМГ дыхат
тельных мышц в восстановительном периоде после клинической смерти
более 20 мин свидетельствует о тяжелом гипоксическом поражении ство-
ла мозга (А. М. Гурвич, 1965) (см. главу XVIII).
Второй и третий типы нормализации структуры дыхательного акта
никогда не наблюдаются после относительно коротких сроков клиниче-
ской смерти и наряду с другими признаками тяжелого гипоксического
поражения мозга, таким, как продолжительный клонус на ЭМГ дыха-
тельных мышц, синусоидальный характер биотоков коры головного
мозга, могут служить признаками неблагоприятного прогноза оживле-
ния.
Нервные механизмы, за счет которых осуществляется активный вы-
дох, более чувствительны к гипоксии, чем нервные механизмы, регули-
рующие вдох. Восстановление активного выдоха при первом типе норма-
лизации структуры дыхательного акта по времени совпадает с появле-
нием роговичных рефлексов. В период умирания также имеется
определенная связь между временем угасания роговичных рефлексов и
выключением экспираторных мышц из акта дыхания, перерезка продол-
говатого мозга на границе продолговатого мозга и варолиева моста
вызывает угасание электрической активности в экспираторных мышцах
в фазу выдоха. Все эти факты позволяют сделать предположение о том,
что образования ствола мозга, принимающие участие в формировании
активного выдоха, располагаются на границе между продолговатым моз-
гом и варолиевым мостом.
Эффективность внешнего дыхания зависит от структуры дыхатель-
ного акта. До восстановления активного выдоха минутный объем дыха-
ния составляет только 20—30% от исходного. С восстановлением актив-
ного выдоха легочная вентиляция начинает постепенно возрастать.
5* 67
Инспираторный центр осуществляет грубую, а экспираторный центр
через рефлексы блуждающего нерва — более тонкую регуляцию дыхания
(Yoshii, Ueda, 1959).
В восстановительном периоде дыхательный центр начинает реагиро-
вать на афферентные импульсы, идущие со стороны рецепторов легких,
через несколько минут после возобновления дыхания, и рефлексы Герин-
га— Брейера для появления первого вдоха не имеют решающего значе-
ния. Доказательством этого являются результаты экспериментов, прове-
денных на ваготомирозанных собаках. После 5-минутной клинической
смерти от кровопотери дыхание у этих собак восстанавливается в те же
сроки, что и у животных с интактными блуждающими нервами — в пер-
вые 4 мин от начала оживления (С. В. Толова, 1967; Е. М. Смиреиская,
1967). Кроме того, как мы уже отмечали, при полном искусственном
кровообращении деятельность дыхательного центра после 10-минутного
прекращения кровообращения, вызванного фибрилляцией желудочков
сердца, восстанавливается в первые 3—4 мин от начала перфузии, не-
смотря на то что искусственное дыхание не применялось.
Сроки восстановления возбудимости дыхательного центра по отноше-
нию к афферентным импульсам зависят от длительности периода гипок-
сии. Афферентные импульсы, идущие в дыхательный центр по блуждаю-
щим нервам, помимо действия на частоту дыхания, оказывают стимули-
рующее влияние на экспираторный центр, способствуя восстановлению
активного выдоха, а следовательно, и более эффективного и в энергети-
ческом отношении более экономного дыхания. С восстановлением актив-
ного выдоха уменьшается амплитуда колебаний биотоков инспиратор-
ных и дополнительных дыхательных мышц.
Для рефлекторной стимуляции деятельности дыхательных мышц
в восстановительном периоде определенное значение имеют дыхательные
рефлексы, замыкающиеся на уровне спинного мозга, выраженность
которых зависит от величины дыхательного объема. Ядро диафрагмаль-
ного нерва в постгипоксическом периоде может служить не только для
передачи импульсов из дыхательного центра продолговатого мозга, но
и генерировать собственную ритмическую активность.
Исследование структуры дыхательного акта в восстановительном
периоде после клинической смерти позволяет установить объективный
критерий полноты восстановления функций центрального и эффектор-
ного компонентов аппарата внешнего дыхания. Усиленная работа дыха-
тельных мышц требует дополнительного расхода энергии, что особенно
нежелательно на фоне неликвидированной гипоксии. Поэтому искусст-
венное дыхание целесообразно отключать только при полной нормали-
зации структуры дыхательного акта, т. е. после исчезновения электриче-
ской активности в дополнительных дыхательных мышцах. О показаниях
•к прекращению искусственой вентиляции легких см. в главе XI.
В восстановительном периоде после оживления о полной нормализа-
ции внешнего дыхания можно судить только на основании комплексного
изучения показателей вентиляции, газообмена и структуры дыхательно-
го акта.
V
УГАСАНИЕ
И ВОССТАНОВЛЕНИЕ ФУНКЦИЙ
ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Введение
В патологии терминальных состояний гипоксические и постгипокси-
ческие изменения центральной нервной системы занимают особое поло-
жение, которое определяется следующими обстоятельствами.
1. Центральная нервная система в целом и высшие отделы головного
мозга в особенности являются в организме образованиями, наиболее лег-
ко повреждаемыми при кислородном голодании: при том, что вес мозга
взрослого человека составляет около 2% от веса всего тела, мозг в спо-
койном состоянии забирает приблизительно 15% минутного объема
сердца и 15—20% всего потребляемого организмом кислорода.
2. Основные функциональные элементы нервной системы — нейроны
в отличие от клеток паренхимы других органов не обладают способно-
стью к регенерации, поэтому гибель нейронов вследствие гипоксии не-
восполнима и возникающие при этом функциональные нарушения могут
быть в некоторых пределах устранены лишь за счет перестройки взаимо-
связей уцелевших нейронов.
3. Головной мозг является органом сознания, мышления, приспособ-
ления организма к окружающей среде, поэтому гибель мозга (даж§
лишь некоторых его отделов) ведет к уничтожению личности, полной
психоневрологической инвалидности, невозможности независимого су-
ществования.
4. Центральная нервная система обеспечивает координацию деятель-
ности всех внутренних органов и систем и организует все реакции гомео-
стаза, поэтому ее разрушение влечет за собой грубые нарушения гомео-
стаза, распада систем жизнеобеспечения.
Однако воздействие любой, самой тяжелой и остро развивающейся
формы кислородного голодания не способно мгновенно и одновремен-
но выключить все функции всех отделов центральной нервной системы;
равным образом и для восстановления неврологических функций даже
после кратковременной гипоксии требуется некоторое время, всегда раз-
ное для различных функций. Разновременность угасания и восстановле-
ния функций мозга при умирании и оживлении, избирательная рани-
мость различных отделов и образований мозга определяются сложной
совокупностью факторов, изученных пока далеко не полностью.
69
Можно утверждать, что неравномерная ранимость существует на лю-
бом уровне мозга: на уровне отдельного нейрона (аксон устойчивее тела
нейрона, его тело устойчивее аксонного холмика), на уровне простейшей
рефлекторной дуги (функции синапса, по-видимому, более уязвимы, чем
функции каждого из двух нейронов), на уровне любого полисинаптиче-
ского рефлекса (некоторые виды вставочных нейронов более ранимы,
чем чувствительные нейроны и мотонейроны), в пределах любого анато-
мического уровня (например, нейроны нижней оливы более ранимы, чем
нейроны других ядер продолговатого мозга, сектор hi—h2 гиппокампа
повреждается при аиоксии намного сильнее, чем другие отделы того же
образования, кора затылочной области повреждается чаще и глубже
коры других областей, из всех слоев коры больших полушарий головного
мозга тяжелее всего страдают III и IV слои). Неравномерная чувстви-
тельность существует на уррвие головного мозга в целом как системы
нейронных констелляций (некоторые области мозга, например кора
больших полушарий и мозжечка, более ранима, чем центры ствола), на
уровне мозга как органа, включающего разнородные тканевые элемен-
ты (клетки астроглии и капилляров устойчивее нейронов) и т. д. Иными
словами, каждый анатомический уровень мозга, каждый его центр, каж-
дая функциональная система включают элементы с разной чувствитель-
ностью к первичному кислородному голоданию и сопутствующему гипок-
сии ацидозу, который вследствие отека и нарушений микроциркуляции
приводит к вторичной гипоксии.
Одним из важнейших факторов, определяющих специфику реакции
разных нейронов на недостаток кислорода, является их различие
в энергетических потребностях. Последние, по-видимому, в свою очередь
определяются степенью разветвленное™ дендритов и, следовательно,
общей площадью клеточной мембраны, поляризация которой требует
постоянного расхода энергии (Dixon, 1967). Системы и центры, включаю-
щие в себя преимущественно нейроны, богатые деидритами (новая кора
с ее богатейшей сетью вставочных нейронов, клетки Пуркинье мозжеч-
ка), согласно этой гипотезе, оказываются особенно ранимыми при гипок-
сии. Вероятно, существенную роль играют и особенности биохимии
нейронов разных областей мозга (теория патоклиза, Vogt и Vogt, I922).
Именно различием биохимической структуры нейронов Mac Lean A963)
пытался объяснить неоаинаков^ю ранимость различных секторов гиппо-
кампа. При умирании от кровопотери, при длительных состояниях арте-
риальной гипотензии важнейшее значение приобретают особенности
кровоснабжения различных образований мозга, так как в этих случаях
в более выгодном положении оказываются области мозга, расположен-
ные ближе к магистральным сосудам (подкорковые области, системы
основания мозга, особенно ствол), функции которых угасают позднее
функций новой коры больших полушарий (Ganshiri, Zylka, 1952), а наи-
более пострадавшими оказываются «водораздельные» области коры
(Brierley, Brown, 1969). На особенности кровоснабжения как на основ-
ной фактор избирательной ранимости мозга указывали Spielmeyer
A925), Lindcnberg A963) и др. Как полагал Scholz A953, 1963), распре-
деление областей повреждения в мозге, пережившем прекращение кро-
70
вообращения, определяется как спецификой обмена веществ различных
видов нейронов, так и особенностями кровоснабжения разных отделов и
участков мозга.
К этим двум факторам избирательной ранимости различных отделов
мозга следует добавить фактор относительной сложности функции (и со-
ответственно ее филогенетического «возраста», В. А. Неговский, 1954),
так как более молодые в филогенетическом отношении функции, являю-
щиеся и более сложными (например, мышление, высшая нервная дея-
тельность), обслуживаются большим числом нейронных систем, располо-
женных на многих, в том числе и на более высоких анатомических уров-
нях и, естественно, оказываются более уязвимыми при кислородном
голодании.
Немаловажное значение имеет и степень функциональной активности
систем мозга (и, следовательно, их энергетические потребности и состоя-
ние кровоснабжения) в момент возникновения гипоксии.
Видимо, именно описанные многообразные формы неравномерности
функциональных (и анатомических) нарушений мозга, которые сочета-
ются с различиями в индивидуальной устойчивости организма в целом,
а также особенности умирания и оживления объясняют и довольно зна-
чительный полиморфизм клинических проявлений постгипоксической
энцефалопатии (Г. А. Акимов, 1971; Steegman, 1951).
Для исследования общих закономерностей угасания и восстановле-
ния функций центральной нервной системы, сравнения относительной
тяжести разных видов умирания и прекращения кровообращения в моз-
ге и во всем организме, оценки различных методов оживления и ведения
постреанимационного периода и решения многих других вопросов па-
тофизиологии мозга при его гипоксии используется ряд параметров.
Эти параметры пригодны для оценки динамики угасания и восста-
новления любой из функций мозга, как простой, так и сложной, при ус-
ловии достаточно точного установления факта наличия или отсутствия
этой функции. Основными среди этих параметров являются следующие
(Gerard, 1938; Sugar, Gerard, 1938; Hirsch. M. Schneider, 1968).
Время сохранения функции (survival time, Oberlebenszeit)—пе-
риод от начала гипоксии любой природы, соответственно от начала уми-
рания до полного исчезновения исследуемой функции. Более удачным
в терминологическом отношении является другой вариант названия
этого параметра — время паралича функции (Hirsch, M. Schneider,
1968). В начале рассматриваемого периода имеется интервал полного
сохранения функции, называемый также свободным интервалом, или
скрытым периодом. Isselhard (I965) выделил своеобразный параметр:
время толерантности (Toleranzzeit)—период гипоксии, совместимый
со спонтанным полным восстановлением функций организма (напри-
мер, кратковременная асистолия при припадке Адамса — Стокса).
Время скрытого восстановления (latency of recovery, Erholungsla-
tenz) — период от момента прекращения гипоксии или от начала ожив-
ления до появления первых признаков восстановления функции. При
оценке динамики восстановления мозга с помощью ЭЭГ наряду со вре-
менем скрытого восстановления оказалось полезным пользоваться вре-
71
менем установления непрерывной электрической активности на ЭЭГ
(А. М. Гурвич, 1966; Brechner e. а., 1961).
Время полного восстановления (recovery time, Erholungszeit) — пе-
риод от момента прекращения гипоксии или от начала оживления до
полного восстановления исследуемой функции.
Время возможного восстановления (revival time,Wiederbelebungsze-
it — в буквальном переводе «время оживления»)—период полного
прекращения кровообращения или аноксии, после которого возможно
полное восстановление функции; этот параметр обычно используется
для оценки устойчивости к кислородному голоданию не какой-либо од-
ной функции, а организма или мозга в целом. При этом предполагает-
ся полное восстановление и структуры мозга. В случае, когда длитель-
ность аноксии или ишемии превосходит время возможного оживления,
обратимые гипоксические изменения переходят в необратимые. В этом
случае говорят о времени возможного неполного восстановления. В по-
следние годы выделено также время гибели мозга, или время деанима-
ции (Deanimationszeit, H. Schneider, 1970)—период полного прекра-
щения кровообращения, после которого возможность восстановления
каких-либо функций мозга исключена.
Между различными перечисленными выше параметрами существуют
связи, которые могут быть выражены математически (А. М. Гурвич
и др., 1972; Blasius, 1950; Ganshirt, Zyika, 1952; Brechner e. a., 1959;
Thies-Puppel, Wiemers, 1961; M. Schneider, 1961). Устойчивость этих
связей при контролируемых и стабильных условиях делает чрезвычайно
полезным их использование как в экспериментальной, так и в клини-
ческой исследовательской работе. Закономерные отношения существуют
не только между различными показателями восстановления функций
мозга, но и между показателями его функционального и морфологиче-
ского восстановления (А. М. Гурвич и др., 1971; Van Harreveld, 1965).
Простота и доступность методов, необходимых для исследования в
эксперименте на животных отношений последнего рода, позволяет поль-
зоваться параметрами функционального восстановления в ближайшие
после возобновления циркуляции крови 30—60 мин для достоверных за-
ключений об объеме и обратимости изменений, возникших в мозге в
результате умирания и прекращения кровообращения.
Неврологические
нарушения при умирании
Последовательность угасания и восстановления функций централь-
ной нервной системы при умирании и оживлении находит отражение в
изменении различных по сложности поведенческих и рефлекторных
реакций (В. А. Неговский, 1954). Особенно ценными для изучения этой
последовательности и лежащих в ее основе процессов являются различ-
ные виды электрографических методик (электроэнцефалография, элек-
трография нервных стволов, активности отдельных нейронов, различных
вызванных потенциалов, электромиография). Данные этих методик
вполне объективны, пригодны для количественной оценки, а использо-
72
ШОмкВ Lie
^Л-Л/\/|^л/к^^^
Рн
Рис. 5. Угасание электрической активности мозга при окклюзии верхней полой вены во
время операции по поводу комбинированного порока сердца у ребенка 7 лет. Гипотер-
мия— 30,6° С. Эфир и фторотаи.
Одна стрелка — начало окклю?ии, две стрелки — восстановление кровообращения ЭЭГ — в монопо-
лярных отведениях от левой лобной Fs и лев^й затылочной Os областей Третья запись сверху—ЭКГ
На каналах IV—VI11 - выделенные полосы частот ЭЭГ лобноП области. Видна общая последова-
тельность угасания ЭЭГ и экзальтация а-ритма в начале ишемии (наблюдение Д. А. Гинзбург).
вание большинства из них возможно при любом уровне бодрствования,
в любой стадии комы, на фоне наркоза и обездвиживания как в экспе-
рименте, так и в клинике.
Угасание функций мозга при умирании проходит через ряд стадий,
длительность и выраженность которых зависят главным образом от
внезапности развития и глубины воздействующей на мозг гипоксии и от
уровня бодрствования организма. Все основные стадии наиболее отчет-
ливо выступают при обескровливании, гипоксической гипоксии или ас-
фиксии организма в состоянии бодрствования или организма, находяще-
гося под поверхностным наркозом. Вслед за скрытым периодом, одно-
временно с возникновением сильного двигательного возбуждения на
ЭЭГ коры и подкорковых отделов больших полушарий наблюдается от-
четливая десинхронизация с усилением частых колебаний и частоты
импульсации отдельных нейронов. Как показали Dell с соавторами
73
ЭКГ
улу^лл^4^^
ОС
Рн
it
Рис. 6. Угасание электрической активности мозга при окклюзии верхней полой вены во
время операции по поводу стеноза устья аорты Больной С. Гипотермия — 30,4° С. Эфир
и фторотаи.
Верхняя кривая — ЭКГ, ЭЭГ в монополярных отведениях от правой лобной Fd и правой затылочной
Od области мозга. Видна общая последовательность угасания ЭЭГ, доминирование Д-волн в лобной
области (наблюдение Д. А. Гинзбург).
A961), эта реакция в значительной мере связана с возбуждением вос-
ходящей активирующей системы сетевидной формации ствола мозга в
результате рефлекса с рецепторов каротидных синусов и других инте-
воиептивных полей; в тот же период или несколько позже может иметь
место и возбуждение корковых нейронов, вызванное непосредственным
воздействием на них гипоксии (В. Б. Малкин и др., 1963; Soderberg,
1962). У человека в начальных стадиях гипоксии часто наблюдается
усиление а-ритма, особенно четкое в случаях, когда гипоксия возникает
на фоне поверхностного наркоза или бодрствования (рис. 5).
В следующей стадии двигательное возбуждение исчезает, начинают-
ся нарушения сознания, а затем умирающий погружается во все более
глубокую кому. Постепенно расширяются зрачки, углубляется и урежа-
ется дыхание. На ЭЭГ в этот период видно прогрессивное замедление
ритмов с нарастанием амплитуды сначала в-волн, а затем и Д-волн,
при угнетении колебаний |3- и а-диапазонов (рис. 6). Импульсация от-
дельных нейронов коры становится в этот период более редкой, импуль-
сы распределяются по группам, нередко связанным с поверхностно-
позитивными фазами А-колебаний (Creutzfeldt e. а., 1961). Активность
74
сетевидной формации остается значительной или несколько нарастает.
В области гиппокампа появляются одиночные пиковые потенциалы
(Passouant, Pternitis, 19С5). Сознание утрачивается обычно на фоне
нарастающих в амплитуде Д-волн.
В этот период Д-волны как у человека, так и у животных довольно
полиморфны. У человека они явно преобладают в лобных областях, где
их амплитуда выше, а форма нередко близка к синусоидальной (см.
рис. 6), у животных (собак) гипоксическая Д-активность более выраже-
на в задних и темеино-височных областях. Существенно, что волны
этого типа одинаково хорошо выражены как в мопо-, так и в биполяр-
ных отведениях и, судя по экспериментальным данным, имеют заметно
более высокую амплитуду и полиморфизм в коре, чем в подкорковых
областях. Важной особенностью Д-волн этой стадии умирания, уста-
новленной как у животных, так и у человека, является низкий коэффи-
циент взаимной корреляции активности разных отделов коры
(Д. А. Гинзбург и др., 1970). Этот признак выступает особенно показа-
тельно при развитии гипоксии на фоне того или иного наркоза в стадии
медленных волн, которые вне гипоксии характеризуются весьма высо-
ким коэффициентом взаимной корреляции (рис. 7). В связи со сказан-
ным использование коррелографа, работающего синхронно с электро-
энцсфалографом, позволяет обнаружить гипоксию даже на фоне нарко-
тической Д-активности, когда визуальный анализ не дает этой
возможности вследствие внешнего сходства ЭЭГ при наркозе и гип-
нозе.
Затем, одновременно с постепенным угнетением дыхания и все
большим расширением зрачков, происходит дальнейшее замедление и
снижение амплитуды электрической активности коры и подкорковых
отделов мозга, а позднее — распад активности на группы, разделенные
интервалами электрического молчания. Последней формой фоновой
активности коры, угасающей нередко после Д-волн и независимо от них,
в ряде случаев оказываются веретена, напоминающие вспышки, наб-
людаемые при барбитуровом наркозе и близкие по своему происхожде-
нию так называемой реакции вовлечения (А. М. Гурвич, 1966; Naquet,
Fernandez-Guardiola, 19G1), возникающей при раздражении неспецифиче-
ских ядер зрительного бугра с частотой порядка 8—12 в секунду. Иног-
да после угасания полиморфных Д-волн в экспериментах на животных
выявляется иная форма активности Д-диапазона — двухфазные нега-
тивно-позитивные колебания стандартной формы (стандартные медлен-
ные комплексы; А. М. Гурвич, 1966, 1970), которые в отличие от наб-
людавшихся ранее полиморфных Д-волн регистрируются более равно-
мерно по всей поверхности коры, главным образом в монополярных
отведениях, выражены в большей мере в подкорковых областях, чем в
коре, и характеризуются исключительно высоким коэффициентом вза-
имной корреляции (до 0,98). Эта форма активности при умирании ха-
рактеризует таким образом более глубокие гипоксические изменения,
чем полиморфная активность. При гипоксии и умирании в клинике эту
форму активности наблюдала Д. А. Гинзбург A972). В некоторых слу-
чаях (при повторной гипоксии, несколько удлиненном умирании) в фа-
75
Fd
0,5
10,5
11,0 мин
1,5 мин
Рис. 7. Падение коэффициента взаимной корреляции при развитии гипоксии
на фоне наркоза у больного во время операции по поводу порока сердца.
Две верхних записи — ЭЭГ анализируемых областей (обозначения те же, что на
рис. 5 и б) Нижняя кривая — изменения коэффициента взаимной корреляции (в ус-
ловных единицах) По оси абсцисс — время в минутах, по оси ординат — значения
коэффициента корреляции. Левая часть рисунка —- углубление эфирного наркоза от
III) к 1П2. Правая часть рисунка — развитие гипоксии мозга в момент окклюзии ниж-
ней (одна стрелка) и верхней (две стрелки) полых вен. Видно резкое падение коэф-
фициента корреляции во время ишемии и появление ишемических Д-волн при высо-
ком коэффициенте в период Д-волн эфирного наркоза (из работы Д. А. Гинзбург с
соавторами. Бюлл. экспер. биол. и мед., 1970, № 10, с. 21—23).
зе угасания электрической активности коры у животных наблюдаются
вспышки ритмических синхронизированных колебаний в области п.
amygdalae (A. M. Гурвич, 1966) и веретена высоких и быстрых коле-
баний в гиппокампе (Passouant, Pternitis, 1965).
Полное угасание электрической активности всех отделов больших
полушарий у ненаркотизированных животных происходит перед терми-
нальной паузой в дыхании. К тому же времени угасают и простейшие
условные рефлексы, которые иногда некоторое время удерживаются да-
же на фоне электрического молчания коры (Т. Я. Павлова, 1971). На
фоне дельта-волн и прогрессирующего угнетения электрической актив-
ности коры наблюдается резкая, но сравнительно кратковременная ак-
тивация сетевидной формации ствола с развитием судорог децеребра-
ционного типа.
Следует отметить, что угасание фоновой электрической активности
не означает полного исчезновения возбудимости коры — в течение не-
которого времени после исчезновения фоновой электрической активно-
сти различные отделы больших полушарий, в том числе кора, еще спо-
собны генерировать вызванные потенциалы как в ответ на прямое раз-
дражение, так и в ответ на раздражение афферентных систем.
В тех случаях, когда во время агонии повышение артериального
давления невозможно (фибрилляция желудочков сердца или асистолия
76
при смерти от электротравмы или инфаркта), в этот период могут на-
блюдаться лишь синхронные с агональными вдохами вспышки электри-
ческой активности в сетевидной формации продолговатого мозга, ко-
торые иногда складываются из ряда ритмических колебаний с частотой
от 9—10 до 20—22 колебаний в секунду, каждое из колебаний соответ-
ствует клоническим подергиваниям мышц, участвующих в акте вдоха
(А. М. Гурвич, 1966). При умирании от кровопотери во время агонии
иногда имеет место повышение артериального давления с временным
восстановлением полиморфной электрической активности, иногда и
простейших условных рефлексов (А. М. Гурвич, 1966; Т. Я. Павлова,
1971), а у человека — сознания. Затем вместе с падением артериально-
го давления электрическая активность полушарий мозга исчезает окон-
чательно и некоторое время остаются лишь упомянутые выше вспышки
в продолговатом мозге.
Когда причиной умирания является гипоксическая, циркуляторная,
цитотоксическая гипоксия, деятельность сердца нередко угасает спустя
20—60 с после последнего агонального вдоха. В случаях, когда причи-
ной смерти является первичное нарушение деятельности сердца, опи-
санные выше вспышки ритмических колебаний в продолговатом мозге,
иногда наблюдающиеся и после полного исчезновения внешнего дыха-
ния, по нашим наблюдениям, являются последним признаком жизни,
который может быть обнаружен путем регистрации фоновой электриче-
ской активности мозга.
Восстановление функций мозга
в постгипоксическом периоде
Рассматривая общую динамику и возможные конечные результаты
восстановления функций мозга при оживлении, необходимо прежде все-
го отметить, что обратный, «зеркальный» по отношению к угасанию
порядок восстановления этих функций является частным и сравнитель-
но редким случаем. Гораздо более частыми как в эксперименте, так и в
клинике являются случаи того или иного нарушения «зеркальности».
Этот факт является естественным, так как точное повторение в обрат-
ном порядке динамики угасания неврологических функций возможно
лишь при условии, если в процессе умирания, во время клинической
смерти и в течение постреанимационной болезни в мозге не только не
возникло никаких даже сравнительно ограниченных по распростране-
нию необратимых изменений, но и функциональные соотношения между
центрами и системами мозга на каждом из этапов оживления оказались
теми же, какими они были на соответствующих этапах умирания. Со-
вершенно очевидно, что при многообразии факторов, определяющих
как повреждения мозга в целом, так и избирательную ранимость тка-
невых и функциональных компонентов центральной нервной системы,
точное повторение при оживлении порядка угасания функций оказыва-
ется маловероятным.
Тем не менее в наиболее общем виде картина восстановления функ-
ций мозга при оживлении, действительно, в ряде случаев, особенно при
77
неосложненном течении постреанимационного периода, кажется обрат-
ной их угасанию, главным образом, на более ранних стадиях, когда про-
исходит восстановление менее пострадавших от гипоксии и более древ-
них стволовых отделов мозга.
Восстановление функций мозга может происходить с различным
темпом и в разной степени. Оно может задерживаться па той или иной
стадии или поворачивать вспять. Нам кажется полезным выделение
следующих основных типов восстановления функций мозга в постреа-
нимационном периоде.
1. Полное восстановление функций мозга.
а) быстрое — с восстановлением нормальных неврологических и
психических функций в пределах не более суток после оживления !;
б) задержанное — с восстановлением сознания в течение нескольких
дней (обычно до 3—4), нормализацией неврологического статуса и пси-
хики—в течение более длительного срока, иногда нескольких недель
и месяцев, с возможным временным ухудшением состояния.
2. Прерванное полное восстановление функций мозга — быстрое и
полное восстановление с отсроченным вторичным ухудшением невро-
логического статуса и исходом в смерть или стойкую психоневрологи-
ческую инвалидизацию.
3. Восстановление неврологических функций с дефектом, совмести-
мым с существованием, не требующим повседневного медицинского
ухода и обслуживания — необратимые изменения высших функций и
неврологического статуса, допускающие, однако, ту или иную форму
общественно полезной деятельности или по крайней мере самообслу-
живание.
4. Частичное восстановление функций мозга с дефектом, исключаю-
щим возможность независимого существования, но совместимым с вы-
живанием в течение длительного срока (месяцев, а иногда и лет) при
условии постоянного ухода.
а) декортикация;
б) децеребрация.
5. Временное частичное восстановление функций мозга без выхода
из глубокого коматозного состояния и гибель в течение постреанимаци-
онного периода.
Разумеется, приведенная классификация, как и многие другие, ох-
ватывает лишь основные типы восстановления, каждый из которых мо-
жет быть детализирован с выделением дополнительных вариантов. Все
виды психических и неврологических нарушений, наблюдающихся у
оживленных больных, объединяются названием «постгипоксическая эн-
цефалопатия» (Stecgman, 1951) или «дисциркуляюрная энцефалопа-
тия», которая может иметь разную степень и динамику течения
(Г. А.Акимов, 1971).
1 Как показывают эксперименты на собаках, при задержке полного восстановления
функций центральной нервной системы даже до 2 сут в мозге обнаруживается отчет-
ливая диффузная гибель наиболее чувствительных нейронов коры больших полушарий
и мозжечка (А. М. Гурвич и др., 1972).
78
В процессе любого полного восстановления происходит обязатель-
ная смена степеней нарушения сознания и функций центральной нерв-
ной системы, соответствующая переходу от наиболее глубокой комы к
оглушению и полному сознанию через кому промежуточной глубины.
Однако при быстром и неосложненном восстановлении этот переход
происходит незаметно, признаки патологии каждого из уровней выра-
жены слабо, нет судорог, и полная картина, «лицо» описываемых далее
ком соответствующей глубины с характерной для каждой из них симп-
томатологией не успевает сформироваться. Может сложиться впечатле-
ние, что оживленный просто постепенно пробуждается от глубокого
сна. Иногда больной приходит в сознание еще во время массажа серд-
ца. Однако специальное и внимательное наблюдение позволяет обна-
ружить признаки последовательного восстановления разных уровней и
систем головного мозга.
О восстановлении функций ствола мозга и систем спинного мозга на
ранних этапах постреанимационного периода судят по появлению са-
мостоятельного дыхания, вагусных влияний на сердце, тонуса сосудов,
спннальных и роговичных рефлексов (нижний ствол и спинной мозг),
затем тонуса мышц (сначала разгибателей, затем сгибателей), реакции
зрачков на свет (верхний ствол). При угнетении мозга барбитуратами
восстановление функций дыхательного центра отстает от восстановле-
ния других функций ствола. В этот период все виды электрической ак-
тивности больших полушарий отсутствуют. На ЭЭГ могут регистриро-
ваться лишь артефакты, связанные с электрическим полем сердца,
усиливающимся тонусом мышц и дыханием. В начале этого периода
артефакты возбуждения дыхательных мышц могут иметь вид вспышек
ритмических колебаний с частотой 9—11 в секунду, которым, по данным
экспериментов на животных, соответствуют такие же вспышки в сете-
видной формации продолговатого мозга (А. М. Гурвич, 1966).
После восстановления основных функций ствола начинается восста-
новление функциональных систем больших полушарий. При неослож-
ненном течении постреанимационного процесса восстановление этих
систем происходит в значительной мере скрыто, о нем можно судить
лишь по ЭЭГ, а несколько позднее — по появлению признаков посте-
пенного уменьшения глубины комы и пробуждения, сначала в виде ре-
акций на болевое раздражение, становящихся все более целенаправлен-
ными, затем в виде открывания глаз на оклик, все более членораз-
дельных и осмысленных ответов на вопросы. Постепенно восстанавли-
ваются сознание, ориентировка в пространстве, другие психические
процессы.
Появление первых признаков электрической активности на ЭЭГ оз-
начает начало функционирования полушарных электрогеиетических си-
стем, происходящее после восстановления функций верхних отделов
ствола. Следует, однако, иметь в виду, что восстановление электриче-
ской активности на ЭЭГ, особенно только А- и G-волн, отражает начало
функционирования наиболее примитивных и древних систем больших
полушарий. И при неосложнениом восстановлении функций мозга эво-
люция электрической активности может происходить по-разному.
79
Fd-Cd
Fd-Fs
Fd
Л
Fs
Рис. 8. «Эксплозивное» восстановление электрической активности мозга, на-
чинающееся с негативно-позитивного медленного колебания стандартной
формы. Активность восстановилась через 3 мин 23 с после прекращения
окклюзии по пых вен.
Больная К., 27 лет. Гипотермия — 31°С. Эфир. Длительность окклюзии 3 мин 25 с.
Стандартные медленные комплексы выражены в основном в монополярных отведе-
ниях Cd - правая центральная область, Fd, Fs — лобные области правого и левого
полушарий соответственно. Нижняя запись — ЭКГ (наблюдение Д. А. Гинзбург).
Варианты этой эволюции в основном сходны у человека и экспери-
ментальных животных. В случае быстрого, стремительного восстанов-
ления электрическая активность восстанавливается внезапно, «экспло-
зивно» (Arfel e. а., 1963) и сразу становится непрерывной. В этот пе-
риод она складывается из колебаний разных частот, среди которых
преобладают полиморфные А-волиы с большой долей в-колебаний и
меньшей — колебаний а-диапазона. Существенно, что такое восстанов-
ление как у животных, так и у человека часто начинается с типичного
негативно-позитивного комплекса («стандартной медленной волны»,
описанной выше в разделе, касающемся умирания). У человека наличие
таких комплексов наблюдала впервые Д. А. Гинзбург (рис. 8). Иногда
внезапному установлению непрерывной активности предшествует корот-
кое низковольтное веретено типа барбитуровой вспышки (рис. 9). В дру-
гих случаях электрическая активность мозга восстанавливается более
постепенно и появляется в виде низковольтных колебаний А- и в-диапа-
80
лМ1
Рас. Р. Восстановление ЭЭГ после временного полного прекращения кровообращения по
благоприятному типу. 1, 2, 3, 4, 5 — последовательные этапы восстановления (экспери-
менты на ненаркотизированных собаках).
А—Б — два примера внезапного (эксплозивного) восстановления непрерывной полиморфной электри-
ческой активности — вариант 1а; В — постепенное восстановление электрической активности одно-
временно в разных областях мозга — вариант 16; Г — восстановление ЭЭГ с первоначальным пре-
обладанием медленных колебаний в височной области — вариант 1в; Д — восстановление ЭЭГ путем
слияния комплексов медленных волн, появляющихся одновременно в разных областях коры, — ва-
риант 1г; Е — общие для всех вариантов поздние этапы эволюции ЭЭГ. Отведения монополярные
(референтный электрод в кости лобных пазух): вверху — от соматосенсорной, внизу — от височной
областей, Масштаб времени и усиления 2 с и 100 мкВ.
зонов. У человека первые колебания появляются в лобных и лобно-цент-
ральных областях, у животных — либо одновременно в различных об-
ластях, либо сначала в какой-либо одной из них (см. рис. 9), чаще в
височной. Весьма важным вариантом восстановления, переходным к
вариантам, свидетельствующим о более глубоких патологических из-
менениях в мозге и наблюдаемым как у человека, так и у эксперимен-
тальных животных, является вариант, когда на ЭЭГ в начале восста-
новления появляются короткие A—2 с) вспышки смешанной Д- и 0-ак-
тивности высокой амплитуды E0 мкВ и выше), разделенные
интервалами полного электрического молчания; в случае благоприятно-
го течения восстановительного периода эти интервалы быстро сокра-
щаются и активность становится непрерывной. Дальнейшая эволюция
ЭЭГ (см. рис. 9) заключается в ее постепенном обогащении колебани-
ями а- и ^-диапазонов, уменьшении выраженности А- и 0-волн и по-
явлении реакции десинхронизации в ответ на внешнее раздражение,
что может предшествовать появлению поведенческих реакций. Иногда
в более раннем периоде А-активность при раздражении может усили-
6 Заказ № 1266
81
ваться (Fischgold, Mathis, 1959). На определенной стадии восстанов-
ления электрической активности в ответ на раздражение может более
отчетливо выступать а-ритм, а позднее наблюдаться и типичная реак-
ция остановки этого ритма.
При неблагоприятном течении постреанимационной болезни восста-
новительный процесс в острой стадии может задержаться на различ-
ных этапах с формированием ком разной глубины; клиническая карти-
на ком оказывается достаточно устойчивой для того, чтобы каждой из
них дать соответствующее описание.
Симптоматика каждой из ком отражает одновременное повреждение
и восстановление систем нескольких анатомических уровней. Для ха-
рактеристики постгипоксических ком важно, что наряду с отсутствием
сознания и нормальных рефлекторных реакций могут быть отмечены
многообразные явления, отражающие нарушения меж- и внутрицент-
ральных отношений и возникновение патологических очагов возбуж-
дения.
Наиболее глубокой является так называемая coma depasse (Molla-
ret, Goulon, 1959), или запредельная кома (Н. К. Боголепов, 1962), на-
зываемая также вегетативной, терминальной комой (Г. А. Акимов,
1971). В этом состоянии у больного сохраняется только деятельность
сердца и внутренних органов, дыхание и другие функции мозга отсут-
ствуют, газообмен обеспечивается респиратором (более подробно об
этом состоянии см. в главе XVIII).
При преобладающем восстановлении нижних отделов ствола боль-
ной оказывается в состоянии вялой, или атонической, комы (И. И. Аста-
пенко, 1966), или комы III (Fischgold, Mathis, 1959), при которой у
больного сознание, спонтанные движения и реакции на болевые раздра-
жения полностью отсутствуют, глаза и рот полуоткрыты, глазные яб-
локи неподвижны или совершают плавающие движения. Тонус мышц
низкий, кожные и, в частности, подошвенные рефлексы отсутствуют.
Имеет место самостоятельное дыхание, часто патологическое, тонус
сосудов удерживается, но не всегда. Роговичные, зрачковые и сухо-
жильные рефлексы, как и реакция зрачков на свет, непостоянны, ча-
сто отсутствуют или вялые. Зрачки расширены или средней величины,
часто асимметричны и деформированы.
На фоне атонии мышц могут наблюдаться разнообразные миоклонии
в виде повторных нерегулярных подергиваний или коротких сокращений
мышц одной или нескольких конечностей или в виде более стереотипных
ритмических устойчивых коротких сокращений мышц лица и (или)
конечностей, особенно часто наружных мышц глаз (Pampiglione,
1967).
Электрическая активность на ЭЭГ полностью отсутствует; в случае
миоклонии на ЭЭГ могут наблюдаться судорожные разряды. Чаще они
связаны с мышечными подергиваниями и являются артефактом, устра-
няемым миорелаксантами (Kurtz e. а., 1970).
В других случаях электрическая активность мозга очень низка («пло-
ская» кривая); иногда в ответ на внешние раздражения она несколько
усиливается [главным образом А-волны лобных областей (Fischgold,
Л-Рпр
Р-Зир
В-Рпр
Рпр-Вкс
Вкс-Рлев
Р-Влев
Л-Рлев
Р-Злев
Л-Рпр
Р-Впр
Л-Рлев
Р-Влев
В-Злев
Зпр-Злев
А
5
В4-32
*^Щ^ ~-ал^
-А-
ЭМГш biceps лев-Н-М ' * t У '" Н « Н
!<■
Рис. 10. Формы электрической активности мозга оживленных людей, свидетельствующие
о глубоком гипоксическом поражении мозга (из работы Kurtz с соавторами; Acta neurol.
belg., 1970, № 70, с. 213—227. Публикуется с любезного разрешения Acta neurol. belg.).
А — изоэлектрическая ЭЭГ (есть лишь артефакты, связанные с региетрацией ЭКГ) одного из боль-
ных через 1 ч после остановки сердца; Б — низкие медленные осцилляции на ЭЭГ другого больного
через 2 ч после остановки сердца; В — прерывистая активность — группы медленных волн и паро-
ксизмальных разрядов, разделенные интервалами электрического молчания, на ЭЭГ третьего боль-
ного через 6 ч после остановки сердца; Г —синхронные с генерализованными миоклоническими
сокращениями мышц пиковые судорожные потенциалч на ЭЭГ четвертого больного. Сокращенные
обозначения областей отведения ЭЭГ: Л —лобная, Р — роландическая, 6 — височная, 3 — затылоч-
ная, Ц — центральная области, ВКС — вертекс, Лев —левая, Пр —правая стороны; масштабы уси-
ления и времени — 50 мкВ и 1 с. Больные, у которых в указанные сроки после оживления наблю-
дается подобная активность, в дальнейшем, как правило, погибают.
Mathis, 1959)]. Нередко при этой коме устойчиво удерживается чередо-
вание вспышек медленных волн с интервалами депрессии (рис. 10).
При задержке постреанимационной эволюции после восстановления
ствола, а иногда и части диэнцефальных систем, у больных формиру-
ется картина так называемой гиперактивной комы, или стадия деце-
ребрации (И. И. Астапенко, 1966; Г. А. Акимов, 1971; Ectors, 1957), —
стадия, промежуточная между комой III и II (Н. К. Боголепов, 1962).
Сознание, реакции на оклик и угрозу отсутствуют, глазные яблоки не-
подвижны в среднем положении, взгляд пустой, сфинктеры не контро-
лируются. Однако роговичные, зрачковые, надбровные рефлексы вызы-
ваются, сухожильные рефлексы повышены, могут иметь место стопные
патологические и защитные рефлексы. Тонус мышц нормальный или
повышен — чаще в разгибателях. На болевые и проприоцептивные раз-
дражения больной реагирует элементарными движениями. В этом со-
стоянии у больных часты вызванные болевыми, реже звуковыми раздра-
жениями тонические судороги, иногда горметонического характера. Мо-
гут иметь место и миоклонии различных мышечных групп. При описьь
ваемой коме наблюдают и значительную гипертермию.
6*
83
На ЭЭГ наряду с полиморфными А-волнами достаточной амплиту-
ды регистрируются колебания р- и а-диапазонов. Характер ЭЭГ до-
вольно устойчив и ее изменения обычно заключаются в усилении Д-
волн в ответ на раздражение, одновременно с усилением дыхания и
учащением пульса, значительно реже при раздражении наблюдается
угнетение А-волн. Вместе с тем могут иметь место периоды спонтанного
уплощения -кривой, совпадающие с замедлением дыхания и пульса.
Описанные выше миоклонии часто сопровождаются синхронными раз-
рядами на ЭЭГ, которые разделены интервалами депрессии активно-
сти (см. рис. 10).
У больных, у которых восстановились и некоторые подкорковые
функции, глубина комы несколько уменьшается [кома I, частично II по
Н. К. Боголепову A962), подкорковая кома, или декортикация, по
Г. А. Акимову A971)]. В этом состоянии могут выявиться следующие
признаки поражения коры и подкорковых образований — симптомы
орального автоматизма (сосательные, жевательные движения), хвата-
тельный рефлекс, хореиформные и атетоидные гиперкинезы, выявляют-
ся или сохраняются миоклонии. Большие судорожные припадки урежа-
ются и ослабевают, внешние раздражения наряду с двигательными ре-
акциями все чаще вызывают сдвиг преобладающих частот в сторону
более быстрых и более низких колебаний.
Полное развитие картин вялой или гиперактивной ком с симптома-
тикой децеребрации или декортикации и с выраженными гиперкинеза-
ми всегда свидетельствует об относительно тяжелом поражении мозга.
Однако степень обратимости этого поражения выясняется лишь со вре
менем (см. главу XVIII).
Если патология мозга хотя и значительна, но обратима, больные
через несколько часов или суток постепенно выходят из коматозного
состояния, переходя в сноподобное состояние, состояние оглушения
разной глубины, после чего у них постепенно восстанавливаются созна-
ние и психические функции.
Однако в состоянии оглушения и на выходе из него у больных могут
возникнуть многообразные психические нарушения: общее двигательное
м речевое возбуждение, аментивно-делириозные психозы, параноидные
психозы со страхом смерти, суицидальными попытками, слуховые, зри-
тельные, обонятельные галлюцинации, нарушения сенсорного синтеза
'(Л. О. Бадалян, В. В. Ковалев, 1964; К. Д. Маслова, 1967; Г. А. Акимов,
1971; Janner, Celio, 1962; Berlyne, Strachan, 1968), психозы корсаков-
ского типа (Г. А. Акимов, 1971; Geisler, Penin, 1968).
И после восстановления сознания у больных могут наблюдаться
многообразные симптомы органического поражения мозга: агнозии,
Апраксин, лобная атаксия, пирамидная недостаточность, гемипарезы,
мозжечковые нарушения, хореоатетоидные гиперкинезы, паркинсонопо-
добные синдромы. Тяжелым осложнением является постишемическая
слепота (Мерный, 1875; X. Б. Залкинд, 1939), которая обычно имеет
корковую природу (Р. Н. Лебедева, Ж. С. Каневская, 1965; Hoyt,
Walsh, 1958), но иногда при ней наблюдается и атрофия зрительных
■нервов (X. Б. Залкинд, 1939). Описана тяжелая патология спинного
64'
мозга — вялые парапарезы, вегетативно-трофические нарушения, нару-
шения функций тазовых органов (Г. А. Акимов, 1971). В последние
годы, после работы Lance и Adams A963), особое внимание обращено
на тяжелейшие, часто генерализованные миоклонии интенционного ти-
па, которые могут полностью парализовать возможность каких-либо
движений (Castaigne e. а., 1968; Fau e. а., 1969; Lhermille e. а., 1971).
Из психических симптомов более стойкими оказываются апатикоабули-
ческий синдром, дисциркуляторная астения, неврозы, вегето-сосуди-
стая и эмоциональная лабильность. Весьма долго, даже в клинически
благоприятных случаях, сохраняются изменения ЭЭГ (обеднение кри-
вой, угнетение а-ритма, очаговые и диффузные медленные волны, пи-
ковые потенциалы).
В течение нескольких недель или месяцев все эти явления у большин-
ства больных исчезают или существенно ослабевают, что делает возмож-
ным возврат к более или менее полной социальной жизни или жизни
в семье.
Однако в части случаев описанные симптомы органической постише-
мической энцефалопатии оказываются стойкими, патологические изме-
нения в мозге не претерпевают обратного развития и не компенсируют-
ся, состояние больных регрессирует к вялой коме и смерти или они пе-
реходят в стадию хронических изменений. Из общеневрологических
явлений более стойкими и поэтому особенно тяжелыми и приводящими
к инвалидности оказываются слепота, миоклонии интенционного типа,
часто сочетающиеся с рядом мозжечковых нарушений, явления паркин-
сонизма. Могут выявиться эпилептические припадки разной тяжести.
Необратимой оказывается также психоорганическая дементность, кото-
рая со временем может даже прогрессировать.
Хронические больные с еще более обширными необратимыми и не-
компенсируемыми постишемическими изменениями мозга обычно оста-
ются навсегда прикованными к постели и способны существовать лишь
при условии непрерывного ухода за ними. Затяжная кома децеребра-
циокного типа во многих случаях переходит в особое состояние, назы-
ваемое апаллическим синдромом (Kjetschmer, 1940), или комой при
бодрствовании (coma vigil). У больных в этом состоянии функции
больших полушарий отсутствуют, больные практически почти полно-
стью парализованы, совершенно безразличны к окружающему, реак-
ции, их сведены к минимуму, колебания на ЭЭГ отсутствуют или нич-
тожны. Функции ствола мозга, в частности дыхание, сохранены. Так
как больные не отхаркивают слизь, приходится систематически сани-
ровать трахею и бронхи через трахеостому. При сохранении у больных
способности к глотанию кормить их приходится через зонд, так как са-
ми они не жуют и пищу не проглатывают. Контроль над сфинктерами
отсутствует. У больных имеется смена сна и бодрствования, не связан-
ная с чередованием дня и ночи, причем периоды бодрствования относи-
тельно кратки. В пределах апаллического синдрома возможен ряд ва-
риантов и градаций (Ch. и F. Scharfetter, 1968; Ingvar, Brun, 1972), но
общая картина остается в общем единой. Гибель таких больных насту-
пает на фоне глубокого общего маразма.
85
Близкое состояние получило название хронического децеребрационно-
Го ступора (Fischgold, Mathis, 1969). В этом случае у больных более
выражено повышение тонуса в сгибателях рук и разгибателях
ног, отмечаются элементарные эмоциональные реакции (насильствен-
ный плач), больных иногда можно кормить с ложки. Со временем по-
вышается тонус и в сгибателях ног, и во всех суставах развиваются
непреодолимые контрактуры, появляются тяжелые трофические нару-
шения кожи. Электрическая активность мозга у таких больных либо
отсутствует, либо предельно снижена и бедна, однако с помощью внут-
ривенного введения коразола (Calhoun, Ettinger, 1966) иногда удается
получить заметное обогащение ЭЭГ. Больные погибают от бронхопнев-
моний, почечной недостаточности, сепсиса.
Число таких больных, которые, однако, иногда могут жить многие
месяцы и годы, относительно невелико: по данным различных авторов,
оно не превышает 3% всех оживлений и обычно лежит в пределах 1—
2,5% (Johnson e. а., 1967; Llnko e. а., 1967; Mantz e. а., 1968; Stephen-
son, 1969), хотя по отношению к числу случаев с удавшимся восстанов-
лением сердечной деятельности доля таких больных возрастает до
13—17% (В. И. Маслов, 1965; Stephenson e. а., 1967). Больные с еще бо-
лее распространенными поражениями мозга (восстановление только
стволовых функций) длительно выживают крайне редко и обычно поги-
бают в течение острого периода постреанимационной болезни.
Однако даже быстрое полное восстановление иногда прерывается,
и на фоне, казалось бы, нормализовавшегося нейропсихического стату-
са внезапно вновь возникает резкое ухудшение, часто с повторным раз-
витием комы (Deutsch, 1917; Gamper, Stiefer, 1937; Sadove e. a., 1961).
В некоторых случаях ухудшение не столь глубоко и выражается в по-
явлении симптомов менее значительного поражения корково-подкорко-
вых систем (афазии, паркинсоноподобные синдромы, гиперкинезы, спа-
стика мышц, депрессия, нарушения ориентировки в пространстве и
времени; Plum e. а., 1962). У некоторых больных с задержкой появля-
ются тяжелые, связанные с движением миоклонии интенционного типа
(Kaftan, 1970). Исход этих ухудшений различен. Во многих случаях
вторичная кома оказывается необратимой и больные погибают, другие
больные остаются тяжелыми инвалидами, у части больных функции
мозга восстанавливаются достаточно полно, хотя признаки его органи-
ческого поражения остаются практически во всех случаях.
Относительно природы вторичного ухудшения известно немногое.
Оно обычно развивается на 2—10-е сутки, изредка позже (до 21 сут)
после гипоксии любой природы и именно в тех случаях, когда видимое
полное восстановление завершилось быстро — в течение первых 24 ч.
В течение светлого промежутка какие-либо признаки патологии мозга
отсутствуют. Общим почти для всех больных являются ранняя двига-
тельная активность и кажущееся достаточно полное восстановление
функций их центральной нервной системы. На вскрытии обнаруживают
демиелинизацию белого вещества больших полушарий и дегенератив-
ные изменения в полосатом теле и коре роландовой области. Природа
явления не установлена (Plum e. а., 1962).
86
Лечение постреанимационных
неврологических осложнений
Профилактика и лечение нарушений функций мозга у оживленных
больных складываются из воздействий двоякого рода: а) мероприятий
общего характера, обеспечивающих оптимальную реанимацию и веде-
ние постреанимационного периода, и б) мероприятий, воздействующих
непосредственно на мозг.
Так как неврологические нарушения у оживленных больных в об-
щей (не неврологической) реанимации связаны с первичными наруше-
ниями газообмена и системного кровообращения, для профилактики и
лечения неврологических осложнений у таких больных мероприятия
первого рода имеют определяющее значение. Их описание приводится
в других главах этой книги.
Лечебные меры второго рода могут бытъ патогенетическими, направ-
ленными на: а) уменьшение энергетических потребностей мозга, что
защищает мозг от воздействия возможной на ранних этапах постреани-
мационного периода вторичной гипоксии, а позднее на улучшение обме-
на веществ в его тканях;
б) предотвращение и устранение нарушений микроциркуляции в
мозге;
в) устранение отека мозга в случае его развития. Мероприятия
могут быть симптоматическими, направленными на то, чтобы:
а) снять судорожные припадки;
б) устранить нарушения в эмоционально-вегетативной сфере и пси-
хике на более поздних этапах восстановления;
в) уменьшить объем нарушений в двигательном аппарате при нали-
чии параличей, парезов, гиперкинезов.
С нашей точки зрения оживленным больным, во всяком случае в
течение постре^нимационного периода, категорически противопоказаны
нейротропные стимуляторы, применяемые с целью ускорения выхода
больных из комы (см. также В. И. Маслов, 1965).
Снижение энергетических потребностей мозга и одновременная про-
филактика отека мозга и судорог лучше всего достигаются сколь возмож-
но более ранней искусственной гипотермией со снижением температуры
тела (не ниже 34—32°С) на срок до 2—3 сут. Гипотермия достигается
физическим охлаждением тела в сочетании с введением нейроплегичес-
кой смеси: 2,5% раствора аминазина A мл), 2% раствора промедола
A мл), 2 мл раствора супрастина или димедрола. По-видимому, в ряде
случаев эффективно и изолированное охлаждение головы (кранио-цереб-
ральная гипотермия). Так же действует введение гамма-оксимасляной
кислоты (ГОМК), которая, несколько снижая чувствительность мозга к
гипоксии, одновременно оказывает и наркотический и противосудорож-
ный эффект. ГОМК вводят через зонд в желудок или парентерально в
разовой дозе 50—100 мг/кг 4—5 раз в сутки.
Улучшение мозгового кровообращения достигается введением сосу-
дорасширяющих и тонизирующих средств (эуфиллина, никотиновой кис-
лоты, раствора хлорида кальция) и препаратов, улучшающих реологиче-
87
ские свойства крови (реополиглюкин) и снижающих ее свертываемость
(гепарин). Важным средством в предотвращении вторичной гипоксии
может быть гипербарическая оксигенация.
Дегидратационные, противоотечные средства (уроглюк, лучше ман-
нитол, глицерин), по нашим наблюдениям, целесообразно применять
лишь при наличии явных признаков отека мозга. В первые 12—18 ч после
оживления они часто вообще не показаны (А. М. Гурвич, 1971). И позд-
нее их следует использовать лишь при повышении ликворного давления
выше 250 мм рт. ст. или при клинических признаках угрожающего вкли-
нения. Применение противоотечных средств бывает показано при терми-
нальных состояниях, осложненных травмой черепа или длительной арте-
риальной гипотензией. При нормальном ликворном давлении применение
кортикостероидов в общем комплексе лечебных мероприятий и легкая
гипервентиляция обеспечивают необходимую профилактику отека мозга.
Для снятия судорог используются ГОМК, нейроплегические смеси,
барбитураты.
Больным показаны также препараты, улучшающие метаболические
процессы, — АТФ, аскорбиновая кислота, витамины группы В, инсулин с
глюкозой, глютаминовая кислота.
К специальным средствам, способствующим восстановлению функций
нервных клеток и применяемым по выходе больного из коматозного сос-
тояния, относится ацефен внутрь и парентерально по 200 мг 2—3 раза в
сутки от нескольких дней до 2—3 нед. Этот препарат также эффективен
при постреанимационных хореоатетоидных гиперкинезах и психооргани-
ческих расстройствах. При миоклониях интенционного характера наибо-
лее эффективными оказались диазепам (валиум) по 50 мг в день, из них
20 мг внутривенно в 250 мл изотонического раствора плазмы в течение
9 дней (Lhermitte е. а., 1971), нитразепам по 3—5 мг в день (Muller e. а.,
1967; Kaftan, 1970) и особенно 5-окситриптофан в сочетании с фенобар-
биталом (гарденалом) —препарат вводят длительно перорально и внут-
ривенно по специальной схеме (Lhermitte e. а., 1971). При формировании
органических нарушений по выходе из комы могут быть рекомендованы
гаммалон, пиритиоксин (энцефабол — Funfgeld, 1967), психотропные
препараты по показаниям психиатра; при параличах и парезах — интен-
сивная реабилитационная лечебная гимнастика, при нарушениях речи —
занятия с логопедом.
Учитывая возможность вторичного ухудшения неврологического ста-
туса, следует при самом благоприятном и быстром течении восстанови-
тельного периода в течение не менее 10—12 дней ограничивать двигатель-
ную активность больных и выписывать их не ранее 2, а по возможности
и 3 недель после гипоксии и реанимации.
VI
КИСЛОРОДНЫЙ БЮДЖЕТ
И КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ
В ТЕРМИНАЛЬНЫХ СОСТОЯНИЯХ
При терминальных состояниях независимо от причины, вызвавшей их
развитие, кислородное голодание (гипоксия) является одним из основ-
ных патогенетических факторов, которые приводят к полному расстрой-
ству функций организма. Так как в обеспечении тканей кислородом при-
нимает участие ряд органов и систем (внешнее дыхание, сердечно-сосу-
дистая система и кровь с ее сложной функцией переноса газов от легких
к тканям и в обратном направлении), то естественно, что нарушение хотя
бы в одном из этих звеньев может повлечь за собой"расстройство кисло-
родного бюджета и вызвать гипоксию тканей (Bird, 1971; Cain, 1963;
Crowell e. a., 1964; Finch, 1972).
Осуществление дыхательной функции зависит от ряда факторов как
физиологического, так и физико-химического характера:легочной венти-
ляции, парциального давления кислорода в альвеолярном воздухе, прони-
цаемости клеточных мембран, объемной скорости кровотока и др. Для
транспорта газов кровью большое значение имеют количество и качество
гемоглобина, способность последнего связывать кислород и отдавать его
тканям, кислотно-щелочное соотношение, концентрация бикарбоната, со-
отношение окисленного и восстановленного гемоглобина, напряжение
кислорода в артериальной и венозной крови, температура, содержание
в крови электролитов и др. Весь этот сложный комплекс, обеспечиваю-
щий достаточное снабжение кислородом тканей в физиологических усло-
виях, в терминальных состояниях оказывается резко измененным.
В крайних стадиях умирания (преагональные, атональные состояния)
уменьшается легочная вентиляция, наступают тяжелые расстройства ге-
модинамики и снижение объемной скорости кровотока, что приводит к
нарушениям транскапиллярного обмена. Наступают резкие изменения
кислотно-щелочного равновесия. Изменяются свойства крови в отноше-
нии диссоциации оксигемоглобина.
В дальнейшем гипоксия, связанная с первичной патологией, усугуб-
ляется изменением условий, обеспечивающих доставку и утилизацию кис-
лорода, что приводит к развитию еще более тяжелой тканевой гипоксии.
Классификация гипоксии. В настоящее время принята следующая
классификация гипоксии:
1. Гипоксическая гипоксия:
89
а) от понижения парциального давления кислорода во вдыхаемом
воздухе;
б) от затруднения проникновения кислорода в кровь через дыха-
тельные пути;
в) гипоксия, возникающая при расстройстве внешнего дыхания.
2. Гемическая гипоксия:
а) анемический тип;
б) гипоксия в результате инактивации гемоглобина.
3. Циркуляторная гипоксия:
а) застойного типа;
б) ишемическая.
4. Тканевая гипоксия, возникающая в результате нарушения способ-
ности тканей потреблять кислород.
В последние годы выяснилось, что к этим четырем типам следует до-
бавить пятый тип гипоксии — гипоксию тканей, возникающую вследст-
вие повышенного сродства гемоглобина к кислороду (МсСопп е. а., 1970,
Del Guercio, 1971; Lovric, 1972). Этот тип гипоксии чаще всего возникает
после трансфузий больших количеств консервированной крови, в кото-
рой, как показали Valtis и Kennedy A954), по мере хранения теряется
способность к диссоциации оксигемоглобина вне зависимости от величи-
ны рН. Тяжелая гипоксия в этом случае может развиться при нормаль-
ном минутном объеме сердца и при высоком содержании кислорода в
артериальной крови вследствие того, что кислород не адекватно осво-
бождается из крови на уровне тканей и возвращается неиспользованным
в венозную кровь. Причиной повышенного сродства гемоглобина консер-
вированной крови к кислороду считают снижение в ней по мере хране-
ния 2,3-дифосфоглицерата.
При терминальных состояниях каждый из перечисленных выше типов
гипоксии может иметь место, но чаще всего встречаются смешанные
формы. Так, например, какова бы ни была причина развития терминаль-
ного состояния и какой бы тип гипоксии при этом ни наблюдался первич-
но, в период преагонального и агонального состояния к нему неизбежно
присоединяется расстройство гемодинамики (циркуляторная гипоксия).
Развитие кислородной недостаточности сопровождается возникнове-
нием очень сложного симптомокомплекса, который складывается не
только из изменений обмена веществ и физиологических функций, выз-
ванных самой гипоксией, но также из проявления защитных реакций
организма и нарушений, обусловленных первичным патологическим про-
цессом (травма, наркоз, аллергия и др.) и, кроме того, интоксикацией
недоокисленными продуктами обмена и изменениями кислотно-щелочно-
го равновесия. В этом симптомокомплексе трудно бывает установить тип
развивающейся гипоксии и определить основное звено в цепи связанных
друг с другом патологических процессов.
Показатели гипоксии. Несмотря на обилие симптомов кислородного
голодания, они не могут служить надежным критерием для оказания со-
ответствующей помощи больному, так как дают возможность лишь приб-
лизительно определить причину гипоксии и ее глубину. Раскрытию при-
роды происходящих при этих условиях изменений может способствовать
90
сопоставление клинических данных с тщательным физиологическим и
биохимическим обследованием больного.
Одним из наиболее характерных показателей гипоксии, отражающих
существо происходящих в организме изменений обмена веществ при не-
достатке кислорода, является увеличение содержания в крови недоокис-
ленных продуктов обмена — органических кислот. В норме в плазме кро-
ви содержится 10—14 мзкв/л органических кислот, при гипоксии уровень
их повышается и в терминальных состояниях нередко доходит до 24—30
и даже до 40 мзкв/л.
Несмотря на ценность этого теста для определения глубины гипоксии,
необходимо учитывать, что возможности (и этого показателя ограничены
в связи с тем, что в восстановительном периоде после тяжелой гипоксии
и тем более после клинической смерти повышенный уровень органичес-
ких кислот в крови может поддерживаться за счет вымывания их из тка-
ней и затрудненного выведения из организма в результате нарушения
функции почек.
В последние годы все чаще для оценки тяжести гипоксии и глубины
нарушений окислительного процесса используются показатели углевод-
ного обмена — содержание пировиноградной и молочной кислот и их со-
отношение. В обычных условиях в присутствии кислорода образующаяся
в тканях пировиноградная кислота окисляется в цикле трикарбоновых
кислот до углекислоты и воды. Некоторое ее количество превращается в
молочную кислоту и соотношение лактат/пируват близко к 10. Наруше-
ние доставки кислорода тканям при гипоксии ведет к увеличению кон-
центрации как пирувата, так и лактата. При этом увеличение лактата
превосходит увеличение пирувата, отношение лактат/пируват возрастает.
Как величина лактата, так и лактат-пируватное соотношение могут слу-
жить для оценки тяжести гипоксии. В 1958 г. Huckabee для оценки глу-
бины гипоксии предложил расчет «избытка лактата», т. е. той части
молочной кислоты, которая образовалась за счет анаэробного гликолиза.
Однако ценность расчета «избытка лактата» как клинического показа-
теля тканевой гипоксии в настоящее время подвергается сомнению
(Alpert, 1965, 1970; Olson, 1963).
Для характеристики гипоксии у больных определяют также гемогло-
бин, гематокритный объем и насыщение кислородом артериальной и ве-
нозной крови. Определение степени насыщения кислородом артериаль-
ной крови необходимо для суждения о полноценности внешнего дыхания.
Недостаточное насыщение кислородом венозной крови может сразу
указать на неблагополучие в гемодинамике и, следовательно, на недоста-
точную доставку кислорода тканям. Одновременное определение органи-
ческих кислот позволит отличить компенсированную гипоксию от неком-
пенсированной.
Динамика нарастания кислородной недостаточности в зависимости от
причины, вызвавшей развитие терминального состояния, может быть раз-
личной. Большое значение при этом имеют длительность умирания, воз-
раст, пол, состояние сердечно-сосудистой системы, компенсаторных реак-
ций и многое другое, что принято обозначать как «индивидуальные
особенности организма».
91
Кислородный бюджет организма и дыхательная функция крови в тер-
минальных состояниях изучались в эксперименте на собаках (Е. М. Сми-
ренская, 1946; Е. М. Смиренская и Е. С. Золотокрылина, 1956; О. Н. Бу-
ланова и И. О. Закс, 1958, 1972; И. Е. Трубина, 1971). В качестве приме-
ра приводим данные в случае умирания от острой кровопотери.
В первые минуты кровопотери, несмотря на уже значительное паде-
ние артериального давления, организм еще справляется с угрожающим
ему кислородным голоданием путем привлечения различных компенса-
торных механизмов. В этом периоде используются компенсаторные воз-
можности всех систем, обеспечивающих доставку тканям кислорода:
внешнего дыхания, кровообращения и физико-химических свойств крови.
Развивается одышка, которая способствует хорошему насыщению арте-
риальной крови кислородом. Объем потерянной крови в незначительной
степени восполняется за счет тканевой жидкости (показатель гематокри-
та крови снижается). Происходит перераспределение крови, благодаря
которому усиливается кровоснабжение жизненно важных органов —
сердца и головного мозга. Одновременно благоприятно изменяется спо-
собность гемоглобина крови связывать и отдавать кислород тканям. Бла-
годаря этим реакциям в начальном периоде кровопотери поддерживается
еще постоянство состава крови по биохимическим показателям. Но если
кровопотеря продолжается, компенсаторные возможности организма
истощаются и черты, характеризующие гипоксический характер обмена,
выступают все более отчетливо.
Из крови, медленно протекающей по сосудам, ткани успевают по-
глотить почти весь кислород. В венозной крови вместо обычных 15—
12 об.% остается всего лишь 4—5 об.% кислорода, а к началу агонии
еще меньше. Артериальная же кровь при острой кровопотере, в отличие
от других случаев, например асфиксии, до конца умирания остается даже
более насыщенной кислородом, чем в исходном состоянии, что можно
объяснить изменением отношения легочной вентиляции к объему цирку-
лирующей крови. Артерио-венозное различие по кислороду в конце уми-
рания оказывается увеличенным по сравнению с исходным в 2—3 раза.
Несмотря на это, к тканям доставляется все меньше и меньше кислорода,
так как общее количество крови в организме уменьшается и ткани испы-
тывают тяжелое кислородное голодание. В этих условиях в крови начи-
нает быстро нарастать общее содержание органических кислот, а также
молочной и пировиноградной кислот.
Ко времени наступления агонии углеводные резервы организма ока-
зываются в значительной мере исчерпанными, в обмен вовлекаются дру-
гие источники энергии и в первую очередь, по-видимому, жиры. В конце
кровопотери возникает кетонемия. Накопление кислот в крови приводит
к развитию ацидоза.
Во время клинической смерти кровообращение в организме прекра-
щается, но обмен веществ, хотя и на очень низком уровне, продолжает
осуществляться. Имеющихся в организме источников энергии при обыч-
ной температуре тела хватает на то, чтобы при отсутствии дыхания и
кровообращения поддерживать жизнедеятельность тканей в пределах 5—
7 мин, в течение которых возможно еще бывает полностью восстановить
92
функции организма. В условиях гипотермии, которая, как известно, сни-
жает потребность в кислороде, этот срок значительно удлиняется.
При медленной кровопотере, при которой артериальное давление дли-
тельно удерживается на низком уровне, резервные возможности организ-
ма часто истощаются в борьбе с кислородным голоданием еще до наступ-
ления клинической смерти и полностью восстановить жизненные функции
становится невозможным, даже если остановка дыхания и кровообраще-
ния еще не произошла (В. А. Неговский, А. М. Гурвич, Е. С. Золотокры-
лина, Н. П. Романова, 1960; О. Н. Буланова, 1969).
При оживлении, после восстановления сердечной деятельности, если
не произошло какого-либо осложнения, насыщение артериальной крови
кислородом вначале благодаря искусственному дыханию, а затем и вос-
становившемуся собственному дыханию мало отличается от исходных
величин и составляет 90—97%. Таким образом, уже в первые минуты
восстановительного периода в организме циркулирует кровь с достаточ-
ным содержанием кислорода. Однако, как показали исследования, прове-
денные в нашей лаборатории, в начале оживления имеется разница в
потреблении кислорода всем организмом и мозгом. Окислительные про-
цессы в мозговой ткани восстанавливались через 25—30 мин. Ткани, ме-
нее чувствительные к кислородному голоданию, чем мозг, не теряли спо-
собности к активному его потреблению, и весь организм в целом в начале
восстановительного периода (через 5—25 мин от начала оживления) по-
глощал кислорода даже на 35—50% больше, чем в норме. Повышенное
потребление кислорода в раннем периоде оживления, по-видимому, свя-
зано с тем, что в течение умирания и клинической смерти в тканях накап-
ливается большое количество недоокисленных продуктов обмена веществ,
для окисления которых требуется дополнительная затрата кислорода.
Повышенный запрос тканей в отношении кислорода в восстановитель-
ном периоде после клинической смерти удовлетворяется благодаря искус-
ственному дыханию, а затем и ряду компенсаторных реакций со стороны
восстановившегося собственного дыхания (увеличение легочной венти-
ляции, потребления кислорода), кровообращения (повышение артериаль-
ного давления, частоты сердечных сокращений и минутного объема
сердца) и физико-химических свойств крови.
В связи с увеличенной объемной скоростью кровотока содержание
кислорода в венозной крови, несмотря на большее его потребление,
остается почти таким же, как и до кровопотери. Накопление кислых про-
дуктов обмена веществ во время умирания и клинической смерти приво-
дит к резкому снижению углекислоты как в артериальной, так и в веноз-
ной крови. Но даже большая потеря углекислоты не может компенсиро-
вать ацидотический сдвиг в крови: рН ее снижается до 7 и ниже. Соот-
ветственно падению рН меняется диссоциация оксигемоглобина, благо-
даря чему обеспечивается более легкая отдача кислорода тканям при
равных условиях его напряжения.
Несмотря на восстановление сердечной деятельности и полноценного
внешнего дыхания, нет уверенности в том, что в восстановительном пе-
риоде в отношении окислительных процессов в тканях в это время все
обстоит благополучно. При исследовании ■количества пиравинопрадной
93
и молочной кислоты в крови животных, переживших клиническую смерть
от кровопотери, было установлено, что повышенный уровень их в крови
оживленных животных удерживается в течение 3—4 ч. Этот факт сви-
детельствует о том, что после клинической смерти «механизм, обеспечи-
вающий быстрое оюисление шгровиноградной кислоты и низкий уровень
ее в крови здоровых животных, оказывается временно нарушенным.
Через 3—6 ч от начала оживления обмен как в целом организме, так
и в мозговой ткани, хотя еще и не приходит к норме, но уже значительно
приближается к ней. В крови снижается содержание кетоновых тел и
органических кислот. Однако все это не исключает того, что после пере-
несенной клинической смерти еще в течение некоторого времени наблю-
даются отклонения в обмене веществ организма, вызванные пережитой
гипоксией и недостаточностью нервной регуляции обмена.
Длительное сохранение нарушений метаболизма и газообмена в тка-
нях в восстановительном периоде может быть связано и с циркуляторны-
ми расстройствами, которые часто развиваются после оживления. Косвен-
ными показателями возможного неблагополучия в гемодинамике могут
служить увеличение артерио-венозного различия по кислороду, снижение
процента оксигемоглобина в смешанной венозной крови и возрастание
коэффициента утилизации кислорода.
У животных, перенесших 5—12 мин клинической смерти от кровопоте-
ри или 10—15 мин остановки кровообращения в результате фибрилляции
и оживленных с помощью аппарата искусственного кровообращения или
комплексным методом, через 2—3 ч после оживления артерио-венозное
различие по кислороду возрастало до 8—12 об%, степень насыщения
кислородом венозной крови снижалась до 55—45%. Столь значительное
увеличение использования кислорода из притекающей крови связано не с
увеличением потребления кислорода тканями, а с уменьшением скорости
кровотока в результате уменьшения минутного объема сердца на 30—
50% по сравнению с исходным. Обнаруженное значительное снижение
сердечного выброса, возможно, обусловлено постгипоксической недоста-
точностью миокарда и состоянием кровообращения в сосудистой системе.
Мы остановились здесь подробно на особенностях кислородного бюд-
жета в терминальных состояниях, вызванных кровопотерей. При терми-
нальных состояниях, вызванных другими причинами, изменения в сис-
темах, обеспечивающих доставку кислорода от легких к тканям, могут
быть совсем иными. Так, например, при асфиксии уже после 2 мин пре-
кращения доступа воздуха в легкие содержание кислорода в крови было
таким низким, что практически к тканям он уже в это время не поступал.
В артериальной крови оставалось всего 2—4 об.%, а в венозной— 1—
2 об.% кислорода. Артерио-венозное различие по кислороду вместо
обычных 4—6 об.% иногда было близко к нулю. Восстановление жизнен-
ных функций становится затруднительным даже после очень небольших
сроков клинической смерти.
Само собой разумеется, что лечебные мероприятия при терминальных
состояниях каждый раз должны проводиться с учетом типа развиваю-
щейся при этом гипоксии и ее глубины. В этом отношении можно привес-
ти следующий пример. В эксперименте на собаках было показано, что
94
при длительном искусственном кровообращении, создаваемом путем пря-
мого массажа фибриллирующего сердца в сочетании с искусственным
дыханием воздухом, развивалась тяжелая гипоксия циркуляторного типа.
Степень насыщения кислородом артериальной крови при этом снижалась
до 70—65%, а венозной — до 30—25%. Течение восстановительного пе-
риода после устранения фибрилляции и восстановления кровообращения
было очень тяжелым, 'и большинство собак погибло от осложнений.
Добавление к вдыхаемому воздуху при искусственном дыхании до
40% кислорода не только устранило артериальную гипоксию, но и изме-
нило весь режим переноса кислорода в благоприятную сторону. Приме-
нением чистого кислорода для искусственного дыхания удалось предот-
вратить развитие ацидоза и добиться выживания животных после 2 ч
массажа сердца (Е. С. Золотокрылина, Н. М. Рябова, Н. С. Колганова,
1964). Однако когда не наблюдалось циркуляторной недостаточности и
насыщение крови кислородом оставалось достаточно высоким, например,
при оживлении после острой кровопотери, применение чистого кислорода
для искусственного дыхания не давало отчетливого положительного эф-
фекта, мало меняло показатели кислотно-щелочного равновесия и кисло-
родного бюджета организма (И. О. Закс, 1966, 1969).
Подробное исследование изменений обмена веществ в различных ста-
диях умирания и оживления в эксперименте, а также тщательное обсле-
дование больных при терминальных состояниях, вызванных различными
причинами, несомненно, расширяет возможности их лечения.
Кислотно-щелочное равновесие
Поддержание кислотно-щелочного равновесия в организме имеет
большое значение для нормальной его жизнедеятельности (С. Я. Каплан-
ский, 1940; Van Slyke, 1934; Kirk, 1946; Astrup, 1955; Astrup, Jorgensen,
Andersen, Engel, 1960; Sigaard-Andersen, 1964; Robinson, 1965; Masoro,
Siegel, 1971; Filley, 1971). Степень кислотности и щелочности жидких
сред организма оказывает влияние на реакции обмена веществ, является
одним из факторов, обусловливающих величину гидратации, проницае-
мости мембран, и играет определенную роль в происхождении отеков.
Ацидоз может быть причиной гемолиза, оказывает влияние на агглюти-
нацию, фагоцитоз и свертываемость крови. Malmejac с соавторами A961)
придают большое значение кислотности среды для устранения такого
частого осложнения 'при восстановлении функций, 'каким является фиб-
рилляция сердца.
Регуляция кислотно-щелочного равновесия. Как известно, постоянст-
во внутренней среды организма обеспечивается и регулируется очень
чувствительным механизмом, составной частью которого прежде всего
являются буферные свойства крови.
Важнейшей буферной системой крови является бикарбонатный буфер,
т. е. соотношение концентрации свободной угольной кислоты Н2СО3 и ее
натриевой соли Na HCO3. Помимо бикарбонатного буфера, в крови имеет-
ся и ряд других, например фосфатный буфер, образованный одно- и дву-
замещенным фосфатом натрия или калия. Буферными свойствами обла-
95
дают 'И гемоглобин в его окисленной и восстановленной форме, а также
и белки. Легким и почкам в регуляции кислотно-щелочного равновесия
принадлежит также немаловажная роль.
При накоплении в крови углекислоты активируется дыхательный
центр, легочная вентиляция увеличивается и избыточное количество угле-
кислоты удаляется из организма. Установлено, что не только углекисло-
та, но и понижение величины рН оказывает активирующее действие на
дыхание, тогда как потеря кислот или увеличение оснований и возраста-
ние рН ведут к гиповентиляции. При этом углекислота задерживается в
свободная углекислота
организме и отношение : z снова выравнивается. Почки
вследствие своей способности синтезировать аммиак могут сохранять
устойчивые основания: аммиак заменяет собой натрий и выделяется
в виде хлорида аммония, а натрий, соединяясь с НСО~3, образует би-
карбонат, который, таким образом, не теряется для организма. Кроме
того, почки обладают способностью заменять кислоты с большой кон-
стантой диссоциации на менее диссоциированные: сильная кислота вы-
деляется, а в организме задерживается более слабая. Часть органических
кислот почки могут выделять в неизмененном виде, что также приводит
к нормализации кислотно-щелочного равновесия.
В случае избытка оснований почки выделяют бикарбонат и задержи-
вают анионы, например хлор. Моча в таком случае становится щелочной.
Возможности компенсации ацидоза и алкалоза колеблются в широ-
ких пределах.
Классификация нарушений кислотно-щелочного равновесия основы-
вается на этиологических признаках. Кроме того, различают компенсиро-
ванные и некомпенсированные формы.
Нарушения кислотно-щелочного равновесия, первично обусловленные
повышением или понижением содержания углекислоты в крови, выде-
ляют в специальную группу, называя их газовыми или дыхательными:
газовый ацидоз, если содержание углекислоты в крови увеличено; газо-
вый алкалоз, если содержание углекислоты в крови уменьшено. Нереспи-
раторные нарушения кислотно-щелочного равновесия называют метабо-
лическими. Если в организме накапливается избыточное количество
кислот или имеет место потеря оснований, говорят о метаболическом
ацидозе (обе эти возможности могут привести к одной и той же клини-
ческой картине, обе они обусловливают тенденцию к снижению рН).
Термин «метаболический алкалоз» характеризует патологические сос-
тояния, обусловленные накоплением оснований или потерей кислот (ве-
личина рН при алкалозах имеет тенденцию к увеличению).
Первичные изменения кислотно-щелочного равновесия могут быть
полностью компенсированы и рН крови остается нормальным, но когда
возможности компенсации оказываются исчерпанными, нормализация
рН не наступает. Такой же эффект, т. е. отсутствие компенсации, может
быть при повреждении компенсирующих систем (дыхания, функции по-
чек) или при недостатке буфера в крови, что часто встречается у больных
в терминальном состоянии. Поэтому кислотно-щелочное соотношение
должно быть оценено и по степени компенсации.
96
Разнообразие нарушений кислотно-щелочного равновесия в организ-
ме подробно описано рядом авторов (Astrup, 1957; Sigaard-Andersen
е. а., 1960).
Кроме чистых форм, встречаются и смешанные формы, когда наслаи-
ваются друг на друга различные формы ацидоза и алкалоза, Смешан-
ные формы расстройства кислотно-щелочного равновесия часто встре-
чаются при терминальных состояниях.
Показатели расстройств кислотно-щелочного равновесия. Диагности-
ка расстройств кислотно-щелочного равновесия в организме непроста.
Для распознавания сдвигов кислотно-щелочного равновесия необходимо
проведение биохимических исследований.
В 1960 г. Astrup с соавторами предложили микрометод для одновре-
менного определения нескольких показателей, достаточно полно характе-
ризующих состояние кислотно-щелочного равновесия: 1) рН — условное
обозначение концентрации ионов водорода, отражающее степень компен-
сации, но не существо сдвигов. В норме величина рН 7,40. 2) рСО2—
напряжение углекислоты в крови, характеризующее респираторный ком-
понент; в норме в среднем составляет 40 мм рт. ст. 3) ВВ — буферные
основания крови (состоят в основном из бикарбонатов и анионов бел-
ка). В норме концентрация их колеблется от 46 до 52 мэкв/л. 4) NBB —
нормальные буферные основания крови — величина ВВ, приведенная к
стандартным условиям (при рН 7, 40; рСО2 40 мм рт. ст.) .5) BE — избы-
ток оснований. При нормальных условиях близок к нулю. Положительная
величина BE указывает на избыток оснований или на дефицит нелетучих
кислот, отрицательная — на избыток нелетучих кислот или на дефицит
оснований. 6) АВ — истинный бикарбонат — концентрация бикарбоната
в плазме. В норме в среднем составляет 24 мэкв/л. 7) SB — стандартный
бикарбонат — концентрация истинного бикарбоната при стандартных
условиях (при рСО2 40 мм рт. ст. и полном насыщении крови кислоро-
дом), основной показатель метаболического компонента. В среднем этот
показатель составляет 24 мэкв/л. 8) ТСО2 — общая СО2 — содержание
углекислоты, рассчитывается по формуле: (РСО2Х0,03)+истинный би-
карбонат. В среднем составляет 25,2 мэкв/л.
На основании анализа по методу Аструпа можно не только дифферен-
цировать газовые нарушения от метаболических, но и определить степень
их компенсации, а также выявить очень незначительные и вполне компен-
сированные отклонения кислотно-щелочного соотношения.
В случае невозможности определения всех показателей кислотно-ще-
лочного равновесия методом Аструпа для выявления газовых рас-
стройств можно ориентироваться на данные о парциальном давлении
углекислоты в альвеолярном воздухе или о содержании углекислоты в
артериальной крови. Однако необходимо отметить, что при терминаль-
ных состояниях, когда часто имеет место нарушение проницаемости ле-
гочных мембран, давление углекислоты в артериальной крови и альвео-
лах становится неодинаковым, и в таком случае определение рСО2 аль-
веолярного воздуха может привести к ошибочному диагнозу.
Содержание общей углекислоты в артериальной крови подвержено
значительным колебаниям в зависимости от многих причин. Уже одно
7 Згаказ № 1266 97
только увеличение количества кислорода в крови приводит к вытеснению»
углекислоты. И обратно: отдача кислорода гемоглобином увеличивает
связывание углекислоты. Низкий уровень общей углекислоты в крови-
может быть как при газовом алкалозе, так и при метаболическом ацидо-
зе. Если изменения кислотно-щелочного равновесия вызваны расстройст-
вом дыхания (гипо- и гипервентиляция), то одновременно с увеличением'
или уменьшением растворенной углекислоты компенсаторно увеличивает-
ся или уменьшается количество бикарбоната и тем самым симулируется*
метаболический ацидоз или алкалоз, который на самом деле является
газовым ацидозом или алкалозом в стадии компенсации. Поэтому
данный показатель может быть использован для суждения о состоянии,
кислотно-щелочного равновесия только в сочетании с другими.
О метаболическом ацидозе более объективно можно судить на осно-
вании данных о концентрации органических кислот в крови (см. выше).
Причины расстройств кислотно-щелочного равновесия в терминаль-
ных состояниях. Основной причиной наступающих расстройств кислотно-
щелочного равновесия в терминальных состояниях является гипоксия.
Расстройства кислотно-щелочного равновесия возникают также и в ре-
зультате того, что на крайних этапах жизни наступает нарушение согла-
сованности в работе систем, управляющих регуляцией кислотно-щелоч-
ного равновесия (центральная нервная система, дыхание, почки, печень)..
Некомпенсированный метаболический ацидоз, обусловленный нарас-
танием содержания недоокисленных продуктов в крови, сопровождает
развитие терминальных состояний, вызванных любыми причинами.
Метаболический алкалоз может возникать как результат передозиров-
ки при лечении щелочами, особенно если выделение бикарбоната с мочой;
затруднено вследствие почечной недостаточности. Причиной его может
быть тяжелая рвота, при этом как следствие потери хлора содержание*
бикарбоната в плазме возрастает. Как показали исследования Е. С. Зо-
лотокрылиной, у больных восстановительный период после реанимации
нередко сопровождается развитием метаболического алкалоза, причины
которого еще недостаточно изучены.
Газовый ацидоз и алкалоз могут развиться в результате неадекватной
вентиляции легких при проведении искусственного дыхания или в ре-
зультате изменений возбудимости дыхательного центра.
Экспериментальные данные о состоянии кислотно-щелочного равно-
весия при терминальных состояниях, вызванных различными причинами.
Подробное исследование кислотно-щелочного равновесия в терминаль-
ных состояниях было проведено в экспериментах на собаках (Grodins,
Lein, Adler, 1946; О. Н. Буланова, 1954; О. Н. Буланова и И. О. Закс,
1962, 1964, 1969; И. Е. Трубина, 1969, 1971; О. Н. Буланова, В. Л. Кожу-
ра, 1968). Клиническую смерть вызывали острой кровопотерей, крово-
потерей с длительным периодом гипотензии, электротравмой, кровопоте-
рей и электротравмой в условиях гипотермии, асфиксией, передозировкой
наркотиков и др. На рис. 11 приведены показатели кислотно-щелочного
равновесия, полученные при умирании от кровопотери и при последую-
щем восстановлении жизненных функций после 5 мин клинической смер-
ти. Восстановление функций проводили с помощью нагнетания в арте-
98
50
40
30
20
,0
-Q
Ё.
<u
о
о;
еска
1 з:
. а:
\ 1
\
\
■Of
Умирание
i
I ч
1 \
[ \
• \
1 \
j \
| V-.
А*.
t '^.
w
....
„г
Оживление
i
._
1-
Зч
6ч
Рйс. 11. Общая СО2, концентрация бикарбоната и растворенная СО2 (мм/л); рСО2 (мм
рт. ст.) и органические кислоты (мэкв/л).
1 — общая СОг; 2 — бикарбонат; 3 — рСО2; 4 — органические кислоты; 5 — растворенная
рию крови с адреналином и искусственного дыхания по методике
В. А. Неговского A960).
В процессе умирания содержание органических кислот в плазме крови
нарастало и к моменту агонии значительно превышало исходную вели-
чину, что свидетельствовало о наличии метаболического ацидоза. Одно-
временное определение рН в венозной крови показало, что в ней в это
время действительно наблюдается ацидотический сдвиг со снижением
рН в среднем до 7,12, но артериальная кровь оказалась даже более ще-
лочной, чем в исходном состоянии. Это обусловлено тем, что в конце
умирания развивалась резкая компенсаторная одышка и в капиллярах.
легких кровь теряла большое количество углекислоты.
Резкое падение напряжения углекислоты в артериальной крови в аго-
нальном периоде является следствием несоответствия между объемом
легочной вентиляции и уровнем кровотока в организме, а также пони-
жения емкости крови в отношении углекислоты в результате нарастания
в ней кислых продуктов обмена.
За время клинической смерти содержание недоокисленных продуктов*
обмена в организме еще больше нарастало. При оживлении после вос-
становления кровообращения кислые продукты обмена начинали вымы-
ваться из тканей и в больших количествах поступали в кровь. Сумма
органических кислот в плазме крови возрастала в 27г—3 раза по срав-
нению с исходной. Концентрация лактата увеличивалась в 4 раза (до
80 мг%) и доля его в общей сумме органических кислот в это время сос-
тавляла 37—40% против 20% в норме. В то же время уровень пирувата
возрастал в значительно меньшей степени, в результате чего увеличива-
лось отношение лактат/пируват.
В артериальной и венозной крови был отмечен некомпенсированный
ацидоз со снижением рН артериальной крови в среднем до 7, 00, а в ве-
нозной — до 6, 96. Нормализация рН, т. е. компенсация ацидоза, насту-
пала в период от Р/г до 4 ч, но компенсированный метаболический аци-
доз сохранялся у оживленных животных еще в течение длительного
времени.
В позднем восстановительном периоде, начиная с 4—6 ч оживления,
постепенно развивался газовый алкалоз со снижением рСОгДо25—27 мм
рт. ст., часто комбинировавшийся с метаболическим ацидозом. Концент-
рация органических кислот в плазме крови длительно удерживалась на
повышенном уровне. Содержание же молочной и пировииоградной кис-
лот к 6-му часу оживления снижалось даже ниже исходных величин.
Доля лактата в общей сумме органических кислот составляла только
10%. Повышенное содержание органических кислот в этом периоде под-
держивается за счет других кислот. Отношение лактат/пируват, а также
«избыток лактата» до конца первых суток оставались на повышенном
уровне, что свидетельствовало о гипоксическом характере обмена.
Если смертельная кровопотеря проходила в условиях глубокой гипо-
термии, то благодаря тому, что обмен веществ при этом был понижен и
потребность в кислороде уменьшена, кислых продуктов обмена в крови
накапливалось несравненно меньше.
Характерные изменения кислотно-щелочного равновесия были отме-
чены в случаях развития терминального состояния и от других причин.
Так, при асфиксии в процессе умирания развивался ацидоз смешанного
типа: метаболический и газовый с повышением парциального давления
углекислоты в артериальной крови до 95—106 мм рт. ст., с увеличением
суммы органических кислот в крови приблизительно в 2 раза, значитель-
ным падением концентрации бикарбоната и снижением рН артериальной
крови до 6, 97. В восстановительном периоде, даже после небольших сро-
ков клинической смерти B—27г мин), вызванной асфиксией, нарушения
кислотно-щелочного равновесия были глубокими и длительными. Хотя
уже через 2—37г ч величина рН возвращалась к исходной, компенсиро-
ванный метаболический ацидоз сохранялся у оживших животных еще
в течение длительного времени.
В восстановительном периоде после клинической смерти от электро-
травмы, так же как и в восстановительном периоде после клинической
смерти, вызванной другими причинами, был отмечен метаболический аци-
доз и гипокапния.
Сравнение данных, полученных в опытах с электротравмой, крово-
потерей и асфиксией, показало, что при равных сроках клинической
смерти восстановление функций после асфиксии протекало значительно
тяжелее. Известно, что не только срок клинической смерти, но и продол-
100
жительность умирания определяют исход реанимации. При асфиксии же
относительная значимость периода угасания функций возрастает, так как
уже через 1—2 мин с начала асфиксии содержание кислорода в арте-
риальной крови падает так низко, что практически газообмен >в тканях
не может осуществляться.
Своеобразные изменения кислотно-щелочного равновесия были отме-
чены нами в опытах, в которых после внезапной остановки сердца (фиб-
рилляция желудочков) кровообращение в организме длительно (в тече-
ние 2 ч) поддерживалось с помощью прямого массажа сердца. Уже в
первые минуты массажа, так же как и в других случаях циркуляторной
недостаточности, например при длительной гипотензии, вызванной крово-
потерей, в организме развивается метаболический ацидоз с увеличением
концентрации органических кислот в крови в 2 раза и более, но после
30 мин массажа дальнейшего углубления ацидотического сдвига в крови
не происходило. Устанавливался как бы новый уровень кислотно-щелоч-
ного соотношения, соответствующий новому, хотя и неполноцен'но'му
уровню гемодинамики. После восстановления нормального кровообра-
щения и прекращения массажа уровень органических кислот в крови
длительно не приходил к норме.
Сопоставление приведенных выше данных показывает, что в кислотно-
щелочном равновесии при умирании от различных причин имелись са-
мые различные нарушения. В первые 10—20 мин от начала оживления
специфические черты отклонения кислотно-щелочного равновесия, обус-
ловленные причиной, вызвавшей развитие терминального состояния, еще
сохранялись, но одновременно к ним присоединялись и неспецифические
изменения кислотно-щелочного равновесия, зависящие от гипоксии, пе-
режитой во время умирания и клинической смерти. Постепенно эти нес-
пецифические черты начинали преобладать, и через 20—30 мин от начала
оживления независимо от причины, вызвавшей остановку сердца, чаще
всего наблюдался метаболический ацидоз на фоне низкого напряжения
углекислоты в крови.
В более поздних стадиях оживления (после 3 ч) рН крови часто ста-
новится даже более щелочным, чем в исходном состоянии. Считают, что
причиной низкого давления углекислоты после устранения ацидоза
является гипервентиляция вследствие повышенной чувствительности ды-
хательного центра к изменениям углекислоты и к ионам Н+, а также
пониженной емкостью крови к углекислоте вследствие метаболического
ацидоза.
Таким образом, при умирании от различных причин изменения кис-
лотно-щелочного равновесия проходят две фазы. Первая из них (период
умирания и начало оживления) носит специфический характер, обуслов-
ленный причиной его развития. Вторая — неспецифическая, начинается
после восстановления у оживающих животных кровообращения и дыха-
ния и продолжается длительное время C ч и более). Эти же закономер-
ности сохранялись и при использовании с целью оживления искусствен-
ного кровообращения. Однако сдвиги в кислотно-щелочном балансе вы-
ражены при этам в достоверно (Р<0,05) меньшей степени, чем при
использовании для оживления других методов (табл. 2.).
101
Таблица 2
Изменения показателей кислотно-щелочного равновесия крови в зависимости от методов
оживления E—10-я минута восстановительного периода)
Причина и длите-
льность клиничес-
кой смерти
Кровопотеря
5 минут
Фибрилляция
15 мин
Метод оживления
АИК
Артериальное
нагнетание кро-
ви
АИК
Непрямой мас-
саж сердца
Количе-
ство эк-
спери-
ментов
6
14
9
7
рн
7,21+0,03
7,05+0,02
7,08+0,03
6,94+0,02
Органичес-
кие кисло-
ты, мэкв/л
14,0+
+0,98
23,7+1,2
21,7+1,5
35,4+2,1
Дефицит осно-
ваний, мэкв/л
—12,7+0,5
— 19,0+0,4
—16,6+0,9
—26,2+0,7
рСО2, мм
рт. ст.
37,3+5,7
48,2+2,2
53,2+4,6
43,5dz4,5
Это обусловлено тем, что с первых минут оживления с помощью
искусственного кровообращения обеспечивается эффективная доставка
кислорода и питательных веществ к жизненно важным органам и быст-
рое удаление из тканей накопившихся недоокисленных продуктов обме-
на, что способствует более быстрому восстановлению обменных процес-
сов. Особенно это относится к оживлению после длительных сроков
клинической смерти, так как в этих случаях только с помощью искусст-
венного кровообращения можно создать адекватный кровоток в мозге и
венечных сосудах. Кроме того, при искусственном кровообращении имеет
место частичная замена свежей донорской кровью, используемой для
заполнения аппарата. Это снижает ацидотический сдвиг в крови и дает
дезинтоксикационный эффект.
Вместе с тем эксперименты показали, что степень выраженности на-
рушений обмена веществ при оживлении с помощью искусственного кро-
вообращения во многом зависит от особенностей его проведения: объем-
ной скорости перфузии, эффективности оксигенации и газообмена,
создаваемых аппаратом, состава перфузата, глубины наркоза.
Описанные закономерные изменения кислотно-щелочного равновесия
в восстановительном периоде после клинической смерти, вызванной раз-
личными причинами, четко могли быть выявлены в эксперименте. В ус-
ловиях клиники дело обстоит значительно сложнее, поскольку еще до
развития терминального состояния организм больного чаще всего стра-
дает от какого-то патологического процесса, и сразу же при поступлении
в стационар ему проводят ряд терапевтических мероприятий (в том чис-
ле длительное искусственное дыхание и медикаментозное лечение), кото-
рые могут оказывать существенное влияние на кислотно-щелочное рав-
новесие и нарушать закономерности, обнаруженные в эксперименте.
Хотя в процессе нормальной жизнедеятельности организма постоянно
возникают отклонения кислотно-щелочного равновесия, но сдвиги, наб-
людающиеся при умирании и восстановлении жизненных функций, не
могут идти в сравнение с ними ни по величине, ни по характеру. В связи
с этим следует заметить, что установление верхней и нижней границ рН,
102
'еще совместимых с жизнью, представляет большой интерес. Blaja,
Crivda A962) считают, что величины рН крови 7 и 8 являются край-
ними пределами, за которыми наступает смерть. Мы же наблюдали сни-
жение рН в артериальной крови до 6, 89 и в венозной крови до 6, 85 с
последующим выздоровлением собак. Максимальный сдвиг рН в арте-
риальной крови в сторону алкалоза с последующим выздоровлением сос-
тавлял 7,58. В венозной крови сдвигов кислотно-щелочного равновесия
в сторону алкалоза не отмечалось.
Несомненно, что и быстрый переход от ацидоза к алкалозу и глубокие
отклонения кислотно-щелочного равновесия создают неблагоприятные
условия восстановления функций организма. Наши исследования пока-
зали, что на ранних этапах восстановительного периода потеря бикарбо-
натов плазмы настолько велика, что пополнение их извне напрашивалось
само собой. В экспериментах на собаках (О. Н. Буланова и К. С. Кисе-
лева, 1959; О. Н. Буланова и Н. П. Романова, 1960) было показано, что
раннее устранение ацидоза способствовало ускоренному восстановлению
жизненных функций и увеличивало число выживших животных.
Особенности нарушения
кислотно-щелочного равновесия у больных
в реанимационной практике
Общепринятым является мнение о наибольшей целесообразности ис-
следования кислотно-щелочного равновесия в артериальной крови. Для
этого необходима катетеризация или пункция периферических артерий.
Предпочтение при этом отдается лучевой или плечевой артерии. Однако
при условиях работы в отделении реанимации, когда многим больным в
течение нескольких дней (иногда недель), часто многократно в день,
приходится определять кислотно-щелочное равновесие, не следует, по-
Бидимому, отказываться от использования капиллярной крови, взятой из
пальца или мочки уха по методу глубокого прокола. Согласно данным
Siggaard-Andersen A960), исследования артериальной и капиллярной
крови при проверке у здоровых людей дали сходные результаты.
При сопоставлении показателей кислотно-щелочного равновесия в
артериальной, венозной и капиллярной крови у наших больных в постреа-
еимационном периоде было обнаружено полное совпадение данных арте-
Таблица 3
Основные показатели кислотно-щелочного равновесия
в капиллярной крови у здоровых людей
(Siggaard-Andersen, 1960)
Основные показатели
рН
рСО2 мм рт. ст.
SB мэкв/л
BE мэкв/л
Средние
показатели
7,388
39,0
23,0
0
Колебания ряда
7,351-7,424
34,0—45,0
21,3—24,8
-2,3—Ь2,3
103
риальной и капиллярнЪй крови в 46% случаев, однонаправленность их
изменений — в 39% случаев. Только в 15% случаев отмечались расхож-
дения. Как правило, это наблюдалось при наличии выраженных нару-
шений периферического кровообращения (по данным реовазографии),
В:в(иду того, что нередко у больных /реанимационного отделешя име-
ется выраженная острая анемия и артериальная гипоксемия (НЬО2 ниже
90%), для большей достоверности анализов целесообразно вносить поп-
равку в положение буферной линии на номограмме 1960 г. Для этого
используется следующая формула:
С = 0,3 X НЬ (в го/о) х 100~НЬ°2 •
100
Величину С надо прибавить к показателям ВВ и BE, найденным по
номограмме, для исследуемой крови. При этом буферная линия крови
сместится вправо. В прямоугольной номограмме 1963 г. количество гемо-
глобина, как известно, учитывается при расчете. При выполнении анали-
зов могут быть также чисто технические ошибки, обусловленные техни-
кой забора крови (соприкосновение с воздухом), а также дефектами
настройки аппарата. Поэтому нам представляется очень важной методи-
ка проверки на достоверность выполненного анализа, рекомендуемая
Ю. Я. Агаповым A968). Наиболее целесообразно это делать, по-види-
мому, путем нанесения буферных линий крови с нормальным содержа-
нием гемоглобина A5 г%) при различных степенях ацидоза и алкалоза
на номограмму Зиггарда-Андерсена (рис. 12). Анализ можно считать
достоверным, если буферная линия испытуемой крови будет параллельна
ближайшей контрольной линии (или почти параллельна). В противном
случае анализ надо повторить.
Формы нарушения кислотно-щелочного равновесия у больных.
У больных в отделении реанимации редко бывают «чистые» формы на-
рушений кислотно-щелочного равновесия. Чаще приходится сталкиваться
с разными степенями компенсации, декомпенсации ацидоза и алкалоза
респираторного или метаболического. Нередки также смешанные фор-
мы нарушений. Поэтому часто только динамика изменений в сопоставле-
нии с этиологией заболевания и клиническим проявлением его позволяет
приблизиться к решению, какое нарушение является основным, а какое
компенсаторным. Тем не менее можно выделить основные формы нару-
шений, указанные выше.
Метаболический ацидоз преобладает в период неотложной реанима-
ции B1% всех наблюдений). Позже он встречается еще реже. Гемодина-
мические нарушения, вызванные кровопотерей, травмой, потерей жидкос-
ти и электролитов из организма, сопровождаются, как правило,
компенсированным или субкомпенсированным метаболическим ацидозом.
Декомпенсацию мы наблюдали сравнительно редко (в 2,7% всех наблю-
дений) только при неэффективности проводимого лечения вследствие
прогрессирования патологического процесса (например, кровотечение,
которое нельзя остановить) или несостоятельности аппарата внешнего*
дыхания. В настоящее время некоторые авторы (В. А. Гологорский^
104
6,9
Сдвиг буферных
оснований
в мэкв/л
10
7,5 7,6
7,7 рН
10
Рис. 12. Схема для проверки анализа на достоверность и для уточнения ха-
рактера нарушений кислотно-щелочного равновесия крови у* больных (по
Ю. Я. Агапову).
На номограмму Зиггарда-Лндерсена нанесены некоторые из буферных линий крови
с содержанием гемоглобина 15 г% (наклонные пунктирные линии), позволяющие
определить достоверность выполненного анализа. Сетки (заштрихованная часть)
и цифры в средней части номограммы позволяют оценивать причинные и следствен-
ные нарушения показателей кислотно-щелочного равновесия. 0 — зона нормы, 1 — рес-
пираторный ацидоз без компенсации; 2— респираторный ацидоз с удовлетворительной
почечной компенсацией; 3 — респираторный ацидоз с полной почечной компенсацией,
эта форма ацидоза всегда компенсирована; 4— метаболический алкалоз с полной рес-
пираторной компенсацией, эта форма алкалоза всегда компенсирована; 5 — метаболи-
ческий алкалоз с удовлетворительной легочной компенсацией; 6 — метаболический
алкалоз без компенсации; 7 — смешанный (метаболический и респираторный) алкалоз
с неэффективной почечной и легочной компенсацией; 8 — респираторный алкалоз без
компенсации; 9 — респираторный алкалоз с удовлетворительной почечной компенса-
цией; 10 — респираторный алкалоз с полной почечной компенсацией (эта форма алка-
лоза всегда компенсирована); 11 — метаболический ацидоз с полной респираторной
компенсацией (эта форма ацидоза всегда компенсирована); 12 — метаболический аци-
доз с удовлетворительной легочной компенсацией; 13 — метаболический ацидоз без
компенсации; 14 — смешанный (метаболический и респираторный) ацидоз с неэффек-
тивной почечной и легочной компенсацией. Для оценки характера нарушений кислот-
но-щелочного состояния данной крови на рекомендуемой номограмме находим точку
пересечения показателей рН и рСО2. По номеру сектора, в котором она окажется,
уточняем диагноз по приведенному описанию.
И. Я. Усватова, 1969) выделяют «синдром метаболического ацидоза».
Клиническая картина его характеризуется отсутствием или спутанностью
сознания, тахикардией, грубыми нарушениями периферического крово-
обращения, тахипноэ или губоким «ацидотическим» дыханием (нередко
с нарушением ритма), часто олигурией или анурией, нередко гипотензи-
ей. Одним из ярких примеров таких нарушений является диабетическая
кома. Снижение рН до 0,7 и даже 6,9 у этих больных не является ред-
костью.
Однако и при благоприятном течении заболевания в процессе лече-
ния иногда наблюдается углубление метаболического ацидоза (как пра-
вило, компенсированного). Это всегда совпадает с периодом наиболее
интенсивной заместительной трансфузионнои терапии (большинство при-
меняемых с этой целью растворов имеют кислую реакцию). Нормализа-
ция периферического кровообращения, очевидно, также может на опре-
деленном этапе сопровождаться поступлением в кровь дополнительных
кислых продуктов обмена вследствие вымывания их из областей с ранее
нарушенной микроциркуляцией.
По нашим наблюдениям, через 6—8 ч лечения степень выраженности
метаболического ацидоза снижалась. Примерно через сутки лечения кис-
лотно-щелочное равновесие, как правило, не имеет грубых отклонений от
нормы, несмотря на сохранение в большинстве случаев дефицита объема
циркулирующей крови, нарушений периферической циркуляции и увели-
ченную сумму органических кислот. В более позднем периоде лечения
новая волна метаболического ацидоза (как правило, компенсированно-
го) сопровождает нагноения, сепсис, длительную гипервентиляцию.
Коррекция метаболического ацидоза. Сдвиги рН, угрожающие жизни,
т. е. имеющие отклонения больше 0,1 единицы от нижней границы 'нор-
мальных показателей, требуют введения в вену щелочных растворов (гид-
рокарбонат или лактат натрия, органический трисамин). Из них наи-
большее значение имеет 4—8% раствор гидрокарбоната натрия, который
вводят внутривенно со скоростью 20—30 капель в минуту. Существует
несколько формул расчета количества его, необходимого для введения.
При определении щелочного резерва на аппарате ван Слайка исполь-
зуется формула, предложенная этим автором:
NaHCO вг= 0.084 X (вес тела в кг)хF0—X)
о
где X — найденный у больного щелочной резерв в объемных процентах.
Singer и Hastings A955) предлагают другую формулу:
NaHCO3 в граммах—0,35X (вес тела в кг) ХТСО2.
Mellemgaardt и Astrup A960) предлагают следующий способ опре-
деления:
NaHCO3 в мэкв/л = 0,3 X (вес тела в кг) ХВЕ в мэкв/л,
где BE — дифицит оснований в мэкв/л. При этом рекомендуется приме-
нять 8,4 или 4,2% растворы. Исходя из расчета грамм-молекулы гидро-
карбоната натрия (84 г), 1 мл первого раствора будет содержать 1 м*экв
гидрокарбоната, а второго — 0,5 мэкв. Вопрос о концентрации раствора
106
решается исходя из потребности организма в жидкости. Э. Д. Нисневич
A969) приводит также формулу Astrup, где расчет производится в виде
5% раствора NaHCO3:
5 о/о раствор NaHCO3 = (вес тела * кг) Х ВЕ •
О. Н. Буланова установила, что после клинической смерти от крово-
потери необходимо во всех случаях, не дожидаясь результатов исследо-
вания кислотно-щелочного равновесия, ввести капельно в виде 8 или 4%
раствора этот препарат в дозе 0,15 г/кг сухого вещества (с последующей
коррекцией по показателям кислотно-щелочного равновесия).
Помимо гидрокарбоната натрия, для устранения метаболического
ацидоза применяется также трисамин в виде 3,6% раствора в дозе 0,12—
0,5 г/кг при скорости введения раствора 1 мл/мин/кг. Нормализация ще-
лочного резерва крови при этом происходит несколько медленнее, чем
при применении гидрокарбоната натрия (В. А. Неговский и И. Е. Труби-
на, 1966). Применение его несомненно целесообразно, поскольку имеются
данные о проникновении трисамина в неионизированном состоянии через
клеточные мембраны и коррекции внутриклеточного рН. Лучший клини-
ческий эффект дает сочетанное его применение с гидрокарбонатом нат-
рия.
Лактат натрия в последние годы широко применяется путем добавле-
ния к солевым растворам. В частности, 0,33% концентрация его при до-
бавлении к раствору Рингера под названием лактасол или рингер-лактат
рекомендуется ЦОЛИПК в качестве заместительной и корригирующей
метаболический ацидоз терапии. Помимо коррекции кислотно-щелочного
равновесия, лактат натрия, как известно, является ценным энергетичес-
ким продуктом (его окисление в организме сопровождается образова-
нием АТФ). Однако при выраженной лактацидемии, часто сочетающейся
с метаболическим ацидозом и дефицитом кислорода в организме, а так-
же при поражении печени введение больших количеств лактата натрия
надо производить с осторожностью.
Необходимо учитывать, что в клинических условиях не всегда воз-
можна точная коррекция метаболического ацидоза на основании приве-
денных расчетов. Основной причиной, помимо сниженного объема внекле-
точного сектора, является продолжение поступления кислых продуктов
обмена 'из тжаией в процессе лечения, а также, шо-видимому, нарушение
транскапиллярного обмена, затрудняющего обмен между кровью и интер-
стициальной жидкостью. Поэтому справедлива рекомендация И. М. Мар-
келова, А. Л. Костюченко, Т. Б. Церингера A969) проводить первона-
чальную коррекцию дефицита оснований лишь на 2/з его величины.
Следует заметить также, что если причины развития метаболического
ацидоза не устраняются своевременно и полно, то применение любых из
перечисленных выше препаратов дает лишь временный эффект. Поэтому
при кровопотере, в частности, основное значение нужно придавать быст-
рому возмещению объема циркулирующей крови, нормализации перифе-
рического кровообращения. Необходимость в коррекции метаболического
-ацидоза при такой тактике лечения возникает значительно реже.
107
Респираторный или дыхательный ацидоз у больных, нуждающихся в*
реанимации, по нашим данным, наблюдается только в 13% случаев.
При этом состояние декомпенсации ацидоза имелось примерно у 7з этих
больных. Первичное накопление углекислоты в крови наблюдалось при*
гиповентиляции центрального происхождения или вследствие нарушения!
механики дыхательного акта. К нарушению выделения углекислоты при-
водили также трахеобронхиальная непроходимость и массивные пораже-
ния легочной ткани или нарушения легочного кровообращения. По нашим
наблюдениям, причиной декомпенсации внешнего дыхания чаще всего бы-
ло развитие острых воспалительных изменений на фоне хронической ле-
гочной недостаточности, множественные переломы ребер, отек легких^
отравления барбитуратами или передозировка анальгетиков наркотичес-
кого действия. Одним из наиболее радикальных методов лечения в таких
случаях была длительная искусственная вентиляция легких (см. главу
XI) с подбором соответствующего режима вентиляции и состава газовойг
смеси.
Алкалоз как респираторный, так и метаболический в практике отде-
ления реанимации наблюдался значительно чаще, чем ацидоз, — в 48,5%
всех случаев. При этом примерно в половине наблюдений приходится^
иметь дело с развитием гипервентиляционного синдрома, т. е. с респира-
торным алкалозом, как правило, декомпенсированным. Помимо компен-
саторного усиления спонтанного дыхания при метаболическом ацидозе-
частой причиной его развития был длительный болевой синдром, раздра-
жение центральных регуляторов дыхания в результате гипертермии, трав-
мы и отека мозга. Большую группу составляют также больные, у кото-
рых длительно проводилось искусственное дыхание. Согласно данным*
ряда авторов (В. Л. Кассиль, 1965; Сага 1964; Gordon, 1969), создание
умеренной гипервентиляции (рСО2 в пределах 30 мм рт. ст.) является'
необходимым условием синхронизации дыхания больных с работой рес-
пиратора и создания «зоны комфорта» при длительном проведении ис-
кусственной вентиляции легких. Однако в ряде случаев, особенно при
травме черепа, чтобы добиться синхронизации дыхания больных с рес-
пиратором, приходилось создавать более значительную временную гипер-
вентиляцию со снижением рСО2 ниже 30 мм рт. ст.
Лечение гипокапнии так же необходимо, как и других видов наруше-
ния кислотно-щелочного равновесия. Однако часто встречаются утверж-
дения, что алкалоз менее вреден, чем ацидоз. Частично это основано на<
том, что алкалоз легче переносится, как правило, не приводит к немед-
ленной смерти. Однако алкалозы, как известно, вызывают гипоксию тка-
ней (Carryer, 1947; Roberts e. a., 1957; Laborit, 1970) прежде всего вслед-
ствие затруднения диссоциации оксигемоглобина (эффект Бора). При
длительной щелочной реакции крови кривая диссоциации оксигемогло-
бина смещается влево и отщепление кислорода от оксигемоглобина зат-
рудняется. Например, при рН 7,6 количество отщепленного кислорода*
от НЬОг в 2 раза меньше, чем при рН 7,2.
Под влиянием гипокапнии усиливается также вазоконстрикция вслед-
ствие влияния пониженного напряжения углекислоты на тонус перифери-
ческих сосудов (М. Е. Маршак и др., 1966; Moore e. а., 1955; Meyer e. а.?.
108
1962, и др.)- При гипокапнии в крови накапливается молочная кислота
(Т. М. Дарбинян и А. Л. Тверской, 1970; Huckabee, 1958; Eichenholz e. a.,
1962; Laborit, 1968). Добавление в таких случаях углекислоты к вдыхае-
мому воздуху, по данным Huckabee, предотвращает дальнейшее ее накоп-
ление. По мнению Hastings и Dowdle A960), ведущее значение при этом
имеет влияние напряжения углекислоты на углеводный обмен. Laborit
считает также, что при снижении рСО2 до 15 мм рт. ст. и ниже тормо-
зится гликолиз, что приводит к развитию необратимого состояния.
Лечение респираторного алкалоза в основном сводится к устранению
причин, его вызывающих. Если это невозможно, то следует переводить
больных на искусственную вентиляцию легких, чтобы создать наиболее
адекватное напряжение углекислоты в крови. При развитии гипервенти-
ляционного синдрома во время длительного проведения ИВЛ, когда не-
возможно снижение МОД респиратора вследствие несинхронности дыха-
ния больного с респиратором на ином режиме, методом выбора является
систематическое введение в вену 4—5% гидрокарбоната натрия по 150—
.200 мл 2—4 раза в сутки. Это позволяет на период вынужденной гипер-
вентиляции поддерживать более высокий уровень углекислоты в крови и
способствует предотвращению или устранению компенсаторного метабо-
лического ацидоза.
В последние годы все больше накапливается данных о развитии ме-
таболического алкалоза у больных, перенесших тяжелые операции,
травму, кровопотерю (Ю. И. Шанин и др., 1965; Е. С. Золотокрылина,
1968; Gruber e. а., 1963; Lyons, Moore, 1966; Simmendinger, Dietzel, 1971,
и др.). Следует заметить, что накопление оснований в плазме крови наб-
людается в период, когда нет уже нарушений жизненно важных функций.
По нашим данным, это начинается в конце 1-х — начале 2-х суток лече-
ния. Избыток оснований в плазме крови сочетается с повышенной сум-
мой органических кислот и активацией аммониогенеза в почках. При бла-
гоприятном течении заболевания метаболический алкалоз достигал мак-
симальной выраженности (SB в среднем 28,3±0,5 мэкв/л и ВЕ+5,3±
±0,6 мэкв) на 2—3-й сутки, постепенно уменьшаясь в последующем. При
развитии осложнений он обычно прогрессировал и становился декомпен-
-сированным.
Причины избыточного накопления оснований в плазме крови при
одновременном наличии избытка органических кислот не совсем ясны.
Согласно данным Darrow A945), Cooke с соавторами A952), дефицит
калия и хлора способствует развитию этого состояния. В наших наблю-
дениях (Е. С. Золотокрылина, 1969) отмечена прямая зависимость между
дефицитом объема циркулирующей крови, общей воды в организме и
накоплением оснований в плазме крови. Очевидно, причиной усиленной
реабсорбции натрия в почках и накопления его в плазме крови является
вторичный гиперальдостеронизм, развивающийся вследствие гиповоле-
мии. У больных с хроническими заболеваниями легких генез этого сос-
тояния иной: быстрое понижение рСО2 в крови в результате проведения
трахеостомии, искусственной вентиляции легких, может вызвать метабо-
лический алкалоз вследствие быстрого снижения рСО2 крови и более
медленной коррекции почками компенсаторно повышенного щелочного
109
запаса крови. Указанный факт является одной из причин больших труд-
ностей в установлении режима искусственной вентиляции легких у этих
больных (В. Л. Кассиль и Н. П. Пронина, 1968).
Патогенетически обоснованной профилактикой и лечением метаболи-
ческого алкалоза является своевременное возмещение объема циркули-
рующей крови (ОЦК) и общей воды в организме. Не менее важно также
производить коррекцию гипокалиемии и гипохлоремии путем системати-
ческого введения хлорида калия в виде 0,7% раствора преимущественно*
в гипертоническом растворе глюкозы с инсулином и витаминами С и
группы В. Количество необходимого препарата в сутки определяется по
выделению калия и натрия с мочой, особенно по их соотношению.
Что касается внутривенного введения растворов соляной кислоты,,
хлорида аммония, то показаниями к их применению, с нашей точки зре-
ния, может быть только опасное для жизни увеличение рН — более 7,6
(например, при проведении ИВЛ). На основании приведенной выше
формулы Мелемгардта и Аструпа можно рассчитать количество, которое
нужно ввести в каждом конкретном случае. Например, у больного весом
70 кг имеется избыток оснований ВЕ= + 10 мэкв/л. Количество хлорида
аммония, которое нужно ввести, будет равно:
0,3 X вес 1ела в кг X BE мэкв/л = 0,3 X 70 X Ю = 210 мэкв.
Для внутривенного введения применяется обычно 0,9% раствор хло-
рида аммония в воде, содержащий 170 мэкв/л. Следовательно, для ка-
пельного введения 210 мэкв (со скоростью 20 капель) нужно 1235 мл
0,9% раствора. М. Вейль и Г. Шубин A971) рекомендуют вводить одно-
моментно около 200 мэкв.
Однако введение нелетучих кислот является в таких случаях лишь
паллиативным мероприятием. Целесообразность широкого применения
этого метода сомнительна еще и потому, что при метаболическом алка-
лозе и без того повышена сумма органических кислот и активируется
аммониогенез в почках (по определению титруемой и общей кислотности
по методике Jorgensen, 1955). Как известно, активация аммониогенеза
является одной из компенсаторных реакций организма, направленных на
выведение избытка ионов водорода из организма.
Как уже указывалось выше, в клинической практике нередко бывают
смешанные формы нарушений кислотно-щелочного равновесия (по на-
шим данным, 17,5% наблюдений), при которых не всегда можно устано-
вить, даже с привлечением клинических тестов, что является причиной,
а что следствием. Выяснить же этот вопрос, особенно в экстренных си-
туациях, чрезвычайно важно. От этого зависит выбор лечения. В этом
плане большую практическую ценность имеет схема, описанная Ю. Я.
Агаповым (см. рис. 12). На этой схеме, нанесенной на номограмму Зиг-
гарда-Андерсена, изображены 14 различных сочетаний расстройств
кислотно-щелочного равновесия: компенсированных, субкомпенсирован-
ных, декомпенсированных, смешанных форм нарушений. Находим точку
пересечения линий рН и рСО2 анализируемой крови на этой схеме. Она
обычно оказывается расположенной в одном из 14 секторов. В прилагае-
мом описании указывается, какой вид нарушения кислотно-щелочного
ПО
равновесия соответствует каждому сектору. Эти данные нельзя прини-
мать безоговорочно. Однако схема, особенно с нанесенными на нее бу-
ферными линиями крови с нормальным содержанием гемоглобина для
проверки анализа на достоверность, является важным подспорьем в ра-
боте.
Таким образом, по нашим наблюдениям, у больных после реанимации
наиболее частым и длительным нарушением кислотно-щелочного равно-
весия, помимо смешанных форм, является респираторный или метаболи-
ческий алкалоз. В этом отношении наши наблюдения согласуются с дан-
ными Lyons и Moore, Hardaway A969). Что касается метаболического
ацидоза, являющегося характерной особенностью терминальных состоя-
ний, то при современных методах лечения, позволяющих, как правила
быстро ликвидировать острые нарушения гемодинамики и дыхания, он
чаще наблюдается на ранних этапах реанимации. При правильном и
своевременном лечении метаболический ацидоз чаще всего бывает ком-
пенсированным и быстро ликвидируется без специального лечения.
В заключение следует заметить, что кислотно-щелочное равновесие
является важным, но далеко не абсолютным показателем состояния
внутренней среды организма. Нарушения кислотно-щелочного равнове-
сия должны учитываться и корригироваться, если это возможно. Однако
иногда отклонений этих показателей в артериальной крови нет. В то же
время состояние больных бывает предельно тяжелым и заканчивается
смертью в ближайшие сутки. Причины этого не ясны. Однако, по всей
вероятности, большую роль в развитии этого явления имеет состояние
периферического кровообращения. Оно является определяющим факто-
ром в обмене между кровью и тканями. При грубых его нарушениях
показатели крови могут существенно отличаться от таковых в интерсти-
циальном пространстве ввиду затруднения обмена жидкостью между
ними. О состоянии же внутриклеточной среды показатели крови вообще,
как известно, не дают прямой информации. Кислотно-щелочное равно-
весие в крови в таких случаях имеет относительную диагностическую
ценность. Решающее значение приобретает клиническая картина, а так-
же сопоставление многих других показателей.
VII
ПАТОЛОГИЯ ПЕЧЕНИ
И ПОЧЕК В ВОССТАНОВИТЕЛЬНОМ ПЕРИОДЕ
ПОСЛЕ ОЖИВЛЕНИЯ
Патология печени
В современной реаниматологии на первое место выступают вопросы,
связанные с ведением восстановительного периода, иными словами — за-
дача лечения своеобразного патологического процесса, возникающего не-
посредственно после оживления и получившего название «постреанима-
ционная болезнь» (В. А. Неговский, 1971).
В патогенезе постреанимационной болезни существенную роль играют
нарушения функций печени и почек, нередко приводящие к гибели успеш-
но оживленного больного через несколько дней после реанимации.
Особенно часто такие осложнения возникают тогда, когда терминаль-
ные состояния развиваются на фоне предшествовавшей длительной гипо-
тензии, в частности при массивной незамещенной кровопотере. На ауто-
псии в таких случаях находят повреждения печени типа центролобуляр-
ного некроза (Н. П. Романова, 1962; Brauer, 1963).
Причиной развития этих изменений является перераспределение кро-
ви в организме, обеспечивающее преимущественное кровоснабжение
центральной нервной системы и сердца за счет остальных органов и тка-
ней. Этот механизм, имеющий несомненное компенсаторное значение, при
длительном умирании может привести к тяжелым, часто необратимым
изменениям паренхиматозных органов (В. А. Неговский, 1962), в част-
ности в печени при этом развиваются глубокие нарушения регионарного
кровообращения и микроциркуляции.
Особенностью кровоснабжения печени является то, что она получает
кровь из двух афферентных сосудов: печеночной артерии и воротной ве-
ны. В обычных условиях 65—85% крови поступает в печень через ворот-
ную вену (Liehtmann, 1963). Однако скорость кровотока в печеночной
артерии и давление в ней в 10 раз выше, чем в воротной вене. Кроме того,
кровь печеночной артерии богаче кислородом, чем кровь воротной вены.
В результате с артериальной кровью печень получает от 30 до 70%
кислорода (Liehtmann, 1953; Winkler, Tygstrup, 1961). Как ^полагают
Papper, Schaffner A957), регуляция кислородного режима печени осу-
ществляется системой печеночной артерии.
При шоке и терминальных состояниях кровоток в печени уменьшается,
особенно в воротной вене, увеличивается сопротивление сосудов печени
(Muller, 1963), порто-кавальный градиент давления и «скачок венозного
112
потенциала» (отношение давления в полой вене на уровне печеночных
вен к давлению в воротной вене) (Condorelli е. а., 1961). При массивной
кровопотере у собак количество оттекающей от печени крови уменьшает-
ся до 18—13% исходной величины (Е. Frank, H. Frank, Jacob, Fine, 1962).
При этом наступает относительная артериализация внутрипеченочного
кровообращения (Winkler, Tygsirup, 1961) в связи с преимущественным
угнетением кровообращения в системе воротной вены.
Многочисленными экспериментами показано, что при травматическом
шоке, кровопотере, во время агонии и в восстановительном периоде после
реанимации в печени происходит сужение капилляров с замедлением
кровотока и агрегацией эритроцитов в них (Ю. М. Левин, 1963, 1973), что
имеет большое значение в механизме расстройств печеночного кровооб-
ращения (Л. Н. Трусов, 1968; Knisely, 1945; Gellin, 1961). Наступает
также сужение мелких вен, постепенное расширение синусоидов с замед-
лением кровотока и агрегацией эритроцитов в них, внутрипеченочное
шунтирование кровотока (С. А. Селезнев, 1969; Senevirathe, 1949).
Большое значение имеет также и наблюдающаяся при шоке и терми-
нальных состояниях централизация внутрипеченочного кровообращения
в связи с наличием порто-портальных анастомозов внутри печеночных
долей и коллатералей на уровне ветвей четвертого порядка печеночной
артерии (М. С. Арбузова, 1960). Было показано также (Daniel, Pric-
hard, 1951), что кровоток в печени может осуществляться через короткие
магистрали, минуя основную массу печеночной ткани. Такая централиза-
ция внутрипеченочного кровообращения при терминальных состояниях
может стать причиной тяжелой гипоксии печени даже при относительно
высоком уровне общего артериального давления.
При изучении внутрипеченочного кровообращения бромсульфалеино-
вым методом было показано, что в восстановительном периоде после кли-
нической смерти от кровопотери продолжительностью в 5 мин крово-
обращение в печени характеризуется большой лабильностью и изменчи-
востью. У большинства животных в течение первых 5—10 мин после
оживления отмечено замедление регионарного кровотока в печени, нор-
мализующееся через 20—25 мин. Иногда отмечается ограничение крово-
тока в синусоидах и прохождение крови по коротким сосудистым путям
печени в первые минуты после оживления или на более поздних этапах
восстановительного периода (В. М. Шапиро, 1967).
Циркуляторная гипоксия печени, вызванная при шоке и терминальных
состояниях расстройствами микроциркуляции, сопровождается более или
менее выраженными нарушениями функций органа. Уменьшается желче-
выделение и снижается содержание в желчи холестерина и желчных
кислот (Е. М. Нейко, 1965). Угнетаются протеиногенная, протромбино-
генная, эмжретор-ная и дезинтоксикациовная функции печени (В. М.
Шапиро, 1970), нарушается регуляция углеводного обмена и синтез
нуклеиновых кислот (В. Л. Кожура, 1969). Выраженность нарушений
этих функций зависит от причин, обусловивших развитие терминальных
состояний, продолжительности умирания и сроков клинической смерти.
Нарушение протеиногенной функции печени. После клинической смер-
ти, наступившей в результате длительно продолжающейся кровопотери и
8 Заказ Ко 1266 Ш'
гипотензии (артериальное давление 40 мм рт. ст. в течение часа),в вос-
становительном периоде содержание белка в сыворотке снижается. Прв
* этом уменьшается количество альбуминов и увеличивается как относи-
тельно, так и абсолютно количество а-глобулинов. При быстром умира-
нии от электротравмы изменения в белковом составе крови незначитель-
ны (В. М. Шапиро, 1966). В результате длительной гипоксии нарушается,
способность печени включать в состав белков меченные аминокислоты
(Bernelli-Zazera, Bassi, Cassi, 1959).
Нарушения протромбиногенной функции печени. В то время как после
клинической смерти продолжительностью в 3—5 мин, наступившей в.
условиях быстрого умирания, содержание протромбина в крови сущест-
венно не меняется, в восстановительном периоде после клинической смер-
ти, наступившей в условиях длительного умирания AУ2—2 ч гипотензии),.
содержание протромбина в крови снижается (В. М. Шапиро, 1966). Это
снижение особенно заметно в крови, оттекающей от печени, что указы-
вает на угнетение ее протромбиногенной функции, а может быть и на за-
держку протромбина в печени.
Нарушения регуляции углеводного обмена. Гипоксия печени при тер-
минальных состояниях отражается и на ее обменных функциях в част-
ности связанных с углеводным обменом. При острой кровопотере вначале
развивается гипергликемия, а затем гипогликемия и истощение запасов*
гликогена в печени (Strawitz, Hift, Ehrhardt, Cline, 1961). При необрати-
мой кровопотере короткий гипергликемический пик предшествует или
совпадает по времени с ранними морфологическими изменениями мито-
хондрий и сопровождается прогрессивным удлинением протромбиновоп>
времени (Hift, Strawitz, 1961). При кровопотере обнаружено увеличение-
содержания сахара и молочной кислоты в верхней полой вене (Guillet^
Braconno, Barbier, Stevanovic, Fizan, 1969). При прекращении крово-
обращения в печени путем пережатия печеночной артерии и воротной
вены на 30—110 мин погибли все собаки, у которых содержание лактата
в ткани печени превысило 17 мкмоль/г, неорганического фосфора —
14 мкмоль/г, а сумма адениннуклеотидов была меньше 1,8 мкмоль/г сухо-
го веса (Farkouth, Daniel, Beaudoin, Mellan, 1971).
Нарушение экскреторной функции печени. Одним из чувствительных
индикаторов функционального состояния печени является ее способность
элиминировать введенный внутривенно бромсульфалеин (БСФ) (М.
Тульчинский, 1965; Bradley, Ingelfinger, 1945; Brauer, 1963). У собак в
норме после введения 5 мг/кг БСФ кривая его концентрации в крови ха-
рактеризуется быстрым падением в течение первых 5 мин, а затем более
медленным снижением. Полная элиминация бромсульфалеина обычна-
заканчивается б течение 10—20 мин. При оживлении после 3—5 мин
клинической смерти, вызванной электротравмой, выведение БСФ не-
сколько замедляется. Показатель задержки БСФ
концентрация БСФ через 10 мин после введения
X100
концентрация БСФ через 1 мин после введения
повышается с 13,4 до 35,8%. Через сутки после оживления выве-
дение БСФ ускоряется и показатель задержки снижается до 22,6%. Пос-
114
ле клинической смерти продолжительностью в 1—3 мин, вызванной кро-
вопотерей и наступившей после длительного умирания, показатель
задержки БСФ через 30 мин после оживления повышается до 42,6±3,9%,
а через сутки еще равен 30,9±6,8%. Отмечается резкое повышение на-
чального уровня кривой элиминации, что свидетельствует об угнетении
начальной, наиболее активной фазы выведения БСФ. Порог выведения
БСФ значительно повышен и при концентрации его в крови, равной 1—
1,2 мг%, выделение его резко замедляется в связи с расстройствами мик-
роциркуляции и угнетением функций гепатоцитов. На следующие сутки
характер кривой элиминации БСФ остается почти таким же, как и непос-
редственно после оживления.
Такой тип кривой элиминации БСФ свидетельствует о плохом прогно-
зе, так как все животные этой группы погибли (В. М. Шапиро, 1967).
Нарушение обмена нуклеиновых кислот. При быстром умирании от
кровопотери в ткани печени уменьшается содержание РНК, причем нор-
мализация ее уровня наступает на 2—3-й сутки восстановительного пе-
риода: в то же время концентрация ДНК как при умирании, так и после
оживления остается без изменений. Иная картина наблюдается при дли-
тельном умирании на фоне IV2—2-часовой гипотензии. В этих условиях
уменьшается содержание в ткани печени не только РНК, но и ДНК, при
этом у выживших животных через 5—6 сут отмечается тенденция к нор-
мализации уровня РНК и ДНК в печени, тогда как у погибающих сни-
жение количества нуклеиновых кислот прогрессирует (В. Л. Кожура*
1969). Эти данные представляют значительный интерес, так как они
выявляют качественные различия в повреждении печени при обратимых
и необратимых состояниях. Если в первом случае страдают элементы
цитоплазмы печеночных клеток, то во втором процесс захватывает и
ядра.
Нарушение дезинтоксикационной функции печени. Одной из актуаль-
ных проблем реаниматологии является вопрос о причинах необратимости
терминальных состояний. Известно, в частности, что при кровопотере,
превысившей определенный критический уровень, реинфузия выпущен-
ной крови не предотвращает гибель животного (Ravin, Fine, Schwein-
burg, 1958). Однако по вопросу о патогенезе этой необратимости сущест-
вуют различные точки зрения. Часть авторов выдвигают на первое место
роль гемодинамических факторов. Так, Fonkalsrud A969) считает основ-
ным в патогенезе необратимости механическое ограничение кровотока
во внутренних органах вследствие спазма сосудов. Кровоток в органах
брюшной полости уменьшается до 10% нормального уровня. Вначале
спазм охватывает венулы и артериолы, а затем только венозные сосуды,
в которых наступает застой. Венозный застой и связанное с ним умень-
шение венозного возврата, по-видимому, являются одним из существен-
ных элементов в патогенезе необратимости (Brickman, Thomas, Vasko,
1967; Lillehei, Longerbean, Bloch, Manax, 1964).
Было замечено, что патологические изменения, характеризующие
поздние стадии шока, — геморрагический некроз слизистой оболочки
кишечника, очаговые геморрагии в стенке кишечника, наблюдаются так-
же у животных, убитых летальной дозой бактериальных эндотоксинов
8* 11S
(Fine, Frank, Ravin, Rutenburg, Schweinburg, 1960). В связи с этим была
выдвинута гипотеза, что необратимость шока и терминальных состояний
связана с поражением антитоксической функции печени и поступлением
в циркуляцию бактериальных эндотоксинов и, в частности, эндотоксина
Е. coli, проникающего через кишечную стенку, измененную в процессе
гипоксии. Broekman, Thomas, Vasko A967) показали, что после введения
эндотоксина Е. coli развивается венозный застой в печени и повышается
давление в воротной вене. К. Н. Федорова и Н. С. Мурашева A968) об-
наружили в сыворотке собак, перенесших клиническую смерть, специфи-
ческие антитоксины в титре от 1:40 до 1:160, тогда как титр антител в
сыворотке нормальных животных ие превышает 1 : 10— 1 : 20. На основа-
нии этих данных авторы приходят в выводу, что в период клинической
смерти и восстановления организм животных подвергался воздействию
эндотоксина кишечной палочки.
Непосредственно после оживления у собак, перенесших 10—12-минут-
ную остановку кровообращения, снижается бактерицидная и комплемен-
тарная активность сыворотки, что, по-видимому, связано с нейтрализа-
цией поступающих в кровь токсинов (С. К. Ананьева, 1972). Интересно,
что макрофаги из брюшной полости нормальных животных проявляют
заметно сниженную фагоцитарную активность в плазме животных в сос-
тоянии шока (Rutenburg, Fine, 1956). Сыворотка крови собак через
30 мин после оживления содержит токсин, убивающий мышей с блокиро-
ванной ретикулоэндотелиальной системой, вторая волна токсемии насту-
пает на 5-е и 9-е сутки после реанимации (Л. Г. Шикунова, Р. В. Недо-
шивина, 1972). В крови собак после оживления обнаружена кратковре-
менная циркуляция микроорганизмов и, в частности, кишечной палочки
C. М. Андреева и соавт., 1972).
В последнее время внимание привлечено к фактору, вызывающему
депрессию миокарда (ФДМ). Этот фактор появляется в крови воротной
вены у животных, перенесших окклюзию сосудов, снабжающих кровью
органы брюшной полости, главным образом поджелудочную железу, и
проникает в общий кровоток через поврежденную печень. Он представ-
ляет собой пептид или гликопептид с молекулярным весом 800—1000.
Показано, что образование ФМД катализируют протеазы, образующиеся
в ишемизированных органах (Lefer, 1970). Установлено, что ФДМ не
является эндотоксином, так как О'н диализирует'ся, небольшие количества
ФДМ образуются и в ишемизированных конечностях (Lefer, Martin,
1970).
Таким образом, нельзя назвать какой-либо определенный токсин,
обусловливающий развитие необратимости терминальных состояний. По-
видимому, мы имеем дело со сложным комплексом токсических веществ
различного происхождения: это недоокисленные продукты обмена
веществ, образующиеся в связи с переходом от окислительного к глико-
литическому типу обмена углеводов, в частности молочная кислота, про-
дукты азотистого обмена (аммиак), накапливающийся в результате по-
тери печенью способности синтезировать мочевину, бактериальные эндо-
токсины и некоторые вазоактивные: вещества* В частности, определенную
роль в патогенезе необратимости терминальных состояний играет
11В
зосодержащий белок — ферритин, который образуется в ретикулоэндо-
телиальных клетках печени и в условиях нормальной оксигенации тут
же инактивируется. При гипоксии активный ферритин поступает в кро-
воток и катализирует окисление адреналина в адренохром, следствием
чего является устойчивая гипотония (Mazur, Liff, Shorr, 1950).
В связи с изложенным становится ясным, что функциональное состоя-
ние печени в значительной степени определяет окончательный исход реа-
нимационных мероприятий. В то же время следует иметь в виду, что
печень сама тяжело страдает во время гипоксии. Установлено, что пече-
ночные клетки чрезвычайно чувствительны к кислородному голоданию,
по-видимому, даже более чувствительны, чем клетки центральной нерв-
ной системы (Bernelli, Zazera, Bessi, Cassi, 1959; Schneider, 1964), и толь-
ко громадная регенераторная способность печеночной ткани позволяет
организму справиться с катастрофическими последствиями перенесенной
гипоксии.
Тем не менее печеночная недостаточность, к сожалению, является
нередким осложнением восстановительного периода после реанимации.
Патогенез острой печеночной недостаточности, развивающейся в ре-
зультате перенесенных терминальных состояний, изучен пока еще недос-
таточно. Полагают, что нарушение цикла мочевинообразования приводит
к транзиту аммиака через печень и накоплению его в мозге. Следствием
этого является трансформация а-кетоглютаровой кислоты в глютамино-
вую. Однако попытки лечения печеночной комы гемодиализом, перито-
неальным диализом и экстракорпоральной очисткой на ионообменных
смолах, приводившие к элиминации большого количества аммиака и к
снижению аммонемии, оказались менее эффективными, чем это можно
было ожидать.
Чаще всего поражения печени, вызванные тяжелой гипоксией не при-
водят к печеночной коме и внешние их проявления весьма скудны (Larkan,
Calamai, Lapierre, Vert, 1968). Тем не менее, поскольку печень играет
ведущую роль в поддержании гомеостаза, последствия этой функцио-
нальной недостаточности на фоне общей дезинтеграции функций организ-
ма могут быть достаточно серьезными. Они проявляются более или менее
выраженными нарушениями обмена веществ, потерей способности к дез-
интоксикации организма, расстройствами гемодинамики и т. ш.
Клинические симптомы вначале ограничиваются слабой желтухой
(последняя может и отсутствовать), кровоточивостью, болезненностью в
правом подреберье. Бедность клинической симптоматики делает весьма
актуальным вопрос о своевременной, по возможности наиболее ранней
диагностике поражений печени при терминальных состояниях. Это обсле-
дование должно быть комплексным и охватывать основные функции
печени.
Выше уже отмечалось, что весьма чувствительным показателем функ-
ционального состояния печени, в частности ее выделительной функции,
является бромсульфалеиновая проба, изменение показателей которой
чарто предшествует изменениям показателей ряда других печеночных
проб (В. М Шапиро, 1967). Большое значение имеют пробы, позволяю-
щие выявить недостаточность гепатоцитов: падение уровня протромбина
117
при отсутствии желтухи и антикоагулянтной терапии свидетельствует о
недостаточности печени (протромбин менее 30% указывает на тяжелую
печеночную недостаточность). При наличии желтухи падение уровня
протромбина имеет сомнительное значение, так как оно может быть свя-
зано с отсутствием адсорбции витамина К в кишечнике (Berand, 1969).
Большое значение имеет исследование некоторых ферментов, повышение
активности которых может указывать на процесс цитолиза печеночных
клеток: аспартат-аминотрансфераза (в норме 20 ИЕ); аланин-амино-
трансфераза (в норме 17 ИЕ); лактатдегидрогеназа (в норме 100—200
международных единиц по Вроблевскому); щелочная фосфатаза (в нор-
ме 15—65 ИЕ) (А. Гиттер и Л. Хельмейер, 1966).
Надежным признаком нарастающей недостаточности печени являет-
ся прогрессирующее падение содержания альбумина в сыворотке при
отсутствии протеинурии; падение уровня альбумина ниже 3% является
признаком тяжелой недостаточности печени. Имеет значение также по-
вышение содержания в крови аммиака, обычно сочетающееся с падением
содержания мочевины ниже 15 мг% (Berand, 1969).
Лечебная тактика. Актуальной, но к сожалению, недостаточно решен-
ной является задача профилактики и лечения поражений печени при тер-
минальных состояниях. Своевременно начатая и предельно активная
борьба с гипотензией, быстрое и полное возмещение потерянной крови
являются важнейшими условиями для профилактики поражений печени.
Особенно благоприятное действие оказывает артериальное нагнетание
крови, быстро усиливающее кровоток в печени (Danziger, 1955). Для пре-
дупреждения внутрисосудистого свертывания крови следует вводить низ-
комолекулярный декстран (реополиглюкин, реомакродекс) (Gellin, Shoe-
maker, 1961).
В настоящее время делаются попытки найти методы патогенетической
терапии печеночной недостаточности, основанные на коррекции много-
образных нарушений обмена веществ, связанных с повреждением печени.
Так, Tholen и Colombi A968) рекомендуют лечить больных с печеноч-
ной недостаточностью комплексом ферментов. При этом они исходят из
того, что при печеночной недостаточности нарушено превращение пиро-
виноградной кислоты в уксусную и а-кетоглютаровой в сукцинат, необ-
ходимое для образования макроэргических фосфатов. Для коррекции
этого нарушения они вводили больным кофермент А, никотинамидаде-
ниндинуклеотид (НАД) и кокарбоксилазу и получили хорошие результа-
ты у 37% больных. Имеются указания (Fodor, Popesco, 1968) на то, что
аспарагиновая кислота нормализует аммонемию, улучшает синтез моче-
вины и энергетический обмен в печеночных клетках и способствует син-
тезу белка.
С. Р. Мардашев, Е. М. Тареев, С. С. Дебов, А. П. Хохлов A967, 1969,
1970) предложили проводить лечение L-глютамином. При острой пече-
ночной недостаточности нарушается метаболизм фенилаланина. При
этом блокируется механизм гидроксилирования фенилаланина в тирозин
Фенилаланин подвергается переаминированию с образованием токсично-
го фенилпирувата, который путем декарбоксилирования превращается
в еще более токсичный фенилацетат. Введение L-глютамина восстанавли-
118
©ает нормальный переход фенилпирувата в фенилацетилглютамин, выде-
ление фенилпирувата с мочой уменьшается. L-глютамин способствует
дезинтоксикации и синтезу нуклеиновых кислот и белков, его назначают
*тю 2—3 г каждые 3 часа круглосуточно через желудочный зонд, в капель-
ных клизмах или в свечах.
Для предупреждения развития гипераммонемии, являющейся одним
.из существенных патогенетических факторов при печеночной недостаточ-
ности, следует ограничить образование аммиака в кишечнике. С этой
«целью необходимо освободить желудочно-кишечный тракт от излившейся
& него крови и давать большие дозы неомицина, ауреомицина, и коли-
мицина, чтобы подавить активность протеолитических микроорганизмов
в кишечнике.
При наличии гипераммонемии рекомендуют применение глютамино-
бой кислоты, которая, превращаясь в глютамин, фиксирует аммиак: ее
назначают внутрь по 1—2 г 2—3 раза в день или внутривенно по 10—
20 мл 1 % раствора. Широкое применение находит также аргинин и осо-
бенно L-орнитин, каждая молекула которого связывает по 2 радикала
NH3. Орнитин назначают в виде а-кетоглютарата (Sarley, Canatte,
•Gauthier, 1968; Muhlmann-Weill, 1970). Хорошее действие оказывает ко-
карбоксилаза, которая катализирует окислительное декарбоксилирова-
ние кетокислот; ее назначают по 100 мг в день в течение 3—5 дней.
Необходима также активная гормональная терапия: назначают гид-
рокортизон в первые 2 суток внутривенно капельно в 100 мг физиологи-
ческого раствора по 125 мг 2—3 раза в сутки, затем внутримышечно по
50 мг через 5 часов с постепенным уменьшением дозы и прекращением
гормонотерапии к концу 2-й недели (Л. Ф. Косоногов, 1972).
Показано также применение антигистаминных препаратов: димедрол
'0,02—0,05 г в 75—100 мл изотонического раствора капельным методом,
дипразин.внутривенно по 5—10 мл 0,5% раствора или супрастин внутри-
мышечно или внутривенно по 1—2 мл 2% раствора. Необходимо введение
достаточных количеств витаминов, особенно группы В (Bi, B2, В6, Bi2,
В15), а также больших доз аскорбиновой кислоты и витамина PP.
При нарушении свертывания крови следует переливать кровь, жела-
тельно свежезаготовленную. Для подавления усиленного фибринолиза
следует вводить аминокапроновую кислоту.
Рекомендуется капельное введение изотонического раствора глюкозы
в дозе 250—300 мл изотонического раствора.
Назначают также липотропные препараты (липокаин 3 раза в день
но 0,2 и метионин по 0,5 г).
Парентеральное питание белковыми гидролизатами начинают со 2-го
дня, вводя внутривенно капельно аминопептид и гидролизин по 300 мл с
100 мл 10% раствора альбумина (Л. Ф. Косоногов, 1972).
К сожалению, консервативная терапия печеночной недостаточности,
особенно дошедшей до стадии комы, далеко не всегда оказывается ус-
зтешной, что заставляет искать более активные пути.
В последнее время намечается применение с этой целью перфузии
печени оксигенированной кровью. В экспериментальных условиях было
достигнуто значительное улучшение исхода реанимации у животных, пе-
119
ренесших двенадцатиминутную остановку кровообращения, при проведе-
нии у них перфузии печени во время клинической смерти (В. М. Шапиро,
1967).
А. 3. Маневич, В. Г. Акопян и Т. Д. Кузнецова A968) применили пер-
фузию печени через реканализованную пупочную вену при острой пе-
ченочной недостаточности у детей, а также профилактически во время
операций, после которых можно было ожидать развития недостаточности
печени. Метод оказался эффективным у 50% больных с острой печеноч-
ной недостаточностью и предупредил развитие тяжелых печеночных
осложнений у всех оперированных больных.
Широко исследуется также возможность временной или постоянной
трансплантации печени. Опубликованы многочисленные работы (Ю. Е.
Березов и др., 1967; М. О. Стернин, 1967; Eiseman, 1963; Goodrich, 1956,.
и др.), посвященные вопросу применения при острой печеночной недоста*
точности трансплантации гомологичной или гетерологичной печени в ус-
ловиях эксперимента и клиники. На этом пути имеются определенные
достижения. Так, Starzl A964) сумел в условиях клиники добиться функ-
ционирования пересаженной печени в течение 23 дней. В условиях реани-
матологической клиники, когда ставится задача дать возможность вос-
становиться пострадавшей собственной печени больного, может оказать-
ся достаточным параллельное гетеротопное «подключение» печени1
донора. Большие перспективы открывает возможность «подключения»
гетерологичной печени, например печени свиньи. Такая печень может
успешно функционировать в течение нескольких часов, операцию эту
можно неоднократно повторять, причем, как показали проведенные ис-
следования, у реципиента не развиваются явления анафилаксии или дру-
гие проявления белковой несовместимости.
Несомненный интерес представляет сообщение об успешном проведе-
нии перекрестного кровообращения между пациенткой с тяжелейшей
печеночной комой, развившейся на почве вирусного гепатита, и ее ма-
терью. Было проведено три сеанса продолжительностью 12, 10 и 87г ч.
Улучшение наступило уже после первого сеанса. Через 3 ч после второга
сеанса исчезли все неврологические нарушения. Больная выздоровела.
Биопсия печени, произведенная через 5 мес после выздоровления, пока-
зала восстановление печеночной ткани. Состояние донора было также
хорошим (Traeger, Fries, 1968).
Обилие методов, предлагаемых для лечения острой печеночной недос-
таточности, является лучшим свидетельством того, что в этой облаете
остается еще много неисследованного, и гепатологические аспекты реани-
матологии требуют дальнейшего детального изучения.
Патология почек
Помимо печеночной недостаточности, ранний восстановительный пе-
риод может осложняться острой почечной недостаточностью или синдро-
мом острой печеночно-почечной недостаточности. Иногда эти нарушения»
выражены слабо и не диагностируются, а иногда они выступают на пер-
вое место и определяют исход заболевания.
120
По образному выражению G. Hamburger, почка — взыскательный ор-
ган, требующий для нормального функционирования определенных усло-
вий. Высокодифференцированные почечные клетки весьма чувствительны
к гипоксии. Это станет более понятным, если учесть, что в норме через
почки, вес которых составляет всего лишь 0,4% веса тела, протекает 25%
минутного объема крови. Во время шока при снижении артериального
давления до 60—40 мм рт. ст. функция почек резко угнетается. Экспери-
ментальные исследования, проведенные на собаках, у которых клиничес-
кая смерть вызывалась кровопусканием, показали, что в постреанима-
ционном периоде в первую очередь нарушаются процессы активной
реабсорбции, что выражается в повышении выделения натрия и появле-
нии в моче сахара. Восстановление основных функций нефрона после
5 мин клинической смерти наступает наЛ5—30-й день (М. А. Усиевич,.
Н. М. Киданов, 1964).
В условиях реанимационной клиники чаще всего приходится сталки-
ваться с двумя формами почечной недостаточности: более легкой —
функциональной почечной недостаточностью и с так называемым еинд-
ромом острой почечной недостаточности, при котором в той или иной сте-
пени нарушаются все функции почек.
Функциональная почечная недостаточность возникает в результате
нарушения водно-солевого баланса, а также расстройств гемодинамики
и дыхания (Hamburger e. a., I962; Kerpel-Fronius, 1962). Выделение этой
формы целесообразно в том отношении, что при ней своевременные й
рациональные лечебные мероприятия предупреждают развитие тяжелых
поражений почек. Изменения в почках при этой форме полностью обра-
тимы, невелики и не всегда могут быть выявлены обычными гистологи-
ческими методиками. Функциональная почечная недостаточность прояв-
ляется умеренными нарушениями процессов фильтрации и реабсорбции,,
что сопровождается олигурией (суточный диурез менее 500 мл) или,
наоборот, полиурией (суточный диурез 2 л и более), небольшой азоте-
мией (мочевина крови до 150 мг%) и умеренными электролитными сдви-
гами.
Острая почечная недостаточность возникает в результате травмати-
ческого, гемотрансфузионного, бактериемического, токсико-аллергическо-
го и ожогового шоков, тяжелых респираторных нарушений, длительного
коллапса, кратковременных B0—30 мин) гипотензий у больных с хрони-
ческими нарушениями кровообращения. Особенно тяжелые формы этоп>
осложнения возникают у больных с хроническими заболеваниями почек.
В большинстве случаев непосредственной причиной повреждения почеч-
ной ткани является гипоксия.
Патоморфологически, независимо от причинного фактора, при острой
почечной недостаточности обнаруживается преимущественный некроз*
эпителия почечных канальцев с повреждением или без повреждения ба-
зальной мембраны (А. А. Демин и др., 1971; Oliver e. а., 1951). Эти пов-
реждения носят чаще очаговый характер. Реже встречаются сегментар-
ные тотальные или даже кортикальные некрозы. Последние почти всегда
приводят к летальному исходу. Преимущественное поражение канальце-
вого аппарата не исключает изменения клубочков.
Несмотря на многообразие причин острой почечной недостаточности,
<в ее течении есть общие закономерности. Можно выделить четыре перио-
да в течении острой почечной недостаточности.
Первый период — это период действия причины, агента. Он отличает-
ся разнообразием клинических симптомов в полном сооответствии с
многообразием причин, его вызвавших. Так, например, при отравлениях
еа первое место выступают симптомы отравления, при тяжелой травме —
проявления травматического шока, кровопотери. На этом фоне начало
•почечных поражений в виде олигурии может остаться незамеченным.
Длительность этого периода невелика — 1—2—5 дней и зависит от силы
-и характера причины. Этот период сменяется вторым периодом — пе-
риодом анурии-олигурии (полное или почти полное отсутствие мочи).
В организме при этом развиваются резкие биохимические сдвиги, накап-
ливаются продукты белкового обмена (мочевина, креатинин, мочевая
кислота, индикан) и развивается гиперазотемия, уремическая интокси-
кация. Задержка воды, усугубляемая чрезмерным введением лечебных
растворов, приводит к общей гипергидратации, отеку легких, мозга. Нару-
шение поддержания почками солевого состава связано с возникновением
гипонатриемии, гипохлоремии и гиперкалиемии, что вредно сказывается
на деятельности миокарда, а при накоплении калия в плазме больше
7 мэкв/л (в норме 4,1—5,1 мэкв/л) может возникнуть остановка сердца.
Накопление радикалов нелетучих кислот (сульфаты, фосфаты), наруше-
ние выделения ионов водорода приводят к развитию тяжелого метабо-
лического ацидоза. Развивается тяжелая анемия (количество эритроци-
тов может снижаться до 1 млн. и менее). Часто низкое вследствие шока
или коллапса артериальное давление сменяется гипертензией. Это один
яз самых опасных периодов, длительность его определяется степенью по-
ражения нефрона, колеблется в широких пределах, но в среднем состав-
ляет около 2 нед.
Если больной переживает период олигурии-анурии, то наступает тре-
тий период — период восстановления диуреза.
Диурез может восстанавливаться медленно — по 100—150 мл в сутки
или быстро — по 500—1000 мл в сутки. В этом периоде целесообразно
выделять фазу полиурии, когда диурез может достигать огромных вели-
-чин — 6—9 л в сутки. Чаще при полиурии суточный диурез составляет
2—3,5 л. Чем больше диурез, тем быстрее снижается азотемия, выводят-
ся задерживавшиеся в организме фосфаты, сульфаты, магний и другие
электролиты. Но этот период как раз и опасен чрезмерной потерей воды
и электролитов.
Длительность этого периода также зависит от степени поражения по-
чек и колеблется от 1 до 5—6 нед.
Восстановление диуреза не означает еще восстановления всех функ-
ций почек. Отделяемая в этот период моча обычно низкого удельного
веса и в сущности представляет собой ультрафильтрат плазмы. Концент-
рационная функция почек восстанавливается обычно значительно позже,
во время четвертого периода — периода выздоровления. С этого времени
постепенно восстанавливается функциональная способность почек по под-
держанию постоянства внутренней среды организма.
122
Лечебная тактика
Реаниматору в своей практике приходится сталкиваться, как правило,
с первым и началом второго периода острой почечной недостаточности.
В дальнейшем больные с почечной недостаточностью поступают в спе-
циализированные почечные центры для гемодиализа.
Лечебные мероприятия в первом периоде должны быть направлены
на устранение причины острой почечной недостаточности, т. е. основного
патологического процесса (шок, отравление, дыхательная недостаточ-
ность и др.). Если же выявляется олигурия, то полезно правильно оце-
нить, чем она обусловлена — продолжающимся коллапсом, централиза-
цией кровообращения с уменьшением почечного кровотока вследствие
шока или уже наступившими морфологическими изменениями почек. Без-
условно, такая оценка всегда затруднительна, но она помогает в выборе
.правильной лечебной тактики. Так, например, при глубокой, но кратко-
временной гипотензии E—15 мин) олигурия или анурия, будучи скорее
проявлением функциональной почечной недостаточности, может само-
стоятельно ликвидироваться. Этот же симптом, возникший вследствие
длительной C0—60 мин) гипотензии, скорее будет свидетельствовать о
развитии острой почечной недостаточности. И если в первом случае нет
■опасности в проведении инфузионной терапии, то во втором, особенно
при интенсивных, массивных вливаниях, существует реальная опасность
гипергидратации, которая ухудшает состояние больного.
Встречающиеся до последнего времени типичные ошибки при ведении
больных в терминальных состояниях или в восстановительном периоде
с явлениями почечной недостаточности, необоснованная избыточная ме-
дикаментозная терапия делают необходимым подробнее остановить-
ся на некоторых особенностях лечебных мероприятий в подобных
условиях.
Диуретики. В последние годы в арсенал реанимационной практики
.вошел ряд различных диуретиков — маннитол, препараты мочевины, фу-
росемид и др. После ликвидации основных проявлений шока, когда выяв-
ляется олигурия, могут быть применены осмодиуретики типа маннитола,
-салуретики типа фуросемида, этакриновой кислоты. Но если имеется
азотемия, то нельзя вводить препараты мочевины. Применение ртутных
диуретиков (меркузал, новурит) совершенно недопустимо, так как пре-
параты ртути могут вызывать или усугублять поражение почек. При ану-
рии вследствие острой почечной недостаточности, а признаком этого мо-
жет служить отсутствие диуретического эффекта, применение всех видов
диуретиков бессмысленно. Более того, все осмотические диуретики при
этом противопоказаны. Противопоказания к применению маннитола, нап-
ример, обусловлены тем, что это высокоосмотическое вещество, не имея
возможности при анурии покинуть с мочой кровяное русло, будет распре-
деляться в межклеточном пространстве, что способствует образованию
так называемых стекловидных отеков, ухудшающих состояние больных.
Отсутствие мочеотделения чрезвычайно затрудняет их ликвидацию.
При отравлениях применять диуретики с целью выведения токсичес-
кого вещества целесообразно в том случае, если это вещество может вьь
123
деляться почками. Кроме того, необходимо учитывать, как долго токси-
ческое вещество может циркулировать в крови, не связываясь с белковы-
ми или другими крупномолекулярными структурами, как быстро оно ока-
зывает токсическое действие. И если, например, применение диуретиков
целесообразно при отравлениях барбитуратами, уксусной кислотой, то
при отравлениях солями тяжелых металлов эффект от их применения
весьма сомнителен, так как соли тяжелых металлов довольно быстро
связываются с сульфгидрильными группами белков и не могут быть вы-
ведены с мочой.
Инфузионная терапия. В комплекс противошоковых мероприятий
обычно входит разнообразная инфузионная терапия (кровь, плазмозаме-
нители, глюкозо-новокаиновые смеси, растворы электролитов), направ-
ленная в основном на восполнение объема циркулирующей крови, борьбу
с проявлениями шока, дезинтоксикацию.
При выявлении олигурии или анурии введение жидкостей должна
проводиться особенно осмотрительно. Безусловно бывают такие ситуа-
ции, когда неустойчивая гемодинамика обусловливает введение очень
больших количеств жидкости, но необходимо помнить, что их объем не
должен превышать суточный диурез более чем на 500—600 мл. При этом
только измерение количества выделенной мочи без учета объема введен-
ной жидкости не может приниматься во внимание для назначения транс-
фузий. Если больной выделил 1500 мл мочи (нормальное количество для
здорового человека), но ему перелито 4000 мл жидкости, диурез следует
расценивать как отрицательный. В таких условиях при отсутствии зна-
чительных внепочечных потерь жидкости (рвота, поносы, обильное пото-
отделение) у больного развивается гипергидратация.
Введение солей натрия без учета содержания натрия в плазме неред-
ко приводит к гипернатриемии. Вследствие этого повышается осмотичес-
кое давление во внеклеточном пространстве, что влечет за собой развитие
внеклеточных отеков с клеточной дегидратацией и симптомами тяжелого
поражения мозга. В диагностике подобного состояния, как и других на-
рушений электролитно-водного баланса, большую помощь оказывает
определение эффективного осмотического давления плазмы. Кроме того,,
этот показатель помогает выбрать правильную тактику в отношении ин-
фузионной терапии.
Наличие азотемии не может служить противопоказанием к гемо-
трансфузиям, если в них есть необходимость (невосполненная кровопо-
теря, анемия другого генеза).
Наконец, инфузионная терапия в условиях искусственного аппарат-
ного дыхания должна быть расширена на величину потерь воды с дыха-
нием, которая может достигать 1,5 л в сутки.
Сосудистые препараты, используемые для повышения артериального
давления, могут применяться с целью возврата в общий активный крово-
ток крови из сосудистых депо при коллапсах (Hamburger e. а., 1962).
Однако многократные введения адреналина, норадреналина и мезатона
опасны, особенно в условиях невосполненной кровопотери. Эта опас-
ность обусловлена главным образом централизацией кровообращешш
(Constantin, 1965). Для нормализации кровообращения при шоке с на-
124
чальными явлениями острой почечной недостаточности некоторые авторы
рекомендуют ганглиоблокаторы (Ю. И. Малышев и др., 1966, и др.).
Кортикостероиды (гидрокортизон, преднизолон) способствуют норма-
лизации гемодинамики и часто применяются в реанимационной практи-
ке. Но необходимо учитывать, что эти препараты способствуют усилению
белкового катаболизма и нарастанию азотемии и гиперкалиемии, что
особенно небезразлично в условиях острой почечной недостаточности.
Кроме того, возможна активизация латентной инфекции.
Для компенсации повышения белкового катаболизма, особенно при
анурии, целесообразно назначать анаболизирующие препараты (тесто-
стерон-пропионат до 200 мг в сутки, феноболин, ретаболил 50 мг 1 раз
в неделю или же метандростенолон до 30 мг в сутки).
Антибиотики. При наличии или опасности возникновения почечных
поражений, назначая антибиотики, необходимо учитывать следующее.
Некоторые антибиотики обладают нефротоксическими свойствами и мо-
гут сами по себе вызывать острые некронефрозы. Особенно это относится
к группам неомицина, полимиксина, стрептомицина. При развившейся
анурии антибиотики, которые в обычных условиях в основном выделяют-
ся почками, накапливаются в организме; при этом легко возникает их
передозировка даже при применении в обычных дозах. Нередки аллерги-
ческие реакции.
При анурии реально существует возможность накопления в организ-
ме и других вводившихся больному препаратов, которые выделяются
почками.
Назначение средств антибактериальной терапии для санации моче-
вых путей, которые оказывают свое действие при выделении почками
(фурадонин, гексаметилентетрамин, сульфаниламидные препараты) при
анурии нецелесообразно. Вследствие возможной аллергической реакции
и кристаллизации в мочевых путях нежелательно назначение сульфа-
ниламидных препаратов при олигурии.
Гемодиализ в большинстве случаев применяется во второй стадии
острой почечной недостаточности приблизительно на 5—7-й день анурии
при развитии уремического синдрома. Обычно к этому времени наблю-
дается повышение содержания мочевины до 250 мг%, может выявляться
гиперкалиемия (калий плазмы 6 мэкв/л и более) в сочетании с другими
электролитными нарушениями. Скорость нарастания азотемии варьирует
и зависит от уровня белкового катаболизма. Поэтому в предельно тяже-
лых условиях шока и острой почечной недостаточности концентрация мо-
чевины крови может нарастать до 100 мг% в сутки, обусловливая фор-
мальные показания к раннему гемодиализу. Но гемодиализ в условиях
шока и тяжелой гипотензии в большинстве случаев оказывается непере-
носимым, поскольку он сам может вызывать нарушение гемодинамики
(А. А. Трикашный и др., 1971). Кроме того, его эффективность бывает
незначительной вследствие необходимости проводить диализ с малым
кровотоком через аппарат и часто прерывать его для проведения меро-
приятий по нормализации гемодинамики.
Прогноз в этой группе больных плохой, но он чаще определяется не
острой почечной недостаточностью. Сочетание острой почечной недоста-
125
точности с дыхательной недостаточностью нередко требует проведения
гемодиализа на фоне искусственной вентиляции легких.
Раннее (до развития выраженной азотемии) применение гемодиализа
бывает оправданным при краш-синдроме (синдроме длительного раздав-
ливания) ввиду рано наступающей высокой гиперкалиемии, в случаях
отравления диализирующимися веществами (пахикарпин, метиловый
сиирт, барбитураты, препараты группы наперстянки), или же для выве-
дения токсических продуктов распада этих веществ (щавелевая кислота
при отравлениях этиленгликолем).
В подобных случаях при определении показаний к диализу необходи-
мо учитывать величину молекулы токсического вещества и его способ-
ность проникать через диализирующую мембрану, длительность циркуля-
ции токсина в кровеносном русле в свободном состоянии, время до
проявления токсического действия, возможность освобождения организма
от яда другими путями.
В подобных сложных ситуациях окончательные показания к гемодиа-
лизу должен определять уролог.
VIII
ПАТОЛОГИЯ ЭНДОКРИННОЙ
СИСТЕМЫ ПРИ ТЕРМИНАЛЬНЫХ
состояниях
Эндокринная система играет первостепенную роль среди факторов-^
определяющих реактивность организма в ответ на действие чрезвычай-
ного раздражителя. При этом не отдельные гормоны, а суммарный эндо-
кринный баланс, предшествующий и формирующийся при состоянии
напряжения (стресс), обусловливает характер и адекватность защитно-
компенсаторных процессов.
Организация гормональных реакций при терминальных состояниях и
при воздействиях, не приводящих к смерти, в принципе одинакова. Во*
время действия неадекватного раздражителя в организме нарастает
содержание гормонов с катаболическим эффектом: активируется симпа-
тико-адреналовая система, увеличивается содержание соматотропного
гормона (СТГ), антидиуретического гормона (АДГ) и адренокортико-
тропного гормона (АКТГ), кортикостероидов, глюкагона и тиреоидных.
гормонов, тогда как секреция инсулина, адреногенов и эстрогенов, обла-
дающих выраженным анаболическим эффектом, обычно относительно'
снижается. В восстановительном периоде после стресса содержание пер-
вой группы гормонов нормализуется (в разное время для каждого гор-
мона), а второй — повышается. Вслед за переходным периодом форми-
руется преобладание гормонов с анаболическим эффектом. Значение
указанных фазовых, перекрывающихся гормональных реакций заклю-
чается в осуществлении последовательных катаболических-анаболичес-
ких эффектов, необходимых для обеспечения повышенной функции орга-
нов и систем при стрессе и процессов восстановления после него.
Одновременная активация катехоламинов, СТГ, АКТГ, глюкокортикои-
дов, глюкагона и тиреоидных гормонов способствует мобилизации и*
катаболизму жиров, углеводов и белков, интенсификации энергетическо-
го обмена. Напротив, инсулин, андрогены и эстрогены в здоровом орга-
низме создают метаболическую основу реализации энергии при стрессе,
а после выхода из него — для нормализации обмена. При этом анаболи-
ческие процессы протекают в более медленном ритме (примерно в 3—6
раз), чем катаболические.
Разумеется, подразделение гормонов на две группы в определенной,
мере условно — «катаболические» гормоны участвуют и в осуществлении,
анаболических эффектов. Как известно, взаимодействие гормонов в регу-
ляции обменных процессов может быть дополняющим, синергическим,
127*
пермиссивны'М ,и антагонистическим, причем ие одинаковым на разные
виды обмена и в различных органах. В физиологических условиях около-
суточный суммарный эндокринный цикл день — ночь также обеспечивает
последовательный переход от максимальной к минимальной анаболиче-
ской и катаболической активности с небольшим перевесом анаболиче-
ских эффектов днем и более глубоким снижением катаболических про-
цессов ночью (Curtis, 1972).
Наряду с указанной однотипностью организации эндокринной реак-
ции при различных видах стресса имеются и специфические отличия,
связанные с особенностями и интенсивностью действия чрезвычайного
раздражителя. Эти отличия изучены недостаточно. Кроме того, длитель-
ность и характер гормональных реакций видоизменяются под действием
сопутствующих внешних факторов и в результате изменений внут-
ренней среды организма (Г. М. Соловьев и др., 1965; Moore, 1959; John-
ston, 1965, 1973; Mason, 1968, 1971; Matsumoto e. a., 1970; Ukai, 1971;
Laborit, 1972; Monden e. a., 1972, и др.). Считается, что неспецифичность'
гормональных реакций определяется наличием общего нервно-психичес-
кого пускового механизма, который затушевывает специфические компо-
ненты реакции на данный раздражитель. Так, голодание, перегревание и
мышечное напряжение в противоположность охлаждению и кровопотере
не повышают секреции кортикостероидов при устранении воздействия на
психику (Mason, 1971). С увеличением интенсивности чрезвычайного раз-
дражителя активация функции щитовидной железы сменяется ее тормо-
жением, однако комплекс различных раздражителей может вызывать ее
активацию.
Характер гормональных реакций во время умирания определяется
исходной реактивностью организма и природой экстремального воздей-
ствия, а также вторичными факторами: изменениями внутренней среды
организма, функции органов и систем. Типичными гормональными реак-
циями в период развития терминального состояния (острое обескровли-
вание, гиповолемическая гипотензия, асфиксия, высотная гипоксия и т. д.)
являются: резкая активация симпатико-адреналовой, гипофизарно-над-
почечниковой и ренин-ангиотензинной систем, повышенное освобождение
АДГ и глюкагона, торможение функций щитовидной и половых желез,
угнетение секреции СТГ и инсулина (Fowler e. а., 1961; Moore, 1965;
Cerchio e. a., 1970, 1971; Hiebert e. а., 1972, и др.)- Адекватная симпатико-
адреналовая реакция является наиболее быстрым и действенным компен-
саторным механизмом, отличающимся, однако, малой продолжитель-
ностью и приводящим к кислородной задолженности. Для поддержания
и продления эффекта этой реакции требуется активация секреции глю-
кокортикоидов в небольших концентрациях, обладающих симпатотони-
ческим действием, а в больших — симпатолитическим. Чрезмернбе уве-
личение концентрации катехоламинов в крови при умирании вызывает
более глубокие нарушения периферического кровообращениями обмен-
ных процессов, резкую активацию лизосомаЛьных ферментов, гибель кле-
ток и быстрое наступление смерти.
Длительная Гиперкатехолакинемия сама по себе может явитьёя Цри-
чиной необратимости терминального состояния. ШпротиЁ, п'рёдупреж-
128
дение чрезмерной симпатико-адреналовой реакции так же, как модели-
рование гипореактивности к катехоламинам, повышает резистентность
организма к экстремальным воздействиям.
Во время умирания наблюдаются фазовые изменения содержания
циркулирующих глюкокортикоидов. При выраженной реакции системы
гипофиз — кора надпочечников развитие терминального' состояния задер-
живается, что дает время для профилактики клинической смерти. На
крайних этапах умирания содержание глюкокортикоидов в крови может
быть увеличенным (за счет активации секреции, но скорее ьследствие
угнетения метаболизма и выведения гормонов), нормальным или пони-
женным (в результате адренокортикотропной недостаточности гипофиза
и подавления синтеза стероидов под действием гипоксии). Глюкокортико-
идная недостаточность различной этиологии может явиться непосредст-
венной причиной острого развития терминального состояния. Необходимо
в то же время учитывать, что глюкокортикоиды в повышенных концент-
рациях усиливают активную компенсацию, увеличивая длительность жиз-
ни при умирании. Однако при чрезмерном увеличении, например после
их введения, может сокращаться период умирания вследствие угнетения
центральной нервной системы (пассивная защита) и задерживаться вос-
становление функции мозга при оживлении.
Во время терминального состояния в эндокринном аппарате так же,
как во всем организме, развиваются повреждения вследствие гипоксии.
При оживлении нередко отмечаются нарушения синтеза и повышенное
освобождение нейросекрета из специфических ядер гипоталамуса и ней-
рогипофиза (Е. Д. Генис и др., 1968—1970). Надпочечники переносят
без морфологических изменений 15 мин полной изолированной ишемии.
После 60 мин во всех случаях инфаркты захватывают 10—60% коры над-
почечников, но без существенных повреждений мозгового вещества
(Kovach e. а., 1966). После возобновления кровотока в надпочечниках
могут возникать и усугубляться уже имеющиеся повреждения. Поджелу-
дочная железа переносит без необратимых изменений до 40—60 мин
ишемии (И. С. Желтиков и др., 1970; Сегга е. а., 1970). Однако в пост-
ишемическом периоде в ней могут нарушаться процессы депонирования
собственных и некоторых стероидных гормонов и резко активироваться
протеолитические ферменты. Поджелудочная железа становится источ-
ником токсических полипептидов, специфически угнетающих миокард и
гладкомышечные элементы сосудов. Перенесшая ишемизацию щрпговид-
ная железа может освобождать тиреоидные гормоны и йодтирозины в
связи с гипоксической активацией лизосомальных ферментов. Яичники
устойчивы к изолированной ишемизации в течение 18—21 мин (Г. Н. Ни-
кгидзе и др., 1971).
В начальном периоде оживления, после возобновления сердечной дея-
тельности, концентрация катехоламинов в крови обычно понижена, по
сравнению с периодом агонии, уровень глюкокортикоидов может оста-
ваться повышенным или невысоким. Наблюдаются резкая гипергликемия,
снижение инсулиноподобнои активности плазмы и толерантности к глю-
козе и активация инсулиназы печени (М. С. Гаевская, 1963; А. В. Волков
и др., 1966—1973; С. А. Хачатрян, 1968—1972).
9 Заказ № 1266 < ■ 129
В дальнейшем гормональный баланс организма изменяется. На его
формирование влияют гормональные реакции периода умирания, тяжесть
перенесенного терминального состояния, степень постгипоксических пов-
реждений и особенности терапии. В течение первых суток выявляются
типичные эндокринные реакции, тесно связанные с темпами восстанов-
ления неврологических функций, степенью повреждения органов и сис-
тем и исходом реанимации. При тяжелых неврологических расстройствах
(декортикация и децеребрация), глубоких повреждениях печени и почек
и предполагаемом неблагоприятном исходе реанимации в течение 9—12 ч
после оживления наблюдается замедленное нарастание уровней глюко-
кортикоидов, катехоламинов и тиреоидных гормонов в плазме. В этих
случаях во время умирания содержание глюкокортикоидов в крови было
относительно низким, а тиреоидных гормонов — высоким. У животных,
выживших после терминального состояния, но с задержанным или непол-
ным восстановлением центральной нервной системы, в течение первых 6—
9 ч отмечается значительное увеличение содержания глюкокортикоидов,
сменяющееся падением их концентрации, и прогрессивное снижение уров-
ня гормонального йода © плазме. У выживших животных по оравмению
с погибшими наблюдался более высокий уровень глюкокортикоидов
в плазме, за нарастаииам следовало резкое падение аих концентрации.
Динамика тиреоидных гормонов была противоположной.
При быстром восстановлении функции центральной нервной системы
и благоприятном прогнозе реанимации повышенная во время умирания
концентрация глюкокортикоидов в плазме снижается через 1—6 ч после
оживления с одновременным падением уровня тиреоидных гормонов. Че-
рез 12 ч происходит новое увеличение, а через 20—24 ч — последующее
снижение содержания глюкокортикоидов; уровень гормонального йода
остается пониженным. Формированию благоприятного типа эндокринных
реакций препятствует моделирование инсулярнои недостаточности после
оживления, но способствует предупреждение активации щитовидной же-
лезы.
При оживлении после кратковременного терминального состояния
снижение концентрации глюкокортикоидов в плазме происходит вне за-
висимости от степени нарастания их уровня во время умирания. Это сви-
детельствует о сохранности контроля над регуляцией секреции глюко-
кортикоидов, а также об удовлетворительном поглощении гормонов
тканями. После длительной клинической смерти такая реакция наблюда-
ется реже и лишь в случаях выраженного увеличения концентрации глю-
кокортикоидов во время умирания. С увеличением тяжести перенесенно-
го терминального состояния содержание глюкокортикоидов плазмы в
раннем постреанимационном периоде более длительно поддерживается
на повышенном уровне при одновременном пониженном освобождении
АКТГ, т. е. преобладают парагипофизарные пути активации надпочечни-
ков и ослаблены экстраадреналовые эффекты АКТГ (например, инсули-
нотропное действие и увеличение объема распределения стероидов в *
организме). Это, очевидно, связано с постгипоксическими расстройства-
ми гипоталамо-гипофизарной системы и с усилением разрушения АКТГ
так же, как и других белковых гормонов в крови. Не исключено наруше-
130
ние поглощения гормонов тканями (например, в связи с резким метабо-
лическим ацидозом и нарушениями микроциркуляции). Одновременно
наблюдаются менее глубокое угнетение щитовидной железы, фазовые
изменения содержания тиреоидных гормонов в плазме или длительное
нарастание их уровня. После длительной клинической смерти отмечается
более выраженная и дольше сохраняющаяся гипергликемия, глубже уг-
нетается освобождение инсулина. В ряде случаев в терминальных ста-
диях постреанимационного периода гипергликемия сменяется гипогли-
кемией вследствие истощения запасов гликогена в печени и недостаточ-
ного развертывания процессов неоглюкогенеза (А. В. Волков и др., 1973;
Bauer e. а., 1969; Ваши е. а., 1969; Cerchio e. а., 1970—1971).
Особенности тераиии восстановительного 'периода наряду с .исходным
гормональным балансом и тяжестью перенесенного терминального сос-
тояния также влияют на течение эндокринных реакций. Если гиповоле-
мия постреанимационного периода компенсирована, то независимо от
срока клинической смерти B—10 мин) в течение первого часа после
оживления активируется симпатический отдел симпатико-адреналовой
системы. Затем, через 6—9 ч, наступает его торможение с относитель-
ным преобладанием активности адреналового звена. Если абсолютная
или относительная гиповолемия сохраняется, происходит длительная (в
течение 9—12 ч) и выраженная активация обоих отделов симпатико-
адреналовой системы, как правило, оканчивающаяся гибелью организма.
Первоначально гормональная реакция, являясь частью нейро-гумораль-
ного регулирующего воздействия, имеет защитно-компенсаторное значе-
ние. Однако в случае невозможности достижения адаптивного эффекта,
в частности при патологии, превышающей компенсаторные возможности
организма, реакция переходит свою физиологическую меру и становится
патологической. Симптомами этого являются чрезмерная длительность и
(или) интенсивность реакции. В здоро;вом организме реакция катехол-
аминов может компенсировать примерно 30% потери объема крови, но
не более.
Гормональный баланс организма, формирующийся в раннем пост-
реанимационном периоде, активно влияет на процессы адаптации, ком-
пенсации и восстановления, облегчая или затрудняя их течение и даже
способствуя развитию патологических изменений. При благоприятных
реакциях: фазовых изменениях секреции глюкокортикоидов и катехол-
аминов, торможении функции щитовидной железы и активации инсуляр-
ного аппарата, через 3—9 ч после кратковременного, а иногда и дли-
тельного терминального состояния происходит стабилизация и тенден-
ция к нормализации ряда показателей энергетического и пластического
обмена (гликемии, мочевой, нуклеиновых и органических кислот, рН
крови, содержания РНК, ДНК во внутренних органах). При неблаго-
приятных эндокринных реакциях: одновременном замедленном нараста-
нии уровня катехоламинов, глюкокортикоидов и тиреоидных гормонов,
угнетении секреции инсулина резко усиливаются катаболические обмен-
ные процессы (ацидоз, гипергликемия или гипогликемия, повышенный
распад пуринов и нуклеиновых кислот и др.)- Эти реакции способствуют
сохранению и нарастанию гипоксии в постреанимационном периоде,
9* 131
препятствуют восстановлению. Одновременное продолжительное нарас-
тание уровней нескольких катаболических гормонов в циркуляции и
резкое угнетение анаболических гормонов в постгипоксических состоя-
ниях свидетельствуют о нарушениях эндокринной регуляции. Благо-
приятные адаптивные гормональные реакции в это время характеризу-
ются снижением концентрации некоторых гормонов в плазме, фазовыми
изменениями их содержания, разнонаправленностью реакций различных
гормонов.
Моделирование благоприятных эндокринных реакций: предупрежде-
ние чрезмерной активации симпатико-адреналовой системы, блокада щи-
товидной железы, повторное введение инсулина с глюкозой, АКЛТ и
глюкокортикоидов при оживлении на фоне уже развившихся патологи-
ческих изменений нормализует обменные процессы и достоверно улуч-
шает окончательные результаты реанимации после длительной клини-
ческой смерти (А. В. Волков и др., 1972, 1973; Voss e. а., 1965). При
этом необходимо учитывать эндогенные гормональные реакции. Так, у
животных с высокой исходной реактивностью коры надпочечников вве-
дение внутриартериально с началом оживления 1—2 мг/кг гидрокорти-
зона улучшает результаты реанимации и препятствует в дальнейшем
эндогенному нарастанию гормонов в крови. Большие дозы гидрокорти-
зона задерживают восстановление функций центральной нервной сис-
темы. Напротив, у животных с низкой исходной реактивностью коры
надпочечников малые дозы гидрокортизона не препятствуют нараста-
нию эндогенных гормонов и не улучшают результатов реанимации.
У них благоприятный эффект достигается применением 10—20 мг/кг
гидрокортизона.
В механизмах формирования гормонального баланса после оживле-
ния важное значение имеет состояние центральной нервной системы и
внутренних органов. Расстройства центральной нервной системы, в зна-
чительной мере обусловленные неблагоприятными экстрацеребральными
факторами, занимают ведущее место в патологии постреанимационного
периода. Известно (И. Р. Петров, 1969—1970; М. И. Митушов и др.,
1970; П. В. Сергеев и др., 1971), что некоторые гормоны (глюкокорти-
коиды, 'инсулот, АКТГ, .прямо или опосредованно повышают устой-
чивость мозга к гипоксии. Вместе с тем центральная нервная система
может активировать или тормозить эндокринные функции. В раннем
постаноксическом периоде после 10—20 мин изолированной полной ком-
прессионной ишемии мозга (во время которой в организме сохранялось
кровообращение и поддерживался газообмен) выявляются типичные
реакции глюкокортикоидов, тиреоидных гормонов и гликемии, отмечен-
ные после клинической смерти.
В остром периоде нарушений мозгового кровоообращения активи-
руется секреция катехоламинов, кортикостероидов, СТГ, но снижается
секреция инсулина и толерантность к глюкозе (Huff e. а., 1972). Эндо-
кринно-обменные реакции при сохраняющейся ишемии мозга быстро, в
течение 9—12 ч, приводят к развитию инфарктов миокарда, жировой
дистрофии печени — расстройствам, резко усугубляющим течение основ-
ного заболевания (Wexler, 1970, 1971).
132
Наряду с гипоксическими изменениями центральной нервной регуля-
ции эндокринных функций определенное значение имеют гипоксические
повреждения внутренних органов (прежде всего печени), мест погло-
щения и эффекта гормонов. Печень является источником гормонов,
местом их действия, метаболизма и инактивации. Она синтезирует спе-
цифические белки, связывающие циркулирующие в крови гормоны и
предохраняющие их от разрушения. Комплексированию гормонов с
белками сыворотки придают важное значение в осуществлении гормо-
нальной регуляции в тканях, капиллярная система которых относитель-
но проницаема для белков. При стрессе метаболизм гормонов в гепато-
цитах и ретикулоэндотелиальных элементах печени понижается при
одновременном снижении их воздействия на обменные процессы. Обмен,
например, гидрокортизона в печени усиливается под влиянием инсулина,
тироксина, адреналина, но замедляется от АКТГ, при печеночной пато-
логии, стрессе, старении, голодании, умирании (С. Г. Генес, 1966; Yates,
1967; Barnabei е. a., 1968; Bercovica e. а., 1970, и др.).
Считается, что при стрессе повышается потребность тканей в гормо-
нах, однако это положение не получило окончательного подтверждения.
Адаптивная концентрация гормона в организме обеспечивается секрецией
эндокринной железы, запасом в виде комплексов гормона с белками
сыворотки и депонирования в тканях, интенсивностью метаболизма,
инактивации и выведения гормона. Действие гормонов требует энер-
гетического обеспечения и осуществляется при их связывании со специ-
фическими рецепторами и при биотрансформации, во время которой
могут образовываться метаболиты с самостоятельной активностью.
Очевидно, что снабжение тканей гормонами определяется кровообра-
щением и состоянием тканевых систем, способных захватывать и акку-
мулировать гормоны.
В начальном периоде длительного умирания не выявлено существен-
ных изменений распределения некоторых гормонов в организме, но нес-
колько снижается скорость освобождения от них плазмы. При этом
фракционный клиренс (доля артериальной концентрации, поглощаемая
органом), например инсулина и СТГ, печенью и почками не изменяется,
а абсолютное удаление гормонов этими органами снижается пропор-
ционально уменьшению кровотока (Lang, 1961; McCirmic e. a., 1969;
Errington e. а., 1972). На крайних этапах умирания существенно сни-
жается скорость удаления гормонов плазмы и резко падает их содер-
жание во внутренних органах. После оживления наблюдаются фазовые
изменения фракционного клиренса глюкокортикоидов тканями головы.
Нарушениям синтеза и депонирования гуморальноактивных веществ в
тканях, а также способности тканей к аккумуляции гормонов отводят
важное место в патогенезе необратимости терминальных состояний.
Вместе с тем при тяжелой гипоксии, гипероксии, перегревании и охлаж-
дении не выявлено существенных изменений указанных показателей по-
требления глюкокортикоидов в организме (Courthney e. а., 1972). Оказа-
лось, что поглощение стероидов скелетными мышцами из притекающей
крови пропорционально концентрации гормона и величине кровотока.
Гормоны, поглощенные тканями, могут поступать в кровоток после насы-
133
щения тканевых мест связывания, при повышении венозного давления,
вследствие конкурентного связывания других гормонов и т. д. При
оживлении животных, лишенных надпочечников, во время острой оста-
новки кровообращения, на фоне прогрессивного падения содержания
глюкокортикоидов в сыворотке крови периодически наблюдалось не-
большое, но достоверное увеличение их уровня. Длительное сохранение
этой реакции прямо коррелировало с поддержанием гемодинамики и
продолжительностью жизни адреналэктомированных животных после
оживления.
Активное влияние гормонов на устойчивость организма к гипоксии
при терминальных состояниях убедительно подтверждается при модели-
ровании эндокринной патологии перед опытом (М. Г. Колпаков, 1962—
1967; Г. Л. Любан, 1963—1972; А. В. Волков, 1964—1973; С. А. Хачат-
рян, 1968—1972; Н. М. Ефремова, 1970). Обнаружено резкое ограниче-
ние возможностей полноценного оживления после клинической смерти
в условиях гипофизарно-надпочечниковой недостаточности, при диабете,
паратиреоидэктомии, тиреотоксикозе, длительной андрогенной недоста-
точности и при беременности. В противоположность этому введение ин-
сулина с глюкозой, АКТГ, глюкокортикоидов и гипотиреоз повышают
резистентность организма к гипоксии, что способствует полноценному
оживлению после длительной клинической смерти. Изменения исходной
резистентности организма к терминальным состояниям связаны с пря-
мым нейрорефлекторным и опосредованным через обмен веществ влия-
нием комплекса гормонов на органы и системы.
При длительной эндокринной патологии специфическое действие са-
мих гормонов на устойчивость к гипоксии затушевывается сопутствую-
щими глубокими метаболическими и структурно-функциональными
изменениями органов. Так, при хроническом тиреотоксикозе, диабете и
гипофизарно-надпочечниковой недостаточности развиваются тяжелые
нарушения функций и всех видов обмена, морфологические поврежде-
ния органов, например миокарда. Все это резко ограничивает возмож-
ности реанимации. Среди эффектов самих гормонов показано, что тирео-
идные гормоны в противоположность глюкокортикоидам и андрогенам
специфически задерживают восстановление сердечной деятельности.
Преобладание инсулина во время оживления как при его избытке, так
и при недостатке «контринсулярных» гормонов убыстряет восстановле-
ние функции дыхательного центра. Глюкокортикоиды повышают устой-
чивость различных отделов центральной нервной системы к гипоксии,
способствуют быстрому восстановлению функций среднего мозга и под-
держанию деятельности сердечно-сосудистой системы.
Влияние избытка или недостатка одного гормона на процессы уми-
рания и оживления в ряде случаев удается корригировать применением
других гормонов, тогда как нормализация баланса данного гормона
остается без эффекта. Так, у животных с длительной андрогенной не-
достаточностью, в противоположность здоровым, однократное введение
тестостерона при оживлении не улучшает исход реанимации. Примене-
ние инсулина при тиреотоксикозе, так же как кортизона при атиреозе,
облегчает оживление. Наряду с корригирующим влиянием гормонов на
134
одних этапах терминального состояния на других их эффект может
суммироваться. При умирании от кровопотери инсулин сокращает дли-
тельность жизни, а кортизон устраняет этот эффект (антагонистическое
действие). Во время оживления выявляется суммарное действие этих
гормонов. Оно выражается в ускорении восстановления дыхания и ро-
говичных рефлексов, в быстрой нормализации гемодинамики.
Действие избытка или недостатка гормона при терминальном состоя-
нии может определяться сопутствующими изменениями секреции дру-
гих гормонов. Неблагоприятное действие овариэктомии на результаты
реанимации удается корригировать одновременной тиреоидэктомией.
Несмотря на задержку восстановления сердечной деятельности при од-
нократном введении тироксина за 6 часов до воздействия, вызвавшего
клиническую смерть, окончательные результаты реанимации благоприят-
ны. Это обеспечивается компенсаторной активацией секреции инсулина
и глюкокортикоидов и повышением чувствительности тканей к гормо-
нальным влияниям в связи с усилением обменных процессов. Напротив,
при длительном тиреотоксикозе происходит перенапряжение и истощение
функций органов и систем.
Таким образом, течение защитно-компенсаторных.процессов при тер-
минальных состояниях зависит от складывающегося в это время суммар-
ного гормонального баланса. В физиологических условиях гормональ-
ный баланс организма меняется в зависимости от пола, возраста, сезона,
времени суток, предшествующих воздействий и т. д. Одновременно изме-
няется и устойчивость организма к гипоксии и другим экстремальным
воздействиям.
Нарушения гормональной регуляции при терминальных состояниях
и в .постреанимационном периоде мюгут быть вызваны как неэндокрин-
ной, так и эндокринной патологией:
1) расстройствами центральной нервной регуляции функций желез
внутренней секреции и межэндокринных взаимоотношений;
2) изменениями синтеза, накопления и освобождения гормонов из
эндокринных желез;
3) нарушениями центральной гемодинамики, периферического крово-
обращения и транскапиллярного обмена, т. е. доставки гормона к
клеткам;
4) изменениями потребления, депонирования, метаболизма и инакти-
вации гормонов поврежденными тканями в условиях нарушенных обмен-
ных процессов (снижением чувствительности тканей к гормональным
регулирующим влияниям). Доля гипоксических повреждений централь-
ной нервной системы и желез внутренней секреции при необратимости
остро развивающегося терминального состояния составляет более 60%.
Гипоксическое воздействие способствует проявлению скрытых эндокрин-
ных расстройств. После перенесенных терминальных состояний нередко
возникновение адренокортикотропной и глюкокортикоидной недоста-,
точности, чрезмерной симпатико-адреналовой реакции, неадекватно по-
вышенного освобождения тиреоидных гормонов, АДГ и альдостерона, а
также резкое угнетение секреции инсулина. Литературные данные о
межгормональных взаимоотношениях и значении отдельных гормонов
135
для организма позволяют полагать, что недостаточность системы гипо-
физ— кора надпочечников и инсулярной функции поджелудочной желе-
зы в определенной мере способствует развитию остальных эндокринных
нарушений. Указанные гормональные расстройства, являясь следствием
перенесенного терминального состояния, в свою очередь после оживле-
ния обусловливают сохранение циркуляторной и тканевой гипоксии, на-
рушений метаболизма, усиливают катаболические процессы и деструк-
цию тканей, т. е. участвуют в формировании необратимости в постреа-
нимационном периоде.
Общей задачей терапии во время терминального состояния и в пост-
реанимационном периоде в клинике является предупреждение развития
эндокринной недостаточности, чрезмерной активации катаболических и
угнетения анаболических гормонов. Необходимо создать условия для
адекватного гормонального обеспечения катаболической фазы стресса,
быстрого наступления анаболической фазы восстановления и облегчения
эффектов гормонов. С этой целью широко применяются глюкокортикои-
ды — гидрокортизон внутриартериально и внутривенно повторно по 0,5—
1—2 мг/кг до 300—1000 мг в сутки в течение 2—3 дней с последующим
постепенным снижением дозы. При сопутствующих инфекционных
осложнениях проводится более длительное введение антибиотиков. Для
профилактики и лечения отека мозга предлагают вводить АКТГ, окси-
тоцин как антагонисты действия и освобождения АДГ, а также глюко-
кортикоид дексаметазон, угнетающий образование спинномозговой жид-
кости (Bernard-Weil e. а., 1967; Joshiyki, 1969). При надпочечниковой
недостаточности проводят полную гормональную заместительную тера-
пию стероидами, моделируя суточные изменения их продукции (С. М.
Лейтес, 1967; Egdahl, 1968). Необходимо отметить, что переливание
больших количеств консервированной крови и кровезаменителей тре-
бует введения гормонов для профилактики перенапряжения и истощения
коры надпочечников. Для лечения некоторых видов шока, характеризую-
щихся низким минутным объемом сердца и высоким общим сосудистым
периферическим сопротивлением, рекомендуют (Sambi e. а., 1964; Lil-
lichei е. а., 1964—1972; Egdahl, 1968; Schumer, 1969; Duchesne e. a., 1972)
большие дозы глюкокортикоидов (до Зги более в сутки). При этом
нужно помнить о заполнении увеличивающегося в связи с вазодилята-
цией внутрисосудистого объема. Эффект такого лечения выражается в
улучшении функции миокарда, снижении общего периферического сосу-
дистого сопротивления, щоддержании целостности гладкомышечных
элементов сосудов, улучшении кровоснабжения тканей, увеличении диу-
реза, нормализации обменных процессов и др.
При острой сердечной недостаточности (кардиогенный шок) эффек-
тивно применение глюкагона (А. А. Лякишев и др., 1972). Для предот-
вращения глубокой артериальной гипотонии рекомендуют синтетические
аналоги вазопрессина (Alsweiler e. а., 1970), применяют также не-
большие количества норадреналина и глюкокортикоидов, дофамин.
Противопоказаниями для введения вазопрессоров являются гиповоле-
мия, повреждение сердца, циркуляторный блок (например, эмболия ле-
гочной артерии).
136
Для нормализации обменных процессов — торможения катаболизма
и активации анаболизма, предупреждения клеточной гипокалиемии,
фибрилляции сердца, проявления ряда эффектов глюкокортикоидов и
т. д. используют инсулин с глюкозой и калием (Hinton e. а., 1971), а
также анаболические стероиды и СТГ. По-видимому, перспективно при-
менение в постреанимационном периоде специфических стероидов с ка-
татоксическим эффектом (Sely, 1970, 1973) для активации процессов
дезинтоксикации в оживленном организме. Введение указанных гормо-
нов необходимо сочетать с адекватным парентеральным питанием и ме-
роприятиями по нормализации функции печени.
Для лечения вторичного гиперальдостеронизма наряду с коррекцией
водно-электролитного баланса и устранением ишемии почек используют
спиронолактон (Г. М. Соловьев и др., 1965; В. В. Меньшиков, 1970;
Ciocatto, 1969), который обладает также кататоксическим эффектом
(Larcan e. а., 1971).
Гормонотерапию нельзя рассматривать изолированно от мероприятий
по нормализации кислородного режима организма, кислотно-щелочного
равновесия, функций внутренних органов и систем и всех видов обмена.
Часто неэндокринные расстройства внутренней среды организма вызы-
вают неадекватные (защитно-лриспособительные) нейро-эвдакринные
реакции, патологический эффект которых перекрывает их адаптивное
значение. Лечение общих нарушений гомеостаза способствует форми-
рованию благоприятных гормональных реакций, а на этом фоне специ-
фическая гормонотерапия еще больше повышает эффективность общих
лечебных мероприятий.
IX
МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
ГОЛОВНОГО МОЗГА И ВНУТРЕННИХ ОРГАНОВ
ПРИ ТЕРМИНАЛЬНЫХ СОСТОЯНИЯХ
Общепризнано, что центральная нервная система очень чувствитель-
на к недостатку кислорода. Однако в литературе до сих пор приводятся
различные сроки полного прекращения кровообращения, после которых
в мозге обнаруживаются необратимые изменения. Эти сроки колеблют-
ся в очень широких пределах — от 2—3 мин (В. П. Курковский, 1941;
Я. Л. Рапопорт и др., 1967; Gomez, Pike, 1909; Grenell, 1946, и др.)
до 25 мин (В. Д. Янковский, 1954, 1968; Н. П. Адаменко, 1963; Н. Ф.
Геря, 1967, 1970). Большинство исследований, проведенных на секцион-
ном материале, говорят о том, что необратимые нарушения развиваются
после 3—5-минутного срока прекращения кровообращения в мозге
(Desmarest, Lhermitt, 1939; Heymacer, Paulson, 1949; Hanks, Pa,pper,
1951; Paprocki, Szszygiel, 1966, и др.).
Разница в интенсивности изменений и их характере, описываемая в
разных работах, зависит, по-видимому, от ряда причин: различия мето-
дик, с помощью которых вызывалось кислородное голодание, глубины и
длительности гипоксии, вида животного, разных методов лечения и др.
Большое внимание, которое уделяется повреждениям головного моз-
га при терминальных состояниях, продиктовано тем, что именно цент-
ральная нервная система часто лимитирует сроки клинической смерти,
после которых возможно полное и стойкое восстановление жизненных
функций. Однако необходимо тщательное обследование и внутренних
органов, так как в ряде случаев изменения в них имеют решающее зна-
чение для прогноза оживления.
Исследования, проведенные в нашей лаборатории, показали, что
выраженность патогистологических изменений зависит от длительности
и тяжести гипоксии (длительности периода умирания и срока клиничес-
кой смерти), функционального состояния центральной нервной системы,
типа высшей нервной деятельности, методов лечения.
Изменения в мозге после перенесенных терминальных состояний бы-
ли обнаружены в нейронах, глие, сосудах. По характеру они были
сходны с теми, которые находили после пребывания в атмосфере с пони-
женным содержанием кислорода, при пережатии основных сосудов, пи-
тающих мозг, при асфиксии, травматическом шоке, злокачественной
форме гипертонической болезни (Ю. М. Лазовский, 1941; Н. В. Бала-
138
Рис. 13 Тотальный тпгролпз и гиперхроматоз ядер в клетках
Пурклиье мозжечка Окраска по Нпсслю Ув.Х400
пина, 1946, 1949; Б. Н. Могильницкий, 1949; П. Е. Снеса;рев, 1950;
Г. Д. Динабург и А. 3. Колчинская, 1951; М. М. Александровская, 1955;
Р. А. Переверзева, М. И. Долгина, 1970, и др.). Основной этиологичес-
кий фактор — кислородная недостаточность — приводит к однотипным
изменениям в мозге.
Высказывания о том, что патоморфологические проявления в цент-
ральной нервной системе по своему характеру сходны при различных
заболеваниях, приведены в ряде известных работ (Л. И. Смирнов, 1947;
Ю. М. Лазовский, 1941; Н. А. Краевский, 1944; И. В. Давыдовский,
А. И. Струков, С. К. Лапин, 1956; М. С. Толгская, 1956, и др.).
Исследования, проведенные в разные сроки после перенесенных тер-
минальных состояний, позволили установить, что гистопатологические
изменения в своем развитии имеют определенную динамику, не завися-
щую от причин, вызвавших терминальное состояние.
При обследовании животных, перенесших 5-минутную клиническую
смерть от острой кровопотери, сразу же после оживления и в ближай-
шие 20—30 мин изменения были небольшими, касались отдельных нерв-
ных клеток и сосудов. Через 3 часа они были выражены уже более
четко: наряду с набуханием значительного числа нейронов отмечалось
распыление тигроидной субстанции, более темное окрашивание ядер,
в части клеток укрупнялись аргирофильные зерна. Через сутки после
оживления изменения были еще более выраженными: имелся тоталь-
ный тигролиз и гиперхроматоз ядер в преобладающем большинстве ней-
ронов (рис. 13), по краю клеток выявлялись зерна «инкрустации»,
часть нервных клеток находилась в состоянии кариоцитолиза вплоть до
139
Рис. 14. Дистония сосудов и перпваскулярпый отек Окраска
по Нисслю. У в Х80.
образования клеток-теней. В части нейронов выявлялась сотовидность
протоплазмы, другие темно окрашивались, становились узкими, вытя-
нутыми; во многих нейронах выявлялась центральная тинкториальная
ацидофилия; количество аргирофильных зерен увеличивалось, отмеча-
лось их склеивание; многие аргирофильные волокна были утолщены;
имелась дистония сосудов, нарушалась проницаемость, выявлялись
периваскулярные отеки и периваскулярные кровоизлияния (рис. 14).
Через 36—48 ч картина снова менялась: с одной стороны, можно
было отметить некоторые признаки восстановления (снова начинал
окрашиваться распыленный на мелкие глыбки тигроид, светлее стано-
вились ядра нейронов), с другой — продолжалось нарастание патологи-
ческого процесса (в протоплазме большинства нервных клеток появля-
лись вакуоли, другие очень темно закрашивались, уменьшались в раз-
мере). В последующие несколько дней вакуолизация протоплазмы
достигала резких степеней. В части клеток вакуоли были настолько
большими, что деформировали тела и отростки, а в других^ были такими
многочисленными, что протоплазма выглядела сотовидной (рис. 15).
Нередко вакуолизация сочеталась с кариоцитолизом. При обследовании
мозга животных в сроки еще более отдаленные (от 4—7 дней до \1/2 лет
после оживления) острых гипоксических изменений уже не отмечалось.
Центральная тинкториальная ацидофилия не выявлялась с 5—7-го дня
после оживления, аргирофильная зернистость приобретала обычный вид
к 12—17-му дню, изменения аргирофильных волокон сохранялись до
30-го дня.
Чем больше проходило времени после оживления, тем большее число
нервных клеток приобретало обычный вид, уменьшалось количество
140
Рис. 15. Резкая вакуолизация протоплазмы нервных клеток в коре
больших полушарий мозга. Окраска по Нисслю. Ув.Х400.
вакуолей и сами они становились мельче. Однако, несмотря на обратное
развитие патологического процесса, некоторое количество нервных кле-
ток погибало при явлениях кариоцитолиза и мелкие участки с погиб-
шими клетками были видны у всех выживших животных, в том числе
и у перенесших лишь 2 мин клинической смерти (рис. 16). Чем дольше
клиническая смерть, тем больше погибает нейронов.
Мозг обладает поистине огромными компенсаторными возможностя-
ми. Состояние и поведение животных через месяц после опыта обычно
не отличаются от состояния и поведения этих животных перед перене-
сенной клинической смертью. Однако при гистологическом обследовании
у них обнаруживаются значительные изменения в коре больших полу-
шарий, мозжечке и аммоновом роге.
Для объективной оценки повреждений мозга проведено сопоставле-
ние данных электроэнцефалографии и неврологического статуса с мор-
фологическими изменениями. Была использована высокая чувствитель-
ность к гипоксии клеток Пуркинье мозжечка и их расположение в один
ряд, что позволяет их легко подсчитать (А. М. Гурвич, Н. П. Романова,
Е. А. Мутускина, 1971). У животных, перенесших прекращение крово-
обращения, вызванное 4—15-минутной фибрилляцией желудочков серд-^
ца (после электротравмы), в течение 2—4 нед регулярно записывали
ЭЭГ (после того как была сделана последняя запись собак забивали и
проводили гистологическое обследование мозга). Оказалось, что нор-
мальная средняя амплитуда высокочастотной составляющей ЭЭГ не
может быть гарантией отсутствия изменений в коре больших полушарий,
141
Рис. 16. Участки, лишенные нервных клеток, в коре больших полу-
шарий мозга Окраска по Нисслю. Ув.Х280.
мозжечке и аммоновом роге. За ее нормальными показателями могут
скрываться как необратимые изменения нейронов, так и небольшие
мелкоочаговые выпадения их в коре и уменьшение количества клеток
Пуркинье до 25%, реже до 50%. Снижение амплитуды высокочастотной
составляющей ЭЭГ на 26—50% отмечали у внешне вполне здоровых
животных, а при гистологическом исследовании у всех этих собак имели
место органические повреждения мозга с уменьшением количества кле-
ток Пуркинье до 50%. Лишь у животных со снижением амплитуды высо-
кочастотной составляющей ЭЭГ более 50% наблюдались нарушения
неврологического статуса и грубые органические изменения во всех отде-
лах мозга. Установление такой корреляции дает возможность количест-
венно оценивать глубину изменений, возникающих в мозге после ишемии.
Изменение амплитуды высокочастотной составляющей ЭЭГ дает воз-
можность проводить такую оценку (пока у животных) прижизненно.
У больных, погибших после перенесенных терминальных состоя-
ний, морфологические изменения аналогичны тем, которые обнаруже-
ны на экспериментальном материале, но носят более выраженный ха-
рактер.
После длительных сроков клинической смерти, при коротком периоде
умирания может не наступить полного восстановления функций цент-
ральной нервной системы. Для иллюстрации можно привести выписку
из истории болезни и данные гистологического исследования больной,
перенесшей клиническую смерть длительностью в 7—8 мин, наступив-
шую во время подготовки к операции.
142
Рис. 77. Участки, лишенные нервных клеток, в коре больших
полушарий мозга. Больная А. Окраска по Нисслю. Ув.ХЗО.
Больная А., 16 лет. Диагноз: коликвационно-кавернозный туберкулез левой почки.
Для проведения нефрэктомии внутривенно введено 400 мл гексенала и 100 мл ли-
стенона. Через 5 мин больная повернута на правый бок. Мгновенно развился цианоз губ
и кожи лица, зрачки расширились. Перестал определяться пульс на периферических ар-
териях. Больная повернута на спину, придано положение Тренделенбурга. Внутривенное
введение глюкозы со строфантином улучшения не дало. Роговичные и зрачковые реф-
лексы отсутствуют. Через 10 мин после появления цианоза наступила остановка сердца.
Произведена торакотомия. Сердце не сокращается. Проведен прямой массаж сердца.
После 6—8 сжатий появились сердечные сокращения, после 15 сжатий массаж прекра-
щен так как сердечная деятельность стала эффективной. Самостоятельное дыхание по-
явилось через 20 мин после восстановления сердечной деятельности, вскоре восстанови-
лись роговичные рефлексы, зрачки сузились, появилась слабая реакция на свет.
В последующие дни многократно наступали спонтанные тонические судороги, а че-
рез 2 нед они появлялись в ответ на внешние раздражения — обследование, уколы,
кормление через зонд. Через месяц больная иногда следила глазами за персоналом,
реагировала гримасой неудовольствия при проведении лечебных процедур. В последую-
щем развились стойкие сгибательные контрактуры конечностей, резко снизился вес. Не-
смотря на очень тщательный уход, появились пролежни с некрозом подлежащих тканей.
Больная погибла через 3 месяца после перенесенной клинической смерти от эмболии
легочной артерии в связи с тромбозом вен таза на почве некроза тканей ягодицы.
На вскрытии выявлено некоторое истончение коры головного мозга,
расширение мозговых желудочков, коликвационно-кавернозный тубер-
кулез левой почки с почти полным разрушением почечной ткани (В. И.
Брауде).
При гистологическом исследовании обнаружены тяжелые изменения
в головном мозге. Количество нервных клеток диффузно уменьшено,
в некоторых участках в третьем слое сохранились лишь единичные ней-
роны (рис. 17). Протоплазма большей части сохранившихся нейронов
143
Рис. 18. Выпадения нервных клеток в аммоновом роге. Больная
А. Окраска по Нисслю. Ув.ХЗО.
сотовидная, во многих распылен тигроид, в нейронах лобной и затылоч-
ной долей видна вакуолизация тигроида. Большое количество нервных
клеток находится в состоянии кариоцитолиза, много клеток-теней.
У большинства погибающих клеток ядра темные, ядерные мембраны
стерты, ядрышки с шипиками, неправильной формы. Заметно уменьшено
количество нервных клеток в зрительном бугре. В зоммеровском секторе
аммонова рога сохранилось лишь несколько сморщенных клеток, далее
по извилине количество их резко уменьшено, многие в состоянии карио-
цитолиза (рис. 18). Клетки Пуркинье мозжечка полностью погибли
(рис. 19). В зубчатом ядре мозжечка количество клеток резко уменьше-
но, большинство сохранившихся имеет округлую форму, короткие от-
ростки и распыленный тигроид. В стволе мозга нервные клетки значи-
тельно более сохранны. Астроцитов много, есть сморщенные, темно за-
крашенные, есть светлые, с набухшими телами, в большом количестве
встречаются клетки в состоянии зернистого распада. Видно скопление
астроцитов вокруг сосудов. Эти клетки имеют хорошо' выраженные «со-
судистые» отростки. Микроглия главным образом палочковидная, с тон-
кими фрагментированными отростками, в меньшем количестве видны
утолщенные, грубые клетки с небольшим количеством коротких отрост-
ков. Олигодендроглия либо отечная (часто клетки собраны в столбики—
«дренажные клетки»), либо отростчатая, нередко с «баллончиками» на
концах отростков. Одни сосуды имеют гомогенизированные, утолщенные
стенки и набухший эндотелий, другие, наоборот, растянуты, стенки их
истончены. Около некоторых сосудов видно скопление зеленого пигмеи-
144
Рис. 19. Гибель клеток Пуркинье в мозжечке. Больная А. Окраска
по Нисслю. Ув.ХЗО.
та. Соединительнотканные волокна в оболочках мозга и сосудах утол-
щены, одни из них набухшие, гомогенизированные, светло окрашены,
другие утолщены, грубые, темно импрегнированы. Аргирофильные зерна
в одних клетках распределены равномерно, в других сосредоточены по
краю и имеют разную величину.
Такая массивная диффузная гибель нервных клеток в различных от-
делах мозга описана рядом авторов на секционном материале у больных,
погибших через отдаленные сроки после перенесенных терминальных
состояний, после сроков клинической смерти, превышающих 5 мин (Т. С.
Матвеева, 1955; Г. А. Акимов, 1960, 1971; Doring, 1936; Bingel, Hampel,
1934; Howkins, McLaughlin, Daniel, 1946; Sayk, 1961, и др.).
Патогистологические изменения у животных, оживленных после кли-
нической смерти длительностью в 5—7 мин, при быстром умирании от-
мечаются и во внутренних органах, но они, как правило, носят обрати-
мый характер. Раньше всего выявляются нарушения проницаемости со-
судов (периваскулярные отеки и кровоизлияния) и отек соединительной
ткани, а несколько позже — явления жировой и белковой дегенерации.
В почках в первые дни после опыта можно отметить мутное набухание
эпителия извитых канальцев, но через несколько дней орган приобретает
обычный вид. Наиболее постоянны и удерживаются более длительное
время изменения в печени: многие печеночные клетки плохо окраши-
ваются, в протоплазме выявляются множественные вакуоли, отдельные
клетки или небольшие группы их погибают. В остальных внутренних
Заказ № 1266
145
органах, кроме полнокровия и отека, наблюдающихся в первые дни пос-
ле опыта, изменений обычно отметить не удается.
В литературе имеются указания на трудность, а иногда и невозмож-
ность восстановления жизненных функций организма в случаях, когда
остановке сердца предшествует длительный период умирания (Б. А. Ко-
ролев, 1944; В. А. Неговский, 1954, 1960; А. В. Гуляев, 1954; и др.).
Е. С. Золотокрылина A957, 1959) в опытах на собаках показала, что*
если после медленной кровопотери прекращения сердечной деятельности,
не наступает, но артериальное давление удерживается ниже критиче-
ского уровня в течение 5 ч, животные погибают в первые часы или дни
несмотря на то, что у них удается восстановить артериальное давление..
Такие результаты были получены тогда, когда нагнетание крови в арте-
рию начинали проводить в преагональном состоянии. При введении кро-
ви в вену животные оказывались нежизнеспособными и при меньших
сроках гипотензии.
При гистологическом исследовании было установлено, что тяжесть
изменений зависит как от длительности гипотензии, так и от методов
лечения. Уже при 2-часовом сроке гипотензии выраженность изменений
зависела от того, в какой стадии терминального состояния — преагональ-
ном или агональном — были начаты мероприятия по оживлению. Хотя
разница во времени составляла всего 1—2 мин, изменения были более
выраженными при выведении из агонального состояния. Изменений бы-
ло больше при внутривенном введении крови по сравнению с внутриар-
териальным ее нагнетанием (Н. П. Романова, 1962).
Сравнивая полученные изменения с теми, которые наблюдались у жи-
вотных, перенесших 5-минутную клиническую смерть от острой кровопо-
тери при коротком периоде умирания, можно было отметить, что после
2-часовой гипотензии изменений в мозге было меньше, после 4-часовой.^
они были примерно равны, а после 5-часовой более выражены, чем при
5-минутной клинической смерти. У 2 животных, перенесших 4-часовую <
гипотензию и проживших 30 дней после опыта, в сердце имелись участки
некроза в стадии организации рубца с отложением солей извести; у со-
баки, погибшей на 6-е сутки после 5-часовой гипотензии, в сердце были
обнаружены множественные очаги некроза мышечных волокон с лейко-
цитарной инфильтрацией вокруг. В печени в первые дни после оживле-
ния наблюдались полнокровие, множественные кровоизлияния, отек, ва-
куолизация протоплазмы печеночных клеток. Отек и вакуолизация были •
четко видны и через месяц после опыта. Наряду с этим отмечалась жи-
ровая дистрофия, степень которой нарастала с увеличением длитель-
ности гипотензии. У выживших собак уже после 2-часовой гипотензии
была видна гибель отдельных печеночных клеток или групп их, а при
увеличении периода гипотензии до 4—5 ч имелись больших или меньших.
размеров участки некроза с разрастанием соединительной ткани и обра-
зованием ложных долек. В почках был обнаружен отек, зернистое пере-
рождение эпителия извитых канальцев, у части животных некротиче-
ский нефроз.
Данные, полученные на экспериментальном материале, подтвержде-
ны и при обследовании умерших больных, перенесших длительные сроки!
146
Рис. 20. Фрагментация мышечных волокон в левом желудочке
сердца. Больная С. Окраска гематоксилин-эозином Ув.х56.
гипотензии в результате кровопотери. Это иллюстрирует следующее
наблюдение.
У больной С, 40 лет, с длительным периодом предшествующих умеренных крово-
течении во время надвлагалищной ампутации матки по поводу фибромиомы возникло
кровотечение (кровопотеря около 1500 мл). В течение 24 ч артериальное давление было
низким или не определялось, несмотря на внутривенное переливание крови, полиглюки-
на и других кровезаменителей. Сознание было все время сохранено. Дробное нагнетание
в артерию 400 мл крови, проведенное в преагональном состоянии, привело к стойкой
нормализации артериального давления. Однако на 4-е сутки развились отеки, олигурия,
в моче определялся белок, гиалиновые, зернистые и восковидные цилиндры При нара-
стании этих явлений больная погибла на 9-е сутки. '
При вскрытии обнаружена выраженная дистрофия паренхиматозных органов по-
верхностные кровоизлияния в сердце, почечных лоханках, слизистой оболочке желудка
Данные микроскопического исследования. Нервные клетки головного мозга в состоя-
нии острого набухания, протоплазма вакуолизирована, многие клетки перегружены липо-
фусцином. Во всех отделах мозга видны клетки в разных стадиях кариоцитолиза вплоть
до образования клеток-теней. Аргирофильные зерна укрупнены, склеены, распределены
неравномерно. Аргирофильные волокна утолщены, многие темно импрегнированы Мик-
роглия с фрагментированными отростками. Астроциты набухшие, есть типа «амебоид-
ных» (лишенные отросткоз) и небольшое количество клеток с зернистым распадом
Стенки многих сосудов утолщены. Периваскулярные отеки. В сердце распространенная
фрагментация мышечных волокон с глыбчатым распадом отдельных волокон и их групп
(рис. 20), отек стромы, полнокровие, множественные мелкие кровоизлияния В печени
множественные мелкие участки некроза, жировая дистрофия (рис. 21). В почках некро-'
тический нефроз.
Таким образом, после длительной гипотензии как у эксперименталь-
ных животных, так и у погибших больных изменения во внутренних ор-
ганах были более тяжелыми и распространенными, чем после коротких
сроков клинической смерти и коротком периоде умирания. В то же время
10*
147
Рис. 21. Участок некроза печени. Крупнокапельное ожирение.
Больная С. Окраска гематоксилин-эозином. Ув.хбб.
изменения в головном мозге были хотя и распространенные, но в боль-
шей части обратимые.
Это не противоречит положению о том, что головной мозг очень чув-
ствителен к недостатку кислорода, но выявляется это при быстром раз-
витии гипоксии. При медленной кровопотере и длительной гипотензии
мозг некоторое время бывает защищен от пагубного воздействия низкого
артериального давления тем, что включается ряд компенсаторных меха-
низмов. Это расширение мозговых сосудов, увеличение потребления кис-
лорода из притекающей крови, спазм сосудов кожи, мышц и внутренних
органов. Однако в случаях, когда спазм сосудов внутренних органов
удерживается слишком долго, в них могут развиться тяжелые пораже-
ния, связанные с ишемией. При чрезмерно длительной гипотензии насту-
пает период, когда артериальное давление прогрессивно снижается за
счет срыва большинства приспособительных механизмов — вторичной
слабости сердца, усиления гемоконцентрации, депонирования крови,
уменьшения скорости кровотока (Г. Ш. Васадзе, 1960). В этих условиях
нарушается и кровоснабжение мозга. Этот период декомпенсации может
быть очень коротким и длиться всего 1—2 мин, но исход оживления
в значительной мере зависит от того, когда начинают проводить меро-
приятия по оживлению: в преагональном или агональном периоде.
При прочих равных условиях наличие двигательного возбуждения во
время умирания или после выведения из терминального состояния ухуд-
шает прогноз оживления. На выраженность патологических изменений
оказывают влияние и методы лечения. Так, например внутривенное вве-
дение раствора гидрокарбоната натрия в восстановительном периоде с
148
целью ликвидации метаболического ацидоза у оживленных животных
снижало патологические изменения в мозге. Такое же положительное
влияние оказывала тотальная кровезамена и плазмаферез.
Артериальное давление 60—70 мм рт. ст. принято считать достаточ-
ным для сохранения функций центральной нервной системы. Однако при
создании такого давления во время массажа сердца лишь до 30 мин его
проведения не наступает морфологических изменений. После 30 мин вы-
являются четкие морфологические изменения в головном мозге и внут-
ренних органах. Если на фоне такого «критического» уровня наступает
хотя бы кратковременное его снижение или очень короткое (на несколь-
ко секунд) прекращение сердечной деятельности, это приводит к тяже-
лым необратимым нарушениям, а жизненные функции либо не удается
восстановить, либо восстановление не бывает полным.
Значительно удлинить сроки клинической смерти удается с помощью
гипотермии. В наших экспериментах получено полное восстановление
функций центральной нервной системы у собак, перенесших в условиях
глубокой гипотермии (ректальная температура 10—14°) клиническую
смерть, вызванную кровопотерей длительностью до 2 ч (В. А. Неговский,
В. И. Соболева, 1955, 1960). В условиях гипотермии морфологические
изменения после 30-минутной клинической смерти примерно равны тем,
которые выявляются после 5 мин клинической смерти, перенесенной при
нормальной температуре тела (Н. П. Романова, 1966).
Патогистологические исследования показывают, что нарушения в го-
ловном мозге после перенесенных терминальных состояний не имеют спе-
цифических черт, присущих именно терминальным состояниям. Их выра-
женность и тяжесть зависят от глубины и длительности кислородного
голодания, длительности периода умирания, срока клинической смерти,
эффективности методов лечения.
Значительная часть нарушений, отмечаемых в первое время, носит
обратимый характер, однако часть нервных клеток погибает даже после
коротких сроков клинической смерти. Наиболее ранимыми образования-
ми являются кора больших полушарий, мозжечок и аммонов рог.
Причиной смерти после выведения из терминальных состояний с пред-
шествующей длительной гипотензией могут быть тяжелые изменения
в сердце. В таких случаях смерть от гемодинамических расстройств на-
ступает в ближайшие часы. При недостаточности функций печени и по-
чек, связанной с тяжелыми, распространенными и необратимыми изме-
нениями в них, смерть наступает через несколько дней после выведения
из терминального состояния.
На выраженность морфологических нарушений оказывают большое
влияние методы лечения и в первую очередь быстрое выравнивание арте-
риального давления и снятие интоксикации за счет нейтрализации или
удаления из организма недоокисленных продуктов обмена.
X
ТЕРМИНАЛЬНЫЕ СОСТОЯНИЯ,
ВЫЗВАННЫЕ ПАТОЛОГИЧЕСКИМИ
ИЗМЕНЕНИЯМИ СЕРДЕЧНО-СОСУДИСТОЙ
СИСТЕМЫ
Успешное развитие реаниматологии, знакомство с методами ее прак-
тического применения врачей различных специальностей позволили зна-
чительно расширить показания к реанимации и проводить ее не только
в операционных и специальных реанимационных залах, но и в палатах
терапевтических стационаров. Естественно, специфика оказания помощи
в указанных условиях сказывается на результатах реанимации и делает
их в ряде случаев менее удачными. Кроме того, если хирурги или акуше-
ры часто имеют дело с так называемой необоснованной смертью (напри-
мер, с гибелью молодого и вполне жизнеспособного организма от крово-
потери, рефлекторной остановки сердца и т. п.), то в терапевтических
стационарах внезапная смерть больного развивается, как правило, при
наличии патологических изменений жизненно важных органов — сердца,
легких, почек. Однако данные патологические изменения в ряде случаев
не являются несовместимыми с жизнью и хотя и осложняют борьбу с тер-
минальными состояниями, но не исключают возможности положитель-
ного исхода.
Лечение кардиогенного шока
Различные нарушения гемодинамики весьма часто сопутствуют остро-
му инфаркту миокарда. Крайне тяжелую степень подобного нарушения
обычно называют кардиогенным шоко?с Этот термин в последние годы
стал весьма популярным как в зарубежной, так и в отечественной лите-
ратуре, хотя понятие кардиогенного шока менее определенно, чем поня-
тие травматического шока. В настоящее время не существует и обще-
признанных критериев кардиогенного шока при инфаркте миокарда.
П. Е. Лукомский A971) считает обязательным следующие критерии: рез-
кое снижение артериального давления, особенно пульсового; изменение
характера дыхания, здешнего вида и поведения больного; наличие оли-
гурии (вплоть до анурни) и ацидоза. Именно совокупность перечислен-
ных критериев позволяет поставить диагноз кардиогенного шока, так как
один только уровень артериального давления, будучи показателем отно-
150
1сительным, не дает права говорить о наличии или отсутствии кардиоген-
ного шока или о его тяжести.
Принято считать, что пусковым механизмом в генезе кардиогенного
шока является снижение сократительной способности пораженного мио-
карда и уменьшение сердечного выброса (ударного и минутного объема).
-На ранних этапах развития болезни организм компенсирует эти измене-
ния и поддерживает кровообращение в жизненно важных органах на
.достаточном уровне за счет тахикардии и спазма периферических сосу-
дов. При первичной недостаточности подобной компенсаторной реакции
наблюдается умеренное снижение артериального давления, которое, как
правило, хорошо поддается лечению прессорными аминами (сердечно-
сосудистый коллапс по В. Н. Виноградову, транзиторная гипотония по
П. Е. Лукомскому). Умеренное снижение артериального давления может
быть обусловлено и рефлекторными нарушениями кровообращения в ре-
зультате выраженного болевого синдрома (рефлекторный шок по
Е. И. Чазову).
Эффективное устранение боли способствует и шантанному исчезнове-
нию упомянутых гемодинамических расстройств.
При нарастающей слабости миокарда компенсаторный спазм перифе-
рических сосудов значительно усиливается и становится более генерали-
зованным. Вазоконстрикции способствует и повышенная активность сим-
пат-адреналовой системы у больных инфарктом миокарда. Выраженные
гемодинамические нарушения в подобных случаях обусловлены не недо-
статочностью периферического сопротивления, а недостаточностью сокра-
тительной способности миокарда, что объясняет часто неэффективное
лечение прессорными аминами. Уменьшение сердечного выброса, выра-
женные нарушения микроциркуляции в сочетании с реологическими и
биохимическими изменениями приводят к гипоксии органов и тканей,
изменению характера обмена веществ в них, накоплению недоокислен-
ных продуктов обмена и ацидозу («истинный» кардиогенный шок по
Е. И. Чазову). Гипоксия и ацидоз в свою очередь способствуют про-
грессированию сердечной слабости. Порочный круг замыкается. Чем
дольше сохраняется спазм периферических сосудов, чем выше общее
периферическое сопротивление, чем выраженнее расстройства микро-
циркуляции, тем больше патологических изменений возникает в организ-
ме, что способствует неэффективности обычно проводимых энергичных
терапевтических мероприятий (ареактивный шок по Е. И. Чазову, П. Е.
Лукомскому, И. Е. Ганелиной, А. С. Сметневу и др.)-
Патогенетическая терапия, направленная на улучшение сократитель-
ной способности миокарда, должна проводиться на фоне симптомати-
ческого лечения, предотвращающего дальнейшее углубление гипоксии
тканей, ликвидирующего ее последствия и нарушенные обменные про-
цессы.
Медикаментозное лечение проводится на фоне немедленно начатой
кислородотерапии (большим потоком увлажненного кислорода от бал-
лона или централизованной системы).
При выраженности «шоковых» симптомов целесообразно введение ле-
карственных средств в сосудистое русло через полиэтиленовый катетер,
151
устанавливаемый либо через локтевую, либо через подключичную вену
до уровня верхней полой вены. Данная методика гарантирует надежные
«ворота» в сосудистое русло даже при возбужденном состоянии больного,
возможность в любое время получения проб крови для соответствующих
исследований, возможность контроля центрального венозного давления
как одного из существенных показателей степени сердечной недостаточ-
ности и критерия качества и скорости введения жидких лекарственных
веществ в вену.
Внутривенные вливания мы начинаем с введения лекарственного кок-
тейля, состоящего из 200—300 мл 5—10% раствора глюкозы с инсули-
ном; 1,5—3 г хлорида калия (раствор хлорида калия не должен быть бо-
лее 1% концентрации); 0,5 мл 0,05% раствора строфантина; витаминов
Bi и В6 по 2—3 мл раствора в ампулах; 30—60 мг преднизолона. При
значительно сниженном артериальном давлении и не слишком высоком
центральном венознОхМ давлении (до 300 мм вод. ст.) в основу указанного
коктейля может быть введен низкомолекулярный полиглюкин, а не глю-
коза. Здесь важно подчеркнуть, что реополиглюкин улучшает перифери-
ческое кровообращение и реологические свойства крови, что чрезвычайно
важно как для улучшения кровообращения в целом, так и для кровоснаб-
жения миокарда.
Так как в повседневной клинической практике обычно трудно (или
даже невозможно) определить степень повышения общего перифериче-
ского сопротивления (реограмма дает относительные показатели и за-
пись реограммы у возбужденного больного затруднительна), препараты
норадреналина или ангиотенинамида целесообразнее вводить не в лекар-
ственный коктейль, а дробно, малыми дозами (по 0,2—0,3—0,5 мл) непо-
средственно в вену. При наличии уже имеющегося у больного значитель-
но повышенного общего периферического сопротивления указанное лече-
ние норадреналшюм ил(и ангиотензином, как правило, не приводит
к повышению артериального давления и от дальнейшего его проведения
следует отказаться.
В этих случаях целесообразно введение ганглиоблокирующих средств
(арфонад, пентамин, бензогексоний), хотя трудность выбора необходи-
мой дозировки, недостаточная управляемость их действием, а также воз-
никающий у врача психологический барьер (введение ганглиоблокаторов
на фоне низкого артериального давления), вероятнее всего, и объясняют
то положение, что применение указанных средств до настоящего време-
ни не стало общепринятым в повседневной клинической практике у боль-
ных с кардиогенным шоком.
Однако в настоящее время мы располагаем группой очень ценных ле-
карственных веществ, позволяющих в какой-то степени найти выход из
указанного затруднительного положения. Речь идет о препаратах для
нейролептанальгезии — фентаниле, дроперидоле и их смеси — таламона-
ле. Способность дроперидола снимать спазм периферических сосудов
и улучшать периферическое кровообращение, способность фентанила на-
дежно устранять боль (очень важный фактор в развитии и поддержании;
кардиогенного шока), хороший седативный эффект этих (препаратов де-
лают их применение при данном заболевании весьма перспективным.
152
Общепринятыми в настоящее время препаратами при противошоко-
вой терапии у больных с инфарктом миокарда являются фибринолизин
и гепарин. Их введение важно для лечения расстройств микроциркуляции
и связанных с ними метаболических нарушений C0 000 единиц фибрино-
лизина +10 000 единиц гепарина внутривенно и по 10 000 единиц гепари-
н-а 4—6 раз в сутки внутримышечно или внутривенно на протяжении не
менее 2—3 суток с начала лечения).
Хорошим, но менее доступным в настоящее время фибринолитиком
является стрептаза.
Устранение или уменьшение явлений метаболического ацидоза дости-
гается внутривенным введением 5% раствора гидрокарбоната натрия
(соды) или трисамина (ТНАМ) в дозах, устанавливаемых на основании
данных исследования кислотнощелочного равновесия.
Применение аппаратного искусственного кровообращения для лече-
ния кардиогенного шока в настоящее время еще не внедрено в широкую
клиническую практику и поэтому в данной главе не рассматривается.
Развитие кардиогенного шока может быть обусловлено и появлением
резких нарушений ритма и темпа сердечной деятельности (аритмический
кардиогенный шок). Сущность реанимационных мероприятий при некото-
рых видах аритмий излагается в одном из разделов настоящей главы.
Лечение остановки сердца
на фоне коронарной патологии
Не останавливаясь на хорошо известных статистических данных о ле-
тальности больных с коронарной патологией сердца, отметим лишь очень
интересный, с точки зрения реаниматологов, факт, установленный еще
в 1948 г. Yater с соавторами: при патологоанатомическом исследовании
погибших от коранариой недостаточности, у 90% !не удалось обнаружить
значительных деструктивных изменений в миокарде. Следовательно,
у большинства этих людей смерть скорее всего не была обусловлена пол-
ной несостоятельностью «изношенного» сердца.
Одной из причин остановки средца у больных с коронарной патоло-
гией является прогрессирующая сердечная недостаточность. Выше ука-
зывалось, что эта причина смерти встречается не часто. В других случаях
внезапное прекращение сердечной деятельности наступает в результате
нарушения специфической проводимости средечной ткани. При этом про-
исходит то, что так наглядно показал Beck, проводя аналогию между ор-
ганизмом и часами, в которых остановился маятник. Механизм их цел,
но они не ходят и нуждаются лишь в маленьком толчке, который пустил
бы их в ход. Им нужно помочь, и они будут ходить, как прежде.
При действии второй причины смерть, как правило, наступает вне-
запно, и механизмом ее является либо фибрилляция желудочков (чаще
всего), либо асистолия. И. Е. Ганелина A968) считает, что внезапная
асистолия наблюдается чрезвычайно редко, в основном у больных с раз-
рывом сердца. Однако в своей практике мы наблюдали внезапную аси-
столию у нескольких больных, которых в последующем удалось успешно
оживить.
1 ' 153-
Помимо указанного выше, благоприятным фактором для успешного
выведения больных с коронарной патологией из состояния клинической
смерти является и то, что момент внезапной смерти у данных больных
.можно предвидеть. Во-первых, большинство внезапно умирающих боль-
ных погибают в первые 2 суток заболевания и в основном только на про-
тяжении этих 2 дней нуждаются в особом наблюдении персоналом, хоро-
шо подготовленным в реанимационном плане. Наиболее удобным явля-
ется мониторное наблюдение. Во-вторых, очень часто у больных с «вне-
запно» наступающей фибрилляцией желудочков имеются предвестники
в виде экстр асистолии, желудочковой тахикардии и т. п., которые также
легче всего своевременно заметить при мониторном наблюдении за
больным.
Мероприятия, направленные на восстановление жизненных функций
у больных с коронарной недостаточностью, хотя и имеют некоторые
особенности, принципиально не отличаются от мероприятий, проводимых
при выведении !из состояния клинической смерти, наступившей в резуль-
тате каких-либо других причин. Поэтому в данной главе мы не даем их
подробного описания, а указываем лишь на некоторые особенности.
Травматическое повреждение (разрыв) пораженного сердца при про-
ведении массажа не исключено, но встречается весьма редко, особенно
при проведении непрямого массажа сердца, даже длительного. Это было
доказано как проведенными в лаборатории экспериментальной физиоло-
гии по оживлению организма АМН СССР специальными эксперимента-
ми на животных с обширным инфарктом миокарда (В. Н. Семенов,
1963), так и повседневной клинической практикой. Боязнь травматиче-
ского повреждения миокарда не может служить доводом к отказу от про-
ведения массажа сердца, так как в настоящее время медицина не распо-
лагает другими достаточно простыми и более совершенными способами
возобновления кровообращения искусственным путем, требующими ми-
нимальной затраты времени на подготовку к их проведению.
При длительном проведении непрямого массажа сердца (или поздно
начатом массаже — на 3—4-й минуте клинической смерти) может раз-
виться атония миокарда, которая чаще всего и является причиной недо-
статочной эффективности массажа. В условиях проведения массажа серд-
ца, пораженного ишемическим или некротическим процессом, возмож-
ность развития атонии миокарда возрастает. При появлении признаков
недостаточной производительности массажа сердца показано немедлен-
ное внутрисердечное введение адреналина, норадреналина или хлорида
кальция. При длительном проведении непрямого массажа сердца, связан-
ном с невозможностью быстрого устранения фибрилляции желудочков
(что объясняется либо сохраняющейся после разряда дефибриллятора
фибрилляцией, либо возобновляющейся вновь после первоначального
устранения, либо временным отсутствием или неисправностью дефибрил-
лятора), предупредить развитие атонии миокарда можно с помощью пе-
риодически проводимого дробного артериального нагнетания полиглю-
кина, так как многократная пункция сердца приводит к значительной его
травматизации и потере времени, связанной с необходимостью прекра-
щать массаж сердца в момент пункции.
/154
Мы уже неоднократно указывали на огромную роль искусственного
дыхания в борьбе с клинической смертью. У больных с коронарной недо-
статочностью даже незначительная дыхательная гипоксия приводит к уг-
лублению возникших обменных нарушений в мышце сердца, значительно
затрудняя восстановление его деятельности.
Сохраняющаяся выраженная гипоксия миокарда затрудняет устране-
ние фибрилляции желудочков и способствует ее возобновлению в слу-
чаях, когда сначала ее удалось устранить. Учитывая сказанное выше, сле-
дует считать обязательным проведение искусственного дыхания одновре-
менно с непрямым массажем сердца в любых случаях внезапной смерти,
вызванных коронарной патологией. При отсутствии аппаратуры для осу-
ществления аппаратного искусственного дыхания необходимо произво-
дить его «изо рта в рот» или «изо рта в нос». Здесь важно еще раз под-
черкнуть необходимость проведения предварительных организационных
мероприятий, направленных на обучение всего персонала терапевтиче-
ских отделений этим методам.
Так как проведение дефибрилляции в условиях выраженной гипоксии
миокарда либо не удается, либо если и устраняет фибрилляцию, то не
приводит к восстановлению эффективной сердечной деятельности, в каж-
дом случае оживления необходимо с помощью массажа сердца и искус-
ственного дыхания как можно быстрее уменьшить гипоксию, добиться
появления на ЭКГ «живой» фибрилляции желудочков I—II стадии
и лишь после этого проводить дефибрилляцию. Не следует также забы-
вать и то, что наличие ишемических или некротических зон в мышце
сердца, особенно при вовлечении в них проводящей системы, не в мень-
шей степени, чем неустраненная гипоксия, затрудняет успешное устране-
ние фибрилляции и часто способствует повторному ее развитию. Это тре-
бует настойчивости при проведении реанимации у больного с коронарной
недостаточностью. Другими словами, основанием к продолжению или
прекращению реанимационных мероприятий у больного должно быть не
количество уже примененных разрядов дефибриллятора, а наличие или
отсутствие признаков эффективного кровообращения в организме, созда-
ваемого массажем сердца.
Восстановительный период требует проведения наряду с мероприя-
тиями, принятыми при лечении терминальных состояний (борьба с оте-
ком мозга, нарушениями кислотно-щелочного и водно-солевого равнове-
сия и др.), обычного курса лечения инфаркта миокарда, т. е. применения
сердечных глюкозидов, антикоагулянтов, антиаритмических средств и Др.
Наиболее благоприятными в отношении последующего течения и про-
гноза являются те случаи, при которых причиной внезапной смерти слу-
жит коронароспазм и в самой сердечной мышце еще не успевают прои-
зойти значительные изменения. Последние могут не развиваться и после
выведения больного из состояния клинической смерти, если причина,
вызвавшая ее (т. е. спазм венечных сосудов), действовала недолго.
Степень поражения сердечной мышцы ишемическим процессом, оче-
видно, должна влиять и на характер восстановления самостоятельной
сердечной деятельности, и на последующую ее эффективность. Но, во-пер-
вых, часто трудно бывает предвидеть величину поражения миокарда и на
155
основании этого решать вопрос о показании или противопоказании?
к оживлению, и, во-вторых, трудность восстановления сердечной деятель-
ности не всегда пропорциональна степени поражения миокарда. В кли-
нике мы наблюдали ряд больных с восстановленной после клинической
смерти сердечной деятельностью, но без признаков восстановления функ-
ции коры головного мозга (ввиду позднего начала мероприятий по реани-
мации), у которых в течение нескольких дней гемодинамика была впол-
не удовлетворительной, а при последующем патологсанатомическом ис-
следовании (смерть наступала из-за необратимых изменений в
центральной нервной системе) обнаруживалось наличие трансмурально-
го инфаркта почти всегда левого желудочка сердца и межжелудочковой
перегородки. Наряду с этим довольно часто приходится наблюдать
безуспешность мероприятий по восстановлению сердечной деятельности»
хотя патологоанатомические изменения, обнаруживаемые затем в мио-
карде, минимальны и проявляются лишь в виде неравномерного крове-
наполнения сердечной мышцы.
Локализация поражения является, вероятно, более существенным
фактором, влияющим на возможность и стойкость восстановления сер»
дечной деятельности. Плохими в отношении прогноза можно считать слу-
чаи, когда в ишемический или некротический процесс вовлекается прово-
дящая система. При этом даже на фоне эффективного массажа сердца
часто или не удается устранить фибрилляцию желудочков, или наблю-
дается повторное ее возникновение. Следует, однако, отметить, что
хотя вовлечение в патологический процесс межжелудочковой перего-
родки и является плохим прогностическим признаком, проводящая систе-
ма может оказаться при этом незатронутой и функционально полно-
ценной.
Предшествующая клинической смерти сердечная недостаточность за-
трудняет, а в ряде случаев делает невозможным восстановление адекват-
ной сердечной деятельности. Тем не менее острое развитие сердечной
недостаточности не служит противопоказанием к оживлению при наступ-
лении клинической смерти: Восстановив сердечную деятельность, следует
продолжать бороться с явлениями сердечной недостаточности. Мы наблю-
дали 65-летнего больного с недостаточностью коронарного кровообраще-
ния, у которого клиническая смерть наступила через несколько минут
после остро возникшего отека легких. После 22 мин проведения непря-
мого массажа сердца и искусственного дыхания восстановилась само-
стоятельная сердечная деятельность, но вместе с этим возобновились
и явления отека легких. Для устранения последнего был проведен весь
комплекс описанных ранее мероприятий, включая трахеостомию и вспо-
могательное аппаратное дыхание. Отек легких удалось купировать. Ьоль-
ной выздоровел и через 2 мес был выписан из больницы.
В зарубежной литературе было выдвинуто положение (Straight e. а.»
1961) о том, что больным с коронарной недостаточностью в возрасте
80 лет проведение мероприятий по оживлению противопоказано. Безус-
ловно, этот показатель является относительным, хотя между возрастом
и степенью выраженности коронарной недостаточности действительно су-
ществует определенная зависимость.
156
Естественно, что наличие сопутствующих заболеваний, таких, как са-
харный диабет, гипертония с поражением почек, легочные заболевания
и др., отрицательно влияет на исход оживления, затрудняя как восста-
новление сердечной деятельности и дыхания, так и нормализацию функ-
ций в последующем восстановительном периоде.
Абсолютных противопоказаний к оживлению больных с коронарной
недостаточностью сердца нет. Однако при некоторых ситуациях оживле-
ние становится бессмысленным, например, при длительном предшествую-
щем существовании резко выраженной сердечно-сосудистой недостаточ-
ности, не поддающейся лечению; при наличии у больных наряду с
коронарной недостаточностью инкурабельных злокачественных новооб-
разований и, наконец, при длительной клинической смерти, приведшей к
необратимым изменениям головного мозга (см. главу XVIII).
Лечение отека легких
Отек легких является одним из частых осложнений целого ряда за-
болеваний, нередко приводящим к развитию терминального состояния
Ичсмерти больного. .В настоящее время патогенез отека легких достаточ-
но хорошо изучен. Укажем лишь, что в терапевтической клинике отек
легких чаще всего возникает у больных инфарктом миокарда как след-
ствие прогрессирующей слабости левого желудочка сердца и снижения
его сократительной способности, приводящих к застою в малом круге
кровообращения и повышению легочно-капиллярного давления. Рас-
стройства гемодинамики приводят к возникновению гипоксии, к выходу
из сосудистого русла плазмы во внесосудистое пространство (в данном
случае в просвет альвеол, чем и объясняется появление у больного обиль-
ной пенистой мокроты). Понижение осмотического давления плазмы на-
ряду с повышением гидродинамического на уровне венозной части капил-
лярного русла еще больше способствует «пропотеванию» жидкой части
крови и усилению отека. Возбуждение симпатико-адреналовой системы
и дыхательного центра также усугубляет указанный патологический про-
цесс. Таким образом, гемодинамические нарушения приводят к гипоксии,
а гипоксия — к углублению гемодинамических и связанных с ними нару-
шений. По мере развития заболевания и при отсутствии эффективного
лечения «порочный круг» замыкается, развивается терминальное состоя-
ние и наступает смерть, причиной которой является именно прогресси-
рующая гипоксия.
В отличие от врача-терапевта, который ведет наблюдение за больным
на ранних этапах развития заболевания, реаниматолог, как правило,
встречается с больными уже в стадии выраженного отека легких, безус-
пешно леченного теми или иными лекарственными средствами, иногда
в довольно больших дозировках.
В связи с этим проведение патогенетического лечения, направленного
на устранение левожелудочковой недостаточности, отодвигается как бы
-на второй план, а первоочередной задачей реаниматолога становится
устранение или уменьшение гипоксии для предотвращения возможного
смертельного исхода.
157
Такое разделение лечебных мероприятий на два этапа является, есте-
ственно, условным, однако оно в полной мере отражает специфику тер-
минальных состояний, описанную выше.
1. Устранение или уменьшение дыхательной гипоксии достигается
в основном двумя способами — кислородотерапией и применением пено-
гасителей.
Смысл кислородотерапии заключается в повышении концентрации,
а следовательно, и парциального давления кислорода в альвеолярном
воздухе, что увеличивает диффузию кислорода в кровь через альвеоляр-
но-капиллярную мембрану и слой жидкости, скопившейся в просвете
альвеолы. Данная задача может быть выполнена длительным (на протя-
жении всего времени проводимого в последующем медикаментозного ле-
чения и в первые часы после его прекращения) подведением большого-
потока кислорода от баллона с манометром через носовые катетеры, вве-
денные через носовые ходы до ротоглотки больного. Нет необходимости
говорить о том, что использование кислородной подушки в подобной си-
туации не может привести к успеху.
Применение пеногасителей не уменьшает количества скопившейся
в просвете альвеол жидкости, но значительно уменьшает занимаемый ею
объем и, таким образом, как бы увеличивает вентиляционную способ-
ность легких. Наиболее распространенным пеногасителем является эти-
ловый спирт. Вдыхание больным паров спирта вместе с пропускаемым
через него кислородом проводится длительно, до тех пор, пока проводи-
мая патогенетическая терапия не даст эффекта и не исчезнут условия, вы-
зывающие «пропотевание» плазмы в просвет альвеол и образование пе-
ны. Удобнее всего пользоваться стеклянной банкой с герметически закры-
вающейся резиновой пробкой (например, склянкой из-под полиглюкина)
с двумя иглами. Кислород из баллона пропускают через слой налитого
на ее дно спирта (последний может быть разведен водой не более чем
наполовину!) и через носовые катетеры подводят к больному. Очень эф-
фективным пеногасителем является антифомсилан, вводимый в дыха-
тельные пути в 1виде аэрозолей по такой же методике или с помощью
обычного ингалятора.
2. На фоне указанной симптоматической терапии немедленно присту-
пают к проведению патогенетической терапии. Важно подчеркнуть, что
у больного с выраженным отеком легких не приходится рассчитывать на
немедленный эффект однократно введенного в вену одного или даже не-
скольких сильнодействующих медикаментов. Необходимо пунктировать
или катетеризировать вену и присоединить капельную систему. Общее
количество вводимой в вену жидкости должно быть небольшим, а меди-
каментозная терапия — комбинированной и непрерывной.
Арсенал применяемых средств для лечения отека легких обширен
и достаточно хорошо известен. К ним относятся:
а) быстро действующие и устраняющие недостаточность левого же-
лудочка сердца сердечные глюкозиды (строфантин, коргликон);
б) хлорид кальция (обладающий положительным инотропным влия-
нием на миокард и способствующий уменьшению проницаемости легочно-
капиллярных мембран);
158
в) антигистаминные средства (димедрол, супрастин, дипразин), по-
нижающие патологическую проницаемость тканевых мембран и способ-
ствующие понижению возбудимости дыхательного центра;
г) витамины (прежде всего витамин С и витамины группы В), обла-
дающие большим диапазоном фармакологического действия, в том числе
оказывающие влияние на проницаемость капилляров и стимулирующие
деятельность сердца;
д) гормональные средства (глюкокортикоиды — преднизолон, гидро-
кортизон) как общетонизирующие средства и средства, подавляющие ак-
тивность гиалуронидазы и способствующие уменьшению проницаемости
капилляров. Дозы указанных препаратов (в перерасчете на гидрокорти-
зон) за 2—3-часовой период лечения могут достигнуть 500—800 мг;
е) мочегонные средства (фуросемид, ртутные диуретики);
ж) нейролептики (таламонал и его составная часть дроперидол), зна-
чительно расширяющие периферическое сосудистое русло, но сохраняю-
щие тонус сосудов и понижающие возбудимость дыхательного центра.
Однократная доза таламонала (каждый миллилитр которого содержит
0,05 мг фентанила и 2,5 мг дроперидола) составляет 1—2 мл, иногда-
4 мл, суммарная же — весьма вариабельна и зависит от продолжитель-
ности проводимого лечения;
з) средства, понижающие возбудимость дыхательного центра (тала-
монал или его составная часть — фентанил, морфин; nota bene — не при-
менять кордиамин у больных с отеком легких!!!);
и) ганглиоблокаторы (арфонад, пентамин, гексоний),расширяющие
периферическое сосудистое русло и успешно заменяющие такие меро-
приятия, как кровопускание, наложение жгутов;
к) средства, улучшающие легочный кровоток (эуфиллин), а также-
сосудорасширяющие средства — но-шпа, папаверин.
В пределах данной главы невозможно дать оценку всем перечислен-
ным лекарственным средствам. Укажем лишь, что, по нашему мнению,
лучшим мочегонным средством в настоящее время является быстродей-
ствующий салуретик фуросемид, который можно вводить многократно
и суммарная доза которого колеблется от 40 до 120 мг. К применению
осмодиуретиков (мочевина) следует относиться очень осторожно, так.
как, вызывая приток жидкости в сосудистое русло, они «заставляют» по-
раженное сердце работать с большей нагрузкой. При неустраненной рез-
ко выраженной гипоксии лучше применять не таламонал (смесь фента-
•нила 'и дроперидола), а только дроперидол ввиду опасности значитель-
ного угнетения дыхания и повышения сопротивляемости мускулатурьг
бронхов. Быстрый терапевтический эффект строфантина проявляется не
всегда. По мнению А. А. Луизада и Л. М. Роша A964), это объясняется
усилением гемодинамическои нагрузки на левое сердце при несостоятель-
ности сократительной способности его левого желудочка. Подобная кар-
тина чаще наблюдается у больных с резко выраженной гипоксией. Еще
раз хотим напомнить, что кислородотерапия должна предшествовать,
и сопровождать терапию сердечными глюкозидами.
В своей практической деятельности мы пользуемся следующей схемой!
лечения больного с начальными стадиями отека легких.
159"
Больного укладывают в постель в полусидячем положении. Немедлен-
но организуют ингаляции кислорода с парами спирта через носовые ка-
тетеры. Пунктируют вену и устанавливают капельную систему со сле-
дующими медикаментами: 20% раствора глюкозы 250 мл; инсулина 14—
16 единиц; 5% раствора витамина С 10 мл; 0,05% раствора строфантина
1 мл; 1% раствора димедрола 4 мл; фуросемида 40 мг. Данный лекарст-
венный «коктейль» вводят медленно капельно, а остальные ингредиенты
(преднизолон, хлорид кальция, нейролептики и др.) по мере необходи-
мости с помощью шприца. При отсутствии тенденции к улучшению со-
стояния больного, а также у больных с высоким или нормальным арте-
риальным давлением через стеклянный тройник к капельной системе
присоединяют ампулу с раствором арфонада E0—100 мг на 200 мл 5%
раствора глюкозы). Скорость введения ганглиоблокатора определяется
гемодинамическими показателями. В случае резкого падения артериаль-
ного давления введение арфонада прекращается и возобновляется вве-
дение лекарственного «коктейля».
Если реаниматолог застает больного с отеком легких в терминаль-
ном состоянии (отсутствие сознания; резчайший цианоз; обильное коли-
чество кровавой пенистой мокроты, буквально вытекающей из дыха-
тельных путей; резко сниженное или неопределяющееся артериальное
давление), на первое место выступают мероприятия не стимулирующие,
а временно замещающие нарушенные функции. Больному немедленно
производят интубацию трахеи (или трахеостомию при наличии соответ-
ствующих условий), освобождают верхние дыхательные пути от мокро-
ты механическим путем и начинают искусственную вентиляцию легких
объемным респиратором или аппаратом типа «Амбу» воздухом с повы-
шенным содержанием кислорода. (Методические особенности проведе-
ния искусственного дыхания при отеке легких излагаются в главе XI.)
Периодически производится механическое удаление мокроты. Медика-
ментозное лечение проводят на фоне искусственной или вспомогатель-
ной вентиляции легких.
В специально оборудованных реанимационных центрах в комплекс
мероприятий по лечению «терминального» отека легких; могут быть
включены оксигенобаротерапия и вспомогательное аппаратное искусст-
венное кровообращение.
Электроимпульсное лечение аритмий сердца
у больных в терминальном состоянии
Среди причин, способствующих развитию тяжелых расстройств ге-
модинамики, важное место занимают нарушения ритма сердечной дея-
тельности, в частности мерцание и трепетание предсердий, а также раз-
личные формы пароксизмальной тахикардии. Особенно неблагоприятно
влияние указанных аритмий на кровообращение при наличии пораже-
ний миокарда или клапанного аппарата сердца. Приступ пароксизмаль-
ной тахикардии, особенно желудочковой тахисистолии, или пароксизм
мерцания предсердий при определенных условиях могут обусловить раз-
витие фибрилляции желудочков.
Многочисленными исследованиями было показано (А. И. Лукашеви-
чуте, 1968; А. Л. Сыркин и др., 1970; Lown, 1963, 1968, и др.), что резкое
возрастание частоты сокращений желудочкрв и различные нарушения
последовательности возбуждения отделов сердца закономерно приводят
к снижению ударного и минутного объема, повышению венозного дав-
ления и развитию застойных явлений в системе малого круга кровооб-
ращения, истощают энергетические ресурсы миокарда. Так, А. В. Сума-
роков A964) показал, что при предсердной тахикардии наступает умень-
шение минутного объема на 30—65% исходного уровня. Коронарный
кровоток снижается при этом в среднем на 38%, отмечается значитель-
ное увеличение венозного давления. При устранении тахикардии нару-
шения кровообращения постепенно исчезают. Сходные явления при же-
лудочковой тахисистолии как в эксперименте, так и в клинике были
отмечены и другими авторами. Обращает на себя внимание резкое ухуд-
шение коронарного кровотока у здоровых собак при экспериментально
вызванной тахикардии с частотой сокращения желудочков 180—200
в минуту. В клинике положение значительно ухудшается в связи с тем,
что у больных приступ аритмии развивается на фоне того или иного
заболевания сердечно-сосудистой системы, что способствует быстрому
нарастанию явлений недостаточности кровообращения. На большую
опасность развития сердечно-сосудистой недостаточности, вызванной
нарушением ритма сердца, указывают многие авторы (А. Л. Сыркин,
1968; И. Е. Ганелина и др., 1970; Castellanos e. а., 1965).
Для устранения приступа пароксизмальной тахикардии или мерца-
ния предсердий применяют методы рефлекторного воздействия (пробы
Ашнера — Даньини, Чермака — Геринга, Вальсальвы, медикаментоз-
ную терапию). Широкое распространение получили такие противоарит-
мические средства, как хинидин, новокаинамид, алкалоиды раульволь-
фии (аймалин), р-блокаторы, соли калия, быстродействующие гликози-
ды наперстянки и др. Указанные средства далеко не всегда, однако,
способны обеспечить быстрое восстановление номотопного ритма, что
особенно важно при наличии тяжелых деструктивных процессов в мио-
карде (Л. И. Фогельсон, 1957). Необходимо учитывать также, что про-
ведение энергичной противоаритмической медикаментозной терапии не-
редко затруднено или невозможно ввиду выраженного депрессивного
влияния, оказываемого большинством препаратов на функции сердечно-
сосудистой системы.
В последние годы начал применяться новый метод лечения аритмий
сердца, в основе которого лежит эффект воздействия на миокард и про-
водящую систему импульса сильного тока. Важнейшие его принципы
были экспериментально разработаны Н. Л. Гурвичем, установившим
оптимальные параметры импульса — форму, амплитуду и продолжи-
тельность (см. главу II). Н. Л. Гурвич, в частности, показал решитель-
ное преимущество одиночного электрического импульса перед перемен-
ным током. В клинике метод электроимпульсной терапии для лечения
мерцания предсердий был успешно применен в 1959 г. А. А. Вишневским
с соавторами. Неоспоримые преимущества трансторакальной дефиб-
рилляции (кардиоверсии) обусловили интерес к этому методу лечения
П Заказ М 1266 161
сердечных аритмий как в нашей стране, так и за рубежом (В. Н. Семе-
нов, 1963; А.' И. Лукашевичуте, 1968; А. Л. Сыркин и др., 1970; Lown,
,1968; Alexander, 1961; Kilip, 1963; Zoll, 1956, и др.).
К преимуществам электроимпульсной терапии следует отнести ее
высокую эффективность. Приступ пароксизмальной тахикардии (супра-
вентрикулярной или желудочковой) удается прекратить почти в 100%
случаев. Восстановление синусовой автоматии при лечении мерцания,
и трепетания предсердий наблюдается обычно более чем у 90% боль-
ных. Необходимо также учитывать, что у большинства больных до при-
менения электроимпульсной терапии делались попытки нормализовать
ритм медикаментозными средствами. Важно отметить и то, что некото-
рые типы нарушения сердечного ритма (фибрилляция и трепетание же-
лудочков) могут быть устранены только с помощью электрического воз-
действия на сердце. Вопросы, связанные с прекращением фибрилляции
желудочков электроимпульсным методом, подробно рассмотрены в гла-
ве II.
Применение одиночного электрического импульса адекватного на-
пряжения (дефибрилляторы ИД-1-ВЭИ; ИД-66; ДКИ-01; ДИ-03 и др.)
не связано с опасностью серьезного повреждающего действия на струк-
туры миокарда. Незначительные и быстропреходящие изменения струк-
тур обнаруживаются лишь с помощью электронной микроскопии (Б. М.
Цукерман, 1965, и др.; В. С. Пауков и др., 1966). Это открывает возмож-
ность многократного использования сеансов кардиоверсии в случае ре-
цидива аритмий. Наш собственный опыт показал, что у больных, кото-
рым электроимпульсная терапия применялась десятки раз, впоследст-
вии не выявлялось каких-либо признаков «повреждения» миокарда.
Важнейшим преимуществом электроимпульсной терапии является
возможность быстрого применения этого метода у больных, находящих-
ся в терминальном состоянии. В случаях, когда назначение препаратов,
оказывающих отрицательно-инотропное действие на сердце, представ-
ляется невозможным или весьма рискованным, электроимпульсный ме-
тод является единственным средством оказания эффективной помощи.
Электроимпульсная терапия тем более показана, чем тяжелее состояние
больного.
Вопрос об экстренном применении электроимпульсной терапии ре*
шается в зависимости от характера и тяжести основного патологиче-
ского процесса. При выраженных расстройствах гемодинамики и дыха-
ния показания к кардиоверсии становятся абсолютными, независимо от
формы пароксизмальной тахикардии или пароксизма мерцания пред-
сердий, длительности приступа и ранее проводимых лечебных меро-
приятий. В литературе имеются обоснованные указания на необходи-
мость отказа от многочасовых, а иногда и многодневных попыток нор-
мализовать ритм путем повторного применения различных противоарит-
мических средств, поскольку затягивание приступа, как правило, может
иметь крайне нежелательные или даже пагубные последствия (В. Н.
Семенов, В. Я. Табак, 1965; А. Л. Сыркин, 1968). Даже наличие обшир-
ного инфаркта миокарда или аневризмы сердца не может служить про-
тивопоказанием к применению экстренной кардиоверсии.
162
При лечении больных, находящихся в терминальном состоянии, воз-
можности общепринятой подготовки к сеансу кардиоверсии резко огра-
ничены. В силу необходимости немедленного вмешательства отпадают
вопросы, связанные с отменой сердечных гликозидов, длительным на-
значением антикоагулянтов, исследованием чувствительности больного
к хинидину. Более того, перед врачом-реаниматором нередко возникает
задача проведения электроимпульсной терапии у больных, которым уже
был безуспешно применен весь доступный арсенал противоаритмиче-
ских средств, включая сердечные гликозиды и C-блокаторы. Естествен-
но, такое положение увеличивает риск возникновения постконверсион-
ных аритмий, в том числе и фибрилляции желудочков.
Заслуживает отдельного упоминания опасность проведения электро-
импульсной терапии у больных, предварительно леченных р-блокатора-
ми, так как вслед за воздействием на сердце разряда конденсатора
у них может наступить асистолия. Последующий массаж сердца в соче-
тании с искусственным дыханием и введением адреномиметиков обычно
малоэффективен и не приводит к возобновлению сердечной деятель-
ности.
В качестве генератора тока были использованы дефибрилляторы си-
стемы Н. Л. Гурвича, конструктивные особенности которых описаны
в главе II. Большая часть сеансов кардиоверсии была проведена без
кардиосинхронизации, чему способствовали следующие обстоятельства.
Во-первых, в условиях ургентного применения кардиоверсии настройка
кардиосинхронизатора занимает излишне продолжительное время, во-
вторых, даже попадание импульса в «ранимую» фазу сердечного цикла
сопровождается развитием фибрилляции лишь в 0,5% случаев (Н. Л.
Гурвич, 1957). Таким образом, кардиосинхронизация при кардиоверсии,
проводимой с помощью импульсов напряжением свыше 3,5 кВ, жела-
тельна, но отнюдь не обязательна. Это тем более справедливо, посколь-
ку возникающая в редких случаях фибрилляция желудочков легко уст-
раняется повторным импульсом.
Процедура электроимпульсной терапии хронических аритмий сходна
с процедурой дефибрилляции. Для ее проведения один из электродов
дефибриллятора накладывают на область лопатки, другой — между II
и V ребром слева, немного отступя от края грудины. Можно пользовать-
ся и ручными электродами, которые сильно прижимают (с помощью изо-
лирующих ручек) к передней поверхности грудной клетки, например
у верхнего и нижнего концов грудины, или справа под ключицей и слева
в области сердечного толчка. Данные различных исследований показы-
вают, что место наложения электродов не оказывает существенного
влияния на исход лечения. Важно подчеркнуть необходимость обеспе-
чения хорошего контакта между кожными покровами больного и по-
верхностью электродов. С этой целью электроды обертывают нескольки-
ми слоями марли и смачивают гипертоническим раствором поваренной
соли.
Существенным элементом сеанса кардиоверсии является наркоз. По-
пытки отдельных авторов отказаться от общей анестезии показали, что
это возможно в двух случаях: 1) когда больные находятся в бессозна-
П* 1ба
тельном состоянии и 2) при использовании импульсов, энергия которых
не превышает 100 Дж (применительно к отечественным моделям дефиб-
рилляторов это соответствует напряжению 3,5 кВ). Поскольку порого-
вые напряжения тока для устранения мерцания предсердий или парок-
сизмальной тахикардии обычно превышают указанную величину, необ-
ходимость общей анестезии становится очевидной.
В настоящее время в клинической практике обычно используют внут-
ривенный барбитуровый наркоз, относительно широко применяют ане-
стетики ультракороткого действия (пропанидид), закись азота, значи-
тельно реже фторотан, предион и др.
Не вызывает сомнения, что риск проведения общей анестезии у боль-
ных в терминальном состоянии может значительно превысить опасность
и частоту осложнений электроимпульсной терапии. В этой связи весьма
показательно замечание Zoll — одного из авторитетных специалистов в
области электролечения аритмий сердца, что вследствие опасности нар-
козных осложнений у наиболее тяжело больных он был вынужден отка-
зываться от кардиоверсии и прибегать к заведомо менее эффективным
медикаментозным средствам.
Опыт применения кардиоверсии у большой группы больных с тяже-
лыми нарушениями кровообращения и дыхания побудил нас к изыска-
нию других методов общей анестезии. С этой целью был испытан элек-
тронаркоз интерференционными токами, принципы которого разработа-
ны группой советских авторов (М. И. Кузин и др., 1966; В. Д. Жуков-
ский, 1971). Методика проведения электроанестезии была модифициро-
вана нами (В. Я. Табак совместно с В. Д. Жуковским) применительно
к специфике кардиоверсии. В работе был использован портативный ап-
парат НЭИП-1. Ток силой 180—200 мА подавали толчком через две па-
ры электродов, укрепленных в положении лоб-затылок и в области со-
сцевидных отростков. Перед началом анестезии больным вводили внут-
ривенно 0,5—1 мг сульфата атропина, 10—20 мг промедола и 20 мг ди-
медрола (последний нередко заменяли дипрозином, супрастином или
дроперидолом). У наиболее тяжело больных премедикацию ограничи-
вали одним лишь атропином.
Электронаркоз начинали после подготовки к кардиоверсии, т. е. в
момент, когда дефибриллятор был заряжен и электроды наложены на
грудную клетку больного. Разряд производили тотчас после начала
электронаркоза, поскольку выключение сознания наступает практически
немедленно. Вслед за разрядом дефибриллятора электронаркоз прекра-
щали. Длительность электроанестезии не превышала 0,5—1 с.
Больные приходили в сознание немедленно после прекращения элек-
троанестезии. Многие из них отмечали различные по своему характеру
ощущения, возникающие в момент подачи тока — мелькание света
в глазах, дрожь и т. д. Как показали наши исследования, кратковремен-
ная электроанестезия не оказывает сколько-нибудь заметного влияния
на уровень артериального давления и дыхание. Отсутствие осложнений,
B'foM числе и у больных, подвергавшихся многократным повторным
сеансам кардиоверсии с использованием кратковременной электро-
дает основание полагать, что этот метод найдет примене-
ние не только в стационарах, но и в условиях работы бригад скорой
.помощи.
Электроимпульсную терапию следует проводить под строгим элек-
трокардиографическим контролем. При использовании обычных мето-
дов записи ЭКГ электрокардиограф во избежание порчи прибора целе-
сообразно отключать от больного (но не от сети!) только в момент раз-
ряда дефибриллятора. В последнее время разработаны специальные
устройства, позволяющие вести непрерывную запись ЭКГ без опасности
повредить аппаратуру.
Оптимальными величинами напряжения для устранения пароксиз-
мальной тахикардии являются 3,5—4,0 кВ, для устранения мерцания
предсердий — 4—5 кВ. У некоторых больных пороговые величины напря-
жения оказываются большими. Изредка можно наблюдать больных, у
которых порог дефибрилляции превышает 7 кВ и, следовательно, мощ-
ность имеющихся в нашем распоряжении дефибрилляторов оказывается
недостаточной. Некоторые авторы для преодоления этой трудности
предложили использовать пищеводный электрод (А. И. Лукашевичу-
те, 1970).
Восстановление синусового ритма наступает обычно немедленно пос-
ле разряда конденсатора. У ряда больных, однако, можно наблюдать
так называемые постконверсионные аритмии — миграцию источника
автоматии, узловой ритм, диссоциацию с интерференцией, неполную
и полную атрио-вентрикулярную блокаду, предсердные, узловые и же-
лудочковые экстрасистолы. О возможности развития фибрилляции желу-
дочков упоминалось выше. Постконверсионные аритмии, как правило,
нестойки и сменяются в большинстве случаев синусовой тахикардией
(с частотой 90—ПО сокращений сердца в минуту). Не исключено, одна-
ко, и возобновление исходного патологического ритма.
При неэффективности первого импульса кардиоверсию тут же повто-
ряют, применяя импульс более высокого напряжения. Последний целе-
. сообразно увеличивать сразу на 1 кВ. Различные авторы допускают
применение 2—5 импульсов подряд, с короткими интервалами. У ряда
больных нам приходилось применять от 5 до 8 сеансов кардиоверсии за
20—30 мин, что было обусловлено рецидивами аритмии. О возможности
многократного использования разрядов дефибриллятора сообщается
в литературе: известны случаи, когда электроимпульсная терапия при-
менялась у одного и того же больного несколько десятков раз на про-
тяжении 1—2 суток.
Терапевтический эффект электроимпульсной терапии необходимо
закреплять противоаритмическими средствами, проводя одновременно
лечение основного заболевания. Мы считаем целесообразным назначать
внутривенные растворы хлорида калия (в составе поляризующей смеси:
1% раствор КС1 в 10% растворе глюкозы + инсулин), панангин, кокар-
боксилазу. Применять, особенно у больных с выраженными циркуля-
торными расстройствами, хинидин, новокаинамид, р-блокаторы следует,
видимо, с большой осторожностью. В последнее время хорошо зареко-
мендовал себя изадрин, введение которого не связано с опасностью раз-
вития коллаптоидного состояния.
165
К осложнениям электроимпульсной терапии, помимо упомянутых
постконверсионных аритмий, относят так называемые нормализацион-
еые эмболии, острый отек легких, возникающий как следствие гемоди-
намических сдвигов. Кроме того, могут иметь место и менее существен-
ные осложнения: гиперемия кожных покровов и ожоги в области нало-
жения электродов.
Указанные осложнения встречаются редко и подробно описаны в ли-
тературе (А. И. Лукашевичуте, 1968; А. Л. Сыркин и др., 1970), поэтому
остановимся на них кратко. Важно лишь подчеркнуть, что применение
электроимпульсной терапии у больных инфарктом миокарда на разных
стадиях развития, а также у больных с аневризмой сердца различной
локализации не сопровождалось тромбоэмболическими осложнениями.
Это позволяет шире ставить показания к электроимпульсной терапии,
хотя вопрос в целом нуждается в дальнейшем изучении.
Лечение терминальных состояний,
связанных с резким замедлением ритма
сердечных сокращений
Терминальное состояние может возникнуть внезапно пр'и резком за-
медлении ритма сокращения желудочков сердца, что приводит к значи-
тельному уменьшению минутного объема сердца. Если последнее выра-
жено в такой степени, которая не может быть компенсирована увеличе-
нием ударного объема сердца, возникает ишемия мозга с потерей созна-
ния — синдром Морганьи— Эдемса— Стокса (по именам авторов, опи-
савших его). Развитие этого синдрома связано с нарушением атр'ионвен-
трикулярной проводимости, что впервые было доказано His в 1889 г.,
который и ввел в медицинскую практику термины «атрио-вентрикуляр-
ная блокада» и «сердечный блок». Причины, приводящие к нарушению
атрио-вентрикулярной проводимости, могут быть самыми различными
(как функционального порядка, так и органического — ишемия миокар-
да, воспалительные явления в нем, травма во время операций на сердце,
интоксикация, нарушения электролитного равновесия), поэтому клини-
ческое проявление этого нарушения проводимости и носит название не
заболевания, а синдрома.
С точки зрения врача-реаниматолога представляют интерес случаи
полной атрио-вентрикулярной блокады, сопровождающиеся клиникой
синдрома Морганьи — Эдемса — Стокса, связанного либо с резким за-
медлением, либо даже с временным полным прекращением сокращений
желудочков сердца. Важно отметить, что указанный синдром может
быть следствием как полной асистолии желудочков сердца, так и раз-
личных форм желудочковой тахиаритмии — пароксизмальной тахикар-
дии, трепетания и фибрилляции желудочков сердца. Точная дифферен-
циальная диагностика возможна с помощью электрокардиографического
исследования.
Обычно в анамнезе у больных имеются указания на периодическое
возникновение синдрома Морганьи — Эдемса — Стокса. Спонтанно не
прекращающийся и затягивающийся во времени приступ сопровож-
166
дается описанной ранее картиной клинической смерти и требует немед-
ленного проведения реанимационных мероприятий — непрямого масса-
жа сердца и искусственного дыхания (по имеющимся показаниям и
электрической дефибрилляции).
После выведения больного из терминального состояния необходимо
продолжать целенаправленную терапию, так как приступы имеют тен-
денцию 'повторяться. Иногда полная атрио-'вентрикулярная блокада с
резким замедлением сокращений желудочков сердца может сохраниться
у больного до конца его жизни.
При действии причин функционального характера в некоторых слу-
чаях может быть эффективным медикаментозное лечение.
а) Симпатомиметические средства, действие которых связано с по-
ложительным хроно- и инотропным влиянием — адреналин, норадрена-
лин, эфедрин, изадрин.
б) Гормональные вещества — кортикостероиды, действие которых
связано с противовоспалительным эффектом, влиянием на симпатиче-
скую нервную систему, способность вызывать гипокалиемию и алкалоз.
в) Средства, понижающие уровень калия в крови (дихлотиазид
в дозах 50—100 мг в сутки). Следует напомнить, что антагонистом ка-
лия может служить хлорид кальция, обладающий и положительным
инотропным влиянием на миокард.
г) Средства, способствующие развитию алкалоза (и, следовательно,
также снижающие уровень внеклеточного калия) — гидрокарбонат
и лактат натрия.
Безусловно, медикаментозная терапия, помимо «патогенетических»
для синдрома Морганьи — Эдемса — Стокса средств, должна включать
в себя средства, направленные на уменьшение сердечно-сосудистой не-
достаточности (сердечные глюкозиды), а также общеукрепляющие сред-
ства и прежде всего — витамин С и витамины группы В.
Несомненно, более эффективной по сравнению с медикаментозной
терапией является электрическая стимуляция сердца, впервые приме-
ненная в эксперименте Hyman в 1932 г., а в клинике — Zoll в 1952 г.
В настоящее время клинические аспекты электрической стимуляции
сердца при полной атрио-вентрикулярной блокаде разработаны достаточ-
но хорошо и подробно описываются в специальных руководствах. Созда-
но большое количество разнообразных приборов для проведения ука-
занной процедуры — электростимуляторов или искусственных водите-
лей ритма [«pacemaker» no Hyman A932)].
Сущность электрической стимуляции состоит в создании искусствен-
ного гетеротопного и постоянно действующего (при стойкой атрио-вен-
трикулярной блокаде) водителя ритма желудочков сердца путем
подведения к ним импульсного электрического тока. Сила тока, генери-
руемого прибором (в зависимости от способа применения электростиму-
ляции), колеблется от 2 до 200 Ма; напряжение — от 1 до 100—120 В;
продолжительность электрического импульса—от 1 до 10 мс; наиболее
оптимальная частота электростимуляции — 60—70 имп/мин.
Методически важно разделять электростимуляцию сердца на по-
стоянную, носящую лечебно-профилактический характер, и временную,
167
применяемую при терминальных состояниях или при угрозе их возник-
новения (В. С. Савельев и др., 1967).
Техника временной электрической стимуляции сердца является более
простой и доступной каждому реанимационному центру. Наиболее
элементарной жвляется непрямая электрическая стимуляция (в част-
ности, накожный ее способ), когда оба электрода-стимулятора
располагаются на передней стенке грудной клетки больного путем их
простого прикладывания к ней. Однако этот способ электростимуляции
имеет ряд очень существенных недостатков (необходимость применения
тока большой величины, вызывающего выраженные болевые явления
при восстановлении сознания у больного; нарушение дыхания вследст-
вие сокращения дыхательной мускулатуры; ожоги кожи). Поэтому мы
пользуемся прямой временной электростимуляцией сердца. Для этого
толстой длинной стерильной иглой под местной анестезией производят
пункцию грудной клетки в шестом-седьмом межреберье слева по перед-
не-подмышечной линии. Игла проводится в направлении к верхушке
сердца: слева направо, снизу вверх, спереди назад. В иглу помещают
тонкую, изолированную на все,м протяжении (кроме кончика в 5—7 мм)
проволоку, простерилизованную каким-либо дезинфицирующим раство-
ром (диоцид, этиловый спирт). Чаще всего мы пользуемся тонкой мед-
ной проволокой, применяемой в многожильном телефонном кабеле.
Иглу подводят к верхушке сердца (участок с наименее выраженной
сосудистой сетью!), миокард прокалывают энергичным, но осторожным
движением иглы, проволоку продвигают в толщу миокарда, иглу (слу-
жащую лишь проводником для проволочного электрода) извлекают,
проволоку же шелковым швом фиксируют к коже грудной клетки боль-
ного. Второй электрод в виде тонкой инъекционной иглы вводят над
областью грудины (до ее надкостницы). Сила тока при таком способе
электростимуляции обычно не превышает 5—10 Ма, напряжение—1 —
5 В. Больной на протяжении всего курса временной электростимуляции
находится под постоянным электрокардиографическим (мониторным)
наблюдением.
Наибольшие успехи в лечении стойкой атрио-вентрикулярной блока-
ды связаны с применением постоянной электростимуляции путем поме-
щения электродов стимулятора непосредственно на желудочки сердца
с имплантацией самого электростимулятора под кожу больного с источ-
ником питания, рассчитанным на несколько лет. Достигнутый техниче-
ский прогресс и совершенствование хирургической техники в специали-
зированных лечебных учреждениях позволили в настоящее время до-
биться больших успехов в лечении больных с синдромом Морганьи —
Эдемса — Стокса.
XI
ЭТИОЛОГИЯ, ПАТОГЕНЕЗ
И ТЕРАПИЯ ОСТРОЙ ДЫХАТЕЛЬНОЙ
НЕДОСТАТОЧНОСТИ ПРИ ТЕРМИНАЛЬНЫХ
состояниях
Развитие острой дыхательной недостаточности у больных с различ-
ными патологическими процессами приводит к терминальным состоя-
ниям, отягощает течение постоперационного и постреанимационного пе-
риодов и является одной из причин летальных исходов. В связи с этим
выяснение этиологии и патогенеза, диагностика, профилактика и лече-
ние этого осложнения являются актуальной задачей реаниматологии.
Однако в настоящее время нет единого представления о сущности ды-
хательной недостаточности. Одни авторы под дыхательной недостаточ-
ностью понимают только такие изменения функций внешнего дыхания,
которые приводят к нарушению газообмена — развитию артериальной
гипоксемии и гиперкапнии (С. И. Вульфович, 1951; А. Л. Избинский,
1963; О. А. Долина, 1965; В. И. Лященко, 1967). Другие считают, что
дыхательная недостаточность может иметь место и при достаточно хо-
рошей оксигенации крови, если последняя осуществляется за счет на-
пряжения компенсаторных механизмов (А. Г. Дембо, 1957; Л. Л. Шик>
1970). Учитывая, что при гипоксии тканей различной этиологии напря-
жение компенсаторных механизмов из полезных факторов превращается
в повреждающие (Л. Л. Шик, 1970; В. А. Неговский, Е. С. Золотокры-
лина, 1971), нельзя не согласиться с мнением А. Г. Дембо о том, что
определение дыхательной недостаточности только на основании нару-
шений газообмена без учета состояния компенсаторных систем организ-
ма является механистичным. Важно заметить, что острая дыхательная
недостаточность может возникнуть не только при поражении органов,
непосредственно участвующих в акте дыхания, но и при нарушениях
функций регулирующих его систем, а также при кислородной задолж-
ности, обусловленной сердечно-сосудистой недостаточностью, анемией,
интоксикацией и другими факторами. В связи с этим из существующих
в настоящее время классификаций острой дыхательной недостаточно-
сти для реаниматологической практики наиболее приемлемо подразде-
ление ее на первичную и вторичную. Первичная дыхательная недоста-
точность возникает при развитии патологических процессов в легких
и дыхательных путях, а также при нарушениях центральной регуляции
дыхания и функций дыхательных мышц. Вторичная дыхательная недо-
статочность обусловливается изменениями в органах, которые не входят
169
в анатомо-физиологический комплекс, обеспечивающий внешнее дыха-
ние, но приводят к нарушению газообмена на различных уровнях (М. К-
Учваткина, 1967).
Этиология и патогенез
острой дыхательной недостаточности
При первичной дыхательной недостаточности в основе патогенеза
развития кислородного голодания лежат нарушения альвеолярной вен-
тиляции, р.авномерности распределения газа, соотношения вентиляции
и кровотока в легких и диффузии газов через альвеолярные мембраны
в кровь легочных капилляров. Большое значение имеет также увеличе-
ние работы, затрачиваемой на дыхание, и ее энергетической стоимости.
Для первичной дыхательной недостаточности характерно снижение на-
сыщения и напряжения кислорода в артериальной крови, гипер- или ги-
покапния, метаболический ацидоз и газовый ацидоз или алкалоз. Выра-
женность указанных нарушений газообмена зависит от характера
патологических процессов, тяжести дыхательной недостаточности и со-
стояния компенсаторных возможностей организма. Клиническая симп-
томатика гипоксии, гиперкапнии и гипокапнии приведена в главе IV.
Из причин, приводящих к несостоятельности функций дыхания, наи-
более существенными являются следующие:
1. Болевой фактор и состояние больного. При некоторых заболева-
ниях (обширная травма грудной клетки, сухой плеврит и т. д.) боль
вызывает уменьшение дыхательного объема и альвеолярной вентиля-
ции. При этом экскурсия ребер и диафрагмы ограничивается не только
на пораженной стороне, но и на непораженной (М. 3. Ротенфельд,
1948). Применение при болевом синдроме наркотиков может вызвать
угнетение дыхательного центра и дренажной функции бронхов. Умень-
шение легочной вентиляции и быстрое истощение компенсаторных функ-
ций наблюдаются и у резко ослабленных больных, находящихся в не-
подвижном положении. У этих больных нарушения функций внешнего
дыхания усугубляются полнокровием легких.
2. Изменения механики дыхания. Это осложнение может развиться
при нарушении каркасности грудной клетки, особенно при возникнове-
нии парадоксального дыхания — западения отдельных областей груд-
ной клетки на вдохе (множественный перелом ребер по нескольким ли-
ниям), при обширных гемотораксах и клапанных пневмотораксах, при-
водящих к коллабированию легких. В ряде случаев большую роль в
развитии нарушений механики дыхания играют внеплевральные поджа-
тая легких вследствие высокого стояния куполов диафрагмы и ограни-
чения ее подвижности (парез желудка и кишечника после операций на
органах брюшной полости, обширные забрюшинные гематомы, длитель-
ное применение наркотиков). Тяжелые состояния этих больных усугуб-
ляются внеклеточной дегидратацией, гипохлоремией, гипокалиемией,
что, по данным С. Blaja и D. Momiceanu A962), приводит к мышечной
гипотонии вплоть до паралича дыхательной мускулатуры. Нарушения
механики дыхания вследствие несостоятельности дыхательных мышц
могут быть связаны с заболеваниями центральной нервной системы,
170
приводящими к нарушению функций ядер или корешков IX, X, XI пар
черепно-мозговых нервов, передних рогов шейного и грудного отделов
спинного мозга, где расположены мотонейроны дыхательных мышц, при
расстройствах нервно-мышечной проводимости (Л. М. Попова, 1960,
1971; В. П. Дорощук, 1967; Grob, 1962), а также при отравлениях фос-
форорганическими соединениями и некоторыми другими ядами
(А. Г. Киссин, 1964).
3. Нарушения трахео-бронхиальной проходимости. Развитию этого
осложнения способствуют обтурация дыхательных путей инородными
телами, сдавление их опухолью, отеком, гематомой; аспирация крови и
рвотных масс, спазм или паралич голосовых связок. В реанимационной
практике наиболее частыми причинами нарушения трахеобронхиальной
проходимости являются скопление слизистого или гнойного секрета в
дыхательных путях (так называемые мокрые легкие) в результате на-
рушения процесса откашливания (кома, боль, резкая слабость и др.)
или повышения секреции (трахеобронхиты), бронхоспазма (некупиру-
ющийся приступ бронхиальной астмы).
4. Пневмонии и ателектазы легких. Развитию пневмоний, несомнен-
но, способствует снижение реактивности организма и нарушение цир-
куляции в малом круге кровообращения. Возникновение ателектазов в
легких чаще всего наблюдается при травмах грудной клетки, некоторых
•осложнениях во время наркоза, при длительных приступах бронхиаль-
ной астмы. При этих патологических процессах нарушение газообмена
обусловливается уменьшением функционирующей поверхности легких,
неравномерным распределением воздуха и нарушением соотношения вен-
тиляции и кровотока (Comroe и др., 1961). В норме полноценное крово-
обращение осуществляется в вентилируемых участках легких, в
нефункционирующих отделах (физиологические ателектазы) оно мини-
мальное. При нарушении соотношения вентиляции и кровотока крово-
снабжение невентилируемых участков приводит к снижению оксигена-
ции крови, оттекающей к сердцу, а недостаточное кровоснабжение вен-
тилируемых участков способствует увеличению физиологического
«мертвого» пространства.
5. Нарушения центральной регуляции дыхания. Эти нарушения име-
ют место при поражении дыхательного центра и его связей с другими
отделами головного и спинного мозга (патологические процессы в го-
ловном мозге, обусловленные гипоксией, нарушением мозгового крово-
обращения, черепно-мозговой травмой, опухолями, абсцессами и др.).
В зависимости от локализации, характера и тяжести поражения цент-
ральной нервной системы дыхательная недостаточность может прояв-
ляться в патологическом ритме дыхания, тахипноэ, брадипноэ. Особен-
но тяжелые формы острой дыхательной недостаточности, вплоть до
апноэ, наблюдаются при сдавлении или смещении ствола головного
мозга. Обычно дыхательная недостаточность обусловливается совокупно-
стью указанных выше причин. Так, например, нарушение механики ды-
хания и его центральной регуляции сопровождается нарушением про-
ходимости дыхательных путей в результате угнетения кашлевого реф-
лекса. Это усугубляет тяжесть гипоксии и гиперкапнии и при некото-
171
рых патологических процессах (черепно-мозговая травма) может
способствовать развитию отека мозга.
При вторичной дыхательной недостаточности в основе развития кис-
лородного голодания лежит несоответствие между повышенной потреб-
ностью тканей в кислороде и возможностями его потребления вследствие*
снижения кислородной емкости крови в связи с анемиями и нарушения-
ми транспорта кислорода при недостаточности периферического крово-
обращения (Е. С. Золотокрылина, 1966). При вторичной дыхательной
недостаточности, обусловленной вышеуказанными причинами, насыще-
ние крови кислородом существенно не меняется,, но увеличивается или
уменьшается артерио-венозная разница по кислороду и снижается его-
напряжение в артериальной крови. Имеет место газовый алкалоз, мета-
болический ацидоз или алкалоз. Подробное описание изменений кислот-
но-щелочного равновесия при этих состояниях приведено в главе VI.
Особенно большое значение в этиопатогенезе гипоксии имеет нарушение
циркуляции крови в малом круге кровообращения (шунтирование и де-
понирование кроози). Последнему, несомненно, способствует повышение
активности свертывающей системы крови и замедление кровотока. Де-
понирование крови в легочных капиллярах наблюдается при тяжелом
шоке и кровопотере. Застойные явления в легких с гипертензией разви-
ваются в основном при левожелудочковой недостаточности сердца раз-
личной этиологии (стеноз митрального клапана, инфаркт миокарда,
грубые нарушения ритма сердца). Резкое повышение давления в малом
круге кровообращения может привести к отеку легких. Это осложнение-
наблюдается при тяжелой травме и массивной кровопотере, когда мас-
сивные внутривенные трансфузии проводятся без контроля за централь-
ным венозным давлением. При длительной гипертензии малого круга
кровообращения у больных с хронической сердечной недостаточностью
происходят изменения в легочной ткани, в основном в ее строме, что при-
водит к несостоятельности всего аппарата внешнего дыхания. Наиболее
серьезным осложнением при нарушениях циркуляции в малом круге
кровообращения являются тромбоэмболии ветвей легочной артерии.
Хирургические вмешательства, проводимые на фоне кровопотери, ин-
токсикации или хронической дыхательной недостаточности, усиливают
кислородное голодание органов и тканей. В этих состояниях компенса-
ция возросшей потребности организма в кислороде затрудняется оста-
точным действием наркотических агентов и релаксантов, болевым син-
дромом и общей слабостью больных. Наиболее тяжелая гипоксия наблю-
дается при сочетании первичной и /вторичной дыхательной недостаточно-
сти, как, например, при раз-витии пневмоний или трахео-бронхиалшой
непроходимости у больных, оперированных (по поводу (Массивного крово-
течения.
Диагностика острой
дыхательной недостаточности
Клиническая симптоматика дыхательной недостаточности определя-
ется выраженностью гипоксии, гиперкапнии, нарушениями метаболизма*
и -их влиянием на функции жизненно важных органов (А. А. Вишнев-
172
ский, Л. Л. Шик, 1969). Независимо от причин, вызвавших гипоксию,
первыми признаками дыхательной недостаточности являются: жалобы
«а недостаток воздуха, одышка (как за счет углубления, так и учаще-
ния дыхания), легкий цианоз (при анемии часто отсутствует), учащение
пульса при нормальной температуре тела. По мере нарастания гипоксии
наблюдаются нарушения сознания. Вначале больные возбуждены, затем
заторможены, нередко появляются галлюцинации и бред. Кожные по-
кровы становятся влажными, более цианотичными или с багровым от-
тенком. Дыхание прогрессивно учащается нередко с включением вспо-
могательных дыхательных мышц и раздуванием крыльев носа. Усили-
вается тахикардия и напряжение пульса, артериальное давление
начинает постепенно повышаться.
Однако указанные клинические признаки дыхательной недостаточно-
сти часто появляются при далеко зашедших патологических процессах в
жизненно важных органах, когда реанимационные1 мероприятия оказы-
ваются уже малоэффективными.
Развитию клинической симптоматики острой дыхательной недоста-
точности предшествует период «скрытой гипоксии», которая выявляется
лишь с помощью функциональных и лабораторных методов обследова-
ния. Длительная «скрытая» гипоксия особенно опасна во время опера-
ций, так как при этом усиливается токсическое действие наркотических
агентов на паренхиматозные органы (Т. П. Макаренко и др., 1965) и в
постреанимационном периоде в связи с интоксикацией недоокисленными
продуктами обмена (В. А. Неговский, 1971).
Диагностика скрытых форм гипоксии и дыхательной недостаточности
имеет большое значение для оказания своевременной целенаправленной
лечебной помощи. О скрытой гипоксии свидетельствует метаболический
ацидоз, увеличение концентрации суммы органических кислот, сниже-
ние насыщения крови кислородом до 94% К Так, определение насыще-
ния крови кислородом позволило диагностировать дыхательную недоста-
точность у 74,8% всех больных после операции на органах грудной по-
лости, в то время как по клиническим признакам это осложнение было
выявлено всего у 24% больных (М. К. Учваткина, 1967).
Из функциональных методов определения скрытой гипоксии можно
упомянуть пробу Уленбрука с регистрацией спирограммы при дыхании
кислородом и воздухом. При скрытой гипоксии дыхание кислородом спо-
собствует или увеличению поглощения кислорода на 10—70% при неиз-
менном минутном объеме дыхания (МОД), или уменьшению МОД при
том же поглощении кислорода по сравнению с дыханием воздухом. Бо-
лее значительное увеличение поглощения кислорода при дыхании кис-
лородом по сравнению с дыханием воздухом свидетельствует о тяжелой
кислородной задолженности.
При тяжелых формах дыхательной недостаточности комплексное об-
следование функций внешнего дыхания, сердечно-сосудистой системы в
сочетании с данными клиники позволяют судить о выраженности гипок-
1 Насыщение крови кислородом у здоровых людей, по данным большинства авто-
ров, соответствует 96—98%.
173
сии, выяснить причины ее возникновения, состояние компенсаторных
реакций и на основании этого наметить необходимое симптоматическое
и патогенетическое лечение. Методы обследования функций внешнего1
дыхания на различных уровнях (вентиляция, газообмен, содержание кис-
лорода и углекислоты в артериальной крови) подробно описаны в моно-
графиях А. Г. Дембо A957), Comroe с соавторами A961), М. Navra-
til с соавторами A966) и в методическом руководстве И. Ф. Мартынова
A971).
Состояние легочной вентиляции (минутный объем дыхания, дыха-
тельный объем, частота дыхания) определяется с помощью спирографа,
а при отсутствии последнего — волюметром. Однако больные с тяжелой
острой дыхательной недостаточностью обычно тяжело переносят даже
2—4-минутное обследование. При этом характер дыхания часто изменя-
ется. Определить максимальную вентиляцию легких не удается, поэто-
му о резервных возможностях дыхания можно судить лишь косвенно по
величинам жизненной емкости легких и ее отношению к дыхательному
объему (в норме жизненная емкость легких превышает дыхательный
объем в 6 раз). С целью устранения отрицательного действия дополни-
тельной нагрузки на больного во время спирографии перед началом
обследования барабан спирографа обязательно заполняют кислородом.
Полученные величины приводят в процентные отношения к должным \
рассчитанным по поглощению кислорода в условиях «основного обмена»
(таблица Ю. А. Агапова).
Из существующих в настоящее время методов анализа газового со-
става крови, позволяющих оценивать эффективность легочной вентиля-
ции и тяжесть гипоксии, предпочтение справедливо отдается определе-
нию парциального давления кислорода, углекислого газа, а также кис-
лотно-щелочного равновесия с помощью микро-рН-метра Аструпа2, а
также определению насыщения крови кислородом кюветным оксиметром
038 или 057.
Заслуживает внимания функциональная проба с записью насыщения
крови кислородом при дыхании 100% кислородом и воздухом, предло-
женная Comroe и модифицированная Е. М. Крепсом. Эта проба отлича-
ется 'простотой и доступностью для стационаров широкого 'профиля. На-
сыщение крови кислородом определяется с помощью отечественного окси-
гемографа 036 М, датчик которого закрепляется'на ушной раковине. После
5—10 мин прогревания уха больного начинается запись, вначале при ды-
хании воздухом, а затем дается 100% кислород до образования плато
(оксигемограмма представляет собой прямую линию, что означает мак-
симально возможное насыщение крови кислородом для данного больно-
го). Затем писч'ик оксигемографа произвольно устанавливают^ на 98%
(нормальное насыщение крови кислородом у здоровых людей). Через
1—2 мин после этого больного переводят на дыхание воздухом, а после
образования плато — вновь на дыхание кислородом.
1 Должными называются физиологические величины, .юлученные из расчетов по
таблицам, формулам, номограммам.
2 Методика изложена в главе VI.
174
Рис. 22. Изменения насыщения крови кислородом (в процентах) при дыхании 100% кис-
лородом и воздухом.
а — умеренно выраженная гипоксия; б, в — тяжелая гипоксия при достаточном газообмене между
альвеолярным воздухом и воздухом и кровью легочных капилляров; г — тяжелая гипоксия (по
клиническим данным) при нарушении газообмена между альвеолярным воздухом и кровью легоч-
ных капилляров. 1—дыхание 100% кислородом; 2 — установка писчика оксигемографа на 98%;
3 — дыхание воздухом.
При сравнительно легкой степени гипоксии разница в насыщении
крови кислородом при дыхании 100% кислородом и воздухом не превы-
шает 8% E,7±1,1). После переключения больного с дыхания воздухом:
на дыхание кислородом насыщение крови кислородом начинает повы-
шаться в первые 15 с A1,0±0,58) и плато образуется не позднее чем,
через 2 мин. С переключением больного с дыхания кислородом на дыха-
ние воздухом насыщение крови кислородом начинает снижаться также
через 5—15 с, а плато образуется в первые 4 мин (рис. 22, а). При тяже-
лой дыхательной недостаточности, но при отсутствии грубых нарушений
газообмена на уровне легкие — кровоток разница в насыщении крови
кислородом при дыхании 100% кислородом и воздухом превышает 8—
10% и даже достигает 20—30% (рис. 22, б). Особенно резкое снижение
насыщения крови кислородом во время дыхания воздухом, как правило,
происходит в первую минуту (рис. 22, в). При выраженных нарушениях
газообмена в легких разница в насыщении крови кислородом предельно
мала и не соответствует клинической симптоматике гипоксии (рис. 22, г).
На нарушение смешения газов в легких указывает более позднее и мед-
ленное снижение насыщения крови кислородом при переключении на.'
дыхание воздухом и такая же замедленная реакция на дыхание кисло-
J75,
родом. У больных с хронической дыхательной недостаточностью, обус-
ловленной пневмосклерозом, эмфиземой легких, в ряде случаев плато
образуется только через 8—12 мин.
Хотя данные этой пробы относительны и далеко не всегда дают до-
стоверное представление о насыщении крови кислородом (нарушение
соотношения вентиляции и кровотока в легких, неравномерность распре-
деления воздуха), тем не менее они позволяют косвенно судить о кис-
лородной задолженности в организме, состоянии газообмена между
альвеолярным воздухом и кровью, а также оценивать эффективность
оксигенотерапии и подбирать необходимое количество кислорода при
проведении искусственной вентиляции легких.
Нарушения функций внешнего дыхания при острой дыхательной не-
достаточности проявляются прежде всего в увеличении или уменьшении
легочной вентиляции и изменениях характера и ритма дыхания.
Гипервентиляция легких возникает как при первичной, так и при
вторичной дыхательной недостаточности и является компенсаторной ре-
акцией организма, направленной на поддержание достаточного газооб-
мена при повышении потребления тканями кислорода. Однако увеличе-
ние легочной вентиляции даже при высоком насыщении артериальной
крови кислородом далеко не всегда устраняет гипоксию тканей в связи
с нерациональным использованием поглощенного кислорода. Об этом
свидетельствует развитие метаболического ацидоза и увеличение кон-
центрации органических кислот в плазме даже при достаточно высоком
напряжении кислорода в артериальной крови (90—94 мм рт. ст.). Ана-
лиз проведенных нами наблюдений и данные Н. А. Кустова A968) по-
казали, что несовершенная компенсация кислородной задолженности
путем увеличения легочной вентиляции имеет место при низких пока-
зателях гемоглобина и грубых нарушениях периферического кровообра-
щения (спазм сосудов) у больных с тяжелой травмой и кровопотерей,
а также при пневмониях и некоторых других патологических процессах,
сопровождающихся нарушением циркуляции в малом круге кровообра-
щения. Однако в этих состояниях, несмотря на гипервентиляцию легких,
развивается тяжелая артериальная гипоксемия, хотя напряжение угле-
кислого газа остается сниженным. Повышение рСО2 хотя бы до нормаль-
ных величин на фоне выраженной гипервентиляции легких свидетельст-
вует об углублении нарушений газообмена.
Изучение состояния легочной вентиляции у больных с дыхательной
недостаточностью, обусловленной послеоперационными пневмониями,
позволило выделить три типа гипервентиляции легких:
1. Увеличение минутного объема дыхания (МОД) не свыше 170% от
должных величин за счет углубления дыхания при одновременном уве-
личении жизненной емкости легких (ЖЕЛ) и частоте дыхания не свыше
30 в минуту (табл. 4). *
2. Увеличение МОД свыше 180% за счет углубления дыхания, но при
резком снижении ЖЕЛ (табл. 5).
3. Увеличение МОД свыше 160% за счет учащения дыхания более 30
вдохов в минуту при дыхательном объеме менее 70% от должных вели-
чин (см. табл. 5).
176
Таблица 4
Показатели внешнего дыхания при дыхательной недостаточности первой
степени (при гипервентиляции легких по первому типу)
Обследова-
ние в сут-
ках
1—2
4—5
Частота дыхания
в мин
25,5+1,42
22,2+0,85
мод
до
ЖЕЛ
в процентах к должным величинам
148,0+9,17
165,0+8,39
67,0+4,02
92,2+4,46
16,0+1,25
28,0+6,8
Таблица 5
Показатели внешнего дыхания при дыхательной недостаточности второй и третьей
степени (при гипервентиляции легких по второму и третьему типу)
Состояние компенсации
Максимальное напря-
жение
Начало декомпенса-
ции
Частота дыхания
в 1 мин
27,0+2,68
41,0+4,48
мод
ДО
ЖЕЛ
в процентах к должным величинам
203,0+23,6
188,0+11,05
113,0+9,03
55,0+9,41
12,5+1,86
13,3+2,17
При увеличении легочной вентиляции по первому типу наблюдается
достаточно хорошая компенсация кислородной задолженности. Клини-
ческая симптоматика гипоксии отсутствует или выражена весьма незна-
чительно (жалобы на недостаток воздуха легко устраняются ингаляци-
ей кислорода). Концентрация органических кислот в плазме снижается
почти до нормальных величин A3—15 мэкв/л), а разница в насыщении
крови кислородом при дыхании 100% кислородом и воздухом умень-
шается с 11—16 до 4—6%.
При максимальном напряжении компенсации (второй тип) и особен-
но при начавшемся истощении (третий тип) развивается клиническая
симптоматика тяжелой гипоксии. Концентрация органических кислот в
плазме увеличивается в среднем до 26,4 мэкв/л, отмечается компенси-
рованный или декомпенсированный метаболический ацидоз и газовый
алкалоз, который по мере нарастания дыхательной недостаточности
уменьшается, а затем переходит в ацидоз. Разница в насыщении крови
кислородом при дыхании 100% кислородом и воздухом увеличивается
до 20—30% или становится предельно малой и не соответствует клини-
ческим признакам гипоксии. Следует заметить, что последние два типа
гипервентиляции легких часто наблюдаются при сочетании первичной
и вторичной дыхательной недостаточности.
Гиповентиляция легких может быть как первичной, обусловленной
несостоятельностью органов дыхания, (угнетение дыхательного центра
агентами наркотического действия, обширные ателектазы легких, на-
рушения механики дыхания и трахео-бронхиальной проходимости), так
12 Заказ № 1266
177
и вторичной — вследствие истощения компенсаторных механизмов. Вто-
ричной гиповентиляции легких (МОД менее 100% от должных величин)
может предшествовать период нормовентиляции или умеренной гипер-
вентиляции легких (МОД 110—130%) при частоте дыхания свыше 30 в
мин. Для легочной и альвеолярной гиповентиляции характерно развитие
артериальной гипоксемии и гиперкапнии. Степень нарушения газообме-
на зависит от недостаточности альвеолярной вентиляции и причин, ее
обусловивших. В ряде случаев, как, например, при трахеобронхиальной
непроходимости, уменьшение легочной и альвеолярной вентиляции на-
блюдается даже при усиленной экскурсии грудной клетки.
Лечение острой дыхательной недостаточности
Лечение острой дыхательной недостаточности является одной из ос-
новных задач реаниматологии. С целью профилактики тяжелых наруше-
ний функций жизненно важных органов оно должно начинаться в ран-
ние сроки (до появления клинических признаков гипоксии) и прово-
диться с учетом этиопатогенетических факторов заболевания и индиви-
дуальных особенностей каждого больного. При тяжелых формах дыха-
тельной недостаточности и особенно в терминальных состояниях часто
мы не можем быстро устранить причину, вызвавшую нарушение дыха-
ния, и реанимационные мероприятия становятся симптоматическими, но
они позволяют поддерживать жизнь больного в течение определенного
периода (иногда в течение нескольких месяцев) до регресса основного
патологического процесса и восстановления адекватного спонтанного ды-
хания. Естественно, наряду с симптоматическим необходимо проводить
и патогенетическое лечение. Комплекс терапевтических мероприятий
прежде всего должен быть направлен на обеспечение полноценного га-
зообмена в организме.
Обезболивание
У больных с тяжелой множественной травмой, переломами ребер,
травмой живота, оперированных на органах грудной клетки, обезболи-
вание способствует устранению расстройств дыхания. Оно заключается
в проводниковой анестезии при помощи оваго-'ои'мпатических, лараиеф-
ральных и спирт-новокаиновых паравертебральных блокад (по
М. О. Фридланду).
Общее обезболивание достигается путем внутривенного введения по
1—2 мл 1—2% раствора промедола в сочетании с антигистаминными
препаратами (димедрол, супрастин по 1 мл через каждые 4—6 ч по
показаниям). Хорошие результаты получены при использовании окси-
бутирата натрия в дозах 60—80 мг/кг и закиси азота с кислородом в со-
отношении 1 : 1, по Б. В. Петровскому и С. Н. Ефуни A961).
Оксигенотерапия
При острой дыхательной недостаточности оксигенотерапия должна
быть длительной и непрерывной, так как даже при кратковременном ее
178
прекращении изменение газового состава крови у больных со снижен-
ными компенсаторными способностями может привести к тяжелым ос-
ложнениям. Содержание кислорода во вдыхаемой газовой смеси не дол-
жно превышать 50—60%. Применение 100% кислорода в течение дли-
тельного времени (более 4—5 ч) может вызвать нарушение процессов
транспорта углекислоты кровью (Н. Н. Савицкий, 1940), привести к
токсическому поражению легочной паренхимы в виде пролиферативных
процессов в периальвеолярных тканях, некроза и сквамозной метапла-
зии эпителия бронхов, ателектазов (Du Bois, 1962; Kafer, 1971, и др.).
Однако кратковременное применение 100% кислорода может оказаться
необходимым, так как при этом напряжение кислорода в артериях по-
вышается на 10—15%, а в тканях на 50% (Boothby e. а., 1939).
Кислород должен быть обязательно увлажнен путем пропускания че-
рез воду.
В последние годы широкое распространение получило применение
при острой дыхательной недостаточности гелио-кислородной смеси, осо-
бенно у больных с обструкцией дыхательных путей и ателектазами, так
как гелий обладает низкой плотностью и высокой диффузионной способ-
ностью. Обычно используют смесь из 70—60% гелия и 30—40% кислоро-
да (О. А. Долина, 1965, 1966, и др.). Гелий можно дозировать через ро-
таметр для закиси азота, умножая показатели его на 3,4. Ингаляция
гелио-кислородной смеси в течение 1 х/2—2 ч улучшает регионарную вен-
тиляцию легких и вентиляционно-перфузионное соотношение, а также
уменьшает парез кишечника за счет снижения содержания азота в орга-
низме. Хорошие результаты были получены нами при использовании
этой смеси у больных с застойными явлениями в малом круге кровооб-
ращения в связи с сердечной патологией.
Эффективность оксигенотерапии во многом зависит от метода ее
проведения. Чаще всего мы пользуемся подведением кислорода через
носовые катетеры. Вводят их в нижние носовые ходы так, чтобы их кон-
чики находились в носоглотке на длину, равную расстоянию от крыла
носа до козелка ушной раковины. По данным Binet и Bochet A955),
Miller A962), носовые катетеры обеспечивают содержание кислорода
во вдыхаемом воздухе от 30 до 45% при скорости подачи кислорода
5—8 л/мин.
Наибольшая концентрация кислорода во вдыхаемой смеси F0—
100%) достигается при применении маски. Для этой цели лучше всего
использовать наркозный аппарат по полуоткрытому контуру или кисло-
родный ингалятор КИ-3. Однако применение маски у больных в состоя-
нии комы опасно в связи с возможностью рвоты и аспирации рвотных
масс.
Восстановление нарушенной механики дыхания
Характер лечения нарушений механики дыхательных движений преж-
де всего определяется причинами, обусловившими развитие этого ос-
ложения. При нарушении каркасности грудной клетки в ряде наблюде-
ний хороший эффект достигается вытяжением путем подвешивания пара-
доксально движущейся части грудной клетки за ребра или грудину к спе-
12* 179
циальной раме. Некоторые авторы в этих условиях рекомендуют остео-
синтез (Crutcher, 1956).
В отношении лечебной тактики при гемо- и пневмотораксах сущест-
вует два противоположных мнения. Одни авторы считают порочным
стремление во чтобы то ни стало эвакуировать воздух и кровь из плев-
ральной полости, другие призывают к ранним активным мероприятиям
(Maloney, 1957, и др.). Мы считаем, что если у больного с гемо- или
пневмотораксом после обезболивания и применения оксигенотерапии ос-
таются явления дыхательной недостаточности и имеется смещение сре-
достения с симптомами венозного застоя, показана пункция плевральной
полости, эвакуация крови и воздуха из нее с оставлением подводного
дренажа для контроля на ближайшие 4—5 ч. Если в течение этого вре-
мени прекращается появление крови или воздуха из дренажа, иглу уда-
ляют. Продолжающееся поступление воздуха является показанием для
дренирования плевральной полости. Если имеются симптомы массивно-
го гемоторакса с продолжающимся кровотечением, то должен быть по-
ставлен вопрос о торакотомии и ушивании раны легкого.
При высоком стоянии диафрагмы вследствие пареза желудка и ки-
шечника показаны повторные паранефральные блокады по А. В. Виш-
невскому, подкожное введение 0,1% раствора прозерина по 1 мл, внут-
ривенное введение 20% раствора хлорида натрия по 10 мл, сифонные
клизмы. Очень важным и эффективным мероприятием является посто-
янная аспирация содержимого желудка при помощи тонкого зонда,
введенного через нос и присоединенного к водяному отсосу.
Указанное выше лечение нарушений механики дыхания должно про-
водиться на фоне оксигенотерапии.
Обеспечение проходимости дыхательных путей
Для обеспечения проходимости дыхательных путей существуют кон-
сервативные и радикальные методы.
а) Консервативные методы обеспечения проходимости дыхательных
путей показаны в основном для профилактики «мокрых легких». При
уже развившейся обтурации бронхов они имеют вспомогательное зна-
чение.
Облегчение поступления секрета из бронхов в трахею достигается
изменением положения больного в постели через каждые 2 ч (что спо-
собствует также улучшению легочного кровообращения) и периодиче-
ским его переводом в положение постурального дренажа. Последнее
осуществляется поднятием ножного конца кровати до 30° на срок от 30
мин до 2 ч. Понятно, что указанные мероприятия можно проводить
только после восстановления компенсаторных реакций кровообращения,
когда исключаются осложнения постуральной этиологии. К сожалению,
частые повороты больного с множественной травмой неосуществимы, а
положение постурального дренажа противопоказано при черепно-мозго-
вой травме, нарушениях мозгового кровообращения и травме грудной
клетки (опасность повышения давления в системе верхней полой вены).
При явлениях трахео-бронхиальной непроходимости следует исключить
180
сидячее и полусидячее положение больного, кроме тех случаев, когда
имеются рентгенологические указания на ателектаз в верхних отделах
легкого.
Полезным является поколачивание и вибрационный массаж грудной
клетки через каждые 2 ч. Поколачивание проводится путем быстрого по-
стукивания кулаком по ладони, положенной на различные области груд-
ной стенки (за исключением области расположения сердца), вибрация—'
путем сотрясения грудной стенки во время выдоха.
При неэффективном кашле применяется «вспомогательный кашель»,
который заключается в быстром и энергичном сжатии грудной клетки
руками при попытке больного откашляться. Если больной лежит на боку,
сжимать надо верхние отделы грудной клетки, а если на спине — ниж-
ние. У больных с черепно-мозговой травмой и переломами ребер это
мероприятие следует проводить с осторожностью.
Аспирация содержимого, скопившегося в глотке, легко осуществля-
ется при помощи зонда или катетера, введенного через нос или рот.
Аспирация секрета из трахео-бронхиального дерева возможна при брон-
хоскопии, которая, однако, является далеко не безразличной манипуля-
цией у тяжелобольного, особенно при частом ее повторении. В большин-
стве наблюдений бронхоскопия может быть успешно заменена «слепой»
катетеризацией бронхов-. Техника ее несложна. После инстилляционной
анестезии гортани 1% раствором дикаина или кокаина тонкий зонд про-
водят через нижний носовой ход до появления у наружного отверстия
его дыхательных шумов. Это свидетельствует о том, что конец зонда на-
ходится у входа в гортань. При очередном вдохе больного зонд быстро
продвигают в трахею, что определяется по появлению кашля (иногда
ввести зонд в трахею удается только с 3—4-й попытки). Затем зонд при-
соединяют к электроотсосу и производят аспирацию секрета. При нали-
чии густого секрета перед аспирацией через зонд в дыхательные пути
вводят одномоментно по 10—15 мл физиологического раствора с анти-
биотиками (из расчета 500 000 ЕД на 100 мл раствора).
Чрезкожная стимуляция кашля также относится к методам профи-
лактики «мокрых легких». Суть метода заключается в следующем: под
местной анестезией делают прокол трахеи через кожу между первым и
вторым хрящевыми кольцами тонким троакаром или специальной иг-
лой. Затем в трахею вводят тонкий полиэтиленовый или тефлоновый ка-
тетер и иглу извлекают. Через катетер систематически вводят в дыха-
тельные пути по 5—10 мл физиологического раствора с антибиотиками.
В ответ на введение возникает кашель (Р. Н. Лебедева, 1965; А. Ж. Ве-
мянг 1965; М. И. Перельман, 1965; Buchwald, 1962, и др.).
Следует подчеркнуть, что все консервативные методы сохранения
проходимости дыхательных путей должны применяться планомерно и ме-
тодично, а не от случая к случаю и выполняться врачом или опытной
медицинской сестрой.
б) Радикальные методы обеспечения проходимости дыхательных пу-
тей.
Коникотомия. При острой обтурации гортани (инородное тело, отек,
травма) показана экстренная коникотомия. Голову больного запрокиды-
181
вают кзади, нащупывают промежуток между щитовидным и перстневид-
ным хрящами и в поперечном направлении рассекают сначала кожу,
а затем конусовидную связку между указанными хрящами. Эту опера-
цию делают экстренно, когда уже нет времени для проведения трахеосто-
мии, а интубация невозможна.
Трахеостомия широко применяется в настоящее время в комплексе
лечения острой дыхательной недостаточности для длительного система-
тического дренирования дыхательных путей и проведения длительной
искусственной вентиляции легких.
Напомним некоторые существенные моменты техники операции. Под
плечи (не под шею!) больного должен быть уложен валик высотой 12—
15 см. Голову приводят в положение максимального разгибания. Ма-
лейший поворот головы в сторону вызывает смещение трахеи
(М. С. Дашкевич, 1948) и может привести к вскрытию трахеи не по сред-
ней линии или ранению пищевода. Анестезия местная. После рассечения
кожи и фасции дальнейшее обнажение трахеи производят только тупым
путем. Перед рассечением в трахею вводят 0,3—0,5 мл 3% раствора ко-
каина или 1% раствора дикаина, после чего ее прошивают шелком, ко-
торый служит держалкой. Скальпелем рассекают промежуток между
хрящами выше держалки, затем из прошитого хрящевого кольца выкра-
ивают трапециевидный лоскут основанием вниз. Обычно достаточно
рассечь одно кольцо, после чего без помощи расширителя в трахею вво-
дят канюлю, обязательно с раздувной манжеткой. Манжетку наполня-
ют воздухом из сухого шприца очень осторожно, так как перераздува-
ние ее может вызвать закрытие отверстия канюли и асфиксию. Кроме
того, переполненная воздухом манжетка оказывает сильное давление
на стенки трахеи, вызывая образование пролежней (Knowlson, Basset,
1970).
Иногда в связи с чрезвычайно глубоким положением трахеи (отек
шеи, чрезмерное развитие жировой клетчатки, подкожная эмфизема) мы
вводили в трахею коротко обрезанную интубационную трубку. В литера-
туре имеются указания на опасность этого мероприятия — соскальзыва-
ние трубки вниз и обтурация ею одного из главных бронхов (чаще ле-
вого). Во избежание этого осложнения трубку вводили в трахею так,
чтобы верхний край манжетки был виден в отверстии трахеи. Затем на
уровне кожи трубку прокалывали в поперечном направлении английской
булавкой. Ни в коем случае нельзя подшивать трубку или канюлю к
коже, так как в любой момент может возникнуть необходимость в ее
быстром удалении (см. ниже).
Эффективность лечебных мероприятий после трахеостомии во многом
зависит от тщательности ухода за больным, что само по себе может
явиться нелегкой задачей.
Так как после трахеостомии эффективность кашля резко снижается
за счет выключения компрессионной фазы, большое значение приобре-
тают постуральный дренаж и частые повороты больного, когда позволя-
ет его состояние (Wilson, Stevenson, 1957; Monsallier, 1962, и др.).
Аспирация секрета из трахеи и крупных бронхов при трахеостомии
является ответственным мероприятием, которое должен проводить врач
182
или опытная медицинская сестра. Очень важно приучить персонал тща-
тельно мыть руки не только после, но и до аспирации. Ее необходимо
делать стерильным катетером Тимана (№ 12—14) или мягким полиэти-
леновым катетером, ни в коем случае не применяя жесткие зонды
(Plum, Dunning, 1956). Перед каждой аспирацией полезно проведение
поколачивания и вибрации грудной клетки в течение 5—7 мин и зали-
вание в трахею 10—15 мл физиологического раствора.
Для проведения аспирации секрета голову больного поворачивают в
сторону, противоположную направлению «клюва» катетера. Последний
присоединяют к аспиратору с помощью тройника, свободное отверстие
которого во время введения катетера остается открытым. Ввести катетер
на достаточную глубину на фоне аспирации, как правило, не представ-
ляется возможным. При возникновении кашлевого рефлекса катетер
проводят как можно глубже во время вдоха, а во время выдоха его прод-
вижение приостанавливается. После введения катетера на максималь-
ную глубину свободное отверстие тройника закрывают пальцем и кате-
тер осторожно извлекают, поворачивая вокруг его оси. Отсасывание
путем продвижения катетера вперед и назад противопоказано. Продол-
жительность каждой аспирации не должна превышать 10—15 с. В за-
висимости от количества секрета в дыхательных путях данное мероприя-
тие повторяют 5—6 раз. При этом при отсасывании секрета из правого
бронха голову поворачивают в левую сторону, а из левого бронха — в
правую.
Во время отсасывания полезно применение вспомогательного кашля,
который осуществляет помощник, встав по другую сторону от больного.
Следует помнить, что даже при правильной технике аспирация не
безралична для больного в состоянии гипоксии и может вызвать тяже-
лые осложнения вплоть до прекращения сердечной деятельности. Поэто-
му перед аспирацией рекомендуется дать больному в течение нескольких
минут подышать чистым кислородом. Желательно применять катетеры
для одноразового 'использования. Если это 'невозможно, >после каждого
сеанса аспирации катетер тщательно промывают водой и помещают в
банку с антисептическими растворами (например, раствор этакридина
лактата 1 : 1000). Для отсасывания из трахеи, полости рта и носоглотки
необходимо применять два разных катетера, помещаемых в разные
банки.
Если не применяется искусственная вентиляция легких, вдыхаемый
воздух должен быть согрет и увлажнен (респираторы выполняют эту за-
дачу). Лучше всего это достигается подключением «искусственного но-
са» (Koch, Allander, Ingelstedt, Toremalm, 1958). «Искусственный нос»
конденсирует пары из выдыхаемого больным воздуха и увлажняет вды-
хаемый воздух за счет накапливающейся в нем влаги. Согревание ос-
новано на том же принципе (рис. 23). Предлагаются также увлажните-
ли по типу водяной бани (Chamney, 1969).
Деканюляция может быть произведена при следующих трех усло-
виях:
а) восстановление сознания у больного;
б) наличие эффективного произвольного кашля;
183
Рис. 23. «Искусственный нос».
в) полное исчезновение симптомов дыхательной недостаточности в
течение 24 ч после отмены искусственной вентиляции легких.
Некоторые авторы предлагают производить деканюляцию постепен-
но, ежедневно заменяя канюлю на меньшую по диаметру в течение 5—6
дней. Полное удаление такой канюли рекомендуется производить только
тогда, когда канюля наименьшего диаметра с закрытой пробкой нахо-
дилась в трахее больного в течение ночи без вредных последствий для
него.
Осложнения трахеостомии. Ранние осложнения связаны с самим хи-
рургическим вмешательством. Это внезапная остановка дыхания, реф-
лекторная или вызванная резким снижением рСО2 после вскрытия тра-
хеи. В редких случаях может развиться пневмоторакс, связанный с ра-
нением купола плевры; эмфизема средостения в результате засасывания
в него воздуха после вскрытия претрахеальной фасции. Неправильная
техника операции, спешка могут привести к ранению пищевода
(В. С. Лянде, 1959; Meade, 1961; Glas, 1962; Nicolas e. a., 1970).
Одним из наиболее частых поздних осложнений является соскальзы-
вание манжеты с канюли. При этом наблюдается либо полная обтура-
ция трахеи, либо клапанный эффект, когда больной делает вдох, но не
может осуществить выдох. Данное осложнение требует немедленного вы-
пускания воздуха из раздувной манжеты и извлечения канюли. Может
также произойти выпадение самой канюли из трахеи, в этой ситуации
у больного появляется голос и рото-носовое дыхание. Необходима сроч-
ная смена канюли. Могут развиваться поздние кровотечения как из ра-
ны (требующие ревизии ее и гемостаза), так и из дыхательных путей.
При последних необходимо обратить особое внимание на технику аспи-
рации и проводить ее по возможности более редко.
Грозным осложнением является фибринозно-некротический трахео-
бронхит. Причины его развития — попадание i дыхательные пути желу-
дочного содержимого, неправильная техника отсасывания, недостаточ-
ное увлажнение вдыхаемого воздуха. Detrie A962) указывает на роль
184
нарушений кровоснабжения органов дыхания после трахеостомии. Сим-
птомами фибринозно-некротического трахеобронхита служат появление
вязкого, трудноотделяемого гнойного секрета с зеленоватыми и корич-
невыми прожилками, наличие корок и пробок в нем, гнилостный запах
из трахеи, напоминающий запах при гангрене легкого. Часто к фибри-
нозно-некротическому трахеобронхиту присоединяются ателектазы.
Лечение фибринозно-некротического трахеобронхита заключается во
введении массивных доз антибиотиков с учетом чувствительности фло-
ры, постоянном капельном введении в трахею (со скоростью 4—6 ка-
пель в минуту) физиологического раствора E00 мл) с пенициллином
или мономицином B млн. ЕД), аскорбиновой кислотой A0 мл 5% рас-
твора), гидрокортизоном B50 мг), химотрипсином B0 мг) (В. Л. Кас-
силь, 1965; А. А. Балябин, 1966). Больных укладывают в положение по-
стурального дренажа, особое внимание обращают на настойчивую пер-
куссию и вибрацию грудной клетки перед каждой аспирацией. Пока-
зано искусственное дыхание с применением аппаратов, снабженных пол-
' ноценным увлажнителем, аэрозоли эвкалиптового масла, 1 % раство-
ра соды.
В результате воспалительных изменений стенки трахеи в последую-
щем может развиться ее стеноз. По данным ряда авторов, это осложне-
ние встречается в 1—8% наблюдений и требует хирургического вмеша-
тельства (Aboulker, 1962; Castaing, 1964; Chevalier, 1968; Hache e. a.,
1969, и др.).
Возникает справедливый вопрос, существуют ли противопоказания к
трахеостомии. Сага A959) считает таковыми большую спешку и отсут-
ствие опытного хирурга и рекомендует в подобной ситуации заменять
трахеостомию интубацией. Мы полностью согласны с этим, если учесть,
что такие обстоятельства нередко возникают в работе врачей скорой
помощи. Кроме того, мы считаем противопоказанием к трахеостомии не-
возможность обеспечения надлежащего ухода в последующем периоде.
Особенно у больных с начинающейся или уже развившейся пневмонией.
Длительная интубация трахеи. В последние годы намечается тенден-
ция по возможности избежать трахеостомии и заменить ее длительной
интубацией трахеи. Если при использовании резиновых эндотрахеаль-
ных трубок последние можно было без опасности развития осложнений
держать в трахее не более 24—48 ч (А. А. Берг, 1966; Echols e. а., 1950,
и др.)? то с появлением термопластических пластиковых трубок длитель-
ность безопасной интубации возросла до 20—35 сут. Правда, большинст-
во авторов рекомендуют держать трубку в трахее не более 5—6 сут,
меняя ее каждые 2 дня (Rui e. а., 1966; Сага, 1969; Otteni, Gauthier-La-
faye, 1969, и др.). Предпочтительнее назотрахеальная интубация, позво-
ляющая легко санировать полость рта, а больным, находящимся в созна-
нии, нормально питаться.
Назотрахеальная интубация может быть выполнена под наркозом с
миорелаксацией при помощи ларингоскопа или слепым путем (Porges,
1969), а также под местной инстилляционной анестезией. Для уменьше-
ния риска регургитации обязательно следует применять прием Селли-
ка — прижатие пищевода щитовидным хрящом. По данным Huguenard
185
с соавторами A967), располагающих большим опытом, 69% больных с
острой дыхательной недостаточностью центрального происхождения мо-
гут обойтись без трахеостомии при условии своевременной интубации.
По мнению некоторых авторов, осложнения при длительном стоянии
эндотрахеальной трубки возникают реже, чем при трахеостомии, и свя-
заны с травматичным введением трубки (Д. Деянов, П. Сатин, 1965;
Haines, Powell, 1955). Однако интубация по сравнению с трахеостомией
не обеспечивает столь хорошего дренирования дыхательных путей, осо-
бенно левого бронха. Поэтому при появлении сухого, вязкого секрета ре-
комендуется произвести трахеостомию.
Наличие канюли или интубационной трубки в трахее позволяет вос-
пользоваться аппаратами искусственного кашля (ИК-1 или ИКАР), со-
здающими кратковременное, от 0,1 до 0,5 с, разрежение воздуха в дыха-
тельных путях (Б. К. Осипов с соавт., 1964; Ю. Н. Шанин с соавт.,
1965, и др.).
Искусственная вентиляция легких
Искусственная вентиляция легких в сочетании с мероприятиями, на-
правленными на устранение нарушений гемодинамики, метаболизма и
свертывающей системы (крови, является од/ним из -существенных методов
восстановления функции организма при терминальных состояниях и
мощным средством лечения дыхательной недостаточности различной
этиологии.
Основными задачами искусственной вентиляции легких являются
поддержание нормальной оксигенации крови и удаление углекислоты.
Кроме того, при ряде патологических процессов работа по обеспечению
дыхания становится непосильной для больного и требует большого рас-
хода энергии (Bjork, 1964; Grenvik, 1966). В этих состояниях искусствен-
ная вентиляция легких, снимая нагрузку с дыхательной мускулатуры,
способствует перераспределению кислорода в организме, улучшает ок-
сигенацию жизненно важных органов.
Эффективность искусственной вентиляции легких во многом опреде-
ляется своевременностью ее проведения. В экстренных случаях, когда
нет возможности провести полноценное обследование больного, показа-
ниями к искусственной вентиляции легких являются: 1) отсутствие са-
мостоятельного дыхания; 2) грубые нарушения ритма или патологиче-
ские ритмы дыхания; 3) учащение дыхания более 40 в минуту, если это
не связано с анемией и гипертермией; 4) клинические симптомы гипок-
сии и гиперкапнии (спутанное сознание; влажность и цианоз или гипе-
ремия кожных покровов; артериальная и венозная гипертензия, тахикар-
дия и др.), не исчезающие после консервативных мероприятий и трахео-
стомии (В. Л. Кассиль, 1965).
Ряд авторов основными показаниями к искусственной вентиляции
легких считают развитие артериальной гипоксемии и гиперкапнии
(Л. М. Попова, 1960; В. А. Гологорский, 1971; Б. С. Кибрик и др., 1971;
Gardner, 1970). Однако указанные выше показания к искусственной
вентиляции легких весьма условны. Известно, что при ряде патологиче-
186
ских процессов, в частности при массивной кровопотере и травматиче-
ском шоке, нарушения газового состава крови и клиническая симптома-
тика гипоксии появляются уже при далеко зашедших и часто необра-
тимых поражениях паренхиматозных органов. По нашему мнению, когда
состояние больных позволяет провести более детальное обследование,
необходимость в искусственной вентиляции легких должна определяться
совокупностью факторов — характером и тяжестью патологических про-
цессов, приведших к дыхательной недостаточности (заболевание органов
дыхания, сердечно-сосудистая недостаточность, анемия), и состоянием
компенсаторных возможностей организма. Так, мы считаем целесооб-
разным расширить показания к искусственной вентиляции легких при
черепно-мозговой травме и в раннем послеоперационном периоде после
обширных операций на головном мозге, особенно сочетающихся с кро-
вопотерей, так как у этих больных даже умеренная гипоксия может сы-
грать фатальную роль. При внутричерепной гипертензии, вызванной
травмой или заболеваниями мозга, искусственная вентиляция легких с
умеренной гипервентиляцией легких способствует стойкому снижению
ликворного давления (С. И. Гельман, 1965; Л. Я. Белопольский, 1969;
Э. М. Николаенко, 1969; Wertheimer, 1960; Gordon, 1971). Известно так-
же благоприятное влияние гипокапнии на течение инфаркта головного
мозга (Soloway, 1968).
С целью профилактики развития тяжелых осложнений, обусловлен-
ных гипоксией и интоксикацией организма недоокисленными продукта-
ми обмена, искусственная вентиляция легких показана в раннем после-
операционном периоде у больных с нарушенными функциями внешнего
дыхания до операции (А. Е. Дорошенко и др., 1971), с хроническими
сердечно-сосудистыми заболеваниями (М. К. Учваткина и др., 1971), а
также у больных, перенесших массивную кровопотерю и интоксикацию
(перитонит, сепсис). По нашим данным, необходимость в проведении
искусственной вентиляции легких от нескольких часов до суток при
кровопотере до 3000 мл возникает главным образом у больных, перенес-
ших длительную артериальную гипотензию при невосполненной крово-
потере, а также после многократных хирургических вмешательств и
осложнений во время наркоза. При кровопотере от 3000 до 5000 мл ис-
кусственная вентиляция легких показана и тогда, когда снижение артери-
ального давления ниже критического уровня G0 мм рт. ст.) не превы-
шает 30 мин независимо от того, имеется ли гипо- или гипервентиляция
легких при кратковременном переводе больного на самостоятельное ды-
хание (К. П. Каверина, Н. М. Рябова и др., 1972).
Для проведения такой продолженной искусственной вентиляции лег-
ких некоторые авторы рекомендуют смену оротрахеальной интубацион-
ной трубки на назотрахеальную (А. И. Трещинский и А. А. Бунятян,
1966; Ю. Н. Шанин и др., 1968; Pontinen, 1967).
При сочетании вторичной и первичной дыхательной недостаточности,
когда имеется гипоксическая, циркуляторная и анемическая гипоксия
(пневмонии на фоне предшествовавшей массивной кровопотери), искус-
ственную вентиляцию легких следует начинать при максимальном на-
пряжении функций внешнего дыхания (минутный объем дыхания свыше
187
/ Рис. 24. Респиратор РО-2. Общий вид.
а — кривые давления (р) и скорости потока газа (v)
в дыхательных путях при использовании респиратора
РО-2; б — схема респиратора РО-2.
170% от должных величин при достаточно глубоком дыхании, но сни-
жении жизненной емкости легких до 30% и менее), когда насыщение и
напряжение кислорода в артериальной крови существенно еще не сни-
жается и имеется гипокапния. Абсолютными показаниями к искусствен-
ной вентиляции легких в этих состояниях является стадия субкомпенса-
ции или начала истощения функций дыхания (увеличение минутного
объема дыхания свыше 160% от должных величин за счет учащения ды-
хания более 30 вдохов в минуту), когда рСОг имеет тенденцию к повы-
шению до нормальных величин, а разница в насыщении крови кисло-
родом при дыхании 100% кислородом и воздухом превышает 10%
или предельно мала и не соответствует клиническим проявлениям ги-
поксии.
188
37
1 — электродвигатель; 2 — воздуходувка; 3 — золотник; 4 — тяга золотника; 5 — кран регулировки
^вентиляции; 6 — мембранный переключающий механизм; 7—пружина; 8 — колокол; 9 — упор;
10 —зажим; 11 — шкала; 12 —мех вдоха; 13 —мех выдоха; 14 — клапан регулировки разрежения;
15 — кран переключения закрытой и полуоткрытой систем; 16, 18 — кран переключения на собст-
венное дыхание; 17 —клапан забора воздуха; 19 —клапан сброса давления; 20 —кран сопротивле-
ния выдоху; 21 — предохранительный клапан разрежения; 22 — влагосборник; 23 — увлажнитель;
24 —предохранительный клапан давления; 25 — кнопка манометра; 26 — манометр; 27 — тройник;
-28 — переходник; 29 — водяной замок; 30 — резиновый мешок; 31 — ротаметры кислорода и закиси
азота; 32 — регулятор отношения времени вдоха и выдоха; 33 — кнопка экстренной подачи кислоро-
-да; 34 — предохранительный клапан ротаметров; 35— кран отключения увлажнителя; 36, 37 —кла-'
паны.
При дыхательной недостаточности, обусловленной патологическими
процессами в органах дыхания или нарушением функций регулирующих
их систем, но при отсутствии анемии и грубых нарушений перифериче-
ского кровообращения устойчивость организма к гипоксии несколько
выше. Поэтому в ряде случаев, как, например, при нарушении трахео-
бронхиальной проходимости, гемо-пневмотораксе, острую дыхательную
недостаточность часто удается устранить консервативным путем. Однако
при развитии трудно устранимых патологических процессов (тяжелые
пневмонии, миастения, миелорадикулоневрит) искусственная вентиляция
легких является необходимым компонентом комплексного лечения.
В этих состояниях к искусственной вентиляции легких можно прибегать
и в более поздних стадиях дыхательной недостаточности, а именно на
фоне гиповентиляции легких и гиперкапнии. Для оказания экстренной
помощи при острых нарушениях дыхания наиболее эффективным мето-
189
Рис. 25. Респиратор Энгстрема. Общий вид.
а — кривые давления (р) и скорости потока газа (v)
в дыхательных путях при использовании респиратора
Энгстрема; б — схема респиратора Энгстрема.
дом считается искусственное дыхание по способу «изо рта в рот» или
«изо рта в нос», а также интубация больного и проведение искусственной
вентиляции легких мешком Рубена, наркозным аппаратом или РПА'.
Однако при тяжелых и длительных нарушениях дыхания наиболее эф-
фективным методом является искусственная вентиляция легких с по-
мощью респираторов.
В экстренных условиях большие надежды возлагаются на респира-
торы, регулируемые отклонением струи газа и не имеющие движущихся
1 Методы проведения экспираторного искусственного дыхания подробно описаны
в главе XX.
19©
ил^ « , ,, in .» л— ' " г — j ~г jr~»»» "vmoi, sj—• эжекторная система актив-
ного выдоха; 10 —манометр давления в шлангах; 11 — регулятор положительного давления в стек-
лянном цилиндре, 12— манометр давления в цилиндре; 13 —регулятор заполнения мешка (вентило-
метр); 14 — предохранительный клапан мешка; 15 — переключатель подачи кислорода- 16 — оотамет-
Кр£?СЛ°Р£Да И 3аКИСоп а30Та; 17-клапан выдоха; 18-клапан свободного вдоха; ' 19 - манометр
эжекторной системы; 20 — переключатель спирометра и создания сопротивления выдоху 21 — пере-
ключатель ручной и автоматической вентиляции; 22 — водяной замок; 23 — спирометр- 24 — шланг
вдоха; 25 — шланг выдоха; 26 — увлажнитель; 27 —влагосборник; 28 — регулятор частоты дыхания
деталей — Целог, РД-300 и др. В условиях стационара наибольшее рас-
пространение получили объемные аппараты типа РО-3, РО-5 (рис. 24),
частотные респираторы непрямого действия — аппарат Энгстрема'
АНД-2 (рис. 25) и прямого действия ДП-8 (рис. 26). Вопрос об эффек-
тивности прессциклических респираторов (ДП-1, ДП-2 и др.) до настоя-
щего времени всеми решался отрицательно (Л. М. Попова, 1962;
В. М. Юревич, 1966, и др.). Однако появились сообщения о необходимо-
сти пересмотреть эту точку зрения. При возможности регулировать ско-
рость потока газа в достаточно широких пределах прессциклические
аппараты обладают рядом преимуществ, в частности, они могут быть
приспособлены к любому ритму дыхания больного (Herzog, 1965).
Подготовка больного. Если сознание сохранено, следует объяснить
больному предстоящие мероприятия, предупредить о возможности не-
приятных ощущений вначале, убедить его в необходимости проведения
искусственной вентиляции легких. Тщательно выслушать легкие (нет
191
Рис. 26. Респиратор ДП-8. Общий вид.
а — кривые давления (р) и скорости потока газа (v)
в дыхательных путях при использовании респиратора
ДП-8; б — схема респиратора ДП-8.
ли пневмоторакса). Если позволяет время, произвести рентгенографию
Грудной клетки. Проверить герметичность раздувной манжетки на каню-
ле или эндотрахеальной трубке, измерить частоту и объем спонтанного
дыхания, тщательно отсосать секрет из дыхательных путей.
Подготовка респиратора. Проверить двигатель на разных
режимах, несколько раз включить и выключить аппарат. Проверить
подачу кислорода. Проверить, промыты ли шланги, нет ли в них воды,
чисты ли присоединительные элементы, все ли они на месте, есть ли вода
в увлажнителе и в водяном замке (последний вначале должен быть
.открыт). Включив аппарат, установить желаемые параметры, присоеди-
нить к нему мешок Дугласа и посмотреть, как он раздувается и спадает-
192
,23
К большому
1 —. электродвигатель; 2 — редуктор; 3 — зксцентрико-кулисный механизм; 4 —шток; 5 —мех;
6 — предохранительный клапан; 7 — шланг; 8 — вентиль; 9 — шланг; 10 — влагосборник; 11 — дюза;
12 — клапан выдоха; 13 —канюля, 14 — клапанная коробка; 15 — клапан вдоха; 16 — отстойник;
17 —водяной манометр; 18 — увлажнитель; 19— шланг; 20 — мех ручного дыхания; 21 — клапанная
коробка; 22 —фильтр; 23 —ротаметр кислорода; 24 —вентиль; 25 — шланг; 26 —редуктор; 27 —рас-
пределительный клапан.
ся. На респираторах Энгстрема и АНД-2 проверить спирометр, на аппа-
ратах типа РО-5 — волюметр. Убедиться в соответствии фактических
объемов задаваемым.
Адаптация больного к искусственной вентиляции легких в ряде слу-
чаев является сложной задачей. Большинство авторов применяют с этой
целью препараты, угнетающие спонтанное дыхание — наркотики, нейро-
плегики, оксибутират натрия и даже миорелаксанты (М. К. Учваткина
и др., 1971; Garin, 1963; Dor, 1964, и др.). Однако мы убедились, что
отсутствие синхронизации дыхания больного с респиратором является
чаще всего признаком относительной гиповентиляции или гипоксии в
результате недостаточности минутного объема дыхания, непроходимости
13 Заказ Л'е 1266
193
дыхательных путей, уменьшения функционирующей легочной поверх-
ности (возникновение ателектазов, пневмония) и нарушения легочного
кровообращения, а также результатом неприятных ощущений, испыты-
ваемых больным в процессе искусственной вентиляции легких (В. Л. Кас-
силь, 1969, 1971). Только при полной невозможности устранения причин
несинхронного дыхания можно применять угнетающие дыхание препара-
ты. Что же касается мышечных релаксантов, то их введение является
свидетельством полной беспомощности врача и оправдано только при
судорожном синдроме и чрезвычайно острых ситуациях, когда нецелесо-
образно затрачивать время на применение других методов синхрониза-
ции и ожидать от них эффекта.
Мы начинаем обычно адаптацию больного к респиратору, подавая
команды «вдох — выдох», если больной в сознании, а также подбирая
такие величины минутного объема дыхания и частоту, при которых
больной не чувствует недостатка воздуха. Сразу же отметим, что ми-
нутный объем дыхания при искусственной вентиляции легких должен
превышать спонтанный минимум на 2—3 л. Увеличиваем подачу кисло-
рода во вдыхаемой газовой смеси обычно до 50%, а при особо тяжелых
ситуациях — до 70—80%. Если в течение 5—10 мин указанные приемы
не дают эффекта, прибегаем к ручной вентиляции легких при помощи
мешка или меха аппарата, сначала при совпадении со спонтанными
вдохами и некотором опережении их, затем, когда больной перестает
участвовать в дыхании, медленно урежаем вдохи и переходим на авто-
матическую вентиляцию легких.
Если все перечисленные мероприятия не дают эффекта или с самого
начала имеются признаки грубого нарушения деятельности дыхатель-
ного центра, следует ввести 2 мл 1% раствора промедола с 1 мл ди-
медрола или супрастина внутривенно, при неэффективности последних —
1 мл 1% раствора морфина. Те же вещества показаны, если искусствен-
ная вентиляция легких сопровождается болевыми ощущениями (напри-
мер, при переломах ребер и недостаточной местной анестезии).
Релаксанты короткого действия вводят только при неэффективности
всех предыдущих мероприятий или при внезапном развитии угрожаю-
щего состояния. За время релаксации следует постараться выявить и
устранить причину несинхронное™. Введение релаксантов длительного
действия, оправданное лишь при некоторых видах патологии (столбняк,
двигательное возбуждение после асфиксии и барбитуровой комы, астма-
тический статус и др.), требует исключительно внимательного наблюде-
ния за больным и настороженности всего персонала.
Признаками полной адаптации к респиратору являются небольшие
дыхательные движения, синхронные с аппаратом, без участия крыльев
носа и апноэ в течение 10—15 с после выключения респиратора.
При появлении несинхронности дыхания больного с респиратором
в последующие дни следует немедленно проверить герметизм шлангов
и присоединительных элементов, функцию респиратора и положение
манжетки (на возможное ее смещение!). При малейшем подозрении на
отсутствие герметизма необходимо выпустить из манжетки воздух и
сменить канюлю. Необходимо тщательно проверить проходимость дыха-
194
тельных путей, выслушать легкие, сделать ренпенограмму на возмож-
ное наличие пневмоторакса!
Выбор минутного объема дыха и и я п в д ых а е м о и
смеси. Ряд исследователей считают, что во время искусственной вен-
тиляции легких следует поддерживать нормокапнию в артериальной
крови (В. Д. Малышев, 1966; Pontinen, 1967). Однако в подавляющем
большинстве наблюдений «зона комфорта» при искусственной вентиля-
ции легких достигается при умеренной гипокапнии, т. е. рСО2 25—30 мм
рт. ст. (Л. М. Попова, 1965; В. Л. Кассиль, 1971; Сага, 1964). По-види-
мому, в условиях нарушенного кровообращения, что часто наблюдается
при острой дыхательной недостаточности, нормокапиия артериальной
крови сочетается с тканевым ацидозом, который корригируется гипер-
вентиляцией. Поэтому в остром периоде основным показателем адекват-
ности вентиляции мы считаем ощущения и поведение больного. Если
последний не отмечает недостатка воздуха, спокоен, легко адаптируется
к респиратору, минутный объем дыхания считается достаточным.
Для выбора адекватного минутного объема дыхания в каждом слу-
чае могут быть использованы наряду с клиническими данными показа-
тели кислотно-щелочного равновесия, артерио-венозная разница по
кислороду и углекислоте, реовазография (в том числе реоэнцефалогра-
фия) и ЭЭГ. Только комплексное обследование позволяет наиболее пол-
ноценно решить вопрос об адекватности вентиляции. Попытки устано-
вить объем искусственной вентиляции легких по номограммам Энгстре-
ма-~ Герцога, Редфорда, Наина и Кении при острой дыхательной недо-
статочности Приводят, как правило, к выраженной гиновентиляции
(А. В. Гологорский, 1971; Л. М. Попова, 1971). Этот факт особенно про-
является при снижении вентиляциоино-перфузионного соотношения в лег-
кИх (М. Н. Дубова и С. Г. Птушкина, 1971; Mollaret e. а., 1959).
Хорошо известно, Что даже у людей со здоровыми легкими при ис-
кусственной вентиляции легких имеется значительная разница между
рО2 в альвеолярном воздухе и в артериальной крови (Frumin с. а., 1959,
и др.)- Поэтому автоматическую вентиляцию легких необходимо прово-
дить газовой смесью, обогащенной кислородом. Степень необходимого-
обогащения может быть выбрана на основании динамического оксигемо-
графического контроля. При наиболее тяжелых формах дыхательной
недостаточности, особенно при поражении легочной ткани, приходится
длительно пользоваться 100% кислородом, постепенно снижая его со-
держание в смеси по мере улучшения состояния больного и оксигемо-
графических показателей. Обнадеживающие результаты получены при
применении гелиево-кислородной смеси. Однако вопрос о возможности
и безопасности длительного применения высоких концентраций кисло-
рода нуждается в дальнейшем изучении.
Далеко не все респираторы обеспечивают полноценное согревание я
увлажнение вдыхаемого воздуха. Наилучшим увлажнителем в настоя-
щее время считается ультразвуковой распылитель (М. Б. Шмерельсон
и др., 1971; Norlander, 1965, 1968; Kay, Allen, 1971), а также генератор
электроаэрозолей, изготовленный в Тартуском университете (Л. М. По-
пова, 1971). Некоторые авторы рекомендуют наряду с обычным увлаж-
13* 195
нителем применять дополнительно «искусственный нос» (В. М. Юревич,
Ю. С. Гальперин, 1968).
Отрицательное влияние искусственной вентиля-
ции легких на внутригрудное и легочное кровообра-
щение и методы его устранения. Работами Werko A947),
Cournand A948), Maloney A954), Hubay A954, 1955) и др. установлено,
что в результате повышения внутригрудного давления во время вдоха
при искусственной вентиляции легких происходит снижение венозного
притока крови к сердцу и легким и уменьшение ударного объема серд-
ца. Это неблагоприятное влияние наиболее выражено при гиповолемии
(Morgan e. а., 1969) (когда компенсация за счет увеличения венозного
притока к сердцу невозможна или ослаблена) и почти совсем отсут-
ствует при снижении бронхиальной проходимости ввиду большого гра-
диента давлений между трахеей и альвеолами. Общеизвестны методы
уменьшения этого влияния — удлинение фазы выдоха (Motley, 1948;
Beck, 1952), активный выдох (Stoffregen, 1961; Wertheimer, 1962), венти-
ляция малыми объемами, с большой частотой (Gray, 1959), асинхронное
дыхание (В. С. Гигаури, 1966). Однако при тяжелых нарушениях рас-
пределения газа в легких и большой частоте искусственного дыхания не
следует стремиться к удлинению выдоха за счет укорочения вдоха. При
указанных условиях больные лучше всего переносят соотношение дли-
тельности фаз 1 : 1,5 или 1:1. Активный выдох способствует спадению
бронхиол (синдром «воздушной ловушки») и увеличению физиологиче-
ского мертвого пространства (Watson, 1962; Rosen, 1965; Bryant, 1967,
и др.). Активный выдох абсолютно противопоказан при отеке легких,
переломах ребер, бронхиальной астме, ателектазах. В последнее время
он применяется нами только при кровопотере и внутричерепной гипер-
тензии. Большая частота искусственного дыхания (более 24 дыханий в
минуту) способствует нарушению распределения газа в легких и обра-
зованию ателектазов и не должна применяться в течение длительного
времени — более 1—2 ч. Асинхронное дыхание неприменимо без мы-
шечной релаксации и не может использоваться в реаниматологической
практике.
Другим отрицательным и трудно устранимым эффектом искусствен-
ной вентиляции легких является нарушение легочного кровообращения
(Spalding, Crampton-Smith, 1969) и равномерности вентиляции отдель-
ных участков. Объем вентилируемых, но не перфузируемых альвеол воз-
растает почти на 70%, что резко увеличивает физиологическое мертвое
пространство и свидетельствует о нарушении общего вентиляционно-
перфузионного соотношения (А. П. Зильбер, 1971). В результате насту-
пает изменение механических свойств легких, в первую очередь сниже*
яие их податливости и развитие микроателектазов *. Этому способствует
и обездвиженность больных. Как известно, уже через 20—30 мин непо-
1 Следует отметить, что эти данные получены в эксперименте или у людей со здо-
ровыми легкими. При уже имеющихся ателектазах искусственная вентиляция легких
в ряде случаев способствует расправлению спавшихся альвеол и уменьшению шунтиро-
вания крови.
196
движного лежания больного начинается выключение из дыхания отдель-
ных участков нижних отделов легких (Campbell, Nunn, 1958; Radford,
1962, и др.)- Особенно выражены эти изменения при большой скорости
газового потока (Jamamura, 1962). В связи с этим для предотвращения
снижения податливости легких рекомендуется периодически, каждые
45—60 мин, увеличивать дыхательный объем до 800—1000 мл на
8—10 мин (Takumi, Aochi, 1970), что на некоторых респираторах делает-
ся автоматически. Такое перераздувание также уменьшает внутрилегоч-
ное шунтирование крови (Nunn e. а., 1965). Необходимо возможно чаще
менять положение больного. Желательно дыхание с частотой 18—20 в
минуту.
Осложнения искусственной вентиляции легких.
Одним из наиболее частых осложнений является пневмония, которая в
той или иной степени развивается почти у каждого больного (Burmeister
е. а., 1968). Нередки также трахеобронхиты вплоть до фибринозно-не-
кротических и ателектазы, которые, по данным В. П. Дорощука A963),
развиваются при искусственном дыхании чаще, чем при спонтанном.
Применение гелиево-кислородной смеси и антибиотиков широкого спект-
ра действия, отказ от активного выдоха при отсутствии прямых к нему
показаний и тщательная аспирация секрета из дыхательных путей позво-
ляют в большинстве наблюдений предотвратить появление ателектазов.
Грозным осложнением является пневмоторакс, одним из первых при-
знаков которого служит десинхронизация дыхания больного с респира-
тором. Установить достоверную связь пневмоторакса с величинами дав-
ления в трахее во время вдоха не удается, у некоторых больных он
возникал при относительно невысоких величинах — 20—25 см вод. ст.
Чаще он развивается у резко истощенных, ослабленных больных и при
наличии абсцедирующей пневмонии. Известны случаи, когда причиной
пневмоторакса являлась неисправность респиратора (Dean e. а., 1971).
При возникновении этого осложнения показана немедленно пункция
плевральной полости и постоянное ее дренирование. Как правило, это
способствует расправлению легкого.
В результате длительного газового алкалоза и компенсаторного
уменьшения реабсорбции бикарбонатов в почечных канальцах может
развиться почечнокаменная болезнь (Л. М. Попова, 1971). Описаны та-
кие осложнения, как сердечная аритмия, вызванная активным выдохом
(Pace-Floridia, Galindo, 1968), повторные фибрилляции желудочков в
связи с резкой гипокапнией (Wirght, Digiovanni, 1969), острый пневмо-
перикардит (Willnow, 1968).
Перевод больных на самостоятельное дыхание явля-
ется ответственным моментом. Естественно, прекращать искусственную
вентиляцию легких можно только при отсутствии клинических признаков
гипоксии и гиперкапнии, стабилизации гемодинамики и нормализации
кислотно-щелочного равновесия и газового состава крови. Частота само-
стоятельного дыхания не должна превышать 30 в мин. Однако решающее
значение имеет динамическое исследование функций дыхания. По мнению
ряда авторов, снижение жизненной емкости легких более чем на 50% от
должной, нарастающая спонтанная гипервентиляция, особенно за счет
197
тахипноэ, высокое поглощение кислорода наряду с повышенным содер-
жанием органических кислот в плазме являются показанием к продол-
жению искусственной вентиляции легких (М. К. Учваткина, 1971;
В. Г. Кудряшов, 1971; Mollarel, 1958; Chopin, 1962). Следует отметить
две самые распространенные ошибки при проведении искусственной вен-
тиляции легких — слишком позднее подключение и слишком раннее от-
ключение больных от респиратора.
Мы начинали отключение респираторов от больных сначала не более
чем на 30 мин, когда разница в насыщении крови кислородом при ды-
хании 100% кислородом и воздухом не превышала 10%. Показаниями к
возобновлению искусственной вентиляции легких было учащение дыха-
ния и пульса, повышение артериального давления, увеличение минутного
объема дыхания за счет учащения дыхания, нарастание гипокапнии и
метаболического ацидоза. По мере улучшения состояния и нормализа-
ции приведенных выше показателей сроки отключения больных от рес-
пираторов удлиняли. Окончательно искусственную вентиляцию легких
прекращали при нормальной температуре тела больного, отсутствии
обширных нагноительных процессов, когда на протяжении 5—6 ч само-
стоятельного дыхания минутный объем дыхания существенно не изме-
нялся или увеличивался за счет углубления дыхания, но не более чем
до 170% от должных величин, и когда данные кислотно-щелочного рав-
новесия свидетельствовали о полном благополучии (не нарастала гипо-
капния и метаболический ацидоз). Чем дольше проводили искусствен-
ную вентиляцию легких, тем длительнее был процесс отключения боль-
ных от респираторов, в среднем он занимал 3—4 сут.
Для более быстрой адаптации больного к самостоятельному дыханию
полезно во время периодов отключения от респиратора проводить дыха-
тельную гимнастику.
Проведение искусственной вентиляции легких при
различных .патологических процессах имеет свои особенности.
У больных с резко сниженным объемом циркулирующей крови пока-
зано применение небольших дыхательных объемов C50—500 мл) при
большой частоте дыхания B6—30 в минуту) и активном выдохе. В этих
условиях наряду с тщательным контролем за артериальным давлением
желательно измерение центрального венозного давления в динамике, что
позволит своевременно зарегистрировать снижение венозного притока к
сердцу и изменить режим искусственной вентиляции легких.
При множественном переломе ребер искусственная вентиляция легких
являемся не только методом лечения дыхательной недостаточности, но
и способом пневматической стабилизации отломков. Обычно приходится
начинать с очень больших минутных объемов — до 20 л/мип и более.
Хорошая адаптация возможна только после тщательной анестезии.
Активный выдох противопоказан. При отсутствии легочных осложнений
длительность искусственной вентиляции легких колеблется в пределах
2—3 нед (В. Л. Кассиль, 1965; Hardy, 1963; Сага, 1967; Poisvert, 1967,
и др.). Травматический пневмоторакс не является противопоказанием к
искусственной вентиляции легких, но требует тщательного дренирования
плевральной полости и строгого контроля.
198
При внутричерепной гипертензии, вызванной травмой или заболева-
ниями мозга, показан активный выдох с целью улучшения венозного
оттока в системе верхней полой вены.
У больных, находящихся в коматозном состоянии, особенно после
травмы, очень часто возникает регургитация и затекание крови в тра-
хею, в связи с чем им с первых же часов показано тщательное дрениро-
вание бронхиального дерева. Поэтому больным с травмой мозга показано
раннее наложение трахеостомы, тем более что искусственную вентиляцию
легких приходится проводить в течение длительного времени —
15—20 сут и более.
Большие трудности возникают при проведении искусственной венти-
ляции легких у больных с нарушением легочного кровообращения.
В связи со значительным увеличением физиологического мертвого про-
странства им приходится задавать чрезвычайно большие объемы как
дыхательные, так и минутные. Кроме того, в этих условиях абсолютно
необходимо наряду с искусственной вентиляцией легких применение
антикоагулянтов, а по показаниям — и фибринолитической терапии.
Большие объемы приходится также применять при хронических за-
болеваниях легких. У этих больных методика искусственной вентиляции
легких зависит от характера поражения легких. При обструктивных
процессах показано более редкое дыхание A8—20 в минуту) с больши-
ми дыхательными объемами (800—850 мл). При этом больные легко
переносят большие величины трахеального давления (до 45—50 см
вод. ст.). При рестриктивных процессах приходится прибегать к более
частому дыханию B6—28 в минуту) малыми дыхательными объемами
(В. Л. Кассиль, Н. П. Пронина, 1969; Mollaret, 1959). У этих больных
повышение трахеального давления выше 35—40 см вод. ст. вызывает
ощущение распирания в груди и нарушения гемодинамики. Отметим
здесь же, что подобной методики приходится придерживаться при рез-
ком снижении податливости грудной стенки, ожирении, синдроме Пикви-
ка (Sarcinelli, Josi, 1969).
Особо следует подчеркнуть, что у больных с длительно существую-
щей гиперкапнией быстрое снижение рСО2 может привести к остановке
сердца (Pontoppidan, 1965; Nitter-Hauges, 1966, и др.)- У большинства
больных нормализация кислородного баланса и кислотно-щелочного рав-
новесия наступает очень медленно, искусственную вентиляцию легких
приходится проводить в течение 4—6 нед, особенно при обострении хро-
нической пневмонии. Хорошим прогностическим при наком является
возможность постепенно снизить минутный объем дыхания и уменьшить
содержание кислорода во вдыхаемом воздухе.
При остром отеке легких, а также при массивных двусторонних пнев-
мониях, сопровождающихся интерстициальпым отеком, искусственную
вентиляцию легких необходимо проводить газовой смесью с высоким
содержанием кислорода и под постоянно повышенным давлением (т. е.
с сопротивлением выдоху), повышая среднее давление в трахее до +10,
+ 15 см вод. ст. При этом не следует проводить аспирацию жидкости из
трахеи (Г. Н. Андреев, 1964; В. Л." Кассиль, 1971; Pariente, 1968; Askrog,
3967; Russel, 1971, и др.). Повышенное внутрилегочное давление способ-
199
ствует вытеснению отечной жидкости из альвеол в кровеносное русло,
снижает приток крови к сердцу из полых вен и к легким через систему
легочной артерии, препятствует спадению бронхиол и альвеол, увеличи-
вает функциональную остаточную емкость легких, резко уменьшает ве-
нозное шунтирование и повышает напряжение кислорода в артериальной
крови.
Вспомогательная искусственная вентиляция лег-
ки х. В последние годы этот метод получает все большее распростране-
ние в целях профилактики и лечения острой дыхательной недостаточ-
ности в пред- и послеоперационном периоде, а также при острых и хро-
нических заболеваниях легких. Вспомогательную искусственную
вентиляцию легких проводят через загубную или рото-носовую маску
двумя способами: аппаратами с триггерной (откликающейся) системой,
когда больной сам регулирует частоту дыхания (Schorer, 1966; Sasahara»
1967; Just, 1969, и др.), и автоматическими респираторами, когда боль-
ной приспосабливается к заданной частоте (В. М. Юревич и др., 1971;
О. И. Горбатов и др., 1971; В. М. Воробьев, 1972, и др.). Наибольшее
распространение получил второй способ, хотя адаптировать больного к
аппарату удается обычно только через 3—4 сеанса, которые проводят
ежедневно 1—3 раза по 30—40 мин. В отдельных наблюдениях вспомо-
гательную искусственную вентиляцию легких мы продолжали почти
непрерывно в течение длительного времени; у одного больного с пневмо-
склерозом, эмфиземой легких, хронической пневмонией и тяжелой деком-
пенсацией (рСО2 доходило до 120 мм рт. ст.) вспомогательную искусст-
венную вентиляцию легких респиратором Byrd Mark-8 мы проводили в>
течение 1V2 лет.
XII
ТЕРМИНАЛЬНЫЕ СОСТОЯНИЯ,
ВЫЗВАННЫЕ КРОВОПОТЕРЕЙ
И ТРАВМОЙ
Патогенез тяжелых стадий острой кровопотери и травмы. В клини-
ческой картине терминальных стадий острой кровопотери и тяжело-
го травматического шока (III—IV стадии) есть общие черты: блед-
ная холодная кожа, частый малый пульс, одышка, жажда, беспо-
койство и др. Сходными оказываются и многие гемодинамические тесты:
снижение артериального давления ниже критического уровня, гиповоле-
мия (снижение объема циркулирующей крови), низкое центральное
венозное давление, анемия, гипопротеинемия, малый сердечный выброс,
плохое кровенаполнение периферических тканей и др. На этом основа-
нии большинство исследователей объединяют эти состояния в группу
гиповолемического шока. Сходство клинической симптоматики и харак-
тера нарушений делает возможным выработку единого подхода к лече-
нию тяжелых стадий острой кровопотери и травматического шока. Как
отмечает В. А. Неговский A960), чем ближе к периоду развития терми-
нальных состояний, тем больше выявляется общих закономерностей»
независимо от причины развития патологического процесса. Поэтому,,
исходя из основного принципа лечения терминальных состояний, перво-
очередной задачей становится нормализация основных функций орга-
низма— кровообращения и дыхания. Однако такой подход оправдан
лишь при проведении неотложных лечебных мероприятий, направлен-
ных на устранение опасных для жизни нарушений.
Для дальнейшего успеха проводимого лечения необходимо учиты-
вать, что, несмотря на известное сходство, имеются существенные раз-
личия в этиологии, патогенезе нарушений функций при «чистой» крово-
потере и множественной тяжелой травме. Особенно это важно при ле-
чении начальных их стадий.
При кровопотере основной причиной развития патологического про-
цесса является уменьшение объема циркулирующей крови, что вызывает
прежде всего нарушения гемодинамики. Вследствие нервнорефлекторных
влияний быстро включаются основные компенсаторные реакции: центра-
лизация кровообращения вследствие спазма периферических сосудов,,
приток жидкости в сосудистое русло из интерстициального пространства
и др. Благодаря этим механизмам кровопотеря до известного предела
может быть компенсирована.
20*
Патогенетически обоснованным при кровотечениях, помимо остановки
кровотечения, является прежде всего возмещение объема циркулирую-
щей крови и жидкости в организме. Если можно немедленно восполнять
кровопотерю «капля за каплю» (например, во время операций), то даже
при массивной кровопотерс патологические сдвиги не возникают или
они будут значительно меньше выражены, чем при невозмещснной крово-
иотере. Осложнения при лечении больных с кровопотерей будут, как пра-
вило, в случаях продолжительных кровотечений, особенно в случаях,
сопровождающихся периодом гипотензии (снижение артериального дав-
ления ниже 80 мм рт. ст) или при запоздалом возмещении кровопотери.
Термином «травматический шок» принято обозначать состояние при
тяжелых травматических повреждениях, сопровождающихся клинически
выраженными нарушениями кровообращения, дыхания, общим тяжелым
состоянием больных (Н. Н. Бурденко, 1938; С. И. Банайтис, 1948;
М. Г. Шрайбер, 1962; Н. А. Беркутов и др., 1963; Г. Д. Шушков, 1967,
и др.). Патогенез этого состояния значительно сложнее. Помимо крово-
потери, которая почти всегда имеет место при травматических повреж-
дениях, важную роль играют патологическая афферентная импульсация
(в том числе болевая) из места повреждения, а также нарушение функ-
ций поврежденных органов. Наряду с описанными выше неспецифиче-
скими нарушениями имеются специфические, зависящие от объема и
локализации травмы.
Только возмещения кровопотери, даже на ранних этапах лечения,
у больных с травматическим шоком недостаточно, чтобы вывести их из
тяжелого состояния (М. Г. Шрайбер, 1964, и др.)- Патогенетически
обоснованным может быть только комплекс лечебных мероприятий, на-
правленный на устранение основных нарушений. Помимо возмещения кро-
вопотери и устранения острой дыхательной недостаточности (в пока-
занных случаях), важную роль играет ликвидация или блокирование
очага патологической импульсации и восстановление или протезирова-
ние функции поврежденных органов.
Основные патологические сдвиги при терминальных стадиях острой
кровспотери и тяжелом травматическом шоке (III—IV стадии). Соглас-
но современным представлениям, кардинальными симптомами шока
является уменьшение объема циркулирующей крови в сочетании с
уменьшенным возвратом крови к правому сердцу, сниженным вследствие
этого центральным венозным давлением, уменьшенным сердечным вы-
бросом (Rashincr е. а., 1962; Wilson, 1965; Shomaker, 19C5; Haidaway с. а.,
1967; Ване, 1969). Артериальная гипотензия также характерна для тя-
желых стадий шока. Несмотря на относительное значение этого показа-
теля, установлена четкая корреляция между уровнем артериального дав-
ления и тяжестью шока (Л. Н. Губарь, Н. И. Егурнов, 1965).
Малый сердечный выброс объясняется главным образом уменьшени-
ем притока крови к правому сердцу. Понижение сократительной функции
миокарда при шоке имеет вторичный характер.
На основании экспериментальных и клинических наблюдений уста-
новлено, что тяжелые стадии шока развиваются при уменьшении объема
циркулирующей крови на 30—40% (Д. Д. Мехтиханов, 1967; И. С. Жо-
202
ров и др., 1967; Cournand e. а., 1943; Noble, Gregersen, 1946; Clarke e. a.,
1956; Shomaker, Jida, 1962). Гиповолемия обусловлена прежде всего
кровопотерей. Однако для тяжелых стадий шока характерно сохранение
ее, несмотря на возмещение кровопотери и даже на введение в организм
излишних количеств жидкости (А. И. Трещинский, Л. П. Чепкий, 1966;
С. П. Маркин, В. М. Стрекаловский, 1967; Prentice с. а., 1954; Shomaker,
1965). Установлено, что чем тяжелее состояние больных, длительнее
гипотензия или позднее переливание крови, тем больше выражен дефи-
цит объема крови после трансфузии, восполняющей предполагаемую
кровопотерю. Это происходит прежде всего в результате патологическо-
го депонирования крови вследствие нарушения микроциркуляции и ре-
гионарного кровотока (см. главу III).
Как уже отмечалось, в начальных стадиях шока централизация кро-
вообращения, т. е. поддержание кровотока в мозге, крупных сосудах,
венечных артериях (В. А. Неговский и др., 1960; Г. Ш. Васадзе, 1960;
Cannon, 1943; Wiggers, 1950) сопровождается уменьшением кровоснаб-
жения в других тканях организма в результате вазоконстрикции.
Chambers и Zweifach A944), Ю. М. Левин A965, 1973), С. А. Селез-
.нев A971), Д. М. Шерман A972) отмечали фазные изменения в сосудах
органов и тканей подопытных животных. Первоначально имелось увели-
чение активности артериол, шунтирование кровотока (переход крови из
артериол в веиулы, минуя капилляры по артерио-венозным анастомо-
зам), затем ослабление активности артериол и прекапиллярных сфинк-
теров при одновременном нарастании венозного и капиллярного застоя
(до полного стаза) под влиянием гуморальных факторов. Нарушения
микроциркуляции усугубляются агрегацией форменных элементов крови
(Knisely, 1945; Gelin, 1956), появлением в кровотоке капель нейтрально-
го жира (Ю. М. Левин, 1965), увеличением вязкости крови (Shomacker,
1965; Litwin, 1965).
По данным Crowell A954), Hardaway и McKay A963), медленно
движущаяся кровь, имеющая кислую реакцию, обладает повышенной
свертываемостью, приводящей к диссеминированной внутрисосудистоп
ее коагуляции. Гиперкоагуляция сопровождается расходованием сверты-
вающих факторов, что можно заметить по лабораторным тестам (см.
главу XIV). Вследствие частичной или полной обтурации отдельных
концевых артериол микротромбами прекращается перфузия отдельных
участков тканей. Молочная кислота продолжает скапливаться, создавая
тяжелый местный ацидоз, в результате которого происходит инактива-
ция клеточных ферментов и часть клеток погибает. Восполнение крово-
потери и возобновление перфузии уже не ведет к их восстановлению.
Однако оставшиеся жизнеспособные клетки в значительной степени их
заменяют (Н. П. Романова, 1962; Г. А. Акимов, 1971; М. Г. Вейль, 1971).
Образование микротромбов ведет к активации эндогенного фибриноли-
зина, что клинически проявляется появлением повышенной кровоточи-
вости (М. С. Мачабели, 1970). Как считает Hardaway, это клиническое
проявление необратимого состояния при шоке.
Существенное влияние па изменение функций при шоке оказывают
также нарушения регионарного кровотока. Большинство исследовате-
203
лей, изучавших шок в1 экспериментах на собаках, отмечали ишемию^
а затем скопление крови в системе мезентериальных сосудов в резуль-
тате повышения резистентности в системе воротной вены и печеночных
сосудах (Andersen e. а., 1961; Selkurt, Rothe, 1962; Berk e. a., 1967). В то
же время Lillehei с соавторами A962) отметили, что у людей, погибших,
от шока, скопление крови наблюдается главным образом в легких. Ана-
логичные наблюдения были сделаны Abel с соавторами A965) на обезь-
янах.
Изменения кровотока в портальной системе и печени (Berk e. а.,.
1967; Ю. М. Левин, С. А. Селезнев, 1965, и др.) приводят к выраженным
нарушениям функций последней (В. М. Шапиро, 1967; С. А. Селезнев,
1971).
Нарушения функции почек также характерны для шока. Они связа-
ны как с расстройством регионарного кровообращения и микроциркуля-
ции (Ю. М. Левин, 1966, 1973; Hinshaw e. а., 1961; Powers, 1965), так и
с нарушением соотношения давления в канальцах и межклеточном про-
странстве.
Изменения дыхания при травматических повреждениях носят пер-
вичный характер лишь при травме грудной клетки или черепа с наруше-
нием витальных функций (В. Л. Кассиль, 1966). Однако в процессе
развития травматического шока возникает недостаточность дыхания
вторичного характера (Г. Д. Дервиз, 1950; Г. А. Пафомов, 1963; Сага,
1964). По данным Н. А. Кустова A968), расстройства дыхания наблю-
дались у 54% больных с повреждениями самой различной локализации,,
при развитии терминальных состояний — у 80—90% больных. Они ха-
рактеризовались прежде всего нарастанием одышки с увеличением ми-
нутного объема дыхания, снижением дыхательного альвеолярного
объема, уменьшением остаточной функциональной емкости легких. В бо-
лее поздние сроки имело место неравномерное распределение воздуха
в легких с соответственным увеличением шунтирования крови. В тяже-
лых стадиях шока и при терминальных состояниях вентиляция может
быть нормальной или повышенной, а газообмен и потребление кислорода
при этом часто понижаются (Л. Л. Шик, 1945; Г. В. Дервиз, Г. А. Пафо-
мов, О. Н. Буланова, 1966). При этом большая роль отводится наруше-
ниям кровообращения малого круга — спазмы артериол, прекапилляр-
ных сфинктеров, приводящие к повышению давления в легочной арте-
рии, микроэмболия агрегатами клеток, поступающими из большого
круга кровообращения, жировая эмболия, артерио-венозное шунтирова-
ние (Hardaway, 1963; Allardice e. a., 1969; de la Bastaic, 1971). Очевидно,
вследствие указанных изменений многие авторы отмечают артериальную
гипоксемию у больных и животных в состоянии шока (Wilson, 1965;,
Moore, 1968; Collins e. a., 1968; Hardaway, 1969). Однако и тот кислород,
который поступает из легких, не всегда используется полноценно (шун-
тирование крови в сосудах большого круга, затруднение диссоциации
оксигемоглобина вследствие смещения кривой диссоциации оксигемогло-
бина влево). Наблюдается также гипокапния, являющаяся следствием?
как гипервентиляции, так и последующего преобладания гликолиза*
(Laborit, 1970). Она усугубляет нарушения периферического кровообра-
204
щения (провоцирует дальнейший спазм периферических сосудов) и спо-
собствует нарастанию гипоксии в тканях.
Нарушения метаболизма при шоке, особенно в терминальных состоя-
ниях, многообразны и мало изучены. Вначале они возникают рефлектор-
но, а затем в результате обратной связи углубляются вторично в резуль-
тате всего комплекса перечисленных выше нарушений основных функций
организма. Нарушения обмена сводятся к первоначальному усилению
всех его видов со сдвигом баланса в сторону катаболизма под влиянием
■как рефлекторного повышения активности симпатической нервной систе-
мы (катехоламины) (von Euler, 1956; Wulner e. a., 1959; Magone, 1962;
Piliego, Rossini, 1963; Veghelyi, 1964 и др.)» так и активации системы
гипофиз — кора надпочечников (Selye Н., 1960; В. Г. Кулагин, 1965;
Ю. Н. Цибин, А. А. Дыскин, 1965; А. В. Волков, 1965; С. М. Лейтес и
Н. Н. Лаптева, 1967; Kusela, 1963 и др.). Ввиду недостаточного снабже-
ния тканей кислородом нарушается течение в них окислительных про-
цессов с накоплением недоокисленных продуктов обмена — органических
кислот. Развивается метаболический ацидоз — характерная особенность
тяжелых стадий шока и терминальных состояний (О. Н. Буланова, 1966;
Р. Л. Гогложа и др., 1968; Huckabee, 1963; Huller e. a., 1967; Weil, Afifi,
1970).
Некоторые авторы считают, что накопление ионов водорода, главным
'носителем которых является молочная кислота, служит основной причи-
ной необратимости тяжелого шока (Schumer, 1966; Shires, 1967;
Xotspeich, 1967).
Гиповолемия, свойственная шоку, сопровождается не только умень-
шением объема циркулирующей крови, но и уменьшением общей воды
организма (вначале во внеклеточном секторе, а затем и в клеточном)
в результате компенсаторной гемодилюции (И. И. Федоров, 1966;
Э. Керпель-Фрониус, 1964; В. Фенцл, 1968; Shires, 1960—1967). Переме-
щение воды в сосудистое русло сочетается с изменением движения
электролитов. В связи с гипоксией наблюдается выход калия из клеток,
развивается гиперкалиемия плазмы (А. А. Крохалев, 1966—1971; И. То-
доров, 1966; И. Р. Петров и Г. Ш. Васадзе, 1967; Oszacki, 1964; Kowach
е. а., 1965), а затем гипокалиемия. Под влиянием гипоксии ткани выде-
ляют биологически активные вещества (вазопрессорную субстанцию),
способствующие развитию необратимых изменений при шоке. При сни-
жении рН, накоплении вазодепрессорных субстанций нарушаются фер-
ментные системы окислительного и гликолитического циклов (В. М. Ви-
ноградов, Э. В. Пашковский, 1968; И. М. Маркелов, 1968; Migone,
Moreo e. a., 1963). Угнетение гликолиза, по мнению Laborit A970), зна-
менует собой развитие необратимого нарушения обмена. Наряду с
устранением нарушений гемодинамики и дыхания патологические сдвиги
в обмене веществ требуют специального лечения.
Лечение тяжелых стадий травматического шока и острой кровопоте-
ри. Исходя из сложности патогенеза шока и многообразия форм наруше-
ний функций при кровопотере и травме, лечение может быть только
комплексным, патогенетически обоснованным на каждой стадии и варьи-
рующим в соответствии с характером, локализацией повреждений и
205
индивидуальными особенностями компенсации. Особенно следует под-
черкнуть необходимость дифференцированного подхода к лечению в
легких и тяжелых стадиях шока.
Профилактика развития тяжелых стадий шока, как правило, являет-
ся значительно более легкой задачей, чем их лечение. Поэтому распозна-
вание и своевременное лечение начальных стадии шока мы рассматрива-
ем как профилактику терминальных состояний. Благодаря достижениям
в работе врачей скорой медицинской помощи (проведение трапсфузион-
ной терапии, общее обезболивание в процессе транспортировки) боль-
ные с множественными повреждениями стали поступать в стационары
с лучшими показателями гемодинамики и общего состояния. Это не
должно усыплять бдительность врачей, особенно если больным предстоят
хирургические вмешательства,
В начальных стадиях травма i и ч е с к о г о шока па гогене^
тически обоснованной терапией является прекращение или уменьшение
потока патологической афферентной имиульсации из места повреждения,
а также передачи ее к высшим отделам мозга. Для этого необходимо воз-
действие на все звенья рефлекторной дуги, так как все отделы нервной
системы оказываются вовлеченными в процесс. Поэтому необходимы
ранняя и надежная иммобилизация, все виды местной и проводниковой
анестезии, включая в необходимых случаях продолженную иеридураль-
ную анестезию (К. М. Винцентиии и др., 1966; П. К. Дьяченко, 1968;
Ю. Н. Шанин и др., 1968; А. Л. Костюченко и др., 1970, и др.).
Следует, однако, подчеркнуть, что регионарную анестезию у больных
с множественными тяжелыми повреждениями следует проводить на фоне
начатой трансфузионной терапии. Чем тяжелее травма, тем более необ-
ходимо предварительное увеличение сниженного объема циркулирую-
щей крови. Особенно это относится к пожилым и старым людям. В про-
тивном случае может наступить внезапное снижение артериального дав-
ления и резкое ухудшение состояния больных вплоть до остановки серд-
ца (прежде всего вследствие падения объема активно циркулирующей
крови).
После стабилизации общего состояния больных и повышения арте-
риального давления выше критического уровня становится возможным
уменьшение передачи и восприятия боли в центральных звеньях рефлек-
торной дуги (вставочные нейроны спинного мозга, ретикулярная фор-
мация ствола головного мозга, подкорковые образования, особенно зри-
тельный бугор, кора головного мозга) путем применения таких аналь-
гезирующих препаратов, как морфин, омнопон, промедол. Однако при
тяжелых повреждениях, когда возможно развитие тяжелых стадий
шока, применение морфина опасно вследствие его угнетающего действия
на дыхательный центр. Показано внутривенное введение половины дозы
промедола A0 мг) и антигистаминных препаратов (через 3—4 ч). Боль-
шой интерес и перспективу представляет применение нейролептаналь-
гезии (см. главу XVII). Этот метод получил хорошую оценку в опера-
ционном и послеоперационном периоде (Т. М. Дарбинян, 1971), в том
числе и при срочных операциях у больных с множественной тяжелой
травмой (В. В. Осеев, 1968; Allegrini, Gantorno, 1966; Spocrcl, 1967).
206
Выключение сознания как в начальных стадиях шока, так и в после-
дующем периоде безусловно показано (А. Н. Беркутов и др., 1963;
П. К. Дьяченко, 1968). При транспортировке в таких случаях применяет-
ся или лечебный наркоз закисью азота с кислородом на стадии анальге-
зии, или наркотические вещества короткого действия — трихлорэтилен
(А. В. Сергеев, 1963; В. В. Поляков, 1970; А. М. Середняцкий и др.,
1970; И. Т. Сущенко и др., 1970). В последние годы получили распростра-
нение и заслуживают внимания препараты направленного действия
(оксибутират натрия). По данным Г. А, Петракова A969), применение
этого препарата в дозе 80—100 мг/кг наиболее целесообразно в сочета-
нии с промедолом и антигистамииными препаратами.
Блокада передачи импульсов в вегетативных ганглиях (Little, 1961;
П. К. Дьяченко, 1968) достигается применением препаратов группы гек-
сония (бензогексоний, пентамин и др.). Последнее возможно только
после возмещения объема циркулирующей крови.
Патогенетически обоснованная комбинация указанных мероприятий
наряду с возмещением объема циркулирующей крови, как правило, спо-
собствует стабилизации кровообращения и предотвращает ухудшение
состояния больных. Хорошим терапевтическим эффектом обладают в
этот период все плазмозамещающие растворы, в том числе и солевые,
особенно в сочетании с кровью и коллоидными растворами в соотноше-
нии 3:1.
В терминальных стадиях травматического шока и
острой кровопотери нельзя начинать лечение с обезболивания. До тех пор,
пока не начато восполнение объема циркулирующей крови, не следует
проводить даже блокады новокаином, так как это может способегвовагь
дальнейшему снижению артериального давления. Лечение таких боль-
ных следует начинать с активной трансфузиоиной терапии и ликвидации
острой дыхательной недостаточности. Весь период лечения можно ус-
ловно разделить на два этапа: 1) реанимация, 2) поелсреашшационный
период.
Неотложная реанимация состоит из комплекса лечебных мероприя-
тий: 1) заместительная трансфузионная терапия; 2) обеспечение адек-
ватного дыхания, 3) остановка кровотечения или других опасных для
жизни нарушений функций органов (включая хирургическое вмешатель-
ство), 4) обезболивание и коррекция нарушенных функций.
Заместительная трансфуз ночная терапия предусмат-
ривает прежде всего ликвидацию опасного для жизни уровня гиповоле-
мии и повышение артериального давления не ниже 80 мм рт. ст. Наряду
с этим необходимо увеличение количества циркулирующих эритроцитов
и повышение онкотического давления плазмы. Объем и скорость транс-
фузии должны быть большими, так как нужно восполнить не только
дефицит объема сосудистого пространства, сниженного в этот период
на 30—40%, но и возместить дефицит воды всего внеклеточного сектора.
Поэтому объем вливания в первые часы лечения, указываемый различ-
ными авторами, колеблется от 8 до 12 л и более (Л. Н. Губарь, Э. М. Но-
виков, 1968; Е. С. Золотокрылина, И. Ф. Виль-Вильямс, 1971; Prentice е. а.,
1954; Hardaway e. а., 1967; Kremer, Bohme, 1968; Baue, 1968, и др.).
207
Schweizer и Howland A968) предлагают в критических ситуациях ско-
рость вливания до 200 мл/мин. Clarce A956) также считает, что в первые
1—2 ч лечения кровопотеря должна быть возмещена примерно на 70%.
Такой темп тансфузий возможен только при вливании в 2—3 вены. Мето-
дом выбора в экстренных ситуациях, когда периферические вены нахо-
дятся в спавшемся состоянии, является катетеризация крупных вен (под-
ключичной, локтевой, яремной). В тех случаях, когда центральное веноз-
ное давление начинает быстро повышаться (свидетельствуя о
несостоятельности правого сердца), а кровопотеря не возмещена и оста-
ется гжютензия, имеются, по нашим данным, все основания для начала
артерио-венозной трансфузии.
Состав трансфузионных сред. Одной из лучших трансфузионных сред,
удовлетворяющих всем перечисленным требованиям, является кровь.
Наилучшие результаты получены от своевременного прямого перелива-
ния крови (Л. Н. Губарь, Н. И. Егурнов, 1965; Э. М. Новиков, 1970).
Однако этот вид трансфузий не может иметь массового применения,
особенно при большом количестве пострадавших. Консервированная
донорская кровь, стабилизированная кислым цитратом натрия (раство-
ры ЦОЛИПК 76 и 2), имеет много отрицательных сторон, возрастающих
по мере увеличения сроков ее хранения. При указанной выше скорости
вливаний эта кровь вызывает интоксикацию цитратом и гипокальцие-
мию, несмотря на введение хлорида или глюконата кальция в дозах
10 мл 10% раствора на каждые 500 мл. В условиях гипоксии токсичность
цитрата повышается, так как понижена скорость его инактивации, опре-
деляемая метаболической активностью тканей, особенно печени. Наибо-
лее рационально в этих случаях уменьшение концентрации анионов
лимонной кислоты в консерванте (рецепт 126 ЦОЛИПК) с добавлением
на каждые 100 мл крови 1,2 мл 10% раствора хлорида кальция
(Е. С. Золотокрылина и Е. А. Носова, 1964).
Наряду с токсическим действием цитрата при одномоментном пере-
ливании больших количеств донорской крови (свыше 2 л) возникает
синдром массивных трансфузий (Д. М. Гроздов, 1968; В. Н. Бураков-
ский, В. А. Аграненко, Я. А. Рудаев, 1968; Б. В. Петровский, 1969; Воуап,
1967). При его развитии могут возникнуть гемолиз, повышенная крово-
точивость, мелкоточечные кровоизлияния, экстрасистолия, печеночно-
почечная недостаточность. Определенную роль в их возникновении игра-
ет иммунологическая несовместимость крови многих доноров, а также
изменения в консервированной крови, возникающие при ее хранении
(увеличение кислотности, гиперкалиемия, гипернатриемия, дефицит
кальция, тромбоцитов, V и VIII факторов свертывания). При этом в
организме может прогрессировать гипоксия как в результате нарушения
микроциркуляции, так и вследствие затруднения отдачи кислорода тка-
ням в результате уменьшения в эритроцитах количества 2,3-дифосфогли-
церата (вследствие хранения) (см. главу VI).
Исходя из сказанного, переливание крови необходимо лишь для по-
вышения показателя гематокрита до безопасного уровня — 30 единиц
(Hardaway, 1969) или для поддержания гемоглобина в пределах 10 г%
C. С. Алагова и В. В. Тимофеев, 1970). Показано использование для
208
этой цели быстро замороженных эритроцитов или их взвеси в физиоло-
гическом растворе (Ф. Р. Виноград-Финкель, А. Е. Киселев, 1969; Schorr,
Marx, 1970).
В литературе имеется много сообщений о лучших результатах лече-
ния при комбинации крови с плазмозамещающими растворами (Е. С. Зо-
лотокрылина и С. С. Чистяков, 1965; Д. М. Гроздов, 1968; Вайе, 1968;
Kremer, Bohme, 1968; de la Bustaic, Picard, 1970), чем при использовании
одной донорской крови.
Применение препаратов, повышающих онкотическое давление в
плазме крови, является необходимым условием нормализации обмена
воды между сосудистым и интерстициальным пространством. Чем тяже-
лее состояние больного и длительнее период кровотечения и гипотензии,
тем важнее это сделать своевременно. Иначе могут возникнуть условия
для развития отека легких и мозга. Наиболее показаны "плазма, белковые
препараты крови, а также синтетический коллоидный раствор — поли-
глюкин. Кратковременный эффект оказывает желатиноль. Однако при-
менение больших доз полиглюкина одномоментно также может вызвать
осложнения. Наиболее опасным является увеличение кровоточивости.
Karlson с соавторами A967) установили, что одномоментное введение
10 мл/кг безопасно, 20 мл/кг допустимо, а 30 мл/кг вызывает диффузное
повышение кровоточивости.
Ввиду обеднения водой всего внеклеточного сектора после больших
.кровотечений (компенсаторная гемодилюция плазмы крови) восполне-
ние дефицита воды в организме также является актуальной задачей в
этот период. В противном случае может происходить дальнейший пере-
ход воды из интерстициального пространства в сосудистое (особенно при
■введении в кровяное русло онкотически активных веществ) с развитием
в конечном счете клеточной дегидратации. Поэтому применение солевых
растворов также необходимо в период неотложной реанимации. Shires
A960) на животных показал, что при кровопотере в 25% объема цир-
кулирующей крови (ОЦК) сокращение объема внеклеточного сектора
превышает кровопотерю на 20%. Хотя эти данные не подтверждены дру-
гими авторами и известна кратковременность пребывания солевых рас-
творав<в сосудистом русле (Joshikazu, Fukuda e. a., 1969), эти растворы
снова нашли широкое применение (раствор Рингера, рингер-лактат,
лактосол). Аргументы в пользу применения солевых растворов в острый
период:
1) восполнение дефицита воды внеклеточного сектора и профилакти-
ка клеточной дегидратации;
2) увеличение щелочного резерва плазмы;
3) профилактика агрегации форменных элементов крови в мелких
-сосудах;
4) поддержание перфузии тканей в критический период;
5) сохранение диуреза;
6) доступность и экономичность.
Однако после массивной, особенно после длительной кровопотери и
после тяжелой травмы избыточное введение солевых растворов, содер-
жащих натрий, опасно вследствие задержки натрия в организме на фоне
34 Заказ № 1266 209
гипокалиемии. Это может вызвать осложнения в виде отека легких и
мозга.
На основе сказанного в заместительной трансфузионной терапии сле-
дует правильно сочетать кровь, коллоидные и солевые растворы. De la
Bastaic и Picard A970) предлагают следующую схему:
1) при оказании первой помощи, при транспортировке, когда главная
задача состоит даже в кратковременном увеличении объема циркули-
рующей крови, целесообразно применять солевые растворы и полиглю-
кин;
2) в стационаре до подбора крови вводить коллоидные и солевые
растворы, не превышая допустимых доз;
3) необходимо переливать кровь в умеренных количествах.
Трансфузию крови следует чередовать с введением солевых и кол-
лоидных растворов. По нашим данным (Е. С. Золотокрылина и
И. Ф. Виль-Вильямс, 1970), в первые часы лечения кровь должна со-
ставлять 40—49% состава трансфузионных средств.
Для осуществления контроля за скоростью инфузии следует рекомен-
довать:
1) наблюдение за динамикой артериального, центрального венозного
давления. Струйное вливание нужно производить до тех пор, пока арте-
риальное давление не повысится до 100 мм рт. ст. (Н. И. Егурнов, 1970),
а центральное венозное давление — до 50—70 мм вод. ст. C. С. Алагова
и В. В. Тимофеев, 1970);
2) выделение мочи по катетеру, введенному в мочевой пузырь, со
скоростью менее 15 мл/ч является основанием для продолжения струй-
ного введения, если не отмечается быстрого повышения центрального,
венозного давления.
Определение общего объема вливаемой жидкости решается индиви-
дуально на основе этих данных. Скорость выделения мочи является
наиболее объективным показателем состояния перфузии тканей. Следует
заметить, что для достижения безопасного уровня указанных показате-
лей часто требуются объемы трансфузий, превосходящие предполагае-
мую кровопотерю. Объем «надтрансфузий» тем больше, чем длительнее
период кровотечения и особенно гипотензии.
Если у больного продолжается активное кровотечение, которое может
быть остановлено оперативным путем, успех достигается только при
одновременном проведении трансфузионной терапии и хирургического
вмешательства. В терминальных состояниях одновременное проведение
массивных трансфузий и хирургического вмешательства под интубаци-
онным наркозом с релаксантами и управляемой вентиляцией является
единственным способом спасения таких больных. Наряду с этим все
больше накапливается фактов о благоприятном влиянии на исход лече-
ния ранних операций, которые до недавнего времени считалось необхо-
димым отложить «до выхода больного из шока». Hardaway A969) сооб-
щает о снижении смертности в ранние сроки на 48% при укорочении
сроков начала операций до 1—2 ч по сравнению с 4—6 ч в прошлые*
годы. А. Н. Беркутов, П. К. Дьяченко, Г. Н. Цыбуляк A967), В. А. До-
линин и Г. Н. Цыбуляк A970), А. Ю. Аксельрод A971), А. А. Шалимов*
и Н. К. Голобородько A971), М. М. Рожинский A971) на большом кли-
ническом материале также доказывают важную роль в реанимационном
комплексе ранней операции, минимальной по объему и максимальна
щадящей силы больного. Для уменьшения травматичности акушерской
операции А. Ю.'Аксельрод A965, 1971) предлагает проведение ее в три
этапа: 1) на фоне активной трансфузионной терапии — начало операции,
временный гемостаз (наложение зажимов на кровоточащие сосуды);
2) прекращение хирургических манипуляций, ликвидация гиповолемии
путем увеличения объема трансфузий (до повышения артериального
давления выше 80 мм рт. ст., центрального венозного давления до 50 мм
вод. ст.), проведение местных блокад новокаином рефлексогенных зон
в области операционного поля; 3) продолжение операции и окончание
ее на фоне капельной трансфузии.
Опыт прежних лет показал, что случаи остановки сердца или ухуд-
шения гемодинамики во время операций совпадали с периодом наиболее
травматичных этапов операции, если не проводилось предварительного
возмещения объема циркулирующей крови и блокады рефлексогенных
зон.
Для успешного проведения хирургического вмешательства большое
значение имеет также коррекция метаболических сдвигов, существую-
щих в этот период. Главным из них является метаболический ацидоз с
угрожающим жизни сдвигом рН в кислую сторону (рН до 7,1—7,0 и
ниже). Для ликвидации резко выраженного дефицита оснований и про-
филактики ацидоза во время операции и в последующие 6—8 ч необхо-
димо применение буферных растворов (см. главу VI) и использование
препаратов, нормализующих окислительно-восстановительные процес-
сы, а также повышающих энергетические ресурсы организма (глюкоза
с инсулином в соотношении 2:1, витамины группы С, В, кокарбоксилаза,
аденозинтрифосфорная кислота).
У больных с массивной кровопотерей и в тяжелых стадиях травмати-
ческого шока, с нашей точки зрения, не следует: 1) начинать лечение
при невосполненной кровопотере с введения прессорных аминов (нор-
адреналин, мезатон, ангиотензин, эфедрин) *; повышение артериального
давления при этом создает видимость благополучия, в то время как на-
рушения микроциркуляции и гипоксическое состояние в тканях прогрес-
сируют; 2) восполнять кровопотерю только солевыми и коллоидными
растворами (особенно в процессе операции); 3) стремиться сразу достиг-
нуть нормальных показателей артериального давления и гематокрита;
4) прекращать внутривенное введение после окончания операций, не-
смотря на обычно наблюдаемую стабилизацию артериального давления
на более высоком уровне, чем в начале операции; продолжительность
непрерывного капельного введения в вену в таких случаях колеблется
от 36 до 48 ч; 5) прекращать управляемую вентиляцию легких и эксту-
бировать больных после появления реакции на интубационную трубку.
Для профилактики острой дыхательной недостаточности и других ослож-
нений показано пролонгирование искусственной вентиляции легких с
1 Это положение не распространяется полностью на другие виды заболевания.
И* 21!
помощью респиратора в течение 6—12 ч (см. главу XI). Не следует так-
же добиваться быстрейшего восстановления ясного сознания после пре-
кращения наркоза. Показано пролонгированное применение анальгети-
ков в сочетании с антигистаминными препаратами или применение
нейролептанальгезии, а также выключение сознания (оксибутират нат-
рия). Последнее позволяет также легче адаптировать больных к респи-
ратору.
Большую группу составляют больные, которые поступают в тяжелом
состоянии, но не нуждаются в срочной операции (закрытые переломы
костей таза, нескольких сегментов конечностей и др.). У этих пострадав-
ших наряду с проведением активной заместительной терапии по изло-
женной схеме особое внимание следует уделять надежной иммобилиза-
ции, а также местному и общему обезболиванию (см. выше).
Нормализация дыхания. Как уже отмечалось, в состоянии
массивной кровопотери и шока, даже без первичных нарушений дыхания
центрального или периферического типа, как правило, имеются явления
дыхательной недостаточности. Тяжелый шок — это прежде всего кисло-
родное голодание тканей, обусловленное не только расстройствами
кровообращения большого круга. Не меньшее значение имеет своевре-
менное устранение дыхательной недостаточности. Поэтому всем больным
с тяжелой травмой и кровопотерей, несмотря на отсутствие клинических
признаков острой дыхательной недостаточности, показана ингаляция
кислорода через носовые катетеры (поток газа 6—8 л/мин). При нали-
чии признаков острой дыхательной недостаточности проведение искус-
ственной вентиляции легких через интубатор или трахеостому является
также одним из важнейших компонентов комплекса неотложной реани-
мации (см. главу XI). Нередко искусственная вентиляция легких долж-
на начинаться одновременно с заместительной трансфузионнои терапией.
При первичных нарушениях дыхания (черепно-мозговая травма с нару-
шением витальных функций, повреждения органов грудной полости,
множественные переломы ребер) проведение искусственной вентиляции
легких часто является первоочередной задачей. В противном случае не
будет эффекта от остальных лечебных мероприятий.
Постреанимационный период
Перечисленный выше комплекс лечебных мероприятий позволяет,
как правило, ликвидировать острые нарушения кровообращения и дыха-
ния. Однако прекращение кровотечения, стабилизация уровня артериаль-
ного давления, хотя и являются необходимым этапом в лечении, не
гарантируют еще благоприятного исхода. Необратимые изменения в
тканях формируются не только в периоде острых циркуляторных нару-
шений. Они могут претерпевать обратное развитие или прогрессировать,
в зависимости от проводимого лечения в восстановительном периоде
(В. А. Неговский, 1970, 1972). Последующее лечение таких больных
представляет не меньшие трудности. Значительная часть их погибает в
разные сроки, иногда в весьма отдаленные (по нашим данным,
в 14,9% случаев).
212
При оценке исходов лечения в литературе редко учитывается эта
поздняя летальность. Почти никогда эти осложнения не связывают с
первыми периодами лечения и последующим ведением таких больных.
В то же время эта связь несомненно существует. Наши прежние наблю-
дения (Е. С. Золотокрылина, 1966, 1969) показали, что, как правило,
у больных с осложнениями в позднем периоде или были тяжелые стадии
шока при поступлении, или дефекты лечения на ранних этапах.
В поздние сроки после выведения из шока смерть, как правило,
наступала от совокупности причин. Наиболее частыми из них были
острая дыхательная недостаточность (пневмонии, ателектазы легких,
тромбоэмболия ветвей легочной артерии, жировая эмболия), перитони-
ты, сепсис, нагноение ран, печеночно-почечная недостаточность.
Однако у ряда больных ухудшение состояния после первоначальной
стабилизации функций кровообращения и дыхания начиналось с разви-
тия осложнений, имеющих, как нам кажется, прямое отношение к пато-
генезу шока. Это касается прежде всего острой почечной и дыхательной
недостаточности (соответственно 13,4 и 32,9% всех смертельных исходов
от осложнений).
Острая попечная недостаточность как осложнение тяже-
лой травмы и кровопотери описана многими авторами (В. И. Бородян-
ский, 1966; А. А. Неверов, 1968; В. К. Новиков, 1970; Vegheli, 1964; Po-
wers, 1965; Bachborn, Eieler, 1967; Cartensen, 1967; Berman, 1971). В на-
ших наблюдениях она всегда была результатом длительной гииотензии
или продолжительного периода недостаточного кровоснабжения перифе-
рических тканей в результате длительной централизации кровообращения
при невосполненной кровопотере, несмотря на нормальный уровень арте-
риального давления. У большинства из этих больных полноценное лече-
ние начиналось с большим опозданием. При обследовании после по-
ступления в отделение реанимации из других больниц, как правило,
обнаруживали гиповолемию, гипопротеинемию, анемию. В наиболее
тяжелых случаях наблюдалось повышение показателя гематокрита, об*
щего белка на фоне гиповолемии, гипернатриемии (натрий в плазме
крови до 160 мэкв/л и выше). У всех больных имелись нарушения пери-
ферического кровообращения (по данным реовазографии), которые ха-
рактеризовались значительным уменьшением кровенаполнения тканей
и повышением сопротивления току крови. Если активная трансфузион-
ная терапия начиналась на 1—2-е сутки лечения, то отмеченные сдвиги
быстро устранялись, функция почек нормализовалась и наступало вы-
здоровление, что доказывает обратимый характер нарушения. Однако
запоздалое лечение анурии (на 5—7-е сут и позже) часто заканчивалось
смертью больных, несмотря на восстановление в процессе лечения выде-
лительной функции почек у многих из них. Гемодиализ также давал
чаще всего временное улучшение. Powers A965) отмечает при этом
смертность в 90% случаев. Помимо нефронекроза, к смерти приводили
присоединявшиеся другие осложнения (чаще всего острая дыхательная
недостаточность).
По мере того как улучшались наши результаты лечения начальных
стадий шока, осложнения со стороны почек стали редкостью. На первый
213
план вышли новые патологические синдромы, до развития которых ра-
нее больные не доживали. К ним следует отнести острую, рано разви-
вающуюся дыхательную недостаточность, инфекцию как местную, так и
генерализованную.
Острая дыхательная недостаточ н о с т ь часто является
причиной раннего ухудшения состояния больных, даже если правильно
проводился первый период лечения. Однако во всех случаях было уста-
новлено наличие длительного гипоксического состояния тканей (позднее
устранение дыхательной недостаточности, длительное существование на-
рушений периферического кровообращения). В период развития острой
дыхательной недостаточности B—3-й сутки лечения) всегда наблюдалось
гипоксическое состояние тканей — повышение суммы органических кис-
лот в 2 раза (М = 22,7=+= 1,5 мэкв/л при норме 9—12 мэкв/л). Характер-
ным для этих больных является длительное нарушение кровенаполнения
периферических тканей (по данным реовазографии) и выраженная ги-
перкоагуляция, иногда до степени развития предтромботического состоя-
ния (А. С. Кукель, А. В. Полстяная, В. Ф. Пожариский, 1968). Острая
дыхательная недостаточность сопровождалась изменениями в легких,
которые принято считать воспалительными. Они характеризовались ран-
ним B—3-й сутки после травмы или кровопотери) и бурным развитием,
заканчивались массивным, часто двусторонним поражением легочной
ткани. Следует подчеркнуть также, что дыхательная недостаточность
выявлялась раньше появления четких изменений на рентгенограмме лег-
ких. Вначале они выражались в усилении рисунка, особенно в прикор-
невых зонах, в появлении неясных пятнистых теней, которые создавали
впечатление начинающегося отека легких. В то же время аускультативно
выслушивалось жесткое дыхание, иногда с бронхиальным оттенком. Еще
через 1—2 сут появлялись типичные воспалительные изменения на рент-
генограмме. «
Не претендуя на освещение всех многочисленных причин развития
пневмонии у больных с травмой, нам представляется важным оста-
новиться на одной из них, тесно связанной с патогенезом шока.
Как уже отмечалось выше, согласно концепции Hardaway, внутри-
сосудистое прижизненное свертывание крови играет существенную роль
в формировании нарушений микроциркуляции и необратимости не только
при шоке, но и в послереанимационном периоде. При возмещении объема
циркулирующей крови (особенно позднем) и улучшении периферическо-
го кровообращения сформировавшиеся микротромбы вымываются из
мелких сосудов, циркулируют с кровью и оседают в большом количе-
стве в сосудах малого круга кровообращения вследствие особенностей
строения сосудистой сети этой области (двойное кровоснабжение, об-
ширное шунтирование при гипоксии). По-видимому, эти нарушения
микроциркуляции в сосудах легких служат основной причиной острой
дыхательной недостаточности, вначале циркуляторного типа. Они созда-
ют условия для развития дальнейших нарушений микроциркуляции
(оседание капель жира, конгломератов из клеток крови, эпителия и др.)
и возникновения воспалительных изменений, углубляющих расстройства
газообмена. Преимущественное поражение легких у больных, погибших
214
от шока, отмечали Lillehei с соавторами A960), Г. Н. Цыбуляк и
К. Т. Табатадзе A968). Сходную картину наблюдали Abel с соавторами
A965) у обезьян с длительной гипотензией, Я. Л. Раппопорт с соавто-
рами A970) у собак после длительного искусственного кровообраще-
ния. Такие изменения в малом круге кровообращения Hardaway A969)
называет «шоковым состоянием легкого». На основании этой концепции
для профилактики и лечения острой дыхательной недостаточности в"
результате развития гиперкоагуляции автор A953) рекомендует раннее
и систематическое применение антикоагулянтов прямого действия. По
рекомендации А. С. Кукель, А. В. Полстяной мы применяли таким боль-
ным гепарин по 20 000—40 000 единиц в сутки (через 6 ч) под контролем
времени свертывания крови, начиная с конца первых — начала вторых
суток лечения. Если концентрация фибриногена превышала 500 мг%
и фибринолитическая активность замедлялась до 300 мин и более, то
наряду с гепарином вводили внутривенно фибринолизин по 10 000—
20 000 единиц в сутки под контролем основных тестов коагулограммы.
Такая терапия проводилась обычно со 2—3-го дня лечения до устранения
явлений дыхательной недостаточности и гиперкоагуляции (от 5 до
,20 дней).
При явлениях клинически выраженной вторичной дыхательной недо-
статочности, наличии указанных изменений в легких и на коагулограмме
антикоагулянтная терапия обязательно сочеталась с активным лечением
антибиотиками и длительной искусственной вентиляцией легких. В боль-
шинстве наблюдений это приводило к обратному развитию патологиче-
ского процесса в легких и выздоровлению больных. В то же время
сочетание только искусственной вентиляции легких с лечением антибио-
тиками, как правило, давало лишь временный результат. Профилакти-
ческое же раннее применение гепарина и при необходимости фибрино-
лизина, как правило, предупреждало развитие острой дыхательной
•недостаточности и изменений в легких на этих этапах лечения (Е. С. Зо-
лотокрылина, 1972).
Развитию дыхательной недостаточности способствует также жировая
эмболия сосудов легких и мозга. Как отмечают многие авторы (Virenque,
1968; Mokkhavesa e. a., 1969; Levis, Pappus, 1969; Peltier, 1971;
Herndorn e. a., 1971), этот диагноз ставится значительно реже, чем сле-
дует. Помимо чисто механического поступления жира в циркулирующую
•кровь при переломах костей, большую роль в ее возникновении играют
нарушения жирового обмена, которые чаще возникают также в резуль-
тате гипоксии при длительных нарушениях микроциркуляции. При по-
дозрении на жировую эмболию в последние годы в нашем отделении
(Е. С. Золотокрылина и В. Л. Кассиль, 1969) проводится терапия, на-
правленная на улучшение реологических свойств крови (реополиглю-
кин, 10% раствор маннитола), применение эмульгаторов жира C0% рас-
твор спирта на 20% растворе глюкозы), антикоагулянтов (гепарин и
фибринолизин в указанных выше дозах). Имеются также данные о по-
ложительном действии липостабила (Е. А. Решетников, 1971). При кли-
нически выраженной дыхательной недостаточности перечисленные меро-
приятия должны сочетаться с длительной искусственной вентиляцией
215
легких. Таким образом, олиго-анурия и раннее поражение легких после
травмы и кровопотери являются в значительной степени следствием ги-
поксии в результате длительного нарушения микроциркуляции. Онгс
представляют собой клинические проявления необратимости, форми-
рующиеся как в период шока, так и в период последующего лечения.
Поэтому особое значение после неотложной реанимации мы придаем
нормализации периферического кровообращения.
Нормализация периферического кровообращения. После восполне-
ния объема циркулирующей крови и нормализации артериального дав-
ления нарушения перфузии тканей еще длительно могут сохраняться
вследствие разных причин. Существенное значение среди них имеют
нарушения микроциркуляции. Важную роль в их устранении играет
улучшение реологических свойств крови. Нормализация кровенаполне-
ния тканей достигается дальнейшим увеличением объема циркулирую-
щей крови, возмещением дефицита воды. Большое значение имеет также
полноценное систематическое обезболивание. Улучшению реологических
свойств крови способствует низкомолекулярный полиглюкин — реополи-
глюкин (Д. М. Гроздов, 1968; Gelin, Shoemaker, 1961; Atik, 1966; Groth,
1966; Gelin, 1967). Согласно данным Gelin, реополиглюкин снижает вяз-
кость крови, увеличивает скорость кровотока и способствует устранению
агрегации форменных элементов крови. Рекомендуемая доза от 0,5 до
2 г/кг, чаще 1 г/кг. Вводят одномоментно или в два приема. Определен-
ным положительным реологическим действием, особенно в области сосу-
дов почек, обладает и 5—10% раствор маннитола.
Принимая во внимание большую £оль гиперпродукции катехолами-
нов в генезе нарушений периферического кровообращения при шоке, не
меньшее значение имеет блокада симпатической нервной системы и
а-рецепторов. С этой целью рекомендуется систематическое и длитель-
ное (до 4—5 сут) применение симпатолитиков, ганглиоблокаторов (гек-
соний, пентамин и другие препараты этой группы), а также слабых рас-
творов новокаина. Получено много фактов положительного действия
вазодилятаторов, применяемых при шоке после восполнения кровопотери
(Laborit, Huguenard, 1956; М. Н. Вейль и Г. Шубин, 1971; Nikersen, 1961;
Lillehei e. a., 1964; Berk e. а., 1967).
Предложено проведение ганглионарного блока без гипотонии, т. е.
уменьшение спазма периферических сосудов и профилактика понижения
артериального давления путем сочетанного применения пентамина и
норадреналина (В. М. Виноградов и П. К. Дьяченко, 1961; И. Н. Ершова,
1970). Авторы сообщают о благоприятных результатах при проведении
операций у больных, находящихся в тяжелой стадии шока. Однако име-
ются сообщения и об отрицательном влиянии метода (И. Г. Сущенко.
1962; Г. А. Шифрин, 1966). Laborit, Huguenard A956) рекомендуют одно-
временно с ганглиоблокирующими препаратами применять антигиста-
минные (димедрол, супрастин, дипразин и др.), холинолитические (атро-
пин). Lillehei A964) особо отмечает благоприятное влияние сочетания
ганглиоблокирующих препаратов и кортикостероидов.
При применении ганглиоблокирующих препаратов всегда наблюдает-
ся увеличение емкости сосудистого русла (иногда на 15%). Поэтому
216
необходимо одновременное увеличение объема циркулирующей крови:
путем постояннных капельных трансфузий, чтобы артериальное давле-
ние не снижалось ниже 100 мм рт. ст.
Мы в течение ряда лет для нормализации периферического крово-
обращения успешно применяли внутривенное капельное C0—40 капель
в минуту) введение 0,25% раствора новокаина пополам с 5% раствором
глюкозы (Д. И. Сальников, 1960). В последние годы при наличии спа-
стического состояния периферических сосудов (данные реовазографии).
0,25% раствор новокаина добавляли во все трансфузионные среды, кро-
ме крови, в пропорции 1:1, 1:2 или 1 :3. При явлениях недостаточности
миокарда, помимо строфантина, положительное инотропное влияние
оказывают |3-стимуляторы. Они оказывают также положительное влия-
ние и на периферическое кровообращение.
Показателем положительного действия а-литиков, |3-стимуляторов и-
ганглиоблокирующих препаратов является увеличение скорости выде-
ления мочи, потепление кожных покровов, порозовение кожи и слизи-
стых оболочек, появление капиллярного пульса в области ногтевого-
ложа.
Наиболее доступным в клинике и достаточно объективным показа-
телем состояния периферического кровообращения является наблюдение
в динамике за изменениями реовазограммы.
Наиболее частым видом патологии было понижение кровенаполне-
ния тканей (снижение амплитуды) и увеличение периферического сопро-
тивления (рис. 27, II). В таких случаях при сочетании с низким цент-
ральным венозным давлением и объемом циркулирующей крови имеются'
показания к продолжению заместительной трансфузии. В случаях удо-
влетворительного кровенаполнения тканей, но при повышенном перифе-
рическом сопротивлении (см. рис. 27, III) показано усилить обезболи-
вание и назначить ганглиоблокирующие препараты. Низкое сопротивле-
ние току крови (см. рис. 27, IV) труднее поддается коррекции.
Наблюдается оно или при плохой компенсации, или при наличии инток-
сикаций (перитонит, сепсис). Определенная положительная динамика
наблюдается при назначении больших доз глюкокортикоидов (до*
1000 мг) с антигистаминными препаратами.
По характеру изменения реовазограммы можно определить степень
восполнения кровопотери (Л. Н. Нагорова, 1971). Изменения кислотно-
щелочного равновесия также находятся в прямой зависимости от дина-
мики реовазограммы (Е. С. Золотокрылина, 1970). При одновременной
записи с различных областей (голова, рука, легкое, печень) можно полу-
чить представление о характере изменения регионарного кровотока.
Коррекция нарушений обмена после реанимации. Несмотря на актив-
ное возмещение кровопотери в первые 6—8 ч лечения, в конце первых
суток, как правило, отмечается гиповолемия (объем циркулирующей
крови 53,5±0,2 мл/кг), снижение центрального венозного давления
B8,9±7,5 мм вод.ст.), снижение гематокрита B8,7±0,2), гипопротеине-^
мия. При благоприятном исходе лечения нормализация этих показате-
лей начинается примерно с 3-х суток. При тяжелом течении заболевания
указанные отклонения могут прогрессировать, особенно в первые
21Г
12 3 4
Рис. 27. Изменение реовазограммы в зависимости от кровенаполнения периферических
тканей (кисть руки).
I — нормальное кровенаполнение: АВ — восходящая часть комплекса; В — вершина; ВД — нисходя-
щая часть комплекса; С — дикротический зубец на нисходящей части комплекса, а — высота ком-
плекса; а<—высота расположения дикротического зубца* II — значительное снижение кровенаполне-
ния тканей. III — снижение кровенаполнения тканей и выраженное повышение сопротивления току
крови IV — сниженное сопротивление току крови. 1 — калибровочный сигнал на электрокардиогра-
фе; 2 — калибровочный сигнал реографической приставки (РП-1М); 3 — запись при скорости 25 мм/с;
4 — запись при скорости 50 мм/с.
4—5 дней. Под влиянием гипоксии и усиленного катаболизма наблю-
дается выход калия из клеток и активное выведение его из организма
с мочой. Особенно много теряется калия, если присоединяются рвота,
аспирация застойного желудочного содержимого, кровопотеря, промы-
вания желудка. Эти причины наряду с недостаточным поступлением
калия с пищей ввиду неполноценного питания приводят к развитию
гипокалиемии (К = 3,2±0,4 мэкв/л). Наряду с этим значительно умень-
шается выведение натрия с мочой (особенно на 4—5-е сут). В резуль-
тате этого увеличивается отношение K/Na в моче до 1 и выше, что, по
мнению Bartter, Liddle A956), является косвенным выражением вторич-
ного гиперальдостеронизма, возникающего рефлекторно при раздраже-
нии барорецепторов сосудистого русла в условиях гиповолемии. Избы-
точные потери калия, а также вторичный гиперальдостеронизм приводят
к накоплению натрия в организме (Keszler и др., 1968; Ф. В. Кузьмина
и И. М. Мейлунас, 1968; Р. Л. Гогложа и др., 1968; Н. С. Колганова,
1968). Если при этом не поступает в организм достаточного количества
воды, развивается гиперосмия плазмы с последующей клеточной деги-
218
дратацией. Последняя усиливает катаболизм и потерю калия клетками.
Повышение осмотического давления плазмы рефлекторно активизирует
продукцию антидиуретического гормона и начинается олигурия. Приме-
нение солевых растворов, содержащих натрий, в этот период опасно, так
как будет способствовать дальнейшему накоплению натрия.
Клинические проявления гипокалиемии хорошо известны. Пониже-
ние тонуса гладкой и поперечнополосатой мускулатуры вызывает мы-
шечную слабость, снижение артериального давления, тахикардию, рас-
ширение сердца, уменьшение амплитуды и уплощение волны Т на ЭКГ,
увеличение продолжительности интервала Q—Г. Развивается парез
кишечника, желудка, что в свою очередь увеличивает потери калия. Для
профилактики и лечения гипокалиемии, помимо устранения гипоксии,
необходимо систематическое введение хлорида калия в гипертоническом
растворе глюкозы с инсулином (по 9—12 г хлорида калия в сутки в
виде 0,7% раствора).
Усиленный катаболизм приводит к повышенному распаду белков
тканей, что ведет к гипоонкии, повышению мочевины крови. Накопление
натрия в организме способствует повышению гидрофильности соедини-
тельной ткани и склонности к отеку подкожной клетчатки, легочной
пгкани, мозга. - '
Электролитные нарушения способствуют сдвигу кислотно-щелочного
равновесия: взамен метаболического ацидоза, существовавшего в пер-
вые часы лечения, в конце первых — начале вторых суток лечения начи-
нается накопление оснований в плазме крови с развитием метаболиче-
ского алкалоза, сочетающегося с гипоксическим состоянием тканей
{увеличение в 2 раза суммы органических кислот).
Развитие осложнений часто сочеталось с прогрессированием метабо-
лического алкалоза или повторным развитием метаболического ацидоза.
Наиболее надежным способом устранения этих нарушений кислотно-
щелочного равновесия была коррекция гиповолемии, нарушений пери-
ферического кровообращения, электролитных сдвигов (гипокалиемии).
При успехе этих мероприятий необходимость в применении щелочных
растворов (при метаболическом ацидозе) и нелетучих кислот (при мета-
болическом алкалозе) в этот период возникала сравнительно редко (см.
главу VI).
Несмотря на поддержание артериального давления на должном уров-
не, отсутствие клинических признаков недостаточности дыхания, напря-
жение кислорода в артериальной крови в первые сутки лечения у 70%
обследованных больных оказалось ниже 80 мм рт. ст. Артерио-венозное
различие по кислороду вследствие этого оказывалось также значительно
сниженным. Уровень лактата и пирувата в артериальной и венозной
крови, повышенный в первые часы лечения в 3—4 раза, в последующие
дни снижался до нормальных показателей. Однако соотношение лак-
тат/пируват оставалось повышенным (избыток лактата по Hucabee) за
счет большего снижения уровня пирувата (В. В. Ивлева, 1973). Пони-
женное напряжение кислорода в артериальной крови и избыток лактата
сохранялись в течение 3—7 дней и более (в зависимости от динамики
состояния больных). Для устранения этих нарушений требовалось систе-
219
матическое проведение оксигенотерапии и коррекция периферического
кровообращения. Очень важным для успешной терапии было своевре-
менное начало длительной искусственной вентиляции легких.
Перечисленные нарушения биохимического состава крови усугубля-
лись тем, что многие больные в течение ряда дней не могли полноценно
питаться (отсутствие или спутанность сознания, застой в желудке, парез
кишечника, рвота и др.). Поэтому возникал вопрос о проведении парен-
терального питания. Известно, что при наличии соответствующих пре-
паратов таким путем можно в течение многих дней поддерживать энер-
гетический баланс (Ю. Н. Кремер, А. А. Шмидт, 1969).
Потребность при постельном режиме равна примерно 1600—1700 ккал
A6,97—17,33 мДж) в сутки. При повышении температуры свыше 37°С
на каждые 0,5°С она'возрастает на 100 ккал @,43 мДж) (Barker, 1955).
По данным Ellison A949), даже 6 ккал/кг @,03 мДж/кг), т. е. примерно
420 ккал A,82 мДж) в сутки, предотвращают развитие ацидоза от голо-
дания и сохраняют тканевые белки за счет утилизации жировых запасов.
При кровопотере, травме, лихорадке резко усиливается катаболизм. При
недостатке питательных веществ в конечном итоге начинают разрушаться
и белки, так как потребность в калориях удваивается. Для уменьшения
катаболизма необходимо: 1) снижение до нормальных величин темпера-
туры тела (жаропонижающие, нейро-вегетативная блокада и умеренное
физическое охлаждение при наличии показаний); 2) применение анабо-
лических гормонов; 3) обеспечение хотя бы минимальной потребности
в калориях, если питание" через рот невозможно.
Наиболее удовлетворяют последнему требованию препараты эмуль-
гированного жира в сочетании с растворами кристаллических амино-
кислот, сбалансированных по солевому составу. При отсутствии этих
препаратов могут быть использованы 10 и 20% растворы глюкозы и
гидролизаты белков. По составу незаменимых аминокислот из отечест-
венных препаратов наиболее подходящими являются фибриносол, гидро-
лизат казеина ЦОЛИПК, аминопептид. Для получения за сутки около
1000 ккал D,33 мДж) А. П. Королев и В. И. Немченко A969) предла-
гают следующую схему парентерального питания: 1 л гидролизатов, 1 л
20% раствора глюкозы с инсулином, 50 г спирта, витамины (утроенная
суточная доза). Однако к применению спирта на фоне гипоксии есть
противопоказания: повышенная утилизация кислорода, повышенное на-
копление недоокисленных продуктов обмена.
При наличии отека мозга или угрозе его развития необходимо исклю-
чить препараты, содержащие натрий, увеличить суточную дозу калия
(чаще 12 г хлорида калия в сутки), строго следить за состоянием онко-
тического давления в плазме (применять альбумин, высокие концентра-
ции плазмы), особо тщательно учитывать и поддерживать баланс воды.
При отрицательном водном балансе и явлениях гипергидратации пока-
зано ограничение объема трансфузий и введение 30% раствора маннито-
ла, иногда фуросемид (с осторожностью). Дозы глюкокортикоидов сле-
дует увеличивать до 20 мг/кг и более. Самым же главным мероприятием
в таких случаях является профилактика и устранение гипоксии. В этом
плане исключительно велика роль своевременно начатой, правильно
220
проводимой и достаточно продолжительной искусственной вентиляции
легких.
Таким образом, внутривенные введения у больных с тяжелой травмой
нельзя прекращать сразу после заместительной трансфузионной тера-
пии. Их следует продолжать с перерывами, капельным способом в сред-
нем 5—7 сут. Однако объем трансфузиолных сред и их состав сущест-
венно изменяются. На первое место выступает нормализация перифе-
рического кровообращения, поддержание баланса воды, электролитов,
парентеральное питание, дезинтоксикация, коррекция анемии, гипопро-
теинемии.
Целесообразно чередовать введение в вену высокомолекулярного рас-
твора с низкомолекулярным, особенно обладающим положительным
действием на реологические свойства крови. Общий объем 'вливаний,
состав трансфузионных сред определяются балансом воды, электроли-
тов, энергетической потребностью. Чаще всего в вену вводят 2—2,5 л
в сутки. Растворы новокаина @,25% в соотношении 1 :2—1 :4) и хлори-
да калия (чтобы получить 0,7% раствор) можно добавлять во все
трансфузионные среды, кроме крови.
Контроль за состоянием больных- Для обеспечения правильной транс-
фузионной терапии необходимо ежедневно строго учитывать количество
вводимой (через рот и внутривенно) и выделяемой жидкости из орга-
низма. Сопоставление этих данных с центральным венозным давлением,
объемом циркулирующей крови и реовазограммой даст возможность
правильно оценить баланс воды и состав трансфузионных сред. Наибо-
лее информативным показателем возмещения объема циркулирующей
крови и состояния правого сердца является давление в легочной арте-
рии, а восстановления перфузии тканей — возобновление выделения
мочи.
Чтобы определить нужное для внутривенного введения количество
хлорида калия, следует ежедневно подсчитывать выделение основных
электролитов с мочой (К, Na, C1). Особенно важно соотношение K/Na.
В норме оно равно примерно 0,5. При увеличении выведения К или ре-
тенции Na эта величина возрастает и наоборот. Надо знать также кон-
центрацию электролитов в плазме крови. Однако при определении одно-
го этого показателя он может вводить в заблуждение. Например, актив-
ный выход калия из тканей будет сопровождаться нормальной или
повышенной концентрацией его в плазме крови. В то же время в орга-
низме будет гипокалиемия. Важную информацию дает определение коли-
чества электролитов в плазме крови (на основе концентрации и объема
плазмы), а также определение их в эритроцитах.
Ежедневная динамика показателей Hb, Ht, общего белка, мочевины
в плазме крови дает возможность своевременно корригировать опасную
для жизни анемию, гипопротеинемию. О степени катаболизма можно
судить по азоту мочевины и общему азоту мочи.
Показатели кислотно-щелочного равновесия и кислородный баланс
(рОг, НЬО,2, потребление Ог) также надо определять ежедневно в пер-
вые 3—7 сут лечения, особенно при подозрении на развитие острой ды-
хательной недостаточности и при проведении искусственной вентиляции
221
легких. Важную информацию в таких случаях дают также показателе
свертывающей и антисвертывающей систем крови.
Таким образом, больные, выведенные из тяжелых стадий травмати-
ческого шока или перенесшие массивную кровопотерю, нуждаются в
многодневной тщательной коррекции возникающих нарушений. Они
чрезвычайно чувствительны ко всяким внешним воздействиям, у них
легко развиваются осложнения, особенно инфицирование ран, перитони-
гы, сепсис. Поэтому наряду с быстрой ликвидацией гипоксии, поддержа-
нием гомеостаза важно строгое соблюдение правил асептики и анти-
септики, повышение иммунных защитных сил организма.
В зависимости от локализации повреждений лечение имеет свои
особенности, которые необходимо учитывать наряду с общими поло-
жениями, изложенными выше. Так, при множественных переломах ко-
стей таза наряду с полноценным обезболиванием и иммобилизацией
(путем вытяжения при больших смещениях половины таза) необходима
многодневная активная заместительная терапия в связи с продолжаю-
щимся кровотечением (В. Ф. Пожариский, 1963, 1965). Множественный
перелом ребер и травма органов грудной полости часто сопровождаются
развитием острой дыхательной недостаточности. Поэтому наряду с обез-
боливанием необходимо особое внимание уделять своевременному устра-
нению гипоксии. Особенно важно своевременно начать искусственную
вентиляцию легких (В. Л. Кассиль, 1966). Лечение закрытой черепно-
мозговой травмы с нарушением витальных функций является наиболее
сложной проблемой. Основными элементами комплексной терапии при
этом являются длительная искусственная вентиляция легких, большие
дозы глюкокортикоидов, гипотермия в показанных случаях. У этих боль-
ных особенно важно тщательно корригировать все возникающие откло-
нения гомеостаза. В то же время применение традиционных дегидрати-
рующих средств не оказывает решающего влияния.
XIII
ТЕРМИНАЛЬНЫЕ СОСТОЯНИЯ,
ВЫЗВАННЫЕ АКУШЕРСКО-ГИНЕКОЛОГИЧЕСКОЙ
ПАТОЛОГИЕЙ
Современные данные о материнской смертности, а также анализ-
смерти женщин при гинекологических операциях свидетельствуют о том,
что снижению летальности может способствовать широкое внедрение
в лечебную практику современных знаний в области реаниматологии.
Необходимость в оказании неотложной специализированной помощи
в сочетании с реаниматологическим комплексом мероприятий может
возникнуть при многих видах акушерско-гинекологической патологии.
Вопросы этиологии, патогенеза, диагностики, клинического течения
и лечения различных видов акушерско-гинекологической патологии под-
робно изложены в специальных руководствах (И. Ф. Жорданиа, 1955;
К. Н. Жмакин и Ф. А. Сыроватко, 1960; И. Л. Брауде и Л. С. Переиани-
нов, 1962; М. С. Малиновский, 1967, и др.). Мы же считаем необходи-
мым подчеркнуть только те особенности, которые связаны с развитием
терминальных состояний.
В акушерско-гинекологической практике терминальные состояния
могут быть обусловлены: массивной кровопотерей, поздним токсикозом
беременных (главным образом эклампсией), перитонитом, сепсисом*
эмболией околоплодными водами, тромбоэмболией и экстрагенитальны-
ми заболеваниями.
В основе развития терминальных состояний при этих видах патоло-
гии лежит циркуляторная, анемическая и гипоксическая гипоксия, а так-
же интоксикация организма недоокисленными продуктами обмена, ток-
синами и бактериальной флорой.
Многолетний опыт работы Московского выездного центра реанима-
ции показал, что наиболее частой причиной развития терминальных
состояний и материнской смертности являются массивные кровотечения,
связанные с атонией и гипотонией матки, патологическим прикреплением
и преждевременным отделением нормально расположенного детскога
места, травмой родовых путей с разрывом матки. Особенно высокая
летальность имеет место при нарушениях гемокоагуляции, которая, как
правило, является следствием массивной кровопотери и внутрисосуди-
стого тромбообразования в результате проникновения тромбопластина
из полости матки в общий кровоток.
22а
В большинстве случаев кровотечения возникают у женщин с отяго-
щенным акушерским анамнезом. Немаловажное значение в развитии
этого осложнения имеют физическое утомление в родах, напряжение
функций центральной нервной системы в связи со страхом перед родами
и болевым фактором в процессе родов.
В ряде случаев кровотечение сочетается с травматическим шоком.
Особенности этиологии и клиническое течение этого состояния в свое
время дали возможность ряду авторов определить его термином «родо-
вой шок» (В. А. Покровекий, 1947, 1952; А. Э. Мандельштам, 1952, и др.).
Наиболее тяжелые формы шока возникают при разрывах матки, преж-
девременной отслойке нормально расположенного детского места, во
время оперативных вмешательств, проводимых без достаточного обез-
боливания.
У некоторых больных при стремительных родах и оперативном родо-
разрешении (извлечение плода при кесаревом сечении, наложение аку-
шерских щипцов, вакуум-экстракция плода) развевается состояние кол-
.лапса. Возникновение на этом фоне кровотечений усугубляет тяжесть
состояния женщин.
Следует отметить, что нарушения гемодинамики, сходные с массив-
ной кровопотерей, могут иметь место и при отсутствии кровотечения
и, таким образом, создать определенные затруднения в диагностике.
В настоящее время рядом исследователей описан синдром сдавления
нижней полой вены маткой или так называемый постуральный гиподина-
мический синдром. Это осложнение обычно развивается в конце бере-
менности и во время родов в случаях, когда женщина лежит на спине.
При этом приток крови к сердцу резко ограничивается, что в свою оче-
редь может привести к значительному снижению артериального давле-
ния. У больных появляются беспокойство, головокружение, тошнота,
одышка, тахикардия. Изменение положения беременной со спины на
бок, а также смещение акушером беременной матки в сторону от сред-
ней линии быстро приводят к нормализации артериального давления и
улучшению общего состояния. Однако нераспознанный и своевременно
не устраненный синдром сдавления нижней полой вены иногда может
привести к возникновению терминального состояния.
При сочетании тяжелых акушерских и гинекологических заболева-
ний с кровопотерей, болью, интоксикацией, сильными отрицательными
эмоциями й т. д. процесс угасания функций организма отличается много-
образием. Причины такого многообразия объясняются различной сте-
пенью выраженности гиповолемии, анемии, травматического фактора,
индивидуальными особенностями организма, типом высшей нервной дея-
тельности, резервом компенсаторных возможностей организма, много-
численностью патологических осложнений беременности и родов. В ча-
стности, к особенностям клинического течения шока на фоне кровопотери
в акушерстве относится стертость всех его фаз. Так, эректильная фаза
шока бывает весьма кратковременной и благодаря хорошей компенса-
ции рожениц далеко не всегда выявляется клинически. При торпидной
фазе шока переход от I—II к III—IV стадиям на фоне проводимого ле-
чения в ряде случаев происходит довольно медленно и трудно диагности-
224
руется. В связи с этим при возникновении затруднений в оценке тяжести4
состояния больных, на наш взгляд, гораздо выгоднее отнести их к боль-
ным с более тяжелой стадией шока, так как это возлагает на врача еще
большую ответственность, служит показанием к применению более ин-
тенсивной терапии, что безусловно приведет к улучшению результатов
лечения.
Реакция организма женщин на кровопотерю во время родов и в ран-
нем послеродовом периоде не всегда адекватна количеству потерянной
крови. Многое зависит от скорости кровотечения, а также от состояния
организма, предшествовавшего кровотечению (отягощенный акушерский
анамнез, эндокринопатия, гипотония, анемия, психическая травма, уста-
лость в результате затяжных родов, поздний токсикоз беременных
и т. д.).
Современные данные об объеме циркулирующей крови и ее компо-
, нентов свидетельствуют о том, что при потере, составляющей 5% от
объема циркулирующей крови C—5 мл/кг), существенных изменений со
стороны гемодинамики не наблюдается, при потере до 10% объема цир-
кулирующей крови F—9 мл/кг) необходимо тщательное и полное воз-
мещение кровопотери. По данным Goltner A966), при дефиците объема
циркулирующей крови в 15% (9—15 мл/кг) гиповолемия сохраняется
даже в тех случаях, когда больным перелито крови несколько больше,
чем величина кровопотери. Е. М. Вихляева A969) при потере 20%
объема циркулирующей крови A2—20 мл/кг) определяет ситуацию кри-
тической.
Профузное маточное кровотечение часто сразу же или через несколь-
ко десятков минут может привести к возникновению преагонального
состояния, сходного с шоком IV степени, хотя компенсаторные функции
организма к этому времени еще не успевают истощиться. Агония, воз-
никшая при быстрой массивной кровопотере, нередко сопровождается
резким двигательным возбуждением, судорогами, которые иногда вво-
дят в заблуждение врачей, ошибочно принимающих это состояние за
проявление эклампсии.
При длительно продолжающемся кровотечении и многочасовой арте-
риальной гипотензии агония наступает при полном истощении всех ком-
пенсаторных функций кровообращения. При этом виде умирания тяже-
лые и даже необратимые изменения в паренхиматозных органах могут
возникнуть до прекращения сердечной деятельности.
При оказании помощи больным особенно важно учитывать фактор
времени. Согласно данным А. Ю. Лурье A955), Ф. А. Сыроватко,
Я. Н. Волкова, Н. И. Любимова A955), Beecham A939), время от нача-
ла атонического кровотечения до наступления смертельного исхода
колеблется в среднем до 4—6 часов. Несмотря на значительную, каза-
лось бы, протяженность этого периода, меры по оказанию помощи ока-
зываются эффективными лишь в первые два часа. Акушерские меро-
приятия, хотя бы и радикальные, но запоздалые, часто не дают нужного
эффекта вследствие возникновения порочного круга (атония матки —
кровотечение — гиповолемия и анемия — гипоксия мозга — нарушение
регулирующей функции центральной нервной системы, усугубляющие
15 Заказ № 1266 225
нарушения сократительной деятельности матки — продолжающееся ма-
точное кровотечение — гипокоагуляция крови) и полного истощения
компенсаторных возможностей организма. Поэтому одновременно с вы-
полнением акушерских операций и приемов следует проводить гемо-
fpaHC(j)y3HH, вливание плазмозаменителей, медикаментозное и гормо-
нальное лечение.
Процесс лечения пред- и терминальных состояний при кровопотере
можно разделить на два существенно отличных этапа: 1—при продол-
жающемся кровотечении и 2 — после его прекращения.
На первом этапе прежде всего предусматривается адекватное возме-
щение объема циркулирующей крови при одновременном проведении
специальных акушерских приемов и операций, направленных на оста-
новку кровотечения. После гемостаза основные задачи сводятся к устра-
нению гиповолемии, анемии, нарушений периферического кровообраще-
ния, дыхательной недостаточности и коррекции метаболизма, то есть
профилактике осложнений, присущих послереанимационной болезни (см.
главу XII).
Следует заметить, что больные с декомпенсированной кровопотерей,
тяжелым шоком и особенно находящиеся в терминальном состоянии
нетранспортабельны. Поэтому лечебные и оперативные мероприятия
у этих больных выполняются на месте — в кровати в палате, на гинеко-
логическом кресле и т. д.
Современная реанимационная и анестезиологическая помощь предус-
матривает горизонтальное положение больной, так как ранее применяв-
шееся глубокое положение Тренделенбурга оказывает отрицательное
влияние на деятельность сердечно-сосудистой системы и дыхания. Поло-
жение Тренделенбурга можно применять лишь в исключительно редких
случаях в целях предупреждения резкой анемизации мозга, когда нет
условий для осуществления крововозмещения или когда отсутствуют
необходимые запасы крови и плазмозаменителей. В таких случаях до-
пускается положение Тренделенбурга под углом 15—20°. С этой же
целью применяется ручное прижатие брюшной аорты, чем достигается
и временное прекращение маточного кровотечения.
Для остановки гипотонического и атонического маточного кровотече-
ния вначале применяется медикаментозная терапия, а в ряде случаев
метод электросокращения матки по 3. А. Чиладзе A963). При отсутст-
вии эффекта от консервативных методов остановки кровотечения пока-
зано хирургическое вмешательство. Наиболее радикальными мероприя-
тиями по остановке кровотечения, обусловленного как атонией матки,
так и другими причинами, являются операции надвлагалищной ампута-
ции или экстирпации матки. Некоторые авторы для этой цели рекомен-
дуют производить перевязку основных сосудов, питающих матку
(Д. Р. Цицишвили, 1960, 1963; М. С. Цирульников, 1960, 1963; Waters,
1952), однако эти оперативные вмешательства не получили широкого
распространения.
При прогрессирующем ухудшении состояния больных в связи с про-
должающимся маточным кровотечением возникают .трудности в выпол-
нении этих операций, связанных как с выбором вида анестезии, так и с
226
большим объемом бперации. Однако при современных методах анесте*
зии с управляемой вентиляцией легких и одновременном возмеще-
нии объема циркулирующей крови п.ри угрожающем жизни маточном
кровотечении срочное хирургическое вмешательство абсолютно необ*
ходимо.
При тяжелых нарушениях гемодинамики операции следует проводить
в два этапа: 1—срочное чревосечение и временная остановка кровоте-
чения путем наложения клемм на сосуды матки, 2— радикальный гемо-
стаз— ампутация или экстирпация матки после повышения артериаль-
ного давления и устранения выраженной гиповолемии с помощью
трансфузионной терапии.
Возмещение кровопотери особенно сложно в тех случаях, когда кро-
вотечение продолжается длительное время или возобновляется после
кратковременной остановки. Это часто имеет место при предлежании
плаценты, гипо- и атонии матки, гипокоагуляции крови.
Для адекватного возмещения кровопотери и поддержания артериаль-
ного давления на достаточно высоком уровне нередко возникает необ-
ходимость в одновременном введении крови и плазмозаменителей в две
и даже в три вены. Однако при артериальной гипотензии массивные
переливания крови, особенно под давлением, следует проводить с боль-
шой осторожностью под контролем центрального венозного давления
(путем катетеризации подключичной вены). Если при компенсирован-
ной кровопотере или резком, но кратковременном снижении артериаль-
ного давления в результате профузного кровотечения внутривенные пе-
реливания крови, как правило, способствуют повышению артериального
давления, то при декомпенсированной кровопотере, длительной гипо-
тензии и истощении компенсаторных функций организма внутривенные
трансфузии обычно не дают положительных результатов и могут ока-
заться опасными в силу перегрузки правого сердца. В этих состояниях
более эффективным мероприятием является артериальное нагнетание
крови.
Наш многолетний экспериментальный и клинический опыт не позво-
ляет согласиться с имеющимися в литературе высказываниями о равно-
ценной эффективности внутривенного и артериального нагнетания крови
при олигемическом шоке и особенно в агональном состоянии. Это поло-
жение правомерно лишь для определенных состояний, когда компенса-
торные функции организма, несмотря на снижение артериального дав-
ления, не успели еще истощиться. Было установлено, что большая
эффективность артериального нагнетания крови по сравнению с внутри-
венным обусловливается существенными различиями в механизме дей- -
ствия этих методов на сердечно-сосудистую систему. Повышение арте-
риального давления при введении в артерию всего 10—20 мл крови и
усиление биоэлектрической активности сердца через 2—7 секунд от на-
чала артериального нагнетания крови, даже во время клинической смер-
ти от кровопотери, свидетельствует о рефлекторной стимуляции сердеч-
ной деятельности в результате раздражения ангиорецепторов. В услови-
ях декомпенсированной кровопотери, в агональном состоянии, особенно
после длительной гипотензии, артериальное нагнетание крови не только
15* 227
восполняет объем циркулирующей крови, но и восстанавливает сосуди-
стый тонус, что в свою очередь способствует повышению артериального
давления и таким образом устраняет неблагоприятное влияние гипотен-
зии на организм, в то время как массивные внутривенные трансфузии в
этих состояниях вызывают резкое повышение венозного давления, рас-
ширение правого сердца и могут привести к развитию фибрилляции
желудочков или асистолии.
При лечении клинической смерти в настоящее время предпочтение
справедливо отдается наружному массажу сердца и искусственной вен-
тиляции легких. В отношении же пути восполнения объема циркулирую-
щей крови при смертельной кровопотере пока еще нет единого мнения.
Проведенные в лаборатории экспериментальные исследования доказали
преимущества артериального нагнетания по сравнению с внутривенным.
В этих состояниях артериальное нагнетание крови хотя и является до-
полнительным мероприятием, но, улучшая кровообращение в венечных
сосудах, создает более благоприятные условия для восстановления сер-
дечной деятельности.
Таким образом, с развитием реаниматологии и накоплением1 новых
знаний о патологических процессах, происходящих при умирании, пока-
зания к артериальному нагнетанию крови значительно сузились, но в
то же время они стали более определенными и патогенетически обосно-
ванными. Само собой понятно, что артериальное нагнетание крови не
исключает внутривенных трансфузий. Оба эти мероприятия проводятся
одновременно.
После прекращения кровотечения по мере восполнения объема цир-
кулирующей крови и нормализации гемодинамики скорость внутривен-
ных трансфузий постепенно замедляется вплоть до струйно-капельного
и капельного введения.
Продолжительность непрерывного капельного переливания зависит
от величины и продолжительности кровопотери, состояния компенса-
торных реакций сердечно-сосудистой системы, глубины нарушений мета-
болизма и варьирует от 8—10 часов до нескольких суток. При наличии
достаточного диуреза не следует бояться длительных капельных внутри-
венных вливаний крови и плаз^мозамещающих растворов.
При компенсированной кровопотере и шоке I—II степени достаточно
восполнить величину кровопотери на 100%. При этом переливают кровь
и кровезаменители, обладающие гемодинамическим действием (поли-
глюкин, реополиглюкин, желатиноль). При суб- и декомпенсированной
кровопотери, шоке III—IV степени и терминальных состояниях воспол-
нение кровопотери на 100% оказывается недостаточным в связи с пато-
логическим депонированием крови. Для нормализации гемодинамики и
устранения выраженной гиповолемии объем трансфузий в первые сутки
должен превышать величину кровопотери на 20—30 и даже 40—50%.
При этом количество крови должно составлять не менее 60—70% от
общего объема вводимой жидкости. При гипокоагуляции предпочтение
отдается теплой донорской крови в сочетании с введением фибриногена
и средствами, угнетающими фибринолитическую активность (см. гла-
ву XIV).
228
Весьма важным является вопрос о возможности использования крови
универсального донора. Мы считаем, что при шоке и терминальном со-
стоянии особенно необходимо переливать одногруппную кровь с обяза-
тельным учетом резус-принадлежности реципиента и донора. Наш опыт
лечения шока и терминальных состояний на фоне массивных кровотече-
ний свидетельствует о большой опасности переливания больших доз
крови универсального донора, что соответствует современным литера-
турным данным (Б. В. Петровский, Ч. С. Гусейнов, 1971). Е. М. Михай-
ленко A963) высказывает мнение, что при тяжелых кровотечениях и
гемодинамических расстройствах переливание крови универсального
донора не должно превышать 700—800 мл. Мы же полагаем, что кровь
универсального донора можно применять лишь в особых условиях
(отсутствие нужной группы крови при необходимости ее немедленного
вливания). И даже при этих условиях допустимо применять кровь уни-
версального донора в количестве, не превышающем 15—25% объема
потерянной крови.
Для устранения гипопротеинемии вводят концентрированный рас-
твор сухой плазмы, нативную плазму, белки. При метаболическом аци-
дозе показано введение 4—8% раствора бикарбоната натрия под контро-
лем состояния кислотно-щелочного равновесия и лактосола. Совершенно
необходимо введение электролитов и прежде всего калия с глюкозой
и инсулином, а также растворов, нормализующих периферическое кро-
вообращение и устраняющих интоксикацию (реополиглюкин, гемодез
и т. д.).
В связи с развитием гормональных нарушений и, в частности, недо-
статочности функций коры надпочечников, при массивной кровопотере,
показана гормональная терапия — внутривенное, а затем внутримвпиеч-
ное введение глюкокортикоидов (гидрокортизон, преднизолон и др.).
Показаниями к прекращению внутривенного введения крови, плазмо-
заменителей и других жидкостей являются значительное улучшение
общего состояния больной, стойкая стабилизация артериального давле-
ния на исходном нормальном уровне при центральном венозном давле-
нии не менее 20 мм вод. ст., ритмичный, хорошего наполнения пульс,
нормализация показателей объема циркулирующей крови, водно-элек-
тролитного и кислотно-щелочного баланса (согласно данным клиниче-
ских и биохимических анализов крови).
Для профилактики и лечения шока все акушерские приемы, манипу-
ляции и хирургические вмешательства необходимо осуществлять при
достаточном обезболивании. Проведение анестезиологических пособий
в условиях шока и терминального состояния при выполнении жизненно
необходимых операций весьма сложно. Учитывая современную оснащен-
ность родильных домов, следует рекомендовать многокомпонентный
эндотрахеальный наркоз с применением релаксантов короткого^действия.
Выполнение каких-либо манипуляций без обезболивания не допустимо
даже в случаях отсутствия выраженной болевой реакции у больной (см.
главу XVII).
По окончании операции больным, перенесшим массивную кровопоте-
рю, показано продолженное искусственное дыхание с помощью наркоз-
229
ных аппаратов или респираторов как при гипо-, так и при гипервентиля-
ции легких (см. главу XI).
В последние годы значительно увеличилась частота поздних токси-
козов беременных и соответственно частота проведения реанимационных
мероприятий.
В настоящее время в акушерской практике создались широкие воз-
можности применения комбинированной терапии поздних токсикозов с
учетом клинической формы, характера сопутствующих осложнений, тя-
жести заболевания, срока беременности, реакции организма беременной
на лекарственные препараты (М. Н. Волох-Иваева, 1965; С. Л. Ващилко,
1970; М. А. Петров-Маслаков и Л. Г. Сотникова, 1971, и др.).
При реанимации больных с тяжелыми формами токсикозов беремен-
ных и кровопотерей следует учитывать те изменения, которые происхо-
дят в организме у этих больных еще задолго до начала кровотечения и
развития шока и терминальных состояний, а именно нарушения микро-
циркуляции, склонность к стазу, агрегации эритроцитов и др. Указанные
причины ведут к нарушению кровоснабжения всех органов и тканей,
а следовательно, к их гипоксии. Вторично на этом фоне развиваются ги-
попротеинемия, гиповолемия, переход натрия и, следовательно, воды из
сосудистого русла в ткани с развитием отека.
Значительное уменьшение объема циркулирующей крови при тяже-
лых токсикозах ведет к тому, что даже при незначительной кровопотере
в периферической крови и сосудах происходят такие же сдвиги, как и
при массивной декомпенсированной кровопотере. Это определенным об-
разом влияет и на комплекс реанимационных мероприятий. Особую роль
приобретает сочетание действий акушера, анестезиолога и реаниматора.
Особенностями анестезиологической помощи у больных с токсикозами
является применение наименее токсичных анестетиков, уменьшение их
дозировки, применение многокомпонентной анестезии (см. главу XVII).
Акушерская тактика у больных с токсикозами второй половины бере-
ненности связана с применением щадящих методов родоразрешения,
которые выполняются под наркозом (по показаниям полостные или вы-
ходные щипцы, операция кесарева сечения). В случаях, когда реанима-
ция производится на фоне продолжающегося кровотечения, не рекомен-
дуются повторные ручные обследования, массаж или тампонада матки,
электросокращение матки по Чиладзе, так как применение этих методов
может ухудшить состояние больной и спровоцировать приступ эпилепсии.
Реанимационная тактика у больных с поздним токсикозом беремен-
ных, осложненным кровопотерей, сводится к адекватному по темпу и
величине восполнению кровопотери при количественном соотношении
крови и плазмозаменителей 2:1. Помимо адекватного восполнения
объема циркулирующей крови, проводится дезинтоксикационная тера-
пия путем внутривенных переливаний гемодеза и др. Большое внимание
уделяется коррекции гипопротеинемии. Для этих целей вводят белко-
вые препараты. Последний обладает и дезинтоксикационным действием.
В связи с сосудистой дистонией и для профилактики развития печеноч-
ной недостаточности показана гормональная терапия. Больным с наи-
более тяжелыми клиническими формами поздних токсикозов беремен-
230
ных (преэклампсия и эклампсия) как во время реанимации, так и в
постреанимационном периоде трансфузионная терапия проводится дли-
тельное время (на протяжении 3—5 и более суток).
Неустойчивость уровня артериального давления проявляется дли-
тельное время даже после возмещения кровопотери. Часто отмечаются
рецидивы падения артериального давления, что вынуждает длительно
продолжать внутривенные капельные введения. Подобная лабильность
сосудистых реакций делает опасным широкое и бесконтрольное приме-
нение аминазина в родах с целью лечения поздних токсикозов беремен-
ных и снижает, особенно в сочетании с кровотечением, эффективность
комплекса мероприятий по лечению шока и терминальных состояний.
Боязнь переливать роженицам с токсикозами второй половины бере-
менности значительные количества крови и плазмозаменителей после
больших кровопотерь является совершенно не обоснованной. Переливая
таким больным кровь в количестве 2000 мл и более, мы наблюдали к
2—8-му дню после перенесенного шока или терминального состояния
значительное улучшение общего состояния, увеличение диуреза, умень-
шение количества белка, цилиндров в моче и т. д. Наши наблюдения под-
тверждают и данные М. А. Тимохиной A963).
У больных с тяжелыми формами нефропатии, преэклампсии и
эклампсии должна проводиться особенно тщательная профилактика по-
чечной недостаточности (своевременная ликвидация гиповолемии и нор-
мализация периферического кровообращения).
Тяжелые формы позднего токсикоза могут привести к развитию тер-
минальных состояний без сопутствующей кровопотери. У некоторых
больных эти состояния являются следствием нарушения мозгового кро-
вообращения вплоть до кровоизлияния в мозг (Н. Н. Антипина и др.,
1968). Наиболее часто реанимационную помощь приходится оказывать
больным, находящимся в состоянии экламптической комы. Ведущими
в ее патогенезе являются отек мозга, судороги и острые нарушения ды-
хания, гемодинамики и функций паренхиматозных органов.
В системе реанимационных мероприятий ведущую роль играет лечеб-
ный наркоз (виадрил) в сочетании с активной гипотензивной и дегидра-
тационной терапией. С ^елью ликвидации артериальной гипертензии
применяют ганглиоблокаторы (арфонад, пентамин и др.), папаверин,
но-шпа, эуфиллин, резерпин и пр. Наряду с этим большое значение при-
дается дезинтоксикационной терапии (внутривенное переливание гемо-
деза и др.), коррекции нарушений периферического кровообращения и
метаболизма вышеуказанными методами. Если указанными мероприя-
тиями не удается прекратить судороги и нормализовать гемодинамику,
показана длительная искусственная вентиляция легких, иногда с при-
менением миорелаксантов в начальном периоде. Абсолютными показа-
ниями к проведению искусственной вентиляции легких являются кома-
тозные состояния.
Таким образом, при реанимации больных с поздними токсикозами
беременных применяются различные варианты комплекса реанимацион-
ных методов лечения в зависимости от клинических форм токсикоза и в
связи с сочетаниями их с другими видами патологических состояний.
231
Комплексное лечение поздних токсикозов беременных и применение
реанимации при преэклампсии и эклампсии привели к отчетли-
вой тенденции снижения материнской смертности при этих состояниях
(М. А. Петров-Маслаков и Л. Г. Сотникова, 1971).
Среди больных с гинекологическими заболеваниями большинство
составляют больные с криминальными септическими абортами и лишь
изредка больные с послеоперационными осложнениями: повторными
внутрибрюшными кровотечениями, перитонитами, тяжелыми пневмония-
ми и др.
У этих больных в основе развития терминальных состояний, как пра-
вило, лежат тяжелая интоксикация и связанные с ней нарушения крово-
обращения (коллапс), печеночно-почечная и надпочечниковая недоста-
точность. Большое значение имеют и нарушения метаболизма (состояние
кислотно-щелочного равновесия, гипокалиемия, гипопротеинемия), а так-
же интоксикационная анемия.
Помимо устранения расстройств гемодинамики, лечение этих боль-
ных должно быть направлено на устранение указанных нарушений.
Выведение больных с акушерско-гинекологической патологией из
терминального состояния еще не гарантирует благоприятного исхода.
Большое внимание уделяется ведению этих больных в восстановитель-
ном периоде, в котором проводится комплекс мероприятий, направлен-
ных на нормализацию гемодинамики, дыхания, обменных процессов,
функции эндокринных желез, почек и печени. Проводится широкое и
активное лечение антибиотиками, диетическое лечение, витаминотерапия
и др.
Следует остановиться более подробно на некоторых частных вопро-
сах ведения восстановительного периода, так как они имеют особое зна-
чение для акушерско-гинекологической клиники.
Мы в своей практике отказались от общепринятого в акушерстве со-
гревания больных грелками, особенно в области затылка и конечностей.
Применение грелок ухудшает состояние больных, отвлекая к периферии
от жизненно важных органов значительные количества крови. Отказа-
лись мы и от применения горячего, сладкого и обильного питья, которое
многими акушерскими пособиями рекомендуется применять при шоке.
Увеличение объема желудка пищевыми массами приводит к смещению
диафрагмы и неблагоприятно сказывается на сердечной деятельности и
дыхании. Отрицательным моментом является и то, что при длительной
гипотензии и нарушенной в связи с этим фильтрационной способности
почек желудок частично осуществляет выделительную функцию и его
следует опорожнять с помощью тонкого зонда, введенного через нос.
Больные, перенесшие хирургические вмешательства и терминальные
состояния, особенно подвержены парезу кишечника, чему немало спо-
собствует уменьшение концентрации ионов калия в плазме. Обычные
методы терапии этого осложнения (гипертоническая или сифонная клиз-
ма, промывание желудка, иногда применение постоянного отсо-
са из него) следует дополнять внутривенными переливаниями рас-
твора глюкозы с хлоридом калия, суточная доза которого может дости-
гать 9—12 г.
232
Независимо от вида патологии трансфузионная терапия должна про-
водиться под постоянным контролем клинического и биохимического
анализа крови, данных кислотно-щелочного равновесия и коагулограм-
мы. Следует измерять почасовой диурез, особенно в течение первых
дней после выведения больных из терминального состояния до установ-
ления полной нормализации функций почек. Обязательно проведение
анализов мочи ежедневно, особенно у женщин с поздним токсикозом
беременных.
Как показали наши наблюдения, непосредственный эффект лечения
больных с явлениями шока или терминального состояния зависит от
правильного и своевременного сочетания специализированной и реани-
матологической помощи, однако не менее важным является и ведение
послереанимационного периода или лечение постреанимационной бо-
лезни. При запоздалом или неадекватном лечении без учета патологиче-
ских процессов, происходящих у больных, выведенных из терминального
состояния, в постреанимационном периоде могут развиться такие серь-
езные осложнения, как постгипоксическая энцефалопатия, тяжелая пе-
ченочно-почечная и дыхательная недостаточность.
При отсутствии специализированной реанимационной службы в
родильных домах и гинекологических отделениях этих больных целесо-
образно транспортировать в отделения и центры реанимации для прове-
дения длительной искусственной вентиляции легких и экстракорпораль-
ного гемодиализа. Транспортировка больных возможна в специализиро-
ванных машинах на фоне продолженного внутривенного переливания
кровезаменителей и искусственной вентиляции легких только при отсут-
ствии подозрений на продолжающееся кровотечение и при стабилизации
артериального давления на исходном уровне не менее 2 часов. Снижение
артериального давления при перекладывании больной на носилки сви-
детельствует о несостоятельности компенсаторных функций и прежде-
временности транспортировки (К. П. Каверина, 1973).
Непосредственно к вопросу о реанимации больных в акушерской
клинике примыкает вопрос об оживлении новорожденных, родившихся
в асфиксии.
Асфиксия
новорожденных и ее лечение
Асфиксия новорожденных не представляет собой самостоятельной
нозологической единицы, а является следствием разнообразной акушер-
ской и экстрагенитальной патологии матери, влияния на плод самых
различных повреждающих факторов (Л. С. Кейлин, 1949, 1956; И. А. Ар-
шавский, 1959; А. П. Николаев, 1969; Л. С. Персианинов, 1961—1969;
В. И. Бодяжина и др., 1966, 1971; К. А. Семенова, 1966, 1971; М. А. Пет-
ров-Маслаков, 1969, 1970 и др.).
Иод термином «асфиксия новорожденных» подразумевают такое
состояние, при котором после рождения ребенка при наличии сердечной
деятельности дыхание отсутствует полностью или имеются слабые, по-
верхностные, нерегулярные или судорожные и редкие вдохи, не обеспе-
чивающие необходимую для газообмена вентиляцию легких.
233
Частота асфиксии у новорожденных составляет 2—10% A6—19% по
данным отдельных авторов) к общему числу родов.
В акушерской практике асфиксию, развивающуюся у ребенка при
рождении, подразделяют на так называемую синюю (около 80—90%
случаев) и белую (в 10—20% случаев). Синюю асфиксию обычно счи-
тают следствием долго продолжающегося хронического внутриутробного
кислородного голодания. Белую асфиксию приравнивают к шоковому
состоянию, рефлекторно вызванному резкими колебаниями внутрима-
точного давления в результате механических воздействий на плод в
процессе родов. При этом у новорожденного имеют место глубокое тор-
можение функции центральной нервной системы с тяжелыми наруше-
ниями гемодинамики по типу шока. Данные аутопсии новорожденных,
погибших от асфиксии, подтверждают наличие этих двух самостоятель-
ных, никогда не переходящих одна в другую форм асфиксии. Так, при
синей асфиксии наблюдается универсальная картина нарушений струк-
туры головного мозга и других паренхиматозных органов, характерная
для длительного кислородного голодания. При белой асфиксии вслед-
ствие острого течения кислородного голодания изменения в клетках
головного мозга менее выражены. Гистологическое исследование мозга
и внутренних огранов показывает острое нарушение гемодинамики в
виде стаза капилляров при запустевании более крупных сосудов. У этих
новорожденных наблюдается большое количество родовых травм, харак-
терны разрывы мозжечкового намета с обширными кровоизлияниями в
желудочки мозга, в спинномозговой канал, в субарахноидальные и суб-
эпендимальные пространства (В. Н. Шишкова, 1957; Е. Б. Красовский,
1965, и др.).
Известно также, что при асфиксии, обусловленной хроническим кис-
лородным голоданием у плода, обменные реакции при рождении оказы-
ваются более интенсивными, чем у здоровых новорожденных. При остро
развивающейся асфиксии в родах у новорожденных отмечается угнете-
ние обменных реакций. По данным Н. Л. Василевской A966, 1969), пре-
обладающие у плода и новорожденного процессы анаэробного гликолиза
усиливаются только в период хронической гипоксии. Это подтверждается
на аутопсии, когда у детей, погибших от острой интранатальной асфик-
сии, количество гликогена в печени было большим E140±580 мг%), чем
у перенесших длительную внутриутробную гипоксию F30±120 мг%).
Если в условиях длительной интранатальной гипоксии компенсаторные
процессы у плода носят преимущественно обменный характер, то во вре-
мя острой гипоксии компенсация нарушений происходит главным обра-
зом рефлекторно — путем ускорения кровотока, изменения просвета со-
судов, увеличения минутного объема сердца, изменения возбудимости и
чувствительности центров продолговатого мозга и др. Несмотря на раз-
личные пути компенсации при этих двух формах гипоксии, им неизмен-
но сопутствуют значительное накопление недоокисленных продуктов
обмена, т. е. явления метаболического ацидоза, при которых наблюдает-
ся сдвиг рН в сторону кислой реакции G,03—7,20 вместо 7,28—7,42
в норме), снижение щелочных резервов B9—40,5 об.% вместо
38,8—44 об.%), дефицит оснований (BE — 21,0—16,3 мэкв/л вместо
234
±2,3 мэкв/л) (Н. С. Бакшеев и др., 1963, 1969; Л. С. Персианинов и др.,
1966, 1969; Г. М. Савельева и др., 1966—1974; Веек, 1958; Saling, 1968,
и др.).
Развитие декомпенсированного ацидоза ведет к резкой гиперкалие-
мии, что на фоне других нарушений обмена у новорожденного при асфик-
сии может играть важную роль в развитии брадикардии A00—70 уда-
ров в минуту и ниже вплоть до отдельных сердечных сокращений).
Н. С. Бакшеев A968) отмечает на определенном этапе асфиксии ком-
пенсаторную роль параллельно развивающейся умеренной гиперкаль-
циемии, предотвращающей падение сердечной деятельности при высоких
концентрациях ионов калия.
Показано (И. А. Аршаъский и др., 1957, 1969), что, несмотря на то
что плоду и новорожденному в норме свойствен умеренный метаболиче-
ский ацидоз 1, небольшое увеличение его у плода и у новорожденного
приводит к снижению возбудимости дыхательного и сердечно-сосудисто-
го центров. В нормальных условиях при перевязке пуповины первый
вдох у новорожденного возникает при прогрессивном снижении содер-
жания кислорода в крови пупочной вены (примерно до 14—20%) и почти
не меняющемся содержании углекислоты (И. А. Аршавский и Н. Е. Озе-
рецковская, 1943; Seidenschnur, 1961, 1966; Wulf, 1968, и др.). Однако
внеутробное дыхание при этом может возникнуть лишь при сохранении
нормальной возбудимости дыхательного центра. Если последняя сниже-
на, то ребенок родится в асфиксии.
Для определения показаний к вмешательству по вызову и поддер-
жанию спонтанной вентиляции легких и нормализации кровообращения
целесообразно пользоваться предложенной Apgar A953) цифровой си-
стемой клинической оценки состояния доношенного новорожденного
(рекомендация научной группы ВОЗ). Оценка проводится по трехбалль-
ной системе «0», «1», «2» пяти наиболее важных клинических показате-
лей: 1) частоты сердцебиений; 2) дыхательных усилий; 3) мышечного
тонуса; 4) реакции на раздражение и 5) окраски кожи через 1—5 мин
после рождения (табл, 6).
Частота сердечных сокращений является важным клиническим пока-
зателем. Так, брадикардия указывает на крайнюю необходимость ре-
анимационных мероприятий, а учащение сердцебиения при искусствен-
ной вентиляции легких является хорошим прогностическим признаком.
Вместе с тем одним из важных моментов адаптации рождающегося ор-
ганизма является и становление функции, отсутствующей во внутри-
утробном периоде, — внешнего дыхания. Время появления дыхания
(длительность асфиксии) у оживляемого ребенка определяет прогноз не
только оживления, но и отдаленное психоневрологическое и физическое
развитие (Б. Н. Клосовский, 1959, 1960; Л. Т. Журба, 1964; Э. С. Ганс-
бург и Е. М. Мастюкова, 1965; Б. В. Лебедев и Ю. И. Барышнев, 1959,
1971; В. А. Неговский и др., 1966; В. В. Агнисенко, 1966, 1968; Ю. А. Дол-
гина и М. И. Корецкий, 1968; Н. С. Бакшеев и др., 1973). В этой связи
1 рН не ниже 7,2; избыток кислот не выше 12 мэкв/л, нормо- или нерезкая гипо-
капния.
235
Таблица б
Оценка доношенного новорожденного при рождении по шкале Эпгар в баллах
Клинические признаки
Частота сердцебиения в минуту 1
Дыхание
Мышечный тонус
Реакция на раздражение подошв, от-
сасывание из верхних дыхательных
путей
Окраска кожи
Оценка в баллах
1
Отсутствует
Отсутствует
—
Отсутствует
(конечности ви-
сят как плети)
Отсутствует
Общая блед-
ность или об-
щий цианоз
1
Ниже 100
Слабое
Слабый крик
Легкое сгиба-
ние в суставах
Гримасы, чи-
ханье
Розовая, конеч-
ности синие
(акроцианоз)
2
Выше 100
Громкий крик
Активные дви-
жения
Громкий крик
Вся розовая
Подсчет при аускультации сердца между 45 и 60 с жизни по секундомеру.
Назначение шкалы
Шкала служит для определения показаний к вмешательству по вызову и поддержа-
нию спонтанной вентиляции легких, нормализации кровообращения. Клиническая оценка
складывается из суммы баллов, полученных по всем пяти признакам через 60 с после
полного рождения (самые низкие показатели). Для определения способности новорож-
денного к адаптации, а при реанимации для оценки ее эффективности проводится по-
вторная оценка через 5 минут после рождения. При длительной реанимации оценка
проводится каждые 5 мин. Новорожденные, родившиеся в хорошем состоянии, имеют
оценку 8—10 баллов; показателем тяжелого состояния, подобного белой асфиксии, яв-
ляется оценка 1—3 балла. Новорожденные с оценкой от 4 до 6 баллов находятся в со-
стоянии разной степени угнетения жизненных функций, соответствующего в основном
разным степеням «синей асфиксии».
Оценка 7 баллов характеризуется выраженным гипоксическим синдромом и также
требует вмешательства при рождении (в основном ощелачивания).
В истории развития новорожденного наряду с оценкой по шкале отмечают время
появления и нормализации дыхания, появления крика и особенности состояния ребенка,
не предусмотренные Apgar.
При тяжелом течении родов следует сразу при рождении определить наличие серд-
цебиения, а позднее оценить частоту сердечных сокращений аускультативно и по секун-
домеру (частота сердечных сокращений аускультативно подсчитывается между 45—60 с
с момента рождения).
вмешательства, направленные на становление собственного дыхания
новорожденного, являются первоочередными. Это наиболее успешно
осуществляется комплексной патогенетически направленной терапией,
сочетающей искусственную вентиляцию легких с попыткой коррекции
нарушений обмена. Искусственная вентиляция легких, ликвидируя ате-
лектаз легких, создает условия для газообмена в них еще до появления
собственного дыхания новорожденного. Для успешного лечения необхо-
дима строгая временная последовательность (см. схему) проведения
определенных вмешательств с учетом характера гипоксии (острой или
236
хронической), приведшей к асфиксии, степени нарушения адаптации
дыхания. Отсутствие собственного дыхания у новорожденного и спустя
1 мин после рождения выходит за границы физиологического апноэ и
времени нарушений, вызванных родами, и требует начала искусствен-
ной вентиляции легких. Начинать ее при апноэ следует не позже, чем
спустя 17г—2 мин после рождения. Необходимо предварительно про-
вести туалет полости рта, носа и трахеи. Для кратковременной искусст-
венной вентиляции легких можно использовать прессциклические аппа-
раты (типа «ДП-5» и «РДА-1»), применяя вначале давление на вдохе
40—50 см вод. ст. со снижением его до 25—30 см после расправления
легких. Для длительной искусственной вентиляции легких рацио-
нально использовать волюметрические респираторы типа «ВИТА-1»
(Т. Н. Гроздова, Н. С. Егорова, 1971). Экспираторное искусственное
дыхание («изо рта в рот») следует применять с большой осторожностью
вследствие опасности разрыва легких новорожденного неконтролируемым
повышением давления в дыхательных путях. Целесообразно начинать
искусственную вентиляцию легких атмосферным воздухом, обогащение
его кислородом проводят после расправления легких при сохраняющем-
ся выраженном цианозе.
При рождении ребенка в состоянии клинической смерти (не более
5 мин) искусственную ветиляцию легких аппаратом с ритмом 20 вдува-
ний в минуту применяют с первой минуты жизни (с момента постановки
диагноза), подключая затем ощелачивание и наружный массаж сердца.
Последний проводят в ритме 80—100 сжатий сердца давлением II и
III пальцев на грудину в фазу выдоха. При необходимости вводят интра-
Схема проведения вмешательства у новорожденного при асфиксии во время рождения
(данные Московского областного научно-исследовательского института акушерства
и гинекологии Министерства здравоохранения РСФСР)
Отсасывание из верхних дыхательных путей при рождении головки ребенка
Рождение ребенка — включение секундомера — аускультация сердца
Дренажное положение головы
Обеспечение плацентарной трансфу-
зии при отсутствии противопоказа-
ний
Отсасывание изо рта, глотки, носа
Механическое раздражение подошв
Локальное охлаждение грудной клет-
ки
Конец 1-й мин жизни
Искусственная вентиляция легких
и непрямой массаж сердца при
состоянии клинической смерти
Оценка по шкале Эпгар
237
Интубация и отсасывание из трахеи
Начало искусственной вентиляции
легких аппаратом
Аналептическая смесь внутривенно
по показаниям
Вспомогательный непрямой мас-
саж сердца
Конец 2-й минуты
Введение в пупочные сосуды гидрокарбоната нат-
рия, глюкозы, кокарбоксилазы
3—4—5-я мин Оценка по шкале Эпгар в конце 5-й мин жизни
Фармакологические средства, улучшающие кровообращение, и
др. (в том числе трансфузия крови или кровезаменителя по
показаниям)
кортикостероиды
по показаниям
6—7—9-я мин
Экстубация трахеи, зондирование и отсасывание из желудка
10—15-я мин жизни
горчичники, АТФ, унитиол, витамины,
кислородотерапия в
первые 2—4 часа жизни
кардиально 0,1 °/о раствор адреналина 0,2—0,3 мл. Следует отметить, что
устранение гипоксии представляет большие трудности, так как в усло-
виях патологического метаболического ацидоза вследствие извращения
ферментных процессов ткани теряют способность использовать кислород.
Введение в кровяное русло щелочных растворов нейтрализует избыток
кислых продуктов обмена, нормализует рН, восстанавливает запасы
бикарбонатов в организме, повышает артериальное давление, способст-
вует восстановлению внешнего и тканевого дыхания, предотвращает по-
вреждения центральной нервной системы и др. (Л. С. Персианинов, 1966;
Г. П. Мартынова, Г. М. Савельева, 1966; В. А. Неговсюш, И. Е. Трубина,
1967; Б. А. Манукян, 1968; Ucher, 1960; Dawes, 1963, и др.).
У новорожденных для коррекции патологического ацидоза крови наи-
более рационально введение гидрокарбоната натрия в пупочные сосуды.
Определение оптимальных доз 5% раствора гидрокарбоната натрия по
Г. М. Савельевой и Б. А. Манукян A968) приведено в табл. 7.
При возможности определения показателей кислотно-щелочного ба-
ланса крови по микрометрическому методу Аструпа количество 5% рас-
238
Таблица 7
Оптимальные дозы 5% раствора гидрокарбоната натрия
Вес новорожденного
в граммах
6—5 баллов
4—1 балла
Оценка по шкале Эпгар
До 3000
количество
10
15
3001—4000
5% раствора
15
20
Свыше 4000
NaHCO3, мл
20
25
Примечание. Иначе говоря, вводят 3—4—5 мл/кг.
твора гидрокарбоната натрия можно рассчитать по формуле Mellem-
gaard A967):
Количество 5о/о раствора = ВЕхвес "°BWHH°" "■»
Как правило, у новорожденного даже при тяжелой степени асфиксии
сердечная деятельность не нуждается в специальной стимуляции. Уже
одно налаживание газообмена в легких, устранение гипоксии и ацидоза
восстанавливают нормальную возбудимость нервных центров, в том
числе и центров симпатической иннервации сердца.
В фармакологической терапии асфиксии новорожденных имеется
еще много спорных положений. В отношении аналептиков очевидно, что
,они должны оцениваться не только по оказываемому ими ближайшему
эффекту, но также иметь показания и противопоказания к применению.
Хороший лечебный эффект при затянувшейся асфиксии оказывают
средства, способствующие улучшению кровообращения. Из них следует
указать на соли кальция, воздействующие через возбуждение симпати-
ческой нервной системы, в виде глюконата или хлорида кальция в дозах
2—3 мл 10% раствора с 7—8 мл 10% раствора глюкозы (вводить медлен-
но и только через пупочные артерии) (Л. С. Персианинов, 1957, 1959,
1969; Н. С. Бакшеев, А. С. Лявинец, 1963, 1969, и др.).
В последние годы начали успешно применять у новорожденных вве-
дение эуфиллина A капля 2,4% раствора в 5 мл 10% раствора глю-
козы — вводить в пупочные сосуды медленно). При выведении из сос-
тояния белой асфиксии в ряде случаев приходится прибегать к
кортикостероидам, при этом однократно вводят 3% раствор преднизо-
лона из расчета 1 мг/кг внутривенно или внутримышечно.
Оптимальной температурой внешней среды для реанимации при
рождении в настоящее время следует считать 25—26°С, при которой
перепад между температурой в полости матки и температурой в родо-
вом зале составляет 12—13°С. Это способствует возникновению мышеч-
ного тонуса с умеренным снижением температуры тела до 35°С (А. И.
Аршавский, 1961; Н. Г. Гулюк, 1961, 1964; В. Ф. Матвеева, М. И. Ко-
рецкий, 1963).
239
При этом в ряде случаев полезным оказывается у физиологически
зрелых новорожденных локальное кратковременное охлаждение грудной
клетки (обрызгивание водой температуры 8—10°С) (И. А. Аршавский,
1961; David, Pinon, 1964, и др.).
Искусственную вентиляцию легких рациональнее проводить атмос-
ферным воздухом или 30—45% смесью его с кислородом. Обнадежи-
вающие результаты получены в результате применения у новорожден-
ных в асфиксии гелио-кислородной смеси (Л. С. Персианинов, Н. Н.
Расстригин, 1971). Представляют большой интерес исследования по ги-
пербарической оксигенации при асфиксии новорожденных (Э. Д. Костин,
А. А. Бадюк, А. С. Слепых, 1969, 1972; Hutchmson, Kerr, Williams e. a.,
1963; Bergofsky e. a., 1964).
Как правило, возникает необходимость в восполнении и сохранении
энергетических ресурсов путем введения в пупочные сосуды 10—20%
раствора глюкозы (тотчас за гидрокарбонатом натрия в равном с ним
количестве), а АТФ A0 мг) и 0,1—0,2 мл 5% раствора унитиола раз-
дельно— через 10—15 мин после рождения и позднее.
Большого внимания требует ведение новорожденного в постреанима-
ционном периоде. Патогенетически направленная терапия — одна из ве-
дущих задач этого периода, является средством борьбы с повышенной
летальностью этих новорожденных в раннем неонатальном периоде и
профилактики поражения центральной нервной системы.
XIV
ИЗМЕНЕНИЯ ФУНКЦИОНАЛЬНОГО
СОСТОЯНИЯ СИСТЕМЫ ГЕМОСТАЗА
ПРИ ТЕРМИНАЛЬНЫХ СОСТОЯНИЯХ,
ВЫЗВАННЫХ ТРАВМОЙ
И КРОВОПОТЕРЕЙ
У больных в терминальном состоянии, вызванном тяжелой травмой и
кровопотерей, отмечается как повышенная кровоточивость, так и тром-
ботические осложнения. На вскрытии погибших в различные сроки после
травмы и кровопотери нередко одновременно обнаруживаются крово-
излияния в различные органы и ткани, а также микро- и макротромбы
в сосудистом русле (Г. М. Голубева, Н. С. Джавадян, 1947; Л. И. Кукуй,
1967; И. П. Петров, В. И. Криворучко и Л. И. Кукуй, 1967; В. Т. Арло-
зоров и др., 1968; Н. Н. Коцюбинский, 1968; А. Н. Беркутов и др., 1968;
Л. Н. Трусов, 1968; Marchiano, 1964; Ferrein, 1964; Hardaway, 1966;
Muller, 1967; и др.). В связи с этим изучение изменений функциональ-
ного состояния системы гемостаза при шоке и терминальных состояниях
различного происхождения, в частности вызванных травмой и крово-
потерей, привлекает внимание отечественных «и зарубежных .исследова-
телей. Это необходимо не только для выяснения механизма тромбоге-
моррагических осложнений при указанных состояниях организма, но и
для разработки методов их целенаправленной профилактики и терапии.
Коагулопатические
кровотечения в родах
В последние годы в отечественной и зарубежной литературе появи-
лось много сообщений, свидетельствующих о том, что остановка крово-
течения в родах и послеродовом периоде во многом зависит от состояния
свертывающей системы крови. Механизм нормального послеродового
гемостаза включает: а) сокращение мускулатуры матки, б) тромбо-
образование в сосудах плацентарной площадки, в) сокращение венозных
стенок, г) увеличение резистентности капилляров.
На протяжении последних 5 лет в родовспомогательных учреждениях
Москвы акушерская бригада Московского центра реанимации наблюда-
ла 665 больных, у которых в родах или раннем послеродовом периоде
развилось массивное маточное кровотечение. В 14,8% случаев этих кро-
вотечений отмечались нарушения гемокоагуляции, развившиеся на фоне
кровопотери, обусловленной различными видами акушерской патологии.
16 Заказ № 1266 241
Malagambo, Pfeifer A961) на основании сравнительных данных ми-
ровой литературы и собственных наблюдений отмечают, что нарушения
свертывания крови наблюдаются в 25% случаев при преждевременной
отслойке нормально расположенной плаценты, в 18% —при предлежа-
нии плаценты, в 14% —при приращении плаценты, в 32% —при наличии
мертвого плода, в 15% —при токсикозах, в 30% —при задержке частей
плаценты, в 70% —при эмболии околоплодными водами и в 3% —при
«нормальных» родах.
К важным факторам, способствующим развитию афибриногенемии в
родах, относятся различные хирургические вмешательства на беремен-
ной матке и травматические повреждения матки и мягких родовых
путей.
Прогноз акушерских кровотечений с нарушениями гемокоагуляции
крайне ^неблагоприятен. Moulinier A960), Stamm с соавторами A963)
считают, что не менее 50% кровотечений на почве афибриногенемии за-
канчиваются летально. Koutsky A962) на основании большого материа-
ла показал, что из женщин, умерших от кровотечения в родах, у 25%
были нарушения в свертывающей системе крови. По данным Purandare
A963) материнская смертность в 12—14% обусловлена нарушениями в
системе гемостаза. При тяжелых кровотечениях в родах и раннем после-
родовом периоде на почве нарушения гемостаза наблюдаются не только
маточные кровотечения, но и генерализованные кровоизлияния в раз-
личные органы и мозг, субарахноидальное пространство, желудок, моче-
вой пузырь. Это может вызвать почечную недостаточность, тяжелые по-
ражения печени, отек мозга.
С целью диагностики острых кровотечений, связанных с нарушением
свертывания крови, необходимо проводить определение функционально-
го состояния системы гемостаза по развернутой коагулограмме. Показа-
тели коагулограммы дают возможность судить о способности крови к
свертыванию (время свертывания крови, толерантность плазмы к гепа-
рину), об уровне прокоагулянтов в крови (протромбиновый индекс, кон-
центрация фибриногена, количество тромбоцитов), об антикоагулянтной
активности крови (свободный гепарин, тромбиновое время, толерант-
ность плазмы к гепарину), о свойствах кровяного сгустка (ретракция
кровяного сгустка) и активности фибринолиза.
В связи с тем что определение развернутой коагулограммы требует
не менее 3 ч, при реанимации больных с акушерскими кровотечениями с
целью выявления механизма развития геморрагического синдрома и
применения целенаправленной терапии важное значение имеет исполь-
зование экспресс-методов диагностики, предложенных 3. Д. Федоровой
A969): время свертывания цельной крови лс Ли — Уайта, определение
фибриногена в пробирках с использованием тест-тромбина, тест лизиса
сгустка, проба с протамин-сульфатом. Хотя перечисленные тесты имеют
ориентировочный характер, они позволяют с учетом клинических данных
поставить предварительный диагноз в течение 20—30 мин. Использова-
ние портативного электрического коагулографа (модель Н-333) попол-
няет арсенал экспресс-методов диагностики, позволяет быстро регистри-
ровать изменения в системе гемостаза.
242
По М. С. Мачабели A970), кровотечения в родах, как правило, свя-
заны с развитием тромбогеморрагического синдрома, основным призна-
ком которого является симптоматическая гипо- и афибриногенемия.
В процессе развития тромбогеморрагического синдрома автор выделяет
следующие стадии: 1) гиперкоагуляцию, 2) нарастание коагулопатии
потребления и фибринолитической активности (дефибрииационно-фиб-
ринолитическая стадия), 3) восстановительная, или стадия остаточный
тромбозов и блокад. Кровотечения различной степени выраженности,
от мелких кровоизлияний до массивных смертельных кровопотерь, возни-
кают во II и III стадиях.
По нашим данным, четкая клиническая картина коагулопатического
кровотечения наступает при кровопотере не менее 1500—1800 мл, чаще
на фоне длительной гипотензии. При этом наблюдаются обильные ма-
точные кровотечения, внутрикожные и подкожные кровоизлияния, обра-
зование гематом, кровоподтеков, гематурия, паренхиматозные кровоте-
чения. Акушерские кровотечения сопровождаются прогрессирующей
потерей ряда факторов свертывания крови, однако выраженность гипо-
коагуляции определяется главным образом снижением концентрации
фибриногена. Большинство авторов считают, что нарушение гемокоагу-
ляции наступает при концентрации фибриногена в крови ниже 100 мг%.
Помимо уменьшения концентрации фибриногена и других факторов, при-
нимающих участие в процессе свертывания крови (факторы II, V, VIII,
XIII), существенную роль в нарушении гемокоагуляции играет умень-
шение количества тромбоцитов и изменение их функциональных свойств
(В. П. Балуда и др., 1963).
Одновременно с этим происходит резкая активация фибринолиза, в
результате чего в кровеносном русле появляются продукты расщепления
фибриногена и фибрина, которые обладают антикоагулянтными свойст-
вами (Morian, Mosure, 1968).
В раннем восстановительном периоде после массивной кровопотери,
сопровождавшейся гипокоагуляцией, как правило, развивается гипер-
коагуляция, обусловленная не только гиперфибриногенемией, но и появ- .
лением в крови фибриногена В, увеличением протромбиновой активнос-
ти крови, снижением фибринолитической активности. Восстановление
резко сниженного в момент кровотечения уровня фибриногена происхо-
дит в течение первчых суток, причем нередко превышает верхнюю гра-
ницу нормы B00—400 мг%). Гиперфибриногенемия находится в прямой
зависимости от тяжести травмы, объема хирургического вмешательства
и величины кровопотери в родах.
Развитие тромбоэмболических осложнений в восстановительном пе-
риоде после массивной кровопотери не менее опасно, чем коагулопати-
ческое кровотечение. Флеботромбоз, возникающий в восстановительном
периоде, может сочетаться с тромбофлебитом вен малого таза, нижних
конечностей в местах венесекций и приводит к тромбоэмболиям ствола и
ветвей легочной артерии. Из 28 больных с тромбоэмболией легочной ар-
терии, наблюдавшихся выездной реанимационно-акушерской бригадой,
выздоровело только 6 родильниц, у которых была медленно текущая
форма тромбоза ветвей легочной артерии.
16* 243
Изменения функционального состояния
системы гемостаза при тяжелой травме
и кровопотере
Сотрудниками хирургической клиники Центрального института гема-
тологии и переливания крови на базе отделений реанимации и неотлож-
ной хирургии Московской клинической больницы имени С. П. Боткина
в течение нескольких лет проводилось изучение динамики изменений
показателей свертывающей системы крови у больных с тяжелой механи-
ческой травмой, сопровождавшейся травматическим шоком различной
глубины и массивной кровопотерей, возникшей в результате ранений
сосудов и паренхиматозных органов, а также при внематочной беремен-
ности. Первое исследование коагулограммы производили в момент
поступления больных в шоковую палату реанимационного отделения или
в операционную неотложной хирургии. Обычно к этому времени проходи-
ло от 20—40 мин до 37г ч от момента получения травмы ,или начала
кровотечения. В связи с отсутствием исходных данных до получения
травмы результаты сравнивали с показателями группы практически здо-
ровых людей.
Наиболее выраженные изменения отмечаются при исследовании фиб-
ринолитической активности крови. У 80% больных фибринолиз был
ускорен в среднем в 2 раза, причем у 45% больных растворение сгустка
происходило за несколько минут. Активность фибринолиза выявляется
очень рано, буквально в первые 10—20 мин после травмы, когда нам
удавалось произвести исследование в это время, даже при сравнительно
компенсированном состоянии гемодинамики.
В наших исследованиях не было обнаружено выраженных признаков
коагулопатии потребления: снижение концентрации фибриногена ниже
физиологической нормы отмечается менее чем в 30% наблюдений. Пока-
затели общей свертывающей активности крови (время рекальцификации,
толерантность плазмы к гепарину), а также антикоагулянтная актив-
ность крови изменялись в сторону как гипо-, так и гиперкоагуляции.
Уровень свободного гепарина был несколько повышен, причем особенно
значительно в группе больных с более выраженным снижением концент-
рации фибриногена и активацией фибринолиза.
Состояние несвертываемости крови при травматическом шоке и кро-
вопотере встречается крайне редко, однако даже умеренная степень
гипокоагуляции в сочетании с множественными повреждениями тканей,
ранением паренхиматозных органов затрудняет гемостаз, приводит к
увеличению кровопотери и, следовательно, отягощает общее состояние
больного.
Следует отметить, что чем тяжелее травма и больше кровопотеря, тем
более выраженные изменения наблюдаются в темостазе. Эти изменения
достигают максимальных значений при терминальных состояниях, дли-
тельной гипотензии, позднем возмещении .кровопотери большими количе-
ствами плазмозамещающих жидкостей.
Наблюдая за динамикой изменений коагулограммы у больных с ме-
ханической травмой и кровопотерей, мы обнаружили, что через 2—3 ч,
244
даже в тех случаях, когда больным еще не была проведена активная
трансфузионная терапия, отмечается тенденция к нормализации пока-
зателей коагулограммы. При этом наиболее значительные изменения
выявляются при исследовании концентрации фибриногена и фибрино-
литической активности. По средним данным к 8—16-му ч от момента
травмы время фибринолиза нормализуется; к концу первых суток у боль-
шинства больных фибринолитическая активность снижена, однако
примерно в 40% наблюдений отмечается умеренная и крайне редко зна-
чительная активность фибринолиза. Концентрация фибриногена через
24 ч достигает верхней границы нормы, а у 29% больных уровень фиб-
риногена в 172 раза превышает норму. Изменения других показателей
коагулограммы в этот период менее существенны: отмечается укороче-
ние времени рекальцификации плазмы, нередко и тромбинового времени,
однако содержание свободного гепарина повышено, что, по-видимому,
носит компенсаторный характер. Указанная направленность изменений
показателей коагулограммы сохраняется и в последующие дни, дости-
гая максимума по средним данным к 5—10-м сут. К этому времени у 6%
больных наблюдаются резко выраженные явления гиперкоагуляции с
нарастанием уровня фибриногена, нередко достигающего 1000 мг% и
более, и с подавлением фибринолиза.
Нарастание гиперкоагуляции в восстановительном периоде приводит
к развитию у больных тромботических осложнений. К осложнениям,
обусловленным гиперкоагуляцией, вероятно, следует отнести не только
инфарктные пневмонии, но и пневмонии, которые протекают без клини-
ческой картины локальных тромбообразований и тромбоэмболии.
Патогенез нарушений гемокоагуляции при тяжелой травме и крово-
потере. Как указывалось выше, при тяжелой травме и кровопотере
наблюдаются фазовые изменения в системе гемостаза, которые уклады-
ваются в схему развития тромбогеморрагического синдрома, предложен-
ного М. С. Мачабели A970). «
В клинических условиях редко улавливается первая кратковременная
фаза, характеризующаяся гиперкоагуляцией крови. Однако в экспери-
ментальных исследованиях твердо установлено, что через 1—5 мин после
острой кровопотери, введения адреналина, нанесения болевого раздра-
жения происходит резкое ускорение процесса свертывания крови. В пос-
ледующем развивается гипокоагуляционное состояние. В восстанови-
тельном периоде после тяжелой травмы и массивной кровопотери вновь
выявляется наклонность крови к гиперкоагуляции.
Раннее повышение свертываемости крови при травме и кровопотере
является одной из защитных реакций организма, направленных на борь-
бу с кровотечением. При повреждении тканей в кровоток поступает тка-
невой тромбопластин, в результате чего усиливается процесс тромбино-
образования. Одновременно с этим у места повреждения сосудистой
стенки формируется тромбоцитарный тромб, в механизме образования
которого существенное значение придается реакции взаимодействия
тромбоцитов с коллагеновыми волокнами, освобождению из поврежден-
ных клеток тромбоцитагрегирующих агентов — АДФ, серотонина, адре-
налина.
245
Повреждение беременной матки в родах создает возможность для
проникновения в зияющие сосуды маточно-плацентарной площадки, а за-
тем в кровоток веществ, богатых тромбопластиновыми субстанциями.
. Основными их источниками являются околоплодная жидкость, содержи-
мое ретроплацентарной гематомы, плацентарная ткань, продукты распа-
да мацерированного плода. Поступающие в кровоток при травме и кро-
вопотере тромбопластиновые вещества способствуют внутрисосудистому
свертыванию крови. В результате этого потребляется ряд прокоагулян-
тов и развивается коагулопатия потребления. В тяжелых случаях наблю-
дается полное отсутствие в крови фибриногена (афибриногенемия).
В ответ на образование в сосудистом русле фибриновых сгустков акти-
вируется фибринолитическая система. В результате усиленного фибри-
нолиза в кровоток поступают продукты распада фибриногена и фибрина,
которые обладают антикоагулянтной активностью. Показатели коагуло-
граммы в этот период указывают на развитие гипокоагуляционного
состояния. В случае массивного поступления в сосудистое русло тромбо-
пластиновых веществ, ведущего к развитию афибриногенемии и рез-
кой активации фибринолиза наступает полная несвертываемость
крови. Клинически эта фаза характеризуется выраженной кровоточиво-
стью. Механизм развития острой несвертываемости крови при попадании
в кровоток тромбопластиновых веществ схематически может быть пред-
ставлен следующим образом:
Тромбопластиновые вещества
I
Протромбин—> Активация фибринолитической ~> Фибринолиз
I системы
Тромбин t
I I
Фибриноген Фибрин Гипофибриногенемия,
продукты расщепления с
антикоагулянтными
свойствами
Несвертываемость крови
(И. А. Ойвин, В. П. Балуда, 1969)
По Б. А. Кудряшову A969), развитие гипокоагулемии и несвертывае-
мости крови при попадании в сосудистое русло тромбиногенных веществ
обусловлено рефлекторным поступлением в кровь активаторов фибрино-
лиза и включением «второй противосвертывающей системы», основными
компонентами которой, по данным автора, являются гепарин и комп-
лексные соединения гепарина с фибриногеном, адреналином, норадре-
налином, антиплазмином, плазминогеном и плазмином, которые обла-
дают неферментативной фибринолитической активностью.
Возникновение гиперкоагуляции в восстановительный период после
травмы и кровопотери, по-видимому, обусловлено усилением синтеза
ряда прокоагулянтов, в частности фибриногена, сохраняющимися нару-
шениями микроциркуляции, гипоксией, вымыванием фибриновых микро-
тромбов, образовавшихся в острый период нарушений системы гемостаза
246
и гемодинамики, снижением антикоагулянтной и фибринолитической
активности крови.
В патогенезе коагулопатических нарушений при травме и кровопотере
наряду с изменениями в системе гемостаза немаловажную роль играют
изменения гемодинамики и состояния 'сосудистой стенки. Иллюстрацией
к оказанному может служить схематическое изображение механизма
острого геморрагического синдрома при акушерской патологии.
Лечение острого
акушерского геморрагического синдрома
При кровотечениях, связанных с нарушением гемокоагуляции, исход
реанимации в значительной степени зависит от выбора трансфузионных
сред. Мы при лечении больных с массивной и продолжающейся крово-
потерей с целью исправления дефекта коагуляции используем: 1) средст-
ва заместительной терапии (фибриноген, прокоагулянты в виде I фрак-
ции Кона, сухая плазма, теплая донорская кровь), 2) ингибиторы фиб-
ринолиза и фибриногенолиза (е-аминокапроновая кислота, трасилол,
контрикал). Весьма эффективным является введение тепаринизирован-
ной донорской крови.
При острых массивных кровотечениях в родах приходится прибегать
к трансфузиям донорской цитратной крови. В этих случаях мы применя-
ем консервированную кровь не более 1—3 сут хранения, так как био-
химические изменения, происходящие в консервированной крови дли-
тельных сроков хранения, лишают эту кровь ряда прокоагулянтов.
Следует отметить благоприятный эффект, оказываемый трансфузиями
теплой донорской крови, которая наряду с заместительным действием
способствует активации свертывающей системы крови, снижению анти-
коагулянтной активности (исследования В. Л. Леменева, 1963).
При лечении акушерских гипофибриногенемических кровотечений
особое значение приобретает введение фибриногена. В наблюдаемых
нами случаях кровотечений с нарушением гемокоагуляции фибриноген
вводили на фоне трансфузий донорской крови. Количество введенного
фибриногена в некоторых случаях доходило до 14—17 г сухого вещест-
ва. Введение фибриногена при массивных кровотечениях мы проводили
только в тех случаях, когда кровопотеря сопровождалась лабораторно
подтвержденным дефицитом фибриногена.
С целью снижения фибринолитической активности крови при крово-
течениях мы используем антифибринолитические препараты: е-амино-
капроновую кислоту A00—700 мл), контрикал A5 000 единиц), трасилол
G5 000 единиц), введение которых должно предшествовать инфузии
фибриногена, чтобы предотвратить его разрушение циркулирующим
плазмином.
Некоторые авторы указывают на опасность применения ингибиторов
фибринолиза при лечении акушерских кровотечений в связи с возмож-
ностью массивного распространения тромбоза. М. С. Мачабели A967)
отмечает, что е-аминокапроновая кислота лишает образовавшиеся в сосу-
дах сгустки способности растворяться и последние организуются. Поэ-
тому М. С. Мачабели с соавторами A967—1970) при остром акушер-
247
Механизм развития акушерского геморрагического синдрома при акушерской патологии (по В. В. Черной, 1972)
Околоплодные воды
Повышенное
образование
плазменных
кининов
1 I
Расширение мел-
ких сосудов
Вторичная ак-
тивация фибри-
нолитической
системы крови
(фибринолиз,
фибриио-
генолиз)
Дефибринация
Продукты расщепления
фибриногена и. фибрина
Торможение процессов
свертывания крови и по-
лимеризации мономеров
фибрина
Внутрисосудистая активация сверты-
вающей системы крови матери
-Внутрисосудистое свертывание крови
(фибринация)
Коагулопатия потребле-
ния (фибриноген, про-
тромбин, Ас-глобулин,
снижение активности
фактора VIIIj, повыше-
ние антитромбиновой и
антитромбопласткновой
активности крови
Гипофибриногенемия
Замедление процесса
свертывания крови
I
Тканевой тромбопластин
(содержимое ретроплацентарной ге-
матомы, мацерированная ткань мерт-
вого плода, плаценты, обрывки деци-
дуальной оболочки и др.)
+ Тромбоциты->Снижение
(уменьшение резистентности
количества, ч стенки сосудов
снижение адге-
зивности и спо-
собности к аг-
регации)
Макро- и микро-
травмы, внутри-
маточные вмеша-
тельства, инъек-
ции и др.
Образование неполно- -^Генерализованные-*
ценного рыхлого, легко кровотечения
лизируемого сгустка
Плацентарная площадка
> Кровотечение маточное <- (внутрикожные и под-
кожные кровоизлияния,
кровотечения во внутрен-
ние органы, маточно-
плацентарная апоплек-
сия)
ском геморрагическом синдроме предлагают вместо ингибиторов фибри-
нолиза вводить антикоагулянты прямого действия, в частности гепарин
в дозе 20 000 единиц одномоментно. Авторы считают, что заместитель-
ная терапия без гепарина не может привести к цели, так как введенный
фибриноген так же свернется, как и фибриноген крови рожениц и ро-
дильниц. М. С. Мачабели рекомендует вводить гепарин в фазу не
только гиперкоагуляции, но и полной несвертываемости крови и обиль-
ного маточного кровотечения. Мы не располагаем опытом введения ге-
парина на высоте коагулопатического кровотечения.
Учитывая результаты исследования В. П. Скипетрова, показавшего,
что протаминсульфат, введенный животным в фазу гипокоагуляции, при-
водит к усилению нарушения в системе гемостаза, мы отказались от
введения этого препарата для остановки коагулопатических кровотече-
ний. В последнее время при кровотечениях с нарушением гемокоагуля-
ции мы почти не применяем синтетические коллоидные растворы (поли-
винол, полиглюкин) в связи с их отрицательным влиянием на процесс
свертывания крови и увеличением за счет этого кровопотери.
Порядок, очередность введения и количество введенных веществ,
влияющих на гемокоагуляцию, зависят как от тяжести состояния боль-
ных, интенсивности и длительности кровотечения, характера и глубины
нарушения процесса коагуляции крови, так и от особенностей патоло-
гических осложнений беременности и родов. Введение трансфузионных
препаратов проводят до наступления терапевтического эффекта — обра-
зования плотного кровяного сгустка, остановки кровотечения и норма-
лизации данных коагулограммы.
При переливании крови необходимо, чтобы темп крововосполнения и
объем переливаемой крови соответствовали объему кровопотери на
каждом этапе реанимации. Для этого трансфузию проводят в 2—3 вены,
а при гипотензии ниже критического уровня F0—70 мм рт. ст.) прибе-
гают к артериальному нагнетанию крови. При проведении транс-
фузионной терапии важными критериями, позволяющими определить
количество вводимых жидкостей и темп их введения, являются объем
циркулирующей крови (плазмы и эритроцитов) и центральное венозное
давление, в определенной степени отражающее объем циркулирующей
крови, емкость сосудистого русла и сократительную способность мио-
карда.
С целью динамического измерения центрального венозного давления,
длительной трансфузионной терапии и взятия крови для биохимического
анализа мы проводили катетеризацию подключичной вены.
Вопрос о показаниях к хирургическим вмешательствам у больных с
коагулопатическими кровотечениями является одним из важных в так-
тике акушера, так как сама операция, преследующая гемостатическую
цель, в этих условиях является источником дополнительного кровотече-
ния. Наши исследования дают основание считать, что операция удаления
матки показана при сочетании тяжелых нарушений свертывающей сис-
темы крови с разрывом матки, атонией матки, перешеечно-шеечном
прикреплении и истинном вращении плаценты, а также при матке
Кувелера. В этих условиях успех терапии и реанимации зависит от сроч-
249
ного и квалифицированного и максимально щадящего хирургического
вмешательства, которое является главным моментом всей противошоко-
вой терапии. Наиболее щадящий характер операции в подобных -слу-
чаях достигается возможным ее расчленением на два этапа. В процессе
выполнения первого этапа операции производят манипуляции, свя-
занные с остановкой кровотечения. При этом одновременно проводят
трансфузионную терапию, направленную на ликвидацию острой гипово-
лемии и гипотензии, вводят комплекс веществ, способствующих
коррекции нарушений свертывающей системы крови. В процессе второго
этапа операции завершается хирургическое вмешательство, которое зак-
лючается в удалении матки. Проведение операции надвлагалищной
ампутации является нежелательным, так как оставшаяся культя стано-
вится источником продолжающегося кровотечения, для устранения пос-
леднего предпринимаются затем релапаротомии, которые нередко могут
стать роковыми. По нашим наблюдениям, 43% больных погибли при
проведении повторных чревосечений.
Общая летальность в группе больных с нарушениями гемокоагуля-
ции, по нашим данным, составляет 30,8%, что несколько ниже данных,
приведенных другими авторами.
Основными компонентами лечения тромбоэмболических осложнений
после кровопотери было применение антикоагулянтов типа гепарина в
сочетании с фибринолизином, стрептазой, а также сердечных гликози-
дов. Введение гепарина нормализовало состояние свертывающей систе-
мы крови, улучшало микроциркуляцию и повышало устойчивость к гипо-
ксии. В восстановительном периоде после массивной кровопотери
гепарин следует назначать профилактически, при наметившейся тенден-
ции к гиперкоагуляции крови. При удаленной матке эти мероприятия
практически безопасны. У больных с сохранившейся маткой, особенно с
обильными кровянистыми выделениями, гепарин следует назначать толь-
ко по прямым показаниям и с большой осторожностью.
Опыт Московского реанимационного центра свидетельствует о том,
что своевременное применение гепарина и фибринолизина в необходи-
мых дозах предотвращает, а нередко и устраняет тромбоэмболические
осложнения у родильниц, перенесших в родах коагулопатические крово-
течения.
Коррекция
гемокоагуляционных нарушений
при травме и кровопотере
Как правило, больные с тяжелой травмой и кровопотерей поступают
в клинику в период выраженных изменений в системе гемостаза в сто-
рону гипокоагуляции. Это обусловливает необходимость применения в
комплексном лечении этих больных ингибиторов фибринолиза и препа-
ратов фибриногена (чистых или в смеси с АГГ), а также свежей или
малых сроков хранения крови, в которой содержатся все необходимые
факторы свертывания крови. Следует учитывать, что введение ингиби-
торов фибринолиза (е-аминокапроновой кислоты, трасилола и др.) долж-
но предшествовать применению фибриногена, поскольку при некорриги-
250
рованном фибринолизе вводимый фибриноген может подвергаться
лизису, а продукты его расщепления, обладая антикоагулянтными свой-
ствами, приведут к усилению состояния гипокоагуляции. Вопрос о при-
менении гепарина при развернутой картине гипокоагуляции с резкой
активацией фибринолиза, снижением прокоагулянтов и общей коагуля-
ционной активности, по нашему мнению, следует решить отрицательно.
Направленность биохимических изменений в сторону гиперкоагуля-
ции и частота тромботических осложнений в поздние сроки после травмы
и кровопотери ставят вопрос о необходимости не только лечебного, но
и профилактического применения антикоагулянтов.
С 1966 г. в отделении реанимации Московской клинической больницы
имени С. П. Боткина мы применяем профилактическое введение антико-
агулянтов у больных, перенесших тяжелый шок и терминальное состоя-
ние. Гепарин назначают под строгим контролем за показателями коагу-
лограммы на 2—3-й сутки в дозах 20 000—30 000 единиц в сутки до
нормализации показателей свертывающей системы крови. При развитии
пневмонии или при других тромботических осложнениях, сочетающихся
с резким возрастанием концентрации фибриногена, суточную дозу гепа-
рина увеличивают до 40 000—60 000 единиц и внутривенно вводят
10 000—30 000 единиц фибринолизина в сутки в два приема с интерва-
лом в 12 ч.
В результате раннего профилактического применения антикоагулянт-
ной терапии в комплексе лечебных мероприятий у больных, перенесших
тяжелую травму и массивную кровопотерю, сопровождавшуюся разви-
тием шокового состояния, наблюдается заметное снижение частоты
тромбоэмболических и тромботических осложнений.
В заключение нам представляется целесообразным еще раз обратить
внимание клиницистов на необходимость тщательного наблюдения за
состоянием свертывающей системы крови у больных с тяжелыми трав-
мами и массивными кровопотерями, особенно если эти состояния сопро-
вождаются глубокими расстройствами гемодинамики и терминальным
состоянием. В острый период возникает опасность развития фибриноли-
тических кровотечений. В это время в комплекс интенсивной противо-
шоковой терапии по имеющимся показаниям следует включать ингиби-
торы фибринолиза, препараты фибриногена, свежую кровь. Однако
следует пояснить, что к концу 1—2-х суток, у таких больных возникает
предрасположенность к осложнениям, обусловленным гипергемокоагу-
ляцией. По нашим данным, на 3—5-е сутки у 63% больных выявлено
резкое подавление фибринолиза и увеличение концентрации фибрино-
гена. Для выяснения оптимальных сроков профилактического примене-
ния гепарина необходимо проводить контроль за коагулограммой,
главным образом за уровнем фибриногена и фибринолитическои актив-
ности крови, по возможности в более ранние сроки и в динамике после
травмы и кровопотери.
Авторы сердечно благодарят проф. В. П. Балуду и канд. мед. наук
Г. Н. Сушкевича за ценные консультации при написании этой главы.
XV
ОСОБЕННОСТИ
РЕАНИМАЦИОННЫХ МЕРОПРИЯТИЙ
ПРИ ОСТРЫХ ЭКЗОГЕННЫХ
ОТРАВЛЕНИЯХ
При тяжелых острых экзогенных отравлениях необходимо направ-
лять усилия на поддержание основных жизненных функций организма и
предотвращение развития необратимых нарушений, связанных как со
специфическим воздействием яда, так и с терминальным состоянием.
Применяемые при данной патологии методы реанимации в основном
соответствуют общепринятым и описаны в соответствующих главах этой
монографии. Однако при острых экзогенных отравлениях имеются ха-
рактерные особенности, которые заключаются в необходимости допол-
нительного проведения ряда лечебных мероприятий, а именно ускорен-
ного выведения токсических веществ из -организма, применения специ-
фической (антидотной) терапии, осуществления лечебных мероприятий,
направленных на защиту и поддержание той функции организма, кото-
рая избирательно поражается данным токсическим веществом.
Прекращение воздействия и удаление
токсических веществ из организма
При отравлениях токсическими веществами, принятыми внутрь,
обязательным и экстренным мероприятием является промывание желуд-
ка через зонд, проводимое независимо от состояния больного и от срока,
прошедшего с момента начала интоксикации. Следует помнить, что в свя-
зи с резким замедлением резорбции в состоянии глубокой комы в желу-
дочно-кишечном тракте может задерживаться значительное количество
токсического вещества, что приводит к пролонгированному ,или рецидиви-
рующему течению заболевания. В коматозном состоянии больного при
отсутствии кашлевого рефлекса и ларингоспазма с целью предотвраще-
ния аспирации рвотных масс в дыхательные пути промывание желудка
производится после предварительной интубации трахеи трубкой с раз-
дувной манжеткой. При отравлениях прижигающими ядами промывание
желудка через зонд в первые сутки является обязательным даже при
наличии крови в промывных водах. Нейтрализация в желудке кислоты
раствором щелочи неэффективна, а применение с этой целью гидрокарбо-
ната натрия значительно ухудшает состояние больного вследствие воз-
можного острого расширения желудка образующимся углекислым газом.
Слабительные средству для эвакуации яда из желудка при отравлениях
252
прижигающими ядами не вводят, чтобы не вызвать продвижения кисло-
ты или щелочи в нижележащие отделы желудочно-кишечного тракта.
У отравившихся прижигающими ядами, а также в сопорозном или
бессознательном состоянии при любом отравлении противопоказано вы-
зывание рвоты. Не менее важно раннее и по возможности полное осво-
бождение кишечника от токсического вещества посредством высоких си-
фонных клизм.
При ингаляционных отравлениях следует прежде всего вывести
пострадавшего из пораженной атмосферы. Персонал должен иметь сред-
ства защиты (изолирующий противогаз). При попадании токсических
веществ на кожу необходимо обмывание кожных покровов проточной
водой. При введении токсических веществ в полости (прямую кишку,
влагалище, мочевой пузырь) производится их промывание водой с по-
мощью клизмы, спринцевания и др. При укусах змей, подкожном или
внутримышечном введении токсических доз лекарственных средств мест-
но применяется холод на 6—8 ч. Показаны циркулярные новокаиновые
блокады конечности выше места попадания токсина.
Удаление токсических веществ
из кровеносного русла
Метод форсированного диуреза. Метод основан на проведении гидра-
тационной терапии с параллельным введением осмотических диуретиков
или салуретиков. Он показан при большинстве интоксикаций, при кото-
рых выведение токсических веществ осуществляется почками (например,
отравления барбитуратами, метиловым спиртом, пахикарпином, гемоли-
тическими ядами и Др.)- Эффективными осмотическими диуретиками
являются лиофилизированная мочевина, которая используется в виде
30% раствора с глюкозой, и 10% раствор маннитола. Перед введением
осмотического диуретика больным в течение 2—3 ч создают (по возмож-
ности под контролем гематокрита и объема циркулирующей крови) вод-
ную нагрузку путем внутривенного введения изотонического раствора
хлорида натрия и 5% раствора глюкозы в количестве от 1500 до 2500 мл.
В результате этого компенсируется имеющаяся у больных к моменту
поступления в стационар дегидратация. Одновременно в крови и моче
определяют концентрацию токсического вещества и электролитов и по
количеству выделенной мочи оценивают функциональную способность
почек. Больным вводят постоянный мочевой катетер с целью измерения
почасового диуреза.
Раствор мочевины вводят внутривенно струйно в течение 10—20 мин
в количестве 1 г/кг. После введения продолжается водная нагрузка раст-
вором, в котором содержится 2,5 г хлорида калия, 6 г хлорида натрия
и 10 г глюкозы на 1 л раствора. Скорость внутривенного введения раст-
вора должна соответствовать скорости диуреза. Данный цикл в случае
необходимости повторяют через 4—5 ч, когда осмотическое равновесие
организма восстанавливается, вплоть до полного удаления ядовитого
вещества из кровяного русла. Маннитол в виде 10% раствора также
вводят внутривенно, струйно в количестве 1 г/кг. Однако учитывая, что
253
маннитол быстро выводится из организма, следует продолжить введе-
ние в одну из вен раствора маннитола со скоростью 300 мл/ч, а в другую
вену одновременно вводить раствор электролитов.
Салуретик фуросемид вводят внутривенно в дозе от 40 до 200 мг
после обычного периода водной нагрузки. Следует учитывать, что при
повторном его применении возможны значительные потери электролитов,
особенно калия, несмотря на введение адекватного диурезу количества
электролитного раствора. Поэтому в процессе лечения методом форси-
рованного диуреза необходим постоянный контроль содержания
электролитов (калий, натрий, кальций) в крови. Для коррекции потерь
кальция больным ежедневно вводят до 20 мл 10% раствора хлорида
кальция. Контроль возможной дегидратации проводят путем регулярного
взвешивания больных на специальной кровати-весах.
При лечении острых отравлений барбитуратами, салицилатами, ме-
тиловым, этиловым спиртами, а также при отравлениях гемолитическими
ядами показано в сочетании с водной нагрузкой проводить ощелачивание
крови. С этой целью внутривенно капелыю вводят от 500 до 1500 мл 4%
раствора гидрокарбоната натрия в сутки с одновременным контролем
кислотно-щелочного равновесия.
Метод форсированного диуреза противопоказан при интоксикациях,,
осложненных острой и хронической сердечно-сосудистой недостаточ-
ностью (стойкий коллапс, нарушение кровообращения II—III степени),
а также при нарушении функции почек (олигурия, азотемия, повышение
содержания креатинина крови более 2,5 мг%). У больных старше 50 лет
эффективность метода форсированного диуреза заметно снижена.
Гемодиализ с использованием аппарата «искусственная почка» явля-
ется эффективным методом лечения некоторых отравлений, при его при-
менении в раннем периоде интоксикации. Поэтому желательно постоянно
иметь в операционной аппарат, готовый к работе. Эффективность ран-
него гемодиализа обусловлена прежде всего способностью токсического
вещества к диффузии из крови через поры целлофановой мембраны
диализатора в диализирующую жидкость. Токсическое вещество должно
удовлетворять следующим условиям: обладать относительно невысоким
молекулярным весом; быстро и в значительных количествах растворять-
ся в биологических жидкостях организма; содержаться в крови в доволь-
но высокой концентрации; не быть прочно связанным с белками и,
липидами.
Доказана возможность эффективного применения раннего гемодиа-
лиза при тяжелых острых отравлениях барбитуратами, салицилатами,
изониазидом, соединениями ряда металлов и мышьяка, дихлорэтаном,,
метиловым спиртом, этиленгликолем, хинином и некоторыми другими
менее распространенными токсическими веществами. В этом отношении
оправдали себя отечественная «искусственная почка» модели
«НИИЭХАИ» марки АИП-553 и АИП-140. Так, при использовании этих
аппаратов значение клиренса барбитуратов составляет от 15 мл/мин для
этаминал-натрия, нембутала, до 35 мл/мин для барбитала, клиренс дих-
лорэтана составляет около 40 мл/мин, метилового спирта — около
150 мл/мин. Подключать аппарат рекомендуется с помощью артерио-
254
венозного шунта в нижней трети предплечья. Единственным абсолютным
противопоказанием гемодиализа с помощью аппаратов «искусственной
почки» у больных с любыми видами острых отравлений является стой-
кое снижение артериального давления ниже 90—80 мм рт. ст., несмотря
на проводимые лечебные мероприятия.
Проведение раннего гемодиализа при различных интоксикациях име-
ет свои особенности. При отравлениях солями металлов и мышьяком
его следует проводить в сочетании с введением до 200 мл 5% раствора
унитиола (внутривенно, капельно в процессе диализа). Унитиол связы-
вает ионы тяжелых металлов и мышьяка и выводит их из депо в кровя-
ное русло. Это в сочетании с высокой способностью самого унитиола
к диализу (его клиренс 35 мл/мин) способствует более быстрому выве-
дению указанных соединений из организма. При отравлениях дихлор-
этаном эффективный клиренс может быть достигнут в первые 3 ч с
момента отравления. В дальнейшем в связи с перераспределением ди-
хлорэтана в жировую среду эффективность диализа резко снижается.
При отравлении барбитуратами, особенно длительного действия,
необходимо введение повышенных'доз гепарина(до 15 000—20 000 еди-
ниц) с целью предотвращения тромбообразования в проводящей систе-
ме аппарата «искусственная почка». «Передозировка» гепарина не пред-
ставляет опасности при работе на аппарате «искусственная почка»,
снабженном устройством для регионарной гепаринизации. В случае
отсутствия этого устройства необходим самый тщательный контроль за
состоянием свертывающей системы крови, так как возможно возникно-
вение внутренних кровотечений. Наибольшая эффективность гемодиали-
за в группе отравлений барбитуратами наблюдается при выведении из
организма барбитуратов длительного действия. Это обусловлено физико-
химическими и токсическими свойствами данных препаратов (высокая
концентрация фенобарбитала и барбитала в крови, меньшая связь с бел-
ками плазмы, большая длительность их нахождения в крови и др.).
Перитонеальный диализ осуществляется путем вшивания в брюшную
стенку специальной фистулы, через которую с помощью полиэтиленового
катетера в брюшную полость вводят 2 л диализирующей жидкости сле-
дующего состава: хлорида натрия 6 г, хлорида калия 0,3 г, хлорида
кальция 0,3 г, гидрокарбоната натрия 7,5 г, глюкозы от 6 до 70 г на 1 л
дистиллированной воды. Через каждые 30 мин производится замена
раствора.
Перитонеальный диализ в отличие от гемодиализа производится в
течение длительного времени (сутки и более) до полного исчезновения
токсического вещества из крови. При наличии симптомов отравления «от-
сутствие» токсического вещества в диализате не может служить обосно-
ванием для прекращения диализа. Смертельные концентрации многих
высокотоксичных соединений (дихлорэтан) в крови настолько незна-
чительны, что в еще большем разведении диализата они не всегда улав-
ливаются применяемыми в настоящее время химико-аналитическими
методами.
При проведении перитонеального диализа следует стремиться к пол-
ной диссоциации токсического вещества в диализате. Это предотвращает
255
его обратную резорбцию в кровяное русло. Для этого в диализирующий
раствор добавляют при отравлениях производными кислот бикарбонат
натрия с целью повышения рН до 8,5, а при отравлениях производными
оснований — аскорбиновую кислоту (до рН 7,2). Эффективность перито-
неального диализа повышается с увеличением разницы осмотического
давления плазмы и диализата, что достигается путем введения в брюш-
ную полость 10 г маннитола на каждую вводимую порцию диализирую-
щей жидкости или повышения содержания глюкозы в диализирующей
жидкости до 30—70 г/л.
Преимущество перитонеального диализа по сравнению с другими кон-
курирующими методами заключается в том, что он сохраняет свою эф-
фективность при перераспределении токсического вещества из крове-
носного русла в ткани. Так, например, при депонировании токсического
вещества в жировой среде (сальник) удаление яда возможно за счет
«контактной диффузии». Перитонеальный диализ эффективен и в слу-
чае соединений токсического вещества с белками плазмы, для которых
целлофан «искусственной почки» и нефрон являются непроницаемыми.
Эффективность перитонеального диализа сохраняется и при явлениях
острой сердечно-сосудистой недостаточности, так как, несмотря на резкое
снижение плаз'мотока, выход токсического вещества в брюшную полость
компенсируется за счет резко повышенной проницаемости сосудистой
стенки. Следует иметь в виду, что при коматозном состоянии введение
жидкости в брюшную полость, ограничивая экскурсию диафрагмы, мо-
жет усугублять нарушения легочной вентиляции. В таких случаях боль-
ных переводят на искусственное дыхание и придают им полугоризонталь-
ное положение.
Показания к гемо- и перитонеальному диализу не строго дифферен-
цированы, так как они применяются при отравлениях одними и теми же
диализирующими ядами. Указанные методы могут чередоваться в зави-
симости от состояния больного. У больных пожилого возраста, а также
при отравлениях веществами, способными соединяться в крови с белко-
выми и липоидными компонентами, преимущество должно отдаваться
перитонеальному диализу.
Операция замещения крови. Для замещения используется 4—5 л
одногруппной резус-совместимой индивидуально подобранной донор-
ской крови или одногруппной резус-совместимой трупной (фибринолиз-
ной) крови. С целью выведения крови у пострадавшего производят сек-
цию большой поверхностной вены бедра, через которую цеитрипетально
вводят на 30 см сосудистый катетер. Переливание донорской крови осу-
ществляется под небольшим давлением из аппарата Боброва через кате-
тер в одну из кубитальных вен. Необходимо соблюдать строгое соответ-
ствие количества вводимой и выводимой крови. Скорость замещения
не должна превышать 40—50 мл/мин. Для предупреждения тромбиро-
вания катетеров внутривенно вводят 5000 единиц гепарина. При исполь-
зовании донорской крови, содержащей цитрат натрия, внутримышечно
вводят 10% раствор глюконата кальция по 10 мл на каждый литр пере-
литой крови. Метод замещения крови как по скорости, так и по объему
выводимых токсических веществ значительно уступает перечисленным
256
выше способам детоксикации организма: Для большинства токсических
веществ, достаточно равномерно распределившихся в водной среде орга-
низма, эффект операции замещения крови не превышает 5—7% от об-
щего количества поступившего в организм токсического вещества. Эф-
фект операции возрастает, если она производится при продолжающейся
резорбции яда из желудочно-кишечного тракта. Клинический эффект
данного метода наиболее выражен при токсическом поражении крови
(отравления метгемоглобин- и сульфметгемоглобинобразователями).
Исключение составляют отравления окисью углерода, так как карбокси-
гемоглобин является нестойким соединением и при удалении больного
из пораженной атмосферы очень быстро происходит обратная его дис-
социация. При отравлении анилином, способным депонироваться в тка-
нях и повторно поступать в сосудистое русло, операция замещения крови
производится повторно при каждом новом критическом повышении уров-
ня метгемоглобина в крови свыше 30%.
Остается дискутабельным вопрос о целесообразности проведения
операции замещения крови при отравлениях гемолитическими ядами
(мышьяковистый водород, уксусная эссенция). Для удаления гемоглоби-
новых шлаков из организма преимущество отдается более простому
методу форсированного диуреза, тем более, что, как известно, замещение
крови при отравлениях гемолитическими ядами способствует резкому
возрастанию билирубинемии.
Последнее время используется возможность восстановления с по-
мощью операции замещения крови нарушенных ферментных систем
организма. Замечено, что на 3—4-е сутки после отравления фосфор-
органическими инсектицидами, когда эффективность реактиваторов хо-
линэстеразы (дипероксима) понижена, замещение крови увеличивает
активность холинэстеразы пострадавшего за счет введения с донорской
кровью активного фермента.
Перспективно с целью дезинтоксикации дренирование грудного про-
тока с параллельным усилением лимфообразования и водной нагрузкой;
проведение перфузии крови больного через колонки со специально по-
добранными ионообменными смолами ,и активированными углями.
Целесообразно сочетанное применение всех указанных выше методов
выведения токсических веществ в зависимости от состояния больного в
конкретный момент и распределения яда в организме.
Специфическая (антидотная) терапия
Специфическая терапия при острых отравлениях проводится в сле-
дующих основных направлениях:
1. Воздействие на физико-химическое состояние яда в желудочно-
кишечном тракте. Например, осаждение раствора нитрата серебра по-
варенной солью, применение адсорбентов внутрь.
2. Воздействие на физико-химическое состояние яда в гуморальной
среде организма. Например, использование тиоловых и комплексообра-
зующих веществ (унитиол, Ыа2 = ЭДТА) для образования растворимых
соединений (хелатов) с металлами и ускоренного выведения их с мочой.
17 Заказ № 1266 257
3. «Выгодное» изменение метаболизма токсических веществ в орга-
низме или их замещение в биохимических реакциях близкими по хими-
ческому строению нетоксическими соединениями. Например, введение
налорфина при отравлении морфином, применение этилового алкоголя
при отравлении метиловым спиртом и этиленгликолем.
4. Использование фармакологического антагонизма в действии на
одни и те же системы организма, например, антагонизма между атропи-
ном и ацетилхолином, прозерином и пахикарпином, что приводит к лик-
видации многих опасных симптомов отравления этими препаратами.
При терминальных состояниях, связанных .с ост(рьими отравлениями,
наибольшее значение (в плане специфической терапии) имеют антидоты,
являющиеся фармакологаческимд антагонистами ядов. Это обусловлено
их высоким непосредственным терапевтическим эффектом. Следует отме-
тить, что антидоты такого действия вводят в дозах, значительно превы-
шающих принятые в" фармакопее. Передозировка подобных антидотов,
как правило, менее опасна, чем их недостаток.
Симптоматическая терапия
Для воздействия на организм человека многих сотен токсических ве-
ществ характерно многообразие поражений различных органов и систем.
Однако наиболее часто терминальное состояние развивается в резуль-
тате нарушения дыхания, сердечно-сосудистой системы, функции печени
и почек.
Синдром нарушения дыхания. А. Нарушение механизма акта дыха-
■ ния. Указанная форма может проявляться в угнетении деятельности ды-
хательного центра; нарушении процесса иннервации дыхательной мус-
кулатуры в виде ее гипертонуса или паралича; дезорганизации ритма
дыхания вследствие клонико-тонических судорог.
Угнетение деятельности дыхательного центра наиболее часто встре-
чается при отравлениях химическими веществами снотворного и нарко-
тического действия (барбитураты, алкоголь и его суррогаты, дихлор-
этан). При указанных отравлениях угнетение дыхательного центра
нарастает параллельно углублению общего наркоза и развитию пара-
лича дыхания соответствует состояние глубокой комы с полной арефлек-
сией. Исключение составляют отравления наркотическими лекарствен-
ными препаратами (кодеин, морфин), при которых степень угнетения
дыхания преобладает над глубиной коматозного состояния и централь-
ный паралич дыхания может наблюдаться даже при сохраненном созна-
нии больных. Характерно, что при данных отравлениях отсутствует
лишь безусловнорефлекторный компонент акта дыхания, а способность
к воспроизведению дыхательных движений сохранена. В связи с этим
больных нередко можно заставить дышать произвольно.
Угнетение дыхательного центра может наступить и вследствие гипок-
сии мозга, вызванной поражением крови или различных органов и сис-
тем. Так, при отравлениях метгемоглобинобразующими ядами возможно
развитие глубокой комы с параличом дыхательного центра, обусловлен-
ной резкой гемической гипоксией. Паралич дыхательного центра может
258
наступить при тяжелом ожоговом шоке, вызванном отравлениями при-
жигающими ядами, при уремической коме и др.
Лечение центрального паралича дыхания при острых отравлениях
проводится по общим принципам, принятым в реаниматологии. Основ-
ным показанием к проведению искусственной вентиляции легких являет-
ся выраженное снижение минутного объема дыхания и развитие дыха-
тельного ацидоза. Следует помнить, что при отравлениях снотворными
препаратами и наркотическими средствами паралич дыхания обуслов-
лен их высокой концентрацией в организме. Поэтому стойкое восстанов-
ление дыхания возможно лишь при сочетанном проведении дезинтокси-
кационных мероприятий.
Хороший терапевтический эффект при отравлениях наркотиками
(кодеин, морфин) оказывает внутривенное введение 10—15 мг налор-
фина, являющегося антагонистом в действии морфина и его производ-
ных на дыхательный центр. При отравлениях ядами крови возобновле-
ние самостоятельного дыхания возможно лишь вслед за восстановлением
способности крови к транспорту кислорода. При острых отравлениях
фосфорорганическими инсектицидами и прозерином причиной расстройств
дыхания является угнетение активности холинэстеразы, сопровож-
дающееся накоплением ацетилхолина. Это проявляется в фибрилляции
грудных мышц, переходящей в гипертонус, что приводит к резкому огра-
ничению дыхательных экскурсий легких, ригидности грудной клетки и
острой эмфиземе. Последующее действие характеризуется «функциональ-
ной миопатией» — грудная клетка опавшая, как бы в состоянии макси-
мального выдоха; ее экскурсии незначительны. Подобная клиническая
картина наблюдается и при отравлениях пахикарпином, который, вытес-
няя ацетилхолин из Н-холинореактивных систем, вызывает ганглионар-
ную и нервно-мышечную блокаду. Для устранения данного вида рас-
стройств дыхания наряду с искусственной вентиляцией легких необхо-
дима активная специфическая терапия — введение реактиваторов
холинэстеразы (дипероксим) при отравлениях фосфорорганическими
инсектицидами и антихолинэстеразных препаратов (прозерин) при от-
равлении пахикарпином.
При клонико-тонических судорогах, приводящих к дезорганизации
ритма дыхания, особенно важно своевременно определить этиологиче-
ский фактор. Если указанный синдром вызван действием судорожных
ядов (стрихнин, изониазид), то благоприятный эффект достигается пу-
тем введения барбитуратов или курареподобных веществ с переводом
больных на искусственную вентиляцию легких. Одновременно прово-
дится дезинтоксикационная и специфическая терапия. Судорожный синд-
ром может быть проявлением острой асфиксии (например, при стенозе
гортани у больных с отравлениями прижигающими ядами). В таких
случаях лишь трахеостомия приводит к восстановлению проходимости
дыхательных путей и купированию судорожного синдрома.
Б. Обтурационно-аспирационная форма нарушений дыхания. Нару-
шение проходимости дыхательных путей вследствие западения языка,
ларингобронхоспазма, стеноза гортани, гиперсаливации, бронхореи и
аспирации в дыхательные пути наиболее часто встречается при отравле-
17* 259
ниях наркотическими ядами. При углублении наркоза появляется атония
мышц языка, бульбарныё расстройства — паралич надгортанника и го-
лосовых связок, теряется способность к самостоятельному дренажу верх-
них дыхательных путей. На этом фоне крайне опасны гиперсаливация и
регургитация, приводящие к аспирации в дыхательные пути и развитию
ателектазов.
Та или иная степень бронхореи наблюдается в коматозном состоянии
при большинстве отравлений снотворными и наркотическими препара-
тами. При отравлениях фосфорорганическими инсектицидами гиперса-
ливация и бронхорея являются ведущими в многогранном комплексе
дыхательных расстройств. Резкая бронхорея ограничивает как вентиля-
цию, так и диффузию легочных газов и приводит к «самоутоплению
больных». При отравлениях седативными препаратами (аминазин, меп-
ротан, хлордиазеноксид и др.) она практически не отмечается.
При коматозных состояниях (за исключением перечисленных выше
отравлений седативными препаратами) целесообразно введение холино-
литиков в обычных терапевтических дозах. При отравлении фосфорорга-
ническими инсектицидами с целью купирования бронхореи рекомендуется
дробное внутривенное введение 0,1%; раствора атропина A0—30 мл,
обязательно в разведении: не менее 20 мл 40% раствора глюкозы на 5 мл
0,1% раствора атропина). Профилактика и лечение ателектазов, особен-
но у больных, длительное время находящихся в коматозном состоянии,
заключается в отсасывании слизи из бронхиального дерева, поколачива-
нии и вибрации грудной клетки, частых изменениях положения больного
в постели или проведении постурального дренажа.
Обтурационно-аспирационные нарушения дыхания при пероральных
отравлениях деструктивными ядами (кислоты и щелочи) могут быть
обусловлены ожогом глоточного кольца, болезненностью акта откашли-
вания и накоплением большого количества вязкого секрета в верхних
дыхательных путях. При ингаляционных отравлениях прижигающими
ядами основное значение имеет их раздражающий эффектна паренхиму
легких и действие на интерорецепторы слизистых оболочек дыхательных
путей. Происходит сокращение мускулатуры голосовых связок, трахеи
и бронхов, что проявляется в виде астматического статуса. При значи-
тельных реактивных воспалительных изменениях, а иногда и в резуль-
тате непосредственного ожога гортани, возможно развитие стеноза по-
следней с выраженной картиной механической асфиксии.
Если в первых двух случаях терапевтический эффект может быть
достигнут консервативными методами (туалет верхних дыхательных пу-
тей, ингаляция соды с антибиотиками, внутривенное введение бронхо-
литиков— 10 мл 2,4% раствора эуфиллина), то при стенозе гортани по-
казана экстренная трахеостомия.
При лечении обтурационно-аспирационной формы нарушения дыха-
ния важнейшим профилактическим и лечебным мероприятием является
своевременная интубация или трахеостомия. Дополнительно к показа-
ниям к интубации, указанным в главе XI, целесообразно ее производить
у больных в коматозном состоянии до начала промывания желудка (для
предупреждения аспирации), а также у больных с отравлениями фос-
260
форорганическими соединениями и пахикарпином для длительной искус-
ственной вентиляции легких при параличе дыхательных мышц.
В. Патологические процессы в легких. При отравлениях химическими
веществами наиболее опасны токсический отек легких, острые пневмо-
нии, массивные гнойные трахеобронхиты,'синдром «водяных легких».
Токсический отек легких возникает при ожогах верхних дыхательных
путей парами хлора, аммиака, крепких кислот, а также при отравлениях
фосгеном и окислами азота. Основной причиной его развития считается
резкое повышение проницаемости легочных капилляров на фоне воспа-
лительных изменений альвеолярной ткани. В отличие от гемодинамиче-
ского отека легких токсический отек характеризуется затяжным течением;
в отечной жидкости содержится большое количество белка, а венозное
давление находится в пределах нормы. Токсический отек легких может
протекать без типичной клиники или с малозначительными проявления-
ми (сухой кашель, боли в груди, тахикардия). Вслед за перенесенным
токсическим отеком легких закономерно наблюдаются острые трахео-
бронхиты и пневмонии; возможно развитие абсцессов легких.
Лечебные мероприятия при токсическом отеке легких должны быть
направлены прежде всего на нормализацию проницаемости сосудистой
стенки и уменьшение воспалительных изменений. Необходимы система-
тическое введение глюкокортикоидов — 30 мг преднизолона с 20 мл 40%
раствора глюкозы внутривенно (всего до 200 мг преднизолона в сутки);
интенсивная антибиотикотерапия. Применяются аэрозоли (с помощью
ингалятора) с димедролом, эфедрином, новокаином. При отсутствии
ингалятора эти же препараты следует вводить парентерально в обыч-
ных дозах. При резко выраженной воспалительной гиперсекреции пока-
заны в умеренных дозировках холинолитики (атропин); на высоте оте-
ка— дегидратационная терапия A00—150 мл 30% раствора мочевины
внутривенно или 40—60 мг фуросемида с 20 мл 40% раствора глюко-
зы). Необходима постоянная оксигенотерапия.
Острые пневмонии при отравлениях развиваются в основном под воз-
действием трех факторов: длительного коматозного состояния, осложнен-
ного обтурационно-аспирационной формой нарушения дыхания; ожога
дыхательных путей прижигающими ядами и длительной интоксикации
любой этиологии. При отравлении снотворными и наркотическими пре-
паратами вероятность возникновения пневмонии тем выше, чем глубже
коматозное состояние. Она чаще возникает у пожилых и ослабленных
больных. При коме длительностью более 60 ч пневмония практически
возникает у всех больных. Как правило, развиваются двусторонние ниж-
недолевые пневмонии, носящие очаговый или сливной характер.
При ингаляционных и пероральных отравлениях прижигающими
ядами возникает геморрагическая пневмония, связанная с ожогом верх-
них дыхательных путей, а часто с непосредственной аспирацией и дейст-
вием прижигающего яда в более глубоких отделах легких. Предпосылкой
для возникновения массивных сливных пневмоний при отравлении фос-
форорганическими инсектицидами являются резкая гиперсаливация и
бронхорея на фоне значительного снижения респираторной активности
легких (гипертонус или паралич дыхательной мускулатуры).
261
Следует отметить, что своевременная диагностика острых пневмоний
при отравлениях нередко затруднена, так как типичные клинические
признаки пневмонии в коматозном состоянии больного могут отсутство-
вать или быть сглажены.
Серьезным и опасным осложнением при острых отравлениях являет-
ся фибринозно-некротический трахеобронхит. Наложение трахеостомы
часто способствует развитию фибринозно-некротического трахеобронхи-
та, так как приводит к недостаточному увлажнению вдыхаемого воздуха,
травматизации трахеи трахеостомической трубкой и при отсасывании
секрета. Однако ведущим в его возникновении следует считать: 1) при
отравлениях прижигающими жидкостями — наличие непосредственного
ожога гортани и начального отдела трахеи; сопутствующего ожога над-
гортанника с нарушением его функции, что приводит к затеканию инфи-
цированной слизи из полости рта в верхние дыхательные пути; 2) при
отравлениях снотворными и наркотическими препаратами — предраспо-
ложенность к трофическим расстройствам в ответ* на любое механическое
воздействие; снижение дренажной функции верхних дыхательных путей
на фоне значительной гиперсекреции; длительная искусственная венти-
ляция легких, способствующая задержке секрета в бронхиальном дереве.
Учитывая сложность раннего выявления воспалительных изменений
в легких и в то же время большую вероятность их развития, необходимо
при тяжелой форме интоксикации любой этиологии проводить раннюю
и массивную антибиотикотерапию. При резкой трахеобронхиальной за-
купорке густым плохо отделяемым секретом и сохраненном кашлевом
рефлексе целесообразно промывание бронхиального дерева 8% раство-
ром гидрокарбоната натрия с антибиотиками.
Следует особое внимание обращать на выявление синдрома «водя-
ных легких», характерного для общей гипергидратации больных в стадии
анурии и более всего для отравлений четыреххлористым углеродом.
Синдром «водяных легких» характеризуется резкой одышкой, астмоид-
ным дыханием. Рентгенологически определяется понижение прозрачнос-
ти легочной ткани за счет усиленного бронхо-сосудистого рисунка и
очаговых теней при пропотевании жидкости в альвеолы. Нередко присое-
диняется выпот в плевральную полость. Поражение не всегда симмет-
рично и зависит от положения больного в постели. С целью консерватив-
ного лечения синдрома «водяных легких» и при отсутствии ожога же-
лудочно-кишечного тракта можно искусственно вызывать диарею с
помощью введения в желудок 200—300 мл 30% раствора сульфата маг-
ния. Если при этом эффект разгрузки легких незначителен, то проводится
гемодиализ.
Г. Нарушение транспорта кислорода кровью. Указанная форма на-
рушения связана с различными по механизму поражениями эритроцитов
и гемоглобина. При отравлении гемолитическими ядами содержание
свободного гемоглобина в плазме редко превышает 5000 мг%, что со-
ставляет около трети активного гемоглобина эритроцитов. При отравле-
ниях окисью углерода, анилином, сульфаниламидными препаратами воз-
можна полная блокада гемоглобина, что сопровождается выраженным
асфиктическим синдромом вплоть до судорог и коматозного состояния.
262
При диагностике острой метгемоглобинемии следует обращать вни-
мание на характерное сине-фиолетовое прокрашивание видимых сли-
зистых оболочек, серо-синюшную окраску кожных покровов. С целью
дифференциальной диагностики гемической гипоксии с гипоксией иной
этиологии следует сравнить каплю венозной крови больного с кровью
здорового человека. Если кровь больного под воздействием кислорода
окружающего воздуха не изменит своей характерной коричневой окрас-
ки, можно с уверенностью диагностировать токсическую метгемоглоби-
немию. Общим для данной формы нарушения дыхания методом лечения
является оксигенобаротерапия. В случае массивной необратимой блока-
ды гемоглобина (сульфметгемоглобинемия) показана операция заме-
щения крови. Если соединение токсического вещества с кровяным пиг-
ментом нестойкое и подвержено обратной диссоциации (карбоксигемо-
глобинемия), хороший лечебный эффект достигается усилением легочной
вентиляции. При отравлении метгемоглобинобразующими ядами наряду
с указанной выше терапией проводится специфическое лечение (дробное
внутривенное введение 1% раствора метиленового синего из расчета
1 мг/кг).
Д. Нарушение тканевого дыхания. Та или иная степень тканевой ги-
поксии всегда имеет место при выраженных интоксикациях любой этио-
логии. Максимально выражена эта форма нарушения процессов дыхания
при отравлении цианидами, блокирующими дыхательный фермент Вар-
бурга. Клинически это проявляется наличием асфиктического синдрома
(одышка, рвота, судороги, кома) без явлений цианоза. При пункции вен
выделяется ярко-алая венозная кровь, насыщение которой кислородом
равноценно артериальной. Основным лечебным мероприятием является
специфическая терапия, направленная на возможно более полное свя-
зывание синильной кислоты. Больным внутривенно вводят до 50 мл 1 %
раствора метиленового синего, 20 мл 30% раствора тиосульфата матр'ия,
свыше 1000 мкг витамина Bi2.
Синдром поражения
сердечно-сосудистой системы
Нарушения гемодинамики при разнообразных острых отравлениях
могут быть обусловлены поражением фактически всех звеньев регуляции
сердечно-сосудистой системы и проявляются в следующих видах пато-
логических состояний: 1) гипертонический синдром; 2) острая сердечно-
сосудистая недостаточность; 3) нарушения ритма и проводимости в
сердце; 4) токсический шок.
Гипертонический синдром характерен для раннего периода ряда
отравлений. При отравлениях фосфорорганическими инсектицидами его
возникновение обусловлено совокупностью действия данных препаратов
на центры продолговатого мозга, симпатические ганглии, хеморецепто-
ры каротидных клубочков и мозговое вещество надпочечников (С. Н. Го-
ликов, 1968). Гипертонический синдром может наблюдаться в начальной
стадии острых ингаляционных отравлений прижигающими ядами (ам-
миак, пары хлора и др.). Спазм сосудов возникает рефлекторно, в ответ
263
на раздражение верхних дыхательных путей. Выявляется отчетливая
взаимосвязь гипертонического синдрома с явлениями асфиксии как
вследствие обтурационных процессов в легких, так и аноксемии (отрав-
ления окисью углерода, анилином и др.).
При лечении гипертонического синдрома должны применяться меро-
приятия патогенетической терапии, при этом назначают в обычных дози-
ровках гипотензивные средства (дибазол, сульфат магния, пентамин).
Острая сердечно-сосудистая недостаточность в раннем периоде при
отравлении наиболее часто обусловлена несоответствием между коли-
чеством циркулирующей крови и объемом сосудистого русла, дезоргани-
зацией процесса микроциркуляции, перераспределением крови (экзоток-
сический шок). При отравлениях барбитуратами недостаточность
кровообращения возникает как от угнетения вазомоторного центра, так
и от их прямого паралитического действия на артериолы и капилляры.
Резкое расширение объема сосудистого русла при неизменном количест-
ве циркулирующей крови приводит к относительной гиповолемии; проис-
ходит депонирование крови в венозной системе. При отравлениях
мышьяком, уксусной эссенцией, дихлорэтаном и некоторыми другими
веществами может наблюдаться гиповолемия за счет резкого нарушения
проницаемости и плазморрагии, а иногда и сопутствующей резкой диа-
реи. Вератриновые алкалоиды, входящие в состав белой чемерицы, могут
вызывать резкое снижение артериального давления нервнорефлекторным
путем.
Основным в лечении острой сосудистой недостаточности и экзотокси-
ческого шока при отравлениях является компенсация имеющейся гипово-
лемии путем внутривенного капельного введения- кровезамещающих
жидкостей (полиглюкин, гемодез, плазма, растворы глюкозы); целесо-
образно введение 60—200 мг преднизолона, сердечно-сосудистых средств.
Нарушения ритма и проводимости в сердце при острых отравлениях
весьма разнообразны. Синусовая тахикардия может быть проявлением
специфического действия токсического вещества, например при отравле-
нии атропином или другими лекарственными веществами, обладающими
холинолитическим эффектом (беллоид, белласпон, димедрол). Однако
в большинстве случаев тахикардия носит вторичный характер и связана
с нарушением внешнего дыхания или с острой сердечно-сосудистой не-
достаточностью. Синусовая брадикардия в значительно большей мере
отражает специфичность действия токсических веществ. Она характерна
при отравлениях сердечными гликозидами, вератрином, соединениями
бария (ВаЫОг, ВаГ\Юз) и фосфороргаиическими инсектицидами.
Нарушения ритма чаще всего бывают связаны с нарушением электро-
литного баланса или специфическим воздействием токсического вещест-
ва на ионный градиент калия (сердечные гликозиды, пахикарпин,
хинин). Нарушения ритма проявляются в виде единичных желудочко-
вых экстрасистол, би-, три- и квадригеминии, а также в виде периодов
частых политопных желудочковых экстрасистол, иногда переходящих в
периоды фибрилляции желудочков. Нарушение проводимости в виде
атрио-вентрикулярной блокады, полной поперечной блокады и внутри-
желудочковой блокады характерно для тяжелых отравлений дихлорэта-
264
ном, фосфорорганическими инсектицидами, барбитуратами, пахикарпи-
ном, хинином. Изменение фазы реполяризации (снижение сегмента 5'—
Г, сглаживание и негативация зубца Т) характерно для всех тяжелых
отравлений, протекающих с коматозным состоянием, ацидозом, и связано
с развивающейся гипоксией или гипокалиемией.
Лечение нарушений ритма и проводимости в сердце включает специ-
фическую терапию, направленную на купирование кардиотоксического
эффекта и профилактику дистрофии миокарда. При отравлениях алка-
лоидами вератрина, фосфорорганическими инсектицидами брадикардию
купируют путем введения атропина. С целью улучшения метаболических
процессов в миокарде назначают витамины группы В, никотиновую кис-
лоту, кокарбоксилазу, инсулин, АТФ, кортикостероиды.
В патогенезе токсического шока, возникающего при отравлениях кис-
лотами и щелочами, ведущее значение имеет болевая импульсация.
При отравлении уксусной эссенцией развитию шока способствует резкий
метаболический ацидоз за счет одномоментной резорбции большого
количества Н+ ионов; массивный внутрисосудистый гемолиз и генера-
лизованное нарушение проницаемости сосудистой стенки. Шок протекает
с типичной для этого тяжелого состояния клинической симптоматикой:
резкие боли по ходу пищевода и в верхней половине живота, бледность
кожных покровов, возбуждение, сменяющееся адинамией, нарастающая
тахикардия, временное повышение артериального давления в эректиль-
ной фазе шока с прогрессивным его падением в торпидной. При этом
отмечается значительное сокращение объема циркулирующей крови
вследствие ожоговой плазмопотери, падение ударного и минутного
объема сердца, повышение периферического сосудистого сопротивления.
Лечение болевого синдрома затруднено в связи со сложностью обезбо-
ливания пищеварительного тракта.
Борьба с болевым синдромом при ожоговом токсическом шоке про-
водится по двум направлениям: 1) уменьшение восприимчивости цент-
ральной нервной системы к боли путем назначения наркотиков и аналь-
гетиков; 2) уменьшение поступления болевых импульсов из очага трав-
мы в центральную нервную систему путем проведения односторонней
ваго-симпатической новокаиновой блокады и внутривенного капельного
введения глюкозо-новокаиновой смеси E0 мл 2% раствора новокаина
с 500 мл 5% раствора глюкозы). Параллельно осуществляется компен-
сация плазморрагии и восстановление объема циркулирующей крови
путем внутривенного введения плазмозамещающи^: растворов; нормали-
зация нарушенного кислотно-щелочного равновесия.
, Синдром поражения желудочно-кишечного тракта является одним из
распространенных проявлений острых отравлений и выражается в виде
рвоты, пищеводно-желудочных кровотечений, токсического гастроэнтеро-
колита. Возникновение рвоты может быть проявлением защитной реак-
ции организма в ответ на поступление в желудок раздражающего ток-
сического вещества или воздействия яда гуморальным путем на рвотный
центр (ингаляционные, пероральные отравления дихлорэтаном). Рвота
и сопутствующий ей гастроэнтерит могут носить неврогенный характер,
будучи обусловленными повышенной моторикой желудочно-кишечного
265
гракта в связи с нарушением его иннервации при отравлении фосфор-
органическими инсектицидами. На ранних этапах данных отравлений
рвота может рассматриваться как благоприятное явление, так как она
способствует удалению токсического вещества из организма. Исключе-
ние составляют те случаи, когда рвота возникает в коматозном состоянии
больного или на фоне резких нарушений дыхания (нарастающий стеноз
гортани, отек легких). Одной из причин рвоты может быть асфиктиче-
ский синдром, с ликвидацией которого рвота прекращается.
Ожоги пищевода и желудка должны настораживать прежде всего с
точки зрения возможной массивной плазмопотери и сверхсильного разд-
ражения нервных окончаний пищеварительного тракта как первопричи-
ны развития шока (см. выше). Следует учитывать, что при глубоких
поражениях пищевода, желудка и начального отдела кишечника возмож-
но их прободение или «контактные ожоги» прилегающих органов (на-
пример поджелудочной железы). Лечение этих осложнений проводится
по принципам, принятым в хирургии.
Пищеводно-желудочные кровотечения наиболее часто наблюдаются
при отравлениях прижигающими ядами, дихлорэтаном, неорганически-
ми солями ртути, а также у больных с острой почечной недостаточ-
ностью. При отравлениях прижигающими ядами возможно раннее и
позднее их появление. Ранние кровотечения носят характер диапедезных
и возникают тотчас после ожога желудка за счет непосредственного
поражения капиллярной сети слизистой оболочки желудка. Поздние
кровотечения происходят за счет отторжения массивных участков нек-
ротизированной слизистой оболочки с обнажением богатого сосудами
подслизистого слоя и образования глубоких эрозивных язв.
В этиологии пищеводно-желудочных кровотечений при отравлениях
большое значение имеют нарушения со стороны свертывающей системы
крови. При тяжелых отравлениях уксусной эссенцией уже в первые
часы отмечается гипокоагуляция, вызванная снижением толерантности
плазмы к гепарину, повышением времени рекальцификации, снижением
содержания фибриногена, ростом фибринолитической активности. При
отравлениях дихлорэтаном также характерна выраженная гипокоагуля-
ция, что связано с увеличением содержания гепарина и фибринолити-
ческой активности. В связи с указанным для остановки кровотечений
необходимо применять гемостатические препараты, снижающие фибри-
нолитическую активность (^-аминокапроновая кислота), проводить пе-
реливание свежеприготовленной цитратной донорской крови; возможно
прямое переливание крови. Обнадеживающий эффект при массивных
желудочных кровотечениях достигается методом локальной гипотермии
с помощью отечественного аппарата (АГЖ-1).
Острые гастроэнтероколиты, характерные для отравлений бледной
поганкой, мышьяком и др., опасны прежде всего развитием дегидрата-
ции. Рекомендуется внутривенное введение жидкости с солевым соста-
вом, идентичным плазме.
Для острой почечной недостаточности при острых отравлениях ха-
рактерно разнообразие вызывающих ее этиологических факторов. Она
возникает при отравлениях нефротоксическими ядами (антифриз, суле-
266
ма, дихлорэтан и др.), гемолитическими ядами (мышьяковистый водо-
род, уксусная эссенция), при глубоких трофических нарушениях на
фоне коматозных состояний (миоренальный синдром), а также при дли-
тельном и глубоком коллапсе на фоне других отравлений. Характерно
большое (до 25%) количество сопутствующих поражений печени, что
часто позволяет говорить об острой печеночно-почечной недостаточности.
Общей для многих токсических веществ является возможность пре-
дупреждения острой почечной недостаточности путем проведения пере-
численных ниже профилактических мероприятий.
При отравлении этиленгликолем ранний гемодиализ с целью его
выведения из организма в первые часы после отравления снижает ве-
роятность возникновения острой почечной недостаточности и наступле-
ния смертельного исхода. Целесообразно с целью коррекции резчайшего
ацидоза внутривенное введение 4% раствора бикарбоната натрия. При
явлениях выраженной токсической энцефалопатии (возбуждение, судо-
роги) положительного клинического эффекта можно добиться лечебными
спинномозговыми пункциями.
При отравлениях соединениями ряда металлов и мышьяка отмечен
период их относительно длительной циркуляции в крови на фоне бес-
симптомного течения заболевания. Это с учетом диализируемости дан-
ных веществ создает очень благоприятные условия для проведения ран-
него гемодиализа, так как отсутствуют «соматические противопоказа-
ния» к его проведению. При использовании гемодиализа в раннем
периоде (первые сутки после отравления) нередко удается избежать
не только развития острой почечной недостаточности, но и характерных
выраженных изменений со стороны желудочно-кишечного тракта.
При отравлениях гемолитическими ядами профилактика острой по-
чечной недостаточности заключается в борьбе с шоком, плазмопотерей
и выведении гемоглобиновых шлаков методом форсированного диуреза.
Клинический синдром уже развившейся острой почечной недостаточ-
ности довольно неспецифичен и его лечение проводится по общеизвест-
ным принципам.
При острой печеночной недостаточности наряду с общепринятыми
мероприятиями благоприятный эффект оказывает трансумбшшкальное
введение 5% раствора глюкозы, витаминов группы В, осуществляемое
после предварительного бужирования пупочной вены.
Рекомендации по диагностике и терапии
наиболее распространенных отравлений
Отравление дихлорэтаном
1,2-дихлорэтан (симметричный дихлорэтан, хлористый этилен, этилен-
дихлорид) — протоплазматический яд, наркотик, вызывающий дистрофи-
ческие изменения в печени, почках и других внутренних органах. Токси-
ческое действие проявляется при приеме дихлорэтана лерарально, «при
поступлении паров яда через дыхательные пути, проникновении через не-
поврежденную кожу. При приеме внутрь 5—10 мл дихлорэтан оказывает
токсическое действие, а 20 мл являются летальной дозой. Дихлорэтан
267
распределяется в организме путем свободной диффузии и накапливается
в тканях, богатых липоидами (центральная нервная система, сальник,
печень, надпочечник). Выведение яда происходит через легкие, почки,
кишечник.
Токсическая энцефалопатия наблюдается у большинства
больных при отравлении дихлорэтаном и проявляется головокружением,
атаксией, выраженным психомоторным возбуждением, клонико-тониче-
скими судорогами, угнетением сознания вплоть до коматозного состоя-
ния. Характерно расширение зрачков, гиперемия склер, гиперемия и
мраморность кожных покровов, особенно в области лица и груди, цианоз
губ, акроцианоз, возможен гипертонус мышц конечностей. У большинст-
ва больных кома сопровождается нарушением дыхания, причем наблю-
дается как аспирационно-обтурационный тип дыхательных расстройств,
так и нарушения по центральному типу до полного апноэ. Возможно
повторное развитие коматозного состояния в поздние сроки (через 10—
20 ч после отравления).
Острый токсический гастрит и гастро-энтерит.
Тошнота, частая рвота с примесью желчи являются ранними признака-
ми отравления. У 15—20% больных через 2—15 ч после отравления
присоединяется острый энтерит, являющийся плохим прогностическим
признаком.
Острая сердечно-сосудистая недостаточность
(токсический шок) может развиться через 2—50 ч после отравления.
Длительность шока обычно не превышает 40 ч. Подобные случаи обыч-
но заканчиваются летальным исходом. Падению артериального давления
может предшествовать его кратковременное повышение, часто на фоне
психомоторного возбуждения, а также период стойкой тахикардии (до
160—180 в минуту).
Токсический гепатит развивается у большинства больных в
первые часы после отравления. Отмечается увеличение печени, которая
пальпируется на 2—4 см ниже края реберной дуги, возможно развитие
печеночной колики с выраженными болями в правом подреберье. Могут
наблюдаться явления геморрагического диатеза, сопровождающиеся
желудочно-кишечным кровотечением и микрогематурией. В крови уве-
личивается содержание билирубина при значительном преобладании
прямого билирубина и активности внутриклеточных ферментов — транс-
аминаз, альдолазы.
Нарушение функции почек проявляется альбуминурией
различной степени с развитием острой почечной недостаточности у 2,5—
3% больных на 3—4-е сут, после отравления.
По клиническому течению различают три основные формы острых
отравлений дихлорэтаном.
1. При легкой форме интоксикации у больных преимущественно
выявляются явления токсического гастрита.
2. Пр'и отравлениях средней тяжести развивается токсический гепа-
тит и указанные выше явления гастрита; со стороны центральной нерв-
ной системы чаще наблюдается заторможенность, реже небольшое воз-
буждение больных;
268
3. При тяжелой форме интоксикации наблюдается сочетание всех
патологических синдромов. У больных отмечается токсический гепатит
и декомпенсированный метаболический ацидоз. На фоне коматозного
состояния, выраженного возбуждения или клонико-тонических судорог
развивается острая сердечно-сосудистая недостаточность.
Летальность при отравлении дихлорэтаном свыше 50%.
При лечении острых отравлений дихлорэтаном основное внимание
уделяют методам ускоренного выведения его из организма, поскольку
специфической (антидотной) терапии до сих пор не разработано. На мес-
те происшествия и в стационаре проводят обильное промывание желуд-
ка через зонд с последующим введением в желудок 50—100 мл вазели-
нового масла, ставят сифонную клизму. Основным методом выведения
яда является перитонеальный диализ, При определении дихлорэтана в
крови производят гемодиализ, осмотический диурез или операцию за-
мещения крови.
Симптоматическое лечение острой почечной и печеночной недоста-
точности проводится по обычным принципам.
Отравление снотворными и другими
психофармакологическими средствами
Основную группу снотворных средств, вызывающих наибольшее ко-
личество отравлений, составляют различные препараты барбитуровой
кислоты. Однако в последние годы заметно увеличивается удельный вес
отравлений новыми препаратами, обладающими снотворным и седатив-
ным свойством, — ноксироном, аминазином, мепротаном, хлордиазенок-
сидом и др. Летальность при отравлениях снотворными и седативными
средствами составляет в последние годы около 1—3%, однако среди
больных, доставляемых в коматозном состоянии, она значительно выше
и достигает 10%.
Коматозные состояния, вызванные этими препаратами, характери-
зуются определенной стадийностью. Последовательно развиваются явле-
ния заторможенности (I стадия отравления), поверхностная кома с по-
вышением или снижением сухожильных рефлексов (II стадия отравле-
ния), и наконец глубокая кома с арефлексией (III стадия отравления),
протекающая с выраженными нарушениями функции дыхания и крово-
обращения. Период выхода из коматозного состояния (IV стадия отрав-
ления) нередко протекает с временным психомоторным возбуждением.
В коматозном состоянии возможно выявление ряда патологических
симптомов (анизокория, симптом Кернига и др.)- Обращает на себя
внимание и непостоянство патологической неврологической симптома-
тики, что в какой-то мере помогает отличать эти коматозные состояния
от ком, вызванных нарушением мозгового кровообращения или череп-
но-мозговой травмой.
Определение содержания барбитуратов в крови методом спектро-
фотометрии показывает зависимость глубины коматозного состояния от
количественного уровня этих препаратов в крови. Так, II стадия отрав-
ления наблюдается при содержании этаминал-натрия в количестве око-
269
ло 1 мг%, барбамила —около 3 мг%, фенобарбитала — более 4 мг%.
Концентрация барбитуратов в спинномозговой жидкости примерно со-
ответствует их содержанию в крови, а в моче — значительно выше (по-
следний показатель не коррелирует с глубиной коматозного состояния).
Важным показателем являются данные электроэнцефалографии,
позволяющие получить характерные для каждой стадии отравления ти-
пы изменения электрической активности мозга. Например, для поверх-
ностной комы характерно появление так называемых барбитуровых
веретен — электроактивности с преобладанием частот 14—16 колеба-
ний в секунду и амплитудой 100—140 мкВ, а в глубокой коме обычно
регистрируется высоковольтная полиритмия с периодами полного элек-
трического «молчания» мозга.
Для лечения острых отравлений снотворными и седативными сред-
ствами прежде всего применяется симптоматическая и реанимационная
терапия, направленная на восстановление и поддержание функции ды-
хательной и сердечно-сосудистой систем, профилактику и лечение пнев-
монии. Традиционный метод интенсивной стимулирующей терапии боль-
шими дозами аналептиков оказался неэффективным и даже опасным при
глубокой коме, осложненной выраженной гипоксией. Кроме того, при
использовании больших доз бемегрида возможно развитие дыхательных
осложнений, связанных с судорожным состоянием.
Основным направлением проводимого лечения следует считать усю>
ренное освобождение организма от снотворных путем максимальной
стимуляции диуреза и внепочечного очищения. Наиболее широко исполь-
зуются методы форсированного осмотического диуреза с помощью мо-
чевины или магнитола, гемодиализ, перитонеальный диализ. При этом
наблюдается быстрое снижение концентрации барбитуратов в крови,
сопровождающееся положительной динамикой клинических данных.
В особо тяжелых случаях целесообразно комплексное применение
указанных выше средств.
Эффективность методов выведения неравнозначна при отравлениях
различными снотворными средствами. В табл. 8 приведены методы
ускоренного выведения препаратов в зависимости от стадии отравления
и его типа.
Таблица 8
Стадия
отравления
I
II
III
IV
Характер лечебных мероприятий
отравление барбитуратами
Форсированный диурез и ощелачива-
ние плазмы
Осмотический диурез
Осмотический диурез
Гемодиализ, за исключением отрав-
лений этаминалом-натрия
Перитонеальный диализ при отравле-
ниях этиаминалом-натрия
Форсированный диурез
отравление небарбитуровыми снотворными
Форсированный диурез
Перитонеальный диализ
Перитонеальный диализ
Форсированный диурез
270
Острые отравления кислотами и щелочами
Особенностью острых отравлений кислотами и щелочами является
развитие ожоговой болезни химической этиологии вследствие прижига-
ющего действия этих веществ на слизистые оболочки желудочно-кишеч-
ного тракта и верхние дыхательные пути с развитием коагуляционного
(при действии кислот) или колликвационного (при действии щелочей)
некроза.
Смертельная доза при поступлении концентрированных кислот и ще-
лочей 50—80 мл.
В клиническом течении острых отравлений крепкими кислотами и ще-
лочами различают следующие стадии: стадию ожогового шока A-е сут),
стадию токсемии B—3-й сут), стадию инфекционных осложнений A —
2-я нед) и стадию стенозирования и ожоговой астении.
Особенности развития и течения шока рассмотрены в разделе «Сим-
птоматическая терапия».
Для стадии токсемии наиболее характерными клиническими призна-
ками служат повышение температуры тела и выраженное психомоторное
возбуждение; в стадии инфекционных осложнений часто развиваются
гнойные флебиты поверхностных вен, использованных для внутривен-
ной терапии; пневмонии; гнойные трахеоброихиты.
Для выявления рубцовых сужений пищевода или желудка необхо-
димо рентгенологическое исследование, проводимое не ранее 3—4-й нед
после отравления, так как до этого времени данные рентгенографии
обычно не показательны.
Развитие ожогового шока и внутрисосудистого гемолиза крайне не-
благоприятно влияет на функцию печени и почек, когда вследствие на-
рушения кровообращения и лимфотока, а также отложения большого
количества гемоглобина возможно развитие токсического пигментного
гепатита и гемоглобинурийного нефроза. Количество выделяемой мочи
(красного или вишневого цвета) быстро уменьшается вплоть до полной
анурии, развиваются желтуха, полостные и периферические отеки, азо-
темия и другие клинические симптомы острой печеночно-почечной недо-
статочности, достигающей своет полного развития на 5—8-е сутки
после тяжелых отравлений.
Лечение острых пероральных отравлений кислотами и щелочами на-
чинают с терапии ожогового шока, пищеводно-желудочных кровотече-
ний, промывания желудка через зонд и удаления свободного гемоглоби-
на методом форсированного диуреза. Профилактика рубцовых сужений
пищевода и желудка осуществляется систематической антибиотикоте-
рапией и назначением глюкокортикоидов (АКТГ 40 единиц или гидро-
кортизона 125 мг внутримышечно в течение 2—3 нед).
В стадии токсемии целесообразны активная гидратационная терапия
(внутривенное введение 5% раствора глюкозы, 0,86% раствора хлорида
натрия, переливание плазмы — суммарно не менее 3 л жидкости в сут-
ки) ; введение витаминов группы В.
Лечение острой почечной и печеночной недостаточности проводится
по общепринятым принципам.
271
Отравления фосфорорганическими инсектицидами
Фосфорорганические соединения тиофос, хлорофос, карбофос и др.
могут поступать в организм через органы дыхания, неповрежденную ко-
жу, желудочно-кишечный тракт. Смертельная доза тиофоса при поступ-
лении внутрь 0,2—2 г. Токсическое действие фосфорорганических соеди-
нений связано с угнетением ряда ферментных систем организма, однако
в первую очередь проявляется их антихолинэстеразное действие, которое
ведет к накоплению в организме избыточных количеств ацетилхолина —
одного из медиаторов нервного возбуждения.
Различают три стадии отравления фосфорорганическими соединени-
ями: I стадия наблюдается у больных с начальными симптомами отрав-
ления. Отмечается умеренный миоз, потливость, саливация, иногда рано
присоединяются явления нерезко выраженной бронхореи. Возможно
психомоторное возбуждение, рвота и спастические боли в животе. Арте-
риальное давление повышено, умеренная тахикардия.
II стадия характеризуется полностью развившейся картиной отрав-
ления. Психомоторное возбуждение сохраняется или постепенно сменя-
ется заторможенностью, а в отдельных случаях коматозным состояни-
ем. Остается выраженный миоз; отсутствует реакция зрачков на свет.
Достигают максимального проявления симптомы гипергидроза (резчай-
шие потливость, саливация, бронхорея). Характерны гиперкинезы хо-
риоидного и миоклонического типов (миофибрилляции). Последние по-
являются на веках, мышцах груди и голеней, а в ряде случаев отмечают-
ся фибрилляции почти всех мышц тела. Периодически возникают общий
гипертонус мышц, тонические судороги. Наблюдается ригидность груд-
ной клетки с уменьшением ее экскурсии. Повышение артериального дав-
ления достигает максимальных величин B50/160 мм рт. ст.). Отмечаются
болезненные тенезмы, непроизвольный жидкий стул, учащенное мочеис-
пускание.
III стадия диагностируется у больных, которые находятся в состоя-
нии глубокой комы, протекающей с резким ослаблением всех рефлексов
или полной арефлексией. Несмотря на выраженную гипоксию, резко
выражен миоз. Стойко держатся симптомы гипергидроза. Однако мы-
шечный гипертонус, миофибрилляции и тонические судороги исчезают,
сменяясь паралитическим расслаблением мускулатуры. Преобладают
центральные формы угнетения дыхания. Отмечается нерегулярность
глубины и частоты дыхательных движений вплоть до паралича дыха-
тельного центра. Максимально урежается число сердечных сокращений
(до 40—20 в минуту) или, напротив, появляется выраженная тахикар-
дия (свыше 120 ударов в минуту). Артериальное давление имеет тенден-
цию к снижению.
У 7—8% больных, поступивших в стационар со II—III стадией от-
равления, начиная со 2-го по 8-й день после отравления отмечается ре-
цидив симптомов интоксикации. Несмотря -на активно проводимое ле-
чение, вновь выявляются перечисленные выше симптомы отравления
фосфорорганическими соединениями, часто в более тяжелых прояв-
лениях.
272
К осложнениям, которыми, как правило, сопровождаются тяжелые
отравления фосфорорганическими соединениями, относятся пневмонии,
острые интоксикационные психозы, нарушения проводимости и ритма
сердца.
Основной принцип лечения больных с острым отравлением фосфорор-
ганическими соединениями заключается в сочетании интенсивных реани-
мационных мероприятий, выведении яда из организма (промывание же-
лудка через зонд, форсированный диурез) и активной комплексной спе-
цифической терапии.
Специфическая терапия острых отравлений фосфорорганическими
соединениями состоит в комбинированном применении холинолитиков
(препаратов типа атропина) и реактиваторов холинэстеразы. В течение
первого часа с момента начала лечения больному проводят интенсивную
атропинизацию, т. е. внутривенное введение атропина до купирования
всех симптомов гипергидроза и появления слабой его передозировки
(сухость кожных покровов, умеренная тахикардия). Это состояние сле-
дует поддерживать добавочным повторным введением меньших коли-
честв атропина (поддерживающая атропинизация) для создания стой-
кой блокады м-холинореактивных систем организма против действия
ацетилхолина на период, необходимый для разрушения и удаления яда.
Средние дозы атропина для проведения указанного лечения приведены
в табл. 9.
В настоящее время имеются реактиваторы холинэстеразы, способные
восстанавливать активность угнетенной холинэстеразы и обладающие
прямым антидотным действием на различные фосфорорганические сое-
Стадия
отравления
I
II
III
Интенсивная
первых
антропинизация
1—-2 ч лечения,
2—3
20—25
30—50
в течение
в мг
Таблица 9
Поддерживающая антропинизация в течение
2—3 сут (всего за сутки в мг)
4—6'
25—50
25—50
динения. Реактиватор холииэстеразы дипероксим вводят внутривенно в
виде 15% раствора по 1 мл повторно, но не более 1 г в сутки в течение
первых 2 дней с момента отравления (дальнейшее введение препарата
неэффективно и опасно в связи с выраженным побочным действием).
Специфическая терапия проводится под постоянным контролем ак-
тивности холинэстеразы. В норме она составляет 4—6 мкмоль и умень-
мл/мин
шается в тяжелых случаях до 1 мкмоль и ниже.
мл/мин
18 Заказ № 1266
XVI
ТЕРМИНАЛЬНЫЕ СОСТОЯНИЯ,
ВЫЗВАННЫЕ УТОПЛЕНИЕМ, ЭЛЕКТРОТРАВМОЙ,
АЛЛЕРГИЧЕСКИМИ РЕАКЦИЯМИ
Патогенез и лечение
терминальных состояний, вызванных
утоплением
Оживление утонувших занимает значительное место в практике реа-
нимационной службы. Объясняется это большим числом умерших в ре*
зультате утопления. Так, опубликованные за последние годы данные по-
казывают, что ежегодно от утопления погибает 7000 человек в США,
1500 —в Англии, 1000 —в ФРГ, 500 —в Австралии (Fullter, 1963;
Griffin, 1966; Giammona, Modell, 1967; Tonner, 1971). Если к этому до-
бавить, что в результате утопления чаще всего погибают люди молодого
возраста, то актуальность проблемы предотвращения наступления смер-
ти по этой причине становится очевидной.
Некоторые авторы сомневаются в возможности получения стойкого
эффекта от реанимации при утоплении в случаях остановки кровообра-
щения (Koittingen, Naess, 1963; Ersland e. a., 1967; Hegendorfer, 1970).
Однако результаты образцово организованной болгарской спасатель*
ной службы позволяют более оптимистически отнестись к возможностям
оживления утонувших (Saev, 1971).
На успех в реанимации можно надеяться лишь в том случае, если
своевременно проводится патогенетическое лечение.
В настоящее время считается доказанным факт, что механизмы уми-
рания при утоплении бывают различными. Смерть в воде может насту-
пить не только от истинного утопления, когда вода попадает в дыха-
тельные пути и легкие, но и в результате рефлекторной остановки серд-
ца, от шока, вызванного холодной водой, от аллергического шока, от
остро развившегося инфаркта миокарда, от вестибулярного раздражения»
особенно при дефектах барабанной перепонки, от черепно-мозговой
травмы, в результате ушиба при погружении в воду и др.
Причиной смерти может быть механическая асфиксия в результате
затянувшегося ларинго- или бронхоспазма. По внешним признакам та-
ких пострадавших относят к группе «цианотических утонувших», но они
отличаются от истинно утонувших тем, что и в этих случаях в дыхатель-
ных путях и легких вода отсутствует или имеется в минимальном коли-
честве. Если случаи гибели людей в результате внезапной первичной ос-
274
тановки кровообращения составляют лишь несколько процентов от об-
щего числа утоплений, то асфиксия без выраженной аспирации состав-
ляет примерно 10%. Правда, утверждать это весьма трудно, так как
в случаях утопления в пресной воде небольшие объемы ее быстро поки-
дают альвеолярное пространство, но именно эта аспирированная жид-
кость и может быть причиной возникновения терминальной гипоксемии
и ацидоза (Modell, 1968; Hegendorfer e. a., 1970).
Экспериментальные данные показали, что своевременно проведенная
реанимация дает наилучший результат именно в случаях лечения тер-
минальных состояний, обусловленных асфиксией без аспирации жидко-
сти (Modell, 1968).
Чаще всего у утонувших помимо асфиксии рефлекторного характера
имеет место тяжелое «отравление водой» (истинное утопление). Пола-
гают, что такой сочетанный механизм развития терминального состоя-
ния имеет место более, чем в 80% всех случаев утопления. Тяжесть и
обратимость патологических процессов при этом во многом зависят от
количества и качества аспирированной жидкости.
Что касается количества аспирированной жидкости, то это, очевид-
но, в основном зависит от длительности процесса умирания под водой.
При наступлении скоропостижной смерти (остановки кровообращения)
окружающая организм вода может вовсе не быть аспирированной.
У большинства же пострадавших создаются все предпосылки для ак-
тивной аспирации жидкости и возникновения так называемого «истин-
ного» утопления. Доказано, что первичная задержка дыхания (умыш-
ленная или обусловленная ларинго-бронхиолоспазмом) приводит к
гиперкапнии и гипоксии, потере сознания, постепенному прекращению
спазмов и возобновлению глубоких дыхательных движений. Продолжи-
тельность этой фазы умирания составляет от одной до нескольких ми-
нут. Во время глубоких дыхательных движений происходит заполнение
дыхательных путей водой, песком, илом. Количество воздуха в легких
резко уменьшается, а следовательно гипоксия и нарушения метаболизма
углубляются. В дальнейшем наступает повторная задержка дыхания,
так называемая терминальная пауза (длительностью 30—60 с), которая
в свою очередь переходит в фазу агональных вдохов (Л. В. Лебедева,
1966).
В отношении качества этой жидкости имеется в виду концентрация
в ней различных электролитов, обеспечивающая определенный осмоти-
ческий градиент между жидкостью, попавшей в альвеолярное простран-
ство, и кровью. В соответствии с этим принято различать утопление в
пресной и морской воде. В первом случае концентрация электролитов (и
отсюда осмотическое давление) в аспирированной жидкости значитель-
но ниже, чем в крови; во втором случае — наоборот.
В связи с этим механизмы и патологические процессы, происходящие
при утоплении в пресной и морской воде, существенно отличаются.
а) Утопление в пресной воде (рис. 28). Известно, что часть аспириро-
ванной жидкости проникает в систему кровообращения (Hegendorfer3
1970). Согласно данным Swann и соавторов A949, 1951, 1962), уже через
2 мин от начала утопления в крови экспериментального животного со
18* 275
Гиперволемия
Гииопротеинемия
HbT Гематокрит
\
Рис. 28. Схема патогенеза терминальных состояний при утоплении в пресной
воде.
держится около 50%' аспирированной жидкости. Это приводит к возник-
новению выраженной гемодилюции и гемолиза, снижению концентрации
ионов натрия, хлора и кальция, а также белков плазмы. Заполнение
альвеолярного пространства легких жидкостью, а также разрушение
пресной водой противоателектазного вещества — сурфактанта альвеол
приводит к нарушению кровообращения в малом круге, в частности, к
значительному шунтированию крови в легких (нарушению соотношения
«вентиляция — кровоток»), а следовательно к углублению гипоксемии и
метаболического ацидоза. Возможны случаи молниеносного отека лег-
ких, связанного с рефлекторным раздражением глоточно-трахеальной
области, переходом электролитов, белков плазмы в заполняющую аль-
веолы жидкость с низким осмотическим давлением. Смешивание (благо-
даря дыхательным движениям) жидкости с воздухом образует пену, а
переход гемоглобина из разрушенных эритроцитов в эту жидкость
обусловливает ее розовый оттенок. В результате гемолиза внутрикле-
точный калий эритроцитов попадает в плазму крови и концентрация его,
несмотря на выраженную гиперволемию, увеличивается (по некоторым
данным, до 8 мэкв/л).
Асфиксия и ацидоз обусловливают выраженное раздражение симпа-
тико-адреналовой системы, сопровождающееся мобилизацией катехол-
аминов в крови со всеми вытекающими отсюда последствиями. Гиперка-
лиемия, гиперадренали'немия, гипоксемия и ацидоз нередко приводят к
276
Отек легких
Гипоксемия
Ацидоз
Морская вода
Гиповотемчя
Гнпорроичшемия
Mg*~ I Na~ T
К+ I Ca~~ T
СГТ
Hb f 1
Гематокрит Т
Рис. 29. Схема патогенеза терминальных состояний при утоплении
в морской воде.
фибрилляции желудочков сердца и смерти пострадавшего (Л. В. Лебе-
дева, 1966; С. К. Саев, Д. Доросиев, 1971; Swarm, 1956, 1962; Redding,
1961; Malm, 1968). При этом, очевидно, имеет значение также количество
аспирированной жидкости. Так, Modell A968) наблюдал возникновение
фибрилляции желудочков у 19% собак, аспирировавших воду в количе-
стве 44 мл/кг. При аспирации жидкости в объеме 22 мл/кг и меньше воз-
никновения фибрилляции желудочков не отмечалось и биохимические
изменения в венозной крови не проявлялись. Встречаются литературные
данные относительно того, что среди утонувших людей у 85% количе-
ство аспирированной жидкости составляет лишь 10 мл/кг или менее и
что при этом ионограмма крови может самостоятельно нормализоваться
в течение одного часа (в случае своевременного извлечения пострадав-
шего из воды) (Modell, Davis, 1969). Исходя из этих данных, Hegendor-
fer и соавторы A970) полагают, что фибрилляция желудочков у свое-
временно извлеченных из воды людей наблюдается редко.
б) Утопление в морской воде (рис. 29). При утоплении в морской воде
также создается осмотический градиент между альвеолярной (аспири-
рованной) жидкостью и кровью пострадавшего. Однако, как уже указы-
валось выше, этот градиент диаметрально противоположен случаям по-
падания в легкие пресной воды, так как содержание электролитов в
морской воде достигает 3,5%, т. е. она явно гипертонична по сравнению
с кровью (Л. В. Лебедева, 1966; Redding e. а., 1961). Электролиты ас-
пирированной жидкости быстро диффундируют в систему кровообраще-
ния, а вода и белки крови — в альвеолы. В связи с этим уменьшается
масса циркулирующей крови (до 45 мл/кг), нарастает содержание ионов
277
калия, натрия, кальция, магния и хлора, увеличивается гематокрит.
Эти изменения можно определить уже через 3 мин после аспирации.
Отек легких развивается и при данном виде утопления, так же как и на-
рушение соотношения вентиляция — кровоток. Однако в отличие от
утопления в пресной воде в этих случаях обычно не развиваются обшир-
ные ателектазы легких, так как при этом меньше страдает сурфактант
альвеол. Не возникает также гемолиз и фибрилляция желудочков серд-
ца. Ведущими опасными факторами и при данной патологии признают
гипоксемию, ацидоз со всеми их последствиями.
Основными задачами при реанимации являются поддержание в ор-
ганизме кровообращения оксигенированной кровью путем проведения
искусственной вентиляции легких, оксигенотерапии и массажа сердца.
В связи с тем, что попадание в дыхательные пути даже небольшого ко-
личества жидкости может привести к развитию отека легких, искусст-
венную вентиляцию легких и оксигенотерапию следует проводить и при
сохранном, но* неадекватном самостоятельном дыхании.
Высокая смертность при утоплении и характер возникающих при этом
нарушений функций дают основание считать, что оказать эффективную
помощь пострадавшим при этом виде умирания нелегко. Для спасения
жизни утонувших необходимо с одной стороны, хорошо организовать
этап взаимопомощи, а с другой — по возможности приблизить и ускорить
включение в реанимацию специализированной помощи.
Различают реанимацию в воде, на катере, на спасательной станции
или на берегу, во время транспортировки и в лечебном учреждении.
1. Реанимация на воде заключается в периодических вдуваниях воз-
духа в нос или рот пострадавшего во время его буксировки к берегу.
(Искусственное дыхание в воде может проводиться только хорошо под-
готовленными, физически сильными спасателями.)
Этот метод следует как можно активнее внедрять в практику, так как
несколько искусственных вдохов, произведенных на воде и тотчас после
извлечения из нее, значительно повышают вероятность успешного ожив-
ления.
2. Реанимация в катере (шлюпке). Пена, пенистая жидкость, ино-
родные тела (песок, ил, аспирированные рвотные массы и др.), находя-
щиеся в дыхательных путях, а также ларингоспазм могут создать серь-
езные затруднения для проведения искусственного дыхания. Исходя из
этого, при реанимации утонувших восстановление проходимости дыха-
тельных путей, искусственное дыхание и массаж сердца следует прово-
дить одновременно (см. главу XX).
При наличии инородных тел в ротовой полости ее очищают пальцем,
обернутым марлей или платком.
Удаление пены и пенистой жидкости из верхних дыхательных путей
наиболее быстро достигается с помощью отсоса. При его отсутствии
пострадавшего, лежащего на животе, приподнимают за бедра или спа-
сающий укладывает пострадавшего животом вниз на бедро, согнутое в
коленном суставе своей левой ноги. Левой рукой спасающий поддержи-
вает лоб пострадавшего, а ладонью (или кулаком) правой руки не-
сколько раз ударяет пострадавшего между лопатками.
278
Некоторые авторы считают, что «откачивание» воды является одной
из наиболее частых ошибок, допускаемых при оживлении утонувших,
так как удалить воду из легких практически невозможно. Однако при
этом происходит потеря драгоценного времени. С этим мнением нельзя
не согласиться. Но что делать, если жидкость или пена настолько бло-
кирует дыхательные пути, что проведение искусственного дыхания ста-
новится невозможным? По-видимому, указанные приемы следует про-
водить с максимальной быстротой, в течение нескольких секунд, после
чего начинать искусственное дыхание.
В процессе искусственного дыхания, когда выделяющаяся жидкость
мешает прохождению воздуха в легкие, следует периодически повторять
•следующий прием. Голову пострадавшего, лежащего на спине, повер-
нуть в сторону, а противоположное плечо приподнять так, чтобы рот
оказался ниже грудной клетки. Когда жидкость вытечет, быстро проте-
реть рот и продолжать искусственное дыхание.
У некоторых пострадавших невозможно открыть рот из-за спазма же-
вательных мышц. Если при этом носовые ходы свободны, следует про-
водить искусственное дыхание «изо рта в нос». Только в том случае,
когда вдуваемый воздух не поступает в легкие через нос, приступить к
•открыванию рта с помощью роторасширителя или любого металличе-
ского плоского предмета.
При подходе катера (шлюпки) к пирсу пострадавшего на доске-но-
силках переносят на берег. Искусственное дыхание и непрямой массаж
сердца в этот период не должны прекращаться. Непрерывность в прове-
дении реанимационных хмероприятий во многом определяет успех лече-
ния.
3. Реанимация на спасательной станции (берегу). Объем и характер
реанимационной помощи на спасательной станции определяются нали-
чием соответствующего оборудования и квалификацией медицинского
работника.
Наиболее надежным методом, обеспечивающим необходимую прохо-
димость дыхательных путей, является эндотрахеальный метод искусст-
венного дыхания. Однако от попыток введения эндотрахеальной трубки
следует отказаться, если для этого потребуется более 15 с, в течение ко-
торых не будут производиться искусственное дыхание и непрямой мас-
саж сердца. При наличии ларингоспазма или попадания в гортань ино-
родного тела производится трахеостомия.
При проведении искусственной вентиляции легких лучше пользовать-
ся аппаратами, регулируемыми по объему или по частоте. Хорошо себя
зарекомендовали ручные дыхательные аппараты, создающие прерыви-
стое положительное давление (без отрицательной фазы на выдохе). Это
аппараты типа АМБУ, РДА-1, РПА-1, РПА-2 и др. Преимуществом этих
аппаратов является также и то, что с их помощью можно осуществлять
искусственное дыхание кислородом, на эффективность которого в случа-
ях утопления указывают многие авторы.
При остановке кровообращения искусственное дыхание необходимо
сочетать с непрямым массажем сердца и другими приемами экстренной
реанимации. В случае возникновения фибрилляции сердца необходима
279
дефибрилляция. Основное условие для успешной дефибрилляции — уст-
ранение гипоксии миокарда.
4. Транспортировку реанимированных больных следует осуществлять
в специализированной машине скорой помощи, где лечение продолжа-
ется в соответствии с особенностями постреанимационного периода.
При правильном проведении реанимации в случаях утопления вос-
становление жизненных функций возможно в сроки от нескольких минут
до часа. После появления первых признаков жизни следует не прекра-
щать мероприятия по оживлению, а проводить их до нормализации ды-
хания и сердечной деятельности. Раздается все больше голосов в пользу
того, что умеренная гипотермия в начальном периоде оживления увели-
чивает шансы на успех. Существует мнение, что искусственное дыхание
и непрямой массаж сердца следует проводить на берегу при погружен-
ном в воду туловище пострадавшего.
5. В стационарных условиях необходимо тщательное наблюдение за
больным, так как иногда после периода относительного благополучия
может наступить резкое ухудшение состояния. Из осложнений, возника-
ющих в послереанимационном периоде, прежде всего следует отметить
отек легких и пневмонии, а при утоплении в пресной воде и ателектазы.
Развитие тяжелых форм дыхательной недостаточности приводит к уг-
лублению кислородной недостаточности и метаболического ацидоза со
всеми вытекающими последствиями и, в частности, к гипоксическому
отеку мозга и церебропатии. К тому же при утоплении в пресной воде
при запоздалом проведении патогенетически обоснованной терапии раз-
вивается почечная недостаточность вследствие гемолиза крови, и сер-
дечная недостаточность в результате выраженной гиперволемии. При
утоплении в соленой воде при гиповолемии имеют место тяжелые нару-
шения периферического кровообращения и циркуляторная гипоксия.
В целях профилактики и лечения указанных осложнений всем пост-
радавшим, выведенным из терминального состояния, показано продол-
жение искусственной вентиляции легких респираторами с содержанием
кислорода во вдыхаемой газовой смеси до 50—60%. При возникновении
отека легких искусственную вентиляцию легких следует проводить с
созданием сопротивления на выдохе без дополнительной аспирации
жидкости из дыхательных путей (см. главу XI). В случае развития ате-
лектазов легких уместно применение кислородно-гелиевой смеси. Есть
основания полагать, что весьма полезной окажется оксибаротерапия.
Однако этот вопрос нуждается в изучении.
При утоплении в пресной воде для предотвращения осложнений, свя-
занных с гемолизом крови (почечная недостаточность) и гиперволемией
(сердечная недостаточность), а также для устранения метаболического
ацидоза оправдано внутривенное переливание растворов гидрокарбона-
та натрия и маннитола (осмотический диурез) под контролем ^почасового
выделения мочи и анализа крови. Однако при резком и стойком повы-
шении центрального венозного давления в ряде случаев показано и кро-
вопускание. При запоздалом проведении осмотического диуреза, когда
развивается олиго- или анурия, в ряде случаев возникает необходимость
в проведении экстракорпорального гемодиализа.
280
В экспериментах, проведенных на животных, неплохие результаты
были получены от применения обменного переливания крови и экстра-
корпорального кровообращения. Надо полагать, что эти методы в даль-
нейшем смогут оказаться полезными и в комплексе реанимационных ме-
роприятий в клинической практике.
Не вызывает сомнения, что при развитии анемии (главным образом
вследствие гемолиза), гипокалиемии (на фоне осмотического диуреза)
и гипопротеинемии показано переливание крови, концентрированных рас-
творов плазмы и электролитов.
При утоплении в соленой воде наряду с мероприятиями, направлен-
ными на устранение гипоксической гипоксии, первоочередной задачей
является устранение гиповолемии и нарушений периферического крово-
обращения путем внутривенного переливания кровезаменителей, обла-
дающих гемодинамическим действием (полиглюкин, реополиглюкин,
желатиноль), а также белковых препаратов. По данным Graus с соавт.
A971), при утоплении в соленой воде при длительной гипоксии и арте-
риальной гипотензии также может возникнуть почечная недостаточность
(острый тубулярный некроз). В этих случаях методом выбора является
экстракорпоральный гемодиализ.
Есть основания полагать, что своевременное лечение послереанима-
ционной болезни при утоплении со строгим учетом специфики происхо-
дящих при этом ,'патологических -процессов позволит снизить летальность,
которая до настоящего времени, к сожалению, остается высокой.
Патогенез и лечение
терминальных состояний, вызванных
электротравмой
При поражении электрическим током может прекратиться работа
сердца, а затем угаснуть и дыхание. При более сильном и длительном
действии тока возможно одновременное прекращение работы сердца и
остановка дыхания.
Наибольшую опасность для жизни при электротравме представляет
ток силой свыше 100 мА, который может вызвать фибрилляцию сердца.
Такой ток может возникнуть в организме при напряжении ПО в, а при
особо низком сопротивлении тела — даже от 65 В. В случае контакта не-
посредственно с поверхностью грудной клетки фибрилляция сердца
может наступить от переменного тока с напряжением 36 В и ниже. Пора-
жающее действие тока на сердце проявляется в течение 1—2 с, а при
большей силе тока A—5 А) —в течение десятых долей секунды. При
кратковременном действии тока дыхание может продолжаться еще не-
сколько минут после прекращения работы сердца.
Непосредственно после отключения от тока пострадавший иногда
оказывается в состоянии крикнуть или что-то сказать и лишь затем те-
ряет сознание. Свидетели таких случаев уверяют, что пострадавший
«жил еще после поражения».
При поражении током высокого напряжения фибрилляция сердца
может не наступить. Результатом такого поражения может быть прек-
281
ращение дыхания при продолжающейся сердечной деятельности. Если
немедленно не начать искусственное дыхание, то остановка сердца не-
минуема. При быстром оказании помощи повреждения, вызванные не-
посредственным действием тока, могут быть сами по себе совсем незна-
чительными и легко обратимыми. Но если это не сделано, то развива-
ются тяжелые нарушения, которые представляют собой не результат
непосредственного действия тока, а вызываются отсутствием снабже-
ния организма кислородом. Недостаток кислорода в организме наступа-
ет одинаково быстро как при остановке дыхания, так и при прекращении
работы сердца. Достаточно прекращения одной из этих функций на 2—3
мин, как наступает состояние клинической смерти.
При внезапной смерти здорового человека, как это бывает при элек-
тротравме, помощь может быть эффективной даже спустя 8—10 мин
после поражения.
При несчастных случаях, вызванных электрическим током, прежде
всего как можно быстрее нужно освободить пострадавшего от дальней-
шего соприкосновения с током, а затем оказать медицинскую помощь.
Оказание помощи пострадавшему после прекращения действия тока
определяется его состоянием. При отсутствии смертельного поражения
(наличие дыхания и пульса) пострадавшего укладывают в постель и сле-
дят за тем, чтобы он соблюдал полный покой. Ни в коем случае ему
нельзя оставаться на ногах и тем более пытаться продолжать работу.
Сохранение жизни непосредственно после поражения не исключает
опасности последующего ухудшения состояния пострадавшего.
При отсутствии дыхания следует немедленно начать искусственную
вентиляцию легких. Применявшиеся ранее в таких случаях ручные мето-
ды искусственного дыхания не обеспечивают поступления достаточного
количества воздуха в легкие. Необходимо использовать искусственное
дыхание «изо рта в рот» или «изо рта в нос», которое обеспечивает по-
ступление в легкие до 1 л воздуха и более 1. Искусственное дыхание сле-
дует проводить до тех пор, пока не восстановится глубокое и ритмичное
дыхание.
Не всегда удается оживить пострадавшего с помощью только искус-
ственного дыхания. Причиной этому может быть неправильное или же
запоздалое его проведение. И в том и в другом случае может наступить
вторичная остановка сердца вследствие асфиксии. Чаще всего безуспеш-
ность искусственного дыхания обусловлена первичным поражением серд-
ца и наступлением фибрилляции желудочков.
Естественно, что при отсутствии работы сердца даже своевременно
начатое и правильно проведенное искусственное дыхание само по себе
недостаточно для оживления организма. В таком случае необходимо на-
ряду с искусственным дыханием проводить наружный массаж сердца
для искусственного поддержания кровообращения в организме2 до
восстановления самостоятельной работы сердца с помощью электриче-
ской дефибрилляции.
1 Методика проведения искусственного дыхания «изо рта в рот» описана в главе XX.
2 Методика наружного массажа сердца описана в главе XX.
282
При электротравме оживление в случае отсутствия помощников мо-
жет быть начато одним человеком, который проводит искусственное ды-
хание и наружный массаж сердца: после 2—3 вдуваний воздуха масси-
рует сердце в течение 15 с и затем вновь вдувает воздух и т. д. Меропри-
ятия по оживлению следует продолжать до появления самостоятельного
дыхания и работы сердца. Восстановление сердечной деятельности узна-
ют по наличию пульса при кратковременном (на 2—3 с) перерыве мас-
сажа.
Длительное отсутствие пульса при появлении других признаков жиз-
ни (начало самостоятельного дыхания, сужение зрачков, порозовение
кожи) может служить указанием на наличие фибрилляции желудочков.
В этом случае самостоятельная работа сердца может быть восстановле-
на путем дефибрилляции сердца. В предвидении такого осложнения ма-
шина скорой медицинской помощи должна быть вызвана без промедле-
ния во всех случаях электротравмы одновременно с началом оказания
помощи на месте поражения.
Подготовка к дефибрилляции сердца не требует приостановки мас-
сажа и искусственного дыхания. Не прекращая эти мероприятия, под-
кладывают под левую лопатку пострадавшего один электрод от дефиб-
риллятора, другой электрод берут за изолирующую рукоятку и, держа
€го в руке, ожидают зарядки конденсатора до необходимого напряжения
D000—4500 В), после чего равномерно и плотно прижимают электрод к
области сердца (по левой сосковой линии между III и V ребром), при-
останавливают массаж и искусственное дыхание и производят разряд
дефибриллятора.
Эффект дефибрилляции сердца выражается в появлении самостоя-
тельного пульса непосредственно после разряда или же в результате по-
следующего продолжения массажа. В случае отсутствия эффекта произ-
водят следующий разряд при несколько большем напряжении (на
500 В).
После восстановления деятельности сердца пострадавшего следует
госпитализировать в отделение реанимации. Доставка в больницу про-
водится со всеми предосторожностями, которые соблюдаются при транс-
портировке больных инфарктом миокарда.
Как было сказано, кратковременное воздействие тока высокого на-
пряжения может 'привести к немедленной смерти. В литературе, одна-
ко, описаны случаи последующей гибели пострадавших при явлениях
эмболии, резкой гипертензии, что объясняется распространенным тром-
бозом в артериолах. Бывает и более поздняя гибель пострадавших
вследствие разрыва крупных сосудов из-за ломкости их стенок, вызван-
ной электротоком. Лечение этих нарушений симптоматическое (введе-
ние гепарина, фибринолизина).
Современная реаниматология располагает эффективными средствами
помощи при поражении электрическим током. Еще недавно решение во-
проса об оживлении пострадавших от действия электрического тока бы-
ло связано со сроком возможного прибытия врача. В настоящее время
решение найдено: жизнеспособность организма может быть сохранена в
течение длительного времени при своевременном оказании помощи сви-
283
детелями несчастного случая. Для этого необходимо, чтобы все категории
трудящихся и в первую очередь электрики и работники смежных про-
фессий были обучены непрямому массажу сердца и искусственному ды-
ханию «изо рта в рот» (или в нос), чтобы в случае внезапной смерти
могли поддерживать у пострадавшего искусственное кровообращение и
дыхание до прибытия машины скорой помощи и оказания квалифициро-
ванной медицинской помощи.
Патогенез и лечение
терминальных состояний, вызванных
аллергическими реакциями
Вместе с увеличением общей заболеваемости аллергическими болез-
нями в последнее время значительно возросло число случаев острых про-
явлений аллергии (А. Д. Адо, А. В. Богова, 1971). Из них наиболее опас-
ными у человека являются анафилактический шок и приступ удушья при
бронхиальной астме, переходящей в астматическое состояние. Эти про-
явления непосредственно угрожают жизни больного и требуют немед-
ленной квалифицированной врачебной помощи вплоть до реанимации.
Анафилактический шок. Наиболее часто анафилактические шоки воз-
никают в ответ на введение лекарственных препаратов: антибиотиков
(Ю. П. Бородин, 1971), местных анестетиков, вакцин, сывороточных
препаратов, витамина Вь сульфаниламидных препаратов, ацетилсали-
циловой кислоты, АКТГ, йодсодержащих и ртутных препаратов, фермен-
тов и др. Чаще анафилактический шок возникает при парентеральном
введении медикаментов, однако пероралыюе, ингаляционное или наруж-
ное применение их может привести у сенсибилизированных лиц к разви-
тию анафилактического шока. Иногда он развивается как осложнение
при специфической диагностике и гипосенсибилизации у больных аллер-
гией. Описаны случаи анафилактического шока при пищевой аллергии
(чаще у детей), от укусов насекомыми, а также при холодовой аллергии
(Н. В. Адрианова, Ю. А. Самушия, 1968).
Анафилактический шок является классическим примером аллергиче-
ской реакции немедленного типа, связанной с присутствием в организме
циркулирующих антител, способных фиксироваться на различных тка-
нях и обусловливающих тем самым их сенсибилизацию к специфическо-
му антигену. Попадание в организм антигена (аллергена) сопровожда-
ется соединением его с фиксированными на клетках антителами. Это в
свою очередь вызывает повреждение клеточных структур и высвобож-
дение из них биологически активных веществ. Основные клинические
проявления анафилаксии являются результатом действия этих высво-
бождающихся веществ (у человека — гистамина и, возможно, медленно
действующего вещества анафилаксина) на различные ткани-эффекторы.
Основным тканевым субстратом, реакция которого определяет внеш-
ние проявления анафилактического шока, является гладкомышечная
ткань, в первую очередь гладкая мускулатура бронхов и сосудов. Из
патофизиологических механизмов этой реакции необходимо подчеркнуть
следующие моменты: сокращение гладкой мускулатуры бронхов и дру-
284
гих органов, нарушение функции артериол и венул, повышение прони-
цаемости капилляров. Гемодинамические нарушения при анафилакти-
ческом шоке у человека начинаются со скопления крови, главным обра-
зом в периферической — венозной системе с последующим уменьшением
венозного возврата к правому отделу сердца, вследствие чего венозное
давление снижается, а сердечный выброс и артериальное давление па-
дают до катастрофического уровня. Определенное значение имеет также
и непосредственное вовлечение в анафилактическую реакцию сердечной
мышцы (И. С. Гущин, 1973). Выход плазмы в экстраваскулярное про-
странство вследствие увеличения проницаемости капилляров и гипоксия
вследствие нарушения проходимости дыхательных путей, вызванной
бронхоспазмом, отеком бронхов, гиперсекрецией бронхиальных желез и
закупоркой секретом просвета бронхов, усиливают недостаточность кро-
вообращения.
Системная анафилактическая реакция, приводящая к смерти, клини-
чески проявляется нарушением внешнего дыхания и недостаточностью
кровообращения. Клинические признаки ее являются результатом вазо-
дилатации, повышения проницаемости сосудов, бронхоапазма, гиперсек-
реции, усиления перистальтики, раздражения чувствительных нервных
окончаний кожи и внутренних органов. Реакция начинается с ощущения
покалывания и зуда в коже лица, рук, головы, слизистых оболочках
полости рта, глаз, влагалища. Покраснение лица сменяется бледностью.
Может отмечаться боль в эпигастральной области, тошнота, рвота, а
также нарушение зрения. При развитии начальных симптомов анафи-
лактического шока больной испытывает чувство страха, беспокойство,
головокружение, возникают головная боль, шум в ушах, проливной пот.
Присоединяется чувство тяжести и стеснения в грудной клетке, боль в
области сердца и одышка. Кашель, затрудненное свистящее дыхание,
отек гортани и век, крапивница могут развиться как сами по себе, так
и в сочетании с другими симптомами. Позже могут возникнуть непроиз-
вольная дефекация и мочеиспускание, кровянистые выделения из влага-
лища, судороги, напоминающие эпилептические.
При развившейся реакции отмечается затруднение дыхания, цианоз и
циркуляторная недостаточность. При перкуссии над поверхностью легких
определяется коробочный звук в связи с развитием обтурационной эм-
физемы, аускультативно-жесткое дыхание, сухие хрипы, более или ме-
нее выраженное удлинение выдоха. Как результат острого повышения
давления в малом круге кровообращения над легочной артерией слышен
акцент II тона, а на ЭКГ заметными становятся изменения, соответству-
ющие правому повороту оси сердца.
Начальные признаки анафилактического шока обычно появляются
через 5—15 мин после поступления антигена в организм. Однако в ряде
случаев шок может возникнуть очень быстро (например, при введении
медикаментов — еще до извлечения иглы) или задержаться до 30—40
мин, а иногда и до 24 ч. Прогноз становится тем хуже, чем раньше и
острее возникли проявления анафилактического шока. Смерть от ана-
филактического шока, как правило (в 50—60%), наступает через 10—15
мин после появления первых признаков реакции (Vidal e. а., 1960).
285
Быстрота возникновения и развития анафилактического шока требу-
ет неотложной врачебной помощи, с несвоевременным оказанием кото-
рой связаны неудачные попытки (до 50% случаев) спасти больного да-
же в специализированных лечебных учреждениях.
Тотчас после возникновения подозрения на анафилактический шок
больного нужно уложить. Если шок возникает после введения медика-
ментов в конечность, необходимо наложить жгут (приблизительно на
25 мин) проксимальнее места введения для уменьшения поступления ан-
тигена в общий кровоток. Для этой же цели место введения обкалывают
адреналином @,1—0,5 мл 0,1% раствора). Каждые несколько минут
у больного определяют уровень артериального давления и частоту пуль-
са. Желательна регистрация ЭКГ. В конечность, свободную от жгута,
еводят по 0,3—0,5 мл 0,1% раствора адреналина (в общей дозе до
2 мл), повторяя инъекции в случае необходимости каждые 5—15 мин.
Следует помнить, что повторные малые дозы адреналина оказываются
более эффективными и менее опасными, чем однократные большие
дозы.
Дополнительно к введению адреналина прибегают к внутривенному
введению антигистаминных средств, что позволяет предотвратить раз-
витие отека гортани. Наиболее показано применение высокоспецифичных
антигистаминных средств. Для проведения внутривенных введений це-
лесообразно ввести катетер в вену путем венесекции или, если возмож-
но, чрескожной пункцией. Если анафилактическая реакция характеризу-
ется острым астматическим приступом и применение адреналина не
оказало на него действия, внутривенно вводят 10 мл 2,4% раствора эу-
филлина (аминофиллина, диафиллина) с 10—20 мл 40% раствора глю-
козы.
В случае необходимости надо отсосать из дыхательных путей скопив-
шийся секрет (и рвотные массы) и наладить подачу кислорода. Обяза-
тельной иногда становится искусственная вентиляция легких. Если r
результате отека гортани развивается непроходимость дыхательных пу-
тей, то проводят трахеостомию или коникотомию. Подача кислорода
должна осуществляться вплоть до ликвидации тяжелого состояния боль*
ного.
В тех случаях, когда шок возникает от применения пенициллина,
после появления первых симптомов реакции необходимо ввести внутри-
венно 1 000 000 ЕД пенициллиназы. При этом следует помнить, что пе-
нициллиназа эффективна при наиболее раннем введении ее, так как она
способна быстро разрушать находящийся в крови свободный пеницил-
лин и, по-видимому, не оказывает действия на уже образовавшийся
комплекс антиген — антитело (Westerman e. а., 1966). Пенициллиназа
иногда может вызывать слабые аллергические реакции, правда, очень
редко, типа анафилактического шока (Becker, 1960).
Применение гормонов коры надпочечников при анафилактическом
шоке в основном рассчитано на предупреждение более поздних прояв-
лений анафилаксии (крапивницы, отека Квинке и др.). Эти препараты
вводят внутривенно (до 100 мг преднизолона или до 20 мг дексамета-
зона).
286
Прибегать ко всем этапам лечения анафилактического шока, как
правило, не приходится. При своевременно оказанной помощи реакцию
удается оборвать в самом начале ее развития. После выведения из ана-
филактического шока больных следует госпитализировать, так как со-
храняется опасность появления более поздних проявлений анафилаксии
и вторичных осложнений (аллергический нефрит, миокардиты, желудоч-
но-кишечные кровотечения и др.).
Астматическое состояние. Когда приступ удушья при бронхиальной
астме, не прерываясь, продолжается несколько часов (до суток и более)
и не обрывается бронхолитическими средствами, принято считать, что
больной находится в астматическом состоянии. Это состояние является
в полном смысле слова чрезвычайной ситуацией в медицинской практи-
ке, требующей неотложного врачебного вмешательства (Н. В. Адриа-
нова, Ю. А. Самушия, 1968; Sheldon e. а., 1967; Herxheimer, 1971). Имен-
но астматическое состояние — наиболее частая причина смерти больных
бронхиальной астмой. Так, только по данным за один год A962), в США
погибло первично от бронхиальной астмы 4896 человек, причем 216 из
них были лица моложе 19 лет (Lanoff, Crawford, 1964). Смерть при аст-
матическом состоянии наступает от удушья вследствие скопления в
бронхах слизи и закупорки ею просвета бронхов, присоединяющейся сер-
дечной недостаточности и недостаточности дыхательного центра.
Патофизиологические механизмы астматического состояния опреде-
ляются прежде всего затруднением прохождения через бронхи, вызван-
ным закупоркой их просвета густой клееобразной и поэтому плохо от-
ходящей слизью. Другие механизмы приступа удушья при бронхиальной
астме (сокращение гладкой мускулатуры бронхов, отек их слизистой
оболочки) хотя имеют и меньшее значение при астматическом состоянии,
тем не менее должны приниматься во внимание. Следствием нарушения
функции внешнего дыхания являются гипоксия, гиперкапния и газовый
ацидоз. Вследствие ацидоза снижается также чувствительность бронхов
к эндогенным и экзогенным бронхолитикам (Sheldon e. а., 1967; Horton
е. а., 1971), что еще более осложняет течение астматического состояния.
Порочный круг при астматическом состоянии обусловлен значительным
обезвоживанием организма больного, вызванным ограниченным прие-
мом жидкости в течение длительного времени. Это приводит к заметному
уменьшению объема крови, к еще большему загустеванию и затруднению
отхождения бронхиального секрета, а следовательно, к еще большему
нарушению газообмена и водного баланса организма.
Астматическое состояние наиболее часто развивается при инфекци-
онно-аллергической форме бронхиальной астмы (по классификации
А. Д. Адо и П. К. Булатова, 1969), но может быть, хотя и в более легкой
форме, и при неинфекционно-аллергической (атопической) бронхиальной
астме. Наиболее острые астматические состояния могут возникнуть при
сочетании бронхиальной астмы с повышенной чувствительностью к аце-
тилсалициловой кислоте или другим антиревматическим и анальгезиру-
ющим препаратам этой группы (Herxheimer, 1971). Такие больные дол-
жны быть особо предупреждены об опасности применения этих медика-
ментов. Значительное увеличение случаев астматическбго состояния и
287
повышение смертельных исходов от него в последние годы были связа-
ны с широким применением больными бронхолитических аэрозольных
препаратов типа изадрина (Speizer e. а., 1968). Использование этих
средств строго по показаниям привело к некоторому снижению смертно-
сти от бронхиальной астмы (Inman, Adelstein, 1969; Backgaard e. a.,
1970).
Все больные в астматическом состоянии подлежат обязательной гос-
питализации, которая необходима не только потому, что в лечебном уч-
реждении может быть оказана своевременная помощь. При госпитали-
зации нередко разрывается контакт больного с аллергенами, которые
могли быть в домашнем помещении. Кроме того, госпитализация оказы-
вает на больного психологически благоприятное действие и вселяет на-
дежду на эффективность новых лечебных средств и приемов.
Каждый больной в астматическом состоянии изнурен длительной и
безуспешной борьбой с затрудненным дыханием и поэтому ему должен
быть обеспечен максимальный покой. Изголовье кровати должно быть
приподнято до положения, при котором больной чувствует себя наиболее
удобно. Больным, находящимся в астматическом состоянии, показано
применение седативных средств («малых» транквилизаторов). Разуме-
ется, назначение таких препаратов, как морфин, угнетающих возбуди-
мость дыхательного центра и тормозящих кашлевой рефлекс, противо-
показано.
По существу является правилом, что больной в астматическом состо-
янии в большей или меньшей степени обезвожен. Поэтому для восста-
новления водного баланса таким больным показано внутривенное вве-
дение жидкости E% раствор глюкозы до 2 л в сутки). Если больной по-
лучает жидкость в течение нескольких суток только парентеральным
путем, то необходимо провести электролитное замещение (введение со-
левых питательных растворов, плазмы крови). Питье следует назначать
небольшими порциями комнатной температуры (не охлажденное), так
как холодное питье может вызвать рефлекторный бронхоспазм. Пища
должна быть жидкой или полупротертой и распределена небольшими
порциями.
Особое внимание врача должно быть обращено на разжижение и эва-
куацию бронхиального содержимого. Этому в значительной степени уже
помогает адекватная гидратация организма. Лучшим отхаркивающим
средством, применяемым при астматическом состоянии, остается йодид
калия. Если больной не может принимать ^препарат через ротв связи с тя-
жестью состояния, то возможно внутривенное введение йодида натрия
@,5—1 г). Если обтурацию бронхов не удается устранить в течение
8—10 ч, то необходимо использовать механический дренаж бронхов. Для
облегчения отсасывания слизи прибегают к ее ферментативному разжи-
жению. Для этой цели эндотрахеально вводят 50 мг трипсина (при от-
сутствии повышенной чувствительности к нему) в 10 мл физиологическо-
го раствора, а затем производят отсасывание.
Применение симпатомиметических средств имеет ограниченные пока-
зания при астматическом состоянии, во всяком случае до ликвидации
ацидоза. Этой цели служит использование ощелачивающих агентов и
288
кислородотерапия. Разумеется, при таком лечении- крайне желательно
постоянно контролировать величины рН, рСО2 и рО2 артериальной кро-
ви. Введение ощелачивающих агентов A00—400 мэкв бикарбоната нат-
рия и трис-буфера) оказывается наиболее эффективным в начальной
стадии астматического состояния, когда еще не развилось выраженное
обезвоживание организма. Следует помнить, что при выполнении этой
процедуры в организм вводят значительное количество натрия. Поэтому
относительным противопоказанием для введения натриевых солей явля-
ется вторичный отек при стероидной терапии. Кроме того, поскольку
при ощелачивании гидрокарбонатом натрия образуется углекислота, то
становится необходимым контроль адекватности вентиляции легких и.
следовательно, выведения СО2. Напротив, трисамин может обеспечить
ощелачивание без обязательного выведения СО2. Если больной действи-
тельно находился в состоянии ацидоза, то улучшение от ощелачивающих
агентов наступает довольно быстро (через 30—60 мин). Быстрая ликви-
дация ацидоза иногда может привести к коллапсу вследствие сосудорас-
ширяющего действия, особенно после предварительного применения со-
судорасширяющих средств.
При астматическом состоянии особое внимание врач должен обратить
на ликвидацию гипоксии. В этой связи целесообразно напомнить неко-
торые экспериментальные данные (Horton e. а., 1971). Известно, что
смерть при асфиксии обусловлена/ с одной стороны, степенью гипоксии,
а с другой — уровнем гиперкапнии. Так, гибель животного наступает
при снижении уровня рО2 в артериальной крови до 10 мм рт. ст. и ниже.
Если же искусственно достигается насыщение крови кислородом, то
смерть не наступает до тех пор, пока рН не снизится до 6,5 или даже
ниже. При гипоксической коме смерть наступает через 5—6 мин, в то
время как при наличии лишь одной задержки выведения СО2 сердце
останавливается через 60—90 мин. Следует иметь в виду также и то, что
у больных в астматическом состоянии предшествующая гиповентиляция
приводит к длительной гиперкапнии. В связи с этим чувствительность
дыхательного центра к избытку углекислоты снижается и поддержание
дыхательного ритма осуществляется за счет аноксической стимуляции
хеморецепторов. Поэтому высокая концентрация кислорода может за-
тормозить стимуляцию дыхательных движений и привести к остановке
дыхания.
В общем же следует придерживаться того правила, что кислородоте-
рапия при астматическом состояния должна быть постоянной и продол-
жительной. Восстановление рО2 крови быстро приводит к уменьшению
сопротивления легочных сосудов и уменьшению нагрузки на правое
сердце.
При проведении искусственной вентиляции легких желательно при-
бегать к эндотрахеальной интубации, поскольку для ее проведения тре-
буется меньше времени, чем для трахеостомии. В том случае, когда не-
обходима длительная искусственная вентиляция, прибегают к трахео-
стомии. Для искусственной вентиляции при астматическом состоянии
более подходящими оказываются респираторы, регулируемые по объ-
ему.
19 Заказ № 1266 289
У многих больных бронхиальной астмой в стадии астматического со-
стояния имеются выраженные признаки легочного сердца. Если в ре-
зультате гипервентиляции рСО2 снизится, например, с 80 до 40 мм рт. ст.„
то это резко сместит рН в течение нескольких минут. У больного с легоч-
ным сердцем, резко перешедшего из состояния газового ацидоза в алка-
лоз, может развиться угрожающая жизни аритмия сердца. Поэтому для
больных с хронической легочно-сердечной недостаточностью безопаснее
оказывается небольшой ацидоз, чем небольшой алкалоз.
Применение препаратов гормонов коры надпочечников при астмати-
ческом состоянии часто оказывается незаменимым. Несомненно, что не-
которые больные (особенно молодые) могут быть выведены из астмати-
ческого состояния и без этих препаратов, однако надолго откладывать
введение кортикостероидов небезопасно. Вводить их следует внутривен-
но в довольно высоких дозах. Так, например, преднизолон (до 100 мг)<
вводят внутривенно капельным способом (для .поддержания постоянной,
концентрации в крови) до 40—60 капель в минуту в объеме 500 мл 5%i
раствора глюкозы. Добавление в этот раствор эуфиллина рассчитано не
столько на его бронхолитическое действие, сколько на улучшение кро-
вотока в малом круге кровообращения. Во избежание возникновения
«синдрома отмены» преднизолон назначают в последующие дни, присту-
пив затем к постепенному снижению дозы препарата (Herxheimer, 1971).
В заключение следует еще раз подчеркнуть, что больные бронхиаль-
ной астмой в астматическом состоянии представляют собой категорию-
лиц, которым яри отсутствии соответствующего лечения угрожает ги-
бель. Однако комплексное и индивидуализированное лечение, направ-
ленное на все основные патогенетические механизмы этого состояния,,
позволяет в большинстве случаев предотвратить смертельный исход,
XVII
АНЕСТЕЗИЯ У БОЛЬНЫХ,
НАХОДЯЩИХСЯ В ТЕРМИНАЛЬНЫХ
состояниях
В настоящей главе делается попытка определения принципов веде-
ния анестезии у больных, находящихся в предельно тяжелых состояниях
различной этиологии. Совершенно очевидно, что в этих состояниях до-
пускается выполнение только необходимых при спасении жизни опера-
ций, кроме того, только тех, которые не могут быть отсрочены даже на
несколько часов, а иногда и минут. Эти операции будут условно назва-
ны реанимационными.
Первостепенное значение в достижении успеха выполнения реанима-
ционной операции имеют правильно выбранные и осуществляемые меры
реанимации и интенсивной терапии. Эти меры, к которым можно отнести
и собственно анестезию, следует проводить в течение всего периода лече-
ния больного: до операции, во время ее выполнения и в послеопераци-
онном периоде.
Первостепенно важным является выбор срока выполнения операции,
решение вопроса о том, безотлагательна ли она, несмотря на предельна
тяжелое состояние, или целесообразно до операции осуществить лечеб-
но-реанимационные мероприятия, а операцию несколько отсрочить.
При возможности всегда желательно провести интенсивную предопе-
рационную лечебно-реанимационную подготовку, а анестезию и операцию
выполнить после улучшения состояния больного. Характер предопера-
ционных реанимационных мероприятий определяется заболеванием и
причиной терминального состояния, но не отличается от общепринятых
методов реанимации. Следует учесть, что чрезмерно длительная консер-
вативная терапия нередко ухудшает прогноз дальнейшего хирургическо-
го лечения. Например, во многих случаях травматического шока целесо-
образно проводить раннюю операцию, не дожидаясь выведения больного
из терминального состояния.
Премедикация (лекарственная подготовка к операции и анестезии)
при терминальном состоянии больного должна осуществляться с осто-
рожностью ввиду возможности чрезмерно .выраженных, неожиданных
или парадоксальных реакций на лекарственные вещества.
В премедикацию следует включить атропин или метацин @,5—1 мг)
для уменьшения вероятности рефлекторных расстройств ритма сердеч-
ной деятельности. Тяжелые формы аритмий (вплоть до фибрилляции
желудочков и остановки сердца) и другие крайне опасные сердечно-со-
судистые нарушения могут возникать в терминальных состояниях при
19* 291
самых минимальных раздражениях рефлексогенных зон. Это и является
основанием для введения атропина в премедикацию, несмотря на неко-
торые неблагоприятные стороны действия этого препарата.
Вводить в премедикацию седативные и анальгезирующие препараты
следует лишь тогда, когда они показаны в комплексе предоперационных
лечебно-реанимационных мероприятий. Такая необходимость может воз-
никнуть при значительном возбуждении, сильных болевых ощущениях,
если эти состояния затрудняют введение в анестезию.
Премедикация антигистаминными препаратами с теоретической точ-
ки зрения показана больным в терминальных состояниях. Однако введе-
ние супрастина, димедрола и других веществ этой группы может выз-
вать усугубление гемодинамических расстройств у больного в терми-
нальном состоянии. В связи с такой опасностью следует чрезвычайно
осторожно пользоваться антигистаминными веществами (вводить очень
медленно уменьшенные дозы) или вообще отказаться от них в предопера-
ционном периоде.
В настоящее время с очевидностью установлена необходимость при-
менения в комплексе лечебных мер при тяжелых расстройствах гемоди-
намики шокового или гиповолемического происхождения препаратов со-
судорасширяющего действия. Активная борьба с резким спазмом пери-
ферических сосудов, явлениями так называемой централизации
кровообращения должна расцениваться как одна из важнейших мер ле-
чебно-реанимационного комплекса.
Мы настойчиво рекомендуем отказаться от попыток «децентрализа-
ции» кровообращения непосредственно в предоперационном периоде, осо-
бенно если у больного имеется некомпенсированная гиповолемия.
Сосудорасширяющие препараты вводить в премедикацию целесооб-
разно только тем больным, которым решено проводить отдельный этап
лечебно-реанимационной подготовки до улучшения показателей крово-
обращения (например, при тяжелых формах шока, расстройствах водно-
солевого баланса). Только если операция может быть отсрочена на
1—2 ч и более, есть время и возможности для корригирующей инфузи-
онно-трансфузионной терапии, то целесообразно попытаться улучшить
периферическое кровообращение с помощью препаратов сосудорасширя-
ющего действия. В других случаях быстрое начало анестезии, искусствен-
ной вентиляции и «реанимационный этап» операции более безопасно
проводить до начала мероприятий, направленных на устранение сосуди-
стого спазма.
Непосредственная премедикация к наркозу может включать ком-
плекс витаминов и препаратов, улучшающих условия работы миокарда.
Многие авторы рекомендуют перед вводным наркозом ввести внутри-
венно витамины Вь В6, Bj2, С, РР, кокарбоксилазу, 40% раствор глюко-
зы и хлорида кальция. Мы не наблюдали существенного улучшения
дальнейшего течения анестезии после введения этих препаратов. Более
перспективным представляется разработка методов премедикации пре-
паратами «антигипоксического» действия, в какой-то мере облегчающими
последствия гипоксии, неизбежной в терминальном состоянии. Известно,
что витамин Bi5 способствует лучшей переносимости гипоксии миокарда,
292
печени, дыхательной недостаточности, а мефенезин и другие антигипок-
санты, по материалам В. М. Виноградова и др. A969), могут удлинить
период клинической смерти при полном прекращении кровообращения.
Оксибутират натрия повышает устойчивость организма к кислородному
голоданию (В. И. Сачков, 1972).
Выбор анестезии. Анестезия и лечебно-реанимационные мероприятия,
во время операции должны рассматриваться как единый комплекс обес-
печения возможности выполнения и успеха реанимационной операции.
Собственно анестезия должна, с одной стороны, представлять минималь-
ную дополнительную травму для предельно тяжелого больного, а с
другой — обеспечить оптимальные условия для проведения операции и
реанимационных мероприятий.
Больной в терминальном состоянии становится чрезвычайно чувст-
вительным к анестезирующим средствам. Поэтому можно считать не-
приемлемым применение глубокого наркоза любым наркотизирующим
веществом. Доказано, что при воздействии на умирающий организм глу-
бокого наркоза реанимация становится менее эффективной (В. А. Негов-
ский, 1960). Повышенная чувствительность больного к наркотизирую-
щим веществам делает опасным однокомпонентный наркоз, при котором
неизбежно приходится применять относительно высокие дозы (или кон-
центрации) анестетиков.
Комбинированное общее обезболивание расценивается большинством
анестезиологов как метод выбора анестезии у больного в терминальном
состоянии. Тем не менее совершенно неправильно считать местную ане-
стезию неприемлемой методикой, если она проводится на фоне реанима-
ционных мероприятий (искусственной вентиляции легких через интуба-
ционную трубку или трахеостому, инфузионно-трансфузионной терапии
и др.). При местной анестезии не угнетаются компенсаторные реакции,
на фоне реанимационных мероприятий она достаточно защищает орга-
низм от операционной травмы. Использование местной анестезии в соче-
тании с мерами реанимации имеет следующие показания: а) отсутствие
материального обеспечения (анестетики, аппаратура) для общего обез-
боливания; б) отсутствие в бригаде врачей специалиста-анестезиолога;
в) относительно небольшая протяженность операционного поля, позво-
ляющая быстро провести местную анестезию допустимыми количествами
анестезирующего препарата.
Заслуживает обсуждения вопрос о возможности использования про-
водниковой анестезии у больных в терминальном состоянии. Ю. Н. Ша-
ниным с соавторами A969, 1971) доказано, что введение в анестезиоло-
гическое пособие перидуральной анестезии обеспечивает оптимальное
состояние метаболизма при хирургическом вмешательстве.
Перидуральная анестезия приводит к существенному снижению арте-
риального давления. Ее проведение является противопоказанным при
гиповолемии любого происхождения, артериальной гипотонии. В то же
время перидуральная анестезия может обеспечить полное длительное
обезболивание до, во время и после хирургического вмешательства и
улучшить течение послеоперационного периода C. В. Павлова, 1971).
Использование длительной перидуральной анестезии для обезболивания
293
в послеоперационном периоде в настоящее время получило достаточно
широкое распространение. Метод может иметь преимущества при тер-
минальных состояниях, связанных с тяжелой обширной травмой, когда
в предоперационном периоде решено проводить противошоковые лечеб-
во-реанимационные мероприятия в достаточно полном объеме. Если ги-
поволемия устранена и гемодинамика относительно стабильна, периду-
ральная анестезия может быть использована в качестве одного из ком-
понентов анестезиологического пособия. Перидуральная анестезия
должна осуществляться с большой осторожностью, дробным введением
тримекаина или другого аналогичного препарата через установленный
в перидуральном пространстве катетер. При этом необходимо осущест-
влять постоянный контроль показателей гемодинамики и использовать
уменьшенные в 2—3 раза концентрации и дозы препаратов.
Общее обезболивание является методом выбора анестезии у больно-
го в терминальном состоянии. Однако для его осуществления обязатель-
ным является наличие в бригаде врачей специалиста-анестезиолога.
В противном случае более целесообразно проводить реанимационную
операцию на фоне местной анестезии в сочетании с комплексом реани-
мационных мероприятий.
Все этапы общего обезболивания у больного в терминальном состоя-
нии должны осуществляться с соблюдением определенных правил и
особенностей.
Вводный наркоз у больного в терминальном состоянии является до-
вольно опасным этапом и требует очень тщательного выбора и предель-
но осторожного введения анестетиков. Лишь при соблюдении этих ус-
ловий можно избежать ухудшения состояния больного.
Опыт показывает, что чем более выражена артериальная гипотензия
до начала наркоза и чем старше больной, тем легче удается выключить
сознание применением малых доз и концентраций анестетиков. Часто
удается, например, введение в наркоз без возбуждения закисью азота с
кислородом в соотношении 1 : 1—2 : 1.
Применение закиси азота с кислородом у больных в терминальном
состоянии мы считаем наилучшим методом вводного наркоза. Однако во
многих случаях больных невозможно ввести в наркоз этим анестетиком,
несмотря на крайнюю тяжесть их состояния.
Из других ингаляционных анестетиков, с нашей точки зрения, наи-
более безопасны эфир и метоксифлуран, особенно если анестезия про-
водится без точно дозирующего испарителя. Эти анестетики следует
давать больному в небольшой концентрации, которая обычно бывает
достаточной для выключения сознания. Если анестезиолог располагает
аппаратом «Полинаркон-2» с универсальным точно дозирующим испа-
рителем, целесообразно при вводном наркозе работать на полуоткрытом
контуре дыхания с подачей эфира в концентрации 2—-6об.% или меток-
сифлурана от 0,5 до 1 об.%. При нарушениях внешнего дыхания приме-
нение для вводного наркоза ингаляционных анестетиков практически
невозможно. Больных с резко уменьшенной альвеолярной вентиляцией
или альвеолярно-капиллярной проницаемостью ввести в наркоз можно
только неингаляционным анестетиком.
294
С теоретической точки зрения, оксибутират натрия мог бы рассмат-
риваться как анестетик выбора для больного в терминальном состоя-
нии, так как он обладает защитным действием в условиях гипоксии
(В. И. Сачков, 19?1). Практический опыт применения этого анестетика
у больных в терминальных состояниях для целей вводного и основного
наркоза пока недостаточен для широких рекомендаций. Оксибутират
«атрия довольно широко используется в реаниматологической практике
и признается препаратом, допустимым к применению у самых тяжелых
'больных. Незначительное влияние на гемодинамику и «антигипоксиче-
ское» действие оксибутирата натрия позволяют считать его весьма пер-
спективным препаратом в анестезиологической практике. К сожалению,
оксибутират натрия относится к веществам длительного действия и не
позволяет осуществлять управляемую анестезию. Многими анестезиоло-
гами считается нежелательным введение подобных препаратов в периоде
•анестезии при реанимационной операции, так как на их фоне затруднена
оценка состояния больного.
Хорошо известны опасности барбитуровых анестетиков у больных в
тяжелых и терминальных состояниях. Тем не менее нередко приходится
применять эти анестетики для вводного наркоза. В таких случаях при
введении гексенала или тиопентала натрия необходимо тщательно и
•объективно (по секундомеру) контролировать скорость введения препа-
рата. Предельно допустимой скоростью мы считаем 50 мг/мин. Эту дозу
можно ввести в 1% растворе в течение минуты E мл) или прибегнуть к
дробному введению отдельных доз по 25 мг B,5 мл 1% раствора или
1 мл 2,5% раствора) с интервалами между дозами в 30 сек. При этом
необходимо непрерывно контролировать показатели гемодинамики. Если
они ухудшаются, скорость введения препарата уменьшают вдвое. Общая
доза анестетика не превышает, как правило, 2—3 мг/кг, а часто состав-
ляет 1—1,5 мг/кг.
Эта техника вводного барбитурового наркоза применяется нами в те-
чение многих лет у больных в терминальных состояниях. При этом мы
не отмечали серьезных осложнений, связанных с введением барбитура-
тов.
Вводный наркоз пропанидидом у больных в терминальных состояни-
ях, по нашему мнению, не имеет преимуществ по сравнению с барбиту-
ровым. Этот вопрос, однако, нельзя считать решенным.
Нейролептанальгезия для введения в наркоз больного в терминаль-
ном состоянии может применяться (и даже иметь преимущества) лишь
в определенной ситуации. Этот вид анестезии противопоказан на ран-
нем этапе проведения лечебно-реанимационных мероприятий, если нет
возможности устранить острую гиповолемию. В других случаях нейро-
лептанальгезия может расцениваться как достаточно безопасный метод
обезболивания.
Предион также применяется у больных в терминальном состоянии,
однако с большой осторожностью. Вводный наркоз может оказаться
вообще ненужным больному в терминальном состоянии. Если больной
без сознания, можно считать допустимым произвести интубацию трахеи
без предварительного введения анестетика. Мышечный релаксант дол-
295
жен быть введен для расслабления мышц, если тонус их сохранен и ин-
тубация без релаксанта затруднена.
Интубация трахеи (оротрахеальная, назотрахеальная или через тра-
хеостому) необходима как для проведения искусственной вентиляции
легких, так и для защиты дыхательных путей от аспирации желудочно-
го содержимого, слюны и слизи. У больного в терминальном состоянии
эндотрахеальный наркоз является методом выбора.
Интубация трахеи в условиях гипоксии, гиперкапнии и ацидоза чре-
вата опасностью рефлекторных расстройств ритма сердца вплоть до era
остановки. Для уменьшения вероятности развития тяжелых форм арит-
мий интубация трахеи у больного в терминальном состоянии должна
выполняться на фоне атропинизации, максимально атравматично и бы-
стро. Выполнение ее на фоне действия мышечных релаксантов имеет
преимущества, если у больного в преагональном или агональном состо-
янии сохраняются тонус мускулатуры и рефлексы с дыхательных путей.
При расслаблении мышц и арефлексии больным в состоянии агонии или
клинической смерти интубацию можно проводить без релаксантов.
Релаксант деполяризирующего типа действия следует вводить на
фоне атропинизации, медленно, в дозе не менее 1 мг/кг. Уменьшенные
дозы, как правило, не вызывают достаточной релаксации. Чем моложе
больной и чем меньше период артериальной гипотензии, тем больше по-
казаний к введению увеличенных до 1,5—2 мг/кг доз его. Предшествую-
щее деполяризирующему релаксанту введение небольшого количества
тубокурарина-хлорида C—5 мг) желательно производить у больных в
терминальном состоянии для уменьшения фибрилляции мышц, которая
может привести к повышению внутрижелудочного давления и регурги-
тации.
Снижение артериального давления при введении релаксанта, которое
может возникнуть вследствие уменьшения венозного притока к сердцу,,
мы не наблюдали. Если позволяет состояние больного, перед интубаци-
ей в течение нескольких минут целесообразно проводить ингаляцию-
кислорода при спонтанном дыхании больного. Искусственная вентиляция
легких масочным способом во время вводного наркоза перед интубацией
не проводится вследствие опасности регургитации желудочного содер-
жимого и его аспирации. В терминальном состоянии опасно проводить
преднаркозное опорожнение желудка, так как введение зонда может
вызвать тяжелые рефлекторные расстройства ритма сердца. Для про-
филактики регургитации применяется прием Селлика, заключающийся-
в сжатии пищевода между гортанью и позвоночником надавливанием на
щитовидный хрящ. Следует надавливать только на срединную часть
шеи, избегая давления по бокам гортани или трахеи: случайное нажа-
тие на сонные артерии у больного в терминальном состоянии может
усугубить гипотензию. Это связано с повышением чувствительности ба-
рорецепторов каротидного синуса.
Назотрахеальная интубация пластиковой трубкой, пригодной для
длительной D—8 сут) искусственной вентиляции легких в послеопера-
ционном периоде, имеет преимущества у больного в терминальном со-
стоянии. Анестезиолог должен владеть техникой назотрахеальной инту-
-96
бации и иметь набор специальных катетеров для туалета дыхательных
путей. Диаметр интубационной трубки, вводимой через нос, может быть
таким же, как при оротрахеальной интубации, или на размер меньше.
Мы настойчиво рекомендуем врачам, недостаточно владеющим инту-
бацией и приемами борьбы с аспирацией, предпочесть трахеостомию с
введением трубки с манжетой непосредственно в трахею до начала нар-
коза и операции.
Поддержание анестезии в период выполнения операции может осу-
ществляться с помощью местного или общего обезболивания. Как уже
отмечалось, при отсутствии специалиста-анестезиолога или необходимого
материального обеспечения реанимационная операция может быть вьь
полнена под местной инфильтрационной или проводниковой анестези-
ей. Анестезия и операция при этом должны проводиться на фоне реани-
мационных мероприятий: искусственной вентиляции легких, трансфузий
и др. Даже если предпочтение отдается общему обезболиванию, нам
представляется необходимой в комплексе анестезиологического пособия
местная анестезия рефлексогенных зон. Это связано с тем, что в усло-
виях ацидоза, гипоксии и гиперкапнии, характеризующих терминальные
состояния, висцеро-висцеральные рефлексы оказываются повышенными,
как указывалось выше, а глубокий наркоз для их подавления абсолютно
противопоказан.
В терминальных состояниях очевидны преимущества поверхностного
наркоза на фоне введения мышечных релаксантов и управляемой венти-
ляции легких. Закись азота является наиболее безопасным анестетиком
у этих больных. Для поддержания наркоза достаточно небольших кон-
центраций закиси азота E0—70%). В сочетании с кислородом E0—
30%) эти концентрации практически безопасны. Точную дозировку за-
киси азота легче осуществить, чем дозировку испаримых анестетиков.
Закись азота позволяет проводить общее обезболивание в течение дли-
тельного времени.
Другой газообразный анестетик — циклопропан, также позволяет
легко поддерживать необходимую глубину наркоза. Однако хотя цикло-
пропан и является анестетиком, нетоксичным для паренхиматозных ор-
ганов, он мало пригоден для больных в терминальном состоянии. Цикло-
пропан обладает сильным парасимпатомиметическим действием и повы-
шает опасность тяжелейших аритмий рефлекторного происхождения.
Нарушения гемодинамики при циклопропановом наркозе особенно веро-
ятны при гиперкапнии, ацидозе и гиперкатехоламинемии любого проис-
хождения.
Если в распоряжении анестезиолога отсутствует закись азота, целе-
сообразно воспользоваться эфиром, желательно в смеси с кислородом.
Оптимальной концентрацией эфира для больного в терминальном состо-
янии является 2—3 об.%. При этом в терминальном состоянии глубина
наркоза соответствует 1-му'уровню III стадии, а не стадии анальгезии,
обычно наступающей при ингаляции эфира в этой концентрации.
Передозировка анестетиков очень легко возникает у больного в тер-
минальном состоянии в связи с его повышенной чувствительностью к ане-
стетикам. Например, концентрация эфира, необходимая для достижения
297'
1—2-го уровня III стадии наркоза у больных с острой кровопотерей
(внематочная беременность), оказалась у наших больных всего 20—
30 мг% (У. Г. Антонова, 1964). Использование испарителей с точной
дозировкой и контроля с помощью электроэнцефалографии является
весьма желательным.
При отсутствии закиси азота и эфира наркоз можно поддерживать
малыми (анальгезическими) концентрациями метоксифлурана. Этот ане-
стетик обладает малой испаримостью и достаточной широтой действия,
что позволяет использовать его для наркоза с помощью простейших дози-
рующих устройств. Доказано, что анальгезирующие концентрации ме-
токсифлурана не токсичны, однако действие их на фоне терминального
состояния в достаточной мере не изучено.
Фторотан и хлороформ, с нашей точки зрения, должны быть исклю-
чены из арсенала анестезирующих средств у больных в терминальных
состояниях. Вследствие быстроты и эффективности их анестезирующего
действия у «сверхчувствительных» к анестетикам больных в терминаль-
ном состоянии делается чрезвычайно легкой передозировка этих препа-
ратов. Мнение о благоприятном сосудорасширяющем действии фторота-
на опровергается имеющимися в настоящее время исследованиями, до-
казывающими, что фторотан в первую очередь угнетает функцию
миокарда (Г. А. Рябов и др., 1972). Исходя из данных этих исследова-
ний, использовать фторотан для «децентрализации» кровообращения
.нерационально и опасно.
Наш практический опыт свидетельствует о том, что наибольшее чис-
ло осложнений, связанных с анестезией, у больных в терминальном со-
стоянии возникало на фоне фторотанового наркоза.
Неингаляционные анестетики можно точно дозировать (особенно при
плохой оснащенности аппаратурой) и, таким образом, при неингаляци-
онном наркозе легче избежать передозировки.
Как уже указывалось, оксибутират натрия E0—65 мг/кг) позволяет
обеспечить стабильную анестезию у больного в терминальном состоянии.
Препарат не обладает вредным влиянием на гемодинамику, токсическим
действием и даже в какой-то степени является защитным «антигипокси-
ческим» средством. Отрицательной чертой его является длительность и
малая управляемость действия, затрудняющие оценку состояния боль-
ного, эффекта реанимации и операции. Предионовый наркоз более или
менее приемлем в терминальном состоянии, однако он обладает теми
же недостатками, что и анестезия оксибутиратом натрия. Гипотензивное
действие предиона может проявиться у больного в терминальном состо-
янии весьма сильно. Хотя этот анестетик не считается противопоказан-
ным больным в терминальном состоянии, применять его надо осторожно
и лишь на фоне хотя бы частично устраненной гиповолемии.
Нейролептанальгезия хорошо зарекомендовала себя у тяжелоболь-
ных. Однако применять ее у больных в терминальном состоянии до уст-
ранения острой гиповолемии небезопасно. Дроперидол, обладающий
сосудорасширяющим действием, можно вводить лишь на втором этапе
реанимационной операции (после хирургического устранения причины
терминального состояния) при отсутствии острой гиповолемии. Этот пре-
298
шарат целесообразно применять тогда, когда возникает необходимость
«ачать борьбу с централизацией кровообращения и спазмом сосудов.
Этиловый спирт применять в терминальных состояниях допустимо
.лишь в вынужденных ситуациях, когда анестезиолог не располагает вы-
'бором анестетиков. Хотя алкогольный наркоз (на фоне мышечных ре-
лаксантов и искусственной вентиляции легких) относительно мало ток-
сичен и протекает при стабильной гемодинамике, он обладает рядом
опасных для больных в терминальном состоянии свойств. Во-первых,
алкоголь имеет очень малую широту действия. Во-вторых, на фоне ал-
когольного наркоза необходимо в дыхательную смесь добавлять кисло-
род, так как даже при искусственной вентиляции легких нельзя избежать
кислородного голодания, вызываемого повышенным потреблением кис-
лорода (В. Т. Бабовникова, 1972).
Если больной находится в состоянии клинической смерти, примене-
ние любых анестетиков при необходимости оперировать больных в таком
состоянии нам кажется ненужным. Висцеро-висцеральные рефлексы, ко-
торые сохраняются у больного в период клинической смерти, не могут
<5ыть устранены анестетиками. Применение ганглиоблокаторов для их
устранения в этом периоде вряд ли рационально. Если есть возможность,
желательно произвести местную анестезию рефлексогенных зон. Полное
расслабление мышц и зияние голосовой щели делают ненужным приме-
нение мышечных релаксантов. В период реанимационной операции в со-
стоянии клинической смерти проводится восстановление кровообраще-
ния и газообмена (массаж сердца, трансфузии, искусственная вентиля-
ция легких и др.).
Особенности искусственной вентиляции легких при анестезии. Как
уже отмечалось, любой вид анестезии у больного в терминальном
состоянии должен проводиться на фоне искусственной вентиляции
легких. Проведению последней у больных в терминальном состоянии по-
священа специальная глава. Искусственная вентиляция легких в период
реанимационной операции имеет некоторые специфические особенности.
Во время операции целесообразно устанавливать режим умеренной
гипервентиляции A20—150% от должного минутного объема дыхания,
если дыхательные пути не повреждены). Если имеется травматическое
повреждение дыхательных путей или легких, объем вентиляции устанав-
ливается со значительным превышением (иногда в несколько раз) дол-
жных величин. Критерием достаточного объема вентиляции в этих слу-
чаях являются лишь клинические и лабораторные показатели газообме-
на и визуальные наблюдения за степенью «раздувания» легких. Простым
правилом определения достаточности объема вентиляции в условиях
пневмоторакса и травмы одного легкого является смещение средостения
при вдохе в пораженную сторону при нормальных дыхательных шумах,
определяемых аускультативно на «здоровой» стороне. Гипервентиляция
должна применяться в терминальных состояниях с большой осторож-
ностью, с тщательным соблюдением мер по уменьшению ее вредных эф-
фектов. В противном случае начало проведения искусственного дыхания
(особенно в режиме гипервентиляции) может привести к усугублению
расстройств гемодинамики и остановке сердца.
299
Наиболее опасные вредные эффекты искусственной вентиляции воз-
никают при резких перепадах внутригрудного давления, зависящих от
столкновения ритмов спонтанной и искусственной вентиляции. Наиболее
опасны возникающие при этом нарушения гемодинамики для больных с
невозмещенной кровопотерей или гиповолемией другого происхождения.
Поскольку полное расслабление мышц является обязательным условием
профилактики этих осложнений искусственной вентиляции, мы считаем
необходимым при сохранении мышечного тонуса в терминальных состо-
яниях применять мышечные релаксанты.
Насильственное навязывание ритма искусственного дыхания, «сбива-
ние» собственного дыхания гипервентиляцией или другими приемами мь*
считаем совершенно недопустимым во время анестезии при реанимаци-
онной операции.
Вредный эффект искусственной вентиляции может зависеть от чрез-
мерно быстрого устранения гиперкапнии, что приводит к снижению арте-
риального давления. Это осложнение особенно вероятно у больных с дли-
тельными нарушениями вентиляции до операции. Начиная анестезию' не
следует после интубации сразу же переходить к режиму гипервентиля-
ции, особенно по полуоткрытой системе. При чрезмерно быстром «отвен-
тилировании» больного гиперкапния сменяется гипокапнией с падением
артериального давления или нарушением ритма сердца. Если начало ис-
кусственной вентиляции совпадает с ухудшением гемодинамики, мы
рекомендуем строго соблюдать объем нормовентиляции при полуоткры-
том контуре или умеренной гипервентиляции при полузакрытом контуре
с периодическим отключением поглотителя углекислоты.
Весьма желательно во время анестезии управляемую вентиляцию
проводить с тщательным контролем минутного объема дыхания, давлений
на вдохе и выдохе и состояния газообмена.
Даже при четком волюметрическом контроле и соблюдении вентиля-
ционного режима с 20—30% превышением должного минутного объема
дыхания при частоте дыхания 16—20 в мин и давлении на вдохе +12,
+ 15 мм рт. ст. можно наблюдать ухудшение гемодинамических показате-
лей, если вентиляция осуществляется мешком наркозного аппарата. При
этом следует перейти на вентиляцию с активным выдохом (мехом или ав-
томатом). Степень разрежения на выдохе надо обязательно контролиро-
вать по мановакуумметру. Разрежение на выдохе не должно превышать
—4—5 мм рт. ст., иначе вредные эффекты активного выдоха превысят его
пользу. Без контроля величины разрежения на выдохе использовать
мех наркозного аппарата опасно, так как им можно создать чрезвычай-
но сильные степени разрежения. Поэтому при отсутствии мановакуум-
метров безопаснее пользоваться ручной вентиляцией мешком наркозного
аппарата. При соответствующем оснащении предпочтение следует отдать
автоматической вентиляции легких одним из современных респирато-
ров.
Во время анестезии для поддержания полной релаксации фракционно
вводят деполяризующие релаксанты. По обычным клиническим симпто-
мам выбирается наименьшая эффективная доза. Опыт показывает, что
эта доза, а также длительность действия релаксанта лишь в малой сте-
300
пени зависят от причины и тяжести терминального состояния. Частой
причиной удлинения эффекта являются нарушения кровообращения и
ацидоз.
В послеоперационном периоде больной, перенесший реанимацион-
ную операцию, часто нуждается в продолженной искусственной венти-
ляции. Нередко длительнре действие миорелаксантов делает невозмож-
ным прекращение искусственной вентиляции после операции. Так назы-
ваемый синдром неостигминорезистентнои кураризации может возникать
после применения деполяризующих релаксантов. Причиной его, вероят-
но, является метаболический ацидоз и истощение щелочных резервов.
Необходимость в длительной искусственной вентиляции в послеопера-
ционном периоде при этих осложнениях не должна явиться причиной
отказа от применения миорелаксантов во время анестезии.
Реанимационная операция должна выполняться с некоторыми осо-
бенностями хирургической тактики. А. Ю. Аксельрод A963) предложил
разделение операции на два этапа. После выполнения первого, реанима-
ционного этапа (остановка кровотечения, герметизация или восстановле-
ние проходимости дыхательной системы и т. п.) операция должна быть
прекращена на время, необходимое для проведения основных лечебно-
реанимационных мероприятий (устранение гиповолемии и расстройств
газообмена, коррекция наиболее тяжелых нарушений обмена и т. п.).
После стабилизации показателей гемодинамики операция продолжается
и выполняется ее второй, восстановительный этап. Перерыв в операции
не должен быть слишком длительным. Однако при обычной хирургиче-
ской тактике, когда хирург не дожидается улучшения состояния больно-
го и продолжает операцию без перерыва, чаще наблюдается прогресси-
рование расстройств гемодинамики или развитие клинической смерти во
время операции.
Послеоперационный период у многих больных, перенесших терми-
нальное состояние и реанимационную операцию, протекает весьма тя-
жело и нередко требует длительных лечебно-реанимационных меропри-
ятий. В некоторых случаях реанимационная операция оказывается на-
столько эффективной, что больной быстро выходит из терминального
состояния и практически не нуждается в продолжении интенсивной те-
рапии и реанимации после оживления.
Анестезиолог никогда не должен даже пытаться перевести на само-
стоятельное дыхание больного, которому искусственная вентиляция не-
обходима в комплексе продолжающихся реанимационных мероприятий.
Показаниями к переводу больного на самостоятельное дыхание после
реанимационной операции являются: во-первых, отсутствие явных фак-
торов, препятствующих нормальной вентиляции (анатомических нару-
шений, расстройств газообмена, водно-электролитного и кислотно-щелоч-
ного равновесия и т. п.); во-вторых, улучшение состояния больного к
концу операции и стабилизация основных гемодинамических показате-
лей.
Если после перевода больного на самостоятельное дыхание развива-
ется спонтанная гипервентиляция (свыше 150% должной), больному
следует немедленно ввести мышечные релаксанты и перевести на управ-
301
ляемую вентиляцию. Синдром гипервентиляции в восстановительном
периоде может вызвать опасные осложнения. Как правило, его возник*
новение зависит от недостаточного восполнения кровопотери (А. Ю. Ак-
сельрод, 1963). При переводе больного на самостоятельное дыхание со-
вершенно недопустимо пытаться ускорить его восстановление с помощью
раздражения дыхательных путей катетером, движениями интубацион-
ной трубки и т. д. Подобные действия чрезвычайно опасны, так как мо-
' гут вызвать рефлекторные нарушения ритма сердца. Даже обычная
кашлевая реакция с общим напряжением и повышением внутригрудного*
давления может привести к гемодинамическим нарушениям и расстрой-
ствам газообмена.
Если самостоятельное дыхание восстанавливается в достаточном объ-
еме, но больной остается без сознания, интубационную трубку не извле-
кают. Экстубация производится только после выхода больного из нар-
коза при условии восстановления нормального (должного) объема и ме-
ханики дыхания (диафрагма и межреберные мышцы сокращаются
плавно, без рывков, синхронно), полного восстановления тонуса мышц и
появления защитных рефлексов дыхательных путей. После восстановле-
ния самостоятельного дыхания и экстубации больной должен не менее
20—30 мин получать кислород (маской, через катетер). Перевод на ды-
хание атмосферным воздухом производится под наблюдением анестези-
олога. При ухудшении показателей гемодинамики или газообмена
больной немедленно переводится на управляемое дыхание, для чего осу-
ществляется или повторная интубация (желательно назотрахеальной
пластиковой трубкой), или трахеостомия. Никогда не следует возлагать
надежды на вспомогательную вентиляцию легких маской в ближайшем
посленаркозном периоде. Как правило, она оказывается неэффективной
и не устраняет расстройств газообмена. Обычное ведение послеопераци-
онного периода допустимо, если у больного устойчивы показатели гемо-
динамики и дыхания, отсутствуют признаки гипоксии и гиперкапнии при,
самостоятельном дыхании атмосферным воздухом, не нарушается про-
ходимость дыхательных путей в положении на спине, полностью восста-
новлен тонус скелетной мускулатуры (больной может поднять и повер-
нуть голову, высунуть язык) и защитные рефлексы дыхательных путей,
и глотки (может кашлять и глотать), восстановилось сознание.
У всех больных с нарушениями жизненно -важных функций в после-
наркозном .периоде необходимо соблюдать правила ведения восстанови-
тельного периода.
XVIII
ПРОГНОЗ ВОССТАНОВЛЕНИЯ
ФУНКЦИЙ ОРГАНИЗМА И ДИАГНОЗ
«СМЕРТИ МОЗГА»
Вводные замечания. Реаниматора всегда интересует вопрос о шансах,
оживляемого человека на выздоровление и о том, будет ли это выздо-
ровление полным. От того, каким будет ответ на этот вопрос, зависит
тактика реаниматора при оживлении и ведении постреанимационноп>
периода, так же как и срочность некоторых лечебных мероприятий. При
абсолютно отрицательном ответе, по-видимому, возникает сомнение в
целесообразности самого оживления (В. А. Неговский, 1971).
Так как при умирании наиболее ранимой в организме является цент-
ральная нервная система, в большинстве случаев исход оживления после
остановки сердца и дыхания в значительной мере зависит от состояния
мозга. Состояние некоторых внутренних органов играет решающую роль
при умирании от их первичного заболевания и при оживлении после
длительной гипотензии, хотя значение состояния мозга и в этих случаях
имеет для прогноза важнейшее значение. Поэтому все основные системы
прогноза в реаниматологии строятся на данных о состоянии функций
мозга.
Трудность прогнозирования перспектив восстановления оживляемого
организма заключается в том, что ответ на вопрос о вероятных конечных
результатах оживления желательно получить насколько возможно-
раньше, так как применение многих лечебных мероприятий имеет смысл
лишь в ходе оживления и в самом начале постреанимационного периода.
Между тем именно в этот период исследователь получает очень мало-
данных о глубине и обратимости повреждений мозга, так как восстано-
вительная эволюция его функций только началась и состояние высших,
наиболее ранимых отделов и систем мозга еще не успело проявиться ни
в положительном,1 ни в отрицательном смысле. И здесь на помощь реани-
матологу приходит совокупность следующих четырех закономерностей^
(А. М. Гурвич, 1974), каждая из которых установлена большим числом
исследователей и подтверждена клинической практикой:
1) устойчивость мозга к аноксии и ишемии имеет определенные пре-
делы, превышение которых неизбежно приводит к его гибели;
2) если после аноксии или ишемии жизнеспособность мозга сохра-
нилась и он не угнетен химическими или физическими депрессантами
(наркотические вещества, гипотермия), его функции после возобновле-
ния циркуляции крови и газообмена не могут не восстанавливаться под
30&
влиянием неустранимого потока афферентных импульсов и гуморальных
воздействий;
3) в чувствительности к аноксии отделов и систем мозга, различаю-
щихся степенью сложности и филогенетическим возрастом, существует
закономерная, устойчивая градация, в частности функции ствола мозга
более устойчивы к аноксии, чем функции больших полушарий;
4) существует строгая математическая зависимость, имеющая экспо-
ненциальную форму, между: а) длительностью ишемии и временем скры-
того восстановления той или иной функции, б) между временами скрыто-
го восстановления более устойчивых и более ранимых функций мозга
(см. также главу V).
Первая закономерность позволяет делать прогноз по величине изве-
стного срока полного прекращения кровообращения. Вторая и четвертая
закономерности позволяют утверждать, что темп восстановления жизне-
способного и не угнетенного депрессантами мозга будет находиться в
закономерной зависимости от длительности и тяжести ишемии и, следо-
вательно, прогноз можно делать по имеющимся показателям восстанов-
ления, даже не зная длительности прекращения кровообращения. Третья
и четвертая закономерности позволяют устанавливать степень повреж-
дения функций высших отделов мозга и более сложных функций на
основании динамики восстановления низших отделов и более простых
функций, т. е. сравнительно рано.
Однако наряду с временными показателями (длительность прекра-
щения кровообращения, сроки восстановления тех или иных функций
мозга) и в неразрывной связи с ними большое значение для прогноза
имеют и качественные показатели — появление форм деятельности моз-
га, свидетельствующих о существенных изменениях меж- и внутрицент-
ральных отношений (различные гиперкинезы, судорожные реакции,
патологические рефлекторные реакции, патологические виды колебаний
на ЭЭГ и т. п.).
Теоретически в качестве прогностических критериев могут использо-
ваться показатели функционального состояния любого отдела мозга,
если установлено, что эти показатели достаточно надежно коррелируют
с глубиной постишемического повреждения мозга. Практически до сих
пор такая корреляция исследована лишь для сравнительно небольшого
числа признаков. Особое значение в прогнозе имеют данные электроэн-
цефалографии вследствие объективности этого метода, большого разно-
образия представляемых им сведений о состоянии мозга и возможности
использования у больных, находящихся в глубокой коме, под действием
миорелаксантов, в состоянии наркоза или гипотермии. Результаты этого
метода, однако, могут считаться достоверными лишь при условии стро-
гого соблюдения установленных технических требований, излагаемых
в последнем разделе настоящей главы. Особо следует иметь в виду, что
ни один электроэнцефалографический показатель не имеет прогностиче-
ского значения, если не определена его эволюция или устойчивость во
времени; при этом чем раньше сделана первая запись, тем надежнее
прогноз (A.M. Гурвич, 1966; Pampiglione, Harden, 1968; Kurtz e. a., 1970).
Разумеется, при прогнозировании следует учитывать также состояние
304
внутренних органов и систем. При этом необходимо иметь в виду, что
некоторые нарушения отражают исчезновение координирующих и ин-
тегрирующих влияний мозга (к ним относятся некоторые изменения
деятельности сердечно-сосудистой и эндокринной систем). Другие явля-
ются следствием прямого действия кислородного голодания и связанных
с ним нарушений микроциркуляции (изменения в печени, глубокий
ацидоз крови). Прогностическое значение изменений во внутренних
органах и системах связано с тем, что определенная глубина этих изме-
нений свидетельствует о постишемической патологии организма, несов-
местимой с его восстановлением.
Прогноз восстановления функций организма может быть ранним,
задержанным и поздним. Ранний прогноз определяется временем, когда
те или иные лечебные вмешательства (например, искусственная гипо-
термия, коррекция метаболического ацидоза и т. п.) могут существенно
повлиять на постреанимационный процесс в случаях повреждений уме-
ренной тяжести. Этот прогноз поэтому устанавливается в пределах пер-
вого часа, а лучше — первых 15—30 мин после начала оживления. За-
держанным является прогноз, устанавливаемый в течение первых суток
после оживления (для более точного установления срока этого прогноза
данных пока нет) —эффективность лечебных мероприятий в этот период
заметно и прогрессивно падает. Прогноз, устанавливаемый в более
поздние сроки, имеет чисто констатационное значение, так как имеющиеся
в нашем распоряжении лечебные мероприятия в этот период оказыва-
ются эффективными лишь в малой мере *.
В заключение вводных замечаний следует подчеркнуть, что в настоя-
щей главе идет речь о прогнозе лишь после прекращения кровообраще-
ния, возникшего на фоне нормотермии у ненаркотизированных больных;
прогноз при черепной травме, интоксикациях и метаболических комах
здесь не рассматривается.
Ранний прогноз. Наиболее ранним является прогноз по длительности
остановки сердца, если эта длительность известна. В настоящее время
он относительно благоприятен при сроке прекращения кровообращения
до 4 мин, сомнителен при величине этого срока 5—6 мин, крайне сомни-
телен при 7—15 мин и безнадежен при более длительных сроках полного
прекращения кровообращения у человека, не находящегося в момент
остановки сердца в состоянии гипотермии. Сообщение о полном вос-
становлений после 20 мин остановки сердца (Stephenson, 1969) является
сомнительным даже для автора и пока не имеет аналогий.
Когда длительность остановки сердца неизвестна, прогноз устанав-
ливают по ходу восстановления функций мозга. Такой прогноз в ряде
случаев имеет преимущества перед предыдущим, так как динамика вос-
1 В данном случае речь идет о лечебных мероприятиях, непосредственно воздейст-
вующих на мозг; предполагается, что газообмен, общая гемодинамика и основные пока-
затели метаболизма корригируются в возможной максимальной степени. Как показано
в главе V, некоторые лечебные мероприятия могут иметь известный успех и спустя не-
сколько суток и недель после оживления, но только в случае, если больной вышел из
коматозного состояния.
20 Заказ № 1266 306
становления мозга отражает не только длительность ишемии, но и осо-
бенности умирания и индивидуальную чувствительность организма.
Наиболее ранним является прогноз по времени появления самостоя-
тельного дыхания и темпу нормализации структуры дыхательного акта
(В. А. Неговский, 1971; см. также главу IV). В эксперименте на живот-
ных надежный прогноз по этим показателям может быть сделан в пре-
делах до 10—20 мин после оживления. У человека, однако, начальные
стадии восстановления дыхания не исследованы и при всем желании
провести такое исследование использование респираторов и миорелакса-
ции делает его весьма затруднительным. У большинства оживленных
лиц с хорошим восстановлением мозга дыхание восстанавливалось в
пределах 20—30 мин, хотя в единичных случаях такое восстановление
описано и при появлении первого вдоха спустя 1 — Р/2 ч (А. М. Гурвич,
1966). Причины расхождения экспериментальных и клинических данных
в этом вопросе не изучены.
Более надежны данные о динамике восстановления электрической
активности мозга, причем их влияние на тактику реаниматора тем боль-
ше, чем раньше начата регистрация ЭЭГ. Быстрое и полное восстанов-
ление функций мозга наблюдается при длительности времени скрытого
восстановления ЭЭГ (см. главу V) до 10—15 мин, особенно в случае
внезапного установления непрерывной активности и ее быстрой нормали-
зации (А. М. Гурвич, 1966; Brechner e. а., 1961). При времени скрытого
восстановления в 15—30 мин нормализация функций мозга возможна,
но часто бывает задержанной. Именно в этом случае во избежание не-
обратимых осложнений необходимо срочное снижение температуры тела,
устранение ацидоза, дезинтоксикация и т. п. (В. И. Маслов, 1965; см.
главу V). При большей длительности рассматриваемого параметра с
высокой степенью вероятности у человека развиваются выраженные
неврологические нарушения. Отсутствие электрической активности моз-
га в течение часа и более у собак связано с гибелью в 100% случаев.
У человека полное неосложненное восстановление функций мозга в
единичных случаях наблюдалось после 2-часового отсутствия электри-
ческой активности (больные в состоянии гипотермии; Fischgold, Mathis,
1959; Arfel, 1970), неполное — после отсутствия активности в течение
45—60 мин (Kurtz e. а., 1970) и даже после 3 ч (Kurtz e. а., 1966).
Если электроэнцефалографическое исследование начато с опозданием
и электрическая активность уже частично восстановилась, полезным яв-
ляется также использование времени установления непрерывной актив-
ности на ЭЭГ, хотя бы в каком-либо одном отведении. Установление
непрерывной активности даже с преобладанием Д-волн в пределах пер-
вых 15—25 мин имеет благоприятное прогностическое значение
(А. М. Гурвич, 1966; Brechner e. a., 196I). Удлинение этого показателя
до 50 мин свидетельствует о нарастающих необратимых изменениях в
ткани мозга, а за пределы 60—70 мин у собак исключает возможность
восстановления высших отделов мозга. У человека значение этого пока-
зателя в пределах первого часа оживления не описано.
Из общих признаков раннего прогноза, судя по данным эксперимента
(см. главу VI), определенное прогностическое значение может иметь
306
глубина ацидоза артериальной крови и содержание в ней суммы органи-
ческих кислот в течение первых 5—10 мин после начала оживления.
Значение этого показателя для прогноза в клинике не проверялось.
Задержанный прогноз. Для прогноза, который устанавливается в
интервале от 1 до 24 ч после оживления, большое значение приобретает
общеневрологическая симптоматика. Быстрое уменьшение глубины ко-
матозного состояния, отсутствие децеребрационных кризов и судорог
любого типа, наличие непрерывной и достаточно выраженной электри-
ческой активности мозга с прогрессивным обогащением ЭЭГ колебания-
ми 0-, а-, а затем и (^-диапазонов при уменьшении Д-волн, появление
реакции депрессии при внешних раздражениях — все это признаки бла-
гоприятного прогноза, дающие основание рассчитывать на полное вос-
становление функций мозга.
Следует, однако, помнить, что при самом благоприятном прогнозе
(и даже скорее всего при таком прогнозе), устанавливаемом в пределах
первых суток после оживления, возможно непрогнозируемое вторичное
ухудшение неврологического статуса после 2—3-х сут постреанимацион-
ного периода (см.главу V).
Вместе с тем задержка восстановления самостоятельного дыхания
или устойчивое дыхание патологического типа, отсутствие роговичных
рефлексов более 3—4 ч, расширенные и особенно деформированные
зрачки, стойкая анизокория, отсутствие реакции на свет свидетельствуют
о тяжелой постишемической патологии ствола. О том же говорит пре-
обладание тонуса разгибателей, сочетающееся с кризами децеребрацион-
ного типа, повторяющимися в течение ряда часов. Большое значение для
прогноза имеют судороги любого типа, особенно устойчивые общие су-
дороги во второй половине первых суток. Все эти неврологические на-
рушения дают основания для тяжелого прогноза — больные с подобными
нарушениями обычно погибают или выживают — со стойкими патоло-
гическими изменениями в мозге (А. М. Гурвич, 1966). Особенно важным
прогностическим симптомом являются ритмические миоклонии, охваты-
вающие одновременно мышцы многих отделов тела, в частности мышцы
век, и сохраняющиеся на фоне глубокой комы в течение многих часов
(Pampiglione, 1967), — это признак безнадежного прогноза.
Для задержанного прогноза большой и в значительной мере само-
стоятельный интерес имеют данные ЭЭГ. Полное отсутствие в этот
период электрической активности, значительное снижение амплитуды
колебаний при их низкой частоте, запись, в которой вспышки активности
чередуются с интервалами отсутствия активности, свидетельствуют о
безнадежном прогнозе не только на восстановление, но и на выживание
(Hockaday e. а., 1965; Pampiglione, Harden, 1968), особенно если подоб-
ный характер ЭЭГ сохраняется более 6 ч (Kurtz e. а., 1970). Существен-
ное улучшение записей со слабой или прерывистой активностью в преде-
лах 2—6 ч после оживления — большая редкость. Устойчивое отсутствие
всякой электрической активности на ЭЭГ более 3 ч после оживления
делает прогноз в отношении восстановления высших отделов мозга без-
надежным (Pampiglione, Harden, 1968; Kurtz e. a., 1970), по-видимому,
и в случаях, когда оживленный во время остановки сердца находился
20* 307
в состоянии умеренной гипотермии (Arfel, 1970). Прогноз является сом-'
нительным при многочасовом сохранении нерегулярных, изменчивых по1
амплитуде, медленных волн, даже если эти волны сочетаются с неболь-
шим числом в-колебаний (Hockaday e. а., 1965; Kurtz e. а., 1970). Для
отрицательного прогноза имеет ценность наличие в записи пароксиз-
мальной активности (пиковых потенциалов, острых волн, комплексов^
пик — волна). При определении перспектив восстановления функций моз-
га имеет также значение спонтанная изменчивость записи, ее реакция в
ответ на внешние раздражения. Совокупность всех электроэнцефалогра-
фических признаков, оцененная по специальной программе с помощью
электронно-вычислительных машин, позволяет делать грубый прогноз
(выживание или смерть) с достоверностью 0,99 только на основании
данных ЭЭГ (Binnie e. а., 1970).
Определенную помощь в суждении о динамике постаноксической
комы оказывает и эволюция потенциалов, возникающих в затылочной
области коры в ответ на вспышки света (Arfel, 1970).
Для установления задержанного прогноза, кроме данных о мозге,
имеет значение также состояние печени (В. М. Шапиро, см. главу VII),
эндокринной системы (А. В. Волков, см. главу VIII) и общего метабо-
лизма. Особенно ценны определяемые с помощью электронно-вычисли-
тельных машин в реальном времени признаки выхода деятельности
сердца из-под контроля мозга и разобщение различных отделов сердеч-
но-сосудистой системы (Ю. Н. Шанин и др., 1970).
Поздний прогноз. В позднем прогнозе следует различать прогноз до
выхода из коматозного состояния (если восстановление сознания воз-
можно) и прогноз в отношении психических и неврологических нару-
шений после выхода из этого состояния — нарушений, которые в той
или иной степени временно наблюдаются почти у всех оживленных
больных.
Для первого прогноза в полной мере сохраняет свое значение все
сказанное выше при характеристике задержанного прогноза [в частности,
выводы Binnie с соавторами A970) о прогнозе по ЭЭГ были основаны
на данных, полученных в интервале 30 мин — 7 сут после оживления].
Однако особое значение приобретают длительность комы и ее глубина;
сохранение у оживляемого больного глубокой, ареактивной комы свыше
4 сут, как правило, с выздоровлением несовместимо (И. И. Астапенко,
1966; см. главу V; А. М. Гурвич, 1966), если кома не была вызвана от-
равлением наркотиками или травмой черепа. Хотя имеются сообщения
о длительности комы до 7—10 сут с последующим полным восстанов-
лением (А. И. Генералов и др., 1968; Milstein, 1963) и даже до 3 нед
(Huguenard e. а., 1968), анализ доступных данных позволяет подозре-
вать, что в этих случаях или кома имела меньшую глубину, или вызвав-
шая ее остановка кровообращения была чем-либо осложнена.
Что касается прогноза в отношении симптомов постгипоксической
энцефалопатии, наблюдающихся по выходе из комы, то он весьма сло-
жен, не разработан и мало связан с прогнозом в отношении восстанов-
ления сознания (И. И. Астапенко, 1972; Mitller e. а., 1967). Кроме хро-
нического децеребрационного ступора и глубокой органической демент-
308
ности, которые обычно оказываются инкурабельными, самые тяжелые
постаноксические нарушения нередко уступают лечению и уменьшаются
благодаря пластичности и компенсаторным возможностям мозга, кото-
рые значительно варьируют у разных больных. Как указано в главе V,
окончательная картина формируется нередко спустя много месяцев,
иногда 1—2 года после оживления, и прогноз восстановления функций
мозга в этих случаях, как и лечение, относится к компетенции не реани-
матора, а невропатолога и психиатра.
Смерть мозга и ее констатация. В тех случаях, когда процесс ожив-
ления задерживается на стадии восстановления сердечной деятельности,
когда процесс восстановления мозга после некоторого периода прогрес-
сивной эволюции поворачивает вспять, а также при некоторых видах
тяжелой интрацеребральной патологии функции центральной нервной
системы оказываются полностью и окончательно угасшими. Это свое-
образное состояние, при котором сохраняется лишь сердечная деятель-
ность, артериальное давление поддерживается сосудистыми аналептика-
ми, а газообмен — искусственной вентиляцией с помощью респиратора,
стало возможным лишь в связи с разработкой и широким распростране-
нием в медицинской практике систем реанимационных мероприятий.
Хотя в реанимационных отделениях многопрофильных больниц подоб-
ные состояния довольно редки (около 1% всех больных; Bushart,
Rittrneyer, 1969; Schuster e. a., 1970), каждый из них создает для реани-
матора немалые проблемы (В. А. Неговский, 1971). Эти проблемы свя-
заны с необходимостью прилагать значительные усилия для поддержа-
ния сердечной деятельности и газообмеш у больных, перспективы вы-
живания которых более чем сомнительны, иногда за счет других, более
жизнеспособных больных; они связаны также с вопросом о правомер-
ности взятия у таких больных органов для трансплантации.
В связи со сказанным в последние годы возник ряд вопросов, требо-
вавших достаточно определенного решения:
а) об условиях развития изолированной гибели центральной нервной
системы в организме с сохранной сердечной деятельностью, клинической
картине подобных состояний и возможности их длительного сохранения;
б) о правомерности приравнивания смерти мозга к смерти организма
в целом;
в) о возможности надежной диагностики изолированной гибели
мозга;
г) о допустимости прекращения реанимационных мероприятий и
обращения с организмом, в котором погиб мозг, как с трупом.
Ответ на все эти вопросы оказался далеко не простым, что привлекло
ко всей этой проблеме внимание большого числа исследователей. За
13 лет, прошедших после описания этого состояния Mollaret с сотрудни-
ками A959I, был проведен ряд национальных и международных симпо-
зиумов и принят ряд систем рекомендаций (В. А. Неговский, 1971; Penin,
Kaufer, 1969; Arfel, 1970).
1 Определение рассматриваемого состояния и анализ его физиологической сущности
впервые дал Bichat в 1800 г. в работе Recherches physiologiques sur la vie et la mort.
21 Заказ № 1266 303
Для патогенеза рассматриваемого состояния наиболее существен
факт значительно более высокой устойчивости к аноксии сердца по
сравнению с любым отделом мозга. Поэтому в каждом случае, когда
длительность прекращения кровообращения превосходила пределы
устойчивости мозга и не достигала пределов устойчивости сердечно-
сосудистой системы, можно при условии интенсивной реанимации ожи-
дать, что восстановится только деятельность сердца, тогда как весь
мозг окажется погибшим. При сохраняющейся сердечной деятельности
и газообмене обычно по истечении 24—48 ч после воздействия на мозг
чрезмерно длительной ишемии развивается интравитальный ареактив-
ный некроз и аутолиз ткани мозга (Kramer, 1966; Schneider, 1970), в ряде
случаев с тромбозом сонных и базилярной артерий (Bots, Kramer, 1964)
или/и с дезинтеграцией капиллярной сети (Gros е. а., 1970).
Однако патогенез рассматриваемого состояния может быть различ-
ным в зависимости от того, что явилось первичной причиной гибели
мозга — интрацеребральные процессы (опухоли, абсцессы, геморрагии,
травмы, хирургические вмешательства, менингоэнцефалиты) или про-
цессы, охватывающие весь организм в целом и вызывающие первичное
прекращение системного кровообращения и газообмена (остановка серд-
ца, асфиксия, аноксическая или иная общая аноксия). В первом случае
основной причиной гибели мозга является его отек с повышением внут-
ричерепного давления и сдавливанием питающих мозг сосудов (имеет
место тотальный инфаркт мозга), во втором — столь выраженный отек
мозга не обязателен, он может появиться сравнительно поздно и имеет
подчиненное значение (А. М. Гурвич, 1971; Schuster e. а., 1970), ведущим
в патогенезе оказывается в этом случае первичный ишемическии некро-
биоз нервной ткани. Следует отметить, что первый механизм значитель-
но более характерен для практики реанимации, гибель мозга вследствие
второго механизма составляет всего 11—15% всех случаев этого состоя-
ния (Arfel, 1970; Schneider, 1970).
Описанные различия в патогенезе влекут за собой необходимость
некоторых терминологических уточнений. Первоначально рассматривае-
мому состоянию было дано название coma depasse (Mollaret, Goulon,
1959), или запредельной комы (Н. К. Боголепов, 1962). Затем оно ха-
рактеризовалось также терминами «деанимация» (Kramer, 1963), «рес-
пираторный мозг», «диссоциированная смерть» (Schneider, 1970),
«острая анэнцефалия» (Warter e. а., 1962), «необратимая кома» (Silver-
man е. а., 1970), «тотальный инфаркт мозга» (Ingvar, 1971) и некоторые
другие. Нам кажется наиболее правильным понятие «смерть мозга»,
которое следует отличать от понятия «мозговая смерть», означающего
смерть в обычном понимании, развившуюся вследствие первичного по-
ражения мозга каким-либо несовместимым с жизнью процессом. Одна-
ко, учитывая сказанное выше о двух патогенетических механизмах
смерти мозга, следует различать смерть всей центральной нервной си-
стемы и смерть только головного мозга: при действии повышенного
внутричерепного давления и вызванного им вклинения отделов мозга в
большое затылочное отверстие некроз охватывает в основном головной
мозг, не распространяясь ниже Ci—С4 сегментов спинного мозга
310
(Schneider, 1970), при втором механизме смерти мозга чаще
и спинной мозг.
Клиническая картина смерти мозга определяется, во-первых, ме-
ханизмами развития этого состояния, во-вторых, длительностью его
сохранения. В основном независимо от механизма развития смерти моз-
га ее клиническая картина имеет почти чистую негативную характери-
стику: при этом состоянии отсутствуют любые проявления спонтанной
деятельности и способности к деятельности любых отделов центральной
нервной системы. Сохраняется лишь сердечная деятельность, тонус сосу-
дов удается поддерживать все с большим трудом непрерывным введе-
нием аналептиков, в течение первых суток может наблюдаться значи-
тельная полиурия (Arfel, 1970; Ibe, 1971), сохраняется деятельность ки-
шечника (Lucking, Gerstenbrand, 1971). Постепенно развивается гипотер-
мия до 33—34° (Ibe, 1971). Однако такая характеристика оказалась
верной лишь для случаев, когда состояние смерти мозга удавалось под-
держивать недолго — часы или 1—2 суток. По мере совершенствования
реанимационных мероприятий, удлинения сроков поддержания сердеч-
ной деятельности и артериального давления и накопления опыта выясни-
лось, что описанная характеристика не является исчерпывающей.
Прежде всего было установлено, что такой типичный для смерти
симптом, как максимальное расширение зрачка, не является абсолют-
ным, так как зрачок может быть расширен не до предела, а примерно
на 3U своей максимальной величины (Schwartz, Vandrely, 1969; Arfel,
1970); глазные яблоки, однако, гипотоничны и роговица мутнеет. Далее
оказалось, что паралич сфинктеров (в частности, недержание мочи)
также имеет место не всегда (Gashes e. а., 1970). И, наконец, что наибо-
лее существенно, при смерти только головного мозга по истечении
1—60 ч возможно восстановление весьма многообразных спинальных
реакций. Артериальное давление начинает удерживаться на уровйе
80—90/40—60 мм рт. ст. без аналептиков, температура тела повышается
до 35—37°, а в претерминальном периоде — до 39°, восстанавливаются
кожные рефлексы (брюшные, кремастерные), сухожильные рефлексы;
при раздражении подошвы наблюдается, хотя и замедленный и двусто-
ронний, но сгибательный рефлекс пальцев ног, иногда — защитный реф-
лекс в виде тройного сгибания ног; в некоторых случаях наблюдают
своеобразные, атипичные шейные рефлексы, сгибательные и разгиба-
тельные синергии ног и рук, могут наблюдаться также пиломоторные
реакции и потоотделение. Клиническая картина смерти мозга осложняет-
ся также тем, что у некоторых больных движения головы и конечностей
могут наблюдаться как бы спонтанно. Хотя в развернутом виде спиналь-
ные рефлекторные реакции наблюдаются сравнительно редко, в той
или иной степени их наблюдали многие клиницисты (Gros e. а., 1970;
Schneider, 1970; Ibe, 1971, и др.) и притом даже после общих аноксиче-
ских воздействий (Schuster e. а., 1970; Butenuth e. а., 1970). Фоном для
описанной картины, по некоторым данным, является низкий тонус мышц
и отсутствие гиперрефлексии (Schuster e. а., 1970). Перечисленные выше
реакции не могут быть вызваны раздражением кожи лица или волоси-
стой части головы (Gros e. а., 1970). Описанная картина возможна; толь^
21* -УЗП
ко в случаях сохранности спинного мозга и объясняется восстановлением
собственных спинальных механизмов после исчезновения явлений спи-
«ального шока. Деятельностью спинальных центров объясняется и вос-
становление температуры (Thauer, 1964; Simon e. a., 1966; Butenuth e. а.,
1970) и тонуса сосудов (Г. П. Конради, 1969; В. М. Хаютин, 1971).
После выхода из состояния спинального шока, а в некоторых случаях
й при тотальной гибели всей центральной нервной системы у больного
со смертью мозга может сохраняться сердечная деятельность и артери-
альное давление в течение многих суток: если средняя продолжитель-
ность этого состояния, по данным разных авторов, колеблется в преде-
лах 4—5 суток, иногда достигая 11—12 сут (Л. М. Попова; цит. по
В. А. Неговскому, 1971; Mollaret e. а., 1959; Arfel, 1970), то в отдельных
случаях их «жизнь» может искусственно поддерживаться до 1—2 мес
(Kramer, 1966), что иногда создает в реанимационных отделениях нема-
лые сложности. Обычной причиной смерти таких больных являются
падение артериального давления, бронхопневмонии, поражение почек.
Вопрос о правомерности приравнивания смерти мозга к смерти орга-
низма в целом решается как советской, так и всей мировой наукой одно-
аначно и положительно (В. А. Неговский, 1971; В. Юрчик, 1973), так как
сознание, мышление, все то, что определяет личность, индивидуальность
человека, а также координация всех органов и систем осуществляется
головным мозгом. Мы, однако, не можем согласиться с теми исследовате-
лями (Rottgen, Rohrer, 1969 l; Ciganek, 1970), которые относят к смерти
мозга и декортикацию. В последнем случае имеет место смерть личности
человека, но не смерть мозга. Уравнивать эти состояния вряд ли целе-
сообразно, ибо тактика врача при них не может быть одинаковой
(В. А. Неговский, 1971).
Существует несколько путей диагноза смерти мозга. Однако, если
учесть ответственность диагноза и серьезность его возможных следствий,
ни один из этих путей не является достаточным сам по себе, диагноз
всегда устанавливается на основании совокупности данных клиническо-
го исследования и результатов использования различных специальных
методик и решающей для диагноза всегда остается клиническая картина
смерти мозга.
Наиболее прямым путем является установление факта физического
разрушения тканевой структуры мозга в объеме, несовместимом с
жизнью. При наличии клинических признаков смерти мозга этот путь
резко сокращает необходимую длительность наблюдения. Однако он
применим лишь в редких случаях массивной открытой травмы черепа,
когда масштабы разрушений очевидны.
Гибель мозга может быть доказана на основании снижения интен-
сивности потребления им кислорода до крайне низкого уровня. Ряд ис-
следователей показали, что потребление мозгом кислорода при смерти
мозга падает до значений менее 10—6% от нормы (Э. И. Раудам и др.,
Г969, 1971; Hoyer, Wawersik, 1968; Walker, 1969; Shalit e. a., 1970;
Brodersen, Jorgensen, 1972). До 2,4—2 об.% и менее снижается артерио-
Работы, помеченные звездочкой, см. в книге Penin, Kaufer (Hrsg) «Der Hirntod».
венозное -различие по кислороду (Э. И. Раудам и др., 1969; Geraud e. а.,
1969; Kaufer, 1969). Этот путь, по-видимому, является достаточно убеди-
тельным при условии устойчивости низких показателей обмена.
Косвенным, но теоретически весьма надежным и быстрым путем яв-
ляется доказательство, что мозг больного находится в условиях, исклю-
чающих возможность сохранения им жизнеспособности, а именно что кро-
вообращение в нем отсутствует или находится на уровне намного ниже
критического. Такое доказательство может быть получено несколькими
методами:
а) артериографией с помощью контрастных веществ (В. А. Негов-
ский, 1971; Gros e. а., 1970; Vlachovitch e. а., 1971);
б) исследованием объемного мозгового кровотока по методу Кети и
Шмидта или с помощью клиренса изотопов (Brock e. а., 1969), в част-
ности при прямой инъекции Кг85 в ткань мозга (Zwetnov, 1971);
в) изотопной ангиографией с помощью макроагрегатов альбумина,
меченного I131 (Brock e. а., 1969), или пертехнетата натрия Тс"
(Goodman e. а., 1969). К этой же группе методов примыкает эхоэнцефа-
лография, с помощью которой может быть показано отсутствие пульса-
ции сосудов мозга (Lepetit, цит. по Arfel, 1970).
Действительно, доказательство отсутствия мозгового кровообраще-
ния (остановка контрастного вещества при артериографии в экстракра-
ниальной части магистральных сосудов, на уровне сифона внутренней
сонной артерии, в месте образования базилярной артерии или на уров-
не виллизиева круга) в течение 20—30 мин при наличии прочих клини-
ческих признаков смерти мозга, по-видимому, достаточно для соответст-
вующего диагноза. Следует заметить, что для диагноза смерти мозга
должно быть показано выключение кровообращения по всем четырем
магистральным сосудам (Gros e. а., 1970; Vlachovitch e. а., 1971). По-
видимому, однако, методы исследования объемного мозгового кровотока
с помощью закиси азота или клиренса изотопов точнее, чем артериогра-
фия, так как эти методы являются количественными. Установлено, в ча-
стности, что при смерти мозга, связанной с повышением внутричерепного
давления, кровообращение в мозге человека обычно близко к 5 мл на
100 г в минуту и лишь в исключительных случаях поднимается до
10 мл/100 г/мин (Vlachovitch e. а., 1971).
Однако, как было показано выше, смерть мозга далеко не во всех
случаях развивается вследствие повышения внутричерепного давления
и поэтому прекращения мозгового кровообращения при ней может и не
быть (Kramer, 1966; Spann, 1967; Wawersik, 1969; Schuster e. a., 1970).
При полной картине смерти мозга и крайне низком потреблении мозгом
кислорода объемный мозговой кровоток может достигать 23 мл/100 г/мин
(Hoyer, Wawersik, 1968), что не делает диагноз смерти мозга неправо-
мерным. '
Наконец, последний и основной путь диагноза 'смерти мозга, также
являющийся косвенным, основан на четырех установленных опытным
путем и описанных в начале главы закономерностях, которые делают
возможным суждение о глубине и обратимости повреждений мозга па
основании длительности паралича тех или иных его функций. Для этого
313
пути основными являются клиническая картина, данные электроэнцефа-
лографии и их неизменность во времени.
В результате обсуждения вопроса о диагнозе смерти мозга нацио-
нальными (США, Франция, ФРГ, Швейцария, Чехословакия, Англия)
ц международными комиссиями специалистов ряда стран, в частности
комиссией по трансплантации сердца совета международных медицин-
ских организаций (CIOMS, 1968), Комитетом по смерти мозга междуна-
родной Федерации обществ ЭЭГ и клинической нейрофизиологии и др.
(см. В. А. Неговский, 1971; Penin, Kaufer, 1969) можно считать обще-
признанными следующие критерии смерти мозга:
1. Полное и устойчивое отсутствие сознания.
2. Устойчивое отсутствие самостоятельного дыхания.
3. Исчезновение любых реакций на внешние раздражения и любых
видов рефлексов.
4. Атония всех мышц.
5. Исчезновение регуляции температуры тела.
E. Сохранение тонуса сосудов только благодаря введению сосуди-
стых аналептиков.
7. Полное и устойчивое отсутствие спонтанной и вызванной электри-
ческой активности мозга.
Все критерии действительны только при нормотермии (температура
тела не ниже 34°) и в условиях, когда исключено действие наркотиков.
Некоторые из этих положений нуждаются в пояснениях.
Прежде всего необходимо отметить, что указанные критерии смерти
мозга приняты до того времени, как накопились данные о возможности
выявления со временем спинальных реакций, стабилизации артериаль-
ного давления и температуры тела. Поэтому в ряде новейших публика-
ций многих исследователей (Arfel, 1970; Schneider, 1970) указано, что
рефлекторные реакции спинального происхождения при наличии доста-
точно веских доказательств смерти мозга не препятствуют диагнозу по-
следней.
Отсутствие самостоятельного дыхания доказывается контролем за
дыхательными движениями при респираторе, выключенном на 1—3 мин
после 10 мин адекватной вентиляции легких, и при нормальном содер-
жании углекислого газа в альвеолярном воздухе (Постановление Гар-
вардского комитета 1968*; Arfel, 1970). Выключение респиратора на столь
длительный срок допустимо лишь при наличии всех прочих признаков
смерти мозга.
Среди воздействий, могущих вызвать рефлекторные реакции или
активацию тех или 'иных систем мозга, предлагаются (раздражение
вестибулярного аппарата путем введения в наружное ухо холодной воды,
кардио-ингибиторные рефлексы, возникающие при давлении на глазные
яблоки или область каротидных синусов, исследование ритма сердца в
ответ на введение атропина, внутривенное введение коразола, меридила,
бемегрида, иногда провоцирующее судорожные реакции.
Особого внимания требует электроэнцефалографическое исследова-
ние, которое при диагнозе смерти мозга должно проводиться только
высококвалифицированными специалистами. Для диагноза смерти мозга
.314
на ЭЭГ активность должна полностью отсутствовать. Поэтому допусти-
мы термины «изоэлектрическая ЭЭГ», «электрическое молчание коры»
(предпочтительный термин), «прямолинейная ЭЭГ», но не «плоская»
или «уплощенная» ЭЭГ, так как в последнем случае на ЭЭГ могут
иметь место слабые колебания.
Запись ЭЭГ должна быть осуществлена при соблюдении следующих
технических требований (Silverman e. а., 1970; Arfel, 1970):
1) использование минимум 10 электродов на скальпе (по между-
народной системе 10—20 —F3-4; СЗ-4, РЗ-4, 01-2, ТЗ-4) и двух ушных
электродов (электроды должны быть игольчатыми); 2) межэлектродные
сопротивления — менее 10 кОм; 3) тщательная и квалифицированная
проверка работы каждого электрода и соответствующего канала с по-
мощью электродного артефакта, вызываемого прикосновением к элек-
троду; 4) использование постоянной времени не менее 0,3 с, а в части
записи — максимальной имеющейся в аппарате @,7—1 с); 5) исключе-
ние фильтров высоких частот (должны свободно проходить колебания
с частотой 30 в с); 6) использование усилений 3,5 и 2,5 мкв/мм,
имея в виду уловить колебания с амплитудой 2,5 мкв; 7) использование
биполярных отведений с межэлектродными расстояниями не менее
8—10 см, а также монополярных отведений, в частности с ухом другой
стороны (особое внимание к лобно-теменным и лобно-височным отведе-
ниям, где обычно появляются первые колебания); 8) использование
аппаратов не менее чем с 8 каналами; 9) параллельная с ЭЭГ регистра-
ция ЭКГ, дыхания — желательно на том же аппарате или на специаль-
ном мониторе (в рассматриваемых состояниях часты артефакты от ЭКГ
и респиратора); 10) в целях контроля за внешними артефактами жела-
тельна также биополярная регистрация потенциалов в области кожи
тыла правого предплечья; 11) использование при регистрации различных
раздражений, в частности ритмическими вспышками света (при смерти
мозга возможно длительное сохранение электроретинограммы в лобных
отделах мозга; Sament e. а., 1969; Arfel, 1970); 12) каждая регистрация
ЭЭГ должна длиться непрерывно не менее 30 мин. К сказанному следует
лишь добавить, что, согласно мнению большинства исследователей и
комиссий, данные ЭЭГ при диагнозе смерти мозга являются абсолютно
обязательными.
Некоторые исследователи предлагают, кроме ЭЭГ, регистрируемой
со скальпа, использовать также погружные электроды с регистрацией и
раздражением подкорковых образований (Jouvet, 1959; Gashes e. a.,
1970, и др.). Однако процедура эта не безразлична для больного (Arfel,
1970) и вряд ли необходима для диагностики смерти мозга, так как ак-
тивность подкорковых образований может наблюдаться лишь при отсут-
ствии и ряда других признаков смерти мозга, прежде всего при сохран-
ности некоторых функций ствола; но в этих случаях электросубкортико-
графия вообще не нужна.
Весьма важными являются данные электромиографии, так как они
помогают отличить нейрогенно обусловленные сокращения мышц от
идиомускулярных подергиваний, которые могут в течение длительного
времени наблюдаться и при полной денервации (Kaufer, 1969*; Elbert,
315
1969*; Rohrer, 1969*; Arfel, 1970). Разумеется, появление на ЭЭГ элек-
тррмиографического артефакта, связанного с нейрогенно обусловленным
сокращением мышц головы, исключает диагноз смерти мозга.
Важнейшим и до сих пор окончательно не решенным является вопрос
о необходимом для диагноза смерти мозга времени сохранения всех ее
признаков. Гарвардский комитет установил срок 24 ч, полагая, что та-
кой период наблюдения является завышенным (Silverman e. а., 1970).
Действительно, Э. И. Раудам с соавторами A969, 1971), как и многие
другие исследователи, полагают достаточным срок в 12 ч, во Франции
установлен срок в 8 ч с повторными исследованиями через каждые 2 ч,
ряд специалистов ФРГ ограничиваются сроком в 6 ч с двумя интервала-
ми по 3 ч (Kubicky, 1969*). В этих странах считают, что 6—8 ч достаточ-
но для проведения необходимых для диагноза дополнительных исследо-
ваний.
По нашим данным, срок в 24 ч, действительно, является завышенным,
а 12 ч — достаточным. Очевидно, однако, что при массивной травме че-
репа с явным разрушением мозгового вещества диагноз смерти мозга
может быть сокращен. Так, А. Н. Беркутов с соавторами A969) полага-
ют, что в этих условиях достаточно 2-часового наблюдения. Вместе с тем
при малейшем сомнении в надежности диагноза, например при появле-
нии спинальных реакций, наблюдение должно быть продолжено и вклю-
чены все доступные методы исследования, особенно артериография
сосудов мозга. Часто при перечислении критериев смерти мозга делается
указание на то, что они недействительны для детей моложе 5—6 лет
(Artel, 1970). Эта оговорка кажется не вполне оправданной, так как
большой опыт прогноза по ЭЭГ, имеющийся у Pampiglione и Harden
A968), основан на исследовании детей, возраст большей части которых
был меньше года. По указанию этих исследователей, определенные
сложности, связанные с особенностями обмена веществ, возникают лишь
у детей в возрасте нескольких недель.
Мы подошли к необходимости дать ответ на последний вопрос, по-
ставленный в начале настоящего раздела: допустимо ли прекращение
реанимационных мероприятий и взятие органов для трансплантации в
случае диагноза смерти мозга. Согласно декларации Всемирной меди-
цинской ассоциации A968) и решению национальных комитетов ряда
стран (В. А. Неговский, 1971), ответ на этот вопрос является утверди-
тельным. В СССР также постепенно накапливается собственный опыт
в этом отношении, который ждет оформления в решениях соответствую-
щих авторитетных органов. Необходимо, однако, чтобы решение вопроса
о прекращении реанимации в каждом случае принимала группа врачей,
в которую входят лечащий врач-реаниматор, невропатолог, электроэн-
цефалографист и представитель администрации больницы.
XIX
ОРГАНИЗАЦИЯ РАБОТЫ
ОТДЕЛЕНИЙ РЕАНИМАЦИИ
ОБЩЕГО ПРОФИЛЯ И ВЫЕЗДНЫХ
РЕАНИМАЦИОННЫХ БРИГАД
Значительное расширение сферы практического применения реанима-
тологии и создание материальной базы (лечебной и диагностической
аппаратуры), увеличение потребности в квалифицированной помощи
наиболее тяжелобольным обусловили в последние десятилетия возник-
новение и развитие сети отделений и центров реанимации как в нашей
стране, так и за рубежом. Концентрация больных, перенесших терми-
нальное состояние, в одном отделении позволяет обеспечить наиболее
полноценное и квалифицированное их обследование при единстве пато-
генетических концепций и врачебной тактики и также сосредоточить и
более рационально использовать высококвалифицированные кадры,
сложную диагностическую и лечебную аппаратуру. В связи с этим при-
обретают особый интерес вопросы наиболее рациональной организации
реаниматологической службы различного профиля. Практика последних
лет показывает, что реаниматологические стационары развиваются в
трех основных направлениях: 1) отделения или палаты послеоперацион-
ной интенсивной терапии, 2) специализированные отделения реанима-
ции, 3) отделения общего профиля.
Послеоперационные отделения интенсивной терапии должны быть
организованы в крупных хирургических клиниках вблизи от операцион-
ной. Их задачей является ведение раннего послеоперационного периода,
а также профилактика и терапия осложнений, которые могут развивать-
ся у больного в связи с анестезией и хирургическим вмешательством и
не требуют длительной реанимации. Эти палаты относятся к анестезио-
лого-реанимационным отделениям и ведение находящихся в них больных
возлагается на анестезиологов совместно с хирургами. Количество коек
в послеоперационных отделениях колеблется от 5 до 10% от общего
числа хирургических коек в зависимости от профиля клиник (Т. М. Дар-
бинян и М. Я. Авруцкий, 1965; Б. А. Королев, С. П. Зорева, 1965;
А. II. Зильбер, 1971; Pulver, 1962; Baumann, 1965; Huguenard, 1967,
и др.).
Планировка послеоперационных отделений интенсивной терапии
часто предусматривает наличие больших залов или палат на 8—12 коек
317
с центральным постом медицинской сестры или отдельные палаты с те-
левизионным наблюдением на сестринском посту (Keszler и др., 1968;
Sadove, Gross, 1956; Ciocatto, 1965, и др.). В эти отделения переводят
из операционной всех больных, перенесших операцию под наркозом,
и оставляют в них от нескольких часов до 2—3 сут в зависимости от тя-
жести состояния, объема хирургического вмешательства и развития ос-
ложнений (Б. Г. Жилис, 1963; Р. Н. Лебедева, 1967, и др.).
Специализированные отделения и центры реанимации предназначе-
ны для лечения тяжелобольных с определенными видами патологии.
Так называемые респираторные центры или отделения создаются при
крупных неврологических клиниках для оказания помощи больным с
нарушениями дыхания при заболеваниях нервной системы (полиомие-
лит, полирадикулоневрит, столбняк, энцефалит и т. д.). Основная задача
этих отделений — проведение длительной, иногда многолетней искусст-
венной вентиляции легких (В. П. Дорощук, 1963; Л. М. Попова, 1965;
Kinney, 1964; Сага, 1965; Ginella, 1966; Hanquet, 1966, и др.).
Лечение больных с отравлениями различными ядами проводится в
токсикологических центрах. При них же организованы информационные
отделы, располагающие картотеками сведений о клинике и лечении от-
равлений, что позволяет оказывать консультативную помощь врачам
других клиник, городов, а иногда и стран (В. Н. Дагаев и Е. А. Лужни-
ков, 1966; Vincent, 1962; Lissac, Pocidallo, 1963, и др.).
Известное распространение получили кардиологические центры реа-
нимации, где в основном оказывают помощь больным с осложненным
инфарктом миокарда (кардиогенный шок, отек легких, нарушения ритма
сердечной деятельности и др.)- В этих отделениях, составляющих обычно
3% от общего числа терапевтических коек больницы, выделяют три типа
коек: а) для больных с острой коронарной недостаточностью, аритмиями
неясной этиологии и полной поперечной блокадой сердца; б) для боль-
ных с отеком легких, эмболией легочной артерии, дигиталисной инток-
сикацией, артериальной гипотензией и сердечной недостаточностью, со-
провождающейся гидро-электролитными расстройствами или почечной
недостаточностью; в) койки усиленного наблюдения. Считают целесооб-
разным на 1 койку типа «а» иметь 4 койки типа «б» и 7 коек типа «в»
(А. И. Смайлис, 1964; Е. И. Вольперт и др., 1967; Minogue, 1964;
Nicolas, 1965, и др.).
Для лечения больных с почечной недостаточностью создаются нефро-
логические реанимационные центры, основной задачей которых является
проведение гемодиализа (М. О. Стернин и С. Г. Орел, 1965; Hamburger,
1954, и др.). В некоторых районах страны могут быть организованы спе-
циальные центры для оказания реанимационной помощи больным с крае-
вой патологией (клещевой энцефалит, столбняк и др.).
Отделения реанимации общего профиля предназначены для проведе-
ния как экстренных, так и длительных реанимационных мероприятий у
больных с остро возникшими терминальными состояниями, вызванными
разнообразными причинами: травматическим шоком, кровопотерей, по-
ражением головного мозга, травмой грудной клетки, острой дыхательной
и сердечной недостаточностью различной этиологии, в том числе и в
318
послеоперационном периоде, и др. Такие отделения организуются на
базе крупных многопрофильных больниц (республиканских, краевых,
областных). В них в отличие от послеоперационных отделений интенсив-
ной терапии поступают больные, доставленные скорой помощью, а также
переводятся тяжелобольные из других стационаров, в которых нерацио-
нально организовывать собственные отделения реанимации (маломощ-
ные больницы, родильные дома и др.).
Число коек в отделениях реанимации общего профиля должно со-
ставлять 1,7—6% коечного фонда всей больницы и быть не менее 6 и не
более 20 (Rise, 1967; Findel, 1968, ,и др.). Целесообразно иметь одно та-
кое отделение на 1 млн. жителей города.
В условиях больших городов, где имеется много лечебных учрежде-
ний без реанимационных отделений, при многопрофильном центре реа-
нимации следует организовать выездные бригады, которые предназна-
чены для оказания специализированной помощи больным, находящимся
в терминальных состояниях в других стационарах, а при необходи-
мости— для транспортировки их в центры реанимации. При поступлении
вызовов из области, края и других городов страны бригады реанимато-
логов следует доставлять на самолетах санитарной авиации.
Ведение больных в многопрофильных отделениях реанимации осуще-
ствляется врачами реаниматологами-клиницистами, хорошо знакомыми
с патофизиологией, современными методами экстренной диагностики и
терапии терминальных состояний различной этиологии. Опыт показыва-
ет, что такие врачи при постоянном лечении тяжелобольных способны
глубже и быстрее оценить тяжесть состояния больного при самых разно-
образных заболеваниях и их сочетаниях и выбрать наиболее рациональ-
ный комплекс лечебных мероприятий, включающий такие сложные
методы, как длительная трансфузионная терапия, искусственная венти-
ляция легких, экстракорпоральное кровообращение и др. Концентрация
тяжелобольных в одном отделении дает реаниматологам большие пре-
имущества в приобретении клинического опыта перед другими специа-
листами, редко видящими подобных больных. Подготовка врача-реани-
матолога, по мнению В. А. Неговского A971), занимает 2—3 года, же-
лательно, чтобы до прихода в отделение реанимации каждый врач
3—4 года проработал в какой-либо другой клинике (терапевтической,
хирургической и др.).
Естественно, что к лечению больных следует привлекать квалифици-
рованных специалистов-консультантов, что легко осуществимо только в
условиях крупного многопрофильного учреждения, однако роль их не
должна переоцениваться. Последнее слово в выборе методов лечения
принадлежит реаниматологу.
Многопрофильное отделение реанимации должно .располагаться в не-
посредственной близости от приемного отделения (или иметь отдельный
вход для доставки больных, минуя приемный покой) и круглосуточно
действующей операционной неотложной хирургии. Совершенно необхо-
димо иметь просторное помещение для первичного обследования и ока-
зания экстренной помощи поступающим больным. Далее нужны палаты
для проведения длительных реанимационных мероприятий, причем необ-
319
ходимо, чтобы больные с септическими и гнойными процессами были
отделены от остальных больных..
В отделении реанимации необходима круглосуточно действующая
лаборатория, выполняющая исследования, которые обычно не делают в
центральных лабораториях больниц или которые нужно многократно
повторять в течение суток.
Наши данные основаны на более чем 10-летнем опыте работы отде-
ления реанимации (заведующая—заслуженный врач РСФСР Т. П. Вель-
ская) Московской клинической больницы имени С. П. Боткина (главный
врач — заслуженный врач РСФСР Н. С. Лапченко), организованного в
конце'1959 г. и являющегося клиническбй базой Лаборатории экспери-
ментальной физиологии по оживлению организма АМН СССР (руково-
дитель— член-корреспондент АМН СССР профессор В. А. Неговский).
Мы не можем, естественно, с одной стороны, расценивать наши условия
как идеальные, а с другой — отдаем себе отчет в том, что в большинстве
лечебных учреждений в настоящее время и эти условия недостижимы.
Однако в последние годы проектируются и строятся крупные больницы,
в которых запланированы отделения реанимации. Учитывая это, мы счи-
таем, что наш опыт может оказаться полезным проектным организациям,
административным органам здравоохранения и врачам, которые будут
работать в центрах реанимации.
Наше отделение занимает площадь 981 м2. Планировка его представ-
лена на рис. 30. Больные, чаще всего минуя приемное отделение, посту-
пают в реанимационный зал № 1 площадью 45,9 м2, где проводятся пер-
вые диагностические и лечебные мероприятия: осмотр, клиническое об-
следование, по показаниям ЭКГ, реовазография, рентгенография, взятие
крови и мочи для анализов, катетеризация сосудов, интубация, трахео-
стомия, массаж сердца, искусственное дыхание, внутривенные и внутри-
артериальные трансфузии и др. Поэтому в реанимационном зале посто-
янно имеется необходимое оборудование: штативы для трансфузий с
подготовленными и заполненными системами, стерильные укладки для
обнажения сосудов и трахеостомии, столик с ларингоскопом, набором
эндотрахеальных трубок, роторасширителем и др., катетеры в дезинфи-
цирующем растворе для отсасывания из трахеи и полости рта, один или
два респиратора типа РО-2, РО-3 или АНД-2, наркозный аппарат, де-
фибриллятор с кардиосинхронизатором, кардиостимулятор, электрокар-
диограф, передвижная рентгеновская установка, холодильник с набором
крови и других трансфузионных сред, шкаф с медикаментами, шприцы,
иглы, хирургические инструменты, сосудистые катетеры в лотках с де-
зинфицирующими растворами, так называемая реанимационная тележка
с аппаратом для непрямого массажа сердца и дефибриллятором и др.
В первом реанимационном зале больной находится на каталке, на щи-
товых носилках не более 24 ч, обычно 6—8 ч, т. е. в течение времени,,
необходимого для проведения наиболее экстренных мероприятий и вы-
ведения больного из наиболее тяжелого состояния. При необходимости
хирургического вмешательства или применения экстракорпорального
кровообращения последние выполняются в операционной силами дежур-
ной бригады хирургов и перфузиологов. Если нужно провести длителъ-
320
Рис. 30. План отделения реанимации Московской клинической ордена Ленина больницы
имени С. П. Боткина.
1 — операционная; 2 — рентгеновский кабинет; 3 — лаборатория коагулологии; 4 — реанимационный
зал № 1; 5—реанимационный зал № 2 (стерильный), 6—кабинет функциональной диагностики
сераечно-сосудисгой системы; 7 — лаборатория экстракорпорального кровообращения; 8 — бельевая;
9, 10 —палаты для септических больных; И —кухня; !2 — кабинет дежурных врачей: 13 — помещение
для ремонта аппаратуры; 14 — конференц-зал; 15 — перевязочная; 16 —комната старшей медицин-
ской сестры, 17 —комната медицинских сестер; 18 — ординаторская; 19—25 — одноместные палаты;
26 — кабинет функциональной диагностики дыхания: 27 — кабинет заведующего отделением; 28 —
биохимическая лаборатория
ные реанимационные мероприятия с особо тщательным соблюдением
условий асептики (например, после экстракорпорального гемодиализа,
в послеродовом периоде и др.)> больных переводят в стерильный реани-
мационный зал № 2 площадью 50,9 м2, где имеются 4 койки, разделен-
ные ширмами. В этом зале может быть налажен контроль за рядом фи-
зиологических показателей при помощи мониторных установок, что осо-
бенно важно для больных с сердечной патологией.
При наличии у больного гнойно-септических процессов их помещают
в специальные палаты, снабженные всей необходимой аппаратурой, ко-
321
торой не должны пользоваться в других подразделениях. Особое внима-
ние следует обратить на стерилизацию аппаратов для искусственной
вентиляции легких. К Сожалению, нередко ограничиваются стерилизаци-
ей только интубаторов, трахеотомических трубок, шлангов и больных
подключают практически к нестерильному аппарату. Это приводит
к переносу инфекции внутри отделения среди больных, у которых и без
того снижены защитные реакции, развитию у них трудно излечимых
пневмоний. В постреанимационных палатах 'необходимо использовать
бактерицидные лампы, а при уборке помещений — дезинфицирующие
средства. После стабилизации основных показателей, обычно через
2—3 сут, если больной нуждается в дальнейших реанимационных меро-
приятиях, его переводят из зала № 2 в одноместные реанимационные
палаты площадью 13,5—15 м2. В этих палатах проводят длительную
(иногда многомесячную) искусственную вентиляцию легких, длительную
трансфузионную терапию, парентеральное питание и др. Хотя такая изо-
ляция больных и несколько затрудняет наблюдение за ними, она благо-
приятно сказывается на психике больного, создает больший комфорт и
уменьшает риск внутрибольничной инфекции. В каждой палате, помимо
функциональной койки и необходимой аппаратуры, имеется индивидуаль-
ный сестринский столик со шприцами, иглами и другими инструментами,
находящимися в дезинфицирующем растворе, а также шкаф с необходи-
мыми для данного больного в течение суток медикаментами. Кроме того,
желательно в каждой палате иметь минимум необходимого оборудова-
ния и медикаментов для оказания экстренной помощи при внезапных
осложнениях (ларингоскоп с набором трубок, мешок Рубена, одноразо-
вые системы для трансфузий, преднизолон, адреналин, строфантин
и т. д.). Необходимо иметь один респиратор типа РО, АЫД-2 или ДП-8
на каждые 2 койки. Все помещения снабжены централизованной подвод-
кой кислорода и вакуумной системой.
Большинство авторов считают, что на 1 койку должно приходиться
от 13,5 до 20 м2 площади (Cuarino, 1966; Hervig, 1968; Ibe, 1966, и др.).
В нашем отделении на 1 койку приходится в среднем 49 м2, но так как
большая часть помещений отведена под вспомогательные службы (лабо-
ратории, аппаратные, стерилизационные комнаты, перевязочные, комнаты
для персонала и др.), то на все палаты и реанимационные залы прихо-
дится 237 м2 B4,1% всей площади отделения). На каждую койку при-
ходится 11,6 м2 полезной площади (по действующим в нашей стране
нормативам 10 м2). Необходимо выделять значительные площади для
аппаратуры.
В отделении работают ежедневно четыре врача-ординатора, пато-
физиологическая группа, включающая биохимиков и врачей функцио-
нальной диагностики, два врача дежурят круглосуточно. В каждом
реанимационном зале и септических палатах имеется -по одному сест-
ринскому /посту. Три иоста обслуживают больных в одноместных
палатах.
В связи с наличием чрезвычайно большого количества сложной
аппаратуры в отделении необходимы инженер и два техника, обеспечи-
вающие ремонт и наладку приборов.
322
Работа врачей отделения складывается из ежедневного ведения
больных и круглосуточных дежурств. Врач-ординатор ведет 4—5 боль-
ных, желательно разной степени тя~ *ести. Возможна некоторая профи-
лизация (одному врачу поручают больных терапевтического, а другому —
хирургического профиля), однако каждый реаниматолог отделения,
опираясь на помощь своих товарищей и консультантов, должен быть
готов к квалифицированному лечению больных с любым видом пато-
логии.
Проведение диагностических и лечебных мероприятий у тяжелоболь-
ных требует от врача исключительной организованности, собранности и
большой затраты сил и времени. Клиническое обследование, забор кро-
ви для анализов, проведение всех мероприятий, включая в ряде случаев
санитарную обработку и кормление больного, контроль за работой лечеб-
ной аппаратуры входят в непосредственные задачи ординатора наряду
с дачей назначений медицинским сестрам. Назначения, помимо фикса-
ции в истории болезни, должны быть подробно (не только дозировка,
но и время и последовательность введения препаратов) выписаны в
специальный лист.
Два дежурных врача осуществляют прием поступающих больных в
реанимационном зале, проводят по показаниям экстренные реанимаци-
онные мероприятия, в случае необходимости участвуют в обеспечении
безопасности хирургического вмешательства, в ночное время контроли-
руют состояние больных в палатах и выполняют необходимые манипу-
ляции. Один из дежурных врачей консультирует также больных в других
отделениях больницы, оказывая необходимую помощь на месте или пере-
водя их в отделение реанимации.
Успешное лечение больных на современном этапе возможно лишь при
тщательном их обследовании и ежедневном, часто многоразовом контро-
ле за основными функциями организма. Поэтому чрезвычайно важное
значение приобретает в отделении реанимации биохимическая лаборато-
рия и служба функциональной диагностики. Роль клинического пато-
физиолога велика и состоит не в выполнении тех или иных исследований
по назначению лечащего врача, а в активном участии в оценке состояния
и выработке рациональных методов лечения в каждом случае. Совмест-
но с ординатором патофизиолог решает, какие исследования необходимо
провести у Данного больного, участвует в обсуждении их результатов и
рекомендуемом лечении.
Основное назначение исследований — получение лнформации о со-
стоянии больного для проведения полноценного лечения на современном
уровне. Поэтому есть исследования, которые нужно производить систе-
матически у каждого больного в тяжелом состоянии. Необходимая аппа-
ратура изготовляется отечественной промышленностью в достаточном
количестве, легко управляема и недорогостояща. К таким показателям
относятся, например, данные реовазографии, исследования крови, цент-
рального венозного давления, баланса электролитов. К обязательным
тестам относятся также показатели кислотно-щелочного равновесия.
Наиболее полную информацию дает исследование с помощью микро-рН-
метра Аструпа. В нашей стране также создан аппарат АЗИВ, позволяю-
323
щий определять все эти показатели в капиллярной крови. Однако при
отсутствии этих аппаратов можно проводить коррекцию метаболических
сдвигов кислотно-щелочного равновесия, определяя щелочной резерв в
плазме крови с помощью малой модели аппарата ван Слайка (см. гла-
ву VI). Этот перечень может быть расширен или изменен в связи с на-
правлением исследований, профилем работы отделения реанимации,
поставленными конкретными задачами, которые могут изменяться по
мере их решения. Например, в нашем отделении внимание уделяется
изучению кислородного баланса и показателей гипоксии (напряжение
кислорода в артериальной, венозной, капиллярной крови, сумма органи-
ческих кислот, концентрация молочной, пировиноградной кислоты, ак-
тивность лактатдегидрогеназы), кислотно-щелочного равновесия. Боль-
шое внимание уделяется также показателям водно-электролитного обме-
на. В динамике определяется концентрация калия, натрия (методом
фотометрии пламени), хлора (титрометрическим методом) в плазме
крови, эритроцитах. Наибольшее значение для определения баланса
указанных электролитов в организме имеет, однако, определение коли-
чества их, выделяемых за сутки с мочой. Систематически исследуются
также показатели коагулограммы. В связи с необходимостью оценки
степени анемии и гиповолемии производятся определения гематокритно-
го показателя, концентрации гемоглобина, общего белка, мочевины,
количества эритроцитов в крови, взятой из вены. Объем циркулирующей
крови и фракций (по разведению синего красителя Эванса) сопостав,-
ляется с величиной центрального венозного давления.
При обследовании функций сердечно-сосудистой системы большое
значение придается состоянию кровенаполнения тканей и регионарному
кровотоку (методом реовазографии) наряду с оценкой в показанных
случаях центральной и общей гемодинамики (центральное венозное дав-
ление, давление в полостях сердца, легочной артерии, фазовый анализ
сердечной деятельности и электрическая активность миокарда).
В динамике наблюдаются также показатели внешнего дыхания, для
чего проводится по показаниям спирография, пневмотахография, а также
рентгенографическое обследование легких передвижным аппаратом и
оксигемография.
Нам представляется целесообразным рекомендовать следующее ла-
бораторное оборудование для вновь открывающихся отделений реани-
мации: центрифуга с гематокритными капиллярами ЦЛК-1 B шт.), фо-
тоэлектроколориметр ФЭК 56 или 57, пламенный фотометр ФПЛ-2 или.
другой марки, рН-метр (ЛПУ-0,1), аппарат ван Слайка (малая модель),
микроскоп, рефрактометр, аппарат Коварского (для определения моче-
вины) E—6 шт.), дистиллятор Д-4, камера Горяева B шт.).
Труд среднего медицинского персонала в отделении реанимации так-
же исключительно сложен и ответственен. Медицинские сестры не толь-
ко должны непрерывно наблюдать за состоянием больного и функциони-
рованием аппаратуры, но и вовремя заметить развитие каких-либо ослож-
нений, а иногда и самостоятельно начать реанимационные мероприятия,
такие как массаж сердца, искусственное дыхание. В обязанность меди-
цинских сестер входит выполнение множества манипуляций, иногда
324
весьма сложных и трудоемких (дренирование дыхательных путей, пово-
рачивание больного, участие в рентгеновских исследованиях и др.)- Они
также фиксируют результаты наблюдения и выполнение назначений в
специальной карте.
В нашем отделении 1 медицинская сестра обслуживает от 1 до
4 больных в зависимости от тяжести их состояния. Особенно тщательного
ухода требуют больные в коматозном состоянии, находящиеся на дли-
тельной искусственной вентиляции легких. Непрерывное совершенство-
вание медицинского персонала является серьезной задачей каждого
реанимационного отделения. Необходимо участие администрации в под-
боре наиболее способных, квалифицированных и выносливых медицин-
ских сестер.
Постоянные занятия со средним медицинским персоналом входят
в обязанность врачей отделения (Г. Н. Андреев, 1967, 1968; Т. П. Вель-
ская и В. Л. Кассиль, 1969; В. А. Неговский, 1971, и др.).
По приказу № 605 Министерства здравоохранения СССР, изданного
в декабре 1969 г., на 12 коек реанимационного отделения выделяется
4,5 ставки врача-биохимика и 4,5 ставки лаборанта. Как показал наш
опыт работы при наличии 20 коек, количество лаборантов должно быть
значительно больше. 4,5 лаборантской ставки необходимы для обеспе-
чения круглосуточных дежурств, эти лаборанты производят самые необ-
ходимые экстренные исследования. Днем на лабораторию приходится
максимальная нагрузка, поэтому днем должны работать, помимо дежур-
ного лаборанта, еще 2 дневных по биохимии и 1—2 лаборанта по функ-
циональной диагностике. Врачебные ставки целесообразно использовать
также для дневной работы: 1—2 врача-биохимика, 1 врач по функцио-
нальной диагностике и 1 патофизиолог.
Выездные бригады состоят из трех групп: общесоматической (врач-
реаниматолог и фельдшер), акушерской (врач акушер-реаниматолог и
фельдшер) и анестезиологической (анестезиолог и анестезист). Биохими-
ческие анализы проводят лаборанты базового отделения и результаты
передают бригаде по телефону. Из лечебных учреждений бригаду вызы-
вает врач, который коротко и ясно излагает данные о состоянии больно-
го, получает рекомендации по проведению мероприятий до прибытия
бригады. К выездным бригадам прикреплена специально оборудованная
машина типа «RAF», в лечебно-диагностический комплекс которой вклю-
чена портативная аппаратура, позволяющая получать достаточный
объем информации о состоянии больного и оказывать квалифицирован-
ную лечебную помощь (рис. 31). Часть аппаратуры размещена и закреп-
лена в машине, некоторые аппараты берутся на вызов по мере необходи-
мости.
Имея портативное оснащение, бригады могут проводить реанимаци-
онные мероприятия и анестезиологические пособия немедленно по при-
бытии на место, а также в машине во время транспортировки больных
в специализированные отделения (центры). За год выездные бригады
оказывают помощь 550—650 больным.
По нашим данным, основной причиной развития терминального со-
стояния у больных с акушерской патологией являлись: массивная крово-
325
Рис. 3L Схема оборудования салона специализированной машины.
1 _ щитовые носилки на выдвигающемся станке, 2, 3 — 10-литровые баллоны с кислородом и за-
кисью азота; 4 — дефибриллятор ИД-166; 5 ~ штатив для флаконов с трансфузионными средами;
6«—электрический отсос ОХ-2; 7—наркозный аппарат УНАП-2; 8 — преобразователь электрического
тока; 9—электрокардиограф ЭКГ-Н с реографической приставкой; 10 — окслгемограф 036-М, или
коагулограф 1433; 11 —штатив для пробирок. 12 — полка-шкаф для медикаментов и трансфузионных
сред; 13 —откидные сидения для медицинского персонала.
потеря B5—40 мл/кг), токсикоз второй половины беременности, тяжелая
интоксикация, связанная с перитонитом, сепсисом.
Наиболее частыми причинами вызова бригады к больным общесома-
тического профиля были: инфаркт миокарда, осложненный отеком лег-
ких или кардиогеиным шоком, нарушением сердечного ритма; длительно
не купирующийся приступ бронхиальной астмы, коматозные состояния
различной этиологии и др. (табл. 10).
, клинический опыт показал, что больные, перенесшие терминальное
состояние, как правило, нуждаются в длительном специализированном
лечении с учетом не только характера основного заболевания, но и осо-
бенностей течения постреанимационного периода. Успешное лечение
15—16% таких больных возможно лишь в реанимационных центрах
или отделениях.
При решении вопроса о переводе больных с нарушениями жизненно
важных функций в отделения (центры) реанимации следует принимать
во внимание два основных момента: отсутствие возможности проведения
длительного специального лечения на месте; возможность обеспечения
максимальной безопасности транспортировки. В каждом отдельном слу-
чае необходимо руководствоваться, с одной стороны, положением о мак-
симальном приближении специализированной помощи к тяжелобольно-
му, с другой — учитывать, что эта возможность имеет предел и длитель-
ное интенсивное лечение в условиях обычного отделения невозможно.
Наш опыт выявил, что показаниями к переводу больных в отделения
реанимации являлись необходимость в длительном проведении искусст-
326
Таблица Ш
Причины развития терминальных состояний, потребовавших вызова выездных бригад
реанимации A971 г.)
Виды патологии
1. Акушерская патология (массивная крсвопотеря, токси-
коз беременности, перитонит, сепсис)
2. Комбинированная травма
3. Острая дыхательная недостаточность (пневмония, брон-
хиальная астма, миастения и др.)
4. Острая сердечно-сосудистая недостаточность (инфаркт
миокарда, гипертоническая болезнь, пороки сердца)
5. Коматозные состояния различной этиологии
6. Психосоматические заболевания
7. Прочие
Всего . . .
Всего больных
236
20
128
98
57
32
46
617
Процент
:
i
21;
5
100
венной вентиляции легких, гемодиализе, экстракорпоральном кровообра-
щении, изолированной перфузии печени, длительной инфузионной тера-
пии с постоянным контролем за основными физиологическими парамет-
рами.
В работе отделения реанимации и выездных бригад большое значе-
ние имеет точная медицинская и научная документация. Многообразие
и быстрота изменений в состоянии больного, происходящих за короткий
срок, требуют тщательной регистрации не только основных физиологи-
ческих показателей и симптомов, но и лечебных мероприятий в их; по-
следовательности. Все записи в истории болезни, в том числе и консуль-
тации, должны быть не только датированы, но в них обязательно указы-
вается время осмотра, также должно быть указано время проведения
некоторых исследований (например, газы крови, кислотно-щелочное
равновесие и объем циркулирующей крови, ЭКГ, ЭЭГ и т. д.). Весьма
рационально вносить данные анализов в сводную карту, вклеиваемую
в историю болезни. Помимо последней, на каждого больного заполняют
специальную карту, в которой тщательно отмечают основные показатели
состояния и все лечебные мероприятия (рис. 32).
При выписке или смерти больного врач заполняет также специаль-
ную учетную перфокарту.
Большой интерес представляет анализ статистических показат
;лей
работы отделения реанимации. За год в отделение реанимации Москов-
ской клинической больницы им. С. П. Боткина на 20 коек поступает от
600 до 750 больных с различными видами патологии (табл. 11). Из них
78—80% доставляют машиной скорой помощи, 14—16% переводя^ из
других отделений больницы и 4—8% —из других лечебных учреждений.
Длительность проведения реанимационных мероприятий колеблется от
нескольких часов (например, при электроимпульсной терапии сердеч-
ных аритмий) до нескольких месяцев (у больных с черепно-мозговой
327
' *6мая1971г.
|!
170
160
150
140
130
120
ПО
100
90
80
70
60
50
40
30
20
10
Дых.
40
35
30
25
20
15
10
5
XapaKiep пульса
и юны сердца
Характер спонтанною
дыхания
Сознание
Поведение
Цве1 кожи
Зрачок и рог. рефл.
Органы грудной и
брюшной полос 1 ей
Выпи i о рот/зонд
Количество мочи
Анализы
Манипуляции
В/в трансфузии
В/а фансфузии
В/в инъекции
П/к и в/м
инъекции
ИВЛ-респираюр
МОД влох/выдох
Дыха!ельн. объем
Macioia
Давление влох/выдох
Кислород л/мин
II20
У//
У/?
s
Не опр.
глухие
аритм.
хриплое
—
судорог
бледн
@@ -
В легки
влажны
Нь
Ht
К-
Ма
МО
-8,5%
-26
2.8
-131.
чев-1
Т по
еднизо/
30 мг
X
\>
•»■
У
V,
Ул
•■■
^^
Нигеви:
ригмич.
аригм.
—
и
X МНОГО
к хрипов
1,2
лиглюки
400,0
афопин
0.8
и30
—
-о
У/,
У/
н
судорог
итубаь
лис!ено
100 мг
РО-3
14/13,5
700
20
28/2
8
и40
—
уу
Уу
У/у
///
Не опр.
и
кровь
250,0
и45
у
у
2
Слабый
ригмич.
—
иг
п52
У/
Уу
Ул
—
элок
пере;
газа
<ольн
кров
250
|2оо
Ул
Слабый
риш
—
хрипов i
мень
240,0
рН
DC
вв
SB
РП
ад "д
ому
fiof ф
HKDBY
ь
0
J кровь 250.0 f
н предн
30 mi
13ОЛ
14/I3.5
500
28
26/2
I0
-7,35
O2-32
-42,2
-19
-6,6-
спирг
из
ахеи
.2»
Уу
У/
У//
—
легких
ше
,5
ция
R-rpa
ф
Т протеин
1 250,0
глюкона
Са-Ю,0
пес
г
14/13
500
28
26/2
8
> Дыхание
► Пульс
Рис. 32. Реанимационная карта.
Лаборатория экспериментальной физиологии по оживлению организма АМН СССР
Центр реанимации. Исследование коагулограммы
Ф.И.О больного, возраст, № и. б., диагноз:
Показатели
1. Время свертывания по
Ли—Уайту G—11 мин)
2. Время рекальцификации
(90—250 с)
3. Протромбиновый индекс
G0-110%)
4. Толерантность к гепари-
ну F—11 мин)
5. Тромбиновое время C0—
40 с)
6. Свободный гепарин G—
8 с)
7. Фибриноген B00—
400 мг%)
8. Фибринолитическая ак-
тивность B10—220)
9. Ретракция кровяного
сгустка D0—50%)
Дата, час
Лаборатория экспериментальной физиологии по оживлению организма АМН СССР
Центр реанимации. Кислородный баланс и кислотно-щелочное равновесие
Ф. И. О. больного, возраст, № и. б., диагноз:
Показатели
рН G,34—7,44)
рСО2 C4—44 мм рт. ст.)
ВВ D0—60 мэкв/л)
sB B1—24 мэкв/л)
АВ A8—22 мэкв/л)
BE (±2,3 мэкв/л)
рО2 (80—100 мм рт. ст.) арте-
рия
рОг C5—45 мм рт. ст.) вена
НЬО2 (92—98%) артерия
НЬО2 E0—75%) вена
Сумма органических кислот
(9—12 мэкв/л)
Лактат F—12 мг%)
Пируват @,4—0,6 мг%)
Дата, час
22 Заказ № 1266
329
Лаборатория экспериментальной физиологии по оживлению организма АМН СССР
Центр реанимации. Биохимический анализ крови и мочи.
Ф. И. О. больного, возраст, № и. б., диагноз:
Показатели
Дата, час
НЬ A3—14г%)
Ht C6—42 ед.)
Эритроциты D 400 000—5 150 000)
Общий белок F—8 г%)
Мочевина A5—20 мг%)
Калий пл. D—5 мэкв/л)
Калий зритр. (80—90 мэкв/л)
Натрий пл. A30—140 мэкв/л)
Натрий эритр. (8—20 мэкв/л)
Хлор крови (80—90 мэкв/л)
Хлор эритр. E0—60 мэкв/л)
Кальций крови E—6 мэкв/л)
Магний крови A,4—2,3 мэкв/л)
ОЦК F0—75 мл/кг)
ОЦП D0—45 мл/кг)
ОЦЭр. B0—30 мл/кг)
Количество мочи A,5—2 л)
Уд. вес A016—1022)
рН (Ср. 6,2)
Калий B—3 г)
Натрий D—6 г)
Хлор E—8 г)
травмой, полирадикулоневритом и др.). Средняя продолжительность
пребывания больного в отделении 6—8 сут (по литературным данным,
в различных отделениях 6—10 сут).
В среднем нагрузка в отделении в день составляет 13—14 больных.
Средняя занятость койки составляет 64—68%. По данным большинства
авторов, она колеблется от 36 до 65%. Такая относительно низкая заня-
тость объясняется необходимостью иметь резервные места для посту-
пающих больных. Стремиться к увеличению загруженности отделения
путем госпитализации в него больных, не нуждающихся в реанимацион-
ной помощи, недопустимо. Смертность составляет от 34,2 до 37,1% (по
литературным данным, смертность в отделениях реанимации в зависи-
мости от их профиля ^колеблется от 25 до 50%) (Т. П. Вельская и др.,
1969; Д. |К. Я3^коЬ и др., 1961; Huguenard, 1965, и др.). От 50 до 52%
всех умерших погибают в первые сутки от момента поступления от не-
устранимых причин или в результате нераспознанных осложнений. На
эту же группу больных приходится наибольшее число расхождений кли-
нико-анатомическйх диагнозов;
Оч^нь сложны и до конца не решены вопросы о показаниях к пере-
воду бол^ырс в отделение реанимации и из него в обычные отделения
по профилю !пат;ологий. ,
Таблица 11
Состав больных, поступивших в отделение реанимации Московской клинической
больницы имени С. П. Боткина A971)
Этиология терминальных состояний
1. Множественная тяжелая травма
2. Тяжелая черепно-мозговая травма
3. Заболевания головного мозга
4. Массивная кровопотеря (внематочная беременность,
желудочно-кишечные и другие кровотечения)
5. Острая сердечная недостаточность (инфаркт миокарда;
пороки сердца и др.)
6. Острая дыхательная недостаточность (пневмония, брон-
хиальная астма, эмболии легочной артерии и др.)
7. «Острый живот» (перитонит, панкреонекроз, тромбоз
мезентериальных сосудов)
8. Интоксикация (барбитураты, уксусная кислота, боту-
лизм и т. д.)
9. Акушерская патология (эклампсия, острая печеночная
недостаточность и др.)
10. Асфиксия
11. Диабетическая кома
12. Сепсис
13. Прочие (электротравма, ожоги, утопления и т. д.)
Всего больных . . .
Всего больных
94
69
54
83
132
35
91
45
18
27
12
7
25
692
Процент
13,58
9,97
7,80
11,99
19,08
5,06
13,16
6,50
2,60
3,90
1,73
1,01
3,61
100,0
В первую очередь в отделение реанимации общего профиля следует
помещать больных с множественной травмой и острыми внезапно воз-
никшими и угрожающими жизни заболеваниями.
Госпитализации в отделение подлежат больные, у которых в данный
момент нет нарушений витальных функций, но, судя по характеру травмы
или заболевания, такие нарушения могут возникнуть в ближайшее
время.
Состояния и виды патологии, требующие помещения больного в ре-
аниматологический стационар, могут быть следующими:
1. Острая сердечная недостаточность, особенно отек легких, острые
нарушения ритма, полная поперечная блокада сердца с приступами
Морганьи — Эдемса — Стокса, не поддающиеся консервативной терапии.
2. Острые нарушения периферического кровообращения (коллапс,
травматический шок, кровопотеря, так называемый кардиогенный шок
и др.).
3. Острые нарушения дыхания, которые требуют или в ближайшее
время могут потребовать активного вмешательства: дренирования ды-
хательных путей, искусственной вентиляции легких и др.
4. Острые нарушения метаболизма (белкового, углеводного, элек-
тролитного, водного). Нарушения кислотно-щелочного равновесия.
5. Острая печеночная и почечная недостаточность, особенно при на-
личии в отделении аппаратуры для гемодиализа.
22*
331
6. Коматозные состояния, сопровождающиеся нарушением виталь-
ных функций (в первую очередь тяжелая черепно-мозговая травма,
гипо- и гипергликемическая кома и др.).
7. Восстановительный период после агонии и клинической смерти.
8. Тяжелые отравления, не поддающиеся быстрому и стойкому ку-
пированию антидотной терапией.
Отказ в приеме больного может быть обусловлен полной беспер-
спективностью лечения (злокачественные опухоли, кровоизлияние в
мозг с прорывом в желудочки, достоверно установленная смерть мозга)
(см. главу XVIII), отсутствием необходимой аппаратуры (чаще всего
респираторов и кардиостимуляторов) и персонала, а при инфекцион-
ном заболевании — опасностью для остальных больных, если нет усло-
вий для надежной изоляции больного. Поэтому врач, сопровождающий
тяжелобольного, должен связаться по телефону или радио с отделения-
ми реанимации и выяснить, куда лучше поместить данного больного.
При современных способах транспортировки больной должен быть до-
ставлен не в ближайшую больницу, а туда, где ему будет оказана наи-
более квалифицированная помощь. Перевод больного в другое отделе-
ние может быть осуществлен только после стойкого восстановления
гемодинамики и спонтанного дыхания и коррекции метаболических
нарушений, когда нет необходимости в дальнейших ежедневных транс-
фузиях, дренировании дыхательных путей и других специальных меро-
приятиях. Мы неочитаем правильной тенденцию к сокращению ,койко-дня
за счет перевода больных в другие отделения через несколько часов
после нормализации артериального давления или восстановления внеш-
не адекватного самостоятельного дыхания, но не можем и согласиться
с наметившимся в последние годы стремлением некоторых врачей отка-
зывать в переводе больных в свои отделения, несмотря на отсутствие
показаний к реанимационным мероприятиям.
Лечебный процесс в отделениях реанимации требует применения
большого количества разнообразных лекарственных препаратов, в пер-
вую очередь трансфузионных сред. В среднем на 1 больного за время
лечения расходуется от 0,5 до 1,1 л крови, от 0,35 до 0,8 л полиглюкина,
0,13—0,3 кг плазмы, 0,55—0,75 л гидролизных белковых препаратов
и т. д. Велик также расход белья и перевязочных материалов — на
отделение в 20 коек он равен расходу в общехирургическом отделении
на 150 коек.
Каждый центр реанимации общего профиля (республиканский, обла-
стной, краевой) является не только лечебным, но и организационно-
методическим учреждением, проводящим обучение врачей и медицин-
ских сестер различных специальностей путем лекций, занятий, обучения
на рабочих местах. Большая роль в этом принадлежит выездным брига-
дам, которые пропагандируют методы реанимации в лечебных учреж-
дениях. Необходимо также обучение приемам экстренной реанимации
лиц немедицинских специальностей, чья работа связана с большим рис-
ком, а также спортсменов и школьников.
XX
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ОБУЧЕНИЮ ДОВРАЧЕБНЫМ
МЕТОДАМ РЕАНИМАЦИИ
Возникновение терминальных состояний, требующих немедленного
оказания эффективной реанимационной помощи в течение первых минут
после несчастного случая за пределами лечебных учреждений — нередкое
явление. Происходит это часто в отсутствие медицинских работников.
Анализ оказанной на месте происшествия помощи показал, что лица
немедицинских профессий, да нередко и медицинские работники до сих
пор еще плохо владеют простыми, но эффективными приемами восста-
новления дыхания и кровообращения. Они часто применяют хорошо
известные, но малоэффективные, а иногда и вредные приемы. В резуль-
тате всего этого выживаемость больных и пострадавших, перенесших
клиническую смерть во внебольничной обстановке, значительно ниже
E—18%) (Askanasa, 1968; Paulsen, Zysgaard, 1968; Poulsen, 1971), чем
в случаях ее возникновения в стационаре G,5—37%) (В. А. Неговский,
1966; Benfield, 1968; Selinger, 1969),
В связи с этим на протяжении последнего десятилетия во всех стра-
нах мира предпринимается попытка обучить всех граждан простым
методам реанимации. Чрезвычайно важное значение для практики здра-
воохранения нашей страны также имеет по возможности более широкое
распространение приемов реанимации среди населения (Б. В. Петров-
ский, 1972). В настоящее время определенная работа проведена лишь
среди организованной части населения (В. А. Неговский, 1966; Poulsen,
1971; Kaminski, 1972). Предстоит еще провести колоссальную работу по
обучению методам реанимации; она выполнима лишь при условии, что
каждый медицинский работник сам в совершенстве овладеет этими прие-
мами и сможет выступить в качестве инструктора-преподавателя в лю-
бом коллективе слушателей, начиная со школьников.
К сожалению, далеко не все врачи в настоящее время способны
выполнить эти требования, хотя и имеются определенные положитель-
ные сдвиги по сравнению с 1966 г., когда среди проверенных нами
789 медицинских работников 47% получили неудовлетворительную
оценку за выполнение методики экспираторной искусственной вентиля-
ции легких и 63% —по непрямому массажу сердца. При этом было выяв-
лено, что показатели эффективности проводимых реанимационных меро-
приятий оказались лучше в группе фельдшеров и медицинских сестер,
чем в группе врачей. Знание этих приемов, умение их при-
333
менять на практике, а также обучать других должно
стать обязательным для всех медицинских работни-
ков. Так, например, в Латвийской ССР введено правило занесения
результатов ежегодных проверок знаний методов реанимации в специ-
альный вкладыш трудовой книжки медицинского работника.
Мы разработали единую программу обучения методам реанимации,
состоящую из: 1) теоретических занятий, касающихся сущности умира-
ния, нарушений обменных процессов в организме, ведущего значения
кислорода, а также о путях попадания кислорода в организм и выделе-
ния углекислого газа. На основе изложенного подчеркивалось исключи-
тельно большое значение в реанимации своевременного применения ме-
тодов, устраняющих гипоксию и гиперкапнию тканей — массажа сердца
и искусственной вентиляции легких; 2) демонстрации диапозитивов и ки-
нофильмов, в которых показаны способы восстановления проходимости
дыхательных путей, методики проведения экспираторной искусственной
вентиляции легких и непрямого массажа сердца; 3) практического обу-
чения, во время которого каждый слушатель должен либо на товарище,
либо на манекене практически усвоить приемы искусственного дыхания
и массажа сердца.
Попытаемся подробнее охарактеризовать каждую из упомянутых
выше ступеней обучения населения методам реанимации. Опыт показы-
вает, что число слушателей во время теоретического изложения мате-
риала практически может быть неограниченным. Однако для практиче-
ского усвоения методов следует ограничить число обучаемых до 20—30
A0—15 пар) на одного инструктора-преподавателя, поскольку обучение
одного человека в среднем занимает 5—10 мин. При этом мы убедились,
что наиболее рациональной формой организации процесса обучения яв-
ляется следующая: в аудиторию примерно на 200 слушателей (спортив-
ный зал, зал клуба и т. п.) прибывает группа инструкторов (анестезио-
логи, реаниматологи) в 8—10 человек. Руководитель группы читает лек-
цию (около 45 мин), сопровождая ее демонстрацией таблиц, муляжей и
цветных диапозитивов. Затем демонстрируется 30-минутный кинофильм
(например, «Пульс жизни»), после чего лектор отвечает на вопросы
слушателей. Далее всех слушателей, которые уже проинформированы
о предстоящей методике обучения, разделяют на группы (желательно
по 20 человек), и каждая группа со своим инструктором занимает в
аудитории определенное место. Для каждой группы слушателей должна
быть заранее приготовлена кушетка или подходящего размера матрац
для гимнастики. При такой подготовке эффективное обучение как теоре-
тическое, так и практическое, например, 200 слушателей, занимает от 3
до 4 ч. При отсутствии возможности обеспечить явку упомянутой группы
инструкторов для параллельного проведения практических занятий целе-
сообразно все же теоретическую часть обучения осуществлять одновре-
менно с максимально возможным числом слушателей. После этого со-
ставляется и оглашается график проведения практических занятий (по
дням и часам).
Работа по подготовке популярной лекции относительно оказания не-
отложной помощи при терминальных состояниях обычно не представляет
334
трудности для медицинского работника. За последние годы опубликова-
но значительное число работ, посвященных данной проблеме. Тем не
менее следует напомнить, что на этой лекции независимо от состава
аудитории (медицинские работники, люди других профессий или школь-
ники) должны обязательно решаться две задачи.
Во-первых, необходимо добиться того, чтобы любой слушатель понял,
что реанимационная помощь при терминальных состояниях должна быть
оказана немедленно. Именно от его знаний и тактики будет зависеть окон-
чательный исход несчастного случая. Мать должна при этом помнить о
своем ребенке, тренер — о своих учениках, работник ГАИ — о постра-
давшем в аварии и т. д. Ожидать приезда работников скорой медицин-
ской помощи не в дверях и не у телефона, а проводя общедоступные
методы реанимации — таково требование науки об оживлении организ-
ма. К сожалению, пока это соблюдается непростительно редко.
Во-вторых, в любой лекции по рассматриваемой теме должны содер-
жаться данные теоретического обоснования преподаваемых методик.
Нужно также напомнить о бессмысленности проведения искусственной
вентиляции легких без массажа сердца в случаях остановки кровообра-
щения. Следовательно, при остановке дыхания нужно сразу после осу-
ществления нескольких искусственных вдохов (вдуваний) проверить
ширину зрачков и наличие или отсутствие пульсации на магистральных
артериях (сонных, бедренных), отсутствие сознания, спонтанного дыха-
ния, пульса на сонных артериях, расширенные зрачки больного или
пострадавшего —- всего этого в совокупности совершенно достаточно,
чтобы немедленно начинать непрямой массаж сердца и искусственное
дыхание. В данной части лекции следует кратко разъяснить основные
причины полного отказа или значительного ограничения использования
так называемых ручных способов искусственной вентиляции легких
(столь популярных в недалеком прошлом). Нужно еще раз напомнить
о низкой эффективности отмеченных методов — малых объемов газооб-
мена, несостоятельности методов устранения быстро развивающегося
ателектаза легких, об отсутствии рефлекторной стимуляции дыхатель-
ного центра продолговатого мозга. В то же время необходимо обосно-
вать преимущества экспериментального метода вентиляции и обратить
внимание слушателей на пригодность выдыхаемого воздуха реаниматора
для повторного использования в газообмене больного. Как известно,
содержание кислорода и углекислого газа в этом воздухе может варьиро-
вать в силу ряда обстоятельств (от глубины вдоха перед выдохом, от
физического напряжения реаниматора и др.)> тем не менее содержание
этих газов при гипервентиляции у реаниматора A6—18% кислорода и
2—4% углекислого газа) вполне позволяет осуществлять газообмен в
легких пострадавшего (Elam, 1958; Noviant, 1961; Lind, 1961; Safar,
1958).
Наши исследования содержания этих газов в выдыхаемом воздухе
272 практически здоровых людей, проведенные при помощи тренировоч-
ного манекена «Оживленная Анна» (Resusci Anne) и электрофизического
спирометра «Spirolyt», согласуются с приведенными данными авторов.
На 5-й мин проведения искусственной вентиляции легких способом «изо
335
рта в рот» в выдыхаемом воздухе реаниматора содержалось 17,08%
кислорода и 3,52 % углекислоты.
Клинические наблюдения, проведенные нами на 60 больных в воз-
расте от 18 до 67 лет, находившихся в состоянии хирургического неинга-
ляционного наркоза и миорелаксации, доказали возможность обеспече-
ния насыщения крови больного кислородом с помощью экспираторной
искусственной вентиляции легких. Применение специального аппарата,
состоящего из пары «оксфордских мехов» и системы клапанов, позволя-
ющей обеспечить постоянство объемов вентиляции, дало возможность
провести сравнительный анализ эффективности вентиляции при исполь-
зовании выдыхаемого и атмосферного воздуха.
При одинаковых режимах искусственной вентиляции легких приме-
нение выдыхаемого реаниматором воздуха приводит к незначительной
гиперкапнии (рСО2 47,47±0,39 мм рт. ст.). Насыщение крови кислородом
при этом значительно не меняется.
Обеспечение проходимости
дыхательных путей
Важнейшей задачей при искусственной вентиляции легких следует
считать восстановление и обеспечение проходимости дыхательных путей.
Уместно напомнить, что основной причиной несостоятельности проведе-
ния искусственной вентиляции легких у тренировочного манекена явля-
лось как раз отсутствие этой проходимости. Демонстрация муляжей, диа-
позитивов и рентгеновских снимков облегчает преподавание этого раз-
дела. Слушатели, таким образом, наглядно убеждаются в том, что самая
частая причина закупорки дыхательных путей — это западение корня
языка и надгортанника, происходящее в результате расслабления жева-
тельных мышц и перемещения нижней челюсти в бессознательном со-
стоянии. Этому способствует наклонение головы больного вперед, при-
водящее в 100% случаев к полной обтурации дыхательных путей (Sa-
far, 1959) (рис. 33). Со времени применения хирургического наркоза
были предложены различные способы предупреждения и устранения
данного осложнения, способного в кратчайший срок привести больного в
состояние тяжелейшей гипоксемии и гиперкапнии: 1) выдвигание вперед
и поддерживание нижней челюсти за ее восходящие отростки; 2) выдви-
гание вперед и поддерживание нижней челюсти за передние зубы;
3) запрокидывание головы (наклонение назад за счет вращения в атлан-
то-затылочном суставе и изгиба шейного отдела позвоночника); 4) при-
менение искусственных воздуховодов.
Первый и второй способы оказались малоприемлемыми при необхо-
димости осуществления искусственной вентиляции легких (как экспира-
торным, так и масочным методом). Кроме того, было трудно обучить им
немедицинскую часть населения. В соответствии с этим с 1958 г. в разных
странах (особенно в Дании и США) стали изучать влияние запрокиды-
вания головы на проходимость верхних дыхательных путей. Многочис-
ленными работами, преимущественно рентгенологическими методами на
наркотизированных (с применением миорелаксантов) добровольцах,
336
Рис. 33. Верхние дыха-
тельные пути у человека
в бессознательном со-
стоянии (муляж). Пол-
ная закупорка верхних
дыхательных путей кор-
нем языка.
Рис. 34. Верхние дыха-
тельные пути у человека
в бессознательном со-
стоянии при максималь-
но запрокинутой голове
(муляж). Пространство
между корнем языка и
задней стенкой глотки
полностью проходимо.
было доказано, что этот способ имеет бесспорные преимущества по срав-
нению с первыми. Наилучший эффект достигается запрокидыванием го-
ловы в сочетании с подтягиванием и прижатием нижней челюсти к верх-
ней (Ruben e. а., 1961; Morikawa, 1961). Именно этот метод нашел самое
широкое применение в клинической практике (рис. 34). Тем не менее лю-
бой инструктор должен знать, что в ряде случаев могут иметь место на-
рушения проходимости дыхательных путей, несмотря на запрокидывание
головы пострадавшего и прижатие его подбородка. Причин для этого
несколько. Во-первых, при выдвигании и прижатии подбородка, осуще-
ствляемом одной рукой реаниматора, а также при герметизации наркоз-
но-дыхательной маски к лицу больного, рот часто закрывается. Следова-
тельно, дыхание у больного должно осуществляться лишь через нос, но
337
ходы последнего могут быть заложены. Во-вторых, при положении
пострадавшего на спине вдуваемый ему через нос воздух обычно легко
достигает альвеол, однако выдох может оказаться затрудненным ввиду
клапанного эффекта мягкого неба (в связи с этим нужно непременно
научиться освободить ротовое отверстие пострадавшего в момент выдо-
ха!). В-третьих, в отдельных случаях (от 1 до 5%) корень языка и над-
гортанник вызывают обтурацию воздухопроводящих путей, несмотря на
применение описанного комбинированного приема, в результате чего со-
храняется либо частичная, либо полная их закупорка (Г. Н. Андреев,
А. Я. Зирнис, 1967; Ruben e. а., 1959; Safar e. а., 1959). В таких случаях,
очевидно, оправдано применение специальных воздуховодов, вводимых
через нос или через рот больного. Однако хотя конструкция многих воз-
духоводов (например, трубки Сафара) весьма простая, их применение
вряд ли допустимо немедицинскими работниками. Такая осторожность
диктуется результатами наших исследований относительно трудностей
определения правильной глубины введения трубки в глотку больного.
Медицинские работники должны знать, что оптимальная проходимость
дыхательных путей будет обеспечена в результате применения воздухо-
вода лишь в том случае, если дистальный конец трубки будет введен за
надгортанник и будет находиться непосредственно у входа в гортань.
При недостаточно глубоком введении воздуховодов закупорка дыха-
тельных путей корнем языка не устраняется; чересчур глубокое введение
приводит к попаданию дистального конца воздуховода в пищевод. Кроме
того, ввиду наличия перпендикулярного среза дистального конца боль-
шинства воздуховодов их продвижение за и под надгортанник больного
затруднительно. При этом сравнительно часто надгортанник отталкива-
ется воздуховодом назад и может вклиниться во вход в гортань. Слиш-
ком глубокое введение воздуховода приводит к попаданию вдуваемого
воздуха в пищевод и желудок больного, способствует регургитации
желудочного содержимого, а иногда — разрыву желудка. Вклинивание
надгортанника во вход в гортань грозит смертельной асфиксией. В ре-
зультате проведенных в течение многих лет исследований мы пришли к
убеждению, что дистальный конец воздуховода (в том числе трубки Са-
фара) должен быть изменен. Его срез вместо перпендикулярного должен
быть косым в передне-заднем направлении (рис. 35). Правильное приме-
нение такого воздуховода заключается в первоначальном введении его
в глотку поглубже, чем предполагалось, с немедленным обязательным
извлечением воздуховода наружу (примерно на 1 см). При такой мето-
дике конец введенного воздуховода попадает под надгортанник и при
некотором извлечении его надгортанник оттягивается от входа в гортань
-(рис. 36).
Осуществление
искусственной вентиляции легких
После изложения материала относительно восстановления и обеспе-
чения проходимости дыхательных путей можно перейти к разъяснению и
показу экспериментальных методов. Наглядно эта методика отражена
в соответствующих учебных фильмах, однако можно успешно использо-
338
Рис. 35. Введение S-образной трубки с косым срезом дистального
конца.
Рис. 36. Рентгенограмма и схема расположения S-образной трубки с косым
срезом дистального конца.
Рис. 37. Искусственная вентиляция легких способом «изо
рта в нос» на манекене фирмы Амбу (Дания).
Рис. 38. М некен «Ожив енная Анна»
вать приготовленные инструктором диапозитивы. Крайне желателен по-
каз метода на манекене непосредственно по ходу изложения материала.
Наибольшей мировой известностью на сегодняшний день пользуются
манекены фирмы AMBU (Дания) (рис. 37) и Асмунд Лайердал (Норве-
гия) (рис. 38) (Hossli, 1959; Dam, 1960; Elam e. a., 1961; Winchell, Safar,
1964). Практические занятия проводятся следующим образом:
1) больного укладывают горизонтально на спину;
340
Рис, 39. Открытие рта пострадавшего.
2) немедленно освобождают шею, грудную клетку и абдоминальную
область больного от давящих предметов и частей одежды (расстегивают
воротник, расслабляют галстук, поясной ремень и др.);
3) для того чтобы убедиться в проходимости верхних дыхательных пу-
тей, открывают рот (часто при этом нужно использовать силу давления
первых пальцев обеих рук) (рис. 39), быстро осматривают его полость.
При наличии жидкости, инородных тел полость рта освобождают от них;
4) после того как принято положение сбоку от пострадавшего (сто-
рона не имеет значения), реаниматор берет одной рукой подбородок,
и другую руку кладет на теменную область головы больного и при по-
мощи обеих рук запрокидывает голову последнего (рис. 40). При запро-
кидывании головы больного не следует применять много силы (особен-
но в случаях травмы мозга).
Дальнейшие действия реаниматора зависят от избранного им приема
проведения искусственной вентиляции легких «изо рта в рот» или «изо
рта в нос». Ряд авторов предпочитают второй метод, мотивируя это сле-
дующими доводами:
а) носовые ходы являются физиологическими путями дыхания, и они
реже обтурируются;
б) при вентиляции через нос вдуваемые газы легче проникают в тра-
хею и меньше в пищевод по сравнению с вдуванием через рот (Ruben,
1961);
5) при дыхании методом «изо рта в нос» реаниматор закрывает рот
пострадавшего I или II пальцем руки, обеспечивающей прижатие под-
бородка. Следует обратить внимание на то, чтобы палец, прикрывающий
рот, не препятствовал герметизации носовых отверстий губами реани-
матора;
341
6) непрерывно поддерживая
голову пострадавшего в запроки-
нутом положении, реаниматор по
возможности выпрямляется и де-
лает глубокий вдох;
7) на мгновение задерживая
выдох, реаниматор наклоняется и
губами охватывает нос пострадав-
шего (рис. 41). Дыхательные от-
верстия могут быть предваритель-
но прикрыты носовым платком,,
марлей или другой воздухопрони-
цаемой тканью;
8) оказывающий помощь дела-
ет быстрый, достаточно сильный
выдох, вдувая при этом выдыхае-
мый воздух в дыхательные пути и
легкие пострадавшего (рис. 42).
В момент вдувания воздуха (не
превышающий 1 с) реаниматор
неотрывно наблюдает за экскур-
сией грудной клетки пострадав-
шего. Это нужно для того, чтобы
убедиться в попадании вдуваемо-
го воздуха в легкие больного, а
также чтобы иметь представле-
ние о необходимом объеме вдува-
ния. В случае отсутствия экскур-
сий грудной клетки и (или) перед-
ней брюшной стенки искусствен-
ная вентиляция не может быть
признана эффективной и следует выяснить причину (плохая герметиза-
ция между ртом реаниматора и носом пострадавшего, недостаточный
объем вдуваемого воздуха, не восстановлена проходимость дыхательных
путей, выраженная ригидность грудной клетки и др.);
9) сразу же после завершения вдувания собственного выдыхаемого
воздуха и достижения расширения грудной клетки пострадавшего реа-
ниматор резко прекращает вдувание и освобождает рот и нос больного
(рис. 42). Можно даже рекомендовать приподнять палец, прикрываю-
щий рот, несколько ранее в момент вдувания последней порции воздуха.
Выходящий при этом через рот воздух способствует началу самостоя-
тельного выдоха пострадавшим. Выдыхаемый пострадавшим воздух
(выдох осуществляется в результате предшествующего повышения внут-
рилегочного давления, эластичности легких и грудной клетки) обычно
поступает в атмосферу через рот. Выяснено, что при положении больного
на спине мягкое небо препятствует осуществлению выдоха через нос.
Следует строго следить за тем, чтобы продолжительность выдоха у
пострадавшего примерно вдвое превышала продолжительность вдувания
Рис. 40. Положение рук реаниматора во
время запрокидывания головы пострадав-
шего.
342
Рис. 41. Вдувание выдыхаемого воздуха в нос пострадавшего
Рис. 42. Положение рук реаниматора во время выдоха пострадавшего.
(соотношение 1:2). Иначе выдох у пострадавшего не будет полноцен-
ным в отношении выведения углекислого газа. На протяжении выдоха
пострадавшего реаниматор выпрямляется и, наблюдая за спадением
грудной клетки у пострадавшего, делает 1—2 нормальных вдоха и вы-
доха, отдыхая от нежелательных последствий собственной преднаме-
ренной гипервентиляции;
343
10) увидев, что приподнятая предшествующим вдуванием грудная
клетка у пострадавшего заканчивает экскурсию при выдохе, реаниматор
вновь делает глубокий вдох, перекрывает пальцем рот пострадавшего,
наклоняется вперед и осуществляет очередное вдувание воздуха. Циклы
вдувания повторяются 12—18 раз в минуту.
В случае проведения искусственной вентиляции методом «изо рта в
рот» реаниматор большим и указательным пальцем руки, находящейся
на лобной области пострадавшего, перекрывает его носовые отверстия.
Второй рукой, поддерживающей нижнюю челюсть, он слегка открывает
рот больного. Губами герметизируется область рта пострадавшего. В от-
личие от ранее рассматриваемого способа в данном случае нос у боль-
ного может оставаться прикрытым и во время фазы выдоха.
Следует также пояснить слушателям, что в случае искусственной
вентиляции маленьких детей реаниматор охватывает своими губами рот
и нос ребенка и осуществляет вдувание сразу через все дыхательные от-
верстия.
Преимуществом обучения экспираторному методу искусственной вен-
тиляции легких на манекенах является возможность оценки количества
вдуваемого воздуха. Для этой цели манекену «Оживленная Анна» при-
дан специальный манометр. При попадании в «легкие» манекена воздуха
в объеме 1—1,5 л стрелка манометра перемещается в зеленый сектор.
На датском манекене вдувание избыточного количества воздуха приво-
дит к открытию специального клапана и раздуванию «желудка». В своей
работе мы использовали также и портативный респирометр Райта
(Wright) и мановакуумметр.
При смене обучаемых следует протереть спиртом «лицо» манекена и
•сменить марлевую салфетку. Необходимо обратить внимание на то, что-
бы обучаемые предварительно вымыли руки, сняли губную помаду, так
как ликвидировать любое загрязнение пластмассы чрезвычайно трудно.
У датского манекена лицевая часть головы съемная и ее можно стерили-
зовать.
Какими бы положительными качествами ни обладала методика пре-
подавания и обучения способам вентиляции на манекенах, следует при-
знаться, что большую ценность имеет разработка методики, позволяющей
обходиться при помощи простейших приспособлений. Согласно нашему
опыту, таким общедоступным приспособлением является резиновый ме-
шок емкостью около 1000 мл, например, камера волейбольного мяча,
которая часто употребляется для дыхательной гимнастики. Обучаемых
распределяют попарно. Каждый в паре побывает в роли как пострадав-
шего, так и реаниматора. Инструктор предварительно информирует
присутствующих об особенностях такого способа обучения. Потом «по-
страдавший» ложится на кушетку и «реаниматор» приступает к оказа-
нию помощи. Инструктор непременно располагается у головы «постра-
давшего» с противоположной стороны от «реаниматора». Последний
проводит весь цикл, изложенный в пп. 1—10, т. е. расстегивает воротник,
поясной ремень; проверяет наличие или отсутствие пульса на сонных ар-
териях, ширину зрачков; запрокидывает голову «пострадавшего» и при-
крывает пальцем рот, предварительно накрытый марлевой салфеткой.
344
После осуществления глубокого вдоха и наклонения над лицом «по-
страдавшего» «реаниматор» охватывает губами мундштук дыхательного
мешка (вместо носа пострадавшего!), поддерживаемого инструктором на
уровне носовых отверстий «пострадавшего», и резко производит выдох,
вдувая воздух в мешок. В этот момент «пострадавший» осуществляет
глубокий вдох, чтобы создать впечатление, что форсированное расши-
рение его грудной клетки является результатом вдувания выдыхаемого
«реаниматором» воздуха в его дыхательные пути. После раздувания
мешка «реаниматор» поступает согласно п. 9. В это время «пострадав-
ший» осуществляет медленный выдох, а инструктор опорожняет дыха-
тельный мешок. Далее все повторяется до полного усвоения методики.
Особое внимание уделяется непрерывному запрокидыванию головы «по-
страдавшего», ритмическому перекрытию и освобождению его ротового
отверстия, быстроте и объему раздувания дыхательного мешка, соотно-
шению фаз вдувания и выдоха.
Еще раз напоминаем, что активное участие «пациента» в имитации
фактора раздувания его легких и медленного выдоха крайне важно,
несмотря на то что это приводит у него к некоторой гипокапнии и голо-
вокружению.
Осуществление
непрямого массажа сердца
Изложение теоретической части материала (лекция, кинофильм, диа-
позитивы) должно дать слушателю необходимую информацию о роли
кровообращения в транспорте кислорода, насосной функции сердца и
последствий остановки кровообращения, а также о диагностике этой
остановки. После повторения основной задачи реанимации, заключаю-
щейся в необходимости доставки кислорода клеткам организма, перехо-
дят к изложению методики непрямого массажа сердца. Поскольку при
непрямом массаже сердца оказывающий помощь должен обеспечить ис-
кусственную систолу и диастолу сердца, достигаемые в результате сжа-
тия сердца между грудиной и грудными позвонками, то, естественно, он
обязан знать некоторые анатомические данные о строении грудной
клетки, а также иметь представление о механизмах восстановления кро-
вообращения, возможных ошибках и осложнениях. В отличие от экспи-
раторной вентиляции легких, неправильным применением которой труд-
но повредить больному, неумело выполненный массаж сердца, как пра-
вило, приводит к различным осложнениям (перелому ребер и ранению
легких или сердца, перелому грудины, разрыву печени, селезенки, же-
лудка). Поэтому некоторые реаниматологи сомневаются в целесообраз-
ности преподавания данного метода реанимации населению. Однако
практика показывает, что и люди без медицинского образования могут
правильно и эффективно проводить непрямой массаж, но нужно согла-
ситься, что учить их этому должны хорошо подготовленные инструкторы-
медики (Winchell, Safar, 1966).
Переходим к изложению последовательности проведения непрямого
массажа сердца, которому, по нашему убеждению, одинаково эффектив-
23 Закаа № 1266 345
3. Место соприкосновения ладонной поверхности луче-запяст-
ного сустава и грудины.
но можно учиться как на тренировочном манекене, так и на ненаркоти-
зированном человеке. В последнем случае нужно категорически требо-
вать соблюдения строжайшей дисциплины как со стороны проводящего
массаж, так и со стороны «пострадавшего».
1. Пострадавшего укладывают на твердую основу (на спине)—на
землю, носилки, скамью, топчан и т. п.
2. Проверяют, расстегнут ли поясной ремень, так как в противном
случае массаж приведет к травме печени.
3. После расстегивания верхней одежды реаниматор при помощи обе-
их рук быстро определяет длину грудины пострадавшего: пальцами од-
ной руки прощупывают на его шее верхний конец грудины (яремную
ямку), второй рукой прощупывают нижний конец грудины пострадавше-
го. Расстояние между обеими руками делят пополам (см. рис. 38).
4. Часть ладони (около луче-запястного сустава) одной руки кладут
непосредственно ниже (в сторону ног) от выявленной середины грудины
пострадавшего. Ладонь второй руки помещают на первую. Пальцы рук
должны быть приподняты и не соприкасаться с грудной клеткой постра-
давшего (рис. 43, 44).
5. Реаниматор становится по возможности стабильно, наклоняясь
настолько, чтобы его плечевой пояс, верхние конечности совпадали с са-
гиттальной плоскостью пострадавшего. Иными словами, руки реанима-
тора должны быть перпендикулярны по отношению к поверхности груд-
ной клетки пострадавшего. (Неоднократно приходилось видеть, когда
даже врачи под этим ошибочно понимают положение, при котором их
глаза находятся непосредственно над грудиной пострадавшего.) Только
при таком положении рук реаниматора можно обеспечить строго верти-
кальный толчок на грудине, приводящий к сдавлению сердца. Следует
346
Рис. 44. Положение рук реаниматора на грудине пострадавшего (вид
сбоку).
разъяснить слушателю и обучаемому, что любое другое расположение
рук реаниматора на грудной клетке пострадавшего (слева от грудины,
выше средней ее линии, на уровне мечевидного отростка и т. п.) совер-
шенн© недопустимо, неэффективно и опасно (в том числе поперечное
положение ладонного сустава по отношению к оси грудины, как это не-
правильно изображено на рисунках некоторых изданий).
6. После этого можно приступать к осуществлению массажа. Однако
если обучение проводится на человеке, то прежде чем начинать массаж,
инструктор обязан напомнить обоим занимающимся о следующем:
а) массаж разрешен лишь после осуществления «пострадавшим» глу-
бокого вдоха;
б) в течение серии толчков (не более 5) «пострадавший» ни в коем
случае не должен препятствовать выходу небольшой порции выдыхаемо-
го воздуха при каждом толчке на его грудине. В противном случае «по-
страдавший» во время массажа будет испытывать распирающую боль за
грудиной;
в) продолжать массаж после совершения полного выдоха нельзя, «по-
страдавший» должен снова глубоко вздохнуть;
г) сила, приложенная к осуществлению толчка, не должна быть чрез-
мерной. Достаточно, если толчок перемещает грудину человека, находя-
щегося в сознании, всего на 1,5—2 см по направлению к позвоночнику.
При этом отчетливо слышен короткий непроизвольный выдох.
В сомнительных случаях инструктор предварительно кладет свою
руку на грудину «пострадавшего» и заставляет в таком виде начинать
массаж. При излишне сильном толчке он сможет амортизировать послед-
ний и потом поправить «реаниматора».
23*
347
Толчок при массаже должен быть без удара, но быстрый и с момен-
тальным прекращением давления при достижении желаемого углубления
грудной клетки. Следует помнить, что в терминальных состояниях, когда
тонус всех скелетных мышц значительно снижен, амплитуда экскурсий
грудной клетки при массаже сердца весьма значительная при сравни-
тельно несильном давлении. Рекомендуемое перемещение грудины в зад-
нем направлении у взрослого на 4—5 см достигается легко (как прави-
ло, силой, которая при ранее изложенной методике тренировки обеспе-
чит необходимый эффект).
Во время фазы прекращения давления руки «реаниматора» ни в коем
случае не должны препятствовать расширению грудной клетки до исход-
ных размеров, так как при этом должна произойти диастола массируе-
мого сердца. Данные хронометрии показывают, что продолжительность
фазы расширения грудной клетки примерно вдвое больше, чем активное
ее сжатие.
Положение рук на грудине остается тем же и в случае массажа серд-
ца у детей. Меняются лишь способ и сила осуществляемого толчка. Де-
тям старшего возраста массаж проводят одной рукой, новорожденным
и годовалым младенцам — кончиками 1—2 пальцев.
Во время обучения на манекенах представляется возможным судить
об эффективности массажа по манометру. Показателями производитель-
ности массажа, проведенного в истинных условиях на человеке, Служат:
появление пульсации сосудов и подъем артериального давления, порозо-
вение окраски кожных покровов (особенно лица) пострадавшего, суже-
ние зрачков, появление самостоятельных вдохов, вначале типа агональ-
ных, и, наконец, сердечной деятельности.
Продолжать реанимационные мероприятия следует в зависимости от
их эффективности. Если признаков жизни нет или они исчезли, несмотря
на весь комплекс (проведенных) реанимационных мероприятий, массаж
сердца и искусственное дыхание можно прекратить через 20—25 мин.
Если признаки эффективности реанимационных мероприятий непре-
рывно усиливаются, весь лечебный комплекс следует продолжать, хотя
бы и несколько часов, до восстановления сердечной деятельности. При
восстановлении эффективной сердечной деятельности массаж сердца
должен быть прекращен, но искусственное дыхание необходимо продол-
жать до восстановления сознания.
Самые частые ошибки при проведении экстренных реанимационных
мероприятий заключаются в перерывах в массаже сердца и раннем прек-
ращении искусственной вентиляции легких.
После усвоения методики непрямого массажа сердца и экспираторной
вентиляции легких можно приступить к завершающему этапу, т. е. к
поочередному применению обоих методов. «Реаниматор» должен осуще-
ствить одно вдувание в «легкие» манекена и проводить сразу после этого
4—5 надавливаний на грудину. Если обучение проводится на человеке,
то следует придерживаться такого же соотношения: одно вдувание —
4—5 надавливаний на грудину, поскольку серия, состоящая из большего
числа надавливаний, причинит боль «пострадавшему». При обучения на
манекене возможны и следующие соотношения: одним реаниматором —
848
на два вдувания 15 движений массажа сердца; двумя реаниматорами —
одно вдувание чередуется с 5 надавливаниями на грудину.
Инструктор на данном этапе преподавания уделяет особое внимание
переходу «реаниматора» от вдувания воздуха к массажу и обратно. Этот
переход следует совершать быстро, без лишних движений (только верх-
няя часть тела реаниматора наклоняется в нужном направлении), по
возможности без ходьбы. Поэтому реаниматору важно с самого начала
занять положение, оптимальное для массажа сердца. При переходе с
массажа сердца на вдувание воздуха каждый раз нужно запрокидывать
голову пострадавшего, поскольку за время массажа снова может про-
изойти обтурация дыхательных путей.
Обучение закончено. К тренировочному манекену подходит другой
слушатель, а в случае отсутствия манекена двое товарищей меняются ме-
стами. Все начинается сначала, инструктор продолжает большое, нуж-
ное и благородное дело... Но насколько прочны приобретенные знания и
навыки, имеется ли большое различие в данном вопросе среди медиков
и немедиков? Данные как наши, так и других авторов показывают, что
приобретенные навыки забываются оч^нь быстро, что заставляет (при-
мерно один раз >в год кратко .повторять обучение или ограничиться лишь
повторной проверкой знаний (Ruben е. а., 1961; Kirimli, 1969; Dob-
rov e. a., 1969).
При проверке знаний у 384 сотрудников системы «Латвэнерго», кото-
рые успешно усвоили простые методы реанимации 1—3 года назад, ока-
залось, что обученные год назад совершили меньше ошибок принципи-
ального характера, чем обученные 2 и 3 года назад. Отсюда и различные
отметки за «техничность исполнения».
Анализ выявленных ошибок показал, что за время, прошедшее со дня
основательного обучения методам реанимации, у слушателей чаще всего
забывается необходимость:
1) запрокидывания головы пострадавшего с приподниманием подбо-
родка;
2) наблюдения за экскурсиями грудной клетки у пострадавшего во
время вдувания воздуха и на выдохе;
3) определения правильного места на грудине для осуществления
массажа сердца.
ЛИТЕРАТУРА
Авдеев М. И. Курс судебной медицины. М., Госюриздат, 1959.
Агапов Ю. Я. Кислотно-щелочной баланс. М., 1968.
Адо А. Д., Богова А. В. Заболеваемость бронхиальной астмой в различных ландшафтно-
климатических зонах СССР. —«Сов. мед.», 1971, № 2, с. 47—50.
Адрианова Н. В., Самушия Ю. Л., Акимов Г. А. Неотложная помощь при аллергических
заболеваниях. М., «Медицина», 1968.
Акимов Г. А. Нервная система при острых нарушениях кровообращения. Л., «Медици-
на», 1971.
Аксельрод А. Ю. Анестезия у больных в терминальных состояниях. — В кн.: Проблемы
реаниматологии. М., «Медицина», 1969, с. 96—134.
Андреев Г. Н. Искусственное дыхание. — «Здоровье», 1969, № 3, с. 17.
Антипина Н. #., Змановский Ю. Ф., Иванов И. П. Особенности мозгового кровообраще-
ния у беременных с поздним токсикозом. — «Вопр. охр. мат.», 1968, № 10, с. 17—22.
Анестезия и реанимация при механических повреждениях и ожогах. — Материалы 3-й
конференции по анестезиологии и реаниматологии. Л., 1970.
Аршавский И. А. Очерки возрастной физиологии. М., «Медицина», 1967.
Астапенко И. И. Центральная нервная система при умирании и оживлении. — В кн.:
Основы реаниматологии. М., «Медицина», 1966, с. 178—187.
Бабский Е. Б., Ульянинский Л. С. Электрическая стимуляция сердца. М., «Медицина»,
1961.
Бакшеев Н. С, Ловинец А. С. Патогенетические основы лечения асфиксии новорожден-
ных.— В кн.: Антенатальная охрана плода. М., 1968, с. 172—181.
Барышнее Ю. И. Родовые повреждения нервной системы новорожденных детей.—
В кн.: Болезни нервной системы новорожденных. М., 1971, с. 119—162.
Вельская Т. #., Кассиль В, Л. Организация реаниматологической службы. — В кн.:
Проблемы реаниматологии. М., 1969, с. 3—28.
Березовская Е. М. Коронарное кровообращение при умирании и оживлении после кли-
нической смерти. Дисс. канд., 1969.
Беркутов А. #., Дьяченко П. К., Цыбуляк Г. Н. Главные итоги изучения шока за истек-
шие 50 лет. — «Вестн. хир.», 1967, № 9, с. 12—22.
Берман В. С. Вопросы гипотензии и кровезамещения в акушерско-гинекологической прак-
тике. — В кн.: Профилактика и лечение шоковых и терминальных состояний в акушер-
ской практике. М., 1967, с. 81—97.
Берман В. С, Шикунова Л. Г. К вопросу о частичном замещении крови при массивных
кровопотерях, вызванных акушерской патологией. — В кн.: Актуальные вопросы пере-
ливания крови и гематологии. Киев, 1967, с. 117—120.
Берман В. С., Каверина К. П., Маневич Л. Е. Особенности анестезиологическо-реанима-
ционной тактики у больных с массивной кровопотерей на фоне тяжелых токсикозов
беременности. — В кн.: Анестезия и реанимация. Л., 1968, с. 55—56.
Боголепов Н. К. Коматозные состояния. М., «Медицина», 1962.
Бондарь 3. А. Клиническая гепатология. М., «Медицина», 1970.
Бородин Ю. П. Аллергия к пенициллину и другим лекарственным препаратам. Дисс.
докт. М., 1971.
Бредикис Ю. С. Электрическая стимуляция сердца. Дисс. докт. Каунас, 1963.
Буланова О. П., Романова Я. П. Борьба с ацидозом при лечении терминальных состоя-
ний.— В кн.: Шок и терминальные состояния. Л., 1960, с. 123—130.
Буланова О. Н., Кожура В. Л. Динамика изменений кислотно-щелочного равновесия и
некоторых других показателей обмена веществ в позднем восстановительном периоде
(от 6 ч до 3 сут) после клинической смерти. — «Пат. физиол.», 1968, № 5, с. 16—20.
Буланова О. #., Закс И. О. Динамика лактата, пирувата и «избытка лактата» в вос-
становительном периоде после оживления. — «Пат. физиол.», 1972, № 5, с. 51—63.
Бунятян А. А. Методы оживления. — «Здоровье», 1969, № 5, с. 7,
Бунятян А. А., Цыбуляк В. А. Оживленная Анна. — «Здоровье», 1969, № 2, с. 9.
350
Вайсбейн С. Г. Неотложные состояния в клинике внутренних болезней. М., «Медицина»,
1966.
Василевская Н. Л. Метаболические механизмы в адаптации плода при различных фор-
мах кислородного голодания. — «Вестн. АМН СССР», 1969, № 1, с. 59—66.
Вишневский А. Л., Цукерман Б. М., Смоловский С. И. Устранение мерцательной арит-
мии методом электрической дефибрилляции предсердий. — «Клин, мед.», 1959, № 8,
с. 26—29.
Вихляева Е. М. О значении определения показателей объема крови для акушерско-
гинекологической практики. — «Акуш. и гин.», 1969, № 11, с. 7—12.
Вопросы клинической реанимации. Под ред. Б. А. Королева. Горький, 1965.
Восстановительный период после оживления. Патофизиология и терапия в эксперименте
и клинике. Труды симпозиума 25—28 ноября 1968 г., Москва. М., «Советская Россия»,
1970.
Ганелина И. Е., Бриккер В. #., Вольперт Е. И. Острый период инфаркта миокарда. Л.,
«Медицина», 1970.
Геря Ю. Ф. Применение метода искусственного кровообращения для оживления собак,
погибших от утопления в соленой воде. — «Физиол. ж. АН УССР», т. 12, 1966, № 2,
с. 225—231.
Гипоксия и наркоз. Материалы научной конференции хирургов и анестезиологов.
Ярославль, 1969.
Гологорский В. А. О некоторых актуальных вопросах искусственной вентиляции лег-
ких. — В кн.: Искусственная вентиляция легких. IV Пленум Правления Всесоюзного
общества анестезиологов и реаниматологов. М., 1971, с. 117—120.
Голуб лева Г. М. Свертывание крови при травматическом шоке. Дисс. канд. М., 1944.
Голублева Г. М. Свертывание крови при травматическом шоке. — «Клин, мед.», 1950,
№ 7, с. 79.
Горизонтов П. Д., Протасова Т. Н. Роль АКТГ и кортикостероидов в патологии. М.,
«Медицина», 1968.
Гурвич Н. Л. Фибрилляция и дефибрилляция сердца. М., Медгиз, 1957.
Гурвич А. М. Электрическая активность умирающего и оживающего мозга. М., «Меди-
цина», 1966, с. 216.
Гурвич А. М. ,Гипоксический отек мозга и его роль в развитии острых постгипоксиче-
ских нарушений неврологического статуса. — «Ж. невропатол. и психиатр.», 1971, № 8,
с. 1262—1268.
Гурвич А. М.} Романова Н. П., Мутускина Е. А. Изменения ЭЭГ и количественная оцен-
ка степени неврологических повреждений после полного временного прекращения
кровообращения в организме. — «Ж. высш. нерв, деят.», 1971, 21, № 4, с. 802—809.
Гурвич Н. Л., Табак В. Я., Семенов В. Н. О механизме развития приступа пароксиз-
мальной тахикардии. — «Клин, мед.», 1966, № 1, с. 62—68.
Гущин И. С. Анафилаксия гладкой и сердечной мускулатуры. М., «Медицина», 1973.
Дарбинян Т. М., Тверской А. Л. Современное состояние учения о кислотно-щелочном
равновесии. — «Сов. мед.», 1970, № 8, с. 11—17.
Дембо А. Г. Недостаточность функции внешнего дыхания. М., 1957.
Джавадян Н. С. Изменения отдельных компонентов свертывающей системы крови при
болевых раздражениях. Дисс. канд. М., 1947.
Джавадян Н. С. К вопросу об изменениях свертывающей системы крови при экспери-
ментальном травматическом шоке. — «Бюлл. экспер. биол. и мед.», т. 32, 1951, № 11,
с. 389.
Долина О. А. Закрытый массаж сердца. — «Здоровье», 1969, № 4, с. 17.
Дьяченко П. К. Шок хирургический. Л., «Медицина», 1968.
Дьяченко П. К., Виноградов В. М. Частная анестезиология. Л., Медгиз, 1962.
Егурнов Е. И. Организация и оснащение реанимационных центров. — В кн.: Реанимация
при травматическом шоке. Л., 1967, с. 144—164.
Ефремова Н. М. Влияние функционального состояния щитовидной железы на развитие
терминального состояния и исход оживления. Дисс. канд. М., 1970.
Золотокрылина Е. С. Динамика изменения кислотно-щелочного равновесия у больных
с тяжелыми стадиями травматического шока. — «Пробл. гематол. и перелив, крови»,
1968, № 9, с. 20—27.
Инфузионная терапия при лечении травматического шока. — «Пробл. гематол.», 1969,
№ 9, с. 10—17. Авт.: Беркутов Л. Н., Цыбуляк Г. Н., Губарь Л. Н., Новиков Э, М.
351
Изменения показателей свертывающей системы крови и тактика трансфузионной тера-
пии при тяжелой травме и шоке. Тезисы докладов XII Международного конгресса по
переливанию крови. М., 1969. Авт.: Кукель А. С, Полстяная А. В., Кукина М. П.,
Кузьмина И. В.
Колпаков М. Г. Надпочечники и реанимация. М. «Медицина», 1964.
Конради Г. П. О механизмах регуляции сосудистого тонуса. Л., «Наука», 1969.
Кассиль В. Л. Показания к искусственному дыханию при острых нарушениях легочной
вентиляции. — В кн.: Вопросы клинической реанимации. Под ред. Б. А. Королева.
Горький, 1965, с. 117—120.
Кассиль В. Л. Автоматическая вентиляция легких в реаниматологии. — В кн.: Пробле-
мы реаниматологии. М., 1969, с. 64—95.
Кассиль В. Л. Актуальные вопросы автоматической вентиляции легких в реаниматоло-
гии.— В кн.: Материалы объединенной конференции по вопросам реаниматологии.
Целиноград, 1970, с. 67—73.
(Кеслер Г., Пасторова #., Ядрный Я., Фенцл В.) Kesler H., Pastorova D., Jadrny H.,
Fenzel V. Реанимация. Прага, 1968.
Кислотно-щелочное равновесие в анестезиологии — реаниматологии. Материалы III Пле-
нума правления Всесоюзного общества анестезиологов и реаниматологов
27—29 ноября 1969 г. М., 1969.
Киссин А. Г. Реанимация при отравлениях уксусной эссенцией. — «Сов. мед.», 1968,
№ 9, с. 86—91.
Клиника и лечение отека легких при инфаркте миокарда. М., 1968.
Клиническая патофизиология терминальных состояний. Тезисы докладов симпозиума.
М., 6—8 декабря 1973 г.
Клосовский Б. Н. Гистологические изменения в центральной нервной системе. — «Бюлл.
экспер. биол. и мед.», 1963, № 3, с. 33—36.
Клосовский Б. П., Космарская Е. Н. Ранние и отдаленные изменения в головном мозге
при разных формах асфиксии. — «Вестн. АМН СССР», 1969. № 1, с. 18—25.
Курковский В. П. Морфологические исследования головного мозга при остром кисло-
родном голодании. — В кн.: Сборник трудов, посвященный Н. Н. Аничкову. М., «Ме-
дицина», 1946, с. 221—228.
Кустов Н. А. Характеристика дыхания при травматическом шоке. — «Хирургия», 1968,
№ 8, с. 30—35.
Лебедева Л. В. Основные закономерности угасания и восстановления сердечной дея-
тельности и дыхания при утоплении и последующем оживлении собак. Труды кон-
ференции, посвященной проблеме патофизиологии и терапии терминальных состоя-
ний в клинике и практике неотложной помощи, 10—12/ХП 1952 г. М., Медгиз, 1954,
с. 70—77.
Левин Ю. М. Регионарное кровообращение при смертельной кровопотере и последую-
щем оживлении (в эксперименте). Дисс. докт. Фрунзе, 1965.
Левин Ю. М. Регионарное кровообращение при терминальных состояниях. М., «Меди-
цина», 1973.
Лейтес С. М., Лаптева Н. Н. Очерки по патофизиологии обмена веществ и эндокринной
системы М., 1967.
Лужников Е. А., Панков А. Г. Опыт применения реактиваторов холинэстеразы при ост-
рых отравлениях фосфорорганическими соединениями. — «Клин, мед.», 1969, № 7,
с. 134—136.
Лужников Е. А., Ярославский А. А., Александровский В. Н. К вопросу об острых от-
равлениях новыми снотворными и седативными препаратами небарбитурового ряда. —
«Тер. арх.», 1970, № Ю, с. 105—109.
Лужников Е. А., Шиманко И, И., Александровский В, Н. Дифференциальный диагноз
и неотложная терапия коматозных состояний при некоторых острых отравлениях.—
«Сов. мед.», 1972, № 2, с. 16—22.
Луизада Л. А., Роша Л. М. Лечение острых сердечно-сосудистых нарушений. М. «Меди-
цина», 1964.
Лукашевичуте А. И. Лечение некоторых нарушений сердечного ритма импульсным то-
ком. Автореф. докт. дисс. Каунас, 1968.
Лукомский Я. Е. Шок у больных инфарктом миокарда. — «Тер. арх.», 1971, № 11, с. 3.
Любан Г. Л. Эндокринные факторы и реактивность организма при реанимации. Труды
Новосибирского мед. ин-та. Новосибирск, 1963, Т. 40.
352
Малиновский М. С. Оперативное акушерство. М., «Медицина», 1967.
Мартынов И. Ф. Функциональные методы исследования внешнего дыхания. М., 1971.
Маслов В. И. Лечение мозговых расстройств после перенесения клинической смерти. —
«Хирургия», 1965, № 9, с. 103—107.
Маршак М. Е. Регуляция дыхания у человека. М., Медгиз, 1961.
Материалы IV Всесоюзной конференции патофизиологов. Патологическая физиология
сердечно-сосудистой системы. Тбилиси, 1964.
Мачабели М. С. Коагулопатические синдромы. М., 1970.
XII Международный конгресс по переливанию крови. Тезисы докладов. М., 1969.
Меньшиков В. В. Гуморальные механизмы регуляции функций организма в норме и па-
тологии. М., 1970.
Механизмы нарушений структуры и функций при шоке и принципы их коррекции. Ма-
териалы симпозиума, октябрь 1971 г. Кишинев, 1971.
Неговский В. А. Восстановление жизненных функций организма, находящегося в со-
стоянии агонии или в периоде клинической смерти. М., Медгиз, 1943.
Неговекий В. А. Патофизиология и терапия агонии и клинической смерти. М., «Медици-
на», 1954.
Неговский В. А. Оживление организма и искусственная гипотермия. М., Медгиз,
1960.
Неговский В. А. Непрямой массаж сердца и экспираторное искусственное дыхание. М.,
«Советская Россия», 1966.
Неговский В. А. Актуальные проблемы реаниматологии. М., «Медицина», 1971.
Неговский В. А., Золотокрылина Е. С, Киселева /С С. Основные принципы патофизио-
логии и терапии терминальных состояний, вызванных кровопотерей, в акушерстве и
гинекологии. — В кн.: XI Всесоюзный съезд акушеров-гинекологов. Тезисы докладов.
М., 1963, с. 139—142.
Неговский В. А., Гроздова Т. Н. Асфиксия новорожденных и ее лечение. В кн.: Основы
реаниматологии. М., 1966, с. 364—382.
Неговский В. А., Берман В. С. Актуальные проблемы реаниматологии в акушерско-ги-
некологической практике. — В кн.: Обезболивание и реанимация в условиях клиники
скорой помощи. Материалы I съезда анестезиологов Украины. Киев, 1966, с. 150—152.
Нейролептаналгезия. Материалы IV Пленума правления Всесоюзного общества анесте-
зиологов и реаниматологов. М., 1971.
Николаенко Э. М. Влияние гипервентиляции на кислотно-щелочной баланс и гемодина-
мику мозга во время нейрохирургических операций. — В кн.: Кислотно-щелочное рав-
новение в анестезиологии — реаниматологии. Материалы III Пленума правления Все-
союзного общества анестезиологов-реаниматологов. 27—29/XI 1969. М., 1969, с. 117—
119.
Обезболивание и реанимация в условиях клиники и скорой помощи. Киев, 1966, с. 248—
249.
Организация службы анестезии — реанимации в многопрофильной больнице. Состави-
тель А. П. Зильбер. Петрозаводск, 1971.
Основы практической анестезиологии. Под ред. Е. А. Дамир и Г. В. Гуляева. М.,
1967.
Основы реаниматологии. Под ред. В. А. Неговского. М., «Медицина», 1966.
Персианинов Л. С. Асфиксия плода и новорожденного. М., «Медицина», 1967.
Петров И. Р. Роль центральной нервной системы, аденогипофиза и коры надпочечников
при кислородной недостаточности. Л., 1967, «Медицина».
Петров И. Р., Васадзе Г. Ш. Необратимые изменения при шоке и кровопотере. М.,
«Медицина», 1966.
Петров-Маслаков М. А., Сотникова Л. Г. Поздний токсикоз беременных. Л., «Медици-
на», Ленингр. отд., 1971.
Петровский Б. В., Гусейнов Ч. С. Трансфузионная терапия в хирургии. М., «Медицина»,
1971.
Прогнозирование окончательных исходов тяжелой травмы и постановка диагноза «моз-
говой смерти» у донора при изъятии сердца для пересадки. — «Экспер. хир. и анесте-
зиол.», 1969, № 2, с. 29—34. Авт. А. Н. Беркутов, Г. Н. Цыбуляк, Э. В. Пашковский,
Н. И. Егурнов.
Пытель А. #. и др. Искусственная почка и ее клиническое применение. М., «Медицина»,
1961.
353
Запредельная кома и критерии смерти мозга. — «Сов. мед.», 1971, № 12, с. 59—63. Авт.
Э. И. Раудам, М. Я. Мяги, А.-Э. А. Каасик, Р. X. Цуппинг, А. А. Тикк.
Репина М. А. Беременность и свертывающая система крови. Л., 1968.
Романова Я. П. О динамике гистопатологических изменений в. головном мозге при
экспериментальной гипоксии. — «Ж. невропатол. и психиатр.», т. 56, 1956, № 1,
с 49—55.
Романова Я. Я. Морфологические изменения в головном мозге и внутренних органах
после длительной гипотензии. — «Арх. пат.», т. XXIV, 1962, № 10, с. 57—63.
Рябова N. М. О критериях перехода от непрямого массажа сердца к прямому. — В кн.:
Актуальные вопросы реаниматологии и гипотермии. М., «Медицина», 1964.
Савельева Г. М. Значение изучения дыхательной функции крови плода для понимания
патогенеза асфиксии плода и новорожденного. — В кн.: Биохимические /нарушения и
их коррекция в акушерско-гинекологической практике. М., 1971, с. 66—71.
Савельев В. С, Костенко И. Г., Савчук Б. Д. Блокада сердца. М., «Медицина», 1967.
Селезнев С. А. Печень в динамике травматического шока. Л., «Медицина», 1971.
Семенов В. Я. Лечение длительного некупирующегося приступа пароксизмальной тахи-
кардии импульсным разрядом электрического тока. — «Тер. арх.», 1964, № 5, с. 94—97.
Семенов В. Я. Восстановление жизненных функций организма, умирающего в резуль-
тате нарушения коронарного кровообращения. Дисс. канд. М., 1966.
Сергиевский М. В. Дыхательный центр млекопитающих и регуляция его деятельности.
М., Медгиз, 1950.
Словиков Б. И. Регионарное кровообращение и напряжение кислорода при смертель-
ной кровопотере и оживлении после клинической смерти (в эксперименте). Дисс. канд.
Новосибирск, 1966.
Смиренская Е. М. Газы крови при угасании и восстановлении жизненных функций орга-
низма. Дисс. канд. М., 1945.
Смольников В. П. Вопросы экстренной анестезиологии. М., 1962.
Сметнев А. С, Петрова Л. И., Закин А. М. Лечение отека легких при инфаркте миокар-
да. Сов. мед., 1971, № 4, с. 10—15.
Соловьев Г. М., Меньшиков В. В., Усватова И. #., Мещеряков А. В. Гормоны надпочеч-
ников в хирургии. М., 1965.
Сумароков А. В. Эктопические аритмии в клинике внутренних болезней. Автореф. дисс.
докт. М., 1964.
Сухинин П. Л., Шиманко И. #., Дагаев В. Н., Яжгур Ф. М. Применение перитонеаль-
ного диализа при острых отравлениях дихлорэтаном. — «Клин, мед.», 1967, № 7,
с. 65—70.
Сухинин П. Л., Лужников Е. А., Фирсов И. Я. Осмотический диурез как метод лечения
острых отравлений барбитуратами. — «Тер. арх.», 1969, № 5, с. 85—89.
Сыркин Л, Л., Недоступ А. В., Маевская И. В. Электроимпульсное лечение аритмий
сердца. М., «Медицина», 1970.
Сыроватко Ф. А., Берман В, С. Врачебная тактика при атонических маточных кровоте-
чениях с декомпенсированной кровопотерей. — «Акуш. и гин.», 1962, № 6, с. 12—20.
Сыроватко Ф. А., Берман В. С. Особенности клиники и лечения шока и терминальных
состояний в зависимости от вида акушерско-гинекологической патологии. — В кн.:
Профилактика и лечение шоковых и терминальных состояний в акушерской практике.
М., 1967, с. 63—80.
Табак В. Я. О лечении приступа пароксизмальной тахикардии одиночным электриче-
ским раздражением сердца. — «Кардиология», 1965, № 6, с. 55—60.
Тареев Е. М. Современные методы лечения острой печеночной недостаточности. —
«Вестн. АМН СССР», 1970, № 9, с. 34—43.
Толова С. В. Структура дыхательного акта при умирании и оживлении организма. Ав-
тореф. дисс. канд. М., 1967.
Травматический шок у человека. Труды III съезда хирургов РСФСР. Горький, 1969,
с. 45—51.
Травматический шок у человека. Материалы конференции. Л., 1968.
Травматический шок. Материалы научной конференции Ленинградского научно-исследо-
вательского института скорой помощи им. Джанелидзе. 28—29/Х 1970 г. Л., 1970.
Трусов Л. Я. Нарушение коагуляционных механизмов гемостаза при умирании организ-
ма от электротравмы и в восстановительном периоде после оживления. Дисс. канд.
М., 1968.
354
Учваткина М. К. Диагностика, профилактика и лечение острой дыхательной недоста-
точности после различных вмешательств на органах грудной клетки. Дисс. канд. Л.,
1967.
Федорова 3. Д. Диагностика и лечение острых кровотечений, обусловленных наруше-
нием свертывающей системы крови в акушерской и хирургической практике. Дисс.
докт. Л., 1969.
Хачатрян С. А. Реанимация в условиях лихорадки и некоторые изменения в обмене ве-
ществ и эндокринной системы. Дисс. докт. Ереван, 1968.
Цукерман Б. М. Лечение сердечных аритмий электроимпульсным методом. — В кн,:
Физиология и патология сердечно-сосудистой системы. М., 1965, с. 33—35.
Чазов Е. И. Проблемы терапии инфаркта миокарда. — «Сов. мед.», 1971, № 4, с. 3.
Чарный А. М. Патофизиология гипоксических состояний. М., Медгиз, 1961.
Чернух А. М., Штыхно Ю, М. Микроциркуляция при терминальных состояниях. —
«Вестн. АМН СССР», № 10, с. 9—14. 7
Шапиро В. М. Протеиногенная и протромбиногенная функция печени при умирании и
оживлении организма. — «Пат. физиол.», 1966, № 3, с. 32—36.
Шерман Д. М. Проблемы травматического шока. М., «Медицина», 1972.
Шик Л. JI. Дыхательная недостаточность и кислородное голодание. — В кн.: Физиоло-
гия и патология дыхания, гипоксия и оксигенотерапия. Киев, 1958, с. 108—117.
Шик Л. Л. Управление дыханием при недостаточности внешнего дыхания. — В кн.: Ма-
териалы I Всесоюзного съезда патофизиологов. Баку, 1970.
Шиманко И. И., Ярославский А. А. О применении раннего гемодиализа при острых от-
' равлениях. -— «Сов. мед.», 1970, № 8, с. 89—94.
Шиманко И. #., Лужников Е. А., Зимина Л. Н. Печеночно-почечная недостаточность
при острых отравлениях. — В кн.: Острые отравления. М., 1970, с. 80—87.
Шушков Г. Д. Травматический шок. Л., «Медицина», 1967.
Юревич В. М. О некоторых спорных вопросах автоматической вентиляции легких в
процессе реанимации. — В кн.: Обезболивание и реанимация в условиях клиники и
скорой помощи. Киев, «Здоров'я»; 1966.
Янковский В. Д. К вопросу о восстановлении функций центральной нервной системы у
животных, погибших от кровопускания и оживленных при помощи искусственного
кровообращения. — «Вопр. физиол.», 1954, № 8, с. 51—63.
Янковский В. Д. Двадцатилетний опыт применения для реанимации в эксперименте
искусственного кровообращения. — «Пат. физиол.», 1968, № 5, с. 6—12.
Alexander S., Kteiger R., Lown B. Use of Experimental Electric Countershock in the treat-
ment of ventricular tachycardia. — «JAMA», 1961, v. 177, N 13, p. 916—918.
Ames R. e. a. Cerebral Ischemia. II. The no reflow phenomenon. — «Am. J. Path.», 1968,
v. 52, N 21, p. 437—453.
Andersen O. S., Engel J., Jrgensen K., Astrup P. A micromethod for determination of pH,
carbon dioxide tension, base excess and standart bicarbonate in capillary blood. The
Scandin. —«J. of clin. lab. Inv.», 1960, v. 12, N 2, p. 172—176.
Andersen L.} Gjengst #., Ersland A. Drowning Atti XXIV Congresso Societa Italiana
Anestesia e Rianimazione. Asiago, 1971, p. 242—245.
Arfel G. Problemes electroencephalographiques de la mort. Masson et Gie, Paris, 1970,
140 p.
(Асканаза 3.) Askanasa Z. Реанимация в кардиологии. Варшава, 1972.
Assemblee generale et reunion des commissions specialisees de la F. I. S. Malmoe (Suede)
13—17 Mai 1971. —«Bull. Inform. Renseignements», 1971, 28, 30.
Baekgaard P., Mosbech J., Nielseu K. R. Mortaliteten of asthma bronchiale i Danmark i re-
lation til anverdelsen of aerosolspray Ugenskrift for Laeger, 1970, Bd 132, S. 2274.
Balint P. Normal, und pathologische Phisiologie f der Nieren. Berlin, 1969.
Вайе Л. E. Recent development in the study and treatment of shock. — «Surg. Gynec. Ob-
stet», 1968, N 127, p. 849—878.
P. R. de la Bastaie, P. Picard. Principles de therapie des hemorrhagies par les solutions
electrolytes. — «Cohn. Anesth.», 1970, v. 18, N 4, p. 461—484.
Barth L., Meger M. Modern Narkose, Jena, 1962.
Berlyne N., Strachan M. Neuropsychiatric sequellae of attemped hanging. — «Brit. J. Psy-
chiat», 1968, y. 114, p. 411—422.
Bird G. G. Oxigen tension and blood oxygen content. — «Anaesthesia», 1971, v. 26,
p. 192—198.
355
(Blaja С, Crivda S.) Блажа К., Кривда С. Теория и практика оживления в хирургии.
Бухарест. Мед. изд-во. Изд. 3-е, 1967.
Brock M., Schurmann K.t Hadjidimos A. Cerebral blood flow and cerebral death. — «Acta
Neurochirurg.», 1969, v. 20, p. 195—209.
Brooks D. /C. Resuscitation. London, Edward Arnold Ltd., 1967, 323 p.
Bustaie P. R., Picard P. Principles de therapie des hemorrhagies par les solutions electro-
lytes. — «Cah. Anesth.», 1970, v. 18, N 4, p. 461—484.
Butenuth L, Schneider H.} Schneider V. Spinale Mechanismen in einem Fall von Hirntod
nach Cyanidintoxication. — «Dtsch. Z. Nervenheilk.», 1970, Bd 197, S. 255—284.
Cahill L M., Byrne J. I. Ventilatory mechanics in hypovolemic shock. — «J. appl. Physiol.»,.
1964, v. 19, p. 679—682.
Cain S. M. O2 deficit incurred during hypoxia and its re'iation to lactate and excess lacta-
te. — «Am. J. Physiol.» (Lond.), 1963, v. 213, p. 57—63.
Campbell E. /. M. The resporatory muscles and the mechanics of breathing. London,
1958.
Car a M. Regulation des echanges respiratoires. — «Ann. anesthesiol. franc», 1968, v. 8,
Spec. 2, p. 1119—1128.
Сага М. L'anestesie-reanimation des grands insuffisants respiratoires. — «Cah. Anesth.»,
1969, v. 17, p. 725—737.
Car a M., Poisvert M. Premiers secours dans les detresses respiratoires. Paris, 1963.
Ciocatto E. (dir) Trattato di rianimazione. Torino, Edizioni Minerva Medica, 1969,
1018 p.
Comroe J. H., Jr. Respiratory gas exchange. Artificial respiration. New York, 1962.
(Comroe J. H.t Forster R. £., Dubois А. В., Briscoe W. A., Carlsen E.) Комбро Дж., Фор-
стер P., Дюбуа А., Бриско У., Карлсен Э. Легкие. Клиническая физиология и функ-
циональные пробы. М., Медгиз, 1961.
Constantin В. Problemes nephrologiques аи service de reanimation generale. — «Ann.
Anesth. Franc», 1965, v. 6, p. 271.
Crowell J. W., Smith E. Oxigen deficit and irreversibel hemorrhagic shock. — «Am. J. Phy-
siol.», 1964, v. 206, p. 313—316.
David G.y Pinon F. Reanimation du nouveau — ne a la naissance. Annales de l'Anesthesio-
logie Francaise, 1964, v. 5, num Spec. Anesthesie en obstetrique. p.
Ditrich P. e. a. Hamadialise und Peritonealdialyse. Springer-Verlag, 1969.
Dobrev J., Stojanov E., Tenev G. On Training of Medical and Stomatological Students in
the Field of Urgent Resuscitation Measures. IV Symposium Anaesthesiologiae Interna-
tionale. Varna. Bulgaria, 1968.
Drucker W. R. Shock and metabolism. — «Surg. Gynecol. Obstet», 1971, v. 132, p. 234—
239.
Dupoux /., Sabathie M., Gillardeau G. Traitement d'urgence des noyades. — «Inform. Med.»,
1971, p. 109.
Egdahl R. H. Postoperative uses of adrenal steroids. — «Am. J. Surg.», 1968, v. 116, N 3,
p. 337—341.
Elam /. O., Ruben H. M., Bittner T. J. Training Laymen in Emergency Resuscitation.—
«Anesth. et Analg.», 1961, v. 40, p. 603—608.
Electroencephalographic prediction of fatal anoxic brain damage after resuscitation from
cardiac arrest. — «Brit. med. J.», 1970, v. 4, N 5730, p. 265—268. Aut.: C. D. Binnie, P. F.
Prior, D. S. L. Loyd, D. F. Scott., J. H. Margerison.
Farkouth E., Daniel A., Beaudoin Г., Me Lean L. Predictive value of liver biochemistry in
acute hepatic ischemia. — «Surg. Gyn. and Obst.», 1971, v. 132, p. 832—838.
Ferrein H. C, Marat G., Feni R. G. Influenze dell'ipossia, dell'ipercapnia e delle shock sul-
la coagulazione ematice. — «Transfusion», 1964, v. 4, p. 21.
Filley G. F. Acid —base and blood gas regulation. London, 1971.
Finch C. /L, Lenfant C. Oxygen transport in man. — «The new Eng. J. of Med.», 1972,
v. 286, p. 407—415.
Fischgold H.} Mathis P. Obnubilation, comas et stuperus. Masson et Cie. Paris, 1959,
126 p.
Frank E.f Frank #., Jacob S.t Fine T. Hepatic blood flow in experimental hemorrhagic
shock. —«Am. J. Physiol.», 1962, v. 202, p. 7—11.
Gaches /., Caliskan A., Findji F., Le Beau /. Contribution a Tetude du coma depasse et de
la mort cerebrale — «Sem. Hop. Paris», 1970, T. 46, p. 1487—1497.
356
<3ergeli M. Effect of small intestinal resection of exclusion in haemorrhagic shock. — «Acta
physiol. Acad. sci. hung.», 1970, v. 37, p. 301—311.
Orausz H., Amend W. I. C, Earley L. E. Acute renal failure complicating submersion in
sea water.— «Am. J. med. Ass.», 1971, v. 217, p. 207—209.
Orenell R. G. Central nervous system resistance, the effects of temporary arrest of cerebral
circulation for of two to ten minutes. — «J. Neuropath, exp. Neurol.», 1946, v. 5, p. 131—
154.
Criteres cliniques et arteriographiques des comas depasses en neuro-chirurgie. — «Ann.
Anesthesiolog. franc», 1970, v. 11, p. 163—171. Aut.: С Gros, B. Vlachovitch, P. Frere-
beau, A. Kuhner, M. Billet, G. Sahut, G. Gavand.
(Hamburger G.) Амбюрже Ж. и др. Почечная недостаточность. М., 1962.
Hamodialise und Peritonealdialyse. Springer — Verlag, 1969. Aut.: P. Ditrich, H. T. Gur-
land, M. Kessel, M. A. Massini, E. Wetzels.
Hardaway R. M. Microcoagulation in shock.— «Am. J. Surg.», 1965, v. 110, p. 298—301.
Bardaway R. M. Clinical management of shock. — «Military Medicine». 1969, v. 134,
p. 645—654.
Hardaway R. M. Syndromes of diseminated intravascular coagulation. Springfield, 1966.
Hardaway R. M., Johnson, Dale G. Influence of fibrinolisin on shock. — «J.A.M.A.», 1963,
v. 183, p. 597—599.
Hardaway R. M. e. a. Intensive Study and Treatment of Shock on Man. — «J.A.M.A.», 1967,
v. 199, p. 115—126.
Herxheimer H. How to prevent death from bronchial asthma. — «Folia allergol.,» 1971, v. 18,
p. 362.
Heymans C. Reviviscence des centres nerveux apres arret de la circulation sanguine.—
«Acta de 1'institut d'anesthesiologie», 1953, T. 1, p. 56—60.
Hirsch H.} Scheider M. Durchblutung und Sauerstoffaufnahme des Gehirns. In: Olivecrona
(Ed.), Handbuch der neurochirurgie, 3-d ed. Springer. Berlin, 1968, p. 434—552.
Hollenberg N. K., Waters I. R.t Faews M. K., Davies R. O., Nikerson. Nature of Cardio-
vascular Decompensation during Hemorrhagic Hypotension. — «Am. J. Physiol.», 1970,
v. 219, p. 1476—1482.
Horton G. E. e. a. Team approach of the treatment of moribund astmatic patients. — «Ann.
allergy.», 1971, v. 29, p. 294.
Hosier R. A. A manuel on cardiac resusciation. Springfield, 1954.
Hoyer S.j Wawesik /. Untersuchungen der Hirndurchblutung und des Hirnstoffwechsels
beim Decerebrationssyndrom. Langenbecks. — «Arch. klin. Chirurgie», 1968, Bd 322,
S. 602—605.
Huguenard P., Jaquenoud P. Exposes d'anesthesiologie. Paris, 1964.
Hunter A. R. Intensive care as a Speciality. — «Lancet», 1967, v. 1, p. 1151—1153.
Kaminski G. B. (red.) Anestezja i reanimacja. Warszawa, 1972.
Killip T. Synchronized DC precordial shock for arrytmias. — «J.A.M.A.», 1963, v. 186,
p. 1—6.
Kinney M. J. The untensive care unit. Anesthesiology, 1964, v. 25, p. 208—214.
Kirimli B. Organization of Cardiopulmonary Resuscitation Training Programs. — «Laval
Med.», 1969, v. 40, p. 265—268.
Kirimly В., Safar P. Arterial versus venous transfusion in cardiac arrest from exsanguina-
' tion. — «Anaesth. Analg. Curr. Res.», 1964, v. 44, p. 819.
Koller Т., Jr. Lamp, Ebner R., Hawrylenko A., Kramer W. Problerne der uberwachung und
Behandlung bei Ubergangsstorungen des Neu — geborenen. — «Genaecologia» (Basel),
1966, v. 162, p. 1—47.
Kramer W. Extensive necrosis of the brain development during reanimation. Proceed.
V-th internat. Congress of Neuropathol. Exerpta med. Found. Internat. Congr. Ser. 1966,
p. 33—45.
Kurtz D., Cornett M., Tempe J. D., Mantz J. M. Interet de TEEG dans les suites d'arret
cardiaque reversible. — «Acta neurol. belg.», 1970, v. 70, p. 213—227.
Laborit H. Bases biologiques generates de la reaction a Tagression. — «Agressologie»,
1972, v. 13, p. 1—54.
Layoff G., Crafword O. Fatalities from bronchial asthma in children. — «Ann. allergy»,
1964, т. 22, p. 349.
357
Larcan A. e. a. La foie du choc. J. de reanimation med-chirurg Nancy, 1968, p. 593—698.
Lassen N. A. Treatment of severe acute barbiturate poisoning by forsed diuresis and ailca-
linisation of urine. — «Lancet», 1960, v. 7146, p. 338—342.
Lefer Л., Martin S. Origin of myocardial depressant factor in shock. —- «Am. J. Physiol.»,
1970, v. 218, T. 5, p. 1423—1427.
Lind P. Teaching Mouth-to-Mouth Resuscitation in Primary Schools. Acta Anaesth. Scand.
Suppl. IX, 1961, p. 63.
Lhermitte F., Talairach J., Buser P., Gautier J. C, Bancaud /., Gras R., Truelle J. U
Myoclonies d'intention et d'action postanoxiques. Revue neurol, 1971, v. 124, p. 5—20r
p. 21—31.
Lovric V. A. The erythrocyte as a cause of disordered oxygen transport. — «Med. J. Austra-
lia», 1972, N 1, p. 183—185.
Lown В., Wittenberg S. Cardioversion and Digitalis. — «Am. J. Cardiol.», 1968, v. 21, N 4,
p. 513—517.
Lyons J. #., Moore F. D. Posstraumatic alkalosis; incidence and pathophysiology of alka-
losis in surgery. — «Surgery», 1966, v. 60, N 1, p. 93—103.
Mackay R., Leeds S. /. Physiological effects of condenser discharges with application to
tissue stimulation and ventricular defibrillation. — «J. appl. PhysioL», 1953, v. 6,
p 67—75.
Masoro E. J., Siegel P. D. Acid — base regulation. Its physiology and pathophysiulogy.
Philadelphia a. London, 1971.
Masson I. W. Overall hormonal balance as' a key to endocrine organization. Psichosomatic
Medicine, 1968, XXX, 5, part 2, p. 791—808.
Marchiano G. Rapid test for fibrinolysis in vivo. — «Minerva anest.», 1964, v. 30, p. 394—
396.
Math P. Centre de reanimation polyvalente. — «Ann. Anesth. franc», 1965, T. 6, p. 43—48.
Mellemgaard K. a. Astrup P. The quantitative determination of surplus amounts of acid
or base in the human body. — «Scand. J. Clin. Labor. Invest.», 1960, p. 187—199.
Modell J. H. e. a. Blood gas and electrolyte changes in human near — drowning victums. —
«J.A.M.A.», 1968, v. 203, p. 337—343.
Morikava S., Safar P., De Carlo J. Influence of the Head — Jaw Position Upon Upper
Airway Patency. — «Anesthesiology», 1961, v. 22, p. 265—270.
Moschlin S. KHnik und Therapie der Vergiftung. Schtuttgart, 1964.
Muhlmann-Weill. L'insuffisance hepatique et son traitment. — «Chaiers d'Anesthesiologie»,
1970, T. 18, p. 801—818.
Mushin W. W., Rendell-Baker L., Thompson P. W. Automatic ventilation of the lung. Lon-
don, 1959.
(Navratil M.} Kadlec /(., Daum S.) Навратил М., Кадлец К., Даум С. Патофизиология
дыхания. Прага, 1967.
Norlander О. P. The use of Respirators in anaesthesia and surgery. — «Acta Anaesth.
Scand.», 1968, Suppl. 30.
Paprocki M., Szszygiel R. Zmiany morfologiczne w mozgu chorego pokrpotrotrwalym
zatrzymaniu akcji serca i oddechu z nastepowym 52 — dniowym przezuciem. — «Patolo-
gica polska», 1966, XVII, 4, p. 571—576.
Pampiglione G., Harden A. Resuscitation after cardiocirculatory arrest. — «Lancet», 1968,
v. 1, p. 1261—1265.
Penin H., Kaufer Ch. (Hrggs) Der Hirntod. Syrnpos. in Bonn. G. Thieme. Stuttgart, 1969.
160 S.
Plum F., Posner J. В., Hain R. F. Delayed neurological deterioration after anoxia. — «Arch.
internat. Med.», 1962, v. 110, p. 18—25.
Poulsen H., Lysgaard A. Emergency — Aid Organisation Acta Anaesth. Scand. Suppl.
XXIX, p. 283—292.
Pritchard J. A. Changes in the blood volume during pregnancy and delivery. — «Anesthe-
siology», 1965, v. 26, N 3, p. 393—399.
Problemes de reanimation. Journees de reanimation medicochirurgicale. Nancy, 25, 26 et
27 avril 1968. Nancy, 1968.
Robinson J. R. Fundamentals of acid —base regulation. Oxford, 1965.
Rothe C. F. Heart failure and fluid loss in hemorrhagic shock. — «Fed. Proa», 1970, v. 29,
p. 1854—1860.
358
Ruben H. M. Manikin for Training in Expired Air Resuscitation. — «Brit. med. J.», I960,
p. 463.
Saev S. K. Resuscitation after drowning. Atti XXIV Congresso Societa Italiana Anestesia
e Rianimazione. Asiago, 1971, p. 256—260.
(Safar P.) Сафар П. Сердечно-легочная реанимация. Руководство для врачей и фельдше-
ров. Пер. с англ. М., 1970.
Safar P. Ventilatory efficacy of mouth — to — mouth artificial respiration. — «J.A.M.A.»,
1958, v. 167, p. 335.
Sating E. Reanimation des Neugeborenen. — «Z. Gebutshilfe Gynak. Beilagcheft», 1968,
Bd 169, S. 36—43.
Scharfetter Ch.} Scharfetter F. Uber das apaalische Syndrom. — «Dtsch. med. Wschr.», 1968r
Bd 93 S 2131 2133
Schneider H. Der Hirntod. — «Nervenarzt», 1970, Bd 41, S. 381—387.
Schreiner J. E. Dialysis of poisons and drugs. — «Drug Intell. and Clinic. Pharm.», 197L
p. 322—340.
Schreiner G. E., Maher J. F. Toxic Nephropathy. — «Am. J. Med.», 1965, v. 38, p. 409.
Schuster H., Busch H., Busch G., Niemczyk H., Baum P., Knette /., Ungern-Sternberg
von A., Lang K. Klmische und elektroencephalographische Beobachtungen beim dissoziir-
ten Hirntod bei Patienten eines internistischen Internsivpflegzentrums. Wiederbel. — Or-
ganersatz —Intensivmed., 1970, S. 10—27.
(Selye H.) Селье Г. Адаптивные стероиды. Развитие проблемы и перспективы. — «Пат.
физиол.», т. XV, 1971, № 2, с. 3—18.
Sheldon J. M. e. a. A manual of clinical allergy, London, 1967.
Siggard-Andersen O. Blood acid — base alignment nomogram. Scadn. — «J. clin. Lab. In-
vest.», 1963, p. 211—217.
S'hock pathogenesis and therapy in international symptosium. Stockholm, 27—30 June,
1961. Springer — Vergla Berlin — Gittengen, Heidenburg, 1962.
Shock and Hypotension. Pathogenesis and treatment. A. Hahnemann Symposium ed. by
M. Z. P. Mills a. J. H. Moyer. Grune a. Strubton. New York, 1965.
Shoemaker W. E. Principles of therapy in shock from hemorrhage, trauma and sepsis. —
«Modern Treatment, 1967, v. 4, p. 256—276.
Silverman D., Masland R. L., Saunders M. G., Schwab R. M. Irreversible coma associated
with electrocerebral silence. — «Neurology», 1970, v. 20, p. 525—533.
Simmerdinger #., Dietzel W. Die metabolische Alkalose wahrend der Intensivbehandlung. —
«Z. prakt. Anasth.», 1971, Bd 6, S. 12—21.
Sladen A., Zauder H. L. Methylprednisolone therapy for pulmonar edema following near
drowning. — «J.A.M.A.», 1971, v. 215, p. 1793—1795.
Stephenson H, E. Cardiac arrest and resuscitation 3-rd ed., Saint Louis, the C. V. Mosby
Company, 1969, 659 p.
Stephenson H. E. Cardiac arrest and resuscitation. 4:th ed. Saint Louis, the C. V. MosDy
Company. 1974.
Symposium: Physiological basis of circulatory shock. — «Fed. Proc», 1970, v. 29, p. 1832—
1873.
Symposium on emergency resuscitation. — «Acta Anaesth. Scand. Suppl.», v. 9.
Symposium Anaesthesiologiae Internationale. — «Abstracta», Praha, 1965.
Symposium on respiration. — «Folia Med. Neerlandica», 1970, v. 13, N 3—4, p. 90—134.
Symposium on respiratory insufficiency. — «Ann. New York Acad. Sci.», 1965, v. 121, N 3,
p. 651—958.
Tonner H. D. Wiederbelebung und Behandlung Ertrunkener. — «Z. Allgemeinmed», 1971,
Bd 47, S. 1059—1069.
Team approach to the treatment of moribund astmatic patients. — «Ann. allergy», 1971,
v. 29, p. 294. Aut.: G. E. Horton, A. Marks, M. W. Wood, R. G. Lovell, D. A. Holaday,
D. Eubanks, J. W. Pate.
Traiiement de l'insuffisance respiratoire. Paris, 1959.
Vlachovitch В., Frerebeau P., Kuhner A., Billet M. Gros C. Les angiographies sous pression
dans la mort du cerveau avec arret circulatoire encephalique. — «Neuro-chirurgie», 1971,
v. 17, p. 81—96.
Wofson L J. Anaesthesia for the injured. Oxford, 1962.
Zoll P. M. e. a. The effects of external electric current on the heart circulation. — «Am.
Heart. J.», 1956, p. 745—756.
ОГЛАВЛЕНИЕ
Предисловие 3
Глава I. Реаниматология и ее задачи— Б. А. Неговский 6
Глава II. Угасание и восстановление функций сердца — Н. Л. Гурвич, Н. М. Ря-
бова, В. Я. Табак 24
Глава III. Регионарное кровообращение и микроциркуляция при терминальных
состояниях — Ю. М. Левин 46
Глава IV. Угасание и восстановление функций внешнего дыхания — С. В. То-
лова 58
Глава V. Угасание и восстановление функций центральной нервной системы —
А. М. Гурвич, Я. И. Астапенко 69
Глава VI. Кислородный бюджет и кислотно-щелочное равновесие в терминаль-
ных состояниях — О. Н. Буланова, Е. С. Золотокрылина, И. О. Заюс,
И. Е. Трубина 89
Глава VII. Патология печени и почек в восстановительном периоде после ожив-
ления— В. М. Шапиро, А. А. Трикашный 112
Глава VIII. Патология эндокринной системы при терминальных состояниях —
А. В. Волков 127
Глава IX. Морфологические изменения головного мозга и внутренних органов
при терминальных состояниях — Н. П. Романова 138
Глава X. Терминальные состояния, вызванные патологическими изменениями
сердечно-сосудистой системы — В. А. Неговский, В. Я. Табак, В. Н. Семенов 150
Глава XI. Этиология, патогенез и терапия острой дыхательной недостаточности
при терминальных состояниях — В. Л. Кассиль, Н. М. Рябова 169
Глава XII. Терминальные состояния, вызванные кровопотерей и травмой —
Е. С. Золотокрылина 201
Глава XIII. Терминальные состояния, вызванные акушерско-гипекологической
патологией — В. А. Неговский, В. С. Берман, Т. Н. Гроздова 223
Глава XIV. Изменения функционального состояния системы гемостаза при тер-
минальных состояниях, вызванных травмой и кровопотерей — С. Т. Сполуден-
ная, А. В. Полстяная 241
Глава XV. Особенности реанимационных мероприятий при острых экзогенных
отравлениях — Е. А. Лужников, В. Н. Дагаев . 252
Глава XVI. Терминальные состояния, вызванные утоплением, электротравмой,
аллергическими реакциями — В, А. Неговский, Г. Н. Андреев, Л. В. Лебедева,
Н. Л. Гурвич, И. С. Гущин 274
Глава XVII. Анестезия у больных, находящихся в терминальных состояниях —
Е. А. Цамир 291
Глава XVIII. Прогноз восстановления функций организма и диагноз «смерти
мозга» — В. А. Неговский, А. М. Гурвич 303
Глава XIX. Организация работы отделений реанимации общего профиля и
выездных реанимационных бригад — В. А. Неговский, Т. П. Вельская,
В. Л. Кассиль, К. П. Каверина, Е. С. Золотокрылина 317
Глава XX. Методические указания по обучению доврачебным методам реани-
мации— Г. Н. Андреев 333
Литература 350