Text
И П.Бабьева, В И Голубев
МЕТОДЫ
ВЫДЕЛЕНИЯ
и ИДЕНТИФИКАЦИИ
ДРОЖЖЕЙ
СПРАВОЧНОЕ ПОСОБИЕ
Москва
«Пищевая промышленность»
1979
36.87
УДК 663.12/. 14 : 576.8.078 + 576.8.093.1
Бабьева И. П., Голубев В. И.
Б12 Методы выделения и идентификации дрожжей.
М.: Пищевая пром-сть, 1979. — 120 с.
40 коп.
Руководство издается впервые. В нем изложены приемы
обнаружения и выделения дрожжей, способы получения и поддержания чистых
культур в лаборатории, а также стандартные методы исследования для
видовой идентификации дрожжей. Описаны модифицированные
авторами методы идентификации дрожжей.
„ 31702—020 36 87
Б 777^7Г-^Г2°-79 2901000000 *??(.
044(01)—79 6П8-5
Рецензенты: д-р биол. наук, проф. И. М. Грачева, канд. биол.
наук А. И. Жукова.
© Издательство «Пищевая
промышленность», 1979 rV
ПРЕДИСЛОВИЕ
Дрожжи в сравнении с любыми другими микроорганизмами
играют наиболее значительную роль в пищевой промышленности.
С давних времен дрожжи используют в заквасках для
получения хлеба и кисломолочных продуктов, при изготовлении пива,
сидра, виноградных и ягодных вин, спирта и крепких напитков. Из
дрожжей получают липиды и полисахариды, белки и многоатомные
спирты, органические кислоты, витамины и ферменты. Дрожжевые
препараты находят применение в медицине, фармакологии и в
качестве кормовых добавок в рационах сельскохозяйственных
животных. Традиционные способы производства с использованием
дрожжей дополняются новыми направлениями, которые составляют в
настоящее время основу микробиологической промышленности.
В последние годы производство дрожжевых продуктов
расширилось в результате внедрения новых продуцентов ценных веществ
при культивировании их на дешевом сырье — углеводородах,
метаноле, этаноле, на гидролизатах торфа и древесины, на отходах
сельского хозяйства. Далеко не исчерпаны все возможности
использования дрожжей.
«Основными направлениями развития народного хозяйства
СССР на 1976—1980 годы» предусматривается увеличить в текущей
пятилетке производство продукции микробиологической
промышленности в 2—2,1 раза, улучшить качество кормового белка, расширить
исследования, направленные на получение высокопродуктивных и
устойчивых промышленных штаммов микроорганизмов —
продуцентов биологически активных веществ, создание более
совершенной технологии производства микробиологической продукции на
основе новых, более дешевых видов сырья. Эти задачи требуют от
ученых и научных работников производственных лабораторий
усилить исследования по направленному поиску новых перспективных
штаммов дрожжей.
Дрожжи очень широко распространены в природе и в
окружающей человека среде. Они активно размножаются в тех
субстратах, где имеются доступные растворимые источники углерода —
простые сахара, спирты, органические кисЛоты, т. е. в соках, сиропах,
на плодах, в нектаре цветов, в сокотечениях деревьев, на
поверхности листьев, в воде и почве. Хотя дрожжи и не вызывают
образования токсических веществ при развитии на пищевых продуктах,
они могут изменять их вкус, запах и внешний вид. Некоторые
дрожжи связаны с насекомыми, теплокровными животными и
человеком и могут быть возбудителями ряда тяжелых заболеваний.
Поэтому выделение дрожжей из очагов их размножения и
проведение видовой идентификации — важные и обязательные этапы
исследования причин порчи продуктов или болезни.
3
В последние годы убедительно была показана чрезвычайная
гетерогенность дрожжей в таксономическом отношении. Достаточно
сказать, что представителей этой группы организмов сейчас
помещают в разные классы или отделы Mycota — царства грибов.
Сам термин «дрожжи» таксономического значения не имеет. Под
«дрожжами» в настоящее время понимают все высшие грибные
организмы, находящиеся в одноклеточной форме в ростовой фазе
и размножающиеся почкованием или делением. Определение
это довольно зыбкое, поскольку немало хорошо известных
дрожжей способно в определенные фазы развития образовывать
различные мицелиальные структуры, а некоторые мицелиальные грибы
при специальных условиях культивирования растут в дрожжеподоб-
ной форме. Преимущественное существование в виде отдельных
клеток тем не менее накладывает на организмы столь большой
отпечаток, что оправдывает рассмотрение дрожжей в качестве
обособленной группы. Важным следствием одноклеточного
существования является, в частности, повышение метаболической
активности, интенсификация обмена с окружающей средой в результате
увеличения отношения поверхности клетки к ее объему.
Несомненно, что повышенная скорость осуществляемых дрожжами процессов
явилась одной из причин давнего практического использования
человеком дрожжевых организмов. Техника культивирования,
методы изучения и идентификации дрожжевых организмов во многих
чертах более близки к бактериологическим, нежели
микологическим. Эта специфика, своеобразие рассматриваемой группы
организмов, огромное практическое значение ее представителей и
обусловливают относительную самостоятельность раздела микологии —
зимологии, посвященного изучению дрожжевых организмов [56].
Одна из главных задач настоящего справочного руководства —
способствовать унификации методов и сред, используемых при
выделении, хранении и идентификации дрожжей. Поскольку в
последние годы в таксономии дрожжей произошло много изменений,
введено немало новых тестов, значительно усовершенствованы старые,
другая задача — обеспечить работников научных и прикладных
лабораторий пособием, в котором учтены эти изменения и описаны
все тесты, проведение которых по современным требованиям
обязательно для полного описания новых таксонов дрожжей.
Быстрый рост списков новых родов и видов дрожжевых
организмов приводит к тому, что составляемые определители требуют
постоянного пересмотра и дополнения. На русском языке имеются
только два соответствующих руководства — Н. А. Красильникова
[10] и В. И. Кудрявцева [11], оба изданные в 1954 г. и поэтому
сильно устаревшие. Значительно больший по объему определитель
на английском языке, составленный группой компетентных авторов
под общей редакцией Дж. Лоддер [55], также не исчерпывает всех
известных к настоящему времени видов дрожжей. Поэтому при
написании данного руководства было решено включить в него
помимо методов и диагностические ключи для всех известных к
настоящему времени родов дрожжей, полные описания которых и
ключи для определения видов внутри них можно найти по
указанным определителям или авторским описаниям.
Книга состоит из трех глав. В первой главе собраны методы,
используемые на всех этапах работы по выделению дрожжей из
разных субстратов и источников, начиная от сбора образцов и под-
4
готовки материала к анализу и кончая получением чистых культур,
поддержанием и хранением их в коллекции. В эту главу
включены также методы количественного учета дрожжей. В связи с тем,
что в настоящее время происходит быстрый рост объема крупных
национальных коллекций в производственных лабораториях и
научных учреждениях, это требует усовершенствования способов
длительного хранения дрожжей без потери их ценных
производственных свойств. Проблема эта очень сложна и далека от более или
менее удовлетворительного решения. Исходя из задач данного
руководства, мы не ставили перед собой цели осветить все
методические стороны этой проблемы. В руководство включены только
краткие рекомендации относительно наиболее распространенных и
апробированных во многих лабораториях методов поддержания и
хранения культур дрожжей.
Во второй главе описаны методы изучения таксономических
признаков, необходимых для идентификации дрожжей. Полный
перечень этих признаков, приводимый в конце главы, представляет
собой одновременно схему, по которой составляется стандартное
описание новых видов дрожжей.
Третья глава «Классификация дрожжей» включает краткие
диагностические описания всех родов, которые входят в упомянутые
выше определители дрожжей [10, 11, 55]. Для тех родов, которые
были,описаны позже, приводятся ссылки на оригинальные
публикации! Чтобы сделать пользование этими описаниями более удобным,
им предпосылаются рабочие ключи. При их составлении мы
исходили из наиболее общепринятой концепции деления дрожжей на
три крупные группы: аскомицетовых, базидиомицетовых и
несовершенных. Этот раздел следует рассматривать как служащий сугубо
прагматическим целям.
Глава I. МЕТОДЫ ВЫДЕЛЕНИЯ
И ПОДДЕРЖАНИЯ КУЛЬТУР ДРОЖЖЕЙ
ОТБОР ПРОБ И ПОДГОТОВКА МАТЕРИАЛА
ДЛЯ КОЛИЧЕСТВЕННОГО УЧЕТА И ВЫДЕЛЕНИЯ
ДРОЖЖЕЙ
В зависимости от программы исследований выбирают тот или
иной метод отбора образцов, позволяющий либо только
обнаружить, либо обнаружить и количественно учесть дрожжевые
организмы в анализируемом субстрате. В разных областях научных
исследований и каждой отрасли промышленности имеются свои
указания относительно деталей правильного отбора проб для
микробиологического анализа *.
Поверхность твердого тела. Ее исследуют путем получения
смыва, отпечатка или соскоба.
Смыв производят стерильной водой непосредственно с
объекта, помещая его в сосуд или же при больших размерах
объекта пользуясь ватными и марлевыми тампонами. Такие тампоны
затем опускают в суспензионную жидкость, встряхивают и делают
высев. Недостатки этого метода заключаются в том, что его, во-
первых, трудно стандартизовать (разные люди прикладывают
разные усилия при смыве) и, во-вторых, вата активно сорбирует
клетки микроорганизмов и суспензия получается обедненной. Для
количественного учета эта техника непригодна. Несмотря на
указанные недостатки, различные методы смыва остаются наиболее
распространенными в области медицинской и санитарной
микробиологии, а также при изучении эпифитной флоры зеленых растений.
В последнем случае используют непосредственный смыв без
тампонов путем перенесения целых листьев или их частей в колбы с
водой. При сравнительных исследованиях из листа вырезают
пластинки стандартной площади, чтобы можно было сделать пересчет
числа микроорганизмов на 1 см2. Листья или вырезанные из них
пластинки встряхивают в колбе с водой 10 мин на качалке, а затем
делают высев. Растирание материала, которое иногда рекомендуют,
не всегда желательно, так как при этом освобождаются токсические
вещества, фитонциды, которые могут оказать губительное действие
на микробные клетки.
Метод смыва с поверхностей применяют и при исследовании
таких объектов, как плоды и овощи, зерно и семена, мясо и шкуры
и т. п., а также с оборудования.
С о с к о б производят стерильным скальпелем непосредственно
в сосуд со стерильной водой. Суспензию перед посевом либо встря-
* Рыкова Л. И., Черняева М. И. Основы
микробиологического контроля консервного производства. М., 1967.— 40 с.
Методы анализа пищевых, сельскохозяйственных и медицинских
препаратов. М., 1974.—743 с.
Методы изучения почвенных микроорганизмов и их
метаболитов. М., 1966, с. 7—25.
6
хивают 10 мин, либо обрабатывают 5 мин на микроразмельчителе
тканей марки РТ-2.
Отпечатки приготовляют прямыми или опосредованными
методами.
Прямые методы основаны на снятии дрожжевых клеток с
исследуемой поверхности различными прозрачными адгезивными
материалами: коллодиевой пленкой, бесцветным лаком, липкой
целлофановой лентой, полиэтиленовой пленкой, смазанной клеящим
веществом. Полученные отпечатки просматривают под микроскопом,
опуская пленки в каплю воды или лактофенола * на предметном
стекле.
Липкой лентой можно снимать и предварительно нанесенную
на поверхность объекта тонкую агаровую пленку. Полоску ленты с
агаром и прикрепившимися к нему дрожжевыми клетками
рассматривают затем под микроскопом без проращивания. Методы
получения отпечатков имеют некоторые общие недостатки: далеко не
все клетки снимаются с исследуемой поверхности; при густой об-
семененности клетки могут располагаться слишком близко друг от
друга и их трудно учитывать. При получении отпечатка с
последующим проращиванием исследуемый объект прижимают к
поверхности плотной питательной среды, а затем его удаляют, и чашки
со средой ставят в термостат. Таким образом удается хорошо
наблюдать плотность заселения и характер распределения дрожжей
на поверхности листовой пластинки (рис. 1). Если объект большого
размера, то поступают наоборот: к нему прижимают
приготовленную среду, пользуясь, например, методом агаровой колбаски.
Колбаски делают из разных питательных агаров, запечатывая их
стерильно в пергаментную обертку. Перед использованием верхнюю
часть колбаски срезают острым стерильным ножом и плотно
прижимают свежую поверхность среза к исследуемому объекту. Срезая
последовательно круглые ломтики, их по 4 размещают в
стерильные чашки Петри (рис. 2) и проращивают во влажной камере.
Отпечатки можно получать с помощью мягких пластичных
материалов, таких, как бархат, замша, вельвет, из которых делают
круглые подушки — репликаторы. Лучший для этих целей
материал — бархат велюр, белый или бледно-желтый (другие краски
могут быть токсичными). Бархат первоначально кипятят, затем
вырезают из него круглые куски и приклеивают их к алюминиевым
дискам такого размера, чтобы они помещались в чашку Петри.
Стерилизуют их завернутыми в бумагу сухим жаром при 160° С 1 ч.
Перед использованием поверхность .бархата смачивают жидкой
питательной средой и прикладывают его к исследуемому объекту на
несколько секунд. Затем (не сдвигая!) осторожно отнимают и
переносят в чашку Петри. Отпечатки делают на серии чашек с
одной или разными средами. После употребления репликаторы
стерилизуют в сосудах с водой автоклавированием 20 мин при 120° С,
подсушивают и расправляют бархат шпателем. Особенно удобно
пользоваться мягкими репликаторами при работе с неровными и
шероховатыми поверхностями.
* Лактофенол получают следующим образом: кристаллы
фенола расплавляют на водяной бане и взвешивают 20 г. Добавляют
20 г молочной кислоты, 40 г глицерина и 20 мл дистиллированной
воды.
7
Рис. 1. Отпечатки листьев растений иа сусло-агаре: слева — нижняя,
справа — верхняя поверхность листа.
Рис. 2. Отпечатки, полученные методом «агаровой колбаски» /, 2,
3 — блоки с последовательными отпечатками; 4 — контрольный
стерильный блок; 5 — агаровая колбаска.
8
Сыпучие и плотные субстраты. Их берут для анализа в cfti*
рильные пергаментные пакеты. Влажные пробы отбирают в
стерильные стеклянные банки или новые полиэтиленовые пакеты.
Отбор проб ила со дна водоемов производят стратомстром, или дио-
черпателем [17]. В других случаях пробы можно брать специальной
ложкой, ножом или шпателем, которые предварительно протирают
спиртом и обжигают.
При сборе образцов почв для экологического исследования
соблюдают специальные правила, гарантирующие получение
репрезентативной выборки. Индивидуальные пробы почвы (не менее 300 г)
берут в разных точках участка рандомизированно или по схеме,
которая зависит от размера обследуемого участка: 3 пробы по
диагонали на участке до 100 м2 и не менее 5 — на больших площадях.
Индивидуальные пробы анализируют либо отдельно, либо из них
готовят смешанные образцы, масса которых должна быть не менее
500 г.
Почвенные образцы при невозможности их немедленного
анализа сразу же после сбора подсушивают или в теплом
помещении на воздухе в приоткрытых с одной стороны пакетах, защищая
их при этом от прямого солнечного света, или в сушильном шкафу
при температуре не выше 28—30° С. Последнее условие нельзя
использовать для почв, в которых требуется провести поиск психро-
фильных дрожжей, так как они при этой температуре погибают.
Эти образцы лучше хранить в замороженном состоянии при —7° С.
Перед приготовлением навески почву измельчают в ступке и
просеивают через сито, удаляя крупные камни и корни растений.
Навеску в 1, 5 или 10 г подвергают 10-минутному растиранию с
водой резиновым пестиком или пальцем в резиновой перчатке и
смывают в колбу порциями той воды, которая приготовлена для
получения суспензии. Навеску можно также обрабатывать 5—
10 мин на микроразмельчителе тканей при частоте вращения
5000 об/мин или 3 мин на низкочастотном дезинтеграторе типа
УЗДН-1 (22 кГц; 0,4 нм).
Прозрачные жидкости или взвеси. Присутствие дрожжей в них
можно установить непосредственно под микроскопом или после
концентрирования на центрифугах при частоте вращения 2000 об/мин
в течение 15—20 мин.
Пробы воды и жидкостей отбирают в стерильные сосуды. Воду
из природных водоемов берут специальными приборами —
батометрами, устройства которых описаны в соответствующих
руководствах по водной микробиологии [17].
Воду из батометров фильтруют через мембранные фильтры с
порами диаметром 1,2 мкм. Далее фильтры либо помещают на
поверхность питательных сред для проращивания клеток дрожжей,
либо окрашивают и наблюдают под микроскопом. Можно брать два
фильтра: один для проращивания или окраски, а другой (нижний)
для контроля на пропускание.
Масла и эмульсии, включая сливочное масло и мороженое,
можно также исследовать методом мембранных фильтров после
обработки их эмульгаторами. Жидкости и взвеси необходимо
анализировать вскоре после отбора проб, а при невозможности этого
хранить в холодильнике не более 1—2 сут, так как далее
первоначальное количество дрожжей в них может существенно измениться.
Воздух. Методы анализа воздуха основаны либо на осаждении
9
аэрозолей, либо на фильтрации его через Жидкости Или твердые
фильтры.
Метод Коха основывается на свободном оседании микробных
аэрозолей на поверхность питательной среды под влиянием
гравитационных сил. Чашки со средой оставляют открытыми на 5—
15 мин, а затем закрывают и помещают в термостат. Этот метод
используют для обнаружения дрожжей в воздухе закрытых
помещений при кратковременной экспозиции чашек. В открытых местах
его использованию мешают горизонтальные токи воздуха.
Все другие методы определения микроорганизмов в воздухе
основаны на принудительном его токе, который создается разными
способами. Для исследования атмосферного воздуха и воздуха
производственных помещений применим щелевой метод с
использованием аппарата Кротова *.
Для санитарно-микологического контроля окружающей среды
на предприятиях по производству белково-витаминных препаратов
и кормовых дрожжей количественный учет дрожжей — продуцентов
рода Candida рекомендуется проводить щелевым методом на
сусло-агаре и МБС— метабисульфитном агаре (МПА+0,2% мета-
бисульфита натрия) с добавлением биомицина в количество
100 000 ед/л. Рост продолжается 48 ч при 37° С [5].
Для фильтрации воздуха через жидкости используют прибор
Киктенко, основанный на осаждении микробных клеток в
улавливающей жидкости, которую затем переносят по 0,1—0,3 мл на
плотную среду и проращивают.
ПОСЕВ И УСЛОВИЯ ВЫРАЩИВАНИЯ
Общий принцип посевов заключается в том, что образец
превращают в такое состояние, когда он может быть серийно
разведен, чтобы сделать из него высев или сразу на чашки, или
перевести клетки сначала на мембранные фильтры.
В качестве суспензионных жидкостей используют стерильную
водопроводную воду, в которую иногда добавляют поверхностно-
активные вещества (например, Твин-80, 1 капля на 0,5 л), 0,5%-ный
раствор NaCl в дистиллированной воде (при выделении осмофиль-
ных и галотолерантных дрожжей), охлажденную до 4—5°С
водопроводную воду (при выделении психрофильных дрожжей).
Высев на плотные среды из подготовленной суспензии делают
пипеткой, внося в каждую чашку по 0,5 мл или по одной капле
измеренного объема. Чашек берут всегда не менее трех для
каждого разведения, чтобы получить среднее число колоний на одной
чашке.
* Устройство и способы применения указанных здесь
приборов описаны в книге И. М. Вольпе, В. Д. Кучеренко
«Практическое руководство по санитарной микробиологии», М., 1970. В этом
же руководстве описаны методы фильтрации воздуха через твердые
нерастворимые фильтры и через растворимые в среде желатиновые
пенистые фильтры. Дополнительные сведения о методах
микробиологического анализа воздуха можно найти в книге Ф. Грегори
«Микробиология атмосферы», М., 1964; в обзоре А. И. Жуковой
«Методы микробиологического исследования воздуха». —
Микробиология, т. 31.
10
После посева чашки инкубируют 24 ч в обычном положении,
чтобы агар адсорбировал жидкость, а затем чашки
перевертывают во избежание попадания на поверхность капель конденсата с
крышки.
При инкубировании посевов большое значение имеет
поддержание определенной температуры. Преобладающее число видов
дрожжей относится к группе мезофильных микроорганизмов с
температурными границами роста в пределах от 2—5 до 30—37° С и
оптимумом при 26—28° С. Среди дрожжей нет истинных
термофилов, для роста которых требуются температуры выше 50е С. При
выращивании дрожжей при температуре 40—45° С необходимо
добавлять в среду олеиновую кислоту.
Подбор температурных условий при выделении дрожжей
зависит от источника выделения и целей исследования. Из
теплокровных животных и из различных органов человека и связанных с ним
субстратов дрожжи выделяют при 37е С, если хотят найти
патогенные формы, и при 28° С в случае поиска сапрофитных видов.
Если дрожжи растут при 37е С, то требуется соблюдать
осторожность, так как среди них могут быть патогенные — Cryptococcus
neoformans или Candida albicans (=Syringospora albicans).
Посевы из материала, где предполагается наличие психро-
фильных дрожжей, инкубируют в холодильнике при температуре
4-5° С.
Сроки инкубирования непосредственно зависят от температуры.
При 37° С инкубируют не более 4Г а в холодильнике не менее
14 сут. Если дрожжи дают визуально-заметный рост при 4—5° С в
течение .7—10 дней, то их относят к истинным психрофилам при
условии, что выше 20е С они не растут. Температурный оптимум
таких дрожжей находится обычно в диапазоне от 10 до 15° С. Псих-
ротолерантные дрожжи вырастают при 5е С в течение 2—3 недель,
а психрофобные при температуре ниже 30° С не растут совсем.
В посевах из почвы, инкубируемых при низких температурах,
удается учесть в 2—3 раза больше дрожжей, чем при 28° С, так как
росту дрожжевых колоний при этом не мешают грибы с быстро
распространяющимся мицелием. Учет опытов в этих случаях
следует производить дважды — через две недели и через месяц.
СРЕДЫ ДЛЯ ВЫДЕЛЕНИЯ ДРОЖЖЕЙ
Стандартные полноценные питательные среды. Эти среды
применяют с целью наиболее полного учета и выделения большинства
видов дрожжей. Наиболее широко используемой полноценной
средой для выращивания дрожжей является солодовое сусло. В его
состав входят глюкоза, фруктоза, сахароза, мальтоза, мальтотрио-
за и мальтотетраоза, а также небольшое количество пентоз — ара-
биноза, ксилоза и рибоза. Азотные компоненты составляют 6—7%
сухих веществ (СВ), среди них аммонийного азота 2,18—2,44 мг
на 100 мл. В сусле имеются аминокислоты, все основные
витамины группы В и минеральные вещества, содержание которых
зависит от используемой воды.
Сусло получают с пивоваренных заводов неохмеленное, после
фильтрации. Его разводят водопроводной водой до концентрации
6-8% СВ.
11
Для приготовления сусла в лаборатории используют ячменный
солод крупного помола с высокой осахаривающей способностью.
В 1 л воды вносят 250 г солода и нагревают до 50е С. Через 30 мин
температуру повышают до 55° С, а еще через 30 мин постепенно
поднимают до 62,5—63° С и не снижают до исчезновения реакции
на крахмал (йодная проба). Полученное сусло отделяют от
дробины путем фильтрации через марлю и вату, разбавляют водой до
нужной концентрации, разливают но колбам и стерилизуют при
112° С 30 мин. Если рН ниже 5,5, то сусло подщелачивают
10%-ным раствором соды или едкого кали до получения рН 5,6—
6,0. Сусло очищают от примесей кизельгуром или отстаиванием в
холодильнике и фильтрацией. Для приготовления плотных сред к
суслу перед стерилизацией добавляют 2% агара или 20%
желатины.
Сусло-агар можно приготовить из сухого солодового экстракта.
20 г порошка растворяют в 400 мл горячей дистиллированной
воды, содержащей 12 г агара, и стерилизуют при 121° С 15 мин.
Из синтетических сред наиболее часто для дрожжей
используют агар Сабуро, называемый также глюкозо-пептонной средой, со
следующим составом (в г на 1 л водопроводной воды): глюкоза
40, пептон 10, агар 20.
Глюкозо-аммонийная среда содержит (в г на 1 л
водопроводной воды) следующие вещества:
Глюкоза 20,0 MgS04 0,5
(NH4)2S04 5,0 NaCl 0,!
KH2P04 0,85 CaCL 0,1
K2HP04 0,15 Агар 20,0
Для обогащения факторами роста к этим средам добавляют
иногда дрожжевой (0,2%) и мясной (0,3%) экстракты и
виноградный сок (3%).
Дифференциальные среды. Их используют при выделении
дрожжей из субстратов, сильно загрязненных другими
микроорганизмами. ~
Для подавления роста сопутствующих микроорганизмов к
указанным выше питательным средам добавляют различные
ингибиторы. Рост большинства бактерий и актиномицетов подавляется при
низком значении рН среды, поэтому чаще всего среды для
выделения дрожжей подкисляют до рН 4,5 путем добавления к ним
минеральных или органических кислот. Для синтетических сред
наиболее применима соляная кислота, для сусловых — молочная,
лимонная или винная. Для подкисления заводского солодового сусла
(6—8% СВ) обычно требуется 3—4 мл/л концентрированной
молочной кислоты. Кислоты добавляют в жидкую или расплавленную
агаровую среду после стерилизации, непосредственно перед
засевом или перед разливкой в чашки Петри. Все дрожжи, кооме
Schizosaccharomyces pombe (pH 5,45), растут при рН до 2,5. Если
брать 3% агара, то среда застывает при рН 4,8.
Вместо кислот используют также антибиотики широкого
спектра действия: стрептомицин (80 мг/л или 100 ед/мл), пенициллин
(20—100 ед/мл), левомицетин (50 мг/л) и др. Их можно добавлять
в среду порознь и в комплексе. Например, против
кислотоустойчивых бактерий применяют следующие смеси антибиотиков: актино-
мишш 2 мг/л+ауреомицин 50 мг/л; пенициллин 60 ед/мл+стрепто-
12
мицин 100 ед/мл; левомицетин (хлорамфеникол) 20 мг/л + стреито-
мицинсульфат 20 мг/л-f хлортетрациклин солянокислый 100 мг/л.
Для отделения сахаромицетов от других дрожжей добавляют
2,5% этилацетата и рН до 4,0 доводят уксусной кислотой. Затем
чашки герметизируют. При этих условиях колонии сахаромицетов
появляются первыми.
Росту дрожжей на питательных средах при высеве из
исходного материала зачастую препятствуют грибы с широко
распространяющимися по поверхности субстрата мицелиальными колониями.
Они имеют общие с дрожжами потребности в источниках
питания, устойчивы к низким значениям рН среды и нечувствительны
к действию указанных выше противобактериальных антибиотиков.
Для ограничения роста микромицетов в среду добавляют
специфические вещества: дифенил (0,005—0,01%) *, бычью желчь (0,25—
0,5%), теллурат калия (0,05—0,15%), пропионат натрия (0,15—
0,25%), — или некоторые красители: бром-крезоловый пурпурный
(0,0025% или 2,5 мл/л 1% раствора), бенгальский розовый
(0,003%), кристаллический фиолетовый (0,001%).
Элективные среды. Их применяют для дрожжей из
специфических мест обитания.
Осмофильные дрожжи, обитающие в природе в гнездах диких
пчел (в меде), обнаруживаемые в производстве сахара и при
порче меда или других продуктов с большим содержанием сахара,
выделяют на средах с высоким осмотическим давлением: на
медовом и осмофильном агарах.
Состав сред:
медовый агар: 70% меда в водопроводной воде и 2% агара;
синтетический «медовый» агар: 60 г глюкозы, 0,5 г
дрожжевого экстракта, 2,5 г агара, 100 мл воды;
осмофильный агар: в сироп, содержащий 35 массовых частей
сахарозы и 10 частей глюкозы, добавляют агар и стерилизуют
20 мин при 112°. Повторное расплавление не рекомендуется.
При выделении осмофильных дрожжей посевы делают на
указанные среды и для сравнения — на обычные. Сахар, мед или
сиропы растворяют в воде и фильтруют через мембранные фильтры,
которые затем помещают для проращивания на агаровые среды.
Почвенные олигонитрофильные дрожжи Lipomyces выделяют на
безазотистых средах. Примером такой среды может служить
модифицированный агар Эшби (в г на 1 л дистиллированной воды):
/,(.f//•-¦//
Сахароза 20,0 NaCl 0,2
К2НР04 0,2 K2S04 0,1
КН2РО, 0,1 Агар 20,0
MgS04.7H20 0,2
Для подавления роста бактерий к этой среде добавляют 80 мг/л
стрептомицина. Посев производят комочками почвы: навеску в
100 мг распределяют на две чашки Петри, по 50 комочков на
каждую. Для равномерного распределения используют трафарет,
который подкладывают под чашку. Учет обрастаний производят че-
* Для получения исходного раствора 100 мг дифенила
растворяют в 1 мл этилового спирта на водяной бане при 40—50° С.
13
рез 25—30 сут инкубирования при комнатной температуре.
Результат выражают в процентах обрастания комочков почвы молочно-
белыми слизистыми колониями липомицетов.
КОЛИЧЕСТВЕННЫЙ УЧЕТ И ВЫДЕЛЕНИЕ ДРОЖЖЕЙ
Дрожжевые колонии в посевах учитывают следующим
образом. Обратную сторону каждой чашки разделяют чернилами или
тушью на большее или меньшее число частей — от четырех до
шестнадцати в зависимости от густоты посева — и просматривают
все колонии па каждой площади с объективом 10Х в
просвечивающем микроскопе или с бинокулярной лупой в отраженном свете.
Описывают все встречающиеся типы колоний в стандартных
терминах (см. гл. II). Из них готовят препараты и микроскопируют
при больших увеличениях. Этот детальный просмотр колоний при
первом посеве очень важен, так как при последующих пересевах
некоторые признаки, например спорообразование, иногда исчезают.
Рекомендуется сразу же делать фотографии или зарисовки.
Колонии разных типов нумеруют и просчитывают отдельно.
Учет производят дважды. В первый срок отмечают с обратной
стороны чашки все выросшие и просчитанные колонии, а затем
оставляют чашки еще на несколько дней для наблюдения за
возможным появлением колоний медленнорастущих дрожжей.
При необходимости количественного учета расчет численности
дрожжей п в единице массы или объема исследуемого материала
ведут по формуле
п — абв;
где а — среднее число колоний на одной чашке Петри;
б— число капель в 1 мл суспензии данного разведения;
в — степень разбавления образца.
Отдельные изоляты (штаммы) получают путем пересева из
индивидуальных колоний в пробирки на те же среды, на которые
производили первичный высев, но без добавления специфических
ингибиторов.
ПОЛУЧЕНИЕ ЧИСТЫХ КУЛЬТУР ДРОЖЖЕЙ
Чистой микробной культурой называют
популяцию, представляющую собой потомство одной или нескольких
клеток одного вида микроорганизма. Каждый новый изолят носит
название штамма, которому присваивают буквенное или номерное
обозначение.
Расами называют производственные штаммы одного вида
дрожжей, различающиеся между собой по степени проявления
физиологической активности.
В генетических исследованиях пользуются так называемыми
клонами — чистыми культурами, полученными от одной споры
или гаплоидной клетки.
Существуют, прямые и непрямые методы получения чистых
культур дрожжей. Первые основаны на выделении одной клетки
14
или споры под непосредственным контролем через микроскоп. Во
втором случае используют косвенные приемы для разделения
клеток.
Прямые методы
Капельный способ Линднера. Суспензию дрожжей разбавляют
жидким суслом до концентрации «100 клеток в 1 мл и
стерильным чертежным пером наносят мельчайшие капельки на необез-
жиренное покровное стекло, простерилизованное фламбированием
в пламени газовой горелки. Капельки располагают в определенном
порядке, обычно по пять капель в два ряда, т. е. всего 10 капель
на стекле. Затем быстро опрокидывают стекло над влажной
камерой, которую запечатывают минеральной смазкой. Все капли
немедленно просматривают под микроскопом и отмечают те из них,
которые содержат по одной единственной клетке. Если все капли
содержат по нескольку клеток, то увеличивают разбавление
суспензии и процедуру повторяют. После трех—четырехдневного
инкубирования, когда отмеченные единичные клетки образуют
микроколонии, последние переносят стерильной иглой или полоской стерильной
фильтровальной бумаги в жидкую среду и размножают.
Метод Линднера в видоизменении Надсона. Чистое покровное
стекло проводят трижды через пламя горелки и края его обводят
мастикой (смесь равных частей парафина и вазелинового масла).
На центральную часть стекла наносят плоскую каплю прозрачной
среды с 10% желатины или 0,5% агара. В теплую и еще
незастывшую среду вносят иглой суспензию дрожжей такого разведения,
чтобы в каплю попало всего несколько клеток. Стекло помещают во
влажную камеру и рассматривают препарат при малом увеличении
микроскопа.
Находят ориентиры, которыми могут быть частички взвеси,
пузырьки воздуха или дефекты стекла, и вычерчивают карту с
расположенными по отношению к ориентирам одиночными клетками
дрожжей. Через каждые 10—20 ч препарат повторно исследуют,
зарисовывая все изменения. Когда отмеченные клетки разрастаются
в микроколонии, покровное стекло перевертывают на предметное и
под контролем глаза при малом увеличении микроскопа переносят
иглой материал в пробирки.
Метод Линднера, упрощенный Вучковичем. Видоизменение Вуч-
ковичем метода Линднера сводится к тому, что капельки
суспензии, содержащие 3—4 клетки дрожжей, снимают петлей, которой
предварительно захватывают стерильную среду, и переносят
штрихом на поверхность плотной среды. Через некоторое время
появляются микроколонии, число которых на одном штрихе должно
соответствовать количеству исходных клеток в отмеченной
капельке.
Из этих колоний пересевом выделяют чистые культуры. Таким
способом можно сразу получить несколько одноклеточных культур
за короткое время.
Выделение спор дрожжей при помощи микроманипулятора.
К использованию микроманипулятора прибегают главным образом
при необходимости изолировать споры из асков, так как
вегетативные клетки легко повреждаются при микроманипулировании.
15
Аски разрывают либо механически прикосновением игл мйкрб-
манипулятора, либо заранее обрабатывая суспензию препаратом
ферментов (например, из пищеварительного тракта виноградной
улитки Helix pomatia), лизирующих клеточную стенку дрожжей.
Для работы с микроманипулятором требуются специальные
стеклянные микроиглы и влажные камеры. Методика их
изготовления и детали работы при извлечении аскоспор дрожжей описаны в
руководствах по генетике и селекции дрожжей [9, 18].
Непрямые методы
В эту группу включаются методы, основанные на разделении
клеток в питательных средах и использовании специфических
биологических особенностей отдельных видов для создания
преимущественных условий для их роста.
Метод поверхностного посева на агаровые среды. Посевы
производят либо из суспензии пипеткой, либо петлей по принципу
«истощающего штриха».
Каплю суспензии, содержащей дрожжевые клетки, наносят на
поверхность застывшей подсохшей среды в чашке Петри.
Стерильным стеклянным шпателем равномерно распределяют каплю но
поверхности. Этим же шпателем можно еще засеять 2—3 чашки на
случай, если в первой будет очень густой рост колоний. Процесс
выделения чистой культуры заканчивается пересевом из отдельной,
выросшей изолированно колонии в пробирку. Контролем чистоты
выделенной культуры служит однородность клеток под микроскопом
и однотипность колоний на чашке при последующем рассеве.
Посев «истощающим штрихом» производят петлей: либо
нанося очень густые штрихи, либо прожигая петлю после каждого
штриха, как это показано на рис. 3.
Рис. 3. Разные способы посева «истощающим штрихом» для
получения отдельных колоний: 1, 2, 3, 4, 5, 6 — последовательность
нанесения штрихов. На двух последних чашках петлю после
каждого штриха прожигают.
Метод рассева на поверхности агаровых сред можно применять
как при работе с уже имеющимися культурами при проверке их
чистоты, так и при первичном выделении дрожжей из любого
субстрата. С целью повышения возможностей избирательного
выделения культур дрожжей определенного вида для рассева использу-
16
tot элективные среды, а при культивировании создают особые
Температурные условия, например психрофилы выделяют при 0°С, а
условно патогенные — при 37° С (см. выше раздел «Посев и
условия выращивания»).
Для выделения дрожжей родов Brettanomyces и Lipomyces
используют их устойчивость к антибиотику актидиону (циклогек-
симиду), добавление которого в среду в концентрации 100—
200 мг/л подавляет рост большинства видов других дрожжей (см.
гл. II).
Выделение чистых культур баллистоспоровых дрожжей. Бал-
листоспоровые дрожжи легко получить в чистой культуре,
используя .их способность отбрасывать споры на значительное расстояние.
Если после посева на поверхность агаровой среды налить
расплавленный агар в крышку чашки Петри и инкубировать ее в
перевернутом положении, то через некоторое время на нижней пластинке
появятся колонии в результате прорастания отстрелявшихся баллис-
тоспор.
ПРОВЕРКА ЧИСТЫХ КУЛЬТУР
Время от времени культуры как в коллекциях, так и в
промышленности проверяют на наличие загрязнений или на появление
мутантов.
Для обнаружения «диких» дрожжей среди сахаромицетов
делают рассев репликатором на лизиновый агар (углеродная
основа + 0,1% L-лизина как единственного источника азота), на
котором S. cerevisiae и S. carlsbergensis не растут, а «дикие» дрожжи
растут. Petite или RD-мутанты (дефектные по дыханию) на сусло-
агаре образуют окрашенные мелкие колонии. На среде с теллури-
том они не восстанавливают последний.
Масса чистых колоний на подходящей среде пересевается как
«материнская» культура. Из 50 одноклеточных культур готовят
гигантские колонии и выявляют мутанты (секторы в колониях),
исследование которых важно с точки зрения использования в
промышленности.
ОЧИСТКА ДРОЖЖЕВЫХ КУЛЬТУР ОТ КЛЕЩЕЙ
С микрофильными клещами, попадающими иногда в грибные
и дрожжевые коллекции, можно бороться с помощью пара-дихлор-
бензола или инсектицида линдана.
В первом случае в плотно закрывающийся контейнер помещают
горсть кристаллов мара-дихлорбензола и пробирку с зараженной
клещами культурой и выдерживают 4 ч. Процедуру повторяют
через неделю, а затем делают пересев.
Во втором случае добавляют 0,1 г/л порошка линдана к
питательной среде, автоклавируют и делают пересев зараженной
культуры на эту среду. Клещи гибнут через 3 мин после попадания
на этот агар, а дрожжи после появления видимого роста
пересевают на обычную среду.
17
ПОДДЕРЖАНИЕ И ХРАНЕНИЕ КУЛЬТУР ДРОЖЖЕЙ
Длительное поддержание чистых культур микроорганизмов
необходимо как при проведении научно-исследовательских работ, так
и в* производстве и при хранении в коллекциях.
Из-за различий биологических свойств видов невозможно
использовать с равноценными положительными результатами один
общий способ хранения для разных культур дрожжей. Большой опыт
по хранению культур микроорганизмов, в том числе и дрожжей,
накоплен сотрудниками крупных национальных коллекций [12, 15, 50],
в которых имеется возможность проверять и оценивать разные
методы хранения применительно к широкому набору дрожжевых
организмов.
Наиболее широко применяемый способ — это поддержание
культур путем их периодических пересевов. В последние два
десятилетия получили распространение также методы хранения
микробных культур под минеральным маслом и лиофильная сушка.
Так как эти три метода применяются уже много лет, то имеется
возможность сравнительной оценки их пригодности для хранения
разных видов дрожжей. Другие, менее широко используемые или
недавно разработанные методы можно рекомендовать лишь для
проверки с обязательным дублированием культур, которые
поддерживаются обычными способами.
Периодические пересевы
Обычно культуры поддерживают, пересевая их на агаровых
средах в двойной повторности. Одна пробирка, которую после
засева совсем не открывают, служит контрольной, а из второй по
мере надобности делают отсевы.
Частота пересевов. Сроки пересевов определяют для
большинства культур дрожжей скоростью высыхания среды. Она зависит
от температуры и влажности помещения, где хранят пробирки.
В голландской коллекции *, насчитывающей более 6000 штаммов
дрожжей, культуры хранят в специально предназначенной для этих
целей, постоянно проветриваемой комнате, где температура
поддерживается зимой 18° С, а летом 20° С. Частота пересевов при
этих условиях — каждые 5—7 мес или 5 раз в два года для
основной массы культур и более частые для немногих других:
например, ежемесячные для Schizosaccharomyces japonicus и каждые две
недели для Cyniclomyces ( = Saccharomycopsis) guttulata.
Промежутки между пересевами можно увеличить за счет
более плотного закупоривания пробирок и снижения температуры
хранения. Так, использование пробирок с завинчивающимися
металлическими крышками вместо обычных ватных пробок
предохраняет от высушивания, но хуже обеспечивает чистоту сохраняемых
культур. Применение вазелинового масла для снижения скорости
высыхания культур также имеет свои недостатки, о чем речь будет
идти ниже. Поэтому хорошо сделанные ватные пробки (их можно
сверху заливать парафином) все же остаются лучшим средством
* г. Дельфт, CBS — Centraalbureau voor Schimmelcultures,
Нидерланды.
18
закрывания пробирок. Они обеспечивают достаточный газообмен,
хорошо предохраняют от микробного загрязнения и легко
изготовляются с помощью специальных машин (например, марки У4.2
Одесского экспериментального завода), которые просты и доступны
для любой лаборатории.
Ватные пробки, однако, не предохраняют культуры от
заражения их микофильными клещами (mites). Для профилактики
используют следующий прием. Перед посевами или пересевами
культур пробку слегка выдвигают из пробирки и наносят на нее каплю
раствора, содержащего 10 г сулемы, 50 мл глицерина, 500 мл
этилового спирта и 450 мл воды. Затем пробку вдвигают в пробирку
и несколько раз проворачивают ее, чтобы смочить внутренние
стенки пробирки. В раствор можно добавить какой-либо краситель для
контроля за равномерностью смачивания.
Температура. Если хранение ведется при температуре в
пределах 15—20° С, то после пересева пробирки сразу же помещают в
коллекционное помещение, за исключением тех культур, которые
требуют для роста более высокой температуры. К последним
относятся, например, такие виды, как Saccharomyces castellii и Toru-
lopsis lactis-condensii, которые инкубируют при 30° С, a Candida
slooffii, Pityrosporum ovale, P. pachydermatis, Torulopsis bo-
vina, T. pintolopcsii и Saccharomyces telluris — при 37° С. Психро-
фильные дрожжи выращивают и хранят при 3—4° С в
холодильнике. Это виды: Candida aquatica, С. curiosa, С. salmonicola и все
представители рода Leucosporidium. При низкой температуре после
появления хорошего роста можно хранить и все другие дрожжи, за
исключением психрофобных видов, ассоциированных с
теплокровными животными, и некоторых устойчивых к полиеновым
антибиотикам мутантов.
Особого внимания требует вид Cyniclomyccs ( = Saccharomycop-
sis) guttulata, который нуждается в низком значении рН
поддерживающей среды (2,5—3,0), в частых пересевах и температуре
37° С.
Среды. Во многих лабораториях и коллекциях дрожжи
поддерживают и хранят на сусло-агаре. Было показано, однако, что
на этой сложной среде при длительном хранении происходит
изменение физиологических свойств, характерных для вида, за счет
адаптации или стабилизации мутантов. В связи с этим для
хранения более пригодна среда следующего состава, которую используют
в голландской коллекции (в %):
Глюкоза 4 Дрожжевая вода
Пептон 0,5 рН 5,8—6,0
Дрожжевую воду готовят, автоклавируя при 121° С 15 мин
суспензию прессованных дрожжей (200 г на 1 л водопроводной
воды) с небольшим количеством яичного белка. После стерилизации
еще горячую воду дважды фильтруют через бумажный фильтр.
Пивоваренные дрожжи лучше поддерживать на сусло-агаре или
на среде следующего состава (в %);
Сусло 3
Дрожжевой экстракт 3
Пептон 5
Глюкоза 1
Агар 2
19
Лучше растут на сусле, чем на глюкозо-пептонной среде, ба-
зидиомицетовые дрожжи, близкие к головневым грибам.
Липомицеты поддерживают на среде с солодовым и
дрожжевым экстрактами, на которой эти дрожжи лучше сохраняют спо-
рообразующую способность:
Глюкоза, г 10
Пептон, г 5
Сусловый экстракт, г 3
Дрожжевой экстракт, г 3
Агар, г 20 ч
Водопроводная вода, л 1
В некоторых коллекциях дрожжи поддерживают в жидких
средах (сусло с дрожжевым автолизатом, пептоном и глюкозой) с
пересевами через 4 мес.
Осмотолерантные дрожжи, например Saccharomyces ( — Zygo->
saccharomyces) rouxii, пересевают на среде с высоким осмотическим
давлением, а именно: на сусло-агаре с 50% глюкозы.
Дрожжи родов Brettanomyces и Dekkera сильно подкисляют
среду в процессе роста и быстро гибнут, поэтому для их
культивирования добавляют в среду 2% СаС03 и делают пересевы через
каждые 2 мес.
Хранение под минеральным маслом
Заливка агаровых культур минеральным маслом преследует
цель задержать высыхание и тем самым увеличить сроки
пересевов.
Наиболее пригодно для заливки культур дрожжей высокоочи-
щенное медицинское вазелиновое масло плотностью 0,8—0,9. Масло
стерилизуют в автоклаве в течение 1 ч при 121° С, а затем
прогревают для удаления влаги в сушильном шкафу при температуре не
выше 150° С или выдерживают при комнатной температуре не
менее 2—3 дней.
Дрожжи выращивают на сусло-агаре или другой среде,
выбранной для хранения.
Все представители рода Cryptococcus лучше сохраняются под
вазелиновым маслом на синтетической среде Ридер в модификации
Кудрявцева [11] (в г на 1 л дистиллированной воды):
(NH,)2S04 3,0 К2НР04 0,1
MgSO, 0,7 Глюкоза 10
NaCl 0,5 Агар 20
КН2ГО4 1,0
Среду готовят в пробирках таким образом, чтобы столбик был
достаточно высоким, а скос небольшим. Через 4—6 сут, когда
штрих хорошо сформируется, культуры заливают маслом таким
образом, чтобы слой его над верхним краем агарового косячка не
превышал 1 см. После заливки культуры хранят в вертикальном
положении либо при комнатной температуре, либо в холодильнике
при 4—6° С. Пересев дрожжей из-под вазелинового масла
производят один раз в год. Для пересевов используют свежие косяки
той же среды, на которой культуры хранились.
20
Опыт многих коллекций свидетельствует об успешных
результатах этого способа хранения дрожжевых культур. Для винных
дрожжей, в частности, было показано, что при хранении под
вазелиновым маслом с пересевами даже через 2—4 года они не теряют
бродильных свойств и хорошо выживают. Имеются указания на
сохранение живых клеток дрожжей под маслом до 10 лет и более
без пересевов.
К недостаткам этого метода хранения следует отнести
следующие: 1) при пересевах масло смешивается с инокулятом и штрихи
получаются хуже обычных; 2) масло разбрызгивается при
обжигании петли и от этого возникает возможность инфицирования
помещения; 3) требуется специальная очистка использованных пробирок
от масла; 4) при стерилизации масла высокими температурами в
нем могут образовываться токсичные для дрожжей вещества.
Лиофилизация
Лиофилизацией называют процесс высушивания под вакуумом
из замороженного состояния. Техника лиофилизации и хранения
лиофилизированных культур сильно варьирует в разных
лабораториях. Вариации касаются сред и сроков выращивания, применения
суспензионных жидкостей, температуры замораживания, условий
хранения и восстановления культур.
Дрожжи, подлежащие лиофилизации, выращивают в
оптимальных условиях на средах, не слишком обогащенных питательными
веществами. Для этой цели пригодна среда Сабуро или глюкозо-
пептонная следующего состава (в %):
Глюкоза 1,0 NaCI 0,5
Пептон 1,0 К2НР04 0,3
Мясной и дрожжевой экстракты по 0,5 Агар 2,5
Дрожжи выращивают и на сусло-агаре. Из 2—5-суточных
культур готовят густую суспензию в специальных суспензионных
жидкостях, содержащих защитные вещества, которые можно
разделить на три группы [3]:
1) коллоидные среды животного, растительного и
минерального происхождения, такие как сыворотка крови, плазма, желатина,
снятое молоко, агар-агар, гель гидрата окиси алюминия и др.;
2) среды с углеводами (чаще всего 10%-ный раствор
сахарозы) и продуктами гидролиза белков — пептоном и
аминокислотами;
3) сложные среды, в состав которых входят вещества,
образующие как коллоидные, так и истинные растворы.
Хорошие результаты получены в голландской коллекции (CBS,
г. Дельфт) при использовании в качестве защитной среды раствора,
содержащего 7,5% инозита, 2% глутамата натрия и 5% декстрина
[50]. рН такой среды доводят до 7 с помощью NaOH.
Ниже приведены 2 варианта сложных защитных сред.
Вариант I
Желатина, % I Аскорбиновая кислота, % 0,25 .
Дрожжевой экстракт, % 1 рН 5,5
Глюкоза, % 0,5
21
Вариант 2
Пептон, г 15 Дистиллированная водь, мл. 200
Бычья сыворотка, мл 100 Сахарова, г 30
Использование 10—20%-ного раствора сахарозы дает хорошую
выживаемость сразу после лиофилизации, но при длительном
хранении жизнеспособность дрожжей резко снижается из-за высокой
остаточной влажности материала.
Важным моментом в процессе лиофилизации является
замораживание суспензии. Для дрожжей при лиофилизации обычно
применяют охлаждение от —30 до —70° С, однако температура около
—15° С, способствующая медленному замораживанию, дает
наилучшие результаты. Есть указания также на успешное использование
режима быстрого замораживания дрожжей при температуре смеси
сухого льда и спирта —78° С и сверхбыстрого замораживания в
жидком азоте при —196° С.
Замороженный материал не должен оттаивать в процессе
высушивания. Продолжительность высушивания меняют в зависимости
от обрабатываемого материала, его объема, состава защитной
среды и используемой аппаратуры. Чем мельче кристаллы,
образовавшиеся при замораживании, тем быстрее проходит высушивание.
Остаточная влажность сказывается на сохранении свойств лиофи-
лизированных дрожжей и на продолжительности последующего их
хранения без потери жизнеспособности.
Сразу же после окончания процесса лиофилизации важно
определить жизнеспособность обработанной культуры, а в случае,
когда была известна концентрация живых клеток в исходной
суспензии, можно установить и процентное отношение оставшихся
живыми от начального количества клеток.
Реактивацию лиофилизированных культур производят путем
переноса части материала либо сразу же в жидкую питательную
среду, либо путем предварительного 8-часового выдерживания в
дистиллированной воде с последующим пересевом на сусло-агар.
Запаянные ампулы с лиофилизированными культурами хранят
в темноте при комнатной температуре или в холодильнике с
температурой 4—6° С. Последнее предпочтительнее, особенно для
дрожжей с высокой остаточной влажностью материала.
Влияние разных факторов лиофилизации (возраста культуры,
концентрации суспензии, скорости замораживания,
продолжительности сушки, сред для восстановления культур, продолжительности
пребывания в парах воды перед добавлением среды для
восстановления и пребывания в среде для восстановления) на
выживаемость дрожжей Saccharomyces cerevisiae и остаточную влажность
установлено методом математического планирования эксперимента
[19]. Для выражения влияния указанных факторов составлены
уравнения регрессии, описывающие процесс в температурной зоне
выше эвтектической (от —10 до —15° С) и ниже ее (от —30 до
—40еС). Таким путем найден режим лиофилизации,
обеспечивающий сохранение выживаемости S. cerevisiae до 30—40% после 9—
17 мес хранения.
Итоги 19—20-летнего хранения культур дрожжей —
представителей 17 род«в, всего 557 штаммов — в голландской коллекции
позволили установить разную пригодность этого метода хранения
для отдельных групп видов. Дрожжи с мелкими клетками и аско-
22
спорами, такие, как Pichia, Hansenula и Debaryomyces, показали
хорошую выживаемость, а крупноклеточные слабоспорулирующие
или неспорулирующие дрожжи родов Saccharomyces, Kluyveromy-
ces, Dekkera и Brettanomyces выживали хуже. Плохо выдерживали
длительное хранение в лиофилизированном состоянии Sporobolomy •
ces, Rhodotorula и Cryptococcus [50].
Для многих культур показано, что их свойства остаются
неизменными при хранении в лиофилизированном состоянии.
Способность к образованию аскоспор сохраняется значительно лучше, чем
при периодических пересевах. Однако для дрожжей рода Candida
из. группы solani—lipolytica было установлено, что через 3 мес
хранения произошли изменения в окислительном метаболизме,
потребностях в факторах роста и осмотолерантности [37]. Таким
образом, и этот широко применяющийся сейчас метод хранения
микробных культур не следует рассматривать как универсальный,
одинаково пригодный для разных видов дрожжей.
Методы криогенного хранения
Замораживание дрожжей проводят при разных режимах,
включая температуры от —10 до —196° С и различные скорости
охлаждения. Устойчивость дрожжей к повреждающим эффектам при
замораживании повышается при добавлении защитных веществ:
глицерина, сахарозы, инозита, диметилсульфоксида, полиэтиленгли-
коля.
В ампулу объемом 1,2 мл вносят 0,2 мл суспензии клеток
дрожжей из стационарной фазы. Начальная концентрация клеток 106—
108/мл 10%-ного раствора глицерина, 6%-ного инозита или другого
защитного вещества. Ампулы запаивают и помещают в жидкостно-
фазовый рефрижератор с температурой —70° С со скоростью
охлаждения 1—2,5° С в мин в зоне критических температур — от —5
до —35° С. Замороженные микроорганизмы хранят в жидком азоте
при —196° С в металлических контейнерах или стеклянных дью-
арах. Существуют контейнеры-рефрижераторы разного объема:
1) 10 л на 250 ампул для краткосрочного хранения в
экспериментальной работе;
2) 35 л на 900 ампул в канистрах;
3) 185 л на 12 000 ампул или 1000 штаммов в 12 повторностях.
В американской коллекции (АТСС) имеются контейнеры на 14 000
и 40 000 ампул для длительного хранения. Для быстрого
оттаивания ампулы погружают в водяную баню с температурой 35—45° С
на 2 мин. При этом необходимо защитить глаза от возможного
взрыва неплотно запаянных ампул. Высев производят на богатую
питательную среду.
Трехлетнее хранение пивных дрожжей в жидком азоте
показало хорошую их выживаемость без изменения ценных
производственных свойств [64].
Хранение на адсорбентах
В качестве адсорбентов используют почву, песок, каолин, сили-
кагель, вату и фильтровальную бумагу. Этот способ хранения не
имеет разработанной стандартной техники.
23
Высокая выживаемость и физиологическая активность
обеспечивается при хранении дрожжей в силикагеле, содержащем
различные микроэлементы, что было показано на углеводородокисляющих
видах дрожжей рода Candida [16]. Двухсуточные культуры
дрожжей, полученные на синтетической среде с 1% парафина на
качалках, смешивали со 150 мл стерильных шариков силикагеля и ос*
тавляли в термостате при 32° С на 24 ч. Через сутки определяли
рН среды и доводили при необходимости до 7—8. Затем культу-
ральную жидкость сливали, шарики силикагеля с дрожжами
помещали в стерильные чашки Петри и высушивали в эксикаторе при
пониженном давлении в течение 5—б сут. После высушивания
культуры дрожжей хранили в течение года при комнатной температуре
в запаянных стеклянных ампулах при давлении 13,33 кПа. Для
реактивации 200 мг шариков силикагеля измельчали в фарфоровой
ступке, порошок переносили в 3—5 мл стерильной воды и после
кратковременного выдерживания делали высев на питательную
среду.
Хранение культур винных дрожжей в виде спор
На сусловых средах винные дрожжи плохо спорулируют и
быстро отмирают. В. В. Абрамовичем [1] был разработан метод
получения активно спорулирующих культур для длительного
хранения их в состоянии спор. Дрожжевой осадок из сброженного сусла
переносят на 2—3%-ный голодный (водный) агар, где 60—80%
клеток образуют споры. Дрожжи сохраняют жизнеспособность на
этой среде до двух и более лет. Этим способом было проверено
18 рас винных дрожжей. Подавляющее большинство проверенных
культур вызывало активное брожение через -1,5—2,2 года
хранения.
Н. И. Бурьян [4] предложила для винных дрожжей способ
хранения без потери их основных производственно ценных свойств
(энергии размножения и дыхания, бродильной активности, кисло-
товыносливости, спиртоустойчивости) путем чередования периодов
активного размножения и пребывания в состоянии спор.
Дрожжи предварительно выращивают 48 ч на среде с 5% (по
объему) автолизата пивных дрожжей и 2% глюкозы, переносят для
спорообразования на измененную среду Адамса (2% агара+0,14%
уксуснокислого натрия), затем 10 сут выдерживают при 15°С, а
для длительного хранения переносят в помещение с температурой
10° С. Через 9—10 мес дрожжи переводят в активное состояние,
засевая споровым материалом колбы со средой, содержащей 18—-
20% сахара (рН 2,7—3,0), а по окончании брожения — в новую
серию колб, среда в которых содержит 28—30% сахара (рН 5,5).
Эти пересевы занимают приблизительно 2 мес, после чего дрожжи
вновь переносят на голодный агар.
Хранение микробных культур под вакуумом —
метод Сорделли
Небольшое количество дрожжей с агаровой среды вводят в
маленькую пробирку, которую закрывают ватной пробкой.
Пробирку помещают в более крупную пробирку из тугоплавкого стекла.
24
На дно ее предварительно вносят несколько стеклянных бус и
кристаллов КОН. Пробирку закрывают резиновой пробкой со
стеклянной трубкой, через которую производят откачку воздуха до
1,3—6,6 кПа. Трубку запаивают парафином. Пробирки хранят при
комнатной температуре.
Хранение коллекционных культур дрожжей
в дистиллированной воде по методу Кастеллани
Пробирки с 8—10 мл стерильной дистиллированной воды
засевают большим количеством инокулята с глюкозного или суслового
агара и хранят при комнатной температуре. По мере испарения
воды ее добавляют в пробирки. Жизнеспособность дрожжей
сохраняется в этих условиях до двух лет и более. Основным
условием успешного хранения дрожжей в дистиллированной воде
является обильный инокулюм. Этот способ хранения проверен на
ряде культур рода Candida и некоторых видах Geotrichum и Crypto-
coccus с положительным результатом. Он оказался непригодным
для таких слабоспорулирующих дрожжей, как Hanseniaspora, Endo-
mycopsis, Nematospora, и некоторых Saccharomyces.
Глава П. МЕТОДЫ ИДЕНТИФИКАЦИИ
ДРОЖЖЕЙ
Общие требования, которые необходимо выполнять в работе
по определению вида дрожжей, сводятся к следующему:
перед определением каждую культуру следует тщательно
проверить на чистоту путем микроскопирования и рассева на плотные
питательные среды;
из каждой исходной культуры готовят пересевом в пробирку с
сусло-агаром так называемую контрольную культуру и
сохраняют ее весь период работы по определению, не открывая этой
пробирки;
все опыты по выявлению физиологических признаков следует
ставить не менее чем в двух повторностях;
при описании морфологических признаков необходимо
использовать стандартные среды и методы культивирования, так как эти
признаки могут значительно изменяться в зависимости от состава
среды и условий выращивания.
Всю совокупность признаков, характеризующих каждый таксон,
можно условно разделить на четыре большие группы:
1) морфологические признаки, описывающие отдельные клетки
и их популяции, а также спосбЬы вегетативного размножения;
2) характеристики полового процесса;
3) физиологические признаки, характеризующие тип питания,
рост и энергетический метаболизм;
4) биохимические признаки, объединяющие особенности
образования различных метаболитов, ферментативную активность и
состав клеточных компонентов.
25
МОРФОЛОГИЯ И ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ
Признаки, сгруппированные в этом разделе, разделяют на
микро- и макроморфологические, поскольку первые изучают с помощью
микроскопа, а вторые — визуально. Микроморфология включает
признаки, характеризующие отдельные вегетативные клетки
(форма, размеры), а также способы вегетативного или бесполого
размножения и образуемые при этом структуры. Макроморфология
объединяет культуральные признаки, характеризующие рост
культуры на плотных (по штриху или в виде гигантской колонии) или
в жидких средах.
Характеристика вегетативных клеток
Клетки дрожжей бывают круглые, округлые, овальные,
яйцевидные, цилиндрические, треугольные, апикулятные
(лимоновидные), колбовидные, стреловидные и серповидные. В некоторых
случаях форма клетки бывает настолько характерна, что она может
служить опознавательным признаком рода. Например, треугольные
клетки образуются у Trigonopsis, серповидные — у Selenotila,
грушевидные и колбовидные — у Schtzoblastosporion, стреловидные —
у Brettanomyces.
У дрожжей не со столь характерной формой клеток в качестве
вспомогательных признаков можно использовать такие, например,
как образование капсул и внутрицитоплазматических включений,
представляющих собой резервные вещества разного химического
состава. Скопляясь в больших количествах, они придают клеткам
весьма характерный вид. Так, у видов Lipomyces часто бывает
столь много жира, что вся клетка представляет собой как бы
вместилище одной громадной липидной вакуоли (рис. 4, а). У
некоторых видов Trichosporon и Candida даже при обильном жиронакоп-
лении липидные капли обычно не сливаются в одну, а оформлены
как отдельные включения (рис. 4, б), Очень своеобразная
мелкогранулярная структура клеток Cryptococcus albidus обязана таким
видом скоплениям многочисленных зерен гликогена (рис. 4, в);
Капсулы на клетках дрожжей различаются как по размерам,
так и по форме. Толщина их варьирует от едва заметного слоя,
обнаруживаемого только под электронным микроскопом
(микрокапсула), до размеров, превышающих в несколько раз диаметр
самой клетки. Капсульный материал обычно равномерно покрывает
клетку, как это бывает у круглых клеток (рис. 5, а); у штаммов
с овальными клетками он более обилен по полюсам (рис. 5, б).
Следует, однако, помнить, что такие признаки, как наличие
капсулы или включений, в очень большой степени зависят от
штамма, условий культивирования и возраста культуры. Поэтому они
имеют в диагностической практике лишь второстепенное значение.
Размеры «взрослых» дрожжевых клеток варьируют у разных
видов от 1;5—2,0 до 10 мкм по ширине и достигают 20 мкм и
более в длину у продолговатых. Мелкими клетками
характеризуются, например, виды Pichia и Hansenula со шляповидными
спорами и апикулятные дрожжи родов Hanseniaspora и Kloeckera.
Крупные клетки имеют сахаромицеты, липомицеты, дрожжи с ли-
26
cC^sfi$r
Рис. 4. Клетки: а — Lipomyces lipofer; б —Candida curiosa;
в — Cryptococcus albidus.
Рис. 5. Капсулы на клетках Cryptococcus albidus: а —круглых;
б — овальных.
моновидными клетками родов Nadsonia, Saccharomycodes и Wicker-
hamia.
Форму и размеры клеток описывают и определяют в культурах
разного возраста на плотных и жидких средах.
1. Солодовое сусло концентрацией 10% СВ.
Если дрожжи относятся к сильным кислотообразователям
(например, Brettanomyces), то к суслу добавляют 2% мела, который
предварительно стерилизуют сухим жаром при 160—180° С в
течение 2 ч.
27
2. Сусло-агар: к среде 1 добавляют 2% агара.
3. Глюкозо-пептонная среда: глюкоза 2%, пептон 1%,
дрожжевой экстракт 0,5%, дистиллированная вода.
4. Глюкозо-пептонный агар: к среде 3 добавляют 2% агара.
5. Морфологический агар (см. табл. 4, с. 48).
Синтетические среды имеют то преимущество перед сусловыми,
что они стандартны по составу и дают более стабильные и потому
сравнимые результаты. Для составления стандартного описания
видов (см. с. 57) лучше поэтому пользоваться морфологическим
агаром.
Первый просмотр и измерение производят в
двух—трехсуточных культурах, выращенных при 25—28° С. В особых случаях,
когда дрожжи растут очень медленно (это могут быть почвенные
дрожжи Lipomyces или психрофильные Leucosporidium), первое
описание делают позже — через одну—две недели инкубации.
Затем культуры оставляют при комнатной температуре (17—18° С) и
еще раз описывают через четыре недели.
При определении размеров измеряют микрометром длину и
ширину не менее чем у 20 клеток и указывают крайние значения. Для
измерения лучше использовать культуры на жидких средах.
Капсулы выявляют на клетках из молодых и старых культур
с плотных сред. Препараты живых клеток (без фиксации) готовят
методом негативного окрашивания черной тушью. Для этого петлю
с культурой смешивают на предметном стекле с каплей туши и
размазывают слегка краем покровного стекла, держа его под углом
45°, а затем накрывают этим стеклом. На черном фоне капсулы видны
как светлый ореол вокруг клетки. Тушь можно заготовить впрок. Ее
разбавляют в два раза, центрифугируют, супернатант стерилизуют
и хранят в запаянных ампулах. Хорошие результаты получаются с
тушью, приготовленной по методу Литтмана: черная тушь 15 мл,
раствор тимерсола (мертиолата) в соотношении 1 : 1000 30 мл,
твин-80 0,1 мл.
Вегетативное размножение и образование ложного
и истинного мицелия
Дрожжи размножаются вегетативно путем почкования,
деления или почкующегося деления. Размножение делением за счет
образования в клетке поперечной перегородки — септы —
характерно для Schzosaccharomyces (рис. 6, а) и дрожжеподобных грибов
сем. Endomycetaceae (например, Endomyces magnusiae). При
почковании на поверхности клетки образуется маленькое
выпячивание — почка, которая увеличивается почти до размеров
материнской клетки и отделяется от нее, оставляя на месте бывшего
прикрепления почковый шрам или рубец в виде кольцеобразного
выступа. Если одновременно или последовательно образующиеся
почки формируются на разных сторонах материнской клетки, то такое
почкование называют множественным или многосторонним
соответственно (рис. 6, б). Почки могут закладываться и на широком
основании, которое сужается к моменту отделения почки; иногда же,
наоборот, почки образуются на узком и довольно заметном
выросте. То и другое встречается у разных представителей рода Crypto-
28
coccus (рис. 6, в). Для рода Sterigmatomyces характерен очень
своеобразный процесс образования почек на длинных выростах,
имитирующих стеригмы (рис. 6, г). Почкование у треугольных
клеток Trigonopsis или у серповидных Selenotila происходит главным
образом на выпуклых частях клетки, а у стреловидных Brettanomy-
ces — на более широком полюсе (рис. 6, д). Почки у Sympodio-
myces закладываются последовательно на кончиках конидиофора
(рис. 6, е). Полярное образование дочерних клеток, начинающееся
с формирования почки на широком основании, а заканчивающееся
появлением четко заметной даже в световом микроскопе септы в
районе перешейка, носит название почкующегося деления.
Монополярная форма его наблюдается у Pityrosporum, биполярная — у
апикулятных дрожжей (рис. 6, ж).
<х,а-
tf
^
осо
ж
Рис. 6. Вегетативное размножение дрожжей.
Если при почковании клетки не разъединяются, а продолжают
образовывать все новые и новые почки, то в конце концов
формируются структуры ложных гиф, из которых складывается
псевдомицелий. Он бывает примитивным, если состоит из продолговатых
клеток приблизительно одинакового размера (рис. 7, а), или же
хорошо развитый, т. е. дифференцируется на длинные клетки псев-
догиф и окружающие их в характерном порядке (кучками,
мутовками, поодиночке) клетки другой формы, именуемые бластоспорами
(рис. 7, б). Разделение двух родов несовершенных дрожжей —
29
Torulopsis и Candida — основано именно на этом признаке, т. е.
наличии псевдомицелия у видов рода Candida и отсутствии
такового у Torulopsis. Однако такое разграничение весьма относительно
из-за значительной изменчивости признака.
Рис. 7. Тины мицелия.
Если дрожжи размножаются делением, то при образовании
нитевидных структур они формируют истинный мицелий. При
распаде такого мицелия на отдельные клетки последние носят
название артроспор. На плотной среде они часто располагаются
характерным зигзагом (рис. 7, в). Эндоспоры — внутриклеточные
бесполые споры — появляются в неопределенном числе в клетках гиф
в старых культурах. Клетки при этом иногда заметно раздуваются
(рис. 7, г).
На септах мицелия дрожжей рода Ambrosiozyma имеются
утолщения около пор, заметные даже в световом микроскопе (рис.
7, д). Образование мицелия с пряжками (рис. 7, е) характерно
для тех дрожжей, которые относят к базидиомицетам.
Так как на практике зачастую бывает трудно отличить
ложный мицелий от истинного, особенно в культурах, где есть и
почкование и деление, то следует обращать внимание на следующее:
1) граница между клетками истинного мицелия — резко
преломляющая свет прямая перегородка; граница между клетками
ложного мицелия представлена их изогнутыми концами и не
отличается по преломлению света от боковых стенок гиф (рис. 8, а);
30
2) в истинных гифах концевые клетки обычно более длинные,
чем предшествующие, а в нитях псевдомицелия — наоборот
(рис. 8, б).
3) у истинного мицелия нет перетяжек в зоне перегородок, а
на псевдомицелии эти перетяжки хорошо заметны (рис. 8, в).
A' I I I I -^ Г I ( I
Рис. 8. Различия между истинным и ложным мицелием: Л —
истинный; Б — псевдомицелий.
Способы вегетативного размножения наблюдают одновременно
с описанием микроморфологии дрожжей на тех же средах в
культурах 2—3-суточного возраста.
Образование мицелия и псевдомицелия изучают на
кукурузном или картофельно-глюкозном агаре методом пластинок, или
культур на стекле (slide-culture).
Кукурузный агар. 12,5 г кукурузной муки в 300 мл
водопроводной воды нагревают на водяной бане при 60° С в течение 1 ч,
затем фильтруют через бумажный фильтр. .Объем фильтрата
доводят до 300 мл, добавляют 3,8 г агара и автоклавируют 15 мин
при 12 Г С. Горячую среду еще раз фильтруют через вату,
разливают по пробиркам и снова стерилизуют при том же режиме.
Картофельно-глюкозный агар. 100 г промытого, очищенного и
измельченного картофеля вымывают в 300 мл водопроводной воды
в течение нескольких часов на холоду. Массу фильтруют через
ткань и автоклавируют в течение 1 ч при 121° С. Для
приготовления агаровой среды к 230 мл этой жидкости добавляют 770 мл
водопроводной воды, 20 г глюкозы и 20 г агара и стерилизуют
в автоклаве 15 мин при 112° С.
Расплавленную среду наливают в чашки Петри и в нее,
зажав пинцетом, опускают и быстро вынимают стерильные
предметные стекла. Покрытые пленкой агара стекла помещают на U-образ-
ную стеклянную подставку в другой чашке Петри. Посевы делают
тонкими штрихами: по три на каждой пластинке параллельно
короткой стороне стекла или по одному вдоль длинной стороны
стекла. Стерильные покровные стекла накладывают на штрихи так,
чтобы под ними не было пузырьков воздуха и чтобы часть штриха
осталась свободной (рис. 9). На дно чашки наливают стерильную
воду во избежание пересыхания слоя агара на пластинке. Через
6—8 дней инкубации при 25° С стекла вынимают и, предварительно
очистив их нижнюю поверхность от агара, помещают на столик
микроскопа для наблюдений. На таких препаратах не нарушается
31
Рис. 9. Препараты на стеклах с
агаровыми пленками для
наблюдения за образованием мицелия.
естественное расположение клеток псевдомнцслия, бластоспор или
артроспор. Образование мицелия и псевдомицелия наблюдают в
анаэробных (под покровным стеклом) и в аэробных (вне стекла)
условиях.
Образование хламидоспор
Хламидоспоры — это толстостенные клетки, образующиеся из
вегетативных клеток интеркалярно и терминально на мицелии
путем округления отдельных клеток гиф и заполнения их липидным
резервным материалом (рис. 10, а). Образование хламидоспор-—
признак, очень характерный для патогенных дрожжей Candida
albicans, поэтому особенно много литературы по выявлению
хламидоспор имеется в медицинской микологии.
У некоторых дрожжей (Cryptococcus, Lipomyces) покоящиеся
вегетативные клетки с толстыми оболочками, заполненные
резервным материалом, образуются без мицелия. При переносе на
свежую среду они почкуются, сбрасывая при этом наружные слои
клеточной стенки (рис. 10, б).
Наблюдают за образованием хламидоспор в старых культурах
на всех средах, предназначенных для изучения морфологии клеток
и псевдомицелия. Для С. albicans характерным признаком является
образование трубок прорастания. Посев производят из 24-часовых
колоний на пластинках с плотной средой (0,1% глюкозы и 2%
агара или кукурузный агар+1,0% твин-80) и покрывают штрихи
или мазок стерильными покровными стеклами. Трубки прорастания
обнаруживаются через 2,5—3 ч инкубации при ЗгС. При
дальнейшем выдерживании пластинок при комнатной температуре через три
дня можно наблюдать образование хламидоспор.
32
Рис. 10. Хламидоспоры и баллистоспоры дрожжей: а — хламидо-
споры на гифах мицелия, терминальные и интеркалярные; б —
хламидоспоры без мицелия, одна из них прорастает; в —
баллистоспоры, симметричные и асимметричные.
Образование баллистоспор
Баллистоспоры — бесполые споры, которые образуются на
заостренных (конических) выростах клеток, так называемых стериг-
мах (рис. 10, б), и при созревании с силой отбрасываются
(отстреливаются). Образование баллистоспор — очень характерный
способ бесполого размножения, по наличию которого выделяют особую
группу дрожжей, включающую роды Sporobolomyces, Bullera, Spo-
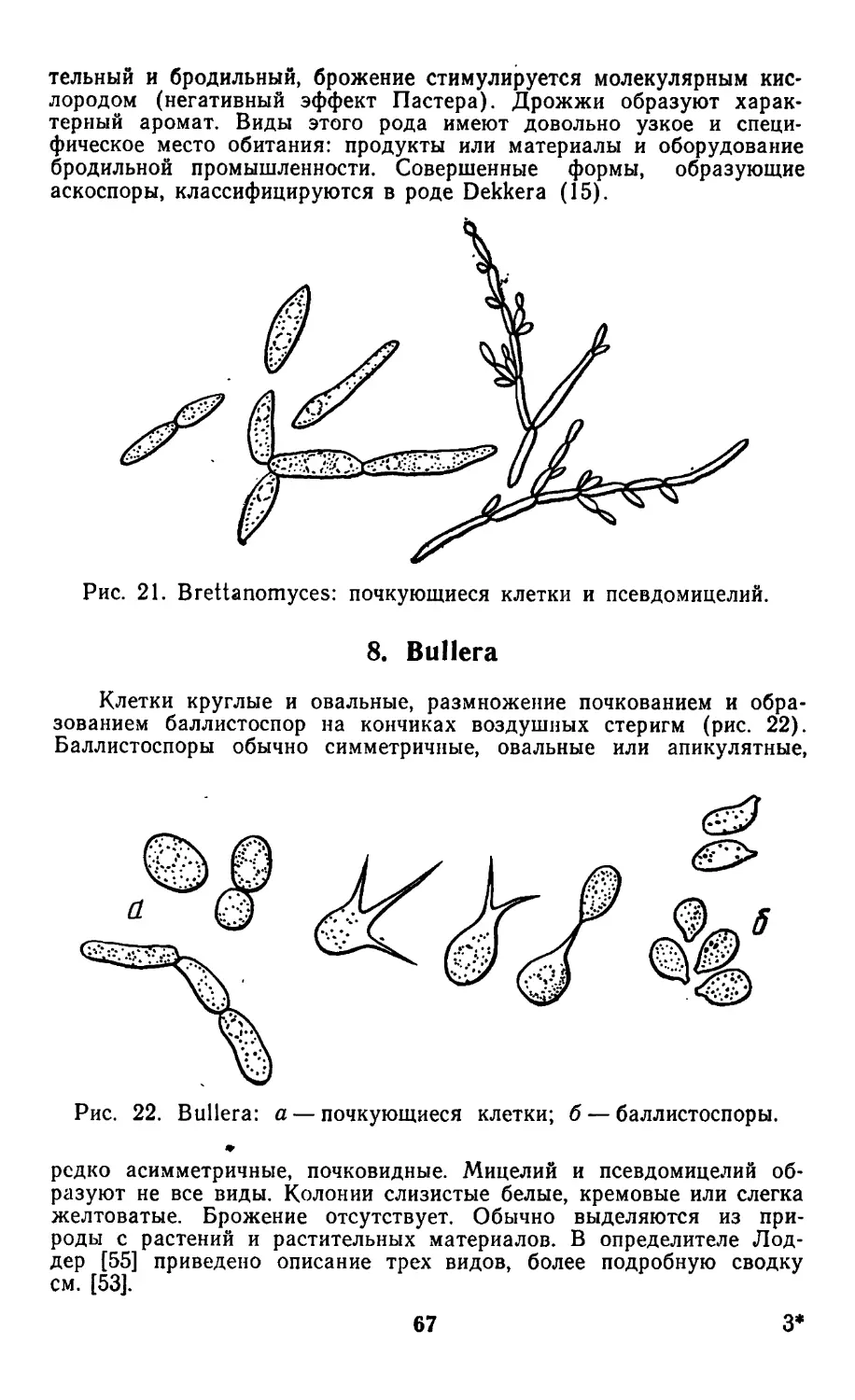
ridiobolus и Tilletiopsis.
Баллистоспоры можно наблюдать по появлению зеркального
отражения штриха или колоний на крышках чашек Петри,
инкубируемых в перевернутом положении. Так как образованию и
отстреливанию баллистоспор способствуют пониженные температуры и
высокая относительная влажность атмосферы, то в опытах
используют следующие приемы. Посев штрихом любой формы производят
на пластинку с картофельным или кукурузным агаром на
предметном стекле, которое помещают в чашку Петри штрихом вниз над
вторым стеклом без агаровой пленки. Между стеклами располагают
небольшую U-образную стеклянную прокладку.
Для поддержания влажной атмосферы в чашку кладут
смоченную стерильной водой вату. Посевы инкубируют при 18—20° С.
Следят за появлением на нижнем стекле визуально заметного
зеркально повторенного штриха, который образуется за счет
отстреленных баллистоспор. При скудном спорообразовании можно не
получить зеркального изображения. В этом случае необходимо до-
2 Зак. 1921
33
биться прорастания спор и появления визуально видимых
колоний. Для этой цели применяют посев двумя параллельными или
перпендикулярными штрихами на кукурузный агар, а в крышку
чашки Петри заливают сусло-агар, на поверхность которого кладут
стерильное стекло таким образом, чтобы оно располагалось над
одним из штрихов. Чашки при инкубировании ставят в перевернутом
положении при температуре не выше 25°С (лучше 18—20°С).
Для поддержания влажности в чашки кладут смоченные водой
комочки ваты. При появлении роста дрожжей снимают с
сусло-агара стекло и наблюдают под микроскопом отстрелявшиеся баллисто-
споры. Отмечают их форму; они, как правило, овальные у Bullera,
почковидно-изогнутые у Sporobolomyces и Sporidiobolus и
серповидные у Tilletiopsis (см. рис. 10, в).
Рост на плотных средах
Определение культуральных признаков дрожжей при росте на
плотных средах сводится к описанию штриха или гигантской
колонии. При этом отмечают цвет, консистенцию, структуру
поверхности и форму края или границы роста.
Культуры по консистенции бывают чаще всего
пастообразными, а также слизистыми, почти полностью стекающими на дно
пробирки, вязкими и клейкими, плотными густыми, кожистыми или
крошащимися. Слизистым ростом характеризуются в основном
Lipomyces, Cryptococcus и некоторые виды Hansenula со шляпо-
видными спорами, тогда как для видов, образующих истинный или
ложный мицелий, например Candida, более обычен рост в виде
плотного складчатого штриха с ворсинчатым окаймлением. Край
хорошо просматривается визуально при просвечивании пробирки
или чашки, а также при наблюдении под малым увеличением
микроскопа.
Цвет штриха или колоний зависит от образования дрожжами
некоторых пигментов. Наличие желтых, оранжевых и красных
пигментов, не проникающих в среду, характерно для Rhodotorula,
Sporobolomyces и некоторых видов Cryptococcus. Образование кир-
пично-красного пигмента пульхерримина, диффундирующего в агар,
специфично для Metschnikowia pulcherrima. Огромное большинство
видов дрожжей не синтезирует пигментов и формирует колонии
бесцветные или слегка кремового или коричневого оттенка при
старении. Розоватая окраска штрихов у некоторых видов Hansenula и
Pichia может быть связана с обильным спорообразованием, а
колонии Nadsonia или Lipomyces становятся коричневыми вплоть до
шоколадного цвета при образовании аскоспор. Появление мелани-
ноподобного пигмента, от которого штрих приобретает цвет от
темно-зеленого до угольно-черного, характерно для Phaeococcus и для
дрожжеподобных грибов рода Aureobasidium (Pullularia), которые
на ранних стадиях роста могут давать неокрашенные штрихи,
неотличимые от других дрожжей.
Для получения стандартного штриха используют две среды:
сусло-агар концентрацией 10% СВ и глюкозо-пептонный агар с
дрожжевым экстрактом. Посев производят прямым штрихом в
пробирки со скошенным агаром. Рост описывают через 6—8 сут при
25 С, а в случае медленнорастущих культур, например Lipomyces,
34
через 8 сут делают первое описание, а затем через 6 нед
просматривают и описывают культуры вторично. Длительное выращивание
производят при комнатной температуре (17—18°С).
Для получения гигантской колонии используют сусло с
желатиной (20%) или морфологический агар (см. табл. 4). Среды
стерилизуют в маленьких колбочках и закашивают. Посев производят
легким уколом иглы в центр скошенной поверхности. Для
фотографирования посев лучше делать в чашках Петри с толстым слоем
агара. Выращивают в течение 30 сут при комнатной температуре.
Для замедления высыхания агара колбочки сверху обвязывают
полиэтиленовым колпачком, а чашки Петри заклеивают сбоку
изолентой или пластырем. При описании отмечают диаметр колонии
и все признаки, указанные для штриха. Кроме того, обращают
внимание на разжижение желатины.
При использовании в диагностических целях культуральных
признаков следует учитывать, что разные штаммы одного вида на
плотных средах могут давать различные формы роста: шероховатые
(R—rough) и гладкие (S—smooth), матовые (М—mat) и
блестящие глянцевые (G—glossy).
Рост в жидких средах
При росте в жидких средах дрожжи вызывают помутнение,
образуют осадок, кольцо или разного характера пленки. Рост в
виде пленки характеризует способность клеток объединяться в ми-
целиальные структуры. При образовании истинного мицелия
пленка обычно толстая и плотная, но в старых культурах она может
превращаться в слизистую массу. Раннее, через 1—2 дня,
образование тонкой тусклой, иногда мелкоморщинистой и всползающей по
стенкам пробирки пленки обычно наблюдается у дрожжей с
окислительным типом энергетического метаболизма.
Рост дрожжей в жидких средах наблюдают и описывают при
использовании солодового сусла концентрацией 15% С В или глю-
козо-пептонной среды с дрожжевым экстрактом. Посев делают в
пробирки или колбочки Эрленмейера и инкубируют 4 нед при
комнатной температуре (17—18°С).
ХАРАКТЕРИСТИКИ ПОЛОВОГО ПРОЦЕССА
Такие признаки, как наличие или отсутствие конъюгации
непосредственно перед спорообразованием, морфология зигот, аско-
спор, образование промицелия со споридиями и ряд других, в
большинстве случаев уже позволяют установить родовую
принадлежность определяемых организмов. Эти признаки имеют высокую
таксономическую ценность, что вполне оправдывает порой
значительные затраты труда и времени на их установление. Выявление
полового процесса, как правило, проходит наиболее успешно и
требует минимальных усилий при обследовании свежевыделенных
штаммов. Нередко они обильно спорулируют на средах для
поддержания культур или уже на средах для выделения при
первичном высеве из анализируемых субстратов. Длительное же
хранение культур в лабораторных условиях обычно ведет к угасанию
половой активности.
35
В результате мейотического (редукционного) деления
диплоидного ядра образуются гаплоидные споры (аскоспоры или
споридии). У гаплоидных дрожжей перед спорообразованием протекает
процесс слияния (копуляция, конъюгация) двух клеток, в котором
принимают участие разные партнеры: две независимые клетки,
материнская клетка и почка, две почки на одной или разных клетках
или почка и отдельная клетка (рис. 11).
Рис. И. Разные способы конъюгации у дрожжей: а — Schizosaccha-
romyces octosporus; б — Debaryomyces hansenii; в — Nadsonia
elongata; г, д, е — Lipomyces spp.
У дрожжей существует явление раздельнополости, в связи с
чем различают гомо- и гетероталличные организмы. У первых конъ-
югировать могут партнеры, образовавшиеся от одной и той же
гаплоидной клетки, или потомки одной споры. У гетероталличных
дрожжей конъюгация возможна лишь между клетками, образовав-
36
шимися от разных гаплоидных клеток, т. е. между ними имеются
стойкие половые различия. Поскольку последние не находят
отражения в морфологии, в микологии вместо термина «пол»
используют термин «тип спаривания», обозначая их знаками «+» и «—»
или же буквами греческого или латинского алфавита: с и а, И и
h—. У аскоспорообразующих дрожжей известен только биполярный
гетероталлизм, среди базидиомицетовых дрожжей имеются
организмы как с би-, так и с тетраполярной системой спаривания.
Для индукции спорообразования у диплоидных и гомоталлич-
ных гаплоидных дрожжей достаточно подобрать соответствующие
условия. Многочисленные используемые для этого методы
сводятся к предварительному выращиванию дрожжей на богатых (пред-
споруляционных) средах и высеву активно растущих культур на
среды, содержащие мало доступного источника углерода, что
ограничивает вегетативный рост и индуцирует мейоз. Приведенные
ниже наиболее общеупотребительные среды не гарантируют успешные
результаты, всегда необходимо. учитывать и специфические
особенности организмов. Например, спорообразованию у осмофильных
дрожжей благоприятствует повышенное содержание в среде NaCl
(10%)» У липомицетов — низкая концентрация в среде азотистых
веществ, организмы рода Nadsonia не образуют аскоспор при
температурах инкубации выше +15° С.
Отрицательные результаты по обнаружению полового процесса
нередко могут быть обусловлены тем, что исследуемые культуры
представляют собой индивидуальные типы спаривания гетероталлич-
ных организмов. В этом случае к ним необходимо подобрать
соответствующий тип спаривания. Для этого используют активно
растущие (односуточные) культуры с предспоруляционной среды,
пересеваемые на нее не менее трех раз ежесуточно. На среды для
спорообразования высевают смеси этих культур. Вначале попарно
смешивают примерно равные количества инокулятов от двух
культур, а далее для смешивания используют уже полученные смеси
двух штаммов, а затем смеси из четырех и восьми штаммов. При
обнаружении в смеси из наибольшего количества штаммов конъ-
югирующих клеток просматривают предыдущие смеси, состоящие
из меньшего количества штаммов. Простой анализ полученных
результатов позволяет выявить ту пару штаммов, смешивание
которых привело к спорообразованию.
Активность спорообразования можно повысить путем
прогревания суспензии клеток при 52—65° С. При этом вегетативные
клетки сохраняют жизнеспособность обычно не более 10 мин, а
споры более термоустойчивы. После этого срока с интервалом в
несколько минут делают высевы. Чашки последнего высева
должны остаться стерильными. Колонии, образовавшиеся на чашках
предыдущего ему высева, выросшие при наибольшем сроке
прогрева суспензии, пересевают на среды для спорообразования.
Полученные в результате термообработки культуры, происходящие от
аскоспор, обладают уже повышенной половой активностью.
При обнаружении аскоспорообразования у идентифицируемых
организмов отмечают количество спор в аске, их форму. Наиболее
часто в аске содержится от одной до четырех—восьми спор, за
исключением некоторых видов родов Lipomyces и Kluyveromyces.
У этих дрожжей количество спор в аске достигает иногда
нескольких десятков. Довольно значительно разнообразие в морфологии
37
аскоспор, что обычно служит ценным таксономическим признаком
(рис. 12). После созревания аскоспор у одних дрожжей аск долгое
время остается интактным, стенки его лизируются постепенно или
разрываются лишь при набухании и прорастании спор. У других
дрожжей аскоспоры высвобождаются сразу же после их
созревания.
Рис. 12. Аскоспоры дрожжей.
В отличие от аскоспорообразующих дрожжей базидиомицето-
вые дрожжи образуют экзогенные половые споры — споридии.
После конъюгации гаплоидных клеток соответствующих типов
спаривания образуется двуядерный (дикариофитный) мицелий с
пряжками, на котором терминально или интеркалярно формируются
толстостенные клетки, наполненные многочисленными включениями
липидов. Эти клетки носят название телио- или телейтоспор. По
форме они могут 15ыть круглыми, овальными, гантелевидными,
угловатыми или грушевидными. Они образуются в основном в толще
агара и для их обнаружения необходимо микроскопирование
кусочка агара из-под колонии. После периода покоя телейтоспоры
могут прорастать септированной (2—4-х клеточной) или несептиро-
ванной (одноклеточной) структурой — промицелием, на котором
образуются споридии. На септированном промицелии споридии
возникают терминально и латерально, на несептированном —
терминально. У некоторых организмов первичные споридии, не отделившись
от промицелия, почкуются, давая вторичные споридии уже
несколько меньших размеров.
Ввиду сравнительно недавнего обнаружения подобных
жизненных циклов у дрожжей сведения об условиях, благоприятствующих
образованию и прорастанию телейтоспор, ограничены. Неплохие
результаты по телейтоспорообразованию наблюдаются при
использовании кукурузного и рисового агара. Мезофильные штаммы
культивируют при комнатной температуре, психрофильные — при 5—
12* С 3 и 5 нед соответственно.
Для обнаружения прорастания телейтоспор кусочки агара
толщиной 1—2 мм из-под культур предварительно вымачивают в
дистиллированной воде от 1 до 12 нед. Затем их помещают в
чашки Петри на сусло-агар или водный агар. Прибегают также к
технике, используемой для выявления образования псевдомицелия на
предметных стеклах (с. 31), которые в этом случае не покрывают
средой. Срок инкубации составляет 1—2 нед. Температура
культивирования и выдерживания в воде для психрофильных штаммов
равна 5—12° С, для мезофильных — комнатная.
38
Среды для образования телейтоспор
и их про ращив ания
Водный агар: в 1 л дистиллированной воды вносят 20 г агара,
автоклавируют 15 мин при 121° С.
Рисовый агар: 20 г риса заливают 1 л водопроводной воды,
доводят до кипения и кипятят на слабом огне 45 мин в прикрытой
колбе. Фильтруют через марлю, охлаждают и объем фильтрата
доводят водопроводной водой до 1 л. Добавляют 20 г агара и
автоклавируют 15 мин при 12 Г С.
Предспоруляционные среды
Сусло-агар с дрожжевым экстрактом
Глюкоза, г 10 Сусло концентрацией
Пептон, г 5 15% СВ, л 1
Дрожжевой экстракт, г 3 Агар, г 20
рН среды должно быть 5—6.
Автоклавируют 20 мин при 112° С.
Виноградный сок: используют свежеотжатый сок, разводя его
до 8—10% СВ, стерилизуют 10 мин текучим паром.
На предспоруляционных средах инкубацию ведут 1—2 сут при
температурах, оптимальных для роста исследуемых дрожжей. Для
посева на гипсовые блоки используют 2—3-суточные культуры.
Среды для аскоспорообразования
Модифицированная среда Городковой
Глюкоза, г
Пептон, г
NaCl, г
1 (или 2,5)
10
5
Агар, г 20
Водопроводная вода, л 1
Иногда в среду Городковой вводят еще 1% мясного экстракта.
Автоклавируют 16 мин при 121° С.
Ацетатный агар Фоувелла: на 1 л дистиллированной воды
берут 5 или 3 г CH3COONa • ЗН20 и 20 г агара. рН среды должно
быть 5—7. Автоклавируют 15 мин при 121° С.
Ацетатный агар Мак-Клари
CH8COONa-3HaO, г 8,2 Дрожжевой экстракт, г 2,5
Глюкоза, г 1 Агар, г 15
КС1, г 1,8 Дистиллированная вода, л 1
Автоклавируют 15 мин при 121° С.
Среда с дрожжевым экстрактом и глюкозой
Дрожжевой экстракт, г 5 Агар, г 20
Глюкоза, г 50 Дистиллированная вода, л 1
Автоклавируют 20 мин при 112° С.
Агаризованная дрожжевая вода: готовят, добавляя к 1 л
дрожжевой воды (приготовление см. на с. 19) 15 г агара.
Автоклавируют 15 мин при 121° С.
39
Гипсовые блоки: 8 частей гипса (2CaS04-H20) смешивают с
3 частями воды и помещают пасту в цилиндрические формы из
бумаги или фольги высотой 3—4 см. Поверхность тщательно
сглаживают. После застывания блоки освобождают от форм,
помещают в высокие чашки и стерилизуют при ПО—-120° С 2 ч. Перед
посевом в чашки наливают стерильной воды слоем 1 см или раствора,
содержащего 1% маннита и 0,5% К2НРО4.
Среда Старки
К2НР04, г 1 СаС12, г 0,05
КН2Р04, г 0,25 Агар, г 20
MgS04-7H20, г 0,25 Водопроводная вода, л 1
Автоклавируют 15 мин при 112° С. После стерилизации
добавляют б мл этилового спирта.
Овощной агар: предварительно готовят экстракт овощей путем
автоклавирования 10 мин при 112° С равных частей промытых и
мелко нарезанных моркови, сахарной свеклы, огурцов и картофеля
в четырех частях воды, после чего экстракт отфильтровывают
через ткань, отжимая осадок. К 1 л полученного экстракта (4% СВ,
рН 6,7) добавляют 20 г сухих дрожжей и 20 г агара.
Автоклавируют 15 мин при 121° С.
На средах для спорообразования дрожжи инкубируют при
температурах несколько меньших в сравнении с оптимальными для
вегетативного роста, в большинстве случаев при 20—25° С. Время
инкубации составляет до 4—6 нед при еженедельном микроскопи-
ровании.
Начинающие исследователи нередко затрудняются отличить ас-
коспоры от внутриклеточных бесполых спор (эндоспор) или от
крупных глобул жира. В таких случаях можно прибегнуть к
окраске.
Метод Виртца. Фиксированные на пламени препараты
заливают 5%-ным водным раствором малахитового зеленого и 3—4 раза
прогревают до появления паров (30—60 с). Окраску можно
проводить, выдерживая препараты 3—5 мин в растворе малахитового
зеленого, подогретого до 80° С. Затем препараты промывают в
проточной воде 0,5 мин и докрашивают 0,5%-ным водным раствором
сафранина (30 с). Зрелые аскоспоры окрашиваются в
сине-зеленый, а вегетативные клетки — в красный цвета. Аскоспоры
дрожжей родов Hansenula, Schizosaccharomyces могут удерживать оба
красителя.
Карбол-фуксиновая окраска. Фиксированные на пламени
препараты заливают раствором Циля (10 мл насыщенного спиртового
раствора основного фуксина с 90 мл 5%-ного фенола) и нагревают
2—5 мин до появления паров. Затем проводят обесцвечивание
препаратов, погружая их в 2%-ный раствор молочной кислоты или в
95%-ный этанол, содержащий 1 мл концентрированной НС1 в
100 мл. Препараты промывают в воде и докрашивают 3—5 мин
1%-ными растворами метиленового синего или нильского голубого.
Зрелые аскоспоры окрашиваются в красный, вегетативные клетки —
в синий цвета. Аскоспоры рода Schizosaccharomyces, а также
после набухания аскоспоры дрожжей родов Hansenula и Pichia не
обладают кислотоустойчивостью и окрашиваются в синий цвет.
40
ФИЗИОЛОГИЧЕСКИЕ ПРИЗНАКИ
Совокупность характеристик, отражающих потребности
дрожжевых организмов в определенных физико-химических условиях
среды, относят к физиологическим признакам. Из этих признаков
для целей идентификации используют следующие: способность к
сбраживанию Сахаров до углекислого газа и этанола в анаэробных
условиях (брожение), усвоение безазотистых источников углерода
путем их окисления в аэробных условиях (ассимиляция),
потребление различных источников азота, рост на среде без витаминов,
максимальные для роста температуры, способность расти при
повышенном осмотическом давлении среды, устойчивость к
антибиотикам.
Общими требованиями при проведении физиологических тестов
являются использование при этом свежих (обычно 1—2-суточных)
активно растущих культур дрожжей, высокоочищенных препаратов
веществ, не содержащих примесей, которые могут обусловить
ложные результаты, и культивирование организмов при оптимальных
для их роста температурах.
Сбраживание Сахаров
Эмпирически давно отмечено, что немало характеристик
дрожжей, в том числе и физиологических, взаимосвязаны. Подобные
корреляции полезно помнить, они могут служить дополнительным
контролем и предостеречь от грубых ошибок. Применительно к
сбраживанию Сахаров наиболее общи два правила:
1) если дрожжи сбраживают какой-либо сахар, то они могут
сбраживать и глюкозу;
2) если дрожжи сбраживают какой-либо сахар, то они могут
также его ассимилировать. Обратное — неверно.
До последнего времени, кроме того, полагали, что красные
дрожжи, пигментация которых обусловлена наличием каротиноидных
пигментов, и дрожжи, образующие крахмалоподобные соединения,
не способны сбраживать какие-либо сахара. Недавно, однако, такие
организмы были описаны (Phaffia rhodozyma, Filobasidium capsu-
ligenum).
Перечень Сахаров, способность к сбраживанию которых
определяют при идентификации дрожжей, указан ниже. Из этих
углеводов специального рассмотрения требует рафиноза, поскольку
данный трисахарид может по-разному сбраживаться дрожжами:
полностью, на 2/з или же на 7з молекулы, что учитывается при
идентификации. О том, насколько полно и каким образом сбраживается
рафиноза исследуемыми организмами можно судить по способности
их к сбраживанию Сахаров, входящих в состав молекулы рафино-
зы (табл. 1), или же по определению остаточных Сахаров в среде.
а-Галактозидаза fi-Фруктозидаза
aD-Галактоза 1-*6 aD-Глюкоза 1-*2(Ш-Фруктоза
Мелибиоза Сахароза
Молекула рафинозы
41
Таблица 1
Возможные варианты сбраживания рафинозы дрожжами
Сбраживание
мелибиозн
+
+
+
сахарозы
+++I
галактозы
+
+ или —
+
Степень сбраживания молекулы рафинозы
Полное
На 2/3 (остается галактоза)
На 1/3 (остается мелибиоза)
HaJ/З (остается сахароза)
Наиболее прост и общедоступен метод установления
способности дрожжей к сбраживанию Сахаров с использованием трубок
Дунбара (рис. 13). Для получения концентрации 2% (рафинозы
4—6%) отдельные сахара растворяют в разведенном в
соотношении 1 : 10 дрожжевом автолизате или в 0,5%-ном растворе
дрожжевого экстракта. Использование в качестве растворителя
дрожжевой воды не рекомендуется, поскольку она часто содержит
значительные количества трегалозы, которая может сбраживаться
дрожжами. Растворы Сахаров разливают по трубкам Дунбара и авто-
клавируют 15 мин при 112° С. При этом в слепом колене трубки
нередко образуются пузырьки воздуха; перед засевом, осторожно
наклоняя трубку, их необходимо удалить. Посев производят
культурами с сусло-агара. Инкубация длится до 24 сут. О способности
Рис. 13. Трубки Дунбара для определения способности дрожжей к
брожению: а — трубка со средой; б — штатив.
42
к сбраживанию сахара свидетельствует образование газа в
закрытом колене трубки.
Дрожжевой автолизат. Прессованные пекарские или пивные
дрожжи заливают равным по массе количеством воды: полученную
суспензию клеток покрывают тонким слоем толуола и выдерживают
трое суток при температуре 60° С, время от времени перемешивая.
После этого суспензию несколько минут кипятят, дают остыть и
с помощью 1 н. раствора КОН доводят значение рН до 6, затем
отстаивают. Надосадочная жидкость (дрожжевой автолизат)
должна быть прозрачной, ее сливают и отфильтровывают через бум а ж*
ный фильтр на воронке Бюхнера под разрежением. Стерилизуют
автоклавированием 20 мин при 112е С.
Ассимиляция источников углерода
Перечень безазотистых источников углерода, проверка
способности к ассимиляции которых обязательна для полной
характеристики вида дрожжей, приведен ниже. Помимо указанных источников
углерода в отдельных случаях проверяют также способность
сбраживать декстрины, ассимилировать метанол, углеводороды (декан,
гексадекан) и больший набор органических кислот: уксусную,
винную, яблочную, пировиноградную, глюкуроновую, глюконовую и
производные последней кислоты — 2-кето- и 5-кетоглюконаты.
Источники углерода
Гексозы Трисахариды
D-Глюкоза*
D-Галактоза*
L-Сорбоза
L-Рамноза (6-дезоксиман-
ноза)
Пентозы
D-Ксилоза
L-Арабиноза
D-Арабиноза
D-Рибоза
Дисахариды
Сахароза*
Мальтоза*
Трегалоза*
Мелибиоза*
Лактоза*
Целлобиоза*
Гликозиды
а-Метил-Э-глюкозид*
Арбутин
Салицин
Рафиноза*
Мелецитоза*
Полисахариды
Инулин*
Растворимый крахмал*
Спирты
Этанол
Глицерин
/-Эритрит (мезо-эритрит)
Рибит (адонит)
Дульцит (галактит)
D-Маннит
D-Сорбит (глюцит)
i-Инозит (мио-, мезоинозит)
Органические кислоты
DL-молочная кислота
Янтарная^кислота
Лимонная кислота
* Соединения, используемые в тестах как на
ассимиляцию» так и на сбраживание.
43
Тесты на утилизацию источников углерода могут быть
поставлены как в жидкой, так и на агаризованной среде (азотной
дрожжевой основе, см. табл. 4). Преимущество первого способа —
возможность количественной оценки роста дрожжей путем измерения
мутности суспензии на нефелометре, тогда как при использовании
агаризованной среды рост оценивается лишь качественно,
визуально. Во втором случае, однако, применение чашечного метода и ино-
кулятора позволяет достигнуть большой экономии времени и сред.
На плотной среде, кроме того, легче обнаружить случайное
загрязнение культуры.
Приготовление иноку лята. Суспензии клеток исследуемых
трехсуточных культур, выращенных на сусле-агаре, готовят в
стерильной воде, в пробирках. Концентрация клеток дрожжей в 1 мл
должна быть примерно равна 10б—107, при этом оптическая
плотность суспензии при 660 нм находится в пределах 0,2—1,1. При
отсутствии нефелометра при приготовлении инокулята можно
воспользоваться карточкой белого картона с начерченными на нем
черной тушью линиями шириной *U мм:
Мутность приготовленной суспензии должна быть такова,
чтобы сквозь нее (в пробирке диаметром 16 мм) эти черные линии
были четко видны.
Посев. Жидкие среды (по 5 мл в пробирке) засевают 0,1 мл
приготовленной суспензии клеток дрожжей.
Агаризованные среды можно также разлить по пробиркам,
приготовив их в виде косяков, или по чашкам Петри. В обоих
случаях каждый штамм на серии сред засевают прямым штрихом.
Перед каждым нанесением штриха петлю вновь вводят в
приготовленную суспензию. Этим достигается внесение примерно
одинакового количества инокулята на каждую среду. Объем суспензии,
удерживаемый в кольце петли, достаточен для посева. Засевая
штрихом при чашечном методе, на каждую чашку можно поместить
6—8 культур (рис. 14, а). Более производителен чашечный метод
при использовании многоточечного инокулятора, с помощью
которого на каждую чашку можно наносить сразу 12—36 культур
(рис. 14, б). Модифицированный многоточечный инокулятор состоит
из круглого основания (диаметр 90 мм, высота 10 мм) с симмет-
44
рично высверленными в нем 24 лунками (диаметр 8 мм, высота
7 мм), и собственно инокулятора с 24 вертикальными штырьками
(диаметр 3 мм, высота 8 мм) с плоскими концами (рис. 15). Ино-
кулятор изготовляют из нержавеющей стали. Перед использованием
основание и сам инокулятор отдельно вкладывают в чашки Петри
заворачивают в плотную бумагу и стерилизуют автокла-
Рис. 14. Рост дрожжей при определении ассимиляционных свойств:
а — посев штрихами; б — посев инокулятором.
щ #||«§|
Рис. 15. Инокулятор для засева чашек Петри.
45
вированием при 12ГС или сухим жаром. Перед посевом
в лунки основания инокулятора вносят суспензии культур
дрожжей. В лунках должен быть такой объем суспензии,
чтобы при введении штырьков инокулятора суспензия не
поднималась до краев лунки. Затем основание инокулятора накрывают
крышкой стерильной чашки Петри. При посеве, приподняв крышку,
осторожно вводят в лунки штырьки инокулятора, затем строго
вертикально и медленно вынимают их (во избежание
разбрызгивания суспензии) и делают отпечаток на среде в чашке Петри. Эту
операцию повторяют при засеве каждой отдельной чашки.
Приготовляемые для засева инокулятором чашки должны быть
заполнены средами на строго горизонтальной плоскости и после
застывания агара на поверхности сред не должно быть капель
конденсационной воды. Во избежание последнего остывшие среды (около
50° С) рекомендуется разливать за 12—16 ч до посева.
Инкубация. Засеянные чашки и пробирки инкубируют до 3—4
нед при температурах, оптимальных для роста исследуемых
дрожжей. Пробирки с жидкими средами инкубируют на качалке в
наклонном положении.
Учет результатов. При любом методе постановки тестов
помимо сред с испытуемыми источниками углерода обязательно должны
быть для сравнения среда без какого-либо источника углерода
(отрицательный контроль) и среда с глюкозой (положительный
контроль).
При использовании жидких сред показания снимают через
7 сут, а в случае медленного роста культур — через 4 нед. Оценка
результатов помимо визуального сопоставления мутности сред,
содержащих испытуемые источники углерода, с отрицательным и
положительным контролями, может быть произведена с помощью
нефелометра или карточки белого картона с начерченными на ней
черной тушью линиями (см. выше). Ниже приводятся
общепринятые варианты оценок (табл. 2).
Таблица 2
Варианты оценок роста в физиологических тестах при выращивании
дрожжей в жидких средах
Показания
нефелометра
(светопропус-
кание), %
0—11
12—24
25—33
34—100
Черные линии шириной
3/4 мм на белом картоне
Не видны
Видны плохо
Неотчетливы края
Видны отчетливо
Оценка роста
Хороший (+)
Медленный (м)
Слабый (ел)
Нет роста (—-)
+++
++
+
^ При использовании агаризованных сред учет результатов в
первый раз проводят через трое суток, а затем через неделю.
Исключением при посеве штрихом на чашках и особенно с применением
инокулятора являются среды с мальтозой и сахарозой. По этим
сахарам показания снимают только в первый срок, поскольку позд-
46
нее культуры, he усваивающие данные дисахарйды, часто
обнаруживают рост за счет избыточного выделения соседними колониями
дрожжей ферментов, гидролизующих эти сахара. В подобных
сомнительных случаях необходимо повторить тестирование культур
в отдельных пробирках. Слабый рост нередко может быть
обусловлен наличием примесей в испытуемых соединениях. При
отсутствии более очищенных препаратов в серию идентифицируемых
штаммов полезно включить культуры видов дрожжей, заведомо
не ассимилирующих те источники углерода, чистота которых
вызывает сомнение.
Иногда дрожжи медленно адаптируются к некоторым источ^
никам углерода и поэтому окончательный просмотр чашек или
пробирок проводят еще через 3—4 нед. В каждый срок рост
оценивают визуально при одновременном сопоставлении роста на
испытуемом источнике углерода с ростом на положительном и
отрицательном контролях. Пробирки или чашки при этом помещают на
черную бумагу. Варианты оценок приведены в табл. 3.
ТаблицаЗ
Варианты оценок роста ["в 'физиологических тестах при выращивании
дрожжей на агаризованных средах
Рост
через 3 сут
через 6 сут
через 3—4 нед
Как на глюкозе
Слабее, чем на
глюкозе
Как на глюкозе
Слабее, чем на глюкозе
Как на
глюкозе
Слабее, чем на глюкозе
Отсутствует
Отс
утствует
Слабее, чем
на глюкозе
Оценка роста
Хороший (+)
Медленный (м)
Очень
медленный (оч. м)
Слабый (ел)
Очень слабый и
медленный
(оч. ел, м)
Нет роста (—)
+++
++
++
+
+
—
Состав азотной основы, применяемой для постановки тестов на
ассимиляцию источников углерода, указан в табл. 4. ,
Среды, приведенные в табл. 4, выпускаются в виде порошка
фирмой «Difco». Перед непосредственным использованием азотную
основу готовят в 10 раз более концентрированную, вносят соответ-
47
Таблица 4
Состав основных синтетических сред
Ингредиенты (на
1 л дистиллированной
воды)
*2
§*
о <->
<i а)
< СР
ос-
к
S-
& «
J2 о
«
СО
Ч
|8
р я
Рь О
Ж та
Я fit
&?
я «
S3
Источники углерода и азота, г
Глюкоза
(NH4)2S04
Аспарагин
Макроэлементы, г
КН2Р04
К2НР02
MgS04
NaCl
СаС12
Аминокислоты, мг
L-Гистидин НС1
DL-Метионин
DL-Триптофан
Витамины, мкг
Пантотенат кальция
Фолиевая кислота
Инозит
Никотиновая кислота
Парааминобензойная кислота
Пиридоксин НС1
Рибофлавин
Тиамин НС1
Биотип
Микроэлементы, мкг
н3ро3
CuS04
KJ
FeCl3
MnS04
Na2Mo04
ZnS04
Промытый агар, г
Количество сухой готовой среды фирмы
«Difco» на 1 л, г
10
3,5
1,5
0,85
0,15
0,5
0,1
0,1
10
20
30
2000
2
10000
400
200
400
200
400
20
500
40
100
200
400
200
400
18
35
0,85
0,15
0,5
0,1
0,1
10
20
20
2000
2
10000
400
200
400
200
400
20
500
40
100
200
400
200
400 |
6,7
10
0,85
0,15
0,5
0,1
0,1
1
2
2
2000
2
10000
400
200
400
200
400
20
500
40
100
200
400
200
400
11,7
ствующий источник углерода и раствор стерилизуют через-фильтр
Зейтца. Асептически его добавляют по 0,5 мл в пробирки с 4,5 мл
дистиллированной воды или 2%-ного водного расплавленного
агара, простерилизованных автоклавированием 15 мин при 121° С.
48
При использований чашечного метода соответствующие
объемы растворов азотной основы с источником углерода вносят в
колбы со стерильным расплавленным агаром, конечная
концентрация которого должна быть 2%, и после осторожного перемеши-.
вания разливают по чашкам. Конечная концентрация источников
углерода в средах 0,5%, за исключением рафинозы (1%). При
введении в среды в качестве источника углерода органических
кислот значение рН с помощью раствора КОН доводят до 5,6—6,0.
Растворимый крахмал и инулин предварительно растворяют в
дистиллированной воде при нагревании и стерилизуют не
фильтрованием, а автоклавированием 15 мин при 112° С. Также отдельно
автоклавированием стерилизуют углеводороды, добавляя их в
среды в концентрации 2% (по объему). Этанол добавляют по
объему без стерилизации.
Приготовление промытого агара. 20 г агара заливают 1 л
дистиллированной воды и выдерживают 8 сут при комнатной
температуре, ежедневно меняя воду. После этого агар еще несколько
раз промывают дистиллированной водой, затем доводят общую
массу до 1 кг и автоклавируют 15 мин при 112° С.
Ассимиляция источников азота
К одному из наиболее ценных таксономических признаков
относят способность дрожжей использовать нитраты в качестве
единственного источника азота в среде. Это один из немногих
физиологических признаков, применяемых при разграничении дрожжевых
организмов на уровне рода (Hansenula—Pichia). При
идентификации же видов внутри родов, включающих как
нитрат-положительные, так и нитрат-отрицательные организмы, дифференциацию
видов, как правило, проводят прежде всего по этому признаку.
Следует учитывать, что некоторые дрожжи способны расти
при очень низком содержании азотистых веществ: за счет
примесей в компонентах среды, а также за счет внутриклеточных
запасов. Для истощения последних перед постановкой теста
идентифицируемые дрожжи полезно 2—3 раза пропассировать на углеродной
основе (см. табл. 4) без источника азота. При приготовлении сред
следует использовать тщательно вымытую посуду и вещества,
входящие в состав среды, марки х. ч. или ос. ч. Приготовление ино-
кулята, постановка теста и учет результатов осуществляются так
же, как при определении способности к ассимиляции источников
углерода. Нитрат калия в углеродную основу вносят в
концентрации 0,78 г/л. В качестве обязательных контролей используют эту же
среду без какого-либо источника азота (отрицательный контроль)
и с сульфатом аммония (положительный контроль). Слабый рост
на среде с KNO3 обычно рассматривают как отрицательную
реакцию. В сомнительных случаях можно прибегнуть к качественной
пробе на присутствие в среде нитрита — промежуточного продукта
восстановления нитрата. При этом используют два реактива.
Реактив I
Сульфаниловая кислота — 0,8 г; 5 н. уксусная кислота (или
разбавленная серная кислота: 1 часть концентрированной на 20 частей
воды) — 100 мл.
49
Реактив 11
сс-Нафтиламин — 0,5 г; 5 н. уксусная кислота — 100 мл.
Несколько капель каждого из реактивов вносят в пробирку, в
которой дрожжи росли на среде с нитратом. В присутствии
нитритов появляется розовая или красная окраска. В случае обильного
роста отрицательная реакция может быть обусловлена полной
утилизацией дрожжами и нитратов, и нитритов. Чтобы установить
присутствие в среде нитратов, в пробирку можно добавить немного
порошка цинка. При этом нитраты восстанавливаются до нитритов
и через некоторое время развивается розовая окраска.
Кроме теста на способность к ассимиляции нитратов иногда
проверяют способность дрожжей к усвоению нитритов.
Диагностическая ценность последнего теста невелика, так как виды,
утилизирующие нитраты, могут ассимилировать и нитриты. В качестве
дополнительного критерия этот тест применяется при
идентификации видов дрожжей, не усваивающих нитраты, но способных
использовать нитриты (Debaryomyces hansenii, Pichia pinus). Ввиду
того, что нитриты токсичны для дрожжей в результате
образования азотистой кислоты при низких значениях рН среды, NaNOa
вносят в среду в концентрации не выше 0,26 г/л.
При идентификации видов рода Saccharomyces используют
тест на способность к усвоению этиламина в качестве
единственного источника азота в среде. Его вносят в среду в концентрации
0,64 г/л. Постановку тестов с нитритом и этиламином и учет
результатов производят так же, как при определении способности
дрожжей к ассимиляции нитратов.
Рост в безвитаминной среде
Способность дрожжей синтезировать все необходимые для
роста витамины или потребность в наличии каких-либо из них в
среде используют при идентификации видов в качестве
дополнительных характеристик. В некоторых случаях потребность в
определенных витаминах присуща всем представителям рода, например все
виды Hanseniaspora, Kloeckera нуждаются в инозите и пантотено-
вой кислоте. В других родах зависимость по каким-либо
витаминам или способность расти на безвитаминной среде характеризуют
отдельные виды или даже разновидности. Наиболее часто дрожжи
нуждаются в обеспечении биотином и тиамином.
Постановка теста на способность к росту в среде. без
витаминов (см. табл. 4) осуществляется аналогично постановке тестов на
способность к ассимиляции источников углерода. Поскольку
дрожжи способны накапливать в клетках значительные количества
витаминов, для приготовления инокулята в данном тесте используют
культуры дрожжей, выращенные в безвитаминной среде.
Медленный и слабый рост рассматривают как неспособность исследуемых
организмов синтезировать все необходимые для роста витамины.
Рост на средах с повышенным осмотическим давлением
Хотя степень осмотолерантности дрожжей обычно всегда
приводится при полном описании видов, для целей диагностики эти
данные находят ограниченное применение. В частности, способ-
50
ность к росту на средах с 50 до 60% (по массе) глюкозы
используют при идентификации разновидностей сахаромицетов.
Способность расти при более низких концентрациях глюкозы проверяют
очень редко, поскольку почти все дрожжи могут развиваться при
содержании в среде 40% глюкозы и ниже.
Дрожжи, устойчивые к высоким осмотическим давлениям,
создаваемым в среде глюкозой, не всегда так же устойчивы к
давлениям, создаваемым солями. При определении галотолерантности
дрожжей используют среды с хлористым натрием концентрациями
от 0 до 27% с интервалом в 1%. При учете результатов
отмечают наивысшую концентрацию NaCl, при которой еще наблюдается
рост. Очень устойчивы к высокой концентрации NaCl в среде
некоторые представители рода Debaryomyces, способные иногда
расти даже в насыщенных растворах (26,5% NaCl при 25еС).
Данные по осмотолерантности дрожжей часто используют в качестве
экологической характеристики.
Среда с 50% (или 60%) глюкозы
Глюкоза, г 50 (60)
Дрожжевая вода (или 1%-ный 50 (40)
раствор дрожжевого автолизата), мл 3"
Агар, % "(по массе от объема
получившегося раствора
глюкозы),
Среду автоклавируют 1{?' мин при 112° С и~ разливают по
чашкам. При использовании среды в пробирках в виде косяков среду
вначале подогревают на водяной бане для расплавления агара,
разливают по пробиркам и затем автоклавируют. Посев производят
штрихом, инкубация длится до четырех недель.
Среда для определения галотолерантности
Глюкоза, г 2
Пептон, г 1
Дрожжевой экстракт, г 0,5
NaCl, г 0 или 1,2. , .26, 27
Вода, мл 100.
Среду разливают в пробирки по 5 мл и автоклавируют 16 мин
при 112° С; инкубируют на качалке 8 сут.
Рост при повышенных температурах
Для большинства видов дрожжей оптимальные температуры
роста находятся в пределах 20—28е С, но имеются также
организмы, лучше развивающиеся при более низких или более высоких
температурах. В последние годы способность дрожжей к росту при
определенных температурах, а точнее максимальных для роста,
все чаще вводят в ключи в качестве дифференцирующего
признака. В зависимости от конкретного рода используют различия в
способности к росту при температурах 20—25, 28—34, 37—39 и
40-45° С.
51
При установлении способности к росту дрожжи культивируют
при разных температурах на сусло-агаре, морфологическом агаре,
жидкой азотной основе с 0,5% глюкозы или в жидкой глюкозо-пеп-
тонной среде с дрожжевым экстрактом. Инокулят готовят таким
же образом, как для тестов на ассимиляцию источников углерода.
На плотную среду посев производят штрихом, жидкие засевают
0,1 мл инокулята. При повышенных температурах на плотной среде
дрожжи инкубируют 2—4 сут. При слабом росте делают пересев
на ту же среду и вновь инкубируют при этой же температуре.
Определяющими являются результаты второго пассажа. При
тестировании в жидких средах инкубацию ведут на качалке. Учет
результатов через 1 и 3 нед производят так же, как в тестах на
ассимиляцию источников углерода.
При определении максимальной температуры роста дрожжи
культивируют в жидкой глюкозо-пептонной среде с дрожжевым
экстрактом. Засеянные пробирки инкубируют в водяных
термостатах при температурах, различающихся между собой на Г. Учет
производят через неделю.
Устойчивость к циклогексимиду (актидиону)
По устойчивости к этому антибиотику дрожжи разделяют на
три группы: очень чувствительные (ингибируются при
концентрации циклогексимида 1 мкг/мл), умеренно чувствительные
(25 мкг/мл) и устойчивые (могут расти при концентрации
антибиотика 1000 мкг/мл). В диагностической практике используют
тест на способность дрожжей к росту при содержании в среде
циклогексимида 100 мкг/мл. Он находит применение при
дифференциации видов родов Saccharomyces и Candida. В качестве
среды используют жидкую азотную основу (см. табл. 4) с 0,5%
глюкозы. Добавляемый асептически раствор антибиотика стерилизуют
фильтрованием. Посев и учет результатов производят аналогично
тестам на ассимиляцию источников углерода; инкубируют на
качалке до четырех недель.
ОБНАРУЖЕНИЕ И АНАЛИЗ НЕКОТОРЫХ МЕТАБОЛИТОВ
В данном разделе описаны лишь те простые качественные
методы определения образования дрожжами некоторых соединений,
ферментов, которые широко распространены в диагностической
практике.
Уреазная активность
Дрожжевые организмы различаются между собой по
способности к разложению мочевины при относительно высокой ее
концентрации в среде. Найдено, что за немногими исключениями уре-
азной активностью обладают дрожжи, имеющие ядерную ДНК
ГЦ-типа.
52
Среда Христеисеиа
Глюкоза, г 1 Феноловый красный, г 0,012
Пептон, г 1 Агар, г 20
КНаР04, г 2 Дистиллированная вода, л 1
NaCl, г 0,5
Среду подогревают на водяной бане для расплавления агара,
перемешивают и рН среды доводят до 6,8. Затем среду разливают
в пробирки по 4,5 мл и автоклавируют 10 мин при 121°?, после
чего асептически в каждую пробирку добавляют по 0,5 мл 20%-ного
раствора мочевины, пропущенного через фильтр Зейтца. Среду
перемешивают и закашивают. Посев производят штрихом. Срок
инкубации длится до 5 сут при температуре, оптимальной для роста
идентифицируемых организмов.
В случае уреазоположительных дрожжей окраска среды в
результате ее подщелачивания становится розово-красной, у уреазо-
отрицательных остается желтой.
Гидролиз арбутина
Способность к расщеплению арбутина (P-D-глюкопиранозид
гидрохинона, СвНнО* — О — СвНЮН) свидетельствует о наличии у
Остаток Остаток
глюкозы гидрохинона
дрожжей р-глюкозидазной активности. Образующийся в результате
гидролиза гидрохинон можно обнаружить при действии раствором
соли трехвалентного железа; среда при этом окрашивается в
темно-бурый цвет. Способность расщеплять арбутин обычно связана
со способностью дрожжей ассимилировать целлобиозу и салицин.
Среда с арбутином
Арбутин, г 5
Дрожжевая вода (или разведенный в 1
10 раз дрожжевой автолизат), л
Агар, г 20
Среду автоклавируют 15 мин при 12ГС. После стерилизации
в еще расплавленную среду асептически добавляют стерильный
1«%-ный раствор хлорного железа (7 мл) или двойной соли
цитрата железа и цитрата аммония, (ЫНОзСвНвОт-РеСвНвОт, осторожно
перемешивают и разливают в чашки. Посев производят штрихом,
инкубация длится 2—7 сут. Вокруг штрихов дрожжей,
расщепляющих арбутин, образуется коричневая зона.
Разжижение желатины
10—20 г желатины растворяют в 90 мл горячей дистиллирован-
ной воды, разливают в пробирки по 4,5 мл и автоклавируют
15 мин при 12ГС, охлаждают до 37° С и асептически добавляют
в каждую пробирку по 0,5 мл углеродной дрожжевой основы (см.
табл. 4), концентрация компонентов в которой в 1Q раз выше, за
53
исключением глюкозы. Содержание последней в концентрированной
среде должно быть 5%. Пробирки оставляют застывать в
вертикальном положении. Посев производят, внося кайлю суспензии
дрожжей на поверхность столбика. Температура инкубации не
выше 25° С, срок — от 7 до 24 сут. В случае значительной протеоли-
тической активности толщина разжиженного слоя может быть
измерена в мм.
Гидролиз жира
Свежий говяжий. жир расплавляют, фильтруют и автоклавиру-
ют 15 мин при 12ГС. Пипеткой вносят его в стерильные теплые
чашки Петри так, чтобы образовался тонкий однородный слой,
излишек жира удаляют. Чашки помещают на 2 ч в холодильник,
затем в них добавляют по 18—20 мл среды Городковой с 0,1%
карбоната кальция. Посев производят штрихами. В случае
положительной реакции вокруг штриха образуется зона просветления
среды.
Образование органических кислот
В процессе роста все дрожжевые организмы в той или иной
степени подкисляют среду в результате выделения органических
кислот (уксусной, изолимонной, лимонной, янтарной, молочной и
др.). В большинстве случаев общая продукция их невелика, за
исключением представителей тех родов (например, Brettanomyces,
Dekkera), у которых кислотообразование настолько значительно,
что хорошо обнаруживается при культивировании их на среде,
содержащей мел.
Меловой агар
Глюкоза, г 50 Агар, г 20
Дрожжевой экстракт, г 5 Дистиллированная вода, л 1
СаС03 (полученный осажде- 5
нием), г
Среду автоклавируют 20 мин при 112° С, затем охлаждают до
50е С, осторожно перемешивают и разливают в предварительно
охлажденные чашки. Посев производят штрихами. При
положительных результатах вокруг штрихов появляются прозрачные зоны.
Образование эфиров
Некоторые дрожжи, например Hansenula, Brettanomyces,
способны образовывать летучие соединения с довольно характерным
запахом. Для их обнаружения дрожжи культивируют 2—5 сут на
сусло-агаре с дрожжевым экстрактом или в дрожжевой воде с 5%
глюкозы. Наличие эфиров устанавливают по запаху.
54
Образование крахмалоподобных соединений
Ряд дрожжевых организмов могут образовывать соединения,
благодаря которым среда и (или) сам штрих при действии
раствором Люголя окрашиваются в синий цвет. Немногие дрожжи
(Cryptococcus macerans, Rhodosporidium infirmo-miniatum, Phaffia
rhodozyma) способны образовывать эти вещества при обычных
условиях культивирования независимо от рН среды, например на
сусло-агаре, другие — лишь на средах со значениями рН ниже 5,0.
Среда для проверки образования крахмалоподобных соединений
Глюкоза, г 10 MgS047H20, г 0,5
(NH4)2S04, г 1 Агар, г 25
КН2Р04, г 1 Дистиллированная вода, л 1
Среду автоклавируют 20 мин при 112° С, охлаждают до 50° С,
подкисляют с помощью НС1 до рН 4,0—4,5 и разливают в чашки, в
которые предварительно внесено по 1 капле дрожжевого автоли-
зата. Срок культивирования составляет 10—12 сут. По истечении
этого срока чашки заливают раствором Люголя (KJ — 2 г, J2 — 1 г,
дистиллированная вода — 300 мл) так, чтобы была смочена вся
поверхность среды и штрихи. Затем оставляют чашки часа на два
на свету. Снимают показания, поставив чашки на белый фон.
В случае очень слабого образования крахмалоподобных
веществ рекомендуется культивирование в жидкой среде с 5%
глюкозы на качалке.
Определение моносахаридного состава внеклеточных
полисахаридов
К данному анализу приходится прибегать при
идентификации некоторых видов дрожжей рода Lipomyces, различающихся
между собой по наличию или отсутствию во внеклеточных
полисахаридах галактозы. Он также бывает полезен и в ряде других
случаев, в частности при дифференциации представителей
несовершенных дрожжей родов Cryptococcus и Rhodotorula. В отличие от
последних в полисахаридах криптококков присутствует ксилоза.
Среды для образования
внеклеточных полисахаридов
Среда Голубева
Гидролизат казеина, г 2 СаС12-2Н20, г 0,001
Na.HP042H20, г 3,56 МпС12.4Н20, г 0,0015
КН2РО^ г 1,82 FeS04.7H20, г 0,01
MgS04'/H20, г 0,5 Дрожжевой экстракт, г 0,4
NaCl, г 0,1 Дистиллированная вода, мл 900
, Среду разливают по 90 мл в колбы на 0,5 л. Отдельно готовят
100 мл 50%-ного раствора глюкозы. Среду автоклавируют 20 мин
при 112° С. Затем асептически в каждую колбу со средой вносят
по 10 мл раствора глюкозы.
55
Среда Горийа
Глюкоза, г 50 NaCl, г 0,1
(NH4),S04, г 1,4 Дрожжевой автолизат, мл 4
КН2Р04, г 1 Водопроводная вода, л 1
MgS04.7H20, г 0,5
Среду разливают по 100 мл в колбы на 0,5 л, в каждую
добавляют по 0,5 г СаСОз и автоклавируют 20 мин при 112° С.
Для инокуляции этих сред используют двух-, трехсуточные
культуры дрожжей, выращенных на той же среде. Инкубацию
ведут на качалке 5—7 сут.
Выделение внеклеточных полисахаридов. Клетки отделяют
центрифугированием. Эта операция иногда осложняется вследствие
высокой вязкости культуральной жидкости. В этих случаях прибегают
к разбавлению ее водой и добавлению КС1 и этанола (1 и 30%
соответственно от объема разбавленной культуральной жидкости).
Для инактивации клеток добавляют 1% хлороформа. Прозрачный
супернатант помещают в целлофановые мешки и на 1—2 сут
ставят на диализ против проточной водопроводной воды. В случае
невысокого образования внеклеточных полисахаридов супернатант
можно сконцентрировать, упаривая его под вакуумом. При этом во
избежание вспенивания и ускорения процесса к супернатанту
добавляют небольшие объемы «-бутанола. Полисахариды осаждают
добавлением при перемешивании 2—4 объемов 95%-ного раствора
этанола. Для лучшего формирования осадка колбу оставляют на
ночь в холодильнике. Осадок отделяют центрифугированием и
несколько раз промывают 95%-ным раствором этанола. Осадок
высушивают в вакуумном эксикаторе над СаС12 и РгО» или же
растворяют в небольшом объеме воды и лиофилизируют.
Полный кислотный гидролиз полисахаридов. Гидролиз
полисахаридов обычно проводят 2 н. раствором H2SO4 при 100° С в
запаянных ампулах. Необходимое время гидролиза для разных
полисахаридов и для максимального выхода отдельных моносахаридных
единиц может варьировать от 1 до 7 ч. В большинстве случаев
гидролиз ведут 2—4 ч. Гидролизат нейтрализуют твердым ВаСОз,
осадок отфильтровывают или отделяют центрифугированием.
Полученный раствор обрабатывают ионообменной смолой КУ-2 (Н+-форма)
и упаривают под вакуумом при температуре не выше 45—50° С.
Идентификация продуктов гидролиза. Растворы гидролизатов
анализируют методом нисходящей хроматографии на бумаге. При
этом используют разные системы растворителей. Одна из наиболее
употребительных систем, обеспечивающая неплохое разделение мо-
носахаров, обычно встречающихся в составе дрожжевых
полисахаридов, — «-бутанол—пиридин—вода (6:4:3).
Проявление хроматограмм производят или раствором AgNOs с
последующим опрыскиванием раствором щелочи или же анилинфта-
латным реактивом. В первом способе образуются пятна
темно-бурого или черного цвета. После проявления, если нужно сохранить хро-
матограммы, их необходимо пропустить через раствор тиосульфата
натрия (200 г/л), промыть водой и высушить. Проявление анилин-
фталатным реактивом менее чувствительно, но позволяет различать
гексозы и пентозы. Первые окрашиваются в светло-бурый, а
последние в красно-бурый цвет.
56
Раствор AgNOe готовят из расчета 0,1 мл насыщенного
раствора соли на 20 мл ацетона.
Раствор NaOH (или КОН) готовят, добавляя к насыщенному
водному раствору щелочи метанол до получения концентрации
щелочи 0,5 н.
Анилинфталатный проявитель. 1,66 г фталевой
кислоты и 0,93 г свежеперегнанного анилина растворяют в 100 мл
водонасыщенного «-бутанола. После опрыскивания хроматограмму
просушивают и прогревают 30 мин в сушильном шкафу при 80° С.
СХЕМА СТАНДАРТНОГО ОПИСАНИЯ НОВЫХ ВИДОВ
ДРОЖЖЕЙ
Рост в жидком сусле: форма клеток и способ вегетативного
размножения в 3-суточной культуре; размеры; образование
пленки, кольца и осадка в 30-суточной культуре.
Рост на сусло-агаре или морфологическом агаре: описание
морфологии клеток в 3-суточной культуре и штриха на 3 и 30 сут
культивирования; описание гигантской колонии.
Рост на пластинках с картофельно-глюкозным или кукурузным
агаром: образование псевдомицелия, истинного мицелия, артро-
спор, хламидоспор.
Образование баллистоспор.
Описание жизненного цикла: гомо- или гетероталлизм, образование
сумок или базидий, место и способ диплоидизации, число и
форма аскоспор, скорость их освобождения из сумок.
Брожение Сахаров: спектр и скорость сбраживания.
Ассимиляция источников углерода: «пестрый ряд» из 30—32
источников.
Ассимиляция источников азота: использование нитратов и
нитритов.
Рост в среде без витаминов (желательно указание на потребность
в тех или иных витаминах, т. е. приведение витаминограммы).
Рост на средах с высокими концентрациями сахара и соли, осмо-
толерантность и галотолерантность.
Рост при 37° С, нижний и верхний температурные пределы роста.
Выделение крахмалоподобных соединений.
Устойчивость к циклогексимиду (актидиону).
Гидролиз мочевины.
Расщепление арбутина.
Разжижение желатины.
Гидролиз жира.
Образование органических кислот.
Образование эфиров.
Моносахаридный состав внеклеточных полисахаридов.
В описании должны быть также сведения о том, когда и
откуда выделены исследуемые дрожжи и на каком количестве
штаммов проведено их изучение.
При составлении описания нового вида желательно сравнение
с типовыми штаммами близких видов. В описании, подготовленном
к опубликованию, должен быть диагноз на латинском языке. Во
всех случаях при внесении изменений в систематику дрожжей
следует руководствоваться правилами «Международного кодекса
ботанической Номенклатуры» [14].
57
Глава III. КЛАССИФИКАЦИЯ ДРОЖЖЕЙ
В классической систематике грибов дрожжи не составляют
единого отдельного таксона. Одноклеточные грибы, которые принято
обозначать неноменклатурным термином «дрожжи», в зависимости
от наличия и типа полового процесса распределяются по трем
классам высших (септированных) грибных организмов: Ascomycetes,
Basidiomycetes и Fungi Imperfecti, или Deuteromycetes.
В последнее десятилетие, однако, в микологии наметилась новая
тенденция [21, 38] к объединению всех дрожжей вместе с
некоторыми фитопатогенными грибами (тафриновыми и головневыми) в
один класс Endomycetes на основании того, что все они имеют
примитивный половой процесс соматогамного типа (слияние двух
недифференцированных клеток), не образуют плодовых тел, и гап-
лофаза у них представлена, как правило, почкующимися клетками.
Образующаяся в результате полового процесса зигота
превращается либо в спорангий (аск), либо прорастает в дикариофитный
мицелий, на котором формируются телиоспоры, дающие экзогенные
споры — споридии.
При составлении рабочих ключей для определения родов
дрожжевых организмов авторы придерживались системы разделения всех
дрожжей на три группы — аскомицетовых (образуют сумки с
эндогенными половыми спорами), базидиомицетовых (образуют
телиоспоры и базидиоподобные спорофоры с экзогенными половыми
спорами) и несовершенных (не имеют полового процесса, образуют
лишь бесполые споры).
Для определения вида внутри найденного рода следует
обратиться, к определителям Lodder [55] и Barnett a. Pankhurst [28].
Последний составлен на основании только физиологических
признаков и может быть использован как дополнение к определителю Л од-
дер. Преимущество его заключается в том, что он издан позднее
и включает более 90 дополнительных видов.
АСКОМИЦЕТОВЫЕ ДРОЖЖИ
А. Вегетативное размножение только делением, почкования нет.
Септированные гифы могут присутствовать, они распадаются
на артроспоры
1) преобладают делящиеся одиночные клетки, мицелия нет или
он скудный Schizosaccharomyces (64)*
2) септироваиный мицелий, обильно развит . Endomyces (17)
Б. Септированные гифы обильны, артроспоры не образуются.
Почкование, если имеется, скудное
1) аскоспоры серповидные Guilliermondella (24)
2) аскоспоры веретеновидные . . .Nematospora (44)
3) аскоспоры шляповидные и сатурновидные
а) сумки образуются из раздутых гифальных клеток,
расположены цепочками Arthroascus ( 5)
* Цифра означает порядковый номер рода в списке
диагностических описаний, следующих за ключами.
58
б) сумки одиночные, в пучках и цепочками,
расположены терминально (на аскофорах), латерально или
интеркалярно
Ambrosiozyma (3)
Cephaloascus'(lO)
Hormoascus (28)
Saccharomycopsis (60)
в) сумки одиночные, образуются из субапикальных
клеток гиф . Stephanoascus (70)
г) сумки образуются только из конъюгирующих
дрожжевых клеток Hyphopichia (29)
В. Почкующееся деление, мицелия не образуют. Клетки апику-
лятные
1) клетки крупные (4—8X8—23 мкм)
а) аскоспоры круглые с шипами или складками,
образуются после педогамной конъюгации . . Nadsonia (42)
б) аскоспоры кепковидные, обычно 1—2 в сумке,
образуются без конъюгации .... Wickerhamia (80)
в) аскоспоры круглые гладкие, обычно 4 в сумке,
расположены парами Saccharomycodes (59)
2) клетки мелкие (1,5—5X2,5—11 мкм), аскоспоры
полушаровидные Hanseniaspora (26)
Г. Вегетативное размножение почкованием, может
присутствовать псевдомицелий
1) аски булавовидные или клиновидные, образуются из
хламидоспор, аскоспоры игловидные Metschnikowia (38)
2) аски мешковидные, прикреплены к материнской клетке,
содержат до 30 спор; олигонитрофилы, обитают в почве
Lipomyces (34)
3) аски толстостенные с трубчатым выростом, аскоспоры
шляповидные Pachysolen (48)
4) аски образуются из вегетативных клеток без или после
конъюгации их между собой или с почкой
а) аскоспоры удлиненно-овальные
— спор 1—4 в аске, термофилы, ассоциированные с
теплокровными животными . . . .Cyniclomyces (13)
— 1 спора в сумке, свободноживущие Lodderomyces (35)
б) аскоспоры круглые и бобовидные, сильное
брожение, нитраты не ассимилируют . . Kluyveromyces (32)
Saccharomyces (58)
Zygosaccharomyces (88)
в) аскоспоры сатурновидные .... Williopsis (82)
г) аскоспоры шляповидные
— нитраты ассимилируют Hansenula (27)
— нитраты не ассимилируют Pichia (51)
— сильное кислотообразование .... Dekkera (15)
д) аскоспоры с бородавчатой поверхностью
— нитраты ассимилируют .... Citeromyces (11)
— нитраты не ассимилируют . . . Debaryomyces (14)
Torulaspora (75)
59
е) аскоспоры со складчатой поверхностью и
экваториальным выступом (форма грецкого ореха)
Schwanniomyces (бб)
ж) аскоспоры линзовидные Wingea (83)
з) аскоспоры мелкие овальные с шероховатой
поверхностью, 1 спора в сумке, почкование может быть на
широком основании Wickerhamiella (81)
БАЗИДИОМИЦЕТОВЫЕ ДРОЖЖИ
А. Образуют телиоспоры, прорастающие промицелием со
споридиями
1) культуры пигментированные . . Rhodosporidium (56)
2) культуры непигментированные . Leucosporidium (33)
Б. Образуют базидиоподобные спорофоры
1) споры расположены венчиком на вершине спорофора
Filobasidium (22)
2) споры в цепочках на вершине раздутого спорофора
Filobasidiella (21)
НЕСОВЕРШЕННЫЕ ДРОЖЖИ
А. Образуют баллистоспоры
1) мицелий с пряжками и хламидоспорами Sporidiobolus (68)
2) мицелий, если образуется, без пряжек или отсутствует
а) колонии розовые и красные, баллистоспоры
почковидные Sporobolomyces (69)
б) колонии бесцветные, баллистоспоры яйцевидные или
круглые Bullera (8)
в) колонии на ранних стадиях развития бесцветные,
затем слабо пигментированы, баллистоспоры изогнутые,
серповидные Tilletiopsis (74)
Б. Баллистоспор не образуют
1) почки (конидии) образуются на стеригмоподобных
стебельках Sterigmatomyces (71)
2) почки (конидии) образуются симподиально на
коротких конидиофорах Sympodiomyces (72)
3) игловидные бластоконидии на септированном мицелии
Aciculoconidium (1)
4) почки образуются на широком основании на полюсах
клетки (почкующееся деление)
а) биполярное образование почек
— сбраживают сахара Kloeckera (31)
— брожение отсутствует . . Schizoblastosporion (63)
б) монополярное образование почек . . Pityrosporum (52)
5) почкование многостороннее, места образования почек
строго не фиксированы
а) клетки треугольные Trigonopsis (79)
б) клетки серповидные Selenotila (67)
60
в) клетки с бичевидными отростками . Mastigomyces (37)
г) клетки круглые и овальные
— преобладает септированный мицелий,
распадающийся на артроспоры . . . Trichosporon (77)
Trichosporonoides (78)
— септированный мицелий, не распадающийся на
артроспоры и (или) псевдомицелий Candida (9 )
Oosporidium (47)
— септированный мицелий и сарциноподобные
группы эндоспор Sarcinosporon (62)
— истинного мицелия не образуют
— активные кислотообразователи, культуры
растут медленно и быстро отмирают. Brettanomyces ( 7)
— культуры бесцветные, инозит не ассимилируют
Torulopsis (76)
— культуры бесцветные или слабо
пигментированы, инозит ассимилируют, сахара не
сбраживают ...... Cryptococcus (12)
— культуры пигментированные (красные, розовые,
оранжевые), инозит не ассимилируют, сахара
не сбраживают Rhodotorula (57)
— культуры красно-оранжевые, инозит не
ассимилируют, сахара сбраживают . . Phaffia (50)
Примечания: 1. В ключ для определения несовершенных дрожжей
не вставлены так называемые черные дрожжи. В культуре на
плотных средах многие грибы сем. Dematiaceae из несовершенных
гифомицетов образуют темноокрашенные (оливковые, коричневые,
черные) колонии, состоящие из одних дрожжевых клеток или с
гифами. В определители дрожжей эти организмы обычно не
включают, так как они классифицируются среди разных родов грибов
и лишь на ранних стадиях развития сходны с дрожжами. Иногда
они в начале роста образуют бесцветные колонии и могут быть
ошибочно приняты за обычные дрожжи. Выделяются эти грибы
из самых разнообразных источников вместе с дрожжами, но в
основном они связаны с живыми растениями (эндо- и эпифиты,
часто патогены или их спутники), а также с разлагающимися
растительными остатками и растительными продуктами.
Дифференцирующие признаки для разграничения «черных
дрожжей»:
А. Образуют септированный ветвящийся мицелий. Колонии
могут быть сначала белыми или оливковыми, затем
становятся черными; гладкие, бархатистые, иногда с
воздушным мицелием, ограниченные и широко
распространяющиеся
а) конидии (радулоспоры) мелкие (1,2X4,0 мкм),
одиночные, редко пучками; мицелий образует субстратные и
воздушные коремии; рост медленный, колонии от
оливковых до черных Exophiala (19)
б) конидии (радулоспоры) крупные (3—4X7—8 мкм),
одиночные и собраны пучками на любых частях мицелия
и на хламидоспорах; рост быстрый, колонии от белых
до кремовых, оливковых и черных или с черными
радиальными и концентрическими полосами . Aureobasidium (6)
61
Б. Септироваиного мицелия не образуют, может
присутствовать примитивный псевдомицелий. Колонии гладкие,
ограниченные, черные, пигмент иногда проникает в среду
Phaeococcus (49)
2. По культуральным признакам некоторые фитопатогенные
грибы, такие, например, как Protomyces и Taphrina, могут
классифицироваться как дрожжи. Они образуют бесцветные дрожжевидные
колонии, которые со временем приобретают красновато-желтую,
оранжевую или коричневую окраску от присутствия некаротиноид-
ных пигментов. Их почкующиеся стадии по физиологическим
признакам сходны либо с Cryptococcus [у Protomyces (53)], либо с
Rhodotorula (у Taphrina). И те, и другие не сбраживают сахара,
образуют крахмалоподобные внеклеточные соединения и це растут
при температуре выше 25° С. В мицелиальной стадии они
паразиты, в почкующейся —.сапрофиты.
3. Вместе с дрожжами из природных субстратов (из сокоте-
чений деревьев, из почвы) и из антропогенных очагов (с кожи и
из кишечника человека) выделяются бесцветные водоросли рода
Prototheca, которые при первичном просмотре могут быть приняты
за дрожжи из-за морфологически и физиологически сходных
признаков. Они могут быть опознаны по способу размножения. Их
описание, включено в общий перечень родов [см. Prototheca (54)].
ДИАГНОСТИЧЕСКИЕ ОПИСАНИЯ РОДОВ ДРОЖЖЕЙ
В эти описания включены все роды дрожжей, которые описаны
в определителях Н. А. Красильникова [10], В. И. Кудрявцева [11]
и J. Lodder, ed. [55]. При составлении описаний использованы
помимо указанных определителей и новые публикации по этим родам.
Ссылки на новые ключи приводятся в тексте.
1. Aciculoconidium
Овальные клетки и разветвленный септированный мицелий, на
котором латерально образуются овальные бластоспоры. Последние
отделяются и почкуются или формируют цепочки, собранные
мутовками на гифах (рис. 16,а). Овальные конидиогенные клетки
образуют от 1 до 4 игловидных конидий (рис. 16,6), которые
отделяются и почкуются (рис. 1б,в). В некоторых гифах происходит
дезартикуляция, но типичные артроспоры не образуются. На
плотных средах быстро распространяющийся рост, приводящий к
образованию крупных бесцветных колоний. Сахара не сбраживают,
нитраты не ассимилируют. Характерен сильный фруктовый аромат.
Единственный вид этого рода—A. aculeatum (Phaff et al.) King et
Jong [36] в определителе Лоддер [55] описан как Trichosporon
aculeatum Phaff et al.
2. Aessosporon
Род создан [25] для совершенных форм Sporobolomyces (69)
и Bullera (8).
62
Рис. 16. Aciculoconidium aculeatum: a — псевдомицелий с бласто-
спорами; б —игловидные бластоконидии; в — прорастание конидий.
3. Ambrosiozyma
Почкующиеся клетки круглые, эллипсовидные, удлиненные
(рис. 17,а). Почки иногда образуются на широком основании. Псев-
Рис. 17. Ambrosiozyma: a — почкующиеся клетки; б —мицелий с
септами; в — пучок асков с аскоспорами.
63
домицелий с пучками бластоспор и разветвленные, регулярно сеп-
тированные гифы; на септах имеются хорошо заметные в световой
микроскоп утолщения вокруг поры с пробкой (рис. 17,6). Бласто-
споры формируются на небольших выростах и при отделении
оставляют рубцы. Аски круглые, эллипсоидные или клиновидной
формы, редко одиночные, чаще располагаются на гифах пучками
латерально или терминально (рис. 17,в). Аскоспоры шляповидные
и сатурновидные, 1—4 в сумке, при созревании становятся
коричневыми и легко освобождаются из сумки. Колонии сначала
кремовые, позже приобретают коричневый оттенок. Нитраты не
ассимилируют. Имеют характерный запах аморфы — декоративного
кустарника. В природе встречаются в ассоциации с жуками-короедами
вместе с другими амброзиальными грибами. Род не сохранил тою
объема, в котором он был впервые описан [59], на основании
способности ассимилировать нитраты из него выделен в
самостоятельный таксон род Hormoascus (28).
4. Anthomyces
Старое название для нектарных дрожжей, которые
классифицируются в настоящее время как Metschnikowia reukaufii. Имеют
характерные клетки в крестообразных комплексах (рис. 18).
Рис. 18. Anthomyces reukaufii: псевдомицелий
и хламидоспоры.
5. Arthroascus
Клетки длинные, почкование выражено слабо, почки на
широком основании полярно закладываются только на молодых
клетках (рис. 19,а). Старые колонии состоят из септированных гиф,
которые имеют перетяжки и легко расчленяются на отдельные
отрезки. На клетках часто заметны «зубчики» (рис. 19,6). Аски
развиваются из вздутых гифальных клеток, имеют веретеновидную
форму и располагаются цепочками (рис. 19,в). Споры 1—2 или
1—4 в сумке, шляповидные, бесцветные (рис. 19,г). Колонии плос-
64
Рис. 19. Arthroascus: a — вегетативные клетки; б — мицелиальные
клетки с зубчиками; в — аски; г — аскоспоры.
кие кожистые с ограниченным ростом. Сахара не сбраживают,
нитраты не ассимилируют. Встречаются в сокотечениях дуба.
Известен один вид A. javanensis (Kloecker) von Arx [22].
6. Aureobasidium
Несовершенные грибы, развивающиеся на поверхности мертвых
и живых листьев или других частей растений, на коже
млекопитающих или на иных субстратах со слабым образованием стромы.
Формирование дрожжевидных колоний, состоящих из одиночных
почкующихся клеток, послужило основанием называть эти грибы
«черными дрожжами». Они известны также под названием Pullu-
laria.
Клетки в культуре полиморфные. Наряду с дрожжевыми
почкующимися клетками имеются септированные гифы (рис. 20,а, б);
клетки в гифах обычно больше в ширину, чем в длину, бесцветные,
но часто вскоре становятся коричневыми и толстостенными
(рис. 20,в); ветвление нерегулярное. Толстостенные клетки имеют
вид хламидоспор или образуют многоклеточные агрегаты. Конидии
развиваются синхронно на зубчиках-спикулах, которые образуются
на любых клетках: на светлых и черных гифах и даже на хламидо-
65
спорах. Они одиночные или собраны пучками на вздутиях и коротких
выростах мицелия; гиалиновые, овальные до цилиндрических. Кони-
диоспоры прорастают с любого конца и дают вторичные споры
почкованием. Часто образуются эндоконидии — бесполые эндогенные
споры (рис. 20,г) Иногда формируются темные одно- или двухклет-
ные артроспоры (рис. 20,д). Наиболее типичный признак рода —
синхронное образование бластоконидий из недифференцированных
гиалиновых клеток.
Рис. 20. Aureobasidium: а — почкующиеся клетки; б — мицелий с
конидиями; в — пигментированный мицелий; г — эндогенные споры;
д — артроспора.
Колонии от кремовых, желтых и розоватых до
светло-коричневых и черных, слизистые и сухие, редко бархатистые; рост быстрый.
Представители этого рода встречаются как сапрофиты или
паразиты на цветковых растениях. Вид A. pullulans (de Bary) Arnaud,
имеющий около 50 синонимов, наиболее широко распространен и
хорошо изучен. Он образует внеклеточный полисахарид — пуллулан,
который применяется в фармацевтической промышленности.
Подробный обзор рода с ключами для определения 14 видов см. [33].
7. Brettanomyces
Клетки эллипсовидные, цилиндрические до
удлиненно-продолговатых, нередко стреловидно-заостренные с одного конца.
Псевдомицелий рудиментарный (рис. 21). На сусле и сусло-агаре рост
медленный, культуры обычно быстро отмирают из-за образования
уксусной кислоты в токсической концентрации. Метаболизм окисли-
66
тельный и бродильный, брожение стимулируется молекулярным
кислородом (негативный эффект Пастера). Дрожжи образуют
характерный аромат. Виды этого рода имеют довольно узкое и
специфическое место обитания: продукты или материалы и оборудование
бродильной промышленности. Совершенные формы, образующие
аскоспоры, классифицируются в роде Dekkera (15).
Рис. 21. Brettanomyces: почкующиеся клетки и псевдомицелий.
8. Bullera
Клетки круглые и овальные, размножение почкованием и
образованием баллистоспор на кончиках воздушных стеригм (рис. 22).
Баллистоспоры обычно симметричные, овальные или апикулятные,
Рис. 22. Bullera: а — почкующиеся клетки; б — баллистоспоры.
редко асимметричные, почковидные. Мицелий и псевдомицелий
образуют не все виды. Колонии слизистые белые, кремовые или слегка
желтоватые. Брожение отсутствует. Обычно выделяются из
природы с растений и растительных материалов. В определителе Лод-
дер [55] приведено описание трех видов, более подробную сводку
см. [53].
67 3*
9. Candida
Клетки круглые, яйцевидные или удлиненные, иногда
неправильной формы. Размножение многосторонним почкованием. Если
почки образуются на полюсах, то не на широком основании.
Псевдомицелий имеется у всех видов, он может быть примитивным, но
обычно дифференцирован на псевдогифы и бластоспоры (рис. 23).
Могут быть хламидоспоры и истинный мицелий. Спиртовое брожение
у многих видов. Колонии чаще всего складчатые, морщинистые, с
мицелиальным краем, но могут быть гладкими и слизистыми.
Рис. 23. Типы псевдомицелия у разных видов Candida.
Род в целом очень гетерогенный, для многих представителей
его получены косвенные и прямые доказательства, что они
являются несовершенными формами аскоспоровых или базидиомице-
товых дрожжей (см. ниже). Патогенный вид С. albicans с хлами-
доспорами перенесен в род Syringospora [58, 60], для которого
описано чередование гапло- и диплофаз без формирования
половых спор. Для С. tropicalis также описано чередование гапло- и
диплофаз [54].
В определителе Лоддер описан 81 вид. Новый ключ для рода
с описанием дополнительно 34 видов составлен Ramirez [46].
Отдельные виды используются для получения кормового белка
из мелассы, отходов винодельческого и целлюлозно-бумажного
производств (С. utilis), для получения белково-витаминных
концентратов (БВК) из нефтяных углеводородов (С. tropicalis, С. gui-
lliermondii) и метанола (С. boidinii).
68
Ниже приведены совершенные аналоги видов рода Candida.
Несовершенная форма
С. bimundalis var. americana
С. bimundalis var. bimundalis
С. capsuligena
С. chodatii
С. ciferrii
С. fabianii
С. guilliermondii pro parte
C. guilliermondii var.
membranaefaciens
C. ingens
С krusei
C. lipolytica
С norvegensis pro parte
С pelliculosa
C. pelliculosa var. cylindrica
C. philogaea
C. pulcherrima
C. reukaufii
C. robusta
С scottii
C. silvicola
С sorbosa
C. frigid a
C. gelida
C. lambica
С macedoniensis
C. melinii
C. nivalis
C. parapsilosis
C. pseudotropicalis
C. shehatae
С utilis
C. valida
Совершенная форма
Hansenula bimundalis var.
americana
H. bimundalis var. bimundalis
Filobasidium capsuligenum
Hyphopichia burtonii
Stephanoascus ciferrii
H. fabianii
Pichia guilliermondii
P. ohmeri
P. humboldtii
P. kudriavzevii
Saccharomycopsis lipolytica
P. norvegensis
H. anomala var. anomala
H. anomala var. schnegii
P. philogaea
Metschnikowia pulcherrima
M. reukaufii
Saccharomyces cerevisiae
Leucosporidium scottii
H. holstii
P. kudriavzevii
Предполагаемые совершенные
формы:
Leu. frigidum
Leu. gelidum
P. fermentans
Kluyveromyces marxianus
H. wingei
Leu. nivalis
Lodderomyces elongisporus
Kl. fragilis
P. stipitis
H. jadinii
P. membranaefaciens
10. Cephaloascus
Культуры состоят из почкующихся клеток, псевдогиф и септи-
рованных гиф, на которых формируются толстостенные приподнятые
аскофоры, гиалиновые и темноокрашенные. Цепочки асков
образуются апикально плотными пучками путем почкования. Зрелые аски
содержат 4 шляповидных аскоспоры (рис. 24). Виды гомо- и ге-
тероталличны. Большинство штаммов выделено из древесины.
Систематическое положение рода рассмотрено у von Arx [22] и
Kurtzman [39].
69
а 1
Рис. 24. Cephaloascus: а —мицелий с бластоконидиями; б —сумки
и споры.
II. Citeromyces
Клетки круглые, округлые, почкование многостороннее.
Псевдомицелий не образуют. Гетероталличны. Из природных субстратов
могут быть выделены как диплоидные, так и гаплоидные штаммы
(рис. 25,а,б). У первых вегетативные клетки непосредственно
превращаются в толстостенный аск с одной, редко с двумя круглыми
бородавчатыми аскоспорами (рис. 25,в). Аски при созревании
Рис. 25. Citeromyces: а, б — гаплоидные и диплоидные клетки; в —
сумки со спорами.
70
U
спор не разрываются. У гаплоидных штаммов аскоспорообразованию
предшествует конъюгация клеток противоположных типов
спаривания; перед конъюгацией происходит агглютинация клеток.
Гаплоидные культуры могут превращаться в однополые диплоидные. При
обильном аскоспорообразовании культуры становятся коричневыми.
Сахара сбраживают, нитраты ассимилируют. Встречаются в
продуктах с высоким содержанием сахара: фруктовых сиропах,
сгущенном молоке. Известен лишь один вид — Cit. matritensis Santa
Maria.
12. Cryptococcus
Клетки преимущественно круглые, овальные, обычно капсули*
рованы (рис. 26). Почкование многостороннее. Истинный мицелий и
псевдомицелий, как правило, не образуют. На плотных средах
молодые культуры гиалиновые, с возрастом бурые, желтоватые, розо-
Рис. 26. Cryptococcus: а — клетки с капсулами; б — клетки в старых
культурах.
ватые, кремовые, у большинства видов — слизистые. Один вид — Сг.
hungaricus образует оранжево-красные колонии уже в молодом
возрасте. Большинство видов при кислых значениях рЫ среды
синтезируют крахмалоподобные соединения. Образуют внеклеточные
полисахариды, в состав которых входят ксилоза, манноза и глю-
куроновая кислота. Сахара не сбраживают, мочевину гидролизуют.
Ассимилируют глюкуроновую кислоту и, за редкими исключениями,
инозит. Распространены повсеместно, особенно часто выделяются из
почв и с растений. Предполагаемыми совершенными формами
некоторых видов криптококков являются представители родов
Filobasidium (22) и Filobasidiella (21). Один из видов — Cr. neofor-
mans патогенен для человека и животных, остальные — сапрофиты,
могут быть использованы для получения внеклеточных
полисахаридов и белково-витаминных концентратов (БВК). В последнем
случае эти дрожжи особенно перспективны при использовании пен-
тозосодержащего сырья.
71
13. Cyniclomyces
Клетки крупные (до 20 мкм) овальные, цилиндрические,
почкование полярное (рис. 27). Образуют псевдомицелий. Вегетативные
клетки без предварительной конъюгации превращаются в аски с 1—4
(иногда до 6) крупными удлиненно-овальными аскоспорами. По-
Рис. 27. Cyniclomyces: вегетативные клетки и сумки со спорами.
следние непосредственно прорастают в вегетативные клетки,
сбрасывая наружную оболочку (экзоспориум), или предварительно
конъюгируют между собой. Слабо сбраживают сахара. Растут при
температуре 30—40 С на средах с повышенным содержанием
аминокислот и высоким содержанием С02 (15%) в атмосфере.
Обитают в кишечном тракте здоровых кроликов. Известен один вид
Суп. guttulata (Robin) Schionning {63].
14. Debaryomyces
Клетки округлые, овальные, почкование многостороннее, часто
множественное. Псевдомицелий не образуют или образуют скудный.
Рис. 28. Debaryomyces: a— Deb. hansenii; б —Deb. formicarius; з—
Deb. cantarellii; г — Deb. marama.
72
Аскоспорообразованию предшествует конъюгация между почкой и
материнской клеткой, которая превращается в аск с 1—4 круглыми
или слегка овальными бородавчатыми аскоспорами (рис. 28).
Сахара не сбраживают или сбраживают медленно, слабо. Нитраты не
ассимилируют. Наиболее часто обнаруживаются на субстратах,
богатых белками. Некоторые виды очень устойчивы к повышенным
концентрациям в среде хлористого натрия.
15. Dekkera
Клетки округлые, овальные, обычно более заостренные с
одного полюса. Псевдомицелий образуют, иногда рудиментарный. Гомо-
талличны, диплоидны. Образуют 1—4 круглые аскоспоры с
тангенциальным ободком, что придает им шляповидную форму
(рис. 29). После созревания аскоспоры быстро высвобождаются из
Рис. 29. Dekkera: и — клетки; б — псевдомицелий; в —сумки со
спорами.
асков и слипаются друг с другом. На сусле растут медленно и
быстро гибнут из-за накопления в среде значительных количеств
уксусной кислоты. Образуют пахучие вещества. Сахара сбраживают,
причем аэрация брожения не подавляет. Наиболее часто
обнаруживаются в бродильных производствах. Аспорогенные формы
идентифицируются как представители рода Brettanomyces (7).
16. Endoblastomyces
Наименование единственного вида Е. thermophilus Odinzova
[И] рассматривается в определителе Лоддер как синоним Trichospo-
ron capitatum Diddens et Lodder.
73
21. Filobasidiella
Клетки круглые, округлые почкующиеся капсулированные.
Виды гетероталличны. После конъюгации клеток соответствующих
типов спаривания образуют истинный мицелий с пряжками, на
котором формируются удлиненные несептированиые булавовидные
базидии. На расширенной вершине их в базипетальных цепочках
образуются базидиоспоры (рис. 33,а). Патогенны для человека и
животных. Два вида этого рода рассматриваются как совершенные
формы Cryptococcus neoformans [41, 42].
Рис. 33. Базидии и базидиоспоры: а — Filobasidiella; б — Filobasi-
ditim.
22. Filobasidium
Клетки круглые, овальные почкующиеся капсулированные. На
плотных средах образуют дрожжеподобные белые или кремовые
слизистые колонии. Гетероталличны. При подборе соответствующих
типов спаривания образуют истинный мицелий с пряжками, на
котором формируются тонкостенные несептированиые удлиненные
базидии, слегка расширенные у вершины, с 5—8 сидячими
овальными тонкостенными неотстреливающимися базидиоспорами
(рис. 33,6). Один из видов — F. floriforme предположительно
рассматривается как совершенная форма Cryptococcus albidus,
другой — F. capsuligenum ранее был описан как Leucosporidium capsu-
ligenum. Ключи к определению видов см. [43, 48].
23. Geotrichum
Конидиальная стадия представителей родов Endomyces и Dipo-
dascus.
76
24. Guilliermondella
Хорошо развитый истинный мицелий с редкими септами, а
также псевдомицелий с бластоспорами овальной формы. Аски
образуются интеркалярно из клеток гиф или из клеток,
формирующихся латерально на гифах {рис. 34). Аскоспорообразованию
предшествует конъюгация между гифами. Аскоспоры серповидные, по
4 в аске. Колонии плотные бугристые, врастают в агар.
Рис. 34. Guilliermondella: а — псевдомицелий, б — аски; в —
аскоспоры.
25. Hansenia
Синоним наименования Hanseniaspora (26).
26. Hanseniaspora
Клетки лимоновидные, овальные, размножающиеся биполярным
почкующимся делением (рис. 35). Некоторые штаммы могут
формировать рудиментарный или хорошо развитый псевдомицелий.
Вегетативные клетки непосредственно превращаются в аски с 1—4
77
оиляповидными или круглыми аскоспорами. Сахара сбраживают,
нитраты не ассимилируют, имеют абсолютную потребность в
инозите и пантотеновой кислоте. Относятся к «сорнякам» бродильных
производств. Аспорогенные формы идентифицируются как виды
рода Kloeckera (31). Новый ключ для видов см. [51]*.
Рис. 35. Hanseniaspora: а — H'spora valbyensis; б —H'spora guil-
liermondii; в — H'spora apiculata.
27. Hansenula
Клетки круглые, овальные, удлиненные, почкование
многостороннее. Могут образовывать истинный мицелий и псевдомицелий.
Гомо- или гетероталличны. Аскоспоры шляповидные или сатурно-
видные. Иногда выступы слабо развиты и тогда форма спор
круглая, полусферическая. В аске от 1 до 4 аскоспор, которые после
созревания быстро высвобождаются (рис. 36). Многие виды сли-
Рис. 36. Hansenula: вегетативные клетки, аски и аскоспоры.
зистые, образуют внеклеточные полисахариды — фосфоманнаны. В
природе встречаются виды свободноживущие или ассоциированные с
* См. также Meyer S. A., Smith M. T, Simone F. P. Systematics
of Hanseniaspora Zikes and Kloeckera Janke.— Antonie van Leeuwen-
hoek, 1978, v. 44, N 1, p. 79—96.
78
жуками-короедами и теплокровными животными. На основании
различий по плоидности вегетативных клеток, форме аскоспор,
бродильной активности В. И. Кудрявцев [11] некоторые виды Hansenula
относит к родам Williopsis (82) и Zygowilliopsis (90).
28. Hormoascus
Клетки круглые, овальные, почкуются на широком основании.
Образуют псевдомицелий и истинный мицелий, септы с утолщением
вокруг пор. Овальные, булавовидные аски образуются в цепочках
апикально или латерально на аскофорах, обычно собранных в
пучок. Аскоспоры шляповидные, по 2—4 в аске (рис. 37). При
обильном аскоспорообразовании культуры становятся коричневыми.
Нитраты ассимилируют. Ассоциированы с жуками-короедами.
Известен один вид Н. platypodis (Baker et Kreger-van Rij) Arx [22].
Рис. 37. Hormoascus platypodis: аски со спорами.
29. Hyphopichia
Вегетируют преимущественно в мицелиальной форме. На гифах
латерально или терминально на зубчиках образуются одноклеточные
конидии (бластоспоры), часто в цепочках (рис. 38). Единственный
известный вид — Н. burtonii (Boidin et al.) v. Arx et v. d.
Walt [24] гетероталличен. Аски образуются после конъюгации
бластоспор, Аскоспоры шляповидные, по 1—4 в аске. Нитраты не
ассимилирует.
30. Issatchenkia
Единственный вид этого рода — I. orientalis Kudridvzev [111
рассматривается в определителе Лоддер [55] как синоним Pichia
kudriavzevii Boidin, Pignal et Besson.
79
Рис. 38. Hyphopichia burtonii: a — мицелий с бластоспорами на
зубчиках; б — аски со спорами.
31. Kloeckera
Клетки лимоновидные (апикулятные), овальные, размножаются
биполярным почкующимся делением. Некоторые штаммы могут
образовывать псевдомицелий. Сахара сбраживают, нитраты не
ассимилируют. Все виды имеют абсолютную потребность в инозите и
пантотеновой кислоте. Часто обнаруживаются в винодельческом
производстве. Род включает аспорогенные формы видов Hansenia-
spora (26).
32. Kluyveromyces
Клетки круглые, овальные или вытянутые, размножающиеся
почкованием. Могут образовывать псевдомицелий. Аски формир^-
Рис. 39. Kluyveromyces: a —Kl. polysporus; б — Kl. fragilis.
80
ются или непосредственно из вегетативных клеток, или же после'
их конъюгации. Аскоспоры гладкие бобовидные, круглые или
овальные, 1—4 в аске, у двух видов по 70 и более (рис. 39). Аски при
созревании разрываются, и освободившиеся аскоспоры часто
слипаются. Сахара сбраживают, нитраты не ассимилируют. Могут
образовывать красные (некаротиноидной природы) пигменты. Виды
клюйверомицетов с бобовидными аскоспорами и слабой бродильной
активностью В. И. Кудрявцев [11] выделяет в роды Fabospora (20)
и Zygofabospora (84).
33. Leucosporidium
Клетки почкующиеся овальные. Обильно образуют
псевдомицелий, иногда истинный мицелий. После конъюгации гаплоидных
клеток противоположных типов спаривания образуется мицелий с
пряжками, на котором терминально или латерально формируются
толстостенные телиоспоры, заполненные каплями липидов. После
периода покоя телиоспоры прорастают септированным или несеп-
тированным промицелием, на котором терминально или латерально
образуются споридии (рис. 40). Нередко телиоспоры могут возни-
Рис. 40. Leucosporidium: а — конъюгация дрожжевых клеток; б —
мицелий с пряжкой; в — терминальная и интеркалярные
телиоспоры; г — промицелий со споридиями.
кать на мицелии без пряжек, который образуется без
предварительной конъюгации клеток (самоспорулирующие культуры).
Нитраты ассимилируют. Виды этого рода — психрофилы; многие
культуры не растут при температурах выше 20° С.
34. Lipomyces
Клетки крупные (до 8—10 мкм в диаметре), круглые, овальные;
в старых культурах заполнены целиком большой каплей жира
(рис. 41). Обычно имеют хорошо выраженные капсулы.
Размножение многосторонним почкованием. Могут образовывать примитивный
псевдомицелий, в котором имеются широкие перетяжки и клетки
разделены септами. В культурах встречаются гигантские клетки.
На плотных средах слизистый рост. Аски мешковидные (см. рис.41),
образуются разными способами: в результате копуляции
«активных» почек между собой или со свободной клеткой, формирующей
81
Рис. 41. Lrpomyces: a — почкующиеся клетки: б — капсула; в —
клетки с глобулами липидов; г — псевдомицелий; д — четырехспо-
розые и многоспоровые аски; е — аскоспоры разных видов.
вырост; редко споры можно видеть и в материнской клетке. У
одного вида (L. tetrasporus) в сумке всегда не более 4 спор; они
овальные, янтарного цвета и имеют продольную штриховку,
хорошо заметную в обычном микроскопе. У четырех других видов
количество спор в сумке строго не фиксировано, их может быть более
30; они круглые или слегка овальные, желтые, гладкие или со
складчатой поверхностью. Все виды не обладают ферментативной
способностью, хорошо растут в среде с высоким отношением
углерода к азоту (до 2000), слабо образуют крахмал в жидкой среде
с низким значением рН. Во внеклеточных полисахаридах
обнаруживается манноза, глюкуроновая кислота и у некоторых видов —
галактоза. Наличие галактозы во внеклеточных полисахаридах
используется как дифференцирующий признак при разграничении
видов. Все виды выделяются только из почв. Новый ключ для
определения видов см. [45].
35. Lodderomyces
Клетки круглые, овальные, вытянутые. Образуют псевдомице-
-лий. Дрожжи гомоталличны. Вегетативные клетки непосредственно
превращаются в аск с 1—2 крупными удлиненными с тупыми
концами, иногда слегка изогнутыми, спорами, которые не освобождаются из
аска при созревании (рис. 42). Дрожжи этого рода используют
высшие парафины, не ассимилируют нитраты. Сахара сбраживают
медленно, слабо. Единственный вид данного рода — Lod. elongispo-
rus (Recca et Mrak) van der Walt рассматривается как совершенная
форма Candida parapsilosis.
82
Рис. 42. Lodderomyces elongisporus: a — вегетативные клетки; б —
псевдомицелий; в — аски с одной аскоспорой.
36. Magnusiomyces
Описан один вид —М. ludwigii (Ludwig) Zender [11],
выделенный из слизетечения дуба. Он рассматривается как синоним Endo-
myces magnusii Ludwig [22].
37. Mastigomyces *
Клетки овальные, размножаются многосторонним почкованием.
Некоторые клетки вытягиваются в длинные (до 30 мкм), постепенно
Рис. 43. Mastigomyces philippovi: почкующиеся клетки и клетки с
хлыстовидными отростками.
Род не был включен ни в один из определителей дрожжей.
83
утончающиеся отроги (рис. 43). На жидких средах образуются
цепочки клеток, формируется кольцо и тонкая, легко оседающая
пленка; на плотных средах колонии серовато-белые, блестящие,
гладкие. Культуры имеют фруктовый запах. Брожение слабое,
нитраты не ассимилируют. Рост наблюдается при температуре от 5
до 25° С. Известен один вид — М. philippovi Imsch. et Kriss [8].
38. Metschnikowia
Клетки круглые, овальные, эллипсовидные, грушевидные,
цилиндрические, серповидные. Псевдомицелий отсутствует или он
рудиментарный, примитивный. В культурах, выделяемых из
природы, часто присутствуют крупные хламидоспороподобные клетки.
Аски булавовидные или клиновидные, образуются из «хламидоспор».
Аскоспоры игловидные, заостренные с одного или двух концов,
1—2 в сумке (рис. 44). Один из видов — М. pulcherrima образует
Рис. 44. Metschnikowia: а — жизненный цикл М. puleherrima; аски:
б — М. lunata; в — М. reukaufii; г — М. Zobellii; д — М. krissii.
кирпично-красный пигмент — пульхерримин, который диффундирует
в среду. Виды из морских источников — паразиты водных
беспозвоночных; виды из наземных экосистем — постоянные обитатели
нектара цветов, возможна их тесная связь с насекомыми-опылителями.
В определителе Н. А. Красильникова [10] представители этого рода
описаны как Monosporella, а в определителе В. И. Кудрявцева
[11] — как Metschnikowiella.
39. Monilia
Старое родовое наименование для организмов, которые в
настоящее время включены в род Candida, например М. albicans—
84
С. albicans. Сейчас это наименование используют для
несовершенных форм грибов рода Sclerotinia.
40. Mycoderma
Старое родовое наименование [10] для дрожжеподобных
организмов, включаемых в настоящее время в род Candida, например
Mycoderma vini—Candida vini.
41. Mycotorula
To же самое (см. 40). Пример: Mycotorula lactis—Candida kefyr.
42. Nadsonia
Клетки лимоновидные (апикулятные), овальные или удлиненные.
Вегетативное размножение биполярным почкующимся делением.
Псевдомицелия нет, или он рудиментарный. Аскоспорообразованию
предшествует копуляция между материнской клеткой и почкой
(педогамия), реже копуляция наблюдается между независимыми
клетками. Аском становится новая почка, образующаяся на
противоположном конце исходной материнской клетки. При
этом возникают характерные «триады» клеток (рис. 45).
Иногда в аск превращается материнская клетка или копулирующая
почка. В аске обычно одна, редко 2—3 круглые коричневые
шиповатые аскоспоры. Старые культуры приобретают шоколадно-коричне-
вый цвет. На жидком сусле образуют пленку. Нитраты не
ассимилируют, сахара не сбраживают или сбраживают слабо.
Рис. 45. Nadsonia elongata: a — вегетативные клетки; б —
псевдомицелий; в — аски со спорами.
85
При температуре выше 25° не растут. Наиболее
распространен вид N. elongata Konokotina, который легко может быть выделен
из весенних сокотечений лиственных деревьев в зоне умеренного
климата; особенно часто встречается в сокотечениях березы. Новый
ключ для определения видов см. [6].
43. Nadsoniomyces
Клетки крупные, овальные и продолговатые, иногда
клиновидные. В старых культурах клетки содержат спороподобные телаг
которых может быть до 17 в одной клетке. По-видимому, это-
вегетативные эндоспоры. Выделены с морских водорослей. Культуры
единственного вида — N. sphenoideus Kudriavzev — не сохранились.
Возможно, эти дрожжи близки к Trichosporon (Tr. cutaneum).
Подробное описание см. [11].
44. Nematospora
Клетки полиморфные, почкование многостороннее. Образуют
хорошо развитый псевдомиделий с цепочками бластоспор и
истинный мицелий из редко септированных разветвленных гиф. Артро-
спор не образуют. Сумки формируются из продолговатых
вегетативных клеток без предшествующей конъюгации и вскоре после
созревания спор лопаются, освобождая веретеновидные споры с
хлыстовидными придатками. В сумке спор обычно 8, они
располагаются пучками по 4 (рис. 46). Может быть более 8 спор. Сахара
сбраживают, нитраты не ассимилируют. Виды этого рода
паразитируют на растениях, вызывая гниль семян и мясистых частей
плодов.
Рис. 46. Nematospora: a — почкующиеся клетки и псевдомицелий;
б — аск со спорами; в — аскоспоры с хлыстовидными придатками,
одна из них прорастает.
45. Octosporotnyces
В. И. Кудрявцев [11] выделяет в этот род восьмиспоровые виды
рода Schizosaccharomyces (64).
86
46. Oidium
H. А. Красильников [10] рассматривает в этом роде организмы*
которые сейчас включаются главным образом в род Trichosporon
[77]. Один из распространенных видов, известный как Oidium lactis
Fres., следует считать синонимом Geotrichum candidum Lk. et.
Pers. [22].
47. Oosporidium
Клетки разной формы, размножаются многосторонним
почкованием, почки закладываются на широком основании и не
отделяются, образуя длинные цепочки (рис. 47). Может быть мицелий с
септами. Артроспор нет. Иногда образуют эндоспоры вегетативным.
Рис. 47. Oosporidium margaritiferum: цепочки вегетативных клеток
и бесполые эндоспоры.
путем. Колонии желтые и оранжево-желтые. Растут медленно.
Дрожжи сахара не сбраживают, нитраты не ассимилируют.
Единственный вид — О. margaritiferum Stautz выделен из слизетечений
вяза, липы и дуба.
•¦ 48. Pachysolen
Клетки эллипсовидные до круглых, иногда апикулятные.
Почкование многостороннее, псевдомицелий скудный или отсутствует.
При спорообразовании клетка образует длинный трубчатый вырост,
на конце которого в круглом вместилище размещаются 4 споры.
В этом месте стенка остается тонкой и легко разрывается, когда
споры созревают. Остальная часть клетки с выростом становится
толстостенной. Споры шляповидные. В гаплоидных культурах
образованию сумок предшествует копуляция, и на сумках видны
прикрепленные сбоку маленькие клетки-конъюганты (рис. 48). В
диплоидных культурах образуются неконъюгированные сумки. Дрожжи
87
томоталличны. Колонии сначала слизистые, потом становятся
маслянистыми. В жидких средах пленки не формируют. Сбраживают
глюкозу, нитраты не ассимилируют, образуют эфиры и внеклеточ-
Рис. 48. Pachysolen tannophilus: аск
с трубчатым выростом и аскоспоры.
ные полисахариды — фосфоманнаны. Род включает всего один
вид — Pa. tannophilus Boidin et Adzet, выделенный из
концентрированных таниновых растворов, экстрагированных из древесины
широколиственных пород деревьев.
49. Phaeococcus
Клетки почкующиеся толстостенные, темно-оливкового до
коричневого цвета, круглые и слегка овальные. Гифы отсутствуют,
иногда имеются цепочки одинаковых клеток (рис. 49). Колонии
ограниченные, блестящие, черные. Пигмент может проникать в
субстрат. Сахара не сбраживают, инозит не ассимилируют. Типовой
вид — Cryptococcus nigricans Rich et Stern [34].
Рис. 49. Phaeococcus: a — Ph. nigricans; б — Ph. cantenatus; в —
Ph. exophiala.
88
50. Phaffia
Клетки вегетативные овальные, иногда в коротких цепочках.
Почкование часто на одном и том же месте, поэтому рубцы
почкования хорошо выражены. Образуют хламидоспоры круглой и
овальной формы (рис. 50). В сусле клетки образуют тонкую
Рис. 50. Phaffia rhodozyma: a —
вегетативные клетки; б — хламидоспоры.
пленку, на плотных средах — оранжево-красные колонии.
Синтезируют крахмалоподобные вещества независимо от рН среды.
Сахара сбраживают, нитраты и инозит не ассимилируют. Единственный
известный вид — Ph. rhodozyma Miller, Yoneyama et Soneda
выделяется из сокотечений лиственных деревьев, главным образом
березы [44].
51. Pichia
Клетки от круглых и овальных до сильно вытянутых.
Размножаются многосторонним почкованием, многие виды образуют
псевдомицелий с бластоспорами, иногда (скудно) — истинный мицелий.
Виды гомо- или гетероталличны. Аскообразованию иногда
предшествует изо- или гетерогамная конъюгация. Аскоспоры круглые,
шляповидные или сатурновидные, обычно гладкие, редко
шероховатые. В аске от 1 до 4 (иногда больше) спор, при созревании они
легко освобождаются (рис. 51). Брожение есть не у всех видов;
Рис. 51. Pichia: a — почкующиеся клетки, псевдомицелий и аски
P. membranaefaciens; б — аски P. farionosa.
5 Зак. 1921 89
нитраты не ассимилируют. Выделяются из разнообразных
источников: встречаются в кустарном виноделии, в рассолах, в сокотече-
ниях деревьев, некоторые виды ассоциированы с насекомыми.
52. Pityrosporum
Клетки округлые и длинно-овальные, при многократном
почковании становятся колбовидными, так как почки образуются на
одном и том же месте, монополярно (рис. 52); закладываются они
на широком основании и отделяются за счет образования септы
U У1/ // Рис- 52- Pityrosporum ovale:
PS <?(f ~~
fj /' i/ f? КИС. DZ. Kliy
&/~)n r\ ^ /'f~* монополярное почкующееся
07/У/ I/ О деление.
(почкующееся деление). Псевдомицелия и истинного мицелия в
культуре почти не образуют. На обычных средах рост слабый, он
стимулируется добавлением липидов или жирных кислот. Сахара
не сбраживают. Оптимальная температура для роста около 36° С.
Обитают на волосатой части кожи млекопитающих, например в
перхоти у человека (Pit. ovale). Предполагают, что Pityrosporum — это
дрожжевая стадия полиморфного рода грибов Malassezia, поэтому
его следует рассматривать как form genus (формальный род).
53. Protomyces
Клетки разной формы — яйцевидные, овальные или
цилиндрические, сильно варьирующие по размерам (6,5—20,0X4,0—13,0 мкм).
Почкование моно- и биполярное. Псевдомицелия не образуют.
Конъюгации в искусственной культуре обычно не происходит, но
низкие температуры инициируют этот процесс. При 15° С в слое
агара наблюдается иногда конъюгация, в результате которой
образуется крупная диплоидная спора. Она продолжает почковаться
и развивает короткие диплоидные гифы с перетяжками. Хламидо-
споры (спорангии) формируются как раздутые толстостенные
секторы септироваиного мицелия в терминальном или интеркалярном
положении. Колонии пастообразные, иногда морщинистые,
кремовые, палево-оранжевые, розовые или желтые и желто-коричневые.
Пигменты — не каротиноиды. На жидких средах образуют кольцо
и островки пленки, в старых культурах — прочная пленка. Все
виды не сбраживают сахара, ассимилируют нитраты, образуют
внеклеточные крахмалоподобные соединения. В природе
паразитируют на растениях, вызывая' образование галлов. Ключ для
определения видов по растениям-хозяевам см. [47].
90
54. Prototheca
Бесцветные одноклеточные водоросли порядка протококковых.
Размножаются путем внутриклеточного расчленения содержимого
клетки на несколько частей, которые округляются и превращаются
в бесполые эндоспоры, называемые автоспорами (рис. 53). На
Рис. 53. Prototheca: а
—вегетативные клетки; б — споран
гии с автоспорами.
сусло-агаре образуют белые дрожжсвидиые колонии и могут быть
ошибочно приняты за дрожжи. В природе занимают с дрожжами
близкие экологические ниши и поэтому нередко выделяются вместе
с ними. Наиболее часто обнаруживают в слизетечениях деревьев.
Некоторые виды патогенны для теплокровных животных. Ключ
для определения видов см. [20].
55. Pullularia
Один из наиболее распространенных синонимов рода «черных
дрожжей» Aureobasidium [6].
56. Rhodosporidium
Организмы существуют в нескольких стадиях. Вегетативные
клетки гаплоидной дрожжевой фазы круглые, овальные или
продолговатые, размножаются многосторонним почкованием,
одноядерные. При смешивании совместимых типов спаривания (их может
быть 2 или 4) происходит конъюгация и плазмогамия, после чего
развивается дикариофитная мицелиальная фаза. На мицелии с
пряжками формируются телиоспоры (телейтоспоры),
различающиеся по форме у разных видов: они могут быть круглыми,
овальными, угловатыми, лимоновидными; одиночные, сдвоенные или в
цепочках. При прорастании спор образуется поперечно-септирован-
ный промицелий, на котором латерально и терминально развиваются
дрожжеподобные клетки — споридии. Они размножаются
почкованием, восстанавливая таким образом гаплоидную дрожжевую
фазу (рис. 54). Известна также самоспорулирующая дрожжевая
фаза, клетки которой внешне не отличаются от описанных выше,
однако они развивают мицелий (без пряжек или с пряжками) без
предварительной конъюгации. Баллистоспор не образуется ни на
одной стадии. Сахара не сбраживают. Некоторые виды образуют
внеклеточные крахмалоподобные вещества и ассимилируют инозит.
Культуры всех видов пигментированы, цвет колоний от оранжевого
до розового. Рост на плотных средах обычно слизистый.
Несовершенные формы классифицируются как Rhodotorula или Cryptococcus
(пигментные виды). Наиболее полный ключ для определения восьми
известных видов см. [30].
91
5*
Рис. 54. Rhodosporidium: a — конъюгация гаплоидных клеток Rhsp.
diobovatum; б — формирование мицелия с пряжками; в — телио-
споры; г — промицелий со споридиями. Внизу телиоспоры; д —
Rhsp. toruloides; e — Rhsp. capitatum; ж — Rhsp. dacryoidum; з —
Rhsp. infirmo-miniatum.
57. Rhodotorula
Клетки круглые, яйцевидные, овальные или удлиненные
(рис. 55). Почкование многостороннее, может быть примитивный
псевдомицелий, редко зачатки истинного мицелия и хламидоспо-
роподобные клетки. Баллистоспор не образуют. Колонии красные и
желтые, часто слизистой консистенции; клетки в таких колониях
имеют капсулы. Инозит, глюкуроновую кислоту не ассимилируют,
сахара не сбраживают, крахмалоподобмые вещества не образуют.
Имеют совершенные формы среди Rhodosporidium. В природе
распространены очень широко, многие ассоциированы с живыми рас-
Рис. 55. Rhodotorula: вегетативные клетки разных видов.
92
тениями и обитают на поверхности листьев как эпифиты. Часто
выделяются из пресных и морских водоемов, из воздуха. Эти
дрожжи перспективны как источники получения витамина А из
каротина и для обогащения этим витамином кормового белка.
58. Saccharomyces
Клетки круглые и овальные, иногда удлиненные (рис. 56).
Вегетативное размножение многосторонним почкованием. Может
быть примитивный псевдомицелий, истинного мицелия нет. Колонии
обычно пастообразные. На жидких средах при продолжительном
культивировании может образовываться пленка, но она не бывает
суХой порошковидной или
всползающей. Аски образуются
преимущественно из
вегетативных диплоидных клеток без
непосредственно
предшествующей конъюгации. При
созревании спор сумки не вскрываются.
Аскоспоры круглые или
слабоовальные, бесцветные, гладкие,
1—4 в аске. Все виды активно
сбраживают сахара и не
используют нитраты. Лактозу и
высшие парафины не
ассимилируют. Дрожжи этого рода с
давних времен распространены
в кустарном виноделии и ши- рис. 56. Saccharomyces cerevisiae:
роко используются в разных почкующиеся клетки и аски со
отраслях бродильной промыш- спорами,
ленности, в связи с чем они
более всех других дрожжей
изучены в разных аспектах. Их систематика, однако, постоянно
пересматривается. Центральный вид — Saccharomyces cerevisiae
Hansen известен в десятках синонимов, которые в настоящее время
рассматриваются как производственные расы, но не
самостоятельные виды.
В разных определителях объем рода Saccharomyces сильно
варьирует. Ван дер Вальт в определителе Лоддер [55] различает
41 вид, среди которых есть диплоидные, гаплоидные и виды с
соматогамной автогамией. В. И. Кудрявцев [11] включает в род
Saccharomyces только диплоидные дрожжи, выделяя гаплоидные
виды в Zygosaccharomyces, а виды с автогамным половым
процессом— в род Debaryomyces. H. А. Красильников [10]
рассматривает виды, объединенные у ван дер Вальта в Saccharomyces, в трех
родах — Saccharomyces, Zygosaccharomyces и Torulaspora. Такое
деление на роды с изменениями в составе видов поддержано в
новой системе [25]. Согласно Д. Ярроу [23], в роде Saccharomyces
оставлено 5 видов с преимущественно диплоидной вегетативной фазой:
S. cerevisiae, S. kluyveri, S. exiguus, S. dairensis, S. servazzi *.
Описанный P. Д. Зубковой [7] вид Kazachstania viticola Zub. рассмат-
ривается как синоним S. dairensis Naganishi [25].
* Новые виды см. Santa Maria J. Biotaxonomic studies on yeast.
Communicationes I. N. I. A., ser. general, 1978, N 3, p. 1—61.
'93
59. Saccharomycodes
Клетки крупные, до 20 мкм и более в длину, лимоновидные
(апикулятные) или удлиненно-овальные. Вегетативное
размножение— биполярное почкующееся деление. Псевдомицелия обычно не
образуют. Сумки возникают без предварительной конъюгации из
диплоидных вегетативных клеток. Они содержат 2 или 4 круглые
аскоспоры с гладкой оболочкой, которые расположены попарно и
в месте соединения иногда имеют узкий ободок (рис. 57,а). Споры
при созревании не освобождаются, а копулируют попарно и, про-
Рис. 57. Saccharomycodes: a — вегетативные клетки и аски с
спорами S'codes ludwigii; б — Saenkia bispora.
растая, разрывают стенку аска. У некоторых штаммов споры
прорастают без конъюгации. Колонии белые пастообразные. На жидких
средах образуют осадок и кольцо. Сахара сбраживают, нитраты не
ассимилируют. Известен всего один вид—S'codes ludwigii Hansen.
Дрожжи, описанные В. И. Кудрявцевым [11] как Saenkia bispora
Kudriavzev (рис. 57,6), Г. Фафф в определителе* Лоддер [55]
рассматривает как синоним S'codes ludwigii. Распространены в
слизетечении дуба, встречаются на поверхности плодов и в
самозабродивших плодово-ягодных соках. Иногда обнаруживаются в
«чайном квасе», В виноделии относятся к «сорнякам» брожения.
60. Saccharotnycopsis
Клетки овальные, удлиненные. Вегетативное размножение
многосторонним почкованием. Кроме того, образуют истинный мицелий
с септами. Имеются виды гомо-и гетероталличные. Аски образуются
на мицелии и расположены на гифах терминально или латерально
поодиночке, группами и в цепочках (рис. 58). Аскоспоры круглые,
овальные, полушаровидные, с экваториальными или смещенными
выступами-ободками, 1—4 в аске. Нитраты не ассимилируют. Виды
этого рода в определителе Лоддер [55] рассматриваются как
представители рода Endomycopsis. Последнее наименование является
94
облигатным синонимом Saccharomycopsis [22, 40, 63]. Широко
используемые в микробиологической промышленности дрожжи
Candida lipolytica, растущие на парафинах, представляют собой
несовершенную стадию Saccharomycopsis lipolytica.
Рис. 58. Saccharomycopsis: a — аски и аскоспоры S'copsis capsularis;
б — S'copsis vini; в — S'copsis fibuligera.
61. Saenkia
Клетки крупные, лимоновидные, с биполярным почкующимся
делением (см. рис. 57,6). Сумки образуются без копуляции, 1—2
споры. Единственный описанный вид — Saenkia bispora Kudriavzev
[11] в определителе Лоддер [55] рассматривается как синоним
Saccharomycodes ludwigii Hansen.
62. Sarcinosporon
Почкующиеся клетки овальной и удлиненной формы. Образуют
псевдомицелий и истинный мицелий с септами и бластоспорами,
которые могут быть одиночными или в цепочках. В дрожжевых
клетках и клетках мицелия образуются бесполые эндоспоры и
возникают сарциноподобные спорангии (рис. 59). Некоторые клетки и
Рис. 59. Sarcinosporon inkin: a — почкующиеся клетки; б — септи-
роваиный мицелий; в — клетки с эндоспорами,
95
эндоспоры внутри спорангия превращаются в толстостенные хла-
мидоспоры. Полового процесса нет. Колонии сухие, крошащиеся,
сначала кремовые, затем коричневые в старых культурах. Сахара
не сбраживают, нитраты не ассимилируют. Выделяются с кожи
человека при дерматозных поражениях. Единственный вид этого
рода — Sarcinosporon inkin (Oho) King et Jong [35] в определителе
Лоддер [55] включен в род Trichosporon (77).
63. Schizoblastosporion
Клетки овально-цилиндрические, иногда грушевидные.
Вегетативное размножение биполярным почкующимся делением (рис. 60).
Почки образуются почти всегда поочередно и при отделении
оставляют на клетке широкий рубец. Псевдомицелия не формируют.
Рис. 60. Schizoblastosporion starkey—
henricii.
Половой процесс неизвестен. Брожения не вызывают, нитраты не
ассимилируют, без витаминов не растут (нуждаются в биотине и
пиридоксине). Обнаруживают хороший рост на многоатомных
спиртах (манните, сорбите) и двууглеродных соединениях — уксусной
кислоте и этаноле. Инозит не используют, крахмалоподобных
соединений не образуют. Описанный единственный вид этого рода —
Schizobl. starkey-henricii Ciferri выделяется из болотных почв [2].
64. Schizosaccharomyces
Клетки от круглых и округлых до цилиндрических.
Вегетативное размножение делением. Истинные гифы, если образуются,
могут распадаться на артроспоры. Сумки формируются из
копулирующих клеток. Аскоспоры круглые или овальные, редко
продолговатые или слегка бобовидные, у разных видов до 4—8 в аске
(рис. 61). Они могут освобождаться из сумок на ранней стадии.
С раствором Люголя дают реакцию на крахмал. Активно
сбраживают сахара, нитраты не ассимилируют. Используются в бродильной
промышленности в странах жаркого климата. Виды с 8 бобовидными
аскоспорами В. И. Кудрявцев [И] выделяет в самостоятельный род
Octosporomyces (45).
9f>
Рис. 61. Schizosaccharomyces: a — Schiz. pomble; б — Schiz. octospo-
rus; в — Schiz. japonicus.
65. Schizotorula
Формальный род, включающий аспорогенные аналоги видов
рода Schizosaccharomyces. В определителе Н. А. Красильникова [10]
указаны два вида, физиологически и морфологически сходные с
шизосахаромицетами, но не образующие аскоспор.
66. Schwanniomyces
Клетки круглые, яйцевидные, иногда удлиненные. Почкование
многостороннее, часто множественное. Псевдомицелий, если
образуют, то скудный и примитивный. Дрожжи Гаплоидные. Аскоспорооб-
разованию предшествует появление на клетке пальцеобразных
выростов или так называемых мейозных почек, с которыми
связана диплоидизация и последующий мейоз ядра. Спор 1—2 в аске,
они круглые, бородавчатые, с экваториальным ободком (по форме
напоминают грецкий орех) и хорошо заметной липидной каплей
(рис. 62). Аски не разрушаются при созревании спор. Колонии
Рис. 62. Schwanniomyces: почкующиеся клетки и аски со спорами.
пастообразные, сначала белые, затем слегка темнеющие. В жидких
средах — осадок и кольцо, пленку не образуют. Сахара
сбраживают, нитраты не ассимилируют. Все виды — обитатели почв, особенно
часто выделяются из луговых почв и черноземов.
97
67. Selenotila
Клетки серповидные до полусферических, иногда круглые или
овальные. Вегетативное размножение почкованием, обычно на
выпуклой стороне или по концам клетки (рис. 63). Иногда клетки
соединены в короткие цепочки, септированных гиф не образуют.
ШШ&'';."'' ^ис- 63. Selenotila: почкующиеся клетки.
Описанные два первых вида — S. nivalis Lagerheim и S. intestina-
lis Krassilnikov не сохранились в культуре. Третий вид — S. peltata
Yarrow сбраживает сахара слабо, нитраты не ассимилирует. Новое
родовое название — Selenozyma Yarrow [25]. Совершенные формы
этих дрожжей описаны среди Metschnikowia [31].
68. Sporidiobolus
В молодых культурах присутствуют дрожжевые клетки,
размножающиеся многосторонним почкованием. В старых культурах
образуется септированный мицелий с пряжками. И на дрожжевых
клетках, и на гифах мицелия формируются простые или
разветвленные стеригмы, несущие на кончиках баллистоспоры асиммет-
Рис. 64. Sporidiobolus: а — баллистоспоры; б — хламидоспоры.
98
ричной формы. Эти споры способны к повторному образованию бал-
листоспор или к почкованию. На мицелии интеркалярно или
терминально образуются круглые коричневые хламидоспоры (рис. 64).
Колонии имеют красновато-коричневый цвет. Сахара не сбраживают.
Выделяются с растений и из почвы в южных странах. В
определителе Лоддер {55] описано два вида. Новый ключ к определению
трех видов см. [26].
69. Sporobolomyces
Клетки дрожжевые от овальных до продолговатых,
размножаются многосторонним почкованием и путем образования
асимметричных почковидных или серповидных баллистоспор на кончиках
воздушных стеригм. Баллистоспоры при созревании с силой
отбрасываются в воздух. Некоторые виды образуют псевдомицелий и
истинные септированные гифы без пряжек (рис. 65). Колонии
Рис. 65. Sporobolomyces: почкование и образование баллистоспор
на отдельных клетках и на гифах мицелия.
обычно красные или розовые, но некоторые виды не пигментированы.
Брожения Сахаров не вызывают. Крахмал не синтезируют. В
природе распространены широко, обитают главным образом на
поверхности листьев разных видов растений, особенно злаковых,
часто обнаруживаются на зерне. Споры этих дрожжей разносятся
ветром и постоянно присутствуют в воздухе. Поиски совершенных
форм среди Sporobolomyces привели к описанию нового рода —
Aessosporon (2). С другой стороны, для вида Sp. odorus Derx был
описан цикл, полностью совпадающий с развитием Sporidiobolus
johnsonii Nyland [27].
70. Stephanoascus
Дрожжевые клетки овальные или цилиндрические, часто в
цепочках и образуют псевдогифы. Преобладают, однако,
септированные гифы, в которых интеркалярно или терминально располагаются
99
конидногенные клетки с зубчиками, несущие одноклеточные
грушевидные бластоконидин. Аски одиночные круглые толстостенные,
развиваются после конъюгации через короткие выросты двух
субапикальных клеток гиф разных типов спаривания. Аски содержат
1—4, чаще 2—3 полусферические шляповидные споры (рис. 66).
Рис. 66. Stephanoascus ciferrii: a — бластоконидин; б —сумки со
спорами.
Колонии пастообразные гладкие или хрупкие складчатые, иногда
с воздушным мицелием и шерстистые. Цвет бледно-кремовый, край
ворсинчатый. Единственный известный вид — St. ciferri Smith, van
der Walt et Johansen [52] — сахара не сбраживает, растет при
37° С. Гетероталличный. Несовершенная дрожжеподобная стадия —
Candida ciferri Kreger—van Rij. Конидиальная форма сходна с
несовершенным грибом Sporothrix Hektoen et Perkins {34].
71. Sterigmatomyces
Клетки круглые и овальные, размножаются путем
своеобразного почкования на длинных стеригмоподобных выростах (рис. 67).
Одна клетка может образовывать от одного до нескольких
выростов, на концах которых развиваются конидии, дающие новые почки,
что приводит в конце концов к формированию разветвленных цепо-
Рис. 67. Sterigmatomyces: а — St. penicillatus; б —St. halophilus.
100
чек. Истинных гиф не образуют. Любой другой способ
размножения неизвестен. Сахара не сбраживают. Один из видов — Sterigma-
tomyces penicillatus образует крахмалоподобные вещества. Колонии
белые (иногда мучнистые), кремовые и желтые, до коричневого,
некоторые образуют розоватый пигмент, диффундирующий в среду.
Выделяются из морской воды, пищевых продуктов, с растительных
субстратов. В определителе Лоддер [55] описано два вида; новый
ключ для шести видов см. [49].
72. Sympodiomyces
Клетки круглые, округлые и овальные, одиночные и в коротких
цепочках. Дрожжевые клетки развивают короткие конидиофоры с
терминальными конидиями, которые образуются симподиально и
при отделении оставляют заметные рубцы (рис. 68). Гифы с сеп-
Рис. 68. Sympodiomyces parvus: симподиальное образование почек.
тами могут присутствовать, но их обычно мало. Бластоконидии на
гифах одиночные или пучками. Сахара не сбраживают, крахмал не
образуют, нитраты не ассимилируют. Максимальная температура
для роста 25° С. Колонии мягкие пастообразные, цвет
тускло-кремовый. Все изоляты единственного вида — Sympodiomyces parvus
Fell et Statzel — получены из воды близ Антарктического материка
[29].
73. Syringospora
Род восстановлен ван дер Вальтом [58] со следующим
диагнозом. Вегетативные клетки размножаются почкованием, образуют
псевдомицелий, истинный мицелий, хламидоспоры и бесполые
эндоспоры. Гаплофаза переходит в диплофазу путем самодиплоидиза-
ции. Диплоидные клетки, которые отличаются от гаплоидных
большими размерами, превращаются в мейоконидиофоры,
образующие почки (мейоконидии) на коротких стеригмах, не отделенных
перегородками. Такой цикл ван дер Вальт [58] наблюдал у
типового вида Candida albicans (Robin) Berkhout, который является
синонимом Syringospora albicans (Robin) Dodge. К этому роду
относятся еще два вида — S. claussenii van der Walt и S. stella-
toidea van der Walt [25].
101
74. Tilletiopsis
В молодых культурах почкующиеся дрожжевые клетки хвосто-
видные, вытянутые, с заостренными концами. Почкование главным
образом по полюсам. В старых культурах формируется септирован-
ный мицелий, который легко расчленяется на отдельные клетки.
На гифах и почкующихся клетках образуются баллистоспоры
серповидной формы. При температурах ниже 20° С могут
образовываться хламидоспоры, терминально или интеркалярно на мицелии.
Они круглые, яйцевидные или клиновидные, располагаются
одиночно или в цепочках (рис. GO). Колонии желтоватые, желтые до
Рис. 69. Tilletiopsis: a — баллистоспоры на дрожжевых клетках и
гифах мицелия; б — хламидоспоры.
коричневого цвета, кремовые и сиреневые. В природе обитают на
поверхности живых и мертвых листьев разных растений, главным
образом древесных пород. Ключ для известных четырех видов с
одной разновидностью составлен К. Тубаки [57].
75. Torulaspora
Род был описан Линднером в 1904 г. и вошел в определитель
Н, А. Красильникова [10] в объеме четырех видов, которые
характеризуются тем, что образуют споры без предшествующей
конъюгации. На клетках при этом, как правило, появлялись конъюгацион-
ные отростки. Спор обычно 1—2 в сумке; они круглые гладкие.
В. И. Кудрявцев [11] объединил этот род с Debaryomyces, приняв
за родовое название последнее. В определитель Лоддер [55] род
Torulaspora не был включен, а отдельные виды были разделены
между Saccharomyces (активно сбраживающие сахара),
Debaryomyces и Pichia (споры бородавчатые или гладкие соответственно).
Род заново был востановлен со следующим диагнозом [61]: клетки
круглые или овальные, размножаются исключительно почкованием,
преимущественно гаплоидные. Аски образуются в результате сома-
тогамной автогамии, реже после слияния независимых клеток или
путем прямой конверсии диплоидных вегетативных клеток. Аско-
споры круглые до удлиненно-эллипсовидных, без ободков, обычно
102
бородавчатые, 1—4 в аскс. Дрожжи этого рода нитраты не
используют. В род включено 28 видов, которые ранее помещали в
Debaryomyces, Pichia, Saccharomyces или Zygosaccharomyces. В этом
объеме род не является гомогенным [25].
76. Torulopsis
Клетки круглые, овальные, яйцевидные или, реже, удлиненные.
Размножение многосторонним почкованием. Псевдомицелия нет или
имеется рудиментарный. Ни бесполых, ни половых спор не
образуют. Колонии бесцветные. Внеклеточные полисахариды
синтезируются, но они не дают реакции на крахмал. Инозит не ассимилируют.
Сахара многие виды сбраживают активно. Род очень гетерогенный.
Некоторые виды имеют совершенные аналоги среди разных родов
преимущественно аскоспоровых дрожжей (см. ниже). Новый род
Entelexis [60] создан для совершенной стадии Т. magnoliae.
Распространены в природе широко, главным образом в сахаросодержащих
субстратах. Выделяются часто из пищевых продуктов. Некоторые
виды ассоциированы с насекомыми, например с пчелами (Т. apis,
Т. apicola) или с позвоночными животными и человеком (Т. glab-
rata).
Совершенные аналоги видов рода Torulopsis
Несовершенная форма Совершенная форма
Т. capsuligena Filobasidium capsuligenum
Т. calliculosa Saccharomyces fermentati
Т. dattila Kluyveromyces thermotolerans
T. globosa Giteromyces matritensis
T. magnoliae Entelexis magnoliae
T. mogii Saccharomyces rouxii
T. sphaerica Kluyveromyces lactis
Предполагаемые совершенные
формы
Т. bovina Saccharomyces telluris
Т. Candida Debaryomyces hansenii
Debaryomyces marama
T. holmii Saccharomyces exiguus
T. molishiana Hansenula capsulata
77. Trichosporon
Почкующиеся клетки разной формы. Псевдомицелий
примитивный или с бластоспорами. Образуют септированные гифы,
распадающиеся на артроспоры (рис. 70). Половых спор нет, могут быть
бесполые эндоспоры. Сахара не сбраживают или очень слабо и
медленно. Род в том объеме, в котором он представлен в
определителе Лоддер [55], очень гетерогенный и состав его постоянно
пересматривается *. Два вида — Tr. aculeatum -Phaff et al. и
Tr. inkin (Oho) do Carmo-Sousa выделены в самостоятельные роды
Aciculoconidium (1) и Sarcinosporon (62) соответственно.
* King D. S., Jong S. С A contribution to the genus
Trichosporon. Mycotaxon, 1977, v. 6, N 2, p. 391—417.
103
Рис. 70. Trichosporon: a — артроспоры; б — бластоспоры; в —
эндоспоры.
78. Trichosporonoides
В молодых культурах почкующиеся клетки овальной и
яйцевидной формы. Затем образуют псевдомицелий с бластоспорами и
септированный мицелий, распадающийся на артроспоры. Эти
признаки делают род сходным с Trichosporon. Кроме того, имеются
конидиофоры с конидиями. Конидиофоры воздушные и погружен-
Рис. 71. Trichosporonoides oedocephalis: a — почкующиеся клетки
и псевдомицелий с бластоспорами; б — мицелий, распадающийся
на артроспоры; в — конидиофоры с конидиями.
104
ные, несептированные, со вздутием на конце. Такие вздутия,
несущие конидии, иногда образуются интеркалярно на мицелии.
Конидии одноклеточные, сначала бесцветные, при созревании
становятся коричневыми, располагаются одиночно на маленьких сте-
ригмах по всей поверхности «головки» конидиофора (рис. 71).
Колонии до образования конидиоспор бесцветные, дрожжеподобные.
При развитии мицелия становятся кремовыми, а при созревании
конидий — желто-коричневыми до черных. Сахара сбраживают,
нитраты ассимилируют. Хорошо растут при 37° С, но образование
конидий в этих условиях подавлено. Описан всего один вид — Trichospo-
ronoides oedocephalis Haskins et Spencer, выделенный от
домашней медоносной пчелы [32, 34]. Организм интересен тем, что он
продуцирует эритрит.
79. Trigonopsis
Клетки треугольные или эллипсовидные, бывают также
ромбовидные и тетраэдрические. Почкование многостороннее у овальных
клеток и по углам у треугольных и тетраэдрических (рис. 72). Псев-
Рис. 72. Trigonopsis variabilis: почкующиеся клетки.
домицелий не образуют. Колонии бесцветные, мягкие. На жидких
средах тонкая пленка. Сахара не сбраживают, нитраты не
ассимилируют. Описан один вид — Trig, variabilis Schachner.
Первоначально эти дрожжи были выделены из пива. Повторные
обнаружения из вин и виноматериалов.
80. Wickerhamia
Клетки апикулятные (лимоновидные), имеются также овальные
и продолговатые. Образуют короткие цепочки. Вегетативное
размножение биполярным почкующимся делением. Аски образуются из
105
вегетативных клеток без предшествующей конъюгации. Споры кеп-
ковидные, с «козырьком», обычно 1—2 в сумке, редко
наблюдается— до 16 спор в одном аске. При созревании спор сумки
вскрываются, разрываясь по экватору на две половинки (рис. 73).
Колонии бесцветные, но в агар диффундирует флюоресцирующий
пигмент (рибофлавин). В жЪдких средах — осадок и кольцо. Сахара
сбраживают, нитраты не ассимилируют. Описан один вид —
W. fluorescens Soneda. Выделен из помета белки, в Японии.
Рис. 73. Wickerhamia fluorescens: вегетативные клетки и споры.
81. Wickerhamiella
Клетки .мелкие, от 1,0—2,0 до 5 мкм (максимально) в длину,
овальные или слегка апикулятные. Помимо обычного почкования
наблюдается образование почек на широком основании. Аски
образуются после конъюгации двух независимых клеток. Аскоспоры
овальные с шероховатой поверхностью, по 1 в аске (рис. 74). Пос-
оо О^ Щ
..<* 5 в
Рис. 74. Wickerhamiella domerqii: a — вегетативные клетки; б —
сумки; в — аскоспоры.
ле созревания спор аски вскрываются терминально. Дрожжи гомо-
талличны. Сахара не сбраживают. Нитраты ассимилируют.
Колонии неслизистые, кремового цвета, мелкие. В жидких средах пленки
не формируют. При 37° С не растут. Хороший рост на средах с
высоким осмотическим давлением. Известен один вид —
Wickerhamiella domerqii van der Walt. Его несовершенная форма — Toru-
lopsis domerqii van der Walt et Kerken [62]. Вид относится к сво*
бодноживущим дрожжам, его специфическое место обитания
неизвестно.
106
82. Williopsis
Клетки круглые или слегка овальные. Почкование
многостороннее. Споры гладкие, но с хорошо заметным выступающим
экваториальным ободком, что придает им сходство с планетой Сатурн
(рис. 75). В аске 1—2 или 1—4 споры. При созревании они не
освобождаются из сумок. Выделяются из почв. В. И. Кудрявцев [11]
помещает в этот род только один вид диплоидных дрожжей —
Рис. 75. Williopsis saturnus: почкующиеся клетки, сумка, аскоспоры
и их копуляция.
W. saturnus (Klocker) Zender. H. А. Красильников [10] включает
в него и гаплоидные дрожжи. В определителе Лоддер [55] и те, и
другие объединены вместе с видами, ассимилирующими нитраты и
образующими шляповидные споры, в род Hansenula. Род Williopsis,
однако, восстановлен снова [25] с тем же диагнозом, который
имеется у Красильникова [10].
83, Wingea
Клетки круглые до эллипсовидных. Вегетативное размножение
многосторонним почкованием. Аски обычно образуются в
результате соматогамной автогамии или, реже, после конъюгации двух
независимых клеток. Споры имеют характерную линзовидную
форму и при созревании становятся коричневыми. Нормально 1—2
споры в сумке (рис. 76). Сахара сбраживают медленно. Нитраты не
ассимилируют. Сходны с видами Pichia, но отличаются от них
формой спор. Описан один вид — Wingea robertsii van der Walt.
Выделен из пищи личинок древесной пчелы в Южной Африке.
Рис. 76. Wingea robertsii: клетки и аски со спорами.
107
84. Zygofabospora
Клетки эллипсовидные, иногда несколько вытянутые и слегка
изогнутые. Размножаются многосторонним почкованием и образуют
примитивный псевдомицелий. Перед спорообразованием клетки
попарно копулируют и зиготы превращаются в сумки. Аскоспоры
бобовидные с гладкой поверхностью, обычно 4 в сумке (рис. 77).
Рис. 77. Zygofabospora marxiana: клетки и аски со спорами.
После созревания легко освобождаются из сумок. Род описан
В. И. Кудрявцевым [11] с двумя гаплоидными видами, которые в
определителе Лоддер [55] рассматриваются как синонимы видов
Z. marxiana (Hansen) Kudriavzev-Kluyveromyces marxianus
(Hansen) van der Walt; Z. krassilnikovii-Kl. drosophilarum (Shehata),
Mrak et Phaff) van der Walt.
85. Zygohansenula
Наименования видов, включаемых в этот род Н. А. Красильни-
ковым [10], рассматриваются в определителе Лоддер [55] как
синонимы гаплоидных видов Hansenula (27).
86. Zygopichia
Названия видов, описанных в этом роде В. И. Кудрявцевым
{11] и Н. А. Красильниковым [10], считаются синонимами разных
видов Pichia в определителе Лоддер [55].
87. Zygorenospora
Род создан Н. А. Красильниковым [10] для видов, которые
имеют почковидные или бобовидные споры и педогамный половой
Процесс. Эти виды включаются сейчас в род Kluyveromyces
[25, 55]. Вид, описанный Н. А. Красильниковым как Z. renospora
Krassilrtikov, был классифицирован В. И. Кудрявцевым [11] как
Zygofabospora krassilnikovii Kudriavzev.
108
88. Zygosaccharomyces
Клетки круглые и овальные. Вегетативное размножение
многосторонним почкованием. Асками становятся зиготы, образующиеся
после изо- и гетерогамной конъюгации отдельных клеток. Аскоспоры
круглые или слегка овальные, гладкие, 1—4, чаще 3—4 в сумке
(рис. 78). Сахара сбраживают. Нитраты не ассимилируют. Общая
биологическая особенность — способность развиваться в субстратах
Рис. 78. Zygosaccharomyces: вегетативные клетки и сумки со
спорами.
с высокими концентрациями сахара (до 80%). Встречаются в меде,
вызывая его порчу. Часто обнаруживаются также в вареньях,
сахарных сиропах, концентрированном виноградном соке, вяленых
фруктах, плодовых консервах и т. д. В природе распространены
в нектаре цветов, на винограднике и фруктах. В определителе Лод-
дер [55] виды этого рода включены в род Saccharomyces. Однако
род снова восстановлен как самостоятельный таксон в составе
восьми видов гаплоидных осмотолерантных дрожжей [25].
89. Zygowillia
Три вида, включенные В. И. Кудрявцевым [11] в этот род,
рассматриваются в определителе Лоддер [55] как гаплоидные виды
рода Pichia (51).
90. Zygowilliopsis
Род создан В. И. Кудрявцевым [11] для единственного вида
Z. californicus, который Н. А. Красильников [10] помещает в род
Williopsis, а в определителе Лоддер [55] он включен в род
Hansenula. В новом определителе родов дрожжей и дрожжеподоб-
ных грибов [25] эти дрожжи рассматриваются в составе рода
Williopsis. Дрожжи этого рода обычно выделяют из почв.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Абрамович В. В. О длительном хранении культур
винных дрожжей.—Виноделие и виноградарство СССР, 1955, № 2,
с. 57—60.
2. Бабьева И. П., Благодатская В. М.
Физиологические характеристики и экология Schizoblastosporion starkeyi—hen-
ricii Ciferri.—Микробиология, 1972, т. 41, вып. 1, с. 99—104.
3. Б л а и к о в Б. И., Клебанов Д. Л. Применение лиофи-
лизации в микробиологии.—М.: Медгиз, 1961.—263 с.
4. Б у р ь я н Н. И. Сравнительное изучение различных
методов хранения культур пивных дрожжей в музее. Труды ВНИИВиВ
«Магарач», 1960, т. 9, с. 53—81.
5. В л о д а в е ц В. В., Немыря В. И. Санитарно-микологи-
ческий контроль окружающей среды на предприятиях
микробиологической промышленности.— Гигиена и санитария, 1977, № 1,
с. 25—28.
6. Голубев В. И. Nadsonia commutata nov. sp.—
Микробиология, 1973, т. 42, вып. 6, с. 1058—1061.
7. 3 у б к о в а Р. Д. Новый род семейства Saccharomycetaceae
из Казахстана.— Ботанические материалы гербария ин-та ботаники
АН КазССР, 1971, вып. 7, с. 53—56.
8. И м ш е н е ц к и й А. А., К р и с с А. Е. Материалы к
изучению несовершенных грибов. I. Новый грибок Mastigomyces Phillip-
povi (nov. gen. nov. sp.), найденный на плодах миробаланы Тег-
minalia chebula — Доклады АН СССР, 1933, № 7, с. 111—116.
9. К о с и к о в К. В. Методы гибридизации и полиплоидии
дрожжей.—Успехи микробиологии, 1975, т. 10, с. 101—119.
10. Красильников Н. А. Дрожжи. В кн.: Определитель
низших растений (под ред. Л. И. Курсанова). М., 1954, т. 3, с. 102—
148.
11. Кудрявцев В. И. Систематика дрожжей.— М.: изд. АН
СССР, 1954.—427 с.
12. Кудрявцев В. И. Коллекция типовых культур
микроорганизмов.— Микробиология, 1963, т. 32, вып. 5, с. 902—910.
13. Кудрявцев В. И., Фатеева М. В.,
Никитина Т. Н. Хранение коллекционных дрожжевых культур под
минеральным маслом.— Микробиология, 1972, т. 41, вып. 5, с. 903—908.
14. Международный кодекс ботанической номенклатуры,
принятый XI Международным ботаническим конгрессом.— Л.:
Наука, 1974.—270 с.
15. Методы хранения коллекционных культур
микроорганизмов под ред. Н. А. Красильникова.— М.: Наука, 1967.—151 с.
16. Парина О. В., Патрикеев В. В., Лысенко С. В.
Исследование выживаемости и физиологической активности неко-
110
торых штаммов дрожжей после длительного хранения в силика-
геле.— Микробиология, 1972, т. 41, вып. 1, с. 164—167.
17. Романенко В. И., Кузнецов С. И. Экология
микроорганизмов в пресных водоемах. Лабораторное руководство.—
Л.: Наука, 1974,-194 с.
18. Сборник методик по генетике дрожжей-сахаромицетов
[И. А. Захаров, С. А. Кожин, Т. Н. Кожина, И. В. Федорова].—Л.:
Наука, 1976.—112 с.
19. Фатеева М. В., Никитина Т. R, Шерман Ф. Б.
Выживаемость и диагностические свойства дрожжей после лиофи-
лизации и хранения.—Изд. АН СССР, 1976, № 4, с. 611—617.
20. А г п о 1 d P., A h е а г n D. G. The systematics of the genus
Prototheca with a description of a new species P. filamenta.—Myco-
logia, 1972, v. 64, N 2, p. 265—275.
21. Arx, von J. A. The genera of fungi sporulating in pure
culture.—J. Cramer Verlag 3301 Lehre, 1970.—288 p.
22. Arx, von J. A. On Endomyces, Endomycopsis and related
yeast-like fungi.— Antonie van Leeuwenhoek, 1972, v. 38, N 3,
p. 289—309.
23. A r x, von J. A. Centraalbureau voor Schimmelcultures,
Progress Report 1975.— Verh. Konink. Ned. Akad. Weten., Afd.
.Natuurk., 1976, 2e reeks, Deel 67.—23 p.
24. A r x, v о n J. A., van d e r Walt J. P. The ascigerous
state of Candida chodatii.— Antonie van Leeuvenhoek, 1976, v. 42, N 3,
p. 309—314.
25. A r x, von J. A., R о d г i g u e s d e Miranda L.,
Smith M. Т., Yarrow D. The genera of yeasts and yeast—like
fungi.— Studies in Mycology, 1977, N 14, p. 1—42.
26. В a 11 о n i W., Florenzano G., Materassi R. A new
species of Sporidiobolus (Spor. veronae) isolated from tropical
bituminous soil.—Ann. Microbiol. Enzymol., 1974, v. 24, N 2, p. 233—240.
27. Bandoni R. J., Lob о К. I., Brezden S. A.
Conjugation and chlamydospores in Sporobolomyces odorus.— Can. J.
Botany, 1971, v. 49, N 5, p. 683—686.
28. Ba r n e 11 J. A., P a n k h u r s t R. J. A new key to the
yeasts.— Amsterdam—London, North-Holland Publ. Co., 1974.—
273 p.
29. F e 11 J. W., S t a t z e 1 A. C. Sympodiomyces gen. п., а
yeast—like organism from southern marine waters.—Antonie van
Leeuwenhoek, 1971, v. 37, N 3 , p. 359—367.
30. Fell J. W., Hunter I. L., Tallman A. S. Marine basi-
diomycetous yeasts (Rhodosporidium spp. n.) with tetrapolar and
multiple allelic bipolar mating systems,—Can. J. Microbiol., 1973,
v. 19, N 5, p. 643-657.
31. Golubev W. I. Metschnikowia lunata nov. sp.—Antonie van
Leeuwenhoek, 1977, v. 43, N 3—4, p. 317—322.
32. H a s k i n s R. H., Spencer J. F. T. Trichosporonoides oedo-
cephalis n. gen., n. sp. I. Morphology, development and taxonomic
position.—Can. J. Botany, 1967, v. 45, p. 515—520.
33. Hermanides — Nijhof E. J. Aureobasidium and allied
genera,—Studies in Mycology, 1977, N 15, p. 141—177.
34. H о о g, d e G. S. Rhinocladiella and allied genera.— Studies
in Mycology, 1977, N 15, p. 1—140.
35. King D. S., Jong S. С Sarcinosporon: a new genus to
111
accomodate Trichosporon inkin and Prototheca filamenta.—Mycota-
xon, 1975, v. 3, N 1, p. 89—94.
36. King D. S., Jong S. C. Aciculoconidium: a new hyphomy-
cetous genus to accomodate Trichosporon aculeatum—Mycotaxon,
1976, v. 3, N 3, p. 401—408.
37. Kockova-Kratochvilova A., Blagodat-
s к a j a V. M. The evaluation of freeze—dried yeasts.— Biologia
(CSSR), 1974, v. 29, N 12, p. 893—901.
38. К г e i s e 1 H. Grundzuge eines naturlichen Systems der
Pilze.—Veb Gustav Fischer Verlag, Jena, 1969.—245 p.
39. Kurt zm an С P. Cephaloascus albidus, a new heterothal-
lic yeastlike fungus.—Mycologia, 1977, N 3, p. 547—555.
40. К u r t z m a n C. P., W i с к e r h a m L. J. Saccharomycopsis
crataegensis, a new heterothallic yeast.— Antonie van Leeuwenhoek,
1973, v. 39, N 1, p. 81—87.
41. Kwon-Chung K. J- A new genus Filobasidiella, the
perfect state of Cryptococcus neoformans.— Mycology, 1975, v. 67, N 6,
p. 1197—1200.
42. К w о n - С h u n g K. J. A new species of Filobasidiella, the
sexual state of Cryptococcus neoformans В and С serotypes.—
Mycology, 1976, v. 68, N 4, p. 942—946.
43. Kwon-Chung K. J. Perfect state of Cryptococcus unigut-
tulatus.—Int. J. Syst. Bacteriol., 1977, v. 27, N 3, p. 293—299.
44. M i 11 e r M. W., Yoneyama M., S о n e d a M. Phaffia,
a new yeast genus in the Deuteromycotina (Blastomycetes).— Int. J.
Syst. Bacteriol., 1976, v. 26, N 2, p. 286—291.
45. Nieuwdorp P. J., Bos P., S1 о о f f W. C.
Classification of Lipomyces.— Antonie van Leeuwenhoek, 1974, v. 40, N 2,
p. 241—254.
46. Ramirez С A compilation of description of new Candida
species with keys to all species of the genus described up to date.—
Microbiol. Espaniola (Madrid), 1974, v. 27, N 1, p. 15—80.
47. R e d d у M. S., Kramer С L. A taxonomic revision of
the Protomycetales.—Mycotaxon, 1975, v. 3, N 1, p. 1—50.
48. Rodrigues de Miranda L. Filobasidium capsuligenum
nov. comb.— Antonie van Leeuwenhoek, 1972, v. 38, N 1, p. 91—99.
49. Rodrigues de Miranda L. Two new species of the
genus Sterigmatomyces.— Antonie van Leeuwenhoek, 1975, v. 41,
N 2, p. 193—199.
50. Rodrigues de Miranda L., Yarrow D. The
maintenance of stock cultures of yeasts.— In: Yeastsas Models in Science
and Technology (Kockova—Kratochvilova A., Minarik E. eds.), Publ.
House of SAS.— Bratislava, 1972, p. 59—67.
51. Smith M. T. Hanseniaspora occidentalis sp. nov.—Antonie
van Leeuwenhoek, 1974, v. 40, N 3, p. 441—444.
52. Smith M. Т., van der Walt J. P., Joh a nn sen E.
The genus Stephanoascus gen. nov. (Ascoideaceae).— Antonie van
Leeuwenhoek, 1976, v. 42, N 1—2, p. 119—127.
53. Stadelmann F. A new species of the genus Bullera
Derx.— Antonie van Leeuwenhoek, 1975, v. 41, N 4, p. 575—582.
54. Sukroongreung S., Rodrigues de Miranda L.
A. new aspect of the life cycle of Candida tropicalis.— Antonie van
Leeuwenhoek, 1973, v. 39, N 1, p. 65—80.
112
55. The Yeasts. A taxonomic study (2nd edition).— Lod-
der J. (ed.) North—Holland Publ. Co., Amsterdam—London, 1970.—
1385 p.
56. The Yeasts. Rose А. И., Harrison J. S. (eds.) v. 1.
Biology of yeasts. 1969.—508 p. v. II. Physiology and biochemistry of
yeasts. 1971.—571 p. v. III. Yeast technology. 1970.—590 p. Acad.
Press, London — New — York.
57. Tubaki K. Studies on the Sporobolomycetaceae in Japan.
I. On Tilletiopsis.— Nagaoa (Tokyo), 1952, v. I, p. 26—31.
58. W a 11 J. P., van der. The genus Syringospora Quinquard
emend.—Mycopath. Mycol. Appl., 1970, v. 40, N 3—4, p. 231—243.
59. Walt J. P., van der. The yeast genus Ambrosiozyma gen.
nov. (Ascomycetes).— Mycopath. Mycol. Appl., 1972, v. 46, N 4,
p. 305—316.
60. W a 11 J. P., van der, J о h a n n s e n E. The perfect state
of Torulopsis magnoliae.— Antonie van Leeuwenhoek, 1973, v. 39,
N 4, p. 635—647.
61. Walt J. P., van der, Johannsen, E. The genus To-
rulaspora Lindner.— CSIR Res. Report (S. Africa, Pretoria), 1975,
N 325, p. 1—23.
62. Walt J. P., van der, Liebenberg N. V. D. W. The
yeast genus Wickerhamiella gen. nov. (Ascomycetes).— Antonie van
Leeuwenhoek, 1973, v. 39, N 1, p. 121—128.
63. Walt J. P., van der, Scott D. B. The yeast genus
Saccharomycopsis Schionning.— Mycopath. Mycol. Appl., 1971, v. 43,
N 3, 4, p. 279—288.
64. W e 11 m a n A. M., Stewart G. G. Storage of brewing
yeasts by liquid nitrogen refrigeration.—Appl. Microbiol., 1973,
v. 26, N 4, p. 577—583.
СЛОВАРЬ МИКОЛОГИЧЕСКИХ ТЕРМИНОВ
Автогамия — самооплодотворение, слияние двух ядер в одной
клетке без предшествующего слияния клеток.
Амброзиальные грибы — грибы, живущие в ассоциации с
жуками-короедами. Мицелий этих грибов выстилает ходы в древесине,
где живут личинки жуков, питающиеся этой грибницей.
Апикальный —• верхушечный.
Апикулятный — имеющий лимоновидную форму с небольшими
тупыми выступами по полюсам.
Артроспора — бесполая спора, образующаяся из клетки гифы
при ее фрагментации за счет образования поперечных перегородок.
Аск (сумка) — орган полового спороношения у аскомицетов,
в котором образуются гаплоидные аскоспоры.
Аскоспора — половая спора, образующаяся в сумке после
редукционного деления ядра.
Аскофор — специализированная гифа, несущая сумку (аск).
Базидия — орган полового спороношения у базидиомицетов, на
котором на стеригмах образуются базидиоспоры, обычно 4.
Баллистоспора — спора, образующаяся на стеригме и с силой
отбрасываемая при созревании.
Бесполая спора — спора, образованию которой не предшествует
половой процесс.
Бластоконидия — бесполая спора, образующаяся почкованием
на боковой поверхности гифы.
Бластоспора — бесполая спора, образующаяся на. ложном
мицелии путем почкования в месте соединения осевых клеток псевдо-
гиф или вблизи конца вытянутой клетки.
Гамета — специализированная половая клетка.
Гаметангий — структура, продуцирующая половые клетки —
гаметы.
Гаплоидная фаза — часть жизненного цикла, когда клетки
содержат одинарный набор хромосом.
Гетерогамия — слияние в половом процессе морфологически
разных клеток, гамет.
Гетероталлизм — явление раздельнополости, когда клетки,
участвующие в половом процессе, происходят от разных талломов
одного вида гриба. Морфологически талломы разного пола обычно
не различаются.
Гиалиновый — бесцветный, стекловидный.
Гифа — один из нитевидных элементов, составляющих тело
гриба.
Головневые грибы — фитопатогенные организмы пор. Ustilagi-
nales, полный жизненный цикл которых включает образование те-
лиоспор, промицелия и гаплоидных споридий.
114
Гомоталлизм — явление обоеполости, при котором в половом
процессе участвуют клетки, происходящие от одной аскоспоры.
Дикариофитный — двуядерный, содержащий дикарион — пару
ядер, каждое из которых происходит от разной родительской особи.
Диплоидная фаза — часть жизненного цикла, когда клетки
содержат двойной набор хромосом.
Зигота — продукт слияния гаплоидных ядер или клеток.
Изогамия — слияние в половом процессе морфологически
одинаковых клеток, гамет.
Интеркалярный — вставочный, расположенный между двумя
клетками гифы.
Кандидоз — заболевание, вызываемое дрожжами рода Candida,
наиболее часто — С. albicans.
Кариогамия — слияние ядер.
Клещи микофильные — микроскопические клещи, питающиеся
живой грибницей, мицелием грибов. Могут заражать грибные
коллекции и, переползая из одной пробирки в другую, приводить к
загрязнению чистые культуры.
Конидия — бесполая спора, образующаяся на
специализированной гифе, конидиогенной клетке, конидиеносце.
Конъюгация, копуляция — слияние двух клеток, за которым
обычно следует слияние ядер и образование зиготы.
Криптококкоз — заболевание, вызываемое дрожжами Cryptococ-
cus neoformans.
Латеральный — расположенный на боковой поверхности, сбоку.
Лизис — растворение клеток, клеточных структур.
Мейоз — редукционное деление ядра, ведущее к образованию
гаплоидного состояния:
Мейоконидиофор — клетка, в которой диплоидное ядро
претерпевает редукционное деление. Общий термин для аска и бази-
дии.
Микоз — заболевание, вызываемое грибом.
Мицелий — совокупность ветвящихся гиф, составляющих
вегетативное тела гриба. Различают воздушный мицелий,
поднимающийся над субстратом; субстратный, проникающий в
субстрат; истинный септированный, имеющий в гифах септы; лож-
н ы й, или псевдомицелий, образованный почкующимися клетками.
Мутанты с дыхательной недостаточностью (/?/)-мутанты, petite-
мутанты) — мутанты дрожжей, у которых отсутствуют некоторые
цитохромы, в результате чего они не способны окислять субстрат
в процессе дыхания и получают энергию лишь вследствие
брожения. Колонии RD-мутантов поэтому мельче в сравнении с
колониями нормальных типов этих же дрожжей. Признак petite связан с
цитоплазматической наследственностью.
Пастеровский эффект — подавление бродильной активности
дрожжей кислородом, переход с бродильного на окислительный тип
обмена под влиянием аэрации. Высокая концентрация глюкозы
вызывает, напротив, подавление окислительного метаболизма, что
носит название обратного (негативного) пастеровского эффекта, или
эффекта Крэбтри.
Педогамия — конъюгация между материнской клеткой и почкой.
Плазмогамия — слияние цитоплазмы двух конъюгирующих
клеток без слияния их ядер.
115
Плодовое тело — структура из плотно переплетенных грибных
гиф, где формируются органы полового спороношения — аски или
базидии. У аскомицетов оно носит название аскокарпа, у базидио-
мицетов — базидиокарпа.
Пора—сквозное отверстие в септе, через которое
осуществляется контакт между двумя соседними клетками гифы. У
аскомицетов пора обычно простая, у базидиомицетов она имеет сложное
строение и носит название долипоры.
Почкование — процесс вегетативного размножения дрожжей, при
котором на материнской клетке возникает выпячивание, соединенное
с исходной клеткой узким перешейком. После отделения почки на
ней остается шрам рождения, а на материнской клетке — почковый
шрам.
Почкующееся деление — процесс вегетативного размножения
дрожжей, при котором почки, закладывающиеся только по полюсам
клетки, образуются на широком основании, и септа между
материнской клеткой и почкой значительно шире, чем при почковании.
Промицелий — ростковая гифа, образующаяся из телиоспоры и
несущая споридии.
Пряжка — небольшая клетка, закладывающаяся сбоку на гифе
против септы; характерна для дикариофитного мицелия базидоми-
цетов.
Псевдомицелий — см. мицелий. Различают примитивный
псевдомицелий, у которого составляющие клетки морфологически почти
не отличаются друг от друга, и хорошо развитый псевдомицелий,
у которого осевые клетки более длинные, а у их сочленений
имеются круглые или овальные мелкие клетки — бластоспоры.
Радулоспора — конидия, образующаяся на маленьких
выступах— зубчиках на боковых поверхностях гиф.
Септа — поперечная перегородка в гифе.
Симподиальный — тип ветвления, при котором боковая ветвь
(гифа) получает дальнейшее развитие, а центральная гифа
прекращает рост.
Соматогамия — тип полового процесса, при котором происходит
слияние двух вегетативных (соматических) клеток.
Спорангий — орган, продуцирующий бесполые эндогенные споры.
Споридия — гаплоидная экзогенная спора, формирующаяся на
промицелий.
Стеригма — шипообразный вырост, несущий базидиоспору или
баллистоспору.
Субапикальный — расположенный под вершиной, близко к
концу гифы.
Сумка — см. аск.
Таллом — вегетативное тело гриба.
Телиоспора, телейтоспора — толстостенная покоящаяся
головневая спора, в которой протекает кариогамия.
Терминальный — концевой.
Тип спаривания — половой тип у гетероталличных грибов.
Способные конъюгировать клетки разных типов спаривания
морфологически не различаются у дрожжей и обозначаются как а и а.
Биполярные гетероталличные грибы имеют два типа спаривания, тетра-
полярные — четыре.
Хламидоспора — бесполая покоящаяся спора с толстой
оболочкой.
116
ПРЕДМЕТНЫЙ
УКАЗАТЕЛЬ
Агар ацетатный Мак Клари 39
— — Фоувелла 39
— водный 38, 39
— глюкозо-пептониый 28
— ка ртофельно-глюкозный 31,
33, 57
— кукурузный 31, 33, 57
— лизиновый 17
— медовый 13
синтетический 13
— меловой 54
— метабисульфитный 10
— морфологический 28, 35, 57
— овощной 40
— осмофильный 13
— промытый 49
— рисовый 39
— Эшби модифицированный 13
Адгезивные материалы 7
Адсорбенты 23
Антибиотик
— актидион (циклогексимид)
17, 52, 57
— актиномицин 12
— ауреомицин 12
— левомицетин (хлорамфени-
кол) 12, 13
— пенициллин 12
— стрептомицин 12
— хлортетрациклин 13
Аппарат Кротова 10
Батометр 9
Белково-витаминный
концентрат БВК 68, 71
Брожение 41, 42
Бычья желчь 13
Гидролиз арбутина 53, 57
— жира 54, 57
— мочевины 57
— полисахаридов 56
Гипсовые блоки 39, 40
Дезинтегратор 9
Дифенил 13
Дночерпатель 9
Дробина 12
Дрожжевая вода 19, 42
агаризованная 39
Дрожжевой автолизат 43
Дрожжевой экстракт 12, 19,
21, 28, 35, 39
Дрожжи аскомицетовые 58
— базидиомицетовые 20, 38, 58
— баллистоспоровые 17
—галотолерантные 10
— гаплоидные 36
— гетероталличные 36
— гомоталличные 36, 37
—дикие 17
— диплоидные 37
— мезофшгьные 11
— несовершенные 5, 58
— олигонитрофильные, 13, 59
— осмофильные 10, 13, 37
— осмотолерантные 20, 109
— патогенные 11, 17, 32
— пекарские 43
— пивные 43
— психрофильные 9, 10, 11, 17,
19,28
— психрофобные 11, 19
— психротолерантные 11
Защитные вещества 21, 23
Ингибиторы роста бактерий 12
грибов 13
Инокулят 44, 49, 50
Инокулятор 44, 45
Йодная проба 12
Капсула 26, 71, 81
Кизельгур 12
Клон 14
Красители
— бенгальский розовый 13
— бромкрезоловый пурпурный
13
— кристаллический
фиолетовый 13
117
— малахитовый зеленый 40
—метиленовый синий 40
— нильский голубой 40
— сафранин 40
— фуксин основной 40
Лактофенол 7
Линдан 17
Лиофилизация 21
Масло минеральное 18, 20
— вазелиновое 18, 20, 21
Мастика 15
Метод агаровой колбаски 7, 8
— Виртца окраски спор 40
— выделения баллистоспоро-
вых дрожжей 17
карбол-фуксиновой окраски
спор 40
— комочков почвы 13
— Коха 10
— Линднера 15
модификации 15
—отпечатка 7
— поверхностного посева 16
— посева истощающим
штрихом 16
— смыва 6
—соскоба 6
Микофильные клещи 17, 19
Микроманипулятор 15, 16
Микроразмельчитель тканей
7, 9
Мутанты 17, 19
Образование крахмалоподоб-
ных соединений 55
— органических кислот 54
— эфиров 54
Образцы почв 9
Пленка 35, 57
Поверхностноактивные
вещества 10
Пол исаха ри д ы внек леточи ыс
55, 56, 57
Прибор Киктенко 10
Проба (-ы) воды 9
— жидкостей 9
— на нитриты 49
Пропионат натрия 13
Пульхерримин 34, 84
Раса 14
Раствор Люголя 55
Раствор Циля 40
Силикагель 23, 24
Солод 12
Среда (ы) Адамса 24
— азотная основа 48
— безвитаминная 48
— виноградный сок 39
—глюкозо-аммонийная 12
— глюкозо-пептонная 12
с дрожжевой водой 19
с дрожжевым экстрактом
12, 19, 28, 35
-с мясным экстрактом 12
с мясным и дрожжевым
экстрактами 21
— Голубева 55
— Горина 56
— Городковой 39
— дифференциальные 12
— для липомицетов 20
— для образования телейто-
спор 39
крахмалоподобных
соединений 55
— для определения галотоле-
рантности 51
—для хранения культур
дрожжей 19
— защитные 21
— предспоруляционные 37, 39
— с арбутином 53
— Ридер 20
— Сабуро 12, 21
— синтетические основные 48
— Старки 40
— углеродная основа 48
— Христенсена 53
— элективные 13, 16
Стратометр 9
Сусло-агар 12, 19, 28
— с дрожжевым экстрактом
39
— с желатиной 35
— солодовое 11, 27, 35
Суспензионные жидкости 21
Теллурат калия 13
Трубка Дунбара 42
Тушь черная по Лнттману 28
стерильная 28
Уреазная активность 52
Устойчивость к циклогексимиду
52
Фильтры мембранные 9, 13
Чистая культура 14—18
Штамм 14
118
ОГЛАВЛЕНИЕ
Предисловие 3
Глава I. Методы выделения и поддержания культур
дрожжей
Отбор проб и подготовка материала для количественного
учета и выделения дрожжей б
Посев и условия выращивания 10
Среды для выделения дрожжей 11
Количественный учет и выделение дрожжей 14
Получение чистых культур дрожжей 14
Прямые методы 15
Непрямые методы 16
Проверка чистых культур 17
Очистка дрожжевых культур от клещей 17
Поддержание и хранение культур дрожжей 18
Периодические пересевы 18
Хранение под минеральным маслом 20
Лиофилизация 21
Методы криогенного хранения ...... 23
Хранение на адсорбентах 23
Хранение культур винных дрожжей в виде спор . . 24
Хранение микробных культур под вакуумом — метод
Сорделли 24
Хранение коллекционных культур дрожжей в
дистиллированной воде по методу Кастеллани .... 25
Глава II. Методы идентификации дрожжей
Морфология и вегетативное размножение 26
Характеристика вегетативных клеток .... 26
Вегетативное размножение и образование ложного и
истинного мицелия 28
Образование хламидоспор 32
Образование баллистоспор 33
Рост на плотных средах 34
Рост в жидких средах 35
арактеристика полового процесса 35
изиологические признаки 41
Сбраживание Сахаров 41
Ассимиляция источников углерода 43
Ассимиляция источников азота 49
Рост в безвитаминной среде 50
Рост на средах с повышенным осмотическим
давлением 50
119
Рост при повышенных температурах .... 51
Устойчивость к циклогексимиду (актидиону) ... 52
Обнаружение и анализ некоторых метаболитов .... 52
Уреазная активность 52
Гидролиз арбутина ... 53
Разжижение желатины 53
Гидролиз жира 54
Образование органических кислот 54
Образование эфиров 54
Образование крахмалоподобных соединений ... 55
Определение моносахаридиого состава внеклеточных
полисахаридов 55
Схема стандартного описания новых видов дрожжей . . 57
Глава III. Классификация дрожжей
Аскомицетовые дрожжи 58
Базидиомицетовые дрожжи 60
Несовершенные дрожжи 60
Диагностические описания родов дрожжей 62
Список использованной литературы ПО
Словарь микологических терминов \\4
Предметный указатель 117
Инна Павловна Бабьева
Владислав Иванович Голубев
МЕТОДЫ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ
ДРОЖЖЕЙ
Редактор И. Н. К о б ч и к о в а
Художник Л. Н. Наумов
Художественный редактор В. А. Чуракова
Технический редактор Т. С. Пронченкова
Корректор Г. Л. Плигина
ИБ № 960
Сдано в набор 26.09.78. Подписано в печать 23.04.79.
Т-06862 Формат 84Х1087з2 Бумага типографская № 2
Литературная гарнитура. Высокая печать
Объем 3,75 печ. л. Усл. печ. л. 6,30 Уч.-изд. л. 7,48
Тираж 4600 экз. Заказ 1921 Цена 40 коп.
Издательство «Пищевая промышленность», 113035,
Москва, М-35, 1-й Кадашевский пер., 12.
Московская типография № 6 Союзполиграфпрома
при Государственном комитете СССР
по делам издательств, полиграфии и книжной торговли.
109088, Москва, Ж-88, Южнопортовая ул., 24.