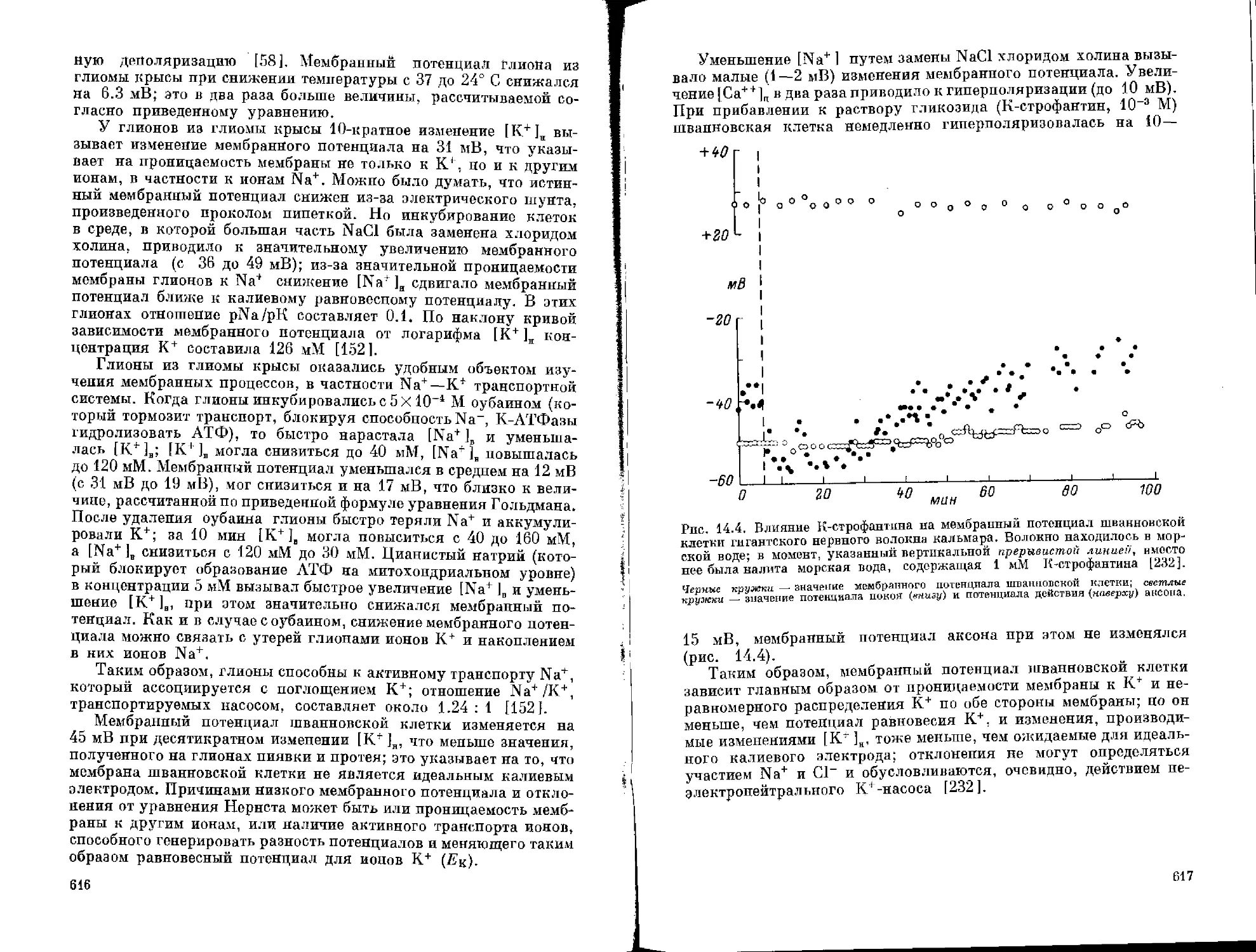
Author: Бехтерева Н.П.
Tags: физиология сравнительная физиология анатомия анатомия человека сравнительная анатомия медицина нервная система
Year: 1979
Text
АКАДЕМИЯ НАУК СССР
ОТДЕЛЕНИЕ ФИЗИОЛОГИИ
РУКОВОДСТВО ПО ФИЗИОЛОГИИ
ОБЩАЯ
ФИЗИОЛОГИЯ НЕРВНОЙ СИСТЕМЫ
6
ЛЕНИНГРАД
«НАУКА»
ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ 1979
УДК 612. 8.014,42:611.8-018
Общая физиология нервной системы. В серии: Руководство по физиологии. Л., «Наука», 1979. 717 с.
В книге излагается современное состояние изучения клеточных механизмов деятельности нервной системы. Рассматриваются механизмы электрической возбудимости мембраны нервных волокон и нервных клеток, механизмы активного транспорта ионов и функциональная роль возникающего при этом электрогепного эффекта. Обсуждается вопрос о химических медиаторах и вызываемых ими процессах в постсинаптических структурах. Специально освещаются проблемы трофических влияний нервных клеток, принципы передачи и переработки информации и сохранения следов (памяти) и другие вопросы. Особое внимание уделено рассмотрению морфологии и физиологических особенностей нейроглиальных клеток, которым в настоящее время отводится важная роль в механизмах нервной деятельности и патогенезе ряда заболеваний центральной нервной системы. Лит. — 2473 пааи7., ил. — 226, табл. — 8.
Редакционная коллегия серий «Руководство по физиологии» и «Методы физиологических исследований»:
Н. П. Бехтерева (зам. отв. редактора), В. А. Кисляков, Г. П. Конради,
П. Г. Коетюк (зам, отв. редактора), К. А. Ланге (отв. секретарь),
Б. Ф. Ломов, В. И. Медведев, А. Л. Поленов, Т. Н. Турлаев, А. М. Уголев, М. М. Хананашвили, В. И. Черниговский (отв. редактор)^ А. И. Шаповалов
Редакционная коллегия тома:
А. П. Авцьш, Л. А. Вихрева (отв. секретарь), П. Г. Коетюк (отв. редактор), Л. Г. Магазаник, А. И. Ройтбак (отв. редактор), Д. А. Сахаров, И. К. Сванидзе (отв. секретарь), Б. И. Ходоров, А. И. Шаповалов
50300-708
О-----------БЗ-96-43-78 2007020000
055(02)-79
IQ/ Издательство «Наука», 1979 г,
II Р^Е Д И С Л О В If Е
Физиология нервной системы, как и многие другие разделы физиологии, за последние десятилетия все более и более ускоряют свое развитие. Разработка методов электрофизиологической регистрации процессов, протекающих в отдельных нервных клетках, открыла путь для перехода от гипотез относительно механизмов в мозговой деятельности к прямому и точному изучению этих механизмов. Первоначально всестороннему анализу были подвергнуты процессы, протекающие лишь в некоторых избранных мозговых структурах; к таким относились в первую очередь двигательные нейроны спинного мозга, работа с которыми была более простой в методическом отношении. Однако методические затруднения были вскоре преодолены, а получаемые результаты оказались настолько важными, что быстро привлекли к себе мощные исследовательские силы в самых различных странах, мира. Благодаря этому новые принципы исследования мозговой деятельности стремительно распространились, и в настоящее время уже нет такого отдела мозга, функция которого не была бы подвергнута подробному анализу на клеточном уровне. Прогресс в направлении анализа нейрональных механизмов в свою очередь стимулировал появление новых методических подходов к изучению процессов объединения отдельных нейронов в системных функциях мозга, а также закономерностей передачи и преобразования информации в мозге как основе его интегративной деятельности.
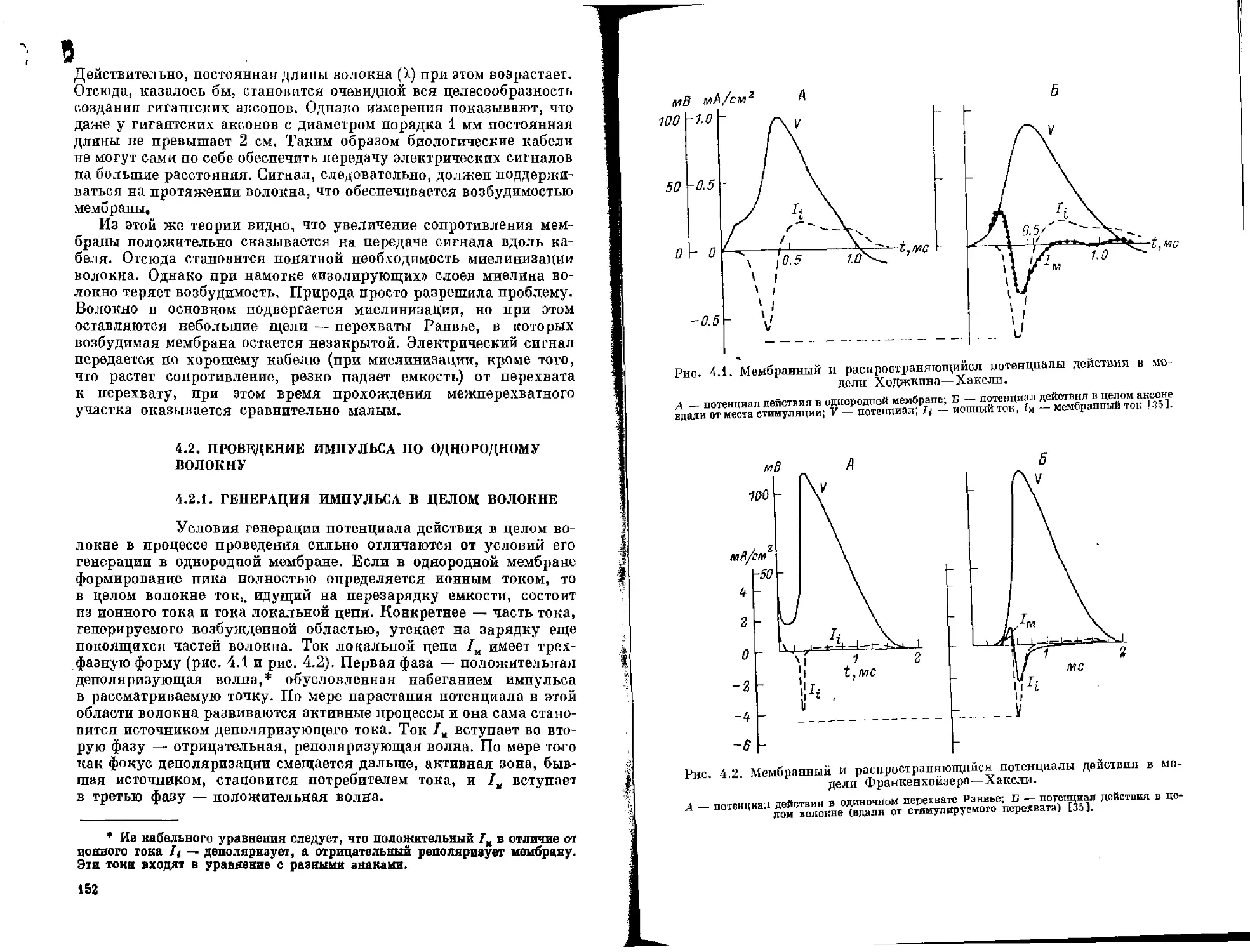
Такие методические успехи, достигнутые в относительно короткий срок, позволили сформулировать новые фундаментальные представления по целому ряду разделов нейрофизиологии. Так, благодаря широкому использованию в ней новых экспериментальных методов в сочетании с математическим и физическим модц: пированием в последние годы получены обстоятельные сведения 0 природе распространяющегося импульса. Точное измерение трансмембранных ионных токов, ставшее возможным благодаря методике фиксации напряжения на мембране, привело к созда-
яию представлений об ионных каналах как элементарных ячейках генерации возбудительного процесса. Важнейшую роль в разделении таких каналов сыграло обнаружение природных химических агентов, обладающих способностью исключительно специфически связываться с соответствующими мембранными структурами; благодаря изучению селективности каналов по отношению к различным неорганическим и органическим катионам стало возможно создание моделей их функциональной архитектоники.
Открытие воротных токов, а также исследование мембранньг шумов позволило перейти к прямому изучению тех группирово в структуре каналов, которые обеспечивают их открывание и закрывание в ответ на сдвиги мембранного потенциала.
Современные успехи в познании механизмов распространяющегося импульса первоначально были обязаны использованию для исследований уникального объекта — гигантских аксонов кальмара. Однако затем благодаря дальнейшему развитию микро-электродной техники и других методик регистрации мембранных токов начало быстро развиваться прямое изучение природы процесса возбуждения в различных структурах — соме нервной клетки, миелинизированных аксонах, нервных окончаниях. Эти работы, в частности, привели к обнаружению новых типов ионных каналов, играющих важнейшую роль в сопряжении мембранных и внутриклеточных процессов.
Столь же быстро произошло накопление новых фактических данных о природе синаптической передачи. Учение о химических медиаторах синаптической передачи стало обширным разделом физиологии нервной системы; получены фундаментальные сведения о механизмах выделения медиатора из специализированных пресинаптических структур, о взаимодействии медиатора с постсинаптическими группировками, предназначенными для «узнавания» медиаторных молекул. И в этой области огромную роль играет использование высокоспецифических нейротоксинов, столь избирательно и прочно связывающихся с хемочувствительными ионными каналами, что их оказывается возможным использовать в качестве инструментов для извлечения соответствующих молекулярных структур из клеточных мембран.
Быстрый прогресс в накоплении фундаментальных сведений относительно механизмов синаптической передачи одновременно ведет к быстрому упрочению теоретической основы современной нейрофармакологии и нейротоксикологии. Большую важность представляют также быстро развивающиеся исследования в области пластичности синаптической передачи, поскольку они открывают путь для проникновения в природу таких важнейших функций нервной системы, как память, обучение, адаптация и т. д.
Прочное установление положения о том, что как распространяющийся импульс, так и локальные синаптические процессы
являются мембранными феноменами, обусловленными наличием в этой поверхностной структуре специализированных высокомолекулярных компонентов, дало вместе с тем толчок к решению вопроса о соотношении между этими процессами и процессами обмена веществ. Была установлена связующая роль трансмембранных ионных градиентов, запасающих энергию обмена веществ в форме, которая может быть немедленно использована для генерации нервных процессов, и обнаружены конкретные биохимические механизмы, ответственные за создание таких градиентов. Выявление локализованных в поверхностной мембране ионакти-вируемых аденозинтрифосфатаз и прямое измерение создаваемых чротивоградиентных (активных) токов ионов сыграло важную золь для понимания энергетических основ основных нервных процессов.
Прямая регистрация активности нервных клеток привела к созданию возможностей для выяснения принципов использования основных нервных процессов в целях кодирования, передачи и переработки информации в нервной системе. В результате осуществления этих возможностей в последнее время стали ясны общие принципы пространственно-временного кодирования передаваемых сигналов, способы отбора значимой информации, механизмы контроля ее передачи и т. д. Наряду с установлением таких общих закономерностей подвергнуты подробному изучению специфические особенности информационных процессов в различных мозговых структурах.
До последнего времени представления о деятельности мозга базировались исключительно на нейронной доктрине; при этом фактически игнорировалось значение нейроглии в собственно нервной деятельности. Однако применение новой техники — электронной микроскопии, микроэлектродной регистрации потенциалов, микробиохимических методов — позволило за несколько последних лет получить достаточно данных о морфологических, электрофизиологических и биохимических свойствах нейроглии, чтобы существенно пересмотреть взгляд на ее роль в нервной деятельности. Теперь уже не вызывает сомнений ее роль в регуляции состава внутримозговой межклеточной среды, в процессе миелинизации, в генерации длительных колебаний электрических потенциалов мозга. Участие нейроглии в механизмах высших форм нервной деятельности и в ряде заболеваний центральной и периферической нервной системы представляется весьма вероятным. Многими исследователями мозг стал теперь рассматриваться как нейронно-глиальная система. В этой книге также подробно рассмотрены ионные основы мембранного потенциала глиальных клеток, механизм его изменений при нервной деятельности, электрическое взаимодействие между глиальными клетками,
Накопление новых фактических данных и гипотез в области нейрофизиологии происходит столь стремительно, что обзорные
и сводные работы оказываются устаревшими уже через несколько лет. В частности, далеко не отражающим современное состояние вопроса является и том по физиологии нервной системы, вышедший в составе многотомного «Руководства по физиологии» в 1969 г. Поэтому оказалось целесообразным подготовить новый том, специально посвященный вопросам общей физиологии нервной системы. Редакционная коллегия сочла необходимым разбить его на две части, первая из которых посвящена нервным клеткам и синапсам, а вторая — нейроглии.
По сравнению с предыдущим изданием в первой части настоящей книги подробно освещено современное состояние проблемы электрической возбудимости, в частности учение о потенциалозависимых ионных каналах; всесторонне представлены новейшие данные о химической и электрической синаптической передаче. Введены специальные разделы о нейрохимических основах памяти, об основных принципах передачи и переработки информации нервными клетками, а также о трофической функции последних.
Во второй части книги изложению физиологии нейроглии предпослана глава о ее морфологии, включающая данные о ее структуре, фило- и онтогенезе и миелинообразовании; без этих сведений понимание функционального взаимодействия нейронов и нейроглии было бы затруднительным.
Литература во всех главах настоящего тома представлена по возможности полно и включает источники, появившиеся до 1976 г.; кроме того, во всех главах даются ссылки на основные сводные работы, в которых можно найти недостающие источники. Редакторы тома и весь авторский коллектив будут весьма признательны за критические замечания по поводу композиции тома и содержания отдельных его глав.
Академик П. Г. Костюк Чл.-корр. АН СССР А. И. Ройтбак
Часть первая
НЕРВНЫЕ КЛЕТКИ II СИНАПСЫ
Глава 1
СТРУКТУРА НЕРВНОЙ КЛЕТКИ
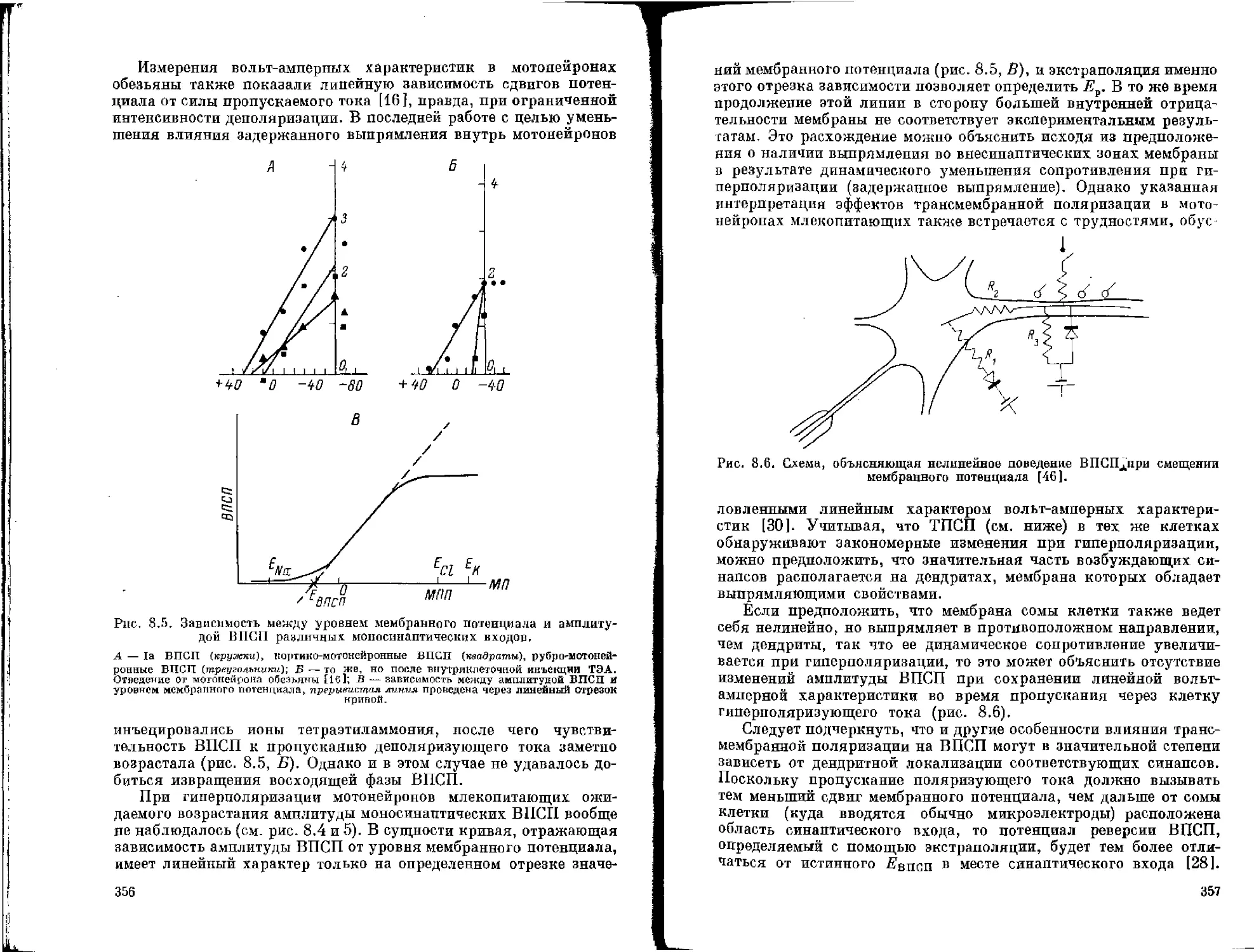
Нервные клетки чрезвычайно вариабельны по своему строению, и по существу нельзя в организме найти два совершенно одинаковых нейрона. Из всех клеток организма (эпителиальных, соединительнотканных и мышечных) нейроны обладают наиболее сложной структурой и функцией. До сих пор все попытки точно приурочить структуру нервных клеток к функции не увенчались успехом. В особой мере это относится к мелким нервным клеткам. В каждой из групп чувствительных, ассоциативных и двигательных нейронов имеется большое разнообразие форм, размеров тела клеток, величины и характера ветвления их отростков. Некоторое представление о различии нейронов в нервной системе млекопитающих дает схема (рис, 1.1 — см. вклейки).
1.1. ТЕЛО НЕЙРОНА
По форме тела различают пирамидные, многоугольные, круглые и овальные клетки. На основании количества отходящих от тела клетки отростков все нейроны подразделяют на муль-типолярные, биполярные и униполярные. Отростки могут отходить более или менее равномерно (радиально) от всей поверхности тела клетки, либо концентрированно от одного из полюсов. Мультиполярные нейроны наиболее вариабельны по форме и имеют по нескольку отростков. Общепринято считать, что один из них — аксон (нейрит), который может начинаться как от тела клетки, так и от проксимальной части одного из дендритов. Однако известно немало примеров клеток с несколькими аксонами [22, 35, 81 ]. От тела биполярной клетки отходят два отростка. Тот из них, который направляется на периферию, принято считать дендритом, а центральный отросток — аксоном. Тела униполярных нейронов имеют овальную форму. От тела клетки отходит один крупный отросток, который на некотором расстоянии делится на два более трнких отростка: периферический и центральный.
Согласно исследованиям А. А. Заварзина [12], форма клеточного тела целиком зависит от местоположения клетки в соответствующем органе нервной системы. Таким образом, совершенно одинаковые в функциональном отношении нервные клетки могут быть разными по форме.
Давно было замечено, что на форму нервных клеток могут оказывать влияние соседствующие с ними кровеносные сосуды, пучки волокон или даже отдельные миелинизированные волокна крупного диаметра. Прижизненные исследования убедительно свидетельствуют о легкой изменчивости формы нейронов под влиянием внешних воздействий. Из перечисленного явствует, что форме нейронов вряд ли можно придавать большое значение в их морфологической, да и функциональной характеристике
Размеры нервных клеток колеблются в широких пределах. У разных по высоте организации животных и даже у одной и той же особи можно наблюдать примеры как очень мелких, так и очень крупных клеток. Так, диаметр клеток-зерен коры мозжечка равен приблизительно 5 мкм, а у моторных клеток головного и спинного мозга он достигает 70 мкм и более. Клеточные тела нервных клеток брюхоногих моллюсков хорошо различимы простым глазом (500—900 мкм).
В нервной клетке существует прямая связь между массой сомы, величиной поверхности дендритов, калибром аксона, количеством коллатералей аксона и толщиной его миелинизированной оболочки. Было выяснено, например, что чем крупнее тела мотонейронов, тем длиннее у них аксон и больше дендритная поверхность нейрона. Нейроны коры головного мозга характеризуются значительной вариабельностью форм [20, 25, 59].
Форма нервных клеток несомненно определяется также комплексом их взаимосвязей с афферентными волокнами. Поэтому можно думать, что чем сложнее межнейронные связи каждого данного нейрона, тем сложнее его внешние очертания. Это положение находит отчетливое подкрепление в усложнении разветвлений дендритов и увеличении числа шипиков в онтогенезе. Хорошим примером сказанному служат богатые синаптическими контактами крупные и гигантские пирамидные клетки нижних слоев коры головного мозга.
Важным звеном в изучении отдельных форм нейронов является выяснение их количественных параметров. В работах большой группы нейроморфологов представлены фактические данные о количественной характеристике тел клеток, аксонов и дендритных разветвлений на разном удалении от тела клетки [7, 18, 25, 56,109,122,130,131,144,147,148]. Необходимо учитывать то обстоятельство, что определение истинных размеров тел нейронов или их отростков сопряжено с ошибками, возникающими из-за действия фиксирующих жидкостей на ткань и, кроме того, из-за фрагментарности гистологических картин.
Электронная микроскопия убедительно дока&ала, что Нервные клетки подобно всем другим клеткам отграничены сплошной плазматической мембраной от внешней среды. При больших увеличениях и достаточно высокой степени разрешения электронного микроскопа видно, что поверхностная плазматическая мембрана нейрона имеет трехслойную структуру. Из них два электронноплотных (белковых) слоя находятся по периферии, а третий (липидный, светлый) — внутри. Ширина каждого из слоев равна примерно 2 нм, а общая толщина мембраны — 6 нм [127].
CV На поверхности плазматической мембраны существуют внешние и внутренние примембранные слои [16]. Материал этих слоев слабо ассоциирован с гидрофобным остовом мембраны и часто теряется при химической фиксации мембран. Благодаря использованию физических методов фиксации авторам удалось выявить примембранные слои, которые по особенностям ультраструктуры и специфике химического состава, по-видимому, являются важной частью активно функционирующих биологических мембран.
При электронномикроскопическом изучении нейронов некоторые исследователи делили их на светлые и темные. Однако в последнее время было отмечено, что это деление, по-видимому, весьма условно, так как параллельно с улучшением техники фиксации материала стало уменьшаться количество выявленных темных клеток [2, 116]. Особенно это стало наглядно после того, как вместо фиксации материала способом погружения была применена перфузия по Палею в модификации Сотело [149].
Вполне возможно, что появление темных клеток на электроно-граммах обусловлено локальной гипоксией, так как в коре головного мозга они встречаются гораздо реже, чем, например, в глубоко расположенных структурах мозга [1 ].
1.1.1. ОРГАНЕЛЛЫ ЦИТОПЛАЗМЫ
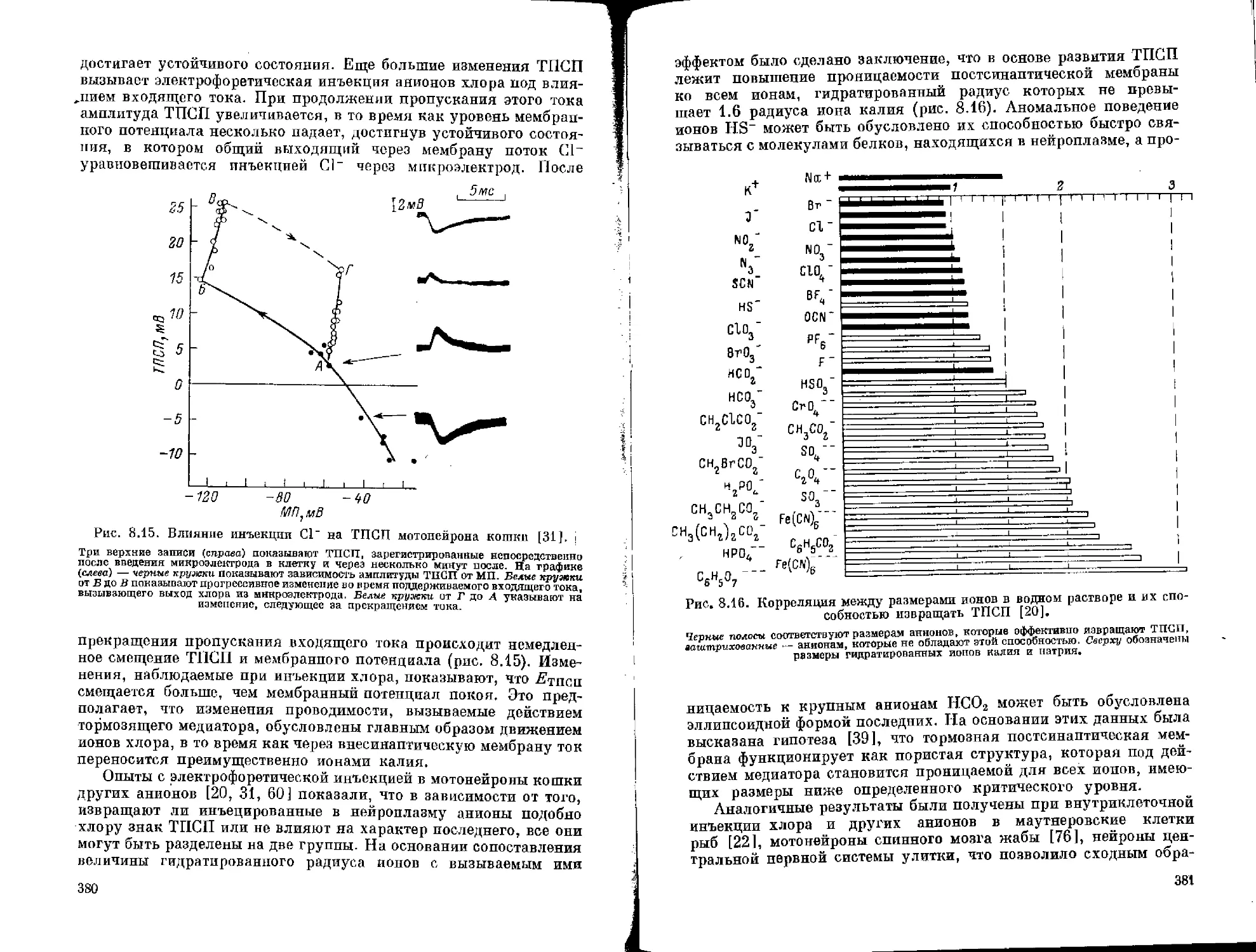
Вещество Ни сел я. Этот компонент цитоплазмы является определенным индикатором состояния нейрона, так как в физиологических экспериментах и в условиях патологии он значительно изменяется.
Гистохимическими методами исследований (окрашивание телец Ниссля пиронином и положительное действие на них РНазы) было доказано, что нисслевские тельца содержат большое количество РНК, которая состоит из четырех мононуклеотидов: аденин —19%, гуанин — 33%, цитозин — 27% и урацил —21% 162]. Количество РНК варьирует в зависимости от типа клеток и их размеров. Она присутствует в нисслевских тельцах нейронов как позвоночных, так и беспозвоночных.
В теле нейрона находятся самые большие скопления вещества иссля. Вокруг нисслевских телец группируются митохондрии. мв«аЯ<Д0М тельце наблюдается от 5 до 10 ориентированных при-рно параллельно друг другу цистерн гранулярного эндоплазма*
тичёского ретикулума. Пространство между цистернами занимают отдельные рибосомы. Нисслевское вещество встречается также в значительном количестве в проксимальных частях дендритов. Далее в дистальном направлении по этим отросткам глыбки уже не обнаруживаются, и, как показывает электронная микроскопия, здесь имеются только одиночные цистерны гранулярного эндоплазматического ретикулума.
При использовании раствора танина как дополнительного ингредиента фиксатора ткани для электронной микроскопии наиболее интенсивно, по нашим данным, окрашиваются проксимальные части дендритов. В небольшом количестве гранулы РНК были обнаружены также в аксонах и в синаптосомах [39, 72], что позволило предположить возможность синтеза белка в аксонах и их терминалях. За последнее время были получены прямые подтверждения этой гипотезы [69].
На электронномикроскопических снимках (рис, 1.2) видно, что тельца Ниссля не имеют четких границ и от скоплений цистерн гранулярного эндоплазматического ретикулума неравномерно отходят на различные расстояния отдельные фрагменты этой сети. Периферия одного тельца посредством тонких одиночных цистерн граничит с другим тельцем. Способствуют стиранию границ также свободно расположенные глыбки РНК. Вероятно, этими обстоятельствами объясняется нечеткость границ телец Ниссля при исследовании их с помощью толуидинового синего или крезилового фиолетового в световой микроскопии.
При больших увеличениях электронного микроскопа видно, что цистерны эндоплазматического ретикулума в местах скоплений располагаются почти параллельно друг другу на расстоянии 0.2—0.5 мкм, часто соединяясь между собой. В результате каждое тельце представляет собой губчатоподобную структуру, в которой преобладают ориентированные в одном направлении удлиненные ячейки. В стенках цистерн имеются поры. Просвет цистерн неравномерен, отчего на снимках видны места сужений и расширений их виутренних полостей.
Наружная поверхность мембран, ограничивающих цистерны эндоплазматического ретикулума, усеяна рибосомами. Иногда они тесно располагаются друг возле друга, образуя скопление, а нередко большой участок мембран совершенно лишен их.
Значительная часть рибосом лежит свободно в цитоплазматическом матриксе, образуя «полисомы» — скопления, состоящие из 5—6 рибосом, окружающих одну центральную. Соотношение связанных и свободных рибосом неодинаково в разных типах нейронов [151 ] и особенно в клетках разных тканей [125].
В целлюлефугальном направлении происходит замена гранулярного эндоплазматического ретикулума гладким. Постепенный переходный ряд между ними свидетельствует о том, что мембраны ретикулума с большим количеством рибосом и мембраны, лишенные их, не являются двумя разными типами эндоплазматической
сети как это предполагалось ранее, а представляет собой две крайние разновидности одной и той же цитоплазматической органеллы.
Непосредственно под плазматической мембраной перикариона или проксимальных частей дендритов обнаружены так называемые субповерхностные цистерны [137], которые представляют собой уплощенные образования с расширениями на концах.
Аппарат Гольджи (или комплекс Гольджи, или пластинчатый комплекс). На светооптическом уровне эта постоян-
ная органелла, присутствующая не только в нервных, но и в клетках других тканей, а также в растительных клетках, имеет вид рыхлой сети, которая охватывает со всех сторон ядро клетки. На срезах обычно видны кольцевидные или изогнутые фрагменты этой сети.
На электронномикроскопических снимках аппарат Гольджи представляет собой комплекс уплощенных цистерн и многочисленных пузырьков разного размера (рис. 1.3). Цистерны в количестве 5—7 тесно прилежат друг к другу. По ширине они превосходят цистерны телец Ниссля, а по длине короче их. Гранулярный материал на внешней поверхности цистерн аппарата Гольджи отсутствует. Благодаря этому признаку, а также наличию светлых расширений аппарат Гольджи легко идентифицировать на экране электронного микроскопа или на снимках. Цистерны часто сообщаются между собой, в результате чего образуется трехмерная сетчатая структура. Если принять во внимание, что весь аппарат имеет вид сжатой сети, окружающей ядро клетки, то станет ясной сложность конфигурации отдельных ее элементов.
По отношению к плоскости среза части аппарата Гольджи
почти всегда расположены в разных направлениях. В том случае если срез проходит по касательной к цистерне, то в ее стенке можно наблюдать поры, расположенные примерно на одинаковом расстоянии друг от друга. На поперечных срезах комплексы цистерн состоят из отдельных замкнутых фрагментов, имеющих неправильно округлую форму. Размер их варьирует от 20 до 100 нм и более. Мембрана пузырьков в большинстве случаев сходна с мембраной цистерн, но у части пузырьков она как бы покрыта тончайшим рыхлым слоем электронноплотного вещества, в котором различима поперечная исчерченность. После того как с помощью ультрацитохимических методов было обнаружено, что эти пузырьки содержат в большом количестве кислую фосфатазу, за ними закрепилось название первичных лизосом wo J. Вполне возможно, что эти пузырьки являются особой разновидностью везикул, объединяющихся с аппаратом Гольджи и участвующих в переносе гидролаз к мультивезикулярным тельцам или другим включениям цитоплазмы, могущим выполнять роль лизосом [113].
^Довольно часто среди везикул, тесно примыкающих к описываемому аппарату, находятся такие, которые весьма напоминают
крупные гранулярные синаптические пузырьки и значительно более крупные, овальные или чашевидные, которые сходны с лизосомами. В зоне аппарата Гольджи постоянно обнаруживаются также мультивезикулярные тела, митохондрии, микротрубочки и центриоли. Все это свидетельствует о тесной связи аппарата с другими органеллами перикариона нейрона и делает его границы до некоторой степени условными.
Мультивезикулярные тела. Обычно они располагаются поодиночке как в теле нейрона, так и в его отростках. Каждое мультивезикулярное тело окружено элементарной мембраной и содержит несколько округлых пузырьков, филаментозный и гранулярный материал, а также мембраноидные структуры. Матрикс, в котором заключены все эти элементы, варьирует от светлого, наиболее часто наблюдаемого, до темного. Сферическая форма мультивезикулярных тел и размеры 0.5 мкм мало подвержены изменениям. Отмечено только, что в случае близкого расположения тела к аппарату Гольджи его мембрана образует выпячивания к цистернам комплекса. Хотя прямых контактов между ними не наблюдали, сравнительно высокая частота их близкого взаиморасположения позволила предположить наличие функциональной связи между этими органеллами.
В свою очередь мультивезикулярные тела, по-видимому, связаны с ячеистыми и окаймленными пузырьками. Было показано, что после введения ферритина в спинальный ганглий взрослой жабы его частички поглощаются путем пиноцитоза нейронами и спустя некоторое время обнаруживаются внутри ячеистых везикул диаметром 100—150 нм, а затем изолируются в мультивезикулярных телах [138]. Было сделано предположение, что несколько ячеистых или окаймленных везикул [78], сливаясь вместе, могут образовывать мультивезикулярное тело. Мелкие ячеистые везикулы, как было отмечено выше, содержат гидролитические ферменты, которые они переносят от аппарата Гольджи к мультивезикулярным телам и, изливая в них свое содержимое, превращают мультивезикулярные тела в лизосомы.
Лизосомы. Гистохимические и ультрацитохимические исследования показали, что эти органеллы содержат в больших количествах кислую фосфатазу и другие гидролитические ферменты [63, 98]. Именно эти ферменты обеспечивают литическую функцию данных органелл. Размер их — на грани разрешающей способности светового микроскопа и варьирует от 0.1 до 0.3 мкм. По форме они представляются овальными или округлыми тельцами. В электронноплотном матриксе этих органелл встречаются гранулы разных размеров и плотности, свернутые мембраны, вакуоли; От окружающей цитоплазмы матрикс отделен однослойной элементарной мембраной. Чем моложе животное, тем более гомогенными выглядят лизосомы. В условиях патологии или в процессе старения лизосомы становятся все более гетерогенными и многие из них превращаются в липофусциновые гранулы.
Пигменты в нейронах. Меланин постоянно содержится в нейронах substantia nigra и locus coeruleus. Присутствие меланина описано в дорсальном ядре блуждающего нерва у макак [144], в ряде ядер ствола мозга и в симпатических нейронах. В глиальных клетках в условиях нормы меланин отсутствует.
Меланин содержит протеин (30%), липиды (1—5%). углеводы (5—10%), РНК (0.3%), железо, цинк, медь [144]. Форма и размеры меланинсодержащих гранул исключительно вариабельны. Окружены они всегда унифицированной мембраной и имеют электронноплотное содержимое. В тех клетках, где имеется меланин, мало или совершенно отсутствует липофусцин.
Липофусциновые гранулы, в отличие от меланина, начинают обнаруживаться в нейронах только с увеличением возраста животных или после перенесенных заболеваний. Липофусцин можно наблюдать в неокрашенных клетках в виде желтых или коричневых частиц. Следует отметить, во-первых, что липофусцин выявляется в некоторых отделах нервной системы, например в симпатических ганглиях, даже у зародышей. Во-вторых, в старческом возрасте не все нервные клетки содержат этот пигмент. Так, клетки Пуркинье почти полностью лишены его. То же характерно и для нейронов боковых рогов спинного мозга.
При электронномикроскопическом исследовании липофусциновые гранулы обнаруживаются прежде всего благодаря своей резкой осмиофилии. Форма и размеры их значительно варьируют, хотя чаще наблюдаются овальные образования диаметром около 1.5 мкм. Содержимое их составляют электронноплотные частицы, пластинки и вакуоли.
Митохондрии. Эти органеллы были наиболее полно изучены с помощью электронной микроскопии [101, 103, 1131. В соме нейронов они имеют вид овальных телец размером 0.5 X 0.2 мкм. Митохондрии ограничены трехслойной мембраной, состоящей из двух осмиофильных слоев и среднего светлого промежутка. Наружная и внутренняя мембраны значительно различаются по ультраструктуре и химизму. Внутри митохондрий располагаются кристы, образованные такими же унитарными мембранами и составляющие непрерывное продолжение наружных мембран.
Матрикс митохондрий описывают в виде гомогенного или мелкозернистого электронноплотного вещества. Просвет между кристами и наружной и внутренней мембранами составляет 6—10 нм. Электронная плотность вещества, содержащегося в просвете крист, выше внутренних мембран.
Число митохондрий в нейронах резко возрастает в условиях посттравматической регенерации отростков.
Микротрубочки и нейрофиламенты. Микротрубочки имеют вид длинных цилиндрических структур диаметром в среднем 24 нм. На поперечном срезе микротрубочки видна плотная стенка толщиной около 6 нм, окружающая более светлую сердцевину, в которой можно различить расположенную в центре
плотную точку, представляющую собой поперечно срезанную неравномерно утолщенную нить.
Микротрубочки состоят из 13 протрфиламентов с диаметром каждого из них около 5 нм. Было установлено, что по реакции на повреждающие воздействия микротрубочки делятся на лабильные и стабильные. Предполагается, что микротрубочки благодаря специфическим конформационным изменениям в молекулах тубулина активно вовлекаются в процесс передачи сенсорной информации [45, 164].. Диаметр нейрофиламентов почти в 3 раза меньше, чем микротрубочек и равен примерно 8 нм. На поперечных срезах они имеют более плотный наружный слой, построенный из глобулярных субъединиц, и светлую сердцевину. Нейрофила-- менты в нейронах беспозвоночных не обнаружены [110].
Глобулярные элементы, видимые па поперечных срезах микротрубочек, представляют собой поперечные срезы филаментов. Это было установлено рядом исследователей после механического разрушения ткани [87, 120] и действия низких температур [115].
Наружные поверхности микротрубочек и нейрофиламентов не гладкие, а содержат периодически повторяющиеся по их ходу '•небольшие сгущения рыхлого электронноплотного вещества, тонкие тяжи которого направляются к близлежащим структурам и соединяются с ними.
Другими цитоплазматическими компонентами нейронов являются реснички, центриоли и разного рода включения. Реснички описаны в нейронах разных отделов нервной системы и у разных по высоте организации животных. Встречаются они на электронномикроскопических снимках нейронов крайне редко, так как в клетке имеется только одна ресничка [93]. Ресничка представляет собою цилиндрическое образование диаметром около 0.1 мкм и длиною несколько микрон. Стенка реснички построена за счет :9 пар дуплетов микротрубочек, которые тесно прилежат друг к другу. Проксимальная часть этой органеллы в нейронах пуста, и поэтому набор микротрубочек здесь обозначают формулой «9+0». У основания ресничек находится базальное тельце, которое -состоит из 9 циркулярно расположенных триплетов микротрубочек. К нему прилежит парабазальное тельце, представляющее собой скопление небольшого количества электронноплотного вещества,..тесно примыкающего к короткой цилиндрической части базального тельца. Ресничка обычно связана с выростом по-. верхностной плазматической мембраны.
Центриоли. Они напоминают по строению базальные тельца ресничек, но не содержат парабазальных телец. Микротрубочки, входящие в их состав, сгруппированы в триплеты. .Располагаются центриоли глубже базальных телец и под прямым углом к ним. В тех случаях, когда в цитоплазме обнаруживаются ;.две центриоли, ресничка в нейроне отсутствует. Это дает основания предполагать, что одна из центриолей превращается в базаль-о'Нее телтще.
В цитоплазме нейронов встречаются, но, по-видимому непостоянно, включения, построенные из микротрубочек, слоистые образования, из нейрофиламентов филаментозные образования (рис. 1.6), а также ядрышкоподобные [146], лабиринтные и везикулярные тела [97]. Располагаются они в разных частях цитоплазмы в количестве 1—2 на нейрон. Размеры таких включений варьируют от долей мкм до 5—6 мкм. Форма их обычно неправильно округлая (рис. 1-4, Л,б).
1.1.2. ЯДРО НЕЙРОНА
Нервная клетка, как правило, содержит одно ядро, хотя в вегетативной нервной системе часты находки дву- или многоядерных (до 15) нейронов. С возрастом количество таких нейронов уменьшается. Некоторые исследователи склонны связывать наличие нескольких ядер в нейроне с возможностью деления нервных клеток [13]. У некоторых животных, например у кроликов, количество многоядерных нейронов в симпатических ганглиях остается значительным в течение всей жизни.
Уже светооптические методики позволили прийти к заключению, что ядра нейронов могут иметь глубокие складки. Электронная микроскопия в деталях представила эти картины. Оказалось, например, что ядра пирамидных клеток коры мозга закономерно имеют складки на одной из сторон, параллельных вертикальной оси клетки.
В ядре нейрона содержится ядрышко (см, ниже). Диаметр его довольно постоянен и равен примерно 4 мкм. Его размеры на фотографиях могут служить эталоном для суждения о величине исследуемых структур. Ядрышко у самок многих животных содержит на своей поверхности округлую массу гетерохроматина — сателлит ядрышка. Поскольку сателлиты имеются у самок и состоят из ДНК, считается, что они содержат Х-хромосомы. Для ядер некоторых крупных нейронов — клеток Пуркинье и пирамидных клеток гиппокампа — доказано, что они содержат двойное количество ДНК, т. е. являются тетраплоидными
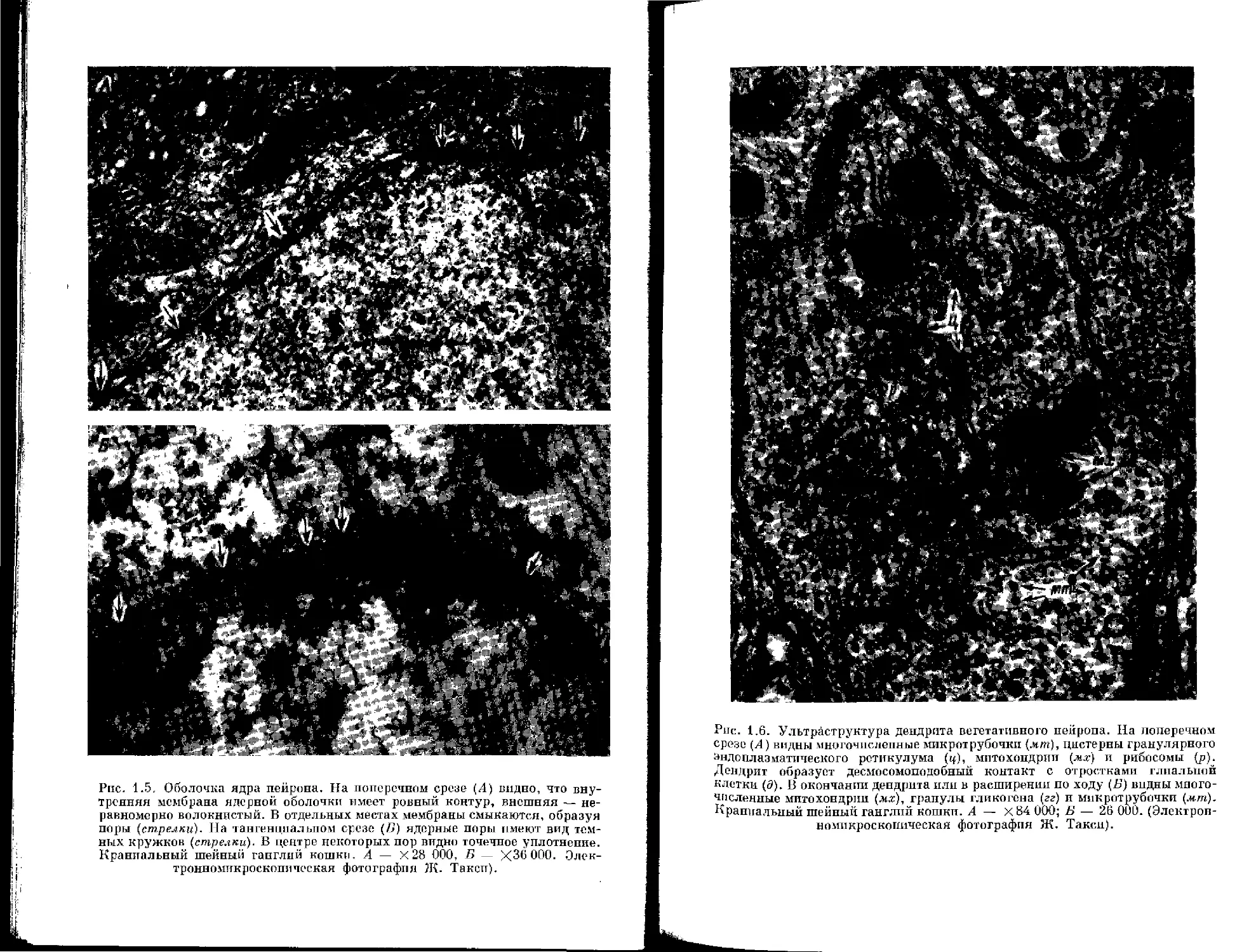
Ядерная оболочка состоит из трех основных элементов — внешней ядерной мембраны, внутренней ядерной мембраны и ядерных пор [36]. Внешняя и внутренняя мембраны в области пор сливаются друг с другом, и оболочка приобретает строение двухслойного мешка с порами (рис. 1.5). Пространство между мембранами называется перинуклеарным пространством или перинуклеарной цистерной. Ширина ее неравномерна, но большая часть составляет 20—30 нм. Мембраны унифицированного трехслойного строения. Внешняя мембрана не следует строго параллельно внутренней. Она может отходить на значительные расстояния от нее и сообщаться в перикарионе с эндоплазматическим ретикулу-
На этом основании некоторые исследователи считают, что
ядерная оболочка является специализированной частью эндоплазматического ретикулума, способствующего разграничению карио- и цитоплазмы [114].
В глубоко сегментированных ядрах вегетативных нейронов многолопастных ядрах у рыб значительно увеличивается поверхность ядра, что, но-видимому, способствует активации ядерно-цйтоплазматических отношений. Сходные картины обнаружены у некоторых водорослей [38], в гигантских нейронах тритонии [27 ] и в ядрах железистых клеток [159]. В экспериментах с электростимуляцией гигантских нейронов моллюсков наблюдалось параллельное увеличение синтеза РНК и появление дополнительных глубоких впячиваний ядерной оболочки [9 ].
Строение ядерных пор отличается большой сложностью, что получило отражение в их названии: цилиндрический комплекс пор, кольчато-поровый комплекс. Собственно, название поры в своем истинном значении совершенно неприемлемо, поскольку никакого открытого отверстия в оболочке на самом деле не существует и цитоплазма не может свободно сообщаться с внутриядерной средой. Согласно Новейшим данным, ядерную пору формируют внешняя и внутренняя мембраны, слившиеся между собой таким образом, что в ядерной оболочке образуется отверстие диаметром около 70 нм. Это отверстие заполнено структурами немембранной природы, которые и составляют комплекс поры. Основание поры заполнено аморфно-фибриллярным веществом, которое образует компактный слой толщиной около 10 нм. Некоторые исследователи называют его диафрагмой поры, отмечая ее разграничительную функцию цито- и кариоплазмы. Непосредственно возле диафрагмы располагаются глобулярные элементы диаметром около 10 нм [37, 77] или структуры фибриллярной природы [24, 61], направленные как в сторону ядра, так и в сторону цитоплазмы. Над внешней мембраной глобулярные субъединицы выступают в виде валика. На препаратах, приготовленных методом замораживания-травления, комплекс поры представляет собой скопление мелких гранул [112]. Ядерные поры окружены кольцевыми аннулярными структурами. Методом негативного контраста было показано, что поры на тангенциальных срезах восьмиугольных очертаний. Аннулярные структуры оказалось возможным отделить от наружной ядерной мембраны. Наружный диаметр аннулярной структуры — около 120 нм, а внутренний колеблется от 0 до 40 нм [79]. На тангенциальных срезах ядра комплексы пор располагаются по поверхности в гексагональном порядке; внутри каждой поры находится темное пятнышко размером около 20 нм. На поперечном срезе оболочки это пятнышко представляет собой утолщение мембраны, закрывающей пору. Непосредственно под этой мембраной располагается тончайшая волокнистая пластинка (zonula nucleum limitans) [154]. Предполагается, что эта структура выполняет механическую или сопутствующую функцию [75, 154].
В составе наружной мембраны ядра у основания Норы находятся короткие нити, направляющиеся из края поры в цитоплазму. По такому пути, по-видимому, возможно сообщение между содержимым ядра и цитоплазмой. Однако убедительных доказательств этому пока не получено. Количество ядерных пор на 1 мкм2 непостоянно и, кажется, зависит от уровня синтеза ДНК. Следовательно, на основании морфологической картины представляется дополнительная возможность наряду с показателями величины ядрышка в ядре судить об активности ядра. Иногда к комплексу поры — поросоме [361 близко прилежат гранулы РНК или фибриллы ДНК.
Кариоплазма. При исследовании ядра с помощью световой микроскопии о строении кариоплазмы можно было получить очень мало сведений, так как она либо слегка, либо вовсе не окрашивалась. При электронномикроскопических исследованиях ядра нейронов были обнаружены возле внутренней мембраны мелкие скопления хроматина. Они оказались прочно прикреплены к мембране, за исключением участков, занятых порами, и при центрифугировании до 150 тыс. g связь между ними не нарушалась. Хроматин состоит из гомогенного сплетения электронноплотных тяжей диаметром около 20 нм. На поперечных срезах они имеют просвет, а при наблюдении их в продольном направлении виден зубчатый контур и периодически повторяемая диагональная исчерченность, что позволяет сделать вывод о внутренней спиралевидной конструкции нитей хроматина. В ядрах крупных нейронов такие спиральные нити распределены более равномерно в кариоплазме, чем в мелких нервных клетках.
В кариоплазме виден очень рыхлый волокнистый матрикс, в котором изредка встречаются плотные гранулы размером около 22 нм. Так как эти гранулы обычно располагаются между хроматиновыми массами, их обозначают как интерхроматиновые частицы. Здесь же встречаются более крупные гранулы размером около 32 нм—перихроматиновые частицы [125 J.
Ядрышко. Среди структур ядра оно занимает место в метаболизме нейрона. Известно, например, что синтез РНК в ядрышке происходит в десятки раз интенсивнее, чем в цитоплазме. Это особенно наглядно видно при люминесцентной микроскопии нейрона. В нервных клетках человека имеется, как правило, только одно ядрышко, а у некоторых животных (крысы, мыши) их часто бывает два или даже больше. Добавочные ядрышки также фельгеннегативные, что отличает их от параяуклеолярных телец, содержащих ДНК. Электронная микроскопия показала, что основную массу ядрышка составляют плотные и интенсивно окрашивающиеся гранулы с диаметром около 17 нм и тончайшие филаменты, которые трудно различать из-за их низкой плотности и очень тесной упаковки. И гранулы, и филаменты, как показали Цитохимические исследования, состоят из РНК и перевариваются Рибонуклеазой [106].
2 Общая физиологии mpasot сиоМю* 17
Кроме того, й ядрышках наблюдается диффузная гомогенная часть — аморфное вещество с низкой электронной плотностью, состоящее из белка, — судя по тому, что оно подвержено хорошо заметному действию пепсина [65]. Все эти три составные части ядрышка могут занимать обособленные участки, что позволяет выделять соответственно гранулярную часть (pars granulosa), волокнистую (pars fibrosa) и аморфную (pars amorpha). Пространственная композиция этих основных компонентов ядрышка и дает весь ряд его структурных модификаций. Нередко эти части переплетены между собой, образуя узловатые и извитые тяжи. В составе этих тяжей отдельные компоненты из-за их плотной упаковки и значительной осмиофилии неразличимы. При альдегидных фиксациях вокруг ядрышка выявляется компактная масса околоядрышкового хроматина. Хотя ядрышко очень четко отделяется от цитоплазмы клетки, оболочка вокруг него отсутствует.
В ядре нервных клеток как с помощью световой, так и особенно электронной микроскопии описан ряд включений. К ним относятся филаментозные включения — длинный прямой пучок филаментов, поперечник которых равен 5—7 нм [93, 151 ]. Описано включение, напоминающее кристаллическую решетку 154], и включение, состоящее из пучка длинных параллельных микротрубочек, местами в сочетании с филаментами [151 ]. Возможно, что эти включения соответствуют тем внутриядерным структурам, которые описаны на светооптическом уровне [51].
1.2. ДЕНДРИТЫ
Накопленный к настоящему времени опыт изучения строения нервной ткани свидетельствует о том, что традиционное деление отростков нейронов на дендриты и нейриты возможно далеко не для всех категорий нейронов. Поэтому идентификация отростков с морфологической точки зрения нередко представляет весьма трудную, порой вообще неразрешимую задачу. До настоящего времени нет ни одного признака, основываясь на котором, можно было бы безошибочно отнести отростки многих нейронов к аксону или дендриту.
Для типичных дендритов и признаки:
Дендриты
От тела нейрона отходит несколько дендритов
Длина редко превышает 700 мкм
По мере удаления от тела клетки диаметр быстро уменьшается
Образовавшиеся в результате деления ветви локализуются возле тела
Имеют шипики
Не содержат синаптических пузырь-ков
аксонов характерны следующие
Аксоны
У нейрона имеется только один аксон
Длина может достигать 1 м
Диаметр сохраняется на значительном расстоянии
Терминали располагаются далеко от тела клетки
ПТипики отсутствуют
Содержат в большом числе синаптические пузырыш
Содержат рибосомы Рибосомы могут обнаруживаться в не-
значительном числе
Лишены миелиновой оболочки Часто окружены миелиновой оболочкой
Считается также, что дендриты гораздо чаще, чем аксоны, имеют бусинковидные расширения по ходу терминальных ветвей [46]. Конфигурация зоны ветвления у дендритов носит более четкий и постоянный характер, чем у аксонов [25].
Каждый из этих признаков, взятый отдельно, малодостоверен, но в совокупности они позволяют с известным приближением идентифицировать отростки нейронов.
За последнее время изучению строения дендритов было уделено много внимания, что нашло отражение в обширных обзорах [18, 25, 131].
Наиболее полные сведения о форме дендритов, способе их отхождения от тела клетки и делении на ветви дают методы Гольджи для нейронов ц. п. с. и окраска метиленовой синыо для вегетативных нейронов и нейронов беспозвоночных. Перспективным для этих целей становится пероксидазный метод [4, 59, 90, 105, 136]. Излюбленные места расположения цистерн гранулярного эндоплазматического ретикулума — расширения по ходу дендритов и внутренние углы в местах бифуркации дендритов. Наиболее распространенными структурами цитоплазмы стволов дендритов являются многочисленные микротрубочки (рис. 1. 6, Л), которые ориентированы вдоль длинной оси волокна. Особенно четко микротрубочки выступают на препаратах, фиксированных смесью глутаральдегида и танина. При атом также хороню окрашивается матрикс дендритов. Аксоны после такой фиксации выглядят более светлыми. Этот факт может служить дополнительным признаком для идентификации отростков нейронов.
Между микротрубочками могут располагаться нейрофиламенты, цистерны эндоплазматического ретикулума, мультивезикулярные тельца, пузырьки и митохондрии (рис. 1. 6, Б). В ветвях дендритов, отходящих от основного ствола, характер эндоплазматического ретикулума меняется. Группы цистерн встречаются редко, возле плазматической мембраны можно видеть лишь отдельные цистерны и лежащие возле них полисомы.
1.2.1. ШИПИКИ ДЕНДРИТОВ
Впервые они были описаны в конце прошлого столетия русскими морфологами [29—31]. В связи с интенсивным изучением рецепторной роли дендритов после почти полувекового забвения в 50-х годах вновь возрос интерес к шипикам. Окончательное признание шипики получили благодаря электронномикроскопическим исследованиям, с помощью которых в них был описан так называемый шипиковый аппарат, состоящий из вакуолей, разделенных электронноплотным веществом [82].
Они были изучены в фило- и онтогенетических аспектах, в разных отделах нервной системы и при разных состояниях организма [26, 91, 139, 145, 1621. Было показано, что шипик состоит из двух частей — ножки и головки. Вариации их размеров и формы определяют три разновидности шипиков: удлиненные, утолщенные и пальцевидные.
Шипики удлиненной формы характеризуются наиболее четко выраженным преобладанием длины (до 3 мкм) над шириной (ножка 0.5 мкм, головка 1 мкм). Ножка шипика в месте отхождения его от дендрита начинается с расширения, которое конусовидно сужается по мере удаления от своего основания. Достигнув минимальных размеров, ножка может начать булавовидно расширяться, образуя головку шипика. Минимальный диаметр ножки иногда сохраняется на расстоянии около 1 мкм, и только затем уже ножка переходит в головку шипика. Это место перехода иногда называют шейкой шипика. Наиболее отчетливо шипики удлиненной формы выявляются на препаратах, изготовленных по методу Гольджи—Бюбенет. Эта разновидность шипиков чаще других встречается в нервной системе. Наиболее характерны они для коры головного мозга и особенно для крупных дендритов пирамидных нейронов.
Для утолщенных шипиков характерно либо равное соотношение длины и ширины, либо даже преобладание ширины над длиной. Они примерно в два раза короче удлиненных шипиков и, следовательно, не превышают 1 мкм в длину. Встречаются такие шипики в несколько раз реже, чем предыдущие. В них шипиковый аппарат состоит из повышенного числа цистерн, иногда в одном шипике содержится два таких аппарата. Хотя митохондрии могут обнаруживаться во всех шипиках, здесь они встречаются явно чаще. Цитоплазма шипиков заполнена тонковолокнистым веществом, которое равномерно распределено от основания до вершины шипика. Синаптический контакт занимает почти всю поверхность головки шипика, достигая самой большой величины среди других разновидностей аксо-шипиковых контактов. Увеличение поверхности соединения может происходить за счет образования выпячиваний поверхности плазматической мембраны шипика [81.
Пальцевидные шипики напоминают первую разновидность. Среди них встречаются изогнутые и разветвленные формы, одиночные и групповые шипики. Последние чаще обнаруживаются па тонких ветвях дендритов в виде частокола [8]. С ними может формировать синаптические контакты одна и та же аксонная терминаль. Отличает их от других разновидностей шипиков отсутствие шипикового аппарата и крайне малая поверхность синаптического контакта.
При изучении шипиков было обнаружено, что в филогенетически молодых отделах нервной системы они представлены наиболее полно. На дендритах периферических вегетативных нейронов они отсутствуют. Вершины своего развития шипики достигают
у пирамидных нейронов коры головного мозга. Крупная пирамидная клетка содержит около 4 000 шипиков, которые занимают 43% общей поверхности тела и дендритов клетки. По плотности расположения шипиков на апикальном дендрите его можно подразделить на три части: начальную, занимающую зону до первых боковых ветвей ствола, среднюю — от места первого до последнего деления дендритов, и конечную, занимающую последнюю, уже неделящуюся ветвь отростка [111].
В начальной зоне дендрита шипики встречаются редко. Считается, что в процессе раннего онтогенеза они отступают от сомы нейрона [66]. Было установлено, что на апикальных дендритах пирамид V слоя сомато-сенсорной и лимбической коры эта зона изменяется в соответствии со становлением зрительной, слуховой и половой (для нейронов лимбической коры) функций.
В средней зоне дендрита общее число шипиков и их плотпость резко увеличиваются [162]. В конечной зоне дендритов количество шипиков вновь резко уменьшается, хотя плотность синапсов нарастает за счет появления их на стволах дендритов [32 ]. Поскольку шипики не всегда содержат шипиковый аппарат, а в мелких веточках дендритов обнаруживается мелкодисперсный матрикс и вакуоли, нет оснований для предположений о различиях в функции между сравниваемыми структурами.
г5"’Шипики оказались чрезвычайно лабильными структурами и в условиях повреждающих воздействий па организм первыми из всех элементов нейронов реагировали на них. После частичной деафферентации нейронов шипики подвергались резорбции в тех частях дендритов, куда поврежденные аксоны ранее приносили импульсы [33, 139, 157].
1,2.2. ЧУВСТВИТЕЛЬНЫЕ ОКОНЧАНИЯ (РЕЦЕПТОРЫ)
Эти приборы образованы терминалями дендритов чувствительных нейронов. Широко принято деление рецепторов на экстеро- и интерорецепторы. К первой группе относятся дистантные чувствительные приборы, строение которых очень сложно и рассматривается в специальных разделах морфологии и физиологии. Ко второй группе принадлежат чувствительные окончания внутренних органов. Построены все они за счет разветвлений дендритов чувствительных нейронов. Перед конечными разветвлениями миелинизированные волокна, образующие рецепторы, теряют миелиновую оболочку. На электронномикроскопических снимках видно, что отщепление миелиновых пластинок начинается с самой внутренней. Они последовательно заворачивают внутрь, образуя карманы, которые заполнены глиоплазмой шванновских клеток’[73].
В тканях внутренних органов широко распространены свободные рецепторы, у которых, в отличие от несвободных (инкап-
аудированных) рецепторов, конечные разветвления нервных волокон вступают в непосредственный контакт с иннервируемой ими тканью и свободно заканчиваются между эпителиальными, соединительнотканными или мышечными клетками. На светооптическом уровне терминали имеют вид копцевых утолщений или фибриллярных пластинок.
Свободные рецепторы нередко носят поливалентный характер, одновременно иннервируя различные ткани. Большинство свободных рецепторов построено за счет многочисленных разветвлений последовательно делящихся волокон. В более общем виде различают два вида чувствительных окончаний — диффузные и компактные. В свою очередь они делятся на рецепторы, имеющие в своем составе специальные клетки или лишенные их.
Диффузные окончания образованы миелинизированными волокнами диаметром 3—6 мкм и представлены древовидными формами с широким распространением ветвей. Такие окончания даже при малых увеличениях светового микроскопа занимают несколько полей зрения.
Волокно, формирующее диффузный рецептор, скупо ветвится на длинные тонкие терминалы, которые расходятся в разные стороны и постепенно закапчиваются свободно среди тканевых элементов. Все рецепторные волокна сопровождаются шванновскими клетками.
Компактные окончания выглядят кустиками или клубочками с ограниченным распространением ветвей (рис. 1. 7). Волокна, образующие подобные рецепторы, берут начало в интрамуральных нервных сплетениях, от которых затем могут уходить на значительные расстояния. Калибр этих волокоп достигает 6—8 мкм. Короткие претерминальные и терминальные ветви одного компактного рецептора могут заходить в зону ветвления другого рецептора, образуя так называемые рецепторные поля.
Описанию интерорецепторов посвящены многочисленные морфологические работы, среди которых следует отметить фундаментальные исследования Лаврентьева 1191, Колосова [14], Жаботин-ского [11], Хабаровой [34].
При электронномикроскопическом изучении эпителия были обнаружены свободные чувствительные окончания, которые имели вид расширенных терминалей дендритов, переполненных митохондриями [55]. Однако сходные образования были расценены некоторыми исследователями как растущие дендриты [151 ]. Последнюю точку зрения подкрепляет то, что заполненные митохондриями профили наблюдаются в ц. н. с. новорожденных животных, и на них обнаруживаются синаптические окончания. Кроме того, вокруг описываемых дендритических расширений часто располагаются глиальные элементы. Вполне возможно, что ультраструктура рецепторных терминалей дендритов и растущих дендритов (например, при спонтанной регенерации отростков) до некоторой стецеци сходна.
1.2.3. СТРУКТУРНЫЕ ОБЪЕДИНЕНИЯ ДЕНДРИТОВ
Дендриты могут объединяться в сложные агрегаты: гломерулы и пучки.
Гломерулы наиболее характерны для экстрамуральных ганглиев вегетативной нервной системы [15, 53]. Они могут быть образованы дендритами одной и той же нервной клетки или дендритами разных клеток. Переплетающиеся ветви дендритов и их терминалей образуют сложный клубок, в котором обнаруживается большое число синаптических окончаний приходящих сюда аксонов. Дендриты могут формировать специализированные дендро-дендритические контакты [2]. Гломерулы несколько иного строения описаны в коре мозжечка, в наружном коленчатом теле и в обонятельной луковице [155, 157].
Пучки дендритов встречаются в разных отделах нервной системы [141, 142]. В вегетативных ганглиях, например в пучках дендритов, окутанных шванновской глией, находится основная масса аксодендритических синаптических контактов.
Апикальные дендриты пирамидных нейронов образуют в коре головного мозга вертикально ориентированные пучки. Расстояние между отдельными пучками равно в среднем 50 мкм. Дендриты в пучках берут начало от средних и крупных пирамид V слоя. По мере восхождения они приближаются друг к другу, и если в проксимальных участках отстоят на расстоянии 5—10 мкм, то в. более дистальных отделах нередко контактируют между собой. На полутонких (3 мкм толщиной) тангенциальных срезах слоя V видно, что поперечно срезанные дендриты в пучках имеют диаметр от 4 до 6 мкм, в то время как на срезах слоя III их диаметр колеблется от 2 до 3 мкм. Пучки апикальных дендритов, вероятно, не обладают строго однотипной конструкцией.
Вертикальные пучки дендритов описаны в разных областях коры мозга крысы, кролика, кошки, обезьяны и человека [3, 76, 108, 126], что позволяет считать подобную форму организации структурных элементов типичной для коры головного мозга млекопитающих.
Если дендритические пучки являются компонентами объединения нейронов в единый морфофункциональный модуль, то каждый из таковых, по-видимому, может дать несколько пучков, которые должны быть связаны друг с другом, а также с телами нейронов определенной системой аксонов. Объединение нейронов в комплексы по вертикали может быть осуществлено возвратными коллатералями аксонов интракортикальных нейронов, в то время как проекционные афференты могут объединять отдельные нейронные модули между собой. В объединениях нейронов с помощью пучков апикальных или базальных дендритов создаются исключительно благоприятные условия как для дивергенции импульсов, когда одно афферентное волокно формирует несколько синаптических контактов с разными дендритами, так и для их конверген-
Цйи h tex случаях, когда на дендритах заканчиваются айсонЬц приходящие от разных источников. В обоих случаях аксонная терминаль, приходящая в пучок дендритов, будет объединять в одну систему нейроны, которым принадлежат данные дендриты. Аксоны в ц. н. с. позвоночных сопровождаются миелиновой оболочкой в большинстве случаев почти до терминалей — таким образом, объединения дендритов в пучки благоприятствуют формированию синаптических контактов по ходу немиелинизированного аксонного окончания.
Вертикальная ориентация нейронных элементов коры мозга — и прежде всего апикальных дендритов пирамидных клеток и их нисходящих аксонов — является основной предпосылкой для формирования нейронных объединений типа колонок или цилиндров 1104]. В вертикальных пучках дендритов предполагается существование специфических условий для протекания ионнообменных процессов [142]. Наличие же десмосомоподобных контактов между дендритами в этих пучках заставляет допускать существование электротонических взаимоотношений, обеспечивающих синхронизацию в работе нейронов в составе такой вертикальной колонки.
1.3. АКСОН (НЕЙРИТ)
Наиболее общее представление о строении аксона можно получить, исследуя нейроны, окрашенные по методу Гольджи. Однако покрытые миелином части аксона плохо поддаются окраске, поэтому рекомендуется брать для исследования материал от новорожденных животных. Их аксоны лишены миелиновой оболочки. При этом следует иметь в виду, что терминальные части аксонов молодых организмов еще полностью не сформировались. Большие возможности для изучения аксонов открывает метод внутриклеточного окрашивания нейронов пероксидазой хрена [59].
У мультиполярных нейронов аксон начинается обычно от тел; клетки, но может отходить и от дендрита. Диаметр аксона нахо дится в прямой зависимости от размера тела клетки и, по-види мому, коррелирует с физиологическими свойствами нейрона. Так, например, чем больше скорость проведения импульсов к аксону, тем больше его диаметр. Наиболее отчетливо эта связь зидна на примере крупных моторных и крупных чувствительных клеток, связанных со стереогнозом. Аксоны, связанные с проведением менее точной чувствительности, как например боль, имеют меныпий диаметр и меныпую скорость проведения импульсов. Соответственно тела таких чувствительных клеток должны быть самыми мелкими в ганглиях.
Общепринято подразделение аксонов на три категории: А, В и С. Волокна группы А и В миелинизированы, а С — лишены миелиновой оболочки. Диаметр волокон группы А, которые составляют большинство коммуникаций ц. и. с., варьирует от 1 до 24
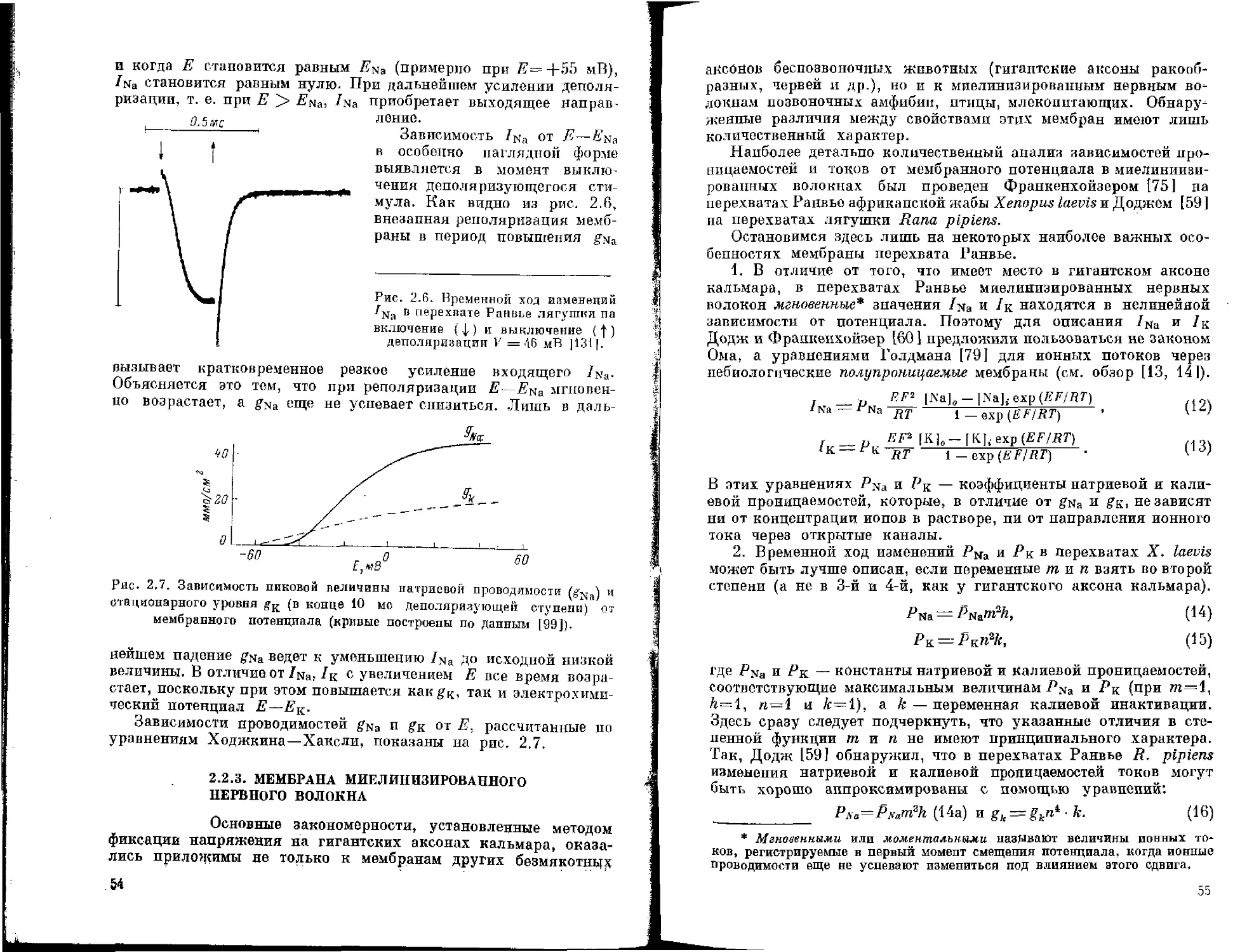
16 мкм, а скорость проведения импульсов равна их диаметру, помноженному на 6. В-волокна характерны для преганглионар-пых аксонов вегетативной нервной системы. Диаметр С-волокна от 0.3 до 1.3 мкм, и скорость проведения импульсов в них несколько меньше величины диаметра, умноженного на 2. В миелинизированных аксонах скорость проведения импульсов выше, чем в немиелинизированных.
Для того чтобы проследить распространение аксонов данной группы нейронов на значительном расстоянии, используют методы повреждения нейронов с последующим обнаружением дегенерирующих аксонов или их терминалей (методы Финка—Хаймера, Наута). С этой же целью применяются методы, основанные па ауторадиографическом исследовании распространения с током аксоплазмы меченых аминокислот, на окрашивании аксонов кобальтом, введенным путем ионтофореза, на ретроградном транспорте экзогенного фермента — пероксидазы хрена 199, 100, 105, 136, 1611. О распространении аксонов и месте локализации их окончаний можно также судить по транснейрональным изменениям деафферентированных нейронов [43, 80].
Аксоплазма. У крупных нервных клеток ей принадлежит около 99% всей цитоплазмы нейрона [116]. Эта цифра становится понятной, если учесть, что длина аксона и его коллатералей может достигать сотен тысяч микрон. Цитоплазма аксонов содержит микротрубочки, нейрофиламенты, митохондрии, агранулярный эндоплазматический ретикулум, везикулы и мультивезикулярные тела. В разных частях аксона существенно меняются количественные отношения между этими элементами. По ходу аксона изменяется также их топографическая специфика. В крупных аксонах, например, нейрофиламенты количественно преобладают над микротрубочками. В тонких аксонах соотношение между ними выравнивается, а в тончайших немиелинизированных волокнах нейрофиламенты почти совсем исчезают и, как правило, выявляются только одни микротрубочки.
Агранулярный эндоплазматический ретикулум на ультра-тонких срезах аксона имеет вид неправильной формы и различных размеров везикул, трубочек и цистерн, которые обычно располагаются параллельно его длиннику. В редких случаях цистерны эндоплазматического ретикулума могут быть ориентированы в поперечном к оси волокна направлении, что придает таким аксонам поперечную исчерченность.
Аксолемма. В пору спора о реальности ее существования наиболее положительные факты и прозорливые догадки о тонком строении аксолеммы высказал Рамон-и-Кахаль [52]. Бесспорные доказательства существования оболочки у аксонов как миелинизированных, так и немиелинизированных были получены только с помощью электронномикроскопических исследований.
После фиксации материала в четырехокиси осмия аксолемма наблюдается в виде трехслойной мембраны толщиной около 7 нм.
После двойной фиксации (глутаральдегид-[-осмиевая кислота) мембрана приобретает асимметричный вид, так как ее наружный слой окрашивается более интенсивно, чем внутренний,
В зоне синаптического контакта мембрана аксона получает ряд дополнительных цитоплазматических элементов в зависимости от того, выполняет ли она здесь роль передающей или воспринимающей части соединения {плотные выступы, ленты, субсинаптическая сеть и др.)- В электрических синапсах наблюдается полное слияние мембран и превращение двух З-слойных мембран в одну 5-слойную. В области перехвата Ранвье аксон обнажен и в его цитоплазме лежит слой электронноплотного вещества, сливающийся с аксолеммой. В паранодальной области (в зоне, пограничной с перехватом Ранвье) аксолемма тесно смыкается с мембраной внутренней поверхности миелиновой оболочки, образуя ряд следующих друг за другом колец, расположенных под прямым углом к длинной оси нервного волокна. На продольных срезах аксолемма приобретает вид серии колец, охватывающих аксон.
Аксонный холмик. Топографически его можно определить как участок аксона от его начала до того места, где наступает сужение аксонного холмика до диаметра аксона. От этого места и до появления миелиновой оболочки простирается начальный сегмент аксона. В немиелинизиров энных аксонах эта часть волокна определяется с трудом, а некоторые авторы считают, что начальный сегмент присущ только тем аксонам, которые покрываются миелиновой оболочкой. Он отсутствует, например, у клеток Пуркинье в мозжечке [145].
В месте перехода аксонного холмика в начальный сегмент аксона под аксолеммой появляется характерный электронноплотный слой, состоящий из гранул и фибрилл, толщиной 15 нм [116, 117]. Этот слой не связан с плазматической мембраной, а отделен от нее промежутками примерно 8 нм. Сходный слой электронноплотного вещества, расположенного в непосредственной близости к внутренней поверхности плазматической мембраны, обнаруживается также в зоне перехвата Ранвье. И оба они напоминают скопление электронноплотного вещества цитоплазмы нейронов в постсинапсах. Однако плотный слой начального сегмента аксона прерывается в местах синаптических соединений, т. е. па участках, соответствующих постсинаптическим мембранам [125].
В начальном сегменте резко уменьшается количество рибосом. Остальные компоненты цитоплазмы начального сегмента — нейрофиламенты, митохондрии, везикулы — переходят из аксонного холмика сюда, не изменяясь ни по внешнему виду, ни по взаиморасположению. На начальном сегменте аксона описаны аксо-аксоналвдые синапсы [116, 122, 163].
Часть аксона, покрытая миелиновой оболочкой, обладает только ей присущими функциональными свойствами, которые связаны с проведением нервных импульсов с большой скоростью и без декремента на значительные расстояния. Проксимальной 36
границей у миелинизированного аксона служит начало миелиновой оболочки, а дистальной — утрата ее. Далее следуют более или менее длинные терминальные отделы аксона.
В аксоплазме описываемой части аксона отсутствует гранулярный эндоплазматический ретикулум и очень редко (скорее в виде исключения) встречаются рибосомы. Как в центральных отделах нервной системы, так и на периферии аксоны окружены отростками глиальных клеток. Крупные аксоны окружены многими слоями, а мелкие — одним-двумя. Шванновские клетки продуцируют миелин, который входит составным элементом в оболочку миелинизированного аксона.
Миелиновая оболочка. Она импрегнируется осмием по методу Марки в светло-коричневый, а по методу Вайгерта и его модификациям в интенсивно-синий цвет. Между толщиной миелиновой оболочки, которая варьирует от долей до 10 мкм и более, и скоростью проведения импульсов по аксону есть прямая зависимость.
При электропномикроскопическом исследовании было показано, что миелиновая оболочка имеет сложное строение. Каждая из концентрически расположенных пластинок состоит из 5 слоев — двух наружных плотных, образующих главную плотную линию, и двух светлых бимолекулярных слоев липидов, разделенных промежуточной осмиофильной линией. Промежуточная линия представляет собой соединение наружных поверхностей плазматических мембран шванновской, или глиальной клетки. Построена она из двух тонких линий, разделенных промежутком, примерно равным 2 нм. Коллоидные соли лантана в эксперименте заполняют это щелевидное пространство, расширяя его [134]. Каждый аксон сопровождается большим числом шванновских клеток. Место, где шванновские клетки граничат между собой, лишено миелина и называется перехватом Ранвье.
Перехваты Ранвье составляют сложную структуру миелинизированных волокон и играют важную функциональную роль в проведении нервного возбуждения. Возле перехвата Ранвье пластинки, составляющие миелиновый сегмент, отслаиваются и направляются к аксону, оканчиваясь в так называемой паранодаль-ной области.
Первыми отщепляются пластинки, лежащие ближе к аксону (и они, следовательно, заканчиваются дальше всех от нодаль-ной зоны), затем те, которые лежат кнаружи от них. Когда пластинки оканчиваются, главная плотная линия миелиновой оболочки расщепляется на свои первичные составные части и образует пространство, вмещающее цитоплазму, по-видимому, шванновской клетки. В ней обнаружены микротрубочки, пузырьки, а также плотные частицы, линейно ориентированные по отношению к аксолемме. В паранодальной области происходит сужение (до 3 нм) пространства, разделяющего аксолемму и мембрану, покрывающую внутреннюю сторону миелиновой оболочки [62 [.
Протяженность перехвата Ранвье миелинизированных аксонов периферических нервов находится в пределах 0.4—0.8 мкм, в ц. н. с. перхват Ранвье достигает 14 мкм. Длина перехватов довольно легко изменяется под действием различных веществ [281. В области перехватов, помимо отсутствия миелиновой оболочки, наблюдаются значительные изменения структуры нервного волокна. Диаметр крупных аксонов, например, уменьшается наполовину, мелкие аксоны изменяются меньше. Аксолемма имеет обычно неправильные контуры, и под пей лежит слой электронно-плотного материала. В перехвате Ранвье могут быть синаптические контакты как с прилежащими к аксону дендритами (аксоден-дритические), так и с другими аксонами [42, 50, 96]. Это важное обстоятельство должно учитываться в физиологических экспериментах, поскольку передача нервных влияний на другие структуры может происходить по ходу аксона в участках, расположенных далеко от окончания данного аксона.
В интернодальных участках миелиновой оболочки периферических нервов с помощью световой микроскопии можно обнаружить насечки Шмидта—Лантермана, имеющие вид воронкообразных щелей, косо направленных под углом 10—12° к оси волокна. В аксонах ц. н. с. эти насечки не обнаружены. Функциональное значение этих образований неизвестно. Предполагается, что они играют механическую роль противодействия торзионным воздействиям на миелиновую оболочку периферических нервов.
При электронномикроскопическом изучении насечек уже первыми исследователями [135] было установлено, что, во-первых, они не являются артефактами фиксации, о чем в течение долгого времени шел спор и, во-вторых, что они представляют собой участки оболочки, в которых пластинки резко изогнуты и расщеплены вдоль главной плотной линии. В местах расщеплений находится цитоплазма шванновских клеток.
1.3.1. КОЛЛАТЕРАЛИ АКСОНОВ
С помощью коллатералей происходит распространение нервных импульсов на большее или меньшее число последующих нейронов.
Аксоны могут делиться дихотомически, как например у зернистых клеток мозжечка. Очень часто встречается магистральный тип ветвления аксонов (пирамидные клетки коры мозга, корзинчатые клетки мозжечка). Коллатерали пирамидных нейронов могут быть возвратными, косоидущими и горизонтальными. Горизонтальные ответвления пирамид простираются иногда на 1—2 мм, объединяя пирамидные и звездчатые нейроны своего слоя. От горизонтально распространяющегося (в поперечном направлении к длинной оси извилины мозга) аксона корзинчатой клетки образуются многочисленные коллатерали, которые заканчиваются сплетениями на телах крупных пирамидных клеток. Подобные 28
аппараты, так же как и окончания на клетках Рэншоу, являются субстратом для осуществления процессов торможения.
Коллатерали аксонов могут служить источником образования замкнутых нейронных цепей. Так, в коре больших полушарий все пирамидные нейроны имеют коллатерали, которые принимают участие во внутрикорковых связях [21, 153]. За счет существования коллатералей обеспечивается в процессе ретроградной дегенерации сохранность нейрона в том случае, если повреждается основная ветвь его аксона [33].
1.3.2. ТЕРМИНАЛИ АКСОНОВ
К терминалям относятся участки аксонов, расположенные дистальнее их последнего деления. Они лишены миелиновой оболочки. Протяженность терминалей значительно варьирует. На светооптическом уровне показано, что терминали могут быть либо одиночными и иметь форму булавы, сетевидной пластинки, колечка, либо — множественными и походить на кисть, чашевидную, моховидную структуры [47]. Размер всех этих образований варьирует от 0.5 до 5 мкм и больше.
Тонкие разветвления аксонов нередко в местах контакта с другими нервными элементами имеют веретеновидные или бусинковидные расширения. Как показали электронномикроскопические наблюдения, именно в этих участках имеются синаптические соединения [2, 72]. Одна и та же терминаль в касательных синапсах дает возможность одному аксону установить контакт с множеством нейронов (например, параллельные волокна в коре головного мозга).
1.4. СИНАПСЫ
Важное значение этих образований в нервной системе привлекло внимание большого числа исследователей. Только за последние годы появилось несколько обширных обзоров, в которых суммируются итоги изучения структуры синапсов [1, 18, 40, 43, 48, 118, 125, 145]. К настоящему времени стало очевидным, что имеются две группы синапсов: химические и электрические (см. главы 7—9).
1.4.1. ХИМИЧЕСКИЕ СИНАПСЫ
Подавляющее большинство синапсов в нервной системе как позвоночных, так и беспозвоночных животных относится к химическим синапсам. В составе синапса имеются две контактирующие части: 1) передающая, представленная окончанием аксона (пресинаптическая); 2) рецепторная, представляющая специфически дифференцированный участок дендрита, тела нейрона или его аксона (постсинаптическая). Обе части контакта разделены синаптической щелью.
Пресинаптическая часть. Электронномикроско пическое изучение синапсов показало, что в его передающей части находится наибольшее число ультраструктурных элементов (прежде всего синаптических пузырьков и митохондрий), анализ которых позволяет выявить характерные особенности контакта.
Для многих отделов нервной системы установлена специфика состава синаптических пузырьков в аксонных терминалях, что позволяет установить источник происхождения и природу аксонов [155, 156].
Вопрос об особенностях строения синаптических пузырьков приобрел определяющее значение для построения общих схем организации нервной системы, и поэтому их изучение в последние годы было в центре внимания морфологов, биохимиков и физиологов [4, 8, 40, 44, 64J. Главным признаком, на основании которого можно сгруппировать и классифицировать везикулы, является их внутреннее строение. Основываясь на нем, все везикулы можно подразделить на две большие группы: агранулярные (светлые пузырьки) и гранулярные (плотные пузырьки).
Агранулярные пузырьки в нервных волокнах, фиксированных четырехокисыо или глутаральдегидом и четырехокисью осмия, бывают четырех видов: круглые, овальные, плеоморфные и сложные. Однако имеются сведения о том, что степень уплощения пу-зурьков зависит от метода обработки материала [116, 125, 163].
Гранулярные везикулы в среднем более крупные, чем агранулярные пузырьки. В зависимости от формы и степени осмиофилии центральной гранулы их можно подразделить на три группы: крупногранулярные с гомогенной и гетерогенной гранулой (60— 120 и 80—200 нм) и мелкогранулярные. Гранула в крупных везикулах занимает почти весь просвет пузырька. В везикулах размером 80—200 нм между оболочкой пузырька и гранулой остается светлый участок в виде кольца. Подобные пузырьки описаны в пуринергических синапсах позвоночных [50]. Мелкогранулярные везикулы являются обязательно составной частью аксонов, иннервирующих гладкую мускулатуру внутренних органов.
Митохондриям в синаптической области в настоящее время уделяется особое внимание, так как установлено, что они осуществляют энергетическое обеспечение синтеза ряда медиаторов. В аксонных терминалях митохондрии не ориентированы. Здесь чаще, чем в аксонах, встречаются сферические формы митохондрий размером 0.3—0.5 мкм. Число их широко варьирует, достигая иногда в крупных терминалях нескольких десятков (рис. 1. 8). Обращают на себя внимание частые случаи обнаружения этих органелл в непосредственной близости к активной зоне пресинаптической части 12, 8, 32].
Микротрубочки в пресинаптической части касательных синапсов проходят в непосредственной близости от активной зоны контакта (рис. 1. 9). В аксонах с поперечно ориентированным эндоплазматическим ретикулумом микротрубочки пронизывают 30
его цистерны через имеющиеся там поры. Именно в этих аксонах наиболее отчетливо удалось наблюдать, что наружная поверхность стенок микротрубочек содержит филаментозный материал, который связывает их друг с другом, с митохондриями, плазматической мембраной или цистернами эндоплазматического ретикулума.
Миелиновая оболочка сопровождает аксон непосредственно до его пресинаптической части (см. рис. 1. 9). Лишенная миелина терминаль иногда простирается по крайней мере на несколько микрон, образуя по своему ходу синаптические контакты с дендритами, телами нейронов и аксонами.
С пресинаптической мембраной тесно связаны так называемые плотные выступы, высота которых достигает 60 пм, ширина — 50 пм и расстояние друг от друга — 100 нм 140, 85]. Эти образования располагаются на пересечениях гексагональных фигур. После обработки материала фосфорно-вольфрамовой кислотой выступы выявляются лучше, чем после других видов фиксации. В материале, фиксированном только глутаральдегидом, в коре мозга крыс была обнаружена тончайшая пресинаптическая сеть [92]. Диаметр ее ячеек составляет примерно 30 нм. Дистальные участки пресинаптической сети связаны с вершинами плотных выступов. В пресинапсах рецепторных клеток позвоночных, так же как и во многих синапсах у беспозвоночных, обнаружены пресинаптические ленты (ribbons), которые представляют собою электронноплотные тяжи длиной 0.3 мкм и шириной 4 нм. Лента может быть по-разному ориентированной по отношению к пресинаптической мембране. Вокруг нее концентрируются синаптические пузырьки.
Синаптическая щель. Ширина ее равна примерно 20 нм. Многими авторами неоднократно отмечалось наличие в синаптической щели электронноплотного вещества. Описывалось оно то в виде ориентированной в продольном направлении мелкозернистой осмиофильной полоски [85], то в виде мостиков, соединяющих обе синаптические мембраны [43]. Была высказана мысль, что эти межламинарные элементы обеспечивают не только механическую связь между мембранами, но и содержат ацетилхолин-эстеразу или другие энзимы. Обнаружено присутствие ацетил-холинэстеразы в межсинаптических органеллах [94]. Иногда осмиофильные нити, пересекающие синаптическую щель, не достигают противоположной (чаще пресинаптической) мембраны и закапчиваются на полпути небольшими утолщениями (см. рис. 1. 9).
Между пре- и постсинаптическими мембранами описаны места сужений до 4—6 нм, называемые gap junctions [49, 150], и полное слияние мембран — tight junctions [43, 125]. В настоящее время стало очевидно, что в последнем типе контактов имеет место электрическая передача импульсов (см. ниже).
Постсинаптическая часть. Сведения о строении постсинаптической части синапса являются самыми новыми в уче-
НИИ о синапсах. Техника световой микроскопии не позволяла изучать рецепторную площадку синаптического соединения.
В участке цитоплазмы, непосредственно прилежащей к постсинаптической мембране, с помощью электронной микроскопии описано несколько дифференцированных структур. Это прежде всего субсинаптическая сеть (рис. 1.10, Л) [41], затем субсинаптические мешочки, или субсинаптические цистерны [82, 881. В дендритических шипиках нейронов мозга млекопитающих обнаружен шипиковый аппарат [86]. В постсинаптической цитоплазме нейронов вегетативной нервной системы амфибий описана субсинапти-ческая полоска [160].
Сходное образование наблюдала Озирская [23] в постспнапти-ческой части нейронов гигантоклеточной области ретикулярной формации крыс. Косицын [17], изучая подобную структуру в ретикулярной формации продолговатого мозга агамы па поперечных и продольных срезах, пришел к выводу, что данная дифференцировка постсинаптической цитоплазмы представлена не полоской, а площадкой электронноплотного вещества. Субсинаптические тела (рис. 1.10, Б) описаны в аксодендритических синапсах промежуточного мозга млекопитающих [1].
В соответствии с данными исследований постсинаптической сети [123] различия этой структуры обусловлены ее неоднородностью и наличием отверстий в ней. Авторы пришли к выводу, что разные типы синапсов, определяемые в основном по структуре постсинаптических дифференцировок, являются вариантами одной и той же формы синаптического контакта. Деление синапсов на симметричные и асимметричные [57] также основано на различии постсинаптических утолщений в разных контактах между нейронами. Однако наличие постепенного переходного ряда между этими типами синапсов и вариаций протяженности постсипаптической сети (рис. 1.10, В, Г) по существу стирает различия между ними.
В небольшом числе случаев в постсинапсе можно обнаружить мультивезикулярные тела и везикулы, которые, вероятно, являются продуктом микропиноцитоза и образуются за счет инвагинации постсинаптической мембраны [118]. Используя методы замораживания-скалывания и замораживания-травления, удалось установить, что пре- и постсинаптическая мембраны имеют различные по рельефу внутреннюю (обозначаемую как А) и внешнюю — В поверхности [71, 90, 116, 125]. Поверхность А усеяна частицами размером 8—10 нм, в то время как поверхность В гладкая.
Существует ряд данных о возможности антидромных синаптических влияний. Морфологическим субстратом, обеспечивающим осуществление антидромного влияния постсинаптической части синапса на лресинаптическую, могут, по-видимому, служить межсинаптические мостики, соединяющие обе синаптические мембраны, десмосомоподобные симметричные структуры, наблю-32
I Заказ 496
ВТ-
Рис. 1.2. Нисслевское тельце в цитоплазме нейрона. Цистерны гранулярного эндоплазматического ретикулума (цг) ориентированы параллельно друг другу. Между цистернами располагаются многочисленные рибосомы (р). Краниальный шейный ганглий кошки. Х40 ООО. (Электронномикроскопическая фотография Ж. Такси).
Рис. 1.3. Аппарат Гольджи (аГ) в порикарионе крупного мультиполярного нейрона. Цистерны агранулярного эндоплазматического ретикулума (ца) близко прилежат друг к другу. Возле них закономерно встречаются гранулярные пузырьки (гп) и первичные лизосомы (пл). Краниальный шейный ганглий кошки. Х32 ООО. (Электронномикроскопическая фотография Ж. Такси).
Рис. 1.4. Филаментозные включения (фв) в цитоплазме нейрона, окруженные владкой (Л) или складчатой мембраной (Б) в латеральном вестибулярном ядре крысы. Х22 ООО (Л), X 28 000 (Б). (Электронномпкроскопическая фотография К. Сотело).
Рис. 1.4 (продолжение).
Рис. 1.5. Оболочка ядра пейрона. На поперечном срезе (4) видно, что внутренняя мембрана ядерной оболочки имеет ровный контур, внешняя — неравномерно волокнистый. В отдельных местах мембраны смыкаются, образуя поры (стрелки). На тангенциальном срезе (В) ядорные поры имеют вид темных кружков (стрелки). В центре некоторых пор видно точечное уплотнение. Краниальный шейный ганглий кошки. А — х 28 000, Б — Х36 ООО. Электронномикроскопическая фотография Ж. Такетт).
Рис. 1.6. Ультраструктура дендрита вегетативного пейропа. На поперечном срезе (Л) видны многочисленные микротрубочки {мт), цистерны гранулярного эндоплазматического ретикулума {ц), митохондрии {мх) и рибосомы (р). Дендрит образует десмосомоподобный контакт с отростками глиальной клетки (9). В окончании дендрита или в расширении по ходу (£>) видны многочисленные митохондрии (мх), гранулы гликогена (гг) и микротрубочки {мт). Краниальный шейный ганглий кошки. А — Х84 ООО; Б — 26 000. (Электронномикроскопическая фотография Ж. Такси).
Рис. 1.6 (продолжение).
Рис. 1.7. Рецепторное окончание компактного типа в интерстициальной ткани предсердия козленка. Варикозности по ходу формирующего рецептор волокна обусловлены перерезкой блуждающего нерва (24 ч после операции). Метод Бильшовского—Гросс. Х630. (Препарат А. Я. Хабаровой).
Рис. 1.8. Чашевидный синапс в ресничном ганглии цыпленка. Митохондрии (мх), активные зоны синапса (стрелки}, им принадлежит только небольшая часть контакта пре- и постсинаптических мембран. Х14 ООО. (Электронномикроскопическая фотография Г. Кенига).
Рис, 1.9. Преслваптическая часть синапсов.
£ — микротрубочки в касательных синапсах проходят транзитом в непосредственной улизости от активной зоны синапса, теменная кора кошки, х21 ООО; Б — микротрубочки <мт) в аксонах с септальным эндоплазматическим ретикулумом (ср) пронизывают цистерны через имеющиеся там поры (л), I грудной ганглий речного рака х 65 000; В — миелиновая
Рис, 1,9 (продолжение)
оболочка (лео) сопровождает аксон (А) непосредственно до его окончания, с — аксоден-дритический синапс; медиальное дорсальное ядро таламуса кошки, х28 ООО; Г — электронноплотное вещество (эв) в синаптической щели (euj), заднее латеральное ядро таламуса кошки, х75 DOO.
Рис, 1.10, Ультраструктурные компоненты постсинаптической части синапсов.
“к субсинаптичсская сеть (се) в шипике дендрита моторной коры кошки, X40 000; кг. сУ°синаптические тела (ст) в дендрите вентрального медиального ядра гипоталамуса :«рысы, х92 000; В — аксодендритический синапс (с) моторной коры мозга обезьяны.
Рис. 1.10 (продолжение)
X 36 000; Г — аксодендритичсские синапсы моторной коры мозга ежа, х28 ООО,
Рис. 1.11. Синаптические комплексы
™^Я^С^ОС'ПЫС “° дтаергектному типу. Аксон (а) одновременно контактирует с 3 дендритами (д—аг), заднее ядро гипоталамуса крысы, х28 ООО; В - конвергенция аксонныт терминалей (а ав) на дендрит {д), теменная кора мозга кошки, х 32 000.
Рис. 3.3. Изолированная сома нейрона виноградной улитки.
А — клетка с двумя введенными микроэлектродами, диаметр сомы 150 мкм; В — электронная микрофотография части изолированной сомы; п — ядро, I — лакуна, cyt — цито плазма [41.
дающиеся в раннем онтогенезе и на ранних стадиях становления синаптических контактов в регенерирующих синапсах, и, наконец, реципрокные и смешанные синапсы [43, 491.
1.4.2. ЭЛЕКТРИЧЕСКИЕ СИНАПСЫ
Эта форма контактов между нейронами встречается значительно реже, чем химические синапсы. Они описаны в нервной системе беспозвоночных, низших позвоночных животных и в ресничном ганглии птиц [43, 88, 145, 1501. Наиболее характерной чертой этих синапсов является полное слияние пре- и постсинаптических полюсов контакта нейронов. Две трехслойные мембраны, сливаясь, формируют одну пятислойную мембрану, состоящую из трех плотных слоев, разделенных двумя более светлыми слоями. При этом средний слой образуется благодаря соединению наружных листков контактирующих плазматических мембран. Общая толщина такой мембраны равна примерно 15 нм.
Считается, что синапсы с резко суженной синаптической щелью также могут выполнять функцию электрических синапсов.
Исследования, проведенные с использованием лантана и пероксидазы хрена, заставили считать, что в зоне электрического синапса имеется тончайшее щелевидпое пространство шириной не более 2 нм [1181 и что это пространство пронизано в поперечном к щели направлении микроканальцами, которые соединяют пре- и постсинаптическую цитоплазму [121 [. Плотная линия в области слияния мембран выглядит прерывистой. При увеличениях порядка 320 000 видно, что микрощелевидное пространство между поверхностными слоями контактирующих мембран занято пластинкой, состоящей из гексагональных ячеек, напоминающих пчелиные соты. На поперечных срезах стенки этих ячеек имеют вид параллельных полосок, пересекающих щель между плотными слоями.
В пресинаптической части электрических синапсов были обнаружены пузырьки, сходные по размерам и форме с синаптическими. Функция их непонятна, так как у тех объектов, где были найдены такие пузырьки, химическая передача отсутствовала. Случаи обнаружения синапсов со смешанной химической и электрической передачей в ресничном ганглии цыпленка [107] и в спинном мозгу лягушки [152], возможно, помогут объяснить присутствие везикул в электрических синапсах.
1.4.3. НЕКЛАССИЧЕСКИЕ ФОРМЫ СИНАПСОВ
Аксо-аксональные синапсы. Вслед за обнаружением этих синапсов в спинном мозгу млекопитающих [84) они были описаны большим числом исследователей в самых разных отделах нервной системы. Исключение, пожалуй, составляет новая кора, где существование аксо-аксональных си
напсов остается под сомнением. Считается, что они могут служить субстратом для осуществления пресипаптического торможения [70, 95J. Принцип строения аксо-аксональных синапсов тот же, что и У других синапсов.
Для идентификации аксо-аксонального синапса необходимы доказательства принадлежности обоих профилей контакта к аксонам. До недавнего времени исследователи для этой цели довольствовались наличием синаптических пузырьков в них. Но после серии работ, в которых доказывалось, что дендриты могут содержать так называемые плеоморфные везикулы, сходные с синаптическими [90, 102, 119], появилась необходимость в новых критериях для опознавания аксона. Исходя из этих новых представлений, следует считать, что в ряде случаев за аксо-аксональные синапсы были ошибочно приняты аксо-дендритические или дендро-дендритические синапсы.
Синаптические влияния одного аксона на другой могут осуществляться не только в области терминалей, но и в других частях аксона. Так, па аксонном холмике крупных пирамид моторной коры мозга кошки описаны аксо-аксональные синапсы, где пресинапсом служили терминали нейритов звездчатых клеток. Сходные контакты были найдены на аксонном холмике клеток Пуркинье. Аксо-аксональные синапсы могут быть образованы также по ходу аксонов в перехватах Ранвье [10, 125].
Дендро-дендритические синапсы. На светооптическом уровне тесные контакты между дендритами наблюдались в разных частях нервной системы. Было установлено, что такие контакты могут формироваться как между дендритами одного и того же нейрона, так и между разными нейронами. Особенно часто подобные контакты наблюдались в сетчатке глаза и в обонятельной луковице [6, 49, 67, 145]. Однако степень сближения контактирующих полюсов дендритов и тонкое строение всего соединения стали известны только после электронпомикроскопических исследований 168, 128, 129, 132, 133]. В этих работах было показано, что дендрит может выполнять не только роль рецепторной части нейрона, как это считалось ранее, по и передающей части, т. е. выполнять функцию аксона. Особенно убедительные данные приведены для обонятельной луковицы крысы [1251. Установлено, что дендрит митральной клетки образует многочисленные синаптические контакты с геммулами дендритов клеток-зерен. Скопления синаптических пузырьков наблюдались в обоих дендритах в непосредственной близости от контактирующих мембран, но не друг против друга, а на некотором расстоянии, что создавало предпосылки для синаптической передачи — в одном случае от дендритов митральных клеток к дендритам клеток-зерен, а в другом — в противоположном направлении. В таламусе кошки также были описаны дендро-дендритические синапсы.
Сомато-дендритические и другие формы синапсов. Расширение сферы электронномикроскопических
исследований привело к обнаружению в покрышке мозга амфибий сомато-дендритических синапсов 1143]. В этом случае в теле нейрона непосредственно в зоне контакта с дендритом наблюдалось скопление синаптических пузырьков, а дендрит характеризовался наличием специализаций, свойственных постсинаптической части. Среди синаптических иузырьков наблюдалось много гранулярных. Наличие хорошо выраженной синаптической щели и асимметричный тип строения свидетельствовали о причастности этой формы контакта к химическому синапсу. В дополнение к со-мато-дендритическим синапсам были обнаружены в наружном коленчатом теле мозга кошки дендро-соматические и сомато-сома-тические синапсы [74, 165]. Во всех случаях ультратонкое строение контактов позволяло думать о химических синапсах. Исследования атипичных форм синапсов имеют большое значение для выяснения закономерностей организации межнейронных связей в нервной системе и поиска возможных путей, с помощью которых происходят замыкания в цепи нейронов. Остается, к сожалению, невыясненной частота обнаружения атипичных синапсов в нервной системе. Накопление фактов о том, что функцию передающих и воспринимающих нейронов могут попеременно выполнять любые части нервной клетки, и о высокой их пластичности, заставляет критически относиться к постулатам классических представлений о полярности нейрона.
1.4.4. СИНАПТИЧЕСКАЯ ОРГАНИЗАЦИЯ НЕРВНЫХ ЦЕНТРОВ
Согласно общепринятому мнению, синапсы функционируют не в одиночку, а во взаимодействии друг с другом, что и определяет итоговый результат нервной деятельности. Фрагментарные картины, которые исследователи получают при изучении срезов нервной ткапи, затрудняют выяснение целостных представлений о взаимоотношениях, существующих между отдельными окончаниями аксонов.
Первые сведения о сложных взаимоотношениях между отдельными компонентами синаптических соединений были получены для гломерул мозжечка [58, 83]. В последующие годы под названием гломерулы были описаны синаптические объединения в наружном коленчатом теле, в некоторых ядрах таламуса [124, 158], в обонятельных и добавочных долях у рака [140]. В ряде случаев отмечалось, что синаптические объединения ограничены глией. Именно за ними закрепилось название гломерула. Остальные объединения принято обозначать как синаптические комплексы. В нейропиле ганглиев беспозвоночных и в ряде рецепторных образований позвоночных выделены сериальные синапсы [43, 152].
Синаптические комплексы в экспериментальных условиях, например при частичной их деафферентации, подвергаются ремо-дуляции [89]. В релейных центрах нервной системы — ядрах
Кларка спинного мозга, гломерулах мозжечка, гломерулах наружного коленчатого тела — крупное афферентное окончание контактирует с большим числом дендритов локальных нейронов, что создает предпосылки для массовой дивергенции импульсов (рис. 1.11, А).
В ассоциативных системах — в ассоциативных ядрах таламуса и в ассоциативной коре мозга большое число афферентных аксонов заканчивается на одном и том же дендрите (рис 1.11, Б). Между терминалями аксонов нередко наблюдаются аксо-аксо-нальные синапсы. Такой способ организации межнейронных связей обеспечивает конвергенцию импульсов и создает условия для интегративной деятельности нейронов [5, 155, 156]. Синаптические комплексы достигают наибольшей сложности в филогенетически новых отделах нервной системы.
При изменении функциональной нагрузки первного центра, например при депривации или, наоборот, стимуляции, его синап-соархитектоника может претерпевать значительные изменения. Вслед за деафферентацией центров и распадом аксонных терминалей наблюдалось замещение освободившихся мест контактов разрастаниями коллатералей аксонов («спраутинг»), принадлежащих другим системам [5, 90, 145].
Заканчивая этот раздел, следует отметить, что морфологическое изучение синапсоархитектоники нервных центров в онто- и филогенезе, а также в условиях адаптации несомненно будет способствовать выяснению морфо-функциональной корреляции при формировании новой мозаики элементов и ансамблей нейронов. Эти исследования позволят также ответить на вопросы о том, насколько длительна эта перестройка и насколько она кардинальна.
ЛИТЕРАТУРА
1 Агаджанова Т. А., Бабминдра В. П. Современные представления об ультраструктуре нейронов и синапсов. — В кн,: Нервная система. 13. Л., 1973, с. 9—23.
2. Бабминдра В. П. Структурная пластичность межнейронных синапсов. Л., 1972. 181 с.
3. БаблшнЗра В. П., Брагина Т. А. Межнейронные отношения в вертикальных пучках дендритов двигательной коры мозга кошки. — ДАН СССР, 1973, 211, № 5, с. 1242—1244.
4. Бабминдра В. П., Валберг Ф. Источники афферентных путей двигательной коры мозга кошки, выявленные с помощью пероксидазного метода. — Арх. анат., 1978, 74, № 5, с. 13—18.
5. Батуев А. С., Бабминдра В. П. Некоторые морфофизиологические предпосылки межнейронпой интеграции. — В кн.: Системный анализ интегративной деятельности нейрона. М., 1974, с. 125—133.
6 Бехтерев В. М. Проводящие пути спинного и головного мозга. Ч. II. СПб., 1898. 289 с.
7. Блинков С. М. Количественные определения морфологических структур ЦНС. — В кн.: Итоги науки и техники. 5. М., 1972. 141 с.
8. Боголепов Н. Н. Ультраструктура синапсов в норме и патологии. М., 1975. 94 с.
9. (Бочарова Л. С., Воровягин В. Л., Дьяконова Т. Л., Вепринцвв Б. Н.} Bocharova L. S., Borovyagin У. L., Dyakonova Т. L., Veprtntsev В. У,
Ultrastructure and RNA synthesis in a molluscan giant'neuron under electrical stimulation. — Brain Res., 1972, 36, N 2,rp. 371—384.
10. Брагина T. А. Две разновидности аксо-аксональныхусинапсов в двигательной зоне коры мозга кошки. — ДАН СССР, 1977, 234, № 4, с. 968— 970.
Н, Жаботинский Ю. М. Нормальная и патологическая морфология нейрона. Л., 1965. 321 с.
12. Заварзин А. А, Очерки по эволюционной гистологии нервной системы. М.-Л., 1941, с. 317.
13. Коблов Г. А. Деление нервных клеток. Саратов, 1974, с. 258.
14. Колосов Н. Г. Иннервация внутренних органов и сердечно-сосудистой системы. М.—Л., 1954. 274 с.
15, Колосов Н. Г., Хабарова А. Я. Структурная организация вегетативных ганглиев. Л., 1978. 70 с.
16. Комиссарчик Я. Ю., Левин С. В. Примембранные структуры клеток к животных (структурная и химическая организация «толстых» мембран). — Цитология, 1974, 16, № 5, с. 528—544.
17. Косицын Н. С. Аксо-дендритические связи ретикулярной формации мозгового ствола рептилий. — ДАН СССР, 1969, 187, № 4, с. 942—944.
18. Косицын Н. С. Микроструктура дендритов и аксодендритических связей в центральной нервной системе. М., 1976, с. 198.
' 19. Лаврентьев Б. И. Морфология чувствительной иннервации внутренних органов. М., 1948. 496 с.
20. Леонтович Т. А. Закономерности качественно-количественной организации нейронов переднего мозга хищных. Автореф. докт. дис. М., 1973.
21. Макарова А. П., Иманкулова Ч, С. Структурная характеристика аксонов пирамидных и звездчатых нейронов. — Матер. XII конф, морфологов Ленинграда. Л., 1974, с, 39—41.
22. Невмывака Г. А. Нервная система дождевого червя. Л., 1966. 241 с.
23. Овирская Е. В. Электронномикроскопическое исследование'синаптических образований в ретикулярной формации мозгового ствола. — В кн.: Электронная и флуоресцентная микроскопия клетки. М.—Л., 1965, с. 68—73.
24. Поляков В. Ю. Интерфазное ядро. — В кн.: Клеточное ядро и его ультраструктура. М., 1970, с. 161—185.
25. Поляков Г. И. Основы систематики нейронов. М., 1973. 309 с,
26, Саркисов С. А., Боголепов Н. Н. Электронная микроскопия мозга. М., 1967. 171 с.
27. Сахаров Д, А. Генеалогия нейронов. М., 1974. 183 с.
28. Сотников О. С. Функциональная морфология живого нервного волокна. Л., 1977. 97 с.
29. (Стефановская М.) Stephanowskaja М. An appendices of dendrite. — Ann. Bull. Sci. med. et nat. Bruxelles, 1897, 15 Avril, p. 65—67.
30. (Суханов C. A.) Suchanow S. A. Sur la structure de neuron. — La cellule, 1898, 14, N 2, p. 31—48.
31. Суханов С. А, Материалы к вопросу о четкообразном состоянии протоплазматических отростков нервных клеток мозговой коры. Дис. М., 1899.
32. Толченова Г. А. Нейронная организация и межнейронные связи теменной коры кошки. Автореф. канд. дис. Л., 1974. 24 с.
33. Усова И. П. Особенности нейронного строения 4 и 17 полей изолированной коры больших полушарий мозга кошки. Автореф. канд. дис. Л., 1975.
34, Хабарова А. Я. Афферентная иннервация сердца и кровеносных сосудов* Л., 1975. 375 с.
35. Цвиленева В. А. Б. эволюции туловищного мозга членистоногих. Л., 1970. 198 с. ’
36. Ченцов Ю. С., Поляков В. Ю. Ультраструктура клеточного ядра. М., 1974. 161 с.
37. Abelson H. T„ Smith А. Н. Nuclear pores: the pore-annulus relationship. — J. Ultrastr. Res., 1970, 30, N 5—6, p. 558—570.
38. Ajzellus B. Fine structural relationship between cell organelles. — J. Cell Biol., 1963, 19, N 1, p. 25-37.
39. Ajika K., Hokjelt T. Ultrastructural identification of catecholamine neurons. — Brain Res., 1973, 57, Nl, p. 107—117.
40. Akert K- Dynamic aspects of synaptic ultrastructure. — Brain Res., 1973, 49, N 2, p. 511-518.
41. Akert K., Pfenninger K. Synaptic fine structure and neuronal dynamics. — In: Cellular dynamics of the neuron. New York, 1969, p. 245—260.
42. Andres К. Я, Uber die feinstruktur besonderer Einrichtungen in mark-haltigen Nervenfasorn der synaptischen Vcrbindungen. — Z. Zellforsch., 1965, 69, N 2, S. 140—154.
43. Andres К. H. Morphological criteria for the differentiation of synapses. —. J. Neuronal transmission, 1975, Suppl. XII, p. 1—37.
44. Atwood H. L., Land F., Morin W. A. Synaptic vesicles: selective depletion in crayfish excitatory and inhibitory axons, — Science, 1972, 176, N 4041, p. 1353—1355.
45. Bardele Ch. F. Struktur, Biochemie und Funktion der Mikrotubuli. — Cytobiologie, 1973, 7, N 4, S. 442—488.
46. Blackstad T. Cortical gray matter. A correlation of light and electron microscopic data. — In: The Neuron. Ed. H. Hyden. Amsterdam, 1967, p. 49—118.
47. Blackstad T. Precise mapping of nervous connections. — Brain Res., 1975, 95, N2-3, p. 191—120.
48. Bodian D. Synaptic types of spinal motoneurons. — In: The Neurosciences. New York, 1967, p. 6—24.
49. Bodian D. Synaptic diversity and characterization by electron microscopy. — In: Structure and function of synapses. New York, 1972, p. 45—65.
50. (Burnstock G.). Вернсток Дж, Пуринергические синапсы и эволюция. — В кн.: Сравнительная фармакология синаптических рецепторов. Л., 1977, с. 26—33.
51. Cajal S. Ramon у. Histologie du systeme nerveux de 1'homme et des ver-tebres. Madrid, 1952. 492 p.
52. Cajal S. Ramon y. Degeneration and regeneration of the nervous system. New York, 1959. 459 p.
53. Castro F. Sympathetic ganglia: normal and pathological. — In: Cytology and cell pathology of nervous system (New York), 1932, 1, N 7, p, 317— 422.
54. Chandler R. L., Willis R. An intranuclear fibrillar lattice in neurons. — J. Cell Sci., 1966, 1, N 2, p. 283—286.
55. Chouchkov Ch. N. On the fine structure of free nerve endings in human digital skin, oral cavity and rectum. — Z. Mikrosk. Anat. Forsch., 1972, 86, N 2-3, S. 273-288.
56. Colon E., Smit G. Quantitative analysis of the cerebral cortex. — Brain Res., 1970, 22, N 3, p. 363—380-
57, Cojonnier M. Synaptic patterns on different cell types in the different laminae of the cat visual cortex. An electron microscope study. — Brain Res., 1968, 9, N 2, p. 268—287.
58. Colonnier M., Guillery R. W. Synaptic organization in the lateral geniculate nucleus of the monkey. — Z. Zellforsch., 1964, 62, N 3, S. 333—355.
59. Cullheim S., Kellerth J.-O., Conradi S. Evidence for direct synaptic interconnections between cat spinal a-motoneurons. — Brain Res., 1977 132, N 1, p. 1—10.
60. Dalton A., Haguenau F. (Eds). Ultrastructure in biological systems. 3. The Nucleus. New York, 1968, 318 p.
61, Daniels E. W., McNifj J. H., Ekberg D. R. Nucleopores of the giant amoeba Pelomyxa corolinensis. — Z. Zellforsch., 1969, 98, N 3, S. 357—377.
62. Damson A., Gredson ;V, Myelination of the axon. — In: Neurochemistry. Ed. C. Adams. Amsterdam, 1965, p. 117—125.
63. De Duve C. The lysosome concept. — In: Lysosomes. Eds A. V. S. de Reuck and M. P. Cameron. Boston, 1963, p. 1—31.
64. (De Robertis E.) Де Робертис Э. Ультраструктура и цитохимия центральных синапсов. — Арх. аиат., 1971, 60, № 5, с. 14—21.
65, (De Robertis Е., Novinski W., Saez F.) Де Робертис Э., Новинский В., Саэс Ф. Биология клетки. М., 1973. 487 с.
66. Doedans К., Schierzorn Н., Nagel J. Die Ontogenese der spinefreien initial Zone der apikal Dendritens. — Gegenbaurs morf, Jarb. Leipzig, 1975, 121, N 1, S. 88—108.
67. Dowling J. Synaptic arrangements in the vertebrate retina: The photoreceptor synapse. — In: Synaptic transmission and neuronal interaction. 28. Ed. M. Bennett. New York, 1974, p. 87—103,
68. Dowling J., Brown J., Major D. Synapses of horizontal cells in the rabbit and cat retinas. — Science, 1966, 153, N 3744, p. 1639—1641.
69. Droz B., Koenig H. The turnover of proteins in axons and nerve endings. New York, 1969, p. 35—50.
70. Eccles J. C. Physiology of synapses. Berlin, 1964. (Русек, перев.: Экклс Дж. Физиология синапсов. М., 1966).
71. Eljvin L. G. The ultrastructure of neuronal contacts. — Progr. Neurobiol., 1976, 8, N 1, p. 45—79.
72. Engstrom A. (Ed.). RNA and protein synthesis. — In; Cellular dynamics of the neuron. New York, 1969, p. 51—72.
73. Engstrom A., Wersall J. Myelin sheath structure in nerve fibre demyelinization and branching regions. — Exp. Cell Res., 1958, 14, N 2, p. 414—432.
74, Famigliette P. Dendro-dendritic synapses in the lateral geniculate nucleus of the cat. — Brain Res., 1970, 20, N 2, p. 181—191.
75. Fawcett D. W. On the occurrence of a fibrous lamina on the inner aspect of nuclear envelope in certain cells of vertebrates. — Amer. J. Anat., 1966, 119, N 1, p. 129—146.
76. Fleischhauer K. Z. On different patterns of dendritic bundling in the cerebral cortex of the cat. — Z, Anat. Entwickl. Gesch., 1974, 143, N 2, S. 115—126.
77. Franke W., Scheer U. The ultrastructure of the nuclear envelope of amphibian oocytes: A reinvestigation. — J. Ultrastr. Res., 1970, 30, N 3—4, p. 288—316.
78. Friend R. L-, Farguhar M. G. Functions of coated vesicles during protein absorption in the rat vas deferens. — J. Cell Biol., 1967, 35, N 2, p, 357— 376.
79. Gall J. G. Octagonal nuclear pores. — J. Cell Biol., 1967, 32, N 2, p. 391— 399.
80. Globus A., Scheibel A . Pattern and field in cortical structure: The rabbit. — J. Comp. Neurol., 1967, 131, N 1, p. 155—172.
81. Gobel S. Neurons with two axons in the substantia gelatinosa layer of the spinal trigeminal nucleus of the adult cat. — Brain Res., 1975, 88, N 2, p. 333—338.
82. GrayE. G. Axo-somatic and axo-dendritic synapses of the cerebral cortex: An electron microscope study. — J. Anat. (London), 1959, 93, N 4, p. 420— 433.
83. Gray E. G. Regular organization of material in certain mitochondria of neuroglia of lizard brain. — J. Biophys. Biochem. Cytol., 1960, 8, N 1, p. 282-285.
84. Gray E. G. A morphological basis for presynaptic inhibition? — Nature, 1962, 193, N 4810, p. 82-83.
85. Gray E. G. Electron microscopy of presynaptic organelles of the spinal cord. — J. Anat. (London), 1963, 97, 1, p. 101—106.
86. Gray E. G. Tissue of the central nervous system. — In: Electron Microscopic Anatomy. Ed. S. M. Kurtz, New York, 1964, p. 369—417.
87. Brimstone A., Clug A. Observations on the substructure of flagellar fibres. — J. Cell Sci., 1966, 1, N 3, p. 351—362.
88. Hama K. Some observations on the fine structure of the giant fibers of the crayfishes (Cambarus virilus and Cambarus clarkii) with special reference to the submicroscopic organization of the synapses. — Anat. Record, 1961, 141, N 2, p. 275—293.
89. Hamori J. Inductive role of presynaptic axons. — Brain Res., 1973, 62, N 2, p. 337—364.
90. Heuser J. E., Reese T. S. Structure of the synapse. — In: Handbook of physiology. Ed. J. Kandel. Amer. Physiol. Soc. Bethesda, 1977, p. 261 — 294.
91. Jacobson S. Dimensions of the dendritic spine in the sensorimotor cortex of the rat, cat, squirrel monkey and man. — J. Comp. Neurol., 1967, 129, Nl, p. 49—58.
92. JonesD., Brearley R. Ultrastructure features of intact rat cerebral cortex.— Z. Zellforsch., 1972, 125, N 4, S. 415-431.
93. Karlsson U. Comparison of the myelin period of peripheral and central origin by electron microscopy. — J. Ultrastr. Res., 1966, 15, N 3—4, p. 451-468.
94. K&sa P. Ultrastructural localization of acetylcholinesterase in the cerebellar cortex with special reference to the intersynaptic organelles. — Hi-stochemie, 1968, 14, N 2, p. 161—167.
95, Katz B. Nerve, muscle, synapse. New York, 1966. (Русек, перев.: Катц Б. Нерв, мышца и синапс. М., 1968. 220’с.).
96, Khattab F. I. Synaptic contacts’at nodes of Ranvier in central nervous system. — Anat. Record, 1966, 156, N 1, p. 91—97.
97. Kohno K., Chan-Palay V., Palay S. L. Cytoplasmic inclusions of neurons in the monkey visual cortex. (Area 19). — Anat. Embryol., 1975, 147, N’2, p. 117—125. ►
98. Lane N. J. Distribution of phosphatases in the Golgi region and associated structures of the thoracic ganglionic neurons in the grasshopper, Melanopus differentialis. — J. Cell Biol., 1968, 37, N 1, p. 89—104.
99. La Vail J. H., La Vail M. M. The retrograde intraaxonal transport of horseradish’peroxidase in the chick visual system. A light and electron microscopic study. — J. Comp. Neurol., 1974, 157, N 3, p. 303—358.
100. La Vail J. H., La Vail M. M. Retrograde interneuronal transport of HRP [in retinal cells of the chick. — Brain Res., 1975, 85, N 2, p. 273—280.
101, (Lehninger 4.) Ленинджер А. Митохондрия. M,, 1966, 316 -c.
102. Liebermann A. R. A class of neurons with presynaptic pericaria, — J. Anat. (London), 1972, 113, N 2, p. 283.
103. (LoevyA., Siekevitz P.) Леви A., Сикевиц Ф. Структура и функция клетки. М„ 1971. 579 с.
104. Lorente de No R. Cerebral cortex: architecture, intracortical connections, motor projections. — In: Physiology of Nervous System. Ed, J. Fulton. Oxford, 1938, p. 129.
105. Maciewicz R. J. Afferents to lateral suprasylvian gyrus of the cat traced with horseradish peroxidase. — Brain Res., 1974, 78, N 1, p. 139—143.
106. Marinozzi R., Bernhard W- Remarks on the organization of the nucleolus. — Exp. Cell Res., 1963, 32, N 3, p. 595—603.
107. Martin A. R., Pilar G. Dual mode of synaptic transmission in the avian ciliary ganglion. — J. Physiol. (London), 1964, 171, N 3, p. 454—475.
108. Massing И7., Flelsehhauer K. Vertical bundles of the dendrites in the rabbit cortex. — Z. Anat. Entwickl. Gesch., 1973, 141, N 2, S. 115—123.
109. Mitra N, Quantitative analysis of the cell types in mammalian neocortex. — J. Anat. (London), 1955, 89, N 4, p. 467—483.
110. Moran A., Rowley J. C. Cytoplasmic order in an invertebrate neuron. — Brain Res., 1974, 74, N 2, p. 373-377.
111. Mungai J. M. Dendritic patterns in the somatic sensory cortex of the rv cat. — j. Anat. (London), 1967, 101, N 3, p. 403—418.
112. Northcote D. П., Lewis D. R. Freeze-etched surfaces of membranes and organelles in the cells of pea root tips. — J. Cell Sci., 1968, 3, N 2, p. 199— 205.
113. Novikoff A. B. Enzyme localization and ultrastructure of neurons. — In: The Neuron. Ed. H. Hyden. Amsterdam, J967, p. 255—318.
114. Palay S. L. The fine structure of secretory neurons in the preoptic nucleus of goldfish (Carassius auratus). — Anat. Record, 1960, 138, N 4, p. 417—443.
115. |Palay S. L. Alveolate vesicles in Purkinje cells of the rat’s cerebellum. — J. Cell Biol., 1963, 19, N 1, p. 89A—90A.
116. Palay 8., Chan-Palay F. General morphology of neurons and neuroglia. — In: Handbook of Physiology. 1. Ed. J. Kandel. Amer. Physiol. Soc. Bethesda, 1977, p. 5—37.
117. Palay 8. L., Sotelo C., Peters A., Orkand P. M. The axon hillock and the initial segment. — J. Cell Biol., 1968, 38, N 1, p. 193—201.
118. (Pappas D., Waxmann 8.) Паппас Д., Ваксман С. Ультраструктура синапсов. — В кн.: Физиология и фармакология синаптической передачи. Л., 1973, с, 3—70.
119. Pasik Р., Pasik Т,, Hamori J., Szentdgothat J. Golgi II type of interneurons in the LGB of the monkey. — Exp. Brain Res., 1974, 17, N 1, p. 18—34.
120. Pease D. C. The ultrastructure of flagellar fibrils. — J. Cell Biol., 1963, 18, N2, p. 313—326.
121. Perracchia C. Structural evidence for intercellular channels. — J. Cell Biol., 1973, 57, N 1, p. 66—76.
122. Peters A. The morphology of axons of the central nervous system. — In: The structure and function of nervous tissue. I. New York, 1968, p. 142— 183.
123. Peters A., Kaiserman-Abramof J. H. The small pyramidal neuron of the rat cerebral cortex. The synapses upon dendritic spines. — Z. Zellforsch., 1969, 100, N 4, S. 487—506.
124. Peters A., Palay 8. L. The morphology of laminae A and AL of the dorsal nucleus of the lateral geniculate body of the cat. — J. Anat. (London), 1966, 100, N 3, p. 451—486.
125. Peters A., Palay S. L., Webster H. The fine structure of the nervous system. The neuron and supporting cells. Ed. J. Kandel. Philadelphia, 1976. 197 p.
126. Peters A., IFaish T. M. A study of the organization of apical dendrites in the somatic sensory cortex of the rat. — J. Comp. Neurol., 1972, 144, N 3, p. 253—268.
127. (Poltcard А.) Поликар А. Молекулярная цитология мембран живой клетки. Новосибирск, 1975. 183 с.
128. Price J. L. The termination of centrifugal fibres in the olfactory bulb. — Brain Res., 1968, 7, N 3, p. 483—486.
129. Rail W., Shepherd G. M., Reese T. S., Brighiman M. W. Dendrodendri-tic synaptic pathway for inhibition in the olfactory bulb. — Exp. Neurol., 1966, 14, N 1, p. 44—56.
130. Ramon-Moliner E. The histology of the postcruciate gyrus of the cat. III. Further observations. — J. Comp. Neurol., 1961, 117, N 2, p. 229—249.
131. Rarnon-Moliner E. The morphology of dendrites. — In: Structure and function of the nervous tissue. I. Ed. G. H. Bourne. New York, 1968, p. 205—264.
132. Reese T. S., Brightman M. W. Electron microscopic studies on the rat olfactory bulb. — Anat. Record, 1965, 151, N 3, p. 492.
133. Reese T. S.r Shepherd G. M. Dendro-dendritic synapses in the CNS. — In: Structure and function of synapses. Ed. G. Shepherd. New York, 1972, p. 121—136.
134. J- P-> Hamilton D. W. The double nature of the intermediate dense line in peripheral nerve myelin. —Anat. Record, 1969, 163, N 1, p. 7—16.
135. Robertson j. D. Structural alterations in nerve fibers produced by hypotonic solutions. — J. Biophys. Biochem. Cytol., 1958, 4, N 4, p. 349— 364.
136. Romagnano M. A-, Maciewicz R. J. Peroxidase labelling of motor cortex neurons projecting to VPL in the cat. — Brain Res., 1975, 83, N 3, p. 469—473.
137. Rosenbluth J. Subsurface cisterns and their relationship to the neuronal plasma membrane. — J. Cell Biol., 1962, 13, N 3, p. 405—421.
138. Rosenbluth J., JVtoig S. L. The distribution of exogenous ferritin in toad spinal ganglia and the mechanism of its uptake by neurons. — J. Cell Biol., 1964, 23, N 2, p. 307—325.
139. Ryugo D. K., Ryugo R., Globus A., Killackey H. P. Increased spines den sity in auditory cortex following visual or somatic deprivation. — Brain Res., 1975, 90, N 1, p. 143—146.
140. Sandeman D. C., Luft S. E. The structural organization of glomerular neuropil in the crayfish. — Z. Zellforsch., 1973, 142, N 1, S. 37—61.
141. Seheibel Seheibel A. Dendrite bundles in the ventral commissure of the cat spinal cord. — Exp. Neurol., 1973, 39, N 3, p. 482—488.
142. Seheibel M., Seheibel A. The dendritic structure of the human Betz cell. — In: Architectonics of the cerebral cortex. Eds M. A. Brazier, H. Petsche. New York, 1978, p. 43— 57.
143. Set&lo G., Szekely G. The presence of membrane specialization indicative of somatodendritic synaptic junctions in the optic tectum of the frog. — Exp. Brain Res., 1967, 4, N 2, p. 237—242.
144. Shantha T. Л., Manocha S. L., Bourne G. HKappers A. The morphology and cytology of neurons. — In: The structure and function of nervous tissue. 11. Ed. G. Shepherd- New York, 1969, p. 2—59.
145. Shepherd G. The synaptic organization of the brain. New York, 1974. 364 p.
146. Shimizu N., Ishii S. Electronmicroscopic observations on nucleolar extrusion in nerve cells of the rat hypothalamus. — Z. Zellforsch., 196a, 67, N 3, S. 367—372.
147. Shall D. The organization of the visual cortex in cat. — J. Anat. (London), 1955, 89, N 1, p. 33-48.
148. Shall D. The organization of the cerebral cortex. New York, 1956. 118 p.
149. Sotelo C., Angout P. The fine structure of the cerebellar central nuclei in the cat. — Exp. Brain Res., 1973, 16, N 4, p. 410—430.
150. Sotelo C. Morphological basis for electrical communications between neurons in the c. n. s. of vertebrates. — In: Neuron concept today. Eds J. Szen-tagothai, J. Hamori. Budapest, 1977, p. 17—26.
151. Sotelo C., Palay S. L. The fine structure of the lateral vestibular nucleus in the rat. I. Neurons and neuroglial cells, — J. Cell Biol., 1968, 36, N 1, p. 151-179.
152. Sotelo C., Taxi J. Electrotonic junctions in the spinal cord of the frog. — Brain Res., 1970, 17, N 1, p. 137—141.
153. Sousa-Pinto A., Paula-Borbosa M., Matos K. Nerve cells in layer I of the cat auditory cortex. — Brain Res., 1975, 95, N 2—3, p. 443—458.
154. Stevens B. J., Andre J. Structure and function of the nuclear membrane. — In: Handbook of Molecular Cytology. Ed. G. Adams. Amsterdam—London, 1969, p. 837.
155. Szent&gothai J. The morphological identification of the active synaptic regions. — In: Excitatory synaptic mechanisms. Ed. W. Anderson. Oslo, 1970, p. 9—26.
156. Szent&gothai J. The module concept in cerebral cortex architecture. — Brain Res., 1975, 95, N 2—3, p. 475—496.
157. Szentagothal J., Hamori J, Growth and differentiation of synaptic structure under circumstances of deprivation of function and of distant connections. — In: Cellular dynamics of the neuron. Ed. J. Andre. New York, 1969, p. 301—320.
158. Szentdgothai J., Hamori J., Tombbl T. Degeneration and electron microscopic analysis of the synaptic glomeruli in the lateral geniculate body, — Exp. Brain Res., 1966, 2, N 2, p. 283—301.
159. Tashlro У., Matsuura S., Marimoto T., Nagata S. Extrusion of nuclear materials into cytoplasm in the posterior silk gland cells of silk worm, Bombyx mori. — J. Cell Biol., 1968, 36, N 3, p. C5—GIO.
160. Taxi J. Contribution a Г etude des connexions des neurones moteurs du systeme nerveux autonome. — Ann. Sci. nat. zool. Paris, 1965, 12е ser., 7, N 3, p. 413-674.
161. Turner P. T., Harris A. B. Ultrastructure of exogenous peroxidase in cerebral cortex. — Brain Res., 1974, 74, N 2, p. 305—326.
162. Valverde F. Apical dendritic spines of the visual cortex and light deprivation in the mouse, — Exp. Brain Res., 1967, 3, N 3, p. 337—352.
163. Walberg F. Elongated vesicles in terminal boutons of the central nervous system a result of aldehyde fixation. — Acta anat., 1966, 65, N 2, p. 224— 235.
164. Wuerker R., Kirkpatrick J. Neuronal microtubules, neurofilaments and microfilaments. — Internet. Rev. Cytol., 1972, 33, p. 45—70.
165. Yokota R.,Yamauchi A . Ultrastructure of the mouse superior cervical ganglion. — Amer. J. Anat. 1974, 140, N 2, p. 281—298.
Глава 2
ЭЛЕКТРИЧЕСКАЯ ВОЗБУДИМОСТЬ НЕРВНОГО ВОЛОКНА
2.1. ОСНОВНЫЕ ПОЛОЖЕНИЯ
В современной физиологии считается установленным, что электрическая возбудимость нервного волокна связана с су-ществованием в его мембране специализированных ионных каналов, обладающих относительно высокой селективностью по отношению к определенным ионам (натриевые, калиевые, кальциевые каналы) и способностью открываться и закрываться в ответ на сдвиги мембранного потенциала.
Ионные токи через эти каналы обеспечивают генерацию потенциалов покоя и действия, т. е. определяют нормальное электрическое поведение мембраны. Однако количественное изучение ионных токов, и в частности исследование зависимостей ионных проницаемостей мембраны от потенциала и времени, возможны только в условиях метода фиксации потенциала (voltage clamp method). Необходимость в применении этого метода становится очевидной из рассмотрения эквивалентной электрической схемы мембраны.
На рис. 2.1, Л пр!1ведена схема, впервые предложенная Ходжкином и Хаксли [98, 99 [ для описания электрического поведения мембраны гигантского аксона кальмара.
На этой схеме через С„ обозначена емкость мембраны, опа составляет около 1 мкФ/см3. и Лк —суммарные сопротивления натриевых и калиевых каналов; эти сопротивления изображены как переменные, поскольку проводимости указанных каналов gN1 и gK являются функциями мембранного потенциала и времени; 2?ма и Ек. — электродвижущие силы, создаваемые разностями концентраций ионов Na+ и К+ соответственно между наруж-44
ным раствором и содержимым аксоплазмы. Величины /?№ и Ек определяются по формуле Нернста:
г* __ FT 1 [Na]0 р ______ ВТ , [К-1„
£Na = — (1)
А___________________
Наружный растбор
Аксоплазма
Б
Рис, 2.1. Эквивалентная схема элемента возбудимой мембраны гигантского аксона кальмара А и временной ход изменений натриевой (gNa) и калиевой ("к) проводимостей при деполяризации мембраны (В).
А — объяснение см. в тексте; Б — сплошные линии показывают изменения и "К ПРИ Длительной деполяризации, прерывистые—при реполяризации мембраны через 0.6 . и 6.3 мс [98].
где Л — газовая константа, F — число Фарадея, Т — абсолютная температура, [Na]„ и [К]о — наружные, a [NaJ( и [К], — внутренние концентрации (активности) этих ионов.
В схему введены также сопротивление Ег и батарея Е{ для учета движения ионов по каналам, которые постоянно находятся
в открытом состоянии; их проводимость от потенциала практически не зависит. Эти каналы получили название «каналов утечки».
В мембране, устроенной таким образом, как это показано на рис. 2.1, А, существуют сложные прямые и обратные связи между мембранным потенциалом, ионными проводимостями и токами.
В самом общем виде эти связи могут быть изображены схематически следующим образом:
..Сдвиг потенциала (zlf)
( Изменения ионных проводимостей
4 Изменения ионных токов
Обратная связь, обозначенная на схеме звездочкой, необходима для нормального электрического поведения возбудимой мембраны (генерации потенциалов покоя и действия), но она мешает изучать зависимость gNa и gK от потенциала и времени, поскольку любое изменение этих проводимостей, вызванное сдвигом Е, тотчас же порождает новое смещение Е, а это в свою очередь изменяет проводимости и токи и т. д.
Метод фиксации напряжения позволяет искусственно разорвать этот замкнутый круг, с помощью особой электронной системы насильственно поддерживающей потенциал в определенной области мембраны на любом заданном уровне. Токи, посылаемые такой электронной системой в мембрану для удержания потенциала на заданном уровне, по своей абсолютной величине равны ионным токам, возникающим в мембране в ответ на сдвиг мембранного потенциала [53, 54, 100, 101, 119].
Регистрируя эти токи, исследователь получает возможность прослеживать изменения ионных проводимостей и проницаемостей при любом заданном потенциале.
На рис. 2.1, Б показан временной ход изменений g\a и gK при сдвиге мембранного потенциала ступенью от уровня покоя — 60 мВ до —4 мВ.
Видно, что в покоящейся мембране g^a очень низка. Под влиянием деполяризации она быстро возрастает, достигает некоторого максимума, а затем экспоненциально уменьшается. Рост gK при деполяризации начинается после некоторой задержки и происходит значительно медленнее, чем подъем gua.
Если ограничиться измерениями временного хода gK только в указанный отрезок времени (как это первоначально делали Ходжкин и Хаксли [99]), то создается впечатление, что временной ход изменений gK качественно отличается от кинетики gNa- Однако при увеличении длительности деполяризации до секунд, можно убедиться, что и gK после начального подъема начинает снижаться. Правда, это падение никогда не бывает полным.
Рис. 2.2 демонстрирует изменения gwa и gK при различных величинах сдрщд мембранного потенциала. Мы видим, дтр цзме-44
яение амплитуды деполяризующей ступени оказывает влияние не только на величину подъема gjja и ёк, но и на скорость их нарастания.
Если принять, что в единице площади мембраны имеется М^а натриевых каналов, и что проводимость каждого открытого канала — есть величина постоянная, т° суммарная натриевая
Рис. 2.2. Временной ход изменений натриевой (Л) и калиевой (Б) проводимостей мембраны гигантского аксона кальмара при различных смещениях мембранного потенциала. Цифры, над кривыми показывают величину сдвига потенциала в сторону деполяризации. Кружки соответствуют экспериментальным данным, сплошные кривые получены путем решения уравнений Ходжкина—Хаксли [99].
проводимость gNa ПРИ Данном потенциале £ и в данный момепт времени t будет, очевидно, определяться величиной
*) = ^Na-4la- Ь (2)
где у — доля каналов, находящихся в открытом — проводящем — состоянии. То же рассуждение, будучи применено по отношению к gK, дает
ёк(Е, t)^MK.g*K.a, (3)
где Мк — число калиевых каналов в единице площади мембраны, ёк — проводимость одиночного открытого калиевого канала, йо — доля каналов, находящихся при данных Е и t в проводящем состоянии.
С этой точки зрения рассмотренные выше изменения gna и gs. могут быть интерпретированы как результат происходящего под влиянием деполяризации изменения доли открытых Na- и К-ка-налов, т. е. изменения величин у и а. Поэтому для понимания наблюдаемой картины необходимо обратиться к описанию свойств того механизма, который обеспечивает открывание и закрывание каналов. Этот механизм получил название ворот канала, причем принято различать активационные (т) и инактивационные (/г) ворота. На рис. 2.3 схематически показаны три основных состояния ионного канала, определяемых положением его активационных и инактивационных ворот: покоя (Л) — m-ворота закрыты,
Рис. 2.3. Схематическое изображениедголожения активационных (ш) и инак-тивациовных (h) ворот^натриевых^каналов, соответствующие состояния покоя (Д), активации (Б) и инактивации (В). Объяснение ум. в тексте.
а /t-ворота открыты; возбуждения (Б)л—"открыты обе пары ворот; и инактивации (В) — m-ворота открыты, а /i-ворота закрыты. Состояние Б соответствует начальному моменту деполяризации, когда m-ворота у большинства каналов уже открываются, а /г-во-рота еще не успевают закрыться, а состояние В — последующей стадии деполяризации, когда при открытых m-воротах инактивационные fe-ворота уже успевают закрыться. В состояниях покоя и инактивации канал является непроводящим. Нетрудно, однако, увидеть принципиальные различия между этими двумя непроводящими состояниями. В покое (Д) канал закрыт, hoj он может быть открыт деполяризующим стимулом. При инактивации же канал закрыт и уже не может быть переведен в проводящее состояние путем дополнительной деполяризации мембраны.
Для того чтобы открыть инактивационные ворота, необходимо прекратить деполяризацию, т. е. вернуть мембрану к потенциалу покоя. Поскольку активационные ворота быстрее реагируют на сдвиг мембранного потенциала, чем инактивационные, в первый момент реполяризации создается ситуация, при которой и те и другие ворота оказываются закрытыми. Лишь позднее, при уже закрытых m-воротах, открываются А-ворота и канал переходит в состояние покоя (Д).
Вполне понятно, что если деполяризацию мембраны прекратить прежде, чем успеет развиться инактивация данного капала, последний из открытого сразу же перейдет в состояние покоя в результате быстрого «захлопывания» m-ворот. Временной ход восстановления gxa в этом случае показан на рис. 2.1, Б штриховой линией.
2.2. МАТЕМАТИЧЕСКАЯ МОДЕЛЬ ВОЗБУДИМОЙ МЕМБРАНЫ
2.2.1. ГИГАНТСКИЙ АКСОН КАЛЬМАРА
Для формального описания зависимости g^a и ёк в мембране гигантского аксоиа кальмара от потенциала Е и времени t Ходжкин и Хаксли [99] предложили следующие эмпирические уравнения.
Для натриевой системы:
= (4)
m = a„(i—m) — $„-т, (5)
Л = ай(1-й)-₽А.Л. (6)
Для калиевой системы:
£к = £кп*> <7)
П = М1 — п) — £„• п. (8)££
В этих уравнениях т и п— безразмерные переменные натриевой и калиевой активации соответственно. При деполяризации мембраны они могут возрастать в пределах от 0 до 1; Л — переменная натриевой инактивации, увеличивающаяся при гиперполяризации и снижающаяся при деполяризации в пределах от 0 до 1; affl; и аи, — константы скоростей натриевой и калиевой активации. ад, — константы скоростей натриевой инактивации. Все а и £ зависят только от потенциала, но не от времени (рис. 2.4). g^a и g& —константы натриевой и калиевой проводимостей, соответствуют тем максимальным значениям, которые могут быть достигнуты при сильной деполяризации мембраны в отсутствие инактивации.
В приведенной системе уравнений отсутствует переменная калиевой инактивации. Объясняется это тем, что процесс калиевой инактивации был обнаружен в гигантском аксоне кальмара лишь много лет спустя [66 J после того, как была сформулирована модель Ходжкина—Хаксли. Однако и в настоящее время этот процесс количественно недостаточно изучен. Он имеет существенное значение для описания поведения мембраны при очень длительных многосекундных сдвигах потенциала, но им можно пренебречь при количественном анализе механизмов генерации потенциала действия, имеющем длительность порядка миллисекунд.
Приведенная система уравнений не учитывает также и процесса медленной натриевой инактивации, развивающегося при длительной деполяризации мембраны [10, 14, 23, 24, 54]. В отличие
4 Общая физиология нервной системы
49
от классической, быстрой натриевой инактивации, характеризующейся постоянной времени порядка единиц миллисекунд, медленная Na-ипактивация имеет постоянные времени порядка сотен миллисекунд (первый компонент) и минут (второй компонент). Медленная натриевая инактивация не успевает развиться во время генерации ПД, поэтому ею можно пренебречь при моделировании нервного импульса. Однако при анализе влияния различных физических и химических агентов на мембрану нервного волокна медленная инактивация обязательно должна учитываться,
Ряс. 2.4. Зависимости констант скоростей ая1, р4„, ап, j3„(/1) и стационарного уровня Л(Лт) (Б) от потенциала в гигантском аксоне кальмара при 20° С; рассчитано по уравнениям Ходжкина—Хаксли [99].
поскольку она вносит существенный вклад в изменения параметров возбудимости и ПД.
Простейшая вероятностная интерпретация приведенных выше уравнений в рамках гипотезы о воротах канала такова. Активационные ворота состоят из трех независимых субъединиц, каждая из которых может находиться в положениях 0 — закрыто или 1 — открыто. Ворота открываются для движения иона только тогда, когда все три субъединицы занимают положение 1.
Если т — доля субъединиц, находящихся при данном Е в данный момент времени в открытом состоянии, то т? — доля каналов, у которых все три субъединицы открыты.
Инактивационные ворота состоят только из одной субъединицы, которая также может находиться в положениях 1 и 0. Соответственно h в уравнении (4) — доля каналов, инактивационные ворота которых открыты.
Понятно, что произведение m?h соответствует доле каналов, находящихся в проводящем состоянии, т. е. величине у в уравнении (1). В то же время £дга — максимальная натриевая проводимость единицы площади мембраны при т =1 и h=i равна произведению общего числа каналов Л/кя на проводимость каждого ИЗ НИХ В открытом СОСТОЯНИИ gNa-
Предполагается, что в калиевых каналах'активационные ворота состоят из 4 независимых субъединиц, могущих занимать положение 0 и 1. Канал открыт только в том случае, если все эти субъединицы находятся в положении 1. Следовательно, о=п4, a — определяется произведением Мк-£к-
В рассматриваемом варианте физической модели константы скоростей ат, ак и ап характеризуют скорости перехода субъединиц соответствующих ворот Na- и К-каналов из положения «закрыто» в положение «открыто». Константы же рм, рА и — скорости перехода этих субъединиц в закрытое состояние.
Состояние О Д» состояние 1
Закрыто £— открыто
При сдвиге мембранного потенциала ступенью переменные т, п, h изменяются во времени по экспоненте; постоянные времени т этих изменений составляют:
%, \^ = 1%-[-₽А).
Стационарные значения указанных переменных при данном потенциале Е:
= + «оо = ав/(ая4-Р„); 7гго = аА/(аА -{- рА).
Далее будут кратко изложены данные новейших исследований, направленных на проверку правомерности такой гипотезы. Мы хотели бы лишь напомнить, что сами авторы математической модели всегда подчеркивали, что предложенные ими уравнения являются эмпирическими и претендуют лишь на то, чтобы в первом приближении дать описание реально существующей в мембране зависимости ионных проводимостей от потенциала и времени.
2.2.2. ИОННЫЕ ТОКИ ЧЕРЕЗ ОТКРЫТЫЕ КАНАЛЫ
Силой, движущей ионы через открытые каналы, является электрохимический градиент, т. е. разность между величиной мембранного потенциала Е в данный момент времени и равновесным потенциалом для соответствующего иона Ek и т. д.
В гигантском аксоне кальмара, находящемся в морской воде с [К ]0 20 мМ при 20° С
^^lnW=25,nS—75 мВ’
а £ка=-^-1п» = +55 мВ.
В гигантском аксоне кальмара было найдено, что отношения между силой ионного тока и электрохимическим градиентом для данного иона в любой момент времени динеины. Это означает,
И
4*
что для описания этих отношений могут быть использованы выражения, подобные закону Ома:
Лча= ^Na С® ^Na)> (®)
Л<~£к(^ ^к)" (Ю)
Здесь и далее; Е — внутренний потенциал волокна минус наружный, принятый за нуль.
Аналогичное уравнение дается для тока утечки:
I^g^E-E^. (И)
Величина Et, по данным Ходжкина и Хаксли [99], варьирует у различных гигантских аксонов в пределах от —56 до —38 мВ, a g; — от 0.13 до 0.50 ммо/см2, средняя — 0.24 ммо/см2.
Заметим, что электрохимические потенциалы для ионов Na и К удобно выражать и в относительных единицах: вместо Е, Е^а, Ек и можно взять величины V, Fn.,, Ук и Уг, показывающие, насколько Е, Е^а, Е& и Е, отличаются от потенциала покоя Ег.
V = E — Er, V^a — E-^a — Er, Vk—Ek—Ег> Vl — El — Ег.
Соответственно
Е — Ек — V — Ук и Е — £Na = y — yNa, E-E^V-- У;.
Общий ток, протекающий через мембрану, представленную эквивалентной схемой рис. 2.1, А, равен алгебраической сумме емкостного тока Ic=CdVIdt, обусловленного изменением плотности ионов на наружной и внутренней поверхностях мембраны и общего ионного тока:
Л = ^Ка + ^к + Л-
В последнее время выяснилось, что в мембране гигантского аксона кальмара наряду с натриевыми и калиевыми электровоз-будимыми каналами существуют также специальные кальциевые каналы [37, 123]. Однако поскольку кальциевый ток через эти каналы очень мал (см. [123]), им можно пренебречь при описании электрического поведения мембраны гигантского аксона.*
На рис. 2.5, А показаны четыре основных компонента мембранного тока в гигантском аксоне кальмара. Как видно, емкостный ток Jc при данной скорости развертки имеет вид быстрого начального пика, 1} мал и не изменяется па протяжении всей депо-
* Функциональное значение входящего /са в нервных волокнах пока не вполне ясно. Весьма возможно, что поступающие в аксоплазму Са11 обеспечивают активацию метаболических процессов, сопровождающих ПД. В пре-синаптических терминалях повышение [Са]; инициирует секрецию медиатора [36, 106].
ляризующей ступени. 7 Na при данной амплитуде деполяризующего стимула от —60 до 0 мВ имеет входящее направление и повторяет временной ход изменений gNa (см. рис. 2.1, Б), начальный подъем 7Na связан с активацией (рост т3), а последующее падение 1на —
с инактивацией (снижение 7г) натриевых каналов.
Калиевый ток 1К имеет выходящее направление, причем скорость активации К-каналов (рост /г4) в нормальных условиях близка к скорости натриевой инактивации.
Зависимость пика 7ка и величины 7g от мембранного потен-
Рис. 2.5. Ионные токи в мембране гигантского аксона кальмара.
А — четыре компонента суммарного ионного тока, возникающего в ответ на смещение мембранного потенциала от —60 до 0 мВ; и -О — емкостный, натриевый, калие-
вый токи и ток утечки*, Б — слева семейство кривых, характеризующих временной ток изменений суммарного ионного тока при различных смещениях мембранного потенциала. Цифры над кривыми — сдвиг потенциала в сторону деполяризации ог уровня потенциала покоя. Справа — зависимость пиковых (Jp) и стационарных (Ц) величин суммарного ионного тока от потенциала [531.
циала показана па рис. 2.5, Б. Как видно, с увеличением деполяризующей ступени пиковая величина /ма Jр вначале возрастает, достигает своего максимума, а затем снижается, падает до нуля и меняет свой знак. Обусловлено это тем, что при увеличении В gNa повышается, а Е—Е^а падает (Е приближается к T?Na). До тех пор пока увеличение gNa превышает падение Е—Ец&, входящий натриевый ток усиливается. Но когда д.ха приближается к своему максимуму, ведущую роль в изменениях 7ыа приобретает величина Е-T?Na- Теперь повышение Е ведет к снижению 7ца,
и когда Е становится равным 7\а (примерно при 2?=+55 мВ), Лга становится равным нулю. При дальнейшем усилении деполяризации, т. е. при Е > 2?яа, ^Na приобретает выходящее направ
0.5 мс
ление.
Зависимость 7ка °т Е—Е^а в особенно наглядной форме выявляется в момент выключения деполяризующегося стимула. Как видно из рис. 2.6, внезапная реполяризация мембраны в период повышения £\а
Рис. 2.6. Временной ход изменений /Na D перехвате Ранвье лягушки на включение (|) и выключение ( f ) деполяризации V =46 мВ [131].
вызывает кратковременное резкое усиление входящего 7Na. Объясняется это тем, что при реполяризации Е—Е«а мгновенно возрастает, а еще не успевает снизиться. Лишь в даль
Рис. 2,7. Зависимость пиковой величины натриевой проводимости (^а) и стационарного уровня gK (в конце 10 мс деполяризующей ступени) от мембранного потенциала (кривые построены по данным [99]).
нейшем падение g>ra ведет к уменьшению 7ца До исходной низкой величины. В отличие от 7на, /к с увеличением Е все время возрастает, поскольку при этом повышается как^ц, так и электрохимический потенциал Е—Ек.
Зависимости проводимостей gNa и g& от Е, рассчитанные по уравнениям Ходжкина—Хаксли, показаны на рис. 2.7.
2.2.3. МЕМБРАНА МИЕЛИНИЗИРОВАННОГО
НЕРВНОГО ВОЛОКНА
Основные закономерности, установленные методом фиксации напряжения на гигантских аксонах кальмара, оказались приложимы не только к мембранам других безмякотнцх 54
аксонов беспозвоночных животных (гигантские аксоны ракообразных, червей и др.), но и к миелинизированным нервным волокнам позвоночных амфибии, птицы, млекопитающих. Обнару-я;енпые различия между свойствами этих мембран имеют лишь количественный характер.
Наиболее детально количественный анализ зависимостей про-ницаемостей и токов от мембранного потенциала в миелиниизи-рованных волокнах был проведен Франкенхойзером [75] на перехватах Ранвье африканской жабы Xenopus laevis и Доджем [59 ] на перехватах лягушки Rana pipiens.
Остановимся здесь лишь на некоторых наиболее важных особенностях мембраны перехвата Ранвье.
1. В отличие от того, что имеет место в гигантском аксоне кальмара, в перехватах Ранвье миелинизированных нервных волокон мгновенные* * значения /ха и /к находятся в нелинейной зависимости от потенциала. Поэтому для описания ZNa и 7к Додж и Франкенхойзер {60] предложили пользоваться не законом Ома, а уравнениями Голдмана [79] для ионных потоков через небиологические полупроницаемые мембраны (см. обзор [13, 141).
1 — Р [Ка]„-|Na]f ехр(£/7ЯГ)
/Na—^Na RT \—^p{EF!RT) ’ '
r EF* [K]0-[KJjeXp(£mr) ,-nv
K— K RT 1 — exp (E F/RT) '
В этих уравнениях PNa и Рк — коэффициенты натриевой и калиевой проницаемостей, которые, в отличие от gNa и Sk, не зависят ни от концентрации иопов в растворе, пи от направления ионного тока через открытые каналы.
2. Временной ход изменений PNa и Рк в перехватах X. laevis может быть лучше описан, если переменные т и п взять во второй степени (а не в 3-й и 4-й, как у гигантского аксона кальмара).
PNa=PNam%, (14)
Рк = Ркп*к, (15)
где PNa и Рк — константы натриевой и калиевой проницаемостей, соответствующие максимальным величинам PNa и Рк (при т=1, А=1, п~1 и к~1), а к—переменная калиевой инактивации. Здесь сразу следует подчеркнуть, что указанные отличия в степенной функции т и п не имеют принципиального характера. Так, Додж [59] обнаружил, что в перехватах Ранвье R. pipiens изменения натриевой и калиевой проницаемостей токов могут быть хорошо аппроксимированы с помощью уравнений:
Рла—Ркатък (14а) и gb = gknl- к. (16)
* Мгновенными или моментальными называют величины ионных токов, регистрируемые в первый момепт смещения потенциала, когда ионные проводимости еще не успевают измениться под влиянием этого сдвига.
Для описания зависимости переменных т, п и йот потенциала и времени используются те же уравнения, что и в модели гигантского аксона кальмара [уравнения (5), (6), (8)).
3. Особенностью мембраны перехватов Ранвье является высокая проводимость утечки, В то время как у гигантских аксонов кальмара g}=0.3 ммо/см2, в перехватах Ранвье составляет около 30 ммо/см2. Именно этим и обусловлено низкое сопротивление покоящейся мембраны перехвата (на единицу площади) и соответственно малая величина постоянной времени мембраны t—RC (см, с. 44).
4. В опытах на Rana esculenta наряду с классическим 7ма найден также натриевый ток 7иа, характеризующийся тем, что он не инактивируется даже при длительной (сотни миллисекунд) деполяризации мембраны. Величина Рна для этого позднего тока составляет лишь 2% от PNa раннего 7n3 [63),
Можно полагать, что Лха протекает через Na-каналы, лишенные инактивационных ворот.
Неинактивирукнцийся /ма не следует смешивать с поздним неспецифическим током I , обнаруженным в перехватах Ранвье X. laevis Франкенхойзером [72]. Этот ток обнаруживается после окончания продолжительного деполяризующего толчка. Он имеет входящее направление и убывает с постоянной времени порядка 1 мс, что значительно превышает т)Л, но меньше хя. Франкенхойзер полагал, что Iр переносится главным образом ионами Na, и потому для его количественного описания предложил уравнения, подобные тем, которые были приняты для описания ?Na [уравнения (12), (14)]. Последующие исследования показали, однако, что I связан с накоплением ионов К, выходящих из волокна во время его деполяризации в околомембранное пространство. Воздействие на перехват агентов, блокирующих К-каналы, устраняет наряду с /к также и I р (см. ниже).
(5. Калиевая инактивация в мембране перехвата Ранвье представляет собой двухфазный процесс [140]. При 21° С постоянная времени т). первой, быстрой, фазы составляет около 0.6 мс, а постоянная времени второй фазы в зависимости от Е варьирует в пределах от единиц до десятков секунд и с увеличением Z?K возрастает. В перехвате Ранвье, так же как и в гигантском аксоне кальмара, калиевая инактивация даже при сильной деполяризации остается неполной кт > 0 (рис. 2.8).
6. Так же как классическая модель гигантского аксона кальмара, модель мембраны миелинизированного нервного волокна не учитывает факта существования медленной инактивации натриевых каналов.
Судя по данным, полученным в опытах на лягушках Rana temporaria и R. ridibunda [10, 14], в состояние медленной инактивации переходят только те натриевые каналы, которые в процессе деполяризации уже подвергались быстрой инактивации, характе-56
ризующейся постоянной времени тд. Обязательным условием для перехода канала из состояния быстрой инактивации в состояние медленной инактивации является присутствие ионов К+ в наружном растворе. В бескалиевом растворе Рингера эти инактивации практически отсутствуют, и /'ыа после секундной сильной деполяризации мембраны так же быстро возвращается к исходной величине, как и после 50 мс деполяризации, обычно используемой для исследования быстрой инактивации. В присутствии же наруж-
20с Юс
Рис. 2.8. Калиевая инактивация в перехвате Ранвье Xenopus laevis.
Вверху — программа стимулов. У, — кондиционирующий препульс (—20 мВ). Длительность 5 с для всех записей. Потенциалы Уг и У, показаны цифрами над каждой записью токов. у у — 33 мс тестирующий стимул длительностью 3 мс, имеющий ту же амплитуду, что и У2, —стационарный калиевый ток; I; —ток утечки. Истинная последовательность проведения измерений в эксперименте а, б, в, г. Точками показан уровень нулевого тока при 20° С [140].
ного К+ после 1 с деполяризующей ступени ионные токи на тестирующие стимулы восстанавливаются с постоянной времени порядка сотен мс (рис. 2.9), причем с увеличением [К]„ скорость развития медленной инактивации и доля Na-каналов, переходящая при данном Е в состояние инактивации, увеличиваются.
На рис. 2.9, Б показаны кривые, характеризующие зависимости стационарных величин ha> (доля натриевых каналов, свободных от быстрой инактивации) и (доля каналов, не перешедших в состояние медленной инактивации) от мембранного потенциала. Как видно, обе кривые имеют одинаковую сигмоидальную форму, однако в то время как hm ири больших Е сильной деполяризации становится равной нулю, в этой области значений потенциала она устанавливается на некотором постоянном, отличном от нуля уровне. С увеличением (К этот уровень закономерно снижается,
повышение же |Са]0 поднимает уровень минимальных значений s™'“ и СдВИГает кривые sa—Е мка —Е вдоль оси напряжения вправо в сторону больших Е.
Наряду с рассмотренной медленной инактивацией, характеризующейся постоянной времени т* порядка сотен миллисекунд.
Рос. 2.9- Медленная натриевая инактивация в мембране перехвата Ранвье.
А — временной ход восстановления после окончания длительной деполяризации, 70 — исходная величина на тестирующий деполяризующий толчок (Етост)- 1(0^ пики 1 jsja на тестирующие толчки, приложенные через различные интервалы времени после окончания кондиционирующей деполяризации (V) 1 с длительности. Ij — пик в когце деполяризующей ступени, 1СХ — экстраполированная величина 7ла. Отношение ItIIv используется для оценки Л^, а отношение /₽лг/70 —для измерения з^ — доли натриевых каналов, свободных от медленной инактивации: В — кривые — Е и ^-£[16].
в перехвате Ранвье [69 J и гигантском аксоне кальмара [24] найдена также «сверхмедленная» натриевая инактивация, имеющая постоянные времени порядка минут.
7. В гигантском аксоне кальмара температурные коэффициенты ()10 постоянных времени процессов активации и инактивации Na- и К-каналов были оценены Ходжкином и Хаксли [991 величиной 3.
В миелинизированных нервных волокнах, но данным, полученным на аксонах X. laevis, величины (?10 констант скоростей этих процессов таковы: а„, — 1.8, — 2.7, аА — 2.8, — 2.9, ал —
3.2, рм — 2.8 [76]; р10 постоянной времени калиевой инактивации тд_=2.8; р]0 для а для [140].
2.2.4. ЭКСПЕРИМЕНТАЛЬНОЕ РАЗДЕЛЕНИЕ ОБЩЕГО ИОННОГО ТОКА НА ЕГО КОМПОНЕНТЫ
Существует несколько экспериментальных приемов разделения суммарного ионного тока на составляющие его компоненты.
Входящий 7fja может быть полностью устранен путем замены ионов Na+ в наружном растворе на непроникающие органические катионы — холин, Трис+, тетраметилдммоний. При этом, однако, 58
начальный выходящий ток, связанный с движением ионов Na из волокна в наружный раствор, сохраняется.
Полное и высоко избирательное подавление как входящего, так и выходящего INa может быть получено путем воздействия на наружную сторону мембраны нервного волокна тетродотоксина (ТТХ) или сакситоксина (STX).
На рис. 2.10 показаны изменения ионных токов, вызываемые воздействием ТТХ на мембрану перехвата Ранвье лягушки.
Рис. 2.10, Разделение суммарного ионного тока на его компоненты с помощью тетродотоксина (ТТХ).
А: а — перехват в растворе Рингера, б — после добавления ТТХ (ЗХ1(Н М). Б — рассчитанные с помощью уравнений типа Ходжкина—Хаксли (см, [59]) изменения ионного тока при блокаде INa. Ионные токи соответствуют потенциалам в диапазоне от —60 до + 75 мВ. Амплитуда каждой ступени — 15 мВ. Ток утечки автоматически вычитали [91].
Обращает на себя внимание поразительное сходство экспериментально наблюдаемых и рассчитанных с помощью уравнений эффектов блокады натриевого тока.
Сходные результаты были получены при воздействии ТТХ и STX на гигантские аксоны омара, рака [143], кальмара [126]. Нечувствительными к ТТХ оказались только натриевые каналы нервных волокон тех животных, которые являются продуцентами этого токсина (например, рыбы Spheroides maculatus и тритона Taricha torosa [126]).
Для блокады калиевого тока применяют обычно тетраэтил-аммоний (ТЭА). В гигантских аксонах кальмара ТЭА эффективен только при его внутриаксональном применении [152], при этом подавляется лишь выходящий 7к- Входящий же I&, возникающий при деполяризации мембраны в гиперкалиевом наружном растворе, полностью сохраняется [29, 33].
В отличие от этого в перехватах Ранвье миелинизированных нервных волокон ТЭА эффективен как при наружном, так и внутри-аксональном (через перерезанный межперехватный участок) применениях [34, 89, 109, 110, 114[.
Рис. 2.11, А иллюстрирует изменения общего ионного тока при воздействии ТЭА на мембрану перехвата Ранвье. Как видно, эти изменения хорошо воспроизводятся на модели мембраны
Рис. 2.11. Специфическое блокирование калиевого тока в мембране перехвата Ранвье при действии 6 мМ ТЭА.
А — экспериментальные записи; Б —данные расчетов с помощью уравнений [591. Ток утечки автоматически вычитали [91].
(рис. 2,11,7?) при изолированном блокировании калиевого тока (Рк > 0).
Наряду с агентами, оказывающими прямое блокирующее действие на ионные каналы, в последние годы найдены вещества, более или менее специфически влияющие на процессы натриевой активации и инактивации. Так, установлено, что при внутренней перфузии гигантского аксона кальмара раствором, содержащим протеолитический фермент проназу, натриевые каналы полностью утрачивают способность к инактивации [32], в то время как натриевая активация не претерпевает заметных изменений (рис. 2.12, А).
В опытах на миелинизированных нервных волокнах избирательное нарушение процесса Na-инактивации может быть достигнуто путем введения внутрь волокна аниона Ю3 [146].
Алкалоид растительного происхождения вератридин как при наружном, так и при внутриаксональном применении нарушает деактивацию натриевых каналов, т. е. закрывание m-ворот после того, как они были открыты деполяризующим стимулом, и одновременно тормозит развитие процесса инактивации. Судя по имеющимся данным (см. обзор 116}), вератридин взаимодействует с натриевыми каналами, у которых одновременно открыты и акти
вационные, и инактивационные ворота.
Способностью удерживать активационные ворота в открытом
Рис. 2.12. Нарушение механизма натриевой инактивации при действии проназы (/) и батрахотоксина (//).
I — входящий в гигантском аксоне кальмара. А — через 128, Б — через 448 и В через 724 с после начала внутренней перфузии аксона проназой. Калиевый ток подавлен с помощью ТЭА. Из сопоставления записей А л Б следует, что полувремя инактивации не зависит от того, является ли инактивация полной (А) или частичной (Б). Г—для сравнения наложены записи А и Б [32J. JJ — неинакти-вир^ющийся входящий 1доа через модифицированные батрахотоксином натриевые каналы в мембране перехвата Ранвье. Деполяризующая ступень от поддерживаемого потенциала —12Q до —7S мВ [17 ].
состоянии после окончания деполяризующего стимула обладает также инсектицид ДДТ.
Алкалоид^животного_происхождения батрахотоксин (ВТХ) (см. [27]) вызывает драматические изменения свойств натриевых каналов [107]: выключается механизм инактивации, в то же время каналы приобретают способность активироваться уже при тех потенциалах —90, —110 мВ, при которых активационные ворота большинства нормальных каналов находятся в закрытом состоянии. Изменяется и кинетика натриевой активации - - S-образный подъем описываемый степенной функцией т, сменяется строго экспоненциальным нарастанием и соответственно
(рис. 2.12, П). Постоянная времени процесса натриевой активации возрастает в 5—10 раз. Вместе с тем падает избирательность каналов к ионам Na (см. ниже) и резко снижается их чувствительность к блокирующему действию таких местных анестетиков, как новокаин, тримекаин, ксилокаин, QX-572.
Качественно сходные с этими изменения свойств каналов вызывает растительный алкалоид аконитин [10, 138].
Представляет большой интерес, что батрахотоксин и аконитин влияют не только на воротную функцию натриевых каналов, но изменяют также их ионную селективность (см. с. 98). Поскольку
эти яды необратимо связываются с рецепторными группами мембраны, применение их в меченой форме, возможно, позволит экстрагировать из мембран компоненты каналов.
Яд африканского скорпиона Letrus поражает главным образом инактивационные ворота: натриевая инактивация резко замедляется и становится неполной. Одновременно несколько сдвигается влево, в сторону отрицательных Е, кривая —Е, так как это происходит при снижении наружной концентрации ионов Са++ [112, ИЗ].
Яд южноамериканского скорпиона Centruroides sculpturatus в отличие от яда Leirus, не влияет на процесс натриевой инактивации, но очень своеобразно изменяет натриевую активацию: после окончания короткого деполяризующего стимула кривая
—Е оказывается на 40-50 мВ сдвинутой влево вдоль оси напряжения в сторону отрицательных Е, и лишь постепенно, с постоянной времени порядка сотен миллисекунд, кривая возвращается к своему исходному положению [49].
Перечисленные данные важны как для понимания взаимоотношений между процессами активации и инактивации изменений потенциала покоя, потенциала действия, следовых потенциалов, возбудимости, аккомодации, способности к ритмической активности, которые возникают при действии указанных агентов на нервные волокна в эксперименте или при токсических поражениях этими ядами человека и животных.
2.3. ИОННЫЕ МЕХАНИЗМЫ ГЕНЕРАЦИИ МЕМБРАННЫХ ПОТЕНЦИАЛОВ ПОКОЯ И ДЕЙСТВИЯ
После краткого обзора данных, полученных методом фиксации потенциала, перейдем к рассмотрению нормального электрического поведения мембраны, при котором ионные токи могут изменять мембранный потенциал.
2.3.1. ПОТЕНЦИАЛ ПОКОЯ
В покоящейся мембране алгебраическая сумма ионных токов равна нулю. При этом, т =0, п =0 и h =0. Потенциал Е, при котором достигается это состояние равновесия потенциал покоя, у различных волокон варьирует в пределах от —60 до -75 мВ. Основоположник мембранной теории Бернштейн [42, 43] полагал, что в состоянии покоя мембрана нервного волокна обладает избирательной проницаемостью для ионов К+ и потому величина потенциала покоя Ег должна соответствовать калиевому равновесному потенциалу рассчитанному по формуле Нернста. Непосредственные измерения с помощью внутриклеточных микроэлектродов показали, однако, что потенциал покоя нервных волокон существенно отличается от £к (табл. 2.1). Выяснилось также, что линейные отношения между In [К]о и Ег, которые
Таблица 2.1
Соотношения между калиевым равновесным потенциалом п потенциалом покоя в различных нервных волокнах
Волокно [КJo мМ [KJ,- мМ Е, мВ Ег, мВ Источник
Гигантский аксон кальмара Loligo ......... 10 400 -89 -50 198]
Гигантский аксон Mi/xicola 10 320 -83 -69 [81]
Мпелпипаированное волокно амфибий Xenopus loeuls 2.5 120 -97 -70 [75]
предсказывает гипотеза Бернштейна, имеют место только в области высоких [К]о — 20-- 50 мМ (рис, 2,13), При низких же [К]о, т. е. в условиях, приближающихся к нормальным, кривая Е значительно отклоняется от теоретической, рассчитанной по формуле Нернста.
Рис. 2.13. Зависимость потенциала покоя от наружной концентрации ионов К+.
А — гигантский аксон кальмара, По оси абсцисс — концентрация ионов К+ в величинах, кратных исходной концентрации (13 мМ) в морской воде (логарифмическая шкала); по оси ординат — изменение трансмембранной разности потенциалов по отношению к потенциалу покоя, принятому за куль [102]. Б — перехват Ранвье лягушки. По оси абечисс— концентрация ионов К+ в мМ (шкала логарифмическая); по оси ординат — абсолютные величины трансмембранной разности потенциалов. Прерывистой линией показан наклон кривой Ек, рассчитанного по формуле Нернста [13J.
Для объяснения этого отклонения Ходжкин и Катц [102] предположили, что потенциал покоя нервного волокна определяется не только калиевым, но также натриевым и хлорным равновесными потенциалами и что вклад каждого из них в величину потенциала покоя зависит от относительной проницаемости мембраны для указанных ионов.
При разработке количественной стороны этой гипотезы авторы исходили из предположения, что ионы движутся в мембране под
влиянием диффузии и электрического поля таким же образом, как и в свободном растворе. Принималось также, что напряженность электрического поля в мембране постоянна (V/a=const, где а — толщина мембраны, V — разность потенциалов), т. е. потенциал падает по толщине мембраны линейно («теория постоянного поля») [79].
Опираясь на эти и некоторые другие положения, Ходжкин и Катц вывели уравнение
„ RT , [KL + PNa lNab + ^Ci [CIL
й —Рк [К],; + PNa |NaL; + РС1 fC]J„ ’ 4
«уравнение постоянного поля», широко используемое в современной физиологии.
Оно предсказывает, что в тех случаях, когда Рк значительно превышает Рыа и Рщ, потенциал покоя должен приближаться к Ек- При низком же Рк существенный вклад в величину потенциала ПОКОЯ ДОЛЖНЫ ВНОСИТЬ Ецл И Eci.'
Подставляя известные из химических измерений концентрации активности ионов К+, Na+ и С1~ в аксоплазме гигантского аксона кальмара, Ходжкин и Катц'нашли, что у покоящегося гигантского аксона кальмара, находящегося в растворе, соответствующем составу морской воды, должны иметь место следующие соотношения коэффициентов проницаемостей:
PK:PNa:Pci = l: 0.04:0.45.
В этом случае удается хорошо описать сдвиги Е при вариациях [К]0 в диапазоне от 1 до 15 мМ (рис. 2.13, А, кривая 7). При увеличении же [К]„ от 15 до 150 мМ, когда развивается сильная деполяризация мембраны (рис. 2.13, А, кривая 2), необходимо принять, что отношения проницаемостей меняются в сторону более значительного превышения Рк над Риа и Ра-
Рк:Рка:РС1 = 1:0.025:0.3.
Дальнейшие исследования, проведенные на изнутри перфузированных гигантских аксонах [38], показали, однако, что ионы С1“, по-видимому, не вносят заметного вклада в величину потенциала покоя — замена КС1 на K3SO4 во внутреннем растворе приводит лишь к очень небольшому изменению Е — последний с —60 увеличился до —55 мВ. Поэтому уравнение (15) было упрощено:
ЯТ IKL+MNab
F in [К]. + ь , (18)
где Ь =Рцл!Рк-
Расчеты показали далее, что при низких [К]о (от 0 до 50 мМ), когда мембрана сильно деполяризована, зависимость Е от 1К]0 может быть описана уравнением (17), если принять, что PNa/PK —
=0.03. При более высоких значениях [К ]s наблюдаемы» изменения потенциала покоя свидетельствуют о понижении Р^ц/Рк до 0.08 за счет падения Рк, вызванного приближением Е к—60 мВ.
В опытах на изнутри перфузированных аксонах было обнаружено также, что снижением наружной концентрации ионов Na+ до 1 мМ или блокада натриевых каналов с помощью ТТХ [127 J вызывает сдвиг Е в сторону гиперполяризации на —7 мВ.
Противоположное влияние на потенциал покоя оказывают «активаторы натриевой проницаемости» батрахотоксин, аконитин, вератридин, граянотоксин [126]. Все они повышают Рыа покоящейся мембраны и вызывают сильную деполяризацию вплоть до реверсии’мембранного потенциала.
Важные, но несколько неожиданные дляУрассматриваемой теории потенциала покоя данные были получены в опытах на гигантских аксонах морского червя Myxicola.
У этих волокон кривая зависимости потенциала покоя от наружной концентрации ионов К имеет тот же вид, что и у гигантских аксонов кальмара: в области [К]о =50 мМ эта кривая приближается к теоретической, рассчитанной по формуле Нернста, а при более низких [K]fl между Е и Ец обнаруживаются значительные отклонения, которые, казалось бы, свидетельствуют о существенном вкладе в величину потенциала покоя других ионов.
Исследование показало, однако, что замена ионов СР на SO7 в наружном растворе не сказывается на величине потенциала покоя. Не изменяется потенциал покоя и при удалении из этого раствора ионов Na+ (замена NaCl на сахарозу или Трис+ [80, 811). Можно было бы предположить, что у аксонов Myxicola мембрана окружена неким «защитным», плохо перемешиваемым слоем, вследствие чего изменения ионного состава раствора мало сказываются на примембранной концентрации этих ионов. Против этого свидетельствует, однако, тот факт, что, в отличие от потенциала покоя, потенциал действия аксона чрезвычайно чувствителен к наружному Na+: уменьшение Na+ ведет к падению овершута в соответствие с формулой Нерпста для ЕКа.
Нечувствительным оказался потенциал покоя волокон Myxicola и к блокаде натриевых каналов с помощью ТТХ [461, что также находится в противоречии с предсказаниями уравнения Гольдмана.
Еще большие трудности возникли при исследовании природы потенциала покоя миелинизированных волокон.
Опыты показали, что деполяризация мембран перехвата Ранвье избытком ионов К+ в растворе может быть резко ослаблена или даже полностью устранена путем добавления в среду блокатора калиевых каналов ТЭА [151, 118, 15J.
Понять такой эффект можно было бы, предположив, что при низкой Рк величина потенциала покоя определяется в основном хлорным равновесным потенциалом. Однако замена ионов С1“ в наружном растворе на другие анионы — пропионат, ацетил-
5 Общая физиология нервной системы 65
глицинат, метилсульфат и др., которые считаются обычно непроникающими через хлорные каналы, — не ослабляют реполяризующего действия ТЭА. Не устраняется последнее и при ингибировании активного транспорта ионов Na+ с помощью убаина или динитрофенола [7].
Резкое ослабление деполяризующего действия избытка ионов К.+ в растворе может быть достигнуто и путем сильной гиперполяризации мембраны перехвата с помощью постоянного тока [154], поскольку при этом Рк оказывается резко сниженной.
Штемпфли [145] обнаружил, что хорошо отпрепарованные нервные волокна мало чувствительны к повышению 1К]а в пределах от 0 до 20 ммоль и лишь при более высоких [К ]в возникает Скачкообразная деполяризация мембраны. В настоящее время автор уточняет, что дело идет главным образом о сенсорных волокнах, обладающих низкой Рк в покое (см. [147]).
Шмидт [137] подсчитал, что для описания кривой Е — [К]0 в области низких значений Ко (<^2.5 мМ) соотношение Pa/Pg. должно составлять примерно 1.4, что в десять раз превышает величину Ра/Рк, найденную по формуле Нернста при исследовании зависимости потенциала покоя от Ко в области [К ]0 > 10 мм (см. рис. 2.3).
Однако при РС1/РК=1.4 удаление ионов С1~ из раствора Рингера должно было бы деполяризовать мембрану перехвата на 20 мВ, между тем как в эксперименте максимальная деполяризация, наблюдающаяся при замене ионов С1~ на сульфат, метилсульфат или этансульфат, составляет всего лишь 3.5 мВ.
Таким образом, вопрос о механизме поддержания в перехвате Ранвье потенциала покоя при низкой [К]о и низких значениях Рк пока еще не получил своего разрешения (см. [28]).
2.3.2. ПАССИВНЫЕ И ПОДПОРОГОВЫЕ АКТИВНЫЕ ИЗМЕНЕНИЯ МЕМБРАННОГО ПОТЕНЦИАЛА
При прохождении гинерполяривующего или слабого деполяризующего тока через нервное волокно, когда натриевая и калиевая проводимости мембраны еще не претерпевают заметных изменений, волокно ведет себя как схема с постоянными емкостями и сопротивлениями.
На рис. 2.14, Л приведена эквивалентная схема безмякотного нервного волокна, помещенного в солевой раствор. Здесь каждый элемент мембраны представлен ячейкой, состоящей из параллельно включенных емкости Ся и омического сопротивления Ra (см. рн . 2.1, А).5Ячейки соединены'между собой сопротивлениями аксоплазмы г(, и сопротивлениями’ наружной среды га. Перед'нами эквивалентная схема кабеля; соответственно свойства волокна, которые определяются этой схемой, получили название кабельных или пассивных. Из дальнейшего (гл. IV) будет видно, что пассивные свойства мембраны и всего волокна в целом в значительной мере
определяют условия возникновения и распространения возбуждения в нервном волокне.
Основными параметрами, характеризующими пассивные электрические свойства мембраны нервного волокна, являются величины ее сопротивления Як и емкости Ск^на единицу площади, в Ом-см2 и Ф/сма, соответственно.
Для из измерения в эксперименте создают условия, при которых мембрана на определенном участке волокна становится
V
Рис, 2.14. Эквивалентная схема пассивных электрических свойств аксона при различных условиях эксперимента t
А — распределенная схема для случая, когда соседние области мембраны связаны между собой сопротивлениями внутренней аксоплазмы (г#*) и наружного раствора (г0К -В аксон шунтирован по длине осевой проволокой. Наружное сопротивление мало, так как аксон погружен в большой объем жидкости; А’о — точка подведения электрического тока.
изопотенциальной. В гигантских аксонах это осуществляется путем введения в волокно через его перерезанный конец низкоомного металлического электрода, шунтирующего сопротивление аксоплазмы. Если при этом аксон поместить в большой объем жидкости и тем самым сделать сопротивление среды пренебрежимо малым по сравнению с сопротивлением мембраны, то эквивалентная схема волокна упрощается до электрической схемы самой мембраны (рис. 2.14, В, ср. рис. 2.1, А). В миелинизированных нервных волокнах площадь мембраны перехвата очень мала — порядка 20-50 мкма. Поэтому принимается, что ток, проходящий через такую мембрану, во всех ее точках вызывает одинаковый сдвиг потенциала. Необходимо лишь устранить ветвление приложенного тока вдоль волокна в другие перехваты. Это достигается с помощью «мостиков-изоляторов»Х(воздушных, вазелиновых) и специально сконструированной электронной системы отрицательной обратной связи, автоматически нивелирующей продольный ток в межперехватном участке волокна [71].
Такая система с достаточной точностью позволяет регистрировать сдвиги мембранного потенциала, не прибегая к помощи внутриклеточных микроэлектродов, необратимо повреждающих тонкие нервные волокна.
Исследования показывают, что в однородно поляризуемом, короче, однородном участке нервного волокна изменения мембранного потенциала при приложении прямоугольного толчка гипер-поляризующего или слабого деполяризующего тока нарастают по экспоненте:
V — IR(I — е~1,кс), (19)
где: ЯС=т— постоянная времени мембраны, т.е. время, в течение которого потенциал нарастает до 63% от своей конечной величины. При выключении тока потенциал возвращается к исходному уровню по экспоненте с той же постоянной времени -г.
Такие изменения мембранного потенциала принято называть пассивными или электротоническими, в отличие от активных, связанных с повышением или снижением ионных проводимостей мембраны.
В гигантском аксоне кальмара и других безмякотных волокнах т; составляет около 1 мс, между тем как в перехватах Ранвье миелинизированных волокон она не превышает 0.06—0.1 мс. Это означает, что у миелинизированных нервных волокон скорость пассивных изменений мембранного потенциала на порядок и более выше, чем у безмякотных аксонов. Вместе с тем емкость мембраны тех и других волокон примерно одинакова и составляет 1—2 мкФ/см2. Из этого вытекает, что различия в величинах т определяются различиями сопротивлений RM этих мембран: у безмякотных волокон Rx =1000—1500 Ом-см2, а у миелинизированных волокон 30-50 Ом-см2. Низкое же Rx мембраны миелинизированного волокна, как уже указывалось, связано с высокой проводимостью утечки (см. с. 56). Таким образом, высокое gt перехватов Ранвье обеспечивает большую скорость изменений мембранного потенциала, вызываемых электрическим током, как извне приложенным, так и возникающим в самом волокне.
По понятным причинам электротонические потенциалы, вызываемые гиперполяризующим и деполяризующим токами одинаковой силы, равны по своей амплитуде, но противоположны по знаку (рис. 2.15, Л). Понятно также, что эта амплитуда находится в линейной зависимости от силы приложенного тока (В).
Симметрия в изменениях мембранного потенциала при действии на мембрану толчков де- и гиперполяризующего токов одинаковой силы нарушается, однако, при приближении силы деполяризующего стимула к порогу: происходящее при этом повышение натриевой проницаемости порождает локальный ответ, который суммируется с электротоническим потенциалом (рис. 2.15, Б),
С увеличением силы тока амплитуда локального ответа возрастает нелинейно, и при достижении суммарного сдвига потен-68
циала некоторой пороговой величины Vt возникает потенциал действия (рис. 2.15, Л).
В случае раздражения нервного волокна постоянным током на долю локального ответа приходится от 20 до 50 % общего сдвига потенциала [13, 84].
Рис. 2.15. Свойства локального ответа.
А *— изменения мембранного потенциала при действии толчков постоянного де- и гипер-поляризующего токов различной силы; Б — графическое вычитание сдвигов потенциала, вызываемых деполяризующим (сплошная линия) и гиперполяризующим (прерывистая линия) токами одинаковой силы; В — зависимость сдвига потенциала от силы приложенного стимула. Длительность толчков 0.05 мс. По оси абсцисс сила тока (деполяризую* щего — со знаком плюс, гиперполяризующего — со знаком минус) в величинах кратных цорогу, принятому за единицу; по оси ординат — сдвиги потенциала, измеренные через 0.3 мс после включения стимула, в произвольных величинах [13].
Особенно значителен локальный ответ на пороговую деполяризацию мембраны в случаях раздражения волокна короткими толчками тока. Если длительность толчка очень мала, натриевая проницаемость мембраны за время действия тока еще не успевает заметно измениться — ее нарастание происходит уже в фазу убывания электротонического потенциала. Это приводит к замедлению падения последнего и появлению горба на его нисходящей фазе. При пороговой силе тока локальный ответ оказывается достаточно большим для возникновения потенциала действия. Более подробно этот процесс будет проанализирован позднее при рассмотрении природы полезного времени раздражения.
2.3.3. МЕМБРАННЫЙ ПОТЕНЦИАЛ ДЕЙСТВИЯ
Потенциал действия, возникающий в однородном (см. выше) участке мембраны аксона, принято называть мембранным ПД — в отличие от распространяющегося импульса в целом нервном волокне. Необходимость такого различения связана с тем, что в однородной мембране генерация ПД целиком и полностью обеспечивается ионными токами /иа, /к, It, в то время как в генезе распространяющегося ПД важную роль играют также «локальные токи», возникающие между возбужденным и соседними покоящимися участками волокна.
По своей амплитуде (100—120 мВ) мембранный ПД на 20—50 мВ превышает величину потенциала покоя («овершут»). Обусловлено это тем, что в фазу подъема ПД трансмембранная разцость потенциалов не просто исчезает, как это вслед за Бернштейном долгие годы полагали исследователи, а возникает реверсия потенциала — внутренняя сторона мембраны на короткое время становится заряженной положительно по отношению к наружной [97].
Причина такой реверсии потенциала — резкое повышение натриевой проницаемости, обусловленное активацией натриевых каналов.
Первичный толчок для натриевой активации дает деполяризация мембраны, вызываемая извне приложенным током. Если эта деполяризация достаточно велика, то далее процесс развертывается по схеме:
Деполяризация мембраны
Активация натриевых каналов
Усиление входящего (при f - Е., ' 1 Na
В результате такой «регенеративной» деполяризации потенциал внутренней стороны мембраны должен был бы достигнуть величины натриевого равновесного потенциала Z?Nai поскольку в момент пика ПД Т’иа значительно превышает Р«_- В действительности, однако, этого не происходит, поскольку деполяризация, во-первых, порождает процесс инактивации, тормозящий рост PNa, а во-вторых, во время деполяризации начинает возрастать также Рк> а следовательно, и выходящий /к- Натриевая инактивация (падение Л) и рост 7к обрывают подъем ПД и обусловливают возвращение мембранного потенциала к исходному уровню, т. е. реполяризацию мембраны.
Временный ход изменений натриевой и калиевой проводимостей мембраны гигантского аксона кальмара в процессе генерации ПД показан па рис. 2.16. Экспериментальные точки полу
чены путем включения системы фиксации потенциала в различные моменты развития ПД. Как видно, восходящая фаза ПД связана с повышением а нисходящая — с падением Pn& и ростом Рк-
Модель Ходжкина—Хаксли хорошо воспроизводит экспериментально наблюдаемую картину и позволяет детально анализировать кинетику процессов активации и инактивации, а также изменений ионных токов в ходе развития ПД.
На рис. 2.17 показаны рассчитанные изменения переменных т, л и А во время генерации ПД в перехвате Ранвье.
Рис. 2,16. Временной ход изменений gNa и gK в гигантских аксонах кальмара Dosidicus (вверху потенциал покоя—78 мВ) п Loligo (внизу потенциал покоя — 64 мВ), измеренные путем фиксации потенциала в различные моменты развития спайка [14].
Как видно, снижение Рма в нисходящую фазу ПД обусловлено не только инактивацией натриевых каналов (снижение Л), но также их деактивацией (падение т), т.е. закрыванием активационных ворот. По своему знаку деактивация противоположна активационному подъему т и также имеет регенеративный характер: снижение Е (реполяризация), начавшееся под влиянием инактивации PNa и роста Рк, вызывает падение т, а это в свою очередь ускоряет снижение Рка, и т.д. Из рис. 2.17 видно, что крутое снижение т приурочено ко второй половине реполяризационной фазы ПД.
Регенеративное снижение Pn;, может быть искусственно ускорено путем нанесения достаточно сильного гиперноляризующего толчка во время нисходящей фазы ПД. В этом случае отчетливо выявляется «порог» для инициации такого регенеративного процесса. Если стимул слаб, то после его выключения мембрана вновь деполяризуется и длительность ПД не укорачивается. Но при достижении реполяризующего стимула достаточной силы ПД
круто обрывается и после окончания гиперполяризующего толчка более уже не восстанавливается.
J22 Рассмотрим теперь кинетику ионных токов, формирующих ПД.
Выше уже говорилось, что общий ток (7Д, протекающий через однородный участок мембраны, равен сумме емкостного тока Ic—Cdv!dt, связанного с изменениями’плотности^ионов на внут
Рис. 2.17. Рассчитанные изменения переменных натриевой активации (т) и инактивации (Л) и калиевой активации (п) во время развития потенциала действия (V) в перехвате Ранвье [75].
Рис. 2.18. Изменения общего ионного тока в одиночном перехвате Ранвье во время потенциала действия (2) пли локального ответа (7), вызванных коротким раздражаю-1/цщм стимулом I* [59].
ренней и внешней сторонах мембраны, и общего ионного тока обусловленного диффузией ионов через мембрану:
л=^4?+к2°)
Если раздражающий стимул имеет очень 'короткую продолжительность (т.е. обрывается до начала подъема ПД), то после окончания стимула, когда 1Я во внешней цепи становится равным нулю, а генерация потенциала действия обеспечивается только ионным током
(24)
Принимая, что емкость мембраны См во время генерации потенциала действия остается постоянной, можно легко рассчитать сдвиги If по изменениям dVldt, непосредственно регистрируемым в опыте. Пример такого расчета приведен на рис. 2.18.
Мы видим," что в период действия короткого стимула (7„) общий "ионный ток If имеет выходящее направление, затем он начинает снижаться, проходит через нуль (в момент перехода
локального ответа в восходящую фазу ПД) и на короткое время становится входящим. Пик входящего lt соответствует максимальной крутизне нарастания потенциала действия (l'max)- Затем скорость деполяризации уменьшается, и на вершине ПД общий ионный ток вновь становится равным нулю. В нисходящую фазу потенциала действия Z,- положителен, т.е. имеет выходящее направление. В конце ПД он несколько возрастает (вследствие
Рис. 249. Изменения ионных токов во время развития потенциала действия в перехвате Ранвье (4) и в гигантском аксоне кальмара (Л). Рассчитаны с помощью уравнений Ходжкина—Хаксли (13].
чего реполяризация мембраны ускоряется), а затем вновь падает к нулю.
Следующий рисунок (рис. 2.19) демонстрирует рассчитанные изменения ZK и It во время генерации ПД в перехвате Ранвье амфибий и гигантском аксоне кальмара.
Видно, что в обоих случаях кривая изменений имеет двугорбый характер. Первая вершина входящего /рга приходится на период, в течение которого рост £ыа/^ыа превышает снижение " ^Na- Затем приближение Е к приводит к падению /на, причем вершина ПД совпадает с областью седла на кривой 7ка-
В начальный период реполяризации вновь временно повышается, поскольку Е—в это время возрастает на большую величину, чем та, на которую снижается Рка (gNa)-
Из рис. 2.19, Б видно, что в гигантском аксоне кальмара суммарный выходящий ионный ток (Zr+Л), обеспечивающий реполяризацию мембраны, почти целиком является калиевым gt и соответственно 1г малы), в то время как в миели-••дамрованнои волокне (рис. 2.19, 4) на долю I, приходится
примерно половина общей величины выходящего тока. В эксперименте эти различия отчетливо выявляются при воздействии на указанные волокна блокатора калиевых каналов ТЭА.
Впервые Тасаки и Хагивара [1531 показали, что введение ТЭА внутрь гигантского аксона приводит к резкому растягиванию нисходящей фазы ПД с образованием длительного (400 мс) плато. В перехвате же Ранвье блокада калиевых каналов с помощью TEA удлиняет нисходящую фазу ПД не более чем в 2—5 раз [1].
[В связи со сказанным специального внимания заслуживает сопоставление ПД в моторных и сенсорных миелинизированных нервных волокнах.
Начало реполяризационной фазы ПД сенсорных волокон круче, чем у моторных. Отсутствует у сенсорных волокон и отчетливый перелом (плечики) на нисходящей фазе — крутизна падения потенциала на протяжении всего периода реполяризации остается примерно одинаковой. Общая длительность ПД сенсорных волокон меньше, чем у моторных. Это различие уменьшается при повышении температуры (в диапазоне от 19 до 32° С), и при 30—32° С длительность ПД тех и других волокон становится примерно одинаковой [1].
Добавление ТЭА в раствор вызывает лишь очень небольшое удлинение нисходящей фазы ПД сенсорных волокон, у моторных же волокон эта фаза удлиняется в 2—5 раз.
Все эти различия в большой мере связаны с тем, что у моторных миелинизированных волокон калиевая система играет значительно большую роль в механизме реполяризации мембраны, чем у сенсорных. Исследования методом фиксации потенциала действительно показали, что кривая п ю—Е у сенсорных волокон примерно на 10 мВ сдвинута вправо по отношению к такой же кривой у моторных аксонов 140, 47]. Различаются, по-видимому, и величины Ек у этих волокон [40, 47].
Активные свойства миелинизированных нервных волокон у теплокровных животных изучены значительно меньше, чем у амфибий. Однако, судя по данным Ноннера и Штемпфли [131], полученным на перехватах Ранвье крысы, и Бург [48], исследовавшей ионные токи миелинизированных волокон голубя, — у теплокровных животных относительный вклад /к в процесс реполяризации мембраны очень мал. При примерно одинаковой плотности Z; максимальная калиевая проводимость у амфибий в 1.5—4 раза выше, чем у голубя и крысы.
Представляет интерес тот факт, что у миелинизированных волокон бразильских амфибий (Bufo martnus icterlcus, Leptoda-ctylus ocellatus), живущих в естественных условиях при высокой температуре, калиевая система значительно менее развита, чем у европейских лягушек [22]. Пытаясь количественно охарактеризовать соотношения между 7иа и 7к в перехватах Ранвье различных животных, авторы взяли отношение 7ка шах (измеренной при сильной предшествующей гиперполяризации мембраны, т. е. при 74
, 1.0) к 1к, полученному при деполяризации мембраны до Z?Ntt. у гигантских аксонов кальмара и омара это отношение равно примерно единице; у перехватов Ранвье R. esculenta —1.4; у R. pi-niens —2.7; У Bufo marluus —3.9; у Leptodactilus ocellatus —3.9; у голубя ~4; у крысы —5—10.
3 Ввиду технических трудностей ПД тонких безмякотных волокон (С-волокон) позвоночных животных изучены пока очень мало. Судя по данным, полученным в условиях методики сахарозного моста, длительность ПД этих волокон существенно (до 10 мс) превышает длительность ПД миелинизированных аксонов.
2.3.4. СЛЕДОВЫЕ ПОТЕНЦИАЛЫ
Пик потенциала действия в нервных волокнах сопровождается следовыми колебаниями мембранного потенциала — следовой деполяризацией или следовой гиперполяризацией. Амплитуда этих потенциалов не превышает нескольких милливольт (5—10% от высоты пика), а длительность их у различных волокон варьирует от нескольких миллисекунд до десятков и сотен секунд (см. [1]).
По своей природе следовые потенциалы (СП) могут быть подразделены на связанные с пассивными изменениями ионных проницаемостей мембраны и на обусловленные работой электрогенных ионных насосов.
Примером СП первого типа может служить следовая гиперполяризация (СГ), наблюдаемая в изолированном гигантском аксоне кальмара (рис. 2.20, А, В). Она связана с инерционностью процесса повышения калиевой проводимости: возросшая во время ПД,
остается некоторое время повышенной после его окончания (см. рис. 2.16), вследствие чего мембранный потенциал устремляется к уровню равновесного калиевого потенциала (2?к----75мВ).*
Максимум СГ соответствует моменту наибольшего приближения Е к Ец. Последующее снижение gNa, обусловленное гиперполяризацией, приводит к устранению последней, причем темп убывания СГ определяется как постоянной времени тм, так и емкостью мембраны Сх.
Вполне понятно, что амплитуда СГ должна, при прочих равных условиях, зависеть от исходного уровня потенциала покоя: чем ближе последний к уровню Ек, тем ниже амплитуда СГ. Так в гигантском аксоне кальмара, не выделенном из организма, потенциал покоя (—70 мВ) примерно равен Ек, поэтому СГ практически отсутствует (рис. 2.20, А). Если же через мембрану пропустить постоянный гиперполяризующий ток и с его помощью сдвинуть потенциал покоя до величин более отрицательных, чем (например, до —100 мВ), то /к =?к(Е—Ек) после окончания пика
* ^к = —75 мВ при [К% = 20мМ. соответствующей концентрации К+ В«крови_кальмара,
ПД из положительного (выходящего) станет отрицательным (входящим), и вместо СГ возникнет СД.
Аналогичная зависимость знака следового потенциала от исходного уровня потенциала покоя имеет место и у других нервных волокон [61, 120, 121|. О связи постспайковой СГ со следовым повышением^натриевой^проницаемости мембраны убедительно
Рис. 2.20. Потенциалы действия и следовые потенциалы в гигантском аксоне кальмара и в перехвате Ранвье лягушки.
А — распространяющийся ПД в интактном (не выделенном из тепа животного), В — в изолированном гигантском аксоне кальмара. А — при температуре 8.5°, Б — при температуре 12.5° С [98]; В — потенциал действия в перехвате Ранвье в нормальном растворе Рингера; Г — при добавлении в раствор Рингера ветатридина (5 х 10-в г/мл). В — и Г — отведение экстраклеточное. При калибровке учтен фактор шунтирования [155].
свидетельствует тот факт, что СГ ослабляется или полностью устраняется при блокаде калиевых каналов с помощью ТЭА или ионов Cs+.
£ Важную роль в генезе следовых потенциалов играет накопление ионов К+ в узких щелях, существующих между мембраной нервного^ волокна] ^окружающими' его ^шванновскими клетками.
Т^В^гигантских аксонах^кальмараТколичество ионов^К+, покидающих волокно во время каждогоЧТД (4х10-12 М/сма), недостаточно велико для того, чтобы изменить концентрацию ионов К+
в околомембранном пространстве. Это происходит только при ритмическом раздражении волокна и проявляется в прогрессирующем снижении амплитуды СГ. После же окончания ритмической активности СГ постепенно возвращается к своей исходной величине. По оценкам Франкенхойзера и Ходжкина [73] такие изменения СГ могут быть количественно объяснены, если принять, что ширина шванновского пространства составляет около 300 А, а проницаемость диффузионного барьера, препятствующего поступлению ионов К+ из указанного пространства в окружающий раствор, имеет величину порядка 5х10-& см/с. После каждого ПД концентрация К+ вблизи мембраны повышается не более чем на 1.2 мМ. «Рассасывание» К+ после окончания ритмической активности происходит в результате диффузии ионов в наружную среду и активного транспорта их в обмен на ионы Na+.
В отличие от гигантских аксонов кальмара, гигантские аксоны ракообразных характеризуются четко выраженной следовой деполяризацией (СД) [141]. Предполагается, что эта СД обусловлена главным образом накоплением ионов калия в околомембран-ном пространстве волокна. Если это так, то, очевидно, шванновское пространство в аксонах ракообразных настолько мало, что для заметного повышения в нем концентрации К+ достаточно выделения даже «одной порции» этих ионов во время ПД. Естественно возникает вопрос — почему следовое повышение Рк не приводит в указанных аксонах к возникновению СГ, подобной той, которая имеет место в аксонах кальмара? Возможно, это связано с тем, что потенциал покоя аксонов ракообразных более отрицателен и, следовательно, ближе к Е&, чем у аксонов кальмара.
Согласно Гингарду и Штраубу [831, на подобном механизме основана СД в безмягкотных С-волокнах симпатического ствола кролика. Изучая зависимость мембранного потенциала от 1g [К ]0, авторы пришли к заключению, что после одиночного пика концентрация ионов К+ в шванновском пространстве повышается на ~3.4 мМ. Предполагая далее, что в исследуемых волокнах во время ПД через 1 см2 мембраны выходит 4—5 X10“12 М К+, авторы оценили ширину шванновского пространства в 145 А. Следует, однако, подчеркнуть, что все эти оценки весьма и весьма приблизительны, поскольку в тонких С-волокнах нет возможности измерять абсолютные величины мембранного потенциала (о них судят лишь по данным, полученным на пучках волокон методом сахарозного моста). Й?
В С-волокнах блуждающего нерва одиночного ПД сопровождается четко выраженной СГ, которая, по-видимому, имеет ту же природу, что и СГ в гигантском аксоне кальмара. Наконец, в без-мякотных волокнах n. saphenus кролика имеет место промежуточная ситуация — здесь ПД сопровождается СД, быстро переходящей в СГ. Й
Обращает на себя внимание большая длительность постспай-ковых следовых потенциалов в безмякотных нервных волокнах.
Так, в симпатических нервах СД спадает с постоянной времени 150 мс, а СГ в волокнах блуждающего нерва достигает своего максимума через 100—200 мс [61].
В отличие от следовых потенциалов, сопровождающих одиночный потенциал действия, следовая гиперполяризация после ритмической стимуляции безмякотных нервных волокон («посттетаническая СГ») обусловлена изменениями не пассивного, а активного транспорта ионов [61, 134]. Механизм активного электрогенного транспорта ионов Na+ будет подробно рассмотрен в гл. 4 настоящего руководства.
Перейдем теперь к рассмотрению следовых потенциалов в миелинизированных нервных волокнах.
Как в целом нервном стволе, так и в тонких пучках миелинизированных аксонов после одиночного суммарного ПД возникает хорошо выраженная СД, длящаяся 100—500 мс. В процессе ритмической стимуляции эта СД суммируется; после же окончания серии стимулов развивается СГ, длящаяся секунды и даже минуты [1, 4, 5, 120, 121 ]. Так же как и у безмякотных волокон, эта посттетаническая СГ в миелинизированных аксонах нечувствительна к ТЭА, но полностью устраняется при воздействиях, тормозящих активный транспорт ионов Na+ из волокна (убаин, динитрофенол) или при замене наружного Na+ на Li+ [7].
Длительная постимпульсная СД и посттетаническая СГ наблюдаются не только в изолированном нерве, но и в нерве, находящемся в организме в условиях нормального кровоснабжения [7]. В отличие от этого в одиночном перехвате Ранвье изолированного нервного волокна СД имеет только очень короткую длительность (2r-t.4.Mc), а посттетаническая СГ, связанная с электрогенным активным транспортом Na+, вообще отсутствует [7, 120, 121]. Постимпульсная СД обусловлена, по-видимому, задержкой ионов К+, выходящих из волокна во время ПД, вблизи мембраны перехвата.
Выше уже говорилось о существовании в паранодальной области миелинизированного волокна некоторого диффузионного барьера, создающего условия для накопления ионов К+ в околомембранном пространстве. Дюбуа и Бергман [651 сделали вывод, что указанное околомембранное пространство имеет толщину порядка 2900 А, а проницаемость диффузионного барьера, отделяющего его от наружного раствора, имеет величину порядка 1.9 Х1О~2 см/с.
Наряду с этим ближайшим к мембране диффузионным барьером в паранодальной области интактного миелинизированного аксона существует, по мнению Каталымова [7], также второй диффузионный барьер, имеющий значительно более низкую проницаемость. Автор полагает, что барьер создает условия для возникновения в, нервном стволе длительной СД после одиночного ПД.
Дри обычных способах препаровки одиночного волокна этот второй барьер легко разрушается, вследствие чего длительная СД исчезает — сохраняется лишь первый компонент СД, имею
щиМ короткую продолжительность. Однако если изолировать нервное волокно таким образом, чтобы исследуемый перехват оставался закрытым внутри нервного ствола или хотя бы «прикрытым» отрезками двух-трех соседних нервных волокон, то в этом случае длительная постимпульсная деполяризадия сохраняется [5].*
Причина исчезновения длительной посттетанической гиперполяризации в изолированном волокне «с открытым перехватом» цока неясна. Поскольку в одиночном волокне «с закрытым перехватом» она хорошо выражена, можно предположить, что во время препаровки волокна либо происходит какое-то повреждение системы активного транспорта в самой возбудимой мембране, либо рвутся какие-то функционально важные^связи, существующие между мембраной перехвата и тесно примыкающими к ней отростками шванновских клеток [7, 115].
2.4. ПАРАМЕТРЫ ВОЗБУДИМОСТИ НЕРВНОГО ВОЛОКНА
2.4.1. ПОРОГОВЫЕ УСЛОВИЯ ВОЗНИКНОВЕНИЯ ПОТЕНЦИАЛА ДЕЙСТВИЯ
При раздражении однородного участка мембраны нервного волокна короткими стимулами локальный ответ перерастает в ПД в момент, когда входящий 7ла по своей абсолютной величине становится равным выходящему /к или сумме 7к+Л-Эту закономерность наилучшим образом можно проследить при математическом моделировании процесса генерации нервного импульса.
На рис. 2.21 представлены данные одного из таких расчетов.
К мембране перехвата Ранвье приложены подпороговый (пунктирные линии) и пороговый (сплошные линии) деполяризующие стимулы 0.01 мс длительности. Начальный подъем потенциала в обоих случаях практически полностью пассивен, поскольку ни f*Nai ни тем более Рк за столь короткое время действия слабого тока не успевают еще существенно измениться. Из-за малого различия в силе примененных стимулов (см. подпись к рисунку) величины V, до которых поднялся потенциал при подпороговой и пороговых плотностях тока, оказались очень близкими (29.78 и 29.85 мВ соответственно). Тем не менее этих различий оказалось достаточно для того, чтобы в первом случае в фазу убывания элек-
* Следует подчеркнуть, что накопление ионов К+ в околомембранном пространстве не является единственно возможной причиной возникновения длительной СД. Последняя может быть обусловлена также.следовым повышением натриевой проницаемости мембраны. Значение этого механизма в наиболее демонстративной форме проявляется в экспериментах с вератридином (рис. 2,20, Г), обладающим способностью длительно удерживать активированные натриевые каналы в проводящем состоянии как в миелинизированных, так и в безмякотных нервных волокнах.
тротонического потенциала возник только локальный ответ, а во втором — локальный ответ, перерастающий в пик ПД.
Из рисунка'видно, что перерастание локального ответа в ПД при коротком раздражении происходит в момент, когда входящий /ха по своей абсолютной величине становится равным выходящему току (/ма=1к+Л). В этот момент Ц =—С dVidt—d). При подпороговой силе стимула повышение Рма оказывается недостаточным
Рис. 2.21. Механизм критической деполяризации мембраны.
А — рассчитааные изменения мембранного потенциала (V), ^Na- и общего ионного тока .Г; в перехвате Ранвье лягушки при действии коротких (0.01 мс) стимулов подпороговой (6.20 мА/см2, прерывистые линии) И пороговой (6.23 мА/см1, спдвитые линии) силы. Б — модель мембраны гигантского аксона кальмара. Изменения I^a, Ig, Ii и Jj при действии еверхпорогового деполяризующего стимула (100 мкА/см1), длительность 0.065 мс, 6.3’ С. В — эмпирическое определение критического уровня деполяризации мембраны при действии длинного раздражающего стимула [14].
для того, чтобы 7ха «догнал» выходящий ионный ток, и потому ПД не возникает.
В перехвате Ранвье ток утечки вносит основной вклад в величину выходящего ионного тока, тормозящего перерастание локального ответа в ПД. В гигантском же аксоне кальмара выходящий ток целиком и полностью определяется специфическим /к, поскольку g; мала, а величина Е такова, что при слабой деполяризации мембраны 7, имеет входящее направление (рис. 2.21, Б).
Если при коротком раздражении деполяризация мембраны в основном обеспечивается входящим ионным током, то в случае раздражения волокна толчками постоянного тока большой длительности входящий 7fra лишь дополняет сдвиг потенциала до критической величины (см. рис. 2.15). Соответственно, условием перерастания локального ответа в ПД во втором случае является равенство не абсолютных величин входящего и выходящего ионных токов, а скоростей нарастания этих токов, т. е.
d/Na d (1К 4- /Л
= —i—-у------ (для перехвата Ранвье),
it р cl l
d Na К
—-т— (для гигантского аксона кальмара),
fl I u* t
(22)
[(23)
Минимальный потенциал, при котором достигается такое ра
венство, соответствует критическому потенциалу (£к) для возникновения ПД.
В соответствии со сказанным при исиользовании в качестве пороговых раздражающих стимулов постоянного тока величину Ес обычно измеряют таким образом, как это показано на рис. 2.21, В. Точка пересечения двух касательных соответствует потенциалу, при котором скорость нарастания входящего тока становится равной скорости нарастания выходящего тока.
В Случае же раздражения мембраны пороговыми стимулами короткой длительности в качестве Ес берут величину Е в момент, когда dV/dt проходит через нуль. Именно в этот момент плотности входящего и выходящего ионных токов становятся равными по своей абсолютной величине.
2.4.2. ПАРАМЕТРЫ ВОЗБУДИМОСТИ
Пороговый потенциал (У() — величина, на которую мембранный потенциал покоя Е необходимо сдвинуть в сторону деполяризации для достижения уровня критического потенциала Ес.
Согласно этому определению, Er-\-Vf^Ec.
Из равенства Vi =Ес—Ег следует, что в зависимости от того, на какую величину и в каком направлении изменяются при данном воздействии на мембрану Ег и Ес, пороговый потенциал будет снижаться, увеличиваться или оставаться не измененным. Ясно также, что Vt может приобретать одно и то же значение при разных абсолютных величинах Ес и Ег.
Рассмотрим некоторые типичные изменения в соотношениях Ег и Ес, наблюдающиеся при действиях на нервное волокно различных химических и физических агентов.
Повышение Vf за счет роста Ес наблюдается при добавлении в омывающую волокно жидкость, ТТХ, местных анестетиков (новокаин, тримекаин, ксилоксин, анестезин и некоторые другие соединения), анестетиков общего действия (уретан, барбитураты и ДР-), а также при увеличении концентрации в среде ионов Са++ или добавлении в раствор Ni++, Go++, Ва++, La+++. Все эти агенты, повышающие Ес при неизменном потенциале покоя, долгое время объединяли в одну общую группу, называя их «стабилизаторами» мембраны [142].
Дальнейшие исследования показали, однако, что повышение Ес (и соответственно Vt), вызываемое указанными агентами, может быть различной природы.
6 Общая физиология нервной системы
81
Так, ТТХ и STX повышает Ес в результате снижения максимальной натриевой проницаемости (Рж)- Последнее связано с прямой блокадой натриевых каналов молекулами токсина. Поскольку при уменьшении /\а входящий /ж падает при всех потенциалах, наряду с ростом Vt снижаются также амплитуда и особенно максимальная крутизна нарастания ПД. При значительном снижении Рж ПД становятся градуальными и в конечном итоге полностью исчезают — на раздражения любой силы возникают лишь локальный ответ. Угнетающее действие ТТХ на генерацию ПД не устраняется ни гиперполяризацией мембраны (анодным током), ни^ путем повышения наружной концентрации ионов Са++.
Местные анестетики — новокаин, тримекаин, ксилокаин — оказывают двоякое влияние на натриевые каналы: снижается Рж и одновременно развивается медленная натриевая инактивация (падает см. с. 58). Оба эти изменения ведут к ослаблению входящего /,\а и, как следствие, к повышению Ес и Vt, снижению амплитуды и крутизны нарастания ПД. Однако в отличие от того, что имеет место при действии ТТХ и STX, в случае применения местных анестетиков длительный гиперполяризующий ток оказывает сильное восстанавливающее влияние на генерацию ПД [15, 16], поскольку при этом устраняется медленная натриевая инактивация.
На принципиально ином механизме основано повышение Ес и Vt при действии двухвалентных катионов.
Повышение [Са]0 или добавление в среду ионов Со+ + , Ni++, Ва++ вызывает сдвиг кривых —Е, —Е, п^—Е и $Ш—Е вправо вдоль оси напряжения в сторону положительных Е. Сдвиг кривой приводит к повышению критического потенциала, поскольку теперь для повышения Ряа и соответственно /ж до прежнего уровня необходимо сильнее деполяризовать мембрану. Двухвалентные катионы, как правило, не влияют на поэтому амплитуда нормального ПД при их применении практически не изменяется.
Трехвалентный La3+ сдвигает та, ha,, Па, в том же направлении, что и двухвалентные катионы, однако при его действии сильно снижается PNa, что приводит к падению амплитуды ПД и Йшах.
Ионы Са++ не оказывают заметного влияния на кинетику ионных проницаемостей, соответственно этому крутизна подъема и падения ПД при повышении [Са ]0 не претерпевает существенных изменений. В отличие от этого, ионы Ni++ и Со++ значительно увеличивают постоянные времени тА, вследствие чего времен-
ной ход развития ПД сильно замедляется. Этот эффект, однако, был получен пока только на миелинизированных нервных волокнах. В гигантских аксонах кальмара и ракообразных ионы Ni++ не оказывают специфического влияния на кинетику процессов активации и инактивации ионных каналов.
Снижение Vf за счет Ед наблюдается в нервных волокнах при уменьшении наружной концентрации Са++. В миелинизированных 82
волокнах потенциал покоя при этом практически не изменяется. Причиной снижения Ес является сдвиг кривой —Е вдоль оси напряжения в сторону отрицательных Е.
Снижение Ес в рассматриваемом случае сочетается с падением амплитуды и крутизны нарастания ПД, поскольку в гипокаль-циевой среде одновременно с кривой тш—Е в сторону отрицательных Е сдвигаются также кривые —Е, зт—Е и
вследствие чего доля натриевых каналов, находящихся при по-
Рис. 2.22. Изменения критического уровня деполяризации Ес и уровня вершины потенциала действия Es перехвата Ранвье при длительной подпороговой деполяризации (Л) и гиперполяризации (В) мембраны постоянным током.
Ег — потенциал покоя, V—сдвиг потенциала, вызванный приложенным током L15].
тенциале покоя в состояниях быстрой и медленной инактивации, увеличивается.
Снижение Vt за счет сдвига потенциала покоя наблюдается при действии подпорогового деполяризующего тока на мембрану — («пфлюгеровское катэлектротоническое повышение возбудимости»). Если бы сдвиг Ег в сторону деполяризации не порождал повышения Ес, то изменения Vf =Ес—ЕТ в точности следовали бы за изменениями Ег. Однако деполяризация вызывает инактивацию натриевых каналов и активирует калиевую проницаемость. Эти изменения влекут за собой повышение Ес. До тех пор пока Д£\, пороговый потенциал остается сниженным, возбудимость. повышена.
На таком механизме снижения V( основано явление следового повышения возбудимости, наблюдаемое в нервных волокнах в стадию следовой деполяризации, сопровождающей ПД (фаза «супернормальности» или «экзальтации», см. ниже).
Деполяризационное повышение Vt развивается при действии на мембрану сильного и достаточно продолжительного постоянного тока («катодическая депрессия Вериго»), а также при сильной деполяризации мембраны избытком ионов К+ в растворе, или при действии батрахотоксина, аконитина, вератридина и некоторых других химических агентов [14],
Причиной подобного повышения Vt является инактивация натриевых каналов (падение Лго и sm) и повышение Рц. Все эти изменения ведут к столь значительному повышению Ес, что Vf = — Ес—Ет, несмотря на рост Ег, увеличивается (рис. 2.22). Одновременно снижается амплитуда и крутизна возрастания ПД. В конечном итоге генерация ПД полностью нарушается, и на раздражающие стимулы возникают только локальные ответы.
Гиперполяризационное повышение Vt возникает при пропускании через мембрану гиперполяризующего тока («пфлюгеровское
анэлектротоническое снижение возбудимости»). Обусловлено оно тем, что в нормальном (неальтери-рованном) волокне Ег при пропускании через мембрану постоянного гиперполяризующего тока сдвигается на большую величину, чем Ес. Причиной снижения Ёс при гиперполяризации является устранение небольшой исходной инактивации (рост Лт) и снижение /’к.
Рис. 2.23. Рассчитанные изменения мембранного потенциала (V) и входящего натриевого тока (7Na) ПРИ П0Р°‘ говом раздражении перехвата.
1 — при стандартных данных модели, в — при двухкратном увеличении постоянной времени активации т.,л. Раздражающий ток: 1 — 0.81В, г — 1.027 мА/см*. Стрелки — моменты достижения У пороговой величины! 1'^1 0)[13].
Гиперполяризационное снижение Vt наблюдается при действии гиперполяризующего тока на мембрану, характеризующуюся сильной исходной натриевой инактивацией и высокой калиевой проницаемостью. Такое сочетание, как уже указывалось, имеет место, например, при альтерации мембраны избытком ионов К+ в растворе. Гиперполяризация мембраны устраняет (или ослабляет) исходную инактивацию, вследствие чего Ес снижается сильнее, чем уменьшается Ег.
Наименьшая сила электрического тока, достаточная для вызова ПД, называется пороговым током: (Д), В отличие от Уг, пороговый ток зависит не только от Ег и Ёс, но также от длительности стимула, которая в свою очередь определяется как пассивными, так и активными свойствами мембраны.
Кривая зависимости 1( от длительности действия стимула получила название кривой «силы—длительности» и была первоначально изучена в опытах на целых нервных стволах [116].'
Исследования показали, что при больших длительностях тока /' устанавливается на некотором постоянном уровне («реобаза»), I по мере же укорочения стимула It возрастает. Минимальное время, необходимое для возникновения ПД на стимул силой, равной 27О, Лапик [116] назвал «хронаксией». При данном Vf величина реобазы (70) находится в обратной зависимости от сопротивления покоящейся мембраны — чем это сопротивление выше, чем меньшую силу должен иметь ток для того, чтобы вызывать необходимый сдвиг потенциала (V = 77?M). Этим частично и объясняется тот факт, что 10 в перехвате Ранвье более чем в 20 раз превышает 1а в однородной мембране гигантского аксона: Vt в перехвате (20 мВ) всего лишь в три раза выше, чем в гигантском аксоне, между тем как 7?„ — примерно в 50 раз ниже.
Пфлюгеровское катэлектротоническое повышение возбудимости оказывается значительно более выраженным, если о нем судить по изменениям Vt, чем по 1д, так как повышение Рк при деполяризации мембраны ведет к падению ее сопротивления.
Детальный анализ зависимости 10 и Vt от различных констант ионной проницаемости был проведен на математической модели возбудимой мембраны (см. [13]).
Минимальное время, в течение которого стимул данной силы должен действовать на мембрану для инициации ПД, называется временной константой раздражения. Она определяется как постоянной времени этой мембраны t=RC, так и постоянной времени процесса натриевой активации тт.
Зависимость «минимального времени» от RC покоящейся мембраны понятна — чем RC выше, тем большую длительность должен иметь ток данной (по отношению к реобазе) силы, для необходимого пассивного сдвига потенциала (см. выше). RC мембраны гигантского аксона кальмара составляет около 1 мс, а мембраны перехвата Ранвье — всего лишь 0.07 мс. Соответственно величины хронаксии указанных мембран отличаются друг от друга почти на порядок.
Хорошо известная зависимость величины хронаксии от температуры определяется влиянием последней на постоянную времени натриевой активации. Расчеты на модели перехвата показали, что двухкратное увеличение х)И (У) практически не изменяет реобазу, но удлиняет хронаксию примерно на 30%.
Рис. 2.23 демонстрирует рассчитанные с помощью уравнений Франкенхойзера—Хаксли изменения мембранного потенциала и входящего 7Na при пороговом раздражении перехвата в случаях нормального (7) и увеличенного в 2 раза (2)
Видно, что увеличение тт привело к повышению минимально необходимого начального сдвига потенциала, что было достигнуто путем повышения If с 0.816 до 1,027 мА/см®. При этом пороговый потенциал практически не изменился, хотя латентный период возникновения ПД'значительно возрос.
Данные этого расчета моделируют эффект охлаждения волокна.
Анализу влияния различных агентов среды (изменений ионного состава, действие анестетиков, наркотиков, постоянного тока и др.) на параметры кривой сила—длительность различных нервов в 20—50-х гг. было посвящено большое число исследований [2, 9а, 12]. К сожалению, интерпретация этих данных в настоящее время крайне затруднена тем, что опыты велись на целых нервных стволах, покрытых оболочками и состоящих из тысяч нервных волокон, различающихся еврей возбудимостью.
2.4.3. ИЗМЕНЕНИЯ ВОЗБУДИМОСТИ ВО ВРЕМЯ И ПОСЛЕ ОКОНЧАНИЯ ПОТЕНЦИАЛА ДЕЙСТВИЯ
Период (фаза) «абсолютной рефрактерное™» мембраны имеет ту же длительность, что и ПД: нанесение тестирующего стимула сколь угодно большой силы в это время не может
Рис. 2.24. «Абсолютная рефракторпость» в мембране гигантского аксона кальмара. Рассчитанные изменения V, gKa HgK, вызываемые сильным деполяризующим толчком короткой длительности (0.01 мс), нанесенным в ре-поляризациоппую фазу ПД в моменты времени 0.6 (А) и 0.8 мс (Б).
каналы переходят в состояние инактивации (Л^лЮ). Приложенный стимул, однако, не остается без последствий для уже возникшего ЙД. Дополнительная пассивная деполяризация мембраны (рис. 2.24), вызванная тестирующим током, практически не изменяя gjfa (происходит лишь задержка его падения), тормозит, однако, подъем й, что естественно несколько удлиняет период «относительной рефрактерное™».
Восстановление возбудимости мембраны определяется в этот период подъемом h (устранением инактивации), снижением Рк (g«) и восстановлением исходного мембранного потенциала.
Тестирующие стимулы, приложенные сразу же после окончания ПД, вызывают лишь градуальные ответы, поскольку число каналов, свободных от инактивации, в это время еще очень мало,
Рис. 2.25. Фаза «относительной рефрактерности» в мембране гигантского аксона кальмара. Рассчитанные изменения V, gK, gNa и Л.
А — низкое Л и высокое Як как причины повышения порога и снижения амплитуды ответа па тестирующий стимул в фазу относительной рефрактерности; Б — градуальные ответы на стимулы равной силы (.1—5); В — изменения ЯИа> соответствующие градуальным ответам, показанным на Б [19].
а калиевая проницаемость повышена (рис. 2.25). В гигантском аксоне кальмара период относительной рефрактерности совпадает со следовой гиперполяризацией мембраны. Поэтому увеличение Vt{=Ec—Ег) в это время обусловлено не только повышенным Ец за счет низкого h и высокого gg, но и низким Е.
В одиночном перехвате Ранвье миелинизированного нервного волокна следовые потенциалы слабо выражены (см. выше), поэтому изменения gNa и gg в фазу относительной рефрактерности определяются главным образом изменениями Рна и Pg. Продолжительность этой фазы, судя по изменениям порогового тока, в изолированном волокне лягушки при 20° С составляет 5—7 мс.
ЗВ целом нервном стволе ПД миелинизированного волокна сопровождается длительной и хорошо выраженной СД, В начальный период СД, когда h еще очень низка, Vt и соответственно It увеличены за счет Ео. Однако в дальнейшем ^’снижается и, поскольку Е увеличен по сравнению с потенциалом покоя, порог Vt оказывается уменьшенным по сравнению с исходной величиной. Этот период получил название периода следового повышения возбудимости, или «супернормальности» («экзальтаций»).
Все агенты, способствующие развитию следовой деполяризации мембраны, усиливают и «супернормальность».
В фазу посттетанической следовой гиперполяризации мембраны увеличение Vt связано главным образом с падением Ег, т. е. основано на том же механизме, что и анэлектротоническое снижение возбудимости. Амплитуда ПД в этот период не только не снижается, но, напротив, имеет даже тенденцию к увеличению, так как Л во время длительной следовой гиперполяризации повышается по сравнению с его исходной величиной.
2.4.4. АККОМОДАЦИЯ
Пороговая сила тока It зависит не только от длительности его действия, но и крутизны нарастания этого тока: уменьшение крутизны ведет к повышению а при некоторой минимальной крутизне ответы на раздражения вообще исчезают. Это явление было известно еще первым исследователям, применившим электрический ток в качестве раздражителя нервов мыпщ [62, 67, 68]. Нернст назвал его «аккомодацией» [129].
На рис. 2.26 показаны изменения порогового потенциала и амплитуды ПД, наблюдающиеся при раздражении одиночного перехвата Ранвье лягушки линейно нарастающими токами различной крутизны. Как видно, уменьшение крутизны до некоторого предела еще не сказывается на величине V,; в дальнейшем Vt и It (не показано) несколько увеличивается (примерно на 20%),* а амплитуда ПД падает. Наконец, при некоторой малой крутизне («минимальный градиент», или «критический наклон») ПД вообще не возникает. Величина критического тока, выраженная в единицах реобазы (с или мА/см2), принята в качестве меры «скорости аккомодации». Величина, обратная минимальному наклону, является временной константой аккомодации (^.).
В основе аккомодации лежат инактивация натриевой (падение h) и повышение калиевой проницаемости (Ик), развивающиеся в процессе деполяризации мембраны. Снижение Л. и рост Рц ведут к повышению порогового потенциала, поскольку при этом ослаб
* Значительно большее повышение порога, наблюдающееся при проведении подобных опытов на целом стволе, объясняется поляризацией оболочки и вовлечением в реакцию ва медленно нарастающие токи волокон, характеризующихся низкой аккомодацией и.высоким порогом [13].
ляется входящий /Na и увеличивается выходящий 1ц С другой стороны, повышение Рк (gK) ослабляет эффективность медленно нарастающего тока, так как снижение сопротивления мембраны ведет к уменьшению электротонического потенциала.
; +Из сказанного становится понятным, что скорость аккомодации нервного волокна при прочих равных условиях тем выше, чем: а) ниже исходное значение ha (т. е. чем большее число каналов при потенциале покоя находится в инактивированном^состоянии);
Рис. 2.26. Экспериментально наблюдаемые (4) [158] и рассчитанные (Б) изменения мембранного потенциала на прямоугольный толчок тока (7) и на линейно нарастающие стимулы разной крутизны {2—9} [78].
б) выше скорость развития инактивации (меньше ~л); в) ниже PNa и чем выше Рк. Сдвиг кривой gK—Е (или Р%—Е) вправо, уменьшающий /к при умеренной деполяризации мембраны, ослабляет аккомодационный рост 1Г Ускорение аккомодации при повышении температуры является непосредственным результатом происходящего при этом уменьшения постоянных времени и тя.
Детальный анализ зависимости минимального наклона от различных констант ионной проницаемости мембраны перехвата Ранвье был проведен Валбо [158] в опытах па миелинизированных волокнах Xenopus и Франкенхойзером и Валбо [78] на математической модели мембраны перехвата Ранвье (см. также [13]).
Аккомодация различных нервных волокон варьирует в весьма широких пределах. Так, у Xenopus минимальный градиент моторных волокон значительно выше (113+43 реобаз/с), чем у сенсорных,
связанных как с быстроадаптирующимися кожными механорецепторами (66 + 43 реобазы/с), так и с медленно адаптирующимися механорецепторами мышц (85.2+23.3 реобазы/с) 1157].
Бергман и Штемпфли [41 ] провели аналогичное исследование на перехватах Ранвье европейских лягушек (7?. esculenta) и также обнаружили, что моторные волокна характеризуются большей скоростью аккомодации (244+14 реобаз/с), чем сенсорные
А
Рис. 2.27. Потенциалы действия и критический наклон раздражающего линейно нарастающего тока в моторных (4, В) и сенсорных (Б, Г) волокнах лягушки. Эффект ТЭА.
А, Б — перехваты Ранвье в нормальном растворе Рингера; В, Г — в растворе Рингера, содержащем 5 мМ ТЭА. Потенциалы действия получены в ответ на короткие надпороговыё стимулы. В нижней части каждого рисунка показан критический наклон линейно нарастающего тока [41].
(89+13 реобаз/с). При этом авторам удалось связать указанные различия с состоянием калиевой переносящей системы в моторных . и сенсорных волокнах. Выло, в частности, обнаружено, что блокада калиевых каналов с помощью ТЭА приводит к значительно большему падению минимального градиента в моторных волокнах, чем в сенсорных. В результате минимальные градиенты тех и других волокон сильно сближаются — у моторных — 47 реобаз/с, у сенсорных — 37 реобаз/с (рис. 2.27).
Аккомодация изолированных миелинизированных нервных волокон теплокровных животных пока еще не изучена. Имеются, однако, данные, полученные на тонких пучках нервных волокон кошки (см. [82]). В этих исследованиях было обнаружено, что 90
кривая аккомодации имеет тенденций образования плато (breakdown of accomodation). У двигательных волокон начальный наклон кривой выше, чем у сенсорных. Соответственно переход кривой в плато у первых происходит на уровне 3—4 реобаз, а у вторых — при 1.5 реобазах [82]. Следует, однако, подчеркнуть, что «нарушение аккомодации» (излом кривой и переход ее в плато) наблюдается и в нервах лягушки (см. [13 J). Поскольку в одиночных нервных волокнах такое явление никем не наблюдалось, естественно возникает мысль, что оно связано с особенностями раздражения многоволоконного препарата. Не исключено, однако, что эти различия имеют более глубокую причину, а именно что они отражают различия в свойствах волокон, находящихся внутри нервного ствола и выделенных из него путем механических разрывов межволоконных связей.
2.4.5. ПОВТОРНЫЕ ОТВЕТЫ НА ПОСТОЯННЫЙ ТОК
Многие нервные волокна отвечают ритмическими разрядами импульсов па постоянный деполяризующий ток. Эта способность к повторным ответам особенно хорошо выражена
Рис. 2.28. Повторные ответы на постоянный ток.
А — перехват Ранвье, V — мембранный потенциал, I — приложенный ток [78]; Б — гигантский аксон кальмара. Сила приложенного постоянного тока увеличивается от 1 до 8 [841.
у сенсорных волокон, для которых длительный генераторный ток, возникающий в рецепторе, является естественным раздражителем. Примеры таких повторных ответов представлены на рис. 2.28.
Как правило, порог для возникновения повторного ответа выше порога для генерации одиночного ПД. Обусловлено это тем, что после окончания первого ПД сопротивление мембраны оказывается сниженным (за счет высокого £к) и потому ток из порогового превращается в подпороговый. Кроме того, продолжающаяся де
поляризация мембраны препятствует полному устранению натриевой инактивации — вследствие чего Vf увеличивается.
Вполне понятно, что способность волокна к повторным ответам должна быть тем ниже, чем большее число каналов находится при потенциале покоя в состоянии инактивации (т. е. меньше исходное ^т).
По данным Бергмана [39 J, у различных сенсорных волокон R- rldibwida и Xenopus число импульсов в повторном разряде примерно пропорционально исходному hm. Такие же отношения были найдены и при варьировании величины данного перехвата в пределах от 0.5 до 1.0 путем деполяризации или гиперполяризации мембраны. Наряду с инактивацией важную роль в ограничении длительности повторного разряда играет повышение Р&. Об этом свидетельствует тот факт, что блокада К-каналов с помощью ТЭА значительно удлиняет повторный разряд в сенсорных волокнах.
ч Зависимость повторных разрядов от исходного уровня делает понятной давно замеченную связь между способностью нервного волокна к ритмическим разрядам и их аккомодацией [39, 85, 104 и др. ]. Соотношения между длительностью повторного ответа и скоростью аккомодации наилучшим образом прослежены на миелинизированных нервных волокнах [157, 158 J. Было обнаружено, что между логарифмом минимального градиента и максимальным числом импульсов в ритмическом ряду существует линейная зависимость. При минимальном градиенте, превышающем 100 реобаз/с, повторные ответы вообще не возникают.
Из рис. 2.28 видно, что увеличение силы деполяризующего тока до определенного предела приводит к учащению ритмического разряда и к увеличению числа импульсов в нем. Однако при дальнейшем повышении силы тока разряд укорачивается и в конечном итоге полностью исчезает — на замыкание тока возникает лишь одиночный ПД. Причиной этого является инактивация натриевых каналов и повышение Р&, развивающиеся при слишком сильной деполяризации мембраны.
При постоянной силе тока длина межимпульсных интервалов в повторном ответе у многих нервных волокон постепенно увеличивается. Это явление, получившее название адаптации, обусловлено, по-видимому, тем, что в процессе длительной деполяризации мембраны происходит постепенное падение ее сопротивления, вследствие чего пассивный сдвиг потенциала, вызываемый приложенным током (IR = U), несколько уменьшается. Чтобы объяснить такое падение сопротивления, было высказано предположение, что наряду с быстрыми калиевыми каналами в мембране нервного волокна существуют также медленные калиевые каналы, активирующиеся при длительной деполяризации [3, 55, 107]. Недавно это предположение получило подтверждение в опытах на гигантских нейронах моллюсков, проведенных с помощью метода фиксации потенциала [133J.
2.5. МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ИОННОЙ ПРОНИЦАЕМОСТИ
За отсутствием методов прямого изучения молекулярной структуры возбудимой мембраны современные представления в этой области строятся почти исключительно на основе тех данных, которые удается получить при исследовании влияния различных химических и физических агентов на трансмембранные ионные токи, мембранные «шумы» и так называемые «воротные токи», связанные, по-видимому, с внутримембранными перемещениями заряженных частиц, «открывающих» и «закрывающих» ионные каналы.
2.5.1. ФУНКЦИОНАЛЬНАЯ АРХИТЕКТУРА НАТРИЕВЫХ II КАЛИЕВЫХ КАНАЛОВ
Изучение механизмов блокирования ионных токов различными химическими соединениями (ТТХ, STX, ТЭА и др-), с одной стороны, и относительной проницаемости каналов для различных неорганических и органических катионов — с другой, привело исследователей к выводу, что в каждом канале следует различать наружное и внутреннее устья и суженную часть поры — «селективный фильтр».
Устья канала способны принимать ион вместе с его гидратной оболочкой. Работа же по частичной или полной дегидратации иона осуществляется в области селективного фильтра.
Наружные и внутренние устья, по-видимому, существенно различаются по своим размерам и химическим свойствам, что проявляется в неодинаковом сродстве к молекулам указанных выше блокаторов каналов.
Избирательность каналов по отношению к тем или иным ионам определяется как стерическими характеристиками селективного фильтра, так и составом химических групп (лиганд), обеспечивающих электростатическое взаимодействие канала с данным ионом[21].
Вопрос о взаимоотношениях между селективным фильтром и воротами канала, а также о локализации ворот в канале пока еще дискутируется. Ряд косвенных данных свидетельствует о том, что ионные каналы образованы белковыми макромолекулами, погруженными в липидный матрикс мембраны.
2.5.2. НАТРИЕВЫЕ КАНАЛЫ
Свойства устьев канала. ТТХ и STX блокируют натриевые каналы в гигантском аксоне кальмара и миелинизированном нервном волокне только при действии на наружную сторону мембраны (см. обзоры [14, 91, 155]). Общим для ТТХ и STX является наличие в их молекулах гуанидиновой группировки. Между тем известно, что ион гуанидия способен проникать через натриевые каналы (см. ниже). Поэтому было
Высказано предйоложение, что гуанидиновая группировка входит в натриевый канал, в то время как остальная часть молекулы препятствует прохождению иона сквозь мембрану. Высокая активность и специфичность действия этих ядов обусловлена тем, что структуры вблизи наружного отверстия канала комплементарны к тем частям молекулы, которые стереохимически расположены вблизи гуанидиновой группы [102].
Хилле [94] попытался конкретизировать это представление (рис. 2.29), предположив, что положительно заряженная группа
Сакситоксин
Тетрадвтоксин
|---------1---------1--------__________।_________I А
0 2 4 6 в 10
Рис. 2.29. Гипотетический механизм блокирования натриевых каналов молекулами сакситоксина и тетродотоксина. Мембрана в области наружного устья канала заштрихована [94].
гуанидия входит в ту узкую часть канала, которая образует селективный фильтр, а основная часть молекулы застревает в наружном устье канала, образуя водородные связи с атомами кислорода, образующими кольцо селективного фильтра. Если эта гипотеза подтвердится, то нужно будет признать, что наружное устье канала в сечении имеет размер 6x10 А.
Гипотеза Хилле основана на данных, полученных при изучении зависимости эффектов ТТХ от pH среды и анализе кривой доза— эффект.
В опытах с изменениями pH было установлено, что активной формой ТТХ и STX является катионная [89, 91 ]. Есть серьезные основания полагать, что в этой форме ТТХ взаимодействует в канале с карбоксильной группой [144].
Из кривой доза—эффект следует, что каждая молекулы ТТХ или STX взаимодействуют только с одним рецептором. Константа тиссопиации образуемых комплексов составляет для STX 1.2 X 10“®М [89], а для ТТХ — 3.6x10'® М [91, 139]. Было установлено
также, что ТТХ и STX конкурируют друг с другом за общий рецецтор в мембране [1561.
Неэффективность ТТХ и STX при их внутриаксональном применении свидетельствует о том, что либо во внутреннем устье натриевого канала нет группировок, обладающйх сродством к этим ядам, либо размеры внутренних устьев недостаточны для того, чтобы в них могли войти молекулы ТТХ и STX.
Блокаторами натриевых каналов со стороны их внутренних устьев являются молекулы четвертичных дериватов местных анестетиков, находящиеся в перманентно заряженной катионной форме [96, 18, 149]. Важной особенностью вызываемого ими блока является его зависимость от потенциала: деполяризующий стимул усиливает снижение вызываемое указанными соединениями. Большинство четвертичных дериватов неэффективны при их приложении к наружной стороне мембраны нервного волокна. Исключение составляет соединение QX-572, обладающее хорошей растворимостью в липидах. Предполагается, что это соединение диффундирует через мембрану и блокирует натриевый канал, входя в его внутреннее устье [96, 18 ]. На сходном механизме основано блокирование натриевых каналов стрихнином и его четвертичным дериватом. Последний эффективен только при внутриаксональном применении [50].*
Селективны й]тф и л ь т р. Натриевые канальГ~обла-дают высокой, но не абсолютной избирательностью к ионам Na+. Относительная проницаемость каналов различных нервных волокон к одновалентным неорганическим катионам показана в табл. 2.2.
Таблица 2.2
Отношения проницаемостен натриевых каналов нервных волокон для катионов металлов (волокно бозмякотпое)
Животное Na LI к нь Cs Т1 Источник
Кальмар (Loligo) . . . 1.0 1.1 0.083 0.025 0.017 [511
Кальмар (Loligo) . , . 1.0 1.0 0.083 0.083 0.05 — [125]
Кальмар (Dosidicus) . . 1.0 — 0.1 — 1 [35]
Лягушка (R. piplens) 1.0 0.93 0.086 0.012 0.013 0.33 [921
В опытах на миелинизированных волокнах Хилле [92, 95 J обнаружил, что натриевые каналы проницаемы также для большого числа органических катионов. Оценивая их размеры, пришли к выводу, что натриевый канал в самой узкой своей части (селективный фильтр) имеет поперечное сечение около 3.5 А.. Замещение в органических катионах —ОН- или —Н-групп на метиловую или
* Было показано, что после разрушения инактивацнонных ворот натриевых каналов проказой (см. с. 61), ТЭА, введенный внутрь’аксона, приобретает способность блокировать эти каиалы*[135].
метиленовую делает катион непроникающим. Для объяснения этого факта было высказано предположение, что селективный фильтр образован кольцом атомов кислорода (рис. 2.30), способных образовывать водородные связи с—ОН или—Н группами органиче-ских^катионов. При образовании таких связей донор (—ОН или —Н) и акцептор (—О) могут сближаться друг с другом на 0.9 А ближе, чем это позволяют вандерваальсовы силы. В результате эффективные размеры катионов уменьшаются до 3 А, что делает возможным их прохождение через пору. Метиловые группы неспособны образовывать водородные связи, и, поскольку их диаметр
Рис. 2.30. Гипотетическая структура селективного фильтра натриевого и калиевого каналов с ангстремной сеткой и попом внутри. В натриевом канале вместе с ионом Na+ находится также молекула воды. Все пронумерованные атомы являются атомами кислорода. В натриевом канале 1' и 4' — отрицательно заряженная
—СОО'-группа [91].
составляет около 3.8 А, через натриевый канал они проходить не могут. Прообразом такой модели натриевой поры послужили «транспортные антибиотики» — макроциклические соединения типа ва-линомицина или нонактина, а также «порообразующий антибиотик» грамицидин [14], содержащие большое количество атомов кислорода, которые электростатически взаимодействуют с катионом.
Для объяснения того, что натриевый канал различает ионы Na+ и К+, кристаллические диаметры которых, составляющие соответственно 1.8 и 2.66 А, значительно меньше размера поры, Хилле вслед за Чендлером и Мевесом [51] предположил, что ион Na+ в поре подвергается только частичной дегидратации и что предпочтение натрия калию определяется эффективной силой поля отрицательно заряженной группы, расположенной в селективном центре. Согласно теории Эйзенмапа [21 ], последовательность Na Li > К [> Rb > Cs характерна для отрицательно заряженного локуса с высокой силой поля, т. е. с малым эффективным радиусом и большой концентрацией зарядов.
Хилле полагает, что роль такого анионного локуса выполняет карбоксильная группа. Ее нейтрализацией при снижении pH автор объясняет наблюдаемое в этих условиях падение 7JNil. Кривая, характеризующая зависимости Z-'ya от pH, близка к кривой диссоциации слабой кислоты с pK(t=5.2.
2.5.3. ДВИЖЕНИЕ ИОНОВ ЧЕРЕЗ ОТКРЫТЫЕ НАТРИЕВЫЕ КАНАЛЫ
Классическое описание ионного транспорта через мембрану основано на представлениях о свободной диффузии и миграции частиц в сплошной среде. Формальным выражением этой концепции являются электродиффузионные уравнения в приближении Гольдмана (см. выше). Одним из необходимых следствий этой теории является «принцип независимости» [95], согласно которому вероятность того, что любой индивидуальный ион пересечет мембрану за данный интервал времени не зависит от других присутствующих ионов.
Экспериментальные исследования показали, однако, что этот принцип нарушается, если в нормальный раствор Рингера добавляются некоторые проникающие катионы, включая Т1+, гуанидий и даже Li+ [95]. Нарушение принципа независимости проявляется и в следующем. Приведенные выше ряды ионных проницаемостей для натриевых каналов были получены с помощью уравнения постоянного поля [13] путем измерения сдвига потенциала реверсии ионного тока при замене Na+ в растворе другим катионом. Судя по этим измерениям, проницаемость натриевых каналов для гидроксиламина почти не отличается от натриевой проницаемости (см. табл. 2.3). В то же время входящий ионный ток, переносимый этим ионом, в 4 с лишним раза меньше INa. Такое же несоответствие сдвига потенциала реверсии и изменения амплитуды ионного тока обнаруживается и при замене наружного Na+ на Т1+ или на гуанидин или гидразин. Для объяснения этих явлений были предложены модели ионного канала, учитывающие наличие в канале потенциальных ям и энергетических барьеров, преодоление которых является необходимым условием для прохождения иона через мембрану [20, 95].
Глубина потенциальной ямы для данного иона определяется коэффициентом сродства иона к лигандной группе канала: чем сродство выше, тем яма глубже. Для того чтобы ион вошел в канал из наружного раствора, необходимо, чтобы сродство иона к лигандной группе было большим, чем к молекулам воды в растворе. Однако если это сродство слишком велико, то ион застревает в канале — не проходит через него сам и препятствует движению других. Ионы Т1+ и некоторые органические катионы характеризуются, по-видимому, таким коэффициентом сродства к каналу, что их движение по каналу оказывается затрудненным. Поэтому ток, переносимый этими ионами, значительно меньше натриевого. Добавление Т1+ в раствор Рингера снижает величины вследствие конкуренции Т1+ с ионами Na+ за общие лигандные группы в каналах. Попытки количественного описания этого процесса были сделаны в работах Чизмаджева и др. [20] и Хилле [95].
Многие данные свидетельствуют о том, что сродство Na к натриевым каналам близко к оптимуму: оно достаточно для того, чтобы
7 Общая физиология нервной системы
97
обеспечить эффективный «захват» ионов Na+ из раствора, но не настолько велико, чтобы воспрепятствовать быстрому переносу иона через мембрану. Нарушение принципа независимости для ионов Na+ наблюдаются только при двукратном повышении нормальной [Na]a[95],
Для дальнейшей разработки моделей понного транспорта через открытые натриевые каналы большой интерес представляет факт значительных изменений ионной селективности Na-каналов при некоторых фармакологических воздействиях на возбудимую мембрану. Так, обнаружено, что при действии батрахотоксина на мембрану перехвата Ранвье последовательность проницаемостей, характерная для нормальных натриевых каналов, сменяется новой: Т1 > NH4 > Na>K > гуанидин >ЙЬ >Cs > Са > метиламин. Последние четыре катиона становятся измеримо проникающими [111. Сходным образом действует па селективность натриевых каналов аконитин [9]. Напомним, что оба эти вещества вызывают драматические изменения также воротного механизма натриевых каналов. Можно полагать, что все эти явления — результат аллостерических изменений структуры каналов, возникающих при взаимодействии указанных агентов с соответствующими мембранными рецепторами.
2.5.4. ВОРОТА НАТРИЕВЫХ КАНАЛОВ
Молекулярные механизмы активации и инактивации натриевых каналов пока еще не расшифрованы. Твердо установленными могут считаться лишь следующие основные факты.
1. При деполяризации мембраны повышению предшествует внутримембранное перемещение каких-либо заряженных частиц (вероятно, переориентация диполей, окружающих канал), регистрируемое в форме медленной компоненты емкостного тока — «тока ворот» [31, 45, 132] (рис. 2.31, Л).
2. На внутренней стороне мембраны, по-видимому в области внутреннего устья натриевых каналов, расположены белковые молекулы, необходимые для осуществления процесса натриевой инактивации, — «инактивационпые ворота». Ферментативное разрушение этих структур с помощью некоторых протеолитических ферментов (проназа и др.)* ведет к исчезновению инактивации при сохранении нормальной активации [32].
3. При фиксированном мембранном потенциале натриевая проводимость мембраны претерпевает непрерывные флуктуации. Измерения спектра мощности этих флуктуаций при фиксированных сдвигах мембранного потенциала свидетельствуют о том, что процессы открывания и закрывания ворот ионных каналов не являются строго детерминированными. От потенциала зависит
* По данным Рохаса и Рудн [135], специфическое действие на инактн-вационные ворота оказывает щелочная протеиназа Ь, содержащаяся в пропазе.
лишь вероятность перехода ворот из одного положения, или конформационного состояния, в другое [56 , 57, 159].
Рис. 2.31. «Воротный натриевый ток» в гигантском аксоне кальмара при его . внутренней перфузии раствором 550 мМ CsF.
Л —временные взаимоотношения изменений Ту и полученных в ответ на тестирующий стимул V=70 мВ> Efc=^70 мВ. Во время записи Ig наружный Na* был заменен на Трис* [31]; Б — подавление Ig при введении во внутренний раствор 10 мМ ZnCl2(^). Записи 1 и <3 сделаны до и после действия ZnCi4; В — влияние кондиционирующей деполяризации (конд) на Jp и вызванные тестирующим стимулом (тест)5 приложенным через интервал Г, мс. 1 — контрольная запись Iff и 1^а; 2 и з — инактивация Ig и J'lMa под влиянием кон-диционирующзй деполяризации; 4 — восстановление обоих токов через 25 мс после окончания кондиционирующего стимула. Стрелки — начало и конец деполяризующего тестирующего толчка. При записях В для регистрации 1д и INa при одинаковом усиления J^a резко уменьшен за счет замены 95% наружного Na+ на Трис*, 2е С [44].
Интерпретация данных, полученных при исследовании воротного тока, наталкивается пока па трудности. Первоначально исследователи полагали, что зарегистрированный быстрый Na-во-ротный ток есть не что иное, как перемещение активирующих
m-частиц, постулированных Ходжкином и Хаксли [99]. Естественно поэтому было попытаться зарегистрировать также Na-инак-тивационный воротный ток, связанный с движением й-частиц. Эти попытки, однако, до сих пор не увенчались успехом. В то же время было обнаружено, что деполяризация, ведущая к инактивации значительно ослабляет и натриевый воротный ток (/j (рис. 2.31, В). В связи с этим возникла идея, что инактивация есть не что иное, как изменение состояния активирующих каналы частиц. Однако и здесь появились трудности, так как, во-первых, обнаружено, что существует компонент воротного тока, устойчивый к быстрой инактивации; во-вторых, выяснилось, что при сдвигах потенциала наряду с «воротными частицами» в мембране перемещаются и какие-то другие диполи, не участвующие, по-видимому, в регуляции проводимости ионных каналов [124]. Фармакология воротного тока изучена пока еще недостаточно. Установлены лишь следующие факты: 1) ТТХ в концентрациях, достаточных для полной блокады каналов, воротный ток (1д) не изменяют [31, 45, 108]; 2) новокаин (1%-ный), полностью подавляющий 1д, значительно снижает и [45]; 3) ионы Zn + +, введенные внутрь гигантского аксона кальмара и миелинизированного волокна лягушки (рис. 2.31, Б), обратимо подавляют как 7иа> так и [124]; 4) при наружном воздействии на мембрану гигантского аксона кальмара ионы Zn + + замедляют кинетику как 7яа, так и 1д [45]; 5) ультрафиолетовое облучение мембраны перехвата Ранвье, необратимо снижающее пик /иа, уменьшает также воротный ток I [70].
Исследования воротных токов в гигантском аксоне кальмара и миелинизированных нервных волокнах продолжаются, и можно надеяться, что в ближайшем будущем причина существующих противоречий станет ясной.
Большое внимание уделяется в настоящее время анализу мембранных шумов. [57, 159]. Было показано, что спектральная мощность токового шума может быть выражена как сумма трех составных частей:
Л. I , SWa(0)
где Л7/ компонент, связанный, по-видимому, с движением ионов по перманентно открытым каналам утечки, 5к — спектральная плотность шума калиевых каналов на данной частоте флуктуации, ^Na — спектральная плотность шума натриевых каналов, /—частота, — частота, при которой £ достигает '/а своей максимальной величины.
Натриевый и калиевый компоненты связаны с флуктуацией числа открытых каналов, что порождает дробовой (лоренцов-ский) шум. Такой шум теоретически был исследован на основе простейшей статистической интерпретации уравнений Ходжкина— Хаксли [87, 148]. Принималось, что в гигантском аксоне актива
ционные ворота натриевых каналов состоят из трех идентичных, но независимых субъединиц, а инактивационные ворота — из одной субъединицы (с. 50). Каждая из этих субъединиц может находиться в одном из двух возможных положений. Вероятности переходов между этими состояниями (константы скоростей ая, Р , а* и Р») являются потенциально и температурно зависимыми. Ныло принято далее, что у каждого канала существует только одно проводящее состояние, при котором все три субъединицы находятся в положении «открыто».
Хилл и Чен [87] показали, что спектр токового шума, связанного с такой кинетикой, может быть выражен уравнением, из которого могут быть получены выражения для экспериментально измеряемых зависимостей величин S (0) — низкочастотного предела спектра мощности натриевого шума и — частоты х/2 максимальной мощности шума от мембранного потенциала. Конти и др. [571 для получения указанных величин в эксперименте производили разделение натриевого и калиевого компонентов токового шума с помощью ТТХ и TEA. Экспериментальные кривые (особенно —Е) хорошо совпали с теоретически рассчитанными, что позволило авторам произвести оценку плотностей натриевых (Л/ха) и калиевых (ЛЛк) каналов в мембране аксона. Зная же величину максимумов натриевой и калиевой проводимостей (?Na и ёк) в исследованных волокнах, авторы получили величины проводимостей одиночных натриевых и калиевых каналов — gNa и £к соответственно.
По данным этого исследования в гигантском аксоне кальмара на 1 мкм2 мембраны приходится около 300 натриевых каналов.
Проводимость одиночного натриевого канала около 4 рмо, а одиночного калиевого канала — около 12 рмо.
Представляет интерес, что приведенная величина плотности каналов близка к той, которую Кейнес и Рохас [106] получили в экспериментах по исследованию натриевого воротного тока (около 480 на 1 мкм2).
Аналогичное исследование было проведено Ноннером и соавт. [130] на перехвате Ранвье Rana esculenta. По данным авторов, полученная проводимость одиночного натриевого канала при деполяризации мембраны на 8—40 мВ (от ZQ составляет 7.9± ±0.9 рмо, Авторы оценили плотность натриевых каналов в 2000 на 1 мкм2. Если каналы распределены по мембране равномерно, то расстояние между ними составляет 225 А..
2.5.5. КАЛИЕВЫЕ КАНАЛЫ
Свойства устьев. Специфическим блокатором калиевых каналов является тетраэтиломмоний (ТЭА). Однако в то время как в гигантском аксоне кальмара ТЭА эффективен только при его внутриаксональном применении, в перехватах Ранвье торможение /к может быть достигнуто как при его внутрен-
нем введении через перерезанный межйерехВатный участок, так й up и наружном воздействиях [91, 931. Второе различие состоит в том, что в гигантском аксоне кальмара ТЭА, введенный во внутри-аксональную жидкость, тормозит только выходящий /к 1331, в то время как в миелинизированном волокне ТЭА как при наружном, так и при внутреннем применениях блокирует 1ц в обоих направлениях [114]. Простейшее объяснение этих различий может состоять в том, что у гигантского аксона кальмара рецептор, с которым связывается ТЭА, расположен только в области внутреннего устья калиевого канала, тогда как в мембране в перехватах Ранвье рецепторы ТЭА имеются как во внутреннем, так и в наружном устьях калиевого канала [93].
Детальное исследование кинетики внутриаксопальной блокады калиевых каналов с помощью ТЭА и его дериватов привело исследователей [29, 30, 34] к выводу, что рецептор, с которым взаимодействуют указанные соединения во внутреннем устье канала, становится доступным для них только после того, как калиевый канал открывается деполяризующим стимулом. Размеры внутреннего устья калиевого канала были оценены в 8 А, что соответствует размеру ТЭА или гидратированного иона К+. Поэтому предполагается, что ТЭА «застревает» во внутреннем устье, а К+ дегидратируется и в такой форме (диаметр около 2.66 А) диффундирует в узкую часть канала и далее вновь обретает гидратную оболочку в области наружного устья канала.
Большой интерес представляют изменения кинетики калиевого тока в случае внутриаксонального действия дериватов ТЭА. У этих соединений одна из этиловых групп заменена на углеводородную цепь, содержащую 1 —9 атомов углерода и потому обладающую высокой гидрофобностью. В присутствии этих соединений внутри волокна 1к в ответ на деполяризующую ступень вначале быстро возрастает, но затем, при продолжающейся деполяризации, начинает снижаться (инактивироваться) и тем быстрее, чем выше концентрация данного деривата во внутреннем растворе и чем длиннее углеводородная цепь. Исследование на модели показало, что такая кинетика блокады калиевых каналов может возникать при условиях, если: 1) блокирующая молекула входит только в уже открытый (активированный) канал; 2) постоянная времени образования комплекса блокатор — рецептор меньше постоянной времени активации каналов и 3) скорость распада указанного комплекса меньше скорости его образования. Предполагается, что низкая скорость распада комплекса блокатора с рецептором в случае действия дериватов ТЭА связана с тем, что в области внутреннего устья калиевого канала находится гидрофобная группа, с которой взаимодействует (связывается) углеводородный «хвост» молекулы деривата ТЭА (см. рис. 2,32).
В опытах как на гигантских аксонах кальмара [44], так и на перехватах Ранвье [40] обнаружено, что калиевые каналы со 102
опоны их внутренних устьев могут быть блокированы не только с помощью ТЭА и его дериватов, но и такими одновалентными катионами, как Gs, Na, Li. Блокирующее действие последних особенно четко проявляется при сильной деполяризации мембраны. Изучение кинетики этой блокады и ее зависимости от потенциала привело Безания и Армстронга [44] к выводу, что внутреннее устье калиевых каналов обладает низкой специфичностью: оно принимает гидратированные ионы К+, Na+, Li+, Cs+. Ионы К + способны дегидратироваться в области селективного фильтра,
®К + ОНО у Полярная С,
группа у
Рис. 2.32. Гипотетическое состояние калиевого канала, когда Св—-дериват ТЭА — находится в аксоплазме. С9 — дериват ТЭА конкурирует с гидратированным К+ за внутреннее устье канала. Показан (точки) гидрофобный участок рецептора Св [30].
другие же моновалентные катионы такой дегидратации не подвергаются и потому застревают во внутреннем устье, тормозя движение через канал ионов К+.
Различия между эффектом ТЭА и его дериватов, с одной стороны, и действием моновалентных катионов на /к — с другой, обусловлены, по мнению этих авторов [44], тем, что ТЭА относительно прочно связывается с рецепторами внутренних устьев каналов и потому может полностью заблокировать их уже при действии в малых концентрациях, между тем как ионы Na+, LP, Cs+ с каналами не связываются и обнаруживают блокирующее действие только при применении в высоких концентрациях.
Наружные устья калиевых каналов как у гигантских аксонов кальмара,, так и у миелинизированных волокон [65 J блокируются ионами Сз+ в случае добавления в омывающий аксон раствор. При этом, однако, тормозится только входящий 7к, выходящий же 7К практически не изменяется.
Селективный фильтр калиевых каналов производит значительно более строгий «отбор» ионов, чем селективный фильтр натриевых каналов. По данных Хилле (931, наиболее детально изучавшего проницаемость калиевых каналов мембраны церехвада Ранвье, дги каналь; измеримо проницаемы только для
ионов К+, Tl+, Rb+ и NHj. Судя по изменениям потенциала реверсии /к при замене наружного К+ на другие катионы, относительная проницаемость калиевых каналов может быть охарактеризована следующим рядом;
Pti : Рк : PRb : Pnh. = 2.3 :1.0; 0.92; ОЛЗ.
Для объяснения полученных данных Хилле 191, 92, 95] предложил модель селективного фильтра. Последний, согласно этой гипотезе, образован кольцом из 5 кислородных атомов; диаметр внутреннего отверстия составляет около 3 А. Такой фильтр не может пропустить ионы Cs+, Rb^ гуанидина, гидразина, метиламина, гидроксил амина, поскольку они имеют размеры, превышающие диаметр фильтра. Ион К+ проходит через фильтр практически полностью дегидратированным. Ионы Li+ и Na+ не проникают через калиевые каналы потому, что анионный участок в селективном фильтре обладает низкой силой электрического поля. Несколько иное объяснение низкой проницаемости калиевых каналов для Na+ и Li+ дали Безания и Армстронг. Согласно теории Мул-линза (см, [14]), проникающий ион должен точно соответствовать диаметру поры, т. е. быть не большим и не меньшим ее диаметра. Только в этом случае стенки поры могут заменить гидратацион-ную оболочку иона. Такое соответствие достигается в калиевых каналах при движении по ним ионов К+. Ионы же Na+ и Li + слишком малы для того, чтобы обеспечить полноценное взаимодействие с кислородными атомами, выстилающими пору.
Воротный механизм. Все попытки зарегистрировать калиевый воротный ток пока что оканчивались неудачно. Причина этой неудачи пока неясны. Судя по косвенным данным, полученным при исследовании блокады калиевых каналов с помощью ТЭА и его дериватов, активационные ворота калиевых каналов расположены у входа во внутреннее их устье.
ЛИТЕРАТУРА
1. Воронцов Д. С. Общая электрофизиология. М., 1961.
2. Голиков Н. В. Физиологическая лабильность и ее изменения при основных нервных процессах. Л., 1950.
3. Ильин В, И., Катина И. Е., Лонский А. В., Маковский В. С., Полищук Е. В. Компоненты калиевого тока мембрапы перехвата Ранвье в условиях фиксации потенциала. — В кн.: Биофизика мембран. Каунас, 1973, с. 286—292.
4. Каталымов Л. Л. Влияние ритмического раздражения на следовые потенциалы нерва, лишенного эпи- и периневральных оболочек. — Бюл. эксп. биол. мед., 1974, 1, с. 6—И.
5. Кагцалымов Л. Л. Особенности следовой деполяризации нерва и одиночных нервных волокон лягушки. — Нейрофизиология, 1974, 6, № 5, с. 532-541.
6. Л'агпалмхов Л. Л. Посттетаническая гииерполяризация изолированного нервного волокна озерной лягушки. — Бюл. эксп. биол. мед., 1975, 3, с. 3—7.
7. Каталымов Л, Л. Следовые потенциалы и Следовые изменения возбудй-мости нерва и одиночных нервных волокон. Автореф. докт. дис. М.( 1976.
8. Лонский А. В,, Ильин В. И., Катина И. Е,, Крутецкая 3. И. Токи смещения натриевых каналов мембраны перехвата Ранвье. — Нейрофизиология, 1976, 8, № 4, с, 410—417.
9. Можаева Г. Н., Наумов А. П., Негуляев Ю. А. Влияние аконитина на некоторые свойства натриевых каналов мембраны перехвата Ранвье. — Нейрофизиология, 1976, 8, с. 152—160.
9а. Насонов Д. Н. Местная реакция протоплазмы и распространяющееся возбуждение. М.- -Л., 1959.
10- Пеганов Э. М., Ходоров Б. И., Шишкова Л. Д. Медленная натриевая инактивация в мембране перехвата Ранвье. Роль наружного калия.— Бюлл. эксп. биол. мед., 1973, 9, с. 15.
11. Ревенко С. В., Ходоров Б. И. Влияние батрахотоксина на селективность натриевых каналов в мембране миелинизированного нервного волокна. — Нейрофизиология, 1977, 9, с. 313 316.
12. Ю. М. Теория и практика хронаксиметрии. Л., 1941.
13. Ходоров Б. И. Проблема возбудимости. Л., 1965.
14. Ходоров Б. И. Общая физиология возбудимых мембран. М., 1975.
15. Ходоров Б. И., Беляев В. И. Исследование механизма действия новокаина на электрическую активность перехвата Ранвье, — Биофизика, 1965, 10, с. 625.
16. Ходоров Б. И., Пеганов Э. М., Шишкова Л. Д. Медленная натриевая инактивация в мембране перехвата Ранвье. — В кп.: Биофизика мембран, Каунас, 1973, с. 620—626.
17. (Ходоров Б., Пеганов Э., Ревенко С., Шишкова Л.) Khodorov В., Pega-nov Е., Revenko S., Shishkova L. Sodium currents in voltage clamped nerve fiber of frog under the combined action of batrachotoxin and procaine. — Brain Res., 1975, 84, p. 541—546.
18. (Ходоров Б., Шишкова Л., Пеганов Э., Ревенко С.) Khodorov В., SliisJi-kova L., Peganov E., Revenko S. Inhibition of sodium currents in frog Ranvier node traeted with local anesthetics. Role of slow sodium inactivation. — In: BBA, 1976, 433, p. 409—435.
19. Тимин E. H., Ходоров Б. И. Анализ механизмов проведения нервных импульсов в стадию относительной рефрактерности на математической модели гигантского аксона кальмара. — Биофизика, 1971, 3, с. 434— 441.
20. Чизмаджев Ю. А., Ходоров Б. И., Айтъян С. X. Теория ионного транспорта через натриевый канал биологических мембран. — ДАН СССР, 1973, 213, с. 722—725.
21, Эйзенман Д. Катионселективные стеклянные электроды и методы их применения. — В ки.: Вопросы биофизики. 1964, с. 215—265.
22. Abbud L., Nonner W., Stampfli R. Membrane properties of Ranvier nodes from south American toads and frogs. — Bol, Zool. Biol. Mar., 1973, 5, p. 105-116.
23. Adelman W., Palti У. The influence of external potassium on the inactivation of sodium currents in the giant axon of the squid. — J. Gen. Physiol., 1969, 53, p. 685—703.
24, Adelman W., Palti У, The effects of external potassium and long duration voltage conditioning on the amplitude of sodium currents in the giant axon of the squid, — J. Gen, Physiol., 1969, 54, p. 589—606.
25. Adelman W., Palti У., Joseph P. Potassium ion accumulation in a periaxonal space and its effect on the measurement of membrane potassium ion conductance. — J. Membrane Biol., 1973, 13, p. 387—410.
26. Adelman W-, Senft J. Dynamic assymmetries in the squid axon membrane. — J. Gen. Physiol., 1968, 51, p, 1025.
27. Albuquerque E. The mode of action of batrachotoxin. — Fed. Proc., 1972, 31, N 3, p. 1133—1138.
28 ; A rhem P., Frahkenhaeuser B., Moore J. tonic currents at resting potential in nerve fibres from Xenopus laevis. Potential clamp experiments. — Acta physiol, scand,, 1973, 88, p. 446 —454.
29. Armstrong C. Interaction of tetraethylammonium ion derivatives with the potassium channels of giant axons. — J. Gen. Physiol,, 1971, 58, p. 413— 437.
30. Armstrong 'C. Potassium pores of nerve and muscle membranes. — In: Membranes. Series of advances, 1975, 3, p. 325—358.
31. Armstrong C., Bezanilla F. Currents related to movement of the gating particles of the sodium channels. — Nature, 1973, 242, p. 459—461.
32. Armstrong C., Bezanilla F., Rojas E. Destruction of sodium conductance inactivation in squid axons perfused with pronase. — J. Gen. Physiol. 1973, 62, p. 375—391.
33. Armstrong C., Binstock L. Anamalous rectification in the squid giant axon injected with tetraethylammonium chloride. — J. Gen. Physiol., 1965, 48, p. 859—872.
34. Armstrong C-, Hille B. The inner quaternary ammonium ion receptor in potassium channels of the node of Ranvier. — J. Gen. Physiol., 1972, 59, p. 388—400.
35. Atwater I., Bezanilla F., Rojas E. Sodium influxes in internally perfused squid giant axon during voltage clamp, — J. Physiol. (London), 1969, 201, p. 657.
36. Baker P. Transport and metabolism of Ca++ ions in nerve. — Progr. Bio-phys. Molec. Biol., 1972, 24, 177—223,
37. Baker P., Hodgkin. A., Ridgway E. Depolarization and calcium entry in squid giant axons. — J. Physiol. (London), 1971, 218, 709—755.
38. Baker P., Hodgkin A., Shaw T. Replacement of the protoplasm of a giant nerve fibre with artificial solutions. — Nature, 1961, 190, p. 885—887.
39. Bergman E. Seuil d’excitation et regimes d’activitd du noeud de Ranvier. (Etude quantitative dans le cadre de la theorie de Hodgkin—Huxley). Theses. 1969. 217 p.
40. Bergman C. Increase of sodium concentration near the inner surface of the nodal membrane. — Pfliig. Arch., 1970, 317, p. 287—302.
41. Bergman C., Stampflt R. Difference de permeability des fibres nerveuse myelinisde sensorielles et matrices a 1’ion potassium. — Helvet. physiol, pharmac. acta, 1966, 24, p. 247—258.
42. Bernstein J. Untersuchungen zur Thermodynamik der bioelektrischen Strome. — Pfliig, Arch., 1962, 92, p. 521—562,
43. Bernstein J, Elektrobiologie. 1912, Braunschwoeig.
44. Bezanilla F., Armstrong M. Negative conductance caused by entry of sodium and cesium ions into the potassium channels of squid axons. — J. Gen. Physiol., 1972, 60, p. 588—608.
45. Bezanilla F., Armstrong C. Properties of the sodium channel gating current. — Cold Spring Harbor Syrup. Quant. Biol., 1976, 40, p. 297—304.
46. Binstock L., Goldman L. Current and voltage-clamped studies on Myxicola giant axons. Effect of tetrodotoxin. — J. Gen. Physiol., 1969, 54, p. 730— 740.
47. Bretag A., Stampflt П. Differences An action potentialsand accommodation of sensory and motor myelinated nerve fibres as computed on the basis of voltage clamp data. — Pfliig. Arch., 1975, 354, p. 257—271.
48. Burg D, Untersuchungen am Ranvierischen Schniirring einzelner Taubenner-venfasern. — Pfliig. Arch., 1970, 317, p. 278—286.
49. Cahalan M. Modification of sodium channel gating in frog myelineted nerve fibers by Centruroides Sculpturatus scorpion venom. — J. Physiol. (London), 1975, 244, p. 511—534.
50. Cahalan M., Shapiro B. Current and frequency dependent block of sodium channels by strychnine. — Biophys. J., 1976, 16 (2), p. 76a,
51. Chandler W., Meves H. Ionic selectivity in perfused giant axons. — J. Cell a. Comp. Physiol., 1965, 66, p. 65—70.
52. Chandler W., Meves П. Evidence for two types of sodium conductance in axons perfused with sodium fluoride solution. — J. Physiol. (London), 1970, 211, 653—678.
53. Cole K. Membranes, ions and impulses. California, 1968.
54, Cole K. Effects of polarization on membrane ion currents. — Biophys. Soc. Abstract, 1958, 12, p. 2.
55. Connor J., Stevens C. Inward and delayed outward membrane currents in isolated neural somata under voltage clamp. — J. Physiol. (London), 1971, 213, p. 1—19.
56. Conti F., Wanke E.Channel noise in nerve membranes and lipid bilayers. — Quart. Rev. Biophys., 1975, 8, p, 451—506.
57. Conti F., De Felice, Wanke E. Pottasium and sodium ion current noise in the membrane of the squid giant axon. — J. Physiol. (London), 1975, 248, p. 45-82.
58. Dtecke F. Die «Akkomodation» des Nervenstammes und des isolierten Ran-vierische Schmirringes. — Z. Naturforschung., 1954, 96, S. 713—729.
59. Dodge F. A study of ionic permeability changes underlying excitation in myelinated nerve fibers of the frog. Thesis of Rockefeller Institute. New York, 1963.
60. Dodge F., Frankenhaeuser B. Sodium currents in the myelinated nerve fibre of Xenopus laevis investigated with the voltage clamp technique. — J. Physiol. (London), 1959, 118, p. 188—200.
61. Douglas W., Ritchie J. Mammalian nonmyelinated nerve fibers. — Physiol. Rev., 1962, 42, 2, p. 297—334.
62. Du Bois Reymond. Untersuchungen fiber die tierische Elektrizitat I. 1848.
63. Dubois J., Bergman C. Late sodium current in the node of Ranvier. — Pflug. Arch., 1975, 357, p. 145—148.
64. Dubois J., Bergman C. Cesium induced rectifications in frog myelinated fibres. - Pfliig. Arch., 1975, 355, p. 361-364.
65. Dubois J., Bergman C. Potassium accumulation in the perinodal space of frog myelinated axons. — Pfliig. Arch., 1975.
66. Ehrenstetn J., Filbert D. Slow changes of potassium permeability in the squid giant axon. — Biophys. J., 1966, 6, p. 553—565.
67. Engelmann T. Beitrage zur allgemeinemMuskel und Nervenphysiologie. — Pfliig. Arch., 1870, 3, p. 247—282.
68, Fick A. Beitrage zur vergleichenden Physiologie der irritablen Substanzen. Braunschweig, 1863.
69. Fox J. On the existence of an ultra-slow inactivation of the sodium and potassium currents through the membrane of the node of Ranvier. — In: BBA, Biomembranes, 1976, 44, p. 232—244.
70. Fox I., Neurncke B., Nonner И7., Stampflt R. Block of gating currents by ultraviolet radiation in the membrane of myelinated nerve. — Pflug. Arch, 1976, 364, p. 143—145.
71. Frankenhaeuser B. A method for recording resting and action potentials in the isolated myelinated nerve fibre of the frog. — J. Physiol. (London), 1957, 135, p. 550—559-
72. Frankenhaeuser B. Instantaneous potassium currents in myelinated nerve fibres of Xenopus laevis, — J. Physiol. (London), 1962, 160, p. 46—53.
73, Frankenhaeuser B., ffodgkin A. The aftereffects of impulses in the giant nerve fibres of Loligo. — J. Physiol. (London), 1956, 131, p. 341—376.
74. Frankenhaeuser B., Hodgkin A - The action of calcium on the electrical properties of squid axons. — J. Physiol. (London), 1957, 137, p. 218—244.
75. Frankenhaeuser B., Huxley A. The action potential in the myelinated nerve fibre of Xenopus laevis as computed on the basis of voltage clamp data. — J. Physiol. (London), 1964, 171, p. 302—315.
76. Frankenhaeuser B., Moore L. The effect of temperature of the sodium and potassium permeability changes in myelinated nerve fibres of Xenopus laevis. — J. Physiol. (London), 1963, 169, p. 431—437.
77. Frankenhaeuser В., Moore L. The specificity of the initial current in myelinated nerve fibres of Xenopus laevis. Voltage clamp experiments. — J. Physiol. (London), 1963, 169, p. 438—444.
78. Frankenhaeuser B., Vallbo A. Accommodation in myelinated nerve fibres of Xenopus laevis as computed on the basis of voltage clamp data. — Acta physiol, scand., 1965, 63, p. 1—20.
79. Goldman D. Potential, impedance and rectification in membranes. — J. Gen. Physiol., 1943, 27, p. 37—60.
80. Goldman L. The effects of some ions on the membrane potential of the giant axon of Myxicola. — J. Cell a. Comp. Physiol., 1968, 71, p. 33—42.
81, Goldman L., Binstock L. Current separations in Myxicola giant axones, — J. Gen. PhysioL, 1969, 54, N 6, p. 741—754.
82. Granit R., Scoglund C. Accomodation and autorhythmic mechanism in single sensory fibres. — I. Neurophysiol., 1943, 6, p. 337—350.
83. Greengard P., Straub R. Afterpotentials in mammalian nonmyelinated nerve fibres. — J. Physiol. (London), 1958, 144, p. 442—462.
84, Hagtmara S., Oomura J. The critical depolarization for the spike in the squid giant axon. — Jap. J. Physiol., 1958, 8, p. 234—245,
85. Hill A. Excitation and accommodation in nerve. — Proc. Roy. Soc. Ser. B, 1936, 119, p. 305—354.
86. Hill A, The strength-duration relation for electric excitation of medullated nerve. — Proc. Roy. Soc. Ser. B., 1936, 119, p. 440—453.
87. Hill T., Chen Yi-Der. On the theory of ion transport across the nerve membrane, IV. Noise from the open-close kinetics of K+ channels. — Biophys. J., 1972, 12, p. 948—959.
88. Hill T. On the theory of ion transport across the nerve membrane. V. Two models for the Cole—Moore K+ hyperpolarization delay. — Biophys., 1972, 12, p. 960-976.
89. Hille B. A pharmacological analysis of the ionic channels of nerve. Thesis of Rockefeller University, New York, 1967.
90. Hille B. Charges and potentials at the nerve surface: divalent ions and pH. — J. Gen. PhysioL, 1968, 51, p. 221—236.
91. Hille B. Ionic channels in nerve membranes. — Progr. Biophys. Molec. Biol., 1970, 21, p. 1—32.
92. Hille B. The permeability of the sodium channel to metal cation in myelinated nerve. — J. Gen. Physiol,, 1972, 59, p. 637—658.
93. Hille B. Potassium channels in myelinated nerve: selective permeability to small cations. — J. Gen. Physiol., 1973, 61, p. 668—696.
94. Hille B. The receptor for tetrodotoxin' and saxitoxin. A structural hypothesis. — Biophys. J., 1975, 15, p. 615—619.
95. Hille B. Ionic selectivity, saturation, and block in sodium channels. A four-barrier model. — J. Gen. Physiol., 1975, 66, 535—560.
96. Hille B., Courtney K., Bum R. Rate and site of action of local anesthetics in myelinated nerve fibres. — In: Molec. mechanisms of anesthesia. Progress in Anesthesiology. 1975.
97. Hodgkin A., Huxley A. Action potentials recorded from inside a nerve fibre. — Nature, 1939, 144, p. 710—711.
98. Hodgkin A. The conduction of the nervous impulse. Liverpool, 1964. (Русск, перев.: Ходжкин А. Нервный импульс. М., 1965).
99. Hodgkin А., Huxley А A quantitative description of membrane current and its application to conduction and excitation in nerve. — J. Physiol. (London), 1952, 117, p. 500— 544.
100. Hodgkin A., Huxley A., Katz B. Ionic currents underlying activity in the giant axon of the squid. — Arch. Sci. Physiol., 1949, 3, p. 129—150.
101. Hodgkin A., Huxley A., Katz B. Measurement of current-voltage relations in the membrane of the giant axon of Loligo. — J. Physiol. (London), 1952, 116, p, 424-448.
102. Hodgkin A., Katz B. The effect of sodium ions on the electrical activity of the giant axon of squid. — J. PhysioL (London), 1949, 108, p. 378.
103. Kao C., Nishiyama A. Actions of saxitoxin on peripheral neuromuscular systems. — J. Physiol. (London), 1965, 180, p. 50—66.
104. Katz B. Multiple response to constant current in frog’s medullated nerve. — J. Physiol. (London), 1936, 88, p. 239—250.
105. Katz B. Nerve, muscle and synapse, New York, 1966, (Русск. перев.: Катц В. Нерв, мышца, синапс. М., 1968.
106. Katz В. The release of neuronal transmitter substances. Liverpool, 1969.
107. Kernell D., Sjoholm M, Repetitive impulse firing: comparisons between neurone models based on «voltage clamp equations» and spinal moto-neurones. — Acta physiol, scand., 1972, 87, p. 40—56.
108. Keynes R., Rojas E. Kinetics and steady-state properties of the charged system controlling sodium conductance in the squid giant axon. — J. Physiol. (London), 1974, 239, p. 393—434.
109. Koppenhbfer E. TEA-Wirkung auf die lonenstrome markhaltiger Nerven-fascrn von Xenopus laevis. — Pfliig. Arch., 1966, 289, p. R9.
110. Koppenhofer E. Die Wirkung von Tetraethylammoniumchlorid auf die Membranstrome Ranvierscher Schnurringe von Xenopus laevis. — Pfliig. Arch., 1967, 293, p. 34—55.
111. Koppenhofer E. The effect of cooper, TTX, cocaine and TEA on resting and action potentials of Nitella. — Pfliig. Arch., 1972, 336, p. 229—310.
112. Koppenhbfer E., Schmidt H. Die Wirkung von Skorpiongift auf die lonenstrome des Ranvierschen Schutirrings. I. Die Permeabilitaten PNa und PK -Pfliig. Arch., 1968, 33, p. 133-149.
113. Koppenhbfer E., Schmidt H. Die Wirkung von Skorpiongift auf die lonenstrome des Ranvierschen Schniirrings. II. Unvollstandige Na-inaktivie-rung. — Pfliig. Arch., 1968, 303, p. 150—161.
114. Koppenhbfer E., Vogel W. Wirkung von Tetrodotoxin und Tetraaethyl-ammoniumchlorid an dec innenseite dec Schniirringsmembran von Xenopus laevis. — Pfliig. Arch., 1969, 313, p. 361—380.
115. Landon D., Williams P. L. Ultrastructure of the node of Ranvier. — Nature, 1963, 199, p. 575—577.
116. Lapique L. L’excitabilite en fonction du temps. Paris, 1926.
117. Lorento De No. R. A study of nerve physiology. — Stud. Rockfeller Inst. Med. Res,, 1947, 132, p. 1—2.
118. Luttgau H, Das Kalium-Transportsystem am Ranvier-Knot an isolierter markhaltiges Nervenfasein. — Pfliig. Arch. 1960, 217, p. 613—633.
119. Marmont G. Studies on the axon membrane. A new method. — J. Cell a. Comp. Physiol., 1949, 34, p. 351—382.
120. Meves H. Die Nachpotentiale isolierter markhaltiger Nervenfasern des Frosches bei Einzelreizung. — Pfliig. Arch., 1960, 271, p. 655—679.
121. Meves H. Die Nachpotentiale isolierter markhaltiger Nervenfasern des Frosches bei tetanischer Reizung. — Pfliig. Arch., 1961, 272, p. 336—359.
122. Meves H. The effect of holding potential on the asymmetry currents in squid giant axons. — J. Physiol. (London), 1974, 243, p. 847—867.
123. Meves H. Calcium currents in squid giant axon. — Philos. Trans. Roy. Soc. Ser. B, 1975, 270, p. 377—387.
124. Meves H. The effect of zinc on the late displacement current in squid giant axon. — J. Physiol. (London), 1976, 254, 787-801.
125. Moore J., Anderson N., Blaustein M.t Takata M., Lettvin Pickard W., Bernstein T., Pooler /. Alkali cation specificity of squid axon membrane. — Ann. New York Acad. Sci., 1966, 137, p. 818— 840.
126. Narahashi T. Chemicals as tools in the study of excitable membranes. — Physiol. Rev., 1974, 54, p. 813—889.
127. Narahashi T., Albuquerque E., Degucht T. Effects of batrachotoxin on membrane potential and conductance of squid giant axons. — J. Gen. Physiol., 1971, 58, p. 54—70.
128. Nernst W. Zur Theorie des elektrisches Reizes.—Pfliig. Arch, 1908,122,p.275.
129. Neumcke B., Nonner W., Stamp)li R. Symmetrical displacement current and its relation with the activation of sodium current in the membrane of frog myelinated nerve. — Pfliig. Arch., 1976, 363, p. 193—203.
130. Manner IT., Conti F., Hille B., Meumcke B., Stampfli R. Current noise andl the conductance of single Na channels. — Pfliig. Arch., 1976, 362, p, R27..
131. Manner W., Stampfli R. A new voltage clamp method. — In: Laboratory, Techniques in membrane Biophysics. Stuttgart—Berlin—New York, 1969,. p. 171—175.
132. Manner W-, Rojas E., Stampfli R. Displacement currents in the node of.' Ranvier. — Pfliig. Arch., 1975, 354, p. 1—18.
133. Partridge L., Stevens C. A mechanism for spike frequency adaptation. — J. Physiol. (London), 1976, 256, p. 315-332.
134, Ritchie /. Possible mechanisms underlying production of afterpotential; in nerve fibers. — In: Biophysics Physiol, a. Parmac. Actions. 1961,, p. 165—182.
135. Rojas E., Rudy B. Sodium conductance inactivation induced by quarternary ammonium compounds in squid giant axons in which the inactivatiom gate has been destroyed. — J. Physiol, (London), 1976, 256, p. 1238—1248..
136. Sato M. Effect of connective tissue sheath on the value of the accommodation constant of a nerve fiber. — Jap. J. Physiol., 1952, 2, p. 270—277..
137. Sehmidt H. Die Abhangigkeit des Ruhepotentials markhaltiger Nerven-fasern von Elektrolytgehalt dec Aussenfliissigkeit. — Ann. Univ. Sara-viensis, 1964, 9, p. 1, 3—69.
138. Schmidt H., Schmitt 0. Effect of aconitine on the sodium permeability of the node of Ranvier. — Pfliig. Arch. 1974, 349, p. 133—148.
139. Schwarz J., Ulbricht W., Wagner H. The rate of action of TTX on myelinated nerve fibres of Xenopus laevis and Rana esculenta. — J. Physiol.. (London), 1973, 233, p. 167—194.
140. Schwarz J., Vogel W. Potassium inactivation in single myelinated nerve-fibres of Xenopus laevis. — Pfliig. Arch., 1971, 330, p. 61—73.
141. Shanes A. Potassium movements in relation to nerve activity. — J. Gen-Physiol., 1951, 34, p. 785—807.
142. Shenes A. Electrochemical aspects of physiological and pharmacological! action in excitable cells. — Pharmac. Rev., 1958, 10, 59—273.
143. Shrager P. Ionic conductance changes in voltage clamped crayfish axons at low pH. — J. Gen. Physiol., 1974, 64, p. 666—690.
144. Shrager P., Profera C. Inhibition of the receptor for tetrodotoxin in nerve membranes by reagents modifying carboxyl groups. — Biochim. biophys. acta, 1973, 318, p. 141—146.
145. Stampfli R. Is the resting potential of Ranvier nodes a potassium potential? — Ann. New York Acad. Sci., 1959, 81, p. 127—145.
146. Stampfli R. Intraaxonal iodate inhibits sodium inactivation, — Expe-rientia, 1974, 30, p. 505—508,
147. Stdmpfli R., Hille B, Electrophysiology of frog peripheral myelinated nerve. 1976.
148. Stevens F. Inferences about membrane properties from electrical noise measurements. — Biophys., 1972, 12, p. 1028—1047.
149. Strichartz G. The inhibition of sodium currents in myelinated nerve by quaternary derivatives of lidocaine. — J. Gen. Physiol., 1973, 62, p. 37—57.
150. Tasaki I. Nervous transmission. Springfield, 1953.
151. Tasaki I. Demonstration of two stable states of the nerve membrane in potassium-rich media. — J. Physiol. (London), 1959, 148, p. 306—331.
152. Tasaki I., Hagiwara S. Demonstration of two stable potential states in the squid giant axon under tetraethylammonium chloride. — J. Gen. Physiol., 1957, 40, p. 859—885.
153. Tasaki I,, Hagiwara S- Demonstration of two stable potential states in the squid giant axon under tetraethylammonium chloride. — J. Gen. Physiol., 1959, 40, p. 859—885.
154. Ulbricht W. Der zeitliche Verlauf der Kalium —Depolarization der Schniirringsmembran bei verschiedener Calcium — Konzentrationen und anodischer Polarization. — Pfliig. Arch., 1963, 277, p. 270—284.
155. Ulbricht W. ionic channels through the axon membrane. (A review). — Biophys. Struct. Mechanism, 1974, 1, p. 1—16.
156. Ulbricht W., Wagner H. The influence of pH on equilibrium effects of tetrodotoxin on myelinated nerve fibres of Rana esculenta. — J. Physiol. (London), 1975, 252, p. 159—202.
157. Vallbo A. Accommodation of single myelinated nerve fibres from Xenopus laevis related to type of end organ. —Acta physiol, scand., 1964, 61, p. 413—428.
158. Vallbo A. Accommodation related to inactivation of the sodium permeability in single myelinated nerve fibres from Xenopus laevis. — Acta physiol, scand., 1964, 61, p. 429—444.
159. Verveen A., De Felice L. Membrane noise. — Progr. Biophys. Molec. Biol., 1974, 28, p. 189—265.
160. Volta A. (1792—1795). In: Le орете di Alessandro Volta. Ed. Nazionale, Milano, 1918-1929,
161. Wagner H., Ulbricht W. The rates of saxitoxin action and of saxitoxin-tetrodoxin interaction at the node of Ranvier. — Pfliig Arch., 1975, 359, p. 297—315.
162. Weiss G, 1. Recherches sur I’excitation des nerfs par les courants de tres courtes durees. — G. R. Soc. Biol., 1901, 53, p. 253.
163. Williams P., London D. The energy service of the nerve fibre. — New Scientist, 1964, 374, p. 166—169.
Г лава 3
ЭЛЕКТРИЧЕСКАЯ ВОЗБУДИМОСТЬ ТЕЛА НЕРВНОЙ КЛЕТКИ
В отличие от нервных проводников, тело (сома, перикарион) нервной клетки стало доступным для электрофизиологического изучения лишь после изобретения микроэлектрода. Поэтому сведения, которыми мы располагаем по данному вопросу, накоплены в основном за последние 20 лет.
Свойства мембраны тела нервной клетки резко отличаются от свойств мембраны нервных волокон ( в дальнейшем для упрощения мы будем пользоваться терминами «нервная клетка» и «нейрон», подразумевая именно тело клетки без отростков — аксона, дендритов и нервных окончаний). Непосредственное участие кальция в процессе электрического возбуждения — генерации нервного импульса — оказалось как раз важным свойством мембраны нервной клетки. В дополнение к системе ионных каналов, идентичных тем, которые обеспечивают возбудимость нервного волокна, нервная клетка имеет развитую систему кальциевых каналов. Мембрана нервной клетки имеет и другие типы ионных каналов, нехарактерные для мембраны нервных проводников.
Важность знания механизмов электрической возбудимости соматической мембраны не ограничивается вопросами, связанными с деятельностью собственно нервной клетки. Как стало ясным в течение последнего десятилетия, кальциевая проницаемость является почти универсальным свойством биологических мембран. Одним из самых удобных объектов для ее изучения (равно как и изучения свойств возбудимых мембран вообще) оказались гигантские нервные клетки • брюхоногих моллюсков. Их размеры (диаметр до 1 мм у некоторых видов животных) позволяет применять эффективнейший метод анализа активности клеточных мембран — фиксацию потенциала, а в последнее время — и замену внутриклеточной среды. В то же время нет особой опасности, что какие-либо «экзотические» свойства данного объекта будут затем безосновательно
приписаны другим объектам: соответствующие исследования, хотя и в ограниченном масштабе, могут быть повторены на других типах нейронов.
3.1. МУЛЬТИИОННАЯ ПРИРОДА ПОТЕНЦИАЛОВ ДЕЙСТВИЯ НЕРВНОЙ КЛЕТКИ
3.1.1. НЕПРЯМЫЕ ДАННЫЕ О НАЛИЧИИ КАЛЬЦИЕВОЙ ПРОВОДИМОСТИ В МЕМБРАНЕ НЕРВНОЙ КЛЕТКИ
Модель генерации нервного импульса, созданная Ходжкином и Хаксли (см. гл. 2), была настолько убедительна, что в течение многих лет вопрос о возможном участии в генерации нервного импульса других ионов, кроме натрия и калия, ставился с большой осторожностью. Тем не менее за 10 лет (с 1957 по 1967 г.) стало совершенно ясно, что кальциевая электрическая возбудимость столь же широко распространена в живой природе, как и натриевая.
Первоначально возбудимость нервной клетки, обусловленная повышением кальциевой приницаемости мембраны, была идентифицирована в нейронах спинальных ганглиев лягушки [591. Нервные импульсы, регистрируемые в безнатриевой среде, зависели от присутствия в ней катионов щелочноземельных металлов: кальция, стронция и бария [77 ]. Зависимость превышения потенциала действия была близка к теоретической для кальциевого электрода. Согласно уравнению Нернста,
р ___ ВТ > [Са++|0 /м
Если мембрана в момент пика потенциала действия близка по свойствам к кальциевому электроду, то для двух различных концентраций наружного кальция и при постоянной концентрации кальция в клетке разность амплитуд пика будет равна
р р _____ [Са^]г ,п\
£1— 2Г [Ca++]i '
При температуре 22° С эта разность должна составить 29.5 мВ на 10-кратное изменение наружной концентрации кальция. Экспериментально была получена величина 30 мВ. Однако такое совпадение, отмеченное многими авторами, оказалось, как выяснилось позднее, в значительной степени случайным. Применение формулы (2) оправдано лишь в тех случаях, когда потенциал во время пика потенциала действия близок к нернстовскому. Однако при существующем на мембране градиенте концентрации кальция потенциал действия должен был бы превышать наблюдаемую амплитуду в несколько раз. Таким образом, описанные изменения пика потенциала действия имеют лишь качественное значение, демон-
8 Общая физиология нервной системы 113
Стрйруя Сильную завйсймбсть его 6т наружной концентрации кальция.
Кальциевые потенциалы действия, регистрируемые в безнатрие-вой среде, оказались нечувствительными к тетродотоксину (ТТХ). В нормальной солевой среде, содержащей ионы кальция и натрия, нейроны спинальных ганглиев амфибий генерируют нервные импульсы с участием обеих сторон ионон. Натриевый компонент нерв ного импульса селективно подавляется ТТХ (5 х 10~8 г/мл), что позволяет допускать существование двух независимых компонентов входящего тока.
Аналогичные результаты были получены при исследовании нейронов симпатических ганглиев лягушки (60]. Что касается
Рис, 3.1. Кальциевые потенциалы действия нервной клетки прудовика.
1 — изотонический раствор, содержащий нормальную концентрацию кальция и сахарозу; г—S —• изотонический раствор хлористого кальция; 6—8 — нормальный ринге ронский раствор. Верхней горизонтальной линией обозначен нулевой потенциал; потенциалы действия были получены стимуляцией нейрона выходящим постоянным током. На 1, 4, 5 и 8 показаны также изменения мембранного потенциала при пропускании через мембрану такого же по величине входящего тока [1].
симпатических ганглиев млекопитающих, то имеющиеся в настоящее время результаты несколько отличны: сохранение возбудимости имело место в растворах, содержащих барий, но не кальций или стронций [82]. Это также указывает на существование в мембране этих нейронов системы (возможно, несколько менее развитой) переноса двухвалентных катионов.
В 1964 г. были получсны данные, указывающие на способность гигантских нейронов моллюсков генерировать нервные импульсы в безнатриевой среде, содержащей ионы кальция [1]. На рис. 3.1 представлены примеры кальциевых потенциалов действия гигантского нейрона. Первоначально были исследованы три вида легочных моллюсков — Helix pomatia, Limnea stagnalis, Planorbis corneus. Задем гигантские нейроны из центральной нервной системы различных моллюсков стали объектом чрезвычайного интереса со стороны электрофизиологов. Данные о способности гигантских нейронов генерировать кальцийзависимые нервные импульсы были подтверждены в исследованиях на других видах моллюсков, в том числе на A plysia californica — виде, обладающем особо 114
крупными нервными клетками — диаметром до 1 мм [53]. Ге-дульдиг и Юнге 141 ] показали, что потенциал действия в нейронах аплазии генерируется с участием натрия и кальция. Натриевый компонент можно было подавить ТТХ, а кальциевый — кобальтом.
Кальциевые потенциалы действия были обнаружены также в нейросекреторных клетках рака [52], а совсем недавно Эллен и Джон Барреты показали, что компонент кальциевого тока существует в мотонейронах спинного мозга лягушки [27]. Этот результат авторы получили, исследуя клетки в изолированных срезах (толщиной 2—4 мм) спинного мозга, что позволило им производить смену ионного состава наружной среды. При помещении препарата в изотонический раствор хлористого кальция с добавлением тетраэтиламмония (ТЭА) большинство клеток оказалось способными генерировать регенеративные деполяризующие ответы, блокируемые марганцем и нечувствительные к ТТХ.
Для более детальной оценки относительного вклада обоих компонентов входящего тока и для изучения их свойств понадобилось использование другого метода — фиксации потенциала.
3.1.2. ПЕРВЫЕ ПРЯМЫЕ ИЗМЕРЕНИЯ
КАЛЬЦИЕВЫХ И НАТРИЕВЫХ ВХОДЯЩИХ ТОКОВ
Первоначально разработанный для гигантского нервного волокна метод фиксации потенциала был применен на нервных клетках моллюсков и рыб Хагиварой и Сайто [45, 46], а также на мотонейронах [38]. Необходимым условием адекватного использования данного метода является условие так называемой пространственной фиксации. Это условие достаточно очевидно: разность потенциалов должна иметь заданную величину на всей площади мембраны, через которую протекает измеряемый ток. Поэтому наиболее пригодными для изучения методом фиксации потенциала в простейшей его модификации оказались униполярные нейроны. Относительно высокое входное сопротивление аксона позволило фиксировать потенциал в соме нейрона с помощью следящей системы, подключенный к двум введенным в сому микро-электродам. Типичная блок-схема установки для фиксации потенциала на мембране нервной клетки представлена па рис. 3-2.
Первые исследования с применением фиксации потенциала показали, что общая картина ионных токов в нервной клетке качественно та же, что и в нервном волокне. Оказалось также, что мотонейроны в силу их геометрических особенностей (наличия дендритов) мало пригодны для исследования данным методом. Существенные отклонения от условия пространственной фиксации наблюдались и в униполярных нервных клетках, однако качественные исследования в последнем случае оказались возможными. Дальнейшие работы по выяснению природы входящего тока с применением фиксации потенциала были проведены в основном на гигантских нейронах моллюсков. Чемберлен и Керкут [30],
применив фиксацию потенциала к нейронам моллюска Helix aspersa, не обнаружили признаков существования кальциевого входящего тока. Натриевый ток в их экспериментах был нечувствителен к ТТХ. Сохранение входящего тока в безнатриевой среде авторы объясняли возможностью существования диффузионных барьеров, затрудняющих устранение натрия из примембранного слоя,
Рис. 3.2. Блок-схема установки для фиксации потенциала на мембране нервной клетки.
1 —• предусилитель с компенсацией входной емкости, входное сопротивление 1010 Ом; в —• операционный усилитель для фиксации потенциала, амплитуда сигнала на выходе гЬ20 В; з — операционный усилитель, преобразующий ток в напряжение. Коэффициенты усиления указаны в [4].
а описанное выше действие кальция на пик потенциала действия — взаимодействием ионов кальция с натрийпереносящей системой. К аналогичному выводу пришел и Мо ретон [70]. Однако затем Крышталь и Магура [17], исследуя нейроны Helix pomatia, прямо измерили в некоторых клетках кальциевый входящий ток. Эксперименты были проведены следующим образом. Препарат помещался в безнатриевый раствор. После полного исчезновения входящего тока, т. е. после вымывания натрия из примембранного слоя, концентрация кальция в растворе резко повышалась. Это приводило в ряде случаев к появлению полноценных потенциалов действия и соответственно позволяло непосредственно измерять каль-
ке
циевый входящий ток. Трудность состояла в том, что большинство нейронов оставались невозбудимыми в этих условиях, а в остальных клетках соотношение натриевых и кальциевых токов сильно варьировало. Гедульдиг и Грюнер [42] провели аналогичное исследование на нейронах аплизии. В данном случае натриевый входящий ток был чувствителен к блокирующему действию ТТХ (10-6 г /мл). После приложения этого вещества был измерен остаточный кальциевый входящий ток, составляющий в нормальных условиях примерно 1/10 натриевого входящего тока.
Исследования входящих токов в нейронах моллюсков осложнились некоторыми факторами. Наличие соединительнотканных оболочек и глии в интактных клетках действительно замедляют изменения ионного состава у наружной поверхности мембраны. Неконтролируемые по потенциалу участки мембраны приводят к существенным погрешностям фиксации потенциала. Последняя трудность усугубляется тем обстоятельством, что свойства мембраны сомы и аксона различны. Применение фиксации потенциала на мотонейронах спинного мозга кошки [26] подтвердило более ранние предположения о разных порогах возбудимости в соме и в аксонах. Применительно к нейронам различных видов моллюсков было показано, что аксон в отличие от сомы всегда и полностью теряет возбудимость в безнатриевой среде [21,83]. Различие свойств начинает сказываться уже на уровне начального сегмента и — более того — сама мембрана сомы в этом смысле негомогенна: близкие к начальному сегменту участки генерируют натриевые потенциалы действия, а удаленные от аксона — кальциевые [54]. Последняя работа была выполнена с использованием одного из описанных ниже методов, разработанных для улучшения пространственных условий фиксации потенциала. Дальнейший анализ электрической возбудимости нервных клеток потребовал в связи с описанными трудностями других экспериментальных подходов.
3.2. ХАРАКТЕРИСТИКА ИОННЫХ КАНАЛОВ МЕМБРАНЫ НЕРВНОЙ КЛЕТКИ
3.2.1. СОВРЕМЕННЫЕ ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ НЕРВНЫХ КЛЕТОК
Негер и Люкс [72], модифицировав более раннюю идею Франка и Тауца [39], разработали метод измерения трансмембранного тока, протекающего через ограниченный участок мембраны. Суть метода состоит в следующем. На мембране нервной клетки обычным способом (согласно рис. 3.2) фиксируется потенциал. К клетке прижимается или подсасывается под давлением в несколько миллиметров ртутного столба двуствольная микропипетка, заполненная нормальным раствором. Подключенная к ней независимая следящая система фиксирует на нулевом уровне потенциал в объеме между кончиком микропипетки и мембраной.
В результате на выходе следящей системы образуется сигнал, пропорциональный току через участок мембраны, ограниченный площадью сечения микропипетки. Преимущество-метода очевидно: измеряется ток, протекающий только через тот участок мембраны, для которого заведомо выполняется пространственное условие фиксации потенциала. Как раз применение этого метода позволило Кадо [54 J прямо показать гетерогенность свойств мембраны сомы и начального сегмента аксона. Недостаток метода — трудности при смене наружного раствора в двуствольной микропипетке. Тем не менее с использованием данного метода был получен ряд важных результатов (см. ниже).
Другим методом, позволяющим существенно улучшить условия эксперимента, оказалась перевязка аксона. Этот метод был первоначально использован Альвинг для локализации генератора ритмоводящей активности [251. Затем Коннор и Стевенс применили перевязку аксона для исследования механизмов электровозбудимости нейронов ряда морских.моллюсков [32 J. На аксоны группы клеток (от 3 до 6 нейронов) накладывалась шелковая лигатура. Расстояние от сомы отдельного нейрона до лигатуры было около 200 мкм. Этим достигалась относительная электрическая изоляция сомы от аксона, контролировавшаяся по распространению постсинаптических потенциалов и по форме кривых трансмембранного тока. Данный метод оказался достаточно эффективным для исследования калиевых выходящих токов в мембране нервной клетки, однако не приобрел широкой популяции ввиду препаративной сложности и недостаточно надежных критериев проверки.
Баумгартен, Чен и Такеда [28], а затем независимо Костенко [3] разработали метод выделения одиночных нервных клеток из центральной нервной системы моллюсков. Метод основан на обработке нервной ткани протеолитическими ферментами (проназа, трипсин и др.) с последующей механической изоляцией нервных клеток. Полученные таким образом нейроны способны длительное время (до нескольких суток) сохранять все свойства нормальной электрической возбудимости. Костюк и сотр. применили к изолированным нейронам метод фиксации потенциала [2, 6]. При такой постановке экспериментов удалось избавиться как от наружных диффузионных барьеров, затрудняющих замену внеклеточной ионной среды (рис. 3.3 — вкл., с. 33), так и от неконтролируемых по потенциалу участков мембраны.
Тело нервной клетки оказалось доступным для более детального анализа. Существовавший разброс в данных о степени участия ионов кальция в электрическом возбуждении нейронов моллюсков был устранен. Однако особенности калиевых выходящих токов в нейронах моллюсков — наличие быстрого выходящего тока и малая чувствительность к специфическому блокатору тетраэтиламмонию — не позволяли проводить детальные исследования входящих токов. Был предложен метод внутриклеточного диализа, позволивший преодолеть эти трудности, а кроме
Tofo — Что особенно важно — осуществлять йолйую аамейу внутриклеточной среды [12, 18]. Объектом метода внутриклеточного диализа служат нейроны моллюсков, выделенные из ганглиев с помощью протеолитических ферментов. Суть метода заключается в следующем (рис. 3.4). Исследуемый нейрон (диаметр от 40 до 200 мкм) помещается в конусообразную пору перегородки, разделяющей верхний п нижний отсеки экспериментальной камеры.
Рис. 3.4. Метод внутриклеточного диализа.
/ — эмиттерный повторитель, 2 — усилитель для фиксации потенциала, J — усилитель, преобразующий мембранный ток я напряжение. UL — переключатель «фиксация—стимуляция». Вертикальной стрелкой показана регулировка давления в нижней камере (18],
Стены поры покрыты клейкой массой. В нижней камере создается отрицательное гидростатическое давление, обеспечивающее слипание мембраны клетки со стенами поры и частичное разрушение участка мембраны, контактирующего с нижним отсеком. Окончательное разрушение барьерных свойств этого участка достигается пропусканием через нижний отсек бескальциевого изоосмотиче-ского раствора. После этого гидростатическое давление снимается. Верхний отсек камеры перфузируется нормальным раствором Рингера (или его заменителем — в зависимости от целей эксперимента). Контактирующий с ним верхний участок мембраны полностью сохраняет возбудимость и генерирует полноценные нервные импульсы. При смене раствора, перфузирующего нижнюю часть камеры, происходит его быстрая диффузия внутрь клетки, приводящая к требуемой замене внутриклеточной среды. Эффективность метода внутриклеточного диализа иллюстрируется следую-
щими примерами: 1) электрическая утечка между стенами поры н мембраной столь мала, что позволяет осуществлять 100%-ное отведение потенциалов действия; 2) состояние мембраны более ста-
<г0м8\___
10*с
10*с
бильно, чем в микроэлектродных экспериментах. Было показано, что ряд «благоприятных» анионов, сохраняющих при внутриклеточном введении «рабочий» участок мембраны, совпадает с полученным при перфузии гигантского аксона кальмара [81]. На рис. 3.5 демонстрируется результат устранения из клетки ионов калия: превращение нисходящей фазы потенциала действия в плато.
Таким образом, в настоящее время существует целый набор экспериментальных приемов, позволяющих производить анализ механизмов элек-
Рис. 3.5. Влияние устранения ионов калия из клетки.
А — потенциалы действия зарегистрированы вначале при диализе клетки калий-фосфатом (вверху), а затем с интервалом 10 с после начала диализа трисфосфатом; В —• кривые трансмембранного ионного тока, полученные в нормальном растворе после устранения калил из клеток. Амплитуды деполяризации указаны возле кривых в МВ.
трической возбудимости нервной клетки. Разработаны^они, однако, применительно к гигантским нейронам моллюсков. Анализ тонких особенностей возбудимости нейронов центральной нервной системы высших животных — видимо, дело недалекого будущего.
3.2.2. КАНАЛЫ ВЫХОДЯЩЕГО КАЛИЕВОГО ТОКА
Первое подобное исследование калиевых выходящих токов в мембране нервной клетки было предпринято Накаджи-мой и Кусано [71] на супрамедулярных нейронах рыбы. Следует отметить, что изучение этих механизмов в меньшей степени подвержено ограничениям, связанным с наличием неконтролируемых по потенциалу пространств, так как именно сому нервной клетки отличает высокая калиевая проводимость [54]. Накаджима и Кусано обнаружили весьма сложную картину поведения калиевых токов: при постоянном деполяризующем смещении эти токи быстро активировались, затем быстро инактивировались до нуля, а после этого снова происходила их активация и инактивация, но уже со значительно меньшими скоростями. Эти явления были затем 120
подробно проанализированы на гигантских нейронах моллюсков [32—34, 72]. Оказалось, что в мембране нервной клетки существуют две независимых системы калиевых каналов: каналы задержанного выходящего тока, аналогичные калиевым каналам нервных волокон, и не имеющие аналога каналы быстрого выходящего тока. Различаются эти системы каналов прежде всего по кинетике. Постоянные времени активации и инактивации отличаются соответственно для быстрого и задержанного токов примерно на порядок.
Эти каналы имеют разную потенциалозависимость. На рис, 3.6 демонстрируются инактивационные* характеристики обоих ком-
ходящего тока, нормированная к его макси- -itf -7Q -30
мальвой величине [7]. V мВ
жителей, чем 50 мВ. Половинная инактивация задержанного выходящего тока достигается при потенциале —20-?—30 мВ, а для быстрого выходящего тока — при -70-?—80 мВ. Рис. 3.6 хорошо иллюстрирует те трудности, с которыми сталкивается исследователь, изучающий входящий ток в нервной клетке: существует узкий диапазон значений мембранного потенциала, при которых быстрый выходящий ток, суммирующийся с входящим током, уже инактивирован, а входящий ток еще не инактивирован. Это диапазон —40?—50 мВ [9]. Истинные значения пиков входящего тока могут быть получены без подавления выходящих токов лишь в этом диапазоне поддерживаемых потенциалов.
Быстрый и задержанный выходящие токи по разному реагируют на ТЭА — известный блокатор калиевых каналов. При действии снаружи ТЭА в большей степени блокирует каналы задержанного выходящего тока. Интересно сравнение данных о чувствительности задержанного тока к ТЭА, полученных на интактных и изолированных нервных клетках: если в первом случае половинное подавление проводимости достигается при концентрации ТЭА 6—8 мм, то во втором — уже при концентрации в 1 мм [10]. Очевидно, что мембрана изолированной нервной клетки значительно доступнее к наружным фармакологическим воздействиям. Быстрый выходящий ток, напротив, более чувствителен к внутриклеточному действию ТЭА, вводимого в клетку ионофоретически через микроэлектрод.
Каково функциональное значение дополнительной системы быстрых калиевых каналов, активирующихся вблизи порогового потенциала?
Ответить на этот вопрос попытались Коннор и Стевенс [32 — 34 [. Используя модифицированную модель Ходжкина—Хаксли, эти исследователи рассчитали поведение нейрона при генерации двух последовательных потенциалов действия в ответ на постоянный стимулирующий ток. Модификация известной модели состояла в учете дополнительного, «быстрого» компонента калиевого тока. Основное уравнение в их расчетах выглядело так:
' <') == с Т7+‘‘ (К - К') + - У«) +
— V,), (3)
где I (t) — приложенный ток, С — мембранная емкость, индексы I, К, А, I относятся соответственно к входящему, задержанному выходящему, быстрому выходящему токам и к току утечки. Отметим основные особенности расчетов Коннора и Стевенса, которые позволят сравнить их модифицированную модель с оригинальной моделью, предназначенной для описания нервных волокон (см. гл. 2). Зависимости проводимостей от времени и потенциала имеют следующий вид: входящий ток
gl(V, t), • (4)
где 4 — переменная, описывающая активацию, В — переменная, описывающая инактивацию; быстрый выходящий ток
О, (5)
задержанный выходящий ток
(6)
Уравнение (6) решалось авторами для относительно короткого промежутка времени прсле приложения стимула, поэтому в последнем случае переменную В не следует идентифицировать с членом, описывающим инактивацию.
Расчеты показали, что быстрый выходящий ток вносит большой вклад в изменения мембранного потенциала в межимпульсном интервале, являясь своеобразным регулятором ритмической активности, Механизм действия этого регулятора легко попять, исходя из чисто качественных соображений. При нормальном потенциале покоя (—404—50 мВ) быстрый выходящий ток почти полностью инактивирован (см. рис. 3.6). Следовая гиперцоляризация частично снимает эту инактивацию, и, следовательно, межимпульсный интервал увеличивается. Эти рассуждения справедливы, однако, лишь для цаибольщих частот импульсации, 1?2
Расчет кинетики иОНнЫх ТоКОв по Модели ХоджКина—ХаКсЛН был сделан также Нетером [72]. Слабым местом этих расчетов является, однако, практическое отсутствие данных об истинном временном ходе натриевого и кальциевого входящих токов. В нервных клетках ТЭА не мог быть использован для разделения входящих п выходящих токов, так как даже в концентрации нескольких десятков миллимолей это вещество не блокирует выходящие токи полностью. В то же время большие концентрации этого вещества оказывают подавляющее действие на входящие токи.
Рассмотрим несколько подробнее вопрос о кинетике инактивации калиевых выходящих токов. Кроме указанных выше работ Коннора и Стевенса, этот вопрос был изучен на интактных нейронах с измерением тока, протекающего через участок мембраны [74], и на изолированных нервных клетках [9, 11].
Быстрый выходящий ток после достижения максимального уровня инактивируется полностью. Временной ход инактивации хорошо описывается экспонентой. Постоянная времени варьирует в пределах 104-50 мс и зависит от потенциала, уменьшаясь с ростом деполяризации.
Данные о кинетике инактивации задержанного выходящего тока несколько противоречивы. В то время как на интактных нейронах временной ход спада задержанного выходящего тока отклонялся от экспоненциального закона, на изолированных клетках он мог быть описан одной экспонентой [9]. Постоянная времени инактивации этого тока была потенциалозависимой и уменьшалась примерно на 60 мс при росте деполяризации на 10 мВ.
Вопрос о причине инактивации задержанного тока неоднократно дискутировался. Предполагалось, что спад тока может быть вызван накоплением ионов калия у наружной стороны мембраны [25] (о существовании неперемешиваемого примембранного слоя см. [40]). Это предположение в основном не подтвердилось: было показано, что инактивация продолжает развиваться в отсутствие тока — после окончания деполяризующего импульса [74]. Следует отметить, однако, что локальное увеличение концентрации калия у наружной поверхности мембраны все же имеет место. Однако оно слишком незначительно, чтобы вызвать сколь-нибудь заметное уменьшение калиевых токов [76].
Инактивация задержанного выходящего тока измеряется постоянными времени порядка сотен миллисекунд. Выход из инактивации представляет собой весьма медленный процесс, измеряемый десятками секунд и характеризующийся сложной кинетикой. Костюк и соавторы, используя технику двухимпульсных экспериментов и фармакологическое воздействие, предприняли попытку установить связь между различными фазами развития задержанного выходящего тока. Вначале была использована идея Чандлера, Ходжкина и Мевеса о возможности нахождения связи между процессами активации и инактивации, высказанная применительно к натриевому току (см. гл. 2). Суть идеи состоит в том,
что если эти процессы связаны, то инактивация должна развиваться с задержкой, необходимой для проявления активации. На рис. 3.7 представлены результаты соответствующего эксперимента. Два деполяризующих толчка следует друг за другом с минимальной задержкой. Ее длительность лимитируется временем, необходимым для того, чтобы каналы задержанного тока закрылись. Длительность первого толчка изменяется, и величина тока, соответствующего второму толчку, служит мерой инактивации, вызванной первым толчком. Поскольку инактцвация развивается по экспоненте, то отклонения от этой зависимости при малых длительностях первого толчка (т. е. на ранних стадиях активации вызванного им тока) могут служить указанием на связь обоих процессов. На рис. 3.7 показано, что отклонений от экспонен-циальности не наблюдается. Поэтому
Рис. 3.7. Временной ход инактивации задержанного выходящего тока. Схема эксперимента представлена сверху.
По оси абсцисс — длительность первого импульса; по оси ординат — амплитуда тока, нормированная к величине, полученной без первого импульса.
sn вяп tnn Кривая — экспонента с постоянной времени 75 мс.
и и ' Межимоульсный интервал 18 см [7].
был сделан вывод о независимом развитии процессов активации и инактивации каналов задержанного выходящего тока.
Поскольку инактивация задержанного выходящего тока продолжается, как указывалось выше, после реполяризации мембраны, то возник вопрос о связи процессов инактивации и выхода из инактивации. Исследовать его удалось используя своеобразное действие верапамила на задержанный выходящий ток: при действии на наружную сторону мембраны это вещество ускоряет кинетику инактивации задержанного выходящего тока [11]. Экспоненциальный временной ход инактивации при этом сохраняется. При растворе верапамила 6х10'5 М постоянная времени инактивации может уменьшаться на порядок. Интересно, что при введении внутрь клетки верапамил оказывает незначительный обратный эффект.
Ускоряя инактивацию задержанного выходящего тока с помощью верапамила, Костюк и сотр. [11] исследовали также изменения процесса выхода из инактивации. Оказалось, что этот процесс начинается раньше; временной сдвиг соответствует ускорению инактивации. Это свидетельствует в пользу существования операционной связи между процессами инактивации и выхода из инактивации.
Кроме описанного выше воздействия на кинетику обоих калиевых токов, верапамил оказывает на них ТЭА-подобное действие, подавляя максимальную калиевую проводимость. Сильнее подавляется при этом задержанный выходящий ток. Аналогичные
результаты получены также на нейронах аплазии [56]. Так как верапамил является также конкурентным блокатором кальциевой проводимости, то следует рассмотреть одну из широко дискутирующихся в последнее время гипотез, согласно которой подавляющее действие верапамила на калиевую проводимость может быть опосредовано его действием на кальциевые каналы. Речь идет о гипотезе Мича, предположившего существование связи между входом кальция в клетку и активацией калийпереносящего механизма. Авторо.ц, представлены следующие аргументы.
1. Инъекции EDTA (агента, связывающего Са) в клетку продлевают потенциалы действия, подавляя калиевую проводимость [65]. Предполагается, что EDTA действует в данном случае путем связывания кальция, входящего в клетку при возбуждении.
2. Повышение внутриклеточной концентрации свободного кальция, осуществляемое введением в клетку Са—EGTA-буфера, увеличивает калиевую проводимость мембраны в покое [66]. Сходный результат получен также на мотонейронах кошки [61 ].
3. Подавление кальциевой проводимости Со++ и другими блокаторами, в том числе верапамилом, снижает калиевый ток. Это снижение повторяет, по мнению Мича, потенциалозависимость кальциевого тока.
4. Калиевый ток, измеряемый в бескальциевой среде, характеризуется более высокой селективностью к ионам калия, чем при измерениях в нормальном растворе. «Хвосты» калиевого тока описываются в бескальциевом растворе одной экспонентой, а в нормальной среде — двумя. Эти данные рассматриваются в качестве доказательств существования двух компонентов калиевого тока: высокоселективного компонента и менее селективного— активируемого входящим в клетку кальцием [67 ].
Гипотеза Мича была подвергнута проверке в работах по исследованию роли кальция в возбуждении нервной клетки. Эти работы выполнены с использованием метода внутриклеточного диализа [5, 15]. Прежде всего были изучены различные способы изменения внутриклеточной концентрации свободного кальция. Трудность осуществления таких изменений состоит в том, что их диапазон находится вне пределов прямых измерений с помощью существующих в настоящий момент методов. Чтобы варьировать концентрацию кальция между 10“8 и 10-7 М, удобно использовать буферные растворы типа Са—Са-хелатирующий агент, так как существуют специфичные хелаты, обладающие константой диссоциации с кальцием порядка 10-7. Такими хелатирующими агентами как раз и являются EGTA и EDTA (первое из соединений более специфично к кальцию). Важное условие точности расчета концентрации свободного кальция в буферном растворе — точный контроль pH, так как константа диссоциации сильно зависит от данного параметра.
Другим приемлемым способом получения заданных низких концентраций кальция служит использование насыщенных по
кальцию растворов с известном содержанием анионов, образующих с кальцием практически нерастворимые соединения. Концентрация свободного кальция в таких растворах рассчитывается по произведению растворимости.
Оба описанных способа были использованы в указанных работах. Использованию Са-хелатирующего агента (EGTA) предшествовал контроль возможности его собственного фармакологи-
Рис. 3.8. Действие_ЕйТА и внутриклеточного кальция на задержанный выходящий ток.
А — эффект увеличения внутриклеточной концентрации свободного EGTA с i мМ (еветп* ляле кружки) до 10 мМ (заполненное кружки) при постоянной концентрации свободного кальция в клетке отношение Са—EGTA/EGTA постоянно; Б — эффект повышения внутриклеточной концентрации кальция. 1 — задержанный выходящий ток при диализе клетки фтористым калием; 2,3 — диализ насыщенными по кальцию растворами с концентрациями кальция, соответственно, 1.4 х Ю“я М и 3.5 X 10“’ М А и Б, По оси абсцисс —- тестирующий потенциал; по осях ординат — амплитуда выходящего тока [12],
ческого действия. Для этой цели в клетке повышалась на порядок концентрация EGTA при постоянной и минимальной концентрации свободного кальция. Оказалось, что это соединение не действует при внутриклеточном применении на входящие токи, однако существенно подавляет задержанный выходящий ток (рис. 3.8, А). Таким образом, допущение Мича о действии хелата на калиевую проводимость посредством связывания внутриклеточного кальция не подтвердилось. Полученный результат указал также на то, что Са—EGTA-буфер не может быть использован для исследования действия кальция на калиевую проводимость, ко может использоваться при изучении входящих токов.
Прямое действие изменения концентрации свободного внутриклеточного кальция на задержанный выходящий ток было изучено с применением насыщенных по кальцию растворов. В качестве связывающих анионов использовались фтор и оксалат. Эффект оказался небольшим; качественно его можно интерпретировать следующим образом: внутриклеточный кальций сдвигает калиевую проводимость н сторону меньшей деполяризации и, судя по наклону вольт-амперной характеристики, мало изменяет ее мак
симальную величину (рис. 3.8, Б). Вывод Мича о повышении под влиянием внутриклеточного кальция калиевой проводимости покоящейся мембраны подтвердился. К аналогичным выводам пришли и исследователи, работавшие с интактными нейронами [64]. В исследованиях Мича была впервые обнаружена необычайно высокая чувствительность нервной клетки к повышению внутриклеточного содержания ионов кальция. Порог чувствительности в 9Х10-7 М, установленный Мичем, был затем снижен более чем на порядок с использованием метода внутриклеточного диализа (см. ниже). .Это свойство еще раз демонстрирует своеобразие свойств нервной клетки: мембрана гигантского аксона практически не реагирует на введение внутрь 10 мМ кальция [29].
Подведем итог основным особенностям калийпереносящих механизмов нервной клетки.
1. Существует дополнительная система быстрых калиевых каналов. Ток, создаваемый этими каналами, не участвует — или почти не участвует [23] — в генерации потенциала действия, а определяет поведение мембраны в промежутке между импульсами при ритмической активности. Для выполнения этой функции быстрый выходящий ток обладает инактивацией, зависящей от времени и потенциала.
2. Задержанный выходящий ток также наделен инактивацией, которая характеризуется рядом свойств, отличающих ее от калиевой инактивации в нервных волокнах [37]. Калиевая инактивация в нервной клетке — сравнительно быстрый процесс. При ритмической активности клетки он сказывается на форме нервных импульсов уже в самом начале разряда [23], вызывая уменьшение скорости реполяризации, а затем удлиняя пик. Интересно, что этот механизм стабилизирует тем самым амплитуду нервного импульса, предотвращая ее уменьшение вследствие инактивации механизмов входящего тока [22, 23]. В связи с этим понятна и другая особенность инактивации задержанного выходящего тока: способность развиваться при потенциале покоя после короткой деполяризации.
Следует отметить, что по сравнению с каналами калиевой проводимости нервных проводников калиевые каналы нервной клетки все еще изучены недостаточно. Предстоит большая работа по систематическому изучению их фармакологии и ионной селективности. С другой стороны понимание функционального значения особенностей калиевых каналов — один из ключей к расшифровке особенностей активности нервной клетки.
3.2.3. КАНАЛЫ ВХОДЯЩЕГО ТОКА
Исследование нейронов аплизии позволило предположить, что в мембране существуют ТТХ-чувствительные натриевые каналы и подавляемые кобальтом кальциевые ка-
налы [42 J. Однако нейроны других видов моллюсков оказались нечувствительны к ТТХ [68, 30]. Исследования, проведенные на изолированных нейронах, показали, что практически все клетки из ганглиев ЦНС различных моллюсков обладают наряду с натриевой и существенной кальциевой проводимостью [2, 4]. Было установлено, что ионы кальция наряду с переносом заряда сохраняют свое действие на потенциалозависимость мембранной проводимости, в том числе и кальциевой. Наряду с обычным
А
6
Рис. 3.9. Зависимость проводимости для пиков входящего тока от мембранного потенциала, измеренная в растворах с различной концентрацией кальция.
А — кривые, полученные в нормальном растворе (кружки) и в безнатриевых растворах; концентрация кальция составляла 7 мМ (яреетики), 19 мМ (квадраты.) и 53 мМ (треугольники). По оси абсцисс — тестирующий потенциал; по оси ординат — проводимость для пиков входящего тока; Б — те же кривые, пронормированные по отношению к максимальным значениям проводимости [51.
сдвигом кривой проводимости по оси потенциала было отмечено и изменение ее формы. На рис. 3.9 представлены кривые проводимости для пиков входящего тока, полученные в нормальном и безнатриевых растворах с е-кратным увеличением концентрации ионов кальция [7]. Кривые описаны уравнением:
_ S max
1+ехр )
(7)
где У1;г — потенциал, соответствующий половинному значению максимальной проводимости gmai, а -- фактор крутизны.
Увеличению наружной концентрации кальция в е раз соответствовал сдвиг кривой проводимости, равный 11—12 мВ. Фактор крутизны а при этом увеличивался примерно на 1.5 мВ, что свидетельствует об уменьшении крутизны кривых. Сдвиг кривой проводимости кальциевого тока превышает аналогичную вели-
чину, полученную для натриевой проводимости на нервном волокне [51]. В терминах теории поверхностного потенциала [43] это может указывать на более близкую локализацию адсорбирующих кальций групп в чувствительной к потенциалу структуре кальциевого канала.
Кальциевый ток в нервных клетках оказался чувствительным к кобальту и верапамилу, а также к более эффективному производному верапамила — Д-600 [56 [. Подтвердилась характерная особенность действия верапамила, обнаруженная ранее на сердечной мышце. [57]: конкуренция с кальцием во взаимодействии с каналом [8]. Это указывает на определенное сходство кальциевых каналов обеих возбудимых мембран.
Однако вопрос о раздельности натриевого и кальциевого компонентов проводимости нервной клетки оставался до последнего времени открытым. Наличие описанных в предыдущем разделе двух калиевых токов не позволяло исследовать подлинную кинетику входящих токов, определить с достаточной точностью соответствующие равновесные потенциалы и инактива-ционные характеристики. Используя двухимпульсную методику, Станден недавно предпринял попытку раздельно измерить кинетику инактивации натриевого и кальциевого токов [80]. Полученные результаты привели его к выводу о том, что соответствующие характеристики обоих токов практически одинаковы. В то же время появились данные, указывающие на возможность существования медленного входящего тока в мембране нервной клетки. Люкс и Экерт, сравнивая результаты измерений количества заряда, перенесенного задержанным выходящим током, с накоплением ионов калия у наружной поверхности мембраны, регистрируемым калийселективным электродом, обнаружили несоответствие обеих величин [63]. Они предложили следующее объяснение этому результату: существует медленно развивающийся входящий ток, как бы «закорачивающий» задержанный выходящий ток и приводящий к уменьшению его измеряемого значения. Согласие экспериментальных данных с этим объяснением могло быть достигнуто лишь при условии, что медленный входящий ток усиливается по мере развития калиевой инактивации. Это в дальнейшем не подтвердилось(не следует забывать, что авторам пришлось оперировать лишь косвенными данными, полученными сложным путем). Годом позже эти же авторы прямо измерили малый неинактиви-рующийся входящий ток в допороговой области, мембранного потенциала. Объектом служил ритмоводящий нейрон виноградной улитки [35]. Этот ток подавлялся кобальтом и усиливался барием. В бескальциевой среде малый неинактивирующийся ток исчезал, и поэтому был сделан вывод о кальциевой его природе. В дальнейшем было показано, что при наличии бария в среде этот ток может наблюдаться и при потенциалах, превышающих пороговое значение [36]. Аналогичные данные получены также Гола [44].
9 Общая физиология нервной системы
129
Первые же эксперименты с применением метода внутриклеточного диализа позволили внести ясность в вопрос о природе и соотношении входящих токов в нервной клетке [12, 14]. Устранение ионов калия из внутриклеточной среды путем замены их на
Рис. 3.10. Разделение натриевого и кальциевого токов после удаления ионов калия из клетки методом внутриклеточного диализа.
А — пример изменений кривой входящего тока в нервной клетке прудовика при удалении натрия из наружного раствора. Наложение кривых производилось с интервалом 5 с. Нижний луч — мембранный потенциал (деполяризующее смещение — 12 мВ; поддерживаемый потенциал — 40 мВ). Б — вольт-амперные характеристики для натриевого (темные кружки) и кальциевого токов (светлые кружки) в нормальном растворе Рингера. Натриевый ток получен как разность токов, измеренных в нормальном и безиатриевом растворах; схема измерений показана внизу. По оси абсцисс — тестирующий потенциал; по оси ординат—-трансмембранный ток [11].
ионы Трис+ выявило два аддитивных входящих тока, переносимых соответственно ионами натрия и кальция.
На рис. 3.10, А показаны характеристики общего ионного тока после замены внутриклеточного калия и его изменения при удалении натрия из наружной среды. Результаты таких измерений для различных потенциалов показаны на рис. 3.10, 2J. Видно, что вольт-амперная характеристика для кальциевого тока сдвинута [30
в сторону большей деполяризации. Качественно это объясняет описанные ранее явления: большую зависимость превышения потенциала действия от концентрации наружного кальция, чем от концентрации натрия [79], и более высокий порог возбудимости в соме, чем в аксоне.
Кроме устранения ионов-носителей, были найдены и другие методы разделения кальциевого и натриевого входящих токов, строго доказывающие наличие двух независимых ионпереносящих систем:
1) Введение в клетку анионов фтора необратимо блокирует кальциевую Ьроницаемость, оставляя нетронутым натриевый входящий ток (о механизме этого действия фтора подробнее см. ниже).
2) Введение в наружный раствор ионов кадмия полностью и обратимо подавляет кальциевую проводимость при введении в наружный раствор 1—2 мМ Cd++. Натриевый ток при действии таких концентраций кадмия не изменяется.
Кинетические характеристики натриевого и кальциевого токов резко различаются. Натриевый ток — быстрый процесс, Качественно не отличающийся от натриевого тока в нервных волокнах. Это подтверждают расчеты кинетики натриевого тока в терминах модели Ходжкина—Хаксли. Хорошая аппроксимация получена с помощью уравнения
(8)
Для сравнения с нервным волокном приведем типичные значения параметров модели при температуре 20° С и деполяризации до нулевой разности потенциалов:
TmNa — 1 ± 0.5 мс; = 3 ± 2 мс.
Кинетика кальциевого тока более сложна. Основная особенность, характеризующая его как медленный процесс, — медленная инактивация, длящаяся много секунд. Начало ее развития хорошо описывается суммой двух экспонент — быстрой и медленной. Формально это может соответствовать допущениям [14] о том, что существует две фракции кальциевых каналов, отличающихся скоростью инактивации, и что кальциевый канал обладает двумя типами инактивационных ворот. Разрешить вопрос, какое из этих допущений верно, пока не удалось (еще одна возможность объяснить сложный характер спада кальциевого тока будет обсуждена ниже — при рассмотрении эффекта внутриклеточного кальция). Рис. 3.11, Л иллюстрирует временной ход кальциевого тона и результат аппроксимации его двумя экспонентами. Такое описание справедливо лишь для начальной стадии развития тока (1—1-5 с). При постоянной деполяризации процесс длится много дольше (рис. 3.11, Б), и количественное описание последующих медленных его изменений пока не проводилось.
Временной ход активации кальциевого тока представлен на рис. 3.12. Этот процесс также развивается медленнее натриевой активации, однако разница в постоянных времени не столь разительна, как в случае инактивации. Представленные на рисунке расчеты выполнены по модифицированному уравнению Ходжкина-Хаксли:
= (9)
з ^10~8а
2с
Рис. ЗЛ1. Кинетика инактивации кальциевого входящего тока,
А — результат описания начальной стадии инактивации кальциевого тока суммой двух экспонент (кррэмксиии обозначены рассчитанные значения); Б — временной ход кальциевого тока при длительной деполяризации. Наружная концентрация кальция 53 мМ. Значения тестирующих потенциалов указаны возле кривых [14].
где переменная h приблизительно соответствует быстрой экспоненте спада кальциевого тока. Вторая степень переменной т лучше отражает более медленную активацию кальциевого тока. Конечно, описание кальциевого тока в терминах модели Ходжкина-Хаксли имеет (во всяком случае, пока) чисто сравнительное значение.
Представленная совокупность данных позволяет сделать окончательный вывод о существовании в мембране нервной клетки независимых систем натриевых и кальциевых каналов. Изучение их подлинной кинетики, потенциалозависимости и фармакологических особенностей в условиях полного разделения токов оказалось возможным с применением метода внутриклеточного диализа. Единственное качественное отличие натриевых каналов
нервной клетки, обнаруженное пока лишь у некоторых видов моллюсков, — их нечувствительность к ТТХ. Другие фармакологические свойства этих каналов, по-видимому, идентичны наблюдаемым в нервных волокнах (например, эффект вератри-дина [62]).
Рис. 3.12. Кинетика активации кальциевого входящего тока.
Кружками обозначены значения* рассчитанные по ураьнению 9 (см. текст) [14].
Особый интерес представляет возможность исследования кальциевых каналов, появившася с применением метода внутриклеточного диализа: до сих пор такая возможность, включающая контролируемую смену вне- и внутриклеточной среды, существовала лишь для гигантского мышечного волокна Balanus. Выше указывалось, что ионы кадмия, действуя снаружи, обратимо блокируют кальциевый входящий ток.
Подробное изучение этого вопроса показало, что зависимость доза—эффект для действия кадмия хорошо описывается изотермой Ленгмюра:
I
I о Кр + ! Cd 1 ’
(10)
где константа диссоциации К,, —7.2хЮ~5 М (рис. 3.13). Напомним, что соответствие изотерме Ленгмюра предполагает взаимодействие одной частицы адсорбента с одним центром адсорбции. Кадмий, наиболее эффективно блокируя кальциевый канал,
Рис. 3.13. Зависимость «доза— эффект» для блокирующего действия кадмия на кальциевый входящий ток. Кривая построена по уравнению 10 (см. текст).
По оси абсцисс — концентрация нэдмия в наружном растворе; ио оси ординат —• нормированный кальциевый тон, Разные значки соответствуют измерениям на различных нейронах [171.
Рис. 3.14. Действие внутриклеточного кальция па кальциевый входящий ток.
А — кривые кальциевого входящего тока до введения кальция в клетку (слева) и после введения в клетку 5.8х10~н М кальцин (справа). Значения тестирующих потенциалов указаны возле кривых; Б — вольт-амперные характеристики дли пиков кальциевого входящего тока, полученные до введения кальция в клетку (кружки), после введения 2.7x1 Q-R М (темные треугольники) и 5.8 X 10~н М (светлые треугольники) кальция. По оси абсцисс — тестирующий потенциал; ио оси ординат — трансмембранный ток [12].
имеет близкий к кальцию ионный радиус. По Полингу, ионный радиус кальция составляет 0.99 А, а ионный радиус кадмия — 0.97 А. Оба указанных обстоятельства позволяют допустить, что ион кадмия является своеобразной пробкой в кальциевом канале [16].
Как указывалось выше, действие наружного кальция на кальциевый канал не отличается в принципе от его действия на другие ионные каналы. Иначе обстоит дело с эффектом внутриклеточного кальция. В предыдущем разделе был рассмотрен вопрос о контро
лируемых изменениях внутриклеточной концентрации свободного кальция. Так как EGTA само по себе не влияло на входящий ток, то Са—EGTA-буферные смеси оказались пригодными для изучения действия внутриклеточного кальция на кальциевый входящий ток [13, 15].
Выяснилось, что кальциевый ток необычайно чувствителен
к повышению концентрации ионов кальция внутри клетки: кон-
центрации 5.8 X10“8 М достаточно для полного подавления кальциевого тока (рис. 3*14). Примерно половинному подавлению соответствует концентрация кальция 2.7х 10~8 М. Этот эффект обратим. Исследования, проведенные ранее на мышечном волокне Balanus, привели к численно очень близким результатам: кальциевый потенциал действия генерировался этим мышечным волокном лишь в том случае, когда внутриклеточная концентрация кальция была ниже 8X10“8 М [48].
Следует отметить, что кальцийхедатирующие агенты не взаимодействуют с каналами входящего тока лишь в том случае, если наружная среда содержит ионы кальция. При удалении всех
Рис. 3.15. Натриевый входящий ток, вызванный действием на мембрану кальций—хелатирующего соединения.
Снпруэки — раствор без магния и кальция, содержащий 20 мМ натрия, внутри — трис-асяартат, 1 мМ EGTA. На двух верхних кривых представлен результат повышения наружной концентрации кальция с 20 мМ до 30 мМ. Значения тестирующих потенциалов указаны возле кривых (мВ) [15].
+ 10 ------------------
I
4-0’ис
двухвалентных катионов из наружного раствора, содержащего ионы натрия, присутствие EGTA внутри или вне клетки приводит к появлению большого натриевого входящего тока (рис. 3.15), протекающего, возможно, по изменившим свои свойства кальциевым каналам [5, 15]. Это изменение селективности обратимо. Взаимодействует с каналом, по-видимому, именно комплексообразующая часть молекулы, так как EDTA проявляет точно такую же активность. В пользу того, что изменяется селективность именно кальциевых каналов, говорит то, что при диализе клетки фтором (т. е. при необратимо заблокированных кальциевых каналах) эффект отсутствует, а также и то, что вызванный натриевый ток подавляется верапамилом и Д-600.
3.2.4. СЕЛЕКТИВНОСТЬ НАТРИЕВЫХ И КАЛЬЦИЕВЫХ КАНАЛОВ
Натриевый канал. При определении равновесного потенциала по пикам натриевого тока обычно получают величины порядка 40—60 мВ [28,2]. Попытка сопоставить эти величины с заданными ионными градиентами была сделана с использованием метода внутриклеточного диализа [4]. Трудность таких измерений состоит в следующем: ускорение процессов активации и особенно инактивации при увеличении деполяризации приводит к сближению пика натриевого тока с емкостным током и примыкающим к нему током переходного процесса проводимости утечки (см. также [31]). Добиться лучшего разделения этих процессов оказалось возможном с помощью вычитания токов, вызванных равными деполяризующими и гиперполяризующими смещениями мембранного потенциала. При этом противоположно направленные емкостные токи и токи утечки (в том случае если они равны) взаимовычитаются, позволяя правильно измерить потенциалозависимый компонент тока. Этот метод продемонстрировал высокую селективность ТТХ-нечувствительных натриевых каналов: в отсутствие ионов натрия внутри клетки (диализ раствором трис-фтор) реверсии этого тока достичь не удавалось. Введение в клетку заданных количеств натрия приводило к выявлению равновесного потенциала, близкого к нернстовскому [4]. Пока нет данных о ряде селективности для натриевых каналов в нервной клетке.
Подход в' рамках теории постоянного поля, по-видимому, окажется пригодным для'его получения.
Жаль ц'и е в ы й к~а нал. Величины Еса при определении их по пикам’кальциевого’тока в интактных [80] и изолированных нейронах [4] лишь’незначительно отличались от натриевых равновесных потенциалов. Это странное — ввиду огромных различий соответствующих ЭДС — явление удалось объяснить, используя метод внутриклеточного диализа [13, 15]. После устранения калиевой’проводимости было обнаружено существование неспецифического выходящего тока, активирующегося при деполяризации мембраны, превышающей 30—50 мВ. Этот ток зависит от времени и потенциала, но не имеет зависящей от времени инактивации. Суммация кальциевого входящего тока с неспецифи-ческим выходящим током и приводит к тому, что видимые значения £са столь существенно расходятся с теоретическим потенциалом кальциевого электрода. Описанные ранее сдвиги пика кальциевого потенциала, действия при повышении наружной концентрации кальция можно объяснить скорее сдвигом кривых ионных проводимостей по оси потенциалов, чем увеличением и без того огромной кальциевой ЭДС. Приведем численный пример: пусть наружная концентрация кальция составляет 10 мМ; эта величина близка к нормальной в растворе Рингера для виноградной улитки. При 136
внутриклеточном кальции 10 8 М, что соответствует максимальной активации кальциевой проводимости,
^=51П7ЙГ“ 2ОО мВ. (И)
с. г [ кл а ]$
Эта величина более чем вдвое превышает максимальные величины превышения потенциала действия, наблюдаемые в опыте.
Другой, в принципе более точный метод измерения £са — получение мгновенных вольт-амперных характеристик. Исполь-зование'этого метода, предъявляющего очень высокие требования к быстродействию системы фиксации потенциала, привело к получению величин Еса, лежащих в пределах 130—200 мВ при диализе клетки фосфатным раствором, связывающим внутриклеточный кальций [13]. Обычно использование таких данных для целей количественного описания пока ограниченно из-за существования неспецифического выходящего тока, искажающего результаты измерений при больших положительных потенциалах.
В порядке обсуждения можно допустить, что чрезвычайно высокая чувствительность кальциевых каналов к внутриклеточному кальцию является своеобразной отрицательной обратной связью, контролирующей поступление кальция в клетку. В связи с этим не исключена и возможность самоблокирования этих каналов, проявляющаяся, например, в качестве одного из компонентов кальциевой инактивации. Механизмом, предотвращающим чрезмерную деполяризацию мембраны, может служить неспецифический выходящий ток, шунтирующий кальциевую проводимость.
Такие особенности кальциевых каналов, как наличие шунтирующего тока, затрудняющего измерение равновесного потенциала и особенно невозможность создания сколько-нибудь значительной концентрации ионов-носителей внутри клетки, делают пока невозможным применение теории постоянного поля для количественной оценки их селективности. Единственным теоретическим подходом к этой проблеме является пока модель Хагивары, разработанная применительно к кальциевым каналам гигантского мышечного волокна Balanus [49, 50]. Модель призвана объяснить следующие свойства кальциевых токов: 1) насыщение кальциевого тока с ростом концентрации кальция; 2) конкуренцию кальция с другими двухвалентными и некоторыми трехвалентными ионами.
Суть модели состоит в следующем. Для того чтобы пройти через мембрану, ион кальция должен адсорбироваться определенным мембранным рецептором: tz tr
Cafl-4X -> СаХ Са, 4-Х. (12)
|К.
При адсорбционном равновесии, поскольку общее число рецеп-
торов X постоянно,
Кс _([^- ^Са1И_Са]й
Аса— [XCaj
(13)
где KGa — константа диссоциации наружного кальция и рецептора. Отсюда
IXCaj—[XJX , + ^/[Са|. • (14>
Согласно определению модели, 7Са — [ХСа]; 1ас~ | Х|. Теперь
/макс
Jca=4 , /а/[Са1 , (15)
1 Т ЛСа/1ьа1о
где 7Са, 7с*а°, КСа — величины в общем случае потепциалозави-симые.
Заметим, что количественное описание модели полностью совпадает с уравнением Михаэлиса—Ментена (равновесный случай) и с изотермой Ленгмюра.
В указанном виде модель описывает насыщение кальциевого тока при повышении наружной концентрации кальция. Если в среде присутствует катион М++, который связывается с тем же рецептором с константой диссоциациино не проникает сквозь кальциевый канал, то уравнение, описывающее кальциевый ток, принимает вид:
/mai
/Са= 1 + + (М1/Хм) XGa/(Caje • (16)
Если 1са — кальциевый ток в отсутствие другого сорта ионов, а /са — ток в их присутствии, то отношение этих токов
1 + [М]0/Км ’ О7)
где
Ям = Км. (1 4“ [Са^/Хса).
Неудобство модели состоит в следующем. Потенциалозави-симость, а значит и зависимость от наружной концентрации двухвалентных катионов измеряемых величин, требует в ряде случаев, например при определении Кса, учета или устранения соответствующих сдвигов характеристик по потенциалу. Авторы достигали этого путем создания высокой концентрации непроникающих двухвалентных катионов. Так, величина Яса, равная 24.6 мМ, была получена в присутствии 100 мМ магния, что не могло не сказаться на полученном результате [49].
По способности конкурентно связываться с предполагаемым рецептором кальциевого канала двухвалентные катионы и лантан расположились в такой ряд:
La+++, UO^>Zn++, Go++, Fe++> Mn++> Ni++>Са++>Mg++.
Как указывалось выше, многие нейроны генерируют не только кальциевые, но и барий- и стронцийзависимые нервные импульсы. 138
Поэтому важно, что моде. ь Хагивары позволяет оценить также и относительную способность кальциевых каналов пропускать эти ионы. Не следует, однако, смешивать такие ряды «пропускной способности» с рядами проницаемости, получаемыми с применением теории постоянного поля. Для отношения токов, полученных, например, в эквимолярных растворах кальция и бария, из уравнения (16) получаем
*Са. g + ^Ba
/Ва С + аКСа ’
где
« = 14-[М№ь С = [Са]0 = | Ва]0.
Отношение максимальных токов в этом уравнении получило название «фактора подвижности», а второй член — «фактора сродства». В отсутствии блокирующих ионов (а=1) был получен такой ряд пропускной способности [501:
/ca:/sr:/Ba = 1.0:1.05:1.3.
Есть предварительные данные о том, что такая же последовательность соблюдается — по крайней мере качественно — и для кальциевых каналов в нейронах моллюсков [20].
Данные о проводимости кальциевых каналов для бария и стронция, а также — в отличие от нервных и мышечных клеток —- для магния получены на сердечной мышце [58].
Итак, количественные данные о селективности кальциевых каналов нервной клетки пока отсутствуют. Однако есть все основания считать, что она сходна с таковой у каналов мышечных волокон и других объектов (см. также [78]).
3.3. ВОРОТНЫЕ токи в мембране НЕРВНОЙ КЛЕТКИ
В гл. 2 описана характеристика и предполагаемая природа воротных токов натриевых каналов аксональной мембраны. Регистрация таких токов в мембране нервной клетки потребовала значительных методических усилий, связанных с особенностями этого объекта. Если до сих пор в электрофизиологии возбудимых мембран речь шла о разделении ионных и емкостных токов, то изучение воротных токов предполагает уже разделение различных компонентов емкостного тока. В принципе для этого требуется все большее «сближение» входов регистрирующей аппаратуры с мембраной — уменьшение последовательного сопротивления, разделяющего измеритель и объект. Уменьшить это сопротивление можно, либо изменяя условия эксперимента, либо компенсируя его средствами электроники, Обычно желаемого
результата можно достичь, комбинируя оба способа. Широко применяемый метод электронной компенсации последовательного сопротивления был разработан Коулом и Муром (подробно см. [69]) применительно к гиганскому аксону кальмара. Однако условия экспериментов с этим объектом и с нервной клеткой — даже если в последнем случае речь идет о методе внутриклеточного диализа — существенно различны. Постоянная времени цепи заряда мембранной емкости т —RnCv, где R„ последовательное сопротивление (в данном случае сопротивление поляризующего электрода -(-сопротивления среды), а См — емкость мембраны. Величина т для аксона кальмара составляет примерно 6Х10-е с, а для нервной клетки 0.5—5Х1О~3 с. Теоретические принципы скорости и точности управления биологическими мембранами с помощью фиксации потенциала были проанализированы недавно Катцем и Шварцем [55]. Особенность их подхода состояла как раз в учете постоянных времени различных мембран, постоянных времени цепей их заряда и поиске оптимальных соотношений этих параметров с характеристиками систем фиксации потенциала. Для случая, когда есть возможность измерять истинный мембранный потенциал, не искаженный падением напряжения на части последовательного сопротивления, был предложен новый способ введения обратной связи, увеличивающий скорость ответа следящей системы. Эта обратная связь оказалась применимой и дала хорошие результаты при использовании в методе внутриклеточного диализа. На рис. 3.16 представлена блок-схема модифицированного метода внутриклеточного диализа. Модификация заключается в том, что введенный в диализируемую клетку микроэлектрод минимизирует ошибку в измерении мембранного потенциала, а обратная связь с регулируемой глубиной увеличивает скорость установления новых значений мембранного потенциала. Эффективное значение постоянной времени цепи заряда мембранной емкости становится равным
г'=Я;См = (Яя-аЯ)Сн, (19)
где а — коэффициент передачи сигнала обратной связи, a R —мас-штабное^сопротивление усилителя тока. При увеличении а, т' уменьшается, а скорость заряда мембранной емкости увеличивается.
Описанная система позволила зарегистрировать в мембране нервной клетки моллюска Helix pomatia воротные токи, связанные с активностью кальциевых каналов [13, 19]. Время установления мембранного потенциала составляло в этих экспериментах 120—150 мкс. Такое быстродействие позволило проводить эксперименты при 20°С.
Для регистрации воротных токов необходимо иметь возможность выключения потенциалозависимых компонентов ионного тока. Калиевые токи выключались путем удаления ионов калия из наружной и внутридцетрццой сред; диад- .провались дцетки 149
изоосмотическим раствором трис-фосфата. В наружном растворе, кроме трис-хлор, присутствовали лишь ионы кальция в нормальной концентрации. Подавление кальциевых токов достигалось добавлением 2 мМ Cd++. Регистрация ионных и воротных токов
Рис. 3.16. Блок-схема установки для измерения воротных токов.
1, 2 — входные повторители; 3 — усилитель фиксации потенциала; 4 — симметричный повторитель; s — усилитель тока; 6 — интерфейс для связи с накопителем’ 7 — электронный ключ; а —регулировка глубины обратной связи [191.
производилась с помощью цифрового накопителя с шагом по времени 50 мкс. Процедура экспериментов не отличалась от применяемой в экспериментах по измерению натриевых воротных токов.
На рис. 3.17 представлен результат эксперимента, в котором были зарегистрированы вначале кальциевые входящие токи как результат суммации одинакового количества равных по амплитуде
гипер- и деполяризующих импульсов, а затем, после блокирования кальциевого тока, — асимметричные токи смещения. В этом случае количество накоплений было больше ввиду малой вели-
Рис. ЗЛ7. Кривые кальциевого входящего тока (слева) и асимметричных токов смещения (справа), полученные в результате суммации токов, вызван ныд равными по амплитуде деполяризующими и гиперполяризующими смещениями мембранного потенциала. Количество циклов накопления составляло 10 для кальциевого токаи 50 для асимметричного тока смещения. Кальциевый ток блокировался ионами кадмия. Значения тестирующих потенциалов указаны возле кривых [19].
Нины сигнала. Основным критерием принадлежности рассматриваемых токов к токам смещения является равенство зарядов, переносимых при положительных и отрицательных сдвигах мембранного потенциала: <?вм— (?выи. Иа рис, 3.18,4 видно, что велййпйы совладают, однако, лищь при умеренных значениях
!Й
деполяризации. При более значительной деполяризации увеличивается. Это увеличение является результатом активации неспецифического выходящего тока. как и ожидается для воротного тока по определению, ограничивается с ростом деполяризации определенным максимальным значением. Таким образом, неспецифический выходящий ток создает определенные трудности при измерении воротных токов в нервной клетке. На рис. 3.18, Б представлены кривые зависимостей от потенциала проводимости
Рис. 3.18. Асимметричный ток смещения, связанный с активацией кальциевой проводимости.
А — асимметричимй ток смещения. Зависимость от потенциала зарядов, переносимых асимметричным током смещения при включении (Qbm) и выключения (0выы) деполяризующего импульса. По оси абсцисс — тестирующий потенциал; по оси ординат — количество электричества. Б — зависимость от потенциала кальциевой проводимости йСа 11
По оси абсцисс — тестирующий потенциал; по оси ораинат — нормированные к максимальным значениям кальциевой проводимости и заряда, перенесенного асимметричным током смещения [19].
кальциевых каналов и (?ЕКЛ. Подобие кривых очевидно. Дальнейшие, более подробные исследования должны показать, существует ли соответствие между зависимостью (?(V) и переменной активации кальциевого тока т (см. уравнение 9).
Как указывалось выше, введение в нервную клетку анионов фтора вызывает необратимое подавление кальциевой проводимости [12]. Оказалось, что это действие фтора ведет одновременно к подавлению асимметричных токов смещения (рис. 3.19). Это является одновременно еще одним доказательством связи этих токов с деятельностью воротного механизма кальциевых каналов и указанием на то, что фтор атакует именно кальциевые «ворота» [13].
Просуммируем доказательства того, что асимметричные токи смещения в нервной клетке отражают процессы открывания и закрывания кальциевых каналов: 1) заряды, переносимые при деполяризации и реполяризации мембраны, равны в области значений потенциала, где не сказывается влияние неспецифического выходящего тока; 2) значение Qm, измеряемое во всем диапазоне
проявления /са, насыщается; 3) потенциалозависимость кальциевой проводимости и £>В1Ц идентична; 4) анионы фтора подавляют /са и асимметричные токи смещения одновременно. Качественное сходство поведения таких «кальциевых» воротных токов с описанным в гл. 2 поведением натриевых воротных токов позволяет постулировать некую общность принципа регуляции ионной проводимости электрическим полем в возбудимых мембранах.
Натриевый воротный ток в нервной клетке пока не зарегистри-рован. Это связано с тем, что его измерение требует примерно
Ч
в y-1D п1А
1мс
Рис. 3.19. Действие внутриклеточного фтора на асимметричный ток смещения. Верхняя кривая получена при диализе клетки фосфатом, а нижняя — после замены фосфата фтором [13].
втрое большего быстродействия при заряде емкости мембраны нервной клетки, чем то, которое уже достигнуто. Попытка зарегистрировать оба воротных тока в нейроне аплизии, предпринятая Адамсом и Гейджем [24], является примером неадекватного методического подхода. Следует учитывать, что в чисто микроэлектрод-ных экспериментах с фиксацией потенциала возникают большие трудности при определении истинного быстродействия системы фиксации вследствие существования емкостной связи между отводящим и поляризующим электродами. Адамс и Гейдж зарегистрировали два пика асимметричных токов смещения. У более позднего пика (по предположению авторов, кальциевый воротный ток) была затянутая восходящая фаза. Это означает, что во время его измерения мембранный потенциал еще не установился, и измеряемому току нельзя поэтому поставить в соответствие сколько-нибудь определенное значение потенциала.
Вопрос о существовании восходящей фазы у воротных токов на самом деле принципиально важен для установления их истинной физической природы. Однако при существующем на сегодня быстродействии самых лучших систем фиксации потенциала решить
его нельзя: любое дальнейшее ускорение заряда мембранной емкости приводит ко все большему соответствию поведения воротных токов с поведением малой потенциалозависимой емкости. Новая область электрофизиологии требует, видимо, и новых методических подходов для решения своих проблем.
ЛИТЕРАТУРА
1. Герасимов В. Д., Коетюк П. Г., Майский В. А. Возбудимость гигантских нервных клеток различных представителей легочных моллюсков в растворах, не содержащих ионы натрия. — Бюл. эксп. биол., 1964, 58, № 1, с. 3—7.
2. Дорошенко П. А., Коетюк П. Г., Крышталь О. А. Действие кальция на мембрану сомы гигантских нейронов моллюсков. — Нейрофизиология, 1973, 5, № 6, с. 621—627.
3. Костенко М. А. Выделение одиночных нервных клеток мозга моллюска Lininea stagnalis для дальнейшего культивирования их in vitro. — Цитология, 1972, 14, № 10, с. 1274—1278.
4. (Коетюк П. Г., Крышталь О. A.) Kostyuk Р. G., Krishtal О. A. Separation of sodium and calcium currents in somatic membrane of mollusc neurones. — J. Physiol. (London), 1977, 270, N 3, p. 545-568.
5. (Коетюк П. Г., Крышталь О. A.) Kosiyuk Р. G., Krishtal О. A. Effect of Са and Ca-chelating agents on the inward and outward current channels in the membrane of mollusc neurones. — J. Physiol. (London), 1977, 270, "N 3, p. 569-580.
6. (Коетюк П. Г., Крышталь О. А., Дорошенко П. A.) Kostyuk Р. G., Krishtal О. A., Doroshenko Р. A. Calcium currents in snail neurones. I. Identification of calcium currents. — Pfliig. Arch., 1974, 348, N 2, p. 83—93.
7. (Коетюк П. Г., Крышталь О. А., Дорошенко П. A.) Kostyuk Р. G., Krishtal О. A., Doroshenko Р. A. Calcium currents in snail neurones. II. The effect of external calcium concentration on the calcium inward current. — Pflug. Arch., 1974, 348, N 2, p. 95-105.
8. (Коетюк П. Г., Крышталь О. А., Дорошенко П. A.) Kostyuk Р. G., Krishtal О. A., Doroshenko Р. A. Properties of inward current channels in the somatic membrane of a nerve cell. — Bioelectrochem. Bioenergetics, 1974, 1, N 3-4, p. 350-354.
9. (Коетюк П. Г., Крышталь О. А., Дорошенко П. A.) Kostyuk Р. G., Krishtal О. A., Doroshenko Р. A. Outward currents in snail neurones. I, Inactivation kinetics. — Comp. Biochem. Physiol., 1975, 51C, N 2, p. 259—263.
10. (Коетюк И. Г., Крышталь О. А., Дорошенко Я. A.) Kostyuk Р. G., Krishtal О. A., Doroshenko Р. A. Outward currents in snail neurones. II. Effect of TEA. — Comp. Biochem. Physiol., 1975, 51C, N 2, p. 265—268.
11. Коетюк П. Г., Крышталь О. А., Дорошенко П. A.) Kostyuk Р. G., Krishtal О. A., Doroshenko Р. A. Outward currents in snail neurones. III. Effect of verapamil. — Comp. Biochem. Physiol., 1975, 51C, N 2, p, 269—274.
12. (Коетюк П, Г., Крышталь О. А., Пидопличко В. И.) Kostyuk Р. G., Krishtal О. A., Pidoplichko V. I. Effect of internal fluoride and phosphate on membrane currents during intracellular dialysis of nerve cells. — Nature, 1975, 275, N'5528, p. 691-693.
13. (Коетюк П. Г., Крышталь О. А., Пидопличко В. И.) Kostyuk Р. G., Krishtal О. A., Pidoplichko V. I. Asymmetrical displacement currents in nerve cell membrane and effect of internal fluoride. — Nature, 1977, 267, N 5606, p. 70-72.
14. Коетюк П. Г., Крышталь О. А., Цындренко А. Я. Разделение натриевых и кальциевых каналов в поверхностной мембране нервных клеток моллюсков. — Нейрофизиология, 1976, 8, № 2, с. 183—190.
15. Коетюк П. Г., Крышталь О. А., Цындренко А. Я. Действие ионов кальция на каналы входящих и выходящих ионных токов в мембране нейронов моллюсков. — Нейрофизиология, 1977, 9, № 1, с. 69—77.
Ю Общая физиология нервной системы _ 145
16. Врышталъ О. А. Блокирующее действие попов кадмия на кальциевый входящий ток в мембране нервной клетки. — ДАН СССР, 1976, 231, № 4, с. 1003-1005.
17. (Врышталъ О. А., Магура И. С.) Krishtal О. A., Magura 1. S. Calcium ions as inward current carriers in mollusc neurones. — Comp. Biochem. Physiol., 1970, 35, N 6, p. 857 -866.
18. Врышталъ О. А., Пидопличко В. И. Внутриклеточная перфузия гигантских нейронов улитки. — Нейрофизиология, 1975, 7, № 3, с. 327—329.
19. Врышталъ О. 4., Пидопличко В. И. Токи смещения, связанные с активацией воротного механизма кальциевых каналов в мембране нервной клетки. - ДАН СССР, 1976, 231, № 5, с. 1248-1251.
20. (Магура И. С.) Magura I. 8. The long-lasting inward current in snail neurones in barium solutions in voltage clamp conditions. — J. Membrane Biol., 1977, 35, N 3, p. 239— 256.
21. (Магура И. С., Висс И., Врышталъ О. A.) Magura I. S., Kiss I., Krishtal О. A. Current-voltage relations of the giant neurone soma membrane of Limnea stagnalis. — Acta physiol, hung., 1971, 40, N 2, p. 221—228.
22. Магура И. С., Врышталъ О, А. Влияние кондиционирующей поляризации сомы гигантских нейронов моллюсков на механизм генерации потенциалов действия. — Нейрофизиология, 1970, 2, № 1, с. 91—99.
23. (Магура И. С., Замеховский И. 3.) Magura I. S., Zamekhousky 7. Z. Repetitive firing in molluscan giant neurones. — J. Exp. Biol., 1973, 59, N 5, p. 767—780.
24. Adams D. J., Gage P. IT. Gating currents associated with sodium and calcium currents in Aplysia neuron. — Science, 1976,192, N 4241, p. 783—784.
25. Alving В. O. Spontaneous activity of isolated Aplysia somata. — J. Gen. Physiol., 1968, 51, N 1, p, 29—45.
26. Araki T., Terzuolo C. A. Membrane currents in spinal motoneurones associated with the action potential and synaptic activity. — J. Neurophysiol., 1962, 25, N 6, p. 772—789.
27. Barrett E., Barrett J. Separation of two voltage-sensitive potassium currents and demonstration of a tetrodotoxin-resistant calcium current in frog motoneurones. — J. Physiol. (London), 1976, 255; N 3, p. 737—774.
28. Baumgarten R.y Chen C. F., Takeda R. Isolation of pacemaker neurones in Aplysia californica, — Fed. Proc., 1971, 30, N 2, 490 Abs.
29. Begenistch T., Lynch C. Effect of internal divalent cations on voltage-clamped squid axons. — J. Gen. Physiol., 1974, 63, N 6, p. 675—689.
30. Chamberlain S. G., Kerkut G. A. Voltage clamp analysis of the sodium and calcium inward currents in snail neurones. — Comp. Biochem. Physiol., 1969, 28, N 4, p. 787—801.
31. Chandler W. K., MevesH. Voltage clamp experiments on internally perfused giant axons. — J. Physiol. (London), 1965, 180, N 4, p. 788—820.
32. Connor J. A., Stevens C. F. Inward and delayed outward membrane currents in isolated neuronal somata under voltage clamp. — J. Physiol. (London), 1971, 213, N 1, p. 1-19.
33. Connor J. A., Stevens C. F. Voltage clamp studies of a transient outward membrane current in Gastropod neuronal somata. — J. Physiol. (London), 1971, 213, N 1, p. 21-30.
34. Connor J. A., Stevens C. F. Prediction of repetitive firing behaviour from voltage clamp data on an isolated neurone soma. — J. Physiol. (London), 1971, 213, N 1, p. 31—38.
35. Eckert R., Lux H. D. A noninactivated inward current recorded during small depolarizing voltage steps in snail pacemaker neurons. — Brain Res., 1975, 83, N 3, p. 486—489.
36. Eckert R., Lux H. D, A voltage-sensitive persistent calcium conductance in neuronal somata of Helix, — J. Physiol. (London), 1976, 254, N 1, p. 129-151.
37. Ehrenstein G., Gilbert D, L. Slow changes of potassium permeability in the squid giant axon. — Biophys. J., 1966, в, N 5, p. 553—566.
38. Frank К., Fuortes M. G. F., Nelson P. G. Voltage clamp of motoneurone soma. — Science, 1959, 130, N 3346, p. 38—39.
39. Frank К., Tauc L, Voltage-clamp studies of molluscan neuron membrane properties. — In: The Cellular Function of Membrane Transport. Ed. J. Hoffman, New Jersey, 1963,
40. Frankenhaeuser B., Hodgkin A. L. The after-effects of impulses in the giant nerve fibers of Loligo. — J. Physiol. (London), 1956, 131, N 2, p. 341—376.
41. Geduldig D., Junge D. Sodium and calcium components of action potential in the Aplysia giant neurone. — J. Physiol. (London), 1968, 199, N 2, p. 347-365.
42. Geduldig D., Gruener R. Voltage clamp of Aplysia giant neurone: early sodium and calcium currents. — J. Physiol. (London), 1970, 211, N 1, p. 217-244.
43. Gilbert D. L., Ehrenstein G. Use of a fixed charge model to determine the pH of the negative sites on the external membrane surface. — J. Gen. Physiol., 1970, 55, N 6, p. 822-825.
44. Gola M. Neurones a ondes-salve des mollusques. — Pfliig. Arch., 1974, 352, N 1, p. 17—36.
45. Hagiwara S., Saito N. Voltage-current relations in nerve cell membrane of ' Onchidium verruculatum. — J. Physiol. (London), 1959, 148, N 1, p. 161 — 179.
46. Hagiwara S., Saito N. Membrane potential change and membrane current in supramedullary nerve cell of Puffer. — J. Neurophysiol., 1959, 22, N 2, p. 204-221.
47. Hagiwara S., Naka K, The initiation of spike potential in barnacle muscle fibers under low intracellular Ca++. — J. Gen. Physiol., 1964, 47, N 1, p. 141-162.
48. Hagiwara S., Nakajima S. Differences in Na and Ca spikes as examined by application of tetrodotoxin, procaine and manganese ions. — J. Gen. Physiol., 1966, 49, N 4, p. 793-806.
49. Hagiwara S., Takahashi H. Surface density of calcium ions and calcium spikes in the barnacle muscle fiber membrane. — J. Gen. Physiol., 1967, 50, N 3, p. 583-601.
50. Hagiwa'a S., Fukuda J., Eaton D. C. Membrane currents carried by Ca, Sr and Ba in barnacle muscle. — J. Gen. Physiol., 1974, 63, N 5, p. 564— 578.
51. Hille B. Charges and potentials at the nerve surface: divalent ions and pH. — J. Gen. Physiol., 1968, 51, N 2, p. 221-236.
52. Iwasaki S., Sato У. Sodium- and calcium-dependent spike potentials in the secretory neuron soma of the X-organ of the crayfish.— J. Gen. Physiol., 1971, 57, N 2, p. 216-238.
53. Junge D. Multi-ionic potentials in molluscan giant neurones. — Nature, 1967, 215, N 5100, p. 546- 548.
54. Kado R. T. Aplysia giant cell: soma-axon voltage clamp current differences. — Science, 1973, 182, N 4114, p. 843 —845.
55. Katz G. M.,' Schwartz T. L. Temporal control of voltage-clamped membranes: an examination of principles. — J. Membrane Biol., 1974, 17, N 3, p. 275— 291.
56. Klee M. R., Lee R. C., Matsuda У. Interaction of D-600 and cobalt with the inward and outward current systems in Aplysia neurones. — Pfliig. Arch., 1973, 343, N 3, p. R60.
57. Kohlhardt M., Bauer B., Krause H., Fleckenstein A. Differentiation of the transmembrane Na and Ca channels in mammalian cardiac fibres by the use of specific inhibitors. — Pfliig. Arch., 1972, 335, N 4, p. 309—322.
58. Kohlhardt M., Haastert H. P., Krause H. Evidence of non-specificity of the Ca channel in mammalian miocardial fibre membranes. Pfliig. Arch., 1973, N 2, p. 125-136.
59. Koketsu K., Cerf J. A., Nishi S. Further observations on electrical activity of frog spinal ganglion colls in sodium-free solutions. — J. Neurophysiol., 1959, 22, N 6, p. 693-703,
60. Koketsu К., Hishi S. Calcium and action potentials ol bull-frog sympahtetic ganglion cells. — J. Gen. Physiol., 1969, 53, N 5, p. 608—623.
61. Krnjevic K., Ltstewicz A. Injections of calcium ions into spinal motonouro-nes. — J. Physiol. (London), 1972, 225, N 2, p. 363—390.
62. Letcht R., Meves H., Wellhoner H. H. The effect of veratridine on Helix pomatia neurones. — Pfliig. Arch., 1971, 323, N 1, p. 50—62.
63, Lux H. D., Eckert R. Inferred slow inward current in snail neuronos. — Nature, 1974, 250, N 5467, p. 574-576.
64. Lux H. D., Eckert R., Hojmeier G., Heyer C. Intracell^ar Ca++ depresses net late outward current in snail neurones, — Biophys. J., 1976, 16, N 3, p. 23a.
65. Meeeh R. W. Prolonged action potentials in Aplysia neurones injected with EDTA. — Comp. Biochem. Physiol., 1974, 48A, N 2, p. 397—402.
66. Meeeh. R. W. Tne sensitivity of Helix aspersa neurones in injected calcium ions. — J. Physiol. (London), 1974, 237, N 2, p. 259—277.
67. Meeeh R. IP., Standen H. B. Potassium activation in Helix aspersa neurones under voltage clamp:''a''component mediated b>- :alcium influx. — J. Physiol. (London), 1975, 249,'NJ2, p. 211-239.
68. Meves H. The ionic requirements for the production of action potentials in Helix pomatia neurones. — Pfliig. Arch., 1968, 304, N 3, p. 215—241.
69. Moore J. W., Cole K. S. Voltage clamp techniques. — In; Physical Techniques in Biological Research. Ed, W. L. Nastuck. Now York, 1963, 6, p. 263.
70. More ton R. B. Ionic mechanisms of the action potentials of giant neurones of Helix aspersa. — Nature, 1968, 219, N 5149, p. 70—71.
71. Nakajima S., Kusano K. Behaviour of delayed current under voltage clamp in the supramedullary neurones of Puffer, — J. Gen. Physiol., 1966, 49, N 4, p. 613-628.
72. Neher E. Two fast transient current components during voltage clamp on snail neurones. — J. Gen, Physiol., 1971, 58, N 1, p. 36—53.
73. Neber E., Lux H. D. Voltage clamp on Helix pomatia neuronal membrane: Current measurements over a limited'area of <he soma surface. — Pfliig. Arch., 1969, 311, N 3, p. 272—277. ‘
7£. r Neber E., Lux H. D, Properties of somatic membrane patches of snail neu-Irones under voltage'clamp. — Pfliig. Arch., 1971, 322, N 1, p. 35—38.
75. Neber E., Lux H. D. Differential action of TEA on two К-current components of a molluscan neurone. — Pfliig. Arch., 1972, 336, N 2, p. 87—100.
l&. ^Neher E., Lux H. D. Rapid changes of potassium concentration at the outer surface offexposed single neurones during membrane current flow. — J. Gen., Physiol., 1973, 61, N'3, p. 385—399.
77. Nishi S,, Soeda H., Koketsu K. Effect of alkali-earth cations on frog spinal ganglion cells. — J. Neuro physiol., 1965, 28, N 3, p. 457—472.
78. Reuter H. Divalent ions as charge carriers in excitable membranes. — Progr. Biophys. Mol. Biol., 1973, 26, N 1, p. 3—43.
79. Standen N. B. Calcium and sodium ions as charge carriers in the action ^potential of an identified snail neurone. — J. Physiol. (London). 1975, 249, N 2, p, 241—252.1
80. Standen N. B, Voltage-clamp studies of the calcium inward current in an identified snail neurone: Comparison with the sodium inward current. — J. Physiol. (London), 1975, 249, N 2, p. 253-268.
81. Tasaki I., Takenaka T. Effects of various potassium salts and proteases upon excitability of intracellularly perfused squid giant axons. — Proc. Nat. Acad. Sci. USA, 1964, 52, N 3, p. 804—810.
82. Toshiro N., Nishi S. Effects of alkali-earth cations on sympathetic ganglion cells of the rabbit. — LifeTSci., 1972, 11, N 4, p.'941.
83. Wald F. Ionic differences between somatic and axonal action potentials in snail giant neurones, — J. Physjol. (London), 1972, 220, N 2, p. 267—281,
Глава 4
ПРОВЕДЕНИЕ НЕРВНЫХ ИМПУЛЬСОВ
4.1. ПАССИВНЫЕ СВОЙСТВА НЕРВНЫХ КЛЕТОК И ВОЛОКОН
4.1.1. КАБЕЛЬНАЯ ТЕОРИЯ
Как уже указывалось в гл. 2, нервные волокна можно уподобить коаксиальному кабелю. Действительно, нервные волокна и клетки погружены в хорошо проводящий раствор электролита. Их внутреннее содержимое — также хорошо проводящий электролит. Оба проводника отделены друг от друга мембраной — довольно неплохим изолятором. Впервые такое представление высказал Германн(53], он же предложил и количественную формулировку гипотезы, основываясь на работах Кельвина, посвященных расчетам Трансатлантического кабеля.
Поскольку внутреннее содержимое и наружная среда клетки являются хорошими проводниками, при отсутствии внешних токов они становятся эквипотенциальными, а значит, и разность потенциалов на мембране будет одной и той же во всех точках волокна. Представим себе, что в некоторой ограниченной области клетки по какой-то причине изменилась разность потенциалов на мембране; тогда соседние области окажутся неэквипотенциальными и между ними потечет ток. Этот ток будет уменьшать (шунтировать) возникшую разность потенциалов и одновременно повышать потенциал в соседних областях. Влияние этого тока естественно будет уменьшаться ио мере удаления от источника сигнала, и в результате установится некоторое распределение потенциала. Теоретически если известны удельные свойства внутреннего и внешнего электролитов и мембраны, можно рассчитать распределение потенциала и его изменение во времени в любой клетке сколь угодно сложной геометрии. Практически же поддаются расчетам в аналитическом виде в основном только, сферические
rl'
(тело нейрона) и цилиндрические (участки аксона или дендритов) образования.
Сферические клетки (сома). При описании сферических клеток принято считать, что их внутреннее содержимое всегда практически эквипотенциально, т. е. мембрана сомы ведет себя в электрическом смысле как единое целое и токи распределены равномерно по всей ее площади. Такое упрощение при реально существующих свойствах мембраны и цитоплазмы вполне допустимо, и это можно строго доказать. Описание поведения такой клетки совпадает с описанием поведения однородной мембраны, которое приведено в гл. 2.
Цилиндрические клетки (аксоны). Описание цилиндрической клетки сложнее, чем описание сферической клетки. В этом случае уже нельзя считать внутренний проводник эквипотенциальным по всей длине. Внешний проводник мы можем сделать эквипотенциальным за счет увеличения объема внеклеточной жидкости. Потенциал па мембране зависит не только от времени (if) после включения тока, но и от расстояния (х) по отношению к месту приложения тока:
2R дх2 dt > R„ ’
где а — радиус волокна, 7? — удельное сопротивление аксоплазмы, и Ям — емкость и сопротивление на единицу площади мембраны. Левая часть уравнения описывает плотность тока через каждую точку мембраны, которая равна сумме плотностей емкостного и омического (V/77J токов, стоящих в правой части
уравнения. Полное решение этого уравнения даже для случая включения импульса постоянного тока весьма сложно, и здесь нет нужды приводить его полностью. Достаточно рассмотреть только некоторые наиболее характерные частные случаи.
Через длительное время (намного большее постоянной времени t—7?М(7Н) после включения импульса емкость мембраны полностью зарядится и емкостной ток станет равным нулю. Кабельное уравнение примет вид:
a d2V V
2R dx2 ~ Я„ *
Его решение (оно называется установившимся):
V (х) = Уо ехр (—ж А),
где Fo — потенциал в начале кабеля (х=0), А — постоянная длины волокна:
> = /->•
Постоянная длины характеризует крутизну затухания потенциала вдоль волокна. Чем больше X, тем дальше по волокну проходит сигнал.
Под стимулирующим электродом потенциал изменяется по закону: __
где; г=2?и См —постоянная времени мембраны, 7 — стимулирующий ток, = ----входное сопротивление аксона, erf(t)—
функция ошибок: erf (1)л?0.84. Постоянная времени теперь измеряется на уровне 0.84 от максимального потенциала, а не уровне 2/3 от максимума, как это делалось в случае однородной мембраны. На больших временах (t -t) потенциал под стимулирующим электродом: У^=о -> IRa> Таким образом, выводятся три экспериментально измеряемые величины: /?в£, X, и -г, которые позволяют найти три прямо не измеряемых параметра волокна: R, R* и Ся.
3 кс периментальные подтверждения кабельной теории. Кабельная гипотеза, высказанная Германном, была принята не сразу. Одним из первых отечественных физиологов, который попытался подтвердить эту гипотезу, был Вериго [79]. Он показал, что возбуждение «перепрыгивает» через короткий наркотизированный участок нерва. Вериго объяснял этот факт тем, что локальные токи, генерируемые возбужденным участком, затекают за невозбудимый участок, стимулируя следующую за ним нормальную часть нерва. Этот опыт лишь косвенно свидетельствует в пользу кабельной теории, поскольку можно было бы предположить, что сигнал передается по ненарушенной аксоплазме каким-либо другим способом. Ходжкин [54] в опытах с солевыми мостиками показал необходимость в электрическом смысле внешней среды. Если волокно разделить на две части масляной перегородкой, то возбуждение не может перейти из одной части в другую, при замыкании же перегородки с помощью проводящих мостиков (вне зависимости от природы мостиков) импульс легко проходит масляную перегородку. Очень важный опыт был проделан дель-Кастильо и Муром [381; они «проткнули» аксоплазму гигантского аксона серебряной проволочкой, что резко ускорило проведение импульса вследствие падения аксиального сопротивления.
Наиболее фундаментальное обоснование кабельной теории дано в работе Ходжкина и Раштона 1571. Они разработали кабельную теорию так, чтобы получить экспериментально измеряемые величины, по которым можно было бы вычислить собственно параметры волокна. Измерения, выполненные ими на толчках постоянного тока, совпали с измерениями, выполненными в лаборатории Кола [39] с помощью методов импедансометрии.
Из изложенной выше теории видно, что для улучшения передачи сигнала вдоль волокна выгодно увеличивать его радиус.
9
Действительно, постоянная длины волокна (X) при этом возрастает. Отсюда, казалось бы, становится очевидной вся целесообразность создания гигантских аксонов. Однако измерения показывают, что даже у гигантских аксонов с диаметром порядка 1 мм постоянная длины не превышает 2 см. Таким образом биологические кабели не могут сами по себе обеспечить передачу электрических сигналов на большие расстояния. Сигнал, следовательно, должен поддерживаться на протяжении волокна, что обеспечивается возбудимостью мембраны.
Из этой же теории видно, что увеличение сопротивления мембраны положительно сказывается на передаче сигнала вдоль кабеля. Отсюда становится понятной необходимость миелинизации волокна. Однако при намотке «изолирующих» слоев миелина волокно теряет возбудимость. Природа просто разрешила проблему. Волокно в основном подвергается миелинизации, но при этом оставляются небольшие щели — перехваты Ранвье, в которых возбудимая мембрана остается незакрытой. Электрический сигнал передается по хорошему кабелю (при миелинизации, кроме того, что растет сопротивление, резко падает емкость) от перехвата к перехвату, при этом время прохождения межперехватного участка оказывается сравнительно малым.
4.2. ПРОВЕДЕНИЕ ИМПУЛЬСА ПО ОДНОРОДНОМУ ВОЛОКНУ
4.2.1. ГЕНЕРАЦИЯ ИМПУЛЬСА В ЦЕЛОМ ВОЛОКНЕ
Условия генерации потенциала действия в целом волокне в процессе проведения сильно отличаются от условий его генерации в однородной мембране. Если в однородной мембране формирование пика полностью определяется ионным током, то в целом волокне ток,, идущий на перезарядку емкости, состоит из ионного тока и тока локальной цепи. Конкретнее — часть тока, генерируемого возбужденной областью, утекает на зарядку еще покоящихся частей волокна. Ток локальной цепи 7М имеет трехфазную форму (рис. 4.1 и рис. 4.2). Первая фаза — положительная деполяризующая волна,* обусловленная набеганием импульса в рассматриваемую точку. По мере нарастания потенциала в этой области волокна развиваются активные процессы и она сама становится источником деполяризующего тока. Ток /м вступает во вторую фазу — отрицательная, реполяризующая волна. По мере то-го как фокус деполяризации смещается дальше, активная зона, бывшая источником, становится потребителем тока, и 7Ж вступает в третью фазу — положительная волна.
* Из кабельного уравнения следует, что положительный /к в отличие от ионного тока — деполяризует, а отрицательный реполяризует мембрану. Эти токи входят в уравнение с разными знаками.
Рис. 4.1. Мембранный и распространяющийся потенциалы действия в модели Ходжкина—Хаксли.
А — потенциал действия в однородной мембране; Б — потенциал действия в целом аксоне вдали от места стимуляции; V — потенциал; — ионный ток, 1п — мембранный ток [35].
Рис. 4.2. Мембранный и распространяющийся потенциалы действия в модели Франкенхойзера—Хаксли.
А — потенциал действия в одиночном перехвате Ранвье; Б — потенциал действия в целом волокне (вдали от стимулируемого перехвата) [35].
Наиболее существенные отличия между условиями генерации потенциала действия в однородной мембране и в целом волокне обусловлены второй фазой 1Я. Действительно, первая фаза 1К обеспечивает в основном пассивный подъем потенциала, в третью же фазу /н невелик. Таким образом ток локальной цепи, а именно вторая его фаза, должен вызвать уменьшение амплитуды и максимальной крутизны восходящей фазы потенциала действия. Такое уменьшение действительно имеет место. В исследованиях на математических моделях Ходжкина—Хаксли и Франкейнхой-зера—Хаксли выяснилось, что амплитуда распространяющегося потенциала действия равна 92 вместо 96 мВ в случае однородной мембраны. В миелинизированном волокне амплитуда потенциала действия равна 111 мВ, а в одиночном перехвате Ранвье — 114 мВ. Максимальная крутизна восходящей фазы также уменьшается в целом волокне по сравнению с однородной мембраной: с 600 до 470 В/с в гигантском аксоне и с 1900 до 1600 В/с в миелинизированном волокне.
На первый взгляд может показаться, что качественное рассмотрение, проведенное выше, верно отражает реально происходящие в волокне события. Однако при рассмотрении рисунков 4.1 и 4.2 обращает на себя внимание следующий факт: амплитуда второй (реполяризующей) фазы 7И составляет почти половину от амплитуды ионного тока It, генерируемого однородной мембраной, в то время как падение амплитуды и максимальной крутизны спайка не очень значительны.
Что же уменьшило влияние локальных токов? При сравнении рисунков 4.1, А с 4.1, Б и 4.2, А с 4.2, Б можно заметить, что плотность ионного тока, генерируемого в целом волокне, выше, чем в случае однородной мембраны. Добавочный ионный ток и идет на частичную компенсацию эффекта токов локальной цепи. Генератор нервных импульсов в ответ на «вмешательство» нагрузки автоматически увеличивает свою мощность, чтобы удержать форму и величину потенциала действия.
Относительную независимость амплитуды и формы потенциала действия перехвата Ранвье от внешнего тока, пропускаемого через пего, заметил Тасаки [73]. Автор прикладывал импульсы деполяризующего и гиперполяризующего токов вблизи вершины пика и при этом зарегистрировал удивительно слабые изменения в развитии потенциала действия. Это явление, по-видимому, основано на том же механизме: в ответ на приложенный ток мембрана перехвата генерирует добавочный ток, так что потенциал действия остается практически неизменным.
Мембранные генераторы стабилизируют параметры потенциала действия не только при изменении нагрузки, но даже и при изменении параметров самого генератора. Так, например, изменение максимальной натриевой проницаемости, что соответствует выключению части натриевых каналов, ведет к непропорционально малым изменениям максимальной крутизны и амплитуды спайков. Этот
эффект был обнаружен Как в экспериментальных [471, так и в теоретических исследованиях. На математической модели перехвата Ранвье было найдено [29, 30], что двукратное снижение максимальной натриевой проницаемости (блокирование половины натриевых каналов) приводит к падению амплитуды пика на 7% и его максимальной крутизны на 35%.
Подробно механизмы стабилизации параметров потенциала действия разобраны в работе Ходорова и Тимина [35]. В этой работе показано, что стабилизация крутизны восходящей фазы обусловлена инерционностью механизма повышения натриевой проницаемости. В нормальных условиях натриевая проницаемость во время восходящей фазы пика не успевает полностью активироваться. При замедлении нарастания потенциала, вызванном любым угнетающим фактором, активируется большая доля натриевых каналов, что ведет к компенсации влияния угнетающего фактора. К моменту достижения потенциалом действия своего пика натриевая проницаемость мембраны во много раз превышает калиевую. По этой причине мембранный потенциал практически достигает величины равновесного натриевого потенциала. В этой ситуации ток через натриевые каналы сравнительно невелик несмотря на то, что открыто много каналов, так что небольшой калиевый ток уравновешивает его. Уменьшение потенциала, вызванное внешними факторами, приведет к тому, что увеличится электрохимический градиент и соответственно возрастет натриевый ток, поскольку общее число открытых натриевых каналов велико, и влияние внешнего фактора будет скомпенсировано.
В этой связи интересно вспомнить предсказание Ухтомского [28] о том, что бегущий импульс не есть проявление всех энергетических ресурсов волокна. «Максимальное возбуждение» должно во много раз превосходить уровень бегущей волны, и постоянство этой волны регулируется какими-то механизмами. В условиях, когда нагрузка на возбужденную область меняется в широких пределах, стабилизация импульса играет очень важную роль, обеспечивая выделение генераторами дополнительной мощности в местах со сниженным фактором безопасности.
4.2.2. СКОРОСТЬ ПРОВЕДЕНИЯ
Одной из важнейших характеристик процесса распространения- возбуждения является скорость распространения импульса. Мысль о том, что скорость проведения определяется пассивными электрическими характеристиками волокна, высказывал еще Лилли [64[. Ходжкин [55] экспериментально изучал влияние сопротивления внеклеточной жидкости на скорость проведения. Увеличение сопротивления внеклеточной жидкости производилось за счет резкого уменьшения ее объема. Волокно вынималось из морской воды и помещалось в масло, при этом оно оставалось окруженным тонким слоем электролита, который не смывался
маслом, и это приводило к падению скорости проведения. Существенно, что активные свойства мембраны остаются при этом неизменными. Катц [61 ] измерил изменения скорости проведения возбуждения при замещении внеклеточного электролита сахарозой. Оказалось, что если при этом объем внеклеточной жидкости велик, то скорость проведения практически не меняется, если же объем мал, то скорость заметно падает. Это легко понять, поскольку сопротивлением, определяющим скорость проведения, является суммарное сопротивление аксоплазмы и внешнего раствора на единицу длины. Когда объем внешней жидкости велик, его сопротивление гх много меньше сопротивления аксоплазмы г2 и увеличение гх слабо сказывается на сумме г^г^. При малом объеме внешней жидкости г1^аг2> поэтому увеличение гх заметно сказывается на сумме rx+r2 и соответственно на скорости проведения. Выше уже упоминалось об эксперименте [38], в котором авторы вставляли серебряную проволочку внутрь аксоплазмы и при этом резко увеличивалась скорость проведения импульса.
При теоретических исследованиях зависимости скорости проведения от электрических констант, характеризующих биологический кабель, существенно было задаться какими-то свойствами мембраны. Было исследовано два типа «теоретических мембран». Это были, во-первых, мембраны, которые отвечали на изменение потенциала мгновенно, и, во-вторых, мембраны, которые обладали инерционностью. Представляет интерес сравнить результаты, полученные на этих двух типах математических моделей.
Модели, в которых мембрана отвечает мгновенно (безинер-ционно) изменениями ионного тока на изменение потенциала, предсказывают следующую зависимость скорости 0 от свойств волокна:
6 --^a^R-'^R^. Т ж м
Коэффициент пропорциональности определяется активными свойствами мембраны, например порогом, амплитудой пика, амплитудой входящего тока и т. д. в зависимости от конкретной модели. Такая зависимость получепа в работе Раштона [71], в которой предполагалось, что мембрана теряет избирательность, как только потенциал на пей превысит пороговый уровень, в работе Оффнера с соавт. [67], в которой сверх этого учтено падение сопротивления у возбужденной мембраны. Аналогичный результат был получен в более поздних и более строго выполненных работах Компанейца и Гуровича [13], Маркина и Чизмаджева [18], в которых мембрана, после того как потенциал на ней превышал пороговый уровень, генерировала импульс входящего тока, который уже ни от чего не зависел. Такой же результат получен в работе Хюн-тера с соавт. [58], в которой ионный ток описывался некоторым полиномом от потенциала. В зависимости от вида полинома менялся коэффициент пропорциональности, но зависимость от элек
трических характеристик биологического кабеля оставалась неизменной.
Модели, в которых скорость активации входящего тока имеет конечное значение (входящий ток развивается с некоторой инерцией), дают другую зависимость скорости проведения от электрических характеристик волокна. Так, в работе Хюнтера с соавт. [58] рассмотрен случай, когда ионный ток описывается выражением:
I. — 1(т,
где Ц — некоторая функция от потенциала (вольт-амперная характеристика полностью открытых натриевых каналов), т — аналог переменной активации в модели Ходжкина—Хаксли. Переменная т описывается уравнением
dm!dt = (inm — т)/тт,
где величина та зависит от потенциала, ~1В — постоянная времени процесса активации.
Решение кабельного уравнения^вместе с приведенными выше уравнениями дает
где g — величина, соответствующая максимальной натриевой проводимости. Это выражение уже дает более слабую зависимость скорости проведения от емкости мембраны. Следует отметить, что зависимость скорости от радиуса осталась неизменной.
Более точное описание ионного тока:
приводит к другому выражению для скорости [22, 58].
0 --
В данном случае получаем еще более слабую зависимость скорости проведения от емкости мембраны и более сильную зависимость от -т; при этом зависимость от радиуса остается прежней.
Такая изменчивость выражения для скорости при выборе разных моделей для описания активных свойств мембраны связана с упомянутым выше свойством нервного генератора стабилизировать параметры пика. Эта изменчивость и появилась тогда, когда стали учитывать инерционность нервных генераторов. Очевидно, что разные генераторы будут по-разному компенсировать изменение условий для развития потенциала действия. Зависимость же скорости от радиуса волокна всегда остается одной и той же по простой причине. При изменении радиуса волокна меняется как постоянная длины невозбужденной области, так и длина возбужденной области. Их соотношение при этом остается постоянным, так что удельная нагрузка остается неизменной, и генератор
Продолжает работать в старом режиме. Аналогичный эффект оказывает изменение удельного сопротивления аксоплазмы.
Увеличение температуры волокна сказывается главным образом на скорости развития активных процессов: последняя увеличивается, т, е. уменьшается постоянная времени процесса активации Это, естественно, должно приводить к увеличению скорости распространения импульса, что и предсказывают описанные выше модели. Эти предсказания, однако, справедливы только в определенных пределах. Дело в том, что приведенная выше теория пе учитывает процесса инактивации натриевой и активации калиевой системы.
При низких температурах (до 20° С) эти процессы не оказывают значительного влияния на скорость проведения импульса, так как скорость определяется в основном передним фронтом потенциала действия, амплитуда пика с нагреванием меняется незначительно.
При более высоких температурах (выше 20° С) процессы натриевой инактивации и калиевой активации начинают вмешиваться в формирование переднего фронта, замедляя его, при этом заметно снижается амплитуда пика, что снижает темп роста скорости с температурой. Наконец, при нагревании выше 30е С скорость импульса падает и с 38° С проведение вообще блокируется. Этот результат был получен в работе Хаксли [60 J, в которой процесс установившегося проведения вдали от стимулирующего электрода исследовался на полной модели Ходжкина—Хаксли.
Таким образом, ускорение проведения нервных импульсов можно достигнуть как за счет «ускорения» работы генераторов, так и за счет увеличения диаметра волокна. У низших животных (кальмары, ракообразные) высокая скорость (до 20 м/с) обеспечивается увеличением диаметра волокна, который достигает величин порядка 100—1000 мкм. У животных, стоящих на более высоких ступенях эволюционной лестницы, нервная система которых перерабатывает значительно больший объем информации, а значит, имеет большее число элементов, такое решение проблемы скорости неприемлемо. Природа нашла лучшее решение, создав миелинизированные волокна. Миелиповая оболочка образуется многими слоями мембран шванновских клеток, которые оборачиваются вокруг волокна. Намотка шванновских клеток приводит к тому, что основная часть волокна становится невозбудимой. Кабель же даже после миелинизации все-таки далек от идеального (константа длины для миелинизированного участка составляет величину порядка 2—6 мм). Поэтому для поддержания нервного импульса в миелиновом покрытии остаются узкие щели шириной около 2 мкм — перехваты Ранвье, в которых мембрана остается открытой. Импульсы «перепрыгивают» из перехвата в перехват, таким образом практически не тратится время на проведение в меж-перехватном участке. Большое сопротивление (около 105 Ом см2) 158
и малая емкость (0.005 мкФ/см2) обеспечивают надежную пассивную передачу сигнала из перехвата в перехват.
Скорость проведения по миелинизированному волокну определяется расстоянием между перехватами; чем больше до определенного предела расстояние между перехватами, тем больше скорость проведения. Межперехватный участок, однако, не может быть очень длинным, так как сигнал на его протяжении все-таки затухает. При увеличении диаметра волокна затухание в миелинизированном сегменте будет менее выраженным, так что этот сегмент может быть длиннее. Удлинение межперехватных участков в толстых волокнах при сохранении надежности передачи сигнала из перехвата в перехват возможно еще и потому, что миелиновая оболочка в толстых волокнах утолщается (отношение внешнего диаметра волокна к диаметру осевого цилиндра у разных волокон примерно одно и то же, порядка 1 : 0.6), что также обусловливает более медленное затухание сигнала. Окончательно, как показывают морфометрические исследования, длина межперехватных участков примерно пропорциональна диаметру волокна. Именно с этим связан тот факт, что скорость проведения импульса пропорциональна диаметру волокна, а не корню из диаметра, как в безмякотном волокне [50, 59, 72, 74]. Время передачи импульса из перехвата в перехват при этом оказывается постоянным для волокон разного диаметра. Так, время перепрыгивания импульса в волокнах лягушки-быка при 24° С составляет примерно 0.07 мс [74] независимо от диаметра волокпа. Следует отметить, что отношение длины межперехватного участка к диаметру волокна неодинаково у разных животных. В частности, у упомянутой лягушки-быка это отношение около 200, у большинства теплокровных животных она около 100 [72]. Скорости проведения, характерные для нервных волокон теплокровных, приведены в таблице.
Скорости проведения импульсов в различных волокнах теплокровных [4]
Тип волокна Диаметр, мкм Скорость проведения, м/с
А« 13-22 70-120
А8 8-13 40-70
Ау 4-8 15—40
' а¥ 1—4 5-15
В 1—3 3—14
с 0.5—1.0 0.5-2
4.3. ПРОВЕДЕНИЕ ИМПУЛЬСА ПО НЕОДНОРОДНЫМ ВОЛОКНАМ
Нервные волокна обычно не имеют постоянной геометрии: они ветвятся либо сливаются, расширяются либо сужаются, миелинизированные волокна оканчиваются безмякотпыми
продолжает работать в старом режиме. Аналогичный эффект оказывает изменение удельного сопротивления аксоплазмы.
Увеличение температуры волокна сказывается главным образом на скорости развития активных процессов: последняя увеличивается, т. е. уменьшается постоянная времени процесса активации тт. Это, естественно, должно приводить к увеличению скорости распространения импульса, что и предсказывают описанные выше модели. Эти предсказания, однако, справедливы только в определенных пределах. Дело в том, что приведенная выше теория не учитывает процесса инактивации натриевой и активации калиевой системы.
При низких температурах (до 20° С) эти процессы не оказывают значительного влияния на скорость проведения импульса, так как скорость определяется в основном передним фронтом потенциала действия, амплитуда пика с нагреванием меняется незначительно.
При более высоких температурах (выше 20° С) процессы натриевой инактивации и калиевой активации начинают вмешиваться в формирование переднего фронта, замедляя его, при этом заметно снижается амплитуда пика, что снижает темп роста скорости с температурой. Наконец, при нагревании выше 30е С скорость импульса падает и с 38° С проведение вообще блокируется. Этот результат был получен в работе Хаксли 160], в которой процесс установившегося проведения вдали от стимулирующего электрода исследовался на полной модели Ходжкина—Хаксли.
Таким образом, ускорение проведения нервных импульсов можно достигнуть как за счет «ускорения» работы генераторов, так и за счет увеличения диаметра волокна. У низших животных (кальмары, ракообразные) высокая скорость (до 20 м/с) обеспечивается увеличением диаметра волокна, который достигает величин порядка 100—1000 мкм. У животных, стоящих на более высоких ступенях эволюционной лестницы, нервная система которых перерабатывает значительно больший объем информации, а значит, имеет большее число элементов, такое решение проблемы скорости неприемлемо. Природа нашла лучшее решение, создав миелинизированные волокна. Миелиновая оболочка образуется многими слоями мембран шванновских клеток, которые оборачиваются вокруг волокна. Намотка шванновских клеток приводит к тому, что основная часть волокна становится невозбудимой. Кабель же даже после миелинизации все-таки далек от идеального (константа длины для миелинизированного участка составляет величину порядка 2—6 мм). Поэтому для поддержания нервного пмпульса в миелиновом покрытии остаются узкие щели шириной около 2 мкм — перехваты Ранвье, в которых мембрана остается открытой. Импульсы «перепрыгивают» из перехвата в перехват, таким образом практически не тратится время на проведение в меж-перехватном участке. Большое сопротивление (около 105 Ом см2) 158
и малая емкость (0.005 мкФ/см2) обеспечивают надежную пассивную передачу сигнала из перехвата в перехват.
Скорость проведения по миелинизированному волокну определяется расстоянием между перехватами; чем больше до определенного предела расстояние между перехватами, тем больше скорость проведения. Межперехватный участок, однако, не может быть очень длинным, так как сигнал на его протяжении все-таки затухает. При увеличении диаметра волокна затухание в миелинизированном сегменте будет менее выраженным, так что этот сегмент может быть длиннее. Удлинение межперехватных участков в толстых волокнах при сохранении надежности передачи сигнала из перехвата в перехват возможно еще и потому, что миелиновая оболочка в толстых волокнах утолщается (отношение внешнего диаметра волокна к диаметру осевого цилиндра у разных волокон примерно одно и то же, порядка 1 : 0.6), что также обусловливает более медленное затухание сигнала. Окончательно, как показывают морфометрические исследования, длина межперехватных участков 'примерно пропорциональна диаметру волокна. Именно с этим связан тот факт, что скорость проведения импульса пропорциональна диаметру волокна, а не корню из диаметра, как в безмякотном волокне [50, 59, 72, 74]. Время передачи импульса из перехвата в перехват при этом оказывается постоянным для волокон разного диаметра. Так, время перепрыгивания импульса в волокнах лягушки-быка при 24° С составляет примерно 0.07 мс [74] независимо от диаметра волокна. Следует отметить, что отношение длины межперехватного участка к диаметру волокна неодинаково у разных животных. В частности, у упомянутой лягушки-быка это отношение около 200, у большинства теплокровных животных она около 100 [72]. Скорости проведения, характерные для нервных волокон теплокровных, приведены в таблице.
Скорости проведения импульсов в различных волокнах теплокровных [4 ]
Тип волокна Диаметр, мкм Скорость проведения» м/с
Аа 13—22 70-120
АЗ 8—13 40—70
Ат 4-8 15—40
а5 1-4 5-15
В 1—3 3-14
с 0.5—1.0 0.5-2
4.3. ПРОВЕДЕНИЕ ИМПУЛЬСА ПО НЕОДНОРОДНЫМ ВОЛОКНАМ
Нервные волокна обычно не имеют постоянной геометрии: они ветвятся либо сливаются, расширяются либо сужаются, миелинизированные волокна оканчиваются безмякотными
терминалями и т. д. Кроме того, нервное волокно может иметь разную возбудимость по своей длине. Импульс, вошедший в однородный участок волокна, движется с постоянной скоростью, сохраняя свою форму. Совершенно иная картина наблюдается вблизи тех мест, в которых меняются характеристики волокна. Пересекая границу, импульс может испытывать трудности вплоть до полного блокирования, или же, наоборот, его проведение может облегчаться. Одна из основных трудностей в экспериментальном изучении механизмов распространения импульсов по неоднородным волокнам состоит в том, что однородный участок, если он достаточно длинен всегда «выправляет» искажения импульса, возникшие на неоднородности, так что на выходе волокна мы имеем стандартный импульс. Для прослеживания изменений потенциала действия вблизи неоднородности необходимо иметь много отведений, что практически бывает невыполнимо. Изменения же ионных токов вообще остаются вне поля зрения исследователя. Между тем понимание событий, происходящих па неоднородности, важно не только для нейрофизиологов. Например, возбуждение из предсердия проходит по очень сложному пути в желудочек, на этом пути встречаются и ветвления, и расширения, и функциональные неоднородности. Это важно иметь в виду при рассмотрении нарушений механизмов проведения возбуждения в сердце, что является часто встречающейся патологией.
4.3.1. ИЗМЕНЕНИЕ ДИАМЕТРА ВОЛОКНА
Одним из наиболее удобных способов изучения влияния расширения волокна на проведение импульса является изучение антидромного проведения. Начальный сегмент имеет форму конуса, который довольно резко у своего основания переходит в сому [451. По мере приближения импульса к телу клетки входное сопротивление кабеля падает вследствие увеличения его диаметра. Это означает, что нагрузка на возбужденную область возрастает, что приводит в свою очередь к снижению амплитуды импульса. Если он останется все-таки достаточно большим, чтобы поднять потенциал в соме выше порогового, то сома возбудится, в противном случае возбуждение заблокируется.
Такое объяснение событий, происходящих на границе расширения волокна, предложено в работах Кумбса с соавт. [42] и Фуор-теса с соавт. [49]. То, что надежность проведения импульсов из начального сегмента в сому низка, было показано в работе Льва [15]. При разных способах отведения от одной и той же клетки (внеклеточное и внутриклеточное) проведение импульса могло блокироваться и не блокироваться. Объясняется это тем, что введение микроэлектрода в клетку небезразлично для последней, возбудимость сомы хоть незначительно, по падает. Однако и незначительного падения возбудимости достаточно для того, чтобы'заблокировать антидромное проведение.
Количественные исследования, проведенные на математических моделях [3, 7, 16, 19, 32], подтвердили качественные выводы. Между тем точные расчеты выявили и ряд интересных особенностей. Так, в работе Маркина и Пастушенко [16] показано, что скорость импульса при подходе к месту расширения падает, а при подходе к месту сужения нарастает. При прохождении границы скорость меняется скачком (рис. 4.3), а в дальнейшем устанавли-
Рис. 4.3. Изменения скорости проведения импульса вблизи места изменения диаметра волокна.
А — волокна расширяется, Б — волокно сужается в точке А'=0. Имтгулъс распространяется в направлении увеличения значений X [16].
вается на новом уровне; отношение установившихся скоростей соответствует предсказанию теории для однородных кабелей:
— Val/Va2*
Происхождение скачка скорости можно объяснить следующим образом. Распределение потенциала и токов в обоих участках волокна описывается кабельными уравнениями (см. выше). На границе справедливы следующие уравнения:
Jim V (х, t)= lim 7(ж, t),
.. ital д¥ .. кя1 dV Jjm —— — lim ,
x-yl—О " "Х ж-Н+0 " &х
где I — координата границы. Иными словами, распределение V (х) в каждый момент времени непрерывно, но терпит излом на границе раздела.
Ионные механизмы формирования импульсов вблизи границы проанализированы с помощью модели Ходжкина—Хаксли. Наиболее ярко все закономерности проявляются при субкритическом расширении волокна. Таким расширением при радиусе основного
ц Общая физиология нервной системы 161
волокна 0.238 мм и температуре 20° С является пятикратное расширение. При шестикратном расширении импульс блокируется [32]. На рис. 4.4 показаны потенциалы действия в различных точках волокна вблизи точки расширения. Можно видеть,
что импульс, приближаясь к границе, уменьшается. В то же время
ионные токи (рис. 4.5) заметно увеличены, т. е. включается механизм компенсации. В точке .¥ = 1.8 см (за 0.2 см до места расширения) амплитуда ионного тока
равна 800 вместо 650 мкА/см2 в однородном кабеле и 470 мкА/ см2 в однородной мембране. По мере дальнейшего продвижения импульса компенсационный механизм не справляется с увеличением нагрузки, и в точке Х=2.0 см амплитуда пика падет до 26 мВ. Ясно, что если бы кинетика ионного тока не менялась, то импульс не достиг бы границы. Возможно, именно этим объясняется раз-
Рис. 4.4. Распространяющиеся потенциалы действия в разных точках теоретического аксона, диаметр которого увеличивается скачком в пять раз.
Аксон схематически изображен слева, вдоль аксона указывают на расстояние (см) от стимулирующего электрода. Стрелкой показано направление распространения импульсов. Стимулы приложены с интервалом 2.5 мс £34].
личие в предсказаниях «безинерционной» модели (критическое расширение 4.1 [19]) и модели Ходжкина—Хаксли.
Потенциал действия в тонкой части волокна (Х = 1.7, 1.8, 1.9 см) имеет двухпиковую форму. Создается впечатление, что импульс отразился от границы. Отраженный импульс затухает, так как он распространяется по рефрактерной области, однако его распространение не прошло бесследно. Процесс восстановления от рефрактерности был приостановлен.
Ретроградная волна — это в основном электротоническая ^волца, до не во всех точках волокна. В точках Х=1.9 и 2.0 см, т. е. непосредственно вблизи границы, причиной появления ретроградной волны действительно является исчезновение нагрузки (толстая часть возбудилась), цо движущей силой все-таки является собственный ионный ток, ток 7М хртри; уменьшается, но на протя-itia
Рис. 4.5. Потенциалы действия и токи, его образующие, в точках, лежащих в непосредственной близости перед местом расширения (см. рис. 4.4).
А — Х=1.8 см; Б — Х=2.0 см [34].
жении практически всего времени подъема потенциала сохраняет реполяризующее направление.
Такие ретроградные волны зарегистрированы экспериментально в процитированных выше работах Кумбса с соавт. [42, 431 и Фуор-теса с соавт. [49]. Ретроградные волны проявляются особенно ярко в тех случаях, когда проведение через границу сильно затруднено. Так, в работе Кумбса с соавт. [42] ретроградная волна особенно хорошо видна на импульсе, который распространялся по рефрактерному волокну (клетка раздражалась парными импульсами). Важно отметить, что отношение диаметра клетки к диаметру начального сегмента значительно превышает величину 5, однако импульс проходит через такое сильное расширение. Это можно понять, если принять во внимание следующие особенности. Во-первых, широкая часть (сома) имеет небольшую длину, что способствует проведению. Во-вторых, расширение здесь не резкое, а постепенное. Беркинблитом с соавт. [7] было показано, что в таком случае импульс может пройти через гораздо большие расширения.
4.3.2. ВЕТВЛЕНИЕ ВОЛОКНА
Теоретический анализ пассивных свойств синцитиальных структур был проведен многими авторами [9, 24, 68]. Хотя эти исследования представляют большой интерес и предлагаемые методы расчета сложных цепей [9, 24] полезны для экспериментов, мы не будем обсуждать этот материал, поскольку настоящий раздел посвящен только активному распространению импульсов. Для простоты рассмотрим узел, в котором сходятся три волокна. Возбуждение может подходить к узлу либо по одной в Случае ветвления, либо по двум в случае слияния ветвям. Распределение потенциала в каждой ветви описывается, как и выше, уравнением для однородного кабеля. В узле справедливы следующие соотношения. Будем отсчитывать расстояние от узла, в каждой ветви будет самостоятельная координата
lim V (xlt i) = limF(a:2, f) = limF(j3, i),
#a->0 яъ->0
2тсаэ r dV n -p-/ =
При приближении импульса к узлу ветвления по одной ветви (для определенности по ветви 1) наблюдаются те же явления, что и на границе изменения диаметра.
Если ^1 = ^2 -ф С3 при С — и у/2аЗ.С’т/7? — аналоге входного сопротивления кабеля, то импульс идет, как в однородном волокне, т. е. нагрузка на генераторы не меняется. Если Ci > Чтч, то импульс ускоряется, как перед сужением, 164
а при Cx < Ca+Cs импульс замедляется, как_перед расширением. Следует особо отметить, что в тех случаях, когда импульс проходит через узел ветвления, он должен пойти по обеим ветвям. Когда возбуждение проходит только в одну ветвь [52], нужно думать, что ветви имеют разную возбудимость.
Более интересные события развиваются при неодновременном приходе импульсов к узлу по двум ветвям. В работе Пастушенко с соавт. [20, 21 ] показано, что при небольшой разнице в моментах прихода импульсов к узлу эта разница становится еще меньше в результате электротонического взаимодействия ветвей. Импульсы как бы стремятся синхронизировать свой приход в узел. К такому же заключению пришли раньше Аршавский с соавт. [3] па базе качественного анализа, и позже такой же результат был получен на модели Ходжкина—Хаксли [8]. В последней работе была рассмотрена ситуация, когда в узле осуществляется логическая функция «запрет». При отношении радиусов аг : аг : а3=1 : 1.5 : 5 импульс блокируется в узле,если он приходит по ветви 1, и возбуждает узел, если он приходит по ветви 2. В тех случаях, когда импульсы при-ходят'по ветвям 1 и 2 (по ветви 1 импульс приходит раньше), проведение из 2 в 3 облегчается при малой задержке Q < 1 мс. При больших временных интервалах проведение из 2 в 3 становится затрудненным и при Q > 1.7 мс проведение второго импульса блокируется и восстанавливается только при Q > 2.8 мс. Блокирование обусловлено инактивацией натриевой и активацией калиевой проводимости мембраны в районе узла под влиянием первого импульса, хотя он вызвал лишь подпороговые изменения потенциала в узле.
Блокирование импульсов в узле ветвления неоднократно наблюдалось в эксперименте [44, 62, 75]. Было, например, показано, что если импульс не проходит по ветви 1 или 2, то он обязательно пройдет по ветви 3. Это было доказано и теоретически, т. е. не существует такого ветвления, при котором импульс не мог бы пройти ни по одной ветви [17]. В работе Таука и Хьюза [75] изучалось влияние ветвления аксона вблизи тела клетки на проведение антидромного возбуждения. Эти результаты непросто интерпретировать, поскольку, кроме ветвления, на проведение влияет еще и расширение, расположенное вблизи ветвления. Однако и в этом случае можно было наблюдать облегчение проведения через узел ветвления при одновременном раздражении двух ветвей.
4.3.3. ПРОВЕДЕНИЕ ИМПУЛЬСА ИЗ МИЕЛИНИЗИРОВАННОГО ВОЛОКНА В БЕЗМЯКОТНУЮ ТЕРМИНАЛЬ
Миелинизированные волокна в области терминали теряют свою изолирующую оболочку. Это увеличивает площадь активной мембраны, которая может секретировать медиатор. Исчезновение миелиновой оболочки создает трудности при пере
ходе импульса в терминаль. Действительно, для этого перехода необходимо, чтобы ток, генерируемый последним перехватом, был достаточен для сверхпорогового смещения потенциала на большой площади открытой мембраны. Исследования, проведенные с помощью внеклеточных электродов [36, 63], показали, что такая трудность действительно существует, но задержка при проведении импульса в терминаль невелика.
Естественно возникают вопросы: что влияет на проведение импульса через переход, как он распространяется вдоль терминали? Рассмотрим вспомогательную задачу [23]. Пусть линия передачи состоит из двух кабелей (межперехватный участок и терминаль), которые имеют общие внутренний (аксоплазма) и внешний (внеклеточная жидкость) проводники. Если на вход такой системы подать потенциал (потенциал в последнем перехвате), то в стационарном состоянии (t -> ск>), когда зарядятся все емкости.
—У1
где — потенциал в начале терминали, 7двр — потенциал в последнем перехвате, L — длина миелинизированного сегмента, D — диаметр осевого цилиндра в миелинизированной части, d — диаметр терминали, g — проводимость покоящейся мембраны терминали. Характеристики терминали и последнего миелинизированного участка вошли в формулу в комбинации d''‘L\g- Таким образом, в соответствии с расчетом можно полагать, что для увеличения надежности передачи сигнала в терминаль наиболее выгодно уменьшение диаметра терминали, менее эффективно сказывается укорочение последнего миелинизированного сегмента и слабо сказывается увеличение сопротивления мембраны. Учет емкости мембраны приводит к очень сложным математическим выражениям. Не приводя их, укажем только, что теперь параметры терминали вошли в конечную формулу в следующей комбинации: d,2L\lgC, где С — емкость мембраны.
Расчеты с использованием модели Франкенхойзера—Хаксли показали [23 ], что если терминаль имеет тот же диаметр, что и осевой цилиндр миелинизированного волокна, то импульс не проходит в терминаль даже при увеличении сопротивления ее мембраны с 33 до 1000 Ом-сма (сопротивление мембраны перехвата и гигантского аксона соответственно). Трехкратное сужение терминали при мембранном сопротивлении 33 Ом-см2 и длине L=1.5 мм уже позволяет импульсу пройти в терминаль, но сужение в 2.5 раза оказывается недостаточным (рис. 4.6). Физический смысл описанного облегчения понятен: сужение волокна ведет к уменьшению площади, на которой распределяется ток, текущий из последнего перехвата. Этому способствует и уменьшение константы длины
в терминали, вызванное сужением. Укорочение последнего миелинизированного сегмента с 1.5 до 1.0 мм может привести к тому, что сужение в 2.5 раза оказалось достаточным для проведения.
Морфологические измерения Ценкера [80] показывают, что в природе широко используются оба описанных способа облегче-
Рис. 4.6. Расчет проведения импульсов из миелинизированной части волокна в безмякотную терминаль в различных точках волокна.
3—5 — импульсы в перехватах (стимулируется нулевой перехват), I—II — импульсы безмякотной терминали в ее начале и на расстоянии 80 мкм от начала. Длина миелинизированных сегментов 1,5 мм. А — диаметр терминали уменьшен в 2.5 раза по сравнению с диаметром осевого цилиндра миелинизированного волокна, импульс блокирован; Б — проведение импульса при 3-кратном сужении терминали по сравнению с диаметром осевого цилиндра волокна [23].
ния проведения. Например, в моторных волокнах, иннервирующих глазную мышцу обезьяны, отношение LlD в претерминальных областях падает до 5—10. В то же время наблюдается и значительное сужение терминали.
Сниженная надежность проведения в области перехода должна вызывать блок проведения именно в этом месте даже при равномерном снижении возбудимости вдоль всего волокна, когда проведение по основному волокну не нарушается. Возможно, что это имеет место при явлениях асфиксии [40], действии барбитуратов [76], высокочастотной стимуляции [14].
4.3.4. ФУНКЦИОНАЛЬНЫЕ НЕОДНОРОДНОСТИ
На рис. 4.7 показано распространение потенциала действия по теоретическому аксону (модель Ходжкина—Хаксли), который, начиная с точки Х=2.025 см, невозбудим (максимальная натревая проводимость в этой области уменьшена в 10 раз). Как видно, импульс «чувствует» невозбудимую зону еще при
приближении к ней: в точке Х = 1.8 см его амплитуда и максимальная крутизна_ниже на 15 и 30% соответственно. Каким ясе образом
Рис. 4.7. Проведение импульса в теоретическом аксоне, часть которого, начиная с 2.025 см, невозбудима.
Стимул наносится В точке X—0. Цифры над кривыми означают расстояние от стимулирующего электрода. Изменения потенциала в невозбудимой зопе показаны пунктиром [35].
Рис. 4.8. Схема, качественно поясняющая влияние невозбудимой зоны на нормальную.
А — схематическое изображение двух частей волокна. Б — ток, текущий в такой цепи, если Е, и Е2 генерируют потенциалы, близкие по форме к нервному импульсу. Обозначения в тексте [35].
это происходит, ведь входное сопротивление невозбудимой зоны не только не уменьшено, а даже увеличено по сравнению с нормой?
Рассмотрим схему (рис. 4.8), дающую качественное объяснение взаимодействия между двумя участками кабеля. Легко найти ток, текущий в этой схеме:
•__^2 (I) — Б] (/)
2г + R
где Еу и Е2 — электродвижущие силы двух генераторов, г — их внутреннее сопротивление, R — сопротивление «аксоплазмы».
Пусть Ё1 (i) и Ё2 (t) имеют вид кривой с максимумом (форма нервного импульса) и сдвинуты на интервал т. Ток i будет иметь вид двухфазной кривой (рис. 4.8). Такой вид i соответствует кривой токов локальных цепей, полученных на полных математических моделях (нет только первой фазы, соответствующей набеганию импульса) — отрицательная волна соответствует реполяризую-щему току. Представим себе, что (/) включается с большей за-
Рис. 4.9. Ионный и мембранный токи, формирующие потенциалтдействия в точке Х=1.8 см в аксоне, представленном на рис. 4.7.
держкой или не включается вообще. Очевидно, что при этом увеличится реполяризующий ток, что приведет к падению амплитуды пика. В случае, представленном на рис. 4.7, пик отрицательной волны Z„ в точке Х=1.8 см увеличен в два раза по сравнению с нормальной величиной, при этом естественно срабатывает механизм компенсации, чем и объясняется слабое изменение формы потенциала действия. Интересно "отметить, что в этом случае практически исчезла третья фаза и сильно затянулась его вторая фаза. Такие изменения 1Я должны были сильно укоротить потенциал действия. В действительности потенциал действия укоротился весьма незначительно, поскольку в это время был сильно увеличен входящий натриевый ток (рис. 4.9).
100
ио
5 50
I ~
7 2 3 4 см
Рис. 4.10. Изменения амплитуды потенциалов действия в теоретическом аксоне, часть которого слабо альтерирована (максимальная натриевая проницаемость снижена в два раза). Аксон схематически показан снизу, альтерированная область затушевана (35].
Рис. 4.11. Анализ изменений потенциалов действия в случае, представленном на рис. 4.10. Потенциалы и токи в нормальном аксоне вдали от точки стимуляции (4); в точке, лежащей перед альтерированной зоной, Х=2.0 см (Б); в точке, лежащей перед задней границей альтерированной области, Х=3.0 см (в) и Х=3.05 см (Г).
Рассмотрим теперь события, происходящие в альтерированной зоне и на ее выходе в нормальную зону. На рис. 4.10 показаны изменения амплитуды рассчитанных потенциалов действия в разных точках волокна, часть которого обработана так, что максимальная натриевая проводимость в ней снижена в два раза (моделирование эффекта малых доз тетродотоксина). Видно, что по мере продвижения импульса в глубь альтерированной зоны его амплитуда падает, а затем вблизи задней границы постепенно восстанавливается. Это происходит в первую очередь из-за изменений свойств мембраны и взаимодействия нормальных и альтерированного участков волокна. По мере удаления от передней границы все больше и больше падает «поддержка» нормальной зоны и амплитуда пика стремится к номинальной для такого кабеля величине. При приближении к задней границе импульс начинает испытывать поддерживающее влияние нормальной зоны, в этом случае увеличивается третья фаза 1Я. Описанные взаимодействия проиллюстрированы рис. 4.11, на котором видно, что вблизи задней границы сильно уменьшена реполяризующая фаза тока /„ и увеличена его третья деполяризующая фаза.
Закономерности распространения импульса, описанные выше, справедливы в принципе и для миелинизированных волокон. Здесь также наблюдаются изменения пиков вблизи передней и задней границы неоднородности. Критическим является переход из первого альтерированного перехвата во второй. Если такой переход состоялся, то дальше импульс будет распространяться. Переход же из нормальной зоны в первый альтерированный перехват еще не означает, что импульс пойдет дальше [31 ].
4.4. ПРОВЕДЕНИЕ СЕРИЙ ИМПУЛЬСОВ. ТРАНСФОРМАЦИЯ РИТМА
Говорить об особенностях распространения серии импульсов имеет смысл только в тех случаях, когда период стимуляции волокна меньше, чем длительность рефрактерного периода. В тех случаях, когда импульсы идут с большим интервалом, распространение каждого из них подчиняется закономерностям, описанным выше, В ряде экпериментальных работ [14, 37, 46, 51, 65, 66] показано, что импульс, вызванный через небольшой промежуток времени после предыдущего возбуждения, распространяется с меньшей скоростью, чем первый. Скорость импульса, распространяющегося по рефрактерному волокну, минимальна вблизи точки стимуляции, далее скорость все время нарастает [46]. Исследуя возбудимость ткани под электродом, Розенблют [69] установил, что разделение рефрактерности на относительную (импульс возникает, но распространяется с меньшей скоростью) и абсолютную (волокно вообще не возбуждается) весьма условно. Если в некоторый период времени волокно находится в состоянии абсолютной рефрактерности для стимулов малой силы, то для стимулов боль
шой силы это состояние может оказаться относительной рефрак-терностью.
В соответствии с этим Розенблют предложил ввести понятие функционального рефрактерного периода, который определен для стимула данной силы. При временах меньших функционального рефрактерного периода импульс данной силы не может возбудить ткань. При этом, естественно, чем больше сила стимула, тем короче функциональный рефрактерный период.
Кинетика формирования импульсов под стимулирующим электродом в рефрактерном волокне была проанализирована в нескольких работах [27, 33L Для возникновения распространяющегося импульса в рефрактерном безмякотном волокне необходимо, чтобы восстановительные процессы дошли до определенной степени не только непосредственно под электродом, но и в некоторой области, прилегающей к месту стимуляции. Именно этим объясняется тот факт, что максимальный ритм, который способно воспроизвести нервное волокно, примерно вдвое реже, чем теоретически ожидаемый на основании измерения длительности абсолютной рефрактерности однородной мембраны [29, 561. В поздний момент периода рефрактерности проведение приобретает инкрементный характер, причем для возникновения его достаточно, чтобы в точке стимуляции возник только локальный ответ. Аналогичная картина развивается в миелинизированных волокнах. Разница состоит только в том, что в конце рефрактерности стимул все-таки должен иметь достаточную силу, чтобы не только вызвать пик в стимулируемом перехвате, но и «помочь» возбудить следующий перехват. Проведение серии импульсов вдали от места стимулирования в этой ситуации подчиняется следующим закономерностям [6, 12 J. В начале волокна импульсы идут с частотой стимулов, на равном расстоянии друг от друга. В дальнейшем каждый импульс, по мере того как предыдущий, разгоняясь, оставляет после себя «лучший» путь, также разгоняется. В конце концов, если волокно достаточно длинно, все импульсы расходятся на такое расстояние, что каждый распространяется по нерефрактерному волокну.
Изучая распространения серий импульсов по нерву, часть которого была альтерирована различными агентами, снижающими возбудимость, Введенский [10, 11] обнаружил, что не все импульсы доходят до конца нерва, более того, при очень высокой частоте стимуляции до конца доходит только первый импульс, все остальные оказываются заблокированными. Примерно в то же время Венкебах [77, 78] обнаружил аналогичное явление в сердце — некоторые импульсы, вышедшие из синусного узла, не доходят до желудочка. В чем же здесь дело — ведь ткань явно возбудима, выпадают не все импульсы, а только некоторые? Многочисленными исследованиями (см. [5]) было показано, что необходимым условием трансформации ритма является наличие неоднородности на пути распространения импульсов,
Для объяснения этого явления Розенблютом [70] была предложена простая идея. В дальнейшем она была формализована и более строго исследована в работах Аршавского с соавт. [1,2] и Смолянинова [25]. Идея основана на простых представлениях о функциональной рефрактерности и монотонном восстановлении возбудимости после окончания потенциала действия, эта идея проиллюстрирована рис. 4.12. Некоторый возбудимый элемент стимулируется серией прямоугольных толчков тока сверхпороговой силы. Пунктирная линия показывает изменения порога: после возбуждения порог становится бесконечно большим, затем скачком падает до некоторого уровня и затем монотонно падает
, iiii'i । । । । । । 11
I I 1 I I I 1 I । I 1 I II с
I \ I I 1 I 1 I \ О
п ti 11 t'-h n И п 'ii П :
Рис. 4.12. Упрощенная модель трансформации ритма.
Пояснения в тексте [70].
до уровня в цокое. Если за время межимпульсного интервала порог упадет до величин, меньших, чем амплитуда стимула, то волокно будет отвечать на каждое раздражение (случай А). Если же после первого стимула порог не успевает достаточно упасть и оказывается выше стимула (случай Б), то волокно вначале не отвечает на раздражение. Однако поскольку импульс длительный, он «ждет», пока порог волокна не упадет ниже его амплитуды. Второе возбуждение возникает с задержкой. Следующее возбуждение возникает с еще большей задержкой, и так до тех пор, пока задержка возбуждения не окажется больше длительности стимула — тогда соответствующий импульс выпадет из серии. Затем вся последовательность событий повторяется. Авторы предполагают, что такая картина разворачивается на границе неоднородности, когда к ней подходит высокочастотная серия импульсов.
В какой-то степени описанные представления отражают реально происходящие события. Однако недостаток этих моделей состоит в том, что они не учитывают влияния самого стимула на ход восстановления порога. Именно из-за этого упрощения такие модели не объясняют пессимального торможения Введенского, при котором только первый импульс проходит через альтерированный участок, остальные же импульсы блокируются.
Действительно, как бы медленно ни восстанавливался порог, сколько бы при этом ни выпало импульсов, радо или поздно порог
примет свое минимальное значение и возникнет новый импульс.
Выше было показано, что даже распространение ретроградной
волны останавливает процесс восстановления, набегающий же импульс тем более должен влиять на ход восстановления.
На рис. 4.13 показано прохождение высокочастотной серии импульсов (период стимуляции 2.5 мс) через теоретический аксон, в небольшом участке которого максимальная натриевая проводи
2.„
,,|Л л.л.л
мость снижена в три раза. Такая альтерация мембраны сама по себе не приводит к блокированию импульса. Однако даже небольшая инактивация натриевых каналов и повышенная калиевая
проводимость, оставшиеся после прохождения первого импульса, оказались достаточными для того, чтобы второй импульс не прошел, — он угас, не дойдя до конца наркотизированного участка. Распространение этого декрементирующего импульса не прошло бесследно для альтерированного участка: состояние рефрактерности углубилось. Третий импульс застал волокно примерно в том же состоянии, что и второй, и все события
Рис. 4.13. Пессимальное торможение Введенского в участке волокна со сниженной натриевой проводимостью. Альтерированная зона затушевана. Межстимульные интервалы — 2.5 мс [351.
повторились. Существенно, что импульсы блокируются не на границе неоднородности, а угасают в глубине наркотизированного участка; таким образом создается область, которая не может выйти из состояния рефрактерности («голова парабиотического участка» по Введенскому). Если бы импульс блокировался точно на границе, то рано или поздно наркотизированный участок вышел бы из состояния рефрактерности и импульс перепрыгнул бы в восстановившийся участок. Следует отметить, что в действительности импульсы затухают именно в глубине, а не на границе альтериро-ранного участка. Это было четко показано в экспериментах с локальным охлаждением волокна 12].
Аналогичное нарушение проведения наблюдается и в случае Геометрических неоднородностей. При сильном расширении во-лоцна и при высокой частоте стимуляции через расширение проходит только первой импульс, в<щ остальные блокируются [34],
Торможение Введенского сменяется периодикой Венкебаха при меньших частотах стимуляции и не столь сильных снижениях гарантийного фактора. На рис. 4.14 показано распространение
Т,СМ
.1ШШГ ДЛЛЛми
2.о AjjAuAi/^еА
100мВ
1.9
.1)1
5 ' ' д; 15 мс
Рис. 4.14. Трансформация ритма в расширяющемся волокне. Волокно показано схематически слева. Межстимульные интервалы — 3.3 мс, диаметр волокна увеличивается в три раза [34].
Л
жшюш 1—»—Г~»—Г(—I—Г—Т—Г Г—»—Г—1—Г/—Г~1—t—Г»—ГП—ГТ
I—V—»—Г—ГI—»—»—»—Г t—г~|—г~Г J—»——Г <—П—гиг
Рис. 4.15. Потенциалы действия в различных участках мотонейрона кошки.
А — регистрирующий микроэлектрод находится в начальном сегменте; В — микроэлек' трод находится в соме. Мотонейрон раздражается антидромно парными стимулами [42 ]•
серии импульсов через трехкратно расширенные волокна при межстимульных интервалах 3.3 мс. Видно, что первые четыре импульса прошли, а пятый — заблокировался. Шестой импульс (не показано) похож на второй, седьмой на третий и т. д. В результате установился режим, при котором выпадал каждый четвертый импульс. Из рисунка четко видно, как прямая и ретроградная
волан «расщепляются» от импульса к импульсу. Именно это рас* щепление является главной причиной выпадения импульса: каждый следующий потенциал действия застает область перед расширением во все более глубокой рефрактерности. Выпадающие импульсы вообще не доходят до границы.
Аналогичное расщепление наблюдали Кумбс с соавт. [421 при антидромном проведении ^парных импульсов в тело клетки.
На рис. 4.15 видны такие двухпиковые потенциалы действия в начальном сегменте. В тех случаях, когда возбуждение не проходит в тело клетки, потенциал действия в начальном сегменте имеет только один пик.
Ретроградные^ волны не столь отчетливо видны в случае функциональных неоднородностей, но и тут они играют важную роль в трансформации ритма. На рис. 4.16 показан случай, когда серия импульсов (межстимульные интервалы 3 мс) идет через умеренно охлажденный (от 20 до 16° С) участок волокна. Видно, что три импульса прошли через этот участок, а четвертый угас. Проследим
Рис. 4.16. Трансформация ритма в «охлажденном» участке теоретического аксона (затушевано). Участок волокна, начиная с Х=2.025 до 2.525 см охлажден с 20 до 16° G ((>10 для констант скоростей аир равно 3). Межстимульные
,мс интервалы — 3 мс [35].
изменения третьего импульса вдоль его пути следования. При вступлении в охлажденный участок он начал падать, затем в точке Х=2.3 см его форма начала специфически меняться, появился второй пик на^сглаженной вершине. Вблизи^задней границы импульс вообще похож на импульс в теплой зоне. Все эти изменения вызваны ретроградной волной, исходящей из нормальной зоны. Следует указать на результат специального моделирования, где было обнаружено, что третий импульс угас бы, если бы охлажденная зона была длинной. В данном же случае импульс все-таки «добрался» до задней границы, но при этом возникла ретроградная волна, которая сделала невозможным прохождение четвертого импульса. Если бы ретроградной волны не было, то четвертый импульс был бы «лучше» третьего, как показал расчет с длинной охлажденной областью.
Явления Трайсформации ритма и блокирования высокочастотной серии импульсов в охлажденной области можно наблюдать не только при искусственно высокой частоте стимуляции, но также и при естественном раздражении соответствующих рецепторов, В этом отношении очень демонстративны эксперименты на афферентных волокнах кошки [48]. Участок волокна длиной 12_мм охлаждался термодом. Было обнаружено, что при температуре 10° С блокируется высокочастотный разряд и не блокируется низкочастотная серия.
* * *
Описанные теоретические и экспериментальные результаты исследования процесса проведения импульсов по нервным волокнам четко показывают, что пересечение импульсом границы неоднородности имеет свои особенности, которые трудно предсказать, даже зная особенности проведения по однородным волокнам. Точно так же проведение серии импульсов имеет свои особенности, которые трудно предсказать, даже если известны механизмы проведения одиночных импульсов. В этом разделе описаны только основные принципы: возникновение ретроградной волны и ее участие в трансформации ритма, механизмы стабилизации потенциала действия, зависимость скорости проведения от характеристик биологического кабеля, приспособительные изменения геометрии в области терминали и т. д. Детали же должны выясняться в каждом конкретном случае. Большую помощь в этом могут оказать математические модели. Количественное описание свойств мембраны, предложенное Ходжкиным и Хаксли, внесло значительный вклад в решение этой проблемы. Предложенная авторами вначале для проверки гипотезы о механизме генерации потенциала действия модель сама оказалась впоследствии объектом экспериментирования. Следует отметить, что эта модель имеет определенные недостатки, поскольку она не включает в себя многие известные теперь медленные процессы. Улучшенные модели, возможно, внесут^некоторые коррекции в наши представления (особенно в случае распространения серий импульсов), но основные принципы, как кажется, останутся неизменными.
ЛИТЕРАТУРА
1. Аршавский Ю, И., Беркинблит М. Б., Ковалев С. А. Периодическая трансформация ритма в одиночных нервных волокнах. — Биофизика, 1962, 7, с. 449—459.
2. Аршавский Ю. И., Беркинблит М. Б., Ковалев С. А. Место возникновения трансформации ритма в нервном волокне с искусственно созданной неоднородностью. — Биофизика, 1962, 7, с. 619—623.
3. Аршавский Ю. И., Беркинблит М. Б., Ковалев С. А., Смолянинов В. В., Чайлахян Л, М. Анализ функциональных свойств дендритов в связи с их структурой. — В кн.: Модели структурно-функциональной организации некоторых биологических систем. М., 1966, с. 28—111.
Общая физиология нервной системы
177
4. Аршавский IO. И., Беркинблит М. Б., Ходоров Б. И. Функциональные свойства нервной клетки и ее частей, — В кн.: Общая и частная физиология нервной системы, В сер, «Руководство по физиологии». Л., 1969,
5. Беркинблит М. Б. Периодическое блокирование импульсов в возбудимых тканях, — В кн,: Модели структурно-функциональной организации некоторых биологических систем. М., 1966, с. 131—158.
6. Беркинблит М. Б. Распространение импульсов в одномерной возбудимой среде, Автореф. канд. дис. Пущино, 1968.
7. Беркинблит М. Б., Введенская Н. Д., Гнеденко Л. С., Ковалев С. А., Холопов А. В., Фомин С. В., Чайлахян Л. М. Исследование на ЭВМ особенностей проведения нервного импульса вдоль волокон с разными степенями расширения. — Биофизика, 1970, 15, с. 1081—1089.
8. Беркинблит М. Б., Введенская II. Д., Гнеденко Л. С., Ковалев С. А., Холопов А. В., Фомин С. В., Чайлахян Л. М. Взаимодействие нервных импульсов в узле ветвления. Исследование на модели Ходжкина— Хаксли. — Биофизика, 1971, 16, с. 103—110.
9. Беркинблит М. Б., Ковалев С. А., Смолянинов В, В., Чайлахян Л. М. Входное сопротивление синцитиальных структур. — Биофизика, 1965, 10, с. 309-316.
10. Введенский Н. Е. О функциональном ритме нерва. — Труды СПб. об-ва естествоисп., 1899, 30, с. 76—78.
И. Введенский Я. Е. Возбуждение, торможение, наркоз. — Собр. соч. IV, первый полутом. Л., 1935.
12. Гельфанд И. М., Цетлик М. Л. О континуальных моделях управляющих систем. — ДАН СССР, 1960, 131, с. 1242—1245.
13. Компанеец А. С., Гурович, В. Ц. Распространение импульса по нервному волокну. — Биофизика, 1966, И, с. 913—916.
14. Коетюк П. Г. Внутриклеточные измерения потенциалов мышечных воло_ кон. Внутриклеточная стимуляция. — Биофизика, 1958, 3, с. 274—285.
15. Лев А. А. Современные физиологические исследования спинальных ганглиев. — В кн.: Современные проблемы электрофизиологических исследований нервной системы. М., 1964, с. 211—249.
16. Маркин В. С., Пастушенко В. Ф. Распространение возбуждения в одной модели нервного волокна. 1. Малое расширение волокна. — Биофизика, 1969, 14, с. 316-323.
17. Маркин В. С., Пастушенко В. Ф., Чизмаджев Ю, А. Электрохимические механизмы распространения возбуждения в нервных волокнах и их моделях. — Итоги науки. Сер. электрохим. М., 1971, 6, с. 165—238.
18. Маркин В. С., Чизмаджев Ю. А. О распространении возбуждения в одной модели нервного волокна. — Биофизика, 1967, 12, с, 900—907.
19. Пастушенко В. Ф., Маркин В. С. Распространение возбуждения в одной модели неоднородного волокна. II. Затухание импульса на неоднородности. — Биофизика, 1969, 14, с. 626—631.
20. Пастушенко В. Ф., Маркин В. С., Чизмаджев Ю. А. Распространение возбуждения в одной модели неоднородного волокна. III. Распространение импульсов в области узла ветвления нервного волокна. — Биофизика, 1969, 14, с. 883—891.
21. Пастушенко В. Ф., Маркин В. С., Чизмаджев Ю. А. Распространение возбуждения в одной модели неоднородного волокна. IV. Узел ветвления как сумматор нервных импульсов. — Биофизика, 1969, 14, с, 1072—1080.
22. Пастушенко В. Ф., Чизмаджев Ю. А., Маркин В. С. О скорости распространения возбуждения в редуцированной модели Ходжкина—Хаксли. II. Медленная релаксация натриевого тока. — Биофизика, 1975, 20, с. 880—886.
23. Ревенко С. В., Тимин Е. Н., Ходоров Б. И. Особенности проведения нервных импульсов из миелинизированной части аксона в безмякотную терминаль. — Биофизика, 1973, 18, с. 1074—1078.
24. Смолянинов В. В. Электрические свойства синцитиев. — В кн.: Модели структурно-функциональной организации некоторых биологических систем. М„ 1966, с. 112—130.
25. Смолянинов В. В. Анализ последовательности циклов Вепкебаха. — Биофизика, 1966, И, с. 337—334.
26, Тасаки И. Проведение нервного импульса. М., 1957.
27. Тимин Е. И., Ходоров Б. И. Анализ механизмов проведения нервных импульсов в стадию относительной рефрактерности на математической модели гигантского аксона кальмара. — Нейрофизиология, 1971, 3, с. 434-441.
28. Ухтомский А. А. Некоторые сближения и перспективы в учении о физиологическом возбуждении. — Собр. соя. 2. Л. 1951, с. 155.
29. Ходоров В. И. Проблема возбудимости. Л., «Медицина», 1969.
30. Ходоров Б. И. Общая физиология возбудимых мембран. В сер. «Руководство по физиологии». М., 1975.
31. Ходоров Б. И., Тимин Е. Н, Теоретический анализ распространения нервного импульса по миелинизированному волокну с измененными функциональными свойствами нескольких перехватов Ранвье. — Нейрофизиология, 1971, 3, с. 316—324.
32. Ходоров В. И., Тимин Е. Н., Виленкин С. Я., Гулько Ф. Б, Теоретический анализ механизмов распространения нервного импульса по неоднородному аксону. 1. Проведение через участок с увеличенным диаметром. — Биофизика, 1969, 14, с. 304—315.
33. Ходоров Б. И., Тимин Е. И., Грилихес Р. И. Анализ механизмов проведения нервных импульсов во время относительной рефрактерности на математической модели миелинизированного нервного волокна. — Нейрофизиология, 1972, 4, с. 201—207.
34. Ходоров Б. И,, Тимин Е. И., Позин Н. В., Шмелев Л. А. Теоретический анализ механизмов проведения нервных импульсов по неоднородному аксону. IV. Проведение серий импульсов через участок волокна с увеличенным диаметром. — Биофизика, 1971, 16, с. 95—102.
35. (Ходоров Б. И., Тимин Е. Я.) Khodorov В. I., Timin Е. N. Nerve impulse propagation along nonuniform fibres. (Investigations using mathematical models). — Progr. Biophys. Molec. Biol., 1975, 30, p. 145—184.
36. Braun M., Schmidt R. F. Potential changes recorded from the frog motor nerve terminal during its activation. — Pflug. Arch., 1966, 287, p. 56—80.
37. Buchtal F., Engback L. Refractory period and conduction velocity of the striated muscle fibre. — Acta physiol, scand., 1963, 59, p. 199—220.
38. Castillo J, del, Moore J. W. On increasing the velocity of nerve impulse. — J. Physiol., 1959, 148, p. 665—670.
39. Cole K. S. Membranes, ions and impulses. Berkeley—Los Angeles, 1968.
40. Collemijn H., van Harreveld A. Intracellular recording from cat spinal moto-neurones during acute asphyxia, — J, Physiol. (London), 1966, 185, p. 1—14.
41. Cooley J. W., Dodge F. A. Digital computer solution for excitation and propagation of nerve impulse. — Biophys. J,, 1966, 6, p. 583—599.
42. Coombs J. S., Curtis D. R., Eccles J. C. The interpretation of spike potentials of motoneurones. — J. Physiol. (London), 1957, 139, p. 198—231.
43. Coombs J. S., Curtis D. R., Eccles J. C. The generation of impulses in motoneurones. — J. Physiol. (London), 1957, 139, p. 232—249.
44. Dun F. T. The delay and blockage of sensory impluses in the dorsal root ganglion. — J. Physiol. (London), 1955, 127, p. 252—264.
45. Fatt P. Electric potentials occuring around neuron during its antidromic activation. — J. Neurophysiol., 1957, 20, p, 27—60.
46, Forbes A., Ray L. И., Griffith F. R. The nature of the delay in the response to the second of the two stimuli in nerve and in the nerve-muscle preparation. — Amer, J. Physiol., 1923, 66, p. 553—617.
47, Fox J. M. Veranderungen der spezifischen lonenleitfahigkeiten der Nerven-дасшЬгац durch ultraviolets Strahlupg. Homburg—Saarbriicken. 1972.
48. Franz D. N., 1ggo A. Conduction failure in myelinated and nonmyelinated axon at low temperature. — J. Physiol. (London), 1968, 199, p. 319—345.
49. Fuortes M. G. F., Frank K., Becker M. C. Steps in the propagation of motoneuron spikes. — J. Gen. Physiol., 1957, 40, p. 735—752.
50. Gasser H. S., Grundfest H. Axon diameter in relation to the spike demensions and conduction velocity in mammalian A fibres. — Amer. J. Physiol., 1939, 127, p. 393—418.
51. Gotch F. The delay in electrical response of nerve to a second stimulus, — J. Physiol. (London), 1910, 40, p. 250-274.
52. Grossman У., Spira M. E., Parnas I. Differential flow of information into branches of single axon. — Brain Res., 1973, 64, p. 379—386.
53. Hermann L. Beitrage zur Physiologic und Physik des Nerven. — Pfliig. Arch., 1905, 109, p. 95—144.
54. Hodgkin A. L. Evidence for electrical transmission in nerve. — J. Physiol. (London), 1937, 90, p. 183-232.
55. Hodgkin A. L. The relation between conduction velocity and electrical resistance outside a nerve fibre. — J. Physiol. (London), 1939, 94, p. 560— 586.
56. Hodgkin A. The conduction of the nervous impulse. Liverpool, 1964. (Русск. перев.: Ходжкин А. Нервный импульс. М., 1965).
57. Hodgkin A. L., Rushton W. A. R. The electrical constants of crustacean nerve fibre, — Proc. Roy. Soc. Ser. B, 1946, 133, p. 444—479.
58. Hunter P. J., McNaughton P. A., Noble D. Analytical models of propagation in excitable cells. — Progr, Biophys. Molec. Biol., 1975, 30, p. 99—144.
59. Hursh J. B. Conduction velocity and diameter of nerve fibres. — Amer. J. Physiol., 1939, 127, p. 131—139.
60. Huxley A. F. Ion movement during nerve activity. — Ann. New York Acad. Sci., 1959, 81, p. 221—257.
61. Katz B. The effect of electrolyte deficiency on the rate of conduction in a single nerve fibre. — J. Physiol. (London), 1947, 106, p. 411—417.
62. Katz B. Action potentials from sensory nerve ending. — J. Physiol. (London), 1950, 111, p. 248-260.
63. Katz B., Miledi R, The effect of temperature on the synaptic delay at the neuromuscular junction. — J. Physiol. (London), 1965, 181, p. 656—670.
64. Lillie R, S. The conditions determining the rate of conduction in irritable tissues and especially in nerve. — Amer. J. Physiol., 1914, 34, p. 414—443.
65. Lucas K. On the refractory period of the muscle and nerve. — J. Physiol. (London), 1909, 39, p. 331—340.
66. Lucas K. On the refractory of the muscle and nerve after passage of propagated disturbance. — J. Physiol. (London), 1910, 41, p. 368—408.
67. OffnerF., Weinberg A., YongG. Nerve conduction theory: Some mathematical consequences of Bernstein Model. — Bull. Mathem. Biophys., 1940, 2, p. 89—103.
68. Rail W. Theory of physiological properties of dendrits. — Ann. New York Acad. Sci., 1962, 96, p. 1071-1092.
69; Rosenblueth A. Functional refractory period of cardiac tissues. — Amer J. Physiol., 1958, 194, p. 171-183.
70. Rosenblueth A. Mechanism of Wenckebach—Luciani cycles. — Amer. J Physiol., 1958, 194, p. 491—495.
71. Rushton W. A. R. Initiation of propagated disturbance. — Proc. Rov. Soc Ser. B, 1937, 124, p. 201-243.
72. Stdmpfli .R. Ban und Funktion isolierter markhaltiger Nervenfassern. — Erg. Physiol. Biochem., 1952, 47, p. 70—128.
73. Tasaki I. Initiation and abolition of the action potential of single node of Ranvier. — J. Gen. Physiol., 1956, 39, p. 377—395.
74. Tasakt I., Ishii I., Ito I. On the relation between the conduction rate, the fibre diameter and the internodal distance of the medullated nerve fiber — Jap. J. Med-Sci. pt Щ. Biophys., 1943, 9, p. 189—199,
75. Таис L., Hughes G. M. Modes of initiation and propagation of spikes in the branching axon of molluscan central neuron. — J. Gen. Physiol., 1963, 46, p. 533-549.
76. Weakly J. N. Effect of barbiturates on «quantal» synaptic transmission in spinal motoneurones. — J. Physiol. (London), 1969, 204, p. 63—77.
77. Wenckebach K. Zur Analyse des unregelmassigen Pulses. — Z. klin. Med., 1899, 36, S. 37—74.
78. Wenckebach K. Die Arhythmie als Ausdruck bestimmter Funktionsstorrungen des Herzen. Leipzig, 1903.
79. Werigo B. F, Zur Frage fiber die Beziehung zwischen Erregbarkeit und Leitungsfahigkeit des Nerven. — Pfliig. Arch., 1899, 76, p. 552—576.
80. Zenker W. Internodien und Fasserkaliber der Terminalen verlaufsstrecke motorischen Fassern der ausseren M. Thyreoarytaenoidens des Rhesusaf-fen. — Z. Zellforsch., 1964, 62, S. 531-545.
U Л й в d 5
АКТИВНЫЙ ТРАНСПОРТ ИОНОВ В НЕРВНОЙ КЛЕТКЕ
5.1. РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ ОБ АКТИВНОМ ТРАНСПОРТЕ ИОНОВ
Неравномерное распределение неорганических ионов между цитоплазмой клетки и внеклеточной средой является постоянной особенностью живого состояния. Электрохимические градиенты, создаваемые на поверхностной мембране этим неравномерным распределением, служат, как это показано в других главах настоящего руководства, в качестве движущей силы для выработки трансмембранных ионных токов — основы всех активных клеточных ответов.
Рядом прямых измерений показано, что основные неорганические ионы внутри клетки находятся в свободном состоянии [12, 16 и др.]; поэтому их накопление или удаление не может быть обусловлено селективным связыванием внутриклеточными структурами. Следовательно, любая живая клетка, в том числе и нервная, должна обладать собственным источником энергии, противодействующим тенденции ионных градиентов к тепловому выравниванию. Идея о возможности переноса ионов через мембрану клетки против существующих электрохимических градиентов (так называемого активного переноса) за счет энергии метаболизма была впервые высказана Дином [34]. Экспериментальное подтверждение существования активного переноса ионов через мембрану нервного волокна, сопряженного с гидролизом макроэргических фосфорных соединений, было представлено Ходжкиным и Кейнсом [44]. Ими было показано, что удаление ионов калия из наружной среды, омывающей волокно, вызывает заметное уменьшение входящего потока этих ионов, сопровождающееся одновременным уменьшением выходящего из волокна потока ионов натрия. Оба потоки одинаково подавлялись низкими температурами и дей
ствием динитрофенола и цианидов — веществ, препятствующих формированию АТФ в ходе окислительного фосфорилирования. Дополнительное подтверждение этой идеи было дано Колдвеллом и сотр. [25]. Они сумели восстановить активный транспорт ионов через мембрану нервного волокна, отравленного цианидом, при помощи инъекции в него АТФ (рис. 5.1).
Иной механизм связи между транспортом ионов и метаболизмом был постулирован Конвеем [31]. Он предположил, что выталкива-
Рис. 5.1. Влияние внутриклеточной инъекции АТФ на выход меченого натрия из отравленного цианидом гигантского аксона кальмара Loilgo.
По оси ибецисс — время в ч; по оси ординат — доля S8Na, потерянного аксоном за 1 мин. Горизонтальная линия сверху — время действия цианида. Первая инъекция АТФ (стрелки) составляла 5.9 мМ, вторая — 3i мМ (внутриклеточная концентрация АТФ —
6.2 нМ) [25].
ние ионов из клетки всегда связано с'переносом'электронов в дыхательных энзиматических цепях и не зависит от^наличия в клетке макроэргических фосфорных соединений. Однако эт1цпредположе-ния не были подкреплены экспериментальными доказательствами. К тому же они оказались в противоречии с данными о количестве ионов натрия, транспортируемых в обмен на одну молекулу потребляемого кислорода.
Существование энзиматического механизма,^который^может использовать энергию, запасенную в виде^макроэргических фосфорных соединений в присутствии ионовТнатрия и калия, было впервые показано Скоу[83], когда он открыл в мембранных фрагментах натрий-калийактивируемую аденозинтрифосфатазу (Na-, К-АТФазу). Правда, факт активации Na-, К-АТФазы одновалентными катионами сам по себе еще не доказывал участия этого фермента в активном переносе ионов через клеточные мембраны, однако дальнейшее его изучение с несомненностью подтвердило такое предположение.
В первую очередь важно было показать, что Na-, К-АТФаза специфически связана с плазматическими мембранами, так как только в этом случае она может осуществлять транспортную функцию. Действительно, в гигантских аксонах Na, К-АТФаза локализуется преимущественно в аксолемме, и лишь небольшая ее активность определяется в аксоплазме 184]. Локализация этого фермента именно в мембранных фракциях мозга подтверждена многочисленными исследованиями. Правда, в ряде случаев Na-, К-ак-тивируемую фосфатазу находили в незначительных количествах и в других субклеточных фракциях, например в эндоплазматическом ретикулуме. Это может быть результатом недостатка методик фракционирования, поскольку фрагменты клеточных мембран при центрифугировании могут в какой-то мере осаждаться вместе с другими клеточными структурами. Вместе с тем не исключена возможность, что и внутри клетки могут быть образования, имеющие собственную систему ионного транспорта.
Весьма существенным обстоятельством для доказательства связи Na-, К-АТФазы с ионным транспортом явилось обнаружение строгой ориентированности активных групп этого фермента в мембране. Было показано, что он расщепляет АТФ только на внутренней стороне мембраны и образующийся в результате ее гидролиза ортофосфат остается в цитоплазме 198]. Активность фермента увеличивается в присутствии ионов калия во внешней Среде. Ионы же натрия, не оказывают активирующего действия снаружи, но обладают таким действием с внутренней стороны мембраны [37 ].
Такая же асимметрия, как указывалось выше, характерна и для ионного насоса. Другие одновалентные катионы, способные замещать ионы калия в транспортном процессе (например, рубидий), также активируют АТФазную реакцию^ только с наружной стороны мембраны.
Во всех случаях между активностью Na-, К-АТФазы ~и выраженностью активного транспорта ионов в данной ткани обнаруживается параллелизм. G другой стороны, факторы, подавляющие активность этой ферментной системы, всегда параллельно подавляют и активный ионный транспорт. Наиболее наглядно это выступает в действии сердечных гликозидов (уобаина), которые, тормозя активный ионный транспорт, всегда тормозят и активируемую ионами калия и натрия часть АТФ-азной реакции. Оба эти процесса развиваются во времени строго параллельно. Сравнительное изучение действия различных глюкозидов показало, что эффективность торможения ими^ ферментативной реакции и способность угнетать перенос ионов убывают в одном и том же порядке (см. обзор [60]). Общим свойством ионного насоса и фермента является также асимметричность взаимодействия с сердечными глюкозидами: тот и другой блокируются ими только с наружной стороны мембраны [98] и одинаково защищаются от инактивации повышением содержания ионов калия во внешней среде.
Все перечисленные выше обстоятельства достаточны для признания тождества между мембранным транспортным механизмом и мембранной Na-, К-АТФазой. Такое отождествление является в настоящее время основой изучения всех сторон активного мембранного транспорта и не встречает каких-либо экспериментальных трудностей. Конечно, строгим доказательством правомерности такого отождествления было бы выделение из мембранных структур полностью очищенной ферментной системы и включение ее затем в искусственную фосфолипидную мембрану так, чтобы она при наличии АТФ могла воссоздать в последней противоградиент-ный транспорт ионов.
5.2. МЕХАНИЗМ ПЕРЕНОСА ИОНОВ В МЕМБРАНЕ
5.2.1. СВОЙСТВА НАТРИЙ-КАЛИЙАКТИВИРУЕМОЙ АДЕНОЗИНТРИФОСФАТАЗЫ
Внутренний механизм, при помощи которого ионы натрия 'и калия переносятся через мембрану нервных и других клеток, остается пока неизвестным, несмотря на обширную литературу о биохимических свойствах Na-, К-активируемой АТФазы. Эти свойства являются общими для всех исследованных биологических мембран, и поэтому в подробном их изложении в руководстве по нейрофизиологии нет необходимости. Подробные обзоры по биохимии Na, К-АТФазы опубликованы в последние годы рядом авторов [33, 38, 85, 99].
Был проведен ряд попыток определить молекулярный" вес Na-К-АТФазной системы; вначале они проводились на частично очищенных препаратах, в которых сам фермент занимал лишь некоторую часть исследуемого материала. Для примерной оценки его молекулярного веса использовался метод радиационной инактивации, который дал величины порядка 190 000—300 000. Молекулярный вес Na-, К-активируемой АТФазы, выделенной из мозга в растворимом состоянии, оказался равным 660 000—690 000 [66]. Анализ показал, что в препарате содержалось около 40% детергента, использовавшегося для растворения мембраны; при исключении этого компонента молекулярный вес собственно Na-, К-АТФазы должен быть равен 270 000 [48 ]. Несколько большие величины получены при исследовании экстрактов Na-, К-АТФазы мозга .центрифугированием в градиенте плотности [69].
Наиболее чистый препарат Na-, К-АТФазы был выделен в лаборатории Накао [74]; при хроматографии на колонке сефарозы он образовал один пик с молекулярным весом 480 000. Из этой фракции при помощи электрофореза на полиакриламидном геле была выделена полипептидная подфракция с молекулярным весом 100 000, которая, вероятно, и является каталитической единицей " фермента. "’Рядом ’последующих исследований была выделена и другая полипептидная фракция с молекулярным весом
около 50 000, которая вместе с первой фракцией образует, по-видимому, белковую субъединицу [17 J. Есть данные о том, что две субъединицы, объединяясь вместе, и образуют натриевый насосный механизм. При этом все каталитические функции выполняет большой полипептид, и именно здесь локализован субстратный центр фермента, а также центр, связывающийся с оубаином. Полипептид с молекулярным весом около 50 000, по-видимому, определяет ионную селективность Na-, К-АТФазы, и в нем находятся структуры, связывающие ионы натрия и калия. Шамоо и сотр. [22, 82] удалось выделить из препаратов Na-, К-АТФазы Na-селектив-ный ионофор; при введении его в искусственную мембрану он вызывал повышение ионной проводимости последней. Однако пока нет каких-либо данных о возможных конформационных изменениях в такой субъединице, которые превращали бы ее из натрий-связывающей в калийсвязывающую форму.
Уже в первых работах по изучению механизма действия Na-, К-АТФазы было выдвинуто предположение, что этот механизм включает образование макроэргического промежуточного продукта [84]. Затем почти одновременно во многих лабораториях было показано, что мембранные препараты Na-, К-АТФазы в определенных условиях включают метку 32Р из меченой АТФ. Это включение происходит только в присутствии ионов магния; оно значительно увеличивается при наличии в среде ионов натрия, причем ни один другой щелочной металл не может заменить натрий в этом процессе. Активирующее действие ионов натрия снимается при введении в среду ионов калия. Исходя из этих данных, принято считать, что расщепление АТФ при действии Na-, К-АТФ-азы осуществляется по крайней мере в два этапа. На первом фосфокиназном этапе, активируемом ионами натрия, фосфат АТФ переносится на акцептор в структуре фермента с образованием промежуточного фосфорилированного продукта. На втором фосфатазном этапе в присутствии ионов калия этот продукт дефосфорилируется с освобождением ортофосфата.
Однако проведение аналогий между этими этапами действия Na-, К-АТФазы и непосредственным переносом ионов натрия и калия через мембрану затруднительно, так как до сих пор остается нерешенным вопрос о локализации соответствующих участков ферментативного процесса в мембране. По одним данным, К-фосфатаз-ная реакция протекает только на внутренней поверхности мембраны, по другим — фосфатаза ориентирована наружу. Затруднительным является и определение того, какой из этих участков блокируется сердечными глюкозидами. Возможно, что существует особая конформационная форма фосфорилированного промежуточного продукта (Е—Р), которая обладает большим сродством к гликозидам. В условиях, активирующих фосфорилирование, концентрация этой формы поддерживается на высоком уровне и вероятность связывания гликозида повышается. При добавлении ионов калия количество ее снижается, и эффективность действия
гликозида падает; это явление лежит в основе упомянутого выше защитного действия ионов калия при отравлении убаином.
Эти представления используются для построения модельных схем транспортного механизма; при этом два промежуточных производных также могут рассматриваться как две формы носителя, селективные к ионам натрия и калия. В частности,
Внутр.
У)
Му АТФ +
Na +
Мг3- Е ~Р — — /Vcc3 •
NayE Му2*
Наружи.
-^ЗВа+
+
+ 2К
Рн-----
2К+^~Хг-Е-Р ^^КуЕ-Р
Рис. 5.2. Схема предполагаемого механизма переноса ионов натрия и калия Na-, К-активируемой АТФазой. Работа насоса начинается с присоединения Na к натринселективяому центру фермента Е, расположенному на внутренней поверхности мембраны. Этот процесс фиксирует носитель на внутренней стороне мембраны и запускает фосфокиназную стадию реакции с АТФ. Образование формы Nas. Е—Р способствует переходу носителя на наружную сторону мембраны и освобождению там Na. Затем форма Е—Р в присутствии Mg преобразуется в форму Е—Р, приобретая при этом сродство к К. Присоединение к ней К стимулирует переход носителя снова на внутреннюю сторону мембраны, где К освобождается. При этом форма Е—Р дефосфорили-руется [13].
Лишко [13] предлагает следующую схему. Работа натриевого, насоса инициируется присоединением Na+ к Na-селективным центрам, расположенным на внутренней поверхности мембраны;: с одним центром у различных объектов может связываться два или три иона натрия. Заполнение Na-селективных центров фиксирует носитель на внутренней поверхности мембраны и инициирует фосфокиназную стадию реакции. Образование в результате этой стадии формы Na—Е~Р способствует переходу носителя на наружную сторону мембраны, где связанный натрий высвобождается во внешний раствор. На следующем этапе форма Е~Р преобразуется в Е=Р, что сопровождается конформационными измене
ниями в структуре носителя. В результате конформационного перехода система приобретает сродство к калию. Присоединение стимулирует переход носителя с наружной стороны мембраны на внутреннюю; именно этот переход подвержен действию сердечных глюкозидов, которые как бы «замораживают» систему в конформации Е=Р. После нагрузки калием носитель перемещается вновь на внутреннюю сторону мембраны и высвобождает калий в цитоплазму. Одновременно фосфоформа Е=Р дефосфорили-руется с высвобождением ортофосфата в клетку. На этом цикл работы насоса завершается (рис. 5,2).
Так как все стадии транспортного процесса в физиологических условиях являются обратимыми, то должна существовать принципиальная возможность реверсии работы насоса. В физиологических условиях снижение внутренней энергии системы в результате одного ферментативного цикла составляет около 4000 кал; поэтому в этих условиях процесс всегда идет в сторону гидролиза АТФ и переноса ионов. Однако если резко увеличить концентрационные градиенты переносимых ионов, то в термодинамическом отношении станет выгодной работа насоса в обратном направлении — синтеза АТФ. Действительно, получены данные о том, что в условиях высоких электрохимических градиентов насосный механизм транспортирует ионы натрия в клетку и ионы калия — из клетки, синтезируя при этом АТФ (28, 35].
Одним из недостатков описанной выше модели является то, что в ней перенос ионов натрия и калия рассматривается как последовательный, ступенчатый процесс. Между тем существует ряд данных в пользу того, что эти ионы должны транспортироваться одновременно. Для преодоления этой трудности можно рассматривать наличие в ферментной системе двух субъединиц, работающих поочередно.
5.2.2. СОПРЯЖЕНИЕ ПОТОКОВ КАЛИЯ
И НАТРИЯ В МЕМБРАНЕ
Сделан ряд попыток прямо измерить потоки ионов натрия и калия в нервных волокнах и нервных клетках, создаваемых насосным механизмом, и таким образом получить непосредственные данные о сопряжении этих потоков в мембране. На гигантском аксоне такое измерение с помощью изотопной методики было проведено Муллинсом и Бриндли [71]; однако высокая ионная проводимость мембраны аксона в покое очень затрудняла работу. По полученным данным, коэффициент сопряжения при низкой внутриаксонной концентрации натрия был 1 : 1, но он увеличивался’ при нормальной концентрации этих ионов до 3 : 2 и даже до 3 : 1 при высокой их концентрации. На нервных клетках попытка провести аналогичные измерения была сделана Куком и сотр. [32 J; эти авторы вводили 21Na в нейрон Aplysia при помощи микроионофореза из внутриклеточного микроэлектрода и изме-188
ряли Затем выходящий их поток, Точность измерений также оказалась очень низкой; по полученным данным, перенос двух ионов натрия из клетки уравновешивался переносом внутрь нее одного иона калия.
Проведены расчеты возможной плотности расположения транспортирующих центров в нервной мембране. Ритчи и Штрауб [81 ] измерили константу диссоциации меченного по углероду оубаина, связавшегося с мембраной немиелинизированных нервных волокон; она оказалась равной 0.5 мкМ. Максимальная насыщающая емкость связывания в том же случае составляла 22.3 пкМ/мг сухого веса. Если считать, что одна молекула оубаина связывается с каждым транспортирующим центром и подавляет его, то эта величина соответствует плотности таких центров в исследуемой ткани. Отношение влажного веса к сухому в исследованных препаратах составляло 5.67, а площадь содержащихся в них мембран — 65 000 см2 на грамм влажного веса. Следовательно, на каждый квадратный микрон должно приходится около 350 транспортирующих центров.
5.2.3. НАТРИЙ-НАТРИЕВЫЙ И КАЛИЙ-КАЛИЕВЫЙ § ОБМЕН
Все измерения потоков меченых ионов натрия и калия показывают, что эти ионы могут не только сопряженно транспортироваться через мембрану, но и обмениваться друг с другом (натрий-натриевый и калий-калиевый обмен). Этот обмен не требует затраты энергии метаболизма, однако он происходит только в присутствии АТФ, которая, по-видимому, катализирует этот процесс. Вероятно, АТФ-зависимый натрий-натриевый и калийкалиевый обмен отражает наличие ионофорных свойств у субъединиц Na-, К-АТФазы; естественно, что, не потребляя энергии, этот обмен не может приводить и к созданию ионных градиентов; его можно рассматривать лишь как вариант облегченной диффузии ионов через мембрану.
В исследованиях Де Вира [96 ] было обнаружено, что одним из факторов, стимулирующих появление АТФ-зависимого натрийнатриевого обмена в нервной ткани, является повышение содержания в клетке АДФ. Проведенные Де Виром измерения потоков 23 Na на гигантских аксонах показали, что инъекция внутрь аксона АДФ вызывает выход этих ионов из волокна; этот выход хотя и подавляется оубаином, однако, в отличие от обычного активного транспорта, не зависит от присутствия во внеклеточной среде ионов калия. Это явление вызвало большой интерес, потому что оно могло быть расценено как указание на возможность таких конформационных изменений в Na-, К-АТФазе при изменении уровня АТФ /АДФ в клетке, при которых ее калий связывающий центр утрачивает избирательность к ионам калия и приобретает сродство к ионам натрия; натрий-калиевый насос превра
щался бы при этом и чисто Натриевый насос. Специальные исследования этого вопроса, проведенные Рожмановой и соавт. [15], показали, однако, что увеличение уровня АДФ не сопровождается потерей Na-, К-АТФазой ее избирательности к ионам калия; в этих условиях для нормальной работы насоса ионы калия так же необходимы, как и в среде без АДФ. Причиной своеобразного действия АДФ является в основном сдвиг влево фосфокиназной реакции, являющейся существенным этапом в механизме действия Na-, К-АТФазы. В связи с таким сдвигом должна существенно снижаться концентрация фосфорилированной формы фермента, необходимой для осуществления калиевого полуцикла транспортного процесса. Натрийселективные центры смогут осуществлять лишь челночные перемещения между внутренней и внешней сторонами мембраны, производя натрий-натриевый обмен, но не участвуя л истинном активном транспорте ионов натрия и калия.
5.3. ЭЛЕКТРОГЕННЫЙ ЭФФЕКТ АКТИВНОГО ТРАНСПОРТА
5.3.1. ВЫЯВЛЕНИЕ ЭЛЕКТРО ГЕННОГО ТРАНСПОРТНОГО ЭФФЕКТА
Очевидно, что возможны два вида функционирования механизма ащтдвного транспорта ионов. Этот механизм может обменивать внутриклеточные ионы на внеклеточные на электроней-тральной основе (заряд на заряд) без какого-либо действия на трансмембранную разность потенциалов. С другой стороны, сумма зарядов, перенесенных в одном направлении, может не компенсироваться суммой зарядов, перенесенных в противоположном на-лгравлении; в этом случае транспортный механизм будет обладать способностью разделять заряды и создавать постоянную разность потенциалов на мембране («электрогенный» активный транспорт). Возможность участия транспортного механизма в генерации мембранного потенциала нервной клетки была предположена даже раньше, чем было доказано само существование этого механизма. -Лундберг и Оскарссон [63 ] описали в нервных волокнах значительную гиперполяризацию после периода аноксии и объяснили ее ^увеличением выделения ионов натрия из таких волокон. Грунд-фест и сотр. [40] исследовали влияния инъекций различных солей в гигантский аксон. При этом они не обнаружили значительных изменений мембранного потенциала и заключили, что такой потенциал создается, в основном деятельностью электрогенного ионного насоса, а не диффузионными процессами. Однако упомянутые уже элегантные эксперименты Ходжкина и Кейнса на тех же аксонах показали, что метаболические ингибиторы не оказывают постоянного действия на мембранный потенциал. Этот факт был интерпретирован как доказательство наличия постоянного сопряжения переноса ионов внутрь клетки и наружу, не сопровождаю
щегося каким-либо нарушением электронейтральности [43]. Примерно в это же время Ритчи и Штрауб [80 ] изучили гиперполяризацию, возникающую в немиелинизированных нервных волокнах после прохождения по ним серии импульсов; они нашли, что такая гиперполяризация обратимо подавляется динитрофенолом и удалением ионов калия из наружной среды. Оба влияния, как уже указывалось, специфически блокируют активный транспорт ионов. Поэтому было бы естественно объяснить этот факт предположением, что ритмическая активность приводит к накоплению излишних количеств ионов натрия в волокне, которые затем выкачиваются из него электрогенным ионным насосом. Однако авторы были, вероятно, так увлечены идеей об электронейтральности работы ионного насоса, что объяснили эту гиперполяризацию как результат уменьшения концентрации ионов калия в непосредственной близости от наружной поверхности мембраны, вызванного усиленным транспортом этих ионов внутрь клетки, и соответствующего повышения калиевого равновесного потенциала.
Строгое подтверждение существования электрогенного активного транспорта было осуществлено Кернаном [52] на поперечнополосатых мышечных волокнах. Так как его методика затем нашла широкое применение, то ее-следует описать подробнее. Мышечные волокна предварительно нагружались натрием при помощи выдерживания их в бескалиевом растворе при низкой температуре. Такие условия, понятно, подавляют транспортный механизм. После возвращения в нормальную солевую среду волокна немедленно начинали откачивать избыточный натрий наружу. В это время мембранный потенциал становился приблизительно на 11 мВ более отрицательным, чем рассчитанное значение калиевого равновесного потенциала. Это превышение могло быть объяснено только несбалансированным (электрогенным) транспортом натрия и калия.
Благодаря применению описанной методики целому ряду авторов удалось убедительно продемонстрировать электрогенный характер активного транспорта также в сердечных и гладких мышечных волокнах (см., например, [91]).
Другим методом обнаружения электрогенного активного транспорта является регистрация тех изменений в трансмембранной разности потенциалов, которые возникают при действии сердечных глюкозидов, блокирующих активность Na-, К-АТФазы. Этот метод нашел широкое применение именно при изучении активного транспорта в нервной ткани как более простой. Однако необходимо иметь в виду, что точное определение вклада электрогенного ионного транспорта в мембранный потенциал таким способом может быть сопряжено со значительными неточностями. Во-первых, ингибиторы сами по себе могут изменить пассивную ионную проницаемость мембраны и, следовательно, изменить диффузионную разность потенциалов на ней. Такая возможность была обнаружена Гедульдигом [36], Костюком и сотр. [10], Акимовым [3] и др. Во-вторых, блокада транспортного механизма приводив .клетку
в нестационарное состояние, при котором происходит потеря ею калия и накопление в ней натрия, что сопровождается изменением концентрационных градиентов для соответствующих ионов и изменением диффузионных разностей потенциалов. Поэтому получаемые данные имеют, как правило, лишь качественный характер. Тем не менее они показывают, что активный ионный транспорт в нервных клетках и нервных волокнах носит электрогенный характер, хотя выраженность электрогенного эффекта в значительной мере зависит от типа субстрата и его функционального состояния.
5.3.2. ВЫРАЖЕННОСТЬ ЭЛЕКТРОГЕННОГО ЭФФЕКТА У РАЗЛИЧНЫХ ОБЪЕКТОВ
В наиболее исследованном объекте — гигантском аксоне кальмара — этот эффект, как уже указывалось выше, является крайне незначительным, и мембранный потенциал практически полностью определяется диффузионными процессами. Вследствие высокой пассивной проводимости мембраны разность потенциалов, которая может быть продуцируема за счет нескомпенси-рованпых активных потоков натрия и калия, может достигать всего 1 —2 мВ и поэтому очень трудно определяется экспериментально. Действительно, Де Вир и Гедульдиг [97] при действии строфантина на гигантский аксон смогли обнаружить деполяризацию, средняя величина которой составляла 1.4 мВ,
В противоположность этому в нервных клетках моллюсков электрогенный активный транспорт обнаруживается очень четко, и его вклад в общую трансмембранную разность потенциалов достигает значительной величины. Следует отметить, что такие нервные клетки являются особенно удобным объектом для изучения электрогенного активного транспорта ионов, и на них был проведен целый ряд очень обстоятельных исследований.
При действии оубаина на нервные клетки моллюсков возникает деполяризация их мембраны на 7—15 мВ [26, 29, 39, 65, 68 J, которая примерно указывает на величину вклада электрогенного транспорта в мембранный потенциал при пребывании клетки в состоянии покоя. Косвенное указание на степень этого вклада дает также измерение температурной зависимости мембранного потенциала клетки. Как показал Айрапетян [1], она значительно превышает таковую для чисто диффузионных процессов.
Нервные клетки моллюсков могут быть легко и быстро обогащены ионами натрия путем ионофоретической инъекции этих ионов в сочетании с каким-либо анионом через внутриклеточный микроэлектрод; при этом может быть прослежен тот электрогенный эффект, который возникнет в связи с вероятной активацией транспортного механизма избыточным содержанием натрия в клетке. Весьма удобным способом такой инъекции является пропускание тока, служащего для ионофореза, через два внутриклеточных электрода (см. схему на рис. 5.3). При этом ток замыкается
между кончиками микроэлектродов внутри клетки, не проходит через мембрану и не вызывает искажений, связанных с переносом ионов через нее. Так как микроэлектроды всегда заполняется концентрированными солевыми растворами для снижения iix сопротивления, то можно принять, что перенос тока через отверстия их кончиков происходит посредством движения ионов лйщь в одном направлении (из микроэлектрода в клетку). Это очень облегчает'расчет количества инъецированных в клетку ионов’по $ор-
4
Рис. 5.3. Схема методики микроионофоретического введения ионов натрия в форме натрий-ацетата в нервную клетку и одновременной фиксации напряжения на мембране.
1 — катодный повторитель; 2 — операционный усилитель для фиксации напряжения; 3 — операционный усилитель для измерения тока; 4 — стимулятор с изолирующим элементом на выходе; 5, 6 — самописцы. — микрореле, включающее цепь фиксации на-пряжепия; К2— микрорело, включающее цепь для иояофореза [101.
муле Фарадея. Указанное предположение подтверждается экспери-1 ментально посредством микрофотометрического определения; количества ионов, выходящих из микроэлектрода в окружающий раствор при достаточно длительном пропускании через него постоянного тока.
Как показано в исследованиях целого ряда авторов, ионофоре-тическое введение натрия в нервную клетку моллюска всегда', сопровождается ее гиперполяризацией, которая достигает макси-, мума (иногда до 20 мВ) к концу инъекции и затем медленно спадает.' Гиперполяризация подавляется действием оубаина и других мета-; болических ингибиторов и удалением калия из наружного раствора) и несомненно отражает активность электрогенного транспортного насоса [7, 8, 51, 70, 92]. ’
Обнаружение электрогенного активного транспорта в нервных : клетках центральной нервной системы высших животных связано *
Общая физиология нервной системы 193
со значительно большими трудностями, так как в этом случае инъекция, как правило, может производиться лишь через один микроэлектрод, и точное определение количества введенного натрия не представляется возможным. Трудно проверить также связь возникающих эффектов с активным транспортом, поскольку нельзя устранить калий из внеклеточной среды, резко охладить клетку и т. д. Тем не менее после инъекции натрия и в нейронах центральной нервной системы высших животных обнаруживается длительная гиперполяризация, аналогичная, вероятно, вызванной инъекцией натрия гиперполяризации в нейронах беспозвоночных [55].
В то же время электрогенный активный транспорт, по-видимому, не принимает заметного участия в поддержании потенциала покоя нейронов мозга высших животных. На мотонейронах спинного мозга кошки показано, что охлаждение сопровождается деполяризацией их мембраны, однако этот эффект вызван изменениями в соотношении калиевой и натриевой проводимости мембраны, а не выключением электрогенного транспортного механизма [53].
Формальное описание вклада электрогенного активного транспорта в генерацию мембранного потенциала может быть сделано, как это предложил Моретон [70], путем включения дополнительного члена в уравнение постоянного поля:
RT} ^к1к1о+рка1МаЫ-рс1]С1^ + л™д/£/?
Л — "У ln Рк [К], + PNa [Na],- + РС1 [Cl]0 + RTMJEF ’
где Рк, Т’на, Ра — соответственно проницаемости мембраны для ионов калия, натрия и хлора, [К]^ [Na],-, [С1]( — активности этих ионов внутри клетки, [К]о, [Na]„, [С1]о — их активности в окружающей среде; R, Т и F имеют обычные значения и Ма представляет чистый поток одновалентных ионов из клетки, вызываемый деятельностью насосного механизма.
Это уравнение исходит из предположения, что в стационарном состоянии в клетке сохраняются условия электронейтральности, и общий ионный ток через ее мембрану поэтому должен быть равен нулю.
Максимально возможный вклад электрогенного транспортного механизма в мембранный потенциал в стационарном состоянии может быть определен теоретически. Муллинс и Нода [72] сделали такой расчет, предположив, что в стационарном состоянии пассивный поток ионов натрия в клетку за счет соответствующего электрохимического градиента должен быть полностью уравновешен активным транспортом этих ионов в противоположном направлении. То же самое должно иметь место для пассивного тока ионов калия из клетки и его активного транспорта наружу. Если предположить, что ионы хлора распределяются между цитоплазмой и внеклеточной средой пассивно, то мембранный потенциал будет определяться исключительно относительной проницаемостью
мембраны к натрию и калию и коэффициентом сопряжения транспортного механизма, переносящего эти ионы:
F- ДГ ь HK]0+MNa]0 F г [КЫ-Й [Najj *
где г — количество выносимых ионов натрия на один внесенный ион калия, Ъ —отношение проницаемостей Рка^к- Когда коэффициент сопряжения достигает единицы (транспортный механизм полностью нейтрален), потенциал покоя определяется уравнением Ходжкина—Хаксли, полученным из теории постоянного поля Гольдмана. Если же транспортный механизм переносит только ионы натрия (г=оо), значение потенциала покоя достигает калиевого равновесного потенциала Ек,
5.3.3. ТРАНСМЕМБРАННЫЕ ТОКИ
ПРИ ЭЛЕКТРОГЕННОМ АКТИВНОМ ТРАНСПОРТЕ
Томас [93] был первым, кто использовал длительную фиксацию напряжения на мембране для измерения трансмембранных токов, возникающих при активации транспортного механизма и лежащих, очевидно, в основе описанной выше длительной гиперполяризации клетки. Работая на гигантских нейронах моллюсков и применяя ионофоретическую инъекцию натрия через внутриклеточный микроэлектрод, он показал, что такая инъекция сопровождается развитием входящего тока. Этот ток пропорционален количеству введенного в клетку натрия. Как и соответствующая гиперполяризация, он подавляется оубаином, бес-калиевым раствором и низкой температурой. Поэтому он обычно обозначается как «насосный» ток.
Заряд, переносимый через мембрану насосным током длительностью Т, может быть вычислен как
Г I
e=J [Z(0-Zo]= J о о
где /„ — начальное значение мембранного тока, I (0 — значение тока в момент времени 0 заряд, перенесенный ионами натрия, инъецируемыми в клетку, равен соответственно
Ч —— Дщ-дек X ^инъек»
гДе Л1Нъек и (инъеп — ионофоретический ток и продолжитель-
ность его пропускания.
По первоначальным данным Томаса, отношение Q/q является весьма устойчивым (примерно 0.3). Наличие такой устойчивости рассматривалось как указание на наличие в транспортной системе фиксированных отношений между количествами выводимого наружу натрия и вводимого в клетку калия. При указанном соотношении около 1 /3 транспортируемого натрия не должно быть
скомпенсировано переносимым в клетку калием; эта неСкомпеН-сированность и создает в мембране постоянную дополнительную эдс.
Наряду с фиксацией напряжения для измерения трансмембранного тока Томас использовал впутриклеточпый натрийселектив-
Рис. 5.4. Изменения мембранного потенциала, внутриклеточной активности ионов натрия и мембранного тока нейрона моллюска Helix при инъекции в пего натрий-ацетата.
Верхняя кривая — мембранный потенциал (черте над кривой отмечает длительность инъекции), средняя кривая—активность пэтрия; нижняя кривая — мембранный ток. Слева ток инъекции 31.3 нА длился 1 мин, справа— 30.1 на 2 мин 103].
пый электрод для непрерывного измерения изменений активности ионов натрия в клетке [94]. Такие измерения показали, что удаление из клетки избыточного натрия происходит параллельно с ослаблением насосного тока (рис. 5.4).
; Однако характеристики насосного тока оказываются более сложными, если последний измерять при различных уровнях поддерживаемого На мембране потенциала. В таких условиях отношение количества зарядов, перенесенных через мембрану насосным током, к количеству зарядов, введенных в клетку с ионами натрия, оказывается непостоянным. Когда мембранный потенциал
поддерживается на уровне ниже —60 мВ, увеличение инъекции натрия приводит к увеличению как насосного тока, так и отношения Qlq. Сдвиг фиксируемого потенциала в сторону гиперполяризации уменьшает зависимость этого отношения от количества инъецируемых ионов п в дальнейшем извращает ее. При мембранном потенциале — <80 мВ увеличение инъекции натрия приводит к уменьшению отношения Qlq. Реверсия зависимости наступает при потенциале фиксации примерно равном -65 мВ, т. о. на уровне калиевого равновесного потенциала для исследованных нейронов [4]. В таблице показаны результаты таких измерений, проведенных на двух нервных клетках.
Зависимость коэффициента эиектрогенпостп натриевого насоса в нервной клетке моллюска Helix от количества инъецированных ионов натрия и фиксируемого уровня мембранного потенциала 16]
Фиксируемый потенциал, мВ Величина инъекции
1.5 мкКл 3.0 мкКл 6.0 мкКл 9.0 мкКл
-50 0.14 0.44
-60 0.14 0.15 0.15 0.24
-80 0.11 0.11 0.05 —
Примечание- Коэффициент электрогенности определялся как отношение количества зарядов, перенесенных через мембрану, к количеству зарядов, инъецированных в клетку.
Более точное описание потенциалозависимости насосного тока может быть получено путем измерения непрерывных вольт-амперных характеристик (ВАХ) мембраны в состоянии покоя и во время активации транспортного маханизма. Для этой цели командное изменение потенциала фиксации, вызывающее постоянно нарастающую гиперполяризацию мембраны от уровня потенциала покоя до примерно —120 мВ, производится до инъекции в клетку ионов натрия и в различные моменты после окончания[8]. Скорость изменения фиксируемого потенциала выбирается таким образом, чтобы обеспечить квазистационариое состояние мембраны на протяжении измерения. ВАХ можно сравнивать в различные периоды развития насосного тока при активации транспортного механизма или при отсутствии активации в связи с замещением инъецируемых натриевых ионов на литиевые или калиевые, а также при блокировании насосного механизма охлаждением или действием оубаина.
Такие измерения показывают, что небольшие инъекции ионов натрия, не превышающие 20—25 мкКл, сами по себе не вызывают изменений пассивной проводимости мембраны нервной клетки, если механизм активного транспорта не функционирует. Следовательно, возникающие при различных условиях функционирова
Ния клетки изменения вызванного такими инъекциями насосного тока могут быть отнесены к изменениям в деятельности самого насосного механизма.
А
Рис. 5.5. Зависимость насосного тока от мембранного потенциала в нервной клетке Helix.
А — мембранный ток, вызванный серией последовательных инъекций ионов натрия, Возле кривых указаны величины (в мкКл) и длительность (черная черта) инъекций; стрелки (2—7) указывают момент регистрации вольт-амперных характеристик; Б — вольт-амперные характеристики мембраны нейрона в различные моменты развития насосного тона, представленного в А. Кривая 7 практически совпадает с кривой 1 н обозначепа точками [10].
Рис. 5.5 показывает особенности изменения насосного тока при изменении фиксируемого уровня мембранного потенциала. Насосный ток был вызван серией инъекций натрия, следующих одна за другой; его увеличение следовало 5-образной кривой. Когда общее количество зарядов, введенных в клетку, достигло 16.3 мкКл, нарастание насосного тока замедлилось. По ходу развития насосного тока периодически регистрировались ВАХ, которые наклады
вались друг на друга при помощи двухкоординатного самописца. Отчетливо видно, что величина насосного тока зависит от мембранного потенциала; ток монотонно уменьшается по мере гиперполяризации мембраны, и при определенном^ ее уровне полностью исчезает. В некоторых клетках, мембранный потенциал у которых можно было сделать в достаточной степени отрицательным, можно наблюдать реверсию насосного тока — из входящего он превращался в выходящий (деполяризующий). На рис. 5.6 приведен
Рис. 5.6. Извращение направления мембранного тока, вызванного инъекцией ионов натрия в нейрон Helix, при значительной гиперполяризации мембраны.
Верхних привал — мембранный потенциал, нижняя — мембранный гол, Величина инъекции (в мкКл) указана возле кривых. Моменты инъекций отмечены на кривой потенциала [4],
пример потенциалозависимого насосного тока, направление которого извращалось при достаточной гиперполяризации мембраны. Непрерывные ВАХ, записанные для этой клетки до инъекции и на максимуме развития насосного тока, пересекались на уровне мембранного потенциала —95 мВ. Как видно из записи, представленной на этом рисунке, вторая инъекция в ту же клетку, сделанная при фиксируемом потенциале —130 мВ, вызвала насосный ток противоположного направления. Вариации в потенциалозависимости насосного тока от клетки к клетке объясняются, вероятно, размерами последних и, соответственно, различными действующими концентрациями ионов натрия в клетке, создаваемыми одними и теми же по величине инъекциями. Поэтому и потенциал реверсии Насосного тока, если он выявляется, также оказывается различным у различных нейронов. С увеличением количества инъецированного натрия он всегда сдвигается в сторону менее отрицательных зна-
чеций мембранного потенциала, достигая в некоторых случаях значения порядка —65 мВ.
Вследствие описанной потенциалозависимости насосного тока мембранная проводимость, измеряемая по наклону ВАХ, увеличивается с увеличением насосного тока. Такое увеличение можно рассматривать как уменьшение внутреннего сопротивления той ЭДС, которая создается насосным механизмом. Следует отметить, что потенциалозависимость насосного тока не является исключительным свойством только нервных клеток. Она была описана и для других возбудимых клеток, в которых можно было в достаточно
О 5 10 15 20 25 30 35
t, мин
Рис. 5.7. Насосный ток в нейроне Helix при двух различных уровнях мембранного потенциала. Инъекции натрия одинаковы в обоих случаях (17 мкКл). Кривые насосного тока получены при потенциалах фиксации —52 мВ и — 78 мВ. В последнем случае проведена серия возвращений к потенциалу фиксации —52 мВ [10].
широких пределах варьировать фиксируемый уровень мембранного потенциала (поперечнополосатые мышечные волокна [90], гладкие мышечные волокна [30] ).
Факт потенциалозависимости насосного тока может играть существенную роль в понимании природы электрогенного транспорта ионов в нервной клетке, и поэтому был сделан ряд попыток дальнейшего анализа этого явления. В опытах Костюка и сотр, [10 ] насосный ток измерялся в данной клетке при ряде переходов поддерживаемого мембранного потенциала от одного его уровня к другому. Если предполагать, что сдвиг мембранного потенциала, влияя на насосный ток, изменяет также скорость транспорта ионов натрия’из клетки, то следует ожидать различных изменений концентрации этих ионов в клетке для каждого уровня поддерживаемого мембранного потенциала.
Ясно, что в этом случае периодические возвращения фиксируемого потенциала от высокого его уровня к низкому и наоборот должны каждый раз демонстрировать иные значения насосного тока, чем те, которые наблюдаются при непрерывной фиксации мембранного потенциала на одном и том же уровне. На рис. 5.7 показаны результаты такого эксперимента. Инъекция натрия (17 мкКл) была сделана вначале при фиксируемом потенциале
—52 мЁ. Затем такая же инъекция была повторена При потенциале -78 мВ. Во время развития насосного тока при этом фиксируемом потенциале последний время от времени возвращался к прежнему уровню (—52 мВ). Насосный ток точно повторял свой временной ход при каждом переходе к прежнему значению поддерживаемого потенциала. Таким образом, этот ток определяется в каждый данный момент только действующим значением мембранного потенциала и не зависит от потенциала, при котором он развивался прежде. Этот опыт является косвенным доказательством того, что активный транспорт ионов натрия из клетки не зависит от мембранного потенциала по крайней мере в области исследованных его значений. Следовательно, наиболее вероятная причина потенциалозависимости насосного тока заключается в изменении входящего потока ионов калия. Если этот поток увеличивается при гиперполяризации мембраны, то он лучше компенсирует выходящий поток натрия, и электрогепный эффект уменьшается. Аналогичное объяснение электрогенного эффекта было предложено ранее Мартиросовым и Микаэляном [14], однако без соответствующих экспериментальных доказательств.
Если потенциалозависимость насосного тока определяется изменением входящего потока ионов калия, то она должна изменяться при изменении концентрации этих ионов в окружающей среде. Действительно, как было показано Костюком и сотр. [10], изменение наружной концентрации калия влияет на потенциалозависимость насосного тока. Уменьшение их концентрации ослабляет эту зависимость и опускает потенциал исчезновения насосного тока на более отрицательный уровень. Однако количественное изучение этого вопроса очень затрудняется наличием вокруг клетки диффузионных барьеров, из которых в непосредственной близости от наружной поверхности мембраны может существовать пространство, содержащее ионы калия в концентрациях, отличных от основного раствора.
Важным достижением в этом направлении была разработка методики полной изоляции нервных клеток. Такие клетки, как показывает электронномикроскопический контроль, полностью лишены каких-либо диффузионных барьеров; в то же время они на протяжении многих часов сохраняют все свои физиологические функции [9]. Опыты на таких изолированных нейронах показали, что двукратное увеличение концентрациикалия в среде сдвигает потенциал реверсии насосного тока на 17 мВ в направлении деполяризации. Двукратное уменьшение концентрации калия сдвигает его на 14 мВ в направлении гиперполяризации. Когда ионы калия в среде замещаются ионами рубидия, максимальное значение насосного тока и его потенциалозависимость оставались неизменными, уменьшалось лишь аномальное выпрямление мембраны, если оно имело место. Удаление из наружной среды ионов натрия (по пламенному фотометру с разрешением 0.3 ммоль) не приводило к заметным изменениям в амплитуде насосного тока и
его потенциалозависимости [6]. Все эти данные подтверждают вывод о том, что именно поток ионов калия внутрь клетки является тем компонентом транспортного механизма, который определяет потенциалозависимость электрогенного эффекта. Ионы рубидия могут, очевидно, замещать ионы калия в этом механизме.
Можно было бы думать, что изменчивость потока ионов калия в клетку и связанная с ним потенциалозависимость насосного тока обусловлены отсутствием фиксированной связи между активным переносом ионов натрия из клетки и ионов калия в клетку при различных энергетических требованиях к транспорту этих двух видов ионов. Уменьшение энергетического барьера для ионов калия (снижение соответствующего концентрационного градиента или увеличение электрического поля) облегчало бы транспорт этих ионов внутрь, увеличивая сопряженность транспортного механизма и уменьшая электрогенный эффект [10]. Однако это предположение плохо согласуется как с данными о реверсии насосного тока при значительной гиперполяризации мембраны, так и с данными об изменении отношения Qlq.
Другая возможная модель исходит из предположения, что насосный механизм может транспортировать ионы натрия и калия (или рубидия) с фиксированной сопряженностью, не зависящей от энергетических барьеров. Однако с увеличением внутриклеточной концентрации ионов натрия и активацией транспортного механизма развивается сопутствующее нелинейное повышение калиевой проводимости мембраны и появление особого калиевого тока. Величина этого тока зависит от активности транспортного механизма, а его направление — от разности между фиксируемым уровнем мембранного потенциала и калиевым равновесным потенциалом 16 ]. Такая модель хорошо объясняет также зависимость отношения Q lq от количества инъецированного натрия и мембранного потенциала. Когда мембранный потенциал фиксирован на уровне потенциала покоя, всегда менее отрицательном, чем Ек, индуцированный калиевый ток имеет выходящее направление, и переносимые им заряды суммируются с зарядами, непосредственно транспортируемыми ионным насосом. В этом случае Q lq может становиться намного больше теоретической величины (0,3). Когда же мембранный потенциал более отрицателен, чем Ек, индуцированный калиевый ток имеет обратное направление и уменьшает электрогенный эффект насоса. Чем больше натрия введено в клетку и чем, следовательно, больше активирован транспортный механизм, тем сильнее индуцированный калиевый ток и тем более значительными получаются отклонения отношения от 0.3.
Предложенная модель объяснила те противоречивые результаты, которые были получены различными авторами при исследовании зависимости насосного тока от мембранного потенциала. Мармор [64] исследовал эту зависимость у гигантских нейронов моллюска Anisodoris и не обнаружил каких-либо изменений тока в области мембранных потенциалов от —30 до —100 мВ. К та-202
кому же выводу пришли Ламберт и сотр. [59], которые исследовали нейроны Helix aspersa. Томас [94] измерял активный транспорт натрия из гигантских нейронов Helix aspersa, используя натрийселективные электроды, и также пришел к выводу, что мембранный потенциал не оказывает непосредственного воздействия на пасосный механизм. Все эти эксперименты были проведены на клетках в стационарном состоянии, т. е, при очень низкой активности ионных насосов.
Внутриклеточные инъекции натрия в нейроны Helix, которые использовали в своих экспериментах Костток и сотр. [10], повышали внутриклеточную концентрацию этих ионов до 8—16 мМ, что приводило к существенной активации транспортного механизма. Насосный ток в этом случае зависел от мембранного потенциала, но у некоторых нейронов эта зависимость была слабой, что, вероятно, было обусловлено большими их размерами. Сильную потенциалозависимость и даже реверсию насосного тока продемонстрировали также Тахара и сотр. [90]; применяемые ими методы* приводили к повышению внутриклеточного натрия до 60—80 мМ. В опытах Кука и сотр. [32] были получены величины Q /д до 0.65; эти авторы использовали инъекции, приводящие к повышению внутриклеточного натрия до 20—30 мМ.
Механизм повышения калиевой проницаемости, сопряженной с активацией натриевого насоса, требует дальнейшего выяснения. Индуцированная калиевая проницаемость явно отличается от калиевой проницаемости, связанной с потенциалозависимыми каналами, участвующими в переносе выходящего тока, так как она нечувствительна к действию ионов тетраэтиламмония (ТЭА). Поскольку этот специфический тип ионных каналов появляется в мембране тогда, когда насосный механизм находится в состоянии высокой активности, то возможно, что они создаются самой калиевой формой Na-, К-АТФазы, функционирующей в роли ионофора.
5.4. АКТИВАЦИЯ ТРАНСПОРТНОГО МЕХАНИЗМА ВО ВРЕМЯ ОСНОВНЫХ НЕРВНЫХ ПРОЦЕССОВ
С физиологической точки зрения большой интерес представляет возможность естественной активации транспортной системы основными клеточными процессами, так как в этом случае транспортный механизм мог бы быть непосредственным компонентом определенных интегративных процессов в нервной системе. Особенно вероятной такая возможность становится в связи с наличием в активном транспорте ионов электрогенного эффекта, который может суммироваться с мембранными электрическими процессами, лежащими в основе всех форм нервной деятельности,
5.4.1. СЛЕДОВЫЕ ПРОЦЕССЫ ПОСЛЕ НЕРВНОГО ИМПУЛЬСА
Уже в начальных экспериментах по исследованию электрогенного ионного транспорта было высказано предположение, что последний может принимать участие в генерации постэф-фектов, следующих после разряда нервных импульсов. Ритчи и Штрауб 180] обнаружили, что посттетаническая гиперполяризация (ПТГ) в демиелинизированных Нервных волокнах может быть значительно подавлена динитрофенолом, исключением ионов калия из внеклеточной среды или заменой в ней ионов натрия па ионы лития. Эти факты согласуются с возможностью посттетанической активации электрогенного транспортного механизма; однако авторы, как указывалось выше, первоначально выбрали для их объяснения иной путь. Позднее Штрауб [88] более подробно исследовал ПТГ при изменениях наружной концентрации ионов калия. Он обнаружил, что в бескалиевом растворе величина ПТГ может превысить величину потенциала покоя на 9 мВ; в таких условиях гиперполяризацию уже никак нельзя объяснить уменьшением содержания калия в примембранном пространстве, и она может отражать лишь работу электрогенного транспортного механизма. Холм и Смит [86] также наблюдали значительную ПТГ в немиелинизироваиных нервных волокнах, находящихся в беска-лиевой среде. Следует обратить внимание на то, что в этих экспериментах все же не было, по-видимому, полного удаления ионов калия из внеклеточных пространств и небольшое количество остававшихся ионов было достаточным для поддержания работы ионного насоса. Возможность участия электрогенного ионного насоса затем широко привлекалась для объяснения генерации ПТГ в других возбудимых тканях.
Айрапетян [2], Байлор и Никольс [21], а также Соколов и Кук [87 ] предположили, что указанный механизм образует внутриклеточную систему обратной связи, которая регулирует частоту импульсной активности в нервной клетке: вход ионов натрия в клетку во время генерации импульса является сигналом, запускающим механизм генерации посттетанической гиперполяризации и уменьшающим тем самым частоту разряда.
Однако последующие более тщательные исследования характеристик мембраны во время развития ПТГ показали необходимость более осторожного подхода к рассматриваемой проблеме. Накаджима и Такахаши [73] впервые обнаружили два компонента с различными временными характеристиками в ПТГ нейрона рецептора растяжения у речного рака. Быстрый компонент развивается уже после нескольких импульсов; гиперполяризуя мембрану, можно вызвать изменение его знака. Он является, по-видимому, следствием увеличения пассивной (калиевой) проницаемости мембраны. При более длительной тетанизации развивается второй, медленный компонент ПТГ. Этот компонент не изменяется 304
при изменении уровня поляризации мембраны и не связан, очевидно, с изменением мембранной проницаемости и может быть вызван активацией электрогенного ионного насоса. К такому же выводу затем пришли Янсен и Никольс [46 ] при исследовании следовых процессов в нейронах пиявки. Ранг и Ритчи [78] исследовали изменения ПТГ симпатических немиелинизированных волокон после перенесения их в бескалиевый раствор; они нашли, что амплитуда начальной части ПТГ при этом не изменяется, но реакция спадает значительно быстрее, чем в нормальном солевом растворе. Поэтому они также пришли к заключению, что ПТГ вызывается двумя различными механизмами: первоначальным увеличением калиевой проницаемости мембраны и последующей активацией электрогенного ионного насоса.
Для более точного выяснения этого сложного вопроса необходимы были прямые измерения мембранных токов в нервных клетках во время развития посттетанического эффекта. Это было сделано Крышталем и Пидопличко [11] и Кононенко и Костю-ком [5рна гигантских нейронах моллюсков с использованием методики фиксации напряжения на их мембране.
На рис. 5.8 показано развитие ПТГ нейрона моллюска, зарегистрированной в условиях постоянства тока. Как видно из рисунка, длительность ПТГ зависит от длительности стимуляции и характеризуется экспоненциальным спадом. Если мембранный потенциал фиксировать на уровне потенциала покоя, отключая фиксацию только на время стимуляции, то можно зарегистрировать посттетанический ток (ПТТ), временной ход которого хорошо совпадает с временным ходом ПТГ. Увеличение частоты или длительности стимуляции увеличивает амплитуду и длительность ПТТ. Аналогичный эффект может быть получен не только при ритмической стимуляции нейрона, но и после постоянной деполяризации его мембраны (1—3 мин) до уровня менее —30 мВ.
Если представленный на рисунке ток есть следствие изменения калиевой проницаемости мембраны, то при сдвиге фиксируемого потенциала в сторону гиперполяризации он должен ослабевать и в конце концов извратить свое направление. Как видно из рис. 5.9, потенциал реверсии действительно существует примерно в области —60 мВ, но только для начального быстрого компонента ПТТ; медленный же компонент ПТТ не зависит от фиксируемого потенциала в области от —50 до —90 мВ. На том же рисунке представлены ВАХ мембраны нейрона, снятые до деполяризующего сдвига, во время быстрого компонента ПТТ и во время развития медленного его компонента (до 6 мин после прекращения деполяризации). Отчетливо видны различия в потенциалозависимостц-обоих компонентов. Такие же различия могут быть обнаружены при регистрации нестационарных ВАХ с использованием скачко-: образных изменений потенциала фиксации. - < г
Разделение ПТТ на два компонента может быть достигнуто) также действиецоубаица. В среде с оубаином стимуляция вызывает»
только небольшой и быстрый гиперполяризующий ток, а медленный компонент отсутствует.
Исходя из приведенных данных, можно с полным основанием; заключить, что посттетаническую гиперполяризацию мембраны нервной клетки могут определять два различных механизма. Один
Рис. 5.8. Посттетаническая гиперполяризация и соответствующие мембранные токи в нейроне моллюска Helix.
А — посттетакическая гиперполяризация; Б — соответствующий мембранный ток; В — мембранные токи при стимуляции с различной частотой и длительностью (цавбры вверху — Частота стимуляции в секунду). Регистрацию тока и потенциала проводили на чернило-питпущсм приборе, поэтому амплитуда ПД уменьшена [5].
из них заключается в длительном повышении калиевой проницаемости мембраны, второй — в стимуляции электрогенного активного ионного транспорта. Второй механизм продлевает посттетанический эффект примерно в 10 раз.
Непосредственная причина посттетанической активации транс-рортнргр механизма не так ясна, как это может показаться с первого взгляда. Хорошо известно, что генерация потенциала действия в срмё нервной клетки связана с появлением входящего тока не только цриов натрия, но и цоцоц кальция [9 ]. Поэтому при-
мВ
-50
-60—
-70 —
-BQ —
-до —
/1
1
2
3
4
5
о
Рис. 5.9. Зависимость посттетанического мембранного тока от уровня фиксируемого на мембране потенциала (нейрон моллюска Helix).
А — верхняя часть рисунка — уровни поддерживаемого потенциала, на мембране; нижняя — записи мембранных тонов при тех же уровнях поддерживаемого потенциала; Б — статические вольт-амперные характеристики соответствующих мембранных токов; 1 — исходная характеристика, Я — непосредственно после конца деполяризации, 3 — через 6 мин после окончания деполяризации [5].
чиной усиления деятельности ионного насоса может быть не только увеличение внутриклеточной концентрации ионов натрия, но и какое-либо специфическое действие ионов кальция. Действительно, по данным Мича [67], ПТГ в нейронах Aplysia может быть устранена при удалении кальция из внеклеточной среды. Однако проведенная в опытах Кононенко и Костю к а [5 ] проверка этого действия на нейронах Helix не подтвердила такого вывода. Замена ионов натрия во внеклеточной среде на ионы лития резко ослабляла длительный ПТТ, и это изменение было полностью обратимым. Аналогичное уменьшение наблюдали, если ионы натрия в наружной среде замещались ионами кальция. В этих условиях медленный компонент ПТТ исчезал полностью, а быстрый сильно уменьшался. Уменьшение же содержания в наружной среде ионов кальция не приводило к заметным изменениям ПТТ. Верапамил— специфический блокатор кальциевых каналов в возбудимых мембранах — также не влиял на течение ПТТ.
По-видимому, отмеченный Мичем эффект был связан с изменением в бескальциевых растворах пассивной проницаемости мембраны, шунтирующей электрогенное действие активного транспортного механизма. В бескальциевых растворах происходит существенное повышение такой проницаемости и соответственно электрогенный эффект должен оказаться замаскированным.
Таким образом, предположение о возможной роли кальциевых ионов в посттетанической активации транспортного механизма не оправдывается. Можно провести примерный расчет того, какое количество ионов натрия входит в клетку во время ее тетанической стимуляции и какое их количество выводится затем из клетки ионным насосом. Потенциал действия в клетке Helix имеет восходящую фазу длительностью 10 мс и сопровождается входящим током порядка 10 7 А; примерно половина этого тока в нормальном солевом растворе переносится ионами натрия. Поэтому если стимулировать нейрон с частотой 3 Гц в течение 3 мин, то он поглотит количество ионов натрия, соответствующее заряду примерно в 2.7х10'е Кл. Расчет количества зарядов, переносимых ПТТ после такой стимуляции, дает величину 1.0Х10'6 Кл. Полученное отношение Q lq находится в соответствии с обычным значением коэффициента электрогенности насосного тока у нейронов улитки.
Сложная природа ПТГ характерна, по-видимому, и для нервных клеток высших животных. Так, Куно, Мияхара и Уикли [57 ] исследовали потенциалозависимость ПТГ у нейронов столба Кларка спинного мозга кошки. Не обнаружив такой потенциало-зависимости, они предположили, что ПТГ генерируется за счет активации электрогенного насоса. Однако проведенные затем Гус-тафссоном, Линдстремом и Такатой [41 ] измерения всегда показывали увеличение калиевой проницаемости клеточной мембраны во время такой гиперполяризации.
Истинное функциональное значение тех сложных процессов, которые разыгрываются в нервной мембране после периода им
пульсного разряда, еще требует дальнейшего экспериментального выяснения. Не вызывает сомнения, что активация транспортного механизма таким разрядом приводит к восстановлению нарушенного ионного равновесия по обе стороны клеточной мембраны и натриевого электрохимического градиента. Предположение о том, что сопровождающая эту активацию гиперполяризация мембраны является дополнительным защитным механизмом, тормозящим клеточную активность и тем самым предотвращающим чрезмерное накопление ионов натрия внутри клетки, логически представляется вероятным. Однако экспериментальная проверка возможного участия такого механизма в физиологической деятельности клетки представляет весьма сложную задачу. Более кратковременное, но интенсивное повышение калиевой проницаемости мембраны, отражающее появление соответствующего выходящего мембранного тока, не имеет отношения к восстановлению трансмембранных ионных градиентов и представляет собой длительный компонент ионного механизма генерации импульсной активности.
5.4.2. ПОСТСИНАПТИЧЕСКИЕ ПРОЦЕССЫ
Большое внимание исследователей привлекает возможность активации транспортного механизма синаптическими медиаторами, и неоднократно высказывались предположения, что система электрогенного транспорта может быть стимулирована при синаптической передаче и что возникающая гиперполяризация может быть частью механизма, который изменяет состояние постсинаптической мембраны. Ниши и Кокетсу 175] и Либет и Кобаяши [61, 62 ] на нейронах симпатических ганглиев наблюдали продолжительные синаптические ответы, не сопровождавшиеся заметными изменениями сопротивления мембраны. Керкут и сотр. [50] нашли, что гиперполяризация, вызываемая в холинорецептивных нейронах моллюсков приложением ацетилхолина, не связана с увеличением мембранной проницаемости для ионов хлора — обычным ионным механизмом генерации гиперполяризационных постсинаптических потенциалов. Она подавляется действием оубаина, но усиливается при внутриклеточной инъекции ионов натрия. Эти же авторы показали, что в таких нейронах ацетилхолин вызывает увеличение проницаемости постсинаптической мембраны для ионов натрия; было высказано предположение, что эти ионы, попадая в клетку, активируют электрогенный транспортный механизм, который и приводит к гиперполяризации мембраны. Подобные же предположения были высказаны Болтон [231, которая также исследовала ацетилхолиновую гиперполяризацию гладкомышечных волокон, связывая ее с изменением концентрации ионов натрия и последующей активацией электрогенного транспортного механизма. Пинскер и Кандел [77] наблюдали в некоторых гигантских нейронах моллюсков двухфазные ТПСП со вторым компонентом, который блокировался низкой тем-
14 Общая физиология нервной системы 209
пературой, оубаином и не извращался при гиперполяризации мембраны. Все эти данные внешне очень хорошо согласовались с представлением о возможности активации электрогенного транспортного механизма при действии на постсинаптическуто мембрану такого медиатора, как ацетилхолин. Однако Кехое и Ашер 149], анализируя более подробно те же эффекты, нашли, что оубаин на самом деле не блокирует генерацию ацетилхолиновых ТПСП, а лишь сдвигает их равновесный потенциал в сторону более положительных значений мембранного потенциала. Причиной такого эффекта может быть подавление при действии оубаина активного переноса ионов калия в клетку и наступающее вследствие этого снижение внутриклеточной концентрации этих ионов, сопровождающееся соответствующим снижением калиевого равновесного потенциала. Если причиной таких ТПСП является обычное повышение проницаемости мембраны для ионов калия, то амплитуда их действительно будет постепенно ослабевать, что может быть принято как проявление прямого действия оубаина на механизм генерации такой реакции. Таким образом, необходимо быть весьма осторожным при попытках объяснения гиперполяризации постсинаптической мембраны медиаторной активацией электрогенного транспортного механизма.
Необходимость осторожного подхода к этой проблеме вытекает также из прямых измерений активностей калия и хлора во время действия на нервную клетку ацетилхолина, проведенных Кунце и Брауном [58]. Прямое приложение ацетилхолина к соматической мембране в этих опытах вызывало в ней два электрических ответа — ранний и поздний. Ранний ответ вызывается изменением проницаемости мембраны для ионов хлора (его равновесный потенциал очень близок к рассчитанному на основании измерений при помощи внутриклеточного хлорного электрода равновесному потенциалу для ионов хлора —57 мВ). Поздний гиперполяризую-щий ответ имел равновесный потенциал — 76 мВ; калиевый равновесный потенциал в той же клетке, рассчитанный по данным измерений с внутриклеточным калийселективным электродом с жидким ионообменником, также был равен —76 мВ. Действие убаина вызывало немедленную деполяризацию, связанную, очевидно, с выключением стационарного вклада электрогенного ионного транспорта в мембранный потенциал (см. выше). Но уровень активности ионов калия внутри клетки (и, следовательно, величина калиевого равновесного потенциала) изменялся очень медленно. Параллельные медленные изменения происходили и в величине равновесного потенциала для позднего ацетилхолинового ответа. Расхождения между равновесным потенциалом этого ответа и Ец отмечались только в том случае, когда ацетилхолин действовал на всю поверхность нейрона. Это может быть объяснено чисто техническими причинами, а именно тем, что изменения мембранного потенциала, вызываемые поляризацией клетки через внутриклеточный электрод, могут быть неравномерными в различных уча
стках клетки: они должны быть меньше в аксоне, в частности в тех его областях, где локализовано больше всего постсинаптических рецепторов.
Все эти измерения приводят необходимым образом к заключению, что все типы синаптических ответов в клетке, вызванных действием ацетилхолина, обусловлены изменениями мембранной проницаемости для различных ионов и не требуют для своего объяснения допущения активации ионного насоса.
Предположительное стимулирующее действие синаптического медиатора 5-гидрокситриптамина на электрогенный натриевый насос в нейронах симпатического ганглия был недавно описан Кокетсу и Ширазавой [56], но механизм этого эффекта не был подробно исследован.
5.4.3. РИТМОВОДЯЩАЯ АКТИВНОСТЬ
Рядом исследователей обсуждалась возможная роль электрогенного ионного насоса в генерации осцилляторных изменений мембранного потенциала нервной клетки и создании в ней ритмоводящей (пейсмейкерной) активности. Некоторые нервные клетки беспозвоночных животных могут в течение длительного времени генерировать ауторитмические разряды. Эти разряды сохраняются даже в том случае, когда клетка подвергается полной изоляции [20]. Непосредственной причиной ритмических разрядов; служит появление периодических колебаний мембранного потенциала. Периодические волны гиперполяризации могут быть связаны с периодической активацией электрогенного натриевого насоса, так как они весьма чувствительны к понижению температуры и действию оубаина [18, 27]. Если мембранный потенциал в периодически активной клетке фиксировать на гребне гиперполяризую-щей волны, то осцилляции прекращаются. Следовательно, последние связаны с местным регенеративным (потенциалозависимым) механизмом [95]. Тем не менее природа процессов, которые обуславливают эти волны и возвращают потенциал к деполяризованному уровню, неясна, и изменения мембранной проницаемости в этом случае не выяснены. Другие исследователи склоняются к мнению о том, что циклические изменения мембранного потенциала связаны только с изменениями мембранной проводимости, и отрицают роль электрогенного активного транспорта в этом явлении [19, 47]. Более вероятно, что активность транспортного механизма существенна для поддержания определенного уровня мембранного потенциала и возбудимости ритмическиактивного нейрона. Были проведены специальные исследования зависимости ауторитмической активности от температуры среды и действия убаина у большого количества нейронов центральной нервной системы моллюсков. Они показали, что температурная зависимость носит весьма сложный характер, и для каждой клетки характерен 9©0Й температурный оцтимум. Если же клетки отравить оубаином,
т
то эта индивидуальность исчезает и все они начинают генерировать разряды максимальной частоты при максимально высокой температуре [100].
5.4.4. ДРУГИЕ ФИЗИОЛОГИЧЕСКИЕ ПРОЦЕССЫ
Некоторыми авторами высказываются предположения, что электрогенный насосный механизм может функционировать также в глиальных клетках. Известно что при микроэлектрод-ных отведениях из серого вещества мозга, в том числе из коры больших полушарий, нередко попадаются клетки, имеющие довольно высокий мембранный потенциал, однако не реагирующие на какие бы то ни было раздражения. Такие «молчащие» клетки обычно рассматриваются как глиальные. Сиперт и Уорд [89] показали, что при вызове в коре больших полушарий распространяющейся судорожной активности в «молчащих» клетках появляется волна деполяризации порядка 5—14 мВ, за которой следует длительная их гиперполяризация в пределах 1—9 мВ. Если во время судорожной активности происходит поступление в межклеточные промежутки значительного количества ионов калия из возбуждающихся нейронов, то это действительно может быть причиной первоначальной деполяризации мембраны глиальных клеток, мембранный потенциал которых определяется почти исключительно калиевым электрохимическим градиентом и последующей активацией калийзависимого электрогенного насосного механизма.
Такие же клетки исследовались Рэнсомом и Голдрингом [79] при стимуляции коры ритмическими стимулами. Ритмические раздражения вызывали в клетках медленные волны гиперполяризации. Их появление было объяснено авторами противоположным образом — активацией в нейронах насосного механизма, увеличивающего поступление в них ионов калия и тем самым уменьшающего их концентрацию в межклеточных пространствах. Вторичным следствием этого может быть повышение калиевого градиента на мембране глиальных клеток и соответствующее повышение их мембранного потенциала.
Очевидно, что вопрос о наличии в глиальных клетках электрогенного транспортного механизма и тем более о возможной функциональной роли медленных колебаний мембранного потенциала этих клеток требует дальнейшего изучения.
Наконец, возможная физиологическая роль электрогенного транспортного механизма обсуждалась и в отношении рецепторных клеток. В некоторых рецепторных клетках зарегистрированы ги-перполяризационные ответы, возникающие после прекращения действия деполяризующего стимула. Эти гиперполяризационные ответы подавляются оубаином и на этом основании связываются с активностью транспортного механизма. Такие ответы зарегистрированы в фоторецепторной мембране моллюсков [54] и в ретинальных клетках латерального глдза [Amuliis [42 ].
Более подробные исследования фоторецепторных клеток Limulus показали, что гпперполяризационный ответ усиливается при инъекции ионов натрия в клетку и подавляется в бескалиевой среде, т. е. во всех отношениях соответствует проявлениям активности злектрогеппого транспортного механизма. Значительная амплитуда этого ответа позволяет думать, что электрогенный ионный насос принимает непосредственное участие в поддержании мембранного потенциала темноадаптпровапной рецепторной клетки, хотя и не имеет отношения к генерации самого рецепторного потенциала при действии света [24].
ЛИТЕРАТУРА
1. Айрапетян С. Н. Влияние температуры на мембранный потенциал гигантских нейронов улитки. — Биофизика, 1969, 14, № 4, с. 663—668.
2. Айрапетян С. Н, О механизме регуляции спонтанной активности гигантских нейронов улитки. — Биофизика, 1969, 14, № 5, с. 866—872.
3. АкимовJO, А. Влияние динитрофенола и азида натрия на электрофизиологические свойства гигантских нейронов виноградной улитки. — Физиол. жури. СССР, 1973, 59, №1, с. 53—61.
4. Кононенко Н. И. Особенности потенциалозависимости тока натриевого пасоса мембраны гигантских нейронов моллюсков. - Нейрофизиология, 1975, 7, № 4, с. 428—433.
5. Кононенко Н. И., Коетюк П. Г. Мембранные токи, индуцированные входом ионов натрия в гигантские нейроны моллюсков. — Нейрофизиология, 1975, 7, № 5, с. 541—549.
6. (Кононенко Н, И., Коетюк П. Г.) Kononenko N.. I., Kosiyuk P. G. Further studies of the potential-dependence of sodium-induced membrane current in snail neurones. — J. Physiol. (London), 1976, 256,'N 3, p. 601—615.
7, Коетюк П. Г, Активный транспорт ионов в нервной клетке и его связь с электрическими процессами на поверхностной мембране. — Укр. биохим. журн., 1970, 43, № 1, с. 9—16.
8. Коетюк П. Г., Крышталь О. А., Пидопличко В. И. Электрогенный натриевый насос и связанные с ним изменения проводимости поверхностной мембраны нейропов. — Биофизика, 1972, 17, № 6, с. 1048—1054.
9. (Коетюк П. Г., Крышталь О. А., Дорошенко П. A.) Kostyuk Р. G., Krishtal О. A., Doroshenko Р. A. Calcium currents in snail neurones. I. Identification of calcium current. — Pflug. Arch., 1974, 348, N 1, p. 83—93.
10. (Коетюк П. Г., Крышталь О. А., Пидопличко В. И.) Kostyuk Р. G., Krishtal О. A., Pidoplichko V. I, Potential-dependent membrane current during the active transport of ions in snail neurones. — J, Physiol. (London), 1972, 226, N 2, p. 373—392.
11. Крышталь О. А,, Пидопличко В. И. О природе гиперполяризации, следующей за ритмическим разрядом в нейронах улитки. — В пи.: Биофизика мембран, Каунас, 1971, с, 507—513.
12. Лев А. А., Бужинский Э. П. О методе определения активности ионов калия внутри мышечных волокон с помощью К+-чувствителытых стеклянных микроэлектродов. — Цитология, 1961, 6, № 3, с. 614—621.
13, Лишко В. К. Натриевый насос биологических мембран. Киев, 1976, 144 с.
14, Мартиросов С. М.. Микаелян Л. Г. Ионный обмен при электрогенном активном транспорте ионов. — Биофизика. 1970, 15, № 1, с. 104—113.
15. Рожманова О. М,, Стельмах Л. Н., Лишко В. К. Изучение влияния АДФ на Na+-, К+-АТФазу мозга. — Биохимия, 1976, 41, № 10, с. 1846—1849.
16. Сорокина 3. А. Активность ионов Калия и натрия в гигантских нейронах моллюсков. — Физиол. жури. АН УССР, 1966, 12, № 6, с. 776—780,
17. Alexander D. В. Isolation a digoxin-binding protein from a brain membrane preparation containing Na-, К-activated ATPase. — FEBS letters, 1974, 45, NJ1, p. 150—154.
18. Ayrapetyan S. N. On the regulation of the mechanism of rhythmic activity of Helix neurones. — In: Neurobiology of Invertebrates. Budapest, 4973,
19. Barker J. L,, Gainer H. Studies on bursting pacemaker potential activity in molluscan neurons. — Brain Res., 1975, 84, N 3, p. 479—500.
20. Baumgarten R., Chen C. F., Takeda R. Isolation of pacemaker neurones in Aplysia californica, — Fed. Proc., 1971, 30, N 2. 490Abs.
21. Baylor D. A., Nicholls J. G. After-effects of nerve impulses on signalling in the central nervous system of the leech. — J. Physiol. (London), i960, 203, N 3, p. 571—589.
22. Blumental R., Shamoo A. E. lonophoric material derived from eel membrane preparations. II. Electrical characteristics. — J. Membrane Biol., 1974, 19, N 1, p. 141—162.
23. Bolton T. B. Electrophysiological evidence of an electrogenic sodium pump in the longitudinal muscle of guinea-pig ileum and its involvement in the response to acetylcholine. — J. Physiol. (London), 1971, 218, N 1, p. 58P— 59P.
24. Brown J. E., Lisman J. E. An electrogenic sodium pump in Limulus ventral photoreceptor cells. — J. Gen. Physiol., 1972, 59, N 6, p. 720—733.
25. Caldwell P. C., Hodgkin A. L., Keynes R. D., Shaw T. The effects of injecting «energy-rich» phosphate compounds on the active transport of ions in the giant axons of Loligo. — J. Physiol. (London), 1960, 152, N 3, p. 561 — 590.
26. Carpenter D. O. Membrane potential produced directly by the Na+ pump in Aplysia neurons. — Comp. Biochem. Physiol., 1970, 35, N 3, p. 371— 385.
27. Chen C. F., Baumgarten R,, HarthO. Metabolic aspects of the rhythmogenesis in Aplysia pacemaker neurons. — Pfliig. Arch., 1973, 345, N 1, p. 179—193.
28. Chmouliovsky M. Synthesis of ATP by reversal of the Na—К pump in rabbit non-myelinated nerve fibres. — Experientia, 1970, 26, N 6, p. 679—681.
29. Chrlstoffersen G. R. G. Steady state contribution of the Na, К—pump to the membrane potential in identified neurons of a terrestial snail, Helix pomatia. — Acta physiol, scand., 1972, 86, N 4, p. 498—514.
30. Connor J. A., Prosser C. L., Weems W. A. A study of pace-maker activity in intestinal smooth muscle. — J. Physiol. (London), 1974, 240, N 3, p. 671—701.
31. Conway L. J. Oxidation-reduction pump, — Science, 1951, 113, p. 270— 273.
32. Cooke J. M., Leblanc G., Tauc L. Sodium pump stoichiometry in Aplysia neurons from simultaneous current and tracer measurements. — Nature, 1974, 251, N 5473, p. 254—256.
33. Dahl J. L., Hokin L. E. The sodium-potassium adenosinetriphosphatase. — Ann. Rev. Biochem., 1974, 43, p. 327—355.
34. Dean R. B. Theories of electrolyte equilibrium in muscle. — Biol. Symp., 1941, 3, p. 331-348.
35. Garrahan P. J,, Glynn I. M. Driving the sodium pump backwards to form adenosine triphosphate. — Nature, 1966, 211, N 5056, p. 1414—1415.
36. Geduldig D. A ouabain-sensitive membrane conductance. — J. Physiol. (London), 1968, 194, N 3, p. 521—533.
37. Glynn I. M. Activation of an adenosinetriphosphatase activity in a cell membrane by external potassium and internal sodium. — J. Physiol. (London), 1962, 160, N 1, p. 18P.
38. Glynn I. M., Karlish S. J. D. The sodium pump. — Ann. Rev. Physiol., 1975, 37, p. 13-55.
39. Gorman A. L. F., Marmor M. F. Steady-state contribution of the sodium pump to the resting potential of a molluscan neurone. — J. Physiol. (London), 1974, 242, N 1, p. 35—48.
40. Grundfest H., Kao C. Y., Altamirano M. Bioelectric effects of ions micro-injected into the giant axon of Loligo, — J. Gen. Physiol., 1954, 38, N 2, p. 245-282,
41. tiustafsson В., Lindstrom S., Takata M. A re-evaluation^of the afterhyperpolarization mechanism in dorsal spinocerebellar tract neurones. — Brain Res., 1971, 35, N 3, p. 543—546.
42. Hansen О. P. Electrogenic Na-K-pump in the retinula .cells of Limulus lateral eye. — Acta physiol, scand., 1972, 84, N 4, p. 40A—42A.
43. Hodgkin A. L. Ionic movements and electrical activity in giant nerve fibres, — Proc. Roy. Soc. Ser. B, 1958, 148, N 1, p. 1—37.
44. Hodgkin A., Keynes H. Active transport of cations in giant axons from Sepia and Loligo. - - J. Physiol. (London), 1955, 128, N 1, p. 28—60.
45. Holmes 0. Effects of pH, changes in potassium concentration and metabolic Inhibitors on the after-potentials of mammalian nonmedullated nerve fibres. — Archs Internet. Physiol. Biochem., 1962, 70, N 2, p. 211— 245.
46. Jansen J. K. S., Nicholls J. G. Conductance changes, an electrogenic pump and the hyperpolarization of leech neurones following impulses. — J. Physiol. (London), 1973, 229, N 3, p. 635—655.
47. Junge D., Stephens C. L. Cyclic variation of potassium conductance in a hurst-generating neurone in Aplysia. — J, Physiol. (London), 1973, 235, N 1, p. 155-181.
48. Kahlenberg A., Dulak 'V. C., Dixon J. F., Galsworthy P, R., Hokin L. E. Studies on the characteristics of the sodium-potassium transport adenosine triphosphatase. V. Partial purification of the lubrol-solubilised buf brain enzyme. — Arch. Biochem. Biophys., 1969, 131, N 1, p. 253—262.
49. Kehoe J., Ascher F. Re-evaluation of the synaptic activation of an electrogenic pump. —Nature, 1970, 225, N 5235, p. 820—823.
50. Kerkut G. A., Brown L. C., Walker R. J. Choliergic IPSP by stimulation of the electrogenic sodium pump. — Nature, 1969, 223, N 5208, p. 864—865.
51. Kerkut G. A., Thomas R. C. An electrogenic sodium pump in snail nerve cells. — Comp. Biochem. Physiol., 1965, 14, N 1, p. 167—183.
52. Kernan R. P. Membrane potential changes during sodium transport in frog sartorius muscle. — Nature, 1962, 193, N 4819, p. 986—987.
53. Klee M. R., Pierau F.-K., Faber D. S. Temperature effects on resting potential and spike parameters of cat motoneurones. — Exp. Brain Res., 1974, 19, N 3, p. 478—492.
54. Koike H., Brown H. M., Hagiwara S. Hyperpolarization of a barnacle photoreceptor membrane following illumination. — J, Gen. Physiol., 1971, 57, N 6, p. 723—737.
55. Koike H., Mono N., Okada У., Oshima T. Activities of the sodium pump in cat pyramidal tract cells investigated with intracellular injection of sodium ions. — Exp. Brain Res., 1972, 14, N 5, p. 449—462.
56. Koketsu K., Shirasawa Y. 5-HT and the electrogenic sodium pump. — Expe-rientia, 1974, 30, N 9, p. 1034—1035.
57. Kuno M., Mlyahara I. T., Weakly I. N. Posttetanic hyperpolarization produced by an electrogenic pump in dorsal spinocerebellar tract neurones. — J. Physiol. (London), 1970, 210, N 4, p. 839—855.
58. Kilnze D. L., Brown A. M. Internal potassium and chloride activities and the effects of acetylcholine on identifiable Aplysia neurones. — Nature New Biology, 1971, 229, p. 229—231.
59. Lambert J. D. C.,. Kerkut G. A., Walker R. J. The electrogenic sodium pump and membrane potential of identified neurones in Helix aspersa. — Comp. Biochem. Physiol., 1974, 47A, N 6, p. 897—916.
60. Lee K. S., Shin M. R., Kang D. H., Chen К. K. Studies on the mechanism of cardiac glycoside action. — Biochem. Pharmac., 1970, 19, N 9, p. 1055— 1069.
61. Libet B., Kobayashi H. Electrogenesis of slow postsynaptic potentials in sympathetic ganglion cells. — Fed. Proc., 1968, 27, N 3, p. 750 (only).
62. Libet B., Kobayashi H. Generation of adrenergic and cholinergic potentials in sympathetic ganglion cells. — Science, 1969, 164, N 3887, p. 1530—1532.
63. Lundberg A., Oscarsson O. Anoxic depolarization of mammalian nerve fibres. — Acta physiol, scand., 1952, 30, Suppl. Ill, p. 99—110.
64, Mar тог М. F. The independence of electrogenic sodium transport and membrane potential in a molluscan neurone. — J. Physiol. (London), 1971, 218, N 3, p. 599—608.
65. Mariner M. F., Gorman Л. L. F. Membrane potential as the sum of ionic and metabolic components. — Science, 1970, 167, N 3914, p. 65—67.
66. Medzihradsky F., Kline M. H., Hokin L. E. Studies on the characteristics of the sodium-potassium adenosinetriphosphatase. I. Solubilization, stabilization and estimation of apparent molecular weight. — Arch. Biochem. Biophys., 1967, 121, N 2, p. 311—316.
67. Meeeh R. W, Calcium influx induces a post-tetanic hyperpolarization in Aplysia neurones. — Comp. Biochem. Physiol., 1974, 48A, N 2, p. 387—395.
68. Mennier J. M., Tauc L. Participation d’une pompe metabolique au potentiel de repos de neurones d’Aplysie. — J. Physiol. (Paris), 1970, 62, Suppl. 1, p. 192-193.
69. Mizuno Л'., Nagano K., Nakao T., Tashima Y., Fujita M:, Nakao M. Approximation of molecular weight of (Na—K)-ATPase. — Biochim. biophys. acta, 1968, 168, N 2, p. 311—320.
70. Moreton R. B. An investigation of the electrogenic sodium pump in snail neurones using the constant field theory. — J. Exp. Biol,, 1969, 51, N 1, p. 181—201.
71. Mullins L. J., Brinley F. J. Potassium fluxes in dialysed squid axons. — J. Gen. Physiol., 1969, 53, N 6, p. 704—740.
72. Mullins L. J., Noda K, The influence of sodium free solution on the membrane potential of frog muscle fibres. — J. Gen. Physiol., 1963, 47, N 1, p. 117—132.
73. Nakajima S., Takahashi K. Post-tetanic hyperpolarization and electrogenic Na pump in stretch receptor neurone of crayfish. — J. Physiol, (London), 1966, 187, N 1, p. 105—127.
74. Nakao T., Nakao M., Nagai F., Kawai K., Fujihira У., Mara У., Fujita M. Purification and some properties of Na, К-transport ATPase. II. Preparation with high specific activity obtained using amino-ethyl cellulose chromatography. — J. Biochem., 1973, 73, N 6, p. 781—791.
75. Nishi S., Koketsu K. Origin of ganglionic inhibitory postsynaptic potential of bullfrog sympathetic ganglion. — J. Neurophysiol., 1968, 31, N 4, p. 717—728.
76. Perrone J. R., Hackney J. F., Dixon J. F., Hokin L. E. Molecular properties of purified (sodium-)-potassium)-activated adenosine triphosphatases and their subunits from the rectal gland of Squalus acanthias and the electric organ of Electrophorus electricus. — J. Biol. Chem., 1975, 250, N 12, p. 4178—4184.
77. Pinsker H., Kandel E. Synaptic activation of an electrogenic sodium pump.— Science, 1969, 163, N 3870, p. 931—935.
78, Rang H. P., Ritchie J. M, On the electrogenic sodium pump in mammalian non-myelinated external cations. — J. Physiol. (London), 1968, 196, N 1, p. 183—221.
79. Ransom B. R., Goldring S. Slow hyperpolarization in cells presumed to be glia in cerebral cortex of cat. — J. Neurophysiol., 1973, 36, N 5, p. 879— 892.
80. Ritchie J. M., Straub R. W. The .hyperpolarization which follows activity in mammalian non-medullated fibres. — J. Physiol. (London), 1957, 136, N 1, p. 80—97.
81. Ritchie F. M., Straub R, W. The movement of potassium ions during electrical activity, and the kinetics of the recovery process in the non-myelina-ted fibres of the garfish olfactory nerve. — J. Physiol. (London), 1975, 249, N 2, p. 327-348.
82. Shamoo A. E., Myers M. Na+-dependent ionophore as part of the small polypeptide of the (Na+-|-K+)-ATPase from eel electroplax membrane. — J. Membrane Biol., 1974, 19, N 1, p. 163—178.
83. Skou J. C. The influence of some cations on an adenosine triphosphatase from peripheral nerves. — Biochim. biophys. acta, 1957, 23, N 2, p. 394— 401.
84. Skou J. C. Further investigation on Mg+ L Na' Reactivated adenosine-tri phosphatase, possibly related to the active linked transport of Na+ and K+ across the nerve membrane. — Biochim. biophys. acta, 1960, 42, N 1, p. 6—23.
85. Skou J. C. The (Na+-)-K+)-activated enzyme system and its relationship to transport of sodium and potassium. — Quart. Rev. Biophys., 1974, 7, N 3, p. 401-434.
86. Smith I. С. H. The after potential and the electrogenic potential in rat C nerve fibres. — J. Physiol. (London), 1975, 252, N 2, p. 71P (only).
87. Sokolove P. G., Cooke I. M. Inhibition of impulse activity in a sensory neuron by an electrogenic pump. — J. Gen. Physiol., 1971, 57, N 1, p. 125— 163.
88. Straub R. W. On the mechanism of posttetanic hyperpolarization in myelinated nerve fibres from the frog. — J. Physiol. (London), 1961, 159, N 2, p. 19P—20P.
89. Sypert G. W., Ward A. A. Unidentified neuroglia potentials during propagated seizure in neocortex. — Exp. Neurol., 1971, 33, N 2, p. 239—255.
90. Tahara T., Ktmtzuka H., Koketsu K. An analysis of the membrane hyperpolarization during action of the sodium pump in frog’s skeletal muscles. — Jsrp. J. Physiol., 1973, 23, N 1, p. 165—181.
91. Tamal T., Kaglyama S. Studies of cat heart muscle during recovery after prolonged hypothermia. Hyperpolarization of cell membranes and its dependence on the sodium pump with electrogenic characteristics. — Circul. Res., 1968, 22, N 3, p. 423—433.
92. Thomas R. C. Measurements of current produced by the sodium pump in a snail neurone. — J. Physiol. (London), 1968, 195, N 2, p. 23P.
93. Thomas R. C. Membrane current and intracellular sodium changes in a snail neurone during extrusion of injected sodium. — J. Physiol. (London), 1969, 201, N 2, p. 495—514.
94. Thomas R, C. Intracellular sodium activity and the sodium pump in snail neurones. — J. Physiol. (London), 1972, 220, N 1, p. 55—71.
95. Wachtel H., WiIsorCW. A. Voltage clamp analysis of rhythmic slow wave generation in bursting neurones. — In: Neurobiology of Invertebrates. Budapest, 1973, p. 59—80.
96. De Weer P. Effect of intracellular adenosine 5'-diphosphate and orthophosphate on the sensitivity of sodium efflux from squid axon to external sodium and potassium, — J. Gen. Physiol., 1970, 56, N 5, p. 583—620.
97 De Weer P., Geduldig D. Electrogenic sodium pump in squid giant axon. — Science, 1973, 179, N 4080, p. 1326—1328.
98. Whittam R. The asymmetrical stimulation of a membrane adenosine triphosphatase in relation to active cation transport. — Biochem. J., 1962, 89, N 1, p. 110—118.
99. Whittam R., Chipperfield A, R. The reaction mechanism of the sodium pump. — Biochim. biophys. acta, 1975, 415, N 1, p. 149—171.
100. Willis J. A., Gaubatz G. L., Carpenter D. O. The role of the electrogenic sodium pump in modulation of pacemaker discharge of Aplysia neurons. — J. Cell. PhysioL, 1974, 84, N 3, p. 463—472.
Глава 6
МЕДИАТОРЫ
6.1. СОДЕРЖАНИЕ ОСНОВНЫХ ПОНЯТИЙ
Медиаторами в нейрофизиологии называются вещества, посредством которых осуществляются синаптические влияния. В химическом синапсе медиатор секретируется во внеклеточную среду одной клеткой, чтобы подействовать на другую клетку, которая чувствительна к нему. Широко распространены синонимы слова «медиатор» — синаптический передатчик, нейротрансмиттер.
Химического содержания понятие «медиатор» не имеет, у него функциональный смысл. Медиаторную функцию могут выполнять вещества, представляющие самые разные классы химических соединений: аминокислоты, их декарбоксилированные производные, эфиры, пептиды и т. д. Одно и то же вещество бывает медиатором и немедиатором. Так, норадреналин — медиатор, когда он выделяется из секреторных окончаний аксона и вызывает сокращение лежащих рядом мышечных клеток, но тот же норадреналин мы назовем гормоном, если он выделяется в кровь хромаффинными клетками надпочечника.
Вообще взаимодействие между клетками с номощыо веществ-посредников не редкость в многоклеточных организмах. Однако не всякое такое посредничество называется синаптической передачей и не всякий посредник — медиатором. Определим медиатор как физиологически активное вещество, которое: 1) попадает во внеклеточную среду в результате специального секреторного процесса, управляемого потенциалом клеточной мембраны и имеющего форму экзоцитоза (опорожнение во внеклеточное пространство цитоплазматических пузырьков, внутри которых запасен продукт секреции), и 2) приходит от места секреции к месту действия посредством диффузии.
Второй из указанных признаков позволяет отличить медиаторы от гормонов. Гормоны, как и медиаторы, выделяются во
внеклеточную среду одними клетками, чтобы влиять на состояние других, и способ секреции медиаторов и многих гормонов, вероятно, одинаков, но, в отличие от медиаторов, гормоны — это агенты не контактного, а дистантного действия. Чтобы дойти до клетки-мишени, гормон должен попасть в подвижную жидкую среду организма. Поэтому у позвоночных животных клетки, секретирующие гормоны, располагаются, как правило, вблизи капилляров. Нервная клетка может служить источником не только медиатора, по и гормона, который в этом случае называется нейрогормоном. Гормоном, нейрогормоном и медиатором может быть одно и то же вещество.
Поскольку медиатор приходит к своей мишени посредством диффузии, очевидно, что место секреции не может быть на большом удалении от места действия. Чаще всего расстояние между ними не превышает немногих сотен и лишь в редких случаях измеряется тысячами ангстрем. Область контакта, включающая источник секреции медиатора и мишень, на которую он действует, называется химическим синапсом.
Химические синапсы имеются у всех организмов, обладающих нервной системой. Значительно реже у них встречаются так называемые электрические синапсы, которым посвящена глава 9.
В построении химического синапса участвуют минимум две клетки — пресинаптическая (она секретирует медиатор) и постсинаптическая (на нее медиатор действует), но каждое из этих звеньев может быть представлено не одной, а несколькими клетками. Постсинаптическому звену посвящены главы 7 и 8. Передача идет в одном направлении, асимметрично. Предполагают, однако, что бывают и так называемые симметричные синапсы, передача в которых возможна в ту и другую сторону, так как каждая сторона контакта способна и к секреции, и к рецепции медиатора. Но даже в примитивных нервных системах, где обнаружены такие симметричные синапсы, большинство синаптических контактов представлено типичными асимметричными синапсами.
Какие клеточные элементы могут служить источником медиатора? Самая распространенная форма пресинаптических образований — это специализированные для секреции медиатора расширенные участки аксона нервных клеток. Такие расширения (их называют варикозными) обычно отсутствуют в проксимальной части аксона, которая служит только для проведения нервных импульсов. Но в терминальных ветвях аксона, где он устанавливает синаптические контакты и где проведение импульсов сопровождается секрецией медиатора, варикозных расширений бывает так много, что аксон становится похожим на бусы. Варикозное расширение аксона представляет собой элементарный пре-синапс — секреторную терминаль. Число таких терминалей у одного нейрона может быть очень большим. Специальные подсчеты показали, что у обычного нейрона головного мозга крысы (дофами
нергический нейрон среднего мозга) имеется примерно полмиллиона варикозных расширений, а общая длина терминальных ветвей аксона составляет более полуметра.
Секреторные терминали аксонов, однако, не единственный источник медиаторов в нервной системе. Имеются убедительные данные о существовании дендро-дендритическнх синапсов, в которых секрецию медиатора осуществляет специализированный участок дендрита (о дендритной секреции см. также [153, 1921). Изредка описывают синапсы, где секреторное нресинаптическое звено представлено телом нервной клетки. Наконец, вообще необязательно, чтобы источником медиатора были только нервные клетки. Хорошо известны типичные химические синапсы, в которых в роли пресинаптического звена выступают первичные рецепторные клетки, — например, палочки и колбочки сетчатки; нейроны в этих синапсах служат постсинаптическим звеном, они принимают информацию, переданную медиатором от рецепторной клетки.
Современное содержание рассмотренных выше и других понятий формировалось постепенно, по мере развития знаний о медиаторах и синапсах. Некоторые из понятий значительно изменили свой объем, а их смысл иногда менялся настолько резко, что порой становился противоположным старому. Например, слово «нейропиль», некогда изобретенное для обозначения тонковолокнистого вещества, обеспечивающего непрерывность протоплазматического субстрата нервных процессов, теперь имеет прямо противоположный смысл и обозначает область, где сосредоточены синаптические контакты между нервными волокнами. Многократно менялось содержание понятия «синапсы», еще совсем недавно синапсами называли только механически прочные контакты с узкой синаптической щелью, а сейчас мы этому признаку уже не придаем значения. Сами медиаторы в течение нескольких десятилетий назывались «гуморальными факторами нервного возбуждения», и лишь затем стало ясно, что выход физиологически активного вещества в кровь пе представляет собой сколько-нибудь существенной части процесса синаптической передачи, — эта утечка имела лишь методическое значение, поскольку другого способа наблюдать секрецию медиатора у физиологии пе было. Позже медиаторы назывались «химическими передатчиками нервных импульсов», но теперь очевидна недостаточность такого определения: во-первых, физиологически значимой оказалась не только секреция, вызванная нервным импульсом, но и фоновая секреция невозбужденной аксонной терминали; во-вторых, обнаружились химические синапсы, в которых вместо двух крайних состояний (покой и потенциал действия) представлены градуальные изменения мембранного потенциала и секреция медиатора то усиливается, то ослабляется.
Нет сомнений, что смысл интересующих нас понятий будет меняться и в дальнейшем.
6.2. РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О МЕДИАТОРАХ
Представление о медиаторах утверждалось в физиологии медленно. Внешние проявления нервных процессов, которые мгновенно связывают отдаленные части организма, таковы, что у самых добросовестных исследователей создавалось впечатление, что субстрат нервных процессов непрерывен, — хотя эта мысль и противоречила клеточпой теории. Но когда стало ясно, что нейронная теория права и субстрат нервных процессов достроен из клеточных звеньев, то в этом случае здравый смысл нашел выход в идее электрической передачи сигнала. Принятию медиаторной гипотезы мешали и другие трудности. Немаловажным было то, что эта гипотеза пришла в физиологию извне — она родилась в среде фармакологов в связи с потребностью в систематизации фармакологических данных.
Другое препятствие крылось в длительной незрелости самой гипотезы. В своем исходном виде медиаторная гипотеза касалась только периферических соединений, т. е. тех мест, где нервная система оказывает свои влияния на эффекторные органы. Теперь мы знаем, что периферические соединения — те же синапсы, но в начале века было иначе: синапсами называли межнейронные контакты, нм приписывали особые свойства, и о них вообще не было речи в спорах между сторонниками и противниками медиаторов. Потребовалось специальное усилие, чтобы резко раздвинуть рамки медиаторной гипотезы и привлечь ее к объяснению внутренних механизмов работы мозга.
В истории изучения медиаторов естественно выделяются следующие главные вехи. Вначале была четко сформулирована гипотеза, объясняющая влияния нервной системы на^ периферические органы посредством особых активных веществ. Прямое экспериментальное подтверждение этой гипотезы датируется 1921 г. В 1924 г. была выдвинута гипотеза об участии веществ-посредников в осуществлении межнейронных связей. В 1933 г. и эта гипотеза получила прямое подтверждение. В 50-х гг. нейрофизиология смогла приступить к идентификации веществ, выпол няющих медиаторную функцию в головном и спинном мозге позвоночных, а также у беспозвоночных животных, и при этом обнаружилось, что медиаторов не два, как думали прежде, а много. Работа по идентификации медиаторов продолжается и поныне и, по-видимому, далека от завершения.
6.2.1. НЕЙРОЭФФЕКТОРНАЯ ПЕРЕДАЧА
Гипотезу об активных веществах — передатчиках нервных влияний на эффекторы следует, по-видимому, считать плодом коллективного творчества кембриджских фармакологов. Эта гипотеза не носила характера абстрактной идеи (как могло быть на более раннем этапе развития науки), а непосредственно
вытекала из опыта фармакологии. Уже было известно, что эффекты симпатических нервных влияний имитируются одними веществами, а парасимпатических — другими; что симпатомиметическими свойствами обладает, в частности, адреналин, который имеется в организме_и даже выделен в кристаллической форме из надпочечников; что многие эффекты и адреналина, и симпатических нервов снимаются некоторыми алкалоидами спорыньи; что дегенерация постганглионарных симпатических волокон не снимает чувствительности гладких мышц к адреналину, а, напротив, повышает ее. Но никто не знал, что такое нейроэффектор-ные соединения и как они устроены: кончаются ли нервные волокна слепо, сливаются ли с мышечными и железистыми клетками.
Точную дату рождения медиаторной гипотезы установить трудно. По воспоминаниям Отто Леви (см. [201 ]), он рассматривал эту возможность во время своей беседы с кембриджским фармакологом Флетчером (W. М. Fletcher) еще в 1903 г. Документально известно, что другой кембриджский фармаколог, Эллиотт, на заседании Физиологического общества 21 мая 1904 г. назвал адреналин веществом, которое могло бы «высвобождаться в каждом случае, когда (симпатический) импульс приходит на периферию» [123].
Эллиотт был в тесном контакте с Лэнгли (см. [124]), в статье которого впервые говорится о химическом посреднике в связи с обсуждением механизма управления скелетными мышцами со стороны моторных нервов [198]. Лэнгли, с именем которого связывают возникновение представлений о постсинаптических рецепторах [11, с. 26—311, исследовал действие никотина и кураре на ^нервно-мышечную передачу и пришел к выводу, что способ действия этих алкалоидов можно понять, предположив, что нервный импульс должен доходить до мышцы не благодаря электрическому разряду, а благодаря секреции особой субстанции в конце нерва.
В этом же научном сообществе были предприняты первые попытки проверить гипотезу экспериментально. Диксон попытался показать, что при раздражении блуждающего нерва в сердце собаки будет высвобождаться активное (как он думал, мускариноподобное) вещество. В то время было еще неизвестно, что успех такого эксперимента определяется ингибированием холинэстеразы, и усилия Диксона не были вознаграждены [118], хотя общая идея эксперимента была правильна. Эллиотт признавался в статье 1914 г.: «Я тщетно пытался открыть активное вещество в мышечных пластинках поперечнополосатой мышцы. . . И однако же, — писал он далее, — трудно отказаться от мысли, что такие открытия ждут нас в будущем» (цит. по [75], с. 13).
Решающий эксперимент был придуман и осуществлен весной 1920 г. Отто Леви.
Впоследствии Леви рассказывал, что идея эксперимента явилась ему ночью, во сне. Он проснулся и сделал запись, но наутро 222
не смог ее разобрать. Сон, однако, повторился на следующую ночь. Теперь Леви по стал его записывать, а оделся, пошел в лабораторию, и в ту же ночь опыт, который впоследствии был удостоен Нобелевской премии, был сделан (см. [201]).
Он заключался в следующем. У лягушки наносилось длительное раздражение на нерв, идущий к сердцу, сердце же находилось на канюле и омывалось изнутри раствором Рингера. В ответ на раздражение нерва наблюдалось торможение биений, во время которого жидкость из канюли отсасывали пипеткой. Если эту жидкость затем вносили в нормально бьющееся сердце, то вновь наблюдали торможение биений.
Как и Диксон, Леви еще не знал о важности ингибирования холинэстеразы, но по счастью кровь была заменена раствором Рингера. Везение сказалось и в том, что Леви ставил свой первый опыт спросонья: по его признанию, на свежую голову он отказался бы от этой идеи, сообразив, что разведение гипотетического передатчика промывной жидкостью не позволит воспроизвести эффект торможения. Эффект, однако, оказался достаточно заметным для того, чтобы сам Леви убедился в необходимости продолжать эксперименты.
Леви развил их дальше и показал, что нечто высвобождающееся в промывную жидкость бывает разным в зависимости от того, тормозится или стимулируется сердце нервом. Для этого он воспользовался сезонными изменениями ответов сердца лягушки на раздражение смешанного вагосимпатического нервного ствола. В условиях, когда действие нерва было тормозящим, в перфузионной жидкости появилось тормозящее, «вагусное вещество» (Va-gusstoff), если же нерв стимулировал биения, в жидкости появлялось стимулирующее вещество (Acceleranstoff) [206, 2071.
Пока медиаторы были фармакологической гипотезой, физиология относилась к пим со скептическим равнодушием. Картина резко изменилась после 1921 г. На сторонников гипотезы и прежде всего на Леви обрушилась лавина неконструктивной критики. Леви обвинили в примитивизме мышления, недемонстративности результатов, недостаточности контролен и в произвольной интерпретации. Однако дело было сделано. Проверка опытов Леви не могла опровергнуть его наблюдений, каждый новый эксперимент только укреплял позиции медиаторной гипотезы.
Исследования сторонников медиаторной гипотезы концентрировались на следующих нейроэффекторных связях у позвоночных: передаче с симпатических постганглионарных волокон, передаче с парасимпатических постганглионарных волокон и передаче с моторных волокон на скелетные мышцы.
Для первого рода соединений, как уже сказано, с 1904 г. был назван кандидат в медиаторы — адреналин. Уже в 1910 г. Бергером и Дэйлом в работе, посвященной соотношению между симпатомиметическим действием веществ и их строением, была высказана мысль, что, если Эллиотт прав и в симпатических
г
окончаниях выделяется активный переносчик, то норадреналин был бы лучшим кандидатом, чем адреналин (см. [75]). Эту (как потом оказалось, правильную) мысль надолго оставили без внимания. Кандидатура адреналина казалась вне сомнений, потому что только адреналин и никакой другой симпатомиметик обнаруживался доступными методами в организме млекопитающих.
После первых опытов Леви предпринимаются попытки получить гуморальный перенос симпатических нервных влияний. Прежде всего сам Леви предположил, что его Acceleranstoff — это продукт секреции симпатических волокон, входящих в состав смешанного вагосимпатического ствола, и это предположение подтвердилось, когда нашли возможность обособленно раздражать симпатические волокна [194]. К началу 30-х гг. гуморальный перенос симпатических эффектов стали получать на органах млекопитающих; например, при раздражении симпатических волокон, идущих к одной петле изолированного кишечника, в перфузате появлялось вещество, тормозившее другую петлю [135]. В лаборатории Кеннона на млекопитающих была разработана методика получения симпатического медиатора («симпатина»), выделяющегося в кровь при раздражении нервов, идущих вдоль печеночной артерии. Тщательное сравнение эффектов «симпатина» и адреналина на гладкие мышцы заставило сделать важный вывод, что это разные вещества [101].
Нужно было как-то объяснить, почему адреналин и «симпатии» действуют неодинаково, и напрашивалась простая интерпретация этих результатов: симпатический медиатор — это не сам адреналин, а какое-то другое, близкое к адреналину вещество. Кеннон, авторитет которого в этой области был велик, предложил очень надуманное объяснение, согласно которому имеются два «симпатина» и они — комплексы неизвестного симпатического медиатора с одним из двух неизвестных факторов. Неудачная рабочая гипотеза надолго отвлекла внимание исследователей от истины, которая уже лежала рядом. Только в 1946 г. шведский фармаколог Эйлер продемонстрировал идентичность симпатического медиатора млекопитающих норадреналину [127]. Адреналин признали симпатическим медиатором у амфибий.
Значительно быстрее был решен вопрос об идентичности Vagusstoff ацетилхолину, и эта заслуга принадлежит Леви. Знания о высокой фармакодинамической активности ацетилхолина имелись уже давно [174], было также известно, что действие этого вещества на висцеральные органы точно соответствует парасимпатическим нервным эффектам [ИЗ]. Кандидат в медиаторы, таким образом, имелся, оставалось сравнить его с естественным гуморальным фактором.
Леви привлек внимание к сходству физических свойств ацетилхолина и Vagusstoff, а вскоре вслед за тем было показано, что оба вещества разрушаются одним и тем же ферментом холинэстеразой, от действия которого их защищает один и тот же алка-
лоид — эзерин, или физостигмин 1208]. Сходство проявляется и в других отношениях: тормозящее действие обоих веществ на сердце блокируется атропином; их активность, потерянная после обработки холинэстеразой, восстанавливается при ацетилировании и др. Возражения, что ацетилхолин не может быть медиатором, так как его нет в организме животных, были сняты после того, как этот эфир холина был получен в чистом виде из селезенки лошади [116].
После открытия'тшгибирующего действия эзерина на холинэстеразу, весьма активную в животных тканях, в частности в крови, стало намного легче собирать ацетилхолин в венозном оттоке от нервных окончаний. В 1932—1933 гг. были обнаружены чувствительные тест-объекты на ацетилхолин — дорсальная мышца пиявки (Фельдберг) и прямая мышца живота лягушки (Чанг и Геддум). Эти методические усовершенствования резко двинули вперед изучение передачи в нейроэффекторных окончаниях. За короткий срок работами ряда авторов, прежде всего Дейла и Фельдберга, было показано, что у млекопитающих ацетилхолин обеспечивает передачу парасимпатических нервных влияний на самые разные гладкомышечные и железистые органы [17].
Складывалось впечатление, что анатомически различимые отделы вегетативной нервной системы, парасимпатический и симпатический, имеют на своих эффективных выходах разные медиаторы — ацетилхолин и адреналин. В этот ответственный момент английский фармаколог Дейл проницательно предупредил уже назревавшее ошибочное представление. Он привлек общее внимание к фактам, которые свидетельствовали о том, что медиаторный химизм постганглионарных волокон может не совпадать с их принадлежностью к парасимпатической или симпатической системе. Из этих фактов следовало, что вопрос о специфическом химизме решается на клеточном, а не на органном уровне. Утверждая такой подход, Дейл предложил называть холинергическими волокна, секретирующие эфир холина, и адренергическими волокна, секретирующие адреналиноподобный медиатор, еще не идентифицированный в то время [114].
Терминология, предложенная Дейлом, оказалась очень полезной и сохранилась до наших дней в уточненном и расширенном виде.
Довольно быстро медиаторная гипотеза была подтверждена и на моторных нервных окончаниях в скелетных мышцах, хотя здесь ее положение было несравненно более трудным. Особенности нервно-мышечных соединений в скелетных мышцах, как тогда казалось, решительно отвергают всякую мысль о секреторном звене в мгновенном и повторяющемся с высокой частотой процессе «передачи импульса» с нерва на мышцу. Давние соображения Лэнгли, основанные на изучении блокирующих эффектов алкалоидов, были забыты, так как не могли гармонировать с господствовавшими в физиологии представлениями. Если для висце-
J5 Общая физиологии нервной систеин 225
ральных органов были известны вещества, полностью воспроизводившие эффекты нервных окончаний, то в отношении скелетных мышц таких знаний у фармакологии пе было (в числе других веществ не воспроизводил эффекта раздражения моторного нерва и ацетилхолин, когда ого добавляли в жидкость, окружавшую скелетную мышцу).
Решающий шаг был сделан профессором физиологии Казанского университета Самойловым [291. Изучая температурный коэффициент процесса распространения возбуждения, Самойлов обнаружил, что этот показатель существенно различен в нерве и в области нервно-мышечного соединения. Данные электрофизиологического эксперимента интерпретировались однозначно. В статье «О переходе возбуждения с нерва на мышцу» Самойлов изложил эти результаты и следующий из них вывод, что «процессы, протекающие в нерве и передаточном звене между нервом и мышцей при пробегании возбуждения, отличаются друг от друга: в нерве преобладают физические компоненты, в передаточном звене — химические. . . На границе двух клеток выделяется какое-то ближе неизвестное вещество, и это вещество служит раздражающим агентом для другой клетки» [51, с. 80].
Статья Самойлова имела решающее значение и для открытия химической передачи в межнейронных синапсах. Что касается дальнейшего изучения моторных окончаний, здесь следующий важный шаг сделал в Берлине Фельдберг, который в опытах на языке собаки показал, что при раздражении моторного нерва, не содержащего вегетативных волокон, в венозном оттоке обнаруживается вещество, сходное с ацетилхолином [133]. Появился кандидат в медиаторы, и нужпо было показать, что ацетилхолин все же способен воспроизводить эффект моторного нерва, если его подвести к мышце должным образом. В течение 1933—1936 гг. в лондонской лаборатории Дейла коллективом ученых (Броун, Гэддум, Фельдберг, Фогт) были получены эти и другие доказательства идентичности медиатора нервно-мышечных соединений ацетилхолину [171.
6.2.2. МЕЖНЕЙРОННАЯ ПЕРЕДАЧА
Убедившись в результате своих экспериментов в том, что нервно-мышечная передача имеет химическую природу и осуществляется веществом-посредником, Самойлов в той же статье выдвинул гипотезу, что таким же способом связаны между собой сами нейроны. «Обобщая. — писал он, — мы могли бы дальше' сказать, что везде, где нет слияния между погранич^ ними клетками и где процесс возбуждения должен перейти с одной клетки па другую, будь то синапс Шеррингтона в центральной нервной системе, будь то граница между эфферентными нервными волокнами и эфферентными органами, мы поймем особенности передачи возбуждения, и потерю во времени, и одно-
СТорбНноеГъ передачи, и суммирование и др., если примем, что из двух соприкасающихся клеток одна выработала в себе способность выделять раздражающее вещество, а другая — способность реагировать на это вещество» 1151, с. 81).
Обобщение Самойлова замечательно не только блестящей догадкой, но и тем, как безукоризненно оно сформулировано. Годом спустя к сходным мыслям пришел другой крупнейший физиолог того времени, Шеррингтон [250]. Но именно Казанский университет, в котором работал Самойлов, оказался местом, где была проверена эта гипотеза и получены решающие факты.
С 1912 г. Быков работал в Казани на верхнем шейном ганглии кошки, исследуя приложимость к межнейронному переключению тех представлений о рецепторной субстанции, которые Лэнгли разработал на мионевральном соединении (см. [8]). Тогда же появилась мысль о гуморальной изоляции этого объекта, ее удалась реализовать в 1918—1921 гг. [9].
ь.s В 1933 г. в опытах с перфузией верхнего шейного ганглия Кибяков показал, что при раздражении преганглионарных волокон в перфузате появляется вещество, которое при подведении к ганглию вызывает возбуждение постганглионарных нейронов (20, 21].
Хотя результаты Кибякова назревали в Казани в течение десятка лет, для большинства физиологов они явились полной неожиданностью. Однако в конце 1933 г. Фельдберг и Гэддум, предприняв проверку экспериментов Кибякова, подтвердили его результаты и получили указания на то, что и в этом случае медиаторную функцию выполняет ацетилхолин [134].
6.2.3. ПРИЗНАНИЕ МЕДИАТОРНОЙ ТЕОРИИ
Середина 30-х гг. явилась своеобразным рубежом в развитии проблемы медиаторов. Этот отрезок истории нейрофизиологии богат различными компромиссными гипотезами, в которых главная роль отводилась электрическому току, а та или даная дополнительная роль — химическому фактору.
Ситуация была очень разной в физиологии разных стран. 'Особенно неблагоприятной она была в США, где Кеннон, единственный видный ученый, занимавшийся медиаторами, был окружен стеной недоброжелательства [65, 75]. Не принимала медиа-торных представлений сильная нейрофизиология Франции. Значительно лучше обстановка для этих взглядов была в Англии 1И Швеции.
В Советском Союзе многие физиологи включились в разработку медиаторных представлений (см. обзоры [2, 12, 22, 23, 62] и др.).
.Группа ученых, изучавшая медиаторную функцию ацетилхолина в скелетных мышцах, работала в 1935—1950 гг. в Ленинграде под руководством Гинецинского. Здесь был открыт фундаментальный факт сужения холинорецептивиой области в онто
генезе мышечного волокна 113], здесь же начались систематические сравнительные исследования, приведшие к важным обобщениям о филогенетической истории этого химического синапса (см. [10, 11]).
В Москве успешно развивались исследования, которые возглавил Коштоянц. Впервые для изучения механизма синаптической передачи были использованы вещества, влияющие на синтез медиатора [28]. Изучение роли сульфгидрильных групп в рецепции ацетилхолина постсинаптическими клетками [35] позволило конкретизировать представление о «рецептивной субстанции». Коштоянц пришел к принципиально важному выводу, что рецепция медиаторов — это функция специальных белков [30]. Развитие этого направления исследований позволило в последующие годы впервые осуществить реакцию между медиатором (ацетилхолин) и рецептором in vitro [44 ] и показать, что холино-рецептор действительно имеет белковую природу [45, 59].
Большое значение для будущего развития проблемы медиаторов имели исследования по медиаторам беспозвоночных, начавшиеся в середине 30-х гг. В лаборатории Коштоянца было показано, что система ацетилхолина представлена у кишечнополостных [40], ленточных червей [3], гастропод [26]; в ганглиях гастропод были также найдены адреналиноподобные вещества [27]. Другим центром сравнительных исследований была в эти годы лаборатория бельгийского фармаколога Бакка, где получили свидетельства холинергических соединений у аннелид, сипункулид и некоторых других беспозвоночных (см. обзор [74]); здесь же удалось впервые осуществить выделение кристаллического ацетилхолина из нервной ткани, использовав для этой цели мозг осьминога [76]. Благодаря работам Бакка и Коштоянца к началу 40-х гг. стало ясно, что синаптическая передача посредством медиаторов представлена на всех уровнях эволюции нервной системы, т. е. является общим принципом ее работы. Из накопленных к тому времени данных следовало также, что химическая природа медиаторов едина у организмов, относящихся к разным зоологическим типам.
6.3, МЕДИАТОРНЫЕ ВЕЩЕСТВА
Выше уже говорилось, что медиаторную функцию выполняют разные, химически неродственные вещества. Несмотря на разнообразие медиаторов, можно все же сказать, что в этой роли выступают, как правило, небольшие органические молекулы, молекулярный вес которых лежит в пределах 150—300 дальтон. Более высоким может быть, по-видимому, молекулярный вес медиаторов пептидергических нейронов, но этот вопрос пока исследован слабо, и сегодня мы больше знаем о нейросекреторной функции пептидов, секретируемых нервными окончаниями, чем о их медиаторной функции.
По-видимому, высокомолекулярные вещества для выполнения медиаторной функции непригодны. Чем меньше размеры молекулы медиатора, тем проще нейрону создавать и поддерживать запасы этих молекул, необходимые для стабильной работы секреторных терминалей. Вместе с тем мелкие молекулы легче убирать из синаптической щели, чтобы сразу же вслед за актом передачи было расчищено место для следующего акта.
Небольшая молекула, однако, не может нести большой информации. По этой причине постсинаптические эффекты медиаторов относительно просты и во многих случаях, по-видимому, ограничиваются триггерным действием на тот или иной ионный канал субсинаптической мембраны. Вместе с тем известны примеры прямого действия медиаторов на энзимные системы постсинаптических клеток, и не исключено, что в некоторых синапсах медиатор может иметь не одну, а несколько точек приложения.
В этом разделе мы рассмотрим, какие известны медиаторы, у каких животных и в каких синапсах они встречаются. Предварительно нужно коснуться критериев, которые применяются при решении вопросов о принадлежности нейронов и синапсов к тому или иному типу медиаторного химизма.
8.3.1. ИДЕНТИФИКАЦИЯ
Тождество между кандидатом и естественным передатчиком считают установленным, если удовлетворены определенные критерии. Вопрос о критериях решался по-разному на разных этапах развития физиологии, что соответствовало ее методическим возможностям. По мере расширения этих возможностей число критериев сокращалось. В принципе, по-видимому, необходимо и достаточно выполнить лишь два критерия — на-копляемости и идентичности действия.
Первый критерий требует, чтобы при физиологических для пресинапса условиях стимуляции в синаптическую щель выделялось вещество-кандидат, количество которого должно быть пропорционально числу стимулов. По второму критерию действие кандидата и действие естественного передатчика на постсинаптическую структуру должно быть одинаковым — как по конечному эффекту, так и по молекулярным механизмам.
Очевидно, что применить эти два критерия довольно трудно, поэтому на практике исследователи широко пользуются «запасными», дополнительными критериями. Критерий присутствия требует, чтобы кандидат содержался в пресинаптической клетке и чтобы его содержание было особенно высоким в ее секреторных участках. По фармакологическому критерию агенты, влияющие на постсинаптические эффекты естественного медиатора, должны сходным образом влиять на эффекты кандидата при его искусственном подведении к субсинаптическим рецепторам.
т
Некоторые критерии, которыми пользовались раньше, признаны ошибочными или существенно изменены. Так, оказался неуниверсальным «критерий инактивирующего энзима», который в своей оригинальной форме гласил, что в синапсе должна присутствовать ферментная система, обеспечивающая разрушение кандидата в медиаторы. Ферментативная инактивация медиатора действительно имеет место во многих холинергических нейроэф-фекторных соединениях, и изучение роли холинэстеразы в такой передаче навело исследователей в свое время на мысль, что в любом химическом синапсе должен присутствовать фермент, выполняющий аналогичную функцию. Эта мысль оказалась ошибочной. Теперь известно, что очистку синаптической щели от медиатора осуществляют разные механизмы: обратный захват пресинапти-ческой структурой, разрушение, диффузия [1, 60, 175]. Поэтому в своем прежнем виде «критерий инактивирующего энзима» непригоден, но ему можно дать новую редакцию, учитывающую разнообразие способов устранения медиатора из синаптической щели. По такому критерию инактивации синапс может быть обеспечен специальным механизмом для быстрого устранения медиатора из синаптической щели; но независимо от того, имеется ли специальный механизм или действует простая диффузия, кандидат должен устраняться с теми же кинетическими характеристиками, что и сам медиатор.
Неудовлетворителен «критерий денервационного повышения чувствительности», хотя его нередко продолжают рекомендовать [195, 222]. Хотя у некоторых постсинаптических структур чувствительность к медиатору действительно повышается после денервации, иногда даже на несколько порядков [93], в других случаях этого нет (например, в локомоторных мышцах рака [148]), так что этот признак не может служить критерием.
Критический анализ сложного вопроса о критериях идентификации медиатора можно найти в ряде специальных работ [6, 72, 277, 278].
При выяснении вопроса о том, не относится ли исследуемая передача к одному из известных типов медиаторного химизма, следует иметь в виду следующее.
Во-первых, нужно иметь список известных медиаторов. Чтобы какое-то вещество оказалось занесенным в этот список, нужно, чтобы его медиаторная функция была строго, т. е. с необходимой полнотой выполнения критериев, доказана хотя бы в одном случае.
Во-вторых, для каждого из медиаторов, занесенных в список, нужно иметь руководящий признак, который позволял бы обнаруживать нейроны и синапсы, пользующиеся этим медиатором, среди всех других нейронов и синапсов.
Пользуясь руководящим признаком, мы даем предварительную идентификацию исследуемой передачи (или, говоря точнее, 230
пресинаптического нейрона), после чего необходимо подтвердить ее, пользуясь критерием идентичности действия.
Реальные возможности сегодняшней нейрофизиологии не всегда позволяют воспользоваться такой относительно простой схемой. Главная трудность заключается в отсутствии простых руководящих признаков. Лучше всего было бы располагать набором гистохимических методов выявления самих медиаторных веществ. Такие методы имеются, но далеко не для всех медиаторов. Широкое применение нашли пока только методы гистохимического выявления катехоламиновых медиаторов и серотонина. Опыт применения этих методов показывает, какой решительный прогресс в изучении определенных типов передачи достигается благодаря тому, что для всех этих типов имеется простой руководящий признак.
Ценным руководящим признаком может служить высокая активность фермента, синтезирующего медиатор. Здесь наиболее перспективными для выявления ферментов представляются иммуногистохимические методы, которые могут дать систему стандартных тестов, охватывающую все известные медиаторы. Иммуногистохимически могут выявляться также какие-то другие специфические белки, сопутствующие определенным медиаторам, — например, сателлитные белки секреторных гранул. Наконец, как руководящий признак (во всяком случае, пока нет более простых и надежных методов) используется субмикроскопическая морфология секреторных органелл.
Подробнее об имеющихся сейчас возможностях будет сказано ниже, при ознакомлении с самими известными медиаторами.
6.3.2. КАТЕХОЛАМИНЫ (ДОФАМИН, НОРАДРЕНАЛИН, АДРЕНАЛИН)
Три родственных в химическом отношении медиатора являются производными тирозина — дофамин, норадреналин и адреналин (в американской литературе два последних вещества называют норэпинефрин и эпинефрин). Мы рассмотрим эти медиаторы вместе только ради того, чтобы избежать повторений при описании некоторых явлений, которые касаются их всех; на самом деле это совершенно самостоятельные медиаторные вещества, каждое из которых выполняет функцию передатчика в своих собственных нейронах.
Общим для этих медиаторов является прежде всего, путь их синтеза. В животных тканях много тирозина, который они получают из пищи. Первый шаг на пути синтеза катехоламинов— катализируемое тирозиноксидазой гидроксилирование тирозина с образованием диоксифенилаланина (ДОФА). Следующая реакция — декарбоксилирование ДОФА — катализируется относительно неспецифической декарбоксилазой ароматических аминокислот; в результате этой реакции образуется дофамин. В нейронах, использующих дофамин в качестве медиатора, на этом дело конча
ется, по в нейронах двух других типов синтез медиатора продолжается. В результате гидроксилирования дофамина дофамин-бета-оксидазой образуется норадреналин. Наконец, в нейронах, способных к синтезу адреналина, имеется еще один фермент—фепил-этаноламин-Х-метилтрансфераза; под действием этого фермента норадреналин метилируется и образуется адреналин. Эти реакции показаны на рис. 6.1.
Рис. 6.1. Образование катехоламинов (реакции правой колонки) и альтернативный путь превращений тирозина, ведущий к образованию тирамина и октопамина (левая колонка).
I — тирозин; II — ДОФА; III — дофамин; IV — норадреналин; V — адреналин; VI — тирании; VII — октопамин.
Таким образом, дофамин, выполняя медиаторную функцию в одних нейронах, в других служит метаболическим предшественником медиатора; то же можно сказать о норадреналине. Вообще функции этих катехоламинов в животных организмах многообразны — так, хорошо известна их гормональная функция, а благодаря исследованиям Бузникова [6, 7] выяснилась их роль в регуляции эмбриогенеза.
Идентификация. Идентичность естественного передатчика дофамину с наибольшей полнотой доказана для синапсов в центральных ганглиях брюхоногого моллюска—катушки с гигантским дофаминсодержащим нейроном, который расположен у этого животного в левом педальном ганглии ([84, 232, 233, 237 ] — в этих работах можно найти ссылки на важные ранние исследования).
Исходными были биохимические данные о высоком содержании дофамина в нервной ткани многих моллюсков, в частности катушки (около 10 мкг на 1 г ткани ганглиев); гистохимические данные о том, что дофамин распределен в нервной ткани неравномерно — он имеется лишь в немногих нервных клетках и локализован преимущественно в варикозных расширениях аксонов этих нейронов, в синаптическом нейропиле; наконец, электрофизиологические данные_р сильных эффектах дофамина на нейроны этого и родственных организмов.
Левый гигантский педальный нейрон был избран для детального анализа как наиболее крупный из известных дофаминсодержащих нейронов. Удалось показать, что это интернейрон, моно-синаптически связанный со многими, в том числе идентифицируемыми, центральными нейронами. При проверке действия восьми медиаторных веществ только дофамин оказывал на постсинаптические клетки эффекты такой же полярности, что и естественный передатчик: в обоих случаях одни, определенные, нейроны деполяризовались, другие гиперполяризовались.
Далее было строго доказано, что первичный катехоламин, находящийся в исследуемом нейроне, действительно является дофамином, он содержится в теле клетки в количестве 5.4+0.6 нмоль на клетку, тогда как измеримых количеств норадреналина в ней обнаружить не удалось. Микрохимические исследования показали также, что нейрон неспособен синтезировать и катаболизировать норадреналин.
Фармакологические агенты, к которым чувствительны рецепторы дофамина, действуют параллельно на синаптические эффекты исследуемого нейрона и на эффекты дофамина на соответствующие клетки.
Очевидно, что критерии идентификации выполнены не с исчерпывающей полнотой. Было бы желательно наблюдать выход дофамина из аксонных терминалей при возбуждении пресинапти-ческого нейрона, а также сравнить ионные механизмы поляризующих эффектов дофамина и естественного передатчика на постсинаптические клетки. Видимо, эти исследования будут вскоре выполнены, но и имеющиеся данные оставляют мало сомнений в правильности идентификации.
Вопрос об идентичности медиатора норадреналину решался, как об этом говорилось, в исследованиях периферических симпатических окончаний млекопитающих. Сведения о медиаторной функции адреналина получены при изучении таких же окончаний у амфибий, и в этом случае идентификация осуществлена наименее надежно, так что некоторые специалисты высказывают в ней Сомнение [14].
Руководящие признаки. Трудная проблема руководящих признаков практически решена для нейронов, имеющих катехоламиновые медиаторы. Реакция конденсации катехоламина с альдегидом позволяет обнаруживать катехоламинсодержащие
нейроны и синапсы в люминесцентный микроскоп, а иммуногистохимия дает возможность надежно дифференцировать три катехоламиновых медиатора. Ввиду большого практического значения этих методов остановимся на них подробнее.
Прямое микроскопическое выявление катехоламинов, а также серотонина — медиаторного вещества индольной природы — стало возможным после 1962 г., когда появился знаменитый метод Фалька и Хилларда (см. полное описание метода в работах [107, 131J). В основе метода лежат две последовательно протекающие
А
гн„ -Н,0 Л СН,-Но г СИ,
NHa C"C4/NH “"'C^N
Нг\
R..,ll СИ
Рис. 6.2. Реакции, лежащие в основе формальдегидного метода люминесцентно-микроскопического выявления биогенных аминов.
А — общая схема реакций; Б — превращения дофамина; В — превращения серотонина. I — исходный арилатиламин; II — продукт его конденсации с формальдегидом; III — продукт дегидрирования конденсированного соединения формальдегидом.
реакции амина с формальдегидом: в ^"результате первойJреакции они конденсируются, а в ходе второй реакции продукт конденсации дегидрируется избыточным формальдегидом. Ко-нечныйТпродукт обеих.Треакций проявляет сильное’свечение (см. схему реакций на рис. 6.2).
В оригинальной прописи этого метода обе реакции проводились одновременно, что создавало ряд ограничений и вынуждало пользоваться газообразным формальдегидом. Процедуру удалось значительно^упростить, когда реакции разделили, подобрав для каждой из них оптимальные условия; получился так называемый «водный» формальдегидный метод, который, однако, имеет собственные огранйчения [56, 57]. Позже был предложен метод, в котором вместо формальдегида взята глиоксалевая кислота; продукт реакции в этом случае обладает еще более сильным свечением, а в гистохимической процедуре учтен опыт разделения последовательных реакций [73, 2031.
Метод формальдегидной конденсации позволяет ио спектральным характеристикам и просто по цвету свечения отличать кате-234
холамины от серотонина и других индольных соединений, но дифференцирование между самими катехоламинами связано с техническими трудностями и недостаточно надежно. Здесь на помощь приходит иммуногистохимия, которая позволяет воспользоваться различиями ферментного состава нейронов, имеющих разные катехоламиновые медиаторы. Применяя антитела против дофа-мин-бета-оксидазы, можно отдифференцировать дофаминергические нейроны, в которых этот фермент отсутствует; оставшиеся катехоламипсодержащие нейроны дифференцируют с помощью антител против фенилэтаноламин-Ы-метилтрансферазы — фермента, который имеется только в тех нейронах, где норадреналин служит предшественником синтеза адреналина 1170, 171].
Рассмотренными методами не ограничиваются возможности распознания нейронов, имеющих катехоламиновые медиаторы. Дополнительные возможности открывает электронная микроскопия. Предположен ряд методических приемов, позволяющих демонстрировать присутствие катехоламинов в везикулярных органеллах цитоплазмы нервных и иных клеток.
Из опыта электронной микроскопии известно, что везикулы, в которых заключен катехоламин, характеризуются электронноплотным содержимым, которое обычно концентрируется в центре такой «dense cored» везикулы. Имеются основания считать, что это плотное ядро образуется в результате цепи реакций, которая начинается реакцией конденсации между амином и фиксирующим альдегидом и заканчивается восстановлением металлического окислителя. Установление катехоламиновой природы содержимого везикул и дифференцирование между аминами основано на использовании разных фиксирующих альдегидов (глютаровый, муравьиный, акриловый), которые применяются в сочетании с тем или иным металлическим окислителем (перманганат, бихромат, четырехокись осмия) [168, 284, 286, 287].
Электронная микроскопия использует также способность нейронов, у которых медиатором служит тот или иной катехоламин, захватывать этот амин нервными окончаниями из внеклеточной среды [1, 175]. Хотя специфичность таких систем захвата не абсолютна, указанное свойство позволяет локализовать катехолами-нергические окончания авторадиографическим методом [49, 89].
Наконец, имеется серия фармакологических агентов, облегчающих определение локализации катехоламинсодержащих нейронов. Одни вещества (например, альфа-метилметатирозин) лишают везикулы таких нейронов плотного содержимого, но никак не влияют на внешний вид везикул, содержащих другие медиаторы; другие агенты (например, 5-оксидофамин), напротив, резко повышают электронную плотность содержимого катехоламинсодержащих везикул [191, 264].
Распространение. По-видимому, имеются два цитологически различимых типа нервных клеток, секретирующих .^атехоламиновые медиаторы. Первый тип — это мелкие интен-
сивно люминесцирующие клетки (small intensely fluorescent — SIF), которые обязаны своим названием тому, что на препаратах, приготовленных по методу Фалька и Хиллирпа, эти клетки светятся намного сильнее «обычных» катехоламиновых нейронов. Второй тип — сами «обычные» катехоламиновые нейроны, примером которых могут служить симпатические гинглионарпые нейроны млекопитающих.
У клеток первого типа относительно короткие отростки, крупные аминсодержащие гранулы (более 100 нм) и высокая концентрация катехоламина в перикарионе. У клеток второго типа длинные аксоны, обильно ветвящиеся и варикозные в своей терминальной области, относительно небольшие гранулы (меньше 100 нм), высокая концентрация катехоламина в варикозных расширениях аксона, но относительно низкая в перикарионе. Объем знаний об «обычных» катехоламиновых нейронах намного больше, чем о SIF-клетках.
Несомненно, что SIF-клетки — это нейронный вариант железистых клеток хромаффинной ткани. Довольно давно изучаются эндокринные функции хромаффинных клеток, но мысль о том, что катехоламин, секретируемый хромаффинной клеткой, может служить не гормоном, а медиатором, возникла лишь несколько лет назад. Группы SIF-клеток закономерно встречаются в симпатических ганглиях млекопитающих [85], и здесь их считают дофаминергическими интернейронами [202], В составе центральной нервной системы SIF-клетки найдены лишь у наиболее примитивных позвоночных — у миноги и некоторых рыб [78]. Достоверных данных о наличии хромаффинных нейронов у беспозвоночных не имеется.
Упомянутое выше мнение о том, что медиатором SIF-клеток симпатических ганглиев является дофамин, нуждается в проверке. Иммунногистохимические данные указывают на то, что эти клетки могут служить источником норадреналина, а также адреналина [122], т. е. тех двух катехоламинов, которые секретируются хромаффинными клетками надпочечников.
Перейдем теперь к «обычным» катехоламиновым нейронам, которые, в отличие от хромаффинных, обнаружены не только у позвоночных, но и у беспозвоночных животных, в том числе и у таких примитивных, как кишечнополостные. Существенное различие в этом отношении между примитивными и сложно организованными животными состоит, по-видимому, в том, что у примитивных имеется только один катехоламиновый медиатор, — дофамин, тогда как в нервной системе млекопитающих представлены все три медиатора.
Дофаминергические нейроны находятся у млекопитающих преимущественно в среднем мозге (нигро-неостриарная система нейронов). Кроме того, дофаминергические клетки имеются в составе сетчатки (их волокна не выходят на ее пределы) и в гипоталамической области (в частности, клетки арочного ядра). Более 236
детальные данные о локализации дофаминергических, а также норадренергических нейронов в мозге млекопитающих можно найти в ряде специальных и обзорных работ [5, 24, 69, 86, 204, 267].
Возможно, что не только клетки среднего мозга являются дофаминергическими. В опытах на собаках были получены сви-детельства дофаминергической иннервации почечных сосудов, активируемой при раздражении среднего мозга 181 ].
Норадренергические нейроны имеются в ц. н. с. млекопитающих в составе среднего мозга, варолиева моста, продолговатого и промежуточного мозга. Они дают начало восходящим волокнам, которые оканчиваются в гипоталамусе, таламусе, лимбических отделах переднего мозга, в коре мозга и мозжечка, а также нисходящим волокнам, которые идут в спинной мозг. Самая значительная группа норадренергических клеток находится в голубом пятне, кроме нее в варолиевом мосте имеются еще две небольшие группы. В среднем мозге норадренергических клеток немного, в продолговатом крупное скопление их расположено в вентролатеральном отделе ретикулярной формации и небольшая группа лежит в комиссуральном ядре, наконец, в промежуточном мозге норадренергические нейроны наряду с дофаминергическими имеются в составе гипоталамо-гипофизарной системы.
У млекопитающих много норадренергических нейронов в составе периферической нервной системы, их тела лежат в симпатической цепочке и в некоторых интрамуральных ганглиях.
Как уже говорилось, ранее эти периферические нейроны считались адренергическими; затем выяснилось, что медиатором здесь служит норадреналин, и в течение четверти века думали, что адренергических нейронов у млекопитающих нет. Теперь вопрос снова пересматривается. В продолговатом мозге крысы среди катехоламинсодержащих нейронов найдены две небольшие группы, в которых представлен полный набор ферментов синтеза адреналина [171]. Микрохимическое определение содержания адреналина в разных участках мозга дало хорошее совпадение с результатами иммуногистохимической локализации феиилэта-ноламин-^метилтрансферазы: адреналин обнаружен, в частности, в латеральном ретикулярном ядре, где лежат тела таких нейронов, и в терминальных областях их аксонов — перивентрикулярной области гипоталамуса и голубом пятне [193].
У представителей других классов позвоночных катехоламинсодержащими являются те же группы нейронов, которые имеют катохоламиновый медиатор у млекопитающих. В этом проявляется общее правило, согласно которому гомологичные нейроны имеют одинаковый тип секреторного химизма [54, 55]. Сравнительные исследования позволяют обнаружить следующие эволюционные тенденции в. распределении катехоламиновых нейронов у позвоночных. Во-первых, уменьшается относительное число и сокращается область распространения таких нейронов в ц. н. с.; так, у костистых рыб норадренергические нейроны еще имеются
в составе спинного мозга, но этого уже нет у наземных позвоночных [78]. Во-вторых, в процессе эволюции позвоночных неуклонно расширяются области, иннервированные катехоламиновыми симпатическими нейронами, при этом у разных классов наблюдаются независимые, но сходные процессы заселения такими нейронами эффекторной периферии и образования новых ганглиев [96]. В-третьих, в процессе эволюции, по-видимому, пмеет место диверсификация катехоламиновых медиаторов. Для постганглпонарных симпатических нейронов это норадреналин у большинства позвоночных, но адреналин у амфибий, хотя сами нейроны несомненно гомологичны. В этом явлении можно видеть как бы модель образования нового медиатора на основе старого.
Имеется большая литература о распределении катехоламиновых нейронов у представителей многих групп беспозвоночных. Такие нейроны обнаруживаются в составе нервной системы на очень раннем этапе ее эволюции — у актиний, но у более примитивных кишечнополостных их не нашли [46, 54, 112]. Интересно, что в простой нервной системе актиний катехоламиновые нейроны, по-видимому, мультифункциональны, т. е. выполняют и сенсорную, и моторную функцию [54, 55]. Такие мультифункци-ональные клетки вообще известны в просто организованных нейронных системах [106,279]. Если это так и если эволюционная история катехоламиновых нейронов начинается с мультифункцио-нальных клеток, то в процессе эволюции нейроны этого химического типа могли приобретать самую разную функциональную специализацию.
Действительно, у беспозвоночных с мягкими покровами ка-теколаминовые нейроны преимущественно расположены на сенсорной периферии; у покрытых хитином членистоногих они сосредоточены в составе центральных ганглиев и являются главным образом интернейронами; у тех и других имеются эфферентные нейроны с катехоламиновым медиатором, которые иннервируют определенные мышцы (например, мышца стенки пениса у голожаберного моллюска [55]), железы (например, слюнная железа мотылька [241]) и т. д.
Преимущественным катехоламином нервной ткани беспозвоночных является дофамин, который, по-видимому, и служит медиатором — по крайней мере у относительно примитивных групп беспозвоночных, имеющих катехолампновые нейроны [183]. Данные о существовании наряду с дофаминергическими норадренергических нейронов имеются для аннелид и членистоногих [121, 186]; вероятно, такова же ситуация у головоногих моллюсков и, возможно, у некоторых гастропод. Надежных данных о наличии у беспозвоночных адренергических нейронов нет, но имеются сильные кандидаты в медиаторы среди веществ, которые родственны трем рассмотренным катехоламинам (тирамин, октопамин). О кандидатах будет сказано ниже.
Катехоламинам беспозвоночных посвящены обзоры [183, 2751, 239
в которые не вошли цепные сравнительные данные о катехоламинсодержащих нейронах плоских червей [37, 82, 209], круглых червей [18, 48], насекомых [186], голожаберного моллюска тритонии [39] и головоногого моллюска осьминога [178, 215]. Выпадает из общего ряда работа, авторы которой нашли адреналин преобладающим катехоламином нервной ткани у беспозвоночного животного — многощетипкового червя Glycera [212].
6.3.3. СЕРОТОНИН (5-ОКСИТРИПТАМИН)
Серотонин имеет много общего с катехоламинами. Обнаруженный сначала в энтерохромаффинных клетках кишечника, а затем в сыворотке крови, он подобно адреналину исходно интересовал исследователей как гормон [41, 126, 131], В память о том периоде, когда серотонину приписывали участие в регуляции сосудистого тонуса, осталось название этого вещества. Сходство с катехоламинами выражено и в строении серотонина, который, как и они, представляет собой арилэтиламмн. Подобно дофамину, который получается при декарбоксилировании ДОФА, серотонин образуется благодаря декарбоксилированию 5-окси-триптофана, причем обе реакции катализируются одним и тем же ферментом — декарбоксилазой ароматических аминокислот. Наконец, оксигруппа, стоящая в 5-м положении индольного кольца молекулы серотонина, обеспечивает сходство реакционных свойств серотонина и медиаторных катехоламинов; благодаря этому сходству способы обнаружения серотонина и катехоламинов во многом одинаковы и эти вещества объединяют общим названием — биогенные амины.
Источником медиаторного серотонина служит аминокислота триптофан. Подобно тирамину, из которого образуются катехоламины, триптофан крови проходит у млекопитающих через гематоэнцефалический барьер; в нервной ткани триптофан гидроксилируется с образованием 5-окситриптофана, который затем декарбоксилируется до серотонина (рис. 6.3); детальнее см. [16, 36, 159].
Идентификация. Исчерпывающие доказательства медиаторной функции серотонина были впервые представлены для окончаний нервных волокон, стимулирующих биения сердца у виноградной улитки.
Кандидатура серотонина в качестве медиатора кардиостимулирующих нервных влияний у моллюсков была предложена американским нейробиологом Уэлшем [273, 274], который наблюдал высокую чувствительность к серотонину у одного из видов двустворок. Интерес к этому вопросу сильно поддержали появившиеся почти одновременно данные о том, что серотонин имеется в мозге позвоночных [266] и что его распределение по отделам мозга весьма неравномерно [68]. В лаборатории Коштоянца группа сотрудников занялась изучением функций серотонина в нервной системе моллюсков. Удалось, в частности, показать, что у ви-
ноградной улитки при раздражении сердечного нерва в сердце выделяется фактор, оказывающий на другое сердце действие, характерное для серотонина [32, 34]. Позже двое из участников этой работы, Шаланки и Ш. Рожа, развили в Венгрии исследование функций серотонина у моллюсков (см. обзор [247]). На том же сердечно-нервном препарате виноградной улитки был выполнен фармакологический критерий [256], а затем и критерий накопляемости: было показано выделение серотонина в промывную жидкость сердца улитки при раздражении нерва [257].
Установленная этими работами медиаторная функция серотонина в сердце гастропод была поставлена под сомнение одной
Рис. 6,3. Образование серотонина.
1 — триптофан; Ы — 5-онситриптофан; III — 5-океитриптамин (серотонин).
из последующих статей, в которой на основе гистохимического исследования авторы сообщали, что в сердце брюхоногого моллюска прудовика серотонин локализован в гранулах внутри мышечных клеток, а нервный контроль осуществляется катехоламином внутрисердечных нервных^клеток [258]. Эти результаты, однако, оказались ошибочными;“гистохимические исследования, проведенные на сердцах разных гастропод, в том числе прудовика, показали, что в сердце нет катехоламинсодержащих нейронов, а серотонин локализован’в_аксонах, приходящих в составе сердечного нерва (см. [55]).
С хорошей полнотой выполнения необходимых критериев идентичность медиатора серотонину доказана не только на нейро-эффекторных, но и на межнейронных синапсах гастропод; для этого использованы парные гигантские серотонинергические интернейроны, имеющиеся в церебральных ганглиях у легочных и заднежаберных моллюсков [109, 155, 158].
Руководящие признаки. В распоряжении исследователя имеются хорошие и относительно несложные воз-
МО/КИости идентификации Серотонийергических нейронов. Ёлагй-даря сходству реакционных свойств серотонина и катехоламинов к серотонину приложимы упомянутые выше методы люминесцентногистохимического и электронномикроскопического обнаружения на срезах ткани, в основе которых лежит реакция конденсации арилэтиламина с альдегидом. Выявление этими методами серотонинергических нейронов имеет некоторые особенности.
В люминесцентном методе Фалька и Хилларпа продукт гистохимической реакции серотонина обладает относительно слабым свечением, которое, кроме того, отличается нестойкостью и гаснет под действием ультрафиолета при просмотре препаратов. Чтобы преодолеть эти трудности, предложен ряд приемов. Одни из них направлены на то, чтобы повысить внутриклеточную концентрацию серотонина — например, ингибированием моноаминокси-дазы — фермента, метаболизирующего серотонин. Хорошие результаты дает нагрузка животных предшественником серотонина — L-триптофаном, которая значительно облегчает избирательное обнаружение нейронов, способных превращать триптофан в серотонин [66]. Другая группа приемов связана с использованием производных серотонина, которые избирательно накапливаются в серотонинергических нейронах и в результате гистохимической реакции дают продукт, обладающий интенсивным свечением. Такими свойствами, в частности, обладают вещества, подобные серотонину, но имеющие одну дополнительную оксигруппу в 6-м или 7-м положении; эти диокситриптамины интересны также тем, что они вызывают избирательную дегенерацию серотонинергических нейронов [87] — эффект, подобный действию 6-оксидофамина на катехоламиновые нейроны [263].
Сказанное выше в полной мере относится и к выявлению серотонина водным формальдегидным методом.
Нужно, однако, учитывать, что люминесцентные методы, основанные на конденсации с формальдегидом, не дифференцируют между серотонином и другими индольными производными. Поэтому желтое свечение продукта реакции, обнаруженное в каких-то клетках, нельзя рассматривать как гарантию того, что в этих клетках находится серотонин, а не другое индольное соединение, которое, быть может, выполняет функцию медиатора. Желательно, чтобы природа гистохимически обнаруженного свечения была удостоверена химическим анализом соответствующего участка нервной ткани. Существуют чувствительные методы, позволяющие определять содержание серотонина в очень небольших навесках ткани и даже в отдельных крупных клетках [217, 219,226,231].
Для предварительной идентификации серотонинергических нейронов может также применяться электронная микроскопия и авторадиография. В электронной микроскопии содержимое везикул, в которых запасен серотонин, выявляют с помощью метода Вуда [183], в основе которого, по-видимому, лежит конденсация
16 Общая физиология нервной системы 241
серотонина с формальдегидом и последующая хромаффиновая реакция. Нужно заметить, иго хромаффинность серотонинсодержащих нейронов, фиксированных формалином, стала причиной того, что эти нейроны (например, у аняелид) были ошибочно идентифицированы как хромаффинные клетки [1511, и это породило некоторые неверные представления о роли адреналина беспозвоночных и эволюции хромаффинной ткани [11, 152]. Хотя Этот вопрос был уточнен, химическая сторона хромаффинной реакции остается во многом неясной и важный для современных исследований вопрос о специфичности метода Вуда требует дальнейшего изучения. Что касается возможностей авторадиографии, они иллюстрируются работой, показавшей, что в нервной ткани имеется специфичный для серотонинергических нейронов захват экзогенного меченого серотонина и 5-окситринтофана, тогда как захват триптофана неспецифичен [234].
Иммунохимическим маркером серотонинергических нейронов может, по-видимому, служить триптофаноксидаза—фермент, катализирующий превращение триптофана в 5-окситриптофан [197]. Дальнейшее превращение 5-окситриптофана в серотонин, как уже говорилось, катализируется малоспецифичной декарбоксилазой ароматических аминокислот.
Распространение. У млекопитающих серотонинергические нейроны найдены только в древних, стволовых частях головного мозга, их отростки не покидают ц. н. с. Тела нейронов лежат преимущественно в срединной области мозгового ствола — в составе дорсального и медиального ядер шва продолговатого, среднего мозга и варолиева моста. Небольшие скопления таких клеток найдены также в каудальной части среднего мозга. Серотонинергические нейроны иннервируют обширные областиц. н. с., включающие новую кору, гиппокамп, бледный шар, миндалину, подбугровую область, ствол головного мозга, спинной мозг, выстилку желудочков мозга [104, 117, 150, 224, 267]. В коре головного мозга окончания этого типа наиболее плотно представлены в фронтальных отделах. В стволе они имеются в ряде ядер черепномозговых нервов, в частности в моторных ядрах блуждающего и тройничного нервов. Недавно найдены проекции серотонинергических нейронов ядер шва в кору мозжечка [251]. Можно думать, что этот характер распределения присущ всем позвоночным, но сравнительных данных, которые позволили бы выявить эволюционные тенденции серотониновых нейронов у позвоночных, пока недостаточно.
Наиболее примитивные из беспозвоночных, у которых в составе нейронной популяции имеются особые серотонинсодержащие клетки, — это плоские черви. Изучение локализации, связей и функций таких клеток представляет большой интерес, так как у плоских червей, возможно, сохранилось примитивное строение, позволяющее реконструировать происхождение и начальные этапы эволюции серотонинергических нейронов. Имеющиеся дан-242
ные об этих нейронах у одной из паразитических трематод противоречивы [82 , 209 J, но результаты, полученные разными авторами на разных видах планарий, довольно однозначны и указывают на то, что серотонинсодержащие нейроны находятся в структурах ортогона 137, 47, 276] и, в отличие от катехоламиновых нейронов планарин, не обнаруживают отношения к эктодермальному эпителию.
Из других видов беспозвоночных неплохо изучены в отношении серотонинергических нейронов аннелиды, моллюски и членистоногие (см. обзор [53]). Обращает на себя внимание тот факт, что во всех трех типах распределение таких нейронов напоминает схему, представленную у турбеллярий: серотонинергические клетки всегда отсутствуют в передних структурах ц. н. с,, являющихся производными эндона, их расположение не характерно) в области эктодермального эпителия, но весьма характерно нахождение в составе «передних» ганглиев — таких как сегментарные ганглии аннелид, ганглии висцеральной дуги, а также педальные ганглии и педальные доли церебральных ганглиев гастропод, стоматогастрические ганглии насекомых.
Функции, выполняемые серотонинергическими нейронами, весьма разнообразны. Только у моллюсков, относительно хорошо изученных в этом отношении, серотонин служит медиатором в окончаниях, которые стимулируют биения ресничек (например,, в жабрах мидии) и сердечные биения (у улитки), вызывают расслабление или, напротив, усиливают сокращения мышц [269]. Гигантские серотонинергические нейроны пиявки (так называемые клетки Ретциуса) регулируют работу желез, выделяющих слизь; вместе с тем у пиявки находят центральные серотонинергические синапсы [2531. Во многих случаях нейроны этого химического типа не связаны с эффекторами и выполняют функцию интернейронов (например, в мозге позвоночных), но серотонинергических нейронов, связанных с выполнением сенсорных функций, пока как будто не находили. 1
6.3.4. АЦЕТИЛХОЛИН
Как и вещества, о которых шла речь выше, ацетилхолин у многоклеточных организмов выполняет не только медиаторную функцию. Известно, что он служит регулятором зародышевого развития [6, 7], входит в состав яда некоторых растений и животных, играет какую-то неясную, но определенно не медиаторную роль в плаценте и т. д. Высказывают мысль, что как медиаторная, так и немедиаторные функции ацетилхолина реализуют способность этого соединения влиять на проницаемость биологических мембран (34, 144]. Ацетилхолину посвящена большая литература 141, 43].
В химическом отношении ацетилхолин стоит особняком средн ц?вестцых медиаторов: он относится к простым эфирам — группе,
в которой никакое другое вещество, насколько сейчас известно, медиаторной функции не выполняет. Ацетилхолин — уксуснокис-лый эфир холина CHSCOOCH2CH2NOH(CH3)3. Он образуется при ацетилировании холина, которое катализируется ацетилтрансферазой холина. Еще одна особенность ацетилхолина как медиатора заключается в том, что, попав в результате секреции во внеклеточную среду, ацетилхолин в ней разрушается; в других изученных случаях медиаторы реутилизирутотся без предварительного разрушения их молекулы. Гидролитическое расщепление ацетилхолина осуществляется у разных животных и в разных тканях весьма разнообразными холинэстеразами, чаще других холинэстераз эту роль выполняет ацетилхолинэстераза, или ацетилгидро-лаза ацетилхолина [4].
Идентификация. Как уже говорилось выше, ацетилхолин был первым из веществ, выполняющих медиаторную функцию, для которого с необходимой полнотой удалось удовлетворить критерии идентификации. Сначала это было сделано на препарате блуждающий нерв—сердце лягушки, затем на ряде нейроэф-фекторных соединений и на передаче с пр егангл ио парного па ганглионарный симпатический нейрон у млекопитающих животных.
В относительно недавние годы очень полно исследована и хорошо доказана идентичность медиатора ацетилхолину для одного из интернейронов (клетка L10) абдоминального ганглия моллюска аплизии [88, 156, 189, 218[.
Руководящие признаки. В течение нескольких десятилетий после установления медиаторной функции ацетилхолина в синапсах периферической нервной системы позвоночных нейрофизиология не могла найти отличительный признак холинергических нейронов. По этой причине очень долго в оценке роли холинергической передачи в ц. н. с физиологи основывались более на убеждениях, чем на знаниях, и многие из них придерживались в этом вопросе крайних мнений, подобно Отто Леви, который в 1949 г. заявлял, что считает все центральные синапсы холинергическими (см. [278]).
Положение еще более усложнилось после появления гистохимического метода выявления холинэстераз 1188]. Некритическая интерпретация результатов, полученных этим н другими сходными методами, приобрела массовый характер и стала причиной множества ошибочных заключений. Чисто методические ошибки локализации фермента, особенно в электронной микроскопии, играли отрицательную роль, но она была не так велика, как роль ошибочных убеждений в том, что присутствие холинэстеразы—признак холинергических нейронов и свидетельство участия ацетилхолина в передаче. В действительности вопрос далеко не так прост. Присутствие холинэстеразы более характерно не для холинергических (т. е. секретирующих ацетилхолин) структур, а для хо-линореактивяых (т. е. чувствительных к ацетилхолину), но и это не общее правило. В некоторых хорошо изученных объектах 244
(ганглии аплизии) распределение холинэстеразы неспецифично, чем оно резко отличается от распределения ацетилхолина и ацетилтрансферазы холина, характерных для холинергических нейронов. Во многом неясный вопрос о локализации и функциях холинэстераз проанализировала недавно Сильвер [252].
Не оправдалась надежда избирательно импрегнировать содержимое холинергических пузырьков смесью цинк—иод—осмий 167]. Последующие исследования показали, что этим методом могут импрегнироваться и везикулы, не содержащие ацетилхолина.
Морфология секреторных пузырьков также не является признаком, позволяющим надежно узнавать холинергические окончания. Хотя во всех исследованных случаях пузырьки, содержащие ацетилхолин, имеют общие черты: у них круглый профиль и они не имеют плотного содержимого, характерного для пузырьков, в которых запасаются биогенные амины, все же эти признаки по всей вероятности присущи синаптическим пузырькам не только холинергических окончаний. Такими же, например, являются пузырьки, содержащие глутамат. Размеры пузырьков, запасающих ацетилхолин, нестандартны: эти пузырьки, например, почти вдвое крупнее в окончаниях на электрических пластинках ската, чем в окончаниях на скелетномышечных волокнах млекопитающего.
Конечно, прямое гистохимическое обнаружение ацетилхолина было бы наилучшим решением проблемы, но пока нет соответствующей методики.
Успешно развиваются методы микрохимического определения ацетилхолина [157]. Усилия направлены также на развитие методов локализации ацетилтрансферазы холина — фермента, который по всей вероятности специфичен для холинергических нейронов. Достигнуты некоторые, но все же скромные успехи в разработке метода гистохимического обнаружения этого фермента [100], одновременно энергично ведется разработка иммуногистохимического метода. Трудности, связанные со слабостью антигенных свойств ацетилтрансферазы холина мозга млекопитающих [210], в значительной степени преодолены, и уже наметились реальные успехи [165, 221, 243]. В перспективе возможна иммунохимическая локализация других белков, специфичных для холинергических нейронов, например везикулина — кислого белка секреторных везикул [281].
Распространение. У млекопитающих хорошо изучено распределение тех холинергических нейронов, у которых секреторные терминали находятся вне ц. н. с. Сюда относится, во-первых, значительная часть эфферентных нейронов интрамуральных ганглиев (в желудке, кишэчнике, мочевом пузыре, сердце и т. д.); во-вторых, эфферентные нейроны спинного мозга и некоторых черепномозговых моторных ядер, иннервирующие скелетную мускулатуру; в-трэтьих, спинномозговые нейроны, иннервирующие хромаффинные клетки; в-четвертых, расположенные в спинном и головном мозге прегапглионарные нейроны,
иннервирующие нервные клетки интрамуральных и экстраму-ральных ганглиев.
Системы холинергических нейронов, расположенных в ц. н. с. и не дающих выходов на периферию, изучены гораздо хуже в связи с методическими трудностями, о которых говорилось выше. Несомненно, что ацетилхолин выполняет медиаторную функцию в мозге (например, в синапсах между аксонными коллатералями спинальных мотонейронов и клетками Реншоу), но до сих пор сохраняется неясность относительно удельного веса и локализации холинергических интернейронов. Имеется большая литература о концентрации ацетилхолина и активности его синтеза разными структурами ц. н. с., о выходе ацетилхолина из них при разных раздражениях, о влиянии перерезок и фармакологических агентов, о локализации холинореактивных структур и структур, проявляющих ацетилхолинэстеразную активность, и т. д. (см. обзор [195]). Вся эта литература позволяет с большей или меньшей уверенностью называть холинергическими некоторые нейронные системы головного мозга: так, холинергические нейроны, вероятно, имеются в составе ретикулярной формации среднего мозга, таламических проекций в первичную сенсорную кору, септальных проекций в гиппокамп (см. также 1146]).
В сравнительном плане вопрос о холинергических связях в ц. н. с. позвоночных практически не изучен, но периферическим связям этого типа посвящена большая литература, позволяющая реконструировать историю развития холинергических нейронов. По мнению Бернстока [96], в процессе эволюции вегетативной нервной системы позвоночных имели место радикальные изменения нейронного состава анатомических структур и, вследствие этого, переиннервация некоторых периферических органов, сопровождающаяся сменой медиаторных механизмов. Так, в противоположность млекопитающим и рептилиям, у которых блуждающий нерв приносит к желудку холинергические волокна, у костистых рыб состав этого нерва иной, а холинергические волокна приходят к желудку в составе симпатических нервов. Вообще Бернсток считает, что симпатический отдел вегетативной нервной системы на ранних этапах эволюции позвоночных был представлен холинергическими нейронами, которые затем все больше и больше заменялись норадренергическими. Если это и так, то не следует думать, что участие холинергических нейронов в иннервации периферических органов уменьшалось в процессе эволюции, — напротив, оно неуклонно расширялось. Сердце, неиннервирован-ное у миксин, иннервируется только холинергическими волокнами у миног и акул; у костистых рыб в сердце появляются холинергические («парасимпатические») нейроны, что обеспечивает дальнейшее увеличение области и плотности холинергической иннервации; у костистых же рыб к сердцу впервые приходят отростки норадренергических нейронов, и в ходе последующей эволюции прогрессируют обе медиаторные системы. В некоторых дру
гих внутренних органах, как и в сердце, интрамуральных холинергических нейронов нет у представителей примитивных групп, но они появляются на каком-то этапе эволюции позвоночных.
В отличие от эфферентных нейронов вегетативных органов, мотонейроны скелетных мышц в истории развития позвоночных дают довольно однообразную картину. Холинергическая иннервация этих мышц представлена у всех позвоночных, включая самые примитивные группы; ацетилхолин сохраняет свою медиаторную функцию и в тех случаях, когда радикально меняется функция эффектора, в частности при превращении некоторых мышц в электрические органы у хрящевых и костистых рыб. Наблюдающееся у млекопитающих разделение альфа-мотонейронов на субпопуляции, связанные с иннервацией медленных (красных) и быстрых (белых) мышечных волокон, очевидно, не является приобретением эволюции позвоночных, так как представлено не только у высших позвоночных, но и у хрящевых рыб [90], миног [262], миксин [70] и даже у ланцетника [163]. Различия между этими двумя нерЪномышечными системами не усиливаются, а скорее сглаживаются в процессе эволюции: в отличие от высших позвоночных, у которых красные и белые мышечные волокна смешаны в одних мышцах, у низших хордовых они разведены по разным анатомическим структурам, что представляется исходной, примитивной ситуацией; замечательно, что размеры синаптических везикул различны в окончаниях на красных и белых мышечных волокнах ланцетника [138] — явление неизученное, но, возможно, существующее и у других позвоночных животных,
В эволюции иннервации сегментарных мышц подмечены еще два примечательных явления. Во-первых, имеются указания на то, что у примитивных позвоночных такие мышцы могут иметь не чисто холинергическую, а двойную иннервацию 119, 91]. Во-вторых, изменился способ контакта холинергического нейрона с мышечной клеткой: у ланцетника, а также у личинки асцидии эти контакты расположены не в мышце, а на поверхности нервной трубки [138, 260]. Знаменательно, что таким же способом контактируют с мотонейронами мышечные клетки стенки тела круглых червей (аксарид) и передатчиком здесь тоже служит ацетилхолин.
Среди беспозвоночных, кроме нематод, кольчатые черви определенно имеют возбуждающие холинергические окончания на мышцах стенки тела, причем тела мотонейронов расположены в сегментарных ганглиях; эти мышцы получают также тормозную иннервацию, где медиатором служит гамма-аминомасляная кислота (см. обзоры [53, 154]).
У членистоногих обнаружены холинергические нейроны [141, 2111; лучше других изучены холинергические мотонейроны, входящие в состав стоматогастрического ганглия омара [213]; при физиологическом и микрохимическом исследовании трех крупных мотонейронов этого ганглия, вызывающих сокращения разных
Пилорических мышц желудка, два из них оказались холинергическими, а третий имеет какой-то другой медиатор. Эта работа опровергла долго державшееся мнение о том, что у членистоногих нет холинергических мотонейронов. Наличие холинергических чувствительных нейронов также хорошо документировано для ракообразных [141 ]. Считается — главным образом на основании косвенных данных, — что в ганглиях членистоногих много холинергических синапсов [38, 236).
Среди моллюсков хорошо изучена в отношении холинергических нейронов аплизия. Число таких нейронов в ганглиях этого брюхоногого моллюска невелико [156, 218]. Некоторые из них являются интернейронами, как клетка Llo абдоминального ганглия, а также холинергические интернейроны плеврального и буккального ганглиев [154]. Другие идентифицируемые холинергические нейроны абдоминального ганглия выполняют эфферентные функции: две клетки тормозят сердцебиения, три вызывают констрикцию сосудов [216], две служат возбуждающими мотонейронами жаберных мышц [102]. По-видимому, прогресс нервной системы сопровождается у моллюсков увеличением удельного значения холинергических нейронов и синапсов: у виноградной улитки доля этих клеток в популяции ганглиозных нейронов больше, чем у апли-зии [125], но особенно мощного развития холинергические системы, очевидно, достигают у головоногих, мозг которых богаче ацетилхолином, чем любая другая нервная ткань (в синаптосомальной фракции мозга осьминога ацетилхолина примерно в 100 раз больше, чем в синаптосомах, полученных из мозга млекопитающих [145, 177]).
Трудно сказать что-либо определенное о холинергических нейронах самых простых нервных систем. Ацетилхолинподобная активность давно уже была найдена у кишечнополостных в участке тела, богатом нервными элементами [40], но с тех пор в этом важном вопросе эволюционная физиология не продвинулась вперед.
6.3.5. ГЛУТАМАТ
Высокое содержание свободных аминокислот характерно для нервной ткани. В мозге млекопитающих среди них доминируют (в порядке убывания) глутаминовая, глутамин, аспарагиновая и гамма-аминомасляная, которые составляют около 75% общего содержания. Стоящая на первом месте в этом списке L-глутаминовая кислота HOOCCHjCHjjCHNHjCOOH — это дикарбоновая аминокислота, входящая^® состав белков и малых пептидов и выполняющая множество других функций. В частности, глутамат служит промежуточным продуктом при синтезе и распаде аминокислот и других азотистых соединений.
В отличие от тирозина и триптофана — аминокислот, служащих предшественниками медиаторных биогенных аминов, глутамат плохо проходит через гематоэнцефалический барьер. Поэтому 248
он не поступает в мозг из крови, а в основном образуется в нервной ткани из глюкозы, приносимой кровью. Предполагают, что в нервной ткани имеются два пула глутаминовой кислоты и соответственно два независимых пула интермедиаторов цикла лимонной кислоты, что связывают с наличием разных популяций митохондрий. Больший пул вовлечен главным образом в генерацию-энергии, тогда как меньший, к которому относится около 10% глутаминовой кислоты, служит для синтетических целей; к этому меньшему пулу относится, по-видимому, и глутамат, выполняющий медиаторную функцию [83, 167].
Идентификация. Тождество медиатора L-глутамату установлено для возбуждающих синапсов на локомоторных мышцах членистоногих — ракообразных и насекомых. Кандидатура глутамата возникла в конце 50-х гг. — после того, как в связи с изучением медиаторной функции гамма-аминомасляной кислоты в тормозных окончаниях было исследовано действие дикарбоно-вых аминокислот на эти мышцы. В течение следующего десятилетия были выполнены критерии идентичности действия, критерий накопляемости, было показано, что рецепторы глутамата сосредоточены в "субсинаптической области и что имеется специфическая транспортная система, обеспечивающая быстрое удаление глутамата из внеклеточного пространства. Этого, однако, казалось недостаточно для окончательного признания глутамата медиатором. К глутамату предъявляли повышенные требования в связи с двумя необычными особенностями нейронов, для которых он был назван медиатором: во-первых, содержание глутамата в этих нейронах не выше, чем в тормозящих нейронах, в которых медиатором служит гамма-аминомасляная кислота; во-вторых, наблюдается сильное фоновое истечение глутамата из окончаний, хотя раздражение вызывает заметную прибавку. Мнение специалистов сводилось к тому, что было бы желательно удостоверить кандидатуру глутамата фармакологическим критерием, для чего требовалось найти агенты, действующие на рецепторы глутамата (см. обзоры [140, 142, 154, 2361).
Вещества, избирательно блокирующие рецепторы глутамата, были найдены среди производных этой аминокислоты [164]. Одно из них — диэтиловый эфир L-глутамата — оказалось агентом, вызывающим эффективное и обратимое блокирование передачи с возбуждающих нервных волокон на мышцу ноги краба [280].
Руководящие признаки. Таковые для глутамат-ергических нейронов не найдены. Секреторные пузырьки в пре-синаптических терминалях таких нейронов у рака имеют круглый профиль, лишены плотного содержимого, их диаметр 44+2 нм, т. е. они не отличаются от синаптических везикул многих холинергических окончаний по своему внешнему виду [249].
Распространение. Судить о том, у каких животных, где и в каком количестве имеются глутаматергические нейроны, будет очень трудно до тех пор, пока не научатся их узнавать.
Чувствительность клеточных мембран к глутамату распространена очень широко и, по-видимому, представляет собой древнейшее их свойство. Исследование, проведенное на нейронах моллюска, показало, что рецептор глутамата, фармакологически сходный с таким рецептором мозга млекопитающих, может управлять разными ионными каналами, вследствие чего одни нейроны возбуждаются, другие тормозятся глутаматом [184]. Это наряду с доступностью самого глутамата создает хорошие предпосылки для развития глутаматергических нейронных систем.
Содержание глутамата в определенной нервной ткани, возможно, коррелирует с количеством глутаматергических нейронов. Однако корреляция может быть более выраженной, если принять во внимание и содержание гамма-аминомасляной кислоты, для которой глутамат служит предшественником. Относительно высоким содержанием глутаминовой кислоты отличается ткань ц. н. с. у членистоногих и позвоночных, наиболее низкое отмечено у иглокожих, средние значения найдены у кольчатых червей и моллюсков, причем в последнем типе глутамата больше в мозге осьминога, чем в ганглиях брюхоногих [230].
У млекопитающих больше всего глутамата в переднем мозге и мозжечке, где концентрация его примерно вдвое выше, чем в стволе головного мозга и в спинном мозге. В самом спинном мозге распределение глутамата неравномерно, его значительно больше в задних рогах, чем в передних. Мнение о том, что глутамат является одним из самых распространенных медиаторов в синапсах ц. н. с. позвоночных, утвердилось в последние годы в нейрофизиологии, и усилия сейчас направлены на то, чтобы обосновать это мнение фактами так же прочно, как это сделано на членистоногих [176, 195, 255, 259].
6.3.6. ГАММА-АМИНОМАСЛЯНАЯ КИСЛОТА (ГАМК)
ГАМК(НООССН2СН2СН21ЧН2) представляет собой продукт декарбоксилирования L-глутаминовой кислоты. Фермент, который катализирует эту реакцию (декарбоксилаза глутаминовой кислоты), специфичен для нервной ткани. Вследствие этого, в отличие от глутамата, ГАМК нельзя найти в каких-либо тканях, кроме нервной. Также для нервной ткани характерна трансаминаза, катализирующая перенос аминогруппы ГАМК на альфа-кетоглютаровую кислоту, в результате чего последняя превращается в глутаминовую, а ГАМК — в семиальдегид янтарной кислоты [50, 58] (рис. 6.4). Отмечая, что эти реакции могут иметь значение в энергетике мозга, Флори [142] вместе с тем обращает внимание на то, что мозг неоднороден и идущий через ГАМК мета-болитический путь скорее всего присущ лишь определенным структурам мозга. В самом деле, исследования последних лет указывают на то, что присутствие декарбоксилазы глутаминовой кислоты 250
f
NAD NADH NAB NABH '
+ H20 +H+ +Ha0 +H +
Рис. 6.4. Предполагаемая схема главных реакций гамма-аминомасляной кислоты [50J.
и высокое содержание ГАМК присуще тем нейронам, в которых ГАМК выступает в роли медиатора.
Идентификация, Доказательства медиаторной функции ГАМК представлены для тормозящих нейроэффекторных соединений членистоногих и для некоторых тормозящих синапсов мозга млекопитающих, в том и другом случае они вполне убедительны (см. обзоры [53, 154, 195, 236)). Обе группы, членистоногие и млекопитающие, находились в исходной точке работы, началом которой послужило наблюдение Флори, что генерация импульсов рецептором растяжения рака тормозится экстрактом ц.н.с. млекопитающих (139). Действующее начало экстракта, названное «фактором!», подвергли затем очистке, и его наиболее активный компонент был идентифицирован как ГАМК [79]. В настоящее время медиаторная функция ГАМК ни у кого не вызывает сомнений.
Руководящие признаки. Гамкергические нейроны характеризуются высоким содержанием ГАМК и активностью декарбоксилазы глутаминовой кислоты. Предложенный еще в 1971 г. люминесцентногистохимический метод выявления ГАМК [282] не получил развития. Большую пользу оказывали в последние годы микрохимические методы определения содержания ГАМК и активности декарбоксилазы, позволившие локализовать несколько гамкергических нейронных систем [147, 154, 195, 231 ]. Наиболее перспективным методом представляется иммунногистохимическая локализация глутаматдекарбоксилазы. Этот метод уже применяют в световой [220, 245] и электронной микроскопии [223].
Распространение. В отличие от других хорошо изученных медиаторов, каждый из которых способен управлять разными ионными каналами субсинаптической мембраны, ГАМК, насколько сейчас известно, вызывает только повышение хлорной проводимости. Электрохимический градиент ионов хлора чаще всего таков, что под действием ГАМК мембранный потенциал сдвигается в негативную область. По этой причине ГАМК стали называть «тормозящим медиатором», и действительно ГАМК выполняет медиаторную функцию во многих тормозящих синапсах позвоночных и беспозвоночных. Однако в случаях, когда постсинаптический нейрон имеет активно работающий хлорный насос, градиент ионов хлора может быть обратным и тогда действие ГАМК становится деполяризующим. Такая ситуация представлена в клетках спинальных ганглиев и в происходящих от них терминалях заднекорешковых волокон в спинном мозге. Возбуждающие эффекты ГАМК известны у беспозвоночных [143].
В головном мозге млекопитающих хорошо изучено несколько систем гамкергических нейронов, выполняющих функцию тормозящих интернейронов. Таковы клетки Пуркинье, Гольджи и корзинчатые нейроны мозжечка, корзинчатые нейроны гиппокампа, зернистые клетки обонятельных луковиц. ГАМК имити-252
рует синаптическое торможение нейронов коры головного мозга. В черной субстанции, где содержание ГАМК особенно высоко, медиатор локализован в терминалях волокон, проходящих через бледный шар и начинающихся в нем или в стриатуме [146]. Иммуногистохимия глутаматдекарбоксилазы указывает на гамкергическую природу значительной части интернейронов неостриатума [220].
В других классах позвоночных нейроны, гомологичные названным, также должны скорее всего иметь медиатором ГАМК, но доступных сравнительных данных немного. Во всяком случае мозг акулы отличается высоким содержанием ГАМК [229]. Сообщают, что у низших позвоночных обнаружен синтез ГАМК в чувствительных волосковых клетках лабиринтов и органа боковой линии [137 ]. Хотя эти клетки секретируют какой-то медиатор и в принципе не исключено, что это ГАМК, следует иметь в виду, что они получают эфферентные окончания, которые могут быть действительным источником обнаруженного здесь синтеза ГАМК. Синтез ГАМК показан также в обонятельном нерве у рыб [242], но и для этих волокон медиаторная функция ГАМК сомнительна, если иметь в виду, что они (правда, у других позвоночных) возбуждают митральные клетки, которые ГАМК тормозит.
Среди беспозвоночных высоким содержанием ГАМК выделяется нервная ткань членистоногих, для которых надежно установлена медиаторная функция ГАМК в тормозящих окончаниях на мышечных клетках, рецепторных нейронах; вероятно, такие окончания имеются и в ганглиях. В ганглиях аннелид, моллюсков, иглокожих и асцидии содержание ГАМК низкое [229]. Это не значит, что гамкергических нейронов у этих животных нет, но если они имеются, то в относительно небольшом числе. По крайней мере для аннелид представлены некоторые факты в пользу медиаторной функции ГАМК в тормозящих нервно-мышечных окончаниях; менее разработанные, но сравнимые данные имеются для таких же окончаний нематод [154].
6.3.7. ГЛИЦИН
Аминокислота глицин, синоним гликоколль (H00CCH2NH2), в свободной форме обнаруживается не только в нервной, но и в других тканях. Это естественно, так как глицин используется для синтеза пептидов. Те участки нервной системы, в которых глицин выполняет медиаторную функцию, отличаются особенно высоким его содержанием, а также наличием специфического натрийзависимого транспортного механизма, захватывающего глицин из внеклеточной среды. По-видимому, этот механизм частично обеспечивает необходимые запасы медиаторного глицина, который может также синтезироваться из глюкозы через 3-фосфоглицериновую кислоту и серин [71].
Идентификация. Медиаторная функция глицина хорошо доказана для некоторых интернейронов спинного мозга
млекопитающих. Хотя по методическим причинам оказалось трудио с достаточной четкостью выполнить критерий накопляв-мости, в пользу кандидатуры глицина представлено много других Свидетельств (см. [195]). Работа по изучению медиаторной роли глицина выполнена в конце 60-х гг. группой американских авторов; один из ее участников подробно описал как историю открытия, так и сами факты [278].
Руководящие признаки. Для глицинергических нейронов не найдены. Все же положение здесь легче, чем в случае глутамата, так как высокая концентрация глицина, вероятно, характерна только для глицинергических нейронов, благодаря чему в ориентировочных поисках может применяться химический анализ ткани. Упомянутая выше специфическая натрийзависи-мая система захвата глицина, по-видимому, также локализована в глицинергических структурах, и это позволяет, используя меченый глицин, локализовать их методом светооптической и электронномикроскопической авторадиографии [205, 238]. Для глицинергических окончаний характерны уплощенные секреторные везикулы, но этот признак у них общий с гамкергическими окончаниями.
Распространение. Глицинергические нейроны у млекопитающих полностью или главным образом сосредоточены в спинном и продолговатом мозге, где эти клетки выполняют функцию тормозящих интернейронов, являясь своеобразными спутниками холинергических альфа-мотонейронов [64, 80, 195, 278]. Поскольку такие мотонейроны простираются до среднего мозга, можно думать, что и там в связи с ними будут Найдены глицинергические интернейроны. Другие нейронные системы глицинергиче-ского типа пока не обнаружены.
Предварительные суждения о распространении глицинергических нейронов возможны на основании данных о содержании (Свободного глицина в разных нервных тканях. «Эталонная» ткань — вентральная область серого вещества спинного мозга кошки, где расположены такие интернейроны, — содержит 7 мкмолей глицина на грамм сырого веса, а ткань, где таких клеток и их отростков нет (передние и задние корешки), содержит .лишь около 0.3 мкмоля [278].
Сравнительные данные разных авторов [71, 230] сводятся st следующему (концентрация глицина везде указана в тех же единицах). У разных исследованных позвоночных от хрящевых рыб до млекопитающих относительно высокое содержание глицина характерно для спинного и продолговатого мозга, в остальных отделах мозга его мало; самое высокое значение (10.1) нашли у акулы, у которой исследовали ткань продолговатого мозга. Среди беспозвоночных исключительно высока концентрация глицина в нервной ткани иглокожих (62—72, радиальный нерв морского ежа и морской звезды). Также много глицина (24—30, до 50, лишь в одной работе 5) в ганглиях членистоногих, но, к сожа-
пению, нет раздельных определений для разных частей нервной системы этого типа. Для ганглиев морских и наземных аннелид,. брюхоногих и головоногих моллюсков получены значения, сравнимые с содержанием в спинном мозге позвоночных. По-видимому, глицинергические нейроны широко распространены в животном царстве. Известно, что некоторые нейроны брюхоногих моллюсков обеспечены рецепторами глицина, которые фармакологически похожи на соответствующие постсинаптические рецепторы нейрог-нов позвоночных [228],
6.3.8. КАНДИДАТЫ
Во многих случаях вопрос о том, внести ли вещество в список медиаторов или оставить в ранге кандидата,, трудно решить однозначно. В отношении восьми веществ, о которых речь шла выше, мнения специалистов в основном сходятся,, но со многими другими веществами положение иное. Мы ознакомимся теперь с веществами, медиаторная функция которых или не получила общего признания, или рассматривается в литературе как заслуживающая внимания рабочая гипотеза.
Вещество Р (Substance Р). Этим именем, происходящим от сокращенного слова «препарат» (preparation), был назван активный сосудорасширяющий агент, выделенный в 1931 г. Эйлером и Гэддумом из кишки кролика ([129], см. также [128]). Наличие вещества Р в задних корешках спинного мозга позволило еще в 1953 г. выдвинуть гипотезу о медиаторной функции этого агента в афферентных волокнах [200]. На эту же функцию указывали факты о неравномерном распределении вещества Р в разных структурах нервной системы млекопитающих [68].
Изучение этого вопроса значительно активизировалось в последние годы. Признано, что вещество Р имеет несколько форм, т. е. это группа родственных веществ, и одно из них — пептид, построенный из И аминокислот, — было выделено, охарактеризовано [105] и затем синтезировано [265]. Удалось показать, что вещество Р обладает сильным деполяризующим действием на нейроны спинного мозга и некоторые другие центральные нейроны позвоночных [190, 196, 235]. Обнаружен фармакологический антагонист, снимающий эффекты вещества Р на спинномозговые нейроны, — лиоресал [2461; однако позже специфичность этого антагонизма была поставлена под сомнение. Разработан радио-иммунохимический метод определения вещества Р, позволивший показать, что в ткани головного мозга вещество Р содержится во фракции нервных окончаний [119]. Наконец, иммуногистсь химически показано, что в кишечнике вещество Р локализовано в особых нервных волокнах, образующих плотную сеть, в основном вокруг ганглиозных нейронов ауэрбахова сплетения, а в спинальных ганглиях найдены тела соответствующих афферентных
нейронов [169, 172, 173]. Видимо, признание медиаторной функции вещества Р является вопросом ближайшего будущего.
Гипоталамические нейрогормоны. В гипоталамусе млекопитающих и других позвоночных имеется около десятка различающихся по химизму систем нейронов, у которых активный продукт попадает в кровь, выступая в роли гормона. Местом секреции служат богатые капиллярами специализированные нейрогемальные области (задняя доля гипофиза, срединное возвышение); активное начало в исследованных случаях пептидной природы. Возможно, продукт секреции таких нейронов действует не всегда дистантно. Если же он действует локально, находя свою мишень вблизи секреторной терминали аксона, то он — по определению — становится медиатором.
Известен ряд фактов, свидетельствующих в пользу такой возможности. Железистые клетки гипофиза, которые обычно находятся под гормональным контролем со стороны пептидергических нейронов гипоталамуса, -в некоторых специальных случаях (например, у угря) получают прямую эфферентную иннервацию от этих нейронов [77, 187]. Нейросекреторные аксоны, следующие к нейрогемальной области, могут иметь возвратную коллатераль, которая обеспечивает синаптические связи нейросекреторной клетки и делает последнюю в некотором смысле интернейроном [227, 268].
Эволюционная история нейронов, вырабатывающих гипоталамические нейрогормоны, изучена довольно плохо у позвоночных и практически совсем не изучена у беспозвоночных, но доступные отрывочные данные указывают на то, что эти нейроны не всегда выполняли нейросекреторную функцию. Так, трипептид, секретируемый одной из групп этих нейронов, называется TRF (thyro-trophin-releasing factor), так как у млекопитающих он вызывает выделение тиреотропного гормона; но у низших позвоночных, также имеющих этот трипептид в своем мозге, он не влияет на функцию щитовидной железы и предположительно выполняет синаптическую функцию в мозге; более того, TRF обнаруживается в нервной ткани моллюска [162], и имеются основания думать, что он здесь идентичен «субстанции X» — медиатору несеротонинергических кардиостимулирующих нервных волокон. Даже в мозге млекопитающих TRF вряд ли используется только как гормон, действующий на клетки гипофиза: TRF имеет выраженные внутримозговые эффекты и вызывает специфические изменения поведения [271].
Вероятнее всего, что гормональная функция веществ, секретируемых пептидергическими нейронами гипоталамуса, является лишь одной из форм их использования. Секреты пептидергических нейронов могут доставить нейробиологам сюрпризы, подобные недавнему сообщению о том, что в желудке и кишечнике крысы имеются нервные волокна, а в спинальных ганглиях — перика-256
рионы, пептид которых связывает антисыворотку против соматостатина — одного из гипоталамических нейрогормонов [169, 172].
Имеются все основания думать, что активные пептиды, выделяющиеся нервными окончаниями разных типов нейронов позвоночных и беспозвоночных животных, — это реальный резерв новых медиаторов.
Тирамин и октопамин. Среди кандидатов в медиаторы есть вещества, родственные уже известным медиаторам. Таковы р-тирамин и октопамин, находящиеся в ближайшем родстве с катехоламиновыми медиаторами и подобно им образующиеся из тирозина (рис. 6.1). В ряду тирозин—тирамин—октопамин последовательно представлены те же реакции, что и в ряду ДОФА—дофамин—норадреналин: первый член ряда превращается во второй в результате декарбоксилирования, а второй и третий в результате гидроксилирования. Как видно из этих рядов на рис. 6.1, каждый член второго ряда отличается от соответствующего члена первого ряда наличием гидроксильной группы в фенольном кольце.
Тирамин присутствует в нервной ткани разных животных, в том числе в мозге млекопитающих (см. обзор [132]). Вопрос о его возможной синаптической функции обсуждался давно, в частности в связи с некоторыми результатами, полученными на актиниях [33], но только в последнее время он приобретает серьезную экспериментальную основу. Обнаружено, что особенно высокой концентрацией тирамина отличаются некоторые (зрительная, верхняя буккальная) доли мозга осьминога, где содержание этого амина в 85 раз выше, чем в мозге крысы, и где он находится в гранулах, чувствительных к резерпину [1801. Известно, что чувствительность к резерпину характерна и для тех гранул, которые запасают для секреции катехоламиновые медиаторы.
Октопамин, впервые открытый в задних слюнных железах осьминога, где его концентрация исключительно высока и превышает 1 мг/г ткани, тоже неравномерно распределен в мозге головоногих моллюсков и тоже связан здесь с чувствительным к резерпину механизмом хранения; интересно, что резерпин не влияет на хранение октопамйна в слюнной железе осьминога [179]. В том или ином количестве октопамин содержится в нервных тканях разных животных (см. обзор [132]), особенно высокая концентрация найдена в головных ганглиях дождевого червя [2391. В медиаторной функции октопамйна почти не приходится сомневаться, так как особые октопаминсодержащие нейроны уже обнаружены у ракообразных [270] и моллюсков [244], причем в первом случае показана секреция октопамйна при деполяризации этих нейронов [130], а во втором найдены особые октопаминовые рецепторы, ответственные за гиперполяризующие эффекты октопамйна [1031. Представлены также данные в пользу возможной медиаторной роли октопамйна в нейроэффекторных окончаниях на органах свечения у насекомого [240].
257
If Общая физиологии нервной система
Гистамин. Это широко распространенное и обладающее высокой физиологической активностью вещество представляет собой декарбоксилированное производное аминокислоты гистидина. Гистамин — один из старейших кандидатов в медиаторы; попытки представить решающие доказательства медиаторной функции гистамина не прекращаются с 40-х гг. (см. обзоры [160, 161], а также [136, 2541). Однако применение чувствительного гистохимического метода обнаружения гистамина не привело к обнаружению гистаминсодержащих нейронов и показало, что в периферической нервной системе крысы гистамин содержится только в соединительнотканных (тучных) клетках [1491. Не исключено, что гистохимическая реакция блокируется в мозге каким-то веществом, присутствующим в его ткани. В самом деле, распределение гистамина в мозге млекопитающих не совпадает с распределением тучных клеток. У некоторых животных (краб, лягушка, рыба) содержание гистамина в нервной ткани выше, чем в любой другой [2851. Гистамин обнаруживают во фракции синаптосом и даже синаптических везикул [181]. Он выделяется из срезов мозга при калиевой деполяризации в результате кальцийзависимого секреторного процесса [261]. Наконец, хорошо известны и давно изучаются специальные гистаминовые рецепторы, имеющиеся у некоторых нейронов позвоночных и беспозвоночных.
Найдены особые гистаминсодержащие нейроны (их два в церебральных ганглиях моллюска аплизии), в которых концентрация гистамина на два порядка выше, чем в других нейронах того же ганглия, что, по-видимому, позволит окончательно решить вопрос о медиаторной функции этого вещества [272].
АТФ. Аденозинтрифосфорная кислота — тоже один из давних кандидатов ([166], обзор старой литературы см. в книге Кибя-кова [22]). Бернсток с сотрудниками в результате тщательного изучения неацетилхолиновой и некатехоламиновой нейроэффек-торпой передачи в мышцах желудка и кишечника позвоночных пришли к выводу, что медиатором здесь является АТФ или ее производное, и предложили называть соответствующие нейроны и синапсы пуринергическими (197, 98], см. также [92]). Экспериментальные данные действительно показывают, что в этом препарате имеют место синаптические эффекты, не воспроизводимые ацетилхолином и норадреналином [63], но воспроизводимые АТФ и родственными веществами. АТФ выделяется при раздражении нерва; причем электронномикроскопически здесь обнаруживаются особые нервные окончания, наполненные везикулами диаметром 80 -200 нм, отличающиеся от везикул холинергических и норадренергических окончаний. Можно интерпретировать эту совокупность данных как возможное свидетельство наличия «пуринерги-ческих» нейронов, но не исключены и другие объяснения. Например, присутствие особых окончаний с крупными везикулами может быть связано с наличием в энтеральном сплетении двух нейронных систем, о существовании которых на первом этапе изучения пурин-258
ергических механизмов не было известно, а именно волокон, содержащих фактор Р, и соматостатинсодержащих волокон (см. выше).
Хорошо известно, что АТФ выделяется при секреции как ацетилхолина, так и норадреналина, поскольку входит в состав содержимого секреторных везикул. Если представить себе, что постсииаптическая структура обеспечена рецепторами АТФ, но не имеет холинорецепторов, то, не нарушив принципа Дейла (см. ниже), мы получим синапс, в котором секреторное окончание — холинергическое, а медиатором служит АТФ. При такой интерпретации имеющихся фактов отпадает необходимость в пу-ринергических нейронах, но АТФ остается кандидатом в медиаторы.
Другие кандидаты. Одновременно с возникновением гипотезы о медиаторной функции глутаминовой кислоты встал вопрос о возможном выполнении той же роли другой дикарбоновой аминокислотой — аспарагиновой. Она также содержится в значительных количествах в ткани мозга и деполяризует многие клетки ц. н. с. позвоночных; Для некоторых входов в гиппокамп млекопитающих аспарагиновая кислота представляется наиболее предпочтительным кандидатом в медиаторы [225]. Аспартат неравномерно распределен в ганглиях аплизии [288]. Высказывают предположение, что в некоторых синапсах медиатором, может быть, является не глутаминовая кислота, а смесь глутаминовой и аспарагиновой. Основанием для этого служат данные, полученные на возбуждающих нервных окончаниях соматической мышцы ракообразных [185, 248]. Хотя аспартат действует на мышцу в 2—10 раз слабее глутамата, это компенсируется тем, что его в возбуждающих нервных волокнах в 4—5 раз больше, чем глутамата; кроме того, в присутствии аспартата эффект глутамата сильно потенцируется. Многое здесь остается неясным — в частности, непонятно, почему еще более высокая концентрация аспартата отмечена в тормозящих волокнах, где медиатором служит ГАМК.
Карнозин — один из распространенных дипептидов, возможно, является передатчиком в окончаниях волокон обонятельного нерва на митральных клетках обонятельных луковиц [214]. Кажется очень вероятным, что в этих синапсах будет найден необычный медиатор, поскольку обонятельные рецепторные нейроны, дающие начало волокнам обонятельного нерва, иммунологически отличны от других нейронов, будучи сходными между собой у животных, относящихся к разным классам позвоночных [182]. Видимо, это особая клеточная линия, имеющая иное, чем другие, происхождение и вследствие этого собственный тип химизма.
Недавно получены данные о том, что сосуды мозга млекопитающих, кроме холинергической и норадренергической иннервации, снабжены особыми нервными волокнами, в которых иммуногистохимически обнаруживается вазоактивный полипептид, выделенный из кишечника [199]. Этот пока не идентифицированный поли
пептид, очевидно, также Нужно внести в список кандидатов в медиаторы.
В разные годы в качестве возможных медиаторов назывались многие другие вещества: триптамин, глутамин, бета-аланин, таурин, некоторые эфиры холина и т. д., однако данные о них носят предварительный характер.
6.4. ВОПРОСЫ ТЕОРИИ
6.4.1. ЕДИНСТВО СЕКРЕТОРНОГО ХИМИЗМА НЕЙРОНА (ПРИНЦИП ДЕЙЛА)
Одна из закономерностей, сформулированная Дейлом уже давно [115] и подтвержденная опытом физиологии, заключается в том, что разные секреторные терминали одного нейрона выделяют один и тот же набор веществ. Прежде полагали, что разные терминали нейрона выделяют одни и тот же медиатор. При этом имелось в виду, что нейрон метаболически един. Не нару-, шая существа этого принципа, важно учесть современные знания о физиологии секреции, согласно которым вещество, выполняющее медиаторную функцию, секретируется не изолированно, а в смеси с сателлитными веществами, которые вместе с ним находились внутри секреторных везикул. Например, вместе с норадреналином из секреторной терминали выходят АТФ, хромогра-нины, дофамин-бета-оксидаза. Теоретически это создает возможность ситуации, при которой в разных терминалях^одного нейрона медиаторную функцию могут выполнять разные компоненты секретируемой смеси. Такая ситуация, как уже говорилось, не явилась бы опровержением принципа Дейла.
На самом деле, не видно теоретического запрета и на прямое нарушение принципа Дейла, но физиология не располагает какими-либо фактами, из которых вытекала бы необходимость в его пересмотре.
6.4.2. АМБИВАЛЕНТНОСТЬ МЕДИАТОРОВ
Экклс весьма неудачно попытался поставить рядом с принципом Дейла предложенный им принцип, относящийся к противоположной стороне синаптической щели. «Второй принцип, — формулировал он, — гласит, что во всех синаптических терминалях нервной клетки медиатор открывает ионные поры лишь одного типа, характерного либо для возбуждающих, либо для тормозящих синапсов. Иными словами, нервная клетка не может быть амбивалентной по механизму своего действия на субсинаптическую мембрану» ([64], с. 145; см. также [120], с. 112).
На самом же деле как амбивалентность медиатора, так и амбивалентность нейрона доказана. Один и тот же медиатор может обеспечить разнообразные синаптические эффекты, различающиеся
цо зйаку действия и по ионному механизму. Чем длительней история изучения данного медиатора, чем больше сравнительных данных о синапсах, где он осуществляет передачу, тем шире видимый нам спектр его постсинаптических эффектов. Лишь наименее изученные медиаторы представляются «возбуждающими» или «тормозящими», но, по-видимому, это временное положение, отражающее неполноту наших знаний о них. Так, глутамат, который сначала числился возбуждающим медиатором ([111, 222] и др.), позже оказался наиболее вероятным передатчиком в некоторых тормозящих синапсах [109].
Амбивалентность нейрона вытекает из амбивалентности медиатора и использует ее. «Принцип», сформулированный Экклсом, мог бы иметь место в случае, если бы свойства постсинаптических структур полностью формировались под контролем пресинапти-ческих терминалей. Хотя морфогенетические влияния нервных окончаний на иннервируемые клетки, в том числе на их рецепторы, существуют, они не настолько сильны, чтобы исключить амбивалентность нейронов. У хорошо изученных в этом отношении гастропод описаны холинергические, серотонинергические и дофаминергические нейроны, у которых разные терминали, секретируя один и тот же медиатор, создают постсинаптические эффекты, неодинаковые по знаку действия и ионному механизму [84, 88, 1081. Думать, что так происходит только у моллюсков, было бы крайне неосмотрительно.
6.4.3. СПЕЦИФИЧНОСТЬ СЕКРЕТОРНОГО ХИМИЗМА НЕЙРОНА
Секреторный химизм нервной клетки не только един, но и специфичен. Каждому нейрону присущ определенный тип химизма, который выражается определенным набором секреторных органелл, ферментов, других специфических веществ и связанной с этим иммунологической специфичностью.
Представление о секреторной специфичности нервных клеток — одно из крупных достижений современной физиологии. Оно возникло в 30-х гг. в виде гипотезы о существовании двух типов нейронов (холинергического и адренергического) и пережило несколько кризисов [95].
Данные, истолкованные как свидетельство секреции ацетилхолина окончаниями норадренергических нейронов, были позже переисследованы, и возможность такой трактовки была с необходимой строгостью исключена. Также не получала подтверждения мысль о том, что степень медиаторной специфичности меняется в процессе эволюции, будучи низкой у нейронов простых нервных систем и относительно высокой в сложных нервных системах. Напротив, имеющиеся данные сравнительной нейрофизиологии и нейрохимии указывают на то, что секреторная специфичность нервных клеток выражена так же полно у разпых беспозвоночных, как и высших
позвоночных животных. Эти факты послужили основанием для предположения, что в течение всей истории развития нервной системы в ней сосуществовали неродственные линии нейронов, имеющие разное происхождение и потому различающиеся по своему химизму [52, 55].
Сомнения в принципе специфичности иногда высказываются в литературе в связи с появлением данных о наличии в том или ином нейроне не одного, а двух или нескольких веществ, известных в качестве медиаторов, и о неоднородности популяции везикулярных органелл в том или ином секреторном окончании. Опровержением принципа специфичности такие данные, конечно, не являются, так как вещества, известные в качестве медиаторов, могут присутствовать в нейроне для выполнения немедиаторной функции, а природа гетерогенности везикул вообще неясна даже в хорошо изученных окончаниях, и ясно только, что не все везикулы принимают участие в секреторном процессе. В общем, несмотря на спорадическое появление сомнений такого рода (например, [94, 99]), принцип медиаторной специфичности получает все более солидную основу, особенно со стороны микрохимических и иммунохимических исследований.
6.4А. ПРОИСХОЖДЕНИЕ И ЭВОЛЮЦИЯ МЕДИАТОРОВ
Довольно долго в физиологии господствовало убеждение, что медиаторы — это вещества, специфичные для нервной системы, и что ферменты синтеза и распада медиаторов появляются в процессе эволюции в связи с возникновением синаптической передачи. В эту теоретическую схему явно не укладывались данные о секреции адреналина надпочечниками, но трудность устраняли гипотезой о происхождении хромаффинных клеток надпочечника из симпатических постганглионарных нейронов.
В опровержении таких убеждений решающую роль сыграли эксперименты и теоретические работы Коштоянца. Основная идея Коштоянца состояла в том, что нервная система унаследовала и использовала системы химической регуляции, существовавшие до ее возникновения. Коштоянц ([34], с. 27), подводя итог этим давним разработкам и касаясь, в частности, ацетилхолина, говорил: «Ацетилхолиновая система уже в донервный этап имеет отношение к таким физиологическим процессам, как регуляция активного транспорта ионов, электрическая возбудимость и ритмическая или периодическая электрическая активность, и, наконец, к таким процессам, как возникновение и распространение возбуждения и разные формы автоматических движений. С появлением в филогенезе животных нервной системы ацетилхолин и холинэстераза как агенты химической регуляции более древних форм включаются в сложную цепь биохимических процессов нервной системы, играя в этой цепи важную функциональную роль».
Открытие новых медиаторов, среди которых оказались такие «банальные» молекулы, как глутамат и глицин, способствовало окончательному преодолению представления о медиаторах как о веществах, специфичных для нервной системы. Альтернативная идея Коштоянца была разработана Бузниковым и Манухиным и вылилась в представление о смене функций «медиаторных веществ». Согласно этому представлению [6], аргументированному в основном данными онтогенетического исследования, ацетилхолин, серотонин, катехоламины регулируют процессы клеточного метаболизма и митоза в раннем онтогенезе, позже выступают в роли локальных гормонов, затем становятся медиаторами и,'ил и гормонами эндокринных желез. Данные сравнительных исследований указывают на то, что сходным образом функции медиаторных веществ могли меняться в филогенезе.
Выше говорилось о широком распространении ряда медиаторов. Эти факты наряду с общностью клеточных рецепторов, явлений электрогенеза и т. д. понимаются современной физиологией как свидетельство того, что «фундаментальные нервные механизмы . . . оказываются сходными во всем животном мире» [25]. Иногда из этих фактов делают вывод, что эволюция медиаторов не имеет места. «Не существует примитивного медиатора, из которого развился другой, может быть, более эффективный медиатор, — пишет Флори [61 ]. — Клетки нашего мозга производят те же медиаторы, что и нервные клетки низших червей».
Такая точка зрения — крайность, которую можно понять как реакцию на противоположные, ныне изжитые представления, по которым медиаторные вещества появились в процессе эволюции нервной системы.
Типы медиаторного химизма действительно одинаковы у высших и низших животных, но в пределах каждого такого типа скорее всего имеет место эволюция и диверсификация медиаторной молекулы [55]. Метаболические ряды дофамин—норадреналин—адреналин, тирамин—октопамин, глутамат—ГАМК, где каждый член ряда отделен от соседнего одной ферментной реакцией, указывают вероятные пути возникновения новых медиаторов посредством изменения в молекуле старого. Доступные сравнительные данные подтверждают эту мысль. Дофамин является единственным или преобладающим катехоламином относительно простых нервных систем первичноротых [183]; адреналин мог стать медиатором симпатических нейронов у амфибий только в результате изменения в молекуле норадреналина, который выполняет эту функцию в гомологичных нейронах у рыб.
Мысль о том, что распространенность медиаторов тоже претерпевает эволюцию, конкретизировалась в виде представления об отборе нейронов. Имеется в виду, что медиаторы, представленные в разных нейронах примитивной нервной системы, неодинаково пригодны для выполнения той же функции в сложной нервной системе, где к синаптической передаче предъявляются более
высокие требования. Это создает предпосылки для процветания одних нейронов и уменьшения относительного числа, вплоть до полного исчезновения, других нейронов [55].
Вопрос о способах действия медиаторов также тесно связан с вопросом об их происхождении. Коштоянц утверждал, что доме-диаторные функции вещества находят выражение в механизмах его постсинаптических эффектов. Господствующему взгляду, что медиатор действует, меняя проводимость тех или иных ионных каналов постсинаптической мембраны, он противопоставил более общую, так называемую энзимо-химическую гипотезу, в рамках которой ионный механизм представляется частным случаем [31, 34].
Несомненно, что среди унаследованных от донервного этапа развития способов действия именно ионный механизм оказался тем, который обеспечил быструю передачу синаптической информации, что сделало возможным прогресс нервной системы. Однако быстрая передача нужна не всем синапсам, и в каких-то случаях эволюция могла пренебречь ионным способом действия и остановить свой выбор на немембранной, даже внутриклеточной точке приложения медиатора.
Помимо отбора точек приложения медиатора большое значение в эволюции химических синапсов могла иметь эволюция рецепторных структур. Уже упомянутые ранние идеи Гинеципского по этому поводу получили развитие в серии исследований Михельсона и сотр., которые на широком сравнительном материале изучили эволюцию холинорецепторов [41—43].
Знания о медиаторах с каждым годом углубляются, и все яснее вырисовываются контуры широкого понимания этого предмета.
Говоря о картине в целом, можно назвать несколько ее черт, просматривающихся с достаточной четкостью.
1. Между позвоночными и беспозвоночными и вообще между организмами, относящимися к разным группам многоклеточных животных, нет существенных различий на уровне химических механизмов синаптической передачи. У самых разных животных имеются одни и те же типы медиаторного химизма, одни и те же способы действия медиаторов. Эволюция химических синапсов не затрагивает физиологической основы процесса передачи и выражается в совершенствовании отдельных молекулярных механизмов, таких как синтез, упаковка, рецепция медиатора и т.п., а также в диверсификации медиаторных молекул.
2. На медиаторном уровне нет различий и между нейронами, с одной стороны, и ненервными клетками (такими, как первичные рецепторные клетки) — с другой.
3. В каждой реальной нервной системе сосуществуют нейроны, относящиеся к разным типам медиаторного химизма. Благодаря множественности медиаторов синаптическая информация может кодироваться не только импульсным разрядом и топографией контакта, но и качеством сигнальной молекулы. Например, в опре-264
деленной нервной структуре разные медиаторы могут быть привлечены к передаче сигналов разной афферентной модальности. Эта возможность, однако, в разных случаях реализуется по-разному: не существует определенных функций, закрепленных за определенным медиатором в достаточно широкой выборке нервных структур.
4. Каждый отдельный медиатор имеет разные способы действия, вместе с тем один и тот же способ действия могут иметь разные медиаторы.
5. Клетки, секретирующие одинаковый медиатор, имеют много черт сходства, даже когда они относятся к очень разным нервным системам.
Последнее положение важно в практическом смысле. Так, при поиске фармакологических средств, специфически влияющих на серотонинергические нейроны ствола мозга человека, удобным и адекватным тест-объектом могут служить крупные серотонинергические нейроны моллюска. Здесь не имеет значения, что названные нейроны человека и моллюска имеют разный внешний вид и связаны с выполнением разных регуляторных функций; гораздо важнее, что у них сходные и специфичные для этого типа нейронов молекулярные механизмы.
Практические возможности, открываемые уже имеющимися знаниями о медиаторах, очевидны. Списки холинергических и адренергических средств показывают, какими разнообразными могут быть воздействия на медиаторный процесс. Потенциально все медиаторы равны между собой в этом отношении.
Новые знапия о медиаторах будут реализовываться и при анализе патогенеза нервных и психических болезней. В этой области уже имеются успехи, но гораздо больше оправданных ожиданий. Достаточно назвать проблему шизофрении: в литературе уже утвердилось мнение, что эта распространенная и страшная болезнь связана с дефектом в каком-то звене какого-то медиаторного процесса. Нейробиологические исследования, ведущие к расширению списка медиаторов, могут сыграть важную роль в решении этой и других аналогичных проблем.
ЛИТЕРАТУРА
1. Авакян О. М. Фармакологическая регуляция высвобождения и захвата норадреналина. Ереван, 1973. 306 с.
2. Альперн Д. Е. Химическая природа нервного возбуждения в организме человека. Харьков, 1939. 232 е.
3. Артемов Н. И,, Лурье Р, Н. Ацетилхолин и холинэстераза в тканях ленточных червей. — Изв. АН СССР. Сер. биол., 1941, № 2, с. 278—282.
4. (БресткинА. П., Брик И. Л., Григорьева Г. М.) Brestktn А. Р-, Brick I. L., Grtgorjeva G. М. Comparative pharmacology of cholinesterases. — In: Comparative pharmacology. 1. Oxford, 1973, p. 241—344.
5. Буданцев А. Ю, Моноаминэргические системы мозга. M., 1976. 193 с.
6. Б узников Г. А. Низкомолекулярные регуляторы зародышевого разви-
7, (Бузников Г. Л.) Buzntkov G. A. 5-hydroxytryptamine, catecholamines, acetylcholine and some related substances in early embryogenesis. — In: Comparative pharmacology. II. Oxford, 1973, p. 594—624.
8. Быков К. M. К физиологии верхнего шейного узла. — Русск. физиол. жури., 1923, 5, с. 309—311.
9. Быков К. М., Павлова А. М. Переживание нервных клеток симпатической системы. — В кн.: Сборник, посвященный 75-летаю академика Ивана Петровича Павлова. Л., 1924, с. 413—425.
10. Гинецинский А. Г. Об эволюции функций и функциональной эволюции. М., 1961. 21 с.
11. Гинецинский А. Г. Химическая передача нервного импульса и эволюция мышечной функции. Л., 1970. 203 с.
12. Гинецинский А. Г., Михельсон Н. И. О гуморальной передаче нервного возбуждения в двигательных окончаниях соматического нерва. — Усп. совр. биол., 1937, 6, с. 399—431.
13. Гинецинский А. Г., КГ амарина Н. М. Тономоторный феномен в денервированной мышце. —Усп. совр. биол., 1942, 15, с- 283—294.
14. Говырин В. А. Трофическая функция симпатических нервов сердца и скелетных мышц. Л., 1967. 131 с.
15. Горкин В. 3. Современные достижения в области биохимии катехоламинов. — Вопр. мед. химии, 1974, 20, с. 227—238,
16. Громова Е. А. Серотонин и его роль в деятельности центральной нервной системы. — Усп. физиол. наук, 1970, 1, с. 25—50.
17. Дайл Г. Передача нервных воздействий с помощью ацетилхолина. — Усп. совр. биол. 1938, 8, с. 405—415.
18. Жучкова Н. И. К исследованию локализации биогенных аминов в нервной ткани. — Труды ГЕЛАН СССР, 1974, 24, с. 36—39.
19. Кашапова Л. А., Сахаров Д. А. Двойная иннервация быстрых волокон туловищной мускулатуры у личинки миноги. —ДАН СССР, 1976, 231, с. 1495—1496.
20. Кибяков А. В. О гуморальном переносе возбуждения с одного нейрона на другой. — Казанский мед. журн., 1933, 5—6, с. 457—467.
21. (Кибяков А. В.) Kibjakow А. Ж Uber humorale Ubertragung der Erregung von einem Neuron auf das andere. — Pflug. Arch,, 1933, 232, p. 432—443.
22. Кибяков А. В. Химическая передача нервного возбуждения. М., 1964. 208 с.
23. Конради Г, П., Михельсон М. Я. Химические факторы нервного возбуждения. — Усп. совр. биол., 1935, 4, с. 171—190.
24. Константинова М. С. Распределение моноамипов в гипоталамусе и гипофизе позвоночных. — Журн. эвол. биохим. физиол., 1971, 7, № 2, с. 213—218.
25. Костюк П. Г. Некоторые эволюционные проблемы в современной нейрофизиологии. — Журн. эвол. биохим. физиол., 1975, 11, № 1, с. 3—10.
26. Коштоянц X. С. О способе действия ацетилхолина, выявленном новым биологическим индикатором, и о холинэстеразе беспозвоночных животных. — Бюл. эксп. биол. мед., 1936, 2, с. 37—40.
27. Коштоянц X. С. Об адреналиноподобных веществах в организме беспозвоночных животных (нервные узлы моллюсков). — Бюл. эксп. биол. мед., 1936, 2, с. 41—43.
28. Коштоянц X. С. О механизме образования химических передатчиков нервного возбуждения. — ДАН СССР, 1938, 19, № 2, с. 317—320.
29. Коштоянц X. С. Очерки по истории физиологии в России. М., 1946. 494 с.
30. Коштоянц X. С. Белковые тела, обмен веществ и нервная регуляция. М., 1951. 100 с.
31. Коштоянц X. С. Энзимохимическая гипотеза возбуждения. — Физиол. журн. СССР, 1950, 36, № 1, с. 92—96.
32. Коштоянц X. С. Об особенностях нервной регуляции и действия «медиаторов» у моллюсков. — Изв. АН АрмССР, 1957, 10, № 1, с. 13—15.
33- Коштоянц X. С. Основы сравнительной физиологии. II. Сравнительная физиология нервной системы. М., 1957. 635 с.
34. Коштоянц X. С. Проблемы эпзимохимии возбуждения и торможения и эволюции нервной системы. М., 1963. 31 с.
35. Коштоянц X, С-, Турпаев Т. М. О роли сульфгидрильных групп в осуществлении действия ацетилхолина п вагусного торможении па сердечную мышцу. — ДАН СССР, 1946, 54, с. 181—183.
36. Курский М. Д,, Бакшеев Н. С. Биохимические основы механизма действия серотонина. Киев, 1974. 296 с,
37. Бурье Б. Л. Моноаминосодержащие нейроны лланарий Polycelis nigra, — Вести. МГУ. Сер. биол.-почв., 1975, № 2, с. 3—13.
38. Мандельштам Ю. Е, Структурно-функциональные особенности синаптического аппарата насекомых. — Журн. эвол. биохим. физиол., 1972, 8, с. 395-403.
39. Манохина М. С., Кузьмина Л. В. Распределение биогенных моноаминов в центральной нервной системе тихоокеанского голожаберного моллюска Tritonia sp. — Журн. эвол. биохим. физиол., 1971, 7, с. 357—361.
40. Митрополитанская Р. Л. О содержании ацетилхолина и холинэстеразы у простейших, губок и кишечнополостных животных. — ДАН СССР, 1941, 31, с. 717 718.
41. (Михельсон М. Я.) Michelson М. J. (Ed.). Comparative pharmacology. I, II. Oxford, 1973. 938 p.
42. (Михельсон M. Я.) Michelson M. J. Some aspects of evolutionary pharmacology. — Biochem. Pharmac., 1974, 23, p. 2211—2224.
43. Михельсон M, Я., Зеймалъ Э. В. Ацетилхолин. Л., 1970. 279 с.
44. Нистратова С. Н., Турпаев Т, М. О взаимодействии ацетилхолина с холипорецепторами в тканевом гомогенате. — Биохимия, 1959, 24, с. 171—176.
45. Нистратова С. Н., Турпаев Т. М. Выделение холипорецепторного белка из сердечной мышцы. — Биохимия, 1961, 26, с. 952—955.
46. Плотникова С. И., Говырин В. 4. Распределение нервных элементов, содержащих катехоламины, у некоторых представителей кишечнополостных и первичноротых. — Арх. анат, гистол. эмбриол., 1966, 50, с. 79—87.
47. Плотникова С. Н., Кузьмина Л. В, Распределение нервных элементов, содержащих биогенные моноамины, у представителя плоских червей — молочно-белой планарии Dendrocoelum lacteum. — В кн.: Физиология и биохимия беспозвоночных. Л., 1968, с. 23—29.
48. Плотникова С. И., Шишов Б. А., Кузьмина Л. В, К изучению биогенных моноаминов в нервной системе аскариды (A scarfs suum'l. — Труды ГЕЛАН СССР, 1969, 20, с. 103—108.
49. Приймак Э, X. Субмикроскопическая локализация норадреналина—Ня в гипоталамусе. — Изв. АН СССР. Сер. биол., 1975, № 4, 613—617.
50. Робертс К). Модель нервной системы позвоночного, основанная в значительной степепн на растормаживании. О ключевой роли системы ГАМК. — Журн. эвол. биохим. физиол., 1973, 9, с. 445—463.
51. Самойлов А. Ф. О переходе возбуждения с двигательного нерва на мышцу. — Б кн.: Сборник, посвященный 75-летию академика Ивана Петровича Павлова. Л., 1924, с. 75—82 (на немецком языке опубликовано в Pflug. Arch., 1925, 208, р. 508- 519).
52. Сахаров Д. А. Основания к построению системы нервных клеток. — Журн. общ. биол., 1970, 31, с. 449—457.
53. (Сахаров Д, A.) Sakharov D. A. Cellular aspects of invertebrate neuropharmacology. — Ann. Rev. Pharmac., 1970, 10, p. 335—352.
54. (Сахаров Д. A.) Sakharov D, A. Evolutionary aspects of transmitter heterogeneity. — J. Neural Transmission, 1974, Suppl. 11, p. 43—59.
55. Сахаров Д. А. Генеалогия нейронов. M., 1974. 183 с.
56. Сахарова А. В., Сахаров Д. А. Дальнейшая разработка простого «водного» метода выявления внутриклеточных моноамцнов. Люминесценция адре
нергических волокон в тканях теплокровных. — Цитология, 1968, 10, с. 1460—1466.
57. (Сахарова А. В., Сахаров Д.А.) Sakharova А. V,, Sakharov D. А . Visualization of interneuronal monoamines by treatment with formalin solution. — Progr. Brain Res., 1971, 34, p. 11—26.
58. Сытинский И. Л. Гамма-аминомасляная кислота в деятельности нервной системы. JI., 1972. 200 с.
59. Турпасв Т. М. Медиаторная функция ацетилхолина ц природа холино-рецептора. М., 1962. 140 с.
60. (Турпаев Т. М., Сахаров Д. A.) Turpayev Т. М., Sakharov D. Л. Comparative physiology of the mechanisms terminating the synaptic action of acetylcholine. — In: Comparative pharmacology. I. Oxford, 1973, p. 345—356.
61. Флори Э. Эволюционные аспекты синаптической передачи. — Жури, эвол, биохим. физиол., 1972, 7, № 1, с. 3—7.
62. Черниговский В, Н. Некоторые вопросы учения о первпо-гуморальной регуляции. — У си. совр. биол., 1938, 9, с. 387—433.
63. Шуба М. Ф., Владимирова И. А. Неадрепергическое синаптическое торможение гладкомышечных клеток желудочно-кишечного тракта. — В кн.: Центральные и периферические механизмы вегетативной нервной системы. Ереван, 1975, с. 376—379.
64. Вкклс Дж. Тормозные пути центральной нервной системы. М., 1971. 168 с.
65. Ярошввский М. Г., Чеснокова С. А. Уолтер Кеннон. М., 1976. 376 с.
66. Aghajanian G. К., Haigler Н. J. L-Tryptophan as a selective histochemical marker for serotoninergic neurons in single-cell recording studies. — Brain Res., 1974, 81, p. 364-372,
67. Akert K., Sandri K. An electron-microscopic study of zinc iodide-osmium impregnation of neurons. I. Staining of synaptic vesicles at cholinergic junctions. — Brain Res., 1968, 7, p. 268—295.
68. Amin A. H., Crowford Г. В. B., Gaddum J. H. Distribution of substance P and 5-hydroxytryptamine in the central nervous system of dog. — J. Physiol. (London), 1954, 126, p. 596-618.
69. Anden N.-E., Dahlstrom A., Fuxe K., Larsson K., Olson L., Ungerstedt U. Ascending monoamine neurones to the telencephalon. — Acta physiol, scand., 1966, 67, p. 313—326.
70. Andersen P., Jansen J. K. S., Ldyning Y. Slow and fast muscle fibres in the atlantic hagfish (Myxine gluttnosa). — Acta physiol, scand., 1963, 57, p. 167—179.
71. Aprison M, H., Davidoff R. A., Werman Я. Glycine: its metabolic and possible transmitter roles in nervous tissue. — In: Handbook of Neurochemistry. 3. New York, 1970, p. 381—397.
72. Aprison M. H., Werman R. A combined neurochemical and neurophysiological approach to identification of central nervous system transmitters. — Neurosci. Res., 1968, 1, p. 143—174.
73. Axelsson S., Bjorklund A.. Falck B., Lindvall O., Svensson L.-A. Glyoxylic acid condensation: a new fluorescence method for the histochemical demonstration of biogenic monoamines.— Acta physiol, scand., 1973,87, p. 57.
74. Bacq Z. M. L’acetvlcholine et Tadrdnaline chez les Invertebres. — Biol. Rev., 1947, 22, p. 73—91.
75. Bacq Z. M. Chemical transmission of nerve impulses. A historical sketch. Oxford, 1975. 106 p.
76. Bacq Z, M., Mazza F. Isolement de chloroaurate d’acetylcholine a partir d’un extrait de cellules nerveuses d’Octopus vulgaris. — Archs Internal. Physiol. Biochi m. 1935, 42, p. 43—46.
77. Bargmann W., Linder E., Andres К. K. Uber Synapsen an endokrinen UEpithelzellen und die Definition sekretorischer Neurone, — Z. Zellforsch., 4967, 77, S. 282—298.
78. Baumgarten H. G. Biogenic monoamines in the cyclostome and lower vertebrate brain. — Progr,'Histochem. Cytochem., 1972, 4 (1), p. 1—90,
79. Bazemore A. W.t Elliott К. A. C., Florey E. Isolation of factor I, — J. Neurochem., 1957, 1, p. 334—339.
80. Belcher G., Davies J., Byall R. И7. Glycine-mediated inhibitory transmission of group lA-excited inhibitory interneurones by Renshaw cells. — J. Physiol. (London), 1976, 256, p. 651—662.
81. BellC., Lang W.J. Neural dopaminergic vasodilator control in the kidney.— Nature New Biol., 1973, 246, p. 27—29.
82. Bennett J., Buedtng E., Localization of biogenic amines in Schistosoma man-soni. — Comp, Biochem. Physiol., 1971, 39A, p. 859—867.
83. Berl S., Clarke D. D. Compartmentation of amino acid metabolism. — In: Handbook of Neurochemistry. 2. New York, 1969, p. 447—472.
84. Berry M. S., Cottrell G. A. Excitatory, inhibitory and biphasic synaptic potentials mediated by an identified dopaminecontaining neurone. — J. Physiol. (London), 1975, 244, p. 589—612.
85. Bjorklund A., Cegrell L., Falck B., Ritzen E. Dopaminecontaining cells in sympathetic ganglia. — Acta physiol, scand., 1970, 78, p. 334—338.
86. Bjorklund A., Nobin A. Fluorescence histochemical and microspectrofluori-metric mapping of dopamine and noradrenaline cell groups in the rat diencephalon. — Brain Res., 1973, 51, p. 193—206.
87. Bjbrklund A., Nobin A., Stenevi U. Effects of 5,6-dihydroxytryptamine on nerve terminal serotonin and serotonin uptake in the rat brain. — Brain Res., 1973, 53, p. 117—127.
88. Blankenship J. E., Wachtel H., Kandel E. R. Ionic mechanisms of excitatory, inhibitory, and dual synaptic actions mediated by an identified interneuron in abdominal ganglion of Aplysia. — J. Neurophysiol., 1971, 34, p. 76—92.
89. Bloom F. E. The fine structural localization of biogenic monoamines in nervous tissue. — Internet. Rev. Neurobiol., 1970, 13, p. 27—66.
90. Bone Q. On the function of the two types of myotomal muscle fibre in elasmobranch fish. — J, Mar. Biol. Ass. UK, 1966, 46, p. 321—349.
91. Bone Q. The dogfish neuromuscular junction: Dual innervation of vertebrate striated muscle fibres? — J. Cell Sci., 1972, 10, p. 657—665.
92. Boyd ff. ATP as a nerve transmitter substance. — J. Theoret. Biol., 1973, 42, p. 49—53.
93. Brown G. L. The actions of acetylcholine on denervated mammalian and frog’s muscles. — J. Physiol. (London), 1937, 89, p. 438—461.
94. Brownstein M. J., Saavedra J, M., Axelrod J., Zeman G. H., Carpenter D. O. Coexistence of several putative neurotransmitters in single identified neurons of Aplysia. — Proc. Nat. Acad. Sci. USA, 1974, 71, p. 4662—4665.
95. Burn J. H., Rand M. J. Acetylcholine in adrenergic transmission. — Ann. Rev. Pharmac., 1965, 5, p. 163—182.
96. Burnstock G. Evolution of the autonomic innervation of visceral and cardio-visceral systems in vertebrates. — Pharmac. Revs, 1969, 21, p. 247—324.
97. Burnstock G. Purinergic nerves. — Pharmac. Revs, 1972, 24, p. 509— 581.
98. Burnstock G. Comparative studies of purinergic nerves. — J. Exp. Zool., 1975, 194, p. 103—134.
99. Burnstock G. Do some nerve cells release more than one transmitter ? Neurosci., 1976, 1, p. 239—248.
100. Burt A. M., Silver A. Histochemistry of choline acetyltransferase: a critical analysis. — Brain Res., 1973, 62, p. 509— 516.
101. Cannon Ж В., Rosenbluth A. Sympathin E and sympathin I. — Amer. J. Physiol., 1933, 104, p. 557—574.
102. Carew T. J., Pinsker II., Rubtnson K., Kandel E. R. Physiological and biochemical properties of neuromuscular transmission between identified motoneurons and gill muscles in Aplysia. — J. Neurophysiol., 1974, 37, p. 1020—1040.
103. Carpenter D. O., Gaubatz G. L. and H, histamine receptors on Aplysia neurons. — Nature, 1975, 354, p. 343—344.
104. Chan-Palay V. Serotonin axons in the supra- and subependymal plexuses and in the leptomeninges; their roles in local alterations of cerebrospinal fluid and vasomotor activity. — Brain Res., 1976, 102, p. 103—130.
105. Chang M. M., Leeman S. E. Isolation of a sialogogic peptide from bovine hypothalamic tissue and its characterization as Substance P. — J. Biol. Chem.. 1970, 245, p. 4784—4790.
106. Coggeshall R. E. A possible sensory-motor neuron in Aplysia californica. — Tissue a. Cell. 1971, 3, p. 637—648.
107. Corrodi H., Jonsson G. The formaldehyde fluorescence method for the histochemical demonstration of biogenic monoamines. — J. Histochem. Cytochem., 1967, 15, p. 65—78.
108. Cottrell G. A., Macon J. B. Synaptic connections of two symmetrically placed giant serotonin-containing neurons. — J. Physiol. (London), 1974, 236, p. 435-464.
109. Cottrell G. A., Macon J., Szczepaniak A. C, Glutamic acid mimicking of synaptic inhibition on the giant serotonin neurons of the snail. — Brit. J. Pharmacol., 1972, 45, p. 684—688.
110. Coupland R. E. The natural history of the chromaffin cell. London, 1965. 279 p.
111. Curtis D. R,. Watkins J. C. The excitation and depression of spinal neurones by structurally related amino acids. — J. Neurochem., I960, 6, p. 117— 141.
112. Dahl E., Falek B., Mecklenburg C. von, Myhrberg H, An adrenergic nervous system in sea anemones. — Quart. J. Microscop. Sci., 1963, 104, p. 531—534.
113. Dale II. H. The action of certain ethers and ethers of choline, and their relation to muscarine. — J. Pharmac. Exp. Therap,, 1914, 6, p. 147—190.
114. Dale II. H. Nomenclature of fibres in the autonomic system and their effects. — J. Physiol. (London), 1933, 80, p. 10—HP.
115. Dale II, H. Pharmacology and nerve endings. — Proc, Roy. Soc. Med., 1935, 28, p. 319-332.
116. Dale H. H., Dudley H. TP. The presence of histamine and acetylcholine in the spleen of the ox and the horse. — J. Physiol. (London), 1929, 68, p. 97—123.
117. Descarries L., Beaudet A., Watkins К. C. Serotonin nerve terminals in adult rat neocortex. — Brain Res., 1975, 100, p. 563—588.
118. Dixon W. E. On the mode of action of drugs. — Med, Magazine, 1907, 16, p. 454-457.
119. Duffy M. J., Mulhall D., Powell D. Subcellular distribution of substance P in bovine hypothalamus and substantia nigra. — J. Neurochem., 1975, 25, p. 305-307.
120. Eccles J. C. Facing reality. New York, 1970, p. 210.
121. Ehinger B., Myhrberg H. E. Neuronal localization of dopamine, noradrenaline, and 5-liydroxytryptamine in the central and peripheral nervous system of Lumbrtcus terrestris (L.). — Histochemie, 1971, 28, p. 265—275.
122. Elfvin L. G., Hokfelt T., Goldstein M. Fluorescence microscopical, immunohistochemical and ultrastructural studies on sympathetic ganglia of the guinea pig, with special reference to the SIF cells and their catecholamine content. — J. Ultrastr. Bes., 1975, 51, p. 377—396.
123. Elliott T. R. On the action of adrenaline. — I. Physiol. (London), 1904. 31, p. 20—21P.
124. Elliott T. R. The action of adrenaline. — J. Physiol. (London), 1905, 32, p. 401—467.
125. Emson P, C., Fonnum F. Choline acetyltransferase, acetylcholinesterase and aromatic L-amino acid decarboxylase in single identified nerve cell bodies from snail Helix aspersa. — J. Neurochem., 1974, 22, p. 1079— 1088.
126. Erspamer U. Occurence of indolealkylamines in nature. — In: Handbuch Exptl PharmakoL (Stuttgart—Berlin—New York), 1966, 19, p. 132—181.
127. Euler U. S., von. A specific sympathomimetic ergone in adrenergic nerve fibres (sympathin) and its relations to adrenaline and norgdrerjaline, -» Acta physiol, scapd,, 1946, 12, p. 73—97,
128. Euler U. S., eon. Pieces in the puzzle. — Ann. Rev. Pharmac., 1971, 11, p, 1—12.
129. Euler U. S„ von., Gaddum J. H. An unidentified depressor substance in certain tissue extracts. — J, Physiol. (London), 1931, 72, p. 74—87.
130. Evans P. D., Talamo B. R., Kravitz E. A. Octopamine neurons: morphology, release of octopamine and possible physiological role. — Brain Res., 1975 90, 340—347.
131. Falck B., Owman C. A detailed description of the fluorescence method for the cellular localization of biogenic monoamines. — Acta Univ. Lunden-sis, 1965, Sectio II, N 7, p. 1—49.
132. Fange R., Hanson A. Comparative pharmacology of catecholamines. — In: Comparative pharmacology. I. Oxford, 1973, p. 391—517-
133. Felberg W. Der Nachweis eines acetylcholinahnlichen Stoffes im Zungen-venenblut des Hundes bei Reizung des Nervus lingualis. — Pfliig. Arch., 1933, 232, p. 88—104.
134. Feldberg W,, Gaddum J. H. The chemical transmitter in a sympathetic ganglion. — J. Physiol. (London), 1934, 81, p. 305—309.
135. Finkelman B. Observations of intestinal inhibition. — J. Physiol., 1930, 70 (цит. по: Альпари, 1939).
136. Fischer H. Vergleichende Pharmacologic von bbertriigersubstanzcn. Berlin, 1971. 1074 S.
137. Flock A., Lam D. M. K. Neurotransmitter synthesis in inner car and lateral line sense organs. — Nature, 1974, 249, p, 142—144,
138. Flood P. A peculiar mode of muscular innervation in amphioxus. Light and electron microscopic studies of the so-called ventral roots. — J. Comp. Neurol., 1966, 126, p. 181—217.
139. Florey E. Uber einen nervosen Hemmungsfaktor in Gehirn and Riicken-mark. — Naturwissenschaften, 1953, 40, S. 413—414.
140. Florey E. Neurotransmitters and modulators in the animal kingdom. — Fed. Proc., 1967, 26, p. 1164—1178.
141. Florey E. Acetylcholine as sensory transmitter in Crustacea. New evidence from experiments demonstrating release of ACh during sensory stimulation. — J. Comp. Physiol., 1973, 83, p. 1—16.
142. Florey E. Gamma-aminobutyric acid, glutamic acid, and related compounds, — In: Comparative pharmacology. II. Oxford, 1973, p. 555—592.
143. Florey E., Cahill A., Bathmayer M. Excitatory action of GABA and acetylcholine in sea urchin tube feet. — Comp. Biochem. Physiol., 1975, 51C, p. 5-12.
144. Florey E., Michelson M. J. Occurrence, pharmacology, and significance of cholinergic mechanisms in the animal kingdom. — In: Comparative pharmacology. I. Oxford, 1973, p. 11—41.
145. Florey E., Winesdorfer J. Cholinergic nerve endings in octopus brain. — J. Neurochem., 1968, 15, p. 169—177.
146. Fonnum F. Localization of cholinergic and alpha-aminobutyric acid containing pathways in brain. — In: Metabolic compartmentation in the brain. London, 1972, p. 245—257.
147. Fonnum F., Storm-Mathisen J., Walberg F. Glutamate decarboxylase in inhibitory neurons, A study of the enzyme in Purkinje cell axons and boutons in the cat. — Brain Res., 1970, 20, p, 259—275.
148. Frank E. The sensitivity to glutamate of denervated muscles of the crayfish. — J. Physiol. (London), 1974, 242, p. 371—382,
149. French M. C., Woodruff G. N., Kerkut G. A. The cellular localization of histamine in the peripheral nerves of rats. — Comp. Gen. Pharmac., 1971, 2, p. 275—280.
150. Fuxe K., Hokfelt T., Ungerstedt U. Morphological and functional aspects of central monoamine neurons. — Internal. Rev. Neurobiol., 1976, 13, p. 93—126.
151. Gaskell J. F. The chromaffine system of Annelides and the relation of this system to the contractile vascular system in the leech, Hirudo medicina-lis. — Philos. Trans. Roy. Soc., 1914, 205B, p. 153—211.
152. Gaskell J. F. Adrenaline in Annelids. A contribution to the comparative study of the origin of the sympathetic and adrenaline-secreting systems and of the vascular muscles which they regulate. — J. Gen. Physiol., 1920, 2, p. 73-85.
153. Geffen L. B., Jessell T. M., Cuello 4. C., Iversen L. L- Release of dopamine from dendrites in rat substantia nigra. — Nature, 1976, 260, p. 258—260.
154. Gerschenfeld H. M. Chemical transmission in invertabrate central nervous systems and neuromuscular junctions. — Physiol. Revs, 1973, 53, p. 1—119.
155. Gerschenfeld H. M., Paupardin-Tritsch D. On the transmitter function of 5-hydroxytryptamine at excitatory and inhibitory monosynaptic junctions. — J. Physiol., 1974, 243, p. 457 -481.
156. Giller E., Schwartz J. II. Cholineacetyltransferase in identified neurons of abdominal ganglion of Aplysia californica. — J. Neurophysiol., 1971, 34, p. 93—107.
157. Goldberg A. M., McCaman R. E. The determination of picomole amounts of acetylcholine in mammalian brain. — J. Neurochem., 1973, 20, p. 1—8.
158. Goldman J. E., Schwartz J. H. Cellular specificity of serotonin storage and axonal transport in identified neurones of Aplysia californica. — J. Physiol. (London), 1974, 242, p. 61—76.
159. Green A. R., Grahame-Smith D. G. Effects of drugs on the processes regulating the functional activity of brain 5-hydroxytryptamine. — Nature, 1976, 260, p. 487-491.
160. Green G. P. Histamine and the nervous system. — Fed. Proc., 1964, 23, p. 1095—1102.
161. Green G. P. Histamine. — In: Handbook of Neurochemistry. 4. New York, 1970, p. 221—250.
162. Grimm-Jorgensen У., McKelvy J. F., Jackson I. M. D. Immunoreactive thyrotrophin releasing factor in gastropod circumoesophagcal ganglia. — Nature, 1975, 254, p. 620.
163. Guthrie D. M. Control of muscular contractions by spinal neuron in amphio-xus {B ranchiostoma lanceolatum). — Nature, 1967, 216, p. 1224—1225.
164. Haldeman S., McLennan II. The antagonistic action of glutamic acid diethylester towards amino-induccd and synaptic excitation of central neurones. — Brain Res., 1972, 45, p, 393—400.
165. Hattori T., Singh F. K., McGeer E. G,, McGeer P. L. Immunohistochemical localization of choline acetyltransferase containing neurons and their relationship with dopaminergic synapses, — Rrain Res., 1976, 102, p. 164—173.
166. Hilton F. A., Hilton P. The capillary dilator substances in dry powders of spinal roots; a possible role of adenosine triphosphate in chemical transmission from nerve endings. — J. Physiol. 1954,126, p. 124—140.
167. Htmwich W. A., Agarwal H. C. Amino acids. — In: Handbook of neurochemistry. 1. New York, 1969, p. 33—52.
168. Hokfelt T. Ultrastructural localization of intraneuronal monoamines — some aspects of methodology. — Progr. Brain Res., 1971, 34, p. 213—222.
169. Hokfelt T., Eide R., JohanssonO., LuftR., Nilsson G., Arimura A. Immunohistochemical evidence for separate populations of somatostatin-containing and substance P-containing primary afferent neurons in the rat. — Neurosci., 1976, 1, p. 131—136.
170. Hokfelt T., Fuxe K., Goldstein M. Immunohistochemical studies on monoamine-containing cell systems. — Brain Res., 1973, 62, p. 461—469.
171. Hokfelt T., Fuxe K., Goldstein M., Johansson O., Hosli L. Immunochemical evidence for the existence of adrenaline neurons in the rat brain. — Brain Res., 1974, 66, p. 235—261.
172. Hokfelt T., JohanssonO., Efendic S., LuftR., Arimura A. Are there somatostatin-containing nerves in the rat gut? Immunohistochemical evidence for a new type of peripheral nerves. — Experientia, 1975, 31, p. 852—854.
173. Hokfelt T., Kellerth J.-O., Nilsson G., Pernow B. Experimental immunohistochemical studies on the localization and distribution of substance P in cat primary sensory neurons, — Brain Res,, 1975, 100, p. 235—252.
174. Runt R., Taveau R. de. On the physiological action of certain choline derivatives and new methods for detecting choline. — Brit. Med. J., 1906, 2, p. 1788-1791.
175. Iversen L. L. Role of transmitter uptake in synaptic neurotransmission. — Brit. J. Pharmac., 1971, 41, p. 571—591.
176. Johnson J. L. Glutamic acid as a synaptic transmitter in the nervous system. A review. — Brain Res., 1972, 37, p. 1—19.
177. Jones D. G. Synapses and synaptosomes. London, 1975. 328 p.
178. Juorio A. V., Barlow J. J. Catecholamine levels in the vertical lobes of Octopus vulgaris and other cephalopods and the effect of experimental degeneration. — Comp. Gen. Pharmac., 1974, 5, p. 281—284.
179. Juorio A. V., Molinoff P. B. The normal occurence of octopamine in neural tissues of the Octopus and other cephalopods. — J. Neurochem., 1974, 22, p. 271-280.
180. Juorio A. V., Philips S. R. Tyramines in Octopus nerves. — Brain Res., 1975, 83, p. 180—184.
181. Kataoka K., De Robertis E. Histamine in isolated small nerve endings and synaptic vesicles of rat brain cortex. — J. Pharmac. Exp. Therap., 1967, 156, p. 114—125.
182. Keller A., Margolis F. L. Immunological studies of the olfactory marker protein. — J. Neurochem., 1975, 24, p. 1101—1106.
183. Kerkut G. A. Catecholamines in invertebrates. — Brit. Med. Bull., 1973, 29, p. 100-104.
184. Kerkut G. A., Nicolaidis S., Piggott S. M., Rasool C. G., Walker R. J. The effect of analogues of glutamic acid on the glutamate receptors of Helix neurones. — Brit. J. Pharmac., 1974, 51, p. 134—135P.
185. Kerkut G. A., Wheal H. V. The excitatory effects of aspartate and glutamate on the crustacean neuromuscular junction. — Brit. J. Pharmac,, 1974, 51, p. 136—137P.
186. Klemm N. Histochemistry of putative transmitter substances in the insect brain. — Progr. Neurobiol., 1976, 7, p. 99—169.
187. Knowles F., Vollrath L. Synaptic contacts between neurosecretory fibres and pituicytes in the pituitary of the eel. — Nature, 1965, 206, p. 1168.
188. Koelle G. B,, Friedenwald J, S. A histochemical method for locating cholinesterase activity. — Proc. Soc. Exp. Biol. Med., 1949, 70, p. 617—622.
189. Koike H., Eisenstadt Schwarts J, M. Axonal transport of newly synthesizes acetylcholine in an identified neuron of Aplysia. — Brain Res., 1972, 37, p. 152—159.’
190. Konishi S., Otsuka M. The effects of Substance P and other peptides on spinal neurons of the frog. — Brain Res., 1974, 65, p. 397—410.
191. Kopin I. J. False adrenergic transmitters. — Annual Rev. Pharmacol., 1968, 8, p. 377—394.
192. Kort J., Zieleman M.f Westerink В. H. C. Dopamine release in substantia nigra? — Nature, 1976, 260, p. 257—258.
193. Koslow S. H., Schlumpf M. Quantitation of adrenaline in rat brain nuclei and areas by mass fragmentography. — Nature, 1974, 251, p. 530—531.
194. Kraupl F. Uber eine Reizung der Forderungsnerven an Froschherzen. — Pfliig. Arch., 1927, 217, p. 327 (цит, по: Удельное M. Г. Нервная регуляция сердца. M., 1961. 382 с.).
195. Krnjevic К. Chemical nature of synaptic transmission in vertebrates. — Physiol. Revs., 1974, 54, p. 418—540.
196. Krnjevic K., Morris M. E. An excitatory action of Substance P on cuneate neurones. — Can. J. Physiol. Pharmac., 1974, 52, p. 736—744.
197. Kuhar M. J., Aghajanian G. K., Roth R. H. Tryptophan hydroxylase activity and synaptosomal uptake of serotonin in discrete brain regions after midbrain raphe lesions: correlations with serotonin levels and histochemical fluorescence. — Brain Res., 1972, 44, p. 165—176.
198. Langley J. H. On nerve endings and on special excitable substances in cells. — Proc. Roy. Soc. London, 1906, 78B, p. 170 (цит. по: Михельсон и Зеймаль, 1970).
18 Общая физиология аервной системы
273
199, Larsson L. I., Edvinsson L., Fahrenkrug J., ffakanson R., Owman Ch., Schaffalitsky de Muckadell 0., Sundler F. Immunohistochemical localization of a vasodilatory polypeptide (VIP) in cerebrovascular nerves. — Brain Res., 1976, 113, p. 400—404;.
200, Lembeck F. Zur Frage der zentralen Uhertragung afferenter Impulse, III, Das Vorkommen und die Bedeutung der Substanz P in den dorsalen Wurt-zeln des Ruckenmarks. — Arch. exp. Pathol, Pharmac., 1953, 219, p. 197—213.
201. Lembeck F., Giere PF. Otto Loewi: Ein Lebensbild in Dokumenten. Berlin, 1968 (цит. no: Bacq, 1975).
202. Libet B., Kobayashi H., Tanaka T. Synaptic coupling into the production and storage of a neuronal memory trace. — Nature, 1975, 258, p. 155—157.
203. Lindvall O., Bjorklund A. The glyoxylic acid fluorescence histochemical method: a detailed account of the methodology for the visualization of central catecholamine neurons. — Histochemistry, 1974, 39, p. 97—127.
204. Lindvall O., Bjorklund A. The organization of the ascending catecholamine neuron systems in the rat brain as revealed by the glyoxylic acid fluorescence method. — Acta physiol, scand., 1974, Suppl. 412. 48 p.
205. Ljungdahl A., Hokfelt T. Accumulation of 3H-glycine in interneurons of the cat spinal cord. — Histochemie, 1973, 33, p. 277—280.
206. Loewi O. Uber humorale Ubertragbarkeit der Herznervenwirkung. I Mit-teilung. — Pfliig. Arch., 1921, 189, p. 239—242.
207. Loewi O. Uber humorale Ubertragbarkeit der Herznervenwirkung. II Mit-teiling. — Pfliig. Arch.,.. 1921, 193, p. 201—213.
208. Loewi O., Navratil E. Uber humorale Ubertragbarkeit der Herznervenwirkung. XI Mitteilung. Uber den Mechanismus der Vaguswirkung von Physostigmin und Ergotamin. — Pfliig. Arch., 1926, 214, p. 689—696.
209. Machado C. R. S., Machado 4. В. M., Pallegrino J. Gatecholamine-con-taining neurons in Schistosoma mansoni. — Z. Zellforsch., 1972, 124, S. 230—237.
210. Malthe-Srenssen D., Eskeland T., Fennum F. Purification of rat brain choline acetyltransferase; some immunochemical properties of a highly purified preparation. — Brain Res,, 1973, 62, p. 517—522.
211, Malthe-Srenssen D., Emson P, C. Distribution of choline acetyltransferase in the nerve cells and nerves of the abdominal ganglia of the king crab, Limulus polyphemus. — I. Neurochem., 1976, 27, p. 341—342.
212. Manaranche R., L’Hermite P. Etude des amines biogenes de Glycera con-valuta K. (Annelids Polychete). — Z. Zellforsch., 1973, 137, S. 21—36.
213. Marder E. Cholinergic motor neurons in the stomatogastric system of the lobster. — J. Physiol. (London), 1976, 257, p. 63—86.
214. Margolis F. L. Carnosine in the primary olfactory pathways. — Science, 1974, 184, p. 909—911.
215. Matus A. I. Histochemical localization of biogenic monoamines in the cephalic ganglia of Octopus vulgaris. — Tissue a. Cell, 1973, 5, p. 591— 601.
216. Mayeri E., Koester J., Kupjermann I., Liebeswar G., Kandel E. R. Neural control of circulation in Aplysia. I. Motoneurons, J. Neurophysiol., 1974, 37, p. 458—475.
217. McAdoo D. J., Coggeshall R. E. Gas chromatographic — mass spectro-metric analysis of biogenic amines in identified neurons and tissues of Hirudo medicinalis. — J. Neurochem., 1976, 26, p. 163—167.
218. McCaman R. E., Weinreich D., Borys H. K. Endogenous levels of acetylcholine and choline in individual neurons of Aplysia. — J. Neurochem., 1973, 21, p. 473—476.
219. McCaman M. W7., Weinreich D., McCaman R. E. The determination of picomole levels of 5-hydroxytryptamine and dopamine in Aplysia, Tri-tonia and leech nervous tissues. — Brain Res., 1973, 53, p. 129—137.
220. McGeer P. L., McGeer E. G. Evidence for glutamic acid decarboxylase containing interneurons in the neostriatum. — Brain Res., 1975, 91, p. 331—335.
221- McGeer P. L., McGeer E. G., Singh V. K., Chase W. H. Choline acetyltransferase localization in the central nervous system by immunohistochemistry. — Brain Res., 1974, 81, p. 373—379.
222. McLennan R, Synaptic transmission. Philadelphia, 1970. 178 p.
223- McLaughlin B. J., Wood J. G., Saito K., Barberg R., Vaughn J. E., Roberts E., Wu J.-X, The fine structural localization of glutamate decarboxylase in synaptic terminals of rodent cerebellum. — Brain Res., 1974, 76, p. 377—391.
224. Miller J. J., Richardson T. L., Fibinger H. C,, McLennan H. Anatomical and electrophysiological identification of a projection from the median cephalic raphe to the caudate-putamen in the rat. — Brain Res., 1975, 97, p. 133—138.
225. Nadler J. V., Vaca К. IP., White W. F.t Lynch G. S., Cetman C, W. Aspartate and glutamate as possible transmitters of excitatory hippocampal afferents. — Nature, 1976, 260, p. 538—539.
226. Neuhoff V., IFrise M. Determination of picomole quantities of alpha-amino-butyric-acid (GABA) and serotonin. — Arzneimittel-Forsch., 1970, 20, p. 368—372.
227. Nicoll R. A ., Barker J, L. The pharmacology of reccurent inhibition in the supraoptic neurosecretory system, — Brain Res., 1971, 35, p. 501—511.
228. Oomura У., Ooyama H., Sawada M., Tanigawa T. Effects of strychnine on glycine depolarization in an Onchidium neuron. — J. Physiol. Soc. Japan, 1972, 34, p. 536.
229. Osborne N. N; Occurrence of GABA and taurine in the nervous systems of the dogfish and some invertebrates, — Comp. Gen. Pharmac., 1971, 2, p. 433-438.
230. Osborne N. N. Occurence of glycine and glutamic acid in the nervous system of two fish species and some invertebrates. — Comp. Biochem. Physiol., 1972, 43B, p. 579—585.
231. Osborne N. N. Microchemical analysis of nervous tissue. Oxford, 1974.
232. Osborne N. N., Priggemeier E., Neuhoff V. Dopamine metabolism in characterised neurones of Planorbis corneus. — Brain Res., 1975, 90, p. 261— 271.
233. Penireath V. W., Berry M. S. Ultrastructure of the terminals of an identified dopaminecontaining neurone marked by intracellular injection of radioactive dopamine. — J. Neurocytol., 1975, 4, p. 249—260.
234. Pentreath V. И4, Cottrell G. A. Uptake of serotonin, 5-hydroxytryptophan and tryptophan by giant serotonin-containing neurons and other neurons in the central nervous system of the snail (Helix pomatia). — Z. Zellforsch., 1973, 143, S. 21—36.
235. Philips J, W., Limacher J. J. Substance P excitation of cerebral cortical Betz cells. — Brain Res., 1974, 69, p. 158—163.
236. Pitman R. M. Transmitter substances in insects: a review. — Comp. Gen. Pharmacol., 1971, 2, p. 347—371.
237. Powell B., Cottrell G. A. Dopamine in an identified neuron of Planorbis corneus, — J. Neurochem., 1974, 22, p. 605—606.
238. Price D. L., Stocks A.t Griffin J. IV., Young A., Peck K. Glycine-specific synapses in rat spinal cord. Identification hy electron microscope autoradiography. — J. Cell Biol., 1976, 68, p. 389—395.
239. Robertson H. A.- Octopamine in the central nervous system of an annelide, Lumbricus terrestris. — Exporientia, 1975, 31, p. 1006—1008.
240. Robertson H. A. Octopamine: presence in firefly lantern suggests transmitter role. — Proc. Can. Fed. Biol. Soc., 1975, 18, p. 66.
241. Robertson H. A. The innervation of the salivary gland of the moth, Man-duca sexta: evidence that dopamine is the transmitter. — J. Exp. Biol., 1975, 63, p. 413—420.
242. Roskoski R., Ryan L. D., Diecke F. J. P. Alpha-Aminobutyric acid synthesised in the olfactory nerve. — Nature, 1974, 251, p. 526—529.
243. Ross C.D., McDouglas D. B., Jr. The distribution of choline acetyltransferase activity in vertebrate retina, — J. Neurochem,, 1976, 26, p. 521—526.
244. Saavedra J. M.. Beotvnstein M. J,, Carpenter D. 0., Axelrod J. Octopa-mine: presence of single neurone of Aplysia suggests neurotransmitter function. — Science, 1974, 185, p. 364—365.
245. Saito K., Barba R., Wu J-Y., Matsuda T., Roberts E., Vaughn J. E. Immunohistochemical localization of glutamate decarboxylase in rat cerebellum. — Proc. Nat. Acad. Sci. USA, 1974, 71, p. 269—273.
246. Saito K., Konishi S., Otauka M. Antagonism between Lioresal and Substance P in rat spinal cord. — Brain Res., 1975, 97, p. 177—180.
247. Salanki J. Serotonin in the neural regulation of the bivalve mollusc Ano-donta cygnea L. — In: Recent developments in neuroanatomy, neurophysiology, neuropathophysiology and neuropharmacology. 3. Budapest, p. 67—89.
248. Shank R. P., Freeman A. R,, McBridge M. J,, Aprison M. H. Glutamate and aspartate as mediators of neuromuscular excitation in the lobster. — Comp. Biochem, Physiol., 1975, 50C, p. 127—131.
249. Sherman R. G., Atwood H. L. Correlated electrophysiological and ultra-structural studies of a crustacean motor unit. — J. Gen. Physiol., 1972, 59, p. 586—615.
250. Sherrington C. S. Remarks on some aspects of reflex inhibition. — Proc. Roy. Soc. Ser. B, 1925, 97, p. 519—545.
251. Shinnar S., Maciewicz R. J., Shofer R. J. A raphe projections to cat cerebellar cortex. — Brain Res., 1975, 97, p. 139—143.
252. Silver A. The biology of cholinesterases. Amsterdam, 1974. 596 p.
253. Smith P. A., Fitzsimons J. T.R., Loker J. E., Walker R. J. 5-Hydroxy-tryptamine as a possible inhibitory neurotransmitter in the central nervous system of the leech, Haemopis sanguisuga. — Comp. Biochem. Physiol., 1975, 52C, p. 65—73.
254. Snyder S. H., Taylor К. M. Histamine in the brain: a neurotransmitter? — In: Perspectives in neuropharmacology. New York, 1972, p. 43—74.
255. Spencer H. J. Antagonism of cortical excitation of striatal neurons by glutamic acid diethyl ester: evidence for glutamic acid as an excitatory transmitter in the rat striatum. — Brain Res., 1976, 102, p. 91—101.
256. S.-Rozsa K., Graul K. Is serotonin responsible for the stimulative effect of the extracardiac nerve in Helix pomatia? — Ann. Biol. Tihany, 1964, 31, p. 85-96.
257. S.-Rdzsa K., Perenyi L. Chemical identification of the excitatory substance released in Helix heart during stimulation of the extracardial nerve. — Comp. Biochem. Physiol., 1966, 19, p. 105—113.
258. S.-Rdzsa K., Zs.-Nagy I. Physiological and histochemical evidence for neuroendocrine regulation of heart activity in the snail Lymnaea stagnalis L. — Comp. Biochem. Physiol., 1967, 23, p. 373—382.
259. Stone T. IV. Blockade by amino acid antagonists of neuronal excitation mediated by the pyramidal tract. — J. Physiol. (London), 1976, 257, p. 187—198.
260. Tannenbaum A. S., Rosenbluth J. Myoneural junctions in larval ascidian tail. — Experientia, 1972, 28, p. 1210—1212.
261. Taylor К. M., Snyder S. H. The release of histamine from tissue slices of rat hypothalamus. — J. Neurochem., 1973, 21, p. 1215—1223.
262. Teravainen H. Anatomical and physiological studies on muscles of lamprey. — J. Neurophysiol., 1971, 34, p. 954—973.
263. Thoenen H. Surgical, immunological and chemical sympathectomy. Their application in the investigation of the physiology and pharmacology of the sympathetic nervous system. — In: Handbuch exp. Pharmac. 33. Berlin, 1972, S. 813—844.
264. Tranter J, P., Thoenen H. Ultramorphologische Veriinderungen der sym-pathischen Nervenendungen der Katze nach Vorbehandlung mit 5- und 6-Hydroxy-Dopamine. — Arch. exp. Pathol. Pharmac., 1967, 257, p. 343.
265. Tregear G. W., Niall N. D., Potts J. T., Leeman S. E., Chang M. M. Synthesis of Substance P. — Nature New Biol., 1971, 232, p. 87—89. j
266. Twarog В., Page I. II. Serotonin content of soma mammalian tissues and urine and a method for its determination. — Amer. J. Physiol., 1953, 175, p. 157—161.
267. Ungerstedt U. Stereotaxic mapping of the monoamine pathways in the rat brain. — Acta physiol, scand., 1971, Suppl. 367, p. 1—48.
268. Vincent J. D., Arnauld E. Vasopressin as a neurotransmitter in the central nervous system: Some evidence from the supraoptic neurosecretory system. — Progr. Brain Res., 1975, 42, p. 57—66.
269. Wabnitz R. W., Wachtendonk D. von. Evidence for serotonin (5-hydro-xytryptamine) as transmitter in the penis retractor muscle of Helix po-matia L. — Experientia, 1976, 32, p. 707—709.
270. Wallace B. G., Talamo B. R., Evans P. D., Kravitz E. A. Octopamine: selective association with specific neurons in the lobster nervous system. — Brain Res., 1974, 74, p. 349—355.
271. Wei E., Sigel S., Loh II., Way E. L. Thyrotrophin-releasing hormone and shaking behaviour in rat. — Nature, 1975, 253, p. 739—740.
272. Weinreich D., Weiner C., McCaman R. E. Endogenous levels of histamine in single neurons isolated from CNS of Aplysia californica, — Brain Res., 1975, 84, p. 341—345.
273. Welsh J. H. The occurence of an excitor amine in the nervous system of Buccinum and its action on the heart. — Anat. Rec., 1953, 117, p. 637.
274. Welsh J. H. Serotonin as a possible neurohumoral agent: evidence obtained in lower animals. — Ann. New York Acad. Sci., 1957, 66, p. 618—630.
275. Welsh J. H. Catecholamines in the invertebrates. — In: Handbuch exp. Pharmak. 33. Berlin, 1972, S. 79-109.
276. Welsh J. H., Williams L. D. Monoamine-containing neurons in Planaria. — J. Comp. Neurol., 1970, 138, p. 103—116.
277. Werman R. Criteria for identification of a central nervous system transmitter. — Comp. Biochem. Physiol., 1966, 18, p. 745—766.
278. Werman R. Amino acids as central neurotransmitters, — In: Neurotransmitters (Res. Publ. Assoc. Res. Nerv. Mental Dis., 50), p. 147—181.
279. Westfall J. A. Ultrastructural evidence for a granule-containing sensorymotor interneuron in Hydra littoralis. — J. Ultrastr. Res., 1973, 42, p. 268—282.
280. Wheal Н. V., Kerkut G. A. The effect of diethyl ester L-glutamate on evoked exitatory junction potentials at the crustacean neuromuscular junction. — Brain Res., 1974, 82, p. 338—340.
281. Whittaker V. P., Dome G., Scotto J. Vesiculine: A possible counter-ion for acetylcholine in the cholinergic synaptic vesicle. — In: 3d Internat. Meeting Internal. Soc, Neurochem. Budapest, 1971, p. 266.
282. Wolman M. A. A fluorescent histochemical procedure for gamma-aminobutyric acid. — Histochemie, 1971, 28, p. 118—130.
283. Wood J. G. Cytochemical localization of 5-hydroxytryptamine (5-HT) jn the central nervous system (CNS). — Anat. Rec., 1967, 157, p. 343.
284. Wood J. G. Positive identification of intracellular biogenic amine reaction product with electron microscopic X-ray analysis. — J. Histochem. Cy-tochem., 1974, 11, p. 1060—1067.
285. Woodruff G. IV., Oniwinde A. B., Kerkut G. A. Histamine in tissues of the snail, crab, goldfish, frog and mouse. — Comp. Biochem. Physiol., 1969, 31, p. 599-603.
286. Woods R. I. Acrylic aldehyde in sodium dichromate as a fixative for identifying catecholamine storage sites with the electrone microscope. — J. Physiol. (London), 1969, 203, p. 35—36P.
287. Woods R. I. The innervation of the frog’s heart. III. Electronmicroscopy of the autonomic nerve fibres and their vesicles. — Proc. Roy. Soc. Ser. B, 1970, 176, p. 63—68.
288. Zeman G. H-, Carpenter D. O. Assymetric distribution of aspartate in ganglia and single neurons of Aplysia. — Comp. Biochem. Physiol., 1975, 52C, p. 23—26.
Глава 7
ПЕРЕДАЧА В ПЕРИФЕРИЧЕСКИХ СИНАПСАХ
Значительная часть сведений о работе синаптических соединений получена при изучении процесса передачи сигналов в периферических синапсах. Эти синапсы, в особенности нервно-мышечные синапсы позвоночных животных, наиболее доступны для детального экспериментального изучения. Поэтому современные представления о механизме освобождения медиатора нервными окончаниями, его взаимодействии с постсинаптической структурой, о генерации постсинаптического потенциала были вначале сформулированы на основании исследования нервно-мышечного синапса и лишь затем использованы при изучении других синапсов.
Несмотря на очевидное существование «генерального плана» строения и функционирования синапса с химическим принципом передачи, имеет место определенная специализация синапсов, приводящая к различиям в важных деталях. Конкретные условия процесса передачи сигнала в каждом отдельном случае определяли совокупность требований и к химическим свойствам медиатора, и к структуре синапса, и к молекулярной организации пре- и постсинаптических мембран. В то же время в структуре и функции отдельных видов периферических синапсов можно усмотреть черты, которые продиктованы происхождением контактирующих клеток. Иными словами, здесь, как и во многих других клеточных образованиях,имеет место сложное взаимодействие генотипических и фенотипических факторов.
7.1. НЕКОТОРЫЕ ОСОБЕННОСТИ СТРОЕНИЯ ПЕРИФЕРИЧЕСКИХ СИНАПСОВ И ИХ СВЯЗЬ С ФУНКЦИЕЙ
Современные представления о принципах синаптической передачи в значительной мере основываются на результатах морфологического исследования синапсов, Зная тонкое строе-£78
ние синапса, возможно оценить и реальное пространство, в котором протекает физиологический процесс, и молекулярное строение участников этого процесса. Поэтому существует тесная взаимосвязь между морфологическим и функциональным подходом к проблеме синаптической передачи. Исчерпывающее изложение деталей морфологии периферических синапсов не входит в задачу настоящего раздела. Основное внимание уделено лишь функционально значимым особенностям их строения.
7.1.1. НЕРВНО-МЫШЕЧНЫЕ СИНАПСЫ ПОЗВОНОЧНЫХ
Рассматривая тонкую структуру синапса, обычно в качестве примера используют нервно-мышечный синапс позвоночных. Это продиктовано как историческими причинами, так и тем, что в этом случае накоплен наибольший объем сведений. Однако следует особо подчеркнуть, что нервно-мышечный .синапс отличает чрезвычайно высокая специализация и потому его структура никак не должна рассматриваться как образец, зная особенности которого, легко составить представление о строении других синапсов.
Скелетная мышца позвоночных животных является одним из немногочисленных примеров органа, получающего только один вид эфферентной иннервации. Большинство других органов позвоночных, а также мышцы беспозвоночных чаще всего иннервируются двумя группами нервов — возбуждающими и тормозящими. Другой важной особенностью нервно-мышечного синапса является то, что он специализирован для передачи главным образом пусковых сигналов. Если некоторые нервные клетки и мышцы беспозвоночных обладают собственной ритмической активностью, а приходящие синаптические влияния лишь взаимодействуют с нею, то в мышцах позвоночных передаваемый через синапс нервный импульс является единственным сигналом, способным побудить мышцу к действию. За некоторыми исключениями, которые будут предметом специального рассмотрения, передаваемый сигнал должен при этом практически одномоментно активировать все функциональные элементы мышечного волокна — саркомеры. Эти функциональные особенности нервно-мышечного синапса находят свое отражение в его структуре.
Мякотное нервное волокно, являющееся аксоном мотонейрона, подходя к мышечному волокну, теряет на очень небольшом участке миелиновую оболочку и тесно прилегает к поверхности мышечного волокна. Безмякотная терминальная часть аксона, как правило, разветвленной формы. Нервные веточки диаметром 1—3 мкм погружены в соответствующие желобки на поверхности мышечного волокна. Их разветвления могут быть собраны в относительно компактную массу, либо расходятся в стороны. Суммарная длина всех разветвлений сильно колеблется, но в фазных волокнах
амфибий может достигать 1 —1.5 мм. Диаметр синаптической зоны мышечного волокна у млекопитающих не превышает, как правило, 50 мкм. Аксоплазма нервной терминали содержит множество синаптических пузырьков диаметром 30—50 нм. Они обладают малой электронной плотностью, но окружены тонкой, сравнительно плотной для электронов оболочкой. Здесь жо располагаются многочисленные митохондрии.
Пространство между поверхностью нервной терминали и поверхностью мышечного волокна является первичной синаптической щелью, ширина которой непостоянна (в среднем 50 нм). Синаптическая щель, по-видимому, заполнена не только межклеточной жидкостью, но и содержит некоторые структурные элементы. Это прежде всего базальная мембрана, являющаяся производной мышечной клетки и состоящая из фиброзных волокон, которые прочно соединяют между собой пре- и постсинаптические мембраны. На базальной мембране сосредоточена основная часть холинэстеразы— фермента, гидролизирующего ацетилхолин. После разрушения базальной мембраны с помощью протеолитических ферментов существенно снижается холинэстеразная активность и удается легко механически отделить нервную терминаль от поверхности мышечного волокна [68, 133]. До такой обработки пре- и постсинаптическая мембраны настолько тесно и прочно структурно связаны, что при попытках выделения фракции синаптических мембран после размельчения ткани всегда обнаруживаются в виде синаптических комплексов, включающих остатки обеих мембран. Специальные методы приготовления препаратов для последующей электронной микроскопии, так называемое замораживание— скалывание, могут дать картину разлома либо пре-, либо постсинаптической мембран, но не поверхностей, обращенных в синаптическую щель [55].
Плазматическая мембрана мышечного волокна, в отличие от мембраны аксона, образует множество мелких постсинаптических складок. Эти складки идут перпендикулярно оси нервной терминали и параллельно друг другу со средним интервалом порядка 0.7 мкм. Каждая складка представляет собой слепой карман, открывающийся в первичную синаптическую щель, объем этого кармана в свою очередь называется вторичной синаптической щелью. Глубина постсинаптической складки колеблется от 0.2 до 0.8 мкм, причем у дна в большинстве случаев складка расширяется, приобретая в продольном сечении Т-образный профиль.
Важной особенностью структуры нервно-мышечного синапса, обнаруженной в последнее время, являются периодические утолщения пресинаптической мембраны, возле которых отмечается скопление синаптических пузырьков, так называемые активные зоны [95]. Эти активные зоны идут с тем же шагом и в том же направлении, что и устья постсинаптических складок, располагаясь над ними [105]. Снаружи нервная терминаль покрыта телами 280
сателлитных шванновских клеток. Пальцеобразные отростки этих клеток периодически со средним интервалом 1—3 мкм про-
Рис. 7.1. Схема продольного среза (А) и трехмерной реконструкции [Б) нервно-мышечного синапса лягушки.
1 — терминаль аксона; 2 — синаптические пузырьки; з — пресинаптическая мембрана;
4 — постсинаптическая мембрана; 5 — базальная мембрана; 6 — синаптические складки;
7 — активная зона; st 10 — мышечное волокно; 9 — пальцеобразные выросты шванновской клетки. По [1051 (А) и [2091 (Б).
никают в пространство между терминалью и мышечным волокном, разделяя первичную синаптическую щель на множество ячеек (рис. 7.1). В нервно-мышечном синапсе фазного мышечного волокна амфибий насчитывается 300—1000 таких ячеек. Каждая
ячейка содержит 1, 2, реже до 4 активных зон и соответствующих им постсинаптических складок. Таким образом, общее число активных зон в одном синапсе может достигать 2000.
Нервная терминаль образует некое подобие варикозного расширения в области каждой ячейки, однако на препаратах, изготовленных из мышц взрослых животных, эти варикозные расширения тесно прилегают друг к другу и практически сливаются. В мышцах головастика они располагаются на большем расстоянии и потому хорошо видны на живых препаратах при использовании интерференционной оптики [192].
Таким образом, нервно-мышечный синапс позвоночных может быть уподоблен конгломерату из множества (до 2000) синаптических пуговок. Как будет видно из дальнейшего изложения, каждая активная зона ведет себя как самостоятельный синапс. Так же как в синапсах, на нервных клетках достаточно высокая надежность передачи обеспечивается большим числом параллельно включенных элементов. Только в отличие от нейрона все эти синаптические элементы тесно сгруппированы по длине нервной терминали и прочно закрыты снаружи футляром из шванновских клеток. Благодаря этому нервный импульс практически синхронно деполяризует нервную терминаль. На это отвечает значительное число активных зон (в нервно-мышечном синапсе амфибий — 100, млекопитающих — 200—300), освобождая медиатор в синаптическую щель. Это в свою очередь приводит к генерированию постсинаптического потенциала, амплитуды которого с избытком хватает для возникновения распространяющегося потенциала действия в мышечном волокне. Таким образом, становится возможным с помощью 1—2 синапсов (точнее, синаптических конгломератов) быстро и надежно управлять работой длинного мышечного волокна.
На примере нервно-мышечного синапса быстрых фазных мы-шечных волокон позвоночных можно видеть, как его структура и функция отвечают основной цели — жесткому, неградуальному управлению мышечным сокращением, которое осуществляет a-мотонейрон. В тех же случаях, когда необходимо добиться с помощью нервного импульса, передаваемого через синапс, тонкой градации степени сокращения каждого мышечного волокна, возникает иннервация другого типа — множественная. Так иннервируются тонические волокна амфибий и рептилий, а также тонические волокна глазодвигательных нервов млекопитающих. Здесь к поверхности мышечного волокна подходят несколько нервных веточек, которые, как правило, являются аксонными терминалями нескольких разных мотонейронов. Число синапсов на одном тоническом волокне лягушки колеблется от 3 до 12 (наиболее часто 7—8), а расстояние между ними — от 100 до 1000 мкм [41, 137]. Б отличие от фазных мышечных волокон, постсинаптический потенциал здесь не приводит к генерации потенциала действия, а непосредственно запускает механизм мышечного сокращения. 282
Может меняться число, последовательность и продолжительность активации отдельных синаптических входов, и тем самым может регулироваться степень и длительность укорочения мышечного волокна.
Существуют различия не только в синаптической организации, но и в микроскопическом строении синаптических входов на мышечных волокнах разного функционального профиля. В основном они касаются степени арборизации нервной терминали и соответственно числа активных зон в пресинапсе, а также развитости субсинаптического аппарата — наличия или числа постсинаптических складок. В тонических волокнах мышц низших позвоночных и в медленных волокнах мышц млекопитающих синапсы более компактны и, по-видимому, содержат гораздо меньшее число активных зон. В тонических волокнах постсинаптические складки полностью отсутствуют, а в медленных мышцах они обнаруживаются, но в меньшем количестве [881.
7.1.2. СИНАПСЫ ВЕГЕТАТИВНЫХ ГАНГЛИЕВ
Функциональная роль синапсов в ганглиях вегетативной нервной системы более разнообразна, чем у нервно-мышечных синапсов. Очевидно, поэтому мы встречаемся здесь с несколькими вариантами строения. Преганглионарные волокна являются аксонами нейронов, лежащих в мозгу. Они образуют синапсы с дендритами и сомой ганглионарных нейронов, причем соотношение числа аксо-дендритических и аксо-соматических синапсов варьирует в разных ганглиях и у разных животных. Характерным для вегетативных ганглиев является наличие перицеллюлярного сплетения, образованного разветвлениями пре-ганглионарных волокон. В отличие от нейронов центральной нервной системы (см. гл. 1 и 8) здесь дендриты и синаптический аппарат окружены плотной капсулой из глиальных клеток с участием в некоторых ганглиях соединительной ткани. Эта «внешняя защита» преганглионарных разветвлений в какой-то мере напоминает покров из шванновских клеток в нервно-мышечном синапсе. Различают два крайних типа образования синапса: 1) точечный, или терминальный, напоминающий синапсы на многих центральных нейронах; 2) линейный, или транзиторный, когда нервная терминаль образует по своему ходу несколько варикозных расширений, каждое из которых дает синаптический контакт с дендритами ганглионарных нейронов. Эти варикозные расширения напоминают активные зоны в пресинаптических терминалях нервно-мышечных синапсов, но расположены они на гораздо больших расстояниях друг от друга. В пресинаптических структурах преганглионарных волокон обнаруживаются скопления синаптических пузырьков. Причем различают два типа пузырьков: светлые, предположительно содержащие ацетилхолин, и грануляр-
ййё, содержащие катехоламины. Пре- и постсинаптическая мембрана в местах контакта утолщены.
Каждый ганглионарный нейрон имеет много синаптических входов. В верхнем шейном симпатическом ганглии кошки их число достигает 200. По-видимому, значительная часть входов служит для передачи одного и того же биологического сигнала — импульсов, приходящих из вегетативных центров (о структуре синапсов вегетативных ганглиев см. подробнее [1, 47, 50, 226]).
7.1.3. СИНАПСЫ ПОСТГАНГЛИОНАРНЫХ ВОЛОКОН
Тонкое строение синапсов, которые образуют постганглионарные аксоны, подходя к сердечным волокнам, гладкомышечным элементам сосудов, кишечника, мочевого пузыря и т.п., изучено недостаточно. Вероятно, одной из причин является крайнее своеобразие этого типа синаптических контактов. Здесь трудно выделить синапс как вполне конкретное морфологическое образование, в которое входят пре- и постсинантические зоны с характерными чертами строения, разделенные более или менее постоянной по ширине синаптической щелью. Так, например, постганглионарные аксоны, отходящие от нейронов интрамуральных ганглиев сердца лягушки, образуют варикозные расширения, подобные тем, которые обнаруживаются на преганглионарных волокнах симпатических ганглиев. Эти варикозные расширения содержат синаптические пузырьки, митохондрии, включения гликогена. Синаптические пузырьки сгруппированы у утолщенной аксональной мембраны. Таким образом, в этом смысле обнаруживается типичный пресинаптический аппарат. Однако мышечные волокна могут отстоять от варикозного расширения на расстоянии от 30 нм до нескольких микрон. Практически невозможно выделить постсинаптическую структуру и определить зону действия освобождающегося медиатора [191 ]. Этот тип синаптической организации не должен был бы вызывать удивления, поскольку эфферентные влияния здесь чаще всего (особенно в сердце) носят не пусковой, а модулирующий характер. Однако возникают трудности в понимании того, как функционирует такой синапс, как регулируется концентрация медиатора у места его действия, если длина диффузионного пути может различаться в несколько сот раз, какова в этом случае функциональная роль холинэстеразы и других ферментов, инактивирующих медиаторы.
7.1.4. СИНАПСЫ МЫШЦ БЕСПОЗВОНОЧНЫХ
Сведения о тонком строении синапсов в мышцах беспозвоночных весьма отрывочны. Относительно систематизированные данные имеются лишь о тонком строении нервно-мышечных синапсов некоторых представителей членистоногих, пиявок, головоногих моллюсков. Но даже то, что к настоящему времени известно, свидетельствует о большом разнообразии организации 284
этих синапсов у беспозвоночных. Здесь можно видеть ctojib жё нечетко сформированные синапсы, что и в гладкомышечных органах позвоночных. У моллюсков встречаются синапсы, напоминающие нервно-мышечный синапс позвоночных: аксон тесно прилегает к мышечному волокну, погружаясь в желобы на его поверхности и даже прободая волокно. Наблюдаются противостоящие друг другу места уплотнения аксональной и мышечной мембран, а также скопления синаптических пузырьков в преси-наптических зонах Ц29]. По-видимому, у моллюсков каждое мышечное волокно несет на себе несколько синапсов (см. обзор [16]).
Весьма сложна синаптическая организация мышц членистоногих. Здесь, как правило, каждое мышечное волокно не только снабжено большим количеством синаптических входов, но и сами входы различаются в структурном и функциональном отношениях. Они призваны передавать быстрые и медленные пусковые, а также тормозящие влияния. Мышцы членистоногих высокоспециали-зированы, это находит свое выражение и в большом разнообразии синаптической организации. Из ультраструктурных особенностей синапсов членистоногих отмечена гораздо большая их изолированность от окружающих тканей. Отростки аксонов образуют нередко синаптические контакты со специальными отростками мышечных волокон насекомых, причем этот синапс плотно замурован снаружи глиальными и соединительнотканными элементами (см. обзор 116]).
h Эти особенности синаптической организации в мышцах беспозвоночных, очевидно, отражают какие-то важные отличительные черты функционирования их нервной системы. Как правило, число центральных нейронов здесь намного меньше, чем у позвоночных, а периферический синаптический аппарат осуществляет не только пусковую, но и регулирующую роль. Интегративная функция здесь частично децентрализована, и к мышечному волокну приходят сигналы, противоположные по знаку.
7.2. ПРОЦЕСС ПЕРЕДАЧИ В НЕРВНО-МЫШЕЧНЫХ СИНАПСАХ ПОЗВОНОЧНЫХ
Процесс передачи складывается из двух последовательных этапов: 1) контролируемой секреции медиатора из нервной терминали и 2) генерации мышечным волокном пост-синаптического ответа на действие медиатора. Способность нервной терминали освобождать определенные количества медиатора в пространство синаптической щели обеспечивается сложным комплексом механизмов синтеза медиатора, транспорта необходимых для этого низкомолекулярных веществ и ферментов к месту синтеза, «упаковки» и хранения запаса медиатора и т. д. Эта сторона деятельности нервной терминали нашла свое отражение в гл. 6, поэтому здесь будут рассмотрены лишь события, непосредственно относящиеся к передаточной функции синапса.
7.2.1. ОСНОВНЫЕ ЭЛЕКТРИЧЕСКИЕ ФЕНОМЕНЫ И ИХ ТРАКТОВКА
Во всех нервно-мышечных синапсах в покое наблюдается относительно редкая спонтанная низкоамплитудная электрическая активность. Впервые она была обнаружена при внутриклеточном отведении из области синапса в мышце лягушки [117]. В дальнейшем стало ясно, что спонтанная активность характерна для всех синапсов с химическим принципом передачи и может считаться одним из отличительных признаков синапсов этого типа. Миниатюрный потенциал концевой пластинки (МП КП) — это элементарный постсинаптический потенциал, очевидно, являющийся следствием спонтанного опорожнения синаптического пузырька (кванта ацетилхолина) в пространство синаптической щели. Участок синаптической мембраны, который является местом действия одного кванта, имеет площадь всего несколько квадратных микрометров, поэтому зоны действия квантов, как правило, не перекрывают друг друга. В таких условиях амплитуда ответа зависит (если условия отведения одинаковы) от числа молекул ацетилхолина, составляющих квант, объема пространства, в котором диффундирует медиатор, плотности рецепторов, с которыми он реагирует, активности холинэстеразы — фермента, разрушающего ацетилхолин, уровня мембранного потенциала клетки и ее входного импеданса. В этом перечне только один параметр — размер кванта медиатора — определяется функцией пресинапти-ческой терминали. Поскольку в большинстве исследований показано, что распределение амплитуд МПКП приближалось к гауссовскому, то было принято, что размер кванта относительно постоянен и только глубокие нарушения синтеза ацетилхолина способны его уменьшить [17, 114, 146]. Однако теперь выясняется, что даже в норме на гистограмме амплитуд МПКП можно выявить по крайней мере три фракции: низкоамплитудные суб-МПКП, нормальные МПКП (их большинство) и гигантские МПКП (чрезвычайно редкие) [69, 172]. После некоторых фармакологических воздействий значительно изменяется соотношение этих фракций в общем числе МПКП. По-видимому, существование квантов, сильно отличающихся по размеру, отражает этапы сложного процесса образования везикул, заполнения их медиатором и транспорта к месту действия.
Статистический анализ временных интервалов между появлением последовательных МПКП показал, что лучше всего этот процесс описывается распределением Пуассона (см. обзоры [17, 145, 146,. 150, 151, 190]). Отсюда возникло представление, что спонтанное освобождение происходит случайно, относительно редко по сравнению с возможностями, обеспеченными запасом везикул (низка вероятность освобождения), и независимо, т. е. каждый акт освобождения везикулы не оказывает влияния на вероятность освобождения соседних везикул.
Ответ на стимуляцию двигательного нерва представляет собой волну деполяризации, которая по своему временному течению сходна с МПКП, но намного больше его по амплитуде: если средняя амплитуда МПКП составляет 0.4—0.6 мВ, то амплитуда потенциала концевой пластинки (ПКП) достигает 30—50 мВ. Прямая регистрация ПКП в мышечных волокнах затруднена тем, что в нормальных условиях ПКП значительно превышает порог генерации потенциала действия мышечного волокна в связи с очень высоким фактором надежности синаптической передачи. Поэтому для исследования ПКП приходится тем или иным образом препятствовать этой генерации, частично блокируя нервно-мышечную передачу. В таких исследованиях обнаружилось, что ПКП представляет собой ответ на синхронизированное выделение большого числа квантов медиатора, электрические эффекты которых суммируются на постсинаптической мембране.
Расчеты, проводимые косвенным методом, показывают, что в синапсе фазного волокна лягушки квантовый состав ПКП (т) в нормальных условиях близок к 100, а в мышцах млекопитающих достигает 200—300. Если везикулы, освобождаемые при спонтанном и вызванном процессах, черпаются из одного и того же их запаса (к), то это значит, что нервный импульс резко увеличивает вероятность (ц) освобождения каждого кванта. Тогда т =рп и все различие вызванного освобождения от спонтанного определяется уровнем вероятности [79]. При этом т является случайной величиной, выраженной целым числом: амплитуда ПКП должна флуктуировать в соответствии с р, а различия между амплитудами отдельных ПКП должны быть кратны средней амплитуде МПКП. Такова квантово-везикулярная гипотеза в ее наиболее краткой и ортодоксальной редакции.
При исследовании механизмов освобождения медиатора стали обнаруживаться факты, которые указывают, что на самом деле ситуация намного сложнее, что формула т—рп является лишь самым первым приближением к действительности. Она справедлива, в частности, при некоторых искусственных условиях, когда т очень мало из-за низкого р, а п — велико. Например, при уменьшении квантового состава ПКП вследствие добавления ионов Mg++ в перфузирующий раствор. В этом случае (если т<^10), то:1) распределение амплитуд ПКП соответствует распределению Пуассона; 2) т=1п(^/^0), где N—общее число стимулов, a jV0 — число стимулов, не вызвавших ответа; 3) ma=CF, т. е. коэффициенту вариации амплитуд ПКП. При т 10 или искусственном уменьшении п ситуация гораздо точнее описывается биномиальным распределением. В нервно-мышечном соединении ракообразных распределение амплитуд постсинаптических потенциалов вообще не подчиняется закону Пуассона ]70, 241]. Таким образом, достаточно, чтобы п снизился, а р поднялась по отношению к определенному уровню, чтобы произошло значительное отклонение от распределения Пуассона. По расче-
там Мартина эти пределы соответственно для п 400, а для р <0.25 [189].
Противоречия между реальным явлением и чисто стохастической его моделью, которые обнаружены при исследовании вызванного освобождения медиатора, кажутся вполне законными и не требуют полного отказа от основных предположений квантововезикулярной гипотезы. Однако постепенно накапливаются факты, заставляющие пересматривать или ограничивать некоторые из этих предположений. Наиболее интенсивной критике подвергается постулат о независимом характере процесса освобождения квантов медиатора. Поскольку запас доступного медиатора в терминали (п) или запас везикул, находящихся на стратегической позиции, должен быть не менее 1000 [70], а средняя частота спонтанного освобождения всего 0.1—1 в 1 с, то вероятность освобождения должна быть очень низка — согласно приведенной выше формуле р < 1Х10-3. Если в этих условиях обнаруживаются отклонения от экспоненциального распределения межимпульсных интервалов, то это может говорить о нарушении принципа независимости появления отдельных МПКП. Действительно, оказывается, что точное соответствие закону Пуассона наблюдается только при соблюдении определенных экспериментальных условий [90]. Если же повысить концентрацию Са++ в растворе, то наблюдается отклонение от этого закона, которое нельзя объяснить просто изменившимся соотношением между р и п. В этих условиях непосредственно после каждого МПКП увеличивается вероятность освобождения следующего кванта [219]. Отклонения от экспоненциального распределения наблюдаются в тонких мышечных волокнах с малой исходной частотой МПКП [173]. Все это позволяет предполагать, что существует определенная, хотя и слабая зависимость между актами спонтанного выделения отдельных квантов.
При внеклеточной регистрации, которая дает возможность отведения от очень малого участка синапса, и значительном уменьшении квантового состава ПКП можно наблюдать облегчающее влияние предшествующего МПКП на квантовый состав ПКП [65]. В то же время при воздействии нервного импульса не обнаруживается взаимного влияния актов освобождения отдельных квантов, составляющих ПКП. По-видимому, для всей популяции везикул, образующих ПКП, вероятность повышается в равной мере [66]. Существование различных фракций квантов медиатора никак не сказывается на квантовом составе и соответственно амплитуде ПКП. По-видимому, очень маленькие кванты, дающие жизнь суб-МПКП, или грозди квантов, вызывающие появление гигантских МПКП, не освобождаются нервным импульсом [69, 208].
Появившиеся за последние годы более подробные сведения о морфологии нервно-мышечного синапса (см. выше) облегчают устранение или ослабление части возражений против классического варианта квантовой гипотезы. Обнаружение активных 288
зон и соответствующих им скоплений везикул позволяет рассматривать активную зону как относительно самостоятельную единицу. В этом случае вряд ли правомочно представление об общем запасе везикул, поскольку кругооборот везикул происходит в каждой зоне независимо друг от друга и группа везикул, расположенная вблизи места освобождения, имеет шансы выделиться именно здесь, а не в других точках терминали. В пользу этого свидетельствует существование четкой положительной корреляции между величиной синапса (суммарной длиной нервных терминалей) и параметрами освобождения (частотой МПКП и квантовым составом ПКП) [18, 177].
Однако стохастическому характеру процесса способствует тот факт, что общее число активных зон и соответственно мест освобождения, как правило, намного превосходит число квантов медиатора, освобождаемых нервным импульсом. Так, например, у лягушки число активных зон может достигать 2000, а освобождается одним импульсом порядка 100 квантов, хотя у млекопитающих и в особенности у человека это соотношение меньше [18]. При этом условии повторная стимуляция нервного окончания не должна обязательно приводить к повторной активности тех же самых пре- и постсинаптических зон. Этим самым может достигаться известный резерв времени для репаративных процессов и повышается надежность передачи в синапсе.
Так как МПКП и ПКП являются местными затухающими ответами, их амплитуда существенно зависит от того, в какой точке мышечного волокна они регистрируются. Затухание сигнала, генерируемого точечным источником, зависит от среды, в которой он распространяется. Поэтому внеклеточно МПКП и ПКП могут быть зарегистрированы лишь в непосредственной близости от нервного окончания. При внутриклеточном отведении по мере удаления от синапса амплитуда ответов падает, а временной ход становится более медленным в соответствии с кабельными свойствами данного мышечного волокна. При прочих равных условиях (главным образом одинаковом размере кванта и одинаковой чувствительности постсинаптической мембраны к медиатору) амплитуда МПКП, регистрируемого в максимально приближенной к месту действия кванта точке, будет прямо пропорциональна входному сопротивлению мышечного волокна [164], которое в свою очередь зависит от диаметра мышечного волокна
1.1/^С. n F d3
R
(П
где — сопротивление мембраны волокна (Ом-см2), г — сопротивление саркоплазмы (Ом-см) и d — диаметр волокна.
Эта чисто физическая и универсальная закономерность имеет большое значение в функции синапсов. Так, в тонких мышечных волокнах ПКП может оставаться эффективным даже при значи-
19 Общая физиология нервной системы 289
тельном уменьшении квантового состава, поскольку вклад каждого кванта в общую деполяризацию здесь выше. Синаптические входы в тоническое волокно могут иметь относительно небольшое число активных зон и располагаться на значительном удалении друг от друга, и тем не менее их активация оказывается достаточной, чтобы вызвать сокращение всего волокна. Это объясняется тем, что тоническое волокно имеет входное сопротивление, в несколько раз более высокое, чем фазное — за счет как большего /?м, так и меньшего d [76]. Особо важную роль приобретают физические условия для генерации и распространения постсинаптических потенциалов, возникающих на дендритах нервных клеток (см. гл. 8.)
7.2.2. ЭЛЕКТРО-СЕКРЕТОРНАЯ СВЯЗЬ.
РОЛЬ ИОНОВ КАЛЬЦИЯ В МЕХАНИЗМЕ ОСВОБОЖДЕНИЯ МЕДИАТОРА
Поскольку нервный импульс деполяризует терминаль двигательного аксона, можно было обоснованно предполагать, что именно деполяризация является тем фактором, который повышает вероятность освобождения квантов медиатора. И действительно, повышение концентрации Кт в растворе или деполяризация нервных окончаний толчками тока резко увеличивают частоту МПКП [180].
Применение техники фокальной стимуляции нервной терминали позволило Катцу и Миледи детально исследовать основные закономерности электро-секреторной связи, т. е. механизма, претворяющего моторный нервный импульс в акт освобождения квантов медиатора (см. [150, 151]).
Было показано, что распространение возбуждения по терминали осуществляется потенциалом действия (ПД), хотя скорость проведения здесь существенно ниже, чем в миелинизированном нерве. Акт секреции как ответ на деполяризацию нервного окончания происходит с некоторой временной задержкой, которая и составляет большую часть измеряемой в физиологическом эксперименте суммарной синаптической задержки. Судя по гистограмме временных интервалов между максимумом локального ПД нервной терминали и начальной фазой постсинаптического ответа, минимальная величина синаптической задержки при фокальной стимуляции — около 0.5 мс, максимум приходится на 1 мс и очень редко этот интервал занимает 2—2.5 мс. Она существенно зависит от температуры, что подтверждает и разъясняет наблюдение Самойлова [45]. Флуктуация синаптической задержки, особенно четко наблюдаемая при понижении температуры, приводит к относительной несинхронности освобождения отдельных квантов. При некоторых фармакологических воздействиях степень этой несинхронности может существенно возрастать, что вызывает «расщепление» ПКП на отдельные компоненты, например, при действии пресинаптических змеиных токсинов [20].
Подробное исследование зависимости между параметрами стимуляции нервного окончания и количеством освобождаемых квантов медиатора было проведено с помощью двух подходов: 1) фокальной стимуляции нервной терминали в мышце лягушки и 2) внутриклеточной стимуляции пресинаптического аксона в гигантском синапсе кальмара. Это позволило составить четкое представление о передаточной функции этих синапсов. Выяснилось, что зависимость между силой стимула и постсинаптическим ответом имеет сигмовидный характер [151, 152, 178]. Секреция
Рис. 7.2. Соотношение между деполяризацией пресинаптического аксона гигантского синапса кальмара и амплитудой постсинаптического ответа.
Наверху — схема расположения микроэлектродов. На графиках', по ординате — амплитуда постсинаптического ответа, по абсциссе — амплитуда прямоугольного импульса (1 мс), раздражающего пресинаптический аксон. Кривая й — начальный участок кривой I, отложенный при большем масштабе. К раствору добавлен тетродотоксин 2x10-’ г/мл [152].
усиливается уже при малых приращениях силы стимула; соответственно этот процесс не имеет порога, однако наблюдается четкое насыщение при увеличении силы стимула (рис. 7.2). Очевидно, амплитуда пресинаптического пика является не только достаточной, но даже избыточной для максимально возможного освобождения медиатора. Существует зависимость не только от силы стимула, но и его длительности, причем здесь также наблюдается насыщение. Трактовка этого факта затруднена тем обстоятельством, что от длительности стимула зависит также синаптическая задержка, которая увеличивается по мере удлинения стимула.
Можно думать, что активная фаза ПД в терминали в нормальных условиях несколько короче оптимальной длительности, поскольку факторы, способные удлинить нисходящую фазу ПД (тетраэтиламмоний, гаунидин, имидазольные соединения) увеличивают квантовый состав ПКП, относительно мало влияя на частоту МПКП [11, 21, 44, 67, 204]. Об это1?же говорят опыты, в ко-
торых подача деполяризационного толчка тока через терминаль во время нисходящей фазы ПД увеличивала выход медиатора, а гиперполяризующего — ослабляла [145].
Применение фокальной стимуляции нервных терминалей в присутствии тетродотоксина и тетраэтиламмония ясно показало, что для функционирования электро-секреторной связи несущественно, каким путем будет достигнута деполяризация пресинаптической мембраны — потенциалом действия, который сопровождается входом ионов Na+ и выходом ионов К+, или электротони-ческим потенциалом без изменения градиента этих ионов [151]. Однако электро-секреторная связь нарушается при удалении из раствора ионов Са++, хотя проведение ПД по терминали в этих условиях может не измениться. Изящные опыты Катца и Миледи, в которых ионы Са+т подводились строго локально с помощью ионофореза к препарату, длительное время находившемуся в бескальциевом растворе, позволили ясно продемонстрировать роль кальция в механизме электро-секреторной связи (рис. 7.3). Оказалось, что появление Са++ в среде, окружающей терминаль, обязательно должно предшествовать деполяризующему толчку тока. Минимальный интервал составляет 50 мс. Затем было ясно показано, что ионы Са++ входят в аксоплазму и что роль деполяризации пресинаптической мембраны состоит в активации специфических потенциалозависимых кальциевых ионных каналов в этой мембране. В особенности наглядны были эксперименты на гигантском синапсе кальмара. При введении в пресинаптический аксон экворина (белка, который начинает светиться в присутствии ионизированного Са++) удалось визуализировать вход ионов Са++ при деполяризации и оценить его размеры [181 ]. Если в покое Са++ в аксоплазме поддерживается на уровне 1Х10-7 М, то превышение уровня 1X10-4 М делает возможной секрецию медиатора. Ионо-форетическая инъекция Са++ в аксоплазму вызывает секрецию медиатора без изменения уровня поляризации пресинаптической мембраны [194].
Роль Са++ в электро-секреторной связи способен выполнять Sr+ + , но примерно в 100 раз менее эффективно [193]. Другие двухвалентные катионы — Be, Mg, Ni, Со, Си, Мп, Zn, а также трехвалентные La, Се не только не замещают Са++, но блокируют его влияние на освобождение медиатора (см. [146]). Особенно эффективно блокируют кальциевые ионные каналы в терминали ионы Мп+ + , Со++ и Ni+ + , в то же время специфические ингибиторы кальциевых каналов верапамил и Д-600 не оказывают влияния на освобождение медиатора [И]. Кальциевые ионофоры (карбоксильные антибиотики, образующие комплекс с Са++ и проникающие в виде комплекса внутрь аксона) увеличивают частоту МПКП [166].
Концентрация Са++ в аксоплазме определяется не только его входом, но и интенсивностью работы систем, стремящихся поддерживать РСа в аксоплазме на стабильно низком уровне. К этим системам относятся: 1) активный транспорт Са++ из аксоплазмы 292
в экстраклСточное пространство; 2) активный транспорт Са++ в митохондрии, так называемая секвестрация Са++ митохондриями;
3) связывание Са++ внутриклеточными буферными системами (рис. 7.4). Самой .мощной системой, способной удалять из аксо-
Рис. 7.3. Влияние аппликации ионов Са++ на освобождение медиатора. Портняжная мышца лягушки, длительно инкубированная в бескальциевом растворе. К нервному окончанию точно подведена микропипетка, содержащая 0.5 М СаС12, — с ее же помощью осуществляется внеклеточное фокальное отведение иостсинаптических токов.
В I и 4 — спонтанная диффузия Са+* из пипетки остановлена «задерживающим» напряжением» поданным на мнкропипетну. В 2 и 3 — ослабление этой «задержки». А — примеры регистрации методом фотографического наложения нескольких пробегов луча, в каждом кадре слева направо: артефакт стимулирующего импульса , внеклеточный потенциал дей' ствин нервной терминали и постспнаптические ответы. Б — результаты автоматического усреднения по 600 таких пробегов в каждом случае. Калибровка общая для всех кадров: по вертикали 1 мВ, по горизонтали — 2 мс [151].
плазмы наибольшее количество ионизированного Са++, является секвестрация митохондриями. Недаром, по-видимому, митохондрии занимают около 6% внутреннего объема терминали и только 1% объема аксона в миелинизированной его части. Целый ряд метаболических ядов и специфических митохондриальных ядов, деятельность которых в конце концов прекращает поступление Са++ в митохондрии, нарушают вызванное освобождение медиа
тора и резко увеличивают частоту его спонтанного освобождения 163, 215].
Существование потенциалозависимых кальциевых каналов в пресинаптической терминали способно объяснить и нелинейную зависимость между деполяризацией терминали и секрецией и сложную зависимость секреции от длительности деполяризующего стимула. Кальциевые каналы должны обладать потенциалозависимым воротным механизмом, а также механизмом инактивации, которые, по-видимому, ответственны за наблюдавшиеся феномены.
Рис. 7.4. Факторы, влияющие на уровень ионизированного кальция в аксоплазме нервной терминали.
1 — вход кальция при деполяризации терминали; 2 — выход медиатора; з — пассивный вход кальция и его удаление наружу активным транспортом; 4 — обмен кальция между аксоплазмой и митохондриями; 5 — связывание кальция белками аксоплазмы и перемещение этих комплексов аксоплазматическим током [215 L
Зависимость ответа на нервный импульс от внешней концентрации Са++ является нелинейной и аппроксимируется степенной функцией, причем показатель степени в разных синапсах варьирует: в мышце лягушки — 3.78 [103], в мышце крысы — 2.6 [146], в гигантском синапсе кальмара — 2.7 [156]. Трактовка этой зависимости противоречива. Сначала считалось, что это результат кооперативного влияния нескольких ионов Са++ на место освобождения [94, 103], т. е. стехиометрия реакции освобождения (в ее конечном звене) в разных синапсах колеблется от 2 до 4 ионов Са++ на 1 квант медиатора. Применение методики фиксации напряжения с помощью двух микроэлектродов, введенных в преси-наптический аксон, позволило убедительно показать, что наблюдаемая в опыте нелинейная зависимость от концентрации Са’1'* вовсе не отряжает особенности конечного звена механизма освобождения, поскольку зависимость между амплитудой входящего тока Са++ и количеством выделяемого медиатора строго линейна. По-видимому, именно вход Са++ внутрь аксона при его деполяризации нелинейно зависит как от уровня смещения мембранного потенциала аксона, так и от концентрации Са++ в растворе [182].
Это еще раз подчеркивает важную, хотя еще и плохо изученную функциональную роль потенциалозависимых кальциевых ионных каналов пресинаптической мембраны в механизме электро-севре-торной связи, В частности, представляется важным установить, в какой мере эти каналы по своей кинетике, селективности и фармакологическим свойствам сходны с кальциевыми каналами сомы нейрона, поскольку сейчас имеются подходы, позволяющие тщательное и точное исследование кальциевых ионных токов через соматическую нейрональную мембрану (см, гл, 3).
Молекулярная природа непосредственного эффекта ионов Са++ в месте освобождения пока еще является предметом спекуляций: предполагается влияние Са++ на поверхностный заряд везикулы или пресинаптической мембраны, что облегчает их взаимодействие [711, либо на специальные контрактильные белки [212], либо на специфический кальциевый рецептор на внутренней поверхности пресинаптической мембраны [150, 151]. Поскольку места освобождения медиатора из некоей абстракции постепенно становятся реально изучаемыми структурами, а молекулярные компоненты пресинаптической мембраны являются предметом пристальных исследований, можно надеяться, что уже в скором будущем удастся идентифицировать молекулярную мишень ионов Са++ в месте освобождения медиатора.
Спонтанное освобождение квантов медиатора возможно в условиях, когда уровень ионизированного Са++ понижается в окружающем растворе до 1 X 10-8 М, т. е. даже более низкого, чем в аксоплазме. Тетаническое раздражение нерва способно повысить частоту МПКП, несмотря на то, что ионы кальция перестают входить внутрь терминали [197]. Некоторые агенты резко повышают частоту МПКП, причем для этого их эффекта совершенно необязательно присутствие Са++ в растворе, К таким агентам относятся: повышение осмотического давления окружающего раствора, алифатические спирты, аминазин, яд паука кара-курта, кофеин [ИЗ, 147, 213].
Все это делает вполне обоснованным предположение, что хотя кальций и является важнейшим физиологическим фактором, определяющим освобождение кванта медиатора, молекулярная реакция слияния везикулы с пресинаптической мембраной возможна без участия кальция. Роль кальция, очевидно, состоит лишь в значительном увеличении вероятности эффективного взаимодействия. Механизм же освобождения может срабатывать и без участия кальция.
7.2.3. ИЗМЕНЕНИЯ ПРОВОДИМОСТИ ПОСТСИНАПТИЧЕСКОИ МЕМБРАНЫ, ВЫЗВАННЫЕ ДЕЙСТВИЕМ МЕДИАТОРА
Уже в первой работе, посвященной анализу ПКП [116), было обращено внимание на то, что при непрямом раздражении амплитуда потенциала действия, регистрируемого в об
ласти концевой пластинки, на 10—20 мВ ниже, чем потенциал действия в безнервной части волокна. Это послужило основанием для предположения, что медиатор вызывает значительное увеличение электрической проводимости в области постсинаптической мембраны. Участок с малым удельным сопротивлением просто шунтирует потенциал действия и тем самым уменьшает его амплитуду- В дальнейшем было прямо показано, что в области концевой пластинки при действии ацетилхолина падает с 3 кОмХ Хсм2 до 1 Ом-см2 [80].
/I Б
Внутри
Внутри
Снаружи.
Рис. 7.5. Эквивалентная схема действия медиатора на постспваптическую мембрану.
А — местный эффект медиатора; Б—действие медиатора на структуру, обладающую кабельными свойствами. Обозначения в тексте [128].
Увеличение проводимости, вызываемое медиатором, естественно объяснить как появление в мембране новых каналов, проницаемых для ионов. В первых работах эффект медиатора часто сравнивали с «коротким замыканием», кратковременным «проколом» мембраны [150]. Была предложена эквивалентная схема такого шунтирования, которая затем была использована и при исследовании действия многих предполагаемых медиаторов в самых разных синапсах. По этой схеме (рис. 7.5, А) батарея Е и резистор 1 /G — мембранный потенциал и сопротивление мембраны соответственно. Параллельно этой цепи может быть включена другая цепь, состоящая из .батареи е, резистора 1/g и ключа К. Пока ключ открыт, напряжение на зажимах схемы (трансмембранная разность потенциалов) равно напряжению Е, т. е. измеряется исходный мембранный потенциал. Эффект медиатора может быть уподоблен замыканию ключа К. При этом в цепи появляется ток. Направление этого токазависит от соотношения ЭДС батарей Е и е , соотношения
резисторов нагрузки 1 )G и 1 1g. Если ЭДС батареи е меньше, чем батареи Е, то ток течет в направлении, указанном пунктирными стрелками, т. е. применительно к концевой пластинке — входит через каналы постсинаптической мембраны и выходит через соседние с нею участки мембраны мышечного волокна. Неизбежно происходит уменьшение измеряемой разности потенциалов F. Падение напряжения V, которое обнаруживается в результате (постсинаптический ответ), равно
’,=t^L=s-^0 ™ И.=е-Е. (2)
Эта схема предсказывает, что по мере увеличения разности потенциалов на мембране Е (гиперполяризации) амплитуда постсинаптического ответа V будет увеличиваться. При деполяризации V начнет уменьшаться вплоть до нуля при Е —е, а при Е е (по абсолютным значениям) направление синаптического тока сменится на противоположное и соответственно величина V снова начнет возрастать, но уже с другим знаком.
Приведенная схема очень хорошо соответствует фактам, наблюдаемым в эксперименте. Если в область концевой пластинки ввести, помимо регистрирующего микроэлектрода, еще один микроэлектрод и соединить его с источником постоянного тока (управляемая батарея, нагруженная на сопротивление 100 мОм), то с помощью такого несложного устройства удается поляризовать мышечное волокно, т. е. произвольно менять разность потенциалов на мембране. Наблюдая за зависимостью амплитуды ПКП или МПКП от уровня мембранного потенциала волокна, при котором они регистрируются, можно видеть все явления, предсказываемые схемой: при увеличении мембранного потенциала (гиперполяризации волокна) амплитуда ПКП возрастает, а при уменьшении (деполяризации) — падает. Если с помощью специальных приемов нарушить мембранно-миофибриллярную связь и тем самым предотвратить сокращение мышечного волокна, то удается глубоко деполяризовать мышечное волокно [142]. В этом случае можно наблюдать последовательное уменьшение амплитуды ПКП, их полное исчезновение, а затем появление реверсированных ПКП, амплитуда которых будет возрастать по мере углубления деполяризации (рис. 7.5, Л). По представленной на рис. 7.5, А схеме это будет равносильно тому, что мы к зажимам «снаружи» и «внутри» подключим генератор тока с бесконечным внутренним сопротивлением. Если ключ К открыт, тогда новое значение мембранного потенциала V=E-j-l /G, если же замкнуть ключ, то
V = (3)
Это дает возможность определить в эксперименте величину е как потенциал реверсии синаптического ответа или потенциал равно
весия постсинаптической мембраны (синаптический нуль-потенциал). В данном случае эти понятия совпадают, хотя существуют ситуации, в которых экспериментально определяемый потенциал реверсии отличается от потенциала равновесия. В особенности это касается синапсов на дендритах нервной клетки.
Наличие емкости С на рис. 7.5, А приводит к тому, что при включении и выключении ключа V достигает максимума и уменьшается не мгновенно. Это значит, что ход функции V (£) будет отставать от I (t), поскольку на разряд емкости С во время фазы подъема ПКП и на ее последующий заряд во время фазы спада ПКП потребуется известное время. Заряд и разряд емкости мембраны живой клетки зависит от геометрии этой клетки и ее электрических свойств. В простейшем случае , изображенном на рис. 7.5, А, если ключ К замкнут на время Т, то фаза возрастания ПКП будет описываться уравнением
(4)
а фаза спада
V=V(T)e~t/B, (5)
где
Го = .-£, т = £.
На самом деле отведение от мышечного волокна следует уподобить отведению от кабеля, простейшая эквивалентная схема которого представлена на рис. 7.5, Б. Здесь g меньше, чем входная проводимость G^—^G/r, где г внутреннее осевое сопротивление мышечного волокна. В этом случае аппроксимация ДУ (t) имеет следующий вид [128]:
В реальном мышечном волокне существует еще очень важное осложняющее электрическую структуру обстоятельство — наличие системы поперечных трубочек, отходящих в глубь волокна от его поверхностной мембраны (Т-система). Поэтому неодинаковость временного хода V (i) и I (t) проще устранить экспериментальным путем, нежели прибегать к расчетам. При использовании метода фиксации напряжения на мембране удается прямо измерить временный ход постсинаптического тока I (i).
Общие принципы метода фиксации напряжения изложены в гл. 2. Применительно к нервно-мышечному синапсу эта техника имеет некоторые особенности. Ввиду относительно небольшой протяженности зоны синапса ( ~ 50 мкм) эквипотенциальность мембраны может быть достигнута точным введением двух микроэлектродов на расстоянии не более 100 мкм друг от друга (рис. 7.6). Желательно, чтобы зона синапса находилась между ними. Один из
электродов служит регистрирующим, отводимый им сигнал усиливается предусилителем с высоким входным сопротивлением (7) и подается на один из входов 2-лучевого осциллоскопа (для контроля изменений потенциала). Одновременно этот сигнал поступает в операционный усилитель (2), к выходу которого подсоединен второй внутриклеточный микроэлектрод — токовый. Созда-
ние. 7.6. Схема фиксации потенциала в области нервно-мышечного синапса.
2 — предусилитель; 2 — усилитель обратной связи; з — усилитель» регистрирующий ток;
4 — осциллограф.
ется возможность глубокой обратной связи: все изменения потенциала на мембране будут компенсироваться, а мембранный потенциал может быть надежно фиксирован на любом произвольно выбранном уровне. Компенсирующий ток, текущий через второй микроэлектрод, регистрируется отдельным усилителем (5), измеряющим изменения потенциала жидкости в ванночке (потенциальная земля). Ввиду относительно небольшого входного сопротивления мышечного волокна при значительной силе синаптического тока (максимальные значения 5х10-7—1Х10-® А) операционный усилитель (2) должен обеспечивать сигнал на выходе +100 В. Время установления нового уровня фиксации, т. е. быстродействие фиксации должно обеспечивать точную передачу синаптических сигналов и составлять <^20 мкс.
7.2.4. ИОННАЯ ПРИРОДА ПОСТСИНАПТИЧЕСКИХ ПОТЕНЦИАЛОВ
Проводимость постсмнаптической мембраны G при действии ацетилхолина увеличивается, очевидно, за счет увеличения проницаемости специфических ионных синаптических каналов в мембране мышечной клетки. Определенная в эксперименте величина потенциала равновесия Ед оказалась равной В среднем
—15 мВ. Это означает, что не может увеличиваться проницаемость исключительно для натрия, поскольку равновесный нернстовский потенциал для ионов Na в данном случае порядка +50 мВ. Приходится отвергнуть и калий в качестве единственного проникающего иона, поскольку его равновесный потенциал близок к —100 мВ. На самом деле Ер ПКП лежит между приведенными величинами. Это и породило представление, что проницаемость активированной постсинаптической мембраны относительно неизбирательна и что при действии медиатора открываются ионные каналы, доступные для любых ионов. В пользу такого представления привлекалось также совпадение Ер с величиной диффузионного потенциала между плазмой крови и саркоплазмой мышечного волокна.
Можно исследовать природу проникающего иона через активированную постсинаптическую мембрану, последовательно заменяя ионы в окружающем растворе На заведомо не проникающие. Если это приводит к исчезновению эффекта медиатора или весьма существенному сдвигу Ер, то можно думать, что заменявшийся ион вовлечен в синаптический электрогенез. Исследования такого типа, проведенные Такеучи и Такеучи [223, 224], показали, что как ПКП, так и ответы на микроаппликацию ацетилхолина весьма чувствительны к изменениям наружной концентрации натрия и калия, но не хлора. В дальнейшем были получены и другие неопровержимые доказательства селективного характера изменений синаптической проницаемости (см. обзоры [108, 121, 126, 128, 146 150]).
Исследования Такеучи и Такеучи, выполненные в условиях фиксации напряжения на постсинаптической мембране мышечного волокна лягушки, выявили ряд очень важных особенностей постсинаптического электрогенеза:
1) увеличивается проницаемость только для катионов (Na, К и в небольшой степени Са); 2) соотношение сдвигов натриевой и калиевой проводимости постоянно (Д£ка/+?к=1.29) и не меняется в любую временную фазу активации, т. е. натриевый и калиевый токи совершенно синхронны; 3) проводимость постсинаптической мембраны не подвержена влиянию изменений электрического поля на мембране, поэтому амплитуда ПКП практически линейно зависит от мембранного потенциала и изменений ионного состава.
Подобное исследование изменений Ер постсинаптического ответа при варьировании концентрации [Na ]„ и [К]п в широких пределах позволило выявить следующую эмпирическую зависимость:
р Р [К],
[Na|E ) 1
Д£К [NaJ, j ^Na >
1 +
G)
где [K]H, [Na]B [K]B, [Na],— концентрации K+ и Na+ в наружном растворе и внутри клетки соответственно, — сдвиг на
триевой проводимости, Д£к — сдвиг калиевой проводимости, 7? — газовая постоянная, Т — абсолютная температура, F — число Фарадея.
Относительная независимость соотношения сдвигов проводимости Л Дм а /Д£к от уровня мембранного потенциала и концентраций проникающих ионов является в известной мере аномалией. Ионные токи постсинаптической мембраны мышечного волокна не могут быть количественно описаны уравнениями, обычно используемыми для описания потенциала покоя и потенциала действия (см. гл. 2 и 3), а это значит, что какие-то важные условия теории постоянного поля Гольдмана не выполняются в активированной постсинаптической мембране [14],
Строгая синхронность изменений натриевой и калиевой проводимости чрезвычайно затрудняет решение вопроса о том, проходят ли катионы Na+ и К+ через один и тот же канал или же существуют селективные одновременно функционирующие каналы для каждого из проникающих катионов- Идея о существовании независимых селективных каналов уже давно дебатируется. Однако до сих пор не существует однозначно трактуемых фактов, на основании которых можно было бы принять или отвергнуть эту гипотезу. Трудно объяснить с позиций унитарного канала и то, что значительное уменьшение [Na]n не оказывает влияния на Д£ка/Д£к, в то время как повышение [К]н уменьшает это отношение [225]. С другой стороны, против существования отдельных ионных каналов говорит исследование зависимости амплитуды ацетилхолинового шума от мембранного потенциала [15].
7.2.5. МЕХАНИЗМ ВЗАИМОДЕЙСТВИЯ АЦЕТИЛХОЛИНА С ХОЛИНОРЕЦЕПТОРОМ
Молекула ацетилхолина обладает совокупностью качеств, которые позволяют ей весьма эффективно выполнять роль медиатора (см. также гл. 6). Она синтезируется из относительно простых и распространенных в организме предшественников. Она невелика по размеру, молекулярный вес иона — 146, обладает полным положительным зарядом на атоме азота, что обусловливает чрезвычайно быструю диссоциацию. Молекула подвижна, потому легко и быстро диффундирует из синаптического пузырька в объем синаптической щели.
К настоящему времени накопилось огромное количество сведений о связи между строением ацетилхолиноподобных веществ и их действием на постсинаптическую мембрану мышечного волокна. Эти сведения не только дали возможность детализировать характер взаимодействия медиатора с мембраной, но и привели к ощутимым практическим результатам. Фармакологическое воздействие на передачу в нервно-мышечном синапсе широко применяется в современной хирургии и невропатологии,
взаимодействовать с
Рис. 7,7. Структура и предполагаемая конформация молекулы ацетилхолина [87].
Молекула ацетилхолина вступает в контакт со специфическим местом на постсинаптической мембране, которое получило название холинорецептора. Совокупность современных знаний о холи-норецепторе позволяет считать, что его функцию выполняет некая макромолекула, встроенная в плазматическую мембрану клетки, обладающая избирательным активным центром, который способен цетилхолином и холинергическими веществами. Сам акт взаимодействия не сопровождается возникновением или разрывом ковалентных связей ни в молекуле ацетилхолина, ни в молекуле холинорецептора, но вызывает, очевидно, изменения конформации макромолекулы холинорецептора, что является началом в цепи явлений, ведущих к эффекту. Таким образом, функциональная роль холинорецептора состоит прежде всего в том, чтобы «узнать» молекулу ацетилхолина среди множества молекул, находящихся в при-мембранном слое внеклеточной жидкости. Способность к «узнаванию» в ходе взаимодействия требует определенной степени комплементарности молекул ацетилхолина и активного центра холинорецептора (в последнее время этот центр так и называют — «узнающий»). Молекула ацетилхолина (рис. 7.7) имеет четвертичный атом азота, окруженный тремя метильными радикалами. Эта так называемая катионная головка расположена на коротком мостике из двух метиленовых групп, который в свою очередь соединен с помощью сложноэфир-
ной связи с уксуснокислым радикалом. Катионная головка является чрезвычайно важным функциональным элементом ацетилхолина, поскольку такой сильно редуцированный его аналог, как тетраметиламмоний, сохраняет выраженную способность деполяризовать постсинаптическую мембрану, причем этот его эффект качественно сходен с эффектом самого ацетилхолина. Очевидно, катионная головка ацетилхолина взаимодействует с анионным пунктом холинорецептора, образуя с ним ионную пару. Этот анионный пункт холинорецептора предъявляет определенные требования к окружению четвертичного азота в молекуле холинергических веществ. Так, последовательная замена метильных радикалов на этильные устраняет способность активировать холино-рецептор, и тетраэтиламмоний относится уже к антагонистам ацетилхолина. Несомненное значение имеет взаимодействие «тела» молекулы ацетилхолина с поверхностью холинорецептора. Принято считать, что помимо анионного пунктд в узнающем центре
холинорецептора имеется также эстератический, или эстерофиль-ныЙ пункт, особенности которого и определяют специфичность холинорецептора. Действительно, из множества химических веществ, обладающих триметиламмониевой катионной головкой, далеко не все способны взаимодействовать с холинорецептором нервно-мышечного синапса позвоночных. Эта способность определяется, очевидно, целым рядом особенностей строения молекулы данного холинорецептора. Подробнее о фармакологии нервно-мышечного синапса см. [2, 40, 51 1.
7.2.6. МОЛЕКУЛЯРНЫЕ СВОЙСТВА ХОЛИНОРЕЦЕПТОРА
Попытки выделить из постсинаптической мембраны ту конкретную молекулу, с которой взаимодействует ацетилхолин, предпринимались уже давно [49, 112]. Весьма заманчива перспектива исследования особенностей этого взаимодействия, устройства активного центра холинорецептора, кинетики конформационных превращений и т. п. При современной технике разделения клеточных компонентов проблема изолирования холинорецептора сводится по существу к поискам достаточно надежной «метки», с помощью которой удалось бы опознать молекулу холинорецептора после солюбилизации компонентов мембраны, подбору условий выделения, которые по возможности меньше денатурировали бы холинорецептор, и, наконец, способа контроля за сохранностью его функциональных свойств. Наибольший прогресс достигнут в поисках «метки» и связан с применением полипептидов, выделенных из яда змей семейства аспидовых (а-бунгарото-ксин, найатоксин и др.). Эти полипептиды относятся к нейротоксинам, поскольку высокоспецифично, и, как правило, необратимо ингибируют некоторые холинорецептивные мембраны и нарушают передачу в соответствующих синапсах.
С помощью нейротоксинов удалось выделить белковые [86, 195] или протеолипидные [1011 компоненты из тканей электрических органов скатов и угрей, из нормальных и денервированных скелетных мышц [64, 196]. Эти компоненты после отщепления меченого токсина сохраняли способность взаимодействовать с ацетилхолином и другими холинергическими агонистами, что послужило веским доказательством при идентификации выделенных белков или протеолипидов в качестве холинорецепторов.
Рецепторные белки имеют, по-видимому, олигомерное строение и состоят из нескольких (2—8) протомеров с молекулярным весом 40—80 тыс. дальтон каждый. Не вполне ясно, насколько одинаковы все протомеры, образующие комплекс. Эти белки гидрофобии и могут находиться в растворе только в присутствии детергентов. Выделенный холинорецепторный белок применяют в качестве антигена, иммунизируя кроликов. Это дало возможность получить антитела против холинорецепторов. В ходе иммуниза
ции у кроликов развивается слабость, т. е, блокада вырабатывающимися антителами собственных холинорецепторов. Сыворотка, полученная от этих кроликов, уменьшает амплитуду МПКП и чувствительность к ионофоретической аппликации ацетилхолина в опытах на нервно-мышечных препаратах кроликов и лягушек [130, 135, 136, 2071.
В пользу представления о холинорецепторе как о белковой молекуле имеются и некоторые косвенные данные. Было показано, что ингибиторы синтеза белка (актиномицин Д, пуромицин) препятствуют появлению экстрасинаптической холинорецепции после денервации мышцы [115, 230]. Известна важная функциональная роль сульфгидрильных групп в механизме действия ацетилхолина [49, 78].
Делаются попытки использовать изолированный холинорецеп-тор в качестве модификатора искусственной фосфолипидной мембраны. Однако такие исследования еще не дали ответа на вопрос, содержит ли выделенный белок, помимо центров, узнающих ацетилхолин, еще и ионоселективное устройство (см. обзоры [89, 101, 1201).
Эта проблема чрезвычайно важна, поскольку ионные эффекты ацетилхолина в разных тканях совершенно различны. Ацетилхолин может повышать проницаемость мембраны либо только для одного из катионов [Na, К, Са), либо для комбинации из них, может снижать проницаемость для К+ или Na+, может увеличивать избирательно ее для С1_ (см. обзоры [26, 29, 30, 126, 1281). Если ионоселективный фильтр является неотъемлемой частью молекулы холинорецептора, то тогда следует предположить существование в природе очень большого числа типов холинорецепторов, поскольку помимо различий в ионном механизме существуют еще различия в фармакологической характеристике узнающих центров холинорецепторов разных тканей. Можно допустить и другой вариант, по которому роль холинорецептора состоит только в управлении состоянием ворот ионного канала, сам же канал представляет собой независимое в молекулярном отношении устройство. Но, к сожалению, пока существуют предпосылки к детальному исследованию только холинорецепторов, выделенных из электрических пластинок и скелетных мышц позвоночных, которые генетически весьма близки друг другу. Нейротоксины избирательно блокируют только эти типы холинорецепторов, а надежные инструменты для выделения других холинорецепторов еще не обнаружены.
Современные представления о функциональной организации холинорецептивной мембраны могут быть проиллюстрированы схемой (рис. 7.8), которая отнюдь не претендует на передачу истинных морфологических отношений между элементами этой мембраны. По этой схеме холинорецептивный белок (или комплекс совместно функционирующих белков) является интегральным, т. е. встроен в мембрану таким образом, что находится в непосредственном кон-304
такте как с наружной, так и внутренней средой клетки. Он содержит активный («узнающий») центр для взаимодействия с ацетил-
Рис. 7.8. Схема функциональной организации холинорецептивной посг-синаптической мембраны.
1 — молекулы фосфолипидов, 2 — холияорецепторный комплекс, з — молекулы ацетилхолина, 4 — ионы натрия в межклеточной жидкости, 5 — узнающий центр холинорецепторов на наружной стороне мембраны, 6 — воротное устройство ионного канала (его положение на внутренней стороне мембраны совершенно произвольно); вверху — состояние покоя, когда канал закрыт, внизу — состояние активности, при втом канал открыт.
холином (на наружной стороне мембраны), воротное устройство, изменения состояния которого определяют «проходимость» ионного канала, и селективный фильтр, способный пропускать только определенный сорт ионов.
7.2.7. КИНЕТИКА ИОННОГО ТОКА И ПРИРОДА АКТИВАЦИИ ПОСТСИНАПТИЧЕСКОЙ МЕМБРАНЫ
Использование техники фиксации напряжения в синаптической зоне дало возможность точно регистрировать временной ход тока концевой пластинки (ТКП). При поддерживаемом уровне мембранного потенциала —80 мВ время возрастания ТКП в портняжной мышце лягушки до максимума составляет 0.5—0.6 мс, а время спада до половины — 1.1—1.2 мс. Спад ТКП на большей части своего протяжения экспоненциален, поэтому общая длительность ТКП составляет 6—8 йс. Лишь начальная и конечная фазы спада отклоняются от экспоненциального хода [170, 171, 186, 187]. Аналогичные результаты были получены при анализе миниатюрных ТКП (МТКП) [122,123]. Это совпадение временного
20 Общая физиология иерввой системы 305
хода ТКП и МТКП свидетельствует о том, что отдельный кванты, составляющие ТКП, выделяются с достаточно высокой синхронностью.
Совершенно очевидно, что временной ход ТКП отражает кинетику активации постсинаптической мембраны. Поскольку этот процесс состоит из ряда последовательных этапов, скорость которых может быть различной, то разумным подходом является поиск наиболее медленного этапа, который определяет временной ход всего процесса в целом. Формально любой из предполагаемых этапов активации постсинаптической мембраны: освобождение ацетилхолина, подход молекулы ацетилхолина к рецептору, образование комплекса ацетилхолин—рецептор, активация этого комплекса, появление ионной проводимости, протекание ионных токов через мембрану, устранение молекул ацетилхолина путем диффузии и энзиматического гидролиза, уменьшение проводимости — может быть лимитирующим.
На протяжении 40 лет со времени первых регистраций ПКП [9, 10] трактовка природы его временного хода претерпела ряд изменений. Вначале казалось, что узким местом является энзиматический гидролиз ацетилхолина [111], поскольку ингибирование холинэстеразы приводит к пролонгированию ПКП. Затем было показано, что процессы диффузии ацетилхолина в синаптической щели столь быстры, что энзиматический гидролиз не может выступать в роли единственного лимитирующего фактора [109]. Это поставило под сомнение гипотезу о том, что временной ход ТКП (функция — 1 (/)) отражает изменение концентрации ацетилхолина в синаптической щели (функцию С (£)). Можно было думать, что состояние повышенной проводимости сохраняется и тогда, когда свободного ацетилхолина у места действия уже нет. Тогда возникло предположение, что наиболее медленным процессом является образование и диссоциация комплекса ацетилхолин—холинорецептор, т. е. время жизни этого комплекса прямо определяет длительность изменений проводимости мембраны. В свете этого представления любые изменения временного хода ТКП под влиянием различных факторов (уровень мембранного потенциала, температура, разнообразные фармакологические воздействия и т. д.) следовало бы рассматривать как результат изменения сродства рецептора к ацетилхолину. Не существует прямых данных, свидетельствующих против такого объяснения. Тем не менее его трудно использовать в ряде конкретных случаев. Прежде всего к ним относится потенциалозависимость временного хода ТКП.
Уже в первых исследованиях ТКП было обнаружено, что гиперполяризация удлиняет, а деполяризация укорачивает его временной ход [223]. В дальнейшем это наблюдение было многократно подтверждено (рис. 7.9, А, Б). Вначале пытались объяснить это явление влиянием выходящего тока в зоне концевой пластинки на ионы ацетилхолина, предполагая, что путем ионофореза этот ток влияет на эффективную концентрацию ацетилхолина в примем-306
бранном слое. Однако тщательный экспериментальный анализ показал несостоятельность этого объяснения [59, 186, 187].
А — шесть ТКП, снятых методом наложения (нижний луч) при разных уровнях мембранного потенциала (верхний луч) от —120 мВ (соответственно нижние пробеги лучей) до + 38 мВ (верхние пробеги лучей). Видно, что ТКП при —120 мВ гораздо длительнее, чем ври +38 мВ; В — спад ТКП (орбината-логарифмичеекая шкала) во времени (абсцисса) при разных уровнях мембранного потенциала (цгцбры приведены у каждой кривой). Видно, что спад имеет экспоненциальный характер; В — совпадение зависимости константы а от уровня мембранного потенциала при разных способах ее определения: квадраты — при анализе ацетилхолиновых шумов, крестики — по спаду ТКП, треугольники — по спаду МТКП. А и Б — по [1861, В — по [59].
Привлекалась гипотеза о существовании различных ионных каналов; при этом постулировалось, что кинетика их различна: натриевый канал открывается на более длительное время, чем калиевый, Поэтому казалось, что В области калиевого равно
веского потенциала (—100 мВ) можно видеть результат работы только натриевых синаптических ионных каналов (длительный ТКП), а в области натриевого равновесного потенциала (+50 мВ) — только калиевых каналов (короткийТКП) 1122, 185]. Однако проверка некоторых следствий этой гипотезы заставила от нее отказаться [169, 186].
Таким образом, постулат о потенциалонезависимости проводимости постсинаптической мембраны следует считать поколебленным, хотя общий принцип электрической невозбудимости постсинаптической мембраны [131], очевидно, справедлив и поныне. Действительно, синаптические ионные каналы не могут быть активированы изначально смещением потенциала на мембране. Это способен сделать только медиатор (в данном случае ацетилхолин). Дальнейшее развитие активации зависит от величины электрического поля на мембране, но зависимость эта довольно слабая. Так, например, при смещении мембранного потенциала на 100 мВ время полуспада ТКП изменяется всего в два раза.
Наиболее разработанная и последовательная модель кинетики механизма активации постсинаптической мембраны была предложена Стивенсом и сотр. [59, 102, 186, 187]. В качестве основы была взята схема, предложенная ранее [81],
А, 3
АХ -+ Р АХР ==t АХР*, (8)
где АХ — молекула ацетилхолина, Р — рецептор в неактивном состоянии, Р* — активированный рецептор, к±, k_t — константы скорости образования и распада комплекса АХР, р и а — константы скорости активации и инактивации рецептора. Исходно было предположено, что первые этапы, т. е. диффузия АХ в пределах синаптической щели и образование комплекса АХР, являются гораздо более быстрыми, чем активация этого комплекса, т. е. Arr, Таким образом, в качестве лимитирующего
фактора был выбран процесс открытия и закрытия ионных каналов. Хотя, как уже указывалось выше, такой выбор не лишен элементов произвола, он позволяет создать более правдоподобную кинетическую модель.
Суть этой модели в следующем. Канал может существовать только в одном из двух состояний — открытом или закрытом. Переход из одного в другое совершается практически мгновенно, т. е. форма элементарных импульсов, из которых складывается ТКП, приближается к прямоугольной. Константы R и а отражают вероятность таких переходов для каждого из множества каналов, участвующих в генерации ТКП. Из общего числа рецепторов в каждый момент времени лишь незначительная часть образует комплекс с ацетилхолином, и вероятность активации уже образовавшегося комплекса относительно мала.
Эти же идеи были применены при анализе ацетилхолиновых шумов. Катц и Миледи [157 ] обнаружили флуктуации мембранного
потенциала в области концевой пластинки при диффузном длительном орошении ее ацетилхолином. Статистический анализ этих флуктуаций позволил предположить, что они отражают элементарные сдвиги потенциала, которые вызваны активацией отдельных холинорецепторов. По коэффициенту вариации амплитуды удалось оценить эту элементарную деполяризацию, а по энергии спектра на разных частотах — среднее время жизни синаптического ионного канала 1159]. Выяснилось, что ни амплитуда элементарного потенциала, ни время жизни каналов не зависит от концентрации ацетилхолина у мембраны или длительности его эффекта. Поэтому они не меняются при воздействии ингибитором холинэстеразы или антагонистами ацетилхолина типа тубокура-рина [158, 160, 163].
Совершенствование методики регистрации ацетилхолиновых шумов в условиях фиксации напряжения позволило измерять кинетику изменений проводимости постсинаптической мембраны [59]. Оказалось, что среднее время открытого состояния ионных каналов практически совпадает со временем полуспада МТКП и ТКП. При этом временные параметры элементарных токов точно так же зависят от температуры и уровня мембранного потенциала, как и МТКП и ТКП (рис.7.9, В). Это очень важное соответствие позволяет при исследовании кинетики постсинаптических токов в равной мере пользоваться как вызванными ответами (ТКП), так и анализом ацетилхолиновых шумов.
Согласно модели, временной ход ТКП зависит от распределения во времени числа элементарных актов проводимости постсинаптической мембраны и распределения их длительностей. Процесс открывания каналов является вероятностным, описывается экспоненциальным законом и зависит от уровня мембранного потенциала и температуры:
p(J7) = e-‘-+fi>. (9)
При этом Ах определяет потенциалозависимость вероятности открытия, но оба коэффициента А± и зависят от температуры. При гиперполяризации и понижении температуры эта вероятность падает, при деполяризации и повышении температуры увеличивается. Время открытого состояния канала также подчиняется экспоненциальному закону и тоже зависит от мембранного потенциала и температуры:
а(У) = е-Мбг. (10)
При гиперполяризации и понижении температуры это время увеличивается (вероятность закрытия падает), а при деполяризации и при повышении температуры каналы закрываются быстрее (с большей вероятностью). .
Если бы с помощью какого-либо приема удалось синхронно открыть большое число каналов, то кривая спада тока (она же кривая распределения во времени числа открытых каналов)
была бы строгой экспонентой. Однако в реальных условиях синапса должен существовать период, во время которого происходит возрастание концентрации ацетилхолина до максимума, идет образование комплекса ацетилхолин—холинорецептор и открытие ионных каналов, но уже начался процесс их закрытия. По-видимому, этому соответствует измеряемое в эксперименте время подъема амплитуды тока до максимума и самый начальный (неэкспоненциальный) участок фазы спада. Далее идет экспоненциальный спад, отражающий кинетику только одного процесса —закрывания ионных каналов (рис. 7.9, Б).
Были получены прямые экспериментальные свидетельства в пользу этой модели. С помощью специальной техники фиксации напряжения очень малых участков холиноцептивной мембраны удалось в ответ на воздействие ацетилхолином зарегистрировать относительно редкие флуктуации тока, имевшие форму прямоугольных импульсов одинаковой амплитуды порядка 2x10”11 мо, но различавшихся по длительности. Распределение этих длительностей соответствовало распределению Пуассона со средним временем порядка 1 мс [200]. Можно думать, что удалось визуализировать изменения проводимости холинорецептивной мембраны, вызванные активацией одиночных каналов (рис. 7.10). Причем параметры этих и одиночных актов, зарегистрированных в прямом эксперименте, полностью совпали с теми, которые были вычислены из данных спектрального анализа при допущениях, предусмотренных моделью [59].
Такая модель кинетики постсинаптических ионных каналов хорошо объясняет влияние целого ряда факторов на временной ход ТКП. Известно, что некоторые фармакологические вещества укорачивают время полуспада ТКП (атропин, барбитураты, хистрионикотоксин) либо удлиняют его (многоатомные спирты, эдрофоний), при действии ряда веществ спад ТКП перестает зависеть от потенциала на мембране (серотонин, диизопропилфтор-фосфат) (см. обзор [30]). В рамках модели можно предполагать влияние этих веществ на константу а, т. е. константу перехода активированного комплекса АХР* в неактивное состояние АХР и потенциалозависимость этого перехода. Способность серотонина угнетать чувствительность постсинаптической мембраны к ацетилхолину [91] и зависимость этого угнетающего эффекта от уровня мембранного потенциала [28] нашли свое рациональное объяснение, когда было показано, что серотонин способен увеличивать потенциалозависимость константы активации р [36]. Поэтому по мере гиперполяризации в присутствии серотонина существенно уменьшалась вероятность перехода комплекса АХР -> АХР* и зависимость ДГ (V) становилась немонотонной (рис. 7.11, А, Б).
Кинетическая модель Стивенса и сотр. предусматривает разумное физическое истолкование. Предполагается существование воротной молекулы, которая управляет селективностью ионных каналов (или каналами, если они разделены и спарены). Взаимен 310
fl
Б
"Л IO#V' ' T' V”"T^R1R
' 250mc
Рис. 7.10. Токи одиночных ионных каналов.
А — схема отведения сигналов от малого участка поверхности денервированного мышечного волокна; 1—s — внутриклеточные микроэлектроды, служащие для фиксации мембранного потенциала в месте отведения, 3 — микропипетка е кончиком 3—5 мкм, содержащая раствор Рингера и холиномиметик. Кончик пипетки плотно прижат к поверхности волокна, таким образом, участок, орошаемый раствором холиномиметика, не превышает 10—15 мкм2, 4 — влектронная система для фиксации потенциала, 5 — усилитель, регистрирующий токи, входящие через активированную мембрану в участке; ограниченном кончиком микропипетки. В — регистрируемые токи при воздействии 2x10-' М суберил-дихолина. Отклонения вниз — периоды, когда ток входит через одиночные каналы внутрь волокна. Мембранный потенциал фиксирован при—120 мВ, температура 8° С. Калибровка по вертикали — 10х10-1г ти> горизонтали — 250 мс [200].
действие ацетилхоЛинА с холинорецептором понижает энергетический барьер прохода воротной молекулы из состояния, при котором она закрывает переход по каналу, в состояние, разрешающее такой проход. Электрическое поле может влиять на уровень энергетических барьеров, если воротная молекула обладает диполем. Действие различных факторов на кинетику изменений проводимости постсинаптической мембраны в свете этой модели легко объяснить либо влиянием на воротную молекулу, либо прямым влиянием на состояние ее гидрофобного окружения. Любой из этих факторов может определять уровень энергетического барьера переходов из одного состояния в другое.
Рас. 7.11. Влияние серотонина на кинетику активации постсинаптпческой мембраны мышцы лягушки.
А — немонотонная зависимость амплитуды ТПП от уровня мембранного потенциала в присутствии серотонина; Б — исчезновение зависимости времени полуспада ТКП от уровня мембранного потенциала, черные критики — норма, светлые кружки — действие серотонина; В — возрастание зависимости константы р от уровня мембранного потенциала, I — норма, й —в присутствии 2х10-‘М серотонина [36].
Несмотря на способность этой модели объяснить большинство существующих фактов и предсказывать новые, она явно не охватывает всего механизма постсинаптической проводимости в целом. Так, уже появляются факты, которые трудно или даже невозможно объяснить существованием только двух состояний ионных каналов с низкой проводимостью (неактивные) и с высокой (активные). Так, например, было показано, что средняя проводимость ионных каналов, открываемых разными холиномиметиками, может различаться более чем в два раза [92, 160]. Спорной является и мгновенность срабатывания воротного механизма [161]. До сих пор невозможно адекватное суждение о том, какая все-таки стадия — образование комплекса ацетилхолин—рецептор или активация этого комплекса — является более медленной и определяет тем самым временной ход ТКП. Необъясненными до сих пор остаются электрохимические особенности постсинаптической мембраны (см. обзоры [29, 30, 921).
7.2.8. НЕКОТОРЫЕ КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ
ПОСТСИНАПТИЧЕСКОГО МЕХАНИЗМА
Непременным условием для проверки существующих теорий постсинаптического механизма и создания новых является точное значение числа взаимодействующих элементов, размеры пространства, в котором это взаимодействие происходит, и реальных скоростей последовательных этапов.
В настоящее время постепенно становится возможным количественно оценить некоторые из необходимых параметров. Эти расчеты обычно проводят применительно к эффекту одного кванта ацетилхолина, поскольку только в этом случае можно обоснованно предполагать, что известное число молекул ацетилхолина одновременно появляется в объеме синаптической щели и действует на определенный участок постсинаптической мембраны. Исходные данные, положенные в основу расчетов, обычно получены разными методами, и потому многие результаты следует рассматривать как первое приближение к действительности.
При выделении содержимого синаптического пузырька ацетилхолин распространяется из объема сферы диаметром 50 нм (Зх X10”17 см3) в новый объем. Если считать, что это простая диффузия и что время достижения максимума концентрации в этом новом объеме меньше или равно времени достижения максимума МТКП — 0.2—0.3 мс, то можно оценить величину объема синаптической щели, в котором действует один квант. Это сфера диаметром 1 мкм. При этом концентрация ацетилхолина по сравнению с исходной в синаптическом пузырьке должна уменьшиться примерно в 66 000 раз. Число молекул ацетилхолина, составляющих один квант, сильно колеблется по разным оценкам — от 4х103 до 1 X 10&. Для нервно-мышечного синапса крысы наиболее заслуживающие доверия данные — 1.5Х104 [146].
Это значит, что максимальная пиковая концентрация ацетилхолина в месте действия к этому моменту должна была бы достигнуть ~8Х1О-® М. Однако на самом деле она, по-видимому, выше примерно на два порядка и приближается к 10~3 М. Причиной тому является гораздо более медленная диффузия ацетилхолина в пространстве синаптической щели, а отсюда и гораздо меньший «рабочий объем», который успевает занять квант ацетилхолина за 0.2—0.3 мс. Оценка площади постсинаптической мембраны, на которой реализуется эффект одного кванта, сильно затруднена сложной геометрией синаптической щели. В наиболее простом случае она должна была бы составить 3—10 мкм2 [57, 150]. Однако необходимо принять во внимание, что скорее всего синаптические пузырьки опорожняются непосредственно над входом во вторичную синаптическую складку. Глубина, на которую молекулы ацетилхолина могут проникнуть в складку, зависит от активности разрушающего их фермента — холинэстеразы. С другой стороны, как
указывалось выше, наибольшую плотность холинорецепторов можно предполагать в непосредственной близости ко входу в синаптическую складку. Поэтому пока приходится исходить из простейших соображений.
Эффект 1 кванта ацетилхолина состоит в увеличении проводимости мембраны на 5.5Х10~8 мо [123]. Значит, удельное сопротивление участка постсинаптической мембраны понижается с 7 X Х101 Ом-см2 в покое до 0.55—1.8 Ом-см2 в состоянии активности. Если принять, что средняя проводимость одного открытого синаптического ионного канала равна ЗхЮ-11 мо [59], то для реализации эффекта одного кванта должно быть активировано порядка 1800 каналов. То же самое получается, если разделить среднюю амплитуду МПКП (0.51 мВ) на среднюю амплитуду элементарного ацетилхолинового потенциала (0.33 мкВ) [159]. Тогда средняя плотность активированных ионных каналов составит 180—600/мкм2. За время активного состояния через один ионный канал переносится заряд, равный ЗхЮ-16 К л, что эквивалентно проходу 1.5 X Х104 одновалентных ионов. В зоне действия одного кванта это составит 2.7Х107 одновалентных ионов, или в пересчете на площадь мембраны 3—9Х1014 ионов/см2.
Оценка числа холинорецепторов неоднократно проводилась авторадиографическими методами сначала с помощью меченого тубокурарина [238], а затем меченого а-бунгаротоксина (см. обзоры [57, 270]). Опубликованные результаты сильно различаются между собой. Если принять минимальные из приводимых величин (им можно отдать предпочтение, так как при их получении в большей мере учитывались многочисленные осложняклцие факторы), то тогда плотность холинорецепторов в нервно-мышечном синапсе мыши составляет 8.500/1 мкм2 [57], а их количество в зоне действия одного кванта соответственно 2.6 Х104—8.5 Х104.
Пока не существует четких данных, котЬрые позволили бы определить, с каким числом активных центров холинорецепторов должны взаимодействовать молекулы ацетилхолина для того, чтобы активировать один ионный канал. Если исходить из существования кооперативного эффекта субъединиц холинорецептора, то можно полагать, что это число приближается к 2 [104, 211]. Но в любом случае получается, что число доступных для ацетилхолина холинорецепторов превышает число реально активируемых при действии кванта ацетилхолина примерно в 10—20 раз. Можно думать, что существование этого превышения (резерва рецепторов) диктуется прежде всего необходимостью создания достаточно высокой вероятности взаимодействия молекул ацетилхолина с холинорецепторами, т. е. большой скорости возрастания эффекта ацетилхолина. Этой же цели должно служить большое число освобождаемых молекул ацетилхолина, которое тоже примерно в 5—10 раз превышает число взаимодействующих. Кроме того, можно предполагать, что последующая активация одной и той же функциональной единицы постсинаптической мембраны
возможна лишь по прошествии некоторого временного интервала, за который элементы, составляющие эту единицу, вернут исходные свойства: макромолекулы, участвующие в этом акте, восстановят исходные конформации, восстановится ионный состав в прилегающих слоях электролитов и т. п. Какая часть избытка холинорецепторов абсолютно необходима для поддержания высокой скорости взаимодействия с ацетилхолином, а какая является действительно резервной, пока не ясно. Попытки экспериментально ответить на этот вопрос приводят к противоречивым результатам 156, 206].
Уточнение и изменение приведенных здесь количественных данных уже в ближайшем будущем представляются несомненными. Но это и есть источник прогресса в постижении механизма эффекта медиатора на постсинаптическую мембрану.
7.2.9. ПОСТАКТИВАЦИОННЫЕ ЯВЛЕНИЯ В НЕРВНО-МЫШЕЧНОМ СИНАПСЕ
Предшествующее изложение механизмов передачи в нервно-мышечном синапсе касалось исключительно эффектов однократных или достаточно редких активаций взаимодействующих структур. В то же время хорошо известно, что управляющая функция мотонейрона осуществляется путем ритмических разрядов, частота импульсов в которых колеблется от 10 до 50имп/с (43]. Поэтому рассмотрение передачи в условиях, наиболее приближенных к нормальным физиологическим, должно обязательно учитывать важный вклад постактивационных процессов и их влияние на эффективность передачи.
Следовая реакция после возбуждающего стимула — непремен ное свойство любой биологической структуры. Как правило, реакция возбудимой ткани существенно зависит от длительности стимулирующего воздействия, ослабляясь во времени. В зависимости от характера возбудимой ткани и стимула этот феномен ослабления ответной реакции носит разное название (аккомодация, инактивация, депрессия, десенситизация, адаптация и т. п.) и, по-видимому, в каждом отдельном случае имеет свою специфическую природу.
Уже на заре электрофизиологического исследования возбудимости нерва и мышцы было обнаружено, что существуют оптимальные частоты стимуляции, дальнейшее же повышение частоты приводит к ослаблению реакции. В частности, стимуляция двигательного нерва высокочастотными стимулами вызывает нарушение нервно-мышечной передачи, так называемое торможение Введен ского [3, 4], за которое ответственно в первую очередь нервно-мышечное соединение.
В дальнейшем возникли споры о том, какое из двух слагаемых передачи оказывается несостоятельным при высоких ритмах стимуляции — пре- или постсинаптический механизмы. В настоящее время стало ясно, что хотя постактивационные феномены имеют
место как в пре-, так и в постсинаптических структурах, именно пресинаитическое звено подвержено наибольшим, изменениям. Стимуляция двигательного нерва парными стимулами при изменении межимпульсного интервала дает возможность выявить следовую реакцию, состоящую в повышении вероятности выброса кванта медиатора в течение нескольких миллисекунд после предшествующего ответа [17, 145]. Выраженность этой следовой реакции существенно зависит от наличия Са++ в среде. Так, если на терминаль препарата, находящегося в бескальциевой среде, наносятся два фокальных стимула, причем второму всегда предшествует кратковременная ионофоретическая аппликация Са++, то ответы на этот второй стимул оказываются намного больше, если аппликация Са++ предшествовала также и первому стимулу [155].
Предполагается, что облегчение объясняется быстрым входом кальция внутрь окончания и относительно медленным его удалением. Если интервал между стимулами меньше периода элиминации этой повышенной концентрации Са++, то приход следующих стимулов приводит к накоплению Са++ и соответственно увеличению вероятности освобождения медиатора. В пользу этого объяснения свидетельствуют результаты исследования посттетанической потенциации, в частности повышение частоты МПКП непосредственно после конца длительной ритмической серии стимулов. Выраженность этого явления зависит от концентрации Са++ в наружном растворе, от интенсивности и длительности стимуляции. Все те факторы, которые способствуют накоплению Са++ в аксоплазме, увеличивают посттетаническую частоту МПКП.
Однако, несмотря на простоту и кажущуюся очевидность этой модели, она не способна объяснить всю совокупность фактов. Оказалось, что облегчение, хотя и более слабое, возможно и в том случае, если первому стимулу не предшествовала аппликация Са++ [155]. Посттетаническая потенциация МПКП наблюдается также и тогда, когда препарат находится длительное время в растворах, лишенных кальция и содержащих комплексоны [197]. Кривые спада частоты МПКП после тетануса неэкспоненциальны, они аппроксимируются 2 или 3 экспонентами, что говорит об участии нескольких молекулярных процессов в этом феномене [19, 197].
Для объяснения всех наблюдавшихся отклонений от простой кинетики пытались привлечь гипотезу о кооперативном действии ионов Са++ на место освобождения [155, 197, 214]. Однако это объяснение, очевидно, придется пересмотреть в связи с обнаружением линейной зависимости между входящим кальциевым током и количеством выделившегося медиатора [182]. Можно думать, что в последующих моделях постактивационных явлений в терминали большая роль будет отведена особенностям кальциевых ионов каналов входящего тока. Естественным продолжением феномена облегчения является депрессия, развивающаяся в ходе рит 316
мической стимуляции (рис. 7,12). Она находит свое выражение в прогрессирующем снижении квантового состава ответов на последующие стимулы. Если квантовый состав первого ответа был несколько снижен по сравнению с нормой, то, как правило, можно наблюдать вначале возрастание амплитуды ответов на 2-й и 3-й и т. д. стимулы, но затем это повышение замедляется и сменяется снижением амплитуды, которое и называют депрессией, Чем выше квантовый состав первого ответа, тем раньше наступает депрессия. Поэтому все воздействия, повышающие
Рис, 7.12. Последовательные изменения постспнаптических потенциалов при ритмической стимуляции нерва. Кривая иллюстрирует развитие облегчения и последующей депрессии [150].
квантовый состав ПКП, углубляют депрессию, например гуанидин, имидазол, повышение концентрации Са++ в окружающем растворе и т. п. Наоборот, уменьшение квантового состава (ионы магния) способствует облегчению и маскирует депрессию.
Если облегчение есть результат повышения вероятности освобождения медиатора (р) за счет следовых реакций, оставленных каждым стимулом, то депрессия является результатом истощения доступного медиатора (п). Большинство фактов хорошо согласуется с этим взглядом. Действительно, все, что ослабляет облегчение, ослабляет тем депрессию, и наоборот. Очевидно, выраженное облегчение приводит к более быстрому истощению п. Чем интенсивнее и длительнее была предшествующая стимуляция, тем быстрее наступает депрессия.
В ходе ритмической стимуляции, при которой освобождается достаточно много медиатора, депрессия приводит в конце концов к стабилизации освобождения на некоем низком, но относительно стабильном уровне. Значительное влияние на этот уровень оказывают процессы мобилизации медиатора, состоящие в образова
нии новых везикул, заполнении их медиатором и транспортировке их к месту действия (рис. 7.13). Интересной особенностью этих процессов является то, что вновь образованные везикулы имеют наибольшие шансы подвергнуться секреции [138]. При этом совершенно необязательно, чтобы они были заполнены ацетилхоли-
Рис. 7.13. Схема, отражающая современные представления о жизненном цикле синаптических пузырьков. Синаптические пузырьки (/) свободно перемещаются в аксоплазме, пока случайно не соприкоснутся с липкими филаментами (2), прикрепленными к пресинаптической мембране в области места выделения. В присутствии ионов Са++ резко снижается энергетический барьер процесса слияния пузырьков с мембраной, что приводит к освобождению медиатора (3). Мембрана пузырька «встраивается» в пресинаптическую мембрану (4). Вблизи участков терминали, покрытых шванновской клеткой (5), происходит впячивание мембраны за счет избыточного мембранного материала (б) и образуются новые пузырьки (7), их мембрана покрыта оболочкой из белковых нитей. Слияние новообразованных пузырьков друг с другом образует цистерны (S). Цистерны включают также материал, поступивший в термина ль с аксоплазматическим током (9). От цистерн отшнуровыва-ются синаптические пузырьки (2), которые уже способны вновь взаимодействовать с местом освобождения [138].
ном. Так, если затормозить синтез ацетилхолина с помощью гемихолиния и пометить пероксидазой вновь образованные везикулы, то оказывается, что они (хотя и не содержат ацетилхолина) относительно быстро проделывают свой жизненный цикл, кончающийся освобождением из терминали [85].
Стройная на первый взгляд теория постактивационных явлений в пресинаптической терминали подчас вступает в противоречие с новыми фактами, что, возможно, потребует ее существенной
перестройки. В частности, в ней, по-видимому, несколько переоценивается роль внутриклеточной концентрации кальция как главного регулирующего механизма. Часть из этих фактов приводилась при изложении процесса облегчения. Применительно к депрессии таким трудным фактом можно считать посттетаническую потенциацию частоты МПКП, которая наблюдается после окончания ритмической серии стимулов и сопровождается глубокой депрессией вызванного освобождения. Если единственная причина — это истощение запаса везикул, то почему на ее фоне частота МПКП может увеличиваться в десятки раз?
Другим странным фактом является ускорение депрессии при действии некоторых фармакологических веществ, которые вовсе не увеличивают квантовый состав первого ПКП. Это наблюдалось при действии тубокурарина [148] и особенно наглядно при действии тайпоксина [20]. Возможно, что имеет место не столько дефицит везикул медиатора, сколько «истощение» мест освобождения, способных выделить везикулу. Иными словами, механизм освобождения обладает рефракторностью, требует некоторого времени для восстановления своих исходных свойств. Причем это время тратится не только на транспорт везикулы на стратегическую позицию, но и на реактивацию места освобождения.
Несомненно существуют и постсинаптические факторы, способствующие феномену торможения Введенского. Нарушение передачи через нервно-мышечный синапс может быть обусловлено не только выпадением ПД из-за снижения амплитуды ПКП в последовательном ритмическом ряду ответов, но и из-за неспособности мембраны мышечного волокна генерировать ПД с требуемой частотой. В особенности значимым этот механизм становится при действии факторов, повышающих порог генерации ПД или приводящих к длительной деполяризации мышечного волокна [22, 52, 53].
Постактивационные явления в собственно постсинаптической хеморецептивной мембране выражаются в ослаблении чувствительности холинорецепторных участков клетки к действию медиатора или его химических аналогов, развивающееся в результате длительного контакта клетки с агонистом, которое принято называть десенситизацией 1227].
Этот феномен был обнаружен при действии ацетилхолина на постсинаптические участки скелетной мышцы позвоночных, сердце, гладкую мышцу, нейроны вегетативных ганглиев, мышцы беспозвоночных, при действии катехоламинов на сердце и сосуды, при действии глутамата на мышцы ракообразных и т. д. Механизмы этого ослабления чувствительности могут быть совершенно различны в разных тканях при действии разных агонистов. Поэтому термин «десенситизация» применяется для обозначения разных молекулярных процессов, имеющих сходное внешнее проявление (см. обзоры [29, 30, 32, 34, 198, 2291).
Функциональная роль десенситизации как процесса, ограничивающего эффект ацетилхолина, по-видимому, различна в разных
синапсах. Длительный аффект ацетилхолина в нервно-мышечном синапсе мог бы иметь место только при условии его накопления в объеме синаптической щели, например при частой ритмической активности двигательного нерва. Поэтому возникло предположение, что некоторую роль в феномене торможения Введенского, помимо депрессии, может играть и десенситизация [228]. Экспериментальная проверка этой идеи натолкнулась па ряд трудностей, не обойденных полностью и доныне. Основная трудность — необходимость сочетать регистрацию ПКП и ацетилхолиновых потенциалов, не блокируя передачу через синапс, чтобы и исходная чувствительность к ацетилхолину и квантовый состав ПКП былимакси-мальными. При этом процесс сокращения волокна должен быть надежно угнетен. Нарушение любого из этих условий делает результат проверочных опытов малоубедительным [5, 34, 205, 228].
Однако все, что мы знаем сегодня о механизмах нервно-мышечной передачи у позвоночных, свидетельствует против возможности функционального значения десенситизации. Несложные расчеты показывают, что здесь не может возникать накопление ацетилхолина и кумуляция его эффектов. Число активных зон в нервно-мышечном синапсе лягушки, как уже указывалось выше, достигает 2000, а среднее число квантов, освобождаемых нервным импульсом, — 100. Это значит, что повторное воздействие кванта ацетилхолина на одну и ту же постсинаптическую зону при частоте 40 имп/с (максимальная частота при естественной импульсации) наиболее вероятно только через 500 мс. Если принять во внимание, что время жизни молекулы ацетилхолина в синаптической щели (при условии если холинэстераза, активна) измеряется единицами миллисекунд, то становится ясно, что за 500 мс пе останется и следа ацетилхолина, принесенного предшествующим квантом. Несомненные признаки накопления ацетилхолина в синаптической щели (устойчивая деполяризация, сопровождающаяся флуктуациями типа «ацетилхолинового шума») наблюдаются лишь после воздейст-ствия антихолинэстеразными веществами и длительной стимуляции двигательного нерва с частотой 100 имп/с [162].
Десенситизация представляет интерес в качестве феномена, изучение которого может пополнить наши сведения о молекулярной организации постсинаптической мембраны. Возникает вопрос, какое из функциональных звеньев механизма активации постсинаптической мембраны является лимитирующим, где именно и каким путем развивается инактивация при длительном действии ацетилхолина. По поводу механизма десенситизации в постсинаптической мембране мышц позвоночных существует две основные точки зрения: 1) десенситизация есть результат перехода холинорецеп-тора в рефрактерное состояние, сопровождающееся изменением его сродства к ацетилхолину [165, 188, 198, 216]; 2) десенситизация отражает рефрактерность механизма ворот ионных каналов постсинаптической мембраны и, возможно, сопровождается изме-320
неиием количества и состояния иопов кальция в этом районе [24— 26, 31—33, 1991. Существует большое число разнообразных фарма-
Рис. 7.14. Влияние температуры на временной ход десенситизации.
А — ответы на микроаппликацию ацетилхолина из 2-канальной микропипетки к области концевой пластинки мышцы лягушки (J, 2, 5). Верхний луч — отведение от области концевой пластинки, нижний луч — ионофоретические толики тока. Справа — соответствующие кривые, отражающие изменения амплитуды тест-ответов во время десенситизации, амплитуда исходных тест-ответов принята за 100% (ордината), время в секундах от начала постоянного потока ацетилхолина из второго канала микропипетки (абсцисса). Стрелка — момент прекращения этого потока. Б — десенситизация, вызванная последовательными короткими аппликациями ацетилхолина из одноканальной микропипетки е частотой 0.5 имп/с в присутствии вещества, потенцирующего десенситизацию (SKF —525 А 5 х 10-’ М). Температура указана слева от осциллограмм [33].
кологических агентов, потенцирующих десенситизацию (см. обзоры: [30, 32, 341), которые действуют как при добавлении их в перфузирующий раствор, так и при ионофоретическом внутриклеточном введении J71 (рис. 7.14).
Л Общая физиология нервной системы 321
7.3. ОСОБЕННОСТИ ПЕРЕДАЧИ В СИНАПСАХ ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ
Современные представления о синаптической организации ганглиев вегетативной нервной системы несколько противоречивы. С одной стороны, ганглий можно рассматривать как некое распределительное устройство, в котором приходящие из вегетативных центров влияния мультиплицируются и передаются на группы ганглионарных нейронов, в свою очередь иннервирую-
Б
Ах
Никотина)ттики [
уГсбобождемие Ar j
Атропин'
- А тропин
впсп X
LN \
Ганглионарная клетка.
Р /
"шл'Г'Г •х-а.дреноблока-W торы
Освобождение катехоламиноб ( допамин}
^Адренерги-ческий интер-\нейрон/
Рис. 7.15. Постганглионарные потенциалы (волны ТУ, LN и Р), вызванные стимуляцией преганглионарных нервов и отводимые от постганглионарного ствола непосредственно вблизи верхнего шейного симпатического ганглия кролпка и механизмы их генерации.
А, о и б — ответы на одиночную стимуляцию в присутствии а^губокурарина (концентрации соответственно 2.5 xlo-5 М и ЗхЮ"3 М), в и г — ответы на тетаническую Стимуляцию (20 Гц) в присутствии d-тубонурарина (концентрации соответственно 1.6X10-5 М и 8х X10-s M). Конец тетануса обозначен стрелкой[107]; Б — схема генерации .V (быстрого ВПСП), LN (медленного ВПСП) и Р (медленного ТПСП) воли [179] и [202].
щих исполнительные органы. При этом нисходящая по преганглио-нарным нервам импульсация содержит только пусковые сигналы. С другой стороны, детальпое исследовапие синаптических входов в ганглионарные нейроны, особенностей действия ацетилхолина и некоторых других фармакологических веществ убедительно показывает гетерогенность этих синаптических входов, сложность синаптической организации ганглия. Таким образом, в ганглии существует морфологический и функциональный субстрат для взаимного влияния нейрона ганглия друг на друга, для системы модулирования передачи основных сигналов, хотя до сих пор не
обнаружены признаки реализации этих возможностей в условиях нормального функционирования (см. обзоры [47, 168, 202]).
Ответ интактного симпатического ганглия ла преганглионар-ную стимуляцию содержит три компонента: быстрый пик, затем медленный отрицательный потенциал длительностью 50—100 мс, который сменяется еще более длительным положительным потенциалом (—500 мс). Быстрый пик отражает, очевидно, суммарный потенциал действия ганглионарных нейронов, а медленные компоненты соответствуют медленной части синаптического потенциала и следовой гиперполяризации после потенциала действия. Это доказывается изменением характера отводимой активности после кураризации ганглия, т. е. во время блокады ганглионарного проведения.
Вместо пика выявляется более медленный (—100 мс) пороговый ВПСП (волна N), за ней непосредственно следует небольшая по амплитуде положительная волна Р, переходящая в длительную (до 2 с) отрицательную волну LN. Углубление кураризации приводит к прогрессивному уменьшению волны N, но волна LN увеличивается. Тетанизация кураризированпого ганглия также приводит к увеличению волн Р и LN [107] (рис. 7.15).
Волны У, Р и LN синаптического происхождения, что доказывается, в частности, их исчезновением при действии ботулинус-токсина. Возможно избирательное подавление той или иной волны холино- и адренолитиками: волна N устраняется тубокурарином, волна LN — атропином, а волна Р — дибенамином. После длительной тетанизации ганглия, который подвергнут действию как тубо-курарина, так и атропина, выявляется очень медленная деполяризация нехолинергяческой природы (волна LLN).
Преганглионарные волокна можно разделить на две группы по скорости проведения по ним: более быстрые В-волокна и медленные С-волокна. Следует отметить, что разные вегетативные ганглии различаются по структуре подходящих к ним преганглионарных волокон, а также по соотношению компонентов синаптического ответа.
Каждый тип синаптического ответа генерируется благодаря активации своих специфических рецепторов и собственного отличного от других ионного механизма. Быстрые ВПСП возникают вследствие действия ацетилхолина на рецепторы никотинового типа, что приводит к увеличению проницаемости постсинаптической мембраны для ионов Na и К. Потенциал равновесия этих ответов в нейронах симпатических ганглиев лягушки —14 мВ [202], в нейронах верхнего шейного симпатического ганглия кошки —30 мВ [48]. По-видимому, вся эта функциональная система близка по своим свойствам постсинаптическому механизму в скелетной мышце позвоночных. Однако несомненно есть различия в фармакологических свойствах никотиновых рецепторов по следующим признакам: 1) существуют вещества, преимущественно действующие на рецепторы ранглия [2]; 2) холинорецепция ганглия не
блокируется нейротоксинами типа а-бунгартоксина, Которые избирательно и необратимо угнетают действие ацетилхолина на скелетные мышцы [35].
Быстрые возбуждающие постсинаптические потенциалы (ВПСП), отводимые внутриклеточно от нейронов симпатического ганглия лягушки (синапсы аксосоматического типа), имеют более медленное течение (время полуспада — 10—14 мс), чем ПКП в мышцах, причем в отличие от мышц постоянная скорости экспоненциального спада ВПСП здесь в 1.3—2 раза больше, чем постоянная времени мембраны (у ПКП совпадает) [202]. Это свидетельствует о том, что временной ход ВПСП ганглионарного нейрона определяется не столько пассивными электрическими свойствами, сколько длительностью активного состояния постсинаптической мембраны. Пока еще невозможно ответить на вопрос, почему в синапсах ганглионарного нейрона активное состояние длится дольше, чем в нервно-мышечных синапсах. Здесь может быть несколько причин: 1) большее время открытого состояния ионных каналов; 2) более длительное присутствие медиатора в синаптической щели каждого синаптического входа; 3) несинхронность выделения квантов ацетилхолина в совокупности синаптических входов.
Аналогом волны LN при внутриклеточном отведении является медленный ВПСП. Он возникает после очень большой синаптической задержки (100—400 мс), причем, в отличие от других известных случаев, эта задержка имеет постсинаптическое происхождение, поскольку микроанпликация ацетилхолина в непосредственной близости к поверхности нейрона вызывает атропиночувствительный ответ с той же задержкой. Медленный ВПСП возникает при действии медиатора на мускариночувствительные холинорецепторы. Его ионная природа до сих пор окончательно не установлена и является предметом дискуссий. Трудность заключается в том, что не во всех клетках и не во всех изученных ганглиях медленный ВПСП сопровождается изменениями сопротивления мембраны нейрона. Возникают противоречия и при трактовке результатов опытов по исследованию зависимости амплитуды этого ответа от уровня мембранного потенциала или эффектов устранения тех или иных ионов из окружающего раствора. Было предложено несколько вариантов ионного механизма: 1) уменьшение калиевой проводимости мембраны [2401; 2) увеличение натриевой проводимости (может быть также и кальциевой) [1671; 3) активация электрогенного ионного насоса (отличного от известных натрий-калиевого или хлорного), которая может сочетаться, с изменением проводимости мембраны [167]. Если принять во внимание сложность и многозвенность эффектов активации мускариновых рецепторов, участие в этом процессе циклической гуанилмонофосфорной кислоты, систем ее синтеза и разрушения, то становятся более понятными и большая сипапти-324
ЦеСКая Задержка, и медленный временной ход, и выраженная зависимость этого синаптического ответа от уровня метаболизма ганглионарного нейрона.
Неясно, в какой мере медленный ВПСП может участвовать в проведении естественной импульсации к интактному ганглию. Во всяком случае, внутриартериальное введение мускариноми-метиков способно вызвать синхронный разряд ганглионарных нейронов, что приводит, например, к сокращению мигательной перепонки (см. обзор [237]). Интересно, что после хронической денервации ганглия или после ингибирования холинэстеразы в нем существенно повышается способность мускариномиметиков (негид-ролизующихся холинэстеразой) воспроизводить эффекты стимуляции преганглионарного ствола [237, 23]. Это позволяет предполагать существование какого-то проводящего пути, использующего мускариновые рецепторы для синаптической передачи [232].
Третий холинергический синаптическии^потенциал — волна Р или при внутриклеточном отведении медленный тормозящий постсинаптический потенциал (ТПСП) — тоже угнетается атропином. Предполагается, что в механизме его генерации участвуют какие-то адренергические структуры; может быть, он имеет диси-наптическую природу, т. е. синапс между преганглионарным волокном и интернейроном холинергичен, а между интернейроном и ганглионарным нейроном адренергичен [110]. Ионный механизм этого ТПСП тоже весьма своеобразен. Он не связан, как большинство известных ТПСП, с увеличением проницаемости для С1- или К+. Обсуждается возможность участия электрогенного К,—Na — насоса в его генерации (см. гл. 5 и обзоры [168, 202]), либо уменьшение проницаемости для Na+ [239].
Поздний медленный ВПСП (аналог волны LLN) имеет нехолинергическую природу, сопровождается падением сопротивления мембраны нейрона и вызывается, по-видимому, длительным увеличением проницаемости для Na+ и К+, поскольку потенциал равновесия этого ответа — 35 мВ и не зависит от наличия С1~ в окружающем растворе [42].
Помимо множественных синаптических входов, по которым преганглионарные волокна передают свои влияния на дендриты и тело ганглионарного нейрона, они образуют синапсы с преган-глионарными же структурами. Очевидно, это напоминает механизм для осуществления пресинаптического торможения (см. гл. 8). В качестве медиаторов в синапсах на преганглионарных терминалях выступают ацетилхолин, причем соответствующие холиноре-цепторы близки к никотиновым [127], либо катехоламины — в частности, предполагается участие допамина [106].
В некоторых вегетативных ганглиях, как например, в цилиарном ганглии птиц, доказано наличие весьма своеобразных синапсов, в которых сочетаются химический и электрический принципы передачи (см. гл. 9).
Синаптические механизмы для передачи влияний из ганглиев вегетативной нервной системы на эффекторные органы отличаются большим разнообразием. В качестве медиаторов здесь, помимо ацетилхолина, могут выступать катехоламины и предположительно серотонин, АТФ, гистамин, субстанция Р. Далеко не во всех случаях медиатор вызывает изменения ионной проницаемости постсинаптической мембраны.
Для большинства органов, иннервируемых вегетативной нервной системой, характерно поступление двух типов нервных влияний — возбуждающего и тормозящего. К тому же физиологическая роль возбуждающих нервных влияний неодинакова в разных тканях. Приходящая импульсация может быть пусковой либо модулирующей- Уже из этого краткого перечня становится ясно, что трудно было бы ожидать общих характерных черт этих многочисленных синапсов.
Сердце было первым объектом, для которого Леви [183] удалось доказать медиаторное действие ацетилхолина (см. гл. 6), Хотя «победное шествие» ацетилхолина началось именно здесь, следует признать, что этот синапс изучен гораздо меньше, чем другие холинергические синапсы. Более ясен механизм постсинаптического действия ацетилхолина. Взаимодействуя с мускариновыми рецепторами, находящимися в мембране сердечного мышечного волокна, ацетилхолин увеличивает проницаемость для ионов К+, что приводит к гиперполяризации и соответственно торможению волокна. Равновесный потенциал эффекта ацетилхолина фактически совпадает с калиевым равновесным потенциалом этих клеток (см. обзор [231]). Изменение проницаемости опосредуется, по-видимому, через систему циклической гуанил-монофосфорной кислоты [124].
Эффект катехоламинов в конце концов сводится к увеличению возбудимости сердечной мышцы. Совсем неясно до сих пор, включает ли этот механизм деполяризацию мышечного волокна за счет увеличения проводимости мембраны. Адренорецепторы сердца относятся к P-типу, т. е. среди катехоламинов наиболее эффективным оказывается пропилнорадреналин. Его действие блокируется пропранололом и другими Р-адренолитиками. Предполагается, что важную роль в механизме действия катехоламинов на сердце играет система циклической 3.5-аденозинмоно-фосфорной кислоты. Таким образом, создается довольно странная ситуация — о пресинаптических структурах имеются в основном морфологические сведения, а о постсинаптических — отрывочные физиологические. Синаптические влияния на гладкомышечные элементы различных внутренних органов (кишка, стенка сосудов, мочевыводящие пути, трахея, бронхи, матка и др.) тоже вряд ли могут рассматриваться вместе ввиду выраженной разнохарактерности этих влияний и соответственно различной структурной и функциональной организации соответствующих синапсов.
Мышцы кишечника получают по крайней мере два типа синаптических влияний: возбуждающие (холинергические) и тормозящие (адренергические). Эффекты обоих медиаторов на гладкомышечные клетки сопровождаются изменением входного сопротивления. Полагают, что при действии ацетилхолина на мускариновые холинорецепторы увеличивается проницаемость для ионов Na+ (и может быть К+), причем потенциал равновесия — 10 мВ [72]. Действие норадреналина на p-адренорецепторы гладкомышечных клеток повышает проницаемость для К+ [54] и частично С1~ [74].
7.4. НЕРВНО-МЫШЕЧНАЯ ПЕРЕДАЧА
У БЕСПОЗВОНОЧНЫХ
Подавляющее большинство представителей животного мира относится к беспозвоночным. По уровню развития и сложности функций диапазон между кишечнополостными и губками, с одной стороны, и насекомыми — с другой, гораздо больше, чем между низшими хордовыми и млекопитающими. Поэтому и неудивительно, что механизмы нервно-мышечной передачи у беспозвоночных чрезвычайно разнообразны. К сожалению, исследованию подверглось сравнительно небольшое число видов, относящихся к каждому типу. Это существенно затрудняет решение вопроса о том, что из наблюдаемых особенностей отражает эволюционные закономерности, а что является результатом специализации.
Настоящий раздел не может претендовать на исчерпывающее изложение всей проблемы нервно-мышечной передачи у беспозвоночных. Его целью является лишь иллюстрация вариантов конкретного воплощения этой функции у разных животных, а также выявление наиболее общих принципов синаптической организации, которые справедливы для всех химических синапсов. Более подробные сведения можно почерпнуть в целом ряде монографий и обзоров последних лет [16, 46, 119, 125, 132].
Среди первичноротых наиболее изучена нервно-мышечная передача у круглых и кольчатых червей, моллюсков и членистоногих.
7.4.1. НЕРВНО-МЫШЕЧНАЯ ПЕРЕДАЧА
У ЧЕРВЕЙ
Своеобразие структуры нервно-мышечных контактов у круглых червей (как правило, все исследования проведены на аскаридах) привлекло внимание как морфологов, так и физиологов (см. обзор [99]). От мышечного волокна отходит пальцевидный отросток, который тесно прилегает к поверхности нервного аксона. Несколько таких пальцевидных отростков, принадлежащих разным мышечным волокнам, переплетаются между собой, местами
образуя так называемые плотные контакты, характерные для электрических синапсов. На срезах аксона обнаруживаются участки уплотнения его мембраны и скопления синаптических пузырьков. Таким образом, судя по морфологическим данным, здесь есть возможности для функционирования как химического синапса между нервным аксоном и мышечными волокнами, так и электрического синапса между самими мышечными волокнами.
При внутриклеточном отведении от мышечных клеток аскариды регистрируются спонтанные разряды типа потенциалов действия явно миогенного происхождения [84], кроме того, в области нервно-мышечных контактов может быть зарегистрирован так называемый синаптический шум, который обусловлен, по-види-мому, миниатюрными ВПСП и ТПСП. Стимуляция нервного ствола приводит к появлению потенциалов действия в мышечных волокнах, причем сразу в нескольких, образующих функциональный синцитий. Медиатором возбуждающего нервного влияния, очевидно, является ацетилхолин, поскольку: 1) он обнаруживается в стенке тела аскариды; 2) холинэстераза локализована в области нервно-мышечного синапса; 3) ацетилхолин и некоторые его никотиноподобные аналоги способны деполяризовать мышечные волокна, при этом только зона переплетения мышечных отростков чувствительна к микроаппликации^ацетилхолина; 4) действие ацетилхолина потенцируется антихолинэстеразными препаратами; более того, прозерин сам вызывает деполяризацию мышечных волокон и учащение спонтанных разрядов; 5) действие ацетилхолина может быть предупреждено d-тубокурарином. Однако остается неясным, играет ли здесь выделение ацетилхолина пусковую роль по отношению к потенциалам действия в мышечном волокне или с помощью ацетилхолина лишь регулируется уровень миогенной возбудимости. Иными словами, необходимо еще уточнить, является ли здесь ацетилхолин истинным медиатором или только модулятором [82].
Мышечные волокна аскариды чувствительны к ГАМК и пиперазину, которые вызывают гиперполяризацию и подавление мышечных разрядов. Это дает основания для предположения, что нервный контроль за мышечной деятельностью"^ нематод осуществляется с помощью двух медиаторов — возбуждающего и тормозящего, которые лишь регулируют миогенный ритм’ [83, 100]. Координация сокращений отдельных мышечных волокон происходит благодаря'наличию между ними электротонических связей через «плотные контакты».
Г Исследование нервно-мышечной передачи у кольчатых червей ограничено несколькими видами. Это пиявки, земляные кольчецы и некоторые полихеты. Подробные сведения имеются о фармакологических особенностях мышц кольчатых червей (см. обзор [2171). Гораздо более скудны электрофизиологические данные. По своему тонкому строению синапсы могут быть отнесены к типу транзиторных, при этом о синаптических зонах можно судить
лишь ио скоплению пузырьков, уплотнение же синаптических мембран отсутствует. Мышечные волокна образуют анатомический синцитий, соединяясь друг с другом с помощью десмозом. Наблюдается множественная иннервация мышечных волокон, причем нервные окончания различаются по структуре и по характеру обнаруживаемых в них пузырьков:, малые светлые 40 нм и большие гранулярные 90—180 нм диаметром (см. обзор [125]).
При внутриклеточном отведении от мышц земляного кольчеца обнаруживаются спонтанно возникающие потенциалы действия и «синаптический шум», состоящий из миниатюрных ВПСП и ТПСП. Стимуляция периферических нервов также приводит к появлению обоих типов ответов ВПСП и ТПСП, причем ВПСП устраняются тубокурарином, а ТПСП — пикротоксином. Судя по распределению межимпульсных интервалов, миниатюрные синаптические потенциалы возникают в нескольких местах вдоль мышечного волокна [140, 1491.
Таким образом, у кольчецов, так же как и у круглых червей, имеется периферическая регуляция двигательной деятельности с помощью возбуждающего и тормозящего медиаторов, хотя конкретное воплощение этого принципа здесь несколько иное.
В качестве возбуждающего медиатора выступает ацетилхолин. Однако холинорецепторы у кольчецов неоднородны. Так, типичные никотиночувствительные холинорецепторы пиявки могут быть разделены по крайней мере на два типа [39, 118, 2181. У сидячих полихет были обнаружены мышечные клетки, которые, по-видимому, обладают мускариночувствительными холинорецепторами [2011. Хроническая денервация мышц кольчецов приводит к повышению их чувствительности к холиномиметикам [13] подобно тому, как это наблюдается у позвоночных. Можно думать, что и здесь локализация холинорецепторов на поверхности мышечных волокон находится под нервным контролем (см. гл. 10).
Тормозящим медиатором предположительно является ГАМК. Какую-то функциональную роль в синаптической передаче у кольчатых червей играют и моноамины, хотя она еще и не выяснена (см. обзор [125]).
7.4.2. НЕРВНО-МЫШЕЧНАЯ ПЕРЕДАЧА У МОЛЛЮСКОВ
Нервно-мышечная передача у моллюсков отличается рядом особенностей, хотя в настоящее время еще не ясно, насколько они характерны для всех представителей этого богатого видами типа животных. Более или менее детализированные сведения имеются лишь о пластинчатожаберных, брюхоногих и головоногих моллюсках.
Структура мышц моллюсков весьма разнообразна. Встречаются 4 типа мышечных волокон: 1) поперечнополосатые; 2) регулярно косоисчерченные; 3) нерегулярно косоисчерченные; 4) гладкие [134]. Эти типы различаются по скорости со
КращеНия, по способности длительно поддерживать тоническое сокращение. Тонкая структура нервно-мышечных синапсов изучена недостаточно, однако имеющиеся сведения позволяют считать, что эти синапсы не имеют кардинальных отличий от встречаемых у других животных. Иннервация мыпщ довольно сложна. Нервы образуют внутри мышцы разветвленные сплетения. Дискутируется вопрос о существовании в этих сплетениях тел нервных клеток [73]. У моллюсков имеются быстрая и медленная двигательные системы, причем это разделение у разных моллюсков достигается совершенно различными путями. Так, у пластинчатожаберных моллюсков имеются отдельные быстрые и медленные мышечные пучки, состоящие соответственно из разных по своей тонкой структуре мышечных волокон. Возможно, и подходящие к ним нервы тоже специализированы. У брюхоногих и в особенности у головоногих моллюсков это разделение на две двигательные системы происходит исключительно за счет специализации нервов: имеются быстропроводящие (толстые и гигантские) и медленнопроводящие (тонкие) аксоны. Но оба вида аксонов образуют синапсы на одних и тех же мышечных волокнах. Поэтому характер сокращения мышечного волокна всецело зависит от получаемой им нервной импульсации (см. обзор [143]).
Мышечные волокна моллюсков, как правило, очень тонки (порядка 8 мкм диаметром) и коротки (1—2 мм); поэтому внутриклеточное отведение сопряжено здесь со значительными техническими трудностями. Тем не менее Тварог с сотр. удалось отвести ВПСП от волокон переднего ретрактора бисуса мидии ABRM, показать сходство этих ВПСП и ответов на ионофоретическую аппликацию ацетилхолина, в частности определить величину потенциала равновесия, составляющего здесь — 12 мВ. По-видимому, ацетилхолин выступает в роли возбуждающего медиатора, увеличивая проницаемость для ионов натрия и калия ([234], Hidaka, Twarog, цит. по обзору [125]). Холинорецепторы мышц моллюсков относятся к никотиночувствительным, хотя и фармакологическая характеристика их несколько своеобразна [37,38, 233].
Важной особенностью нервно-мышечной передачи у моллюсков является существование специальных тормозящих нервов, регулирующих длительность активного состояния мышцы. Возможно, что у моллюсков имеются обычные тормозящие нервы, подобные тем, которые участвуют в периферической регуляции двигательной деятельности у червей или членистоногих, т. е. нервы, окончания которых выделяют тормозящий медиатор, приводящий К гиперполяризации мышечных волокон. Но, кроме того, здесь мы впервые встречаемся с нервами, которые выделяют на своих окончаниях расслабляющий медиатор. Это наиболее подробно исследовалось Тварог и сотр. в опытах на ABRM, Было показано, что стимуляция нервов, подходящих к ABRM вызывает как сокращение мышц, так и их расслабление, причем
после блокады холинергического механизма передачи возбуждающих влияний с помощью пропантелина остается только расслабляющее влияние. Аналогичным эффектом обладает серотонин (5-окситриптамин), который в сравнительно низких концентрациях расслабляет мьппцу, находящуюся в состоянии длительного сокращения. При этом серотонин не влияет на уровень мембранного потенциала мышечных волокон, но уменьшает их входное сопротивление. Эффект серотонина существенно зависит от концентрации кальция в окружающем растворе. Совокупность полученных фактов позволила выдвинуть гипотезу о том, что серотонин выступает в роли расслабляющего медиатора, который увеличивает проницаемость для выходящего из волокон кальция, либо усиливает его связывание внутри волокон. В результате концентрация кальция в миоплазме снижается, что приводит к расслаблению [141].
7.4.3. НЕРВНО-МЫШЕЧНАЯ ПЕРЕДАЧА У ЧЛЕНИСТОНОГИХ
Проблемы синаптической организации двигательной системы членистоногих исследуются весьма интенсивно. Поэтому некоторые аспекты функции химических синапсов у членистоногих изучены более подробно, чем у позвоночных. Этой теме посвящено значительное число^обзоров, детально излагающих ее современное состояние [6, 16, 61, 62, 75, 128, 132, 144, 210, 221, 235, 236,^242].
Существует ряд особенностей функциональной организации нервно-мышечной передачи у членистоногих. Прежде всего следует указать на полинейрональный (одно мышечное волокно может получать нервные влияния от нескольких нейронов) и поли-терминальный (каждый аксон образует несколько или даже много синаптических контактов вдоль длины мышечного волокна) характер иннервации. Если у животных, принадлежащих к другим типам, включая позвоночных, сочетание этих двух-принципов встречается лишь у части мышечных волокон, то у членистоногих это является общим правилом. Возбуждающие нервы здесь делятся на «быстрые» и «медленные», т. е. иннервация носит к тому же полифуикциональный характер. Существует развитая тормозящая иннервация, которая, по-видимому, тоже является полинейронаЛьной и политерминальной. Тормозящие нервы образуют синаптические контакты но только с мышечными волокнами, но и с возбуждающими аксонами. Эти аксо-аксональные синапсы осуществляют, очевидно, пресинаптическое торможение.
Таким образом, создается сложная, но весьма эффективная система периферического регулирования активности мышечных волокон, которая обеспечивается гораздо меньшим числом нейронов по сравнению с позвоночными животными. Естественно, что большое число функциональных элементов, входящих в си
наптическую организацию, дает дополнительные возможности для специализации мышечных волокон. Они могут получать либо весь «набор» нервных влияний, либо только их часть. К тому же может варьировать как плотность расположения различающихся по функции синаптических контактов, так и их численное соотношение.
Степень развития периферической тормозящей системы гораздо выше у ракообразных, чем у насекомых, т. е. можно думать, что в ходе эволюции этого типа происходила цефализация тормозной функции, что регулирование двигательной деятельности в большей мере переходило в ведение межнейрональных механизмов.
Нервно-мышечные синапсы членистоногих (в особенности насекомых) отличаются также своею изолированностью от окружающих тканей. Они либо погружены в мышечные волокна и замурованы специальными клетками — лемно бласта ми, либо, напротив, нервная терминаль контактирует с отростком мышечного волокна, но это образование тоже находится в плотном окружении глиальных элементов.
Элементарные процессы, обеспечивающие синаптическую передачу, сходны с теми, которые уже были изложены выше. Наиболее существенное отличие от нервно-мышечных синапсов позвоночных состоит, видимо, в том, что в качестве возбуждающего медиатора выступает вместо ацетилхолина глутаминовая кислота, точнее, ее анион — глутамат. Получен целый ряд фактов, позволяющих считать глутамат единственным кандидатом на роль возбуждающего медиатора: 1) глутамат обнаруживается в экстрактах нервов ракообразных; 2) при ионофоретической аппликации глутамат действует только в зоне возбуждающих синапсов; 3) для получения ответа требуются очень малые количества глутамата — порядка 1ХНГ1® — 1 X1СГ17 М, причем временной ход ответа на аппликацию глутамата и' ВПСП одинаков; 4) глутамат намного активнее близких ему по строению аминокислот; 5) ионные механизмы действия глутамата и синаптического медиатора полностью совпадают [221 ]. Очевидно, глутамат увеличивает проницаемость для ионов натрия, но~неменяет ее для ионов хлора, участие~К+~и Са++ в постсинаптическом электрогенезе у насекомых представляется сомнительным (рис. 7.16) [60]. При действии глутамата на постсинаптическую мембрану мышцы краба обнаруживается «глутаматный шум», подобный тому, который описан при действии ацетилхолина на постсинаптическую мембрану мышц позвоночных. Анализ спектра этого шума позволяет считать, что время открытого состояния ионных каналов составляет здесь около 2 мс и что для генерации’одного миниатюрного возбуждаю-щего’постсинаптического потенциала должно”открыться порядка 5000^’ионных каналов [96]. Эти данные по порядку величины весьма близки полученным на мышце лягушки’при действии ацетилхолина, В то же время проводимость одиночного канала, акти
вируемого глутаматом в мембране мышцы саранчи, примерно в 10 раз больше, чем в мыпще лягушки (2.3 X10“10 мо), причем проводимость в отличие от ситуации в холинорецепторной мембране здесь зависит от температуры, уменьшаясь при охлажде-
Рис. 7.16. Постсинаптический потенциал и ток в разгибателе голени саранчи.
А — ВПСП, зарегистрированный внутриклеточно (asepxp) и соответствующий ему пост-синаптический ток в условиях фиксации потенциала на мембране волокна на уровне потенциала покоя (оиизу). Б — зависимость между мембранным потенциалом и амплитудой ВПСП (круаеки) или амплитудой ответов на микроаппликацию тлютамата (квадратики). По от ординат — синаптический ток в условных единицах. По оси абсцисс — мембранный потенциал [60].
нии. Время жизни «глутаматных» ионных каналов, подобно «ацетилхолиновым» каналам, зависит от уровня мембранного потенциала, но зависимости эти различаются по знаку: «глутаматные» каналы при гиперполяризации закрываются быстрее [58], тогда как «ацетилхолиновые» — медленнее [59, 159]. Время открытого состояния «глутаматных» каналов в мышце дрозофилы совсем слабо зависит от мембранного потенциала, однако очень сильно.
от температуры [8]. Временной ход о гнетов мышечного волокна на воздействие кванта глутамата здесь тоже определяется кинетикой активационных каналов, а не изменениями во времени концентрации медиатора [96, 971.
Общепризнанным тормозящим медиатором в нервно-мышечпых синапсах членистоногих является гамма-аминомасляная кислота
Рис. 7.17. Потенциал реверсии ТПСП и ответов на понофоретическую аппликацию ГАМК. Нервно-мышечный препарат рака.
Н — ответ на стимуляцию тормозного нерва с частотой 30 имп/с, ГАМК — ответ на аппликацию из микропипетки. Сверху вниз — регистрация тока через микропипетку, заполненную ГАМК, последовательные регистрации ответов прк мембранном потенциале —70, —68, —66, ~64 и —62 мВ соответственно. Потенциал реверсии обоих ответов при —66 мВ. Калибповки: ток через пипетку — 5x10-’ А, амплитуда ответов — 2 мВ, время — 1 с [2211.
(ГАМК). Механизм действий ГАМК состоит в увеличении проницаемости для ионов хлора, что приводит к гиперполяризации мышечных волокон (рис. 7,17) и ослаблению эффекта возбуждающего медиатора, а в случае пресинаптического торможеция приводит к гиперполяризации возбуждающего нервного окончания и соответственно уменьшению количества освобождаемого возбуждающего медиатора. Известны примеры того, что в одном и. том же мышечном волокне рака существуют оба тормозных
механизма, причем в обоих случаях торможение осуществляется с помощью ГАМК и увеличения хлорной проницаемости.
* * *
К сожалению, весьма скудна информация о синаптической организации иглокожих и низших хордовых (полухордовые, оболочечники, бесчерепные). Она была бы особенно ценна при сопоставлении с обширными данными о нервно-мышечной передаче у позвоночных животных, поскольку такое сравнительное рассмотрение важно для понимания эволюции двигательной системы вторичноротых.
Практически ничего не известно о тонкой структуре иннервации мышц иглокожих — в частности, образуют ли аксоны синаптические контакты с каждым из мышечных волокон, либо возбуждение передается от волокна к волокну. Не получены пока данные о существовании у иглокожих периферической системы регуляции или специализации мышечных волокон. В силу методических особенностей объектов этого типа более обширна информация о химической чувствительности мышц иглокожих.
Сведения о нервно-мышечной передаче у оболочечников (асцидии) отличаются теми же особенностями: практически ничего не известно о структуре и функции нервно-мышечных контактов, но имеются данные о химической чувствительности мышечных волокон.
Мышцы животных, принадлежащих обоим типам, возбуждаются при действии ацетилхолина или его аналогов, однако фармакологическая характеристика холинорецепции отличается большим своеобразием (см. обзор [16]).
ЛИТЕРАТУРА
1. Бабминдра В. Л. Ультраструктура синапсов симпатических ганглиев. — В кн.: Межнейронная передача в вегетативной нервной системе. Под ред. П. Г. Костюка. Киев, 1972, с. 16—24.
2. Барлоу Р. Введение в химическую фармакологию. М., 1959.
3. Введенский Н. Е. (1886). О соотношении между раздражением и возбуждением при тетанусе. — Поли. собр. соч. 2. Л., 1951.
4. Введенский Н. Е. (1892). Соотношение между ритмическими процессами и функциональной активностью возбужденного нервно-мышечного аппарата. — Поли. собр. соч. 3. Л., 1952, с. 84—93.
5. Владимирова И. А. Исследование химической чувствительности концевой пластинки поперечно-полосатого мышечного волокна лягушки в ходе ее ритмической активации. — Физиол. журн. СССР, 1964, 50, с. 1358— 1363.
6. Воскресенская А. Я. Функциональные свойства нервно-мышечного прибора насекомых. М.—Л., 1959.
7. (Выскочил ф., Магазаник Л. Г.) Vyskocil F., Magazanik L. G. The desensitization of postjunctional muscle membrane after intracellular ap-; plication of membrane stabilizers and snake venom polypeptides. — Brain
Has., 1972, 49, p. 417—419.
8, Выскочил Ф., Магаза ник Л. Г. Синаптические ионные токи в мышечных волокнах дрозофилы. — Журн. эвол. биохим. и физиол., 1978, 14, с. 448-452.
9. Гинецинский А. Г. Химическая передача нервного импульса и эволюция мышечной функции. Л., 1970.
10. Гинецинский А. Г., Михельсон Н. И. Электрические явления при непрямом раздражении мышцы, отравленной кураре, — Физиол, журн. СССР, 1935, 19, с. 980—986.
11. Готгильф И. М. Влияние имидазольных соединений на нервно-мышечные синапсы при изменении pH среды. — ДАН СССР, 1972, 206, с. 733— 736.
12. Готгильф И. М., Магазаник Л. Г. Влияние блокаторов кальциевых каналов (верапамил, Д-600 и ионы марганца) на освобождение медиатора из двигательных нервных окончаний в мышце лягушки. — Нейрофизиология, 1977, 9, с. 415—422.
13. Давид О. Ф., Рожкова Е. Я. Изучение холинорецепции мышц дождевого червя. — Жури. эвол. биохии. физиол., 1971, 7, с. 59—65.
14. Дунин-Барковский В. Л., Ковалев С. А., Магазаник Л. Г., Потапова Т. В., Чайлахян Л. М. Потенциалы равновесия постсинаптической мембраны, активированной различными холиномиметиками, при изменении внеклеточной ионной среды. — Биофизика, 1969, 14, с. 658— 694.
15. Дунин-Барковский В. Л., Чайлахян Л. М., Чудаков Л. И. О влиянии мембранного потенциала на ацетилхолиновый шум концевой пластинки. — ДАН СССР, 1974, 214, с. 224—227.
16. Жуков Е. К., Итина Н. А., Магазаник Л. Г., Мандельштам Ю. Е., Последов Г. А., Свидерский В. Л., Скоробовичук Н. Ф., Ушаков В, Б. Развитие сократительной функции мышц двигательного аппарата. Л., 1974.
17. Каменская М. А. Современные представления о механизме квантового освобождения медиатора из моторных нервных окончаний скелетной мышцы. — Усп. физиол. наук, 1972, 3, с. 22—63.
18. Каменская М. А. Физиологический анализ процесса секреции медиатора из нервных окончаний скелетной мышцы животных и человека. Автореф. докт. дис. МГУ, 1976.
19. Каменская М. А., Кирзон М. В., Мизулина Е. В. Изменения частоты миниатюрных потенциалов двигательной концевой пластинки в процессе многократных тетанических раздражений моторного нерва. — Физиол. журн. СССР, 1971, 57, с. 52—59.
20. (Каменская М. А., Теслгв С,) Kamenskaya М. A., Thesleff S. The neuromuscular blocking action of an isolated toxin from the Elapid (Oxyuranus scutellactus}. — Acta physiol, scand., 1974, 90, p, 716—724.
21. (Каменская M. А., Влмквист Д,, Теслев C.) Kamenskaya M. A., Elm-gvlst D., Thesleff S. Guanidine and neuromuscular transmission. II. Effect on transmitter release in response to repetitive nerve stimuli. — Arch, Neurol., 1975, 32, p. 510—518.
22. Коетюк П. Г. Внутриклеточное отведение потенциалов мышечных волокон, Пессимум. — Биофизика, 1959, 4, с. 134—143.
23. Лукомская Н. Я. Изменение холинорецепции верхнего шейного симпатического ганглия кошки после денервации. — Журн. эвол. биохим. физиол., 1969, 5, с. 65—73.
24. Магазаник Л. Г. О механизме десенситизации постсинаптической мембраны мышечного волокна. — Биофизика, 1968, 13, с. 199—202.
25. Магазаник Л. Г. Влияние симпатических аминов на десенситизацию постсинаптической мышечной мембраны к действию ацетилхолина. — Физиол. журн. СССР, 1969, 55, с. 1147—1155.
26. Магазаник Л. Г, Длительные изменения свойств хемочувствительной постсинаптической мембраны. —Труды II Съезда Всесоюзн. физиол. о-ва. 1. Л., 1970, с. 13-19.
27. Магазаник Л. Г, Влияние некоторых мембранных Стабилизаторов иа функцию нервно-мышечного синапса. — Физиол. журн. СССР, 1971, 57, с. 1313-1.321.
28. Магазаник Л. Г. Влияние серотонина па элеитрогенез в постсинапти-ческой мембране мышечного волокна. — В кн,: Биофизика мембран. Каунас, 1973, с. 430—435.
20. Магазаник Л. Г. Функциональная организация холинорецептивных постсинапгических мембран. — В кн.: Структура и функция биологических мембран. М., 1975, с. 240—265.
30. (Магазаник Л. Г.) Magazanik L. G. Functional properties of postjunctional membrane. — Анн. Bev. Pharmac. Physiol., 1976, 16, p. 161—175.
31. (Магазаник Л. Г., Выскочил Ф.) Magazanik L. G., Vyskocil F. Dependence of acetylcholine desensitization of the membrane potential of frog muscle fibre and on the ionic changes in the medium. — J. Physiol. (London), 1970, 210, p. 507—518.
32. (Магазаник Л. Г., Выскочил Ф.) Magazanik L. G., Vyskolil F. Desensiti-zation at the motor end-plate. — In: Drug receptors. Ed. Rang. H. P. London, 1973, p. 105-119.
33. (Магазаник Л. Г., Выскочил Ф) Magazanik L. G., Vyskocil F. The effect of temperature on desensitization kinetics at the post-synaptic membrane of the frog muscle fibre. — J. Physiol. (London), 1975, 249, p. 285—300.
34. (Магазаник Л. Г., Выскочил Ф.) Magazanik L. G., Vyskoiil F. Desensitization at the neuromuscular junction. — In: Motor innervation of muscle. Ed. S. Thesleff. London, 1976, p. 151—177.
35. Магазаник Л. Г,, Иванов А. Я., Л укомская Н. Я. Исследованиедействия ’полипептидов змеиного яда па холинорецепцию изолированного симпатического ганглия кролика. — Нейрофизиология, 1974, 6, с. 652— 653.
36. Магазаник Л. Г., Иллеш И., Снетков В. А, Влияние серотонина на потенциалозависимость тока концевой пластинки мышечного волокна, — ДАН СССР, 1976, 227, с. 1268—1271.
37. Магазаник Л. Г., Лукомская Н. Я., Федоров В. В., Потапьева Н. И., Снетков В. А. Влияние полипептидов змеиного яда на холинорецептивные мембраны морских беспозвоночных. — Журн. эвол. биохим. физиол., 1974, 10, с. 411—412.
38. Магазаник Л. Г., Михельсон М. Я. Изменения холинорецепции мышц в процессе эволюции (анализ холинорецепции мышцы моллюска Му-tilus edulis). — Физиол. журн. СССР, 1963, 49, с. 725—735.
39. Магазаник Л. Г., Потапьева И. Н. Особенности блокирующего действия полипептидов змеиного яда на холинергические механизмы спинной мышцы пиявки. — Бюл. эксп. биол. мед., 1975, 79, с. 39—41.
40. Михельсон М. Я., Зеймаль Э. В, Ацетилхолин. О молекулярном механизме действия. Л., 1970.
41. Наследов Г. А., Федоров В. В. К вопросу о переходных волокнах в скелетной мускулатуре лягушки. — Арх. анат., 1965, 49, № 8, с. 72—76.
42. Ниши С. Электрогенез мускариновых и нехолинергических медленных ВПСП в клетках симпатического ганглия амфибий. — В кн.: Межнейронная передача в вегетативной нервной системе. Под ред. П. Г. Ко-Стюка, Киев, 1972, с. 112—135.
43. Персон Р. С. Двигательные единицы и мотонейронный пул. — В кн.: Физиология движений. Л., 1976, с. 69—101.
44. Полетаев Г. И. О пресинапгическом действии имидазола на первно-мышечное соединение лягушек. — Бюл. эксп. биол. мед., 1970, 69, с. 14-17.
45. Самойлов А. Ф. О переходе возбуждения с двигательного нерва на мышцу. — В кн.: Сборник, посвященный 75-летию И. П. Павлова. Л., 1924, с. 75—82.
46. (Сахаров Д. A.) Sakharov D. A. Cellular aspects of invertebrate neuropharmacology. — Ann. Rev. Pharmac., 1970, 10, p. 335—352.
47. Скок В. И. Физиология вегетативных ганглиев. Л., 1970.
22 Общая физиология нервной системы 337
48. Скок В. И., Савич В. Л, Свойства нейронов и синаптическая передача в симпатическом ганглии. — В кн,: Синаптические процессы. Киев, 1968, с. 109—120.
49. Турлаев Т. М. Медиаторная функция ацетилхолина и природа холино-рецептора, М., 1962.
50. Учизоно Л. Сравнительное изучение строения синапсов вегетативной и соматической нервной системы. — В кн.: Межнейронная передача Гв вегетативной нервной системе. Под ред. П. Г. Костюка. Киев, 1972, с. 5—16.
51. Харкевич Д. А. Фармакология курареподобных средств. М., 1969.
52. Шамарина Н. М. Синаптическая передача в топических и нетонических [мышцах. М., 1971.
53. Шаповалов А. И. Клеточные механизмы синаптической передачи. М., 1966.
54. Шуба М. Ф., Клевец М. Ю. 1ош1ий механизм гальмтвшм дп адреналину та норадреналину на гладком’язов! к.тптини. — Ф1з1ол. жури. (Киев), 1967, 13, №3, с. 5-11.
55. Akert К., Ререг К., Sandrl С. Structural organization of motor endplate and central synapses. — In: Cholinergic mechanisms. Ed. P. G. Waser. Now York, 1975, p. 43—57.
56. Albuquerque E. X., Barnard E. Л., Jansson S.-E., Wieckowski J. Occupancy of the cholinergic receptors in relation to changes in the endplate potential. — Life Sci., 1973, 12, p 1, p. 545—552.
57. Albuquerque E. X., Barnard E.A., Porter C. W., Warnick J. E. The density of acetylcholine receptors and their sensitivity in the postsynaptic membrane of muscle endplates. — Proc. Nat. Acad. Sci. USA, 1974, 71, p. 2818—2822.
58. Anderson C. R., Cull-Candy S. G., Miledi R. Glutamate and quisqualate noise in voltage-clamped locust muscle fibers. — Nature, 1976, 261, p. 151—153.
59. Anderson C. R., Stevens C. F. Voltage clamp analysis of acetylcholine produced end-plate current fluctuations at frog neuromuscular junction. — J. Physiol. (London), 1973, 235, p. 655-691.
60. Anwyl R., Usherwood P. N. R. Voltage clamp studies of glutamate synapse. — Nature, 1974, 252, p. 591 — 593.
61. Atwood H. L. Crustacean neuromuscular mechanisms. — Amer. Zool., 1967, 7, p. 527—551.
62. Atwood H. L. Peripheral inhibition in crustacean muscle. — Experien-tia, 1968, 24, p. 753—763.
63. Baker P. F. Transport and metabolism of calcium ions in nerve. — Progr. Biophys. Molec. BioL, 1972, 24, p. 179—223,
64. Barnard E. A., Chiu T. H., Jedrzejczyk J., Porter C. W., Wieckowski J. Acetylcholine receptor and cholinesterase molecules of vertebrate skeletal muscles and their nerve junctions. — In: Drug receptors, Ed. H. P. Rang. London, 1973, p. 225—240.
65. Barrett E. F., Barrett A. R.t Martin A. R., Rahamtmojf R. A note on the interaction of spontaneous and evoked release at the frog neuromuscular junction. — J. Physiol. (London), 1974, 237, p. 453—463.
66. Barrett E. F., Stevens C. F. Quantal independence and uniformity of presynaptic release kinetics at the frog neuromuscular junction. — J. Physiol. (London), 1972, 227, p. 665—689.
67. Benoit P. R., Mambrini J. Modification of transmitter release by ions which prolong the presynaptic action potential. — J. Physiol. (London), 1970, 210, p. 681-695.
68. Betz И7., Sakmann B. «Disjunction» of frog neuromuscular synapses by treatment with proteolytic enzymes. — Nature New Biol., 1971, 232, p. 94—95.
69. Bevan S. Sub-miniature end-plate potentials at untreated frog neuromuscular junctions. — J. Physiol. (London), 1976, 258, p. 145—155.
70. Bittner G, D., Harrison J. A reconsideration of the Poisson hypothesis for transmitter release at the crayfish neuromuscular junction. — J. Physiol. (London), 1970, 206, p. 1—23.
71. Blioch Zh. L., Glagoleva J. M., Liberman E. A., Nenashev V. A. A study of the mechanism of quanta! release transmitter at a chemical synapse. — J. Physiol. (London), 1968, 199, p. 11—36.
72. Bolton T. B. The permeability change produced by acetylcholine in smooth muscle. — In: Drug receptors. Ed. Rang H. P. London, 1973, p. 87—104.
73. Bowden J. The structure and innervation of lamellibranch muscle. — Internet. Rev. Cytol., 1958, 7, p. 295—335.
74. Biilbring E. Action of catecholamines on the smooth muscle cell membrane. — In: Drug receptors. Ed. Rang H. P. London, 1973, p. 1—15.
75. Bullock T. H., Horridge G. A. Structure and function in the nervous systems of invertebrates. Two volumes. San Francisco, 1965.
76. Burke W., Ginsborg B. L. The action of the neuromuscular transmitter on the slow fibre membrane. — J. Physiol. (London), 1956, 132, p. 599— 610.
77. Capek R., Esplin Don W., Salehmoghaddam S. Rates of transmitter turnover at the frog neuromuscular junction estimated by electrophysiological techniques. — J. Neuro physiol., 1971, 34, p. 831—841.
78. Castillo J. del, Escobar I., Gljon E. Effects of the electrophoretic application of sulfhydryl reagents to the endplate receptors. — Internal. J. Neu-rosci., 1971, 1, p. 199—209.
79. Castellio Z. del, Kats, B. Quanta! components of the endplate potential. — J. Physiol. (London), 1954, 124, p. 560 — 573.
80. Castillo J. del, Kats B. The membrane change produced by the neuromuscular transmitter. — J. Physiol. (London), 1954, 125, p. 546—565.
81. Castillo J. del, Katz B. Interaction at end-plate receptors between different choline derivatives. — Proc. Roy. Soc. Ser. B, 1957, 146, p. 369— 381.
82. Castillo J. del, de Mello PF. C., Morales T. The physiological role of acetylcholine in the neuromuscular system of Ascaris lumbricoides. — Archs Internet. Physiol. Biochim., 1963, 71, p. 741—757.
83. Castillo J. del, de Mello W. C., Morales T. Inhibitory action of f-amino-butyric acid (GABA) on Ascaris muscle. — Experientia, 1964, 20, p. 141 — 145.
84. Castillo J. del, de Mello W. C., Morales T. The initiation of action potentials in the somatic musculature of Ascaris lumbricoides. — J. Exp. Biol., 1967, 46, p. 263—279.
85. Ceccarelli B., Hurlbut PF. P. The effect of prolonged repetitive stimulation in hemicholfnium on the frog neuromuscular junction. — J. Physiol. (London), 1975, 247, p. 163—188.
86. Changeuz J.-P., Kasai M., Lee C. Y. Use of a snake venom toxin to characterize the cholinergic receptor protein. — Proc. Nat. Acad. Sci. USA, 1970, 67, p. 1241—1244.
87. Chothia C. Interaction of acetylcholine with different cholinergic nerve receptors. — Nature, 1970, 225, p. 36—38.
88. Coers C. Structure and organization of the myoneural junction. — Internal. Rev. Cytol., 1967, 22, p. 239—267.
89. Cohen J. B., Changeuz J.-P. The cholinergic receptor protein in its membrane environment. — Ann. Rev. Pharmac., 1975, 15, p. 83—103.
90. Cohen I., Kite. H., Van der Kloot W. The intervals between miniature endplate potentials in the frog are unlikely to be independently or exponentially distributed. — J. Physiol. (London), 1974, 236, p. 327—339.
91. Colomo F., Rahamimoff R., Stefani E. An action of 5-hydroxytryptamine on the frog motor end-plate. — Europ. J. Pharmac., 1968, 3, p. 272—274.
92. Colguhoun D. Mechanism of drug action at the voluntary muscle endplate. — Ann. Rev, Pharmacol., 1975, 15, p. 307—326.
93. Colquhoun D., Dionne V. E., Steinbach J. II., Stevens С. F. Conductance of channels opened by acetylcholine-like drugs in muscle end-plate. — Nature, 1975, 253, p. 204—206.
94. Cooke J. D., Okamoto K., Quastel D. M. J. The role of calcium in depolarization-secretion coupling at the motor nerve terminal. — I. Physiol. (London), 1973, 228, p. 459-497.
95. Couteauz R., Pecot-Dechavassine M. Vesicules synaptiques et poches au niveau des «zones actives» de la jonction ncuromusculaire. — C. R. Acad. Sci. (Paris), 1970, 271D, p. 2346—2349.
96. Crawford A. C., McBurney R. A'. Glutamate «noise» at the excitatory neuromuscular junctions of a crustacean. — J. Physiol. (London), 1975, 251, p. 73P—74P.
97. Crawford A. C,, McBurney R. N. On the elementary conductance event produced by L-glutamate and quanta of the natural transmitter at the neuromuscular junctions of Maja squinado, — J, PhysioL (London), 1976, 258, p. 205—225.
98. Cull-Candy S. G. L-glutamate receptors in locust muscle fibres. In: Motor innervation of muscle. Ed. S. Thesleff, London, 1976, p. 263—288.
99. Debell J. T. A long look at neuromuscular junctions in nematodes. — Quart. Rev. Biol., 1965, 40, p. 233—251.
100. De Mello W. C., Castillo del J., Morales T. Mechanism of the paralysing action of piperasine on Ascaris muscle cells. — Brit, I. Pharmac., 1964, 22, p. 463—477.
101. De Robertas E. Molecular biology of synaptic receptors. — Science, 1971, 171, p. 963—971.
102. Dionne V. E., Stevens C. F. Voltage dependence of agonist effectiveness at the frog neuromuscular junction: resolution of a paradox — J. Physiol. (London), 1975, 251, p. 245—270.
103. Dodge F. 4., Rahamimoff R. Co-operative action of calcium ions in transmitter release at the neuromuscular junction. — J, Physiol. (London), 1967, 193, p. 419—432,
104. Dreyer F., Peper K. Density and dose-response curve of acetylcholine receptors in frog neuromuscular junction. — Nature, 1975, 253, p. 641—643.
105. Dreyer F., Peper K., Akert K., Sandri C,, Moor H. Ultrastructure of the «active zone» in the frog neuromuscular junction. — Brain Res,, 1973, 62, p. 373—380.
106. Dun N., Nishi S. Effects of dopamine on the superior cervical ganglion of the rabbit. — J. Physiol. (London), 1974, 239, p. 155—164.
107. Eccles R. M. Responses of isolated curarized sympathetic ganglia. — J. Physiol. (London), 1952, 117, p. 196—217.
108. Eccles J. C. Physiology of synapses. Berlin, 1964. (Русск. перев.: Экклс Дж. Физиология синапсов. М., 1966).
109. Eccles J. С., Jaeger J. С. The relationship between the mode of operation and the dimensions of the junctional region at synapses and motor endorgans. — Proc. Roy, Soc. Ser. B, 1958, 148, p. 38—56.
110. Eccles R. M., Libet B. Origin and(hlockade of the synaptic responses of curarized sympathetic ganglia. — J. Physiol. (London), 1961, 157, p. 484—503.
111. Eccles J. C., Macfarlane W. V. Action of anticholinesterases on end-plate potential of frog muscle. — J. Neurophysiol., 1949, 12, p. 50—80.
112. Ehrenpreiss S., Fleisch J. H., Mittag T, W. Approaches to the molecular nature of pharmacological receptors. — Pharmac. Rev., 1969, 21, p. 131— 181.
113. Elmqvist D., Feldman D. S. Calcium dependence of spontaneous acetylcholine release at mammalian motor nerve terminals. — J. Physiol. (London), 1965, 181, p. 487—497.
114. Elmqvist D., Quastel D. M. J. Presynaptic action of hemicholinium at the neuromuscular junction. — J. Physiol. (London), 1965, 177, p. 463—482.
115. FambroughD. M. Acetylcholine sensitivity of muscle fiber membrane. Mechanism of regulation by motoneurons. — Science, 1970, 168, p. 372—373.
{16. Fatt P., Katz В. An analysis of the end plate potential recorded with an intracellular electrode. — J. Physiol. (London), 1951, 115, p. 320—370.
117. Fatt P., Katz B. Spontaneous subthreshold activity at motor nerve endings. — J. Physiol. (London), 1952, 117, p. 109—128.
118. Flacke W., Yeoh T. S, Differentiation of acetylcholine and succinylcholine receptors in leech muscle. — Brit. J. Pharmac., 1968, 33, p. 145—153.
119. Florey E. Neurotransmitters and modulators in the animal kingdom. — Fed. Proc., 1967, 26, p. 1164—1178.
120. Fulpius B. IP, Characterization, isolation and purification of cholinergic receptors. — In: Motor innervation of muscle. Ed. J. Thesleff. London, 1976, p. 1—29.
121. Gage P, IF. Generation of end-plate potentials. — Physiol. Rev., 1976, 56, p. 177—247.
122. Gage P. PF., Armstrong С. M. Miniature end-plate currents in voltage-clamped muscle fibres. — Nature, 1968, 218, p. 363—365.
123. f(?age P. W., McBurney R. N. Miniature end-plate currents and potentials generated by quanta of acetylcholine in glycerol-treated toad sarto-rius fibres. — J. Physiol. (London), 1972, 226, p. 79—94.
124. George W. J.t Wilkinson R. D., Kadowitz P. J. Influence of acetylcholine on contractile force and cyclic nucleotides levels in the isolated perfused rat heart. — J. Pharmac., 1973, 184, p. 228—243.
125. Gerschenfeld H. M. Chemical transmission in invertebrate central nervous systems and neuromuscular junctions. — Physiol. Rev., 1973, 53, p. 1 — 119.
126. Ginsborg B. L. Ion movements in junctional transmission. — Pharmac. Rev., 1967, 19, p. 289-316.
127. Ginsborg B. L. On the presynaptic acetylcholine receptors in sympathetic ganglia of the frog. — J. Physiol. (London), 1971, 216, p. 237—246.
128. Ginsborg B. L. Electrical changes in the membrane in junctional transmission. — Biochim. biophys. acta, 1973, 300, p. 289—317.
129. Graziadei P. Ultrastructure of the motor nerve endings in the muscles of Cephalopod. — J. Ultrastr. Res., 1966, 15, p. 1—13.
130. Green D. P. L., Miledi R., Vincent A. Neuromuscular transmission after immunization against acetylcholine receptors. — Proc. Roy. Soc. Ser. B, 1975, 189, p. 57—68.
131. Grundfest II. Electrical inexcitability of synapses and some consequences in the central nervous system. — PhysioL Rev., 1957, 37, p. 337—361.
132. Grundfest H. Neuromuscular transmission in arthropods. In: Internat. Encycloped. Pharmac. Toxicol. Oxford—New York, 1972, Sect. 14, 2, p. 621—654.
133. Hall Z. W., Kelly R. B. Enzymatic detachment of end-plate acetylcholinesterase from muscle. — Nature New Biol., 1971, 232, p. 62—63.
134. Hanson J., I.oivy J. Structure and function of the contractile apparatus in the muscles of invertebrate animals. — In: The structure and function of muscle. 2. New'York—London, 1960, p. 265—335.
135. Heilbronn E. Neuromuscular transmission after immunization with nicotinic acetylcholine receptor.— In: Motor innervation of muscle. Ed. S. Thesleff. London, 1976, p. 177—212.
136. Heilbronn E., Mattson C. The nicotinic cholinergic receptor protein: Improved purification method, preliminary amino acid composition and observed auto-immuno response. — J. Neurochem., 1974, 22, p. 315—317.
137. Hess A. Vertebrate slow muscle fibers. — Physiol. Rev., 1970, 50, p. 40— 62.
138, Heuser J. Morphology of synaptic vesicle discharge and reformation at the frog neuromuscular junction. — In: Motor innervation of muscle. Ed, S, Thesleff. London, 1976, p. 51—115.
139. Heuser J. E., Reese T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction, — J. Cell Biol,, 1973, 57, p. 315-344.
140. Hldaka T., Ito У,, Kuriyama. H., Tashiro N. Neuromuscular transmission in the longitudinal layer of somatic muscle in the earthworm. — J. Exp. Biol., 1969, 50, p. 417-430.
141. Hldaka T., Osa T,, Twarog В. M. The action of 5-hydroxytryptamine on Mytilus smooth muscle. — J. Physiol. (London), 1967, 192, p. 869— 877,
142. Howell J. H., Jenden D. J. T-tubules of skeletal muscle: morphological alterations which interrupt excitation—contraction coupling. — Fed. Proc., 1967, 26, p. 553.
143. Hoyle G, Muscle and neuromuscular physiology. — In: Physiology of Mol-lusca. 1. New York, 1964, p. 313—351.
144. Hoyle G. Neural control of skeletal muscle. — In: The Physiology of the Insecta. II. Ed. M. Rockstein. New York, 1965, p. 313—351.
145. Hubbard J. I. Mechanism of transmitter release. — Progr. Biophys. Molec. Biol., 1970, 21, p. 33—124.
146. Hubbard J. I. Microphysiology of vertebrate neuromuscular transmission. — Physiol. Rev., 1973, 53, p. 674—723.
147. Hubbard J. I., Jones S. F., Landau E. M, An examination of the effects of osmotic pressure changes upon transmitter release from mammalian motor nerve terminals. — J. Physiol. (London), 1968, 197, p. 639— 657.
148. Hubbard J. /., PPilson D. F. Neuromuscular transmission in a mammalian preparation in the absence of blocking drugs and the effect of d tubocura -rine. — J. Physiol. (London), 1973, 228, p. 307—325.
149. Ito У., Kuriyama IV., Tashiro N. Miniature excitatory junction potentials in the somatic muscle of the earthworm, Pheretima communissima, in sodium free solution. — J. Exp. Biol., 1969, 50, p. 107—118.
150. Katz B. Nerve, muscle, synapse. New York, 1966. (Русск. перев.: Катц E. Нерв, мышца и синапс. М., 1968. 220 с.).
151. Katz В. The release of neural transmitter substances. Liverpool, 1969.
152. Katz B., Miledi R. Input-output relation of a single synapse. — Nature, 1966, 212, p. 1242—1245.
153. Katz B., Miledi R. Tetrodotoxin and neuromuacular transmission. — Proc. Roy. Ser. B, 1967, 167, p. 8—22.
154. Katz B., Miledi R. Modification of transmitter release by electrical interference with motor nerve endings. — Proc. Roy. Soc, Ser. B, 1967, 167, p. 1—7.
155. Katz B., Miledi R. The role of calcium in neuromuscular facilitation. — J. Physiol. (London), 1968, 195, p. 481—492.
156. Katz B>, Miledi R. Further study of the role of calcium in synaptic transmission. — J. Physiol. (London), 1970, 207, p. 789—801.
157. Katz B., Miledi R. Membrane noiso produced by acetylcholine. — Nature, 1970, 226, p. 962—963.
158. Katz B., Miledi R. Further observations on acetylcholine noise. — Nature. New Biol., 1971, 232, p. 124—126.
159. Katz B., Miledi R. The statistical nature of the acetylcholine potential and its molecular components. — J. Physiol. (London), 1972, 224, p.665— 699.
160. Katz B., Miledi R. The characteristics of end-plate noise produced by different depolarizing drugs. — J. Physiol. (London), 1973, 230, p. 707— 717.
161. Katz B., Miledi R. The effect of procaine on the action of acetylcholine at the neuromuscular junction. — J. Physiol. (London), 1975, 249, p. 269— 284. '
162. Katz B., Miledi R. The nature of the prolonged endplate depolarization in anti-esterase treated muscle. — Proc. Roy. Soc. Ser. B, 1975, 192, p. 27—38.
163. Katz B., Miledi R. The analysis of end-plate noise — a new approach to the study of acetylcholine/receptor interaction. — In: Motor innervation of muscle, Thesleff S, (Ed.). London, 1976, p. 31—50.
164. Katz В., Thesleff 5. On the factors which determine the amplitude of the «miniature end-plate» potential. — J. Physiol. (London), 1957, 137, p. 267—278.
165, Katz B., Thesleff S. A study of the «desensitization» produced by acetylcholine at the motor end-plate. — J. Physiol. (London), 1957, 138, p. 63— 80.
166. Kita H., Van. Der Kloot W. Effects of the ionophore X-537A on acetylcholine release at the frog neuromuscular junction. — J. Physiol. (London), 1976, 259, p. 177—198.
167. Kobayashi H., Libet B. Is inactivation of potassium conductance involved in slow postsynaptic excitation of sympathetic ganglion cells? Effects of nicotine. — Life Sci., 1974, 14, p. 1871—1883.
168. Koketsu K. Cholinergic synaptic potentials and the underlying ionic mechanisms. — Fed. Proc., 1969, 28, p. 101—112.
169. Kordas M, The effect of membrane polarization on the time course of the end-plate current in frog sartorius muscle. — J. Physiol. (London), 1969, 204, p. 493 - 502.
170. Kordas M. An attempt at an analysis of the factors determining the time course of the end-plate current. 1. The effects of prostigmine and the ratio of Mg2+ to Ca2+. — J. Physiol. (London), 1972, 224, p. 317—332.
171. Kordas M. An attempt at an analysis of the factors determining the time course of the end-plate current. II. Temperature. — J. Physiol. (London), 1972, 224, p. 333-348.
172. Krlebel M. E., Gross С. E. Multimodal distribution of frog miniature end-plate potentials in adult, denervated and tadpole leg muscle. — J. Gen. Physiol., 1974, 64, p. 85—103.
173. Kriebel M. E., Stolper D. R. Non-Poisson distribution in time of small-and large-mode miniature end-plate potentials. — Amer. J. Physiol., 1975, 229, p. 1321—1329.
174. Kuba K., Koketsu K. Ionic mechanism of the slow excitatory postsynaptic potential in bullfrog sympathetic ganglion cells. — Brain Res., 1974, 81, p. 338-342.
175. Kuba K., Koketsu K. Decrease of Na+ conductance during desensitization of the frog end-plate. — Nature, 1976, 262, p. 504—505.
176. Kuba K., Tomita T. Effects of noradrenaline on miniature end-plate potentials and on end-plate potential. — J. Theoret. Biol., 1972, 36, p. 81—88.
177. Kuno M., Turkanis S. A., Weakly J. N. Correlation between nerve terminal size and transmitter release at the neuromuscular junction of the frog. — J. Physiol. (London), 1971, 213, p. 545—556.
178. Kusano K. Further study of the relationship between pre- and postsynaptic potentials in the squid giant synapse. — J. Gen. Physiol., 1968, 52, p. 326—345.
179. Libet B. Generation of slow inhibitory and excitatory postsynaptic potentials. — Fed. Proc., 1970, 29, p. 1945—1956.
180. Ltley A. W. The effect of presynaptic polarization on the spontaneous activity at the mammalian neuromuscular junction. — J. Physiol. (London), 1956, 134, p. 427—443.
181. Llinas R., Blinks J. B., Nicholson C. Calcium transient in presynaptic terminal of squid giant synapse: detection with aequorin. — Science, 1972, 176, p. 1127—1129.
182. Llinas R., Steinberg J. Z., Walton K. Presynaptic calcium currents and their relation to synaptic transmission. Voltage clamp study in squid giant synapse and theoretical model for calcium gate. — Proc. Nat. Acad. Sci. USA,.1976, 73, p. 2918—2922.
183. Loewi O. Ubar humorale Ubertragkeit der Herznervenwirkung. — Pfliig. Arch., 1921, 189, p. 239—242.
184. Longenecker H, E<> Hurlbut W. Л/auro A., Clark А. ТУ. Effects of black widow spider venom on the frog neuromuscular junction. — Nature, 1970, 225, p, 701-705.
185. Мае по Т. Analysis of sodium and potassium conductances in the "procaine end-plate potential. — J. Physiol. (London), 1966, 183, p. 592—606.
186. Magleby K, L., Stevens C. F. The effect of voltage on the time course of end-plate currents. — J. Physiol. (London), 1972, 223, p. 151—171.
187. Magleby К. L., Stevens C. F. A quantitative description of end-plate currents. — J. Physiol. (London), 1972, 223, p. 173—197.
188. Manthey A. A. The effect of calcium on the desensitization of membrane receptors at the neuromuscular junction. — J. Gen. PhysioL, 1966, 49, p. 963-976.
189. Martin A. R. A further study^of the statistical composition of the endplate potential. — J. Physiol. (London), 1955, 130, p. 114—122.
190. Martin A. R. Quantal nature of synaptic transmission. — Physiol. Rev., 1966, 46, p. 51—66.
191. McMahan U. J., Kuffler S. W. Visual identification of synaptic boutons on living ganglion cells and varicosities in postganglionic axons in the heart of the frog. — Proc. Roy. Soc. Ser. B, 1971, 177, p. 485—508.
192. McMahan U. J., Spitzer N. C., Peper K. Visual identification of nerve terminals in living isolated skeletal muscle. — Proc. Roy. Soc. Ser. B, 1972, 181, p. 421—430.]
193. Meiri U., Rahamimoff R. Activation of the transmitter release by strontium and calcium ions at the neuromuscular junction. — J. Physiol. (London), 1971, 215, p. 709—726.
194. Miledi R, Trasmitter release induced by injection of calcium ions into nerve terminals. — Proc. Roy. Soc. Ser. B, 1973, 183, p. 421—425.
195. Miledi R., Molinoff P., Potter L. T. Isolation of the cholinergic receptor protein of Torpedo electric tissue. — Nature, 1971, 229, p. 554—557.
196. Miledi R., Potter L. T. Acetylcholine receptors in muscle fibres. — Nature, 1971, 233, p. 599 -603.
197. Miledi R., Thies R. Tetanic and post-tetanic rise in frequency of miniature end-plate potentials in low-sodium solutions. — J. Physiol. (London), 1971, 212 , p. 245-258.
198. Nastuk W. L. Activation and inactivation of muscle postjunctional receptors. — Fed. Proc., 1967, 26, p. 1639—1646.
199. Nastuk W. L., Parsons R. L. Factors in the inactivation of post-junctional membrane receptors of frog skeletal muscle, — J. Gen. PhysioL, [1970, 56, p. 218—249.
200. Neher E., Sakmann B. Single-channel currents recorded from membrane of denervated frog muscle fibres. — Nature, 1976, 260, p. 799—802.
201. Nicol J. A. C. Muscle activity and drug action in the body wall of the sa-bellid worm Bran.chom.ma vesiculasum (Montaga). — PhysioL comp. oecoL, 1952, 2, p. 339—345.
202. Nishi S. Ganglionic transmission. In: The peripheral nervous system. Ed. J. I. Hubbard. New York, 1974, p. 225—255.
203. Nishi S., Koketsu K, Electrical properties and activities of single sympathetic neurons, in frogs. — J. Cell. Comp. PhysioL, 1960, 55, p. 15—30.
204. Otsuka M., Endo M. The effect of quanidine on neuromuscular transmission. — J. Pharmac., 1960, 128, p. 273—282.
205. Otsuka M., Endo M., Nonomura Y. Presynaptic nature of neuromuscular depression. — Jap. J. Physiol., 1962, 12, p. 573—584.
206. Paton W. D. M., Waud D. R. The margin of safety of neuromuscular transmission. — J. PhysioL (London), 1967, 191, p. 59—90.
207. Patrick J., Lindstrom J. Autoimmune response to acetylcholine receptor. — Science, 1973, 180, p. 871—872.
208. Pecot-D'echavassine M. Action of vinblastine on the spontaneous release of acetylcholine at the frog neuromuscular junction. — J. PhysioL (London), 1976, 261, p. 31—48.
209. Peper K., Dreyer F., Sandri C., Akert K., Moor H. Structure and ultrastructure of the frog motor end-plate. A freezeetching study. — Cell Tiss. Res., 1974, 149, p. 437-455.
210. Pitman R. M. Transmitter substances in insects: a review. — Comp. Gen. Pharmac., 1971, 2, p. 347—371.
211. Podleski T. R. Cooperativity of the electropiaque membrane. In: Drug receptors. Ed. И. P. Rang. London, 1973, p. 135—148.
212. Puzkin S., Nicklas W. J., Berl S. Actomyosin like protein in brain: subcel-lular distribution. — J. Neurochem., 1972, 19, p, 1319—1333.
213. Quastel D. M. J., Hackett J. T., Cooke J. D. Calcium: is it required for transmitter secretion? — Scinece, 1971, 172, p. 1034—1036.
214. Rahamimoff R. A dual effect of calcium ions on neuromuscular transmission. — J. Physiol. (London), 1968, 195, p. 471—480.
215. Rahamimoff R. The role of calcium in transmitter release at the neuromuscular junction. — In: Motor innervation of muscle. Ed. S. Thesleff. London, 1976, p. 117—149.
216. Rang H. P., Ritter J. M. On the mechanism of desensitization at cholinergic receptors. — Molec. Pharmac., 1970, 6, p. 357—382.
217. Rozhkova E. K. Pharmacology of cholinergic systems in annelids, — In: Internal. Encycloped. Pharmac. Therap., Sect. 85. Oxford—New York, 1973, p. 169—189.
218. Ross D. H., Triggle D. J. Further differentiation of cholinergic receptors in leech muscle. — Biochem. Pharmac., 1972, 21, p. 2533—2534.
219. Rotshenker S., Rahamimoff R. Neuromuscular synapse: stochastic properties of spontaneous release of transmitter. — Science, 1970, 170, p. 648— 649.
220. Salpeter M. M., Eldefrawi M. E. Sizes of end-plate compartments, densities of acetylcholine receptors and other quantitative aspects of neuromuscular transmission. — J. Histochem. Cytochem., 1973, 21, p. 769—778.
221. Takeuchi A. Excitatory and inhibitory transmitter actions at the crayfish neuromuscular junction. — In: Motor innervation of muscle. Ed. S. Thesleff. London, 1976, p. 231—261.
222. Takeuchi A., Onodera K. Effects of kainic acid on the glutamate receptors of the crayfish muscle. — Neuropharmacology, 1975, 14, p. 619—625.
223. Takeuchi A,, Takeuchi N. Active phase of frog’s end-plate potential. — J. Neurophysiol., 1959, 22, p. 395—411.
224. Takeuchi A., Takeuchi N. On the permeability of end-plate membrane during the action of transmitter. — J. Physiol. (London), 1960, 154, p. 52—67.
225. Takeuchi N. Some properties of conductance changes at the end-plate membrane during the action of acetylcholine. — J. Physiol. (London), 1963, 167, p. 128-140.
226. Taxi J. Morphological and cytochemical studies on the synapses in the autonomic nervous system. — In: Mechanism of synaptic transmission (Progr. Brain Res., 1969, 31, p. 5—27).
227. Thesleff S. The mode of neuromuscular block caused by acetylcholine, nicotine, decamethonium and acetylcholine. — Acta physiol, Scand., 1955, 34, p. 218-231.
228. Thesleff S. Motor end-plate «desensitization» by repetitive nerve stimuli. — J. Physiol. (London), 1959, 148, p. 659—664.
229. Thesleff S. Effects of motor innervation on the chemical sensitivity in muscle. — PhysioL Rev., 1960, 40, p. 734—752,
230. Thesleff S. Functional properties of receptors in striated muscle. — In: Drug receptors, Ed. Rang. H. P. London, 1973, p. 121—133.
231. Trautwein W. Generation and conduction of impulses in the heart as affected by drugs. — Pharmac. Rev., 1963, 15, p. 277—332.
232. Trendelenburg U. Transmission of preganglionic impulses through the muscarinic receptors of the superior cervical ganglion of the cat. — J. Pharmac., 1966, 154, p. 426—430.
233. Twarog В. M. The pharmacology of molluscan smooth muscle. — Brit. J. Pharmac., 1959, 14, p. 404—407.
234. Twarog В. M. Excitation of Mytilus smooth muscle. — J. Physiol. (London), 1967, 192, p. 857-868.
235. Usherwood P- W. R. Insect neuromuscular mechanisms. — Amer. Zool., 1967, 7, p. 553—582.
236. Usherwood P. N. R. A critical study of the evidence for peripheral inhibitory axons in insect. — J. Exp. Biol., 1968, 49, p. 201—222.
237. Voile R. L. Modification by drugs of synaptic mechanisms in autonomic ganglia. — Pharmacol. Rev., 1966, 18, p. 839—869.
238. Waser P. G. Receptor localization by autoradiographic techniques. — Ann. New York Acad. Sci., 1967, 144, p. 737—755.
239. Weight F. F., Padjen A. Slow synaptic inhibition evidence for synaptic inactivation of sodium conductance in sympathetic ganglion cells. — Brain Res., 1973, 55, p. 219—224.
240, Weight F. F., Votava J. Slow synaptic excitation in sympathetic ganglion cells.’ evidence for synaptic inactivation of potassium conductance. — Science, 1970, 170, p. 755—758.
241. Wernig A. Estimates of statistical release parameters from crayfish and frog neuromuscular junctions. — J. Physiol, (London), 1975, 244, p. 207 — 221.
242. Wiersma C. A. G. The neuromuscular system. — In: The Physiology of Crustacea. 2. New York, 1961, p. 191—268.
Глава 8
ПОСТСИНАПТИЧЕСКИЕ ПРОЦЕССЫ В ЦЕНТРАЛЬНЫХ НЕЙРОНАХ
Хотя термин «синапс» был введен в физиологию для обозначения контакта между нейронами Шеррингтоном [84], однако еще в 60-х годах прошлого столетия И. М. Сеченов [10] подчеркивал, что вне межклеточной связи нельзя объяснить способы происхождения даже самого элементарного рефлекса.
Действительно, являясь главным, если не единственным механизмом взаимодействия нейронов, синапсы обеспечивают все основные проявления работы мозга и его отдельных центров и определяют специфические особенности организации мозга.
Решающие факты в изучении природы синаптических процессов в нервных клетках были получены с помощью микроэлек-тродной техники, позволившей успешно решить такие кардинальные проблемы, как природа возбуждения и торможения в нервных клетках. Было убедительно показано, что каждый из этих основных нервных процессов осуществляется с помощью специальных синаптических приборов, причем определяющее значение имеют свойства постсинаптической мембраны.
Чем сложнее устроены живые организмы и их центральная нервная система, чем больше число составляющих мозг нервных элементов, тем большее значение приобретают синаптические связи между нервными клетками. Очень важной особенностью синаптической организации нервной клетки высших животных является колоссальное число индивидуальных синаптических контактов, воздействующих на ее постсинаптическую мембрану. Так, число синаптических связей, получаемых каждым мотонейроном млекопитающих, составляет несколько тысяч, а число синапсов на клетке Пуркинье мозжечка достигает двухсот тысяч [40].
Различные синаптические контакты отличаются друг от друга механизмом действия, локализацией, функциональными особенностями, однако для того чтобы правильно понять интеграцию всех этих разнообразных процессов, необходимо детально про-
йцалийирбвать природу постсинаптических эффектов, вызываемых основными типами синапсов: возбуждающих и тормозящих.
В настоящее время хорошо известно, что синаптическое возбуждение и торможение может осуществляться в центральных синапсах как с помощью химического, так и электрического механизма. Более того, одна и та же нервная клетка может получать синапсы, воздействующие на постсинаптическую мембрану через посредство химических медиаторов и чисто электрическим путем. Даже один синаптический прибор может утилизировать одновременно химический и электрический механизмы передачи (смешанные синапсы). Однако ввиду того, что значительная часть нейронов получает синапсы только медиаторного типа, целесообразно отдельно рассмотреть синаптические воздействия, осуществляемые через синапсы с химическим механизмом.
Точный анализ постсинаптических эффектов возможен только при условии выделения моносинаптических эффектов, т. е. процессов, не осложненных значительными преобразованиями на пути к исследуемой клетке. Именно идентификация моносинаптических возбуждающих проекций позволила значительно продвинуться в выяснении механизмов синаптического возбуждения у позвоночных и беспозвоночных животных. Этот подход оказался исключительно плодотворным и при изучении синаптического торможения, хотя в последнем случае из-за частого включения специальных тормозящих нейронов в пути осуществления тормозных влияний значительная часть исследований у позвоночных основана на анализе дисинаптического торможения.
8.1. ПОСТСИНАПТИЧЕСКОЕ ВОЗБУЖДЕНИЕ
8.1.1. ОБЩАЯ ХАРАКТЕРИСТИКА ВПСП И СОЗДАЮЩЕГО ЕГО ПОСТСИНАПТИЧЕСКОГО ТОКА
Как уже указывалось в гл. 6 и 7, в синапсах с химическим механизмом передачи возбуждающий медиатор, освобождаемый пресияаптическими окончаниями, воздействует на хеморецепторы постсинаптической мембраны. В результате этой реакции происходит специфическое изменение электрических свойств мембраны нервной клетки, приводящее к развитию локального процесса деполяризации, обозначаемого как возбуждающий постсинаптический потенциал (ВПСП). Указанное название подчеркивает развитие ВПСП именно в постсинаптической мембране.
Поскольку освобождение медиатора пресинантическими нервными окончаниями может происходить не только под воздействием нервного импульса или искусственной деполяризации пресинаптической мембраны, но и спонтанно, ВПСП могут быть как вызванными, так и спонтанными. В свою очередь спонтанные ВПСП возникают как в результате спонтанной импульсации в пресинапти-
ЧесКих нейронах, так и в результате случайных выбросов МёДиА-тора пресинаптическими нервными окончаниями. И в том и в другом случае ВПСП элементарны по своему характеру [58, 66}. Примеры элементарных ВПСП в мотонейроне кошки показаны на рис. 8.1, А. Видно, что форма индивидуальных реакций очень
Рис. 8.1. Унитарные и комплексные ВПСП в мотонейронах котики.
А — унитарные ВПСП с разным временным течением в одном и том же мотонейроне [27]; В — ВПСП, вызываемое раздражением мышечных афферентов группы 1а стимулами возрастающей интенсивности II—9); сверху — потенциалы заднего корешка, внизу — внутриклеточные потенциалы [39].
сильно варьирует, что может быть обусловлено различной локализацией соответствующих синапсов на поверхности мотонейрона. Следует отметить, что в некоторых пейронах центральной нервной системы число квантов медиатора и соответственно величина элементарного ВПСП невелики. Такой характер элементарных ВПСП наблюдается в спинальных мотонейронах [70]. Однако в других случаях пресинаптическое волокно может освобождать многие сотни квантов медиатора, как например лазаующие волокна, окан-
Чивающиеся на клетках Пуркинье мозжечка [40]. Амплитуда элементарного ВПСП может зависеть не только от числа квантов медиатора и локализации возбуждающего синапса, но и от входного сопротивления ностсинаптической клетки.
Временное течение ВПСП, возникающих в результате активизации группы пресинаптических волокон, например при раздражении мышечного нерва, может быть более сложным, чем при элементарных процессах, обусловленных активностью одного пресинап-тического окончания. Эго связано с тем, что такой комплексный ответ представляет собой результат временной и пространственной суммации эффектов, возникающих с определенной степенью асинхронности в различных точках постсинаптической мембраны. Временная суммация обусловлена неодновременным приходом импульсов, распространяющихся по разным волокнам с неодинаковой скоростью проведения. Пространственная суммация зависит от различной локализации на поверхности постси-наптической мембраны синапсов, образуемых разными нресииапти-ческими волокнами. И даже одно и то же волокно в принципе может образовывать контакты с разными участками постсинаптической мембраны.
Неодинаковая локализация синапсов, образуемых разными волокнами, проявляется, например, значительными различиями во временном течении элементарных ВПСП мотонейронов кошки, вызываемых активацией разных индивидуальных волокон группы 1а [77].
Тем не менее, если общее число активированных волокон сравнительно невелико, а скорость проведения по ним практически однозначна, комплексные ВПСП, регистрируемые в большинстве исследований, могут иметь достаточно простую форму, приближающуюся к усредненной форме элементарных постсинаптических реакций.
ВПСП, возникающие в нейронах млекопитающих, наиболее подробно изучены в спинальных мотонейронах кошки, где была показана возможность избирательной активации моносинаптиче-ских входов, образуемых волокнами длинных проекционных путей. Моносинаптические ВПСП, вызываемые синхронной волной в волокнах мышечных афферентов группы 1а, сравнительно мало изменяют свое временное течение по мере возрастания своей амплитуды в зависимости от силы раздражения (иными словами, количества активированных пресинаптических волокон) (рис. 8.1, Б), Это позволяет предполагать суммацию достаточно однородных элементарных реакций. Моносинаптические ВПСП, вызываемые импульсами .в волокнах группы la (1а ВПСП), обычно достигают максимума в течение 1—1.5 мс, после чего затухают по экспоненте с постоянной временя около 4.7 мс.
Временное течение ВПСП, возникающих при активации других воздействующих входов мотонейрона, может отличаться от 1а ВПСП [12]. В других нейронах центральной нервной системы 350
эти различия могут быть еще более выражены. Особенно большую продолжительность имеют ВПСП нейронов мозга беспозвоночных.
Деполяризация постсинаптической мембраны, регистрируемая во время развития ВПСП, развивается медленнее и продолжается более продолжительный период, чем создающий ее постсинаптический ток. Опыты с фиксацией потенциала, проведенные с по-
Рис. 8.2. ВПСП и соответствующий ему постсинаптический ток при моно-синаптическом возбуждении мотонейрона [21].
А — снизу ВПСП, сверху — ток при отсутствии фиксации потенциала; Б — сверху ток, снизу — потенциал во время фиксации; В — график развития во времени постсинаптического тока (I) и ВПСП [2].
мощью введения в мотонейроны кошки двух раздельных микроэлектродов, один из которых служит для регистрации ВПСП, а другой для пропускания тока, нейтрализующего постсинаптический ток [21], позволили провести измерения последнего. Эти опыты показали, что постсинаптический ток, обусловленный активацией синапсов образуемых мышечными афферентами группы 1а, достигает максимального значения за 0.3—0.5 мс до вершины ВПСП и имеет общую продолжительность менее 2 мс (рис. 8.2). Это показывает, что активная фаза изменений, возникающих в постсинаптической мембране под действием возбуждающего медиатора, значительно менее продолжительна, чем ВПСП, длительность которого зависит от пассивных электрических свойств клеточной мембраны.
8.1.2. ИЗМЕНЕНИЕ ПРОВОДИМОСТИ
ПОСТСИНАПТИЧЕСКОЙ МЕМБРАНЫ ВО ВРЕМЯ ВПСП
Изменения свойств постсинаптической мембраны, приводящие к возникновению постсинаптического тока, могут быть продемонстрированы с помощью измерения изменений проводимости мембраны во время развития ВПСП путем: регистрации изменений входного сопротивления нервной клетки. Имеющиеся данные показывают, что в большей части исследованных синапсов
медиатор увеличивает проводимость постсинаптической мембраны, хотя в некоторых нервных клетках синаптическое возбуждение сопровождается уменьшением проводимости [51, 91].
Оценка изменений проводимости постсинантической мембраны нейрона во время развития ВПСП может быть произведена различными способами. Все они основаны на пропускании электрического тока через введенные в клетку микроэлектроды с помощью:
1) пропускания коротких прямоугольных толчков тока и измерения изменений их амплитуды и формы. В случае центральных нейронов позвоночных, ВПСП которых имеют быстрое временное течение, а значительная часть возбуждающих синапсов может быть расположена на большом электро тоническом расстоянии от сомы нейрона, этот метод недостаточно чувствителен для обнаружения измеиений сопротивления во время одиночного синаптического ответа;
2) пропускания через мембрану синусоидального тока в сочетании с фазовым детектором и усреднением на ЭВМ; хотя указанный метод позволяет получить кривые изменения во времени синфазной и квадратурной составляющих импеданса раздельно от ВПСП, он также недостаточно чувствителен и не выявляет изменений проводимости во время моносинаптических ВПСП, имеющих небольшую амплитуду;
3) пропускания через мембрану постоянного тока достаточной интенсивности, чтобы вызвать изменение амплитуды ВПСП [16]; ввиду того что постоянный ток, распространяющийся по кабельным структурам нейрона, в меньшей степени подвержен затуханию, чем импульсный или синусоидальный ток, результаты, получаемые с помощью метода постоянного тока, в меньшей степени зависят от расположения синапсов на сомато-дендритяой мембране.
Изменения сопротивления во время ВПСП Д7? могут быть рассчитаны по закону Ома как
где I — сила поляризующего тока, a dV — изменения амплитуды ВПСП, или — графически — тангенс угла наклона линии зависимости амплитуды ВПСП от силы поляризующего тока, так как Дй представляет собой производную dVldl— функции, выражающей указанную зависимость. Применение всех указанных методов показало, что изменения проводимости во время развития мойосинаптических ВПСП в мотонейронах млекопитающих при активации мышечных афферентов группы 1а, стволово-спинальных и кортико-спинальных волокон очень невелики и составляют обычно не более 5% входного сопротивления нейрона. Так, в опытах на мотонейронах обезьяны изменения сопротивления во время кортико-мотонейронных ВПСП составляют в среднем
12+2 кОм, рубро-мотонейронных ВПСП 12+4 кОм и 1а ВПСП 22+3 кОм.
Графики зависимости Д7? от времени нарастания или скорости нарастания ВПСП [16] свидетельствуют о том, что положительная корреляция между этими величинами отсутствует. Это пе подтверждает представления о том, что ВПСП с более медленной скоростью нарастания должны быть менее чувствительны к инъецируемому в клетку току из-за более дистального по отношению к соме расположения соответствующих синапсов. fe* *"'
Можно предполагать, что незначительное увеличение проводимости постсинаптической мембраны, обнаруживаемое во время развития ВПСП, свидетельствует о сравнительно ограниченном числе ионных каналов, открываемых возбуждающим’медиатором, или'Ь дистальной локализации активированных синаптических входов. Кроме того, нельзя исключить возможность того, что наряду с повышением проницаемости к одним ионам (например, ионам натрия) происходит уменьшение проницаемости к другим (ионам”калия).
8.1.3. ЭКВИВАЛЕНТНАЯ СХЕМА СИНАПТИЧЕСКОГО ВОЗБУЖДЕНИЯ НЕРВНОЙ КЛЕТКИ
Изменение электрических параметров постсинаптической мбмбраны'нервной клетки во время развития ВПСП могут быть представлены с помощью эквивалентной схемы,'отражающей
возбуждающей синапс
Рис. 8.3. Эквивалентная электрическая схема возбуждающего синаптического входа.
Пояснения в тексте.
возможность увеличения проводимости участков мембраны, контролируемых возбуждающими синапсами. На рис. 8.3 приведена упрощенная электрическая схема мембраны нервной клетки,
23 Общая физиология нервной системы
353
представленная в виде параллельно включенных элементов вне-синаптической и синаптической мембраны. Основные электрические характеристики впесинаптической мембраны представлены сопротивлением (7?м) и емкостью (С\,) мембраны, батареей мембранного потенциала (Е„) и величиной внутреннего продольного сопротивления Синаптически контролируемое сопротивление (Ra) включено последовательно с источником напряжения (Еа) синаптического пути проводимости. Действие возбуждающего медиатора аналогично замыканию ключа, включающего шунт На, в результате чего в цепи течет ток, обусловленный тенденцией мембранного потенциала (Ем) смещаться в сторону Еа. При прочих равных условиях смещение мембранного потенциала должно быть тем больше, чем больше разность между Ея и Е„. Деполяризация мембраны при включении 7?е будет развиваться в случае, если Еа отличается от Ev в сторону меньшей отрицательности, и будет тем больше, чем сильнее сдвинута Еа в сторону положительных значений.
8.1.4. ВЛИЯНИЕ ТРАНСМЕМБРАННОЙ ПОЛЯРИЗАЦИИ. ПОТЕНЦИАЛ РАВНОВЕСИЯ ВПСП
Пропускание через мембрану нервной клетки электрического тока может быть использовано не только для обнаружения изменений проводимости, сопровождающих развитие ВПСП, но и для изучения зависимости между амплитудой ВПСП и величиной мембранного потенциала.
В опытах с введением в мотонейроны спинного мозга кошки двухканальных микро электродов, один из стволов которых использовался для регистрации синаптических реакций, а другой для пропускания поляризующего тока, было показано, что снижение трансмембранной разности потенциалов сопровождается уменьшением амплитуды 1а ВПСП 132]. При смещении мембранного потенциала до примерно +9 мВ происходило извращение ВПСП, который превращался из деполяризационного в гиперполяризационный ответ (рис. 8.4). Данные, приведенные на рис. 8.4, показывают, что 1а ВПСП этого мотонейрона имеет потенциал реверсии, равный приблизительно -]-3—|5 мВ.
Однако указанный результат удалось достигнуть только в небольшой части исследованных клеток. В большинстве случаев, как показали последующие исследования ]16, 44, 71, 90, 93], 1а ВПСП, а также моносинаптические ВПСП, вызываемые активацией быстропроводящих волокон супраспинальных путей, даже при сильной деполяризации уменьшаются почти до нуля, но не извращаются. Поэтому потенциал реверсии (Ev) приходится определять путем экстраполяции. Рис. 8.5, А демонстрирует Ef, определяемые указанным способом в поясничном мотонейроне обезьяны при активации мышечных афферентов группы 1а, рубро-спинальных и кортико-спинальных проекций. Как видно на этом 354
рисунке и как показывают результаты, полученные на других клетках [16], мо носина птических ВПСП оказывается смещенным в сторону положительных значений мембранного потенциала.
Аналогичные результаты были получены и при экстраполяции зависимости между уровнем мембранного потенциала и величиной моносинаптических ВПСП, вызываемых в мотонейронах спинного мозга амфибий при раздражении нисходящих путей и задних корешков [18]. Отсутствие истинной реверсии начальной фазы моносинаптических ВПСП может свидетельствовать об электрическом меха
низме передачи в части активированных синапсов.
Трудности, связанные с прямым определением Лвпсп> обусловлены тем, что его положительные значения требуют очень интенсивной трансмембранной деполяризации и соответственно пропускания токов очень большой интенсивности. Так, при смещении мембранного потенциала в сторону Квпсп в мотонейронах кошки или обезьяны требуются токи порядка 120—200 пА. При пропускании через клетку токов большой интенсивности могут наблюдаться искажения, связанные с нелинейным поведением внесинаптической мембраны (задержанное выпрямление).
Ито и Ошима [61 ] в опытах на мотонейронах кошки отметили, что сопротивление мембраны может заметно уменьшаться под действием сильной деполяризации. Наличие задержанного выпрямления в мембране мотонейронов кошки обнаружено также Араки и Терзуоло [21], которые иссле-
+ 3
Рис. 8.4. 1а ВПСП яри различных уровнях мембранного потенциала (указан на записях в мВ) [31],
довали вольт-амперные характери-
стики в режиме фиксированного потенциала. Однако Кумбс и соавт. [30, 32] в большей части исследованных мотонейронов кошки наблюдали линейный характер вольт-амперных характеристик.
Измерения вольт-амперных характеристик в мотонейронах обезьяны также показали линейную зависимость сдвигов потенциала от силы пропускаемого тока [16], правда, при ограниченной интенсивности деполяризации. В последней работе с целью уменьшения влияния задержанного выпрямления внутрь мотонейронов
Рис. 8.5. Зависимость между уровнем мембранного потенциала и амплитудой ВПСП различных моносинаптических входов.
А — 1а ВПСП (кружки), портико-мотонейронные ВПСП (квадраты), рубро-мотоней-ровные ВПСП (треугольники); Б — то же, но после внутриклеточной инъекции ТЭА. Отведение от мотонейрона обезьяны [161; В — зависимость между амплитудой ВПСП и уровнем мембранного потенциала, прерывистая линия проведена через линейный отрезок кривой.
инъецировались ионы тетраэтиламмония, после чего чувстви-тельность ВПСП к пропусканию деполяризующего тока заметно возрастала (рис. 8.5, Б). Однако и в этом случае не удавалось добиться извращения восходящей фазы ВПСП.
При гиперполяризации мотонейронов млекопитающих ожидаемого возрастания амплитуды моносинаптических ВПСП вообще не наблюдалось (см. рис. 8.4 и 5). В сущности кривая, отражающая зависимость амплитуды ВПСП от уровня мембранного потенциала, имеет линейный характер только на определенном отрезке значе
ний мембранного потенциала (рис. 8.5, 5), и экстраполяция именно этого отрезка зависимости позволяет определить Ер. В то же время продолжение этой липни в сторону большей внутренней отрицательности мембраны не соответствует экспериментальным результатам. Это расхождение можно объяснить исходя из предположения о наличии выпрямления во внесинаптических зонах мембраны в результате динамического уменьшения сопротивления при гиперполяризации (задержанное выпрямление). Однако указанная интерпретация эффектов трансмембранной поляризации в мотонейронах млекопитающих также встречается с трудностями, обус-
Рис. 8.6. Схема, объясняющая нелинейное поведение ВПСЩпри смещении мембранного потенциала [46].
ловленными линейным характером вольт-амперных характеристик [30]. Учитывая, что ТПСП (см. ниже) в тех же клетках обнаруживают закономерные изменения при гиперполяризации, можно предположить, что значительная часть возбуждающих синапсов располагается на дендритах, мембрана которых обладает выпрямляющими свойствами.
Если предположить, что мембрана сомы клетки также ведет себя нелинейно, но выпрямляет в противоположном направлении, чем дендриты, так что ее динамическое сопротивление увеличивается при гиперполяризации, то это может объяснить отсутствие изменений амплитуды ВПСП при сохранении линейной вольт-амперной характеристики во время пропускания через клетку гиперполяризующего тока (рис. 8.6).
Следует подчеркнуть, что и другие особенности влияния трансмембранной поляризации на ВПСП могут в значительной степени зависеть от дендритной локализации соответствующих синапсов. Поскольку пропускание поляризующего тока должно вызывать тем меньший сдвиг мембранного потенциала, чем дальше от сомы клетки (куда вводятся обычно микроэлектроды) расположена область синаптического входа, то потенциал реверсии ВПСП, определяемый с помощью экстраполяции, будет тем более отличаться от истинного г'впсп в месте синаптического входа [28].
Учитывая это обстоятельство, а также трудности, связанные с пропусканием токов большой интенсивности как через клетку, так и через микроэлектрод, можно рассчитать £Впсп> используя представления об эквивалентной электрической схеме мембраны нервной клетки [92],
ЛВПСП — ----55---55--- > W
где 7?м — сопротивление мембраны в покое, Rtjj — эффективное сопротивление во время ВПСП, Е* — мембранный потенциал покоя, V— мембранный потенциал во время ВПСП (£м—Увпсп)-Указанная зависимость, вытекающая из эквивалентной схемы рис. 8.3, если пренебречь емкостью мембраны (что можно сделать в случае пропускания постоянного тока), хотя и не устраняет возможные неточности, связанные с дистальной локализацией синапсов, но позволяет определить все необходимые значения £впшь используя пропускание через нервную клетку токов небольшой интенсивности.
Анализ уравнения (2) показывает, что 7?м—Rej,j, представляет собой ДЯ, специально измеренные в мотонейронах обезьяны (см. выше). Таким образом, чем меньше Дй, тем больше £висп сдвинут в сторону положительных значений, и наоборот. Численные значения ДЙ, полученные в эксперименте (16 ], хорошо согласуются с положительными значениями ВПСП, определяемыми в тех же клетках путем экстраполяции.
8.1.5. ИОННЫЕ МЕХАНИЗМЫ ГЕНЕРАЦИИ ВПСП
Увеличение проводимости, обнаруживаемое в нервной клетке во время развития ВПСП, предполагает, что химический медиатор, вступающий в реакцию со специфическими рецепторами постсинаптической мембраны, открывает пути, по которым через мембрану проводятся ионы, находящиеся в окружающей среде и нейроплазме. Зависимость между амплитудой ВПСП и величиной мембранного потенциала показывает, что проникновение ионов через мембрану обусловлено процессами пассивной диффузии, зависящей от трансмембранной разности потенциалов.
К ионам, которые находятся в достаточно высокой концентрации снаружи или внутри нервной клетки, чтобы вносить существенный вклад в ионую проводимость, относятся натрий, калий и хлор. Равновесный потенциал для каждого из них Ех (т. е. уровень мембранного потенциала, нри котором направленные наружу и внутрь пассивные потоки сбалансированы) определяется уравнением Нернста [79]:
где х обозначает сорт иона, Zx— его валентность, [z]t. — внутренняя, [х]0 — наружная концентрации, R — газовая постоянная, Т — абсолютная температура, F — число Фарадея. Для более точных расчетов вместо концентрации должны использоваться термодинамические активности ионов.
I Учитывая, что точные концентрации (а тем более активности) ионов внутри нервных клеток млекопитающих неизвестны, Ех для каждого определенного сорта ионов может быть рассчитан только приблизительно. По расчетам Экклса [38] Ек, Eci и £ца в мотонейронах кошки составляют —90, —70 и +60 мВ соответственно. По данным рентгеноспектрального микроанализа внутриклеточная концентрация калия в яейроплазме мотонейронов амфибий составляет 60—80 мМ fl ]. Учитывая, что в нормальном растворе Рингера, используемом для перфузии спинного мозга лягушки, содержится 2 мМ калия, величина Ек в этих клетках составляет около —90 мВ, что близко совпадает со значением, полученным по измерениям равновесного потенциала следовой гиперполяризации после антидромного потенциала действия [1, 75]. £+а в мотонейронах лягушки может быть рассчитан на основании измерений величины превышения потенциала действия над потенциалом покоя и может быть принят равным +50—[-60 мВ [12]. Eqi, учитывая результаты рентгеносцектрального микроанализа нейроплаамы мотонейронов лягушки и содержания хлора в экстраклеточной среде, может быть принят равным —504—60 мВ. Исходя из того, что средняя величина мембранного потенциала покоя в мотонейронах лягушки составляет —65 мВ [1, 12], ан мотонейронах кошки принимается равной —70 мВ [38], можно заключить, что, в отличие от мышечного волокна позвоночных, Е& нейронов центральной нервной системы значительно сдвинут в сторону отрицательных значений по отношению к величине мембранного потенциала, что может быть обусловлено работой калиево-натриевого насоса. Последнее вытекает из термодинамических расчетов Уссинга [89], установившего зависимость между величиной мембранного потенциала (Ея) и потенциала равновесия для данного иона (Ех)
р р FT 1П (ж) Е" Ех~ ZXF 1 Mt(x) ’
(4)
где Мо (х) — поток, направленный наружу, a Mt {х) — поток, направленный внутрь.
В случае К +
(5)
где Мк-рит11 — поток, направленный внутрь. Таким образом, именно благодаря существованию насоса £”к имеет величину на 20—25 мВ более отрицательную, чем мембранный потенциал покоя. Можно также предполагать в нейронах позвоночных существование хлорного насоса.
По аналогии с Ех для различных ионов £впсп может быть определен как уровень мембранного потенциала, при котором ионные токи, текущие через активированную возбуждающим медиатором постсинаптическую мембрану и направленные внутрь и из клетки, полностью сбалансированы. Положительные или близкие к 0 значения ВПСП в мотонейронах позвоночных позволяют предполагать, что активация постсинаптической мембраны возбуждающим медиатором вызывает повышение проницаемости преимущественно к ионам натрия, в то время как другие ионы, имеющиеся в больших концентрациях в экстраклеточной среде (ионы СГ) или в нейроплазме (ионы К+), не принимают существенного участия в качестве переносчиков постсинаптического тока.
Действительно, внутриклеточная инъекция в мотонейроны кошки ионов К.+ или С1~ не оказывала существенного влияния на 1а ВПСП [32 ]. Однако ввиду высокой внутриклеточной концентрации ионов К+ и значительной исходной проницаемости кК+ вне-синаптической мембраны возбудимых клеток, лежащих в основе поддержания мембранного потенциала, трудно добиться с помощью внутриклеточной инъекции ионов К+ значительного перераспределения содержания этих ионов в клетке. Поэтому для выяснения ионных механизмов генерации ВПСП важно иметь возможность модифицировать экстраклеточную среду. В центральной нервной системе млекопитающих такую модификацию осуществить очень трудно. В тоже время изменения ионного состава окружающей нервные клетки среды могут быть эффективно осуществлены с помощью перфузии различными растворами мозга низших позвоночных или беспозвоночных животных. Это позволяет экспериментально определить 2?впсп при замене различных ионов в окружающем нервные клетки растворе.
В опытах на мотонейронах лягушки, в которых для облегчения быстрой диффузии заменяемых растворов использовался изолированный рассеченный продольно препарат продолговато-спинного мозга, было установлено, что 4—5-кратное уменьшение ионов натрия в окружающей среде путем замены их эквивалентным количеством холина или сахарозы заметно сдвигает Евпсп ответов, вызываемых активацией волокон нисходящих путей в сторону потенциала покоя. Указанный эффект недостатка натрия является обратимым (рис. 8.7).
10-кратное уменьшение ионов калия в перфузирующем растворе в большинстве случаев не влияло существенно на 7?впсп- Сдвиги в величине Евпсп отсутствовали также при полном замещении ионов хлора ионами сульфата.
Если активированная возбуждающим медиатором постсинаптическая мембрана нервной клетки ведет себя в соответствии с уравнением Такеучи и Такеучи [87], эмпирически выведенным для описания влияния сдвигов ионной среды на 7?р активированной медиатором концевой пластинки мышечного волокна позвоночных, то опыты с заменой иоцов натрия, калия и хлора в окружающей
Мотонейроны среде свидетельствуют о том, Что дейоляризйЩия во время генерации ВПСП обусловлена почти исключительно возрастанием натриевой проводимости (<?иа) постсинаптической мембраны. Следует, однако, отметить, что свойства активированных медиатором ионных каналов концевой пластинки мышечного волокна лягушки могут существенно отличаться от свойств ионных
Рас. 8.7. Влияние изменения наружной концентрации ионов натрия на потенциал реверсии ВПСП в мотонейроне изолированного спинного мозга [18].
По оси абсцисс — мембранный потенциал; по оси орбинатп — амплитуда ВПСП. I — в нормальном физиологическом растворе, II — в растворе с 5-кратным уменьшением концентрации иоиов натрия, III — восстановление в нормальном физиологическом растворе. Стрелками указаны значения потенциала покоя.
каналов постсинаптической мембраны мышечных волокон других животных и тем более от нейронов центральной нервно й| системы.
Как известно, ионная ^проводимость различных возбудимых мембран зависит не только от их проницаемости к определенным ионам, но и от~концентрации и распределения последних по обе стороны мембраны [65]. Уравнение Такеучи и Такеучи основано на допущении, что соотношение изменений натриевой и калиевой проводимости ((?на/^к) остается постоянным при изменении наружной концентрации ионов натрия или калия в окружающей среде. Можно, однако, ожидать, что изменения наружной концентрации натрия или калия будут влиять на проводимость мембраны, не влияя при этом на ее проницаемость для этих ионов. В таком случае изменения £впсп при изменении наружных концентраций
ионов будут определяться не уравнением Такеучи и Такеучи, а Гольдмана [54] и Ходжкина—Катца [56]
J7 __ RT 1 K° + PNa/?K • Na0 Лвпсп — р 1п К. + PNa/PK • Na{ •
(6)
Согласно этому уравнению изменения наружной концентрации ионов натрия (или хлора, если бы последний являлся переносчиком постсинаптического тока) должны вызывать значительные сдвиги равновесного потенциала ВПСП, что и наблюдалось в экспериментах на мотонейронах амфибий при уменьшении концентрации ионов натрия в окружающем растворе [18], в то время как изменения наружной концентрации калия не должны существенно влиять на потенциал равновесия ВПСП- Поэтому отсутствие заметных сдвигов величины £Впсп, наблюдаемое при десятикратном уменьшении концентрации ионов калия в среде, перфузирующей изолированный спинной мозг лягушки, может быть объяснено не только отсутствием повышения калиевой проводимости во время генерации ВПСП, но и тем, что активированная возбуждающим медиатором постсинаптическая мембрана нервной клетки ведет себя в соответствии с уравнением Гольдмана—Ходжкина—Катца, а не Такеучи и Такеучи, как в случае концевой пластинки.
Таким образом, имеющиеся данные не позволяют окончательно решить вопрос о том, связана ли генерация ВПСП в мотонейронах позвоночных с одновременным увеличением натриевой и калиевой проводимости или только с избирательным повышением проницаемости к ионам натрия. Следует отметить, что избирательное увеличение натриевой проводимости логически привело бы к относительному увеличению эффективности возбуждающих синапсов ввиду положительной величины Как следует из эквивалентной схемы (рис. 8.3), в этом случае активированная возбуждающим медиатором постсинаптическая мембрана должна более эффективно деполяризовать нервную клетку, тогда как параллельное открытие калиевых каналов будет уменьшать возбуждающий эффект как вследствие сдвига £ВПсп в сторону потенциала покоя, так и в результате увеличения шунтирующего эффекта. Поэтому при избирательном включении натриевой проводимости число открытых натриевых каналов должно быть значительно меньшим, чем при одновременном увеличении натриевой и калиевой проводимости-Последнее обстоятельство может иметь существенное значение при ограниченной площади синаптических контактов.
Некоторые свойства ВПСП, как например отсутствие шунтирования потенциала действия, линейная суммация эффектов при сочетанной активации нескольких синаптических входов [12], согласуются с предположением о преимущественной роли натриевой проводимости в генерации ВПСП в мотонейронах позвоночных.
Исследования, проведенные на нейронах центральной нервной системы моллюсков [25, 51], также показывают суще
ствование возбуждающих синапсов, ионные механизмы которых основаны на избирательном повышении натриевой проводимости постсинаптической мембраны.
Деполяризация нервной клетки может быть достигнута не только за счет увеличения проницаемости ее мембраны к ионам натрия, но и при уменьшении проницаемости к ионам калия. Этот механизм, правда, гораздо реже обнаруживается при генерации ВПСП. Так, в нейронах центральной нервной системы моллюсков показана возможность развития постсинаптической деполяризации в результате избирательного снижения калиевой проводимости [51].
Таким образом, генерация ВПСП может развиваться в результате открытия или закрытия ионных каналов постсинаптической мембраны. Ионные механизмы генерации ВПСП связаны с работой каналов, по которым движутся катионы, в то время как анионы не принимают участия в генерации ВПСП (за исключением редких случаев существования сильно сдвинутого в сторону положительных значений £ci)- Это важное свойство постсинаптической мембраны возбуждающих синапсов может быть связано с наличием анионных группировок в стенках ионных путей, активируемых возбуждающим медиатором.
8.1.6. ПРЕДПОЛАГАЕМЫЕ МЕДИАТОРЫ СИНАПТИЧЕСКОГО ВОЗБУЖДЕНИЯ И ИХ ДЕЙСТВИЕ НА ПОСТСИИАПТИЧЕСКУЮ МЕМБРАНУ
Несмотря на широкое распространение химического механизма передачи в центральной нервной системе позвоночных и беспозвоночных животных, лишь в крайне ограниченном числе центральных синапсов удалось с достаточной степенью достоверности выявить вещества, являющиеся медиаторами синаптического возбуждения. Совокупность критериев, необходимая для безупречной идентификации медиатора в каждом конкретном синаптическом приборе, в настоящее время Достаточно хорошо известна [39, 921. Главным из них несомненно является установление факта, что приход потенциала действия в пресинаптическое окончание вызывает освобождение данного химического агента, который к тому же выделяется в достаточном количестве, чтобы вызвать постсипаптический эффект, аналогичный ВПСП. Очень важное значение имеет также установление качественного сходства между эффектами микроаппликации таких предполагаемых медиаторов и явлениями, развивающимися в постсинаптической мембране во время развития ВПСП (см. гл. 6).
В настоящее время выявлено несколько химических агентов, которые содержатся в тканях различных участков мозга, выделяются при раздражении мозга и в то же время обладают специфическим возбуждающим действием на нервные клетки. К ним относятся ацетилхолин, дикарбоксильцые аминокислоты (ц в церрую
очередь глутамат), моноамины (катехоламины и серотонин), полипептиды (группа субстанции Р) и некоторые другие соединения.
Роль ацетилхолина как медиатора синаптического возбуждения в центральной нервной системе позвоночных оказалась значительно более ограниченной, чем это прежде предполагалось. Так, установлено, что он не может быть медиатором возбуждения в синапсах мотонейронов млекопитающих [39]. В то же время пе вызывает сомнения участие ацетилхолина в передаче возбуждения с возвратных коллатералей моторных аксонов на клетки Реншоу [39], где он, по-видимому, способен активировать как пикотино-, так и мускариночувствительные рецепторы постсинаптической мембраны.
Холинергическая передача, по-видимому, существует и в некоторых других звеньях интраспинальных путей, о чем говорят результаты опытов с дендротоксинами — полипептидами, избирательно блокирующими холинорецепторы в спинном мозге лягушки [78], а также в коре больших полушарий и хвостатом ядре млекопитающих [68]. Ацетилхолин является также возбуждающим медиатором во многих синапсах мозга беспозвоночных [50].
Глутамат — наиболее представленная в центральной нервной системе позвоночных аминокислота. В спинном мозге оп сконцентрирован преимущественно в области входа дорсальных корешков, что послужило основанием для предположения, что глутамат является медиатором в синапсах, образуемых окончаниями первичных афферентов [52]. Систематические микроионофорети-ческие исследования показали, что он возбуждает как нейроны спинного мозга, так и кортикальные, стволовые и мозжечковые нейроны [34, 68].
Серотонин обнаруживается в мозге позвоночных и моллюсков. Наиболее типична его локализация в срединных отделах ствола мозга и спинного мозга, причем показано, что он содержится в синаптических пузырьках [68].
Недавно было установлено, что субстанция Р и близкие к ней полипептиды содержатся в спинном и головном мозге и оказывают возбуждающее действие на различные спинальные и церебральные нейроны [55, 69, 80], В спинном мозге кошки полипептиды группы субстанции Р находятся главным образом в дорсальной части дорсального рога. Ее количество после перерезки дорсальных корешков резко уменьшается. Высказано предположение, что субстанция Р может быть возбуждающим медиатором первичных афферентов.
Исследования механизмов действия предполагаемых медиаторов на постсияаптическую мембрану проведено пока еще на ограниченном числе нервных клеток.
Действия глутамата изучалось главным образом на нейронах позвоночных. Установлено, что микроаппликация глутамата вызывает деполяризацию мотонейронов кошки, причем этот эффект 334
ие сопровождается существенным увеличением проводимости [45]. В опытах на клетках культуры ткани спинного мозга показано, что деполяризующее действие глутамата резко уменьшается при удалении ионов натрия из окружающего клетки раствора [57].
В опытах на изолированном спинном мозге амфибий было показано, что деполяризация, вызываемая микроаппликацией глута-
мата, сопровождается незначительным снижением входного сопротивления мотонейронов, но в некоторых клетках наблюдается увеличение входного сопротивления, а потенциал равновесия глутаматного потенциала находится в области нулевых значений мембранного потенциала (рис. 8.8). Однако получить истинную реверсию глутаматных ответов обычно не удается. Таким образом, действие глутамата на постсинаптическую мембрану мотонейронов обладает определенным сходством с действием медиатора, освобождаемого первичными афферентами или волокнами нисходящих путей. Это ставит вопрос об участии глутамата в синаптической передаче возбуждения на мотонейроны и другие нервные клетки центральной нервной системы.
Мембранные эффекты ацетилхолина и серотонина были иссле-
мВ I
+ 15 «Г
-20
Рис. 8.8. Деполяризация, вызываемая Микроаппликацией глутамата к мото нейрону изолированного спинного мозга лягушки, при разных уровнях мембранного потенциала.
ЮмВ
дованы главным образом иа нейронах моллюсков. Микроапплика-ция ацетилхолина или серотонина через микроэлектрод, подведенный к соме нейронов моллюсков, показала, что эти вещества могут вызывать деполяризацию как за счет преимущественного увеличения натриевой проводимости постсинаптической мембраны [25, 51], так и в результате угнетения калиевой проводимости [51 ]. Действие указанных веществ оказалось идентичным действию естественных медиаторов возбуждающих синаптических влияний и изученных на тех же самых нейронах.
Таким образом, ионные механизмы действия предполагаемых медиаторов синаптического возбуждения достаточно близко совпадают с эффектами, наблюдаемыми во время генерации ВПСП*
8.1.7. РАСПРЕДЕЛЕНИЕ ВОЗБУЖДАЮЩИХ ВХОДОВ И ИХ ВЗАИМОДЕЙСТВИЕ
Сравнение ВПСП, возникающих в результате активации различных синаптических входов нервной клетки, показывает, что они имеют неодинаковое временное течение. Так, в мотонейронах кошки ВПСП, вызываемые вестибуло-спинальными или ретикуло-спинальными импульсами, нередко быстрее достигают вершины, чем 1а ВПСП. Еще более явные, статистически достоверные различия наблюдаются между временными параметрами ВПСП, возникающими в мотонейронах макаки резус при активации мышечных афферентов группы 1а, ство-’ лово-спинальных и кортико-спи-нальпых путей [16, 17].
Распределение временинараста-—----ния восходящей фазы кортико-
мотонейронных, рубро-мотонейрон-ных и 1а ВПСП у макаки резус свидетельствует о преобладании быстрых ответов при активации
5
Рис, 8.9. Взаимодействие рубро- и кортико-мотонейронных ВПСП в поясничном мотонейроне обезьяны [12].
1 — усредненные рубро-мотоясйронные ВПСП;
3 — усредненные нортико-мотонсйронные ВПСП; — их алгебраическая сумма; 4 — результат суммации в мотонейроне; 5 — разница между 3 и 4. Калибровочный импульс — 1 мВ (удвоен на 3), 1 мс.
рубрального и афферентного входа и медленных реакций при активации кортикального входа. Указанные различия могут быть обусловлены неодинаковым пространственным расположением соответствующих синапсов на поверхности мотонейрона. Об этом же говорят исследования на хроматолизированных клетках [131 и данные об организации нисходящих и ; афферентных проекций [73, 86].
Поскольку генерация ВПСП связана с повышением проводимости постсинаптической мембраны, можно ожидать, что в случае пространственной близости активированных входов соответствующие ВПСП будут суммироваться нелинейно в результате взаимного шунтирования. Наоборот, цри значительном пространственном разделении взаимодействующих входов суммация должна имет^ 36^
характер тем более приближающийся к линейному, чем больше электротоническое расстояние между активированными синапсами.
Взаимодействие моносинаптических ВПСП, возникающих в мотонейронах кошки при раздражении различных мышечных нервов, показывает, что суммация может развиваться как линейно, так и нелинейно [27]. Нелинейность суммации выражается в том, что суммарный ответ достигает меньшей амплитуды, чем та, которая должна бы быть при алгебраическом сложении отдельных ответов, усредненных на ЭВМ.
Суммация усредненных моносинаптических ВПСП, вызываемых в мотонейронах кошки ретикуло-спинальиыми и афферентными импульсами, показывает, что в большинстве случаев деполяризация, создаваемая каждым входом, суммируется линейно [9].
Наконец, только линейная суммация наблюдалась при взаимодействии рубро- и кортико-мотонейронных ВПСП, различия между временным течением которых были наиболее существенны (рис. 8.9). Эти результаты позволяют предполагать значительное пространственное разделение различных возбуждающих входов, которые могут быть локализованы на различных дендритах нервной клетки. Такая организация возбуждающих синаптических входов, вероятно, функционально оправданна, так как создает условия для максимального взаимного облегчения конвергирующих воздействий и уменьшает возможность взаимного ослабления за счет шунтирования.
8.1.8. КОРРЕЛЯЦИЯ МЕЖДУ ЭКСПЕРИМЕНТАЛЬНЫМИ ДАННЫМИ И МОДЕЛЬНЫМИ ПРЕДСТАВЛЕНИЯМИ
Трудности, связанные с экспериментальным анализом механизмов передачи возбуждения в межнейронных синапсах, обусловлены многими факторами, среди которых особенно важен геометрический, связанный со спецификой распределения возбуждающих входов на соме и дендритах нервной клетки. В принципе один и тот же эффект, характеризующий функциональные особенности синаптического возбуждения, может быть достигнут за счет неодинаковой локализации синапсов или вследствие различных изменений ионной проницаемости постсинаптической мембраны под действием химического медиатора или разной кинетикой ионной проводимости во время ВПСП.
Ввиду недостаточной точности имеющихся сведений о пространственной организации синаптических возбуждающих входов и об ионных механизмах генерации ВПСП большое значение приобретает анализ свойств ВПСП на различных моделях.
В абстрактной математической модели Релла [82 ] весь нейрон, приведенный к эквивалентному цилиндру, подразделяется на ячейки, расположенные на различном электротоническом расстоянии
от центра (сомы клетки). Основное значение придается зависимости свойств ВПСП от электротонического расстояния синаптического входа от сомы нейрона, причем принимается равномерное распределение 1а-синапсов по всем дендритам, а механизм генерации ВПСП и свойства мембраны в каждом звене модели рассматриваются как идентичные. Главным следствием, вытекающим из анализа ВПСП на модели Релла, является строгая зависимость формы ВПСП и его чувствительности к трансмембранной поляризации от удаленности соответствующего синаптического входа от сомы клетки. Однако указанная зависимость не была обнаружена в эксперименте [16, 93].
Хотя модель Релла более точно отражает явления, происходящие в нервной клетке в результате синаптического возбуждения, чем эквивалентная схема точечного синаптического входа (рис. 8.3), разделение всей мембраны на отдельные ячейки отражает лишь самый приближенный характер зависимости свойств ВПСП от локализации синапсов. Эта зависимость, кроме того, выражена в единицах константы длины (X) и постоянной времени мембраны (т), которые не всегда сопоставимы с пространственными размерами клетки и ее дендритных отростков. Более того, константа длины фигурирует в модели Релла не в применении к отдельным дендритам, а для эквивалентного цилиндра, аппроксимирующего весь абстрактный нейрон. Поэтому каждая ячейка модели объединяет синапсы, расположенные на всех дендритах на данном электро-тоническом расстоянии от сомы. В приложении к реальному мотонейрону локализация такой ячейки довольно неопределенна, так как электротоническое расстояние зависит как от линейного расстояния, так и от толщины каждого дендрита и степени его ветвления, а синаптический вход не обязательно распределен на нескольких или тем более всех дендритах, а может быть сосредоточен только на одном из них, причем на определенном расстоянии от сомы. Число ветвей и соответственно количество синапсов, соответствующих одной ячейке на модели Релла, растет в геометрической прогрессии к периферии, и, следовательно, ячейки неравноценны. Поэтому модель Релла не позволяет рассмотреть входы, сосредоточенные на одном или ограниченном числе дендритов, и количественно оценить характеристики постсинаптического потенциала, возникающего в конкретной точке, на определенном расстоянии от сомы клетки. Кроме того, эта модель не может точно отражать свойства реального мотонейрона в связи с принятыми в ней многочисленными допущениями и упрощениями.
Более приближенной к реальным условиям является аналоговая модель нервной клетки, построенная на основании измерения электрических параметров конкретного мотонейрона и реконструкции его структуры после прижизненного окрашивания про-ционовыми красителями [8, 23]. Указанный подход позволяет сопоставить условия генерации ВПСП на различных линейных расстояниях от сомы клетки при регистрации в соме с помощью ими-368
тации ВПСП кратковременным включением шунта в любой точке аналоговой модели (рис. 8.10).
Исследование зависимости амплитуды и временного течения ВПСП от локализации входа на модели мотонейрона обезьяны показывает, что по мере удаления входа от сомы амплитуда ВПСП закономерно уменьшается, а время нарастания увеличивается (с 0.7 до 3 мс на расстоянии 400 мкм при длительности включения шунта 0.5 мс). Кроме того, увеличивается латентный период начала ВПСП. Задержка достигает 1 мс, когда вход локализован на расстоянии 400—500 мкм от сомы.
Важно подчеркнуть, что сравнение искусственных ВПСП, возникающих на одном и том же расстоянии от сомы, но на разных дендритах, свидетельствует о том, что время нарастания ВПСП может различаться в 1.5—2 раза, а амплитуда в 3 раза (рис. 8.10, Д) Фактором, способствующим увеличению скорости нарастания ВПСП,является большой диаметр и меньшее ветвление дендритов. Самые существенные различия между параметрами ВПСП, возникающих на равно удаленных от сомы точках, но на разных дендритах, наблюдались на расстоянии 100—250 мкм. Эти результаты показывают, что в случае неравномерного распределения синапсов по дендритам ВПСП с более крутым фронтом нарастания могут возникать дальше от сомы клетки, чем ВПСП, локализованные проксимальнее, но на тонких, сильно разветвленных дендритах.
При сравнении искусственных ВПСП, вызываемых включением шунта на 0.1 и 0.5 мс, было отмечено, что время шунтирования существенно влияет на передний фронт потенциала только при небольших расстояниях (50—100 мкм) входа от сомы. Следовательно, при дистальной локализации синаптического входа время нарастания ВПСП в большей степени зависит от электротонического расстояния и кабельной емкости дендритов, чем от времени изменения проводимости в активированной точке. Указанные результаты согласуются с расчетами Релла [821 и Джека и Редмана [62], полученными на математической модели нейрона, аппроксимированного эвивалентным цилиндром.
По данным, полученным на аналоговой модели, взаимодействие двух ВПСП, вызываемых кратковременным повышением проводимости в'разных точках мембраны, приводит к линейной суммации, когда расстояние между входами не превышает 200 мкм, независимо от величины шунта. Наибольшее приближение к линейной сумме достигается, если входы локализованы на разных дендритах, что согласуется с выводами, сделанными на основании исследования взаимодействия различных синаптических входов в реальных мотонейронах [9].
Аналоговая модель дает также возможность исследовать влияние трансмембранной поляризации на искусственные ВПСП, возникающие в любой точке мембраны. Модельные опыты свидетельствуют о том, что как деполяризация, так и гиперполяризация в одинаковой степени влияют на амплитуду искусственных
24 ООщач физиология нервной системы 369
Рис. 8.10. Структура (Л), локализация (Б) и аналоговая модель мотонейрона обезьяны (В), временное течение искусственных ВПСП, вызываемых в различных точках модели (Г, Д) (8].
ВПСП, что значительно отличается от результатов, полученных на живых клетках [16, 44, 85]. По-видимому, эти различия могут быть обусловлены наличием выпрямляющих свойств у разных участков мембраны (см. рис, 8-6), которые не вводились в аналоговую модель. Эффект трансмембранной поляризации очень сильно зависит от расстояния входа от тела клетки. Так, при локализации входа на дендрите на расстоянии 50 мкм от сомы амплитуда ВПСП изменяется на 40% на фоне поляризующего тока 30 нА. При этом ДЯ=5кОм. По мере удаления активируемого входа от сомы чувствительность к поляризующему току прогрессивно уменьшается. При расстоянии входа 300 мкм от тела ток 30 нА изменяет амплитуду ВПСП всего на 13%. При расстоянии свыше 400 мкм изменения амплитуды ВПСП практически неразличимы. При фиксированном расстоянии в пределах 50—300 мкм от сомы деполяризующий ток не только уменьшает амплитуду ВПСП, но и вызывает его реверсию, причем реверсированный ответ является зеркальным отображением ответа при нормальном мембранном потенциале. Величина тока реверсии возрастает по мере удаления входа от тела, что находится в полном соответствии с математическими расчетами [28, 82].
Для удобства измерений на аналогов ой модели можно использовать прием искусственного выключения мембранного потенциала. В этом случае без приложения поляризующего тока амплитуда ВПСП равна нулю. На фоне пропускания можно регистрировать исключительно приращения амплитуды связанные с трансмембранной поляризацией [8]. Полученные таким образом потенциалы по своей форме не отличаются от искусственных ВПСП, что и следует ожидать, исходя из теории линейных цепей, согласно которой результат не зависит от того, каким образом создается управляемый потенциал на мембране. Величина и форма изменений потенциала, регистрируемых в соме, зависит от расстояния активируемого входа от сомы, толщины и ветвления дендритов в такой же степени, что и сам ВПСП, и уменьшается по мере удаления входа от сомы за счет электротонического затухания. Как известно, затухание в 7 раз [2, 71] происходит на расстоянии 7л. Количественно такие же результаты получаются на модели.
В итоге на аналоговой модели мотонейрона обнаруживается четкая корреляция между временем нарастания ВПСП и чувствительностью их к поляризации — в отличие от результатов, полу-ных на живых клетках [16, 90]. Можно, таким образом, предполагать, что даже полного геометрического соответствия с конкретным мотонейроном и данных о его входных характеристиках недостаточно для полной имитации всех свойств синаптических входов и различных участков мембраны мотонейрона. Кроме того, данные, полученные на модели, позволяют предполагать, что в реальных клетках механизм передачи в разных синапсах может быть различен. : Тем не менее, учитывая значительное сходство реальных if Искусственных ]ВПСП, мощно предполагать, что последние имити-
руют многие важные свойства реальных синаптических реакций. Сравнение времени нарастания ВПСП, получаемых в живых клетках при активации различных моносинаптических входов — из моторной коры, ядер ствола мозга или волокон группы 1а,— с модельными ВПСП дает основания допустить, что синапсы, образуемые кортико-спинальными волокнами, располагаются на расстоянии 50—250 мкм от тела клеток (максимальная плотность 150 мкм), рубро-спинальными — 50—150 мкм от сомы, с максимумом плотности на 100 мкм. Определение локализации мотонейронов, окрашенных проционовым желтым (рис. 8.10, Б), и сопоставление ее с местами окончания нисходящих волокон [73] пе противоречит такому допущению. 4
Если сравнить результаты, полученные в эксперименте и на модели с точки зрения чувствительности ВПСП к изменению трансмембранной разности потенциалов и величины изменений проводимости Д7?/7 во время ВПСП, то и в этом случае максимум плотности синапсов входа моторной коры оказывается на расстоянии 50—100 мкм от тела мотонейрона, а входа из красного ядра и афферентов группы 1а — на расстоянии 100—150 мкм.
Измерение электротонической длины IX дендрита мотонейрона обезьяны (рис. 8.10) показывает, что в целом этот дендрит, распространяющийся на расстояние 400 мкм, имеет электротоническую длину, соответствующую 1.3 А. Его начальный участок протяженностью 220 мкм имеет электротоническую длину 0.5 X. Эти цифры не противоречат расчетам Релла [82] и Джека и Редмана [62], которые были основаны на аппроксимациии всей совокупности дендритов мотонейрона одним эквивалентным цилиндром.
Измерение величины затухания искусственных ВПСП, регистрируемых в соме, показывает, что при удалении входа от сомы на расстояние 400 мкм амплитуда быстрого ВПСП очень сильно уменьшается. Затухание постоянных сдвигов потенциала, распространяющихся из сомы на дендрит, происходит всего в 3.5 раза в точке, удаленной на 400 мкм от сомы, и в 1.6 раза в точке, удаленной на 200 мкм. Столь существенная разница в затухании при распространении к соме и от сомы объясняется тем, что распространение в сому по одному дендриту сильно шунтируется входным сопротивлением остальных дендритов, как бы включенных параллельно соме.
Таким образом, инъецируемый в клетку ток может влиять на дистально расположенные входы, в то время как активация последних должна вызывать незначительные изменения в соме. Для объяснения функциональной значимости дистальных синаптических входов можно предположить, что в реальных клетках существуют какие-то неизвестные до сих пор свойства, — например, что мембрана дендритов имеет большее, чем мембрана сомы, удельное сопротивление, а емкость между внутренней и наружной средой в области дендритов меньше. Не исключено также, что в случае дистальных синапсов основное значение имеет не сдвиг потенциала, а перенос заряда [83].
Можно предположить, что постоянная времени мембраны денд-дритов в действительности существенно меньше той величины, которая была рассчитана на аналоговой модели. Тогда затухание быстрых ВПСП будет значительно меньшим. Янсек и Редман [64] предполагают, что постоянная времени дендритов мотонейронов кошки больше постоянной времени мембраны сомы. Поэтому нельзя исключить того, что в реальных нейронах дендриты обладают свойством значительно лучше проводить сигналы от периферии к соме, чем это вытекает из расчетов на модели.
8.1.9. ГЕНЕРАЦИЯ ПОТЕНЦИАЛОВ ДЕЙСТВИЯ ПОД ВЛИЯНИЕМ ВПСП
Важным показателем эффективности синаптического возбуждения нервной клетки является процесс генерации импульсов под воздействием деполяризации, создаваемой ВПСП. Необходимым условием для генерации разряда является снижение трансмембранной разности потенциалов до определенного критического уровня [38], при котором включается регенеративный процесс, обусловленный открытием потенциалозависимых ионных каналов внесинаптической мембраны.
Условия возникновения потенциала действия в нервной клетке под влиянием синаптического возбуждения значительно отличаются от таковых в нервно-мышечном соединении позвоночных. Это связано с неодинаковой электрической возбудимостью различных участков мембраны нейрона и сложной пространственной организацией возбуждающих синапсов на поверхности нервной клетки.
Анализ данных, полученных при возбуждении мотонейронов кошки синхронным залпом в мышечных афферентах группы 1а, позволил заключить, что потенциал действия возникает в низкопороговой области аксонного холмика или начального сегмента аксона [38], откуда он затем распространяется по аксону и на сома-дендритную мембрану.
Аналогичный механизм был выявлен и в ряде других нервных клеток [39]. По мнению Экклса, указанный способ синаптического возбуждения импульсной активности нейрона очень важен для его интегративной функции. Благодаря низкому порогу возбудимости начального сегмента обеспечивается гораздо большая интеграция всех синаптических влияний, чем это могло бы быть, если бы импульсы генерировались в любом участке на поверхности сома-дендритной мембраны, в любой дендритной ветви. В последнем случае какая-нибудь специальная группа возбуждающих синапсов могла бы, как это предполагал Лоренте де Но [74], вызывать импульсы несмотря на относительную недостаточность всего возбуждающего синаптического притока и даже при наличии тормозных влияний в других зонах мембраны. Примером нарушения интегративной функции, по Экклсу [43], являются функциональные изменения при хроматолизе, когда эффективность возбуждающего
действия синаптических входов перестает зависеть от уровня деполяризации, создаваемой ими в соме нейрона.
Установление факта существования особой триггерной зоны, в которой происходит генерация разряда нервной клетки, поднимает вопрос о функциональной значимости синапсов, расположенных на отдаленных участках дендритов. Этот вопрос особенно важен в связи с данными о том, что плотность синапсов па удаленных от сомы ветвях дендритов не уменьшается и что, таким образом, относительная численность аксо-дендритных контактов очень велика -[4, 49, 88].
Несмотря на то, что результаты исследований на модели предполагают сильное затухание синаптических потенциалов, возникающих вдали от сомы (и, следовательно, триггерной зоны нейрона), можно ожидать, что ВПСП, возникающие при активации синапсов, расположенных на тонких дистальных дендритах, могут создавать в месте своего возникновения значительно более интенсивную деполяризацию, чем синапсы, локализованные, в области сомы и толстых проксимальных дендритов. Такое предположение вытекает из данных о высоком входном сопротивлении тонких дендритных веточек [66]. Из-за этого фактора амплитуда дендритных ВПСП может достигать значительно большей величины, в то время как низкая электрическая возбудимость дендритов будет препятствовать возникновению разряда в области синаптического входа.
Следует также отметить, что в нервной клетке, получающей множество синаптических входов и подвергающейся длительной синаптической бомбардировке, синаптические возбуждающие влияния могут вызывать длительные сдвиги трансмембранной разности потенциалов.
Даже незначительные по амплитуде ВПСП, возникающие при активации индивидуальных синаптических входов или отдельных синапсов, могут достигать критического уровня на фоне деполяризации, создаваемой остальными синаптическими воздействиями, конвергирующими на данной клетке. Линейная зависимость между интенсивностью деполяризации и частотой разрядов нейрона [11, 53] обеспечивают осуществление точной градации между интенсивностью проходящих в клетке возбуждающих синаптических влияний и импульсацией на ее выходе.
8.2. ПОСТСИНАПТИЧЕСКОЕ ТОРМОЖЕНИЕ
8.2.1. ОБЩАЯ ХАРАКТЕРИСТИКА ТПСП И СОЗДАЮЩЕГО ЕГО ПОСТСИНАПТИЧЕСКОГО ТОКА
Медиатор, выделяемый пресинаптическими окончаниями, может таким образом изменять свойства постсинаптической мембраны, что способность клетки генерировать возбуждение будет частично или полностью подавлена. Этот эффект принято обозначать как торможение,
Специфика тормозных синаптических воздействий, вызывающих подавление активностей нейронов центральной нервной системы, была впервые и наиболее подробно изучена на мотонейронах млекопитающих. Исследования, проведенные Экклсом и его сотрудниками [26, 31, 38, 39], показали, что тормозящий эффект, возникающий в мотонейронах мышц-антагонистов при раздражении мышечных афферентов группы 1а сопровождается гиперноля-ризацией нейрона. Такой гиперполяризационный ответ получил название «тормозящий постсинаптический потенциал» (ТПСП) в связи с тем, что местом его возникновения является постсинаптическая мембрана. В дальнейшем было установлено, что постсинаптическое торможение не обязательно сопровождается гиперполяризацией мембраны, так как более важное значение имеет не сдвиг мембранного потенциала, а лежащие в его основе изменения ионной проводимости.
В спинальных мотонейронах возникновение ТПСП в ответ на раздражение мышечных афферентов обязательно связано с включением в тормозной путь дополнительного звена специального вставочного тормозящего нейрона, аксон которого и выделяет медиатор, вызывающий развитие ТПСП в постсипаптической мембране. Кроме тормозящих вставочных нейронов системы 1а, были выделены и другие промежуточные клетки, обладающие такой же функцией, например клетки Реншоу [38], нейроны проприоспи-нальных нисходящих путей [6, 12 ] и др. Ярким примером специализированных тормозящих нейронов являются клетки Пуркинье коры мозжечка, аксоны которых вызывают ТПСП в нейронах латерального вестибулярного ядра и различных ядер мозжеч-ка[ 59].
Так же как и в случае ВПСП, ТПСП могут быть не только вызванными, но и спонтанными[24, 66]. Только часть спонтанно возникающих ТПСП блокируется тетродотоксином в дозах, устраняющих импульсную активность нейронов [29]. Это предполагает, что по механизму возникновения спонтанные миниатюрные ТПСП сходны со спонтанными миниатюрными ВПСП и обусловлены случайным выбросом квантов тормозящего медиатора.
Несмотря на то, что ТПСП обычно исследовались путем активации дисинаптических путей при раздражении периферических нервов, техника интраспинальной микростимуляции обеспечила возможность выделения моносинаптических ТПСП, возникающих в спинальных мотонейронах в результате прямого раздражения промежуточных нейронов [3, 12, 63, 72]. На рис. 8.11, А показаны ТПСП, возникающие в мотонейроне кошки при околодороговом интраспинальном раздражении. Они обусловлены активацией ограниченного числа промежуточных нейронов и приближаются по форме к элементарным потенциалам.
Подлинно элементарные ТПСП вызываются раздражением одиночных промежуточных нейронов через микроэлектрод при параллельном внутриклеточном отведении от мотонейронов [3,
63]. Их амплитуда 8—220 мкВ, т. е. во много раз Меньше максимального ТПСП, и они могут быть зарегистрированы только с помощью компьютера, позволяющего выделять сигнал, амплитуда которого значительно меньше величины фонового синаптического шума.
На рис. 8.12 показан пример элементарного моносинаптического ТПСП, возникающего в поясничном мотонейроне кошки в ответ на раздражение индивидуального проприоспинального нейрона,
Рис. 8.11. Моносинаптические ТПСП, вызываемые в мотонейронах кошки интраспинальной микростимуляцией {72].
А — ответы на околопороговые стимулы; Б — ответы на стимулы возрастающей силы (.1—5); В — изменения, вызываемые аппликацией деполяризующего (1,2) и гиперполяри-зующего (4, 5) тока. Стрелки указывают начало ТПСП.
расположенного на несколько сегментов ростральнее исследуемого мотонейрона. Амплитуда элементарного ТПСП, приведенного на этом рисунке, составляет всего лишь^40^мкВ, синаптическая задержка — 0.3 мс, его форма близка к форме обычного комплексного ТПСП.
На рис. 8.11, Б показан эффект возрастания^амплитуды ТПСП по мере увеличения силы интраспинального раздражения. Временное течение ТПСП мало меняется при увеличении их амплитуды, что предполагает сходную пространственную организацию синапсов, составляющих указанный тормозный вход. Средняя продолжительность восходящей фазы моносинаптических ТПСП составляет около 1.0 мс, время полуспада 1.9 мс, что очень близко к временным параметрам ТПСП, вызываемых в мотонейронах раздражением мышечных афферентов группы 1а [26, 31], 376
1
iMC
Рис. 8.12. Параллельное отведение унитарного моноспиалтического ТПСП мотонейрона и активности проприоспинального вставочного нейрона, образующего тормозной синапс с данным мотонейроном [3J.
I — ответ проприоспинального нейрона на прямое раздражение через екстраклеточпый микрозлектрод; 2 — антидромный ответ проприоспинального нейрона при раздражении вентральной поверхности спинного мозга на уровне седьмого поясничного сегмента; 3 — усредненная на ЭВМ внутриклеточная запись унитарного моносинаитичесиого ТПСП. вызываемого в мотонейроне седьмого поясничного сегмента прямым раздражением про-прпоспииальпого нейрона.
Рис. 8.13. Тормозной постепнаптический ток во время ТПСП [21].
Л — ТПСП, регистрируемый двумя раздельными внутриклеточными микрозлектродами; В — сверху ТПСП, внизу ток в отсутствие фиксации потенциала; В — сверху ТПСП, внизу ток во время фиксации потенциала; Г — ТПСП (Г) и постсинаптический ток (II).
Создающий ТПСП постсинаптический ток должен быть направлен из клетки в активированных медиатором участках постсинаптической мембраны и входить в клетку через остальную поверхность постсинаптической мембраны. Прямая регистрация постсинаптического тормозного тока (рис. 8.13), который протекает через мембрану, находящуюся в режиме фиксированного потенциала, позволила выявить его интенсивность и временное течение [21]. Оказалось, что в случае постсинаптического торможения тормозящий постсинаптический ток достигает вершины еще за 0.5—0.8 мс до вершины ТПСП и затухает примерно через 2 мс. Таким образом, активная фаза тормозного эффекта значительно короче общей продолжительности ТПСП.
8.2.2. ВЛИЯНИЕ ТРАНСМЕМБРАННОЙ ПОЛЯРИЗАЦИИ НА ИЗМЕНЕНИЯ ПРОВОДИМОСТИ ВО ВРЕМЯ ТПСП
В отличие от ВПСП ТПСП обнаруживают очень высокую чувствительность к сдвигам мембранного потенциала, закономерно изменяясь при пропускании через клетку поляризующего тока. На рис. 8.11, В видно, что деполяризующий ток значительно увеличивает амплитуду моносинаптических ТПСП, в то время как гиперполяризующий уменьшает или даже извращает гиперполяризационные ответы. Зависимость между уровнем мембранного потенциала и ТПСП носит линейный характер при пропускании токов в обоих направлениях. Потенциал равновесия ТПСП, Ктпсп в мотонейронах кошки оказался равным —80 мВ (при мембранном потенциале покоя —70 мВ). В мотонейронах амфибий Етнсп составляет —504—-70 мВ [2 ] при мембранном потенциале покоя в среднем —65 мВ.
Высокая чувствительность ТПСП к трансмембранной поляризации предполагает значительное изменение проводимости постсинаптической мембраны во время его развития. Резкое уменьшение входного сопротивления мотонейронов действительно легко выявляется при различных способах определенйя сопротивления мембраны во время ТПСП [12, 14, 15]. В мотонейронах спинного мозга кошки входное сопротивление уменьшается на 400—500 кОм (при исходном сопротивлении порядка 1—2 МОм) во время развития ТПСП с амплитудой в несколько милливольт. Это предполагает, что контролируемые медиатором пути ионной проводимости ностсинаптической мембраны могут в значительной степени шунтировать соседние участки мембраны нервной клетки. Кроме того, значительная зависимость ТПСП от мембранного потенциала предполагает преимущественно соматическую локализацию соответствующих синапсов.
5Учитывая отмеченные выше свойства ТПСП, эффект воздействия тормозного медиатора на постсинаптическую мембрану может быть отображен на эквивалентной электрической схеме рис. 8.14. Поскольку ^тпсп близок или равен мембранному по-378
тенциалу покоя, включение синаптического шунта 7?( не приводит к значительным изменениям Е„ и влияние тормозного входа огра-
Тормомщий
Рис. 8.14. Эквивалентная электрическая схема тормозного синаптического входа.
ничивается главным образом шунтированием внесинаптических участков мембраны. Количественные параметры R, и Es (Етпсп) хорошо согласуются с результатами расчетов по уравнению (2), основанному на такой эквивалентной схеме.
8.2.3. ИОННЫЕ МЕХАНИЗМЫ ГЕНЕРАЦИИ ТПСП
Близость £тпсп к мембранному потенциалу покоя позволяет предполагать, что ионные токи, текущие через постсинаптическую мембрану во время развития ТПСП, обусловлены повышением проницаемости последней к ионам хлора или калия, потенциалы равновесия которых в мотонейронах кошки составляют —70 и —90 мВ соответственно.
Действительно, электрофоретическая инъекция в мотонейроны ионов хлора превращает гиперполяризационный ТПСП в деполяризационный ответ [39]. Этот факт объясняется тем, что во время действия тормозящего медиатора мембрана становится легко проницаемой для ионов хлора, которые движутся вдоль электрохимического градиента. В результате перераспределения ионов хлора между нейроплазмой и наружной средой, создаваемого внутриклеточной инъекцией, 7?ci изменяется таким образом, что больше анионов С1 выходит из клетки, чем входит в нее, что и приводит к превращению гиперполяризационного в деполяризационный ответ.
Записи ТПСП, приведенные на рис. 8.15, показывают, что уже простая диффузия ионов С1~ в клетку из электрода, заполненного хлоридом калия, приводит к извращению ТПСП, который затем
достигает устойчивого состояния. Еще большие изменения ТПСП вызывает электрофоретическая инъекция анионов хлора под влиянием входящего тока. При продолжении пропускания этого тока амплитуда ТПСП увеличивается, в то время как уровень мембранного потенциала несколько падает, достигнув устойчивого состояния, в котором общий выходящий через мембрану поток С1~ уравновешивается инъекцией С1_ через микроэлектрод. После
Рис. 8.15. Влияние инъекции С1" на ТПСП мотонейрона кошки [31]. i
Три верхние записи (справа) показывают ТПСП, зарегистрированные непосредственно после введения микроэлектрода в клетку и через несколько минут после. На графике (слева) — черные кружки показывают зависимость амплитуды ТНСП от МП. Белые кружки от Б до В показывают прогрессивное изменение во время поддерживаемого входящего тока, вызывающего выход хлора из мннроэпектрода. Белые кружки от Г до А указывают на изменение, следующее за прекращением тока.
прекращения пропускания входящего тока происходит немедленное смещение ТПСП и мембранного потенциала (рис. 8.15). Изменения, наблюдаемые при инъекции хлора, показывают, что Лтпсн смещается больше, чем мембранный потенциал покоя. Это предполагает, что изменения проводимости, вызываемые действием тормозящего медиатора, обусловлены главным образом движением ионов хлора, в то время как через внесинаптическую мембрану ток переносится преимущественно ионами калия.
Опыты с электрофоретической инъекцией в мотонейроны кошки других анионов [20, 31, 60] показали, что в зависимости от того, извращают ли инъецированные в нейроплазму анионы подобно хлору знак ТПСП или не влияют на характер последнего, все они могут быть разделены на две группы. На основании сопоставления величины гидратированного радиуса ионов с вызываемым ими
эффектом было сделано заключение, что в основе развития ТПСП лежит повышение проницаемости постсинаптической мембраны ко всем ионам, гидратированный радиус которых не превышает 1.6 радиуса иона калия (рис. 8.16). Аномальное поведение ионов HS- может быть обусловлено их способностью быстро связываться с молекулами белков, находящихся в нейроплазме, а про-
К
Г NO/ 6 V SCN"
HS"
СХо3’ 0тО/ нс о' и
HCOj’ СН2С1СОг' к СН.ВгСО/ £ 6
VV снэсн3сог-сн3(снг\сог-
НРО4 с6н5о7 —
Рис. 8.16. Корреляция между размерами ионов в водном растворе и их способностью извращать ТПСП [20].
Черные -полосы соответствуют размерам анионов, которые эффективно извращают ТПСП, аагитрижованиые - анионам, которые не обладают этой способностью. Сверху обозначены размеры гидратированных ионов калия и натрия.
ницаемость к крупным анионам НСО2 может быть обусловлена эллипсоидной формой последних. На основании этих данных была высказана гипотеза [39], что тормозная постсинаптическая мембрана функционирует как пористая структура, которая под действием медиатора становится проницаемой для всех ионов, имеющих размеры ниже определенного критического уровня.
Аналогичные результаты были получены при внутриклеточной инъекции хлора и других анионов в маутнеровские клетки рыб [221, мотонейроны спинного мозга жабы [76], нейроны центральной нервной системы улитки, что позволило сходным обра-
зом объяснить ионный механизм генерации ТПСП в различных центральных нейронах.
Следует отметить, что, хотя анион С1 является единственным проникающим анионом, который находится в достаточной концентрации для создания эффективного тормозящего постсинаптического тока, согласно гипотезе пористой мембраны, в генерации ТПСП должны принимать также участие катионы К [39]. Если ТПСП вызывается только движением анионов хлора вдоль электрохимического градиента, £С1 должен соответствовать &гпсп-Однако, по расчетам Экклса, Еа составляет —70 мВ, а £тпсп —80 мВ. Было высказано предположение о существовании в мотонейронах хлорного насоса, функция которого заключается в снижении £С1 к более деполяризованному уровню, чем величина мембранного потенциала покоя, и важной роли ионов калия в создании ТПСП.
Опыты с внутриклеточным введением в мотонейроны кошки катионов К не противоречат такой возможности [31], однако они имеют существенный недостаток, связанный с влиянием инъецированных катионов на потенциал покоя. Кроме того, в этих условиях может произойти перераспределение содержания внутриклеточного хлора.
В экспериментах с введением в клетку двухканальных микроэлектродов и пропусканием тока между ними удалось устранить осложнения, связанные с пропусканием тока между внутриклеточным микроэлектродом и землей. Результаты указанных экспериментов позволили предположить, что при низком уровне внутриклеточного калия происходит активация нейронального хлорно-калиевого насоса, что позволяет поддерживать содержание хлора на уровне диффузионного равновесия [19, 39], и что ионы калия участвуют в переносе тормозящего постсинаптического тока.
В то же время более точные эксперименты с модификацией ионного состава окружающего клетки среды показывают, что генерация ТПСП обусловлена или избирательным повышением проницаемости постсинаптической мембраны к ионам калия (в нейронах легочных моллюсков Onchidium [81 ]) или только к ионам хлора (нейроны аплизии и мотонейроны амфибий). Такой механизм можно понять, если открываемые тормозящим медиатором ионные каналы содержат заряженные группировки, позволяющие обеспечивать высокую селективность в отношении анионов и катионов.
8.2.4. МЕДИАТОРЫ ТОРМОЖЕНИЯ И ИХ ДЕЙСТВИЕ НА ПОСТСИНАПТИЧЕСКУЮ МЕМБРАНУ
Вещества, способные специфическим образом воздействовать на постсинаптическую мембрану и вызывать в ней такие же изменения, как тормозящий медиатор, можно разделить на две группы. К первой группе относятся такие, которые всегда и у всех животных вызывают только тормозящий эффект. Ко вто-382
рой — те, которые в некоторых клетках вызывают возбуждение, в некоторых торможение и даже могут возбуждать и тормозить различные участки постсинаптической мембраны одной и той же нервной клетки.
К первой группе относятся так называемые тормозящие аминокислоты: глицин, гамма-аминомасляная кислоты (ГАМК), таурин, аланин, серин и некоторые другие. Особенно большое значение имеют, по-видимому, глицин и ГАМК. К предполагаемым медиаторам второй группы относятся ацетилхолин, глутамат, серотонин и другие вещества, уже упомянутые в разделе о медиаторах постсинаптического возбуждения.
У позвоночных глицин обнаружен ~ главным образом в пределах продолговатого и спинного мозга, при этом установлено, что он выделяется под влиянием электрического раздражения. В спинном мозге эффекты, вызываемые глицином, подавляются -67 специфическим антагонистом постсинаптического торможения — стрихнином 134]. ~65
' — -63
Рис. 8.17. Потенциал равновесия эффектов, вызываемых микроаппликацией глицина в мотонейроне лягушки [2]. -59
Цифры слева — величины мембранного потен-
циала. 2 л
Анализ механизма действия глицина на постсинаптическую мембрану, проведенный с помощью внутриклеточного отведения от нервных клеток и параллельной микроаппликации глицина через экстраклеточный микроэлектрод, показывает, что, так же как и медиатор тормозных путей, глицин вызывает в мотонейронах кошки гиперполяризацию и увеличение проводимости [33, 94].
В опытах на мотонейронах амфибий было установлено [2], что потенциал равновесия эффектов, вызываемых микроаппликацией глицина, составляет в среднем —62 мВ, что близко к средней величине мембранного потенциала покоя (—65 мВ). Зависимость между действием глицина на постсинаптическую мембрану и уровнем мембранного потенциала показана на рис. 8.17.
Внутриклеточное введение ионов хлора или снижение хлора в окружающей среде сдвигает потенциал равновесия глициновых ответов в сторону деполяризации, что свидетельствует об участии ионов С1~ в генерации наблюдаемых реакций.
Как видно на рис. 8.18, замена ионов хлора в перфузирующем растворе на ионы сульфата приводит к резкому сдвигу потенциала
равновесия ответов мотонейрона на микроаппликацию ГАМК в сторону деполяризации, в то время как изменение наружной концентрации ионов калия оказывает незначительное влияние. Обычно увеличение наружной концентрации ионов калия если и сдвигает потенциал равновесия глициновых или ГАМК ответов,
\в]10мМ
I И 2мМ
[/(] 2мМ
[й] 105 нМ [Cl] 105мМ
I kzlCrtf/W I 1
0 40 во 120 160
мин
[Мх] 110мМ
[Ж] ЮмМ
мВ
-60 -
-во -
О 40 80 120
мин
Рис. 8.18. Влияние изменения концентрации ионов калия, хлора и натрия в перфузирующем растворе на потенциал равновесия ответов мотонейрона лягушки при микроаппликации ГАМК [2].
Треугольниками обозначен потенциал равновесия, адрнылш круаиксини — мембранный потенциал повоя.
то этот сдвиг оказывается пропорциональным изменению величины потенциала покоя [2]. Удаление ионов натрия из среды путем замещения его на эквивалентное количество холин-хлорида не влияет на потенциал равновесия ответов, вызываемых микроаппликацией ГАМК и глицина. Таким образом, опыты с влиянием изменения наружной концентрации различных ионов показывают, что, так же как в случае ТПСП, постсинаптические эффекты, вызываемые микро аппликацией ГАМК и глицина, должны быть обус-
ловлены селективным увеличением проницаемости мембраны к ионам хлора.
Еще более веское подтверждение такого заключения дают опыты с измерением входного сопротивления мотонейронов во время развития ответов на микроаппликацию ГАМК и глицина в условиях изменения ионного состава среды [21 ввиду того, что ионная про-
* ' и и
3 П<ГГгПТПтГ ’
5 rmrnmrm “
.. . 105 «IV! 2«М
\VI ’TITTY «
„ 105 «М 2мМ
| Ю«в рл?0л7
2с
Рис. 8.19, Влияние удаления ионов хлора (3, 4) и увеличения концентрации ионов калия (5) на изменение проводимости мембраны при аппликации ГАМК, выявляющееся в нормальном растворе по измерениям электротонических потенциалов [2].
Продолжительность перфузия каждым раствором указана в минутах. I — ток ионофореза.
водимость мембран зависит не только от их проницаемости к определенным ионам, но и от концентрации и распределения последних по обе стороны мембраны [65]. Опыты, в которых сопротивление мембраны определялось с помощью пропускания через внутриклеточный микроэлектрод прямоугольных толчков тока, показали, что во время аппликации ГАМК и глицина происходит значительное увеличение проводимости постсинаптической мембраны (рис. 8.19). Удаление ионов хлора из окружающей среды приводит к постепенному уменьшению изменений проводимости, развивающихся под влиянием апплицируемых аминокислот. После пребывания мозга в бесхлорном растворе в течение 2—3 ч изменений про-
25 Общая физиология нервной системы
385
водимости во время действия ГАМК и глицина практически ие обнаруживалось. Увеличение концентрации калия в 5 раз на фоне отсутствия ионов хлора не приводит к заметным изменениям проводимости (рис. 8.19). Указанные результаты указывают на высокую степень селективности при открывании ионных каналов постсинаптической мембраны в результате взаимодействия ее рецепторов с апплицируемыми аминокислотами.
Таким образом, глицин и ГАМК являются очень вероятными кандидатами на роль медиатора постсинаптического торможения в центральной нервной системе позвоночных (см. гл. 6).
Убедительны также данные о функциональной роли ГАМК и глицина. У позвоночных они обнаруживаются в достаточно больших концентрациях только в пределах центральной нервной системы. Особенно высокое содержание ГАМК находят в черной субстанции и бледном шаре, менее значительное — в коре мозга и мозжечка, в спинном мозге, в сетчатке.
В экспериментах, проведенных на центральных нейронах различных моллюсков, было показано, что эффекты, аналогичные тем, которые вызываются у позвоночных глицином и ГАМК, могут создаваться аппликацией ацетилхолина [25], глутамата [81] и серотонина [51].
8.3. ПРЕСИНАПТИЧЕСКОЕ ТОРМОЖЕНИЕ
Частным случаем синаптических тормозных эффектов является так называемое пресинаптическое торможение, проявляющееся в уменьшении эффективности действия на нервную клетку возбуждающих синапсов в связи с активностью в соседних пресинаптических путях,
В основе пресинаптического торможения лежит взаимодействие пресинаптических окончаний, осуществляемое за счет синаптических контактов между ними, так что мембрана волокон одной группы является постсинаптической по отношению к мембране волокон другой. Существование аксо-аксональпых синапсов такого типа было выявлено электронномикроскопическими наблюдениями. Таким образом, на уровне аксо-аксональпых синапсов, являющихся структурным субстратом пресинаптического торможения, передача осуществляется в принципе так же, как и в других синапсах, однако результатом транссинаптических воздействий является подавление функции’звена, которое является постсинаптическим по отношению к системе волокон тормозного пути и пресинаптическим по отношению к исследуемой клетке.
Впервые данные, свидетельствующие о том, что торможение синаптической передачи возбуждения под влиянием афферентного раздражения может развиваться вследствие угнетения пресинаптического звена, были получены на мотонейронах кошки Фрэнком и Фуортсом [47], показавшими, что раздражение одних мышечных афферентов’может вызывать уменьшение моносинаптических ВПСП, 386
вызываемых активацией других, хотя это и не сопровождается изменениями мембранного потенциала покоя или возбудимости мотонейрона.
В дальнейшем процессы, лежащие в основе пресинаптического торможения, были детализованы в лаборатории Экклса [39].
В опытах с внутриклеточным отведением от внутримозговых афферентных волокон было установлено, что наблюдаемая депрессия ВПСП совпадает с деполяризацией первичных афферентных волокон. Такой же эффект вызывает их искусственная деполяризация (42 J. На основании этих данных было сделано заключение, что деполяризация пресинаптических окончаний является причиной пресинаптического торможения, так как уменьшение амплитуды потенциала действия пресинаптических окончаний приводит к уменьшению количества освобождаемого им медиатора.
Другой причиной развития пресинаптического торможения может быть увеличение проводимости мембраны или нарушения механизма электросекреторной связи, лежащей в основе функционирования пресинаптических окончаний.
Характерной особенностью деполяризации пресинаптических волокон во время пресинаптического торможения является медленное развитие и большая длительность (несколько сотен миллисекунд) даже после одиночной афферентной волны. Это резко отличается от временного течения постсинаптического торможения. Однако причина указанных различий неясна. Можно предполагать, что в спинном мозге позвоночных длительная пресинаптическая деполяризация поддерживается высокочастотными ритмическими разрядами, генерируемыми специальными вставочными нейронами, включенными в цепь пресинаптического тормозного пути [5].
Ввиду того что пресинаптическое торможение угнетается пикротоксином, можно предполагать, что его медиатором является ГАМК. С такой интерпретацией согласуются результаты опытов, показавших участие ГАМК в осуществлении пресинаптического торможения в периферических синапсах [35, 36].
В последнее время высказывается предположение, что развитие пресинаптического торможения может быть обусловлено увеличением наружной концентрации ионов калия вблизи пресинаптических окончаний возбуждающих волокон. Однако получены данные, указывающие на то, что первичная деполяризация афферентов сопровождается скорее повышенным выходом хлора из окончаний первичных афферентов, чем увеличением экстраклеточного калия [35]. Это совпадает с характерным действием на мембрану предполагаемого медиатора пресинаптического торможения — ГАМК.
Пресинаптическое торможение довольно широко используется в различных отделах центральной нервной системы позвоночных и беспозвоночных животных, а у последних также и в нервно-мышечном соединении. В опытах на кошках установлено, что пре-
Синаптическое торможение может быть вызвано в терминалях всех основных типов толстых афферентных волокон (1а, 16, II от мышечных рецепторов и А-альфа от кожи), вступающих в спинной мозг, причем оно распространяется не только на коллатерали этих волокон к сегментарным нейронам, но и на коллатерали к нейронам восходящих путей. Интенсивное пресинаптическое торможение может быть создано нисходящими путями, берущими начало из различных уровней мозга 16]. Хорошо выражено пресинаптическое торможение и в пределах головного мозга. Так у рыб оно наблюдается на маутнеровских нейронах 148], где оно вызывается действием тех же самых афферентных волокон, которые вызывают постсинаптическое торможение маутнеровской клетки. Ввиду того, что стрихнин в этом случае угнетает как пост-, таки пресинаптическое торможение, и то и другое, по-видимому, связано с освобождением одного и того же медиатора. Таким образом, медиатор, выделяемый окончаниями тормозного пути, изменяет свойства постсинаптической мембраны маутнеровской клетки и мембраны возбуждающих ее пресинаптических окончаний, возбудимость которых снижается. Указанный механизм пресинаптиче-ского торможения очень похож на пресинаптические торможения в нервно-мышечном соединении ракообразных [35, 36].
8.4. ИНТЕГРАЦИЯ ПОСТСИНАПТИЧЕСКОГО ВОЗБУЖДЕНИЯ И ТОРМОЖЕНИЯ В НЕРВНОЙ КЛЕТКЕ
Работа нервных центров и составляющих их нервных клеток во многом зависит от взаимодействия приходящих к ним возбуждающих и тормозящих синаптических влияний. Поэтому хотя для удобства экспериментального анализа каждый из этих основных нервных процессов обычно рассматривается изолированно, тем не менее необходимо также учитывать принципы интеграции возбуждающих и тормозящих эффектов. Это тем более важно, что функция тормозящих синапсов заключается именно в подавлении или ограничении процессов возбуждения, развивающихся в постсинаптической мембране, а не во влиянии на покоящуюся нервную клетку.
8.4.1. ВЗАИМОДЕЙСТВИЕ ВОЗБУЖДАЮЩИХ И ТОРМОЗЯЩИХ ПОСТСИНАПТИЧЕСКИХ ЭФФЕКТОВ
В клетках центральной нервной системы позвоночных в наиболее простой форме взаимодействия ВПСП и ТПСП могут быть рассмотрены с помощью оценки суммации эффектов, вызываемых включением возбуждающих и тормозящих синаптических входов. Исследования, проведенные с помощью усреднения постсинаптических потенциалов на цифровой вычислительной машине, показывают, что суммация ВПСП и ТПСП обычно имеет нелиней-
йыи характер. Пример нелинейной суммации моносинаптиче-ского 1а ВПСП и дисинапгического ретикулоспинального ТПСП показан на рис. 8.20, где видно, что суммарная реакция мотонейрона на сочетанную активацищ взаимодействующих входов примерно в два раза меньше алгебраической суммы обоих потенциалов. Наибольшая степень нелинейности наблюдается при совмещении начальных фаз ВПСП и ТПСП, т. е. в момент, когда лежащие в их
Рис. 8.20. Взаимодействие моноспнаптического 1а ВПСП п ТПСП п диси-нантического ретикуло-спинального ВПСП в мотонейроне макаки [12].
г — усредненный 1а ВПСП; g — усредненный ретлкупо-спинальный ТПСП; з — их алге-браическая сумма; 4 — результат их взаимодействия на мотонейроны; 5 —- разность между 4 и з. Калибровочный импульс I мВ, 1 мс удвоен на з.
основе изменения проводимости достигают максимума [12]. Это согласуется с представлением о том, что нелинейность суммации, отражающая эффективность постсинаптического торможения, обусловлена в первую очередь повышением проводимости постсинаптической мембраны под действием тормозящего медиатора.
Механизм взаимодействия ВПСП и ТПСП предполагает, что наибольшая степень нелинейности (или, иными словами, наиболее выраженный тормозящий эффект) будет иметь место при незначительном электротоническом расстоянии между возбуждающим и тормозящим входами. В то же время имеющиеся данные о распределении синапсов на поверхности мотонейрона свидетельствуют
о том, что тормозящие входы расположены преимущественно в области сомы, в то время как многие возбуждающие синапсы имеют дендритную локализацию.
Эквивалентная схема рис. 8.21, суммирующая имеющиеся представления об ионных механизмах действия возбуждающих и тормозящих синапсов на постсинаптическую мембрану, позволяет также рассмотреть условия взаимодействия указанных входов.
Поскольку постсинаптическое возбуждение обусловлено преимущественно повышением проницаемости соответствующего участка мембраны к ионам натрия (проницаемость к ионам хлора не изменяется, а проницаемость к ионам калия, возможно, ме-
Внвсинаптическая область
ВозЗуждающий Тормозящий
синапс _ синапс
। Внесинаптическая (
| область f
о Экстраклетйчная
J,___среда
м
=К
м
м
। я
4-—с
(Мг (Ж
"cl
'X
“^^Внутриклеточная среда
Рис. 8.21. Эквивалентная схема, отражающая взаимодействие постсинап-^ тического возбуждения и торможения в нервной клетке.
няется очень мало), то включение активируемого возбуждающим медиатором пути проводимости стремится сместить трансмембранную разность потенциалов в сторону деполяризации (ВПСП). Напротив, действие тормозящего медиатора, сопровождающееся повышением проницаемости мембраны к ионам хлора (и/или возможно к ионам калия) будет стремиться к удержанию мембранного потенциала на уровне потенциала покоя и таким образом противодействовать эффекту возбуждающего входа.
Поскольку действие тормозящего входа будет зависеть в первую очередь от величины создаваемого мембраной шунта, эффект нелинейной суммации будет наибольшим при соседнем расположении возбуждающего и тормозящего входов.
В случае если возбуждающий синапс расположен на дистальном дендрите, а тормозящий на соме (или, иными словами, продольное сопротивление внесинаптической области между входами на эквивалентной схеме рис. 8.21 будет очень велико), ВПСП будет затухать по мере распространения к соме в соответствии с электротоническим расстоянием. Кроме того, он будет уменьшаться по величине и растягиваться во времени из-за емкости мембраны (С^. Если ВПСП достигает сомы в момент развития ТПСП, то он дополнительно будет зашунтирован сопротивлением 1/<?сь При очень значительном увеличении проводимости суммация будет нелинейной. Однако если величина этого шунта будет
того же порядка, что и сопротивление мембраны (/?„), шунтирование пе будет столь существенным. Кроме того, для быстрых сигналов имеет значение некоторая компенсация затухания ВПСП за счет того, что с. подключением тормозящего синаптического шунта уменьшается постоянная времени мембраны (т„). Если в отсутствие ТПСП т„=7?м Си, то в момент действия тормозящего медиатора
где Ва — тормозящий синаптический шунт (1/Gci)- Следовательно, во время развития ТПСП емкость мембраны будет менее эффективно шунтировать быстрый ВПСП. Поэтому степень нелинейности при суммации ВПСП и ТПСП может быть очень незначительна, что и наблюдалось в ряде случаев, например при взаимодействии 1а ВПСП и ТПСП [39]. При линейной суммации взаимодействие целиком определяется суммарным сдвигом трансмембранной разности потенциалов.
Рассмотренные выше варианты взаимодействия ВПСП и ТПСП приложимы для объяснения суммации наиболее простых, элементарных синаптических эффектов. При асинхронной синаптической бомбардировке или сочетании полисинаптических воздействий взаимодействие между тормозящими и возбуждающими влияниями в ностсинаптической мембране может быть значительно более сложным.
8.4.2. ГЕТЕРОГЕННОЕ ДЕЙСТВИЕ ОДНИХ И ТЕХ ЖЕ МЕДИАТОРОВ НА РАЗЛИЧНЫЕ УЧАСТКИ ПОСТСИНАПТИЧЕСКОЙ МЕМБРАНЫ
В центральной нервной системе позвоночных возбуждающие и тормозящие воздействия на нервную клетку осуществляются через посредство различных химических медиаторов (39, 68]. Есть основания предполагать, Что даже различные возбуждающие или различные тормозящие входы одного и того же нейрона используют различные медиаторные вещества.
Однако в центральной нервной системе моллюсков окончания аксона одного и того же нейрона могут вызывать противоположные эффекты в разных зонах постсинаптической мембраны. Такие же результаты были получены и при микроаппликации предполагаемых медиаторов, которые могут как возбуждать, так и тормозить одну и ту же клетку. Указанные результаты свидетельствуют о том, что по крайней мере у беспозвоночных рецепторы постсинаптической мембраны, вступающие в реакцию с молекулами медиатора, могут открывать различные ионные каналы, что значительно усложняет интеграцию синаптических влияний, поступающих к нервной клетке.
Так, на идентифицированных нейронах абдоминального ганглия аплизии было показано, что одна и та же клетка или ацетил-
холин могут вызывать торможение одних нейронов, возбуждение других, а также комбинированный возбуждающе-тормозящий эффект [25]. Ионтофоретическая аппликация серотонина вызывает в одних и тех же нейронах аплизии или улитки 6 различных типов ответов [51], 4 из них связаны с увеличением ионной проводимости мембраны, в то время как два обусловлены уменьшением ее проводимости. Указанные ответы включают деполяризацию вследствие повышения натриевой проводимости, деполяризацию вследствие уменьшения калиевой проводимости и гиперполяризацию вследствие селективного увеличения калиевой или хлорной проводимости или в результате уменьшения проводимости для калия и натрия.
Столь широкое многообразие при действии на клетку только одного предполагаемого медиатора показывает, что пространственная организация рецепторов, включающих различные ионные каналы, может определять интегративные возможности нейрона.
* * *
Таким образом, анализ процессов, развивающихся в постсинаптической мембране нервных клеток в результате воздействия возбуждающих и тормозящих медиаторов, позволил значительно уточнить функциональные характеристики и механизмы генерации ВПСП и ТПСП. Установлено, что в основе как ВПСП, так и ТПСП лежат изменения проницаемости постсинаптической мембраны к ионам, находящимся в высокой концентрации в экстра-клеточной или внутриклеточной среде. В большинстве исследованных синапсов происходит увеличение ионной проницаемости, однако возможно также ее уменьшение. Ионные механизмы генерации постсинаптических потенциалов отличаются очень высокой специфичностью, и именно селективность активированных медиаторов ионных каналов мембраны в значительной степени определяет функциональную направленность, возбуждающий или тормозящий характер постсинаптических процессов.
В связи с тем, что потенциал равновесия ТПСП лежит вблизи потенциала покоя, а тормозящие синапсы, вероятно, локализованы проксимально по отношению к соме нейронов, ионные механизмы генерации ТПСП изучены наиболее полно, хотя степень селективности ионных каналов к анионам и катионам нуждается в уточнении. Установлено, что сущность постсинаптического торможения определяется не столько сдвигом мембранного потенциала в сторону гиперполяризации, сколько изменениями ионной проводимости, стремящимися зафиксировать трансмембранную разность потенциалов и не допустить ее сдвигов в сторону деполяризации.
Ионные механизмы генерации ВПСП изучены менее полно в связи с методическими трудностями, обусловленными положительными значениями потенциала равновесия ВПСП (внесинапти-ческая мембрана ведет себя нелинейно при сильной деполяризации) 392
ii дендритной локализацией значительной части возбуждающих синапсов. Тем не менее можно заключить, что в основе ВПСП лежит деполяризация, развивающаяся вследствие повышения проницаемости мембраны к ионам натрия и стремящаяся сдвинуть трансмембранную разность потенциалов к критическому уровню для генерации разрядов.
Отличительной особенностью нейронов центральной нервной системы является большое количество синаптических входов, конвергирующих на одной клетке. Функциональные свойства синапсов, их пространственная организация, свойства рецепторов постсинаптической мембраны и молекулярные механизмы, лежащие в основе открывания ионных каналов, определяют процессы интеграции различных синаптических сигналов, приходящих к нервной клетке из разных источников.
ЛИТЕРАТУРА
1. Буровика Б. В., Чмыхова И. М., Шаповалов А. И. Количественное определение содержания калия в мотонейронах спинного мозга лягушки методом рентгеносиектрального микроанализа. — Журн. эволюц. биохим., физиол., 1975, 11, № 3, с. 278—284.
2. Велумян А. А., Шаповалов А. И., Ширяев Б. И, Ионные механизмы действия глицина и гамма-аминомасляной кислоты на постсипаптическую мембрану мотонейронов амфибий. — ДАН СССР, 1976, 230, № 2, с. 485— 488.
3. Кожанов В. М., Шаповалов А. И. Синаптические эффекты, вызываемые в мотонейронах раздражением одиночных проприоспинальных нейронов. — Нейрофизиология, 1977, 9, № 3, с. 300—306.
4. Косицын Н. С. Микроструктура гигантоклеточной области ретикулярной формации ствола мозга. Автореф. канд. дне. Л., 1962.
5. Костюк П. Г. Торможение. — В кн.: Общая и частная физиология нервной системы. В сер. «Руководство по физиологии». Л., 1969, с. 104—137.
6. Костюк П. Г. Структура и функция нисходящих систем спинного мозга. Л., 1973.
7. Курчавый Г. Г., Данько С. Г., Зубков А. А., Каминский Ю. Л. Метод измерения импеданса мембраны мотонейронов во время синаптических воздействий. — Физиол. журн. СССР, 1972, 58, № 12, с. 1309—1312.
8. Курчавый Г. Г., Моторина М. В., Шаповалов А. И. Исследование распределения синаптических входов па аналоговой модели мотонейронов. — Нейрофизиология, 1973, 5, № 3, с. 289—297.
9. Курчавый Г. Г., Шаповалов А. И. Взаимодействие моносинаптических влияний на альфа-мотонейроны кошки при супраспинальном и афферентном раздражении. — ДАН СССР, 1971, 200, № 5, с. 1246—1248.
10. Сеченов И. М. О механизмах в головном мозге лягушки, угнетающих рефлексы спинного мозга. — В кн.: И. М. Сеченов, И. П. Павлов, И. Е. Введенский. Физиология нервной системы. 1952, М., с. 52—60.
11. Шаповалов А. И. Множественные разряды и ритмическая активность нейронов спинного мозга при раздражении через внутриклеточный электрод. — Физиол. журн. СССР, 1964, 50, № 4, с. 444—456.
12. Шаповалов А. И. Нейроны н синапсы супраспинальных моторных систем. Л., 1975.
13. Шаповалов А. И., Грантынъ А. А. Надсегмептарные синаптические влияния на хроматолизированные мотонейроны. — Биофизика, 1968, 12, № 2, с. 260—269.
14. Шаповалов А. И., Грантынъ А. А., Курчавый Г. Г. Коротколатентные ретикуло-спинальные синаптические проекции на альфа-мотонейроны. — Бюл. виси. биол. мед., 1967, 64, № 7, с. 3—9.
15. Шаповалов А. И., Курчавый Г. Г., Строганова М. П. Синаптические механизмы вестибуло-спинальных влияний на мотонейроны. — Физиол. журн. СССР, 1966, 52, № 12, с. 1401—1409.
16. {Шаповалов А. И., Курчавый Г. Г.) Shapovalov 4. I., Kwchavyi G. G. Effects of trans-membrane polarization and TEA injection on monosynap-[ tic actions from motor cortex, red nucleus and group la afferents on lumbar motoneurons in the monkey. — Brain Res., 1974, 82, N 1, p. 49—67.
17. Шаповалов А. И., Томарова 3. 4., Карамян О. А., Курчавый Г. Г. Ретинуло-спинальные и вестибуло-спинальные синаптические влияния на поясничные мотонейроны обезьяны. — Нейрофизиология, 1971, 3, № 2, с. 408—417.
18. Шаповалов А. И., Ширяев В, И. Ионные механизмы возбуждения постсинаптической мембраны нейронов центральной нервной системы позвоночных. — ДАН СССР, 1975, 225, № 2, с. 477—479.
19. Araki Т., Ito М., Kostyuk Р. G., Oscarsson О., Oshima Т. Injection of alkaline cations into cat spinal motoneurones. — Nature, 1962, 196, p. 1319— 1320.
20. Araki T., Ito M., Oscarsson O. Anion permeability of the synaptic and non-synaptic motoneurone membrane. — J. Physiol. (London), 1961, 159, p. 410—435.
21. Araki T., Terzuolo C. A. Membrane currents in spinal motoneurones associated with the action potential and synaptic activity. — J. Neurophysiol., 1962, 25, p. 772-789.
22. Asada Y. Effect of intracellularly injected anions on the Mauthner cells of goldfish. — Jap. J. PhysioL, 1963, 13, N 3, p. 583—598.
23. Barret J. N., Crill W. E. Specific membrane properties of cat motoneurones. — J. PhysioL (London), 1974, 239, p. 301—324.
24. Blankenship J, E., Kuno M. Analysis of spontaneous subthreshold activity in spinal motoneurones of the cat. — J. Neurophysiol., 1968, 31, p. 195—209.
25. Blankenship J. E., Wachtel H., Kandel E. R. Ionic mechanisms of excitatory, inhibitory and dual synaptic actions mediated by an identified interneuron in abdominal ganglion of Aplysia. — J. Neurophysiol., 1971, 34, N 1, p. 76—92.
26. Brock L. G., Coombs J. D., Eccles J. C. The recording of potentials from motoneurones with an intracellular electrode. — J. PhysioL (London), 1952, 117, N 4, p. 431—460.
27. Burke R. E. Composite nature of the monosynaptic excitatory postsynap-tic potential. — J. Neurophysiol., 1967, 30, N 6, p. 1114—1137.
28. Calvin Ж H. Dendritic synapses and reversal potentials: theoretical implications of the view from the soma. — Exp. Neurol., 1969, 24, N 2, p. 248— 264.
29. Colomo F., Erulkar S. D. Miniature synaptic potentials at frog spinal neurones in the presence of tetrodotoxin. — J. Physiol. (London), 1968, 199, p. 205—221.
30. Coombs J. S., Curtis D. R., Eccles J. C. The electrical constants of the motoneurone membrane. — J. Physiol. (London), 1959, 145, p. 505—528.
31. Coombs J. S., Eccles J. C., Fatt P. The specific ionic conductances and the ionic movements across the motoneuronal membrane that produce the inhibitory post-synaptic potential. — J. PhysioL (London), 1955, 130, p. 326—373.
32. Coombs J. S., Eccles J. C., Fatt P. Excitatory synaptic action in motoneurones. — J. Physiol. (London), 1955, 130, p. 374—395.
33. Curtis D. 'R., Ilosli L., Johnston G. A., Johnston I. H. The hyperpolarization of spinal motoneurones by glycine and related amino acids. — Exp. Brain Res., 1968, 5, p. 235—258,
34. Curtis D. R., Johnston G. A. Amino acid transmitters in the mammalian central nervous system. — Erg. PhysioL Biochem, 1974, 69, p. 97—187.
35. Davidson N., Simpson H. K. L. Concerning the ionic basis of presynaptic inhibition. — Experientia, 1976, 32, p. 348—349.
36. Dudel J. Presynaptic inhibition of the excitatory nerve terminal in the neuromuscular junction of the crayfish. — Pfliig Arch., 1963, 277, p. 537—557.
37. Dudel J., Kuffler S. Presynaptic inhibition at the crayfish neuromuscular junction. — J. Physiol. (London), 1961, 155, p. 543—562.
38. Eccles J, C. The Physiology of Nerve Cells. Baltimore, 1957.
39. Eccles J. C. The Physiology of Synapses. Berlin—Gottingen—Heidelberg, 1964.
40. Eccles J. C. The Understanding of the Brain. New York, 1973.
41. Eccles J. C., Eccles R. M., Ito M. Effects produced on inhibitory postsynap-tic potentials by the coupled injections of cations and anions into motoneurones. — Proc. Roy. Soc. Ser. B., 1964, 160, p. 197—210.
42. Eccles J. C., Kostyuk P. G., Schmidt R. F. The effect of electrical polarization of the spinal cord on central afferent fibres and on their excitatory synaptic action. — J. Physiol. (London), 1962, 162, p. 138—150.
43. Eccles J. C., Libet B., Young R. R, The behaviour of chromatolyzed moto-neurones studied by intracellular recording. — J. Physiol. (London), 1958, 143, p. 11—40.
44. Edwards F. f?., Redman S. J., Walmsley B. The effect of polarizing current on unitary la excitatory post-synaptic potentials evoked in spinal motoneurones. — J. Physiol. (London), 1976, 259, N 3, p. 705—724.
45. Engberg I., Flatman J. A., Lambert J. D. C. DL-Homocysteate-induced motoneurone depolarization with membrane conductance decrease. — Proc. Brit. Pharmac. Soc., 1975, 75, p. 12—13.
46. Fatt P. Postsynaptic cell characteristics determining membrane potential changes. — In: Lecture Notes in Biomathematics, 1974, 4, p. 159—170.
47. Frank K., Fuortes M. G. F. Presynaptic and postsynaptic inhibition of monosynaptic reflexes. — Fed. Proc., 1957, 16, p. 39—40.
48. Furukawa T., Fukami Y., Asada Y. A third type of inhibition in the Mauth-ner'ccll. — J. Neurophysiol., 1963, 26, p. 759—774.
49. Gelfan S. Neuronal interdependence. — Progr. Brain Res. 1964,11, p. 238— 260.
50. Gerschenfeld H. M. Chemical transmission in invertebrate central nervous systems and neuromuscular junctions. — Physiol. Rev., 1973, 53, p. 1—119.
51. Gerschenfeld H. M., Paupardin-Tritsch D. Ionic mechanisms and receptor properties underlying the responses of molluscan neurones to 5-hydroxytryptamine. — J. Physiol. (London), 1974, 243, p. 427—456.
52. Graham L. T., Shank R. P., Werman R., Aprison M. N. Distribution of some synaptic transmitter suspects in cat spinal cord: glutamic acid, aspartic acid, f-aminobutyric acid, glycine and glutamine. — J. Neurochem., 1967, 14, p. 465-472.
53. Granit R. Effects of stretch and contraction on the membrane of motoneurones. — In: Muscular afferent» and motor control. Nobel Symposium I. Stockholm, 1966, p. 37—50.
54. Goldman D. E. Potential, impedance and rectification in membranes. — J. Gen. Physiol., 1943, 27, p. 37—60.
55. Henry J. L., Kmfevlc K., Morris M. E. Substance P and spinal neurones. — Can. J. Physiol. Pharmac., 1975, 53, p. 423—432.
56. Hodgkin A. L., Kats, B. The effect of sodium ions on the electrical activity of the giant axon of the squid. — J. Physiol. (London), 1949,108, p. 37—77.
57. Hosli К., Andris P. F., Hosli E. Ionic mechanisms associated with the depolarization by glutamate and aspartate on human and rat spinal neurones in tissue culture. — Pfliig. Arch., 1976, 363, p. 43—48.
58. Hubbard J. I,, Stenhouse D., Eccles R. M. Origin of synaptic noise. — Science, 1967, 157, p. 330—331.
59. ItoM. Neurophysiological aspects of the cerebellar motor control system. — J. Internal. Neurol., 1970, 28, p. 154—172.
60. Ito M., Kostyuk P, G., Oshima T. Further study of anion permeability in cat spinal motoneurones. — J.(Physiol. (London), 1962, 164,*p. 150—156.
61. Ito M., Oshima T. Electrical behaviour of the motoneurone membrane du* ring intracellularly applied current steps. — J. Physiol. (London), 1965, 180, p. 607—635.
62. Jack J. J. B., Redman S. J. An electrical description of the motoneurone and its application to the analysis of synaptic potentials. — J. Physiol. (London), 1970, 215, p. 321—352.
63. JankoiL’ska E., Roberts IF. J. Synaptic actions of single interneurones mediating reciprocal la inhibition of motoneurones. — J. Physiol. (London), 1972, 222, p. 623—642.
64. Jansek R., Redman S. J. The amplitude, time course and charge of unitary excitatory post-synaptic potentials evoked in spinal motoneurone dendrites. — J. Physiol. (London), 1973, 234, p. 665—688.
65. Katz B. Nerve, muscle and synapse. New York, 1966. (Русск. перев.: Кац Б. Нерв, мышца и синапс. М., 1968).
66. Katz В., Mtledi R. A study of spontaneous miniature potentials in spinal motoneurones. — J. Physiol. (London), 1963, 168, p. 389—422.
67. Kerkut G-, Thomas R. The effect of anion injection and changes in the external potassium and chloride concentration on ths reversal potentials of the IPSP and acetylcholine. — Comp, Biochem. Physiol., 1964, 11, p. 199— 213.
68. Krnjevic K. Chemical nature of synaptic transmission tn vertebrates. — Physiol. Rev., 1974, 54, N 2, p. 418- 540.
69. Kontshi S., Otsuka M. The effects of substance P and other peptides on spinal neurons of the frog. — Brain Res. 1974, 65, p. 397—410.
70. Kuno M. Quantal components of excitatory synaptic potentials in spinal motoneurones. — J. Physiol. (London), 1964, 175, p. 81—99.
71. Kuno M., Elinas R. Alterations of synaptic action in chromatolysed moto-neurones of the cat. — J. Physiol. (London), 1970, 210, p. 823—838.
72. Kuno M., Weakly J. N. Quantal components of the inhibitory synaptic potential in spinal motoneurones of the cat. — J. Physiol. (London), 1972, 224, p. 287—303.
73. Kuypers H. G. M. The descending pathways to the spinal cord, their anatomy and function. — Progr. in Brain Res., 1964, 11, p. 178—202.
74. Lorente de N6 R. Synaptic stimulation of motoneurones as a local process. — J. Neurophysiol., 1938, 1, p. 195—206.
75. Matsuiira S.. Effects of changes in extracellular K+ concentration on resting and action potentials of the toad spinal motoneuron. — Osaka City Med. J., 1969, 15, Nl, p. 29-45.
76. Matsuura S., Endo K, Anion permeability of the inhibitory subsynaptic membrane of the spinal motoneuron of the toad. — Jap. J. Physiol., 1971, 21, p. 265—277.
77. Mendell L. M., Henneman E. Terminals of single la fibres: location, density and distribution within a pool of 300 homonymous motoneurones. — J. Neurophysiol., 1971, 34, p. 171—187.
78. Mtledi R., Szczepantak A. C. Effect of dendroaspis neurotoxins on synaptic transmission in the spinal cord of the frog. — Proc. Roy Soc. Ser. B, 1975, 190, p. 267—274.
79. Nernst W. Die elektromotorische Wirksamkeit der lonen. — Z. physik. Chem., 1889, 4, S. 129—181.
80. Otsuka M., Kontshi S., Takahashi 7'. Hypothalamic substance P as a candidate for transmitter of primary afferent neurons. — Fed. Proc., 1975, 34, N 10, p. 1922—1928.
81. Oomura У., Ooyama K-, Sawada M. Analysis of hyperpolarizations induced by glutamate and acetylcholine on onchidium neurones. — J. Physiol. (London), 1974, 243, p. 321—341.
82. Rail W. Distinguishing theorethical synaptic potentials computed for different soma-dendritic distribution of synaptic input. — J. Neurophysiol., 1967, 30, N 6, p. 1138-1168.
83. Redman S. J. A quantitative approach to integrative function of dendrites. — Internat. Rev, Physiol., 1976, 10, p. 117—144.
84. Sherrington C. S. The central nervous system, — In: A test-book of Physiology. London, 1897.
85. Smith T. G., Wuerker R. B., Frank K. Membrane impedance changes during synaptic transmission in cat spinal motoneurones. — J. Neurophysiol., 1967, 30, N 6, p. 1072—1096.
86. Sprague J. M., Ha H. The terminal field of dorsal root fibres in the lumbosacral cord of the cat, and the dendritic organization of the motor nuclei. — In: Progress in Brain Research, Organization of the spinal cord. II. Amsterdam, 1964, 120—154.
87. Takeuchi A., Takeuchi A. Further analysis of relationship between endplate potential and end-plate current. — J. Neurophysiol., 1960, 23, p. 397— 402.
88. Terzuolo C., Llinas R. Distribution of synaptic inputs in the spinal motoneurone and its functional significance. — In: Muscular Afferents and Motor Control. Nobel Symposium I. Stockholm, 1966, p. 373—384.
89. Ussing H. H. Transport of ions across cellular membranes. — Physiol. Rev., 1949, 29, p. 127-155.
90. Walmsley B. Analysis of unitary la excitatory postsynaptic potentials evoked in cat spinal motoneurones. Ph thesis. Monash University. Melbourne, 1975.
9f. Weight F. F. Mechanisms of synaptic transmission. — Neurosci. Res., 1971, 4, p. 1—27.
92. Werman R. Criteria for identification of a central nervous system transmitter. — Comp. Biochem. Physiol., 1966, 18, p. 745—766.
93. Werman'R;, Carlen P. L. Unusual behaviour of the la EPSP in cat spinal motoneurons. — Brain Res., 1976, 112, p. 395—401.
94, Werman R., Davidoff R. A., Aprison, M. H, Inhibitory action of glycine on spinal neurons in the cat. — J. Neurophysiol., 1968, 31, p. 81—95.
Г лав a 9
ЭЛЕКТРИЧЕСКИЕ СИНАПСЫ
В 1863 г. Краузе [102] предположил, что сигнал с концевой пластинки на мышцу передается электрически. Эта идея была поддержана Германном [89] и Кюне [104]. С другой стороны, Дюбуа-Реймон в большой работе 1874 г. [65] четко сформулировал альтернативу — электрическая или химическая передача — и высказался в пользу химического механизма. Электрическая теория синаптической передачи достигла пика популярности в 30-е гг. [30], а затем начала уступать свои позиции. Как уже указывалось в гл. 6, химическая природа передачи была выявлена во влиянии блуждающего нерва на сердце еще в 1921 г. в классических опытах Леви [112]. Далее она была показана для симпатических ганглиев, для нервно-мышечной передачи; наконец, Дейль распространил химическую гипотезу на синапсы центральной нервной системы [59]. Однако дискуссии продолжались до 50-х гг. [30], когда применение микроэлектродной техники позволило экспериментально отвергнуть идею электрической передачи в синапсах. Казалось, химическая теория окончательно победила. Но прошло всего несколько лет, и те же микроэлектродные методы позволили строго доказать существование электрического синапса у рака [73]. Это казалось исключением из правила. Но в последующие годы число исключений начало все более возрастать [30, 42]. Была обнаружена электрическая передача в сердечном ганглии омара, между нейронами ганглиев пиявки и моллюска, между нейронами рыб. В последние 20 лет накопился солидный список примеров электрической передачи. В 1971 г. Бекер и Ллинас показали наличие электрических синапсов у млекопитающих [33]. Таким образом, после ряда драматических событий, когда научное общественное мнение склонялось к признанию то электрического, то химического механизма передачи возбуждения, оказалось, что оба эти механизма реально существуют. В одних случаях сигналы через синапсы переносятся с помощью химических передатчиков,
в других — посредством электрического тока. Более того, обнаружены примеры, когда в одном и том же синапсе уживаются оба способа передачи; в этих случаях говорят о «смешанных синапсах».
9.1. ОСНОВНЫЕ СВОЙСТВА ЭЛЕКТРИЧЕСКИХ СИНАПСОВ И МЕТОДЫ ИХ ИДЕНТИФИКАЦИИ
Рассмотрим в самой общей форме различия между механизмом действия химического синапса и электрического синапса. Схема химического синапса изображена на рис. 9.1, Л.
Рис. 9.1. Схематическое изображение работы химического (А) и электрического (Б) синапсов. Стрелками показано распространение тока в результате изменения проницаемости постсинаптической мембраны (А) и распространение тока через электрический синапс (Б).
Импульс, приходящий по аксону, вызывает выделение медиатора, который, диффундируя через синаптическую щель, достигает постсинаптической мембраны. Взаимодействие медиатора с рецепторами постсинаптической мембраны приводит к изменению ионной проницаемости этой мембраны и к возникновению синаптического тока, который течет через синаптическую щель. Падение напряже
ния на_наружной мембране нейрона, создаваемое этим током, и называют постсинаптическим потенциалом (ПСП). Такой механизм работы ^накладывает определенные условия tна ^синаптическую щель: если щель будет слишком широкой, возрастет время диффузии медиатора и время синаптической задержки, если щель будет слишком узкой, ее сопротивление току будет велико, синаптический ток мал и он создаст маленький ПСП.
Схема электрического синапса изображена на рис. 9.1, Б. Механизм работы электрического синапса точно такой же, как и механизм распространения импульса по нервным волокнам. Внутри нервного волокна электрический ток течет от возбужденной области к невозбужденной и там вытекает наружу, деполяризуя волокно. В электрическом синапсе ток из возбужденной терминали аксона затекает в постсинаптическую клетку и вытекает наружу через ее мембрану, создавая ПСП. Такой механизм работы требует, во-первых, возможно более узкой щели, чтобы ток через нее не мог вытекать в наружную среду, во-вторых, возможно более низкого сопротивления пре- и постсинаптической мембран, поскольку они в случае электрического синапса находятся на пути синаптического тока.
Для идентификации электрических синапсов используются электрофизиологические, морфологические и фармакологические критерии.
9.1.1. ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ КРИТЕРИИ
Наиболее прямым критерием электрического синапса является следующий. При введении микроэлектродов в пре-синаптический и постсинаптические элементы подаются импульсы тока в пресинаптический элемент и измеряются сдвиги потенциала в постсинаптическом элементе. Как ясно из предыдущего, в случае электрического синапса заметная доля тока должна затекать в постсинаптическую клетку. При такой постановке эксперимента можно измерить одну из основных величин, характеризующих синапс, — коэффициент передачи, т. е. отношение потенциалов, возникающих в пре- и постсинаптическом элементах. Можно также выяснить, обладает ли синаптическая мембрана выпрямляющими свойствами. В некоторых работах был использован такой прямой метод изучения электрического синапса [74, 160]. В других случаях не удавалось ввести электрод в пресинаптическое волокно вблизи синапса, но можно было ввести его на некотором расстоянии от синапса в сому клетки, аксон которой образует синапс, и в сому постсинаптической клетки. При этих условиях регистрации необходимо учитывать кабельные свойства участка от местоположения токового электрода до места синапса; часть наблюдаемых явлений может быть обусловлена свойствами именно этого участка, а не самого электрического синапса. В таких условиях проводилось изучение электрических синапсов у пиявки, моллюсков и др. [34, 68, 83, 107, 122, 149, 159].
Короткая синаптическая задержка может быть хорошим признаком электрического синапса, когда два электрода введены близко от него; если точная морфология изучаемой системы неизвестна, то длинный латентный период не означает, конечно, что синапс не электрический. Существенным признаком химического синапса является зависимость ПСП от мембранного потенциала клетки. У химического синапса существует равновесный потенциал, и сдвигом мембранного потенциала ПСП химического синапса можно существенно уменьшить и даже извратить. В случае электрического синапса нет оснований ожидать такой зависимости ПСП от мембранного потенциала клетки. Действительно, в ряде случаев показано, что ПСП электрического синапса не зависит от сдвига мембранного потенциала. Однако при использовании этого критерия следует помнить, что химические синапсы, расположенные па дендритах, также могут быть очень слабо чувствительными к сдвигу мембранного потенциала. С другой стороны, ток, которым вызывается сдвиг мембранного потенциала, может через электрический синапс затекать в пресинаптическую терминаль и вызывать в зависимости от свойств ее мембраны те или иные изменения пресинаптического, а следовательно, и постсинаптического потенциала.
При изучении нервной системы позвоночных часто вообще а* не удается ввести электроды в пре- и постсинаптический элементы, и тогда о наличии электрического синапса судят по косвенным признакам (см. ниже).
9.1.2. МОРФОЛОГИЧЕСКИЕ КРИТЕРИИ
В случае химического синапса ширина синаптической щели имеет порядок 20 нм. В случае электрического синапса шель заметно уже (порядка 5 нм) и обычно содержит специализированные структуры (см. ниже). Кроме ширины щели, некоторым критерием химической передачи может служить наличие в пресинаптической терминали везикул, в которых, как предполагается, находится медиатор. Вначале казалось, что в электрическом синапсе везикул быть не должно, так как в них медиатор не участвует в передаче. Однако Паппас и Беннет [127] показали, что в аксонах, образующих электрические синапсы у рыб, имеются такие же пузырьки, как и в химических синапсах, хотя никаких признаков химической передачи обнаружить в этих синапсах не удалось. Везикулы наблюдались также в электрических синапсах маутнеровских клеток и др. Таким образом, этот критерий оказался непригодным.
9.1.3. ФАРМАКОЛОГИЧЕСКИЕ КРИТЕРИИ
Показано, что в ряде случаев химические синапсы более чувствительны к действию разнообразных фармакологических средств и ионов магния и кобальта, блокирующих хими-
2в Общая физиология авряиой оистемы 401
ческую передачу. Передача в электрических синапсах магнием и кобальтом не блокируется. Следует, однако, заметить, что в ряде случаев те вещества, которые будут весьма эффективно блокировать химические синапсы одного типа, могут не оказывать влияния на такие синапсы другого типа.
Как правило, в экспериментальных работах пользуются всей совокупностью описанных выше критериев (короткая синаптическая задержка, высокий коэффициент передачи, независимость величины ПСП от мембранного потенциала, узкая синаптическая щель, устойчивость передачи к действию магния и кобальта). Однако нередко экспериментальные условия таковы, что они не дают возможности использовать процедуры, позволяющие четко отличить электрический синапс от химического, а также от электро-тонических взаимодействий, осуществляемых через межклеточную среду без каких-либо специализированных структур. В литературе немало весьма нечетких описаний «электрического взаимодействия клеток». Ниже будут рассмотрены случаи синаптической передачи, для которых ее электрическая природа либо строго доказана, либо является весьма вероятной.
9.2. ЭЛЕКТРИЧЕСКИЕ СИНАПСЫ БЕСПОЗВОНОЧНЫХ
9.2.1. СЕПТАЛЬНЫЕ СИНАПСЫ ГИГАНТСКИХ АКСОНОВ
У некоторых видов кольчатых червей и ракообразных нервные стволы содержат гигантские аксоны, которые делятся поперечными перегородками на сегменты [22]. По этим аксонам импульсы распространяются в любом направлении со сравнительно большой скоростью. Следовательно, перегородки не оказывают значительного влияния на продольное протекание тока в гигантских волокнах [56 , 66 , 71, 93, 94, 138]. Эти перегородки не обладают выпрямляющими свойствами. У дождевого червя длина отдельного сегмента слишком мала по сравнению с константой длины [94[, поэтому более подходящими для детальных исследований оказались септальные аксоны рака [93, 160]. На этом объекте удалось измерить синаптическую задержку на одной септальной перегородке (0.1—0.2 мс). Ватанабе и Грундфест [161] вводили по Два микроэлектрода с каждой стороны перегородки (токовый и регистрирующий). Было показано, что коэффициент передачи через септальную перегородку 0.37, сопротивление перегородки не зависит от направления протекания тока и равно 0.2—0.4 МОм. Удельное сопротивление перегородки около 1 Ом/см2 [31] при удельном сопротивлении внешней мембраны 1000— 3000 Ом/см2 [160].
В аксонах кольчатых червей сопротивление септальной перегородки оказалось еще меньше, хотя точно и не было измерено: поэтому задержка на перегородке крайне мала — меньше 0.05 мс [54].
Перегородки увеличивают сопротивление продольному току и снижают скорость проведения. Теория проведения по таким волокнам развита в работах Маркина и Пастушенко [18, 20].
В комиссурах, соединяющих между собой септированные гигантские аксоны, также имеются электрические синапсы [30, 160, 164].
8.2.2. СИНАПСЫ МЕЖДУ НЕЙРОНАМИ СЕРДЕЧНОГО ГАНГЛИЯ ОМАРА
В ганглии омара крупные клетки электротонически связаны друг с другом. При этом от клетки к клетке достаточно эффективно передаются медленные потенциалы, но не передаются импульсы [84, 158, 159]. В одну из клеток вводились токовый электрод и регистрирующий, в другую — регистрирующий. При подаче толчков тока во второй клетке регистрировалось отклонение потенциала. При этом коэффициент передачи зависел от частоты переменного тока, пропускаемого через токовый электрод (А =0.33 для 20 Гц и к =0.04 для 250 Гц [82]). Сопротивление мостика, связывающего две клетки, было равно для постоянного тока 5—16 МОм [84]. Мембрана сомы клеток ганглия оказалась невозбудимой, и пики возникали только в аксонах. Если рассматривать «мостик», связывающий две клетки, как отрезок кабеля, то по приведенным цифрам можно оценить его активные и реактивные свойства. Для более точных оценок требуется более детальное знание морфологии. Сходные данные были получены в последнее время и на сердечном ганглии другого вида омаров [155].
9.2.3. СИНАПСЫ МЕЖДУ НЕЙРОНАМИ ГАНГЛИЯ ПИЯВКИ
В каждом сегментарном ганглии пиявки имеются две гигантские клетки (клетки Ретциуса), электротонически связанные между собой [68 , 83, 106]. При одновременной внутриклеточной регистрации в этих клетках наблюдались синхронные медленные колебания потенциала и часто синхронные импульсы. Мембрана сомы клеток оказалась невозбудимой. По-видимому, электрические синапсы образованы разветвлениями аксонов, мембрана которых возбудима. Для пиявки нет электронномикроскопических работ, в которых были бы найдены морфологические корреляты электрических синапсов. С этим связана трудность интерпретации результатов, полученных на пиявке: по регистрации в невозбудимой соме приходится судить о процессах, которые происходят на неизвестном расстоянии где-то в веточках аксонов. В связи с этим коэффициент передачи между сомами двух клеток — достаточно условная величина, мало говорящая про условия передачи в самом электрическом синапсе.
Показано, что коэффициент передачи между сомами клеток : Ретциуса одинаков для гиперполяризующих и для деполяризующих толчков и равен 0.25—0.5 для длительных толчков Дтока.
Таким образом, выпрямления здесь нет. Коэффициент передачи существенно зависел от частоты пропускаемого переменного тока и при 50 Гц убывал примерно в 10 раз [72]. Входные сопротивления нейронов составляли примерно 15 МОм; сопротивление «мостика», связывающего клетки, — 30 МОм. Сходные результаты были получены и для гигантских мотонейронов пиявки [151].
Работы с электротонической передачей сигналов между нейронами пиявки были продолжены Никольсом и др. и Терешковым и др. [23—25]. В работах Никольса и Пурвеса [122, 123] показано, что у пиявок существуют электрические синапсы между сенсорными клетками (рецепторами прикосновения) и мотонейронами. Они обеспечивают рефлекс укорочения при прикосновении к коже пиявки. Эти синапсы являются выпрямляющими и передают деполяризацию от сенсорных клеток к мотонейронам, а гиперполяризацию — в обратном направлении. Коэффициент передачи между сомами составляет 0.02. В то же время пик в сенсорной клетке может вызвать пик в аксоне мотонейрона, т. е. связь на уровне аксонов достаточно сильна. Выпрямление оказалось очень значительным: при гиперполяризации рецептора на 50 мВ в мотонейроне нельзя было обнаружить и следа ответа.
У пиявок обнаружен еще и третий тип электрического синапса, но его функциональное значение неизвестно. Это синапсы между сенсорными клетками — рецепторами прикосновения [37]. В этих синапсах деполяризация может распространяться в обоих направлениях между клетками, а гиперполяризация — ни в одном направлении.
Интересно следующее: а) мембрана сомы гигантских нейронов не выпрямляет; электрические синапсы между сомами гигантских нейронов также не выпрямляют; б) мембрана сомы сенсорной клетки выпрямляет; ее контакт с мотонейроном, мембрана которого не выпрямляет, дает синапс с односторонним выпрямлением; в) синапс двух сенсорных клеток, мембраны которых выпрямляют, обладает двусторонним выпрямлением. Это указывает на то, что нелинейные свойства электрической связи обусловлены поверхностными, а не контактными мембранами мостика.
В работах Терешкова и др. изучалось влияние безнатриевых и бескальциевых растворов на электрическую передачу между гигантскими нейронами пиявки. Авторы пришли к выводу, что передача не осуществляется просто участком низкоомных мембран. Этот вывод почти бесспорен, поскольку измеряемый участок включает сомы клеток, какие-то отрезки их аксонов и сам электрический синапс; однако трудно сказать, на какой из этих элементов действует измененный раствор.
9.2.4. ГИГАНТСКИЙ МОТОРНЫЙ СИНАПС РАКА
С небольшой работы Фуршпана и Поттера [73) на этом объекте начался современный этап изучения электрических синапсов. Изучение велось с помощью микроэлектродов, 404
введенных в пре- и постсинаптические волокна. Была измерена синаптическая задержка, которая составила примерно 0.1 мс. Показано, что латеральное гигантское волокно образует контакт с гигантским моторным волокном, образуя синапс с односторонним проведением. В одну сторону импульс проходит с короткой задержкой, в другую — не проходит. Когда импульс идет в моторном аксоне, то в латеральном аксоне регистрируется потенциал менее 0.3 мВ. Выпрямление выявляется также с помощью передачи толчков тока разного направления в пре- и постсинаптическое волокно [73].
В дальнейшем было показано, что гигантское латеральное волокно образует электрические синапсы не только с гигантским моторным волокном, но и с обычными флексорными мотонейронами [170].
9.2.5. СИНАПСЫ МЕЖДУ НЕЙРОНАМИ ГАНГЛИЕВ МОЛЛЮСКОВ
В целом ряде работ было обнаружено электрическое взаимодействие между нейронами моллюсков [13, 14, 16, 31, 53, 54, 107, 119, 149, 154]. У моллюсков показано существование электрической связи как между парами клеток (часто с неизвестными функциями), так и в группе клеток между собой. В парах клеток найдена сильная связь, обеспечивающая передачу как медленных электротонических сигналов, так и импульсов [54], и более слабая связь между другими парами, при которой медленные сигналы передаются хорошо, а быстрые сигналы очень сильно затухают.
В работах Геттинга и Уиллоуса [76—78] изучалось электрическое взаимодействие между нейронами плеврального ганглия тритонии. Показано, что в группе, содержащей около 30 нейронов, все клетки электрически связаны. Передача от одной клетки к другой не блокировалась магнием и кураре, величина сигнала не зависела от уровня мембранного потенциала нейрона. Авторы при помощи 4 внутриклеточных микроэлектродов регистрировали практически одновременное возникновение пиков в 4 нейронах этой группы. Поскольку за ПД этих клеток следовала фаза гиперполяризации, а электрические синапсы не обладали выпрямляющими свойствами, нейроны этой группы оказывали друг на друга не только возбуждающее, но и тормозящее влияние. Авторы отметили, что такую группу клеток уже следует рассматривать как аналог возбудимой ткани и учитывать, например, шунтирование ПД одной клетки всеми остальными, с которыми она непосредственно связана. Средний коэффициент передачи между сомами двух клеток для постоянного тока был равен 0.19. Клетки ганглиев разных сторон тела также электрически связаны между собой, и среднее значение коэффициента передачи равно 0.07. По-видимому, нейроны тритонии связаны между собой аксонными мостиками, которые ведут себя как низкочастотные фильтры.
Коэффициент передачи существенно зависел от частоты сигнала {рис. 9.2). Это свойство «мостиков» приводит к тому, что медленные сигналы передаются гораздо лучше пиков, а постсинаптические потенциалы заметно затягиваются. Коэффициент передачи
Рис. 9.2. Зависимость коэффициента передачи между нейронами моллюска от частоты переменного тока.
Коэффициент передачи измерялся как отношение изменений потенциала от пика до пика в пре- и в постсинаптической клетках. Кривая 1 — оба нейрона в одном и том же плевральном ганглии, кривая 2 — связанные нейроны расположены в симметричных ганглиях [7В).
для пиков оказался равным 0.02. Модель для этой клеточной системы будет рассмотрена ниже,
Левитан с соавт. [107] показали на заднежаберном моллюске, что величина электрической связи между клетками может регулироваться действием обычных химических синапсов на отдельные клетки. Этот же вопрос был рассмотрен в работе Спиры и Беннетта [149]. Мы разберем его в разделе 9.6.
9.2.6. СВЯЗЬ РЕЦЕПТОРНЫХ КЛЕТОК БЕСПОЗВОНОЧНЫХ
В разделе о нейронах пиявки мы уже говорили, что у них обнаружена электрическая связь между сенсорными нейронами. В работе Мюллера [118] такая связь обнаружена между фоторецепторными нейронами рака. Интересно, что в каждом омматидии связь существует только между нейронами, которые воспринимают свет с одной и той же плоскостью поляризации, и отсутствует в случае нейронов, реагирующих на свет с перпендикулярным направлением вектора поляризации. Связь осуществляется не между телами клеток, а, по-видимому, между отростками аксонов. Синапсы не обладают выпрямляющими свойствами. Коэффициент передачи высок. Такие же отношения, как между рецепторами с разным направлением ^плоскости поляризации, были установлены и между клетками, чувствительными к желтому и голубому цвету, причем «желтые» клетки не были электрически связаны с «голубыми».
Еще один электрический синапс описан в зрительной системе саранчи [125] между интернейронами, входящими в систему детекторов движения. Передача в этом синапсе сохранялась при блокирующих фармакологических воздействиях, охлаждении препарата, высокой частоте стимуляции. Синапс обладает высоким коэффициентом передачи (около 0.5), через него передаются импульсы, но в обратном направлении они не проходят. По-видимому, это первое описание электрического синапса у насекомых.
Кроме того, следует отметить наличие электрической связи с выпрямлением между клетками омматидия лимулюса [143] и между волосковыми клетками статоцита моллюска [61].
Таким образом, для беспозвоночных известно лишь два объекта, где удалось строго изучить электрическую передачу: это синапс септированных аксонов и гигантский моторный синапс рака. В остальных случаях морфология синапсов точно не известна, а поэтому и микроэлектродное измерение с введением электродов непосредственно в пре- и постсинаптическую область невозможно. В результате измеряются свойства некоторой области, куда, кроме синапса, входит еще «довесок» неизвестных размеров и с неизвестными свойствами.
С учетом этого замечания можно сказать, что у беспозвоночных обнаружены электрические синапсы с коэффициентами передачи от 1 до сотых долей, электрические синапсы, надежно передающие импульсы и, напротив, хорошо передающие только медленные сдвиги потенциала, электрические синапсы симметричные и выпрямляющие.
9.3. ЭЛЕКТРИЧЕСКИЕ СИНАПСЫ ПОЗВОНОЧНЫХ
9.3.1. ЭЛЕКТРИЧЕСКИЕ СИНАПСЫ МЕЖДУ НЕЙРОНАМИ У РЫБ
По-видимому, первыми, показавшими наличие электрических синапсов у позвоночных, были работы Беннетта и др. [47, 48] на супрамедуллярных нейронах рыбы-шара. Эти нейроны, вероятно, связаны аксонными «мостиками». Коэффициент передачи, измеряемый между телами соседних нейронов двумя внутриклеточными электродами, равен 0.15 и менее. При этом выпрямления не происходит. «Мостики» более эффективно передают медленные потенциалы и в этом сходны с «мостиками» клеток сердечного ганглия омара. У рыбы-шара 50—100 нейронов этого типа связаны между собой, образуя такую же сеть, как у моллюсков. Ряд важных данных об электрических синапсах получен при изучении системы нейронов, управляющих работой электрических органов рыб (рис. 9.3). Простейшая система такого назначения у электрического синапса состоит из двух нейронов, лежащих в спинном мозге каждый на своей стороне тела (рис. 9.3, Л). Каждый нейрон иннервирует одновременно все электрические Ч
Malzpterurus Gymnotids Astroscopes
Средний мозг
Momyriis Ops&nus, Cesteropelecus
Рис. 9.3. Электрические синапсы в системах управления электрическими органами, плавательным пузырем и плавниками разных видов рыб.
1 — дендро-дендритные, 2 — аксо-соматические электрические синапсы; з — аксо-сома-тические химические синапсы [39].
пластины своей стороны тела. Оба нейрона тесно связаны электро-тонически, так что импульс в одном из них возбуждает и симметричный нейрон [50]. Эти два гигантских нейрона не соприкасаются ни сомами, ни дендритами. Связь между ними обусловлена аксосоматическими электрическими синапсами, образуемыми разветвлениями афферентных аксонов, которые оканчиваются на обеих гигантских клетках и таким образом связывают их между собой.
У гимнотид (рис. 9.3, Б) в управление электрическим органом вовлекается несколько уровней нервной системы. В продолговатом мозге находится от 30 до 50 (а иногда и больше) ритмоводящих клеток. Там же лежит релейное ядро, содержащее нейроны следующего порядка. Их аксоны спускаются в спинной мозг, где возбуждают электромоторные нейроны, дающие аксоны к электрическому органу. При этом клетки-ритмоводители электрически связаны между собой дендритами и коллатералями аксонов. Клетки-ритмоводители образуют электрические синапсы на релейных медуллярных нейронах, которые оказываются связанными через разветвления афферентных волокон. Наконец, релейные нейроны образуют такие синапсы на электромоторных нейронах. Таким образом, в этой системе показана трехнейронная дуга с электрической передачей [49, 52].
В работах Беннетта и соавт. [45, 511 была изучена система управления электрическим органом рыб из семейства мормирид (рис. 9.3, Г). Здесь командные нейроны лежат в среднем мозге, имеется реле в продолговатом мозге и электромоторные нейроны в спинном. Командные нейроны находятся в симметричных структурах с двух сторон. Они образуют электрические синапсы на нейронах медуллярного реле, и сами электрически связаны через это реле. Медуллярные нейроны связаны дендритами и через афференты. Они образуют на электромоторных нейронах химические синапсы. Сами электромоторные нейроны электрически связаны своими дендритами.
Работа Беннетта и др. [451 была одной из первых, в которой, кроме электрофизиологических данных, были приведены электронномикроскопические снимки, показывающие области сближения мембран между дендритами взаимодействующих клеток.
Обнаружена связь и между мотонейронами ядра, иннервирующего мышцу плавательного пузыря у жабы-рыбы (рис. 9.3, Д). Эти мотонейроны разряжаются синхронно с частотой 100—200 имп/с, в результате чего жаба-рыба издает с помощью плавательного пузыря характерные звуки. Электронная микроскопия обнаружила в этом случае щелевые контакты аксо-соматические и аксо-дендрит-ные. Электрофизиологические доказательства электрической связи в этом случае носят косвенный характер. Антидромное раздражение аксонов части мотонейронов ядра вызывало небольшой сдвиг потенциала в других мотонейронах. Латентный период этой реакции (0.3—0.4 мс) заставляет предположить электрическую
передачу, так как он кажется слишком коротким для передачи в химических синапсах холоднокровного животного.’Имеются основания считать, что связь и в этом случае осуществляется разветвлениями пресинаптических волокон, образующих электрические синапсы на разных мотонейронах.’При возникновении в мотонейронах ТПСП и внутриклеточном отведении от волокон в них также наблюдалась небольшая гиперполяризация [127 ].
Следует остановиться несколько подробнее на работе Ауэрбаха и Беннетта [341, в которой впервые было показано существование выпрямляющих электрических синапсов в нервной системе позвоночных. Эти синапсы образованы гигантскими волокнами, приходящими J из продолговатого мозга рыб к мотонейронам, управляющим движениями грудных плавников у летающей пресноводной рыбы клинобрюшки (рис. 9.3, Е). Во время полета она машет плавниками с довольно высокой частотой.
Входные сопротивления этих мотонейронов равны в среднем 0.9вМОм. Приход импульса по пресинаптическому волокну вызывал в мотонейроне ВПСП, равный 8 мВ. Входное сопротивление пре-синаптического волокна, измеренное методом прямоугольных толчков с помощью двух микроэлектродов, равно 0.5 МОм. Время задержки ВПСП в этом синапсе порядка 50 мкс. Таким образом, на каждой стороне есть два гигантских волокна, которые образуют разветвления, дающие электрические синапсы со всеми мотонейронами своей стороны.
На этом препарате удалось непосредственно измерить характеристики электрической связи. Пропуская ток и регистрируя потенциал по другую сторону синапса, авторы показали его нелинейность. На основании измерения этой нелинейности было рассчитано, как должно меняться входное сопротивление при разных силах тока. Эксперименты подтвердили эти расчеты. Сопротивление синапса в покое равно примерно 25 МОм. При приходе импульса по волокну оно падало до 10 МОм; напротив, при гиперполяризации волокна на 50 мВ оно возрастало до 50 МОм. Коэффициент передачи для импульса был равен 0.05—0.1.
Количественные измерения показали, что связь двух мотонейронов через гигантское волокно должна быть довольно слабой. Однако опыты показали, что при антидромном раздражении части мотонейронов в других мотонейронах возникает ПСП до 5—6 мВ, хотя афферентное волокно при этом антидромно не возбуждается. Это указывает на то, что мотонейроны связаны еще каким-то дополнительным электрическим путем. Авторы полагают, что это дендро-дендритные контакты. Такие двойные пути уже были ранее показаны для’электромоторного ядра гимнотов.
г В итоге авторы анализируют полную электрическую схему, учитывающую, что все 40 мотонейронов связаны между собой и с двумя входными волокнами.
Электрическая'связь между нейронами рыб была также показана для мотонейронов глазодвигательных ядер, которые связаны, 410
по-видимому, разветвлениями афферентных волокон [97, 98, 103] и для системы маутнеровских клеток [63 ]. В вестибулярной системе показаны электрические синапсы между первичными афферентами и нейронами латерального вестибулярного ядра [101].
9.3.2. ЭЛЕКТРИЧЕСКИЕ СИНАПСЫ У АМФИБИИ, РЕПТИЛИЙ И ПТИЦ
Данные об электрических синапсах для этих классов позвоночных значительно беднее, чем для рыб. В ряде случаев отсутствуют точные доказательства электрической природы синапсов,
В литературе имеются данные о наличии электрической связи между мотонейронами лягушки и жабы [57, 80, 81, 113, 157]. Вместе с тем в тщательной электронномикроскопической работе Сотело и Такси [148] в передних рогах спинного мозга лягушки практически не было обнаружено синапсов типа щелевых контактов. Эти авторы предполагают, что морфологическим субстратом электрической связи являются длинные, параллельно идущие области дендритов двух мотонейронов, не разделенные глией. Такие структурные образования едва ли правильно называть электрическими синапсами, возможно, здесь более уместно говорить об эфаптической передаче или проэлектротонической связи через среду. Для лягушек имеются также данные об электрических синапсах между нейронами вестибулярных ядер [133]. Электрические связи в сетчатке черепах будут рассмотрены ниже.
У птиц наиболее детально исследованы электрические синапсы в цилиарном ганглии цыпленка. Собственно, это классический пример так называемых смешанных синапсов, в которых осуществляется и химическая и электрическая передача.* Мартин и Пилар [114, 115] показали, что в синапсах цилиарного ганглия имеет место как ортодромная, так и антидромная передача. При внутриклеточном отведении в нейроне цилиарного ганглия регистрировался ВПСП из двух компонентов. Первый компонент не имел заметной синаптической задержки, а задержка второго была 1.5—2 мс. Первый компонент не менялся при гиперполяризации клетки, а второй увеличивался. Только второй компонент блокировался фармакологически. Все это говорит о том, что первый компонент создается непосредственно электрическим током пре-синаптического окончания, а второй — химическим медиатором.
Первоначально при выведении у цыплят обнаруживается только химическая передача, электрическая же возникает лишь в десятидневном возрасте; сходное явление обнаружено и у голубей [90, 105]. Морфологический субстрат электрической передачи в этом случае — большой чашевидный синапс, в котором и нейрон,
* Заметим, что ряд смешанных синапсов был описан в последнее время между нейронами спинного мозга миног [1, 136, 137].
Й синаптическое окончание окружены общей миелиновой оболочкой, предотвращающей вытекание тока через синаптическую щель во внешнюю среду.
Электрическая связь в синапсах цилиарного ганглия является достаточно сильной: в обычных условиях ток, затекающий через этот синапс, вызывает возникновение пика в постсинаптическом нейроне.
Электрическая передача у птиц предполагается также в очень быстро передающих синапсах между лабиринтными афферентами и нейронами вестибулярных ядер голубя [165].
9.3.3. ЭЛЕКТРИЧЕСКИЕ СИНАПСЫ У МЛЕКОПИТАЮЩИХ
При изучении связи нейронов млекопитающих, расположенных в глубине мозга, практически невозможно ввести два электрода в связанные клетки. Поэтому здесь используется другая методика, впервые использованная в работах Беннетта и соавт. на нейронах рыб [38].
Пусть имеется группа электрически связанных нейронов, дающих аксоны в какой-то нерв. В одну из клеток вводится микроэлектрод. Затем нерв раздражается для вызова антидромных ответов. Если сила тока надпороговая для аксона регистрируемой клетки, то наблюдается антидромное вхождение импульса в сому. При подпороговой для этого аксона силе раздражения антидромного импульса не будет, но в других, более низкопороговых аксонах возникнут антидромные импульсы и придут в их сомы. Если эти более низкопороговые клетки электрически связаны с регистрируемой клеткой, то в ней возникнут изменения потенциала, обусловленные токами, причина которых — антидромные пики в соседних клетках. Эти сдвиги потенциала, так называемая «быстрая деполяризация», и считаются свидетельством электрической связи. Чтобы отличить их от ВПСП химических синапсов, используют ряд дополнительных тестов. Во-первых, их латентный период должен быть достаточно коротким. Но при этом возникает вопрос о том, от какого момента следует отсчитывать латентный период быстрой деполяризации. Если считать от времени прихода собственного антидромного импульса, то латентный период может быть отрицательным, когда аксоны соседних клеток толще, и в их тела антидромные импульсы приходят раньше. Поэтому отсчет ведется от момента прихода антидромных импульсов в самых толстых аксонах данной группы, или от начала суммарного вызванного потенциала в данной группе. Во-вторых, амплитуда быстрой деполяризации не должна зависеть от уровня мембранного потенциала клетки. Однако по этому критерию электрические синапсы нельзя отличить от химических, расположенных на дендритах. Таким образом, доказательство электрической связи клеток в этом случае нельзя считать вполне строгим. Кроме того,
описанный метод, очевидно, применим только к наиболее высоко-пороговым нейронам, так как в низкопороговых антидромный импульс возникнет раныце, чем в соседних клетках, и быстрая деполяризация не может быть замечена. Существенное усовершенствование этой методики было предложено Бекер и Ллина-сом [35 J в работе, в которой впервые было показано существование электрической связи между нейронами млекопитающих. Бекер и Ллинас предложили и использовали метод встречных импульсов. Они за короткое время до подачи антидромного импульса раздражали регистрируемую клетку через внутриклеточный электрод, так что импульс, идущий из сомы, и антидромный импульс сталкивались в волокне и гасили друг друга (рис. 9.4, А). Тогда антидромные импульсы, идущие по нерву, проникают в тела всех соседних клеток, кроме той, которую только что раздражали. Это позволяет, во-первых, изучать все нейроны, а не только высокопороговые, а во-вторых, использовать при раздражении гораздо более сильные стимулы, которые вызывают антидромные ответы во всех соседних нейронах.
Метод встречных импульсов весьма эффективен при не слишком высоком коэффициенте связи изучаемых нейронов, когда орто-дромный импульс, вызванный в соме, не вызывает возбуждения соседних клеток, электрически связанных с регистрируемой. При высоком коэффициенте связи встречные импульсы будут возникать во всех нейронах и гасить антидромные импульсы во всех нейронах сразу, что не позволит обнаружить быструю деполяризацию. Детали этой методики представлены в работе Гогена с соавт. [79], где обсуждаются возникающие трудности и пути их преодоления.
В работе Бекер и Ллинаса [35] изучались сенсорные нейроны первого порядка ядра пятого нерва крысы (рис. 9.4, Б). Эти нейроны являются аналогом нейронов спинального ганглия. Это униполярные нейроны без дендритов с одним Т-образно ветвящимся отростком, место бифуркации находится на расстоянии 200—300 мкм от сомы. Чувствительная веточка идет от веретенных рецепторов жевательных мышц, а центральная веточка идет в моторное ядро тройничного нерва. Сома нейрона возбудима, и импульс, проходя точку ветвления, проникает в нее.
До проведения электрофизиологических исследований было показано, что между сомами этих нейронов, а также между сомами и аксонами имеются области тесного сближения мембран [55, 91]. Таким образом, в случае млекопитающих существование электрической связи сначала было предсказано морфологами, а затем подтверждено физиологами.
При электрическом раздражении тройничного нерва наблюдалась быстрая деполяризация в изучаемых нейронах. Латентность деполяризации колебалась от 0 до 0.5 мс (в среднем 0.18 мс). Ее амплитуда составляла в среднем 1.48 мВ (колебания от 0.3 до 5.4 мВ). Как правило, такая деполяризация возникала по закону
Рис. 9.4. Электрические синапсы млекопитающих.
Л — схематическое изображение группы клеток мезенцефалического ядра крыса и организации эксперимента. Аксоны трех изображенных клеток Т-образно ветвятся, посылая отростки в тройничный нерв (налево) и в моторное ядро тройничного нерва (направо). Клетки возбуждались электрическим раздражением тройничного нерва (япшиул), а в среднем нейроне через микроэлектрод вызывался встречный импульс (направление импульсов изображено стрелками у аксонов). Электрические синапсы изображены треугольничками: слева — сомато-соматический, справа — аксо-соматкческий синапс [35); Б — схематическое изображение электрической связи нейронов латерального вестибулярного ядра крысы черев общее пресинаптическое волокно. Изображены два постоинаптических нейрона а и б. Пресинаптическое волокно образует с обоими нейронами щелевые контакты (зачернены). Потенциал действия (ПД) в нейроне а вызывает через эти контакты быструю деполяризацию (БД) нейрона б [100 J.
«все или ничего» — это значит, что регистрируемая клетка имела всего одного электрически связанного с ней соседа. Однако были случаи, когда быстрая деполяризация состояла из двух или даже из трех дискретных волн (два или три связанных соседа). Часто эта деполяризация вызывала пик в нейроне.
Быстрая деполяризация не зависела от мембранного потенциала регистрируемой клетки. Так как в данном случае нейроны не имели дендритного дерева, то такая независимость не может быть объяснена удаленностью химических синапсов от сомы. В ядре оказались связанными между собой около 10% клеток. Функциональное значение этой связи неизвестно.
В работе Корна с соавт. [100 J даны морфологические и электрофизиологические доказательства электрической связи между гигантскими нейронами ядра Дейтерса у крыс. По морфологическим данным гигантские клетки не контактируют между собой сомами или дендритами. Однако коллатерали толстых афферентных волокон образуют с гигантскими нейронами синапсы «смешанного типа», т. е. там видны и обычные синаптические мембраны с везикулами, и участки сближения мембран, где щель имеет ширину всего около 2 нм, а протяженность зон контакта составляет 0.3— 0.5 мкм.
Антидромно возбуждались волокна вестибуло-спинального тракта с внутриклеточной регистрацией нейронов ядра Дейтерса. В половине регистрируемых клеток была зарегистрирована быстрая деполяризация. Ее латентный период равнялся примерно 0.15 мс, амплитуда варьировала от 0.8 до 4 мВ. В условиях «встречных импульсов» можно было наблюдать и вдвое большую деполяризацию, так как можно было увеличить силу раздражения. В отличие от быстрой деполяризации в ядре Дейтерса, в нейронах ядра V нерва, в вестибулярном ядре деполяризация имела градуальный характер, ее амплитуда постепенно нарастала с увеличением силы антидромного раздражения. Это указывает на то, что отдельная клетка вестибулярного ядра электрически связана с большим числом соседей.
Авторы предположили, что одно афферентное волокно дает смешанные синапсы на нескольких нейронах, в результате все гигантские нейроны оказываются связанными в некоторую общую систему (рис. 9.4, В). Такие связи нейронов через афферентные волокна были постулированы еще в ранних работах Беннетта и соавт. и наиболее непосредственно доказаны для спинного мозга рыб [1171.
В работе Вили [168] приведены аргументы о том, что электрическая связь нейронов вестибулярных ядер осуществляется, по крайней мере отчасти, через афферентные волокна, приходящие из лабиринта.
В работах Ллинаса, Бекера и Сотело [109, 145] получены морфологические и электрофизиологические доказательства электрической связи между нейронами нижних олив кошки. Внутри-
клеточно регистрировались нейроны нижних олив, антидромно раздражались их аксоны в мозжечке. Наблюдалась быстрая деполяризация с латентным периодом от 0 до 0.3 мс. Ее амплитуда градуально менялась в зависимости от силы антидромного стимула и не зависела от уровня мембранного потенциала регистрируемой клетки. Результаты объясняются наличием электрических синапсов между дендритами оливарных клеток, где электронномикроскопически обнаружены специализированные контакты.
В работе Гогена и др. [79] приведены данные, позволяющие предполагать наличие электрической связи между мотонейронами глазодвигательного ядра кошки. Коэффициент связи в этом случае довольно высок, и БД часто вызывает импульс в нейроне.
9.3.4. ЭЛЕКТРИЧЕСКИЕ СИНАПСЫ В РЕЦЕПТОРНЫХ СИСТЕМАХ ПОЗВОНОЧНЫХ
Часть описанных выше примеров относилась к афферентным системам. Мы уже говорили об электрических синапсах между вестибулярными афферентами и нейронами вестибулярных ядер у крыс и у голубей. Первая работа на млекопитающих 135] тоже выполнена на афферентных нейронах, передающих импульсы от жевательной мускулатуры. Ниже приводятся еще несколько примеров.
Имеются данные о наличии электрической связи между рецепторными клетками и афферентными волокнами в электрорецептор-ных органах рыб [40, 150, 152].
Интересные данные получены для горизонтальных клеток сетчатки рыб. Согласно результатам электрофизиологических исследований [17, 121 ], горизонтальные клетки одного слоя в сетчатке рыб образуют непрерывный проводящий пласт, т. е, по существу являются, подобно миокарду и гладким мышцам, функциональным синцитием. Электронномикроскопические данные [8, 169] согласуются с физиологическими, так как между дендритами горизонтальных клеток найдены специализированные контакты, участки резко сближенных мембран — «нексусы» или щелевые контакты. В работах Бызова, Трифонова и Чайлахяна [11, 26, 27] проанализирована электрическая структура слоя горизонтальных клеток. Данные этих исследований говорят за то, что в нормальных условиях контактная мембрана горизонтальных клеток не создает заметного сопротивления для тока, текущего вдоль пласта горизонтальных клеток. Таким образом, слой горизонтальных клеток в сетчатке рыб является аналогом возбудимой непрерывной среды. В работе Канеко [92] показано, что через контакты между горизонтальнЯйк клетками рыб могут проникать из одной клетки в другую достаточно крупные молекулы флюоресцирующей краски.
В работе Симона [141} были изучены две популяции горизонтальных клеток сетчатки черепахи. Показано, что горизонтальные клетки, принадлежащие к первой популяции (имеющие большую 416
площадь суммации), электрически связаны между собой, но не с клетками второй популяции. В этом отношении характер связи таков же, как в случае рецепторов рака, где электрически связаны клетки, воспринимающие свет с одним направлением плоскости поляризации.
К особому смешанному типу может быть отнесен синапс между фоторецепторами и горизонтальными клетками в сетчатке рыб и рептилий [10]. Специализированных контактных структур здесь не обнаружено. Однако хемочувствительная постсинаптическая мембрана дендритов горизонтальных клеток глубоко впячивается в пресинаптическую мембрану фоторецепторов. В связи с этим по оценке авторов сопротивление синаптической щели может быть достаточно большим, и между фоторецепторами и горизонтальными клетками существует некоторая электрическая связь. Эта связь, по мнению авторов, должна заметно возрастать при деполяризации пресинаптической мембраны, так как она приводит к увеличению проводимости как пресинаптической мембраны (увеличение проницаемости этой мембраны для ионов кальция), так и постсинаптической мембраны (под влиянием медиатора увеличивается проницаемость этой мембраны к ионам натрия и калия). В связи с этим синаптический ток, генерируемый горизонтальной клеткой в результате выделения медиатора фоторецептором, должен частично затекать в фоторецептор и влиять на МП пресинаптической мембраны. Эти представления удовлетворительно объясняют ряд экспериментальных фактов [12, 36]. На основании этого формулируется гипотеза об обратной положительной связи в работе описанного синапса при взаимодействии химического и электрического компонентов передачи сигнала от фоторецептора к последующему нейрону сетчатки [10].
9.4. «ЭЛЕКТРИЧЕСКИЕ СИНАПСЫ» В ИЕНЕРВНОЙ ТКАНИ
После описания электрических синапсов в нервной ткани животных, стоящих на разных уровнях эволюционного развития, коротко опишем распространение этих структур в других типах тканей.
9.4.1. МИОКАРДИАЛЬНАЯ ТКАНЬ
Высокопроводящие контактные мембраны повсеместно распространены в миокардиальной ткани у очень широкого круга животных. В ряде электрофизиологических работ, выполненных на волокнах Пуркинье сердец копытных животных [162], предсердиях лягушки и крысы [156, 166], желудочке лягушки [3], было показано, что электротоническое влияние распространяется далеко за пределы одной клетки. Например, длина клетки Пуркинье -—150 мкм, а константа длины волокон Пуркинье 2 мм.
27 Общая физиология нервной системы
417
Это указывает на то, что коэффициент передачи между сердечными клетками 0.95 и выше. Такой, высокий коэффициент передачи может быть обеспечен, как показывают расчеты, только в том случае, если средняя проводимость контактных или синаптических мембран в миокарде на 3—4 порядка выше проводимости поверхностной мембраны, т. е. ее удельное сопротивление определяется омами или долями ома [4]. Показано также, что контактные мембраны между сердечными волокнами ведут себя линейно.
Итак, хотя миокардиальная ткань состоит из отдельных морфологически обособленных клеток, однако в электрическом или функциональном отношении она является непрерывной синцитиальной структурой. Колонку миокардиальных клеток без существенных ошибок можно рассматривать как непрерывное волокно, аналогичное мышечному или нервному. Особенности электрического поведения миокардиальной ткани, помимо электрических синапсов, обусловлены еще ветвлением, образованием густых сетей анастомозов. Миокардиальные клетки по существу объединяются в непрерывные трехмерные сети. Как пассивные, так и ак тивные электрические свойства подобных геометрически неоднородных возбудимых систем рассмотрены в ряде работ (см. гл. 4).
Морфологические данные по исследованию контактных мембран миокарда коррелируют с физиологическими. В области контактов найдены специализированные структуры — сближенные участки противолежащих мембран соседних клеток со щелью 20 нм — так называемый щелевой контакт (gap junction),
9.4.2. ГЛАДКОМЫШЕЧНАЯ ТКАНЬ
Представления о миокардиальной ткани, возникшие в последнее десятилетие, целиком относятся и к гладкомышечной. Здесь также показано, что между клетками гладких мышц различных типов у широкого круга животных имеются высокопро-водящие контактные мембраны, т. е. также имеют место электрические синапсы. Это показано как в электрофизиологических исследованиях 128, 120], в которых доказана электрическая природа распространения возбуждения от клетки к клетке и высокий коэффициент передачи, так и в морфологических [62], в которых найдены специализированные структуры между клетками или щелевые контакты. Таким образом, гладкомышечную ткань также необходимо рассматривать как непрерывную трехмерную возбудимую среду.
9.4.3. НЕВОЗБУДИМЫЕ ТКАНИ
Большой неожиданностью было обнаружение электрических синапсов у широкого круга невозбудимых тканей. Впервые в 1964 г. между клетками слюнной железы личинки дрозофилы был обнаружен высокий коэффициент передачи (около 0.9) [111]. В дальнейшем электрическая связь большей или мень-418
шей степени (коэффициент Передали составлял от 0.1 до 0.95) была обнаружена в различных тканях взрослых животных; между клетками печени крыс и мышей, в мальпигиевых канальцах почки, в эпителии мочевого пузыря жабы, в щитовидной железе хомяка и крысы и др.; ме/кду бластомерами на ранних стадиях эмбриогенеза у зародышей лягушки, аксолотля, ряда рыб, морского ежа, морской звезды и др.; между клетками в культурах разных тканей (см. обзоры [42, 1101). Для многих перечисленных объектов были обнаружены морфологические корреляты электрических синапсов: участки сильно сближенных мембран соседних клеток - щелевые контакты [42, 43]. Есть основания предполагать, что для невозбудимых тканей такие контакты имеют иной функциональный смысл, чем для возбудимых [7].
9.5. СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ ЭЛЕКТРИЧЕСКИХ СИНАПСОВ И ИХ ЛОКАЛИЗАЦИЯ
По-видимому, первые работы по морфологии электрических синапсов были выполнены на септированных волокнах [85, 86] и на гигантском моторном синапсе рака [134]. В этих работах было показано, что в электрических синапсах синаптическая щель имеет меньшую ширину, чем в химических. Робертсон предположил, что в области контакта мембраны полностью сливаются. В связи с этим в последующих морфологических работах шел поиск структур с тесным сближением мембран.
Структура такого рода, коррелирующая с электрофизиологически установленной особенностью синаптической передачи, была обнаружена у позвоночных [45] на электромоторных нейронах мормирид. В нервной системе млекопитающих специализированные синапсы были обнаружены в тригеминальном мезенцефали-ческом ядре [91], в ядре Дейтерса крысы [146]. Эти морфологические находки получили затем электрофизиологическое подтверждение (см. выше). Особенностям морфологии чашевидного синапса цилиарного ганглия птиц посвящено несколько подробных работ [60, 153].
В ряде случаев морфологи обнаружили щелевые контакты или слияния мембран, которые пока еще не изучены в физиологических экспериментах. Так, например, были обнаружены специализированные контакты между фоторецепторами аксолотля [58], между нейронами глазодвигательных ядер лягушки и хамелеона [161], между разнообразными нейронами в коре мозжечка гимнотовых рыб и лягушки [144], между дендритами нейронов неокортекса приматов [142] и др. Большой интерес с эволюционной точки зрения представляет обнаружение щелевых контактов у низших многоклеточных, в частности между мышечными отростками эпителиально-мышечных клеток гидры [15, 871.*
* В настоящее время получены данные о существовании электрических синапсов у актиний [139] и с большей вероятностью у иланарий [96].
Более подробные сведения по изучению общей морфологии электрических синапсов можно найти в обзорных работах Паппаса и Ваксмана [191, Питерса, Палея и Уэбстера [211.
9.5.1. ТОНКАЯ СТРУКТУРА ЭЛЕКТРИЧЕСКИХ СИНАПСОВ
Как уже говорилось, первоначально морфологическим субстратом электрической передачи считалось полное слияние контактных мембран и образование общей пятислойной мембраны толщиной около 15 нм [45, 127, 134].
Однако дальнейшее развитие электронномикроскопической техники позволило установить, что в действительности структуры, называемые «тесный контакт», могут быть разного типа: наряду с истинным слиянием мембран встречаются и случаи сближенных мембран, разделенных узкой щелью (gap junction). Эти исследования велись широким фронтом на разнообразных тканях (на эпителии, печени, сердце и др.). Результаты, полученные на одной ткани, помогали понять наблюдения, сделанные на другой. В связи с этим подробный анализ развития представлений о структуре электрически проницаемых контактов выходит за рамки главы [42, 43, 1101.
Паппас и Беннетт [127 ] описали ряд электрических синапсов рыб. Средняя линия в области смыкания мембран кажется прерывистой, а на тангенциальных срезах наблюдается структура, напоминающая веревочную лестницу, причем отдельные полоски лежат на расстоянии 8—9 нм друг от друга. Робертсон еще в 1963 г. [135] описал картину из упакованных гексагональных структур в синапсах на дендритах маутнеровских клеток золотой рыбки. Каждая фасетка повторяется с периодом 9.5 нм и имеет центральный участок диаметром 2.5 нм. В дальнейшем у ряда объектов была описана узкая межклеточная щель и периодическая структура в ней. Так, у дождевых червей в септе были обнаружены щелевые контакты с шириной щели 6.5—7.5 нм, некоторые синапсы содержали пузырьки, напоминающие везикулы химических синапсов [85, 124]. Брайтман и Риз [55] подтвердили наличие гексагональной структуры в электрических синапсах маутнеровской клетки и показали, что ширина щели в нем около 2 нм. Гексагональная структура показана также в септированном аксоне рака [129—131]. По их данным ширина щели в электрическом синаисе аксона рака составляет около 2 нм, период гексагональной решетки имеет порядок 10 нм. Сотело и Ллинас [144] описали электрический синапс в мозжечке гимнотовых рыб, лягушек и млекопитающих. По их данным, ширина щели в нем равна 1.5—2.0 нм, а период решетки 8.5—9.0 нм. Таким образом, данные для разных объектов достаточно сходны. Диаметр центрального канала, через который предположительно осуществляется связь клеток, согласно всем имеющимся электронномикроскопическим данным, равен
примерно 1 нм. Кроме микроскопических методов, наличие перио-дической структуры в щелевых контактах показано также методом рассеяния рентгеновских лучей.
Эксперименты с красителями продемонстрировали, что их молекулы могут проходить через электрический синапс из одной клетки в другую, не выходя в экстраклеточную среду. В частности, такие данные были получены для проциона желтого (молекулярный вес 625) на электрическом синапсе септированного аксона рака [129]. В результате таких экспериментов структура типа «веревочной лестницы» была интерпретирована как совокупность каналов, соединяющих контактирующие клетки, не имеющих выхода в щель. Пейтон, Беннетт и Паппас [129] предложили модель «щелевого контакта с каналами», которая в настоящее время является общепринятой (рис. 9.5).
Предполагается, что межклеточные каналы могут иметь дополнительное значение в переносе молекулы РНК, циклического АМФ и т. д. (11401 и др.). Эти находки на новом уровне ставят старую проблему: синцитиальная ткань или нейронная структура. Становится ясным, что в ряде случаев цитоплазма нервных клеток непосредственно соединяется относительно широкими (диаметром 1.0—1.5 нм) гидрофильными каналами. В связи с развитием современной биохимии это дает повод для разнообразных предположений.
На электрическом синапсе септированного аксона рака получены данные о том, что в мембране каждой из контактирующих клеток имеются глобулы-полуканалы [131 ]. Возможно, что такие полуканалы плавают в мембране и за счет плотной упаковки образуют гексагональную структуру. Два полуканала противолежащих мембран соседних клеток, соединяясь, образуют непрерывный гидрофильный канал между этими клетками. Согласно этой гипотезе, везикулы, обнаруживаемые вблизи электрических синапсов, играют транспортную роль, доставляя глобулы, образующие каналы и другие вещества, к синаптическим мембранам. Это предположение заслуживает серьезного внимания. Дело в том, что везикулы неоднократно были обнаружены в синапсах разных объектов, в то же время функционально смешанный характер синаптической передачи был показан лишь для двух объектов: цилиарного ганглия птиц и нейронов миноги.
В ряде работ показано, что высокопроводящие контактные мембраны электрических синапсов резко увеличивают свое сопротивление при механическом повреждении соседних клеток, при действии гипертонических растворов, при удалении ионов кальция из наружного раствора, при охлаждении, при действии ингибиторов дыхания и окислительного фосфорилирования, при пропускании сильного деполяризующего тока, при увеличении pH, при увеличении концентрации ионов кальция внутри клетки [19, 32, 42, ПО, 126, 128]. Вероятнее всего, в основе разобщающего действия всех этих факторов лежат два разных механизма: либо они способствуют
расхождению противолежащих мембран соседних клеток (гипертония, устранение ионов кальция из наружной среды, увеличение pH), либо они способствуют увеличению концентрации ионизированного кальция внутри клетки (прокол наружной мембраны,
Рис. 9.5. Схематическое изображение щелевого контакта на основании данных электронной микроскопии и сколов замороженных срезов.
А — схема электронномикроскопической картины двух мембран (М, и М2) соседних клеток при поперечном ультратонком срезе, прошедшем через щелевой контакт (щк), основная особенность которого — наличие узкой щели (в 20—30 Пм) между прилежащими мембранами, ifi и Чг — цитоплазмы соседних клеток. Б — та же схема (/), увеличенная в четыре раза (взят участок, обведенный на фрагменте А прямоугольником 1) после обработки препарата гидроокисью лантана, который прокрашивает щель только частично (участки черного цвета в узкой щели между мембранами), участки белого цвета — гидрофобные мостики, которыми соединены через щель обе мембраны (лантан не проникает); на схеме (II) электронномикроскопической картины тангенциального среза (параллельного плоскости мембран в районе щели) через тот же щелевой контакт, который представлен на фрагменте 1 с гексагональной упаковкой гидрофобных мостиков между мембранами (белые кружки), черный фон — это щель, заполненная лантаном. Вертикальные пунктирные линии между I и II указывают на соответствие между мостиковыми структурами на поперечном срезе и кружками на тангенциальном срезе. Черные кружочки в центре белых указывают па существование в центре мостиков гидрофильных структур, заполненных лантаном. В — схема щелевого контакта, увеличенная еще в 5 раз (взят участок, обведенный на фрагменте I прямоугольником 2) с дополнительными элементами (глобулярными структурами ГС) на основании данных, полученных при скопах мембран после замораживания, два типа глобулярных структур (плотные и редкие точки) встроены в мембраны, ломаными линиями доказаны зоны соединения (ЗС) наружных глобул двух противолежащих мембран, с образованием непрерывного гидрофильного канала (ГК), проходящего через обе мембраны и щель (щ).
отравление цианидом или динитрофенолом, вспрыскивание в клетку ионов кальция). Механизм разобщающего действия ионов кальция при росте их внутриклеточной концентрации не выяснен.
В настоящее время в литературе общепринятыми являются представления о том, что морфологическим субстратом электрических синапсов являются «щелевые контакты с каналами». В большинстве изученных случаев это, по-видимому, так. Однако
возможны и другие варианты. Так, в цилиарном ганглии птиц электрическая передача обусловлена большой площадью контакта (порядка 1000 мкма) и миелиновой изоляцией синапса. В спинном мозге лягушки связь, по-видимому, обусловлена параллельным ходом дендритов мотонейронов, не разделенных глией,’иЛт. д. Расчеты показывают, что при обычной площади синапса и ширине щели в 20 нм может быть получена достаточно хорошая электрическая связь двух клеток за счет низкого удельного сопротивления синаптических мембран — порядка 1^Ом-сма (см. ниже).
9.5.2. ЛОКАЛИЗАЦИЯ ЭЛЕКТРИЧЕСКИХ СИНАПСОВ
В настоящее время показано существование областей тесного сближения мембран, которые считаются морфологическим субстратом электрического синапса, с самой разной локализацией. Так, в работах Беннета и др. в нервной системе рыб были выявлены синапсы с самой разной локализацией: аксо-соматические, аксо-дендритные, дендро-дендритные, сомато-соматические, дендро-соматические и аксо-аксональные [45, 49—51, 117, 1271 (см. также рис. 9.3). В коре мозжечка разных видов животных показаны аксо-дендритные, дендро-дендритные, сомато-соматические и дендро-соматические электрические синапсы [144].
Кроме того, аксо-соматические электрические синапсы были обнаружены на гигантских нейронах ядра Дейтерса [100, 147] и на ганглиозных клетках сетчатки приматов [64]; аксо-дендритные синапсы — на гигантских нейронах ядра Дейтерса [99]; дендро-дендритные электрические синапсы — в обонятельной луковице крысы [131], в неокортексе приматов [142], на нейронах нижней оливы кошки и обезьяны резус [145]; сомато-соматические синапсы — на нейронах тригеминального мезенцефаличе-ского ядра мыши [91 ] и в вентральном кохлеарном ядре крысы [145]; дендро-соматические синапсы — в неокортексе приматов [142] и в вентральном кохлеарном ядре крысы [145]; аксо-аксональные синапсы — у беспозвоночных, в частности это гигантский моторный синапс рака [1351, у рыбы-шара и рыбы Саргассова моря [49].
Электрическая связь между клетками может быть образована и некоторым косвенным образом: одно и то же афферентное волокно может образовывать электрические синапсы с телами или дендритами разных нейронов, таким образом связывая их. Морфологические доказательства этого типа связи были получены на спинальных электромоторных нейронах электрического угря [117].
9.6. МОДЕЛИ РАБОТЫ ЭЛЕКТРИЧЕСКИХ СИНАПСОВ
При моделировании работы электрических синапсов в основном рассматривались две схемы организации синапса: «тесный контакт» и «щелевой контакт без каналов». В первом слу-123
чае предполагалось слияние пре- и постсинаптической мембран так, чтобы ток в этой области мог бы идти только из одной клетки в другую, не выходя в наружную среду (рис. 9.6, А, Б). В случае
Рис. 9.6. Схематическое изображение и эквивалентные схемы двух типов электрических синапсов.
А п В — «тесный контакт», А — емкость синаптической мембраны не учитывается, Б — с учетом емкости синаптической мембраны; В — «щелевой контакт без каналов». яв11 и Явх2 — сопротивление мембраны первой и второй контактирующих клеток; для «тесного контакта» Йк и Св — сопротивление и емкость контактных мембран; для «щелевого контакта» Дк — сопротивление, обусловленное свойствами контактных мембран и среды, заполняющей щель, Лщ — сопротивление утечки через щель, 1 И и, , — токовые и регистрирующие электроды.
щелевого контакта принималось, что пре- и постсинаптическая мембраны разделены некоторым промежутком, так что часть тока вытекает через него в окружающую среду (рис. 9.6 В). Моделей с щелевым контактом в современном смысле этого слова, т. е. с наличием каналов, осуществляющих протоплазматическую связь клеток в зоне синапса, не существует,
Модель TecHoto контакта наиболее подробно проанализирована в работе Беннетта [381. Сопротивление цитоплазмы и наружной среды принималось пренебрежимо малым. Рассматривалась задача: как определить входные сопротивления клеток и сопротивление синаптической мембраны, если в каждую из клеток введены токовый и регистрирующий электроды. Если через оба токовых электрода пропускать токи такой силы, чтобы потенциалы обеих клеток стали равны, то при этом ток через синапс не идет, клетки «развязываются» и их входные сопротивления легко определяются
V V
= -у- .
Такой прием был применен в работе Ватанабе и Грундфеста [1601. Беннетт ввел понятие коэффициентов передачи, т. е. отношений VJV-l и Т]/Е2, и показал, что эти коэффициенты, вообще говоря, не равны друг другу и зависят от входных сопротивлений клеток. Действительно,
ь ____V IV — г^иа —
® 1 ’
ь V /V — — 1
/Лл11+,Лй-/ + Ла/Ли1 •
Если сопротивление синаптической мембраны (ДД стремится к нулю, то коэффициент передачи стремится к 1.
Далее Беннетт рассматривал модель электрического синапса с учетом емкостей мембран. Принималось, что потенциал первой клетки — заданная функция времени, и определялся ход изменения потенциала во второй клетке. В частности, рассматривалось, как будет меняться потенциал во второй клетке (Уа) при возникновении импульса в первой клетке, какую амплитуду будет иметь и насколько будет запаздывать максимум потенциала во второй клетке по сравнению с первой.
Решение показало возможность возникновения некоторых парадоксальных ситуаций. Так, если емкость синаптической мембраны велика по сравнению с емкостью мембраны второй клетки, напряжение во второй клетке зависит от тока через контакт (а этот ток может быть в значительной степени емкостным), то последний определяется не величиной потенциала в первой клетке, а скоростью его изменения. При этих условиях потенциал во второй клетке может начать падать раньше, чем в первой. Возможны также возникновения двухфазных ПСП в ответ на однофазный пресинаптический потенциал.
Модель щелевого контакта без каналов неоднократно анализировалась в литературе [46, 65, 951. Ее анализ проводился для оценки того, какая доля тока из пресинаптического окончания затекает в постсинаптический нейрон в обычных химических синапсах. Экклс и Егер [671 для случая, когда щель имеет ширину
20 нм, Диаметр синапса 2 мкм, удельйое Сопротивлейие Щелевой среды 100 Ом-см3, а сопротивления пре- и постсинаптических мембран равны 500 Ом-см3, пришли к следующей оценке: около 99.9% тока будет утекать через синаптическую щель наружу. Еще большую утечку получил Катц [95]. В упомянутых работах даны приближенные оценки, полученные на основе существенных упрощений.
В работе Мартина и Пилара [116] были изучены пассивные электрические свойства нейронов цилиарного ганглия и преси-наптических окончаний, их морфология, а затем была построена аналоговая модель электрической передачи в этом синапсе, который рассматривался как щелевой контакт. Входные сопротивления нейронов и пресинаптических окончаний, а также их постоянные времени были близки (27.6 и 24.8 МОм, 1.55 и 1.48 мс соответственно). Эти измерения были проведены при пропускании толчка тока через внутриклеточный электрод, введенный в клетку или в окончание, и характеризовали свойства системы, а не отдельных элементов, так как при пропускании тока часть его утекала через электрический синапс. Средние значения коэффициентов передачи, которые могут быть получены из данных Мартина и Пилара, равны 0.15 для передачи с окончания на клетку и 0.1 для передачи в обратном направлении. Синаптическое окончание занимает около 25% поверхности ганглионарной клетки, имеющей диаметр порядка 40 мкм. Ширина щели равна 20 нм. Аналоговая модель была набрана из сопротивлений и емкостей. Сопротивление щелевой среды было принято за 200 Ом-см2. Элементарные сопротивления и емкости подбирались соответственно площади колец из предположения однородности (вся синаптическая зона делилась на 9 колец равной ширины) и притом так, чтобы получить пассивные характеристики и коэффициенты передачи, совпадающие с экспериментальными. К сожалению, переменных в модели было слишком много, и точных значений параметров синапса таким путем выявить не удалось. Однако важным является заключение, что в таком большом синапсе наблюдаемые явления можно объяснить при столь большом сопротивлении синаптических мембран, как 750 Ом-см2. Авторы предположили, что асимметрия в коэффициенте передачи может определяться различной емкостью пре- и постсинаптических мембран.
В ряде работ были получены более точные аналитические оценки свойств щелевого контакта [4, 5, 88, 167 ]. Основной вывод всех этих работ состоит в том, что заметные коэффициенты передачи, а следовательно, и эффективная работа электрического синапса обычных размеров могут быть обеспечены лишь при низких сопротивлениях синаптической мембраны (порядка 1 Ом-см2). Расчеты показали, что эффективность синапса может быть повышена при заполнении тонкой синаптической щели жироподобными веществами с высоким удельным сопротивлением. Такой заполнитель не сильно мешает продольному току течь из клетки в клетку (щель весьма тонка), но значительно уменьшает утечку через щель.
По-видимому, именно такая ситуация существует в синапсах цилиарного ганглия цыпленка.
В работах Маркина и Пастушенко [18, 201 рассмотрено на модели распространение импульса по септированному аксону, где септы рассматриваются как синапсы типа плотного контакта, а в работе Хеппнера и Плонси [881 та же задача рассмотрена для волокна с щелевыми синапсами. В работах Маркина и Пастушенко оценено снижение скорости проведения, обусловленное наличием септ. При некоторых условиях эту скорость можно рассчитывать, равномерно распределяя сопротивление септ по всей длине волокна и добавляя его к сопротивлению аксоплазмы.
Как говорилось выше, у ряда объектов (сердечный ганглий омара, нейроны пиявки, моллюсков) коэффициент передачи зависит от частоты переменного тока. Обычно это объясняется фильтрующими свойствами отростков аксонов, образующих электрический синапс. Однако легко сообразить, что такой же особенностью должен обладать чисто омический электрический синапс между сомами двух клеток (см. рис. 9.6, Л). При пропускании постоянного тока коэффициент передачи будет равен 2/7?Е12+ +Rk, какая-то доля напряжения будет падать на сопротивлении синапса — эта доля будет тем больше, чем меньше входное сопротивление клетки. При пропускании переменного тока сопротивление синапса останется тем же, а сопротивление клетки упадет, так как параллельно с омическим сопротивлением ее мембраны включена мембранная емкость, через которую тоже может идти переменный ток. По этой причине большая доля напряжения будет падать на сопротивлении синапса, и коэффициент передачи будет тем ниже, чем выше частота переменного тока.
На основании таких соображений была построена простая модель электрической связи клеток Ретциуса пиявки [721. Модель привела к несколько неожиданному выводу: оказалось, что простейшее предположение об омической природе электрического синапса позволяет объяснить все основные данные как по передаче медленных изменений потенциала, так и по передаче импульсов. Не возникло необходимости учитывать кабельные свойства участков аксонов, соединяющих эти клетки. Параметры модели (сопротивление мембраны нейрона — 15.7 мОм, ее емкость — 0.0021 мкФ, сопротивление электрического синапса — 34.9 мОм) вполне разумны. Однако в случае других объектов учет кабельных свойств аксонов, по-видимому, необходим.
Как уже говорилось, эффективность электрического синапса зависит от величины входного сопротивления клетки. Поэтому ясно, что синапс без выпрямления, связывающий две клетки — большую и маленькую — может иметь совершенно разную эффективность в зависимости от направления своего действия. В частности, импульс в большой клетке может вызывать синхронный импульс в маленькой, в то же время импульс в маленькой создаст лишь ВПСП той иди иной величины в большой клетке. Для элек-
трического синапса возможен эффект «геометрического выпрямления». Ц
Входное сопротивление клеток зависит не только от их величины, но и от удельного сопротивления их мембраны; поэтому всякое изменение сопротивления мембраны меняет электрическую связь клеток. В частности, если на одну из электрически связанных клеток будут действовать обычные химические синапсы, то они, «продырявливая» мембрану, будут снижать входное сопротивление клетки и уменьшать эффективность действия на нее электрических синапсов (рис. 9.7, Л). Управление эффективностью электрических синапсов с помощью химических было обнаружено на нейронах буккального ганглия заднежаберного моллюска [107] и подробно изучено [149]. Регистрировались две клетки разного размера. Коэффициент передачи от большой клетки к маленькой был больше чем в обратном направлении. Медленные потенциалы передавались лучше, чем импульсы.
При действии на клетки химических синапсов коэффициент передачи убывает во много раз. Входное сопротивление клеток падает примерно вдвое. В этих опытах «развязывание» клеток, соединенных’электрическим синапсом, было осуществлено возбуждением тормозящих синапсов и сопровождалось гиперполяризацией обеих клеток. Правда, это торможение не было очень глубоким, и клетки можно было возбудить через другие возбуждающие пути.
Эти эксперименты содержат два очень интересных момента, отмеченных авторами: во-первых, коэффициент передачи падает гораздо сильнее, чем это ему полагается по простой формуле к — р . Во-вторых, коэффициент передачи падает для мед--г «ь
ленных потенциалов и почти не меняется для импульсов. Ясно, что клетки связаны где-то аксонными мостиками и на эти мостики тоже действуют химические синапсы. Если это так, то регуляция связи идет двумя путями: меняется и входное сопротивление клеток, и константа длины линии передачи, связывающей их. Другой вариант объяснения — химические синапсы как-то прямо действуют на мембраны электрического синапса — кажется маловероятным.
В работе Сотело и соавт. [145] было показано электронномикроскопически, что на дендритах нейронов нижних олив в области
Ряс. 9.7. Управление эффективностью электрического синапса с помощью химического синапса.
А — структурная и эквивалентная электрическая схемы, эффективное входное сопротивление нейрона зависит от активности химического синапса, так как при этом меняется Яр; В — гломерула нижней оливы, д — дендриты нейронов нижней оливы, ПТ —пре-синаптические терминали, стрелки показывают место щелевых контактов, В — предполагаемое действие химических синапсов на связь нейронов нижних олив, слева клетки элекгротонически связаны, справа — клетки электротонически разделены вследствие шунтирования сопротивления дендритной мембраны в гломеруле при выделении ме-» диатора из пресинаптических окончаний [10&1,
щелевых контактов расположены также обычные химические синапсы (рис. 9.7, Б). По мнению авторов, эти химические синапсы могут разрывать электрическую связь между дендритами, меняя сопротивления наружных мембран как пре-, так и постсинаптического дендрита [108].
Бызовым предложена аналоговая электрическая модель работы синапса фоторецептор—горизонтальная клетка [9]. В ней задавались небольшие изменения сопротивления пресинаптической мембраны фоторецептора как функция мембранного потенциала, а также большие изменения сопротивления постсинаптической мембраны горизонтальной клетки как функция концентрации медиатора в синаптической щели. На основании морфологических данных принимались определенные значения сопротивления щели. По этой модели в результате увеличения или уменьшения выделения медиатора в синаптическую щель и соответствующего изменения синаптического тока менялось падение напряжения на пресинаптической мембране фоторецептора, определяемое долей синаптического тока, затекающего в рецептор. Анализ показал, что в такой модели электрическая связь между фоторецептором и горизонтальной клеткой определяет обратную положительную связь в работе химического синапса. Автор модели подчеркивает, что небольшие изменения сопротивления щели сильно влияют на эффективность обратной положительной связи, имеющей чисто электрическую природу. Используя эти идеи, существенно было бы проанализировать в подобном плане и другие химические синапсы, имеющие относительно большие площади пре- и постсинаптических мембран.
Процессы суммации для электрических синапсов теоретически слабо изучены. В работе Беркинблита и др. [61 показано, что электрические синапсы «щелевые без каналов», вероятно, малопригодны для суммации: если суммируется действие больших электрических синапсов, то один синапс дает почти максимально возможный потенциал, и другие к нему мало что добавляют; если же суммируется действие маленьких синапсов, то максимальный пост-синаптический потенциал составляет лишь малую долю пресинаптического.
При описании работы Ауэрбаха и Беннетта [34 J на пресноводной летающей рыбе уже говорилось, что авторы проанализировали электрическую связь целой сети мотонейронов. Другая детальная модель для системы нейронов, связанных электрическими синапсами, была развита Геттингом [76J. Модель должна была объяснить поведение системы из 30 триггерных нейронов плеврального ганглия тритонии. Геттинг предположил, что в этой системе каждая клетка связана с каждой, все коэффициенты передачи и входные сопротивления нейронов одинаковы и, наконец, что емкостью синаптической мембраны можно пренебречь. Эти предположения экспериментально достаточно обоснованы. Принято также, что синапсы прямо связывают сомы кцедок, хотя эю за-
йедомб не так (см. выше об электрических синапсах моллюсков). Входное сопротивление такой системы клеток равно:
п__ (Д14~ Д»)
“ (iV1) 7?! н-тга ’
где — входное сопротивление одной клетки, Т?2 — синаптическое сопротивление, (У+1) — число клеток в группе.
Входное сопротивление можно выразить также через коэффициент передачи:
здесь k — коэффициент передачи. Если учесть, что средний коэффициент передачи равен 0.2, а число клеток в группе 30, то получим, что входное сопротивление системы связанных клеток будет примерно на порядок меньше, чем у отдельной клетки.
Для проверки модели измерялось входное сопротивление системы в покое (порядка 4.35 МОм) и после того, как клетка, в которой производились измерения, и одна из соседних клеток связывались системой фиксации напряжения. Во втором случае шунтирование измеряемой клетки уменьшалось (в частности, ток вообще не уходил в фиксируемую клетку). Модель предсказывает в этих условиях рост входного сопротивления системы на 20%. Экспериментально наблюдался рост входного сопротивления на 17%. Предсказания о постоянной времени системы выполнялось хуже, по-видимому, вследствие неучета аксонов, в пользу чего говорит измерение постоянной времени нейрона моллюска, не имеющего электрических синапсов.
Поскольку ВПСП зависит от входного сопротивления системы и ее постоянной времени, Геттинг пришел к выводу, что система связанных клеток должна быть устойчива к синаптическому входу, действующему на отдельный нейрон. Напротив, при синхронном приходе синаптических сигналов на все клетки системы они будут менять потенциал одновременно, токи между ними течь не будут, шунтирование будет отсутствовать и систему будет легче возбудить (см. также [44]). Таким образом, система связанных нейронов должна быть помехоустойчивой, но быстро и мощно отвечать на нужный сигнал.
На основе описанной модели, используя аналоговое вычислительное устройство, Геттинг и Уиллоус [78] изучили возникновение пачек импульсов в сети нейронов, связанных электрическими синапсами. Несколько одновременно возбужденных нейронов возбуждали своих соседей, при этом постимпульсная следовая гиперполяризация была невелика и кратковремениа вследствие шунтирующего действия остальных нейронов. Частота возбуждения нейронов сети постепенно возрастала, и когда большая часть нейронов возбуждалась синхронно, то следовая гиперполяризация не шунтировалась, приобретала большую амплитуду и длительность
и обрывала пачку импульсов. Модель хорошо соответствовала работе нейронной сети тритонии, обеспечивающей при помощи периодических пачек плавательные движения.
Система нейронов, связанных электрическими синапсами, является одним из частных случаев синцитиальных тканей. Для описания электрического поведения синцитиальных двумерных и трехмерных структур типа сердца или гладкой мышцы была развита достаточно детальная теория [41. Была показана связь входных сопротивлений и входных емкостей таких систем с их структурной организацией, зависимость распределения потенциалов в таких системах от конфигурации источников тока. Проанализирована связь элементарных свойств мембраны с системными свойствами таких структур, особенности возникновения и распространения в них возбуждения. Низкое входное сопротивление системы по сравнению с 7?в1 отдельного элемента, более короткая постоянная времени, помехоустойчивость — общие свойства всех
синцитиальных структур.
В модельных опытах были количественно проанализированы свойства узла ветвления — основного элемента крупноячеистых синцитиальных структур — выявлены особенности проведения возбуждения через него, процессы суммации в узле и т. д. [2]. Слияние большого количества приходящих тонких волокон в одно толстое волокно эквивалентно нейрону (толстое волокно), на котором оканчивается большое количество электрических синапсов типа щелевого контакта с каналами без выпрямления. Здесь толщина приходящего волокна при прочих равных условиях определяет эффективность синапса. Такой тип электрических синапсов, как показывает анализ, имеет широкие функциональные возможности для пространственной суммации (эти возможности не беднее, чем у химического синапса) в отличие от рассмотренного ранее типа со щелью, но без каналов. Точность временного совпадения сигналов, необходимая для пространственной суммации, определяется в этом случае длительностью ПД в пресинаптических волокнах и постоянной времени нейрона.
9.7. ФУНКЦИИ ЭЛЕКТРИЧЕСКИХ СИНАПСОВ
9.7.1. БЫСТРОДЕЙСТВИЕ И НАДЕЖНОСТЬ
Ввиду того, что синаптическая задержка в электрических синапсах короче, чем в химических, обычно высказывается предположение, что эти синапсы стоят в тех цепях, которые обслуживают срочные реакции организма. Эта точка зрения находит известную поддержку в том, что электрические синапсы у ряда животных входят в области нервной системы, обеспечивающие реакцию бегства, спасения от опасности. Так, у дождевого червя система гигантских волокон обеспечивает координированное сокращение тела типа вздрагивания, отдергивания [22 L У пиявок ги-
гантские нейроны тоже обслуживают срочные сокращения продольной мускулатуры [151]. Электрические синапсы, образуемые гигантским латеральным аксоном на мотонейронах рака, входят в систему, обеспечивающую быстрое подгибание брюшка или убегание [169]. Точно так же у летучих пресноводных рыб электрические синапсы расположены в системе, предназначенной для спасения бегством [34], а у тритонии в системе рефлекса уплывания [76].
Следует, однако, заметить, что реальный выигрыш во времени электрические синапсы могут дать лишь в многонейронных цепях. Разница в одну-две миллисекунды не имеет практического значения. Поэтому быстродействие синапсов имеет жизненное значение только для аннелид. Если сигнал должен проводиться через несколько десятков ганглиев, а длительность синаптической задержки при температуре обитания этих животных имеет порядок 2—4 мс, то выигрыш составляет десятые доли секунды. У ракообразных и рыб наличие электрических синапсов в системе спасения бегством может быть связано с другими их свойствами. Электрический синапс не требует синтеза медиатора, он малоутомляем, выдерживает высокую частоту импульсации. Вот эта его надежность и постоянная готовность к работе может быть причиной его расположения в жизненно важных рефлекторных путях.
9.7.2. РОЛЬ ЭЛЕКТРИЧЕСКИХ СИНАПСОВ ДЛЯ СИНХРОНИЗАЦИИ РАБОТЫ НЕЙРОНОВ
Электрическая связь двух или нескольких клеток должна способствовать синхронизации их работы. Клетка более деполяризованная, чем другие, будет шунтироваться остальными клетками, а клетка, которая остается в своей деполяризации, будет получать деполяризующий ток от своих соседей и подтягиваться к общему уровню. Ситуация здесь такая же, как в синусном узле. Для осуществления этой функции электрические синапсы должны быть симметричными.
Простейшие синхронизирующие системы состоят всего из двух нейронов и обеспечивают одновременность работы органов двух сторон тела. Так, в каждом сегменте пиявки имеется два гигантских мотонейрона, аксоны которых иннервируют продольные мышечные волокна контралатеральной половины тела [151]. Эти мотонейроны связаны эффективными электрическими синапсами без выпрямления. Б результате возбуждение одного из этих мотонейронов приводит к возбуждению парного мотонейрона и тем самым к одновременному сокращению всей продольной мускулатуры сегмента. Таким образом, сокращение оказывается симметричным и происходит на обеих сторонах тела практически без задержек. Система из двух связанных нейронов обеспечивает одновременность разряда электрических органов обеих сторон тела у электрического сома [50].
2g Общая физиология нервной системы 433
Й других случаях электрически связаны не две клетки, а нё-сколько десятков нейронов, образуя некоторый аналог возбудимой среды. Обычно это мотонейроны, которые должны работать максимально синхронно и вдобавок нередко с высокой частотой, что требует надежности синаптической передачи. Такой характер связи встречается в группах мотонейронов рыб, управляющих высокочастотной работой эффекторных органон, таких как электрические органы, мышцы, управляющие взмахами плавника летучих рыб, мышцы плавательного пузыря рыбы-жабы, которым эта рыба издает звуки, и т. д. Такие же связи существуют и между мотонейронами, которые должны сработать дружно, синхронно, не обеспечивая высокочастотной ритмичной работы, например, нейроны глазодвигательных ядер рыб, вестибулярных ядер амфибий и млекопитающих и др.
9.7.3. ВОЗНИКНОВЕНИЕ (ФОРМИРОВАНИЕ) ЗАЛПОВ ИМПУЛЬСОВ В СИСТЕМАХ
ЭЛЕКТРИЧЕСКИ СВЯЗАННЫХ КЛЕТОК
В нейронной системе, координирующей «реакцию убегания» морского моллюска тритонии, была обнаружена триггерная система из электрически связанных нейронов, запускающих эту реакцию [163]. Эта система состоит примерно из 30 нейронов. При возбуждении одного из них импульсы возникают и в соседних нейронах, после задержки на время проведения возникают в следующих нейронах, затем вновь в первом ит. д. Возникает система с положительной обратной связью, в которой формируется залп импульсов. Такой залп можно вызвать, искусственно раздражая всего один нейрон триггерной группы. Механизм прекращения залпа связан со следовой гиперполяризацией клеток после пика и взаимодействием гиперполяризации от разных нейронов через невыпрямляющие электрические синапсы [78]. В этом смысле электрические синапсы позволяют клеткам выравнивать не только уровень возбуждения, но и уровень торможения.
9.7.4. ЗНАЧЕНИЕ ВЫПРЯМЛЕНИЯ В ЭЛЕКТРИЧЕСКИХ СИНАПСАХ
Обычные химические синапсы обеспечивают направленную передачу сигнала. Очевидно, смысл выпрямления в электрических синапсах также состоит в том, чтобы не пропустить сигналы в неправильном направлении. Наиболее четко выпрямление обнаружено в моторном синапсе рака, на мотонейронах плавников летучих рыб и на мотонейронах пиявок. Во всех этих случаях мотонейроны полифуикциональны. Они могут участвовать не только в том движении, которое запускается электрическими синапсами, но и в менее экстренных движениях, запускаемых другими входами. Очевидно, следует озаботиться, чтобы при работе от других входов сигнал от мотонейрона не попал в систему с электрической 434
передачей, что вызвало бы совсем другой режим работы. Так, например, у летучей рыбы при полете мышцы плавников работают от электрической системы. В этом режиме все мотонейроны разряжаются весьма синхронно и часто. В то же время при обычном плавании грудные плавники рыбы тоже работают, но в другом режиме. Они управляются небольшим числом мотонейронов, работающих несинхронно и получающих сигналы через химический синапс. Если бы сигнал от мотонейронов мог пройти в гигантское волокно, связывающее все мотонейроны, это повлекло бы срабатывание всех мотонейронов и резкий рывок плавника. Кроме того, импульс ушел бы по гигантскому волокну и попал в другие системы организма (в систему маутнеровских клеток), с которыми гигантские волокна связаны электрически. Совершенно такая же ситуация и в случае моторного синапса рака. Мотонейроны его брюшка могут работать от других входов, которые вызывают медленные плавные движения. Импульсы из мотонейронов не попадают в гигантское волокно, что привело бы к другому режиму работы.
Интересно, что «развязывание» системы нейронов может быть обеспечено не только выпрямляющими синапсами. Электрические «мостики», которые работают как фильтры, пропуская более медленные сигналы и не пропуская импульсы, тоже могут способствовать раздельной работе нейронов. Так, например, в глазодвигательном ядре рыб одни синаптические входы оканчиваются на дендритах клеток и вызывают в них пики. При этом каждый мотонейрон работает независимо от других. Все ядро обеспечивает плавное движение глаза. Напротив, вход, оканчивающийся на сомах этих же мотонейронов, создает более медленные ВПСП, которые через электрические «мостики» выравнивают уровень потенциала всех нейронов ядра и приводят к их дружному срабатыванию, что обеспечивает резкий скачок глаза [97].
Как отмечалось в разделе о моделировании работы электрического синапса, односторонняя передача может быть обусловлена различием в размерах связанных нейронов. Кроме того, связь нейронов может регулироваться влиянием химических синапсов на эти нейроны. Спира и Беннетт [1491, изучавшие такую регуляцию на буккальном ганглии моллюска, высказывают гипотезу, что одновременное срабатывание электрически связанных клеток вызывает резкое расширение глотки, ведущее к захвату добычи. Напротив, при действии химических синапсов те же мотонейроны начинают работать независимо, обеспечивая более локальные сокращения мышц глотки, связанные с продвижением пищи в желудок.
Ллинас [108] высказывает интересные соображения о функциях электрических синапсов между дендритами нейронов нижних олив. Он предположил, что все нейроны нижних олив связаны и образуют непрерывную возбудимую среду. Аксоны нейронов, ркружающих нижние оливы, окднцивщотся на тех же дендритах,
28* 435
где расположёны и электрические синапсы. Работа химических синапсов приводит к «развязыванию» нейронов нижних олив (рис. 9.7, В). В зависимости от того, какое движение должно быть совершено, на системе нижних олив возникает тот или иной рисунок, те или иные группы остаются связанными или работают независимо. А это в свою очередь ведет к управлению клетками Пуркинье мозжечка, а через них и нейронами моторных нисходящих трактов.
9.7.5. РОЛЬ ЭЛЕКТРИЧЕСКИХ СИНАПСОВ В РЕЦЕПТОРНЫХ СИСТЕМАХ
Электрические связи достаточно распространены в сенсорных системах как беспозвоночных, так и позвоночных животных. Они связывают тактильные рецепторы пиявок, волосковые клетки органов равновесия моллюсков, нейроны глаз рака и лимулюса, горизонтальные клетки рыб и черепах. Выдвинут ряд гипотез о роли электрической связи в таких системах. Одно из предположений состоит в том, что такая связь расширяет рецептивные поля и сглаживает случайные колебания сигнала. Согласно другой гипотезе, связь горизонтальных клеток в сетчатке играет роль, аналогичную латеральному торможению и позволяет подчеркивать края и выделять контуры объектов.
В основе последней гипотезы лежат следующие факты и соображения. При исследовании на ЭВМ модели слоя горизонтальных клеток [29], сформулированной на основании экспериментальных данных [11, 156], было показано, что синаптический ток, генерируемый горизонтальными клетками при имитации однородного освещения сетчатки, существенно не меняется при изменении общей интенсивности света в довольно широких пределах. В случае неоднородного освещения сетчатки изменения мембранного потенциала горизонтальных клеток при переходе через границу изменения интенсивности света имеют довольно плавный размытый характер, тогда как величина синаптического тока горизонтальных клеток претерпевает резкий скачок от минимальных значений до максимальных между соседними горизонтальными клетками, через которые проходит граница изменения интенсивности света. Этот факт в сочетании с гипотезой Бызова об обратной связи в работе синапса [9] приводит к представлению, что высокая электрическая связь между горизонтальными клетками, организующая их в непрерывный электрический слой, может действительно приводить к подчеркиванию края и выделению контуров.
9,7.6. СРАВНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ И ЭЛЕКТРИЧЕСКИХ СИНАПСОВ
Подробное сравнение свойств электрических и химических синапсов проведено в работах Беннетта [39,411. Мы остановимся лишь на некоторых центральных моментах этого вопроса.
Быстродействие.В химическом синапсе процесс передачи включает в себя ряд звеньев: выделение переносчика, его диффузию через щель, взаимодействие с рецептором и лишь затем изменение проницаемости постсинаптической мембраны, которое вызывает синаптический ток и ПСП. Тем не менее длительность всех этих процессов весьма мала, и у млекопитающих время синаптической задержки составляет обычно 0.2—0.3 мс, а у холоднокровных животных при 20° 0.3—1 мс. В электрическом синапсе латентный период ПСП практически отсутствует. Однако для возникновения пика требуется конечное время, которое тратится на зарядку емкости мембраны постсинаптической клетки. Если сопротивление в синапсе велико и постоянная времени пост-синантической мембраны тоже значительна, то в электрическом синапсе может возникнуть задержка не меньшая, чем в химическом. Тем не менее в экспериментальных работах в электрических синапсах наблюдались столь короткие задержки, как 0.1 мс [50, 74, 160] или 0.05 мс и менее [34, 56].
Односторонность передачи. В химическом синапсе передача является односторонней. Для электрического синапса правилом является скорее двусторонняя передача. Выпрямляющие свойства электрического синапса описаны для небольшого числа объектов: моторного синапса рака, синапсов пиявки и аплизии, синапсов зрительной системы лимулюса (и, возможно, саранчи) и, наконец, синапсов на мотонейронах грудных плавников клинобрюшки. Сопротивление мембраны моторного синапса рака в зависимости от направления тока меняется примерно в 50 раз. Хорошее выпрямление показано и для электрических синапсов пиявки. В электрических синапсах клинобрюшки сопротивление синаптической мембраны меняется в 2—3 раза.
Усиление. Мощности, развиваемые в пре- и в постсинаптических структурах, в случае химического синапса никак не связаны между собой. В пресинаптическом волокне энергия импульса тратится лишь на выделение медиатора, который играет роль пускового механизма для постсинаптической мембраны. Генерация ПСП в постсинаптической клетке обеспечивается ее собственными ресурсами. Напротив, в электрическом синапсе мощность, развиваемая прёсинаптическим волокном, должна непосредственно вызвать возбуждение. Поэтому входные сопротивления этого волокна и постсинаптической клетки должны быть согласованы между собой. Так, например, с помощью электрического синапса, образованного тонким волокном, невозможно возбудить большой нейрон или большое мышечное волокно, входное сопротивление которых низко. Здесь было бы необходимо иметь предварительное плавное расширение пресинаптического волокна и большую площадь контакта для соответствующего увеличения мощности ЭДС пресинаптического волокна. Напротив, в случае химического синапса возбуждение передается без таких приспособлен
ний, и в этом смысле химический синапс осуществляет усиление сигнала.
Возможность торможения. Такая возможность для химического синапса очевидна; в них знаки изменения потенциала в пре- и в постсинаптических элементах могут быть никак не связаны между собой. Знак ПСП определяется химической природой медиатора и рецептора. Напротив, электрический синапс плохо подходит для передачи торможения, и поэтому во всем предыдущем изложении мы встречались только с возбуждающими синапсами. Впрочем, если в одной из двух электрически связанных клеток под действием химического синапса возникнет гиперполяризация, то она будет передана и во вторую клетку (см. выше о синхронизующих синапсах). Специализированные тормозящие конструкции были описаны только для маутнеровских клеток рыб [69, 70, 75, 99]. Пресинаптическое волокно подходит к аксонному холмику маутнеровской клетки и, по-видимому, отделяется от нее щелью. Пресинаптическая терминаль скорее всего невозбудима. Когда по пресинаптическому волокну приходит импульс, то из терминали ток вытекает наружу. Этот ток выходит наружу через соматическую мембрану маутнеровской клетки. Как правило, зона электрического синапса, где ток втекает в клетку, не играет роли, но в случае маутнеровских клеток эта зона—самый возбудимый участок нейрона, и его гиперполяризация тормозит клетку. В отличие от химического торможения, электрическое не сопровождается снижением входного сопротивления нейрона. Фактически этот способ торможения аналогичен действию анода при искусственном раздражении. С этой точки зрения описанное устройство не есть истинный электрический синапс со специализированными мембранами. Его работа обусловлена сильной эфаптической связью за счет высокого сопротивления межклеточной среды. С помощыо’’такого же механизма маутне-ровские клетки могут тормозить близлежащие нейроны продолговатого мозга [69 , 70 , 99].
Описанный способ торможения требует создания высокого сопротивления внеклеточной среды и организации специальной структуры (например, аксонная чашечка маутнеровской клетки) для достаточно равномерной гиперполяризации аксонного холмика. Он, очевидно, может функционировать только тогда, когда в нейроне есть участок с особо высокой возбудимостью; при одинаковости порогов всей йембраны ток возбудит ту ее зону, где он будет вытекать наружу.
Наряду с этими недостатками электрическое торможение имеет и преимущества, главное из которых быстродействие; для химического торйожения, как правило, используется вставочный нейрон, вырабатывающий тормозящий медиатор, что приводит по крайней мере к двум синаптическим задержкам. Это особо важно для маутнеровских клеток, которые участвуют в реакции ускользания рыбы от опасности, активируя мускулатуру одной 438
половины тела и обеспечивая его быстрый изгиб, возбуждение одной маутнеровской клетки -немедленно запирает симметричную, предотвращая одновременное их возбуждение, что привело бы к бессмысленному сокращению всех мышц. Таким образом, система двух маутнеровских клеток работает как триггер [39 J.
Интересная система передачи торможения описана у аплизии [31J. У этого моллюска имеются большой и маленький нейрон, связанные выпрямляющим электрическим синапсом. Направление выпрямления таково, что маленький нейрон может возбуждать большой, но при возникновении пика в большом нейроне сопротивление синапса высоко, и ток в маленький нейрон не проходит. Однако вслед за возбуждением в большом нейроне возникает заметная следовая гиперполяризация. Теперь электрический синапс пропускает ток в маленький нейрон. Таким образом, через этот синапс маленький нейрон может возбуждать большой, а большой—тормозить маленький. Возникает эффект, несколько сходный с действием возвратной тормозной коллатерали.
Суммация. В случае химического синапса временная суммация может быть обусловлена двумя причинами: «хранением» ПСП за счет постоянной времени мембраны нейрона и накоплением медиатора в синаптической щели. В случае электрическог синапса может действовать лишь первая причина. В некоторых случаях она может быть вполне эффективной (см., например, [76J). Пространственная суммация при работе электрических синапсов также в некоторых случаях была показана (см. раздел 9.3.3).
Командный и локальный типывзаимодей-с т в и я. Сравнивая в самой общей форме особенности работы химических и электрических синапсов нельзя не отметить, что они преимущественно приспособлены для разных типов управления и регуляции. Химический синапс идеально устроен для односторонней передачи сигнала по типу команды. Постсинаптическая структура всегда имеет подчиненное значение. Наоборот, электрический синапс без выпрямления является идеальной структурой для осуществления симметричного двустороннего взаимодействия между соседями. В этом случае обе клетки находятся в равном положении и поведение их определяется непрерывным взаимным влиянием через один и тот же электрический синапс.
Ярким примером двух указанных типов взаимодействия может служить управление движениями скелетной мускулатуры и сокращениями сердца. Движения скелетных мышц осуществляются по программе, задаваемой ц. н. с. Данная конкретная мышца сокращается согласно сигналам, приходящим из мозга, у нее при этом нет никакого непосредственного взаимодействия с другими мышцами, участвующими в этом движении. Это команднопрограммный тип взаимодействия. Для такого взаимодействия удобны химические синапсы.
В случае же сокращения сердца возникновение возбуждений, его распространение и соответственно хронотопография сокращения осуществляются без программы, приходящей извне. Все эти процессы определяются непрерывным локальным электрическим взаимодействием большого количества клеток, объединенных в синцитиальную структуру электрическими синапсами.
Может возникнуть впечатление, что для такого взаимодействия удобнее всего непрерывная протоплазматическая связь между клетками, как и думали раньше про миокардиальную ткань. Однако живучесть таких систем, по-видимому, низка, так как локальное повреждение мембраны распространялось бы на значительные расстояния, как это имеет место у скелетных мышечных волокон. В случае же истинной клеточной структуры устойчивость резко повышается. Любое повреждение одной или нескольких клеток, как отмечалось выше, сразу же приводит к резкому возрастанию сопротивления контактных мембран электрического синапса соседних клеток, и здоровые клетки изолируются от повреждения. В этом процессе проявляется еще одна важная функция электрических синапсов.
9.7.7. ИЗМЕНЯЕМОСТЬ СИНАПСОВ И СВЯЗЬ С БИОХИМИЧЕСКИМИ ПРОЦЕССАМИ
В отличие от химических на электрических синапсах не получено достоверных данных о процессах типа посттетанической потенциации. Предполагается, что химические синапсы, работа которых более тесно связана с биохимическими процессами, скорее могут быть субстратом обучения и памяти. С другой стороны, электрические синапсы позволяют нейронам обмениваться химическими соединениями с довольно большим молекулярным весом, осуществляя какой-то тип клеточных коммуникаций.
Нередко высказывается мнение, что основной тип клеточных взаимодействий — выделение некоторых химических веществ (гормонов) во внешнюю по отношению к клетке среду, в частности в кровь, через посредство которой гормон достигает клетки-мишени. С этой точки зрения аксоны нервных клеток — линии связи для быстрой передачи далеких сигналов, конечная цель которых вызвать выделение все тех же гормонов или медиаторов в непосредственной близости от клеток-мишеней. Назначение химических синапсов в этом смысле — локализация места действия гормонов или медиаторов.
Однако изучение разнообразных тканей в последнее десятилетие показало, что весьма распространенным является обмен химическими веществами через специализированные контакты клетки с клеткой, а не через внешнюю среду. Возможно, электрические синапсы — одно из проявлений этого, по-видимому, весьма древнего механизма. С другой стороны, наличие проницаемых контактов между клетками могло играть существенную роль
в использовании электрических сигналов для межклеточных коммуникаций. Можно надеяться, что дальнейшее изучение различных тканей позволит прояснить в настоящее время очень слабо изученный вопрос об эволюционных отношениях химических и электрических синапсов.
ЛИТЕРАТУРА
1. Батуева И. В.. Шаповалов А. И. Синаптические воздействия, вызываемые в мотонейронах миноги при супраспинальпом и интраспинальпом раздражении. — Нейрофизиология, 1974, 6, № 6, с. 629—635.
2. Беркинблит М. Б., Введенская Н. Д., Гнеденко Л. С., Ковалев С. А., Фомин С. В., Холопов А. В., Чайлахян Л. М. Взаимодействие нервных импульсов в узле ветвления. (Исследование на модели Ходжкина — Хаксли). — Биофизика, 1971, 16, А» 1, с. 103—НО.
3. Беркинблит М. Б., Ковалев С. А., Смолянинов В. В., Чайлахян Л. М. Электрическая структура миокардиальной ткани. — ДАН СССР, 1965, 163, № 3, с. 741—744.
4. Беркинблит М. Б., Ковалев С. А., Смолянинов В. В., Чайлахян Л, М. Электрическое поведение миокарда как системы и характеристики мембран клеток сердца. — В кп.: Модели структурио-фуикциональной организации некоторых биологических систем. М., 1966, с. 71—111.
5. Беркинблит М. Б., Ковалев С. А., Смолянинов В, В., Чайлахян Л, М. Модель клеточных контактов (электрические свойства). — Биофизика, 1971, 16, №3, с. 504—511.
6. Беркинблит М. Б., Ковалев С. А., Смолянинов В. В., Чайлахян Л. М. Как суммируется действие электрических синапсов. — Биофизика, 1972, 17, № 6, с. 1129—1131.
7. Божкова В. П., Бойцова Л. Ю., Ковалев С. А., Миттелъман Л. А., Чайлахян Л. М., Шаровская Ю. Ю., Шилянская Э. Н. Высокая проницаемость контактных мембран — возможный механизм межклеточного взаимодействия. — В кн.: Межклеточные взаимодействия в дифференцировке и росте. М., 1970, с. 183—193.
8. Боровявип В. Л. Субмикроскопическая морфология и структурная взаимосвязь рецепторных и горизонтальных клеток сетчатки ряда низших позвоночных. — Биофизика, 1966, 11, № 5, с. 810—817.
9. Бызов А. Л. Модель механизма обратной связи между горизонтальными клетками и фоторецепторами сетчатки позвоночных. — Нейрофизиология, 1977, 9, № 4, с. 402—407.
10. Бызов А. Л., Трифонов Ю. А. Гипотеза об электрической обратной связи в синаптической передаче фоторецептор—нейроны второго порядка сетчатки позвоночных. — В кп.: Синаптические процессы. Киев, 1968, с. 231-248.
11. Бызов А. Л., Трифонов Ю. А., Чайлахян Л. М. Влияние поляризации горизонтальных клеток сетчатки щуки па распространение в них электрических потенциалов. — Нейрофизиология, 1972, 4, №1, с. 90—96.
12. {Бызов 4. Л., Церветто Л.} Byzov A. L., Cervetto L. Effects of applied currents of turtle cones in darkness and during the photoresponses. — J. Physiol. (London), 1976.
13. {Герасимов В. Д.) Gerasimov V. D, Electrical properties and connections of CNS giant nerve cells of Hirudo medicinalis. — In: Neurobiology of invertebrates. Ed. J. Salanki. New York, 1967, p. 285—292.
14. Герасимов В. Д., Акоев Г. И. Особенности электрической активности гигантских нервных клеток пиявки Hirudo medicinalis в различных солевых растворах. — Журн. эволюц. биохим. физиол., 1967, 3, № 2, с. 234—240.
15. Гуляев Д. В. Электронномикроскопическое исследование контактов нервных и эпителиально-мышечных клеток Hydra vulgaris. — Журп. общей биол., 1976, 37, .К; 2, с. 304—309.
16. Карпенко Л. Д., Чораян О. Г. Нейроны с электротопической передачей возбуждения в правом париетальном ганглии виноградной улитки. — ДАН СССР, 1972, 205, № В, с. 1496—1500.
17. Макги.иод В. В. В кн.: Синаптические процессы. Киев, 1968, с. 247.
18. Маркин В. С., Пастушенко В. Ф. Распространение возбуждения в нервном волокне с перегородками. I. Расчет скорости импульса. — Биофизика, 1973, 18, № 2, с. 346—353.
19. Паппас Дж., Ваксман. С. Ультраструктура синапсов. — В кп.: Физиология и фармакология синаптической передачи. Л., 1973, с. 7—30.
20. Пастушенко В. Ф., Маркин В. С. Распространение возбуждения в нервном волокне с перегородками. 2. Блокирование импульса перегородкой. — Биофизика, 1973, 18, № 4, с. 694—699.
21. Питерс 4., Палей С., Уэбстер Г. Ультраструктура нервной системы. М., 1972. 173 с.
22. Проссер Л., Браун Ф. Сравнительная физиология. М., 1967. 766 с.
23. Терешков О. Д. Угнетающее влияние безнатриевой среды и холина на межнейронную электрическую передачу в ЦНС пиявки. — ДАН СССР, 1973, 213, №6, с, 1454—1457.
24. Терешков О. Д., Фомина М. С. Электрическая передача между несимметричными нейронами в ганглии пиявки. — Нейрофизиология, 1971, 3, № 5, с. 550—556.
25. Терешков О. Д., Фомина М. С., Гурин С. С. Электрофизиологические свойства парных гигантских клеток пиявки. — Биофизика, 1969, 14, № 1, с. 86—90.
26. Трифонов Ю. А., Чайлахян Л. М., Базов А. Л. Исследование природы электрических ответов горизонтальных клеток сетчатки рыб. — Нейрофизиология, 1971, 3, № 1, с. 89—98.
27. (Трифонов Ю. А., Бызов А. Л., Чайлахян Л. М.) Trifonov Ju. A., Byzov A. L., Chatlahian L. М. Electric properties of subsynaptic and non-synaptic membranes of horizontal cells in fish retina. — Vision Res , 1974, 14, N 3, p. 229-241.
28. Шуба. M. Ф. Физический электроток в гладкой мышце. — Биофизика, 1961, 6, №1, с. 52—57.
29. Шура-Бура Т, М. Модель слоя горизонтальных клеток сетчатки. — Биофизика, 1976, 21, № 3, с, 566—569.
30. Экклс Дж. Физиология синапсов. М., 1966. 395 с.
31, Arvanttaki A., Chalaza nit. is N. Interactions &ectriqnes entre le soma ge-ant A et les somata immediatement contigus (Ganglion pleurobranchial d’Aplysia). — Bull. Inst, oceanogr., 1959, 1141, N 1, p. 1—30.
32. Asada У., Bennett M. V. L. Experimental alteration of coupling resistance at an electrotonic synapse, — 1. Cell Biol., 1971, 49, N 1, p. 159—172.
33. Asada У., Pappas G. D., Bennett M. V. L. Alteration of resistance at an electrotonic junction and morphological correlates. Fed. Proc., 1967, 26 N 2, p. 330.
34. Auerbach A. A., Bennett M. V. L. A rectifying electrotonic synapse in the central nervous system of a vertebrate. — J. Gen. Physiol,, 1969 53 N 2, p. 211—237.
35. Baker R., Llinas R. Electrotonic coupling between neurones in the rat mesencephalic nucleus. — J. Physiol. (London), 1971, 212, N 1, p. 45— 63.
3(> . Baylor D. A., Fuortes M. G. F., O’Brian P. M. Receptive fields of cones in the retina of the turtle. — J. Physiol. (London), 1971, 214, N 2, p 265_
294.
37. Baylor D. A., Nicholls J. D. Chemical and electrical synaptic connexions between cutaneous mechanoreceptor neurones in the central nervous system of the leech. — I. Physiol. (London), 1969, 203, N 3, p, 591—609.
38. Bennett M. V. L. Physiology of electrotonic junctions. — Ann. New York Acad. Sci., 1966, 137, N 2, p. 509—539,
39. Bennett Jlf. V. L. Similarities between chemically and electrically mediated transmission. — In: Physiological and biochemical aspects of nervous integration. Ed. F. D. Carlson. New York, 1968, p. 73—128.
40. Bennett Af. V. L. Electroreception. — In: Fisch physiology. Ed. W. S. Hoar, D. S. Randall. New. York, 1971, p. 493—574.
41. Bennett M. V. L. A comparison of electrically and chemically mediated transmission. — In: Structure and function of synapses. Ed. G. D. Pappas, D. P. Purpura. New York, 1972, p. 221—256.
42. Bennett M. 7. L. Function of electrotonic junction in embryonic and adult tissues. — Fed. Proc., 1973, 32, N 1, p. 65—75.
43. Bennett M. V. L. Permeability and structure of electrotonic junction and intracellular movement of tracers. — In: Intracellular stainingn in neurobiology. Ed. S. B. Kater, C. Nicholson. New York, Amsterd m, 1973, p. 115-133.
44. Bennett M. V. L. Flexibility and rigidity in electrotonically couples systems. — In: Synaptic transmission and neuronal interacion. Ed. M. V. L. Bennett. New York, 1974, p. 153—177.
45. Bennett M. V. L., Aljure E., Nakajima Y. Electrotonic junctions between teleost spinal neurons: electrophysiology and ultrastructure. — Sciense, 1963, 141, N 3577, p. 262-264.
46. Bennett M. 7. L., Auerbach A. A. Calculation of electrical coupling of cells separated by a gap. — Anat. rec., 1969, 163, N 2, p. 152.
47. Bennett M. V. L., Crain S. M., Grundfest H. Electrophysiology of supra-medullary neurons in Spheroides maculatus. 1. Orthodromic and antidromic responses. — J. Gen. Physiol., 1959, 43, N 1, p. 159—188.
48, Bennett M. 7. L., Crain S. M„ Grundfest H. Electrophysiology of supra-medullary neurons in Spheroides maculatus. 3. Organization of the supra-medullary neurons. — J. Gen. Physiol., 1959, 43, N 1, p. 221—250.
49. Bennett M. 7. L., Nakajima Y., Pappas G. D. Physiology and ultrastructure of electrotonic junction. 1. Supramedullary neurons. — J, Neurophysiol., 1967, 30, N 2, p. 161—179.
50. Bennett M. V. L., Nakajima K., Pappas G. D. Physiology and ultrastructure of electrotonic junction. 3. Giant electromotor neurons of Afalapteru-rus electricus. — J. Neurophysiol., 1967, 30, N 2, p. 209—235.
51. Bennett M. 7. L., Pappas G. D., Aljure E., Nakajima Y. Physiology and ultrastructure of electrotonic junction. 2. Spinal and medullary electromotor nuclei in Mormyrid fish. — J. Neurophysiol., 1967, 30, N 2, p. 180— 208.
52. Bennett M. 7. L., Pappas G. D., Gimenez M,, Nakajima Y. Physiology und rultrastructure of electrotonic junction. 4. Medullary electromotor nuclei in gymnotid fish. — J. Neuro physiol., 1967, 30, N 2, p. 236—300.
53. Berry M. S. A system of electrically coupled small cells in the buccal ganglia of the pond snail Planorbis corneus. — J. Exp. Biol., 1972, 56, N 3, p. 621—637.
54. Berry M. S. Electrotonic coupling between identified large cells in the buccal ganglia of Planorbis corneus. — J. Exp. Biol., 1972, 57, N 1, p. 173—185.
55. Brightman M. 17., Reese T. S. Junction between intimately apposed cell membranes in the vertebrate brain. — J. Cell Biol., 1969, 40, N 3, p. 648— 677.
56. Bullock T. H. Functional organization of the giant fiber system of Lumbri-cus. — J. Neurophysiol., 1945, 8, N 1, p. 55—71.
57. Charlton В. T., Gray E. G. Electron microscopy of specialized synaptic contacts suggesting possible electrical transmission in frog spinal cord. — J. Physiol. (London), 1965, 179, N 1, p. 2P—4P.
58. Custer N. 7. Structurally specialized contacts between the photoreceptors of the retina of the axolotl. — J. Comp. Neurol., 1973, 151, N 1, p. 35— 56.
59. Dale H. H. Pharmacology of nerve endings. — Proc. Roy. Soc. Med., 1935, 28, N 4, p. 319-332.
60, De Lorenzo A. J. The fine structure of synapses in the ciliary ganglion of the chick. — J. Biophys., Biochem. Gytol., 1960, 7, N 1, p. 31—36.
61. Detwiler P. B., Alkon D. L. Hair cell interactions in the statocyst of Her-missenda. — J. Gen. Physiol., 1973, 62, N 5, p. 618—642.
62. Dewey M. M., Barr L, Intercellular connection between smooth muscle cells; the nexus. — Science, 1962', 137, N 3531, p. 670.
63. Diamond J. The Mauthner cell. In: Fish physiology. 5. Ed. W. S. Hoar, D. I. Randall. New York, 1971, p. 265—346.
64. Dowling G. E., Boycott В. B. Organization of the primate retina: electron microscopy. — Proc. Roy. Soc. Ser. B., 1966, 166, N 1, p. 80—111.
65. Du Bois-Reymond E. Experimentalkritik der Entladung Hypothese uber die Wirkung von Nerve auf Muskel. Monatsber. Kgl. Preuf. Acad. Wiss. Berlin 20 Apr. 1874. — Sitzungsber. Phys.-Math. K. L. 874, S. 519—560.
66. Eccles J. C., Granit R.t Young J. Z. Impulses in the giant nerve fibers of earthworms. — J. Physiol. (London), 1932, 77, N 1, p. 23P—24P.
67. Eccles J. C., Jaeger J. C. The relationship between the mode of operation and the dimensions of the junctional region at synapses and motor endorgans. — Proc. Roy. Soc. Ser. B., 1958, 148, N 1, p. 38—56.
68. Eckert R. Electrical interaction of paired ganglion cells in the leech. — J. Gen. Physiol., 1963, 46, N 3, p. 573—588.
69. Faber D. S., Korn H. An electrically mediated inhibitory action of the Mauthner cell upon adjacent medullary neurons. — J. Gen. Physiol., 1973, 61, N 2, p. 261—268.
70. Faber D. S., Korn H. A neuronal inhibition mediated electrically. — Science, 1974, 179, N 4073, p. 577—578.
71. Frank E., Jansen J. K., Rinvik E. A multisomatic axon in the central nervous system of the leech. — J. Comp. Neurol., 1975, 159, N 1, p. 1—13.
72. French A. S., Di Caprio R. A. The dynamic electrical behaviour of the electrotonic junction between Retzius cell in the leech. — Biol. Cybernetics, 1975, 17, N 3, p. 129—135.
73. Furshpan E. J., Potter D. D. Mechanism of nerve-impulse transmission at a crayfish synapse. — Nature, 1957, 180, N 4581, p. 342—343.
74. Furshpan E. J., Potter D. D. Transmission at the giant motor synapses of the crayfish. — J. Physiol. (London), 1959, 145, N 2, p. 289—325.
75. Furukawa T., Furshpan E. J. Two inhibitory mechanism in the Mauthner neurons of goldfish. — J. Neurophysiol., 1963, 26, N 1, p, 140—176.
76. Getting P. A. Modification of neuron properties by electrotonic synapses.
1. Input resistance, time constant, and integration. — J. Neurophysiol., 1974, 37, N 5, p. 846-857.
77. Getting P. A., Willows A. O. D. Burst formation in electrically coupled neurons. — Brain Res., 1973, 63 (complete), p. 424—429.
78. Getting P. A., Willows A, O. D. Modification of neuron properties by electrotonic synapses. 2. Burst formation by electrotonic synapses. — J. Neurophysiol., 1974, 37, N 5, p. 858—868.
79. Gogan P., Guerttaud J. P., Horcholle-Bossavit G-, Tyc-Dumont S. Electrotonic coupling between motoneurons in the abducent nucleus of the cat. — Exp. Brain Res., 1974, 21, N 2, p. 139—154.
80. Grinnell A. D. A study of the interaction between motoneurons in the frog spinal cord. — J. Physiol. (London), 1966, 182, N 3, p. 612—648.
81. Grinnell A. D. Electrical interaction between antidromically stimulated frog motoneurones and dorsal root aff erents: enhancement by gall amine and TEA. — J. Physiol. (London), 1970, 210, N 1, p. 17—43.
82. Hagiwara R. Nervous activities of the heart in Crustacea. — Erg. Biol., 1961, 24, N 2, p. 287—311.
83. Hagiwara S., Morita H. Electrotonic transmission between two nerve cells in leech ganglion. — J. Neurophysiol., 1962, 25, N 6, p. 721—731.
84. Hagiwara S., Watanabe A., Saito N. Potential changes in syncytial neurons of lobster cardiac ganglion. — J. Neurophysiol., 1959,22, N 5, p. 554—572.
85. Лата К. Some observations on the fine structure of the giant nerve fibers of the earthworm, Eisenia foetida. — J. Biophys., Biochem. Cytol., 1959, 6, N 1, p. 61—06.
86. Hama K. Some observations on the fine structure of the giant fibers of the crayfishes (Gambarus Virilus and Cambar us Clarkit) with special reference to the submicroscopic organization of the synapses. — Anat. rec., 1961, 141, N 4, p. 275-293.
87. Hand A. R., Gobel S. The structural organization of the septate and gap junction of Hydra. — J. Cell Biol., 1972, 52, N 2, p. 397—408.
88. Heppner D. B., Plonsey R. Stimulation of electrical interaction of cardiac cells. — Biophys. J., 1970, 10, N 11, p. 1057—1075.
89. Hermann L. Handbuch der Physiologie. 1. Leipzig, 1879.
90. Hess A., Pilar G., Weakly J, N. Correlation between transmission and structure in avian ciliary ganglion synapses. — J. Physiol. (London), 1969, 202, N 2, p. 339—354.
91. Hinrichsen C. F. L., Larramendi L. M. H. Synapses and cluster formation of the mouse mesencephalic fifth nucleus. — Brain Res., 1968, 7, N 2, p. 296—299.
92. Kaneko A. Electrical connections between horizontal cells in the dogfish retina. — J. Physiol. (London), 1971, 213, N 1, p. 95—105.
93. Kao С. У. Postsynaptic electrogenesis in septate giant axons. 2. Comparison of medial and lateral giant axon of crayfish. — J. Neurophysiol., 1960, 23, N 6, p. 618—635.
94. Kao С. У., Grundfest H. Postsynaptic electrogenesis in septate giant axons. 1. Earthworm median giant axon. — J. Neurophysiol., 1957, 20, N 6, p. 553-573,
95. Katz B. Nerve, muscle, synapse. New York, 1966. (Русск. перев.: Катц Б. Нерв, мышца и синапс. М., 1968. 220 с.).
96. KoopovAtz Н. Electrophysiology of the peripheral nerve net in the polic lad flatworm Freemanta lltoricola. — J. Exp. Biol., 1975, 62, N 2, p. 469— 479.
97. Korn H., Bennett M. V. L. Electrotonic coupling between teleost oculomotor neurons; restriction to somatic regions and relation to function of somatic and dendritic sites of impulse initiation. — Brain Res., 1972, 38, N 2, p. 433—439.
98. Кот H., Bennett M. V. L. Vestibular nystagmus and teleost oculomotor neurons: functions of electrotonic coupling and dendritic impulse initiation. — J. Neurophysiol., 1975, 38, N 2, 430—451.
99. Korn H., Faber D. S. An electrically mediated inhibition in goldfish medulla. — J. Neurophysiol., 1975, 38, N 2, 452—471.
100. Кот И., Sotelo C., Crepel F. Electrotonic coupling between neurons in the rat lateral vestibular nucleus. — Exp. Brain Res., 1973, 16, N 2, 255-275.
101. Korn H., Sotelo C., Kotchabhakdt N., Bennett M. V. L. Fish lateral vestibular neurons: electrotonic transmission from primary vestibular afferents, electrotonic coupling between vestibulo-spinal neurons and identification of efferent cells to the labyrinth. — Biol. Bull., 1974, 147, N 2, 486—487.
102. Krause W. liber die Endigung der Muskelnerven. — Z. Nat, Med., 1863, 18, Ser. 3, N 1, 136-160.
103. Krtebel M, E., Bennett M. V. L., Waxman S. G., Pappas G. D. Oculomotor neurons in fish: electrotonic coupling and multiple sites of impulse initiation. — Science, 1969, 166, N 3904, 520—524.
104. Kiihne IF. On the origin and the causation of vital movement. — Proc. Roy. Soc., 1888, 44, N 5, 427—448.
105. Landmesser L., Pilar G. The onset and development of transmission in the chick ciliary ganglion. — J. Physiol. (London), 1972, 222, N 3, p. 691—713.
106. Lent С, M. Retzius cells from segmental ganglia of four species of leeches: comparative neuronal geometry. — Comp. Biochem. Physiol., 1973, 44, A, Nl, p. 35—40.
107. Levitan Я., Таис L., Segundo /. P. Electrical transmission among neurons in the buccal ganglion of a mollusc Navanax tnermis. — J. Gen. Physiol., 1970, 55, N 4, p. 484—496.
108. Llinas R. Electrical synaptic transmission in the mammalian central nervous system. — In: Golgi centennial symposium. Proceedings. Ed. M. Santini. New York, 1975, p. 379—386,
109. Llinas R., Baker R., Sotelo C. Electrotonic coupling between neurons in the cat inferior olive. — J. Neurophysiol., 1974, 37, N 3, p. 560—571.
110. Loewenstein W. R. Membrane junctions in growth and. differentiation. — Fed. Proc., 1973, 32, N 1, p. 60—64.
111. Loewenstein W. R., Kanno Y. Studies on an epithelial (gland) cell junction.
1. Modifications of surface membrane permeability. — I. Cell Biol., 1964, 22, N 5, p.,.565-586.
112. Loewi O. Uber humorale Ubertragbarkeit dec Herznervenwirkung. — Pfliig Arch. 1921, 189, N 3, p. 239—242.
113. Magherini P. C., Precht W., Schwindt P, C. Some electrical properties of frog motoneurons in the in situ spinal cord. — Exp, Brain Res., 1975, 23, Suppl., p. 132,
114. Martin A. R., Pilar G. Dual mode of synaptic transmission in the avian ciliary ganglion. — J. Physiol. (London), 1963, 168, N 2, p. 443—463.
115. Martin A. R., Pilar G. Transmission through the'ciliary'’ganglion of the chick. — J. Physiol. (London), 1963, 168, N 2, p7 464—475.
116. Martin A, R., Pilar G. An analysis of electrical coupling at synapses in the avian ciliary ganglion. — J. Physiol. (London), 1964,171, N 3, p. 454— 475.
117. Messier R. M., Pappas G. D., Bennett M. V. L. Morphological demonsra-tion of electrotonic coupling of neurons by way of presynaptic fibers. — Brain Res., 1972, 36, N 2, p. 412—415.
118. Muller K. J. Photoreceptors in the crayfish compound eye: electrical interactions between cells as related to polarized light sensitivity. — J. Physiol. (London), 1973, 232, N 3, p. 573—595.
119. Murrey M. J. Impulse occlusion and subthreshold gating in electrically coupled molluscan neurons. — J. Comp. Physiol., 1975, A103, N 2, p. 189—208.
120. Nagai T., Prosser C. L. Electrical parameters of smooth muscle cells. — Amer. J. Physiol.", 1963, 204, N 5, p. 915—924.
121. Naka К. T., Rushton W. A. The generation and spread of S-potentials in fish (Cyprinidae). — J. Physiol. (London), 1967, 193, N 2, p. 437—461.
122. Nicholls J. (?., PurvesD. A. Monosynaptic chemical and electrical connexions between sensory and motor cells in the central nervous system of the leech. — J. Physiol. (London), 1970, 209, N 3, p. 647—667.
123. Nicholls J. G., Purves D. A. A comparison of chemical and electrical synaptic transmission between single sensory cells and a motoneurone in the central nervous system of the leech. — J. Physiol. (London), 1972, 225, N 3, p. 637—656.
124. Oesterle D., BarthTF. G. Zur Feinstruktur einer elektrischen Synapse. Die Septen dec dorsalen Riesenfasern von Regenwiirmern (Lumbrlcus ter-restris, Eisenia foetida). — Ъ, Zellforsch., 1973, 136, N 1, S. 139—152.
125. O’Shea M., Rowell С. H. F, A spike-transmitting electrical synapse between visual interneurones in the locust movement detektor system. — J. Comp. Physiol., 1975, 97, N 2, p. 143—158.
126. Pappas G. D., Asada Y., Bennett M. V. L. Morphological correlate of increased coupling resistance at an electrotonic synapse. — J. Cell Biol., 1971, 49, N 1, p. 173—188.
127. Pappas.fi.'D., Bennett M. V. L. Specialized junctions involved in electrical transmission between neurons. — Ann. New York. Acad. Sci., 1966, 137, N 2, p. 495—508.
128. Payton B. W., Bennett M. V. L., Pappas G. D. Temperature-dependence of resistance at an electrotonic synapse. — Science, 1969, 165, N 3893, p. 594—597.
129. Payton В. W., Bennett M. V. L., Pappas G. D. Permeability and structure of junctional membranes at an electrotonic synapse, — Science, 1969, 166, N 3913, p. 1641-1643.
130. Peracehia C. Low resistance junctions in crayfish. 1. Two arrays of globules in junctional membranes. — J. Cell Biol., 1973, 57, N 1, p. 54—65.
131. Peracehia C. Low resistance junctions in crayfish. 2. Structural details and further evidence for intercellular channels by freeze-fracture and negative staining. — J. Cell Biol., 1973, 57, N 1, p. 66—76.
132. Pinching A. J., Powell T. P. S. The neuropil of the glomeruli of the olfactory bulb. — J. Cell Sci., 1971, 9, N 2, p. 347—377.
133. Precht W., Richter A., Ozawa S., Shimazu H. Intracellular study of frog’s vestibular neurons in relation to the labyrinth and spinal cord. — Exp. Brain Res., 1974, 19, N 4, p. 377—393.
134. Robertson J. D. Ultrastructure of excitable membranes and the crayfish median — giant synapse. — Ann. New York Acad. Sci., 1961, 94, N 2, p. 339—389.
135. Robertson J. D. The occurence of subunit pattern in the unit membranes of club endings in Mauthner cell synapses in goldfish brains. — J. Cell Biol., 1963, 19, N 1, p. 201—221.
136. Rovalnen С. M. Dual electrical and chemical transmission at large synapses in lamprey spinal cord. — J. Gen. Physiol., 1973, 61, N 2, p. 254,
137. Rovainen С. M. Synaptic interactions of reticulospinal neurons and nerve cells in the spinal cord of the sea lamprey. — J. Comp. Neurol., 1974, 154, N 2, p. 207—224.
138. Rushton W. A. H. Action potentials from the isolated nerve cord of the earthworm. — Proc. Roy. Soc. Ser. B, 1945, 132, N 5, p. 423—437.
139. Shelton G. A. В. The transmission of impulses in the ectodermal slow conduction system of the sea anemone Galliactis parasitica. — J. Exp. Biol., 1975, 62, N 2, p. 421—432,
140. Sheridan J. D. Dye movement and low resistance junction between reaggregated embryonic cells. — Develop. Biol., 1971, 26, N 4, p. 627—636.
141. Simon E. J. Two types of luminosity horizontal cells in the retina of the turtle. — J. Physiol. (London), 1973, 230, N 1, p. 199—211.
142. Sloper J. J. Gap junctions between dendrites in the primate neocortex. — Brain Res., 1972, 44, N 2, p. 641—646.
143. Smith T. G., Bauman F., Fuortes M. G. F. Electrical connections between visual cells in the ommatidium of Limulus. — Science, 1965, 147, N 3664, p. 1446—1448.
144. Sotelo C., Llinas R. Specialized membrane junctions between neurons in the vertebrate cerebellar cortex. — J. Cell Biol. 1972, 53, N 2, p. 271—289.
145. Sotelo C., Llinas R., Baker R. Structural study of the inferior olivary nucleus of the cat. Morphological correlates of electrotonic coupling. — J. Neurophysiol., 1974, 37, N 3, p. 541—559.
146. Sotelo C., Palay S. L. The fine structure of the lateral vestibular nucleus in the rat. 2. Synaptic organization. — J. Cell Biol., 1968, 36, N l,p. 151 — 179.
147. Sotelo C., Palay S. L. The fine structure of the lateral vestibular nucleus in the rat. II. Synaptic organization. — Brain Res., 1970, 18, N 1, p, 93— 115.
148. Sotelo C., Taxi J. Ultrastructural aspects of electrotonic junction in the spinal cord of the frog. — Brain Res., 1970, 17, N 1, p. 137—141.
149. Spira M. E., Bennett M. V. L. Synaptic control of electrotonic coupling between neurons. — Brain Res., 1972, 37, N 2, p. 294—300.
150. Srivastava С. B. L Morphological evidence for electrical synapse of „gap" junction type in another vertebrate receptor. — Experientia, 1972, 28, N 9, p. 1029-1030.
151. Stuart A. E. Physiological and morphological properties of motoneurones in the central nervous system of the leech. — J. Physiol.-(London), 1970, 209, N 3, p. 627—646.
152. Szabo T., Sakata H., Ravaille M. An electrotonically coupled pathway in the central nervous system of some teleost fish gimnotidae and mormyri-dae. — Brain Res., 1975, 95, N 2—3, p. 459—474.
153. Takahashi K., Hama K. Some observations of the fine structure of the synaptic area in the ciliary ganglion of the chick. — Z. Zellforsch., 1965, 67, N 2, S. 174—184.
154. Tauc L. Interaction non synaptique entre deux neurons adjacents du ganglion abdominal de 1’Aplysie. — C. R. Acad. Sci. (Paris), 1959, 248, p. 1857—1859.
155. Tazaki K. Impulse activity and pattern of large and small neurones in the cardiac ganglion of the lobster Panulirus faponieus. — J. Exp. Biol., 1973, 58, N 2, p. 473—486.
156. Trautwein И7., Kuffler S. W., Edwards C. Changes in membrane characteristics of heart muscle during inhibition. — J. Gen. Physiol., 1956, 40, N 1, p. 135—145.
157. Washizu У. Single spinal motoneurons excitable from two different antidromic pathways. — Jap. J. Physiol., 1960, 10, N 2, p. 121—131.
158. Watanabe A. The interaction of electrical activity among neurons of lobster cardiac ganglion. — Jap. J. Physiol., 1958, 8, N 4, p. 305—318.
159, Watanabe A., Bullock T. H. Modulation of activity of one neurone by sub-treshold slow potentials in another in lobster cardiac ganglion. — J. Gen. Physiol., 1960, 43, N 6, p. 1031—1046.
160. Watanabe A., Grundfest H. Impulse propagation at the septal and commis-surae junctions of crayfish lateral giant axons. — J. Gen. Physiol., 1961, 45, N 2, p. 267-308.
161. Waxman S. G., Pappas G. D. An electron microscopic study of synaptic morphology in the oculomotor nuclei of three inframammalian species. — J. Comp. Neurol., 1971, 134, N 1, p. 41—72.
162. Weidmann S. The electrical constants of Purkinje fibres. — J. Physiol. (London), 1952, 118, N 3, p. 348-360.
163. Willows A. O. D,, Dorsett D. A., Hoyle G. The neuronal basis of behavior in Trttonia. 3. Neuronal mechanism of a fixed action pattern. — J. Neurobio]., 1973, 4, N 3, p. 255—285.
164. PFilson D. M. The connections between the lateral giant fibers of earthworms. — Comp. Biochem. Physiol., 1961, 3, N 4, p, 274—284.
165. Wilson V. J., Wylie R. M. A short latency labyrinthyine input to the vestibular nuclei in the pigeon. — Science, 1970, 168, N 1, p. 124—127.
166. Woodbury J. W,, Crill W. E. On the problem of impulse conduction in the atrium. — In: Nervous inhibition. Ed. E. Florey. Oxford, 1961, p. 124—135.
167. Woodbury J. W., Crill W. E. The potential in the gap between two abutting cardiac muscle cells. A closed solution. — Biophys. J., 1970, 10, N 11, p. 1076—1083.
168. Wylie R, M. Evidence for electrotonic transmission in the vestibular nuclei of tho rat. — Brain Res., 1973, 50, N 1, p. 179—183.
169. Yamada E,, Ishikawa T. The fine structure of the horizontal cells in some vertebrate retinae. — Cold Spring Har. symp. quant. Biol., 1965, 30, h>. 383—392.
170. Zucker R. S. Crayfish escape behavior and central synapses. 3. Electrical junction and dendrite spikes in fast flexor motoneurons. — J. Neuro physiol., 1972, 35, N 5, p. 638—651.
Глава 10
ТРОФИЧЕСКАЯ ФУНКЦИЯ НЕРВНОЙ СИСТЕМЫ
10.1. ИСТОРИЯ РАЗВИТИЯ ПРЕДСТАВЛЕНИЙ О ТРОФИЧЕСКОЙ ФУНКЦИИ НЕРВНОЙ системы
Зависимость метаболизма тканей от нервных влияний была обнаружена первоначально в опытах с денервацией и реиннервацией [3, 18, 21, 119, 1261 и при клинических наблюдениях мышечных атрофий и трофических язв вследствие повреждения нервов.
Начальные предположения о механизме трофического влияния нервной системы на периферические ткани сводились к представлению о наличии специальных трофических нервов. Такое представление было разработано Самуэлем [204] в его книге «Трофические нервы». Самуэль стремился экспериментально показать, что вазомоторные нервы не оказывают влияния на метаболизм ткани. Он предполагал поэтому, что необходимо признать наличие трофических нервных волокон; трофическое влияние он усматривал в непосредственном воздействии трофических нервов на метаболизм. Работы Клода Бернара и Самуэля легли в основу учения о трофоневрозах.
Павлов также склонялся к признанию наличия трофических нервов, и его первоначальное мнение специфических трофических нервов обосновывалось на наблюдениях за деятельностью сердца [32]. В более поздних своих работах Павлов [33] разработал на основании изучения трофических нарушений представление о трофических рефлексах.
Идея трофических рефлексов была наиболее последовательно разработана Сперанским и его сотрудниками. Сперанский указал на рефлекторный характер нейродистрофических нарушений, возникающих после перерезки периферических нервов. Он подчер-
Общая физиология нервной систему
449
кивал значение афферентного раздражения [38, 39}, однако отвергал возможность специализации трофической функции нервной системы.
Представления о значении симпатических нервов для трофической регуляции были выдвинуты и Орбели [30, 31 ] в теории адаптационно-трофической функции нервной системы. Согласно данным Гинецинского [8], сократительная способность мышцы, истощенной рядом сокращений, восстанавливается в случае тетанического раздражения симпатических нервных волокон. Однако последующие эксперименты показали, что это явление возникает, по-видимому, не вследствие прямого действия симпатических нервов на мышцу, но на основании косвенного влияния через систему кровообращения [2].
Прямое трофическое действие афферентных волокон предполагали также Выберн-Масов [231], Григорьева [12, 13] и Никифоров [29]. Другие же авторы считали, что поскольку каждое функциональное действие совершается через цикл биохимических процессов, то каждый отдел нервной системы, выполняя ту или иную специфцческую функцию, осуществляет тем самым и трофическое действие [26, 39].
Классической моделью для изучения трофических влияний нервной системы стала поперечнополосатая мышца. Тауэр [220] первая пришла к заключению, что все денервационные'изменения в мышце наступают исключительно только вследствие перерезки передних корешков. Было показано, что общая трофическая функция моторного нейрона проявляется прежде всего в регуляции восстановительных метаболических процессов [14]. РНК нейрона, равно как и других тканей, также участвует преимущественно в восстановительных процессах и не должна иметь прямого отношения к специфической функции нейрона [7].
Ясно, что каждое функциональное действие нейронов сопровождается изменением метаболизма, особенно нуклеиновых кислот и белков [146]. На основе гистологической и цитохимической корреляции была достаточно обоснована связь деятельного состояния нейронов с изменениями метаболизма при синаптическом возбуждении и торможении. Деятельное состояние нервной системы сопровождается также рядом изменений структуры нервных и окружающих их глиальных клеток. Вопрос заключается в том, какие из этих функциональных изменений можно назвать нейротрофическими.
Ясное определение этих взаимоотношений стало возможным лишь благодаря методам современной клеточной физиологии. При их помощи было показано, что феномены, регулирующие связи между отдельными клетками, простираются от простого межклеточного взаимодействия в регуляций роста в условиях тканевых культур вплоть до межклеточных взаимодействий, участвующих в формировании и поддержании дифференцировки тканей в процессе развития и в зрелом возрасте. Нельзя было
ожидать, что в основе всвх этих процессов лежит единый механизм. Возникло предположение, что существуют две основные системы связи между нейронами и между нейроном и мышечной клеткой; существование их и было действительно доказано. Чрезвычайно быстрые процессы, продолжающиеся миллисекунды и появляющиеся при проведении нервных импульсов, при синаптических реакциях облегчения и угнетения базируются первично на ионной основе (см. [25, 93]), и их можно сравнительно легко отличить от длительных «нейротрофических» процессов, поддерживающих и восстанавливающих структуру и функциональные способности клеток (см. обзоры [93, 116, 119, 136]).
То, что агенты и/ или механизмы «неимпульсной» природы эффективны в отношениях между нервными клетками и клетками другой природы, было хорошо показано на тканевых культурах [77, 136, 171]. Однако оставалось неясным, какую роль эта долгосрочная («неимпульсная») деятельность нейронов играет в нормальных условиях in vivo во взрослом организме.
Так как нервно-мышечные связи позволили относительно легко Изучать воздействие нервных передатчиков и различного рода клеточных контактов, то внимание было прежде всего обращено на нейротрофические связи между нервной и мышечной клетками и на их дифференцирование из других межклеточных механизмов. 1
Моторный нейрон можно рассматривать как нейросекреторную клетку, которая передает мышечной клетке долгосрочную информацию, необходимую для поддержания структуры и метаболизма постсинаптических клеток. То, что многие свойства мышечных клеток долгосрочно регулируются посредством этого нейронального механизма, было ясно показано перестройкой различных свойств быстрых и медленных мышц, происходящей после перекрестной реиннервации. Это было установлено прежде всего для сократительных свойств мышц, которые изменялись в соответствии с новой «чужой» иннервацией [61 ].
Такие влияния часто определяются как «долгосрочная регуляция поддержания (long-term maintenance regulation), не опосредствованная нервными импульсами» [126, 136, 184].
Можно было предположить, что аналогичные общие закономерности существуют также и в межнейрональных отношениях. Такая точка зрения подкрепляется, например, данными о реакциях в нейронах после аксотомии (см. [120,123]) (рис. 10.1). Различие состоит в мультисинаптической природе центральных межнейронных кот тактов и в отсутствии точных данных о природе медиатора. Поэтому изучение нейротрофических связей между нервной и мышечной клетками оказывается гораздо более доступным, чем исследование аналогичных связей между нервными клетками.
При обсуждении «трофической функции нервной системы» заслуживают внимания еще два аспекта, а именно влияние высших нервных центров на «трофику» тканей и значение трофических.
процессов в процессах памяти (хранении информации). Первый аспект касается кортикальных регуляций функции внутренних органов, т. е. кортико-висцеральной физиологии [6, 27]. В этом аспекте рассматривается прежде всего вопрос об условнорефлекторной природе явления, связанного, конечно, в первую очередь с импульсной активностью, передающейся к эффектору преимущественно через вегетативные нервы. Сосудодвигательные ме-
Рис. 10.1. Упрощенная модель, показывающая аналогичные изменения в периферических (наверху) и центральных (внизу) нейронах после перерезки клеточного отростка, в результате которой развиваются ретроградные клеточные сдвиги (хроматолиз, 1) и вторичные дегенеративные изменения в пре-терминальных (2) и терминальных (3) сегментах. Последние приводят к временной «абортивной регенерации» [66], вызванной временно сохраненным аксоплазматическим током с временной трансспнаптпческой (4) активацией мышечной плп нервной клетки.
ханизмы играют несомненно также важную роль в метаболизме. Существенное значение для метаболизма внутренних органов — как и мышцы—имеют периферические нейроны, которые в качестве «конечного общего пути» принимают участие не только в рефлекторных процессах [206], но и в поддержании (maintenance) зависимости периферических органов от нервной системы.
Что касается механизмов памяти, то в них, вероятно, одновременно принимают участие процессы на молекулярном, клеточном и системном уровнях (см. главу 11). Нейротрофические процессы играют роль, по-видимому, скорее в механизмах долговременного хранения информации в нервной системе, чем в механизмах приобретения информации, которые зависят первично от импульсной активности. Первоначальная молекулярная гипотеза
обучения и памяти на основе синтеза новых информационных макромолекул [146] оказалась неудовлетворительной. Более вероятно, что запечатление и хранение информации базируются на межклеточных связях и на синаптических контактах между нейронами. Вероятно, здесь принимают участие не только процессы импульсной активности (как, например, реверберация возбуждения в нейронных цепях), но и пластические изменения в клетках, особенно метаболизм РНК и белков (см. [35, 43]).
Пресинаптическая стимуляция приводит к повышению синтеза РНК в нервных клетках даже при исключении генерации постсинаптических потенциалов [7, 107]. В синаптической регуляции белков [45] принимают, следовательно, участие также неимпульс-ные механизмы. Наконец, было обращено внимание и на неимпульсные механизмы в процессах образования синапсов [75, 93]. Процессы роста важны не только в течение пренатального развития, но и иостнатально в процессах поддержания и расширения синаптических контактов при так называемой коллатеральной регенерации. Такие процессы роста могут представлять структуральную основу морфогенетической памяти.
Если рассматривать нейрон как нейросекреторную клетку, то пе должно казаться неожиданным, что активные вещества (и пе только передатчики) могут высвобождаться также и неимпульсным механизмом и оказывают влияние на постсинаптическую структуру. Наконец, нельзя упускать из виду и другие типы межклеточных связей, которые влияют на «поддержание контактов», как например связей нейронов и сателлитных клеток в нервной системе (см. [34, 168]), которые, может быть, также играют роль в механизме памяти [36].
Таким образом, исследование трофической функции нервной системы перешло от общих наблюдений изменения в тканях после денервации и от дискуссий о «трофических» нервах к конкретному изучению нейротрофических связей путем анализа межклеточных нейрохимических коммуникаций, проводимого часто па молекулярном уровне. С методологической точки зрения такой подход стал возможным на основе более точного знания функции медиатора, отношения медиатора к ностсинаптическим рецепторам [28, 157], равно как и на основе изучения дифференцировки и организации клеточных мембран и всего синаптического комплекса. Участие неимпульсных механизмов в дифференцировке постсинаптической мембраны было показано прежде всего в работах с тканевыми культурами (см. [77, 136]). Для понимания значения нейросекреторных механизмов в нейротрофических процессах решающее значение имело открытие и анализ аксоплазматического транспорта в нейроне (см. [176, 191 ]), который представляет собой, по-видимому, соединяющее звено в пути нейротрофических коммуникаций.
Такие исследования можно было осуществить преимущественно на нервно-мышечном соединении благодаря большой длине аксона.
Поэтому основной материал для доказательства наличия нейротрофических механизмов получается пока именно при изучении межклеточных отношений между нервной и мышечной клетками.
10.2. КОНЦЕПЦИЯ НЕЙРОТРОФИЧЕСКОЙ ФУНКЦИИ И ЕЕ ДОКАЗАТЕЛЬСТВА
В обзорных работах, посвященных нейротрофическим функциям, выдвигаются разные аспекты проблемы, как например изучения денервации и регенерации [119], нервной регуляции чувствительности к ацетилхолину (АХ) и ацетилхолинэстеразы (АХЭ), свойств «красных» и «белых» мышц [116], способности мотонейрона к дифференцировке в опытах с перекрестной реиннервацией (см. [21 ]) или «индуктивных функций», поддерживающих синаптические связи [136]. При обсуждении трофической функции нейрона дискутируются самые различные процессы трофических эффектов, наблюдаемых в тканевых культурах и при регенерации конечностей, вплоть до проблем деятельности и бездействия и динамических свойств медленных и быстрых мышц (см. [117, 123]).
Определение и различение трофической функции нейрона затрудняется, конечно, тем, что: а) передатчик трофических влияний до сих пор биохимически не определен (это заставляет прибегать к непрямым доказательствам); б) нейротрофические связи представляют собой один из компонентов межклеточных отношений, который необходимо дифференцировать от других компонентов; в) существуют связи между синтезом и высвобождением нервного передатчика и выделением нейротрофических агентов. Так, например, механизмы, посредством которых передатчик и нейротрофические вещества высвобождаются из пресинаптических окончаний в нервно-мышечном соединении, взаимодействуют с постсинаптической мембраной, оказываются аналогичными и некоторые метаболические процессы в постсинаптической клетке (например, изменения концентрации аденоин-3', б'-монофосфата — циклического АМФ) могут активироваться как путем нейротрофической [67, 169], так и гормональной [113] регуляции.
Представление о том, что зависимость мышцы от нерва нельзя полностью объяснить нейрональной активностью, связанной с высвобождением передатчика, было подкреплено следующими фактами: а) высвобождением белков параллельно с высвобождением нервных передатчиков [188, 209]; б) наличием нейросекреции, представляющей собой конкретную модель нейротрофических механизмов [51, 205]; в) аксоплазматическим транспортом белков, передвигающихся с разной скоростью [175, 191, 230] и принимающих участие в синтезе и восстановлении многочисленных белков, вовлеченных в различные функции синапсов [52, 90]; г) сложной природой синаптического аппарата, включающего связанные с гликопротеинами комплексные механизмы синтеза и высвобожде
ния пузырьков и синтеза мембранных рецепторов [52, 56]; д) метаболическим действием дистального отрезка нерва после его перерезки, которое зависит от длины этого отрезка [16, 177 J; е) нервно-обусловленным усилением роста при регенерации конечности у амфибий, независимым от проведения импульсов [208, 217]; яг) нейротрофическими воздействиями, опосредствованными афферентными нервами [193, 235]; з) специфическими изменениями в мышце после перерезки нерва, оказывающими влияние на стабильность мембраны и межклеточных компонентов [117,121,215 ]; и) трофическими эффектами, происходящими на первых этапах регенерации мышцы [18,40,41 ]; к) результатами «диссоциационных»опытов, в которых вызывались разные эффекты при блокировании проведения импульсов или аксоплазматического тока [47, 119, 141, 1731; л) трофическими влияниями нейронов на мышцу в тканевой культуре без наличия синаптической передачи и даже без контакта между нервной и мышечной клетками [77, 137, 171, 218]; м) возможностью перехода веществ из пресинаптического аксона в постсинаптическую клетку [160, 163].
Существование нейротрофических функций доказывается также многочисленными опытами по изучению нервных воздей-тавий на мышцу в тканевой культуре, развития и регенерации, денервации и реиннервации, коллатерального роста (collateral sprouting), перекрестной реиннервации и регенерации. В настоящей главе будут рассмотрены из вышеперечисленных лишь такие влияния нейрона, которые явно вызваны его неимпульсной активностью.
10.2.1. ТКАНЕВЫЕ КУЛЬТУРЫ
Исследование тканевых культур имеет большое значение для доказательства существования нейротрофических воздействий и позволит, по-видимому, произвести химическое определение нейротрофических агентов. Культивированные мышечные клетки имеют ряд автономных механизмов, при этом заметные биохимические изменения проявляются, например, во время слияния миобластов, в том числе повышение активности АХЭ [104], возникновение АХ-рецепторов и АХ-чувстви-тельности [92, 101, 195]. Имеют место кодированные сдвиги в мышечной клетке, регулированные, по-видимому, экспрессией генов. Трофические влияния могут осуществляться посредством контакта или диффузии агентов. Б культуре фрагментов спинного мозга и мышцы может проявляться синаптическая передача в присутствии кураре [73, 76, 77], после хронического воздействия на такие эксплантаты гемихолиния (НС-3) могут формироваться нервно-мышечные связи. Мышечной атрофии в хронической культуре можно избежать путем эксплантации в культуру спинномозговых ганглиев; восстановление и дифференцировка происходят также после многомесячной изоляции культивированных мышечных клеток. Экстирпация участка спинного мозга
(денервация in vitro) влечет за собой атрофию, но мышечное волокно может сохранить свое первоначальное состояние, если в культуру добавить задние корешки или симпатические ганглии, которые дают начальный, «неспецифический» трофический стимул для ранних фаз регенерации’ [77].
Клональные клеточные линии из нейробластомы обладают способностью образования нервно-мышечных контактов с клональными линиями клеток скелетной мышцы [137] после того, как токсины связывались с АХ-рецепторами, а нервные клетки лишались запасов АХ и не могли быть активированы этим медиатором [195]. Высвобождение АХ из нерва или наличие функциональных АХ-рецепторов не является необходимым условием для образования нервно-мышечного синапса [136]. Падение активности АХЭ в культивированных конечностях саламандры можно замедлить с помощью нервных эксплантатов или экстрактов [170] (рис. 10.2— вкл.). Особенно ярким эффектом обладают эксплантаты чувствительных ганглиев, замедляющие исчезновение изгибов саркоплазматической мембраны и потерю АХЭ концевой пластинкой. Специализация постсинаптических клеток в комплексных тканевых культурах может, очевидно, происходить благодаря неимпульсной активности и действию диффузи-бильных веществ. Усиливающаяся более специфическая зависимость мышечной клетки от воздействий двигательного нейрона устанавливается, по-видимому, на более поздних стадиях развития.
10.2.2. РАЗВИТИЕ И РЕГЕНЕРАЦИЯ
Доказательства в пользу наличия нейротрофических механизмов получили в исследованиях процесса образования нервно-мышечной связи (концевой пластинки и хеморецепторов), морфогенеза в течение регенерации конечностей у амфибий, метаморфоза насекомых и регенерации мышцы. Эмбриогенез нервно-мышечной связи проходит последовательные стадии, прежде чем достигается полная специализация пре- и постсинаптических структур [139, 213, 232]. Первые признаки образования нервно-мышечной связи, например утолщение постсинаптической мембраны, отмечаются уже тогда, когда приближающиеся аксоны еще отделены от мышцы щелью в 200—300 нм. Аксоны при этом содержат пузырьки подобно зрелым концевым аксонам [139], что свидетельствует о возможности нейротрофических влияний путем диффузии активных веществ. Особого внимания заслуживает изучение развития холинорецепторных свойств мышечных волокон. Скелетные мышцы к моменту рождения обладают чувствительностью к АХ на всем своем протяжении; в процессе постнатального онтогенеза холинорецепторная зона быстро су-суживается, и у кролика через 9—10 дней ограничивается уже, как у взрослого животного, только областью вхождения нерва [9—11]. Эти данные были подтверждены при микроэлектро-
физиологических исследованиях [85]. Йо-видимому, малодифференцированная хеморецепция по всей поверхности клеточной мембраны, связанная с наличием внесинаптических холиноре-цепторов, является исходным свойством клетки. Дифференциация хеморецепции, равно как и ее пространственное сужение на синаптическую область, происходит постепенно в процессе развития. Решающим фактором является здесь, очевидно, влияние нерва, так как после денервации мышечное волокно вновь становится чувствительным к АХ также и во внесинаптической области; во время реиннервации чувствительность к АХ опять концентрируется в синаптической области.
Однако неясно, принимают ли в этих процессах участие также и чисто миогенные механизмы и представляет ли нервное воздействие явление импульсной или неимпульсной (нейротрофической) природы. Способность мышечных волокон реагировать на АХ свидетельствует о наличии АХ-рецепторов; уже миобласты и миотубы обладают чувствительностью к АХ, которая по мере развития постепенно повышается [92, 100], что говорит в пользу участия первично миогенных механизмов. Чувствительность к АХ, наличие холинорецепторов и синтез АХЭ отмечаются еще до иннервации. Возникновение высокой чувствительности к АХ в месте нервно-мышечного контакта, концентрация рецепторов представляет собой важный этап во взаимодействии между нервом и мышечной клеткой.
С эволюционной точки зрения интересно, что тонические (с многочисленными синаптическими контактами) и фазические (фокально иннервированные) волокна различно реагируют на АХ [22]. Аналогичная реакция на АХ встречается в тонических волокнах низших позвоночных и птиц и в незрелых волокнах млекопитающих. Данное сходство было отмечено уже давно и касается также сократительных свойств мышцы [19, 20].
Развитие нервно-мышечной связи не прекращается иммобилизацией мышцы [155]; но, с другой стороны, колхицин и винбластин, блокирующие аксоплазматический транспорт, приводят к остановке развития нервно-мышечных связей [154]. Структурная дифференцировка пластинки связана, следовательно, скорее с механизмами аксоплазматического транспорта, чем с импульсной активностью [150, 156].
Нейротрофические влияния играют роль в чувствительной иннервации, в частности, рецепторов интрафузальных мышечных волокон; данные влияния a priori независимы от импульсной активности. Развитие мышечных веретен не зависит от моторной иннервации, но дифференцировка веретен после деафферентации прекращается [235—237]. Здесь можно предположить наличие морфогенетического нейротрофического влияния чувствительных концевых аксонов, т. е. высвобождение «трофических» агентов. Плотные пузырьки (dense core vesicles), которым приписывается нейросекреторная природа, были найдены в чувствительных тер
минальных аксонах, равно как и в процессе развития пластинки в тканевых культурах in vivo [77]. Вкусовые тельца дегенерируют после денервации и вновь восстанавливаются при реиннервации [180, 233]. Такие наблюдения собственно и привели впервые к представлению о транспорте вещества гормональной природы от нейрона к аксональному окончанию.
Наличие нейротрофических явлений было убедительно показано в процессе регенерации конечностей после их ампутации у амфибий. Моторные, чувствительные, а также центральные нейроны могут предоставлять нейротрофическое вещество, обеспечивающее такую регенерацию. Но необходимо и пороговое количество нервных волокон («количество аксоплазмы» — [208]). В способности нервов стимулировать регенерационный процесс играет роль критический период регенерации и время денерваций. На очень раннем этапе развития у саламандры могут регенерировать и анейрогенные трансплантаты конечностей независимо от того, иннервированы они или нет; но затем регенерация становится зависимой от нервов [217]. Анейрогенные мышцы конечностей у Amblystoma развиваются и дифференцируются вначале нормально, но через две недели происходит деструкция мышечных волокон [223]. Подобные поздние эффекты денерваций были отмечены также в развитии мышц насекомых [74, 189]. П] В процессе пре- и постнатального развития постепенно проявляются характерные различия сократительных 'свойств быстрых и медленных фазических, а также фазических^и тонических волокон в зависимости от степени зрелости двигательной системы при рождении [20, 72, 130]. Различия в АТФ-азной активности и способности саркоплазматического ретикулума связывать кальций в быстрых и медленных волокнах оказываются здесь, очевидно, очень важными. После фетальной денервации миофибрил-логенез и дифференцировка саркотубулярной системы протекают нормально, но дифференцировки разных типов мышечных волокон не происходит [135]. Дифференцировка типов волокон зависит, по-видимому, от постнатальной дифференцировки различных типов пластинок [194], и, возможно, что здесь принимает участие прежде всего импульсная деятельность [123].
10.2.3. ДЕНЕРВАЦИЯ
После денервации в мышце происходит целый ряд изменений, касающихся свойств мембраны, АХ-чувствитель-ности и АХ-рецепторов, синтеза и деградации белков, структуры и активности ферментов, связанных как с сопряжением между возбуждением и сокращением (excitation-contraction coupling), так и с доставкой и утилизацией энергии (см. обзоры [21, 116, 117, 121, 136]). Соответствующие изменения не являются необходимым следствием отсутствия трофической функции нейрона, скорее они связаны с отсутствием импульсной активности, т. е.
с бездеятельностью. Опыты, показывающие лишь количественные различия в наступлении денервационных изменений, ограничиваются только констатацией фактов, но не доказывают, что здесь имеет место истинное трофическое нарушение.
В связи с этим важно применение адекватных показателей нейротрофической функции, касающихся прежде всего неимпульсной активности нейрона, связанной с аксоплазматическим транспортом, и стимуляции синтеза специфических белков в мышце. Чаще всего такими показателями служили: 1) изменения свойств мембраны мышечных волокон, 2) изменения чувствительности к АХ, распределения и синтеза холинорецепторов, 3) изменения сократительных свойств и 4) изменения ферментативного аппарата мышцы. Денервационные изменения мембранных свойств следующие: падение мембранного потенциала и повышение сопротивления мембраны [461, появление потенциалов действия, резистентных к тетродотоксину [215], возникновение фибрилляционных потенциалов, начинающихся в форме спонтанных колебаний мембранного потенциала [216], центробежное распространение чувствительности к АХ [11].
FHa основе денервационных опытов возникло предположение, что чувствительность к АХ регулируется нейротрофическим агентом [184], и в качестве первого кандидата рассматривалось спонтанное высвобождение АХ, продуцирующее миниатюрные потенциалы концевой пластинки. Однако прямое влияние АХ на протеосинтез в мышце не известно. Падение мембранного потенциала [46], повышение концентрации РНК и ДНК [125] начинаются гораздо раньше, чем исчезают миниатюрные потенциалы. Быстрая деполяризация мембраны (уже через 3 ч после денервации) представляет собой, по-видимому, начальную ответную реакцию постсинаптической мембраны, и ее можно вызвать посредством блокады аксоплазматического тока [47, 159]. Наконец, прямое длительное раздражение денервированной мышцы может ослабить и даже прекратить развитие внесинаптического повышения чувствительности к АХ in vivo [152, 153, 173, 174] и в тканевой культуре [198]. Регуляция чувствительности к АХ и синтез холинорецепторов — это, очевидно, комплексный процесс, в котором принимают участие как импульсные, так и неимпульсные механизмы, а также другие факторы, например вещества, высвобождаемые делящимися клетками [57]. Поэтому такие глобальные изменения, как, например, атрофия, не могут, конечно, служить адекватными показателями этих процессов. Пока не удалось определить специфические ультраструктурные изменения в денервированной мышце. В гистохимическом отношении была описана предпочтительная атрофия волокон II типа (обладающих высокой АТФазной активностью” [97]) и сдвиг к более гомогенной популяции «красных» волокон [106]. Различия в энзиматическом профиле мышечных волокон после денервации постепенно стираются [23, 44], чего не было обнаружено
при атрофии вследствие бездеятельности. Это свидетельствует о потере дифференцировочного влияния нейрона, однако все еще нельзя утверждать, что при этом речь идет о выключении нейротрофического механизма.
Первоначальное представление о том, что сократительные свой' ства регулируются трофическим фактором, высвобождаемым из нерва 161], вызывает сейчас сомнение. Хроническое раздражение денервированной мышцы приводит к укорочению времени СО' кращения in vivo 160, 183] и in vitro [120]. При этом частота раздражения является, очевидно, решающим фактором в трансформации времени сокращения мышцы в опытах со стимуляцией как денервированной 1173, 174], так и иннервированной мышцы ]202]. Более того, не было отмечено раннего, временного изменения времени сокращения после денервации, зависимого от длины отрезка перерезанного нерва, что говорило бы о зависимости его от аксоплазматического тока и нейротрофических влияний. Следовательно, изменения сократительных свойств не могут служить надежным показателем нарушения трофической функции нейрона.
Денервационная атрофия представляет по существу нарушение регуляции расщепления и синтеза белков. Отмечается повышение лизосомальных ферментов и деградация белков [108, 119, 182], понижение синтеза белков [108], повышение включения фосфора 33Р [42] и аминокислот в белки денервированной мышцы in vivo [119], что является, однако, результатом повышения доставки субстрата [121]. Нарушения метаболизма белков особо выражены после функциональной нагрузки денервированной мышцы; они свидетельствуют об общем нарушении восстановительных процессов, управляемых трофической функцией нейрона. Обнаруживается также сдвиг от синтеза сократительных белков к синтезу саркоплазматических белков [187] и нарушения метаболизма дипептидов [37]. Данные исследования в настоящее время дополнены изучением изменений в разных клеточных компартаментах (см. обзор [123]).
Однако определить специфичность денервационных изменений не удалось. Ряд денервационных явлений не получил до сих пор объяснения. К числу таких явлений принадлежит повышение концентрации РНК, аккумуляция рибосом [105], высвобождение квантов АХ из шванновских клеток [82] и быстрое падение содержания АХЭ в синапсе [116] денервированной мышцы. Нерв необходим, очевидно, для индукции АХЭ на пластинках [238]. Очень незначительное изменение активности этого фермента можно обнаружить при^тенотомии или иммобилизации [117].
Важные данные в пользу значения нейротрофических механизмов дали опыты, в’которых'сравнивались изменения в мышце, нерв которой был перерезан'на'различных'расстояниях от мышцы. В данном~случае~влияние импульсной’активности было выключено (см. обзорные работы [123, 136, 1761). Показано, что дегене-460
рация аксонов в пластинках [15, 16], потеря миниатюрных потенциалов [185], фибрилляция и повышенная чувствительность к АХ [177], повышение протеолитической активности [120], понижение мембранного потенциала [46] и другие нарушения наступают раньше в денервированной мышце с коротким нервным отрезком. Это свидетельствует о постепенной потере трофических веществ (транспортируемых, по-видимому, с аксоплазматическим током), которая происходит раньше в мышце с коротким отрезком нерва (рис. 10.3).
Значение денервационных экспериментов — классического подхода к изучению нейротрофических взаимоотношений — огра-
гоо
Рис, 10.3. Количество интактных концевых пластинок (/), уровень гликогена после введения глюкозы (2), уровни активности протсолити- 150 ' ческпх ферментов (5), холинэстеразной активности (4), и время сокращения (5) мышц, иннервированных малоберцовым нервом, через о
24 ч после перерезки нерва, прове- <—>-100% денной высоко на бедре. Данные выражены в процентах к уровням при перерезке вблизи мышцы. «Высокая» перерезка малоберцового нерва __ была проведена на одной стороне, а перерезка вблизи мышцы — на противоположной.
Видно, что денервационные изменения
в мышце с длинным нервным отрезком L_ _
наступают позже, но время сокращения 7
не меняется,
ничено тем обстоятельством, что в результате перерезки нерва происходит как прекращение импульсной активности, так и «депривация» нейротрофических агентов. Данное ограничение относится также к «фармакологической денервации», например, при ботулиновой интоксикации [86, 214], которая, по-видимому, приводит к блокаде высвобождения не только АХ, но и нейротрофических агентов из нервных окончаний. Отсюда вытекает значение «диссоциационных» опытов, при которых выключается только импульсная активность или аксоплазматический ток. Блокирование аксонального транспорта колхицином или винбластином приводит к развитию внесинаптической чувствительности к АХ и других «денервационных» изменений [47, 141 ] без блокады проведения импульсов. С другой стороны, выключение одной только импульсной активности не имеет последствием ни изменений пресинаптических аксонов, ни других денервационных сдвигов [125]. В диафрагмальных мышечных волокнах, «децентрализованных» от интактной нервно-мышечной связи путем сдавления, развивается высокая АХ-чувствительность, ко
торая сохраняется на протяжении 15 дней, несмотря на очень быстрое восстановление нормального проведения потенциалов действия через поврежденный участок к неповрежденной части
Рис. 10.4. Развитие чувствительности к АХ и передачи потенциала действия после раздражения диафрагмального нерва, через 3 дня (наверху) и 10 дней (внизу) после сдавления диафрагмы.
1 — сегмент с интактной иннервацией, г — «децентрализованный» сегмент мышечного волокна, з •— место сдавления. Показано развитие и сохранение повышенной чувствительности к -АХ в сегментах 2 л 3 (жирная линия), в то время хак передача потенциалов действия через сегмент 3 (см. стрелки) быстро восстанавливается. В случае регенерации
• потенциала действия нижний луч представляет его первую производную [227 ].
мышечных волокон [225]. Таким образом, опыты с «диссоциацией» (рис. 10.4) могут предоставить информацию о взаимосвязи между обеими главными системами коммуникации, действие которых одинаково прекращается в результате денервации.
10.2.4. РЕИННЕРВАЦИЯ И КОЛЛАТЕРАЛЬНАЯ РЕГЕНЕРАЦИЯ
Реиннервация мышцы приводит к восстановлению нервно-мышечной связи [53, 2321, обмена веществ [1191, -мембранных свойств [1811, гистохимической картины и сократитель
ных свойств [72] мышцы. Повышение синтеза белка и ускорение включения в них аминокислот осуществляется в этом случае не за счет повышенной доставки субстрата (как это имело место в денервированной мышце), а за счет настоящей стимуляции процессов синтеза, которые, конечно, регулируются нейрональным путем. Стимуляция синтеза белков связана, очевидно, также с транспортом веществ, играющих важную роль в восстановлении и поддержании аксона. Скорость аксонального тока в регенерирующем нерве действительно повышена [112, 164]. На ранних стадиях регенерации аксоны находятся в контакте с мышечным волокном без нервно-мышечной передачи, но они опосредуют уже трофические 'эффекты [124]. При регенерации конечностей^ [80] и при реиннервации мышц, у птиц [54] или у лягушки [81, 82] наблюдалась «фаза без передачи» (non-transmitting phase). Существование такой фазы образования синапсов при реиннервации было доказано также и при применении бунгаротоксина [98] или d-тубокурарина [73], что несомненно свидетельствует об участии нейротрофических механизмов в этом процессе. Реполяризация мембраны при реиннервации протекает быстро, частота миниатюрных потенциалов возрастает лишь постепенно, а чувствительность к АХ остается очень долго повышенной (как и в денервированной мышце). Это объясняется, вероятно, тем, что из нерва высвобождается вещество, которое непосредственно регулирует мембранный потенциал, а в регуляции внесинаптической чувствительности к АХ принимают участие разные нейротрофические вещества, кроме спонтанно высвобождающегося АХ [46, 181].
Реиннервация и редифферёнциация постсинаптических структур моторной пластинки протекает тоже в регенерирующей мышце в результате интоксикации ботулином (рис. 10.5) [150].
Коллатеральная регенерация аксонов может происходить вдоль аксона или дистально с образованием новых пластинок. Это — компенсационная реакция аксона, которую можно изучать как в центральной, так и в периферической нервной системе. Возможно, что речь идет о нормальном процессе восстановления синаптических контактов. Как будет показано ниже, в ц. н. с. он рассматривается как общий механизм восстановления при травме [178], а также и как основной механизм пластичности [93]. Соседние чувствительные аксоны прорастают в денервированную область кожи и приводят к гиперневротизации; образование новых пластинок можно было отметить после блокады импульсной активности [148]. При нормальных условиях иннервированная мышца не принимает новой добавочной иннервации; это происходит лишь после ее денервации или повреждения. Кажется, что повышение чувствительности к АХ, например, после повреждения мышечных волокон представляет одно из условий развития добавочной иннервации [136].
10.2.5. ПЕРЕКРЕСТНАЯ РЕИННЕРВАЦИЯ
Перекрестная реиннервация (или гетеро-иннервация) происходит при перекрестном соединении двигательных нейронов с медленной или быстрой мышцей, или же при имплантации «чужого» нерва в денервированную мышцу. Опыты с перекрестной реиннервацией показали решающую роль мотонейронов в возникновении и поддержании различий в функциональных характеристиках мышечных волокон [21]. Этой проблематике посвящены многочисленные работы (см. 172, 116, 121, 136]). Сократительные свойства [61], миозин-АТФазная активность [62], биохимические [88] и ультраструктурные особенности [151, 236], контрактура в ответ на кофеин [96, 127] и многие другие свойства мышцы трансформируются в зависимости от типа иннервирующего нейрона. Основным предположением о механизме осуществления такой трансформации является образование пластинки «чужого» типа [140], опосредствующей специфичность «чужого» нейрона (рис. 10.6). Так, например, после перекрестного соединения «медленного» нерва, иннервирующего нормально тоническую мышцу в фазическую мышцу, обнаруживается понижение квантового содержания АХ [227 ] и чувствительности к АХ [226]. Свойства мотонейрона остаются после перекрестной реиннервации по существу без изменений или редифференциру-ются в процессе восстановления до первоначального состояния [167]. Поэтому нерв играет такую важную роль в трансформации мышцы. Однако в ней принимают участие также миогеяные факторы; важным оказывается период времени, в котором была проведена перекрестная реиннервация. Трансформация, вызванная у старших животных, может быть очень неполной [54]. Пластичность постсинаптической структуры изменяется, следовательно, в процессе развития. То обстоятельство, что реакция мышечной контрактуры изменяется прежде, чем происходит восстановление нервно-мышечной передачи, свидетельствует об участии в перекрестной реиннервации нейротрофических механизмов. Данное предположение нельзя, конечно, принимать на основе данных о трансформации скоростей мышечного сокращения [61 ], которая первично регулируется посредством импульсной активности нерва. Исследования перекрестной реиннервации являются исключительно важными с точки зрения нейрональной специфичности [118, 121], но их значение для анализа нейротрофических механизмов очень ограничено в связи со сложностью экспериментальных приемов и трудностью дифференцирования миогенной нейротрофической и импульсной активности в таких опытах.
10.2.6. РЕГЕНЕРАЦИЯ МЫШЦЫ
Уже первое описание регенерации мышцы после пересадки измельченной мышечной ткани, проведенной Студит-ским [41}, показало, что трансплантация мышцы представляет 464
собой исключительно важный метод для изучения нервно-мЫшёЧ-ных соотношений. Мышечная ткань дегенерирует и вновь регенерирует; при этом трофическое влияние нерва первоначально трактовалось как воздействие на «пластическое состояние» мышцы [17, 40]. Оказалось, однако, что это «пластическое состояние» обусловлено сильной активацией сателлитных клеток, образующих запасную популяцию, важную для регенерации [68]. Нерв
Рис. 10.7. Сокращение быстрой мышцы m. extensor digitorum longus, трансплантированной в гнездо медленной мышцы m. soleus (слева), и медленной мышцы, пересаженной в гнездо быстрой (справа), через 30 дней после «перекрестной трансплантации» и реиннервации мышц. Видна трансформация кривой сокращения в перекрестно пересаженной мышце. Прямое раздражение in vitro. Горизонтальная линия— 10 мс [7].
не оказывал влияния на первые стадии регенерации, но дифференцировка была нарушена начиная со стадии миотуб [18]. Регенерация и восстановление осуществляются на первых стадиях реиннервации, еще до возобновления нервно-мышечной передачи [18 ], что свидетельствует об участии в них нейротрофических механизмов. Сократительные свойства и гистохимическая картина дифференцируются от характерных для медленной до характерных для быстрой мышцы в таком порядке, как это наблюдается в процессе онтогенетического развития [69, 70]. При перекрестной пересадке (например, быстрой мышцы в гнездо медленной мышцы) трансформация оказывается очень полной и более совершенной, чем после перекрестной иннервации (рис. 10.7), именно потому, что нерв, по-видимому, оказывает большее влияние на дедифферен-цированную ткань (или на «пластическое состояние») [70].
10,3. МНОЖЕСТВЕННОСТЬ МЕХАНИЗМОВ РЕГУЛЯЦИИ СВОЙСТВ ПОСТСИНАПТИЧЕСКИХ КЛЕТОК
Свойства постсинаптических клеток регулируются разными механизмами — они связаны, конечно, не только с трофической функцией нейрона. Важность дифференциации этих механизмов очевидна уже при выборе адекватных параметров нейротрофических функций; это различение не легко, но необходимо, особенно в работах по физиологии развития. Межклеточные взаимоотношения обеспечиваются множественной регуляцией; здесь можно коснуться лишь важнейших из них и привести некоторые примеры.
30 Общая физиологии нервной системы
465
ю.3.1. Первичные (авторегул яционные) механизмы
Следует иметь в виду, что даже в клетках тканевых культур был обнаружен ритм количественных изменений синтеза белков (например, в ацинарных клетках околоушной слюнной железы [4, 5]). Такие ритмы были отмечены также в нейроглиальных клетках (34]. Неясно, чем обеспечивается синхронная работа клеток. Частота колебаний зависела от частоты внешних воздействий на железы; можно говорить о «клеточной па-
Рис. 10.8. Временной ход изменений времени сокращения и тетанического напряжения денервированных (штриховые линии) и иннервированных (сплошные линии) трансплантатов длинного разгибателя пальцев (m. extensor digitorum longus) крыс, подвергнутых действию меркаина.
Жирные линии — соответствующие изменения максимального тетанического напряжения иннервированных и денервированных трансплантатов. Тонкие линии — изменения времени сокращения. Видно первоначальное укорочение времени сокращения и повышение тетанического напряжения как в иннервированных, так и в денервированных трансплантатах [71].
мяти», которая может играть важную роль как элементарный внутриклеточный контрольный механизм 15]. По-видимому, речь идет о «кодированных» генетических механизмах; об этом свидетельствует также обнаружение роли «миогенных» механизмов в мышце в процессе развития.
Известно, что первые фазы развития мышечных волокон протекают без влияния иннервации [103]. Координированное развитие холинорецепторов, чувствительность к АХ, митотической активности и синтезу филаментов [100] в тканевых культурах также говорят в пользу существования внутриклеточных генетических контрольных механизмов. В трансплантатах мышцы при отсутствии нерва до известного срока происходит не только. синтез филаментов, но и уменьшение времени сокращения [711
(рис. 10.8). Возникли вопросы о том, в какой мере может осуществляться дифференцировка мышц при отсутствии нервных влияний. Мышечные волокна различных мышц различаются по структуре, сократительным, метаболическим и мембранным свойствам [20, 21, 72, 116, 121, 123]. По существу различные данные отражают разные свойства иннервирующих их мотонейронов [61, 65]. С этим связана узкая корреляция между физиологическими и гистохимическими свойствами нервных и мышечных клеток и моторных единиц [65] и гомогенная гистохимическая картина отдельных моторных единиц [94]. В тканевой культуре нельзя обнаружить дифференцировку различных гистохимических типов [50]. Электрофоретическая картина низкомолекулярных цепей эмбрионального миозина быстрой мышцы не отличалась от таковой мышцы зрелых животных [210]. Переходная первая фаза развития медленных мышц (m. soleus морских свинок) — замедление времени сокращения и потеря быстрых волокон (с высокой АТФазной активностью) развивается как во время первой стадии онтогенеза, так и в трансплантированной денервированной мышце [131]. Следовательно, миогенные (очевидно, генетические) механизмы первично функционируют без влияния нейрона, который, однако, позже постепенно приобретает решающую роль в «поддержании» и дифференцировке мышечных волокон. Об этом свидетельствует поздний распад анейрогенных конечностей [223] или мышц насекомых во время метаморфоза после денервации [189].
10.3.2. ИМПУЛЬСНАЯ АКТИВНОСТЬ
Повышенная активность или, наоборот, бездеятельность оказывают действие на синаптические^функции и метаболизм мышцы [121, 200]. Это подтверждается данным об изменениях сократительных свойств, гистохимической картины и чувствительности к АХ после раздражения in vivo и in vitro. Частота раздражения представляет собой, по-видимому, важнейший фактор, так как трансформация этих свойств протекает различным образом в зависимости от частоты раздражения как в денервированной [173], так и в нормальной мышце [202]. С другой стороны, при бездеятельности отмечаются лишь очень небольшие изменения скорости сокращения [102], спонтанного высвобождения медиатора и чувствительности к АХ. Данный вопрос нельзя считать пока разрешенным. Однако нет сомнения в том, что в регуляции скорости сокращения, гистохимической картины и чувствительности к АХ импульсной активности нейрона принадлежит большое значение. То, что ботулиновый токсин блокирует высвобождение АХ и вызывает изменения в мышце, подобные денервации (например, повышение чувствительности к АХ), привело к представлению об АХ как о «нейротрофическом» агенте [86г87, 214]. Дальнейшие исследования показали, однако, невер-
ность такого представления: ботулиновый токсин может блокировать также выделение и других «нейротрофических» агентов. «Диссоциационные» опыты [47, 125, 141, 173] ясно говорят о том, что в регуляции свойств мышцы принимают участие совместно как импульсная, так и нейротрофическая активность нейрона.
10.3.3. ГОРМОНАЛЬНЫЕ МЕХАНИЗМЫ
Гормональные механизмы можно лучше всего исследовать в мышцах, деятельность которых сильно зависит от гормонов, —в так называемых target-мышцах. Так, например, в мышце levator ani крысиной самки, зависящей от андрогенов, происходит быстрая инволюция. После перинатального введения тестостерона мышцу можно сохранить и при денервации [63]. На этих стадиях тестостерон может воздействовать в качестве трофического гормона относительно независимо от нервных влияний. На более поздних этапах онтогенеза взаимодействие с нервом оказывается, однако, важным; при денервации в этот период не происходит тестостеронзависимого повышения протеосинтеза, как в иннервированной мышце. Совокупность нервных и гормональных влияний удалось показать в опытах с перекрестной реиннервацией этой мышцы. Миотропный гормон (тестостерон) повышает протеосинтез в мышце после кастрации, но не вызывает изменения гистохимической картины сократительных элементов, трансформированных «чужой» иннервацией [133] (рис. 10.9). Медленная мышца — m. soleus, трансплантированная в гнездо мышцы levator ani, изменяет свою гистохимическую картину и скорость сокращения, но не приобретает чувствительности к гормону [134]. Гормональным рецепторам свойственна, следовательно, первично миогенная природа. Значение гормона для мышцы (например, ювенильного гормона для метаморфоза) очень велико. Отсутствие этого гормона влечет за собой очень быструю дегенерацию и инволюцию некоторых мышц у взрослого шелкопряда [172].
10.3.4. ДРУГИЕ МЕХАНИЗМЫ
При рассмотрении механизмов регуляции свойств клеток нельзя игнорировать также гуморальные и периферические факторы. Изменения скорости тока крови и связанные с этим изменения доставки субстрата в процессе развития представляют собой важный добавочный фактор в дифференцировке различных метаболических типов мышцы [145]. Иммуннофлюоресцентными методами [114] было доказано участие иммунных реакций. Иммуннохимические изменения были отмечены также в денервированной мышце [142]. Периферические факторы, например удлинение мышцы, оказывают влияние на скорость сокращения, а отчасти и на гистохимическую картину в денервированной мышце [109, 129, 183]. Все это усложняет анализ и точное определение 468
«нейротрофического» влияния. Рис. 10.10 иллюстрирует множественную регуляцию мышечных свойств.
Рис. 10.10. Схема, иллюстрирующая множественную регуляцию свойств мышцы и 6 типов взаимодействий, происходящих в нерв но мышечном соединении и на мышечной мембране впе этого соединения.
1 — спонтанное квантовое высвобождение АХ, вызывающее миниатюрные потенциалы; 2 — потенциалы действия (ПД>, вызывающие высвобождение из синаптических пузырь-ков АХ, реагирующего с АХ-рецепторами и вызывающего деполяризацию, которая передается посредством тубулярной системы; высвобождение Са++ из цистерны саркоплазматического ретикулума и последующее сокращение мышечных волокон; з — высвобождение «нейротрофических агентов», выделяемых в нейроне я транспортируемых посредством аксоплазматического тока (АТ) и транссинаптичсской передачи (включающей, по-види-мому, темные «нейросекреторные» пузырьки — «dense core vesicles», DCV); при этом происходит экзо- и эцдоцитоз; 4 —• сосудодвигателъные механизмы, активируемые адренергическими нейронами и вызывающие повышение кровотока, ускорение снабжения субстратом и усиление метаболизма митохондрий (М); 5 — гуморальные регуляции'посредством транскапиллярной передачи, иллюстрируемые эффектом андрогенов, оказывающих воздействие на ядерные рецепторы (И) в гормон-сенситивной. мышце и вызывающих повышенный протеосинтез (ПС); £ — ретроградные нейронные изменения, вызываемые повышением протеосинтеза в мышечных волокнах (например, посредством андрогенов), приводящие к повышению синтеза нервных передатчиков и нейротрофических агентов, (Модифицировано и дополнено пз [1731.
10.4. ТРОФИЧЕСКАЯ ФУНКЦИЯ АФФЕРЕНТНЫХ НЕРВНЫХ ВОЛОКОН
Афферентные нервы обладают двумя нейротрофическими, неимпульсными функциями. Можно различить прямое морфогенетическое и трофическое влияние на периферические органы и регуляторную функцию с обратной связью, зависящую, вероятно, от внутриаксональных центростремительных импуль
сов. Нейротрофическое морфогенетическое влияние доказано наличием: а) зависимости структуры вкусовых почек от вкусовых нервов [193, 234]; б) стимулирования регенерации конечностей у амфибий чувствительными нервами посредством неспецифического, стимулирующего рост вещества немедиаторной природы [207, 208]; в) дифференцировки и поддержания рецепторов [235].
После деафферентации развиваются в некоторых органах трофические нарушения [12, 29]. Возможно, что здесь играют роль неопределенные до сих пор межклеточные механизмы, вызванные активацией мезенхимальных элементов. Тем не менее первичный «трофический» нейрон для мышцы — это нейрон моторный. Далее, нельзя забывать, что во всех нервах проходят эфферентные адренергические волокна, в которых «нейросекрет» (катехоламины) транспортируется аксоплазматическим током к периферическим органам [79]. Механизмы секреции белков, транспорта и высвобождения передатчика (норадреналина) у них аналогичны другим нейронам [209]. Главные трофические воздействия опосредуются, однако, не прямым изменением тока крови и доставки субстрата. Прямые нейротрофические влияния нерва на гладкую мускулатуру пока неизвестны.
Ретроградные внутриклеточные (неимпульсные) механизмы важны для поддержания функционального состояния нейрона, они принимают участие в так называемой «хроматолитической» реакции нейрона после перерезки аксона, обусловливающей повышение синтеза РНК и протеосинтеза [58], потерю синаптических окончаний [55] и изменение прямой возбудимости [167]. Потеря синаптических окончаний не происходит после длительной блокады потенциалов действия, но окончания, распавшиеся после аксотомии, не восстанавливаются, если не возобновится нервно-мышечная связь [78]. Сигнал для хроматолиза не связан с импульсной активностью, и реакция повышения протеосинтеза одинакова после перерезки как эфферентных, так и афферентных волокон [15]. Кроме этого нейротрофического механизма или сигнала существует другой сигнал, связанный с образованием синаптического передатчика. Эти два механизма удалось различить [229]. Хроматолитическую реакцию в нейроне можно вызвать блокадой транспорта без изменения проведения импульса [78, 197].
10.5. НЕЙРОТРОФИЧЕСКИЕ АГЕНТЫ, АКСОПЛАЗМАТИЧЕСКИЙ ТРАНСПОРТ И ТРАНССИНАПТИЧЕСКАЯ ПЕРЕДАЧА
10.5.1. НЕЙРОТРОФИЧЕСКИЕ АГЕНТЫ
Химическая структура нейротрофических агентов неизвестна, и поэтому здесь неизбежны гипотетические рассуждения. Можно предполагать, что соответствующее вещество сип-470
'Тезируется в нейронах, транспортируется в аксойах, высвобождается в синапсах, относительно независимо от импульсной активности нейрона и контролирует синтез и деградацию белков в иннервируемых тканях. Таким представлениям лучше всего отвечает нейросекреторный механизм [119]. Нейросекреторная природа нейронов гипоталамо-нейрогипофизарной системы была отмечена уже давно [51, 205]. Связь с исполнительным органом может, конечно, реализоваться различным способом; нейросекрет может активировать другие гормоны после высвобождения в гемолимфу, например ювенильный гормон в corpora alata насекомых [190]. Полипептиды, синтезированные в ядрах гипота-ламо-гипофизарной системы, высвобождаются прямо в капилляры. Существует ряд переходов от диффузного действия гормонов ча расстоянии вплоть до локализированного действия нейротрофических агентов в нервно-мышечном синапсе. Однако элементы, необходимые для синтеза, транспорта, хранения, высвобождения и ресинтеза очень похожи с морфологической и функциональной точки зрения [49]. Это относится к процессу высвобождения веществ в синаптическое пространство, процессу экзоцитоза или к процессам взаимодействия полипептидов или нервного передатчика со специфическим рецептором нервной клетки [196]. Как было уже показано, АХ не может являться единым агентом, опосредующим нейротрофические воздействия в нервно-мышечной синапсе. Он синтезируется в нервных окончаниях и высвобождается из них в квантах. К концевым аксонам транспортируется фермент, синтезирующий АХ, т. е. ацетилхолинтран-сфераза, но не один АХ [144]. Одновременно с АХ при раздражении нерва высвобождаются кислые белки и АТФ [188]. Гормоны нейрогипофиза транспортируются совместно с нейрофизином (carrier protein) в нейросекреторных гранулах, и их высвобождение вызвано, возможно, потенциалом действия и связанным с ним входящим током кальция. Интересно, что «плотные пузырьки», которым приписывается нейросекреторный характер, можно обнаружить при регенерации в синаптической щели. Все это свидетельствует о сходных механизмах высвобождения передатчика и нейросекреторного вещества (см. [144, 209]).
Из нерва после раздражения могут высвобождаться различные вещества, например глутаминовая кислота или белки, связывающие АХ [165]. Высвобождаемые из нерва вещества могут поддерживать мышечные клетки в тканевой культуре [219 ]. Ацетилхолинэстеразная активность мышечных клеток повышается после добавления спинномозгового экстракта в культивационную среду [192]. Диффузибильный фактор, высвобожденный из гомогената нерва, может поддерживать АХЭ-активность в культуре мышцы [170, 171 ] и имеет, очевидно, значение также и для процесса локализации холинорецепторов в культуре [211 ].
Нейротрофический агент оказывает, по-видимому, влияние на синтез ДНК, РНК и белков. Денервация регенерирующих
Койечностей после ампутации у тритона [891 или мышц насекомых после ecdysis [189] приводит к понижению синтеза ДНК, РНК и белков. Вещества из нерва повышают митотическую пролиферацию клеток.
Данные воздействия — скорее неспецифической природы — осуществляются прежде всего на ранних стадиях развития. Постнатально и у высших животных имеют место более специфические влияния (например, в регуляции митоза вкусовых сосочков [234]). Возможно, что нейротрофическое вещество на более поздних этапах развития оказывает влияние на часть генома мышцы путем дерепрессии, что может объяснить повышение содержания ДНК и протеолитической активности в денервированной мышце [119] или развитие внесинаптических АХ-рецепторов после блокады ДНК-зависимого синтеза РНК [215].
Макромолекулы могут являться действующим фактором в нейротрофических воздействиях. Синтез и аксональная миграция макромолекул, восстановление синаптических белков [52, 90] интенсивно изучаются в настоящее время с точки зрения поддержания функции аксонов и аксональных окончаний. Постсинаптические функции таких механизмов но стоят пока на первом плане исследований; концепция нейросекреторной функции нейрона включает, однако, и представление о том, что полипептиды, выделяемые в нейроне и транспортируемые внутриаксо-нально, могут регулировать протеосинтез в мышце.
10.5.2. АКСОНАЛЬНЫЙ ТРАНСПОРТ
Описаны две системы аксонального транспорта — медленный, со скоростью в 1—3 мм/день, и быстрый, со скоростью примерно в 400 мм^день [175, 176, 191 ]. Раньше был описан медленный транспорт [230] в качестве фактора постоянного роста или проксимо-дистальной конвекции аксоплазмы. Соответствующая скорость близка к скорости регенерации. Наличие связи между медленным аксональным транспортом и ростом аксона правдоподобно, но до сих пор не объяснено [111].
Аксональный транспорт поддерживает непрерывность аксона и синаптических мембран и восстанавливает белки, гликопротеины, ферменты и другие вещества, исчезающие в ходе локального расщепления, экзоцитоза в синаптическую щель и ретроградной миграции к нейрону. Все это происходит прежде всего благодаря быстрому транспорту, на который не оказывают влияния процессы возбуждения. Транспорт продолжается после блокады потенциалов действия и не повышается при усиленной активности нерва. Аксональный транспорт осуществляется в обоих направлениях [175]; центростремительный ток контролирует, по-видимому, синтез белков в нейроне и играет также роль «сигнала» для хроматолиза после аксотомии. Различные вещества, ферменты, 472
передатчики и макромолекулы передвигаются в аксоне с разной скоростью.
Аксоплазматический транспорт можно зарегистрировать по накоплению веществ после нарушения непрерывности аксона (рис. 10.11) и по наблюдению за продвижением меченых соединений после их введения в нейрон. Значение аксоплазматического тока для поддержания целостности аксона было показано на проксимо-дистальном распространении валеровской дегенерации [176]. Скорость аксонального транспорта можно приблизительно измерить в опытах с перерезками нерва на разных расстояниях от мышцы и наблюдением времени наступления тех или иных изменений. Оно составляет 80 мм/день для падения синтеза гликогена и повышения протеолитической активности [16, 120], 320 мм/день для потери миниатюрных потенциалов [185], ИЗ мм/ день для понижения ацетилхолинтрансферазной активности [221 ], 48 мм/день для ' фибрилляции и повышения чувствительности к АХ [177]. Таким образом, кажется, что различные нейротрофические агенты, постепенное истощение которых оказывает после перерезки нерва влияние на сроки наступления денервационных изменений, передвигаются в аксоне с различной скоростью. Ацетилхолинтрансфераза движется в центральном отрезке перерезанного нерва в 5 раз медленнее, чем ацетилхолинэстераза [222]. Точным авторадиографическим изучением скорости транспорта белков к пресинаптическим структурам ganglion ciliare цыпленка были обнаружены быстро продвигающиеся белки (288 мм/день), служащие для восстановления разных компонентов мембраны, и медленно передвигающиеся белки (1—10 мм/день), служащие, по-видимому, для возобновления аксоплазматических компонентов. Быстрый транспорт касается, вероятно, микротубул, а медленный — прежде всего растворимых белков [91]. Быстрый ток продолжается после перерезки нерва и не зависит непосредственно от синтеза белков, но очень зависит от кислорода и температуры [176, 191]. Медленный ток имеет, по-видимому, отношение к аксональному росту. Аксоплазматический ток прекращается колхицином, что объясняется влиянием этого вещества на микротубулы. Колхициновая блокада вызывает в мышце изменения, похожие на денервационные [47,141].
10.5.3. ТРАНССИНАПТИЧЕСКИЙ ПЕРЕНОС ВЕЩЕСТВ
Важным является вопрос о том, возможен ли прямой перенос нейротрофических веществ от пресинаптических структур к постсинаптическим. В связи с этим следует иметь в виду опыты, показывающие вступление меченых соединений из аксонов в мышцу [162, 163] и в утрикулярный нейроэпителий [48], а также транссинаптический перенос в центральной нервной системе [110]. Механизм такого переноса может заключаться в диффузии веществ, прямом переходе макромолекул или в сложных синапти-
ческих процессах, связанных с высвобождением синаптических пузырьков, с экзоцитозом, пиноцитотической активностью постсинаптической мембраны и эндоцитозом 152, 56, 138]. Часто предполагается существование связи мембраны пузырьков, в которых содержатся, может быть, как нервный передатчик, так и трофическое вещество, с мембраной нейрона и экзоцитозом; плотные пузырьки были отмечены прямо в синаптической щели пластинки [149]. Меченые нейрональные белки можно действительно обнаружить в мышце [162]. Необходимо, однако, исключить постсинаптический протеосинтез, Гистоавторадиографические исследования ganglion ciliare цыплят показали, что после угнетения протеосинтеза небольшое количество белков или пептидов может прямо транспортироваться в постсинаптические структуры [911. Синаптический транспорт макромолекул не был поэтому до сих пор убедительно доказан, ж._______
10.6. РЕГУЛЯЦИЯ СВОЙСТВ ПОСТСИНАПТИЧЕСКИХ РЕЦЕПТОРОВ
Новые методы — авторадиография, мечение с помощью альфа-бунгаротоксина [100], молекулярная фармакология [28] и анализ генерации местного электрического ответа на действие медиатора — все это создало новые подходы к решению вопроса о нервной регуляции постсинаптических рецепторов — в первую очередь, конечно, холинрецепторов. Так, например, удалось определить повышение густоты рецепторов в денервированной мышце [99] и период полураспада меченых холино-рецепторов (24 ч в культивированных мышечных клетках [84]).
На определенных этапах эволюции в межклеточных коммуникациях появляются, по-видимому, особые вещества, которые индуцируют в определенных местах специфические рецепторы. Речь идет о процессе, который можно сравнить с предполагаемым механизмом образования антител. Доказательства в пользу изменения структуры холинорецепторных молекул и способа взаимодействия с ацетилхолином в процессе онто- и филогенеза под влиянием нервной системы очень убедительны [9, 10, 28]. При этом необходимо, конечно, помнить, что: 1) образование холинорецепторов в клеточной мембране — основное свойство, первично независимое от иннервации [176, 191, 211] и, вероятно, кодированное генетически; модифицирующая же функция нервной системы заключается, по-видимому, в угнетении внесинаптической чувствительности на более поздних этапах развития; 2) различные клетки не являются чувствительными лишь к одному типу медиатора — например, центральные нейроны чувствительны к ацетилхолину, глутаминовой кислоте, ГАМК, глицину, а также К другим «нейротрофическим», до сих пор химически неопределенным передатчикам, и поэтому следует предполагать существование разных рецепторов для различных передатчиков; 3) в регуляции
чувствительности принимают участие и различные механизмы — так, например, высокой чувствительностью к АХ обладают также волокна после повреждения [158]. Активность мышцы [152, 153] понижает внесинаптическую чувствительность к АХ, Кажется, что пролиферация клеток и развитие холинорецепторов также причинно связаны [57].
В данной связи интересна прежде всего роль нейротрофических механизмов в регуляции холинорецепторов. Следующие данные свидетельствуют в пользу того, что в регуляции холинорецепторов принимают участие такие механизмы. Отмечены повышение чувствительности после блокады нерва колхицином, следовательно, после блокады аксоплазматического тока [14, 47 ], и диссоциация между внесинаптической чувствительностью к АХ и импульсной активностью. Повышение такой чувствительности отмечается в мышечном сегменте, временно изолированном от сегмента с сохраненной иннервацией [225], в реиннервированной мышце в течение длительного времени после восстановления импульсной активности [181 ] и при восстановлении импульсной активности после интоксикации ботулиновым токсином [59]. Имеется зависимость повышения внесинаптической чувствительности к АХ в денервированной мышце от длины перерезанного нерва [177]. Холинорецепторы в нервно-мышечных культурах развиваются без нервно-мышечной передачи и без прямого контакта [137], а развитие локализации холинорецепторов происходит даже после применения d-тубокурарина и альфа-бунгаротоксина [77, 136].
10.7. СПЕЦИФИЧНОСТЬ НЕЙРОТРОФИЧЕСКИХ МЕХАНИЗМОВ
Концепция «нейрональной специфичности» касается в первую очередь образования специфических детерминированных связей в нервной системе в процессе развития и регенерации. Она предполагает наличие избирательного межклеточного биохимического сродства и была разработана прежде всего при исследованиях зрительной системы (см. [147]). Высокая нейрональная специфичность в нервно-мышечных взаимоотношениях проявляется уже в зависимости свойств разных мышц или мышечных волокон (тонических и фазических, быстрых и медленных) и от характера иннервации. Ока проявляется в процессе развития, во время реиннервации, при образовании и поддержании специфических свойств мышц и при трансформации после гетероиннервации. Правда, доказательства в пользу участия нейротрофических механизмов во всех этих процессах не всегда убедительны.
Нервно-мышечные связи, образующиеся в процессе эмбриогенеза, обнаруживают в общем точно детерминированное соответствие между нервной и мышечной клетками. Такое строгое
Соответствие пе обнаруживается в Процессах реиннервации мышцы у высших позвоночных. Однако специфическая реиннервация существует у беспозвоночных [74] и у костистых рыб [179]. Это свидетельствует о высокой степени «межклеточного узнавания», по существу повторении картины эмбриогенеза. Наличие избирательной реиннервации должно предполагать механизм «нейротропизма», т.е. химико-трофического притяжения [66]. Действительно, наблюдалось, что медленные и быстрые мышцы реин-нервируются преимущественно собственными нервами, что регенерирующие аксоны избирательно направляются к определенному типу мышечных волокон; но это нельзя считать общей закономерностью. Можно сказать, что проблема нейротропизма пока не разрешена.
Роль нервной системы в поддержании специфических свойств концевых органов в течение жизни совершенно ясна. Она проявляется также в потере различий между быстрыми и медленными мышцами после денервации [119] и в процессе старения [132]. Вопрос заключается в том, проявляется ли также и здесь действие специфического нервного фактора. Можно было бы предполагать, что решающим является сильное падение спонтанного высвобождения медиатора [128]. Но при очень сильной атрофии после кастрации обнаруживается нормальная частота спонтанного высвобождения ацетилхолина [224] (рис. 10.12).
Различные мембранные свойства тонических и фазических мышц у амфибий и птиц, равно как и различные свойства быстрых и медленных мышц у позвоночных поддерживаются и регулируются различными нейронами, что проявляется в особенностях чувствительности этих мышц к АХ. С этой точки зрения мышечные волокна специализированы таким образом, что они реагируют максимальной деполяризацией на АХ, а не на другие передатчики [166J, и принимают иннервацию только в состоянии химической чувствительности, как это имеет место после денервации [11] или повреждения [158]. В настоящее время часто предполагается, что дальнейшая дифференцировка мембранных свойств быстрых и медленных мышечных волокон развивается в результате функциональной адаптации к тому типу активности (или частоте раздражения), которому мышца подвержена [173, 174, 202]. С этой точки зрения изменения чувствительности к АХ индуцируются первым нервно-мышечным контактом и поддерживаются постнатально типом активности. Данный механизм, связанный с импульсной активностью и являющийся результатом специфичности нервной клетки, несомненно имеет место постэмбрионально, но он не должен играть решающую роль на первых этапах развития, как показывают наблюдения развития нервно-мышечных контактов в культурах приблокаде нервно-мышечной передачи[77,136J.
Высокая степень нейрональной специфичности проявляется в трансформации мышечных свойств после гетероиннервации мышцы, т. е. при перекрестной реиннервации, трансплантации 476
или имплантации «чужого» перва в мышцу. Гетероиннервация — это по существу экспериментальный тест специфичности нейрона, опосредованной специфическим типом нервно-мышечной связи 154, 140, 161 ]. В процессе онтогенетического развития степень возможной трансформации изменяется. Например, сократительные и ультраструктуральные свойства фазических и тонических мышц у цыплят не менялись, если перекрестная реиннервация
Рис. 10.12. Миниатюрные потенциалы ^концевой пластинки в мышечных волокнах андроген-сенситивной’мышцызП1.-1еуа1ог_апАнормальной крысы в возрасте 3 мес (7), в сильно атрофированной мышце трехмесячной] кастрированной крысы (2) и в мышце крысы в возрасте 28 мес (3). Видно сохранение нормальной частоты миниатюрных потенциалов в сильно ’атрофированном мышечном волокне кастрированного животного (2) и почти полное исчезновение миниатюрных потенциалов в атрофированном мышечном волокне сенильной крысы (3). Записи при комнатной температуре. Внизу одиночные миниатюрные потенциалы [224].
производилась у старших животных. Трансформация оказалась, однако, успешной у только что вылупившихся цыплят [236]. Кроме факторов нейрональной специфичности, в этом процессе принимают участие также и первичные миогенные механизмы, оказывающие влияние на миогенез независимо от нервных воздействий. Значение этих миогенных механизмов ясно для первых общих стадий миогенеза, но не объяснено с точки зрения развития различных типов мышечных волокон. Неясно также, оказывают ли эти первичные механизмы влияние на дальнейшее развитие различных типов мышц. Кажется скорее, что более поздняя дифференцировка регулируется нервным путем, а именно импульсной активностью [122].
В определении нейрональной и миогенной специфичности принимают, по-видимому, участие генетические, невыясненные пока механизмы. Цитодифференцировка позвоночных рассматривается часто как депрессирование генома тотипотентных эмбриональных клеток с большим значением мРНК (см. [24, 1151). Генетические механизмы в собственно мышечных клетках намечены координированной последовательностью клеточных процессов на первых этапах развития [100, 143], Затем накладывается нейрональный генетический механизм, который может оказать влияние на экспрессию генов в мышечпой клетке [118,121]. Об этом свидетельствуют прежде всего опыты с перекрестной реиннервацией. Такие генетические интерпретации оправданны, конечно, лишь тогда, когда обнаруживаются качественные изменения в синтезе специфических белков. На избирательную экспрессию генетической информации указывают изменеиия легких цепей миозина после перекрестной реиннервации [203] или па протяжении развития мышцы [130]. Протеосинтетическая емкость изолированных рибосом в медленной мышце изменяется после имплантации быстрого нерва, и это индуцированное нервом изменение приводит к дифференцированному изменению ферментативной активности (гликолитическая активность повышается, а окислительная падает), что происходит, возможно, в результате действия различных мРНК [64]. Невероятно, чтобы такая сложная биологическая информация могла опосредствоваться быстро действующими передатчиками с низким молекулярным весом. Генетическая информация, необходимая для синтеза белков, передается скорее комплексными молекулами, полипептидами, обеспечивающими установление синаптических связей, идентификацию специфических целевых клеток и индукцию изменений в синтезе специфических белков, в частности ферментов (см. [165]). Здесь несомненно принимают участие неимпульсные механизмы.
10.8. ФУНКЦИОНАЛЬНОЕ ЗНАЧЕНИЕ НЕЙРОТРОФИЧЕСКИХ ФУНКЦИЙ
Приведенные в предыдущих разделах данные показывают, что существование трофической функции нейрона в настоящее время не вызывает сомнений. Изучение функционального значения нейротрофических механизмов затруднено, однако, тем, что до сих пор пе удалось биохимически определить нейротрофические агенты, равно как и тем, что неимпудъсные и импульсные нейротрофические влияния нейрона тесно взаимосвязаны. Участие нейротрофических механизмов предполагается при нервных травмах и восстановлении после них, в компенсаторных механизмах реакций нервной системы, в процессах памяти и пластичности, в процессе старения и при некоторых нервных и мышечных заболеваниях.
Что касается нервной травмы, то особый интерес представляет возможность временного прекращения проводимости с сохраненной непрерывностью аксонов [212]. На основе изучения течения этого типа атрофии, и особенно быстрого возобновления трофики после таких повреждений, был сделан вывод, что «анатомическая непрерывность нерва, а не импульсная активность препятствует атрофии и фибрилляции мышцы» [83]. В настоящее время, после открытия плазматического тока, это гипотетическое представление получило конкретное содержание.
Компенсаторные процесы после травм касаются не только условной и безусловной деятельности ц.н.с., но включают также и трофические механизмы [1]. В основе таких нейротрофических механизмов лежит, возможно, механизм коллатеральной регенерации.
Доказательства в пользу значения коллатеральной регенерации в ц.н.с. после повреждений весьма убедительны [186, 199, 228]. После повреждений ц.н.с. отмечается аксональный рост, новые Синаптические контакты (reoccupation of a synaptic territory), а также образование функциональных контактов [95]. Регенерация и коллатеральный рост представляют собой, невидимому, важные механизмы функционального восстановления в центральной и периферической нервной системе. Однако адекватный стимул для этого роста пока неизвестен.
Встает вопрос, имеют ли такие механизмы функциональное значение также и в нормальных условиях. Спонтанная дегенерация, потеря и восстановление нервно-мышечных связей посредством коллатеральной регенерации во время жизни были описаны [93], но не были подтверждены [232]. Такой механизм потери и регенерации синаптических контактов мог бы представлять собой структуральную основу процесса памяти [45], но эта идея носит пока чисто гипотетический характер.
Спонтанные изменения в поддерживании синаптических контактов можно наблюдать в мышцах старых животных [132]. При старении происходит сильное падение синтеза нейрональных белков и ацетилхолинтрансферазы, уменьшение и спонтанного высвобождения АХ, что, однако, не связано с повышенной чувствительностью к этому медиатору. Последующая интенсивная старческая атрофия мышцы без перерождения аксонов является результатом не понижения спонтанного высвобождения АХ, а пониженной секреции неопределенных до сих пор нейротрофических веществ [224]. Потеря способности поддерживать синаптическую связь приводит на последних этапах к потере мышечных волокон. При этом можно отметить две стадии. Прежде всего возникают «молчащие» синапсы, у которых контакт еще сохраняется, и «молчащие окончания аксонов» (silent axon terminals), которые затем оттягиваются от нарушенного субнейрального аппарата. В старческих мышцах можно отметить коллатеральную регенерацию, по не образование новых контактов. Однако возможность
потери и активации (новообразования) синаптических контактов существует, и этот нейротрофический механизм мог бы иметь важное значение в явлении пластичности в центральной п периферической нервной системе. Механизм синаптической модуляции с точки зрения влияния повышенной и пониженной деятельности включает, по-видимому, как импульсные, так и пеимпульсные, нейротрофические процессы.
Различение данных механизмов все еще чрезвычайно трудно, но представляет очень важную задачу нейрофизиологии. Пока не будет осуществлено химическое определение нейротрофических агентов, это различение останется главной задачей исследования трофической функции нейрона.
ЛИТЕРАТУРА
1. Астратян Э. А. Комненесаторные приспособления в свете учения И. П. Павлова. — В кп.: Физиология центральной нервной системы. М., 1953, с. 399-432.
2. Беритов И. С. Общая физиология мышечной и нервной систем. 1. М., 1959, с. 561.
3. Боровский М. Л. Регенерация нерва и трофика. М, А., 1952.
4. Бродский В. Я. Трофика клетки. М., 1966, с. 354
5. Бродский В. Я. Следовые явления в функциональной динамике синтеза белка. — Журн. высш, иервн. деят., 1973, 23, с. 1023, 323—329.
6. Быков Б. М. Кора головного мозга и внутренние органы. М.—Л 1947, с. 285.
7. Гейиисман Ю. Я, Структурные и метаболические проявления функции [нейрона. М„ 1974, с. 205.
8. Гинецинский А. Г. Влияние симпатического нерва на функцию скелетной мышцы, утомляемой в анаэробных условпях. — Русск, физиол. журя., 1926, 9, с. 93.
9. Гинецинский А. Г, Холинергическая структура мышечного волокна. — Физиол. журн. СССР, 1947, 33, с. 413.
10. Гинецинский А. Г. Химическая передача нервного импульса и эволюция мышечной функции. Л., 1970, с. 202.
11. Гинецинский А. Г., Шамарина Н. М. Топомоторпый феномен в денервированной мышце. — Усп. совр. биол., 1942, 15, с. 283—294.
12. Григорьева Т. А. О причине трофических расстройств в лишенных чувствительности участках организма. — ДАН СССР, 1951, 78, № 2, с. 387—390.
13. Григорьева Т. А. Чувствительный нейрон как фактор целостности и адекватной дифференцированности иннервируемых им структур. — Арх. анат. гистол. эмбриол., 1959, 36, № 3, с. 3—12.
14. Гутман Э. Трофическая функция нервной системы. — Усп. совр. биол., 1962, 53, № 3, с. 323—346.
15. Гутманн Э. Импульсная и безымнульсная активность нервно-мышечной системы. — В кн.: Сензорная организация движений. Л., 1975, с. 97— 102.
16. Гутманн Э., Водичка 3., Зелена Й, Изменения в поперечнополосатой мышце .после перерезки нерва в зависимости от длины периферического отрезка. — Чехослов. физиол., 1955, 4, с. 200—204.
17. Женевская Р. П. Развитие иннервации мышцы, восстановленной путем пересадок измельченной мышечной ткани. — ДАН СССР, 1954, 96, № 1, С. 217—220.
18. Женевская Р. П. Нервно-трофическая регуляция пластической активности мышечной ткани. М., 1974. 239 с.
19. Жуков Е. К. Очерки по нервно-мышечной физиологии. Л., 1969, с. 286.
20. Жуков Е. К., Итина Н. Л., Магазаник Л. Г., Мандельштам Ю. Е., Неследов Г. А,, Свидерский В. Л., Скоробовичук Н. Ф., Ушаков В. В. Развитие сократительной функции мышц двигательного аппарата. Л., 1974, с. 339.
21. Итина Н. А. Влияние мотонейронов па функциональные характеристики скелетных мышц позвоночных (эффекты денервации и перекрестной реиннервации). — Усп. совр. биол., 1973, 75, с. 419—440.
22. Итика Н. А., Наследив Г. А., Скоробовичук Н. Ф. Новые данные о распределении ацетилхолинорецепторов на мышечном волокне. (Проблема внесинаптической ацетилхолинорецепции). — Журн. эвол. биохим. физиол., 1969, 5, с. 98—105.
23. Кантор Л. Ф., Шевес Г. С. — В кн.: Нервная трофика и дистрофический процесс. Киев, 1969, с. 69.
24. Конюхов В. В. Генетический контроль клеточной дифференцировки. — Усп. совр. биол., 1973, 76, с. 171—188.
25 Коетюк П. Г. Структура и функция нисходящих систем спинного мозга. Л., 1973.
26 Коштоянц X. С. Белковые тела, обмен веществ и нервная регуляция. М.-Л., 1951.
27. Курцин И. Т. Спорные вопросы учения о кортикальной регуляции функций внутренних органов XI съезд Всесоюз. физиол. о-ва им. И. П. Павлова. 1. Л., 1970, с. 247—254.
28. Михельсон М. Я., Зеймаль Э. В. Ацетилхолин. Л., 1970, с. 265.
29 Никифоров А. Ф. Афферентный нейрон и нейродистрофические процессы. М., 1973, с. 191.
30 Орбели Л. А. Лекции по физиологии нервной системы. М.—Л., 1938, с. 310.
31 Орбели Л. А. Эволюция нервпо-мышечпого прибора. — Избр. труды. 1. М.—Л., 1944 (1961), с. 183—192.
32 Павлов И. П. Центробежные нервы сердца. — Поли. собр. соч. 1. М.— Л., 1951, с. 87—250.
33 Павлов И. П. О трофической иннервации. — Поли. собр. соч. 1. М.—Л., 1951, с. 577—582.
34. Певзнер Л. 3. Функциональная биохимия нейроглии. Л., 1972, с. 200.
35 Рованов С. И. Нейрон и память. — Усп. совр. биол., 1973, 76, № 3 (6), с. 447-456.
36. Ройтбак А. И. Гипотеза о механизме образования временных связей. - ДАН СССР, 1969, 187, № 5, с. 1205-1208.
37. Северин С. Е. Влияние денервации на обмен веществ скелетной мышцы. — В кн.: Проблема нервной трофики в теории и практике медицины. М., 1963, с. 290—298.
38. Сперанский А. Д. Элементы построения теории медицины. М., 1937.
39. Сперанский А. Д. Учение о нервной трофике как путь исследовательской работы в медицине, — Избр. труды. М., 1955, С. 415.
40. Студитский А. Н. Закономерности восстановления мышц у высших позвоночных животных. — В кн.: Вопросы восстановления органов и тканей позвоночных животных. М., 1954, с. 225—264.
41. Студитский А. Н. Экспериментальная хирургия мышц. М., 1959, с. 338,
42. Фердман Д. Л. Биохимия дистрофии и атрофии мышц. — В кп.: Вопросы биохимии мышц. Киев, 1954, с. ИЗ—124.
43. Китенкова Р. А. Электрофизиологическое исследования памяти на уровне отдельного нейрона. — Усп. совр. биол., 1971, 71, с. 374—390.
44. Шевес Г. С., Рюмина В. И. Особенности окислительных процессов в различных мышцах после денервации. — Укр. биохим. жури., 1966, 38, с. 229-234.
45. Элаев Н. P.O характере синаптической регуляции синтеза белков в нервных клетках. — ДАН СССР, 1975, 222, № 6, с. 1477—1479.
46. Albuquerque Е. X., Schuh F. Т., Kaufmann F. С. Early membrane depolarization of the fast mammalian muscle after denervation. — Pfliig. Arch., 1971, 328, p. 36-50.
47. Albuquerque E. X., Warnick J. E., Tasse J, R., Sansone F. M. Effects of vinblastine and colchicine on neural regulation of fast and slow skeletal muscles of the rat, — Exp. Neurol., 1972, 37, p. 607—634.
48. A Ivarez J., Puschel M. Transfer of material from efferent axons to sensory epithelium in the goldfish vestibular system. — Brain Res., 1972, 37, p. 265—278.
49. Andres К. H. Morphological criteria for the differentiation of synapses in vertebrates. — Neural Transmission, 1975, Suppl. XII, p. 1—37.
50. Askanas V., Shafiq S. A., Milhorat A. T. Histochemistry of cultured aneu-ral chick muscle. Morphological maturation without differentiation of fiber types. — Exp. Neurol., 1972, 37, p. 218—230.
51. Bargmann W. Neurosecretion. — Internet. Rev. Cytol., 1966, 19, 183— 201.
52. Barondes S. H. Synaptic macromolecules: identification and metabolism. — Ann. Rev. Biochem., 1974, 43, p. 147—168.
53. Bennett M. R., McLachlan E. M., Taylor R. S. The formation of synapses in reinnervated mammalian striated muscle. — J. Physiol. (London), 1973, 233, p. 481—500.
54. Bennett M, R., Pettigrew A. G., Taylor R. S. The formation of synapses in reinnervated and cross-innervated adult avian muscles. — J. Physiol. (London), 1973, 230, p. 331—357.
55. Bltnztger K., Kreutzberg G. Displacement of synaptic terminals from regenerating motoneurons by microglial cells. — Z. Zellforsch. Mikrosk. Anat., 1968, 85, S. 145-157.
56. Bloom F. E., Iversen L. L., Schmitt F. Macromolecules in synaptic function. — Neurosci. Res. Progr. Bull., 1970, 8, p. 329—449.
57. Blunt R. J., Jones R., Vrbovd G. The use of local anaesthetics to produce prolonged motor nerve blocks in the study of denervation hypersensitivity. — Pfliig. Arch., 1975, 355, p. 189—204.
58. Brattgard S.-О., Edstrom J.-E., Hydin H. The chemical changes in regenerating neurons. — J. Neurochem., 1957, 1, p. 316—325.
59. Bray J. J., ffarris A. J. Dissociation between nerve-muscle transmission and nerve trophic effects on rat diaphragm using type D Botulinum toxin, — J. Physiol. (London), 1975, 253, p. 53—77.
60. Brown M. D. Role of activity In the differentiation of slow and fast muscles. — Nature, 1973, 244, p. 178—179.
61. Buller A. J., Eccles J. C., Eccles R. M. Interactions between motoneurons and muscles in respect to the characteristic speeds of their responses. — J. Physiol. (London), 1960, 150, p. 417—439.
62. Buller A. J,, Mommaerts TP. F. H. M., Seraydarian K. Enzymic properties of myosin in fast and slow twitch muscles of the cat following crossinnervation. — J. Physiol. (London), 1969, 205, p. 581—597.
63. Bureiovd M., Gutmann E., Hanzlihovd V. Differential effects of castration and denervation on protein synthesis in the levator ani muscle of the rat. — J. Endocrinol., 1972, 54, p. 3—14.
64. BureSovd, M., Hanzlikovd V., Gutmann E. Changes of ribosomal capacity for protein synthesis, contraction and histochemical properties of muscle after implantation of fast nerve into denervated and into self reinnervated slow soleus muscle of the rat. — Pfliig. Arch., 1975, 360, p. 95—108.
65. Burke R. E., Levine D. N., Tsairis P., Zajac F. E. Physiological typesand histochemical profiles in motor units of the cat gastrocnemius: — J. Physiol. (London), 1973, 234, p. 723—748.
66. Cajal S. Ramon y. Studies in Vertebrate Neurogenesis. Transl. by Guth L. Springfield, III., 1960. 432 p.
67. Carlsen R. C. The possible role of cyclic AMP in the neurotrophic control of skeletal muscle. — J. Physiol. (London), 1975, 247, p. 343—361.
68. Carlson В. M. The regeneration of skeletal muscle — a review. — Amer. G. Anat., 1973, 137, p. 119-150.
69. Carlson В. M., Gutmann E. Development of contractile properties of minced muscle regenerates in the rat, — Exp. Neurol., 1972, 36, p. 239—249.
70. Carlson В. M., Gutmann Е. Transplantation and «cross» transplantation of free muscle grafts in the rat. — Experientia, 1974, 30, p. 1292—1294.
71. Carlson В. M., Gutmann E. Free grafting of the extensor digitorum lon-gus muscle in the rat after Marcaine pretreatment. — Exp. Neurol., 1976, 53, p. 82—93.
72. Close R. J. Dynamic properties of mammalian skeletal muscles. — Physiol. Rev., 1972, 52, p. 129—197.
73. Cohen M. IV. The development of neuromuscular connexions in the presence of d-tuhocurarine. — Brain Res., 1972, 41, p. 457—463.
74. Cohen M. J. Trophic interactions in excitable systems of invertebrates. — Ann. New York Acad. Sci., 1974, p. 364—380.
75. Cotman C. W., Banker G. A. The making of a synapse. — In: Revs Neu-rosci., 1974, i, p. 1—62.
76. Crain S. M., Peterson E. R. Development of paired explants of fetal spinal cord and adult skeletal muscle during chronic exposure to curare and hemicholinium. — In vitro, 1971, 6, p. 373.
77. Crain S. M., Peterson E. R. Development of neural connections in culture. — Ann. New York Acad. Sci., 1974, 228, p. 6—34.
78. Cull R. E. Role of nerve-muscle contract in maintaining synaptic connections. — Exp. Brain Res., 1974, 20, p. 307—310.
79. Dahlstrom A. Axoplasmic transport (with particular respect to adrenergic neurons). — Philos. Trans. Soc. Ser. B, 1971, 261, p. 325—358.
80. Dennis M. J. Physiological properties of junctions between nerve and muscle developing during salamander limb regeneration. — J. Physiol. (London), 1975, 244, p. 683-702.
81. Dennis M. J., Miledi R. Characteristics of transmitter release at regenerating neuromuscular junctions. — J. Physiol. (London), 1974, 239, p. 571 — 594.
82. Dennis M. J., Miledi R. Non-transmitting neuromuscular junctions during an early stage of end plate reinnervation. — J. Physiol. (London), 1974, 239, p. 553—570.
83. Denny-Brown D., Brenner C. Paralysis of nerve induced by direct pressure and by tourniquet I. — Arch. Neurol. Psychiatr., 1944, 51, p. 1—20.
84. Deureotes P. N., Fambrough D. M. Acetylcholine receptor turnover in membranes of developing muscle fibers. — J. Cell Biol., 1975, 65, p. 335— ‘358.
85. Diamond J., Miledi R. A study of foetal andmew-born rat muscle fibres. — J. Physiol. (London), 1962, 162, p. 393—408.
86. Drachman D. B. Is acetylcholine the trophic neuromuscular transmitter? — Arch. Neurol., 1967, 17, p. 206—218.
87. Drachman D. B. The role of acetylcholine as a neurotrophic transmitter. — Ann. New York Acad. Sci., 1974, 228, p. 160—176.
88. Drahota Z., Gutmann E. Long term regulatory influence of the nervous system on metabolic differences in muscles of different function. — Physiol. bohemoslov, 1963, 12, p. 339—348.
89. Dresden M. H. Denervation effects on newt limb regeneration: DNA, RNA and protein synthesis. — Develop. Biol., 1969, 19, p. 311—320.
90. Droz B. Renewal of synaptic proteins. — Brain Res., 1973, 62, p. 383— 394.
91. Droz B., Koenig H. L. Di Giamberardino L. Axonal migration of protein and glycoprotein to nerve endings. I. Radioautographic analysis of the renewal of protein in nerve endings of chicken ciliary ganglion after intracerebral injection of 3H-lysine. — Brain Res., 1973, 60, p. 93—127.
92. Dryden W. F., Erulkar S. D., Il aba G. de la. Properties of the cell membrane of developing skeletal muscle fibres in culture and its sensitivity to acetylcholine. — Clin. Exp. Pharmac. Physiol., 1974, 1, p. 369—387.
93. Eccles J. C. Trophic interactions in the mammalian central nervous system. — Ann. New York Acad. Sci., 1974, 228, p. 406—422.
94. Edstrom L,, Kugelberg E, Histochemical composition, distribution ot fibers and fatiguability of single motor units. — J. Neurol. Neurosurg. Psychiatr., 1968, 31, p. 424—433.
95. Eidelberg E,, Stein D. G. Functional recovery after lesions of the nervous system. — Neurosci. Res. Progr. Bull., 1974, 12, p. 195—303.
96. Elul R., Miledi R., Stefani E. Neural control of contracture in slow muscle fibres of the frog. — Acta physiol, latinoamer,, 1970, 20, p. 194—226.
97. Engel W. K. The essentiality of liisto-and cytochemical studies of skeletal muscle in the investigation of neuromuscular disease. — Neurology, 1962, 12, p. 778—784.
98. Essen D. van, Jansen J. K. S. Reinnervation of rat diaphragm during perfusion with bungarotoxin. — Acta physiol, scand., 1974, 91, p. 571 — 573.
99. Fambrough D. M. Revised estimates of extrajunctional receptor density in denervated rat diaphragm. — J. Gen. PhysioL, 1974, 64, p. 468—472.
100. Fambrough D. M., Hartzell H. C., Powell J. A., Rash J. E., Joseph N. On the differentiation and organization of the surface membrane of a postsynaptic cell—the skeletal muscle fibre. — In: Synaptic Transmission and Neuronal Interaction. Ed. M. V. L. Bennett. New York, 1974, p. 285— 313.
101. Fambrough D,, Rash J. E. Development of acetylcholine sensitivity during myogenesis. — Develop. Biol., 1971, 26, p. 55—68.
102. Fischbach G. D., Robbins TV. Changes in contractile properties of disused soleus muscle. — J. Physiol. (London), 1969, 201, p. 305—320.
103. Fischman D. A. Development of striated muscle. In: The Structure and Function of Muscle. Ed. G. H. Bourne. London, 1972, 1/1, p. 75—148.
104. Pluck R. A., Strohman R. C. Acetylcholinesterase activity in developing skeletal muscle cell in vitro. — Develop. Biol., 1973, 33, p. 417—428.
105. Gauthier G. F., Schaeffer S. F. Ultrastructural and cytochemical manifestations of protein synthesis in the peripheral sarcoplasm of denervated and newborn skeletal muscle fibres. — J. Cell Sci., 1973, 14, p. 113—137.
106. Gauthier G. F., Dunn R. A. Ultrastructural and cytochemical features of mammalian skeletal muscle fibres following denervation. — J. Cell Sci., 1973, p. 525—547.
107. Gisiger V. Triggering of RNA synthesis by acetylcholine stimulation of the postsynaptic membrane in a mammalian sympathetic ganglion. — Brain Res., 1971, 33, p. 139—146.
108. Goldberg A, L. Mechanisms of growth and atrophy of skeletal muscle. In: Muscle Biology. Ed. R. G. Cassens. New York, 1972, 1, p. 81—118.
109. Goldspink G., Tabary C., Tabary J. C., Tardieu C., Tardieu G. Effect of denervation on the adaptation of sarcomere number and muscle extensibility to the functional length of the muscle. — J. Physiol. (London), 1974, 236, p. 733—742.
110. Graf stein B. Transneuronal transfer of radioactivity in the central nervous system. — Science, 1971, 172, p. 177—179.
111. Graf stein B. Role of slow axonal transport in nerve regeneration. — Acta Neuropathol., 1971, Suppl, 5, p. 144—152.
112. Grafsteln B., Murray M. Transport of proteins in gold fish optic nerve during regeneration. — Exp. Neurol., 1969, 25, p. 494—508.
113. Greengard P., Costa E. Role of cyclic AMP in cell function. — In: Advances in Biochem. Psychopharmac., 3. New York, 1970. 386 p.
114, Groschel-Stewart U., Meschede K., Lehr I. Histochemical and immunochemical studies on mammalian striated muscle fibres. — Histochemie, 1973, 33, p. 79-85.
115. Gurdon J. B. The Control of gene expression in animal development. Cambridge Mass., 1974. 260 p.
116. Guth L. «Trophic» influences of nerve on muscle. — Physiol. Rev., 1968, 48, p. 645-687.
117. Guth L. «Trophic» effects of vertebrate neurons. — Neurosci. Res. Progr. Bull., 1969, 7, p. 1—73.
118. Guth L. A review of the evidence for the neural regulation of gene expression in muscle, — In: Contractility of Muscle Cells and Related Processes. Ed. R. J. Podolsky. New Jersey, 1971, p. 189—201.
119 Gutmann E. Neurotrophic relations in the regeneration process. — Progr. Brain Ros., 1964, 13, p. 72—112.
120 Gutmann E. The trophic function of the nerve cell. — Scientia, 1969, 104, p. 1—20.
121. Gutmann, E. Critical evaluation and implications of denervation and reinnervation studies of cross striated muscle. — Methods Neurochem. (New York), 1973, 5, p. 189—254.
122. Gutmann E. The multiple regulation of muscle fibre pattern in cross striated muscle. — Nova Acta Leopold., 1973, 38, p. 193—218.
123. Gutmann E. Neurotrophic Relations. — Ann. Rev. Physiol., 1976, 38, p. 177—216.
124. Gutmann E., Young J. Z. The reinnervation of muscle after various periods of atrophy. — J. Anat., 1944, 78, p. 15—43.
125. Gutmann E., Zak R. Nervous regulation of nucleic acid level in cross-striated muscle. Changes in denervated muscle. — Physiol, bohemoslov., 1961, 10, p. 493—500.
126. Gutmann E., Hnik P. Denervation studies in research of neurotrophic relationships. — In: The denervated muscle. Ed. E. Gutmann. Prague, 1962, p. 13-56.
127. Gutmann E., Hanzllkovd 7. Effects of accessory nerve supply to muscle achieved by implantation into muscle during regeneration or its nerve. — Physiol, bohemoslov., 1967, 16, s. 244—250.
128. Gutmann E., Hanzllkovd V., Vyskocil F. Age changes in cross striated muscle of the rat. — J. Physiol. (London), 1971, 219, p. 331—343.
129. Gutmann E., Schiaffino S., Hanzllkova V. Mechanism of compensatory hypertrophy in skeletal muscle of the rat. — Exp. Neurol., 1971, 31, p. 451—464.
130. Gutmann E., Melichna J., Syrovy I. Developmental changes in contraction time, myosin properties and fibre pattern of fast and slow skeletal muscles. — Physiol, bohemoslov., 1974, 23, p. 19—27.
131. Gutmann E., Melichna J. A., Herbrychova A., Stichova J. Different changes in contractile and histochemical properties of reinnervated and regenerated slow soleus muscles of the guinea pig. — Pfliig. Arch., 1976, 364, p. 191—194.
132. Gutmann E., Hanzllkovd, V. Fast and slow motor units in aging. — Geron-tologia, 1976, 22, p. 280—300.
133. Hanzllkova V., Gutmann E. Effect of foreign innervation on the androgensensitive levator ani muscle of the rat. — Z. Zellforsch., 1972, 135, S. 165-174.
134. Hanzllkovd F., Gutmann E. The absence of androgen-sensitivity in the grafted soleus muscle innervated by the pudendal nerve. — Cell Tiss. Res., 1974, 145, p. 121—129.
135. Hanzllkovd. V., Schiaffino S. Studies on the effect of denervation in developing muscle. III. Diversification of myofibrillar structure and origin myofibrillar structure and origin of the heterogeneity of muscle fibre types. — Z, Zellforsch., 1973, 147, S. 75—85.
136. Harris A. J. Inductive functions of the nervous system. — Ann. Rev. Physiol., 1974, 36, p. 251—305.
137. Harris A. J., Heinemann S., Schubert D., Tarakis H. Trophic interaction between cloned tissue culture lines of nerve and muscle. — Nature, 1971, 231, p. 296—301.
138. Heuser J. E., Reese T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. — J. Cell Biol., 1973, 57, p. 315-344.
139. Hirano H. Ultrastructural study on the morphogenesis of the neuromuscular junction in the skeletal muscle of the chick, — Z. Zellforsch., 1967, 79, S. 189—208.
140. Hnlk P., Jirmanovi I., Vyklicky L.t Zelena J. Fast and slow muscles of the chick after nerve cross-union. — J, Physiol. (London), 1967, 193, p. 309—325.
141. Hofmann W. W., Thesleff S. Studies on the trophic influence of nerve in skeletal muscle. - Europ. J. Pharmac., 1972, 20, p. 256—260-
142. Hollan S. R., Novak E., Koszeghy .8., Stark E. Immunochemical study of denervated muscle proteins. — Life Sci., 1965, 4, p. 1779—1783.
143. Holtzer H., Rubinstein J., Chi J., Dienstman 8., Biehl J. The phenotypic heterogeneity of myogenic clones and what cells synthesize which molecules. — In: Exploratory concepts in Muscular Dystrophy. Ed. A. T. Mil-horat. Amsterdam, 1974, p. 3—14.
144. Hubbard J. Microphysiology of vertebrate neuromuscular transmission. — Physiol. Rev., 1973, 53, p. 674—723.
145. Hudlickd 0. Muscle Blood Flow. Amsterdam, 1973. 219 p.
146. Hyden H. The neuron. — In: The Cell. 4. Eds I. Brachet, A. Mirsky. New York—London, 1960, p. 215—323.
147. Jacobson M. Developmental Neurobiology. New York, 1970. 465 p.
148. Jansen J. K. 8., Lome T., Nikolaysen K., Westgard R. Hyperinnervation of skeletal muscle fibers: dependence on muscle activity. — Science, 1973, 181, p. 559- 561.
149. Jirmanovd I. Ultrastructure of motor endplates during pharmacologically g? [induced degeneration and subsequent regeneration of skeletal muscle. — J. Neurocytol., 1975, 4, p. 141—155.
150. Jirmanovd I., Thesleff S. Motor end-plates in regenerating rat skeletal muscle exposed to botulinum toxin. — Neurosci., 1976, 1, p. 345—347.
151. Jirmanova I., Zelena J. Ultrastructural transformation of fast chicken . muscle fibres induced by nerve cross union. — Z. Zellforsch., 1973, 146, S. 103-121.
152. Jones R., Vrbovd G. Effect of muscle activity on denervation hypersensitivity. — J. Physiol. (London), 1970, 210, p. 144—145 P.
153. Jones R., Vrbovd G, Two factors responsible for denervation hypersensitivity. — J. Physiol. (London), 1974, 236, p. 517—538.
154. Juntunen J. Effects of colchicine and vinblastine on neurotubules of the sciatic nerve and cholinesterases in the developing myoneural junction of the rat. — Z. Zellforsch., 1973, 142, S. 193—204.
155. Juntunen J. Morphogenesis of the myoneural junctions after immobilization of the muscle in the rat. — Z. Anat. Entwickl. Gesch., 1973, 143, S. 1-12.
156. Juntunen J. Morphological studies on the induction of the postsynaptic membrane of the myoneural junction. — Acta Inst. Anat. Univ. Helsinki, 1974, Suppl. 7, p. 9—32.
157. Katz B. Nerve, muscle and synapse. New York, 1966. 193 p.
158. Katz B., Miledi R. The development of acetylcholine sensitivity in nerve-free segments of skeletal muscle. — J. Physiol. (London), 1964, 170, p. 389—396.
159. Kaufman F. C., Warnick J. E., Albuquerque E. X. Uptake of 3H-colchi-cine from silastic implants by mammalian nerves and muscles. — Exp. Neurol., 1974, 44, p. 404—406.
160. Kerkut G. A., Shapira A., Walker R. J. The transport of 14C labelled material from CNS to muscle along a nerve trunk. — Comp. Biochem. Physiol., 1967, 23, p. 729—759.
161. Koenig J. Contribution а Г etude de la morphologic des plaques motrices des grands dorsaux anterieur et posterieur du poulet apres innervation croi-see. — Arch. Anat. Microsc. Morphol. Exp., 1970, 59, p. 403—426.
162. Korr I. M., Appeltauer G. 8. L. The time course of axonal transport of neuronal proteins to muscle. — Exp. Neurol., 1974, 43, p. 452—463.
163. Korr I. M., Wilkinson P. N., Chornock F. W. Axonal delivery of neurop-lasmic components to muscle cells. — Science, 1967, 155, p, 342—345.
164. Kreutzberg G. W., Schubert P. Changes in axonal flow during regeneration of mammalian motor nerves. — Acta"' Neuropathol., 1971, Suppl. 5, rp. 70-75.
165. Krnjevio K. Chemical nature of synaptic transmission in vertebrates. — Physiol. Rev., 1974, 54, p. 418—540.
166. Krnjevic K., Miledi R. Acetylcholine in mammalian neuromuscular transmission, — Nature, 1958, 182, p. 805—806.
167. Kuno M., Miyata Y., Munoz-Martinez E. J. Properties of fast and slow Imotoneurones following motor reinnervation. — I. Physiol. (London), 4974, 242, p. 273—288.
168. Kufjler S- W., Nicholls J. G. The physiology of neuroglial cells. — Erg. ’Physiol., 1966, 57, p. 1—90.
169. |bent3 С. T. L. A role of cyclic AMP in a neurotrophic process. — Nature, 1972, 238, p. 154—155.
170. JLentz T. L. Development of the neuromuscular junction. HI. Degeneration of motor end plates after denervation and maintenance in vitro by nerve explants, — J. Cell Biol., 1972, 55, p. 93—103.
171 Lentz С. T. L. Neurotrophic regulation at the neuromuscular junction. — Ann. New York Acad. Sci., 1974, 228, p. 323—337.
172. Lockshin R., Williams С. M. Programmed cell death. Ш. Neural control of the break down of the intersegmental muscles of silk moths. — J. Insect. Physiol., 1965, 11, p. 601—610.
173 Limo T., Rosenthal /. Control of ACh sensitivity by muscle activity in the rat. — J. Physiol. (London), 1972, 221, p. 493—513.
174. Limo T., Westgaard R. H., Dahl If. A. Contractile properties of muscle: [control by pattern of muscle activity in the rat. — Proc, Roy. Soc. Ser.
B, 1974, 187, p. 99—103.
175. Lubinska L. Axoplasmic streaming in regenerated and in normal fibres. — Progr. Brain Res., 1964, 13, p. 1—71.
176. Lubinska L. On axoplasmic flow. — Internal. Rev. Neurobiol., 1975, 17, p. 241-296.
177. Luco J. 7., Eyzagutrre C. Fibrillation and hypersensitivity to ACh in rdenervated muscle. Effectjof length of degenerating nerve fibres. — JI. Neurophysiol., 1955, 18, p. 65—73.
178. Lynch G., Deadwyler S., Cotman С. Ж Post-lesion axonal growth produ-[ces permanent functional connections. — Science, 1975,180, p. 1364—1366.
179. Mark R. F. Selective innervation of muscle. — Brain Med. Bull., 1974, 30, p. 122—125.
ISO. fAfay Я. M. The relation of nerves to degenerating and regenerating taste buds. — J. exp. Zool., 1925, 42, p. 371—410.
ISl. ^JMcArdlc J. J., Albuquerque E, X. A study of the reinnervation of fast and slow mammalian muscles. — J. Gen. Physiol., 1973, 61, p. 1—23.
182. ^McLaughlin J., Abbod L. G., Bosman B. Early elevations of glycosidase, acid phosphatase, and acid proteolytic enzyme activity in denervated skeletal muscle. — Exp. Neurol., 1974, 42, p. 541—554.
183. Melichna J., Gutmann E. Stimulation and immobilization effects on contractile and histochemical properties of denervated muscle. — Pfliig. Arch., 1974, 352, p. 165—178.
184. Miledi R. An influence of nerve not mediated by impulses. In: The effect of use and disuse on neuromuscular junctions. Eds Gutmann E., Hnik P. Amsterdam—London—New York, 1963, p. 35—40.
185. *AfiIedi 7?., SlaterC. R. On the degeneration of rat neuro-muscular junctions after nerve section. — J. Physiol. (London), 1970, 207, p. 507—528.
186. Moore R. J., Bjbrklund A., Stenevi U. Growth and plasticity of adrenergic neurons. — In: The Neurosciences, Third study program, Eds F. O. Schmitt J. C. Wordon Cambridge, 1974, p. 961—977.
187. Muscatello U., Margreth A., Aloisi M. On the differential response of sarcoplasm and myoplasm to denervation in frog muscle. — J. Cell Biol.. 1965, 27, p. 1-24,
188. Musick J., Hubbard J, I. Release of prolein from mouse motor nerve terminals. — Nature, 1972, p. 279 - 281.
189. NUesch H., Bienz-Isler G. Die Entwicklung denervierter Imaginalmuskeln bei Anther a polyphemus (Lep.) und die Frage der entwicklungsfordernden Nervenwirkung. — Zool, Jb. Anat,, 1972, 89, S. 333—350.
190. Nov&k V. J. A. Insect hormones. Methuen—London, 1975. 478 p.
191. Ochs S. Systems of material transport in nerve fibers (axoplasmic transport) related to nerve function and trophic control, — Ann. New York Acad. Sci., 1974, 228, p. 202—223.
192. Oh T., Johnson D. D,, Kim S. U. Neurotrophic effect on isolated chick embryo muscle in culture. — Science, 1973, 178, p. 1298—1300.
193, Olmstead J. M. D. The nerve as a formative influence in the development of taste buds. — J. Comp. Neurol., 1920, 31, p. 465—468.
194. Padykula H. A., Gauthier G, F. The ultrastructure of neuromuscular junctions of mammalian red, white and intermediate skeletal muscle fibres. — J. Cell. Biol., 1970, 46, p. 27—41.
195. Patrick J., Heinemann S. F., Lindstrom J., Schubert D., Steinbach J. H. Appearance of acetylcholine receptors during differentiation of a myogenic cell line. — Proc. Nat. Acad. Sci. USA, 1972, 69, p. 2762—2766.
196. Petersen О. H. Cell membrane permeability change: an important step in hormone action. — Experientia, 1974, 30, p. 1105—1107.
197. Pilar G,, Landmesser L. Axotomy mimicked by localized colchicine application. — Science, 1972, 177, p. 1116—1118.
198. Purves D., Sakmann B. Membrane properties underlying spontaneous activity of denervated muscle fibres. — J. PhysioL (London), 1974, 239, p. 125-153.
199. Raisman G. Neuronal plasticity in the septal nuclei of the adult rat. — Brain Res., 1969, 14, p. 25—48.
200. Robbins Z. Long-term maintenance and plasticity of the neuromuscular junction. — In: The neurosciences. Eds F. O. Schmitt, F. G. Worden. 3. Cambridge, 1974, p. 953—959.
201. Roth S. A molecular model for cell interactions. — Quart. Rev. Biol., 1973, 48, p. 541—563.
202. Salmons S., Vrbovd G. The influence of activity on some contractile characteristics of mammalian fast and slow muscle. — J. Physiol. (London), 1969, 201, p. 535—549.
203. Samaha F. J., Guth L., Albers R. W. The neural regulation of gene expression in the muscle cell. — Exp. Neurol., 1970, 27, p. 276—282.
204. Samuel S. Die trophischen Nerven. Koenigsberg, 1860.
205. Scharrer E. The final common path in neuroendocrine integration. — Arch. Anat. Microscop. Morphol. Exp., 1965, 54, p. 359—370.
206. Sherrington C. S. Integrative action of the nervous system. New Haven-London, 1906. 411 p.
207. Singer M, The influence of the nerve in regeneration of the amphibian extremity. — Quart, Rev. Biol., 1952, 27, p. 169—200.
208, Singer M. Neurotrophic control of limb regeneration in the newt. — Ann. New York Acad. Sci., 1974, p. 308—321.
209. Smith A. D. Summing up: some implications of the neuron as a secreting cell. — Philos. Trans. Roy. Soc. Ser, B, 1971, 261, p, 423—437.
210. Sreter F. A., Holtzer S., Gergely J., Holtzer H. Some properties of embryonic myosin. — J. Cell Biol., 1972, 55, p. 586—594.
211. Steinbach J., Harris A. J., Patrick J.t Schubert D., Heinemann S. Nerve-muscle interaction in vitro. Role of acetylcholine. — J. Gen. Physiol., 1973, 62, p. 255—270.
212. Sunderland S. Nerves and nerve injuries. Edinburgh—London, 1968. 1161 p.
213. Terdvdinen H. Development of the myoneural junction in the rat. — Z. Zellforsch., 1968, 87, S. 249—265.
214. Thesleff S. Supersensitivity of skeletal muscle produced by botulinum toxin. — J. Physiol. (London), 1960, 151, p. 598—607.
215. thesleff S. Physiological effects of denervation of muscle. Ann. New •'«York Acad. Sci., 1974, 228, p. 89—103.
2i&. \Thesleff S., Ward M. R. Studies on the mechanism of fibrillation poten-e —ftials in denervated muscle. — J. Physifol. (London), 1975, 244, p, 313— 323.
217. Thornton C. S., Thornton M. T. Recuperation of regeneration in denervated limbs of Amblystoma larvae. — J. Exp. Zool., 1970, 173, p. 293—300.
218 Tolar M. Development of the neuromuscular system in vitro. Prague, 1973. Ill p.
219. Tolar M., Hanzllkovd V., Gutmann E. The effect of external factors on development of the chick skeletal muscle tissue in vitro. — Physiol, bohemoslov., 1974, 23, s. 182—183.
220. Tower S. S. Function and structure in the chronically isolated lumbosacral spinal cord of the dog. — J. Comp. Neurol., 1937, 67, p. 109—132.
221. Tucek S. Choline acetylase activity in skeletal muscles after denervation.— Exp. Neurol., 1973, 4, p. 23—35.
222. Tuiek S. Transport of cholineacetyltransferase and acetylcholinesterase in the central stump and isolated segments of a peripheral nerve. — Brain Ba ’Res., 1975, 86, p. 259—270.
223. Tweedie C, D., Popiela H., Thornton C. S. Ultrastructure of the develop-[ment and subsequent breakdown of muscle in aneurogenic limbs (Amby-stoma). — J. Exp. Zool., 1974, 190, p. 155—166.
224. Vyskocil F., Gutmann E. Spontaneous transmitter release from motor nerve endings in muscle fibres of castrated and old animals. — Experientia, 1969, 25, p. 945—946.
225. \Vyskocil F., Gutmann E. Control of ACh sensitivity in temporarily uncon-I nected («decentralized») segments of diaphragm-muscle fibres of the rat. — (Pfliig. Arch., 1976, 367, p. 43-47.
226. Vyskocil, F., Vyklicky L. Acetylcholine sensitivity of the chick fast muscle after cross-union with the slow muscle nerve. — Brain Res., 1974, 72, p. 158—161.
227. Vyskocil F., Vyklicky L., Huston R. Quantum content at the neuromuscular junction of fast muscle after cross-union with the nerve of slow muscle in the chick. — Brain Res., 1971, 26, p. 443—445.
228. Wall P. D., Egger M. D. Formation of new connexions in adult rat brains after partial deafferentation. — Nature, 1971, 232, p. 542—545.
229. Watson W. E. Cellular responses to axotomy and to related procedures. — Brain Med. Bull., 1974, 30, p. 112—115.
230. Weisr P., Hiscoe H. B. Experiments on the mechanism of nerve growth. — 7. Exp. Zool., 1948, 107, p. 315—395.
231. Wyburn-Mason R. Trophic nerves. London, 1950.
232. Zacks S. I. The motor end-plate. Huntington—New York, 1973. 495 p.
233. Zalewski A. A. Regeneration of taste buds after reinnervation by peripheral or central fibers of vagal ganglia. — Exp. Neurol., 1969, 25, p. 429— 437.
234. Zalewski A. A. Regeneration of taste buds after transplantation of tongue and ganglia grafts to the anterior chamber of the eye. — Exp. Neurol., 1972, 35, p. 519—528.
235. Zelend, J. Development, degeneration and regeneration of receptor organs. — Progr. Brain Res., 1964, 13, p. 175—213.
236. Zelend J., Jirmanovd I. Ultrastructure of chiken slow muscle after nerve cross-union, — Exp. Neurol., 1973, 38, p. 272—285.
237. Zelend J., Soukup T. Development of muscle spindles deprived of fusimo-tor innervation. — Z. Zellforsch., 1973, 144, S. 435—452.
238. Zelena J., Szentdgothai J. Verlagerung der Lokalisation spezifischer Cholinesterase wahrend der Entwicklung der Muskelinnervation, — Acta histochim., 1956, 3, p. 284—296.
Глава 11
НЕЙРОХИМИЧЕСКИЕ АСПЕКТЫ ПАМЯТИ
11.1. ОСНОВНЫЕ ПОЛОЖЕНИЯ
Память является одним из наиболее характерных свойств живого образования. Различают два вида памяти: наследуемую (генетическую) и ненаследуемую (индивидуальную) память. К ненаследуемому виду памяти принадлежит иммунная и нейрологическая память. Нейрологическая память характерна для животных, имеющих нервную систему.
Память у животных, не имеющих нервной системы, выражается в элементарных реакциях привыкания к раздражениям внешней среды, в адаптации к действию повторных биологически индифферентных раздражителей [51. Процесс привыкания сопровождается усилением новообразования РНК, т. е. активацией генети-геского аппарата. Важным является тот факт, что при переходе привыкания в утомление синтез РНК не усиливается, а снижается. Анализ привыкания показал, что и в донервных организмах приобретенные реакции можно причислить к категории явлений, характеризующих следовые процессы, т. е. к памяти [15J.
Появление нервной системы внесло в ненаСледуемую память новые категории явлений, связанные в основном с развитием межнейронных синаптических связей. При изучении основ нейрологической памяти мы должны исходить из уникальных свойств нервной ткани и в первую очередь того факта, что воспринимаемая информация кодируется в нервной системе не в отдельной клетке и тем более не в программированных молекулах, а в наборе нервных клеток. Каждому отдельному виду информации должен соответствовать свой специфический набор нейронов. Поэтому намять, как ее понимают нейрофизиологи, должна записываться и репродуцироваться в виде динамического процесса в ансамбле нейронов [4].
Как было показано в предыдущих главах, сборка нейронов в ансамбль происходит двумя взаимосвязанными путями: био
электрической импульсацией и химическими сигналами. Недавно проведенные исследования показали участие, кроме нейропередатчиков, и других специфических соединений, например полипептидов [39]. Мы располагаем подробными данными о природе агентов, принимающих участие в объединении нейронов в ансамбли. Но мы почти ничего не знаем о закономерностях сборки: каким образом «узнают» друг друга нейроны, является ли ансамбль постоянно действующим структурным образованием или он образуется при необходимости и после распадается для того, чтобы вновь восстановиться при повторении раздражения.
В функциональной активности нервных клеток ведущую роль играют возбудимые мембраны. Работа мембран регулируется специфическими мембранными ферментами (ацетилхолинэстера-зой, Na+, К+-АТФазой, аденилциклазой) и нейропередатчиками. Эффект нейропередатчиков реализуется в мембранах специфическими рецепторными белками [38]. Можно предполагать, что процесс обучения сопровождается сдвигами в распределении нейропередатчиков и последующей активацией работы триады ДНК-РНК-белок. Положение о том, что генетическому аппарату принадлежит важная роль в явлениях памяти, широко распространено. Генетический аппарат выполняет свою обычную работу морфогенеза, активации и регуляции метаболических процессов. Но в нервной ткани эта работа может найти особое выражение в связи с уникальной организацией пространственно-функциональных взаимоотношений клеток, объединенных в ансамбли.
Для выяснения этого вероятного участия генетического аппарата в явлениях памяти необходимо ответить на два вопроса: 1) каким образом может активизироваться генетический аппарат и 2) как может реализоваться закодированная в нем информация. Ответить на второй вопрос в данный момент не представляется возможным. Он усиленно изучается в исследованиях генетически наследуемой памяти, а также в исследованиях механизмов иммунитета. Что же касается первого вопроса, уже имеются предпосылки для его успешного решения. Активация генетического аппарата в процессе консолидации памяти может находить свое выражение, очевидно, в усилении новообразования ферментов и белков, имеющих отношение к функции нервных клеток. Выясне-нию’этого вопроса посвящено большое количество работ (см. обзоры [12, 32]). Биохимические подходы к явлениям памяти обсуждались недавно Кометиани [9,10], Кафиани [7 ] и Ашмариным [2, 3].
11.2. КРАТКОСРОЧНАЯ ПАМЯТЬ
11.2.1. ВОСПРИЯТИЕ СЕНСОРНЫХ РАЗДРАЖЕНИЙ
Первая стадия процесса запоминания связана с получением информации, которая передается в центр. Клеточные механизмы этой стадии изучены относительно хорошо.
Афферентные сигналы идут от рецепторной клетки в центр одним и тем же способом — в виде разрядов потенциалов действия. Как будет показано в гл. 12, одна афферентная пмпульса-ция отличается от другой в зависимости от вида раздражения лишь распределением разрядов во времени. Далее такая импуль-сация, несущая информацию, перекодируется посредством нейропередатчиков одновременно во многих последующих клетках.
Из-за трудностей технического порядка молекулярные механизмы восприятия сенсорных раздражений (кроме зрительных) изучены мало. Можно лишь предполагать, что принцип рецепции всех сенсорных раздражений одинаков. Воспринимает раздражение какой-то рецепторный белок, в котором конформационные и химические изменения связаны с изменением ионной проницаемости мембраны и генерацией афферентной импульсации. Так, рецептором светового раздражения является сложный протеин — родопсин, который под влиянием света распадается на белок и хроматофор — трансретинадь. За этой реакцией следует серия обратимых ферментных превращений хроматофора, в которых самое важное значение имеют окислительно-восстановительные реакции и работа Na+-, КА-АТФазы [25, 36].
11.2.2. ЭНГРАММА КРАТКОСРОЧНОЙ ПАМЯТИ
Одним из механизмов сохранения следов в нервной системе, который широко обсуждался в литературе, может быть реверберация импульсов в замкнутых цепях нейронов.
Самовозбуждение нейронов в таких цепях может поддерживаться посттетанической потенциацией, которая обнаруживается в нервных окончаниях в продолжение некоторого времени после раздражения пресинаптического нейрона. Продолжительность посттетанической потенциации и депрессии совпадает с продолжительностью краткосрочной памяти, и поэтому нередко считают, что активность замкнутой цепи нейронов является выражением энграммы краткосрочной памяти [14, 27].
” Краткосрочная память, которая связана с активным состоянием ревербирующей цепи, не сопровождается заметными биохимическими сдвигами. Связь нейронов в ансамбле осуществляется импульсацией, которая циркулирует в цепи. Этим можно объяснить тот факт, что в результате воздействия таких факторов, как наркоз, гипотермия, электрошок, контузия, полностью выключается краткосрочная память, в то время как долгосрочная остается без изменения.
г~"*Было предпринято много попыток выяснить, связана ли краткосрочная память с кодированием информации в программированных молекулах или дело ограничивается реверберацией импульсов возбуждения в ансамбле нейронов. Был испытан ряд соединений, специфически тормозящих синтез РНК и белков или же задерживающих передачу информации от ДНК. Специаль
ное изучение этого вопроса привело к заключению, что необходимости новообразования РНК и белков при краткосрочной памяти нет.
11.3. ДОЛГОСРОЧНАЯ ПАМЯТЬ
11.3.1. ДОЛГОСРОЧНАЯ ПАМЯТЬ И РНК
Долгосрочная память связана с консолидацией «следов» памяти. Если каким-либо способом выключить краткосрочную память, т. е. нарушить предполагаемую реверберацию в нейронных цепях, то долгосрочная память также расстраивается. Следовательно, долгосрочная память зависит от функционирования систем, лежащих в основе краткосрочной, и то, что две формы памяти тесно связаны друг с другом, являются разными проявлениями одного процесса.
Участие генетического аппарата в явлениях долгосрочной памяти может выражаться прежде всего в направленном, строго отрегулированном синтезе ферментных систем и пластического материала, которым, со своей стороны, обеспечиваются превращения веществ, лежащих в основе функциональной активности клетки.
Давно известно, что интенсивность обновления белков в головном мозгу коррелирует с его функциональным состоянием. Вместе с тем показано, что обучение животного новым навыкам сопровождается усилением новообразования РНК. В связи с открытием факта, что генетическая память закодирована в программированных молекулах, было предпринято много попыток доказать, что информация, характерная для нейрологической памяти, также воспринимается и хранится благодаря синтезу специфических РНК и белков. Эти попытки представляют в данный момент лишь историческое значение. Сейчас все больше сторонников находит тот взгляд, что нейрохимические основы памяти связаны с такой активностью генетического аппарата, которая обеспечивает синтез пластического материала для консолидации следов памяти и регуляции обменных процессов,
1Можно считать доказанным, что процессы выработки условных рефлексов и обучение сопровождаются общим усилением метаболизма и синтезом специфических, характерных для обучения РНК и белков. Однако никто еще не показал, что при этом синтезируются такие специфические молекулы, которые характерны не для обучения вообще, а для отдельных видов информации [17],
Известно, что определенная часть новообразовавшихся программированных молекул, в частности РНК, используется в функциональной активности синапсов. Это было показано, например, в опытах с ортодромией активацией синаптических мембран нейронов моллюска Aplysia. Ответная реакция нейронов изучалась по изменениям импульсации и внедрению меченого уридина в^РНК. Контролем_служили опыты с прямым раздражением
нейронов или их антидромной активацией синапсов. Усиление внедрения меченого уридина имело место только после ортодромией активации синаптических мембран. Одновременно было показано, что усиление внедрения метки в РНК обусловлено не ионными сдвигами или трофическими влияниями, а освободившимся из синаптических везикул ацетилхолином. Из этих опытов следует два важных вывода: усиление новообразования РНК обусловлено активацией генома, и в этой активации принимает участие ацетилхолин [32].
Привлекают внимание методически хорошо выполненные опыты с переучиванием плавания у золотых рыбок. Процесс освоения нового поведения сопровождался новообразованием РНК с измененным составом оснований. Опыты были поставлены в вариациях, в которых элиминировались влияние физических нагрузок, активный ответ на стрессовое раздражение и другие факторы. Сделан вывод, что новообразование РНК в процессе освоения нового поведения является песпецифическим, но оно необходимо для консолидации следов памяти, т. е. синтез РНК является необходимым условием, облегчающим обучение [34].
Весьма убедительным доказательством наличия связи между явлениями памяти и новообразованием РНК являются результаты опытов по конкурентной гибридизации ДНК. Применение метода гибридизации связано с обнаружением Хиденом и Ланге того факта, что в процессе обучения образуется РНК с измененным составом пуриновых оснований. В начальной стадии обучения образуется РНК, обогащенная аденином и урацилом, а в последующей начинают доминировать гуанин й'цитозин.
Уже в 1966 г. были получены данные, которые дали надежду на успешное применение этого метода для решения вопроса о специфичности РНК, образующейся в процессе обучения [23].
Принцип метода заключается в использовании препарата односпиральной ДНК, который смешивается с препаратом РНК, полученным из мозга обученных и необученных животных. Сравнивают величины метки в гибридах после спаривания с препаратами РНК, полученными: 1) из мозга необученных животных, которым предварительно вводился немеченый оротат, 2) из мозга необученных, которым вводился меченый оротат, 3) из мозга обученных с немеченым оротатом и 4) из мозга обученных животных, но с меченым оротатом.
В опытах, в которых изучался сравнительный эффект обучения и моторной активности, было установлено, что в процессе обучения образуется качественно новая РНК. Но делать окончательный вывод оказалось затруднительным ввиду того, что специфическая РНК была обнаружена в таких малых^количествах, что ее не хватило для насыщения ДНК [23, 32].
В более чистом методическом виде такие опыты были проведены с брюшными ганглиями Aplysta. Немеченые препараты ДНК и РНК готовились из очищенных гонад, а меченый препарат РНК— 494
из нейронов П-2, которые активировались синаптически. Были подобраны более оптимальные соотношения РНК и ДНК, время инкубации и количество контрольных опытов. Препарат из нейронов, подвергшихся возбуждению через синапсы, и препарат из покоящихся нейронов были гибридизированы в присутствии конкурентной РНК, полученной из гонад. Анализ показал, что в условиях более или менее полного насыщения ДНК испытуемыми РНК разница между активированными и покоящимися нейронами составила 4%. Интересно отметить, что разница между гомологичной РНК дрожжей и РНК нейронов доходила до 70%.
Из приведенных данных нужно заключить, что 96% РНК в нейронах является общей и только 4% вовлекается в процесс активации. При сравнении РНК нейронов и гонад, т. е. функционально и структурно разных образований одного и того же животного, общей оказывается 92% РНК. Это значит, что 8% общего количества РНК является специфической для нервной клетки, из которой половина каким-то образом используется в процессе обучения. В процессе стимуляции нейрона, когда усиливается процесс транскрипции, образуется новая РНК, но одновременно может быть использована «нейрон-специфическая» РНК, уже представленная в общем котле [32].
То, что обучение сопровождается новообразованием РНК, доказывается также тем фактом, что торможение синтеза РНК вызывает расстройство памяти. Для этой цели обычно применяли антибиотик актиномицин Д. Но полученные данные вызывали сомнение потому, что актиномицин Д, во-первых, тормозит синтез РНК в мозге только на 70%, и, во-вторых, оказывает сильное токсическое действие на организм. Были предложены новые ингибиторы синтеза РНК — алкалоид камптотесин, а также бром-туберцидин. Они дают более выраженный эффект как ингибиторы транскрипции и как агенты, вызывающие амнезию, связанную с торможением консолидации следов памяти. Нужно упомянуть также, что альфа-аманитин также обнаруживает амнестический эффект. Этот антибиотик используется как специфический ингибитор ДНК-зависимой РНК-полимеразы [17].
Подытоживая вышесказанное, можно заключить, что процесс обучения сопровождается новообразованием такой РНК, которая характеризует не усиление метаболизма вообще, а приобретение новых навыков. В то же время эта РНК специфична для обучения вообще, но не для каждого отдельного вида стимуляции.
11.3.2. ДОЛГОСРОЧНАЯ ПАМЯТЬ И БЕЛКИ
Участие специфических белков в явлениях памяти доказывается усилением их новообразования в процессах обучения и тренировки и расстройством памяти при торможении их биосинтеза.
Много внимания^обращалось, во-первых, на специфичность связи усиления синтеза белка с явлениями памяти и, во-вторых, на характер нарушений формирования и консолидации Гследов памяти при^торможении синтеза белков в головном мозге.
^Усиление синтеза белков доказывается увеличением внедрения в них вметки ^после ^предварительного введения меченых аминокислот. Большое значение придается методической стороне исследования, а именно выбору вводимой аминокислоты и исследуемого участка головного мозга, а также учету неспецифических сдвигов, которые сопровождают процесс обучения. Наиболее достоверные результаты были получены в опытах переучивания крыс доставать пищу из узкой пробирки непредпочитаемой лапой. В процессе обучения значительно усиливалось включение метки из предварительно введенного меченного тритием лейцина в белковые фракции микросом, митохондрий, синаптосом и синаптических мембран гиппокампа [301.
Были предприняты попытки идентифицировать специфические белки. Исследования, проведенные в этом направлении, дали определенные положительные результаты. Имеется в виду белок S-100, который был обнаружен в нервной ткани в 1965 г. [31]. Было показано, что при переучивании крыс в гиппокампе усиливается новообразование именно этого белка. Большой интерес представляет тот факт, что интрацеребральное введение антисыворотки к белку S-100 крысам резко нарушает способность крыс к переучиванию [24].
При обсуждении вопроса о связи обучения и тренировки с новообразованием специфических белков нужно упомянуть также гликопротеины. Было обнаружено, что содержание одной из фракций гликопротеинов увеличивается более чем в 4 раза. Этот белок представлен в глиальных клетках и назван астроцитином [18].
Недавно появились данные о том, что процесс переучивания золотых рыбок плавать по-новому сопровождается наряду с новообразованием РНК синтезом 3 новых фракций белков в головном мозге. В контроле различий во внедрении метки обнаружено не было. Увеличение внедрения метки не было выявлено также в опытах с физической нагрузкой; не было найдено разницы и при выполнении рыбками обычных поведенческих актов [35].
Предпринятые в последние годы исследования влияния торможения синтеза белков на память оказались весьма плодотворными. Из ингибиторов синтеза белков наибольшее распространение получили циклогексимид и его дериват ацетоксициклогексимид, а также пуромицин. К сожалению, все они, кроме основного эффекта торможения синтеза белков, обладают и побочными действиями [121.
Изучению влияния ингибиторов синтеза белков на обучение и хранение следов памяти посвящено много работ. Большее внимание обращалось на постановку таких опытов, в которых по возможности было устранено действие побочных факторов.
Недавно предложен еще один ингибитор синтеза белка — анизо-мицин, который, как выяснилось, менее токсичен, чем пуромицин, обладая при этом большой эффективностью действия [21 ].
В связи с расстройством памяти в результате торможения синтеза белков был поставлен вопрос об идентификации последних. Поиски этих белков увенчались успехом; одним из них оказался холинорецепторный белок [8, 11J. Нужно думать, что торможение синтеза и других рецепторных белков будет расстраивать память.
Суммируя данные об участии белков в обучении, хранении и воспроизводстве информации, следует заключить, что для закрепления следов памяти нормальное функционирование механизмов трансляции обязательно. Однако в начальной стадии долговременной памяти используются, вероятно, запасы специфических белков; поэтому может создаться ситуация, в которой необходимости в новообразовании белков нет.
11.3.3. УЧАСТИЕ НЕЙРОПЕРЕДАТЧИКОВ
В ЯВЛЕНИЯХ ПАМЯТИ
Как уже указывалось в гл. 6, в области биохимии нейропередатчиков имеются крупнейшие достижения, известны источники, которые используются в синтезе нейропередатчиков, а также пути их биосинтеза, изучены свойства ферментов, которыми регулируется их уровень в головном мозге и т. д. Одним из больших успехов в области изучения механизма действия нейропередатчиков следует считать открытие циклической 3',5'-аденозин-монофосфорной кислоты. Этот кофактор играет роль второго посредника в действии некоторых нейропередатчиков. Как выяснилось, 3',5'-аденозинмонофосфат необходим для реализации в клетке эффектов не только нейропередатчиков, но и гормонов.
Несмотря на большие успехи в области биохимии нейропередатчиков, имеются затруднения при интерпретации результатов их действия в нервные клетки. Причину затруднений нужно искать в том, что нервная ткань построена из неоднозначных функционально-структурных единиц, ответные реакции которых на одно и то же раздражение могут быть совершенно разными. Они зависят от специфики ферментного аппарата, качества и количества рецепторных белков, компартментализации биологически активных веществ, направленно изменяющих обменные процессы, и, наконец, от работы генетического аппарата, которым определяется функциональное состояние клетки в целом.
Основная масса нейропередатчиков иммобилизована в хранилищах-везикулах. При раздражении они освобождаются, переходят в синаптическую щель и действуют на специфические рецепторные белки.
^Эффекты нейропередатчиков в конечном итоге выявляются в изменениях функционального состояния животного организма.
32 Общая физиология иераиой системы 497
Была проделана большая работа по выяснению связи сдвигов в функциональном состоянии с изменениями распределения нейропередатчиков в головном мозге. Однако методические трудности не позволили пока получить данных, точно характеризующих ответные реакции.
В выяснении значения ацетилхолина в явлениях памяти большую роль сыграли исследования Дейча и его сотрудников [201-Показано, что интрацеребральное введение антихолинэстеразных соединений (физостигмина, диизопропилфторфосфояата) приводит к синаптическому блоку, в результате чего тормозится консолидация следов памяти. Причину торможения нужно искать в избыточном накоплении ацетилхолина. Введение крысам ингибиторов ацетил-холинэстеразы спустя 3 мин после выработки рефлекса приводило к тому, что повторное обучение через сутки требовало больше сочетаний. Введение ингибитора спустя 3 дня после выработки рефлекса не изменяло способности повторного обучения по сравнению с контролем, а введение на 5—14-й день сильно ухудшало эту способность. Введение же ингибитора на 28-й день после выработки рефлекса заметно улучшало способность к воспроизведению рефлекса. Улучшение способности воспроизводства уже забытых навыков под влиянием ингибиторов ацетилхолинэстеразы Дейч и сотр. [22] объяснили устранением распада ацетилхолина и облегчением синаптической передачи.
Было предпринято исследование влияния усиления ацетил-холинэстеразой активности на поведенческие акты животного. Были отобраны две группы крыс с хорошо выраженными навыками доставать пищу из узкой пробирки левой или правой лапой. Выяснилось, что после переучивания крыс в продолжение 6 дней ацетилхолинэстеразная активность области коры, контралатеральной по отношению к используемой лапе, достоверно увеличивалась [1 ]. Это усиление ацетилхолинэстеразной активности устранялось после интракраниального введения пуромицина. Следовательно, рассматривался процесс трансляции и новообразования фермента. Авторы заключили, что работа системы ацетилхолина—ацетилхолинэстеразы тесно связана с явлениями памяти.
Эффект психотропных веществ, как известно, в основном опосредован сдвигами в распределении в головном мозге моноаминов [6]. Например, установлено, что депрессия, вызываемая транквилизатором резерпином, обусловлена его отрицательным действием на иммобилизацию моноаминов, в результате чего их содержание в нервной ткани резко снижается. Оказалось, что резерпин тормозит работу тех механизмов, которые обеспечивают способность везикул адсорбировать моноамины [37].
В основе действия другого транквилизатора аминазина (хлорпромазина) лежит, по-видимому, его эффект на проницаемость клеточных и субклеточных мембран [22]. Изменением мембранной проницаемости нужно объяснить отрицательное влияние аминазина на иммобилизацию 5-гидрокситриптамина, а также норадре-
малина, в результате чего в нервных клетках увеличивается их свободная форма с последующей инактивацией и снижением запаса. Одновременно аминазин снижает способность рецепторных белков связываться с аминами.
Антидепрессанты в основном принадлежат к группе психотропных соединений с хорошо выраженной способностью тормозить моноаминоксидазу, в результате чего в головном мозге заметно увеличивается содержание всех моноаминов и одновременно снижаются продукты их дезаминирования [19].
Представляет интерес тот факт, что дача свободных аминокислот в малых количествах, в условиях, исключающих их дисбаланс в организме, вызывает закономерные сдвиги в содержании нейропередатчиков в головном мозге, а отсюда значительные сдвиги его функциональной активности [28].
В реализации эффектов психотропных соединений, а также свободных аминокислот принимает участие, вероятно, циклический аденозинмонофосфат (3',5'-АМФ). Поэтому должна существовать корреляция между действием психотропных соединений и аминокислот, с одной стороны, и изменением содержания 3',5'-АМФ — с другой.
Действительно, в хронических опытах после подкожного введения аминазина во всех отделах мозга крыс (кроме коры больших полушарий) наблюдалось достоверное снижение содержания 3',5'-АМФ. В острых опытах, после однократного введения аминазина, во всех участках мозга также обнаруживалось достоверное снижение содержания 3',5'-АМФ [16, 28].
В опытах с хроническим введением резерпина во всех участках мозга отмечалось достоверное снижение содержания 3',5'-АМФ.
Антидепрессанты (нардил и парнат) в результате ингибирования моноаминоксидазы увеличивают в мозге содержание моноамина. При этом значение имеет не столько увеличение их содержания, как изменение соотношения между ними. Введение нардила в хронических опытах вызвало достоверный прирост 3',5'-АМФ в коре больших полушарий и в продолговатом мозге. В остальных отделах мозга прирост не был достоверным. В отличие от нардила, парнат усиливал продукцию 3',5'АМФ во всех участках мозга крыс [16, 281.
Таким образом, имеется закономерная связь между действием психотропных веществ и сдвигами в содержании 3',5'-АМФ в мозге. Транквилизаторы имеют тенденцию снижать продукцию 3',5'-АМФ, а антидепрессанты — усиливать ее. С другой стороны, изучение связи между сдвигами в содержании 3', 5'-АМФ и активностью головного мозга не дало возможности выявить корреляцию между ними. По-видимому, нейротропные вещества, которыми вызывались сдвиги в содержании 3',5'-АМФ, оказывают*неоднозначное действие на память и поведение животных [16].
Более определенная’*’картина'’’зависимости между сдвигами в распределении нейропередатчиков и З'^'-АМФ/с'одной стороны,
и изменением функционального состояния животного, — с другой, получена в опытах нагрузки крыс свободными аминокислотами. Крысам к обычной диете добавляли малые количества свободных аминокислот (125 мг/кг живого веса) в продолжение —2 мес.
Изучалось изменение в распределении свободных аминокислот, моноаминов и содержания 3',5'-АМФ, с одной стороны, и сдвиги в функциональной активности головного мозга — с другой.
Нагрузка крыс смесью глутамата и метионина имела следствием прежде всего значительные изменения как в распределении свободных аминокислот, так и моноаминов во всех отделах головного мозга. Увеличивалось отношение аминокислот-нейропередатчиков, принимающих участие в процессах возбуждения (глутамат и аспартат), к аминокислотам-нейропередатчикам, принимающим участие в процессах торможения (гамма-аминомасляная кислота и глицин).
Имело место также значительное увеличение содержания в мозге адреналина и дофамина и в меньшей степени других аминов. Представляет интерес тот факт, что обнаруживалось закономерное снижение соотношения норадреналина к 5-гидрокситрип-тамину (серотонину). Наконец, нужно отметить, что нагрузка животных смесью глутамата и метионина вызывало значительное увеличение содержания 3',5'-АМФ и вместе с тем заметно улучшало условнорефлекторную память. Животные становились более подвижными, латентный период условного рефлекса и число необходимых сочетаний с сигналом сокращались.
Совершенно другая картина наблюдалась после нагрузки крыс тирозином, и в особенности триптофаном. Отношение аминокислот-передатчиков возбуждения к аминокислотам-передатчикам торможения снижалось, отношение норадреналина к 5-гид-рокситриптаиину увеличивалось, содержание 3',5'-АМФ снижалось, а условнорефлекторная память ухудшалась.
Говоря о стимуляции продукции 3',5'-АМФ в нервной ткани нейропередатчиками, нужно иметь в виду, что мы имеем дело со сложным явлением. В зависимости от условий среды эффект усиления колеблется в широких пределах, и часто он вообще не обнаруживается. Исключение представляют катехоламины, в присутствии которых активность аденилциклазы, как правило, увеличивается.
3',5'-АМФ участвует в обменных процессах в двух направлениях: активированием протеип-фосфоксиназных реакций и регуляцией 'обмена внутриклеточного кальция. Свою функцию второго посредника 3',5'-АМФ не может выполнить в отсутствие ионов кальция. Поэтому более правильным является утверждение, что’’роль второго посрэд ника "’нужно приписать системе: ионы кальция1—3',5'-АМФ [33].
Была предложена схема взаимосвязи действия нейропередатчика с активностью 3',5'-АМФ. Согласно этой схеме, нейропередатчик реагирует с рецепторным белком и одновременно активи
руется адепилциклаза. Этот процесс сопровождается изменением проницаемости мембран, в результате чего облегчается перенос ионов кальция через мембрану. Активация аденилциклазы усиливает продукцию 3',5'-АМФ. Переход ионов кальция инициирует ряд внутриклеточных превращений: активацию фосфодиэстеразы и аденилциклазы, стимулирование протеипкипазных реакций я усиление проницаемости мембран для одновалентных катионов (191.
3',5'-АМФ участвует в протеипкиназных реакциях, в стимулировании переноса терминального фосфата АТФ на фермент. Фосфорилированная протеинкиназа в следующей стадии реакции используется как источник фосфатного остатка в активировании мишени: фермента или белка [29]. В 1968 г. было обнаружено, что 3',5'-АМФ стимулирует фосфорилирование гистонов, одной из фракций ядерных белков [291. В нервной ткани обнаружен еще другой субстрат фосфорилирования. Им оказался мембранный белок синаптосом [26J.
В последнее время усиленно изучается механизм возможного участия 3',5'-АМФ в активации генетического аппарата. Эти исследования еще не закончены, но полученные результаты дают много нового в выяснении генетических механизмов, связанных с явлениями памяти. Во-первых, было установлено, что гистоны, представленные в хроматине вместе с ДНК, при участии 3',5'-АМФ фосфорилируются и этим создаются условия для дерепрессии генома [291.
Важную роль в повышении матричной активности хроматина приписывают также фосфорилированию негистоновых ядерных белков, обладающих способностью активно фосфорилироваться в периоды активации генома [29К
11.3.4. ДЕЙСТВИЕ ЭКСТРАКТОВ МОЗГА ОБУЧЕННЫХ ЖИВОТНЫХ
Большую известность получили опыты, по данным которых введение экстракта мозга обученных животных реципиентам облегчает выработку в них аналогичных навыков. Проблема «переноса памяти» широко дискутировалось в литературе. Вопросы, связанные с ней, разрабатываются и сейчас во многих лабораториях [13, 391.
Большие трудности пришлось преодолеть при решении вопроса о материальной сущности тех активных начал, которые вырабатывались в мозге в процессе тренировки. Этим началом оказались, ио данным Унгара, сравнительно простые соединения — полипептиды и пептиды [391. Первый специфический полипептид, осуществляющий «перенос памяти», был назван скотофобином. Из 5 кг мозга крыс удалось выделить 300 мкг активного начала. Скотофобин образуется в мозге крыс, тренированных избегать темного помещения. Попадая в темную коробку из-за естествен-
ного влечения к темноте, крыса получала болевое электрическое раз-дражение’и научалась бежать в светлое помещение. Из ее мозга готовился экстракт, который очищался от балласта методами диализа и хроматографии. Проверка его активности осуществлялась биологическим тестом — введением препарата в мозг реципиента. У реципиента препарат должен был облегчать выработку рефлекса избегания темного помещения.
Было установлено, что скотофобин представляет пятнадцатичленный полипептид. Синтетический препарат оказывал действие, аналогичное естественному. Выл разработан ультрамикрометод количественного определения дапсил-деривата скотофобина тонкослойной хроматографией. Показано, что максимум скотофобина обнаруживается в коре мозга крыс после шестидневной тренировки в количестве 100—200 нг/г свежей ткани. Спустя 15 дней содержание скотофобина сходит на нет.
Другое активное начало — амелетин — было выделено из мозга крыс, тренированных к действию звука электрического звонка. Амелетин построен из шести аминокислотных остатков. Синтетический препарат также оказывал эффект, аналогичный естественному. Содержание амелетина достигает максимума (200 нг/г свежей ткани) после 16 дней тренировки.
Третий активный полипептид был выделен из мозга золотых рыбок, тренированных к избеганию синего цвета путем перехода в аквариум, освещенный зеленым цветом. Он был назван хромо-диопсином. Для приготовления препарата был использован мозг 10 000 рыбок. Хромодиопсин содержит 12 аминокислотных остатков. Изучение структуры других полипептидов продолжается.
Для выяснения роли «переносчиков памяти» в сложной цепи событий, сопровождающих процессы восприятия и хранения информации, нужно исходить из данных, характеризующих образование в мозге «переносчиков».
Во-первых, в нетренированном мозге «переносчик» не обнаруживается. Во-вторых, «переносчик» после определенного времени исчезает, в то время как приобретенный’навык~не’стирается, а запоминается.
Первые два факта говорят о возможности'использования «переносчиков» для «узнавания» и сборки нейронов в ансамбль. Когда сборка ансамбля закапчивается, потребность в «переносчиках» пропадает. Вопрос’о специфичности «переносчиков»‘*'при-современном состоянии’'проблемы’трудно~репгить. Это можно’будет сделать только тогда, когда в распоряжении исследователя будут сотни «переносчиков». Это дало бы возможность выяснить’связь структуры и свойств’пептидов с их эффектами. Г'"”
Конечно, синтез «переносчиков» генетически предопределен. Однако вывод о том, что в разнообразии «переносчиков» кодируется воспринимаемая'информация, что'каждому поведенческому акту должен соответствовать’свой «переносчик»,'’нельзя’считать правильным. Исходя из представлений, которые нашли’экспери-502
ментальное подтверждение в нейрофизиологии, более закономерным было бы предполагать, что «переносчики памяти» выполняют роль приспособительного механизма, которым облегчается «узнавание» нейронов и их сборка в ансамбль,
11.3.5. ВОЗМОЖНЫЕ МЕХАНИЗМЫ УЧАСТИЯ ГЕНЕТИЧЕСКОГО АППАРАТА
В ЯВЛЕНИЯХ ПАМЯТИ
Положение о том, что генетическому аппарату в явлениях нейрологической памяти принадлежит ведущая роль, неоспоримо. Но нужно иметь в виду, что генетический аппарат и в нервной ткани выполняет свою обычную работу синтеза белков-ферментов и регуляции их действия. Особенность нейрологической памяти заключается в том, что информация воспринимается ансамблем нейронов, действующим как единое целое. Каждому биту информации должен соответствовать свой набор нейронов. Специфические для нервной системы особенности проявляются не столько на уровне программированных молекул, сколько на уровне пространственно-функциональных взаимоотношений, на уровне ансамблей нейронов, объединенных синаптическими связями.
Основой нейрологической памяти является работа синаптического аппарата, в которой ведущая роль принадлежит нейропередатчикам, мембранным ферментам и рецепторным белкам. Образование и устранение нейропередатчиков регулируется ферментами, а синтез и регуляция действия последних осуществляется генетическим аппаратом. Нейропередатчики, со своей стороны, принимают участие в активации генетического аппарата посредством 3',5'-АМФ.
Таким образом, генетический аппарат в поведенческих актах должен участвовать при помощи механизма, в основе работы которого лежит принцип отрицательной обратной связи по схеме:
.------- Нейроиередатчик--------------
Циклический аденозинмоно* фосфат
I
Генетический аппарат
I
Ферменты, регулирующие уровень нейропередатчикоп
В вышеприведенной схеме нужно считать экспериментально доказанным, что мембранные ферменты и рецепторы принадлежат к группе функциональных белков, специфичных для нервной ткани. Их биосинтез индуцируется генетическим аппаратом.
Рецептора] лй белок
Торможение синтеза мембранных ферментов и рецепторных белков приводит к расстройству памяти. Экспериментально доказанным нужно считать также наличие связи между действием нейропередатчиков и активацией генетического аппарата. Эта связь осуществляется, по-видимому, работой системы: 3',5'-АМФ—аденил-циклаза—фосфодиэстераза. Вместе с тем остаются совершенно невыясненными те пути, которыми в нейрологической памяти реализуется закодированная в ДНК информация. В этом направлении сделаны только первые шаги.
ЛИТЕРАТУРА
1. Алексидзе И. Г. Об изменении АХЭ-активности специфических областей коры мозга крыс при обучении. — ДАН СССР, 1971, 198, № 6, с. 1455— 1456.
2. Ашмарин И. П. О возможной роли иммунохимических процессов в механизмах памяти. — Журн. эвол. биохим. физиол., 1973, 9, № 3.
3. Ашмарин И. П. Загадки и откровения биохимии памяти. М., 1975.
4. Бершпашвили И. С. Память позвоночных животных, ее характеристика и происхождение. М., 1974.
5. Воронин. Л. Г. Филогенетическая эволюция условно-рефлекторной деятельности. Руководство по физиологии. Физиология высшей нервной деятельности. Ч. I. М., 1970, с. 473—506.
6. Илъюченок Р. Ю. Фармакология памяти и поведения. М. — Новосибирск. 1972.
7. Кафиани К. А. Макромолекулярные синтезы и механизмы памяти. — Труды 5-й Всес. конф, по нейрохимии. Тбилиси, 1970, с. 52—69.
8. Клейн Е. Э., Чоговадзв И. С., Заилите или Э. А. Изучение участия си-?наптосомальных белков в механизмах памяти. — Изв. АН СССР, Сер.
биол., 1975, 1, № 1, с. 39—46.
9. Кометиани Л. А. О биохимических основах памяти. Труды 4-й Всес. конф, по биохимии нервной системы. Тарту, 1969, с. 22—45.
10. К оме тиа ни П. А. Биохимические аспекты памяти животных. — В кн.: Успехи нейрохимии. Л., 1974, с. 7—18.
11. Кометиани Л. А., Алексидзе Н. Г., Клейн Е. Э. Об участии генетического аппарата в явлениях памяти и обучения. — Физиол. журн. СССР, 1976, 62, № 1, с. 10—21.
12. Кругликов Р. И. Нейрохимические механизмы процессов формирования и фиксации временных связей. — В кн.: Итоги пауки и техники. Физиология человека и животных. 16. М., 1975, с. 59—118.
13. Крилов О. А. Воспроизведение условнорефлекторной деятельности введенных биохимических субстратов. — Усп. физиол. наук, 1974, 5, № 4, с. 22-51.
14. Смирнов Г. Д. Ультраструктура синапсов и проблема синаптической передачи. — Усп. совр. биол., 1967, 63, Ks 2, с. 249—260.
15. Тушмалова Л. А. Сравнительно-физиологическое исследование структурно-функциональных механизмов памяти. Автореф. докт. дис. М., 1976.
16. Чикваидзе Н. Л., Джалиашвили Т. А., Иорданишвили Г. С. Изучение Ы связи действия нейротропных веществ на распределение биогенных аминов, 3',5'-АМФ в головном мозге. — В кн.: Вопросы биохимии нервной и мышечной систем. 3. Тбилиси, 1977.
17. Agranoff- В. W. Biochemistry of learning processes; biochemical concomitants of the storage of behavioral information. — In: Biochemistry of sensory function. Berlin, 1974, p. 597—623.
18. Bogoch S. Brain glycoproteins and studies supporting the «sigh-post» theory. — In: 4th Internal. Meet. Internet. Soc. Neuroch., Tokyo, 1973, p. 100.
19. De laTorre J. G. Dinamics of brain monoamines. New York, 1972.
20 Deutsch /. A. The cholinergic synapses and the site of memory. — Science, 1971, 174, N 4011, p. 788—794.
21. Flood Bennet E. L., Orme E., Rosenziveig M. R. Effects of protein synthesis inhibition on memory tor active avoidance training. — Physiol. Behavior, 1975, 14, N 2, p. 177—184.
22. Gabay S. Phenothiasines: neurochemical aspects of their model and action. — In: Handbook of Neurochemistry. Ed. A. Lajtha, New York. 1971, p. 325— 347.
23. Geito J. Successial competition DNA—RNA hydrotization procedures to detect the presence or absence qualitative changes in RNA during behavioral events. — J. Psychobiology, 1972, 2, N 3, p. 163—176.
24. ffyden H., Lange P. W- Immunophoretic identification of S-protein in brain. — In: Biology of memory. Ed. C. Adam. Budapest, 1971, p. 69— 84.
25. Jaenicke L. (Ed.) Biochemistry of sensory functions. Berlin, 1974.
26. Johnson E. M., Ueda T., Maeno H., Greengard P. Adenosine 3',5'-monop-hosphate dependent phosphorylation of a protein in synaptic membrane fractions from rat cerebrum. — J. Biol.
27. Kandel E. R., Spencer W. A. Cellular neurophysiological approaches in the study of learning. — Physiol. Rev., 1968, 48, p. 65—137.
28. Kometiani P. A., Chilingarov A. O. Effect of changes in distribution of free amino acids, monoamines and cyclic S^S'-adenosinemonophosphate in the brain and of its functional activity. — Biochem. Exp. Biol., 1974/1975, 11, N 4, p. 319—331.
29. Langan T. A. Cyclic AMP and histone phosphorylation. — Aim, New York. Acad. Sci., 1971, 185, N 1, p. 166—181.
30. Levitan L- B., Ramires G., Munhycski W. E. Amino acid incorporation in the brain of rats trained to use nonpreferred paw in retrieving food. — Brain Res., 1972, 47, N 1, p. 147—156.
31. Moore B. W., McGregor J. Chromatographic and electrophoretic fractionation of soluble proteins of brain and liver. — J. biol. chem., 1965, 240, N 4, p. 1647—1653. *
32. Peterson R. P., Peng Lo J. The role of macromolecules in neuronal function in Aplysia. — Progr. Neurobiol., 1973, 2, N 2, p. 179—203.
33. Rasmussen HGoodman D. B., Tenenhouse A. Cell communication, calcium ions and cyclic adenosine monophosphate. — Critical Rev. Biochem., 1972, 1, p. 95-148.
34, Shashoua V. E. RNA metabolism in goldfish brain during acquisition of new behavioral patterns. — Proc. Nat. Acad. Sci. USA, 1970, 65, N 1, p. 160—167.
35. Shashoua V. E. Brain biochemistry and learning: evidence for the synthesis of three specific proteins in goldfish brain. — In: 5th Internet. Meet. Internet. Soc. Neurochem. Barcelona, 1975, p. 473.
36. Shichi H. Molecular biology of visual process. — In: Basic Neurochemistry. Eds G. Siegel, R. W. Albers, R. Katzman, B. Agranoff. 2d ed. Boston, 1976, p. 148—166.
37. Shore P, A. Reserpine: survey in the pharmacology. — In: Handbook of Neurochemistry. Ed. A. Lajtha. New York, 1971, p. 349—356.
38. Triggie D. У. Neurotransmitter receptor interactions. New York, 1971.
39. Ungar G- Peptides and behaviour. — Internat. Rev. Neurobiol., 1975, 17, N 1, p. 37—60.
Глава 12
КОДИРОВАНИЕ И ПЕРЕДАЧА СООБЩЕНИЙ В НЕРВНОЙ СИСТЕМЕ
В настоящей главе представлены лишь основные данные и идеи, относящиеся к вопросу кодирования сообщений в центральной нервной системе. В последнее время вышли в свет ряд монографий и обзоров по вопросам кодирования сенсорной информации, к которым можно обратиться в случае необходимости [2, 4, 14, 18, 23, 25, 26, 60].
12.1. ОСНОВНЫЕ ТЕРМИНЫ
Под термином «код» в технике связи понимают преобразование передаваемого сообщения в комбинацию сигналов, а сама операция перевода сообщения в последовательность сигналов называется кодированием сообщения. Широкое использование этого термина в различных областях привело к тому, что он приобрел множество значений, например, у криптологов, лингвистов, генетиков и т. д. При рассмотрении принципов передачи сообщений в нервной системе может возникнуть вопрос о правомерности использования этого термина, так как далеко не всегда мы в состоянии точно определить, с помощью каких сигналов передаются сообщения (точнее, установить, что идентифицированный нами сигнал полностью несет содержание передаваемого сообщения). Тем не менее использование терминов «код» и «кодирование» в настоящее время общепринято для описания передачи сообщений в нервной системе; это можно объяснить хотя бы тем, что придумывание новых терминов далеко не всегда ведет к более глубокому пониманию существа проблемы.
Термин «информация» в своем первоначальном смысле означал знание человека о тех или иных явлениях в природе и обществе. Однако по мере развития теории информации и введения понятия «количество информации» этот термин измецил'свое'первоначаль-
Ж
ное значение и начал употребляться для обозначения сведений, абстрагированных от свойств реальных событий и объектов. Границы абстрагирования весьма условны и определяются спецификой решаемой задачи. Имеет ли смысл в таком случае широко пользоваться этим термином при рассмотрении не очень определенных вопросов передачи сообщений в нервной системе? Очевидно, что это следует делать без злоупотребления, не прикрывая термином отсутствие понимания и помня, что материальной формой воплощения информации является сообщение.
Термин «частота» нередко используется нри описании последовательностей событий. Строго говоря, этот термин в основном предназначен для описания колебательных, периодических процессов. Поскольку в нервной системе носителем информации является последовательность дискретных потенциалов действия, то применение этого термина в данном случае не совсем правомерно. Однако, учитывая широкое распространение этого термина в физиологической литературе, от него трудно отказаться. При этом под «частотой» следует понимать число импульсов за единицу времени.
Остальные термины, которые будут использованы в настоящей главе, не требуют особых обсуждений, так как их значения определены в предыдущих главах. Следует только указать, что некоторые из них, например ВПСП, рефрактерный период, будут использованы при описании моделей нейронов, для которых они определяют лишь форму и временные параметры моделируемых процессов, но не их природу. В моделях форма ВПСП может быть формализована, что упрощает создание модели.
12.2. ОСНОВНЫЕ ПРИНЦИПЫ КОДИРОВАНИЯ ИНФОРМАЦИИ В НЕРВНОЙ СИСТЕМЕ
12.2.1. ОБЩИЕ ПОЛОЖЕНИЯ
По-видимому, одним из начальных вопросов при рассмотрении механизмов кодирования сообщений в нервной системе является следующий: можно ли утверждать, что у различных животных или даже в различных отделах нервной системы одного животного используются одинаковые принципы кодирования и передачи сообщений?
Имеющиеся в настоящее время факты свидетельствуют, что это не так. Скорее следует предполагать, что даже один и тот же канал передачи сообщений в нервной системе может в различных ситуациях использовать разные виды кодов, а в различных каналах могут использоваться разные механизмы передачи сигналов.
Если рассматривать физиологические механизмы, то можно представить себе передачу сообщений в нервной системе сигналами двух видов: а) импульсными последовательностями, б) неимпульсными сигналами (электрическими, гуморальными). В настоящее время имеются экспериментальные доказательства возможности
НСиМйульс1гой передачи сообщений, например, в сетчатке Глаза. В мозге имеется большое число короткоаксонных нейронов. Возможно, что эти клетки выполняют функции передачи сообщений, не используя потенциалы действия. Накоплен ряд данных о так называемых полевых эффектах, при которых слабые электрические взаимодействия между нервными клетками могут быть физиологически эффективными. Хотя экспериментальное изучение этих явлений чрезвычайно затруднительно, о них не следует забывать при рассмотрении вопросов передачи и преобразования сигналов в нервной системе.
Тем не менее ни у кого не вызывает сомнения тот факт, что сигналы на большие расстояния (от миллиметров до метров) за ограниченное время передаются в центральной нервной системе с помощью потенциалов действия. Поэтому в настоящей главе будут рассмотрены только вопросы, связанные с кодированием сообщений с помощью последовательностей потенциалов действия.
12.2.2. ПРИНЦИП «МЕЧЕНОЙ ЛИНИИ»
Выдвинутая Мюллером еще в 1826 г. идея о том, что специфика восприятия различных внешних сигналов обусловлена передачей по соответствующим нервам «специфических энергий», оказалась плодотворной для понимания функции периферических отделов ряда сенсорных систем. В современном представлении идею, высказанную Мюллером, можно изложить так: сенсорные рецепторы чувствительны к раздражению одного качества, и их центральные проекции организованы таким образом, что любая импульс а ция от таких рецепторов будет оценена как сообщение об этом качестве. Этот принцип Буллок [34] назвал впоследствии принципом «меченой линии». Принцип «меченой линии» справедлив для многих, но не всех сенсорных путей. Например, показано, что сигналы о действии различных химических веществ возникают в периферических отделах вкусовой системы в одних и тех же рецепторах и передаются по одним и тем же волокнам [55]. Есть также основания полагать, что сигналы о температурных и механических воздействиях на кожу также могут передаваться по одним и тем же каналам. Тем не менее хеморецепция и температурная рецепция — это скорее исключения из правила, а не его опровержение. Идея «меченой линии» справедлива для большинства видов рецепции, однако она объясняет лишь, каким образом может различаться качество сигнала, но пе другие его характеристики. Принцип «меченой линии» в определенной мере может действовать и в последующих звеньях нервной системы. Однако широкая конвергенция синаптических входов на нейронах центральных структур (см. гл. 8) свидетельствует о том, что только этим принципом объяснить передачу специфичности сигналов во всех отделах нервной системы нельзя.
12.2.3. ЧАСТОТНОЕ КОДИРОВАНИЕ
Одним из самых распространенных принципов кодирования и передачи сообщений об интенсивности стимула на различных уровнях нервной системы можно считать частотное кодирование. Этот вид кодирования впервые экспериментально обнаружен Эдрианом и Метьюзом [27J в афферентных волокнах, идущих от рецепторов растяжения мышцы. Иногда этот вид кодирования называют среднечастотным, подчеркивая тем самым, что в нем имеет значение только количество импульсов, а не временные соотношения между ними. Среднечастотный код можно считать одним из основных кодов, используемых в нервной системе. Этот вывод подкрепляется тем, что в качестве механизма, способного «читать» этот код, может использоваться самый простой: каждый приходящий импульс создает затухающий во времени ВПСП; в результате суммации таких ВПСП достигается порог возбуждения клетки и генерируется потенциал действия. Чем выше частота входных импульсов, тем чаще случаи достижения порога и тем выше частота ПД на выходе «читающего нейрона». Это не значит, конечно, что между частотой входных импульсов и частотой выходных должно обязательно существовать линейное соотношение. Сигнал, представленный средпечастотным кодом, может линейно передаваться всей системой, в то время как отдельные ее элементы могут существенно его преобразовывать. Так, например, в экспериментах Патриджа и Кима [571 электрически раздражалась веточка вестибулярного нерва у кошки и регистрировалось сокращение одной из мышц конечности. Когда раздражение производилось последовательностью стимулов, частота которых изменялась по синусоидальному закону, сокращение мышцы с небольшими искажениями воспроизводило синусоиду. Однако ответы отдельных двигательных единиц значительно отличались от характеристики стимулирующего потока. Прямое раздражение двигательного нерва синусоидально модулированной последовательностью стимулов вызывало ответ мышцы, который был менее линейным, чем при стимуляции веточки вестибулярного нерва. Следовательно, вся система, включая ее обратные связи, может компенсировать нелинейности отдельных ее компонентов. Этот пример свидетельствует также о том, что среднечастотный код может использоваться не только в афферентных отделах нервной системы, но также и в эфферентных. Эффективное использование среднечастотного кода в эфферентной системе было хорошо продемонстрировано в экспериментах Битнера [31 ]. Один мотонейрон создает различные окончания на мышце, открывающей клешню рака, и каждое из этих окончаний действует в своем диапазоне частот. Изменение частоты разрядов мотонейрона может вызвать сокращение одной или другой группы мышечных волокон.
При анализе сообщений, передаваемых с помощью среднечастотного кода, естественно возникает вопрос — за какое время
следует измерять число импульсов. Выбор этого времени может производиться с позиции экспериментатора и с позиции следующего нейрона, воспринимающего сообщение. Эти позиции далеко не одинаковы. Экспериментатор, как правило, рассматривает один поток импульсов, к нейрону же в результате конвергенции входов поступают многие потоки. Естественно, что при этом за одно и то же время наблюдения поступающее число импульсов будет разным. Правда, известен класс случайных процессов (так называемых эргодических), для которых усреднение по «-регистрациям длительностью t эквивалентно одной длительности nt. Но для того чтобы считать процесс эргодическим, необходимо выполнение целого ряда условий. Процессы установления частоты разрядов в каждой клетке при этом должны быть идентичными, разряды во время поддерживаемой стимуляции не должны коррелировать и т. д. В организме эти условия не выполняются даже для рецепторов одного типа, так как они, как правило, обладают различными порогами и при одной и той же интенсивности стимула продуцируют различающиеся по частоте разряды. Следовательно, оценки экспериментатора и реального нейрона принципиально различны.
С точки зрения экспериментатора среднюю частоту можно измерять либо по числу импульсов за определенный временной интервал, либо за время, в течение которого регистрируется определенное число импульсов. Величина временного интервала или число импульсов, выбираемые для определения средней частоты, устанавливаются по некоторым физиологическим соображениям. Чаще всего средняя частота измеряется по полной регистрации. Реальный же нейрон, по-видимому, не может производить выбор среди этих альтернатив. Вопрос о том, не используют ли нейроны различных систем разные методы оценки средней частоты, пока остается неясным.
12.2.4. ИНТЕРВАЛЬНОЕ КОДИРОВАНИЕ
Имеется ряд данных о том, что в различных отделах нервной системы при различных условиях могут изменяться временные интервалы между импульсами, а их средняя частота следования оставаться без изменений. Такой принцип кодирования называют интервальным кодом. Примеры такого кодирования были получены как на низших, так и£на высших животных.
Показано, что сила сокращения мышцы существенно зависит от временной структуры импульсной последовательности, поступающей по двигательному нерву. Н. Е. Введенский в 1907 г. первым обратил внимание на значительное усиление мышечного сокращения при нерегулярной стимуляции нерва 16]. Затем Вирсма и Адамс [74] показали, что сокращение мышц у ракообразных Ъо много'раз больше при последовательностях импульсов в двигательном нерве, состоящих из коротких и длинных интер
валов, чем при одинаковых интервалах и той же средней частоте. Сегундо и др. [64, 66] также нашли, что вероятность появления разряда у ганглиозных клеток аплизии существенно зависит от временной структуры входного импульсного потока.
Для центральной нервной системы получение таких данных затруднительно. Для убедительного заключения о том, что генерация разряда в одиночном нейроне зависит от структуры поступающих к нему импульсов, необходимо, чтобы в исследуемой системе не было промежуточных нейронов, переключающих или создающих обратные связи, число пресинаптических окончаний должно быть невелико, а время интегрирования нейроном не должно быть коротким, иначе каждый постсинаптический потенциал не будет влиять на последующие, и т. д. Иными словами, необходимо доказать, что чувствительностью к изменениям временной структуры входного потока обладает отдельный нейрон, а не нервная сеть, в которую он включен. В связи с этим представляется необоснованным предположение Бернса [2] о том, что перестройка межимпульсных интервалов без изменения средней частоты — основной способ кодирования сообщений у нейронов коры мозга.
Тем не менее мы располагаем данными об интервальном кодировании в системе вкусовой чувствительности. Недавно было обнаружено [55], что интенсивность вкусового раздражителя кодируется средней частотой разрядов, а качество (переход от NaCl к сахарозе) — интервалами между ними. Психофизические эксперименты показали, что временные интервалы между событиями могут обусловливать качество ощущения; например, сформированные во времени световые вспышки могут вызвать эффект появления цвета [50]. Однако трудно себе представить, чтобы отдельный максимальный интервал являлся буквой алфавита, которым пользуется нервная система. Его слишком трудно было бы измерить. Скорее можно думать о наборе интервалов (pattern) как носителе сообщения. Существующие данные о том, что нейроны в состоянии дискриминировать потоки различной временной структуры, свидетельствуют в пользу различения посылок, состоящих из нескольких, а не отдельных интервалов.
12.2.5. ПРОСТРАНСТВЕННО-ВРЕМЕННОЕ КОДИРОВАНИЕ
Когда мы рассматриваем различные виды кодирования сенсорных сигналов, необходимо учитывать, что эти сигналы передаются к нейронам следующего порядка по многим параллельным каналам и речь идет всегда о пространственно-временном кодировании. ^Одпим из ярких примеров пространственно-временного кодирования является система кожной чувствительности. В подушечках стопы кошки имеются быстро адаптирующиеся механорецепторы, которые генерируют один-два импульса на каж
дый механический стимул. Адекватная стимуляция вызывает импульсацию в ряде афферентных волокон. В волокнах, идущих от наиболее деформированных участков кожи, импульсы имеют наименьшую латентность, а в волокнах, идущих от более удаленных участков, наибольшую. На рис. 12.1 представлена схема кодирования в параллельных каналах. Таким образом создается пространственно-временной код, который содержит информацию об интенсивности стимула.
Однако экспериментальное исследование кодов, передаваемых по параллельным каналам на уровне центральных нейронов,
Рис. 12.1. Схема кодирования сигналов рецепторами кожной чувствительности.
А — среднечастотное кодирование медлеиноадаптирующимиея рецепторами при двух одновременно действующих стимулах (указаны стрелками); Б — пространственное иодирование быстроадаптирующимися рецепторами при двух последовательно действующих стимулах [34].
наталкивается на значительные методические трудности. Одна из них заключается в том, что при одновременном отведении активности двух или трех случайно выбранных единиц необходимо определить, в каких функциональных взаимоотношениях находятся эти единицы.
Обычно для такого определения пользуются методами статистического анализа, в частности построением и анализом функций кроссинтенсивности [59, 62]. На моделях нейронов, имеющих различные виды связей, были получены основные формы функций кроссинтенсивности [53], которые могут быть положены в основу классификации результатов, получаемых в экспериментах. Этот метод можно было бы считать совершенным, если бы всему многообразию видов связей соответствовало столько же форм функций .кроссинтенсивности. Однако уже модельные эксперименты показывают, что такого соответствия нет. Например, пик на функции кроссинтенсивности может быть получен при прямой, возбуждающей связи между нейронами, но сходный пик может возникать и при конвергенции возбуждающих входов или даже
ИЗ
при одновременном торможении нейронов из общего источника. Тем не менее в относительно простых ситуациях эта методика дает возможность по результатам внеклеточной регистрации делать заключения о структурной-организации исследуемого центра. Недавно был предложен метод графического представления на плоскости взаимодействия трех импульсных потоков [61].
Одним из основных при рассмотрении механизма пространственного кодирования является вопрос о том, кто обрабатывает сообщения, поступающие по параллельным каналам. В общей форме можно думать, что это делает либо популяция нейронов, либо существуют отдельные нейроны, способные «узнавать» временную структуру импульсных потоков, конвергирующих к ним по параллельным входам. Основным возражением против гипотезы о возможном различении сообщений на уровне отдельного нейрона является то, что в таком случае какое-либо повреждение этого нейрона являлось бы катастрофой для выполнения соответствующей функции.
12.2.6. КОДИРОВАНИЕ ЧИСЛОМ ИМПУЛЬСОВ И ДРУГИЕ СПОСОБЫ ПЕРЕДАЧИ СИГНАЛОВ
В исследованиях, проводившихся на рыбах и насекомых, были обнаружены и другие виды кодирования. Например, в нервных волокнах, идущих от латеральной линии электрической рыбы, были обнаружены вспышки импульсов в ответ на адекватный стимул [33].
Число импульсов в пачке было тем больше, чем сильней был стимул. При этом никаких систематических изменений величины межимпульсных интервалов не наблюдалось. Следовательно, информация об интенсивности стимула кодировалась только числом импульсов или длительностью посылки. Впоследствии аналогичные принципы кодирования были обнаружены и у теплокровных животных в системе кожной и зрительной чувствительности (см. ниже).
Своеобразный принцип передачи сигналов в эфферентной системе насекомых был обнаружен Вилсоном [75]. Одиночный нервный импульс или пачка импульсов достигает двигательного аппарата, запускает его и вызывает взмах крыла. Точное время прихода импульсной посылки обеспечивает правильную ритмику движения крыльев. Однако форма посылки, т. е. количество импульсов в ней и интервалы между ними, существенного значения не имеет. Такую передачу сигналов можно было бы определить как команду «пуск».
Команда «пуск» может использоваться в случаях запуска высшими центрами механизмов выполнения стереотипных актов [22]. Конечно, информация, содержащаяся в такой посылке, не имеет существенного значения, информативным является только ее наличие или отсутствие.
33 Общая физиология нервной системы
513
12.3. ПЕРЕДАЧА РАЗЛИЧНЫХ КОДОВ СИНАПТИЧЕСКИМИ СОЕДИНЕНИЯМИ
12.3.1. ЭКСПЕРИМЕЦТАЛЬНЫЕИССЛЕДОВАНИЯ
Если на пути передачи импульсов от нейрона к нейрону включен синапс, то в нем несомненно должна происходить определенная трансформация передаваемых сообщений.
Пресинаптические терминали и создаваемые ими синаптические соединения можно разбить, основываясь на амплитуде создаваемых ими постсинаптических потенциалов (ПСП), на две крайние категории. К первой можно отнести соединения, создающие большие ПСП. Эта категория соединений была подробно исследована как у низших 134], так и у высших животных. Сента-готаи и Альбертом [70] были описаны «гигантские» синаптические окончания, создаваемые афферентными волокнами на первых центральных нейронах дорсального спинно-мозжечкового тракта. Длинный (несколько сот микрон) параллельный контакт между афферентными терминалями и дендритами клетки и 10—15 концевых бляшек размером 6—8 мкм создают синаптическое соединение, площадь которого может достигать 1000 мкм8 и более. Активация такого гигантского синапса вызывает ВПСП, амплитуда которых может достигать нескольких милливольт. К другой категории могут быть отнесены соединения, которые создают маленькие ПСП, например синаптические окончания афферентных волокон на мотонейронах, каждое из которых может создавать ВПСП амплитудой 0.2—0.3 мВ [42].
Естественно, что от амплитуды возникающих ПСП очень зависит отношение «вход—выход» для нейрона. Если в «мощном» соединении даже отдельный ПСП в состоянии вызвать генерацию разряда в нейроне, то для «слабых» соединений обычно требуется суммация большого числа ПСП. Отсюда априори можно сделать предположение о том, что только «мощные» соединения в состоянии обеспечивать передачу, кроме средней частоты входного потока, еще и таких его характеристик, как величины межимпульсных интервалов. Для «слабых» соединений (если импульсы, приходящие по многим из них, независимы) единственным значимым параметром может быть средняя частота; другие характеристики входных потоков при суммации будут теряться.
Иначе может обстоять дело, если разряды, приходящие ко многим «слабым» соединениям, коррелированы. Такая корреляция может возникать в рецепторах при одновременном воздействии на них'стимула^возможна она^и на уровне центральных нейронов. Корреляция*в работе'нейронов может быть обусловлена рядом причин: а) прямым’электрическим взаимодействием нейронов, б) прямым химическим взаимодействием, в) синаптическим взаимодействием через систему возбуждающих связей, г) синаптическим взаимодействием через систему тормозящих свя-514
зей [151. Корреляция в работе «слабых» соединений приводит к тому, что их суммарное действие становится сравнимым с действием «мощного» соединения, и в этих условиях нейрон, на котором происходит конвергенция коррелированных влияний, может передавать не только значение средней частоты, но и другие параметры входящих потоков.
Кроме амплитуды ПСП, большое влияние на передачу сообщений могут оказывать также ряд других характеристик нейрона — величина порога, длительность рефракторности, постоянная времени затухания ВПСП и др.
Порог возбуждения нейрона не остается стабильным во времени, его изменения могут быть обусловлены рядом факторов, например изменением фоновой «слабой» синаптической активации, изменением проницаемости клеточной мембраны в результате различных гуморальных воздействий, изменением кислородного режима и т. д.
Левитан и др. [44] на моллюске аплизия получили данные о том, что входные последовательности, состоящие из трех импульсов с различными интервалами между ними, могут вызывать различную по уровню деполяризацию нейрона. Этот результат объясняется просто, если учесть экспоненциальное затухание ВПСП и их суммацию на мембране. Легко показать аналитически, что при экспоненциальном затухании ВПСП и их линейной суммации больший уровень деполяризации будет достигнут при входной последовательности типа «длинный—короткий» интервал, а не наоборот. Это справедливо, конечно, только в том случае, если длина интервала не превышает времени полного затухания ВПСП.
Более подробное экспериментальное исследование реакций таких нейронов на различную структуру входных потоков было проведено Сегундо и Перкелом [63, 65]. Постсинаптические потенциалы в нейроне вызывались электрической стимуляцией нерва. Были использованы различные временные последовательности: регулярно следующие стимулы, регулярно следующие пары стимулов, тройки стимулов, следующие со случайными интервалами, и т. д. Все последовательности стимулов имели одинаковую среднюю частоту и одинаковое количество коротких, средних и длинных интервалов, но различались по своей временной структуре. Стимулы вызывали сравнительно большие, но подпороговые ВПСП.
Исследование показало, что если размер ВПСП достаточно велик, то выход нейрона (вероятность генерации им импульса) может зависеть от точного порядка следования интервалов во входном потоке. Поэтому авторы предложили ввести термин «оптимальный временной поток» стимулов и определили его как такой, который вызывает наибольшее среднее число разрядов в нейроне. «Оптимальность» потока прежде всего зависит от величины вызываемых им ВПСП и его средней частоты, но при определенных размерах ВПСП и средней частоте «оптимальность»
может зависеть и от других статистических характеристик входного потока.
Таким образом, можно полагать, что для объяснения большинства случаев, в которых нейрон как бы отдает предпочтение определенной временной структуре входного потока, достаточно учесть такие параметры, как амплитуда и форма ВПСП, характер их суммации на мембране и изменения порога нейрона, и нет необходимости наделять нейрон необъяснимыми механизмами «узнавания» сигналов со специфической временной структурой.
12.3.2. ИССЛЕДОВАНИЯ НА ИМИТАЦИОННЫХ МОДЕЛЯХ НЕЙРОНОВ
Так как исследовать передачу импульсных потоков при одновременном действии на нейрон многих входов, т. е. в режиме пространственно-временной суммации, на реальных нейронах очень трудно, то оправданным является исследование таких ситуаций на имитационных моделях нейронов и простейших нейронных сетей. Имитационная модель нейрона представляет собой логико-аналитическую программу, реализованную на ЭВМ, в которой учтены основные известные функции реальных нейронов. Одной из первых работ такого направления можно считать модель-программу, созданную Перкелом [58]. Исследование на модели передачи различных потоков было осуществлено Сегундо и др. [64]. Состояние модели в любой момент времени определялось двумя переменными: мембранным потенциалом и порогом. Каждый входной импульс вызывал ВПСП, форма которых была одинакова, и суммация их происходила линейно. Следует указать, что авторам пришлось ввести некоторую формализацию в связи с общей сложностью модели. Количеством входов к модели можно было варьировать от 1 до 128, в широких пределах могли также изменяться амплитуды создаваемых ВПСП. Эксперименты, проведенные на модели, были разбиты на две группы: а) исследование влияний независимых входов, б) исследование влияний взаимозависимых входов.
Эксперименты первой группы показали, что при увеличении числа входов и соответствующем уменьшении амплитуды создаваемых каждым из входов ВПСП поток импульсов на выходе модели имеет тенденцию становиться регулярным при любой временной структуре входных потоков. Однако число входов, необходимых для создания регулярного выхода, очень зависело от величины ВПСП, постоянной времени восстановления порога после разряда и т. д.
Эксперименты второй группы показали, что при наличии временной связи между импульсами входных потоков структура выходной последовательности существенно зависит от временного распределения импульсов на входах. Эта зависимость увеличивается при усилении связи между входами или увеличении их 516
числа. Таким образом было получено косвенное доказательство роли корреляции активности многих входов в процессе передачи различных кодов.
Более поздние работы, также выполняемые на имитационных моделях нейронов [40], подтверждали, что модель, основанная исключительно на простых механизмах суммации ВПСП и изменениях порога, может быть избирательной к структуре входных потоков. Эта избирательность существенно зависит от величины создаваемых этими входами ВПСП.
Приведенные выше результаты экспериментов, выполненных на реальных нейронах и их моделях, наводят на мысль о возможности функциональной классификации синаптических соединений, основанной на способности обеспечивать передачу различных кодов. Соединения, создающие большие ВПСП и обеспечивающие передачу нейроном тонкой структуры входных потоков, можно было бы назвать «интервальными» соединениями. Соединения, которые создают небольшие ВПСП, обеспечивают только сдвиг мембранного потенциала нейрона пропорционально средней частоте импульсов, приходящих к этому соединению. Такие соединения можно было бы назвать «среднечастотными» соединениями. Однако если в работе таких «среднечастотных» соединений появляется корреляция, то это может способствовать их приближению к «интервальным». Возможно, что роль «слабых» соединений действительно может изменяться от медленного влияния на уровень мембранного потенциала при передаче тонических сигналов до передачи сложной структуры входных сигналов при динамической деятельности.
Может возникнуть впечатление, что те характеристики входных потоков, которые передаются «слабыми» соединениями и практически не влияют на деятельность нервной клетки, бесследно теряются в этих соединениях и поэтому не могут претендовать на роль сигналов, передающих сообщения в нервной системе. Однако не следует думать, что одновременную работу многих несвязанных «слабых» входов можно рассматривать как источник шума.
Действительно, как мы увидим ниже, возможности передачи сообщений таким способом довольно ограничены, но поскольку уровень мембранного потенциала, а следовательно, и величина порога играют большую роль в деятельности нейрона, то влияние «слабых» входов нельзя рассматривать просто как шум, мешающий передаче полезных сигналов.
12.3.3. ОЦЕНКА ПЕРЕДАЧИ СООБЩЕНИЙ С ПОМОЩЬЮ ИНФОРМАЦИОННОЙ МЕРЫ
В качестве общей меры, которая позволяет сравнить передачу сообщений разными соединениями, используется количество информации, передаваемой за единицу времени.
Количество информации, содержащейся в сообщении, можно определить следующим образом:
I-— -кв 2 рм,
где к — постоянная, G — количество символов в рассматриваемом сообщении, п — количество символов в используемом алфавите, Р — априорная вероятность j'-го символа (формула Шеннона). Это статистическое определение информации, при котором появление в сообщении любого символа подряду причин может произойти с определенной вероятностью; но эта вероятность не зависит от ценности всего передаваемого сообщения. Является ли эта информация ценной или бесполезной, может быть определено только ее получателем, в нашем случае нейронами. Однако еслщ рассматривать количество информации как абсолютную величину, не касаясь ее ценности, то такая величина является полезной, так как имеет одно и то же численное значение для любого, наблюдателя. В теории информации принято рассматривать информацию I как безразмерную величину и выражать ее в двоичных единицах (битах). Если речь идет о передаче информации по каналу связи, то единицей измерения может быть выбрано количество двоичных единиц (бит) за единицу времени (секунду). Информация, передаваемая в единицу времени посредством алфавита, содержащего п символов, с вероятностью появления каждого из них Pj и средним временем передачи символа Ь, определяется соотношением
п c=(-2p/°s^.
/=1
если ввести упрощающее предположение, что все п символов равновероятны, то
с log п
Используя эти выражения, можно определить количество информации, которая^может быть передана за единицу времени при использовании различных кодов. Такие расчеты были проведены Старком с соавт. [67] по данным, полученным при изучении двигательных реакций^рака на световое раздражение фото-чувствительного хвостового^ганглия.
Скорость передачи информации в афферентном волокне, идущем от фоторецептора при использовании интервального кода, составит более 100 бит/с. Если же допустить, что информация передается с помощью среднечастотного кода, то пропускная способность канала падает до 3 бит/с, и тем не менее авторы полагают, что именно такой способ кодирования используется в этой системе.
При оценке количества передаваемой информации не следует забывать о вариабельности “^клеточныхуразрядов во времени. Даже разряды от мышечных рецепторов при фиксированном положении мышцы нестабильны во времени 132, 36, 49]. Вариабельность разрядов во времени, если ее рассматривать как случайное явление, сопутствующее передаче сигналов, ограничивает количество* информации, которую нервная система может передать и оценить. Стейном [69] предложено уравнение, показывающее связь между количеством передаваемой информации и статистическими характеристиками импульсной активности,!
dp-
7~10g У 2Kl bv'p, ’
?0
где о-о и — минимальныйУи максимальный’межимпульсный интервал, t — время'стимуляции, «"'и а — среднее значение и стандартное отклонение для межимпульсных интервалов.
v Время, за'которое может быть’ оценено количество информации по этой формуле, определяется минимальным’количеством межимпульсных интервалов, по которым может быть получено значение среднего и дисперсии с заданной точностью. Следовательно, при низкой частоте следования импульсов это время может составить несколько секунд, а при высокой — быть значительно короче. Количество информации, передаваемое от медленно адаптирующихся мышечных рецепторов, вычисленное по этой’формуле, было равно 2.7 бита. С другой стороны, количество информации тесно связано с числом дискриминируемых категорий передаваемых сообщений. Эта связь выражается простым соотношением
/ = log Д/,
где М — максимальное число дискриминируемых категорий внешнего сигнала.
Объединяя обе формулы, получим
___ Рч
Ро
Число дискриминируемых уровней сигнала, передаваемых медленно адаптирующимися кожными рецепторами, будет приблизительно равно 6—7 [68]. Эта величина согласуется с психофизическими измерениями, которые показали, что только около семи градаций в предъявляемых стимулах различаются'человеком [52]. Это совпадение количества категорий, кодируемых периферическими рецепторами и оцениваемых высшими центрами, позволило Маунткаслу ]541 выдвинуть для нервной системы
принцип «линейного оператора», согласно которому коды периферических рецепторов в значительной мере сохраняются вплоть до нейронов коры. При этом, конечно, не обязательно, чтобы зависимость «вход—выход» для каждого передающего звена была одинаковой; нужно лишь, чтобы общая передаточная функция всего тракта достаточно хорошо воспроизводила коды рецепторных образований.
Таким образом, применение теории информации к оценке сообщений, передаваемых в нервной системе, позволяет выдвинуть интересные предположения о возможных механизмах ее преобразования на различных уровнях. Однако об использовании того или иного вида кодирования отдельными звеньями, по-видимому, лучше судить, основываясь на функциональной роли этого звена в естественной деятельности всего организма. В связи с этим ниже будет рассмотрен ряд конкретных путей передачи сенсорной информации в нервной системе теплокровных. Будут последовательно рассмотрены принципы кодирования сообщений на уровне рецепторных образований, передача и преобразование этих кодов первыми центральными нейронами.
12.4. ПЕРИФЕРИЧЕСКОЕ КОДИРОВАНИЕ СООБЩЕНИЙ В НЕКОТОРЫХ СЕНСОРНЫХ СИСТЕМАХ
12.4.1. КОДИРОВАНИЕ СИГНАЛОВ МЫШЕЧНЫМИ И СУХОЖИЛЬНЫМИ РЕЦЕПТОРАМИ
При исследовании рецепторов растяжения скелетной мышцы лягушки Эдриан и Цоттерман [27] впервые показали, что с увеличением растяжения мышцы в одиночном афферентном волокне увеличивается не амплитуда разрядов, а их частота, т. е. что при передаче сообщений в нервной системе значение имеет не форма потенциалов действия, а период их следования. Как было установлено позже (см. [8]), в мышцах существуют три типа рецепторов растяжения: первичные окончания и вторичные окончания мышечных веретен и сухожильные органы. Импульса-ция от первичных окончаний была описана Метьюзом [48]. Им было показано, что в афферентных волокнах, идущих от веретен, регистрируется залп импульсов в ответ на растяжение мышцы, частота которого зависит от скорости растяжения. Если мышцу оставляли растянутой, частота импульсов постепенно снижалась и через 10—30 с достигала стационарной величины. Катц [411 назвал начальную часть реакции, зависящую от скорости растяжения, «динамической» фазой, а последующую со стабильной частотой —- «статической». Им также было показано, что после прекращения растяжения наступает пауза в разрядах. Такой тип разряда характерен для наиболее толстых сенсорных волокон, берущих начало от анулоспиральных, или первичных окончаний, окружающих ядерную сумку (см. рис. 12.2). Афферентные во-
локна вторичных окончаний, которые обвиваются вокруг дистального участка экваториальной области веретена (область миотрубки), впервые удалось идентифицировать Мертону [51 ]. Особенностью разряда от вторичных окончаний является то, что у него сравнительно слабо выражена динамическая фаза. Отсутствует также пауза после освобождения мышцы от нагрузки. Таким образом, если первичные окончания сигнализируют как
Веретено
Первичное окончание
Вторичное окончание
ОсбоВождение
Стимул
Линейное расточение
Синусоидальное
Удар растяжение
llllllllllllll
IIIIIIIIIIIII
Рис. 12.2. Схема кодирования рецепторами веретен механических смещений различной формы [9].
о длине мышцы, так и об ее изменениях, то вторичные передают сообщения лишь о длине.
Метьюзом было показано, что устанавливающиеся во время растяжения стационарные разряды характеризуются высокой регулярностью и их частота изменяется пропорционально логарифму изменения растягивающего груза [48]. Соотношение же между изменением длины веретена и частотой разрядов является линейным [56]. Следовательно, логарифмический характер преобразования обусловлен скорее всего механическими свойствами мышцы, а рецепторные преобразователи в определенном диапазоне работают линейно. На рис. 12.3 показана зависимость между частотой разрядов и степенью растяжения мышцы. Как видно для данной скорости растяжения, динамическая фаза разрядов рецептора линейно зависит от величины натяжения. Разряд в статическую фазу
имеет ту же характеристику, но в противоположность динамической не зависит от скорости растяжения.
[fe Подробный статистический анализ импульсной активности в первичных и вторичных афферентных волокнах от мышечных рецепторов у кошки^был проведен Метьюзом и Стейном [49]. Этими авторами было показано, что регулярность разрядов существенно зависит от наличия активности в иннервирующих интра-фузальные мышечные волокна гамма-эфферентах. При наличии такой гамма-эфферентной иннервации разряды как в первичных, так и во вторичных волокнах становятся менее регулярными.
Амплитуда растяженияt мкм
Рис. 12.3. Соотношение между частотой разрядов веретен и величиной растяжения мышцы. Величины для динамических разрядов получены при линейном растяжении со скоростью 2.6 мм/с, для статических — спустя 200 мс после фиксации мышцы в определенном положении [56].
Повышение вариабельности разрядов приводит к тому, что с помощью среднечастотного импульсного кода первичные афферентные волокна могут передать лишь 2,7 бита информации в 1 с, а вторичные — 4.7 бита, в то же время при отключенной гамма-активации первичные афференты могут передавать 4.8 бита в 1 с, а вторичные — 6.3 бита. Таким образом, гамма-активация, повышая вариабельность в разрядах рецепторных образований, приводит к ограничению передаваемой ими информации, а следовательно, и числа дискриминируемых состояний мышцы.
Сухожильные органы являются, по данным Метьюза (см. [91), датчиками напряжения мышцы. Они чувствительны как к постоян
ному напряжению мышцы, так и к скорости увеличения напряжения, т. е. обладают статической и динамической фазами. Чувствительность к скорости позволяет сухожильным органам оптимально реагировать на быстрые растяжения.
Таким образом, основная информация о состоянии мышц и сухожилий передается от рецепторных образований к нейронам следующего порядка с помощью среднечастотного кода.
12.4.2. КОДИРОВАНИЕ СИГНАЛОВ КОЖНЫМИ РЕЦЕПТОРАМИ
Подробное описание всех видов кожных рецепторов приведено в соответствующем томе руководства [12]. Более подробно среди них изучена активность рецепторов прикосновения, давления и рецепторов волос. Импульсные разряды от механорецепторов можно разделить на фазные, тонические и смешан
ные. Однако такое деление не является абсолютным — один и тот же рецептор при различных видах раздражения может реагировать и как фазный, и как тонический, хотя динамическая фаза деформации для кожных рецепторов более значима.
Среди общего числа тактильных рецепторов преобладают рецепторы фазного типа. Например, у обезьян они составляли 55 из 70 исследованных [35]. Число потенциалов действия, генерируемых фазным рецептором, зависит от скорости нарастания стимула в определенном диапазоне скоростей (1—40 мм/с). Этим рецепторам присуща высокая скорость адаптации. Так, среди рецепторов фазного типа, расположенных на подушечке лапы кошки, встречаются такие, в которых даже на сверхпороговое раздражение возникает только один импульс [45). В этом случае информация об интенсивности может быть передана только путем активации большого количества волокон, т. е. с помощью пространственного кодирования.
Однако другие типы рецепторов, в частности рецепторы Пинкуса—Игго, исследованные Вернером и МаунткасломЧ [73], создают в афферентных волокнах поддерживающиеся разряды при постоянной стимуляции, во всяком случае в течение’небольших периодов времени. При этом число импульсов за определенный временной интервал (например, 50 или 100 мс) находится в следующем отношении к интенсивности стимула:
X = k-Sn,
где Н — среднее число разрядов, к — коэффициент пропорциональности, S — интенсивность стимула, п — показатель степени.
Эта зависимость несколько отличается от логарифмической, описанной^выше для мышечных рецепторов. Более подробно с этими различиями можно познакомиться в [23].
Кожные рецепторы функционируют не изолированно друг от друга, а объединяются в рецептивные поля, в пределах которых отдельные’рецепторы могут иннервироваться веточками’одного и того жеУафферентного волокна. Рецептивные поля существенно перекрываются, что увеличивает количество каналов, по которым информация о стимуле может поступать в центральную нервную систему.
Вместе с тем известно, что одновременное раздражение одного рецептивного поля в двух точках никогда не'вызывает двух раздельно воспринимаемых ощущений. Для- этого необходимо раздражать рецепторы в двух соседних полях. Электрофизио-логически’ показано, * что раздражение тактильных рецепторов кожи может” тормозить" активность окружающих. Вероятно, одним из механизмов, создающих натрецепторном уровне такое латеральное ' торможение, 'является ^антидромное ’распространение импульсов по веточкам одного афферентного водоцна от моста их слияния 137],
Следует обратить внимание на то, что пороги чувствительности тактильных рецепторов непрерывно изменяются во времени. Так, величина порогового стимула для тактильного рецептора подушечки лапы кошки варьировала при последовательных испытаниях на 3—22% [29]. Это приводит к тому, что при повторных идентичных раздражениях разряды в отдельном афферентном волокне существенно различаются по своей временной структуре, особенно при слабых раздражениях [11, 53]. Это обстоятельство, в частности, говорит о том, что использование в отдельных каналах системы кожной чувствительности интервального кодирования маловероятно. Также мала вероятность использования в быстро-адаптирующихся рецепторах среднечастотного кода. У таких рецепторов (рецепторы волос) информация может передаваться только числом импульсов в отдельном канале и числом параллельно работающих каналов. Лишь в медленноадаптирующихся рецепторах может использоваться среднечастотное кодирование.
12.4.3. ПЕРИФЕРИЧЕСКОЕ КОДИРОВАНИЕ В ЗРИТЕЛЬНОЙ СИСТЕМЕ
Так как механизмам фоторецепции посвящены соответствующие тома руководства, в настоящем разделе будут освещены'лишь общие и отличительные черты кодирования внешних сигналов в сетчатке.
Фоторецепторы (колбочки и палочки) представляют собой первые нейроны зрительной системы.'Кроме того, в сетчатке находятся еще два последующих нейрона зрительного пути — биполярные и ганглиозные клетки. Эти^основные виды клеток, образующих три слоя, дополняют еще две группы с латеральными связями (горизонтальные и амакриновые клетки). Взаимосвязи между всеми этими клетками показаны на рис. 12.4. Известно, что освещение рецепторной клетки вызывает гиперполяризацию ее мембраны. Существует S-образная зависимость между логарифмами интенсивности света и изменением потенциала в рецепторной клетке [71]. Горизонтальные клетки также отвечают гиперполяризацией на световое раздражение. Одна половина биполярных клеток отвечает на включение света гиперполяризацией, другая половина — деполяризацией. Только на уровне амакриновых и ганглиозных клеток наблюдается импульсная активность. Остальные нейроны сетчатки имеют очень короткие отростки, так что передача сигналов между слоями может осуществляться электротонически [5, 59]. Ганглиозные клетки являются выходными клетками сетчатки, аксоны которых направляются в зрительный нерв. Исследования импульсной активности ганглиозных клеток показали, что по характеру реакций на световое раздражение их можно разделить на два типа — тонические и фазные. Тонические нейроны генерируют импульсы в течение всего времени действия света. Фазвде (цейроцод этого тица больше) отведает
только в момент его включения или выключения. Предполагается, что возбуждение на них передается через амакриновые клетки, так как у амакриновых клеток также наблюдается реакция фазного типа.
Особое значение в передаче сигналов от зрительных рецепторов имеют размеры рецептивных полей. Рецептивные поля разных уровней обладают разной степенью сложности. Диаметр рецептивного поля центрально расположенной биполярной клетки составляет приблизительно 100—200 мкм. Это соответствует разветвлениям ее дендритного дерева и свидетельствует о конвергенции большого числа рецепторов к одному бццоляру, что обе-
спечивает пространственную суммацию. На уровне биполярных нейронов существует эффективный механизм латерального торможения, который обусловлен деятельностью горизонтальных клеток. Большое значение механизма латерального торможения в зрительной рецепции особенно четко было продемонстрировано при исследовании зрительного аппарата мечехвоста (Limulus), У этого животного глаз состоит из многих отдельных светочувствительных элементов (омматидиев), каждый из которых посылает свое нервное волокно в головной ганглий. Хартлайн, Вагнер, и Ратлифф [21 ] продемонстрировали наличие тормозного взаимодействия между омматидиями. Такое торможение осуществляется боковыми ветвями волокон зрительного нерва, и его глубина пропорциональна частоте разрядов в соседних нервных волокнах. Наличие латерального торможения позволяет резко увеличить контрастность контуров воспринимаемого изображения, что существенно улучшает остроту восприятия.
Наличие латерального торможения на уровне сетчатки у высших животных позволяет выполнять на этом уровне и более сложные операции переработки зрительной информации, в частности при восприятии движущихся предметов (см. [71]).
Зрительной системе, так же как и другим сенсорным системам, присуще явление адаптации. Однако в этой системе процесс адаптации обеспечивается целым комплексом механизмов, действующих на разных уровнях.
Таким образом, в зрительной системе уже на уровне сетчатки может происходить такой анализ информации, получаемой от фоторецепторов, который позволяет выделить наиболее существенные элементы световых раздражений и передать сообщения о них в центральную нервную систему.
12.4.4. ПЕРИФЕРИЧЕСКОЕ КОДИРОВАНИЕ СИГНАЛОВ В СЛУХОВОЙ СИСТЕМЕ
Импульсную активность в слуховой системе можно регистрировать только в волокнах слухового нерва. Волокна этого нерва являются аксонами биполярных клеток, тела которых расположены в спиральном ганглии. Непосредственными преобразователями механических перемещений, вызванных звуковым давлением, в электрические сигналы являются волосковые клетки кортиева органа. Сами волосковые клетки не обладают электрической возбудимостью, а оказывают какое-то (вероятно, химическое) действие на дендриты биполярных клеток, где и генерируется импульсный разряд.
Ясно, что характер разряда, передаваемого по волокнам слухового нерва, должен передавать по крайней мере два параметра раздражения: интенсивность и частоту звука. Регистрация активности в отдельных волокнах, как и следовало ожидать, показала, что частота разрядов возрастает при усддеции интенсивности 526
звука. Зависимость частоты импульсов от интенсивности звука (в децибелах) выражается S-образной кривой [131. Однако кодирование интенсивности в рецепторном звене слуховой системы осложняется влиянием частоты звука на частоту разрядов клеток. Если частота звука ниже 2 кГц, то во многих афферентных волокнах наблюдается по одному или нескольку импульсов, синхронизованных с определенной фазой звуковой волны. В связи с этим высказывалось предположение, что частота импульсов в нервном волокне соответствует частоте воспринимаемого звука [10]. Поскольку одиночное волокно не может передавать импульсы с частотой выше 1000 в 1 с, то предполагалось, что сигналы о более высоких частотах передаются по нескольким волокнам, работающим совместно. Однако это предположение не получило экспериментального подтверждения для всего частотного диапазона.
Широко распространенным является основанное на резонансной теории Гельмгольца представление о том, что улитка является механическим частотным анализатором и волокна, иннервирующие рецепторы разных участков базилярной мембраны, передают сигналы о различных частотных составляющих звукового раздражителя [17]. Таким образом, интенсивность раздражителя кодируется средней частотой импульсов, а его частота — по принципу «меченой линии». Эта простая схема кодирования, однако, потребовала существенных уточнений, так как исследования Бекеши [30] показали, что резкой частотной настройки участков базилирной мембраны не существует. Было показано, что в волокнах слухового нерва регистрируются ответы на довольно широкий диапазон частот; существует, правда, определенная частота, на которую волокно отвечает при минимальной интенсивности сигнала, но чем больше интенсивность звука, тем шире частотный диапазон ответов для данного волокна [13]. Для объяснения возможности передачи сигналов о частоте звуковых раздражений был привлечен механизм «латерального торможения», уже упоминавшийся ранее. Тормозное взаимодействие между волокнами слухового нерва наблюдали многие исследователи [13]. Еще более выраженным этот механизм является в последующих звеньях слуховой системы.
Несмотря на обилие экспериментальных исследований в области кодирования информации в слуховой системе, вопрос этот явно еще далек от своего разрешения. Сейчас можно сделать лишь заключение о том, что система оперирует не одним видом кода, а их комплексной группой [1].
Таким образом, рассмотрение принципов кодирования информации в периферических отделах различных сенсорных систем не позволяет выделить какие-то общие принципы. Лишь в отдельных более простых системах (мышечная рецепция, некоторые механорецепторы кожи) используются сравнительно простые законы преобразования внешнего стимула в импульсный разряд. Зрительная и слуховая системы в процессе филогенетического
развития настолько усложнились, что элементы частотного кодирования существенно дополнились другими видами кодирования. Важную роль в передаче сигналов в этих системах начало играть латеральное торможение, улучшающее выделение полезной для организма информации.
12.5. ПЕРЕДАЧА И ПРЕОБРАЗОВАНИЕ СИГНАЛОВ ЦЕНТРАЛЬНЫМИ НЕЙРОНАМИ
Дальнейшие преобразования информации, поступающей от рецепторов, изучены пока крайне недостаточно. Поэтому в настоящем разделе мы остановимся лишь на отдельных примерах передачи информации через центральные нейроны, в частности нейронами спинного мозга. Эти более простые примеры могут помочь представить себе хотя бы в общих чертах те преобразования, которые происходят на уровне центральных нейронов.
В упрощенном виде схема передачи афферентной информации в спинном мозге представлена на рис. 12.5, А. Даже такая упрощенная схема показывает, что изучение принципов передачи сообщений при наличии большого числа обратных связей весьма затруднительно. Поэтому в экспериментах, как правило, большую часть обратных связей устраняют (используют перерезки и наркоз), что позволяет перейти от схемы рис. 12.5, А к значительно более простой схеме, представленной на рис. 12.5, Б. Рассмотрим на основании этой схемы существующие данные о передаче проприоцептивных сигналов в дорсальном спинно-мозжечковом тракте (ДСМТ).
В ДСМТ Лундбергом и Оскарссоном были выделены пять классов первых центральных нейронов [46]. Первые два передают проприоцептивную информацию и составляют приблизительно 53% от общего числа клеток. Третий и четвертый передают экс-тероцептивную информацию, в них входит около 19% нейронов. Пятый, передающий смешанную информацию, составляет всего 8% нейронов. На основании этих данных можно сделать заключение о том, что, несмотря на широкую конвергенцию афферентных волокон на центральных нейронах, в рассматриваемой афферентной системе соблюдается принцип «меченой линии». Этот принцип в определенной мере соблюдается и внутри подгрупп. Так, первый класс нейронов активируется афферентными волокнами группы I и II от рецепторов веретен, но не активируется волокнами 1Ь, идущими от сухожильных рецепторов. Третий класс активируется волокнами рецепторов давления подушечки лапы, но не волокнами рецепторов волос и т. д.
Однако принцип «меченой линии» в основном относится к выделению качественных, а не количественных признаков. Хорошо известно, что на каждом центральном нейроне конвергирует довольно большое число афферентных волокон. Так, средняя величина рецептивного поля одного афферентного волокна, реагирую* 528
щего на легкое прикосновение к коже, равняется 5x4 мм. Нейроны же второго порядка имеют рецептивное поле’средней величины 63x32 мм [24].
Экспериментальные исследования, проведенные на нейронах первого класса, позволили установить, что на одном нейроне конвергирует приблизительно 10—15 волокон группы 1а. Какие же
Рис. 12.5. Упрощенная схема основных связей в системе проприоцептивного контроля без экспериментальных ограничений (А) н у спинального животного с перерезанными вентральными корешками (Б).
преобразования могут осуществлять нейроны второго порядка с поступающими сигналами? Таких преобразований, по-видимому, может быть несколько. Прежде всего они могут улучшать соотношение си-гнал/шум. Эту ситуацию легко себе представить, если допустить, что полезные сигналы (вызванные внешним стимулом), приходящие по многим афферентным входам, коррелируют, в то время как случайные (спонтанная активность рецепторов) независимы. Далее эти нейроны могут извлекать особо важные характеристики сигнала, т. е. устранять избыточность в информации, поступающей от рецепторов. Такое выделение могло бы осуществляться за счет адаптации или изменения возбудимости нейрона цепями обратных связей. Наконец, центральные нейроны могут изменять принципы кодирования информации, которые использовались в периферическом отделе афферентной системы.
34 Общая физиология аерввой системы 520
Общепринятой характеристикой, достаточно хорошо описывающей поведение отдельного звена сложной системы, является передаточная функция. Однако при определении передаточных функций нейронов высших порядков осложняющим обстоятельством является наличие у них фоновой активности. Фоновая активность нейронов регистрируется при отсутствии контроля руемых внешних воздействий и характерна для всех сенсорных систем. Относительно механизма образования фоновых разрядов у нейронов различных систем в настоящее время нет единого мнения. У нейронов ДСМТ первого класса она, вероятно, определяется постоянным афферентным притоком импульсов по многим входам [20]. Информационное значение этой активности в настоящее время неясно.
Впервые передаточные функции отдельных нейронов ДСМТ были измерены Лапортом, Лундбергом и Оскарссоном [43] при регистрации реакции этих нейронов на электрическое раздражение соответствующих афферентных волокон. Затем измерения были повторены с помощью частотномодулированных по синусоидальному закону импульсных последовательностей, использованных для электрического раздражения соответствующих афферентных нервов и последующего сопоставления демодулированных кривых «вход -выход» [19]. В результате этих исследований было показано, что нейроны первого класса, передающие сигналы от рецепторов мышечных веретен, обладают линейной передаточной функцией.
У нейронов, передающих сигналы от кожных рецепторов, она имеет сложную нелинейность. Однако основным недостатком электрической стимуляции является одновременное раздражение многих входов, что может значительно облегчать возбуждение нейрона и тем самым упрощать его передаточную функцию. В связи с этим Янсеном с сотр. [38] были проделаны эксперименты, в которых активация нейронов ДСМТ осуществлялась путем механического растяжения соответствующей мышцы задней конечности. Была получена передаточная функция, связывающая среднюю частоту импульсной активности нейронов ДСМТ и величину растяжения мышцы. Эта функция оказалась линейной и хорошо описывалась уравнением типа
F = а 4- Ъх,
где F — частота разрядов нейрона в имп/с, х — величина растяжения мышцы в мм, а и b — коэффициенты.
Учитывая, что между величиной удлинения мышцы и средней частотой разрядов в афферентных волокнах существует линейная зависимость (см. выше), можно полагать, что передаточная функция нейронов второго порядка при адекватной стимуляции также линейна. Аналогичная работа была проведена при растяжении мышцы по синусоидальному закону [39]. В целом были получены 530
сходные результаты. Позднее было предпринято еще более подробнее статистическое исследование передачи проприоцептивной информации нейронами ДСМТ [72], которые привели к выводу о том, что нейроны второго порядка могут оценивать состояние мышцы по средней частоте поступающих импульсов.
После того как к нейрону поступает п межимпульсных интервалов каждый длительностью t{, оценка средней частоты может быть представлена как
п
/и стремится к средней частоте, когда п стремится к бесконечности. Хорошее приближение /„ к среднему значению получается при п, близком к 150. При этом /„ гораздо быстрее сходится к среднему, если межимпульсные интервалы берутся в том порядке, в котором они регистрируются в реальной последовательности, и значительно медленнее, если порядок следования интервалов искусственно изменить. Это значит, что нейроном второго порядка может быть передана достаточно хорошая оценка состояния мышцы при использовании среднечастотного кода с помощью 150 импульсов. Однако в «слишком» хорошей сходимости /я к среднему, по-видимому, нет необходимости. Обозначим минимальное число интервалов, необходимое для получения оценки средней частоты с заданной точностью, как В таком случае минимальное время, за которое можно получить оценку средней частоты,
АГ min
>=1
Анализ показал, что величина jVmin зависит от уровня растяжения мышцы. При слабом растяжении мышцы и соответственно больших межимпульсных интервалах на выходе нейрона Лгш]п обычно мало, и наоборот. Благодаря такой зависимости время, необходимое для оценки с определенной точностью средней частоты, не зависит от степени растяжения мышцы. Этот вывод не распространяется на очень низкие частоты, когда разряды в основном обусловлены фоновой активностью нейрона. Среднее время для оценки частоты на выходе нейрона, полученное по экспериментальным данным, составляет 250 мс. Таким образом, нейрон ДСМТ в состоянии передавать информацию от мышечных рецепторов с помощью среднечастотного кода за довольно короткое время, и с помощью такого кода могут быть переданы даже относительно быстрые изменения состояния мышцы.
Можно попытаться сделать ориентировочную оценку количества информации, которая может быть передана нейроном ДСМТ. Ралоэ [72] подсчитал, что зц 200 мс кдждоо афферентное волокно
группы la может передать около 4,6 бит информации,* Если допустить, что около 15 афферентных волокон конвергируют на один нейрон второго порядка и все они работают как независимые каналы, то информация, получаемая нейроном, составит около 70 бит. Но поскольку все эти 15 волокон передают информацию о мышечной длине и разряды в них независимы, то можно считать, что нейрон второго порядка получает импульсную последовательность просто в 15 раз более длительную, чем от одного волокна. В такой одной длинной записи не содержится вовсе 70 бит информации, а всего лишь, по расчетам Валоэ, около 6.6 бит. С другой стороны, если рассчитать по формуле Стейна (см. выше) количество информации, передаваемое нейроном ДСМТ за 200 мс, то она оказывается равной 3 битам. Следовательно, потеря информации в этом звене может составить 3.6 бита, т. е. половину. Однако в действительности потери, вероятно, гораздо меньше. Во-первых, каждое афферентное волокно передает информацию к определенному числу нейронов второго порядка (степень такой дивергенции неизвестна). Во-вторых, величины, принятые при расчетах, весьма условны.
Несколько иначе обстоит дело с третьим и четвертым классами нейронов, передающими экстероцептивную информацию. Как правило, быстроадаптирующиеся нейроны второго порядка этого класса генерируют более длинную серию разрядов, чем отдельный рецептор. Механизм образования групповых разрядов в этих нейронах подробно рассмотрен Уоллом [24] и заключается не в особых свойствах самих нейронов, а в особенностях организации их синаптических входов. Изменение интенсивности раздражения от порогового к максимальному не сопровождается изменением величины латентного периода первого импульса, и имеются лишь незначительные изменения частоты следования импульсов в серии. Таким образом, интенсивность тактильного раздражения, передаваемая быстроадаптирующимися рецепторами по параллельным каналам, на уровне нейронов второго порядка преобразуется в число импульсов в отдельных каналах, что указывает на принципиальную возможность изменения вида кодирования при передаче через релейные нейроны.
В то же время нейроны второго порядка, активируемые от мед-ленноадаптирующихся кожных механорецепторов, отвечают на адекватное раздражение регулярными разрядами, и в этом случае информация может передаваться с помощью среднечастотного кода [471. Таким образом, даже в одной системе нейронов, передающих экстероцептивную информацию по одному спинальному тракту, могут использоваться различные принципы кодирования и передачи сенсорной информации.
• Эта оценка по сравнению с оценками других авторов (см., например 176]) несколько завышена,
Если кратко рассмотреть другой путь передачи информации от ножных и мышечных рецепторов — так называемый лемнисковый тракт, образованный нейронами нежного и клиновидного ядер, то и здесь ответы нейронов на адекватную стимуляцию быстро-адаптирующихся рецепторов волос представлены групповыми разрядами.
В то же время нейроны, которые активируются при движении суставов или от медленноадаптирующихся кожных рецепторов, дают не пачки, а потоки импульсов. Вероятно, и в этом случае используются различные принципы кодирования информации.
О том, что различные принципы кодирования сигналов используются на уровне вторых нейронов в зрительной и слуховой системах, уже говорилось выше.
Работами ряда авторов показано наличие нисходящих влияний на передаточные характеристики релейных нейронов. Это показано для нейронов ДСМТ первого класса и релейных нейронов кожной чувствительности. Эти влияния могут осуществляться с помощью механизмов как пресинаптического, так и постсинаптического торможения [16}. Нисходящие влияния участвуют непосредственно в процессе кодирования, действуя в ряде случаев на рецепторные образования, а затем и в процессе передачи и преобразования кодов на уровне следующих релейных нейронов. Однако характер этого участия в большинстве случаев остается малоизученным.
Заключая главу, следует, по-видимому, сказать, что проблема кодирования и передачи сообщений в нервной системе, являясь весьма важной и интересной, требует еще дальнейшей разработки.
ЛИТЕРАТУРА
1. Альтман Я. А. Слуховая система. — В кн.: Физиология сенсорных систем. Под ред. А. С. Батуева. Л., 1976, с. 159—198.
2. Верне В. Неопределенность в нервной системе. М., 1969.
3. Бриллюэн Л. Наука и теория информации. М., 1960, с. 392.
4. Буллок Т. X. Язык нервных клеток. В кн.: Системная организация физиологических функций. М., 1969, с, 11—17.
5. Бызов А. Л. Электрофизиологические исследования сетчатки. М., 1966, с. 195.
6. Введенский Н. Е. Отрывистая тетанизация. — Поли. собр. соч., 4. Л., 1953, с. 270—271.
7. Глезер В. Д. Зрительная система. — В кн.: Физиология сенсорных систем. Под ред. А. С. Батуева. Л., 1976, с. 108—158.
8. Голдман С. Теория информации. М., 1957, с. 446.
9. Гранит Р. Основы регуляции движений. М., 1973, с. 367.
10. Девис Г. Периферическое кодирование слуховой информации. — В кн.: Теория связи в сенсорных системах. М., 1964, с.’232—250.
ИДЕсаков А. И., Дмитриева Т. М. Нейрофизиологические основы тактильного восприятия. М., 1971. 130 'с.
V2.* Ильинский О. Б. Физиология сенсорных систем, ч. III. Физиология -’механорецепторов. Л., 1975. 559 с.
Кацуки Я, Нервные’механизмы слуховых ощущений у кошки. В кн.: Теория связи ц сенсорных системах. М., 1964, с, 288—306,
14. Кеййель В. Д. Физиология органов чувств. М., 1975. 215 с.
15. Костю к П. Г. Некоторые общие вопросы нейронной интеграции. — В кн.: Механизмы объединения нейронов в нервном центре. Л., 1974, 'с. 6-12.
16. Костюк П. Г. Структура и функция нисходящих систем спинного мозга. Л., 1973, с. 279.
17. Милнер И. Физиологическая психология. М., 1973. с. 647:
18. Прибрам, К. Языки мозга. М., 1975, с. 464.
19. Пятигорский Б. Я. Частотный метод исследования передачи информации через синаптические соединения мозга. — В кн.: Исследования по бионике. Республиканский межведомственный сборник. Киев, 1965, с. 94— 103.
20. Пятигорский Б. Я. Фоновая активность нейронов дорсального спинно-мозжечкового тракта. — Нейрофизиология, 1970, 2, № 1, с. 26—34.
21. Ратлифф Ф, Тормозное взаимодействие в элементах сетчатки. — В кн.: Теория связи в сенсорных системах. М., 1964, с. 338—354.
22. Септаготаи Я., Арбиб М. Концептуальные модели нервной системы. М., 1976. 198 с.
23. Сомьен Дж. Кодирование сенсорной информации. М., 1975, с. 415.
24. Уолл П. Две системы передачи кожных ощущений. — В кн.: Теория связи в сенсорных системах. М., 1964, с. 166—184.
25. Физиология сепсорных систем. Под ред. А. G. Бутаева. Л., 1976, с. 400.
26. Чораян О. Г. Информационные процессы в нервной системе. Ростов н/Д. 1976, с. 106.
27. Adrian Е. D., Zotterman G. The impulses produced by sensory nerve-endings. Pt. 2. The response of single end organ. — J. Physiol. (London), 1926, 61, p. 151-171.
28. Amassian V. E., Macy I., Waller H. I., Leader H. S., Swift M. Transformation of afferent activity at the cuneate nucleus. — In: Information Processing in the Nervous System. Proc. ХХП Internal. Congress, Leiden, 1962. Eds R. W. Gerard, I. W. Duyff. Amsterdam, 1964, p. 235—254.
29. Armet С. I,, Gray I. A. B., Hansperger R. IP., Lal S. The transmission of information in primary receptor neurones and second order neurones of phasic system. — J. PhysioL (London), 1962, 164, p. 395—421.
30. BekeSy von G., Rosenblith N. A. The mechanical properties of the ear. In: Handbook of experimental psychology. Ed. S. S. Stevens. New York, 1951, p. 1075—1115.
31. Bittner G. D. Differentiation of nerve terminals in the crayfish opener muscle and its functional significance. — J. Gen. Physiol., 1968, 51, p. 731—758.
32. Buller A. I., Nicholls S. G., Strom G- Spontaneous fluctuations of excitability in the muscle spindle of the frog. — J. Physiol. (London), 1953, 122, p. 409—418.
33, Bullock T. H., Hagiwara S., Kusano K., Negishi K. Evidence for a category of electroreceptors in the lateral line of gymnotid fishes. — Science, 1961, 134, p. 1426—1427.
34. Bullock T. H. Mechanisms of integration. — In: Structure and Function in the Nervous systems of invertabrates. 1. Eds T. H. Bullock and G. A. Hor-ridge. San Francisco—London, 1965, p. 257—351.
35. Gray I. A. В. Biological receptor mechanisms. — Sympos. Soc. Exp. Biol., 1962, 16, p. 345—354.
36. Hagiwara S. Analysis of interval fluctuation of the sensory nerve impulse. — Jap. J. Physiol., 1954, 4, p. 234—240.
37. Hunt С. C., McIntyre A. K. Properties of cutaneous touch receptors in cat. — J. Physiol., (London), I960, 153, p. 88—98.
38. Jansen I. K. S., Nicolaysen K., Rudjord T. Discharge pattern of neurons of the dorsal spinocerebellar tract activated by static extention of primary endings of ipuscle spindles. — J. Neurophysiol., 1966, 29, p. 1061—1086,
Ж
39. Jnsen /. К. S,t Poppele R. E., Terznolo G. A. Transmission of proprioceptive information via the dorsal spinocerebellar tract. — Brain Res., 1967, 6, p. 382—384.
40. Katayama I., Murata K. Role of microstructure of nerve impulse train in relation to transmission of neuronal activity and coding mechanism of neural information. - Kybernetik, 1974, 16, p. 119—126.
41. Katz B. Action potentials from a sensory nerve endings. — J. Physiol. (London), 1950, 111, p. 248—260.
42. Kuno M., Mijahara J. Г. Analysis of synaptic efficacy in spinal motoneurones from «quantum» aspects. — J. Physiol. (London), 1969, 201, p. 479— 492.
43. Laporte V., Lundberg A., Oscarsson 0. Functional organization of the dorsal spinocerebellar tract in the cat. II. Single fibre recording in Flechsig's fasciculus on electrical stimulation of various peripheral nerves. — Acta physiol, scand. 1956, 36, p. 188—203.
44. Levitan, H., Segundo J. P., Moore G. P. Statistical analysis of membrane potential fluctuation. — Biophys. J., 1968, 8, p. 1256—1274.
45. Lindblaom V. Properties of touch receptors in distal glabrous skin of the monkey. — j. Neurophysiol., 1965, 28, p. 966—985.
46. Lundberg A., Oscarsson O. Functional organization of the dorsal spinocerebellar tract in the cat. VII. Identification of units by activation from cerebellar cortex with recognition of five functional subdivisions. — Acta physiol, scand., 1960, 50, p. 356—374.
47- Mann M. D. Axons of the dorsal spinocerebellar tract which respond to activity in cutaneous receptors, — J. Neurophysiol., 1971, 34, p. 1035— 1050.
48. Matthews В. H. C. The response of a single end organ. J. Physiol. (London), 1931, 71, p. 64-110.
49. Mathews P. В. C., Stein R. B. The regularity of primary and secondary muscle spindle afferent discharges. — J. Physiol. (London), 1969, 202. p. 59—82.
50. MacKay D. M. Visual noise as a tool of research. — J. Gen. Physiol., 1965, 72, p. 181—197.
51. Merton P. A. Slowly conducting muscle spindle afferents. — Acta physiol, scand., 1953 , 29, p. 87—88.
52. Miller G. A. The magical number seven, plus or minus two. Some limits on our capacity for processing information, — Psychol. Rev., 1956, 63, p. 81—97.
53. Moore G., Segundo S. P., Perkel D. H., Levitan H. Statistical signs of synaptic interaction in neurons. — Biophys. J., 1970, 10, p. 876—900.
54. Mountcastle V, B. The problem of sensing and the neural coding of sensory events. — In: The Neurosciences. A study program. Eds G. C. Quarton, T. Melnechuc and F. 0. Schmitt. New York, 1967, p. 393—408.
55. Ogawa H., Yamashita S., Sato M. Variation in gustatory nerve fibre discharge pattern with change in stimulas concentration and quality. — J. Ncurophysiol., 1974, 37, p. 443—457.
56. Ottoson D., Shepherd G. M. Transducer properties and integrative mechanisms in the frog's muscle spindle. — In: Handbook of sensory physiology. 1. Principles of receptor physiology. Berlin—Heidelberg—New York, 1971, p. 443—499.
57. Partridge L. D., Kim I. H. Some dynamic aspect of motor responses to vestibular signals. Thesis University of Tennessee. Memphis, Tennessee, 1968.
58. Perkel D. H. Application of a digital computer simulation of a neural network. — In: Biophysics and Cybernetics system. Ed. M. Maxfield, A. Cellahan. Washington, 1965, p. 37—51.
59. Perkel D. H. Spike trains as carriers of information. — In: The Neurosciences Second study program. Ed. F. O. Schmitt. New York, 1970, p. 587— 596.
60. Perkel D. H., Bullock T. H. Neural coding. — Neurosci. Res. Progr., 1968, Bull. 6, p. 405-527.
61. Perkel D. H,, Gerstein L., Smith M. S., Tatton W. G. Nerve-impulse patterns: a quantitative display technique for three neurons. — Brain Res., 1975, 100, p. 271—296.
62. Poggio G. F., Viernstein L. 1. Time series analysis of impulses sequences of thalamic somatic sensory neurones. — J. Neurophysiol., 1964, 27, p. 517—545.
63. Segundo J. P., Perkel D. H. The nerve cell as an analyzer of spike trains. — In: UCLA Forum in Medical Sciences Noll, The Interneuron. Ed. M. A. B. Brazier, California, 1969.
64. Segundo 7. P., Perkel D. H., Wuman ff., Hegstad Й., Moore G. P. Inputoutput relations in computersimulated nerve cells. Influence of the statistical properties, strength, number and inter-dependence of excitatory pre-synaptic terminals. — Kybernetik, 1968, 4, p. 157—171.
65. Segundo J. P. Communication and coding by nerve cells. — In: The Neurosciences. Second study program. Ed. F. 0. Scmitt. New York, 1970, p. 569— 586.
66. Segundo J. P.t Moore G. P., Stensaas L., Bullock T. H. Sensitivity of neurons in Aplysia to temporal patters of arriving impulses. — J. Exp. Biol., 1963, 40, p. 643—667.
67. Stark L., Negrete-Martineze I., Yankelevich G., Theodoridis G. Experimental studies of information coding in nerve puls trains. — Mathem. Biosci. 1969, p. 451—485.
68. Stein R. B. The role of spike trains in transmitting and distorting sensory signals. — In: The Neurosciences. Second study program. Ed. F. O. Schmitt. New York, 1970, p. 597—604.
69. Stein R. B. The informational capacity of nerve cells using a frequency code. — Biophys. J., 1967, 7, p. 797—826.
70. Szentagothal J., Albert A. The synaptology of Clarke’s column. —Acta morph, hung., 1955, 5, p. 43—51.
71. Tonita T., Kaneko A., Murakami M., Pantier E. Spectral response curves of single cones in the carp. — Vision Res., 1967, 7, p. 519—531.
72. Wallde L. On the transmission of information through sensory neurons. — Biophys. J., 1970, 10, p. 745—763.
73. Werner G., Mountcastle V. B. Neural activity in mechanoreceptive cutaneous afferents: stimulus-response relation, Weber functions and information transmission. — J. Neurophys., 1965, 28, p. 359—397.
74. Wiersma C. A. G., Adams R. T. The influence of nerve impulse sequence on the contraction of different muscle of Crustacea. — Physiol, comp, ecol., 1950, 11, p. 20-33.
75. Wilson D. M. The central nervous control of flight in a locust. — J. Exp. Biol., 1961, 38, p. 471—490.
Часть вторая
НЕЙРОГЛИЯ
Глава 13
МОРФОЛОГИЯ НЕЙРОГЛИИ
В этой главе приводятся данные световой и электронной микроскопии о строении астроцитов, олигодендроцитов и микроглиоцитов, принципы их гистологической идентификации и методы количественной оценки. Затем излагаются сведения об отношении глии к нейронам, синапсам и сосудам и о реактивных и деструктивных изменениях. Превращения глии в процессе культивирования рассматриваются как модели процессов ее дифференцировки, миелинообразования и реакции на действие нейротропных веществ. В главе представлены подробные сведения о филогенезе и онтогенезе нейроглии и о механизме миелогенеза. Точки зрения авторов отдельных разделов по некоторым вопросам не всегда идентичны, но это отражает состояние вопроса. Некоторые добавочные морфологические сведения, представляющие специальный интерес при анализе физиологических фактов, приведены в следующей главе.
13.1. ДАННЫЕ СВЕТОВОЙ МИКРОСКОПИИ]
О СТРОЕНИИ ГЛИИ
13.1.1. КЛАССИФИКАЦИЯ ГЛИАЛЬНЫХ КЛЕТОК
Под термином «невроглия» Вирхов в 1846 г. описал межуточную ткань центральной нервной системы, видя в ней своеобразную склеивающую субстанцию. Дальнейшее изучение тонкой структуры нейроглии в центральной нервной системе животных и человека, ее эмбрионального и постнатального развития и особенно ее участия в патологических процессах позволило показать, что в понятии «нейроглия» объединяются весьма различные по морфологии, происхождению и функции элементы. Заслуга первых исследователей заключалась в установлении того, что в мозге имеется обособленная ткань, отличная в морфологическом и химическом отношении от нервных клеток и нервных волокон.
Дейтерсом в 1865 г. были открыты паукообразные клетки — астроциты. Вейгерт в 1895 г. описал способы окраски глиальных волокон. Было доказано наличие в глии, кроме ядер и протоплазмы, особых фибрилл как химически отличающихся от них образований. Кахаль в 1913 г. открыл элективный метод выявле-ния астроцитов, разделив их на волокнистые и протоплазмати-ческие. Он пришел к выводу о существовании трех элементов клеток центральной нервной системы, а именно нервных клеток, астроцитов (макроглия) и безотросчатой глии (адендроглия). Работами Кахаля было окончательно установлено, что нейроглия неоднородная и включает в себя клетки не только эктодермального, но и мезенхимного генеза.
По вопросу об общей структуре глии до сих пор существует две теории.
Согласно первой из них, клетки нейроглии связаны в одно целое. Между глиозными клетками имеется трехмерная протоплазменная сеть (глиоретикулум), в которую вплетены глиозные клетки с их отростками. Согласно второй теории, клетки нейроглии — совершенно самостоятельные элементы со свободно оканчивающимися отростками.
В изучении невроглии крупным успехом явились исследования Ортеги, открывшего в 1921 г. методы серебряной импрегнации, которые выявили своеобразные клеточные элементы в центральной нервной системе, получившие по его предложению название микроглии и олигодендроглии. Изучению астроцитарной глии способствовало в дальнейшем появление новых методов окраски эктодермальной глии (Кахаль, Снесарев, Эйнарсон). К эктодермальным элементам глии относйтся астроциты, протоплазменные и волокнообразующие, эпендима, олигодендроглия, шванновские клетки и сателлиты глиозных клеток. В мезодермальных клетках глии Кахаль выделил «третий элемент», а именно микроглию, приписывая ей мезенхимное происхождение.
В литературе клетки мезоглии называются по-разному: клетки Ортеги, микроглия, микроглиоциты и мозговые гистиоциты. Будучи блуждающими элементами, они проникают в мозг, где сначала’распространяются по белой субстанции; на более поздних стадиях эмбрионального развития они попадают из белой субстанции в серую. Мезенхимное происхождение мезоглии признают Снесарев, Александровская, Авцын, Ортега, Кахаль и др.
Некоторые исследователи не считают доказанным мезенхимный генез этих элементов и объединяют их с астроцитами и олигодендроглией. Кроме вышеназванных элементов, выделяются в качестве особого вида эпендимная глия и др. К периферической глии относят шванновские клетки периферических нервов и нервных окончаний, а также сателлиты нервных узлов анимальной и вегетативной нервной системы. В мозжечке своеобразными глиальными формами являются клетки Фаньянса и так называемые эпителиальные клетки Гольджи. Пенфильд [240] в основу своей клас-538
сификации ввел также топографический принцип, подразделяя астроцитарную глию на периваскулярную, субпиальную, маргинальную и сателлитную «иллеровские клетки» — астроциты сетчатки. Олигодендроглию он подразделил на интерфасцикулярную, расположенную между миелиновыми волокнами, и сателлитную псринейрональную глию. Неоднородность глиальных клеток, наблюдающаяся под световым микроскопом, в еще большей степени выявляется при субмикроскопических исследованиях [54, 130].
Количественный метод морфологического изучения различных видов нейроглии используется в качестве одного из методов объективной регистрации глиальных элементов при анализе различной функциональной активности нейронов, а также и для гистопатологических исследований в плане более полного и объективного выявления изменений глиальных клеток.
Реакцию нейроглии при функционировании нейронов оценивают по изменению количества клеток перинейрональной и общей глии и изменению размеров ядер глиальных клеток. Так, например, количество перинейрональной глии может изменяться вследствие характерной для глиальных клеток способности к передвижению [125], а также и к пролиферации [62, 128] и др. Колебания объема клеток нейроглии могут развиваться в результате высокой лабильности белкового метаболизма, поскольку значительные сдвиги в содержании нуклеиновых кислот и белков, обнаруживаемые в глиальных клетках под влиянием различных факторов [46, 135], должны сопровождаться изменением размеров их ядер.
Методически при окраске по Эйнарсону количество перинейрональной глии определяется по числу ядер, прилежащих к нейронам или основанию их отростков. Общая глия подсчитывается на единицу площади исследуемой области. Измерения величины проводятся как у прилежащих к нейронам глиальных клеток (сателлитов), так и у свободной глии, т. е. глиальных клеток, которые не прилежат к нейронам. Полученные цифровые данные обрабатываются статистически.
Отдельные виды глиальных клеток дифференцируют по их ядрам, которые отчетливо выявляются при окраске галлоциани-ном — хромовыми квасцами. Ядра астроцитов имеют относительно крупные размеры и овальную форму, тонкую мембрану и мелкие глыбки хроматина, равномерно распределяющиеся по всей кариоплазме. Для ядер олигодендроглии характерны относительно меньшие размеры, овальная форма, крупные глыбки хроматина и толстый контур ядерной мембраны. Ядра микроглии можно отличить по неправильной форме (палочковидной, треугольной и др.) и по наличию плотно расположенных глыбок хроматина, придающих ядру темную окраску. Морфологическая перестройка клеток нейроглии в процессе усиленного функционирования может быть связана с повышением активности нейронов, когда возрастает роль глиальных элементов в метаболическом обеспечении функции нейронов.
13.1.2. НОРМАЛЬНАЯ МОРФОЛОГИЯ АСТРОЦИТОВ
Астроцитарная глия (макроглия, эктоглия) представлена паукообразными клетками и волокнами. Различают протоплазматические и волокнистые, т. е. содержащие глиофибриллы формы. Имеются также переходные формы. На рис. 13. 1, А показаны фиброзные астроциты в белом веществе полушарий мозга. Протоплазматические астроциты представляют собой самые крупные клеточные элементы нейроглии, размером от 15 до 25 мкм, с довольно толстыми отростками; располагаются они главным образом в сером веществе мозга. На рис. 13.1, В показан протоплазменный кустовидный астроцит с множеством отростков. Волокнистые астроциты, напротив, очень малы. Диаметр их тел равен 7—И мкм и сосредоточены они преимущественно в белом веществе. Отростки астроцитов очень тонки и содержат глиальные волоконца. На рис. 13.1, В представлены гипертрофированные фиброзные астроциты с хорошо выраженными глиофибриллами, ядра с крупными глыбками хроматина. На рис. 13.1, Г изображен гигантский протоплазменный астроцит серого вещества коры большого мозга. Ядра астроцитов выявляются с помощью обычных ядерных красителей (гематоксилином), а также по методу Ниссля и Эйнарсона (хромовокислыми квасцами). Их протоплазма и отростки окрашиваются золото-сулемовым методом Кахаля. Глиальные же волокна окрашиваются методами Вейгерта и Гольцера.
Типичные астроциты характеризуются длинными маловетвя-щимися отростками, большая часть которых заканчивается на стенках небольших сосудов. Их ядра крупные, круглые или овальные и содержат небольшое количество хроматина. Реакция Фель-гена дифференцирует в них глыбки дезоксирибонуклеиновой кислоты (ДНК). В протоплазме астроцитов обнаружен аппарат Гольджи, центросома и мелкие округлые или палочковидные митохондрии, получившие название глиозом. Последние выявляются ио методам Кахаля, Альтмана и располагаются также и в отростках астроцитов.
Рибонуклеиновой кислоты (РНК) в нормальных астроцитах немного, но она накапливается в пролиферирующих элементах. Типичного ядрышка в астроцитах нет, Снесарев предполагал наличие в телах астроцитов глиозом, которые служат носителями ферментов, и отметил своеобразие в послойном распределении глиозной зернистости, связанное с закономерностью распределения нейронов коры.
В астроцитах наблюдаются гиперпластические и гипертрофические процессы. Пролиферативные реакции астроцитарной глии имеют широкий диапазон от простого набухания до мощной пролиферации, приводящей к образованию глиоза. Гиперпластические процессы проявляются в увеличении перинуклеарной плазмы. Ядра обычно увеличиваются в объеме и закрашиваются светлее обычного. В ядре появляются образования, похожие на ядрышко.
Ядерная мембрана хорошо очерчена. В протоплазме этих клеток отмечается окрашиваемость фуксинофильной и митохондриальной зернистости. Размножение астроцитов при патологических условиях совершается митотическим или амитотическим путем. Митотическая форма деления глиальных ядер — явление редкое. Амитозы глиальных ядер встречаются чаще. Ядра при этом принимают неправильную дольчатую форму, и процесс заканчивается полным разделением (рис. 13.2, Б).
При гипертрофии в протоплазменных астроцитах отмечается увеличение цитоплазмы. Волокнистые астроциты увеличиваются за счет развития волокон (рис. 13.2, Л). При этом развивается глиоз или местное разрастание астроцитов. Возможна комбинация тех и других явлений. Гипертрофия астроцитов достигает иногда таких пределов, что они, округляясь, принимают вид тучных, округленных клеток. Иногда астроциты образовывают зернистые шары. Однако фагоцитарную функцию астроцитов большинство авторов не наблюдали [4, 62].
Пролиферация астроцитарной глии является закономерной фазой в формировании мозгового рубца. Из астроцитов возникают опухоли мозга — астроцитомы. Увеличение числа астроцитов наблюдается при различных функциональных воздействиях. К ним относится воздействие небольших доз (в пределах физиологических) постоянного магнитного поля, токов сверхвысокой частоты, шумовых воздействий, снотворных средств [7, 9—13, 29].
Дистрофические реакции астроцитов выражаются в простой атрофии, дегенерации и даже полной гибели клеток и отростков. Под атрофией понимается постепенное сморщивание глиальных клеток. В зависимости от интенсивности вредного фактора возникают различные формы дегенеративного метаморфоза. Начальные формы этих изменений характеризуются набуханием и гомогенизацией плазмы с пикнозом ядер (рис. 13.2, В).
Набухшие астроциты в дальнейшем характеризуются набуханием отростков и пикнотичным ядром, гомогенной протоплазмой (амебоидные формы астроцитов). Их ядра иногда увеличиваются, хотя обычно они при этих формах уменьшаются. Глиозные фибриллы исчезают, и клетки с короткими отростками становятся похожими на амебу. В амебоидных формах появляются разнообразные зернистости, а именно базофильные, фуксинофильные и липоидные. В некоторых случаях в астроцитах появляются вакуоли. В этих клетках, лишенных отростков, иногда наблюдается деление ядер. Такие изменения астроцитов могут быть вызваны также и недостатком в тканях мозга кислорода (тканевой асфиксией). Редкое изменение астроцитов заключается в остром и хроническом их ожирении, которое может произойти при нарушениях циркуляции, при острых и хронических инфекциях, интоксикациях и опухолях мозга.
Н В астроцитах может откладываться железо, соли, кальций и т. д. В астроцитах также обнаруживают мукопротеины [197].
13.1.3. НОРМАЛЬНАЯ МОРФОЛОГИЯ ОЛИГОДЕНДРОГЛИИ
Олигодендроглия (олигоглия, олигодендроглиоциты) относится, как и астроциты, к эктодермальной глии, сюда относят также эпендиму, шванновские и субкапсулярные клетки. Количественное распределение различных форм нейроглии представлено у Криспин—Экснера [184]. По Криспин—Экснеру, в коре больших полушарий олигодендроглиоцитов 29, астроцитов 61.5, а микроглии 9.5%, в мозолистом теле соответственно40, 54 и 6 %.
В бледном шаре, зрительном бугре и коленчатых телах олигодендроглиоцитов 57, астроцитов 30—40, микроглии 6—8%. В черной субстанции олигодендроглиоцитов 62, в красном ядре 77.5%. В продолговатом мозге олигодендроглия также количественно преобладает над астроцитами и микроглиоцитами.
По Снесареву, в коре больших полушарий по направлению сверху вниз с каждым слоем число олигодендроглии возрастает. Особенно увеличивается число сателлитов нервных клеток. В качестве спутников пирамидных клеток олигодендроциты располагаются у их основания. Олигодендроглия может быть спутником и сосудов. В белом веществе олигодендроглии больше. На рис. 13.3, А показаны плотные отростчатые олигодендроциты с пуговчатыми утолщениями отростков в белом веществе полушарий мозга; в сером веществе их меньше. Ядра олигодендроглиоцитов меньше, чем у астроцитов. Они ограничены тонкой оболочкой и содержат нежные хроматиновые зерна.
Структура клеточной плазмы олигодендроглии изменяется в зависимости от местонахождения. В молекулярном слое мозжечка, в продолговатом и спинном мозге содержатся самые большие глио-зомы. Наиболее мелкие глиозомы наблюдаются в интрафасцику-лярных олигодендроглиоцитах.
Различают четыре основных типа олигодендроглии. Первый тип встречается в головном мозге. На рис. 13.3, В показан гипертрофированный плотный олигодендроглиоцит в коре большого мозга с ветвящимися длинными отростками, покрытыми шиповидными выростами. На рис. 13.3, Г показаны плотные периваскулярно расположенные олигодендроглиоциты в коре большого мозга. Отдельные вакуоли имеются в теле клетки.
Второй тип олигодендроглиоцитов значительно больших размеров, рассеянных исключительно в белом веществе. Третий тип — очень крупные клетки, расположенные вдоль толстых миелиновых волокон мозга,мозжечка и спинного мозга. Их значительно меньше, чем клеток первых двух типов олигодендроглии. Эти клетки имеют от одного до четырех толстых отростков, которые образуют вокруг нервных волокон сетки и местами кольца в форме воронок. Наконец, четвертый тип олигодендроглиоцитов состоит из одно- и двухполюсных клеток, напоминающих клетки Шванна в периферических нервах. Тело клетки в виде веретена расположено на поверх-542
ностн нервного волокна, покрывая его тонким пластом в виде сети. Этот тип особенно часто встречается в ножках большого мозга, в мосту, в продолговатом мозге.
Встречаются, помимо этих четырех типов олигодендроглии, еще многочисленные промежуточные формы. Некоторые авторы настаивают на морфологическом тесном сходстве олигодендроглиоцитов с клетками Шванна.
Снесарев из массы интрафасцикулярных клеток выделил особый их вид под названием «дренажных клеток». На рис. 13.3, В показаны дренажные безотростчатые олигодендроглиоциты в белом веществе полушарий мозга. При длительных отеках мозговой ткани синусы этих клеток растягиваются и сливаясь друг с другом, образуют целые ходы. Олигодендроглиоциты играют важную роль в образовании миелина и являются его опорным элементом.
Функция олигодендроглии многообразна вследствие неоднородности самой олигодендроглии. Гистохимически в олигодендроглиоцитах найдены карбонангидраза и порфирин, имеющие отношение к функции дыхания. В связи с этим сателлиты, очевидно, могут изменять скорость окислительных процессов в нервных клетках. М. Шейбел и А. Шейбел [265] обнаружили синапсоподобные окончания терминальных ветвлений аксонов на олигодендроглиоцитах и одновременно нервных клетках.
Хиден и Пигон [163] у экспериментальных животных методом химического и физического количественного определения РНК, цитохромоксидазы и сукциноксидазы в нервных клетках и клетках олигодеядроглиоцитах — сателлитах ядра Дейтерса — обнаружили уменьшение количества РНК и указанных выше ферментов в олигодендроглии и одновременное увеличение их в нервных клетках после вестибулярной стимуляции.
Скорость синтеза нуклеотидов в глии выше в 2—2.5 раза, чем в нейронах. Количественное превосходство числа глиальных клеток, которых на порядок больше, чем нейронов, дает основание полагать, что суммарный обмен веществ ткани мозга в действительности отражает обмен веществ нейроглии.
Пролиферация олигодендроглии определяется в процессе повышенного функционирования нейронов и выражается прежде всего в увеличении числа перинейрональных сателлитов.
При патологических процессах участие олигодендроглии очень многообразно, Пенфильд и Коун отметили «острое набухание» олигодендроглии как результат интоксикации. При этом ими описывалось появление вакуолей в цитоплазме' этих клеток. В мозге определялись гипертрофированные'олигодендроглиоциты с ясными отростками и утолщениямщна их концах в виде баллончиков. Олигодендроглия размножается амитотическим путем и принимает даже амебоидную форму. Она может так же, как и микроглия, образовывать звездчатые формы. Клетки олигодендроглии бывают перегружены жиром и принимают форму, сходную с зернистыми шарами в очагах размягчения в белом веществе мозга.
Количественное увеличение олигодендроглии может протекать в форме плотных, тотально имнрегнируемых клеток с длинными отростками, или же рыхлых дренажных клеток с короткими отростками. Все эти изменения являются выражением пролиферативных реакций олигодендроглии.
Дистрофические изменения олигодендроглии выражаются в атрофических изменениях, в уменьшении их тел и отростков, в сморщивании ядер. Сателлиты нервных клеток сильно реагируют пролиферацией на дистрофические и некробиотические изменения нейронов. Они окружают гибнущие нервные клетки и в конце концов резорбируют продукты ее распада (феномен нейронофагии). Из олигодендроглии может происходить образование зернистых шаров, которые активно фагоцитируют продукты распада миелина.
13.1.4. НОРМАЛЬНАЯ МОРФОЛОГИЯ МИКРОГЛИИ
Микроглия (мезоглия, микроглиоциты, клетки Ортеги) мезенхимного генеза развиваются из полибластов оболочек мозга, которые проникают в мозг в поздние стадии эмбрионального развития, но они приносятся также и сосудами. На ранней стадии развития эти клетки отличаются свойствами блуждающих клеток. Они распространяются главным образом в белой субстанции, а впоследствии проникают и в серую, причем микроглиоциты движутся и вдоль волокон, и вдоль сосудов. О мезенхимном происхождении микроглии свидетельствует факт появления ее клетки из окружающей мозг мезенхимы (и отчасти из сосудов) и рассеивание их по всей мозговой ткани. Когда организация мозговых оболочек и сосудов мозга достигает наибольшей высоты, совершается обширная инвазия этих гистиоцитарных клеток в мозг. Появление этих клеток удобно наблюдать в первые же дни (2—5) постнатальной жизни животных. Вначале микроглиоциты круглой формы, затем при движении выпускают малые или большие псевдоподии, а в стадии покоя они делаются ветвистыми. От микроглии к олигодендроглии нет переходов, так как по природе это различные клетки. В функциональном отношении микроглия в мозге является представительницей ретикуло-эндотелиальной системы организма. Ей присущи основные свойства гистиоцитов: фагоцитоз, эритролиз, а также способность захватывать разного рода тканевые остатки. Активность микроглии особенно повышается при патологических условиях: при травмах, воспалениях и т. д. Она гипертрофируется, превращается в палочкообразные клетки и зернистые шары.
Ядра микроглии обычно удлиненной, овальной или неправилы ной формы; иногда же они согнуты. Обычно ядра темно окрашиваются. По общей структуре их сравнивают то с адвентициальными клетками, то с лимфоцитами. Они отличаются богатством хроматина, причем зерна микроглии крупнее хроматиновых зерен олигодендроглиоцитов и астроцитов. Количество протоплазмы в телах 544
Рис. 10.2. Моторные пластинки трехглавой мышцы саламандры после 1 нед в культуре, окрашенной на холинэстеразную активность.
А — мышца в культуре в присутствии эксплантированного сенсорного ганглия, SC — сянапшчвская щель; Ё — мышца без прибавления ганглия; мышца обнаруживает перерождение нервного окончании, регрессию моторной пластинки и потерю холинэстеразной активности. В культуре мыпшы исчезают нервные окончания, но сохраняется постсинапти-ческан структура и холинэстеразная активность [170].
И Заказ '.VH
Рис. 10.5. Продольные срезы длинного разгибателя пальцев (m. extensor digitorum longus), сделанные через 4 дня после введения мтготокснческого бупивакаипа, вызывающего дегенерацию н последующую регенерацию мышечных волокон, и через 5 дней после введения ботулнн-токспна, блокирующего высвобождение АХ из окончаний. Видны нервные окончания (//) с синаптическими пузырькам в дифференцирующейся мышечной клетке с хорошо развитыми синаптическими изгибами (СИ). (Фотография И. Ирмаповой).
Рис. 10.6. Моторные пластинки на одиночных мышечных волокнах, окрашенных на АХЭ.
1 — пластинка быстрого типа в фокально иннервированной нормальной контрольной задней длинной мышце спины. 2 — пластинка быстрого типа в перекрестно иннервированной передней длинной мышце спины; з — пластинка медленного типа в нормальной контрольной множественпо-ипнервироваиной передней длинной мышце спины цыпленка [236].
Рис. 10.9. Гомогенная гистохимическая картина АТФазной активности мышечных волокон в нормальной мышце in. levator ani (7) в перекрестно иннервированной мышце крысиных самцов, кастрированных через два месяца после перекрестного соединения большеберцового нерва со срамным нервом (2) и в перекрестно иннервированной мышце кастрированных крыс, получавших ежедневно тсстостерон-проиионат на протяжении одного месяца после кастрации (5). Масштаб — 100 мкм [133].
Рис. 10.11. Продольный срез миелинизированного нервного волокна из проксимального отрезка приблизительно 500 мкм над зоной сдавления нерва (4 часа после сдавлеяия). Видий аккумуляция органелл, вызванная задержкой аксоплазматического тока. Центральная зона нейрофиламентов окружена аккумулированными пузырьками, трубочками и митохондриями. Масштаб — 1 мкм. (Снимок J. Zelena),
w
Рис. 13.1. Строение астроцитов о
Рис 13.1 (продолжение).
В — гипертрофированные фиброзные астроциты с хорошо выраженными глиофибрил-лами. Ядра е крупными глыбками хроматика. Окраска по Снесареву, Х900; Г — гигантский протоплазменный астроцит серого вещества коры большого мозга. Окраска по Бильшовскому, Х900.
Рис. 13.2. Строение астроцитов.
— гиперплазия фиброзных астроцитов. Окраска по Кахатю х фиброзных астроцитов. Окраска но Ках2то* х 000*
Х400; В —деление
Рис, 13.2 (продолжение).
J3__гомогенное набухание астроцитов с пикнозом ядер. Окраска по Кахалю, X90(L
Рис. 13.3. Строение олигодендроцитов. Окраска по Александровской, Х900.
А — плотные отростчатые олигодендроциты с пуговчатыми утолщениями отростков. Белое вещество полушарий мозга; — дренажные бвэотростчатыс олигодендроциты в белом веществе полушарий мозга;
Рис. 13.3 (продолжение).
В — гипертрофированный плотный олигодсндроглиоцит в коре большого мозга с ветвящимися длинными отростками, покрытыми шиповидными отростками; Г — отростчатые плотные, периваскулярно расположеЕШые олигодендроциты в коре большого мозга. Отдельные вакуоли в теле клетки.
Рис. 13.4. Строение микроглиоцитов. Окраска по Александровской, Х900-
А — мн огоотр сетчатые ветвистые клетки (I—микроглии; Б — звезда размножения микроглии; В — атрофия микроглии с истончением отростков.
Рис. 13.5. Протоплазматический астроцит коры головного мозга кошки. Х39 ООО.
Я — ядро, ЯГ — комплекс Гольджи, ЭС — эндоплазматическая сеть, Р — рибосомы, J'K — частицы гликогена, <Р — глиофнбриллы, МТ — митохондрия, ПТ — плотное тело, ИРЕ — Ирссинаптическая терминаль, Д — дендрит, С — Синапс, А — отросток астроцига. Контуры клетки обведены тушью,
Рис. 13.6. Фиброзный и протоплазматический астроциты в коре головного мозга.
А — фиброзный астроцит подлежащего белого вещества коры головного мозга кошки» X 32 000; Б — отростки протоплазматического астроцита в нейропиле коры головного мозга кошки, х70 ООО (по [35]). М — миелиновое нервное волокно, К — кровеносный капилляр. Остальные обозначения см. рис. 13.5.
I ч
Рис. 13.7 (продолжение). астроциты (АС), контактирующие с олигодендроцитом (ОЛ). Внутреннее коленчатое теле головного мозга кошки, Х21 ООО (по [34]). Остальные обозначения см. рис. 13.5 и 13.6.
клеток обычно небольшое, однако в изобилии она в их отростках. Протоплазма кажется более или менее губчатой в теле и в местах отхождения ее отростков. Клетки микроглии отличаются большой ветвистостью отростков. Обычно их 2—3, но может быть и больше. Отростки бывают разной длины и толщины. Кроме того, главные отростки 2—3 раза делятся дихотомически, причем и последующие отростки продолжают еще ветвиться. Все отростки — как основные, так и дополнительные — покрыты мелкими веточками, прямыми или с разветвлениями на концах, которые придают клетке мохнатый вид. Их называют обычно шипиками. Клетки микроглии имеют свободные окончания и друг с другом не анастомозируют. Размножение клеток микроглии идет главным образом амитотически, особенно на стадии миграции. Митозы наблюдаются обычно у клеток, выступающих в роли макрофагов. Микроглии больше в сером веществе, чем в белом.
Хотя характер структуры микроглии постоянен, однако существуют многочисленные отклонения от основного типа. Иногда встречаются клетки с одним большим выростом, разветвленным вдали от тела клетки, получающимся как результат неправильного деления. Имеются также многополюсные клетки. Они имеют самую разнообразную форму. Наряду с клетками, обладающими тремя или четырьмя отростками, могут встречаться клетки с шестью отростками и более. Многополюсные клетки чаще встречаются в мозговой коре, где они находятся в изобилии и за счет богатства ветвлений напоминают «корнеплоды» (рис. 13.4, А). В мозолистом теле между нервными волокнами, вокруг сосудов и вокруг нервных клеток встречаются сплющенной формы клетки с неправильным угловым силуэтом. Наличие таких двухполюсных, удлиненных, палочкообразных уплощенных клеток свидетельствует, по-видимому, о пластичности протоплазмы и ее способности к приспособлению.
Часть клеток микроглии располагается в молекулярном слое коры и мозжечка, другие же в изобилии видны около сосудов и на них. В мозжечке много микроглии; ее больше в серой, чем в белой мозговой субстанции. Микроглия располагается не только в молекулярном, но и в зернистом слое. В мозжечке встречаются те же формы, что и в коре большого мозга. В слое зерен микроглия становится многополюсной и звездообразной и отростки ее распространяются во все стороны. Она располагается также по ходу дендритов клеток Пуркинье. В большом количестве она встречается по ходу сосудов, где принимает плоскую форму. Большое количество микроглии отмечается в слое малых и больших пирамидных клеток, и часто они сопутствуют нервным клеткам. В аммоновом роге клетки микроглии располагаются параллельно верхушечным продолжениям пирамидных клеток. Здесь много трехполюсных форм, но много также и двухполюсных, особенно в stratum radiatum. В зрительном бугре микроглия распространяется более равномерно. В белом веществе так же, как и во внутренней капсуле,
35 Общая физиология нервной системы
545
она распространяется по ходу нервных пучков. В зрительном нерве и в сетчатой оболочке определяется наличие микроглии.
Кроме микроглии, в мозге имеется другая разновидность подвижных клеток — гистиоциты. Последние тесно связаны со стенками сосудов и располагаются по их ходу продольно. В местах деления капилляров их называют перицитами.
Пролиферация микроглии выражается в подвижности и в особенной ее чувствительности к повреждающим воздействиям. Через несколько минут после воздействия на мозг возникает гипертрофия и начинается пролиферация клеток микроглии. Микроглия размножается амитотическим путем. Вновь образовавшиеся клетки могут распределяться в виде кустовидпых разрастаний, в виде фигуры звезды (рис. 13.4, Б), глиозных узелков, розеток и т. д.
Дистрофические изменения микроглии разнообразны в зависимости от эндо-экзогенных причин, темпа и силы их действия. К числу патологических форм клеток относятся амебовидные формы, которые наблюдаются часто вблизи очагов размягчения и кровоизлияний. В условиях подавления реактивности организма (шизофрения, истощение, некоторые интоксикации) микроглия оказывается резко атрофичной (рис. 1.4, В).
13.1.5. МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ ГЛИИ ПРИ ДЕЙСТВИИ РАЗНЫХ ФАКТОРОВ
Весьма широко распространена мысль о вторичном участии нейроглии в различных физиологических процессах. Нейроглии может принадлежать определяющая роль в реакциях мозга на воздействие различных физических факторов (магнитные и электромагнитные поля, ионизирующая радиация) или химических агентов. Морфологические изменения в нейроглии при таких воздействиях возникали раньше, чем какие-либо изменения нейронов. При этом на ЭЭГ появлялось преобладание медленных волн и веретен, что обычно сопровождалось снижением порога реакции на периферический стимул, а также замедлением выработки и реализации уже выработанных условных рефлексов [7]. Совокупность морфологических, электрофизиологических и поведенческих данных позволила предположить, что наблюдаемая картина соответствует параметрам превентивного торможения (591, возникающего в центральной нервной системе в ответ на действие слабого стимула. Это предположение подтвердилось в экспериментах по комплексному изучению морфологических и электрофизиологических характеристик различных областей коры больших полушарий при звуковых воздействиях разной интенсивности [6, 9-13].
Таким образом, различные факторы внешней среды, действуя непосредственно или рефлекторным путем на мозг, могут вызывать неспецифическую реакцию нейроглиального комплекса. Важная 546
роль нейроглии в этой реакции подчеркивается не только прямыми наблюдениями за структурой и функцией нейроглии, но и медленным характером протекания реакций, что несвойственно нейронам. Эти факты подтверждают гипотезу о существовании в нервной системе медленной контролирующей системы, в которой глии отводится первое место [53].
13.2. УЛЬТРАСТРУКТУРА НЕЙРОГЛИИ
Внедрение в гистологическую технику электронномикроскопического метода исследования значительно расширило наши познания о структурной организации нейроглиальных клеток. Актуальные вопросы, выдвинутые световой микроскопией и оставшиеся нерешенными ввиду ее низкой разрешающей силы, теперь нашли свое решение. Систематическое электронномикроскопическое исследование нейроглиальных клеток позволило установить тончайшее строение этих клеток и обнаружить их тесные контакты с другими элементами нервной системы.
При электронномикроскопической идентификации нейроглиальных клеток за основу берутся данные световой микроскопии — величина и форма тела и ядра, особенности ветвления отростков, характер распределения отдельных видов глии в центральной нервной системе и т. д.
Применение в большинстве ранних электронномикроскопических исследований [109, 199, 267 и др.] несовершенных методов фиксации и обработки материала, приводящих к образованию многочисленных артефактов, являлось основной причиной разногласий, а иногда и противоречивых результатов. Дальнейшее усовершенствование электронномикроскопических методов с применением перфузионной фиксации параформальдегидом и глутаральдегидом и использованием в качестве заливочного материала эпоксидных смол дало возможность получить более однородную картину тончайшей структуры нейроглиальных клеток.
Электронномикроскопическое исследование центральной нервной системы подтвердило существование трех типов нейроглиальных клеток — астроцитов, олигодендроцитов и микроглиоцитов.
13.2.1. АСТРОЦИТЫ
Астроциты по размерам превосходят другие типы глиальных клеток и имеют наиболее низкую электроннооптическую плотность ядра и цитоплазмы [40, 47, 54, 210, 218, 221]. Ядра протоплазматических астроцитов овально-удлиненные, реже бобовидной и угловатой формы; располагаются в центре клетки. Контуры ядерной оболочки несколько извилисты, но глубоких впячиваний не образуют. Межмембранное пространство ядерной оболочки местами локально расширено; зерна хроматина распре-
делены в ядре равномерно (рис. 13.5) и только изредка наблюдаются их скопления в отдельных областях ядра.
Эндоплазматическая сеть в астроцитах развита слабо и представлена в основном короткими плоскими цистернами, на поверхности которых расположено небольшое число рибосом. Группы из нескольких цистерн одинаково часто встречаются как в периферической, так и перинуклеарной областях цитоплазмы. Свободные рибосомы располагаются в виде одиночных гранул или групп; в целом их количество незначительно. Комплекс Гольджи обладает типичным строением и расположен преимущественно в перинуклеарной области. Компоненты эндоплазматической сети и комплекса Гольджи в отростках встречаются чрезвычайно редко. Митохондрии благодаря темному матриксу четко выделяются па фоне светлой цитоплазмы (см. рис. 13.ф. Их размеры и форма значительно варьируют, особенно больших размеров они достигают в отростках. Наряду с митохондриями, имеющими типичное для этих органелл строение, некоторые исследователи [83, 220] в астроцитах описали митохондрии с кристами разнообразной формы. В астроцитах обычно наблюдаются плотные тела различной величины с гомогенным содержимым, которые чаще беспорядочно разбросаны по всей цитоплазме, а иногда можно заметить их локализацию около комплекса Гольдяш.
Одним из наиболее характерных признаков, отличающих протоплазматические и фиброзные астроциты от других нейроглиальных клеток, является наличие как в перикарионе, так и отростках тонких фибрилл, 7—9 нм в диаметре, образующих параллельные пучки различной толщины и длины. Эти пучки часто располагаются в непосредственной близости от ядра и как бы окружают его. Количество и толщина фибриллярных пучков в протоплазматических астроцитах варьирует в широких пределах. Так, например, в коре больших полушарий глиофибриллы обнаруживаются во всех протоплазматических астроцитах, в то время как в коре мозжечка некоторые астроциты вообще лишены их [40, 47 и др.].
Другой особенностью астроцитов, являющейся одним из критериев при их идентификации, является наличие в цитоплазме большого числа зерен гликогена, которые беспорядочно разбросаны в перикарионе и отростках, причем их количество в различных астроцитах меняется в широких пределах/Особенно богаты зернами гликогена тончайшие отростки и сосудистые ножки этих клеток (рис. 13.5; 13.6, А, Б-, 13.7).
Цитоплазматическая мембрана протоплазматических астроцитов, в отличие от других клеток, имеет различное и сложное очертание, что обусловлено проникновением цитоплазмы глубоко между окружающими структурами нейропиля в виде узких (от 20Jhm до 1 мкм и более) пластинок.
Перияейрональное расположение протоплазматических астроцитов в коре больших полушарий довольно частое явление, при 548
этом ультраструктурная организация этих клеток не отличается от таковой свободных астроцитов.
Отростки астроцитов благодаря многочисленным разветвлениям занимают значительную площадь в нейропиле. Они разнообразной величины и формы и легко распознаются из-за низкой плотности матрикса и наличия в них частиц гликогена и пучков глиофибрилл. Тонкие пластинчатые отростки протоплазматических астроцитов часто окружают пре- и постсинаптические терминали и изолируют их от других, лежащих по соседству нервных элементов (см. рис. 13.6, Б).
Как тела, так и отростки астроцитов находятся в тесном контакте почти со всеми структурными компонентами нервной ткани— с телами нейронов, со стволами и разветвлениями дендритов, аксонными терминалями, миелиновыми нервными волокнами (см. рис. 13.5; 13.6, Л, Б; 13.7, Л), с другими глиальными клетками (см. рис. 13.7, В) и базальной мембраной капилляров. В последнем случае они покрывают до 80% поверхности капилляров. Особо следует отметить, что во всех случаях между цитоплазматическими мембранами астроцита и прилежащей структуры контакты наподобие синапсов или десмосом не образуются. Исключение составляют синапсоподобные контакты на перикарионе и отростках астроцитов в обонятельной луковице рукокрылых 12371 и medium eminence крыс [135, 311].
Большая часть характерных черт ультраструктурной организации протоплазматических астроцитов (плотность ядерного и цитоплазматического матрикса, конфигурация, количество и рас пределение отдельных органоидов и т. д.) присуще и фиброзным астроцитам. Можно назвать лишь несколько признаков, позволяющих отличить друг от друга эти клетки. В первую очередь следует отметить, что в цитоплазме фиброзных астроцитов гораздо больше глиофибрилл, мощные пучки которых занимают значительную часть перикариона и выходят в отростки (см. рис. 13.6, А, 13.7, Л). Кроме того, контуры фиброзных астроцитов не так извилисты и не повторяют форму окружающих структур. В отличие от протоплазматических астроцитов, они не имеют тончайших отростков пластинчатой формы; в большинстве случаев отростки последних на поперечных срезах округлого, овального или угловатого очертаний. Ядра фиброзных астроцитов имеют неровные контуры и ядерная оболочка чаще, чем в протоплазматических астроцитах, образует глубокие инвагинации [37, 129].
Однако все вышеперечисленные признаки не дают возможности четко отличить друг от друга фиброзные и протоплазматические астроциты (особенно в коре больших полушарий); еще в ранних исследованиях, выполненных на уровне светового микроскопа [4, 60, 266], указывалось о существовании переходных форм между этими клетками.
13.2.2. ОЛИГОДЕНДРОЦИТЫ
Перикарион олигодендроцитов большей частью имеет округло-овальное очертание и отличается от других клеток высокой электронной плотностью ядерного и цитоплазматического матрикса. Относительно большое ядро расположено эксцентрично, и цитоплазма сконцентрирована на одном полюсе клетки, с других сторон ядро окружено ее узкой каемкой [40, 182, 219, 305 J.
Хроматин в ядре олигодендроцитов в большинстве случаев собран в крупные глыбки, которые располагаются как непосредственно под ядерной оболочкой, так и в других участках ядра. Наружная мембрана ядерной оболочки, в отличие от внутренней, извилиста, и на ней местами расположены цепочки рибосом. Межмембранное пространство ядерной оболочки часто расширено и достигает значительных размеров, что обычно не наблюдается в других глиальных клетках (рис. 13.8, 13.9, А, Б).
Вакуолярная система — эндоплазматическая сеть и комплекс Гольджи — в цитоплазме олигодендроцитов хорошо развита и ее компоненты часто локализуются на одном из полюсов клетки. Гранулярная эндоплазматическая сеть представлена несколько расширенными цистернами различной длины, которые иногда собраны в группы на периферии или в перинуклеарной области перикариона; то же можно сказать и о компонентах комплекса Гольджи. Кроме рибосом, связанных с мембранами эндоплазматической сети, в цитоплазме олигодендроцитов в большом количестве содержатся свободные рибосомы, часто собранные в виде полисом. Обилие свободных рибосом наряду с осмиофильностыо основного вещества и обуславливает высокую электронную плотность цитоплазмы. В цитоплазме олигодендроцитов равномерно распределены округлые митохондрии, имеющие типичное для этих органелл строение. Часто встречаются плотные тела различной формы и величины как с гомогенным, так и зернистым содержимым (рис. 13.9, Л).
Наиболее характерным для олигодендроцитов является наличие в перикарионе и отростках микротрубочек, имеющих 20— 25 нм в диаметре. В перикарионе они распределены равномерно, без какой-либо ориентации, тогда как в отростках расположены взаимно параллельно (см. рис. 13.9, А, Б).
Из-за малочисленности отростки олигодендроцитов редко обнаруживаются в нейропиле. Они неправильного очертания, имеют сходную с перикарионом электронную плотность и не образуют таких тончайших разветвлений, как астроцитарные отростки. Идентификация отростков олигодендроцитов несколько затруднена вследствие отсутствия в них характерных структур. Микротрубочки обуславливают их некоторое сходство с дендритами и начальными сегментами аксонов, однако на отростках олигодендроцитов синаптические контакты никогда не образуются и их плотность всегда больше плотности дендритов и аксонов.
Такова в целом ультраструктура олигодендроцитов. серого вещества коры головного мозга млекопитающих независимо от того, являются ли они перинейропальными, перикапиллярными сателлитами или свободными клетками. Что же касается белого вещества мозга, то, по данным большинства исследователей 139, 182, 201 и др. ], здесь наблюдается два типа межфасцикуляр-пых олигодендроцитов — светлые и темные. Темные олигодендроциты характеризуются более электронноплотным матриксом, чем светлые; а плотность ядерного и цитоплазматического матрикса последних та же, что и олигодендроцитов серого вещества.
Олигодендроциты, аналогично астроцитам, контактируют почти со всеми структурными компонентами нервной ткани. При непосредственном контакте олигодендроцитов с пресинап-тическими терминалями (рис. 13.10, А, Б) противостоящие мембраны и межклеточные щели имеют сходство с обычными цитоплазматическими мембранами и межклеточными щелями и не обнаруживаются характерные для синапсов уплотнения мембран, что указывает на отсутствие истинных синапсов на этих клетках (14, 38, 41, 182 и др.1. Однако Манина [361 отмечает, что некоторые пресинаптические терминали образуют на олигодендроцитах активные контакты с уплотнением мембран и концентрацией в этой области синаптических пузырьков.
При контакте нейрона и олигодендроцита щель между их плазматическими мембранами составляет 15—20 нм. В области контакта в олигодендроцитах не обнаружено каких-либо специфических образований — обычно в этой области наблюдаются свободные рибосомы, митохондрии и единичные цистерны эндоплазматической сети (см. рис. 13.8, 13.9, В). В нейронах же в области контакта, помимо розеток свободных рибосом и компонентов агранулярной эндоплазматической сети, часто располагаются подповерхностные цистерны.
Таким образом, макроглиальные клетки — астроциты и олигодендроциты — характеризуются целым рядом четко выраженных особенностей, благодаря которым значительно облегчается идентификация этих клеток.
В заключение следует отметить, что в литературе имеются указания о существовании переходных форм между астроцитами и олигодендроцитами [14, 109, 175, 238]. Однако большинство исследователей [134, 179, 209, 221] отрицает существование таких клеток в нормальном материале; по их мнению, переходные формы макроглиальных клеток появляются при различных патологических состояниях.
13.2.3. МИКРОГЛИОЦИТЫ
Проблема идентификации микроглиоцитов в электронном микроскопе наиболее сложна, а существующие данные противоречивы. Так, например, ряд исследователей [37, 109, 2211
s
a
s
a a
описал микроглиоциты как наиболее электронноплотные элементы нервной ткани. По мнению других авторов [99, 213, 2921, клеточные элементы с высокой электронной плотностью являются олигодендроцитами и малыми нейронами, подвергнувшимися повреждающему воздействию в результате применения несовершенных методов фиксации и проводки материала. Одной из причин таких разногласий является относительная малочисленность, микроглиоцитов в центральной нервной системе интактных животных. Поэтому на современном этапе большинство исследователей, учитывая тот факт, что при различных экспериментальных воздействиях и патологических состояниях микроглиоциты активируются и их количество значительно возрастает, при идентификации этих клеток наряду с интактным используют и экспериментальный материал [81, 290, 312].
Согласно Данным вышеуказанных исследователей, микроглиоциты по плотности цитоплазматического и ядер-ного матрикса занимают промежуточное положение между астроцитами и олигодендроцитами — они плотнее астроцитов и намного светлее олигодендроцитов. Ядра микроглиоцитов чрезвычайно полиморфны, хроматин распределен неравномерно и в основном образует скопления у ядерной оболочки, последняя часто глубоко инвагини-
рована. Межмембранное пространство ядерной оболочки местами расширено, но никогда не достигает таких значительных размеров, как у олигодендроцитов.
Ядро микроглиоцитов окружено узким ободком цитоплазмы, которая чаще сконцентрирована на полюсах клетки. Цитоплазма относительно бедна органеллами — гранулярная эндоплазматическая сеть представлена в виде редких длинных извитых цистерн, малое число свободных рибосом равномерно распределено по цитоплазме, комплекс Гольджи занимает перинуклеарное положение, митохондрии и плотные тела обнаруживаются по всей цитоплазме (рис. 13.10, В). Микроглиоциты резко отличаются от других клеток отсутствием в цитоплазме глиофибрилл, зерен гликогена и микротрубочек.
Аналогичная ультраструктурная организация характерна и для клеток, описанных Воном и Питерсом 1292], Блинзингером и Крейцбергом [82] и рассматриваемых ими как «третий тип» нейроглиальных клеток или так называемые мультипотенциаль-ные клетки, а не как микроглиоциты.
Для наглядности и облегчения идентификации отдельных типов нейроглиальных клеток данные об их ультраструктурной организации сведены в таблицу (см. с. 552), в основу которой положены таблицы, приведенные в работах Манаини и Валь-•берга [221 ] и Микеладзе [37 ].
13.3. ОТНОШЕНИЕ ГЛИИ К НЕЙРОНАМ, СИНАПСАМ И СОСУДАМ
В структурно-функциональной организации мозга большую роль играет архитектоника глии и нейроглиальные взаимоотношения, которые в настоящее время привлекают все большее внимание. Это определяется тем, что, согласно опубликованным в последние годы фактам, глию уже нельзя рассматривать только как трофическую или опорную ткань мозга. Гораздо важнее то, что глиальные клетки принимают участие в процессах возбуждения, памяти и т. д.
Принципиально меняет отношение к функции глии ее роль в образовании миелина, показанная электронномикроскопически [89, 91, 242, 244], и участие глии в образовании новых связей и миелина в зависимости от функциональной активности нейрона, что высказано в интересной гипотезе Ройтбака [52].
Все зто определяет интерес к структуре и архитектонике глиальных клеток. Основу современных представлений о нейроглии заложили труды Снесарева [61], Кахаля [94], Ортеги дель Рио [157—159]. Электронная микроскопия открыла новый этап в исследовании глии, раскрыв детали ультраструктуры глиальных клеток различных типов и их взаимоотношений с нейронами, капиллярами и т. д. [47, 109, 221, 238, 267]. Однако и до настоя
щего времени светооптические исследования вносят много ценного в исследование глии [4, 5, 265].
Отростки протоплазматических астроцитов (рис. 13.11) нередко образуют расширение у стенки капилляров, тесно контактируя с базальной мембраной (рис. 13.12). Обычно отростки астроцитов занимают 60—80% поверхности капилляров, но в некоторых случаях они образуют как бы футляр вокруг капилляров. Олигодендроциты часто являются сателлитами нейронов и прилегают к миелиновым волокнам (рис. 13.13), в образовании оболочек которых они участвуют.
Основываясь на морфологических данных, можно подчеркнуть некоторые функциональные свойства астроцитов и олигодендроцитов.
Основными функциями астроцитов являются опорная, трофическая (и связанная с ней выделительная), барьерная, фагоцитарная (и связанная с ней репаративная) и изолирующая. Основными функциями олигодендроцитов являются трофическая, миелипообразование и фагоцитарная, заместительная.
В настоящем разделе более подробно будут рассмотрены трофическая и изолирующая функции глиальных клеток. Трофическая функция глиальных клеток осуществляется либо одним астроцитом (сосудистая ножка астроцита, расположенная на капилляре, и другой отросток той же клетки, контактирующей с телом или отростками нейрона), либо путем астроцит—олигодендроцит—нейрон, либо, хотя это вызывает большие сомнения, по схеме астроцит—астроцит—нейрон.
Являясь основным трофическим путем и окружая капилляры, .астроциты выполняют, можно думать, важную роль в осуществлении гематоэнцефалического барьера наряду с эндотелиальными клетками и базальной мембраной капилляров.
Система нейрон—глиальная клетка—капилляр очень полиморфна и динамична. Она зависит от гемодинамики и механизмов микроциркуляции, закономерностей нейроноархитектоники и си-напсоархитектоники, уровня метаболизма нейронов и активности нервных клеток. Последнее особенно важно подчеркнуть: было отчетливо показано, что повышенная активность нейронов зрительной области коры больших полушарий и латерального коленчатого тела, вызванная стимуляцией мелькающим светом, сопровождается не только изменениями нейронов, но и заметной активацией глиальных клеток, которая выражается в некотором увеличении количества органелл клеток-сателлитов, расширении площади соприкосновения между нейроном и прилегающими к нему отростками глиальных клеток, увеличении количества отростков глиальных клеток, соприкасающихся с телом нервной клетки.
При этом следует подчеркнуть, что сателлитами нейронов могут быть и астроциты, а не только олигодендроциты (рис. 13.14).
Можно думать, что увеличение площади соприкосновения отростков глиальных клеток и тел нейронов связано с повышенным уровнем белкового обмена нейронов, так как сходные картины (естественно с большей степенью выраженности) наблюдались в нейронах латерального коленчатого тела при ретроградной дегенерации, па ранних стадиях процесса, когда синтез протеино» и нейронов резко усилен.
Наоборот, длительная зрительная депривация, вызванная содержанием крыс и кроликов в темноте в течение 2—2.5 мес, вы-вызывает некоторое уменьшение количества отростков астроцитовг что особенно заметно по периметру сомы нервных клеток.
Патологическая импульсация и патологическое возбуждение-нейронов в зеркальном эпилептическом очаге вызывают закономерную и значительную перестройку глиальных клеток. Наряду с общим увеличением количества глиальных клеток заметно возрастает процент олигодендроцитов с повышением осмиофилии цитоплазмы, в них отчетливо выявляется количество элементов! гранулярного ретикулума, полирибосом и рибосом, митохондрий. Возрастает количество олигодендроцитов-сателлитов и их отростков в нейропиле.
Одна из наименее изученных и наиболее интересных функций глиальных клеток — изолирующая. В сером веществе изолирующая функция принадлежит в первую очередь отросткам астроцитов, в белом веществе — интерфасцикулярным олигодендроцитам. Закономерная организация межнейрональных связей подразумевает не только строгую архитектонику тончайших разветвлений аксонов, дендритов и синапсов между ними, но и разделение их в необходимых случаях отростками глиальных клеток.
Это сближает исследование закономерностей распределения тончайших отростков глиальных клеток с изучением закономерностей синапсо-архитектоники, которая является важным самостоятельным направлением в нейрогистологии и вносит ряд важных положений в понимание структурно-функциональной организации мозга [15, 54].
И синапсоархитектоника, и глиоархитектоника — весьма динамичные и пластичные системы, но тесно связанные между собой, что выявляется и в замещении и аутолизе дегенерирующих окончаний глиальными клетками и в нормальном строении мозга.
Особенно отчетливо выявляется это в гломерулах подкорковых образований (рис. 13,15), например, в латеральном коленчатом теле, верхних буграх четверохолмия или зрительном бугре. Принцип гломерулярной организации заключается в том, что, основной пресинаптический аксон какой-либо системы волокон и некоторые дополнительные аксоны других систем волокон образуют между собой и на входящих в гломерулу дендритах многочисленные закономерным образом организованные синапсы, а вся эта группа аксонов и ветвей дендритов заключена в капсулу, состоящую из нескольких слоев мембран глиальных клеток.
В гломерулах мембраны глиальных клеток как бы изолируют ют внешних влияний небольшую группу синапсов, в которых осуществляется, на наш взгляд, определенный уровень интеграции влияний, приходящих по различным системам волокон.
Другим примером изолирующего влияния отростков глиальных клеток являются характерные для подкорковых образований зрительного анализатора синаптические поля. В отличие от гло-мерул, синаптические поля содержат в основном аксоны, и, следовательно, наиболее распространенной формой межнейрональных «связей являются аксо-аксональные синапсы. При этом следует подчеркнуть, что эти аксоны принадлежат нескольким системам волокон, а не двум-трем, как в гломеруле, и четкая, многослойная капсула из мембран глиальных клеток отсутствует. Однако отростки астроцитов обычно окружают синаптическое поле, полностью или частично отграничивая его от расположенных вокруг структур.
Изредка в латеральном коленчатом теле удавалось наблюдать своеобразные межнейрональные контакты между одним аксоном и одним дендритом, в которых было несколько активных зон синапсов, имеющих повышение электронной плотности синаптических мембран и скопления у пресинаптической мембраны синаптических пузырьков. Своеобразие этих контактов заключалось в том, что они были окружены капсулой из мембран глиальных клеток, как гломерула, но только внутри ее располагалось не несколько аксонов и дендритов разных систем нейронов, а один аксон и один дендрит. Такие сочленения образовывались в латеральном коленчатом теле между ретино-колликулярными аксонами и дендритами нейронов латерального коленчатого тела, посылающих аксоны в кору больших полушарий. Принадлежность аксона и дендрита к тем и другим системам волокон была установлена на основании типичных изменений при прямой и ретроградной дегенерации.
В коре больших полушарий нередко можно наблюдать, как отростки астроцитов разделяют друг от друга аксо-соматические синапсы или синапсы на крупных ветвях дендритов (рис. 13.16, 13.17). В нейропиле коры больших полушарий тонкие ветви аксонов, дендритов и глиальных клеток переплетаются так причудливо и сложно, что порой даже идентификация отростков глиальных клеток представляется весьма сложной задачей (см. рис, 13.16). Если веточки дендритов можно идентифицировать по наличию в них трубочек, шипики — по шипиковому аппарату, аксоны — по наличию синаптических пузырьков (дополнительным и четким критерием для аксонов и дендритов служат синаптические мембраны в области синапса), то отростки астроцитов можно отличить по их неровному, неправильному контуру. Отростки протоплазматических астроцитов как бы заполняют свободные промежутки между элементами нервных клеток (отростки фиброзных астроцитов легко отличаются по наличию в них пучков нейро
фибрилл). Следует отметить, что отростки астроцитов в некоторых: случаях как бы разделяют нейропиль на отдельные участки или отдельные скопления синапсов (см. рис. 13.17).
В то же время, анализируя взаиморасположение аксонов, дендритов, синапсов и отростков глиальных клеток, возникает вопрос — отростки глиальных клеток только ли изолируют одну группу синапсов от другой или наряду с этим они как-то участвуют в механизмах синаптической передачи? Точно так же — увеличение площади соприкосновения с возбужденным нейроном и изменение ультраструктуры олигодендроцитов, являющихся его-сателлитом, — определяется ли это только повышенными трофическими потребностями активно работающего нейрона или вовлечением олигодендроцита в функцию нейрона? Подходя только с морфологических позиций к решению этого вопроса, трудно дать исчерпывающий ответ. По-видимому, здесь необходимы комплексные морфофизиологические эксперименты, продолжающие исследования Ройтбака [52] и Аладжаловой [3].
Следует подчеркнуть, что глиальные клетки являются весьма, лабильными и их изменения, хотя они еще изучены пока явно недостаточно, не только резко меняют вид самой глиальной клетки, и структуру ткани в целом.
При некоторых патологических процессах мозга (гипоксия, сосудистые заболевания, некоторые демиелинизирующие заболевания и т. д.) состояние и степень поражения глиальных клеток определяют возможность репаративных и компенсаторно-восстановительных процессов.
Отек и набухание мозга прямо связаны' с увеличением размеров астроцитов и их отростков.
Известный из патогистологии факт о периваскулярном отеке или расширении перикапиллярных пространств, связанный с целым рядом патологических процессов в центральной нервной системе, в настоящее время находит четкое объяснение в выраженном набухании отростков астроцитов, прилежащих к сосудам.
Изменения ультраструктуры глиальных клеток, как правило, взаимосвязаны с изменениями нейронов и соотношений между глиальными и нервными клетками. Например, при гипоксии одним из первых симптомов поражения мозга является изменение межнейрональных контактов, выражающееся в набухании пресинаптического отростка, перераспределении и частичном изменении формы и размеров или даже разрушении синаптических пузырьков, появлении отдельных фибрилл и т. д. Одновременно вблизи измененных синаптических контактов видны несколько расширенные отростки глиальных клеток, содержащие скопления гранул гликогена. Позднее наблюдается набухание концевых ножек астроцитов, содержащих пакеты гранул гликогена и вакуоли, которые локализуются у тел нейронов, в ультраструктуре которых начинаются дистрофические изменения.
13.4. ГЛИЯ В ТКАНЕВОЙ культуре
Исследователи всегда стремились к изучению живых, неповрежденных клеток. Наиболее распространенным методом, дающим возможность сохранить глиальные и нервные клетки в живом состоянии достаточно длительное время, является метод культивирования вне организма на естественных или искусственных питательных средах.
Несмотря на измененные условия существования, по прошествии периода адаптации [27] культивируемые клетки в основном сохраняют присущую им структурную организацию и функциональную активность, что создает благоприятные условия для использования таких клеток в качестве моделей [104, 105, 160].
Клетки нейроглии морфологически и функционально неоднородны и обладают различно выраженной способностью к таким общим проявлениям активности, как фагоцитоз и миграция. Высокая степень гистобластической потенции глиальных клеток способствует образованию в условиях культивирования большого многообразия структур. Особенно сложным является анализ картин, возникающих на периферии эксплантата, в области зоны роста кусочка, взятого от эмбрионов или новорожденных животных. Поэтому во многих исследованиях, посвященных превращениям нейроглии в условиях тканевых культур, вопросам идентификации клеток уделяется большое внимание [23, 25, 43, 48, 63 , 65, 131, 141, 161, 212 , 228, 275].
Разработка новых методов культивирования и повышение разрешающей способности фазоконтрастной микроскопии позволяют в настоящее время идентифицировать нейроглию на отдельные клеточные типы.
Накаи и Окамото [228] подробно изучены превращения нейроглии в культуре и описаны основные признаки, характерные для клеток каждого глиального типа. По данным этих авторов, астроциты отличаются относительно крупным перикарионом (диаметр 30—50 мкм), содержат одно ядро круглой формы. В зоне цитоплазмы встречаются мелкие гранулы. Многочисленные отростки часто несут мембранные расширения, которые могут сливаться и образовывать ундулирующую мембрану. Отростки соседних клеток обычно контактируют, что ведет к образованию сетевидной структуры. Олигодендроциты отличаются значительно меньшим перикарионом (диаметр около 10 мкм). От тела клетки отходят несколько отростков, причем отходят они от перикариона без конечного расширения, характерного для астроцитов (рис. 13.18). Большие трудности представляет идентификация в культуре микроглиоцитов, поскольку у них хороша выражена способность к миграции и фагоцитозу, что свойственно также соединительнотканным клеткам и лейкоцитам, также выселяющимся в зону роста. Хлопин [63, 64] специально рассматривает вопрос относительно симуляции нейроглией клеточных
производных мезенхимы и нейронов. Для идентификации нервных клеток обычно используют окраску, выявляющую вещество Ниссан, а также метод фазового контраста. Следует отметить, что нервные клетки после выхода из эксплантата в зону роста содержат меньшее количество субстанции Ниссля, чем нейроны, оставшиеся в эксплантате [161]. Одним из признаков, характерных для нервных клеток, может служить также высокая степень импрегнации [43].
Исследуя гистогенез различных отделов центральной нервной системы в тканевой культуре, удается проследить дифференцировку эмбриональных глиальных клеток на отдельные клеточные типы [49|. Глиобласты обычно представлены грушевидными клетками, несущими два полярных отростка. Отличие последних от отростков, несущих варикозные расширения, заключается в способности отдельных участков нитевидных отростков распластываться на субстрате. На конце отростки несут филоподии, имеющие вид ундулирующих мембран. Дифференцировка таких клеток ведет к увеличению объема ядра и цитоплазмы. Цитоплазма становится базофильной. Эти изменения, происходящие в течение первой недели культивирования, приводят к появлению астро-бластов. Дифференцированные астроциты обладают большим числом отростков, из которых один может быть магистральным и достигать 300—700 мкм. Возможно, этот отросток является аналогом так называемых асгроцитных ножек, устанавливающих контакт со стенкой капилляров. В крупных отростках можно обнаружить глиофибриллы. Путем многократного пасажа может быть получена чистая культура волокнистых астроцитов [229].
Дифференцировка глиобластов в олигодендробласты ведет к появлению веретеновидных клеток с относительно короткими отростками и двоякопреломляющиии каплями липоидов в цитоплазме [49]. На число отростков олигодендроцитов (сателлитов) оказывают влияние условия культивирования [44]. Между незрелыми олигодендроцитами и астробластами существуют переходные формы, которые впоследствии превращаются в астроциты. В то же время среди эмбриональных глиальных клеток могут наблюдаться такие, которые отнести к какой-либо группе затруднительно, эти клетки округлой формы обладают отростками с выраженными ундулирующиии мембранами и многочисленными цитоплазматическими включениями [141]; очевидно, они являются переходными формами между основными типами глиальных клеток.
После миграции глиальных клеток из состава эксплантата часть из них сохраняет отростки, благодаря которым осуществляются межклеточные контакты. Конгакты^между глиальными клетками в условиях тканевых культур выполняют не только механическую функцию, но играют важную роль в регуляции колебания количества белка в телах глиальных клеток.
Рис. 13,8. Перинейрояальный олигодендроцит коры головного мозга кошки. (Х39 ООО).
Н,, Нг, Н3 — нейроны. Стрелками указана топкая астроцитарная пластинка, разделяющая олигодендроцит и нейрон Ht. Остальные обозначения см. рис. 13.5.
III Заказ 496
Рис. 13.9. Олигодендроциты коры головного мозга кошки.
Стрелитлги
указаны микротрубочки. Остальные обозначения см. рис. 13.5. Увел. А — 36 000, Б — 37 000.
Рис. 13.9 (продолжение)
Рис. 13.10. Непосредственный контакт олигодендроцита с прссинаптпческой терминалью (указан стрелками).
А — кора головного мозга, х45 ООО (по [41]); Б — внутреннее коленчатое тело, х51 ООО;
Рис. 13.10 (продолжение).
В — микроглиоцит корьЦголовного мозга^копии, Х24 ООО. Обозначении см. рис. 13.5 и 13.7.
Рис. 13.11. Астроцит. Кора больших полушарий кошки. хЗО ООО.
Рис. 13.12. Часть стенки капилляра с прилежащими к ней отростками астроцитов. Кора больших полушарий. ХЗО ООО.
Рис. 13.13. Олигодендроцит с отчетливо выделяющейся электронной плотностью цитоплазмы. Он, с одной стороны, сателлит нейрона, с другой — при лежит к миелиновым волокнам. Х18 ООО.
Рис. 13.14. Астроцит — сателлит нейрона в зоне начала дендрита. Кора больших полушарий, ХЗО ООО.
Рис. 13.15. Гломерула латерального'коленчатого тела, X 57 000.
Рис. 13.16. Нейропиль коры больших полушарий с многочисленными сП' напсами и отростками глиальных клеток. хЗО ООО.
Pile. 13.17. Аксо-соматическле и аксо-дендрптпческпе синапсы в коре больших полушарий. X 30 000.
Рис. 13.18. Отростки глиальных клеток в культуре ткани.
А — олигодендроцит из мозолистого тела шестидневного котенка ла 6-й день культивирования, Х1250; Б—фиброзный астроцит ий мозолистого тела трехдневпого котенка на 3-й день культивирования, Х750 [223].
Рис. 13.21. Электронная микрофотография поперечного среза развивающегося седалищного нерва девятидневного крысенка. Различные стадии миелинизации аксонов: безмякотные (ЛЛ), окруженные цитоплазмой шванновской клетки —Ад), с одним витком меваксона (Л4) и миелинизированный аксон (А6). Х20 ООО. [245].
Рис. 13.24. Ультраструктура мембран периферического миелина с главными плотными и интрапериодическими линиями; последние местами расцеплены. Электронная микрофотография, Х150 ООО.
Il
Рис. 13.26. Поперечное сечение зрительного нерва 15-дневного крысенка. Различные стадии образования мезаксоном рыхлого миелина, между ламел-ламп которого расположена цитоплазмы олигодендроцита. Электронная микрофотография, Х44 ООО. [245].
Звездочкой помечен внутренний мезаксон аксона А.
Рис. 13.27. Соединения отростков олигодендроцита с миелпиом многих нервных волокон. Методика Ортеги. ХЮОО.
О — отросток олигодендроцита, М — миелин.
С помощью прижизненной интерферометрии удалось показать, что сухой вес тела мигрировавших в зону роста изолированно лежащих глиальных клеток ритмически колеблется. Колебательные изменения сухого веса могут достигать 50%. Аналогично меняется размер тела клеток; предполагается, что изменения сухого веса тела глиальных клеток связаны с периодической миграцией цитоплазмы в отростки и обратно. Обращает внимание возникновение синхронных колебаний сухого веса в контактирующих глиальных клетках. Экспериментально доказано значение межклеточного контакта в возникновении синхронных изменений |23, 56, 57]. Возможно, наблюдаемые колебания сухого веса являются следствием пульсации глиальных клеток.
Подробно изучено поведение глиальных (шванновских) клеток в культурах чувствительных ганглиев, уже в первые часы после эксплантации видны одиночные нейриты, выходящие из плотных краев ганглия 118, 31, 45, 230, 2701 и, по-видимому, проникающие между клетками оболочки или направляющиеся в разрывы этой оболочки, образовавшиеся при ее повреждении в процессе эксплантации. В течение первых суток наблюдения можно отметить значительный рост нейритов (до 1 мм и более). Рост отростков имеет преимущественно радиальный характер. Концы развивающихся нейритов имеют цитоплазматические расширения, конусы роста, снабженные псевдоподиями. Движения псевдоподий хаотичны, они как бы «ощупывают» растущими волокнами поверхность, по которой в дальнейшем будет происходить их рост. По-видимому, первоначальный рост нейритов отражает некоторые достаточно ориентированные ростовые силы [196], хотя видимый путь роста зависит от факторов окружающей среды и описанных под термином «контактное водительство» [302, 303].
В первые сутки и в еще большей мере в последующие дни отмечается выход в зону роста клеток, образующих оболочку ганглия — фибробластов. Форма и размеры их самые различные. Для клеток этого ряда характерно округлое или овальное светлое ядро, содержащее большое количество вакуолей. Клетки быстро распластываются на коллагене, движение их происходит за счет образующихся псевдоподий, движение не имеет какой-либо определенной направленности. Значительная часть клеток быстро дегенерирует.
Начиная с конца первых суток культивирования в зоне роста отмечается появление веретенообразных шванновских клеток. Число их в последующие дни заметно увеличивается, однако в своем движении фибробласты обгоняют клетки глии, и перемещение шванновских клеток осуществляется как бы по подстилающему слою клеток оболочечного типа. Было установлено, что шванновские клетки перемещаются активно [194], при этом подчеркивалась разница в поведении свободно мигрирующих и прикрепившихся к аксонам клеток. Те шванновские клетки, которые, очевидно, не участвуют в миелинообразовании
30 Общая физиология аервной системы
561
и не устанавливают контактов с аксонами, обнаруживают пластичность формы и миграционную и пролиферационную способность. В этой ситуации они не обнаруживают тенденции к образованию стабильных ассоциаций между собой. Однако при изменении некоторых метаболических и функциональных показа-
Рис. 13.19. Перемещение шванновских клеток вдоль миелинизирующегося аксона куриного эмбриона в течение девяти дней наблюдения [223],
Цифры слева — дни наблюдения одного и того же волокна с шестью шванновскими клетками.
телей они связываются с осевыми цилиндрами и их миграционная способность исчезает 1226].
Шванновские клетки в условиях культуры передвигаются вдоль аксона, и таким образом значительно меняется их положение в течение нескольких дней наблюдения (рис. 13.19). Шванновские клетки in vivo в нервах головастиков тоже медленно передвигаются вдоль нервных волокон, могут переходить с одного волокна на другое, выпуская псевдоподии [277].
При введении в эксплантат ткани заднекорешкового ганглия искусственных волокон из нейлона, стекла или вольфрама диаметром 5—25 мкм было обнаружено, что шванновские клетки прикреплялись к ним и покрывали их через несколько дней по всей длине: многие клетки двигались вдоль искусственного волокна, пульсируя во время движения. Шванновские клетки, вращаясь
,5В2
вокруг искусственных Волокон, образовывали вокруг них миелин [108].
С помощью замедленной киносъемки изучалось движение шванновских клеток в диссоциированных культурах заднекорешковых ганглиев эмбрионов цыплят и было показано, что первоначально разделенные клетки в процессе культивирования уста-
Рис. 13.20. Динамика движения отростков олигодендроглиальной клетки, находящейся в контакте с пирамидным нейроном. Зона роста. Зрительная кора мозга новорожденной белой крысы. 8 суток культивирования. Зарисовки. Увел. ок. 7Хоб. 90.
Цифрами указано время в мин, прошедшее с начала наблюдения.
навливают определенные связи друг с другом; сателлитные клетки постепенно окружают сому нейрона, шванновские клетки подходят к регенерировавшим отросткам нейритов, вдоль которых и происходит их дальнейшее перемещение со скоростью до 15 мкм в час [191]. Сателлит, прилежащий к нейрону, может 'оставаться неподвижным, в то время как его отростки находятся к постоянном движении, наползая на тело нейрона; меняется и 'количество отростков (рис. 13.20). Это ведет к колебанию площади 'контакта глиальной клетки с нейроном [55]. Двигательная ак*
тивность отростков олигоглиальных клеток стимулируется введением в питательную среду К+ [58],
Относительно движения глии в эксплантатах различных отделов центральной нервной системы число наблюдений невелико [149—151, 249]. Миграция клеток в культурах центральной нервной системы происходит следующим образом: вначале отмечается движение макрофагов и клеток микроглии, затем в зоне роста появляются олигодендроциты и, наконец, астроциты. Миграция астроцитов осуществляется медленными скользящими движениями за счет образования колеблющихся мембранных псевдоподиоподобных окончаний [2261. Однако имеются утверждения, что одним из важных свойств астроглии является ее низкая миграционная способность [49], что приближает ее по данному показателю к нейронам, сома которых, очевидно, неспособна к активной миграции 1196].
В краевой зоне эксплантата коры мозга новорожденной крысы наблюдаются передвижения олигодендроцитов, вполне четко изменяется расстояние между наблюдаемым олигодендроцитом и соседними элементами, процесс этот стимулировался увеличением [К+]н [58].
Одной из весьма характерных особенностей глиальных клеток в культуре является их сократительная активность, которая особенно свойственна олигодендроцитам и шванновским клеткам [126]. Еще в 1935 г. в олигодендроцитах глиомы случайно были обнаружены «необычные ритмические пульсации» [100]. Это наблюдение побудило к проведению более систематических исследований с использованием замедленной киносъемки, в которых была установлена пульсаторная активность нормальных олигодендроцитов in vitro [197], Более поздние наблюдения подтвердили установленный факт [78, 224, 248]. В большинстве названных работ были использованы препараты мозолистого тела [197 ], хотя имеются наблюдения, что олигодендроциты серого вещества коры головного мозга человека ведут себя в культуре аналогичным образом [196], равно как и глиальные клетки в культурах зрительного нерва [136].
Пульсация олигодендроглиальных клеток носит ритмический характер с систолической фазой длительностью примерно 1.5 мин и фазой расслабления, длящейся 3.5—4 мин. Частота сокращений у разных клеток различная и может варьировать от 2 до 20 в час [247]. Сами пульсации проявляются в виде толкательных движений с уменьшением объема тела клетки и соответствующим набуханием клеточных отростков. Измерения показывают, что укорочения основных отростков при этом не происходит [196].
Сократительная активность клеточных тел астроцитов могла усиливаться или вызываться под влиянием стимуляции электрическими импульсами прямоугольной формы, при этом ответная реакция клеток наблюдалась либо непосредственно вслед за при-564
воженными стимулами, либо с латентными периодами различной длительности от 1.5 до 4 мин [143].
Глиальные клетки продолжали пульсировать и после воздействия MgCla, СаС12 и даже анестетиков. Движение амебы также не подавлялось в этих условиях [285].
В ответ на сильное электрическое раздражение непосредственно возникало сокращение: фаза сокращения длилась 1— 3 мин, фаза расслабления 10 мин [285]. Иногда наблюдались синхронные вздрагивания массы глиальных клеток в отсутствие внешнего стимула; это указывает на наличие какого-то взаимодействия между клетками: продолжительность этого медленного сократительного процесса в глиальных клетках сравнима с продолжительностью распространяющейся депрессии Леао в коре.
«Электрические ответы» глиальных клеток на сильное электрическое раздражение — обратимое изменение потенциала покоя с одновременным уменьшением импеданса мембраны, зависящие от интенсивности стимула, — как будто сигнализирует начало последовательности событий, приводящих к сократительным ответам; временные отношения между электрическим и сократительным процессами в глиальных клетках в некоторых отношениях подобны наблюдаемым в гладких мышцах [285].
Реснитчатые эпендимальные клетки, относящиеся к нейроглии, рассматривают как самые примитивные нейроглиальные клетки центральной нервной системы; у некоторых низших позвоночных они представляют единственный вид глии. Реснитчатый аппарат продолжает функционировать до 35 мин после исчезновения трансмембранной разности потенциала и деструкции клетки от введения микроэлектрода.
Ламсден [196] не счел, однако, возможным признать существование спонтанной активности у клеток астроглии, считая этот феномен специфическим для олигодендроглиальных и шванновских клеток; наблюдавшаяся [102, 141 ] сократительная активность, по его мнению, относилась к клеткам переходного типа, а не к истинным астроцитам. Возможность существования переходных форм от олигодендроглии к астроглии в культуре признается рядом исследователей [245].
В культурах ткани ц. н. с. было изучено влияние некоторых фармакологических веществ на сократительную способность олигодендроглиальных клеток, В частности, было показано, что вазоконстриктор серотонин вызывал длительное тоническое сокращение олигодендроцитов [77, 126, 224], норадреналин приводил к состоянию их расслабления [126]; аналогичным образом клетки олигодендроглии реагировали и на введение в среду хлорпромазина [229]. Под действием барбитала натрия олигодендроциты прекращали пульсирующие движения, увеличивались в размерах и возрастала их тинкториальная способность; но через час пульсирующие движения восстанавливались с ускоренной частотой [126]. Увеличение размеров клеток объясняется тем, что
происходит задержка вещества, которое в норме они выделяют во время фазы сокращения; в это время они сильнее окрашиваются на неспецифическую холинэстеразу.
Ацетилхолин (0.5 мг/мл) и эзерин (0.0001—0.001 мкг/мл) ускоряли движения олигодендроцитов вокруг тел нейронов и аксонов и усиливали пульсирующие движения [126]. В исследовании Наказава [229] олигодендроциты в культуре производили 8—10 сокращений в час; не было особых отличий в зависимости от срока инкубации. При перфузии средой, содержащей 25 мкг/мл хлорпромазина (аминазина), происходило увеличение частоты сокращений с 8—13 до 17—19. Серотонин (10 мкг/мл) то же увеличивал частоту сокращений. Резерпин (50 мкг/мл) не оказывал действия, но в комбинации с серотонином происходила остановка сокращений. Поскольку олигодендроциты являются самыми многочисленными глиальными клетками в мозге, обладают высоким окислительным метаболизмом и связаны с миелинообразованием, влияние фармакологических веществ на них представляет специальный интерес.
Наблюдения в органных культурах ткани периферической нервной системы (тригеминальные и задяекорешковые ганглии) показали, что шванновским клеткам присуща такая же сократительная активность, как и клеткам олигодендроглии [18, 67, 106 , 250]. Время и ритм пульсаций варьируют от клетки к клетке. Длительность фаз пульсаций неодинакова, чаще наблюдается более короткая, систолическая, по сравнению с более длительной, диастолической, фазой. Длительность полного цикла сокращения клетки по разным данным различна: от 5—8 [250] до 15—18 мин [18, 106] и даже до 72 мин [77]. Удлинение цикла связывается с возрастом животных, ткань мозга которых бралась для культивирования; частый ритм пульсаций у клеток из эмбриональной ткани и из ткани новорожденных по сравнению с клетками из ткани взрослых животных объясняется более высокой скоростью обменных процессов в незрелой ткани [67]. В различных клетках обнаруживается разное число пульсаций, так же как и разные интервалы между фазами — от нескольких до десятков минут. Сократительная активность шванновской клетки проявляется главным образом в изменениях объема клетки на уровне ядра. В фазе диастолы поперечник шванновской клетки больше в 1.5— 2 раза, чем в фазе систолы. По данным Померат [248], пульсация наиболее сильно выражена к 6—9 дню культивирования, хотя она может быть обнаружена и через 25 дней после посева.
В диссоциированных культурах сократительная активность шванновских клеток не наблюдалась [191].
Функциональное значение пульсаторной активности глии еще окончательно не выяснено. Пульсация олигодендроглиальных и шванновских клеток может играть важную роль в процессе миелинообразования, а также в продвижении питательных веществ в различные структуры нервной ткани. Она может служить 566
для проталкивания аксоплазмы нейрона и влиять на ток жидкости в межклеточных пространствах 1108].
Размножение клеток нейроглии в тканевых культурах происходит путем митотического [195, 248] и амитотического [48] деления. Накаи [227] сравнивает пролиферационную активность клеток нейроглии в культуре с активностью этих клеток при патологических процессах в организме. Такое сопоставление верно отражает условия, в которых растут клетки культуры. В то же время Хлопин [65], анализируя условия культивирования, отмечает, что рост и пролиферация клеток в культуре носят особый характер, поскольку эти же процессы в условиях травмы организма тесно связаны с явлениями воспаления и регенерации.
Пролиферативные процессы часто ведут к увеличению числа ядер в культивируемых астроцитах, что может быть следствием амитотического или митотического деления ядра, без последующей цитотомии, многополюсного митотического деления ядра без деления перикариона и образование синцития, благодаря слиянию одноядерных глиальных клеток [227]. Аномальные митозы ведут к образованию анеуплоидных клеток [48]. Авторадиографическое изучение пролиферации глиальных клеток спинномозговых ганглиев и спинного мозга крыс и мышей в культуре [202] обнаружило максимальное увеличение включения 3Н-тимидина в глиальные клетки на 7—12-й и 15—19-й дни культивирования. Нервные клетки не метились. Ряд авторов, исследуя культуру головного мозга 7-дневного куриного эмбриона [168], обнаружили метку не только в астробластах, олигодендробластах, но также и в нервных клетках.
w Внесение в питательную среду растущих нервных волокон стимулирует митотическое деление шванновских клеток.
Полученные в последнее время данные электронной микроскопии указывают на тесный контакт между глиальными и нервными клетками, выражающийся в глубоком проникновении отростков в цитоплазму клетки или в установлении специализированных контактов [42, 68, 190]. Такая интимная связь обусловливает корреляцию, существующую в белковом обмене между нервной клеткой и сателлитом [162]. В этом отношении интерес представляет взаимосвязь между глиальными и нервными клетками, устанавливающаяся в процессе культивирования [126].
В некоторых случаях удается избирательно ускорить дифференцировку диссоциированных корковых нервных клеток по сравнению с клетками глии, например меняя концентрацию денатурированного коллагена, используемого в качестве субстрата [165]. Число сателлитов может достигать пяти. Они обычно тесно прилежат к перикариону, но в области зоны роста нервные клетки, распластываясь по субстрату, оказываются лишенными сателлитов и быстро гибнут [17, 1651. Естественно, что частота контактов между глиальными клетками значительно бблыпая в толще эксплантата, чем в области зоны роста [304].
Согласно данным ряда исследователей, в процессе культивирования нервные клетки участвуют в установлении синаптических связей 1173, 256, 280]. Характерно, что и в условиях диссоциированной культуры спинного мозга нервные клетки этой способности не теряют. Возникшие синапсы могут быть идентифицированы как возбуждающие и тормозящие [114].
Существующие данные дают возможность считать, что присутствие в диссоциированной тканевой культуре глиальных клеток стимулирует образование межнейрональных связей. Барон и др. [288] наблюдали появление контактов между нервными клетками спинномозговых ганглиев в материале, взятом от новорожденных крыс: авторы важное значение придают фактору роста. Однако в культурах фракции только нервных клеток даже в присутствии фактора роста были нарушены процессы прикрепления клеток и образования межнейрональных связей. Предполагается активное участие глиальных клеток в процессах аг-грегации диссоциированных клеток из мозга новорожденных крыс и образование ими концентрических структур, сходных со структурами, возникающими при нормальном миелогенезе [66]. Сохранение глиальными клетками в диссоциированных культурах специфической активности подтверждается способностью таких клеток к образованию миелина [268].
Исследование глиальных клеток в тканевой культуре позволяет обнаружить ряд структурных и функциональных особенностей при осуществлении процессов миелинизации, образования межклеточной субстанции, установлении межклеточных контактов, явлений пульсации и т. д. Особую ценность в этом отношении представляют прижизненные исследования, благодаря которым удается изучить превращения глиальных клеток в динамике. Сохранение глиальными клетками присущей им специфичности дает возможность использовать эти данные для понимания реакций клеток в условиях организма.
13.5. ОНТОГЕНЕЗ И ФИЛОГЕНЕЗ НЕЙРОГЛИИ
13.5.1. ОНТОГЕНЕЗ НЕЙРОГЛИИ
Одну из первых попыток объяснить происхождение глиальных клеток предпринял Гис [147]. Среди клеток, прилегающих к просвету нервной трубки, он выделил «герминативные» клетки, из которых, по его мнению, в дальнейшем возникали нейроны. Остальные радиально ориентированные клетки колончатого эпителия он назвал спонгиобластами и предположил, что именно из них развивается глия.
Несмотря на высказанное десять лет спустя мнение Шапера, что однородные эпителиальные клетки нервной трубки способны порождать как нервные, так и глиальные элементы, концепция Гиса преобладала до середины тридцатых годов XX в, В 1935 г, 568
Зауэр 1263] обнаружил, что герминативные клетки Гиса представляют собой не что иное, как биполярные клетки нервной трубки. Ядра этих клеток передвигаются в зависимости от фазы митотического цикла в определенную область радиально ориентированной клетки и в метафазе прилегают к просвету нервной трубки. Тем не менее термины «спонгиобласт», а позднее «глиобласт» устойчиво закрепились для обозначения предшественников глии.
В начале нашего века Кахаль [93] пришел к заключению, что глия происходит из элементов примитивной медуллярной пластинки, а также выделил в нервной системе отличающиеся от нейронов и астроцитов клетки, названные им «третьим элементом». Несколько позже Ортега [155] с помощью разработанного им метода импрегнации углекислым серебром разделил «третий элемент» на олигодендроглию и микроглию.
Астроциты и олигодендроциты он объединил под общим название «микроглия» и так же, как Кахаль, пришел к выводу об их нейроэктодермальном происхождении. Микроглию он твердо отнес к клеткам, возникающим из мезенхимы. Мезенхимные компоненты нейроглии были еще в прошлом столетии выделены рядом исследователей, но особенно четко Робертсоном, которому принадлежит термин «мезоглия». Данные этого автора основываются на применении разработанного им же метода импрегнации нервной ткани солями платины, которым, однако, ие пользовалось большинство авторов, не скупившихся на критические замечания по адресу концепции о мезенхимном компоненте в составе нейроглии.
Сейчас принято, что почти все типы нейронов ц. н. с. и макроглии имеют общего родоначальника, а именно клетки эпителия нервной трубки, которые называются различными авторами по-разному: герминативными клетками, эпендимными клетками, примитивными эпендимными клетками [272], матричными клетками [120], нейроэпителиальными герминативными клетками [164], медуллярным эпителием [74, 314]. После рождения источником глиальных клеток служит субэпендимная зона. Полагают также, что небольшое количество глиальных клеток образуется в наружном зернистом слое мозжечка крыс и после нрекращения продукции микронейронов на 15—20 день жизни [71, 122]. Пока неясно, дают ли одни матричные клетки нейроны, а другие глию или они полностью эквипотентны в этом отношении. Матричные клетки кажутся однородными как по ультраструктурным особенностям [80, 212, 298], так и по характеру синтеза ДНК и кинетике клеточной пролиферации [124].
Невозможно привести все предлагавшиеся схемы цито-и гистогенеза нервной системы. В пейроонкологии до настоящего времени сохранила свое значение схема гистогенеза нормальной нервной системы и нейроэктодермальных опухолей мозга, предложенная Бейли и Кушингом [74] (см. схему 1). Они считали, что медуллярный эпителий нервной трубки, продуцируя незрелые нейробласты, пинеальную паренхиму и хориоидальный эпителий,
о
Я
О
ей и X о № Ч
щ я
Схема 1 Медуллярный эпителий (по [314])
5 Я
* К а-Я
Ф
о £ is! КС » а> С Ф
порождает также спонгиобласт и медуллобласт. Из спонгиобласта развиваются эпендимные элементы и астробласты. Медуллобласт является в основном предшественником олигодендроцитов, но может также образовывать астро-и нейробласты. Однако морфологические критерии для выделяемых этими авторами промежуточных клеточных форм оказались недостаточно четкими. В первую очередь это относится к понятию медуллобласт.
Отсутствие у ранних мигрантов из матричной зоны признаков, позволяющих выявить потенции их дальнейшего развития, привело к упрощению схем гистогенеза ц. н. с., что охотно принимается гистологами, но вряд ли приемлемо для исследователей в области нейроонкологии. Дело в том, что число морфологических типов глиом превышает число незрелых и зрелых глиальных элементов, выделяемых при изучении нормальной нервной ткани. Это, вероятно, говорит о большем многообразии глии. К тому же при исследовании медуллобластомы в культуре ткани выделяются элементы, имеющие признаки нервных и глиальных клеток [198], что в какой-то мере может свидетельствовать о существовании общего плюропотентного предшественника.
Векслер и Меллер [299], предлагая свою схему (см. схему 2), особо выделяют полярный глиобласт (ранее называвшийся «полярным спонгиобластом») как элемент, обладающий очень широкими потенциями дифференцировки. Если эти клетки остаются близко у поверхности желудка, они превращаются в глио-эпителиальную эпендимную клетку. Если же они теряют связь с внутренней поверхностью, то дифференцируются в типичный мигрирующий глиобласт. Эти авторы подразделяют дифференцировку нервной системы на три стадии: 1) стадию недифференцированных матричных клеток, 2) стадию первичной дифференцировки и 3) стадию окончательной дифференцировки и созревания. Во второй стадии, в качестве предшественника макроглии, этот автор выделяет только одну клеточную форму — глиобласт. Однако в третьей стадии исследования ультраструктуры развивающейся глии позволили выделить целый ряд промежуточных форм астро-
Схема 2
Матричная клетка (по [299])
| ф
Эпендиме- *—> Полярный бласт эпендимобласт
| или глиобласт
Глиобласт
Хориоидальная эпителиальная кцеткд
Эпендимная клеткд
Астроцит
Олигодендроцит
Ф Нейробласт
Примитивный Ф
Униполярный Ф
Мультиполяр-г пый 4 Цервцая цдетка
цитов и особенно олигодендроцитов на разных этапах их созревания.
Момент, в который глиобласт «выбирает» окончательный путь развития, и способствующие этому условия точно неизвестны. Косвенным свидетельством в пользу довольно поздних сроков такого «выбора» могут служить сообщения о клетках, занимающих промежуточное положение между астроцитами и олигодендроцитами [140, 254]. Имеются противоречивые мнения о возможности превращения олигодендроцитов в астроциты. Такое превращение описано в культуре нервной ткани [49, 227]. Эта возможность, однако, отрицается другими исследователями, работавшими методом электронной микроскопии [89, 221, 283]. Трудности этой трактовки известны каждому исследователю, пытавшемуся идентифицировать те или иные клетки в тканевых культурах. Не менее велики трудности идентификации и при использовании электронного микроскопа.
При попытках проследить развитие глиальных клеток следует четко разграничить возникновение ранних предшественников глии — глиобластов — и появление в нервной ткани клеток, достаточно зрелых, чтобы отнести их к тому или иному глиальному типу.
Если размножение нейронов происходит короткое время только в матричной зоне, то эмбриональные глиобласты сохраняют способность к размножению повсеместно, т. е. и за пределами этой зоны. Например, при прекращении образования нейронов после 8-го дня инкубации число митозов в матричной зоне заднего и спинного мозга куриного зародыша резко падает [121, 137], но вспышки пролиферативной активности глиобластов в различных областях мозгового плаща могут наблюдаться в более поздние сроки. Грачева [20] обнаружила увеличение синтеза ДНК в глиобластах спинного мозга крысы на 18-й день эмбрионального развития, а в головном мозге в тех же масштабах на 20-й день. В верхних буграх четверохолмия синтез ДНК среди глиальных клеток наиболее высок на третий день после рождения. В спинальных ганглиях 15-дневного крысиного эмбриона 60% нервных клеток участвовало в пролиферации, тогда как на 20-й день их пролиферативная активность сильно снижалась.
Оценивая эти данные, Грачева [20] подчеркивает, что повсеместная пролиферация глиобластов вне матричного слоя указывает, что спонгиобласты составляют лишь основу, из которой в дальнейшем разовьются глиальные элементы. Она обращает внимание на тесную связь пролиферации глиобластов с дифференциацией нейробластов и формированием нервных связей и предполагает, что при формировании глиобластов имеется два этапа: 1) выселение глиобластов из матричного слоя почти одновременно с нейробластами, создающее исходную клеточную популяцию для формирования нейроглии; 2) пролиферация глиобластов на месте в связи с дифференциацией цейробцастов и их отростков, что сцособствует 573
обеспечению нервных клеток необходимым количеством глиальных элементов. Обусловленность окончательной дифференцировки глиобластов созреванием нервных клеток, возможно, объясняет, почему глиобласты остаются так долго «спящими» до того, как начнут делиться.
В дальнейшем Грачева [22], изучая гистогенез коры больших полушарий крысы с помощью двойной метки с 3Н- и 14С-тимидином, показала, что глиобласты мигрировали в соответствующий слой коры через 1—2 сут после укомплектования его нейробластами, одновременно с продолжающимся выселением нейробластов в следующие слои коры. Полученная глиобластами метка утрачивалась к 30-му дню, что свидетельствовало об их продолжающейся пролиферации. Таким'образом, матричная зона одной и той же генерации поставляет в кору как нейробласты, так и глиобласты.
Глиобласты внутри матричного слоя не могут быть идентифицированы, но их можно легко узнать после миграции в белое вещество, где отсутствуют нейробласты [76, 299]. Эти клетки обычно имеют небольшое веретенообразное тело с овоидным ядром, хроматиновые глыбки которого тесно прилегают к оболочке. В слабо развитой цитоплазме заметен комплекс Гольджи и много свободных рибосом. Эндоплазматический ретикулум обычно плохо развит. Глиальные волокна отсутствуют.
На основании электронномикроскопического изучения зрительного нерва крысы Вон и Питерс [289, 292] выделили в качестве основного элемента развития нейроглии так называемый «малый глиобласт». По их предположению, эта клетка гипотетически является дериватом клеток матричной работы и способна повторно вступать в генеративный цикл или дифференцироваться в «большой глиальный предшественник», который в дальнейшем и созревает в’один из типов глии.
Ряд авторов [49, 74, 211, 291, 293] выделяют также астробласт как форму, непосредственно предшествующую зрелому астроциту. Он напоминает глиобласт, но уже имеет многочисленные радиальные отростки и гликоген в теле клетки и концевой ножки. При созревании астробласта в астроцит ядерное содержимое становится более гомогенным, расширяются цистерны эндоплазматического ретикулума, митохондрии удлиняются и становятся менее плотными, увеличивается число глиальных волокон, в то время как микротрубочки делаются менее заметными [293]. У грызунов развитие астроцитов происходит в основном в пренатальном периоде и заканчивается через месяц после рождения [251].
Большая часть данных, полученных как на световом, так и на ультраструктурпом уровне, свидетельстует о более поздней окончательной дифференцировке олигодендроцитов по сравнению с астроцитами. По данным Вона [289], олигодендроциты в развивающемся зрительном нерве крысы могут быть определены через некоторое время после начала миелинизации, а олигодендротлио-Сщасты — на 3—7-й цепь хщсле рождения. Они ррзцикдтот цз боль
ших глиальных предшественников, в которых наблюдается значительное увеличение размеров цитоплазмы, цистерн комплекса Гольджи, гранулярного эндоплазматического ретикулума, числа микротрубочек и плотных профилей митохондрий. Установлено также, что олигодендроциты на электронномикроскопическом уровне могут сильно отличаться по плотности ядра и цитоплазмы 197, 182).
Полученные в лаборатории Леблона [188, 274] результаты показали, что олигодендроциты крыс продолжают свое развитие в течение длительного периода после рождения. На полу тонких срезах с последующей электронной микроскопией они выделили в мозолистом теле крысы три подтипа олигодендроцитов, различающихся по величине и плотности: светлые (обширная цитоплазма, неконденсированный хроматин ядра), средние (более плотные и мелкие клетки с мелкими хроматиновыми глыбками в ядре) и темные (еще более мелкие и плотно окрашенные клетки с большими хроматиновыми массами в ядрах неправильной формы). Используя авторадиографию с 3Н-тимидином, эти же авторы смогли проследить в постнатальном периоде возникновение светлых олигодендроцитов из свободных субэпендимных клеток и изменения соотношения этих форм олигодендроцитов с возрастом. В мозолистом теле одномесячных крыс преобладали светлые олигодендроциты (2/3 от общего числа), а в пятимесячном возрасте присутствовали только темные клетки. По сути дела подобные промежуточные стадии созревания олигодендроцитов, только под другими названиями, выделяются и другими авторами [289].
Таким образом, лостнатальное созревание олигодендроглии у грызунов продолжается гораздо дольше, сильно перекрывая сроки интенсивной миелинизации мозга (т. е. 5—20-й дни после рождения). Ряд опубликованных в последние годы сообщений указывает, что в зонах миелинизационпого глиоза до и во время миелинизации присутствует большое количество незрелых форм [283, 307], претерпевающих в этот период заметные изменения клеточной структуры и объема ядер. Зрелые олигодендроциты появлялись несколько позже. Например, в передней комиссуре они отмечались на 32-й день жизни [283]. К тому же, по данным Хирозе и Басса [146], пик глиальной пролиферации в зрительном нерве крысы скорее совпадает с периодом миелинизации, а не предшествует ему, как полагали раньше [84, 271]. Эти факты дали основания для предположения, что миелинизация осуществляется не совсем зрелыми формами олигодендроцитов, которые иногда называют «активными» олигодендроцитами [283, 293].
Связь миелинизации с появлением определенных форм олигот дендроглии хорошо продемонстрирована на так называемых «неврологических мутантах» — мышах с наследственными на-рушениямии миелинизации мозга. У этих животных единственное отличие от нормы заключается в остановке дифференциации «светлых» овдгд^ендроццтов в «среццед» и «торице» $51
В 1967 г. Вон и Питерс [291 ] выделили в зрительном нерве взрослой крысы так называемый «третий тип» нейроглии [471. Эти клетки по размерам меньше олигодендроцитов и астроцитов, а по плотности занимают промежуточное положение. В их цитоплазме почти не встречается микротрубочек, заполняющих тело п отростки олигодендроцитов, а также глиофиламентов и гликогена, характерных для астроцитов. Гранулярный эндоплазматический ретикулум часто необычной формы и состоит из длинных, причудливой формы цистерн. Подобные клетки обнаружены также в формирующейся коре больших полушарий крысы [97]. Вон предположил родство этих клеточных элементов клеток с малыми глиобластами. По его мнению, в эмбриональном периоде они дают начало астроцитам и олигодендроцитам, а в последующей жизни сохраняются в центральной нервной системе как переживающие мультипотентные клетки. Он также высказал предположение о связи между этими клетками и микроглией, о чем будет сказано ниже. Если эти данные верны, то это подтверждает гипотезу Авцына и Ильиной [1 ], что олигодендроглия не является единой клеточной формой нейроглии.
Эпендима. Дефинитивная эпендима желудочков мозга — образование вторичное. Она возникает при истощении матричного слоя тогда, когда в нем образуется все меньше и меньше клеток в результате деления и последующего выселения из него глиальных предшественников. У оставшихся в околожелудочковой зоне клеток увеличивается отросток, и они становятся истинными эпендимными клетками. У кролика эпендимный слой становится заметным уже на 9-й день эмбрионального развития [286 J. Однако между разными областями мозга существуют большие различия во времени, необходимом для истощения матричного слоя. Этот срок, очевидно, короче в филогенетически более древних отделах стенки желудочковой системы.
В мозгу куриного зародыша самыми ранними признаками дифференцировки эпендимы являются увеличением апикального отростка и появление ресничек и микровиллей [299]. Однако созревание базальной части эпендимоцита происходит только после редукции матричной зоны. По данным Шахенмайра [264], у крыс формирование респичатого эпителия выстилки желудочков и pl. chorioideus происходит на 18-й день эмбрионального развития. В это же время среди выстилки третьего желудочка становятся заметными и танициты. Окончательное созревание эпендимы наступает на 30—34-й день после рождения.
Глия п. н. с. Шванновские клетки, как и вегетативные нейроны, ведут свое происхождение из нервного гребешка. В 1924 г. Гаррисон [138] показал, что при удалении нервного гребешка шванновская оболочка не образуется. В дальнейшем это было подтверждено методами экспериментальной эмбриологии и авторадиографии [233, 308]. Снесарев [62] отмечал также, что в ка-
честве спутника отдельных нервных волокон шванновские клетки появляются сравнительно поздно.
Микроглия. Мнение о самостоятельности и независимости развития микроглии широко распространено, но все еще оспаривается отдельными авторами. Ортега [154, 1561, выделивший этот клеточный тип, тогда же предположил мезенхимное происхождение микроглии.
По мнению его, микроглиобласты появлялись в мозге млекопитающих в последние месяцы внутриутробной жизни, раньше всего под мягкой мозговой оболочкой, и были генетически связаны с элементами последней. Затем микроглиобласты проникали в мозг по ходу сосудов и направлялись к желудочкам. В процессе миграции форма их изменялась. Вначале опи были веретенообразными, затем приобретали округлую форму, потом эти клетки становились амебоидными и, наконец, заменялись зрелыми клетками Ортеги с развитыми отростками. Местами интенсивного проникновения микроглии в мозг называют область прикрепления tela chorioidea, ножки мозга в месте прикрепления мягкой мозговой оболочки и адвентиций крупных и средних сосудов [62]. Работы Ортеги получили многочисленные подтверждения, хотя спор о гистогенезе до сих пор еще не завершен.
В последующих работах сроки появления микроглии в ткани мозга были передвинуты на более раннее время и связывались с началом васкуляризации мозга. Санта и Юба [169, 262] обнаружили появление микроглии у 8-дневного эмбриона крысы и у трехмесячных человеческих эмбрионов. По данным Авцына и Рабинович [2], мезоглия обнаруживалась на втором месяце развития человеческого эмбриона. Источником этих элементов они считают гистоциты мозговых оболочек, сосудистой стенки и крови. По данным этих авторов, диссеминация мезенхимы в ц. и. с. представляет собой существенный факт в развитии головного мозга. С этими данными совпадают результаты исследований Кершмана [172].
Тем не менее в 60-х гг. существование микроглии как самостоятельной в гистогенетическом отношении единицы было вновь поставлено под сомнение. Основанием для этого послужили неудачи в идентификации микроглии нормального мозга на электронномикроскопических препаратах (подробнее см. [47]). Кроме того, с помощью мечения 3Н-тимидином клеток периферической крови обнаружилось, что около 60—80% зернистых шаров и других меченых клеток в асептической ране мозга происходят из мононукле-арных лейкоцитов крови [180].
Б то же время другие авторы на основании данных электронномикроскопического изучения импрегнированных углекислым серебром клеток вновь высказались в пользу происхождения микроглии из перицитов мелких кровеносных сосудов [216].
Почти одновременно Вон и Питерс [292, 293] выдвинули против мезенхимного происхождения микроглии возражения, которые кажутся им серьезными. Они главным образом основаны на резуль-576
татах электронномикросконического изучения Зрительного нСрВй крысы в нормальных и патологических условиях и выделении в нем элементов уже упоминавшегося «третьего нейроглиального типа».
Увеличенное количество подобных клеток в развивающемся мозге [97, 2891, присутствие их в других отделах ц. н. с. [82] и их сходство с малыми глиобластами позволили Вону и Петерсу предположить, что эти элементы представляют собой переживающие во взрослом организме остатки мультипотенциальной глии, составляющей резерв для глиогенеза в зрелом мозге.
Из опубликованных данных этих же авторов следует, что эти клетки способны увеличиваться в числе и превращаться в фагоциты при перерезке зрительного нерва, что свидетельствует об их сходстве с классической микроглией [294].
На этом основании в 1971 г. Вон и Питерс [293] вернулись к гипотезе о едином происхождении всех типов нейроглии от одного предшественника, особенно подчеркнув при этом нейроэктодермальное происхождение микроглии. Основные доводы сторонников этой гипотезы следующие. 1. При электронномикроскопическом исследовании в разные сроки не обнаружена инвазия в паренхиму мозга микроглиоцитов из оболочек мозга и сосудистой стенки. В зрительном нерве микроглия обнаруживалась до проникновения в него сосудов. 2. Описанные Юба [169] микро глиобласты в мозге эмбриона человека во многих отношениях напоминают начальную стадию образования глиобластов J121J.3. Клетки, наблюдающиеся при импрегнации карбонатом серебра на границе мозга и оболочек, выявлялись всегда только на нейральной стороне. Кроме того, метод Ортеги в эмбриональном материале выявляет также незрелые глиальные предшественники [123]. 4. Область интенсивного образования микроглии на дне бокового желудочка, описанная Кершманом [172], совпадает с областью сильного развития субэпендимной зоны и может трактоваться как миграция глиобластов из области их происхождения. Отмечено также сходство клеток субэпендимной зоны с субпиальными и периваскулярными клетками крысиного мозга [80]. 5. Клетки «третьего типа» по Вону и Питерсу сходны с микроглией при световой микроскопии и присутствуют во взрослой интактной нервной ткани^примерно в том же количестве, что и микроглия. 6. Клетки «третьего типа» увеличивались в числе и превращались в фагоциты при уоллеров-ской дегенерации. Миграция адвентициальных клеток и лейкоцитов при этом отсутствовала.
Естественно, что возникшее противоречие стимулировало интерес к этой проблеме. В отличие от работ, связанных с непосредственным нанесением раны мозга, изучение глиальной реакции при периферических повреждениях без непосредственного повреждения ц. н. с. показало соответствие количества появившихся меченых клеток количеству покоящейся микроглии, т. е. ее активацию 1174, 282].
37 Общая физиология нервной системы
577
Таким образом, сложилось Представление о зависимости фагоцитарной реакции ц. и. с. от характера ее повреждения. При ретроградной дегенерации источник фагоцитов мозга скорее эндогенный, чем экзогенный. При травме большинство фагоцитов представляют собой клетки крови. По крайне спорному мнению Кита-мура [176], теория Ортеги должна быть пересмотрена и микроглия расчленена на две различных до происхождению группы. Одна из них, «покоящаяся отростчатая микроглия» Ортеги, возникает из субэпендимной зоны мозга и имеет нейроэктодермальное происхождение. Вторая — активная амебоидная микроглия по Ортеге — появляется в измененной ткани мозга и имеет гематогенное происхождение. Противоречивость позиции Вона и Питерса очевидна. Среди ряда типов олигодендроцитов они нашли элементы, сходные в ультраструктурном отношении с микроглией. Вместо того чтобы подвергнуть сомнению гистогенетическую гомогенность олигодендроцитов, они пришли к сомнению в мезенхимной природе микроглии, которая на самом деле является мозговым гистоцитом. Вопрос о гистогенезе микроглии вновь подвергся изучению в работе Захарченко [28], который, пользуясь рядом методов, подтвердил ее происхождение из пиальной и сосудистой мезенхимы.
Постнатальное размножение глии. По всей вероятности, какая-то часть глии сохраняет способность к делению во взрослом состоянии. Синтез ДНК глиальными клетками взрослых млекопитающих является сейчас твердо установленным фактом [20, 22, 152, 214]. Кроме грызунов, меченые клетки обнаружены в мозгу и у других млекопитающих и птиц: голубей [73 ], кошек [178], обезьян 1133] и даже у человека [167], хотя число этих клеток обычно очень невелико (по данным Грачевой [20] — 0.02 — 0.05% в мозге взрослой мыши).
Можно предложить два возможных объяснения появления в мозгу меченых глиальных клеток: либо блокирование синтеза ДНК у глиальных клеток не является необратимым, либо в нервной ткани имеются клетки на более низкой ступени дифференцировки. Размножение шванновских клеток при повреждении аксона свидетельствует в пользу первого предположения, в других случаях может быть справедливым как то, так и другое мнение. Тем пе менее точные данные о том, какие глиальные клетки пролиферируют, начали появляться только недавно.
В 1961 г. Смарт и Леблон [274] представили убедительные авторадиографические доказательства деления глиальных клеток в постнатальный период. Они выделили два типа метящихся глиальных предшественников, диффузно распределенных по всей толще среза,' и показали постепенное перемещение метки от этих клеток в зрелые астроциты и олигодендроциты.
В дальнейшем эта группа исследователей, применив метод полутонких срезов с последующей электронной микроскопией и авторадиографией, смогла подтвердить и дополнить полученные данные. Подсчет клеток показал [188], что в мозолистом теле 578
мозга мыши от трехнедельного до пятимесячного возраста популяция микроглии оставалась постоянной. Число астроцитов возрастало в этой структуре до одномесячного возраста, но не изменялось в коре. У трехнедельных мышей две трети олигодендроцитов было представлено светлыми и средними разновидностями, тогда как у взрослых животных преобладали темные олиго дендриты. Последовательная смена пиков меченных 3Н-тимидином глиальных клеток на диаграммах временного распределения [239] показала последовательность развития олигодендроцитов от светлых олигодендроцитов (максимальная метка на 4—7-й день) к темным (максимальная метка на 21-й день). В дальнейшем пролиферация темных олигодендроцитов не возобновлялась. Включение метки в астроциты у животных старше одномесячного возраста сильно снижалось и оставалось на низком уровне.
Основываясь на изучении динамики синтеза ДНК после рентгеновского облучения, Грачева [20] относит совокупность глиальных клеток мозга взрослых крыс к обновляющейся популяции, хотя и с очень продолжительным сроком обновления. Синтез ДНК в глиальных клетках отсутствовал на первые сутки после облучения, появлялся на 2—4-е сутки, значительно превосходил контрольные цифры на десятый день и затем снижался до нормы, повторяя таким образом последовательность стадий тканевой репарации, наблюдающейся в других тканях с высоким пролиферативным индексом. К такому же заключению Грачева пришла при подобном изучении субэпендимной зоны.
Субэпендимная зона. Подробную сводку о субэпендимной зоне можно найти в работе Смарта [273 ], а также в монографиях Грачевой [20] и Якобсона [1641. По всей вероятности, эта область может иметь существенное значение для воспроизведения глии в постнатальный нериод.
Субэпендимная зона обособляется вскоре после формирования эпендимы на границе между эпендимой и остальной тканью. У грызунов распространение субэпендимной зоны ограничено частями желудочка, подстилающего палео- и неокортекс. Впереди от боковых желудочков субэпендимные клетки собираются в тяж, продолжающийся в обонятельные доли.
В филогенетически более древних частях (архикОртексе, стволе и спинном мозгу) она отсутствует. Характерной особенностью субэпендимной зоны является очень высокая по сравнению с Другими частями мозга пролиферативная активность, составляющая 0.15-0.33% [21].
Смарт [273] выделил в субэпендимной зоне клетки с темно-окрашенными (преобладали у новорожденных животных) и светлоокрашенными ядрами. Оба эти клеточных типа были способны к размножению на месте и являлись, вероятно, глиальными предшественниками.
Есть предположение, что в ранний период после рождения в руб эпендимной зоне, помимо гции, возникает короткоаксонные
микронейроны {72, 273]. Однако их продукция быстро прекращается, в то время как макроглия продолжает производиться и во взрослом состоянии. Роль субэпендимной зоны во взрослом мозге неясна. Наиболее вероятным предположением будет то, что она служит для замены погибших глиальных элементов.
В 1972 г. Прива и Леблоп [252] в мозолистом теле одномесячной крысы электронномикроскопически выделили клетки, подобные клеткам субэпендимного слоя, некоторые из которых имели промежуточные черты между олигодендроцитами и астроцитами. Авторы назвали их свободными субэпендимными клетками и предположили, что они дифференцируются в оба типа макроглии.
В дальнейшем в этой же лаборатории [239] при введении 3Н-тимидина пятинедельным крысам обнаружено перемещение метки из субэпендимного слоя в свободные субэпендимные клетки мозолистого тела, а затем в «светлые», «средние» и «темные» олигодендроциты. Таким образом, удалось достаточно убедительно продемонстрировать формирование макроглии элементами субэпендимного слоя.
Количество субэпендимных клеток уменьшается с возрастом, однако их пролиферативные потенции не меняются [51 ]. Клетки, покидающие субэпендимную зону, распределяются в прилежащих отделах мозга неравномерно, что позволяет предположить существование определенных путей миграции [50 , 203].
Обсуждая пролиферацию глиальных клеток в ц. н. с. взрослого млекопитающего, следует упомянуть одно обстоятельство, не получившее до настоящего времени удовлетворительного объяснения. Почти все исследователи, применившие авторадиографию для изучения нервной системы, отмечают крайнюю редкость или отсутствие митозов и несоответствие их числа количеству меченых ядер глиальных клеток. К тому же следует принять во внимание данные, показывающие диплоидность астроцитов [187]. Попытки увеличить число митозов при помощи колхицина не удавались [88]. В субэпендимной зоне, где митотическая активность явно выражена, не все митозы реагировали на колхицин.
Имеются косвенные доказательства в пользу возможного деления: появление меченых пар через сутки после введения метки, увеличение числа меченых клеток вдвое через три дня и снижение интенсивности метки при наблюдении через продолжительный срок. Грачева [20] приводит следующие предположения для объяснения видимого отсутствия митозов в ц. н. с. Во-первых, скорость митоза может быть необычайно высока, и он успевает завершиться до того, как фиксатор проникнет в ткань' [133]. Во-вторых, возможно наличие растянутого генеративного цикла у глиальных клеток.
По-видимому, способ фиксации может существенно влиять на количество обнаруживаемых митозов. По данным Кавана [101], число митозов вокруг раны мозга увеличивалось вдвое при замене фиксации погружением фиксацией с помощью перфузии. ПятйД
часть всех митозов, по мнению автора, принадлежала астроцитам, однако идентификация этих клеток на парафиновых срезах вызывает сомнение.
Сейчас нельзя полностью отрицать предполо?кение, высказанное Пенфильдом [240] и поддержанное Лафамом [187], что увеличение численности глиальных клеток при некоторых условиях может происходить с помощью амитоза. Эта точка зрения продолжает бытовать среди патологов.
Реактивная гиперплазия и увеличение количества астроцитов наблюдается при многих патологических состояниях — гипогликемии, хроматолизе нейронов и др. Известно, что митозы очень редки у доброкачественных форм астроцитов, которые в основном диплоидны.
13.5.2. ФИЛОГЕНЕЗ НЕЙРОГЛИИ
Филогенез глиальных клеток изучен менее полно, чем филогенез нейронов. По-прежнему справедливо высказывание Заварзина [26], отметившего, что имеющийся материал достаточен только для того, чтобы показать, что глиальные элементы беспозвоночных и низших позвоночных по своему строению и происхождению вполне сравнимы с глиальными элементами высших позвоночных. В общих чертах строение глии и характер ее взаимоотношений с другими элементами нервной системы отражает уровень эволюционного развития вида.
Данные, характеризующие глию беспозвоночных, получены в основном при изучении нервной системы червей, насекомых и моллюсков (подробнее см. [26]). Отсутствие в толще нервной ткани кровеносных сосудов является важной особенностью нервной системы беспозвоночных, объединяющей их с низшими хордовыми и отличающей от высших позвоночных. В этом случае, вероятно, повышается трофическая роль нейроглии.
В нервной системе дождевого червя уже обнаруживаются глиальные сателлиты, окружающие нервные клетки, тогда как маргинальная глия еще не развита [128].
Большой интерес представляют одиночные гигантские глиальные клетки пиявок, заключающие в себе все нейроны и большую часть аксонов одного пучка [185]. В этих клетках содержится фибриллярный материал, который легко может быть окрашен. По-видимому, этот тип глиальной клетки у пиявки единственный, хотя уже на этом уровне филогенеза отмечаются различия между глиальными клетками разных отделов нервной цепочки [103].
В то же время у моллюсков и насекомых, находящихся на высших ступенях эволюции беспозвоночных, уже имеются системы, по строению и происхождению аналогичные макроглии позвоночных [26, 247]. Глиальные и эпителиальные элементы формируют вокруг гигантских нейронов моллюсков капсулу и образуют длинные отростки, глубоко вдавливающиеся в тело этих клеток ]3 центральных ганглия^ пасекрмьтх выделяют 3—4 ?ица рлиаль’
ных клеток, различающихся по структуре и локализации. Часть из них имеет цитоплазматические фибриллы, а глиальные клетки периферических нервов по строению и функциям напоминают шванновские [95, 247].
У низших хордовых, по свидетельству большинства авторов, эпендимные клетки представляют собой основной глиальный компонент, тем не менее и неэпендимная глия описывалась неоднократно даже у самых низко развитых видов. У сальп Бон [86] описал элементы, окружающие нервное волокно и похожие на шванновские.
Нервная трубка ланцетника состоит в основном из эпендимных клеток, длинные отростки которых достигают периневральной поверхности и оканчиваются на ней выраженной концевой ножкой [69, 70, 2311. Тем не менее в крыше центрального мозга описан второй глиальный тип, не образующий концевых ножек [128], а также и третий глиальный тип, напоминающий астроциты [222], а по другим данным [87], и шванновские клетки.
Нервная система круглоротых сохраняет свой примитивный характер [79, 222]. Тем не менее у миксин отмечают глиальные клетки с отростком, окружающим капилляр, и имеющие характеристики, общие с астроцитами [221].
Глиальные клетки с хорошо выраженными фибриллами обнаружены у акул и костистых рыб. Типичные астроциты впервые описаны у костистых рыб Ачукарро [69] при импрегнации по методу Гольджи. У скатов астроцитоподобные клетки преобладают над эпендимными [153]. Изучая ультраструктуру нервной системы у костистых рыб, Крюгер и Максвелл [183] выделили, кроме астроцитов, еще и элементы, напоминающие олигодендроглию млекопитающих.
Начиная с земноводных доля неэпендимных глиальных элементов неуклонно увеличивается. Появляются основные типы нейроглии. Тем не менее астроциты хвостатых и бесхвостых амфибий гораздо примитивнее астроцитов млекопитающих. Имеется только один тип этих клеток вытянутой, а не звездчатой, как у млекопитающих, формы. Концевые ножки этих клеток в основном связаны с пиальной поверхностью, а не с кровеносными сосудами [271, 2811.
Стенсаас и Стенсаас [281 ] отметили также многообразие форм олигодендроцитов в нервной системе жабы. Микроглии жабы подобна примитивной псевдоподияльной разновидности этих клеток у млекопитающих, но никогда не была обнаружена в качестве сателлитов нейрона. У американского протея описаны клетки, окружающие группу аксонов, а не один аксон [185]. У травяных лягушек методом Белецкого удается выявить клетки микроглии [1].
У рептилий появляются хорошо развитые сосудистые отростки астроцитов [69], увеличивается их доля в нейропиле, а распространение эпендимных концевых ножек уменьшается [183].
У птиц преобладает два типа астроцитов, фиброзные и протоплазматические, и впервые появляется способность к формирода-
цию Периваскулярной глиальной мембраны [69, 701. Также возникают типичные олигодендроциты [174], однако перинейрональные клетки довольно редки.
Для млекопитающих характерно дальнейшее развитие ножек астроцитов, полностью изолирующих капидляр для остальной ткани. В тесной связи с развитием коры мозга находится увеличение доли протоплазматических астроцитов [69, 70, 183].
В процессе эволюции выявляется тенденция глии терять эпендимное положение и вступать во вторичную связь с кровеносными сосудами и нервными клетками [174]. Филогенетическое усложнение строения нейроглии проявляется также в увеличении числа и толщины глиальных отростков, усилении морфологической связи нейрона и глии, развитии глиальных сателлитов.
13.6. МИЕЛОГЕНЕЗ
В процессе развития нервной системы млекопитающих и человека миелинизация нервных волокон играет решающую роль для нормального функционирования того или иного ее отдела. Когда миелинизация достигает определенной степени зрелости, делаются возможными нормальные физиологические процессы в проводящих системах, ассоциативных и комиссуральных связях и т. п. Безмякотные волокна в основном обеспечивают выполнение вегетативных функций нервной системы.
Изучение развития миелиновой оболочки дает возможность понять структуру зрелого миелина и сопоставить морфологические и биохимические данные с ее ролью в функционировании нервных волокон. Такие исследования помогают также установить общебиологические закономерности структуры клеточных мембран в нервной системе, имеющих чрезвычайно важное значение в процессах ее жизнедеятельности.
Широкое использование электронной микроскопии впервые дало возможность на субмикроскопическом уровне подробно в динамике изучать миелиногенез в центральной (ц. н. с.) и периферической (п. н. с.) нервной системе, однако и в настоящее время в этом очень сложном процессе многое остается недостаточно ясным.
Благодаря новым биохимическим методам и особенно хроматографическому разделению отдельных классов липидов и белков, их изменения во время миелинизации стали доступными для весьма точного анализа.
В настоящее время твердо установлено, что в ц. н. с. миелин образуется олигодендроцитами, а в п. н. с. шванновскими клетками. Только у высших позвоночных специализированная нейроглия — олигодендроциты способны продуцировать зрелый плотный миелин, в то время как у беспозвоночных и низших хордовых, по-видимому, имеется лишь один тип глии. Последняя хотя
И образует многослойные оболочки вокруг аКсойа, но не продуцирует плотный миелин.
В зависимости от сроков созревания центральной и периферической нервной системы в эмбриональном и /или постнатальном периоде у человека и у отдельных видов животных миелиногенез наблюдается в различное время и происходит в целлюлофугальном направлении. В ц. н. с. миелинизация начинается раньше в филогенетически более старых отделах. С последней четверти прошлого столетия [117 ] известно, что отложение миелина в ц. н. с. сначала происходит в спинном мозге и в заднем отделе головного мозга, а потом распространяется в ростральном направлении. У людей миелин появляется с 22-й по 36-ю неделю эмбриогенеза [170], но в corpus callosum его можно обнаружить только на 2-м месяце постнатального развития, причем в слабой степени [186]. У некоторых видов животных процесс миелинизации достигает значительной степени уже в эмбриональном периоде, как например в головном мозге быка [110 и др. ]. У крыс, которые представляют очень удобный объект для таких исследований вследствие довольно четко очерченных временных границ миелинизации, активный процесс ее в ц. н. с. начинается на 10—12-й день, достигая максимума к 20—30-му дню [235]. В дальнейшем скорость отложения миелина снижается, но этот процесс более медленно, вероятно, происходит в течение всей жизни [204]. У кошек миелиногенез начинается значительно позже и, например, в corpus callosum наблюдается не ранее 4 нед. после рождения [119].
В п. н. с. миелинизация происходит в кранио-каудальном направлении, и первые миелиновые волокна появляются сначала в плечевом сплетении, а несколько позже в седалищном нерве. В нервных стволах она распространяется в проксимо-дистальном направлении [279]. В седалищном нерве крысы миелинизацию отдельных нервных волокон ужеможно отметить на 2-й день после рождения, к 5-му дню их мало, но в последующие дни происходит быстрая аккумуляция миелина [119, 255, 310 и др. ]. У лягушек миелинизация периферических нервных волокон, по-видимому, происходит в течение всей жизни [16].
В^период активной миелинизации нервная система весьма чувствительна к различным патогенным воздействиям, в частности по отношению к острому голоданию молодых животных [114, 309]. При голодании наблюдается резко выраженное понижение аккумуляции липидов и белков миелина ц. н. с., что объясняют в первую очередь редукцией числа миелинообразующих олигодендроцитов. Резкое уменьшение количества миелина (62% от контроля), наблюдается у новорожденных крыс при гипотирои-дизме [207].
13.6.1. МИЕЛИНИЗАЦИЯ
В ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЕ
В настоящее время общепризнано, что миелин в п. н. с. образуется шванновскими клетками. Уже при светооптических исследованиях ряд авторов отводили им решающую роль в процессе миелинизации [24, 33, 234, 276} и др.
Шванновские клетки эктодермального происхождения. Они мигрируют вдоль аксонов в виде леммобластов [138, 278 и др.]. В процессе миграции они митотически делятся, причем особенно интенсивно непосредственно перед началом миелинизации [119], В результате миграции и пролиферации шванновские клетки располагаются в нервных стволах тяжами вокруг пучков растущих аксонов, отделяя их от окружающих тканей. В образованных цитоплазмой шванновских клеток трубках находятся многочисленные (до 90 и больше) тесно расположенные голые аксоны. Пролиферирующие шванновские клетки постепенно разделяют всю массу осевых цилиндров на более мелкие пучки. В дальнейшем, как видно при электронном микроскопировании, один из тонких осевых цилиндров утолщается и окружается цитоплазмой отдельной шванновской клетки (рис. 13.23). Для миелинизации его диаметр должен быть не менее 2 мкм [245]. В конечном итоге в цитоплазме шванновской клетки находится только один миелинизированный аксон, и как редкое исключение их бывает два и больше.
Цитоплазма шванновских клеток до миелинизации слабо выражена и определяется только возле ядра, в перехватах и насечках. При миелинизации шванновские клетки активизируются: тела их принимают сигарообразную форму, цитоплазма резко гипертрофируется, в ней видны многочисленные органеллы (эндоплазматический ретикулум, комплекс Гольджи, митохондрии и др-), обеспечивающие повышенный синтез белков, липидов
и энзимов.
При светооптических исследованиях перед началом миелинизации нервных волокон в цитоплазме шванновских клеток появляются липидные капли, а при окраске по Бекеру видно много зернистых включений, содержащих фосфолипиды, которые составляют один из основных классов липидов миелина с самого начала его отложения [32]. Вскоре образуются тонкие и короткие сегменты миелина, отделенные друг от друга свободными посте
пенно уменьшающимися промежутками.
Ценные сведения о миелинизации получены в культурах п. н. с. Они в основном подтверждают прижизненные наблюдения [96, 205, 297 и др.].
Непосредственно перед миелинизацией, так же как и in vivo, среди массы тонких аксонов выделяются одиночные более толстые, которые окружаются цитоплазмой отдельной шванновской клетки. Сначала миелин отлагаетсц на осевом цилиндре сегментарно в виде
отдельных тонких пластинок, которые в дальнейшем утолщаются и распространяются вдоль нервного волокна, оставляя свободными только места перехватов; последние, как и насечки, хорошо выражены. В культурах миелиновые оболочки не достигают такой толщины, как in vivo.
В последние годы были опубликованы аналогичные наблюдения о ходе миелинизации в культурах диссоциированных нейронов спинальных ганглиев эмбрионов цыплят [192] и новорожденных белых мышей [269].
Только иснользоваяие электронной микроскопии дало возможность подробно проследить процесс миелинизации в периферических нервных волокнах [110, 127, 258—260 и др.], хотя до сих пор в этом вопросе полной ясности нет. Наиболее широкое признание получила выдвинутая Герен гипотеза об образовании миелиновых оболочек нервных волокон п. и. с. На основании исследований ранних стадий миелинизации периферических нервных волокон у эмбрионов мышей и цыплят она пришла к выводу, что миелин образуется в результате спиралевидного вращения дубли-катуры плазматической мембраны шванновской клетки вокруг аксона. Плазматическая мембрана шванновских клеток, как и олигодендроцитов, имеет толщину 75—80 А и при средних увеличениях электронного микроскопа кажется плотной линией. Однако при большей разрешающей силе она имеет трехслойную структуру и состоит из двух плотных линий толщиной около 25 А каждая и более светлого промежутка шириной 30 А. Предполагается, что в плотных линиях находится белок, а в промежуточном пространстве — липиды; последние ориентированы радиально по отношению к длиннику мембраны. В противоположность богатому липидами миелину, образующемуся из плазматической мембраны, липиды в последней составляют только 20—30% сухого веса [287].
Современное состояние вопроса о структуре клеточных мембран, в частности плазматической, и миелина подробно анализируется в ряде монографий [107, 168,236].
До начала миелинизации аксон располагается в углублении плазматической мембраны и только частично, с одной стороны, окружен цитоплазмой шванновской клетки, от которой отделен двойной мембраной, образованной его аксолеммой и плазматической мембраноййпванновской клетки («аксон-шванновская» мембрана [258]). Постепенно аксон все больше и больше вдавливает поверхность шванновской клетки, которая со временем полностью окружает его. В месте, где встречаются края углубления, наружные поверхности плазматической мембраны, плотно прилегая друг к другу, образуют мезаксон, который, таким образом, представляет дубликатуру плазматической мембраны шванновской цлетки (рис. 13.22). При этом плазматические мембраны располагаются параллельно друг другу с промежутком в 130—135 А,
а у наружного конца мезаксона они обычно сливаются вместе. В первоначально описанных в мезаксоне двух слоях плазматической мембраны при высоких разрешениях электронной микроскопии показано, что каждая из них имеет трехслойное строение, как и другие клеточные мембраны, в частности как плазматическая мембрана.
Удлиняясь, мезаксон спирально вращается вокруг аксона, образуя все новые и новые первоначально рыхло расположенные
Рис. 13.22. Схема постепенного окружения аксонов (а—г) цитоплазмой швап-[новской клетки [62].
Обозначения: т — мезансон, 0 — базальная мембрана, Sch — шванновская клетка. На вставке', взаимоотношения мембраны шванновской клетки и аксолеммы.
витки (ламеллы или пластинки) миелиновой оболочки; при этом сначала между ламеллами сохраняется тонкий слой цитоплазмы шванновской клетки. Таким образом, слои миелина располагаются вокруг аксона не строго концентрически, а в виде спирали. Одновременно с образованием мезаксоном спиралей вращается и шванновская клетка с ядром, движение которой в культурах п. н. с. наблюдалось некоторыми авторами [224, 225, 246, 251 ].
До сих пор точно не выяснено, происходит ли рост мезаксона за счет его внутреннего или наружного конца, хотя большинство авторов склоняется к мнению, что первый играет основную роль, При образовании спиральных витков в начале миелинизации на поперечных серийных срезах было установлено, что окончание мезаксона на поверхности аксона перемещается, а начало его от плазматической мембраны шванновской клетки остается на одном и том же месте [296],
По мере созревания миелийа цитоплазма, находящаяся между витками мезаксона, исчезает и ламеллы тесно прилегают друг к другу. В плотно упакованном миелине мезаксон сохраняется у обоих концов спирально расположенных ламелл, пересекая изнутри и снаружи расположенную цитоплазму. В местах прилегания ламелл образуются главные плотные линии высокой электронной плотности, а внутри ламелл располагаются более тонкие интрапериодические линии (рис. 13.23). Интрапериодическая липин
Рис. 13.23. Сравнительная схема структуры миелиновой оболочки периферического (Л) и центрального (Б) нервного волокна [241].
Со — цитоплазма миелинообразующей клетки (шванновской или олигодендроцита); Ах — аксон; Jtf0 — наружный мезаксон; Af, — внутренний мезаксон; D — главная плотная линия миелина; I — интрапериодическая линия миелипа; С, — цитоплазма во внутреннем витке миелина.
при малых увеличениях электронного микроскопа кажется одной, но при большой разрешающей силе наблюдается расщепление ее на две более тонкие линии с промежутками 15—20 А (рис. 13.24). Эти наблюдения указывают на то, что образующие интрапериоди-ческую линию наружные поверхности плазматической мембраны шванновской клетки полностью не сливаются вместе, а только тесно прилежат друг к другу [245].
Обе плотные линии отделены друг от друга светлым промежутком. Расположенную между двумя главными плотными линиями мембрану часто называют «периодом идентичности» и рассматривают как структурную единицу миелина. Различия между двумя плотными линиями в мембранах миелина объясняют наличием «фактора различия» [112, ИЗ], зависящего от асимметрии структуры внутреннего и наружного слоев плазматической мембраны шванновской клетки. Несмотря на многочисленные исследования и вы
сказанные гипотезы о причинах асимметрии в мембранах миелина, вопрос этот до сих пор остается невыясненным [193].
Еще нет точных данных о химическом составе главных плотных и промежуточных линий ламелл миелина, но есть основания предполагать, что они содержат белки, которые при фиксации соединяются с 0s04 [232], В светлом слое ламеллы предположительно находятся липиды, состоящие из двух молекул фосфолипидов с холестерином и одной молекулы цереброзида [112, ИЗ].
Диаметр аксона в основном определяет возможность миелинизации шванновскими клетками того или иного нервного волокна, при этом в п. н. с. он должен быть не меньше 2 мкм. О характере его стимулирующего влияния на миелинизацию до сих пор высказаны только гипотезы. Количество ламелл нарастает с увеличением диаметра аксона; так, в блуждающем и седалищном нервах мыши вокруг наиболее тонких волокон бывает 5 ламелл, а вокруг наиболее толстых — 95 [118]. В зависимости от диаметра аксона варьирует также длина межузлового сегмента миелина, образованного одной шванновской клеткой. Например, в малоберцовом нерве взрослых крыс волокна с диаметром 3.5 мкм имеют межузловые сегменты длиной около 350 мкм, а у наиболее толстых волокон с диаметром 11.6 мкм они достигают 800 мкм [147]. На основании экспериментов с установлением анастомозов между проксимальным концом перерезанного богатого миелиновыми волокнами нерва (n. sternohyoideus) и дистальным отрезком шейного симпатического ствола, состоящего в основном из безмякотных волокон, высказано предположение, что регенерирующие аксоны, проникая в последний, стимулируют образование вокруг них миелина шванновскими клетками различного происхождения, в том числе и такими, которые ранее были связаны только с безмякотными волокнами [301].
Несмотря на широкое признание гипотезы Герен о механизме миелинизации нервных волокон п. н. с., некоторые авторы [16,30,200] предполагают, что первоначальное формирование ламелл происходит непосредственно внутри цитоплазмы шванновских клеток. Против образования миелина путем спиралевидного вращения плазматической мембраны шванновской клетки в некоторой степени говорит наличие в ней изредка нескольких аксонов, находящихся на разных стадиях миелинизации.
Образование новых слоев миелина нельзя объяснить только вращением мезаксона, в этом процессе должны принимать участие и другие, пока еще малоизвестные факторы [245]. Так, при образовании миелиновой оболочки она должна приспосабливаться к увеличению диаметра аксона и его росту в длину. В отношении удлинения аксона можно предполагать, что отложение новых веществ в миелине происходит за счет сохранившейся цитоплазмы в области перехватов. Увеличение диаметра аксона, вероятно,
происходит только тогда, когда миелин еще имеет рыхлое строение, а не путем скольжения ламелл по отношению друг к другу, как предполагают некоторые авторы [1471.
13.6.2. МИЕЛИНИЗАЦИЯ в центральной нервной системе
В настоящее время на основании электронномикроскопических исследований всеобщее признание получил взгляд, что миелин ц. н. с. образуют олигодендроциты [91, 182, 208, 215, 241,243, 244 и др.]. Эту точку зрения высказал еще в 1922 г. Б. С. Дойников.
Изучение миелинизации в разных отделах ц. н. с. у различных видов животных привело к выводу, что миелиновая оболочка образуется путем спиралевидного вращения вокруг аксона мезак-сона, состоящего из двух плазматических мембран отростка олигодендроцита. Такие же наблюдения сделаны в длительно живущих культурах мозжечка [143, 261] (рис. 13.25). Однако в этом процессе многое остается неясным.
Только в двух сообщениях высказано предположение, что астроциты также могут миелинизировать нервные волокна ц. н. с. [295, 305], но данные этих авторов недостаточно убедительны.
В норме олигодендроциты имеют небольшие размеры, с круглым или овальным ядром, окруженным узким ободком цитоплазмы, содержащей мало органелл. Немногочисленные широкие отростки этих клеток делятся на более тонкие разветвления. В противоположность шванновским клеткам п. н. с., которые закономерно расположены вдоль нервных волокон, олигодендроциты и их отростки плотно упакованы с другими структурами мозговой ткани.
Перед началом миелинизации и во время ее в соответствующих отделах ц.н.с. олигодендроциты гипертрофируются и пролиферируют с резкой активизацией своих функций, в том числе с повышением активности многих энзимов [85, 306, 313 и др.]. Это так называемый глиоз миелинизации.
Миелинизация нервных волокон ц. н. с. начинается с установления контакта между отростком олигодендроцита и аксоном. Первоначально отростки только прилежат к части поверхности аксона, а затем, удлиняясь, распространяются до полного его окружения. При этом наружные поверхности его плазматической мембраны вступают в контакт друг с другом, образуя мезаксон. Таким образом, как и в п. н. с., мезаксон представляет двойную плазматическую мембрану, которая удлиняется и, как пишет Бунге [91], «неизвестным путем образует рыхло расположенные слои миелина». Сначала спиралевидные витки (ламеллы) мез-аксона расположены рыхло, и между ними сохраняется узкий слой цитоплазмы. Однако уже в начальной стадии миелинизации на электронных микрофотографиях виден одновременно рыхлый
и компактный миелин [75] (рис. 13.26). Это, возможно, объясняет наличие в неочищенном миелине двух типбв его.
Количество ламелл в миелине ц. н. с. никогда не бывает столь большим, как в и. н. с. Так, в зрительном нерве крысы только изредка встречаются нервные волокна, у которых больше 15 ла-мелл, в то время как в седалищном и тройничном нервах этих же животных число их достигает почти ста [245]. Как ив и. н. с., объем аксонов в основном определяет миелинизацию нервного волокна; в ц. н. с. миелинизируются очень тонкие аксоны, начиная с 0.3 мкм в диаметре [206].
В развивающейся ц. н. с. молодых животных связь тела олигодендроцита через его отросток с цитоплазмой, расположенной вплотную снаружи от миелиновой оболочки, убедительно показана [89, 243, 244]. Однако, несмотря на многочисленные попытки, такое соединение не удалось установить в зрелом миелине взрослых животных. По-видимому, это зависит от того, что по мере увеличения объема головного мозга такая связь значительно удлиняется и делается извилистой. Прямым доказательством этой связи в зрелом миелине служат препараты, импрегнироваиные серебром по методике Ортеги (рис. 13.27).
По мере созревания миелиновой оболочки цитоплазма между се ламеллами исчезает, и они вплотную прилежат друг к другу (компактный миелин, см. рис. 13.25). Наружные поверхности мезаксона образуют интрапериодическую линию, а внутренние, цитоплазматические стороны соединяются вместе в виде главных более темных плотных линий миелина. Спиральное расположение ламелл компактного миелина, наблюдаемое в электронном микроскопе, согласуется с гипотезой образования его в ц. н. с. путем вращения отростка олигодендроцита. В некоторых участках интрапериодическая линия расщепляется, и в ней образуется щелевидное пространство шириной 20 А [144].
В плотной миелиновой оболочке цитоплазма сохраняется только кнутри от нее, возле аксона, а также снаружи в виде наружного цитоплазматического языка или петли, т. е. у концов спирали мезаксона. Наружные и внутренние цитоплазматические языки миелиновой оболочки чаще всего располагаются в одном и том же квадранте ее окружности [243, 284]. Под миелиновой оболочкой цитоплазма обычно видна на значительном протяжении, а снаружи количество ее бывает вариабельным. Описанная как «наружный языковый отросток», цитоплазма имеет такую форму только на поперечных срезах, а в действительности она в виде гребня распространяется на всем протяжении межузлового сегмента [245]. В области наружного цитоплазматического языка две мембраны мезаксона расщепляются, и одна из них находится над ним, а другая непосредственно прилежит к наружной мембране миелина.
Так как расположенная снаружи цитоплазма занимает на поперечном сечении только 5—^20% поверхности миелиновой
оболочки, то соседние миелиновые оболочки часто непосредственно прилежат друг к другу, и в этих местах образуются соединения, напоминающие интрапериодическую линию.
В начальных стадиях миелинизации в ц. и. с. наблюдаются необычные картины структуры миелиновой оболочки. Например, два соседних отростка олигодендроцита могут образовать отдельные концентрически расположенные спирали миелиновых ла-мелл вокруг одного и того же аксона 1145]. Иногда в развивающемся миелине ц. и. с. объем миелиновой оболочки слишком большой для аксона, который в этих случаях окружен только одним витком миелина [116 и др.]. Обычно в зрелом, плотном миелине такие отклонения от нормальной картины отсутствуют, но изредка встречаются двойные концентрически расположенные миелиновые оболочки вокруг аксона [144].
Ряд авторов [89, 144 и др. ] отметили в ранних стадиях миелинизации наличие вблизи миелина масс цитоплазмы, не связанных с отростками олигодендроцитов, и на отдельных электронных микрофотографиях нельзя было выяснить их происхождение. Однако на серийных электронномикроскопических срезах была установлена связь этих «независимых» масс цитоплазмы с цитоплазмой олигодендроцитов в виде «червеобразных отростков», соединенных с одним из слоев миелина [177]. При образовании компактного миелина эти добавочные отростки исчезают, и их судьба остается неизвестной; возможно, что они, уплощаясь, превращаются в ламеллу миелина.
В отношении процесса миелинизации центральных нервных волокон до сих пор многое остается неясным и требует объяснения. Так как один и тот же олигодендроцит может быть связан с несколькими сегментами различных нервных волокон [90, 92, 244 и др.], то вращение его отростков вокруг более одного аксона во время миелинизации трудно понять [168, 245]. Для преодоления этого противоречия в процессе миелинизации ц. и. с. предположили образование ламелл путем скольжения их одной над другой [144]. Однако эта гипотеза недостаточно обоснована.
Несколько отростков олигодендроцитов могут заканчиваться на одном и том же сегменте миелина [89, 144 и др. ].
До сих пор нет ясного представления и о том, образуются ли новые ламеллы миелиновой оболочки снаружи или кнутри от нее. Некоторые авторы [181, 261] полагают, что как наружная, так и внутренняя часть мезаксона участвует в отложении новых слоев миелина. Весьма вероятно, что это происходит в наиболее внутренней и наружной мембранах возле перехватов, где они находятся в непосредственном контакте с цитоплазмой отростка олигодендроцита [144]. Ряд исследователей основную роль в этом процессе отводят внутреннему концу спирали мезаксона, расположенному между миелином и аксоном [89, 98, 245], — «активно растущей области». Против этой точки зрения высказывается возражение, что при отложении миелина на внутренней поверх-593
ности миелиновой оболочки последняя может сдавить увеличивающийся в диаметре аксон; однако это предположение недостаточно обосновано, так как при росте аксона миелин еще имеет рыхлое строение с относительно нестабильной структурой, что дает возможность его ламеллам приспосабливаться к увеличению диаметра аксона через конформационные изменения.
Не выяснен также вопрос, где отлагается новый миелин при удлинении межузловых сегментов в результате роста нервных волокон: накладывается ли он на межузловой сегмент или у концов ламелл, где расположена паранодальная цитоплазма.
Как и в отношении п.н.с., высказывается мнение, что миелиновая оболочка центральных нервных волокон образуется иным путем, чем вращение вокруг аксона плазматической мембраны олигодендроцита [181,200,257]. В соответствии с этим находящиеся в олигодендроцитах цитоплазматические пузырьки (липопротеиновые коацерваты) могут сливаться вместе, образуя скопления двойных мембран. Эти пузырьки представляют промежуточное звено в транспорте белков и липидов к месту образования ламелл миелина.
ЛИТЕРАТУРА
1. Ав^ын А. И., Ильина Л. И. Невроглия. — БМЭ, т. 20. М., 1961, с. 191— 221.
2. Авцын А. И., Рабинович А. Я. О развитии гистиоцитов мозга (мезоглии) у человеческого эмбриона. — Труды психиатр, клин. I Моск. мед. ин-та, 1937, 3, вып. 4, с. 41.
3. Аладжалова И. А. Медленные электрические процессы в головном мозге. М,, 1962.
4. Александровская М. М. Невроглпя при различных психозах. М., 1950.
5. Александровская М. М. Сосудистые изменения в мозгу при различных патологических состояниях. М., 1955.
6. Александровская М. М. Морфологические и метаболические изменения невроглии в ц. н. с. при некоторых функциональных состояниях. — В кн.: Симпозиум «Функции невроглии». Тезисы. Тбилиси, 1976, с. 39.
7. Александровская М. М., Кругликов Р. И., Холодов Ю. А. Барьерные механизмы нейроглии в процессе торможения при воздействии слабых раздражителей. — В кн.: Физиология и патология гисто-гематических барьеров. М., 1968.
8. Александровская М. М., Чиженкова Р. А. Некоторые электрические и морфологические изменения в головном мозге при действии слабым звуком. — Физиол. журн. СССР, 1969, 55, № 6, с. 669—674.
9. Александровская М. М., Чиженкова Р. А. Электрические и морфологические исследования разных областей коры больших полушарий при воздействии слабым звуком. — Физиол. журн. СССР, 1970, 56, № 3, с. 312— 317.
10. Александровская М. М., Чиженкова Р. А. Анализ глиальной реакции в двигательной области коры головного мозга при применении звуковых стимулов разной интенсивности. — Физиол. журн. СССР, 1972, 58, № 2, с. 145-150.
11. Александровская М. М., Чиженкова Р. А. Корреляция электрических и морфологических явлений в коре больших полушарий кролика. — ДАН СССР, 1972, 202, № 3, с. 721.
12. Александровская М. М., Чиженкова Р. А. Анализ изменений числа глиальных клеток в слуховой области коры головного мозга при приме-
38 Общая физиология нервной системы
нении звуковых стимулов разной интенсивности. — Физиол. журн. СССР, 1973, 59,‘ № 6, с. 870—874.
13. Александровская М. М., Чиженкова Р. А. Глионейроиальные взаимоотношения и электрогенез мозга. — ДАН СССР, 1974, 216, .Vs 6, с. 1423— 1427.
14. Боголепов Я. Н. Некоторые вопросы взаимоотношения отростков нервных и глиальных клеток в области синапсов. — В кн.: Длительные электрические потенциалы нервпой системы. Тбилиси, 1969, с. 113—123.
15. Боголепов Я. Н. Ультраструктура синапсов в норме и патологии. М., 1975.
16. Боровягин В. Л. Некоторые данные электронномикроскопических исследований ультраструктуры периферических нервных волокон лягушки. — Цитология, 1960, 2, с. 138—143.
17. Викторов И. В-, Аерелигина Т. А., Хаспеков Л. Г. Исследование развития и дифференцировка чувствительных ганглиев мышей в условиях оргаиотипической культуры ткани. — В кн.: Функционально-структурные основы системной деятельности и’механизмы пластичности мозга. 1974.
18. Вилънер Б. Я., Лущицкая Я. И. К динамике развития культуры гассерова гапглия крыс. — Изв. АН БССР. Сер. биол. наук, 1972, 4, с. 100— 110.
19. Грачева Я. Д. Авторадиографическое выявление при помощи 3Н-тимидина синтеза ДНК в клеточных элементах нервной системы белых крыс после общего рентгеновского облучения. — Радиология, 1963, 3, № 1, с. 81 — 87.
20. Грачева Н. Д. Авторадиография синтеза нуклеиновых кислот и белков в нервпой системе., Л., 1968.
21. Грачева Н. Д. Авторадиографическое изучение пролиферативной активности субэпепдимных клеток головного мозга. — Цитология, 1969, 11, № 12, с. 1521—1527.
22. Грачева Я. Д. Сроки возникновения и пути миграции клеток в гистогенезе коры полушарий большого мозга. — Арх. анат. гист. и эмбриол., 1973, 65, №'7, с. 21—30.
23. Дидимова Е. В., Сванидзе И. К. Рост и дифференцировка клеток нейроглии коры головного мозга на ранних этапах культивирования. — Цитология, 1972, 14, с. 1279—1283.
24. Дойников Б. С. Гистологические и гистопатологические исследования над периферическими нервами. Дис. на соискание степени ученого специалиста по психиатрии и нервным болезням. Пгр., 1922.
25. Ененко С. О., Шунгская В. Е. К вопросу о росте клеток олигодендроглии в культуре ткани. — Цитология, 1964, 5, с. 639—642.
26. Заварзин А. А. Гистологическое исследование чувствительной нервной системы и оптических ганглиев насекомых. СПб., 1913.
27. Залкинд С. Я., Цыпкин Л. Б. Некоторые вопросы дифференцировки и адаптации в клеточных культурах. — Цитология, 1971, 13, с. 547—562.
28. Захарченко В. И. Морфология игистогенез микроглии животных и человека. — В кн.: Морфогенез и регенерация. Тюмень, 1970, с. 369—377.
29. Клосовский Б. Я., Космарская Е. Я. Деятельное и тормозное состояние мозга. М., 1961.
30. Комиссарчик Я. Ю. Электронномикроскопическое-исследованпе ранних стадий миелинизации седалищного нерва куриного эмбриона. — Арх. анат., 1962, 63, с. 69—76.
31. Коновалов Г. В., Родштейн О. А. Особенности роста нейронов шванновских клеток в культуре чувствительного узла тройничного нерва. — Архив"анат., гистол. и эмбриол., 1972, 63, с. 92—100.
32. Коновалов Г. В., Чумасов Е. И. Морфология периферической нервной ткани в культуре. — В кн.: Руководство по культивированию нервно^ ткани. (Под ред. Б. Н. Вепринцева). М-, 1976, с, 103—132,
^3. Лавдовский М. Л. Новые данные для гистологии, истории развития и физиологии периферических нервов и нервных концевых приборов. — Воен.-мед. жури., 1884, 151, с. 119—155.
34. Лазриев И. Л. Ультраструктура малых нейронов внутреннего коленчатого тела головного мозга кошки. — Изв. АН ГрузССР. Сер. биол., 1976, 2, № 4, с. 27—31.
35. Лазриев И. Л., Кикнадзе Г. И, О синапсоархитектонике теменной и слухе вой областей коры головного мозга кошки. — Арх. анат., 1975, 68, № 4, с. 9-12.
36. Манина А. А. Ультраструктурные изменения и репаративные процессы в ЦИС при различных воздействиях. Л., 1971.
37. Микеладзе А. Л. Электронномикроскопическая характеристика нейроглии. — Арх. анат., 1967, 52, № 3, с. 29—37.
38. Микеладзе А. Л. Нейронно-глиальные взаимоотношения в коре головного мозга по данным электронной микроскопии. — В кн.: Длительные электрические потенциалы нервной системы. Тбилиси, 1969, с. 124—135.
39. Микеладзе А, Л., Дзамоева Э. И. Ультраструктура олигодендроцитов мозолистого тела. — Сообщ. АН ГрузССР, 1970, 59, № 2, с. 470—472.
40. Микеладзе А. Л-, Дзамоева Э. И. Некоторые особенности ультраструктуры макроглиальных клеток коры головного мозга. — Арх. а лат., 1972, 58, № 11, с. 15—25.
41. Микеладзе А. Л., Ройтбак А. И., Дзамоева Э. И. О контактах аксонных терминалей с олигодендроцитами в коре головного мозга. — ДАН СССР, 1971, 200, № 4, с. 970—972.
42. Милохин А. А., Решетникова С. С. Новые данные по инфраструктуре глио-нейроналышх взаимоотношений. — Труды Леяингр. о-ва естественен., 1972, с. 81—82.
43. Оленев С. И. Изменения нейронов и нейроглии в культуре больших полушарий мозга. — Архив анат., гистол. и эмбриол., 1962, 42, с. 46—53.
44. Оленев С. И. Клетки спинального ганглия куриного эмбриона в культуре. — Труды I Ленингр. мед. ин-та им. акад. И. Павлова и Ленингр. о-ва анатомов, гистологов и эмбриол. Л., 1971, с. 106—111.
45. Оленев С. Н., Быстров В. Д., Воскресенская Л. В., Штарк М. Б. Изучение роста нервных волокон спирального ганглия в культуре с применением перфузионной камеры и микрокиносъемки. — Цитология, 1970, 12, С. 810—812.
46. Певзнер Л. 3. Функциональная биохимия нейроглии. М., 1972.
47. Питерс А., Палей С., Уэбстер Г. Ультра структура нервной системы. М., 1972.
48. Пылъдвере К. И. Проблема биологической специфичности глиоэпенди-мальной ткани. — Уч. зап. Тартусск. гос. ун-та, 1972, 189, с. 108—120.
49. Пылъдвере К. И. О некоторых спорных вопросах гистогенеза нейроглии по данным тканевых культур. — Арх. анат., гистол. и эмбриол., 1971, 60, № 1, с. 27—38.
50. Резников Я. Ю. Особенности перемещения глиальных клеток мозга интактных мышей и мышей с травмой мозга в первые часы после синтеза ДНК и клеточного деления. — Онтогенез, 1975, 6, № 1, с. 71—79.
51. Резников К. Ю. Включение 3Н-тимидипа в клетки коры теменной области и клетки субэпендимной зоны у двухнедельных мышей в норме и при травматизации мозга. — Онтогенез, 1975, 6, .№ 2, с, 169—176.
52. Ройтбак А. И. Нейроглия и образование новых нервных связей в коре мозга. — В кн.: Механизмы образования и торможения условных рефлексов. М-, 1973.
53. Русинов В. С. Доминанта. М., 1969.
54. Саркисов С. А., Боголепов Н. Н. Электронная микроскопия мозга. М., ' 1967.
55. Сванидзе И. Л., Брегвадзе И. А, Структурные особенности макроглиальных клеток коры головного мозга в условиях тканевой культуры. — Цитология, 1968, 10, с. 1036.
56. Сванидзе И. К., Дидимова Е. В. Изучение динамики Сухого веса живых глиальных клеток. — Цитология, 1974, 16, с. 187—192.
57. Сванидзе И. В., Дидимова Е. В. Межклеточные контакты и синхронизация колебаний сухого веса глиальных клеток. — Цитология, 1975, 17, с. 1226—1228.
58. Сванидзе И, К., Ройтбак А. И., Дидимова Е. В. Влияние ионов калия на двигательную активность глиальных клеток коры мозга в условиях тканевой культуры. — ДАН СССР, 1973, 211, с. 1450—1452.
59. Симонов Б, В. Три фазы в реакциях организма на возрастающий стимул. М., 1962.
60. Снесарев П. Е. Глиоархитектопика коры большого мозга. — В кн.: Цитоархитектоника коры большого мозга человека. М., 1949, с. 138—154.
61. Снесарев И. Е. Теоретические основы патологической анатомии психических болезней. М., 1950.
62. Снесарев И. Е. Нейроглия. — В кц.; Многотомное руководство по невроглии. 2. М., 1955, с. 219—263,
63. Хлопин Н. Г. Рост и превращение вне организма нейроглии зрительных путей. — Арх. анат., гистол. и эмбриол., 1939, 22, с. 279—289.
64. Хлопин Н. Г. Культура ткани. Л., 1940.
65. Хлопин II. Г. Общебиологические и экспериментальные основы гистологии. М.—Л., 1946.
66. Цыпкин JI. Б., Ройхель В. М. Изучение особенностей агрегации клеток некоторых однослойных культур. — Арх. анат,, гистол. и эмбриол., 1971, 61, с. 5—13.
67. Шарипов И. К., Епенко С. О., Сахно Ю. Ф., Смирнова? Н. Л., Шунз-ская В. Е. Исследование подвижности в культивируемой нервной ткани взрослых кроликов методом центрафферентноЙ микрокиносъемки. — Биофизика, 1972, 17, с. 246—251.
68. Adamo N., Datgneult Е. Ultrastructural morphology of Schwann сеЦ-neuronal relationships in the spiral ganglia of cats. — Amer. J. Anat., 1973, 138, p. 73—77.
69. Achuearro N, De 1’evolution de la neuroglia et specialement de ses relations avec 1’appareil vasculaire. — Trab. Lab. invest, biol. Univ. Madrid, 1915, 13, p. 169—212.
70. Achuearro N. On the evolution of neuroglia and specially their relation to the vascular apparatus. — J. Nerv. Ment. Dis., 1918, 48, p. 333—357.
71. Altman J. Proliferation and migration of undifferentiated precursor cells in the rat during postnatal gliogenesis, — Exp. Neurol., 1966, 16, p. 263— 278.
72. Altman J. Autoradiographic and histological studies of postnatal neurogenesis. — J. Comp. Neurol., 1969, 137, p. 433—458.
73. Altman J., Altman E. Increased utilization of amino-acids and cellular proliferation demonstrated autoradiographically in the optic pathway of pigeons. — Exp. Neurol., 1962, 128, p. 431—474.
74. Bailey P., Cushing H. Tumors of the glioma group. Philadelphia, 1926.
75. Bass IV. H., Xetsky M. A., Young E. Microchemical studies of postnatal development in rat cerebellum. 1. Migration and differentiation of cells. — Neurology, 1961, 19, p. 258—268.
76. Bellars R. The development of the nervous system in chick embryos studied by electron microscopy. — J. Embr. Exp. Morphol., 1959, 7, p. 94— 115.
77. Benitez H., Murray M., Wolley D. Effects of serotonin and certain of its antagonists upon oligodendroglial cells in vitro. — Excerpta Medica, section VIII -Neurol. Psychiatr., 1955, 8, p. 458.
78. Berg О., К alien B. Studies in rat neuroglia cells in tissue culture. — J. Neuropath. Exp. Neurol., 1959, 18, p. 458—467.
79. Bertolini B. Ultrastructure of the spinal cord of the lamprey. — J. Ultrastr. Res., 1964, 11, p. 1—24.
80. Blakemore IP. The ultrastructure of the subependimal plate in the rat. — J. Anat., 1969, 104, p. 423—433.
81. Blinzinger К., Hager H. Elektronenmikroskopische Untersuchungen iiber Feinstruktur Ruchender und Progressiver Mikrogliazellen im Saugetien-gehirn, — Beitr. pathol. Anal., 1962, 127, N 2, p. 173—192.
82. Blinzinger K., Kreutzberg G. Displacement of synaptic terminals from regenerating motoneurons by microglial cells. — Z. Zellforsch. 1968, 85, N 1, S. 145-157.
83. Blinzinger K., Rewcasfle iV. B., Hager H. Observation од prismatic type mitochondria within astrocytes of the Syrian hamster brain. — J. Cell Biol., 1965, 25, N 2, p. 293—303.
84. Blunt M., Wendel-Smith C., Baldwin F. Glia-nerve fibre relationships in mammalian optic nerve. — J. Anat., 1965, 99, p. 1—11,
85. Blunt M. I., Wendell-Smith С. P., Paisley P. B., Baldwin F. Oxidative enzyme activity in macroglia and axons of cat optic nerve. — J. Anat., 1967, 101, p. 13—26.
86. Bone Qu. Observation upon the nervous system of pelagic tunicates. — Quart. J. Microscop. Sci., 1959, 100, p. 167—182.
87. Bone Qu. The central nervous system in Amphioxus. — J. Comp. Neurol., I960, 115, p. 27-51.
88. Brians W. A. Mitotic activity in the brain of the adult rat, — Anat. rec., 1959, 133, p. 65—71.
89. Bunge M. B., Bunge R. P„ Ris H. Ultrastructure study of remyelination in an experimental lesion in adult cat spinal cord. — J. Biophys. Biochem. Cytol., 1961, 10, p. 67-94.
90. Bunge M. B., Bunge R. P., Pappas G. D. Electron microscopic demonstration of connections between glia and myelin sheath in the developing mammalian central nervous system. — J. Cell BioL, 1962, 12, p. 448—453.
91. Bunge R. P. Glial cells and the central myelin sheath. —Physiol. Rev., 1968, 48, p. 197—251.
92. Bunge R. P., Glass P. M. Some observations on myelin-glial relationship and on the etiology of the cerebrospinal fluid exchange lesions. — Ann. New York Acad. Sci., 1965, 22, p. 15—28.
93. Cajal S., Ramon y. Histologie du systeme nerveux de 1’homme et des vertebras. Paris, 1909—1911.
94. Cajal S. Ramon y. Contribucion al conocimiento de la neuroglia del cerebro humane. — Trab. Lab. invest, biol. Univ. Madrid, 1913, 11, p. 255—315.
95. Cajal S. Ramon y., Sanchez D. Contribucion al conocimiento de los centres nerviosos de los insectos. — Trab. Lab. invest, biol. Univ. Madrid. 1915, 13, p. 1—94.
96. Caley D. W., Butler A. B. Formation of central and peripheral myelin sheaths in the rat: an electron microscopic study. — Amer. J. Anat., 1974, 140, p. 339—348.
97. Caley D., Maxwell D. An electron microscope study of the neuroglia during postnatal development of the rat cerebrum. — J. Comp. Neurol., 1968, 133, p. 45—69.
98. Caley D. W., Maxwell D. S. Development of the blood vessels and extracellular space during postnatal maturation of rat cerebral cortex. — J. Comp. Neurol., 1970, 138, p. 31—49.
99. Cammermeyer J. The life history of microglial cells. — Neurosci. Res., 1970, 3, N 1, p. 44—121.
100. Canti R. G., Bland J. O. HL, Russel D. S. Ass. Res. Nerv. Meat. Dis., 1935, 16, p. 1. Cited: Lumsden С. E. Nervous tissue in culture. — In: The structure and function of nervous tissue. Ed. G. N. Born. New York, 1968, p. 67-140.
101. Cavanaugh J. B. The proliferation of astrocytes around a needle wound in the rat brain. — J. Anat., 1970, 106, p. 471—487.
102. Chang J. J., RM W. Contractile responses to electrical stimulation of glial cells from the mammalian central nervous system cultivated in vitro. — J. Cell Comp. Physiol., 1959, 53, p. 139—144.
103. Coggeshall R. The ganglion connective junction in the CNS of the leech Hirudo medicinalis. — J. Morphol., 1966, 119, p. 417—424.
104. Crain S., Bomslein M. Bioelectric activity of neonatal mouse cerebral cottex during growth and differentiation in tissue culture. — Exp. Neurol., 1964, 10, p. 425—450,
105. Crain S., Peterson E. Complex bioelectric activity in organized tissue cultures of spinal cord (human, rat and chick). — J. Cell Comp. Physiol., 1964, 64, p. 1—13.
106. Cravioto IL, Lockwood R. The behavior of normal peripheral nerve in tissue culture. — Z. Zellforsch., 1968, 90, S, 186—201.
107. Davison A. JV. The biochemistry of the myelin sheath. In: Myelination. Eds A. N. Davison, A, Peters. 1970, p. 80—161.
108. Ernyei S., Young M. R. Pulsatile and myelin forming activities of Schwann cells in vitro. — J. Physiol. (London), 1966, 183, p. 469—480.
109. Farcuhar M., Hartmann J, Neuroglial structure and relationships as revealed by electron microscopy. — J. Neuropath. Exp. Neurol., 1957, 16, p. 18-39.
110. Fernandez-Mordn H., Finean J. Electron microscope and lowangle X-ray diffraction studies of the nerve myelin sheath. — J. Biophys., Biochem. Cytol., 1957, 3, p. 725—748.
111. Fewster M. E., Einstein E. R,, Csejtey'J., Blackstone S. C. Proteins in the bovine oligodendroglia cells at various stages of brain development. — Neurobiol., 1974, 4, p. 388-407.
112. Finean J. B. X-ray diffraction studies of the myelin sheath in peripheral and central nerve fibers. — Exp. Cell Res., 1953, 5, p. 202—215.
113. Finean J, B. Electron microscope and X-ray diffraction studies of the effects of dehydration on the structure of nerve myelin. I. Peripheral nerve. — J. Biophys., Biochem. Cytol., 1960, 8, p. 13—29.
H4.^Fischbach G., Dicker M. Electrophysiologic and morphologic properties of neurons in dissociated chick spinal cord cell cultures, — Develop. Biol., 1974, 37, p. 100—116.
115. Fishman Af., Madyastha P., Prensky A. L. The^effect of undernutrition on the development of myelin in the rat central nervous system. — Lipids, 1971, 6, p. 458—465.
116. Fleischhauer K., Wartenberg EL Elektronenmikroskopische Untersuchungen iiber das Wachstum der Nervenfasern und liber das Auftreten von Mark-scheiden im Corpus callosum der Katze. — Z. Zellforsch., 1967, 83, S. 568—581.
117. Flexig P. Zum Entwicklungsgeschichte der Associationssysteme im men-schlichen Gehirn. — Neurol. Zentralbl., 1894, 13, S. 606—608.
118. Friede R. L., Samorajski T. Relation between the number of myelin lamellae and axon circumference in fibers of vagus and sciatic nerves of mice. — J. Comp. Neurol., 1967, 130,(p. 223—232.
119. Friede R. L., Samorajski T. Myelin formation in the sciatic nerve of rat. A quantitative electron microscopic, histochemical and radioautographic study. — J. Neuropath. Exp. Neurol., 1968, 27, p. 546—570.
120. Fujita S. The matrix and cytogenesis in the developing CNS. — J. Comp, Neurol., 1963, 16, p. 18—39.
121, Fujita S. The autoradiographic study of the origin and fate of the subpial glioblasts in the embryonic chick spinal cord. — J. Comp. Neurol., 1965, 124, p. 51-60.
122. Fujita S. Quantitative analysis of cell proliferation and differentiation in the cortex of the postnatal mouse cerebellum. — J. Cell Biol., 1967, 32, p. 277—287.
123. Fujita S. Genesis of glioblasts in the human spinal cord as revealed by Feulgen cytophotometry. — J. Comp. Neurol., 1973, 151, p. 25—34, 124, Fujita S., Fujita H. Electron microscopic studies on the neuroblast differentiation in the CNS of a domestic fowl. — Z. Zellforsch., 1963, 6, p. 463-478.
125. Geiger R. S. Subcultures of adult mammalian brain cortex in vitro. — Exp. Cell Res., 1958, 14, p. 541—566.
126, Geiger R. The behavior of adult mammalian brain cells in culture. — Internet. Rev. Neurobiol., 1963, 5, p. 1—52.
127. Geren B. The formation from the Schwann cell surface of myelin in the peripheral nerves of chick embryos. — Exp. Cell Res., 1954, 7, p. 558—562.
128. Glees P. Neuroglia, Morphology and Function. Oxford, Springfield, 1955.
129. Goulter H. D. Electron microscopic identification of glial cells in the central nervous system of adult mice and rats after perfusion fixation. — Anat. rec., 1964, <48, N 2, p. 273.
130. Gray E. Tissue of central nervous system. In: Electron microscopic anatomy. New York, 1964, p. 369—471.
13i. Gutllery R., Hanna M-, Sobkowiez G., Scott L. Relationships between glial and neuronal elements in the development of long term cultures of the spinal cord of the fetal mouse, — J. Comp. Neurol., 1970, 140, p. 1-15.
132. GUldner F., Wolff J. R. Neurono-glial synaptoid contacts in the median eminence of the rat. — Brain Res., 1973, 61, N 1, p. 217—234.
133. Hain R., Rieke И7., Everett N, Evidence of mitosis in neuroglia as revealed by radioautography employing tritiated thymidine, — J. Neuropath. Exp. Neurol., 1960, 19, p. 147—148.
Ramberger A. Difference between isolated neuronal and vascular glia with respect to respiratory activity. — Acta physiol, scand., 1963, Suppl. 58, p. 203.
135. Bamberger A-, Hyden N. Inverse enzymatic changes in neurons and glia during increased function and hypoxia. — J. Cell Biol., 1963, 16, p. 521 — 525.
136. VHansson H. A., Sourander P. Studies on cultures of mammalian retina. — Z. Zellforsch., 1964, 62, p. 26-47.
137. Harkmark IF. Cell migrations from the rhombic limb to the inferior olive, the nucleus raphe and the pons, — J. Comp. Neurol., 1954, 100, p. 115— 209.
138. Harrison R. Neue Versuche und Beobachtungen fiber die Entwicklung des peripheren Nerven der Wirbeltiere. Bern, 1904.
139. Harrison R. Neuroblast versus sheath’cells in the development of peripheral nerves. — J. Comp. Neurol., 1924, 37, p. 121—203.
140. Hartmann J. Identification of neuroglia in an electron micrographs of normal nerve tissue. — Proc. IV Internet. Congr. Neuropath. (Stuttgart), 1961, 2, p. 32—35.'Ч
141. Hauw J-, Boutry J., Greenlee S., Robineaux R. Morphology of cultured guinea-pig cerebellum. I. Pattern of development. Comparison of phase contrast cinematography and silver impregnations of various cell types. — Cell Tiss. Res., 1974, 152, p. 141—164.
142. Hild W. Das morphologische, kinetische und endokrinologische Verhalten von hypothalamischen und neurohypophysaren Gevebe in vitro. — Z. Zellforsch., 1954, 40, S. 257—312.
143. Hild W. Structure and function of neuroglia. — In: Macromolecular specificity and biological memory. Cambridge Mass., 1962, p. 49—51.
144. Hirano A., Dembitzer H. M. A structural analysis of the myelin sheath in the central nervous system. — J. Cell Biol., 1967, 34, p. 555—567.
145. Hirano A., Levine S., Zimmerman H. Remyelination in the central nervous system after cyanide intoxication. — J. Neuropath. Exp. Neurol., 1968, 27, p. 234-245.
146. Hirose G., Bass R. Maturation of oligodendroglia in rat optic nerve. — J. Comp. Neurol., 1973, 152, p. 201—209.
147. His W. Die Entwicklung der ersten Nervenbahnen beim menschlichen Embryo iibersichtliche Darstellung. — Arch. Anat. Physiol. Anat. Abt., 1887, Suppl., 368—378.
148 Hiscoe H. B. The distribution of nodes and incisures in normal and regenerating nerve fibers. — Anat. rec., 1947, 99, p. 447.
149 Hogue M. J. Human fetal brain cells in tissue cultures: their identification wJ motility. — J, Exp. Zool,, 1947, 106, p, 85—107,
150. Hogue M. J. Brain cells from human fetuses and infants, cultured in vitro after death of the individuals. — Anat. rec., 1950, 108, p. 457—475.
151. Hogue M. J. A study of adult brain cells grown in tissue cultures. — Amer. J. Anat., 1953, 93, p. 397-428.
152. Homm.es 0., Leblond C. Mitotic division of neuroglia in the normal adult rat. — J. Comp. Neurol., 1967, 129, p. 269-278.
153, Horstmann E. Die Faserglia des Selachiergehirns. — Z. Zellforsch. 1954, 39, S. 588-617.
154. Hortega P. del Rio. El tercer elemento de los centros nerviosos. — Bol. Soc. Esp. biol., 1919, 9, p. 69-120.
155. Hortega P. del Rio. La microglia у transformation en cellules en bostocito у en cuerpos granuloadiposos. — Trab. Lab. invest, biol. Univ. Madrid, 1920, 18, p. 37-82.
156. Hortega P. del Rio. Microglia. — In: Cytology and cellular pathology of the nervous system. 2. New York, 1932, p. 483—534.
157. Hortega P. del Rio. Estudios sobre la neuroglia. La glia — escasas radiac-tiones (oligodendroglia). — Bol. Real Soc. Esp. Hist. Nat., 1921, 21, p. 63—92.
158. Hortega P. del Rio, Tercera aportacion al conocimiento morfologico e interpretation functional de la oligodendroglia. — Mem. Real Soc. Esp. Hist. Nat., 1928, 14, p. 5—122.
159. Hortega P. del Rio. Microglia. — In: Cytology and Cellular Pathology of the Nervous System. Ed. W. Penfield. New York, 1932, 2, p. 483— 534.
160. Hbsli L. Die Nervengewebekultur ein Modell zur Untersuchung synapti-scher Mechanismen im Zentralnervensystem. — Bull. Schweiz. Akad. med. Wiss., 1974, 30, p. 21—28.
161. Hosli L., Hosli E., Andres P. Light microscopic and electrophysiological studies of cultured human central nervous tissue. — Europ. Neurol., 1973, 9, p. 121—130.
162. Hyden H. Neuron. Amsterdam, 1967.
163. Hyden H., Pigon A. A cytophysiological study of the functional relationship between oligodendroglial cells and nerve cells of Deiters nucleus. — J. Neurochem., I960, 6, p. 57—72.
164. Jacobson M. Developmental neurobiology. New York, 1970.
165. Jaros G., Sensenbrenner M., Downes T., Meyer B., Mandel P, Simplifications to substrate preparation for the cultivation of dissociated nerve cells. — Experientia, 1975, 31, p. 251—253.
166. Jaros G., Sensenbrenner M., Mattender E., Rechenmann R., Mandel P. Etude trace-autoradiographique de la proliferation des cellules nerveuses en culture. — C. R. Acad. Sci. Paris, 1974, 279, p. 1101—1104.
167. Johnson H., Haymaker W., Rubini J. A radiographic study of a human brain and glioblastoma multiform after the in vivo uptake of tritiated thymidine. — Cancer, 1960, 13, p. 636—642.
168. Johnston P. V., Roots В. I. Nerve Membranes. Oxford—New York—Toronto—Sydney—Braunschweig, 1972.
169. Juba A. Das erste Erscheinen und die Urformen des Hortegaschen Microglia des Menschen. — Arch. Psychiatr., 1934, 102, p. 225—232.
170. Keene M. F. L., Hewer E. F. Some observations of myelination in the human central nervous system. — J. Anat., 1931, 66, p. 1—13.
171. Kerns J., Hinsman E. Neuroglial response to sciatic neurectomy. — I. Comp. Neurol., 1973, 151, p. 237—280.
172. Kershman J. Genesis of microglia In the brain. — Arch. Neurol. Psychiatr., 1939, 14,' p. 24-50.
173. Kim S., Monkacsi J. Morphological and cytochemical characteristics of neurons in cultures of mouse sympathetic ganglia. — Exp. Neurol., 1954, 45, p. 94—103.
174. King J. A comparative investigation of neuroglia in representative vertebrates. — J. Morph., 1966, 119, p. 435—466.
60Q
175. King J. S. A light and electron microscopic study of perineuronal glial cells and processes in the rabbit neocortex. — Anat. rec., 1968, 161, N 1, p. Ill—114.
176. Kitamura T. The origin of brain macrophages. Some considerations on the microglial theory of Del Rio Hortega. — Acta pathol. jap., 1973, 23, p. 11-26.
177. Knobler R. L., Stempak J. G., Laurencin M. Oligodendroensheathment of axons during myelination in the developing rat central nervous system: a serial section electron microscopical study. — J. Ultrastr. Res., 1974, 49, p. 34—49.
178. Koenig H, An autoradiographic study of nucleic acid and protein turnover in the mammalian neuraxes. — J. Biophys., Biochem. Cytol., 1958, 4, p. 785— 792.
179. Koenig H., Barron K. D. Reactive gliosis. A histochemical study. — J. Neuropath. Exp. Neurol., 1963, 22, N 2, p. 236—239.
180. Konigsmark B., Sidman R. Origin of brain macrophages in the mouse. — J. Neuropath. Exp, Neurol., 1963, 22, p. 643—674.
181. Korey S, Glia, lipogenesis and formation of myelin. — Arch. Neurol., 1960, 2, p. 140—145.
182. Kruger L., Maxwell D. S. Electron microscopy of oligodendrocytes in normal rat cerebrum. — Amer. J. Anat., 1966, 118, p. 435 —441.
183. Kruger L., Maxwell D. Comparative fine structure of vertebrate neuroglia: Teleost and Reptiles. — J. Comp. Neurol., 1967, 129, p. 115—142.
184. Kryspin-Exner W. Beitrage zur morphologia der Glia im Nisslbiede. — Z. Anat. Entwickl. Gesch., 1943, 112, p. 389—416.
185. Kuffler 8., Nicholls M. The physiology of neuroglial cells. — Erg. Physiol., 1966, 57, p. 1—90.
186. Langworthy 0. R. Development of behavior patterns and myelinization of tracts in the nervous system. — Arch. Neurol. Psych., 1932, 28, p. 1365— 1382.
187. Lapham L. Cytological and cytochemical studies of neuroglia. I. A study of the problem of amitosis in reactive protoplasmic astrocytes. — Amer. J. Pathol., 1962, 41, p. 1—21.
188. Ling E.., Leblond C. Investigation of glial cells in semithin sections. II. Variation with age in the numbers of the various glial cell types in rat cortex and corpus callosum. — J. Comp. Neurol., 1973, 149, p. 73—81.
189. Ling E., Paterson J., Privat A., Mori S., Leblond C. Investigation of glial cells in semi thin sections. I. Identification of glial cells in the brain of young rats. — J. Comp. Neurol., 1973, 149, p. 43—47.
190. Livingston R,, Pfenriinger K., Moor II., Akert K. Specialized paranodal and interparanodal glial-axonal junctions in the peripheral and central nervous system, A freeze-etching study. — Brain Res., 1973, 58, p. 1—25.
191. Lodin Z., Booher J., Kasten F. H. Phase-contrast cinematographic study of dissociated neurons from embryonic chick dorsal root ganglia cultured in the Rose chamber. — Exp. Cell Res., 1970, 60, p. 27—39.
192. Lodin Z., Faltin J., Booher J. Fibre formation and myelination of cultivated dissociated neurons from chicken dorsal root ganglia. — Neurobiol., 1973, 3, p. 66—87.
193. London Y., Demel R. A., Geurts van Kessel W. S. M. The protection of Au myelin basic protein against the action of proteolytic enzymes after interaction of the protein with lipids at the air-water interface. — Biochem. biophys. acta, 1973, 311, p. 520—530.
194. Lubinska L. Sedentary and migratory states of Schwann cells. — Exp. Cell Res., 1960, Suppl 8, p. 74—90.
195, Lumsden E. Biology of Neuroglia. Springfield, 1958, p. 141—161.
196. Lumsden E. Nervous tissue in culture. In: The structure and function of nervous tissue. Ed. G. H. Borne. New York, 1968, p. 67—140.
197. Lumsden E., Pomerat C. Normal oligodendrocytes in tissue culture. A preliminary report on the pulsative glial cells in tissue cultures from the cor-
ptis callosum of the normal adult rat brain. — Exp. Cell Res., 1951, 2, p. 103—114.
198. Lunsden C. Tissue culture in relation to tumours of the nervous system. — In: The pathology of tumours of nervous system. 1971, p. 334—420.
199. Luse S. 4. Two views concerning criteria for identification of neuroglia cell types by electron microscopy. — In: Biology of Neuroglia. Springfield, 1958, p. 50—57.
200. Luse S. The fine structure of the morphogenesis of myelin. — In: The biology of myelin. 1959, p. 59—81.
201 Luse S. A. The ultrastructure of normal and abnormal oligodendroglia, — Anat. rec., 1960, 138, p. 461—469.
202. Manuelidis L., Manuelidis E. An autoradiographic study of the proliferation and differentiation of glial cells in vitro. — Acta neuropath. (Berlin), 1971, 18, p. 193—213.
203. Mares V. An autoradiographic study of regional differences in DNA synthesis in the brain of young adult mice. — Acta histochim., 1975, 53, p. 70-76,
204. Marks N., Stern F., Lajtha A. Changes in proteolytic enzymes and protein during maturation of the brain. — Brain Res., 1975, 86, p. 307—322.
205. Martin J., Webster H. Mitotic Schwann cells in developing nerve: their changes in shape, fine structure and axon relationships. — Develop. Biol., 1973, 32, p. 417-431.
206. Matthews M, A. An electron microscopic study of the relationship between axon diameter and the initiation of myelin production in the peripheral nervous system. — Anat. rec., 1968, 161, p. 337—352.
207. Maithieu J. M., Brady В. O., Quarles R. H. Change in a myelinassociated glycoprotein in rat brain during development: metabolic aspects. — Brain Res., 1975, 86, p. 55—65.
208. Maturana H. R. The fine anatomy of the optic nerve of anurans — an electron microscopic study. — J. Biophys. Biochem. Cytol., I960, 7, p. 107— 120.
209. Maxwell D. S., Kruger L. Small blood vessels and the origin of phagocytes in the rat cerebral cortex following heavy particle irradiation. — Exp. Neurol., 1965, 12, p. 33-54.
210. Maxwell D. S., Kruger L. The fine structure of astrocytes in the cerebral cortex and their response to focal injury produced by heavy ionizing particles."— J. Cell Biol., 1965, 25, p. 141—156.
2Ц, Meller K., Breipohl W., Glees B. Early cytological differentiation in the cerebral hemisphere of mice. — Z. Zellforsch., 1966, 72, S. 525—533.
212. Meller K., Breipohl IV., Wagner H., Knuth A. Die Differenzierung isolierter Nerven und Gliazellen aus trypsiniertem Ruckenmark von Huhnerem-bryonen in Gewebe culture. — Z. Zellforsch., 1969, 101, S. 135—151.
213. Meller K., Wechsler 1У. Elektron mikroskopische Befunde am Ependym des sich entwickelnden Gehirns fon Hiihnerembryonen. — Acta neuropath., 1964, 3, p. 609—626.
214. Messier B., Leblond C., Smart I. Presence of DNA synthesis and mitosis in the brain of young adult mice. — Exp. Cell Res., 1958, 14, p. 224—226.
215. Metuzals J. Ultrastructure of myelinated nerve fibers in the central ner-vous system of the frog. — 1963, 8, p. 30—47.
216. Mori 8., Leblond C. Identification of microglia in light and electron microscopy. — J. Comp. Neurol., 1968, 131, p. 57 —80.
217. Morijs., Leblond С. P. Identification of microglia in light and electron microscopy. — J. Comp. Neurol., 1969, 135, p. 57—65.
218. Mori .S., Leblond С. P. Electron microscopic features and proliferation of astrocytes in the corpus callosum of the rat. — J. Comp. Neurol., 1969, 137, p. 197—225.
219. Mori 5., Leblond С. P. Electron microscopic identification of three classes of oligodendrocytes and preliminary study of their proliferative activity in the corpus callosum of young rats. — J. Comp. Neurol., 1970, 139, p. 1-30.
220. Mugnainl E. Helical filaments in astrocytic mitochondria of the corpus striatum in the rat. — J. Cell Biol., 1964, 23, p. 17.
221. Mugniani E,, Walberg F. Ultrastructure of neuroglia. — Ergebn. Anat. Entwicklungsgesch., 1964, 37, p. 194—236.
222, Muller E, Studien uber Neuroglia. — Arch, mikroscop, Anat., 1900, 60, p. 11-62.
223. Murray M. R. Response of oligodendrocytes to serotonin. — In: Biology of Neuroglia. Springfield, 195S, p. 176—190.
224. Murray M. R. Factors bearing on myelin formation in vitro. — Progr. NeurobioL, 1959, 4, p. 201—221.
225. Murray M. R. Myelin formation and neuron histogenesis in tissue culture.— In: Comparative Neurochemistry. Ed. D. Richter. 1964, p. 49— 58.
226. Murray M. R. Nervous tissue in vitro. — In: Cells and tissue in cultures. II. New York, 1965, p. 375—455.
227. Nakai J. Transformation and multiplication of glial cells. — In: Morphology of neuroglia. Tokyo, 1963, p. 71—74.
228. Nakai J,, Okamoto M. Identification of neuroglial cells in tissue culture. — In: Morphology of Neuroglia. Ed. J. Nakai. Tokyo, 1963, p. 65—102.
229. Nakazawa T. Biological response of oligodendrocyte and astrocyte in tissue culture, — In: Morphology of neuroglia. Ed. J. Nakai. Tokyo, 1963, p. 103-106.
230. Nakazawa T. Selectivity in fasciculation of nerve fibres in vitro. — J. Comp. Neurol., 1965, 125, p. 193—205.
231. Nansen F. The structure and combination of the histological elements of the CNS. — Bergen Museum Aarsb. 1887.
232. Napolitano L., Lebaron F., Scaletti J. Preservation of myelin lamellar structure in the absence of lipid. — J. Cell Biol., 1967, 34, p. 817—825.
233. Navar G. Experimental analysis of the origin of the autonomic ganglia in the chick .embryo. — Amer. J. Anat., 1956, 99, p. 473—505.
234. Nemilojf A. Uber die Beziehung der sog. «Zellen der Schwannschen Scheide® zum Myelin in den Nervenfasern von Saugetieren. — Arch, mikroscop. Anat., 1910, 76, p. 329—348.
235. Norton W. T. Myelin. — In: Basic neurochem., 1972, p. 366—386.
236. Nystrom R. A. Membrane physiology. New Jersey. 1973.
237. Palactos Pru L. E., Mendoza Briceno V. R. An unusual relationship between glial cells and neuronal dendrites in olfactory bulbus of Desmodus rotundus. — Brain Res., 1972, 36, N 2, p. 404—408.
238. Palay S. L. An electron microscopical study of neuroglia. — In: Biology of Neuroglia. Springfield, 1958, p. 24—38.
239. Paterson J., Privat A., Ling E., Leblond C. Investigation of glial cells in semithin sections. III. Transformation of subependimal cells into glial cells, as shown by radioautography after ®H-thimidine injection into the lateral ventricle of the brain of young rats. — J. Comp. Neurol., 1973, 149, p. 83-102.
240. Penfield PF. Neuroglia, normal and pathological. In: Cytology and cellular pathology of the nervous system (New York), 1932, 11, p. 421—479.
241. Peters A. The structure of myelin sheaths in the central nervous system of Xenopus laevis (Daudin). — J. Biophys. Biochem. Cytol., 1960, 7,
242. Peters A. The formation and structure of myelin sheaths in the central nervous system. — J. Biophys. Biochem. Cytol., 1960, 8, p. 431—446.
243. Peters A. Further observations on the structure of myelin sheaths in the central nervous system. — J. Cell Biol., 1964a, 20, p. 281—296.
244. Peters A. Observations on the connexions between myelin sheaths and glial cells in the optic nerves of young rats. — J. Anat., 1964b, 98, p. 125— 134.
245. Peters A.t Vaughn J. E. Morphology and development of the myelin sbeath. — In: Myelination. Eds A. N. Davison, A. Peters. 1970, p. 3—79.
?46. Peterson E. R., Crain S. M., Murray MS R. Activities of Schwann cells during myelin formation in vitro. — Anat. rec.,: 1958, 130, p. 357.
247. Pipa R. Studies on the hexapod nervous system. III. Histology and histochemistry of cockroach neuroglia. — J. Comp. Neurol. 1961, 116, p. 15— 26.
248. Pomerat С. M. Rhythmic pulsative activity in cells from central nervous system. — Anat. Res., 1952, 112, p. 473-479.
249. Pomerat С. M. Functional concepts based on tissue cultures studies of neuroglial cells. — In: Biology of Neuroglia. Eds W. F. Windle, С. C. Thomas. Springfield, 1958, p. 162—175.
250. Pomerat С. M., Hendelman W. J., Raiborn C. W., Massey A. J. F. Dynamic activities of nervous tissue in vitro. — In: The Neuron. Ed. H. Hyden. New York—Amsterdam, 1967, p. 119—178.
251. Prlvat A. Postnatal gliogenesis in the mammalian brain. — Internal. Rev. Cytol., 1975, 40, p. 281—323.
252. Prlvat A., Leblond C. The subependimal layer and neighbouring region in the brain of the young rat. — J. Comp. Neurol., 1972, 142, p. 151—171.
253. Privat A ., Mandon P., Brian M. Contribution de la microscope electroni-que a balayage pour 1’etude du tissue nerveux en culture organisee. — Exp. Cell Res., 1971, 71, p. 232—235.
254. Ramon-Molliner E. A study of neuroglia. The problem of transitional forms. — J. Comp. Neurol., 1958, 110, p. 151—171.
255. Rawlins F, A., Smith M. E. Myelin synthesis in vitro: a comparative study of central and peripheral nervous tissue. — J. Neurochem., 1971, 18, p. 1861—1870.
256. Rees R.f Bunge R. Morphological and cytochemical studies of synapses formed in culture between isolated rat superior cervical ganglion neurons. — J. Comp. Neurol., 1974, 157, p. 1—11.
257. Robertis De E., Gerschenfeld H., Wald F. Cellular mechanism of myelination in the central nervous system. — J. Biophys., Biochem. Cytol., 1958, 4, p. 651—658.
258. Robertson J, D. Recent electron microscope observations on the ultrastructure of the grayfish median — to motor giant synapse. — Exp. Cell Res., 1955, 8, p. 226—229.
259. Robertson J. The ultrastructure of cell membranes and membranous cell organelles. — Biochem. Soc. Symposia, 1959, 16, p. 3—43.
260. Robertson J. The molecular structure and contact relationships of cell membranes. — Progr, Biophys. Biophys. Chemie, 1960, 10, p. 343—418.
261. Ross L. L., Bornstein M. B., Lehrer G. M. Electron microscopic observations of rat and mouse cerebellum in tissue culture. — J. Cell Biol., 1962, 14, p. 19—30.
262. Santha K. Untersuchungen fiber die Entwicklung der Hortegaschen Microglia. — Arch. Psychiatr. Nerv., 1932, 96, S. 36—37.
263. Sauer F. Cellular structure of the neural tube. J. Comp. Neurol.. 1935, 63, p. 13-23.
264. Sckachenmayr W. liber die Entwicklung von Ependym und Plexus chorioi-deus der Ratte. — Z. Zellforsch., 1967, 77, S. 25—63.
265. Scheibel M. E., Scheibel A. B. Nfeurons and neuroglia cells as seen with the light microscope. — In: Biology of neuroglia. Ed. W. F. Windle. Springfield, 1958, p. 5—23.
266. Schlote W. Zur Gliaarchitektonik der menschlichen Grosshirnrinde im Nissl-Bild. — Arch. Psychiatr. Neurol., 1959,199, 6, p. 573—595.
267. Schultz R. L., Maynard E, A., Pease D. C. Electron microscopy of neurons and neuroglia of cerebral cortex and corpus callosum. — Amer. J. Anat., 1957, 100, p. 369-407.
268. Seeds A., Vatter A. Synaptogenesis in reaggregating brain cell culture. — Proc. Nat. Acad. Sci. USA, 1971, 68, p. 3219—3222.
269. Shahar A., Grunfeld У., Spiegelstein M. У., Monzaln R. Myelinization in long-term cultures of dissociated mammalian neurons. — Brain Bes., 1975, 88, p. 44-51.
270. Shimizu Y. The satellite cells in cultures of dissociated spinal ganglia, — Z. Zellforsch., 1965, 67, p. 185—185.
271. Shonbach C. The neuroglia in the spinal cord of the newt. — J. Comp. Neurol., 1969, 135, p. 93—120.
272. Sidman R., Miair I., Feder N. Cell proliferation and migration in the primitive ependymal zone. An autographic study of histogenesis of the nervous system. — Exp. Neurol., 1959, 1, p. 322—333.
273. Smart I. The subependimal layer of the mouse brain and its production as shown by radioautography after thymidine—H3 injection. — J. Comp. Neurol., 1961, 116, p. 325—347.
274. Smart I,, Leblond C, Evidence for divisions and transformation of neuroglia cells in the mouse brain as derived from radioautography after injection of thymidine-H3. — J. Comp. Neurol., 1961, 116, p. 349—367.
275. Sobkowicz H., Guillery R., Bernstein E. Neuronal organization in long term cultures of the spinal cord of fetal mouse. — J. Comp. Neurol., 1968, 132, p. 365—396.
276. Sokolansky G. Die Morphogenese der Markscheide der peripherischen Nervenfasern bei manchen Wirbelttieren und beim Menschen. — Anat. Anz., 1930, 69, p. 161—184.
277. Speidel С. C. Studies of living nerves. — Amer. J. Anat., 1933, 52, p. 1 — 79.
278. Speidel С. C. Studies of living nerves. III. Phenomena of nerve irritation and recovery degeneration and repair. — J. Comp, Neurol., 1935, 61, p. 1-79.
279. Speidel С. C. In vitro studies of myelinated nerve fibers. Internet. — Rev. Cytol., 1964, 16, p. 173—231.
280. Spoerrt C. Some in vitro observations in cultures of human fetal cerebral cortical tissue. — Arch. Anat. Hist. Embryol., 1970, 53, p. 81—95.
281. Stensaas L., Stensaas S. Astrocytic glial cells, oligodendrocytes and microgliacytes in the spinal cord of the toad. — Z. Zellforsch., 1968, 84, S. 184— 213.
282. Stenwig A. The origin of brain macrophages in traumatic lesions, Wale-rian degeneration and retrograde degeneration. — J. Neuropath. Exp. Neurol., 1972, 31, p. 696—704.
283. Sturrock R. Histogenesis of the anterior commissure of the mouse brain. — J. Anat., 1974, 117, p. 17—53.
284. Sturrock R, R. A quantitative electron microscopic study of myelination in the anterior limb of the anterior commissure of the mouse. — J. Anat., 1975, 119, p. 67—75.
28ti . Tasaki I. Excitability of neurons and glial cells. — Progr. Brain Res., 1965, 15, p. 234—242.
286. Tennyson V. The fine structure of the developing nervous system. — In: Developmental Neurobiology. Springfield, 1970, p. 47—116.
287. Vandenheuoel F. A. Lipid protein interactions in the lipoprotein systems of membranes. — J. Amer, Oil Chem. Soc., 1966, 43, p. 258—264.
288. Varon S., Reiborn C., Burnham P. Implication of a nerve growth factorlike antigen in the support derived by ganglionic neurons from their homologous glia in dissociated cultures. — Neurobiology, 1974, 4, p. 317— 327.
289. Vaughn J. An electron microscopic analysis of gliogenesis in rat optic nerves. — Z. Zellforsch., 1969, 94, S. 293—324.
290. Vaughn J., Hinds P. L., Skoff P. R. Electron microscopic studies of Wal-lerian degeneration in rat optic nerves. I. The multipotential glia. — J. Comp. Neurol., 1970, 140, N 2, p. 175—184.
291. Vaughn J., Peters A. Electron microscopy of the early postnatal development of fibrous astrocytes. — Amer. J. Anat., 1967, 121, p. 131—152.
292. Vaughn J., Peters A, A third neuroglial cell type. An electron microscopic study. — J. Comp. Neurol., 1968, 133, N 2, p. 269—288.
293. Vaughn J., Peters A. The morphology and development of neuroglial cells. — In: Cellular aspects of neural growth and differentiation. Los Angeles, 1971, p, 103—134.
294, Vaughn J., Scoff R. Neuroglia in experimentally altered CNS. — In: The structure and function of nervous system. New York, 1972, p. 39—72.
295, Walberg F. Further electron microscopical investigations of the inferior olive of the cat. — In: Topics in Basic Neurology. 6. Eds W. Bargmann, J. P. Schade. 1964, p. 59-75.
296. Webster H. F. The pattern of membrane growth in Schwann cells during the formation and enlargement of peripheral myelin sheaths. — J. Cell Biol., 1969, 43, p. 154-155.
297. Webster H., Martin J. R„ O’Connell M. The relationship between interphase Schwann cells and axons before myelination. A quantitative electron microscopic study. — Develop. Biol., 1973, 32, p. 401—416.
298. Wechsler W. Elektronenmikroscopischer Beitrag zur Histogenese der Weissen Substanz des Rucken marks von Huhnerembryonen. — Z. Zellforsch., 1966, 74, S. 232—251.
299. Wechsler IF., Metier K. Electron microscopy of neuronal and glial differentiation in the developing brain of the chick. — Progr. Brain Res., 1967, 26, p. 93—144.
300. Wegglesicorth V. The histology of the nervous system of an insect. — Quart. J. Microscop. Sci., 1959, 100, p. 299—313.
301. Weinberg ff. J., Spencer P. S. Studies on control of myelinogenesis. I. Myelination of regenerating axons after entry into foreign unmyelinated nerve. — J. Neurocytol., 1975, 4, p. 395—418,
302. Weiss P, Nervous system (neurogenesis). — In: Analysis of development. Ch. 1, sec. 7. Eds В. H. Willier, P. A. Weiss, V. Hamburger. Philadelphia-London, 1955, p. 346—401.
303. Weiss P. Guiding principles in cell locomotion and'coll gation. — Exp. Cell Res., 1961, Suppl. 8, p. 260.
304. Wolff J., Hbsli E.t Hosli L. Basement membrane material and glial cells in spinal cord cultures of newborn rats. — Brain Res., 1971, 32, p. 198— 202.
305. Wendell-Smith С. P., Blunt M. Baldwin F. The ultrastructural characterization of macroglial cell types. — J. Comp. Neurol., 1966, 127, N 2, p. 219-240.
306. Wonder M., Kozik M., Owsianowskl M. A histoenzymatic study of neuroglia during myelination of the rabbit brain. — Folia histochem, cytochim., 1969, 7, p. 135—150.
307. Wendler M., Mularek O. Rozwaj neurogliju wswietle badati kariometrycz-nych. — Folia morphol., 1971, 30, p. 43— 50.
308. Weston J. A radioautographic analysis of the migration and localization of trunk neural crest cells in the chick. — Develop. Biol., 1963, 6, p. 279— 340.
309. Wiggins R. C„ Benjamins J. A., Krtgman M. R-, Morell P. Synthesis of myelin proteins during starvation. — Brain Res 1974, 80, p. 345— 349.
.310 . Wiggins R, C., Benjamins J. 4., Morell P. Appearance of myelin proteins in rat sciatic nerve during development. — Brain Res., 1975, 89, p. 99—
311. Wittkowski W. Zur Ultrastruktur der Gefassfortsatze von Ependym und Gliazellen im Infundibulum der Ratte. — Z. Zellforsch., 1972, 130, p. 58— 69.
312. Wong-Rilley M. T. Terminal degeneration and glial reactions in the lateral geniculate nucleus of the squirrel monkey after eye removal. — J. Comp. Neurol., 1972, 144, p. 61—92.
313. Yonezawa T., Bornstein E., Peterson E., Murray M. A histochemical study of oxidative enzymes in myelinating cultures of central and peripheral nervous tissue. — J. Neuropath. Exp. Neurol., 1962, 21, p. 479—487.
jJ14. Zalch K., Mennel H. The biology of brain tumours. In: Handbook of Clj? pical Necrology. 16. New York—^ipsterdam, 1974, p. 5§,
Глава 14
ФИЗИОЛОГИЯ НЕЙРОГЛИИ
Главной структурной и функциональной единицей нервной системы является нервная клетка; выходным ее путем является аксон, основная функция которого состоит в проведении возбуждения к другим нервным клеткам или эффекторам; тело и дендриты воспринимают и перерабатывают сигналы (нервные импульсы), приходящие от других нервных клеток; на них располагаются синапсы, образуемые терминалями аксонов. Но есть исключения: с одной стороны, имеются нейроны, лишенные аксона (например, гранулярные клетки в обонятельной луковице, с которых тормозящее влияние на митральные клетки передается посредством дендро-дендритических синапсов); с другой стороны, имеются нейроны с идентифицированным аксоном, дающие только градуируемые потенциалы, но не нервные импульсы (например, горизонтальные и биполярные клетки сетчатки).
Нервные клетки уже давно 14] названы нейронами; в этом разделе по аналогии глиальные клетки будут обозначаться как глионы. Глионы не имеют отростка, который соответствовал бы аксону; на глионах не обнаружено синапсов; контакты терминалей аксонов, наполненных синаптическими пузырьками, с мембраной олигодендроцитов и астроцитов не являются, как правило, истинными синапсами. Лишь в последнее время, как уже выше отмечалось, знания об особенностях глионов начали базироваться на данных электрофизиологии, и в этой главе будут подробно рассмотрены основные эксперименты, фактические выводы и теоретические заключения о электрофизиологических и биофизических особенностях глионов. Как говорилось в предисловии, мозг стал в последнее время рассматриваться как нейронно-глиальная система, в которой нейроны и глионы взаимосвязаны; в этой главе будут рассмотрены некоторые конкретные механизмы этого взаимодействия. Электрофизиологический метод смог быть использован и при решении вопроса о составе жидкости межклеточных щелей
ц.н.с, и движении в них веществ. Относительно трофической функции, которая раньше в основном приписывалась нейроглии, оказалось труднее всего получить прямые данные, и сведения по этому вопросу отрывочны. Как будет видно, своеобразные свойства глионов дали возможность построения новых теорий относительно высших форм деятельности мозга — процессов обучения и памяти.
14.1. ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ГЛИОНОВ
14.1.1. МЕМБРАННЫЙ ПОТЕНЦИАЛ ГЛИОНОВ
При проколе мембраны глиона микроэлектродом не возникает характерный для нейрона разряд импульсов — разряд повреждения (рис. 14.1). Как будет видно из других разделов этой главы, глионы ни при каких условиях не обнаруживают импульсной активности: пропускание через мембрану электрического тока, ионтофоретическая аппликация возбуждающих медиаторов, повышение концентрации ионов К+ в окружающей среде не приводят к возникновению импульсов, которые напоминали бы потенциалы действия нейронов; не обнаруживается также колебаний мембранного потенциала, которые напоминали бы постсинаптические потенциалы (ВПСП и ТПСП).
Мембранный потенциал глионов отличается стабильностью по сравнению с мембранным потенциалом нейронов центральной нервной системы (ц.н.с.), который может снижаться или повышаться в зависимости от преобладания возбуждающих или тормозящих влияний. Факт стабильности мембранного потенциала можно использовать как физиологический аргумент в пользу отсутствия непосредственного синаптического действия на глионы. Но мембранный потенциал глионов может медленно изменяться в связи с периодическими изменениями Нервной активности (рис. 14.1). Как будет показано, эти изменения мембранного потенциала глиона обусловлены не прямыми синаптическими влияниями, а изменениями химического состава межклеточной среды.
Глионы обладают высоким сравнительно с нейронами мембранным потенциалом [41, 124, 147, 148, 175, 178, 186, 203]: 90 мВ и более; это касается глионов всех отделов ц.н.с. беспозвоночных, низших позвоночных и млекопитающих. Несмотря на малую величину глионов в коре мозга, при удачном вхождении микроэлектродом можно длительное время — 40 мин и больше — регистрировать высокий стабильный мембранный потенциал [41 ]. В культуре мозговой ткани мембранный потенциал глионов достигает 70-80 мВ [124, 133].
Путем инъекции краски внутрь клетки через отводящий микроэлектрод с последующим гистологическим изучением маркированных клеток коры мозга кошки было установлено, что клетки, у которых отсутствовала импульсная активность при наличии 608
высокого стабильного мембранного потенциала, обладали гистологическими характеристиками макроглиальных клеток [111, 137].
50мв\I 1с
Рис, 14Л. Эффекты от вхождения микроэлектродом в нейроны и глионы коры мозга,
А — верхние записи: вхождение в нейроны вызывает разряд повреждения; мембранный потенциал 50 и 60 мВ соответственно; нижняя запись — вхождение в глион не вызывает разряда повреждения; мембранный потенциал 75 мВ [1341. Б — вхождение в глион не вызывает разрядов; мембранный потенциал 80 мВ; в связи с вспышками электрической активности — веретен — возникают медленные сдвиги мембранного потенциала Глиона [111]. В — верхние записи; после вхождения в корковый глион мембранный потенциал 80 мВ; справа — эффект раздражения поверхности коры; как после прокола мембраны, так и при раздражении не возникает импульсной активности; нижнвд запись — микроэлектрод в том же треке попал в нейрон, мембранный потенциал 70 мВ; разряд повреждения. Время логарифмическое [41].
Однако часто при вхождении микроэлектродом в глион обнаруживается сравнительно низкий мембранный потенциал. Так, мембранный потенциал корковых глионов варьирует в пределах 20-90 мВ [41 ].
39 Общая физиология нервной системы
609
При регистрации мембранного потенциала большого Числа глионов коры мозга обнаружено бимодальное распределение его величин: 51 и 80 мВ, и было высказано предположение, что одна группа исследованных глионов — это астроциты, другая — олигодендроциты (138]. У амеб также было обнаружено бимодальное распределение величин мембранного потенциала: 14.4 и 59.6 мВ, но было установлено, что «низкий» мембранный потенциал регистрировался при неудачном введении микроэлектрода [21 ]. Таким образом, есть основания полагать, что низким мембранным потенциалом обладают поврежденные глионы [1881; что высокий мембранный потенциал регистрируется при попадании в тело глиона, а низкий — при попадании в его отростки, которые неминуемо повреждаются микроэлектродом [82]. Но, конечно, не только это обстоятельство определяет величину регистрируемого мембранного потенциала; в другом месте специально будет, рассмотрен вопрос зависимости мембранного потенциала глиона от функционального состояния данного пункта ц. н. с.
Можно было бы, наконец, думать, что низкий мембранный потенциал связан с делением глионов, которые, в отличие от нейронов, сохраняют эту способность в постэмбриональном периоде; однако в исследованиях культуры ткани было установлено, что концентрация ионов К'1' внутри глионов не изменяется в фазе их деления [152], что свидетельствует против этого предположения.
Глионы в культуре ткани мозга обладают обычно сравнительно низким мембранным потенциалом, что связывают с рядом факторов. Во-первых, отведение производится чаще всего от клеток-одиночек, а выход клетки в зону роста и обособление ее вызывают в ней значительные функциональные изменения [14]. Во-вторых, при старении культуры мембранный потенциал глионов снижается, например, к 16-му дню он падал до 10—20 мВ (с 30—70 мВ); видимо, это снижение мембранного потенциала обусловлено изменением соотношения К+ к Na+ внутри глионов из-за понижения активности Na+, К+-АТФазы [226]. В-третьих, меньшая величина мембранного потенциала глионов in vitro по сравнению с глионами in situ может быть связана с тем, что [К+ ] в питательной среде составляет 4.5 мМ, а в межклеточной жидкости в норме она обычно равна 3 мМ [151 ].
При регистрации мембранного потенциала глионов культуры ткани отмечалось, что он обычно быстро падает — за 0.5 мин после проникновения микроэлектрода мембранный потенциал мог упасть до низких величин, даже до нуля [240]. Это объясняется тем, что глионы в условиях культуры ткани пульсируют и повреждаются микроэлектродом. Интересно отметить, что если глионы глиомы крысы культивировались в присутствии дибутирил-циклической АМФ, то внутриклеточное отведение возможно было производить в течение 10 мин и больше и мембранный потенциал стойко держался на исходном уровне [114].
В культуре ткани мозга не обнаружено различий в величине1 мембранного потенциала в зависимости от того, производилось, ли внутриклеточное отведение от астроцитов или олигодендроцитов [124, 240]. В недавно проведенном исследовании на зрительной области коры мозга кошки с применением новой методики; окраски удалось удачно окрасить несколько клеток, которые по1 электрофизиологическим показателям были отнесены к глионам; при гистологическом изучении этих клеток одна была признана олигодендроцитом, остальные — астроцитами [138].
Шванновские клетки считаются аналогами олигодендроцитов ц. н. с., но электрофизиологические свойства их своеобразны. Мембранный потенциал покоя шванновской клетки гигантского волокна кальмара оказался равен 40 мВ; он был ниже мембранного потенциала аксона. Аксоны имели диаметр 250—400 мкм; шванновские клетки имели 60—100 мкм в длину и ширину и толщину в 5 мкм; микроэлектрод вводился в клетку косо; низкие величины мембранного потенциала не связаны с повреждением клетки от его вхождения: стабильность мембранного потенциала в течение 10 мин указывает на эффективное «заклеивание» мембраны вокруг кончика микроэлектрода; при повторных вкалываниях в данную шванновскую клетку потенциал оставался таким же [232].
14.1.2. ИОННЫЕ ОСНОВЫ МЕМБРАННОГО ПОТЕНЦИАЛА ПОКОЯ ГЛИОНОВ
Зрительный нерв протея — удобный объект для изучения электрических свойств глионов; в нем не содержится тел нейронов, он состоит из немиелинизированных нервных волокон диаметром около 2 мкм и сравнительно больших глиальных клеток; высокий мембранный потенциал глионов — до 90 мВ — обусловлен не каким-то особым механизмом, как можно было предполагать, а неодинаковым распределением ионов К+ по обе стороны мембраны [149]. При изменении [К+ ]н мембранный потенциал изменяется соответственно уравнению Нернста:
23°С)-
Ь’ — мембранный потенциал в мВ, R — газовая константа, F — число Фарадея, Т — абсолютная температура, [К+ ]„ концентрация ионов К+ внутри клетци, [К+ ]в — концентрация ионов К+ снаружи.
В этих опытах в течение 2 мин раствор с тестируемой [К+ ] омывал препарат. Как видно на рис. 14.2, А, исходный мембранный потенциал составлял 90 мВ; уменьшение [К+] в омывающем растворе от 3 мМ (нормальное содержание К+ в тканевой жидкости) до 0.3 мМ вызвало гиперполяризацию; мембранный потенциал увеличился на 35 мВ, т. е. достиг 125 мВ, омывание нормальным раствором вернуло мембранный цотенцидц к исходной вели
чине. Увеличение [К+ ] в растворе с 3 до 30 мМ вызвало деполяризацию; мембранный потенциал уменьшился на 59 мВ, т. е. снизился до 41 мВ; он вернулся к исходной величине медленнее, чем в предыдущем случае; с другой стороны, гиперполяризация достигла максимума за большее время, чем деполяризация.
/I
Рпс. 14.2. Зависимость мембранного потенциала глиона от концентрации К+ в наружной среде [149].
А — влияние изменения [К+] в омывающей жидкости на мембранный потенциал глиона зрительного нерва протея. Горизонтальная линия над осциллограммами — потенциал микроэлектрода в омывающем растворе. Стрелками обозначено, когда раствор с [К+1а 3 мМ заменялся раствором с измененной [К+]. Б — отношение между мембранным по тенциалом глиона (орбгшалш) н концентрацией К+ в омывающей жидкости (абсцисса), /Трерыеиспгой линией показано отклонение от уравнения Нернста при [К+]я 0.3 мМ.
На рис. 14.2, Б показано взаимоотношение между мембранным потенциалом глиона и [К+ ]п; в пределах 1.5—75 мМ изменение мембранного потенциала происходит точно в соответствии с уравнением Нернста; мембранный потенциал изменяется на 59 мВ при 10-кратном изменении [К+ отклонение имеется только при 0.3 мМ (прерывистая линия). Отсюда было сделано заключение, что мембранный потенциал глиона в покое определяется
отношением между внутренней и наружной [К], Другие ионы практически не участвуют в его происхождении: замена Na+ или С1~ в омывающем растворе почти не сказывается на мембранном потенциале, т, е, проницаемость мембраны к Na+ и другим ионам чрезвычайно низка по сравнению с К+ 1149]; изменение pH от 7 до 9 не влияло на мембранный потенциал [67], Таким образом, мембрана глиона зрительного нерва протея ведет себя как точный калиевый элек- ид трод. SO Ь
Мембранный потенциал глио
на зрительного нерва протея изменялся в зависимости от температуры (рис. 14.3): оп линейно -gg снижался с 89 до 83 мВ при охлаждении омывающего раствора с 25 до 5° С в полном соответствии с уравнением Нернста: _ глиальная мембрана является не только калиевым электродом, но и термометром [67 ]. Это еще раз
_________ S4- -
Рис. 14.3. Зависимость мембранного потенциала глиона от температуры. Изменение мембранного потенциала глиона зрительного нерва протея при -gg -изменении температуры омывающего
раствора с 24.5 до 4.5° С [67]. д
подтверждает, что мембранный потенциал этих глионов обусловлен отношением [К+ ]„ к [К+ ]п, и что проницаемость к другим ионам низка. Потенциал покоя — около 90 мВ — близок к потенциалу равновесия для ионов К+ (Ек).
Предполагалось, что глия может играть роль функционального внеклеточного пространства из-за высокого содержания в ней ионов Na+. Однако то обстоятельство, что мембрана глиона ведет себя как калиевый электрод, делает маловероятным это предположение, согласно которому Na+ должен являться главным внутриклеточным катионом. Зная взаимоотношение между мембранным потенциалом и [К+]я, можно получить значение внутриклеточной концентрации К+. На рис. 14.2, Б видно, что при экстраполяции кривой зависимости мембранного потенциала в глионе зрительного нерва протея от [К+ ]и мембранный потенциал становится равным 0 при [К+],=100 мМ, т, е. когда[К+ ]я = [К+ ]в. Сходные измерения, проведенные на глионе пиявки дали величину [К+], 100 мМ. Опыты с прямым определением с помощью пламенной фотометрии содержания К и Na в глионах пиявки показали, что в них содержится в 4 раза больше К, чем Na, т. е. [Na+ ]„ составляет не более 25 мМ,
В опытах на нейронах улитки выяснено, что при небольшом увеличении [К+ ]я мембранный потенциал мало изменяется; только при увеличении [К+]н выше 15 мМ изменения приближаются к теоретическим для калиевого электрода; при нормальной концентрации К+ в окружающей среде мембранный потенциал существенно зависит от Na+ [16]; высокая натриевая проницаемость (pNa/pK = 0.1) обусловливает сравнительную нечувствительность мембранного потенциала к изменениям [К.+ ]в. Для глиальных клеток беспозвоночных и амфибий характерна строгая логарифмическая зависимость мембранного потенциала от концентрации ионов калия в наружной среде и в силу этого большая, чем у нейронов чувствительность к изменениям [К ]н; так, при 5-кратном увеличении [К — с 4 до 20 мМ — нейрон пиявки деполяризовался на 5 мВ, а глион — на 25 мВ [172].
При продвижении микроэлектрода через изолированный зрительный нерв крысы попадание в глион сигнализировалось скачком мембранного потенциала до 85 мВ без разряда импульсов; при проникновении в аксон обнаруживалась импульсная активность. 10-кратное увеличение [К+]я (от 3.1 мМ) приводило к снижению мембранного потенциала на 42 мВ; уменьшение концентрации наружного Na+ на 80% не вызывало изменений мембранного потенциала; в свободных от ионов С1_ растворах мембранный потенциал заметно не менялся [82]. Таким образом, мембранный потенциал глиона млекопитающих, видимо, тоже зависит преимущественно от трансмембранного градиента ионов К+; но кривая зависимости мембранного потенциала от [К+ ]н несколько отличается от таковой у беспозвоночных и амфибий, у которых при 10-кратном изменении [К+ ]н мембранный потенциал изменяется на 59 мВ согласно уравнению Нернста.
Отклонение от уравнения Нернста обнаружили и глионы коры больших полушарий мозга кошки. В опытах с проникновением микроэлектродом в глионы верхних слоев коры и омыванием ее поверхности искусственной спинномозговой жидкостью, в которой часть NaCl заменялась на К.С1, было установлено, что при 10-кратном повышении [К+ ]я мембранный потенциал уменьшался на 38 мВ; при омывании раствором с [К+ ] меньше 3 мМ происходила гиперполяризация мембраны глиона (трудности постановки опыта с [К ]я порядка 100 мМ проистекали из-за развития распространяющейся депрессии). Используя вышеизложенный принцип, можно было определить [К+ ]„, которая оказалась равной 200 мМ, т. е. в 2 раза выше, чем в глионах беспозвоночных и амфибий [187]. Внутриклеточная концентрация других ионов должна быть низкой — иначе не могло бы удерживаться осмотическое равновесие; действительно, ]Na+ ]„ глионов из глиомы крысы составляет 18 мМ [151 ]. Если бы мрмбрака глиона в коре вела себя как идеальный калиевый электрод, то при 10-кратном изменении [К+ ]ч мембранный потенциал изменился бы не на 39, а на 60 мВ [178]. Отсюда делдетсд заключение о тем, что и другие ионы участвуют
is происхождении мембранного потенциала глии. Замена С1~ на SO4 в омывающем растворе, а также увеличение [Са+ + ] до 40 мМ не влияли на мембранный потенциал; при омывании коры раствором, в котором Na+ был заменен холином, возникала гиперполярмзация до 9 мВ [187 ]. Это указывает, на то, что мембрана глиона коры проницаема для Na+, и на возможное участие Na+ в происхождении мембранного потенциала, который может быть выражен измененным уравнением Гольдмана—Ходжкина—Катца:
j?_RT |51 1 ^+1а -ф Р [Ка*]ц_filLr + р [Na+]a
[K+h g [K+l
где
p = pNa/pK == 0.04,
Итак, мембранный потенциал глиона коры, видимо, обусловлен двумя катионами: К и Na. Однако вопрос еще не выяснен окончательно, ибо нельзя исключить наличие в мембране глиона электрогенного насоса, активность которого зависела бы от [К+ ]н. В опытах с омыванием коры знание точной величины коэффициента диффузии D имеет решающее значение для правильного определения [К+ ]я в коре, и сообщение о меньших величинах глиальной деполяризации по сравнению с ожидаемыми согласно уравнению Нернста были, может быть, основаны на расчетах с использованием завышенных значений D [94]. Так, анализ изменений мембранного потенциала глионов спинного мозга кошки в связи с изменениями [К+ ]н, измеряемой калиевым электродом, привел к заключению, что отношения подчиняются уравнению Нернста; описанные выше отступления от уравнения Нернста, обнаруженные в опытах с глионами коры мозга кошки, объясняются тем, что при этом [К+ ]н приравнивалась концентрации К+ в омывающей кору жидкости, а не определялась непосредственно в ткани [201 ]. Как бы там ни_было, мембранный потенциал глионов ц. н. с. млекопитающих в значительно большей мере зависит от К+, чем мембранный потенциал нейронов. Есть указания на то, что мембранный потенциал культивируемых глионов коры мозга новорожденных крыс определяется не только К+, но и С1~ [11 ]; но при исследовании глионов культивируемых глиом было установлено, что G1- не определяют мембранный потенциал [151 ]. Как мы видели, мембранный потенциал глионов коры_ мозга in situ не зависит от изменений [С1~ ]я; он не_изменялся также ири ионто-форетическом введении С1~ внутрь коркового глиона [146].
Мембранный потенциал глионов коры мозга ненаркотизиро-ванной кошкиизменялся в связи с изменением температуры; пока температура не падала с 38° до 34° G глионы не начинали деполяризоваться; при охлаждении до 33.4° мембранный потенциал снижался на несколько мВ. Предполагается, что первично, уже при 36.2° С, происходит деполяризация нейронов, которая приводит к выделению К+в внеклеточное пространство; это вызывает глиаль.
йую деполяризацию [58], Мембранный потенциал глиона из глиомы крысы при снижении температуры с 37 до 24° С снижался на 6.3 мВ; это в два раза больше величины, рассчитываемой согласно приведенному уравнению,
У глионов из глиомы крысы 10-кратное изменение [ К+ ]н вызывает изменение мембранного потенциала на 31 мВ, что указывает на проницаемость мембраны не только к К! , но и к другим ионам, в частности к ионам Na+. Можно было думать, что истинный мембранный потенциал снижен из-за электрического шунта, произведенного проколом пипеткой. Но инкубирование клеток в среде, в которой большая часть NaCl была заменена хлоридом холина, приводило к значительному увеличению мембранного потенциала (с 36 до 49 мВ); из-за значительной проницаемости мембраны глионов к Na+ снижение [Na+]H сдвигало мембранный потенциал ближе к калиевому равновесному потенциалу. В этих глионах отношение pNa/pK составляет 0.1. По наклону кривой зависимости мембранного потенциала от логарифма [К+ ]н концентрация К+ составила 126 мМ [152].
Глионы из глиомы крысы оказались удобным объектом изучения мембранных процессов, в частности Na+—К+ транспортной системы. Когда глионы инкубировались с 5 X 10-4 М оубаином (который тормозит транспорт, блокируя способность Na-, К-АТФазы гидролизовать АТФ), то быстро нарастала [Na+]B и уменьшалась [К+]в; [К+ ]в могла снизиться до 40 мМ, [Na+]B повышалась до 120 мМ. Мембранный потенциал уменьшался в среднем на 12 мВ (с 31 мВ до 19 мВ), мог снизиться и на 17 мВ, что близко к величине, рассчитанной по приведенной формуле уравнения Гольдмана. После удаления оубаина глионы быстро теряли Na+ и аккумулировали К+; за 10 мин [К+ ]в могла повыситься с 40 до 160 мМ, a [Na+]B снизиться с 120 мМ до 30 мМ. Цианистый натрий (который блокирует образование АТФ на митохондриальном уровне) в концентрации 5 мМ вызывал быстрое увеличение [Na+ ]в и уменьшение [К+]в, при этом значительно снижался мембранный потенциал. Как и в случае с оубаином, снижение мембранного потенциала можно связать с утерей глионами ионов К+ и накоплением в них ионов Na+,
Таким образом, глионы способны к активному транспорту Na+, который ассоциируется с поглощением К+; отношение N а+ /К+, транспортируемых насосом, составляет около 1.24: 1 [152].
Мембранный потенциал шванновской клетки изменяется на 45 мВ при десятикратном изменении [К+ ]л, что меньше значения, полученного на глионах пиявки и протея; это указывает на то, что мембрана шванновской клетки не является идеальным калиевым электродом. Причинами низкого мембранного потенциала и отклонения от уравнения Нернста может быть или проницаемость мембраны к другим ионам, или наличие активного транспорта ионов, способного генерировать разность потенциалов и меняющего таким образом равновесный потенциал для ионов К+ (£к).
Уменьшение [Na+ 1 путем замены NaCl хлоридом холина вызывало малые (1—2 мВ) изменения мембранного потенциала. Увеличение [Са++]а в два раза приводило к гиперполяризации (до 10 мВ), При прибавлении к раствору гликозида (К-строфантин, 10-3 М) шванновская клетка немедленно гиперполяриэовалась на 10—
Рис. 14.4. Влияние К-строфантина на мембранный потенциал шванновской клетки гигантского нервного волокна кальмара. Волокно находилось в морской воде; в момент, указанный вертикальной прерывистой линией, вместо нее была налита морская вода, содержащая 1 мМ К-строфантина [232].
Черные кружки — значение мембранного потенциала шванновской клетки; светлые кружки — значение потенциала покоя (в?шзу) и потенциала действия (наверху) аксона.
15 мВ, мембранный потенциал аксона при этом не изменялся (рис. 14.4).
Таким образом, мембранный потенциал шванновской клетки зависит главным образом от проницаемости мембраны к К+ и неравномерного распределения К+ по обе стороны мембраны; но он меньше, чем потенциал равновесия К+, и изменения, производимые изменениями [КЛ ]я, тоже меньше, чем ожидаемые для идеального калиевого электрода; отклонения не могут определяться участием Na+ и С1_ и обусловливаются, очевидно, действием не-электронейтрального К+-насоса [232].
14.1.3. ПАССИВНОЕ ПОВЕДЕНИЕ ГЛИАЛЬНОЙ’МЕМБРАНЫ
Как говорилось, глионы но дают разрядов повреждения при проколах. Как известно, механизм генерации потенциала действия нейрона запускается смещением мембранного потенциала в сторону деполяризации. Мы видели, что глионы пиявки и протея не генерируют электрических импульсов, когда мембрана
Рис. 14.5. Пассивные электрические свойства глиона. Глиоп в зрительном нерве протея [149].
А — два микроэлектрода с сближенными по возможности кончиками, каждый регистри-рувт потенциал покоя 75 мВ. Прямоугольные толчки тока, пропускаемые через один электрод» смещают мембранный потенциал, регистрируемый вторым электродом. Входное сопротивление этой клетки было постоянным (2.1 МОм). Когда раздражающий или регистрирующий электрод извлекали из клетки, исчезали электротонические потенциалы. H-ujttHtze кривые: ток, регистрируемый во время толчков. Прерыекспгая линия показывает нулевой мембранный потенциал. Б — вольт-ампернан характеристика того же глиона, полученная па основании ответов, показанных в Л. Входное сопротивление глиона оставалось постоянным.
деполяризуется при увеличении [К+ ]п. Глионы не дают импульсной электрической активности даже и тогда, когда мембранный потенциал смещается в больших пределах путем инъекции в него электрического тока. Рис. 14.5 иллюстрирует это пассивное поведение мембраны глиона зрительного нерва протея. Мембранный потенциал глиона смещался током, пропускаемым через внутриклеточный микроэлектрод, а изменения мембранного потенциала регистрировались вторым микроэлектродом. Мембранный потенциал мог быть смещен до 100 мВ и больше в том иди другом ца-618
прайлеййй — СлйалЬНаЯ мембрана вела себя пассивно, Наподобие омического сопротивления, не давая «активного ответа»; при этом входное сопротивление (изменение потенциала/приложенный ток) глиона оставалось постоянным. Итак, глионы амфибий не обладают механизмом генерации сигналов, которые напоминали бы нервные импульсы. На рис. 14.6 приведены результаты сходного опыта, проведенного на нейроне и глионе ганглия пиявки. При деполяризации нейрона возник ритмический разряд импульсов; глиальная клетка не дала при пропускании через нее тока каких-либо активных электрических реакций. Даже при деполяризации мембраны до пулевого уровня в глионах не удавалось вызвать
Рис. 14.6. Электротонические потенциалы нейрона и глиона пиявки [17].
А — кат- и анэлектротонические потенциалы нейрона при пропускании через него тока 2хЮ-а А; при деполяризации возникли потенциалы действия, Б — электротонические потенциалы глиона.
генерацию активных процессов; возникали только в зависимости от направления поляризации кат- или анэлектротояические из-менения [17, 104]. Соответственно этим данным в опытах на культивируемых глионах, происходящих от глиомы крысы, пропускание деполяризующих толчков тока и выключение гинерполяри-зующего тока не приводило к генерации потенциалов действия, тогда как при тех же условиях клетки, происходящие от нейробластомы, давали нервные импульсы [151]. Глионы коры мозга кошки также не обнаруживали активного ответа при смещениях мембранного потенциала в больших пределах (рис. 14.7). Вольт-амперная характеристика была линейной в пределах +60 мВ и выше. Толчки тока при снятии вольт-амперной характеристики могут быть сравнительно короткими из-за малой постоянной времени мембраны корковых глионов [216, 211]. В опытах с инъекцией толчков тока в корковый глион через микроэлектрод не было обнаружено изменений проводимости мембраны во время деполяризации, достигавшей 23 мВ [188].
В шванновской клетке гигантского аксона кальмара отношение между силой пропускаемого через нее тока и возникающими изменениями мембранного потенциала линейное; при смещениях мембранного потенциала на 35 мВ в сторону деполяризации не возникало импульсных ответов [227].
Как было показано, мембрана глиальной клетки электрически пассивна: мембранный потенциал может быть смещен в любом на
правлении, в физиологических пределах, без признаков ответа; однако при раздражении глионов в культуре ткани был обнаружен их ответ на электрическое раздражение. В этих опытах отводящий микроэлектрод вводился под визуальным контролем в глион, а пипетка диаметром 5—15 мкм на расстоянии 15 мкм от мембраны служила для раздражения; стимул (10—50 мка, 0.2—20 мс) вызывал снижение мембранного потенциала в случае, если последний был не ниже 15—20 мВ; после быстро развивающейся деполяризации следовало медленное возвращение к потенциалу покоя с 1 = 4 с при 27° С. Этот электрический ответ
Рис. 14.7- Электрические потенциалы коркового глиона [211].
Сверху — суперпозлрованные толчки тока, положительные и отрицательные, которые прикладывались трансмембранно. Снизу — изменения мембранного потенциала глиона коры мозга кошки в ответ на эти толчки; мембранный потенциал повоя 80 мВ
глиона не изменялся при охлаждении, он вызывался и катодными ? и анодными стимулами; он суммировался при достаточном сближении стимулов; он подавлялся под действием прокаина (0,1%) и уретана (2%); он не вызывался у макрофагов [123, 124, 240].
При пропускании тока через срезы коры мозга кошки возникало падение импеданса такого же временного течения, как вышеописанный ответ глиальных клеток [214]. В ответ на электрический стимул импеданс массы глиальных клеток из культуры ткани, всосанных в пипетку, снижался на 45—60 с [238]. В культуре ткани глиальные клетки отвечали на такие раздражения медленным сокращением (см. гл. 13).
Как было выяснено, электрический ответ глии возникает в результате повреждения мембраны. При внеклеточном раздражении > повреждение мембраны может являться следствием электроосмотического давления со стороны пипетки, через которую подается ток. При раздражении через внутриклеточный электрод электрический ответ глии возникал при любом направлении толчков тока, когда прилагаемое к мембране напряжение достигало 250 мВ.
Повреждение мембраны в этом случае могло быть следствием и диэлектрического пробоя [240], Рассматриваемый электрический ответ глии в культуре ткани неспецифичен для глии: мембрана любой клетки, в частности нейрона, мышечной клетки, фибробласта и др,, подвергается «пробою», когда прилагается трансмембранное напряжение больше 250 мВ [239],
14.1.4. БИОФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ ГЛИОНОВ
Знание биофизических величин мембраны глионов — в первую очередь 7?и (удельного сопротивления) и Ся (удельной емкости) дало бы основу для решения некоторых вопросов о функции глии, например вопроса о том, может ли глия влиять на распределение электрических токов в нервной тйани. Относительно удельного сопротивления мембраны глионов сведения противоречивы. С одной стороны, имеются сообщения о чрезвычайно низком 7?и глионов. В опытах на культуре ткани мозжечка в глион вводилось два стеклянных микроэлектрода и определялось «входное сопротивление» (Вах) как сопротивление между кончиком электрода внутри клетки и внеклеточной средой; оно рассчитывается по падению напряжения на участке между электродом и внеклеточной жидкостью в ответ на инъекцию в цитоплазму тока известной силы. у глионов диаметром около 15 мкм равнялось 0.6—1.7 МОм; умножая площадь глиона на эту величину, рассчитывали Яя, т. е. сопротивление мембраны на единицу площади, которое оказалось равным 3—10 Ом*сма, т. е. на два порядка ниже, чем R„ нейронов [214]. В культуре эпендимальной глии, где точнее можно измерить площадь глиона (8 X 10-в см2), при 0,2—0.35 МОм рассчитанное было ниже — 1.6—3 Ом-см2[123].
Но, во-первых, в расчет /?м могла вкрасться ошибка из-за неправильного определения площади глиона. Точное определение площади глиона, в особенности его отростков, связано с большими трудностями; значительное занижение площади должно, очевидно, привести к заниженным величинам R*. Так, следующий пример показывает, что при оценке электрических свойств мембраны необходимо учитывать ее истинную площадь: измерение постоянной времени мембраны т гигантских нейронов моллюска дали величины, которые заставляли предполагать наличие крайне высокой См — примерно 25 мкФ /см2; ио электронномикроскопическое исследование показало, что мембрана этих нейронов имеет сложную структуру, за счет чего площадь может быть по крайней мере в 10 раз больше, чем гладкая на вид поверхность этой шаровидной клетки [3]. Во-вторых, ошибка могла проистекать от наличия контактов низкого электрического сопротивления между глио-нами: действительно, если глионы образуют электротонический синтиций, то полученные величины 7?В1 не выражают сопротивления мембраны отдельного глиона. Именно неопределенность пло
щади глиальной мембраны в зрительном нерве протея, в котором глионы связаны многочисленными соединениями низкого сопротивления, не позволила определить 7?в, хотя было определено в пределах 0.5—5 МОм [148]. Относительно эпендимальной глии есть данные о том, что глионы и тут соединяются друг с другом и что в местах контактов мембраны слипаются [243].
При учете указанных фактов были получены значительно более высокие значения R„. В монослое клеток культуры переднего мозга человеческого эмбриона идентифицировались астроциты (по наличию зерен гликогена и по реакции на белок S-100) и тщательно измерялась их площадь (используя фотомикрографическую планиметрию); площадь астроцита в среднем равнялась 8700 мкм2, а рассчитанное /?м в среднем 326 Ом-см2. RtI оказалось одинаковым у контактирующих и у изолированных астроцитов [215]. Возможно, что в этих двух случаях поверхность для прохождения тока примерно одинакова; отсюда следует, что или в примененных условиях культивирования глионы не контактировали путем слипания мембран, или наличие указанных контактов иесущественно для распространения электрического тока (см. ниже).
Можно думать, что глионы в условиях культуры ткани обладают другими свойствами, чем глионы in situ; так, в исследовании, результаты которого излагались выше, мембранный потенциал астроцитов равнялся в среднем 7.7 мВ. Но и в опытах на коре мозга кошки у глионов с мембранным потенциалом 70—92 мВ были получены величины R„ 193—482 Ом-см2 [216]. Сравнительно низкое 7?и должно свидетельствовать о высокой ионной проводимости — не менее 1.29Х1013 К+ ионов/ (с-см2-мВ). В этих исследованиях Rx рассчитывалось на основании постоянной времени мембраны т, которая прямо определялась по кривой изменения потенциала мембраны при пропускании прямоугольного толчка тока и равнялась в среднем 384 мкс; близкая к этой величине т корковых глионов — 450 мкс — была установлена в другом исследовании (рис. 14.7); в очаге эпилептогениого глиоза астроциты имели в два раза меньшую т [105]. Таким образом, т корковых глионов оказалась равной 1/20 т клеток Беца. Придается большое значение тому обстоятельству, что т коркового глиона того же порядка, что и фаза спада потенциала действия коркового нейрона, т. е. фаза повышенной К+- проводимости [216].
На основании данных о площади корковых астроцитов (8700 мкм2), входном сопротивлении (ср. 10.49 мОм) и постоянной времени рассчитывалась удельная емкость мембраны: Сн = 0.8— 2 мкФ/см2; отсюда удельное сопротивление J?K= = 193— 482 Ом-см2.
Максимальная величина 7?вх культивируемых глионов (происходящих от глиомы крысы) оказалась равной у глионов-одиночек 8 мОм; рассчитанное после измерений площади глионов Яи составило 72 Ом-см2, что значительно меньше R„ клеток нейробластомы; это указывает на большую ионную проводимость мембраны
глионов по сравнению с таковой нейронов. Если принять, что Cv этих глионов 1 мкФ/см®, то постоянная времени т составит 70 мкс, т. е. будет много меньше т нейронов [152 ]. Рассчитана была также постоянная длины отростков глионов; диаметр самых тонких отростков составляет 1000 А и меньше; X = [(d/2)-(/?M/7?j)]°-5 и должна быть не меньше 18.4 мкм, если принять 7?м=200 Ом-сма, Rt~ 60 Ом-см [216].
Согласно исследованиям этого вопроса другой группой исследователей, R* глионов высокое. Высокое входное сопротивление глионов пиявки и электротоническое распространение потенциалов на большое расстояние — больше 700 мкм — вдоль глиальной клетки коннективы (в которую можно вставить токовый и отводящий электроды) указывают на то, что эти клетки обладают высоким 7?м. По расчетам 7?и глиона ганглия пиявки не меньше 1000 Ом-сма, т. е. не уступает нейронов [150].
Как говорилось, RB3 и значительно не отличаются у корковых глионов культуры ткани с низким (7.7 мВ) мембранным потенциалом и корковых глионов in situ с высоким (70.5 мВ) мембранным потенциалом [216, 215]; это соответствует данным об отсутствии корреляции между /?вх и мембранным потенциалом, полученным при исследовании корковых глионов [146]; с другой стороны, сообщалось о том, что ниже у корковых глионов с высоким мембранным потенциалом [211]. Есть указание на то, что перед митозом глионов уменьшается и что, вероятно, уменьшается и R„ 1215 ]. Под действием ионов Са++, Mg++ и Ва++ RB1 может увеличиваться при отсутствии изменений мембранного потенциала [136, 144]. При ионтофоретической аппликации к корковым глионам ацетилхолина в половине случаев происходило значительное (до 80%) увеличение /?вх [145], что может быть обусловлено реакцией ацетилхолина с холинорецепторами мембраны глионов. Экстрацеллюлярная аппликация тетраэтил аммония к корковым глионам не вызывала заметных изменений RBI и мембранного потенциала; но длительная внутриклеточная инъекция вызывала постепенное нарастание сопротивления [144]. Ионтофоре-тическая аппликация динитрофенола к глионам коры не приводила к значительным изменениям 7?вх [106].
14.1.5. БИОФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ МИЕЛИНА
Миелиновая оболочка обладает высоким удельным омическим сопротивлением и емкостью. Уже давно было обнаружено в опытах на хирургически изолированном нервном волокне седалищного нерва жабы, что порог раздражения резко изменяется с перемещением раздражающего микроэлектрода вдоль волокна: порог был самым низким, когда микроэлектрод помещался прямо на перехват Ранвье, и самым высоким, когда он находился на миелиновой оболочке посредине между двумя перехватами; по
роги могли соотноситься как 1 : 5. Было сделано заключение о том, что миелиновая оболочка является электрическим изолятором и что раздражающий ток входит и выходит только в области перехватов [47, 48, 213]. Но миелиновая оболочка не является идеальным изолятором, а ведет себя подобно конденсатору с утечкой [47]. Миелиновая оболочка нервного волокна лягушки обладает следующими электрическими характеристиками (по [51 ]):
Диаметр волокна
Толщина миелиновой оболочки
Емкость на единицу длины миелиновой оболочки
Емкость па единицу площади
Диэлектрическая постоянная
Сопротивление, умноженное на единицу площади
Удельное сопротивление
14 мкм
2 мкм
10—16 мкмкФ/см
0.0025—0.005 мкФ/см2
5-10
0.1—0.16 мОм-см2
500—800 мОм -см
Было найдено, что проводимость (и, следовательно, плотность тока, проходящего через миелиновую оболочку) составляет одну десятитысячную проводимости мембраны перехвата Ранвье в покое. Слои миелиновой оболочки расположены на расстоянии 85 А друг от друга; следовательно, в оболочке толщиной 2 мкм должно содержаться около 210 слоев. Исходя из данных таблицы, можно рассчитать, что емкость одного слоя составляет 1.2 мкФ/см2, а сопротивление каждого слоя должно равняться около 500 Ом-см2; эти характеристики близки к таковым мембраны глиальной клетки. Таким образом, электрические характеристики миелиновой оболочки вполне соответствуют представлению, согласно которому она состоит из многих витков отростка шванновской или олигодендроглиальной клетки. Функции миелина как электрического изолятора соответствует то, что он необычайно богат липидами (70—80% сухого веса), среди которых выделяются цереброзиды — единственный тип липидов, отличающийся от находимых в нейронах и глии [130].
Принцип метода измерения емкости и сопротивления миелиновой оболочки [213 ] состоит в том, чтобы столкнуть два импульса в межперехватном участке, где регистрируется направленный наружу ток, и разделить регистрируемый ток на емкостную и омическую компоненты (рис. 14.8). Крутой спад тока, отводимого через миелиновую оболочку, указывает на то, что она обладает емкостью. Так как амплитуда потенциала действия на перехвате известна, то можно определить абсолютные величины емкости и сопротивления миелиновой оболочки. Электрический ток через миелиновую оболочку определяется по формуле [48]:
Приложение кокаина и уретана к миелиновой оболочке в меж-перехватном участке, а также ее локальное охлаждение несколько увеличивает ее сопротивление, не влияя на токи действия на перехватах: емкость ее при этом не изменяется. Локальная апплика-цияЗсапонина приводит к прогрессирующему усилению тока, текущего! через мембрану и к увеличению ее емкости (см. рис. 14.8),— происходит растворение миелиновой оболочки,
Рис. 14.8. Увеличение утечки тока действия через миелиновую оболочку после воздействия на нее сапонином [212].
Сверху дала схема постановки опыта: межперехватный участок находится на мостике-изоляторе; перехваты Ранвье одновременно возбуждаются путем приложения стимулов и нерву с двух сторон. На каяевой осциллограмме: сверху — изменение емкости миелиновой оболочки, выраженное величиной выходящего через нее тока; снизу — изменение проводимости. 1 — межперехватный участок в растворе Рингера; S — через 6 мин после аппликации к межперехватному участку сапонина; з — через 25 мин.
утечка тока через нее увеличивается, и через некоторое время прекращается проведение возбуждения через межперехватный участок к следующему перехвату, так как большая часть тока действия шунтируется [47].
При экспериментальной димиелинизации проводящих путей спинного мозга, вызванной микроинъекцией дифтерийного токсина (приводящей, очевидно, к повреждению олигодендроцитов), происходит блокирование проведения, если длина альтерированного участка составляет 5 мм и больше; в отдельных волокнах проводимость сохраняется, но скорость резко замедляется, и потенциалы действия не могут следовать высокому ритму раздражения. Эти явления тоже объясняются уменьшением поперечного сопротивления и увеличением емкости [163].
Время проведения в межперехватном участке при развитии димиелинизации может увеличиваться в 25 раз [190]. В перифе-
4Q Общая физиология нервной системы
625
рических нервах сходное явление — резкое снижение потенциалов действия уже при частоте раздражения 10 /с — происходит при демиелинизации, возникающей при экспериментальном аллергическом неврите 180]. Вопрос о том, обладает ли мембрана волокна в межперехватном участке электрической возбудимостью, остается открытым.
Из-за указанных электрических свойств миелиновой оболочки ток действия распространяется по межперехватному участку с конечной скоростью: он «перепрыгивает» от одного перехвата к другому с задержкой в межперехватном участке; промежуток времени, необходимый для этого распространения, определяет в основном скрытый период возбуждения перехвата Ранвье [47]. В нервных волокнах теплокровных при длине межперехватных участков 0.75—1.45 мм время проведения между перехватами равняется 20 мкс [190].
Время проведения в межперехватном участке должно увеличиваться при уменьшении толщины миелиновой оболочки, из-за уменьшения крутизны нарастания потенциала действия, обусловленного увеличением ее емкости; с другой стороны, должно существовать некоторое оптимальное число слоев миелиновой оболочки, при котором токи действия будут распространяться наиболее быстро [51 ]. Факт наличия емкости в миелиновой оболочке важен и с точки зрения теории электрического раздражения нервных волокон. Судя по кривой изменения порогов при приложении к нервному волокну постоянного напряжения, ток, проходящий через миелиновую оболочку, имеет начальный кратковременный пик, т. е. спадает с малой постоянной времени; при выключении тока наблюдается пик противоположного направления; с этим обстоятельством связывают явление, наблюдаемое па целом нерве, когда при выключении тока возникает возбуждение на аноде [47].
14.1.6. ЭЛЕКТРИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ МЕЖДУ ГЛИОНАМИ
Одним из отличительных свойств глионов является пассивное распространение изменений потенциала от одного к другому. Как видно на рис. 14.9, при пропускании толчка тока через мембрану одного глиона происходит распространение электротонического потенциала в соседний глион; декремент его составил 5:1. Это распространение свидетельствует о том, что глиальные клетки взаимосвязаны путями низкого сопротивления.
В опытах на зрительном нерве протея микроэлектрод, через который инъецировался ток, и микроэлектрод, через который отводилось изменение потенциала, располагались в глионах на разных расстояниях вдоль нерва. Амплитуда и изменение во времени электротонических потенциалов менялись в зависимости от расстояния, разделяющего электроды — потенциал был тем слабее и тем медленнее развивался, чем больше было расстояние. Вход>
ное сопротивление, естественно, падало с увеличением расстояния; на расстоянии 50 мкм оно составляло 0.3—7 МОм, на расстоянии 1 мм - 0.03 МОм [149].
Сходные опыты были проведены в условиях культуры ткани на эксплантатах мозжечка и среднего мозга крысы. Отводящий микроэлектрод помещался в одном глионе, а микроэлектрод, через который пропускался ток, — во второй глион на том или другом расстоянии от первого. Измерялись изменения напряжения в первой клетке, которые вызывались пропусканием тока через вторую клетку; потом «токовый» электрод переносился ближе, в другую
Рис. 14.9. Электрическая связь между глионамп. Ганглий пиявки, 12° С. Токовый электрод (I) в глионе; через него подается прямоугольный толчок тока 6Х10'8 А, Продолжительность 400 мс [150].
А — отводящий электрод в том же глионе; Б — отводящий электрод в соседнем глионе; В — отводящий влектрод выведен из глиона.
клетку, пока наконец оба электрода не оказывались в одной клетке. Применялся толчок тока 5 мс, 5х10-8 А. Он вызывал измеримые изменения напряжения на расстоянии до 200 мкм между электродами при условии, что не было перерыва в цепи клеток. Распространение тока ослабевало и исчезало, если отводимая или инъецируемая током клетка проявляли признаки повреждения и изменяли свои контуры. Макрофаги и фибробласты, лежащие рядом с глионами, не участвовали в передаче прикладываемого тока. Электрическая связь между глиальными клетками отмечалась постоянно в изучавшихся культурах [236].
Таким образом, глион не обладает специальным механизмом активного распространения потенциалов, но, несмотря на это, изменения потенциала пассивно распространяются на значительное расстояние.
Время нарастания и спада электротонических потенциалов в глиальных клетках было изменчивым; при расстоянии между электродами около 50 мкм время подъема и спада составляло 30—60 мс; но оно могло составлять несколько миллисекунд или
быть столь малым, что подъем злектротонического потенциала сливался с емкостным артефактом.
В центральной нервной системе мембраны ее элементов отделены расстоянием 200 А и больше. Но выяснилось, что глионы местами вступают друг с другом в тесный контакт [180, 1681.
Многие из этих контактов являются 7-слойными и характеризуются наличием в центральной щели 20—30 А шириной решетки полигональных субъединиц, в происхождении которых участвуют обе плазматические мембраны; эти контакты получили название «щелевых» (gap junctions). Они найдены в ц. н. с. млекопитающих в большом количестве между соседствующими астроцитами, а также между эпендимальными клетками, между астроцитами и олигодендроцитами и между отростками олигодендроцитов [68, 167]; площадь их может составлять несколько мкм2 [84]. Они имеются и в ц. н. с. беспозвоночных, а также в культуре мозговой ткани, но они не обнаруживались на периферии зоны роста.
Очевидно, эти контакты представляют собой места пониженного электрического сопротивления и создают анатомическую предпосылку возможности злектротонического распространения электрического тока из одной глиальной клетки на соседние [150]. Их количество и распределение в определенном объеме мозга определяло бы количество и направление движения электрических токов, генерируемых при активности глии.
Если электрический ток, т. е. ионы, могут проходить между клетками, то, может быть, это касается и многих мелких молекул, что может лежать в основе метаболического взаимодействия между глиальными клетками. С щелевыми контактами ассоциированы ортогональные комплексы частиц величиной 50 А, может быть, представляющие собой связанные с глиальной мембраной ферменты, влияющие на трансмембранный переход метаболитов [84].
В связи с рассматриваемым вопросом представляют интерес данные, полученные при исследовании железистого эпителия дрозофилы; в нем установлено наличие точек «слипания» контактирующих мембран, в которых межклеточная щель резко сужена или даже облитерирована; эти точки располагаются регулярно на расстоянии 1000 А одна от другой [131]. В опытах с введением токового микро электрода в одну клетку, а отводящего микроэлектрода в другую было выяснено, что инъецируемые толчки тока улавливаются на большом расстоянии — декремент их такой, как если бы железа представляла кабельный проводник диаметром 1.2 мм. По расчетам удельное сопротивление в области контактов на 4 порядка ниже, чем сопротивление остальной поверхности; инъецированная в клетку краска (флюоресцеин) через несколько минут окрашивает все клетки без утечки ее в межклеточное пространство, т. е. она свободно диффундирует только через контактирующие участки мембран [132].
У пиявки мостики низкого сопротивления, очевидно, отсутствуют между нейронами и глией, что было прямо тестировано [150]: если мембранный потенциал нейрона смещался на 80—100 мВ в направлении гипер- или деполяризации, в соседнем глионе не отмечалось изменений потенциала больше 1—2 мВ, С другой стороны, смещение глиального потенциала в широких пределах не изменяло мембранный потенциал нейрона.
Проницаемость этих участков зависит от концентрации Са'" внутри клетки: при увеличении Са++ путем инъекции его внутрь клеток связь ослабевает и нарушается; при введении в центр клетки связь не нарушается — она нарушается при инъекции около щелевого контакта. Деполяризация клетки и падение из-за увеличения проницаемости к Na+, происходящие при введении Са++, не являются причиной нарушения связи: 1) если фиксировать напряжение на мембране, то все равно связь нарушается; 2) деполяризация при увеличении [К?]я до 90 мМ, т. е. при снижении мембранного потенциала почти до 0, не нарушает связи, даже если действие К+ продолжается часами. Таким образом, деполяризация недостаточна для прекращения связи. Са++ соединяется с мембранами в области щелевых контактов, вызывая конформацию каналов диффузии, соединяющих клетки [192], Как выяснено в отношении электрических синапсов гигантских аксонов рака, связь нарушается при механическом повреждении аксона, нри погружении в раствор с низким содержанием С1~ или Са++; нарушение связи ассоциируется с разъединением мембран в области соединения, в промежуток внедряются отростки шванновских клеток [179].
Связи между глионами, щелевые контакты, наличие которых предполагал Галамбос, назвав их глиапсами [98, 100], с одной стороны, устойчивы и не разрываются под действием осмотических сил [68]; с другой стороны — можно думать, что они лабильный коэффициент связи между глионами изменяется при изменениях ионного состава межклеточной жидкости, при повреждении глионов и др.
* В зрительном нерве протея токи действия нервных волокон не вызывают заметных изменений мембранного потенциала окружающих глиальных клеток. Как видно на рис. 14,10, Л, при положении микроэлектрода вне клетки во время возбуждения нервных волокон регистрируется трехфазный потенциал: он возникает как падение напряжения на участке между кончиком отводящего микроэлектрода и индифферентным электродом в омывающей жидкости при распространении синхронных потенциалов действия. Когда микроэлектрод находится внутри глиона, то при повторении стимула отводится такой же трехфазный начальный потенциал (рис. 14, 10, Б), т. е. электрическое поле внутри клетки и снаружи не различаются; это указывает на то, что ток действия нерва не вызывает никакого изменения потенциала мембраны (относительно следующей за трехфазным пиком мощной деполяризации
При отведении изнутри глиальной клетки см. ниже). Аналогично в опытах с расположением микроэлектрода внутри шванновской клетки, окружающей гигантское нервное волокно кальмара, от нее при прохождении по волокну нервного импульса регистрируются колебания потенциала в пределах всего 1 мВ [232].
Гиперполяризация нейрона в ганглии пиявки на 80 мВ пропусканием тока 2х10~8 А сопровождается гиперполяризацией окружающей глиальной клетки на 0.3 мВ; если б не было межкле-
А
50мс
Змв
Рис. 14.10. Отсутствие влияния тока, генерируемого аксонами на мембранный потенциал глиона. Микроэлектрод в зрительном нерве протея; посредством наружных раздражающих электродов наносится стимул максимальной интенсивности [177].
А — кончик электрода расположен внеклеточно (Нм=0); В — кончик электрода введен в глион и регистрирует мембранный потенциал в 84 мВ.
точного пространства, то по расчетам из глиона отводился бы потенциал на порядок больше.
Очевидно, что межклеточные щели шириной около 200 А, связанные с омывающей жидкостью, представляют собой эффективные пути для электрического тока и изолируют электрически два типа клеток — глионы и нейроны — друг от друга.
В отличие от низших животных, у теплокровных в культуре ткани были получены данные, свидетельствующие о наличии электрической связи между некоторыми нейронами и глионами; нейроны, обладающие электрической связью, имели низкий мембранный потенциал и низкое сопротивление — 20—40 мВ и 0.3 МОм, т. е. того же порядка, что и у глионов в условиях культуры; от этих нейронов не регистрировались потенциалы действия. Электрическая связь не обнаружена между глионами и теми нейронами, которые генерировали потенциалы действия. Образование соединений низкого сопротивления между нейронами и глионами может представлять собой динамический процесс, которым определенные нейроны «выключаются»: они молчат, так как ток шунтируется
из нейронов к неироглии через путь низкого сопротивления, параллельный сопротивлению мембраны [236].
На рис. 14.11 представлена электрическая модель трех маленьких клеток, связанных друг с другом посредством электротони-ческих мостиков. Можно решить, каковым будет поведение такой цепи нейронов при приложении к ней постоянного тока, используя закон Кирхгофа и интегрируя соответствующие дифференциальные уравнения [127]. При моделировании свойств электротонического синцитиума (т. е. синцития «глиальных клеток», связанных электротоническими соединениями) были получены следующие результаты.
Рпс. 14.11. Эквивалентная схема трех клеток (7, 2, 3), электрически связанных посредством щелевых контактов (7—2 и 2—5) [127].
С — емкость, Д — сопротивление, Е — мембранный потенциал.
1. Чем больше сопротивление мембраны «глиальных клеток», тем дальше распространяются сдвиги потенциала от «деполяризованной» зоны в неактивную, иначе говоря, относительная величина определяет постоянную длины «синцития», но чем больше тока уходит, г. е. чем дальше электротоническое распространение, тем меньше изменение потенциала в «активной» зоне. Уменьшение ограничивает сдвиг потенциала деполяризованной зоной и увеличивает интра- и экстрацеллюлярные сдвиги потенциала в этой зоне.
2. При увеличении сопротивления связи между глиальными клетками ослабевает сдвиг внеклеточного потенциала и усиливается сдвиг внутриклеточного; бесконечное сопротивление изолирует одну клетку от другой и предотвращает внеклеточный ток.
3. Уменьшение сопротивления внеклеточной «среды» приводит к уменьшению внеклеточного падения напряжения и усиливает внутриклеточное [201].
Повышение /?В1 под действием ацетилхолина может иметь физиологическое значение в смысле изменения коэффициента связи между глионами — по аналогии с результатами, полученными в системе рлектротоничесци связанных нейронов моллюска [204].
По расчетам Трахтенберга и др. [215], если принять сопротивление щелевых'контактов 100 Ом-см®, поверхнрсть соединения 20 мкм® и наличие 100 соединений на 1 глион, то сопротивление мембраны в области этих контактов должно составлять 500 МОм, т. е. в 266’раз больше сопротивления остальной мембраны; делается вывод’о том, что незначительная часть тока, пересекающего мембрану'глиона, проходит через места соединений с другими гли-онами. С другой стороны, приняв во внимание сравнительно низкое 7?м глионов, можно думать, что распространение тока между активными и неактивными частями глиального синцития должно быть очень ограниченным’'[181 ]. Но, как указывалось, электрический ток, инъецируемый в глион в культуре ткани у теплокровных животных, улавливается в другом глионе на расстоянии 200 мкм [236]. В коре больших полушарий кошки глиальные потенциалы, видимо, распространяются электротонически на расстояние 3 мм и больше [39]. Таким образом, фактические данные не подтверждают приведенные теоретические расчеты.
14.1.7. ВЛИЯНИЕ ВОЗБУЖДЕНИЯ НЕРВНЫХ ЭЛЕМЕНТОВ НА ГЛИОНЫ
Как говорилось, глионы граничат с нервными элементами — с нервными волокнами в нервах, с волокнами, дендритами и телами нейронов в ц. н. с., отделяясь от них 'щелями, ширина которых составляет около 200 А; мембрана глионов беспозвоночных и амфибий в зрительном нерве ведет себя как почти идеальный калиевый электрод: мембранный потенциал находится в логарифмической зависимости от концентрации К+ в наружной среде соответственно уравнению Нернста в пределах от 1.5 до 75 мМ, т. е. мембранный потенциал глионов чрезвычайно чувствителен к изменениям [К+ ]н, изменяясь на значительные величины при сравнительно малых повышениях [К+]п (см. рис. 14.2, Б). По классическим представлениям о природе потенциала действия реполяризация мембраны нервного волокна является результатом выхода ионов К+ из нервной клетки; ионы К+ должны также выходить из нейрона во время постсинаптических возбуждающих потенциалов. Таким образом, при возбуждении нервных элементов происходит выделение ионов К+ в наружную среду, и из-за малого объема внеклеточной жидкости в щелях [К+ ] в них может достичь значительных величин: достаточно выделения малого количества ионов К+ в эти узкие щели, чтобы значительно изменилась [К+]п. Поскольку глиальная мембрана исключительно чувствительна к изменениям [К+ ]н, то возбуждение нейронов может обусловить деполяризацию мембраны соседних с ними глионов [177]. По расчетам увеличение [К+ ] на 1 мМ в межклеточной щели шириной 250 А вызывает деполяризацию мембраны глиона на 7.6 мВ [216].
При возбуждении^электрически возбудимой мембраны из-за перехода ионов Na+ внутрь и ионов К+ наружу должно произойти
на некоторый период времени изменение их концентрации у наружной и внутренней сторон мембран. По расчетам [156], так как V—Q/C, заряд, переносимый во время потенциала действия (100 мВ) для мембраны емкостью 1 мкФ* равен 10-1Х10~е= 10 7 к/см2; при ширине межклеточных щелей 200 А [К+ ]я увеличится при этом на 1.5 мкмМ/см3. Изменения [К+1П действуют на все мембраны, граничащие с данным объектом. Этот процесс был смоделирован на ЭВМ; анализ модели показал, что это ионное взаимодействие выражается в преходящей деполяризации глиальной и нейронной мембран; величина и временное течение взаимодействия являются функциями электрохимических характеристик мембран, ширины щели между ними и времени восстановления нормальной [К+ 1п. Если постоянная времени диффузии К+ через межклеточные каналы была значительно меньше, чем межстимульный интервал, то изменения мембранного потенциала глиона успевали завершиться до момента очередного возбуждения; если же постоянная времени диффузии была значительно больше межстимульного интервала, то мембранный потенциал глиона обнаруживал логарифмическую суммацию, характеризующую К+-зависимую мембрану. Проводимость мембраны глиона была взята в 100 раз больше, чем проводимость нейрональной мембраны, и, следовательно, постоянная времени мембраны была малой и не могла обусловить медленный спад мембранного потенциала 11561.
Рис. 14.12 иллюстрирует опыт, в котором отводящий микроэлектрод был введен внутрь глиона зрительного нерва протея, нерв подвергался электрическому раздражению. При нанесении одного стимула развилась глиальная деполяризация (ГД) — мембрана деполяризовалась на 2,4 мВ за 0.15 с, после чего началась реполяризация (рис. 14.12,4). При частоте раздражения 1/с наблюдалась суммация глиальной деполяризации; при частоте раздражения 5/с и выше эффекты отдельных залпов_импульсов сливались (рис. 14.12, В и Г); ГД могла достичь плато 48 мВ, что предполагает повышение [К+ ]н до чрезвычайно высоких значений — порядка 20 мМ, но фактически [К+] вокруг возбужденных аксонов должна была быть еще больше: только часть каждой глиальной клетки обращена к нейрональной мембране, остальные ее части граничат с другими глиальными мембранами.
Сходный эффект наблюдался в ц. н. с. пиявки: раздражение периферического нервного корешка по ритму 10/с могло привести к деполяризации глиона в ганглии на 12 мВ, что соответствует увеличению [К+1я на 10 мМ [171].
Стимулы, вызывавшие возбуждение меньшего количества волокон, вызывали меньшую ГД, т. е. ГД была тем больше, чем большее количество аксонов возбуждалось. В следующих опытах зрительный нерв протея помещался в раствор с тем или другим содержанием К+, микроэлектрод вводился в глион и нерв подвергался пробным раздражениям. На рис. 13, А мембранный потенциал покоя глиона составлял 89 мВ при нормальной [К+ ]
в растворе, равной 3 мМ, короткая серия стимулов, нанесенная на нерв, вызвала деполяризацию мембраны на 12.3 мВ. В растворе с [К? ] 4.5 мМ мембранный потенциал покоя упал до 78 мВ; повторение того же раздражения вызвало деполяризацию мембраны на 9.3 мВ. Когда 1К+]Н была уменьшена до 1.5 мМ, мембранный потенциал покоя увеличился до 105 мВ и ГД на раздражение
Ряс. 14.12. Деполяризация глиона под влиянием нервных импульсов. Внутриклеточная регистрация от глионов в изолированном зрительном нерве протея (177].
А — потенциал покоя 86 мВ, деполяризация! следующая за одиночным стимулом, нанесенный на нерв; В — при стимулах частотой 1/с потенциалы суммируются; В — другой глиом, частота стимулов 2/с; Г — 5/с,
достигла 18.5 мВ. На рис. 14.13, Б эти экспериментальные данные перенесены на график: эффекты раздражения нерва изображены вертикалями (с открытым кружком); они уменьшаются со снижением исходного мембранного потенциала, но при сопоставлении с логарифмической шкалой [К+]Е видно, что раздражение нерва каждый раз вызывает выделение одного и того же количества К+, а именно 1.8 мМ.
Мы знаем, что мембрана глиона электрически невозбудима и ведет себя при прохождении через нее электрического тока как цепочка из омического сопротивления и емкости; поэтому длительные сдвиги мембранного потенциала глиона при прохождении 634
рядом с ним залпа нервных импульсов не могут быть следствием электрического действия нервных импульсов. Приведенные факты убедительно свидетельствуют в пользу калиевого механизма ГД при возбуждении нервных элементов.
Рве. 14.13. Эффект изменения ]К+]В на глиальную деполяризацию (ГД) [177].
Л — глион зрительного нерва протея; ГД вызывается стандартной серией импульсов (Ге, Ю/с) при разных концентрациях калия в омывающем растворе; цифры обозначают [К+]й в мМ; Б — графическое изображение этих результатов; ГД от раздражения нерва изобижены вертикалями (с открытым кружком)» построенными на теоретической кривой зависимости мембранного потенциала от [К+1В согласно уравнению Нернста,
Если деполяризация глии происходит вследствие аккумуляции ионов К+ в межклеточных щелях, то надо ожидать, что при ритмическом раздражении каждый последующий залп импульсов будет вызывать меньшую глиальную деполяризацию по сравнению с предшествовавшей: логарифмическое отношение между мембранным потенциалом и [К+ ]я означает, что добавление данной концентрации к+ к жидкости вокруг глиона вызывает меньшую депо
ляризацию, если фоновый уровень высокий, и большую деполяризацию, если [К+ ]„низкая; иначе говоря, несмотря на то, что при ритмическом раздражении количество выделяющегося из возбуждаемых волокон ионов К+на каждый залп остается постоянным, каждый последующий залп будет вызывать все меньшую ГД из-за логарифмической зависимости между мембранным • потенциалом и [К+]н. На рис. 14.14приведены данные, полученные па глионе из коры мозга, подтверждающие это предположение.
Корковые глионы деполяризуются в ответ на раздражение поверхности коры при интенсивности стимулов, видимо, достаточной для возбуждения’С-волокон; ГД’и'в'этом^случае1 ’увеличивается
Рис. 14.14. Прогрессивное ослабление ответов глиона па отдельные стимулы при ритмическом раздражении. Глион супрасильвиевой извилины кошки, мембранный потенциал 70 мВ, частота эпикортикального раздражения 30/с[42|.
с увеличением силы и частоты стимулов (рис. 14.15). Максимальная деполяризация после 0.6 с раздражения составляла 20 мВ [411.
При частоте эпикортикального раздражения 30—50zc ГД достигала 30 мВ за 1—3 с раздражения; это соответствует (по данным, полученным на глионе зрительного нерва амфибий) наибольшей ГД, которая может возникнуть в результате нервной дея-тел ьности.
При омывании поверхности коры растворами с разной [К+1 было установлено, что деполяризация коркового глиона в ответ на прямое раздражение коры ослабевала при смене раствора с 3 мМ КЛ на раствор с15мМК+, т. е. как и в аналогичных опытах на глионе зрительного нерва протея.
После одного электрического стимула, нанесенного на таламическое ядро, ГД в корковых глионах наступала со скрытым периодом 10 мс, достигала вершины за 35 мс при общей длительности 90—150 мс в разных глионах; максимальная амплитуда ГД на 1 стимул составляла 0.5 мВ. Серия импульсов вызывала суммацию ГД и медленно нарастающий ответ; ГД максимальной величины (18 мВ) вызывалась при частоте раздражения 50/с, достигала вершины за 4—5 с. Принимая, что [К+]„ и мембранный потенциал глиона находятся в соответствии с уравнением Нернста, и принимая [К+ ]н равной 3 мМ, [К+ ]„ должна составлять 110 мМ при мембранном потенциале 95 мВ [113], что соответствует [К+]Б в глионах пиявки и протея; с другой стороны, она в два раза
меньше [К+]в, которая была рассчитана для коркового глиона в опытах с омыванием поверхности коры растворами с разной [К+].
Можно думать, что нервные импульсы вызывают деполяризацию глионов посредством медиатора, выделяющегося из синаптических окончаний нервных волокон или из касательных синапсов. Глиальные клетки в коре мозга могут находиться в прямом
Рис. 14.15. Деполяризация коркового глиова при раздражении поверхности коры. Глион на глубине 2730 мкм в коре мозга кошки, супрасильвиева извилина, мембранный потенциал 65 мВ, микроэлектрод введен на расстоянии 1 мм от раздражаемого пункта [41].
А — при стандартной напряжении раздражающих стимулов меняется их частота (сверху вниз) 5, 10, 20, 30, 50 имп/с; В —частота стимулов 20/с, напряжение меняется (сверху вниз) 20, 30, 50, 70, 100 В. Отклонение вверх означает деполяризацию.
контакте с бутонами пресинаптических терминалей, однако в области контакта не видны характерные уплотнения цитоплазматических мембран [1091; бутоны, контактирующие с олигодендроцитом, могут содержать или округлые, или уплощенные синаптические пузырьки. Не образуя специализированных контактов с мембраной глиона, эти бутоны могут, с другой стороны, образовывать типичные синаптические контакты с рядом лежащим нейроном [25]. Можно думать, что медиатор, выделяющийся в синаптическую щель, может путем диффузии по отрезку межклеточной щели достичь области расположения мембраны олигодендроцита и вызвать ее деполяризацию [25, 114].
Сведения о влиянии медиаторов на мембранный потенциал глионов противоречивы. В глионах ганглия пиявки не обнаружено
заметных его изменений под действием ацетилхолина [17]. В глионах культуры ткани мозжечка кролика ионтофоретическая аппликация ацетилхолина, адреналина, норадреналина и глутамата не вызывала эффекта; по условиям опытов могли быть обнаружены только быстрые и большие изменения мембранного потенциала [240]. В коре мозга кошки глионы деполяризуются при ионтофоретической аппликации ацетилхолина (рис. 14.16) и гамма-аминомасляной кислоты [146]; но деполяризация происходила у небольшого числа испытанных глионов; возникало,
(АХ). Отводящий микроэлектрод в глионе коры мозга кошки. Ацетилхолин выделялся из экстрацеллюлярно расположенной микропипетки выходящим током, сила которого обозначена в нА [146].
однако, как уже отмечалось, закономерное повышение входного сопротивления [145].
Но при внутриклеточном отведении потенциалов глионов из культивируемой в присутствии дибутирил-циклического АМФ глиомы крысы было обнаружено, что на ионтофоретическую аппликацию ацетилхолина (толчками тока 350 нА, продолжительностью 100 мс) они отвечали гиперполяризацией порядка 20 мВ [114]; после длительной аппликации ацетилхолина ответы ослабевали, наступала десенситизация. d-тубокурарин не влиял на ответ, атропин блокировал его; ответ необратимо блокировался а-бунгаротоксином. Увеличение концентрации К+ в среде приводило к деполяризации мембраны глиона. Некоторые глионы спонтанно ритмически гиперполяризовались с частотой около 1/мин, величина гиперполяризации могла достигать 20 мВ, продолжительность — несколько секунд. То, что гиперполяризация глиона под действием ацетилхолина может быть заблокирована атропином, но не d-тубокурарином, указывает на то, что рецец-638
торы ацетилхолина На поверхности этих Глионов мускаринового типа. Неожиданным оказывается эффективность «бунгаротоксина, хотя это соединение считается ингибитором ацетилхолиновых рецепторов никотинового типа.
Ионные основы гиперполяризационных ответов глионов неизвестны, как и их физиологическое значение. Высказывается предположение, что они могут иметь отношение к циклам сокращения—расслабления глионов [114], однако это не гармонирует с тем, что в этих глионах удавалось долго (по сравнению с культивировавшимися в отсутствии дибутирил-циклической АМФ) производить внутриклеточное отведение.
Во время деполяризации коркового глиона, вызванной прямым или транскаллозальным раздражением коры, сопротивление мембраны не изменяется [188, 211J. То же было установлено в отношении глионов спинного мозга: входное сопротивление не изменялось во время их деполяризации, вызываемой раздражением периферического нерва [200]. Это также указывает на несинаптический механизм глиальной деполяризации, так как RM нейронов значительно снижается во время синаптической активности. С другой стороны, величина глиальной деполяризации и характер ее протекания в глионе не зависят от величины мембранного потенциала, когда последний смещается пропусканием через внутриклеточный микроэлектрод электрического тока, что находится в резком контрасте с обычным поведением постсинаптических потенциалов, которые меняют амплитуду, а иногда форму и знак при пропускании через нейрон поляризующих токов.
Как говорилось, во время глиальной деполяризации, обусловленной возбуждением нервных элементов, т. е, действием ионов К+, не изменяется проводимость мембраны; это имело место и при величинах деполяризации 23 мВ, что соответствует [К+]в около 10 мМ и даже при величинах деполяризации 30 мВ во время судорожной активности, что соответствует по расчетам увеличению [К+ ]н до 10 мМ [211]. В этом отношении мембрана глиона отличается от мембраны нейрона: у последней при увеличении [К+]н происходит быстро нарастающее увеличение проводимости [16].
При моделировании глиального синцития оказалось, что расстояние, на которое по синцитию распространяется электротонически ГД, зависит от сопротивления мембраны глионов; по одним данным, как указывалось, сопротивление мембраны глионов порядка 10 Ом-см2, по другим — порядка 108 Ом-см2. Моделирование дало результаты, согласно которым с увеличением RM, т. е. постоянной времени, нейронно-глиальное взаимодействие ослабевает на 20% и запаздывает на 2—5 мс [201].
Увеличение концентрации К+ во внеклеточном пространстве при возбуждении нервных элементов было прямо показано с помощью калийселективного микроэлектрода. В разных отделах ц. н. с. млекопитающих — спинном мозге, мезэнцефали-
ческой ретикулярной формации, наружном коленчатом"^теле, в разных слоях коры больших полушарий при отсутствии специальных раздражений — [К? ]н примерно та же, что и в спинномозговой жидкости (чуть выше 3 мМ). По одним данным, [К+ ]д не изменяется при введении микроэлектрода, вызывающем повреждение корковых элементов [97], По другим данным, 1К+]Н временно повышается в связи с проколом и повреждением клеток [117]. В мезэнцефалической ретикулярной формации в области расположения спонтанно разряжающегося нейрона возникало повышение [К+]в на 0.02—0.2 мМ; изменения [К+]в запаздывали на 20—200 мс по отношению к началу разряда, большая часть этой задержки связывается с тем, что калийселективный электрод находился сравнительно далеко от нейронов. С помощью расчетов на компьютере удалось определить повышение [К+]н на 0,01—0.02 мМ после одного потенциала действия [210].
В спинном мозге при раздражении чувствительного нерва уровень [К+]и повышался; антидромное же раздражение передних корешков не вызывало заметного повышения уровня [К+ ]н даже в переднем роге. Можно, следовательно, думать, что постсинаптические потенциалы действия, возникающие при ортодромном раздражении не обусловливают повышения [К+ ]н; источником КЛ является или пресинаптическая импульсная активность или синаптические потенциалы тел клеток и дендритов [202]. При раздражении седалищного нерва по ритму 100/с [К+ ]н повышается в интермедиаторном ядре до 5.5 мМ [234]. В наружном коленчатом теле раздражение мезэнцефалической ретикулярной формации приводило к сдвигам [К+ ]п до 3 мМ выше исходного уровня; раздражение зрительной коры вызывало большие сдвиги — до б мМ; увеличение [К+]п происходило в ответ и на вспышки света [198].
При электрическом раздражении коры мозга кролика [К+ ]в увеличивалась с увеличением интенсивности, частоты и длительности раздражения и достигала 10 мМ [97]. Слабое биполярное раздражение коры стимулом длительностью 0.1 мс вызывало чисто отрицательный начальный компонент прямого ответа; при этом ]К+]П увеличивалась на 0.1 мМ. Более интенсивный стимул, дававший прямой ответ с добавочным отрицательным компонентом, приводил к увеличению [К+ ]н до 70% выше уровня покоя; при частоте раздражения выше 5/с [К+]в увеличивалась на 6—15 мМ. После одиночного стимула [К+]в достигала максимума ва 50—200 мс и спадала затем за несколько секунд. Восстановление происходило быстрее после отдельных стимулов или короткого тетануса (0.5—2 с), чем после длительного раздражения (1—5 с) [159].
Раздражение мезэнцефалической ретикулярной формации вызывало увеличение [К+]н в зрительной коре кошки на 1.5—2 мМ; по прекращении раздражения [К+ ]я возвращалась к исходному уровню за несколько секунд [199]. В некоторых из приведенных 640
примеров увеличения [К? ]я одновременная внутриклеточная регистрация обнаруживала деполяризацию глионов, протекавшую параллельно изменению концентрации К+ (см. подробнее ниже). Установлено, что имеется хорошая корреляция между импульсной активностью популяции нейронов и уровнем [К+]я; таким образом, изменения [К+ 1п являются показателем глобального изменения нейронной активности [199]. Мы видели, что таким же показателем являются изменения мембранного потенциала глиона: так как каждый импульс оставляет за собой инкремент К+ в межклеточной щели, то уровень мембранного потенциала глиона будет указывать на количество прошедших по соседству с ним нервных импульсов. В^ц. н. с. выделение К+ происходит также при возбуждении^нервных^окончаний и генерации постсинаптических потенциалов; глиальная мембрана будет «регистрировать» количество общей нейронной^активности в соседстве с данным глионом [148]. Но понятие «соседство» весьма относительно: во-первых, деполяризация глионов под действием К+ в данном пункте глиального синцития, распространяясь электротонически, может вызвать деполяризацию целой сферы этого синцития и, таким образом, регистрируемая ГД может быть^ результатом возбуждения не соседних, а сравнительно отдаленных нервных элементов; во-вторых, простая диффузия К+ в межклеточных щелях может привести к ГД на некотором расстоянии от первичного возбужденного очага.
Одиночный потенциал действия в гигантском аксоне не вызывал заметной электрической реакции шванновской клетки; после же тетанического раздражения (250/с) возникала ее гиперполяризация длительностью 10 мин и больше. Гиперполяризация шванновской клетки возникала и в случае пропускания через мембрану аксона в условиях фиксированного на ней напряжения толчков тока деполяризующего направления 50/с. Это не могло быть следствием чисто электрического влияния, так как мембрана шванновской клетки ведет себя пассивно при пропускании через нее электрического тока 1227]. Можно было думать, что гиперполяризация мембраны шванновской клетки каким-то образом связана с выходящим из мембраны аксона током ионов К+ и аккумуляцией их в щелях, о которой свидетельствует следовой отрицательный потенциал, длящийся несколько сот миллисекунд. Но в специальных опытах, когда NaCl в наружном растворе за-мещался_КС1 и_затем этот раствор быстро заменялся нормальным, гипарполяризация шванновской клетки не развивалась [227]. Итак, мембранный потенциал шванновской клетки изменяется при возбуждении соседствующего с ней аксона: выход электрического тока из мембраны аксона приводит к гиперполяризации мембраны шванновской клетки.
Инкубация препарата гигантского волокна в растворе, содержащем трипсин, не влияла на мембранный потенциал шванновской клетки, но устраняла возникновение ее гиперполяризации
41 Общая физиология нервной системы
641
после прохождения по аксону серий нервных импульсов. Была установлено, что прибавление к внешней среде (морской воде) d-тубокурарина (10-9) устраняло гиперполяризацию; эзерин продлевал ее, что указывает на участие холинергического меха' низма (2281.
Уже через 2 мин после добавления в наружную среду карбамилхолина, устойчивого к холинэстеразе аналога ацетилхолина, шванновская клетка гиперполяризировалась. После замещения раствора карбамилхолина морской водой мембранный потенциал клетки возвращался к исходному уровню. Ацетилхолин быстро гидролизуется имеющейся в тканях холинэстеразой, которая может быть ингибирована эзерином. На рис. 14.17 показан эффект одноминутной аппликации ацетилхолина до и после добавления эзерина в морскую воду; в отсутствие эзерина мембранный потенциал возвращается к исходной величине за 2 мин, добавление эзерина значительно продлевает гиперполяризацию. Введение в раствор d-тубокурарина вызывает кратковременную гиперполяризацию шванновской клетки, после чего мембранный потенциал возвращается к исходному; на этом фоне добавление карбамилхолина не вызывает эффекта; после удаления кураре карбамилхолин вызывает обычный эффект гиперполяризации мембраны шванновской клетки. Все указанные вещества не влияли на мембранный потенциал гигантского аксона.
Карбамилхолин увеличивал чувствительность мембранного потенциала шванновской клетки к изменениям [К+ ]Е — снижение [К+ 1н в морской воде приводило гиперполяризацию на 15 мВ; после же добавления карбамилхолина то же изменение [К+ ]„ приводило к гиперполяризации на 49 мВ.
Тетродотоксин вызывал гиперполяризацию на 2 мВ мембраны аксона, но не влиял на мембранный потенциал шванновской клетки и на гиперполяризационный эффект карбамилхолина.
Таким образом, эффекты наружной аппликации к мембране шванновской клетки ацетилхолина (и карбамилхолина) подобны эффекту проведения серии нервных импульсов в прилегающем аксоне. Никотин (но не мускарин) воспроизводит эффект ацетилхолина. Отсюда следует, что рецепторы ацетилхолина в мембране шванновской клетки никотинового типа. Бунгаротоксин, который необратимо блокирует рецепторы ацетилхолина, необратимо устраняет гиперполяризацию шванновской клетки, возникающую от прохождения нервных импульсов в гигантском аксоне или от аппликации ацетилхолина или карбамилхолина. Характерно, что d-тубокурарин, сам обратимо блокируя гиперполяризацию, ап-плицированный заранее, предохраняет от необратимого действия бунгаротоксина [230]. Изложенные данные подкрепляют предположение о наличии рецепторов ацетилхолина в мембране шванновской клетки и об участии холинэргической системы во взаимодействии между аксоном и шванновской клеткой. Следует отметить, что наличие холинэстеразы в мембране аксона кальмара
было прямо показано, но еще не выяснено, однако, выделяется ли при возбуждении гигантского аксона ацетилхолин из аксона или из шванновской клетки [229, 231].
Спонтанные постсинаптические миниатюрные потенциалы в нервно-мышечном синапсе исчезают после дегенерации нервной
Рис. 14.17. Гиперполяризация шванновской клетки под действием ацетилхолина [229].
Гиперполяризацвя мембраны шванновской клетки гигантского аксона кальмара, вызываемая ацетилхолином (АХ) и карбамилхопином (KX); продление ее эзерином (Эз) и блокирование d-тубокурарином (d-T). Велась регистрация мембранного потенциала нервного волокна (линия) и мембранного потенциала разных шванновских клеток данного волокна (точки) в условиях омывания его раствором, содержащим те или другие вещества, время действия которых обоэяанеяо сверху на каждом рисунке.
терминали. Но в нервно-мышечном соединении лягушки после дегенерации волокна обнаружены были миниатюрные потенциалы необычного характера [65]. Видимо, в их происхождении участвуют шванновские клетки, которые после дегенерации перемещаются и покрывают рецепторные участки субсинаптической мембраны [127]. Шванновская клетка начинает; выделять кванты ацетилхолина только после дегенерации нервных волокон. Электрическое раздражение шванновской клетки, лежащей около синаптического окончания двигательного волокна, может вызвать электрические ответы мышечного подокна (от нескольких мВ
до 30 мВ), они вызываются и катодными и анодными толчками, нерегулярны, ослабевают по ходу раздражения; они перестают возникать после кураризации, на них не влияет тетродотоксин, ионы La или Са, но актиномицин подавляет их. Характер электрических ответов указывает на то, что ацетилхолин выделяется из шванновской клетки не квантами; видимо, этот эффект связан с пробоем мембраны шванновской клетки (см. с. 621) и утечкой молекул ацетилхолина; показательно, что при этом в ней происходят резкие морфологические изменения [83]. Пардахотоксин (яд рыбы из Красного моря Pardachirus marmoratus) приводит к увеличению потенциала концевой пластинки и к учащению миниатюрных потенциалов. Среди происходящих при этом морфологических изменений специально отмечается гипертрофия шванновских клеток, начинающих концентрическими слоями окружать пресинаптическую терминаль [2051.
14.1.8. УСТРАНЕНИЕ К+ ИЗ МЕЖКЛЕТОЧНЫХ ЩЕЛЕЙ
Если деполяризация глиона обусловлена аккумуляцией К+ в щелях, то'нисходящая ее часть должна отражать процесс «очищения» щелей от избытка К+. Данные, приведенные на рис. 14.18, вполне соответствуют представлению об аккумуляции К+ в щелях и очищении щелей от К+ путем диффузии.
Рис. 14.18, Спад деполяризации, вызванной длительной и короткой серией импульсов. Глион из зрительного нерва протея, потенциал покоя 86 мВ [177].
А — серия стимулов 10/с длительностью 27 с; Б — короткая серия стимулов 7 5/с; моменты прекращения раздражения совмещены.
В данном случае после длительного раздражения нерва, т. е. после большой по величине и длительности глиальной деполяризации, спад ее продолжается 70 с, после короткого раздражения — 30 с. Аккумуляция К+ уменьшается после удаления глии, окружающей нейроны.
.’^Предполагается три возможных механизма устранения из межклеточных щелей ионов К+, накопившихся в результате возбуждения нервных элементов: 1) диффузия в межклеточной жидкости; 2) перераспределение посредством электрических токов 644
в глиальном синцитии; 3) активный метаболический перенос в глионы и нейроны.
Диффузия. На рис. 14.19 слева представлена часть нервной структуры (сома или отросток нейрона): к ее мембране справа прилегают нервные и глиальные отростки; межклеточное пространство представлено щелью W между «первичной нервной мембраной» и граничащими с ней мембранами; временем диффузии К+ через щель можно пренебречь. Диффузия К+ из щели W
произойдет тем скорее, чем больше каналов Wc; их будет сравнительно мало при прилегании к «первичной нервной мембране» крупных элементов — тел клеток, и их будет много на! единицу площади, когда с ней соседствуют тонкие отростки — нервные и глиальные. Устранение аккумулиро-ванных'щ щели ионов К+ происходит путем их диффузии по системе межклеточных каналов,
Рис. 14.19. Схематическое изображение щелей и «каналов» в коре мозга [156].
Слева — участок нейрона (H); к его мембране (стрелка) прилежат, отделяясь щелью W, мембраны нейронных и глиальных (г) элементов (стрелки), между которыми образуются каналы Wc; расстояние между каналами определяет их количество на единицу длины.
представленных в правой части схемы. Минимальная постоянная времени для диффузии К+ составляет по расчетам 0.61 мс, максимальная — 40 мс [156].
Для выяснения механизма очищения щелей от К+ измерялась скорость этого процесса при разных температурах. На рис. 14.20 сверху показана деполяризация глиона зрительного нерва протея при его стимуляции (5/с, 10 с) при 20° С, внизу ответ той же клетки при 2° С. Как видно, глиальная мембрана реполяризуется медленнее при низкой температуре. Рассчитанный (?1О=1.26, для зависящего от метаболизма входа К+ в аксон кальмара (?10=3. Отсюда делается заключение, что исчезновение К+ из межклеточных щелей после раздражения нерва происходит прежде всего благодаря диффузии его через систему межклеточных щелей [67]. Эти опыты не дают указаний на участие «электрического механизма», движущая сила которого должна происходить от раз-рости .мембранного потенциала в разных частях глиального син
цития (см. ниже), если, конечно, не предполагать, что этот процесс имеет низкий (?io-
В опытах с ионтофоретической инъекцией К+ в кору на разных расстояниях от регистрирующего К+ электрода получены данные о том, что К+ распределяются путем свободной диффузии с диффузионным коэффициентом, равным 1/6 такового в растворе,
Рис. 14.20. Зависимость спада глиальной деполяризации (ГД) от температуры. Глион из зрительного нерва протея [67].
запись — ГД, вызванная раздражением нерва (5/сг период раздражения обозначен точками) при 20° С; прерывистая линия — потенциал покоя. Нилеиля запись — то дав при 2° С (артефакты стимулов увеличились). На графике: по абсциссе — время в секундах после прекращения раздражения; по ординате — рассчитанные по изменениям мембранного потенциала [К+]н (после вычитания 3 мМ, логарифмическая шкала). Четырехугольники — при 20° С, кружки — при 2° С.
содержащем 150 мМ NaCl и 3 мМ КС1 [159]. Низкий коэффициент диффузии в мозге по сравнению с водным раствором обусловлен, видимо, извилистостью межклеточных щелей [94]. Ограничение для диффузии создается, полагают, также наличием фиксированных зарядов и/или мукополисахаридов [156].
Э л е к т р.и ческое перераспределение К+. Факт возникновения электрических токов, которые сопровождают глиальную деполяризацию, когда активируется ограниченная группа клеток, предполагает распределение накопившихся в щелях ионов К+: возникающий при деполяризации данной группы глионов ток может проносить К+ по системе связанных
Глионов. Количественные аспекты этого процесса еТЦе неизвестны [177]. Согласно этой гипотезе, глионы являются пассивными путями движения ионов К+. Из-за высокой проницаемости глиальной мембраны к ионам К+ при увеличении [К+ ]п ионы К+ входят в глионы, одновременно происходит деполяризация их мембраны, т. е. уменьшается отрицательный потенциал внутренней стороны мембраны; в результате разности потенциалов между данными глионами и связанными с ними электротонически другими глионами ионы К* начинают двигаться из цитоплазмы деполяризованных глионов в цитоплазму соседних, которые в свою очередь более или менее деполяризуются. Таким образом, глиальный синцитий действует как обходный путь узких и извилистых межклеточных щелей [201]. Из анализа модели глиального синцития следует, что чем эффективнее он действует как транспортер ионов К+, тем большим должен быть электрический ток в межклеточной жидкости [201]. Если же исходить из того, что соединения между глионами не могут служить эффективными путями движения электрического тока [215], то главную роль в распределении К+ надо приписать электрическим токам, возникающим в пределах глиона между деполяризованным участком его мембраны и остальными его частями, в частности между телом и отростками. По расчетам при увеличении [К+ ]н на 1 мМ количество ионов К+ на 1 см2 наружной поверхности глиальной мембраны увеличивается на 1.5Х1012, что приводит к деполяризации ее на 7.6 мВ; возникающий электрический ток может унести накопившиеся ионы К+: глиальные отростки позволяют осуществить их распределение на значительное расстояние; ионы К+ движутся до тех пор, пока имеется разность концентраций их во внеклеточном пространстве [216].
При условии интенсивного и длительного возбуждения нейронов центральной нервной системы соседствующие глионы окажутся в условиях повышенного содержания К+ в среде со всех сторон и во всех частях, и электрический механизм устранения К+ не сможет оперировать [118]. В этом случае единственной возможностью снизить [К* ]н может быть активация ионных насосов.
Зрительный нерв протея через 2 мес после энуклеации глаза и дегенерации немиелинизированных аксонов состоит из глионов, сохраняющих нормальное строение и нормальные электрические характеристики. На такой глиальной «трубке» с использованием флюорометрической техники было обнаружено, что увеличение [К+ ]н с 6 до 12 мМ вызывает снижение флюоресценции митохондриального НАД.Н (восстановленной формы пири-дин-нуклеотида) из-за окисления его в НАД [176]. Каким образом деполяризация мембраны глиона приводит к изменению его метаболизма, еще не выяснено; есть указание, что ионы Са++ играют при этом определенную роль. Итак, сравнительно малые увеличения [К+]в вызывают метаболический ответ глии. Видимо, в данном случае он не связан с механизмом активного очищения
межклеточных щелей от избытка ионов К+, ибо, как выше указывалось, <210 реполяризации мембраны глиона зрительного нерва протея слишком мал, чтоб предполагать зависимость этого процесса от метаболизма.
Активный перенос К+. У глионов амфибий, как только что говорилось, не удалось выявить этот механизм, хотя ясно, что нервные элементы должны восполнить потерянный во время потенциалов действия калий.
В корковых глионах, в которых деполяризация вызывалась прямым раздражением коры, реполяризация протекала линейно, Я _________________________________________________
Рис. 14.21. Реполяризация коркового глиона. Деполяризация глиона коры мозга кошки вызывалась раздражением таламического ядра (20/с); раздражение длилось or 1 с (А) до 8 с (Г) [113].
если ход ее откладывался на полулогарифмической шкале; полувремя (<0 5) спада составляло 4— 1.5 с, и^в опытах на наркотизированных препаратах мало зависело от силы, частоты и продолжительности раздражения. Время реполяризации после деполяризации, вызванной тетаническим раздражением вентролатерального таламического ядра, также не зависело от силы, частоты и продолжительности раздражения; так, при продолжительности раздражения^от 1 до 8 с^во'всех случаях|реполяризация длилась 2.5 с (рис. 14.21). Но после небольшой деполяризации, вызванной низкочастотным раздражением, спад ее, перенесенный на полулогарифмическую шкалу, представлен был! прямой, после же деполяризации, вызванной раздражением частотой 50/с, когда амплитуда ее была больше 10 мВ, ход реполяризации от-клонялся^от экспоненты [113]. При^измерении^ [К+ ]н калий-селективным электродом в сенсомоторной коре ненаркотизирован-ных кошек было установлено, что при сильном раздражении вентрального заднелатеральноголядра [К+]а на глубине 600 мкм увеличивается больше чем на 1 мВ ив£0 5 спада равнялось 1.7 с; при слабом раздражении [К+ ]„ увеличивается на 0.4 мМ и t0 5= =3.5 с [117], т. е. очищение межклеточных щелей от ионов К+ происходило быстрее после большей аккумуляции их. Если вблизи
микроэлектрода, измеряющего [К+ ]н, посредством другого микроэлектрода путем ионтофореза стандартными порциями увеличивать [К+], то после введения первой порции К+ наступает фаза андершута [К+ ]п, т. е. снижения [К+]я ниже нормы; введение в это время второй порции К+ вызывало в среднем на 19% меньший по амплитуде калиевый потенциал, a t0 5 уменьшалось в среднем на 23% [117]. Эти факты указывают на наличие~меха-низма активного устранения К+ при аккумуляции их в межклеточных щелях.
Видимо, ионы К+ удаляются активным транспортом [1191 посредством Na-, К-АТФазы, присутствие которой показано на'наружной стороне мембраны глионов. У незрелых животных калиевый потенциал в ответ на электрическое раздражение коры спадает длительнее, чем у взрослых, что связывается с низкой концентрацией Na-, К-АТФазы в незрелом мозге [170].
В опытах, произведенных на обогащенных фракциях нейронов и глии, были получены факты, указывающие на возможность активного глиального контроля [К+ ]и [118]. Во-первых, было установлено, что фракция глионов способна аккумулировать значительно больше ионов К + , чем нейроны, и что эта разница максимальна при изменениях [К+]я в пределах 5—10 мМ, т. е. при низких [К+]н. Во-вторых, активность АТФазы оказалась в 2.5 раза выше у глионов; АТФаза глиальных мембран в 3.5 раза сильнее стимулировалась ионами К+, при увеличении [К+]„ с 3 до 10 мМ, чем АТФаза мембран нейронов. Высказывалось предположение о том, что обнаруженные отличия между нейронами и глионами просто связаны с тем, что глионы при центрифугировании более резистентны к повреждению, чем нейроны [201]; однако в опытах с микрохирургической изоляцией нейронов было обнаружено, что изолированные целые нейроны не обнаруживали Na-, К-АТФазной активности, в то время как обрывки глионов обладали высокой активностью [118], Кроме того, было показано в два раза большее поглощение 42К глиомой, чем нейробластомой; оно устранялось оубаином [140]. В связи с этими данными представляет интерес тот факт, что эмбриональные астроциты, выращиваемые в условиях аноксии, сохраняя способность к размножению, не могут поддерживать высокую [К+]в и имеют малый мембранный потенциал [182].
В ц. н. с. мышей-мутантов, описанных Сидманом и сотр. [197], отсутствуют зрелые олигодендроциты. Срезы среднего мозга, продолговатого мозга и мозжечка заметно не увеличивали потребления О2 при увеличении [К+ ]н, тогда как у срезов мозга нормальных мышей потребление Os резко увеличивалось. Отсюда можно заключить, что стимулируемое ионами калия дыхание является специфической функцией олигодендроцитов и, видимо, активное очищение межклеточных щелей от ионов К+ является преимущественно функцией олигодендроцитов [135]. В связи с этим интересно отметить, что олигодендроциты отсутствуют
у беспозвоночных и имеются в малом количестве у амфибий [33]. Может быть, с этим обстоятельством можно связать отсутствие механизма активного устранения избытка К+ у этих животных.
Итак, имеются веские основания считать, что глионы способны аккумулировать К+ против концентрационного градиента благодаря действию Na-, К-АТФазы и таким образом регулировать уровень [К+ ]„. Когда при длительном интенсивном возбуждении нервных элементов происходит накопление некоторого большого количества ионов К+, то к простой диффузии и к механизму электрического переноса подключается активный транспорт ионов К+ в глиальные клетки посредством ионного насоса. Но вопрос о том, играет ли активный транспорт в глионах роль в очищении межклеточного пространства от избытка К*, продолжает дискутироваться.
При барбитуровом наркозе после ГД, вызванной электрическим раздражением коры или таламического ядра, не была выражена гиперполяризация корковых глионов [133, 1131. Она была выявлена в опытах на ненаркотизированных животных [189]: ГД по прекращении раздражения постепенно спадала, затем кривая мембранного потенциала пересекала исходный уровень, и глион на длительное время — до 4 мин — переходил в состояние гиперполяризации, амплитуда которой увеличивалась при увеличении периода раздражения; если раздражения следовали вскоре одно за другим, то амплитуда глиальной гиперполяризации прогрессивно нарастала. Амплитуда глиальной гиперполяризации не зависит от величины ГД к моменту прекращения раздражения: при очень длительном раздражении ГД ослабевает, как уже говорилось, а глиальная гиперполяризация нарастает. Глиальная гиперполяризация оказалась связанной со скоростью устранения К+ из межклеточных щелей: амплитуда ее тем больше, чем быстрее происходит реполяризация глиона.
При прямом определении [К+]а посредством калийселек-тивного микроэлектрода на ненаркотизированных препаратах (в противоположность наркотизированным) по прекращении раздражения коры или таламического ядра, как правило, происходило снижение [К + ]п до 2.1 мМ [117]. Таким образом, в основе глиальной геперполяризации может лежать снижение [К+]в ниже исходного уровня. Этому предположению соответствуют следующие факты: 1) во время глиальной гиперполяризации не меняется проводимость мембраны; 2) на фоне глиальной гиперполяризации пробные раздражения коры вызывают деполяризационные ответы глиона большей амплитуды, чем при исходном мембранном потенциале, и амплитуда их постепенно снижается по мере ослабления гиперполяризации [189]; 3) кривая изменения [К+]н от 2.1 мМ до нормального уровня 3 мМ сходна с протеканием во времени глиальной гиперполяризации [117].
Однако в то время как глиальная гиперполяризация не зависит существенно от величины ГД к моменту прекращения раз-650
дражения и усиливается в связи с повторными и длительными раздражениями, андершут [К + ]н зависит от величины калиевого потенциала (т. е. [К*]^ во время раздражения, не усиливается при повторных раздражениях и при увеличении продолжительности раздражения. В то время как пробные раздражения вызывают на фоне гиперполяризации глиона усиленные деполяризационные ответы, электрофоретически вводимый К+ па фоне сниженной [К + ]Е вызывает ослабленный К+-ответ [189, 117]. Причины этих расхождений остаются невыясненными. Во всяком случае, эти данные ясно указывают на то, что регистрация [К+]п посредством калийселективного микроэлектрода не подменяет внутриклеточной регистрации изменений мембранного потенциала глионов.
Глиальная гиперполяризация может быть обусловлена усиленной деятельностью электрогенного Na-, К-насоса корковых нейронов, приводящей к падению {К + ]я ниже нормального уровня. Чтоб объяснить то обстоятельство, что гиперполяризация глионов много длительнее гиперполяризации корковых нейронов, допускается, что насос продолжает работать и тогда, когда мембранный потенциал нейронов становится нормальным, и что, кроме того, требуется время, чтоб восстановилась нормальная [К+я ] посредством пассивных механизмов переноса К+. Прямое раздражение коры приводит к ее метаболическому ответу, о котором судят по изменению флюоресценции, связанному с окислением НАД.Н; но на основании изучения флюоресценции митохондриальной НАД.Н интактной коры нельзя определить, где происходят изменения метаболизма — в нейронах или глионах, или в тех и других [157 J.
Глиальная гиперполяризация может быть результатом действия стимулируемого ионами К+, направленного внутрь Cl-насоса [101]: у астроцитов, культивируемых в среде, содержащей 140 мМ 3®С1, скорость поглощения ®вС1 была функцией [К + ]н. Таким образом, гиперполяризация может быть обусловлена активным поглощением глионами ионов С1~, опосредственным ионами К1. Но инъекция С1~ внутрь глионов не вызывала изменений мембранного потенциала [146]; при использовании микроэлектродов, заполненных КС1, диффузия С1_ из кончика микро-электрода быстро приводила к реверсии ТПСП нейронов, но не влияла на мембранный потенциал и ответы глионов [41, 42].
Соответственно тому, что усиление активности нейронов сопровождается увеличением [К + ]п, ослабление импульсной активности корковых нейронов относительно фонового уровня после периода их возбуждения ассоциируется со снижением [К + ]а ниже исходного уровня покоя, которое, очевидно, обусловлено стимуляцией Na-, К-насоса нейронов из-за повышения [Na+]B. Раздражение пирамидного тракта вызывает торможение пирамидных нейронов и снижение [К + ]а, максимальное на глубине 500 мкм [117]; можно думать, что в это время происходит гипер
поляризация глионов в этой области; если это будет подтверждено в опытах с внутриклеточным отведением глионов, то будет получено явление гиперполяризации глионов без их предварительной деполяризации.
14.2. НЕЙРОГЛИЯ И ДЛИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ НЕРВНОЙ СИСТЕМЫ
Генерация длительных электрических потенциалов свойственна всем отделам нервной системы: после потенциала действия нервного волокна развиваются следовые электрические потенциалы; в ответ на вспышку света сетчатка генерирует длительные электрические потенциалы, которые составляют электро-ретинограмму; приход залпа импульсов в спинной мозг приводит к возникновению отрицательности серого вещества, длительность реакции измеряется секундами; в коре больших полушарий в ответ на периферический стимул после кратковременного первичного ответа развивается длительный поверхностно отрицательный потенциал продолжительностью до нескольких секунд. Происхождение длительных электрических потенциалов оставалось до последнего времени неизвестным; но многие исследователи приходили к мысли об участии нейроглии в их происхождении. За последние 10 лет был достигнут большой Д прогресс в выяснении природы длительных электрических потенциалов нервной системы. Хотя они возникают в связи с интенсивной деятельностью — возбуждением и торможением нейронов, нейроны не являются их основными генераторами; в ряде случаев доказано, что источником токов, которые лежат в основе длительных изменений потенциала, являются глиальные клетки.
14.2.1. НЕРВЫ
Опыты, в которых удалось сопоставить следовые электрические потенциалы нервных волокон с изменениями мембранного потенциала глионов, привели к интересным заключениям. На рис. 14.22 видно, что тетанизация зрительного нерва лягушки Rana pipiens приводит к медленно нарастающей деполяризации глиона и параллельно развивающейся отрицательности поверхности нерва, на фоне которой протекают его потенциалы действия соответственно ритму раздражения; по прекращении тетанизации кривые спадают, причем реполяризация глиона происходит медленнее, чем возвращение к исходному уровню внеклеточного потенциала, отводимого от поверхности. Суммарный отрицательный потенциал, отводимый от нерва, представляет собой результат суммации следовых отрицательных потенциалов, возникающих при нанесении иа нерв стимулов такой интенсивности, при которой вовлекаются С-волокна. На основании таких опытов было сделано предположение о том, что отрицатель-
ныи следовыи потенциал зрительного нерва отражает глиальную деполяризацию, что глионы, связанные мостиками низкого сопротивления, являются основным источником медленной отрицательности нерва, поскольку глионы сильнее деполяризуются при накоплении ионов К* в межклеточных щелях, чем нервные волокна 1148]. Сходные отношения между внутриклеточным потенциалом глиона и потенциалом поверхности нерва были обнаружены в зрительном нерве лягушкиfRana ridibunda [18].
1мВ
50мс
Рис. 14.22. Длительные потенциалы нерва. Зрительный нерв лягушки [148]. А — внеклеточное «монофазное» отведение около перерезанного конца нерва; сложный потенциал действия, вызываемый одиночным максимальным стимулом; коротколатентное отклонение выражает ответ миелинизированных аксонов, затем следует ответ немиелинизированных волокон, за которым регистрируется слабый отрицательный следовой потенциал. Б — (верхняя запись) те же условия отведения, что и в А, только раздражение 10/с, медленная скорость развертки. Отрицательные следовые потенциалы суммируются; нижняя запись — одновременное внутриклеточное отведение от глиона.
Эти предположения нашли подтверждение в опытах на зрительном нерве протея, в которых сравнивались изменения мембранного потенциала глиона и потенциала поверхности^нерва при инъецировании электрического тока в глион на том или другом расстоянии от места внутри- и внеклеточной регистрации (рис. 14.23, Л). Мембранный потенциал глиона и потенциал поверхности нерва изменяются совершенно одинаково во времени, и первый и второй линейно связаны с интенсивностью тока; но потенциал нерва, регистрируемый с помощью сахарозного мостика, в два раза уступает по абсолютной величине снижению мембранного потенциала глиона (рис. 14.23, Л). При введении токового микроэлектрода ближе к месту отведения, т. е. ближе к микроэлектроду, введенному для регистрации мембранного потенциала в глион, и к сахарозному мостику на нерве, изменения мембранного потенциала глиона и потенциала поверхности увеличивались и протекали быстрее, т. е. инъецированный ток распространялся электротонически, вызывая изменения мембран-
його потенциала вдех Глионов в области отведения. Если токовый микроэлектрод извлекался из глиона и оказывался внеклеточно в толще нерва, то пропускание через него тока не вызывало значительных изменений мембранного потенциала отводимого глиона и потенциала поверхности нерва (рис. 14.23, Б). Такие же опыты, произведенные после удаления глаза и перерождения всех нерв-
___________ \5мВ
0.5с
lW л?5
Рис, 14.23. Электрические потенциалы, регистрируемые от нерва и из глиона 175].
а — зрительный нерв протея; а — ряд глионов. Через 1-й микроэлектрод, на расстоянии 1024 мкм от сахарозного мостика в глиои инъецировался толчок тока; от 2-го,находящегося на расстоянии 90 мкм от мостика, регистрировались изменения мембранного потенциала. Одновременно регистрировались изменения потенциала поверхности нерва между двумя электродами по обе стороны мостика (нижние записи), А — токовый и отводящий микро-влектроды в глионах; Б — токовый микроэлектрод извлечен из глиона и находится во внеклеточном пространстве.
ных волокон, дали такие же результаты, но потенциал поверх-пости «глиального нерва» по абсолютной величине приближался к изменению мембранного потенциала глиона. Эти опыты показывают, что потенциал поверхности нерва отражает изменения мембранного потенциала глионов и что в нормальном нерве аксоны играют роль параллельных шунтов для глиальных клеток [75]. Как говорилось, снижение [К + ]н с 3 до 0.3 мМ вызывает гиперполяризацию мембраны глиона на 30—40 мВ; нейроны же сравнительно нечувствительны к таким изменениям и гиперпо-ляризуются только на несколько мВ. Если глия обусловливает
потенциал поверхности зрительного нерва, то изменения [К + ]я должны проявляться при отведении от поверхности. Действительно, при снижении [К + ] в растворе (см. рис. 14.23) до 0.3 мМ от поверхности нерва регистрировалась гиперполяризация 14 мВ (а на «глиальных нервах» — до 28 мВ), которая в силу вышесказанного полностью связана с изменением мембранного потенциала глии. Нужно допустить, что изменения глиального потенциала при тетанизации нерва находят отражение на поверхности нерва из-за неравномерной деполяризации глионов синцития; выделяющиеся из возбужденных волокон ионы К+ в силу анатомического расположения пучков волокон и глии оказываются в большей концентрации по отношению к одним глионам; создается разность потенциалов между разными участками глиального синцития, и начинает течь ток.
Возникновение следового отрицательного потенциала гигантского аксопа кальмара можно объяснить, исходя из накопления ионов К+ в щели между аксоном и шванновской клеткой, обусловливающего следовую деполяризацию мембраны аксона [95]. Поэтому нельзя трактовать следовые отрицательные потенциалы периферических нервов по аналогии с таковыми зрительного нерва (относящегося к ц. н. с.). Мы видели, что "шванновские клетки, покрывающие гигантский аксон кальмара, гиперполя-ризуются в связи с проведением серии импульсов аксоном и что это происходит вследствие деятельности холинергического механизма.
Пока еще нет сведений об участии шванновских клеток в происхождении следовых отрицательных потенциалов в периферических нервах теплокровных; неизвестно, связаны ли шванновские клетки посредством щелевых контактов; неизвестно, как изменяется их мембранный потенциал в результате возбуждения нервных волокон. Шванновским клеткам приписывали важную роль в происхождении медленного компонента электротона [208], который, как и следовые потенциалы, чувствителен к ряду нейрофармако-логических веществ [8]; вопрос остается невыясненным.
14.2.2. СЕТЧАТКА
Электроретинограмма (ЭРГ), отводимая от роговицы, состоит из 4 основных компонентов; при включении света возникает отрицательное колебание а, за которым следует медленная положительная волна Ь; вслед за ней развивается длительное положительное отклонение с; при выключении света регистрируется положительная волна d. До последнего времени происхождение ЭРГ оставалось невыясненным. Изучение электрических реакций глионов сетчатки приблизило к выяснению природы &-волны ЭРГ.
Мюллеровские клетки — глиальная система сетчатки — простираются от внутренней пограничной мембраны до наружной;
каждая клетка представляет собой колонну цитоплазмы толщиной 15—20 мкм, расширяющуюся у внутренней мембраны до 40 мкм, от нее отходят многочисленные отростки, и, таким образом, нейронные элементы сетчатки окружаются глией; отростки мюллеровских клеток соединяются посредством щелевых контактов, в’которых остается щель 20—30 А. [164].
В опытах с внутриклеточным отведением ответов мюллеровских клеток’сетчатки^протея — с последующей гистологической их 'идентификацией^иутем^инъекции краски через отводящий
Рис. 14.24. Деполяризация мюллеровской клетки при освещении сетчатки. Сетчатка протея [164].
Справа — изменения мембранного потенциала мюллеровской клетки при освещении глаза; длительность освещения обозначена опусканием и поднятием сигнальной линии; внутриклеточное отведение. Слева — ЭРГ, отводимая макроолектродом от поверхности стекловидного тела. В Б интенсивность света большая, чем в А.
микроэлектрод — было установлено, что они обладают высоким мембранным потенциалом — до 85 мВ. В ответ на световое раздражение сетчатки мюллеровская клетка отвечала медленной деполяризацией, достигавшей 15 мВ (рис. 14.24). Оказалось, что эти ответы имеют тот же скрытый период и ту же форму, что и Ь-волна электроретинограммы (ЭРГ). Кривые зависимости амплитуды ответа мюллеровской клетки и 6-волны ЭРГ от интенсивности света совпадают. Рецептивное поле данной мюллеровской клетки очень большое — 1—2 мм. Нейроны сетчатки не обладают столь высоким мембранным потенциалом и не генерируют медленных потенциалов, сходных с 6-волной. Предполагается, что ответ мюллеровской клетки возникает вследствие возбуждения нейронов в внутреннем ядерном слое: ответ этих нейронов — горизонтальных клеток и биполяров — наступает с меньшим скрытым периодом, чем деполяризация мюллеровских клеток; в результате повышения на этом уровне сетчатки [К + ]н происходит локальная деполяризация мембраны мюллеровской клетки и возникают внеклеточные токи, что отражается в возникновении 6-волцы 656
ЭРГ {164], Возможно, что не только 6-волна ЭРГ, но и другие ее компоненты связаны с активностью мюллеровских клеток [245].
Омывание сетчатки с одной ее стороны раствором с пониженной [С]- ] или повышенной [К + ] приводило к ослаблению 6-волны, очевидно, из-за деполяризации мембраны мюллеровских клеток [115, 141]. Если 6-волна отражает ответ глии, то становится понятным, каким образом она является столь тонким индикатором психофизически определяемых порогов: 6-волна, т. е. деполяризация глионов, является интегральным выражением возбуждения комплекса нейронов сетчатки, отвечающих на данный световой стимул [244],
14.2.3. СПИННОЙ МОЗГ
При тетанизации заднего корешка или чувствительного нерва потенциал серого вещества сегмента, куда вступают данные афферентные волокна, сдвигается в отрицательную сторону. Этот сдвиг при продвижении электрода через серое вещество не реверсирует, т, е. остается отрицательным во всем сером веществе. Потенциал достигает максимума за 0.5—3 с раздражения; необходима 1 мин отдыха, чтоб следующее раздражение могло вызвать сдвиг такой же амплитуды, которая у шейки заднего рога достигает 8 мВ; возбуждение толстых А-волокон менее эффективно, чем возбуждение тонких: при возбуждении С-волокон увеличивается не только амплитуда сдвига, но и время его спада по прекращении раздражения [200]. й
Эти длительные сдвиги не коррелируют с внутриклеточно отводимыми синаптическими потенциалами нейронов: мембранный потенциал нейрона или уменьшается, или увеличивается при раздражении — в зависимости от того, является ли афферентный приток возбуждающим или тормозящим; форма длительных синаптических потенциалов нейрона варьирует от нейрона к нейрону; по прекращении раздражения потенциал, регистрируемый из нейрона, спадает всегда гораздо быстрее, чем потенциал, отводимый экстрацеллюлярно в непосредственной близости от него. С другой стороны, глиальные клетки дают при тетаническом раздражении афферентных нервов длительную деполяризацию, достигающую 14 мВ, очень сходную с длительным отрицательным сдвигом, регистрируемым из внеклеточной жидкости, окружающей эти клетки; но спад последнего протекает быстрее [200].
Опыты с измерением [К+]я в сером веществе спинного мозга с помощью калийселективного микроэлектрода позволили установить, что при тетанизации афферентного нерва [К + ]н может повыситься с 3 до 5.5 мМ [234]. Между амплитудой отрицательного сдвига потенциала серого вещества и логарифмом увеличения [К + ]и имелась положительная линейная корреляция ]202].
Наконец, в опытах с одновременным введением трех микроэлектродов в данный пункт серого вещества спинного мозга —
42 Общая физиология нервной сдстемм
657
первого для внеклеточной регистрации длительных отрицательных сдвигов потенциала, второго для внутриклеточной регистрации деполяризационных сдвигов мембранного потенциала глиальной клетки, третьего, калийселективпого, для регистрации сдвигов [К+]а — была показана замечательная корреляция этих трех переменных. Таким образом, возникающий в сером веществе спинного мозга Jnpn тетапизации афферентных волокон инкремент [К Ч/точно^коррелирует с величиной регистрируемого в этой
Рис. 14.25. Схема возникновения сдвигов потенциала серого вещества в заднем роге при тетаническом раздражении афферентного нерва. Способы от- ведения от глии (а), нейронов (в) и внеклеточного пространства (б) [200].
д', б' не' — регистрируемые потенциалы (отклонение наверх — положительность). Прерывистая линия на а' изображает «чистую» глиальную деполяризацию; а" показывает вклад глии в сдвиг потенциала серого вещества; а" — вклад ВПСП нейронов. Кривая чистой глиальной деполяризации получена путем вычитания экстрацеллюлярных токов нейронов из мембранного потенциала глии.
области отрицательного сдвига внеклеточного потенциала и с деполяризационным сдвигом мембранного потенциала глиальной клетки. Следует отметить, что спад внеклеточного потенциала по прекращении раздражения происходит скорее, чем реполяри-зация глиона и возвращение [К + Jn к исходному уровню [158].
На рис. 14.25 приводится схема, поясняющая существующие представления (200 J о механизме возникновения длительных отрицательных сдвигов потенциала серого вещества спинного мозга.
Длительные электрические потенциалы задних корешков спинного мозга по протеканию во времени значительно отличаются от рассмотренных сдвигов потенциала серого вещества, т. е. их нельзя как будто отнести к электрическим реакциям глии и изменениям [К+]а [158]. Различие в протекании электротони-
ческих потенциалов задних корешков й изменений [К+[н пытаются объяснить разной локализацией окончаний первичных афферентов и калийселективного электрода по отношению к разряжающимся нейронам [233, 234 J. Таким образом, вонрос о происхождении электротонических потенциалов задних корешков (и связанного с ними пресинаптического торможения) остается еще не решенным.
14.2.4. КОРА БОЛЬШИХ ПОЛУШАРИЙ МОЗГА
Еще в доэлектронномикроскопическую эру высказывались предположения о том, что глия является генератором основных волн электроэнцефалограммы (ЭЭГ). При этом считалось, что деятельность сателлитов, служащая поддержанию возбудимости корковых нейронов, проявляется в альфа-ритме, а тормозящее влияние сателлитов на корковые нейроны проявляется в бета ритме [142, 143]. На основании данных электронной микроскопии о глиа-нейронной организации центральной нервной системы выдвинуто было положение о том, что в первом приближении глию можно считать генератором медленных волн ЭЭГ, к которым причислялись альфа-волны, дельта-волны и потенциалы при эпилепсии [98], и что непосредственной причиной их возникновения являются колебания ионного состава среды, в которой расположены нейроны [46, 224]. Нейроглии было приписано, наконец, участие в происхождении спонтанных сверхмедленных колебаний потенциала [1 ].
В мезэнцефалической ретикулярной формации посредством калийселективного электрода были отмечены колебания [К+ ]н в пределах 0.02—0.2 мМ при изменениях спонтанной импульсации рядом лежащих нейронов. На основании кривой зависимости мембранного потенциала коркового глиона от [К+ ]я можно ожидать изменения мембранного потенциала порядка 0.1—1 мВ. Поскольку глиальные потенциалы имеют чрезвычайно медленное, измеряемое секундами течение, очевидно, что глия не участвует в происхождении основных ритмов ЭЭГ, генераторами которых являются, видимо, исключительно нейроны; может быть, она участвует в происхождении колебаний потенциала частотой ниже 1 с, которые при обычном использовании усилителей переменного тока не регистрируются при отведении ЭЭГ.
Действительно, при внутриклеточном отведении потенциалов глионов не обнаруживалась ритмическая активность ЭЭГ-диапазона [911, но целые периоды нейронной активности — вспышки серий веретен в электрокортикограмме (ЭКоГ) — находят свое отражение в изменениях мембранного потенциала глиона (см. рис. 14.1), которые в свою очередь могут находить отражение в колебаниях потенциала поверхности коры. Не отмечалось «сверхмедленных» колебаний потенциала мембраны глиальных клеток, но специально вопрос не исследовался.
При электрическом раздражении поверхности коры, когда интенсивность стимулов в несколько раз превышает порог вызова дендритных потенциалов — ВПСП верхушечных дендритов — и когда возбуждаются, видимо, немиелинизированные волокна, возникают медленные электрические потенциалы большой длительности [73]. При частоте раздражения 5/с и выше они суммиру-
Рис. 14.26. Длительные отрицательные потенциалы поверхности коры [32].
А — медленный отрицательный потенциал при отведении на расстоянии 0.5 мм от пункта раздражения; Б — отсутствие его при отведении на расстояния 3 мм; В — ослабление медленного отрицательного потенциала на второй стимул, нанесенный через 0.9 с после первого; Г — постоянное отрицательное отклонение, зарегистрированное на расстоянии 1.5 мм от раздражаемого пункта при частоте раздражения 100 в 1 с; раздражение продолжалось 3 с.
ются — возникает отрицательный сдвиг потенциала поверхности коры [107]. Медленный потенциал распространяется с декрементом на расстоянии нескольких миллиметров, ответ на 2-й стимул резко ослаблен на фоне отрицательного потенциала предыдущего .стимула. По прекращении тетанизации коры потенциал поверхности коры возвращается к исходному уровню обычно за 3 с (рис. 14.26). Амплитуда отрицательного сдвига потенциала увеличивается при увеличении силы и частоты раздражения. Предположение об участии глии в происхождении этих отрицательных сдвигов потенциала [31, 32] подтверждается
результатами микроэлектродных исследований; они чрезвычайно сходны с изменениями мембранного потенциала глионов, регистрируемыми внутриклеточно в это время в том же пункте коры [133, 72, 206, 41].
Как видно на рис. 14.27, А, глиальная деполяризация и отрицательный сдвиг потенциала поверхности коры параллельно на-
Рис. 14.27. Отрицательные сдвиги потенциала поверхности коры, глиальная деполяризация и нейронная гиперполяризация.
На всех осциллограммах верхние кривые — внутриклеточные потенциалы, нижние кривые потенциалы поверхности коры; отклонение вверх означает отрицательность макроэлектрода и деполяризацию при внутриклеточном отведении. А и Б — микроэлектрод в одном треке попадает сначала в глион на глубине 615 мкм, затем в нейрон иа глубине 820 мкм; А — микроэлектрод в глионе, мембранный потенциал 80 мВ, эффект раздражения, частота стимулов 50/с, период раздражения виден по петлям раздражающего тока; Б — микроэлектрод в нейроне, мембранный потенциал 25 мВ, эффект такого же раздражения (по [49]). В и Г — другой препарат; В — микроэлектрод в глионе, мембранный потенциал 80 мВ, эффект раздражения, частота стимулов 50/с; Г — эффект такого же раздражения, мембранный потенциал упал до 60 мВ [41].
растают в течение первых 0.5 с раздражения; еще большее сходство в протекании глиальной деполяризации и отрицательного сдвига видно на рис. 14.27, Г: начальная часть подъема кривых и их спад протекают строго параллельно. Кратковременный подъем кривой по прекращении раздражения связан, может быть, с явлением отдачи — с разрядом нейронов, заторможенных во время тетанизации коры. Как хорошо известно, при электрическом раздражении поверхности коры во многих корковых нейронах в области приложения раздражения возникают ТПСП.
Отрицательный сдвиг не является отражением гиперполяризации массы корковых нейронов. Несоответствие между ТПСП, отводимыми внутриклеточно из нейронов, и отрицательным потенциалом на поверхности коры демонстративно выступает при ее тетаническом раздражении. На рис. 14.27, В видно, что гипер
поляризационный сдвиг мембранного потенциала нейрона быстро — за 20 мс — достигает максимального значения и затем, при непре-кращающемся раздражении, прогрессивно ослабевает; отрицательный сдвиг протекает совершенно иначе: он медленно нарастает, достигая вершины за 400 мс; по прекращении раздражения ход изменений мембранного потенциала нейрона и отрицательного сдвига также разный.
Итак, отрицательный сдвиг потенциала поверхности коры коррелирует с деполяризацией глиона. Но не всегда эти две электрические реакции протекают строго параллельно. Во-первых, спад глиальной деполяризации по прекращении раздражения обычно длится дольше, чем спад отрицательного сдвига (см. рис. 14.27, А); причины этого еще не выяснены. Во вторых, в начале раздражения нарастание глиальной деполяризации и отрицательного сдвига часто протекают не параллельно; так, на рис. 14.27, В видно, что глиальная деполяризация нарастает значительно круче, чем отрицательный сдвиг. Наконец, кривая спада глиальной деполяризации может затягиваться до 10 с и более, она отклоняется при этом от экспоненты и носит неправильный характер; это ассоциируется с разрядом импульсов соседнего нейрона, которые отводятся микроэлектродом, находящимся в глионе [42].
Мембранный потенциал покоя глиона зависит от ряда факторов. Во-первых, когда в связи с введением микроэлектрода в глион повреждается мембрана, то внутрь могут просачиваться ионы Na+, что приводит к прогрессирующему снижению мембранного потенциала (см. рис. 14.27, В и 14.27, Г). При углублении в кору, прежде чем проникнуть в данный глион, микроэлектрод повреждает и разрушает то или иное число клеток, что может привести к временному увеличению [К+ ]н и снижению мембранного потенциала отводимого глиона. Во-вторых, мембранный потенциал глиона зависит от импульсной активности соседствующих нервных элементов: чем она интенсивнее, тем выше [К+]н и ниже мембранный потенциал. Можно думать, что форма отрицательного сдвига на поверхности коры соответствует форме протекания глиальной деполяризации в большей части глионов в данном пункте коры.
Таким образом, отрицательный сдвиг потенциала, отводимый от поверхности коры, может точно соответствовать деполяризационному сдвигу мембранного потенциала отводимого внутриклеточно глиона, но это далеко не всегда должно обязательно случиться. О причинной зависимости отрицательных сдвигов потенциала поверхности коры от глиальной деполяризации свидетельствует и линейная зависимость между амплитудой отрицательных сдвигов и величиной деполяризации глионов в верхних 0.5 мм толщи коры [186]. В пользу того, что отрицательный сдвиг потенциала на поверхности коры отражает деполяризацию глионов, говорит также тот факт, что пороги вызова их электрическим раздражением коры совпадают. Когда интенсивность
стимулов мала и возникают только дендритные потенциалы, то не происходит деполяризации мембрапы глиона. При той интенсивности стимулов, при которой возникает отрицательный сдвиг потенциала на поверхности коры, возникает и деполяризация глиона; с усилением раздражения обе реакции параллельно усиливаются [421.
При изучении электрического поля второго компонента прямого ответа коры было установлено, что этот потенциал, постепенно затухая, распространяется от пункта раздражения по горизонтали и по вертикали, т. е. по поверхности и в толщу коры, на расстояние Змм [401. Для объяснения этого явления привлекались уже упомянутые сведения, согласно которым электрический ток может электротонически распространяться от одного глиона к другому через места тесного соприкосновения глиальных мембран. При локальном раздражении коры рассматриваемый медленный отрицательный потенциал регистрируется в объеме коры, имеющем форму сферического сегмента [51; это электрическое поле отражает, видимо, деполяризацию глионов в указанном объеме коры. Когда раздражение коры производится в отсутствие наркоза, то естественно происходит иррадиация возбуждения по цепям нейронов; при этом количество возбужденных нейронов прогрессивно уменьшается по мере отдаления от первичного фокуса [21]; соответственно должен уменьшаться инкремент [К+1н, т. е. должна ослабевать глиальная деполяризация. Итак, можно думать, что при возбуждении модуля коры он оказывается окруженным сферой глионов с постепенно возрастающим к периферии мембранным потенциалом.
Можно думать, что деполяризация корковых глионов и сдвиг отрицательного потенциала на поверхности коры при ее электрическом раздражении возникают прямо под действием раздражаю щего тока вследствие пробоя мембраны глионов; но, во-первых, деполяризация глиона возникает при сравнительно небольших интенсивностях стимулов [41 ], во-вторых, после аппликации те-тродотоксина сдвиг отрицательного потенциала перестает вызываться даже верхмаксимальными толчками тока [40], хотя мембранный потенциал глионов не изменяется под действием тетро-дотоксина [207].
В последнее время выяснен еще ряд важных обстоятельств. Во-первых, с помощью калийселективного микроэлектрода установлено, что в области раздражаемого пункта коры при развитии отрицательного сдвига потенциала увеличивается [К+ ]н до 6— 15 мМ, временное течение процесса сходно с течением сдвига потенциала на поверхности коры, лишь спад длится дольше (рис. 14.28). Во-вторых, кривая зависимости амплитуды отрицательного сдвига от [К+]„, определенной калийселективным электродом, соответствует кривой зависимости деполяризации глиона от 1К+]Я [2011, Наконец, в опытах с прямым раздражением
коры и одновременной регистрацией метаболического ответа коры (флюоресценции НАД.Н), [К+]п и сдвига внеклеточного потен-циала*’установлено наличие корреляции между этими тремя про цессами [157].
* Итак,Готрицательные^”сдвигит потенциала поверхности коры весьма информативныГони'свидетельствуют о реакции глиального синцития, о’[К+]а, т. е. об’интенсивности’возбуждения нервных элементов, об окислительном метаболизме,*”связанном с деятельностью нейронно-глиальных^модулей коры.
Рис. 14.28. Изменения [К+]п, сопровождаемые отрицательным сдвигом потенциала поверхности коры при ее прямом раздражении [159].
/иг — эффект кратковременного, справа — эффект Длительного раздражения; верхние записи — потенциалы поверхности норы, нижние — [К+], регистрируемые капийселек-тинным микроэлектродом на глубине 500 мкм (расстояние между калийселективным и ЭКоГ электродами 1.5 мм). Отрезок записи выпущен. Стрелками обозначены начало и прекращение раздражения.
Все сказанное относится к отрицательному сдвигу потенциала при прямом электрическом раздражении коры; требуются специальные исследования для выяснения природы отрицательных сдвигов потенциала при естественных условиях активизации коры. Однако можно считать несомненным участие деполяризации глионов в их происхождении. Деполяризация корковых глионов регистрируется при раздражении разных таламических ядер: VA [72]; VL [113]; PV и paracentralis [133]. ГД возникает и под действием транскаллозальных стимулов [211]. При внутриклеточном отведении из глионов соматосенсорной области коры установлено, что они отвечают длительной деполяризацией на электрическое раздражение передней лапы [72]. В зрительной области коры кошки глионы отвечали деполяризацией порядка 1—7 мВ на соответствующие зрительные стимулы; предпочитаемая ориентация стимула была такой же, как для соседних нейронов на расстоянии около 50 мкм; рецептивное поле для глионов было большим, чем для нейронов; глионы давали некоторую реакцию
йа стимулы любой ориентаций, т. е. были йе так тонко настроены, как нейроны. Часть реакций глионов могла быть обусловлена выделением К+ из неориентированных афферентов; кроме того, из-за электрической связи между глионами ГД одного глиона могла отражать реакцию глионов, принадлежащих соседним колоннам нейронов [138].
Эпилептический процесс может возникнуть при действии достаточно длительной и интенсивной нервной импульсации, приводящей к возбуждению значительное количество нервных элементов, при повреждении нервной ткани, вызванной^заморажи-ванием, при аппликации ряда химических веществ (стрихнин, метразол, пенициллин, алюминиевая паста, растворы с сниженным содержанием С1- и др.). При энилептизации в корковых нейронах начинают возникать пароксизмальные деполяризационные сдвиги мембранного потенциала, которые вызывают высокочастотный разряд нервных импульсов. Выяснено, что сдвиги потенциала поверхности коры, сопровождающие эпилептическую активность, являются результатом суммации не постсинаптических потенциалов корковых нейронов, а глиальных деполяризационных и гиперполяризационных потенциалов.
Пароксизмальные деполяризационные сдвиги представляют, очевидно, гигантские ВПСП, возникающие из-за пластических изменений в синаптическом аппарате [26]. В опытах на культуре ткани гиппокампа _были получены данные в пользу того, что пароксизмальные деполяризационные сдвиги возникают не в соме, а в дендритах [247]. Следует отметить возможность возникновения деполяризационных сдвигов мембранного потенциала несинаптической природы, например, в нейроне рецептора растяжения под действием стрихнина [43]. Во всяком случае, эпилептическая активность нейронов приводит к усиленному поглощению ими ионов Na+ и выделению в межклеточные щели ионов К+.
При^внутриклеточной регистрации^из корковых глионов во время эпилептической активности было обнаружено, что каждому судорожному потенциалу соответствовала медленная деполяризация мембраны глиона [133]. ГД достигает 25 мВ и длится до 6 с; она^начинается через 12—14 мс после судорожного потен-циала^на поверхности коры, достигая вершины за 130 мс [183].
Сходные реакции возникали при судорожных потенциалах в гли-онах гиппокампа [90]. ГД клеток в верхних слоях коры была зеркальным отображением сдвигов потенциала, регистрируемых на поверхности [183]. Когда серия судорожных потенциалов вызывалась^стимуляцией таламического ядра, то ГД суммировались (рис. 14.29); амплитуда деполяризации могла достигать 30 мВ, спад ее по прекращении стимуляции мог длиться 20—30 с. Как и в нормальной коре, имелась линейная зависимость мажду величиной ГД и величиной отрицательного сдвига потенциала поверхности коры.
Потенциалы нейронов, регистрируемые внутриклеточно, во время судорожной активности не коррелируют со сдвигами отрицательного потенциала поверхности коры, но хорошо коррелируют с сравнительно быстрыми потенциалами ЭКоГ; при этом характерным для нейронов является, как го-
Рис. 14.29. Деполяризация корковых глионов во время эпилептических разрядов в коре. Кора мозга кошки; усилители постоянного тока [183].
I 1 мВ
| 20 мВ
5с
ЭКоГ (верхняя запись) и внутриклеточные потенциалы глиона (нижняя запись) при судо-рожных разрядах — при спонтанных и вызванных раздражением таламического ядра VL. Моменты нанесения стимулов обозначены точками внизу. 2 — мембранный потенциал покоя глиона 67 мВ, 2 — он снизился до 58 мВ»
верилось, деполяризационный пароксизмальный сдвиг, за которым следует гиперполяризация продолжительностью 100— 300 мс [1861. То же самое имеет место в гиппокампе (рис. 14.30). Видимо, нейроны мало причастны к происхождению длительных отрицательных сдвигов.
ZllmS 0.Z5 г
Рис.*14.30.^Электрические реакции нейрона и глиона гиппокампа во время Q судорожного разряда [90]. * ;
Верхняя запись — микроалектрод введен в гиппокампальный нейрон; электрическая реакция во время спонтанного судорожного разряда. Нижняя запись — микроэлектрод продвинут на 100 мкм и попал в глион; электрическая реакция во время спонтанного судорожного разряда. Отклонение наверх — положительность.
ГД во время отдельных судорожных разрядов является следствием аккумуляции ионов К+, выходящих из нейронов во время пароксизмальных деполяризационных сдвигов мембранного потенциала и высокочастотных потенциалов действия. По расчетам ГД с амплитудой 20 мВ возникает при повышении [К+ ]и до 6.3 мМ, если исходить изуравнения Нернста, или до 9.5 мМ, если исходить из кривой, полученной на основании специальных исследований на глионах коры [187].
При некоторой длительности стимуляции противоположного полушария (100/с) можно получить эпилептиформную электрическую активность в виде малого нли большого судорожного эпи
зода; ГД при этом длится в течение судорожного эпизода (рис. 14.31), а ее амплитуда пропорциональна исходному мембранному потенциалу. Амплитуда ГД достигала максимума (до 12 мВ при малом, до 30 мВ при большом судорожном эпизоде) за 2—5 с.
По прекращении судорожного эпизода ГД быстро спадала. У 8% глионов она переходила в глиальную гиперполяризацию [112] длительностью до 6 с при малом и до 110 с при большом эпизодах и амплитудой 1—9 мВ. Амплитуда глиальной гиперполяризации не^обнаруживала связи с мембранным потенциалом.
Рис. 14.31. Изменение мембранного потенциала коркового глиона во время приступа аспространяющейся эпилептической активности в коре мозга кошки [211].
Сверху — ЭКоГ» отводимая макроэлектродом; снизу — внутриклеточная эпилептическая реакция глиона, мембранный потенциал покоя 60 мВ; вертикальные черточки от пропускаемых через микроэлектрод толчков тона для определения входного сопротивления глиона.
Пик ее достигал максимума за 2.5 с по прекращении судорожного эпизода, длительность гиперполяризации была пропорциональна его интенсивности и длительности [211].
Глиальная гиперполяризация ассоциировалась с положитель ным сдвигом потенциала поверхности коры. Глионы в фокусе судорожной активности, испытывающие в период после судорожного эпизода гиперполяризацию, действуют как источник тока для менее поляризованных глионов на периферии, и таким образом генерируется положительный сдвиг потенциала поверхности коры [186]. Ни во время ГД, ни во время глиальной гиперполяризации не происходило изменения входного сопротивления глиона. Во время гиперполяризации амплитуда ГД, следующих синхронно с судорожными волнами ЭКоГ, увеличивалась [112]. Отмечается, что в гиппокампе после судорожного эпизода, во время которого глионы деполяризовались до 25 мВ, их гиперпо-ляризации не происходило [90].
После судорожного эпизода в нейронах развивается гипер-цоляризация длительностью 10—15 с, но глиальная гиперполя
ризация после судорожного эпизода длится много дольше. Эта постпароксизмальная гиперполяризация нейронов подобна таковой после тетанического раздражения нормальной коры; последнюю считают обусловленной деятельностью Na+-Hacoca [189]. Глиальная гиперполяризация может, как уже говорилось, являться или пассивным ответом глионов на снижение [К+]я ниже нормального уровня из-за резкого снижения активности нейронов после судорожной их активности или же быть проявлением деятельности электрогенного насоса глии, опосредованного К+ поглощения глионами ионов С1- [112]. При переходе к судорожной активности [К+ ]н повышается еще больше, чем при отдельных судорожных разрядах, достигая 10мМ,и, судя по ГД, остается на этом уровне; это значительно меньше той [К+ ]„ (19 мМ), которая достигается при интенсивном раздражении зрительного нерва протея.
При определении [К+ ]я с помощью калийселективного микроэлектрода во время распространяющейся судорожной активности в коре мозга ненаркотизированной кошки, вызванной транскаллозальным раздражением, оказалось, что она прямо связана с величиной активности (амплитуда X длительность); в период между судорожными эпизодами она составляла 4 мМ, во время распространяющейся судорожной активности она увеличивалась на 7 мМ, т. е. прямо измеренные величины [К+ ]я совпали с рассчитанными на основании мембранного потенциала глио нов [126].
На кураризированных кроликах при развитии судорожных потенциалов в последействии от электрического раздражения коры и во время судорожного эпизода [К+ ]н нарастала с 3.32 до 9—10 мМ и как бы фиксировалась на этом уровне. При этом было выяснено, что ни начало, ни окончание судорожной электрической активности не связано с определенным уровнем [К+ ] [971.
В опытах, где электрическим раздражением коры вызывалась сначала распространяющаяся депрессия, а по ее прекращении — судорожная активность, при отведении одного и того же пункта в толще коры и параллельном измерении [К+ ]п в этом пункте, было четко показано, что во время судорожной активности [К+ ]„ увеличивается много меньше, чем при распространяющейся депрессии, например на 8 и 50 мМ соответственно [207]. [К+]в, большая чем 10 мМ, регистрировалась при судорожной активности в коре, склонной к распространяющейся депрессии [117]. Пароксизмальные сдвиги мембранного потенциала нейронов обусловлены не ионами К+, а синаптической активностью, но прогрессирующее увеличение при этом [К+ ]и может быть причиной возникновения судорожного эпизода из-за прогрессирующего увеличения возбудимости [90]. Показательно, что увеличение [К+]и не является непосредственной причиной возникновения судорожной активности и — на основании вышесказанного — не является
причиной прекращения судорожного разряда: для этого требовалось бы прогрессивное нарастание [К+ ]в во время пароксизма.
На основании имеющихся данных нельзя с уверенностью дать ответ на вопрос, связано ли «плато» и тенденция [К+ ]н возвращаться к нулевой линии, несмотря на продолжающееся раздражение, с снижением выделения К+ в связи с подавлением генерации импульсов из-за повышенной [К+], или же это связано с активацией очистительного механизма, или же действуют вместе оба механизма [97, 166].
Ионы К+ должны входить в возбужденные до этого разветвления аксонов корковых нейронов и в их дендритные отростки; масса этих сплетений во много превышает массу тел нейронов. Показательно, во-первых, что дифенилгидантоин, стимулируя Na-, К-АТФазу и усиливая поглощение К+ гигантским аксоном, является эффективным противосудорожным веществом; во-вторых, что пресинаптические окончания из эпилептогенного очага поглощают К+ из среды в два раза слабее, чем в норме [93]. В процессе «очищения» межклеточных щелей от ионов К+ важная роль может принадлежать глионам; как уже говорилось, они способны поглощать К+ из окружающей среды при увеличении [К+ ]а.
Снижение способности глии устранять К+ из внеклеточного пространства рассматривается некоторыми авторами как важный фактор в развитии эпилепсии [182]. Действительно, в эпилептическом очаге, который развивался через 6 нед после инъекции в кору алюминиевой пасты, глионы обнаруживали ряд изменений. Входное сопротивление уменьшалось в 6 раз; постоянная времени мембраны глиона составляла в среднем 255 мс, т. е. была в два раза меньше, чем у нормальных глионов. «Эпилептический глион» при пропускании через его мембрану электрического тока до 6 нА реагировал только пассивными изменениями мембранного потенциала [105].
В то же время мембранный потенциал «эпилептических» глионов был нормальной величины [112]; в периоды между эпизодами эпилептической активности мембранный потенциал глионов достигал 105 мВ [186] (следствие гиперполяризации), и они отвечали ГД на раздражение коры. Величина глионов достигала 22 мкм при норме 7—10 мкм, количество соединяющих глионы щелевых контактов резко увеличивалось [105]. Обладая большим объемом цитоплазмы, «эпилептические» глионы содержат большее число митохондрий [112]; активность окислительных ферментов в них должна быть резко увеличенной [96]. В очаге эпилептического глиона число капилляров увеличено и они покрыты многочисленными ножками астроцитов. Все эти факты не подкрепляют предположение о дефектности глии в эпилептических очагах; наоборот, они свидетельствуют о повышенной активности глии, в "частности, о повышенных способностях глионов при эпилепсии «очищать» межклеточные щели при аккумуляции В йих ионов К+ [112, 105].
После нескольких секунд электрического раздражения коры мозга кролика около пункта раздражения может наступать прогрессивное ослабление электрической активности. Требуется 20— 60 с, чтобы развилась максимальная депрессия; восстановление нормальной картины электрической активности происходит примерно через 10 мин. Депрессия эта распространяется со скоростью 1—6 мм/мин на все полушария [155]; у кошки она распространяется обычно в пределах извилины. Она может быть легко вызвана аппликацией к коре раствора КС1 [71, 15].
При распространяющейся депрессии (РД) процесс угнетения электрической активности протекает параллельно со сдвигом потенциала поверхности коры, увеличением ее импеданса и дилатацией пиальных сосудов. Амплитуда отрицательного сдвига потенциала поверхности коры достигает 15 мВ, продолжительность 0.7-2 мин. Отрицательному сдвигу часто предшествует сравнительно кратковременное небольшое положительное отклонение; после отрицательного сдвига обычно регистрируется положительный — меньшей амплитуды и большей (2—5 мин) длительности [71]. Но в случае вызова этого явления проколом коры продолжительность отрицательного сдвига может превысить 5 мин [38]. Во время РД происходит увеличение [К+ ]и до 60 мМ, прямо измеренной калийселективным микроэлектродом [235, 207], и таким образом получила подкрепление гипотеза, согласно которой происхождение и распространение РД связаны с ионами К+ [108].
В опытах с внутриклеточной регистрацией электрических потенциалов глионов было установлено, что во время РД они деполяризуются (рис. 2.32) [133, 121, 122, 207]. Таким образом, получило подтверждение предположение о том, что отрицательный сдвиг потенциала поверхности коры при РД связан с нейроглией [103, 98, 119]. ГД может предшествовать глиальная гиперполяризация.
ГД при Р Д зависит от исходного мембранного потенциала глиона: чем он выше, тем быстрее развивается ГД и тем большей величины она достигает. Скорость ее развития составляет 0.36—2.8 мВ /с, ре-поляризация происходит в два раза медленнее. ГД может достичь 48 мВ [122]. ГД протекает параллельно с отрицательным сдвигом потенциала в коре около отводимого глиона и на поверхности коры (рис. 14.32), тогда как деполяризация нейронов не вполне соответствует этим регистрируемым внеклеточно сдвигам потенциала — в частности, наступает позже на 10—30 с. С другой стороны, как отрицательный сдвиг потенциала коры, так и ГД являются зеркальным отображением кривой изменения [К+ ]п [162, 207 ]. Итак, отрицательный сдвиг потенциала коры есть отражение ГД, обусловленной увеличением концентрации ионов К+ в межклеточных щелях, которая достигает величин, никогда не наблюдающихся ни в норме, ни даже при эпилептической актирцорти, ПолрщительцыЙ сдвиг, развивающийся после отрц,
дательного, вызван, надо полагать, снижением [1<+ ]п ниже исходного уровня [69]. При прямом измерении обнаружено, что [К+ ]и,
спадая, может действительно снижаться ниже начального уровня [207 ]. Поэтому в ряде случаев после ГД регистрировалась глиальная гиперполяризация [121 ]. В пользу глиального происхождения отрицательного сдвига потенциала говорит и отсутствие его реверсии в глубине коры; видимо, создается закрытое электрическое поле в глиальном синцитии [71]. Огромное увеличение [К+]д заставляет полагать, что оно обусловлено не только разря-
дами нейронов, поскольку даже при эпилептической активности мй [К+]и увеличивается только до -4-0 -10 мМ. В пользу этого свидетельствует и тот факт, что РД со -50 -всеми ее атрибутами возникает при глубоком барбитуровом нар- -60 -козе (200 мг/кг нембутала) [77], когда ЭКоГ сводится к нулевой -70 -линии, а также и то обстоятель-
но -
Рис. 14.32. Изменение мембранного потенциала корковых глионов во время медленно распространяющейся депрессии. Сенсомоторная
кора кролика. Микроэлектрод в глионе [122].
Распространяющаяся депрессия вызывалась введением в кору 0.03 мл раствора КС1. Сверху — глиальная деполяризация; снизу — внеклеточный потенциал.
ство, что ГД в этолг случае может предшествовать разряду нейронов [207 ]. Амплитуда отрицательного сдвига потенциала коры изменяется в связи с изменением температуры с (210, равным 1, т. е. возникновение его связано с физикохимическими по природе процессами; скорость распространения РД изменяется при изменении температуры с ()10, равным 3—4 [71]. Скорость распространения процесса составляет в среднем 65 мкм /с [38 ] — больше, чем скорость диффузии ионов К+, и меньше, чем скорость распространения активности посредством нервных импульсов.
РД может быть вызвана аппликацией КС1 (но не электрическим раздражением) в отравленной тетродотоксином области коры, где она распространяется в пределах этой области и отсюда в нормальную кору 1206, 207 ]. Мембранный потенциал глионов в отравленной тетродотоксином области коры не отличается от нормального. Скорость распространения отрицательного сдвига, его амплитуда и конфигурация тут варьируют, но могут быть такими же, как в нормальной коре. Соответственно отрицательному
сдвигу регистрируется деполяризация мембраны глионов; отрицательный сдвиг протекает параллельно с изменением [К+ ]к. В норме РД связана с нервными импульсами — и при прямом электрическом раздражении коры, и при раздражении противоположного полушария или подкорковых ядер и при аппликации глутамата и других веществ, и при аппликации KG1 — во всех этих случаях отрицательный сдвиг ассоциируется с разрядом нейронов. Но опыты с тетродотоксином указывают на то, что для возникновения и распространения РД возбуждение электрически возбудимых мембран не является необходимым условием. Этому выводу как будто противоречат данные, полученные в опытах с временной ишемиза-цией полоски коры шириной 5 мм, в результате которой происходит гибель нейронов при сохранности глионов: РД не распространяется через такую полоску коры 1128]. Видимо, для возникновения и распространения РД необходимо сохранение нормального анатомического соотношения между элементами коры, которое, очевидно, не нарушается в значительной мере при отравлении тетродотоксином, но нарушается при ишемии; тесное соседство элементов коры, наличие щелей шириной около 200 А являются анатомической предпосылкой возникновения РД.
В опытах на культуре глионов было обнаружено, что механические, электрические и химические (КС1) раздражения приводят к возникновению сдвига электрического потенциала между двумя сторонами эксплантата; это сопровождалось изменением импеданса: после кратковременного снижения происходило его длительное увеличение. Введение в питательную среду оубаина блокировало электрические изменения. В опытах на культуре нервной ткани, в которой имелись и глионы, и нейроны, к указанным двум изменениям присоединялась депрессия импульсной активности нейронов [2371.
Морфологические и цитохимические данные указывают на то, что во время РД происходит движение ионов Na+ и С1“ внутрь дендритов и глии: наблюдается набухание нейронов и олигодендроцитов, астроциты сморщиваются. Последнее может являться следствием перемещения цитоплазмы из тела в отростки [78]. С помощью хлорселективного электрода показано, что при РД в мозжечке во время отрицательного сдвига потенциала происходит уменьшение [С1~ ]и от исходного уровня 165 до 70—50 мМ [173].
Ионные ^процессы, лежащие в основе РД, не совсем ясны. По одним представлениям при РД ионы К+ выделяются и из нейронов, и из глионов [69, 237, 207 ]. С другой стороны, предполагается, что резкое увеличение [К+ ]н есть результат блокирования буферной функции глии, что под действием агента, вызывающего РД, происходит метаболический шок, выражением чего служит деполяризация глионов, которая возникает до начала изменения [К+ ]я [207 ] Но, как выше отмечалось, есть указания на то, что глиальной деполяризации предшествует ее гиперполяризация [122], положи
тельное отклонение перед отрицательным сдвигом [15], может быть, является отражением глиальной гиперполяризации на поверхности коры. Доказано, что процесс поглощения К+ из среды срезом мозга после электрического раздражения связан с использованием энергии метаболизма [691. В культуре глионов увеличение [К+]. приводит к увеличению потребления Оа [120]. Показательно, что при РД возникает «метаболический сигнал»: кривая флюоресценции, выражающая окисление НАД.Н, протекает параллельно отрицательному сдвигу (т. е. глиальной деполяризации) и кривой К+-потенциала [162]. Предполагается, что «метаболический сигнал» коры отражает окислительные процессы в митохондриях глионов.
Относительно механизма возникновения отрицательного сдвига потенциала поверхности коры и глиальной деполяризации, возникающих в отравленной тетродотоксином области коры при аппликации КС1, имеется следующее предположение: К+ деполяризует пресинаптические терминали, происходит усиленное выделение медиатора и выход К+ из нейронов [201 ]. В связи с этим следует отметить, что скорость распространения РД в сетчатке снижается при уменьшении Са++ в среде и процесс останавливается в бескальциевой среде [160]. Как известно, ионыСа++ необходимы для выделения медиатора в синапсах. К сожалению, пока еще не были предприняты опыты с внутриклеточной регистрацией электрической активности нейронов при РД в отравленном тетродотоксином участке коры.
По предположению Герца [119], ионы К+ активно переносятся глионами посредством Na-, К-АТФазы; перегрузка буферных возможностей глии приводит к накоплению К+ в межклеточных щелях и возникновению РД. В пользу этой возможности говорит факт возникновения РД при подавлении метаболизма и ионных насосов действием цианидов, оубаина и др. [71 ].
По аналогии с локальным потенциалом и потенциалом действия нервного волокна можно представить медленный отрицательный потенциал в прямом ответе коры и отрицательный сдвиг потенциала поверхности коры при РД родственными друг другу процессами: при достаточном (критическом) увеличении [К+ ]ж процесс становится неградуальным и начинает распространяться на большие расстояния без декремента. РД может быть вызвана проколами коры при диаметре прокалывающей пипетки 20 мкм и больше, критическим является прокол поверхностных слоев, так как прохождение затем пипетки через средние и глубокие слои не вызывает РД [38]. Можно думать, что разрушение расположенной на поверхности коры структуры толщиной 15 мкм, состоящей из нескольких слоев связанных между собой глионов [116], приводит к выходу ионов К+ из разрушенных глионов, что служит причиной возникновения РД.
На основании опытов, поставленных на культуре глионов, в которой вызывали аналог РД, было высказано предположение
43 Общая физиология нервной системы
673
о том, что глионы при деполяризации выделяют Х-вещество, деполяризирующее следующие глионы [201]. Может быть, этим веществом является глутамат, аппликация которого к коре может вызвать РД 171J. Интересно отметить, что в опытах с двумя изолированными сетчатками перфузат, притекающий от сетчатки-донора, претерпевающей РД, вызывал РД в сетчатке-реципиенте [161].
Увеличение импеданса при РД связывается, как говорилось, с сужением межклеточных щелей, которое, судя по опытам на культуре глии, может быть результатом изменений конфигурации глии при сокращениях глионов [237 ]. Интересно, что продолжительность сократительного процесса в глионах (см. гл. 1) сравнима с продолжительностью РД; фазу сокращения (в среднем 2.8 мин) и фазу расслабления (в среднем 11 мин) можно по длительности сопоставить с отрицательным и положительным сдвигами потенциала поверхности коры. На основании опытов с измерением импеданса коры во время РД было рассчитано, что сопротивление мембраны (7?и) глионов увеличивается [185], чему трудно дать объяснение, так как во время глиальной деполяризации, вызванной увеличением [К+ ]д, сопротивление глиальной мембраны не изменяется, а под действием ацетилхолина 7?и глиона увеличивается.
Причины дилатации пиальных сосудов при РД остаются невыясненными. Сосудистая реакция наступает спустя минуту и больше после начала изменения потенциала поверхности коры. Показано, что при увеличении [К+ ] в среде с 2.7 до 12.7 мМ происходит расслабление гладких мышц сосудов, что in vivo должно соответствовать вазодилатации [64]. Микроинъекция в кору мозга кошки раствора с [К] 5—12 мМ вызывает дилатацию пиальных сосудов в данном участке коры [10]. Можно думать, что вазодилатация при^РД возникает вследствие действия ионов К+, диффундирующих из коры к ее поверхности. Но можно предполагать, что глия участвует в происхождении сосудистого компонента РД. Кахаль [100] выдвинул гипотезу, согласно которой астроциты, сокращаясь, расширяют просвет капилляров и артерий, со стенками которых они связаны ножками. При увеличении концентрации К+ в среде усиливается двигательная активность глионов в культуре ткани коры мозга [45J. Можно думать, что увеличение [К+ ]п в поверхностных слоях области коры, захваченной РД, приводит к сокращению астроцитов, натягиванию их ножек и расширению сосудов, лежащих на поверхности коры.
14.3. НЕЙРОГЛИЯ И ДВИЖЕНИЕ ВЕЩЕСТВ В НЕРВНОЙ СИСТЕМЕ'
14.3.1. ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР
У пиявки и ряда других беспозвоночных — Апа-donta cygnea (коннектива), Limnaea stagnalis (ганглий), Mauduca sexta — не было обнаружено ни анатомического, ни функционального барьера между кровью (или омывающей жидкостью) и межклеточной жидкостью; межклеточные щели ограничены нервными и глиальными мембранами, их ширина 150—250 А. Движение ионов от наружного раствора в межклеточные щели, о котором судили по развитию деполяризации нервных волокон, происходит путем простой диффузии; время достижения диффундирующими ионами нервных элементов зависит от длины (извилистости) внеклеточных щелей — например, в коннективе Anadonta, где длина путей всего на 40% больше ее радиуса, обмен совершается за 1.2 мин, а в коннективе Mauduca, межклеточные щели которой много более извилисты, обмен происходит за 2.2 мин [193].
Показателем наличия и Деятельности гематоэнцефалического барьера (ГЭБ) является отличие состава диализата крови от состава цереброспинальной и межклеточной жидкостей [12, 23]. Так, белки, жирные кислоты и аминокислоты находятся в цереброспинальной жидкости в значительно меньшем количестве, чем в плазме крови; различия касаются и электролитного состава. Цереброспинальная жидкость сецернируется не только сосудистыми сплетениями, но и самим мозгом: стенками желудочков и пиальной субарахноидальной поверхностью — и состав ее отражает не только активность ГЭБ, но и метаболическую деятельность мозга [62]. Функционально ГЭБ должен рассматриваться как система, лимитирующая свободный обмен между кровью и мозгом, вернее, регулирующая состав внутренней среды мозга и сохраняющая ее постоянство: при резком повышении или снижении проницаемости ГЭБ нарушается процесс формирования и фиксации временных связей; постоянство внутренней среды является условием нормальной психической деятельности [23]. Жесткое сохранение постоянства ионного состава межклеточной жидкости в мозгу необходимо для проведения потенциалов действия в пресинаптические терминали и для синаптических процессов, столь чутко отзывающихся на изменения концентрации ионов в окружающей среде. ГЭБ, обеспечивающий не только избирательное прохождение химических веществ из коры в мозг, но и выведение из мозга в кровь, является сложным механизмом, который, как выяснено, подвергается регулирующим воздействиям со стороны нервной системы [23].
Множество фактов свидетельствует о том, что основным морфо-догическим субстратом ГЭБ является эндотелий сосудов мозга.
Мозговые капилляры отличаются от капилляров других органов: инъецированная в вену метиленовая синь не проникает в клетки и волокна мозга, но попадает в волокна периферической нервной системы. Окраска ткани мозга происходит только через некоторое время после смерти [102]. Мозговые капилляры состоят из эндотелия, базальной мембраны и астроцитарного «чехла». В связи с данными электронной микроскопии о покрытии глией большей части поверхности капилляров [29] некоторое время функцию ГЭБ стали целиком связывать с глией [87, 19].
Барьером для проникновения веществ из крови в цереброспинальную жидкость и межклеточную жидкость мозга служит эндотелий капилляров мозга. Клетки эндотелия соединены по всей окружности, межклеточные пространства закрыты, т. е. эндотелий капилляров является непрерывным барьером. Астроциты и эпендимальные глионы соединены между собой точечными контактами и не образуют, таким образом, сплошного барьера, что позволяет веществам диффундировать вокруг них. На рис. 14.33 схематически показано взаимоотношение между кровью, мозгом и цереброспинальной жидкостью у позвоночных. Межклеточные пространства между эндотелиальными клетками мозговых капилляров и между эпителиальными клетками сосудистого сплетения замкнуты благодаря соединению соседних клеток по всей окружности (zonulae occludentes); образующийся таким образом физический барьер препятствует выходу белковых молекул из крови и препятствует или замедляет выход меньших молекул [85]. Но те молекулы, которые способны пройти через стенки капилляров или сосудистого сплетения, могут далее диффундировать по водным межклеточным пространствам. Это касается молекул диаметром меньше 100 А, что доказано опытами с введением их в цереброспинальную жидкость.
Точечные щелевые контакты между глиальными или эпендимальными клетками не препятствуют диффузии через межклеточные щели. На рис. 14.34 взаимоотношения между кровью, цереброспинальной жидкостью и мозгом изображены полусхематически. Пунктирные линии проведены вдоль открытых для диффузии межклеточных щелей, соединяющих цереброспинальную жидкость в желудочке с поверхностью мозга. Контакты между астро цитами и между эпендимальными глиальными клетками не препятствуют диффузии; соединения эндотелиальных клеток капилляров и соединения эпителиальных клеток сосудистого сплетения желудочков представляют барьер для диффузии. Исследования с применением широкого спектра изотопов дали основание заключить, что проникновение в мозг из крови различных веществ происходит преимущественно через ^стенку капилляров в межклеточную жидкость мозга [23]. ' *
МЦВ «безбарьерных» участках мозга, например в area postrema, в plexus chorioideus, эндотелий капилляров пористый. С другой стороны, у акулы соединения между эндотелиальными клетками 676
открытого типа; предполагается, что роль ГЭБ тут играет глия, но не выяснено, образует ли она при этом сплошной барьер [154]. В онтогенезе появление ГЭБ совпадает с появлением в мозге у молодых животных мукополисахарида (гиалуроновой кислоты), образующего так называемое «основное вещество», за-
Рис. 14.33, Схематическое изображение структур, отделяющих кровь в капиллярах и цереброспинальную жидкость от нейронов в мозге позвоночных [76]. 1 — эндотелий; г — базальная мембрана; .3 — перикапиллярная глия; 4 — нейроны; S — субэпендимальная глия; 6 — эпендима; 1 — щелевые контакты; я — зоны замыкания; я — хориоидальный эпителий; 10 — соединительная ткань; 11 — хориоидальный эндотелий.
полняющее межклеточные щели, в выработке которого участвует глия [130, 23].
Разность потенциалов, измеряемая между поверхностью коры (и других отделов ц. н. с.) и кровью в яремной вене, составляет от —2 мВ до +3.5 мВ [218]. Она отражает, видимо, разность потенциалов по обе стороны эндотелия мозговых сосудов, обусловленную, вероятно, разной концентрацией ионов Н+ в крови и цереброспинальной межклеточной жидкости [243].
Было доказано, что 'при ацидозе и алкалозе частота дыхания регулируется концентрацией ионов Н+ в цереброспинальной жидкости, а не в плазме крови, и было сделано предположение
о том, что разница в концентрации ионов Н+ в цереброспинальной жидкости и плазме крови поддерживается работой насоса, расположенного в стенке капилляров.
Предполагается, что часть С02, образовавшегося при метаболизме нервных элементов ц. н. с., не диффундирует в кровь в виде
Рис. 14.34. Полусхсматическое изображение взаимоотношений между кровью, мозгом и цереброспинальной жидкостью в мозге мыши [68].
Л — отросток астроцита; С — хориоидальный эпителий; С$ — строма хориоидального сплетения; Е — эндотелий мозговых сосудов; ЕС — эндотелий сосудов хориоидального сплетения; Ер — эпендима; GJ — ягелевой контакт (gap junction); N — нейрон; Р — pia; S. CSF —• цереброспинальная жидкость в субарахноидальном пространстве; TJ ~ зона замыкания (tight junction); V. CSF — цереброспинальная жидкость желудочков. Жаркая стрелка показывает путь, которым вещества, проникшие через решетчатый эндотелий хориоидального сплетения, могут попасть в мозг.
молекулярного СО2, а соединяется с Н2О в присутствии угольной ангидразы; механизм локализован, вероятно, в периваскулярной глии. Затем Н+ и И СОТ обмениваются с СГ и Na+ плазмы крови, вода переходит осмотически в межклеточную жидкость; возможен и обмен Nat на К+ [217]. С этим представлением гармонирует то, что в глионах содержится в 6 раз больше угольной ангидразы, чем в нейронах, что в процесс калийзависимого поглощения ионов СГ вовлекается угольная ангидраза [140] и что в базальной мембране на поверхности отростков астроцитов чрезвычайно высока активность АТФазы [23],
Итак, основным морфологическим барьером между кровью и цереброспинальной жидкостью является эндотелий капилляров. Но ткань мозга всюду отделена от цереброспинальной жидкости — эпендимой желудочков, мягкой мозговой оболочкой и поверхностной глией (рис. 14.34). Имеются также данные о наличии барьерного механизма между резервуарами цереброспинальной жидкости и паренхимой 194 J, анатомическую основу которого могут составлять отростки астроцитов, образующие на поверхности коры слоистую структуру [184, 116]. Но в нервной системе протея электрофизиологическими методами не было получено фактов, которые свидетельствовали бы о наличии между цереброспинальной жидкостью и межклеточной жидкостью барьера, препятствующего свободной диффузии [76].
Предположению о том, что глиальные отростки «запечатывают» экстрацеллюлярное пространство вокруг синаптического комплекса, образуя синаптический барьер, предотвращающий диффузию медиатора [86, 87], противоречит то обстоятельство, что норадреналин, глицин, ГАМК могут проникать из внеклеточного пространства в синаптические щели; кроме того, передатчики могут выходить из синаптических щелей, поскольку они обнаруживаются в цереброспинальной жидкости [243]. В наружном коленчатом теле участки синаптических контактов с релейными нейронами окружены глиальными клетками, образующими «синаптические гломерулы»; резкие повышения [К+]н не нарушают тут синаптическую передачу [198]. Предполагается, что астроцитарные капсулы, окружающие некоторые синаптические комплексы, защищают их от влияния изменений [К+ ]я. Однако нет прямых данных, указывающих на то, что глиальные капсулы предотвращают или замедляют диффузию химических веществ в синаптические щели или из них.
В опытах с определением скорости блокирования возбуждения гигантского аксона кальмара тетродотоксином были получены факты, свидетельствующие о том, что шванновские клетки представляют барьер для свободной диффузии [139].
Итак, глия, видимо, не играет существенной роли в образовании барьера между кровью и цереброспинальной жидкостью. Имеются данные о том, что глия может замедлять диффузию катионов из цереброспинальной жидкости в мозг, может быть, из-за наличия фиксированных анионных зарядов на наружной поверхности мембраны глионов (см. ниже); не исключается, что имеющиеся в некоторых мозговых образованиях глиальные капсулы могут защитить участки синаптических контактов от влияния изменений состава межклеточной жидкости.
14.3.2. ВЙЁкЛЕЮЙЙОЁ ПРОСТРАНСТВО И ПУТИ ДВИЖЕНИЯ ИОНОВ И МОЛЕКУЛ В ТКАНИ МОЗГА
Расчеты, сделанные на основании данных, полученных при измерении импеданса, при применении изотопных методов и электронной микроскопии, указывают на величину внеклеточного пространства, которая составляет от 5—6 до 12—24% объема мозга [243], т. е. от 50 до 200 мл на 1 кг веса мозга.
Ширина межклеточных щелей в центральной нервной системе при обычной технике электронномикроскопических исследований составляет 150 — 200 А 1125]. Вероятно, процедура фиксации ткани приводит к асфиксии, к переходу ионов G1- и воды в дендриты и глию и к сужению межклеточных щелей. Если кора предварительно замораживалась, чтоб исключить асфиксию ьпри фиксации, то обнаруживались (в 1-м слое) более широкие межклеточные щели [220, 221].
Если иметь данные о количестве выделяющегося К+ из нервных элементов в щель и о увеличении [К+] в щели, то можно рассчи тать ширину щели:
Ширина щели
Количество К+, выделяющегося изаксона (М/сма), Увеличение концентрации К+ в щелях (М/см’) '
Волокна протея при однократном возбуждении освобождают, видимо, то же количество К+, что и немиелинизированяые волокна млекопитающих, а именно 1 пкМ/см2, а глион в зрительном нерве деполяризуется при этом на 3.1 мВ, что эквивалентно увеличению [К+ ]я в окружающем внеклеточном пространстве на 0.39 мМ. Отсюда ширина щели составляет 260 А [177]. Исходя из сходного принципа была рассчитана ширина щели, отделяющей гигантский аксон кальмара от шванновской клетки, и получена величина 150-300 А [51].
Межклеточные щели в центральной нервной системе, в частности в коре мозга, содержат, как уже говорилось, «основное вещество», красящееся на мукополисахариды, которые вырабатываются, по крайней мере частично, глиальными клетками: установлено, что клетки глиомы синтезируют гиалуроновую кислоту [130].
Возникает вопрос, открыты ли электрониомикроскопические щели для прохождения ионов и молекул, способны ли двигаться ионы и молекулы в лабиринте узких извитых щелей, содержащих плотное вещество, и если способны, то какова скорость движения.
Предполагалось, что вещества, попадая из крови в мозг, проникают к поверхности нейронов через окружающую их глию, черев которую, таким образом, должно было происходить быстрое и обратимое движение различных веществ. Однако в опытах 680
на ганглии пиявки была показана ошибочность этого предположения [172].
Микроэлектрод вводился в глион ганглия; при увеличении [К+ ] в омывающем растворе с 4 до 59 мМ мембранный потенциал падал, достигая нового уровня с £05=7 с; после замены раствора нормальным мембранный потенциал возвращался к исходному уровню с f0 5=21 с. Опыты были проведены с разными [К* ], и оказалось, что глион вел себя как калиевый электрод, т. е, мембранный потенциал подчинялся уравнению Нернста
Е~ ^o=-Fin
К4-**тест.
Крвягер.
При замене Na* сахарозой или холином мембранный потенциал глиона не изменялся. Эти факты доказывают, что Na, сахароза и холин не диффундировали через глиальную клетку. Во-первых, как раньше говорилось, мембрана глии малопроницаема ионами Na+, во-вторых, быстрый поток этих веществ в изотонической концентрации через глиальную цитоплазму привел бы к резкому изменению мембранного потенциала путем изменения внутренней концентрации К+. Эти опыты указывают также, что и ионы К+ диффундируют в этих условиях по межклеточным щелям, а не через цитоплазму глии. Предположение о том, что движение ионов Na+ и К+ может происходить через глию посредством активного их транспорта путем пиноцитоза было опровергнуто опытами с охлаждением ганглия до 1—4° G, вызывавшим остановку пиноцитоза, но не устранявшим и заметно не изменявшим эффектов, свидетельствующих о движении ионов. Итак, межклеточные щели в ц. н, с. пиявки являются эффективными путями движения ионов и молекул, происходящего с большой быстротой.
Ограничения диффузии для ионов К+ и Na+ по каналам шириной 150—200 А малы; для частиц сахарозы коэффициент диффузии составляет 0.82 от такового в свободном растворе — таким образом, время, требуемое для изменения концентрации вокруг нейронов, зависит от длины пути, а не от ширины щелей. Определенные с помощью электрофизиологической методики скорости диффузии через нервную систему пиявки оказались ниже рассчитанных теоретически; возможно, что фиксированные заряды в щелях или на ограничивающих их мембранах влияют на скорость диффузии (см. ниже). В случае коннектив и ганглиев пиявки расстояния от омывающего раствора до нервных элементов не превышают 25 мкм; такого же порядка расстояния отделяют нейроны в мозге у позвоночных от ближайшего капилляра [172]. Продвижению веществ по межклеточным щелям на большие расстояния — из цереброспинальной жидкости в желудочках и субарахноидальном пространстве в паренхиму мозга (рис. 2.34) — могут способствовать пульсирующие движения глиальных клеток, особенно олигодендроцитов,
Калийселективный микроэлектрод с диаметром порядка 10 000 А не может находиться в межклеточной щели, ширина которой почти на 2 порядка меньше; он будет находиться в области разрушенных нервных и глиальных элементов или в области, откуда «отодвинуты эти элементы», в «мертвом пространстве» порядка 10—15 мкм. Если коэффициент диффузии для ионов К+ D=1.85X 10-5 см2/с, то время для установления равновесия К+ при изменениях [К+ ] в окружающих неповрежденных участках мозговой ткани равно по расчетам всего 10—70 мс. В опытах, в которых в кору мозга кошки вводились микроэлектрод для ионофоретической инъекции К+ и на расстоянии до 40 мкм от него калийселективный микроэлектрод, было установлено, что ионы К+ могут перемещаться в ткани мозга путем свободной диффузии, т. е. с большей скоростью. Коэффициент диффузии составляет 1 /6 такого в свободном растворе. В такой же степени удлинены t0 5 нарастания и спада [К+ ]н. Это обусловлено узостью и извилистостью межклеточных щелей [159, 94],
Электрическое сопротивление межклеточных щелей, видимо, небольшое; если отводящий микроэлектрод находился в ганглии пиявки, занимая внеклеточную позицию, а рядом пропускался ток через другой микроэлектрод, то при токе порядка 10~8 А регистрировались небольшие изменения потенциала — всего 0.1—0.2 мВ [150]. Токи, используемые для измерения импеданса мозга, переносятся главным образом внеклеточными ионами [220]; удельное сопротивление коры мозга (208—256 Омсм) определяется площадью поперечного сечения межклеточного пространства, Предполагается также возможность движения токов через глию на основании данных о сравнительно низком удельном сопротивлении глиальной мембраны. Движение электрического тока в межклеточных щелях может в значительной степени зависеть от ионных зарядов макромолекул заполняющего их вещества [59].
14.3.3. ИОННЫЙ СОСТАВ жидкости МЕЖКЛЕТОЧНЫХ ЩЕЛЕЙ
Межклеточная жидкость, заполняющая межклеточные щели, не может прямо быть подвергнута химическому анализу. Вместе с тем вопрос о ее химическом составе представляет особый интерес в связи с тем, что ионное окружение нейронов должно, как уже говорилось, влиять на синаптические процессы и на возникновение и проведение нервных импульсов. Это касается содер^-жания в щелях ионов К+. Предполагалось, что состав жидкости в межклеточных щелях отличается от состава переброспиняльттой жидкости из-за деятельности глионов. Но в нервной системе пиявки глиальные клетки не изменяют содержания К+ и Na+ в межклеточной жидкости. Так, мембранный потенциал и потенциалы действия нейрона ганглия пиявки совершенно одинаковы до и после удаления окружающей его глиальной цитоплазмы. При одновре^-332
менной регистрации мембранного Потенциала нейрона ганглия пиявки in situ и нейрона того же ганглия в участке, где часть капсулы была вскрыта, т. е. в условиях соприкосновения его с омывающей жидкостью, оказалось, что оба нейрона одинаково изменяли мембранный потенциал при изменении [К+ ]и. Единственное отличие состояло в том, что нарастание и спад деполяризации в последнем случае происходили быстрее. При изменениях [Na+ ]н потенциалы действия обоих нейронов изменялись одинаково, что указывает на то, что вокруг них имеется одинаковая концентрация Na+ [172].
Метод использования глиальной мембраны для измерения [К+]н оказался столь чувствительным, что удалось определить [К+] в межклеточных щелях. Если протея выдерживать в воде с повышенным содержанием К+, то в крови [К+ ] повышается до 8.8 мМ (при норме 2,1 мМ), а в цереброспинальной жидкости до 4.1 мМ (норма 1.9 мМ). Глиальные клетки в зрительном нерве изменяют при этом мембранный потенциал в точном соответствии с изменениями [К+ ] в цереброспинальной жидкости (мембранный потенциал мышечных волокон изменяется соответственно [К+ ] крови). На этом основании был сделан вывод о том, что межклеточная жидкость вокруг аксонов и глиальных клеток в зрительном нерве имеет то же содержание К+, что и цереброспинальная жидкость [76]. Это, видимо, относится и к мозгу теплокровных: измерения [К+]н в коре мозга кошки, кролика, крысы с помощью калийселективного микроэлектрода дали величины около 3 мМ — чрезвычайно близкие к [К+ ] в цереброспинальной жидкости [235, 159]. Естественно, что когда в данной точке коры в связи с возбуждением тут нейронов происходит увеличение [К+ ] в щелях, то какое-то время [К+ ]Е тут будет выше, чем [К+ ]я в соседних участках коры и чем [К+] в цереброспинальной жидкости. В исследованиях на теплокровных было показано, что концентрация некоторых веществ в цереброспинальной жидкости может отличаться от их содержания в мозговой ткани [23 ]. С одной стороны, это может быть связано с тем, что главным путем поступления веществ из крови в мозг являются кровеносные сосуды мозга, а не цереброспинальная жидкость. С другой стороны, видимо, глионы участвуют в регуляции состава непосредственной микросреды нейронов [70], в поддержании гомеостаза мозга [225].
В межклеточных щелях ткани мозга плазматические мембраны нейронов и глионов соединены посредством межклеточного пространства, в которое проецирует анионные головки ганглиозидов, гликопротеинов и мукополисахаридов; последние преобладают на поверхности глиальных мембран [130]. С этими группами могут связываться одно- и двухвалентные катионы и вода. Фермент гиалуронидаза, катализирующий гидролиз гиалуроновой кислоты (кислого мукополисахарида), при введении его в желудочки вызывает снижение импеданса перивентрикулярных мозговых структур [59]. Наличие в межклеточных щелях макромолекул, способных
связывать ионы, особенно Са++, будет существенно влиять На перемещение ионов [55]. Триада, мембрана нейрона—межклеточное вещество—мембрана глиона рассматривается как некое функциональное единство [56].
Астроциты, которые играют важную роль в процессах перераспределения воды и С1- [96], вероятно, участвуют и в перераспределении Са++: белок S-100, который локализуется преимущественно в астроцитах, обладает способностью избирательно связывать Са++ [222].
14.4. О ТРОФИЧЕСКОЙ ФУНКЦИИ ГЛИИ
Уже в прошлом столетии допускали, что глия обеспечивает нейроны питательными веществами, но сведения о трофической функции глии и в настоящее время фрагментарны. Л. А. Ор-бели в 1932 г. предположил, что между шванновскими клетками и аксоном существуют какие-то интимные взаимоотношения, несомненно химические [27 ]. У рака аксон 100 дней после перерезки сохраняет возбудимость и выделяет передатчик, что объясняют тем, что питательные вещества продолжают поступать из окружающих шванновских клеток [130]. Такое же объяснение можно дать тому факту, что после энуклеации глаза у лягушки безмиелиновые волокна зрительного нерва не дегенерируют по крайней мере 100 дней [24]. Если аксон сохраняет связь с сомой нейрона, разрушение окружающей глии долгое время не отражается на его функции. Так, после отрыва слоя шванновских клеток от гигантского аксона кальмара, разрушения глии вокруг аксонов и нейронов пиявки [148], а также вокруг нервных волокон коннективы Anadonta [193] импульсная активность в течение длительного периода наблюдений не нарушается.
В области перехвата Ранвье отростки шванновской клетки отделены от мембраны аксона щелью всего в 50 А и чрезвычайно богаты митохондриями [153]. На этом основании предполагается, что отростки шванновской клетки поставляют энергию, требуемую натриевым насосом в области перехвата. Исходя из этого посттетаническая депрессия демиелинизированных аксонов объясняется аккумуляцией ими ионов Na+ при длительной импульсной активности [190].
Но вопрос о механизме трофического действия шванновских клеток далек до разрешения. После интраперитонеальной инъекции меченой аминокислоты у тритона она сначала обнаруживается в Шванновской клетке, потом в миелиновой оболочке и, наконец, в аксоплазме [130]. Может быть, вещества проникают из шванновских' клеток к аксоплазме через насечки Шмидта—Лантермана. Этому могут способствовать пульсирующие движения шванновских клеток [92].
В ганглии насекомых нет циркуляции гемолимфы — видимо, глиальные инвагинации являются механизмом, посредством кото
рого вещества поступают в нейроны. У таракана распространение глиальных инвагинаций совпадает с распределением гликогена; после голодания зерна гликогена уменьшаются, после еды — вновь появляются [130].
Как говорилось, после денервации мышцы шванновские клетки в области нервно-мышечных соединений начинают выделять порции ацетилхолина. Внутрибрюшинное введение актиномицина— вещества, блокирующего синтез РНК, — предотвращало выделение ацетилхолина шванновскими клетками. Предполагается, что дегенерация нервных окончаний индуцирует в шванновских клетках синтез РНК, связанной с процессами синтеза и выделения ацетилхолина [63].
В опытах с ионтофоретической инъекцией посредством микроэлектрода меченых аминокислот (3Н-глицина и 3Н-лейцина) в глион ганглия пиявки происходила их быстрая инкорпорация в цитоплазму нейронов (клетки Ретциуса). Это показывает, что глионы способны выделять аминокислоты в межклеточные щели, откуда они проникают в соседствующие нейроны [104]. Есть указания на то, что глионы секретируют белки в окружающую их среду [194] — в частности, молекулы фактора роста. В культуре ткани только нейроны, окруженные глией, могут быть культивированы на значительный период времени [33]. При культивировании эмбриональной ткани головного мозга нейроны раньше и интенсивнее развивались при посеве на слой астробластов, чем на слой других клеток — менингиальных или фибробластов. Введение глиальных клеток в культуру диссоциированных нервных клеток индуцировало ее морфологическую дифференциацию и заменяло введение нервного фактора роста [223, 165]. Было высказано предположение, что глия может быть эндогенным источником нервного фактора роста для нейронов не только in vitro, но и in vivo [223].
Стимулом для выделения глионами веществ может быть аккумуляция в межклеточных щелях ионов К+ при возбуждении нейронов и деполяризация мембраны глиона, происходящая при увеличении [КЛ]Н [148, 222]. Фриде [96] считает, что олигодендроциты поддерживают нормальный метаболизм нейронов на всем их протяжении; он исходит при этом из найденной им корреляции между длиной аксона данного нейрона и количеством его клеток-сателлитов. Размер перикариона клетки Пуркинье увеличивается с увеличением величины животного (мышь — кролик — лошадь), но отношение массы аксоплазмы к перикариону значительно больше у крупных нейронов, чем у малых, в связи с чем увеличивается метаболическая потребность перикариона; это усугубляется большей длиной и ветвлением дендритов у крупных клеток. Количество глиальных клеток, связанных с перика-рионом, увеличивается с увеличением длины аксона в линейном отношении [96, 130].
14.5. НЕЙРОГЛИЯ И НЕРВНАЯ ДЕЯТЕЛЬНОСТЬ
Имеются многочисленные данные, часть которых была приведена в § 1 главы 13, об увеличении числа клеток нейроглии вокруг функционирующих нейронов, увеличении числа сателлитов, т. е. тел глионов, примыкающих к нейрону. Явление это особенно хорошо изучено на симпатическом ганглии и в спинном мозге. В верхнем шейном симпатическом ганглии кошки — в связи с раздражением преганглионарных волокон в течение более 30 мин — методом авторадиографии установлено увеличение числа сателлитов; последние ассоциировались в большинстве случаев с нейронами, обнаруживавшими признаки высокой метаболической активности. При этом не было получено Никаких указаний на митотическое деление глионов. После введения М-холинолитика электрическое раздражение преганглионарных волокон не вызывало этой реакции, т. е. для ее возникновения необходимо было интенсивное возбуждение нейронов [195, 196].
Структурная перестройка нейроглии в активированном спинальном нервном центре крысы [9] закономерно проявлялась в увеличении числа перинейрональных сателлитов у мотонейронов. Такая реакция глии возникала в ответ на генерацию нейронами одних только потенциалов действия (антидромная стимуляция мотонейронов на фопе снятия постсинаптического торможения столбнячным токсином). Дополнительное включение возбуждающего синаптического действия (ортодромная стимуляция мотонейронов после угнетения постсинаптического торможения столбнячным токсином) усиливало эти структурные изменения. Постсинаптическое торможение (раздражение гигантоклеточного ядра ретикулярной формации) не приводило к увеличению числа сателлитов. Возрастание числа перинейрональных сателлитов следует связать с вызванными генерацией ВПСП и потенциалов действия сдвигами концентрации ионов в перинейрональной среде — очевидно, в первую очередь с увеличением [К+]н. Опыты на симпатическом ганглии с атропином и опыты с вызовом ТПСП в спинном мозге указывают на то, что для возникновения рассматриваемой глиальной реакции недостаточно только возбуждения пресинаптических волокон.
Специальное исследование с подсчетом общего количества глиальных элементов в активированном (разными указанными способами) центре позволило установить, что состав перинейрональных сателлитов не может пополняться за счет деления глиальных элементов или же миграции их из соседних отделов мозга.
Наиболее вероятный механизм увеличения числа перинейрональных сателлитов должен заключаться в том, что в активированном нервном центре глионы, которые располагали? е, ранее вдали от тел функционирующих нейронов, перемещаются ио направлению к ним и вступают с ними в непосредственный контакт. Очевидно, при формировании контакта добавочных сателлитов 686
с телом нейрона освобождается та часть его поверхности, к которой прилегали прежде отростки глионов [9]. Увеличение числа сателлитов обнаружено в наружном коленчатом теле и зрительной области коры мозга крыс при световой стимуляции [6]. В опытах на кошках под легким нембуталовым наркозом раздражение внутреннего коленчатого тела, вызывавшее в слуховой проекционной области коры первичные ответы по ритму стимуляции (ЗО^с) с отрицательной фазой большой амплитуды, приводило к цитологическим изменениям сомы нейронов слуховой коры и к появлению у тела почти каждого нейрона 1—5 глиальных ядер [53]. Так как возникновение отрицательной фазы первичного ответа предполагает разряд корковых нейронов [34], то и эти опыты свидетельствуют об увеличении числа сателлитов в связи с усиленной импульсной активностью нейронов. Если в симпатическом ганглии это явление выявлялось после 30 мин стимуляции преганглионарных волокон, то в коре мозга требовалось менее полминуты раздражения специфических афферентов. Можно думать, что в ц. н. с., именно в коре мозга, олигодендроциты более реактивны.
Увеличение числа сателлитов в коре мозга наблюдалось в результате прямого эпикортикального электрического раздражения [44]. Реакция коры мозга на поляризацию (анод на поверхности, 2 мкА) выражалась, в частности, в увеличении числа сателлитов; число глионов, прилегающих к пирамидным нейронам, возрастало на 37%, прилежащих к промежуточным — на 104%; даже через 75 мин после окончания поляризации число сателлитов оставалось повышенным [28]. Число сателлитов увеличивалось в двигательной области коры у собак после многократного условнорефлекторного сгибания лапы [19].
Наконец, следует отметить, что во время глубокого барбитурового наркоза в коре мозга кошки наблюдалось увеличение количества сателлитов — от 1 до 5 у каждого нейрона [13]. Этот факт как будто противоречит приведенным выше данным, поскольку при глубоком наркозе нейронная активность ослабевает; значение его еще не выяснено.
Еще Кахаль указывал па то, что глиальные клетки, — видимо, олигодендроциты — обладают структурой ядра, указывающей на способность подвергаться митозу. Результаты исследования, произведенного на взрослых крысах, которым инъецировался 3Н-тимидия с последующей авторадиографией, свидетельствуют о том, что в мозге все время имеет место низкая митотическая активность. Сравнительно малая величина меченых ядер указывает на то, что это олигодендроциты или их спонгобластические предшественники. Парные меченые ядра оказывались иногда иа расстоянии 80 мкм, что указывает на большую скорость миграции клеток после митоза. Итак, в мозге взрослых крыс происходит постоянное митотическое деление глиальных клеток, в основном олигодендроцитов [79].
Дегидратация у крыс приводила к глиальной пролиферации только в тех участках, в частности в nucl. supraopt., которые на основании других исследований раздражаются при дегидратации 1169]. У мышей в первой стадии голодания в вентромедиальном ядре гипоталамуса, где на основании физиологических исследований локализуют «пищевой центр», наблюдались изменения содержания рибонуклеопротеидов и гликогена в нейронах и пролиферация олигодендроцитов 152]. Итак, физиологическая стимуляция может индуцировать в данном нервном центре митоз олигодендроцитов.
У крыс, выращенных в условиях обогащенной среды (они могли свободно двигаться, общаться друг с другом, на них действовали разнообразные внешние раздражители), или у взрослых крыс после пребывания их некоторое время в условиях обогащенной среды увеличивается масса серого вещества коры мозга за счет увеличения количества глии [61 ]; общее количество глии может увеличиваться в зрительной области коры, главным образом в нижних слоях, на 25%. Пролиферируют, очевидно, недифференцированные клетки, развивающиеся затем в олигодендроциты; не было установлено, занимают ли эти клетки позицию сателлитов или связываются с нервными волокнами [88, 89]. По авторадиографическим исследованиям, в условиях обогащенной среды происходит усиленная миграция глиальных клеток из субэпендимного слоя бокового желудочка по волокнам корковой радиации в кору [60].
О механизме пролиферации глионов очень мало известно. В исследованиях на периферической нервной системе и культуре ткани нервных ганглиев выяснено, что, видимо, какое-то вещество, выделяющееся из аксонов, необходимо для стимуляции этого процесса. Так, дегенерация аксонов приводит к «реактивной» пролиферации глионов [222]; к этому же ведет раздавливание нервных волокон; особенно мощным фактором пролиферации шванновских клеток является наличие в их культуре растущих аксонов [246].
Таким образом, увеличение количества глионов-сателлитов при сравнительно кратковременной активации нервных центров происходит из-за дислокации клеточных тел; ее физиологическое значение может состоять в метаболическом обеспечивании усиленно функционирующих нейронов и в изменении геометрии межклеточного пространства. Пролиферация олигодендроцитов, происходящая при длительных воздействиях — жажде, голоде, пребывании в обогащенной внешней среде, — имеет в своей основе митоз глионов; физиологический смысл этой реакции, помимо вышеуказанного, может заключаться в увеличении возможности процесса миелинизации центральных аксонов и их терминалей.
Вопрос о роли нейроглии в механизме высшей нервной деятельности почти ’нс разработан экспериментально; имеются, однако, интересные теоретические соображения. Предполагается, 688
что нейроглии генетически свойственно программировать деятельность нейронов (выражением чего служат врожденные и приобретенные поведенческие реакции), что нейроны в большой мере выполняют инструкции, получаемые от глии [98, 99]. Доказательство участия глии в обучении и хранении памяти усматривается в том, что у обученных крыс изменяется соотношение оснований РНК в глионах [129 ].
Мы видели, что изменения мембранного потенциала глионов, происходящие при изменениях [К+ ]я, являются интегральным выражением импульсной и синаптической активности нейронов, иначе говоря, глионы обладают большими возможностями интеграции синаптических, гуморальных и ионных влияний. Высказывается мысль о том, что значимое для организма событие, вызывающее длительную реверберацию импульсов в ансамблях нейронов, стимулирует перестройку активности окружающих их глионов; этим обеспечивается фиксация энграммы в виде модификации структур макромолекул, может быть из-за депрессии определенных участков ДНК [54] или изменения отношений в концентрации нейронной и глиальной РНК [30]. Особое значение придается ионным процессам, происходящим на поверхностях противостоящих глиальных и нейронных мембран [2], и в макромолекулах, заполняющих межклеточные щели [55, 59], Посредством этого жидкостного матрикса может осуществляться взаимодействие между нейронами и глионами. Триада нейроны—глия—межклеточное вещество выступает как единое целое по отношению к процессам, ведущим к накоплению информации, мерой которого могут быть изменения импеданса при научении [56].
Выше говорилось об изменениях в нейроно-глиальном комплексе в V слое коры мозга при поляризации анодом постоянного тока, в частности об увеличении числа глиальных сателлитов и длительном сдвиге в содержании РНК в промежуточных нейронах. Очаг этот обладает доминантными свойствами и был использован как модель для исследования краткосрочной памяти; делается вывод о том, что следовый процесс при поляризации обусловлен длительной активацией интернейронов коры и, возможно, глиальной реакцией [7 ].
Допускается, что глионы направляют конусы роста нервных волокон, чем определяется возникновение новых связей между нейронами, т, е, консолидация следов [30], и что рост и ветвление аксонов и дендритов, лежащие в основе обучения и памяти, регулируются глией: площадь мембран нервных элементов лимитируется каким-то образом глией и не может превысить некоторой критической величины [209].
G другой стороны, предполагается, что гибель бездействующих нейронов может быть своеобразным механизмом хранения информации и что в уничтожении бездействующих нейронов участвуют глионы [81]. С этим гармонирует как будто уменьшение числа
44 Общая физиология нервной системы
689
нейронов и увеличение числа глионов в зрительной области коры крыс, выращенных в обогащенной среде [88].
В основе замыкания временных связей лежат, согласно наиболее распространенной точке зрения, изменения в области синапсов, в результате которых «потенциальные» синапсы превращаются в эффективные. При анализе рассматривается корковый нейрон, на котором конвергируют импульсы от безусловного и условного раздражений. По гипотезе Гриффита [110], этот нейрон при «безусловном возбуждении» выделяет в синаптическую щель вещество F (нервный фактор роста?); при приходе импульсов «условного раздражения» выделяется другое вещество — Т-пе-реносчик, помогающий F пересечь щель; возбуждение неспецифических афферентов активизирует глиальные клетки, выделяющие вещество (тРНК?), способствующее вхождению F через мембрану в потенциальный синапс, в результате чего эффективность последнего увеличивается.
Согласно предложенной недавно глиальной гипотезе, в 'основе образования и укрепления временных связей лежит миелинизация центральных аксонов, возбуждающихся от условного раздражения [35]. При действии безусловного раздражения в соответствующих областях коры неминуемо происходит деполяризация глионов: возбуждение большого числа нервных элементов под действием импульсов из специфических и неспецифических путей приводит к аккумуляции в межклеточных щелях ионов К+. Постулируется, что деполяризация олигодендрицитов служит сигналом к образованию миелина; в пользу этого говорит тот факт, что в культуре ткани коры мозга при увеличении [К+ ] в питательной среде до 5 мМ и более усиливаются движения отростков олигодендрицитов и образовываются новые отростки [45]; далее полагается, что условием миелинизации является совпадение во времени деполяризации олигодендроцита (продолжающейся несколько секунд по прекращении раздражения) и физико-химических изменений в прилегающих аксонах после их предшествующего возбуждения (от действия условного раздражения), длящихся минуты. Миелинизация пресинаптических аксонов и волокон, образующих синапсы «по ходу», должна, видимо, приводить к увеличению надежности распространения возбуждения в пре-синаптические разветвления. При этом может происходить увеличение количества выделяющегося медиатора в синаптические щели из-за увеличения количества электричества в нервном импульсе, электротонически достигающем области расположения синаптических пузырьков. В то же время пресинаптические участки аксонов’могут оказаться защищенными от деполяризующего действия ионов К+, выделяющихся из окружающих нейронов при их усиленной активности. С этой гипотезой согласуются многие факты из области морфологии и биохимии глии: наличие в коре мозга миелинизированных пресинаптических участков аксонов [37]; увеличение массы глии в коре у крыс, выращенных
в обогащенной среде [88, 89]; увеличение числа сателлитов корковых нейронов в связи с выработкой условного рефлекса [19]; непрерывно продолжающееся увеличение количества миелина в мозге от рождения до старости [174]; тесная связь количества миелина в мозге со способностью к обучению [219]. Основные явления условнорефлекторной деятельности получают рациональное объяснение из этой глиальной гипотезы образования условных рефлексов [36, 37]. Исходя из этой гипотезы увеличение числа глиальных сателлитов при создании очага доминанты и при выработке условного рефлекса рассматривается как источник для увеличения количества миелинизированных аксонных окончаний [7]. Согласно гипотезе, нарушение миелинообразования должно вести к затруднению или невозможности выработки условных рефлексов [36]. С этой точки зрения были рассмотрены выявленные при электронномикроскопическом исследовании коры мозга деструктивные изменения в глии при экспериментальном неврозе у собак, механизм которого в некоторых случаях заключается в нарушении замыкательной деятельности коры [50].
Очевидно, дальнейший прогресс в решении основных проблем высшей нервной деятельности во многом зависит от разгадки функций глии.
ЛИТЕРАТУРА
1. Аладжалова Н. А. Медленные электрические процессы в головном мозге. М., 1962.
2. Аладжалова Н. А. Роль глиа-нейральных поверхностей раздела в механизме краткосрочной памяти. — 10-й съезд Всесоюз. физиол. о-ва им. И. П. Павлова. М., 1964, 2, № 1, с. 23—24.
3. Аршавский Ю. И., Беркинблит М. В., Ходоров В. И. Функциональные свойства нервной клетки и ее частей. — В кн.: Общая и частная физиология нервной системы. (Ред. П. Г. Костюк). В сер. «Руководство по физиологии». М.—Л., 1969, с. 37—72.
4. Беритов И. С. Общая физиология мышечной и нервной систем, 1. М., 1947.
5. Бобров А. В. Электрическое поле в коре больших полушарий при медленном компоненте ее прямого ответа. — Физиол. журн. СССР, 1971, 57, № 5, с. 656-664.
6. Бродовская Ф. А. Количественные изменения зрительного анализатора при функциональной деафферентации. — Журн. высш, нервн. деят., 1967, 17, № 3, с. 548—552.
7. Бразовская Ф. А., Павлыгина Р. 4. Изменение нейроно-глиального комплекса в двигательной коре кошки при стимуляции постоянным током. — В кн.: Электрическая активность головного мозга при образовании простых форм временной связи. (Ред. В. С. Русинов). М., 1972, с. 74—85.
8. Воронцов Д. С, Влияние стрихнина, гамма-аминомасляной кислоты, ацетилхолина и хинина на развитие физического электротона в нерве. — Физиол. журн. СССР, 1963, 49, № 5, с. 677—684.
9. Гейнисман Ю. Я. Структурные и метаболические проявления функции нейрона. М., 1974.
10. Дежчеико И. Т., Буров С. В., Дерий А. Н. О возможном участии ионов калия в регуляции местного мозгового кровотока. — Физиол. журн. СССР, 1975, 61, № 4, с, 577—584.
И. Жуковская II. М., Чайлахян Л. М. Изменение мембранного потенциала различных, типов клеток в культуре нервной ткани в зависимости от ионного состава наружной среды. I. Влияние ионов калия на мембранный потенциал. Внутриклеточная концентрация ионов калия. — Цитология, 1970, 12, № 10, с. 1248—1254.
12. Кассиль Г. Н. Гемато-энцефалический барьер и спинномозговая жидкость. — В кн.; Общая и частная физиология нервной системы. (Ред. П. Г. Коетюк). В сэр. «Руководство по физиологии». М.—Л., 1969, с. 175-192.
13. Клосовский Б, II., Кос.нарская Е. Н. Деятельное и тормозное состояние мозга. М., 1961.
14. Кокина Н. Н., Жуковская Н, М. Потенциалы покоя клеток различного типа в культуре нервной ткани. — Цитология, 1968, 10, № 8, стр. 953— 963.
15. Королева В. И., Кузнецова Г. Д, Свойства распространяющейся депрессии при создании в коре головного мозга крысы двух калийных очагов. В сб.: Электрическая активность головного мозга при образовании простых форм временной связи. (Ред. В. С. Русинов). М., 1972, с. 130—144.
16. Коетюк П. Г. Современные электрофизиологические исследования нервной клетки. — В кп.: Проблемы современной нейрофизиологии (ред. В. II. Черниговский). М.—Л., 1965, с, 5—36.
17. Коетюк И. Г. Медленные потенциалы в нервной системе некоторых беспозвоночных животных. — В кн.: Длительные электрические потенциалы нервной системы. (Ред. А. И. Ройтбак). Тбилиси, 1969, с. 15—33.
18. Кравченко В. Ф. К вопросу о нейроглиальном взаимодействии в зрительном нерве. — Ж. высш, первн. деят., 1971, 21, № 4, с. 867—868.
19. Купарадзе М. Р,, Костенко II. А. О пластических перестройках в коре головного мозга собаки при условном оборонительном рефлексе. — Гагр-ские беседы, 1972, 6, с. 341—347.
20. Лабори Г. Метаболические и фармакологические основы нейрофизиологии. М., 1974.
21. Лев А. А. Ионная избирательность клеточных мембран. Л., 1975.
22. Ливанов М. Н. Нейрокинетика. — В кп.: Проблемы современной нейрофизиологии. (Ред. В, Н. Черниговский). М-—Л., 1965, с. 37—72.
23. Майзелис М. Я. Гематоэнцефалический барьер и его регуляция. М., 1973. ;
24. Мантейфель Ю. Б. Вызванные потенциалы зрительного центра среднего мозга амфибий. М., 1974.
25. Микеладзе А. Л., Ройтбак А, И., Дзамоева Э. И. О контактах аксонных терминалей с олигодендроцитами в коре головного мозга. — ДАН СССР, 1971, 200, №,4, с. 970—972.
26. Окуджава В. М. Основные нейрофизиологические механизмы эпилептической активности. Тбилиси, 1969.
27. Орбели Л. А. Лекции ио физиологии нервной системы. Избр. труды. М„ 1962, 2, с. 470.
28. Павлыгина Р. А., Русинов В. С. Нейрофизиологические процессы в микроструктурах коры большого мозга при замыкании простых форм временной связи. — Ж. высш, нервн. деят., 1976, 26, № 1, с. 51—58.
29. Пастухов В. 4. Взаимоотношение капилляров и нейронов в различных образованиях головного мозга и мозжечка. — Физиол. ж. СССР, 1974, 60, № 9, с. 1423—1427.
30. Прибрам К. Языки мозга. М., 1975.
31. Ройтбак А. И. К вопросу о природе коркового торможения. — Ж. высш, нервн. деят», 1963, 13, № 5, с. 859—869.
32. Ройтбак А. И. Медленные отрицательные потенциалы коры и нейроглия. — В кп.: Современные проблемы физиологии и патологии нервной системы. (Ред. В. В. Парии). М., 1965, с. 68—92.
33. Ройтбак А. И. Современные данные и представления о функции нейроглии. — В кн.: Интегративная деятельность нервной системы в норме и патологии. (Ред. П, К. Анохин, А. М. Чернух). М., 1968, с. 79—96.
34. Ройтбак А. И. Природа электрической активности коры больших полушарий. ~~ В ки.: Общая и частная физиология нервной системы. (Ред. П. Г. Коетюк). В сер. «Руководство по физиологии». М.—Л., 1969, с. 455—480.
35. Ройтбак А, И. Гипотеза о механизме образования временных связей. — ДАН СССР, 1969, 187, № 5, с. 1205-1208.
36. Ройтбак А. И. Гипотеза о механизме образования временных связей при выработке условного рефлекса. Гагрские беседы. 1972, 6, с 274— 291.
37. Ройтбак А. И. Нейроглия и образование новых нервных связей в коре мозга. — В ки.: Механизмы формирования и торможения условных рефлексов. (Ред. В. С. Русинов). М., 1973, с. 82—94.
38. Ройтбак А. И., Бобров А. В. Медленно распространяющаяся депрессия при проколах коры. — ДАН СССР, 1975, 221, № 1, с. 251—254.
39. Ройтбак А. И., Бобров А. В. Изменения прямых ответов коры во время распространяющейся депрессии. — В кн.: Современные тенденции в нейрофизиологии. Л., 1977.
40. Ройтбак А. И., Бобров А. В., Кашакашвили Р. Л,, Липецко В, И., Микеладзе А. Л. О природе медленного отрицательного потенциала прямого ответа коры. — В кн.: Основные проблемы электрофизиологии головного мозга {ред. М. Н. Ливанов). М., 1974, с. 118—129.
41. Ройтбак А. И., Фанарджян В. В. Внутриклеточные потенциалы корковых глиальных клеток при электрическом раздражении коры. — ДАН СССР, 1973, 211, № 3, с. 748-751.
42. Ройтбак А. И., Фанарджян В. В. Анализ изменений мембранного потенциала глиальных клеток коры мозга при ее электрическом раздражении. — В кн.: Функции нейроглии. (Ред. А. И. Ройтбак). Тбилиси, 1979, с. 89-106.
43. Русинов В. С., Швец Т. Б., Эзрохи В. Л. Длительные электрические потенциалы в коре большого мозга и их функциональное значение. — В кн.: Длительные электрические потенциалы нервной системы. (Ред. А. И. Ройтбак). Тбилиси, 1969, с. 282—306.
44. Сванидзе И. К., Дидимова Е. В., Мусеридзе Д. П., Брегвадзе И. А., Шерешева Н. Б. Влияние функциональной активности на распределение РНК в пирамидных нейронах и нейроглии двигательной коры головного мозга. — В кн.: Вопросы биохимии нервной и мышечной систем. Тбилиси, 1972, 2, с. 5—27.
45. Сванидзе И. К., Ройтбак А. И., Дидимова Е. В. Влияние ионов калия на двигательную активность глиальных клеток коры мозга в условиях тканевой культуры. — ДАН СССР, 1973, 211, № 6, с. 1450—1452.
46. Соколов Е. Н. Природа фоновой ритмики коры больших полушарий. — В кн.: Основные вопросы электрофизиологии центральной нервной си* стемы. (Ред. А. Ф. Макарченко) Киев, 1962, с. 157—188,
47. Тасаки И. Проведение нервного импульса. М., 1957.
48. Тасаки И. Нервное возбуждение. М., 1971.
49, Фанарджян В. В., Ройтбак 4. И. Отрицательные сдвиги потенциала поверхности коры и гиперполяризация корковых нейронов при электрическом раздражении коры. — ДАН СССР, 1974, 218, № 5, с. 1253—1256.
50. Хананашвили М. М. Механизмы нормальной и патологической условно-рефлекторной деятельности. Л., 1972.
51. Ходжкин А. Нервный импульс. М., 1965.
52, Хусаинова И. С, Топография изменений нейроглии в головном мозге белых мышей при голодании. — Бюлл. эксп. биол. мед., 1968, 66, № 10, с. 109—111.
53. Чолокашвили Е. С. Изменение нервных клеток слуховой коры в связи с их деятельностью. — В кн.: Современные проблемы деятельности и строения центральной нервной системы. Тбилиси, 1965, с. 169—172.
54. Шелихов В. Н., Дергачев В. В., Полетаев А. Б., Наумова Т. С. О возможной роли нейроглии в деятельности нервной системы. — Усп. физиол. паук, 1975, 6, № 3, с. 90—109.
55. Эйди У. Р. Организация мозговых структур с точки зрения передачи и хранения информации. — В кн.: Современные проблемы электрофизиологии центральной нервной системы. (Ред. В. С. Русинов). М., 1967, с, 324—340.
56. Эйди В. Р. Клеточные механизмы и характеристики нервной системы при обработке информации. — В кн.: Системная организация физиологических функций. (Ред. В. В. Пария, А. М. Чернух). М., 1969, с. 219— 238.
57. Adey W. В. Evidence for cerebral membrane effects of calcium, derived from direct-current gradient, impedance and intracellular records. — Exp. Neurol., 1971, 30, N 1, p. 78—102.
58. Adey W. R, Biophysical and metabolic bases of cooling effects on cortical [[membrane potentials in the cat. — Exp. Neurol., 1974, 42, N 1, p. USES 140.
59. Adey W. R., Kado R. T., McIlwain J. T., Walter D. O. The role of neuronal elements in regional cerebral impedance changes in alerting, orienting and discriminative responses. — Exp. Neurol., 1966, 15, N 4, p. 490—510.
60. Altman J., GopalD. D. Autoradiographic examination of the effects of enriched environment on the rate of glial multiplication in the adult rat brain. — Nature, 1964, 204, N 4964, p. 1161—1163.
61. Bennett E. L., Rosenzweig M. R., KrechD., Diamond M. C. Further evidence for a relation between environmental complexity, learning ability and number of glial cells. — Physiologist, 1965, v. 8, N 3, p. 322.
62. Bering F. A. The cerebrospinal fluid and the extracellular fluid of the brain. — Fed. Proc,, 1974, 33, N 9, p. 2061—2063.
63. Bevan S., Miledi R., Grampp W. Induced transmitter release from Schwann cells and its suppression by actinomicin D. — Nature New Biology, 1973, 241, N 107, p. 85—86.
64. Biamino G., Wessel H.-J. Potassium induced relaxation of vascular smooth muscle: a possible mechanism of exercise hyperaemia. — Pfltig. Arch., я 1973, 343, N 2, p. 95-106.
65. Birks R., Katz B,, Miledi R. Physiological and structural changes at the amphibian myoneural junction in the course of nerve degeneration. — J. Physiol., 1960, 150, NJ, p. 145—168.
66. Bourke R. S., Tower D. B, Fluid compartmentation and electrolytes of cat cerebral cortex in vitro — II. Sodium, potassium and chloride of mature cerebral cortex. — J. Neurochem., 1966, 13, N 11, p. 1099—1117.
67. Bracho H., Orkand R. K. Neuron—glia interaction: dependence on temperature. — Brain Res., 1972, 36, N 2, p. 416—419.
68. Brightman M. W., Reese T. S. Junctions between intimately apposed cell membranes in the vertebrate brain. — J. Cell. Biol,, 1969, 40, N 3, p. 648— 677.
69. Brtnley F. /. Ion fluxes in the central nervous system. — Internal. Rev. Neurobiol., 1963, 5, p. 183—242.
70. Bunge R. P. Structure and function of neuroglia: some recent observations. — In: The Neurosciences. Second study program. Ed. F. O. Schmitt. New York, 1970, p. 782— 797.
71. Bures J., Buresova O., Krivanek J. The mechanism and application of Leao’s spreading depression of electroencephalographic activity. Prague, 1974.
72. Castellucci У. F., Goldring S. Contribution to steady potential shifts of slow depolarization in cells presumed tojae glia. — Electroenceph. Clin. Neurophysiol., 1970, 28, N 2, p. 109—118. г* u
73. Chang H.~T. Dendritic potential of cortical neurons produced by direct electrical stimulation of the cerebral cortex. — J. Neurophysiol., 1951, 14, N 1, p.' 1—21. » lj. t
74. Chang Л Hild W. Contractile responses to electrical stimulation of glial cells from the'mammalian central nervous system-Cultivated in vitro. — J. Cell. Comp. Physiol., 1959, 53, N 1, 139—151. т
75, Cohen M. W. The contribution by glial cells to surface recordings from the optic nerve of an amphibian. — J. Physiol., 1970, 210, N 3, p, 565— 580.
76. Cohen M. W., Gerschenfeld H., Kuffler S. W. Ionic environment of neurones and glial cells in the brain of an amphibian. — J. Physiol., 1968, 197, N 2, p. 363—380.
77. Collewifn H., Van Harreveld A. Membrane potential of cerebral cortical cells during spreading depression and asphyxia. — Exp. Neurol., 1966, 15, N 4, p. 425—436.
78, Collewifn H., Schade J. P. Changes in the size of astrocytes and oligodendrocytes during anoxia, hypothermia and spreading depression. Progress in Brain Research. Biology of Neuroglia. Ed. E. D. P. De Robertis. Amsterdam-London—New York, 1965, 15, p. 184—195.
79. Dalton M. M., Hommes О. R., Leblond С. P. Correlation of glial proliferation with age in the mouse brain. — J. Comp. Neurol., 1968, 134, N 4, p. 397—399.
80. Davis P. A. Impairment of repetitive impulse conduction in experimentally demyelinated and pressure-injured nerves. — J. Neurol., Neurosurg. Psychiat., 1972, 35, N 4, p. 537—544.
81. Dawkins R. Selective neurone death as a possible memory mechanism. — Nature, 1971, 229, N 5280, p. 118—119.
82. Dennis M. J., Gerschenfeld H. M, Some physiological properties of identified mammalian neuroglial cells. — J. Physiol., 1969, 203, N 1, p. 211—222.
83. Dennis M. J,, Miledi R. Electrically induced release of acetylcholine from denervated Schwann cells. — J. Physiol., 1974, 237, N 2, p. 431—452.
84. Dermietzel R. Junctions in the central nervous system of the cat. III. — Cell Tiss. Res., 1974, 149, N 1, p. 121—135.
85. Dermietzel R. Junctions in the central nervous system of the cat. IV. — Cell'Tiss. Res., 1975, 164, N 1, p. 45—62.
86. De Robertis E. D. P. Some new electron microscopical contributions to the biology of neuroglia. Progress in Brain Research. Biology of Neuroglia. Ed. E. D. P. De Robertis. Amsterdam—London—New York, 1965, 15, p. 1—11. it&
87. De Robertis E., Gerschenfeld H. M. Submicroscopic morphology and function of glial cells. — Internal. Rev. Neurohiol., 1961, 3, p. 1—65.
88. Diamond M. C., Krech D., Rosenzwelg M. R. The effects of an enriched environment on the histology of the rat cerebral cortex. — J. Comp. Neurol., 1964, 123, N 1, p. 111—119.
89. Diamond M. C., Law F., Rhodes H., Lindner B., Rosenzweig M. R. Increases in cortical depth and glia numbers in rats subjected to enriched environment. — J. Comp. Neurol., 1966, 128, N 1, p. 117—125.
90. Dichter M. 4., Herman Ch. J., Setzer M. Silent cells during interictal discharges and seizures in hippocampal penicillin foci. Evidence for the role of extracellular K+ in the transition from the interictal state to seizures. — Brain Res,, 1972, 48, compl., p. 173—183.
91. Elul R. The genesis of the EEG. — Intemat. Rev. Neurobiol., 1972, 15, p. 228—272.
92. Ernyei S., Young M. R. Pulsatile and myelin-forming activities of Schwann cells in vitro. — J. Physiol., 1966, 183, N 2, p. 469—480.
93. Eseueta A . V., Davidson D., Hartwig G., Reilly E. The freezing lesion. II. Potassium transport w ithin nerve terminate isolated from eliptogenic foci. — Brain Res., 1974, 78, N 2, p. 223—237. J
94. Fischer R. N., Pedley T. 4., Prince D. A. Kinetics of potassium movement in normal cortex. — Brain Res., 1976, 101, N’2, p. 223—237.
95. Frankenhaeuser B., Hodgkin A. L. The after-effects in impulses in the giant nerve fibres of Loligo. — J. Physiol., 1956, 131, N 2, p. 341—376.
96. Friede R. L. Enzyme histochemistry of neuroglia. Progress in Brain Research. Biology of Neuroglia. Ed. E. D. P. De Robertis. Amsterdam— _ ^London—New York, 1965, 15, p. 35—47.
97. *Futamachi K. J., Mutant R., Prince D. A. Potassium activity In rabbit cortex, — Brain Res., 1974, 75, N 1, p. 5—25.
98. Galambos R. A glia—neural theory of brain function. — Proc. Nat. Acad. Sci. USA, 1961, 47, p. 129-136.
99. Galambos В. Introductory discussion on glial function. - Progress tn Brain Res., 1965, 15, p. 267-277.
100. Galambos R. The glia-neuronal interaction: some observations. — J. psychiat. Res., 1971, 8, p. 219—224.
101. Gill T. H., Young О. M., Tower D. B. The uptake of 3,CI into astrocytes in tissue culture by a potassium-dependent, saturable process. — J. Neurochem., 1974, 23, N 6, p. 1011—1018.
102. Glees P. Neuroglia. Morphology and function. Ch. C. Thomas Publisher. Springfield—Illinois, 1955.
103. Glees P. The biology of the neuroglia: a summary. Biology of Neuroglia. Ed. W. F. Windle, publ. Ch. C. Thomas. Springfield, Illinois, 1958, p. 234-242.
104. Globus 4., Lux H. D., Schubert P. Transfer of amino acids between neuroglia cells and neurons in the leech ganglion. — Exp. Neurol., 1973, 40, N 1, p. 104—113.
105. Glotzner F. L. Membrane properties of neuroglia in epileptogenic gliosis. — Brain Res., 1973, 55, N 1, p. 159-171.
106. Godfraind J. M., Kawamura H., Krnjevic K., Pumain R, Actions of dinitrophenol and some other metabolic inhibitors on cortical neurones. — J. Physiol., 1971, 215, N 1, p. 199-222.
107. Goldring S., O'Leary J, L. Pharmacological dissolution of evoked cortical potentials. — Fed. Proc., 1960, 19, N 2, n. 612—618.
108. Grafstein B. Mechanism of spreading cortical depression. — J. Neurophy->iol., 1956, 19, N 1, p. 154—171.
109. Gray E. G. Axo-somatic and axo-dendritic synapses in the cerebral "cortex: an electron microscope study. — J. Anat. (London), 1959 , 93, N 4, p. 420—433.
110. Griffith J. S. A theory of thejnature of memory, — Nature, 1966, 211, N 5054, p. 1160—1163.
Ilf. Grossman R. G., Hampton T. Depolarization of cortical glial cells during electro-cortical activity. — Brain Res., 1968, 11, N 2, p. 316—324.
112. Grossman R. G., Rosman L. J. Intracellular potenttials of inexcitabe cells in epileptogenic cortex undergoing fibrillary gliosis after a local injuri. — Brain Res., 1971, 28, NJ!, p. 181—201.
113. Grossman R. G-, Whiteside L., Hampton T. L. The time course of evoked depolarization of cortical glial cells. — Brain Res., 1969, 14, N 2, p. 401— 415.
114. Hamprecht B., Kamper W., Amano T. Electrical response of glioma cells to acetylcholine. — Brain Res., 1976, 101, N 1, p. 129—135.
115, Hanawa L., Kuge K., Matsumura K. Effects of some common ions on the transretinal DC potential and the electroretinogram of the isolated frog retina. — Jap. J. Physiol., 1967, 17, N 1, p. 1—20.
116. Haug H. Die Membrana limitans gliae superficialis der Sehrinde der Katze. — Z. Zellforsh,, 1971, v. 115, N 1, S. 79—87.
117, Heinemann U., Lux H. D. Undershoots following stimulus-induced rises of extracellular potassium concentration in cerebral cortex of cat. — Brain Res., 1975, 93, N 1, p. 63—76.
118. Henn F. A., Haljamae H., Hamberger A. Glial cell function: active control of extracellular K+ concentration. — Brain Res., 1972, v. 43, N 2, p. 437—443.
119. Herts L. Possible role of neuroglia: a potassium-mediated neural—neuroglial—neuronal impulse transmission system. — Nature, 1965, 266, N 4989, p.-1091—1094.
120. Herts L., Dittmann, Mandel P. K+ induced stimulation of oxygen uptake in cultured cerebral glial cells. — Brain Res., 1973, 60, N 3, p. 517—520.
121, Higashida H., Mitarai G., Watanabe S. A comparative Study of membrane potential changes in neurons and neuroglial cells during spreading depression in the rat. — Brain Res., 1974, 65, N 3, p. 411—425.
122, Higashlda H., Miyake A., Tarao H., Watanabe S. Membrane potential changes of neuroglial cells during spreading depression in the rabbit. — Brain Res., 1971, 32, N 1, p. 207—211.
123. J77t/d.IV., Takanaka T., Walker F. Electrophysiological properties of epen-
131 dymal cells from the mammalian brain in tissue culture. — Exp. Neurol., 1965, 11, N 4, p. 493—501.
124ЛHild W., Tasaki I. Morphological and physiological properties of neurones and glial cells in tissue culture, — J. Neurophysiol., 1962, 25, N 2, p. 277— 304.
125. Horstmann E., Meves H. Die Feinstruktur des molekularen Rindengraues und ihre physiologische Bedeutung. — Z. Zellforsch., 1959, 49, S. 569— 604.
126. HotsonJ. R., SypertG. IP., Ward A. A. Extracellular potassium concentration changes during propagated seizures in neocortex. — Exp. Neurol,, 1973, 38, N 1, p. 20—26.
127. Hubbard J. 1., Llinas R., Quastel D. M. J. Electrophysiological analysis of synaptic transmission. Publ. E. Arnolds, London, 1969.
128. Hull C. D., Van Harreveld A. Absence of conduction of spreading depression through cortical regions damaged by asphyxiation. — Amer. J. Physiol., 1964, 207, N 4, p. 921-924.
129. Hyden H. RNA — a functional characteristic of the neuron and its glia. Brain Function. Vol. II. RNA and brain function. Memory and learning. Ed. M. A. B. Brazier. Berkeley—Los Angeles, 1964, p. 29—68.
130. Johnston P. W., Roots В. I. Nerve membranes. A study of the biological and chemical aspects of neuron-glia relationships. Oxford—New York— Toronto—Sydney—Braunschweig, 1972.
131. Kanno Y., Loewenstein IP. R. Low-resistance coupling between gland cells. Some observations on intercellular contact membranes and intercellular space. — Nature, 1964, 201, N 4915, p. 194—195.
132. Kanno У., Loewenstein W. R. Intercellular diffusion. — Science, 1964, 143, N 3609, p. 959—960.
133. Karahasht У., Goldring S. Intracellular potentials from «idle» cells in cerebral cortex of cat. — Electroenceph. Elin. Neurophysiol., 1966, 20, N 6, p. 600-607.
134. Karahasht У., Sheptak P., Moossy J., Goldring S. Intracellular potentials from experimental glial tumors. — Arch. Neurol., 1966, 15, N 5, p. 538— 540.
135. Keen P., Osborne R. H., Pehrson U. M. M. Respiration and metabolic compartmentation in brain slices from a glia-deficient mutant, the Jimpy mouse. — J. Physiol., 1976, 254, N 1, p. 22P—23P.
136. Kelly J. S., Krnjevic K., Somjen G. Divalent cations and electrical properties of cortical cells. — J. Neurobiol., 1969, 2, N 2, p. 197—208.
137. Kelly J. S., Krnjevic K,, Yim G. K. W. Unresponsive cells in cerebral cortex. — Brain Res., 1967, 6, N 4, p. 767—769.
138. Kelly J. P., Van Essen D. C. Cell structure and function in the visual cortex of the cat. — J. Physiol., 1974, 238, N 3, p. 515— 547.
139. Keynes R. D., Bezanilla F., Rojas E., Taylor R, E. The rate of action of tetrodotoxin on sodium conductance in the squid giant axon. — Phil. Trans. Soc. Ser. B, 1975, 270, N 908, p. 365—375.
140. Kimelberg H. K. Active potassium transport and [Na+, +K+] ATPase activity in cultured glioma and neuroblastoma cells. — J. Neurochem., 1974, 22, N 6, p. 971—976.
141. Knighton R. W. An electrically evoked slow potential of the frog’s retina. I. Properties of response. — J. Neurophysiol., 1975, 38, N 1, p. 185—197.
142, KornmUller A. E. Erregbarkeitssteuernde Elemente und Systeme des Nervensystems. — Fortschr. Neur. Psychiat., 1950, 18, N 8, p. 437—467.
143. Kornmdller A. E. Zum Wesen des EEG auf Grund spezieller. Untersu-chungen Congress of Neurological Sciences, Brussels, 1957, vol. III. EEG, Clinical Neurophysiology and Epilepsy. London—New York—Paris, 1959, p. 243-247.
144. Krnjevic К., Pumain. R., Renaud L. Effects of Ba2+ and tetraethylammo-nium on cortical neurons. — J. Physiol., 1971, 215, N 1, p. 223- 245.
145. Krnjevic K., Pumain R., Renaud L. The mechanism of excitation by acetylcholine in the cerebral cortex. — J. Physiol., 1971, 215, N 1, p. 247—268.
146. Krnjevic K., Schwartz S. Some properties of unresponsive cells in the cereb-ral cortex. — Exp. Brain Res., 1967, 3, N 4, p. 306—319.
147. Kuffler S. W. Studies on the physiology^of neuroglial cells. — In: Proc. 24 Internal. Congr. of Physiol. Sci. Abstf (Washington), 1968, 6, p. 79— 80.
148. Kufjler S. W., Nicholls J. G. The pyhsiology of neuroglial cells, — Erg. Physiol., 1966, 57, N 1, p. 1—90.
149. Kuffler S. W., Nicholls J. G., Orkand R. K. Physiological properties of glial cells in the central nervous system of amphibia. — J. Neurophysiol., 1966, 29, N 4, p. 768—787.
150. Kuffler S. W., Potter D. D. Glia in the leech central nervous system. Physiological properties and neuron-glia relationship. — J. Neurophysiol,, 1964, 27, N 2, p. 290-320.
151. Kukes G., De Vellis J., Elul R. A linked active transport system for Na+ and K+ in a glial cell line. — Brain Res., 1976, 104, N 1, p. 93—105.
152. Kukes G., Elul R., De Vellis J. The ionic basis of the membrane potential in a rat glial cell line. — Brain Res., 1976b, 104, N 1, p. 71—92.
153. Landon D. N., Langley О. K. The local chemical environment of nodes of Ranvier: a study of cation binding. — J. Anat., 1971, 108, N 3, p. 419— 432.
154. Lasansky A. Nervous function at the cellular level: glia. — Ann. Rev. Physiol., 1971, 33, p. 241—256.
155. Leao A. A. Spreading depression of activity in the cerebral cortex. — J. Neurophysiol., 1944, 7, N 6, p. 359—390.
loK^Lebovits R. M. A theoretical examination of ionic interactions between 'neural and non-neural membranes. — Biophys. J., 1970. 10, N 5, p, 423—444.
157. Lothman E., LaManna J., Cordingley G., Rosenthal M., Somjen G. Responses of electrical potential, potassium levels and oxidative metabolic activity of the cerebral neocortex of cats. — Brain Res., 1975, 88, N 1, p. 15—36.
158. Lothman E. W., Somjen G. G. Extracellular potassium activity, intracellular and extracellular potential responses in the spinal cord. — J. Physiol., 1975, 252, N 1, p. 115-136.
159. Lux H. D., Neher E. The equilibration time course of [K.+]o in cat cortex. — Exp. Brain Res., 1973, 17, N 2, p. 190—205.
160. Martines-Ferreira H., De Oliveira Castro G., Struchiner C, J., Rodrigues P. S. Circling spreading depression in isolated chick retina. — J. Neurophysiol., 1974, 37, N 4, p. 773—783.
161. Martines-Ferreira H., De Oliveira Castro G.t Struchiner C. J., Rodrigues P. S. Liberation of chemical factors during spreading depression in isolated retina. — J. Neurophysiol., 1974, 37, N 4, p. 785—791.
162. Mayevski A., Zeuthen Th., Chance B. Measurments of extracellular potassium, ECoG and pyridine nucleotide levels during cortical spreading depression in rats. — Brain Res., 1974, 76, N 2, p. 347—349.
163. McDonald W. I., Sears T. A. The effects of experimental demyelination on conduction in the central nervous system. — Brain, 1970, 93, N 3, p. 583—598.
164. Miller R..F., Dowling J. E. Intracellular responses of the Muller (glial) cells of mudpuppy retina: their relation to b-wave of the electroretinogram. J. Neurophysioi., 1970, 33, N 3, p. 323—341.
165. Monard D. Distinction between nerve growth factor and glial factor. — Nature, 1975, v. 258, N, p. 444—445.
166. Moody W. J., Futamachi K. J., Prince D. A. Extracellular potassium activity during epileptogenesis. — Exp. Neurol., 1974, 42, N 2, p. 248— 263.
167. Morales R,, Duncan. D. Specialized contacts of astrocytes with astrocytes and with other cell types in the spinal cord of the cat. — Anat. Rec., 1975, 182, N 2, p. 255—265.
168. Mugnatni E., Walberg F. Ultrastructure of neuroglia, — Erg. Anat. Entwicklungsgeschichte, 1964, 37, p. 193—236.
169. Murray M. Effects of dehydration on the rate of proliferation of hypothalamic neuroglial cells. — Exp. Neurol., 1968, 20, N 3, p. 460—468,
170. Mutant R,, Futamacki K. J., Prince D. A. Potassium activity in immature cortex. — Brain Res., 1974, 75, N 1, p. 27—39,
171. Nicholls J. G., Baylor D, A. The after-effects of nerve impulses on glial cells and integrative processes in leech ganglia. — Proc. 24 Internet. Congress of Physiological Sciences. Abstr. Washington, 1968, 6, p. 117— 118.
172. Nicholls J. G., Kuffler S. W. Extracellular space as a pathway for exchange between blood and neurons in central nervous system of leech. The ionic composition of glial cells and neurons. — J. Neurophysiol., 1964, 27, N 4, p. 645-673.
173. Nicholson Ch., Kraig R. P. Chloride and potassium changes measured during spreading depression in catfish cerebellum. — Brain Res., 1975, 96, N 2, p. 384-389.
174. Norton W. T., Poduslo S. E. Myelination in rat brain: changes in myelin composition during brain maturation. — J. Neurochem., 1973, 21, N 4, p. 759—773.
175. Orkand R. K. Neuroglial—neuronal interactions. In: Basic Mechanism of the Epilepsies. Boston, Little Brown, 1969, p. 737—746.
176. Orkand P. M., Bracha H., Orkand R. K. Glia] metabolism: alteration by potassium levels comparable to those during neural activity. — Brain Res., 1973, 55, N 2, p. 467—471.
177. Orkand R. K., Nicholls J. G., Kuffler 8. W. The effect of nerve impulses on the membrane potential of glial cells in the central nervous sustem of amphibia. — J. Neurophysiol., 1966, 29, N 4, p. 788—806.
178. Pape L. G., Katzman R. Response of glia in cat sensorimotor cortex to increased extracellular potassium. — Brain Res., 1972, 38, N 1, p. 71—92.
179. Pappas G. D., Asada У., Bennett M. V. L. Morphological correlates of increased coupling resistance at an electrotonic synapse. — J. Cell. Biol., 1971, 549, N 1, p. 173—188.
180. Peters A. Plasma membrane contacts in the central nervous system. — J. Anat., bond., 1962, 96, N 2, p. 237—248.
181. Pollen D. A. On the generation of neocortical potentials. In: Basic Mechanisms of the Epilepsies. Eds. H. H. Jasper, A. A, Ward Jr., A. Pope. Little Brown, Boston, 1969, p. 411—420.
182. Pollen D. A., Trachtenberg M. C. Neuroglia: gliosis and focal epilepsy. — Science, 1970, 167, N 3922, p. 1252—1253.
183. Prince D. A. Cortical cellular activities during cortically occuring inter-ictal epileptiform discharges. — Electroenceph. clin. Neurophysiol., 1971, 31, N 5, p. 469-484.
184. Ramsey H. J. Fine structure of the surface of the cerebral cortex of human brain. — J. Cell Biol., 1965, 26, N 2, p. 323—333.
185. Ranch J. B. Specific impedance of cerebral cortex during spreading depression, and an analysis of neuronal, neuroglial and interstitial contributions. — Exp. Neurol., 1964, 9, N 1, p. 1—16.
186. Ransom B. R. The behaviour of presumed glial cells during seizure dis-Lcharge in cat cerebral cortex. — Brain Res., 1974, 69, N 1, p. 83—99.
187. Ransom B. R., Goldring S. Ionic determination of membrane potential П of cells presumed to be glia in cerebral cortex of cat. — J. Neurophysiol., 1973a, 36, N 5, p. 855—868.
188. Ransom"B. R., Goldring 8. Slow depolarization in cells presumed to be glia in cerebral cortex of cat. — J. Neurophysiol., 1973b, 36, N 5, p. 869—
L. *878,
189. Hansom. В. R., Goldring S. Slow hyperpolarization in cells presumed to be m glia in cerebral cortex of cat. — J. Neurophysiol., 1973c, 36, N 5, p. 879— 892.
190. Rasminsky M., Sears T. A. Internodal conduction in undissected demyelinated nerve fibers. — J. Physiol., 1972, 227, N 2, p. 323—350.
191, Robertson D. M., Vogel F. S. Concentric lamination of glial processes in oligodendrogliomas. — J. Cell Biol., 1962, 15, N 2, p. 313—334.
192. Rose B., Loewenstein W. R. Permeability of cell junction depends on local cytoplasmic calcium activity. — Nature, 1975, 254, N , p. 250—252.
(93. Sattelle D. B., Howes E, A. The permeability to ions of the neural lamella and the extracellular spaces in the C. N. 8. of Anodonta cygnea. — J. Exp. Biol., 1975, 63, N 2, p. 421—431.
194. Schubert D. Protein secretion by clonic glial and neuronal cell lines. — Brain Res., 1973, 56, compl., p. 387—391.
195. Schwyn R. C. An autoradiographic study of satellite cells in automic ganglia. — Amer. J. Physiol., 1967, 121, N 3, p. 727—740.
196. Schwyn R., Hall J. Studies of neuroglial activity in autonomic ganglia during electrical stimulation and drug administration. — Anat, Rec., 1965, 151, N 3, p. 414.
197. Sidman R. L., Dickie M. M., Appel S. H. Mutant mice (Quaking and Jimpy) with deficient myelination in the central nervous system. — Science, 1964, 144, N 3626, p. 309-311.
198. Singer IF., Lux H. D. Presynaptic depolarization and extracellular potassium in the cat lateral geniculate nucleus. — Brain Res., 1973, 64, N 1, p. 17—33.
199. Singer Ж, Tretter F., Cynader M. The effect of reticular stimulation on spontaneous and evoked activity in the cat visual cortex. — Brain Res., 1976, 102, N 1, p. 71-90.
200. Somjen G. G. Evoked sustained focal potentials and membrane potential of neurons and of unresponsive cells of the spinal cord. — J. Neurophysiol., 1970, 33, N 4, p. 562—582.
201. Somjen G. G. Electrophysiology of neuroglia. — Ann. Rev. Physiol., 1975, 37, p. 163-190.
202. Somjen G. G., Lothman E, W. Potassium, sustained focal potential shifts, and dorsal root potentials of the mammalian spinal cord. — Brain Res., 1974, 69, N 1, p. 153—157.
203. Speckmann E. J. Neuere Ergebnisse zur Elektrophysiologie der Gliazel-len. — Hippokrates, 1973, 44, N 3, p. 324—326.
204. Spira M. E., Bennett M. V. L. Synaptic control of electrotonic coupling between neurons. — Brain Res., 1972, 37, N 2, p. 294—300.
205. Spira M. E., Klein M., Hochner B., Yarom Y., Caslel M. Ultrastructural changes accompanying the disturbances of neuromuscular transmission caused by Pardachirus toxin. — Neurosci., 1976, 1, N 2, p. 117—124.
206. Sugaya E., Karahashi Y., Sugaya A., Haruki F. Intra- and extra-cellular potentials from «idle» cells in cerebral cortex of cat. — Jap. J. Physiol., 1971, 21, N 2, p. 149—157.
207. Sugaya E., Takato M., Noda У. Neuronal and glial activity during spreading depression in cerebral cortex of cat. — J. Neurophysiol. 1975, 38, N 4, p. 824—841.
208. Svaetichin G., Negishi K,, Fatehchand R., Drujan B. D., Selvin de Testa A. Nervous function based on interactions between neuronal and non-neuro-nal elements. Progress in Brain Research. Biology of Neuroglia. Ed. E. D. P De Robertis. Amsterdam—London—New York, 1965, 15, p. 243—266.
209. Swallow R. J. A neuron-glial cell mod*51 deduced from neurological and psychological considerations. (Engineering in medicine and biology). — In.: Proc. 18th Ann. Conf. Philadelphia, 1965, p. 83.
210. Sykova E., Rothenberg S., Krekule I. Changes of extra-cellular potas-rtrsium concentration during spontaneous activity in the mesencephalic reticular formation of tjip ratt — Brain Res., 1974, 79, N_2, p. 333—337,
211. Sypert G. W., Ward 4. A. Unidentified neuroglia potentials during propagated seizures in neocortex. — Exp. Neurol., 1971, 33, N 2, p. 239—255.
212. Tasaki I. New measurments of capacity and resistance of myelin sheath and nodal membrane of isolated frog nerve fiber. — Amer. J. Physiol., 1955, 181, N 1, p. 639—650.
213. Tasaki I. Physiological properties of the myelin sheath and of the node of Ranvier. — Progress in neurobiol., 1959, 4, p. 159—172.
214. Tasaki I. Excitability of neurons and glial cells. Progress in Brain Research. Biology of Neuroglia. Ed. E. D. P. De Robertis. Amsterdam—London— New York, 1965, 15, p. 234—242.
215. Trachtenberg M- C., Kornblith, Hduptli J. Biophysical properties of cultured human glial cells. — Brain Res,, 1972, 38, N 2, p. 279—298.
216. Trachtenberg M. C., Pollen D. A, Nouroglia: biophysical properties and physiologic function. — Science, 1970, 167, N 3922, p. 1248—1252.
217. Tschirgi R. D. The blood—brain barrier. Biology of Neuroglia. Ed. W. F. Windle, publ. Ch. C. Thomas. Springfield, Illinois, 1958, p. 130— 138.
218. Tschirgi R, D., Taylor J. L. Slowly changing bioelectric potentials associated with the blood—brain barrier. — Amer. J. Physiol., 1958, 195, N 1, p. 7—22.
219. Tsukada Y., Nomura M., Nagai K., Kohsaka S., Matsutani T. Correlation between neurochemical changes and behavioral abnormalities on experimentally produced cerebral damaged rats. — 5th Internat. Meeting Internat, Soc. Neurochem., Barcelona, Spain. Abstracts, 1975, p. 487.
220. Van Harreveld 4., Crowell J., Malhotra S. K. A study of extracellular space in central nervous tissue by freeze-substitution. — J. Cell Biol,, 1965, 25, N 1, p. 117—137.
221. Van Harreveld A., Malhotra S. K., Khattab F. I. Changes in cerebral cortical extracellular space during asphyxiation and spreading depression. — Physiologist, 1966, 9, N 3, p. 311.
222. Varon S. Neurons and glia in neural cultures. — Exp. Neurol., 1975, 48, N 3, p. 93—134.
223. Varon Saier M. Culture techniques and glial-neuronal interrelationships in vitro. — Exp. Neurol., 1975, 48, N 3, p. 135—162.
224. Vatter O. Die Stromquellen von EEG und ERG, ihre Beziehungen zu Ein-zelzellentladung, Bestande-potential und Gewebs-impedanz. Biomed.
[Technik, 1972, 17, N 4, p. 137—157.
225. Vernadakis A. Neuronal-glial interactions during development and aging. — Fed. Proc., 1975, 34, N 1, p. 89—95.
226. Vernadakis A., Berni A. Changes in the resting membrane potentials of glial cells in culture. — Brain Res., 1973, 57, N 1, p. 223—228.
227. Villegas J. Axon-Schwann cell interaction in the squid nerve fibre, — J. Physiol., 1972, 225, N 2, p. 275—296.
228. Villegas J. Effects of tubocurarine and eserine on the axon-Schwann cell relationship in the squid nerve fibre. — J. Physiol., 1973, 232, N 1, p. 193—208.
229. Villegas Z, Effects of acetylcholine and carbamylcholine on the axon and Schwann cell electrical potentials in squid nerve fibre. — J. Physiol., 1974, 242, N 3, p. 647—659.
230. Villegas J. Characterization of acetylcholine receptors in the Schwann cell membrane of the squid nerve fibre. — J. Physiol., 1975, 249, N 3, p. 679—689.
231. Villegas J. Effects of cholinergic compounds on the axon-Schwann cell relationship in the squid nerve fibre. — Fed. Proc., 1975, 34, N 5, p. 137Q— 1373. r
232. Villegas J., Villegas R., Gimenez M. Nature of the Schwann cell electrical potential. Effects of external ionic concentrations and a cardiac glyco
— J, Gep. Physiol,f 51, N 1, p. 47—64,
233. Vyklicky L., Sykova E., Kriz N. Slow potentials induced by changes of extracellular potassium in the spinal cord of the cat. — Brain Res., 1975, 87, N 1, p. 77-80.
234. Vyklicky L., Sykova E., Kriz N., Ujec E. Post-stimulation changes of extracellular potassium concentration in the spinal cord of the rat. — Brain Res., 1972, 45, N 2, p. 608—611.
235. Vyskocil F., Kriz N., Bures J. Potassium-selective microelectrodes used for measuring the extracellular brain potassium during spreading depression and axonic depolarization in rats. — Brain Res., 1972, 39, N 1, p. 255-259.
236. Walker F. D., Hild TP. J. Neuroglia electrically coupled to neurons. — Science, 1969, 165, N 3888, p. 602—603.
237. Walker F. D-, Hild TP. Л Spreading depression in tissue culture. — J. Neurobiol., 1972, 3, N 3, p. 223—235.
* 238. Walker F. D., Takenaka T. Electric impedance of neuroglia in vitro. — Exp. Neurol., 1965, 11, N 3, p. 277—287.
239. Wardell W. M. «Dielectric breakdown» as a second mechanism of the electrical response of neuroglia. — J. PhyisoL, 1964, 175, N 1, p. 52—54P.
240. Wardell W. M. Electrical and pharmacological properties of mammalian neuroglial cells in tissue-culture. — Proc. Roy. Soc. Ser. B, 1966, 165, N 1000, p. 326—361.
241. Watanabe 5., Mitarai G., Takenaka S. The glial cell in the cerebral cortex of the cat. — In: Proc. 24 Internat. Congr. of Physiol. Sci. Abstr. (Washington), 1968, 7, p. 459.
242. Watson W. E. A quantitative study of some neuroglial responses to neuronal stimulation. — J. Physiol., 1972, 225, N 2, p. 54P—55P.
243. Watson W. E. Physiology of neuroglia. — Physiol. Rev., 1974, 54, N 2, p. 245—271.
244. Wttkovsky P. Peripheral mechanisms of vision. — Ann. Rev. Physiol., 1971, 33, p. 257—280.
245. Wttkovsky P., Dudek F. E., Ripps H. Slow PHI component of the carp electroretinogram. — J. Gen. Physiol., 1975, 65, N 2, p. 119—134.
246. Wood P. M., Bunge R. P. Evidence that sensory axons are mitogenic for Schwann cells. — Nature, 1975, 256, p. 662—664.
247. Zipser B., Crain S. M., Bornstein M. B. Directly evoked «paroxysmal» depolarizations of mouse hippocampal neurons in synaptically organized explants in long-term culture. — Brain Res., 1973, 60, N 3, p. 489—495.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Адаптация 92
— в зрительной системе 526
Аденилциклаза 491
Адреналин (эпинефрин) 222 -225, 231, 232, 235—239, 242, 263, 638
Адреноглия 538
Адренолитики 323
— ^-адренолитики 326 Аккомодация 88—92 — временная константа 88 — скорость 88, 89
Аконитин 61, 65, 83, 98
Аксолемма 25, 26
Аксоплазма 25
Актиномицин 644
— D 304
Аланин 383
Аминазин 295
Аминокислоты дикарбоксильные 363
Амины биогенные 239
Анестезин 81
Антибиотики транспортные 96
-- — налиномицин 96
— — грамицидин 96
— — нонактин 96
Антидепрессанты 499
Аппарат (комплекс) Гольджи, или ] пластинчатый комплекс 11, 12 548, 550, 554, 574, 585
Астробласты 571, 573
Астроциты 537, 538, 540—542, 547— 549, 555, 560, 564, 565, 567, 569, 571, 573, 575, 580—583, 590, 611, 684
АТФаза 649
— Na-, К-АТФаза 183—187, 189— 191, 203, 491, 492, 649, 650, 673
Ацетилхолин (АХ) 209—211, 224— 228, 243—248, 262, 263, 280, 283, 286, 296, 299—306, 308—310, 312—315, 318—330, 332, 335, 363—365, 383, 386, 392, 456, 457,
459—464, 467, 471, 474, 476, 479, 494, 498, 566, 623, 631, 638, 639, 642—644, 685
— идентификация 244
— — руководящие признаки 244
— распространение 245—248
— — чувствительность 455, 457— 459, 461, 463, 464, 467
Ацетилтрансфераза холина (ацетил-холинтрансфераза) 244, 245, 471, 473, 479
Ацетилхолинэстераза (АХЭ) 244, 455— 457 , 460, 471, 473, 491, 498
Барбитураты 81, 310
Барий 129, 139
Батрахотоксин (ВТХ) 61, 65, 83, 98
Ботулиновый токсин (ботулин) 323, 463, 467, 468, 475
а-Бунгаротоксин 324, 463, 474, 475, 639
Венкенбаха периодика 175
Верапамил 124, 125, 129, 135, 208, 292
Вератридин 61, 65, 79, 83, 133
Вещество, вагусное (Vagusstoff) 223, 224
— Ниссля 9, 10
— стимулирующее (Acceleranstoff) 223, 224
Винбластин 457
Возбудимость, нервного Гволокна 79-88
— период следового повышения, или супернормальность (экзальтация) 88
— повышение пфлюгеровское кат-электротопическое 83, 85
— снижение пфлюгеровское аи-электротоническое 84, 88
Возбуждение, постсинаптическое 348 — проведение, из миелинизированного волокна в безмякотную терминаль 165—167
— — по нервному волокну 155—159
— —.— функционально неоднородному 159—160, 167—171 ,
— — при ветвлении волокна 164, 165 „
— — при изменении диаметра волокна 160—164
— — серий импульсов 171—177
— — суммация, временная 350, 439
— — — пространственная 350, 439 — трансформация ритма 172—177 Волокно(а) нервное(ые), адренергические 225, 237, 238 •««
— — мембрана, кабельные (пассивные) свойства 66, 67
— — холинергические 225
Гамма-аминомасляная кислота (ГАМК) 247-253, 259, 263, 328, 329, 334, 335, 383—387, 474, 500, 638, 679
— идентификация 252
— — руководящие признаки 252
— распространение 252, 253
Гематоэнцефалический барьер (ГЭБ) 675-677
Гемихолиний 318, 455
Гидразин 104
Гидроксиламин 104
5-Гидрокситриптамин 211, 498, 500
Гиперполяризация посттетаническая (ПТГ) 204—206, 208
Гипотеза, Бернштейна 62, 63
— Бызова 436
— Герен 586, 589
— Гриффита 690
— квантовая 288
— квантово-везикулярная 287, 288
— кооперативного действия ионов кальция 316
— Коштоянца энзимо-химическая 264
— медиаторная 221—233
— Мича 125
— Ройтбака 554
Гистамин 258, 326
Глиапсы 629
Гликозиды сердечные 184, 186, 187
Глионы (глиальные клетки) 607— 623, 626, 627, 629—639, 640, 644— 655, 657—659, 662—674, 676, 679—681, 683—690
— биофизические характеристики 621—622
— мембранный потенциал 608—611, 637
— — — ионные основы 611—618 — электрическая связь между глионами 626—632
Глиобласты 560, 572, 573, 577
Глицин (гликоколль) 253—255, 263, 383—386, 474, 500, 679, 685
— идентификация_253, 254
— — руководящие признаки 254
— распространение 254, 255
Глия астроцитарная (макроглия, эктоглия) 540, 541
Гломерулы 35
Глутамат (L-глутаминовая кислота) 248—250, 259, 261, 263, 332-334, 364, 365, 383, 386, 638
— идентификация 249
— — руководящие признаки* 249
— распространение 249, 250
Гормоны^218, 219, 468,^471
Граянотоксин 65
Гуанидин 93, 94, 97, 98, 104, 291, 317
Д-600.129, 135, 292
ДДТ.61
Декарбоксилаза ароматических аминокислот 231, 242
Дендротоксины 364
Деполяризация глиальная (ГД) 633—636, 639, 641, 646, 650, 653, 662, 665—671
Депрессия 315—317, 319, 320
— католическая Вериго 83
— распространяющаяся (РД) 670— 674
Десенситизация 315, 319—321
Дибенамин 323
Дибутил-циклический АМФ 638, 639
Диизопропилфторфосфат 310
Динитрофенол 66, 78, 183, 191, 204, 623
Диоксифенилаланин (ДОФА) 231, 232, 239, 257
Дофамин (допамин) 231—234, 236, 238, 257, 263, 325, 500
— — бета-оксидаза 232, 235
Имидазол 317
Имидазольные соединения 291
Информация 506, 517—519
Ионы, обмен натрий-калиевый 189 — — натрий-натриевый 189, 190
Кабель биологический 156, 157
Кадмий 131, 133, 134, 142
Кальций 134,135,137, 290, 292—295, 316—319, 331, 500
Кальцнйхелатирующие агенты 125,
Каналы ионные 44—57, 117, 300, 308—311, 314, 320
— — активация натриевая 60—62 ---ворота 48—51, 71, 93, 304, 305
— — — активационные 48, 100, 104
— — — инактивационные 48, 95, 98, 101
— — входящего тока 127—135
— — выходящего калиевого тока 120-123, 126, 127
— — —-------быстрого 121—123,
127
— — — — — задержанного 121 — 124, 126, 127, 129
— — калиевые 101
— — — блокаторы 101—104
— — — селективность 136
— — — селективный фильтр ЮЗ-104
— — — ток воротный 104
— — — устья 101
— — кальциевые 127, 136—139
— — — селективность 136—139
— — натриевые 93—101
— — — блокаторы 95
— — — ворота 98, 99
— ТОКи 98- -Ю0
— — — селективность 136
— — — селективный фильтр 95, 96
— — — ТТХ-нечувсгвительные 139
— — — ТТХ-чувствительные 127
— — устья 93
— — проводимость 101
— — утечки 46
Карбамилхолин 642
Кариоплазма 17
Карнозин 259
Катехоламины 231—239, 263, 284, 364, 470
Кислота, аденозиндифосфорная
(АДФ) 189, 190
— 3',5'-аденозинмонофосфорная циклическая (3',5' АМФ) 326, 497, 499-501, 503, 504
— аденозинтрифосфорная (АТФ) 183—189, 258, 259, 326, 471, 500
— аспарагиновая 248, 259
— гамма-аминомасляная (ГАМК) см. Гамма-аминомасляная кислота
— гиалуроновая 677
— глутаминовая 474
— гуанилмонофосфорная 324, 326
— дезоксирибонуклеиновая (ДНК) 471, 472, 491, 492, 494, 495, 504, 540, 543, 569, 572, 573, 578 и 689
— рибонуклеиновая (РНК) 450, 453,
460, 470—472, 478, 490—496, 540, 543, 685, 689
Клетка(и), амакриновые 2^524, Ц,52 5
— биполярные 524—526
— волосковые кортиева органа 526
— Гиса 568, 569
— глиальные см. Глионы
— Гольджи, эпителиальные 538
— горизонтальные 524—526
— маутнеровские 388, 401, 411, 420, 435, 438, 439
— мелкие интенсивно люшшесци-рующие 235, 236
— мюллеровские 655, 656
— Пуркинье 350, 375, 436, 685
— Реншоу 29, 246, 364, 375
— Ретциуса 403, 427, 685
— Фаньяеа 538
— хромаффинные 236, 242
— шванновские (Шванна) 21, 22, 27—29, 281—283, 318, 460, 538, 542, 543, 561, 562, 565—567, 575, 576, 582, 583, 585—589, 611, 630, 641-644, 655, 680, 684, 685, 688
Кобальт 125, 129
Кодирование сообщений (код) в нервной системе 506—533
— — в сенсорных системах 520— 528
— — интервальное 510, 511
— — основные принципы 507
— — пространственно-временное 511—512
— — центральными нейронами 528—533
— — частотное (среднечастотное) 509, 522, 524, 532
— — числом импульсов 513
Кокаин 625
Колхицин 457, 461, 473, 475, 580
Концевая пластинка 477
Кофеин 295
Коэффициент сопряжения ионных потоков 188, 195
Ксилокаин 61, 81, 82
К-строфантин 617
Кураре 222, 455
Лейцин 685
Лизосомы 12
Магний 139, 317
Макроглия 538, 569
Медиатор(ы), (синаптический передатчик, нейротрансмиттер, нейропередатчик) 218—265, 284—290, 292—296, 300, 301, 308, 315—319, 324, 326-328, 331, 332, 334,
348-354, 358, 360, 362—366, 374, 375, 380—382, 391, 392, 399—401, 474, 497—501, 503, 504, 637, 679
— амбивалентность 260, 261
— идентификация 229—231
— кандидаты 255—260
— принцип специфичности 262
— происхождение и эволюция 262— 264
— синаптического возбуждения . 363—366
— — торможения 382—386
Мембрана, аксон-шванновская 581 — глиона 632, 633 — — гиперполяризация 638 — — пассивные свойства 618—621 — кальциевая проницаемость 112, 113
— постсинаптическая 305—312
— «стабилизаторы» 81
Межклеточная, жидкость 682, 683 — щель 680, 682
Метиламин 98, 104
Метод, авторадиографии 254
— Альтмана 540
— Вайгерта (Вейгерта) 27, 540
— внутриклеточного диализа 118, 119, 125, 127, 130, 132, 133, 136, 140 №
— выделения одиночных нервных клеток 118
— Вуда 241, 242
— Гольджи 24
— Гольджи—Бюбенет 20
— Гольцера 540
— замораживания-скалывания 32
— измерения трансмембранного тока 117, 118
— Кахаля 540
— Коула и Мура 140
— Марки 27
— Наута 25
— Ниссля и Эйнарсона 540
— Ортега 569
— перевязки аксона 118
— пероксидазный 19, 24
— травления 32
— фазового контраста 560
— Фалька и Хилларпа (формальдегидной конденсации) 234, 241 — фиксации потенциала (напряжения) 44, 46, 54, 74, 92, 112, 115, 116, 118, 195,.205, 298, 305, 309, 310
— Финка—Хаймера 25
Миелин 554, 568, 583—585, 587—593, 691
— биофизические характеристики 623-626
Миелиновая оболочка 27, 28, 31, 583, 586, 587, 590—592, 623—626
Миелогенез 583—593
Микроглиобласты 576, 577
Микроглиоциты 537, 547, 551, 559, 583
Микроглия (мезоглия, микроглио-цисты, клетки Ортеги) 538, 544— 546, 576—578
Микротрубочки 13, 14, 19, 25, 30, 31, 550, 554
Миобласты 457
Миотубулы 457, 465
Митохондрии 13, 19, 25, 30, 548, 550, 554, 573, 574, 585
Модель, кальциевых токов Хаги-вары 137—139
— Коннора и Стивенса 122
— нейрона, аналоговая 368, 369, 371, 373
— — имитационная 516, 517
— перехвата Ранвье, математическая 155
— Релла 367, 368
— Стивенса 310
— Франкенхойзера—Хаксли 153,
154, 166
— Ходжкина—Хаксли 71, 113, 122, 123, 131, 132, 153, 154, 157, 158, 161, 162, 165, 167, 177
Мускариномиметики 325
Насечки Шмидта—Лантермана 28, 684
Насос ионный 184
— — натриевый 190, 203, 211
— — натрий-калиевый 189
— — хлорный 382
— — электрогенный 190—194, 202, 203, 204, 211, 212
Нейроглиальные взаимоотношения 554—558
Нейроглия, архитектоника 554, 556 — культивирование 559—568 — — размножение клеток 567 — онтогенез 568—581 — — постнатальный 578, 579 — роль в механизме в. н. д. 686—691 — трофическая функция 684—685 — филогенез 581—583 Нейрогормоны 219 — гипоталамические 256, 257 Нейрон (нервная клетка) 7—9 — аксонный холмик 26, 373 — амбивалентность 260, 261 — отростки 7—9
— — аксон (нейрит) 7, 18, 24, 25
— — — коллатерали 28, 29
—------начальный сегмент 26, 373
— — — терминали 29, 31
— — дендриты 7, 18
— пигменты, липофусциновые гранулы 13
— — меланин 13
тело 7, 9
— специфичность секреторного химизма 261, 262
— ядро 15—18
--- кариоплазма 17
---оболочка 15, 16
— — поросома 17
— — поры 16
— — ядрышко 15, 17, 18
Нейроны, адренергические 261
— Гольджи 252
— гамкергические 252 -254 ^
— глицинергические 254, 255
— глутаматергические 249, 250
— дофаминергические 236—238, 261
— катехоламинсодержащие и 237— 239
— корзинчатые, гиппокампа 252 — — мозжечка 252 ЕЯ
— норадренергические 237, 238, 246 — пептидергические 256 _
— иуринергические 258, 259 j Ц
— Пуркинье 252
— серотонинергические 241—243,
261, 265
— холинергические 245—248, 254, 261
Нейротрофические агенты 470, 471, 473, 478
Нейрофизин 471
Нейрофиламенты 13, 14, 19, 25
Нервный импульс, следовые процессы 204—209
Никетин 222
Новокаин 61, 81, 82
Норадреналин (норэпинефрин) 218, 224, 231—233, 235—238, 257, 263, 327, 470, 498, 500, 638, 679
— идентификация 232, 233
— — руководящие х признаки 233, 235
— распространение 235
Октопамин 232, 238, 257, 263 5-Окситриитамин см, серотонин 5-Окситриптофан 239, 240, 242 Олигодендроглиобласты 573 Олигодендроглия (олигоглия, олигодендроглиоциты) 538, 539, 542—544, 575
Олигодендроциты 537, 547, 550, 555, 559, 564—566, 569, 572-575, 584, 586, 590, 592, 593, 611, 637, 681 г 685, 687, 688
Органеллы, межсинаптические 31 — цитоплазмы 9—15
Оубаин 66, 78, 184, 186, 187, 189, 192, 195, 197, 205, 209—212, 616, 673
Память 490—504
— долгосрочная 493—497
— краткосрочная 491—493
— «перенос памяти» 501
Пардахотоксин 644
Перенос веществ транссинаптический 473, 474
Перехват Ранвье 26—28, 54—60, 63, 65—68, 71—75, 78, 79, 85, 87—91, 98, 100—102, 104, 152— 154, 158, 624, 626, 684
Пероксидаза 318
Пикротоксин 387
Пиноцитоз 474
Пиперазин 328
Потенциал(ы), действия 49, 50, 65, 69—88, 91, 92, -290-292, 295, 319—509
— — генерация 373
— — — в целом волокне 152—155
--- мультиионная природа ИЗ
— — кальциевые 114, 115
— — фаза супернормальности, или экзальтации 83
— длительные 652—674
— концевой пластинки (ПКП) 287— 291, 295, 297, 298,. 300, 306, 317, 319, 320/324
— — — миниатюрные (МПКП). 286-292, 295, 297, 304, 314, 316, 319, 459, 461, 463
— мембранный (МП) 66, 68, 69
— — шванновских клеток 611, 616, 617, 619
— покоя 62—66
— постсинаптические 400, 401, 410, 437, 439, 514, 515
— — возбуждающие (ВПСП) 323— 325, 328—330, 332, 333, 348-363, 366—369, 371—375, 386-393, 410—412, 427, 431, 507/509, 514-517, 660, 665, 686
— — — ионные механизмы генерации 358—363
— — потенциал реверсии 354, 355, 357
— — ионная природа 299
— — тормозящие (ТПСП) 209, 210, 325, 328, 329, 334, 357, 375—382, 388—392, 410, 651, 661, 686
— — — ионные механизмы генерации 379—382
— равновесия ностсинаптической
мембраны (синаптический нуль-потенциал) 297, 298
— реверсии синаптического ответа 297
— следовые 75—79, 88
Потенцнация, постсинаптическая 316, 319
— посттетаиическая 492
Принцип, Дейла 260
— линейного оператора 520
— меченой линии 508, 527, 528
— независимости движения ионов
через мембрану 97, 98
Прозерин 328
Проназа 61, 98, 118
Пропантелин 331
Пропилнорадреналин 326
Пропионат 65
Пропраналол 326
Пуромицин 304
Раздражение, временная константа 85
Резерпин 257, 566
Реобаза 85, 89
Рефлексы трофические 449
Рефрактерность 171, 174, 176
— абсолютная 86, 171
— относительная 86, 87, 171
Рефрактерный период, функцио-
нальный 172, 173
Рецепторные (рецептивные) поля 22,
523, 525, 528
Рецепторы [(чувствительные окончания) 21
— адренорецепторы 326, 327
— ацетилхолия-рецепторы 455— 459, 472
— диффузные 22
— зрительные (фоторецепторы)
524-526
— [интерорецепторы 21, 22
— кожные 522, 523
— компактные 22
— мускариновые 324, 325—327, 329, 330, 364
— иикотиночувствительные 329, 330, 364
— растяжения 520—522
— — мышечные веретена 520
— . — вторичные 520—522
— — — — первичные 520—522
— — сухожильные органы 520, 522
— свободные 21, 22
— экстерорецепторы 21
Рубидий 201, 20?
Сакситоксин (STX) §9, 82t 93, 94
Сапонин 6?5
Серин 383
Серотонин (5-окситриптамин) 231, 234, 235, 239—243, 263, 326, 331, 364, 365, 383, 386, 391, 310, 312 — идентификация 239
— — руководящие признаки 240— 242
— распространение 242, 243
Сетчатка 524—526
Симпатии 224
Синапс(ы) 29, 219—221, 226, 228, 347-353, 357, 358, 364, 366, 374, 376
— аксо-аксональные 26, 33, 34, 36, 331
— активные зоны 280, 282, 283, 289, 290
— вегетативных ганглиев 283, 284
— — — линейный (транзиторный) 283
— — — точечный (терминальный) 283
— возбуждающие 348, 363
— гигантские 514
— дендро-дендритические 34, 220
— дендро-соматические 35
— мышц беспозвоночных 284, 285
— нервно-мышечных позвоночных 279—283, 315—320
— постганглионарных волокон 284
— реципрокные 33
— сериальные 35
— смешанные 33, 348, 399, 411, 415
— сомато-дендрические 34, 35
— сомато-соматичеокие 35
— тормозящие 348
— химический 29—33, 219, 220, 228, 328, 331, 348
— электрический 29, 33, 219, 328, 348, 398—441
— — критерии 400—402
— электро-секреторная связь в нем 290, 292, 295
Синаптическая щель 29, 31, 280, 284, 313, 320
— — вторичная 280
— — первичная 280
— — элементы межламинарные 31
Синаптические, контакты аксо-ден-дритические 23, 28
— — дендро-дендритические 23
— — тесный (плотный) 328, 420, 423, 425, 427
— — щелевой 418, 420, 421, 424— 426, 631, 632, 656, 676, 628, 629
— — — без каналов 423—425, 430
— — — с каналами 421, 422
— пузырьки (везикулы) 30, 31, 33, 283, 284, 313, 318, 319, 457, 471, 474 1
— соединения, интервальные 517
— — мощные 514, 515
— — передача информации ими 514—516
— — среднечастотныо 517
Синцитий глиальный 645, 671
Система, гипоталамо-гипофизарнал 471
— слуховая 526, 527
Следовая, деполяризация 75—78, 88
— — постимпульсная 78, 79
— гиперполяризация 75—77
— — посттетаническая 78, 79, 88
Спирты, алифатические 295
— многоатомные 310
Спорыньи алкалоид 222
Стимулы, «оптимальный временной поток» 515
Стрихнин 95, 383, 388, 665
Стронций 139
Строфантин 192
Субстанция (вещество) Р 255, 256, 326, 364
Субэпендимная зона мозга 577—580
Тайпоксин 319
Таурин 383
Тела мультивезикулярные 12
Теория, Гельмгольца резонансная 527
— Гольдмана постоянного поля 64, 301
— информации 506, 520
— кабельная 149—152
— мембранная 62
— Муллинза 104
— Эйзенмана 96
Терминаль секреторная (пресияапс) 219
Тетраэтиламмоний (ТЭА) 58—60, 65, 66, 74, 76, 78, 90, 92, 93, 95, 101—104, 115, 118, 121, 124,4 28, 203, 291, 292, 302, 356, 623
Тетродотоксин | (ТТХ) 59, 65, 81, 82, 93, 94, 100, 101, 114—117, 133, 171, 291, 292, 375, 459, 671, 679
Тирамин'232, 238, 257, 263
Тирозин 231, 232, 257, 500
Тканевые культуры 455, 456, 459
Токсины змеиные 290
— — альфа-бунгаротоксин 303, 314
— — найатоксин 303
Ток(и) ионный(е) 51—62, 71, 72, 305
— — воротный 139—144
— — входящие 122, 126, 128
— — — кальциевые 115—117, 123, 129—137;
— — — натриевые 115—Ц7, 123, 430, 131
— — — медленный 129
— — калиевый в бескальциевой среде 125
— — кальциевый 295
— — кнпетика 305
— — концевой пластинки (ТИП) 305-310, 312
— — — миниатюрный (МТКП) 305—307, 309, 313
— — мгновенные (моментальные) значения 55
— — насосный 195—203
— — натриевый 98—100, 144
— — неспецифический выходящий 136, 137, 143
— — — поздний 56
— — пороговый 84
— — посттетанический (ПТТ) 205, 207, 208
— — смещения асимметричные 142—144
Торможение, латеральное 523, 526— 528
— пессимальное Введенского 173, 175, 315, 319, 320
— постсинаптическое 374—386, 388, 533
— пресинаптическое 34, 331, 386— 388, 533
Тракт, дорсальный спинно-мозжечковый (ДСМТ) 528, 530—533 — лемнисковый 533 Транквилизаторы 498, 499 Транспорт, аксоплазматический 453, 457, 461, 463, 470, 472, 473, 475 — активный ионов 182—213 — — — активация 188, 202—206, 208—211
— — — кальция 292, 293
— — — механизм 185, 194, 202, 212
— — — — натриевый насосный 186, 187
— — — электро генный 190—203 — — — — трансмембранные токи 195
Трансформация ритма 171, 177
Тримекаин 61, 81, 82
Трипсин 118, 641
Триптофан 239—241, 500
Трофоневрозы 449 d-Тубокурарин 309, 314, 319, 322, 323, 328, 329, 638, 642
Уравнение, Гольдмана 362
— Гольдмана—Ходжкина—Катца 6154
— кабельное 150, 157
- Нернста (13, 358, 612, 632, 666, 681
— постоянного поля Ходжкина— Катца 64, 362
— Стейна 519, 532
— Такеучи и Такеучи 360—362
— Ходжкина—Хаксли 49, 100, 195
Уретан 81, 625
Фактор, I 252
— подвижности 139
— Р 259
— роста 685
— сродства 139
Формула, Нернста 45, 62, 63, 65, 66
— Шеннона 518
Фтор 131, 143, 144
Функция, кроссинтенсивности 512
— передаточная 530
Хистрионикотоксин 310
Ходжкина—Хаксли схема 44
Холннолитики 323
Холиномиметики 311, 312, 329
Холинорецептор 301—306, 308—310,
312, 314, 320
— активный центр 302
Холинэстераза 280, 284, 286, 306,
309, 313, 320, 325, 328, 566, 642
Хронаксия 85
Центриоли 14
Цианиды 183
Цитоплазма 9—15
Шипики 18—21
Шипиковый аппарат 19, 32
Шум, мембранный 100, 101
— — дробовой (лоренцовский) 100
— синаптический 328, 329
Эдрофоний 310
Эзерин (физистигмин) 225, 566, 642
Экворин 292
Экзоцитоз 218, 474
Электрокортикограмма (ЭКоГ) 659, 666, 667, 671
Электроретинограмма (ЭРГ) 655— 657
Электроэнцефалограмма 659
Эндоцитоа 474
Эпендима 575
Яд паука кара-курта 295
ОГЛАВЛЕНИЕ
Стр.
Предисловие (П. Г. Кастюк, А. И. Ройтбак) ........... 3
Часть первая
НЕРВНЫЕ КЛЕТКИ И СИНАПСЫ
Глава 1. Структура нервной клетки (В. П. Бабминдра,) .... 7
1.1. Тело нейрона . ........................................... 7
1.1.1. Органеллы цитоплазмы (9). 1.1.2. Ядро нейрона (15).
1.2. Дендриты ................................................. 18
1.2.1. Шипики дендритов (19). — 1.2.2. Чувствительные окончания (21). — 1.2.3. Структурные объединения дендритов (23).
1.3. Аксон (нейрит)............................................ 24
1.3.1. Коллатерали аксонов (28). — Терминали аксонов (29).
1.4. Синапсы ................................................ 29
1.4.1. Химические синапсы (29). —1.4.2. Электрические синапсы (33). — 1.4.3. Неклассические формы синапсов (33). — 1.4.4. Синаптическая организация нервных центров (35).
Литература .................................................... 36
Глава 2. Электрическая возбудимость нервного волокна (Б, И. Ходоров) .................. . . •........................... 44
2.1. Основные положения ....................................... 44
2.2. Математическая модель возбудимой мембраны................. 49
х 2.2.1. Гигантский аксои кальмара (49). — 2.2.2. Ионные токи через открытые каналы (51). — 2.2.3. Мембрана миелинизированного нервного волокна (54). — 2.2.4. Экспериментальное разделение общего ионного тока на его компоненты (58).
2.3. Ионные механизмы генерации мембранных потенциалов покоя и действия ..................................................... 62
2.3.1. Потенциал покоя (62). — 2.3.2. Пассивные и подпороговые активные изменения мембранного потенциала (66). — 2.3.3. Мембранный потенциал действия (70), - 2.3.4. Следовые потенциалы (75).
2.4. Параметры возбудимости нервного волокна................... 79
2.4.1. Пороговые условия возникновения потенциала действия (79). — 2.4.2. Параметры возбудимости (81). — 2.4.3. Изменения возбудимости во время и после окончания потенциала действия (86). — 2.4.4. Аккомодация (88). — 2.4.5. Повторные ответы на постоянный ток (91).
2.5. Молекулярные механизмы ионной проницаемости............... 93
2.5.1. Функциональная архитектура натриевых и калиевых
навалов (93). — 2.5.2. Натриевые каналы (93). — 2.5.3. Движение ионов через открытые натриевые каналы (97). — 2.5.4. Ворота натриевых каналов (98). - - 2.5.5. Калиевые каналы (101). Литература.................................................. 104
Глава 3. Электрическая возбудимость тела нервной клетки
(О. Л. Крышталь) .................................... 112
3.1, Мультиионная природа потенциалов действия нервной клетки 113 3.1.1. Непрямые данные о наличии кальциевой проводимости в мембране нервной клетки (113). — 3.1.2. Первые прямые измерения кальциевых и натриевых входящих токов (115).
3.2. Характеристика ионных каналов мембраны нервной клетки . . , 117
3.2.1. Современные электрофизиологические методы исследования нервных клеток (117). — 3.2.2. Каналы выходящего калиевого тока (120). — 3.2.3. Каналы входящего тока (127). — 3.2.4. Селективность натриевых и кальциевых каналов (136).
3.3. Воротные токи в мембране нервной клетки................... 139
Литература..................................................... 145
Глава 4, Проведение нервных импульсов (Е, Н. Тимин) .... 149
4.1. Пассивные свойства нервных клеток и волокон.............. 149
4.1.1. Кабельная теория (149).
4.2. Проведение импульса ио однородному волокну............... 152
4.2.1. Генерация импульса в целом волокне (152). — 4.2.2. Скорость проведения (155).
4.3. Проведение импульса по неоднородным волокнам ............ 159
4.3.1. Изменение диаметра волокна (160). — 4.3.2. Ветвление волокна (164). — 4.3.3. Проведение импульса из миелинизированного волокна в беэмякотную терминаль (165). — 4.3,4. Функциональные неоднородности (167).
4.4. Проведение серий импульсов. Трансформация ритма.......... 171
Литература.................................................... 177
Глава 5. Активный транспорт ионов в нервной клетке (П. Г. Ко-стюк) ........................................... 182
5.1. Развитие представлений об активном транспорте ионов .... 182
5.2. Механизм переноса ионов в мембране . .................... 185
5.2.1. Свойства натрий-калийактивируемой аденозинтрифосфатазы (185). — 5.2.2. Сопряжение потоков калия и натрия в мембране (188). — 5.2.3. Натрий-натриевый и калий-калиевый обмен (189).
5.3. Электрогенный эффект активного транспорта................ 190
5.3.1. Выявление электрогенного транспортного эффекта (190). — 5.3.2. Выраженность электрогенного эффекта у различных объектов (192). — 5.3.3. Трансмембранные токи при электрогенном активном транспорте (195).
5.4. Активация транспортного механизма во время основных нервных процессов ..................................................... 203
5.4.1. Следовые процессы после нервного импульса (204). — 5.4.2. Постсинаптические процессы (209). — 5.4.3. Ритмоводящая активность (211). — 5.4.4. Другие физиологические процессы (212).-
Литература . ............................................... 213
Глава 6. Медиаторы (Д. А. Сахаров)........................... 218
6.1. Содержание основных понятий.............................. 218
6.2. Развитие представлений о медиаторах..................... 221
6.2.1. Нейроэффекторная передача (221). ~ 6.2.2. Межнейрон
ная передача (226). — 6.2.3. Признание медиаторной теории (227).
6.3. Медиаторные вещества......................................
6.3.1. ’Идентификация (229). — 6.3.2. Катехоламины (дофамин, норадреналин, адреналин) (231). — 6.3.3, Серотонин (5-окси-триптамин) (239). — 6.3.4. Ацетилхолин (243). — 6.3.5. Глутамат (248). — 6.3.6. Гамма-аминомасляная кислота (ГАМК) (250). — 6.3.7. Глицин (253). — 6.3.8. Кандидаты (255).
6.4. Вопросы теории ...........................................
6.4.1. Единство секреторного химизма нейрона (принцип Дейла) (260). — 6.4.2. Амбивалентность медиаторов (260). — 6.4.3. Специфичность секреторного химизма нейрона (261). — 6.4.4. Происхождение и эволюция медиаторов (262).
Литература ....................................................
Глава 7. Передача в периферических синапсах (Л. Г. Магазаник)
7.1. Некоторые особенности строения периферических синапсов и их связь с функцией .............................................
7.1.1. Нервно-мышечные синапсы позвоночных (279). — 7,1,2. Синапсы вегетативных ганглиев (283). — 7.1.3. Синапсы постганглионарных волокон (284). — 7.1,4, Синапсы мышц беспозвоночных (284).
7.2. Процесс передачи в нервно-мышечных синапсах позвоночных . . 7.2.1, Основные электрические феномены и их трактовка (286). — 7.2,2. Электро-секреторная связь. Роль ионов кальция в механизме освобождения медиатора (290). — 7.2,3. Изменения проводимости постсинаптической мембраны, вызванные действием медиатора (295). — 7.2.4. Ионная природа постсинаптических потенциалов (299). — 7.2.5. Механизм взаимодействия ацетилхолина с холинорецептором (301). — 7.2.6. Молекулярные свойства холинорецептора (303). - 7.2.7. Кинетика ионного тока н природа активации постсинаптической мембраны (305). — 7.2.8. Некоторые количественные характеристики постсинаптического механизма (313). — 7.2.9. Постактивационные явления в нервно-мышечном синапсе (315).
7.3. Особенности передачи в синапсах вегетативной нервной системы
7.4. Нервно-мышечная передача у беспозвоночных ................
7.4.1. Нервно-мышечная передача у червей (327). — 7.4.2. Нервно-мышечная передача у моллюсков (329). — 7.4.3. Нервно-мышечная передача у членистоногих (331).
Литература ....................................................
Глава 8. Постсинаптические процессы в центральных нейронах (А. И. Шаповалов).............................................
8.1. Постсинаптическое возбуждение ............................
8.1.1. Общая характеристика ВПСП и создающего его постсинаптического тока (348). — 8.1.2. Изменения проводимости постсинаптической мембраны во время ВПСП (351). — 8.1.3. Эквивалентная схема синаптического возбуждения нервной клетки (353). — 8.1.4. Влияние трансмембранной поляризации. Потенциал равновесия ВПСП (354). — 8.1.5. Ионные механизмы генерации ВПСП (358). — 8.1.6. Предполагаемые медиаторы синаптического возбуждения и их действие на постсинаптическую мембрану (363). — 8.1.7. Распределение возбуждающих входов и их взаимодействие (366). — 8.1.8. Корреляция между экспериментальными данными и модельными представлениями (367). — 8.1.9. Генерация потенциалов действия под влиянием ВПСП (373).
8.2. Постсинаптическое торможение .............................
8.2.1. Общая 'характеристика ТПСП и создающего его пост
228
260
265
278
278
285
322
327
335
347
348
синаптического тока (374). — 8.2.2. Влияние трансмембранной поляризации на изменения проводимости во время ТПСП (378). — 8.2.3. Ионные механизмы генерации ТПСП (379). 8.2.4. Медиаторы торможения и их действие на постсинантиче скую мембрану (382),
8.3. Пресинаптическое торможение................................. 386
8.4. Интеграция постсинаптического возбуждения и торможения в нервной клетке ............................................... 388
8.4.1. Взаимодействие блуждающих и тормозящих постсинаптических эффектов (388). — 8.4.2. Гетерогенное действие одних и тех же медиаторов на различные участки постсинаптической мембраны (391).
Литература ...................................................... 393
Глава 9. Электрические синапсы (М. Б. Беркинблит, Л. М. Чайлахян) .................................................... 398
9.1. Основные свойства электрических синапсов и методы их идентификации .......................................... 399
9.1.1. Электрофизиологические критерии (400). — 9.1.2. Морфо- _
логические критерии (401). — 9.1.3. Фармакологические кри- 1
терии (401).
9.2. Электрические синапсы беспозвоночных ....................... 402
9.2.1. Септальные синапсы гигантских аксонов (402). — 9.2.2. Синапсы между нейронами сердечного ганглия омара (403). — 9.2.3. Синапсы между нейронами ганглия пиявки (403). — 9.2.4. Гигантский моторный синапс рака (404). — 9.2.5. Синапсы между нейронами ганглиев моллюсков (405). — 9.2.6. Связь рецепторных клеток беспозвоночных (406).
9.3. Электрические синапсы позвоночных........................... 407
9.3.1. Электрические синапсы между нейронами у рыб (407). — 9.3.2. Электрические синапсы у амфибий, рептилий и птиц (411). — 9.3.3. Электрические синапсы у млекопитающих (412). — 9.3.4. Электрические синапсы в рецепторных системах позвоночных (416).
9.4. «Электрические синапсы» в ненервной ткани................... 417
9.4.1. Миокардиальная ткань (417). — 9.4.2, Гладкомышечная ткань (418). — 9.4.3. Невозбудимые ткани (418).
9.5. Структурно-функциональные особенности электрических синапсов и их локализация ............................................... 419
9.5.1. Тонкая структура электрических синапсов (420). — 9.5.2. Локализация электрических синапсов (423).
9.6. Модели работы электрических синапсов........................ 423
9.7. Функции электрических синапсов ............................. 432
9.7.1. Быстродействие и надежность (432). - - 9,7.2. Роль электрических синапсов для синхронизации работы нейронов (433). — 9.7.3. Возникновение (формирование) залпов импульсов в системах электрически связанных клеток (434). — 9.7.4.
Значение выпрямления в электрических синапсах (434), — 9.7.5. Роль электрических синапсов в рецепторных системах (436). — 9.7.6. Сравнение свойств химических и электрических синапсов (436). — 9.7.7. Изменяемость синапсов и связь с биохимическими процессами (440).
Литература ...................................................... 441
Глава 10. Трофическая функция нервной системы Э. Гутманн |j. 449
10.1. История развития представлений о трофической функции нервной системы....................................................... 449
10.2. Концепции нейротрофической функции и ее доказательства . . 454
10.2,1. Тканевые культуры (455). — 10.2.2. Развитие и регенерация (456). — 10.2.3. Денервация (458). — 10.2.4. Реиннервация и коллатеральная регенерация (462). — 10.2.5. Перекрестная реиннервация (464). — 10.2.6. Регенерация мышцы (464).
10.3. Множественность механизмов регуляции свойств постсинаптических клеток ................................................... 465
10.3.1. Первичные (авторегуляционные) механизмы (466). — 10.3.2. Импульсная активность (467). — 10.3.3. Гормональные механизмы (468). — 10.3.4. Другие механизмы (468).
10.4. Трофическая функция афферентных нервных волокон .... 469
10.5. Нейротрофические агенты, аксоплазматический транспорт и транссинаптическая передача . ................................. 470
10.5.1. Нейротрофические агенты (470). — 10.5.2. Аксональный транспорт (472). — 10.5.3. Транссинаптический перенос веществ (473).
10.6. Регуляция свойств постсинаптических рецепторов............ 474
10.7. Специфичность нейротрофических механизмов................. 475
10.8. Функциональное значение нейротрофических функций .... 478
Литература ..................................................... 480
Г лава И. Нейрохимические аспекты памяти (П. А. Кометиани) 490
11.1. Основные положения ....................................... 490
11.2. Краткосрочная память ..................................... 491
я 11.2.1. Восприятие сенсорных раздражений (491). — 11.2.2. Энграмма краткосрочной памяти (492).
11.3. Долгосрочная память....................................... 493
11.3.1. Долгосрочная память и РНК (493). — 11.3.2. Долгосрочная память и белки (495). — 11.3.3. Участие нейропередатчиков в явлениях памяти (497). — 11.3.4. Действие экстрактов мозга обученных животных (501). — 11.3.5. Возможные механизмы участия генетического аппарата в явлениях памяти (503).
Литература ..................................................... 504
Глава 12. Кодирование и передача сообщений в нервной системе
(Б. Я. Пятигорский)....................................... 506
12.1. Основные термины.......................................... 506
12.2. Основные принципы кодирования информации в нервной системе 507
12.2.1. Общие положения (507). — 12.2.2. Принцип «моченой линии» (508). —- 12.2.3. Частотное кодирование (509). — 12.2.4. Интервальное кодирование (510). — 12,2.5. Пространственно-временное кодирование (511). — 12.2.6. Кодирование числом импульсов и другие способы передачи сигналов (513).
12.3. Передача различных кодов синаптическими соединениями . . . 514
12.3.1. Экспериментальные исследования (514). — 12.3.2. Исследования на имитационных моделях нейронов (516). — 12.3.3. Оценка передачи сообщений с помощью информационной меры (517).
12.4. Периферическое кодирование сообщений в некоторых сенсорных системах ....................................................... 520
12.4.1. Кодирование сигналов мышечными и сухожильными рецепторами (520). — 12.4,2. Кодирование сигналов кожными рецепторами (522). — 12.4.3. Периферическое кодирование в зрительной системе (524). — 12.4.4. Периферическое кодирование сигналов в слуховой системе (526).
12.5. Передача и преобразование сигналов центральными нейронами 528 Литература ..................................................... 533
Часть втирая
НЕЙРОГЛИЯ
Глава 13. Морфология нейроглии ..................... 537
13.1. Данные световой микроскопии о строении глии (М. М. Але-
ксандровская) ...................... . 537
13.1.1. Классификация глиальных клеток (537). — 13.1.2. Нормальная морфология астроцитов (540). — 13.1.3. Нормальная морфология олигодендроглии (542). — 13.1.4. Нормальная морфология микроглии (544). — 13.1.5. Морфологические изменения глии при действии разных факторов (546).
13.2, Ультраструктура нейроглии (Э. И. Дзамаева, И. Л. Лазриев) . . 547
13.2.1. Астроциты (547). — 13.2.2. Олигодендроциты (550). — 13.2.3. Микроглиоциты (551).
13.3. Отношение глии к нейронам, синапсам и сосудам (Н. Н. Боголепов) .................... ........ . . . . . ... , 554
13.4. Глия в тканевой культуре (Б. Я. Вильнер, А. И. Ройтбак, И. Л. Сванидзе) .............. .................... 559
13.5. Онтогенез и филогенез нейроглии(54 . II. Авцын, А. С. Халанский) 568 13.5.1. Онтогенез нейроглии (568). — 13.5.2. Филогенез нейроглии (581).
13.6. Миелогенез (Ю. М. Жаботинский)................ 583
13.6.1. Миелинизация в периферической нервной системе (585). — 13.6.2. Миелинизация в центральной нервной системе (590).
Литература ......................................... 593
Глава 14. Физиология нейроглии (А. И. Ройтбак)................. 607
14.1. Электрофизиологические особенности глионов............... 608
14.1.1. Мембранный потенциал глионов (608). — 14.1.2. Ионные основы мембранного потенциала покоя глионов (611). — 14.1.3. Пассивное поведение глиальной мембраны (618). — 14.1.4. Биофизические характеристики глионов (621). — 14.1.5. Биофизические характеристики миелина (623). — 14.1.6. Электрическое взаимодействие между глионами (626). — 14.1.7. Влияние возбуждения нервных элементов на’глионы (632). — 14.1.8. Устранение К+ из межклеточных щелей (644).
14.2. Нейроглия и длительные потенциалы нервной системы .... 652
14.2.1. Нервы (652). — 14.2.2. Сетчатка (655). — 14.2.3. Спинной мозг (657). — 14.2.4. Кора больших полушарий мозга (659).
14.3. Нейроглия и движение веществ в нервной системе........... 675
14.3.1. Гематоэнцефалический барьер (675). — 14.3.2. Внекле-
точное пространство и пути движения ионов и молекул в ткани мозга (680). — 14.3.3. Ионный состав жидкости межклеточных щелей (682),
14.4. О трофической функции глии................................ 684
14.5. Нейроглия и нервная деятельность.......................... 686
Литература...................................................... 691
Предметный указатель............................................ 703
ОБЩАЯ ФИЗИОЛОГИЯ НЕРВНОЙ СИСТЕМЫ
В серии:
РУКОВОДСТВО ПО ФИЗИОЛОГИИ
Утверждено к печати
Отделением физиологии Академии наук СССР
Редактор издательства В. П. Лебедев
Художник М. И. Разулевич
Технический редактор А. П. Чистякова
Корректоры С. В. Добрянская,
С. И, Семиглазова и Г, И, Суворова
И Б М 8452
Сдано в набор 04.07.79. Подписано к печати 30.11,79. М-27334.
Формат 60x90"/;,. Бумага типографская М 1. Гарнитура обыкновенная.
Печать высокая. Печ. л. 45---3 печ. л. на меловой бумаге = 48 усл. печ. л.
Уч.-изд. л. 59.67. Тираж 6400. Изд. 6926. Тип. заК. 496. Цена 4 р. SO к.
Издательство «Наука» Ленинградское отделение
199164, Ленинград, Б-164, Менделеевская лин., 1
Ордена Трудового Красного Знамени
Первая типография издательства «Наука»
199034, Ленинград, Б-34, 9 линия, 12