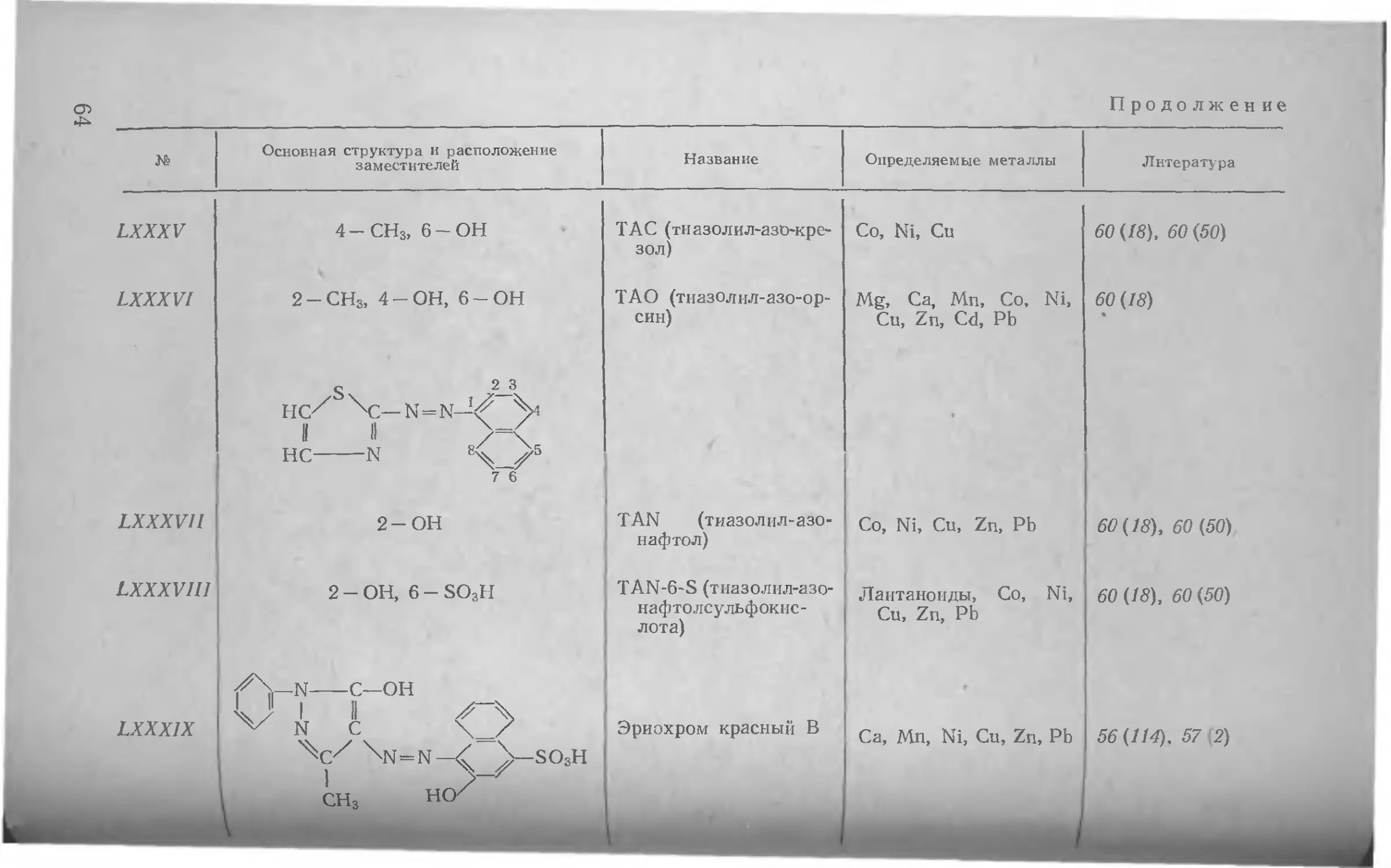
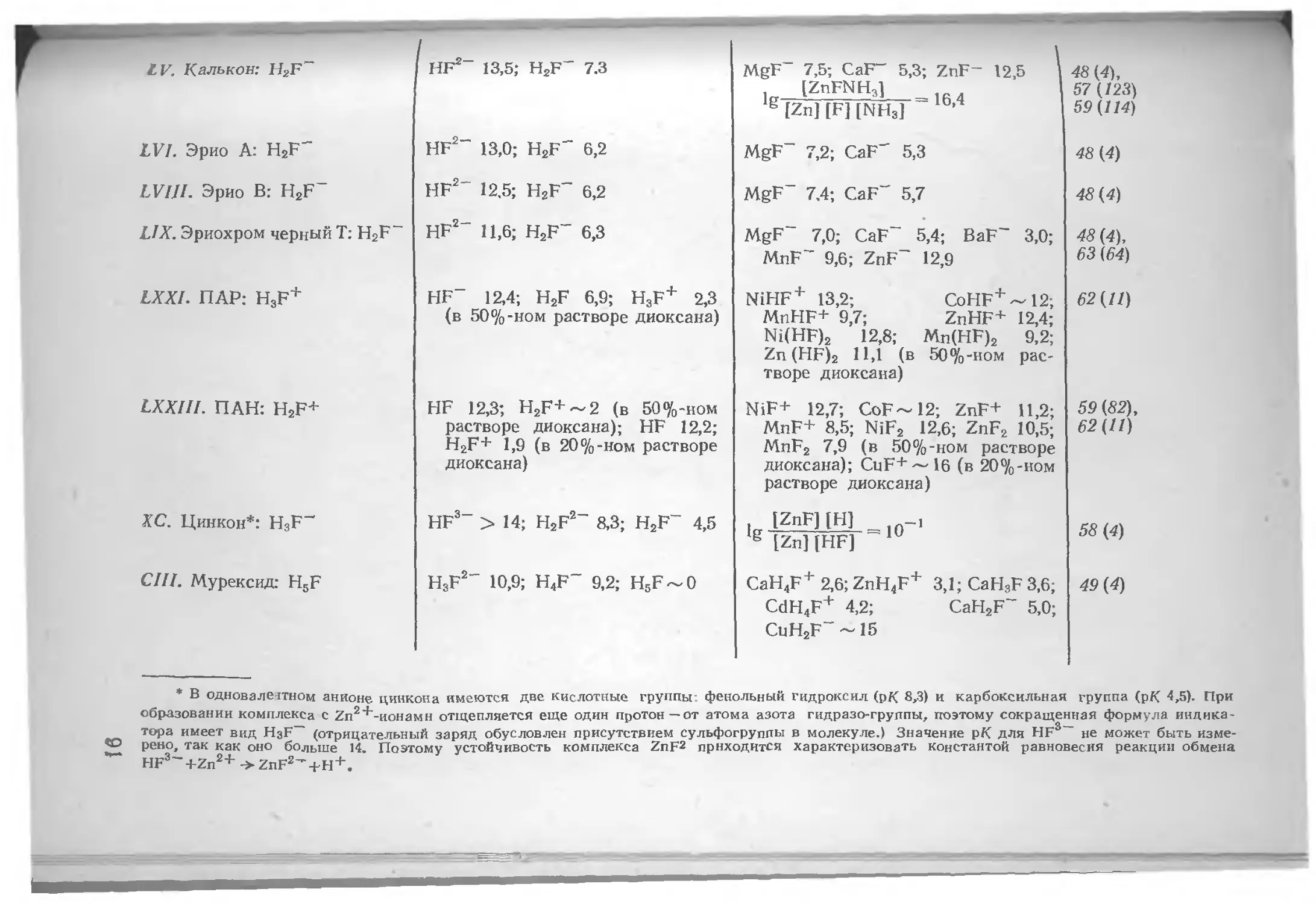
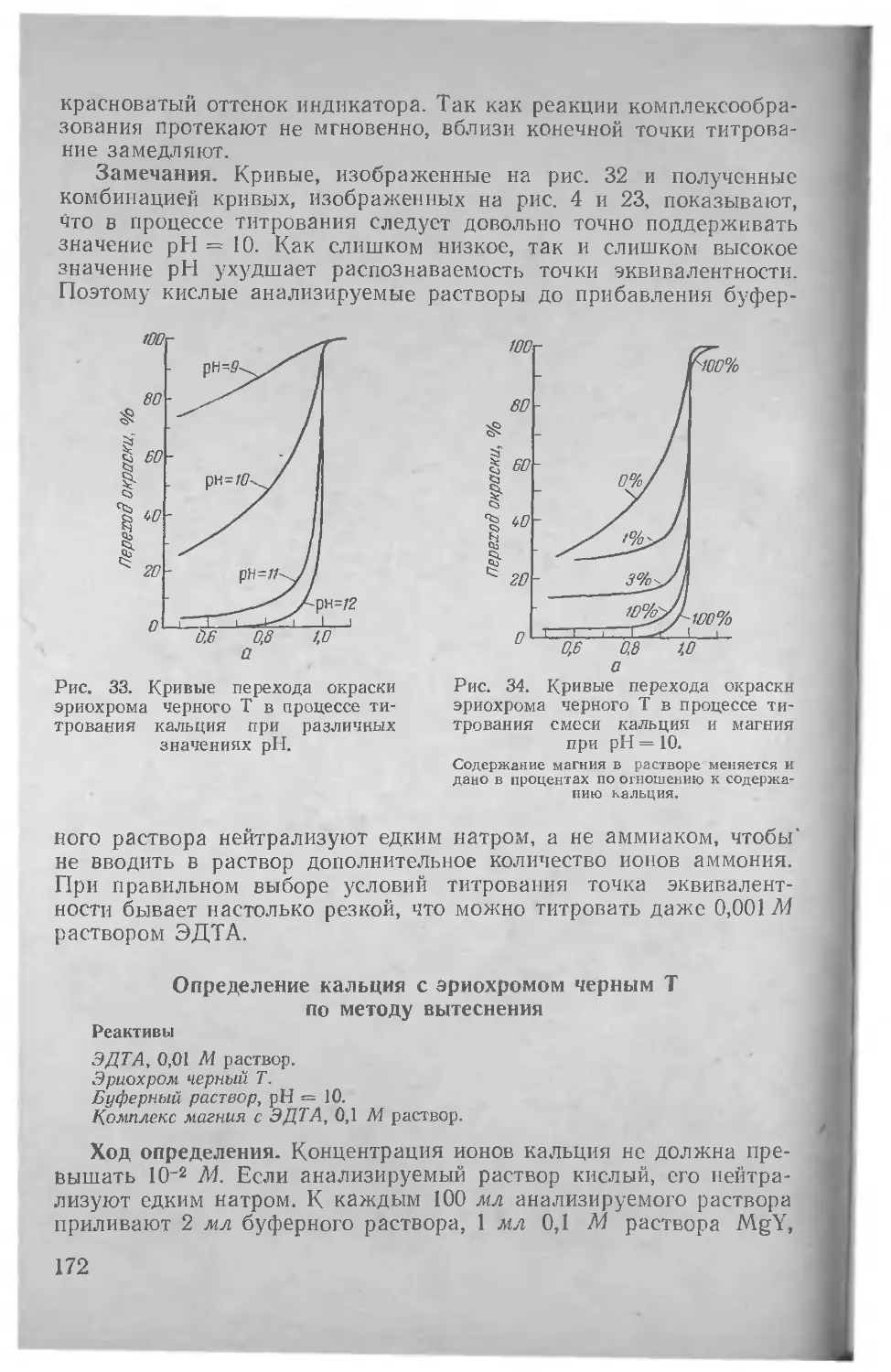
Author: Шварценбах Г. Флашка Г.
Tags: химические методы анализа химия химическая промышленность
Year: 1970
Text
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Г.ШВАРЦЕНБАХ. Г.ФААШКА
Die komplexometrische Titration
Von
Dr. Gerold Schwarzenbach
Professor an der Eidg.Techn. Hochschule, Zurich, Schweiz und
Dr. Hermann Flasclika
Professor am Georgia Institute of Technology, Atlanta, Georgia, U.S.A.
Mit 42 Abbildungen und 12 Tabellen
Funfte, vollig neu verfaBte Auflage
1 • 9 • 6 • 5
FERDINAND ENKE VERLAG STUTTGART
Г. ШВАРЦЕНБАХ, Г. ФЛАШКА
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Перевод с немецкого Ю. И. ВАЙНШТЕЙН
ИЗДАТЕЛЬСТВО „ХИМИЯ"
Москва 1970
УДК 543.244.6 Ш 33
Шварценбах Г., Флашка Г., Комплексонометрическое титрование.
Книга содержит подробное изложение основ комплексонометрического титрования. В ней описано большое число индикаторов, даны константы образования и устойчивости их комплексов с катионами, рассмотрены вопросы селективности и маскирования, подробно изложены различные инструментальные методы индикации точки эквивалентности с указанием достигаемой точности определения, приведены всевозможные ме- / тоды титрования более чем 50 элементов и способы элиминирования мешающих факторов.
Книга предназначена для широкого круга работников химико-аналитических лабораторий предприятий и научных учреждений различных отраслей промышленности.
В книге 42 рисунка, 11 таблиц, 1437 библиографических ссылок.
2-5-5
14-70
СОДЕРЖАНИЕ
Предисловие авторов к пятому изданию . ..........7
ЧАСТЬ I
ОБЩИЕ СВЕДЕНИЯ О РЕАКТИВАХ ДЛЯ ТИТРОВАНИЯ, ИНДИКАТОРАХ И ИНСТРУМЕНТАЛЬНЫХ МЕТОДАХ ИНДИКАЦИИ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
Глава I. Титрование растворами комплексообразующих веществ ... 13
Глава II. Аминополикарбоновые кислоты . . ........... 18
Глава III. Образование и устойчивость комплексонатов . . . 23
Глава IV. Кривые комплексоиометрических титрований . 30
Глава V. Индикаторы для комплексонометрических титрований . 40
1. Индикаторы, образующие слабоокрашенные комплексы с металлами . 40
2. Металлохромные индикаторы......................................... 43
3. Флуоресцентные индикаторы ...................................... 70
4. Окислительно-восстановительные индикаторы........................ -75
5. Чистота и номенклатура индикаторов.............................. 79
Глава VI. Изменение окраски металлохромных индикаторов ... 84
I. pH- и рМ-индикаторы................... .... 84
2. Зависимость констант индикатора от pH .... 85
3. Константы индикатора.............................................. 88
4. Кривые перехода окраски........................................ 92
5. Отчетливость перехода окраски................................... 94
Глава VII. Инструментальные методы индикации точки эквивалентности 98
1. Фотометрическое титрование ........................................98
2. Потенциометрическое титрование.............................. ... 106
3. Кондуктометрическое титрование . . . .... 111
4. Высокочастотное титрование ................................. . . 112
5. Амперометрическое титрование .... . . . .113
6. Кулонометрическое титрование . . 115
7. Хронопотенциометрическое титрование . . . 116
8. Термометрическое титрование .... . . . 117
9. Радиометрическое титрование ... . . 118
Глава VIII. Методы титрования и их точность 119
1- Прямое титрование................... ... 119
2. Обратное титрование ............................................. 121
3. Титрование по методу вытеснения.................................. 123
4. Титрование суммы ионов и селективное титрование ................. 125
5
5. Комплексонометрия в сочетании с реакциями осаждения . . . ’28
6. Цианидные методы .............................................. • 129
7. Амальгамные методы........................................... . • 130
8. Алкалиметрическое комплексонометрическое титрование ..... 132
Глава IX. Способы повышения селективности определений . . . 134
1. Разделение . . . ... .... 135
2. Маскирование . . . .... . . . • 135
3. Демаскирование .................................................. 140
4. Последовательное титрование ............................ .... . 141
5. Косвенный анализ ...... ..... 145
ЧАСТЬ II
МЕТОДЫ ТИТРОВАНИЯ И МЕТОДИКИ ОПРЕДЕЛЕНИЙ
Глава X. Применяемые реактивы и
1. Титрованные растворы . 147
2. Растворы индикаторов . . 152
3. Буферные смеси . . . . 153
4. Другие реактивы .... 154
5. Литий............ . . 154
6. Натрий ............. . 154
7. Калий, рубидий, цезий . 156
8. Бериллий ...............158
9. Магний и кальций .... 159
10. Барий и стронций .... 177
И. Бор........................182
12. Алюминий ................183
13. Скандий . . 192
14. Иттрий и лантаноиды . 193
15. Плутоний ...............197
16. Титан.....................198
17. Цирконий и гафний .... 202
18. Торий................. 208
19. Ванадий........... . . 212
20. Ниобий и тантал . 215
21. Хром .... . 217
22. Молибден . ... 222
23. Вольфрам . . . 225
24. Уран . . .226
25. Марганец . . 229
26. Рений . . .233
27. Железо . 233
Литература ..
Предметный указатель . .
определяемые вещества . . 147
28. Кобальт .........240
29. Никель ................ . 244
30. Платиновые металлы . . . 248
31. Медь ....................251
32. Серебро ...... 257
33. Золото ................259
34. Цинк ....................259
35. Кадмий ................268
36. Ртуть ............... . . 270
37. Галлий . . . 273
38. Индий . . 275
39. Таллий ....................277
40. Углерод п его соединения . 281
41. Кремний . . .... 289
42. Германий .... . . 290
43. Олово . .... 29Я
44. Свинец . . . 293
45. Соединения азота ... 298
46. Фосфор . . 299
47. Мышьяк ... . . 304
48. Сурьма ..................306
49. Висмут . ... . . 337
50. Кислород .........311
51. Сера н ее соединения . .311
52. Селен............. . . 316
53. Фтор ......................317
54. Другие галогены ... 319
... 321
. 355
ЯННИКУ БЬЕРРУМУ
ПОСВЯЩАЕТСЯ
Профессор Янник Бьеррум открыл ступенчатое комплексообразование. Мы обязаны ему многими достоверными величинами устойчивости металлокомплексов. Эта небольшая книга показывает, как полезно знание таких величин для аналитической химии.
ПРЕДИСЛОВИЕ АВТОРОВ К ПЯТОМУ ИЗДАНИЮ
В сообщении, сделанном на заседании Швейцарского химического общества весной 1945 г. [45 (3)], впервые было показано, что катионы металлов, рассматриваемые как кислоты Льюиса, можно титровать солями щелочных металлов нитрилотриуксусной и эти-лендиаминтетрауксусной кислот, анионы которых выступают в роли оснований. При этом точку эквивалентности устанавливают по изменению pH раствора. Это открытие явилось неожиданным результатом систематических исследований процессов комплексообразования с участием аминокарбоновых кислот. Одним из исследуемых объектов была урамилдиуксусная кислота [46(1)]. При получении этой аминобар биту ровой кислоты в некоторых случаях наблюдалось окрашивание реакционной смеси (при стоянии) в красный цвет, которое было обусловлено образованием небольших количеств мурексида вследствие окисления реакционной смеси кислородом воздуха. При промывании реакционного сосуда жесткой водопроводной водой случайно было замечено изменение окраски, вызванное взаимодействием мурексида с ионами кальция; в результате изучения этого явления возникло представление о ме-таллиндикаторе [49(4)]. Естественно, что при комплексонометрическом титровании ионов кальция стали использовать мурексид. Кроме того, были предприняты поиски металлиндикаторов на ионы других металлов. Оказалось, что в качестве металлиндикаторов можно использовать некоторые технические протравные красители и, в частности, ряд представителей группы эриохрома черного. Исследование соответствующих равновесий показало [48(4)], что наилучшим из этих индикаторов является эриохром черный Т. В январе 1948 г. впервые было описано применение эриохрома черного Т для комплексонометрического определения жесткости воды [48(5)].
1945 г. можно считать годом открытия комплексонометрического титрования. Начиная с 1950 г. этот метод получил международное признание для определения жесткости воды [50(4)—50(9)]. скоре комплексонометрический метод стали использовать для
7
определения не только щелочноземельных, но и других металлов, а применение маскирующих средств дало возможность использовать его и для анализа смесей металлов.
В 1955 г. (через 10 лет после открытия метода) вышло в свет первое издание этой книги — первая монография по комплексоно-метрии, содержавшая около 100 страниц. В ней было показано, что сложные химические равновесия, с которыми мы постоянно сталкиваемся при комплексонометрических титрованиях, можно рассмотреть теоретически с помощью простых математических методов, если ввести понятие об эффективных константах устойчивости (ранее называвшихся «кажущимися константами») хелатных комплексов, вычислить которые можно с помощью коэффициентов распределения.
В течение нескольких лет книга выдержала еще три издания (в 1956, 1957, 1960 г.), которые были лишь незначительно расширены по сравнению с первым. Настоящее — пятое издание монографии, которое выходит в свет через 20 лет после появления комплексонометрического титрования, почти полностью написано заново, так как в нем охвачен сильно возросший за эти годы экспериментальный материал. В то время как в первом издании была приведена 181 библиографическая ссылка, в настоящем издании их 1437, хотя публикации, не содержащие ничего принципиально нового, в книге не упоминаются. В списке литературы приведены работы, опубликованные до конца 1963 г. От составления этого списка в алфавитном порядке (по фамилиям авторов) пришлось отказаться для того, чтобы в дальнейшем можно было включать в него новые публикации без изменения нумерации ссылок. Список литературы разделен на группы, каждую из которых составляют работы, опубликованные в одном и том же году; по количеству ссылок в разных группах можно судить о развитии комплек-. сонометрии в различные годы.
В настоящее время комплексонометрия выросла в аналитический метод, с помощью которого можно определять большинство известных элементов (см. схему, стр. 146). В распоряжении .исследователя теперь имеется целый ряд хелатообразующих веществ, применяемых в качестве титрантов, многочисленные маскирующие агенты, позволяющие проводить селективные титрования в многокомпонентных смесях, различные инструментальные методы индикации точки эквивалентности, а также около 120 цветных индикаторов. Маловероятно, что в будущем будут найдены новые титранты и индикаторы, по своим свойствам значительно превосходящие существующие. Теория различных вариантов метода комплексоно-] метрического титрования полностью разработана, и известно, от каких факторов зависит точность различных определений. Однако универсальное применение точной теории еще невозможно вследствие недостаточности имеющихся данных по устойчивости комплексов. Кроме того, из приведенных в книге приблизительно 100 ме-таллохромных индикаторов подробно изучено в настоящее время^
6
только 16 соединений, при помощи которых можно определять тишь небольшое число ионов металлов. Так же скудны наши сведения об устойчивости металлокомплексов, которые образуют наиболее часто применяемые маскирующие вещества. Выяснение всех этих данных требует проведения трудоемких исследований, которые однако, необходимы, так как, лишь имея точные сведения об устойчивости различных комплексов, можно будет исчерпать все возможности комплексонометрии. Весьма важен для аналитической практики метод селективного комплексонометрического титрования, который дает возможность, благодаря комбинированию различных хелатообразующих титрантов, маскирующих веществ и индикаторов, определять, например, цинк в присутствии кадмия или кадмий в присутствии цинка, несмотря на химическое сходство обоих катионов (см. стр. 266, 269). Для правильного подбора наиболее выгодных комбинаций требуется опять-таки знание величин констант устойчивости соответствующих комплексов.
Во второй части книги мы сочли нецелесообразным давать просто прописи титрований, так как методики в большинстве случаев должны быть приспособлены к соответствующим конкретным условиям. Поэтому для каждого комплексонометрически определяемого элемента обсуждаются в общем виде возможные способы титрования и мешающие факторы с тем, чтобы читатель сам мог найти наиболее подходящий метод для решения интересующей его проблемы, используя при необходимости упоминающуюся в книге оригинальную литературу. Те методики, которые приведены в книге, имеют скорее характер практических примеров.
Герольд Шварценбах Герман Флашка
ОБОЗНАЧЕНИЯ, ПРИНЯТЫЕ В КНИГЕ
Краткие обозначения
Mv+: катион металла с зарядом v+
М*; другой катион металла (если в растворе определяются раздельно оба катиона)
А?‘~: простой лиганд с зарядом Х~, например NH3, ОН", СНзСОО-. или другие вещества, применяемые для приготовления буферных смесей, и вспомогательные комплексообразующие вещества, например тартрат, цитрат и т. п.
трен: р,Р',Р"-триаминотриэтиламин
пентен: N.N.N'.N' тетра-(Р-аминоэтил)-этилендиамин
ЭДТА: этилендиаминтетряуксусная кислота или ее анион
НТА: нитрилотриуксусная кислота или ее анион
ДЦТА: транс-1,2-диаминоциклогексантетрауксусная кислота или ее анион
ГЭДТА: р,р'-диаминодиэтилгликолевый эфир-М.М-М'М'-тетрауксусная кислота
ДТПА: диэтилентриамиипентауксусная кислота или ее анион
Z>,_; обычное обозначение хелатообразующих веществ, например молекул полиаминов или анионов ЭДТА, НТА, ДЦТА, ГЭДТА, ДТПА
Y4-: анион ЭДТА
Е?‘~: непротонированный анион металлиндикатора, являющийся красителем анион металлиндикатора, не являющийся красителем
isopr: —СН(СН3)з, изопропил
gl: —СН2—NH—СН2—СООН, метиленглициновая группа ,СН2СООН
mgl: —СН2—N\
ХСН3
/СН2СООН
mim: —СН2—, метилениминодиацетатная
'СН2СООН группа
группы, содержащиеся в молекулах красителей
е: молярный коэффициент экстинкции ji: ионная сила раствора Стехиометрические числа
г. число лигандов в комплексе МА?-1А
Ю
п- максимально возможное значение I для соответствующего иона металла
/•' число кислотных протонов в комплексе II/Z/_X или (соответ-
вующие ступени ионизации хелатообразующего вещества или красителя)
СТ т: максимально возможное значение / в сильнокислом растворе
Концентрации
Г ]• концентрация, выраженная в молях на литр, например [М] — концентрация свободных, лишь сольватированных ионов металла. Заряд частиц при обозначении концентрации не указывается
рМ = — 1g [М]
[ ];: аналитическая общая концентрация, например [М]г — общая концентрация металла в растворе, [Z]z — общая концентрация хелатообразующего вещества, с учетом всех продуктов ионизации и всех комплексов с ионами металлов
рМ/ = — 1g [Mh
[ сумма концентраций ионов, относящихся к одной группе, например: п
[М]' = 2 [МА/]: общая концентрация ионов металла, не связанных с хела-i=0
тообразующим веществом
т
[Z]' = 2 [H/Z]: общая концентрация хелатообразующего вещества, не свя-1=0
занного с ионами металла т
[F]' = 2 [H/F]: общая концентрация красителя, не связанного с ионами 1=0
металла
т
[MF]' = 2 [МН/F]: общая концентрация различных протонированных комп-i=i
лексов металл — краситель (1:1)
Коэффициенты
а: число молей титранта, приход щееся на один моль определяемого компонента, например число молей ЭДТА, приходящееся на грамм-атом металла. В точке ' '
эквивалентности а равняется целому числу (обычно единице) rzr
коэффициент распределения Г71 при концентрации ионов водорода [Н]
АЛ. [F'J
коэффициент распределения
ан:
аН: рода [Н]
коэффициент распределения
IMr I рода [Н]
а - [MZJ л..
м—fzF+1
при концентрации ионов водо-
при концентрации ионов водо-
вспомогательного комплексообра-
₽л: коэффициент распределения для зующего вещества А
Рв: аналогичный коэффициент распределения для вспомогательного комплексообразующего вещества В
Ра> Pg: аналогичные коэффициенты распределения ионов металла М*
11
Константы равновесия
k,%: константы равновесия, соответствующие концентрациям, выраженным в молях на литр. При численных значениях констант указывается, при какой ионной силе р и температуре справедливо соответствующее значение
К- константы для отдельных ступеней процесса, например;
к *H'ZJ
[Н] . [Hz_tZ]
pAy=lg.7<HZ> этот положительный логарифм константы образования соответствует отрицательному логарифму константы диссоциации и, следовательно, обычному значению рК кислоты (донора протонов) HjZ; рХ красителей обозначаются рК| или рХц.н
„ [МА;] « г
ХмАг = "|А]~[,4д. ~f’ обозначается также как Ki
КМ2 =' гшТТГ : константа образования комплекса металл — хелатообра-|MJ (ZJ
зующее вещество
„ [MF]
KMF = : константа образования комплекса металл — краситель
х; общие константы ряда ступеней процесса, например:
IH/ZJ v
ihPrT’
I
ff [MZ]
Amz' [M] [Z]'
„eff [MZ]
AM'Z [M]' [Z]
„eff . [MZ]
[M]' [zy
эффективные константы образования хелатных комплексов MZ, справедливые при определенной концентрации ионов водорода [Н], или определенной концентрации лиганда [А], или определенной концентрации того или другого
л
Эффективные константы устойчивости применяются и для характеристики комплексов с красителями: X^'F’ Xm-F' (иногда обозначаются как Х^р)
Часть I
ОБЩИЕ СВЕДЕНИЯ О РЕАКТИВАХ ДЛЯ ТИТРОВАНИЯ, ИНДИКАТОРАХ И ИНСТРУМЕНТАЛЬНЫХ МЕТОДАХ ИНДИКАЦИИ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
ГЛАВА I
ТИТРОВАНИЕ РАСТВОРАМИ КОМПЛЕКСООБРАЗУЮЩИХ ВЕЩЕСТВ
Химическая реакция может быть применена в объемном анализе лишь тогда, когда она удовлетворяет следующим условиям:
1. Реакция должна протекать быстро.
2. Реакция должна протекать стехиометрически.
3. Свободная энергия реакции должна быть достаточно большой.
При соблюдении этих условий точку эквивалентности можно найти либо по изменению окраски индикатора, либо с помощью индикаторного электрода, либо измерением электропроводности или диффузионного тока на ртутном капельном электроде.
При образовании комплексов металлов названные три условия не всегда выполняются. С одной стороны, это касается медленно протекающих реакций, например реакций образования устойчивых комплексов, прежде всего комплексов кобальта (III), хрома (III) и металлов платиновой группы. С другой стороны, многочисленные быстро образующиеся комплексы обычно представляют собой нестабильные продукты присоединения, так что в этом случае не выполняется условие 3. Исключениями из этого правила являются комплексы Hg2+-, Ag+- и №2+-ионов (прежде всего с СХН-иона-ми), реакции образования которых издавна используются в некоторых методах объемного анализа [47(3), 63(64)].
В большинстве случаев при образовании простых комплексов не выполняется также и условие 2. Замена молекул воды из гидратной оболочки ионов металлов, находящихся в водном растворе, Другими лигандами, например NH3 или CN-, протекает, как правило, ступенчато [А(3)], напоминая реакцию нейтрализации многоосновной кислоты. При постепенном прибавлении раствора лиганда к раствору, содержащему ионы металла, образуется ряд различных комплексов, большинство которых, как правило, присутствует в растворе одновременно и в значительных концентрациях вследствие взаимного наложения ступеней протекающего процесса, омплексообразование заканчивается полностью лишь после при-вления комплексообразующего реагента в значительном избытке.
13
Конечная точка поэтому не может быть отмечена ни по быстрому падению концентрации ионов металла, ни по быстрому увеличению концентрации свободного лиганда, т. е. конечная точка нечетка, как и в случае нейтрализации очень слабой многоосновной кислоты, например полифенола [49(6)].
Можно достигнуть лучших результатов, если вместо нескольких отдельных молекул аммиака применить в качестве лиганда, например, органический полиамин, атомы азота которого расположены в молекуле таким образом, что при комплексообразовании могут возникать 5- или 6-членные циклы [52(17), 55(118)]. В качестве примера приведем р, р', р"-триаминотриэтиламин и N, N, N' N'-тетра-(р-аминоэтил)-этилендиамин, которые для краткости будем обозначать «трен» и «пентен» [50(3), 53(2)]; их структурные формулы даны ниже. В определенных условиях молекулы этих полиаминов способны присоединять протоны; ниже приведены значения логарифмов констант образования таких продуктов присоединения;
/СН2—СН2—NH2
N—СН2—СН2—NH2
\сн2—СН2—nh2
трен
РМ = 10,29; рК2 = 9,69; рК3 = 8,56
H2N—СН2—Н2СЧ /СН2—СН2—NH2
>N—СН2—СН2—N<
H2N—СН2—H2CZ чсн2—сн2—nh2
пентен
рК1 = 10,20; рК2 = 9,70; рК3 = 9,14; p2C4 = 8,56
При применении подобных лигандов, с одной стороны, упрощается стехиометрия комплексообразования и уничтожается сту пенчатость процесса [52(17), 55(118)], так как для образования комплекса требуется вместо четырех или шести отдельных моле-| кул аммиака:
Ni2+ —> Ni(NH3)2+ —> Ni(NHs)g+ Ni(NH3)|+ (J
лишь одна-единственная молекула полиамина (Z): Ni2+ + Z —> NiZ2+
(2)
С другой стороны, при этом выигрывают в так называемом эффекте комплексообразования [52(50), 54(55)], под которым по-| нимают повышение устойчивости хелатного комплекса по сравнению с соответствующим комплексом с простыми лигандами. Эффект комплексообразования выражается логарифмом отношения кон- * стант равновесия реакций (2) и (1):
и
[Ni(NH3)6]
[Ni] [NH3]6
= 3-108
^NiZ~
(Ni(Z)l [Ni] [Z]
= 2- 1019
(3)
(3a)
14
Для данного случая эффект комплексообразования Ек равен: Ек = ^NIZ - 1g К6 = 10>8 (4)
Как видно из этого примера, эффект комплексообразования достигает значительной величины. Этот вывод справедлив не только для комплексов никеля, но имеет общее значение. Общий характер эффекта комплексообразования обусловлен тем, что он является чнтоопийным эффектом и не имеет ничего общего с прочностью координационных связей [52(50), 54(9), 54(63), 63(80)] между ионом металла и различными лигандами.
В табл. 1 приведены константы образования аммиачных комплексов M(NH3)T+ различных ионов металлов М:
[M(NH3)(]
Л‘ [M(NH3)j_j] [NH3] w
где i принимает все значения от 1 до максимального координационного числа п. Эти константы соответствуют отдельным ступеням реакции комплексообразования между ионом металла и аммиаком. Произведение отдельных констант идентично так называемой общей константе образования щ рассматриваемого нами комплекса:
[M(NH3)Z] . „ v v ТГ „
Значения 1g х, для i = 4 и i = 6 также приведены в табл. 1. При вычислении эффекта комплексообразования константы щ и х6 сравнивают с константами образования комплексов ионов металлов с треном и пентеном (Я№н).
Таблица I. Логарифмы констант образования аммиачных и полна минных комплексов (при 20° С и Ц = 0,1) [57(138), 59(140)]
Катион 1g Ki IgKs IgKs lgK4 Ig Kb 1g Kb 1g Щ 1g «в lg lg KMZn
Со2+ №2+ 2,1 1,6 1,1 0,8 0,2 -0,6 5.6 5,2 12,8 15,8
2,8 2,2 1,7 1,2 0,7 0,0 7,8 8,5 14,8 19,3
Сц2+ 4,1 3,5 2,9 2,1 — — 12,6 — 18,8 22,4
Zn2+ Cd2+ 2,3 2,6 2,3 2,1 2,4 1,4 2,1 0,9 —0.3 — 1,7 9,1 6,9 4,9 14,7 12,3 16,2 16,8
Hg2+ 8,8 8,7 1,0 0,8 19,3
Ag+ 3,2 3,8 — — — 7,8 —
О процессах комплексообразования, которые происходят при ctJP°BaHHH’ дает представление рис. 1. В качестве примера рас-абсТРИВйеТСЯ титРование никеля аммиаком и пентеном. По оси
Цйсс графика отложено количество атомов аммиачного или
15
аминного азота, приходящихся при титровании на один ион никеля; по оси ординат приведены значения pNi(pNi =—IgtNi]), аналогичные значениям pH при алкалиметрическом титровании.
При прибавлении органического основания к раствору соли металла, не обладающему буферным действием, естественно, изменяется не только концентрация никеля, но и pH раствора. Это приводит к выпадению осадка гидроокиси никеля, который затем растворяется. Выпадения осадка можно избежать, если проводить титрование в присутствии значительного избытка хлорида аммония. В таких условиях увеличение pH происходит медленно. (Эти замечания нужны для объяснения условий титрования ионов никеля.)
Общая концентрация ионов металла [Ni); при титрований одинакова для всех случаев и равна 10-3 моль/л.
Кривая } показывает ход титрования ионов никеля аммиаком в присутствии 0,1 М раствора NHiCl. В точке . "
а — 6 моль NH3 на 1 моль Ni, концентрация свободных ионов никеля понижается только на ’/s первоначальной -величины, вследствие чего эта точка не может быть отмечена по скачку pNi. Комплексообразование становится почти полным только после прибавления большого избытка аммиака.
Совершенно иначе выглядит кривая 2, изображающая ход титрования ионов никеля пентеном (также в присутствии 0,1 М раствора NH4CI). На кривой наблюдается резкий скачок pNi, но не в точке эквивалентности, а с некоторым запозданием, так как только после связывания всего никеля pH раствора начинает быстро расти, что способствует увеличению устойчивости вого комплекса.
Образование хелатных комплексов дит в более благоприятных условиях, трование проводят при постоянном и значении pH. Кривая 3 показывает титрование М раствора хлорида аммония и 0,1 М раствора
Рис. 1. никеля
эквивалентности, в которой
пентено-
Кривые титрования аммиаком и пентеном.
пентеном в среде 0,1
происхо-если ти-высоком
никеля
аммиака, т. е в буферном растворе с pH = 9,3. В присутствии аммиака никель существует в виде аммиачного комплекса, вследствие чего повышается значение pNi и кривая титрования начинается не при pNi = 3, а при pNi = 6,9. В процессе титрования аммиачный комплекс никеля переходит в пентеновый и к концу титрования наблюдается скачок pNi, точно совпадающий с точкой эквивалентности. Величина этого скачка даже несколько больше, чем величина скачка pH при титровании соляной кислоты раствором NaOH *.
Из рассмотрения кривых титрования, изображенных на рис. 1, следует, что органические полиамины с успехом можно применять в комплексонометрии в качестве титрантов. Однако их применение ограничено титрованием лишь тех ионов металлов, которые легк присоединяют атомы аминного азота в качестве лигандов, прежде всего Си, Ni, Со, Zn, Cd и Hg. Кроме того, полиаминные комплексы очень чувствительны к кислотам, потому что, как уже говорилось, молекулы полиаминов способны присоединять несколько про-
* Кривые титрования, изображенные на рис. 1, рассчитаны на основании констант, данных в табл. 1, по уравнениям, приведенным в главе IV.
16
ов Например, молекула пентена уже при pH = 7 существует в виде H4Z4+, поэтому при комплексообразовании ион металла вытесняет четыре протона:
Ni2+ + H4Z4+ —> NiZ2+ + 4H+ (7)
Эффективная константа устойчивости TCniz/ комплекса, образующегося при pH = 7, значительно меньше константы /<niz [уравнение (За)]:
К — [N*Z] . g . „д
ANiZ' - [Ni] [Zf 4’9 10
4
где [Z]' = 2 [ВД /=о
Тем не менее полиамины представляют интерес для комплексо-нометрии, так как их можно использовать для целого ряда селективных титрований. К сожалению, они до сих пор трудно доступны в чистом виде, вследствие чего вопрос о применении их в объемном анализе в качестве титрантов еще мало изучен [57(9), 57(87), 57(88), 59(113)].
2
ГЛАВА П
АМИНОПОЛИКАРБОНОВЫЕ КИСЛОТЫ
В настоящее время в комплексонометрии применяются в качестве комплексообразующих веществ почти исключительно аминополикарбоновые кислоты, среди которых главное место принадлежит этилендиаминтетрауксусной кислоте (ЭДТА). Ее анионы могут образовывать пятичленные хелатные циклы с ионами металлов.
Этилендиаминтетрауксусную и нитрилотриуксусную (НТА) кислоты можно рассматривать как производные органических оснований трена и пентена, получающиеся путем замещения в последних конечных групп —СН2—NH2 на группы —СООН. Карбоксильные группы тоже способны быть лигандами для иона металла, что можно продемонстрировать на примере ацетат-иона [57(148)]: ацетатные комплексы, хотя они и неустойчивы, образуются практически со всеми многозарядными ионами металлов. Если же эта общая способность карбоксильных групп к образованию комплексов усиливается эффектом комплексообразования, как это имеет место в случае анионов аминополикарбоновых кислот, то последние являются уже сильными комплексообразователями с меньшей (по сравнению с полиаминами) селективностью, реагирующими почти с любым ионом металла. В то время как аммиак и полиамины образуют продукты присоединения только с катионами металлов побочных подгрупп, аминополикарбоновые кислоты образуют комплексы также с катионами металлов основных подгрупп, например с ионами алюминия, редкоземельных элементов, щелочноземельных металлов и, в меньшей степени, даже с Li+- и Na+-ионами.
Ниже приводятся структурные формулы и сокращенные обозначения некоторых аминополикарбоновых кислот, применяющихся в аналитической практике:
НООС—СН2 СН2—СОО~
Н—N—СН2—СН2—N—Н
"ООС—СН2 СН2—СООН
ЭДТА, или Н4У
18
/СН2—соон н—N—СН2—COO"
\сн2—соон
НТА
сн2 н
/ \ 1+ /СН2—СОО“
Н2С CH—N<
I I хсн2—соон
I I /СН2—соон
Н2С CH—N<
\ / 1+ ХСН2—СОО"
сн2 н
ДЦТА
ноос—сн2 н сн2—соо
н—N—СН2—СН2—N—СН2—СН2—N—Н / I \
-ООС-СН2 СН2—СОО" сн2-соон
ДТПА
НООС—СН2 J2H2—СОО"
Н—N—СН2—СН2—О—СН2—СН2— О—СН2— СН2—N—Н
"ООС—сн2 сн2—соон
ГЭДТА
Анион ЭДТА обозначают Y4', а любое другое хелатообразующее вещество обозначают Zx" [например, полиамин (X = 0) или анионы НТА (2 = 3), ДЦТА (2 = 4), ДТПА (2 = 5) и ГЭДТА (2 = 4)].
Для более чем 95% всех комплексонометрических титрований применяют ЭДТА. Нитрилотриуксусную кислоту используют только для некоторых редко встречающихся алкалиметрических-комп-лексонометрических титрований [46(2), 48(1), 48(2)] или в качестве вспомогательного лиганда. Более дорогостоящая, чем остальные комплексоны, транс-1,2-диаминоциклогексантетрауксусная кислота (ДЦТА) образует обычно более устойчивые и более прочные комплексы, чем ЭДТА (табл. 2). Диэтилентриаминпентауксусная кислота (ДТПА) образует комплексы с ионами металлов с координационным числом 8, причем эти комплексы более устойчивы, чем комплексы ЭДТА; поэтому ДТПА должна иметь преимущество при титровании больших катионов, прежде всего катионов лантаноидов и актиноидов. Однако на практике она еще мало испытана. Особенно интересна (3,(У-диаминодиэтилгликолевый эфир-М,Ц,М',М'-тетрауксусная кислота (ГЭДТА), магниевый комплекс которой по своей устойчивости сильно отличается от аналогичных комплексов кальция, стронция, бария (табл. 3).
В табл. 2 и 3 приведены константы устойчивости комплексов пяти перечисленных аминополикислот с различными катионами (С молярным соотношением 1:1), вычисленные по уравнению (8):
К - [MZ] т
рл/- [М] [ZJ
2:
19
Таблица 2. Логарифмы констант устойчивости комплексов ЭДТА и ДЦТА (при 20° С и (I = 0,1) (57(15), 57(130), 57(138), 59(126), 59(140), 60(107), 60(172), 60(180), 60(193), 61 (39), 61 (53), 61 (165), 62(100), 62(156), 63(51), 63(77)]
Катион ЭДТА ДЦТА Катион ЭДТА ДЦТА
н+/=1 2 10,26 12,35 Zr4+ 29,5
6,16 6,12 Hf4+ 19 1 (?)
3 2,67 3,52 V2+ 12,7
4 2,0 2,4 V3+ 25,9
5 l-,6 VO2+ 18,8 20,1
6 0,9 V0o+ 18,1
Ве2+ -9 Mn2+ Fe2^ 13,8 17,4
Mg2+ 8,7 11,0 14,3
Са2+ Sr2+ Ва2+ Ra2+ 10,7 8,6 7,8 7,1 13,2 10,5 8,6 Fe3+ Co2+ Ni2+ Pd2+ 25,1 16,3 18,6 18 5 29,3 19,6
А13+ Sc3+ V3+ La3+ Eu3+ Eu2+ Lu3+ 16,1 23 1 18,1 15,5 17,0 7,7 19,8 18,3 19,8 16,9 19,3 22,2 Cu2+ Ag+ Zn2+ Cd2+ Hg2+ Ga3+ In3+ 18,8 7,3 16,5 16,5 21,8 20,3 24,9 22,0 19,3 19,9 25,0 23,6
UO*+ — 10 Tl+ 5,3
U4+ 25.5 Tl3+ 21,5
Pu3+ 18,1 Sn2+ 22,1 (?)
Am3+ 18,2 Pb2+ 18,0 20,3
Ti3+ 21,3 Bi3+ 27,9
TiO2+ 17,3
Таблица 3. Логарифмы констант устойчивости комплексов НТА, ДТПА и ГЭДТА (при 20° С и Ц = 0,1) (56(125), 57(138), 57(139), 58(115), 59(142). 60(198), 62(101)]
Катион НТА ДТПА ГЭДТА Катион HTA ДТПА ГЭДТА I
Н+/=1 9,73 10,58 9,46 Мп2+ 7,4 15,6 12,3
2 2,49 8,60 8,85 Fe2+ 8,8 16,0 11,8
3 1,9 4,27 2,68 Fe3+ 15,9 27,9
4 2,64 2,0 Со2 + 10,4 19,3 12,3 I
5 1,5 Ni2+ 11,5 20,2 11,8
Mg2+ 5,4 5,2 Cu2+ 13,0 21,5 17,8 I
Са2+ 6,4 10,9 11,0 Ag+ 5,4
Sr2+ 5,0 8,5 Zn2+ 10,7 18,6 12,9 i
Ва2+ 4,8 8,4 Cd2+ 9,8 19,3 16,1 1
Y34- 11,4 22,2 Hg2+ 26,7 23,2 I
La3+ 10,5 19,6 15,8 Pb2+ 11,4 18,9 11,8 I
Lu3+ 12,2 22,6
20
Следует напомнить, что в выражение для константы устоичй-
I входят концентрации, а не активности компонентов реакции. о°СТ1Так называемые концентрационные константы, вычисленные С?Т° раствора с определенной ионной силой, равной 0,1 (они соот-^ствуют английскому выражению «conditional constants»). Эти БеТстанты не только легче определять, чем термодинамические Еонстанты, но они удобнее в применении на практике, потому что растворы,’подлежащие титрованию, всегда содержат какие-либо электролиты. В частности, при комплексонометрических титрованиях часто возникает необходимость добавления буферных растворов, при этом получается раствор с ионной силой около 0,1. Термодинамическими константами можно пользоваться только в тех случаях, когда известны коэффициенты активности всех присутствующих ионов, что, конечно, невыполнимо. При пользовании концентрационными константами следует знать, что в растворах с |.i<0,l значения Kmz немного больше, чем приведенные в таблицах, а в растворах с ц > 0,1 —наоборот, меньше. Константы устойчивости комплексов изменяются и в тех случаях, когда к титруемому раствору прибавляют полярные органические растворители, например спирт, ацетон или диоксан; такие добавки приводят к повышению устойчивости комплексов. Значения констант (см. табл. 2 и 3) зависят от температуры и, за небольшим исключением (комплекс магния с ЭДТА), уменьшаются с ростом температуры [63(80)]. Поскольку изменение энтальпии при реакции комплексообразования мало, этот эффект невелик и составляет около 0,01—0,02 единиц (для 1g Kmz) на градус.
В табл. 2 и 3, кроме ионов металлов, включен также ион водорода. Анион Z>_ каждого из пяти упомянутых комплексонов можег связывать несколько протонов, образуя, в соответствии с уравнениями отдельных стадий диссоциации, ионы HZ1_Z, H2Z2~?l, ..., в общем виде H,ZJ’_\ Приводимые в таблицах значения логарифмов констант образования этих «водородных комплексов» идентичны обычным значениям рК (так как логарифм константы образования равен отрицательному логарифму константы диссоциации):
[H7Z]
’g^HyZ-'g [Н] [Ну_,2] ~₽К'
Следует учесть, что индекс / означает число протонов, содержащихся в частице H3-ZJ_\ тогда как обычно индекс у рК численно равен абсолютной величине заряда частицы H3_1Zj_1_z. Так, в случае ЭДТА lg/CH4Z = рА4 равен отрицательному логарифму первой константы диссоциации свободной кислоты H4Y, 1g Дн3г = рА3 — ^трицательному логарифму второй константы диссоциации, рАг— Дицательному логарифму третьей и pKi — отрицательному ло-п Рифму четвертой констант диссоциации. Путаницы не может НРИЙИЗОИТИ’ еСЛИ пРинимать последовательность численных значе-вг констант такой, чтобы наибольшее значение рК всегда соот-твовало частице с наименьшим числом j протонов.
21
Из табл. 2 и 3 видно, что Кт НТА и Кт и Kh2z Других четырех кислот не характеризуют диссоциацию карбоксильных групп, поскольку значения рК для карбоновых кислот не превышают 5 Можно полагать, что при ступенчатом протонировании аниона ZK-Н+-ионы сначала присоединяются к атомам азота и только после образования аммониевых оснований происходит протонирование карбоксильных групп. Исследование инфракрасных спектров ЭДТА показало, что в ионах HY3- и НгУ2- имеются связи N—Н (соответственно, одна или две), а протонированные карбоксильные группы присутствуют только в H3Y~ и H4Y [63(25), 63(26)]. Эти результаты подтверждаются при изучении спектров ЯМР растворов аминокарбоновых кислот [63(23)]. Электронейтральные молекуль комплексонов имеют в растворе бетаиновую структуру, что пока4 зано приведенными выше структурными формулами, содержащими одновременно положительно заряженные группы аммониевого! основания и отрицательно заряженные карбоксильные группы] Этим объясняется небольшое значение рК карбоксильных групп так как последние приобретают сильнокислотные свойства под' действием положительно заряженных групп аммониевого основания, имеющихся в молекуле. Твердые свободные аминополикарбо-1 новые кислоты, по-видимому, ведут себя иначе [55(56)].
Если возникают сомнения в бетаиновом характере незаряженных молекул H?Z, то это вполне понятно, так как последние, как и молекулы всех аминокислот, обладают слабоосновными свойствами. Свободная ЭДТА присоединяет в сильнокислом растворе еще пятый и шестой ионы водорода к обеим ионогенным карбоксильным группам [60(193)], что позволяет найти значения рА частиц H3Y+ и H6Y2+ (см. табл. 2).
ГЛАВА lit
ОБРАЗОВАНИЕ И УСТОЙЧИВОСТЬ КОМПЛЕКСОНАТОВ
Процесс, происходящий при сливании раствора, содержащего ионы металла, и раствора комплексообразующего вещества, как правило, не может быть изображен уравнением (10)
MV+ + ZA_ —> MZ4’"’1 (10)
[которому соответствует уравнение (8) для вычисления константы устойчивости комплекса], так как свободные анионы начинают появляться в растворе только при pH 10. Например, при сливании раствора НТА, нейтрализованного щелочью (pH = 7), и раствора соли металла происходит следующая реакция:
MV+ + HZ2“ —> MZv-3 + H+ (11)
В процессе образования комплекса с металлом освобождаются ионы водорода и понижается pH раствора. Если раствор не обладает буферными свойствами, это понижение может составить несколько единиц pH.
При взаимодействии ЭДТА с солями металлов в зависимости от кислотности среды происходят следующие реакции [47(2)]:
при pH = 7-9: MV+ + HY3- —> MYv-4 + H+ (12)
при pH = 4-5: Mv+ + H2Y2- —> MY'v-4 + 2H+ (13)
В общем виде процесс комплексообразования может быть описан уравнением:
Mv+ + H7Z/-z —> MZV-X + /H+ (14)
Константа равновесия данного процесса может быть представлена следующим выражением:
[MZ] [Нр KMZ
К [М] [H/Z] xH/Z (15)
* 1g К = lg KMZ ~ kh/Z * (16)*
где lg«H/Z = pK1 + pK2+ ••• + pKf (16a)
“Формула, отмеченная звездочками (¥), внесена редактором.
23
Пользуясь уравнением (15), можно, например, вычислить кон станты равновесия реакций (11), (12) и (13) по данным, приведен ным в табл. 2 и 3.
Способность ионов 7)' присоединять протоны обусловливает зависимость свободной энергии комплексообразования от величи ны pH. Свободную энергию комплексообразования вычисляют исходя из значений эффективных констант комплексообразования (ЛмУн пРи Данной концентрации ионов водорода [Н]: f^eff ) [MZ1 t MzJH fM] fz]ZH
где [Z]^ = (2 [H;Z]) =aH(Z] \/=0 /Н
В уравнении (17) величина [Z]h означает общую концентрацик комплексообразующего вещества, не связанного с металлом, при концентрации ионов водорода [Н]. Эту величину можно вычислить если известно значение коэффициента распределения ан; послед ний определяют из следующего уравнения:
ан = 1 + [Н] KHZ + [Н]2 + [Н]3 Khz^h2z^h3z + • • • =
= 1 + 2 [HPeh z (18 /=i 1
Эффективную константу комплексообразования можно найти комбинируя уравнения (8), (17) и (17а):
Azeff \ kmz ан
Только в редких случаях сильнощелочных растворов (pH > 11] устойчивость комплексов можно характеризовать значениямиКмг (см. табл. 2 и 3). Почти всегда титрование проводят при значИ' тельно более низких величинах pH и устойчивость комплекса опре деляют с помощью констант 7(mz'. Эти константы вычисляют п уравнению (19), пользуясь значениями 1g ан, взятыми из табл и На рис. 2 графически представлена зависимость 1g ан от pH.
Таблица 4. Значения lgaH для аминополикарбоновых кислот при различных pH, вычисленные но уравнению (18)
(’7)
fl7a
(IS
pH 1 2 3 4 5 6 7 8 9 10 11 12 1
ЭДТА 18,0 13,5 10,6 8,4 6,5 4,7 3,3 2,3 1,3 0,45 0,07 0,01 J
ДЦТА 20,4 16,5 13,2 10,6 8,5 6,7 5,7 4,4 3,4 2,4 1,4 0,5' 1
НТА 11,2 8,6 6,9 5,7 4,7 3,7 2,7 1,7 0.8 0,19 0,02 0,001
ДТПА 22,7 18,3 14,6 11,7 9,6 7,2 5,2 3,3 1,7 0,70 0,14 0,0'
ГЭДТА 18,0 15,3 12,5 10,3 8,3 6,3 4,3 2,6 0,77 0,12 0,01 0,01’ г
24
, (.ACuY'l
[(/CznY')pH=5
количествах [(Д1пу')рн=2 = lo3,O; (^CuY')pH=2= 1°5’3];
трехвалентного железа в
[(apH=2= ""
Рис. 2. Коэффициент ан для НТА, ЭДТА и ДЦТА как функция концентрации нонов водорода:
1 - НТА 2 - ЭДТА, 3 - ДЦТА.
Вчияние кислотности среды на устойчивость комплексов можно стрировать несколькими примерами. Щелочноземельные ме-ИЛТы при добавлении эквивалентного количества ЭДТА в раство-тал с pH > Ю полностью связываются в комплекс, однако при Р?? g устойчивость полученных ассоциатов настолько мала l(№ff у') = Ю2’2; (АюаУ') == 104’2], что их нельзя больше титровать, поскольку для этого требуется, чтобы эффективная константа устойчивости комплекса была не меньше Ю6. Присутствие щелочноземельных металлов не мешает титрованию двухзарядных ионов тяжелых металлов при pH = 5, так как комплексы последних в таких слабокислых растворах еще довольно устойчивы = Ю10,0; (KcuY')pH=5= Ю12’3]. При pH = 2 комплексы двухвалентных тяжелых металлов образуются уже в незначительных но комплекс ------------- ------- 3 тех же условиях вполне устойчив = 1011’6], поэтому ионы железа (III) (и некоторые другие трех- и четырехзарядные катионы) можно определять весьма селективно в такой сильнокислой среде.
Из табл. 4 видно, что ан для ДЦТА при любых значениях pH больше, чем для ЭДТА, что обусловлено большим значением pAi у циклической кислоты. Поэтому эффективные константы устойчивости комплексов ДЦТА при pH < 10 вряд ли больше, чем у комплексов ЭДТА. Следовательно, в этом отношении дорогостоящая ДЦТА не имеет никаких преимуществ по сравнению с ЭДТА для практических целей; однако она сможет найти применение в аналитической химии, если будут использованы ее кинетические * свойства, причем основанные на использовании этих свойств методы таковы, что не мо-ЭдТдЫТЬ основань1 на применении
Но и уравнение (19) не дает точного выражения зависимости устойчивости комплексов от концентрации ионов водорода во всем интервале значений pH. Это объясняется тем, что комплексы аминопо-икарбоновых кислот с металлами Ут присоединять протоны (MZV-Z—►.
сильнокислом растворе мо-
в сильнокислом растворе мо-
—------ --------MHZ’v-*'-1’1), а в щелочном рас-
— гидроксильные группы [MZ’v-x~>MZ(OH),v-^-1]; при этом Имеется в виду скорость образования металлокомплексов. — Прим, перев.
25
Н+-ион присоединяется к карбоксильной группе, не являющейся лигандом, а ОН~-ион либо вытесняет из сферы лигандов карбоксильную группу, либо повышает координационное число цен-1 трального иона до 7 или 8 [49(1), 61(177)]. Поэтому устойчивость комплексонов как при низких, так и при высоких значениях pH изменяется меньше, чем это следует из уравнения (19). У комплексов двухвалентных металлов этот эффект возникает при pH < 3 и pH > 10, и его численная величина очень мала. То же самое имеет место для комплексов лантаноидов и актиноидов. Комплексы Alni I V111, FeIn, Biiri, Gairr, Inm, Tlrv, ThIV значительно более кислые [49(1)] и присоединяют гидроксильную группу уже в нейтральном растворе. Ионы этих многовалентных металлов, комплексы кото рых характеризуются очень большими величинами констант устойчивости (Amy > 1020), всегда титруют в сильнокислой среде, так как вследствие гидролиза только в таких условиях не связанный с хелатообразующим веществом металл может существовать i виде свободного катиона. В аналитической практике вообще избегают области pH, в которой MZ3~X переходит в MZ(OH)2~\ В свя-1 зи с этим нет необходимости в усложнении уравнения (19); в то же время образование и водородных, и гидроксокомплексов можно] количественно учитывать введением аналогичного ан коэффициен-1 та распределения [59(143), 63(64)].
Уравнение реакции (14) также не отражает процесс полностью! поскольку наряду с образованием комплекса MZV-X (с молярным соотношением 1 : 1) в исключительных случаях наблюдается образование комплекса MZ2~2?' (с молярным соотношением 1:2). Это в частности, происходит с НТА, анион которой может занимать только 4 координационных места. Большие многозарядные катио ны могут образовывать комплексы с молярным соотношением 1 :2 и с шестидентантным анионом ЭДТА, например ThY-l'. Свободная энергия связывания второго аниона хелатообразователя (т. е. кон станта равновесия Amz2 процесса MZ + Z<^MZ2) всегда очеш мала по сравнению с энергией связывания первого анионя (Amz » Amz2). Например, Дтьу=1023 и Атьу2 = Ю12 [52 (41)], т. е. образование комплексов MZ2 с ЭДТА не имеет значения для аналитической практики. Триэтилентетрамингексауксусная кислот тоже может образовывать комплексы с металлами с молярным соотношением 2 : 1 [62 (102), 63 (27)].
В комплексонометрии определяемый металл часто присутствуе в титруемом растворе не только в виде свободного иона Mv+ или хелатного комплекса MZV~X, но и в виде других комплексов, обра зованных этим металлом, например аммиачных, если титрованш проводится в аммиачном растворе (аммиак обычно прибавляю' к титруемому раствору для- понижения кислотности среды, но пр> этом в некоторых случаях может происходить осаждение гидро окиси металла). Другие вещества, применяемые для приготовле' ния буферных смесей, например ацетаты, тоже образуют комплзК
26
ионами Mv+. Для предотвращения выпадения гидроокиси сЫ С та иногда прибавляют к раствору тартрат, цитрат и другие WeT 1Лнения. Все эти вещества называются вспомогательными ком-соедн газующими веществами и обозначаются А?_. Реакцию ПЛеК о вещества с катионом Mv+, которая протекает всегда ступен-ТаК°Г можно изобразить уравнением, аналогичным уравнению (1):
л_ А^—
... Д—-> МА2~2Х
дЯ,—
-=± MAj“zz ...
А?'~ <
м
MA^“nX
(20)
^Соответствующие константы равновесия выражаются уравнениями, аналогичными уравнениям (5) и (6):
AMaz= [МА^ПА] (21)
ИмА‘= [мтг’=ПКмА/ (21а)
Подобно тому как ранее был введен коэффициент распределения, характеризующий, согласно уравнению (17а), водородные комплексы хелатообразующего вещества Zx~, в данном случае можно ввести коэффициент распределения Ра, описывающий комплексы иона металла Mv+ со вспомогательным комплексообразующим веществом А.
Общая концентрация металла, не связанного с аминополикарбоновой кислотой, выражается уравнением:
[М]' = [М] + [МА] + [МА2] ... = ^ [МАг] = ₽а 1М1 (22)
1=0
Коэффициент распределения ₽а вычисляют используя значения констант устойчивости, которые можно найти по уравнению (21а):
Ра = 1 + (А] хМА + [А]2кМА2 ... =1 + 2 [А]*Хма. (23)
z=i 1
Естественно, комплексы МА, с простыми лигандами устойчивы, чем комплексонаты MZV-X, поэтому при прибавлении хелатообразующего вещества в раствор с определенным значением pH, содержащий ионы металла и простой лиганд, происхо-ctv Реакция межДу различными комплексами МАг и продуктами
Упенчатой диссоциации аминополикарбоновой кислоты HjZ:
MZv-z +/А?/+/Н+ (24)
с Равновесие этого сложного процесса очень просто описывается “омощыо коэффициентов распределения ан и рА. Комбинируя
менее
MA^' + H-Z'^ 1 1
27
уравнения (8), (17а) и (22), можно получить следующее выражение для константы равновесия этого процесса:
ff [MZ]
*M'Z' [Mf [ZY анрд
(25)
Коэффициенты распределения Ра для NH3 можно легко вычис-1 лить по уравнению (23), исходя из величин констант устойчивости аммиачных комплексов, приведенных в табл. 1. В табл. 5 даны
Рис. 3. Коэффициент PNh3 как функция концентрации аммиака.
результаты таких вычислений; некотоД рые из этих результатов представлены также на рис. 3.
Аналогичным образом, если известны константы устойчивости тартратных л цитратных комплексов [57(148)], можно по уравнению (23) вычислить коэффициенты распределения ртартр и ₽ЦИтр и| определить эффективную константу устойчивости комплексоната MZ'v-*- в присутствии тартрат- и цитрат-ионов. Иногда, следует принимать во внимание также наличие ацетатных комплексов, если, например, титрование проводят в ацетат ном буферном растворе. Некоторые металлы (Cd2+, Pb2+, Hg2+) образуют комплексы с хлорид-ионами; в этом случае вычисляют коэффициент распределения pci- Большое число подобных коэффициентов распределения приведено в новой книге Андерса Рингбома [63(64)].
Возможно одновременное присутствие в растворе двух и более вспомогательны! комплексообразующих веществ. Для слу чая двух простых лигандов (обозначая
мых А и В) общая концентрация ионов металла, не связанных с комплексоном [М]', составит:
п I
[МГ ММ] + £ [МА.] + 2 [MBJ = рд, Е [М] (2Й
fl I
Pa в = 1 + 2 [-A]1 kMa. + 2 = Pa + Pb ~ 1 I2'
i-i 1 i=i 1
В том случае, когда к раствору прибавлен только один прости лиганд, в комплексообразовании всегда могут участвовать ОН" ионы, поэтому, в соответствии с уравнением (27), следует приба вить к величине рА, определяемой уравнением (23), вели1, (и (₽он—1); Рон также вычисляют по уравнению (23), принима [А] = [ОН] и има = хмон- Но практически почти во всех случи;
28
Таблица 5. Значения 1g PNHb Для некоторых металлов при различных р NH3 (р HN3 = — lg [NH3])
р NH3 0 1 2 3 4 5 6
Со2+ 6,1 2,2 0,5 0,05 0,01 0,00 0,00
Ni2+ 9,0 4,3 1,3 0,24 0,08 0,09 0,00
Сп2*- 12,6 8,6 4,9 2,0 0,94 0,26 0,03
Zn2+ 9,1 5,1 1,5 0,2 0,02 0,00 0,00
Cd2+ 7,2 3,5 1,1 0,1 0,01 0,00 0,00
Hg2+ 19,4 15,9 13,5 11,5 9,5 7,5 5,5
Ag+ 7,0 5,0 3,0 1,1 0,09 0,01 0,00
концентрация гидроксокомплексов в растворе достаточно мала, чтобы членами суммы |3он можно было пренебречь по сравнению с величиной Ра- Например, при увеличении pH гидроксокомплексы начинают образовываться лишь незадолго до выпадения гидроокиси металла; выпадения осадка можно избежать, если прибавить простой лиганд А, но при этом должно соблюдаться неравенство Ра Рон-
Наконец, рассмотрим случай титрования металла М в присутствии другого металла, образующего гораздо менее устойчивый комплекс с Z, чем М, и поэтому могущего присутствовать в растворе в сравнительно большой концентрации [например, титрование ионов тяжелого металла (Сп2+) в присутствии большого количества ионов кальция в слабокислой среде (в ацетатном буферном растворе)]. Не связанный с титруемым металлом М комплексон Z находится в растворе либо в виде протонированных анионов, либо в виде комплексоната кальция, и его распределение может быть описано с помощью величин ан [см. уравнение (18)] и оса. Коэффициент распределения аса вычисляется по уравнению
аСа = 1 + [Са] KCaZ (28)
Эффективную константу устойчивости комплекса MZ в присутствии ионов кальция и простого лиганда А (например, ацетата) в буферном растворе с определенным значением pH вычисляют по уравнению
Kmz
__ ___________
M'z' (ан + аса-ОРл
(29)
ГЛАВА IV
КРИВЫЕ КОМПЛЕКСОНОМЕТРИЧЕСКИХ ТИТРОВАНИЙ
Характерные особенности метода титрования лучше всего вы-J являются при рассмотрении кривых титрования. При комплексонометрическом титровании изменяется значение рМ. От резкости скачка рМ в точке эквивалентности зависят выбор подходящего] метода установления конца титрования (визуального, с помощью] цветного индикатора, или инструментального) и точность получае-1 мых результатов.
1. Наиболее простым случаем является прямое титрование ионов единственного металла М в буферном растворе, содержащем чаще всего один вспомогательный лиганд А. К раствору приливают из бюретки раствор соли щелочного металла какой-либо аминополикарбоновой кислоты. Нашей задачей является рассмотрение концентрации [М] ионов металла (следовательно, и рМ) как функции количества молей прибавленного хелатообразующего вещества, приходящегося на один моль металла.
Будем считать, что [М]< и [А]/, а также значения pH и ионной силы раствора не изменяются в процессе титрования, т. е. пренебрежем небольшим разбавлением титруемого раствора, происходя-! щим при добавлении раствора титранта. Введем следующие обо-| значения:
число молей титранта, приходящееся на 1 моль определяемого! компонента
общая концентрация металла
[М], = [М]'+[MZ] (31)
общая концентрация комплексона [Z], = «[M],= (Z]' + [MZ] (зл
Используя уравнения (25), (31) и (32), можно вычислить концентрации [М]', [Z]' и [MZ] для каждого значения а, а-используя еще и уравнение (22), можно рассчитать также концентрацию [М]
На рис. 4—10 приведены построенные на основании таких pad четов кривые титрования для случаев, когда в качестве титрант была взята ЭДТА. Вспомогательным лигандом был аммиак, коте
.. вместе с присутствующим в растворе хлоридом аммония обра-РЬ1Игвал буферную смесь с pH = 8—11. Было принято, что сумма 30Вцентраций ионов аммония и аммиака остается постоянной в Учение всего титрования и равна 0,1 моль!л\
[А]< = [NHJ + [NH3] = 0,1
Концентрация вспомогательного лиганда изменяется с изменением pH и может быть определена исходя из константы основности аммиака (рКнд = 9,3):
пН ........... 4 5 6 7 8 9 10 11 12
— 1g [А]...... 6,3 5,3 4.3 3,3 2,32 1,48 1,08 1,01 1,00
Выбранная общая концентрация титруемого металла [М]( равна Ю'3, поэтому кривые титрования при а = 0 начинаются от значения’ рМ = 3, если не происходит в заметной степени образования
Рис. 4. Кривые титрования магния раствором ЭДТА при различных значениях pH.
Рис. 5. Кривые титрования кальция раствором ЭДТА при различных значениях pH.
Рис. 6. Кривые титрования бария раствором ЭДТА при различных значениях pH.
присутствующим в растворе аммиаком. Од-
комплекеа металла с
нако если такой комплекс образуется, т. е. Ра, согласно уравнению (23), больше единицы, то при а = 0, [М]' = 10-3 и [М] = 10-3/рА значение рМ оказывается больше 3. Чем больше концентрация аммиака [А] и константа образования аммиачного комплекса хмай тем ольше становится Ра, следовательно, тем больше также значение Р н перед точкой эквивалентности, что приводит к уменьшению т ачка рМ в конечной точке. При титровании щелочноземельных ме-п ллов, когда образования аммиачных комплексов практически не Роисходит, кривые титрования начинаются при рМ = 3; с другой
Роны, в случае Zn, Ni и Си при pH > 7 значение рМ, соответ-
31
ствующее а = 0, возрастает с ростом pH. Из трех названных ме| таллов наиболее прочные аммиачные комплексы образует мед! (II), поэтому начальное значение рМ для Си2+ является наибольшим.
Следует обратить внимание на то, что [А] выше, чем [М](, только npJ pH 8. Тем не менее [А] есть величина постоянная вследствие того, что в рас-
Рнс. 7. Кривые титрования никеля Рис. 8. Кривые титрования ма I раствором ЭДТА при различных раствором ЭДТА при различи^ значениях pH. значениях pH.
творе присутствует большой избыток NH^-hohob и pH раствора остается nJ стоянным. Поэтому вычисление рА, ан и Кдр/' является простой задачей. П1 необходимости сохранять постоянное значение pH < 8 кроме аммиачного буфч ного раствора добавляют другой буферный раствор, обладающий достаточн! буферной емкостью для поддержания требуемой концентрации ионов водород Без добавления такого буферного раствора значение pH в процессе титровав
32
н । агг я, так как, в соответствии с уравнением (14), образование м дет т' ‘„ркса сопровождается выделением ионов водорода. деЗ jro
ч точкой эквивалентности (а > 1) значение рМ определяется
-очиг [ьно величиной эффективной константы устойчивости !I<Lh , гсМ уравнение (19)], так как практически весь металл нахо-А 1<7' L *• ------- /ГЛЛ/71 _. 1Л_.Ч\ и К0НцеНТрацИЯ
л Л Я в виде хелатного комплекса ([MZ] ~ 10~3) Д .IT'-'*
Рис. 9. Кривые титрования цинка раствором ЭДТА при различных значениях pH.
Рис. 10. Кривые титрования железа (III) раствором ЭДТА при различных значениях pH.
металла в растворе [М] не зависит от присутствия вспомогатель-иого лиганда. Чем выше значение pH, тем ниже, согласно уравнению (18), значение ан и тем больше величина №ff. Следовательно, качение рМ после точки эквивалентности увеличивается с умень-ением концентрации ионов водорода. Разумеется, это увеличение РМ pH > ю уЖе очень незначительно, так как и при pH = 10 зна-г. Н?е ап Для ЭДТА составляет лишь 2,8, а при дальнейшем повы-(''абИИ Щ'елочности раствора оно быстро стремится к единице
3
553
33
Из кривых титрования (рис. 7, 8 и 9) ясно видно, что при пре. ведении комплексонометрических титрований следует тщательно подбирать условия определений. Для того чтобы при титровании образовывался по возможности устойчивый комплекс и, кром-
того, скачок рМ был наибольшим, желательно проводить реакцию при высоких значениях pH. Это выгодно лишь при титровании ще лочноземельных металлов. При титровании ионов тяжелых метал( лов прибавленное в составе 6} ферного раствора вещество основного
характера (NH3) связывает в комплекс титруемый металл, вслед
ствие чего начальная ветвь кривой титрования располагается
выше
и скачок рМ в точке эквивалентности (при а = 1) уменьшается То же самое происходит и тогда, когда для повышения pH приме
няют не аммиак, а другие вещества основного характера, так к зи многие вещества, способные связывать протон, могут присое наняться к иону металла в качестве лиганда, т. е. могут играть роли вспомогательного комплексообразующего вещества и вызывать повышение значения рА. Даже при наличии акцептора протонов, не имеющего сродства к титруемому иону металла, невозможно суще ственное увеличение скачка рМ, так как в этом случае при повы шении pH к ионам металла присоединяются ионы гидроксила до тех пор, пока не наступает выделение гидроокиси металла. Теоре тически лучшими веществами для буферных растворов являются те, которые почти не образуют комплексов с металлом и предотвращают выпадение осадка гидроокиси. Таким требованиям лишь в какой-то степени отвечают аммиак и различные органические амины. Поэтому практические возможности комплексонометрии узко ограниченны.
Кривые титрования железа (III) (рис. 10) рассчитаны тольк< для низких значений pH, так как практически титрование всегда проводят в кислых растворах. Обычно при этом не добавляют him какого специального вспомогательного лиганда. Увеличение значе] ния рМ перед точкой эквивалентности при рН = 3 и 4 по сравнению с кривыми титрования при рН = 1 и 2 вызвано образованием гидр-оксокомплексов — значения констант образования этих комплексов используют для вычисления (Зон [51(1)] по уравнению (23).
Итак, на рис. 4—10 приведены кривые титрования ряда металлов. Кривые титрования многих других металлов можно найти, ис пользуя тот же самый метод расчета. Однако, если в качеств-вспомогательных лигандов применяют тартрат, цитрат или други; мало изученные вещества, часто бывают неизвестны величия констант образования соответствующих комплексов, необходимы-для вычисления коэффициента распределения рА. Значения неко торых из этих коэффициентов распределения можно найти в книг* Рингбома [63(64)].
2. Для того чтобы составить представление о селективно- 1 комплексонометрических титрований, рассмотрим кривые одновр-менного титрования двух металлов.
34
обозначим оба металла через М и М*. Для расчета кривых и^вания необходимо иметь значения пяти основных концентра-Г11Т“Р[М1', [М*]', [MZ], [M*Z] и [Z]'. Их можно определить, пользуясь изведенными ниже уравнениями (34—38), для любого значения а Определяемого уравнением (33)]:
число молей титранта, приходящееся на 1 моль определяемого компонента а =_______________________________
[МЬ+[МД
(33)
общие концентрации металлов
( [M],= [M]'+[MZ] (34)
i [м F = [мд + [M*z] (35)
общая концентрация комплексона
[Z], = [Z]' + [MZ]+]M’Z] (36)
эффективные константы устойчивости
f ^eff [MZ] (37)
( W [Zy I ,feff [M*Z]
(38)
I "m-'z' [MH'[Z]'
Легко предвидеть, как будет выглядеть кривая титрования, если устойчивости комплексов MZ и M*Z будут сильно различаться (Дмг' Дм*/'). Такой крайний случай мы можем рассмотреть на примере титрования железа (III) в присутствии кальция раствором ЭДТА при рН = 3. Для Ре3+-ионов на рис. 10 приведена простая кривая титрования. Для Са2+-ионов в таком растворе эффективная константа устойчивости комплексоната Дсау' примерно равна 1, т. е. кальций практически не связывается в комплекс, так что в процессе титрования рСа остается постоянным и равным —lg[Ca](. Следовательно, в этом случае, как и во всех случаях, когда эффективная константа устойчивости комплекса одного из . металлов очень мала (Дм*/' тровать другой металл.
-ЭД!Л при pH = 3 в присутствии меди (II), эффективная константа Устойчивости комплекса которой (ДсиУ'= Ю8’2) еще достаточно высока в кислых растворах. Первые порции прибавляемого раствора ЭДТА, естественно, связывают в комплекс ионы железа (Дг₽у' =
Л и кривая титрования выглядит вначале так, как будто медь отсутствует в растворе (рис. 10). Однако скачок pFe (до знания pFe = 9,3), указывающий на то, что все железо, содержащееся в растворе, связано в комплекс,
Давания чистого железа (III), так как на кривой имеется вто-
104), можно в его присутствии ти-
__Рассмотрим другой случай: титрование железа (III) раствором Устойчивости комплекса которой (Дсцу' = Ю8’2) еще достаточно высока в кислых растворах. Первые порции прибавляемого раствора ЭДТА, естественно, связывают в комплекс ионы железа (Дг₽у' = Л и кривая титрования выглядит вначале так, как будто медь отсутствует в растворе (рис. 10). Однако скачок pFe (до знания pFe = 9,3), указывающий на то, что все железо, содержа-тиДеСЯ в РаствоРе, связано в комплекс, меньше, чем в случае poi”' —--- -«чши zr\^..nо11), так как на кривом имеется вто-размытый скачок, который соответствует связыванию Си2+-
з*
35
ионов в комплекс CuY2-. Когда при дальнейшем титровании к присутствующим в растворе Сн2+-ионам прибавлено эквивалентное их содержанию количество ЭДТА, мЫ наблюдаем скачок pFe до значения (около 13), которое соответствует верхней границе скачка при титровании чистого железа (III) [см. рис. 10]. На всей кривой изменения pFe видны два скачка (эта кривая аналогична двум нижним кривым, изображенным на рис. 15). Величина рСи при титровании остается постоянной (и равной —lg[Cu]() до того мо-
ДО ДО 7,0 О
Рис. 12. Кривые титрования стронция и магния при их совместном присуя ствии при pH = 10.
Сплошные кривые изображают ход пзчЛ нения pMg, пунктирная кривая —ход изменения pSr. Соотношение Sr Mg для кр -вых А и В равно, соответственно, 1 J
10 . 1.
0,6 0,8 1,0
а
Рис. И. Кривые титрования кальция и магния при их совместном присутствии при pH = 10.
Сплошные кривые изображают ход изменения pMg, пунктирная кривая —ход изменения рСа. Соотношение Са : Mg для кривых А, В и С равно, соответственно, I : 1» 10 . 1 и 100 : 1.
мента, пока все железо не свяжется в комплекс с ЭДТА; посте этого она медленно повышается вплоть до наступления небольшого скачка в точке эквивалентности. Таким образом, если устойчивость комплексов обоих металлов сильно отличается друг от друга, но эффективная константа устойчивости комплекса второго металла все же довольно велика (Km*z'>106), на кривых титрования па; блюдаются два скачка рМ и один скачок рМ*. Если каким-либо методом, визуальным или инструментальным, удается зафиксир<л| вать оба скачка рМ или первый скачок рМ и скачок рМ*, то об* металла можно последовательно определять одним и тем же тиС1 рованием.
36
F пи комплексы металлов М и М* имеют примерно одинаковые к ктивные константы устойчивости, то оба металла при прибав-эфФе к ним ЭДТА образуют комплексы почти одновременно, и ЛеНИомУ после добавления эквивалентного количеству металла М п0Э?,чества ЭДТА скачка рМ не произойдет. Однако после прибавления количества ЭДТА, эквивалентного сумме [М]; + [М*]г (ри а = 1), происходит скачок как рМ, так и рМ*; любой из этих
-----!1—11--11—1।1—111—11____I 1------1
О,к 0,6 0,8 1,0 1,2
Рис. 13. Кривые титрования бария и магния при их совместном присутствии при pH = 10.
Сплошные кривые изображают ход изменения pMg, пунктирная кривая —ход изме нения рВа. Соотношение Ba : Mg для кривых А н В равно, соответственно, I : I и 10 :1.
Рис. 14. Кривые титрования кальция и магния при совместном присутствии в соотношении 1 : 1 при pH = 13. Сплошные кривые изображают ход изменения pMg, пунктирные кривые —ход изменения рСа. Кривые I рассчитаны в предположении, что Mg (ОН)2 не осаждается. Кривые 11 рассчитаны для случая осаждения Mg(OH)2 и установившегося равновесия с осадком.
скачков можно использовать для индикации конечной точки титрования суммы обоих металлов. Это явление имеет особое значение Для титрования щелочноземельных металлов. Кривые титрования этих металлов приведены на рис. 11—13.
При определении жесткости воды проводят титрование смеси альция и магния (см. рис. 11). Конечную точку титрования суммы эоих металлов почти всегда фиксируют по скачку pMg, так как я иона магния имеются лучшие индикаторы, например эриохром РНый Т. На рис. 11 видно, что скачок pMg очень резок даже в РИсутствии большого избытка ионов кальция.
37
Все сказанное справедливо и для случая титрования ионов кальция по методу вытеснения. К раствору, в котором определяют кальций, прибавляют комплекс ЭДТА с магнием (MgY2-). При этом Са2+-ионы вытесняют из комплекса эквивалентное количество Mg2+-noHOB, которые затем оттитровывают раствором ЭДТА. Таким образом, затраченное на титрование количество ЭДТА соответствует содержанию кальция в растворе.
Стронций, для которого тоже не найден хороший индикатор, также можно определять по методу вытеснения. К раствору прибавляют MgY2- и получают смесь строн
te
1—1 < 1- I .1 I I < I I I
О Q2 О,it 0,8 0,8 1,0 1,2 а
ция и магния, при титровании которой наблюдаются скачки pSr и pMg (см. рис. 12). Поскольку величины констант образования комплексов SrY2- и MgY2-очень близки, кривые изменения pSr и pMg почти совпадают при титровании равных количеств обоих металлов.
Аналогичным образом можно проводить титрование и тогда, когда фактически не происходит никакого вытеснения (см. рис. 13). Например, барий можно титровать в присутстви ииндикатора на магний после прибавления комплексона-та магния. Так как комплексонат бария менее устойчив по сравнению с ком плексонатом магния (ЛваУ < AmJt), Ва2+-ионы вытесняют Mg2+-nonbi лишь в очень незначительном количестве. Тем не менее при а= 1, кроме скачка рВа, наблюдается также скачок pMg, который можно использовать для установления точки эквивалентности.
На рис. 14 наглядно показано, что можно титровать не только сумму рис. 11), но также и кальций в при
Рис. 15 Кривые титрования цинка и бария при их совместном присутствии в соотношении 1:1 при pH = 11 и различных концентрациях аммиака.
[Znl^fBal^IO”3.
кальция и магния (с
сутствии магния. Эти катионы резко различаются по их сродству к иону гидроксила: константа устойчивости комплексного иона MgOH+ равна 380 [51 (12)], а комплексного иона СаОН+ —лишь 25(53(59)]. Поэтому при высоких концентрациях ионов гидроксила (например, при рН = 13) эффективная константа устойчи-i вости комплекса Mgy2- становится значительно меньше, чем такая же константа комплекса CaY2 , и при прибавлении к раствору эквивалентного содержанию кальция количества ЭДТА (при й=0,5) происходит отчетливый скачок рСа (см. пунктирную кривую I на рис. 14), который можно наблюдать, например, с помощью мурексида. Если при подщелачивании раствора до рН=13 выпадает гидроокись магния (произведение растворимости которой равно 10-10), то условия для титрования кальция становятся еше более
38
репринтными (см. пунктирную кривую 77 на рис. 14). Но вместе ®лаем результаты определения кальция в этом случае всегда ока-С Т аются пониженными, так как некоторое количество кальция со-осаждается с Mg (ОН) 2- Поэтому лучше проводить титрование в гомогенном растворе.
Титрование смеси двух металлов при переменном соотношении иллюстрируется рис. 15. Изображенные на этом рисунке кривые получены при титровании ионов бария по методу вытеснения (с добавлением комплексоната цинка) в аммиачном растворе. В табл. 2 приведены значения констант устойчивости комплексонатов ZnY2 и BaY2-; константа ZnY2- в 108’7 раз больше таковой для BaY2-. Однако, в то время как Ва2+-ионы не связываются аммиакам, Zn2+-HOHbi образуют очень прочные аммиачные комплексы, поэтому при добавлении к титруемому раствору амми
ака увеличивается рА для цинка и уменьшается, согласно уравнению (25), эффективная константа устойчивости комплексоната ZnY2'. Вследствие этого в растворе, содержащем около 1 моль[л аммиака, эффективные константы устойчивости комплексов ZnY2-и BaY2- приблизительно одинаковы. На рис. 15 показано влияние увеличения концентрации аммиака на ход кривой изменения pZn при титровании суммы ионов цинка и бария. При [NH3] = 0,1 значение ' Kzn'v' Ква'у', при повышении же концентрации аммиака
значения обеих эффективных констант сближаются, что приводит к исчезновению скачка pZn при a = 0,5. Однако при a = 1 на кривой титрования имеется скачок, который указывает на конец титрования суммы Zn и Ва. Таким образом, если к раствору бария прибавлен комплексонат ZnY2- и раствор подщелачивают аммиаком до концентрации последнего порядка 0,5—1 М, а потом титруюг раствором ЭДТА до появления скачка pZn (фиксируемого с помощью эриохрома черного Т), то по расходу комплексона можно определить содержание бария в растворе.
ГЛАВА V
ИНДИКАТОРЫ ДЛЯ КОМПЛЕКСОНОМЕТРИЧЕСКИХ ТИТРОВАНИЙ
В комплексонометрических титрованиях для обнаружения скачка рМ в точке эквивалентности обычно используют изменение окраски, обусловленное разрушением ранее образовавшегося ком.! плекса определяемого металла с индикатором. При этом в зависи-| мости от интенсивности окраски таких комплексов следует разлив чать два случая: 1. Окраска образовавшегося комплекса харак-| терна для самого комплекса [например, у роданидных комплексов железа (П1)]; эти комплексы слабо окрашены. 2. Индикатор является органическим красителем, способным образовывать ком плекс с металлом; в этом случае окраска обусловлена структур ными особенностями лиганда; такие комплексы интенсивно окра-j шены.
Кроме того, существуют флуоресцирующие соединения, способ ные образовывать комплексы с металлами и используемые в каче-i стве флуоресцентных-индикаторов. Наконец, имеются окислительно-восстановительные индикаторы, которые можно применять дл| установления точки эквивалентности в комплексонометрических титрованиях; при этом металл, скачок рМ которого фиксируется,, должен являться одним из компонентов окислительно-восстановительной системы. Таким образом, мы имеем четыре типа индикаторов, которые будут рассмотрены далее в соответствующих разделах этой книги. Наиболее важной является группа индикаторов — 1 комплексообразующих красителей, рассматриваемая во второе разделе настоящей главы.
1. ИНДИКАТОРЫ, ОБРАЗУЮЩИЕ СЛАБООКРАШЕННЫЕ КОМПЛЕКСЫ С МЕТАЛЛАМИ
Для индикации точки эквивалентности при комплексонометрИ' ческом определении железа (III) используют его способность обр? зовывать комплексы с рядом простых комплексообразующих в® ществ.
В первую очередь следует упомянуть роданид-ионы (7), которЫ образуют с железом (III) окрашенные в кроваво-красный цви [48(47), 60(161)] комплексы [Fe(SCN),]3-i. Эти, соединения мая устойчивы (см. табл. 6), поэтому к раствору рекомендуется пр>1* бавлять спирт или ацетон, препятствующие диссоциации указание
40
лексов. Значение pH раствора должно сохраняться между 2 К°3 для того чтобы величина 0он для железа была небольшой ** 60 (99)]. Поскольку роданидные комплексы слабо окра-
5 ны 'следует применять большой избыток NH4SCN, для того 1116 бы в конце титрования весь металл, еще не связанный в ком-4 с ЭДТА, присутствовал в виде окрашенных роданидных П мплексов. При приближении к точке эквивалентности обусловливая этими комплексами окраска становится все менее интенсивной и конечную точку очень трудно установить точно, так как образующийся при титровании комплекс железа с ЭДТА FeY-окрашен, к сожалению, в желтый цвет. При прибавлении эфира или пмплового спирта роданид железа экстрагируется этими растворителями, поэтому окраска переходит из водного слоя в слой органической жидкости [53 (18)].
Кобальт (II), образующий окрашенный в синий цвет роданид-
пый комплекс, тоже можно титровать, используя в качестве индикатора SCN_-noHbi в присутствии большого количества спирта или ацетона.
Общеизвестна реакция фенолов с хлоридом железа (III). Родственные фенолам вещества, например салициловая кислота (//) [55(23)], сульфосалициловая кислота (III) [52 (22), 60 (162)], З-окси-2-нафтойная кислота (IV) [61 (44)], тирон (V) [51 (5)] и бензгидроксамовая кислота (VI) [61 (103)], тоже образуют с ионами железа (HI) окрашенные соединения, представляющие собой весьма стабильные хелатные комплексы. Поэтому такие вещества можно применять в качестве индикаторов при комплексонометрическом титровании железа (III). Молекулы этих веществ содержат по две функциональные группы, способные координироваться с ионом металла с образованием пяти- или шестичленных хелатных циклов. Образующиеся комплексы индикаторов с железом (III) могут иметь состав нс только 1 : 1, но также 2: 1 и 3: 1 (в табл. 6 приведены данные об устойчивости всех этих комплексов).
Таблица 6. Логарифмы констант устойчивости водородных и железных комплексов индикаторов, образующих слабоокрашенные комплексы с металлами
№ Индикатор isKHJ te Ah2j s KpeJ 1S Kpej2 >S KFeJ3
I Родаиид-ион .... 2,3 1,6 -0,2
п Салициловая кислота . 13,1 3,0 15,8 H,7 7,5
III Сульфосалициловая кислота 11,7 2,7 14,4 10,8 7,1
V Тирон 12,6 7,7 20,7 15,2 11,0
IV Бензгидроксамовая кислота 8,8 — 11,1 9,4 7,4
Для обозначения анионов бесцветных индикаторов мы поль-• Мея буквой J, поэтому протонированные частицы, существующие
41
в кислом растворе, H2J или HJ:
Z\Z°H
I II '^/'^соон
II салициловая кислота (H2J)
будут изображаться
'OjS/^'cOOH
in
сульфосалициловая кислота (HgJ*-)
краткими формулами
/\ZVCOOH
1 5 ।
V\Z\0H
IV
З-окси-2-нафтойная кислота (HgJ)
s°,-
А/°н
II I
"OsS/^^OH
VI бензгидроксамовая кислота (HJ)
v тирон (h2j2~)
Салицилатные и гидроксаматные комплексы железа окрашены в красно-коричневый цвет, комплекс с оксинафтойной кислотой (с молярным соотношением 1:1)—в синий цвет, а комплексы с тироном — в зеленый (с молярным соотношением 1:1), фиолетовый (1:2) и светло-желтый (1:3) цвета. В противоположность металлохромным индикаторам важным отличительным признаком! всех перечисленных индикаторов является слабая окраска их ком-1 плексов (молярные коэффициенты экстинкции около 103); поэтому чтобы наблюдать эту окраску, необходимо применять индикаторы в концентрации, приблизительно в 10 раз превышающей концентрацию титруемого железа. Титрование проводят только в кисло? среде (рН = 1—4), так как при pH > 4 эффективные константы устойчивости комплексов металла с индикатором и с ЭДТА мало отличаются одна от другой.
На рис. 10 показаны кривые титрования железа (III) раствором! ЭДТА при общей концентрации металла 10~3 М. Десятикратный избыток индикатора в этом случае соответствует значению суммы [Н J]+[H2J], равному 10-2 М, и приблизительны!
расчет с использованием цифровых данных, приведенных в табл. 6,. показывает, что в упомянутой области pH и при данной концентра ции железа в растворе образуются в значительной концентрация! только комплексы состава FeJ и FeJ2. Исчезновение окраски этих комплексов при титровании наблюдается при уменьшении их концентрации приблизительно до 5 • 10-5 М, что соответствует значению pFe, которое лежит как раз в области скачка на кривых^ титрования, изображенных на рис. 10, т. е. конец титрования точно совпадает с точкой эквивалентности. Однако вследствие малой интенсивности окраски комплексов железа с индикатором точность титрования не слишком велика, так как несколько] процентов присутствующего в растворе железа могут существовать в виде комплекса с индикатором и тогда, когда наблюдаете! исчезновение окраски этого комплекса или (при обратном титр<И
42
тн) ее возникновение. Обусловленную этим ошибку титрования ВаН-но сильно уменьшить, если для определения конечной точки М°пменять фотометрический метод.
ПР Способность салициловой и сульфосалициловой кислот сбрасывать комплексы с железом (III) используют для определения 7f4+ Hf4+, Tb4+, Bi3+ и некоторых других многозарядных ионов медов методом обратного титрования избытка ЭДТА раствором Тсоли железа (54 (92), 60 (160)].
При определении висмута (III) прямым методом роль, аналогичную роданид-ионам для железа и кобальта, играют иодид-ионы (V//) [48 (7), 53 (58), 54 (6)] и тиомочевина (VIII) [54(44)]. Иодидные и тиомочевинные комплексы В13н-иона имеют довольно интенсивную желтую окраску, так что исчезновение этой окраски в результате образования комплекса металла с ЭДТА можно использовать для установления точки эквивалентности. Однако устойчивость и различимость окраски комплексов висмута с обоими индикаторами таковы, что метод опять-таки является недо-стяточно точным.
2. МЕТАЛЛ ОХ РОМНЫЕ ИНДИКАТОРЫ
Металлохромные индикаторы представляют собой органические красители, способные изменять свою окраску при образовании комплексов с металлами. По сравнению с описанными в предыдущем разделе металлиндикаторами они имеют ценное преимущество: интенсивность окраски их комплексов с металлами в 10— 100 раз больше (молярный коэффициент экстинкции 104—105). Поэтому отчетливое изменение окраски можно наблюдать при концентрации металлохромного индикатора порядка 10-6—10-5 М. При этом количество металла, связанного с индикатором, настолько мало (около 0,1% всего присутствующего количества металла), что при расчете результатов определения им можно пренебречь. Свободный индикатор также почти всегда окрашен (поскольку речь идет о красителе), так что конец титрования устанавливается не по исчезновению или появлению, но по изменению окраски. Только фталеины являются одноцветными индикаторами, но и у них окраска комплекса с металлом обусловлена структурными особенностями молекулы лиганда, причем эта окраска более интенсивна по сравнению с окраской металлокомплексов индикаторов, описанных в разделе 1.
Строение металлохромных индикаторов (общие сведения)
Металлохромные индикаторы, так же как и титранты, приме-емые в комплексонометрии, должны обладать способностью об-к Зовь1вать внутрикомплексные соединения, поскольку только та-Комплексы имеют удовлетворительную стабильность. Следо-ельно, молекула красителя должна содержать по крайней мере
43
два атома (О или N), которые в качестве лигандов могут координироваться с ионом металла и участвовать в обоазовании пятнили шестичленных хелатных циклов. Если хотя бы один атом-лиганд, связанный с металлом, в то же время входит в состав ауксохромной или хромофорной группы молекулы красителя, ю при комплексообразовании происходит изменение окраски. Конечно, присоединение иона металла вообще значительно меньше изменяет спектр поглощения красителя, чем присоединение протона, однако в большинстве случаев при образовании комплекса с металлом молекула красителя теряет один протон, и при эт^и изменение окраски часто бывает столь же резким, как и у кислотно-основных индикаторов.
Трифенилметановые красители
Характерным представителем этого большого класса краси телей, применяемых в качестве индикаторов, является бензаурин (IX). Интенсивная красная окраска аниона бензаурина обусловлена поглощением света электронами цепи сопряжения, состоящей из связанных через атом углерода колец А и В и атомов кисло рода, играющих роль ауксохромов и расположенных в пара-положении к центральному атому углерода. Стрелки показывают, что при смещении электронов бензоидное кольцо А превращается в хиноидное, а хиноидное кольцо В — в бензоидное. Оба состояния осуществляются одновременно, так что отрицательный заряд аниона распределяется поровну между обоими атомами кислорода.
IX
Краситель IX является
pH-индикатором, так как в
КИСЛО!
среде к атому кислорода присоединяется протон и окраска инди катера изменяется ог красной к желтой. Однако бензаурин в! применяют в аналитической практике, потому что как в сильно кислой, так и в сильнощелочной среде его окраска очень медление исчезает; в последнем случае вследствие присоединения ОН-группь к центральному атому углерода образуется бесцветный карбинол. Эту реакцию можно предотвратить, если ввести в бензолыю<‘ ядро С соответствующий заместитель в орто-положение к цент ралъному атому углерода. Так как кольцо С не участвует в цеп> сопряжения, обусловливающей окраску индикатора, такое зам® щепие не оказывает существенного влияния на эту окраску. Н&и
44
„ е эффективными заместителями являются атомы галогенов б°сульфогруппа. Например, молекулы сульфофталеинов содержат " положении 2" сульфогруппу, и это препятствует переходу инди-вяТора в бесцветный карбинол (сульфофталеины относятся к двух-ветным pH-индикаторам, которые в кислом растворе окрашены желтый цвет, а при повышении pH приобретают красную или сиНюю окрасу). У фталеинов положение 2" занято карбоксильной гоуппой, которая тоже препятствует образованию карбинола п •вязанному с этим обесцвечиванию красителя.
Как у фталеинов, так и у сульфофталеинов наличие алкильных заместителей в положениях 3,3' и 5,5' вызывает батохромное смещение области поглощения света; интервалы йерехода окраски при этом сдвигаются в сторону более высоких значений pH (ср. фенолфталеин с тимолфталеином и феноловый красный с тимоловым синим). Замещение галогенами в положениях 3,3' и 5,5' тоже вызывает углубление цвета, но переход окраски при этом наступает при более низких значениях pH (ср. феноловый красный с бромфеноловым синим).
Фталеиновые и сульфофталеиновые индикаторы практически не способны образовывать комплексы с металлами. Однако если в молекулу такого индикатора по соседству с фенольной оксигруппой (в положения 3,3' или 5,5') ввести заместитель, который, так же как и атом кислорода, способен координироваться с ионом металла (с образованием пяти- или шестичленного хелатного цикла), то получающееся соединение является металлиндикатором. Так как электроны ауксохромных атомов кислорода принадлежат к той электронной системе молекулы, которая обусловливает поглощение света, то понятно, что координирование металла с этими атомами оказывает влияние на окраску соединения. У большинства металлиндикаторов такого типа заместители, способные образовывать комплекс с металлом, имеются в обоих кольцах (и А, и В), хотя в принципе достаточно, чтобы молекула металлиндикатора обладала единственной способной к хелатообразованию структурной группой.
Среди заместителей, которые’ находясь в положениях 3,3' и 5,5', способны придать трифенилметановому красителю свойства хелатообразователя и металлиндикатора, прежде всего следует назвать окси-, карбокси- и метилениминодиацетатную группы. Ниже (см. формулы X, XI и XV) приведены примеры красителей, содержащих эти группы в указанных положениях и представляющих собой превосходные комплексонометрические индикаторы № (43), 54 (45), 54 (75), 54 (77), 54 (78), 56 (38), 56 (39), 56 (41), ° (84), 57 (72), 57 (79), 59 (28), 61 (2)]. В табл. 7 представлены Другие металлиндикаторы этого же типа с такими же или ана-Д°1ичными заместителями. Следует подчеркнуть, что в соедине-иях X—XVII, за исключением алюминона (XII), в кольце С в гп,Т°'Положении к центральному атому углерода имеются сульфо-Р/ппы или атомы галогена, которые препятствуют переходу инди-10ра в бесцветный карбинол.
45
т
Структурные формулы X, XI и XV дают представление о форме в которой краситель существует в сильнокислом растворе, гда карбоксильные, окси- и аминогруппы протонированы. В этих условиях цепь сопряжения, состоящая из центрального атома угле-рода, колец А и В и ауксохромных оксигрупп, оказывается положительно заряженной. В то же время сульфогруппы, которые и и сильнокислом растворе могут не присоединять протон, заряжены отрицательно. Таким образом, молекула красителя в сильнокнс-лом растворе представляет собой биполярный ион, обычно окрашенный в желто-красный цвет; при pH около 1 эта окраска переходит в желтую вследствие отщепления протона от одной из ауксохромных оксигрупп. При дальнейшем повышении pH до 7—8 вторая ауксохромная оксигруппа тоже отдает свой протон, в результате чего желтая окраска индикатора переходит в пурпуровою, фиолетовую или синюю. Отщепление протонов от карбоксильных групп соединений XI и X V в области pH 3—5 и от фенольных групп, находящихся в положении 3,3', соединения X [56 (38)], так же как и от азота в соединении XV при pH выше 8, не приводит к большому изменению окраски [60 (51)].
Комплексы индикаторов с металлами имеют ту же окраску, что и полностью депротонированные анионы красителей в сильнощелочном растворе (фиолетовую, синюю). При образовании этих комплексов особенно резкое изменение окраски происходит в тех случаях, когда при pH ниже 7 присутствующий в растворе в виде желтой протонированной формы краситель переходит непосредственно в темноокрашенный комплекс с металлом.
ОН ОН
н0\А А/он
X пирокатехиновый фиолетовый (НЩ)
соон соон
XI эриохромцианин R(H4F)
он
сн2—ООО"
СНг—N—Н
х'чсн2—соон
XV ксиленоловый оранжевый (ЩГ)
46
В качестве примера на рис. 16 представлены спектры поглоще-пирокатехипового фиолетового при различных значениях pH, н”я h/Ke еГо комплекса с висмутом.
атомами кислорода
с
2,5
2,0
1,5
0,5
<О
ID
°100 500 EDO 700
Л, нм
Рис. 16. Спектры поглощения пирокатехииового фиолетового:
1 — сильнокислый (pH < 0) раствор (H4F); 2 — слабокислый
(pH 5) раствор (H3F); 3 — слабощелочной (pH ~ 8,5) раствор (HgF); 4 — комплекс с висмутом (Bi2F).
Мс гекула со структурой X обозначена H4F в соответствии с наличием в ней рх .«ходящих в состав фенольных групп атомов водорода. В анионе H3F~ I ' ' ТЫр у у
онирован один из двух ауксохромных атомов кислорода, в Н2г оба эти а свободны от протонов. В синем комплексе красителя с висмутом Bi2F2+ '' пьтй атом металла, как мы полагаем, координирован КЯного из колец А или В. При образовании ком-°текса pii2F2+ в качестве промежуточного про--кта образуется также быстро исчезающий ком-текс с молярным соотношением 1 : 1, фиолетовую пкпаск' которого можно наблюдать при комплек-сонометрическом титровании висмута в присутствии пирокатехииового фиолетового непосредственно перед точкой эквивалентности.
Молекулы индикаторов XVIII, XIX и XX (табл. 7) содержат карбоксильные группы. Эти индикаторы — собственно фталеины, производные известных кислотно-основных индикаторов — крезол-и тимолфталеина. Один из них — металл-фталеин (XVIII) является первым соединением, на примере которого было показано, что введением метилениминодиаце-татных групп в молекулу рН-индикато-ра можно превратить его в рМ-индика-тор [53(1)].
В отличие от сульфофталеинов, содержащих в положении 2" сульфогруппу, фталеины могут образовывать лактонное кольцо, в котором кислород карбоксильной группы, находящейся в положении 2", присоединяется к центральному атому углерода. Это происходит тогда, когда ауксохромные атомы кислорода в кольцах Л и В (в положениях 4 и 4') протонированы, т. е. в кислом растворе. Лактоны, так же как и карбинолы, бесцветны ввиду того, что и в тех и в других невозможно образование цепи сопряжения, обусловливающей окраску, и поэтому фталеины, в противоположность сульфофталеинам, яв-яются одноцветными индикаторами. В кислом растворе они бес-ветны, и лишь при повышении pH гидроксильные группы в положениях 4 PJ ntX/'in'ZXTTT Г ГТ Л а» л л
крывается Цвет.
11О?ТИ пР0Цессы можно рассмотреть более подробно на примере ,еталлфталеина (XVIII).
теряют протоны, лактонное кольцо рас-и индикатор окрашивается в красный или синий
47
Таблица 7. Мет ал л индикаторы, имеющие структуру типа IX*
№ Расположение заместителей Назв ание Определяемые металлы Литер ату f ।
X 3 - ОН, 3' - он, 2" - £О3Н Пирокатехиновый фиолетовый Th, Ga, In, Bi 54(75), 54(77) 54(78), 56 (ЗЛ 56 (41), 56 (8 \
XI 3 - СООН, 5 - СН3, 3'—СООН, 5'—СН3, 2" - SO3H Эриохромциа-нин R Al, Zr, Th, Fe 53(43), 54(15, 57(72), 59(:'b)
XII 3-СООН,3'-СООН, 3"-СООН, 4" -ОН Алюминон Al 61 (2)
XIII 3 - СООН, 5 - СН3, З'-СООН, 5'—СН3, 2" — Cl 3"--SO3H, 6" -Cl Эриохромазу-рол S Ca, Sr, Ba, Al, Zr, Fe, Cu 55 (26), 55 (27). 55(29), 55(30', 55 (31), 56 (28), 59 (14) 1
XIV 3-СООН, 5 —СН3, З'-СООН, 5'-СН3, 3"—Az, 6"-Cl Хромоксан зеленый GG Mg, Ca, Th, V, Ni, Cu , 57 (32)
XV 5 —mim, 3 —СН3, 5' — mim, 3' — СН3, 2" - SO3H Ксиленоловый оранжевый Al, лантаноиды, Th, Sc, Y, Zn, Cd, Hg, Pb, Bi 56 (39), 57 (79), 57 (137)
XVI 5 —mim, 3 — CH, 3'-CH3, 2''—SO3H Семиксиленоловый оранжевый 62 (18)
XVII 5 — mim, 3 — isopr, 6 — CH3, 5' — mim, 3' — isopr, 6' — CH3, 2" - SO3H Метилтимоловый синий Pd, Pb, Sn, Sb 57(61), 58(34)
XVIII 5 — mim, 3 — CH3, 5' — mim, 3' — CH3, 2" - COOH Металлфталеин Ca, Sr, Ba 53 (1), 57 (50), 58(2)
XIX 5 — mim, 3' — isopr, 6—CH=, 5'—mim, 3'—isopr, 6'—CH3, 2"-SO3H Тимолфталексон Ca, Sr, Ba 59 (46)
XX 5 —gl, 3 —isopr, 6-CH3, 5' —gl, 3' — isopr. 6' — CH3, 2" - SO3H Г лицинтимоло-'вый синий Cu 58 (50)
* Расшифровка встречающихся в таблице сокращений дана в разделе «Об' иычм принятые в книге>, — Прим» ред»
СНз сн3
„ r но\ A
НООС—Н2СХ I || I II /СН2-СООН
нА-н,с/)/\с/'^\сн<_Ан -ООС-Н2С/ " |jZ Асн2—сосг
АА\С/
XVIII металлфталеин (HgF)
Приведенная структурная формула индикатора соответствует незаряженной молекуле (биполярному иону), присутствующей
рис. 17. Спектры поглощения различных продуктов ионизации металлфталеина, а также его комплексов:
/~F6~; 2-Ba2F2“; 3-Ca2F2“ 4-Mg2F2-; 5-Zn2F2-; 6-H2F4-; 7~HFS-.
^нльнокислом растворе, которую обозначают сокращенной фор- ;Лои H6F в связи с тем, что в ней имеются 6 кислотных протонов. ,ЛИ. PH = 3 от карбоксильных групп отщепляются ионы водорода 1п6г _> H4F2\), но раствор остается бесцветным. При pH = 7—8 п^екула теряет следующие два протона (H4F2- —>II2F4~), что со-Р°ио>кдается появлением розовой окраски, присущей аниону H2F4~
4 iaK 553 49
(спектр поглощения этого аниона изображен на рис. 17, кривая С) Остающиеся еще в анионе Н2Г4- кислотные атомы водорода обрЛ зуют водородные мостики между ауксохромными атомами кисли, рода и атомами азота иминодиацетатных групп. Лишь при pH от 11,5 до 13 происходит полное депротонирование индикатор^ (H2F4-—> HF5-—> F6-); при этом коэффициент экстинкции приобрел тает высокие значения, что является типичным для производньц бензаурина (рис. 17, кривые 7 и /). Комплексы индикатора с С<( Sr, Ва окрашены почти так же интенсивно, как и полностью де протонированный анион F6- (рис. 17); однако комплекс с магние. окрашен значительно слабее, комплекс с цинком практически бес. цветен (см. спектры поглощения комплексов магния и цинка нц рис. 17), и комплексы с тяжелыми металлами тоже практически бесцветны. Поэтому металлфталеин является хорошим индикатс ром только на щелочноземельные металлы. Определения проводя при pH от 10 до 11,5, так как в таком растворе индикатор окрашец< в слабый розовый цвет, а прибавление Са2+-, Sr2+- или Ва2+-ионо вызывает появление глубокой фиолетово-красной окраски.
В табл. 8 приведены индикаторы, относящиеся к тому же клас су трифенилметановых красителей, но имеющие общую структур-типа XXI:
XXI
Эта структура отличается от структуры IX лишь кислородны I мостиком между кольцами А и В (соединяющим положения 2 и 2'). В кольце С в орто-положении к центральному атому углерода co-j держится, так же как и у индикаторов типа IX, одна сульфо- ил' карбоксильная группа.
Индикаторы пирогаллоловый красный (XXII) и бромпирогал-ловый красный (XXIII) по своим свойствам аналогичны пирокатехиновому фиолетовому (X). Их кислые растворы окрашены Б желтый цвет, а при отщеплении протонов от ОН-групп (при соответствующем повышении pH или при образовании комплекса с таллом) окраска переходит в красную или фиолетовую. Следов-1 тельно, глубоко окрашенные формы соединений XXII и XXIII ПЧ глощают в более коротковолновой области, чем аналогична формы индикатора X, так как кислородный мостик между атома я углерода 2 и 2' обусловливает гипсохромный эффект.
В веществах XXV и XXVI имеются такие же или аналогична заместители, как в металлфгалеине (XVIII). Flo в противополо^ 50
типа 8- Металлиндихаторы, имеющие структуру типа XXI*
—- Расп о пожен не заместителей Название Определяемые металлы Литература
V// з - ОН, 3' - он. 2" - SO3H П ирогаллоловый красный Лантаноиды, Th 5С (85). 56 (88), 56 (90), 56 (92), 59 (20)
VY/// з-OH, 5—Вг, З'-ОН, у—Вг, 2" — SO3H Б ромпирогалло-ловый красный Со, Ni, Pb, Bi 56 (90), 56 (91), 59 (20)
X.Y/P 3 _ ОН, 3' - ОН, 2" — СООН Г аллоцианин ** Ga 55 (79), 60 (13), 61 (30), 61 (31), 61 (32), 62 (30), 62 (31)
XXV 3-mim ***, 5-mim***, 2"-СООН Кальцеин Са, Sr, Ba, Мп 58 (47), 58 (52), 58 (54)
XXVI 3-mgl***, 5-mgl***, 2" - СООН Метилкальцеин Са, Sr, Ba, Мп ,59(11), 62(50)
* Расшифровка встречающихся в таблице сокращений дана в разделе «Обозначения принятые в книге».— Прим. ред.
** Общепринята следующая структурная формула галлоцианина:
ОН
<CH4N\^\/°\Jb°
СООН Прим. ред.
*** Положение этих групп в молекулах еще точно не установлено [59 (144)J.
ность бесцветному металлфталеину кальцеины в кислом растворе окрашены в желто-зеленый цвет, так как их карбоксильная группа, находящаяся в положении 2", не образует в кислой среде лактонного кольца с центральным атомом углерода, но лишь слабо протонируется. При добавлении щелочноземельных металлов, особенно кальция, окраска этих индикаторов при соответствующем pH переходит в темно-желтую или коричневую, в то время как комплексы щелочноземельных металлов с металлфталеином окрашены в красный цвет. Различие в окрасках опять-таки объясняется наличием кислородного мостика между атомами углерода 2 и 2'.
Основная структура кальцеина, лишенного заместителей в положениях 3 и 5 (т. е. структура XXI с карбоксильной группой в положении 2"), идентична структуре флуоресцеина, имеющего характерную желто-зеленую флуоресценцию в области средних ачений pH. Кальцеин и метилкальцеин также флуоресцируют, и
Щелочном растворе наблюдается большое различие в интеНсив-чет™ Флуоресценции свободного индикатора и его комплекса с <1 ,наллоы- Поэтому точку эквивалентности, например, при опреде-ии Са2^-ионов прямым или обратным титрованием, можно
51
установить по исчезновению или по появлению флуоресценции, особенно при наблюдении в ультрафиолетовых лучах (см. раздел 3 этой главы). Имеющиеся в продаже препараты кальцеина, ищ флуорексона, чаще всего содержат, к сожалению, довольно мною' незамещенного флуоресцеина, что сильно мешает установлению точки эквивалентности с помощью названного металлохромною индикатора.
Азокрасители
В азокрасителях ароматические ядра связаны друг с другом че рез азогруппы —N=N—. В орто- или пара-положении к хромофорной азогруппе расположены ауксохромные заместители, чащ, всего окси- или аминогруппы (первичные, вторичные или третичные). Все азокрасители являются кислотно-основными индикато рами (например, у технических азокрасителей изменение окраск должно происходить только в сильнокислой или сильнощелочно области). Причина изменения окраски этих соединений в зависимости от кислотности среды заключается в том, что при понижении pH происходит присоединение протонов к ауксохромный окси- или аминогруппам или к атому азота азогруппы" +
(R—N=N—R->R—N=NH — R), а при повышении pH протекаем обратный процесс.
Азокрасителю можно придать способность образовывать комплексы с металлами, если в его молекулу ввести группы, могущие играть роль лигандов, причем таким образом, чтобы при компля ксообразовании могли возникать пяти- или шестичленные хелатные циклы. Если в число лигандов входит ауксохромная группа, комплексообразование влияет на окраску получающегося соединения! при этом, если ион металла связан также и с азогруппой, наблю дающийся переход окраски бывает исключительно четким. Связь азогруппы с металлом обеспечивается введением заместителей, играющих роль лигандов, в орто-положение к азогруппе. У многих металлохромных азоиндикаторов орто-положения заняты окси группами (о, о'-диоксиазокрасители), причем эти группы являютс одновременно и ауксохромами, и лигандами. В отдельных случая в качестве лигандов, находящихся в орто-положении к азогруппе выступают группы —СООН или —AsO3H2.
В качестве примера рассмотрим подробнее индикатор эриохром черный Т, упоминавшийся выше в разделе о комплексопометриче-ских титрованиях [46(2), 48(4)] и являющийся, пожалуй, наиболв часто применяемым металлохромным индикатором. Его структур ная формула, изображенная ниже, соответствует окрашенной! красный цвет форме, в которой индикатор присутствует в раствор при рН<6. Эта форма индикатора, коротко обозначаемая Ня отрицательно заряжена вследствие наличия в молекуле ионизиря ванной сульфогруппы, которая придает красителю способное!! растворяться в воде. Два атома водорода в сокращенной формул!
52
ачают протоны оксигрупп, отщепляющиеся при подгцелачи-°б°ЗН раствора: при pH = 6,3 красная форма H2F_ переходит в си-которая при pH =11,5 переходит в желто-оранжевую НК" эстью' депротонированную форму F3-. Металлокомплексы окра-ПС ы в красный пли фиолетовый цвет, и переход окраски при их ^пазовании особенно резок, если реакция происходит в интервале 7______н, отвечающем существованию формы HF2-, так как при
Р м синяя окраска раствора переходит в красную. Для аналитической практики имеют значение лишь комплексы с молярным соотношением 1.1.
no2 no2
эриохром черный Т (H2F )
металлокомплеке эриохром а черного Т (MF~)
так как при тех малых концентрациях индикатора и ионов металла, которые соответствуют конечным точкам комплексонометриче-ских титрований, комплексы с молярным соотношением 1 :2 образуются в столь незначительном количестве, что их можно не учитывать. На рис. 18 изображены спектры поглощения продуктов ионизации эриохрома черного Т в отсутствие металла, а также магниевого комплекса красителя.
Комплексообразующие азокрасители вообще очень многочисленны, поскольку они могут быть производными как бензола, так и нафталина, и, кроме того, число мест, по которым возможно замещение в этих молекулах, довольно значительно, так что даже при использовании немногих заместителей получающиеся соединения оказываются весьма разнообразными.
До настоящего времени пробовали применять в качестве метал-похромных индикаторов примерно 100 азокрасителей. Те из них, которые, согласно литературным данным, уже используются на практике, перечислены в табл. 9.
Большинство из них (тридцать восемь) составляют моноазокра-сители, являющиеся производными бензола или нафталина, при-чем в последних азогруппы могут располагаться как в а-, так и в P-положении. Из этих 38 индикаторов 26 являются о, о'-диокси-Вз°красителями, образующими связи с металлом аналогично эрио-рому черному Т. Три индикатора являются о-окси-о'-карбоксиазо-Расителями, в которых ион металла координируется с атомом кис-к^Рода карбоксильной группы, атомом азота азогруппы и атомом
Сл°рода оксигруппы. В двух индикаторах XXX VIII и LIV по ^-седству с азогруппой расположена группа — AsO3H2, что , с°бствует образованию комплексов с многозарядными ионами
53
Л, нм
Рис. 18. Спектры поглощения эриз-хрома черного Т:
7-pH ~ 5(h2F“), 2 — pH ~ 8 (HF2-);
3 — pH — 13 (f3-), 4 — комплекс с магнием
тяжелых металлов, например с Тп4+-ионами. В индикаторах XXXV и XXXVII содержатся метиленглициновая и метилениминодпац,. татная группы, которые вместе с оксигруппами, расположении? в пара-положении к азогруппе, участвуют в связывании ион, металла.
Из этих 38 индикаторов чаще всего применяются эр j SE (XLV), эрио A(LVI) и, конечно, эриохром черный Т(2./Я Прекрасным индикатором, пользующимся большой популярностью является калмагит (ХАА/рЯ имеющий перед эриохромом чеЯ ным Т то преимущество, что ею водные растворы более устойчи вы. Применение калькона (LV особенно оправдывает себя при титровании ионов кальция в при сутствии ионов магния при pH « = 12. Для определения кальшц обстоятельно исследовано такая применение индикатора CAL-красного (LVII).
Дисазокрасители LXV—LXI и трисазокраситель LXX имею небольшое применение в аналитической практике.
Индикаторы LXXI—LXXVIяр ляются производными пиридина, в которых азогруппа располож. на по соседству с атомом азот< пиридина и, кроме того, в ортоположении к оксигруппе, находя щейся в ароматическом ядре При взаимодействии этих инди
каторов с ионом металла образуются два пятичленных хелатных цикла, как видно из приведенной ниже структурной формулы комплекса ПАН (LXXIII) с медью:
N—=N--\
Так как при этом в образовании связей с металлом участвую два атома азота и лишь один атом кислорода, индикаторы боле селективны, чем о, о'-диоксиазокрасители, у которых координируются с металлом два атома кислорода и один атом азота. Ос( бенно устойчивы комплексы пиридиновых азоиндикаторов с
54
никелем, медью, цинком и кадмием; со многими другими б;|ЛЬ нами например с марганцем, свинцом и висмутом, обра-bjTII° непрочные ассоциаты. Молярные соотношения металла и 3>1°Тителя в комплексах могут быть как 1:1, так и 1 :2. Свобод-*'РаСкрасители в нейтральной или слабокислой среде окрашены в нЫетЫй цвет, а их металлокомплексы имеют окраску от красной ^'^иолетовой. Особенно интенсивно окрашены (и исключительно Устойчивы) медные комплексы.
У В связи с этим целый ряд металлов можно определять обратим титрованием избытка ЭДТА стандартным раствором CuSO4 в присутствии ПАН (LXXIJI) [или ПАР (LXXI)].
Комплексы металлов с ПАН обычно очень плохо растворимы, поэтому при прямом титровании конечная точка получается размытой, так как образующиеся осадки не успевают растворяться в момент появления избытка ЭДТА в растворе. Комплексы с ПАР растворимы лучше. Другие приведенные в табл. 9 пиридиновые азокрасители мало применяются в аналитической практике.
Азоксины (LXXVII—LXXXIII) содержат в качестве одного из компонентов красителя 8-оксихинолин (оксин), в котором атом кислорода оксигруппы и атом азота хинолина способны координироваться с металлом. Эти индикаторы при присоединении металла изменяют свою окраску от красной к желтой. Образующиеся при этом комплексы в большинстве случаев слишком мало устойчивы, чтобы их можно было использовать в комплексонометрии. Хорошие результаты получаются только при прямом титровании Zn2+- и Си2+-ионов, а также при обратном титровании избытка ЭДТА раствором соли меди при определении какого-либо другого металла.
Тиазолилазофенолы (LXXXIV— LXXXVIII) обладают свойствами, аналогичными свойствам пиридиновых азокрасителей, и могут быть использованы в анализе так же, как ПАР и ПАН. Свободные индикаторы при pH = 7 окрашены в желтый цвет; при прибавлении щелочи их окраска переходит в красную или фиолетовую, так как при этом оксигруппы, расположенные в орто-положении к азогруппе, теряют свои протоны. Металлокомплексы тиазолилазофенолов окрашены в красный, синий или 'фиолетовый цвет. В присутствии этих индикаторов Со2+-, Ni2+-, Cu2+-, Zn2+- и pb +-ионы можно непосредственно титровать в области pH = 4—7, а ионы ряда других металлов можно определять обратным титро-та.н’1ем избытка ЭДТА Си2+-ионами. Особенно удобен индикатор AN-6-S, так как, в связи с присутствием сульфогруппы в его мо-* екуле, его металлокомплексы наиболее растворимы.
Эриохром красный В (LXXXIX) представляет собой сульфиро-нный р-нафтол, соединенный через азогруппу с фенилметилпира-лоном; енольная форма последнего содержит обладающую кис-„°Тным характером оксигруппу, расположенную по соседству с ^группой. Поэтому эриохром красный В по свойствам близок т ’°-Диоксиазокрасителям. Индикатор имеет желтую окраску, ко-Рая переходит в красную при прибавлении ионов металла.
55
СП О
Таблица 9. Металлиндикаторы, относящиеся к классу азокрасителей*
Основная структура и расположение заместителей
Название
Определяемые металлы
Литература
5_6 2' 3' 4<^ N = N—^>4'
П $5'
XXVII 2-ОН, 3-SO3H, 5-С1, 4'—ОН, б'-ОН Омега хром темно-красный (гранатовый) N1 57 (43)
XXVIII 6-СООН, 2'— ОН, 5'-СН3 Хром бордо В Са, Mg, Zn 58 (115)
XXIX 3-SO3H, 4-ОН, 5—SO3H, 2’~ ОН, 3' - ОН, 4' - ОН Хром коричневый RR Th 60 (55)
5_6 2£3' 4<^ ^>—N = N— \^ /4'
О , Г 6' •
XXX 6 - СООН, 2' - ОН, 3' - SO3H, & - SO3H Лаковый алый (пурпуровый) С Са 57 (109)
XXXI 3 - Cl, 5 - SO3H, 6 - ОН, 2' - ОН Магнезон С a, In 57 (43)
XXXII 3 - SO3H, 5 - NO2, 6 - ОН, 2' - ОН Ализариновый хром черный R Feill, Bi, Th 57 (43)
XXXIII 3 - SO3H, 6 - ОН, 2' - ОН Хром фиолетовый для меха Mg, Ca, Sr, Ba, Mn, Zr 58 (91)
XXXIV 3-СН3, 6-ОН, 2'— ОН, 4'— SO3H Калмагит Mg, Йа 60(134)
XXXV 2 - ОН, 4 - ОН, 2' - ОН, 4' - SO3H Сульфонафт олдзоре-зорцин Zr
_ _ХХХУ7_ 4 - SO3, X t;l, 4'-ОН Г ищиннафтоло ыи 1 Фнолвфиый Mr C , Co 59 (17 \
1 1 11 // / 4 — NO2, 3r — mim, 4' — OH Нафтоловый (Ьиолето- 1 вый Mg, Мп, Со, Cu, Zn, \ Cd, Bi 57 (81)
xxxvm / 6-AsO3H2, 2z-OH, 3'-SO3H, 6'-SO3H 5 6 4^ V-N = N x2' < * \^/ \У\Х\7' 5 2 vl II lR' 4' 5' Торин Bi, Th, U 60 (17)
XXXIX l'-OH, 3'-SO3H, 6'-SO3H, 8'-OH Хромотроп 2R Th 61 (37)
XL 4 - SO3H, 1' - OH, 3' - SO3H, 6' - SO3H, 8'-OH SPADNS Th, Zr 55 (92)
XL1 6 - COOH, V - OH, 3' - SO3H, 6'-SO3H, 8' -OH Хромотроп 2С FeHI, Th, Zr 60 (41)
XLII 6 - OH, 1' - OH, 3' - SO3H, 6' - SO3H, 8'-OH Кислотный хром темносиний Mg, Ca Zn 58(9), 60(87)
XLII I 4 — NO2, 6-OH, l'-OH, 3'.-SO3H, 6'- SO3H, 8'-OH Эриохром зеленый Н Ca, Ga 57 (43)
XLIV 3-SO3, 6-OH, l'-OH, 3'-SO3H, 6' - SO3H, 8' - OH Кислотный хром синий к Mg, Ca, Mn, Cd, Pb 58(9)
XLV 3-C1, 6-OH, l'-OH, 3'-SO3H, 6'-SO3H, 8'-OH Эрио SE Mg, Ca, Mn, Ni, Zn, Cd, Pb 58 (8), 58 (35), 61 (120)
XLVI 3-NO2, 5 —Cl, 6-OH, l'-OH, 3'-SO3H, 6'-SO3H, 8' —NH2 Г аллион Ga 60 (191)
XLV II 3-C1, 5 —SO3H, 6-OH, l'-OH, 5' —SO3H Эриохром фиолетовый Mg, Ca, Mn, Ni, Zn, Cd, Hg, Pb 61 (126)
XLVIII 3 - Cl, 6 - OH, 1' - OH, 4' - SO3H Кислотный хром фиолетовый В Fell I 57 (43)
XLIX 3-C1, 5 —SO3H, 6-OH, l'-OH Хром прочный синий RLL Ca, Sr, Ba, Ni, Cd 57 (43)
Расшифровка встречающихся в таблице сокращений дана в разделе «Обозначения, принятые в книге». — Прим. ред.
№ Основная структура и расположение заместителей
L 2 - Cl, 3 - Cl, 5 - Cl, 6 - ОН, Г - ОН, 4'—SO3H
LI 2 - Cl, 3 - Cl, 5 - Cl, 6 - ОН, 1' - OH, b'-SO3H, T- SO3H, 8'-NH2
LII 2-Cl, 3 — Cl, 5-Cl, 6-OH, l'-OH, 5'—SO3H, 8'-NH—CO—CH3
LIU 3-SO3H, 4-OH, l'-OH, 5'-OH
LIV 6-AsO3H2, l'-OH, 3'-SO3H, 6' - SO3H, 8' - OH 3 2 2£3' N = N— < Z8 8O 6 7 7' 6'
LV 2 - OH, 2' - OH, 4' - SO3H
LVI 2 - OH, 4 - SO3H, 6 - NO2, 2' - OH
LVIl 2-OH, 4—SO3H, 2'-OH, 3'-COOH 3 2 > X A zk
Продолжение
Название Определяемые металлы Литература
Солохром прочный Са, Мп, РЬ 57 (43)
фиолетовый В
Омега хром прочный Mg, Са, Мп, Ni 59 (98)
синий 2G
Эриохром темно-синий Mg, Мп, Zn, Cd 59 (100)
BRL
Эриохром черный PW Mg, Са, Мп, Fe, Zn, Cd, Pb 57 (43)
Арсеназо Mg, Са, лантаноиды, Th, U, Pu 58 (61), 61 (89)
Калькой Mg, Ca, Mn, Zn, Cd 56 (61), 57 (123),
57 (124), 59 (102), 59(112), 60(146)
Эрио А Mg, Mn, Ni, Cu, Zn, Pb 48 (4), 58 (7)
CAL-Red Ca 56 (26)
/ J ///
- ОН, 4 - SO3H, Г — ОН
их 2—ОН, 4 —SO3H, 6 —NO2, Г-ОН
LX 2-ОН, 8 — SO3H, l'-OH, 3'-SO3H, 7'—NH2
LXI 4 - SO3H, 1' - OH, 3' - SO3H, 6' - SO3H 8'-OH
LXII 5 - SO3H, 1' - OH, 3' - SO3H, 6' - SO3H, 8'-OH
LXIII 3-SO3H, 6-SO3H, 8-OH, l'-OH, 3' - SO3H, 6' - SO3H, 8' - OH
LXIV 4—SO3H, l'-OH, 7'-NO, 3'-SO3H, 6' - SO3H, 8' - OH N=N\J\/N=N f IL 5^/3 1 4' I 8 8" 1" 2Z^\/Z'\z 7"z^\/Xo’ 3I II L J II I* X/\X‘ 4 5 5" 4"
LXV 2 - OH, 1' - OH, 4' - SO3H, 2" - OH
LXVI 2-OH, l'-OH, 4' —SO3H, 2"-OH, 6"-SO3H
СП о
Эрио В
Mg, Ca, Zn, Cd, Zr, 51 (18), 60 U78j 61(36)
LJIV
Эриохром черный Т Mg, Mn, Zn, Cd, In, Pb, Zr, лантаноиды 46 (2), 48 (4)
Алый 3R Cu 56(1/5)
SNADNS Zr, Th 60 (53)
SNADNS-5 Th 60 (192)
Бериллон II Mg 59 (139)
Нитрозо-SNADNS Zr, Th 60 (145)
Кислотный ализариновый черный SE Ca, Mn 57 (43)
Кислотный ализариновый черный SN Ca, Sr, Ba, Mn, Ni, Zn, Cdv-Th 60 (155)
о о
Основная структура и расположение заместителей
LXVII
LXV111
LXIX
Продолжение
Название Определяемые металлы Литература
Прочный сульфоновый черный F Сц 57 (42)
Яркий конго синий РЬ 57 (77)
Стильбазо Bi, Th 61 (147)
LXX
LXX1
LXXII
SO3H || I A^'A'i ,АЛОН HoZpso-«
OH
SOsH
Кальцнхром * (структура ие доказана)
ПАР (пнриднл-азо-ре-зорцин)
РАО (пнриднл-азо-орсин)
Sr, Ba, А1, лантаноиды, Мн, Ni, Си, Zn, Cd, Hg, In, Tn, Bi, Pb
Си
* По данным A. M. Лукина и сотр. [ЖАХ, 18, 444 (1963)1, кальцнхром имеет следующую структуру:
NaO3S
NaO3S
- Н2О
(Прим. пер.).
60 {154)
57 (5), 59 (67), 60 (130),
60 (167), 61 (36),
61 (137), 62 (11)
60 (20)
о го
Основная структура и расположение заместителей
LXX1I1
2-ОН
LXXIV
2 - ОН, 3 - ОН, 6 - SO3H
n-n\^\/v7
J 11 lfi
3\/\Z
4 5
LXXV
LXXVI
1 - ОН, 3 - SO3H, 6 - SO3H, 8 - ОН
1 - ОН, 3 - SO3H, 6 - SO3H, 8 - nh2
5 - SOsH, 8' - OH
2 - OH, 4 - SO3H, 8' - OH
LXXVII
LX XVHl \
Продолжение
Название Определяемые металлы Литература
ПАН (пириднл-азо- Mg, Са, Sr, Ba, А1, 55 (18), 55 (19),
нафтол) лантаноиды, Mn, V, 55 (20), 56 (43),
Fe, Со, Ni, Си, Zn, 56 (44), 56 (46),
Cd, Hg, Ga, In, Tl, 58 (64), 58 (107),
Bi, Pb, Th, U 59 (82), 60 (167),
61 (60), 62 (11)
PADNS (пиридил-азо- Cd, Си, Zn, Pb 60(20)
днокеннафталин-
сульфокислота)
РАСА (пнрндиназохро- Си 58 (28)
мотроповая кислота)
РАНА (пнрндиназо- Си 58 (28)
Аш-кислота)
। а-Нафтилазоксин Ga 62 (48}
Овдисульфо-а-нафтил- Mg, Ca 57 (122
i/Л
5' — SO3H, 8'—OH
LXXX
4- SO3H, 5'—SO3H, 8'—OH
LXXXI
LXXX1I
8 1 2 xt xt 7'
,Z\/YN-N\Z\/Ny
5 4 5' V
6 - SO3H, У - SOsH, 8' - OH
5—SO3H, 7 —SO3H, 5'-SO3H, 8'-OH
LXXX1I1
4 - OH, 6 - OH
LXXX IV
сл
I
а-Нафтилазоксинсуль-фокислота
SNAZOXS, или NAS
Лантаноиды, Mn, F< I 57(122), 62(49)
Со, Ni, Cu, Zn, Cd, \
Th, Ga I
Лантаноиды, Fe, Со, 60 (67)
Ni, Cu, Zn, Cd, Hg, Pb, Bi, In, Mn, Zr, Mo, Sn, Ti, Th
Нафтилазоксин C Ga
Дисульфонафтил-азо- ТП11
8-окснхинолинсуль-фокнслота (Р-нафтнл-азоксин 20)
61(112)
62 (68)
П иридилазоксин
ТПП
61 (132)
TAR (тназолнл-азо-ре--зорцин)
Mg, Ca, Mn, Со, Ni, Cu, Zn, Cd, Pb
60(18), 60(50)
о 4^
№
Основная структура и расположение заместителей
LXXXV
LXXXVI
4 — СН3, 6-ОН
2-СН3, 4-ОН, 6-ОН
LXXXVII ' 2-ОН
LXXXVIII 2 - ОН, 6 - SO3H
I N--С—ОН
। U 1 ||
LXXX1X I N С \=/
\n=N—< SO3H
1
сн3 но/
Продолжен не
Название Определяемые металлы Литература
ТАС (тиазолил-азо-кре-зол) Со, Ni, Си 60(18), 60(50)
ТАО (тиазолил-азо-ор-син) Mg, Са, Мп, Со, Ni, Си, Zn, Cd, Pb 60 (18)
TAN (тиазолнл-азо-нафтол) Со, Ni, Си, Zn, Pb 60(18), 60 (50)
TAN-6-S (тпазолил-азо-нафтолсульфокпс-лота) Лантаноиды, Co, Ni, Си, Zn, Pb 60(18), 60(50)
Эриохром красный В Ca, Mn, Ni, Си, Zn, Pb 56(114). 57 2)
Индикаторы различных структурных типов
формазаиы представляют собой особый вид азокрасителей. паКтерная для соединений этого вида структура показана ни-'ХаЦ_На примере структуры дифенилформазанов:
2_3 aj=N—^>4
X—6,5,
NH—^>4' бЛ>'
Следующие два соединения, имеющие такую структуру, применяются в качестве комплексонометрических индикаторов:
цинкон (ХС): X—С6Н5, 3—SO3H, 6—ОН, 2'—СООН, применяется для определения Zn,Ca [54 (90), 55 (2), 57 (9), 58 (4)];
дитизон (Х’С7): X—SH, применяется для определения Na, Al, Ni Zn, Cd, Pb, Bi [53 (16), 55(98), 57(82), 58(16-), 58(26), 60(27), 60(147), 61(61), 61(62)].
Своеобразие этих соединений заключается в том, что в их молекулах при образовании комплексов с металлами происходит отщепление протонов не только от заместителей кислотного характера, но и от гидразогруппы.
Цинкон (Х’С) в сильнокислом растворе окрашен в красно-фиолетовый цвет, характерный для аниона HSF~, содержащего протонированные окси-, карбокси- и гидразогруппу и ионизированную сульфогруппу; при рН=4,5 окраска переходит в желтую (НзР-—> -»H2F2~), а при pH = 8,3 — в красно оранжевую (H2F2-->HF3-). Комплекс индикатора с цинком ZnF2- окрашен в синий цвет; в этом комплексе ион металла координируется с обоими атомами азота, непосредственно соединенными с бензольными ядрами, и с атомом кислорода одного из заместителей, находящегося в орто-поло-жении к азо- или гидразогруппе. Титрование цинка в присутствии Цинкона проводят при pH около 10, так как в таких условиях переход окраски бывает особенно четким. Цинкон используют и для определения Са2+-ионов в присутствии Mg2+- ионов титрованием раствором ГЭДТА. При этом в титруемый раствор прибавляют незначительное количество Zh2+-hohob и конечную точку фиксируют с помощью цинкона по скачку pZn, происходящему одновременно со скачком рСа.
Дитизон (ХС7) обладает зеленой окраской, а его комплексы баллами окрашены в желтый, красный или фиолетовый цвет. еталл в этих комплексах координируется с атомом серы и ато-М азота азо- или гидразогруппы. Вследствие плохой раствори-циСТИ в воде индикатора и его комплексов с металлами титрова-тог Па°ДЯТ в водно-ацетоновой или водно-спиртовой среде. Кроме °, в качестве среды для титрования можно применять двухфазные 5 Зак. 553
системы, содержащие хлороформ или четыреххлористый угле-род. В этом случае дитизон и его комплексы с металлами растворяются в органической фазе, в которой и происходит изменени окраски. Таким способом титруют металлы, образующие сульфиды—никель, цинк, кадмий, свинец и висмут; алюминий опреде ляют обратным титрованием раствором соли цинка, а натрий-—
Таблица 10. Металлиндикаторы, относящиеся к классу оксихннонов *
№ Основная структура и расположение заместителей Название Определяемые металлы Литература
хсп о но\А/он II II НО/Ч|/'ЧОН о Родизоновая кислота Sr, Ва 60 (190)
хеш о но\/\/с1 Хлораниловая кислота Zr 54(45)
11 1 С1/ у \он о
XCIV о он A/VOH II II 1 \Z\Z II 1 О он Нафтоловый пурпуровый Th 56 (19)
о 8 II 1
XCV XCV1 6UUU3 5 II 4 о 1 - ОН, 4 - ОН 1 - ОН, 2 - ОН, 3 - SO3H Хинизарин Ализарин S Th Al, лантаноиды, Th, Pu Tl111, Bi 60 (106) 53 (19)
XCVI1 1 — ОН, 2—ОН, 3—mim Ализарннкомп-лексон Pb, Zn, Co, In, Th, Ce 58 (3), 60 102)
XCV1II 1-ОН, 2 —СвНнО5, ** 3-ОН, 4-ОН, 5-СООН, 6-ОН, 8 —СН3 Карминовая кислота Лантаноиды, Zr, Th 57 (6C), 58 (79)
* Расшифровка встречающихся в таблице сокращений дана в разделе «Обозна^е принятые в книге». — Прим. ред.
** Строение этого радикала точно не установлено. — Прим. ред.
66
венным путем — титрованием цинка в смешанном уранилаце-Se натрия и цинка.
Ярко выраженной способностью образовывать соединения сме-ллами обладают оксихиноны. Природные вещества, содержащие Тксихиноны, — ализарин и кошениль — веками применялись для °кпаски текстиля, и было известно, что в этом процессе участвуют °еталлы. К образованию комплексов с металлами способны простые оксибензохиноны, и особенно оксинафтохиноны и оксиантрахиноны. Выше приводится ряд оксихинонов, применяющихся в качестве индикаторов при комплексонометрических титрованиях.
Родизоновая кислота, имеющая желтую окраску, образует с
Sr2+- и Ва2+-ионами коричнево-красные осадки, появление которых можно использовать для индикации точки эквивалентности при обратном титровании избытка ЭДТА. Аналогично ведет себя хлораниловая кислота. Нафтоловый пурпуровый и оксиантрахиноны
применяются прежде всего в качестве индикаторов при титровании тяжелых многозарядных катионов лантаноидов и актиноидов в сильнокислом растворе. Особенно часто применяют индикатор XCVI— ализарин, в который введена сульфогруппа с целью придания растворимости красителю. Растворимость красящего вещества кошенили — карминовой кислоты — обусловлена присутствием в ее молекуле остатка сахара. Ализаринкомплексон можно исполь-
зовать при комплексонометрическом титровании некоторых металлов в кислом растворе. Это следует особенно подчеркнуть, так как его комплекс с церием (III) можно применять для фотометрического определения фторид-ионов [60(194)].
Во всех упомянутых комплексных соединениях металл координируется с кислородом карбонильной группы и кислородом соседней депротонированной оксигруппы. Таким образом, в оксихинонах атомами-донорами являются только атомы кислорода, что делает понятным их сродство к многозарядным катионам с незаполненными d-оболочками.
Приводимые ниже природные красители, тоже применяемые в комплексонометрии, являются ароматическими оксикетонами со следующей структурой:
НО О
2 3
Кверцетин (XCIX): 3—ОН; применяется для определения U, п> фторид- и сульфат-ионов [58(77)].
Морин (С): 2—ОН; применяется (также и в качестве флуоресцентного индикатора) для определения Al, In, Ga [55(36)].
кп Ь1Це Один природный краситель — гематоксилин, являющийся Р сящим веществом сандалового дерева, применяется для
Б*
67
комплексонометрического определения алюминия и т. п. [(55(8) 60(117), 61 (40)] и имеет следующее строение *:
ОН
но/ /он а
Давно известна способность нитрозофенолов образовывать комплексы с металлами (это свойство, например, положено в основу весового метода определения кобальта при помощи а-нитрозо-|3-нафтола). Одно из соединений этого класса — нитрозо-Р-соль [56(57), 57(51), 60(115), 61(19)] применяется в качестве индикатора при комплексонометрическом титровании циркония. Ниже приводится ее структурная формула:
NO ^\А/°Н I II I
NaO3s//////sO3Na сн
Мурексид — краситель, с давних пор получаемый из животного материала и представляющий собой аммонийную соль пурпуровой кислоты, хорошо известен, но лишь недавно была обнаружена его способность связывать в комплексы ионы металлов [41 (3)]. Краснофиолетовый анион мурексида имеет строение, изображеннО' структурной формулой СШ. На этой формуле, отображаюше! одну из четырех возможных «предельных структур» аниона, стрелками показаны электронные смещения, соответствующие его истинному мезомерному состоянию. В этом состоянии отрицательный заряд аниона равномерно распределен между четырьмя атомами кислорода, расположенными в центральной части молекулы. Свободная окрашенная в желтый цвет пурпуровая кислота получается только при прибавлении сильных минеральных кислот (H4F'w -> H5F, р/С ~ 0); она очень неустойчива и почти мгновенно гидр лизуется, так что ее фиолетовые растворы уже при pH < 3 все бь? стрее и быстрее обесцвечиваются с возрастанием концентрации водородных ионов.
При повышении pH раствора в анионе мурексида отщепляют* еще два протона — от иминогрупп. В связи с этим, поскольку
* Формула CI дана редактором, так как в оригинале гематоксилину °® бочио приписана структура, характерная для кверцетина и морина. — Пом- Р' 68
сопровождаются сине-фиолетовую
лекуле красителя имеются четыре иминогруппы, анион мурек-а обозначают сокращенной формулой H4F~ Переходы H4F--*
^ H3F2- (р/С = 9,2) и H3F2--^H2F3- (рК = 10,5)
изменением красно-фиолетовой (рис. 19)-
окраски в
/>-О О*,
<-|| |Р
.NH—С\ r>C-NH4
о=с CcTN=r4 /С=О
ст
анион мурексида Н4Г"
II II /NH-С. /С—NH4
О=С C-N=C С=О
XNH-CZ ; XC-NHZ I ! II О-—-де--------О
металлокомплекс мурексида MH4F'> 1
Способность мурексида образовывать металлокомплексы обусловлена строением его молекулы, допускающим возможность образования двух пятичленных хелатных циклов при его взаимодействии с металлом благодаря одновременному координированию иона металла с центральным атомом азота и двумя атомами кислорода (см. структурную формулу металлокомплекса MH4FV~1). Следует отметить, что анион пурпуровой кислоты может образовывать комплексы даже с ионом кальция, а также со всеми катионами переходных металлов и металлов с заполненными tZ-оболоч-ками [49(5), 54(33), 54(35), 54(46), 55(49), 56(2), 56(16), 57(69), 57(104), 59(43), 60(82), 60(103)]. Однако константы образования большинства этих комплексов невелики. Реакции их образования пока точно не известны, так как в растворе могут одновременно присутствовать не только свободные ионы красителя H4F~, H3F2-, НгР3-, но и различные комплексы с металлами с молярным соотношением 1 : 1 (MH4Fv-1, MHsF4'-2, MH2Fv-3 и т. д.). Области существования этих соединений охарактеризованы в гл. VI в связи с рассмотрением диаграмм зависимости рМ от pH.
Хромофорная система сопряженных двойных связей, аналогичная той, что имеется в мурексиде, присутствует и в ряде других красителей [49(5)]. Однако эти красители не имеют значительного применения в комплексонометрии, за исключением одного — нингидринового красителя CIV, полученного при нингидриновой реакции на белок [57(5)] и используемого для определения кальция, Цинка, меди и никеля:
civ
Индикаторы CV и CVI являются производными щавелевой
69
кислоты Соединение CV—N,N -бис- (2-оксиэтил)-дитиооксамид получено из рубеановодородной кислоты, которая, как известно
2г образует с медью и никелем пн-
Рис. 19. Спектры поглощения мурек-сида:
/ — нейтральный раствор (ЩР'); 2—сильнощелочной раствор (ЩН3”); 3 — комплекс с кальцйем при pH=13 (СаНгР); 4 — комплекс с медью при pH = 8 (CuH2F~).
тенсивно окрашенные осадки. Ме-таллокомплексы соединения CV можно получать в растворенном состоянии, если прибавлять к раствору большое количество ацетона (75%); в такой среде можно титровать как Си2+-, так и Ni2+-HOHbi, устанавливая точку эквивалентности по изменению окраски раствора от красной к фиолетовой [62 (4), 63 (29)]. По-видимому, ион металла участвует в образовании пятичленного хелатного кольца, координируясь с обоими атомами серы соединения CV. Исследование комплексообразующих свойств соединения CVI — глиоксаль-бис-(2-оксиани-ла)—показало [57 (140)], что в данном случае ион металла координируется с атомами кислорода депротонированных оксигрупп и с обоими атомами азота, образуя три конденсированных пятичленных хелатных цикла. В присутствии этого индикатора можно титровать Са2+-ионы в сильнощелочном растворе (приблизитель-
но в 0,1 н. растворе NaOH), причем в точке эквивалентности наблюдается переход розовой окраски раствора в желтую [59 (151), 61 (142), 62 (46)]:
N—
s=c/ НС но/
I I
s=c\ НС но\
'NH—сн2—сн2—он
CV \__/
CVI
3. ФЛУОРЕСЦЕНТНЫЕ ИНДИКАТОРЫ
Молекулы флуоресцирующих соединений также могут содер" жать несколько атомов, способных быть лигандами, поэтому такие соединения тоже могут образовывать комплексы с металлами-Связывание иона металла обычно сопровождается изменением флуоресценции комплексообразующего вещества, при этом ме'
70
ся или цвет, или интенсивность флуоресценции (вплоть до Н пного тушения флуоресценции при прибавлении металла). Изме-П°ние флуоресценции, так же как и изменение окраски, можно ис-11 „ьзовать для индикации точки эквивалентности при комплексо-ометрическом титровании. Флуоресцентные индикаторы называют также «металлофлуорохромными» [59 (12)] или «металлофлуоресцентными» [60 (45)]. Их особенно удобно применять при титровании окрашенных растворов. С таким титрованием приходится стал
киваться при определении многих переходных металлов, комплексы которых с ЭДТА зачастую более интенсивно окрашены, чем акво-комплексы, как, например, СоУ~-ион, присутствие которого в растворе затрудняет индикацию конечной точки титрования при помощи окрашенного индикатора. Изменение флуоресценции лучше всего наблюдать в темноте (светонепроницаемый кожух с глазком), освещая сосуд для титрования ультрафиолетовыми лучами (кварцевая лампа) [59(149)]. Большей частью изменение флуоресценции бывает
очень резким, поэтому таким методом можно устанавливать конец титрования с большой точностью. Правда, для глаз исследователя наблюдение за изменением флуоресценции раствора более утомительно, чем наблюдение за изменением окраски индикатора.
Уже в течение многих лет для определения алюминия используют морин (С), поскольку добавление последнего к раствору, содержащему алюминий, вызывает появление желто-зеленой флуоресценции. Аналогичные явления наблюдаются и в тех случаях, когда раствор содержит галлий или индий, поэтому морин применяют для индикации точки эквивалентности при титровании раствором ЭДТА галлия [55 (36)] и индия [53 (38)].
Давно известен также тот факт, что оксинаты некоторых металлов флуоресцируют сильнее или иначе, чем свободный 8-окси-хинолин (CVII). Поэтому не удивительно, что оксин используют в качестве индикатора для комплексонометрического титрования галлия в присутствии гидроксиламина при pH от 2,5 до 3,5 (тартратный буферный раствор); точку эквивалентности отмечают по ослаблению флуоресценции раствора [58 (40)]. В качестве флуоресцентного индикатора применяют также 8-оксихинолин-5-суль-фокислоту (CVIII), которая при взаимодействии с металлами образует растворимые комплексы (а не осадки). Этот реактив в Растворе цинка при pH ~ 10 (аммиачный буферный раствор) дает сильную желто-зеленую флуоресценцию, которая исчезает в конечной точке титрования цинка раствором ЭДТА [58 (19)]:
ОН
&п.*сихииолин- или оксин (CVII)-. Х-Н. иксихинолин-5-сульфокислоТа (CVIII): X — SOjH,
71
Кислые растворы З-окси-2-нафтойной кислоты (IV) имеют зеленую флуоресценцию, которая при добавлении алюминия переводит в синюю; это явление используют для индикации конечной точки титрования ионов алюминия. С помощью З-окси-2-нафтойной кислоты можно раздельно определять титрованием раствором ЭДТА железо (III) и алюминий при их совместном присутствии; при этом железо титруют при pH около 2 до исчезновения синей окраски его комплекса с индикатором (см. стр. 42), а затем при рН = 3 (глициновый буферный раствор) титруют алюминий до перехода синей флуоресценции раствора в зеленую [61 (44)].
В результате поисков новых флуоресцентных индикаторов был синтезирован кальцеин (XXV) [56 (72)]. Этот реактив, являющийся продуктом конденсации флуоресцеина, формальдегида и иминодиуксусной кислоты, применяют преимущественно для титрования ионов кальция в сильнощелочном растворе. Точку эквивалентности вначале устанавливали по изменению окраски раствора от зелено-желтой к коричневой [56 (72)]. Одновременно с изменением окраски происходит изменение флуоресценции [56 (72), 57 (103)], причем, как оказалось, в случае чистого вещества (называемого также флуорексоном [58 (47)]) изменение флуоресценции бывает гораздо более резким, чем переход окраски [58 (54)]. В нейтральном растворе, в котором отсутствуют металлы, флуорексон флуоресцирует почти так же, как и обычный незамещенный флуоресцеин, однако, в противоположность последнему, флуоресценция флуорексона исчезает при добавлении в раствор едкого кали, если концентрация последнего превышает 0,025 М.
Если к сильнощелочному раствору флуорексона прибавляют щелочноземельные металлы, особенно кальций, стронций или барий, флуоресценция появляется снова, но при образовании комплексов этих катионов с ЭДТА она тушится, что и используют для установления конца титрования [60 (6), 61 (7)]. Натрий, находясь в растворе в больших концентрациях, тоже вызывает флуоресценцию значительной интенсивности, поэтому при титровании щелочноземельных катионов раствор нужно подщелачивать едким кали, а не едким натром [58 (52)]. В области pH от 4 до 10 флуоресценция свободного кальцеина тушится ионами меди, поэтому ряд металлов можно определять обратным титрованием избытка ЭДТА| стандартным раствором Си2+-ионов, устанавливая конечную точку титрования по тушению флуоресценции кальцеина. Таким образом определяют ионы меди, кобальта и хрома (III) [59 (7), 59 (12)], а также молибдена [61 (138)]. Можно также проводить прямое титрование меди раствором ЭДТА или полиамина [59 (11)]. ДлЯ определения кальция наряду с кальцеином применяют и еще одия флуоресцентный индикатор — метилкальцеин (XXVI), являющийся продуктом конденсации флуоресцеина с формальдегидом и N-Me' тилглицином [60 (65)].
72
Успешный синтез кальцеина послужил стимулом к исследова-ниям, направленным на введение атомов лигандов и в другие Флуоресцирующие соединения с целью сделать их способными к связыванию металлов; в особенности это относится к бесцветным производным кумарина и ксантона, которые, как известно, прекрасно флуоресцируют [60 (126)] и, кроме того, меняют цвет флуоресценции в зависимости от pH раствора. В частности, конденсацией 4-метилумбеллиферона с формальдегидом и иминодиуксус-ной кислотой был получен интересный металлофлуоресцентный индикатор [60 (63), 60 (64), 60 (126)], названный одним автором умбелликомплексоном, а другими — кальцеином синим и обладающий, по-видимому, строением, соответствующим формуле CIX [неясно расположение в его молекуле группы —СН2—N(—СН2— —СООН)2, которая может находиться также в положении 8]:
НОД А Ог^О
НООС-Н^ J I L
)n-h2c<V \jf НООС—Н2(У 1
CIX СНз
Умбелликомплексон — бесцветное, плохо растворимое в воде вещество (оно становится растворимым при добавлении к воде слабых оснований, например ацетата натрия). Даже сильно разбавленные растворы его обнаруживают при pH от 4 до 10 интенсивную синюю флуоресценцию с максимумом интенсивности при длине волны 445 нм. При этом возбуждение обусловлено действием ультрафиолетовых лучей, и лучший выход флуоресценции достигается при возбуждении светом с длиной волны 370 нм, которая почти соответствует одному из двух максимумов интенсив-йости излучения ртутно-кварцевой лампы. При pH > 10 флуоресценция ослабляется, а при pH = 12 практически тушится. Катионы марганца, железа, кобальта, никеля, меди, ртути, свинца и висмута в области pH от 4 до 10 полностью тушат флуоресценцию умбел-ликомплексона, Zn2+- и Сс12+-ионы тушат частично, а катионы с незаполненными d-оболочками — Mg2+, Са2+, Sr2+, Ва2+ — не тушат совсем. В сильнощелочном нефлуоресцирующем растворе (при pH около 13) в присутствии Са2+-, Sr2+- и Ва2+-ионов вновь возникает яркое свечение, Mg2+-, Zn2+-, Cd2+- и РЬ2+-ионы в тех же условиях вызывают лишь слабую флуоресценцию, а остальные ионы металлов не оказывают никакого влияния. На этих явлениях основаны методы установления точки эквивалентности комплексонометрических титрований с помощью умбелликомплексона. Например, катионы щелочноземельных металлов титруют раствором ЭДТА в сильнощелочной среде до исчезновения флуоресценции. Тяжелые металлы обычно определяют обратным титрованием при pH от 4 Д° 10, оттитровывая избыток ЭДТА раствором Си2+-ионов; появляющиеся в растворе после достижения точки эквивалентности свободные ионы меди полностью тушат флуоресценцию.
73
Еще один флуоресцентный индикатор был получен конденсацией метилумбеллиферона с формальдегидом и N-метилглицином (вместо иминодиуксусной кислоты) [60 (65)]. Его назвали метилкальцеин синий; структурная формула этого индикатора СХ приведена ниже:
Н3<\ xn—;
НООС—н2с/
СХ СНз
Следующая группа флуоресцентных индикаторов была открыта в процессе поисков окислительно-восстановительных индикаторов [60 (153)]. Это производные бензидина (CXI—CXVI)-.
Y X
НООС—Н2Сх \ / /СН2—СООН
XN—/ Ч-Z
НООС— Н2с/ / \ 7 ^СНг—СООН
X Y
CXI-. X — ОСН3> Y — Н; СХ1Г. X — ОС2Н5, Y — Н;
CXIII: X — СООН, Y — Н; CXI У. X - ОСН3, Y — SO3H;
CXV: X — ОС2Н5, Y—SO3H; CXVI: X —OR, Y —СООН.
Растворы о-дианизидинкомплексона (CXI) и о-фенетидинком-плексона (СХП) обнаруживают в области pH от 4 до 10 синюю флуоресценцию, которая тушится при введении в раствор Си2+-ионов. Поэтому с помощью этих индикаторов можно определять многие катионы методом обратного титрования избытка ЭДТА раствором соли меди [проверено на катионах висмута, кадмия, кальция, церия, железа (II) и (III), ртути, индия, лантана, никеля, свинца, тория, таллия, олова и циркония]. Такие же явления, но .с более интенсивной флуоресценцией, наблюдаются в растворах содержащих сульфогруппы соединений CXIV и CXV-, в анализе их применяют аналогично соединениям СХ! и СХП. Карбоновые кислоты СХШ и XCVI флуоресцируют лишь в растворах с рН>8, их свечение тушится Са2+-ионами, поэтому последние можно непосредственно определять в присутствии индикаторов [60 (153)].
Производные стильбена (CXVII) и (CXVIII) по своим свойствам аналогичны производным бензидина [62 (155)]. Растворы обоих соединений при pH=4 обнаруживают синюю флуоресценцию, которая тушится Си2+-ионами. Используя это явление для индикации точки эквивалентности, можно определять ряд металлов обратным титрованием избытка ЭДТА раствором соли меди:
X
НООС—Н2С\ \ /СН2—СООН
^N—/ СН=СН— Z г/
НООС—Н2с/ Z хСн2—СООН
X
CXVH: X = Н; CXVIII X = SO3H.
74
4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ИНДИКАТОРЫ
а) Если титровать хелатообразующим реагентом раствор, в котором находятся в равновесии два различных валентных состоя-ния какого-либо металла, то в точке эквивалентности происходит резкое изменение окислительно-восстановительного потенциала раствора, обусловленное тем, что устойчивость комплексов ионов металла различной валентности различна. Скачок окислительно-восстановительного потенциала в точке эквивалентности можёг быть обнаружен не только потенциометрически (см. раздел 2 гл. VII), но и с помощью цветного индикатора.
Характерным объектом, на примере которого были исследованы подобные явления, является система Feni/Fen, где соотношение констант устойчивости комплексов Fe3+- и Ре2+-ионов с ЭДТА составляет около 1011. Железо (III) можно титровать даже в сильнокислом растворе, в котором железо (II) практически не образует комплекса. Поэтому окислительно-восстановительный потенциал раствора Е = Ео + 0,059 (lg [Fe3+]— lg[Fe2+]) при гаком титровании зависит от концентрации железа (III), поскольку концентрация железа (II) остается практически постоянной. Следовательно, изменение Е связано с изменением [Fe3+], и скачок окислительно-восстановительного потенциала, соответствующий скачку pFe (см. рис. 10, стр. 33), происходит тогда, когда к раствору добавлено количество ЭДТА [51 (16)], эквивалентное содержанию железа (III). Концентрация двухвалентного железа при этом не имеет существенного значения, так как она влияет лишь на абсолютное значение Е, а не на его изменение в процессе титрования. Скачок окислительно-восстановительного потенциала получается и в том случае, когда к исследуемому раствору трехвалентного железа совершенно не прибавлено двухвалентное железо, так как очень малые, но вполне достаточные количества железа (II) всегда присутствуют в препаратах железа (III).
Наряду с железом еще ряд переходных металлов может существовать в растворе в различных валентных состояниях. Однако принципиальную возможность индикации конечной точки комплексонометрического титрования этих металлов по скачку окислительно-восстановительного потенциала чаще всего не удается использовать практически. Дело в том, что нормальный потенциал окислительно-восстановительных пар TiIV/TiIn, VnI/Vn и Сгш/Сгп настолько мал, что соответствующие растворы, содержащие в достаточной концентрации форму с низшей валентностью, ведут себя как сильные восстановители, поэтому они очень чувствительны к кислороду воздуха и даже выделяют водород. Наоборот, система щШ/Мп11 представляет собой сильный окислитель, а у пары £оШ/СоП медленно протекает образование комплексонатов ко-альта (III). Подходящим объектом для комплексонометрического Титрования в присутствии окислительно-восстановительных НДикаторов являются соли меди. Из ее ионов, соответствующих
Двум валентным состояниям, лишь Си2+-ионы образуют стабильный комплекс с ЭДТА, тогда как Си+-ионы практически не участвуют в комплексообразовании. Поэтому окислительно-восстановительный потенциал системы СцН/Си1 Е = Ео + 0,059 (lg [Cu2+]— lg[Cu+]) зависит от концентрации Си2+-ионов (см. рис. 8, стр. 32). Нормальный потенциал Ео системы CuH/Cu1 составляет лишь 0,17 в по сравнению с 0,76 в пары Feni/Feu. Однако медь можно титровать примерно при таком же потенциале, как железо, если ввести в раствор немного роданид-ионов, которые связывают в прочный комплекс одновалентную медь; при этом концентрация меди (I) становится очень малой, но достаточной для того, чтобы ее можно было определить. Такого же эффекта можно достигнуть при добавлении больших количеств хлорид-ионов [56 (109)].
При комплексонометрическом титровании ванадия (V) точку эквивалентности также можно устанавливать с помощью окислительно-восстановительного индикатора [56 (100), 57 (15), 58 166), 63 (1)].
Из многочисленных органических красителей, которые способны обратимо восстанавливаться и окисляться с изменением окраски {56 (126)], лишь немногие пригодны для использования в качестве окислительно-восстановительных индикаторов при комплексонометрических титрованиях. К числу этих немногих соединений относятся два производных дифениламина, которые в окисленной форме представляют собой интенсивно окрашенные индофенол (CXIX) и индамин (СХХ):
H2N=<^=\ = N—^>—ОСН3
CXIX вариаминовый синий
(CH3)2N=<3>= N-<^J>-N(CH3)2 схх
Виидшедлера зеленый
Лейкооснование соединения CXIX, представляющее собой 4-мет-окси-4'-аминодифениламин и продающееся под названием «вариаминовый синий В-основание», хорошо зарекомендовало себя при комплексоцометрическом титровании железа (III) [53 (36), 57 (117), 60 (89)]. Бесцветное лейкооснование в слабокислом растворе окисляется свободными Ре3+-ионами в темно-фиолетовыи краситель CXIX-.
2Fe3+ + H2N—ОСН3 —>
—> 2Fe2+ + H2N=<^’-\=N—<^^>—OCH3 +Не-
нормальный потенциал окислительно-восстановительной системы краситель — лейкоформа при pH = 2 равен 0,60 в [53(36)].
76
оЭтому индофенол вновь восстанавливается образовавшимися ре2+-ионами, как только все Бе3+-ионы связываются в комплекс ЭДТА; следовательно, в конечной точке комплексонометрического титрования фиолетовый раствор обесцвечивается. Этот метод титрования железа особенно пригоден для микро- или ультрамикроопределений [54(60)].
Вариаминовый синий можно использовать еще и для определения меди в области pH от 5 до 6, так как в такой среде Си2+-ионы тоже окисляют лейкооснование в индофенол, если к раствору прибавлено немного SCN~- или много С1_-ионов. После того как все Си2+-ионы исчезают в результате образования комплексоната, реакция идет в обратном направлении [55(17), 56(109)], и наблюдается обесцвечивание раствора. Можно также проводить обратное нитрование избытка ЭДТА Си2+-ионами. Этот метод используют для определения алюминия [56(106)].
Вместо вариаминового синего можно применять краситель СХХ, который продается в виде двойной цинковой соли под названием «краситель Биндшедлера зеленый». Как ни странно, изменение его окраски при титровании бывает более заметным, если технический продукт перед употреблением оставляют на несколько месяцев на свету. В этом случае раствор красителя в воде имеет коричневатую, а не зеленую окраску, а прибавление Бе3+-ионов при значениях pH между 2 и 3,5 вызывает появление интенсивной зеленой окраски, которая при связывании всего железа (Ш) комплексоном вновь резко исчезает [56(108)]. Присутствующий в индикаторе цинк не мешает, если титрование проводят в области pH < 3,5. Разложившийся под действием света краситель Биндшедлера зеленый применяют также при обратном титровании избытка ЭДТА в случае определения хрома (III) [56(111)]. Появление зеленой окраски хорошо заметно, несмотря на то что комплекс ЭДТА с хромом СгУ- сам окрашен в интенсивный фиолетовый цвет.
Конечную точку титрования железа (III) раствором ЭДТА в кислой среде можно устанавливать также с помощью какотелина (CXXI). Это вещество, строение которого не установлено, легко получается нитрованием алкалоида бруцина (А-11). Водный раствор какотелина окрашен в желтый цвет, который под действием восстановителей средней силы переходит в аметистовый. Железо (П) в присутствии железа (Ш) не может восстанавливать индикатор, однако, после того как все железо (III) переходит в ком-плексонат, наступает изменение окраски. При пользовании этим методом необходимо прибавлять к титруемому раствору соль двухвалентного железа и, чтобы помешать окислению последнего, проводить титрование в атмосфере углекислого газа [56 (27), 57 (11)].
Комплекс пятивалентного ванадия с ЭДТА настолько неустойчив [57(15), 58(66)], что большинство двух- и трехвалентных металлов вытесняет из него свободные ионы ванадия (V), способные
77
в слабокислом растворе окислять бесцветный дифенилкарбазид (CXXII) в дифенилкарбазон, тут же образующий фиолетовый комплекс с ванадием:
,NH—nh—c6h5 zNH—nh—с6н5
o=c^ —> o=c<
W-NH—C6H5 Ж=N—C6HS
дифенилкарбазид дифеиилкарбазои
На использовании этого явления основаны методы определения многих металлов — марганца, свинца, цинка, меди, никеля, титана, ванадия, циркония, алюминия, таллия, тория, кадмия, кобальта, олова, хрома и редкоземельных металлов [56(100)]. При прямом титровании к исследуемому раствору, содержащему буферную смесь с pH от 4,5 до 5,5, прибавляют небольшое количество комплекса ванадия (V) с ЭДТА и дифенилкарбазид или дифенилкарбазон и титруют раствором ЭДТА до изменения окраски. При обратном титровании к раствору прибавляют избыток ЭДТА, индикатор и титруют раствором соли ванадия (V) или раствором соли марганца, цинка, свинца и т. д. тоже до изменения окраски. Если в качестве индикатора применяют дифенилкарбазон, изменение окраски в точке эквивалентности следует объяснить образованием комплекса ванадия (V) с индикатором, а не окислительно-восстановительным процессом.
С помощью дифенилкарбазида можно также устанавливать конечную точку титрования ЭДТА в кислой среде раствором нитрата ртути (II). При появлении первых избыточных Н§2+-ионов раствор окрашивается в фиолетовый цвет. Это явление используют для определения алюминия методом обратного титрования [60 (150)].
б) Появление или исчезновение (т. е. скачкообразное изменение концентрации) Zh2+-hohob в растворе, содержащем окислительно-восстановительную пару [Fe(CN)6]3-/[Fe(CN)6]4-, сопровождается скачком окислительно-восстановительного потенциала. Это явление обусловлено тем, что 7п2+-ионы прочно связывают гексацианоферрат (II)-ионы (с образованием комплекса или осадка). Поэтому в присутствии Zn2+-noHOB окислительно-восстановительный потенциал раствора становится настолько большим, что в этом растворе может происходить окисление бензидина (СХХШ) или 3,3'-диметилнафтидина (CXXIV), приводящее к образованию окрашенных в синий цвет продуктов. На использовании этого явления основано определение большого числа ионов металлов методом обратного титрования: к анализируемому раствору приливают в большом избытке ЭДТА, затем добавляют гексацианоферраты (III) и (II) и бензидин [54(41), 54(42), 56(99)] или З.З'-диметил-нафтидин [53(34), 53(35), 54(57), 55(67)] и при значениях pH около 5 титруют избыток ЭДТА раствором соли цинка до появ-
78
ления синей или фиолетовой окраски:
сххш
бензидин
С XXIV
З.З'-диметилнафтидин
Вместо бензидина или 3,3'-диметилнафтидина можно применять также вариаминовый синий В-основание, который в точке эквивалентности окисляется в соединение CXIX [59 (59), 60 (89)].
5. ЧИСТОТА И НОМЕНКЛАТУРА ИНДИКАТОРОВ
Промышленность, производящая специальные реактивы, применяемые в аналитической химии, выпускает и все основные комплексонометрические индикаторы. Следует отметить, однако, что не всегда эти индикаторы представляют собой химически однородные, чистые соединения. При получении красителей и особенно их ' солей даже многократные перекристаллизация и переосаждение не приводят к получению требуемых чистых соединений. Вместо этого получаются смеси изомеров, отдельные компоненты которых можно отделить друг от друга лишь с помощью хроматографии или электрофореза. Например, не являются химически однородными индивидуальными веществами многие имеющиеся в продаже диоксиазокрасители, такие, как эриохром черный Т. Индикаторы, содержащие метилениминодиацетатную группу (например, XV—XIX, XXV, CIX), тоже, как правило, неоднородны, так как получаемая при конденсации исходного красителя с формальдегидом и имино-диуксусной кислотой реакционная смесь лишь с большим трудом может быть разделена хроматографически. Тем не менее все упомянутые вещества, несмотря на их неоднородность, можно применять в качестве индикаторов без предварительной очистки, хотя следует сказать, что чистые индикаторы обеспечивают более четкое изменение окраски или флуоресценции. В тех случаях, когда требуется сделать заключение о составе и устойчивости комплекса, ни в коем случае не следует пользоваться непроверенными готовыми индикаторами, иначе можно придти к неправильным выводам.
Большинство имеющихся в продаже азокрасителей, перечисленных в табл. 9, представляют собой технические протравные красители, т. е. такие красители, для закрепления которых на волокне Необходима обработка последнего солями металлов (протравами). Эти красители можно приобретать у предприятий, производящих их для нужд текстильной промышленности. Однако при этом необходимо проявлять особую осторожность, поскольку все сказанное ранее о неоднородности красителей в наибольшей степени относится к техническим красителям. Во многих случаях красители
79
наносятся на волокно уже непосредственно в виде готовых метал-локомплексов; в таком же виде они поступают и в продажу, хотя на их этикетках это не указывается. Совершенно ясно, что такие металлизированные красители уже невозможно применять при анализе в качестве индикаторов.
Среди описанных индикаторов имеются и такие, которых до настоящего времени еще нет в продаже. Эти соединения приходится готовить самим, и в каждом данном случае в оригинальных статьях, как правило, приводятся способы их синтеза. Однако пользуясь этими прописями, не всегда можно получить однородные продукты, а в некоторых случаях возможно даже возникновение сомнений в правильности приведенной автором структурной формулы вновь синтезированного красителя [например, (£ХХ)].
Названия индикаторов запутаны. Если эти названия выведены согласно правилам номенклатуры органических соединений, они бывают обычно очень длинными, и поэтому слишком неудобными в употреблении. Вследствие этого часто пользуются сокращенными научными названиями [например, HHSNN для 2-окси-4-сульфо-(1-азо-1,)-2/-окси-3'-нафюйной кислоты] или тривиальными названиями, зачастую образованными от названия металла, для определения которого применяется соответствующий индикатор (например, кальцеин, магнезон, торин, цинкон). Для красителей, которые применяются в текстильной промышленности, поставляющая их фирма часто вводит название по своему выбору (например, эриохром черный Т — протравной краситель акционерной фирмы «Гейги», которая многократно использует приставку «эрио» для обозначения своих продуктов); для этих же красителей употребительны сокращенные технические Торговые названия (например, эрио’Т). К сожалению, во многих случаях одно и то же соединение фигурирует под различными тривиальными названиями, так как каждая фирма-поставщик выбирает для своего продукта свое собственное название (например, соединение (XXV) известно как кальцеин, флуоресцеинкомплексон и флуорексон).
Для того чтобы облегчить читателю этой книги нахождение структурной формулы какого-либо упоминаемого в литературе комплексонометрического индикатора, ниже приведены в алфавитном порядке сопоставленные друг с другом названия этих индикаторов и после каждого названия указан номер, которым обозначен соответствующий индикатор в разделах 1—4 этой главы.
Индикаторы для комплексонометрических титрований
Римские цифры означают порядковые номера, под которыми соответствующие индикаторы упоминаются в табл 6—10 и разделах 1—4
Азнн-бнс-нпдапдирп CIV
Азиндибарбитуровая кислота CIII Ализарин S XCVI
Ализаринкоыплексоп XCVII
Ализаринметилиминодиуксусная кислота XCVII
Ализариновый красный S XCVI Ализариновый фтор синий XCVII Ализариновый хром черный R XXXII Ализаринсульфокислота XCVI
Алый 3R LX
Алюминон XII
80
днизидинкомплексон ДА/ дн113идинком плексон-3,3'-днкарбоно-
Бая кислота CXVI
Днизидинкомплексон-3,3'-дисульфо-кислота CXIV
Днтраиол прочный черный SE LXV фсеназо LIV
Арсеназо I LIV
Ауринтрикарбоновая кислота XII
Бензаурин IX
Бензгидронлам ад VI
Бензгидроксамовая кислота VI
Бензидин CXXIII
Бензидинкомплексон-2,2'-дикарбоно-вая кислота CXIII
Бензо синий FBL LXVIII
Бериллон II LXIII
Биндшедлера зеленый СХХ
N N'-Бис-(2-оксиэтил)-дитиооксамид
CV
М,М'-Бис-оксиэтилрубеановая кислота CV
Бриллиантовый ализариновый черный SN LXVI
Бриллиантовый конго синий LXVIII
Бриллиантовый конго синий BFL
LXVIII
Бриллиантовый прочный синий FB
LI
Бриллиантовый хром синий 8RL L
Бромпирогаллоловый красный XXIII
Вариаминовый синий CXIX
Варнаминовый синий В-основание
CXIX
Галлеин XXIV
Галлион XLVI
Галлоцнанин XXIV
Гематоксилин CI
Гидрон I LI
Глиоксаль-бнс-(2-оксиаиил) CVI
Глициннафтоловый фиолетовый GNN
XXXVI
Глицинтимоловый синий XX
о-Дианизидинкоплексон CXI
Дибром пирогаллолсулвфофталеин
ЗД -Днметилнгфтидин CXXIV '•4-Дноксиаитрахинон XCV
*>2-Диоксибензол-4,6-дисульфокисло-
ЗД-Диоксифлуоресцеин XXIV
Дисульфонафтнл-азо-8-оксихннолнн-сульфокислота LXXXII
Дитизон XCI
п 1Н00ксаль0ксиэтиламнД CV Дифенилкарбазид СХХП
Дифенилкарбазон СХХП Дифенилтиокарбазон XCI Дихлордиоксибензохинон XCIII
H-Индикатор LXX
Иодид-ион VII
Какотелин CXXI
Калмагит XXXIV
Калькой LV
Кальконкарбоновая кислота LVII
Калькохром черный PV LIII Кальценн XXV
Кальцеин W XXV
Кальценн синий CIX
Кальцихром LXX
Кампеш, синий сандал (Blauholzfarb-stoff) CI
Карминовая кислота XCVIII Катехиновый фиолетовый X Кверцетин CXIX
Кислотный ализариновый красный В XXX
Кислотный ализариновый фиолетовый XXXIII
Кислотный ализариновый черный R XXXII
Кислотный ализариновый черный SE LXV
Кислотный ализариновый черный SN LXVI
Кислотный хром зеленый XLIII Кислотный хром красный В XXX Кислотный хром сине-черный LII,
LV
Кислотный хром синий XLIV, XLVII, . XLIX, LV
Кислотный хром синий К XLIV
Кислотный хром синий 2R XL1X Кислотный хром синий RRA XLVII Кислотный хром темно-синий LII,
XLII
Кислотный хром фиолетовый XXXIII
Кислотный хром фиолетовый В
XLVIII
Кислотный хром черный NSA LXVI
Кислотный хром черный S LXVI Коринф CA XLV
Краситель (реактив) Паттона и Ридера LVII
о-Крезолсульфофталенн-бнс-метнл-иминоднуксусная кислота XV о-Крезолсульфофталеин монометнл-нминоднуксусная кислота XVI
о-Крсзолфталеин-бнс-метнлиминоди-уксусная кислота XVIII
о-Крезолфталенпкомплексон XVIII о-Крезолфталексон XVIII Ксиленоловый оранжевый XV
6 Зак. 553
81
Лаковый алый (пурпуровый) С XXX Люмогаллнон XXVII
Магнезон XXXI
Металлфталенн XVIII
Метахром бриллиантовый синий 8RL L
Метнлкальценн XXVI
Метнлкальценн синий СХ
5-Метнл-4- (2-пнрндилазо) -резорцин LXXII
Метилтимоловый синий XVII Метнлфталексон XVIII Метомега хром синий 2RL XLIX Метомега хром темный BLS XXXI Метомега хромцнаннн BLL LII Морин С Мурекснд СIII
Нафтарсон XXXVIII Нафтидин CXXIV а-Нафтнлазокснн LXXVII Р-Нафгнлазоксин S LXXXI а-Нафтнлазокснн 2S LXXXII а-Н афтилазоксинсульфокислота
LXXIX а-Нафтилазоокснхннолнн LXXVII Нафтоловый пурпуровый XCIV Нафтоловый фиолетовый XXXVII Неоторин L1V
Ниагара брнллантовый синий BFL LXVIII
Нингидриновый краситель CIV Нитрозо-Р-соль СП
Нитрозо-хромотроповый 8В LXIV Нитрозо-SNADNS LXIV
2-Окснбензойная кислота II Оксин CVII
З-Окси-2-нафтойная кислота IV Оксинсульфокислота CVIII 2-Оксн-5-сульфобензойная кислота
III
Оксисульфо-а-нафтилазоксин LXXVIII
Оксихинолин CVII
8-Оксихинолин-5-сульфокислота
CVIII
Омега хром зеленый F XLIII
Омега хром красный В LXXXIX Омега хром прочный синий В XLV Омега хром прочный синий 2G LI Омега хром сине-черный В LVIII Омега хром синий GFS XLVII Омега хром темно-красный (гранитовый) XXVII
Омега хром темно-фиолетовый D XXXIII
Омега хром фиолетовый В XLVIII Омега хром черный Р LVI Омега хром черный Т LIX
82
Палатнновый хром зеленый XLIII Палатнновый хром фиолетовый
XXXIII
Палатнновый хром черный S LXVI ПАН LXXIII
ПАР LXXI
Пиридилазодиоксинафталинсульфо-кнслота LXXIV
Пиридилазо-Н-кислота LXXVI Пнриднлазо-Р-кнслота LXXV Пиридилазоксин LXXXIII
1 - (2-Пиридилазо) -2-нафтол LXXIII Пирнднлазоорсин LXXII
4- (2-Пиридилазо) -резорцин LXXI Пнрогалловый красный XXII Пнрогаллолсульфофталеин XXII Пнрогаллолфталеин XXIV Пирокатехиндисульфокислота V Пирокатехиновый фиолетовый X Пирокатехинсульфофталеин X Плазмокоринф В XLV Поттинг черный PV НИ
Пордукт разложения красителя Бнндшедлера зеленого СХХ
Прочный протравной синий XLII
Прочный сульфоновый черный
F LXVII
Прочный темно-синий 2Р XLVII Пурпуреат аммония CIII Пурпуровая кислота СIII
Роданид-ион 1
Родизоновая кислота ХСП
Салициловая кислота II Семиксиленоловый оранжевый XVI Солохром прочный серый RA XXXII Солохром прочный синий В LII Солохром прочный темный 2R XLVII, XLIX
Солохром прочный фиолетовый В L Солохром темно-синий В LV Солохром фиолетовый R XXXIII Солохром черный AS (или A) LVI Солохром черный 6BN LVIII Солохром черный RN XXXII Солохром черный WDFA (или Т)
LIX
Стильбазо LXIX
Стильбазо R LXIX
Сульфаниловая кислота-азо-хромо-троповая кислота XL
Сульфо-а-нафтилазооксихинол ин-сульфокислота LXXX
Сульфо-Р-нафтилазооксихинолин-сульфокислота LXXXI
Сульфонафтолазорезорцин XXXV
Сульфосалициловая кислота III
Тетраоксибензохинон ХСП
Тиазолил-азо-крезол LXXXV
Тиазолил-азо-Р-нафтол LXXXV1I
Тиазолил-азо- р-н афтолсульфокислота LXXXVHI
Тиазолил-азо-орснн LXXXVI
Тиазолнл-азо-резорцнн LXXXIV
Тимолсульфофталеин-бнс-метнлимн-нодиуксусиая кислота XVII
Тимолфталеин-бис-метилиминодиук-сусная кислота XIX
Тимолфталеинкомплексон XIX
Тимолфталексон XIX
Тиомочевина VIII
Тиосалициловая кислота III Тиоцианат I
Тирон V
Торин XXXVIII
Торон XXXVIII
Торонол XXXVIII
Умбеллнкомплексон CIX
Умбеллнферронм етнлим нноднуксус-ная кислота CIX
Феназо черный SA LXVII Фен етндннком плексон СХП Фенетидинкомплексон-3,3'-дисульфокислота CXV
Фенолсульфофталеин-3,3'-дикарбоно-вая кислота XI
Флуорексон XXV Флуоресцеин-бис-метилаланнн XXVI Флуоресцеин-бис-метнлиминоднук-сусная кислота XXV
Флуоресценнкомплексон XXV Фталеиновый пурпуровый XVIII
Хннизарнн XCV
Хлораниловая кислота ХСШ Хром бордо В XXVIII Хром коричневый BR XXIX Хром красный В LXXXIX Хром прочный красный В LXXXIX Хром прочный синий 2В XLV Хром прочный синий FB LI Хром прочный синий RLL XLIX Хром прочный темно-снний R XLIV Хром прочный фиолетовый XXXIII Хром прочный черный A LVI Хром прочный черный PV LIII £ )ом сине-черный В LVIII Хром синий 2R XLVII Хром черный Т LIX Хромазурол S XIII
Хромоген черный EAG (или ЕА) LV1 Хромоген черный LVIX Хромоксан зеленый GG XIV
Хромотроп 8D ДА/ Хромотроп 2С XLI Хромотроп 2R XXXIX Хромотроп красный 2R XXXIX
Цинкон ХС
Черный Т LIX
Черный для шерсти N XXXII
Эрно A LVI
Эрио В LVIII
Эрно R LV Эрио SE XIV Эрио Т LIX Эриохром зеленый Н XLIII Эриохром красный В LXXXIX Эриохром красный РЕ XXX Эриохром сине-черный В LVII1 Эриохром сине-черный R LV Эриохром сине-черный RSS LV Эриохром синий 2RL XLIX Эриохром синий SE XLV Эриохром темно-синий BRL LII Эриохром фиолетовый XLVII Эриохром фиолетовый BA XXXIII Эриохром черный A LVI Эриохром черный PV LIII Эриохром черный SR XXXII Эриохром черный Т LIX Эриохром азурол S XIII Эриохром цианин R XI
Яркий конго синий LXVIII
APANS XXXVIII ВТ их CAL-Red LVII DSNADNS LXIII ЕВТ LIX HHSNN LVII NAS LXXX РАСА LXXV PADNS LXXIV РАНА LXXVI РАО LXXII SNADNS LXI SNADNS-4 LXI SNADNS-5 LXII SNAZOXS LXXX SPADNS XL ТАС LXXXV TAN LXXXVII TAN-6-S LXXXVIII TAO LXXXVI TAR LXXXIV
6:
ГЛАВА Vl
ИЗМЕНЕНИЕ ОКРАСКИ МЕТАЛЛОХРОМНЫХ ИНДИКАТОРОВ
1. pH и рМ-ИНДИКАТОРЫ
Металлохромные индикаторы реагируют на изменение рМ ана-
логично тому, как кислотно-основные индикаторы на изменение pH. Эта аналогия подтверждается аналогией соответствующих уравнений:
Металлохромные индикаторы: рМ = lg — 1g
[MFJ' [F]'
Г IT
pH-Индикаторы: pH = pKHJ - lg
(39)
(40)
[F]' и [MF]' означают концентрации различающихся своей окраской не связанного с металлом красителя и металлокомплек-сов того же красителя. Аналогичную систему представляют собой ионизированная J и протонированная HJ формы рН-индикатора, которые тоже окрашены в разные цвета. Аналогичность выражений (39) и (40), объясняющих изменение окраски рМ- и рН-инди-каторов, обусловлена тем, что при рассмотрении связывания ионов металла и ионов водорода принимается во внимание практически только образование продуктов присоединения с молярным соотношением 1:1. Уравнения (39) и (40) вытекают непосредственно из закона действующих масс, примененного к соответствующим реакциям [уравнения (41) и (42)]:
Mv + Fa“
MF,’V-Z'
Н++^“ —> Ш1-^
(41)
(42)
Часто комплекс металла с красителем состава 1 : 1 способен присоединять еще вторую или даже третью молекулу красителя (MF—>MF2 —>MF3), чего не встречается, естественно, у протонсо.-держащих соединений. Константы образования комплексов с молярным соотношением 1 : 1 почти всегда во много раз больше таких же констант для высших комплексов, поэтому при низких концентрациях красителя (~ 10~5) и ионов металла, не вошедших в комплекс и присутствующих в растворе в точке эквивалентности комплексонометрического титрования (<10-5), учитывают лишь продукты присоединения состава 1:1. Кроме того, существуют и биметаллические комплексы с красителем M2F, аналогичные ДвУк' протонной форме pH-индикаторов (J-> Ш-> H2J); присоединение
84
>ооих ионов металла происходит абсолютно независимо друг от друга.
Изменение окраски почти всегда является следствием превращения комплекса состава 1:1 в не связанный с металлом краситель и наоборот; процессы описываются уравнениями (41) и (39). Возможен также случай, когда биметаллический комплекс M2F непосредственно превращается в не связанный с металлом краситель F, минуя стадию образования комплекса MF. В этом случае уравнение (39) должно соответствующим образом измениться; например, его последний член (—lg[M2F*/[F]') нужно было бы умножить на коэффициент 1/2.
2. ЗАВИСИМОСТЬ КОНСТАНТ ИНДИКАТОРА ОТ pH
а) Металлохромные индикаторы являются одновременно и рН-индикаторами. Так, известный индикатор эриохром черный Т в кислом растворе в отсутствие многозарядных ионов металлов окрашен в красный цвет; при pH = 6,3 эта окраска переходит в синюю, а при pH = 11,5 в оранжевую (см. также стр. 53). Аналогичные явления наблюдаются практически у всех металлохром-ных индикаторов.
Величина, обозначенная в уравнении (39) через [F]', представляет собой сумму концентраций различных — протонированных и непротонированных — форм красителя, не связанного с металлом
lFr=fF] + fHF] + fH2F]+ ... (43)
Аналогично этому, символом F' в уравнении (41) обозначен не связанный с металлом краситель, независимо от того, в какой форме он находится. Вследствие этого изменение окраски, обусловленное протеканием реакции (41), бывает различным при различных pH раствора, хотя в результате реакции образуется всегда один и тот же металлокомплекс MF. Например, эриохром черный Т образует красный комплекс с магнием MgF~. При pH < 6 образование этого комплекса едва заметно для наблюдателя, так как в такой среде происходит переход красного водородного комплекса H2F- в красный же металлокомплекс MF-. В то же время при значениях pH от 7 до 11 наблюдается изменение окраски от синей к красной (HF2-—>MF~), а при pH выше 12 — от оранжевой к крас--Ной (F3-—>MF_). В соответствии со всем сказанным количество ионов водорода, освобождающееся в результате реакции (41), зависит от pH, так же как и константа равновесия этой реакции (эффективная константа устойчивости комплекса MF)
yeit (MF) KMF MF [М] [Ff «н
(44)
гДе /(MF — не зависящая от pH константа равновесия реакции (45)
Mv+ + Fx- = MFv-x (45)
85
и а£ — коэффициент распределения красителя, находящегося в. виде различных протонированных форм
анИ — РТ; ан ~ 1 [h12^hf^h2f + • • (46)
Логарифмы констант /Chf, Mh2f и т. д. идентичны значениям р/( соответствующих кислот, т. е. доноров протонов (например, у эриохрома черного Т: p/Ci = 11,5 и р/Сг = 6,3):
pKf=lg/<HF; pK£ = lgKH2F и т. д. (47)
Таким образом, реакция образования комплексов металлов
с красителями описывается
при помощи таких же уравнений, как р главе III [уравнения (17—19)] — реакция образования бесцветных ком-плексонатов.
Полученные соотношения можно рассмотреть на примере взаимодействия эриохрома черного Т с магнием. Это взаимодействие схематически изображено на рис. 20. По оси ординат отложены значения рМ магния, соответствующие изменению окраски индикатора наполовину (т. е. [MF]' = =[F]' и, согласно уравнению (39), рМ = lg /Cmf), а по оси абсцисс — значения pH раствора. При прибавлении
Рис. 20. Области существования и окраска различных форм эриохрома черного Т в процессе титрования магния:
1 — H2F", красная. 2 — HF2-, синяя; З-F3^, оранжевая; 4 — MgF~, красная, 5 —осадок Mg(OH)2.
вой Реформы) попадае!
магния к раствору красителя с определенным значением pH (поддерживаемым при помощи соответствующей буферной смеси) рМ уменьшается, и наша система из области существования не связанного с металлом красителя (находящегося в виде красной H2F~-, или синей HF2-, или оранже-в область существования металлоком-
плекса MgF~ (окрашенного в красный цвет), что сопровождается изменением окраски. Область перехода, в которой индикатор
имеет смешанную окраску, на рисунке показана белым цветом, и в этой области лежит кривая, изображающая зависимость рМ oj pFI при [MF]' = [F]'. На рис. 20 показана также область, в которой произведение [Mg] [ОН]2 превышает произведение растворимости гидроокиси магния, т. е. 10-10, и где, следовательно, должен выпадать осадок этой гидроокиси.
б) В большинстве случаев (как и в случае эриохрома черно го Т) металл и краситель образуют лишь один-единственный комплекс с молярным соотношением 1 : 1, и тогда эффективная константа устойчивости металлокомплекса /Cmf, зависимость которой от pH выражается уравнением (44), соответствует такой 'ке
86
константе в уравнении (39). Однако встречаются и такие случаи, когда не только краситель, не связанный с ионами металла, но и его металлокомплекс (1:1) представляет собой pH-индикатор и, в зависимости от кислотности среды, может существовать в различных протонированных формах. Первая публикация на эту тему [49(4)] была посвящена мурексиду (его структурная формула CIII приведена на стр. 69); для этого индикатора, который, как уж говорилось, является аммонийной солью пурпуровой кислоты, характерно то, что не связанный с металлом анион пурпуровой кислоты H4F и его металлокомплекс MH4F’V-1 способны в достаточно щелочных растворах отщеплять протоны иминогрупп. Таким образом, в уравнении (39) не только концентрация [F'], но и концентрация [MF]', представляет собой сложную величину [см. уравнения (43) и (48)]
[MF]' = [MFJ + [MHF] + [MH2F] + ... (48)
Если известны значения р/( доноров протонов MHF’V+1-A, MH2Fv+24 и т. д., можно, как и раньше, вычислить коэффициент а, который учитывает факт существования комплекса MF' в виде различных форм
[MF]' = c$f[MF] (49)
Тогда константу равновесия реакции (41) можно выразить следующим уравнением:
„ [MF]' c$F
(50)
Мурексид обычно применяют в качестве индикатора на Са2+-ионы. Взаимодействие мурексида с кальцием схематически изображено на рис. 21 (по оси ординат обложены значения рСа, соответствующие переходу окраски, по оси абсцисс — значения pH). Не связанные с ионами металла формы индикатора H4F" (краснофиолетовая), H3F2~ (фиолетовая) и H2F3- (сине-фиолетовая) находятся в равновесии с комплексами CaH4F+ (желто-оранжевый), CaH3F (красно-оранжевый) и CaH2F~ (красный).
Более сложный случай представляет собой взаимодействие металлфтал еина с кальцием в области pH от 6 до 14, которое схематически изображено на рис. 22 (обозначения координатных осей те же, что на рис. 21). Здесь в равновесии с металлокомплексами с молярным соотношением 1 : 1 CaHF3- (розовый) и CaF4~ (темнокрасный) находятся пять не связанных с металлом форм индикатора: H4F2-, H3F3- (бесцветные), H2F4-- (бледно-розовая), HF5-(розовая) и F6- (темно-красная). Кроме того, при высоких концен-тРациях кальция (т. е. низких значениях рСа) образуются биметаллические комплексы Ca2F2-, окрашенные в темно-красный цвет. Из рис. 22 видно, что только в узкой области pH от 10,6 до 12 возможно резкое изменение окраски, которая в таких условиях при Уменьшении рСа (т. е. при добавлении кальция) переходит из
87
светло-розовой в темно-красную. При pH > 12 изменения окраски практически не наблюдается, так как из темно-красного иона индикатора F6- образуется также темно-красный комплекс CaF4~ При pH < 10,6 из светло-розового водородного комплекса H2F4' получается лишь немного более интенсивно окрашенный розовый комплекс с кальцием CaHF3', и только при прибавлении большего количества кальция образуется темно-красный комплекс Ca2F2~ (при концентрации кальция около 10~4). Тем не менее в области
Рис. 21. Области существования и окраска различных форм мурексида в процессе титрования кальция:
1 — H4F, красно-фиолетовая; 2 — HgF2“, синефиолетовая; 3 — НгР3“, сине-фиолетовая;
4 — CaHF, желто-оранжевая; 5—CaHgF, красно-оранжевая; 6— CaHgF”, красная.
Рис. 22. Области существования и окраска различных форм металл-фталеина в процессе титрования кальция:
/ —H4F2-\ бесцветная; 2 — HgF3-, бесцветная; 3 ~ HgF4”, бледно-розовая; 4 — HF5', розовая; 5 — F6“, темно-красная; 6 — СаНШ" розовая; 7 — CaF4-, темно-красная;
S — CaaF2-, темно-красная.
значений pH = 10,0—11,5 металлфталеин является прекрасным индикатором на Са2+-ионы (а также Sr2+- и Ва2+-ионы), в особенности когда на розовую окраску не связанных с ионами металла форм металлфталеина (HF5~ и H2F4-) накладывается зеленая окраска добавочного красителя (при применении смешанного индикатора, см. раздел 5 этой главы).
3. КОНСТАНТЫ ИНДИКАТОРА
Лишь немногие из приведенных в главе V индикаторов настолько подробно изучены, что для них можно было бы составить диаграммы перехода окраски типа тех, что изображены на рис. 20—-22-Для этого необходимо знать значения рК красителей, не связанны^ с ионами металла, значения констант устойчивости их металло-комплексов и, возможно, их поведение в качестве акцепторов или
88
доноров протонов. Такие данные — те, что известны в настоящее время, — представлены в табл. 11.
В недавно опубликованной книге Рингбома [63 (64)] кроме значений констант Kmf> вычисленных с использованием тех же данных, какие приводятся в табл. 11, можно найти еще некоторые значения рК металлиндикаторов, которые автор определил непосредственно экспериментальным путем.
В первом столбце табл. 11 перед названием каждого индикатора приводится номер, которым был обозначен данный индикатор в главе V. После названия индикатора дается сокращенная формула, показывающая, в какой форме этот индикатор существует в сильнокислом растворе (рН = 0). Многие индикаторы даже в сильнокислых растворах присутствуют в виде анионов, благодаря тому, что в их молекулах содержатся сульфогруппы, придающие им растворимость в воде.
Во втором столбце табл. 11 приводятся (для тех случаев, когда они известны) значения рД различных не связанных с металлами форм красителей, т. е. числа, расположенные справа от сокращенных формул HjF, означают
[H/F]
РК для H/F = lg [н] =Р#7
Для вычисления коэффициента распределения а? [см. уравнение (46)] используют величины = ЮрКЛ
В третьем столбце приводятся значения логарифмов констант устойчивости металлокомплексов, т. е. числа, расположенные справа от формул, означают:
для комплексов (1 : 1) MH/F (г от 0 до 4):
[мнл
lg [M]’[HzF] “lgAMHzF
для комплексов (1:2) М (H/F)2 (i от 0 до 1):
[M(HfF)2]
Ig [М (HZF)] [HZF] g Am(H/F)2
для комплексов (2:1) M2F:
_[M2F]__ lg [MJ [MF] lgAM2F
Константы кислотности протонированных металлокомплексов. представляющие интерес для вычисления a”F [см. уравнение (49)], не приводятся, так как их можно вычислить на основании данных табл. 11, например:
рК для MHF: lg [MF] = 1g Кднр — lg Kmf + O’1)
89
CD О
Таблица 11. Логарифмы констант образования протонированных форм некоторых индикаторов и констаит устойчивости их металлокомплексов (ц~0,1)
Индикатор рК красителей, не связанных с ионами металлов Логарифмы констант устойчивости металлокомплексов Литература
X. Пирокатехиновый фиолетовый: H4F HF3- 11,7; H2F2- 9,8; H3F- 7,8; H4F 0,2 BiF- 27,1; Bi2F2+ 5,2; ThF 23,4; ThF4+ 4,4; GaF- 22,2; Ga2F2+ 4,6 59 (150), 56 (37), 58 (118)
XIII. Эриохромазурол S: H4F HF3- 11,5; H2F2- 4,9; H3F- 2,5 61 (185)
XV. Ксиленоловый оранжевый: HeF HF5- 12,3; H2F4— 10,5; H3F3- 6,4; H4F2- 3,2; H5F~ 2,6 Некоторые значения опреде- лены прямым экспериментом [63 (64)] 60 (51)
XVII. Метилтимоловый синий: HeF HF6- 13,4; H2F4- 11,2; H3F3- 7,2; H4F2- 4,5 MnHF3- 9,2; некоторые значения Кдор определены прямым экспериментом [63 (64)] 58 (48)
XVIII. Металлфталеин: H6F HF5- 12,0; H2F4- 11,4; H3F3- 7,8; H4F2- 7,0; H6F~ < 3; H6F < 2 MgF4- 8,9; Mg2F2- 5,2; MgHF3- 7,5; CaF4- 7,8; Ca2F2- 5,0; CaHF3- 6,4; BaF4- 6,2; Ba2F2- 3,0; BaHF3- 4,8 53(1)
XXXIII. Хром фиолетовый для меха: H2F- HF2- 13,0; H2F- 7,0 MgF- 7,6; CaF- 5,6; NiF- 14,9; CuF- 20,8; ZnF- 12,5 61 (186), 62 (157)
XXXIV. Калмагит: H2F- HF2- 12,4; H2F- 8,1 MgF- 8,1; CaF- 6,1 60 (134)
XLV. Эриохром SE:H3F2- HF4- 11,9; H2F3_ 10,5; H3F2- 8,0 CaF3- 4,3 (при ji = 1), 5,0 (при j H = 0,l) / 61 (120)
IV. Калькой: H2F 2_ HF2 13,5; H2F 7.3 MgF 7,5; CaF- 5,3; ZnF~ 12,5 1 [ZnFNH3] g [Zn] [F] [NH3] 16,4 *8 (4), 57 (123) 59(114)
LVI. Эрио A: H2F" HF2' 13,0; H2F" 6,2 MgF- 7,2; CaF" 5,3 48(4)
LVIII. Эрио В: H2F- HF2' 12,5; H2F~ 6,2 MgF- 7,4; CaF" 5,7 48(4)
LIX. Эриохром черный T: H2F~ HF2' 11,6; H2F" 6,3 MgF- 7,0; CaF- 5,4; BaF-MnF- 9,6; ZnF- 12,9 3,0; 48 (4), 63 (64)
LXXI. ПАР: H3F+ HF 12,4; H2F 6,9; H3F+ 2,3 (в 50%-ном растворе диоксана) NiHF+ 13,2; CoHF+' MnHF+ 9,7; ZnHF+ Ni(HF)2 12,8; Mn(HF)2 Zn (HF)2 11,1 (в 50%-hom творе диоксана) -12; 12,4; 9,2; рас- 62(11)
LXXIII. ПАН: H2F+ HF 12,3; H2F+~2 (b 50%-hom растворе диоксана); HF 12,2; H2F+ 1,9 (в 20 %-ном растворе диоксана) NiF+ 12,7; CoF~12; ZnF+ 11,2; MnF+ 8,5; NiF2 12,6; ZnF2 10,5; MnF2 7,9 (в 50%-hom растворе диоксана); CuF+~16 (в 20%-ном растворе диоксана) 59 (82), 62(11)
XC. Цинкон*: H3F~ HF3' ' > 14; H2F2- 8,3; H2F' 4,5 [ZnF] [Н] , g [Zn] [HF] ~ 10 58(4)
CIII. Мурексид: H5F H3F2 " 10,9; H4F~ 9,2; H5F~ -0 CaH4F+ 2,6; ZnH4F+ 3,1; CaH3F 3,6; CdH4F+ 4,2; CaH2F- 5,0; CuH2F-~15 49(4)
* В одновалентном анионе цинкона имеются две кислотные группы фенольный гидроксил (рК 8,3) и карбоксильная группа (рК 4,5). При образовании комплекса с Zn2"^-ионами отщепляется еще один протон —от атома азота гидразо-группы, поэтому сокращенная формула индика-тора имеет вид НзР~ (отрицательный заряд обусловлен присутствием сульфогруппы в молекуле.) Значение рК для HF3~ не может быть изме-У рено, так как оно больше 14. Поэтому устойчивость комплекса ZnF2 приходится характеризовать константой равновесия реакции обмена HF3~+Zn2+ ->ZnF2-+H+.
4. КРИВЫЕ ПЕРЕХОДА ОКРАСКИ
Нам представляется целесообразным выражать переход окраски индикатора в процентах, т. е. указывать, какая доля красителя (в процентах) при различных значениях pH представлена в виде не связанной с ионами металла формы и какая — в виде металло-комплекса:
[FT Переход окраски = 100 ‘ %
О где [F]( = [F]' + [MF]'.
Комбинируя уравнения (52) и (50), получаем:
гт ЮО
Переход окраски =-------%
1 + [M]/^F
Используя уравнение (53) и данные табл. 11, можно рассчитать перехода окраски некоторых индикаторов. Результаты та
(52)
(53)
кривые
Рис. 23. Кривые перехода окраски эриохрома черного Т в процессе титрования магния при различных значениях pH: pH —12, красная -> оранжевая; pH — 10, красная -> синяя.
Рис,-24. Кривые перехода окраски эриохрома черного Т в процессе титрования кальция при различных значениях pH: pH = 12, красная -> оранжевая; pH = 10, красная -> синяя.
Рис. 25. Кривые перехода окраски эриохрома черного Т в процессе титрования цинка при различных значениях pH: pH —10, красная -> синяя.
ких расчетов графически представлены на рис. 23—30. По кривым, приведенным на этих рисунках, можно проследить, как при уменьшении концентрации металла (т. е. при повышении значения pH. происходящем в результате образования комплекса металла с ЭДТА) краситель отдает металл и образуется окрашенная в ДрУ' гой. цвет не связанная с металлом форма красителя. Так как эффективная константа устойчивости 2(ме, согласно уравнениям (44) и (50), зависит от pH, то различным значениям pH титруемого рас-
92
твора соответствуют различные кривые перехода окраски. При расчетах кривых было принято, как и раньше (см. стр. 31), что требуемое значение pH раствора устанавливается с помощью буферной смеси аммиак — хлорид аммония, причем сумма [NH3] + [NH4] в течение всего титрования остается постоянной и равной 0,1 М.
Рис. 26. Кривые перехода окраски мурексида в процессе титрования кальция при различных значениях pH:
pH — 12—13, красная -> синяя; pH — 10, красная фио летевая.
Рис. 27. Кривые перехода окраски мурексида в процессе титрования никеля при различных значениях pH:
pH = 12, желтая -> фиолетовая, pH=6, оранжевая -> -> красно-фиолетовая.
Рис. 28. Кривые перехода окраски мурексида в процессе титрования меди при различных значениях pH:
pH = 11, желтая -> фиолетовая, pH =9, желтая -> красно фиотетовая, pH = 6, оранже вая -> красная»
Поскольку символы [F]' и [MF]' означают [см. уравнение (43) и (48)] суммарные концентрации различных отличающихся по окраске форм индикатора, то от pH раствора зависит не только значение рА1, при котором происходит изменение окраски индикатора, но и характер этого изменения; так, при титровании меди при
93
pH = 5 окраска мурексида переходит из оранжевой в красную (CuH4F+ -> H4F~), а при pH = 11 — из желтой в фиолетово-синюю (CuH2F-^H2F3~).
Различные формы металлфталеина имеют максимумы поглощения света при одной и той же длине волны (рис. 17); все они окрашены в красный цвет,- но различаются по интенсивности окраски. Если интенсивность окраски полностью депротонирован-ного и не связанного с ионами металла аниона F6- принять за 100%, то значения (в процентах) интенсивости других форм индикатора будут составлять соответственно: HF5~— 20; H2F4~— 7-H3F3- —0; CaF4-—100; Ca2F2~—100; CaHF3~ — 20; BaF4-— 100,
Рис. 29. Кривые изменения интенсивности окраски металлфталеина в процессе титрования кальция при различных значениях pH.
Интенсивность окраски, °/о
Рис. 30. Кривые изменения интенсивности окраски металлфталеина в процессе титрования бария при различных значениях pH.
Ba2F2"— 100; BaHF3~— 20; Mg2F2-— 20; Zn2F2-— 2. В соответствии с этой особенностью металлфталеина на кривых рис. 29 и 30 дано не изменение окраски, согласно уравнению (53), а изменение интенсивности окраски в зависимости от рМ (рСа и рВа).Эти кривые отчетливо показывают, что индикатор применим в очень узких пределах pH. Аналогично металлфталеину ведут себя тимолфталек-сон и глицинтимоловый синий, также являющиеся одноцветными индикаторами.
5. ОТЧЕТЛИВОСТЬ ПЕРЕХОДА ОКРАСКИ
Сопоставление кривых, приведенных на рис. 4—15 и иллюстрирующих зависимость рМ от прибавленного количества титранта я> с кривыми перехода окраски, изображенными на рис. 23—30, дает
24
возможность определять резкость изменения окраски индикатора в точке эквивалентности. Ясно, что интервал превращения индикатора (соответствующий пологому участку кривой перехода окраски) должен находиться на крутом участке кривой титрования в районе а — 1. Хороший индикатор полностью изменяет окраску, т. е. переходит из формы MF в форму F, в интервале значений а от 0,99 до 1,01. Если интервал превращения индикатора только приблизительно совпадает со скачком рМ на кривой титрования, наблюдается «размытый» переход окраски, т. е. начинающийся слишком рано или заканчивающийся слишком поздно. Ошибки определения, получающиеся вследствие неточного установления истинного значения рМ в конечной точке титрования (т. е. значения рМ в истинной точке эквивалентности), будут рассмотрены в главе VIII. «Размытость» может иметь также совершенно другое происхождение — она может обусловливаться медленностью протекающей реакции перехода металла из его комплекса с индикатором в комплекс с ЭДТА. Подобную «кинетическую размытость» можно устранить нагреванием титруемого раствора или добавлением катализатора, что, конечно, невозможно в случае, если причиной является неблагоприятное положение равновесия.
Следует обратить внимание еще на .одну — совершенно другую— сторону вопроса об отчетливости изменения окраски, связанную с психосоматическими процессами в сетчатке глаза и в мозгу наблюдателя. Предполагается, что титрование проводят при благоприятном освещении и на светлой подложке. В таком случае изменение окраски будет тем отчетливее, чем более различны для глаза исходная и конечная окраски (т. е. окраски чистого MF и чистого F). Согласно учению о цвете, предельные цвета должны быть, по возможности, дополнительными, т. е. взаимно дополнять друг друга до белого цвета. Дополнительными цветами, например, являются: красный — сине-зеленый, оранжевый — синий, желтый — индиго, желто-зеленый — фиолетовый и т. д. Индикатор, окраска которого изменяется от одного дополнительного цвета к другому, в промежуточной точке становится бесцветным (или серым), так как цветовые тона взаимно погашают друг друга; поэтому такую точку особенно легко заметить.
Само собой разумеется, что индикатор, выбранный потому, что переход его окраски соответствует истинному скачку рМ, лишь в редких случаях изменяет свой цвет на дополнительный. Однако можно приблизиться к этому идеалу, если использовать наложение окрасок, т. е. примешать к исследуемому раствору индифферентный краситель (индифферентный с химической точки зрения), создающий цветной фон, благодаря чему предельные окраски до и После конечной точки титрования становятся дополнительными. К индикатору, изменяющему окраску от желтой к красной, можно примешать немного синего красителя (определенного оттенка) в соответствующей концентрации, в результате чего окраска будет Меняться от желто-зеленой (получающейся в результате смешения
95
желтого и синего цветов) через серую к фиолетовой (красный плюс синий цвета). В точке эквивалентности раствор становится практически бесцветным, так как светло-серый цвет едва заметен, и точку эквивалентности можно установить лучше, чем в отсутствие индифферентного красителя, когда титрование проводят до окрашивания раствора в оранжевый цвет с определенным красным оттенком. Если при значении рМ, соответствующем переходу окраски, кривая титрования почти вертикальна (большой скачок рМ), цвет титруемого раствора мгновенно изменяется от одного до другого дополнительного цвета; таким образом, конечная точка титрования получается чрезвычайно резкой.
Такие «экранирующие красители», улучшающие индикацию конечных точек комплексонометрических титрований, были предложены уже давно, причем их подбор осуществлялся опытным путем. Эмпирические поиски нужных индифферентных красителей и их оптимальных концентраций, естественно, очень трудоемки и утомительны. Заслуга Рейли, Флашки и Лорента [60 (68)] состоит в том, что они нашли способ систематического достижения такой цели. Этот способ основан на развитии общей теории цветности и дает возможность количественно характеризовать отчетливость перехода окраски индикатора. Основываясь на абсорбционных спектрах обеих форм индикатора, можно выбирать индифферентный краситель и по его спектру судить о концентрации, в которой его следует взять, для того чтобы предельные цвета при переходе окраски максимально приближались к дополнительным. Флашка [61 (184)] предложил простую схему вычислений и описание проведения определений для случая р.Н-индикаторов. Эту схему можно применять и для металлохромных индикаторов. Однако следует помнить, что найденный таким образом смешанный индикатор нельзя безоговорочно использовать для определения всех металлов, которые можно титровать с соответствующим металлиндика-тором. Комплексы красителя с различными металлами часто окрашены в различные цвета (например, комплексы мурексида с кальцием и медью, см. рис. 19), поэтому, чтобы достигнуть максимального цветового эффекта, для каждого металла следовало бы составлять свой смешанный индикатор. Но чаще всего какой-либо смешанный индикатор оказывается лучше простого одновременно для многих ионов металлов. Так, для определения меди и никеля можно применять почти один и тот же смешанный индикатор на основе мурексида, и лишь для титрования кальция смесь нужно изменять Стабильность растворов смешанных индикаторов обычно такая же, как и у простых индикаторов; однако встречаются растворы и с худшей устойчивостью; в таких случаях целе сообразно применять твердый носитель (поваренная соль или сахар).
Отметим, что исследователи при работе с индикаторами должны уметь правильно распознавать цвета. Дело в том, что часто наблюдаются небольшие различия в восприятии окраски ра3"
96
дичными людьми, даже если они не страдают дальтонизмом. Для наблюдателей, не способных правильно оценивать окраски, следует несколько изменять (путем подбора) состав смешанного индикатора.
Ниже приводится несколько примеров смешанных индикаторов. Для титрования кальция предложена [51(14)] смесь из 0,2 г мурексида и 0,5 г нафтолового зеленого В (растертая с 100 г NaCl); переход окраски от оливково-зеленой через красновато-серую в чисто синюю. Другой смешанный индикатор для титрования кальция (обозначается как гидрон II) представляет собой смесь в соотношении 1 : 2 из 0,5%-ного раствора эриохрома зеленого и 0,75%-ного раствора нафтолового желтого S; красная окраска переходит в зеленую [60 (108)]. Для улучшения перехода окраски при титровании кальция или суммы кальция и магния применяют смесь эриохрома черного Т (0,5 е) и метилового желтого (0,125 г); в качестве растворителя используют диэтаноламин (100 мл). При титровании лантаноидов [56 (95)] применяют смесь ализаринового S (45 мл 0,5%-ного этанольного раствора) и метиленовой синей (15 мл 0,1%-ного водного раствора). Для титрования тория предлагается смесь, состоящая из ализаринового S и ксиленолового цианола FF [57 (121)]. Для определения Ва2+-и S02--hohob рекомендована смесь растворов родизоната натрия (0,05%-ный) и 1-метиламино-4-(n-толил)-антрахинона (0,5%-ный в 50%-ном этаноле) в соотношении 1:5 [59 (83)]. При титровании В13+-ионов в присутствии тиомочевины [53(20)] переход окраски — от желтой к бесцветной — можно улучшить добавлением генцианы фиолетовой; получающийся при этом смешанный индикатор изменяет окраску от зеленой к фиолетовой. При титровании ионов кальция с ме-таллфталеином окраска, которую имеет раствор после титрования (розовая), перекрывается при прибавлении диаминового зеленого и метилового красного (0,05 г и 0005 г на 0,1 г металлфталеина, соответственно) [53 (1)]. Еще лучше должен быть раствор 0,3 г металлфталеина, 0,3 г нафтолового зеленого В и 0,5 мл концентрированного раствора аммиака в 100 мл воды [56 (68)].
Изменение свечения флуоресцентных индикаторов также улучшают добавлением других веществ [61 (85), 62 (151)].
7 Зак. S5.T
ГЛАВА Vll
ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ИНДИКАЦИИ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
В комплексонометрическом титровании, как и в большинстве объемно-аналитических методов, обычно отдается предпочтение визуальному установлению точки эквивалентности с помощью цветных индикаторов благодаря простоте и быстроте этого метода. Но, наряду с визуальными, давно применяются инструментальные методы индикации конечной точки. При сравнительной оценке визуальных и инструментальных методов сложность, быстрота, аппаратурное оформление метода и т. д. не являются единственными критериями. Например, в главе IX показано, что основание для предпочтительного выбора того или иного метода обычно является более глубоким и может быть связано с проблемой селективности. Кроме того, инструментальные методы иногда дают точные результаты в тех случаях, когда визуальная индикация вообще не возможна, например при титровании мутных и сильно окрашенных растворов или растворов, содержащих вещества, блокирующие или разрушающие индикатор (окислители!). Наконец, лишь инструментальные методы индикации дают возможность автоматизировать процесс титрования.
До настоящего времени многие из известных инструментальных методов использовались лишь в простейших случаях и еще не нашли применения в аналитической практике, что, естественно, не уменьшает потенциальную возможность их применения в будущем.
Ниже приводится краткий обзор инструментальных методов индикации точки эквивалентности и их практического применения, причем последовательность изложения сов-ершенно не связана с эффективностью методов. Описание экспериментального проведения определений дается лишь в тех случаях, когда имеют место значительные отклонения от обычного хода титрования.
1. ФОТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
При фотометрических титрованиях вычерчивают график зависимости экстинкции (светопоглощения) титруемого раствора от расхода титранта. По полученной кривой титрования (в случае необходимости экстраполируя взаимно наклоненные прямолинейные участки кривой до точки пересечения) устанавливают конеч
98
ную точку титрования. Этот способ используют для всех возможных типов титрования, и литература по этому вопросу весьма обширна. Что касается аппаратурного оформления метода, то следует сослаться на прекрасный обзор [58(22)], охватывающий основные положения, теорию и методики фотометрических титрований, а также на список литературы, включающий работы до 1957 г. [58 (23)]. Обе эти публикации принадлежат Гэдриджу, и в них обсуждаются все методы титрования, включая комплексонометрический. Теория и практика автоматических методов титрования подробно освещены в монографии Филлипса [59 (81)].
В данной книге по каждому из рассматриваемых ниже вопросов приводятся лишь наиболее важные ссылки. Работы, описывающие какой-либо известный принцип титрования, отличающийся лишь оригинальным аппаратурным оформлением, не упоминаются.
Способы индикации конечной точки
Существует несколько различных способов оптической индикации конечной точки комплексонометрического титрования, которые отличаются друг от Друга, главным образом, по своей селективности.
А. Индикация по ступеням («Stufenindikation»). В этом способе индикации конечную точку можно устанавливать как визуально, так и с помощью фотоэлемента. Характерной чертой данного способа является то, что концентрация прибавленного индикатора очень мала по сравнению с концентрацией титруемого вещества. Индикаторы большей частью являются органическими красителями (ет от 103 до 105), образующими с титруемым металлом комплекс, который распадается в конце титрования, что вызывает мгновенное изменение светопоглощения. Кривая титрования, в идеальном случае практически горизснтальная, в точке эквивалентности почти вертикально поднимается вверх или опускается вниз, а затем вновь идет горизонтально. Отсюда и произошли названия «индикация по ступеням» и «индикатор по ступеням» [61 (49)].
Б. Индикация по наклону («Neigungsindikation», «Slope-Indication»). В данном способе, как и в предыдущем, точка эквивалентности устанавливается по перегибу кривой титрования, однако, В отличие от способа «А», здесь речь идет не о двукратном, а об однократном перегибе. В идеальном случае кривая титрования состоит из двух наклоненных друг к другу прямолинейных участков (один из которых чаще всего более или менее горизонтален). Точка перегиба соответствует точке эквивалентности, т. е. в точке эквивалентности изменяется наклон кривой; отсюда и название способа «индикация по наклону» [61 (49), 62 (27)]. Существуют три разновидности этого способа.
Б-1. Самоиндикация, или индикация с помощью внутреннего индикатора («Selbstanzeige»). Сюда относятся системы, к которым не требуется прибавлять индикатор. Для наблюдения за
7*
99
ходом титрования используют поглощение света веществами (одним или несколькими), участвующими в происходящей при этом реакции. Например, при титровании окрашенных катионов переходных металлов спектры поглощения комплекса, присутствующего в растворе перед титрованием (акво- или амминокомплекса двухвалентной меди), и комплекса, образующегося в процессе титрования (комплекса ЭДТА с медью), отличаются друг от друга. Следовательно, можно выбрать такую длину волны, при которой во время титрования изменяется светопоглощение: оно линейно растет или уменьшается, по мере прибавления раствора титранта, до наступления точки эквивалентности, а затем остается постоянным Молярный коэффициент экстинкции окрашенных металлокомплексов, как правило, невелик (ет около 101—102), поэтому удовлетворительная интенсивность окраски получается при концентрациях металла в пределах 10-2—10-3.
Для индйкации конечной точки можно использовать также светопоглощение прибавляемого титрованного раствора комплексообразующего вещества. Например, металлокомплексы ЭДТА поглощают свет при длине волны около 220 нм значительно слабее, чем не связанные с металлом протонированные анионы НгУ2- и НУ3-, которые начинают появляться в растворе после точки эквивалентности, если значение pH раствора не слишком велико.
Б-2. Самоиндикация вследствие прибавления избытка индикатора. В этом способе к анализируемому раствору прибавляют индикатор в количестве, по меньшей мере эквивалентном количеству определяемого металла, а чаще всего даже в большом избытке. Как и в способе «А», образуется комплексное соединение индикатора с титруемым металлом, но обычно оно имеет значительно меньший молярный коэффициент экстинкции, чем металлокомплекс металлохромного индикатора, применяемого в способе «А». Так как весь определяемый металл связывается в комплекс с индикатором, система является теперь «самоиндицирующей», и кривые титрования идентичны тем, которые получаются в способе «Б-1». В качестве примера можно упомянуть определение висмута, образующего с взятой в избытке тиомочевиной комплекс желтого цвета. Этот комплекс в процессе титрования раствором ЭДТА постепенно разлагается, причем измеряемое при соответствующей длине волны светопоглощение линейно уменьшается и после достижения конечной точки становится постоянным. В качестве другого примера можно привести определение меди, где амминокомплекс [Сн(ЫНз)4]2+ переходит в комплекс с ЭДТА СнУ2“. Смотря по тому, является ли аммиак растворителем или индикатором, этот тип титрования относится к способу «Б-1» (где о нем уже говорилось) или к способу «Б-2». При определении очень малых концентраций металла можно прибавить в избытке металлохромный индикатор и, таким образом, получить самоиндицирующую систему с достаточно высокой экстинкцией. Этот метод особенно пригоден для ультрамикроопределений. Например, таким способом можно титровать
I0Q
доли микрограмма магния в присутствии избытка эриохрома черного Т [62(27)].
Б-3. Индикация с помощью прибавленной самоиндицирующеи системы. В качестве индикатора можно применить самоиндицирую-щую систему, если определяемый металл образует более прочные комплексы, чем металл, используемый в индикаторной системе. Например, для титрования висмута прибавляют медь; если в качестве титранта используют ЭДТА, то в первую очередь связывается с комплексоном висмут. Этот процесс не сопровождается изменением светопоглощения. После того как весь висмут перейдет в комплекс с ЭДТА, будет образовываться комплекс с медью, экстинкция раствора возрастет, и изменится наклон кривой титрования. Медь в данном случае ведет себя как спектрофотометрический индикатор особого рода [54 (50)], и притом совершенно не так, как металлохромный индикатор в способе «А», поэтому форма кривой титрования будет тоже совершенно другой. Чтобы исключить путаницу с известным понятием «спектрофотометрический индикатор», целесообразно в данном случае рассматривать медь как «индикатор по наклону кривой титрования».
По кривой титрования раствора, содержащего висмут и медь в качестве определяемых веществ, можно установить точки эквивалентности для обоих металлов. Кривая начинается с горизонтального отрезка (висмут), за которым следует восходящая ветвь (медь), после чего кривая снова становится горизонтальной. Математическая обработка результатов подобных титрований приводится в работе [61 (113)].
Системы, превращающиеся в самоиндицирующие при прибавлении избытка металлохромного индикатора, можно использовать для раздельного титрования ультрамикроколичеств металлов при их совместном присутствии. Так, можно с успехом провести определение субмикрограммовых количеств кальция и магния за одно титрование [62(27)], если к раствору, содержащему буферную смесь с pH = 10, прибавить избыток калмагита (эриохром черный Т также пригоден для этого титрования, но он несколько менее устойчив). Образуется самоиндицирующая система магний — калмагит, являющаяся индикатором по наклону кривой титрования для Са2+-иона, который практически не реагирует с красителем. Поскольку кальций сильнее связывается с ЭДТА, чем магний, он титруется сначала, и получают кривую титрования, состоящую из трех частей: горизонтальной, наклонной и снова горизонтальной. Первый перегиб кривой соответствует окончанию титрования кальция, второй — окончанию титрования магния. Следует заметить, что при обычном титройании раствора, содержащего кальций и Магний, с применением калмагита в качестве индикатора по ступеням (т. е. прибавленного в значительно меньшем количестве, чем Количество, эквивалентное содержанию магния) можно получить Только сумму обоих металлов.
10)
Теоретическое обсуждение
Математическая обработка результатов титрований по способу «А» приводится в работах различных авторов [53(45), 54(43), 54(69), 54(70), 55(12), 57(19), 59(122), 61(117)]. В одной из этих работ [54(43)] на основании математических выкладок, полностью согласующихся с экспериментом, сформулированы следующие оптимальные условия индикации по ступеням:
а. Эффективная константа устойчивости комплекса металла с титрантом должна быть значительно больше аналогичной константы комплекса с индикатором —• по меньшей мере на сорок процентов.
б. Эффективная константа устойчивости комплекса металла с индикатором должна быть как можно больше, а именно, не менее 104—'О5.
в. Концентрация индикатора должна быть как можно меньше.
г. Концентрация определяемого металла должна быть как можно больше.
д. Разница в величинах молярных экстинкций комплекса индикатора с металлом и свободного индикатора должна быть как можно больше.
Если записать последнее условие как «достаточное различие в цвете», то получим, что перечисленные условия почти идентичны условиям визуального титрования. Главное различие между фотометрическим и визуальным титрованием состоит в том, что в случае первого можно получить хорошие результаты при более значительных отклонениях от идеальных условий.
Фотометрическое титрование особенно часто используют для определения микроколичеств, когда очень трудно выполнить условие «в». (При визуальных титрованиях, конечно, необходимо учитывать возможность работы с избытком индикатора, т. е. с само-индицирующей системой.) Если же при этом и условие «б» выполняется не идеально, кривые титрования оказываются размытыми, но и с помощью таких кривых еще можно получать точные результаты. Последнее зависит от того, что принимают за точку эквивалентности: начало, конец или середину ступени. Если известны константы образования комплексов с индикаторами, можно рассчитать теоретически положение перегиба на кривых и указать, как следует поступать на практике, чтобы получить правильные результаты (например, титрование кальция с мурексидом, см. рис. 37).
Рингбом [62(118)] указывает, что можно математически обосновать выбор точки эквивалентности и внести соответствующую поправку в результаты. Последнюю можно рассчитать, если известны значения констант устойчивости всех присутствующих в растворе комплексов и концентраций участвующих в реакции веществ Конечно, следует пользоваться эффективными константами, которые, однако, в условиях аналитических определений не всегда можно рассчитать достаточно точно, а иногда и вообще нельзя
102
рассчитать. Особенно затруднено проведение определения тогда, когда реакция протекает в описанных выше предельных условиях, так что результат вычислений весьма ненадежен. В таких случаях, как правило, проще провести холостое титрование в идентичных условиях с точно известными количествами исследуемых веществ и на основании полученных таким образом кривых титрования решить, какую именно часть кривой следует использовать для установления точки эквивалентности.
Для способов «Б» математическую обработку результатов предложил Флашка с сотр. [61(49), 61(48)]. Математические уравнения для специального случая «Б-3» предложены Рейли [61(113)].
Применение
Фотометрическую индикацию точки эквивалентности по ступеням кривых титрования особенно часто рекомендуют для определения кальция [54(10), 55(12), 55(69), 56(48), 57(17), 58(84), 59(35), 60 (175), 61 (9)]. Дело в том, что изменение окраски мурексида недостаточно резко для человеческого глаза. Метод получил практическое применение для определения кальция в сыворотке [54(19), 58 (45), 59 (107)], моче [54 (19), 58 (96)] и спинномозговой жидкости [56(4)], а также в водорастворимой части гипса [55(52)], в воде [57 (54)], кварце [61 (9)], стали [60(112)], цементе [57 (17)] и силикатах [59(112)]. Кроме мурексида, при фотометрическом титровании кальция применяют и другие индикаторы, например фталеинком-плексон [55(7), CuY—ПАН [62(119)], а также кальцеин (для определения небольших количеств кальция в солях лития [61(7)], силикатах [61 (180)] и в сыворотке крови [59(91)]).
Фотометрическое титрование кальция в аликвотной порции анализируемого раствора часто совмещают с определением суммарного содержания кальция и магния во второй аликвотной порции, для того чтобы таким образом определить содержание магния. Естественно, этот метод можно применить и для определения одного только магния. В качестве индикатора при этом используют преимущественно эриохром черный Т [53(45), 54(69), 54(70), 56 (48), 57 (18), 58 (84), 59 (122), 61 (8)]. Метод нашел практическое применение в анализе кварца [61 (9)], цемента [57(17)], стали [60(112)], сыворотки [59(129)] и спинномозговой жидкости [56(4)]. Для определения суммарного содержания кальция и магния в сыворотке предложено употреблять в качестве индикатора также пирокатехиновый фиолетовый [60(175)]. Метод применяют и для анализа силикатов [59(112), 61(180)].
Для определения кальция и магния в одной порции раствора сначала при pH = 10 титруют кальций раствором ГЭДТА в присутствии мурексида, а затем, при другой длине волны, титруют магний раствором ЭДТА в присутствии эриохрома черного Т [61(50)].
103
Перечисленные методы используют также для фотометрического определения жесткости воды [50 (4)].
Для фотометрического титрования множества других металлов используют самые разнообразные индикаторы. Например, торий определяют в присутствии хромазурола S [55(71)], пирокатехинового фиолетового [59(76)], ализаринового красного S [59(95)], арсеназо I [62(19)], нафтолового пурпурового [56(19)] или SNADNS [62(5)]; барий [56(10), 56(71)], цинк [56(25), 63(47)] и кадмий [63(47)] определяют с применением эриохрома черного Т; стронций определяют в присутствии фталеинкомплексона [60 (109)], редкоземельные металлы — в присутствии ализаринового красного S[59 (95)] и арсеназо I [61 (54), 62 (19)] (только эрбий определяют с ПАР [60 (130)]. Для определения висмута и меди применяют пирокатехиновый фиолетовый [59(21)], висмута и свинца — ксиленоловый оранжевый [60 (47)], никеля — мурексид [57 (63)] с одновременным маскированием кобальта нитрозо-Р-солыо; к титрованию никеля сводится определение серебра [57(75)] и палладия [55 (1)] — после обменной реакции любого из этих металлов с цианидным комплексом никеля.
Высокую точность фотометрического титрования используют для проверки пригодности комплексоната кадмия как вещества для установки титра; в качестве индикатора применяют азоксин [60(100)]. Железо определяют в присутствии салициловой кислоты при рН = 1—2; определению не мешает алюминий [60 (144)]. Для определения алюминия применяют хромазурол S [61(149)]. Молибден определяют после восстановления сульфатом гидразина прямым титрованием в слабокислой среде в присутствии ализа-ринкомплексона [60(83)]. Кобальт после окисления перекисью водорода в щелочной среде весьма селективно определяют обратным титрованием избытка ЭДТА раствором соли висмута в сильнокислом растворе; в качестве индикатора применяют пирокатехиновый фиолетовый [61(51)]. Никель можно непосредственно определять в присутствии железа, замаскированного пирофосфатом. После того как оттитрован никель, можно прибавить в избытке ЭДТА, провести обратное титрование раствором соли никеля и таким образом определить железо [58 (38)]. При определении циркония обратным титрованием избытка ЭДТА раствором соли железа в качестве индикатора применяют гидроксамовую кислоту [55 (80)].
Самоиндикацию в видимой области спектра используют при определении железа [53 (37), 53 (39)], меди [53 (37), 53 (39), 62 (1), 63(45)] и никеля [53(37)]. В ультрафиолетовой области спектра проводят титрование кальция, магния, цинка, кадмия, титана, циркония [54(14)], висмута и свинца [55(97)] и молибдена [59(62)]. Титан образует самоиндицирующую систему с перекисью водорода [57(20), 60(136)], а кобальт — с роданид-ионами в 50%-ном водном растворе ацетона [60 (171)].
Индикацию по наклону кривых титрования с использованием меди в качестве фотометрического индикатора применяют для 104
определения висмута [54(51)], кальция [57(13), 57(14), 61(113)], магния [61(113)], а также для селективного определения кадмия в присутствии цинка [62(26)].
Определения в большинстве случаев весьма селективны, о чем свидетельствуют приводимые далее примеры. Скандий можно определять в присутствии 60-кратного количества редкоземельных металлов с применением меди в качестве индикатора по наклону кривой титрования. На принципе самоиндикации основано последовательное титрование смесей железа и меди [53(39)], висмута и меди [54(51)]. Индикация по ступеням в сочетании с изменением pH раствора дает возможность определять микрограммовые количества тория и редкоземельных металлов: сначала при pH = 2 титруют торий в присутствии арсеназо, затем повышают pH раствора добавкой уротропина и определяют редкоземельные металлы с тем же индикатором [62 (19)]. Аналогичным образом проводят последовательное титрование висмута и свинца в присутствии ксиленолового оранжевого [60 (47)]. О возможности последовательного определения кальция и магния в одном растворе уже упоминалось [61 (50), 62(27)].
Во всех перечисленных методах в качестве титранта применяется исключительно ЭДТА. Как показывают приводимые ниже примеры, применение других комплексообразователей может привести к дальнейшему повышению селективности. Например, титрование меди раствором трена в слабокислой среде с самоиндика-цией является почти специфичным [57(87), 57(88)]. Кадмий можно титровать в присутствии цинка раствором ДТПА [61 (113)] или, еще лучше, раствором ГЭДТА [62 (26)] с применением меди в качестве индикатора по наклону кривой титрования. Кальций в присутствии более чем стократного количества магния можно определять титрованием раствора ГЭДТА при pH = 10, используя в качестве индикатора мурексид [61(50)].
Для автоматизации фотометрического титрования соединяют автоматическую бюретку с самописцем и, таким образом, получают полную кривую титрования. Если необходимо установить только перегиб кривой в точке эквивалентности, большей частью достаточно записать зависимость светопроцускания от объема раствора титранта; это дает возможность упростить аппаратуру. Кроме того, можно полученным в фототитраторе током приводить в действие реле, которое в конечной точке титрования прекращает вытекание жидкости из бюретки. Выходящий ток можно также однократно или дважды дифференцировать при помощи соответствующей электронной схемы, получая в результате первую или вторую производную функции, изображаемой кривой титрования (это усовершенствование предложено Мальмштадтом); принципы метода и его применение изложены в работе Хаджииоанноу [59(121)]. С помощью автоматического титрования определяют торий [54 (12)], медь и цинк [59 (120)], медь, железо и кобальт [60 (78)]. Автоматические методы применяют для определения
105
кальция и магния в доломите и известняке [58(110)], сыворотке [59 (118)], карбонатах [55 (87)] и воде [59 (119), 63 (46)]. При автоматическом определении кальция в сыворотке в качестве индикатора применяют флуоресцеинкомплексон [59 (91)], при определении микроколичеств тория используют кверцетин [58 (70)].
2. ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Если металл присутствует в растворе в окисленной (ион Мох) и восстановленной (ион Mr-") формах, заряды которых отличаются на п зарядов электронов (равновесие: Мох + пе~ Mr-"), то образование комплексов металла в такой системе всегда сопровождается изменением окислительно-восстановительного потенциала Е раствора, так как катионы Мох и Mr-" образуют комплексы различной устойчивости. Напишем уравнение Нернста для потенциала индифферентного электрода-.в растворе, не содержащем еще хелатообразующего вещества Z
[МОх]'
Ea = E0 + S/n\g-^E. (54)
где Еа— начальный потенциал; Ео — нормальный потенциал; S — известный, зависящий от температуры численный фактор, равный приблизительно 0,06 в.
После того как ионы металла низшей и высшей валентности связываются в комплексы (Мох—> MOxZ и Mr-"-*MrZ), потенциал электрода приобретает значение Ее:
[MOxZ]
Ее = Е0 + S/n lg L °? J + S/n lg (55)
где Ee — конечный потенциал; Кох и Ar— эффективные константы устойчивости комплексов MoxZ и MrZ:
. [MOxZ] [MrZ]
ох PWlZ]'’ R [Mr]'[Z]'
(56)
[Уравнение (55) получается путем подстановки в уравнение (54) значений [Мох]' и [Мн]', взятых из уравнения (56).]
Когда ионы обеих валентностей полностью переходят в соответствующие комплексные соединения, отношение [MOxZ]/[MrZ] в уравнении (55) становится равным первоначальному отношению [МОх]7[Мн]', и, таким образом, изменение потенциала (Еа — Ее) зависит только от отношения констант устойчивости Ан/Аох- Последнее часто бывает очень малой величиной, например, для системы Fem/Fen и ЭДТА в качестве комплексообразующего вещества Ar/Aox = 10-11, и Ее приблизительно на 660 мв меньше Еа.
Используя уравнение (55), Шварценбах и Геллер [51 (1)] вычислили константу устойчивости комплекса Feni с ЭДТА, измерив по
106
тенциал пары Feni/Fen в присутствии ЭДТА и зная константу устойчивости комплекса с Fe11.
При введении комплексообразующего вещества изменение потенциала происходит ступенчато, так как сначала реагирует тот катион, который образует более устойчивый комплекс (как правило, Мо,<). Например, если титруют смесь Fe3+- и Ре2+-ионов раствором ЭЦТА, то получается большой скачок потенциала, как только будет добавлено количество комплексообразователя, эквивалентное содержанию железа (III). Если проводить такое титрование при pH < 3, то вообще происходит только этот первый скачок потенциала, так как эффективная константа устойчивости комплекса FenY2~ становится настолько малой, что присутствующие в растворе Ее2+-ионы практически больше не связываются в комплекс. Количество железа (II) в растворе при этом влияет лишь на абсолютную величину Еа и Ее, в то время как высота скачка (Еа— Ее) от него не зависит. Можно даже титровать Fe111 раствором ЭДТА с помощью инертного электрода без добавления Fe11, так как в любом растворе железа (III) всегда содержится чрезвычайно малое количество железа (II) [иначе, согласно уравнению (54), окислительно-восстановительный потенциал оказался бы бесконечно большой положительной величиной], достаточное для того, чтобы привести электрод в рабочее состояние.
Потенциометрический метод был впервые практически применен Пршибилом ссотр , [51 (16)] для определения железа (III). С помощью ацетатной буферной смеси доводят pH раствора железа приблизительно др 5, гладкий платиновый электрод используют в качестве индикаторного электрода, а каломельный — в качестве электрода сравнения. При титровании 0,1 М раствором ЭДТА потенциал в конечной точке падает на 350 мв на каждые 0,04 мл раствора титранта; потенциал устанавливается практически моментально. При более низких значениях pH скачок тоже наблюдается точно в точке эквивалентности, однако величина его меньше, и установление потенциала происходит тем медленнее, чем больше кислотность раствора. Вид кривой титрования почти такой же, как и при окислительно-восстановительном титровании, только после скачка быстрее начинается почти горизонтальный участок.
Белчер с сотр. [55 (104]) изучали поведение системы СцП/Си1 в присутствии ЭДТА. Медь (II) можно титровать таким же способом, что и железо (III), причем незначительная добавка роданид-ионов значительно улучшает скачок в конечной точке [55 (105)]. При титровании ртути (II) раствором ЭДТА с платиновым электродом тоже происходит скачок потенциала, соответствующего, по-видимому, системе Hgn/Hgr.
Большое число металлов можно определять обратным титрованием избытка ЭДТА стандартным раствором железа (III), а именно: алюминий, висмут, кобальт, никель, кадмий, свинец, цинк [51(16)]. титан [60(135)] и смесь алюминия, железа и хрома [57 (29)].
107
В качестве электродов кроме платинового с успехом применяют также серебряный [60(111), 62(17)] и ртутный (электрод — донная ртуть) [57 (22)] и платиновую проволоку, покрытую электролитически полученной двуокисью свинца [62 (135)]. Во многих случаях, когда платиновый электрод в комбинации с внешним каломельным электродом не пригоден, получены хорошие результаты с электродными парами платина — вольфрам или платина—молибден (оба электрода опущены в титруемый раствор) [56(6)]. При титровании свинца раствором ЭДТА с применением электродной пары Pt—W в точке эквивалентности наблюдается большой скачок потенциала [55(73)]; таким же способом можно фиксировать конец титрования меди, никеля, кадмия, цинка и даже магния [55 (32), 62 (16)]. Так как скачок в точке эквивалентности при определении свинца особенно велик, было испробовано обратное титрование стандартным раствором соли свинца, которое оказалось пригодным для определения бария в никелевых сплавах [57(26)]. Процессы, протекающие при этом на электродах и приводящие к возникновению потенциала, пока не выяснены.
Интересно применение платинового электрода в присутствии окислительно-восстановительной пары гексацианоферрат (III)/гексацианоферрат (II) для обратного титрования избытка ЭДТА стандартным раствором цинка [54(41)]. К титруемому раствору прибавляют очень малые количества K4[Fe(CN)e] и Кз[Йе(СП)б]. Первые же появившиеся в растворе после точки эквивалентности свободные 7п2+-ионы связывают в комплекс [Ре(СП)б]4--ионы, в результате чего происходит скачкообразное увеличение потенциала. Например, при определении алюминия и хрома (III) в одном и том же растворе [60 (158)] вначале оба катиона связывают большим количеством комплексона, а затем избыток ЭДТА оттитровы-вают раствором цинка. После этой первой конечной точки титрования в раствор вносят NaF, при этом алюминий переходит в комплекс [AlFe]3-, а освободившуюся ЭДТА вновь титруют стандартным раствором соли цинка; хром определяют по разности.
Особое значение приобрел стационарный ртутный капельный электрод, теория и применение которого обобщены Шмидом [62(29)]. Индикаторный электрод представляет собой каплю ртути, находящуюся в воронкообразном расширении стеклянной трубки, согнутой в виде буквы «J»; потенциал ртути измеряют с помощью платиновой проволоки, припаянной к нижнему колену стеклянной трубки. В качестве внешнего электрода применяют каломельный или хлоро-серебряный электрод. В том случае, если исследователя интересует не абсолютное значение потенциала, а лишь его скачок в точке эквивалентности, можно применять также амальгамированную золотую или серебряную проволоку.
В раствор, содержащий ионы металла Mv+, которые определяют с помощью такого ртутного индикаторного электрода, вносят сначала несколько капель раствора комплексного соединения ртути с
108
ЭДТА, в результате чего устанавливается следующее равновесие: Mv+ + HgY2- MYv-4 + Hg2+ (57)
Обычно это равновесие сдвинуто влево, так как комплекс HgY2-, константа устойчивости которого равна 1022, значительно более стабилен, чем комплекс MY^-4. Очень малая по сравнению с концентрацией HgY2- концентрация не вошедших в комплекс Hg2+-HOHOB определяет потенциал ртутной капли Ejig:
£Hg = £o + O,O31g[Hg2+] (58)
где £о — нормальный потенциал пары Hg2+/Hg.
В уравнение (58) можно подставить значение концентрации Hg2+-noHoB из следующего уравнения, выражающего закон действия масс для реакции (57):
[Hg2+] [MY]_ А KHgY IM] [HgY]
Тогда потенциал ESg можно выразить следующим образом: Ему [М]
£Hg = % + °-03 'g + °>03 'g [HgY] + °'03 >g -[myT (60)
Если, как бывает в большинстве случаев, равновесие (57) сильно сдвинуто влево, концентрация комплекса [HgY2-] во время титрования раствором ЭДТА практически не изменяется; таким образом, в уравнении (60) переменной величиной является лишь последний член. Отношение концентраций [M]/[MY] в начале титро? вания очень велико, а после точки эквивалентности сильно уменьшается, что влечет за собой уменьшение потенциала. В точке эквивалентности это падение потенциала происходит скачкообразно. При приближении к точке эквивалентности основное количество титруемого металла уже переходит в комплекс с ЭДТА, концентрация [MY] в таком случае уже практически не изменяется и уменьшение Eng связано только с уменьшением рМ. Следовательно, вблизи точки эквивалентности электрод регистрирует изменение рМ, которое было теоретически рассмотрено в главе IV (рис. 4—10).
Если равновесие (57) не сильно сдвинуто влево, скачок потенциала ртутной капли в точке эквивалентности невелик, так как в этом случае прибавление раствора ЭДТА сопровождается не только уменьшением последнего члена в уравнении (60), но и одновременным увеличением предпоследнего члена. Как показал Рингбом [63 (64)], практически при проведении анализов эффективная константа устойчивости комплекса HgY2- чаше всего достигает значения около 1012, так как в растворе присутствуют ионы хлора и Другие простые лиганды (NH3, ОН-), с которыми Hg2+-HOHbi образуют комплексы (т. е. коэффициент распределения р для ртути оказывается намного больше, чем для титруемого металла). Это и
109
приводит к сдвигу равновесия (57) вправо. Тем не менее, скачок потенциала ртутной капли в точке эквивалентности все-таки имеет место.
Из уравнения (60) видно, что с помощью ртутного капельного электрода можно определять также константу образования Аму комплекса металла с ЭДТА. Для этого следует создать в растворе известные концентрации HgY2-, Mv+ и MYV-4; тогда -Eng будет зависеть только от отношения констант устойчивости Аму/Ащу. Этот метод был развит Шварценбахом и Андереггом [54 (28)] и Рейли и Шмидтом с сотр. [56 (76), 58 (11), 58 (12), 58 (14)].
Рейли с сотр. впервые практически исследовали комплексонометрическое титрование большого числа металлов с потенциометрической индикацией точки эквивалентности при помощи ртутного капельного электрода, в том числе и последовательное титрование. Например, титрованием смеси висмута, свинца и кальция при трех различных последовательно установленных значениях pH можно определить все три металла.
Большое число металлов можно определять также обратным титрованием избытка ЭДТА титрованным раствором Hg(NO3)2 [58(57)]. Возможности метода можно расширить, если дополнительно ввести маскирующие реагенты [58 (62)]. Описаны следующие определения: тория [58(58)]; алюминия и марганца [58(59)]; бинарных смесей щелочноземельных металлов или магния с цинком или кадмием [58(60)] и бария, стронция или магния со свинцом, кобальтом, никелем или медью [58(56), [58(60)]; бинарных смесей ртути [60 (163)] с лантаном [59 (125)], хромом [61 (13)], галлием или индием [61 (14)]; скандия и палладия [62 (120)]; висмута [59 (124)] и ртути в тройных смесях с двумя другими металлами [60 (164)].
Ртутный капельный электрод применяют также для индикации точки эквивалентности при определении меди, цинка, свинца и кальция с помощью кулонометрически генерированной ЭДТА [56(77)].
Применение ртутного капельного электрода не ограничивается титрованиями раствором ЭДТА. Из других комплексонов используют, например, ГЭДТА для определения кальция [63(65)], а также отличающиеся большей селективностью полиамины, такие, как трен или тетраэтиленпентамин [59 (113), 62 (99)]. Как и при титровании раствором ЭДТА, к титруемому раствору следует прибав лять немного комплексного соединения ртути с комплексообра зующим веществом, которое используют в качестве титранта.
Для индикации точки эквивалентности при комплексонометрических титрованиях можно применять также электроды под током, с помощью таких электродов определяют кадмий [54 (22)] и кальций [59 (73)], а также цинк и медь в сыворотке, используя в качестве титранта полиамин [62 (99)]. С поляризованными ртутными электродами можно определять кадмий и свинец [59 (80)]. Описано применение поляризации переменным током [60(32)].
ПО
3. КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Происходящее в ходе комплексонометрического титрования изменение электропроводности можно использовать для установления точки эквивалентности, если на графике вычертить зависимость электропроводности от прибавленного объема раствора титранта. При титровании растворов, содержащих буферные смеси, перегиб кривой титрования в точке эквивалентности плохо выражен, так как при таких условиях комплексообразование не сопровождается появлением или исчезновением ионов с высокой подвижностью и электропроводность раствора в основном обусловливают электролиты, входящие в состав буферной смеси. В растворах, не обладающих буферными свойствами, получаются большие эффекты, так как в них комплексообразование связано с большими изменениями pH. В аналитической практике, однако, в общем случае необходимо применять буферные растворы, иначе уменьшение pH при комплексонометрическом титровании будет слишком большим, что вызовет сильное снижение устойчивости комплекса. Поэтому титрование без буферных смесей применяют только в случае сильно разбавленных растворов. Другое ограничение возможностей применения кондуктометрии связано с необходимостью поддерживать как можно более низкую концентрацию индифферентного электролита, для того чтобы избежать работы с сильно проводящим фоном.
Хелл с сотр. [54 (32)] используют кондуктометрическое титрование для стандартизации растворов солей металлов. Метод является более быстрым и точным, чем другие методы, но вряд ли имеет практическое значение. Те же авторы изучали также влияние степени разбавления и концентрации аммиачного буферного раствора на ход кривых титрования.
Прямое титрование растворами ЭДТА и ДЦТА (точнее, их двунатриевых солей) было обстоятельно изучено Выдрой и Карликом [57 (34)]. Ход кривых титрования для обоих комплексонов почти идентичен, но ДЦТА образует более устойчивые металлокомплек-сы. Форма кривых сильно зависит от условий титрования. В слабокислых растворах, не содержащих буферных смесей, кривые до точки эквивалентности довольно круто поднимаются вверх вследствие накопления в растворе весьма подвижных Н+-ионов. Участок кривой после точки эквивалентности имеет очень малый наклон, или совсем горизонтален, или даже немного наклонен вниз. Величина наклона в этом случае зависит от pH раствора и связана с буферным действием растворов титрантов. Хорошие результаты, как и предполагалось, получаются только для сильно разбавленных растворов. В растворах, содержащих аммиачную буферную смесь, кривые титрования вначале поднимаются медленно, но после точки эквивалентности сразу становятся крутыми, что обусловлено появлением в растворе подвижных продуктов
1JJ
диссоциации титранта. Наиболее удобно применение боратного буфера. В этом случае выделяющиеся при титровании ионы водорода вначале связываются, и кривые идут горизонтально, но после точки эквивалентности они поднимаются вверх.
Тит'рование ряда металлов (кальция, стронция, бария, магния, цинка, кадмия, меди, никеля, кобальта и марганца) проводят в различных условиях, но их кривые титрования почти одинаковы. Титрование кальция и магния в боратном буферном растворе используют для определения общей жесткости воды. Метод имеет особое преимущество, если в растворе присутствуют окислители (например, гипохлорит-ионы), разрушающие индикаторы (например, эриохром черный Т), применяющиеся при визуальной индикации конечной точки [57(35)]. Определение жесткости воды кондуктометрическим методом предложила также Пасовская [57(28)].
/
4. ВЫСОКОЧАСТОТНОЕ ТИТРОВАНИЕ
В «классическом» кондуктометрическом титровании работают с частотами порядка Ю3 гц. При высокочастотном титровании используют гораздо более высокие частоты вплоть до нескольких мегагерц. Форма кривых титрования и ограничения в применении метода в общем такие же, как и в низкочастотном титровании. Существенное преимущество высокочастотных методов состоит в том, что в них не требуется погружать электроды в исследуемый раствор; кроме того, эти методы более чувствительны, особенно к присутствию Н+-ионов. Последнее является причиной того, что высокочастотное титрование используют для выяснения некоторых принципиальных вопросов комплексонометрии. Бледэл и Найт [54(2)] исследовали дифференциальным методом стехиометрические соотношения при титровании меди, цинка, кальция и магния раствором ЭДТА и считают, что в пределах точности метода молярное соотношение при образовании комплексов равно 1:1. Интересно, что в пределах одной серии измерений ошибка при титровании сульфата магния в 2—4 раза больше, чем при титровании хлорида магния. Объяснение этому явлению еще не найдено. Те же авторы исследовали пригодность ЭДТА (свободной кислоты и двунатриевой соли) для использования в качестве вещества для установки титра и применяли высокочастотное титрование для оценки различных продажных препаратов [54(3)].
Хара и Уэст исследовали с помощью высокочастотных методов образование различных металлокомплексов ЭДТА, используя как прямое титрование, так и кислотно-основное титрование растворов, содержащих металл и комплексообразующее вещество в различных соотношениях. Кроме обычных металлов, были исследованы также серебро и таллий, которые, как удалось доказать, тоже образуют комплексы в молярном соотношении 1 : 1 [54(47)]. Ионы уранила в области pH = 3,5—5 тоже образуют комплекс, устойчивость которого хотя и мала, но вполне достаточна для проведения
112
титрований [55(42)]. Изучением комплексообразования с помощью высокочастотного метода занимался также Цапп [60(56)]. Метод использовали для определения различных металлов, включая торий [55 (43)] и редкоземельные элементы [56 (59)], в растворах, не содержащих буферных смесей, а также при большом разведении (до 10-4 М) [55 (41)]. Белломо и Бруно установили, что чувствительность метода при определении большого числа металлов [ртути, свинца, цинка, кадмия, никеля, кобальта, меди, церия (III) и алюминия] составляет от 2 до 6 мкг/мл [58(18), 60(149)]. Щелочноземельные металлы и магний титруются неудовлетворительно.
Разработанные методы используют для определения алюминия в алюминий-магниевых, никелевых и хромо-никелевых сплавах [58(27)] и для анализа природных вод [62(117)].
5. АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Преимущество амперометрического титрования состоит в том, что его можно проводить в отсутствие комплексообразующего индикатора. Это положительно сказывается на селективности метода и создает возможность для проведения во многих случаях последовательных титрований. Кроме того, метод очень чувствителен и допускает титрование очень малых количеств и при очень низких концентрациях. Например, сообщается об успешном и поразительно точном определении кадмия в растворах с концентрацией до КН М [56 (22)]. Во многих случаях можно применять отделение путем осаждения, так как осадки чаще всего не мешают определению.
В большинстве работ, посвященных амперометрическому комплексонометрическому титрованию, описано применение ртутного капельного электрода в его классической форме. Пршибил с сотр. [51(15)] впервые предложили амперометрическое титрование для определения висмута и кадмия, а также некоторых других полярографически активных металлов. Как показано ниже, их примеру последовали многие другие исследователи. Кроме классического метода используют также переменнотоковую полярографию с «прямоугольной» волной; этим способом определяют, например, железо (III) в сильно разбавленном растворе с рН=4,7—5 [61 (35)] и индий [62 (36)], причем в последнем случае возможно последовательное титрование смесей индия с кадмием или свинцом. Мартин и Рейли [59 (148)] применили титрование с двумя стационарными поляризованными ртутными капельными электродами и разработали теоретические основы этого метода. Наконец, сообщается [58 (74)] о применении вращающегося ртутного- капельного электрода.
Наряду с ртутными применяются и платиновые электроды. Например, вращающийся платиновый микроэлектрод используют при титровании железа(III) [59(44)] и при определении алюминия обратным титрованием избытка ЭДТА раствором - железа (III)
8 Эик. 553
113
[60(151)], стационарный электрод из платиновой фольги — для определения цинка в кобальтовых ваннах [57(101)]. Вибрирующий платиновый электрод [60 (189)] применяют для титрования ванадия, причем последний может присутствовать в пробе в трех- или четырехвалентном состоянии. Если в растворе содержатся обе формы, то при последовательном титровании наблюдаются два скачка, первый из них соответствует ванадию(III). О титровании с применением двух поляризованных платиновых электродов («метод резкой конечной точки») сообщает Кис [58(44)]. Этим методом можно титровать торий в количестве от 0,3 до 15 мг с точностью 0,4% [60(57)]. Гуэррин и др. [60(66)] описывают применение медного электрода. При помощи графитового электрода [63(48)] титруют уран в концентрации 10-3—10~8 г в 25 мл после восстановления его до урана (IV). Для определения циркония ( + 1,1 в) применяют танталовый вращающийся электрод. С танталовым электродом можно титровать также ртуть [60(74)].
Полярографически активные металлы определяют’ простым титрованием при потенциале предельного тока; например, так определяют титан [61(72)], висмут [51(15), 60(42)], кадмий [51(15), 56(22), 56(94)], галлий [59(130)] и железо [57(33), 58(41)]. Неактивные металлы можно определять методом обратного титрования. Например, алюминий определяют обратным титрованием избытка ЭДТА раствором железа (III) [60(151)], цирконий — обратным титрованием раствором висмута [56 (13), 60 (71)]. Гольдштейн с сотр. [63(13)] предложили в качестве универсального титранта для обратного титрования раствор, содержащий УО2+-ионы. Другой метод определения неактивных металлов — амперометрическое титрование активного металла, вытесненного определяемым неактивным металлом. Например, в сильноаммиачном растворе Са2+-ионы вытесняют из комплекса ZnY2- эквивалентное количество 7п2+-ио-нов; последние затем оттитровывают раствором ЭДТА [52 (36), 54 (88), 63 (73)]. Вытеснением РЬ2+-ионов из PbY2- можно определить Тй4+-ионы [57(91)]. Следующий метод определения неактивных металлов состоит в использовании «волны комплексона». Так называемая «волна комплексона» на самом деле не имеет никакого отношения к восстановлению или окислению комплексона, речь идет о волне, соответствующей окислению электродной ртути. Поскольку это окисление, в зависимости от состава раствора, протекает при различных потенциалах, определение следует проводить при различных, соответствующих каждому данному случаю напряжениях на ячейке. Однако потенциал в любом случае является сильно положительным, что следует рассматривать как большое преимущество метода, так как при этом определениям не мешает кислород. Тем самым устраняется необходимость длительного удаления воздуха из раствора. Метод использования анодной волны был впервые описан Мишелем и др. [53 (51), 54 (29)], а Рейли ссотр. [56(78), 62(33)] разработали применение этого метода для последовательного титрования смесей железа и марганца; цинка и маг
114
ния; висмута и свинца; меди, цинка и магния и других. Этот метод, конечно, пригоден и для определения активных (полярографически восстанавливающихся) ионов. В заключение следует упомянуть еще об одном способе титрования неактивных металлов — с использованием в качестве амперометрического индикатора активного металла. Теория такого титрования совершенно аналогична теории описанного в этой главе фотометрического титрования с установлением конечной точки методом «индикации по наклону». Для применения этого способа необходимо соблюдение условия, заключающегося в том, что определяемый металл должен давать более устойчивый комплекс с титрантом, чем металл, используемый в качестве индикатора. С изменением концентрации последнего, после того как весь определяемый металл свяжется в комплекс, связано изменение наклона кривой титрования (выражающей зависимость диффузионного тока от прибавленного количества раствора титранта) в точке эквивалентности. Этим методом можно титровать кальций и магний, если в качестве индикатора применить таллий (I) [62 (64)]. При введении меди в качестве индикатора можно определять кадмий в присутствии значительных количеств цинка [63(9)]. Используя в качестве индикатора желе-зо(П), можно определять торий [62 (32)].
Ниже приводятся некоторые примеры практического применения амперометрического комплексонометрического титрования. Этот метод используют для определения никеля и кадмия в аккумуляторной жидкости [62 (10)], циркония в ниобиевых сплавах [60 (71)], алюминия [60 (151)] и висмута [60 (95)] в сплавах, ртути в органических соединениях после их озоления [58(86)]; для определения кальция с вытеснением им ионов цинка в растворах с большим содержанием щелочи [63(73)], индия в сфалерите [58(100)] и металлическом кадмии [56(15)]; цинка в ваннах для кобальтовых покрытий [57(101)]; в сплавах [56(3)] и маслах [53 (48)]. С помощью амперометрического титрования можно проводить также определение ЭДТА [55 (86), 59 (73), 60 (88)] и ДЦТА [60 (88)].
6. КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Рейли и Портерфильд [56(77)] в качестве основы для разработки метода кулонометрического титрования использовали способность ртути(II) восстанавливаться из ее комплекса с ЭДТА. При этом освобождается эквивалентное количеству восстановленной ртути количество ЭДТА, которое связывается в комплекс с определяемым металлом. При работе с током силой около 45 ма легко можно достигнуть 100%-ного выхода по току. Выделение ртути протекает на ртутном электроде; катодное и анодное пространства разделены перегородкой из пористого стекла; в качестве анода используют платиновую пластину. Ход титрования контролируют потенциометрически с помощью ртутного капельного электрода. Перед титрованием совершенно необходимо удалить из рас
8*
115
твора кислород. При практическом проведении титрования к раствору ЭДТА прибавляют вначале в небольшом избытке соль ртути и доводят pH раствора до 8,5 с помощью аммиачного буфера. После этого избыток ртути титруют обратно кулонометрически. Затем вносят анализируемый раствор и продолжают титрование (под током) до повторного появления скачка потенциала. Зная количество тока, потребленного на предварительное и основное титрование, рассчитывают содержание определяемого вещества Таким способом определяют медь, свинец, цинк и кальций.
Шмид и Рейли [56(124)] для титрования солей железа(Ш) использовали FeY2~, электролитически генерированный из раствора FeniY_. Конечную точку фиксировали потенциометрически с помощью гладкого платинового электрода.
Кулонометрический метод можно использовать для определения очень малых количеств металлов. Современные технические средства дают возможность поддерживать на постоянном уровне даже самые малые токи, а измерять время можно с очень высокой точностью. Таким образом, «титрант» (электроны) можно подавать со сколь угодно малой скоростью, не разбавляя пробы в процессе титрования.
Используя эту возможность кулонометрического метода, Монк и Стид [62 (25)] определяли кальций, никель, медь, цинк, кадмий, стронций, барий и свинец при pH = 10,5 и цинк, кадмий, иттрий и неодим при pH = 4,5. Для титрования требовался всего один миллилитр раствора; точку эквивалентности устанавливали с помощью пары поляризованных ртутных электродов. При трех-пяти повторных анализах коэффициент вариации составляет лишь 0,5—1%.
7. ХРОНОПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Этот способ титрования основан на следующем принципе. На электрод, опущенный в неподвижный успокоенный раствор, мгновенно подают постоянный ток и наблюдают изменение потенциала электрода во времени. Раствор содержит индифферентный электролит, поэтому сила тока, обусловленного переносом восстанавливающихся (или окисляющихся) веществ к электроду, определяется диффузиег! (как в полярографии). При замыкании электрической цепи потенциал электрода сразу возрастает, достигая значения потенциала разложения первого вещества, и в течение короткого времени сохраняет это значение, затем снова растет до величины потенциала разложения следующего вещества, выделяющегося на электроде, так как в непосредственной близости от электрода запас первого вещества быстро истощается. Теоретически показано и экспериментально подтверждено, что время остановки напряжения у значения потенциала разложения соответствующего вещества— так называемое переходное время — прямо пропорционально корню квадратному из концентрации этого вещества. Если на
116
нести на график зависимость квадратного корня из времени остановки потенциала от объема раствора титранта, то получаются две взаимно наклонные прямые, точка пересечения которых соответствует точке эквивалентности титрования. Рейли и Скрибнер использовали этот метод для титрования меди раствором ЭДТА [55(75)]. Если принять во внимание существенные затраты на аппаратуру и учесть, что те же самые определения можно проводить значительно более простым способом, то станет ясно, что у этого метода мало перспектив на использование в аналитической практике.
8. ТЕРМОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Этот метод, называемый также «энтальпическим» титрованием, основан на измерении теплового эффекта процесса комплексообразования. Согласно описанной Йорданом методике [57(97)], концентрированный стандартный (приблизительно одномолярный) раствор комплексона подают с постоянной скоростью из бюретки в калориметр, в котором находится исследуемый раствор. Изменение температуры раствора регистрируется с помощью термисторов, включенных в мостиковую схему, и записывается самописцем. На кривых титрования (выражающих зависимость температуры от объема раствора титранта) в точке эквивалентности имеется зубец. Чувствительность определения свинца, меди, цинка, кадмия, никеля, кобальта, кальция и магния составляет 0,5—2 ммоль]л при точности около 3%. Аналогичные результаты для многочисленных двухвалентных ионов металлов получил Гармелин [62(44)].
Кривые титрования можно также использовать для вычисления теплот реакций.
Представляет интерес возможность применения этого метода для последовательного титрования присутствующих в одном растворе нескольких металлов, даже если константы устойчивости их комплексов довольно близки друг к другу. В этом случае решающее значение имеет не только отношение констант устойчивости, но и разница в теплотах реакций комплексообразования. Метод особенно пригоден для определения кальция и магния титрованием раствором ЭДТА, поскольку соответствующие тепловые эффекты не только сильно различаются между собой, но даже имеют противоположные знаки.
До настоящего времени практическое применение этого метода было весьма ограниченным. Возможно, его расширению будет способствовать разработанная Пристли и др. [63(66), 63(67)] аппаратура, которая автоматизирует и, следовательно, сильно упрощает определения. Объем раствора титранта можно отсчитывать по счетчику или записывать полную кривую титрования самописцем. Таким способом изучено множество разнообразных методов титрования (в том числе и не комплексонометрических).
117
9. РАДИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Принцип этого сравнительно нового метода проще всего объяснить на примере комплексонометрического титрования цинка. К анализируемому раствору цинка прибавляют немного твердого йодата серебра, содержащего радиоактивное серебро. Эта соль мало растворима и образует с раствором гетерогенную систему. Если затем к раствору прибавить титрованный раствор ЭДТА, то сначала в комплекс с ЭДТА связываются ионы цинка, и лишь потом, после полного перехода цинка в комплекс, с ЭДТА начинает связываться серебро, что сопровождается скачкообразным увеличением растворимости йодата серебра. Поэтому точку эквивалентности можно зафиксировать, наблюдая за растворимостью осадка в процессе титрования. Для получения каждой точки кривой титрования отфильтровывают часть анализируемого раствора и измеряют радиоактивность фильтрата, после чего взятую часть раствора снова объединяют с остальным раствором. Наносят на график зависимость интенсивности излучения от объема раствора титранта и получают две наклоненные друг к другу кривые, точка пересечения которых соответствует точке эквивалентности. Теоретические основы радиометрического титрования рассмотрены в работе Брауна с сотр. [58(32)]. Было исследовано радиометрическое определение кальция, стронция и магния [59 (60)], а также меди и цинка [60(133)] в чистых растворах. Практическое применение этого метода ограничено, так как те же металлы можно определять значительно проще с помощью других методов.
ГЛАВА VIII
МЕТОДЫ ТИТРОВАНИЯ и их точность
В этой главе будут охарактеризованы в общих чертах различные методы титрования. Точность каждого метода зависит от вида кривой титрования и может быть заранее предсказана, если известны все необходимые для вычислений константы равновесия. Будут рассмотрены также вопросы, связанные с условиями титрования одного металла в присутствии другого и с эффективностью применения маскирующих средств.
1. ПРЯМОЕ ТИТРОВАНИЕ
При прямом титровании pH анализируемого раствора доводят до определенного значения обычно при помощи буферных смесей, причем входящие в их состав вещества, как правило, образуют комплексы с определяемым металлом. Затем приливают из бюретки титрованный раствор комплексона, чаще всего раствор ЭДТА, до наступления изменения окраски индикатора, которое наблюдают визуально или, если применяют инструментальный метод индикации точки эквивалентности, до наступления резкого изменения коэффициента экстинкции, потенциала электрода, электропроводности, диффузионного тока и т. д.
Как уже говорилось в гл. IV, в точке эквивалентности происходит скачок рМ, который должен быть возможно более резким. Значение рМ, точно соответствующее точке эквивалентности (рМэ), можно вычислить, пользуясь уравнением (61)
РМЭ = 1/2 (lg K$z, + PMt) + lg ₽A (61)
Это уравнение получается из уравнений (25, 30, 31 и 32), если учитывать, что в точке эквивалентности а = 1 и концентрация [М]' ничтожно мала по сравнению с концентрацией [MZ] (так как к концу титрования практически весь металл связывается в комплекс с титрантом).
На практике, регистрируя переход окраски индикатора при титровании, устанавливают не точное значение рМэ, а более или менее отличающееся от него значение рМ, которое мы обозначим рМк. Это отклонение измеряемого значения рМ от истинного
ДрМ = рМк — рМэ
(62)
119
приводит к тому, что в Для вычисления этой
Ошибка титрования
результатах титрования появляется ошибка, ошибки предложено [63 (64)] уравнение*, (в % от [М]/) составляет
460. АрМ И, <У/а
(63)
При рассмотрении уравнения (63) видно, что несовпадение значения рМ в конечной точке со значением рМ в истинной точке эквивалентности тем меньше сказывается на величине ошибки титрования, чем круче скачок рМ в точке эквивалентности. Если концентрация [М]г велика, то начальная ветвь кривой титрования расположена в области малых значений ординат (рМ); если значение /(m'z' велико, то следующая за скачком конечная ветвь кривой титрования лежит в области больших значений ординат; следовательно, скачок становится тем длиннее и круче, чем больше величина произведения в знаменателе правой части уравнения.
* В истинной точке эквивалентности концентрации не связанных в комплекс металла и комплексообразующего вещества в точности равны друг другу, и металл практически весь присутствует в виде комплекса MZ:
[M]'=[Z]'; [MZ]3=[M]f
eff [MZ]
M'z' [M]' [Z]'
U')
(2')
Если концентрации не связанных в комплекс металла и комплексообразующего вещества в фактически определяемой точке эквивалентности обозначить [М]' и [Z]'c, то ошибку титрования (в процентах от [М]() можно выразить уравнением (3')
[Z]' — [М]'
Ошибка — 100 --руц- (3')
Рассмотрим теперь разности
A [Z] = [Z]'- [Z]'; А[М] = [М]'-[М]' (4')
В непосредственной близости от точки эквивалентности концентрация [MZ] практически постоянна и равна концентрации [М]( и, согласно уравнению (2'), произведение ([7И]Э + А [7И] ) ( [Z]3 + A [Z] ) постоянно; следовательно
А[М]=- A [Z] (5')
Если принять во внимание уравнения (5') и (Г), то уравнение (3') можно написать в следующем виде:
Ошибка = -100(6')
Но так как d [М]/[М] = d In [М] = —2,3с? рМ, и поскольку мы рассматриваем линейную часть скачка рМ, то получим
А [М]/[М] = - 2,3 АрМ (7')
Если в уравнение (6') подставить значение А[М] из уравнения (7') и вместо [М] ввести значение [М]э из уравнений (Г) и (2'), то получим уравнение (63).
120
С удачно подобранным индикатором (величина lg/(mf должна быть, по возможности, равной рМэ) можно невооруженным глазом зафиксировать правильное значение рМ с точностью около ±0,2—0,5 единиц рМ. Так как концентрация титруемых металлов в большинстве случаев составляет 10~4—10-2 М (в среднем [M]z = = 10~3), ясно, что величина эффективной константы устойчивости образовавшегося хелатного комплекса должна быть равна по меньшей мере 107, если ошибка титрования не должна превышать 1%. При титровании магния раствором ЭДТА эти условия хорошо соблюдаются при pH = 10, тогда как титрование бария уже представляет собой предельный случай. При индикации точки эквивалентности с помощью инструментальных методов значение рМэ можно определить с большей точностью, следовательно, ДрМ и ошибка титрования оказываются меньше. Однако при комплексонометрических титрованиях скачок рМ в конечной точке часто бывает настолько большим, что и визуальный метод дает очень точные результаты. Например, при определении кадмия в 0,1 М растворе аммиака с pH = 10 (Am'z'= 1012’5), концентрацией [М], — 10-4 и ДрМ = 0,5 ошибка титрования составляет лишь 0,01%. В этом случае нет необходимости определять рМэ с большой точностью; более того, индикатор в точке эквивалентности резко переходит из одной формы в другую, окрашенную иначе. ч-
Следует отметить, что уравнение (63) не учитывает то количество металла, которое в точке эквивалентности еще связано с индикатором. Это, однако, не существенно, если концентрация индикатора мала по сравнению с концентрацией [М](.
2. ОБРАТНОЕ ТИТРОВАНИЕ
Прямое титрование, естественно, предпочитают обратному. Однако применять прямое титрование в некоторых случаях невозможно, например когда не существует соответствующего индикатора на определяемый металл, или когда металл слишком медленно реагирует с титрантом, или когда при благоприятных для титрования значениях pH металл выделяется из раствора. В таких случаях часто применяют обратное титрование, при котором к определяемому металлу М прибавляют в небольшом избытке раствор ЭДТА и последний титруют обратно ионами второго металла М*. Если металл М образует комплекс медленно, то перед обратным титрованием следует нагреть анализируемый раствор или подождать, пока М полностью не свяжется в комплекс. Если металл М выпадает в осадок при благоприятных для титрования значениях pH, то раствор титранта, взятый в избытке, прибавляют к подкисленному анализируемому раствору, а затем доводят pH раствора до значения, необходимого для обратного титрования. Разумеется, для металла М*, который используют при обратном титровании, должен существовать соответствующий индикатор.
121
При обратных титрованиях играет роль как ошибка в титре раствора комплексона, так и ошибка в титре раствора металлам*, что особенно неблагоприятно в тех случаях, когда прибавляют большой избыток раствора ЭДТА и результат титрования затем вычисляют по разности двух близких по величине чисел. Ошибка, являющаяся следствием того, что при обратном титровании значение рМэ, которое должно соответствовать точке эквивалентности, определяют не точно, не превышает, однако, ошибки при прямом титровании металла М* и также быть может вычислена при помощи уравнения (63). Соответствующее значение рМэ получают используя уравнение (61), в которое подставляют константу и коэффициент Рд для металла М*, применяемого для обратного титрования.
Если определяемый металл медленно реагирует с комплексоном, комплекс MZ разрушается тоже медленно; такой комплекс ведет себя инертно, и его присутствие не оказывает никакого влияния на форму кривой обратного титрования. В таком случае эта кривая идентична кривой прямого титрования ионов М*, но имеет противоположное направление.
Хорошим примером являются определения хрома (III) и кобальта [в последнем случае обратное титрование проводят после окисления кобальта, в результате которого получается инертный комплекс кобальта(Ш)]. Комплексонаты CrY~ и CoY“ настолько инертны, что обратное титрование избытка ЭДТА можно проводить даже в сильнокислом растворе, применяя металлы М*, образующие более стабильные комплексы, чем CrY~ или CoY-, например железо(III), торий или висмут.
Комплексонаты некоторых других металлов, реагирующих с ЭДТА не слишком медленно, тоже являются достаточно инертными, так что иногда их присутствие удивительно мало мешает обратному титрованию. Эффективная константа комплексоната алюминия A1Y~ при pH = 3 составляет лишь 105’5; несмотря на это, можно без затруднений оттитровать избыток ЭДТА раствором соли железа (III), так как реакция обмена A1Y'+Fc3+—>FcY_+А13*' протекает достаточно медленно. При определении никеля избыток прибавленного раствора ЭДТА можно оттитровать в кислом растворе даже раствором соли висмута при охлаждении льдом, чтобы замедлить реакцию обмена NiY2- + Bi3+—► BiY~ + Ni2+.
Если комплекс MZ не является инертным, то величина эффективной константы устойчивости комплекса M*Z не должна превышать величины такой же константы комплекса MZ, ибо в противном случае после достижения точки эквивалентности обратного титрования прибавляемые ионы М* вытесняли бы М из MZ с образованием M*Z, чего не должно быть, так как индикатор реагирует именно на ионы М*. Вследствие этого индикация точки эквивалентности оказалась бы невозможной или неправильной, поскольку было бы невозможным достаточно скачкообразное уменьше-
122
ние рМ*. При выборе металла для обратного титрования следует принимать во внимание, что величина эффективной константы устойчивости комплекса M*Z должна быть меньше соответствующей величины для MZ, но больше, чем 107:
^M'Z' > Ю7 (64)
При соблюдении условий (64) кривая обратного титрования будет аналогична кривой прямого титрования металла М*, но направление первой кривой будет противоположно направлению второй. Комплекс MZ, как и в предыдущем случае, не вступает в обменную реакцию, но уже не по кинетическим причинам, а благодаря своей стабильности. Оценить величину рМ* можно опять-таки при помощи уравнения (61), а ошибку, являющуюся следствием недостаточно точного совпадения рМ*к и рМэ> при помощи уравнения (63).
Условия (64) будут выполняться практически всегда, если использовать для обратного титрования магний, так как большинство металлов образует более устойчивые комплексы с ЭДТА, чем магний. И действительно, для обратных титрований особенно часто применяют именно магний, который удобен еще и тем, что для него есть хороший индикатор — эриохром черный Т. Поскольку величина константы устойчивости комплекса MgY~ не намного больше, чем 107, точка эквивалентности может быть не слишком отчетливой. Чаще всего условия (64) оказываются выполненными и в том случае, когда для обратного титрования применяют Мп2+-ионы; в этом случае точка эквивалентности бывает более резкой. Если комплексонат титруемого металла очень устойчив, в роли М* могут выступать и многие другие металлы, например цинк и медь, которые пригодны для титрования в кислых растворах.
3. ТИТРОВАНИЕ ПО МЕТОДУ ВЫТЕСНЕНИЯ
Если прямое титрование невозможно в силу причин, которые были сформулированы в предыдущем разделе, хорошим выходом из положения может быть как обратное титрование, так и титрование по методу вытеснения. К анализируемому раствору обычно прибавляют комплексное соединение магния с ЭДТА; при этом, если комплексонат определяемого металла М устойчивее комплекса MgY2', что имеет место практически всегда, происходит следующая реакция вытеснения:
M^+MgY2- —> MY’2“'' + Mg2+ (65)
Следовательно, в растворе катион Mv+ замещается Mg2+-HOHOM, который всегда можно оттитровать, поскольку для него имеется много хороших индикаторов. Если прямое титрование Мг+-иона невозможно из-за медленного протекания его реакции с ЭДТА, то реакция (65) тоже протекает медленно, поэтому необходимо ждать, пока процесс пройдет полностью, и даже ускорить его нагреванием
123
раствора, прежде чем начать титрование выделившегося магния. Если имеется опасность выпадения в осадок металла М при том значении pH, при котором проводится титрование, то комплексонат магния прибавляют к кислому раствору, а затем последний подщелачивают аммиаком.
Разумеется, титруемый металл можно замещать и другими металлами, а в качестве комплексообразующего вещества совсем не обязательно применять ЭДТА. В общем случае определяемым металлом М вытесняют из комплекса M*Z металл М*, после чего вместо М титруют М*. Реакция вытеснения
M + M’Z —> MZ + M* (66)
протекает лишь в том случае, если величина эффективной константы устойчивости комплекса MZ больше такой же величины для M*Z. Однако эффективная константа устойчивости комплекса M*Z должна быть равна по меньшей мере 107, для того чтобы ошибка титрования не оказалась слишком большой. Следовательно, при титровании по методу вытеснения тоже должны выполняться условия (64). Кривая титрования смеси MZ и М* (выражающая зависимость рМ* от количества прибавленного раствора титранта) имеет практически такой же вид, как если бы комплекс MZ отсутствовал, поэтому рМэ можно определять при помощи уравнения [61), а ошибку титрования — по уравнению (63).
При добавлении избирательно действующих вспомогательных комплексообразующих веществ можно, в известных условиях, добиться обменной реакции М с M*Z даже в том случае, если Kmz<Km*z', так как благодаря сильному увеличению Рд— коэффициента распределения для иона М* — может оказаться, что ^M'z'-> Так, например, барий, для которого не существует хорошего индикатора, можно заместить в растворе цинком, если прибавить раствор аммиака в концентрации около 1 М; при этом /<|п'у уменьшается до величины 10 , т. е. становится меньше, чем Двау К раствору, в котором определяют ион бария, прибавляют комплексонат цинка ZnY2-, подщелачивают аммиаком и титруют вытесненные из комплекса ионы цинка раствором ЭДТА. Верхняя кривая на рис. 15 иллюстрирует ход изменения pZn при таком титровании. Скачок в точке эквивалентности при pZna = 14,3 [по уравнению (61)] еще хорошо выражен и может фиксироваться с помощью эриохрома черного Т. Резкость перегиба даже лучше, чем можно ожидать в результате сравнения рис. 15 и 25, так как комплекс металла с индикатором в сильноаммиачном растворе имеет состав ZnF(NH3)-, а не ZnF-. Вследствие этого величина эффективной константы устойчивости комплекса индикатора с металлом оказывается немного больше той величины, которая получается при вычислении по уравнению (50) с использованием данных табл. 12.
Обменная реакция (66) имеет значение и при прямом титровании М в случае, если для индикации точки эквивалентности при-124
меняют второй металл М* с соответствующим ему индикатором. Равновесие реакции (66) при этом обычно сдвинуто влево, так что замещения иона М в растворе ионом М* не происходит, кроме того, концентрация прибавленного комплекса M*Z, как правило, мала по сравнению с [М],. Тем не менее, в момент завершения образования комплекса металла М, как уже говорилось в главе IV, происходит скачок рМ*, так как при этом скачкообразно возрастает lg [ZJ; этот скачок рМ*, фиксируемый с помощью индикатора на М*, используют для установления конца титрования иона М.
Таким способом можно индицировать с помощью ртутного капельного электрода точку эквивалентности комплексонометрического титрования многих металлов, если к анализируемому раствору прибавить небольшое количество комплекса HgY2-. Тогда в уравнении (66) М* означает Hg2+, а индикатором является электрод, фиксирующий скачок pHg. В других случаях в качестве индикатора используют смесь ПАН и комплекса меди(II) с ЭДТА. Краситель ПАН ведет себя избирательно по отношению к Си2+-ионам и очень отчетливо реагирует на них. Например, при титровании ионов алюминия [в уравнении (66) М=А13+ и М* = Си2+] практически не происходит замещения А13+-ионов Си2+-ионами, если к А13+ прибавлен CuY2-, так как константа устойчивости A1Y-меньше таковой для CuY2-. Тем не менее, при равновесии, изображаемом уравнением (66), концентрация Си2+-ионов все-таки достаточно велика, для того чтобы образовался комплекс Си — ПАН, который в конце титрования А13+-ионов снова разлагается и вызывает изменение окраски, так как при этом рСи скачкообразно увеличивается.
4. ТИТРОВАНИЕ СУММЫ ИОНОВ И СЕЛЕКТИВНОЕ ТИТРОВАНИЕ
Если в растворе присутствуют два металла, то обычно можно без затруднений определить их общее содержание. Если катион М образует более устойчивый комплекс, чем М*, то при добавлении к анализируемому раствору титрованного раствора хелатообразующего вещества сначала связываются ионы М, а затем М*. При титровании суммы катионов выбирают такой индикатор, который фиксирует скачок рМ*, соответствующий концу комплексообра зо-вания. Как и при титровании по методу вытеснения, присутствие комплекса MZ, образовавшегося в результате реакции комплексона с первым металлом, практически не оказывает влияния на ход титрования металла М*; следовательно, значение рМэ можно получить из уравнения (61), а ошибку титрования — из уравнения (63), в котором АрМ = рМк —рМэ- Разумеется, в оба уравнения должна входить эффективная константа устойчивости комплекса M*Z.
Если комплексы MZ и M*Z имеют в достаточной степени различающиеся эффективные константы устойчивости, то связывание
125
в комплекс металла М заканчивается довольно большим скачком рМ, фиксация которого с помощью индикатора на ионы М дает возможность определять М в присутствии М*. Следовательно, можно избирательно титровать М в присутствии М* и, в сочетании с результатами суммарного титрования, определять содержание обоих металлов. Для оценки возможности проведения подобных избирательных и последовательных титрований необходимо проследить за изменением рМ, а именно, исследовать только область первого скачка на кривой, при этом нужно рассчитать значение рМ, соответствующее точке эквивалентности (рМэ), и оценить ошибку, являющуюся следствием того, что при титровании не удается точно определить это значение рМ [из-за чего значение рМ в конечной точке (рМк) несколько отличается от истинного значения (рМэ)].
До окончания избирательного титрования иона М второй металл М* практически не должен связываться в комплекс, поэтому его концентрация остается постоянной: [М*]' = [М*]<. Присутствие иона М* приводит к некоторому снижению скачка рМ, так как комплекс MZ в присутствии М* имеет меньшую эффективную устойчивость, нежели в отсутствие второго металла. Это обстоятельство учитывается, если в уравнении (67) eff ____________________________ [MZ]
^M'Z' iZy
величину [Z]' будем рассматривать как общую концентрацию комплексообразующего вещества, не связанного с катионом М
И' = 2 [H/Z] + [M‘Z] = [Z] (ctH + ам. - 1) (68)
(67)
т. е. если к обычной сумме концентраций различных не связанных с металлом форм комплексообразующего вещества Z прибавим концентрацию Z, связанного со вторым металлом. Коэффициент распределения ан рассчитывают, как обычно, по уравнению (18), а коэффициент ам4 по уравнению (69):
= l + (69)
Ра
в котором Рд — коэффициент распределения для металла М’ — можно вычислить по уравнению (23). [Если М* = Са, коэффициент ам* вычисляют по уравнению (28).] В зависимости от сравнительной величины ан и ам„ в уравнении (68) можно пренебречь тем или другим из этих коэффициентов, но тот случай, когда aM,<aH> нас не интересует, так как при этом M*Z является настолько слабым комплексом, что ион М* совершенно не мешает титрованию иона М Поэтому для эффективной константы устойчивости комплекса MZ в присутствии второго металла М* получаем следующее выражение:
eft _ kmzPa .
tA'z’ [М’]г KM.Z₽A
126
Подставляя эту константу в уравнение (61), для значения рМ в точке эквивалентности селективного титрования металла М в присутствии М* получаем
рМэ = 1/2 (lg KMZ — lg KM.Z + lg ₽a + lg Pa + + P^i) (71)
Если ту же константу подставим в уравнение (63), то получим выражение для ошибки селективного титрования. Ошибка титрования (в % от [М]() составляет
460 ДрМ
'[M^KM,zpAV/a . [Mli KMZP1 /
(72)
Это уравнение показывает, что ошибка селективного титрования пропорциональна отношению эффективных констант устойчивости комплексов обоих металлов. Если считать АрМ = 0,5 (визуальное титрование) и принять, что общие концентрации обоих металлов приблизительно равны ([A'I*]z/[AI]/ = 1), то по уравнению (72) мы находим, что отношение Am*z/Amz должно быть не больше 10-4—10-5, для того чтобы ошибка не превышала 1%. Металл, который требуется определять селективно, должен, соответственно, образовывать комплекс в 104—105 раз более устойчивый, чем комплекс второго металла. Поэтому можно, например, титровать кальций в присутствии магния раствором ГЭДТА, но не раствором ЭДТА (табл. 2 и 3). При инструментальной индикации точки эквивалентности АрМ может быть меньше 0,5, так что в этом случае и при меньшей разнице констант устойчивости комплексов MZ и M*Z можно получить приемлемые результаты.
Следует отметить, что ошибка селективного титрования зависит не от абсолютной концентрации [Мф титруемого металла, а от отношения [М*ф/[М]г; кроме того, она не зависит от разбавления, как это имеет место при титровании одного металла, где ошибка возрастает с увеличением разбавления [уравнение (63)]. С другой стороны, согласно уравнению (71), рМэ увеличивается с разбавлением раствора. Следовательно, можно подобрать такую концентрацию раствора, при которой значение рМ, соответствующее точке эквивалентности, совпадает с рМ перехода окраски применяемого индикатора. И в самом деле, различные авторы отмечали, казалось бы, странный факт, что при разбавлении титруемого раствора переход окраски в точке эквивалентности избирательного титрования оказывался более резким.
Ошибка титрования зависит не от абсолютных значений констант устойчивости образующихся комплексов, но от их соотношения. Следовательно, при известных обстоятельствах целесообразно применять в качестве титранта комплексообразующее вещество, дающее менее устойчивые комплексы, чем ЭДТА, но с большей разницей между MZ и M*Z, например трен для определения никеля в присутствии марганца (lgKNiz = 14,8; lgAMnz = ==5,8) вместо ЭДТА (lg Aniy = 18,6; 1g Amay = 13,4).
127
Во многих случаях условия для селективного титрования можно создать путем применения избирательно действующих вспомогательных комплексообразующих веществ. При прибавлении последних должен повышаться Рд, т. е. коэффициент распределения металла, в присутствии которого требуется определять другой металл. На этом свойстве основано, в общих чертах, так называемое маскирование.
Комплексы ЭДТА с лантаном и цинком имеют, например, приблизительно одинаковую устойчивость, поэтому при титровании можно определять только сумму этих металлов. Если же к раствору прибавить цианид калия, цианид-ионы свяжут в комплекс практически только ионы цинка — при концентрации KCN 0,1 М и pH = 8 pzn = 10'1, следовательно, отношение эффективных констант устойчивости комплексов LaY- и ZnY2- примет значение около 1010. Таким образом, цинк маскируется цианид-ионами и больше не мешает титрованию лантана.
Другой пример касается определения цинка в присутствии кадмия. Их комплексы с ЭДТА имеют почти одинаковую устойчивость, и титрование этих металлов в аммиачном растворе дает только их сумму. Если же прибавить к раствору иодид калия до концентрации не ниже 0,5 М, то практически в иодидный комплекс связывается только кадмий (получается [CdY4]2-), и |3yd увеличивается до значения 105. Поэтому эффективная константа устойчивости комплекса CdY2- будет в 105 раз меньше такой же константы комплекса ZnY2-, т. е. становится возможным селективное титрование цинка в присутствии кадмия. Если же, напротив, требуется определить кадмий в присутствии цинка, в качестве титранта следует использовать раствор ГЭДТА, поскольку в этом случае Acaz в 102’2 раза больше, чем Kzdz (табл. 3). Если, кроме того, прибавить еще вспомогательное комплексообразующее вещество, предпочтительно связывающее цинк, например трен (табл. 1), то становится возможным селективное определение кадмия в присутствии цинка.
О маскировании см. далее в главе IX.
5. КОМПЛЕКСОНОМЕТРИЯ В СОЧЕТАНИИ С РЕАКЦИЯМИ ОСАЖДЕНИЯ
а) Во многих случаях определяемый компонент раствора можно выделить в виде трудно растворимого осадка, содержащего металл, который можно титровать; этот осадок затем отфильтровывают, промывают, снова растворяют, и комплексонометрически от-титровывают содержавшийся в осадке металл. Этот принцип был впервые применен для определения натрия [52 (25)] титрованием цинка в осадке NaZn(UO2)sAc9 • aq и для определения фосфат-ионов [52(23)] титрованием магния в осадке Mg(NH4)PO4 • aq. Следующие примеры — определение пирофосфат-ионов путем титрования цинка в ZnaPsOy [55(H)] или марганца в МщРгО?
128
[55(109)], определение молибдена и вольфрама титрованием кальция в СаМоО4 и CaWO4 [55 (99)]. При титровании свинца проводят предварительное селективное выделение его в виде РЬОг [55 (74)], при титровании кальция — выделение его в виде CaSO3 [54 (5)], при определении никеля и кобальта их предварительно выделяют в виде сульфидов осаждением тиоацетамидом [55 (63), 55 (77)]. Пектин определяют осаждением с помощью кальция и титрованием последнего после растворения осадка [54 (54)]. Этот принцип используют для определения ряда органических соединений и фармацевтических препаратов (см. часть II).
б) Во многих случаях определения проводят также следующим образом. К исследуемому раствору прибавляют в избытке металл, который можно титровать и который образует осадок с определяемым компонентом раствора. Но вместо того, чтобы определять металл в выделенном из раствора осадке, титруют избыток металла в фильтрате. На этом принципе основано определение сульфат-ионов [53 (1)], при котором после осаждения BaSO4 избыток бария титруют раствором ЭДТА. Аналогичным образом мсжно определять хромат-, оксалат- [55 (22)], сульфид-ионы [55 (13)] и другие анионы.
6. ЦИАНИДНЫЕ МЕТОДЫ
Цианид-ион резко выделяется из числа других лигандов благодаря высокой устойчивости его комплексов с некоторыми металлами. Например, для [Ni(CN)4]2~ х4 = 1028, для [Ag(CN)2]~ Хг = 1022, для [Hg(CN)4]2~ х4= 1036. Из лигандов, занимающих одно координационное место, только цианид-ион способен при взаимодействии с этими металлами конкурировать с ЭДТА и вытеснять ее из комплексов с ними. На использовании этого свойства основано комплексонометрическое определение цианид-ионов, а также серебра, палладия, золота и галогенов.
а) При определении цианид-ионов в аммиачный анализируемый раствор вносят в избытке NiSO4 и избыток NРайонов титруют обратно раствором ЭДТА в присутствии мурексида [52 (32)].
б) Серебро, палладий (II) и золото (III) реагируют с цианидным комплексом никеля следующим образом:
[Ni(CN)4]2~ + 2Ag+ —> Ni2++ 2[Ag(CN)2]~ (73)
[Ni(CN)4]2~ + Pd2+ —> Ni2++ [Pd(CN)4]2~ (74)
[Ni(CN)4]2~ + Au3+ —> Ni2+ + [Au(CN)4]" (75)
При определении благородных металлов [52 (26), 53 (21), 55(1)] готовят аммиачный раствор чистой перекристаллизованной соли K2[Ni(CN)4], приливают к нему анализируемый раствор и выделившиеся свободные ионы никеля титруют раствором ЭДТА. Аммиачный раствор K2[Ni(CN)4] растворяет также труднорастворимые осадки хлорида, бромида, иодида и роданида серебра, при этом, согласно уравнению (73), освобождается количество никеля,
9 Зак. 553
129
эквивалентное количеству не только серебра, но и связанного с ним аниона. Поэтому, для того чтобы определить ионы галогенов (за исключением фтора) или роданид-ионы, их осаждают нитратом серебра, осадок промывают, вносят в аммиачный раствор соли K2[Ni(CN)4] и титруют никель [52 (26)].
7. АМАЛЬГАМНЫЕ МЕТОДЫ
Еще в 1955 г. Вебер в короткой заметке [55 (15)] указал на возможность осуществления взаимодействия веществ, обладающих окислительными свойствами, с жидкими амальгамами, с последующим комплексонометрическим титрованием переходящих в раствор ионов металлов. Более ничего им опубликовано не было. Скрибнер и Рейли [58 (13)] подробно исследовали возможность применения этой идеи и пришли к исключительно интересным результатам. Оказалось, что выбором подходящей амальгамы, установлением нужного значения pH раствора, соответствующим прибавлением реактивов можно иногда улучшить селективность определений при анализе смесей металлов. Но особенно важным оказалось то обстоятельство, что этот метод дает возможность — удивительно, что до настоящего времени этим совершенно не воспользовались—косвенного комплексонометрического определения тех веществ, в особенности органических соединений, которые нельзя определять прямым комплексонометрическим титрованием. В качестве примера были проведены определения некоторых нитро- и нитрозосоединений, причем полученные результаты оказались весьма удовлетворительными.
При применении этого метода различают четыре его разновидности.
I. Замещение легко титруемого или маскируемого металла другим, не обладающим подобными свойствами. В качестве примера рассмотрим смесь свинца и марганца. Аликвотную часть анализируемого раствора используют для титрования суммы обоих металлов. Во второй аликвотной части с помощью амальгамы цинка обменивают свинец на цинк, который легко маскируется цианид-ионами, после чего определение марганца уже не вызывает затруднений. Содержание свинца вычисляют по разности. Распространение этого принципа на анализ тройных смесей, например смеси свинца, цинка и кальция, вполне возможно, если дополнительно ввести операцию демаскирования цианида цинка формальдегидом.
II. Замещение трудно титруемого или маскируемого металла другим, легко титруемым или маскируемым. В качестве примера подобного случая, противоположного предыдущему, приведем анализ смеси меди и никеля. Снова в одной аликвотной части анализируемого раствора определяют общее содержание металлов. Вторую аликвотную порцию встряхивают с амальгамой свинца, причем медь обменивается на свинец, а никель в такую реакцию не вступает. После прибавления цианид-ионов для маскирования ни-
130
келя определяют свинец, количество которого эквивалентно количеству меди. Содержание никеля вычисляют по разности.
III. В этом случае используется различие между эквивалент
ными соотношениями в реакции восстановления и реакции, происходящей при титровании. Например, при титровании смеси висмута и свинца раствором ЭДТА сначала определяют общее содержание обоих металлов, причем оба реагируют с комплексоном в молярном отношении 1:1. Во второй аликвотной порции в результате реакции с амальгамой свинца ВР^-ионы обмениваются на
РЬ2+-ионы, причем в раствор вместо 2 г-атом висмута переходят 3 г-атом свинца. Поэтому на титрование второй порции расходуется большее по сравнению с первой порцией количество ЭДТА. Зная количество комплексона, израсходованное при первом и втором титровании, можно рассчитать содержание обоих металлов.
IV. К этой группе относятся определения всех веществ, которые недоступны или труднодоступны прямому комплексонометрическому титрованию. Например, ионы серебра и таллия (I) можно, используя амальгаму цинка или кадмия, обменять на легко титруемые Zn2+ или Cd2+. Подобным же способом титруют многие восстанавливающиеся органические соединения, например нитросоединения, а также восстанавливающиеся анионы, например ар
Рис. 31. Аппарат для восстановления с помощью амальгамы:
/ — горло со шлифом; 2 — газоподводящая трубка со стеклянным фильтром; 3 — кран.
сенат- или хромат-ионы.
Легко видеть, что различные комбинации описанных выше типов
амальгамного титрования можно использовать для анализа многокомпонентных смесей, разделяя последние на соответствующие аликвотные порции. Многочисленные примеры таких определений приведены в оригинальных работах. Следует отметить, что указанные примеры относятся к системам, которые можно титровать и другими комплексодометрическими способами.
Практически определение состоит из следующих операций: 1. Установление требуемого значения pH анализируемого раствора при помощи буферных смесей. 2. Удаление кислорода из анализируемого раствора, так как используемый для восстановления неблагородный металл в амальгаме может окисляться кислородом. 3. Прибавление амачьгамы, которая затем должна реагировать с анализируемым раствором. 4. Удаление амальгамы после
9*
13’
восстановления. 5. Титрование раствором ЭДТА. Скрибнер и Рейли описали специальный встряхиваемый сосуд, в котором можно осуществить все эти операции. Очень хорошо себя оправдал также аппарат, изображенный на рис. 31. После внесения в колбу анализируемого раствора, содержащего соответствующую буферную смесь, аппарат продувают азотом, поступающим через трубку со стеклянным фильтром 2, затем через горло 1 прибавляют из градуированной капельной воронки требуемое количество амальгамы (около 5 мл} и включают вибромешалку, которая разбивает жидкую амальгаму на мелкие капельки; после восстановления (в течение 5—10 мин} сливают амальгаму через капиллярный кран 3, вносят через горло 1 индикатор, вставляют в этот шлиф бюретку и проводят титрование.
Скрибнер и Рейли обстоятельно исследовали влияние pH, а также дали рекомендации об оптимальных количествах и концентрации амальгамы и’скорости восстановления. При работе с растворами с низким значением pH небольшое количество неблагородного металла из амальгамы может с выделением водорода перейти в раствор. В таких случаях следует проводить холостой опыт с растворами известной концентрации и результаты этого опыта учитывать при вычислениях.
Асени [61 (154)] применил амальгамный метод для анализа смесей серебра с висмутом и серебра с кадмием.
8. АЛКАЛИМЕТРИЧЕСКОЕ КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
В разделе 3 этой главы было показано, что определяемый катион можно вытеснить М£2+-ионами и последние затем оттитровать. Следует заметить, что определяемый ион металла можно вытеснить также эквивалентным количеством ионов водорода, которые затем можно оттитровать алкалиметрически раствором щелочи [46 (2)]. Для этого в реакцию (65) вместо магниевого комплекса MgY2- вводят водородный комплекс ЭДТА, т. е. HY3- или H2Y2-; в этом случае реакция описывается уравнением (12) или (13).
При практическом проведении титрования устанавливают рядом две бюретки с 0,1 М раствором NaOH и 0,1 М раствором ЭДТА (Na2H2Y). К анализируемому раствору, который не должен содержать веществ, применяемых для приготовления буферных смесей, приливают сравнительно большое количество NH4CI и pH-индикатор (смесь метилового красного и бромкрезолового зеленого) и доводят кислотность раствора до значения, соответствующего рН = 5 (цвет индикатора — серый). Затем приливают немного Na2H2Y и выделившуюся кислоту титруют раствором NaOH. Обе эти операции повторяют до тех пор, пока прибавление раствора ЭДТА больше не вызывает понижения pH Результат титрования вычисляют по расходу NaOH: каждая грамм-молекула щелочи со
132
ответствует 1/2 грамм-иона металла. Методика неудобна тем, что анализируемый раствор необходимо точно нейтрализовать, что часто сопряжено с трудностями из-за гидролиза соли металла. Однако этот метод рекомендуется для предварительного титрования при необходимости проведения обратного титрования, поскольку при этом не требуется индикатор на определяемый ион металла; таким способом можно избежать прибавления большого избытка раствора ЭДТА. Титрование проводят непосредственно вслед за алкалиметрическим титрованием после добавления буферной смеси и индикатора на металл, который используют для обратного титрования.
Переход окраски pH-индикатора лишь тогда бывает мало-мальски четким, когда прибавленный избыток раствора ЭДТА минимален, так как не связанная с металлом ЭДТА в области pH 5—7 обладает буферными свойствами (НгУ2--* HY3*). НТА не проявляет таких свойств в интервале pH от 3 до 10, поэтому изменение окраски получается более резким, если для алкалиметрического комплексонометрического титрования используют двунатриевую соль НТА [48 (1), 48 (2)] — в этом случае реакция протекает в соответствии с уравнением (11). Выделяющиеся при реакции (11) Н+-ионы можно оттитровать также иодометрически; для этого прибавляют иодид-иодатную смесь и выделившийся иод оттитровывают тиосульфат-ионами [Z3- в реакции (76) означает анион НТА]:
MV+ + HZ2~ +1/6Ю^ + 5/61~ —> 1/2Н2О + 1/2Ц +MZV-3 (76)
ГЛАВА IX
СПОСОБЫ ПОВЫШЕНИЯ СЕЛЕКТИВНОСТИ ОПРЕДЕЛЕНИЙ
Аминополикарбоновые кислоты типа ЭДТА образуют довольно прочные комплексы почти со всеми многовалентными катионами, что и положено в основу метода комплексонометрического титрования. Эта общая способность к комплексообразованию является, с одной стороны, преимуществом, так как с помощью одного-един-ственного титрованного раствора можно определять большое число различных элементов, а с другой стороны — недостатком, так как она обусловливает низкую избирательность определений.
Константы образования некоторых комплексов с ЭДТА все-таки достаточно отличаются друг от друга, для того чтобы можно было селективно титровать соответствующие металлы в присутствии других. Для этого, как уже упоминалось в разделе 4 главы VIII, необходимо, чтобы эффективные константы устойчивости различались по крайней мере в 104—105 раз. При взгляде на табл. 2 видно, что алюминий, лантаноиды, а также двухвалентные катионы кобальта, никеля, меди, цинка и кадмия можно титровать в присутствии катионов щелочноземельных металлов, a Fe3+-, Ga3+-, In3+-, Tl3+-j Bi3+-, Zr4+-, ТИ4+-ионы, образующие комплексы с константами устойчивости выше 1020, — в присутствии почти всех двухвалентных металлов, что подтверждается практикой. При практическом проведении титрования уменьшают, по мере надобности, pH раствора настолько, чтобы металлы, которые не нужно титровать, практически совсем не связывались в комплекс, так как при увеличении ан эффективные константы устойчивости их комплексов сильно уменьшаются. Титрование алюминия и двухвалентных катионов тяжелых металлов в присутствии щелочноземельных металлов проводят при pH раствора около 5, селективное титрование других трехвалентных катионов в присутствии двухвалентных — при рН = 3 и ниже. Благодаря этому можно обходиться без вспомогательного комплексообразующего вещества, всегда необходимого при более высоких значениях pH, для того чтобы предохранить определяемый металл от выпадения в осадок в виде гидроокиси Вспомогательное комплексообразующее вещество (например, аммиак) привело бы к снижению эффективных констант устойчивости комплексов титруемых металлов с ЭДТА и, вследствие этого, — к ухудшению селективности.
В некоторых случаях можно проводить селективное ти!рование, которое невозможно осуществить с использованием ЭДТА, приме-134
няя другой комплексон, например можно титровать кальций в присутствии магния раствором ГЭДТА, но не ЭДТА. Значительно более избирательными, по сравнению с аминополикарбоновыми кислотами, титрантами являются полиамины, которые практически связывают в комплекс лишь ионы переходных металлов (табл. 1). Однако для практического использования в анализе они мало пригодны, так как устойчивость полиаминовых комплексов быстро падает с уменьшением значений pH (что обусловлено большими значениями pAj).
Поскольку число таких случаев, когда константы устойчивости комплексов ЭДТА с присутствующими в анализируемом растворе металлами различаются больше чем в 104—105 раз, мало, часто возникают затруднения при необходимости комплексонометрического титрования одного металла в присутствии другого. Во многих случаях приходится перед титрованием проводить разделение металлов. Иногда к цели может привести прибавление маскирующих веществ, а иногда даже удается создать условия для последовательного титрования нескольких металлов.
1. РАЗДЕЛЕНИЕ
Для целей разделения прежде всего можно использовать осаждение одного ий компонентов раствора с последующим отфильтровыванием осадка. При этом часто используют осадители, обычно применяемые в гравиметрии. Однако следует подчеркнуть, что требования к осадку в гравиметрическом и титриметрическом анализе совершенно разные. Для титриметрических целей требуется лишь тщательное отделение сопутствующих металлов, но не обязательно, чтобы осадок имел строго стехиометрический состав. Например, для разделения можно применять осаждение тиоацетамидом сульфидов [55 (62)], в большинстве случаев непригодных для гравиметрического анализа, а также реакции цементации [62 (152)].
Большой интерес представляет применение ионного обмена [58 (42), 59 (6)], на которое впервые указал Вюнш [57 (111)]. Во многих случаях происходящее при обмене сильное разбавление анализируемого раствора не является препятствием для последующего комплексонометрического титрования. Перспективы метода изложены в монографии Самуэльсона [63 (82)].
Экстракция в сочетании с титрованием раствором ЭДТА применяется уже давно [53 (40), 54 (38)]. О других возможностях разделения экстракцией говорится в монографии Фрайзера и Морриса [57 (141)].
2. МАСКИРОВАНИЕ
Под маскированием какого-либо компонента раствора понимают химическое связывание его прибавленным маскирующим веществом, вследствие чего данный компонент не принимает участия в последующей химической реакции, т. е. не титруется при
135
комплексонометрическом титровании другого компонента раствора. Маскирование металла может быть осуществлено путем его осаждения, связывания в комплекс, окисления или восстановления.
Маскирование путем осаждения. В этом методе маскируемый металл удаляют из раствора осаждением. Но, в отличие от разделения, при маскировании осадок перед титрованием не отделяют от раствора путем фильтрования. Ясно, что концентрация замаскированного осаждением иона металла, которую можно рассчитать исходя из произведения растворимости осадка, должна стать столь малой, чтобы не могло быть никакого взаимодействия этого металла с ЭДТА.
Примером уже давно [48 (7)] применявшегося маскирования путем осаждения является титрование кальция в присутствии магния в сильнощелочном растворе (кривые титрования изображены на рис. 14), при котором образуется осадок Mg(OH)2. На этом примере отчетливо видны слабые стороны маскирования осаждением, а именно, приводящее к заниженным результатам частичное соосаждение определяемого металла, а также адсорбция осадком индикатора, обусловливающая размытый переход окраски последнего. Осадок часто затрудняет распознавание изменения окраски даже и в том случае, когда не происходит адсорбции индикатора.
Другие металлы можно маскировать путем осаждения гидроокисей, например железо (1П), титан (IV), цирконий или олово (IV), но опять-таки возникают осложнения, связанные с соосаж-дением титруемого металла, поскольку гидроокиси почти всех металлов труднорастворимы и склонны к взаимному соосаждению. Более селективным осадителем является Б_-ион, который используют для маскирования кальция и магния [54 (74), 61 (81), 62 (89)] и алюминия [54 (74)]. Железо (III) в известных условиях тоже можно маскировать F'-ионом [61 (109), 62 (23)]. Малые количества алюминия маскируют кремнекислым натрием в щелочном растворе [61 (64)]. Фосфат-ион выделяет титан (IV) даже из его комплексо-ната, что используют для непрямого определения титана, так как комплексы FeY~ и A1Y" в такой реакции не участвуют [54 (42)]. Еще более избирательно действует сульфатщон, которым можно осаждать свинец при титровании В13+-ионов [60 (95)], а также маскировать барий. Очень селективно действует сульфид-ион, но из-за темной окраски образующихся осадков его можно применять только для маскирования следов металлов. При определении жесткости природных вод сульфид-ион прибавляют для удаления обычно присутствующих следов тяжелых металлов (железа, меди) с целью избежать блокирования индикатора (эриохрома черного Т). Для той же цели применяют диэтилдитиокарбамат.
Маскирование путем комплексообразования. Подавляющее большинство методов маскирования основано на образовании растворимых устойчивых комплексов. Маскирующее вещество при этом должно быть избирательным комплексообразующим веществом, так чтобы определяемый металл М как можно более слабо, а ме
136
шающий металл М* как можно более сильно связывались в комплекс и отношение эффективных констант устойчивости A'Mz₽a/^M’z₽a» таким образом, становилось как можно больше. При добавлении А (вспомогательное комплексообразующее вещество, являющееся маскирующим веществом) должен увеличиваться только коэффициент распределения Рд маскируемого металла, но не коэффициент распределения Ра определяемого металла, и отношение констант должно возрасти по крайней мере до величины 104—105 для того, чтобы ошибка титрования, согласно уравнению (72), была небольшой. При этом следует различать полное и частичное маскирование мешающего металла. При первом Am*z становится настолько малой, что М* вообще не реагирует с титрантом, тогда как при частичном маскировании после полного завершения образования комплекса металла М с титрантом последний реагирует также с М* и может оказаться возможным последовательное титрование.
Особенно удобны маскирующие вещества, которые образуют очень устойчивые комплексы с мешающими металлами, так как в этом случае и при малых концентрациях достигаются большие значения [в уравнении (23) константы велики, поэтому концентрация А может быть небольшой]. Если комплексы М*А< неустойчивы, необходимы высокие концентрации маскирующих веществ, вследствие чего увеличивается ионная сила раствора, что нельзя считать благоприятным. Но в некоторых случаях и со слабыми комплексообразующими веществами можно получить хорошие результаты. Например, при маскировании кадмия иодид-ионами, при котором добавляют до 50 г KI на 100 мл раствора, можно титровать малые количества цинка в присутствии почти 3000-кратного количества кадмия (неопубликованные исследования Флашки и Бутчера, см. также раздел 4 этой главы). При маскировании тория сульфат-ионами последние также необходимо добавлять в большом количестве [59 (ПО), 60 (46)].
Ниже перечислены наиболее важные маскирующие вещества в порядке возрастания их избирательности: вещества, в которых донором электронов является кислород, и фторид-ион; вещества, в которых донорами электронов являются азот и сера; иодид- и цианид-ионы.
Ион гидроксила ОН- чаще всего используют в качестве осадителя; но при маскировании алюминия превращением его в алюминат, которое осуществляют при титровании кальция, образуется растворимый комплекс. Фторид-ион, в общем, тоже является мало селективным осадителем; однако с трех- и четырехзарядными катионами он образует растворимые комплексы, так что F'-ион можно, например, применять для маскирования олова (IV) при определении олова (II) [59 (25)] Почти все карбонаты металлов трудно растворимы, уранил же образует растворимый карбонатный комплекс, поэтому СО|”-ион применяют для маскирования иО2+-иона [52 (25)]. Пирофосфат-ионом можно маскировать железо (III)
137
[56 (98), 58 (38)] и небольшие количества алюминия [56 (98)]. Аце-тат-ион является слабым комплексообразующим веществом, но он делает возможным титрование галлия, по-видимому, вследствие того, что мешает образованию гидроксокомплексов [61 (78)]. Сульфосалициловую кислоту применяют для маскирования алюминия при определении железа (III) [58 (62)] и для маскирования как алюминия, так и железа (Ш) (в комбинации с F_-hohom для маскирования тория) при определении лантаноидов [62 (89)]. Алюминий можно замаскировать также тироном [55 (68)]. Ацетилацетон используют для маскирования железа, алюминия, палладия и ура-нил-иона [60 (30)], прежде всего для маскирования алюминия при определении свинца или цинка [63 (14)]. Тартрат-ион применяют в качестве вспомогательного комплексообразующего вещества при титровании свинца в щелочном растворе [52 (24), 52 (29)] или же для удержания магния в растворе при титровании кальция при рН=12 [61(88)]. В холодных растворах тартрат-ион используют также для маскирования малых количеств железа и алюминия при определении марганца [60 (77)] и для маскирования вольфрама [59 (3)], а также ниобия, тантала и вольфрама при титровании кобальта [59 (2)]. Фритц с сотр. показали [58 (62)], что повышение избирательности титрований раствором ЭДТА достигается применением цитрат-иона. Триэтаноламин мало избирателен и является слабым комплексообразующим веществом (так как в образовании координационных связей участвует только один атом азота и три ОН-группы); его применяют для маскирования трехзарядных Fe3+-, А13+-, Мп3+-ионов [63(H)] и Сг3+-иона [61 (94)] в щелочной среде. С марганцем при этом образуется (вследствие окисления воздухом) зеленый комплекс триэтаноламин — Мпш, окраска которого настолько интенсивна, что перекрывает окраску индикатора, если присутствуют большие количества марганца.
Простейшим комплексообразующим веществом, в котором в образовании координационных связей участвует атом азота, является аммиак, часто используемый в качестве составной части буферных смесей при комплексонометрических титрованиях. При этом он, кроме того, препятствует выпадению гидроокисей металлов, образующих амминокомплексы, повышая значение Ра этих металлов. Но при большой концентрации аммиака в растворе он может помешать реакции металла с индикатором -или даже с ЭДТА; например, он препятствует титрованию меди в присутствии мурексида. Хорошими маскирующими веществами для никеля, меди, цинка и кадмия являются полиамины; тетраэтиленпентамин используют при титровании щелочноземельных металлов или свинца [59(114)]. о-Фенантролин маскирует те же металлы, а также марганец при титровании индия [60 (48)].
Соединения, в которых в образовании координационных связей участвует атом серы, являются избирательными маскирующими веществами для металлов, образующих нерастворимые сульфиды. Тиомочевину применяют для маскирования меди [57 (107)], причем
138
при титровании железа (III) последнее следует Защищать от восстановления при помощи фторид-ионов [61 (95)]. Димеркаптопропанол, или BAL [54 (79)], в комбинации е цианид-ионом пригоден для разделения смесей различных металлов. Аналогичным образом ведут себя унитол [60 (37), 60 (38), 60 (59), 60 (60)] и тиогликоле-вая кислота [61 (96)]. С помощью цистеина можно замаскировать кадмий и цинк [61 (114)], с помощью 0-аминоэтилмеркаптана— медь, цинк, кадмий, никель, кобальт и ртуть [63(75)]. 3-Меркаптопропионовую кислоту применяют для маскирования свинца [61 (62), 63 (76)], а тиосемикарбазид — для маскирования ртути при титровании цинка или кадмия [57 (83)].
Цианид-ион образует комплексы почти с теми же ионами металлов, что и аммиак, только цианидные комплексы значительно устойчивее амминокомплексов.’Цианид калия часто применяют для маскирования кобальта, никеля, меди, цинка, кадмия, ртути и благородных металлов при определении щелочноземельных металлов, лантаноидов, марганца и других металлов. При определенных условиях можно замаскировать также железо и марганец [61 (93)].
Очень избирательно действует иодид-ион, который в небольших концентрациях маскирует только ртуть (II) [57 (65)]. Как уже упоминалось выше, используя большие концентрации иодид-иона можно замаскировать также кадмий и свинец.
Интересно, что в качестве вещества, маскирующего титан (IV), используют перекись водорода. В кислом растворе перекись водорода мешает образованию многоядерного гидроксокомплекса титана, медленно реагирующего с ЭДТА, и тем самым способствует прямому титрованию этого металла [60 (136)]. В щелочной среде достигается полное маскирование [57 (3)].
Окислительно-восстановительное маскирование. В некоторых случаях можно маскировать мешающие металлы путем перевода их в другое валентное состояние.
Маскирование путем восстановления возможно, например, для железа (III) [56 (84)]; этого достигают прибавлением гидроксиламина или аскорбиновой кислоты. Константы устойчивости комплексов железа (II) и железа (П1) различаются приблизительно в 1010 раз, так что многим селективным титрованиям Ре2+-ионы, в противоположность Ре3+-ионам, не мешают. Восстановление железа применяют при маскировании его цианид-ионами; при этом образуются [Ре(СМ)6]4~-ионы, которые мешают меньше, чем обладающие довольно сильными окислительными свойствами и окрашенные [Ре(СМ)б]3~-ионы. Об интересном окислительно-восстановительном маскировании железа и марганца в присутствии цианида калия сообщает Пршибил [61 (93)]. При титровании цинка [58 (63), 59 (49)] или нцкеля [58 (16)], 61 (108)], 62 (45)] медь (II) можно замаскировать ЗгОз^-ионами, при этом происходит ее восстановление до меди (I) и образование тиосульфатного комплекса последней. Таллий чаще всего не мешает титрованию других металлов,
139
если присутствует в виде одновалентного иона; поэтому таллий (III) восстанавливают цистеином [61(1'4)] или сернокислым гидразином. Ртуть можно восстановить до металла аскорбиновой [56 (84)] или муравьиной кислотой [62 (22)]. Так как при этом металл осаждается, можно говорить об одновременном маскировании осаждением.
Многовалентные ионы металлов образуют, как правило, более устойчивые комплексы с ЭДТА, чем ионы с меньшей валентностью. Но иногда и их маскируют путем окисления, так как маскируемый металл переходит при этом в устойчивый оксо-анион, например Сг3+_> СгОз”. Аналогичным образом можно замаскировать молибден, вольфрам и ванадий, окислив их до молибдат-, вольфрамат- и ванадат-ионов, если они присутствуют в растворе в виде мешающих, образующих комплексы с ЭДТА ионов более низкой валентности.
Кинетическое маскирование. Существуют ионы металлов, образующие устойчивые комплексонаты, присутствие которых тем не менее не мешает титрованию других металлов, потому что эти ионы очень медленно реагируют с комплексообразующим веществом. Такие ионы Рейли метко назвал «кинетически замаскированными». Хорошим примером является хром (III), в присутствии которого без помех можно титровать другие металлы, хотя константа устойчивости CrY- равна приблизительно 1023. Смесь хрома (III) и ЭДТА оставляют на продолжительное время, для того чтобы произошло заметное комплексообразование. Это явление наряду с другими используют для разделения смеси железа, хрома и алюминия [57 (29)].
Естественно, что кинетическое маскирование осуществляется не путем добавления тех или иных веществ. Химические реакции всегда можно замедлить понижением температуры. Например, никель, в противоположность другим металлам, в растворе, охлажденном льдом, очень медленно вытесняется Ш3+-ионами из своего комплекса с ЭДТА NiY2-, на чем основано селективное определение никеля [55 (66)]. В комплексах с ДЦТА хром (III), кобальт (III) и никель (II) маскируются кинетически еще лучше, чем в комплексах с ЭДТА.
Кинетический эффект используют также при определении маг-лия, кальция, меди, никеля или цинка в присутствии алюминия, замаскированного триэтаноламином. В таком растворе замаскированный алюминий медленно реагирует с индикатором эриохро-мом черным Т и блокирует последний. Но при охлаждении раствора до температуры ниже 5° С этого явления не наблюдается.
3. ДЕМАСКИРОВАНИЕ
Часто бывает желательно демаскировать какой-либо замаскированный ранее металл для того, чтобы получить возможность его оттитровать. Если имеется смесь металлов М и М*, то можно сначала замаскировать М* и оттитровать М, затем демаскировать М*
140
и определить также и его. Демаскирование особенно важно при последовательных титрованиях.
Во многих случаях демаскирование можно осуществить путем изменения pH раствора. Если, например, при титровании кальция в сильнощелочном растворе магний замаскирован в виде Mg(OH)2, можно последующим снижением pH раствора до значения 9—10 демаскировать магний и после этого оттитровать его. При маскировании алюминия в виде алюминат-иона можно вновь сделать его доступным для титрования, если снизить pH раствора до значения 5. В других случаях демаскирование достигается повышением pH раствора, например в случае замаскированного сульфат-ионом тория [60 (46)] и замаскированного бромид-ионом таллия (III) [61 (130)]. В обоих случаях демаскирование по отношению к ЭДТА эффективно при подщелачивании раствора до pH = 4—5. Вследствие происходящего при этом увеличения эффективных констант устойчивости комплексов с ЭДТА (благодаря уменьшению ан) становится возможным титрование тория и таллия (III), несмотря на присутствие сульфат- или бромид-ионов.
Если маскирование осуществляют путем восстановления, соответствующий металл можно опять окислить, после чего снова возможно е’о титрование. Например, железо, замаскированное аскорбиновой кислотой, и медь, замаскированную тиосульфат-ионами, можно демаскировать при окислении.
Если металлы замаскированы связыванием их в комплекс, то для демаскирования следует удалить из раствора комплексообразующее вещество. Демаскирование металлов, замаскированных фторид-ионами, достигается, например, добавлением Ве2+-ионов (—> [BeF4]2-), а демаскирование Нд2+-ионов, замаскированных SCN-ионами,— прибавлением Ад+-ионов [59 (55)]. Широко применяется демаскирование цинка и кадмия из их цианокомплексов. Его осуществляют путем прибавления формальдегида [52 (6), 53 (27)] или хлоральгидрата [53 (101)], которые реагируют с HCN с образованием нитрила гликолевой кислоты:
4Н++ [Cd(CN)4]2-+ 4СН2О —> Cd2++ 4НО - СН2 - CN (77)
Кобальт, никель, медь и ртуть при этом остаются полностью замаскированными, как и в том случае, когда цинк демаскируют из его цианокомплекса подкислением раствора до pH = 6 [59(26)].
Другие примеры демаскирования читатель может найти в разделе о последовательном титровании.
Блокирование индикатора, например, эриохрома черного Т ионами меди можно устранить, если прибавить метанол, этанол или ацетон [62(138)].
4. ПОСЛЕДОВАТЕЛЬНОЕ ТИТРОВАНИЕ
Определение является особенно изящным, когда в растворе, содержащем несколько определяемых металлов, удается последовательно оттитровать их, да к тому же одним и тем же титрантом.
141
В этом разделе описываются возможные случаи таких последовательных титрований.
Если металлы образуют комплексы, эффективные константы устойчивости которых достаточно сильно отличаются друг от друга, то при внесении комплексообразующего вещества эти металлы последовательно связываются в комплексы, и исследователю остается лишь фиксировать точки, в которых заканчивается комплексообразование каждого из этих металлов. Наблюдение изменения окрасок индикаторов невооруженным глазом при этом оказывается неэффективным, так как окраска одного индикатора мешает распознаванию изменения окраски другого. Поэтому целесообразно применять инструментальные методы индикации конечных точек титрования. Их применение дает возможность проводить определение до трех металлов за один прием (во многих случаях после каждой ступени титрования повышают pH раствора). В качестве примеров приведем амперометрическое титрование по методу «волны комплексона» смесей ванадия(III) с ванадием (IV) [60(189)], железа с марганцем, меди с кальцием, висмута со свинцом и кальцием [56 (78)] и меди с никелем, никеля с цинком, меди с цинком и кальцием [62 (33)]. Смеси индия и кадмия и индия и свинца определяют при помощи переменнотоковой полярографии с «прямоугольной» волной [62(36)]. С двумя поляризованными электродами можно проводить ступенчатое титрование смеси меди и цинка тетраэтиленпентамином, которое используют при анализе сыворотки. Потенциометрическую индикацию точки эквивалентности применяют при последовательном титровании цинка и кадмия [58(60)] и свинца, меди, никеля и кобальта [58 (56)] в присутствии щелочноземельных металлов. Фотометрически, но без добавления органического индикатора (т. е. с самоиндикацией по светопоглощению титруемого иона металла, его комплекса или применяемого для титрования комплексообразующего вещества) можно проводить последовательные титрования раствором ЭДТА следующих смесей: железа и меди [53(39)], висмута и меди [54(51)], кальция и магния [62 (27)], свинца и висмута [55 (97)]. Для титрования с самоиндикацией смеси меди и никеля используют трен [57(87)]. Термометрический метод применяют для последовательного титрования смеси кальция и магния [57 (97)].
Если в качестве индикаторов хотят применить красители, то для ступенчатого титрования удобно, чтобы один и тот же индикатор реагировал на все металлы, определяемые при последовательном титровании. При применении двух цветных индикаторов желательно, чтобы первый индикатор был одноцветным, т. е. обесцвечивался бы в точке эквивалентности и не мешал распознаванию изменения окраски второго индикатора. При применении двух двухцветных индикаторов для лучшего распознавания точки эквивалентности используют фотометрическую индикацию. Приведем примеры Кальций в растворе с pH = 10 титруют с мурексидом, после чего фотометрически определяют магний с эриохромом чер
142
ным т [61 (50)]. С эриохромом черным Т определяют цинк при рН = 6,8 и магний при рН=10 [53 (33)]. Висмут при рН = 1 и свинец при pH = 5 определяют с ксиленоловым оранжевым [60(62)] или с галлеином [61 (32)]. Медь при pH от 5,1 до 5,4 и цинк при pH — 9 определяют с пирокатехиновым фиолетовым [60(159)], причем содержание меди должно превышать содержание цинка. Железо (III) при рН = 3—4 и марганец при рН = 6—6,5 определяют с метилтимоловым синим [58(102)]. Торий при pH = 2 и лантаноиды в уротропиновом буферном растворе определяют с арсеназо [62 (19)]. В присутствии'ксиленолового оранжевого [63 (8)] определяют цирконий в 0,25—1 н. растворе НС1 или H2SO4 при температуре 80—90° С, а после него —торий в растворе с pH = 1,5—2,5. При последовательном титровании смеси железа(III) и алюминия в присутствии 3-оксинафтойной кислоты последняя сначала является цветным индикатором, затем — флуоресцентным индикатором [61 (44)]. При последовательном титровании смеси тория с редкоземельными металлами в присутствии ксиленолового оранжевого триэтилентетрамингексауксусной кислотой получаются лучшие переходы окраски, чем при титровании раствором ЭДТА [63(27)]. При титровании железа (III) в присутствии салициловой кислоты, за которым следует титрование или марганца, или кальция, или магния в присутствии эриохрома черного Т, целесообразно в качестве титранта применять раствор ДЦТА, а не ЭДТА, так как при этом железо легче маскируется кинетически и эриохром черный Т труднее блокируется [55(89)].
Можно также после прямого титрования первого металла изменять pH раствора и проводить обратное титрование второго металла. Например, железо(III) титруют при pH = 2, затем для определения алюминия прибавляют избыток ЭДТА и оттитровы-вают последний стандартным раствором соли железа (III) после недолгого кипячения раствора для полного связывания алюминия в комплекс и повышения pH раствора до значения 5; при обоих титрованиях в качестве индикатора используют сульфосалициловую кислоту [62(13)]. Вебер предлагает оттитровывать избыток ЭДТА титрованным раствором соли меди, применяя в качестве индикатора Биндшедлера зеленый [57(6)]. Железо, алюминий, марганец, кальций и магний можно определять последовательно следующим образом [60 (169)]: железо (III) титруют при pH = 2 с сульфосалициловой кислотой; затем повышают pH раствора до значения 3 и определяют алюминий обратным титрованием избытка ЭДТА стандартным раствором соли меди в присутствии индикатора ПАН; затем тоже обратным титрованием избытка ЭДТА раствором соли меди с индикатором ПАН определяют марганец при pH = 5; далее раствор делят на две половины, в одной доводят pH среды до 10 и определяют общее содержание кальция и магния обратным титрованием раствором соли меди с индикатором ПАН, в другой после осаждения кальция оксалат-ионами подобным же образом оттитровывают магний. Недостатком такого сложного
143
последовательного определения является то, что ошибки отдельных титрований при этом суммируются.
При определении смеси железа(III) и железа(II) вначале проводят титрование железа (III) в отсутствие воздуха, затем раствор окисляют и определяют железо (II) уже в виде железа (III) [55 (23), 61 (10)].
Хорошие возможности для последовательного титрования открывает демаскирование ранее замаскированного металла. При анализе смеси кальция и магния сначала при высоком значении pH титруют кальций в присутствии магния, замаскированного в виде выпавшей в осадок гидроокиси, затем снижают pH раствора и титруют перешедший в раствор магний [57(124), 60(128), 61 (88)]. Висмут можно титровать в присутствии ртути, замаскированной с помощью цианида калия; затем, добавляя AgNO3, проводят демаскирование и определяют ртуть [59(55)]. Свинец можно титровать в присутствии кадмия или цинка, если второй металл замаскирован цианид-ионами; затем с помощью формальдегида проводят демаскирование и определяют второй металл [52(29), 53(27)]. Иногда демаскирование осуществляют путем изменения pH раствора. Например, железо(Ш) титруют при pH = 2 с индикатором — салициловой кислотой в присутствии замаскированного бромид-иона-ми таллия (III); затем повышают pH раствора до значения 4—5 и титруют таллий (III) с индикатором ПАН [61 (130)].
Кинетическое маскирование используют при последовательном титровании смеси алюминия и хрома(III) [59(90)]. Сначала определяют алюминий обратным титрованием избытка ЭДТА раствором соли железа(III) в присутствии индикатора тирона после выдерживания раствора в течение 5 мин при температуре 40—50° С (чтобы полностью произошло образование комплекса A1Y-); затем прибавляют новую порцию ЭДТА, раствор кипятят и после того, как весь хром(III) перейдет в комплекс, избыток ЭДТА титруют обратно.
При другом способе комбинированного прямого и обратного титрования, при котором содержание одного из компонентов определяют по разности, сначала определяют общее содержание обоих металлов, затем один из металлов маскируют и освободившееся при этом эквивалентное количество комплексообразующего вещества титруют обратно раствором соли какого-либо подходящего металла. Об определении такого типа сообщает Сайо [61(128)]: сначала определяют общее содержание свинца и ртути обратным титрованием избытка ЭДТА раствором соли цинка; затем, прибавляя NaCl, удаляют ртуть из ее хелатного комплекса и освободившуюся ЭДТА титруют раствором соли цинка. Подобным же образом сначала определяют общее содержание свинца и таллия (III), затем при помощи восстановления сульфит-ионами разрушают комплекс таллия(III) с ЭДТА и освободившийся комплексон ’-игруют раствором соли цинка. Комбинируя оба способа, можно анализировать также смесь всех трех металлов — свинца, ртути и тал
144
лия(III). Тот же Сайо описывает анализ тройной смеси железа, алюминия и титана [54(42)]: сначала проводят суммарное титрование; затем с помощью фосфат-ионов удаляют титан из его комплекса с ЭДТА и определяют содержание выделившейся в свободном состоянии ЭДТА; наконец, осаждают алюминий фторид-ионами и титруют выделившуюся ЭДТА. Скрибнер [59(111)] аналогичным образом анализирует смесь магния и марганца; сначала он определяет общее содержание металлов, затем маскирует магний в виде Mgp2 и титрует освободившуюся при этом ЭДТА.
Другие примеры последовательных титрований можно найти во второй части книги перед описаниями определений отдельных элементов. Ступенчатое титрование в сочетании с определениями в аликвотных пробах зачастую дает возможность проводить просто поразительные анализы многокомпонентных смесей. Следует ожидать, что путем подбора подходящих индикаторов, pH, маскирующих и демаскирующих агентов можно будет достигнуть еще больших успехов в этом отношении.
5. КОСВЕННЫЙ АНАЛИЗ
Принцип косвенного определения состоит в том, что, исходя из количества взятой для анализа пробы и из результата суммарного титрования, составляют два параллельных уравнения, по которым можно вычислить содержание обоих компонентов. Практическое применение этот метод получил в анализе смесей циркония и гафния (см. далее). При анализе смесей лантаноидов этот метод дает среднюю величину атомного веса, по которой можно судить о составе проанализированной пробы. Метод можно применить и для анализа смесей, содержащих более двух компонентов, если, наряду с взятием навески и определением общего содержания металлов, проводить другие экспериментальные определения, например титрование с частичным маскированием, для того чтобы получить соответствующие уравнения. Ошибки результатов таких косвенных анализов, в общем, все-таки довольно велики.
10 Зак 553
Часть II
МЕТОДЫ ТИТРОВАНИЯ
И МЕТОДИКИ ОПРЕДЕЛЕНИИ
Во второй части этой книги, после обсуждения методов приготовления и использования титрованных растворов, растворов индикаторов и буферных смесей, рассматриваются вещества, определяемые комплексонометрически, в том порядке, который обозначен стрелками на схеме (цифры под символами элементов означают номер соответствующего раздела главы X). Цианид-ион рассматривается как производное углерода, роданид-ион — как производное серы.
Для каждого рассматриваемого вещества вначале обсуждаются в общих чертах различные возможные способы его комплексонометрического определения (на основании литературных данных), с указанием применяемых индикаторов и факторов, мешающих определению. Далее указывается, каким титрованиям других веществ интересующее нас вещество мешает, и как подобные помехи можно устранить (маскирующие вещества). Затем перечисляются случаи применения упомянутых способов титрования в аналитиче
146
ской практике. Наконец, для тех случаев, когда авторы книги разработали собственные методики определения рассматриваемого вещества, приводится детальное изложение этих методик. Прч практическом выполнении анализа, в зависимости от наличия в анализируемом растворе тех или иных посторонних элементов, следует вводить соответствующие изменения в методики.
Не приводится описание операций, которые должны быть выполнены перед собственно титрованием (например, осаждение). Во многих случаях вместо описания определения следует ссылка на другое определение, например при определении калия, которое сводится к титрованию кобальта, или при определении галогенов, которое сводится к титрованию серебра.
ГЛАВА X
ПРИМЕНЯЕМЫЕ РЕАКТИВЫ
И ОПРЕДЕЛЯЕМЫЕ ВЕЩЕСТВА
1. ТИТРОВАННЫЕ РАСТВОРЫ
Раствор ЭДТА
Приготовление. Помимо многих других преимуществ, комплек-сонометрия имеет еще одно, очень важное для аналитической практики, а именно: титрованный раствор готовят непосредственно по навеске, и при соблюдении соответствующих условий его титр абсолютно не изменяется.
В преобладающем большинстве случаев титрованный раствор ЭДТА готовят растворением соли Na2H2Y-2H2O с молекулярным весом 372,16. Эта соль высокой степени чистоты имеется в продаже. Продажные препараты, согласно собственному опыту авторов книги и в соответствии с данными Блэделя и Найта [54(2)], имеют влажность от 0,3 до 0,5%. Принимая во внимание это обстоятельство, можно непосредственно из навески приготовить раствор для титрования, который для общих целей имеет достаточно точно известную молярность. Влагу можно удалить высушиванием' препарата при 80° С и 50 %-ной влажности воздуха (в пересчете на 25°С). 100%-ная чистота и постоянная масса препарата достигаются в течение четырех дней [54(2)]. Высушивание при более высокой температуре нецелесообразно, так как при этом улетучивается и кристаллизационная вода. Полная дегидратация достигается без особого труда, если препарат сушат при 130—150° С. При этом состав полученного продукта строго стехиометричен, однако, к сожалению, едва ли это выгодно, так как безводная соль обладает значительной гигроскопичностью. Термогравиметрические исследования [57(74), 60(85)] подтверждают, что содержащая воду натриевая соль не отвечает строгим требованиям, предъявляемым к веществам для установки титра.
10*
147
Для приготовления 0,100 М раствора растворяют 37,22 г Na2H2Y-2H2O в 1 л дистиллированной воды. Более разбавленные растворы можно получить разбавлением этого основного раствора или соответствующим уменьшением навески препарата.
Чрезвычайно удобный путь, к которому, как ни странно, на практике очень редко обращаются, состоит в приготовлении раствора из свободной кислоты с молекулярным весом 292,13. В продаже имеется кислота квалификации «чистая для анализа»; кроме того, ее легко приготовить, если раствор натриевой соли подкислить серной или соляной кислотой. Предпочитают соляную кислоту, так как из нее легче удаляются следы железа. Осадок отсасывают, тщательно промывают водой и сушат при 110° С. Такой препарат не гигроскопичен, устойчив и имеет очень высокую чистоту. Навеску растворяют в щелочи, причем берут 2 г-экв NaOH или КОН на 1 моль ЭДТА. Для растворения соли можно также использовать аммиак.
Для приготовления 0,100 М раствора ЭДТА 29,21 г свободной кислоты и 9 a NaOH растворяют приблизительно в 400 мл воды. По охлаждении до комнатной температуры раствор разбавляют дистиллированной водой до 1 л. Более разбавленные растворы можно получить разбавлением основного раствора или пропорциональным уменьшением навески.
Хранение. При хранении титрованного раствора обращают особое внимание на сосуды для хранения. Мягкое стекло для этой цели непригодно, так как через короткое время с поверхности стекла переходит в раствор значительное количество ионов щелочноземельных и других мешающих металлов. Для закаленного стекла это менее характерно, в особенности если стекло долгое время было в употреблении или было обработано горячим сильнощелочным раствором ЭДТА. Так как в настоящее время сосуды из синтетических материалов считаются наиболее пригодными для обычных лабораторных нужд, то именно их предпочитают для хранения растворов. Ими пользуются преимущественно для хранения сильно разбавленных титрованных растворов. Уменьшение титра раствора в сосудах из пластических масс практически не имеет места. В стеклянных сосудах, в зависимости от состава стекла, уменьшение титра часто принимает значительные размеры, как показывают исследования Флашки и Садека [57 (92)].
Сосуды из пластмасс, между прочим, рекомендуются и для хранения других растворов, таких, как буферные, растворы для обратного титрования и т. д., в особенности если речь идет о щелочных растворах. Лишь для некоторых индикаторов, например ПАН, пластмассовые сосуды непригодны, так как индикатор растворим в органическом материале.
Установка титра. Молярность применяемого титрованного раствора для общих целей, как уже говорилось выше, достаточно точно может быть рассчитана из навески, если применять препараты надежного происхождения. Однако, если имеется подозрение в на
148
личии в препарате примесей, которые могут быть заимствованы также из взятой для растворения воды (стеклянный сосуд, неисправная установка для дистилляции, истощенный ионит и т. д.!), или если требуется повышенная точность определений, установка титра неизбежна. Способ установки титра следует выбирать применительно к обстоятельствам (иначе могут получиться неправильные результаты), особенно если речь идет о растворах, содержащих примеси. Предположим, что раствор ЭДТА загрязнен примесями кальция и цинка. Если устанавливать титр раствора при pH = 10 по магнию, то с последним будет реагировать лишь та часть комплексона, которая не связана с цинком и кальцием. Если провести титрование в присутствии KCN, то мешать будет только кальций. Если устанавливать титр раствора при pH = 4 по меди, то мешать будет лишь цинк. Наконец, если устанавливать титр раствора при pH = 2 по железу, ни цинк, ни кальций не будут мешать, и мы получим полное содержание ЭДТА. Таким образом, в зависимости от условий получаются 4 различных результата! Если значение титра, полученного по железу, принять за основу для титрования, проводимого при pH =10, то будет получен ошибочный результат, и стандартизация потеряет свой смысл. Золотое правило науки о титровании: «Устанавливай титр в условиях, в которых будет проводиться собственно определение!» — имеет здесь особенное значение. К тем случаям, когда при приготовлении растворов все следы металлов фактически исключены, это относится в меньшей степени.
Вещества для установки титра. Для установки титра раствора ЭДТА можно применять многие вещества, однако те, что перечислены ниже, особенно пригодны для этой цели. ,
Особенно важны вещества, по которым устанавливают титр ЭДТА для последующего определения кальция и магния, так как эти титрования проводят наиболее часто. Из обычных продажных препаратов, без сомнения, наилучшим является СаСОз. Это соединение легко получается в высокочистом виде, переносит сушку в широком интервале температур и не гигроскопично. Результаты исследований Барша [55(21)] подтверждают, что карбонат кальция как вещество для установки титра имеет преимущество перед оксалатом, гидроокисью и сульфатом.
Шэд [52(45)] рекомендует кислую кальциевую соль яблочной кислоты, которую можно легко получить чистой в форме гексагидрата и которую одновременно можно применять для установки титра щелочей. Эквивалентный вес соли вполне соответствует целям, для которых ее используют, однако это соединение в продаже отсутствует.
Из солей магния особо упоминаются MgSC>4-7H2O [52 (12)] и Mg (Юз) 2 • 4Н2О. Чтобы обеспечить точное содержание воды в первой соли, необходимо хранить ее над смесью из MgSC>4 • 7Н2О и воды в соотношении 5:1. Вторая соль обладает значительным эквивалентным весом, при хранении она устойчива и теряет воду, согласно термограмме, только при температуре выше 110° С.
149
Для общих целей стандартизации, кроме уже упомянутых, рекомендуется большое число других соединений. Вшештал с сотр. [59(13)] в своем литературном обзоре провели сравнительное исследование, результаты которого оценили статистически, и предложили новые вещества. Такие металлы, как Си, Ni, Zn, Fe или Bi с чистотой 99,99% и выше, имеются в продаже. Однако, за исключением висмута, все они имеют относительно низкий эквивалентный вес. Висмут же имеет тот недостаток, что он покрыт окисной пленкой, которую необходимо удалять промыванием в азотной кислоте. По понятным причинам, авторы предлагают соли, кристаллизующиеся без кристаллизационной воды или не являющиеся гигроскопичными после удаления последней. Окись цинка легко может быть получена в высокочистом виде, но имеет низкий эквивалентный вес. С этой точки зрения предпочтительнее HgO, предложенная Барша [59(56)]. Вшештал и др. [59(13)] считают PbClg весьма подходящим для установки титра веществом. Оно легко получается в чистом виде перекристаллизацией, в нем отсутствует кристаллизационная вода, оно устойчиво при хранении и сушке, практически не адсорбирует влагу и обладает большим эквивалентным весом. Хлорид свинца можно использовать для установки титра как в кислой (ацетат — ксиленоловый оранжевый), так и в щелочной (тартрат — аммиак — эриохром черный Т) среде.
Удовлетворительные эквивалентные веса имеют соли органических соединений. Вшештал и сотр. [59 (13)] предпочитают дипири-дилроданиду цинка, предложенному Будешинским [56(83)], соответствующее кадмиевое производное. Для предложенного Флэшкой [52 (22)] двойного сульфата типа шенита подчеркивается необходимость сушки в контролируемых условиях.
Пауэлл и сотр. [60(100)] предложили интересное с теоретической точки зрения вещество для установки титра. Комплекс CdHV (У=оксиэтилэтилендиаминтриуксусная кислота) может быть получен в чистом ₽иде перекристаллизацией; он безводен, имеет высокий эквивалентный вес и может быть использован для установки титра оснований и комплексона. Для последней цели, однако, необходимо сначала разрушить триуксусную кислоту кипячением с персульфатом в кислом растворе. Из-за этого обстоятельства способ не имеет практического значения.
Растворы других комплексонов
Приготовление применяемых иногда растворов других комплексонов аналогично приготовлению растворов ЭДТА. Чаще всего • исходят из свободной кислоты, которую растворяют в небольшом количестве воды с 2 эквивалентами NaOH, и затем раствор разбавляют до определенного объема. Необходимое количество кислоты рассчитывают исходя из ее молекулярного веса: НТА — 191,14; ДЦТА —346,34; ГЭДТА — 380,35; ДТПА —393,18. Титр раствора устанавливают по соответствующему титрованному раствору соли металла. *
150
Растворы солей металлов
Стандартные растворы сульфата магния или сульфата цинка применяют для обратных титрований. Их готовят из грубо взвешенных препаратов MgSO4-6H2O или ZnSO4-7H2O и устанавливают их титр с помощью титрованного раствора ЭДТА. Раствор сульфата марганца для обратных титрований получают аналогичным путем.
Растворы нитрата висмута применяют для обратных титрований в кислой среде. 0,0100 М раствор Bi(NO3)3 готовят растворением 2,090 г чистого металла приблизительно в 7 мл концентрированной HNO3 с последующим разбавлением водой до 1 л. Такой раствор является одновременно 1/20 М по HNO3.
0,100 М раствор меди готовят растворением 6,354 г чистейшего металла в возможно малом количестве FINOS, затем удаляют окислы азота кипячением, раствор охлаждают и разбавляют до 1 л водой.
Если титр раствора меди для обратных титрований нужно устанавливать по раствору ЭДТА, то проще приготовить его растворением 25 г CuSO4 • 5Н2О в 1 л воды.
При приготовлении растворов солей металлов обычно не имеет значения, какой анион присутствует в растворе употребляемой соли. Однако для некоторых определений характер аниона важен; в этих случаях следует подбирать соответствующую соль или растворять металл в соответствующей кислоте.
Растворы комплексонатов металлов
Комплексонаты MgY2- и ZnY2- в виде 0,1 М растворов применяют при титрованиях методом вытеснения. В продаже имеется натриевая соль Na2MgY-4H2O, которую, если она достаточно чиста, можно непосредственно применять в твердом состоянии. Однако всегда следует проверять, действительно ли препарат содержит Mg и ЭДТА в молярном соотношении 1 : 1. Раствор соли должен иметь pH между 8 и 9; после добавления небольшого количества аммиачной буферной смеси с pH = 10 и нескольких капель раствора эриохрома черного Т раствор должен окрашиваться в грязно-фиолетовый цвет, который при добавлении одной капли 0,01 М раствора ЭДТА переходит в синий, а при добавлении одной капли 0,01 М раствора MgSO4 — в красный. Аналогичная натриевая соль комплексоната цинка Na2ZnY-4H2O для проверки ее чистоты подвергается такой же процедуре.
Растворы комплексонатов MgY2- и ZnY2-, а также дасто употребляемых CuY2- и HgY2- (как и комплексонатов других металлов) можно приготовить следующим образом. Готовят приблизительно 0,1 М растворы ЭДТА и какой-либо соли требуемого металла. Затем раствор соли металла порциями по 25 мл титруют 2—3 раза раствором ЭДТА, находят среднее значение объема
151
ЭДТА, затраченной на одно титрование, и смешивают этот объем ЭДТА с 25,00 мл раствора соли металла. Проверку стехиометрич-ности состава комплексоната металла, находящегося в растворе, в каждом случае следует проводить по методу, описанному выше для MgY2-.
2. РАСТВОРЫ ИНДИКАТОРОВ
Ниже описано приготовление растворов наиболее важных и в настоящее время наиболее часто употребляемых индикаторов. Если раствор индикатора неустойчив, целесообразно применять твердый носитель [51(20)].
Эриохром черный Т. Навеску красителя 0,2 г растворяют в 15 мл триэтаноламина и 5 мл абсолютного этанола. Такие растворы сохраняются не менее одного месяца.
Для получения твердого разбавленного индикатора растирают 0,25 г эриохрома черного Т с 100 г NaCl в тонкий пылевидный порошок. В качестве носителя можно использовать также сахар.
Мурексид. Около 0,5 г красного порошка красителя размешивают в нескольких миллилитрах воды и хорошо встряхивают. Не-растворившейся части красителя дают осесть и для титрования используют находящийся над осадком насыщенный раствор. Чтобы раствор индикатора всегда был свежим, ежедневно декантируют старый раствор и добавляют новую порцию воды.
В твердом состоянии индикатор применяют в виде растертой массы, состоящей из 1 а мурексида и 100 г NaCl (или сахара).
Металлфталеин. К смеси, состоящей из 0,18 г крезолфталеин-бис-метилиминодиуксусной кислоты и 0,02 г нафтолового зеленого (таблица красителей Шульца № 5), прибавляют несколько капель концентрированного раствора аммиака и разбавляют до 100 мл. Раствор устойчив в течение одной недели.
Тирон. Применяют 2%-ный раствор двунатриевой соли пирокатехиндисульфокислоты. Бесцветный раствор устойчив в течение длительного времени.
Пирокатехиновый фиолетовый. Растворяют 0,1 г продажного индикатора в 100 мл воды. Раствор устойчив в течение нескольких месяцев.
Эриохромазурол S. Растворяют 0,4 г красителя в 100 мл воды. Раствор устойчив.
Дитизон. Растворяют 25 мг свежеперекристаллизованного дитизона в 100 мл этанола. Раствор устойчив лишь несколько дней.
Ксиленоловый оранжевый. Растворяют 0,1 г индикатора в небольшом количестве воды, содержащей несколько капель 1 М раствора NaOH, и разбавляют до 100 мл. Раствор устойчив в течение нескольких недель.
ПАН. Растворяют 0,05 г индикатора в 100 мл этанола или ме* танола. Раствор устойчив в течение нескольких месяцев.
152
3. БУФЕРНЫЕ СМЕСИ
Следующие вещества рекомендуются для приготовления буферных смесей для различных областей pH.
pH = I. В качестве буферных растворов применяют 1 М растворы НС1 и HNO3.
pH = 2 - 4. Гликокол и его солянокислая соль. Применяют твердую аминокислоту. Ее по мере надобности прибавляют к растворам, в которых требуется создать высокую кислотность. Для той же цели применяют м-хлоранилин.
pH = 4 — 6,5. Ацетат натрия — уксусная кислота. Готовят 1 М растворы уксусной кислоты и ацетата натрия, которые смешивают перед применением.
pH = 6. Уротропин, 20%-ный раствор или твердое вещество.
pH = 6,5 — 8. Триэтаноламин и его солянокислая соль. Готовят 1 М растворы N(C2H4OH)3 и НС1, которые перед применением смешивают. Следует принимать во внимание, что триэтаноламин является хелатообразующим веществом и, как таковой, образует весьма устойчивые комплексы со многими ионами металлов. Это в большинстве случаев нежелательно, так как происходит уменьшение скачка рМ в точке эквивалентности. Поэтому концентрация свободного триэтаноламина в растворе должна быть как можно меньшей. Таким же недостатком в этом интервале pH обладают малеаты и веронал. Фосфатная буферная смесь совершенно не пригодна, так как образуются осадки фосфатов металлов. Идеальным веществом для буферного раствора в области pH = 6—8 является имидазол, ониевая соль которого имеет значение рК, почти точно равное 7, и благодаря своему строению не образует хелатных комплексов с металлами. Но вследствие высокой стоимости имидазола вряд ли можно рассматривать его как вещество, пригодное для использования в буферных растворах. Для создания pH = 7 можно успешно применять аммиачный буферный раствор, но его буферная емкость, естественно, мала. Поэтому при работе с ним необходимо тщательно контролировать pH, нанося капли исследуемого раствора на индикаторную бумагу. Таким образом создаются идеальные условия, при которых комплексообразование металлов оказывается крайне незначительным.
pH = 8 - И. Аммиак — соль аммония. Готовят 1 М растворы аммиака и хлорида аммония, которые перед употреблением смешивают. Глициновый и боратный буферные растворы не рекомендуются для этого интервала pH, так как их комплексы с металлами, как правило, значительно более устойчивы по сравнению с амминокомплексами. Кроме того, борат-ион образует осадки с ионами некоторых металлов.
pH = 10. Чаще всего соответствующую буферную смесь готовят следующим образом: 70 г хлорида аммония смешивают с 570 мл концентрированного раствора аммиака (плотность 0,90) и разбавляют до 1 л.
153
Для получения этого буферного раствора применяют реактив особой чистоты. Продажный раствор аммиака очень часто содержит небольшие количества щелочноземельных металлов, поэтому целесообразно пользоваться свежеприготовленным раствором аммиака, получая его пропусканием в воду газообразного аммиака из баллона.
pH = 11 — 13. В качестве буферного раствора применяют 1 М раствор NaOH.
4. ДРУГИЕ РЕАКТИВЫ
Маскирующие вещества. Цианид калия, сульфид натрия, фторид натрия, триэтаноламин, тирон, диэтилдитиокарбамат натрия, димеркаптопропанол (БАЛ).
Демаскирующие вещества. Формальдегид (30%-ный раствор), хлоральгидрат.
Восстановители. Аскорбиновая кислота, сернокислый гидроксиламин.
Окислители. Перекись водорода, пероксодисульфат калия.
Все эти вещества не должны содержать примесей ионов металлов, особенно кальция. На содержание металлов следует проверять прежде всего KCN, Na2S и формалин (с помощью эриохрома черного Т после прибавления буферного раствора с pH — 10).
5. ЛИТИЙ
Определение лития, согласно Де Суса [61 (173)], можно осуществить косвенным методом. Хлорид лития отделяют от хлоридов калия и натрия известным классическим способом. Хлорид лития растворяют и ионы хлора осаждают нитратом серебра. При вытеснении серебра из выделенного AgCl цианидным комплексом никеля (см. раздел 28 настоящей главы) освобождается никель, который оттитровывают раствором ЭДТА. Метод разработан для микроопределений, и при определении 50—500 мкг Li2O его точность равна 0,5% (с тенденцией к отрицательным значениям). При определении 10—50 мкг ошибка метода составляет около минус 1—2%.
6. НАТРИИ
Натрий можно определить косвенным методом, если выделить его в виде тройной соли NaMn(UO2)3Ac9 и после растворения осадка оттитровать металл Мп. Флашка [52 (25)] впервые предложил этот метод для микроопределения металлов с использованием тройной соли цинка. Применяемый в качестве индикатора при титровании цинка эриохром черный Т блокируется уранил-ионами, поэтому для маскирования последних следует добавлять в раствор карбонат-ионы. Маскирование урана можно и не осуществлять, если проводить титрование в 50%-ном этанольно-водном растворе с дитизоном в качестве индикатора; это особенно удобно при анализе сыворотки [59(36), 59(37)].
154
В состав тройной соли вместо цинка могут входить и другие металлы, например Mg [60(19)], Со и Ni [57(44)]. Долежал с сотр. [62 (122)] определяли от 10 до 250 мкг Na, осаждая его в виде тройной соли кобальта, а уран, присутствующий в осадке, определяли восстановлением аскорбиновой кислотой и обратным титрованием избытка ЭДТА раствором соли тория с ксиленоловым оранжевым в качестве индикатора.
Гальярди и Реймерс [58(94)] сообщают о том, что ионы натрия выделяют из ионита, содержащего магний (сильнокислая сульфо-кислотная смола, например Леватит S-100), эквивалентное количество Mg2+-HOHOB, которые затем оттитровывают раствором ЭДТА с эриохромом черным Т в качестве индикатора. Аналогично ведет себя калий, и поэтому, если присутствуют оба металла, определяют их сумму.
Определение натрия получило применение в анализе сыворотки [59 (36), 59 (37)], стекла [62 (121)] и сточных вод при добыче природного газа [60(19)].
Определение натрия
Реактивы
Цинк-уранил-ацетат.
Промывной раствор, необходимый для обработки осадка.
ЭДТА, 0,01 Л4 раствор.
Эриохром черный Т.
Буферный раствор, pH = 10.
Соляная кислота, приблизительно 1 М раствор.
Карбонат аммония, приблизительно 1 М раствор или твердая соль.
Ход определения. Фильтр с промытым осадком натрий-цинк-уранил-ацетата, в котором должно содержаться около 5 мг натрия, смачивают в стакане 3—5 мл соляной кислоты, прибавляют около 50 мл воды, полученную суспензию кипятят и сливают через фильтр. После отмывки фильтра полученный раствор (около 100 мл) нейтрализуют карбонатом аммония и добавляют еще небольшой избыток последнего, чтобы связать уранил-ионы в карбонатный комплекс. К чуть желтоватому раствору прибавляют 2 мл буферного раствора и индикатор и титруют 0,01 М раствором ЭДТА до изменения окраски. Благодаря присутствию урана перед точкой эквивалентности раствор имеет смешанную — желтоватокрасную окраску, переходящую в зелено-голубую в точке эквивалентности.
Замечания. Титрование Zn можно проводить в интервале pH от 7 до 10, поэтому ему не мешают присутствующие ионы аммония. В связи с этим для растворения осадка можно использовать и большие количества НС1, а вместо буферной смеси можно применить просто раствор аммиака.
Осаждение тройной соли можно осуществить с помощью любого из имеющихся многочисленных классических способов. Обычно в качестве промывной жидкости рекомендуют насыщенный
155
тройной солью этанол. Но так как иногда все же происходит гидролиз ионов цинка и цинк выпадает в осадок, вследствие чего получаются завышенные результаты, то авторы на основании собственного опыта и в соответствии с предложениями Катена и Ланга [А (10)] предпочитают в качестве промывной жидкости уксусную кислоту, насыщенную тройной солью. При микроопределениях пользуются фриттой или, что еще лучше, фильтрующей палочкой [59(37)1. Естественно, можно работать с центрифужными стаканчиками. Таким образом, можно надежно определять десятые доли миллиграмма натрия, особенно если применять для титрования 0,001 М раствор ЭДТА.
При эпизодических определениях едва ли выгодно готовить раствор карбоната аммония (он неустойчив); нейтрализацию раствора можно осуществить без ущерба для определения с помощью твердой соли.
7. КАЛИЙ, РУБИДИЙ, ЦЕЗИЙ
Калий можно определять только косвенным путем. Большинство методов основано на осаждении его в виде K2MI[Co(NO2)e] и оттитровывании содержащегося в осадке кобальта. Флашка с сотр. первыми сообщили [56(122)] о подобном определении с помощью соли, где металлом М1 был Na. После растворения осадка, полученного по известному способу, в разбавленной соляной кислоте и прибавления небольшого количества мочевины для удаления окис-лов азота титруют Со с мурексидом в слабоаммиачном растворе (см. стр. 243). При титровании в уксуснокислом растворе в присутствии смешанного индикатора CuY — ПАН наблюдается более резкая точка эквивалентности. Определять Со можно также обратным титрованием избытка ЭДТА раствором соли цинка с эриохро-мом черным Т [57(68), 60(79)], однако, во избежание блокирования индикатора, титрование следует выполнять быстро. Сен [57(108)] определяет содержание Со титрованием его в ацетоноводной смеси, содержащей большое количество роданид-ионов.
При определении калия этим методом встречаются некоторые затруднения, связанные с самим процессом осаждения. Осадок относительно легко растворим, поэтому следует работать с большим избытком осадителя. Это означает, что необходимо последующее тщательное промывание осадка, чем, однако, нельзя злоупотреблять. Кроме того, состав осадка сильно зависит от условий осаждения, и стехиометрическое соотношение К : Со = 2 : 1 чаще всего точно не соблюдается. Это является причиной того, почему этот метод применяют преимущественно для анализа сыворотки, где воспроизводимость условий осаждения достигается относительно просто.
Этот метод можно применять не только для определения К+-ионов, но (без всяких изменений) и для определения NHt-, Rb+- и Cs+-hohob. Сен [58(99)] использует для осаждения
156
ионы серебра, т. е. М1 = Ag. Полученные таким образом осадки трудно растворимы и имеют более стехиометрический состав. Однако метод имеет ограниченное применение, так как определению мешают ионы хлора. Кроме ионов аммония и тяжелых щелочных металлов, этим методом можно определять также таллий(I).
Особое внимание следует обратить на присутствие аммиака. Мы всегда имеем возможность выпарить раствор и удалить соли аммония прокаливанием, но эти методы требуют много времени и сложны. Если концентрация аммиака ниже 0,02 М (или может быть соответствующим образом понижена без уменьшения концентрации К+-ионов при разбавлении раствора), то, согласно данным Голаска и сотр. [60(185)], удаление аммиака не вызывает затруднений, если применить для этого формальдегид. При реакции аммиака с формальдегидом образуется уротропин, который при концентрации ниже упомянутой не реагирует с осадителем. Печар [60(1)] предлагает для удаления аммиака проводить окисление бромом в щелочной среде; избыток Вг2 полностью удаляют восстановлением муравьиной кислотой в слабокислой среде.
Гальярди и Реймерс [58 (94)] нашли, что из ионита, содержащего магний (сильнокислая сульфокислотная смола типа Леватита S-100), калий вытесняет эквивалентное количество Mg2+-HOHOB, которые титруют комплексонометрически с эриохро-мом черным Т. Так как натрий ведет себя аналогичным образом, в случае присутствия обоих ионов определяют их сумму. Процессу ионного обмена должно предшествовать полное удаление всех других ионов металлов, что ограничивает практическое применение метода.
Несколько более сложный путь определения калия [60(25)] и рубидия [61(28)] предлагает Суса Эти металлы осаждают обычным образом b виде перхлоратов, выделенный осадок сушат и восстанавливают СЮ4-ИОНЫ до С1_-ионов. Ионы хлора осаждают в виде AgCl и определяют серебро комплексонометрическим титрованием, используя реакцию последнего с цианидным комплексом никеля.
Очень точные результаты, не зависящие от состава анализируемого раствора, были получены Флашкой и Садеком [58(37)] при применении тетрафенилборатного метода. Теграфенилбор реагирует с ртутью (II) согласно следующему уравнению:
B(Ph)^ + 4HgCl2 + ЗН2О —> ЗН+ + 4Hg(Ph)Cl + Н3ВО3 + 4С1~
Следует отметить, что эта реакция протекает и в том случае, если Hgn связана с ЭДТА. Таким образом, можно осадить тетра-фенилбором К+ (и другие ионы, образующие с тетр а фенил бором нерастворимые соединения, например Rb+-, Cs+-, Т1+-, МН4+-ионы, а также некоторые органические вещества), выделенный осадок растворить в ацетоне и ввести его в реакцию с раствором HgY. Выделившееся количество ЭДТА титруют обратно в ацетатной среде раствором Zn с ПАН в качестве индикатора. Так как один исходный
157
ион калия соответствует четырем ионам цинка при обратном титровании, ошибки титрования практически мало влияют на точность определения, которая скорее зависит от тщательности выполнения операций осаждения и промывания.
Циогола и др. [60(196)] сообщают об определении Cs осаждением с помощью KBiI4 и обратным титрованием избытка Bi в фильтрате раствором ЭДТА.
Перечисленные методы применяют для определения калия при анализе сыворотки [56(122), 57(86), 60(1), 60(79)], мочи [61(176)] и эритроцитов [60(79)].
8. БЕРИЛЛИЙ
Константу устойчивости комплекса Be с ЭДТА вычислили Меррилл, Гонда и Арнольд [60(107)] на основании радиометрических
измерений коэффициентов распределения на ионитах в присутствии и в отсутствие ЭДТА; они нашли, что 1g/< = 9,8 (ц около 0,1).
Позднее этой же проблемой занимались Адамович и Нападайло [61(165)]. Русские авторы исследовали равновесие ионного обмена при pH около 2 и и = 0,04—0,05. В этих условиях, согласно их дан-
может существовать кислый комплекс, для которого [BeHY-] . „ о о гл
[в 2+]Ihy ~] ’ % = О™ опРовеРгают существование ком-
ным, К =
плекса ВеУ2-, так как на основании данных своих измерений считают, что устойчивость этого комплекса должна соответствовать величине 1g К около 17. Но такая высокая устойчивость слишком велика по сравнению с устойчивостью MgY; кроме того, она находится в противоречии с тем фактом, что Be в присутствии ЭДТА* осаждается аммиаком; произведение растворимости Ве(ОН)2 не
настолько мало, чтобы могло произойти осаждение гидроокиси при столь высокой устойчивости комплексоната. Согласно неопубликованным результатам Флашки, вычисленный по кривой титрования едким натром смеси Be с ЭДТА lg/<BeY равен 9,2 (при комнатной температуре и р = 0,1). При этом можно было использовать лишь короткий отрезок кривой в области pH = 4—5, так как при более высоких значениях pH кривые искажаются вследствие явлений гидролиза (получающиеся осадки обнаруживаются по появлению опалесценции). При вычислениях не учитывалась воз-
можность существования продуктов гидролиза и кислых комплексов. Старостин и др. [63(4)] изучали растворение Ве(ОН)2 в растворах ЭДТА при различных значениях pH при 20° С и ц = 0,3. Авторы пришли к выводу, что при pH = 7—7,5 присутствует комплекс ВеУ2-, для которого 1g/< = 10,2. Выше pH = 7,5 существует комплекс ВеОНУ3-, рА% которого равен 5,4.
Относительно низкое значение константы устойчивости и большая склонность Ве2+-ионов к гидролизу затрудняют титрование. В слабокислой ацетатной среде можно определять Бе обратным титрованием избытка ЭДТА титрованным раствором соли кобаль
158
та в ацетоно-водной смеси (1 : 1), содержащей роданид-ионы. В этом случае прибавление органического растворителя, по-видимому, вызывает значительное повышение эффективной константы устойчивости комплекса Be с ЭДТА [55 (103)].
Косвенный метод определения Be основан на следующем принципе [59(71)]. Бериллий осаждают с помощью лутеосоли из аммиач-но-карбонатного раствора в виде
[Со (NH3) 6] [ (Н2О) 2Ве (СО3) 2 (ОН) 3] • ЗН2О
При этом целесообразно прибавлять ЭДТА для маскирования Fe и А1. Осадок отделяют, промывают, разлагают кислотой и содержащиеся в нем ионы кобальта титруют раствором ЭДТА с мурек-сидом.
9. МАГНИИ И КАЛЬЦИИ
Магний и кальций являются основными или побочными составными частями многочисленных природных или искусственных продуктов. Классические методы анализа этих двух катионов требуют больших затрат времени, тогда как комплексонометрическое титрование предоставляет исследователю возможность изящного определения обоих металлов, что сильно способствовало быстрому внедрению этого метода в аналитическую практику. Нам кажется целесообразным обсуждать одновременно оба металла, так как почти всегда они присутствуют вместе, и поэтому важно знать поведение смеси Са и Mg, даже если требуется определить лишь один из этих элементов. Анализ биологических жидкостей, благодаря его большому практическому значению, рассматривается в отдельном разделе. Приведенные литературные ссылки представляют собой лишь часть всех относящихся к данной теме публикаций, что кажется нам совершенно справедливым, так как большинство работ, с точки зрения собственно комплексонометрического титрования, не содержит ничего нового. Цитируемые работы все же дают полное представление о существующих возможностях метода и об еще не разрешенных проблемах.
Магний. Определение Mg с помощью ЭДТА было уже давно описано Шварценбахом с сотр. [48(5), 48(7)]. Примененный ими индикатор эриохром черный Т является одним из наиболее часто применяемых в настоящее время. Выполнение титрования в микромасштабе [52(22)] и даже определение микрограммовых количеств [52(37), 57(134)] не вызывает затруднений. Были обстоятельно изучены вопросы точности комплексонометрических определений [60(33)] и стехиометрии титрования [60(129)].
Устойчивость комплексов ЭДТА и индикатора с Mg довольно высока, чтобы можно было проводить титрование с достаточной точностью; изменение окраски в точке эквивалентности (из винно-красной в синюю) несколько менее четкое, чем при других комплексонометрических титрованиях. Следует титровать до полного исчезновения красного оттенка, распознать которое, однако,
159
нетрудно. Реакция в точке эквивалентности протекает несколько замедленно, поэтому раствор следует немного подогревать.
Эриохром черный Т и многие аналогичные красители блокируются следами тяжелых металлов, прежде всего меди, которые, однако, нетрудно удалить, применяя соответствующие маскирующие вещества. Цианид калия устраняет помехи со стороны Cu, Ni, Со, Fe и т. д. Такую же функцию выполняют Na2S (при этом примеси тяжелых металлов осаждаются в виде сульфидов) и Мп — о титровании Mg в присутствии большого количества Мп см. [61 (81)] Алюминий можно замаскировать с помощью триэтаноламина, причем следует проводить титрование при 5° С [55 (84)], так как в противном случае возможен переход А1 из комплекса с маскирующим веществом в комплекс с индикатором.
Помехи, вызванные присутствием следов тяжелых металлов, часто можно устранить путем использования метода обратного титрования. При этом мешающие примеси связываются в комплекс с ЭДТА и реагируют с индикатором лишь медленно или совсем не реагируют; таким образом, обратное титрование может быть закончено до того, как наступит блокирование индикатора. Если, например, проводят обратное титрование раствором Zn, то содержание Си до 20 мг в литре раствора не оказывает вредного влияния. На том же принципе построен предложенный Ганом [58 (76), 60(124)] метод защитного титрования, основанный на относительном отсутствии помех и заключающийся в том, что известное количество титрованного раствора ЭДТА титруют анализируемым раствором.
Кроме эриохрома черного Т, применяют большое число других индикаторов, например алюминон [61 (2)], позволяющий проводить последовательное титрование смеси Fe—Al—Ca—Mg, лаковый алый С [57 (109)], красители ряда кислотного хрома синего [58 (68)], хромоксан зеленый [58 (89)], пирокатехиновый фиолетовый [56 (41)], арсеназо I [62 (90)]. Дил и др., с одной стороны [60 (36)], и группа исследователей во главе с Белчером, с другой [57 (43)], исследовали большое число красителей с точки зрения их пригодности в качестве индикаторов. В последнее время большим успехом пользуется калмагит [60 (134)]; по устойчивости комплексов с металлами и по изменению окраски он практически идентичен эриохрому черному Т, но его раствор более устойчив.
Индикация конечной точки титрования с помощью инструментальных методов включает преимущественно фотометрическое титрование, которое выполняют либо с самоиндикацией в УФ-областп [54 (14)], либо с эриохромом черным Т [53 (45), 54 (69), 55 (12)], либо с другими индикаторами, например с хромазуролом S [57 (102)] или калмагитом [61 (50)]. При определении Mg и при последовательном титровании смесей Ni—Mg, Zn—Mg или Bi—Mg применяют также потенциометрическое титрование с ртутным катодом или амперометрическое титрование [62 (33)]. Ниже -будут описаны также кондуктометрические [57 (34)] и термометрические [57 (97), 63 (67)] определения.
160
Мешающее влияние Mg на титрование других металлов проявляется только в щелочной среде, так что его присутствие едва ли составляет проблему при определении других металлов с тех пор, как стало возможным проводить титрование в кислом растворе. Маскировать Mg можно осаждением его в виде гидроокиси в сильнощелочном растворе (едкий натр) или с помощью фторид-ионов [54 (74)1
Титрованием Mg в присутствии фосфат-ионов занимался Колье [55(58), 54(25)], который советует удалять большие количества этих ионов экстракцией. Иониты также являются хорошим средством для удаления фосфат-ионов. Часто бывает достаточно сильного разбавления анализируемого раствора, для того чтобы замедлить образование MgNH4PO4, так как это соединение легко образует пересыщенные растворы. Кроме того, определять Mg в присутствии фосфат-ионов можно путем обратного титрования. О титровании Mg в присутствии Са будет сказано ниже. Здесь же можно отметить возможность отделения Са в виде молибдата [56 (58)] и титрования Mg в фильтрате, если требуется определение одного только Mg
Магний можно определять комплексонометрически в фармацевтических препаратах [53(12)], в алюминиевых сплавах [53(47), 57 (94), 57 (102)], в сплаве электрон [61 (64)], в чугуне и литейном чугуне [53(44), 56(7)], в титане [58(69)], сульфате никеля [52(3)], порохах [56 (93)], в почве и растительных материалах [51 (7)], горных породах [58(89)j>. минералах [51(36)] и урановых шлаках [60(69)].
Кальций. Кальций является одним из первых металлов, для которых был описан метод комплексонометрического титрования [48 (7)]. Титрование можно проводить в сильно разбавленных растворах, а также при наличии малых количеств Са [52 (22), 52 (37)„ 58 (134)]. Применяемый при этом индикатор мурексид был подробно изучен [49(4), 60(103)], и его часто употребляют в настоящее время. В сильнощелочной среде (рН=12) происходит изменение красной окраски мурексида в сине-фиолетовую, не столь резкое, как у многих других металлохромных индикаторов. Раствор мурексида устойчив в течение лишь нескольких часов, поэтому индикатор целесообразно вносить в твердом виде, растертым с 100 частями NaCL Следует учитывать также окислительное или гидролитическое разложение мурексида в анализируемом растворе, в особенности при фотометрических титрованиях, когда разложение иногда становится заметным благодаря медленному уменьшению светопоглощения. Для улучшения распознаваемости точки эквивалентности были предложены смешанные индикаторы, например 0,2 г мурексида с 0,5 г нафтолового зеленого В, хорошо перемешанные с 100 г NaCl [51(14)].
В качестве индикаторов на Са было предложено много других веществ, которые, однако, не всегда превосходят мурексид. Приводим некоторые из них: калькой [57 (123)], CAL-Red [56 (26)],
11 Зак. 553
161
эриохром сине-черный SE (Эрио SE) [58 (36)], кислотный хром сине-черный [60 (96)] и другие [59(75), 62(146)]. Все эти вещества являются о, о'-азосоединениями, сходными с эрио' ромом черным Т. Систематическое исследование индикаторных свойств таких веществ принадлежит Дилу и сотр. [60(36)]. Многочисленные соединения были изучены также Белчером и сотр. [57(43)]. Позднее в качестве индикаторов на Са были испытаны: лаковый алый С [57 (109).], омега хром сине-зеленый BL [59 (101)], фткпеинкомплек-сон [53(1), 56'54)], глиоксаль-бис-(2-оксианил) [55(46)], хромазу-рол S [55 (31)], Н-кислота [59 (147)], кислотный ализариновый черный SN [60 (155)] и пирогаллолкарбоновая кислота [56 (1)]. С алюминоном [61(2)] возможно последовательное титрование смеси Fe—Al—Са—Mg. Упоминаемый ниже синтезированный Вестом [60(154)] кальцихром идентичен, по видимому, гидрону, предложенному русскими авторами [60(108), 61(5)]. Для определения Са пригодны также метилтимоловый синий [58(34)] и пирокатехиновый фиолетовый [58(41)].
Кальцеин [56(72), 57(103)] можно применять и как цветной [62(150)], и как флуоресцентный индикатор (УФ-лучи). Флуоресце-инкомплексон за точкой эквивалентности имеет вызванную загрязнениями остаточную флуоресценцию [62 (149)], которая перекрывается при добавлении фенолфталеина (0,25 г фенолфталеина на 1 г индикатора) [61 (85)]. Аналогично обстоит дело с кальцеином (кальцеином W), для перекрывания остаточной флуоресценции которого был предложен акридин [62(151)]. Тимолфталексон тоже рекомендуется в качестве флуоресцентного индикатора на Са[61(34)]. Чтобы обеспечить распознавание точки эквивалентости без помех, Тофт с сотр. [63(74)] предложили простой прибор, который оправдал себя при титровании с кальцеином, а также сослужил хорошую службу при титровании с другими'флуоресцентными индикаторами.
Практически все индикаторы на Са дают резкий переход окраски только при высоком значении pH раствора. Однако существуют некоторые индицирующие системы, функционирующие при рН< 11, например комплекс Mg с ЭДТА (его дббавляют по меньшей мере в количестве 5% от содержания присутствующего Са) или ZnY в комбинации с эриохромом черным Т, а также комбинации ZnY с цинконом [58 (4)] и CuY с ПАН [56 (44)]. При этом одновременно титруется присутствующий в растворе Mg.
Обычно предпочитают индикаторы, действующие при высоких значениях pH, так как магний, часто сопутствующий кальцию, при этом выпадает в осадок в виде гидроокиси (см. ниже). Следует учесть, что используемая для подщелачивания щелочь не должна содержать карбонатов, а также не должна поглощать их из воздуха, воды или других реактивов, так как в противном случае выпадает осадок СаСОз. Осадок снова растворяется в течение титрования, если проводить его медленно. Однако выгоднее и экономичнее по времени избегать образования осадка, для чего удаляют
162
карбонат-ионы и титруют е довольно разбавленных растворах с целью предотвращения возможного выпадения в осадок Са(ОН)2. Избежать образования мути можно также при применении метода обратного титрования.
Факторы, мешающие титрованию кальция, были подробно изучены. Присутствующие в большинстве природных и искусственных продуктов Fe и А1 могут быть выделены с помощью разнообразных способов. Отделение путем осаждения раствором аммиака возможно всегда, но часто оно отнимает много времени, так как может оказаться необходимым двойное осаждение. О маскировании Fe, Al и Мп можно прочитать в разделах, касающихся определения соответствующих элементов. Если в растворе присутствует только А1, то для определения Са нет необходимости что-либо предпринимать, так как при обычных титрованиях при высоком pH А1 присутствует в виде алюминат-ионов, которые не реагируют с комплексоном. Однако следует обращать внимание на выбор индикатора, так как некоторые красители в указанных условиях блокируются алюминием. В случае очень высокого содержания А1 следует обратиться к ссылкам [55(46), 60(96)], а в случае высоких концентраций Мп — к ссылке [61 (81)].
Титан можно замаскировать перекисью водорода (см. определение титана). Широкие возможности для маскирования открывает применение цианида калия и ионитов. Следует принимать во внимание также возможность помех со стороны анионов. О помехах, создаваемых гидроксил- и карбонат-ионами, уже говорилось. Гексацианоферрат (II)-ион, присутствовавший в растворе сначала или же образовавшийся при маскировании Fe, может образовать муть вследствие малой растворимости его кальциевой соли; муть снова исчезает в процессе титрования. Особенно обстоятельно были изучены помехи, связанные с присутствием фосфат-ионов. Небольшие количества последних не мешают титрованию Са. Предельно допустимое соотношение Р : Са = 4 : 1 [55(58)], но оно сильно зависит от разбавления раствора.
Большие количества РО4 -ионовне помешают определению, если прибегнуть к методу обратного титрования. Циммерман [58(6)] предлагает для определения Са в присутствии фосфат-ионов титрованный раствор, 0,1 /VI по ЭДТА и 0,05 М по ZnY. В крайнем случае, при исключительно высоком содержании фосфат-ионов, их отделяют методом ионного обмена [53(5;] или экстракцией [54(25)].
Со времени применения титрования в кислой среде Са уже не является сильной помехой при определении других металлов. При некоторых титрованиях в щелочной среде (но не при титровании Mg) Са можно замаскировать с помощью фторид-ионов [54(74)].
Точность и воспризводимость комплексонометрических определений Са хорошая, что подтверждается многочисленными исследованиями, например [60(33), 60(129)].
11
163
Существует много инструментальных методов определения Са. Чаще всего предпочитают фотометрическое титрование, так как невооруженным глазом трудно распознать переход окраски мурексида [53(45), 54(10), 54^69), 55(12), 55(52), 55(69), 57(54), 58(96), 59 (35)]. Применяют и другие индикаторы, например калькой [59(112)], CuY — ПАН [62(147)], металлфталеин [55(7)]. Фотометрическое титрование можно проводить с самоиндикацией в УФ-области (228 нм) [54(14)]; его можно автоматизировать при использовании различных индикаторов [58(110), 59(119)]. Описана индикация точки эквивалентности по наклону кривой титрования при добавлении Си2+-ионов [57(13), 57(14)]. Амперометрическая индикация с ртутным капельным электродом [62 (33)] дает возможность проводить последовательное титрование таких смесей, как, например, Ni—Са или Си—Zn— Са, причем для индикации используют «волну комплексона». В сильноаммиачном растворе Са можно определять косвенным амперометрическим методом: из комплексоната цинка Са2+-ионы вытесянют 7п2+-ионы, которые затем оттитровывают [52(36), 54(88), 63(73)]. При потенциометрическом титровании с ртутной каплей в качестве электрода целесообразно пользоваться раствором ГЭДТА, так как при этом не мешает Mg [57(10), 63(65)]. Газлам с сотр. [60(111)] проводят потенциометрическое автоматическое титрование с серебряным электродом; этим методом можно последовательно титровать смесь Са—Mg. Описаны радиометрическое [59(60)] и кондуктометрическое [57(34)] титрования. Особенно интересна термометрическая индикация точки эквивалентности [57(97), 63(67)] применительно к анализу смеси Са—Mg, поскольку теплоты образования комплексонатов обоих металлов не только различны, но даже противоположны по знаку.
Число практических применений комплексонометрического определения Са огромно. Ниже приведены лишь некоторые из возможных случаев. Так как определение Са часто связано с определением Mg, рекомендуем читателю обратиться к разделам, касающимся определения смеси Са и Mg и жесткости воды. С использованием визуальной индикации проводятся анализы стеаратов [53(8)], сахарных соков [57 (14)], казеина [61 (15)], воды [51 (14), 52(48)], дождевой воды [55(50)], фармацевтических препаратов [50 (9), 51 (10), 51 (И), 53 (12), 55 (107), 56 (102)], трикальцийфосфата [60 (179)], технических фосфатов [62 (146)], растительных материалов [52(40)], фотографических материалов [57(24)]. канифоли [54(98)], а также определение свободной извести в силикатах [55(25), 58(95)] и Са в каустической соде [62(145)], причем в последнем случае применяют концентрирование Са на хелатообразующей ионообменной смоле-Дауэкс А-I. Фотометрическое титрование с мурексидом используют для определения водорастворимой части гипса [55 (52)] и анализа вод [57 (54)]. Кальцеин используют в качестве фотометрического индикатора при определении Са в солях лития [61(7)]. При анализе фуража Са титруют с ртутным капельным электродом [63(65)] раствором ГЭДТА.
164
Смеси кальция с магнием. Отделение кальция от магния можно проводить различными способами. Разделение [61(87)] всегда возможно, но отнимает много времени. Для целей разделения целесообразно'применять ионообменные смолы [54(8)]. Герке [54(5)] предлагает отделять Са в виде сульфита. Можно осаждать Са классическим способом в виде оксалата и после озоления и растворения осадка комплексонометрически оттитровывать. В случае очень малого содержания Са осадок оксалата кальция можно растворить в кислоте, прибавить ЭДТА и после подщелачивания раствора оттитровать избыток ЭДТА. Однако после осаждения кальция в виде оксалата изменение окраски эриохрома черного Т при титровании Mg в фильтрате бывает недостаточно резким, поэтому количество применяемых оксалат-ионов ограничивают до минимума.
Более изящными являются методы, в которых избегают разделения обоих металлов. Наиболее часто применяемый метод состоит в титровании Са в сильнощелочном растворе в присутствии осадка гидроокиси магния и в определении суммы Са и Mg во второй аликвотной части раствора (причем все сказанное выше о титровании Mg принимается во внимание), с последующим вычислением содержания Mg по разности *. Если в смеси много Са и мало Mg, вряд ли при анализе возникнут затруднения. Если ситуация менее благоприятна, следует обратить внимание на ряд обстоятельств, обсуждение которых можно найти в оригинальной литературе [54(34), 58(1), 58(39)].
Присутствие Mg(OH)i может мешать, во-первых, потому, что имеется возможность соосаждения Са, во-вторых, потому, что изменение окраски индикатора может стать не резким из-за адсорбции красителя хлопьевидным осадком.
Прибавление сахара [54(34), 58(9)] должно воспрепятствовать соосаждению Са, однако это не подтверждается другими авторами [60(33)]. Соосаждение можно, по мнению Флашки и Гудитца [52(30)], свести до минимума, если вначале к нейтральному или кислому анализируемому раствору прибавить количество ЭДТА, не намного превышающее эквивалентное кальцию количество, и лишь после этого подщелачивать. Щелочь всегда следует прибавлять медленно по каплям и раствор хорошо перемешивать. Согласно Льюису с сотр. [60(33)], при этом осаждается незначительное количество ЭДТА, которое при стоянии, благодаря рекристаллизации Mg (ОН) 2, снова переходит в раствор. Для лучшего распознавания изменения окраски индикатора (например, мурексида) целесообразно, но, безусловно, не обязательно, проводить осаждение в мерной колбе; объем раствора следует довести до метки, и, после того как осадок отстоится, прозрачную аликвотную часть фильт
* Если раствор содержит много соли аммония, последнюю следует удалить кипячением, так как в противном случае невозможно установить в растворе требуемое высокое значение pH.
165
рата использовать для обратного титрования небольшого избытка ЭДТА.
Баух и сотр. [61(107)] получили хорошие результаты при очень большом содержании Mg (определение около 0,5% Са, содержащегося в MgO), медленно осаждая Mg (ОН) 2 0,5 М раствором NaOH (к щелочи было прибавлено незначительное количество KCN и NH2OH • НС1) при энергичном перемешивании и титруя Са непосредственно в суспензии раствором ЭДТА с CaL-Red в качестве индикатора. Важность медленного осаждения при энергичном перемешивании подчеркивают также Льюис и Мельник [60(33)].
Как показывает исследование, проведенное Кенни с сотр. [58(39)], конечное значение pH раствора, применяемый индикатор и его количество также оказывают влияние на результаты титрования. В этом отношении важны результаты, полученные Белчером и др. [58(1)]. Из многочисленных испытанных индикаторов наиболее пригодным оказался калькой. Точка эквивалентности в присут ствии осажденного Mg(OH)2 была более четкой, чем в чистых растворах Са, причем в присутствии Mg не были получены заниженные результаты для Са, что имеет место при применении других индикаторов (например, мурексида, метилтимолового синего или кальцеина).
Нечеткие переходы окраски, обусловленные адсорбцией индикатора осадком Mg(OH)2, можно улучшить, если индикатор прибавлять уже после осаждения магния, и, кроме того, если перед добавлением красителя выждать, пока осадок не приобретет кристаллический характер. Как указывают Лотт и Ченг [59(102)], прибавление нескольких капель поливинилового спирта предотвращает уменьшение четкости перехода окраски индикатора. Аналогичное действие ацетилацетона наблюдали Бурже и др. [60(140)].
Суммируя сказанное выше, можно отметить, что имеются различные возможности улучшения условий определения, но едва ли можно предложить удовлетворительную для всех случаев методику определения; для каждого конкретного случая следует подбирать оптимальные условия, для того чтобы достигнуть наибольшей точности. Поэтому неудивительно, что есть много сообщений об опытах, поставленных с целью избежать выделения в осадок Mg(OH)2. Для этой цели предлагают[57 (105), 61 (88)]прибавлять к раствору винную кислоту. Согласно нашим опытам и в соответствии с данными других авторов [60 (140)], винная кислота пригодна для предотвращения выпадения магния в осадок, но при этом получаются завышенные результаты для Са, если в качестве титранта использовать раствор ЭДТА. Если же вместо ЭДТА взять ГЭДТА [60(140)], результаты определения Са получаются правильными, так как комплекс магния с этим компексоном менее стабилен, чем комплекс кальция. В этой связи интересно отметить, что точка эквивалентности титрования с кальконом получается резкой лишь тогда, когда соотношение Mg: Са равно, по крайней мере, 1. Если спавнить эти сведения с упоминавшимися выше данными Белчера
166
и др. [58(1)], то следует признать, что до сих пор еще не ясно, каким образом осаждение магния и его комплексообразование влияют на образование комплекса Са—калькой в точке эквивалентности.
Одна из главных проблем определения Са в присутствии Mg состоит в отсутствии до сих пор простого индикатора на Са для визуальных определений, функционирующего при таких значениях pH, когда Mg еще остается в растворе. Рингбом [58(4)] разрешил это затруднение, применив косвенную индикацию точки эквивалентности с помощью системы Zn—ГЭДТА—цинкон. В растворе устанавливают рН = 9,5—10 с помощью буферного раствора, содержащего 25 г буры, 2,5 г NH4C1 и 5,7 г NaOH в 1 л. В чистых растворах получаются очень резкие переходы окраски и правильные значения содержания Са. Но для этого необходимо, чтобы, во-первых, концентрация аммония соблюдалась очень точно и, во-вторых, отношение Са : Zn равнялось приблизительно 10; выполнение этих оптимальных условий при практическом проведении анализов, к сожалению, не всегда возможно. Другой путь описывают Флашка и Ганчоф [61(50)]: они титруют раствором ГЭДТА с мурексидом в качестве индикатора при pH около 10. При фотометрической индикации можно определять Са в присутствии более чем 100-кратного избытка Mg. Кальций в присутствии магния можно также потенциометрически титровать раствором ГЭДТА при pH = = 10 [57(10)].
Следует сослаться еще на метод Штрафельда [60(35)], в котором Mg осаждают фосфат-ионами при pH = 9 и затем в присутствии осадка определяют Са обратным потенциометрическим титрованием избытка ЭДТА титрованным раствором соли кальция с ртутным капельным электродом. Прибавленное количество фосфата должно быть очень точным. С одной стороны, этого количества должно хватить, чтобы снизить растворимость MgNH4PO4 настолько, чтобы он не вступал в реакцию с ЭДТА, с другой — количество фосфата не должно быть слишком велико, так как в противном случае выпадает осадок Са3(РО4)2. Литературных данных, касающихся соосаждения Са, не имеется.
После всего сказанного еще раз подчеркиваем, что едва ли можно дать универсальную методику работы, однако существуют удовлетворительные модификации стандартных методов, основываясь на которых можно для всех случаев, встречающихся в практике, выбрать пригодную для работы методику. Не следует забывать, что большинство исследований проводится на чистых растворах, а при практическом анализе условия определения осложняются вследствие высокой концентрации солей, присутствия мешающих элементов и прибавленных для их устранения маскирующих веществ.
Наиболее изящными являются последовательные титрования, так как, с одной стороны, они экономят время, а с другой — требуют меньшего количества анализируемого раствора, что при
167
Практических определениях часто очень важно Такие опыты проводились и дали очень хорошие результаты, по крайней мере, на искусственных растворах. Кэрэш [53 (32)] сначала титрует Са с мурексидом при рН = 13, затем подкисляют раствор, причем муре-ксид, гидролизуясь, разрушается, доводит pH до 10 и титрует Mg с эриохромом черным Т. Описанные выше затруднения, возникающие при определении Са в присутствии Mg (ОН) 2, естественно, имеют значение и здесь. Лотт и Ченг [57 (124)] сначала титруют Са с каль-коном при высоком значении pH, затем снижают pH раствора, прибавляя кислоту и хлорид аммония, и продолжают титрование с эриохромом черным Т для определения Mg. Шмидт и Рейли [57 (10)] исключают ошибку, вызываемую осаждением магния, для чего они сначала в прозрачном растворе при pH = 9,5—10 титруют Са раствором ГЭДТА в присутствии индикаторной системы Рингбома, представляющей собой смесь Zn — ГЭДТА — цинкон, затем прибавляют KCN для маскирования Zn и титруют Mg раствором ЭДТА с эриохромом черным Т. Флашка и Ганчоф [61(50)] пользуются фотометрической индикацией точки эквивалентности. Сначала они титруют Са с мурексидом раствором ГЭДТА при pH = 10, затем прибавляют эриохром черный Т, меняют длину волны света и определяют Mg титрованием раствором ЭДТА. Субмикрограммовые количества Са и Mg можно определить по одной кривой фотометрического титрования; при этом используют комплекс Mg—калмагит в качестве самоиндицирующей системы для установления конечной точки титрования Са по наклону кривой титрования [62(27)].
Определение Са и Mg упомянутыми выше методами применяют в анализе разнообразных материалов, например лимфы насекомых [54(4)], известняка [52 (39), 58 (110), 61 (87)], доломита [58 (89), 61(87)], магнезита [52(30), 61(50)], известковых и силикатных пород [55 (87), 61 (180)], почв [51 (7), 53 (61), 55 (24)], стеклянных порошков [61 (9)], стекла [54 (20)], руд и шлаков [53 (52), 59 (112), 61(34), 61(68)], цемента [56(17)], стали [60(112)] и подобных материалов [53(55)]; каменной соли [58(85)], рассолов[53(31),54(64)], морской воды [54(40)] и других растворов с большим содержанием щелочи [63(73)], а также сварочной проволоки, содержащей Мп [60(49)], пульпы [52(15)], сточных вод угольных разработок[61 (10)], обычных вод [60 (111)] и специальных минеральных вод [52 (8)], молока [53(54), 54(21), 62(96)], консервированных фруктовых соков [58 (33)], фармацевтических препаратов [51 (10), 55 (107), 56 (102)], растительных материалов после озоления [50 (11), 51 (7), 60 (86)], в частности табачного пепла [57 (96)], животных тканей [55 (9)] п биологических материалов вообще [61(119)].
Кальций и магний в биологических жидкостях. Комплексонометрическое определение Са и (или) Mg в крови, сыворотке, моче и спинномозговой жидкости в настоящее время является стандартным титриметрическим методом, применяемым почти во всех лабораториях. Число публикаций, относящихся к этой области, пре
168
высило сотню. Так как многие из предложенных методов лишь незначительно различаются в деталях, здесь для объяснения принципов определений будут рассмотрены только некоторые из опубликованных работ.
Кальций в сыворотке впервые определили Гринблатт и Гартман [51(17)], проводя титрование с мурексидом в сильнощелочном растворе. Другие авторы описывают этот же метод лишь с небольшими изменениями [52(2), 52(9), 52(16), 54(53)] или с фотометрической индикацией [54(19), 58(45)]. Применяются и другие индикаторы, например кальценн [57 (46)], преимущественно в Уф-области [57 (36)], причем можно вычертить кривую титрования [59 (91)]; этим методом можно анализировать очень малые количества сыворотки (20 мкл) [62 (39)]; можно применять фотометрическую индикацию [59 (129)]. Кроме того, применяют CAL-Red [58(20)], калькой [60(146)], фталеинкомплексон [56(68)], кислотный ализариновый черный SN [60(156)] и флуоресцентные индикаторы [60(6), 60(81)]. Обстоятельное сравнение] например [55 (53)]) этих методов с классическим оксалатным методом отчетливо показало преимущества комплексонометрического метода.
Кальций в моче можно определять стандартным методом с ЭДТА так же, как его определяли в других материалах [54(19)], или фотометрическим титрованием [58 (96)], или с добавлением флуорексона [61 (182)]. Вследствие повышенного содержания фосфатов в моче при ее анализе часто оказывается полезным сильное разбавление анализируемого раствора или, во избежание выпадения в осадок трудно растворимых соединений, применение обратного титрования.
Кроме этих методов, разработанных специально для определения Са, подходящие способы определения Са могут встретиться и среди описываемых далее методов определения Са и Mg, так как многие определения Са связаны с определением Mg.
Первое определение магния в сыворотке описали Голасек и Флашка [52(33)]. Кальций осаждают в виде оксалата и титруют после растворения осадка, тогда как Mg определяют в фильтрате после центрифугирования. Преимущество этого метода состоит в том, что оба металла можно определять в одном растворе. Аналогичным преимуществом обладает метод, предложенный Гьессингом [60(128)], в котором осуществляется последовательное титрование. Сначала Са титруют фотометрически с мурексидом в щелочном растворе (NaOH), причем небольшие количества Mg(OH)2, остающиеся в растворе, по-видимому, в коллоидной форме, не мешают. Затем прибавляют глицин и кипятят. При этом мурексид разрушается и гидроокись магния растворяется; после этого титруют Mg с эриохромом черным Т Однако большинство методов основано на использовании двух аликвотных проб В одной пробе Са титруют в растворе с высоким значением pH с мурексидом 1см выше) или с другим индикатором, например Эрио SE [58 (36)], а в другой — оттитровывают сумму Са и Mg. В последнем титровании обычно
169
пользуются эриохромом черным Т. Метод пригоден для работы с ультрамикроколичествами [51(13)] и выигрывает в точности, если применять фотометрическое титрование [59(63), 59(107), 60(175)]. Процесс титрования можно автоматизировать [59(118)].
Кальций и магний в моче можно определять так же, как и в сыворотке, но с небольшими изменениями [58(93)].
Кальций и магний в плазме [51(9)] и в спинномозговой жидкости [56(4)] определяют совершенно так же, как и в сыворотке.
Определение жесткости воды. Определение жесткости воды уже очень давно было описано Шварценбахом с сотр. [46(2)] и является первым методом комплексонометрического титрования, использованным в практике. В литературе можно найти многочисленные методики определения жесткости воды [50(5), 50(6), 50(7), 50 (8), 52 (47), 52 (48), 55 (47)], включая микроопределения
[53 (62)].
Следует различать две группы методов; определение общей жесткости и раздельное определение кальциевой и магниевой жесткости. При определении общей жесткости титруют сумму Са и Mg. Титрование обычно проводят в растворе с pH = 10 с эриохромом черным Т в качестве индикатора. Чтобы переход окраски индикатора был резким, необходимо присутствие по меньшей мере 5% Mg (по отношению к содержанию Са). Так как для разных по происхождению вод это условие не всегда соблюдается, следует прибавлять известное количество Mg и учитывать его при вычислениях или, еще лучше, вводить в анализируемый раствор в виде комплекса магния с ЭДТА. При выполнении серийных анализов гораздо проще употребить титрованный раствор, в котором наряду с ЭДТА (H2Y2~) содержится необходимое количество MgY2-.
При изучении факторов, мешающих этим титрованиям, выяснено [53(42)], что к ним относятся главным образом небольшие примеси тяжелых металлов, которые или вызывают перерасход титранта, или блокируют индикатор. Их удаление не вызывает затруднений, если прибавить в качестве маскирующих веществ смесь KCN с аскорбиновой кислотой или триэтаноламин. Хорошим маскирующим веществом для большинства металлов, кроме А1, является также Na2S [53(62)]. Часто маскирующие вещества вводят в буферный раствор. Ган [58(76)] избегает помех или снижает их, оттитровывая известное количество стандартного раствора ЭДТА анализируемой водой. Однако этот прием затруднителен для практического применения. При титровании с хромазуролом S помехи менее опасны [55(31)], так как этот краситель мало подвержен блокированию. Однако переход окраски в этом случае менее резок, чем при использовании эриохрома черного Т.
При раздельном определении кальциевой и магниевой жесткости обычно используют две аликвотные порции раствора. В одной части раствора титруют Са при высоком значении pH, в другой при pH = 10 титруют сумму Са и Mg. Магний вычисляют по вязкости. Титрование кальция, как правило, не вызывает затруднений.
170
а
Рис. 32. Кривые перехода окраски эриохрома черного Т в процессе титрования магния при различных значениях pH.
так как во всех нормальных водах содержание Са сильно превы* шает содержание Mg.
Для анализа вод, содержащих полифосфаты, Брук предложил (52(7)] проводить предшествующее титрованию Са разделение методом ионного обмена. Шнейдер и др. [51 (18)] при определении жесткости сахарного сиропа применяли в качестве индикатора эриохром сине-черный В.
Комплексонометрическому определению постоянной жесткости может предшествовать кислотно-основное определение временной жесткости, после которого комплексонометрическое титрование можно проводить непосредственно в том же самом растворе.
Сообщают [50 (4)] о фотометрических титрованиях, представляющих интерес для анализа окрашенных вод. Фотометрическая индикация позволяет автоматизировать титрование [50 (119)]. Лаци [63 (46)] описывает полуавтоматический метод, в котором полученная в присутствии эриохрома черного Т кривая титрования вычерчивается самописцем. На кривой получаются два перегиба, первый из которых соответствует окончанию титрования Са. Таким образом, возможно одновременное определение кальциевой и магниевой жесткости. Эрдей и др. [62 (117)] тоже получили два перегиба на кривой при высокочастотном титровании. Кондуктометрическое титрование [57(28), 57 (35)] оправдало себя при анализе мутных и окрашенных вод. Поскольку в природных водах концентрация солей обычно
анализа весьма пригоден кондуктометрический метод, благодаря отсутствию мешающего определению электропроводности фона.
незначительна, для их
Прямое определение магния с эриохромом черным Т
Реактивы
ЭДТА, 0,01 М раствор.
Эриохром черный Т.
Буферный раствор, pH =10 .
Ход определения. Концентрация Mg в анализируемом растворе не должна превышать 10-2 М. Кислые анализируемые растворы предварительно нейтрализуют едким натром. Затем к каждым 100 мл раствора приливают 2 мл буферного раствора, несколько капель эриохрома черного Т и титруют до перехода красной окраски в синюю. С последней каплей раствора титранта должен исчезнуть
171
красноватый оттенок индикатора. Так как реакции комплексообразования протекают не мгновенно, вблизи конечной точки титрование замедляют.
Замечания. Кривые, изображенные на рис. 32 и полученные комбинацией кривых, изображенных на рис. 4 и 23, показывают, что в процессе титрования следует довольно точно поддерживать значение pH = 10. Как слишком низкое, так и слишком высокое значение pH ухудшает распознаваемость точки эквивалентности. Поэтому кислые анализируемые растворы до прибавления буфер
Рис. 33. Кривые перехода окраски эриохрома черного Т в процессе титрования кальция при различных значениях pH.
эриохрома черного Т в процессе титрования смеси кальция и магния при pH = 10.
Содержание магния в растворе меняется и дано в процентах по отношению к содержанию кальция.
ного раствора нейтрализуют едким натром, а не аммиаком, чтобы не вводить в раствор дополнительное количество ионов аммония. При правильном выборе условий титрования точка эквивалентности бывает настолько резкой, что можно титровать даже 0,001 М раствором ЭДТА.
Определение кальция с эриохромом черным Т по методу вытеснения
Реактивы
ЭДТА, 0,01 М раствор.
Эриохром черный Т.
Буферный раствор, pH = 10.
Комплекс магния с ЭДТА, 0,1 М раствор.
Ход определения. Концентрация ионов кальция не должна превышать 10'2 М. Если анализируемый раствор кислый, его нейтрализуют едким натром. К каждым 100 мл анализируемого раствора приливают 2 мл буферного раствора, 1 мл 0,1 М раствора MgY,
172
2—4 капли эриохрома черного Т и титруют до перехода красной окраски в синюю. С последней каплей раствора титранта должен совершенно исчезнуть красноватый оттенок. Вблизи конечной точки титрование замедляют.
Замечания. Кривые, приведенные на рис. 33 и полученные комбинацией кривых, изображенных на рис. 5 и 24, показывают, как изменяется цвет эриохрома черного Т, если Са2+-ионы титруют без добавления комплексоната магния. При этом даже при pH = 11 не получается резкого перехода окраски, кроме того, в таком сильнощелочном растворе не получается чистого синего цвета, так как в этой области pH эриохром черный Т ведет себя как кислотно-основной индикатор [HF2- (синяя) —>F3~ (коричневая)].
Кривые, изображенные на рис. 34, показывают улучшения, достигнутые в результате прибавления комплексоната магния. Так как комплексонат кальция устойчивее комплексоната магния, происходит вытеснение Mg и — как следствие — одновременное титрование Са и Mg (см. рис. 11). „Кривые, изображенные на рис. 34, получены комбинацией рис. 11 и 23. Они показывают, что добавление только 1% Mg уже значительно улучшает распознаваемость точки эквивалентности. При прибавлении 10% Mg получают практически максимальный возможный эффект Дальнейшее прибавление MgY2-привело бы лишь к ненужному повышению ионной силы раствора и уменьшению скачка pMg. При правильном проведении титрования изменение окраски бывает настолько резким, что можно проводить микроопределения, используя даже 0,001 714 раствор ЭДТА.
Определение суммы кальция и магния с эриохромом черным Т.
Определение жесткости воды
Реактивы
ЭДТА, 0,01 М раствор.
Эриохром черный Т.
Буферный раствор, pH = 10.
Комплекс магния с ЭДТА, 0,1 М раствор (для некоторых случаев). Маскирующие вещества, для железа и меди (в некоторых случаях).
Ход определения. К 100 мл анализируемой воды прибавляют 2 мл буферного раствора и, если необходимо, маскирующее вещество, а также несколько капель эриохрома черного Т и тотчас титруют до перехода красной окраски в синюю. В точке эквивалентности должны исчезнуть последние остатки красного оттенка.
Если анализируемая вода не содержит магния, следует прибавить комплексонат магния и, таким образом, вести определение по описанной выше методике.
Аналогичным образом анализируют растворы, полученные из пород, почв, золы и т. д., после отделения или маскирования тяжелых металлов.
Замечания. Точку эквивалентности можно сделать несколько более резкой, если анализируемую воду предварительно подкислить
173
соляной кислотой, прокипятить около 1 мин для удаления СОг, после охлаждения нейтрализовать едким натром и затем прибавить буферный раствор и индикатор. О влиянии магния см замечания к предыдущей методике.
Прямое определение кальция с мурексидом
Реактивы
ЭДТА, 0,01 М раствор
Мурексид.
Едкий натр, 1 М раствор.
Хлорид кальция, 0,01 М раствор (для некоторых случаев).
Ход определения. К каждым 100 мл анализируемого нейтрального раствора (кислые растворы нейтрализуют едким натром), в которых содержится не более 5 мг Са, приливают 10 мл раствора NaOH и, если необходимо, маскирующее вещество. Затем прибавляют к раствору индикатор и тотчас титруют до перехода красной окраски в фиолетовую Титрование следует начинать как можно быстрее после прибавления NaCH, во избежание выпадения осадка СаСО3.
Замечания. Кривые перехода окраски индикатора, изображенные на рис. 35, получены комбинацией кривых, изображенных на рис. 5 и 26. Из рис. 35 ясно, что титрование следует проводить при pH = 12. Индикатор изменяет окраску при еще довольно низких значениях рСа, что обусловливает своеобразную форму кривых перехода, показанных на рис 35, с резким углом в точке с абсциссой а=1, соответствующей 100%-ному переходу окраски. Вершина этого угла лежит в точке эквивалентности, но последнюю визуально трудно распознать, поэтому титрование проводят до полного исчезновения красного оттенка. При фотометрическом титровании, т. е. при регистрации в процессе титрования коэффициента экстинкции, лучше всего при длине волны 480 нм или 590 нм [см. кривые поглощения мурексида (H2F2-) в щелочном растворе и комплекса кальция с мурексидом (CaH2F“), рис. 19], точку эквивалентности можно определить очень точно и тем самым заметно повысить точность метода.
Условия титрования кальция в присутствии магния характеризуют кривые, изображенные на рис. 14. В сильнощелочном растворе (pH = 13) гидроокись магния столь трудно растворима, что остающийся в растворе кальций дает в точке эквивалентности настолько резкий скачок рСа, как если бы магний отсутствовал (кривая II, рис. 14). Если предварительно раствор подщелочить, подождать 1—2 мин, пока выпадет осадок гидроокиси магния, затем прибавить индикатор и титровать, в конечной точке наблюдают очень резкий переход окраски. Однако результаты определения Са получаются заниженными на несколько процентов, так как осадок гидроокиси магния, выпадая, увлекает и кальций. После изменения окраски индикатора часть соосажденного Са снова растворяется,
174
вследствие чего окраска мурексида при стоянии снова становится красной; значит, раствор должен быть дотитрован. Если содержание магния в растворе очень мало, вначале Mg(OH)2 не выпадает вовсе, и можно оттитровать пересыщенный раствор. Пунктирная кривая I на рис. 14 изображает такое титрование; видно, что при связывании всего кальция комплексоном (при а = 0,5) происходит небольшой скачок рСа, который все же удовлетворительно фикси-
руется мурексидом, так что получаются правильные значения содержания Са, но с немного большим разбросом, чем в отсутствие Mg. Такая ситуация может встретиться при определении кальцие-
вой жесткости природных вод.
Чтобы получить правильные результаты в присутствии большого количества магния (анализ магнезитов), сначала связывают кальций взятой в небольшом избытке ЭДТА, затем подщелачивают раствор, при чем выпадает чистая гидроокись магния,не содержашая кальция, и потом обратно титруют избыток ЭДТА. Такое определение можно проводить, например, следующим образом. В мерную колбу емкостью 1000 мл вносят 500 мл раствора магнезита, содержащих не более 20—40 мг кальция, приливают ЭДТА в количестве, немного большем, чем (при предварительном титровании 'приблизительно определяют это количество) эквивалентное содержанию кальция, 2 мл триэтаноламина (для маскирования примесей железа и марганца), нейтрализуют и затем создают щелочную среду прибавлением 100 мл 1 н. раствора NaOH. Затем
Рис. 35. Кривые перехода окраски мурексида в процессе титрования кальция при различных значениях pH.
объем раствора доводят до метки, раствор перемешивают и остав-ляют на 30 мин. Отбирают пипеткой 200 мл прозрачного раствора, находящегося над осадком, прибавляют индикатор и обратно титруют небольшой избыток ЭДТА 0,01 М раствором СаС12.
Прямое определение кальция с металлфталеином
Реактивы
ЭДТА, 0,01 М раствор
Смесь металлфталеина с нафтоловым зеленым
Аммиак, 1 М раствор.
Хлорид аммония, 1 М раствор
Ход определения. Титруемый раствор должен содержать 10“3 — 10-4 г-атом Са в 1 л. Кислые анализируемые растворы сначала нейтрализуют едким натром. Затем прибавляют к каждым 100 мл раствора 0,3 мл индикатора, 5 мл раствора аммиака и, если
175
Рис. 36. Кривые изменения интенсивности окраски металлфталеина в процессе титрования кальция при различных значениях pH.
требуется, несколько капель раствора NH4C1 и титруют до мгновенного исчезновения красной- окраски индикатора. Оттитрованный раствор имеет серую окраску.
Замечания. Кривые изменения интенсивности окраски металл-фталеина в процессе этого титрования, показанные на рис. 36, получены комбинацией кривых, изображенных на рис. 5 и 29. Из рис. 36 видно, что наиболее благоприятны условия титрования при pH раствора около 11 или немного ниже. Если pH уменьшается до 10, то изменение окраски становится размытым, если же pH > Н, то после перехода точки эквивалентности остается интенсивная красная окраска раствора. При pH = 10,5—11 конечное значение интенсивности окраски в точке эквивалентности составляет лишь 10—13% от первоначального значения. Эту остаточную окраску можно замаскировать, если примешать к индикатору нафтоловый зеленый.
Чтобы раствор имел pH = 11, в нем кроме аммиака должно присутствовать очень малое количество аммонийной соли. Как правило, освобождающихся при комплексообразовании ионов водорода бывает достаточно, чтобы часть аммиака перевести в NHJ-ионы. Если этого не происходит, то в точке эквивалентности остается интенсивная красная окраска, поэтому следует прибавить несколько капель хлорида аммо
ния. При фотометрической индикации точки эквивалентности результаты титрования заметно улучшаются.
Прямое определение кальция с кальконом [57 (123)]
Реактивы
ЭДТА, 0,01 М раствор.
Калькой
Едкое кали, 2 М раствор.
Диэ гиламин.
Ход определения. Концентрация кальция в титруемом растворе должна быть около 10-2Л1. Кнслые растворы сначала нейтрализуют едким натром или едким кали. К каждым 100 мл нейтрализован ного анализируемого раствора приливают 5—7 мл диэтиламина Этого количества вполне достаточно для установления значения pH раствора около 12,5. Затем прибавляют индикатор калькой и титруют (тотчас, чтобы предотвратить выпадение осадка СаСО3) раствором ЭДТА до устойчивой чисто-синей окраски.
Замечания. Требуемое значение pH титруемого раствора можно установить также с помощью КОН или NaOH.
176
Некоторые наблюдатели отмечают, что точка эквивалентности при титровании с кальконом получается более резкой, если присутствует небольшое количество магния. В этом случае, если Mg в анализируемом растворе отсутствует, прибавляют 1—2 мл 0,1 М раствора соли магния. Затем медленно при сильном перемешивании подщелачивают раствор. Количество диэтнламина, указанное выше, достаточно для установления соответствующего pH в присутствии Mg. При титровании в присутствии Mg иногда после конечной точки раствор при стоянии вновь обесцвечивается; тогда следует прибавить еще 1—2 капли титрующего раствора ЭДТА, чтобы получить устойчивую синюю окраску. Поэтому, если в растворе присутствует магний, перед отсчетом по бюретке следует подождать около полминуты.
В качестве титранта вместо ЭДТА можно применять ГЭДТА, особенно тогда, когда определение Са проводят в присутствии большого количества Mg и для предотвращения выпадения Mg в осадок прибавляют винную кислоту.
' 10. БАРИЙ И СТРОНЦИЙ
Константа устойчивости комплекса SrY (1g А = 8,63) приблизительно равна такой же константе для MgY (1g К = 8,69); соответствующий комплекс бария менее устойчив (1g А = 7,76). Следовательно, барий и стронций можно титровать только в щелочном растворе. При этом в обычных условиях титрования легко могут выпасть в осадок труднорастворимые карбонаты, вследствие чего определение почти всегда проводят по методу вытеснения или по методу обратного титрования.
Определение Sr по методу вытеснения с применением комплексонатов MgY или ZnY в присутствии эриохрома черного Т в качестве индикатора дает вполне хорошие переходы окраски [48 (5)]. При титровании Ва условия менее благоприятны. Сравнение констант устойчивости соответствующих комплексонатов показывает, что титрование Ва практически вряд ли возможно. Но Мэнс и др. [52(49)] указывают, что необходимо учитывать также константы устойчивости комплексов с индикатором. Например, рассмотрим реакцию с эрнохромом черным Т (Ind)
MgY2-+ Ва — Ind < * Mg — Ind + BaY2-
IgA 8,7 ~2 7,0 7,8
Величина константы равновесия этой реакции составляет около 104, что вполне достаточно для проведения титрования по методу вытеснения. После завершения реакции обоих металлов с комплексоном происходит также скачок pMg, несмотря на то, что Mg2+-HOH связывается в комплекс скорее, чем Ва2+-ион (см стр. 38). Сийдериус [54 (37)] отмечает, что на изменение окраски индикатора, а, следовательно, и на точность титрования оказывают большое
\2 Зак 553
177
влияние концентрация буферного раствора, посторонних солей, а также pH раствора, и поэтому следует придерживаться оптимальных условий определения.
Благодаря растворимости сульфата бария в щелочном растворе ЭДТА Ва2+-ионы можно отделить от ионов других металлов осаждением сульфатом и после растворения осадка в ЭДТА определить обратным титрованием избытка ЭДТА Многие сведения, касающиеся определения Ва, можно почерпнуть из исследований по применению сульфата бария для косвенного определения сульфат-ионов.
Балчо и Доплер [54(94), 56(97)] занимались определением очень малых количеств бария и получили хорошие результаты (определение около 50 мкг с точностью 3%), если для обратного титрования использовали раствор MgCl2. Они применяли смешанный индикатор, состоящий из тропеолина 00 (1 часть), эриохрома черного Т (2 части) и NaCl (500 частей). Индикаторную ошибку исключали двойным титрованием.
Тэйс [55(31)] применял в качестве индикатора хромазурол S. Однако переход окраски не очень резок; кроме того, титрованный раствора ЭДТА при этом должен иметь концентрацию больше 0,05 М. Кроме того, следует прибавлять точно известное количество MgCl2, чтобы достигнуть удовлетворительною изменения окраски индикатора. Драгушин [61(148)] описывает прямое титрование при pH = 9,5 в присутствии смешанного индикатора, изменяющего окраску от фиолетовой к зеленой. При этом он приливал к анализируемому раствору 20 м.г свежевзмученного в 2—3 мл воды родизоната натрия, а затем вносил по каплям 1%-ный водный раствор голубого щелочного до появления пурпурового окрашивания.
Очень резкие переходы окраски были получены с металлфталеи-ном, предложенным в качестве индикатора Шварценбахом и др. [53(1)] ( см. замечания к методикам). В особенности хорошие переходы окраски получаются в 50 %-ном спиртовом растворе. Однако в этом случае следует проводить обратное титрование избытка ЭДТА титрованным раствором соли бария, иначе могут выпасть в осадок нерастворимые карбонаты.
Смешанный индикатор (металлфталеин с нафтоловым зеленым) и здесь лучше простого индикатора. Мак-Кэллум [56(54)] рекомендует смешанный индикатор, состоящий из 0,1 г металлфталеина, 0,005 г метилового красного и 0,05 г дианилового зеленого (№ 576 Allied Chemical and Dye Corp.) в 100 мл раствора.
Гордон с сотр. описали фотометрическое определение малых количеств бария. При длине волны 650 нм можно оттитровать с эриохромом черным Т от 0,5 до 5 мг Ва [56 (10)] (без реакции вытеснения с MgY или ZnY). Еще меньшие количества Ва можно определять с металлфталеином при длине волны 570 нм [56(71)].
Поляк [57(26)] определял потенциометрическим методом небольшие количества Ва прямым титрованием или обратным титрованием избытка ЭДТА титрованным раствором MgCl2, ппименяя пару шектродов Pt—W. Об амперометрическом титровании Ва сооб
178
щают Кэмпбелл и Рейли [62 (33)]. Для индикации точки эквивалентности они использовали так называемую «волну комплекса».
Методы определения Ва находят практическое применение в анализе воды [56(54)] и лечебных вод [54(94), 56(97)]. Кемуля [61.(71)] определяет Ва в ферритах бария, осаждая его сульфат-ионами, растворяя осадок в ЭДТА и оттитровывая избыток последней раствором соли магния. Аналогичным образом определяют небольшое содержание Ва (до 0,05%) в никелевых сплавах [57(26)]. Де Суса [60(23)] анализирует минералы, определяя в них Ва осаждением карбонат- или хромат-ионами с растворением осадка в ЭДТА и обратным титрованием избытка ЭДТА раствором соли бария. Барит можно непосредственно растворить в ЭДТА и избыток последней обратно оттитровать [61(148)]. Верма и др [57(1201] сообщают о последовательном титровании смеси Zn—Ва Сначала цинк титруют при pH = 6,7 с эриохромом черным Т, затем добавляют в избытке ЭДТА, доводят pH раствора до значения 10 и определяют Ва обратным титрованием избытка ЭДТА раствором соли магния. Заглавие цитируемой статьи приводит в заблуждение, так как в ней обсуждаются лишь результаты, полученные в чистых растворах, тогда как о фактическом анализе литопонов, в котором могут встретиться затруднения с растворением материала пробы, ничего не говорится.
Бидерман иШварценбах [48 (5)] определяют стронций, используя реакцию вытеснения с комплексонатом MgY в присутствии эриохрома черного Т в качестве индикатора. Огава и Муша [60 (109] титруют 0,1—6 мг Sr в 50 мл раствора фотометрически с металлфта-леином при длине волны 580 нм и рН = 10—11,5 с точностью около 1 %.
Вольф [60(37)] сообщает о возможности использовать унитиол в качестве вещества, маскирующего ионы Zn, Cd, Hg, Pb и Sn при титровании Sr и Ва. При определении других металлов небольшие количества Ва можно замаскировать сульфат-ионами. На холоду реакция между BaSO4 и ЭДТА протекает довольно медленно, и, таким образом, титрование заканчивается раньше, чем существенное количество осадка перейдет в раствор.
Определение стронция и бария по методу вытеснения с эриохромом черным Т Определение с комплексонатом магния
Реактивы
ЭДТА, 0,01 М раствор.
Эриохром черный Т.
Буферный раствор, pH = 10.
Комплекс магния i ЭДТА, 0,1 М раствор
Ход определения. Анализируемый раствор нейтрализуют едким натром. Затем к каждым 100 мл раствора приливают 10 мл 0,1 М раствора MgY, 2 мл буферного раствора и 2—4 капли эриохрома черного Т. Титруют раствором ЭДТА до перехода красной окраски в синюю.
12*
179
Замечания. Изменение окраски индикатора при определении Sr и в особенности Ва бывает значительно менее резким, чем в случае определения кальция. Это обусловлено различными величинами констант устойчивости их комплексонатов. Константа устойчивости BaY2* равна лишь 107-8, в то время как для MgY-2, т. е. комплекса того катиона, на который реагирует индикатор, она равна 108’7. Поэтому при прибавлении комплексона в первую очередь связывается Mg, что приводит к «раннему» переходу окраски индикатора, как это показано на рис. 37 и 38. .Кривые, изображенные на
Рис. 37. Кривые перехода окраски эриохрома черного Т в процессе титрования смеси стронция и магния при pH = 10.
Содержание м-агния в растворе меняется и дано в процентах по отношению к содержанию стронция.
Рис. 38. Кривые перехода окраски эриохрома черного Т в процессе титрования смеси бария и магния при pH = 10.
Содержание магния в растворе меняется и дано в процентах по отно пению к содержанию бария.
этнх рисунках, получены комбинацией кривых, изображенных на рис. 12, 13 и 23. Они показывают, что изменение окраейи заметно наступает уже до точки эквивалентности и заканчивается в самой точке. Прибавление больших количеств комплексоната магния ненамного улучшает положение.
При фотометрической индикации точки эквивалентности барий можно титровать раствором ЭДТА и не прибавляя магния [56(10)].
Определение с комплексонатом цинка
Реактивы
ЭДТА 0,01 М раствор.
Эриохром черный Т.
Аммиак, концентрированный раствор.
Комплекс цинка с ЭДТА, 0,1 М раствор.
Хлорид аммония, 1 М раствор.
Ход определения. К приблизительно 100 мл нейтрального или нейтрализованного едким натром анализируемого раствора, содержащего не более 5 • 10 4 г-ат бария или стронция, приливают 10 мл
180
раствора комплексоната цинка и 1 мл раствора хлорида аммония. Затем прибавляют аммиак до его концентрации 0,5 М (3—4 мл 25%-ного раствора аммиака на 100 мл анализируемого раствора), несколько капель индикатора и титруют до перехода красной окраски в синюю.
Замечания. Как было объяснено в теоретической части, в анализируемом растворе концентрация аммиака должна быть такой, чтобы коэффициент рА имел значение порядка Ю8. При этом в точке эквивалентности получается довольно хорошо выраженный скачок pZn, как это видно из рис. 45. Скачок pZn выражен лучше при pH =11, чем при pH = 10. Более высокое значение pH следует соблюдать прежде всего потому, что скачок pZn (см. рис. 15) и переход окраски индикатора (см. рис. 25) должны быть приведены в соответствие. При pH = 10 окраска эриохрома черного Т изменяется слишком рано, тогда как при pH = 11 переход окраски индикатора (см. рис. 25) происходит как раз в области резкого увеличения pZn (см. рис. 15).
Для создания значения pH = 11 с помощью аммиачной буферной смеси необходимо, чтобы отношение [NHJ]/[NH3] было равно 0,02. Следовательно, при 0,5 М — наиболее благоприятной — концентрации аммиака концентрация солей аммония не должна превышать 0,01 М.
Определение бария обратным титрованием с эриохромом черным Т
Иногда вместо титрования по методу вытеснения бывает удобнее применять обратное титрование 0,01 Л4 раствором сульфата цинка. Такое титрование особенно пригодно для определения бария в осадке BaSO4. Осадок взбалтывают с точно отмеренным и взятым примерно в двойном избытке 0,1 At раствором ЭДТА и прибавляют 4 мл концентрированного (25%-hoii'o) раствора аммиака. Затем осадок медленно растворяют при кипячении, концентрацию аммиака при этом поддерживают постоянной. Затем приливают 1 мл 1 М раствора NH4C1 и индикатор, раствор разбавляют приблизительно до 100 мл и титруют избыток ЭДТА стандартным раствором соли цинка до перехода синей окраски в красную. В точке эквивалентности вновь начинает выпадать осадок BaSO4, так как в этих условиях произведение концентраций соответствующих ионов снова превышает произведение растворимости BaSOj.
Чтобы в процессе растворения осадка не извлечь щелочноземельные металлы из стекла, рекомендуется пользоваться посудой из стекла «Викор» или кварца.
181
Прямое определение бария или стронция с металлфталеином
Реактивы
Рис. 39. Кривые изменения интенсивности окраски металлфталеина в процессе титрования бария чри различных значениях pH.
ЭДГА, 0,01 ТЛ раствор.
Хлорид бария, 0,01 М раствор
Смесь металлфталеина с нафтоловым зеленым
Аммиак, концентрированный раствор.
Хлорид аммония, 1 М раствор (в некоторых случаях).
Этиловый спирт.
Ход определения. К каждым 100 мл нейтрального анализируемого раствора (кислые растворы нейтрализуют едким натром), содержащего 5 • 10-4—5 • 10-3 г-атом[л металла, приливают 0,3 мл индикатора, 5—10 мл аммиака и тотчас титруют, чтобы предотвратить выпадение осадка карбоната бария. Точку эквивалентности фиксируют по внезапному исчезновению красной окраски индикатора.
Если анализируемый раствор в точке эквивалентности все еще остается довольно сильно окрашенным в красный цвет, то понижают pH, прибавляя некоторое количество хлорида аммония. Затем приливают в небольшом избытке ЭДТА, прибавляют этиловый спирт (так, чтобы его содержание в растворе составляло около 50%) и обратно титруют избыток ЭДТА титрованным раствором соли бария. Добавление спирта способствует переходу серой окраски раствора в зеленоватую (в связи с присутствием нафтолового зеленого), которая в конечной точке обратного титрования очень резко переходит в красную.
Замечания. Изменение интенсивности окраски металлфталеина в ходе прямого титрования (в водной среде) представлено кривыми, изображенными на рис. 39, полученными комбинацией кривых, представленных на рис. 6 и 30. Ясно, что при этом титровании следует поддерживать точное значение pH =11. Уже при pH = 10,5 переход окраски становится размытым, а при pH = 11,5 интенсивность остаточной окраски составляет около 30% от первоначальной Добавление спирта заметно улучшает условия перехода окраски в точке эквивалентности. Спирт можно добавлять только при обратном титровании, так как иначе тотчас выпадает осадок ВаСОз-
11. БОР
Бор в виде борной кислоты, согласно Борхерту 159(54)], можно определить косвенным путем, осаждая его в форме боротартрата бария (BasB2Ci2H8O24 • Н2О) с последующим титрованием бария. В качестве осадителя используют раствор, содержащий 13 а ВаС12'2Н2О, 14 г винной кислоты и 240 г NH4C1 в 1 л. В мерную
182
колбу емкостью 100 м/ вливают около 10 мл анализируемого раствора, содержащего 0,1—3 мг В, раствор аммиака и доводят объем раствора до метки осаждающим раствором. Через 2 ч выпавший осадок отфильтровывают через сухой фильтр и 10 мл фильтрата разбавляют до 100 мл. В 25 мл полученного разбавленного раствора определяют избыток бария прямым титрованием 0,01 М раствором ЭДТА фталеинкомплексоном в сильноаммиачном растворе, содержащем 30% этилового спирта, или обратным титрованием избытка ЭДТА раствором соли магния с эриохромом черным Т. Содержание бария в осаждающем растворе определяют аналогичным образом, но анализируемый раствор заменяют дистиллированной водой. Этот метод применяют для определения бора в ваннах для термической обработки сталей.
12. АЛЮМИНИЙ
Алюминий можно определять как прямым, так и обратным комплексонометрическим титрованием; однако в обоих случаях следует принимать меры предосторожности, обусловленные своеобразным поведением алюминия. Алюминий характеризуется резко выраженной склонностью к образованию полиядерных гидроксо-комплексов, лишь очень медленно реагирующих с ЭДТА. Вэннинен и Рингбом [55(98)] предложили математическую формулу, показывающую, что концентрация ионов водорода, ниже которой можно практически не учитывать образования гидроксосоединений, зависит от концентрации алюминия. Эта предельная концентрация водородных ионов может быть приближенно вычислена по формуле:
[Н] = ]^10“8Са!
Следовательно, если принять CAi равной 10-2 М, то чтобы можно было пренебречь образованием гидроксокомплексов, титрование следует проводить при pH = 3,3. При этом pH значение схн для ЭДТА уже столь высоко, что эффективная константа устойчивости комплекса A1Y- равна лишь 106-7 и скачок рМ в точке эквивалентности титрования уже невелик. Фактически же при pH = 3 еще возможно прямое титрование А1, и получаются неожиданно хорошие результаты. При немного более низких значениях pH алюминий уже не поддается титрованию. Следует указать на то, что если величина эффективной константы устойчивости комплексоната алюминия составляет 106> 7, то трудно понять, почему титрование железа раствором ЭДТА при pH = 2 уже в присутствии умеренных количеств А1 дает отчетливо завышенные результаты. Такое несоответствие между теорией и практикой нуждается в объяснении.
Инертность А1 в реакциях комплексообразования является причиной того, что вначале мы обсуждаем только методы обратного титрования. Таких методов много, причем в них используются разнообразные индикаторы и титранты. Первое определение алюминия описывает Пршибил [51 (15)]; он проводил обратное
183
титрование ионами железа с потенциометрической индикацией точки эквивалентности. Этот же автор предложил одну из первых методик с визуальной индикацией [53(12)]. Она состоит в обратном титровании при pH = 10 избытка ЭДТА раствором соли цинка с эриохромом черным Т. Обратное титрование' проводят быстро и в холодных растворах, иначе А1 блокирует индикатор. Метод после разработки методов определения в кислой среде потерял свое значение. Проведение обратных титрований в кислых растворах отличается высокой селективностью; это значит, что по крайней мере кальций и магний, а иногда и марганец не мешают определениям.
Тер Хаар и Бацен [54 (104)], а также Чернихов [55 (51)] сообщают об обратном титровании на холоду при pH около 3,5 избытка ЭДТА титрованным раствором соли тория с ализарином S. Результаты первых авторов получаются приблизительно на 1 % заниженными, поэтому ими предложен эмпирический фактор, полученный стандартизацией по раствору А1. Этот метод был применен Флашкой и др. [53(22)] для определений микроколичеств; при содержании А1 менее 1 мг систематической ошибки не наблюдали. При микроопределениях обратное титрование проводят в кипящих растворах для того, чтобы А1 быстрее и полностью связывался в комплекс с ЭДТА. Реакция комплексообразования А1 с ЭДТА протекает не мгновенно, так что небольшие количества А1 некоторое время остаются в растворе, не связываясь в комплекс. Кипячение ускоряет реакцию, и, таким образом, комплексообразование завершается. Эту особенность впервые отметили Мильнер и Вудгэд [54 (91)], предложившие кипятить раствор в течение 2 мин перел тем как начинать обратное титрование (солью железа). Такая продолжительность кипячения во многих случаях, но не во всех, бывает вполне достаточной. Время кипячения раствора, необходимое для полного завершения комплексообразования А1, зависит от pH раствора, содержания примесей [62(87)], происхождения раствора и избыточного количества комплексона. Если содержание последнего довольно высоко (50% и выше), то комплексообразование протекает полностью в течение нескольких минут и без кипячения [55(64)]. Эти обстоятельства следует учитывать при использовании комплексонометрического титрования А1 в практическом анализе.
Далее, следует с самого начала избегать образования медленно реагирующих гидроксокомплексов. В довольно кислых растворах (рН<1) они, естественно, отсутствуют. Если же избыток кислоты нейтрализовать аммиаком, едким натром или каким-либо другим сильным основанием, неизбежно местное пересыщение раствора щелочью и образование гидроксосоединений алюминия, которые потом разрушаются очень медленно. Поэтому Флашка и Абдин [56(45)] рекомендуют сначала уменьшать кислотность раствора до значений pH приблизительно от 0 до 1. В таких условиях гидроксо-комплексы образуются лишь в умеренных количествах, а если ме
184
стами и образуются, то снова быстро распадаются. Конечное значение pH, при котором проводят титрование, устанавливают прибавлением буферного раствора, чем исключаются местные явления «перенейтрализации». Это особенно важно, когда обратное титрование проводят при высоких значениях pH. К кислому анализируемому раствору прибавляют щелочь всегда лишь после добавления ЭДТА.
В качестве раствора для обратного титрования рекомендуют раствор железа (III). Мильнер [54(91)] проводит обратное титрование с сульфосалициловой кислотой при pH = 6,5. Этот метод рекомендуют и другие авторы [60(160), 62(13)]. Брхачек [59(19)] в качестве индикатора использует салициловую кислоту. Переходы окраски и константы обоих индикаторов практически одинаковы, но сульфопроизводное имеет преимущество благодаря большей растворимости. Обратное титрование раствором железа возможно, кроме того, с 3-окси-нафтойной кислотой [61(44)], тиреном [59(9)], ацетилацетоном [62 (3)] и хромазуролом S [60 (122)].
Другим популярным титрантом, применяемым для обратного титрования, является раствор цинка. В"качестве индикаторов используют эриохромцианин R [53(43), 61(64)], ксиленоловый оранжевый [60(150), 61(131)], смесь гексацианоферратов (II) и (III) с диметилнафтидином [61(42), 55(67)], бензидин [51 (41)] или вари-аминовый синий [60(89)].
Последний индикатор был применен Вебером [56(106)] и в том случае, когда титрованный раствор цинка содержал небольшое количество меди. К анализируемому раствору прибавляют немного раствора, содержащего роданид-ионы, и фиксируют с помощью индикатора скачок потенциала в окислительно-восстановительной системе СцЯ/Си1. Смешанный раствор цинка и меди для обратного титрования имеет преимущество перед чистым раствором меди, так как сильно окрашенный комплекс CuY2- образуется лишь в малых концентрациях, благодаря чему изменение окраски в точке эквивалентности не искажается, что особенно важно при обратном титровании большого избытка ЭДТА.
В других методах обратное титрование проводят раствором свинца с ПАР в качестве индикатора [59(79)], раствором меди с кальцеином W [59(9)] и цинка с эриохромом черным Т при pH = 7 в охлажденном до 10° С растворе [58(5)]. Банья и Эрдей [60(150)] обратно титруют раствором соли ртути и применяют дифенилкарбазид в качестве индикатора; точка эквивалентности при этом оказывается исключительно размытой и запаздывает. Однако, если добавить, согласно Пршибилу, немного о-фенантролина, переход окраски наступает моментально и точно в точке эквивалентности. Механизм этой каталитической реакции нуждается в более подробном изучении.
Особенно интересен метод Вэннинена и Рингбома [55 (98)], который широко применяется для многих практических анализов. ЭДТА титруюг раствором цинка при pH = 4,5 с дитизоном в качестве
185
индикатора в растворе, содержащем около 50% этанола и ацетатную буферную смесь. Точка эквивалентности исключительно резкая. Авторы предложили полную математическую обработку результатов титрования. Многие исследователи сообщают о дополнительном изучении этого метода и сравнении его с другими методами комплексонометрического титрования [60(110), 62(7), 62(9)]. Готтшалк [60(127)] на основе статистических подсчетов указывает, что капельная ошибка составляет около 0,05 мл при титровании 0,1—0,001 М растворами. Добавление спирта необходимо, чтобы удержать в растворе индикатор и его комплекс с цинком; кроме того, автор считает, что спирт обладает способностью повышать устойчивость комплекса A1Y- на 2—4 порядка.
Особым вниманием в последнее время пользуются методы прямого титрования. Один из подобных методов с резкой точкой эквивалентности предлагают Флашка и Абдин [56(45)]. Они проводят титрование в кипящем сильноуксуснокислом растворе с pH = 3 и CuY — ПАН в качестве индикатора. Сообщается о проверке метода и о его практическом применении [62(34)]. Тихонов [62(88)] обнаружил некоторую тенденцию метода к заниженным результатам и предложил устанавливать раствор ЭДТА по стандартному раствору А1, если необходима большая точность определений. Ива-мото [61(66)] отмечает, что винная кислота при титровании не мешает и даже создает благоприятные условия, препятствуя заметному образованию гидроксосоединений. Титрование проводят в кипящем растворе при pH = 3,7, причем в качестве индикатора вместо ПАН используют, благодаря лучшей растворимости, ПАР. Тейс [55(26)] и Пауль [56(28)] описывают прямое титрование с хромазуролом S в ацетатной буферной среде с pH = 4, однако точка эквивалентности достигается медленно и бывает нерезкой, отчего Тейс предпочитает проводить обратное титрование раствором соли алюминия. В аналогичных условиях, согласно Тэйлору [55(8)], проводят определение с применением гематоксилина в качестве индикатора. Автор избегает трудностей, связанных с нечеткой точкой эквивалентности, титруя известное количество комплексона анализируемым раствором. Неудобство этого метода очевидно. В короткой заметке Кунду [61(2)] указывает на возможность проведения титрования AI с алюминоном в кипящем растворе при рН=4,4. Кристиансен [61 (44)] применяет флуоресцентную индикацию точки эквивалентности. В глициновом буферном растворе с pH = 3 в ультрафиолетовых лучах А1 дает с 3-оксинафтойной кислотой синюю флуоресценцию, которая в точке эквивалентности переходит в зеленую. Необходимо подогревать раствор до 50° С, чтобы ускорить переход окраски.
Алюминий мешает определению других катионов, во-первых, потому, что он титруется одновременно с ними, а во-вторых, он может блокировать индикатор. Возможности маскирования алюминия изучали Пршибил с сотр. Триэтаноламин [53(11), 54(76)] маскирует А1 в щелочном растворе, препятствуя реакции его с
186
ЭДТА, но не может помешать блокированию эриохрома черного Т при продолжительном стоянии раствора. Поэтому целесообразнее титрование проводить быстро и лучше всего в охлажденном до 15° С растворе. Впрочем, в сильнощелочной среде, например при титровании кальция, А1 маскируется, переходя в алюминат, и не мешает, если применяют индикатор, который не блокируется. Особенный интерес представляет маскирование А1 фторид-ионами [54(74)] с образованием [A1F6]3“-hohob. Согласно последним исследованиям [62(87)], можно отказаться от предписанного вначале кипячения раствора. Полного маскирования алюминия по отношению к ЭДТА можно достигнуть на холоду, если к раствору прибавлен пяти- или шестикратный избыток фторид-ионов. Маскирование фторид-ионами важно не только для предотвращения помех со стороны алюминия, но имеет особое значение и с точки зрения селективного определения этого металла. В кипящем растворе фто-рид-ионы связывают алюминий, уже связанный с ЭДТА. Это открывает возможность сначала прибавлять к анализируемому раствору ЭДТА и избыток последней оттитровывать обратно, причем происходит связывание в комплекс всех катионов, способных к комплексообразованию. Потом вводят фторид-ионы и кипятят раствор, при этом освобождается связанная с алюминием ЭДТА, которую можно оттитровать. Конечно, ионы других металлов, реагирующие с фторид-ионами, должны отсутствовать. Этот метод применил Сайо [54(41)]; для обратного титрования он использовал раствор цинка со смешанным индикатором, состоящим из гексацианоферратов (II) и (III) и бензидина. Фурлани [60(158)] провел в тех же условиях определение с потенциометрической индикацией точки эквивалентности. Фторидный метод был подробно изучен Циммерманом и др. [58 (5)], в особенности с точки зрения внедрения его в аналитическую практику. Титрование выделившейся в свободном состоянии ЭДТА выполнялось раствором цинка с эриохромом черным Т при pH = 7 в охлажденном до 10° С растворе.
Замаскировать А! можно также с помощью сульфосалициловой кислоты, если титруют торий при pH = 1,6 [60(70)] или редкоземельные металлы при pH = 7—8 [62(89)] с арсеназо в качестве индикатора. Сьерра [62(15)] при определении цинка с эриохромом черным Т в растворе с pH = 7 маскирует А1 тартрат-ионами. Сайо в короткой заметке указывает на возможность маскирования алюминия пирофосфат-ионами [56(98)]. Об интересном способе маскирования алюминия сообщают Галаш и др. [61 (64)],,которые применяли для этой же цели кремнекислый натрий при определении магния в сплаве электрон. Содержание Mg определяют обратным титрованием избытка ЭДТА раствором цинка или титрованием Mg в щелочной среде с эриохромцианином R. При таком маскировании часто образуется нерастворимый силикат алюминия.
Пршибил и др. указывают на преимущества замены ЭДТА комплексоном ДЦТА [55(90), 62(87)]. Эти исследования важны не
187
столько для определения алюминия в чистых растворах, сколько для анализа смеси Fe—Al—Ti.
Особенное значение в аналитической практике имеет часто встречающееся в различных комбинациях определение Fe и А1 в их смеси. Как уже сообщалось, исходя из величин констант об разевания соответствующих комплексов, следует ожидать, что последовательное титрование возможно без затруднений на следующей основе: в сильнокислом растворе сначала титруют Fe, затем повышают pH раствора и определяют AI. Это возможно в том случае, если присутствует вспомогательное комплексообразующее вещество и подобраны определенные индикаторы. Вспомогательное комплексообразующее вещество может одновременно служить индикатором. Например, Бегельфер [62 (13}] сообщает, что в присутствии большого количества сульфосалициловой кислоты можно сначала оттитровать Fe при pH = 2—3, затем прибавить ЭДТА, повысить pH до значения 4—4,5, прокипятить раствор и после охлаждения обратно оттитровать избыток ЭДТА стандартным раствором соли железа. Вебер [57(6)] вначале титрует Fe с сульфосалициловой кислотой, а затем определяет А1 обратным титрованием избытка НТА раствором меди с Биндшедлера зеленым. Согласно Вакамацу [60(169)], можно определять Fe с сульфосалициловой кислотой, а А1 — обратным титрованием ЭДТА раствором меди с индикатором ПАН. Кристиансен [61 (44)] сначала титрует Fe при pH = 2 до перехода синей окраски 3-оксинафтонной кислоты в желтую, затем продолжает титрование при рН=4—5 в ультрафиолетовых лучах до изменения флуоресценции от синей к зеленой.
О последовательном титровании смеси А1—Сг сообщает Фур-лани [60(158)]. Сначала он определяет А1 обратным титрованием раствором цинка в присутствии гексацианоферратов (II) и (III), применяя потенциометрическую индикацию точки эквивалентности. Затем при кипячении хром связывают с ЭДТА и после охлаждения обратно титруют избыток комплексона. Литеану и др. [59(90)] проводят определения аналогичным образом, одн'ако для обратного титрования применяют раствор железа с визуальной индикацией конечной точки по тирону. Об определении всех трех компонентов смеси Fe—Al—Сг с применением анализа в аликвотных порциях и по разности сообщают Пашак и Допплер [57 (29)].
Лишь коротко сообщается о возможности замаскировать о-фе-нантролином другие металлы при определении А1 [59(23)]. Высокая цена реактива не позволяет проводить практические анализы, если требуется ’ обработать большие количества анализируемого раствора.
Инструментальную индикацию точки эквивалентности при определениях А! применяют Пршибил и др. [51(15)], которые потенциометрически титруют избыток ЭДТА раствором железа Пашак и Допплер [57(29)] использовали этот метод для анализа смеси Fe—Сг—А1. Сайо в короткой заметке [54(41)] отмечает, что точку эквивалентности можно зафиксировать потенциометрически при об
188
ратном титровании избытка ЭДТА раствором цинка с гексацианоферратами (II) и (III) в качестве индикатора; более обстоятельно этот способ был изучен Фурлани [60(158)]. Амперометрическую индикацию точки эквивалентности с помощью вращающегося платинового электрода при обратном титровании раствором соли железа использовал Бабенышев [60(151)], а Гольдштейн и др. [63(13)] фиксировали точку эквивалентности при обратном титровании избытка ЭДТА стандартным раствором ванадил-ионов при помощи стационарного электрода из платиновой фольги.
Согласно Рингбому [53(57)], можно пользоваться фотометрическим методом, в котором избыток ЭДТА оттитровывают обратно раствором меди в присутствии мурексида при pH =• 5. Элофсон [61(149)] получил отличные результаты, применяя для обратного титрования раствор цинка с хромазуролом S. Вэллраф [61 (42)] определяет А1 фторидным методом в присутствии других металлов. Выделившуюся в свободном состоянии ЭДТА он титрует раствором цинка со смешанным индикатором, состоящим из гексацианоферратов (II) и (III) и диметилнафтидина.
Комплексонометрическое определение А1 находит исключительно разнообразное практическое применение. Во многих случаях, для того чтобы достигнуть разделения металлов, пользуются осаждением, экстракцией или процессами ионного обмена. Ниже приведены некоторые примеры практического применения комплексонометрического определения алюминия: его определяют в фармацевтических препаратах [53(12)], в алюмоацетатных квасцах DAB VIII, в шлаках [55(51), 55(96), 61(77)], глинах [63(42)], ката-лизаторных массах [60(139)], в растворах алюминатов [60(160)], в криолите [58(75)], ферросилиции [59(19)], рудах [61(45)]; цементе [61(42)], в сточных водах каменноугольных разработок [61(174)], циркониевом песке [61(45)], силикатах [55(51), 55(81), 55(96)]. Существуют разнообразные методики определения AJ в сплавах [54(91), 55(78), 59(9)], особенно в магниевых [60(151)] и цинковых сплавах [61(175)1, а также в сплаве электрон [61(64)]; в тугоплавких металлах [59 (103)], латуни, бронзе [55 (3)] и стали [62 (34)].
Прямое определение алюминия со смешанным индикатором CuY — ПАН
Реактивы
ЭДТА, 0,01 М раствор.
Комплекс меди с ЭДТА, раствор (см. стр. 151).
ПАН.
Бромфеноловый синий, 0.1%-ный спиртовый раствор.
Аммиак, концентрированный раствор.
Ацетат аммония, 10%-ный раствор.
Уксусная кислота.
Ход определения. К кислому анализируемому раствору добавляют аммиак до pH между 0 и 1 (по индикаторной бумаге) Затем приливают каплю бромфенолового синего и, добавляя ацетат аммония, доводят окраску раствора до сине-серой, после чего быстро
189
приливают 5 мл концентрированной уксусной кислоты; pH раствора должен составлять приблизительно 3 (по индикаторной бумаге или pH-метру), если необходимо, его корректируют с помощью уксусной кислоты или ацетата аммония. После приливания нескольких капель комплексоната меди и индикатора ПАН (до появления глубокой фиолетовой окраски) раствор нагревают до кипения. Далее проводят титрование, причем-раствор поддерживают все время в состоянии, близком к кипению. Около точки эквивалентности окраска индикатора переходит в желтую, так как ЭДТА быстрее реагирует с Си — ПАН, чем с А1, однако фиолетовая окраска снова быстро возвращается. Восстановление окраски индикатора замедляется около точки эквивалентности, поэтому необходимо прибавлять титрант по каплям. Точку эквивалентности считают достигнутой, когда желтая окраска раствора остается неизменной после кипячения в течение полминуты. Для предосторожности кипятят еще одну минуту, причем иногда появляется еще слабый красный оттенок, который исчезает при прибавлении последней капли ЭДТА.
Замечания. Если присутствуют большие количества А1, для титрования применяют 0,1 М раствор ЭДТА. Все присутствующее в растворе железо титруется совместно с А1, так что метод можно использовать для суммарного определения Fe и AL Если содержание железа велико, то рекомендуется предварительно приблизительно оттитровать Fe с сульфосалициловой кислотой, так как уже при pH =8 3 при нагревании оно может гидролизоваться (коричневый налет на перегретых местах на стенках сосуда). Определению не мешают щелочноземельные металлы и Mg; Ti выпадает в осадок в результате гидролиза и не мешает, несмотря на то, что очень большие его количества увлекают с собой немного А1; Мп в количестве 20—30 мг в 150 мл не мешает.
Определение алюминйя обратным титрованием раствором хлорида железа (Ш) с салициловой кислотой
Реактивы
ЭДТА, 0,1 М раствор.
Хлорид железа (III), 0,1 М раствор.
Салициловая кислота, кристаллическая.
Соляная кислота, приблизительно 1 М раствор Аммиак, приблизительно 1 М раствор.
Ацетат натрия, 1 М раствор.
Ход определения. Осадок алюминия [например А1(ОН)з, осаждением которого А1 отделяют от сопутствующих металлов] с содержанием металла 30—50 мг растворяют в небольшом объеме соляной кислоты и приливают в небольшом избытке ЭДТА В смеси устанавливают значение pH ~ 6 прибавлением по каплям раствора аммиака (контролируемым по бумаге, пропитанной метиловым красным, капельной пробой). Затем растворы быстро кипятят,
190
по охлаждении разбавляют по меньшей мере до 100 мл и прибавляют 3 мл раствора ацетата натрия. Теперь pH смеси должен быть около 6—6,5. Далее добавляют 0.2 г кристаллического индикатора, растворяют его и титруют стандартным раствором FeCl3 до появления красно-коричневой окраски, устойчивой в течение короткого времени. В ходе титрования значение pH раствора не должно быть ниже 5. Чтобы избежать понижения pH, необходимо к раствору прибавить несколько капель аммиака.
Замечания. Комплексонат железа значительно устойчивее соответствующего комплексоната алюминия (см. табл. 2). Поэтому после достижения точки эквивалентности при обратном титровании происходит следующая реакция:
A1Y~ + Fe3+ —> FeY~ + Al3+
Однако она протекает медленно, так что в точке эквивалентности обеспечивается достаточно высокая для реакции с индикатором концентрация ионов железа. При стоянии, и быстрее—при нагревании оттитрованного раствора коричневая окраска салицилата железа снова бледнеет. Значение pH в точке эквивалентности должно сохраняться в „узких пределах. Если pH слишком высок, салициловая кислота не реагирует с Ее3+-ионами, так как ОН-- и ацетат-ионы начинают конкурировать с индикатором [образуя Fe(OH)2+- и Ее2(ОН)24+-ионы и ацетатные комплексы железа] Если, с другой стороны, значение pH слишком низко, то приведенная выше реакция ускоряется и, таким образом, прибавляемое железо лишь вытесняет алюминий из его комплексоната.
Как и при всех комплексонометрических титрованиях с применением железа (III) и фенольных индикаторов, точность этого метода составляет лишь около 1%. Употребление очень разбавленных растворов не рекомендуется.
Определение алюминия обратным титрованием раствором сульфата цинка с дитизоном
Реактивы
ЭДТА, 0,05 М раствор.
Сульфат цинка, 0,05 М раствор.
Буферный раствор, содержащий 1 моль ацетата аммония и 1 моль уксусной кислоты в 1 л.
Дитизон, спиртовый раствор.
Ход определения. К анализируемому раствору, содержащему 5—15 мг А1 в 50 мл, приливают в избытке ЭДТА и доводят pH раствора до 4,5 с помощью буферной смеси. Затем быстро кипятят, снова охлаждают и почти удваивают объем добавлением спирта. Затем прибавляют 2 мл индикатора на каждые 100 мл раствора и проводят обратное титрование раствором ZnSO4. В точке эквивалентности зеленовато-фиолетовая окраска очень резко переходит в красную.
191
с
Замечания. Прибавление спирта необходимо, так как дитизон нерастворим в воде; кроме того, спирт улучшает процесс титрования, повышая устойчивость A1Y- по сравнению с ZnY2-. В точке эквивалентности pZn равен 7—8. Если буферный раствор добавить до введения ЭДТА, то можно получить заниженные результаты, в особенности если пренебречь кипячением раствора, так как образуются многоядерные гидроксокомплексы алйУминия, которые затем не полностью разлагаются раствором ЭДТА.
13. СКАНДИЙ
Вюнш [55(91)] применил для определения Sc предложенную Флашкой (см. ниже) для определения редкоземельных металлов методику прямого титрования с эриохромом черным Т в тартратном растворе с pH = 10 и нашел, что проводить титрование нельзя, так как индикатор блокируется. Однако титрование возможно, если к раствору, содержащему яблочную кислоту, прибавить буферную смесь, состоящую из 1 М раствора NH4OH и 1 М раствора NH4CI, до pH = 7,5—8 (ниже pH = 7,5 образуется красная протонированная форма свободного эриохрома черного Т, выше pH = 8 происходит блокирование индикатора). Яблочную кислоту необходимо прибавлять для того, чтобы избежать осаждения Sc в виде гидроокиси. Понижение pH раствора приводит, таким образом, к более благоприятному соотношению эффективных констант устойчивости комплексов металла с индикатором и с комплексоном. Аналогичного результата можно достигнуть и при pH = 10, если прибавить органический растворитель. Например, в 50%-ном этанольно-водном растворе реакция между 5с3+-ионами, эриохромом черным Т и ЭДТА протекает обратимо, и можно оттитровать избыток ЭДТА стандартным раствором соли магния [61(12)]; о комплексе скандия с эриохромом черным Т см. статью Вюнша [61 (12)].
Более удобным благодаря его селективности является титрование в кислой среде. Киннунен [57(137)] титрует 5с3+-ионы при pH = 3—4 раствором ЭДТА с ксиленоловым оранжевым. Ченг [55(20)] сообщает об образовании окрашенного комплекса Sc с ПАН. Комплекс устойчив в интервале pH между 1,5 и 4, однако при прямом титровании точка эквивалентности бывает нечеткой. Поэтому предпочитают проводить обратное титрование избытка ЭДТА раствором меди с ПАН (стр. 54), так как при этом получается исключительно резкая точка эквивалентности. При прямом титровании также наблюдается резкая точка эквивалентности, если для ее индикации применяют систему CuY — ПАН (см. стр. 256).
Согласно Фритцу [59(96), можно весьма селективно оттитровать Sc, если вместо визуальной индикации с комплексообразующим индикатором применить фотометрическую индикацию точки эквивалентности с медью в качестве индикатора по наклону кривой титрования (см. стр. 99). Титрование проводят при рН = 2,7 и длине волны 745 нм. Сначала — при связывании скандия в ком
492
плекс — изменения светопоглощенйя не происходит, но при переходе через точку эквивалентности кривая титрования резко поднимется вверх, так как образуется сильно поглощающий комплексонат меди CuY. Титрованию мешают ионы металлов, имеющих высокие константы устойчивости их ком плексон атов (например, Fe111, Bi, Th, Zr и др.), однако многие другие ионы металлов, присутствующие в растворе, не мешают. Скандий, например, можно определять со средней ошибкой около ±0,5% в присутствии следующих ионов металлов (числа в скобках означают допустимый избыток постороннего металла): Y(60), La(20), Сеш(40), Nd(40), Sm(50), Dy(50), Yb(10), Lu(40), Al(30), Co(40), Cd(40), Pb(15), UO2+(70).
Щелочноземельные металлы не мешают, даже если присутствуют в больших концентрациях. Железо(Ш) следует восстановить до железа (II) реакцией с восстановленным свинцом. Вследствие протекающего в процессе титрования обратного окисления соотношение Sc : Fe11 =1:1 наиболее приемлемо. Не изучена возможность удаления кислорода воздуха с помощью азота или другого инертного газа. Было испытано применение в качестве восстановителя аскорбиновой кислоты. Однако ее количество должно быть строго ограниченным, так как в случае ее избытка восстанавливается медь, применяющаяся в качестве индикатора. Из обычных анионов не мешают хлорид-, перхлорат-, нитрат- и аце-тат-ионы. Мешает сульфат-ион, если его концентрация в растворе превышает 0,1 М. Сообщается о методах обратного титрования в щелочной среде раствором соли ртути (потенциометрический метод) [62(120)] и раствором соли никеля с мурексидом [62(6)].
14. ИТТРИЙ И ЛАНТАНОИДЫ
Впервые о прямом титровании редкоземельных металлов сообщил Флашка [55(65)]. Титрование с эриохромом черным Т проводят при pH = 8—9 в кипящем растворе, содержащем тартрат-ионы; pH раствора не должен быть выше 9, так как иначе комплексы индикатора с металлами оказываются настолько прочными, что не разрушаются под действием ЭДТА. Прибавление тартрат-ионов необходимо для предотвращения выпадения гидроокисей металлов, а кипячение ускоряет реакцию. Этот метод был применен для определения микроколичеств Y, Sm, Рг и Gd. Основываясь на аналогии в химическом поведении и на сравнительной близости значений констант устойчивости комплексов редкоземельных металлов, можно предсказать, что и другие представители этой группы металлов будут вести себя аналогично. Действительно, практически все трехвалентные ионы редкоземельных металлов, за исключением прометия, можно титровать комплексонометрически. Определениям мешает CeIV, но его можно легко восстановить аскорбиновой кислотой. Вряд ли стоит сомневаться в том, что и Pm тоже можно определять комплексонометрически. Константа устойчивости
13 Зак. 553
193
его комплекса с ЭДТА в интервале pH от 1,8 до 9, согласно утверждению Бруно и Барбиере [61(123)], равна 1,5-1016 (25°С), а его комплекс имеет состав PmY-. Прямое титрование редкоземельных металлов в щелочном растворе (пиридиновый буферный раствор) можно проводить также, используя в качестве индикатора хром-азурол S, это было проверено на примере лантана и церия [59 (14)].
С тех пор как были найдены новые индикаторы, стало возможным титровать редкоземельные металлы и в кислой среде, что обусловило более высокую избирательность определений, так как в этих условиях Mg и щелочноземельные металлы, а в некоторых случаях и Мп не мешают. При подобных титрованиях в качестве индикаторов можно использовать бромпирогалловый красный [56(88)] и ксиленоловый оранжевый [57(147), 8(113), 59(24), 62(91)] в растворах, содержащих ацетатный или уротропиновый буферный раствор. Можно также применять карминовую кислоту [58(79)] при pH = 3,7, галлеин [62(30)] в уротропиновом растворе, ализариновый S в растворе с pH — 4 [56(59)] в смеси с метиленовым синим; при том же pH очень хорошо себя зарекомендовал пирокатехиновый зеленый [60(187)]. Азоксин S [61 (112)] служит для индикации точки эквивалентности при pH = 6. Сообщается об исключительных результатах при титрованиях с арсенази г58(61)]. В общих случаях определяют сумму редкоземельных мет . тлов в растворе с pH не ниже 4,5. При определении отдельных редкэземельных элементов оптимальными являются другие значения pH, как это отмечают Гимези и др. [62(90)]. При определении Сеш рекомендуют pH = 6, лантана — pH = 4,5, тогда как иттрий и эрбий можно титровать еще при pH = 3. Сравнительным исследованием методов прямого титрования занимались Лиль и Раман [63(49)].
Сообщается также о методах обратного титрования. Флашка [55(65)] обратно титрует избыток ЭДТА раствором соли цинка при pH = 8—9 с эриохромом черным Т или при pH = 5 со смешанным индикатором, содержащим гексацианоферраты(II) и (III) и диме-тилнафтидин. Ченг [58(64)] титрует раствором соли меди с ПАН при pH = 3. Такамото [55(103)] предлагает проводить обратное титрование раствором соли кобальта в 50%-ной ацетоно-водной смеси, содержащей ацетат- и роданид-ионы. Можно проводить обратное титрование ЭДТА раствором соли никеля с мурексидом в аммиачном растворе [62(6)]. Мисуми [59(87)] рекомендует для обратного титрования раствор Mg с эриохромом черным Т и применяет этот метод для определения редкоземельных металлов после их осаждения в виде оксалатов и растворения осадка в щелочном растворе ЭДТА [63(50)]. При pH = 5 можно определять лантан в виде дибутилфосфатной соли путем обратного титрования стандартным раствором соли лантана с ксиленоловым оранжевым [63(15)]. Можно также проводить обратное титрование раствором соли лантана с арсеназо при pH = 8—9 [62(127)].
Из электрохимических методов высокочастотное [56(59)] и амперометрическое [60(7)] титрование применяют для титрования Ен 194
раствором ДТПА при pH=5 и потенциале 0,85 в (Нас. КЭ). Получил распространение фотометрический метод с применением, например, арсеназо в качестве индикатора. Метод очень чувствителен и весьма пригоден для микроопределений [61 (54), 62(19)]. Лэйн и Фритц [57(25)] указывают, что даже 7,5 • 10“7 М растворы Nd удовлетворительно титруются 10~5 М раствором ЭДТА. Ефимов [60(130)] проводил фотометрическое титрование Ег и суммы редкоземельных металлов с ПАР при длине волны 504 нм и pH = 8. Крауш [59(137)] определял с ксиленоловым оранжевым в ацетатном растворе с pH = 5,8 и длине волны 580 нм Се, Pr, Nd, Sm и Gd и при pH = 5,2 — La. Брил и др. [59(95)] применили фотометрическое титрование с ализарином S (при 520 нм) для определения редкоземельных металлов из iруппы церия и европия; они отмечают также возможность проведения обратного титрования раствором лантана.
Особенное внимание было обращено на последовательное титрование тория с редкоземельными металлами. Чернихов [60(70)] сначала при pH = 1,5—2,5 определял Th титрованием с ксиленоловым оранжевым, затем он повышал pH раствора добавлением к нему уротропина и продолжал титрование для определения редкоземельных металлов. Метод пригоден при соотношении Th : редкоземельные металлы = 70. Небольшие количества Fe удаляют восстановлением аскорбиновой кислотой, А1 можно замаскировать сульфосалициловой кислотой; Мп титруется совместно с редкими землями. Чернихов указывает на невозможность использовать арсеназо в качестве индикатора при титровании редкоземельных металлов после титрования тория, так как индикатор блокируется при том pH раствора, при котором титруют редкоземельные металлы, несмотря на то, что Th связан с ЭДТА. Блокирования можно избежать, если, как предлагает Кутейников [62(89)], провести «двойное маскирование», прибавив еще сульфосалициловую кислоту. Сочетание ЭДТА с сульфосалициловой кислотой полностью препятствует реакции между Th и арсеназо в области pH = 1—6 и 9—10 и частично препятствует при pH = 6—9. Таким образом, редкоземельные металлы можно титровать при pH — 5. Другое достоинство сульфосалициловой кислоты состоит в ее способности замаскировать А1 в количестве До 1,5 мг]мл. Аскорбиновая кислота маскирует до 2 ла Fe в 50 мл.
Последовательное фотометрическое титрование микрограммо-вых количеств Th и редкоземельных металлов описывает Пешкова с сотр. [62(19)]. В качестве индикатора используют арсеназо, который должен присутствовать в растворе по крайней мере в эквивалентном количестве по отношению к Th. Титрование последнего проводят при pH = 2. В заключение титруют редкоземельные металлы в уротропиновом буферном растворе. Поскольку индикатор находится в растворе в большом избытке, весьма странно, что не упомянуто о блокировании его при титровании с визуальным установлением конечной то^ки. Оносова титрует [62 (6)] Th в кислом
>3* 195
растворе с пирокатехиновым фиолетовым, а затем определяет редкоземельные металлы обратным титрованием избытка ЭДТА раствором никеля с мурексидом в аммиачном растворе. Брилл и др. [59(95)] описывают последовательное титрование с фотометрической индикацией точки эквивалентности с применением ализари-
на S в качестве индикатора; Th они титруют при pH = 2,8, затем прибавляют ЭДТА и ацетатный буферный раствор, доводя pH раствора до значения 3,7, и нагревают до 85° С. После этого избыток ЭДТА титруют обратно раствором лантана.
Мильнер и Эдвардс [58(113)] сообщают о возможности последовательного титрования смеси Bi—Nd или Рг; Bi определяют при pH = 2 с ксиленоловым оранжевым, а редкоземельный металл при pH = 6.
Титрованию редкоземельных металлов мешают ионы многих металлов. В кислой среде при pH от 5 до 6 Mg и щелочноземельные металлы почти не мешают. Помехи, вызванные присутствием Мп, зависят от pH раствора, концентрации Мп и примененного индикатора. Небольшие количества железа можно замаскировать, восстановив его аскорбиновой кислотой [62(89)] или солянокислым гидроксиламином [59(95)]; А1 маскируют с помощью сульфосалициловой кислоты [58(61), 62(89)]. Фритц отмечает [58(61)], что удвоенный по сравнению с содержанием редкоземельных металлов избыток UVI не оказывает влияния на определение этих металлов; Hg можно замаскировать иодид-ионами, a Zn, Cd, Hg и Pb — диэтилдитиокарбаматом и тиомочевиной.
Определение редкоземельных металлов и ЭДТА в одном растворе очень важно с точки зрения использования метода ионного обмена (в промышленности и исследовательских лабораториях). Мартыненко [58(114)] проводит осаждение редкоземельных металлов в виде оксалатов и определяет их гравиметрически после озоления до окислов; в другой аликвотной порции титрует не связанную с металлом ЭДТА и вычисляет общее содержание комплексона на основе результатов обеих операций. Терехин и Тананаев [62(91)] решают эту проблему исключительно изящным способом. В нагретом до 60—70 °C растворе при pH = 2 они проводят титрование ЭДТА раствором Fe с сульфосалициловой кислотой. При этом редкоземельные металлы полностью вытесняются из их комплексов, и авторы определяют общее содержание ЭДТА. К оттитрованному раствору прибавляют уротропин и вытесненные из комплексов редкоземельные металлы определяют титрованием раствором ЭДТА с ксиленоловым оранжевым.
Иногда интересно узнать средний атомный вес смеси редкоземельных металлов. Это можно просто и довольно точно сделать по методу, предложенному Флашкой [55 (65)]: смесь окислов металлов взвешивают, растворяют и затем титруют раствором ЭДТА. Рассчитывают по формуле: А + 24=100G/V, где A, G, V означают, соответственно, средний атомный вес, количество окислов в миллиграммах и объем 0,0100 М раствора ЭДТА в миллилитрах. Если
196
в растворе присутствуют большие количества иттрия, то, как предлагает Патровски [59(24)], можно определить содержание иттрия, имеющего более низкий атомный вес, непосредственно по среднему атомному весу смеси редкоземельных металлов.
Практическое применение комплексонометрическое титрование находит при определении редкоземельных металлов в монацитовом песке и технических полупродуктах [59(95), 62(19)], в сплавах Bi—U—Nd [58(113)] и продуктах радиактивного распада [62(127)].
15. ПЛУТОНИЙ
Изучение реакции комплексообразования между Ри и ЭДТА затруднено тем, что Ри может находиться в различных валентных состояниях, в которых ему присуща повышенная склонность к гидролизу; вследствие этого, кроме нормальных комплексов в молярном отношении 1:1, могут получаться соединения состава 1 :2. Кабанова и др. [60 (10)] сообщают о способности PuIV восстанавливаться до Puv в растворе ЭДТА при рН = 3—5 с образованием комплекса в отношении 1:1; 1 моль ЭДТА восстанавливает 6 г-ион РиОг+. При большом избытке ЭДТА в растворе реакция медленно проходит дальше до образования Puiv. Гельман [59 (92)] вычислила константу устойчивости комплекса ЭДТА с Puv, присутствующим в виде плутонил-иона (1g К = 10,2), исследуя ионообменное равновесие при pH = 4—5. По аналогичному методу Формэн и Смит [57(130а)] получили более высокое значение константы — 1g К = 16,4 (в 0,1 М растворе КС1). Кабанова [61(18)] приводит значение 1g К—12,9 (в 0,1 М растворе КС1) и отмечает, что кроме нормального комплекса присутствует еще комплекс состава 1 :2.
Для Ри1П и PuIV значения 1g К, согласно Метцу [57 (64)], лежат между 16 и 26. Формэн и Смит [57(130а)] вычислили константы устойчивости из констант обменного равновесия на ионите при 20° С в 0,1 М растворе КС1 и нашли, что 1g К = 18,1 и 17,7 (значение для PuIV вычислено для гидролизованных ионов металла). Дальнейшие исследования по комплексообразованию авторы [57(130 6)] проводили спектрофотометрическим методом в 1 н. растворе азотной кислоты, в котором PuIV совершенно не гидролизуется. Они получили для lg KPulv значение 24,2. При расчетах не было учтено, что в столь кислых растворах ЭДГА образует протонированные комплексы HSY+ и H6Y2+. Клыгин с сотр. [59(126)], определив константы устойчивости протонированных комплексов, пересчитали константу устойчивости комплекса PuIVY и получили значение 1g К = 26,1.
Комплексонометрическое определение Риш (без определения константы устойчивости) впервые провел Мильнер [56(75)] при pH = 2,5 (pH контролируют в процессе всего титрования, и если требуется, регулируют его, применяя обратное титрование избытка ЭДТА раствором соли тория). Для индикации точки эквивалентности используют смешанный индикатор — ализарин S и метиленовую
197
синюю. Раствор Ри1П готовят растворением металлического плутония в соляной кислоте. Исключительно резкую точку эквивалентности получают при работе со свежими сильно разбавленными растворами. Напротив, состарившиеся растворы дают нечеткое изменение окраски; с раствором трехнедельной давности получается совершенно непригодный цветовой эффект. Прибавление метиленовой синей не является безусловно необходимым, но полезно для того, чтобы всегда получался одинаковый переход зеленой окраски в пурпуровую, так как из-за синей окраски раствора Ри1П конечная окраска в точке эквивалентности, получаемая с одним только ализарином, изменяется в зависимости от содержания плутония.
Палей [60(58)] титрует PuIV с арсеназо в сильнокислой среде (в 0,1—0,2 Л4 растворе НС1 или HNO3). Определение селективно, и примеси La, UO22+, Pb, Сгш и Ni не мешают. Даже Fein не мешает, если его содержание составляет менее 4% от содержания Ри.
Определение Pu с CuY — ПАН или ксиленоловым оранжевым в качестве индикатора описывают Браун и др. [63(6)]. Согласно авторам, можно поступать следующим образом. Сначала проводят обратное титрование избытка ЭДТА раствором меди с ПАН, далее прибавляют фторид-ионы и выделившееся эквивалентное по отношению к плутонию количество ЭДТА снова титруют раствором меди.
Содержание Ри в топливе для реактора Боаз с сотр. [62(65)] определяют комплексонометрическим титрованием, причем избыток ЭДТА они обратно титруют фотометрически раствором цинка с дитизоном.
16. ТИТАН
Впервые комплексообразование титана с ЭДТА изучили полярографически Блумер и Кольтгоф [52(11)]. При pH = 2,5 их соотношения вполне наглядны, полярографические волны полностью обратимы. Авторы предположили, что в растворе присутствуют комплексы TiIVY и TiinY, и вычислили их константы устойчивости. Пецсок и Маверик [54(96)] сообщают о расширенном полярографическом исследовании. При pH = 2 потенциал полуволны (равный— 0,22 в относительно ^1ас. КЭ) не зависит от pH, и реакция соответствует уравнению: TiY + e^*TiY~. При pH немного выше 2,5 условия более сложные, так как наступает гидролиз титана; гидролиз иногда продолжается до образования осадка, которое обнаруживается по опалесценции раствора. Логарифм константы устойчивости комплекса TiinY равен 21,3. Для комплекса TiIVY Нельзя вычислить константу, так как комплекс находится в равновесии не с Ti4+-, а с ТЮ2+-ионами. Константа равновесия реакции TiY + H2O^±TiO2+ 4- 2НТ + Y4+ имеет величину 3- 10-23. Безусловно, в растворе присутствует также комплекс титанил — ЭДТА (TiOY2-), для которого IgA = 17,3,
198
Явление гидролиза и медленное протекание реакции комплексообразования являются причиной некоторых неточностей при комплексонометрических определениях Ti без добавок перекиси водорода, что (см. ниже) вызывает необходимость в обратном титровании. Сайо [54(42)] определяет титан следующим образом. К кислому анализируемому раствору прибавляют ЭДТА и ее избыток титруют обратно раствором цинка со смешанным индикатором [гексацианоферраты(П) и (III) и бензидин] после добавления ацетатной буферной смеси. Если присутствуют другие металлы, способные титроваться совместно, к оттитрованному раствору прибавляют фосфат натрия и кипятят. При этом в осадок выпадает весь присутствующий в растворе Ti в виде фосфата. По охлаждении раствора выделившееся (эквивалентное по отношению к титану) количество ЭДТА титруют раствором цинка. Этот метод можно использовать для определения Ti4+ в присутствии Fe3+, А13+ и других ионов металлов, не маскируемых фосфат-ионами. Сайо [56(100)] предлагает также проводить обратное титрование раствором соли ванадия (V) с дифенилкарбазидом (или дифенилкарбазо-ном). Однако более конкретных данных не приведено, и следует ожидать, что точности определения вредит соосаждение; кроме того, содержание фосфат-ионов должно быть строго определенным, так как их избыток может вызвать разложение комплексонатов и других ионов.
Шир и Пршибил [55(90)] определяли титан в растворе, содержащем пиридин, и проводили обратное титрование избытка ДЦТА раствором цинка с эриохромом черным Т в качестве индикатора. Те же авторы проводили обратное титрование избытка ЭДТА раствором меди с пирокатехиновым фиолетовым [56(86)] в пиридин-ацетатном буферном растворе (pH = 4—5). Киннунен [57(137)] сообщает об обратном титровании избытка ЭДТА раствором соли таллия (III) с ксиленоловым оранжевым в качестве индикатора в растворе с ацетатной буферной смесью (отсутствуют указания о точности метода, особых предосторожностях, скорости реакции и т. п.). Прямое определение титана раствором ЭДТА при pH = 2 с амперометрической индикацией точки эквивалентности описывают Такао и Муша [61(72)]. Точность метода около 2%.
Свитцер и Брикер [54 (14)] указывают, что при прибавлении перекиси водорода образуется пероксокомплекс титана с ЭДТА, более устойчивый, чем нормальный комплекс. При обратном титровании избытка ЭДТА раствором железа с салициловой кислотой в точке эквивалентности не происходит реакции вытеснения. Обратное титрование раствором железа в присутствии перекиси проводят фотометрически при длине волны 540 нм при pH == 1,9. Указывается на возможность прямого фотометрического титрования титана в присутствии перекиси.
Прямое титрование Ti обстоятельно изучили Муша и Огава [57(20)]. Авторы проводили титрование при pH от 0,4 до 4 и длине волны 365 нм. При более низких значениях pH определению не
199
Мешают Zn, Al, щелочноземельные металлы и не мешает заметно Zr, если их концентрации не превышают 200 мг!л\ Мо и W должны отсутствовать. Авторы приводят также значения констант устойчивости пероксокомплекса титана с ЭДТА:
[TiO(H2O2)Y2~] 20. [TiO(H2O2)Y2~]
[TiO(H2O2)2+] [Y4-] ’ [TiOY2~] [H2O2]
При сравнении с упоминавшейся выше константой устойчивости комплекса, не содержащего перекиси водорода, ясно видно стабилизирующее действие перекиси. Наряду с упрочнением комплекса, что уменьшает вероятность протекания реакции вытеснения в точке эквивалентности обратного титрования, значительное преимущество применения перекиси заключается в том, что комплексообразование между пероксотитанатом (IV) и комплексоном протекает гладко, и явления гидролиза не мешают определениям.
Либер [60(136)] проводит прямое титрование Ti с визуальной индикацией конечной точки, после того как к анализируемому раствору прибавляет отмеренный объем раствора железа (III). Ионы железа с салициловой кислотой используются в качестве индикатора; добавленное количество железа, конечно, должно быть учтено. Однако визуально определяемая точка эквивалентности не очень резкая, и поэтому Либер рекомендует фотометрическую индикацию.
В общем случае в присутствии перекиси предпочтительно обратное титрование. Бибер и Вечера [61(82)] обратно титруют избыток ЭДТА раствором висмута с ксиленоловым оранжевым (см. также [63 (61), 63 (63)]). Титрование следует проводить в сильнокислой среде при температуре ниже 20° С; для успешного титрования необходимо, чтобы отсутствовали сульфат- и хлорид-ионы, в противном случае происходит выпадение в осадок труднорастворимых соединений висмута. По этому методу можно анализировать смесь Fe—Ti последовательным титрованием. Вначале в отсутствие перекиси титруют Fe при 70° С с сульфосалициловой кислотой, которая является индикатором и одновременно мешает выпадению гидроокиси титана. Оттитрованный раствор охлаждают до 20° С, добавляют к нему перекись и ЭДТА и избыток последней обратно титруют раствором соли висмута.
Ограничения, связанные с необходимостью работать в холодном растворе и при отсутствии сульфат- и хлорид-ионов, отпадают, если, согласно Вилкинсу [59 (4)], избыток ЭДТА обратно титруют в присутствии перекиси водорода раствором соли меди с ПАН. Определение проводят в ацетатном буферном растворе. Применение кальцеина W в качестве флуоресцентного индикатора [59(9)] имеет преимущество перед применением ПАН и других цветных индикаторов, заключающееся в том, что можно определять большие количества титана, так как гашение флуоресценции в точке эквивалентности не перекрывается желтым фоном раствора
200
Ласснер и Шарф [61(168)] также рекомендуют обратное титрование раствором соли меди с ПАН при pH = 5—5,2 в горячем (70—80° С) растворе. При изучении мешающих элементов авторы сделали наблюдение, что Nb в присутствии перекиси водорода образует с ЭДТА довольно устойчивый пероксокомплекс, который делает невозможным определение титана [60(3)]. При работе с ДЦТА эти явления не обнаруживаются, и поэтому предпочитают пользоваться ею, так как в этом случае можно определять титан даже в присутствии ниобия и тантала. При применении ДЦТА, в противоположность применению ЭДТА, в ходе обратного титрования присутствующий в растворе молибден (см. дальше) легко вытесняется медью из комплекса с ДЦТА, поэтому с этим комплексоном можно проводить определение титана также в присутствии Мо и W. В более поздней работе Ласснер и Шарф [62(50)] рекомендуют флуоресцентную индикацию точки эквивалентности, так как при этом желтый цвет раствора почти не мешает, и предлагают в качестве индикаторов метилкальцеин и метилкальцеин синий.
Описано потенциометрическое обратное титрование ЭДТА раствором Fe111 (Джуффрэ и Капици [60(135)]). Титрование проводят при pH = 1,6—1,9. Установление точного значения pH раствора является важным, так как pH сильно влияет на форму кривой титрования, высоту скачка и положение точки эквивалентности. В процессе титрования следует все время контролировать и, если необходимо, корректировать pH. Преимущество метода состоит в возможности титрования титана в присутствии А1. Те же авторы [62(80)] описывают фотометрическое определение Ti в присутствии А1; избыток ЭДТА обратно титруют раствором соли железа (III) с сульфосалициловой кислотой при pH = 1,5 и длине волны 510 нм.
Следует заметить, что пероксотитанат настолько устойчив в щелочной среде, что можно вводить в раствор перекись водорода для маскирования Ti при титровании других металлов с эриохромом черным Т в качестве индикатора [57(3)]. О маскировании Ti в присутствии ЭДТА осаждением фосфат-ионами упоминалось выше [54(42)].
Титрование Ti находит практическое применение при анализе различных веществ, однако обычно требуется предварительное его выделение с помощью экстракции или ионного обмена. При определении Ti и Fe в шлаке, ферротитане, ильмените предварительно проводят экстракцию купферроном [61 (82)]. Сплавы магнитных металлов подвергают ионообменному разделению [59(9)]. Определение титана с помощью фотометрического титрования находит применение в анализе сырья, полупродуктов и готовой продукции в известковой и цементной промышленности [60(136), 61(42)]; кроме того, титан определяют в твердых металлах [61 (168)], сплавах [63(62), 63(63)] и без предварительного отделения потенциометрически [60(135)] или фотометрически [62(80)] в присутствии А1 — в алюминиево-титановых катализаторах.
201
17. ЦИРКОНИЙ И ГАФНИЙ
Уже давно было описано титрование Zr раствором ЭДТА, но процессы, происходящие при самом титровании и при подготовке анализируемого раствора к титрованию, не были полностью объяснены. Это, однако, не является помехой для успешного проведения точных определений. Гафний ведет себя вполне аналогично цирконию, как об этом сообщается во всех работах, и поэтому все, что будет сказано ниже о поведении циркония, относится также и к гафнию.
Морган и Юстус [56(60)] определили константы устойчивости комплексов ЭДТА с цирконием: IgA =19,4 (ц = 0,1, 25° С)—и гафнием: lgA== 19,1. Авторы сообщают об образовании комплекса с молярным соотношением 1 : 1, однако они не установили, идет ли речь о комплексе 7г4+-иона, или цирконил-иона, или о каком-либо другом комплексе, а также в какой форме присутствует в равновесном растворе цирконий, не связанный в комплекс. Значения констант получены при фотометрическом исследовании равновесия по методу вытеснения с помощью CuY2". Ивасе [59(52)] приводит другое значение константы устойчивости комплекса ZrY: IgA — = 18,0 (р, = 0,1, 25°С). Низкие значения устойчивости комплекса не объясняют того факта, что цирконий титруется в сильнокислой среде. В литературе упоминаются методики, в которых рекомендуется применять растворы для титрования вплоть до двунормальных по кислоте (!); однако уже при pH = 0,5 значение сщ для ЭДТА составляет 19,1! Возможно, что комплекс исключительно прочен, чему, однако, противоречит существующая возможность прямого титрования, или же играет роль довольно известная склонность циркония к реакциям гидролиза, протекающим по неизвестному или недостаточно изученному механизму. Мусил и Тейс [55(30)] сообщают, например, что для титрования свежеприготовленного раствора ZrCl4 требуется столько ЭДТА, сколько соответствует образованию комплекса состава Zr : Y = 1 : 2. При долгом стоянии или непродолжительном кипячении раствора происходит гидролиз, и требуемое для титрования количество ЭДТ^ в этом случае уже точно соответствует образованию комплекса в молярном отношении 1 : 1. В ранее опубликованном кратком сообщении Кирш и Цалетка [63(51)] сообщают об исследовании равновесия ЭЦТА — Zr методом сорбции на силикагеле в 1—5 н. растворе азотной кислоты. Были получены следующие значения констант равновесия: lg AzrY = 28,5 ± 0,3 (в 1 н. растворе HNOg) и 30,6 ± ±0,2 (в 5 н. растворе HNO3). Величина 1g А = 29,5 ± 0,5 при р = 0,1. по-видимому, получена вычислением. Эти величины значительно лучше согласуются с известными результатами титрования.
Первое прямое титрование описывают Фритц и Фулда [54(45)]. Авторы исследовали поведение карминовой кислоты, хромазурола S и хлораниловой кислоты в качестве возможных индикаторов, но нашли эти вещества непригодными для такой цели. С ализарино-202
вым цианоловым RC, а еще лучше с эриохромцианином RC получены резкие изменения окраски при pH = 1—2. В качестве оптимального они рекомендуют pH = 1,3—1,5. Цирконий в растворе должен присутствовать в концентрации 3—5 • 10~3 М. Вблизи точки эквивалентности следует титровать медленно. На основе этих исследований был разработан метод обратного титрования, в котором избыток ЭДТА обратно титруют в горячем растворе стандартным раствором соли циркония. Согласно авторам, совместно титруется и Fein. Для исключения этой помехи ионы железа (П1) восстанавливают амальгамой цинка, но в этом случае титрование следует проводить в отсутствие воздуха, во избежание окисления образовавшихся Ре2+-ионов. Как позже показали авторы, восстановление аскорбиновой кислотой или, в некоторых случаях, 5п2+-ионами проходит так же активно и значительно проще.
Банэрье [55(92)] применяет SPADNS в качестве индикатора при pH = 2; железо можно замаскировать аскорбиновой кислотой; титрованию мешают Ni, Си, Ag, молибдат-, фосфат- и сульфат-ионы. Тот же самый индикатор рекомендует также Датта [60(145)].
Мусил и Тейс [55(30)] с успехом применяли в качестве индикатора хромазурол S, тогда как Фритц и Фулда [54(45)] не смогли получить с этим веществом хороших результатов. Однако прямое титрование оказалось не особенно удачным, поэтому было предложено титровать известное количество стандартного раствора комплексона анализируемым раствором, содержащим 10% соляной кислоты. Сложность метода оставляет мало надежд на внедрение его в аналитическую практику. Горюшина'и др. [57(66)] для индикации точки эквивалентности применили эриохром черный Т. В 2 н. растворе соляной кислоты, содержащем ионы циркония, образуется при нагревании сине-фиолетовое соединение с эриохромом черным Т, которое в точке эквивалентности при титровании раствором ЭДТА разлагается; при этом окраска раствора становится розовой. Селективность метода значительна в сильнокислом растворе. Так как Sn не мешает определению, можно прибавлять к раствору Sn (II) для восстановительного маскирования малых количеств Си, V и Мо, а также Fe (III), если количество последнего не превышает 100 мг. Допустимо присутствие сульфат-ионов в количестве до 200 мг. Другие комплексообразующие ионы, такие, как фосфат, оксалат, тартрат и фторид, мешают определению циркония. Авторы применили в качестве индикатора также карминовую кислоту, что находится в противоречии с более ранними исследованиями [54(45)]. Сун [60(13)] использует в качестве индикатора в области pH = = 0,5—1,6 галлеин; более резкое изменение окраски происходит при pH около 1. Реакция с индикатором протекает медленно; рекомендуется через 10 мин после достижения конечной точки проверять раствор на возможное возвращение первоначальной окраски. Из сорока восьми исследованных ионов лишь SbIn, CeIV, Fein, Мош, Sn11 или SnIV, Т1ш, хромат, перманганат, ванадат, молибдат, оксалат, тартрат, фторид и сульфат мешают определениям,
203
если присутствуют в растворе в количестве, эквивалентном содержанию циркония. Однако многие из них либо присутствуют редко, либо легко могут быть удалены или без затруднений обезврежены путем их окисления или восстановления. Коркиш предлагает применять солохром фиолетовый R [58(91)] при микро- или макроопределениях Zr в 1 н. растворе НС1. Однако индикатор реагирует с большим числом ионов других металлов, легко подвергается окислительному или восстановительному разрушению, и поэтому его применение ограничено анализом более или менее чистых растворов циркония, которые можно получить путем разделения на ионитах. Аналогично ведет себя рекомендованный тем же автором солохром черный 6 BN [60(178)], для которого необходимо даже отсутствие нитрат-ионов. Титрование миллиграммовых количеств Zr проводят с точностью 1—2% и микрограммовых количеств с точностью 5—6%.
Одним из лучших индикаторов является ксиленоловый оранжевый, который ввели Клыгин и Коляда [61(91)] для прямого титрования циркония в 0,25 н. растворе серной кислоты. В то время как при титровании с некоторыми другими индикаторами сульфат-ионы мешают, в данном случае для получения более резкой точки эквивалентности еще прибавляют сульфат натрия. В очень сильнокислом растворе не мешают даже ионы Fein, In, Se, Th, Y, Ni и Co11 (в количествах до 10 мг в 300 мл), несмотря на то, что их комплексы с ЭДТА очень устойчивы. Также не мешают ванадат- (если его количество не превышает 100 мг) и молибдат-ионы. Фосфат-, оксалат- и фторид-ионы должны, однако, отсутствовать; Bi в условиях титрования реагирует с индикатором и поэтому мешает. Согласно Лукьянову [62(61)], допускается присутствие Си в значительных количествах, если титрование проводят в 0,5 н. растворе серной кислоты и в качестве маскирующего вещества используют тиомочевину. Для прямого титрования в 0,9 ± 0,3 н. растворе НС1 рекомендуется ксиленоловый оранжевый [62(59)]. В этом случае помехи незначительны, прежде всего не мешает UVI, если его содержание в 100 мл раствора не превышает 1 г. Применение ксиленолового оранжевого делает возможным проведение последовательного титрования смееи Zr—Th, согласно Володарской и др. [63(8)]. Сначала титруют Zr прй 80—90° С в 0,25—1 н. растворе соляной или серной кислоты, затем повышают pH раствора до значения 1,5—2,5 и определяют содержание Th. Если необходимо исключить Ее3+-ионы путем восстановления их до Fe2+, то следует применить солянокислый гидроксиламин, так как использование аскорбиновой кислоты приводит к заниженным результатам.
Сульфонафтилазорезорцин при титрованиях в 2 н. растворе НС1, согласно Кононенко и Полуэктову [62(60)], является подходящим индикатором. Определению не мешает сульфат-ион. Кроме того, не мешают Sn11 и SnIV, так что Sn11 можно прибавлять в раствор для восстановления Fein и других мешающих элементов.
204
Маюмдар [60(41)] применяет карбоксифенилазохромотроповую кислоту (хромотроп 2С) в качестве индикатора при прямом титровании циркония при pH = 1,4—2,8 в нагретом до 50° С растворе. Сульфат-ион не мешает; с помощью аскорбиновой кислоты можно замаскировать значительные количества железа.
С тех пор как были подобраны подходящие индикаторы для прямого титрования, потеряли значение разработанные в предыдущие годы методы обратного титрования, в особенности при высоких значениях pH, когда избирательность определений заметно снижена. Однако метод, предложенный Фритцем и Джонсоном [55(108)], является исключением, так как он допускает присутствие некоторых ионов, которые обычно мешают прямому титрованию, прежде всего тартрат-иона. Обратное титрование избытка ЭДТА проводят раствором Bi в присутствии тиомочевины при pH = 2. Определению не мешает сульфат-ион, поэтому его можно добавлять для маскирования Th. Молибдат- и фосфат-ионы в присутствии тартрата не мешают. Для маскирования Nb и Та можно использовать винную кислоту; она предотвращает выпадение в осадок их гидроокисей. Тиомочевина выступает не только в роли индикатора, но, крод-ie того, маскирует Си и прежде всего связывает Bi, так что становится возможным титрование в присутствии хлоридов без выпадения в осадок труднорастворимого соединения BiOCl.
Титрованный раствор железа многие авторы применяют для обратного титрования. Мильнер и Пеннах [54(92)] проводят обратное титрование при pH = 5—6 с салициловой кислотой, тогда как Володарская [60(93)] применяет в тех же условиях сульфосалициловую кислоту. Панде и др. рекомендуют 2-окси-З-нафтойную кислоту [60(15)] и о- или n-крезотовую кислоту [60(16)]. В обоих случаях прибавляют в избытке ЭДТА, pH анализируемого раствора доводят до значения 6 и раствор кипятят одну минуту, затем его охлаждают до 30° С, добавляют ацетатный буферный раствор (до pH = 4) и проводят обратное титрование.
Обратное титрование раствором меди с ПАН при pH — 5 рекомендует Эндо [60(141)]. Киннунен [57(137)] обратно титрует при pH = 1—2 раствором висмута или при pH == 2—3 раствором тория с ксиленоловым оранжевым. Обратное титрование раствором тория с ксиленоловым оранжевым было позднее предложено Лукьяновым и др. [60(61)], что объясняется, по-видимому, неосведомленностью о работе Киннунена. Русские авторы предложили в качестве индикатора также арсеназо. Белчер и сотр. [60(153)] упоминают о возможности определения Zr обратным титрованием избытка ЭДТА раствором меди с о-дианизидином или о-дифенети-динтетрауксусной кислотой в качестве флуоресцентных индикаторов. Детали методики, примеры или указания о помехах не приводятся. Возможно обратное титрование раствором соли цинка с смешанным индикатором, состоящим из гексацианоферратов (II) и (III) и бензидина [56 (99)], или раствором ванадия
205
с дифенилкарбазидом [56 (100)]. В заключение следует упомянуть метод Такамото [55 (103)], проводившего обратное титрование раствором соли кобальта в 50%-ной водно-ацетоновой смеси в присутствии роданид-ионов.
Фотометрическую индикацию точки эквивалентности применяют при обратном титровании раствором соли железа с салициловой кислотой [54(14)] и бензгидроксамовой кислотой [55(80)] Амперометрическую индикацию можно использовать при обратном титровании избытка ЭДТА раствором соли висмута [56(13), 60(71)] или соли ванадия [63(13)]. Представляет интерес амперометрическое титрование с применением вращающегося танталового электрода, описанное Хадеевым и Квашиной [60(75)]. Индикацию осуществляют по волне окисления ЭДТА, выделяющейся в свободном состоянии после точки эквивалентности, при потенциале +1.2 в (относительно каломельного электрода). Определению мешают Fein, Sbin, Bi, SnIV, Ta, W и Mn. Помехи, вызванные фторид-ионами, ртутью (II) и медью, присутствующими в незначительном количестве, можно исключить прибавлением А1, С1_-ионов или винной кислоты; при большем содержании примесей помехи в значительной степени уменьшаются. Сообщается также [58(12)] о потенциометрическом титровании с ртутным капельным электродом.
Практическое применение комплексонометрическое определение циркония находит, например, при анализе сплавов, руд и концентратов [60(61)], в особенности после ионообменного разделения [60(177)] и при анализе смесей Cu—Zr [62(61)], Пт—Zr [59(110)], Mg—Zr [60(93)], ниобиевых сплавов [60(71)], боридов и нитридов [59(85)], сиккативов [59(116)] и циркониевого песка [63(52)].
При всех описанных определениях циркония совместно с ним _ всегда титруется присутствующий в растворе гафний. Насколько можно видеть из опубликованных данных, гафний можно определять по методам, описанным для циркония. О простом, по-види-мому, отделении гафния от циркония с помощью экстракции циклогексаном сообщает Хошино [62 (128)]. После реэкстракции гафния в водную фазу его титруют комплексонометрически. Раздельное определение компонентов смеси Zr—Hf возможно с помощью косвенного анализа на основе различия атомных весов обоих металлов. Сначала известным методом осаждают вместе цирконий и гафний и после озоления весовым методом определяют сумму их окислов. Далее окислы растворяют и титрованием раствором ЭДТА определяют сумму обоих металлов. Можно также работать с аликвотными пробами. Из полученных данных составляют два параллельных уравнения, решение которых дает требуемые результаты.
Полуэктов и др. [62(130)] предлагают следующие формулы для расчета (в мг)-.
и п _ 0,008124 —аМ . оМ-0,004764
0,00336 ’ Zr°2 0,00336
206
где А — масса суммы окисей в миллиграммах, а и Л1 — соответственно объем (в миллилитрах) и молярность раствора ЭДТА.
Прямое определение циркония (и гафния) с ксиленоловым оранжевым
Реактивы
ЭДТА, 0,01 М раствор.
Ксиленоловый оранжевый.
Соляная, хлорная или серная кислота, концентрированный раствор.
Аммиак.
Ход определения. К анализируемому раствору, содержащему 30—50 мг металла в 100 мл, прибавляют аммиак (только до появления заметной остающейся мути). Затем измеряют объем раствора и к каждым 100 мл раствора прибавляют 3 мл концентрированного раствора НС1 или НС1О4 или 1 мл H2SO4 и кипятят, чтобы разрушить все продукты гидролиза. Охлаждают приблизительно до 50° С, прибавляют индикатор и титруют раствором ЭДТА (медленно при приближении к точке эквивалентности) до изменения красной окраски в чисто-желтую.
Замечания. Если 7г(и/или Hf) отделять, осаждая его в виде гидроокиси или с помощью миндальной кислоты и т. д., то осадок можно прямо растворить в приблизительно 6 н. растворе кислоты и полученный раствор затем разбавить (включая промывные воды) настолько, чтобы конечная концентрация кислоты составляла 0,3 н.
Определение циркония (и гафния) обратным титрованием раствором хлорида железа (Ш) с салициловой кислотой [54 (92)]
Реактивы
ЭДТА, 0,1 М раствор.
Хлорид железа (III), 0,1 М раствор (устанавливается одни по другому). Салициловая кислота, кристаллическая.
Аммиак, приблизительно 1 М раствор.
Уксусная кислота, 1 М раствор.
Ход определения. К кислому анализируемому раствору, содержащему приблизительно 100 мг Zr в 100 мл, приливают в небольшом избытке раствор ЭДТА и смесь нагревают до кипения. Затем прибавляют по каплям аммиак, пока pH раствора не достигнет значения 6—7, и кипятят в течение 2 мин. По охлаждении приливают 3 мл уксусной кислоты и еще раз 2 мл аммиака. После такой операции pH раствора соответствует значению 5. Наконец, прибавляют 0,2 г кристаллического индикатора и титруют раствором FeCI3 до появления слабой красной окраски.
Замечания. Как обычно, в случае использования реакции между производным фенола и железом для индикации точки эквивалентности следует пользоваться не слишком разбавленными растворами. Титрование можно проводить еще 0,02 М титрованным
207
раствором. Реакция образования комплекса циркония с ЭДТА протекает медленно. Поэтому раствор вначале сразу нагревают и только потом нейтрализуют, так как иначе может выпасть в осадок гидроокись циркония, которая потом лишь с трудом снова растворяется.
18. ТОРИЙ
В 1952 г. Кэбелл [52(41)] показал, что Th образует с ЭДТА устойчивый комплекс , а в 1953 г. независимо друг от друга Фритц и др. [53(19)] и Тер-Хаар и Базен [53(9)] применили это открытие для комплексонометрического определения Th. В качестве индикатора при прямом титровании при pH = 2,8 они применили ализарин S, использованный позднее другими авторами [54(99), 60(72)], причем можно достигнуть более резкой точки эквивалентности, если прибавить ксиленоловый цианоловый FF [57(121)]. Оуэнс и Ио [60(106)] исследовали соединения, аналогичные ализарину S, а именно, 2-хинизаринсульфонат (титрование проводят при pH = = 2—3,4) и 2-феноксихинизарин-3,4-дисульфонат, причем предпочтительнее оказался последний, так как с ним можно проводить титрование при pH = 1,4—3,4. В настоящее время для титрования тория в кислой среде в распоряжении исследователей имеется боль шое число других индикаторов, например азокрасители [А (7), 60(54), 60(55), 60(188), 61(37)], хромоксановые красители [57(32)] и в особенности азосоединения ряда хромотроповой кислоты [55(94), 56(53), 57(51), 63(18)]; далее, индофенолкомплексоны [60(52)], галлоцианины [61(73)], гематоксилин [61(40)], диоксисульфофталеин [60(H)], оксигидрохинонфталеин [61(65)], стильбазо [61(147)], эриохромцианин R [58(15)], карминовая кислота [58(79)] и торин [62(90)]. Находят применение системы цинк — дитизон [61 (61)] при pH = 3 в 60%-ном спирте, Feni — KSCN [59(138)], а также окислительно-восстановительная система ванадий (V) — ЭДТА—дифенилкарбазид [63(1)] в ацетатном буферном растворе и система Fe11 — какотелин [57(11)]. Особенно обстоятельно описано применение ксиленолового оранжевого[59(НО),60(46),60(72), 60(152), 63(8), 63(16), 63(27)], пирокатехииового фиолетового [54(77), 56(84), 57(30), 57(132), 57(133), 58(77), 60(72), 62(6)], арсеназо [60(72), 62(89), 62(90)] и хромазурола [59(14), 61(74)]. С последним индикатором применяют также антранилдиуксусную кислоту в качестве титранта [59(76)]. Эти индикаторы особенно ценны благодаря резкому переходу окраски, а также возможности проводить с ними титрования при низких значениях pH. Однако Аппл [60(152)] показал, что в растворах с большой концентрацией нейтральных солей переход окраски ксиленолового оранжевого сильно ухудшается. В этих случаях можно достичь улучшения прибавлением метиленовой синей [63(8)].
Сообщается также об определении Th с помощью обратного титрования избытка ЭДТА. Обратное титрование можно проводить стандартным раствором соли тория с ализарином S [53(22)], рас
208
твором соли меди с ПАН [58(43), 58(108), 62(92)], с ксиленоловым оранжевым [60(152)] или с о-дианизидинтетрауксусной кислотой [60(153)] и раствором соли кобальта в ацетоно-водной смеси, содержащей роданид-ионы [55(103)]. Описано обратное титрование раствором железа (III) с 2-окси-З-нафтойной кислотой [60(15)] или с о- или га-крезотовой кислотой [60 (16)]. Представляют интерес об ратные титрования в том случае, когда Th отделен от мешающих элементов, что достигается осаждением с помощью оксалат-[60(72)] или, что более селективно, иодат-ионов [57(30), 60(72), 62(92)]. Осадок растворяют в титрованном растворе ЭДТА и титруют обратно избыток последнего.
Определению тория обычно мешает присутствие ионов металлов, образующих устойчивые комплексы с ЭДТА, например Bi, Zr, Hf, FenI и т. д. Какие элементы могут присутствовать и с какой концентрацией, зависит от применяемого индикатора и pH титруемого раствора. Чем меньше значение pH, тем селективнее титрование. Малат и др. [59(14)] проводят титрование при pH = 1—2 с хромазуролом S, причем щелочные, щелочноземельные металлы, Ag, TI (I), Mn, Zn и Cd не оказывают вредного влияний Большие количества Со, Сг и U мешают вследствие собственной окраски их ионов. Частично совместно титруются Yn и Ga; присутствие никеля легко приводит к завышенным результатам. В присутствии Al, РЬ и Си в точке эквивалентности окраска изменяется не от фиолетовой к желтой, а от фиолетовой к красной, что менее отчетливо. Железо (III) и ртуть можно замаскировать восстановлением их с помощью аскорбиновой кислоты. Сук и Малат [54(77)] сообщают, что титрованию тория при pH —2,5 с пирокатехиновым фиолетовым не мешают щелочные, щелочноземельные металлы, Mn, U, РЬ, Со, Ni, Al, Zn, Cd и редкоземельные металлы; Fein при содержании до десятикратного количества можно замаскировать аскорбиновой кислотой, но следует избегать большого избытка восстановителя, так как от этого страдает резкость точки эквивалентности [56(84)]. Тот же индикатор применил Лупан [58(77)], причем определения он проводил в 60%-ном спиртовом растворе. Не мешают La, Рг, Nd, а Сеш может присутствовать в пятисоткратиом количестве. Согласно Банерье, SPADNS применяется в качестве индикатора при pH = 3,1. Щелочные, щелочноземельные металлы, Cd, Со, А1, La, Ge и V не мешают, если присутствуют не более чем в десятикратном количестве; железо можно замаскировать аскорбиновой кислотой. Чернихов [60(72)] описывает титрование тория при pH = = 2,4—2,6 с ксиленоловым оранжевым, при этом можно замаскировать до 10 ла циркония в 50 мл раствора с помощью тартрат-ионов или триоксиглутаровой кислоты.
Высокое значение константы устойчивости комплекса тория с ЭДТА позволяет проводить многократные последовательные титрования, при которых сначала в сильнокислом растворе определяют Th, а затем в растворах с более высоким значением pH титруют Другие металлы. Исключительное практическое значение имеет
[4 Зак. 553
209
последовательное титрование смесей тория с редкоземельными металлами, о чем будет сказано ниже. При использовании этого общего принципа все же приходится иногда принимать во внимание осложнения, обусловленные способностью связанного с ЭДТА тория реагировать при повышенных значениях pH с некоторыми индикаторами. Такое блокирование индикатора в первую очередь описано для арсеназо (см. раздел, касающийся редкоземельных металлов). Пршибил сообщает о блокировании ксиленолового оранжевого [63(27)], когда после определения тория приходится проводить титрование с тем же индикатором двухвалентных металлов с константами устойчивости комплексов от 1016 до 10'8 при pH = 5 — 6. Однако, если вместо ЭДТА применить комплексоны, образующие более устойчивые комплексы с упомянутыми металлами, такие, как ДТПА или триэтилентетрамингексауксусная кислота, то не возникает никаких затруднений.
Особое значение имеет относительно высокая устойчивость комплексов, образованных торием с сульфат-ионами, что можно использовать для маскирования тория. Эффективность маскирования тем большая, чем ниже pH раствора. Пршибил [60(46)] находит, что для этой цели наиболее пригоден pH ниже 1, однако можно проводить определение и при несколько более высоких значениях pH. Маскированием сульфат-ионами можно воспользоваться для селективного определения тория. Согласно Мильнеру [59(110)], можно определять Th в присутствии Zr следующим образом. Сначала определяют сумму Th и Zr обратным титрованием избытка ЭДТА раствором висмута с ксиленоловым оранжевым при pH = =2,5—2,7. Оттитрованный раствор подкисляют до рН = 1,2—1,3 и добавляют 2 г сульфата аммония. После этого эквивалентное по отношению к торию количество ЭДТА, выделившееся в свободном состоянии, титруют раствором висмута с тем же индикатором Содержание циркония вычисляют по разности. Пршибил [60(46)] распространил метод Мильнера на определение Fein и некоторых других трех- и двухвалентных ионов металлов. С металлами, образующими менее устойчивые комплексы, возникают затруднения, так как при обратном титровании в сильнокислом растворе эти металлы частично или полностью вытесняются из комплексов с ЭДТА и, таким образом, либо полностью определяются вместе с торием, либо по крайней мере приводят к завышенным результатам. Аналогичным принципом пользуются Роджерс и Броун [63(16)]. При pH = 3 они титруют сумму тория и других присутствующих в растворе металлов (если последние реагируют с ЭДТА при pH = 3) с ксиленоловым оранжевым. Затем прибавляют фторидный буферный раствор с pH = 3 и нагревают до кипения. Выделившееся эквивалентное по отношению к торию количество ЭДТА титруют стандартным раствором меди с ПАН. Из 27 изученных катионов определяются совместно с торием при прямом (первом) титровании лишь ионы Bi, Cd, Cu, Со, Cem, Feni, Ni, Pb, Zn, Zr, Pu и Crni. Примечательно то, что хотя Сгш титруется
210
совместно, Al в этих условиях не титруется. Из металлов, титрующихся совместно с Th, лишь Pu, CeIV, Zr могут быть выделены с помощью фторид-ионов из их комплексов с ЭДТА. CeIV легко восстанавливается в Се1П, который не реагирует с фторид-ионами. Таким образом, определение тория получается в высшей степени селективным. При исследовании влияния примесей металлов ограничивались содержанием их в количестве лишь 3 мг в присутствии 20—40 мг тория, и теперь остается ждать, пока будут проведены опыты в присутствии большего количества примесей. Все же, по-видимому, метод дает возможность высокоселективного определения тория после отделения, благодаря которому сильно сокращается концентрация примесей. Ионы Hg2+, Ga3+, In3+ и Tl34" не исследовались, однако можно ожидать, что они будут титроваться совместно с торием, но без последующего взаимодействия с фторид-ионами.
При определениях тория применяют амперометрическое титрование с ртутным капельным электродом с использованием реакции обмена с PbY2~ [57 (91)] и с двумя поляризованными платиновыми проволочными электродами при 1,48 в [60(57)]. Амперометрической индикацией пользуются также при обратном титровании избытка ЭДТА раствором соли ванадия [63(13)]. Хара и Уэст [55(43)] описывают высокочастотное титрование сильно разбавленных растворов тория. Бэнкс [55(71)] проводит фотометрическое титрование при длине волны 585 нм с хромазуролом S. Брилл и др. [59(95)] применяют ализарин S для прямого и обратного титрований (стандартным раствором тория), Датта [62(6)] титрует с P-SNADNS-6 при длине волны 590 нм, а Пешкова и др. [62(19)] рекомендуют арсеназо I при длине волны 755 нм. Автоматическая индикация точки эквивалентности была осуществлена, согласно Мальмштадту [54 (12)], при pH = 3,1 и длине волны 290 нм при прямом либо 290 или 320 нм при обратном титровании раствором меди и, согласно Менису и др. [58 (70)], при применении кварцетина в качестве индикатора. Панг [59(84)] сообщает о комплексонометрическом определении тория титрованием раствором CeY~, причем светопоглощение комплексоната церия в УФ-области используют для фотометрической индикации. Ртутный капельный электрод можно применять для потенциометрической индикации точки эквивалентности [58(12)].
Практическое применение комплексонометрическое определение тория нашло в анализе руд и минералов [59(138), 61(20)], особенно монацита [57(30), 60(72)], сплава Ауэра [56(40)], сплавов с Mg [60 (93)], с Mg, Си и А1 [63 (8)], с U [54(99), 57 (132), 57(133), 58 (15)], с Bi [57 (132), 57 (133)], Zr [59 (110)], W [58 (43)] и в анализе топлива для реакторов [60(152)].
Много сделано по предварительному разделению, главным образом с помощью ионитов. О применении последовательного титрования смесей тория с редкоземельными металлами см. раздел, касающийся анализа последних.
14*
211
Прямое определение тория с пирокатехиновым фиолетовым
Реактивы
ЭДТА, 0,01 М раствор.
Пирокатехиновый фиолетовый.
Аммиак_ разбавленный раствор.
Ход определения. В анализируемом растворе,, в котором концентрация тория не должна превышать 5’10-3 г-ат'/л, устанавливают значение pH = 2, добавляя по каплям раствор аммиака до появления красноватого оттенка по бумаге конго. Затем прибавляют пирокатехиновый фиолетовый, который должен принять синюю окраску. Если раствор имеет все еще красноватый оттенок, его pH слишком низок; следовательно, нужно добавить еще несколько капель аммиака. Затем титруют слегка подогретый (примерно до 40° С) раствор до перехода окраски в желтую. Так как при комплексообразовании выделяются ионы водорода, иногда необходимо вблизи точки эквивалентности прибавить несколько капель аммиака.
Замечания. В слишком холодных растворах реакция комплексообразования протекает медленно, поэтому переход окраски в точке эквивалентности получается размытым. Вместо пирокатехинового фиолетового можно с успехом применить в качестве индикатора краситель хромотроп 10В [А (7)].
В обоих случаях в присутствии сульфат-ионов получаются размытые точки эквивалентности. Добавление BaCls устраняет это осложнение. В этом случае точка эквивалентности бывает резкой даже в молочно-белой суспензии.
19. ВАНАДИЙ
О прямом комплексонометрическом титровании ванадия впервые сообщили Флашка и Абдин [56(44)]. Раствор ванадата в ацетатном буферном растворе с pH выше 3,5 кипятят с аскорбиновой кислотой и после полного восстановления титруют при нагревании образовавшиеся ¥О2+-ионы раствором ЭДТА с СцУ—ПАН. Определению не мешают ионы As, РО^~и W; Мо должен отсутствовать, так как его окраска перекрывает возникающую в точке эквивалентности темно-синюю окраску индикатора. Другой прямой метод определения предложили Каймал и Жом [62(95)]. В сернокислом растворе ионы ванадия восстанавливают сульфит-ионами, кипятят для удаления избытка SO2 и затем pH раствора доводят до значения 3; по охлаждении и прибавлении спирта (приблизительно равного объема) титруют раствором ЭДТА с Н-бензоил-Н-фенил-антраниловой кислотой в качестве индикатора. В растворах, содержащих более 40% спирта, при pH = 3,5—5 достигают, согласно
212
Хара [61(61)], очень резкого перехода окраски в точке эквивалентности, когда в качестве индикатора применяют дитизонат цинка.
Ионы ванадия (IV) можно определять и с помощью обратного титрования. Киннунен [55(4)] восстанавливает VIV сульфит ионами в слабокислом растворе, приливает раствор ЭДТА и кипятит до завершения комплексообразования; затем доводит pH раствора до значения 10 (аммиачным буферным раствором), прибавляет немного аскорбиновой кислоты и титрует обратно раствором марганца с эриохромом черным Т. В более поздней работе автор [57(137)] описывает селективное определение ванадия обратным титрованием в кислой среде (pH = 2—3) с применением титрованного раствора соли тория с ксиленоловым оранжевым. Сен [58(90)] проводит обратное титрование солью кобальта с тиоацетамидом в спирто-водном растворе. В качестве флуоресцентных индикаторов при обратном титровании раствором меди в ацетатном буферном растворе Белчер и др. [60(153)]применили о-дианизидинтетрауксус-ную кислоту, а Уилкинс [59(8)] — кальцеин. Возможно обратное титрование раствором соли свинца с пирогаллоловым красным [59(20)]. Фритц и сотр. [62(93)] описывают следующее высокоселективное определение ванадия. Анализируемый раствор пропускают через катионит, затем ванадий селективно вымывают разбавленным кислым 1%-ным раствором Н2Ог. После удаления перекиси кипячением приливают ЭДТА и избыток последней обратно титруют стандартным раствором цинка с нафтилазоксином С.
Образование комплексов ЭДТА с пятивалентным ванадием изучали Рингбом и др. [57(15)] и Сайо [56(100), 58(66)]. Последний предложил применять титрованный раствор соли ванадия (V)
для обратного титрования при комплексонометрическом определении других металлов; в качестве индикатора использовался дифе-нилкарбазон [56(100)]. В более поздней работе описывается прямое определение ванадия (V) [62 (94)], с перечислением встречающихся трудностей. Возможно прямое титрование с индикатором дифенилкарбазоном в очень узком интервале pH = 6,7—6,9. При pH < 6,7 ванадий частично существует в форме декаванадата, который очень медленно реагирует с ЭДТА. При pH > 6,9 индикатор не вступает в реакцию с ионами ванадия. Поэтому исходят из щелочного раствора ванадата, в котором кипячением с хлоридом аммония устанавливают требуемое значение pH. Однако время кипячения следует строго регулировать, иначе значение pH снижается слишком сильно и раствор делается непригодным. Метод можно улучшить, если титрование проводить в присутствии сахара, маннита или глицерина. При этом титруют при pH раствора 4,7—6,8. Какабадзе и Уилсон [61(16)] сообщают об опыте прямого титрования раствора пятивалентного ванадия, 0,03 н. по хлорной кислоте, с ксиленоловым оранжевым; однако они сами мало доверяют этой методике. В противоположность прямому определению,
213
можно проводить обратное титрование ванадия (V) в широком интервале pH от 3,5 до 6. Для этой цели рекомендуют анализируемый раствор, содержащий ацетатную буферную смесь, кипятить с избыточным количеством ЭДТА и по охлаждении обратно титровать избыток ЭДТА раствором цинка с дифенилкарбазоном [62(94), 62(110)] или растворами Zn, Pb или Cd с пирокатехиновым фиолетовым [62(94)]. Точка эквивалентности, однако, не слишком резкая; прибавление метиленовой синей улучшает эффективность ди-фенилкарбазона.
Сайо [58(66)] отмечает, что эффективная константа устойчивости комплекса ванадия (V) с ЭДТА (УОгУ3-) практически не зависит от pH в интервале pH от 3,5 до 6 (значение lg №tf составляет 7—8). При pH раствора < 3,5 значение эффективной константы устойчивости быстро уменьшается, так как ан растет, а при pH > 6 уменьшение Keii обусловливается образованием метавана-дат-ионов. Таким образом, ванадий (V) в названном интервале рН = 3—6 вытесняется из комплекса с ЭДТА всеми ионами металлов, титрующимися в данных условиях; следовательно, систему ванадий (V)—ЭДТА — дифенилкарбазон можно применять для целей индикации точки эквивалентности [63 (1)]. Реакции вытеснения и взаимодействия с индикатором иногда протекают медленно, поэтому точка эквивалентности может получаться размытой.
Косвенный метод определения микроколичеств ванадия (> 10 мкг V2O5) был предложен Суса [62 (97)]. Ванадат-ион осаждают в виде серебряной соли, которую отфильтровывают. При добавлении [Ni(CN)4]2- происходит реакция вытеснения; выделившиеся ионы никеля титруют раствором ЭДТА с мурексидом (см. стр. 258).
О потенциометрическом титровании У02+-ионов при pH = 3,5 с платиновым электродом сообщают Рейли и др. [58(12)]. Церковница [60 (189)] описывает амперометрическое титрование ионов ванадия при рН = 3—4 и потенциале +0,9 в (Нас. КЭ) с вибрирующим платиновым электродом, причем титруются V111 и VIV. Если ванадий присутствует в обеих валентных формах, на кривой титрования имеются два перегиба, из которых первый соответствует концу титрования V111. Гольдштейн и др. [63(13)] предлагают применять амперометрическое обратное титрование раствором УО2+-ионов для определения ионов Al, Zr, Th и других металлов в буферном растворе с pH = 4.
Комплексонометрическое определение ванадия находит применение в анализе магнитных сплавов [59(8)] и ванадата свинца [62 (ПО)]. В последнем случае определяют сумму РЬ и V обратным титрованием избытка ЭДТА титрованным раствором цинка с дифенилкарбазоном при pH = 6. Затем pH раствора доводят до значения 10, при этом УОгУ3- разлагается; выделившееся эквивалентное по отношению к ванадию количество ЭДТА обратно титруют раствором цинка с кислотным хромом синим.
214
Прямое определение ванадия в присутствии CuY — ПАН
Реактивы
ЭДТА, 0,01 М раствор.
Ацетатный буферный раствор, pH = 4—5.
Комплекс меди с ЭДТА, раствор.
ПАН.
Аскорбиновая кислота.
Ход определения. В анализируемом растворе, содержащем около 20 мг ванадия в 50 мл, устанавливают pH = 4 прибавлением щелочи или кислоты и разбавляют буферным раствором. Вносят аскорбиновую кислоту, при этом раствор окрашивается в синий цвет. Затем раствор кипятят до перехода синей окраски в синевато-зеленую. Прибавляют несколько капель раствора CuY, индикатор, и раствор еще горячим титруют раствором ЭДТА до перехода фиолетовой окраски в желтую.
Замечания. Методика относится к растворам, содержащим ионы ванадия (V). Если в растворе присутствует только VIV, в восстановлении нет необходимости. Если в растворе присутствует большое количество V, добавление аскорбиновой кислоты в количестве, превышающем необходимое, может вызвать понижение pH раствора (который не должен опускаться ниже 3,5). В таких случаях целесообразно растворить аскорбиновую кислоту в небольшом количестве воды и нейтрализовать щелочью. Раствор аскорбиновой кислоты неустойчив.
20. НИОБИЙ И ТАНТАЛ
Образование комплекса ниобия с ЭДТА впервые зафиксировали Феррет и Мильнер [56(123)] в результате полярографических исследований. При полярографическом определении Nb в растворе ЭДТА Кеннеди [61(169)] не получил линейной зависимости между высотой волны и концентрацией. Кирби и Фрайзер [63(12)] более подробно изучали полярографическое восстановление комплекса ниобия с ЭДТА и установили, что стабильность раствора и полнота комплексообразования достигаются лишь при кипячении раствора. Высота волны и потенциал полуволны зависят от pH раствора и избыточного количества ЭДТА. В реакции восстановление Nbv->NbIV в зависимости от pH участвуют один или два протона, на основании чего можно сделать заключение о присутствии гидролизованного комплекса. О составе и устойчивости комплекса ничего нельзя сказать. Шпаужус и Гупфер [61(170)] указывают, что, начиная с pH = 4,3, происходит сильный гидролиз. В растворах для титрования условия еще менее благоприятны, так как обычно концентрация Nb в них значительно большая, чем в растворах для полярографии.
Лесснер и Шарф [60(3)] сообщают, что ниобий (V) ведет себя аналогично титану, и при добавлении к раствору перекиси
215
водорода происходит стабилизация комплекса с ЭДТА. Причиной этого является замещение ОН-групп группами —О—О—Н в координационных местах, не занятых ЭДТА, вследствие чего дальнейший гидролиз прекращается. Чисто внешне образование смешанного комплекса Nb с Н2О2 и ЭДТА становится заметным по появлению желтой окраски; область существования смешанного комплекса (в зависимости от pH) была установлена фотометрически. Ионы пероксониобия (V) при рН = 3—4 в состоянии вытеснять ионы меди из ее комплекса с ЭДТА. Однако попытка использовать это свойство для определения ниобия потерпела неудачу, так как для перехода окраски в точке эквивалентности требуется излишек 0,05 7W раствора ЭДТА более чем в 1 мл.
Ионы пероксониобия (V) реагируют и с другими хелатообразующими веществами. При pH = 3 с ДЦТА образуется хелатный комплекс, который при pH = 5 уже настолько диссоциирован, что ДЦТА в присутствии ионов пероксониобия (V) полностью взаимодействует с ионами меди. Это обстоятельство использовано для определения титана в присутствии Nb (и Та). Полуколичественные данные о смешанных комплексах Ti, Nb и Та сообщают Ласснер и Пюшель [63(37)].
Пероксокомплекс ниобия реагирует также с металлиндикато-рами [63 (37)]; например, с метилтимоловым синим при pH=5 он образует темно-синее соединение. Этот факт используют для высокоселективного определения ниобия [62(77)].
Ионы пероксониобия (V) образуют наиболее прочные комплексы с НТА, ДТПА, ГЭДТА [63(37)]. Это обстоятельство позволяет проводить определения ниобия обратным титрованием титрованным раствором меди [33(38)]. К кислому раствору ниобия, содержащему перекись водорода, приливают в избытке 0,05 М раствор НТА и доводят pH раствора до значения 5,0—5,5 с помощью буферного ацетатного или уротропинового растворов. Далее обратно титруют избыток НТА 0,05 М раствором меди с флуоресцентным индикатором метилкальцеином. Соотношение Nb и НТА при реакции равно 1:1. При анализе чистых растворов ниобия с содержанием 1—5 мг Nb получено стандартное отклонение, соответствующее 0,008—0,011 мл 0,05 М раствора титранта.
Аналогичным образом можно проводить титрование с ГЭДТА. Обычно для того, чтобы хелатообразование было количественным, необходимо после добавки ГЭДТА довести раствор до кипения. Обратное титрование проводят по охлаждении до комнатной температуры.
Вакамацу [60 (170)] сообщает о косвенном комплексонометрическом определении ниобия. В присутствии перекиси водорода при pH = 6—6,5 ниобий осаждают хлоридом цинка из 30 %-ной водно-ацетоновой смеси. Отфильтрованный осадок растворяют в НС1, прибавляют ЭДТА и потом в ацетатном буферном растворе обратно титруют избыток ЭДТА раствором меди с ПАН при pH = 4—5. При точно выдержанных условиях состав образовавшегося осадка
216
соответствует соотношению 2n: Nb « 0,4, что является основой для вычисления результатов анализа. Метод рекомендуется для определения ниобия в железе и стали.
Опубликованные в литературе сведения о тантале еще более скудны, чем о ниобии. Кирби и Фрайзер [61(171)] исследовали реакцию комплексообразования между Та и ЭДТА полярографическим методом. В интервале pH от 3,3 до 5,6 потенциал полуволны тантала сдвигается при прибавлении ЭДТА с —1,23 до —1,36 в. В процессе восстановления Tav до TaIV участвует один протон. О составе и устойчивости легко гидролизующегося комплекса не имеется никаких сведений.
Метод титрования ниобия раствором НТА, описанный выше, пригоден и для тантала (частное сообщение Ласснера), однако имеется мало данных, касающихся применимости метода, величины ошибок, помех и т. п., для того чтобы можно было сделать окончательные выводы. В работе Вакамацу [60(170)] имеется примечание, что «тантал ведет себя аналогично ниобию», из чего, однако, не следует, что описанный выше косвенный метод определения ниобия применим и к танталу.
Помехи, являющиеся следствием присутствия ниобия и тантала при титровании других металлов, незначительны. То, что является затруднением при титровании Nb или Та, а именно, высокая склонность ниобия и тантала к образованию полиядерных комплексов, в данном случае является преимуществом, так как оба металла выпадают в осадок. Конечно, приходится считаться с соосажде-нием, а иногда с адсорбцией индикатора гидроокисью ниобия (или тантала). Осадок можно удалить маскированием с помощью винной кислоты или фторид-ионов, чем пользуются в том случае, когда определенный металл не реагирует с данным маскирующим веществом. Этот метод получил применение при определении кобальта [59 (2)] и молибдена [59 (3)].
21. ХРОМ
Скорость реакции комплексообразования между хромом и ЭДТА (и другими комплексообразующими веществами этого типа) настолько мала, что даже не возникает мысли о прямом титровании Сг; его можно определять лишь обратным титрованием. Но здесь сталкиваются с определенными трудностями. Комплекс CrY~, устойчивый при pH ниже 5—6, окрашен в интенсивный краснофиолетовый цвет; выше pH 6—7 присутствуют гидроксокомплексы красно-синего цвета, поэтому приходится считаться с перекрыванием окраски индикатора в точке эквивалентности, если содержание хрома в обычно применяемом для титрования объеме раствора превышает несколько миллиграммов. Поэтому следует работать либо в сильно разбавленном растворе, либо фиксировать точку эквивалентности с помощью инструментальных методов. Применение флуоресцентных индикаторов улучшает положение. Интересный
217
способ описан Арбузовым и др. [61(75)]. Узкий пучок белого света пропускают через титруемый раствор на белый экран и на получающемся световом пятне с помощью соответствующего светофильтра наблюдают изменение окраски.
Чтобы хром полностью перевести в комплекс с ЭДТА, требуется длительное кипячение. По данным различных авторов, продолжительность кипячения составляет от 2 до 15 мин. Время, необходимое для кипячения раствора, зависит от характера и содержания примесей, и прежде всего от того, в какой форме присутствует сам "хром, т. е. в форме акво-, хлоро- или сульфатокомплек-са. Павлов и др. [60 (105в)] изучали влияние лиганда, связанного с агомом хрома, на количество ЭДТА, необходимое для полного комплексообразования. Они обнаружили четкое различие между хлоро-, нитрато- и сульфатокомплексами. На основе наших опытов выяснено, что продолжительность кипячения раствора менее 10 мин в общем случае недостаточна. Однако в особенно благоприятных случаях этого вполне достаточно. В общем реакцию можно ускорить с помощью восстановителей, так как небольшое количество хрома (II) катализирует комплексообразование хрома (III).
В этой связи представляет интерес сообщение Пршибила [51 (19)] о том, что комплексообразование между хромом (III) и ЭДТА протекает незамедлительно, если хромат-ионы восстанавливают в присутствии ЭДТА (возможно, аскорбиновой кислотой). Автор объясняет это тем, что комплексообразование между свободным ионом хрома и ЭДТА происходит моментально и полностью до того, как пройдет медленная реакции образования акво-, хлоро- и других комплексов. Айкенс и Рейли [62(74)] изучили эту реакцию более подробно и сделали предположение, что вначале быстро протекающая реакция комплексообразования проходит через промежуточную ступень связывания пяти- и четырехвалентного хрома, а затем происходит окончательное восстановление до хрома (П1) и уже самопроизвольное превращение ранее образовавшихся комплексов в комплекс с ЭДТА. Возможно, что образуется также небольшое количество хрома(II), которое оказывает каталитическое влияние. Однако Бек и Барди [61(166)] полагают, что восстановлению подвергается хроматокомплекс (СгОг^У. Этот комплекс должен существовать по аналогии с известными соединениями молибдата с ЭДТА.
Комплексонометрическое определение хрома отличается от других методов обратного титрования только тем, что анализируемый раствор подвергается более длительному кипячению для достижения полного комплексообразования. Уже полученный комплекс стабилен и прочен, благодаря чему возможно проведение обратного титрования при низких значениях pH, что выгодно с точки зрения селективности определения.
Вебер [56 (111)] обратно титрует пбсле 1—2 мин кипячения раствором железа при pH = 4—5 с Биндшедлера зеленым (старые растворы дают лучший переход окраски). Киннунен [55(4)] пред-
218
лагает проводить обратное титрование в аммиачной среде раствором марганца с эриохромом черным Т. В более поздней работе он рекомендует обратное титрование при pH = 4—4,5 раствором соли тория с ксиленоловым оранжевым, что весьма удобно, так как присутствующие щелочноземельные металлы не титруются совместно с хромом. В обеих статьях приводится время кипячения 15 мин Литеану [59(90)] кипятит в течение 5 мин и титрует раствором железа (П1) с применением тирона в качестве индикатора. Вейнер [57(16)] кипятит раствор в течение 10 мин и обратно титрует в аммиачной среде при 40° С раствором никеля с мурексидом. Обратное титрование раствором никеля применяет также Павлов [60 (105п)]. Кипячение в течение 15лши рекомендует также Уилкинс [59 (7)]. Обратное титрование он проводит раствором меди, причем в качестве флуоресцентного индикатора применяет кальцеин. Таким способом определяются большие количества хрома (до 40 мг и более в 100 мл). Ферма [60 (80)] обратно титрует также раствором меди при pH = 3—5 до тушения зеленой флуоресценции индикатора кальцеина, но вместо ЭДТА применяет ДЦТА. Этот метод выгоден тем, что хром можно определять в присутствии бихромат-ионов (или присутствующих в исходном раствора хромат-ионов). В то время как ЭДТА в кислом растворе уже на холоду окисляется бихроматом, ДЦТА не реагирует и при более длительном кипячении. Камерон [61 (136)] избегает затруднений, связанных с индикацией по изменению окраски индикатора, применяя экстрактивное определение в точке эквивалентности. Избыток ЭДТА после 5 мин кипячения и охлаждения раствора до комнатной температуры обратно титруют при pH = 8,5 раствором кобальта. В качестве индикатора используют роданид-ионы в присутствии трифенил-метиларсонийхлорида и хлороформа, так что после встряхивания можно наблюдать изменение окраски индикатора в органической фазе.
Пашак и Допплер [57 (29)] применяют для обратного титрования раствор железа (III) и определяют точку эквивалентности потенциометрически; предписывается кипячение в течение 5 мин. Хотя в приведенных примерах определяют всего лишь 3—4 мг хрома, надо полагать, что с помощью инструментальной индикации точки эквивалентности можно будет определять большее содержание хрома.
Калифа [62(75)] описывает фотометрический метод, который можно назвать квазипрямым. К нескольким равным порциям анализируемого раствора прибавляют возрастающие количества ДЦТА, кипятят и по охлаждении добавляют воду до одинакового веса (или объема). Измеряют поглощение света и строят график зависимости светопоглощения от добавленного количества раствора титранта. По общепринятому методу экстраполяции устаналивают точку эквивалентности. Этот весьма сложный способ едва ли имеет перспективу конкурировать с более простым методом обратного Титрования.
219
Изучены помехи, появляющиеся вследствие присутствия хрома при титровании других металлов, и найдено, что они могут быть легко устранены. Исключительная реакционная инертность хрома оказывается в этом случае выгодной, так как упомянутые другие металлы полностью оттитровываются, пока хром успеет прореагировать с титрантом в количестве, мешающем определению. Рейли очень метко назвал это «кинетическим маскированием». При титровании в щелочном растворе хром может мешать вследствие образования осадка гидроокиси. Однако добавка винной кислоты предотвращает выпадение осадка. Вопросами химического маскирования неоднократно занимался Пршибил [61(94)]. Продолжительным кипячением (5 мин) с триэтаноламином хром можно перевести в триэтаноламиновый комплекс, окрашенный в темный рубиново-красный цвет. Однако, несмотря на то, что хром маскируется, он мешает, перекрывая переход окраски индикатора в точке эквивалентности, за исключением случаев, когда присутствует в малых количествах. Максимальная концентрация хрома, не вызывающая помех, зависит от применяемого индикатора и еще от возможного сильного разбавления анализируемого раствора в процессе титрования. В качестве одной из возможностей маскирования упоминается длительное кипячение с аскорбиновой кислотой. Раствор приобретает синевато-зеленый цвет, и после добавки аммиака выделения гидроокиси хрома не происходит. Предполагается, что образуется комплексное соединение. Окраска его довольно слабая, и, например, Са, Мп или Ni можно титровать в аммиачном растворе в присутствии хрома в концентрации до 1 мг/мл. Пршибил отмечает, что хромат-ион в щелочной среде не реагирует с индикаторами метилтимоловым синим и тимолфталек-соном, тогда как эриохром черный Т окисляется и разрушается в течение 10 мин. Это открывает возможность маскировать хром, переводя его в хромат; однако ничего не сказано о том, каким методом окисления лучше пользоваться
Инертность хрома частично используется при его определении в присутствии других металлов и при проведении последовательных титрований, причем в большинстве случаев наиболее целесообразной является работа с аликвотными порциями раствора.
Вебер сообщает [56(111)] о последовательном определении смеси Fe—Сг. Сначала железо титруют раствором ЭДТА при комнатной температуре в смеси ацетатного и монохлорацетатного буферного раствора с pH = 3,5 с индикатором Биндшедлера зеленым. К оттитрованному раствору приливают в избытке ЭДТА и кипятят в течение 5 мин\ охлажденный до комнатной температуры избыток ЭДТА обратно титруют раствором железа. При кипячении индикатор не разрушается.
Литеану [59(90)] описывает последовательное титрование смеси А1—Сг. К анализируемому раствору сначала приливают в избытке ЭДТА, доводят pH раствора до значения 5—6 и нагревают в течение 5 мин при 40—50° С, причем А1 полностью связывается в ком
220
плекс, тогда как Сг, очевидно, не вступает в реакцию. По охлаждении до 20° С проводят обратное титрование раствором железа с тироном. К оттитрованному раствору снова прибавляют в избытке ЭДТА и кипятят в течение 5 мин. Затем охлаждают до комнатной температуры и повторяют обратное титрование раствором железа; из полученных данных рассчитывают содержание хрома. Метод разработан для определения около 1—6 мг СггОз и AI2O3. При повышении pH раствора в процессе титрования и большем содержании окислов металлов неизбежными будут помехи вследствие выпадения осадков гидроокисей.
Пашак и Допплер [57 (29)] описывают способ разделения смесей Fe—Al—Сг. К аликвотной пробе анализируемого раствора pH = 1,5 приливают ЭДТА, нагревают до 50° С и тотчас обратно титруют потенциометрически избыток ЭДТА раствором железа. Это титрование дает содержание железа. Ко второй аликвотной пробе прибавляют ЭДТА, кипятят в течение 5 мин, охлаждают до 40° С и доводят pH раствора до значения 5—6 с помощью ацетатного буферного раствора. Обратное титрование раствором железа дает общее содержание всех трех компонентов смеси. В третьей, аналогично обработанной аликвотной пробе обратным титрованием, проведенным при pH = 1,5, определяют общее содержание железа и хрома.
Практическое применение комплексонометрическое определение хрома находит в анализе ванн для хромирования [58(97)]. Однако ЭДТА в присутствии хромовой кислоты окисляется, поэтому рекомендуется проводить осаждение последней нитратом ртути(I). Так как Hg1 диспропорционируется в присутствии ЭДТА, следует удалять избыток осадителя, что достигается прибавлением ионов хлора. Оба осадка крупнокристаллические, быстро оседают, не обладают склонностью к соосаждению и вместе отфильтровываются. Павлов с сотр. [60 (105^)] определяют хром в пленках высокополи-мерных материалов. Пленку кипятят с раствором ЭДТА, при этом происходит быстрое растворение хрома. Потом прибавляют титрованный раствор никеля и избыток последнего титруют с мурексидом.
Об определении хрома в минералах и сталях после окисления до хромата см. ниже.
Хромат- и бихромат-ионы можно определять после их восстановления до хрома(III). Айкенс [62(74)] восстанавливал их в избытке ЭДТА. В этом случае отпадает необходимость в продолжительном кипячении раствора, так как хром тотчас и притом полностью связывается в комплекс, если соблюдаются правильные условия. Восстановление происходит при взаимодействии с бисульфитом натрия в растворе с pH = 6,6, содержащем триэтаноламин или триэтаноламин в смеси с ацетат-ионами. Соотношение хромата и бисульфита в реакционной смеси зависит от количества присутствующего хромата, что вызывает затруднения при практическом применении этого метода. Обратное титрование избытка ЭДТА
221
проводят при pH = 2,5—3,5 раствором соли тория с ксиленоловым оранжевым.
Хромат и бихромат, как и другие анионы, можно определять, осаждая их катионом, титоуемым комплексонометрически. Это позволяет определять хром после окисления его до хромат-ионов. Исходя из этой возможности, Исагаи и Таткешита [55 (22)] разработали метод, в котором хромат-ионы осаждают титрованным раствором бария и избыток последнего в фильтрате титруют обратно раствором ЭД ГА. Этот метод был использован для определения хрома в сталях после отделения Fe и Си на ионообменной смоле Дауэкс IR-120 (в Н+-форме).
Суса применил [61 (25)] этот метод к определению хрома в минералах. Из-за возможных помех со стороны других металлов во время титрования он предлагает определять Ва в отфильтрованном осадке. Для этого осадок растворяют в кислоте, хромат-ионы восстанавливают иодидом калия и хром осаждают в виде гидроокиси. В фильтрате находится только Ва, который может быть легко оттитрован с металлфталеином (см. стр. 182).
22. МОЛИБДЕН
Молибден, как шести- так и пятивалентный, образует комплексы с ЭДТА состава Mo : Y = 2 : 1, что впервые было установлено полярографическим методом [56 (30)]. Комплекс с Mov более устойчив, чем с MoVI, и даже настолько прочен, что способен вытеснять медь из ее комплекса с ЭДТА [59 (3)]. О прочности комплекса можно судить по тому, что хотя Mov и не в состоянии вытеснить Bini из его комплекса с ЭДТА, однако уже образовавшийся комплекс Mov — ЭДТА противостоит разложению под действием висмута [59(3)].
О косвенном комплексонометрическом определении Мо впервые сообщил де Суса [55(99)]. Метод основан на осаждении молибдата кальция и определении Са в осадке. Впоследствии Ласснер и Шлезингер [57(21)] улучшили и упростили этот метод. На том же принципе осаждения основан метод Умеда [60 (97)], который проводит осаждение титрованным раствором свинца и избыток свинца обратно титрует при pH = 10 раствором ЭДТА в аликвотной части фильтрата. Методы осаждения потеряли практический интерес с того момента, как были разработаны более прямые методы титрования.
При описании методов определения металлов обратным титрованием избытка ЭДТА титрованным раствором цинка с применением смешанного индикатора, состоящего из гексацианоферра-тов(П) и (III), для индикации точки эквивалентности Сайо упоминает также об определении молибдена [56(99)]. Однако в работе ничего не сказано о способе проведения определения, точности, чувствительности метода и т. п. Киннунен [58(80)] кратко информирует об определении MoVI обратным титрованием избытка ЭДТА при оН = 5,5 раствором цинка и применении в качестве индика-222
тора ксиленолового оранжевого. Он сообщает, что точка эквивалентности так плохо и нерезко выражена, что практическое использование метода находится под вопросом. При таких условиях титрования, как предполагают, образуется комплекс в молярном соотношении 1 : I. Бусев и Чжань Фань [59 (62)] обстоятельно изучили этот метод и установили его непригодность. После испытания большого числа веществ они сообщают о пригодности смешанного индикатора, составленного из пирокатехииового фиолетового и индигокармина. Анализируемый раствор с pH около 4—5 титруют теплым; можно определить от 80 до 300 мг Мо с точностью около 2%. Образование комплекса в отношении 2: 1 подтверждается полярографическими данными. Определению мешают W, Мп, Fe, Zn, Ni, Си и Со. В холодных растворах не мешают Sr, Са и Mg, тогда как при нагревании они способствуют выпадению осадков; Ва всегда вызывает выпадение осадка. Точку эквивалентности можно зафиксировать также амперометрическим методом, но результаты сильно зависят от pH раствора, так что следует очень точно поддерживать его оптимальное значение, равное 4,7.
Более обещающими являются методы, основанные на образовании комплексов с пятивалентным молибденом. Во всех предложенных методах для быстрого и полного восстановления применяют сернокислый гидразин. Состав комплекса ЭДТА с Мо, окрашенного в интенсивно желтый цвет, также отвечает соотношению 2: 1. Восстановление проводят в сильнокислом растворе в присутствии ЭДТА, избыток которой затем обратно титруют при соответствующем pH раствора. Бусев и Чжань Фань [59(61)] обратно титруют раствором цинка с эриохромом черным Т при pH = 10. Целесообразнее проводить титрование в кислой среде вследствие большей его селективности, прежде всего потому, что при этом W не мешает даже тогда, когда присутствует в значительной концентрации. Клыгин и Коляда [61 (90)] применяют для обратного титрования сульфат циркония, растворенный в 1 н. растворе серной кислоты. Гедридж [60 (83)] считает непригодным проведение обратного титрования раствором цинка с ксиленоловым оранжевым при pH = 5,3, так как всегда получаются заниженные результаты. Возможной причиной этого считают образование перекиси водорода при относительно высоком значении pH. Поэтому следует проводить обратное титрование при более низком pH, но уже без ксиленолового оранжевого. В качестве индикатора при этом применяют ализаринкомплексон, и точку эквивалентности фиксируют фотометрически. Эндо и Томори [62(125)] ничего не сообщают о получении заниженных результатов, когда титрование проводят раствором соли свинца с ксиленоловым оранжевым в растворе, содержащем уротропин. Обратное титрование раствором меди с ПАН при pH = 4,5 описали Кавачата и др. [62 (41)].
Бусев и Чжань Фань [59(61)] кратко упоминают о возможности прямого титрования Mov при pH = 1,8 фотометрическим методом (при длине волны 387 нм).
223
Особенно обстоятельно изучением хелатометрического определения молибдена занимались Ласснер и Шарф [59 (3), 61 (138), 61(139)]. Приводимые ниже методики основаны на работах этих авторов.
Молибден (VI) мешает определению других металлов, если титрование проводят в слабокислом растворе. Вследствие частично происходящего хелатообразования с ЭДТА получается размытый переход окраски индикатора и в некоторых случаях перерасход титранта. Некоторые индикаторы полностью блокируются молибденом. Ацетилацетон, одно из возможных маскирующих средств в кислой среде, маскирует, однако, и большое число других металлов [60 (30)]. При pH = 10 молибден (VI) не мешает определениям, так как он присутствует в форме аниона, который не реагирует с ЭДТА, но следует иметь в виду возможность образования труднорастворимой соли металла. В этих случаях метод обратного титрования устраняет затруднения.
В аналитической практике определение Мо находит применение в анализе сплавов [63 (43)], в особенности твердых металлов [59 (3), 61 (138)], ферромолибдена [62 (41), 62 (125), 63 (43)] и трех-окиси молибдена [62 (41), 62 (125)].
Определение молибдена обратным титрованием
Реактивы
ЭДТА, 0,05 М раствор.
Сульфат меди (II), 0,05 М раствор.
Серная кислота, раствор 1:1.
Аммиак, концентрированный раствор.
Сернокислый гидразин.
Винная кислота.
Этиловый спирт.
ПАН.
Ход определения. Анализируемый раствор, содержащий не более 30 мг Мо в 100 мл, приблизительно нейтрализуют и приливают к нему в избытке раствор ЭДТА. Вносят 5 г винной кислоты, от 2 до 5 г сернокислого гидразина, подкисляют 2 мл раствора серной кислоты (1:1) и кипятят в течение 5 мин. Затем доводят pH раствора с помощью аммиака до значения около 4 и прибавляют этиловый спирт в количестве, соответствующем 30 %-ному его содержанию в анализируемом растворе. Прибавляют индикатор ПАН и титруют раствором CuSC>4 до появления фиолетовой окраски, после чего тщательно снова обратно титруют раствором ЭДТА до чисто-желтого цвета.
Расчет. 1 моль ЭДТА реагирует с 2 г-атом Мо. Следовательно, 1,00 мл 0,0500 М раствора ЭДТА соответствует 9,594 мг Мо.
Замечания. Применение высокочастотного титрования (см. стр. 112) сильно снижает капельную ошибку. Определение можно проводить в присутствии значительного содержания W, который
224
полностью маскируется винной кислотой. В отсутствие тартрат-ионов вольфрам препятствует полноте восстановления молибдена. Винная кислота маскирует также ионы Ti, Nb и Та. Фторид-ион можно привлечь для маскирования ионов Th, Al, Се и U. Мешают определению ионы Bi, Zn, Со, Cd, Ni, Си, Mg, V, Сг и Pb, для которых в настоящее время не известно эффективное в данных условиях титрования маскирующее вещество; Fe111 мешает, так как оно восстанавливается до Fe11, которое восстанавливает Си2+-ионы при обратном титровании.
Однако возможно определение Мо в присутствии небольших количеств примесей (кроме Fe) при следующих условиях. В аликвотной порции анализируемого раствора проводят титрование раствором ДЦТА вместо ЭДТА без предварительного восстановления сернокислым гидразином. Молибден (VI) не связывается совсем или лишь незначительно связывается комплексоном ДЦТА, поэтому по результатам титрования определяют общее содержание всех металлов, кроме Мо. Во второй аликвотной порции титрование проводят после восстановления сернокислым гидразином н получают общее содержание остальных металлов и молибдена; содержание последнего вычисляют по разности.
При микроопределении 0,5—2 мг Мо титрование можно проводить 0,005 М раствором ЭДТА в присутствии до 5.00-кратного количества W.
При больших концентрациях Мо мешает интенсивная желтая окраска его комплекса с ЭДТА. В этом случае целесообразно в идентичных условиях определения (спирт можно не прибавлять) титровать с кальцеином в УФ-лучах, причем точку эквивалентности устанавливают по тушению интенсивной зеленой флуоресценции; можно с большой точностью определить до 90 мг Мо.
23. ВОЛЬФРАМ
Попытки определения W прямым или обратным титрованием до настоящего времени заканчивались неудачей. Киннунен [58(80)] попробовал пойти следующим путем. К сильнокислому раствору, содержащему вольфрамат-ионы, он приливал определенный объем ЭДТА, доводил pFI раствора прибавлением ацетатной буферной смеси до значения 5 и избыток ЭДТА титровал обратно титрованным раствором Т11П с ксиленоловым оранжевым. Однако точка эквивалентности настолько плохо выражена, что практическое применение этого метода невозможно.
Косвенные методы оказались более успешными. Де Суса [53 (60)] осаждает вольфрамат кальция и определяет содержание кальция в отфильтрованном и промытом осадке. Белковская [62(84)] проводит определение W следующим образом. К анализируемому раствору, содержащему около 1 мг W в 1 мл, она приливает отмеренный объем 0,1 М раствора Pb(NO3)2, выпавший в осадок вольфрамат свинца отфильтровывает и избыток свинца
15 Зак. 553
225
в фильтрате определяет обратным титрованием добавленного раствора ЭДТА раствором цинка с эриохромом черным Т.
Ласснер и Шарф изучали, как мешает вольфрам определению других металлов. Особенный интерес представляет изучение влияния W на титрование Мо. Маскирование W винной кислотой [59 (3)] проходит успешно, так как тартрат-ион не мешает титрованию определяемых металлов. Следует упомянуть данные [61 (139)], указывающие, что комплекс ДЦТА с W, по-видимому, менее прочен, чем комплекс ЭДТА. Поэтому авторы рекомендуют применять первый комплексон в качестве титранта при титровании других металлов, при этом отпадает необходимость маскировать вольфрам. В качестве индикатора при прямых титрованиях используют систему Си—ПАН —ДЦТА, а при обратном титровании раствор меди с ПАН.
24. УРАН
Точное исследование реакции комплексообразования иона уранила с ЭДТА впервые провел Кэбелл [52 (41)]. На основании результатов ацидиметрического титрования растворов, содержащих в избытке ионы уранила и ЭДТА, было установлено, что образуется комплекс в отношении UO2+:Y = 2:1. Существование других буферных областей дает возможность предположить, что образуются также протонированные комплексы. Кривые титрования можно рассматривать лишь до pH около 6, так как затем они искажаются (из раствора выпадают осадки). Девис [61(146)] исследовал -полярографическим методом равновесие между уранилом и ЭДТА, но не смог ни уточнить, ни расширить результаты Кэбелла. Хара и Уэст [55(42)], применив высокочастотный метод как для ацидиметрических титрований смесей уранила с ЭДТА, так и для прямого определения уранила раствором ЭДТА, получили кривые титрования с очень резкими перегибами, соответствующими точному отношению UO2+:Y = 2:1. Рао и сотр. [57 (12)] установили такой же состав с помощью диаграмм по Джобу. Обширное исследование провели Козлов и Крот [60(172)]. На основе спектрофотометрических измерений показано существование трех различных комплексов, которые были получены также препаративным методом. При pH ниже 2 присутствует уже описанная Бритцингером и Гессе [А (9)] «соль» UO2H2Y в ионизированном состоянии. При повышении значения pH раствора образуется комплекс (СОгЦУ, устойчивый в интервале pH от 3 до 6, если отношение молярных концентраций UQ2 и Y составляет около 2:1,2. При прибавлении возрастающих количеств ЭДТА присоединяется еще одна молекула лиганда и образуется комплекс иОгУ2- с молярным отношением 1 : 1. Возможность существования протонированных комплексов была исключена на основании теоретических соображений, но было предположено образование гидр-оксокомплексов и при pH >7 — полимерного продукта гидролиза уранила. В присутствии достаточного избытка ЭДТА можно избе
226
жать гидролитического осаждения уранила при pH раствора до 8—9,5. Козлов и Крот на основании фотометрических данных вычислили константы устойчивости комплексов и получили для (UOshY и PJOsY2- значения 1g К = 15,2±0,3 и 10,4±0,2, соответственно (24° С, ц = 0,1).
Если принять во внимание, что во избежание осаждения приходится работать при относительно низких значениях pH, причем необходимо считаться с высоким значением 1g ан, то не удивительно, что при полученных таким образом низких значениях эффективных констант устойчивости титрование уранила наталкивается на трудности.
Хара и Уэст [55(42)] сообщают о возможности титрования уранила осциллополярографическим методом лишь в очень разбавленных растворах, почти полностью свободных от примесей. Лес-снер и Шарф [58 (83)] исследовали возможность титрования с визуальной индикацией конечной точки. При прибавлении определенных органических растворителей они добились достаточного повышения значения эффективных констант устойчивости, чтобы сделать титрование возможным. Лучше всех оправдал себя изопропанол, прибавляемый в двойном объеме к анализируемому раствору. Титрование проводят при рН=4,4 (с уротропиновым буферным раствором) при нагревании (80—90° С) с применением индикатора ПАН, но переход красной окраски в желтую в точке эквивалентности недостаточно резкий. Высокоселективное определение уранила в смеси с ионами других металлов возможно следующим образом. Титрование проводят, как описано выше, и получают при этом общее содержание уранила и других титруемых металлов. Затем прибавляют фосфат натрия, причем в осадок выпадает весь присутствующий в растворе уранил, после чего титруют выделившееся в свободном состоянии эквивалентное по отношению к уранилу количество ЭДТА. Сравнительно высокое содержание изопропанола ограничивает применение метода сильно разбавленными растворами, так как растворимость солей в смеси изопропанол : вода = 2:1 незначительна.
Ионы уранила вряд ли мешают комплексонометрическому титрованию других металлов, кроме случаев, когда возможно осаждение нерастворимых соединений или блокирование индикаторов. И то, и другое легко устранимо в щелочной среде, если замаскировать уранил карбонат-ионами [52(25)] или перекисью водорода [58(82)].
Определение четырехвалентного урана дает значительно лучшие результаты. Константу устойчивости комплекса UIVY в молярном соотношении 1 : 1 вычислили из фотометрических измерений Клыгин с сотр. [59(126)] и нашли ее равной 4,2- 1025, что подтвердилось в работе [62(81)] таким же порядком этой величины (6,8-1025). Киннунен [57(137)] первым описал определение UIV. Растворы уранила при рН = 3—4 в присутствии ЭДТА восстанавливают аскорбиновой кислотой при кипячении в течение 10 мин-, по
15*
227
охлаждении доводят pH раствора до значения 2—3 и обратно титруют избыток комплексообразующего вещества раствором соли тория или таллия (ПР с ксиленоловым оранжевым. Метод был проверен Ловаси [61 (67)] и применен для определения содержания примесей, содержащихся в урановых растворах. Будешински и др. [62 (124)] проводили восстановление с помощью S2O^ -ионов и обратное титрование избытка ЭДТА раствором соли тория с метилтимоловым синим.
Клыгин [61 (89)] при продолжительном кипячении в течение 5—8 мин восстанавливает уранил амино-иминометансульфиновой кислотой и прямо титрует при pH = 1,7 раствором ЭДТА, применяя арсеназо I в качестве индикатора. Значение pH должно поддерживаться в пределах ±0,1 единицы. Рождественская и др. [63(48)] пользовались тем же методом восстановления, но проводили при pH = 2 прямое амперометрическое титрование с графитовым электродом при +0,2 в (по отношению к насыщенному мер-кур-иодидному электроду).
Палей и Сюй Ли-юань [61 (79)] титруют UIV с тороном при pH = 1—1,8. При низком значении pH титрование вполне селективно. Щелочные, щелочноземельные металлы, Mg, Zn, Cd, Al, La, Сеш, TiIV, Мп, Crni, Ni и Pb не мешают; допускается присутствие Th, CeIV и Fe11 в отношении 10: 1, тогда как Со, Си, Bi и Hgn должны совершенно отсутствовать. Мешают также фторид-ионы.
Коркиш [61 (36)] проводит титрование UIV в растворах от 0,01 до 0,2 н. по соляной кислоте, содержащих 1 мг U в 1 мл. Соло-хром черный 6В применяют в качестве индикатора; в точке эквивалентности он изменяет синюю окраску в красную; Bi, Си, Zr, Hf, Th и Sn11 мешают, образуя синие комплексы с индикатором. Восстановление в анализируемом растворе до UIV осуществляется непосредственным внесением гранулированного цинка или пропусканием раствора через цинковый, свинцовый или серебряный редуктор. Образовавшийся U111 подвергают воздействию кислорода воздуха в течение 1—2 мин, при этом он окисляется до четырёхвалентного урана. По этой методике можно проводить также микроопределения.
Как видно из литературы, исследования помех со стороны примесей проводились таким образом, что мешающий элемент прибавляли к анализируемому раствору после восстановления урана. В известной степени это искажало истинную картину, так как некоторые элементы, прибавленные к исходному раствору, после восстановления уже не присутствуют или присутствуют в очень малом количестве и в таком валентном состоянии, которое не мешает определениям. Например, CeIV восстанавливается до Сеш, который уже не мешает; Hg11 выделяется на редукторе в виде металлической ртути и задерживается и т. д. Поэтому эти методы, по-видимому, являются более селективными, чем кажется. Правда,
228
в некоторых случаях необходимо выделять уран экстракцией или ионным обменом; по этому вопросу в литературе имеется много безукоризненных и быстрых методик. Описание практического применения данных методов вряд ли до сих пор где-нибудь опубликовано.
25. МАРГАНЕЦ
Комплексонометрическое определение марганца уже давно было описано Бидерманом и Шварценбахом [48(5)] и проводится с помощью обратного титрования избытка ЭДТА раствором магния с эриохромом черным Т. В качестве раствора для обратного титрования можно применять также раствор цинка. Флашка сообщает о микроопределении марганца [52(22)] после реакции вытеснения с MgY2- и о прямом определении микро- [53 (24)] и макроколичеств [53(25)]. Прямое титрование с эриохромом черным Т не вызывает затруднений, если определения проводят при pH около 10 и прибавляют восстановитель, препятствующий окислению Мп11. В качестве восстановителей в аналитической практике употреблялись аскорбиновая кислота и гидроксиламин.
В случае больших концентраций марганца и при применении обычных буферных растворов с pH = 10 образуется Мп (ОН) 2-Хотя выпавшая муть исчезает в процессе титрования, все же следует проводить титрование медленно. Поэтому Флашка [53 (24), 53(25)] предлагает прибавлять тартрат-ион в качестве вспомогательного комплексообразующего вещества, чтобы помешать осаждению. Так как тартратный комплекс марганца реагирует с комплексоном медленно, нужно работать при повышенной температуре. Следует избегать слишком высоких концентраций тартрат-ионов, так как они неблагоприятно влияют на резкость перехода окраски индикатора. Поэтому Вебер [57 (2)] проводит титрование без тартрата при pH = 8, когда еще не происходит выпадения гидроокиси марганца. Конечно, емкость применяемого аммиачного буферного раствора при таком низком значении pH невелика. Пршибил [54(79)] удерживает Мп в растворе с помощью триэтаноламина. В этом случае особенно важна добавка аскорбиновой кислоты или гидроксиламина, так как иначе происходит окисление Мп11 и образование комплекса Мпш — триэтаноламин зеленого цвета, который комплексонометрически неактивен. Однако, по-видимому, наиболее простой способ состоит в соответствующем сильном разбавлении анализируемого раствора, что не оказывает влияния на точность результатов; при этом комплексы Мп как с индикатором, так и с ЭД ГА достаточно устойчивы, чтобы можно было гарантировать получение прекрасного перехода окраски даже в сильно разбавленных растворах.
Так как при комплексонометрическом титровании марганец ведет себя аналогично магнию, практически все индикаторы на магний могут быть использованы в тех же условиях и для титрования марганца, поскольку к раствору прибавляют лишь восстановитель.
229
Следовательно, можно применить о, о’-диоксиазокрасители [53(42)], пирокатехиновый фиолетовый [56(41)] и другие индикаторы. Точка эквивалентности получается более резкой благодаря большей константе устойчивости комплекса с марганцем. Исходя из этого, Киннунен [55—(4)] предложил заменить часто применяемый при обратных титрованиях титрованный раствор магния титрованным раствором марганца. Кроме того, Мп можно титровать с такими индикаторами, которые при определениях магния не применяются или приводят к неудовлетворительным результатам, например фталеинкомплексон [58(2)], метилтимоловый синий [58(102)], эриохром красный В [57 (2)], смешанный индикатор, состоящий из ванадия с дифенилкарбазидом [63(1)], флуоресцеинкомплексон [59(22)], метилкальцеин и метилкальцеин синий [60(65)] и муре-ксид [62(126)].
Определять марганец можно также обратным титрованием избытка ЭДТА раствором соли кобальта в 50 %-ной ацетоно-водной смеси в присутствии KSCN [60 (169)]. Обычно применяют также индикацию точки эквивалентности инструментальными методами, как-то: кондуктометрическим [54 (32)], фотометрическим [53 (45), 54 (69), 54 (70)], потенциометрическим (с ртутным капельным электродом) [57 (8), 58 (Н), 58(12),60(29)] и высокочастотным[54(47)].
Константа устойчивости комплекса MnY2- (1g К =13,8) слишком мала, чтобы можно было просто титровать Мп в присутствии щелочноземельных металлов. С другой стороны, константа достаточно велика, так что Мп мешает титрованию тяжелых металлов, за исключением тех, которые имеют очень прочные комплексонаты со значением 1g К > 20. Это существенно для практических анализов, так как либо Мп является примесью, либо его определение затруднено или даже невозможно в том случае, если сопутствующие металлы трудно маскируются. Особое значение имеют смеси Са, Mg, Мп и Fe, Al, Мп, часто встречающиеся при анализе силикатов, причем в зависимости от проведения операции разделения марганец может присутствовать в первой или второй группе. Существует много исследований по разделению обеих групп. Сообщается о более или менее успешных опытах последовательных титрований.
Одной из возможностей является разделение, например отделение марганца от щелочноземельных металлов и магния с помощью тиоацетамида [55 (62)] или от железа осаждением в виде МпОг при помощи КСЮз [55 (68)] или же отделение железа экстракцией [54 (39)]. Конечно, маскирование или последовательное титрование являются более изящными методами и прежде всего менее продолжительными. Первые опыты по маскированию Мп провел Пршибил [53(H)], предложивший триэтаноламин. Б щелочной среде благодаря окислению воздухом образуется интенсивно окрашенный в изумрудно-зеленый цвет комплекс трехвалентного марганца с триэтаноламином, устойчивый к действию ЭДТА. Однако из-за яркой собственной окраски комплекса содержание маскируе
230
мого таким образом марганца должно быть ограничено; если присутствует более 3—4 мг его в 400 мл конечного раствора, переход окраски большинства индикаторов так сильно перекрыт, что они для титрования непригодны. В растворе, содержащем замаскированный марганец, Пршибил титрует Са с мурексидом.
Маскирование Са и Mg фторид-ионами, впервые описанное Пршибилом [54(74)], использовал Вебер [57(2)] при определении Мп. Можно замаскировать до 10 мг магния; в присутствии возрастающего количества Са получаются заниженные значения для Мп, особенно при содержании Са около 15—20 мг. Это обусловлено адсорбцией марганца фторидом кальция, как показали Повондра и Пршибил [61(84)]. Это затруднение можно устранить, если к раствору, содержащему Мп, Са и Mg, прибавить в избытке ЭДТА, раствор подщелочить и потом внести фторид-ионы. Так как теперь Са и Mg связаны с ЭДТА, то осадок пока не образуется вовсе. После этого проводят обратное титрование раствором марганца (в котором содержится немного гидроксиламина), причем сначала связывается избыток ЭДТА, а затем вытесняются из комплексоната Са и (или) Mg, выпадающие в осадок в виде фторидов, причем никакой адсорбции не происходит, так как марганец присутствует в виде комплекса с ЭДТА. Точка эквивалентности при обратном титровании фиксируется по резкому переходу синей окраски эриохрома черного Т в красную.
Радько [60 (77)] отделяет Мп, Са и Mg друг от друга при помощи титрования в трех аликвотных порциях. При pH — 10 в присутствии гидроксиламина определяют общее содержание трех катионов титрованием с кислотным хромом тенмо-синим в качестве индикатора. При pH = 12 определяют Са после осаждения Мп с помощью Na2S и Mg в виде гидроокиси. В заключение определяют марганец, после того как Са и Mg будут замаскированы в виде фтоРидов. При анализе руд Мацуи [61(47)] определяет марганец титрованием в двух аликвотных порциях. В первой порции после добавки триэтаноламина и гидроксиламина определяют сумму Са, Mg и Мп. Ко второй аликвотной порции прибавляют лишь триэтаноламин, при этом маскируется Мп и определяется сумма Са и Mg. В обоих случаях в качестве индикатора применяют метилтимоловый синий. Последовательное титрование смеси Fe—Мп проводят, согласно Радько [60 (76)] следующим образом. Сначала титруют Fe при pH = 2—3 с сульфосалициловой кислотой, затем прибавляют тартрат-ион и гидроксиламин, доводят pH раствора до значения 10 и титруют с кислотным хромом синим. Можно также определять смесь А1—Мп или (Al + Fe) —Мп, при этом сначала определяют А1 (или сумму Fe и А1) обратным титрованием избытка ЭДТА раствором железа с сульфосалициловоп кислотой при более низком значении pH и затем, как уже упоминалось выше, определяют Мп (см. также [60 (169)]).
Хотя значение константы устойчивости комплекса марганца с ЭДТА более чем достаточно для получения резкой точки
231
эквивалентности, все же исследователи уделяли внимание и применению ДЦТА, образующей более устойчивый комплекс. Это объясняется’ не столько большей устойчивостью комплекса с Мп, сколько большой разницей между константами устойчивости комплекса с Мп и комплексов с Са и Mg. Согласно Кэрэшу [58 (102)], при применении ДЦТА марганец титруется еще при pH = 6—6,5 с метилтимоловым синим, а также в присутствии умеренных количеств (несколько миллиграммов) Са и Mg без необходимости их маски-.рования. Пршибил указывает [55(89)], что выгодно применять ДЦТА при последовательном титровании смеси Fe—Мп. При pH = 2—3 железо титруют с салициловой кислотой, а затем при pH = 10 марганец титруют с эриохромом черным Т. При аналогичных титрованиях с использованием ЭДТА в качестве титранта железо освобождается из комплекса и блокирует индикатор.
Марганец образует комплекс с цианид-ионами, слишком слабый, чтобы в обычных условиях титрования он мог препятствовать реакции с ЭДТА или с индикатором. Поэтому KCN можно использовать в качестве маскирующего средства для остальных катионов, образующих копмлексы с цианид-ионами [53 (25)], и поступать так же, как и в случае магния. Однако при особых обстоятельствах можно, согласно Пршибилу [61(93)], замаскировать, марганец с помощью цианид-иона. Готовят раствор с триэтаноламином, вначале сильнощелочной, что позволяет марганцу перейти, окисляясь воздухом, в комплекс Мпш — триэтаноламин. Затем добавляют KCN и снижают pH раствора до 10 прибавлением уксусной кислоты. Раствор становится почти бесцветным, так как образуется гексацианокомплекс марганца Мпш. Если отсутствуют Fe и А1, то можно определять Са. Таким способом можно замаскировать до 80 мг Мп. Есть и другой интересный способ окисления марганца в присутствии Fe. К кислому анализируемому раствору прибавляют триэтаноламин и подщелачивают добавлением 20—30 мл концентрированного раствора аммиака. Затем вносят KCN. Образовавшийся гексацианоферрат (III) окисляет при этом Мп11 согласно следующему уравнению реакции:
Fe(CN)|“ + Mn(CN)|- ^=> Fe(CN)g_ + Mn(CN)|-
Необходимо, чтобы Fe присутствовало в количестве, больше эквивалентного по отношению к марганцу. Цианокомплексы Fe11, Мпш и избытка Fe111 комплексонометрически неактивны. Однако титрование щелочноземельных металлов наталкивается на трудности, так как, например, выпадает в осадок труднорастворимый цианоманганат кальция, который лишь медленно реагирует с ЭДТА.
Свинец и висмут можно замаскировать с помощью БАЛ [54(79)], после чего марганец, как обычно, титруют с эриохромом черным Т.
Практическое применение комплексонометрическое титрование марганца находит при определении Мп в металлургическом шлаке,
232
металлах и неорганическом сырье [61(84)], силикатных породах [61(47)], сиккативах [61(143)], сплавах [54(39)], зеркальном чугуне [55(68)] и ферромарганце [59(30), 60(92)].
Прямое определение марганца
Реактивы
ЭДТА, 0,01—0,1 7И раствор.
Триэтаноламин солянокислый, 20%-ный раствор.
Буферный раствор, pH = 10.
Эриохром черный Т.
Аскорбиновая кислота.
Ход определения. К кислому анализируемому раствору прибавляют 10—15 мл раствора солянокислого триэтаноламина и на кончике шпателя — аскорбиновую кислоту, нейтрализуют и доводят pH раствора до значения 10 с помощью нескольких миллилитров буферного раствора. Затем вносят индикатор и титруют до резкого перехода красной окраски в синюю.
Замечания. Триэтаноламин маскирует небольшие количества железа, а также алюминия. Если присутствует большое количество железа, следует прибавлять также KCN. В этом случае рекомендуется прибавлять большее количество аскорбиновой кислоты, чтобы восстановить весь образовавшийся гексацианоферрат (III), что целесообразно ускорить непродолжительным нагреванием. Титрование марганца следует, однако, проводить в холодном растворе, в противном случае алюминий блокирует индикатор. Магний и щелочноземельные металлы титруются совместно.
26. РЕНИЙ
Косвенное определение рения, присутствующего в виде перре-ната, проводят, согласно Хамагучи и Сугисита [61(172)], следующим образом. Перренат осаждают из слегка кислого или нейтрального' раствора в виде TlReO4, осадок подвергают центрифугированию, промывают и растворяют в смеси соляной кислоты и брома; при этом таллий (I) окисляется до таллия (III). Затем доводят pH раствора до значения 5 и титруют раствором ЭДТА с ксиленоловым оранжевым. Молибдат-, перманганат-, роданид-, бромат-, иодат- и галогенид-ионы должны отсутствовать. Не мешают хлорат и перхлорат.
27. ЖЕЛЕЗО
Шварценбах уже давно [48(7)] описал комплексонометрическое определение Fein. Титрование проводят при pH = 2—3 с тироном в качестве индикатора. Комплексообразование Fe111 протекает медленно, поэтому рекомендуется небольшое подогревание раствора, хотя оно и не является обязательным. Возможно использование и
233
других индикаторов. Точка эквивалентности при титровании с Тироном характеризуется исчезновением зеленого оттенка с переходом в желтый цвет (окраска комплекса FeY-) и при микроопределениях бывает исключительно резкой. В настоящее время метод применяют для многочисленных практических анализов. Если такое титрование железа сопровождается определением другого металла при повышенном значении pH, то следует учитывать, что при высоком значении pH тирон образует также комплексы в молярном отношении 1:2 и 1:3 фиолетового и красного цвета [51(5)]. При этом комплекс в отношении 1 :3 более стабилен, чем комплекс 1:1, так что в щелочном растворе железо выходит из комплексоната, и ЭДТА выделяется в свободном состоянии.
При применении этого метода для микроопределений железа Флашка [52(22)] предложил в качестве индикатора сульфосалициловую кислоту. Другие авторы тоже применяли этот индикатор [57 (6), 59 (97), 60 (162), 62 (13)]. Можно применять и салициловую кислоту; практически точки эквивалентности идентичны, однако сульфосоединение имеет преимущество благодаря большей растворимости, что не только более удобно, но и важно в случае присутствия А1 (благодаря возможности маскирования последнего).
Предложено большое число других соединений, содержащих фенольную гидроксильную группу, в качестве индикаторов на железо, как, например, о-карбоксифенилазохромотроповая кислота [60(41)], З-окси-2-нафтойная кислота [60(14), 61 (44)] или гидроксамовая кислота [61(103)]. Последняя позволяет проводить титрование при очень низких значениях pH (1 — 1,5), что очень важно в отношении примесей (в особенности А1). При низком значении pH (1,7) пригодная а-бД'-триметилформаурин-З.З'-дикарбоновая кислота (структура IX в главе V с группой СН3 вместо кольца С, метильной группой в положениях 5 и 5' и СООН-группой — в 3 и 3' [62 (54)]. Находят применение и такие индикаторы, как койе-вая кислота [5-окси-2-(оксиметил)-1,4-пирон] [56 (82)], саларцид (салицилальдегидсемикарбазон) [60(118)], CuY—ПАН [56 (45), 61 (66)], CuY — ПАР [61 (66)], ацетилацетон [61 (1), 61 (116),62 (2)], хромазурол S [55(29)] и роданид-ион [47(4), 53(18), 57(4), 60 (161), 61(63)]. Достоинства и недостатки последнего были уже ранее критически рассмотрены на основании теоретических выводов [53(18)]; обсуждалась также целесообразность его использования в экстракционном методе в точке эквивалентности. Были исследованы различные трифенилметановые красители с целью применения их в качестве индикаторов [57(59)].
Следует сказать, что переход окраски при комплексонометрическом титровании Fe111 обычно менее резок, чем, например, при обычном окислительно-восстановительном титровании. Это прежде всего относится к применению индикаторов — производных фенола, которые часто необходимо прибавлять в таких количествах, которые по сравнению с обычными концентрациями индикаторов являются значительными (см. главу V, раздел 1). Абсолютная кон
234
стана устойчивости комплекса Fe111 с ЭДТА (1g/( = 25,1) весьма высока, так что Fe111 можно определять почти без помех при низких значениях pH раствора; однако следует учитывать, что эффективная константа устойчивости комплекса в обычных условиях титрования не всегда высока. Самое низкое допустимое значение pH при титровании раствором ЭДТА с индикатором обычно составляет около 1, так как в этом случае из-за большой величины коэффициента ан эффективная константа устойчивости равна лишь Ю7’9. С возрастанием pH ан быстро уменьшается, но возникают осложнения в связи с образованием гидроксокомплексов. При pH, незначительно превышающем 10, Fe111 выделяется из комплекса с ЭДТА и выпадает в осадок в виде гидроокиси. Это следует принимать во внимание при последовательных титрованиях, так как может наступить вытеснение Fe111 другим металлом уже при довольно низких значениях pH.
При титровании железа можно также применять окислительно-восстановительные индикаторы, например вариаминовый синий [54 (60), 60 (89)], Биндшедлера зеленый [56 (107)] и комбинированные индикаторы — Fe11 с какотелином [56(27)] и KSCN с п-анизи-дином [60(99)].
Описание методов обратного титрования можно найти в литературе, например титрования в кислой среде раствором соли тория с ксиленоловым оранжевым [57 (137)], раствором соли меди с о-ди-анизидинтетрауксусной кислотой (флуоресцентный индикатор) [60(153)] и в аммиачной среде раствором цинка с эриохромом черным Т [55(90)] с применением ДЦТА. Эти и другие методы обратного титрования имеют значение главным образом при определении суммарного содержания Fe111 и других металлов.
Константа устойчивости комплекса Fe11 — ЭДТА значительно меньше (1g К =14,3), чем для комплекса Fe111 — ЭДТА. Все же возможно титрование Fe11, например при pH = 4 с метилтимоловым синим [58(102)] раствором ДЦТА или при более высоком значении pH раствором ЭДТА с 2-пиридинальдоксимом [63(57)]. Эти способы представляют интерес лишь для специальных случаев, так как в нормальных условиях железо обычно присутствует в трехвалентном состоянии. Имеет значение, однако, возможность определения Fe111 в присутствии Fe11 или обоих ионов железа в одном растворе [55 (23)]. Сначала титруют FeIn с салициловой кислотой, затем Fe11 окисляют пероксодисульфатом и продолжают титрование. При наличии Fe11 следует всегда титровать в отсутствие воздуха, так как Fe11 в присутствии комплексонов является сильным восстановителем. Нормальный потенциал системы Feni/Fen в отсутствие ЭДТА составляет +0,77 в, тогда как в присутствии избытка комплексона уменьшается приблизительно до +0,1 в. В этом случае раствор является настолько сильным восстановителем, что восстанавливаются посторонние вещества, например Ag+-iiOHbi [52(14)]. Очень большое различие в константах устойчивости комплексонатов Fe11 и Fe111 создает основу для
235
восстановительного маскирования железа аскорбиновой кислотой или гидроксиламином.
Как уже упоминалось выше, высокая устойчивость комплекса Fe111 — ЭДТА позволяет проводить довольно селективное определе-' ние его в сильнокислой среде. Чем ниже pH раствора, тем избирательнее титрование. Особый практический интерес представляет определение Fe в присутствии А1. Учитывая различия в значениях их констант устойчивости, можно было ожидать, что А1 не будет мешать. Однако на самом деле это не так, кроме случаев титрования при очень низких значениях pH (<2). Это явление еще не получило объяснения, и в литературе имеются противоречивые сведения о помехах, причиной которых является А1. Эти помехи (приводящие к завышенным результатам для Fe благодаря частичному совместному титрованию с А1) не являются только функцией pH раствора, но зависят еще от концентрации солей в титруемом растворе, температуры (А1 связывается в комплекс очень медленно!) и применяемого индикатора. Чем ниже устойчивость комплекса железа с индикатором, тем лучше. Часто можно достигнуть улучшения условий путем замены ЭДТА другим комплексоном, главным образом ДЦТА. Можно также идти по пути селективного маскирования А1 (см. раздел, касающийся определения А1), однако это не применимо при последовательном титровании.
Последовательное титрование смеси Fe—Al возможно различными путями. Например, Вебер [57(6)] сначала титрует железо с сульфосалициловой кислотой, а затем определяет содержание А1 при pH = 5 обратным титрованием избытка НТА раствором соли меди с Биндшедлера зеленым. Кристиансен [61 (44)] сначала определяет железо при pH = 2 с З-окси.-2-нафтойной кислотой в растворе, охлаждаемом внесением кусочков льда. После того как достигается точка эквивалентности титрования Fe (переход синей окраски в желтую), раствор нагревают до 50°С, повышают pH до 3 и титруют А1 с тем же индикатором в УФ-лучах до перехода синей флуоресценции в зеленую. Fe можно также оттитровать с сульфосалициловой кислотой при pH = 2, а затем при pH = 4—5 определить А1 обратным титрованием избытка ЭДТА стандартным раствором железа [62(13)]. По отношению к А1 маскирующее действие оказывает сульфосалициловая кислота. Допускаются большие количества А1, если сначала определить содержание Fe при pH = 1—2 с алюминоном, затем повысить pH раствора до 4,4 и титровать А1 с тем же индикатором. Этот разработанный Кунду [61 (2)] метод позволяет даже проводить заключительное титрование Са и (или) Mg при pH = 10. Особенно пригодно использование инструментальных методов индикации точки эквивалентности, например фотометрической индикации при рН=1 или даже немного ниже, при применении сульфосалициловой кислоты в качестве индикатора [60(144)].
Высокой селективностью отличается способ с применением ксиленолового оранжевого (ХО), в котором протекают теоретиче-236
ски интересные процессы [59 (27)]. В растворе, содержащем практически только Ёе3+-ионы, реакция FeinXO (синяя) + ЭДТА ^Fe^’Y + ХО (желтая), по которой проводят индикацию точки эквивалентности, протекает настолько вяло, что даже при температуре кипения индикатор следует считать блокированным. Если же присутствует немного Ее2+-ионов, то после комплексообразования свободного (т. е. не связанного с ХО) Fe111 образуется немного FenY, и в точке эквивалентности протекает следующая быстрая окислительно-восстановительная реакция: FeniXO + + FenY = FenXO + FenIY. Получающийся при этом комплекс FenXO нестабилен при низких значениях pH и тотчас разрушается с образованием свободного ХО, желтая окраска которого и фиксируется в точке эквивалентности. Чем ниже значение pH, тем больше Fe11 должно присутствовать в растворе. Так, например, для определения 20 мг Fe111 при pH — 1,5 необходимо 2 г сульфата двухвалентного железа. Температура также оказывает влияние на требуемое для определения содержание Fe11. Можно определить около 50 мг Fe111 при комнатной температуре также в присутствии 0,5 г А1, если, кроме того, будет добавлено эквивалентное по отношению к алюминию количество F_-hohob, которые маскируют также Zr. Торий не мешает, так как для его маскирования достаточно сульфат-ионов, введенных в виде соли железа (II). Количество Сг, которое может присутствовать, ограничивается интенсивной окраской самого Сг. Из обычно присутствующих трехвалентных ионов металлов мешают лишь Bi и Те. Немного мешают двухвалентные металлы. Разумеется, следует проводить титрование в отсутствие воздуха, чтобы избежать ошибки, связанной с титрованием окисленного Fe11.
Уже ранее были описаны инструментальные методы определения железа. Пршибил [51(15)] рекомендует потенциометрическую индикацию в ацетатном буферном растворе при pH около 5, при которой скачок потенциала в точке эквивалентности на платиновом электроде соответствует приблизительно 350 мв на каждые 0,04 мл 0,1 М раствора ЭДТА, и потенциал устанавливается практически мгновенно. Обратное потенциометрическое титрование избытка ЭДТА раствором соли железа (III) позволяет определять многие другие металлы, например, при работе с аликвотными пробами при разложении сложных смесей, состоящих из Fe, Al и Сг [57(29)]. Окислительно-восстановительное поведение пары Fein/Fen в присутствии ЭДТА с точки зрения использования в анализе изучали Белчер и др. [55(104]. Сообщается об амперометрическом титровании [57(33)] с вращающимся Pt-электродом [58(41), 59(44)] и об опытах с переменным током («квадратноволновой» полярограф) [61 (35)], при которых можно определить FeIIT с помощью ЭДТА и затем в том же растворе Fe11 с помощью гексационоферрата (II).
Благодаря собственной окраске комплекса FeY- можно легко проводить фотометрическое титрование с самоиндикацией [53(37)],
237
например, при последовательном титровании смеси Fe—Си [53(39)], а также с добавлением индикатора, как-то: сульфосалициловой кислоты [60(144)] или феррона [59(123)]. Фотометрическая индикация, позволяет также автоматизировать процесс титрования [60 (78)].
Учитывая, что Fein, являющееся главной или побочной примесью в большинстве материалов, образует очень устойчивые ком-плексонаты, легко видеть, что его маскирование имеет большое практическое значение. Этой проблемой занимаются уже давно и с успехом. Для маскирования Fe111 в щелочной среде применяются различные методы. Пожалуй, чаще всего применяемый способ, предложенный Пршибилом [53(10), 54(76), 55(89), 59(16)], состоит в образовании комплекса железа с триэтаноламином, в результате чего прекращается реакция железа с комплексонатами и почти со всеми индикаторами. Чтобы применить этот метод на практике, следует обратить внимание на некоторые его детали. Добавка триэтаноламина вызывает подщелачивание раствора, что иногда приводит к выпадению гидроокиси железа, которая потом (часто при нагревании) лишь медленно реагирует с маскирующим веществом. Поэтому целесообразно или исходить из сильнокислого анализируемого раствора, в котором после добавки триэтаноламина медленно создают нужное значение pH, или применять триэтаноламин в виде его солянокислой соли.
Триэтаноламин маскирует также ионы некоторых других металлов, например А1 и Мп, поэтому особое значение придают маскированию цианид-ионами для специальных случаев, предложенному Флашкой и Пюшелем [54(62)]. Поступают следующим образом: к кислому анализируемому раствору прибавляют немного тартрат-ионов, чтобы избежать выпадения гидроокиси железа при окончательном подщелачивании раствора. Затем прибавляют KCN и немного аскорбиновой кислоты и нагревают до кипения, при этом Fe переходит в гексацианоферрат (II). По окончании реакции раствор становится почти бесцветным. Таким способом можно замаскировать значительное количество Fe. Непосредственно после этого возможно демаскирование ионов Zn и Cd с помощью формалина [56(47)]. Если Fe присутствует в большом количестве, в растворе может образоваться муть, так как гексацианоферраты (II) многих металлов, включая Са и Mg, имеют незначительную растворимость. В таких случаях можно проводить определения медленно и в горячем растворе, причем муть в ходе титрования снова исчезает, или же применять обратное титрование избытка ЭДТА.
Пршибил [61 (93)] сообщает об интересном методе взаимного маскирования Fe и Мп в присутствии KCN. В почти нейтральном растворе (pH — 7—8) можно замаскировать Fe сульфосалициловой кислотой, если нужно определить редкоземельные металлы [62(89)]. Для маскирования Fe в кислой среде лучшим средством является аскорбиновая кислота; еще один метод [56 (84)] основав
238
на востановлении Fera до Fe11, причем последнее вследствие малой устойчивости своего комплексоната не мешает определению других металлов, образующих более стабильные комплексы. Можно применять и другие восстановители, например солянокислый гидроксиламин. При этом необходимо удалить кислород воздуха. Же-лезо(Ш) можно также титровать аскорбиновой кислотой (методом обратного титрования), причем оно одновременно и определяется, и маскируется, после чего можно проводить другие комплексонометрические определения.
Железо(III) можно также восстановить с помощью тиомочевины, которую применяют для маскирования Си. Чтобы избежать восстановления, прибавляют Р_-ионы, которые маскируют Fe111 в присутствии тиомочевины.
Практическое применение методы титрования железа получили в анализах ферросилиция и силикатов [59 (19)], феррохрома и хромитов [61 (181), крови [54 (26)], гемоглобина [55 (70)], золы животных тканей [55(9)], накипи на котлах [55 (61)], известняка [52 (46)], почв [53 (61)] и цемента [61 (42)]. Можно анализировать ванны для покрытий [62 (52)], хромировочные ванны [57 (49)], целлюлозу [57 (27)], сиккативы [60(131)], шлаки [61(77)], медные [54 (67)] и ванадиевые сплавы [59 (1)], катализаторные массы [59 (97)] и шахтные сточные воды [61 (10)]. Предложен интересный метод определения металлического железа в оксидных шлаках [61 (46)]. Анализируемый раствор обрабатывают раствором HgClz в этаноле в атмосфере СОг, причем в реакцию вступает лишь элементарное железо. После отфильтровывания осадка в фильтрате окисляют присутствующее Fe11 до Fe111 и последнее титруют в присутствии тирона в растворе с pH = 2, содержащем С1_-ионы.
Прямое определение железа (П1) с тироном, салициловой кислотой, сульфосалициловой кислотой или хромазуролом S
Реактивы
ЭДТА, 0,1 7И раствор.
Тирон (салициловая кислота, сульфосалициловая кислота или хромазуролЭ). Пероксодисульфат.
Гликокол, твердый.
Ход определения. Анализируемый раствор должен содержать от 20 до 70 мг железа и в не слишком большом избытке соляную кислоту. Следует опасаться того, что часть железа находится в двухвалентном состоянии, поэтому к раствору прибавляют несколько кристалликов пероксодисульфата и недолго кипятят. Затем вносят в небольшом избытке гликокол, достаточно 0,2—0,5 г на каждые 100 мл раствора (pH = 2—3), около 2 мл раствора тирона и титруют теплый (40° С) раствор до исчезновения синей окраски. Точка эквивалентности фиксируется в момент исчезновения последних следов зеленого оттенка, когда ра-створ становится Чисто желтым
239
Замечания. При применении очень разбавленного раствора ЭДТА переход окраски в точке эквивалентности размытый, в особенности в очень холодных растворах. Если пользуются ацетатным буферным раствором, концентрация ацетат-ионов должна быть небольшой, так как в противном случае Fe связывается в ацетатный комплекс и точка эквивалентности распознается еще хуже.
Можно в качестве индикатора применить также роданид-ион [47 (4)], 53(18)]. Если в качестве индикатора используют салициловую кислоту, то ее прибавляют в количестве около 0,2 г в виде твердой соли на каждые 100 мл анализируемого раствора и определение проводят при pH = 4.
Если в качестве индикатора используют хромазурол S [55 (29)], то титруют теплый раствор при pH = 3. В точке эквивалентности зелено-синяя окраска раствора переходит в оранжевую.
Прямое определение железа (HI) с вариаминовым синим
Реактивы
ЭДТА, 0,01 7И раствор.
Вариаминовый синий
Разбавленный буферный аммиачно-гликоколовый раствор
Ход определения. Анализируемый раствор должен содержать около 5 мг трехвалентного железа на каждые 100 мл. Если раствор сильнокислый, к нему добавляют аммиак до слабого изменения окраски по бумаге конго (pH — 2—3). Хорошо себя проявила добавка гликокола в количестве 0,2—0,5 г. Затем вносят каплю индикатора и проводят титрование. Исходный сине-фиолетовый раствор вблизи точки эквивалентности становится серым и с последней каплей ЭДТА окраска переходит в желтую (окраска комплекса железа с ЭДТА).
Замечания. Более точно точку эквивалентности можно получить по скачку окислительно-восстановительного потенциала потенциометрическим титрованием с блестящим платиновым электродом [51 (15)].
28. КОБАЛЬТ
Впервые о возможности комплексонометрического титрования кобальта с роданид-ионом в качестве индикатора было сказано в патенте [А (8)] и в работе Бидермана и Шварценбаха [48 (5)]. Многие авторы более подробно изучали этот метод Такамото [55 (100), 55 (101)], используя ацетоно-водный раствор (1:1) как среду для определения почти всех тяжелых металлов [55 (102), 55 (103)], проводит обратное титрование избытка ЭДТА титрованным раствором соли кобальта. По его данным, следует точно установить значение pH раствора, для чего нужно прибавлять 3 мл 6 М раствора аммиачно-ацетатного буфера на каждые 35 мл анализируемого раствора. Сен [58 (90)], напротив, находит, что pH не оказывает
240
существенного влияния и что можно получать правильные значения в интервале pH от 6 до 12. Сен Сарма [55(115)] указывает, что при определении малых количеств Со имеет значение соблюдение точных условий титрования, так как иначе интенсивность окраски комплекса Со — SCN и его состав подвергаются нежелательным колебаниям. В качестве оптимальной рекомендуется смесь, состоящая из 30—35% (объемных) ацетона и 5% роданида аммония. При этом можно определять до 25 мкг Со в 10 мл раствора с удовлетворительной точностью [60(171)]. При меньшем содержании кобальта и требуемой большей точности рекомендуется применение фотометрической индикации. Вместо ацетона можно использовать также амиловый спирт, с тем преимуществом, что при этом можно экстрагировать роданидные комплексы кобальта, что делает определение более селективным. В этом случае можно даже определять Со в присутствии не особенно больших количеств Ni. В качестве микрометода Флашка [55 (22)] описывает прямое титрование Со с мурексидом, однако этот метод можно безоговорочно применить и для макроопределений. Для титрования Со существует большое число других индикаторов. Назовем лишь некоторые: пи-рогалловый красный [56 (85)] и его бромпроизводное [56 (88)], нафтоловый фиолетовый [57 (81)], пирокатехиновый фиолетовый [54 (78)], ксиленоловый оранжевый [57 (79)] и метилтимоловый синий [58 (34)]. Резкую точку эквивалентности можно получить также со смешанными индикаторами, как, например, CuY — ПАН [56 (43)], CuY — нафтилазоксин [57 (122)] и ванадий (V) —ЭДТА— дифенилкарбазой [63 (1)].
Сообщается также о применении полезного иногда метода обратного титрования. Харрис и Суит [54(102)] обратно титруют раствором цинка с эриохромом черным Т в аммиачном растворе. Кин-нунен рекомендует соль марганца в качестве раствора для обратного титрования [55(4)]. Однако эриохром черный Т легко блокируется ионами кобальта, вследствие чего титрование следует проводить быстро. Анализируемые растворы с блокированным индикатором следует отбрасывать. Предпочтительнее проводить обратное титрование в кислой среде из-за его большей селективности. В этом случае можно проводить обратное титрование раствором меди с ПАН [56 (43), 56 (46)] или раствором соли ванадия (V) с Дифенилкарбазидом или дифенилкарбазоном. Лукашевский и др. [57 (84)] применяют в качестве индикатора дитизон и обратно титруют в 50 %-ной спирто-водной смеси раствором цинка. Камерон и Гибсон [61 (135)] используют экстрактивное определение точки эквивалентности. Определение проводят в водном растворе и экстрагируют в хлороформный слой с помощью роданид-ионов или трифенилметиларсонийхлорида. Обратно титруют избыток ЭДТА Раствором соли кобальта, при этом точку эквивалентности фиксируют по появлению синей окраски слоя органического растворителя. Методы обратного титрования применяются не только для
16 Зак 55<5
241
определения кобальта, но также и для определения целого ряда других металлов [61 (136)].
Кобальт(П) легко окисляется до Сош перекисью водорода в присутствии комплексона в щелочной среде. При этом с ЭДТА образуется темно-синий окрашенный комплекс Coni(OH)Y2-, который при подкислении присоединяет протон и переходит в фиолетовый комплекс СоП1(Н2О) Y-. При прибавлении основания процесс протекает в обратном направлении. При стоянии акво-комплекс теряет воду и образуется также фиолетово-красный анион CoinY~, который потом лишь медленно в сильнощелочной среде может перейти обратно в синий гидроксокомплекс. Все комплексные соединения Со111 являются исключительно прочными и устойчивы даже в сильнокислом растворе, что может быть использовано для определений с повышенной селективностью. Сайо [56 (99)] проводит обратное титрование раствором цинка в кислой среде с гексацианоферратами (II) и (III) й бензидином, после того как кобальт был окислен в щелочной среде, причем количество перекиси водорода должно быть строго определенным. Нерезкая точка эквивалентности получается в том случае, если недостаточно точно подобрано необходимое для окисления Со количество Н2О2. При обратных титрованиях Киннунен [57 (137)] применяет раствор соли тория или таллия (III) с ксиленоловым оранжевым. В обоих методах количество определяемого Со сильно ограничено, так как интенсивная окраска комплекса ConiY легко перекрывает изменение окраски индикатора в точке эквивалентности. Поэтому Флашка предлагает фотометрическую индикацию (см. ниже). Удобно также пользоваться флуоресцентными индикаторами. Особый интерес представляет собой определение Со в присутствии- Ni и раздельное определение смеси Ni—Со, которые обсуждаются в разделе, касающемся определения никеля.
Определение Со с помощью инструментальных методов индикации конечной точки охватывает амперометрический [54 (29)], кондуктометрический [54 (32), 57 (34)], термометрический [57 (97)] и высокочастотный методы титрования [55 (41), 55 (117)]. Потенциометрическая индикация с помощью ртутного капельного электрода возможна для макро- [58 (12)] и ультрамикроколичеств [57 (8)]. Автоматизацию титрования Со выполнил Мальмстад. Рингбом описывает фотометрическое титрование с применением мурексида. Обратное титрование ЭДТА раствором соли кобальта в ацетоно-водной смеси, содержащей роданид-ионы, дает очень хорошие результаты для Со, а также для других металлов, в особенности при работе с микроколичествами [60 (71)]. Фотометрическое определение Со можно осуществлять также в УФ-области [54 (97)]. Особенно пригодна фотометрическая индикация, если кобальт присутствует в трехвалентном состоянии. Флашка и Ганчоф [61 (51)] окисляют Со в щелочной среде и прибавленный избыток ЭДТА обратно титруют при pH = 1 раствором висмута с пирокатехино
242
вым фиолетовым, причем мешают лишь ионы металлов, образующих устойчивые комплексы, таких, как Bi, Fe111, Zr или Th.
При определении других металлов с константами устойчивости от Ю16 До Ю20 одновременно титруется и Со11. Однако это не мешает определению металлов, образующих более устойчивые комплексы, если титрование проводят при низких значениях pH. Кобальт можно замаскировать цианид-ионом; при окислении воздухом образуются цианидные комплексы цианида с Сош, окрашенные в желтоватый цвет. Если этим путем замаскированы большие количества Со, то могут возникнуть помехи, являющиеся следствием этой окраски, если индикацию конечной точки проводят визуально. Цианокомплексы кобальта (III) не разлагаются формальдегидом.
Комплексонометрическое титрование Со практически используется при определении его в твердых металлах [60 (5)], канифоли [55 (35)], нафтенатах [55(116)] и других сиккативах [58 (25), 61 (143)], а также в магнитных сплавах [57 (39)]. Лякур [55 (5)] описывает интересную возможность определения содержания кобальта титрованием на пятне, а затем отделением хроматографически на бумаге от Си и -Zn.
Прямое определение кобальта с мурексидом
Реактивы
ЭДТА, 0,01 М раствор.
Мурексид.
Аммиак, приблизительно 1 М раствор.
Ход определения. Кислый анализируемый раствор, содержащий не более 25 мг Со в каждых 100 мл, нейтрализуют раствором аммиака до pH = 6. Затем прибавляют индикатор, который еще в кислом растворе окрашивается в оранжево-желтый цвет. Образовавшийся комплекс кобальта с мурексидом (по-видимому, CoH4F+) является кислотно-основным индикатором при последующей нейтрализации раствора, причем раствор аммиака вносят по каплям До тех пор, пока не произойдет перехода окраски в желтую (—>CoH2F_). После этого титруют раствором ЭДТА до резкого изменения желтой окраски в фиолетовую. Так как раствор обладает незначительной буферной емкостью, то значение pH вследствие образования свободных ионов водорода при комплексообразовании может настолько понизиться, что желтый комплекс кобальта с индикатором снова переходит в оранжевый комплекс. В этом случае прибавляют еще одну каплю аммиака, после чего опять возвращается желтая окраска, и продолжают титрование.
Замечания. Соотношение констант устойчивости амминокомплекса и мурексидного комплекса кобальта таково, что при избытке аммиака комплекс с индикатором снова разлагается. При следовании описанной выше методике условия скачка в точке
16*
243
эквивалентности являются оптимальными, так как при очень малой концентрации аммиака в растворе кобальт, еще не связанный с ЭДТА, присутствует практически в виде Со2+-ионов. При этом предотвращается опасность окисления металла кислородом воздуха, в результате которого может образоваться очень прочный гексаммин-комплекс кобальта(Ш), который уже не может вступать в реакцию с ЭДТА.
29. НИКЕЛЬ
Еще в 1948 г. Шварценбах [48 (7)] описал метод прямого титрования никеля в сильноаммиачном растворе с мурексидом в качестве индикатора. Этот метод был использован Флашкой с сотр. Для определения микро- [52 (22)] и ультрамикроколичеств [57 (125)] и дает исключительно резкую точку эквивалентности. В этом случае, как почти при всех определениях Ni, вблизи точки эквивалентности следует титровать медленно, так как скорость образования комплекса с никелем не очень велика. Часто при замедлении реакции помогает нагревание раствора. В качестве других индикаторов для титрования в щелочной среде можно назвать пирокатехиновый фиолетовый [56 (4J,)] и хромазурол S [59 (14)]. Переход окраски последнего индикатора можно сделать более резким, если поддерживать в растворе небольшую концентрацию аммиака и добавить пиридин. Недостатком определения Ni в аммиачном растворе является возможность совместного титрования Mg и щелочноземельных металлов.
Эти помехи не возникают, если титрование проводят в кислой среде, что возможно, согласно Флашке и др. [56 (44)], при прямом титровании с индикаторной системой CuY — ПАН в кипящем растворе. Конаган [56 (57)] титрует при pH = 5 ди-Na-l-HHTpo-зо-2-нафтол-3,6-дисульфонафтенатом. Фритц [61 (112)] применяет нафтилазоксин С в ацетатном буферном растворе или в растворе с pH = 8. В последнем случае цитрат-ионы не мешают, что важно при применении его для маскирования, например Sn или Th. SNAZOXS [60 (67)] в качестве индикатора применяют для определения Ni в ацетатном буферном растворе. Для индикации можно использовать также систему ванадий — ЭДТА — дифенилкарбазон [63(1)].
Никель можно определять также методом обратного титрования, что удобно, так как в этом случае небольшая скорость реакции не играет роли. Обратное титрование можно проводить раствором -меди в присутствии, например, ПАН [56 (43), 56 (46)], каль-цеина W [59 (9)] или о-диапизидинтетрауксусной кислоты[60 (153)]. Два соединения, упомянутые последними, являются флуоресцентными индикаторами. Можно также проводить титрование раствором цинка с помощью косвенной окислительно-восстановительной индикации точки эквивалентности гексацианоферратами (II) и (HI) и диметилнафтидином [55 (67)] или бензидином [56 (99)]. Киннунен рекомендует проводить обратное титрование раствором соли тория
244
или таллия (III) с ксиленоловым оранжевым [57 (137)], тогда как Тер-Хаар и Венцен [56 (5)] при относительно более низком pH (2,8) раствора обратно титруют раствором соли тория с ализарином S. Такамото [55 (102)] рекомендует обратное титрование раствором кобальта в ацетоно-водной смеси, содержащей роданид-ионы; такой же раствор для обратного титрования применяют Камерон и сотр. [61 (136)], причем они прибавляют тройную смесь роданида с трифенилметиларсонийхлоридом и хлороформом, а переход окраски наблюдают в органической фазе.
Это перечисление дает лишь краткое представление о существующих методах. Практически можно применять любой индикатор на медь и раствор меди для обратного титрования. То же относится к цинку, применяемому в качестве титранта для обратного титрования.
Менее благоприятно обратное титрование в щелочной среде, так как при этом совместно титруются щелочноземельные металлы и Mg. Однако этот метод также имеет значение, так как никель можно выделить в осадок в виде диметилглиоксимата никеля; осадок растворяют в НС1 и оставляют реагировать с ЭДТА, а избыток последней титруют затем раствором цинка с эриохромом черным Т [53 (26)]. Эта комбинация аналитических операций применяется для специфического и быстрого определения Ni в отсутствие Pd. По сравнению с гравиметрическим методом этот метод обладает тем преимуществом, что соосаждение с диметилглиокси-мом не существенно.
Суитцер и Брикер [54 (14)] титруют никель фотометрически, используя самоиндикацию при pH = 4 и длине волны 1000 нм. Этот метод применили Брэйк и др. [57 (63)] для титрования Ni в присутствии нитрозо-Р-соли, служащей для маскирования Со. Рингбом [53 (45)] применяет в качестве индикатора мурексид. Тот же индикатор вводит в раствор Девальд [58 (38)] при определении Ni в присутствии Fe, замаскированного пирофосфат-ионом. Сильвер-стон [62 (16)] сообщает о потенциометрическом титровании после выделения никеля в виде диметилглиоксимата. Можно проводить титрование с ртутным капельным электродом для определения ультрамикроколичеств никеля [57 (8)] и последовательного титрования смесей. Последнее проводят также с помощью амперометрической индикации при потенциале «волны комплексона» [62 (33)].
Исходя из положения никеля в таблице констант устойчивости комплексов металлов с ЭДТА, можно легко предсказать, что определению Ni будет мешать большое число ионов других металлов и, в свою очередь, никель будет мешать при комплексонометрических титрованиях других металлов. Маскирование никеля цианид-ионом является простым и действенным. Цианидный комплекс никеля устойчив и прочен, поэтому для демаскирования ионов Zn и Cd Можно применить формальдегид, не вызвав разложения комплекса [Ni(CN)4]2’. Особое внимание было уделено анализу смеси никеля с кобальтом. Брэйк и др. [57 (63)] прибавляют нитрозо-Р-соль
245
к анализируемому раствору, причем образуются соответствующие комплексы обоих металлов. В результате кипячения с азотной кислотой разрушаются избыток реактива и комплекс с Ni, тогда как комплекс с Со остается незатронутым, после чего Ni определяют фотометрически. Флашка и Пюшель [55 (66)] используют свойство Ni медленно вступать в реакцию для его селективного определения. Раствор с pH = 10 и небольшой буферной емкостью, содержащий Ni и Со, титруют раствором ЭДТА с пирокатехиновым фиолетовым. Затем снижают pH раствора до значения 2 с помощью азотной кислоты и охлаждают добавлением льда. Титруют раствором висмута; при этом происходит быстрое вытеснение Со из его комплекса, тогда как никель остается связанным в комплекс. Метод применим для определения никеля в присутствии некоторых других металлов, например Си, Cd, Zn, Pb и других, содержание которых можно определить по разности. Пршибил и др. [54 (80)] используют в своей работе следующий принцип; Ni и Со связывают в комплексы с ЭДТА, подщелачивают раствор и ConY окисляют перекисью водорода до CoinY. Затем добавляют KCN, с которым реагирует лишь никель, вытесняющийся из комплексо-ната. Выделившееся в свободном состоянии эквивалентное содержанию никеля количество ЭДТА обратно титруют раствором магния с эриохромом черным Т. Вследствие интенсивной собственной окраски ConiY возможности метода ограничены определением небольшого содержания ионов Со. ЭДТА выгодно заменять комплексоном ДЦТА [55 (114)].
Разделение другой часто встречающейся в практике смеси, а именно Ni—Си, возможно при маскировании Си тиосульфат-ионом. Этот способ маскирования ввел Ченг [58 (63)]. Для титрования ионов Ni используют ПАН, однако точка эквивалентности в нагретом до 50° С растворе получается размытой. Поэтому Калиниченко [58 (16)] проводит титрование при pH = 8 в присутствии мурексида. Китагава [62 (45)] предпочитает проводить селективное определение в кислом растворе и избегает размытой точки эквивалентности, применяя обратное титрование раствором индия в присутствии индикатора ПАН. Киннунен вносит тиомочевину для маскирования меди [57 (137)] и обратно титрует раствором соли тория с ксиленоловым оранжевым.
Маскирование Fe можно выполнять с помощью пирофосфат-иона [56 (98), 58 (38)]. Титрованию Ni не мешает маскирование других металлов фторид-ионом [54 (74), 61 (112)].
Многокомпонентные системы можно разделить, согласно Рейли [58 (13)], амальгамным методом (см. стр. 130). В заключение следует еще упомянуть инструментальные методы, такие, как амперометрический и потенциометрический, пригодные для последовательных титрований различных бинарных и тройных систем (см. соотв. раздел).
Практическое применение комплексонометрическое титрование находит при определении никеля в гальванических ваннах [54 (11)].
246
57 (62), 61 (102)], аккумуляторной жидкости [62(10)], ферритах 161 (70)’, 62 (45)], марганцевых катализаторах [57 (47)] и сплавах гео (86)1, в сплавах с медью [58 (16)], с железом [59 (31)], в сплаве альнико (Fe—Al—Ni—Со) [58 (42)] и Al— Ti—Ni [59 (9)], причем часто применяется многократное разделение с помощью ионного обмена. Кроме того, никель определяют в кобальте и его солях после предварительного отделения [55 (114), 56 (87)], в сталях после отделения его в виде диметилглиоксимата [52 (42)] и сплавах с ниобием [62 (85)].
Прямое определение никеля с мурексидом
Реактивы
ЭДТА, 0,01 М раствор.
Мурексид.
Хлорид аммония, приблизительно 1 М раствор.
Аммиак, концентрированный раствор.
Вещества для маскирования.
Ход определения. Нейтрализуют кислый анализируемый раствор, который должен содержать не более 15 мг Ni в каждых 100 мл, прибавляют индикатор и, если необходимо, вещество для маскирования. К приблизительно ней
тральному анализируемому раствору приливают еще 10 мл раствора NH4C1. Если pH раствора ниже 7, то индикатор окрашивается в оранжево-желтый цвет (соответствующий комплексу NiH4F+); в этом случае приливают по каплям раствор аммиака до тех пор, пока окраска раствора не перейдет в желтую (комплекс NiH2F~). После этого начинают титрование и доводят его почти до точки эквивалентности. Если при этом окраска вновь становится оранжевой, благодаря происходящему снижению pH, то прибавляют еще каплю аммиака и продолжают титрование. Около точки экви-
Рис. 40. Кривые перехода окраски мурексида в про-
валентности раствор сильно подщелачивают (добавляют около 100 мл концентрированного раствора аммиака) и титруют до резкого перехода желтой Ькрас-
цессе титрования никеля при различных значениях pH.
(Обратить внимание на увеличенный масштаб оси абсцисс по сравнению с рис, 32—39.)
Ки в сине-фиолетовую.
Замечания. Известны все данные, позволяющие количественно
PH от 7 Наиболее
оценить процессы, происходящие при этом титровании. Комбинируя кривые, показанные на рис. 7 и 27, можно получить рис. 40. :, изображенных на рис. 40, видно, что во всем интервале до 12 получается довольно хороший переход окраски, резкий и наиболее яркий переход окраски получается
247
в сильнощелочном растворе. Однако не следует начинать титрование сразу при pH = 10—12, так как при этом в растворе часто по является муть вследствие выпадения в осадок гидроокиси никеля или основной его соли. Поэтому нужно прибегать к уже описанному методу, согласно которому титрование сначала проводят в нейтральном растворе, который сильно подщелачивают лишь незадолго до точки эквивалентности. При этом имеет практическое значение то, что в присутствии никеля мурексид можно применять также в качестве pH-индикатора, который фиксирует конечную точку нейтрализации. Однако мурексид не следует сразу вносить в сильнокислый исходный раствор, так как он быстро подвергается гидролитическому расщеплению.
Определение никеля обратным титрованием (после осаждения диметилглиоксимом)
Реактивы
ЭДТА, 0,01 М раствор.
Сульфат магния или цинка, 0,01 М раствор.
Эриохром черный Т.
Соляная кислота, приблизительно 2 М раствор.
Едкий натр, приблизительно 2 М раствор.
Метиловый красный.
Буферный раствор, pH = 10.
Ход определения. Осадок диметилглиоксимата никеля растворяют в возможно малом объеме горячей соляной кислоты. К раствору прибавляют в небольшом избытке ЭДТА и нейтрализуют едким натром по метиловому красному. Затем раствор разбавляют до концентрации никеля менее чем 5 • 10-3 М, вносят на каждые 100 мл анализируемого раствора 2 мл буферного раствора, индикатор и титруют раствором соли магния или цинка до перехода синей окаски в красную. Перетитрованные растворы отбрасывают.
Замечания. Осуществление этого определения возможно лишь потому, что реакция между NiY2- и красителем протекает крайне медленно, пока'ЭДТА присутствует в избытке. Как только достигается точка эквивалентности, pNi скачкообразно уменьшается, и образуется комплекс Ni с эриохромом черным Т, который уже не разлагается, если снова добавить Na2H2Y.
Можно получить еще более резкую точку эквивалентности, если для обратного титрования вместо растворов MgSO4 или ZnSO4, применить раствор MnSO4 [55 (4)].
30. ПЛАТИНОВЫЕ МЕТАЛЛЫ
Сведения о комплексных соединениях платиновых металлов с ЭДТА скудны. Было точно доказано существование комплекса 1г с ЭДТА [56 (52)], который был использован для его спектрофотометрического определения.
248
Реакция комплексообразования между Pd и ЭДТА положена в основу определения [55 (1), 55 (59), 58 (81), 60(186), 62(78)]. Устойчивость комплекса [55 (60)], который при pH от 4 до 9 имеет состав PdY2-, была определена по изменению потенциала; 1g К = 18,5 ± 0,6 (25° С, ц = 0,2). Для Rh спектрофотометрическим методом установлено существование комплекса с ЭДТА [58 (78)], который получен также препаративным путем, но до настоящего времени ничего йе известно о его аналитическом применении. На основании помех, наблюдающихся при титровании Pd, сделано заключение о существовании комплексов Ru и Pt.
Флашка применил реакцию вытеснения
[Ni(CN)4]2~ + Pd2+ [Pd(CN)4]2- + Ni2+
для определения микроцоличеств Pd. Выделяющиеся в свободном состоянии ионы Ni титруют в аммиачном растворе в присутствии мурексида. Аналогичную реакцию используют для косвенного определения серебра, причем вытеснение практически проходит мгновенно. Однако с Pd скорость реакции в аммиачном растворе незначительна. Поэтому или раствор оставляют в покое на некоторое время, или ускоряют реакцию с помощью слабого нагревания. Другая возможность состоит в подкислении раствора и затем в немедленном (NCN!) подщелачивании аммиаком. В кислой среде вытеснение происходит практически мгновенно.
Киннунен и Мериканто [65 (1)] применили этот метод для анализа сплавов и нашли, что переход окраски мурексида не. особенно резок. Поэтому они рекомендуют либо титровать фотометрически, либо определять освободившиеся ионы Ni обратным титрованием избытка ЭДТА титрованным раствором марганца. В этом случае следует титровать быстро, так как возникает опасность блокирования индикатора (эриохрома черного Т) ионами никеля. Чтобы избежать этого, они советуют (в более поздней работе) охлаждать анализируемый, раствор до 5° С, вносить индикатор и быстро титровать раствором марганца. При этом переход окраски значительно более резкий.
В каком бы варианте ни применяли метод с цианидным комплексом никеля, никогда Ru, Os, Rh и Ir не мешают. Мешает Pt, так как она тоже реагирует с цианидным комплексом никеля (а также золото). Протекает ли эта реакция частично или полностью— неизвестно, во всяком случае, ничего не сообщается о применении этого принципа для определения платины.
Первый метод комплексонометрического определения Pd, основанный на образовании комплекса Pd с ЭДТА, был предложен Мак-Невином и Криге [55 (59)]. Избыток ЭДТА обратно титруют раствором цинка с эриохромом черным Т. Так как Pd образует исключительно устойчивый амминокомплекс, то при обратном титровании нельзя применять обычный аммиачный буферный рас
твор; pH раствора следует доводить до значения около 10 с помощью едкого натра. Если титрование проводят в присутствии хлорид-ионов, то платина не мешает, так как хлорокомплексы платины (II) и (IV) достаточно прочны, чтобы помешать образованию комплекса с ЭДТА. Определению мешает Rh, в присутствии которого получаются заниженные по содержанию Pd результаты даже до 50% (О; 0 причине такого странного мешающего влияния ничего не известно. Если титрование осуществляют при комнатной температуре и быстро, то полученные в присутствии Ru и 1г заниженные результаты находятся в допустимых границах. Если Ru и 1г присутствуют в количестве 30% (вес.) от количества Pd, то результаты завышаются на 2—3%.
Об опытах обратного титрования в сильнощелочной среде (pH от 10 до 14) с применением титрованного раствора кальция сообщает Церкасевич [60 (186)]. Для индикации точки эквивалентности применяют обозначаемое как «Н-индикатор» соединение, по-видимому, идентичное кальцихрому, описанному Вестом. При содержании Pd от 1 до 10 мг точность метода составляет ±15%. Эти данные, по-видимому, являются результатом заблуждения. Обратное титрование в щелочном растворе можно выполнить потенциометрическим методом с ртутным электродом [62 (120)].
Определение Pd возможно также в кислой среде; это опять-таки обратное титрование, так как до сих пор не известен подходящий металлиндикатор на Pd. Киннунен и Мериканто описывают два метода. Первый [55 (1)] основан на обратном титровании избытка ЭДТА раствором висмута при pH = 1—2 в присутствии пирокатехинового фиолетового. Этот метод, как считают, менее точен, чем метод с цианидным комплексом никеля, причем он требует отсутствия СЕ-ионов, но зато обладает тем преимуществом, что присутствие Pt не мешает. По второму методу [58 (81)] обратное титрование проводят раствором соли тория при pH = 3 или раствором соли таллия(III) при pH = 4—5 с ксиленоловым оранжевым в качестве индикатора.
Юрист и Тюйкова [62 (78)] описывают обратное титрование раствором цинка при pH = 6 с ксиленоловым оранжевым. Сообщается о разделении смесей Pd — Pb. Аликвотную часть анализируемого раствора титруют при pH = 6 по описанному выше способу и получают общее содержание Pd и РЬ. В аммиачном растворе второй аликвотной пробы, содержащей тартрат-ионы, определяют РЬ. В этом случае в качестве индикатора применяют кислотный хром синий или метилтимоловый синий; Pd, который при втором титровании замаскирован в виде амминокомплекса, определяют по разности.
Практическое применение различных методов охватывает определение Pd в сплавах Pt — Pd [58 (81)], в смесях солей платины и палладия [55 (1)], фармацевтических препаратах [60 (186)] и в пастах, содержащих Pd и РЬ [62 (78)].
250
Косвенное определение палладия
Реактивы
ЭДТА, 0,01 М раствор.
Аммиак, концентрированный раствор.
Мурексид, индикатор в порошке с NaCl.
Тетрацианоникелат (II) калия, кристаллический.
Ход определения. К приблизительно нейтрализованному анализируемому раствору, содержащему до 20 мг двухвалентного палладия, прибавляют 10 мл концентрированного раствора аммиака и 0,2—0,25 г тетрацианоникелата калия, быстро нагревают раствор и разбавляют до 150—200 мл. Титруют после прибавления мурексида до пеоехода желтой окраски в фиолетовую.
Расчет. Так как 1 г-атом Pd вытесняет 1 г-атом Ni, расчет ведут по уравнению:
А • М • 106,4 = В
где А и М — соответственно, объем (в миллилитрах) и молярность раствора ЭДТА и В — количество палладия (в миллиграммах).
Замечания. Палладий обязательно должен присутствовать в растворе в виде Pd11, что достигается, если нужно, кипячением с соляной кислотой. После растворения сплава в царской водке раствор следует многократно выпаривать с НС1. Из других благородных металлов определению не мешают Ir, Os, Rh и Ru. Должны отсутствовать Ag, Au и Pt.
31. МЕДЬ
Комплексонометрическое определение меди не вызывает затруднений и может проводиться как прямым, так и обратным титрованием в интервале pH от 4 до 10 в зависимости от условий и применяемого индикатора. Описанный ранее Шварценбахом [48(7)] и модифицированный Флашкой [52(22)] метод микроопределений в аммиачной среде в присутствии индикатора мурексида широко используется на практике и в настоящее время благодаря простоте и резкому переходу окраски индикатора. Даже самые маленькие количества меди можно титровать на пятне после хроматографического отделения [58 (8)]. Единственный момент, которому следует уделить особое внимание, — это необходимость избегать слишком большого избытка аммиака, так как иначе точка эквивалентности не будет резкой или совсем не будет наблюдаться. Это относится не только к случаю применения мурексида, но и многих других индикаторов, и обусловливается тем, что амминокомплексы меди по сравнению с соответствующими комплексами с индикаторами имеют значительно большую прочность. Чтобы избежать избытка аммиака, проще всего прибавлять раствор аммиака по каплям до тех пор, пока образовавшийся сначала осадок Си(ОН)2 снова не растворится, что сопровождается окрашиванием раствора в глубокий синий цвет, характерный для
251
тетрамминокомплекса; после этого раствор сильно разбавляют водой. Такое разбавление не только необходимо для того, чтобы снизить концентрацию аммиака, но часто имеет целью уменьшение концентрации ионов меди, чтобы воспрепятствовать перекрыванию перехода окраски индикатора относительно интенсивной окраской комплекса Си с ЭДТА.
Для титрования меди в аммиачном растворе кроме мурексида применяются и другие индикаторы, например пирокатехиновый фиолетовый [54 (81)], эриохромцианин [57 (72)], нитрозохромотро-повая кислота [61 (19)]; целесообразно применять также ксилен-цианол FF [62 (137)], хромазурол S [55 (27)], прочный сульфоновый черный F [57 (42), 58 (3)] и другие.
Благодаря большей селективности в некоторых случаях предпочитают титрование в кислой среде. В этом случае чаще всего применяют индикатор ПАН, предложенный Ченгом, [55 (18)], характеризующийся наиболее резким переходом окраски. ПАН можно также использовать и в аммиачном растворе, однако переход окраски в этом случае далеко не такой резкий. При работе с индикатором-ПАН в кислом растворе следует обратить внимание на некоторые моменты. Как сам индикатор, так и его комплекс с медью (и другими металлами) плохо растворимы в воде. Поэтому точка эквивалентности получается размытой, так как титрант медленно взаимодействует с присутствующим, по-видимому, в коллоидной форме комплексом ПАН с медью. Возможно также, что этот комплекс сам по себе медленно реагирует. Следовательно, с практической точки зрения, желательно ускорить реакцию, что может быть достигнуто либо титрованием в горячем растворе, либо в растворах, содержащих 50% этанола, метанола или ацетона. Наверное, и другие органические растворители обладают аналогичным эффектом.
Благодаря высокой резкости перехода окраски раствор меди, содержащий ПАН, является наиболее употребительным раствором для обратного титрования [56 (43)]. Иногда можно воспользоваться для обратного титрования раствором, содержащим как медь, так и цинк (что очень выгодно), так как можно при этом снизить интенсивность синей окраски, обусловливаемой присутствием ионов меди.
Поскольку комплекс ПАН с медью намного устойчивее ассоциатов этого индикатора с другими металлами, можно использовать систему CuY — ПАН для индикации точки эквивалентности при прямом титровании большого числа других металлов [56 (44)].
Следующие индикаторы применяют для титрования меди в кислом растворе; ксиленоловый оранжевый [56 (39)], пирокатехиновый фиолетовый [54(81)], производные о-нитрофенола [56 (57)1, виолуровую кислоту [63 (56), хромазурол S [55 (27)] ПАР 157 (5)], SNAZOXS [60 (67)], азоксин [61 (112)], глицпнтимоловый синий [62 (23)] и 75%-ный спиртовый раствор М,М'-бис-(2-оксиэтил)-ди-
252
тиооксамида [62(4)]. Раствор с pH = 2,9 является оптимальным для индикатора 7-(2-пиридилазо)-8-оксихинолина [63 (70)].
Наряду с металлохромными индикаторами для индикации точки эквивалентности применяют также флуоресцентные индикаторы, например флуоресцеинкомплексон [59 (22)] или кальцеин W [59 (11)], причем в последнем случае достигают значительного повышения селективности при использовании трена в качестве титранта. Описаны также окислительно-восстановительные индикаторы, например вариаминовый синий [55 (17)] (причем добавка небольшого количества KSCN [56 (109)], в особенности в присутствии большого количества ионов меди, способствует более резкому переходу окраски индикатора) или смесь KSCN и п-анизидина [61 (115)].
Часто предпочитают обратное титрование, например, раствором меди с ПАН [56 (43)], при этом в противоположность прямому титрованию нагревание или добавление органических растворителей необязательно. Киннунен [57 (137)] рекомендует в качестве титранта для обратного титрования раствор соли тория или таллия (III) с ксиленоловым оранжевым, тогда как Такамото [55 (102)] обратно титрует раствором кобальта в ацетоно-водной смеси в присутствии роданид-ионов. Камерон и др. [61 (136)] применяют смесь KSCN, трифенилметиларсонийхлорида и хлороформа, проводя обратное титрование раствором кобальта с экстрактивной индикацией точки эквивалентности.
Белчер и др. [55 (104)] занимались изучением электрохимических свойств окислительно-восстановительной системы CuT/Cun в присутствии и в отсутствие ЭДТА и показали возможность прямого потенциометрического титрования с платиновым электродом. С ртутным капельным электродом титровали Рейли с сотр. [58 (11), 59 (113), 62 (29)] и указали на возможность последовательного титрования. Титрование с применением двух поляризованных ртутных электродов применяют для определения меди в сыворотке и селективного последовательного титрования смеси Си-—Zn, причем в качестве титранта применяют пентен, который не реагирует с Щелочноземельными металлами и магнием [62 (99)]. Возможно также амперометрическое титрование [62 (33)], позволяющее определять такие смеси, как, например, Си—Ni или Си—Zn—Са, последовательным титрованием. Сообщается о радиометрическом титровании [60 (133)], а также о высокочастотном [55(41], кондуктометрическом [57 (34)], кулонометрическом [56 (77), 62 (25)] и термометрическом [57 (97), 63 (67)] титрованиях.
Для определения меди особенно предпочитают фотометрическое титрование, так как Си может служить внутренним индикатором [53 (37), 62 (1)], хотя можно также проводить титрование в присутствии таких индикаторов, как пирокатехиновый фиолетовый [59 (21)] (при последовательном титровании смеси Bi—Си) или Мурексид [53 (45), 54 (43), 54 (69), 54 (70)]. При определении других металлов также часто применяют Си в качестве внутреннего индикатора для индикации точки эквивалентности «по наклону
253
кривой титрования» (см. стр. 99,) [57 (13), 57 (14), 61 (113), 62 (26)]. На этом принципе основано последовательное титрование смесей, например Fe—Си [53 (29)] или Cu—Bi [54(51)]. Селективность оп- | ределения меди фотометрическим титрованием повышается, если I использовать другие хелатные комплексообразующие вещества, I в первую очередь трен [57 (87), 57 (88)]. С последним определение I меди почти специфично. Фотометрическая индикация позволяет I автоматизировать определение [59 (120), 60 (78)].
Исходя из величины константы устойчивости комплекса меди с ЭДТА, можно без труда установить, что титрованию меди, с одной стороны, мешает большое число других металлов, с другой стороны, медь совместно титруется со многими другими металлами. Помехи со стороны меди могут быть, однако, обусловлены не только совместным титрованием с другими металлами, но и блоки- । рованием некоторых индикаторов благодаря присутствию следов 1 меди. Можно избежать блокирования, по крайней мере для индикатора эриохрома черного Т, если применять соответствующие маскирующие вещества, а также если работать с растворами, содержащими метанол, этанол или пропанол [62 (138)].
Медь можно легко и надежно маскировать с помощью KCN, о чем сообщалось уже давно, однако, к сожалению, одновременно с Си будут маскироваться многие другие металлы, часто сопутствующие меди. Если присутствуют Cd и Zn, то возможно применение альдегида для демаскирования. Если при титровании сопутствующего металла в качестве индикатора применяют эриохром черный Т, последний следует вносить только после того, как медь будет полностью замаскирована CFF-ионами, так как в противном случае вследствие окисления происходит разложение индикатора с образованием окрашенного в желтый цвет соединения [59 (146)], или же в растворе должен присутствовать восстановитель (например, аскорбиновая кислота), чтобы воспрепятствовать такому процессу. Возможно, что аналогичным образом будут разлагаться и другие индикаторы. Ченг [58 (63), а затем и Кароли [59 (49)] рекомендуют тиосульфат как относительно селективное маскирующее средство для меди в слабокислом растворе, если необходимо проводить определение цинка. Однако следует избегать слишком большого избытка маскирующего вещества, так как одновременно может частично замаскироваться и цинк. Добавку маскирующего вещества не трудно точно соизмерить, так как за процессом маскирования можно следить по обесцвечиванию синей окраски, характерной для ионов меди. Лысцова [61 (109)] указывает, что медь можно замаскировать тиосульфатом также при титровании никеля. Кэрэш [57 (39)] описывает маскирование меди путем добавления KI или KSCN и аскорбиновой кислоты при определении цинка или кобальта. При этом медь восстанавливается до Си1 и выпадает в осадок в виде соответствующего труднорастворимого соединения.
Всесторонне рассматривается определение меди и других металлов в одном растворе. В этих методах используются индикация
254
инструментальными методами, маскирование и демаскирование или и то, и другое одновременно. Выше уже говорилось об анализе смесей Си с Zn, Ni или Со. Пршибил и др. [55 (89)] описывают определение меди в присутствии Fe, Ni, Со и Мп при применении ДЦТА. Можно анализировать смесь Hg—Си [57 (65)], причем сначала определяют сумму обоих металлов обратным титрованием раствором соли меди с мурексидом, затем ртуть маскируют с помощью KI и освободившуюся ЭДТА определяют титрованием раствором меди. Калифа и др. [58 (57), 59 (124), 59 (125), 60 (163), 61 (14)] анализируют многочисленные бинарные и некоторые тройные смеси меди с другими металлами потенциометрическим обратным титрованием раствором соли ртути при применении маскирования и при работе с аликвотными пробами. Интересно поступает Аоки [60 (159)], который определяет смесь Си—Zn последовательным титрованием. Сначала при pH = 5 он определяет медь в присутствии пирокатехинового фиолетового, затем в присутствии того же индикатора титрует цинк при pH = 9. Метод более точен, если цинка содержится меньше, чем меди.
Практическое применение комплексонометрических методов определения меди распространяется на анализ самых разнообразных вещей, например монет [55 (76)], сплавов вообще [54 (67)], особенно с А1 [55 (78)] или с W [59(1)]. В рудах медь определяют, осаждая ее ксантогенатами, и после растворения осадка проводят титрование [62 (66)]. Далее, медь определяют в линолеатах [59 (89)], в кобальте и его солях [56 (87)], в растворах меди в этилендиамине [58 (106)] и (электрометрически с двумя поляризованными ртутными электродами) в сыворотке [62 (99)]. Особенно многочисленны работы по определению меди в гальванических ваннах для покрытий из меди и латуни [56 (51), 57 (62), 59 (49), 61 (145)]. Присутствующие во всех случаях цианид-ионы удаляют нагреванием с кислотой и Н2О2. Цинк определяют после демаскирования формальдегидом, а содержание меди вычисляют по разности после суммарного их определения.
Прямое определение меди с мурексидом
Реактивы
ЭДТА, 0,01 М раствор.
Мурексид.
Аммиак, приблизительно 1 М раствор.
Хлорид аммония, приблизительно 1 AI раствор.
Ход определения. В 100 мл анализируемого раствора должно содержаться не более 20 мг Си. Кислые растворы нейтрализуют Раствором аммиака, который затем добавляют в небольшом избытке для достижения pH раствора около 8. В случае слабокислых Растворов на 100 мл пробы прибавляют еще около 10 мл раствора NH4C1, чтобы последующее добавление аммиака не слишком
255
повышало значение pH. Затем вносят индикатор и титруют раствором ЭДТА до перехода желтой окраски в фиолетовую.
Замечания. При помощи рис. 41, полученного комбинацией кривых, изображенных на рис. 7 и 28, можно найти наиболее благоприятное для титрования значение pH. В противоположность со
ответствующему методу, описанному для определения никеля, оп-
Рис 41. Кривые перехода окраски мурексида в процессе титрования меди при различных значениях pH.
(Обратить внимание на увеличенный масштаб оси абсцисс по сравнению с рис. 32—39.)
ределение меди лучше проводить при низком значении pH. Это объясняется тем, что аммиачные комплексы меди значительно устойчивее аналогичных комплексов никеля, вследствие чего избыток аммиака может разложить комплекс меди с мурексидом (см. рис. 3). Следовательно, высокой концентрации аммиака следует избегать. Однако, чтобы удержать металл в растворе, некоторое количество аммиака, конечно, необходимо. Благодаря присутствию большого количества NHt -ионов поддерживается низкое значение pH и уменьшается опасность осаждения основных солей меди, например Сп2(ОН)3С1. Для интервала рН=7—8 аммиачный буферный раствор является, конечно, не слишком хорошим. Однако триэтаноламин применить
нельзя, так как его комплексы с ионами меди значительно прочнее,
чем комплексы меди с аммиаком.
Прямое определение меди с ПАН
Реактивы
ЭДТА, 0,01 М раствор.
ПАН, 1%-ный раствор в метаноле или этаноле.
Ацетатный буферный раствор, pH = 5.
Метанол пли этанол.
Ход определения. К нейтральному анализируемому раствору, содержащему 20—30 мг Си на каждые 100 мл, приливают 5 мл ацетатного буферного раствора и 3—5 капель раствора индикатора. Тотчас доводят раствор до кипения и титруют раствором ЭДТА до очень резкого перехода темно фиолетовой окраски в канареечножелтую. Вместо нагревания раствор можно разбавить спиртом (от 30 до 50%) и титровать при комнатной температуре.
Замечания. Если титрование проводят не в спиртовом растворе, то часто на поверхности раствора образуется тонкая пленка индикатора ПАН, которая может прилипать к стенкам колбы. Чтобы удалить краситель, недостаточно только промыть колбу. Необхо
256
димо следы его растворить в кислоте или спирте, чтобы избежать нежелательного присутствия красителя при дальнейшем употреблении посуды.
Определение различных металлов в присутствии индикаторной системы CuY — ПАН
Реактивы
ЭДТА, 0,01 М раствор.
Комплекс меди с ЭДТА, раствор (см. стр. 154).
ПАН.
Ацетатный буферный раствор, pH = 5.
Ход определения. К нейтральному анализируемому раствору приливают 5 мл ацетатного буферного раствора на каждые 100 мл, 3—5 капель раствора CuY и несколько капель раствора ПАН. Раствор нагревают до кипения и титруют раствором ЭДТА до перехода темно-фиолетовой окраски в канареечно-желтую.
Замечания. Этот общий метод анализа применяют для определения большого числа металлов, например Pb, Hg, Zn, Cd, Ni, Co; для определения ванадия следует прибавлять аскорбиновую кислоту; А1, так же как и Fe, можно титровать в сильнокислом растворе, а также определять их сумму. Можно определять даже Mg и щелочноземельные металлы. Индикаторная смесь пригодна также для титрований в аммиачной среде, но переход окраски менее резок. Преимущество этой индикаторной системы перед некоторыми другими индикаторами состоит в том, что она не подвержена блокированию. Можно также проводить титрование на холоду, в присутствии спирта, кроме случая определения А1.
• 32. СЕРЕБРО
Устойчивость комплекса Ag с ЭДТА (lg/C=7,2) [53 (46)] слишком мала, чтобы можно было определять этот металл прямым титрованием с визуальной индикацией конечной точки с использованием комплексообразующих индикаторов. Однако возможно прямое потенциометрическое титрование ионов Ag с электродом из серебряной проволоки [62(17)]. Титрование проводят в боратном буферном растворе с pH около 9. Хотя скачок потенциала выражен очень хорошо, этот метод имеет небольшое практическое значение, так как все металлы, имеющие более прочные комплексо-наты, титруются совместно с серебром.
Серебро можно определять косвенным путем по реакции с амальгамой [58(13)]. Асени [61 (154)] использовал эту возможность для определения Ag в смеси Ag—Bi и Ag—Cd, причем применял амальгаму висмута или кадмия. Эквивалентное серебру количество висмута или кадмия переходит из амальгамы в раствор, который титруют раствором ЭДТА (см. 131).
17 Зак. 553
257
Другой путь косвенного определения Ag состоит в использовании обменной реакции с цианидным комплексом никеля, при которой выделяется эквивалентное по отношению к серебру количество Ni; последний титруют раствором ЭДТА с мурексидом [52 (28)] или смесью тимолфталексона с диметиловым желтым [62 (123)] в качестве индикаторов. Реакция обмена протекает количественно также с труднорастворимыми солями серебра, вследствие чего можно в один прием провести титрование осадка, полученного после отделения [52 (28)]. Таким образом, титрование серебра получило большое значение, так как сделало доступным определение комплексонометрическим методом анионов, способных давать осадки с А^+-ионами (см., например, раздел о галогенах). Был разработан метод для определения микроколичеств [52 (26)]; при определении нескольких миллиграммов Ag он дает удовлетворительные результаты, особенно, если точку эквивалентности фиксируют фотометрически [57 (75)].
Практическое применение метод обм-ена получил при анализе AgN'Og [62 (123)], монет, содержащих серебро [55 (76)], и фотографических материалов [57 (24)].
Косвенное определение серебра
Реактивы
Тетрацианоникелат (II) калия, твердый (о его получении см. статью Флашки [52(26)]).
ЭДТА, 0,01 AI раствор.
Мурексид.
Аммиак, концентрированный раствор.
Хлорид аммония, приблизительно 1 М раствор.
Ход определения. К анализируемому раствору или к твердому соединению серебра с содержанием около 100 мг Ag приливают 10 мл раствора аммиака, 10 мл раствора NH4C1 и вносят 0,2 г цианидного комплекса никеля. При этом образуется прозрачный раствор, чему способствует слабое подогревание (например, в случае определения Agl). Затем раствор разбавляют до 100—200 мл, добавляют индикатор и титруют до перехода желтой окраски в фиолетовую.
Расчет. Так как, согласно реакции обмена (см. уравнение, приведенное ниже), необходимы 2 г-атом Ag, чтобы вытеснить 1 г-атом титруемого Ni, то эквивалентный вес серебра равен удвоенному атомному весу.
Замечания. Константа устойчивости комплексного иона [Ni(CN)4F~ равна 1027, комплексного иона [Ag(CN)2]“ Ю21 [А(5)]. Отсюда для константы равновесия реакции
2Ag+ + [Ni(CN)4]2- 2[Ag(CN)2]“ + Ni2+
получаем значение 10IS, указывающее на то, что реакция практически полностью протекает слева направо. Если цианидный комплекс
258
никеля присутствует в избытке, то концентрация свободных ионов серебра уменьшается до 10-10, чего вполне достаточно для растворения труднорастворимых солей, таких, как AgCl, AgBr, AgSCN, но не Agl. Однако при этом существует опасность образования труднорастворимого цианида никеля:
Ni2+ + [Ni(CN)4J2~ Ni[Ni(CN)4J
Чтобы предотвратить это, к раствору следует прибавить много аммиака, который связывает в амминокомплекс освободившиеся из цианидного комплекса ионы никеля. В этом случае ионы серебра, не связанные с CN'-ионами, присутствуют также в виде амминокомплекса [Ag(NHs)2]+. Если концентрация аммиака равна 1 М, что имеет место после разбавления при работе по приведенной выше методике, то для константы реакции обмена имеем
[Ni]'[Ag(CN)2]2 [Ag]'2 [Ni(CN)J ,Ь
где [Ni]' и [Ag]' означают общие концентрации никеля и серебра, не связанных с цианид-ионами:
6
[Ni]' = [Ni(NH3)j] = 2,6 10s[Ni]
г=0
?
[Ag]'= 5 [Ag(NH3)J = 107[Ag]
i=0
Следовательно, в присутствии избытка цианидного комплекса никеля в аммиачной среде общая концентрация серебра [Ag]' снижается до 10~8 и концентрация свободных ионов серебра [Ag] — до 10-15, что достаточно для переведения в раствор даже труднорастворимого иодида серебра.
33. золото
Киннунен и Мериканто [55 (1)] сообщают о косвенном комплексонометрическом определении золота. Сплав золота растворяют в царской водке и после отфильтровывания осадка AgCl, получающегося вследствие присутствия (постоянного) серебра, золото многократно извлекают эфиром и эфир из объединенного экстракта выпаривают. Оставшийся водный раствор нейтрализуют и золото определяют по методу, описанному для определения Pd или Ag, и заключающемуся в вытеснении с помощью цианидного комплекса никеля и последующем титровании раствором ЭДТА выделившихся из цианидного комплекса ионов никеля.
34. ЦИНК
Комплексонометрическое определение цинка не вызывает никаких затруднений и уже ранее было описано Бидерманом и Швар-Ценбахом [48(5)]. При этом определении цинк титруют в аммиачном
буферном растворе с pH = 10 в присутствии эриохрома черного Т, причем получается исключительно резкая точка эквивалентности. Не составляют затруднений микро- [52 (22)] и ультрамикроопределения [52 (37), 57 (134)]. Можно проводить титрование на пятне после хроматографического разделения на бумаге [55 (5), 56 (8), 59 (40)]. Практически можно применять при титровании цинка все красители — производные эриохрома черного Т, описанные как индикаторы на магний. В качестве флуоресцентного индикатора можно использовать 8-оксихинолин-5-сульфонат [58 (19)]. При титровании в щелочных растворах пригодны пирокатехиновый фиолетовый [54 (78), 56 (41), 60 (159)], цинкон [55 (2), 58 (4)], нафтоловый фиолетовый [57 (81)], метилтимоловый синий [58 (34)] и мурексид [53 (8), 54 (46), 60 (132)]. Преимущество мурексида перед эриохромом черным Т и большинством его производных состоит в том, что следы тяжелых металлов мурексид не блокируют. Концентрация аммиака при применении цинкона должна поддерживаться точно определенной и небольшой. В присутствии же мурексида желательно полное отсутствие аммиака; титрование проводят при pH = 8—8,5 или в растворе, содержащем этаноламин при pH = 13 [63 (20)]. Если используют растворы с более низкими значениями pH, например с pH = 6 в присутствии эриохрома черного Т [53 (33)] (при этом целесообразно добавлять яблочную кислоту [61 (108)]) или с pH =8 в присутствии мурексида, то при этом уменьшаются помехи и, прежде всего, не мешают значительные количества магния.
С точки зрения селективности, титрование в кислой среде является предпочтительным. В распоряжении исследователей имеются прекрасные индикаторы, например ПАН [55(18)] или CuY — ПАН [56 (44)], ксиленоловый оранжевый [57 (79), 59 (26), 61-(108), 63 (14), 63 (21)] и метилтимоловый синий [58(34), 61(108)], которые применяют в растворе, содержащем ацетон или уротропин. Особенно резкую точку эквивалентности дает дитизон [55 (98)] в 50%-ном спиртовом растворе с pH = 4—5. Индикацию точки эквивалентности в ацетатном буферном растворе с рН=4,5 можно проводить с помощью косвенной визуально наблюдаемой окислительно-восстановительной реакции. При этом в растворе, содержащем гексацианоферраты(II) и (III), используют в качестве индикаторов 3, З'-диметилнафтидин [53 (34), 53 (35), 55 (67)], бензидин [56 (99)] или вариаминовый синий [57 (117)]. Вследствие медленного протекания реакции в точке эквивалентности при прямом титровании предпочитают при таком способе индикации обратное титрование стандартным раствором сульфата цинка. Возможно также обратное титрование раствором соли кобальта в ацетоноводном растворе, содержащем роданид-ионы.
Возможно амперометрическое титрование при потенциале выделения цинка [51 (15)] или по «воине комплексона» [57 (101), 62 (33)], оно описано для определения Zn в маслах [53 (48)] и сплавах [56 (3)]. Возможно также последовательное титрование си
260
стем Zn—Mg, Zn—Ca, Cu—Zn—Ca [62 (33)]. Сообщается также об электрометрической индикации с двумя поляризованными электродами с применением тетраэтиленпентамина [62 (99)].
Применяют обратное потенциометрическое титрование раствором железа(Ш) при pH = 5 —6 [51 (16)] или прямое титрование со стационарным ртутным капельным электродом [58(12)]. В последнем случае возможно определять микрограммовые количества цинка [57 (8)]. Применяют также высокочастотное [54 (2), 55(41)], радиометрическое [60 (133)] и термометрическое титрования [57 (97), 62 (44)]. Особое внимание уделено фотометрическому титрованию, которое можно проводить либо в УФ-области методом самоиндикации [54 (14)], либо в присутствии индикаторов (главным образом, эриохрома черного Т) [53 (45), 54 (69), 56 (25), 56 (73)], либо автоматически [59 (120)]. Фотометрическое титрование цинка в присутствии большого количества кадмия описано в разделе, относящемся к кадмию.
Из рассмотрения таблицы констант устойчивости комплексов с ЭДТА видно, что определению цинка мешают ионы большого числа других металлов. К счастью, мы имеем в распоряжении много способов селективного определения, и в частности, определения цинка в присутствии сопутствующих элементов, включая железо, в природных и искусственных материалах [56 (47)]. Особенно важным является демаскирование цианидных комплексов цинка. Для этой цели применяют формальдегид [52 (6), 53 (27)] и хлораль-гидрат [53(10)]. В аммиачном растворе формальдегид реагирует как со свободными, так и со связанными с цинком (и кадмием!) цианид-ионами с образованием нитрила гликолевой кислоты; при этом ранее замаскированный цинк выделяется в свободном состоянии и может быть оттитрован. Другие комплексонометрически активные комплексообразователи, реагирующие с цианид-ионами, такие, как Fe111, Fe11, Hg, Си, Ni и Со, выделяются медленно или даже вовсе не выделяются и остаются замаскированными. Их следы, и в первую очередь следы меди, все же могут выделяться и, таким образом, мешать определению. Эти помехи заключаются даже не в совместном титровании —для этого слишком незначительны количества мешающих металлов, но, главным образом, в блокировании эриохрома черного Т, который обычно применяют в качестве индикатора. Поэтому приходится принимать меры предосторожности, чтобы избежать подобных явлений. Можно заменить эриохром черный Т другим, не блокируемым индикатором, например пирокатехиновым фиолетовым или мурексидом [60 (132)], но переход окраски у них менее резок. При использовании формальдегида в качестве демаскирующего средства следует принимать во внимание, что альдегид реагирует с аммиаком с образованием уротропина, что может вызвать понижение pH раствора.
Яноусек [59 (26)] сообщает об интересном кислотном демаскировании цианида цинка. При pH около 6 цианидный комплекс
261
цинка настолько сильно диссоциирует, что цинк реагирует с ксиленоловым оранжевым и ЭДТА, тогда как Си, Ni и Со остаются замаскированными. Хотя выделение синильной кислоты при указанном pH протекает медленно и в умеренных количествах, все же работу следует проводить в вытяжном шкафу!
Особый практический интерес представляет определение смеси меди и цинка, для анализа которой, кроме упомянутого цианидного метода, имеются и другие возможные варианты. Аоки [60 (159)] описывает метод последовательного титрования. Сначала он титрует при pH = 5,1—5,4 ионы меди с пирокатехиновым фиолетовым, а затем доводит pH раствора до значения pH = 9 и определяет ионы цинка в присутствии того же индикатора. Метод непригоден, если содержание цинка превышает содержание меди, так как в этом случае ионы цинка частично титруются совместно с ионами меди. Другая возможность состоит в маскировании ионов меди тиосульфат-ионами, согласно Ченгу [58 (63)]. Однако количество маскирующего вещества следует точно дозировать (по исчезновению синей окраски аквокомплекса меди), так как иначе ионы цинка тоже связываются в комплекс, и переход окраски индикатора ПАН становится нечетким. Разработан метод определения микроколичеств [63(21)], причем в качестве индикатора в нем применяют ксиленоловый оранжевый. Сумму цинка и меди определяют в присутствии мурексида, и затем по разности вычисляют содержание меди. Кроме того, медь можно замаскировать восстановлением аскорбиновой кислотой или иодидом калия (в присутствии роданид-ионов [57 (39)]).
Можно достигнуть повышения селективности при определении цинка, если ЭДТА заменить более селективным титрантом. Для этой цели, в первую очередь, используют полиамины, которые реагируют лишь с ограниченным числом катионов. Применение таких титрантов стало возможным с тех пор, как обнаружилось, что цинков является весьма селективным индикатором. Рейли и др. [57 (9)] сообщают о применении в качестве титранта трена. Джонсон [62 (99)] электрометрически титрует раствором тетраэтиленпентамина с двумя поляризованными электродами. Для анализа смеси Cd —Zn получил значение комплексон ГЭДТА, так как комплекс кадмия с этим комплексоном значительно более устойчив, чем комплекс с цинком. На этом основано микроопределение обоих металлов фотометрическим методом. Индикацию точки эквивалентности проводят по «наклону кривой титрования» (см. стр. 99), применяя в качестве индикатора мурексид [63 (11)].
Фабрегаз и др. [62 (98)] используют разницу в значениях констант устойчивости комплексонатов цинка и кадмия следующим образом. В присутствии большого содержания сульфат-ионов свинец вытесняется из комплекса с ГЭДТА ионами кадмия, но не ионами цинка. Образовавшийся сульфат свинца отфильтровывают и в фильтрате титруют ионы цинка раствором ЭДТА в присутствии эриохрома черного Т. Метод пригоден, если отношение Cd : Zn со-
262
пыли HgCl
ставляет около 20. Однако цинк можно титровать с визуальной индикацией конечной точки раствором ЭДТА с ксиленоловым оранжевым в присутствии до 300-кратного (молярного) избытка Cd, если последний, согласно Флашке и Бутшеру [63 (81)], замаскировать иодид-ионами, взятыми в высокой концентрации. Как отмечают те же авторы (неопубликованные сведения), даже избыток Cd в несколько тысяч раз не мешает, если проводить фотометрическое титрование раствором ДТПА.
Для маскирования цинка кроме цианид-ионов можно применять также BAL [54 (79)] и унитиол [60 (59)], 60 (60)]
В качестве маскирующих веществ для удаления других металлов при титровании цинка упоминаются ацетилацетон [63(14)] и триэтаноламин [54 (76)] для маскирования А1, а также фторид-ион для маскирования А1, Са и Mg [54 (74)].
Поскольку цинк титруется легко и с резким переходом окраски индикатора, его часто применяют для установки титра растворов комплексонов. Для этого используют металлический цинк или его соль, причем особенно подходящим, благодаря высокому эквивалентному весу, является пиридиново-роданидный комплекс цинка [56 (83)]. Кроме того, растворы солей цинка являются наиболее употребительными для обратных титрований при определении других металлов. Резкие переходы окраски в реакциях вытеснения получаются в присутствии таких смешанных индикаторов, как ZnY-цинкон [58 (4)] в щелочной среде и 2пУ-дитизон[61 (61)] в кислой и нейтральной среде.
Комплексонометрическое определение цинка применяют в анализе самых различных материалов. Цинк определяют в продуктах металлургического производства и сплавах [52 (6), 53(26), 53 (40), 56(3)], особенно в сплавах алюминия [53 (6), 54 (89), 56 (87), 61 (122), 61 (175)]; в сплавах In—Zn—Sn [63 (19)], латуни [55 (3), 57 (39), 59 (49)], бронзе [55 (3), 57 (39)], сплавах с медью [54 (67)], с ураном [54 (46)] и ферритах [61 (70), 61 (104)]. Кроме того, цинк определяют в породах и концентратах [55 (77), 58 (55)], водах [58 (88)], конденсированном паре [54 (71)], цинковых солях [61 (108)], ваннах для прядения [52 (44)], маслах [53 (48)], стеарате цинка [53 (8)] и золе животных [55 (9)] и растительных тканей [58 (19)]. В ваннах для покрытия цинк титруют после демаскирования формальдегидом [54 (24), 54 (52), 56 (56), 58 (21), 59 (120)]. В лаковой и пигментной промышленности используют определение цинка при анализе пигментов [55 (44)], в особенности ZnO [52 (35), 56 (67)], и литопонов [57 (120)], сиккативов [61 (143)] и канифоли [54 (98)]. Существует множество методов для анализа фармацевтических препаратов [53 (12), 57 (113), 60 (98), 60 (173), 61 (6)], в первую очередь инсулина [53 (53), 54 (82), 58 (73)]. Теоретически интересно определение металлического цинка в присутствии ZnO в цинковой
• Анализируемый раствор с pH = 6 кипятят с раствором 2, причем в реакцию вступает лишь металлический цинк, 263
который и переходит в раствор. После фильтрования ртуть удаляют восстановлением солянокислым гидроксиламином в аммиачном растворе и цинк определяют в присутствии эриохрома черного Т.
Определение цинка (и кадмия) с эриохромом черным Т
А. Определение в отсутствие меди, кобальта, никеля
Реактивы
ЭДТА, 0,01 М раствор.
Эриохром черный Т.
Буферный раствор, pH = 10.
Ход определения. В 100 мл анализируемого раствора должно
содержаться не более 25 мг Zn (или 50 мг Cd). Кислые растворы
Рис. 42. Кривые перехода окраски эриохрома черного Т в процессе титрования цинка при различных значениях pH.
сначала нейтрализуют едким натром, в некоторых случаях после предварительного отделения трехвалентных металлов с помощью ацетат-ионов. Затем к каждым 100 мл раствора прибавляют 2 мл буферного раствора, индикатор и титруют до перехода красной окраски в синюю. С последней каплей раствора титранта исчезает красноватый оттенок окраски.
Замечания. Кривые титрования цинка, полученные комбинированием кривых, изображенных на рис. 9 и 25, представлены на рис. 42. Из рис. 42 видно, что определение цинка можно выполнять в интервале pH от 7 до 10, и при этом получается настолько рез-
(Обратить внимание на увеличенный масштаб оси абсцисс по сравнению с рис. 32—39-)
кий переход окраски, что можно при-менить даже 0,001 М раствор ЭДТА. Растворы не должны быть холодными
(от 30 до 40° С); pH раствора не следует понижать меньше 7, так
как иначе не связанный с металлом эриохром черный Т начинает переходить в свою красную форму HzF-. При рН>10 скачок pZn (рис. 42) быстро уменьшается. В действительности положение не настолько неблагоприятное, как этого можно было бы ожидать в
соответствии с рисунком, так как в присутствии большого содержания аммиака получается резкий переход окраски. Причиной этого является образование смешанного комплекса с красителем ZnF(NH3)x.
Так как константы устойчивости комплекса кадмия с эриохромом черным Т никогда не определялись, мы не можем вычертить
кривую титрования кадмия, аналогичную кривым, представленным на рис. 42. Однако известно, что кадмий можно титровать в интервале pH от 7 до 10.
264
Б. Определение в присутствии меди, кобальта, никеля
Реактивы
ЭДТА, 0,01 ТА раствор.
Сульфат магния, 0,01 М раствор.
Эриохром черный Т.
Аммиак, концентрированный раствор.
Цианид калия, 1 М раствор.
Хлоральгидрат, 1 М раствор или формальдегид, 1 М раствор.
Хлорид аммония, 1 М раствор.
Ход определения. Предварительным титрованием определяют в анализируемом растворе содержание катионов тяжелых и щелочноземельных металлов, причем поступают следующим образом. К кислому анализируемому раствору приливают в избытке раствор ЭДТА (а мл), на каждые 100 мл прибавляют 2 мл раствора NH4C1, аммиаком доводят pH раствора до значения 10 (до посинения тимолфталеиновой бумаги), прибавляют эриохром черный Т и титруют раствором MgSO4 (быстро, чтобы избежать блокирования индикатора) до появления красной окраски (количество титранта— b мл). Разность а — b дает общее содержание присутствующих металлов. Затем на каждые 100 мл титруемого раствора прибавляют 2 мл раствора KCN, вследствие чего Си, Со, Ni, Zn и Cd переходят в цианидные комплексы и освобождается эквивалентное количество ЭДТА, которую оттитровывают раствором MgSO4 после прибавления новой порции индикатора. Расход титранта (с мл) пропорционален содержанию тяжелых металлов.
Для основного титрования берут столько анализируемого раствора, чтобы общее содержание тяжелых металлов составляло 1 — 5*10-1° г-атом (определяют предварительным титрованием). Нейтрализуют раствором NaOH, избегая образования осадка, добавляют 2 мл KCN и разбавляют до 100 мл. Если при предварительном титровании обнаружены щелочноземельные элементы (а — b — с > 0), то прибавляют эриохром черный Т и титруют раствором ЭДТА до перехода красной окраски в синюю. Затем демаскируют цинк добавлением 6 мл хлоральгидрата. Спустя минуту после добавления последнего восстанавливают прежнее значение pH раствора внесением 8 мл раствора NH4C1, добавляют еще несколько капель раствора аммиака, если нужно, снова добавляют эриохром черный Т и титруют раствором ЭДТА окрашенный в красный цвет анализируемый раствор до перехода его окраски в синюю. По расходу ЭДТА вычисляют содержание цинка или кадмия.
Если для демаскирования применяют формальдегид, то берут Удвоенное по отношению к теоретическому количество (4 мл 1 М раствора формалина) и выжидают перед обратным титрованием лишь несколько секунд.
Замечания. Брутто-константы устойчивости цианидных комплексов цинка и кадмия [А (2), А (4), 54 (103)] составляют около Ю 19. Чтобы эти металлы не реагировали с эриохромом черным Т,
265
необходимо, чтобы их значения рМ были не ниже 14 при pH = 10 (см. рис. 25). Этого можно достигнуть, если концентрация свободных CN'-иопов в растворе составляет по меньшей мере Ю*2 М (тогда [Zn(CN)4] ~J0-3 М, [Zn] ~ К)"14 М; [CN] « 10-2 М). Лишь при таком количестве цианид-ионов возможно титрование присутствующих щелочноземельных элементов без помех со стороны цинка и кадмия.
Для последующего демаскирования ионов обоих металлов необходимо снизить концентрацию цианид-ионов приблизительно до 10-4 М, вследствие чего концентрация ионов цинка возрастает до 10-6 М и, как видно из рис. 25, при pZn = 6 эриохром черный Т будет присутствовать в виде красного комплекса с цинком. Это понижение концентрации цианид-ионов от 10-2 до 10-4 часто легко достигается при применении альдегида. Однако при этом pH раствора повышается, так как, согласно уравнению реакции
/ОН
HCN + RCH=O —> RCH \CN
из реакционной смеси исчезает HCN, убыль которой восполняется в результате следующей реакции:
CN- + Н2О HCN + ОН-
Это повышение pH может вызвать даже осаждение гидроокиси цинка или кадмия. Добавление хлорида аммония снова приводит к удовлетворительному для титрования значению pH.
Константа устойчивости цианидного комплекса никеля составляет около 1027, такая же константа для [Cu(CN)4]3-— около 1028 [59 (140)]. При концентрации свободных цианид-ионов 10-2 М значение pNi составляет около 22, а после добавления альдегида (примем, что при этом [CN] = 10“4 М) pNi составляет только 14. Опыт показывает, что при такой небольшой концентрации свободных ионов никеля последний еще не реагирует с эриохромом черным Т. Но снижать и дальше значение pNi нельзя, так как при значении pNi около 9 необратимо образуется комплекс никеля с красителем. Следовательно, применение этого способа очень ограничено, так как возникают трудности, если в растворе присутствует слишком много никеля или меди. Альдегид также следует добавлять с осторожностью. Большой избыток этого демаскирующего вещества приводит к блокированию индикатора демаскированными никелем и медью. Это почти всегда происходит при стоянии оттитрованных растворов, даже если титрование прошло без помех. Хлоральгид-рат демаскирует медленнее, чем формальдегид, и поэтому он менее опасен в этом отношении.
Если необходимо определить малые количества Zn или Cd в присутствии больших количеств других металлов, то лучше всего при
266
менять экстракционный метод [53 (40), 54 (38)]. К раствору анализируемого вещества добавляют тиомочевину (маскирование Си и Ni) и фторид-ион (маскирование Fe), а также большие количества роданида аммония, и экстрагируют роданиды цинка и кадмия ме-тилизобутилкетоном. После отделения кетонный слой разбавляют водой и, чтобы смесь не расслаивалась, добавляют ацетон. Полученный раствор титруют по методу «А».
После маскирования меди и никеля цианидом калия можно также осадить цинк в виде сульфида цинка, осадок промыть и снова растворить и цинк оттитровать по методу «А» [54 (89) ]
Определение цинка с диметилнафтидином [53(34)]
Реактивы
ЭДДА, 0,1 М раствор.
Гексацианоферрат (II) калия, 1% ный раствор.
3,3'-Диметилнафтидин, 1%-ный раствор в ледяной уксусной кислоте.
Ацетат натрия, приблизительно 1 М раствор.
Серная кислота, приблизительно 1 М раствор.
Ход определения. Анализируемый раствор должен быть приблизительно 0,01 М по цинку. Кислые растворы нейтрализуют едким натром (по индикаторной бумаге с метиловым красным). К каждым 100 мл раствора добавляют 1 каплю раствора гексацианоферрата калия и 2—3 капли диметилнафтидина, 3 мл ацетата натрия и около 0,5 мл соляной кислоты; pH смеси должен быть между 5 и 6, а цвет раствора должен быть фиолетово-красным. Затем титруют раствором ЭДТА до тех пор, пока окраска раствора заметно не ослабеет. К концу титрования раствор добавляют очень медленно, выжидая около 15 секунд после каждой капли. От последней капли ЭДТА исчезает через указанный промежуток времени оставшийся розовый оттенок, и раствор становится бесцветным.
Замечания. Точка эквивалентности достигается медленно, так как реакция между образовавшимся гексацианоферратом (II) цинка и ЭДТА протекает медленно. Поэтому предпочитают избыток ЭДТА обратно оттитровывать раствором сульфата цинка. В этом случае точка эквивалентности достигается быстрее, так как образование гексацианоферрата(II) цинка с первой каплей избытка раствора ZnSO4 протекает быстро. При обратном титровании раствором сульфата цинка можно также определять Си, Ni, Al, Cd, Pb и др. Хотя этот интересный метод в значительной мере потерял свое значение после введения металлохромных индикаторов, используемых в кислом растворе, все же он до сих пор имеет практическое при--менение в некоторых серийных определениях. В качестве косвенных окислительно-восстановительных индикаторов вместо соединений иафтидина можно использовать также бензидин или вариаминовый синий.
267
35. КАДМИЙ
Кадмий по отношению к ЭДТА и ко всем исследованным до настоящего времени индикаторам ведет себя аналогично цинку, и его комплексонометрическое определение не вызывает затруднений. Уже ранее сообщалось о макро- [48 (5)] и микроопределениях [55 (22)] кадмия с мурексидом. Однако комплекс кадмия с эриохромом черным Т слабее соответствующего комплекса цинка, поэтому следует добавлять небольшое количество аммиачного буферного раствора, иначе точка эквивалентности будет нерезкой. Это относится также к некоторым другим индикаторам.
Из большого числа индикаторов, предложенных для определения кадмия, можно отобрать следующие: пирокатехиновый фиолетовый [54 (78)], нафтоловый фиолетовый [57 (81)], метилтимоловый синий [58 (34)], галлеин [62 (30)] и глицинтимоловый синий [59 (17)], которые применяют в буферном растворе с pH = 10. Фталеиновый пурпуровый, рекомендуемый Белчером и др. [58 (2)], также может служить индикатором в аммиачном растворе, однако он блокируется ионами многих металлов, в том числе и цинка. Врхлабски и Окач [62 (46)] сообщают о том, что глиоксаль-бис-(2-оксианил) образует в щелочной среде фиолетовый комплекс с кадмием, но не с цинком (последнее объясняется высокой устойчивостью амминокомплексов цинка). На основании своих исследований, которые позволили разработать метод последовательного титрования смеси цинка с кадмием, использовав вышеупомянутый принцип, Флашка полагает, что, по-видимому, образуется комплекс индикатора с цинком, который настолько сильно диссоциирует, что индикатор подвергается окислительному или гидролитическому разложению. В более прочном комплексе с кадмием индикатор делается стабильным.
В слабокислой среде с pH = 5 — 6 можно применять ПАН [56 (43)] или CuY —ПАН [56 (44)], азоксин [57 (122)], SNAZOXS [60 (67)], ксиленоловый оранжевый (уротропиновый буферный раствор) [57 (79)] и VY — дифенилкарбазид [63 (1)]. Бовалини [53 (16)] применяет цитратный раствор с pH = 5,3 и — в качестве индикатора— дитизон, не добавляя спирта, тогда как Хара [61 (61)] проводит определения в 60 %-ном спиртовом растворе с pH = 4,5.
Описаны также обратные титрования в присутствии, например, ПАН раствором сульфата меди [56 (43)], раствором соли кобальта в 50%-ной ацетоно-водной смеси в присутствии роданид-ионов [55 (102)], раствором сульфата цинка с цинконом [55 (2)], раствором сульфата цинка с косвенной окислительно-восстановительной индикацией с помощью смеси гексацианоферратов(П) и (III) с ди-метилнафтидином [54 (77), 55 (67)], бензидином [56 (99)] или с ва-риаминовым синим [57 (117)].
Описание индикации точки эквивалентности с помощью инструментальных методов можно найти во многих работах. Описано амперометрическое титрование с классическим ртутным капельным
268
электродом [51 (15), 56 (94)]. Этот метод можно применять в сильно разбавленных растворах (10-7 Л4!) с большой точностью [56 (22)]. Рейли и др. [62 (33)] пользуются для индикации «волной комплексона». Амперометрическая индикация привлекается также для титрования с помощью кулонометрически генерированной ЭДТА [56 (77)]. «Квадратноволновая» полярография [62 (36)] и метод с наложением небольшого поляризующего постоянного тока [54 (22)] являются модификациями амперометрического метода.
Потенциометрическая индикация с применением ртутного капельного электрода [58 (12), 58 (62)] и с обратным титрованием раствором соли ртути [58 (57), 58 (60)] особенно привлекательна благодаря хорошей селективности и возможности последовательных титрований. Имеются сообщения о высокочастотных [55 (41), 55(112)], кондуктометрических [54 (32), 57 (34)] и термометрическом [57 (97)] титрованиях. Косвенное определение кадмия возможно также при восстановлении амальгамой [58 (13)]. Этот метод позволяет раздельно определять бинарные смеси.
Титрование кадмия мало избирательно, однако можно до известной степени повысить селективность, если применять инструментальные методы. Применяется предварительное разделение, например экстракция роданидных комплексов [54 (38)]. Методы с использованием маскирующих средств или аликвотных проб применяют для раздельного опоеделения многокомпонентных смесей. В этом случае пользуются возможностью маскировать кадмий цианистым калием и демаскировать его формальдегидом [52 (6), 52 (29)]. Этот способ позволяет определять кадмий в присутствии свинца, щелочноземельных и других металлов, и в первую очередь, в присутствии значительных количеств железа [56 (47)]. Во избежание реакции с ЭДТА кадмий можно замаскировать иодидом калия (в высоких концентрациях), который не мешает определению цинка. Другими веществами, маскирующими кадмий, являются BAL [54 (79)] и унитиол [60 (37), 60 (38), 60 (59), 60 (60)].
Особый интерес представляет определение кадмия в присутствии цинка. Суитцер и Брикер [54 (14) проводят титрование с фотометрической самоиндикацией при длине волны 236 нм в очень концентрированном растворе едкого натра. Цинк присутствует в виде цинката, и кадмий предохраняют от выпадения в осадок в виде гидроокиси добавкой небольшого, точно определенного (!) количества цианистого калия. Ту же задачу, однако, можно решить более простым и для практики более выгодным способом. Так как амминокомплекс цинка значительно более прочен, чем такой же комплекс кадмия, можно добиться различия эффективных констант устойчивости комплексонатов в аммиачном растворе благодаря различию факторов Pnh3- Разница не настолько велика, чтобы было возможно титрование с индикатором, но достаточна для инструментальной индикации по «наклону кривой титрования». Например, Рейли и др. [61 (ИЗ)] титруют раствором ДТПА с применением меди в качестве фотометрического индикатора «по наклону
269
кривой титрования». Значительно более удобно, согласно Флашке [62 (26)], титрование раствором ГЭДТА, так как в этом случае уже с самого начала константы комплексов с цинком и кадмием отличаются друг от друга почти на два порядка. И здесь Сп2+-ионы в сильно аммиачном растворе используются в качестве индикатора, связываясь в комплекс после ионов кадмия до или совместно с ионами цинка, вызывая изменение наклона кривой титрования.
Можно определять микрограммовые количества кадмия и цинка по одной кривой фотометрического титрования, если титрование проводят в присутствии мурексида [63(H)] или цинкона. Краситель прибавляют в избытке по отношению к цинку. Комплекс цинка с красителем является индикатором на кадмий «по наклону кривой титрования». По двум перегибам на кривой титрования можно вычислить соответствующий расход комплексона на титрование кадмия и цинка.
Описанный выше принцип индикации с помощью ионов меди можно применить и к амперометрическому титрованию, причем в этом случае титрование проводят при потенциале волны меди (—0,30 в относительно Нас. КЭ) [63 (9)]. При отношении Zn : Cd = = 500 можно получить еще удовлетворительные результаты.
Практическое применение комплексонометрическое титрование кадмия находит прежде всего в анализе ванн для покрытий, причем для анализа цианидных ванн применяют формальдегид в качестве демаскирующего средства [54 (24), 54 (52), 56 (56), 58 (21)]. Кадмий можно определять в амальгаме, после того как ртуть бу дет восстановлена муравьиной кислотой до металла и отфильтрована [62 (22)]. Среди других упоминается анализ сплавов [54 (38), 57 (100)], аккумуляторной жидкости [62 (10)] и особенно сплавов Sn—Pb—Cd—Ni [62 (62)1. Ченг [62 (51)] анализирует сложные соединения типа Hg—Те—Cd, определяя сначала суммарным титровании общее содержание Hg и Cd, а затем, после добавки вис-мутола (для осаждения ртути) титрует освободившуюся ЭДТА раствором сульфата цинка с эриохром черным Т.
Описание методов определения кадмия приведено в разделе, касающемся определения цинка.
36. РТУТЬ
Комплексонометрически можно определять только двухвалентную ртуть, так как Hg2+-noHbi в присутствии ЭДТА диспропорцио-нируются до Hg11 и металла. Первые методы, о которых мы сообщаем, являются косвенными и выполняются обратным титрованием [48 (5)] или методом вытеснения с помощью MgY2- [52 (22)]. Прямо ионы ртути можно титровать, применяя систему CuY — ПАН в уксуснокислом растворе [56 (44)]. Различные индикаторы непосредственно реагируют на Hg и могут быть использованы при комплексонометрическом титровании. Ксиленоловый оранжевый [57 (135),
270
57 (136), 61 (21)] и метилтимоловый синий [56 (44)] дают резкие переходы окраски в растворах, содержащих уротропин. Допустимы значительные количества хлорид-ионов. Однако с увеличивающимся содержанием последних переход окраски ухудшается до тех пор, когда большие концентрации иона хлора не парализуют полностью образование комплекса с индикатором. Как сообщают, при титровании с ксиленоловым оранжевым хлорид-ионы удаляют добавлением нитрата серебра. Образующийся при этом осадок не нужно отфильтровывать. Однако после внесения индикатора следует сразу и быстро провести титрование, так как краситель сенсибилизирует хлорид серебра и вызванное воздействием света почернение осадка делает нерезким переход окраски.
Позже Эрдэй и др. [60 (150)] предложили дифенилкарбазид в качестве прямого индикатора. Однако реакция между комплексом с индикатором и ЭДТА протекает исключительно медленно, но ее можно ускорить и сделать практически мгновенной, добавив немного о-фенантролина. Механизм этой каталитической реакции не получил объяснения.
Исключительно хорошо можно определять ртуть потенциометрическим методом. Используя эту возможность, Калифа и др. применяли растворы солей ртути для обратного титрования при определении других металлов. Рейли, Шмид и сотр. при комплексонометрическом титровании ионов других металлов применяют HgY2- в комбинации с ртутным капельным электродом. О теории и применении этих методов можно получить справку в разделе, касающемся потенциометрии. Далее, отсылаем читателя к разделу об амперометрическом титровании. Здесь же укажем лишь на прямое амперометрическое определение ртути с обычными ртутным [58 (86)] и танталовым [60 (74)] электродами.
Помехи, вызываемые присутствием ртути при титровании других металлов, могут быть сравнительно легко исключены, так как ртуть может быть замаскирована почти селективно. Уже давно [48 (5)] была показана возможность замаскировать ртуть иодид-ионами. Уено [57 (65)] использовал этот способ при анализе растворов, содержащих медь и ртуть. Сначала определяют сумму обоих металлов обратным титрованием избытка ЭДТА раствором меди с мурексидом. Затем после добавки иодида калия определяют титрованием раствором меди выделившееся эквивалентное содержанию ртути количество ЭДТА.
Согласно последним данным, существует возможность замаскировать ртуть, восстановив ее до металла кипячением с аскорбиновой кислотой в кислом растворе [56 (84), 57 (83)]. Сообщается о маскировании ртути унитиолом [60 (59), 60 (60)]. Ченг описывает маскирование ртути осаждением висмутолом [62 (52)]. Этот способ он применяет для анализа материалов, содержащих Cd и Hg. Сначала определяется сумма обоих металлов, затем ртуть осаждают висмутолом и освободившуюся ЭДТА титруют раствором сульфата Цинка с эриохромом черным Т,
271
В качестве маскирующего вещества Барша применяет родапид-иоп, что позволяет проводить последовательное титрование смеси висмута с ртутью [59 (55)]. Сначала определяют висмут, в то время как ртуть маскируют роданидом калия. Затем ртуть демаскируют прибавлением нитрата серебра и титруют.
Широкое практическое применение нашло комплексонометрн-ческое титрование ртути в анализе фармацевтических препаратов. Ртуть определяют в мазях [53 (12), 57 (113), 59 (55)] и патентованных средствах, содержащих ртуть [56 (18), 57 (100), 57 (135), 57 (136), 61 (21)]. В органических соединениях, содержащих ртуть, ее определяют, после сожжения, визуальным методом [61 (110)] или амперометрически [58 (86)]. Сообщают об анализе блеклой руды [63 (24)]. Михаль [56 (69)] определяет небольшие количества ртути в рудах и концентратах, при этом он отгоняет металл, растворяет его и титрует комплексонометрически.
Определение ртути с эриохромом черным Т по методу вытеснения
Реактивы
ЭДТА, 0,01 М раствор.
Комплекс магния с ЭДТА, 0,1 М раствор.
Эриохром черный Т.
Буферный раствор, pH = 10.
Ход определения. К 100 мл анализируемого раствора, в котором должно содержаться более 50 мг ртути, приливают 5 мл раствора MgY и нейтрализуют едким натром по метиловому красному (по индикаторной бумаге). Затем добавляют 2 мл буферного раствора, немного индикатора и титруют раствором ЭДТА до перехода красной окраски в синюю Легкое подогревание раствора ускоряет реакцию в точке эквивалентности.
Замечания. Если присутствуют металлы, титрующиеся совместно, то к оттитрованному раствору прибавляют 1—2 г твердого иодида калия, при этом образовавшийся во время титрования HY2' переходит в [Н14]2- и освобождается ЭДТА в количестве, эквивалентном содержанию ртути. ЭДТА можно снова оттитровать раствором MgSO4 или ZnSQi до появления красной окраски раствора.
Ртуть определяют с успехом обратным титрованием. 1\ кислому раствору прибавляют в избытке раствор ЭДТА, нейтрализуют едким натром, добавляют буферный раствор с pH = 10 и обратно титруют раствором сульфата магния или цинка.
Отличные результаты получают при определении в слабокислой среде, если титрование проводят в присутствии системы CuY — ПАН. В этом случае поступают так же, как и при определении меди по общеизвестному методу, указанному в разделе, касающемся меди.
272
37. ГАЛЛИЙ
О титровании визуальным методом микроколичеств Ga сообщают Флашка и сотр. [54 (61)]; избыток ЭДТА обратно титруют паствором соли цинка, магния, свинца или марганца с эриохромом черным Т в качестве индикатора. Если применяют аммиачный буферный раствор с pH = 10, то переход окраски при обратном титровании нерезок и часто возвращается первоначальная окраска. Если же титрование выполняют при pH = 9 — 9,5 или ниже, то подучаются отличные результаты. В качестве лучшего раствора для обратного титрования рекомендуют раствор сульфата марганца, с которым переход окраски значительно более резок, чем с солями свинца и особенно магния; даже по сравнению с сульфатом цинка он имеет преимущество, состоящее в возможности применения маскирования цианидом калия. В противоположность алюминию, эриохром черный Т не блокируется галлием. Требуемое значение pH раствора вначале целесообразно устанавливать обычным буферным раствором и в заключение добавлять несколько миллилитров 10%-ного раствора хлорида аммония. Те же авторы проводят обратное титрование избытка ЭДТА раствором сульфата пинка в слабокислом растворе, причем в качестве индикатора применяют смесь гексацианоферратов (II) и (III) с диметилнафтиди-ном. Флашка и Абдин [56 (44)] сообщают о прямом титровании в присутствииzCuY — ПАН при pH от 3 до 5 в горячем растворе, содержащем ацетат. Метод пригоден для макро- и микроопределений. Позднее Ми и Корбет [61 (78)] ближе ознакомились с этим методом и показали, что применяемый буферный раствор оказывает большое влияние на процесс титрования. С фталатным буферным раствором и тем же pH получается размытая точка эквивалентности и слишком низкие результаты. Ацетат-ион, очевидно, ведет себя также и как вспомогательное комплексообразующее вещество и маскирует галлий, препятствуя образованию медленно или совсем не реагирующих гидроксосоединений. В отсутствие аце-тат-ионов галлий выпадает в осадок в виде гидроокиси при pH около 3, тогда как в их присутствии осадок появляется лишь при pH около 6. Ми и Корбет понижают интервал pH, при котором выполняется титрование, до 1,6—2,0 (CuY — ПАН в качестве индикатора), что повышает селективность. Фторид-ион не мешает определению и поэтому может с успехом применяться для маскирования присутствующего А1.
Упомянем также обратное титрование избытка ЭДТА раствором соли кобальта в ацетоно-водной смеси с большим содержанием Роданид-ионов [55 (103)], прямое определение с галлопианином при pH = 2 с переходом синей окраски в красную в точке экви-Еалентности [55 (79)] и при таком же pH в присутствии индикатора эзоксина с переходом желтой окраски в розовую [62 (48)]. Кинну-Нен [57 (137)] описывает прямое титрование с ксиленоловым оран-'Крвым, по получает очень размытую точку эквивалентности и
18 Зак 553 273
поэтому предпочитает обратное титрование избытка ЭДТА раствором соли тория или таллия (III). Получил применение также пирокатехиновый фиолетовый в ацетатном буферном растворе [55 (36)]э причем при прямом титровании в точке эквивалентности наблюдается переход синей окраски в желтую. Тот же индикатор, согласно Флашке и Садеку [56 (42)], с успехом применяют при обратном титровании избытка ЭДТА раствором нитрата висмута в сильнокислом растворе. Титрование еще возможно при pH, близком к 2, и при этом оно является высокоселективным. Мешают лишь Bi, In, Fe111, Hg, Th, Zr, образующие особенно устойчивые комплексы с ЭДТА; Fe и Hg можно замаскировать восстановлением их аскорбиновой кислотой.
Патровски [53 (38)] в своей ранней работе описывает титрование галлия в УФ-лучах при применении морина в качестве флуоресцентного индикатора. Оно выполняется либо в растворе, содержащем ацетатную буферную смесь, либо при pH = 3,5 в растворе, содержащем ацетат и фторборат [55 (36)], причем в последнем случае маскируется А1 при содержании его до 40-кратного избытка. Точка эквивалентности фиксируется по внезапному исчезновению флуоресценции. Грегори и Джефри [62 (20)] находят, что интенсивность флуоресценции комплекса галлия с морином возрастает при добавке некоторых органических растворителей (например, метанола или ацетона) и, кроме того, при пониженном pH (от 4 до 1,7). Еще они считают, что выгодна добавка небольшого количества индикатора метилового красного, так как при этом маскируется остающаяся в точке эквивалентности незначительная остаточная флуоресценция и точка эквивалентности оказывается заметно более резкой, так что титрование может быть проведено даже без УФ-лампы, а лишь на ярком солнечном свету.
Кроули [58 (40)] определяет очень небольшие количества галлия (от 50 до 1000 мкг) в тартратном растворе при рН = 2,5—3,5 флуориметрически с оксином в УФ-лучах. Позднее Коренман и др. [60 (195)] проводили исследование флуоресцентных методов определения галлия.
Худина [59 (130)] сообщает об амперометрическом титровании при pH = 1,5—2,5 и потенциале около —0,9 в (Нас. КЭ). При более низком значении pH определение галлия весьма избирательно и прежде всего благодаря присутствию фосфат-ионов.
Практическое применение находит титрование галлия в при сутствии морина в анализе бокситов [53 (38)] и технических растворов солей алюминия [62 (20)]; CuY — ПАН применяют в качестве индикатора при определении галлия в электролитных ванна [60 (165)] и сплавах As—Sb—Ga [61 (121)]. При анализе пород применяют обратное титрование раствором цинка с эриохромом черным Т [56 (49)]. В большинстве случаев необходимо проводит предварительное отделение сопутствующих металлов с помощь экстракции и (или) ионного обмена.
274
38. ИНДИЙ
Прямое определение визуальным методом макро- [53 (28)] и кроколичеств индия [53 (23)] впервые описали Флашка и сотр. Они титруют при pH = 10 в присутствии эриохрома черного Т, прием в растворе в качестве вспомогательного комплексообразую-пего вещества присутствует винная кислота для предотвращения ыпадения в осадок 1п(ОН)з. Определение аналогично определению свинца (см. стр. 297), с той лишь разницей, что титрование проводят в кипящем растворе. Кипячение необходимо, так как реакция между тартратным комплексом индия и ЭДТА при комнатной температуре протекает медленно.
Согласно Долежалу и др. [56 (89)], можно проводить титрование и при комнатной температуре, если в качестве комплексообразующего вещества применяют этилендиамин (который одновременно способствует установлению нужного значения pH). Однако количество этилендиамина должно быть строго ограниченным. Малая концентрация этилендиамина способствует получению размытой точки эквивалентности и возвращению первоначальной окраски индикатора; с другой стороны, с ростом его избытка точка эквивалентности ухудшается и даже совсем не проявляется. Те же авторы также рекомендуют обратное титрование в щелочной среде раствором сульфата цинка или магния с эриохромом черным Т. В этом случае добавка тартрата не нужна. Описывается также возможность обратного титрования избытка ЭДТА раствором сульфата меди с пирокатехиновым фиолетовым в пиридиновом буферном растворе.
Титрование в щелочном растворе удобно тем, что для маскирования целого ряда ионов металлов, которые часто сопутствуют индию (в первую очередь цинк и кадмий), можно применить цианид калия. Все же Са и Mg титруются совместно с индием. Из-за этого предпочитают проводить определение в кислой среде.
Ченг [55(19)] прямо титрует при pH = 2,3—2,5 в присутствии индикатора ПАН. С тем же индикатором титрование проводят также при pH = 7—8 в растворе, содержащем ацетат аммония и винную кислоту в качестве вспомогательного комплексообразующего вещества. В этих условиях уже можно применить маскирование цианидом калия и, кроме того, все же значительно снизить влияние Са и Mg. В точке эквивалентности красная окраска переходит в желтую. Применение смеси CuY — ПАН при pH = 2,5—3 [56 (44)] дает заметно более четкий переход темно-фиолетовой окраски в желтую.
Киннунен [57 (137)] прямо определяет индий при pH = .3—4,5 с ксиленоловым оранжевым или определяет избыток ЭДТА обратным титрованием раствором соли тория или таллия (III). В последнем случае фосфат-ион не мешает, но фторид должен отсутствовать. Копаница и Пршибил [60 (48)] рекомендуют применять °т же индикатор при pH = 3—3,5 и получают более резкий пере
18
275
ход окраски при работе с теплым раствором (от 50 до 60° С) Д/щ шающее влияние многих металлов исключают с помощью о-фенан- I тролина. Высокая цена этого реагента позволяет вводить его в ка] честве маскирующего вещества лишь при серийных определения? микроколичеств.
Высокая устойчивость комплекса индия с ЭДТА InY (1g Д' = = 24,9) позволяет проводить титрование при pH = 2 и ниже. К сс жалению, до настоящего времени не известен индикатор для прямого титрования в упомянутых условиях. Однако возможно опр< деление индия в сильнокислом растворе обратным титрование избытка ЭДТА раствором нитрата висмута с пирокатехиновьщ фиолетовым. Флашка и Садек [56 (42)] воспользовались этим обстоятельством и, как и следовало ожидать, нашли, что метод вполне удобен. Так, например, можно определять индий в присутствии 350-кратного количества цинка. Допускается 50-кратное содержание свинца и 10-кратное содержание Hi, Со и даже Си. Не мешают магний и щелочноземельные металлы. Можно также титровать в присутствии умеренных количеств А1, но медленно и в подогретом до 60° С растворе. Согласно неопубликованным исследованиям Флашки, титрование можно проводить даже при pH несколько ниже 2, если пользоваться фотометрической индикацией точки эквивалентности. В этих условиях не мешают даже большие количества обычно мешающих элементов.
Бусев и Талипова [62 (49)] применяют в качестве индикатора 7- (нафтилазо) - или 7- (4-сульфо-1-нафтилазо) -8-оксихинолин-5-суль-фонат. Конец титрования устанавливают по переходу желтой окраски в красную при pH = 2,5—3. Не мешают определению Zn, Cd, Al, Мп и Mg.
Флуоресцентную индикацию впервые применил Патровски [53 (38)]. Он титрует в УФ-свете в присутствии морина. Точку эквивалентности устанавливают по тушению интенсивной зеленой флуоресценции. Белчер и др. [60 (153)] применяют о-дианизидин-тетрауксусную кислоту при pH = 5,5—6,0, причем обратно титруют избыток ЭДТА раствором сульфата меди в УФ-свете до тушения весьма интенсивной флуоресценции. Так как по этому методу определяется большое число других металлов, то селективность его
по отношению к индию невелика.
Согласно Гамму и Фурсе [62 (36)], амперометрическим титрованием можно последовательно определить смеси In—Cd и In—Pb, изменяя pH. Трейндл [56 (15)] титрует амперометрически при 5° С
в растворе, содержащем иодистый калий. В этих условиях допу стим 10 000-кратный избыток ионов кадмия.
Практическое применение определение индия находит в аналш электролитных ванн [60 (65), 60 (166)], причем в качестве индика- | тора применяют смесь CuY— ПАН при pH = 2,5. Индий опреДС' ляют в сплавах Ag—In [56 (89)], 1н—As—Se [61 (41)] и In—Zn—Si [63 (19)]. При определении индия в сфалерите применяют предварительное отделение его экстракцией в сочетании с амперометри-
276
ским титрованием [58 (100)]. Экстракцию индия эфиром из раствора, содержащего 1,5 и. раствора H2SO4 и 1 н. раствор KI, с за-кпючительным титрованием в присутствии ПАН применяют для анализа концентратов [62(114)].
39. ТАЛЛИЙ
Первые комплексонометрические определения таллия провел флашка [52 (27)]. К раствору таллия (III) прибавляют комплекс магния с ЭДТА, нейтрализуют и после небольшой добавки буферного раствора с pH = 10 титруют освободившийся магний раствором ЭДТА с эриохромом черным Т. При содержании таллия от 30 мкг до 2 мг получается резкая точка эквивалентности и хорошие результаты. По методу, предложенному Флашкой, можно достигнуть селективного определения таллия, если Т11 осадить ь виде иодида и осадок растворить при кипячении с концентрированной азотной кислотой; при этом в результате окисления образуется Т11П, который можно оттитровать по приведенному выше методу. В более поздних исследованиях Пршибил, однако, отмечает [61 (92)], что окисление азотной кислотой протекает неполностью и что следует применить царскую водку. Если в растворе присутствует не окисленный Т11, получаются сильно размытые переходы окраски индикатора, что не удивительно, если учесть низкую константу устойчивости комплекса Т11 с ЭДТА. Боутен с сотр. [57 (53)] определил, что IgATi'v = 5,81 (20°С, р, = 1).
Все же устойчивость комплексоната таллия (I) достаточно высока, чтобы можно было проводить прямое фотометрическое титрование. Эту возможность использовали Фоли и Потти[56 (118)], проводившие титрование при длине волны 222 нм в растворе с pH = 10, содержащем хлорид аммония и аммиак. Перегиб кривой титрования в точке эквивалентности резкий, и ее кривизна в области точки эквивалентности лишь едва заметна. Косвенный метод определения Т11 предложил Сен [58 (99)], который в осадке T12Ag[Co(NO2)6] определяет содержание кобальта обратным титрованием избытка ЭДТА раствором соли кобальта в 50%-ной ацетоно-водной смеси в присутствии роданид-ионов в качестве индикатора. Эквивалентный вес таллия (408,74) исключительно высок.
Все последующие описания относятся к определению трехвалентного таллия. Устойчивость комплекса TlinY_ значительна (IgA = 21,5, 20°С, ц = 0,1) [60 (180)], что позволяет проводить определения таллия в сильнокислой среде и выгодно сказывается на селективности определения. И все же часто в растворе присутствует одновалентный таллий. Как уже упоминалось выше, окисление выпариванием с царской водкой легко осуществимо. Вго рекомендует также Киннунен [57 (147)]. Если окисляют выпавший в осадок ТП, то необходимо, чтобы соосажденный иодид Серебра не являлся помехой [52 (27)]. Окисление можно выполнить
277
также с помощью брома или смеси бромида и бромата калця [60 (187)]. При применении этого метода окисления следует, одн ко, учитывать, что при pH г= 2»--3 и ниже невозможно проводит, титрование, так как таллий маскируется бромид-ионами. Такое маскирование происходит в присутствии ксиленолового орание] вого, ПАН и ПАР [61 (130)]. Маскирующее действие бромид-ионов возрастает с повышением pH до 4—5. В качестве окислителя м, жно назвать также пероксодисульфат аммония [58 (107)].
Бусев [60 (181)] описывает определение Т1ш обратным титрованием избытка ЭДТА раствором цинка с эриохромом черным Т в растворе с pH = 8. Этот метод особенно пригоден для того, чтобы осадок состава С2зН24О2Н4-НТ1Вг4 (осаждение бис-антипиридил-метаном), полученный после окисления таллия бромид-броматной смесью, титровать комплексонометрически после растворения ЭДТА.
Другая возможность состоит в обратном титровании избытка ЭДТА раствором соли тория [56 (118)] при pH = 3,5 в присутствии индикатора — ализарина.
Прямое титрование Т1ш при pH = 4—5 описал Киннунен [51 (137)]; здесь индикатором служит ксиленоловый оранжевый. Точка эквивалентности настолько резкая, что раствор Т11П предложен для обратных титрований при определении других металлов По сравнению с раствором соли тория, предложенным для этой же цели, раствор таллия удобен тем, что фосфат-, сульфат- и фторид-ионы не мешают и поэтому могут вводиться в анализируемый раствор в качестве маскирующих веществ для других металлов. Пршибил [61 (92)] рекомендует аналогичный метод и ссылается на то, что в этих условиях можно определять ТРП в присутствии Т11.
Прямому определению таллия посвящен ряд работ Бусева с сотр. Они сообщают об исследовании комплексов трехвалентного таллия с ксиленоловым оранжевым, ПАН и ПАР [60 (167)]. Были получены следующие значения для эффективных констант устойчивости (при pH = 2,0) комплексов, образующихся всегда в молярном отношении 1 : 1, и для положения максимумов на кривых поглощения (при том же pH): 8,0• 104; 1,9-102; 1,7• 104 и 580, 560 и 520 нм. Авторы показывают, что для трех индикаторов наиболее низкое значение pH, при котором еще возможно титрование, составляет 2,0; 1,8 и 1,7. Титрование в присутствии ПАН характеризуется наивысшей избирательностью благодаря малой устойчивости комплекса с индикатором.
Бусев и сотр. [61 (157)] исследовали также применимость 8-окси-7-(2-пиридилазо)-хинолина в качестве индикатора. Переход фиолетовой окраски в желтую резкий и протекает в интервале pH от 1,0 до 3,5. Определению не мешают Zn, Cd, Mg, Мп и Al. При применении этого индикатора возможно определение Т1 и Bi в одном растворе. Сумму обоих металлов определяют при pH — 1,8—2 прямым титрованием. Затем Т1ш восстанавливают небольшим количе
278
ством сульфита натрия и освободившееся эквивалентное по отношению к таллию количество ЭДТА титруют раствором сульфата меди с тем же индикатором. Определение таллия возможно также присутствии циркония, если последний замаскирован фторид-ионами.
Определять висмут и таллий по описанному выше принципу можно также и при применении в качестве индикатора ПАН [58 (Ю7)]. Следует отметить, что в данном случае сумму обоих металлов определяют при pH = 4—5; pH устанавливают с помощью твердого ацетата натрия, и при этом не происходит гидролиза висмута. Метод намного менее селективен по сравнению с описанным выше, так как Zn, Cd и Al титруются совместно.
Авторы исследовали и другой индикатор — нафтилазоксин [62 (68)]. Переход окраски (фиолетовой в желтую), однако, достаточно резок лишь в присутствии больших количеств таллия.
Бусев [61 (130)] описывает также определение таллия обратным титрованием избытка ЭДТА раствором соли железа при температуре от 40 до 60° С, причем в качестве индикатора использует сульфосалициловую кислоту. С этим индикатором можно проводить последовательное титрование смеси Fe—TI. Сначала в теплом растворе с pH = 1,8—2, содержащем КВг, титруют железо, так как таллий замаскирован бромид-ионами. Затем приливают в избытке ЭДТА, с помощью ацетата натрия доводят pH раствора до значения 4—5 и обратно титруют раствором соли железа. В этой работе описана теоретически интересная возможность определения таллия, основанная на обратимости частично протекающей реакции: Т13+ + 21~ Т1+ + 12. Анализируемый раствор, содержащий вин-
ную кислоту, сначала нейтрализуют аммиаком по тропеолину 00; затем, добавляя 1 М раствор винной кислоты, добиваются возвращения первоначальной окраски индикатора (pH около 7,5). Потом добавляют раствор иодида калия, причем равновесие в приведенной выше реакции частично сдвигается слева направо и освобождается иод. Когда затем начинают титровать раствором ЭДТА, Т1Ш связывается в комплекс, реакция меняет направление и идет справа налево. Если наблюдается обесцвечивание окраски иода, указывающее на то, что почти весь Т11П прореагировал с ЭДТА, прибавляют раствор крахмала и заканчивают титрование при исчезновении синей окраски.
Белчер и сотр. [60 (153)] упоминают о возможности определения таллия обратным титрованием избытка ЭДТА раствором соли меди с о-дианизидинтетрауксусной кислотой в качестве флуоресцентного индикатора. Сайо определяет таллий обратным титрованием избытка ЭДТА раствором соли цинка в присутствии гекса-Цианоферратов (II) и (III) и бензидина [56 (99)] или раствором [56 0дд)Н^адия (V) с дифенилкарбазидом или дифенилкарбазоном
Инструментальную индикацию точки эквивалентности ввел У сев [58 (107)], использовав амперометрическое титрование с
279
вращающимся платиновым электродом. Рейли и Шмидт [58 (12)1 определяли Т1ш потенциометрически с ртутным капельным электродом обратным титрованием избытка ЭДТА раствором соли цинка в ацетатном буферном растворе с pH = 4.
Комплексонометрическое определение таллия находит практц. ческое применение в анализе сплавов Т1—Zr [61 (157)]. Сплавы растворяют в серной кислоте, таллий окисляют пероксодисульфат, ионами, разбавляют раствор так, чтобы его молярность по кислоте составляла 0,5 М, добавляют фторид калия для маскирования циркония и оттитровывают таллий в присутствии 8-окси-7-(2-пири-дилазо)-хинолина. Сплавы, содержащие Sb, As и Р [60 (181)], после растворения окисляют бромид-броматной смесью, сурьму маски-руют винной кислотой, таллий выделяют в осадок с помощью бис-антипиридилметана. Осадок, как описано выше, подвергают комплексонометрическому титрованию. Сообщают об определении таллия в кадмиевых брикетах и в шлаках [58 (107)]; после окисления пероксодисульфатом таллий определяют с большой селективностью амперометрическим титрованием при pH = 2.
Определение таллия с эриохромом черным Т по методу вытеснения
Реактивы
ЭДТА, 0,01 М раствор.
Эриохром черный Т.
Буферный раствор, pH = 10.
Царская водка-
Едкий натр, приблизительно 1 М раствор.
Комплекс магния с ЭДТА, приблизительно 0,1 М раствор.
Ход определения. Отфильтрованный и промытый раствором KI иодид таллия (от 10 до 30 мг) растворяют в нескольких каплях царской водки; выделившийся иод и окислы азота удаляют, выпаривая раствор почти досуха. Остаток растворяют в воде, разбавляют раствор до 100 мл, добавляют 5 мл MgY, нейтрализуют раствором NaOH, добавляют 2 мл буферного раствора, индикатор и титруют раствором ЭДТА до перехода красной окраски в синюю. Титровать необходимо до исчезновения красноватого оттенка.
Замечания. Этот метод разработан как метод титрования, применяющийся в сочетании с выделением таллия в виде иодида таллия. Если в растворе присутствует Ag, то оно соосаждается с таллием, но не мешает титрованию, за исключением тех случаев, когда (уже при не очень больших его количествах) образует неисчезающую и мешающую титрованию муть. Поэтому Ag может служить уловителем очень маленьких количеств Т1. Если в исхоД' ном растворе присутствует также РЬ, то можно провести осажД1 J ние иодидов таллия и серебра в присутствии ЭДТА [51 (21)] в ацетатном буферном растворе, причем свинец не выделяется в осадо>
280
40. УГЛЕРОД И ЕГО СОЕДИНЕНИЯ
Карбонат (углекислота)
При определении углерода в сталях, согласно Кавачата и др. [62 (42)], проводят сожжение их до СОг, который поглощают определенным объемом раствора Ва(ОН)2. Избыток бария определяют титрованием раствором ЭДТА с эриохромом черным Т, без удаления образовавшегося ВаСО3. Количества углерода до 0,05% можно определять с точностью ±0,0028% (абсолютных).
Карбонат-ион в водах определял Бербени [60 (142)] следующим образом: в аликвотной части анализируемого раствора после удаления СО2 определяют содержание Са титрованием в сильнощелочном растворе в присутствии мурексида. Ко второй аликвотной части приливают отмеренное количество раствора Са(ОН)2, в осадок выпадает СаСО3, а остающийся в растворе Са оттитровы-вают. По разности обоих расходов определяют содержание СО2, учитывая добавленное количество Са. Ценин [55 (82)] определяет углекислоту аналогичным образом.
Лаукс [61 (144)] определяет карбонат-ион, обрабатывая анализируемый раствор щелочным раствором соли кальция на водяной бане. Полученный осадок СаСО3 отфильтровывают и определяют содержащийся в нем Са. Метод применяют для анализа отходящих газов при производстве этаноламина. Жекерес и др. [62 (136)] описывают определение карбонатов щелочных металлов в присутствии гидроокисей, осаждая карбонат-ион измеренным количеством нитрата стронция; избыток стронция обратно титруют с бромпирогаллоловым красным (в присутствии небольшого количества соли магния).
Цианид
Гудитц и Флашка [52 (32)] отмечают, что мурексид является исключительно хорошим индикатором при прямом титровании циа-нид-иона раствором соли никеля. Резкость точки эквивалентности компенсирует недостаточно высокий эквивалентный вес. Однако, из-за значительной летучести синильной кислоты, удобнее проводить определения косвенным путем и избыток никеля обратно титровать раствором ЭДТА с мурексидом. Преимущество этого метода перед титрованием по Либиху заключается в том, что галогены и роданид не мешают и допустимо даже присутствие небольших количеств гексацианоферратов (II) и (III). В присутствии последних, при большом количестве цианид-иона, возникает незначительное помутнение, снова исчезающее в процессе титрования, которое следует проводить медленно.
Этот метод использовала Шаршунова [56 (121)] для определения цианида в горьком миндале.
Раздельное определение смесей галогенов с цианидом описано в разделе, относящемся к галогенам.
281
Косвенное определение цианида
Реактивы
ЭДТА, 0,01 М раствар.
Сульфат никеля, 0,01 М раствор (титры этих растворов устанавливаются один по другому).
Мурексид.
Аммиак, концентрированный раствор.
Хлорид аммония, приблизительно 1 М раствор.
Ход определения. К 50 мл 0,01 М раствора NiSO4 приливают 10 мл хлорида аммония и 10 мл концентрированного раствора аммиака и в полученный раствор вносят анализируемый раствор, содержащий около 40 мг цианид-иона. Затем прибавляют несколько капель индикатора, который должен принять желтую окраску, и быстро титруют раствором ЭДТА до перехода окраски в фиолетовую.
Замечания. При внесении раствора цианид-иона в нейтральный раствор сульфата никеля возникает опасность образования труднорастворимого цианида никеля Ni[Ni(CN)4], Поэтому, как предписывается выше, вначале раствор сильно подщелачивают аммиаком. Правда, аммиачный раствор соли никеля не очень устойчив, так как иногда может выпадать осадок гидроокиси. Поэтому титруют по возможности быстро, сразу после приготовления смеси.
Расчет показывает, что устойчивость цианидного комплекса никеля вполне достаточна для проведения этого титрования. Чтобы мурексид при pH = 10 изменял свою окраску, необходимо, чтобы значение pNi равнялось по меньшей мере 11 (см. рис. 27). Можно принять, что концентрация цианидного комплекса никеля в точке эквивалентности равна около 10-3М Тогда, исходя из величины общей константы устойчивости этого комплекса, равной 1027, получим концентрацию свободных цианид-ионов, равную 2-Ю-5 М что составляет около 0,5% общей концентрации цианид-ионов, равной 4- 10~3 М. Следовательно, в точке эквивалентности (pNi ~ И) ЭДТА освобождает из цианидного комплекса никеля около 0,5% от общего количества CN_-hohob. Правда, следует указать, что все эти равновесия устанавливаются, по-видимому, медленно и титрование заканчивается раньше, чем никель снова освободится из цианидного комплекса.
Органические соединения (например, фармацевтические препараты)
В этом разделе будет рассматриваться определение органических соединений и функциональных групп, но при исключении неорганических компонентов. Определение последних можно найти в разделах, относящихся к соответствующим элементам. Небольшое количество металлоргаиических соединений занимает промежуточное положение, и мы приводим их здесь, так как определение 282
одержания в них металла на основе стехиометрического состава Созволяет сделать заключение о количестве определяемого вещества. П органические вещества можно определять, конечно, только кос-рнно, титрованием металла, реагирующего стехиометрически с опре-еляе'мым веществом. Для этого приводят во взаимодействие эти соединения с ионом металла или элементарным металлом, причем могут происходить реакции осаждения, комплексообразования, присоединения, восстановления, окисления или несколько этих процессов одновременно. Наиболее часто применяется реакция осаждения.
Часто поднимают вопрос, что предпочтительнее — определять содержание металла в выделенном осадке или обратно титровать избыток ионов металла в фильтрате. Дать исчерпывающий ответ на этот вопрос невозможно; от конкретных условий зависит, какому методу оказать предпочтение. Преимущество определения содержания металла в осадке состоит в том, что необходим лишь один титрованный раствор, если металл можно определять прямым титрованием. Если же осадок нужно растворить в ЭДТА или же вообще прямое титрование невозможно, то для обратного титрования избытка ЭДТА требуется другой титрованный раствор, который— что, впрочем, необязательно — должен содержать применяемый для осаждения металл. При применении этого метода требуется тщательное промывание осадка, что иногда вызывает осложнения, если, например, фильтрование проходит медленно или, вследствие некоторой растворимости осадка, промывание приводит к потерям; чтобы их избежать, необходимы специальные растворы для промывания.
Эти недостатки отпадают, если применяют обратное титрование избытка осадителя, благодаря чему часто достигается заметная экономия времени. При анализе не очень труднорастворимых соединений часто применяют значительный избыток осадителя, следствием чего является большой расход ЭДТА. Применение лишь небольшой аликвотной порции для обратного титрования приводит к многократному умножению ошибки титрования и поэтому снижает точность определения. Далее, при опытах с аликвотными порциями количество определяемого вещества должно быть точно определенным, причем нижний предел его ограничивается растворимостью осадка в конечном объеме, а верхний — количеством прибавленного осадителя. В заключение следует обратить внимание на то, содержит ли определяемое вещество сопутствующие катионы, которые определяются комплексонометрически, так как они совместно титруются в фильтрате. Часто органические вещества могут вступать в реакцию с комплексонатом металла, и их определение заканчивается титрованием освободившегося комплексона.
Хотя число определяемых комплексонометрически органических еЩеств весьма значительно, все же не исчерпаны все возмож-°сти этого метода, и можно ожидать значительного роста соот
283
ветствующих работ в этой области. Методы, конечно, отнюдь не специфичны, напротив, они часто недостаточно селективны. Кроме того, едва ли возможно универсальное применение одного и того же метода. От вещества к веществу, даже если они принадлежат к одному классу, требуются незначительные изменения в методике (например, меняются pH раствора, количество избытка металла, время, затрачиваемое на отдельные операции, процесс промывания осадка и т. д.), так что невозможно предложить универсальную методику; поэтому в каждом отдельном случае нужно обращаться к оригинальным работам.
Из последних литературных обзоров следует упомянуть обзор Хенарта [61 (162)], в котором содержатся указания на неопубликованные опыты автора, а кроме того, сообщается об определении неорганических компонентов в органических соединениях. Борхерт [61 (124)] опубликовал обзор по анализу фармацевтических препаратов, в котором наряду с определением металлов содержится также определение органических веществ.
Осаждение с помощью кальция. Исходное анализируемое соединение омыляют, осаждают пектин [54 (54)] в виде кальциевой соли и после растворения осадка определяют содержание кальция титрованием. Жирные кислоты, если нужно, также выделяют после омыления в виде кальциевого мыла и избыток Са обратно титруют в фильтрате. По этому способу определяют общее содержание жирных кислот в мылах [55(111)] и количество связанной и свободной олеиновой кислоты в других продуктах [60 (157)]. Определение эфиров и хлорангидридов щавелевой кислоты, предварительно омыленных, основано [57 (127)] на осаждении оксалата кальция и обратном титровании избытка Са.
Осаждение с помощью меди. Кидд [52(38)] пользуется осаждением ионами меди(1) для определения ацетилена. Выделенный ацетилид растворяют и содержание меди определяют титрованием с мурексидом. Это было первое применение комплексонометрического титрования для анализа органических веществ. Антилюизит образует соединение с медью и может быть определен высокочастотным титрованием меди [55(112)]. Согласно Будешинскому [56 (35)], хинин осаждают хлоридом меди(1) в ацетоно-бензольном растворе (1:1) и содержащуюся в осадке медь определяют комплексонометрически. Лептазол [56 (29)], теофиллин [59 (133)] и производные миндальной кислоты, применяемые в фармации [59 (134)], также осаждают ионами меди и определяют по содержанию меди в растворенном осадке. Каптакс (2-бензотиазолтиол) осаждают медью и избыток последней оттитровывают в фильтрате [63 (58)].
Осаждение с помощью ртути. Гельмштадтер [59(133)] сообщает об определении амидопирина, никотинамида, эфиров никотиновой кислоты и 4-изопропилфеназона, которые выделяют в осадок с помощью HgCl2. Для осаждения теобромина используют ацетат ртути. Избыток ртути определяют в фильтрате; для этого к филь-
284
ту приливают в избытке раствор ЭДТА, который обратно тит-ТР т раствором соли цинка с эриохромом черным Т. Аналогичным пособом определяют барбитураты [61 (163)]. По этому методу "о определить с хорошими результатами барбитал, фено- и ^иклобарбитал, плохие результаты получаются при определении Ц]езобарбитала, и метод совершенно не пригоден для определения наркозана. Для определения барбитуратов Роушди и др. [61 (57)] используют обратное титрование раствором соли марганца, а не цинка, или прямое титрование ионами ртути при pH = 5 в присутствии CuY — ПАН. Применяемые в качестве антиоксидантов про-пнлгаллат [59 (57)] и этилгаллат [61 (134)], в случае необходимости, выделяют экстракцией, кипятят с титрованным раствором ртути, после чего избыток ртути определяют обратным титрованием избытка ЭДТА раствором соли цинка с эриохромом черным Т.
Осаждение с помощью серебра. Геннарт осаждает сульфонамиды [62 (70)] и 6-пуринтиол [62 (71)] нитратом серебра и в фильтрате определяет комплексонометрически избыток серебра никельцианидным методом (см. стр. 258). Шаршунова и др. [55 (113)] определяют бромоформ (в сиропах) омылением солью серебра и комплексонометрическим титрованием образовавшегося AgBr никельцианидным методом. Аналогичным образом определяют СНС1з [61 (156)].
Осаждение с помощью никеля. Арикава [54(23)] разработал определение спиртов, основанное на переводе спирта в ксантогенат, который осаждают в виде соли никеля. Осадок растворяют в аммиаке и комплексонометрически с мурексидом определяют содержание никеля. Геннарт применяет комплексонометрическое титрование никеля для определения диоксимов [61 (159)]. Аналогичным способом — в виде осадков с никелем — определяют и другие соединения, после того как их полностью оксимируют. На этом принципе основано определение диацетилена [59 (132)], монооксимов [59 (158)]. о-ацилфенолена [61 (160)] и вицинальных дикетонов [61 (161)]. Осаждение с помощью диэтилдитиокарбамината никеля применил Неббия для определения вторичных аминов [53 (50)] и гексаметиленимина в присутствии гексаметилендиамина [57 (31)]. с помощью комплекса никеля с треном можно выделить в осадок Длинноцепочечные алкоксисульфонаты [57 (128)], что было использовано при анализе промывных растворов [57 (128)]. Осаждение пирамидона никелем и титрование последнего в присутствии мурексида должно быть специфическим определением [59 (145)].
Осаждение с помощью висмута. Пропилгаллат [60(120)] осаждают висмутом, избыток которого в фильтрате определяют обратным титрованием в присутствии ксиленолового оранжевого или пирокатехинового фиолетового. Для осаждения чаще всего приме-яют тетраиодвисмутат. Будешински [50 (32)] применил его с успе-°м Для определения кофеина, 8-метилкофеина, уротропина, ами-пирина и различных четвертичных аммониевых, фосфониевых и
285
арсониевых оснований. В соответствующих условиях он прово-дИг осаждение в мерной колбе, затем доводит объем до метки и в аликвотной порции фильтрата определяет избыток Bi прямым титрованием раствором ЭДТА; при этом получается резкая точка! эквивалентности — по обесцвечиванию интенсивной желтой окрас ки тетраиодвисмутата. Перед титрованием нужно прибавить немного тиосульфата натрия, чтобы полностью восстановить иод В другой работе Будешински и Ваничкова [56 (34)] сообщают <; применении этого метода для определения теофиллина, хинина аналергена и диваскола. По этому методу определяют также ане-урин [57 (85)] Другие авторы использовали этот принцип для определения хелидонина (chelidonium majus) и суммы алкалоидов в корнях [59 (77)], в растениях и настойках [61 (38)]. Этим же методом определяют антигистамины (хлоргидраты антазолина, дифенгидрамина, трипеленамина и хлорпирамин) [62 (73)]. Эуфиллин [59 (135)] осаждают с помощью KBiI4 и комплексонометрически определяют содержание Bi в осадке. При определении солей пиперазина [63 (60)] в фильтрате избыток висмута титруют амперометрически.
Будешински [56 (36)] упростил определение, введя следующие изменения. Органическое основание (папаверин, наркоз ин, "кодеин, стрихнин и бруцин) он осаждает в форме тетраиодвисмутатов в кислой среде прибавлением раствора, содержащего комплексонат висмута и иодид калия. После доведения растворов до определенного объема фильтрует и в аликвотной порции фильтрата опре деляет освободившуюся ЭДТА при pH = 9,1 (обратный буфер) титрованием раствором соли цинка с эриохромом черным Т. Происходящая при этом реакция вытеснения Zn2++ BiY_^ZnY2-+ Bi3 искажает точку эквивалентности. В более поздней работе Кербл [59 (29)] улучшил метод, проведя титрование раствором соли тория с метилтимоловым синим в качестве индикатора. Сообщается об определении кофеина, тиамина (анейрин), сукцинилхолина, тио-спазмина, бруцина, папаверина и морфина
Осаждение с помощью кадмия. Комарицкая [61(17)] осаждает ларусан ацетатом кадмия и определяет металл в осадке. Метод применяют для определения фармацевтических препаратов в порошке и таблетках. Кастильони [57 (48)] осаждает пиридин хлорп дом кальция в сильноспиртовом растворе и затем определяет содержание кадмия в осадке Метод пригоден для быстрого определения пиридина в денатурированном спирте. Осаждением растворов CdCh можно определить также лептазол [60 (197)]. Осаждение с помощью иодида кадмия ввел Будешински [57 (56)] для определи ния различных четвертичных аммониевых оснований. Зайце" [57 (112)] использует этот метод для определения солянокислого хинина, обратно титруя в фильтрате избыток кадмия. Можно упростить определение [60 (43)], если проводить осаждение растворо комплексоната кадмия в присутствии KJ и после фильтрования в аликвотной порции фильтрата обратно титровать выделившуюся в
286
вободном состоянии ЭДТА раствором кальция с метилтимоловым С шим. Кроме других органических оснований таким способом можно определить флексацил, хлорпромазин и хинин.
' Особенно широкое применение получило осаждение с помощью „оданида кадмия. Грэбер и Шнайдер [55 (48)] определяют по этому способу пирамидон; после фильтрования осадок растворяют в аМмиаке и титруют раствором кадмия в присутствии эриохрома черного Т. В этом случае осаждение более селективно, чем в случае иодвисмутата, и дает возможность определять пирамидон в фармацевтических препаратах, содержащих также кофеин, барбитурат, кодеин, аспирин, фенацетин и хлораль. Будешински определяет диметиламиноантипирин обратным титрованием избытка кадмия в аликвотной порции фильтрата. Метод позволяет определять также амидопирин [55 (40), 58(111)], гидразид изоникотиновой кислоты [55 (38), 55 (40)] и уротропин [55 (38)].
Осаждение с помощью цинка. Будешински [55(39)] определяет 8-оксихинолин и некоторые его производные, образующие с ионами металлов нерастворимые соединения, осаждая их сульфатом цинка и обратно титруя избыток последнего в аликвотной порции фильтрата с эриохромом черным Т (см. также [62 (132)]). На том же принципе основано разработанное Роушди и др. [61 (57)] определение некоторых барбитуратов.
Осаждение с помощью свинца. Согласно Ладе [61(3)], пирокатехин осаждают ацетатом свинца и избыток свинца в аликвотной порции фильтрата определяют обратным титрованием избытка ЭДТА раствором соли цинка с эриохромом черным Т.
Определение с помощью окислительно-восстановительных реакций. Антиоксиданты в жирах Седлачек определяет восстановлением иона серебра. В прямом методе анализа образовавшееся металлическое серебро отфильтровывают, растворяют и титруют; в косвенном методе анализа непрореагировавший ион серебра титруют в фильтрате... В обоих случаях определение серебра выполняют по никельцианидному методу (см. стр. 258). По этому методу определяют нордигидрогваяретовую кислоту [60 (39)], бутилоксианизол [60 (40)], аскорбинпальмитат и некоторые галлаты [61 (133)]. Альдегиды, гидроксиламин, гидразин и некоторые его производные Будешински определяет [61 (83)] окислением кипящим раствором HgY. Освобождается эквивалентное восстановленной ртути количество ЭДТА, которое титруют раствором нитрата свинца с метилтимоловым синим. Об определении органических производных гидразина [62 (72)] путем восстановления талия(III) см. стр. 299. На окислительно-восстановительном процессе основано определение сахаров. Бултасова [54 (7)] описывает метод определения глюкозы в биологических жидкостях. Для этого известным образом восстанавливают в щелочном растворе медь(II) до гидроокиси меди(1), осадок отфильтровывают, промывают и раство-Ряют в азотной кислоте, затем в этом растворе медь комплексоно-етрически титруют в присутствии мурексида. Как и в других
287
методах, основанных на этой восстановительной реакции, при комплексонометрическом титровании пользуются эмпирическим фак. тором пересчета. Аналогичный метод разработали Поттерат J I Эшман [54 (93)] и применили для определения сахара в шокола--[55 (14)]. Метод Поттерата и Эшмана Рентшлер [57 (95)] применил для определения содержания сахара в подслащенных и перебродивших напитках. Стрит [58 (98)] сообщает об упрощенном определении сахара (в биологических материалах), когда оттитровы-вается избыток невосстановленных Сп2+-ионов без отделения от осадка, содержащего Си1. О применении восстановления с помощью меди при определении D-глюкозамина и его производны;.; см. [63 (59)]. Аскорбиновая кислота восстанавливает Нё2+-ионы до Hg2+, которые выделяют в виде Hg2Cl2. После отделения осадка и окислительного растворения его определяют содержание в нем ртути [62 (133)]. Некоторые многовалентные спирты и а-оксикис-лоты можно определить, если окислить их с помощью РЬО2 и затем комплексонометрически оттитровать образовавшиеся РЬ2+-ионы [63 (22)]. О косвенном определении органических веществ восстановлением амальгамой [58 (13)] говорится в соответствующем разделе первой части этой книги.
Определение функциональных групп. Карбоксильные группы в целлозольве можно определить, согласно Дерингу [56 (120)], следующим образом. После кипячения с соляной кислотой и основательного промывания целлюлозу смешивают с титрованным раствором соли цинка, фильтруют, промывают и присутствующие в фильтрате в избытке ионы цинка оттитровывают. Для вычисления количества карбоксильных групп применяют эмпирический фактор. Будешински [57 (57)] изучал условия, в которых нитро- и нитрозогруппы восстанавливаются в результате стехиометрической реакции с металлом. Наиболее пригодным металлом оказался кадмий. Выделившееся количество ионов кадмия, эквивалентное по отношению к восстановленным группам, определяют комплексонометрически. Метод пригоден для полумикроопределений. Тот же автор [57 (58)] сообщает о методе определения двойной углеродуглеродной связи. Анализируемый продукт в метанольном растворе в присутствии эфирата фторида бора в качестве катализатора реагирует с ацетатом ртути, при этом ионы ртути присоединяются по двойной связи. Оставшиеся в избытке ионы ртути определяют косвенным путем обратным титрованием избытка добав ленной ЭДТА раствором соли цинка в присутствии эриохрома черного Т.
Различные методы. Аминокислоты и пептиды Будешински [57 (55)] определяет следующим образом. Анализируемый раствор встряхивают со свежеосажденным фосфатом меди, причем Си2+-ионы связываются в комплекс с аминокислотой. Избыток фосфата меди отделяют центрифугированием, декантируют й в фильтрате комплексонометрически в присутствии ПАН тМ
288
dViot ионы меди, связанные с аминокислотой. Метод можно, согласно Голаске и сотр. [60 (182), 61 (164)], модифицировать, используя вместо фосфата меди гидроокись меди в момент образования. Метод применяют для определения белка в сыворотке и моче и пользуются эмпирическим фактором пересчета. Сьострём и риттер [56 (119)] определяют алкалоиды, пропуская анализируемый паствор через катионит, содержащий ионы магния, и титруют с эриохромом черным Т выделившиеся в стехиометрическом количестве ионы магния. Пильц [58 (112)] определяет препарат для защиты растений метасистокс-1, омыляя его щелочным раствором плюмбита, экстрагируя образовавшееся меркаптосоединение свинца, разлагая его соляной кислотой, и определяя затем содержание pb обратным титрованием избытка ЭДТА раствором соли цинка. Будешински [60 (44)] указывает, что сульфиды, тиомочевину и их производные можно определять обменной реакцией с комплексо-натом кадмия. При осаждении CdS освобождается в количестве, эквивалентном по отношению к сульфидной сере, ЭДТА, которую обратно титруют раствором соли кальция с метилтимоловым синим. Металлорганические соединения — диалкил- и диарилолово прямо титруют, как указывает Бюргер [61 (69)], с пирокатехиновым фиолетовым. Геннарт [62 (69)] определяет магнийгалоидорга-нические соединения (соединения Гриньяра) по содержанию металла после их разложения соляной кислотой. Адамова и Зыка [55 (88)] определяют фосфат кодеина путем осаждения фосфора раствором соли магния и комплексонометрическим титрованием этого металла в осадке. Осаждение антипирина в виде [Fe(Ant)3(SCN)s] с заключительным титрованием Ре3+-ионов, содержащихся в осадке, должно быть специфическим [62 (13ч)].
41. КРЕМНИЙ
О косвенном микроопределении от 0,5 до 5 мг кремневой кислоты сообщает Иеник [61 (22)]. Кремневую кислоту в щелочном, содержащем ацетон растворе осаждают в виде CoSi4OB раствором Co(NO3)2. Осадок центрифугируют, многократно промывают водным раствором метанола и растворяют в аммиачном растворе ЭДТА. Добавляют буферный раствор с pH = 10 и эриохром черный Т (иногда тропеолин 00 для улучшения перехода окраски), и избыток ЭДТА обратно титруют раствором магния. Таким способом определяют содержание Со в осадке. Определение продолжается 20 мин и дает стандартное отклонение лишь 2,7%.
Дащенко [62 (76)] разработал метод определения кремневой кислоты в шлаках, по которому результаты получаются из двух комплексонометрических титрований. Сначала 0,1 а анализируемого препарата экстрагируют водой и едким кали в приборе для Отряхивания, разбавляют водой и содержащийся в экстракте Са титруют раствором ЭДТА с мурексидом. Этим титрованием устанавливают так называемую «основность» раствора. Вторую пор-
19 Зак. 553 осп
цию препарата (0,1 г) разлагают соляной кислотой, раствор нейтрализуют и снова титруют Са, на этот раз в присутствии триэтаноламина, с мурексидом в сильнощелочной среде. Содержание кремневой кислоты получают делением результата второго титрования на результат первого титрования. Точность определения составляет ±1,4% (относительных).
42. ГЕРМАНИЙ
О косвенном методе определения Ge сообщают Ким и Рим [62 (154)]. К анализируемому раствору, содержащему 0,2—0,5 мг GeIV в 1 мл, прибавляют 10 мл 5 %-него раствора винной кислоты и 5%-ного раствора ВаС12 и затем с помощью аммиачного буфера доводят pH раствора до значения 9—10. Добавляют 1 мл 0,25%-ного раствора поливинилового спирта для стабилизации осадка и оставляют стоять в течение 5 мин. Отфильтровывают осадок барийгерманотартрата, промывают 3—4 раза раствором осадителя (смешивают равные объемы винной кислоты и раствора ВаС12) и отсасывают досуха. Далее растворяют осадок в соляной кислоте (1 :1), переносят в мерную колбу емкостью 50—100 мл и доводят объем до метки. В аликвотной порции раствора (соответствующего объема) создают pH = 10 и содержащийся в ней Ва титруют в присутствии эриохрома черного Т. Определение аналогично определению, разработанному для бора (см. стр. 183), и применено для анализа пород. Так как осаждение весьма селективно, то обычно сопутствующие металлы мешают незначительно. Описанное в методе промывание осадка, по-видимому, не вполне удовлетворительно.
43. ОЛОВО
Олово, как двух-, так и четырехвалентное, образует комплексы с ЭДТА. Константу устойчивости комплекса Sn11 —ЭДТА вычислил Смит [61 (39)] на основе полярографического исследования равновесной реакции обмена между Sn11 и ThY. Значение 1g К = = 22,11 необычно высоко для двухвалентного металла. Наряду с комплексом с молярным отношением металл : ЭДТА =1:1 существует также комплекс состава 2:1, который был выделен [62 (140)]. Кроме того, имеются указания на существование гидроксокомплек-са. Происходящие при комплексообразовании процессы, вследствие небольшого гидролиза и способности Sn11 к окислению, сложны и нуждаются в дальнейшем выяснении. В связи с этим следует упомянуть полемику между Лангером [62 (140)] и Смитом [62 (141)]-О комплексах SnIV известно еще меньше.
Первое комплексонометрическое определение олова описал Такамото [55 (102)], который определял олово обратным титрованием избытка ЭДТА раствором соли кобальта при pH == 4—5 в ацетоно-водной смеси с большим содержанием роданид-ионов.
290
Пубски [59 (25)] описал прямое титрование в присутствии метил-тимолового синего при pH = 5—6. При этом можно замаскировать SnIV смесью тартрат- и фторид-ионов и сурьму с помощью тартрат-ионов.
Киннунен [57 (137)] впервые описал определение Sniv. К сильнокислому анализируемому раствору прибавляют ЭДТА, доводят pH раствора с помощью ацетата аммония до значения 2—2,5 и затем обратно титруют избыток ЭДТА раствором соли тория с ксиленоловым оранжевым. Аналогичным образом проводит анализ Янковски [57 (80)] (см.стр.292).Оба автора указывают на главную трудность метода, которая состоит в том, чтобы при нейтрализации раствора не допустить выпадения в осадок гидроокиси. Скорость, с которой связывается в комплекс олово, может оказаться меньшей, чем скорость гидролиза. Поэтому процессу нейтрализации уделяют особое внимание.
При титровании ионов олова медь можно замаскировать тиомочевиной. Помехи, являющиеся следствием присутствия олова (IV) при определении других металлов, можно исключить с помощью смеси фторид- и тартрат-ионов [59 (25)], триэтаноламина [57 (80)] и унитиола [60 (59), 60 (60)], если, конечно, определяемый металл сам не маскируется этими реагентами.
Комплексонометрическое определение находит практическое применение при определении содержания олова в медных сплавах [57 (107)]. Сплав растворяют в царской водке, избегая, по возможности, нагревания, раствор разбавляют, нейтрализуют после добавления ЭДТА и обратно титруют избыток последней. При анализе припоя, содержащего Sn и РЬ [62 (28)], после его разложения выпариванием с серной кислотой к остающемуся сульфату свинца прибавляют ЭДТА, раствор нейтрализуют до значения pH = 2,0— 2,2, отфильтровывают PbSO4 и избыток ЭДТА обратно титруют раствором нитрата висмута в присутствии ксиленолового оранжевого. Следует заметить, что в этом методе (и, вероятно, во многих других) не имеет значения, присутствует ли олово (II), или олово (IV), или смесь того и другого, так как обе формы образуют комплексы в молярном отношении 1 : 1, имеющие высокую устойчивость. Сурьма не мешает определению.
Вакамацу [62 (144)] применяет метод Киннунена для определения олова в стали после отделения железа; Фуруя [63 (72)] определяет олово в фосфористых бронзах. Кониши [62 (143)] модифицирует метод Киннунена для определения Sn11 и SnIV в гальванических ваннах. Юрист и др. [62 (62)] анализируют сплавы Sn—Pb— Cd—Ni, определяя в одной аликвотной порции общее содержание всех металлов при pH = 5 обратным титрованием избытка ЭДТА раствором соли железа (сульфосалициловая кислота в качестве индикатора), а во второй аликвотной порции определяя при pH =
Ю общее содержание металлов, за исключением олова (замаскированного с помощью тартрат-ионов). Содержание послед-него вычисляют по разности.
19*
291
Определение олова с пирокатехиновым фиолетовым обратным титрованием раствором ацетата цинка [57 (80)]
- Реактивы
ЭДТА, 0,05 М раствор.
Ацетат цинка, 0,05 М раствор.
Уксусная кислота.
Аммиак, раствор 1 : 1.
Ацетат натрия, 3 М раствор.
Пирокатехиновый фиолетовый.
Тимоловый синий.
Ход определения. К сильнокислому анализируемому раствору, содержащему до 150 мг олова, приливают 30,00 мл ЭДТА, 2 мл уксусной кислоты и при сильном перемешивании медленно нейтрализуют раствором аммиака (1: 1) до перехода окраски индикатора тимолового синего. После добавления 10 мл раствора ацетата натрия pH раствора имеет значение около 5. Затем раствор разбавляют до 150—200 мл, нагревают до 70—80° С, прибавляют пирокатехиновый фиолетовый и титруют раствором ацетата цинка до перехода окраски в синюю.
Замечания. Нейтрализацию следует проводить медленно. Прибавление уксусной кислоты должно воспрепятствовать переней-трализации благодаря созданию буферного раствора, однако, несмотря на это, следует избегать местного пересыщения щелочью, проводя нейтрализацию медленно и сильно перемешивая. Если образуется муть, то, согласно собственным опытам автора, лучше всего снова сильно подкислить раствор и с большими предосторожностями начать проводить нейтрализацию.
Точку эквивалентности устанавливают по реакции между ионами олова и пирокатехиновым фиолетовым. Практически эта реакция протекает моментально, однако реакция замещения SnY + Zn2+-> ZnY2- + Sn4+ протекает на холоду медленно и поэтому титрование проводят при повышенной температуре.
Определению не мешают Sbv, щелочноземельные металлы и магний. Мешают Bi, As111, Asv, Sbin, W, Mo, Ti, Al, Mn, Cr, Zr в комплексообразующие анионы, такие, как тартрат, цитрат и оксалат; Ag мешает, окисляя индикатор, но титрование в присутствии серебра возможно, если индикатор прибавляют незадолго до точки эквивалентности или обновляют и определение быстро проводят до конца. Совместно с Sn титруются Pb, Cu, Cd, Zn и Ni. Однако, используя дифференциальный метод титрования, можно определить Sn в присутствии умеренных количеств этих металлов. В аликвотной порции анализируемого раствора, согласно приведенной выше методике, определяют общее содержание этих металлов, включая олово. Во второй аликвотной порции олово маскируют с помощью триэтаноламина и обратно титруют избыток ЭДТА раствором ацетата цинка с эриохромом черным Т при pH = 10; Sn определяют по разности.
292
Трудностей, возникающих в процессе нейтрализации, можно избежать, если нейтрализацию проводить в гомогенном растворе. Это предусмотрено в описанном ниже методе, который основан на неопубликованных исследованиях Флашки и Вольфрама и разработан для анализа аналитически чистых солей олова.
Определение олова обратным титрованием раствором соли меди в присутствии ПАН
Реактивы
ЭДТА, 0,1 М раствор.
Нитрат меди, 0,1 А1 раствор.
Ацетатный буферный раствор, pH = 5.
Уротропин, 20%-ный водный раствор.
ПАН.
Тимоловый синий.
Ход определения. К сильно подкисленному соляной кислотой анализируемому раствору приливают 30 мл раствора ЭДТА,- немного индикатора тимолового синего и нагревают до кипения. Медленно по каплям прибавляют 20%-ный раствор уротропина при помешивании и постоянном кипячении до появления желтой окраски раствора. Затем вносят 20 мл буферного раствора с pH = 5, разбавляют до 200 мл и охлаждают до комнатной температуры. После прибавления небольшого количества индикатора ПАН титруют раствором нитрата меди до перехода окраски раствора в фиолетовую и в заключение титруют раствором ЭДТА до перехода фиолетовой окраски в зелено-желтую.
44. СВИНЕЦ
Комплексонометрическое титрование свинца можно осуществлять без затруднений по методу вытеснения или обратного титрования как в кислых, так и в щелочных растворах. Первое прямое комплексонометрическое определение свинца описал Флашка, который, применив реакцию обмена с ZnY [52 (22)] или MgY[52 (24)], титрует освободившийся Zn или Mg с эриохромом черным Т. По этому способу можно с достаточной точностью определять микро-и макроколичества РЬ. Реакция обмена является излишней, если свинец титруют при pH = 10 в присутствии Тартрат-ионов [52 (24), 52 (29)]. Тартрат-ион является вспомогательным комплексообразующим веществом и мешает выпадению в осадок РЬ(ОН)2. Комплекс эриохрома черного Т со свинцом, конечно, не имеет такой яркой винно-красной окраски, как соответствующие комплексы магния или цинка, его окраска — блеклая сине-фиолетовая. Исчезновение красноватого оттенка в точке эквивалентности распознается, однако, более отчетливо, чем при титровании ионов Mg, что обусловливается более высокой устойчивостью соответствующего комплекса со свинцом. Следует обратить внимание на необходи
20 Зак. 553 293
мость избегать большого избытка тартрат-ионов, так как при этом эффективные константы устойчивости комплексов свинца с инди-катором и с ЭДТА сильно снижаются и теряется резкость пере хода окраски в точке эквивалентности. Гэтц [55 (74)] предлагает поэтому применять ДЦТА, так как благодаря более высокой устойчивости комплекса РЬ с ДЦТА концентрация тартрата и рЦ раствора оказывают меньшее влияние. Наряду с эриохромом черным Т предложены [60 (87)] родственные ему соединения ряда кислотного хрома синего. Кроме того, для работы в щелочной среде можно применить в качестве индикатора метилтимоловый синий [58 (34), 61 (127)], имеющий то преимущество, что следы меди и других тяжелых металлов не блокируют этот индикатор.
Для прямого определения РЬ в кислом растворе применяют различные индикаторы. Метилтимоловый синий [58 (34)] дает резкий переход синей окраски в желтую в уротропиновом буферном растворе. В аналогичных условиях получают четкое изменение красной окраски в желтую, если применяют ксиленоловый оранжевый [56 (39), 57 (79)]. Можно использовать ацетатный буферный раствор, если концентрацию ацетат-ионов поддерживать небольшой. С увеличением их количества переход окраски заметно растягивается. В уротропиновом растворе переход окраски настолько резок, что рекомендуется проводить обратное титрование избытка ЭДТА раствором соли свинца при определении большого числа ионов других металлов. Для прямого определения свинца в слабокислом растворе, кроме того, рекомендуют галлеин [61 (31)], пирокатехиновый фиолетовый [57 (78)], пирогаллоловый красный и его дибромпроизводное [56 (90)] и яркий конго синий [57 (77)]. Далее рекомендуют CuY — ПАН [56 (44)] и VY — дифенилкарбазид [63 (1)]. 6,13-Дигидро-6,13-диокси-1,4,8,11-пентаценхинон-2,9 дисульфокислота [62 (47)] в ацетатном буферном растворе с pH =_7—8 или в уротропиновом буферном растворе образует соединение со свинцом, окрашенное в синий цвет, которое при титровании разлагается в точке эквивалентности с резким переходом окраски в светло-желтую. Количество уротропина и время кипячения перед титрованием строго регламентированы.
Различные авторы рекомендуют для прямого определения свинца дитизон, однако точка эквивалентности не отвечает стехиометрическим соотношениям, кроме случаев титрования в спирто-водной смеси. Бовалини [53 (16)] получает заниженные результаты при прямом титровании в водных растворах и поэтому рекомендует метод, в котором присутствующий в растворе комплексон обратно титруют анализируемым раствором свинца и при котором получают правильные результаты в пределах обычных отклонений. Минами и Сато [55 (33)] описывают микротитрование с экстрактивной индикацией конечной точки титрования дитизоном и отмечают, что для получения правильных результатов необходимо, чтобы титр раствора ЭДТА устанавливался по стандартному раствору свинца-Кортли [57 (82)] пользуется 50%-ным спирто-водным раствором
294
и получает правильные результаты для 0,03—6 мг свинца. Аналогичные сведения исходят от Хара [61 (62)], который титрует при pH = 4,5 в 45%-ном водно-этанольном растворе.
В литературе описано также большое число методов обратного титрования свинца. Бидерман и Шварценбах [48 (5)] обратно титруют раствором магния или цинка с эриохромом черным Т в буферном растворе с pH = 10. Киннунен [55 (4)] рекомендует для обратного титрования при работе в аналогичных условиях раствор марганца, так как получается более резкая точка эквивалентности, чем с раствором магния; кроме того, раствор марганца имеет преимущество перед раствором цинка, поскольку в его присутствии можно проводить маскирование цианидом калия. В кислой среде получаются превосходные результаты при микро- [56 (46)] и ультрамикротитрованиях [57 (125)], если обратное титрование проводят раствором меди с ПАН при pH = 5—6. Блоуд и др. [63 (40)] высоко оценивают этот способ индикации, так как благодаря ему можно определять свинец в присутствии фосфат-ионов и щелочноземельных металлов. Такамото проводит обратное титрование раствором соли кобальта в ацетоно-водной смеси (1:1) в присутствии роданид-ионов [55 (102)].
Рекомендуются обратные титрования с косвенной окислительно-восстановительной индикацией с помощью смеси гексацианоферратов (II) и (III) с диметилнафтидином [55 (67)], бензидином [56 (99)] или вариаминовым синим [60 (89)]. Применяется также флуоресцентная индикация при обратном титровании раствором меди с о-дианизидин- или с о-дифенетидинтетраацетатом в качестве индикаторов [60 (153)].
Циоголя и др. [62 (109)] сообщают о косвенном методе, в котором раствор свинца взаимодействует с металлическим цинком в среде едкого натра; после фильтрования оттитровывают Zn2+-ионы, перешедшие в раствор.
Сообщают об амперометрическом титровании с квадратноволновым полярографом [62 (36)], фотометрических титрованиях с са-моиндикацией в УФ-области [55 (97)] или в присутствии ксиленолового оранжевого [60 (47)], о термометрическом [57 (97)] и потенциометрическом титрованиях. Последний метод разработан для определения от макро- [58 (12)] до ультрамикроколичеств [57 (8)] с применением ртутного капельного электрода или биметаллической пары электродов [55 (73)].
Особенно эффективно изучается последовательное титрование смеси Bi—Pb. Это понятно, поскольку комбинация этих элементов присутствует в большинстве природных продуктов и сплавов и определение их классическими методами длительно и трудоемко. Константы устойчивости соответствующих комплексов Bi и РЬ с ЭДТА отличаются достаточно сильно, чтобы было возможно титрование с индикатором, которое особенно благоприятно, поскольку оба металла можно титровать с одним и тем же индикатором. Во всех методах используется один и тот же принцип. Сначала опре
20* 295
деляют Bi в сильнокислом растворе (pH около 1); затем доводят pH раствора до значения 5 прибавлением ацетата или уротропина и титруют РЬ. Ундервуд проводит фотометрическое определение с самоиндикацией в УФ-области [55 (97)]. Потенциометрическим ме тодом с ртутным капельным электродом можно проводить определения без индикатора [58 (12)]. С применением индикаторов, на-пример ксиленолового оранжевого, можно проводить титрование визуальным [60 (62)] или — при • определении микроколичеств — фотометрическим методом [60 (47)]. Для последовательного определения пригоден также галлеин [61 (32)].
Об определении в одном растворе РЬ и V сообщают Кусакина и Якимец [62(110)]. Сумму РЬ и V определяют обратным титрованием избытка ЭДТА раствором цинка с дифенилкарбазидом при pH = 6, затем pH раствора доводят до значения 10, при этом ванадий выделяется из комплекса с ЭДТА, и освободившуюся ЭДТА титруют раствором цинка с кислотным хромом синим в качестве индикатора.
Отделение свинца в виде сульфата позволяет проводить во многих случаях гладко и просто удаление свинца из многокомпонентных систем. Осадок растворяется в ацетатном буферном растворе, или в комплексонатах MgY, ZnY, или в ЭДТА, и может быть подвергнут титрованию. Хизада [60 (91)] применяет этот метод, используя при прямом титровании в качестве индикатора смесь CuY — ПАН, тогда как Каролев [59 (70)] предпочитает ксиленоловый оранжевый или метилтимоловый синий. Многие металлы можно замаскировать цианид-ионом [59 (29)], тогда они не мешают титрованию свинца, даже если присутствуют в значительных количествах. Щелочноземельные металлы титруются совместно, так как маскирование цианидом возможно лишь в щелочной среде. Однако в кислой среде щелочноземельные металлы совместно с РЬ не титруются, и поэтому комбинация маскирования с титрованием аликвотных проб в кислом и щелочном растворе дает возможность проводить разделение многокомпонентных смесей. При титровании свинца Fe, Al и Мп маскируют с помощью триэтаноламина. О комбинации различных маскирующих веществ, например при анализе смеси РЬ—Мп—Zn, сообщает Пршибил [54 (73)1, [54 (79)]. У Пршибила описано также применение BAL [54 (79) ] и о-фенантролина для целей маскирования [59 (23)] при анализе смесей. Согласно Хара [61 (62)], при титровании цинка можно замаскировать свинец кипячением с 3-меркаптопропионовой кислотой. О применении унитиола в качестве маскирующего средства сообщает Морачевский [60 (59), 60 (60)].
Определение свинца находит практическое применение в анализе горючих и тетраэтилсвинца [53 (49), 54 (31), 57 (23), 59 (78)] руд и концентратов [54 (100), 55 (74), 58 (55), 59 (70), 60 (147)], сиккативов [58 (25), 61 (143)], цинковых белил [52 (35)], присадок в минеральных маслах [53 (7)] и фторборатных растворов для гальванических ванн [57 (45), 60 (176)]. Особое внимание уделяют ана
296
ЛИЗУ сплавов [54 (100), 62 (62)]. Здесь следует упомянуть об анализе смеси Bi—РЬ [60 (62)], металла для отливки типографского Шрифта [60(116)], металла для паяния [62 (28)], бронзы и латуни [55 (3)], сплавов на основе меди [54 (67)] и свинца [55 (34)], специальных сталей [61 (155)], сплава РЬ—Ag [62 (62)], низкоплавких сплавов РЬ—Bi—Cd—Zn [59 (32)], сплавов Pb—Sb—Sn—Cu [62 (111)] и ферритов [61 (98)]. Можно определять свинец в хромате [61 (60)] и ванадате [62 (110)], фармацевтических препаратах [54 (82), 57 (113), 61 (6)] и в теллуридах свинца высокопрецизионным методом [61 (127)].
Прямое определение свинца с эриохромом черным Т [52 (24), 52 (29)]
Реактивы
ЭДТА, 0,01 М раствор.
Эриохром черный Т.
Буферный раствор, pH = 10.
Тартрат калия и натрия, приблизительно 1 раствор.
Цианид калия (в некоторых случаях).
Ход определения. К анализируемому раствору, который не должен содержать более 30 мг РЬ в 100 мл, приливают 5 мл раствора (1:4) тартрата или триэтаноламина (если определяют осадок PbSCU, то его растворяют в тартрате или триэтаноламине) и приблизительно нейтрализуют раствором NaOH. В случае необходимости добавляют маскирующее вещество, например KCN. Затем вносят 2 мл буферного раствора, индикатор и титруют до перехода окраски от красной к синей. Раствор при этом не должен быть холодным (около 40°С). С последней каплей ЭДТА должен исчезнуть красноватый оттенок.
Определение свинца по методу вытеснения [52 (35)]
Реактивы
ЭДТА, 0,01 М раствор.
Эриохром черный Т.
Буферный раствор, pH = 10.
Комплекс магния с ЭДТА, приблизительно 0,1 М раствор.
Едкий натр, приблизительно 1 М раствор.
Ход определения. К анализируемому раствору, в 100 мл которого не должно содержаться более 30 мг РЬ, приливают 5 мл раствора MgY (в случае анализа PbSOj последний непосредственно растворяют в растворе MgY) и приблизительно нейтрализуют раствором NaOH. Если необходимо, добавляют маскирующее вещество, затем 2 мл буферного раствора, индикатор и титруют до перехода окраски от красной к синей.
297
Замечания. Обратное титрование тоже является хорошим мето-дом определения свинца. При этом добавляют в небольшом избытке раствор ЭДТА, нейтрализуют, вносят буферный раствор и индикатор и титруют раствором ZnSO4 или MgSO4
Прямое определение свинца с ксиленоловым оранжевым [56 (39), 57 (79)]
Реактивы
ЭДТА, 0,01 М раствор.
Ацетатный буферный раствор, pH = 5.
Уротропин, 20%-ный раствор.
Ксиленоловый оранжевый, 0,1%-пыи раствор.
Ход определения. Анализируемый раствор, содержащий не более 50 мг РЬ в 100 мл, если нужно, предварительно нейтрализуют раствором едкого натра до pH = 2—3 и затем добавляют 3 мл ацетатного буферного раствора или лучше 10 мл уротропинового буферного раствора; при этом pH раствора должен иметь значение около 5. Прибавляют несколько капель раствора индикатора и титруют раствором ЭДТА до перехода окраски от красно-фиолетовой к чисто желтой.
Замечания. При большом содержании свинца pH раствора сильно снижается в процессе титрования. Поэтому рекомендуется контролировать pH раствора вблизи точки эквивалентности и, если нужно, исправлять его, прибавляя раствор уротропина. Следует избегать высокой концентрации ацетатного буферного раствора, так как при этом точка эквивалентности получается размытой. Метод можно видоизменить в метод обратного титрования. В этом случае осадок PbSO4 растворяют в избытке раствора ЭДТА, после чего нейтрализуют, добавляют раствор уротропина и обратно титруют раствором соли свинца до слабо-красноватой окраски. Так как'сульфат свинца сравнительно быстро растворяется в растворе ЭДТА, небольшой избыток последнего легко поддерживать путем непосредственного добавления комплексона; таким образом можно избежать сильного изменения pH раствора при обратном титровании.
41. СОЕДИНЕНИЯ АЗОТА
Об определении аммиака путем осаждения иона аммония можно прочитать в разделе, относящемся к калию.
Определение гидразина, гидроксиламина и некоторых их производных возможно, как указывает Будешински, косвенным окислительно-восстановительным методом [61 (83)]. Пробу кипятят в кислом растворе с комплексонатом ртути HgY2-. При восстановлении ртуть выделяется из комплексоната в виде металла; освободившееся при этом эквивалентное количество ЭДТА титруют раствором соли свинца с метилтимоловым синим,
Берка и Бусев [62 (72)] применяют реакцию между гидразином п таллием (III) (2T13++N2H4—>2T1++N2 + 4H+) в качестве основы для комплексонометрического определения гидразина. К кислому анализируемому раствору добавляют двойной избыток титрованного раствора сульфата таллия (III) и затем по каплям добавляют раствор аммиака до образования постоянной мути. Последнюю растворяют добавкой уксусной кислоты, и в заключение титруют избыток Т1Ш раствором ЭДТА в присутствии ПАН. Берка применил этот метод и для определения производных гидразина, например гидразида изоникотиновой кислоты, семикарбазида и бензоил-гидразина. При этих определениях в качестве индикатора используют ПАР.
46. ФОСФОР
Фосфат. Косвенное определение ортофосфатов можно проводить с помощью комплексонометрического титрования раствором магния после осаждения фосфата в виде десятиводного магний-аммоний-фосфата. Этот метод описали Флашка с сотр. для определения как микро-[52 (53)], так и макроколичеств [52 (31)]. При микроопределениях осадок растворяют в кислоте, раствор сильно разбавляют, нейтрализуют, устанавливают определенное значение pH и прямо титруют магний раствором ЭДТА с эриохромом черным Т в качестве индикатора. В случае присутствия больших количеств фосфат-иона при подщелачивании раствора осадок выпадает вновь, поэтому к кислому раствору прибавляют титрованный раствор ЭДТА, избыток которого после нейтрализации раствора и добавки буферной смеси обратно титруют раствором магния. Почти одновременно и независимо друг от друга Де Лоренци и Аль-дровани [52 (10)] разработали метод определения фосфата, применяющийся для определения содержания фосфорной кислоты и в анализе фармацевтических фосфорсодержащих соединений. Они проводят осаждение титрованным раствором магния и определяют комплексонометрически избыток ионов магния.
Гудитц, Флашка и Петцольд [52 (31)] исследовали влияние помех на осаждение магний-аммоний-фосфата и в качестве маскирующего средства использовали ЭДТА. Если при осаждении присутствует ЭДТА, то она связывает имеющиеся в растворе многовалентные катионы; при добавлении осаждающей смеси (MgCl2+ + NH4CI + NH3) сначала связывается избыток маскирующего вещества, а затем осаждается фосфат-ион. Это вполне возможно, т- к. комплексонат Mg имеет небольшую константу устойчивости, поэтому магний может вытеснять лишь немногие металлы из их Комплексов с ЭДТА. Описанный способ маскирования особенно эффективен, когда нужно определять фосфат в присутствии ионов
Однако, если присутствуют ионы Fe, Al и Ti, этот способ неприемлем; тогда для их маскирования добавляют цитрат-ион. Бериллий удерживают в растворе с помощью сульфосалициловой кислоты. В этих условиях можно определять фосфат в присутствии
299
от десяти- до стократного количества упомянутых выше мешающих элементов, а также в присутствии Cu, Ni, Со, Zn, Cd, Pb, Bi ц других металлов. Определение состоит в получении осадка, разумеется, с стехиометрическим составом; необходимо избегать со-осаждения комплексонометрически активных ионов металлов поэтому при применении этого метода следует соблюдать все меры предосторожности, принимаемые при гравиметрических определениях. Для достижения большей точности упомянутые авторы рекомендуют еще переосаждение, особенно если нужно определять малые количества фосфора в присутствии больших количеств мешающих элементов и посторонних солей. На эту необходимость вновь указывает в последнее время Землянский [61 (111)]. Уже в первых работах упоминается о возможности удаления мешающих катионов с помощью ионного обмена. Спорек [58 (104)] описывает практический ход анализа, включающий ионный обмен, а также предшествующее ему отделение фосфата с помощью молибдата в сильно подкисленном азотной кислотой растворе. Затем в щелочном растворе фосфоромолибдата проводят осаждение магния. В этом случае Мо не мешает, так же как и при титровании комплексоном. Спорек сообщает также об отделении As путем концентрирования анализируемой пробы до сиропообразной консистенции в присутствии НВг. В заключение избыток брома удаляют кипячением с азотной кислотой.
Эшман и Брошон [56 (55)] модифицировали магниевый метод, осуществляя осаждение при комнатной температуре путем нейтрализации этаноламином кислого, содержащего магний анализируемого раствора. В этих условиях становится излишним (необходимое в других методах для достижения полноты осаждения) продолжительное время эксперимента. Конечно, при этом методе присутствующие Fe и А1 удаляют предварительной экстракцией купферроном. Авторы указывают, что медленного выпадения осадка в случае малых количеств фосфата можно избежать, если добавить точно известное количество фосфата, которое, конечно, следует учесть при вычислениях.
Като и др. [55 (11)] применяют магниевый метод для определения ортофосфата в фильтрате после осаждения пирофосфата ионами цинка. Бенневич и др. [59 (109)]и Хозуми [61 (153)] описывают модифицированный магниевый метод, в котором фильтрование излишне. Метод разработан для определения фосфора в органических соединениях после мокрой обработки и состоит в осаждении 0,005 М титрованным раствором соли магния. После добавки раствора магния анализируемый раствор разбавляют в 2 раза этанолом, вследствие чего осаждение ускоряется и делается более полным и, кроме того, растворимость осадка настолько уменьшается, что при обратном титровании он не вступает в реакцию, й титруют. Бусс и др. [63 (53)] сообщают об обстоятельном изучений способа определения фосфора путем образования ZnNH4PO4- Ме'| тод разработан в трех вариантах для микро-, полумикро- и макро"
300
определений и основан на реакции осаждения фосфата при pH раствора 6,5—7,0, который устанавливают добавлением моноэта-поламина. Осаждение ионами цинка имеет то преимущество, что Б процессе титрования цинка при pH = 10 не происходит вновь выпадения осадка, и титрование цинка с эриохромом черным Т дает значительно более резкую точку эквивалентности, чем титрование магния. Для осаждения и косвенного определения фосфата применяют кроме магния и цинка также торий и висмут. При этом осаждение и титрование можно проводить в кислом растворе, что очень выгодно для повышения селективности. Киннунен [57 (147)] кипятит слабокислый анализируемый раствор после прибавления известного объема нитрата тория, охлаждает, доводит объем до метки и определяет в аликвотной порции фильтрата избыток тория титрованием с ксиленоловым оранжевым в качестве индикатора. Отсутствуют сведения о контрольных анализах, а также детализированные данные о pH, количествах фосфата, ограничениях метода, источниках ошибки и т. п. — см. также [63 (55)].
Осаждение с помощью ионов Bi впервые предложили Женже и Салмон [57 (73)]. Избыток ионов Bi обратно титруют в аликвотной порции фильтрата в присутствии пирокатехииового фиолетового. Веда и др. [61 (24)] проводят определение аналогичным путем, ио применяют в качестве индикатора ксиленоловый оранжевый. Кислотность раствора для полноты осаждения должна поддерживаться в узком интервале. В слишком кислом растворе фосфат висмута растворим, в то время как в слабокислом растворе выпадают хлопьевидные, трудно фильтрующиеся осадки, адсорбирующие и увлекающие ВР+-ионы и продукты их гидролиза. Соколовчи с сотр. [62 (55)] считают оптимальным для осаждения интервал pH от 0,7 до 1. Эти авторы сообщают также о возможности замаскировать Ре3+-ионы восстановлением их аскорбиновой кислотой и ионы ртути — реакцией обмена с муравьиной кислотой. При титровании избытка ионов висмута применяют пирокатехиновый фиолетовый.
Ридель [59 (74)] решает изящным путем проблему установления оптимальной кислотности раствора, равной 0,2 н. по хлорной кислоте. Анализируемый препарат выпаривают с азотной кислотой досуха и к остатку добавляют 13 мл 1 н. раствора хлорной кислоты, после чего раствор вновь концентрируют до начала выделения паров хлорной кислоты. По охлаждении вносят пипеткой титрованный раствор нитрата висмута и нагревают до кипения. Затем при энергичном перемешивании медленно прибавляют 80 мл кипящей воды. При таком способе осаждения из гомогенного раствора выпадает крупнокристаллический порошкообразный осадок. Последний не нужно удалять из раствора, так как он не мешает титрованию избытка Bi. Титрование проводят после разбавления раствора водой приблизительно до 300 мл с применением в качестве Индикатора пирокатехииового фиолетового. Выпаривание раствора лорной кислоты следует проводить осторожно и прекратить, как
301
только начнут выделяться пары кислоты, иначе произойдет потеря кислоты и не будет гарантирована точно установленная кислотность раствора. Метод имеет и другое преимущество, заключающееся в том, что мешающие хлорид-ионы автоматически удаляются Присутствующий и мешающий сульфат можно удалить перед выпариванием с азотной кислотой осаждением нитратом бария. Избыток Ва2+-ионов не мешает. Помехи со стороны Fe исключаются путем восстановления его гидразином. Поскольку гидразин продается только в виде солянокислой или сернокислой соли и оба аниона мешают определению фосфата, то следует применять 1идр-азингидрат, который в разбавленном (!) растворе можно безопасно нейтрализовать хлорной кислотой. По-видимому, можно также проводить восстановление раствором аскорбата натрия. Восстановление железа проводят непосредственно перед добавлением раствора нитрата висмута. Согласно Риделю, мешающие ионы Hg и Sb легко удаляются осаждением их в виде сульфидов. Из остальных мешающих ионов металлов можно назвать только очень редко присутствующие в растворе In, Ga, Zr и Th. Контрольные анализы показывают, что для количеств около 5 мг РО^-ионов в 100 мл раствора отклонения составляют лишь несколько десятых процента. Однако можно определять и меньшие количества, если упомянутые выше добавки соответственно уменьшить. Ридель приводит также полезное эмпирическое правило для определения количества висмута, требуемого для осаждения фосфат-ионов: ожидаемое количество РО^-ионов (в миллиграммах) плюс десять равно объему (в миллилитрах) добавленного 0,01 М раствора висмута (содержащего HNO3 в концентрации от 0,5 до 0,7 М).
Комплексонометрическое определение фосфат-ионов находит практическое применение в анализе сыворотки [52 (34)], фармацевтических препаратов [55 (88)], чугуна [63 (54)], феррофосфата [57 (106)], сплавов Р—Си [63 (55)], органических соединений после сожжения в герметическом сосуде [58 (24), 59 (109)], пероксофосфатов [54 (87)], вин после их озоления [54 (86)], пищевых продуктов [56 (55)], урановых концентратов [58 (105)], руд, шлаков [63 (54)] и удобрений [63 (54)].
Метафосфат. Эшман и Брошон определяют метафосфат, превращая его при кипячении с серной кислотой в ортофосфат, содержание которого определяют по магниевому методу. Гексаметафосфат можно определить, согласно Верефу и Фюлопу [62 (131)], осаждением инозитфосфорной кислоты ионами меди в слабокислой среде и обратным титрованием избытка металла в фильтрате раствором ЭДТА с ПАН.
Пирофосфат и триполифосфат. Пирофосфат при кипячении с сер ной кислотой переходит в ортофосфат, который можно определить по магниевому методу [56 (55)]. Однако этого продолжительного процесса можно избежать и осадить пирофосфат как таковой. Для этого пользуются раствором цинка [55(H)] Осаждение протекает количественно при pH = 3,8—4,1 [55 (ПО)]. Метод имеет то преимУ'
302
щество, что выделенный и промытый осадок Zn2P2O7 растворяется непосредственно в аммиачном буферном растворе, и ионы цинка оттитровывают в присутствии эриохрома черного Т. Затем в фильтрате можно быстро определить присутствующую ортофосфорную кислоту по магниевому методу. Аналогично ведет себя триполифосфат, который также может выпадать в осадок при pH около 4 и может быть определен титрованием освободившихся ионов цинка [55(110)]. Рэмэкерс [56 (117)] подробно излагает способ определения три- и пирофосфата в растворе триполифосфата. Нильс и Ги-фер [55 (109)] предпочитают осаждать пирофосфат солями марганца. Осадок получают при pH =4,1 и через 16 ч отфильтровывают. Присутствующие в растворе в избытке ионы Мп определяют титрованием раствором ЭДТА с эриохромом черным Т при рН = 10 в присутствии гидроксиламина. Осаждение протекает количественно, если в растворе присутствует не больше 0,2 мг Р2О^_ в 1 мл и по меньшей мере пятикратный избыток Mn-ионов. Ортофосфат должен отсутствовать.
Гипофосфит. Чоголя и др. [62(56)] окисляют гипофосфит азотной кислотой при кипячении, осаждают титрованным раствором нитрата висмута и избыток последнего в фильтрате обратно титруют в присутствии пирокатехинового фиолетового. Изящен метод Фулопа и др. [62 (57)], использующих сильные восстановительные свойства гипофосфита. Анализируемый раствор кипятят с комплексонатом ртути, при этом Нц'2+-ионы, связанные в комплекс, восстанавливаются до металла и освобождается эквивалентное гипофосфиту количество ЭДТА. Свободную ЭДТА титруют раствором сульфата меди с ПАН в качестве индикатора.
Косвенное определение фосфата
Реактивы
ЭДТА, приблизительно 2 М раствор (для маскирования).
Сульфат магния, приблизительно 1 М раствор (для осаждения).
Аммиак, концентрированный раствор.
ЭДТА, 0,1 М раствор.
Сульфат магния, 0,1 М раствор (титры этих растворов устанавливают одни по другому).
Эриохром черный Т.
Соляная кислота приблизительно 1 М раствор.
Едкий натр, приблизительно 1 М раствор.
Буферный раствор, pH = 10.
Винная кислота, 1 М раствор.
Цианид калия.
Аскорбиновая кислота.
Сульфосалициловая кислота.
Ход определения. Кислый анализируемый раствор не должен содержать более 350 мг РО|~-ионов. К нему добавляют в достаточном количестве 2 М раствор ЭДТА, чтобы связать в комплекс &се присутствующие в нем многовалентные катионы. В присутствии се, Al, Ti или Bi добавляют 1—2 мл винной кислоты; Be маски-
303
руют незначительным количеством сульфосалициловой кислоты Затем вносят в избытке 1 М раствор M.gSO4 и в кипящий раствор по каплям медленно приливают концентрированный раствор аммиака. После того как количество образовавшегося осадка перестанет увеличиваться, вносят еще в избытке раствор аммиака и дают смеси постоять несколько часов. Для получения очень точных результатов осадок следует переосадить. Затем его отфильтровывают и основательно промывают 1 М раствором аммиака.
Фильтр с осадком переносят в стакан и приливают приблизительно 10 мл 1 М раствора соляной кислоты, добавляют 50 мл воды, полученную суспензию нагревают до кипения, фильтруют через новый фильтр и промывают фильтровальную массу. Объем жидкости должен теперь составлять около 150—200 мл. Затем вливают небольшой избыток титрованного раствора ЭДТА, немного раствора KCN и аскорбиновой кислоты. Раствор нейтрализуют 1 М раствором едкого натра, приливают 2—4 мл буферного раствора, индикатор и обратно титруют ЭДТА титрованным раствором MgSO4 до перехода синей окраски в красную.
Замечания. Если определяемое количество фосфата очень мало, то можно проводить также прямое титрование. Раствор осадка в соляной кислоте можно затем нейтрализовать и добавлять буферный раствор, не опасаясь немедленного выпадения осадка, т. е. можно пересыщенный раствор MgNH4PO4 прямо титровать раствором ЭДТА. При подобных определениях лучше всего применять 0,01 М раствор ЭДТА; соответственно уменьшают конечный объем и количество остальных реактивов. Можно исключить операцию нейтрализации и добавление буферного раствора, если осадок растворить точно в 10 мл 1 М раствора соляной кислоты и добавить перед титрованием 20 мл ЗМ раствора аммиака. Полученный при этом раствор соответствует соотношению концентраций аммиака и NH+-ионов, отвечающему буферному раствору с pH = 10.
Аналогичным путем можно определить также пирофосфат. Его осаждают цинком или марганцем в уксуснокислом растворе, отфильтрованный и промытый осадок Zn2P2O7 растворяют прямо в аммиачном буферном растворе, а осадок марганца обрабатывают, как описано выше, по магниевому методу.
47. МЫШЬЯК
Мышьяк можно определять комплексонометрически лишь косвенным путем. В литературе описаны методы, основанные на различных принципах. Малинек и Рехак [56 (31)] используют методы, разработанные для определения фосфорной кислоты (см. стр. 299), для определения аналогично реагирующей мышьяковой кислоты. Известным способом арсенат-ион осаждают в сильноаммиачноМ растворе магнием, промытый осадок растворяют в соляной кислоте и к анализируемому раствору добавляют избыток титрованного 364
раствора ЭДТА. После нейтрализации и добавления буферного раствора с pH = 10 обратно титруют избыток ЭДТА раствором сульфата магния с эриохромом черным Т. Возможно также прямое титрование содержащегося в осадке магния, если в кислом растворе, содержащем растворенный осадок, восстановить Asv до As111 непродолжительным кипячением с 2 г сернокислого гидразина и 0,5 г КВг. После подщелачивания раствора присутствующий в нем арсенит не мешает титрованию магния. Аналогично тому, как это имеет место при определении фосфата, можно при осаждении ввести для маскирования мешающих элементов ЭДТА, тарой и винную кислоту. Метод используют при анализе сплавов, содержащих в большом количестве мышьяк [56(21)]. Вместо магния можно Применять для осаждения арсенатов цинк [60 (12)]. Этот метод выгоден потому, что выделенный и промытый осадок быстро растворяется в буферном растворе с pH = 10, в котором и оттитровывают Zn. Метод разработан для анализа лекарственных препаратов, но, конечно, может иметь более широкое применение. Естественно, при использовании упомянутых выше маскирующих веществ (для исключения помех при осаждении) можно вносить соответствующие изменения в методику.
Метод, описанный Васильевым и Анастасеску [60 (94)] для анализа фармацевтических препаратов, тоже можно без всяких затруднений применять в других областях. К подкисленному анализируемому раствору арсената добавляют в избытке титрованный раствор висмута, отфильтровывают выпавший осадок BiAsO4 и определяют в фильтрате избыток Bi титрованием раствором ЭДТА. Уэда и др. [62 (108)] проводят анализ аналогичным путем, но осадок растворяют и титруют содержащийся в нем Bi с ксиленоловым оранжевым. Не мешают Са, Mg, Zn, Со, Ni и Си. На основании собственных опытов авторов книги следует указать, что метод с применением Bi дает хорошие результаты лишь в определенном интервале концентраций кислоты, так как из-за растворимости осадка в слишком кислых растворах или возможности соосажде-ния окиси висмута или основных солей висмута в недостаточно кислых растворах необходимо сравнительно жестко соблюдать требования относительно оптимальной области pH.
Описанные до сих пор методы могут быть использованы лишь Для определения Asv. Если присутствует As111, то его следует сначала окислить. Мышьяк (Ш) можно определить без окисления, если применить метод Черни [58 (10)]. В этом методе мышьяк осаждают в виде трисульфида, осадок отделяют и промывают, растворяют в аммиачном буферном растворе и добавляют титрованный раствор соли кадмия. Не отфильтровывая выпавший в осадок CdS, обратно титруют избыток Cd раствором ЭДТА с эриохромом черным Т. Этот метод применяют при анализе обычного и Ноздреватого чугуна и руд.
Об интересной возможности определения As111 и Asv или их смеси сообщает Стефанач [62 (58)]. Метод разработан для опреде
305
ления мышьяка в органических веществах после сожжения их по Шэнпгеру, однако может иметь общее применение. Принцип метода заключается в осаждении арсенита и арсената в виде сере-бряных солей, вытеснении серебра в образовавшемся осадке цианидом никеля и титровании выделенного затем в свободном со-состоянии никеля (см. стр. 258). Так как на осаждение 1 г-атом как As111, так и Asv требуется 3 г-атом серебра, то не имеет значения, в какой форме присутствует мышьяк; анализ смеси обеих валентных форм мышьяка дает правильные значения общего содержания мышьяка. Недостатком метода является необходимость отсутствия галогенов и других анионов, образующих осадки с ионом серебра.
Мышьяк лишь незначительно мешает комплексонометрическому титрованию других металлов, кроме случаев, когда возможно выделение в осадок нерастворимых соединений. Сообщается о маскировании мышьяка с помощью унитиола [60 (59), 60 (60)].
Для определения мышьяка используют методики, описание которых приводится в разделе, касающемся определения фосфатов.
48. СУРЬМА
Сообщается о получении комплексов трехвалентной сурьмы с ЭДТА [59 (68), 59 (131)] и другими комплексонами [59 (131]. Описанные опыты комплексонометрического титрования сурьмы не вполне удовлетворительны. Определение Sb обратным титрованием избытка ЭДТА раствором соли кобальта в 50%-ной ацетоно-водной смеси в присутствии роданид-ионов дает плохую точку эквивалентности [55 (100), 55 (103), 58 (80)]. Однако метод находит практическое применение в анализе теллуридов сурьмы и висмута [63 (39)]. Точка эквивалентности почти неразличима, если обратное титрование проводят раствором сульфата цинка с ксиленоловым оранжевым при pH = 5 — 5,5 [58 (80)]. Дубски [59 (25)] сообщает об окраске, которую дает метилтимоловый синий в присутствии Sb111, что, однако, не пригодно для индикации конца титрования. Часто сурьмяный комплекс бывает слишком малоустойчивым, и Sb111 частично или полностью вытесняется металлом, применяемым для обратного титрования. О прямом титровании сообщает Жар-дэн [59 (69)]. В первоначальный сильнокислый анализируемый раствор вносят КС1 и НС1 и нейтрализуют раствором аммиака до pH = 2—3. При этом раствор мутнеет от выпадения SbOCl; муть исчезает при медленном добавлении раствора титранта. После добавления каждой небольшой порции раствора ЭДТА ожидают почти 5 мин и процесс проводят до получения полной прозрачности раствора. Легко понять, что такой метод едва ли можег быть внедрен в практику.
Пятивалентная сурьма, по-видимому, комплексов с ЭДТА не образует.
303
о помехах, обусловленных присутствием сурьмы при определении других металлов, известно немного. Возможно маскирование S^ni винной кислотой при титровании олова [59 (25)] или висмута [63 (39)]. Сурьма является одним из металлов, который можно маскировать с помощью унитиола [60 (59), 60 (60)].
49. ВИСМУТ
Миклош и др. [61 (53)] определили константу устойчивости комплекса Bi с ЭДТА на основании полярографического исследования равновесия реакции обмена с FeY- и нашли, что 1g/С = = 27,94 (20°С, ц. = 0,1, KNO3). Поэтому титрование Bi можно проводить при довольно низких значениях pH, и оно относительно селективно. При титровании необходимо применять сравнительно кислые растворы, так как в противном случае определению мешают явления гидролиза. Уже ранее Шварценбах [48 (7)] описал возможность прямого титрования, при котором точка эквивалентности фиксируется по обесцвечиванию тетраиодидного комплекса висмута, окрашенного в желтый цвет. Этот метод более подробно изучил Ченг [54 (6)], который нашел, что лучшие результаты получаются при pH = 1,5—2,0 и содержании KI около 10 мл его 0,5%-ного раствора в 50 мл титруемого раствора. Сначала прибавляют около 1—2 мл раствора КТ, а затем, когда обесцвечивание первоначальной окраски указывает на приближение точки эквивалентности, прибавляют и остальной раствор. Гренквист [53 (20)] использует обесцвечивание тиомочевинного комплекса висмута (также желтого цвета) и для получения более резкого изменения окраски добавляет немного генцианы фиолетовой. Титрование проводят при pH от 2,5 до 4,0 в присутствии больших количеств тиомочевины (2,5—3,0 г в 50 мл) и кислого фталата калия (1 г в 50 мл). Фритц [54 (44)] улучшил этот метод: он, во-первых, вообще не добавляет буферного раствора, а во-вторых, снижает концентрацию тиомочевины до 0,5—1 г в 50 мл раствора, после чего титрует Bi при pH = 2 и ниже безукоризненно и с меньшими помехами. Не мешают даже хлорид-, сульфат- и значительное количество тартрат-ионов. Последние можно использовать для маскирования Sb111; Th маскируют с помощью сульфат-, a Be, Nb и Та — фторид-ионов. Помехи, вызываемые присутствием Ие3+-ионов, исключают введением аскорбиновой кислоты; РЬ и другие обычно присутствующие катионы не мешают, однако SnIV и Zr должны отсутствовать. Визуальная индикация по обесцвечиванию иодо- или тиомочевинного комплексов не дает хороших результатов, так как переход окраски менее резок, чем в случае применения окрашенных индикаторов. Однако в последнем случае возможность помех больше, чем в методе с тиомочевиной.
Для определения Bi предложено большое число металлохром-ных индикаторов. Из них можно выделить пирогаллоловый
307
красный [56 (85)], дальцин — бис- (аллилтиокарбонил) -тидразип [60 (121)], торон [56 (74)], ПАН [57 (131)], гематоксилин [59 (136) 60 (117)], стильбазо [60 (147)], галлеин [61 (30)], метилтимоловый' синий [59 (55)], пирокатехиновый фиолетовый [59 (21)] и ксиленоловый оранжевый [60 (47)]. Согласно Сайо [63 (1)], точку эквивалентности можно зафиксировать также с помощью системы ванадий (V) —ЭДТА — дифенилкарбазид.
Таттов и Шотт [62 (82)] подвергают подробному критическому исследованию комплексонометрическое определение висмута. В качестве стандартного был выбран метод титрования с пирокатехиновым фиолетовым и с ним сравнивали определение с ксиленоловым оранжевым, ПАН, ПАР, тороном, тиомочевиной, гематоксилином, метнлтимоловым синим и бромпирогаллоловым красным. Лучшим показал себя ПАР, так как с ним получены точные данные и наименьшие отклонения (концентрация Bi от 0,5 до 900 мг!мл). Хорошие результаты дали также метилтимоловый синий и гематоксилин, но область разброса результатов шире. Хотя ксиленоловый оранжевый, торон и тиомочевина дают меньшие отклонения, однако получаются несколько завышенными результаты по сравнению со стандартным методом.
Во второй своей работе [62 (83)] те же авторы изучали влияние гидролиза и образования поликатионов на результаты титрования. Полученные данные указывают на недопустимость нейтрализации едким натром, аммиаком или пиридином кислого анализируемого раствора до нужного для титрования значения pH. Местное пересыщение раствора щелочью приводит к образованию поли-ядерных соединений, которые лишь очень медленно или вовсе не реагируют с ЭДТА. Вследствие этого получаются заниженные результаты и размытые переходы окраски индикаторов. Образовавшиеся поликатионы при добавлении кислоты растворяются очень медленно. Если нейтрализацию проводят приблизительно 1 М раствором кислого карбоната натрия или ацетата натрия, то никаких затруднений не встречается.
В настоящее время лучшим из рекомендуемых индикаторов является пирокатехиновый фиолетовый. В интервале pH от 1,5 до 2,0 свободный индикатор окрашен в желтый цвет. С ионами Bi он образует комплекс с глубокой чисто синей окраской состава Вг индикатор = 2: 1. С повышением кислотности раствора цвет этого комплекса становится фиолетовым. Это позволяет проводить нейтрализацию анализируемого раствора перед титрованием по изме нению окраски комплекса с индикатором, который при этом ведет себя как кислотно-основной индикатор. При проведении собственно титрования непосредственно перед точкой эквивалентности в растворе отсутствует избыток свободных попов висмута, и комплекс состава 2: 1 разлагается с образованием комплекса состава 1 : 1, окрашенного в красный цвет. Таким образом, появление красной окраски всего раствора или, по крайней мере, появление ее в месте падения капли ЭДТА предупреждает о приблн-
308
жении точки эквивалентности. Переход окраски в точке эквивалентности в чисто желтую исключительно резок.
Рекомендованы также некоторые методы обратного титрования. Ландгрен [52 (1)] обратно титрует избыток ЭДТА в боратном буферном растворе раствором сульфата магния с эриохромом черным Т. Белчер и др [60 (153)] применяют о-дианизидинтетрауксус-ную кислоту в качестве флуоресцентного индикатора и обратно титруют раствором сульфата меди. Тер Хаар и Базен [54 (17)] используют ализарин S и раствор соли тория. Однако эти методы не имеют преимущества перед методами прямого титрования, за исключением случаев, когда присутствуют анионы, главным образом хлорид-ионы.
Инструментальную индикацию точки эквивалентности уже давно ввел Пршибил [51 (15)], который проводил амперометрическое титрование. Усатенко [60 (95)] и Жданов [60 (42)] указывают, что при использовании этого метода получаются хорошие результаты. Рейли и др. [62 (33)] титруют амперометрически, фиксируя точку эквивалентности по «волне комплексона» (см. стр. 114. Возможно также потенциометрическое титрование с ртутным капельным электродом (см. стр. ПО). Фотометрическое титрование изучал Ундервуд. Он устанавливал конечную точку либо по изменению светопоглощения тиомочевинного комплекса, либо по методу самоиндикации с использованием Си в качестве внутреннего индикатора; эти методы позволяют проводить последовательное титрование смеси Bi—Си [54 (51)]. С помощью самоиндикации в УФ-области [55 (97)] можно проводить последовательное титрование смеси Bi—Pb. Изучение цветных реакций между Bi и ксиленоловым оранжевым привело Кортлы и Врештала [60 (47)] к разработке метода фотометрического титрования микрограммо-вых количеств Bi, который применим и для проведения последовательного микротитрования смеси Bi—Pb.
Флашка с сотр. [56 (42)] рекомендуют растворы висмута в качестве прекрасного титранта для обратного титрования в сильнокислых растворах. Между прочим, с помощью такого титранта можно фотометрически определить Ni в присутствии Со по методу замороженных растворов [55 (66)] и Со (после окисления его до Со1П) в присутствии Ni и других металлов [61 (51)]. Благодаря высокому эквивалентному весу Bi и исключительно резкой точке эквивалентности титрования с пирокатехиновым фиолетовым Пршибил рекомендует чистый для анализа металлический висмут в качестве основного вещества для установки титра растворов ЭДТА в кислой среде.
Комплексонометрическое определение висмута можно проводить в присутствии значительных количеств свинца (до 1 :5000) и тем самым решить старую аналитическую проблему. При применении определенных индикаторов можно даже проводить последовательное титрование смеси Bi—Pb Сначала тчтррот висмут в сильнокислом растворе (pH — 1—2), а затем после повышения pH
21 Зак 553 ЗОЭ
до 5—6 титруют свинец. Это определение, например, можно проводить визуальным методом с применением ксиленолового орац. жевого [60 (62)] или фотометрически [60 (47)]. Повышение pH раствора целесообразно осуществлять с помощью добавления ур0. тропина. Для подобных определений пригодны также галлеин [61 (32)] и метилтимоловый синий [59 (55)]. Само собой разумеется что в данном случае особое преимущество имеют инструментальные методы. С их использованием Рейли и др. (см. гл. VII) смогли определять последовательно три элемента, например Bi, Pb, Са.
Определение Bi очень селективно. Мешать могут лишь те элементы, которые образуют очень устойчивые комплексонаты, например Fe, Hg, In, Zr, Hf и др. Какой элемент (и в какой концентрации) допустим в растворе, зависит от кислотности раствора и применяемых индикаторов и маскирующих средств. О преимуществах, которыми обладает в этом отношении метод Фритца, уже упоминалось вначале. При восстановлении с помощью аскорбиновой кислоты маскируются не только ионы железа, но также и ноны ртути [56 (84)] (восстановление до металла), при этом раствор нужно нагревать. Впрочем, ионы Hg11 маскируются также рода-нид-ионами [59 (55)].
Комплексонометрическое определение висмута находит практическое применение в первую очередь в анализе сплавов. Примеры и подробные описания определений можно найти во многих статьях [54 (101), 57 (132), 57 (133), 58 (113), 59 (32), 60 (62)]. Усатенко определяет висмут амперометрическим титрованием в свинцовых сплавах в присутствии осажденного в виде PbSO4 свинца [60 (95)]. Комплексонометрическое титрование висмута является основным методом анализа фармацевтических препаратов [52 (1), 53 (20), 54 (85), 55 (72), 57 (119), 58 (51), 59 (55), 61 (125)]. Висмут используют для косвенного определения органических соединений путем осаждения их с помощью тетраиодвисмутата (см. стр. 285).
Прямое определение висмута
Реактивы
ЭДТА, 0,01 М раствор.
Пирокатехиновый фиолетовый.
Гидрокарбонат натрия, твердый.
Ход определения. Анализируемую пробу растворяют в небольшом объеме концентрированной азотной кислоты и избыток растворителя почти полностью выпаривают. Затем раствор разбавляют так, чтобы в 100 мл его содержалось не более 20—30 мг Bi> и добавляют индикатор. Последний должен принять чисто синюю окраску. Если цвет раствора фиолетовый или с красноватым оттенком, его кислотность слишком высока и к нему добавляют NaHCO3 до получения чисто синего цвета (этому соответствует pH около 2 5). Затем титруют раствором ЭДТА до резкого пер1 310
хода окраски в желтую. Так как при комплексообразовании образуются ионы водорода, то pH раствора в процессе титрования может снова сильно снизиться; это устраняют добавлением еще нескольких крупинок NaHCO3.
При pH выше 4 окраска переходит из синей прямо в желтую. Если кислотность несколько выше (около рН=3), то близко к точке эквивалентности окраска переходит в промежуточную, а именно в фиолетовую, которая сохраняется лишь в процессе приливания нескольких капель раствора титранта, а затем с последней каплей исключительно резко переходит в желтую.
Замечания. В присутствии Cl’-ионов (Вт- и I- удаляются при выпаривании с HNO3) всегда выпадает BiOCl, что затрудняет установление оптимального значения pH. В этом случае удобнее проводить обратное титрование. К кислому анализируемому раствору приливают в небольшом избытке титрованный раствор ЭДТА, доводят pH раствора до значения 2,5—3 и обратно титруют избыток ЭДТА 0,01 АТ раствором Bi(NO3)3.
50. КИСЛОРОД
Роска и Ланжен [63 (71)] описывают метод определения растворимого кислорода в воде. К 100 мл анализируемого раствора в сосуде с пришлифованной пробкой прибавляют реактивы в следующем порядке: 2 мл 15%-кого раствора салицилата натрия, от 150 дс^ 200 мг комплекса Fe11 с сульфатом этилендиамина и 0,5 мл 20%-ного раствора трис-(оксиметил)-аминометана. Сосуд сразу закрывают, и притом так, чтобы над жидкостью не осталось пузырьков газа. Затем содержимое сосуда хорошо перемешивают. Сосуд открывают и тотчас вносят 5 мл 15%-ного этанольного раствора малеиновой кислоты. В заключение титруют 0,02 М раствором ЭДТА до исчезновения красно-фиолетовой окраски салицилатного комплекса железа(III).
Особенно важно, чтобы комплекс сульфата этилендиамина с Fe11 был совершенно свободен от ионов Fem. Метод дает в пробах чистой воды такие же результаты, что и стандартный метод Винклера, но характеризуется несколько меньшей точностью. В случае загрязненной воды, по-видимому, комплексонометрический метод имеет преимущества, так как возникает значительно меньше помех.
51. СЕРА И ЕЕ СОЕДИНЕНИЯ
Элементарную серу, согласно Гимези, Ради и Эрдею [62 (79)], можно определить следующим образом. Анализируемый раствор, содержащий от 30 до 80 мг серы, обрабатывают 25 мл изопропилового спирта при нагревании. Далее приливают точно отмеренный объем 0,2 М раствора K.CN (10—20 мл) и оставляют охлаждаться. Цианид-ионы и сера реагируют с образованием роданид-ионов. После этого определяют избыток цианид-ионов. Для этого вносят с помощью пипетки 0,05 М раствор соли никеля, доводят
21*
311
pH добавлением буферного раствора до значения 10 и обратно титруют избыток никеля 0,05 М раствором ЭДТА с мурексидом В холостом опыте устанавливают титр раствора KCN по раствору соли никеля; 1 мл 0,2 М раствора цианида калия соответствует 6,4128 мг серы. В процессе титрования цианид-ионов 1 г-ат Ni реагирует с 4 моль KCN (см. комплексонометрическое определение цианид-ионов, стр. 282).
Определение серы в органических соединениях, сплавах и дру. гих материалах проводят чаще всего после сожжения или мокрого озоления и заканчивают комплексонометрическим титрованием сульфат-иона.
Сульфид
Кивало [55 (13)] первым сообщил о косвенном комплексонометрическом определении сульфида. Анализируемый раствор сульфида щелочного металла вносят с помощью пипетки в нейтральный или слабокислый раствор соли меди, сульфид меди отфильтровывают и обратно титруют в фильтрате избыток меди раствором ЭДТА с мурексидом. Растворы цинка или кадмия не употребляют, так как выпадающие в осадок сульфиды не имеют стехиометрического состава. Аналогичный метод описал Морис [56 (80)]. При более подробном изучении метода Бартельс и др. [59 (128), 60 (101)] обнаружили, что в присутствии небольших количеств сульфида осадок не нужно отфильтровывать. По сравнению с иодо-метрическим методом комплексонометрическое определение сульфида дает несколько заниженные значения содержания сульфида. Последние авторы объясняют это тем, что растворы сульфид-ионов могут содержать тиосульфат- и сульфит-ионы, которые реагирую с иодом, но не реагируют с медью. Таким образом, при комплексонометрическом методе определяется фактическое содержание сульфида.
Будешински [60 (44)] описывает другой метод. Анализируемый раствор кипятят с подщелоченным едким натром раствором CdY, причем выпадающий CdS имеет стехиометрический состав. В фильтрате выделившееся эквивалентное по отношению к сульфиду количество ЭДТА титруют раствором хлорида кальция с метилтимоловым синим. Не мешают присутствующие сульфит-, тиосульфат-и роданид-ионы; метод можно распространить на определение серы в тиомочевине и некоторых ее производных.
Об определении сульфида в смесях с сульфатом [61 (179)] и тиосульфатом [61 (26)] сообщает Суса.
Сульфид можно также окислить до сульфата и в виде последнего определить комплексонометрически.
Сульфат
Мунгер, Нипплер и Ингольс [50 (10)] первыми описали комплексонометрическое определение сульфат-иона. Метод состоит в том, что определенный объем титрованного раствора хлорида ба
312
рия добавляют к анализируемому раствору и избыток Ва обратно титруют раствором ЭДТА. Вследствие того, что этому методу присущи принципиальные недостатки, его изучали и модифицировали многие авторы. С одной стороны, переход окраски при титровании бария не особенно резок и все замечания, относящиеся к определению Ва (см. стр. 177), в этом случае имеют еще большее значение, поскольку титрование Ва проводят в присутствии осадка BaSO4, с другой стороны, принципиальный источник ошибки лежит в самом процессе осаждения сульфата, так как BaSO4 может быть лишь с трудом получен в чистом виде и со стехиометрическим составом. Имеются описания процесса осаждения BaSO4 при гравиметрических определениях, при которых получаются точные значения, что, однако, является результатом компенсации ошибок метода. Однако такой компенсации не происходит при комплексонометрическом определении.
Улучшение перехода окраски в точке эквивалентности было достигнуто путем замены обычно применяемого эриохрома черного Т другими индикаторами. Особенно хороший переход окраски получается с фталеинкомплексоном [53 (1), 58 (117), 60 (101)], при этом целесообразно проводить определение в растворах, содержащих спирт. С помощью спирта подавляется растворение осадка BaSO4 и таким образом уменьшается возможность протекания реакции между осадком и избытком ЭДТА. Фталеинкомплексон выгодно вводить в составе смешанного индикатора. Предлагается примешивать к нему нафтоловый зеленый или раствор, состоящий из 0,1% фталеинкомплексона, 0,005% метилового красного и 0,05% дианилового зеленого [56 (54)]. Следующий смешанный индикатор составлен на основе родизоновой кислоты [59 (83)]: смесь 1 части (по объему) 0,05 %-кого раствора родизоната натрия и 5 частей 0,5%-ного (в 50%-ном спирте) раствора 1-метиламино-4-(п-толиламино)-антрахинона. Однако раствор родизоната неустойчив, и его нужно ежедневно готовить свежим. Драгузин [60 (190)] рекомендует свежеприготовленную суспензию из приблизительно 20 мг родизоната натрия в 2—3 мл воды и нескольких капель 1 %-кого раствора щелочного голубого.
При определении очень малых количеств сульфата Ито и Абе [59 (42)] рекомендуют фотометрическое титрование при длине волны 640 нм с эриохромом черным Т в качестве индикатора. Осадок BaSO4 не отфильтровывают, а поддерживают в суспендированном состоянии постоянным перемешиванием, так что колебания фона при светопоглощении сводятся к минимуму. Боос [59 (108)] обратно титрует избыток Ва потенциометрически с ртутным капельным электродом.
При обратном титровании избытка бария, конечно, титруются совместно с ним все присутствующие в растворе ионы металлов, определяемые комплексонометрически. Чтобы получить содержание сульфата, необходимо либо во второй аликвотной порции раствора определить расход ЭДТА на титрование этих металлов и
313
учесть это при вычислениях [50 (10)] —однако точность определений недостаточна, особенно в случае малого содержания сульфата—.либо выделить осадок. Можно задержать все катионы с по мощью ионита [53 (1), 59 (108)] и сульфат определить в элюате Часто, однако, при этом имеет место нежелательное сильное разбавление раствора. В этих случаях может быть с успехом применена методика, предложенная Белчером с сотр. [54 (1)] и доработанная Джексоном [54 (56)]. Авторы использовали наблюдения Пршибила и др. [52 (13)] о способности BaSO4 растворяться в щелочном растворе ЭДТА. Согласно описанию Белчера, осадок BaSO4 отфильтровывают, промывают и растворяют в определенном объеме аммиачного титрованного раствора ЭДТА. Однако скорость растворения осадка очень мала, поэтому необходимо продолжительное кипячение, при котором убыль испаряющегося аммиака должна непрерывно возмещаться. Эту трудность устранили другие авторы, подщелачивая анализируемый раствор 5%-ным раствором триэтаноламина [59 (51)] или, что еще лучше, едким натром [59 (51), 59 (72)]. Осадок растворяется тогда полностью в достаточном избытке ЭДТА в течение 5—10 мин. В этом методе есть опасность извлечения титрующихся ионов из стенок сосуда. Следует применять тугоплавкое стекло, которое предварительно обрабатывают горячим щелочным раствором ЭДТА или, что еще лучше, кварцевую или платиновую посуду. Применение жаропрочных сосудов из искусственных материалов также позволяет избежать источников этих ошибок.
Другой и по своему значению более выгодный метод определения сульфата основан на осаждении PbSO4, о чем первым сообщает Шнейдер [56 (101)]. Крупнокристаллический сульфат свинца менее склонен к соосаждению и легче получается со стехиометрическим составом, чем сульфат бария. Он без труда растворяется в аммиачном растворе ЭДТА, и свинец можно оттитровать с резким переходом окраски в точке эквивалентности. Таким образом, метод прост и в значительной мере свободен от помех, но и у него есть недостаток — относительно высокая растворимость сульфата свинца. Однако добавка спирта может устранить этот недостаток. Шнайдер проводит определения в 20%-ном этанольном растворе; при pH около 0,6 можно определять сульфат даже в присутствии фосфата. Спорен [58 (104)] применяет изопропиловый спирт. Аш-броок [61 (106)] рекомендует 50%-ный этанол и отстаивание до полного осаждения осадка в течение около 3 ч. Одлер работает с 20%-ным метанольным раствором [61 (52)]; осадок PbSO4 он отфильтровывает, промывает и растворяет в аммиачном растворе ЭДТА, после чего обратно титрует избыток ЭДТА раствором сульфата цинка с эриохромом черным Т [56 (101), 58 (104), 61 (106)]-Можно сэкономить время, затрачиваемое на обратное титрование, если, согласно Одлеру [61 (52)], осадок растворить в растворе ацетата натрия и свинец прямо титровать с ксиленоловым оранжевым-
314
Калья и др. [61 (150)] растворяют PbSC>4 в тартратном растворе и прямо титруют свинец с эриохромом черным Т при pH = 10.
Комплексонометрическое определение сульфат-ионов находит практическое применение в чрезвычайно большом числе случаев, что не удивительно, так как взамен медленного весового метода найден быстрый титриметрический метод определения. Например, содержание сульфата или сецы определяют в водах [50 (10), 57(116)], каменной соли [58 (85)], в щелоках [54 (64)], нефтяных продуктах [56 (12)], цементе [61 (150)], в ваннах для прядения [52 (44)], барите [62 (104)], гипсе [63 (2)], поташе [62 (107)], железе и стали [55 (106), 63 (33)], в угле [57 (93)], в вискозном волокне [56 (79)] и в марганцевых щелочных экстрактах [61 (11)]. Далее, комплексонометрический метод использован для определения SO3 в воздухе [59 (51)] и для контроля реакции сульфирования [61 (140)]. Описаны анализы бинарных смесей сульфата с пероксодисульфатом [61 (27)], сульфидом [61 (179)] или сульфитом [62 (106)]. Особенно многочисленны сообщения об определении серы в органических соединениях [54 (15), 59 (128), 60 (44), 62 (ЮЗ)]. Очень хорошо оправдали себя комплексонометрические методы в комбинации с сожжением вещества по Шенигеру [56 (20), 59 (108), 63 (34)]. Изучено также определение серы, скомбинированное с сожжением в трубке Прегля [59 (66)] и после выщелачивания пробки из серебряной ваты в трубке для сожжения [61 (178)]. Кэрбл и др. [56 (33)] сообщают об определении серы в органических веществах, которое не сопровождается осаждением серы барием или свинцом. Растворяют сульфат марганца, образовавшийся в количестве, эквивалентном по отношению к сере, в трубке для сожжения на наполнителе из перманганата серебра, и Мп11 титруют комплексонометрически.
Косвенное определение сульфата
Реактивы
ЭДТА, 0,01 М раствор.
Хлорид бария, 0,01 М раствор (титры этих растворов установлены один по другому).
Смесь металлфталеина с нафтоловым зеленым.
Аммиак, концентрированный раствор
Едкий натр, приблизительно 1 М раствор.
Этиловый спирт.
Ход определения. Часть анализируемого раствора, содержащего 20—50 мг сульфата, слегка подкисляют и при нагревании к нему по каплям медленно прибавляют взятый в небольшом избытке 0,01 М раствор ВаС12 (каждый миллилитр раствора ВаС12 осаждает около 1 мг сульфата). Реакционную смесь оставляют на некоторое время на водяной бане, чтобы перевести осадок в крупнокристаллическую и нерастворимую форму, затем охлаждают и Нейтрализуют суспензию 1 М раствором NaOH. Объем раствора
315
теперь должен составлять около 100 мл. Вносят 0,3 мл индикатора и 5—10 мл аммиака, и красную суспензию титруют 0,01 Л4 рас. твором ЭДТА до резкого исчезновения красной окраски. После достижения точки эквивалентности добавляют еще небольшой избыток титрованного раствора ЭДТА, так как обратным титрованием в спиртовом растворе точку эквивалентности можно определить еще точнее. Отмечают объем оттитрованного раствора добавляют такой же объем спирта, причем окраска становится зеленоватой, и затем выполняют второе — обратное — титрование 0,01 М раствором ВаС12, конец которого легко отмечают по появлению красной окраски.
Расчет. Берут разность между эквивалентными количествами ВаС12 и ЭДТА и рассчитывают отсюда содержание сульфата.
Замечания. См. замечания, относящиеся к методу титрования бария.
Роданид
Роданид можно определять по методу, описанному для галогенов (см. стр. 319), осаждением в виде серебряной соли и обменной реакцией серебра в отфильтрованном осадке с цианидом никеля. О раздельном определении смесей галогенов с роданид-ионами говорится в разделе о галогенах (стр. 320). Ралея и Сими-нинц [60 (104)] описывают определение 1—6 мг роданида следующим образом. К анализируемому раствору добавляют известный объем титрованного раствора соли меди (0,01 714) и продувают через раствор SO2 в течение нескольких минут. Отфильтровывают выпавший в осадок CuSCN, pH фильтрата доводят до значения 10 и избыток меди обратно титруют с мурексидом (аналогично методу, описанному на стр. 255). Определению мешают иодид-и циа-нид-ионы, но не мешают хлорид и бромид.
52. СЕЛЕН
Определение селена, присутствующего в виде селената, Лиу и Ченг [58 (31)] проводят следующим образом. Селенат осаждают с помощью свинца в 30 %-ном спиртовом растворе с pH = 2—3, фильтруют и осадок промывают. Осадок растворяют в растворе, содержащем аммиак и хлорид аммония (pH = 10), аскорбиновую кислоту и отмеренный объем титрованного раствора ЭДТА. Избыток ЭДТА обратно титруют раствором сульфата марганца с эриохромом черным Т. Селенит можно определить таким же способом, если его предварительно окислить перманганатом калия до селената. Избыток перманганата разрушают перекисью водорода. Не мешают малые количества Cu, Fe, Ni, Со и ТеОГ, но Bi, Hg, SO?- и AsO®- должны отсутствовать.
Элементарный селен можно определять по методу Эрдэя с сотр-[62 (79)]. Селен реагирует с определенным количеством цианида, 316
согласно схеме реакции KCN + Se—> ScCN. По окончании реакции вносят раствор соли никеля с целью определить содержание не вступивших в реакцию цианид-ионов, и избыток ионов Ni оттитровываюг раствором ЭДТА (см. определение цианид-ионов, стр. 282).
53. ФТОР
Косвенное определение фтора, как указывают Белчер и Кларк [53 (14)], возможно путем титрования его раствором соли кальция, фторид-ион осаждают при pH = 4,5 титрованным раствором соли кальция. Осадок CaF2 отфильтровывают и в фильтрате определяют избыток кальция обратным титрованием в присутствии эриохрома черного Т. Как доказано, при титровании чистых растворов кальция с эриохромом черным Т точка эквивалентности получается нерезкой, но может быть улучшена при добавлении незначительного количества MgY2-. Однако авторы не использовали этой возможности. Затруднения и возможные ошибки метода связаны, однако, не с процессом титрования раствором Са, а в большей степени с процессом осаждения. Так как фторид кальция растворяется без особого труда, то для достижения полноты осаждения следует добавлять в значительном избытке хлорид кальция. Это обстоятельство обусловливает при обратном титровании большой расход титранта, что неблагоприятно влияет на воспроизводимость определений. Фторид кальция выделяется медленно, поэтому для полноты осаждения раствор оставляют на несколько часов или лучше на ночь. Вследствие этого осадок получается слизистым. Преимущество этого метода по сравнению с обычным методом титрования раствором соли тория состоит в том, что десятикратный избыток сульфат- и фосфат-ионов не мешает. Контрольные анализы, проведенные автором, показывают, что этот метод дает хорошие результаты при определении от 5 до 65 мг фтора. При определении менее 5 мг фтора получаются заниженные результаты.
Белчер и Кларк не смогли устранить указанное затруднение, когда к анализируемому раствору прибавили спирт, чтобы ускорить осаждение и достигнуть его полноты. В противоположность этому, Окада и Сугюяма [57 (118)] работали с 75%-ными спиртовыми растворами и таким образом определяли микроколичества фторид-иона с точностью около 1 %; осаждение они проводили 2,5 или 5-Ю-3 М раствором соли кальция.
По другому пути косвенного определения фтора пошел Лас-ловски, который комплексонометрическим титрованием определяет свинец в соединении PbCIF. При титровании свинца получается значительно более резкая точка эквивалентности, но затруднение также связано с процессом осаждения. Хотя осадок PbCIF получается мелкокристаллическим, однако он не вполне нерастворим, поэтому и в этом случае требуется избыток осадителя. Условия осаждения, в особенности при определении микроколичеств, следует строго соблюдать, иначе состав осадка не будет соответствовать
317
стехиометрическому соотношению Pb:F = 1 : 1. Метод разработан для определения 0,2—2 мг фтора с точностью около 2—3%. Для достижения полноты осаждения раствор оставляют в покое на 24 ч.
Вшештал с сотр. [58 (46)] модифицировал метод Ласловского в метод обратного титрования избытка свинца в фильтрате. Метод разработан для определения 4—40 мг фтора и полнота осаждения в нем достигается в течение 1 ч.
Метод Белчера и Кларка находит практическое применение при определении фтора в органических соединениях после разложения в бомбе или любым другим обычным способом разложения [57 (129)].
Определение фтора с помощью хлорида свинца
Реактивы
Хлорид свинца, 0,75%-ный раствор (приблизительно 0,03 М). Приготовляют насыщением воды хлоридом свинца при температуре кипения, охлаждением до комнатной температуры, фильтрованием выпавшего осадка и последующим раз бавлением фильтрата водой в количестве одной десятой от объема фильтрата; точное содержание свинца в растворе устанавливают по раствору ЭДТА.
ЭДТА, 0,05 М раствор.
Метиловый оранжевый, 0,1%-ный раствор.
Азотная кислота, разбавленный раствор.
Fdrtifi натр разбавленный раствор.
Тартрат натрия и калия.
byqi^priMii pat чвор, ри = 10, состоящий из хлористого аммония и аммиака. Уротропин, 1 % -ный раствор.
Эриохром черный Т, в смеси с поваренной солью в порошке.
Ход определения. Не более 50—70 мл анализируемого раствора, содержащего от 5 до 40 мг фтора (в виде соли щелочного металла), вносят в мерную колбу емкостью 250 мл. Приливают 2—3 капли метилового оранжевого и добавлением разбавленной азотной кислоты или едкого натра добиваются перехода окраски индикатора. Затем медленно приливают при энергичном перемешивании 150 мл (точно отмеренные) раствора хлорида свинца; при этом pH раствора снижается, поэтому его нейтрализуют 1%-ным раствором уротропина. Через час объем раствора в колбе доводят до метки, энергично взбалтывают и фильтруют через сухой бумажный фильтр с синей полосой. Первые порции фильтрата отбрасывают, из остальной части пипеткой отбирают 150 мл (в случае малого содержания фторида — 100 мл) и переносят в колбу для титрования. Добавляют около 1 г тартрата калия и натрия, 10 мл буферного раствора, немного эриохрома черного Т и титруют раствором ЭДТА до перехода красно-фиолетовой окраски в синюю и исчезновения розового оттенка.
Расчет.
[йМРЬ-ЙМЭДТА^] 18,998 = В
318
где а и Ь, Л4рь и Мэдтл— соответственно, объем (в миллилитрах) и молярность растворов РЬС12 и ЭДТА, А—объем (в миллилитрах) взятого для титрования фильтрата и В — количество фтора (в миллиграммах) .
Замечания. Приведенная выше методика является модификацией метода Вшештала, согласно неопубликованным исследованиям Флашки и Вольфрама. В оригинальной работе Вшештала описывается титрование в растворе, содержащем уротропин, в присутствии пирокатехинового фиолетового или ксиленолового оранжевого. Вследствие незначительной буферной емкости уротропинового раствора, в качестве раствора титранта нужно применять аммиачный раствор ЭДТА с точно установленной кислотностью, трудоемкое определение которой окупается при проведении многочисленных анализов. Вместо предложенного выше титрозанного раствора хлорида свинца можно также применить титрованные растворы ацетата или нитрата свинца; но в этом случае к анализируемому раствору прибавляют на кончике шпателя хлорид натрия и осаждение проводят в теплом растворе. Однако полученные результаты подвержены, по-видимому, более сильным отклонениям. В приведенном выше методе точность определений достигает около 1—2%. Для серийных анализов веществ близкого состава рекомендуется вычислять титр раствора титранта из анализа стандартной пробы. Сульфат в количестве, превышающем 3—4 мг (рассчитанном на сульфат аммония), вызывает заметное завышение результатов.
54. ДРУГИЕ ГАЛОГЕНЫ
Косвенное определение галогенов (за исключением фтора) возможно по методу титрования нитратом серебра [52 (28)], описанному на стр. 258. Галогенид серебра осаждают обычным способом, фильтруют и промывают. Бумажный или простой стеклянный фильтр с осадком вносят прямо в сильноаммиачный раствор цианида никеля, что не мешает титрованию. Превосходные результаты получаются также при определении микроколичеств.
Метод находит применение при определении хлорид-ионов в биологических жидкостях [56 (62)] и галогенов в органических веществах после разложения их по Кариусу [59 (47)] или сожжения в аппарате Шенигера.
Хлорид можно определять, согласно Александровичу [62 (112)], следующим образом. К раствору, содержащему 2—4 мг Cl-ионов в Ю мл, добавляют 20 мл 0,01 М титрованного раствора нитрата Висмута, сначала по каплям, до появления мути. Затем добавляют 100 мл воды и титруют избыток висмута в растворе 0,01 М рас-TjopoM ЭДТА. В качестве индикатора используют пирокатехино-вый фиолетовый или насыщенный спиртовый раствор гематоксилина (0,5 г гематоксилина растворяют в 100 мл горячего этилового спирта и оставляют стоять в течение недели). Al, Ni, Zn, Cu, Mn,
Ca, Mg, Ba, Sr и Fe11 не мешают; Fem маскируют путем восстановления аскорбиновой кислотой. Метод применяют для анализа поваренной соли.
Хлорид-[62 (113)] и бромид-ионы [63(41)] можно также определять, как описывает Гусев и др., титрованием солью свинца 2-(2-Гидрокси-нафтилметиленамино)-пиридин, С1бН14ОЫ2, образует с хлоридом и бромидом в растворе, содержащем РЬ2+-ионы осадки состава RPbX2, где R означает органический лиганд’ X — хлорид или бромид. Отфильтрованный осадок растворяют в азотной кислоте, к раствору добавляют уротропин и титруют с ксиленоловым оранжевым присутствующий в растворе свинец.
В ряде работ Суса описывает применение серебряного метода в сочетании с другими методами для анализа галогенидов и (или) кислородных кислот галогенов. В число соединений, определяемых таким способом, можно включить роданид-ион. Например, при анализе бромид-броматной смеси в одной аликвотной порции осаждают бромид в виде AgBr и после реакции вытеснения с цианидом никеля проводят титрование никеля. Во второй порции восстанавливают бромат, затем проводят осаждение серебром, которое дает сумму бромида и бромата, после чего содержание последнего рассчитывают по разности [60 (26)]. В случае смеси хлорида и иодида в одной аликвотной порции раствора определяют сумму галогенов осаждением серебром и последующим титрованием. Вторую аликвотную порцию обрабатывают при нагревании бихроматом, причем хлорид окисляется до хлора, который испаряется при кипячении. Образовавшийся из иодида иодат восстанавливают, осаждают в виде Agl и определяют 1--ионы. Содержание хлорида получают по разности [60 (22)]. Смесь бромида и иодида анализируют аналогичным образом [60 (24)]. Хлорат и перхлорат восстанавливают хлоридом аммония в аликвотной порции раствора и определяют их сумму. Во второй порции раствора восстанавливают двухвалентным железом лишь хлорат и определяют его содержание [60 (21)]. Тройные смеси, состоящие из хлорид-, цианид-и роданид-ионов, анализируют следующим путем. В одной части анализируемого раствора осаждают все три компонента в виде серебряных солей. Осадок кипятят с азотной кислотой, причем AgCN разрушается, роданид-ион окисляется до сульфата, a AgCl остается без изменений Осадок AgCl отфильтровывают и оттитровывают. В фильтрате по методу, описанному на стр. 315, комплексонометрически определяют сульфат, количество которого эквивалентно содержанию роданида. Во второй порции определяют цианид по методу, описанному на стр. 282, обратным титрованием избытка никеля раствором ЭДТА [61 (29)].
ЛИТЕРАТУРА
А (до 1945)
А (1) Ruggli Р., Zimmermann А., Карр F., Helv., 13, 784 (1930).
А (2) В г i 11 о n Н. Т. S_. D о d d Е. N„ J. Chem. Soe„ 1932, 1940.
А (3) В j е г г u m J., Metal Ammine Formation in Aqueous Solution, Dissertation, Kopenhagen, 1941.
A (4) Leden I., Potentiometrisk Undersokning av nagra Kadmiumsalters Kom-plexitet, Doktordissertation, Lund, 1943.
A (5) Gauguin R., J. Chim. phys., 42, 28 (1945).
A (6) S ch wa r z enb a ch G., Willi A., Die Stabilital der Tironkomplexe von Mg, Ca, Mn, Co, Ni, Cu, Zn, Cd, не опубликовано.
A (7) S ch w ar z enb a c-h G., A n d r e g g G., Die Komplexe der Chromotrop-farbstoffe, не опубликовано.
A (8) Schwarzenbach G., Schnorf P., швейц, пат. 660408; пат. CHIA 2583890, 2583891.
A (9) Brintzinger FL, Hess G.. Z. anorg. Chem., 249, 113 (1942).
A (10) Kathen H„ L a n g K-, Bioch. Z., 318, 308 (1927).
A (11) Gutzeit G„ Helv., 12, 713 (1929).
1945
45 (1) Schwarzenbach G., Kampitsch E., Steiner R., Helv., 28, 828 (1945).
45 (2) Schwarzenbach G., Kampitsch E., Steiner R., Helv., 28, 1133 (1945).
45 (3) Schwarzenbach G., Schw. Chem. Ztg., № 9 (1945).
46
46
(1) Schwarzenbach 364 (1946).
(2) Schwarzenbach 29, 811 (1946).
1946
G., Kampitsch E., Steiner R., Helv., 29,
G., Biedermann W., Bangerter F., Helv.,
1947
47
47
47
47
47
(1) Schwarzenbach G., Willi A., Bach R. O., Helv., 30, 1303 (1947).
(2) Schwa rzenbach G., Ackermann H., Helv., 30, 1798 (1947).
(3) К о 11 h о f f I. M., Stenger V. A., Volumetric Analysis, v. II, New York, 1947, p. 204, 284, 331.
(4) Biedermann W., Dissertation, Ziirich, 1947.
(5) Koi th off I. M., Stenger V. A., Volumetric Analysis, v. II, New York, 1947.
1948
48 (1)
48 (2
48 (3
48 (4)
48 (5)
48 (6)
48 (7)
Schwarzenbach Schwarzenbach Schwarzenbach Schwarzenbach Biedermann W., Schwarzenbach Schwarzenbach
G„ Biedermann W., Helv., 31, 331 (1948)'. G., Biedermann W., Helv., 31, 456 (1948). G„ Biedermann W., Helv., 31, 459 (1948). G., Biedermann W., Helv., 31, 678 (1948). Schwarzenbach G., Chimia, 2, 1 (1948). G., Ackermann H., Helv., 31. 1029 (1948).
G., Komplexon—Methoden, Zofingen, 1948.
321
1949
49 (1) Schwarzenbach G., Hetv., 32, 839 (1949).
49 (2) Ackermann H., S c h w a r z e n b a c h G„ Helv., 32, 1543 (1949).
49 (3) Schwarzenbach G., Ackermann H., Helv., 32, 1682 (1949).
49 (4) Schwarzenbach G., Gysling H., Helv., 32, 1314 (1949).
49 (5) Gysling H, Schwarzenbacn G, Helv., 32, 1484 (1949).
49 (6) Schwarzenbach G., Chimia, 3, 1 (1949).
49 (7) Schwarzenbach G., Ackermann H., Ruckstuhl P., Helv 39
1175 (1949). ” ’
1950
50 (1) Bjerrum J., Chem. Rev., 46, 381 (1950).
50 (2 S c h m i d 1 i n H. U., Studienabschlufiarbeit, Zurich, 1950.
50 (3) Prue J. E, Schwarzenbach. G., Helv., 33, 963 (1950).
50 (4) Betz J. D., Noll C. A., J. Am. Waler Works Assoc., 42, 49 (1950).
50 (5) Marcy V. M„ Power, 94, 105 (1950).
50 (6) Marcy V. M., Power, 94, 92 (1950).
50 (7) Diehl H„ Goetz С. A., H a c h С. C.. J. Am. Water Works Assoc 42
40 (1950).
50 (8) Goetz C. A., Loomis T. C., Diepl H., Anal. Chem., 22, 798 (1950).
50 (9) Mattocks A. M., Hernandez H. R., J. Am. Pharm. Assoc., 39, 519 (1950).
50 (10) Munger J. R., N i p p 1 e r R. W., I n g о 1 s R. S.. Anal. Chem., 22, 1455 (1950).
50 (11) Wilsen A. E„ Anal. Chem., 22, 1571 (1950).
1951
51 (1) Schwarzenbach G., Heller J., Helv., 34, 576 (1951).
51 (2) Schwarzenbach G., F r e i t a g, Helv., 34, 1492 (1951).
51 (3) Schwarzenbach G., Freitag, Helv., 34, 1503 (1951).
51 (4) S c h w a r z e n b a c h G., H e 11 e r J., Helv., 34, 1889 (1951)
51 (5) S c h w a r z e n b a c h G„ W i 11 i A., Helv., 34, 528 (1951).
51 (6) H e 11 e r J., S c h w a r z e n b a c h G., Helv., 34, 1876 (1951)'.
51 (7) Cheng K. L., Bray R. H„ Soil Sci., 72, 449 (1951).
51 (8) M a r t e 11 A., C a 1 v i n M., «Chemistry of the Metal Chelate Compounds», New York, 1951.
51 (9) Buckley E. S., jr., Gibson J. G., В a r t о 1 о 11 i T. R., J. Lab. Clin., Med., 38, 751 (1951).
51 (10) Landgren O., Svenk Farm. Tidskr., 55, 578 (1951).
51 (11) Griffenhagen G. B., Pfisterer J. L., Sloth S. K-, J. Am. Pharm. Assoc., 40, 359 (1951).
51 (12) Davies C. W., J. Chem. Soc., 1951, 1256.
51 (13) Sobel A. E„ Hanok A., Proc. Soc. Expt. Biol. Med., 77, 737 (1951).
51 (14) Knight A. G., Chem. Ind., 1951, 1141.
51 (15) Pribil R., Mat у ska B., Coll. Czech. Chem. Comm., 16, 139 (1951).
51 (16) Pribil R., Kondela Z., Maty ska B., Coll. Czech. Chem. Comm., 16, 80 (1951).
51 (17) Greenblatt I. J., Hartman S., Anal. Chem., 23, 1708 (1951).
51 (18) S ch n e i d er F., E m me r i ch A., Zucker Beihefte, 1, 53 (1951).
51 (19) Pribil R., S i m 0 n V., D о 1 e z a 1 J., Coll. Czech. Chem. Comm., 16»
573 (1951).
51 (20) Flaschka H., Schoninger W., Z. anal. Chem., 133, 321 (1951)-
51 (21) Pribil R., Coll. Czech. Chem. Comm., 16, 86 (1951).
1952
52 (1) Landgren O., Svensk Farm. Tidskr., 56, 241 (1952).
52 (2) Holtz A. H., Seekles L„ Nature, 169, 870 (1952).
52 (3) Longford K. L., Electroplating, 5, 41 (1952).
52 (4) Hol P. J., Leendertse G. C., Chem. Weekbl., 48, 181 (1952).
52 (5) Porter J. D., Chem. Anal., 41, 33 (1952).
322
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
52
(6) Kinnunen J„ Mericanto В., Chem. Anal., 41, 76 (1952).
(7) Brooke M Holbrook M., Chem. Anal., 41, 80 (1952).
(8) Botha G. R., Webb M. M„ J. Inst. Water Eng., 6, 459 (1952).
(9) Elliot W. E., J. Biol. Chem., 197, 641 (1952).
(10) De Lorenzi F., Aldrovandi R., Farm. Sci. e Tec. (Pavia), 7, 309 (1952).
(11) В 1 u m e r M., Kolthoff I. M., Experienta, 8, 138 (1952).
(12) Brunisholz G„ Genton M„ Plattner W., Helv., 36, 782 (1952).
(13) Pribil R., Marincova D., Chem. Listy, 46, 542 (1952).
(14) Pribil R., Simon V., Dolezal J., Reductiometric Detection and Determination of Ag, Sbornik Celost. Pracovni Konf. Anal. Chem., Prag, 1952, str. 90.
(15) Smith L. E., Pulp and Paper, 26, 86 (1952).
(16) Nielsen H., Nord. Med., 48, 1059 (1952).
(17) SchwarzenbachG., Anal. chim. acta, 7, 141 (1952).
(18) Ackermann H., Schwarzenbach G., Helv., 35, 485 (1952).
(19) Schwarzenbach G., Anderegg G., Sallmann R., Helv., 35, 1785 (1952).
(20) Heller J, Schwarzenbach G., Helv., 35, 812 (1952).
(21) S ch a w arz enb a ch G., Anderegg G., Helv., 35, 1794 (1952).
(22) Flaschka H., Mikrochem., 39, 38 (1952).
(23) Flaschka H., Holasek A., Mikrochem., 39, 101 (1952).
(24) Flaschka H., Mikrochem., 39, 315 (1952).
(25) Flaschka H., Mikrochem., 39, 391 (1952).
(26) . Flaschka H., Mikrochem., 40, 21 (1952).
(27) Flaschka H., Mikrochem., 40, 42 (1952).
(28) Flaschka H., Huditz F., Z. anal. Chem., 137, 104 (1952).
(29) Flaschka H., Huditz F„ Z. anal. Chem., 137, 172 (1952).
(30) Flaschka H., Huditz F. Radex Rundschau, 1952, 181; 1954, 21.
(31) Huditz F., Flaschka H., Petzold I., Z. anal. Chem., 135, 333 (1952).
(32) Huditz F., Flaschka H., Z. anal. Chem., 136, 185 (1952).
(33) Holasek A., Flaschka H., Z. phisiol. Chem., 290, 57 (1952).
(34) Flaschka H., Holasek A., Z. physiol. Chem., 289, 279 (1952).
(35) Flaschka H., Fette und Seifen, 54, 267 (1952).
(36) Pribil R., V i c e n i v a E., Chem. Listy, 46, 535 (1952).
(37) Debney E. W., Nature (London), 169, 1104 (1952).
(38) Kydd P. H., J. Am. Chem. Soc., 74, 5536 (1952).
(39) Banks J., Analyst, 77, 484 (1952).
(40) Mason A. S., Analyst, 77, 529 (1952).
(41) Cabell M. J., Analyst, 77, 859 (1952).
(42) Harris W. F., Sweet T. R., Anal. Chem., 24, 1062 (1952).
(43) Banewitz J. J., Kenner C. F., Anal. Chem., 24, 1186 (1952).
(44) Ueno K., Anal. Chem., 24, 1363 (1952).
(45) Shead A. C., Anal. Chem., 24, 1451 (1952).
(46) Cheng K. L., Kurtz T., Anal. Chem., 24, 1640 (1952).
(47) Diskant E. M., Anal. Chem., 24, 1856 (1952).
(48) Knie K., Osterr. Wasserwirtschaft, 4, 13 (1952).
(49) Manns Th. J., R e s c h о w s к у M. U., C e r t a A. J., Anal. Chem., 24, 908 (1952).
(50) Schwarzenbach G., Helv., 35, 2344 (1952).
1953
53
53
53
53
53
(1) Anderegg G„ Flaschka H., Sallmann R., Schwarzen'-bach G„ Helv., 37, 113 (1953).
(2) SchwarzenbachG., Moser P., Helv., 36, 581 (1953).
(3) Schwarzenbach G., Sander a, Helv., 36, 1089 (1953).
(4) Wheelwright E. J., Sped ding F. H., Schwarzenbach G., J. Am. Chem. Soc., 75, 4196 (1953).
(51 Brunisholz G., Genton M., Plattner E., Helv., 36, 782 (1953).
323
53 (6) Faller E. F„ Z. anal. Chem, 139, 15 (1953).
53 (7) Bionda G., Atti Acad. Sci. Torino, 88, 195 (1953).
53 (8) Bionda G., Atti Acad. Sci. Torino, 88, 384 (1953—1954).
53 (9) ter H a a r K-, Bazen J., Anal. chim. acta, 9, 235 (1953).
53 (10) Pfibil R„ Coll Czech. Chem. Comm., 18, 783 (1953).
53 (11) Pfibil R., Coll. Czech. Chem. Comm., 19, 58 (1954); Chem. Listy 47 1333 (1953).
53 (12) Pfibil R., C i h a 1 i к J., Dolezal J., S i m о n V., Zyka J., Czech Farm., 2, 38 (1953); Czech. Farm., 2, 75 (1953); Czech. Farm., 2, 113 (1953)-Czech. Farm., 2, 147 (1953); Czech. Farm., 2, 184 (1953); Czech. Farm 2 223 (1953).
53 (13) P r i b i 1 R., C i h a 1 i к J., D о 1 e z a 1 J., S i m о n V., Z у к a J., Pharma-zie, 8, 561 (1953).
53 (14) В e 1 c he r R, Clark S J., Anal. Chim. Acta, 8, 222 (19531.
53 (15) Bell R. P., George J. H. B., Trans. Farad. Soc., 49, 619 (1953).
53 (16) Bovalini E., Casini A., Ann. chim. (Roma), 43, 287 (1963).
53 (17) Boulanger F., Chim. analyt., 35, 253 (1953).
53 (18) Ly der sen D., Gjems O., Z. anal. Chem., 138, 249 (1953).
53 (19) Fritz J. J., Ford J. J., Anal. Chem., 25, 1640 (1953).
53 (20) Gronquist К- E., Farm. Rev., 52, 305 (1953).
53 (21) Flaschka H., Mikrochim. acta, 1953, 226.
53 (22) Flaschka H, ter Haar ft., Bazen J., Mikrochim. acta, 1953, 345.
53 (23) Flaschka H., Mikrochim. acta, 1953, 410.
53 (24) Flaschka EL, Amin A. M., Mikrochim. acta, 1953, 414.
53 (25) Flaschka H., Chem. Anal., 42, 56 (1953).
53 (26) Flaschka EL, Chem. Anal., 42, 84 (1953).
53 (27) Flaschka FI., Z. anal. Chem., 138, 332 (1953).
53 (28) Flaschka EL, Amin A. M., Z. anal. Chem., 140, 6 (1953).
53 (29) Strafford N., Analyst, 78, 733 (1953).
53 (30) Wi 11 i a m s R. J. P., Analyst, 78, 586 (1953).
53 (31) De Sousa A., Anal. chim. acta, 9, 305 (1953).
53 (32) Koros E„ Mag. Kern. Fol., 59, 317 (1953).
53 (33) BrownE. G., HayesT. J., Anal. chim. acta, 9, 1 (1953).
53 (34) Brown E. G., Hayes T. J., Anal. chim. acta, 9, 6 (1953)'.
53 (35) Brown E. G., Hayes T. J., Anal. chim. acta, 9, 408 (1953).
53 (36) Erdey L., Bo dor A., Z. anal. Chem., 137, 410 (1953).
53 (37) Sweetser P. B., Bricker С. E., Anal. Chem., 25, 253 (1953).
53 (38) Patrovsky V., Chem. Listy, 47, 1338 (1953).
53 (39) Underwood A. L., Anal. Chem., 25, 1910 (1953).
53 (40) Kinnunen J., Wennerstrand B., Chem. Anal., 42, 80 (1953)'.
53 (41) Kinnunen J., Wennerstrand B., Chem. Anal., 42, 30 (1953).
53 (42) С т io н к e л ь T. Б., Я к и м е ц Е. М., С а в и н о в с к и й Д. А., ЖАК 8, 163 (1953).
53 (43) S a j о I., Mag. Kem. Fol., 59, 319 (1953).
53 (44) Sa jo I., Rep as P., Kohaszati Lapok, 8, 225 (1953).
53 (45) Ringbom A., Sand as P. E., Finska Kemist Medd, 1953, 14.
53 (46) Ringbom A., Linko E., Anal. chim. acta, 9, 80 (1953).
53 (47) Sergeant J. C., Metallurgia, 48, 261 (1953).
53 (48) Pickles D., Washbrook С. C., Analyst, 78, 304 (1953).
53 (49) G r ti n w a 1 d A., Erdol und Kohle, 6, 550 (1953).
53 (50) Nebbia L., Guerrini F., Chim. e ind., 35, 896 (1953).
53 (51) Got fart J., Michel G.h, Duyckaerts G., Anal. chim. acta, 9,
184 (1953).
53 (52) Graue G., Zohler A., Angew. Chem., 65, 532 (1953).
53 (53) Weitzel G., Fretzdorff A. M., Strecker F. J., Roester U., Z. physiol. Chem., 293, 190 (1953).
53 (54) Jenness R., Anal. Chem., 25, 966 (1953).
53 (55) Jonckers M. D. E., Chim. analyt., 5, 101 (1953). . .
53 (56) H i 11 e b r a n d G. E. F., В r i g . t H. A., Hoffman J. J., Applied Inorganic Analysis, 2nd ed., N. Y., 1953.
324
53 (57) R i n g о о m A., Komplexbildningreaktioner som bas for kemisk analys, Nord. Kjemikermote, 8. Meeting, Oslo, 1953, p. 96.
53 (58) Schwarzenbach G., Fla'schka H., Komplexonmethoden, Zofin-gen, 1953.
53 (59) Bell R. P., George J. H. B., Trans. Farad. Soc., 49, 619 (1953).
53 (60) de Sousa A., Anal. chim. acta, 9, 309 (1953).
53 (61) Cheng K. L„ Bray R. H., Kurtz T., Anal. Chem., 25, 347 (1953).
53 (62) Flaschka H., Mell. Textilber., 34, 1059 (1953).
1954
54 (1) Belcher R., Gibbons D., West Г. S., Chem. and Ind., 1954, 127, 850; Analyst, Sv, 751 (1955).
54 (2) В la e del W. J., Knight H. T., Anal Chem., 26, 743 (1954).
54 (3) В la e del W. J., Knight H. T., Anal. Chem., 26, 741 (1954).
54 (4) v a n A s p e r e n К., E s c h J., Nature, 174, 927 (1954).
54 (5) Gehrke Ch. W., Aff sprung H. E., Lee Y. C., Anal. Chem., 26, 1944
(1954).
54 (6) Cheng K. L., Anal. Chem., 26, 1977 (1954).
54 (7) Bultasova H., Horakova E., Chem. Listy, 48, 1698 (1954).
54 (8) C a mb e 11 D. N., К e n n e г С. T., Anal. Chem., 26, 560 (1954).
54 (9) Carini F. F., Martell A. E., J. Am. Chem. Soc., 76, 2153 (1954}.
54 (10) Chalmers R. A.. Analyst, 49, 519 (1954).
54 (11) Longford K. L., Electronlating, 7, 46 (1954/.
54 (12) M a 1 m s t a d t H. V., Gohrbrandt E. C., Anal. Chem., 26, 442 (1954).
54 (13) Martell A. E., Chaberek St., Anal. Chem., 26, 1692 (1954).
54 (14) Sweetser P. B., Bricker С. E., Anal. Chem., 26, 195 (1954).
54 (15) T e 11 w e i 1 e r T., P i 1 z W., Naturwiss., 41, 332 (1954)
54 (16) Vo dak Z., Lemin ger O., Coll. Czech. Chem. Comm., 19, 925 (1954); Chem. Listy, 48, 552 (1954).
54 (17) ter Haar K-, В a z e n J., Anal. chim. acta, 10, 23 (1954).
54 (18) Suzuki S., J. Chem. Soc. Japan, Pure Chem. Sec., 75, 962 (1954).
54 (19) Poulie N. J., Chem. Weekbl., 50, 698 (1954).
54 (20) C lu ley H. J., Analyst, 79, 567 (1954).
54 (21) Christianson G., Jenness R., Coulter S. T., Anal. Chem., 26, 1923 (1954).
54 (22) A d a m s R. N„ Anal. Chem., 26, 1933 (1954).
54 (23) Arikawa Y., Kato T., Technol. Rep. Tohoku Univ., 19, 104 (1954).
54 (24) Mahr C., Otterbein H., Metalloberflache, 8B, 117 (1954).
54 (25) Collier R. E., Chem. Anal., 43, 41 (1954).
54 (26) Haber li E., Experientia, 10, 34 (1954).
54 (27) Schwarzenbach G., Gut R., Anderegg G., Helv., 37, 937 (1954).
54 (28) Schwarzenbach G., Anderegg G., Helv., 40, 1773 (1954).
54 (29) Michel G., Anal. chim. acta, 10, 87 (1954).
54 (30) Faber J. S„ Pharm. Weekbl., 89, 705 (1954).
54 (31) Milner O. J., Ship man G. F., Anal. Chem., 26, 1222 (1954).
54 (32) H a 11 J. L., G i b s о n jr. J. A., W i 1 к i n s о n P. R., P h i 11 i p s H. 0., Anal. Chem., 26, 1484 (1954).
54 (33) Brunisholz G., Helv., 37, 1546 (1954).
54 (34) Bond R. D., Tucker В. M., Chem. and Ind., 1954, 1236.
54 (35) Moser J. H., Williams M. B., Anal. Chem., 26, 1167 (1954).
54 (36) M u r a c a R. F., R e i t z M. T., Chem. Anal., 43, 73 (1954).
54 (37) Sijderius R., Anal. chim. acta, 10, 517 (1954).
54 (38) Kinnunen J., Wennerstrand B., Chem. Anal., 43, 34 (t954).
54 (39) Kinnunen J., Mericanto B., Chem. Anal., 43, 93 (1954).
54 (40) de Sousa A., Anal. chim. acta, 11, 221 (1954).
54(41) Sa jo L, Mag. Kern. Fol., 60, 268 (1954).
54 (42) Sa jo L, Mag. Kern. Fol., 60, 331 (1954).
325
54 (43) F о г t u i n J. M. H., К a r s t e n P., К i e s H. L., Anal. chim. acta 10 356 (1954).
54 (44) Fritz J. S., Anal. Chem., 26, 1978 (1954).
54 (45) Fritz J. S„ Fulda M. O., Anal. Chem., 26, 1206 (1954).
54 (46) Fritz J. S., Fulda M. O., Margerum S. L., Anal. chim. acta ю 513 (1954).
54 (47) Hara R., West P. W., Anal. chim. acta, 11, 264 (1954).
54 (48) Quentin E., Z. Lebensmittelunters., 99, 85 (1954).
54 (49) Harris W. F., Sweet T. R., Anal. Chem., 26, 1648 (1954); H arris W. F., S we et T. R., Anal. Chem., 26, 1649 (1954).
54 (50) Underwood A. L., J. Chem. Educ., 31, 394 (1954).
54 (51) Underwood A. L., Anal. Chem., 26, 1322 (1954).
54 (52) Leftin J. P„ Metal Finishing, 52, 74 (1954).
54 (53) Kenny A. D., T о v e r u d S. U., Anal. Chem., 26, 1059 (1954).
54 (54) Holt R., Analyst, 79, 623 (1954).
54 (55) Irving H., Williams R. J. P., F e r r e 11 D. J., Williams A. E J. Chem. Soc., 1954, 3494.
54 (56) Jackson P. J., Chem. and Ind., 1954, 435.
54 (57) Brown E. G., Hayes T. J., Analyst, 79, 220 (1954).
54 (58) Brown E. G., Metallurgia, 49, 101, 151 (1954).
54 (59) Flaschka H., Amin A. M., Z a к i M. R., Chem. Anal., 43, 67 (1954).
54 (60) Flaschka H., Microchim. acta, 1954, 361.
54 (61) F 1 a s c h к a H., A b d i n e H., Mikrichim. acta, 1954, 657.
54 (62) Flaschka H., Piischel R., Z. anal. Chem., 143, 330 (1954).
54 (63) Charles R. G., J. Am. Chem. Soc., 76, 5854 (1954).
54 (64) H ol P. J., Chem. Weekblad, 50, 21 (1954).
54 (65) Vikery R. C„ J. Chem. Soc., 1954, 1181.
54 (66) Kinnunen J., Merikanto B., Chem. Anal., 43, 13 (1954).
54 (67) Kinnunen J., Wennerstrand B., Metallurgia, 50, 149 (1954).
54 "(68) Laszlovsky J., Mag. Kem. Fol., 60, 209 (1954).
54 (69) Ringbom A., Svensk Kem. Tidskr., 66, 159 (1954).
54 (70) Ringbom A., Wanninen E., Anal. chim. acta, 11, 153 (1954)
54 (71) С а в и н о в с к и й Д. А., С т ю н к е л ь Т. Б., Я к и м е ц Е. М., Электрические станции, 25, 49 (1954).
54 (72) Agren A., Acta chem. scand., 8, 266 (1954).
54 (73) Pribil R., Komplexometrie, Broschiire der Chemapol, Prag, 1954
54 (74) Pribil R., Coll. Czech. Chem. Comm., 19, 64 (1954).
54 (75) M a 1 a t M., S u k V., R у b a O., Chem. Listy, 48, 203 (1954); Coll. Czech. Chem. Comm., 19, 258 (1954).
54 (76) Pribil R., Coll. Czech. Chem. Comm., 19, 465 (1954); Chem. Listy, 48, 382 (1954).
54 (77) Suk V., Malat M., Ryba O., Coll. Czech. Chem. Comm., 19, 679 (1954); Chem. Listy, 48, 533 (1954).
-f>4 (78) Malat M., Suk V., Jenickova A., Coll. Czech. Chem. Comm., 19, 1156 (1954); Chem. Listy, 48, 663 (1954).
54 (79) Pribil R., Roubal Z., Coll. Czech. Chem. Comm., 19, 1162 (1954); Chem. Listy, 48, 818 (1954).
54 (80) Pfibil R., Coll. Czech. Chem. Comm., 19, 1171 (1954)'; Chem. Listy, 48, 825 (1954).
54 (81) Suk V., Malat M., Jenicl<oya A., Coll. Czech. Chem. Comm., 20, 158 (1955); Chem. Listy, 48, 1511 (1954).
54 (82) Pribil R., C i h a 1 i k J., D о 1 e z a 1 J., S i m о n V., Z у k a J., Czech. Farm., 3, 84 (1954); Czech. Farm., 3, 242 (1954).
54 (83) Schmitz B., Dtsch. Apoth. Ztg., 94, 532 (1954).
54 (84) Seris G., Ann. Falsif., 47, 29 (1954).
54 (85) Zimmer P„ Herzog K., Pharmazie, 9, 628 (1954).
54 (86) Seavo V., Boll. Lab. Chim. Provinziali (Bologna), 5, 65 (1954).
54 (87) Scavo V., Boll. Lab. Chim. Provincial! (Bologna), 5, 63 (1954).
54 (88) Laitinen H. A., Sympson R. F., Anal. Chem., 26, 556 (1954)
326
54 (89) Sergeant J. C., Metallurgia, 50,252 (1954).
54 (90) Rush R. M„ Yoe J. H„ Anal. Chem., 26, 1345 (1954).
54 (91) M i 1 n e r G. W. C., Wood he ad J. L., Analyst, 79, 363 (1954).
54 (92) Milner G. W. C., Phen nah P. J., Analyst, 79, 475 (1954).
54 (93) Potterat M„ Eschmann H., Mitt. Lebensm. Hyg. (Bern), 45, 312 (1954).
54 (94) В a 11 e z о H., Doppler G., Mikrochim. acta, 1954, 403.
54 (95) MacNevin W. M., Kriege О. H., Anal. Chem., 26, 1768 (1954).
54 (96) Peczok R. L., Maverick E. F., J. Am. Chem. Soc., 76, 358 (1954).
54 (97) Burtner D. C„ Diss. Abstr., 14, 755 (1954).
54 (98) Pokorny J PribylJ., Chem. Zvest-i, 8, 329 (19a4).
54 (99) F u r b у E., Determination of Th in U-Alloys, A. E. R. Establ (Great Britain), Report C/R, 1435 (1954).
54 (100) Kinnunen J., Wennerstrand B., Chem. Anal., 43, 65 (1954).
54 (101) Kinnunen J., Wennerstrand B., Chem. Anal., 43, 88 (1954).
54 (102) Harris W. F„ Sweet T. R., Anal. Chem., 26, 1649 (1954).
54 (103) Suzuki S., J. Chem. Soc. Japan. Pure Chem. Sec., 75, 96 (1954).
54 (104) ter Haar К., В a z e n J., Anal. chim. acta, 10, 108 (1954).
1955
55 (1) Kinnunen J., Mericanto B., Chem. Anal., 44, 11 (1955).
55 (2) К i n n u n e n J., M e r i c a n t о B., Chem. Anal., 44, 50 (1955).
55 (3) Kinnunen J., Mericanto B., Chem., Anal., 44, 75 (1955).
55 (4) Kinnunen J., Wennerstrand B., Chem. Anal., 44, 33 (1955).
55 (5) LacourtA., HeyndrickxP., Mikrochim. acta, 1955, 61.
55(6) S a r § u-n 6 v a M., C i c m a n с о v a, Czech. Farm., 4, 187 (1955).
55 (7) В e r t s c h i n g e r J. P., Schw. Apoth. Ztg., 93, 410 (1955).
55 (8) Taylor M. P., Analyst, 80, 153 (1955).
55 (9) Hamm R., Biochem. Z., 327, 149 (1955); Mikrochim. acta, 1956, 268.
55 (10) Siggia S., Eichlin D. W., Rheinhart R. C., Anal. Chem., 27, 1745 J55).
55 (11) Kato T., Hagiwara Z., Shinozawa S., Tsukada S., Technol. Rep.. Tohoku Univ., 19, 93 (1954); Japan Analyst, 4, 84 (1955).
55 (12) Karsten P., К i e s H. L., v a n Engelen H.. Th., J., de Hoog P., Anal. chim. acta, 12, 64 (1955).
55 (13) Kivalo P., Anal. Chem., 27, 1809 (1955).
55 (14) Potterat M., Int. Fachschr. Schokolade Ind., 10, 1 (1955).
55 (15) Wehber P., Mikrochim. acta, 1955, 911.
55 (16) Wehber P., Mikrochim. acta, 1955, 812.
55 (17) Wehber P., Mikrochim. acta, 1955, 927.
55 (18) Cheng K. L., Bray R. H., Anal. Chem., 27, 782 (1955).
55 (19) Cheng K- L„ Anal. Chem., 27, 1582 (1955).
55 (20) Cheng K. L., Williams jr. T. R., Chem. Anal., 44, 96 (1955).
55 (21) Barcza L, Acta Pharm. H_ngar., 25, 102 (1955).
55 (22) Isagai K-, Tateshita N., Japan Analyst, 4, 222 (1955).
55 (23) Hoshikawa G., Japan Analyst, 4, 582 (1955).
55 (24) Tucker В. M., J. Austral. Inst. Agr. Sci., 21, 100 (1955).
55 (25) Verma M. R., Bhuchar V. M., T h e r a 11 i 1 K- L„ Sharma S. S., J. Sci. Ind. Res., 14, 192 (1955).
55 (26) Theis M., Z. anal. Chem., 144, 106 (1955).
55 (27) Theis M„ Z. anal. Chem., 144, 275 (1955).
55 (28) Macek K., Pfibil R., Coll. Czech. Chem. Comm., 20, 715 (1955).
55 (29) Theis M., Musi 1 A., Z. anal. Chem., 144, 351 (1955).
55 (30) Musil A., Theis M., Z. anal. Chem., 144, 427 (1955).
55 (31) Theis M., Radex-Rundschau, 1955, 333.
55 (32) Поляк Л. Я., Зав. лаб., 21, 1300 (1955).
55 (33) Mi na mi E., Sato G., Japan Analyst, 4, 579 (1955).
55 (34) Pinkston J. L., Kenner С. T., Anal. Chem., 27, 446 (1955).
55 (35) Pokorny J., Pfibil J., Chem. Zvesti, 9, 20 (1955).
327
55 (36) Dolezal J., P a t г о v s к у V., S u 1 с e к Z., Svasta J., Chem Listv 49, 1517 (1955). y'
55 (37) Budesinsky B., Czech. Farm., 4, 71 (1955).
55 (38) Budesinsky B., Czech. Farm., 4, 185 (1955).
55 (39) Budgsinsky B., Czech. Farm., 4, 221 (1955).
55 (40) BudeSinsky B„ Pharmazie, 10,597 (1955).
55 (41) Hara R., West P. W., Anal. chim. acta, 12, 72 (1955).
55 (42) Hara R., West P. W., Anal. chim. acta, 12, 285 (1955).
55 (43) Hara R., W e s t P. W., Anal. chim. acta, 13, 189 (1955).
55 (44) Swann M. H., Adams M. L., Anal. Chem., 27, 2005 (1955).
55 (45) Green H., J. Brit. Cast Iron Res., 6, 20 (1955).
55 (46) Jankovists L., Erdey L., Acta Chim. Hungar., 7, 155 (1955).
55 (47) Love S. K-, Thatcher L. L., Anal. Chem., 27, 680 (1955).
55 (48) Groebel W., Schneider E., Z. anal. Chem., 146, 191 (1955).
55 (49) Diggins F, W., Analyst, 80, 401 (1955).
55 (50) Davis I., Hopkinson G., Analyst, 81, 551 (1955).
55 (51) Чернихов Ю. А., Добкина Б. M., Херсонская Л. M, Зав лаб., 21, 638 (1955).
55 (52) C a m p e n W. A. C., N i j s t L. J. H., N e i s P. J., Chem. Weekbl., 51 945 (1955).
55 (53) E 1 d j a r n L., Nygaard O., S v e i n s s о n S. L., Stand. J. Clin. Lab. Invest., 7, 92 (1955).
55 (54) Doering H., Das Papier, 9, 58 (1955).
55 (55) Abbott D. D., R e b e r L. A., J. Am. Pharm. Assoc. Sci. Ed., 44, 287 (1955)
55 (56) Chapman D., J. Chem. Soc., 1955, 1766.
55 (57) Gerlach K., Angew. Chem., 67, 178 (1955)
55 (58) Collier R. E., Chem. and Ind., 1955, 587.
55 (59) MacNevin W. M., Kriege О. H., Anal. Chem., 27, 535 (1955).
55 (60) MacNevin W. M., Kriege О. H., J. Am. Chem. Soc., 77, 6149 (1955).
55 (61) Butt L. T„ Strafford N., Anal. chim. acta, 12, 124 (1955).
55 (62) Flaschka H., Abdine H., Chem. Anal., 44, 8 (1955).
55 (63) Flaschka H., A b d i n e H., Chem. Anal., 44, 30 (1955).
55 (64) Flaschka H., Abdine H., Mikrochim. acta, 1955, 37.
55 (65) Flaschka H., Mikrochim. acta, 1955, 55.
55 (66) Flaschka H., Pfischel R., Z. anal. Chem., 147, 353 (1955).
55 (67RF 1 a s c h k a H., Franschitz W., Z. anal. Chem., 144, 421 (1955)\
55 (68) Flaschka H., Piischel R., Chem. Anal., 44, 71 (1955).
55 (69) Aconsky L., Mori M., Anal. Chem., 27, 1001 (1955).
55 (70) Chiarioni T., Bonati F., L’Attenco Parmese, 26, 40 (1955).
55 (71) Banks С. V., Edwards R. E., Anal. Chem., 27, 947 (1955).
55 (72) Brooks H. E., Johnson C. A., J. Pharm. Pharmacol., 7, 836 (1955).
55 (73) Буданова Л. M., Платонова О. П., Зав. лаб., 21, 1294 (1955).
55 (74) Goetz С. A., Debbrecht F. J., Anal. Chem., 27, 1972 (1955).
55 (75) R е i 11 е у С. N., Scribner W. G., Chronopotentiometric Titrations, Anal Chem., 27, 1210 (1955).
55 (76) A m i n A. M„ Chem. Anal., 44, 17 (1955).
55 (77) Amin A. M., F a r a h M. Y., Chem. Anal., 44, 62 (1955).
55 (78) Amin A. M., Chem. Anal., 44, 66 (1955).
55 (79) Milner G. W. C„ Analyst, 80, 77 (1955).
55 (80) Milner G. W. C., Edwards J. W„ Analyst, 80, 879 (1955).
55 (81) Milner G. W. C., Woodhead J. L., Anal. chim. acta, 12, 127 (1955).
55 (82) Цен ин А. А., Гидрохим. материалы, 23, 165 (1955).
55 (83) Яцимирский К. Б., ЖАХ, 10. 94 (1955).
55 (84) Ritchie J. A., Analyst, 80, 402 (1955).
55 (85) Yо u n g A., Anal. Chem., 27, 418 (1955).
55 (86) Wise W. S., Schmidt N. O., Anal. Chem., 27, 1469 (1955).
55 (87) Shapiro L., Brannock W. W., Anal. Chem., 27, 725 (1955).
55 (88) Adamova E., Zyka J., Czech. Farm., 4, 9 (1955).
328
55 (89) Pfibil R., Coll. Czech. Chem. Comm., 20, 162 (1955); Chem. Listy, 49, 179 (1955).
55 (90) Sir Y., P f i b i 1 R., Coll. Czech. Chem. Comm., 20, 871 (1955).
55 (91) Wiinsch L„ Coll. Czech. Chem. Comm., 20, 1107 (1955); Chem. Listy,
49, 843 (1955).
55 (92) Banerjee G., Z. anal. Chem., 147, 105 (1955).
55 (93) Banerjee G., Z. anal. Chem., 147, 417 (1955).
55 (94) Banergee G., Anal. Chem., 148, 349 (1955).
55 (95) Bond R. D, Chem. and Ind., 1955, 941.
55 (96) S a j о L, Acta chim. Hungar., 6, 233, 243, 251 (1955).
55 (97) Wilhite R. N., Underwood A. L., Anal. Chem. 27, 1334 (1955).
55 (98) Wanninen E., Ringbom A., Anal. chim. acta, 12, 308 (1955).
55 (99) de Sousa A., Anal. chim. acta, 12, 215 (1955).
55 (100) Takamoto S., Japan Analyst, 4, 178 (1955).
55 (101) Takamoto S, J. Chem. Soc. Japan, Pure Chem. Sec., 76, 13-39 (1955).
55 (102) Takamoto S., J. Chem. Soc. Japan, Pure Chem. Sec., 76, 1342 (1955).
55 (103) Takamoto S., J. Chem. Soc. Japan, Pure Chem. Sec., 76, 1344 (1955).
55 (104) Belcher R., Gibbons D., West T. S., Anal. chim. acta, 12, 107
(1955).
55 (105) Belcher R., Gibbons D., West T. S., Anal. chim. acta, 13, 226 (1955).
55 (106) Belcher R., Gibbons D., West T. S., Analyst, 80, 751 (1955).
55 (107) Faber J. S., De Complexometrische Titratiemethode bij het Onderzoek van Geneesmiddelen, Dissertation, Groningen (Holland), 1955.
55 (108) Fritz J. S., Johnson M„ Anal. Chem., 27, 1653 (1955).
55 (109) Niels ch W., Giefer L„ Z. anal. Chem., 142, 323 (1955).
55 (110) A к i у a m a T., Fujiwara M., Okamoto H., Fusaka K-, Bull.
Kyoto Coll. Pharm., 1955, 19.
55 (111) Webster H. L., Robertson A., Analyst, 80, 616 (1955).
55 (112) Nogami H., Nakagowa F., J. Pharm. Soc. Japan, 75, 1289 (1955).
55 (113) Sarsunova M., Cicmancova, Czech Pharm., 4, 187 (1955).
55 (114) Vy dr a F., Pfibil R., Coll. Czech. Chem. Comm., 21, 1147 (1955).
55 (115) Sen Sarma R. N., Sci. and Culture (India), 20, 448 (1955).
55 (116) Leggieri G., Chimica (Mailand), 10, 287 (1955).
55 (117) Nogami H., Nakagowa F., J. Pharm. Soc. Japan, 75, 1289 (1955).
55 (118) SchwarzenbachG., Analyst, 80, 713 (1955).
1956
56 (1) Kovarik M., Moucka M., Z. anal. Chem., 150, 146 (1956).
56 (2) Я к и м е ц Е. М., Чернавина Н. М., Труды Уральского политехнического института, 57, 106 (1956).
56 (3) Жданов А. К., Хадеев В. А., М а крицкая Е. К., Зав. лаб., 22, 1286 (1966).
56 (4) Zak В., Hindman W. Н., В a gin ski Е. S., Anal. Chem., 28, 1661 (1956).
56 (5) Т er Н а а г К., В a z е n J., Anal. chim. acta, 14, 209 (1956).
56 (6) Кабанов Б. II., Поляк Л. Я., ЖАХ, 11, 678 (1956).
56 (7) Reichert R., Z. anal. Chem., 150, 250 (1956), Giefierei, 44, 51 (1957).
56 (8) La court A., Heyndrickx P., Mikrochim. acta, 1956, 1621; 1956,
1685.
56 (9) S j 6 s t г о m E., R i 11 n e г W., Z. anal. Chem., 153, 321 (1956).
56 (10) Rowley K., S t о e n n e r R. W., Gordon L., Anal. Chem., 28, 136 (1956).
56 (11) Specht F., Z. anal. Chem., 149, 85 (1956).
56 (12) Hinsvark O. N., O’Hara F. J., Anal. Chem., 28, 919 (1956).
56 (13) В л а д и м и p о в а В. M., Зав. лаб., 22, 529 (1956).
56 (14) Zak В., Hindman W. Н., В a gin ski Е. S., Anal. Chem., 28, 1661 (1956).
56 (15) Treindl L., Coll. Czech. Chem. Comm., 21, 1300 (1956);
56 (16) Сочеванова M. M., ЖАХ, 11, 219 (1956).
22 Зак. 553
329
56 (17) Kaneniwa N., J. Pharm. Soc. Japan, 76, 136 (1956).
56 (18) Irifani N„ Tanaka T., Sakai E., J. Pharm. Soc. Japan, 76, 10RR (1956).
56 (19) Kato T., Hogiwara Z., Sasaki I., Technol. Rep. Tohoku Univ 21, 15 (1956).
56 (20) S ch a ni ger W., Mikrochim. acta, 1956, 869.
56 (21) Гуревич А. Б., К а л и н a - Ж и х а р е в а В. И., Труды научно-технического общества Министерства черной металлургии УССР, 4, 127 (1956).
56 (22) N i kelly J G., С о о k е W. D., Anal. Chem., 28, 243 (1956).
56 (23) Phillipp В, Ноуте H„ Faserf. und Textilt, 7, 525 (1956).
56 (34) BudeSinsky B., Vanickova E., Czech. Farm., 5, 77 (1956).
56 (35) Budesinsky B., Vanickova E., Czech. Farm., 5, 277 (1956).
56 (36) BudeSinsky B., Czech. Farm., 5, 579 (1956).
56 (27) Rao G. G., Rao V. N., Somidevamma G., Z. anal. Chem., 152 346 (1956).
56 (28) Paul R. M., Biochem. J., 62, 38 (1956).
56 (29) Paulsen A., Medd. Norsk. Farm. Selskap, 18, 139 (1956).
56 (30) Peczok R. L. Sawyer D. T., J. Am. Chem. Soc., 78, 5496 (1956).
56 (31) Mali nek M., Rehak B., Coll. Czech. Chem. Comm., 21, 777 (1956).
56 (32) Budesinsky B., Coll. Czech. Chem. Comm., 21, 146 (1956).
56 (33) К or bl J., Pribil R., Coll. Czech. Chem. Comm., 21, 322 (1956).
56 (34) Budesinsky B., Vanickova E., Czech. Farm., 5, 77 (1956).
56 (35) BudeSinsky B., Vanickova E., Czech. Farm., 5, 277 (1956).
56 (36) Budesinsky B., Czech. Farm., 5, 579 (1956).
56 (37) R у b а О., C i f k a J., M a 1 a t M., Suk V., Coll. Czech. Chem. Comm., 21, 349 (1956).
56 (38) C i f k a J., R у b a O., S u k V., M a 1 a t M., Chem. Listy, 50, 888 (1956).
56 (39) Korbl J., Pribil R„ Chem. Anal., 45, 102 (1956); 46, 28 (1957).
56 (40) Mai at M., Pelican J., Suk V., Chem. Anal., 45, 61 (1956).
56 (41) Malat M., Suk V., Chem. Anal., 45, 30 (1956).
56 (42) Flaschka H., Sadek F., Z. anal. Chem., 149, 345 (1956).
56 (43) Flaschka H., A b d i n e H., Chem. Anal., 45, 2 (1956).
56 (44) Flaschka H., A b d i n e H., Chem. Anal., 45, 58 (1956).
56 (45) Flaschka H., Ab dine H., Z. anal. Chem., 152, 77 (19b6)
56 (46) Flaschka H., A b d i n e H„ Mikrochim. acta, 1956, 770.
56 (47) Flaschka EL, POschel R., Z. anal. Chem., 149, 185 (1956)'.
56 (48) Lheureux M., Henry S., H a n i s e t P., Ind. chim. beige, 21, 695 (1956).
56 (49) Черкашина T. В., Зав. лаб., 22, 276 (1956).
56 (50) Morgan L. О., Justus N. L., J. Am. Chem. Soc., 78, 38 (1956).
56 (51) Gutman F. W., Plating, 43, 345 (1956).
56 (52) Mac Nevin W. M., Kreige О. H., Anal. Chem., 28, 16 (1956).
56 (53) Datta S. K., Z. anal. Chem., 149, 328 (1956).
56 (54) McCallum J. R., Canad. J. Chem., 34, 921 (1956).
56 (55) Eschmann H., Brochon R., Chem. Anal., 45, 38 (1956)'.
56 (56) Чернуха Г. H., Гуркина К. М., Зав. лаб., 22, 656 (1956).
56 (57) Conaghan Н. F., N. S. Wales Dept. Mines Tech. Rep., 4, 104 (1956).
56 (58) G h о s h A. К., R а у К. L., Anal. chim. acta, 14, 504 (1956).
56 (59) H a r a R., W e s t P. W., Anal. chim. acta, 14, 280 (1956).
56 (60) Cheng K. L., Lott P. F., Anal. Chem., 28, 462 (1956).
56 (61) Cheng К L., Chem. Anal., 45, 79 (1956).
56 (62) Chmelar V., Chem. Listy, 50, 1326 (1956).
56 (63) Ab dine H., Arzneimittelforschung, 6, 698 (1956).
56 (64) Chew B., Lindley G„ Metallurgia, 53, 45 (1956).
56 (65) А л и м a p и н И. П-, Головина А. П., Г и б а л о И. М., Вестник Московского государственного университета, Сер. мат., мех., астрон., физ. и хим., 1956, 135.
56 (66) А 11 s о р р Н. J., Analyst, 81, 469 (1956).
56 (67) Б е л а в с к а я Ю. И., Зав. лаб., 22, 422 (1956).
330
56 (68) Bo I her К., Schw. med. Wschr., 86, 68 (1956); Labor. Praxis. 10, 5 (1957).
56 (69) Michal J., Jankovsky J., Pavlikova E., Z. anal Chem., 153, 83 (1956).
56 (70) Brauninger H., Mengaring S., Pharmazie, II. 574 (1956).
56 (71) С о h e n A. I., G о r d о n L., Anal. Chem., 28, 1445 (1956).
56 (72) Diehl H., E 11 i n b о e J. L., Anal. Chem., 28, 882 (1956).
56 (73) Ringbom A., Finska Kem. Medd., 65, 82 (1956).
56 (74) Rady G., Erdey L., Z. anal. Chem., 152, 253 (1956).
56 (75) Milner G. W. C., Wood he ad J. L., Analyst, 81, 427 (1956).
56 (76) Schmid R. W., R e i 11 e у C. N., J. Am. Chem. Soc., 78, 2910, 5513
(1956).
56 (77) Re i Iley C. N., Porterfield W. W., Anal. Chem., 28, 443 (1956).
56 (78) R e i 11 e у C. N., Scribner W. G., Temple C., Anal. Chem., 28, 450
(1956).
56 (79) Maurice M. J., Bestimmung von Schwefel in Rayon via Cu, N. V. On-derzoekingsinst. «Research», 1956.
56 (80) Maurice M. J., Chem. Weekbl., 52, 122 (1956).
56 (81; Amin A. A. M„ Chem. Anal., 45, 95 (1956).
56 (82) Sommer L., Kolafik Z., Coll. Czech. Chem. Comm., 21, 1645 (1956).
56 (83) Budesinsky B., Coll. Czech. Chem. Comm., 21, 255 (1956).
56 (84) Cffka J., Malat M., Suk V., Coll. Czech. Chem. Comm., 21, 412 '1956).
56 (85) Suk V., M a I a t M., Jenickova A., Coll. Czech. Chem. Comm., 21, 422 (1956).
56 (86) Sir Z., Pribil R., Coll. Czech. Chem. Comm., 21, 872 (19561.
56 (87) Vydra F., Pribil R., Coll. Czech. Chem. Comm., 21, 1149 (1956).
56 (88) Jenickova A., Suk J., Malat M., Coll. Czech. Chem. Comm., 21, 1257 (1956).
56 (89) Do le za I J., S i r Z., J a n а сeк K-, Coll. Czech. Chem. Comm., 21, 1300 (1956).
56 (90) Jenickova A., Malat M., Suk V., Coll. Czech. Chem. Comm., 21, 1599 (1956).
56 (91) Vo dak Z., Lemin ger O., Chem. Listy, 50, 2028 (1956).
56 (92) V о d a к Z., L e m i n g e r O., Coll. Czech. Chem. Comm., 21, 1522 (1956).
56 (93) Vfestal J., Navir J., Ji lek A., Chem. Zvesti, 10, 188 (1956).
56 (94) Tanaka N., Oiwa I. T., Kodama M., Anal. Chem., 28, 1555 (1956).
56 (95) Brunisholz G., Cahen R., Helv., 39, 324, 2136 (1956).
56 (96) Erdey L., Rady G., Z. anal. Chem., 149, 250 (1956).
56 (97) В a 11 e z о H., Doppler G., Mikrochim. acta, 1956, 734.
56 ( 98) Sa jo L, Mag. Kem. Fol., 62, 37 (1956).
56 (99) Sa jo L, Mag. Kem. Fol., 62, 56 (1956).
56 (100) Sa jo L, Mag. Kem. Fol., 62, 176 (1956).
56 (101) Schneyder J., Mittl. Landw. Bundesanst. Austria, Ser. A, Rebe und Wein, 6, 155 (1956).
56 (102) Faber J. S., Pharm. Tijdschr. Belgie, 33, 25 (1956).
56 (103) Faber J. S., Pharm. Tijdschr. Belgie, 33, 73 (1956).
56 (104) Faber J. S., Pharm. Weekbl., 91, 145 (1956).
56 (105) Faber J. S., Pharm. Weekbl., 91, 177 (1956).
56 (106) Johannsen W., Bobowski E., Webber P., Metallurgia, 10, 211 (1956).
56 (107) WehberP, Z. anal. Chem., 149, 161 (1956).
56 (108) Wehber P., Z. anal. Chem., 149, 241 (1956).
56 (109) Wehber P., Z. anal Chem., 149, 244 (1956).
56 (110) Wehber P„ Z. anal. Chem., 149, 419 (1956).
56 (111) Wehber P., Z. atiai. Chem., 150, 186 (1956).
56 (112) Wehber P., Z. anal. Chem., 153, 249 (1956).
56 (113) Wehber P., Z. anal. Chem., 151, 276 (1956).
56 (114) Wehber P., Z. anal. Chem., 153, 253 (1956),
22’
331
56 (115) Wehber P., Johannsen W., Z. anal. Chem., 195, 324 (1956).
56 (116) В a r n a r d j r A. J., Broad W. C., Flaschka H., Chem. Anal. 45 86, 11 (1956); 46, 18, 46, 76 (1957).
56 (117) Raemaekers R., Coll. Czech. Chem. Comm., 21, 1430 (1956); С. r 238—239 (1954); Ind. chim. beige, 20, 603 (1955).
56 (118) Foley W. T„ Pottie R. F„ Anal. Chem., 28, 1101 (1956).
56 (119) Sjostrom E., Rittner W., Z. anal. Chem., 153, 321 (1956).
56 (120) Doering H„ Papier, 10, 140 (1956).
56 (121) Sarsunova M., Czech. Farm., 7, 196 (1956).
56 (122) Flaschka H., Holasek A., Z. physiol. Chem., 303, 9 (1956).
56 (123) Ferrett D. J., Milner G. W. C., J. Chem. Soc., 1956, 1186; Nature 175, 477 (1955).
56 (124) Schmid R. W., Reilley C. N., Anal. Chem., 28, 520 (1956)
56 (125) Schwarzenbach G., Gut R., Helv., 39, 1589 (1956).
56 (126) Brennecke, Erna, «Oxidations-Reduktions-Indikatoren» in «Neuere Mafianalytische Methoden», Stuttgart, 1956
1957
57 (1) Borchert O., Fertigungstechnik, 7, 389 (1957).
57 (2) Wehber P., Z. anal. Chem., 154, 122 (1957).
57 (3) Wehber P., Z. anal. Chem., 154, 182 (1957).
57 (4) Wehber P., Johannsen W., Z. anal. Chem., 158, 7 (1957).
57 (5) Wehber P., Z. anal. Chem., 158, 10 (1957).
57 (6) Wehber P., Z. anal. Chem., 158, 321 (1957).
57 (7) Ab d - E 1 R a h e e m A. A., Netherl. Milk Dairy J., 11, 122 (1957)'.
57 (8) Sadek F. S., R e i 1 1 e у C. N., Microchem. J., 1, 183 (1957).
57 (9) R e i 11 e у C. N., Sheldon M. V., Chem. Anal., 46, 59 (1957).
57 (10) Schmid R. W„ Reilley C. N., Anal. Chem., 29, 264 (1957).
57 (11) Rao V. N., Rao G. G„ Z. anal. Chem., 155, 334 (1957).
57 (12) Rao G. G, Somidevamma G., Z. anal. Chem., 157, 27 (1957).
57 (13) Ramaiah N. A., Vishnu, Anal. chim. acta, 16, 569 (1957).
57 (14) Ramaiah N. A., Indian Sugar, 7, 1 (1957).
57 (15) Ringbom A., Siitonen S, Skrifvars B., Acta chem. scand., 11, 551 (1957).
57 (16) Weiner R., Ney E., Z. anal. Chem., 157, 105 (1957).
57 (17) Wallraf M., Tonindustr. Ztg. u. Keram. Rdsch., 81, 41 (1957).
57 (18) Wallraf M„ Z. anal. Chem., 156, 332 (1957).
57 (19) Musha S., Munemori M., Ogawa K., Bull. Chem. Soc. Japan, 30, 675 (1957).
57 (20) Musha S., Ogawa K-, J. Chem. Soc. Japan, Pure Chem. Sec, 78, 1686 (1957).
57 (21) Lassner E., Schlesinger H., Z. anal. Chem., 158, 195 (1957).
57 (22) P olein J., Coll. Czech. Chem. Comm., 22, 1057 (1957).
57 (23) Russ J. J., Reeder W., Anal. Chem., 29, 1331 (1957)'.
57 (24) S j о s t e d G., G r i n g a s L., Chem. Anal., 46, 58 (1957).
57 (25) Lane W. J., Fritz J. S„ U. S. A. E. C. Rep., ISC—945 (1957).
57 (26) Поляк Л. Я-, ЖАХ, 12, 224 (1957).
57 (27) Phillipp В., Ноуте H., Faserf. u. Textilt., 8, 34 (1957)
57 ( 28) Пасовская Г. Б., ЖАХ, 12, 523 (1957).
57 (29) Р a t z a k R., Doppler G., Z. anal. Chem., 156, 248 (1957).
57 ( 30) Hara S., К a t i h a r a S., Rep. Sci. Res. Inst., 33, 343 (1957).
57 (31) N e b b i a L., G u e r r i e r i F„ Chim. e ind., 39, 672 (1957)’.
57 (32) Мустафин И. С., Кашковская Е. А., Зав. лаб., 23, 519 (1957).
57 (33) Рейшахрит Л. С., С ухо боков а Н. С., ЖАХ, 12, 146 (1957).
57 (34) Vydra F., Karlik М, Coll. Czech. Chem. Comm., 22, 401 (1957).
57 (35) Vydra F., Karlik M., Coll. Czech. Chem. Comm, 22, 979 (1957).
57 (36) Ashby R. O., Roberts M., J. Lab Clin. Med., 49, 958 (1957).
57 (37) Baron D. N., В e 11 U. L., Clin, chim acta, 2, 327 (1957).
57 (38) F a b e r J. S., J. Am. Pharm. Assoc., 46, 512 (1957).
57 (39) Koros E., Remport-Horvath Z., Chem. Anal., 46, 91 (1957).
332
57 (40) E m i К., T о e i К., М i у a t а Н., J. Chem. Soc. Japan, Pure Chem. Sec., 78, 736 (1957).
57 (41) Emi K., Toei K., Taka mot о S., J. Chem. Soc. Japan, Pure Chem. Sec., 78, 741 (1957).
57 (42) Belcher R., Close R. A., West T. S., Chem. and Ind., 1957 1647.
57 (43) Belcher R., Close R. A., West T. S.. Chem. Anal., 46, 86 (1957)': 47, 2 (1958).
57 (44) GagliardyE., Reimers H„ Mikrochim. acta, 1957, 784.
57 (45) Gabrielson G., Metal Finisching, 1957, 56.
57 (46) Andersch M. A., J. Lab. Clin. Med., 49, 496 (1957).
57 (47) Добрынина О. H., Б о г a p e в а К. Г., Маслоб.-жир. пром-сть, 1957, 40.
57 (48) Castiglioni A., Z. anal. Chem., 156,426 (1957).
57 (49) Det t пег H. W., Metalloberflache, II, 12 (1957).
57 (50) Emi K-, Toei K-, Wada T., J. Chem. Soc. Japan, Pure Chem. Sec., 78, 974 (1957).
57 (51) Datta S. K., Anal. chim. acta, 16, 115 (1957).
57 (r'2) Delga J. et Storck J., Ann. Pharm. Franc., 15, 299 (1957).
57 (53) Bouten J., Verbeck F., Eeckhaut J., Anal. chim. acta, 17, 339 (1957).
57 (54) Carpenter H., Limnol. and Oceanogr., 2, 271 (1957)
57 (55) Budesinsky B., Coll. Czech. Chem. Comm., 2, 230 (1957).
57 (56) Budesinsky B., Vanickova E., Coll. Czech. Chem. Comm., 22, 236 (1957).
57 (57) Budesinsky B., Coll. Czech. Chem. Comm., 22, 1141 (1957).
57 (58) Budesinsky B., Coll. Czech. Chem. Comm,, 22, 1147 (1957).
57 (59) Korbl J., Pribil R., Coll. Czech Chem. Comm., 22, 1122 (1957).
57 (60) Korbl J., Kraus E., J a n i с e к F., Pribil R., Coll. Czech. Chem. Comm., 22, 1416 (1957).
57 (61) Korbl J., Coll. Czech. Chem. Comm., 22, 1789 (1957).
57 (62) Braun К- H-, Chem. Techn., 9, 541 (1957).
57 (63) Brake L. D., McNabb W. M., Hazel J. F., Anal. chim. acta, 17, 314 (1957).
57 (64) Metz C. F„ Anal. Chem., 29, 1748 (1957J.
57 (65) Ueno K-, Anal. Chem., 29, 1668 (1957).
57 (66) Горю шин а В. Г., Романова Е. В., Зав. лаб., 23, 781 (1957).
57 (67) Ек С., Rev. universelie Mines, 13, 249 (1957).
57 (68) Pi Iler i R., Z. anal. Chem., 157, 1 (1957).
57 (69) Greene jr. A., Chem. Anal., 46, 104 (1957).
57 (70) Martens G., Schwarz K-, Z. anal. Chem., 159, 22 (1957).
57 (71) Ma shall J., Geyer L., Bull. Res. Council Israel, 6, 74 (1957).
57 (72) Manoliu C., Revista Chim., 8, 716 (1957).
57 (73) Genge J. A. R., Salmon J. E., Lab. Practice, 6, 695 (1957).
57 ( 74) Duval C., Anal. chim. acta, 16, 545 (1957).
57 (75) Gedansky S. J., Gordon L., Anal. Chem., 29, 566 (1957).
57 (76) Patrovsky V., Huka M., Coll. Czech. Chem. Comm., 21, 37 (1957).
57 (77) Vfestal J., Kotrly S., Coll. Czech. Chem. Comm., 22, 1775 (1957).
57 (78) Vfestal J., Havir J., Coll. Czech. Chem. Comm., 22, 316 (1957).
57 (79) Korbl J., Pfibil R., Emr A., Coll. Czech. Chem. Comm., 22, 961 (1957).
57 (80) Jankovsky J., Coll. Czech. Chem. Comm., 22, 1052 (1957)\
57 (81) Budesinsky B., Coll. Czech. Chem. Comm., 22, 1579 (1957).
57 (82) Kotrly S„ Coll. Czech. Chem. Comm., 22, 1765 (1957)
57 (83) Korbl J., P f i b i 1 R., Coll. Czech. Chem. Comm., 22, 1771 (1957).
57 (84) Lukaszewski G. M., R e d f e r n J. P., Salmon J. E., Lab. Practice 6, 389 (1957).
57 (85) Budesinsky B., Vanickova E., Czech. Farm., 6, 308 (1957).
57 (86) Flaschka H., Holasek A., Rosenthal M., Z. physiol. Chem 308, 183 (1957).
57 (87) Flaschka H., Soli man A., Z. anal. Chem,, 158, 253 (1957).
333
57 (88) Flaschka H., So liman A., Z. anal. Chem., 159, 29 (1957).
57 (89) Flaschka H., Kh ala f alia h S., Z. anal. Chem., 156, 401 (1957).
57 (90) Flaschka H., Barnard A. J., Broad W. C., Chem. Anal., 46, log
(1957); 47, 22, 52, 78, 109 (1958).
57 (91) Flaschka H., Barakat M. F., Z. anal. Chem., 156, 321 (1957).
57 (92) Flaschka H., Sadek F., Z. anal. Chem., 156, 23 (1957).
57 (93) Maj urn d ar S. K-, В a n e r j e e N. G., J. Industr. Chem. India, 29, 213 (1957).
57 (94) Буданова Л. M., Волоцарская P. С., Зав. лаб., 23, 797 (1957).
57 (95) Rentschler H., T anner H., D j u n g P., Mitt. Lebensm. Hygiene Bern, 48, 238 (1957).
57 (96) Schneyder J., Fachl. Mittl. Osterr. Tabakregie, 1957, 25.
57 (97) Jordan J., Alleman T. G., Anal. Chem., 29, 9 (1957).
57 (98) Калеис О. Ю., Аптечное дело, 6, 29 (1957).
57 (99) Sommer L., Kolafik Z„. Coll. Czech. Chem. Comin., 50, 203 (1957).
57 (100) Iritani N., Tanaka T., J. Pharm. Soc. Japan, 77, 106 (1957).
57 (101) Kao H. H., Yun W., Pei Ching Ta Hsueh Pao Tzu Ian K’o Hsueh 3, 217 (1957).
57 (102) Kanie T., Japan Analyst, 6, 711 (1957).
57 (103) Tucker В. M., Analyst, 82, 284 (1957).
57 (104) Толмачев В. H., Вестфрид Ц. Ю., ЖНХ, 2, 60 (1957).
57 (105) Tichomirova С. Т., Si mack ova О., Coll. Czech. Chem. Comm., 22, 982 (1957).
57 (106) Wakamatsu S., Japan Analyst, 6, 579 (1957).
57 (107) Kinnunen J., Wennerstrand B. Chem. Anal., 46, 34 (1957)
57 (108) Sen B„ Z. anal. Chem., 157, 2 (1957).
57 (109) Кузнецов В. И., Михайлов В. А., ЖАХ, 12, 59 (1957).
57 (НО) Кузнецова Е. Т., Талалаева О. Д., Тихонов А. С., ВХО им. Менделеева, 2, 151 (1957).
57 (111) Wiinsch L., Coll. Czech. Chem. Comm., 22, 1339 (1957).
57 (112) Зайцев А. А., Аптечное дело, 6, 48 (1957).
57 (113) Schmitz В., Dtsch. Apoth. Ztg., 97, 399 (1957).
57 (114) Крылова A. H., Аптечное дело, 6, 28 (1957).
57 (115) S a t о T., I ke g a m i A., Japan Analyst, 6, 706 (1957).
57 (116) Scholz L., Mitt. Inst. Wasserwirtsch., 2, 60 (1957).
57 (117) Erdey L., P 6 1 о s L., Anal. chim. acta, 17, 458 (1957).
57 (118) Okada K., Sugiyama T. Ann. Rep. Takamine Lab., 9 (1957).
57 (119) Laszlovszky J., Acta Pharm. Hung., 3, 125 (1957).
57 (120) Verma M. R., Bhuchar V. M., Paint Manuf., 27, 384 (1957).
57 (121) Ve r m a M. R., P a u 1 S. D., Curr. Sci., 26, 178 (1957).
57 (122) Fritz J. S., Lane W. J., Bystroff A. S., Anal. Chem., 29, 821 (1957).
57 (123) Hildebrand G. P., Reilley C. N„ Anal. Chem., 29, 258 (1957).
57 (124) Lott P. F., Cheng K. L„ Chem. Anal., 46, 30 (1957).
57 (125) Flaschka H., Sa de kF., Mikrochim. acta, 1957, 1.
57 (1261 Renault J. et Gautier J. A., Bull. Soc. chim. Franc., 1957, 208.
57 (127) Hennart C. et Merlin E., Anal. chim. acta, 17, 534 (1957).
57 (128) Gautier J. A. et Renault J., Chim. anal., 39, 189 (1957).
57 (129) Hennart C. et Merlin E., Anal. chim. acta, 17, 463 (1957)
57 (130) Foreman J. K., Smith T. D., J. Chem. Soc., 1957, 1752; J. Chem. Soc., 1957, 1758.
57 (131) Бусев А. И., ЖАХ, 12, 386 (1957).
57 (132) Milner G. W. C., Nunn J. H., Anal. chim. acta, 17, 259 (1957).
57 (133) Milner G. W. C., Nunn J. H., Anal. chim. acta, 17, 494 (1957).
57 (134) Flaschka H., Sadek F., Mikrochim. acta, 1957, 1.
57 (135) Pribil R., Koros E., Acta Pharm. Hung., 27, 1 (1957).
57 (136) Pribil R., Koros E., Barcza L., Acta Pharm. Hung.. 27, 145 (1957).
57 (137) Kinnunen J., Wennerstrand B., Chem. Anal., 46, 92 (1957).
334
57 (138) Bjerrum J., Schwarzenbach G., Si lien L. G., Stability Constants of Metal Complexes, Tabellenwerk, Chemical Soc. London, 1957, pt. 1.
57 (139) Schwarzenbach G., Senn H., Anderegg G., Helv., 40, 1886 (1957).
57 (140) Bayer E., Ber., 90, 2325 (1957).
57 (141) Morrison G. H., Freiser H., Solvent Extraction in Analytical Chemistry, New York, 1957.
1958
58 (1) Belcher R., Close R. A., West T. S„ Taianta, 1, 238 (1958).
58 (2) Belcher R„ L e о n a r d M. A., W e s t T S., Chem. and Ind., 1958, 128.
58 (3) Belcher R., Leonard M. A., West T. S., J. Chem. Soc. (London), 1958, 2390.
58 (4) Ringbom A.. P e n s a r G., W a n n i n e n E., Anal. chim. acta, 19, 525 (19r8).
58 (5) Ci merman Ch., Alon A., Ma shall J., Taianta, 1, 314 (1958).
58 (6) Cimerman Ch., Alon A., Ma shall J., Anal. chim. acta, 19, 461 (1958).
58 (7) A b d - E1 Raheem A. A., A m i n A. A. M., Anal. chim. acta, 19, 327 (1958).
58 (8) Abd El Raheem A. A., Amin A. A. M., Z. anal. Chem., 163, 340 (1958).
58 (9) СгюнкельТ. Б., Я к и м е ц Е. М„ Зав. лаб., 24, 23 (1958)
58 (10) Cerny A., Hutnicke Listy, 13, 715 (1958).
58 (11) Reilley С. N., Schmid R. W., Anal. Chem., 30, 947 (1958).
58 (12) Reilley C. N., Schmid R. W., Lamson D. W., Anal. Chem., 30, 953 (1958).
58 (13) Scribner W. G„ Reilley C. N., Anal. Chem., 30, 1452 (1958).
58 (14) Reilley C. N., H о 11 о w a у J. H., J. Am. Chem. Soc., 80, 2917 (1958).
58 (15) Willard H. H., Mosen A. W., Gardner R. D., Anal. Chem., 30, 1614 (1958).
58 (16) Калиниченко И. И., Зав. лаб., 24, 266 (1958).
58 (17) Либерман М В., Зав. лаб., 24, 147 (1958).
58 (18) Be 11 ото A., Bruno Е., Atti soc. peloritana sci, fis. math, e nat, 5, 245 (1958—1959).
58 (19) Badrinas A., Publ. Instit. Biolog. Applicada, 28, 75 (1958).
58 (20) Baehr a B. N., Dauer A., Sobel A. E., Clin. Chem., 4, 107 (1958).
58 (21) Baker R A, Metal. Ind. (London), 92, 491 (1958).
58 (22) H e a d r i d g e J. B., Photometric Titrations, Pergamon Press, London — New York, 1958.
58 (23) Headridge J. B„ Taianta, 1, 293 (1958).
58 (24) Fleischer K. D., S о u t h wo r t h В. С., H о d ecke r J. H., T u c k e r-mann M. M., Anal. Chem., 30, 152 (1958).
58 (25) Lucchesi C. A., Hirn C. F., Anal Chem., 30, 1877 (1958).
58 (26) Costa A. C.. Chem. Anal., 47, 39 (1958).
58 (27) Bruno E., В e 11 о m о A., Atti. soc. peloritana sci. fis. math, e nat, 5, 327 (1958—1959).
58 (28) Sommer L., Hni lickova M., Naturwiss., 45, 544 (1958).
58 (29) Franzon O., Ivarsson G., Samuelson O., Svensk. Pappertid., 61, 165 (1958).
58 (30) Longford K. L., Electroplating, 11, 439 (1958).
58 (31) Liu S., Chang M., Acta chim. Sinica, 24, 306 (1958).
58 (32) Braun T., M a x i m L, G a I a t e a n u I., Nature (London), 182, 936 (1958).
58 (33) Bennet M. C., Schmidt N. O, Inst. Sugar J. 60, 225 (1958).
58 (34) Korbl J.. P f i b i 1 R., Coll. Czech Chem. Comm., 22, 873 (1958).
58 (35) Flaschka H„ Taianta, 1, 60 (1958)
58 (36) Flaschka H., Abd-El'Raheem A. A., S a d ek F„ Z. physiol. Chem 310, 97 (1958).
335
58 (37) Flaschka H., Sadek F., Chem. Anal., 47, 30 (1958).
58 (38) Dewaid A., Acad. Rep. Pupul. Romine, Ser. stiint. chim., 5, 125 (1958)
58 (39) Kenny A. D., Cohn V. C., Anal. Chem., 30, 1366 (1958).
58 (40) Crawley R. H. A., Anal. chim. acta, 19, 540 (1958).
58 (41) Жданов А. К., Хадеев В. А., Кац А. Л., Узб. хим. ж., 1958, 27
58 (42) Wilkins D. H„ Hibbs L. E., Anal, chim., 18, 372 (1958).
58 (43) Wilkins D. H., Anal. chim. acta, 19, 441 (1958).
58 (44) Kies H. L., Anal. chim. acta, 18, 14 (1958).
58 (45) Foss О. P., Andersen B., Scand. J. Clin. Lab. Invest., 10, 437 (1958)'.
58 (46) Vfestal J., Havir J., Brandstetter J., Kotrly S., Coll. Czech. Chem. Comm., 23, 886 (1958).
58 (47) Korbl J., Vydra F„ Coll. Czech. Chem. Comm., 23, 622 (1958).
58 (48) Korbl J., Kakac B., Coll. Czech. Chem. Comm., 23, 889 (1958).
58 (49) Korbl J., Pfibil R., Coll. Czech. Chem. Comm., 23, 1213 (1958).
58 (50) Korbl J., Kraus E., Pfibil R., Coll. Czech. Chem. Comm., 23, 1219 (1958).
58 (51) Budesinsky B., Korbl J., Czech. Farm., 7, 78 (1958).
58 (52) Korbl J., Vydra F., Pfibil R., Taianta, 1, 281 (1958).
58 (53) Budesinsky B., Coll. Czech. Chem. Comm., 23, 895 (1958).
58 (54) Korbl J., Vydra F., Pfibil R., Taianta, 1, 138 (1958).
58 (55) Файнберг С. Ю., Бляхман А. А., Филатова JI. H., Зав. лаб., 24, 18 (1958).
58 (56) Khalifa H., Z. anal. Chem., 159, 410 (1958).
58 (57) Khalifa H., Patzak R., Doppler G., Z. anal. Chem., 161, 264 (1958).
58 (58) Khalifa H., Z. anal. Chem., 161, 401 (1958).
58 (59) Khalifa H., Z. anal. Chem., 163, 81 (1958).
58 (60) Khalifa H., Anal. chim. acta, 18, 310 (1958).
58 (61) Fritz J. S., Oliver R. T., Pietrzyk D. J.. Anal. Chem., 30, 1111 (1958).
58 (62) Fritz J. S, Richard M. J., Karraker S. K-, Anal. Chem., 30, 1347 (1958).
58 (63) Cheng K. L., Anal. Chem., 30, 243 (1958).
58 (64) Cheng K. L„ Chem. Anal., 47, 93 (1958).
58 (65) Bieber B., Vecera Z., Przeglad Odlewictwa, 3, 66 (1958).
58 (66) Sa jo I., Acta chim. Hung., 16, 115 (1958).
58 (67) Булевский О. Б., Зав. лаб., 24, 535 (1958).
58 (68) Мустафин И. С., Кашковская Е. А., Зав. лаб., 24„ 1060 (1958).
58 (69) Miles М. J., Me si mer W. J., Atkin М., Anal. Chem., 30, 361 (1958).
58 (70) Menis О., Manninger D. L., Ball R. G., Anal. Chem., 30, 1772 (1958).
58 (71) Dur ch am E. J., Ryskiewich S. P., J. Am. Chem. Soc., 80, 4812 (1958).
58 (72) Saito M., Nagamura S., Ueno K., Chem. Anal., 47, 67 (1958).
58 (73) Merz K- W., Lehmann H., Dtsch. Apoth. Ztg., 98, 391 (1958).
58 (74) Tanaka N., Koizumi T., Ma ray am a T., Ko da ma M., S a k u-ma Y., Anal. chim. acta, 18, 97 (1958).
58 (75) Griiner K-, Soukup M., Drahotska B., Hutnicke Listy, 13, 153 (1958).
58 (76) Hahn. F. L„ Angew. Chem., 70, 712 (1958).
58 ( 77) Lupan S., Rev. Chim. (Bukarest), 9, 101 (1958).
58 (78) M a c N e v i n M., McBride H. D., H a k k i 1 a E. A., Chem. and Ind., 1958, 104.
58 (79) Dobrowolski J., Chem. Analit. (Warschau), 3, 609 (1958).
58 (80) Kinnuneji J., Wennerstrand B., Chem. Anal., 47, 38 (1958).
58 (81) Kinnunen A., Mer ik an to B., Chem. Anal., 47, 11 (1958).
58 (82) Lassner E., Scharf R., Z. anal. Chem., 159, 212 (1958).
58 (83) Lassner E., Scharf R., Z. anal. Chem., 164, 398 (1958).
58 (84) Stengel E., Riemer G., Z. anal. Chem., 167, 118 (1958),
.336
58 (85)' Riva В., Ann Chim. (Roma), 48, 950 (1958).
58 (86) S outh worth В. С., H о d e с к e r J. H., Fleischer K- D., Anal. Chem., 30, 1152 (1958).
58 (87) Ottendorfer L. J., Metallurgia, 58, 105 (1958); Chem. Anal., 47, 96 (1958).
58 (88) Павелкина В. П., Донской Б. М., Зав. лаб., 24, 548 (1958).
58 (89) Мустафин И. С., Кашковская Е. А., РЖХим, 1958, реф. № 70523.
58 (90) Sen В., Anal. chim. acta, 19, 551 (1958).
58 (91) К о г k i s с h J., F a r a g A., Z. anal. Chem., 165, 6 (1958).
58 (92) W a n rf i n e n E., Suomen Kemistelehti, B31, 303.
58 (93) Yabro C. L„ Golby R. L., Anal. Chem., 30, 505 (1958).
58 (94; Gagliardi E., Reimers H., Z. anal. Chem., 160, 1 (1958).
58 (95) Verma M. R., Bhuchar V. M., T h e r a 11 i I K. J., Sharma S. S., Analyst, 83, 160 (1958).
58 (96) Knappe E., В о eke 1 V., Pharmazie, 13, 610 (1958).
58 (97) Weiner R., Ney E., Z. anal. Chem., 161, 432 (1958).
58 (98) Street H. V., Analyst, 83, 628 (1958)'.
58 (99) Sen B„ Anal. chim. acta, 19, 320 (1958)
58 (100) Цы вина Б. С., Владимирова В. М., Зав. лаб., 24, 278 (1958).
58 (101) Studlar К-, Janousek I., Hutnicke Listy, 13, 805 (1958).
58 (102) Koros E., Proc. Intern. Sympos. Microchem. Birmingham, 1958, 474.
58 (103) Koros E., Poczok L., Mag. Kern. Fol., 64, 250 (1958).
58 (104) Sporek K. F., Anal. Chem., 30, 1032 (1958).
58 (105) Sporek K- F., Chem. Anal., 47, 12 (1958).
58 (106) Sara J., uBerndt W., Svensk Pappertid., 61, 353 (1958)'.
58 (107) Бусев А. И., Типцова В. Г., ЖАХ, 13, 180 (1958).
58 (108) Бусев А. И., Киселева Л. В., Черкесов А. И, Зав. лаб., 24, 13 (1958).
58 (109) Бусев А. И., Петренко А. Г., Зав. лаб., 24, 1449 (1958).
58 (ПО) Malmstadt Н. V., Hadji io anno u Т. Р., Anal. chim. acta, 19, 563 (1958).
58 (111) Beral H., Demetrescu E., Stoicescu V., Grintescu P., Zentralhalle, 97, 524 (1958); Farmacia, 1958, 357.
58 (112) Pilz W., Z. anal. Chem., 164, 241 (1958).
58 (113) Milner G. W. C., Edwards J. W., Anal. chim. acta, 18, 513 (1958).
58 (114) Мартыненко Л. И., Научные доклады высшей школы. Хим. и хнм. технол., 1958, 718.
58 (115) Bognar J., Jellinek О., Kohaszati Lapok, 13, 508 (1958).
58 (116) Iwantscheff G., Das Dithizon und seine Anwendung in der Mikro-und Spurenanalyse, Verlag Chemie. Weinheim. 1958.
58 (117) I r i t a n i N., T a n a k a T., Japan Analyst, 7, 42 (1958).
58 (118) Ry ba O., Ci fka J., Jeihova D., Malat M., Suk V., Coll. Czech. Chem. Comm., 23, 71 (1958).
1959
59 (1) Lassner E., Scharf R., Reiser P. L., Z. anal. Chem., 165, 88 (1959).
59 (2) Lassner E., Scharf R., Planseeber Pulvermet., 7, 129 (1959).
59 (3) Lassner E„ Scharf R., Z. anal. Chem., 167, 114 (1959); 168, 429 (1959).
59 (4) Wilkins D. H., Anal. chim. acta, 20, 113 (1959)'.
59 (5) Wilkins D..H., Anal. chim. acta, 20, 271 (1959).
59 (6) W i 1 k i n s D. H., H i b b s L. E., Anal. chim. acta, 20, 273 (1959).
59 (7) W i 1 k i n s D. H., Anal. chim. acta, 20, 324 (1959).
59 (6) Wilkins D. H., Hibbs L. E., Anal. chim. acta, 20, 427 (1959).
59 (9) Hibbs L. E„ Wilkins D. H., Taianta, 2, 16 (1959).
59 (10) Wilkins D. H., Taianta, 2, 12 (1959).
59 (11) Wilkins D. H., Hibbs L. E„ Taianta, 2, 201 (1959).
59 (12) Wilkins D. H., Taianta, 2, 277 (1959)'.
337
59 (13) Vrestal J., Havir J., Brandstetter J., Kotrly S., Coll. Czech Chem. Comm., 24, 360 (1959).
59 (14) Malat M., Tenor ova M., Coll. Czech. Chem. Comm., 24, 632 (1959).
59 (15) Honda M., Korbl J., В azant V., Pribil R., Coil. Czech. Chem. Comm., 24, 700 (1959).
59 (16) Pribil R., Korbl J., Kysil B„ Vobora J., Coll. Czech. Chem Comm., 24, 1799 (1959).
59 (17) Bundesinsky B., Coll. Czech. Chem. Comm., 23, 1804 (1959).
59 (18) Korbl J., Pribil R., Coll. Czech. Chem. Comm., 24, 2266 (1959).
59 (19) Brhacek L., Coll. Czech. Chem. Comm., 24, 2811 (1959).
59 (20) Malat M., Suk V., Tenorova M., Coll. Czech. Chem. Comm 24, 2815 (1959)
59 (21) Suk V., Miketukova V., Coll. Czech. Chem. Comm., 24, 2818 (1959).
59 ( 22) V у d r a F., P f i b i 1 R., К 6 r b 1 J., Coll. Czech. Chem. Comm., 24, 2623 (1959).
59 (23) Pribil R., Vydra F., Coll. Czech. Chem. Comm., 24, 3103 (1959).
59 (24) Patrovsky V., Coll. Czech. Chem. Comm., 24, 3305 (1959).
59 (25) Dubsky I., Coll. Czech. Chem Comm., 24, 4045 (1959).
59 (26) Janousek I., Studlar K-, Coll. Czech. Chem. Comm., 24, 3799 (1959).
59 (27) Vydra F., Pribil R., Korbl J., Taianta, 2, 311 (1959).
59 ( 28) Suk V., Miketukova V., Coll. Czech. Chem. Comm., 24, 3629 (1959)
59 (29) Budesinsky B., Korbl J., Coll. Czech. Chem. Comm., 24, 1791 (1959)
59 (50) Pribil R., Kopanica M., Chem. Anal., 48, 35 (1959).
59 (31) P f i b i 1 R., К о p a n i с a M., Chem. Anal., 48, 66 (1959).
59 (32) Pribil R., Kopanica M., Chem. Anal., 48, 87, 89 (1959).
59 (33) Pribil R., Taianta, 3, 91 (1959).
59 (34) Pribil R„ Taianta, 3, 200 (1959).
59 (35) H о 1 a s e к A., L i e b H., W i n s a u e г K-, Mikrochim. acta, 1959, 402.
59 (36) Holasek A., Dugan dzic M., Mikrochim. acta, 1959, 488.
59 (37) Dugandzic M., Flaschka H., Holasek A., Clin. chim. acta, 4, 819 (1959).
59 (38) Barnard jr. A. J., Broad W. C., Flaschka H.. Mikrochem. J., 3, 43 (1959).
59 (39) Шапиро M. Я., ЖАХ, 14, 365 (1959)
59 (40) Lacourt A., Heyndrickx P„ Mikrochem. J., 3, 181 (1959).
59 (41) Iritani N., Tanaka T., Oishi H., Japan Analyst, 8, 30 (1959).
59 (42) Ito T., Abe M., J. Chem. Soc. Japan, Ind. Chem. Sec. 62, 1801 (1959).
59 (43) Kanie T., Nagoyashi Kogyo Kenkynjo Hokoku, 20, 12 (1959).
59 (44) Усатенко Ю. И., Виткина M. А., Зав. лаб., 24, 1058 (1959).
59 (45) Цы в ина Б. С., Конькова О. В., Зав. лаб., 25, 1430 (1959).
59 (46) Wronski М., Chem. Anal. (Warschau), 4, 641 (1959).
59 (47) Ishidate M, Kimura E., Japan Analyst, 8, 739 (1959).
59 (48) Vorisek J., Coll. Czech. Chem. Comm., 24, 3921 (1959).
59 (49) Karolev A., Budevskii O., Godishnik Nauch. Inst. Met. i Polezni Iskopaemi, 1, 163 (1959).
59 (50) Ernsberger F. M., J. Am. Ceramic Soc., 42, 373 (1959).
59 (51) Rumler F., H e r b о 1 s h e i m e r R., Wo II G., Z. anal. Chem, 166, 23 (1959).
59 (52) Iwase A., Nippon Kagaku Zasshi, 80, 1142 (1959).
59 (53) Borchert O., Plaste und Kautschuk, 6, 562 (1959).
59 (54) Borchert O., Taianta, 2, 387 (1959).
59 (55) Barcza L.. Koros E., Chem. Anal., 48, 94 (1959).
59 (56) Barcza L., Acta Pharm. Hung., 29, 11 (1959).
59 (57) Sedlacek B. A. J., Z. Lebensm. Unters. u. Forsch, 111, 108 (1959).
59 (58) Koros E., Barcza L., Chem. Anal., 48, 69 (1959).
59 (59) Erdey L., Chem. Anal., 48, 106 (1959).
59 (60) Браун T., Максим И., Галацеану И., ЖАХ, 14, 542 (1959).
338
59 (61) Бусев А. И., Чжан Фань, Вестник МГУ, Сер. мат. мех., астр., физ. II хим., 14, 203 (1959).
59 (62) Бусев А. И., Чжань Фань, ЖАХ. 14, 445 (1959)
59 (63) Robinson Н. М. С.. Rathbun J. С.. Can. J. Biochem. Physiol., 37, 225 (1959).
59 (64) Петриков а М. Н., ЖАХ, 14, 239 (1959).
59 (65) Ко марь Н. П., ЖАХ, 14, 152 (1959).
59 (66) I s h i d a t е М., Kimura E.J Japan Analyst, 8, 733 (1959).
59 (67) Kristiansen H., Langmyhr F. J., Acta chem. scand., 13, 1473 (1959).
59 (68) Jar din CL, Medicine Tropicale, 19, 703 (1959).
59 (69) Jar din CL, Medicine Tropicale, 19, 708 (1959)
59 (70) Кар о лев A. H„ Койчев М. К., Зав. лаб., 25, 546 (1959).
59 (71) Misumi S., Taketatsu Т., Bull. Chem. Soc. Japan, 32, 593 (1959).
59 (72) Morris A. G. C., Chem. AnaL. 48, 76 (1959).
59 (73) Knight W. S., Os ter young K- A., AnaL chim. acta, 20, 481 (1959).
59 (74) Riedel K-, Z. anal. Chem., 168, 106 (1959).
59 (75) КоренМан И. M., Танина В. Г., Л е й ф е р Е. И., Труды по химии и хим. технол., 2, 108 (1959).
59 (76) Dragulescu С., Simonescu Т., Menessy I., Acad. Rep. Pupul. Romine, Ser. Stiint chim., 6, 21 (1959).
59 (77) Ochynska J., Krowczynski L., Chem. AnaL (Warschau), 4, 309 (1959).
59 (78) Brandt M., van der Berg R. H., AnaL Chem., 31, 1921 (1959).
59 (79) Langmyhr F. J., Kristiansen H., Anal. chim. acta, 20, -524 (1959)
59 (80) Tanaka N., Sakuma Y., Japan Analyst, 7, 223 (1959).
59 (81) Phillips J. P., Automatic Titrators, Academic Press, New York, 1959.
59 (82) Pease B. F., Williams M. B., AnaL Chem., 31, 1044 (1959).
59 (83) Мустафин И. С., Молот Л. А., Изв. вузов, Хнм. и хим. технол., 2, 493 (1959).
59 (84) Pang К-, Hsu Т. М., W и С. Н., J. Chin. Chem. Soc. (Taiwan), 6, 12 (1959).
59 (85) Никитина E. И., Зав. лаб., 25, 142 (1959).
59 (86) Ottendorfer L. J., Chem. AnaL, 48, 97 (1959).
59 (87) Misumi S., Taketatsu T., Bull. Chem. Soc. Japan, 32, 973 (1959).
59 (88) Harder R., Chabe,ek S., J. Inorg. Nuclear Chem., II, 197 (1959).
59 (89) Lucchesi C. A., Stearns J. A., Hirn C. F., Chem. AnaL, 48, 9 (1959).
59 (90) Liteanu C., Crisan L, Calu C., Stud. Univers. Babes. Bolyai, 1, 105 (1959).
59 (91) C a r t i e r P. et С 1 ё m e n t - M ё t r a 1 J., Clin. chim. acta, 4, 357 (1959).
59 (92) Гельман А. Д., Артюхин П. И., Москвин А. И., ЖНХ, 4, 1332 (1959).
59 (93) Lewandowski A., Witkowski Н., Prace Korn. Mat. Przyr. Poznan Tow. Przyj-Nauk., 7, 3 (1959).
59 (94) Chaberek S., Frost A. E., Doran M. A., Bick well N J., J. Inorg. Nuclear Chem., Il, 184 (1959).
59 (95) Bril K. Y„ Holzer S., Rethy B„ AnaL Chem., 31, 1353 (1959).
59 (96) Fritz J. S„ P i e t r z у k D. J., AnaL Chem., 31, 1157 (1959).
59 (97) Бога рев а К. Г., Маслоб.-жир. пром-сть. 25, 44 (1959).
59 (98) Abd-El Raheem A. A., Z. anal. Chem., 167, 98 (1959).
59 (99) Abd-El Raheem A. A., Dokhana M. M., Z. anal. Chem., 168, 165 (1959).
59 (100)Abd-El Raheem A. A., Dokhana M. M., AnaL chim. acta, 20, 133 (1959).
59 (101) Abd-El Raheem A. A., Mo u s t a f a A. S., AnaL chim. acta, 21, 379
(1959)
59 (102) L о 11 P. F., C he n g K. L., Chem. Anal., 48, 13 (1959)
339
59 (103) Cheng К. L„ War mu th F. J., Chem. Anal., 48, 74 (1959).
59 (104) H a 1.1 J. L., G i b s о n J. A., W i 1 к i n s о n P. R., Proc. West. Va Acad. Sci., 31—2, 143 (1959—1960).
59 (105) Berndt W., S a r a J., Coll. Czech. Chem. Comm., 24, 3181 (1959)
59 (106) Булевский О. Б., Каролев А. Н., Каранов Р. А., Симова-Филиппова Л., Зав. лаб., 25, 1439 (1959).
59 (107) Claes Н. J., de Donker К-, Ros sei le N„ Chem. Weekbl., 55, 39 (1959)
59 (108) Boos R. N„ Analyst, 84, 633 (1959).
59 (109) Bennewitz R., Tanzer I., Mikrochim. acta, 1959, 836-
59 (110) Milner G. W. C., Edwards J. W., Anal. chim. acta, 20, 31 (1959).
59 (111) Scribner W. G., Anal. Chem. 31, 273 (1959).
59 (112) R i 1 e у J. P., W i 11 i a m s H. P., Mikrochim. acta, 1959, 804.
59 (113) Reilley C. N., Vavoulis A., Anal. Chem., 31, 243 (1959).
59 (114) Reilley C. N., Schmid R. W., Anal. Chem., 31, 887 (1959).
59 (115) Hoyle W„ West T. S., Taianta, 2, 158 (1959).
59 (116) Hirn C. F., Lucchesi C. A., Anal. Chem., 31, 1417 (1959).
59 (117) Malmstadt H. V., Hadiiioannou T. P., J. Agric. Food Chem., 7, 418 (1959).
59 (118) Malmstadt H. V., H a d j i i о a n n о u T. P., Clin. Chem., 5, 50 (1959).
59 (119) Malmstadt H. V., Hadjiioannou T. P., J. Am. Water Works Assoc., 51, 411 (1959).
59 (120) Malmstadt H. V., H a d j i i a n n о u T. P., Anal. chim. acta, 21, 41 (1959).
59 (121) H a d j i i о a n n о u T. P., Thesis, Urbana III, 1959. Univ. Microfilm (Ann Arbor Mich.), L. C. Card. № Mic, 60—1849.
59 (122) Musha S., Munemori M., Ogawa K-> Bull. Chem. Soc. Japan, 32, 132 (1959).
59 (123) M u s h a S., О g a w a K-, Japan Analyst, 8, 161 (1959).
59 (124) Khalifa H., S о 1 i m a n A., Z. anal. Chem., 169, 109 (1959).
59 (125) Khalifa H., Hamdy M., SolimanA., Z. anal. Chem., 171, 178 (1958).
59 (126) Клыгин A. E., Смирнова И. Д., Никольская Н. А., ЖНХ,
4, 2766 (1959).
59 (127) Diehl Н., Lindstrom F., Anal. Chem., 31, 414 (1959).
59 (128) Bartels U., Hoyme A., Chem. Techn. (Berlin), 11, 600 (1959)'.
59 (129) Bett I. M., Fraser G. P., Clin. chim. acta, 4, 346 (1959).
59 (130) Чудинова H. H., ЖАХ, 14, 636 (1959).
59 (131) Chu Y. C., Chi J. A., Yao Hsueh Pao, 7, 136 (1959).
59 (132) Hennart C. et Merlin E., Chim. anal., 41, 287 (1959).
59 (133) Helmstadter G„ Mitt, dtsch. pharm. Ges., 29, 91 (1959).
59 (134) Helmstadter G., Dtsch. Apoth. Ztg., 99, 589 (1959).
59 (135) Beral H., Demetrescu E., Stoicescu V., Grintescu P., Zentralhalle, 98, 49 (1959).
59 (136) Черкесов А. И., Мельникова А. С., Зав. лаб., 25, 140 (1959).
59 (137) Grouch E. A. C., Crawford С. M., A. E. R. E. Report C/R 2843 (1959).
59 (138) Зайковский Ф. В, ЖАХ, 14, 440 (1959). '
59 (139) СочевановаМ М, Сочеванов В. Г., Бюл. научно-техн, информ. Министерства геологии и охраны недр СССР, 1959, 98.
59 (140) Bjerrum J., Schwarzenbach G., Sillen L. G., Tabellenwerk, Chemical Soc. London, 1959, pt. II.
59 (141) В о n d J., J о n e s T. L, Trans Farad. Soc., 55, 1310 (1959).
59 (142) Anderegg G., Nageli P., Muller F., Schwarzenbach G., Helv., 42, 827 (1959)
59 (143) Ringbom A., Treatise on Analytical Chemistry, Ed. by I M. Kolthoff and P. J. Elving, v. 1, The Interscience Encyclopedia Inc., New York, 1959, ch. 14.
59 (144) Hoelzl-Wallach O. F., Surgenor D. M., Soderberg J.> Delano E, Anal. Chem., 31, 456 (1959).
340
59 (145) Dick J., Ristici J.j Acad. Rep. Pupul. Romiine, Ser. sfiint. chim., 6, 47 (1959)
59 (146) Flaschka H., EDTA-Titrations, Pergamon Press, London — New York, 1959.
59 (147) Церкасевич К. В., в сб. «Исслед. в области фармации, Запорожский гос. фармацев. ин-т, 1959, стр. 120.
59 (148) Martin А. Е., Reilley С. N„ Anal. Chem., 31, 992 (1959)
59 (149) Wilkins D. Н., Taianta, 2, 88 (1959).
59 (150) Wald vo gel P., Dissertation ETH, Ziirich, 1959.
59 (151) Goldstein D., Anal. chim. acta, 21, 339 (1959).
1960
60 (1) Pec ar M., Mikrochim. acta, 1960, 567.
60 (2) Dugandzic M., Holasek A., Wiener med. Wochensch., 110, 460 (1960).
60 \3) L a s s n e r E., S c h a r f R., Taianta, 7, 12 (1960).
60 (4) Lassner E., Scharf R., Chem. Anal., 49, 22 (1960).
60 (5) L a s s n e r E., S ch a r f R., Chem. Anal., 49, 44 (1960).
60 (6) W tins ch L., Casopis Lekarnu Czech., 99, 754 (1960).
60 (7) Kobayashi M., Iwase A., Yamagata Daigaku Kiyo, 5, 301 (1960).
60 (8) van Schouwenburg J. Ch., Anal. Chem., 32, 709 (1960).
60 (9) Сочеванова M. M., Сочеванов В. Г., Зав лаб., 26, 543 (1960).
60 (10) Кабанова О. Л., Дану шенков а М. Я., Палей П. Н., Anal,
chim. acta, 22, 66 (1960).
60 (11) Зайковский Ф. В., Герхард Л. И., Труды комиссии по аналитической химии АН СССР, 11, 346 (1960).
60 (12) Suk Ch. С., J. Pharm. Soc. Korea, 5, 16 (1960).
60 (13) Sun P J., J. Chinese Chem Soc. Formosa, 7, 143 (1960).
60 (14) Pande C. S, Srivastava T. S., Z. anal. Chem., 172, 356 (1960).
60 (15) Pande C. S., S r i v a s t a v a T. S., Z. anal. Chem., 173, 195 (1960).
60 (16) Pande C. S., Srivastava T. S., Z. anal. Chem., 175, 29 (1960).
60 (17) Jonston M. B., Barnard jr. A. J., Broad W. C., Rev. Univ. Ind.
Satander, 2, 137 (1960).
60 (18) Jensen B. S., Acta chim. scand., 14, 927 (1960).
60 (19) Iwata S., Japan Analyst, 9, 178 (1960).
60 (20) Hni lickova M., Sommer L., Z. anal. Chem., 177, 425 (1960).
60 (21) de Sousa A., Chem. Anal., 49, 18 (1960)
60 (22) de Sousa A., Chem. A.nal., 49, 45 (I960).
60 (23) de Sousa A., Chem. Anal., 49, 75 (1960).
60 (24) de Sousa A., Anal. chim. acta, 22, 520 (I960).
60 (25) de Sousa A., Anal. chim. acta, 22, 522 (I960).
60 (26) de Sousa A., Z. anal. Chem., 174, 337 (1960).
60 (27) Krijn G. C„ Den Boef G., Anal. chim. acta, 23, 35 (1960).
60 (28) Krijn G. C„ Den Boef G., Anal. chim. acta, 23, 186 (1960).
60 (29) Krijn G. C., Koster A. S., Den Boef G., Anal. chim. acta, 23, 240 (1960).
60 (30) Jablonski W. Z., Jonson E. A., Analyst, 85, 297 (1960).
60 (31) H о 1 P. J., Chem. and Techn. (Amsterdam), 16, 645 (1961); 17, 133 (1962).
60 (32) Katigawa T., Bull. Chem. Soc. Japan, 33, 1124 (I960).
60 (33) Lewis L. L., Melnick L. M., Anal. Chem., 32, 39 (1960).
60 (34) Lewis L. L., Straub W. A., Anal. Chem., 32, 96 (1960).
60 (35) Strafelda F., Rihova J., Coll. Czech. Chem. Comm., 25, 1444 (I960).
60 (36) Diehl H., Ellinboe J. L., Anal. Chem., 32, 1120 (1960).
60 (37) Вольф Л. А., Зав. лаб., 26, 1353 (1960).
60 (38) Вольф Л. А., Журн. ВХО Д. И. Менделеева, 5, 232 (1960).
60 (39) S е d 1 а с е к В. A. J., Fette und Seifen, 62, 669 (1960).
60 (40) Sedlacek В. A. J., Fette und Seifen, 62, 1041 (1960).
60 (41) Majumdar A. K-, Savariar С. P., Z. anal. Chem., 174, 197 (1960).
341
60 (42) Жданов А. К., X а д е е в В. А., И ш а п к о д ж а с в С. Д., Узб хим ж, № 3, 29 (1960).
60 (43) Budesinskv В., Korbl J., Coll. Czech Chem. Comm., 25, 76 (1960)
60 (44) Budesinsky B., Vanickova E., u. Korbl J., Coll. Czech. Chem Comm., 25, 456 (1960).
60 (45) Korbl J., Svoboda V., Taianta, 3, 370 (1960).
60 (46) Pfibil R., Burger K., Taianta, 4, 8 (1960).
60 (47) Kotrly S, Vfestal J., Coll. Czech. Chem. Comm., 25, 1148 (1960).
60 (48) К о p a n i с a M., Pfibil R., Coll. Czech. Chem. Comm., 25, 2230 (1960).
60 (49) P о von dr a P., Pfibil R., Chem. Anal., 49, 109 (1960).
60 (50) Svoboda V., Taianta, 4, 201 (1960).
60 (51) Rehak B., Korbl J., Coll. Czech. Chem. Comm., 25, 797 (1960).
60 ( 52) Svoboda V., Dorazil L„ Korbl J., Coll. Czech. Chem. Comm., 25, 1037 (1960).
60 (53) Wanninen E., Acta Acad. Aboensis Math. Phys., 21, 110 pp (1960).
60 (54) Zaki M. R., Shakir K., Z. anal. Chem., 174, 274 (1960).
60 (55) Zaki M. R„ Shakir K-, Z. anal. Chem., 177, 196 (1960).
60 (56) Zapp E. E., Pungor E., Ann. Univ. Sci. Budapest, Sec. Chim., 2, 341 (1960).
60 (57) П алей П. H., Удальцова H. И., Труды комиссии no аналитической химии АН СССР, 11, 299 (1960).
60 (58) Палей П. Н., Чжан Вэнь-цин, ЖАХ, 15, 598 (1960).
60 (59) Мор аче веки й Ю. В., Вольф А. Л., Уч. зап. Ленингр гос. ун-та им. А. А. Жданова, сер. хим. наук, 1960, 144
60 (60) М о р а ч е в с к и й Ю. В., В о л ь ф А. Л., ЖАХ, 15, 656 (1960).
60 (61) Лукьянов В. Ф., Князева Е. М., ЖАХ, 15, 69 (1960).
60 (62) Лукьянов В. Ф., Седина Л. И., ЖАХ, 15, 595 (1960).
60 (63) Wilkins D. Н., Taianta, 4, 79 (1960).
60 (64) Wilkins D. Н„ Talanta, 4, 182 (1960).
60 (65) Wilkins D. H., Anal. chim. acta, 23, 309 (1960).
60 (66) G u e r r i n G., D e s b a r r e s J., et T r e m i 11 о n B., J. Electroanal. Chem., 1, 226 (1960).
60 (67) Guerrin G., Sheldon M. V., and Reilley C. N., Anal. Chem., 49, 36 (1960).
60 (68) Reilley C. N., Flaschka H., Laurent B., Laurent S., Anal. Chem., 32, 1218 (1960).
60 (69) Me Ke nd J., Anal. Chem., 32, 1193 (1960).
60 (70) Черннхов Ю. А., Трамм P. С., Певзнер К- С., Зав. лаб., 26, 921 (1960).
60 (71) Черннхов Ю. А., Владимирова В. М., Зав. лаб., 26, 1207 (1960).
60 (72) Черннхов Ю. А., Л у к ь я н о в В. Ф., Козлова А. Б., Зав. лаб., 14, 567 (1959); ЖАХ, 15, 452 (1960).
60 (73) Laszlovsky J., В а г с z a L., К о г о s Е., Ann. Univ. Sci. Budapest, Sec. ChiH, 2, 277 (1960).
60 (74) Хадеев В. А., Базарбаев A. T., Узб. хим. ж., № 5, 38 (1960).
60 (75) Хадеев В. А., Квашина Ф. Ф., Изв. вузов, Хим. и хим. технол., 3, 251 (1960).
60 (76) Радько В. А., Якимец Е. М., Труды Уральского политехнического института, Хим. техн, и контр, пр-ва, сб. 96, 1960, стр. 166.
60 (77) Радько В. А., Якимец Е. М., Труды Уральского политехнического института. Хим. техн, и контр, пр-ва, сб. 96, 1960, "тр 176.
60 (78) М а 1 m s t a d t H. V., H a d j i i о a n n о u T. P., Anal. chim. acta, 23, 288 (1960).
60 (79) Herbin ger W., Hubmayer W., Klin. Wochenschr., 38, 822 (1960).
60 (80) Verma M R., Agarwal К. C., J. Sci. Ind. Res. (India), 19B, 319 (1960).
60 (81) Вихеев E. П., Каракашов А. В., Вопросы медиц. хим., 6, 435 (1960).
342
60 (82) Chaturvedi R. K-, Current Sci. (India), 29, 128 (1960).
60 (83 Headridge J. B., Analyst, 85, 379 (1960).
60 (84) Iritani N., Tanaka T., Japan Analyst, 9, 1 (1960).
60 (85) WendlandlW.W., Anal. Chem., 32, 848 (1960).
60 (86) Ward G. M., Heeney H. B., Can. J. Plant. Sci., 40, 589 (1960).
60 ( 87) Стюнкель T. Б., Михалева 3. А., Труды Уральского политехнического института. Хим. техн, и контр, пр-ва, сб. 96, 1960, стр. 159.
60 (88) Roubalova D„ Dolezal J., Chem. Anal., 47, 76 (1960).
60 (89) Erdey L., P о 1 о s L., Z. anal. Chem., 174, 333 (1960).
60 (90) Erdey L., Buzas I., Anal. chim. acta, 22, 524 (I960).
60 (91) Hisada M.. Kashikawa K., Japan Analyst, 9, 87 (1960).
60 (92) Stu dl a r K., Chem. Anal., 49, 106 (1960).
60 (93) Володарская P. С., Зав. лаб., 26, 925 (1960).
60 (94) Vasiliev R., Anastasescu G. Rev. Chim. Bukarest, 11, 298 (1960).
60 (95) Уса те н ко Ю. И., Виткина M. А., Зав. лаб., 26, 542 (1960).
60 (96) Попов M. А., Зав. лаб., 26, 540 (1960).
60 (97) LJmedaM., Japan Analyst, 9, 172 (1960).
60 (98) Terpilowski J., Manczyk R., Acta Polon. Pharm., 17, 267 (1960).
60 (99) Singh B., Sahota S. S., Mankota M. S., Z. anal. Chem., 173, 275 (1960).
60 (100) Powell J. E., Fritz J. S., James D. B., Anal. Chem., 32, 954 (196u)
60 (101) Philipp B., Bartels U., Hoy me H., Mittls. Blatt Chem. Ges. DDR, Sonderheft, 1960, 359.
60 (102) Stankoviansky S., Podany V., Jasinger F., Mayer P„ Chem. Zvesti, 14, 265 (1960).
60 H03) Ramaiah N. A., Chaturvedi R. K., Current Sci (India), 29, 305 (1960).
60 (104) Rale a R., S i m i n i n с E., An. Stiint Univ., Al. I. Cuza, 6, 171 (1960).
60 (105) Павлов H. H., Кузнецов A. P., Арбузов Г. А., Изв. высших технол. учебн. завед. легкой пром., № 1, 54 (1960); № 2, 55 (1960); № 3, 28 (1960).
60 (106) Owens Е. G., Yoe J. Н., Anal. chim. acta, 23, 321 (1960).
60 (107) Merrill J. R., Honda M., Arnold J. R., Anal. Chem., 32, 1420 (1960).
60 (108) Мустафин И. С., Кручкова Е. С., ЖАХ, 15, 20 (1960); Зав. лаб., 27, 1668 (1961).
60 (109) Ogawa К., Musha S., Bull. Univ. Osaka, Prefect. Ser. A, 8, 63 (1960).
60 (110) Nydhal Z„ Taianta, 4, 141 (I960)'.
60 (111) Haslam J., Squirrell D. С. M., Blackwell I. G., Analyst, 85, 27 (1960).
60 (112) Takagi T., Imoto H., Japan Analyst, 8, 782 (1959).
60 (113) Morris A. G. C., Chem. Anal., 49, 105 (1960).
60 (114) Costa A. C., Anais. Assoc. Brazil Quim., 19, 21 (1960).
60 (115) Costa A. C., Anais. Assoc. Brazil Quim., 19, 29 (1960).
60 (116) С о s t a A. C„ Anais. Assoc. Brazil Quim., 19, 145 (1960).
60 (117) Cosh A. C„ Anal. chim. acta., 23, 126 (1960).
60 (118) Malowan L. S., Alegre M., Ciencia (Mexico), 20, 20b (1960).
60 (119) Minami E., Watanuki K, Japan Analyst, 9, 958 (1960).
60 (120) Malkus Z., Horacek J., Prumysl potravni, 11, 43 (1960).
60 (121) Dutt N. K, Sci. and Culture (India) 25, 695 (1960).
60 (122) Matsuo T., Sugawara M., Japan Analyst, 9, 706 (1960).
60 (123) Hansel man R. B., Rogers L. R., Anal. Chem., 32, 1240 (I960)'
60 (124) Hahn F. L„ Z. anal. Chem., 174, 121 (1960).
60 (125) Dwyer F P, Garvan F. L, J. Am. Chem. Soc., 82, 4823 (1960)
60 (126) Eggers J. H., Taianta, 4, 38 (1960).
60 (127) Cottschalk G., Z. anal. Chem., 172, 192 (1960).
60 (128) Cjessing L., Tidsk. Norske Loegeforening, 80, 494 (1960).
60 (129) Gjems O., Analyst, 85, 738 (I960).
343
60 (130) Ефимов И. П., Иванов В. М„ ЖАХ, 15, 750 (1960).
60 (131) Lucchesi С. A., Hirn С. F., Anal. Chem., 32, 1191 (I960)'.
60 (132) Liteanu С., Murgu G., Z. anal. Chem., 175, 1 (1960).
60 (133) Galateanu L, Maxim I., Braun T., Z. anal. Chem., 172, 274 (1960).
60 (134) Lindstrom F., Diehl H„ Anal. Chem., 32, 1123 (1960).
60 (135) Giuffre L., Capizzi F. M., Ann. Chim. (Roma), 50, 405 (1960).
60 (136) Lieber F„ Z. anal. Chem., 177, 429 (1960).
60 (137) Lemberez Y., Storck J., Terlain B., Ann. Pharm. Franc., 18, 285 (1960).
60 (138) Endo Y., Koroki C., Japan Analyst, 9, 993 (1960).
60 (139) Elo A., Polky J. R., Anal. Chem., 32, 294 (1960).
60 (140) Burg R. A., Conaghan H. F., Chem. Anal., 49, 100 (1960).
60 (141) Endo Y., Takagi H., Japan Analyst, 9, 503 (1960).
60 (142) Berbenni P., Boll. Lab. Chim. Provinciali, 11, 249 (I960)'.
60 (143) Duns tone J. R., Madsen N. P., Bell H. R., Analyst, 85, 519 (1960).
60 (144) Davis D. G., Jacobson W. R., Anal. Chem., 32, 215 (1960).
60 (145) Datta S. K-, Chim. analyt, 42, 562 (I960)'.
60 (146) Boxer J., Clin. chim. acta, 5, 82 (1960).
60 (147) Bhattacharyya B. N., Gupta N., Indian J. Appi. Chem., 23, 164 (1960).
60 (148) В e r n d t W„ S a r a J., Taianta, 5, 281 (I960)'.
60 (149) Bruno E., Rass. Chim., 12, 31 (1960).
60 (150) Banyai E., Gere E. B., Erdey L., Taianta, 4, 133 (1960).
60 (151) Бабенышев В. M., Кузнецова О. M.f ЖАХ, 15, 568 (1960).
60 (152) Apple R. F„ White J. C„ Chem. Anal., 49, 42 (1960).
60 (153) Belcher R., Rees D. L, Stephen W. L, Taianta, 4, 78 (1960).
60 (154) Close R. A., West T. S., Taianta, 5, 221 (1960).
60 (155) Close R. A., West T. S„ Anal. chim. acta, 23, 361 (1960).
60 (156) С 1 о s e R. A., We s t T. S., Anal, chim acta, 23, 370 (1960).
60 (157) Antonacci M., Chim. e ind., 42, 375 (1960).
60 (158) Furlani A. D„ Cazz. chim. ital., 90, 1380 (1960).
60 (159) Aoki M., Kimura H., Ymauchi T., Bull. Nagoya Inst. Technol., 13, 260 (1960).
60 (160) Башкирцева А. А., Прудникова Л. Д., Зав. лаб., 26, 1107 (1960).
60 (161) Башкирцева А. А., якимец Е. М., Труды Уральского политехнического института, сб. 94, 1960, стр. ПО.
60 (162) Б а ш к и р ц е в а А. А., Якимец Е. М., Труды Уральского политехнического института, сб. 94, 1960, стр. 117.
60 (163) Khalifa Н., А11 a m М. G., Anal. chim. acta, 22, 421 (1960)
60 (164) Khalifa H., Osman F. A., Z. anal. Chem., 178, 116 (1960).
60 (165) Co cozza E. P., Chem. Anal., 49, 46 (1960).
60 (166) Co cozza E. P., Chem. Anal., 49, 124 (1960).
60 (167) Бусев А. И., Типцов а В. Г., ЖАХ 15, 573 (1960).
60 (168) Бусев А. И., Типцов а В. Г., Изв. вузов, Хим. и хим. технол., 3,
69 (1960).
60 (169) Wakamatsu S., Japan Analyst, 9, 238 (1960).
60 (170) Wakamatsu S., Japan Analyst, 9, 587 (1960).
60 (171) Sen Sarma R. N„ Anal. Chem., 32, 717 (1960).
60 (172) Козлов А. Г., КротН. H., ЖНХ, 5, 1959 (1960).
60 (173) Schmitz B„ Dtsch. Apoth. Ztg., 100, 693 (1960).
60 (174) Sierra F., Sanchez C., Anal. Real. Soc. Espan. Fis. Quim. 56, 5 (1960).
60 (175) Kortum G„ Klin. Wochenschr., 38, 452 (1960).
60 (176) Юрист И. M., Шахова П. Г., Зав. лаб., 26, 1354 (1960).
60 (177) Korkisch J., Z. anal. Chem., 176, 403 (1960).
60 (178) Korkisch J., Z. anal. Chem., 176, 42 (1960).
60 (179) Ince A. D„ Forster W. A, Analyst, 85, 608 (1960).
344
60 (180) Бусев А. И., Типцов а В. Г., Соколова Т. А., ЖНХ, 5, 249 (1960).
60 (181) Бусев А. И., Типцов а В. Г., Изв. вузов. Хим. и хим. технол., 3, 69 (1960).
60 (182) Holasek A., Dugandzic М., Arztl. Lab., 6, 21 (1960).
60 (183) Dugandzic М., Н о 1 a s е k A., Wiener Med. Wochenschr., 110, 460 (1960).
60 (184) Dragusin L, Rev. Chim. (Bukarest), 11, 110 (1960).
60 (185) Holasek A., Lieb H., Pecar M., Mikrochim. acta, 1960, 750.
60 (186) Церкасевич К. В., Аптечное дело, 9, № 6, 32 (1960).
60 (187) Aseni G., ’nf. Quim. Anal., 14, 121 (1960).
60 (188) Raheem A. A., Abd El, Mou stafa A. S., Amin A. A., Z. anal. Chem., 175, 19 (1960).
60 (189) Церковницкая И. А., Кустова H. А., Вестник ЛГУ, Сер. физ. и хим., 15, вып. 30, 148 (1960).
60 (190) Dragusin L., Rev. Chim. (Bukarest), 11, ПО (1960).
60 (191) Корен м ан И. М., Шевякова Ф. Р., Кувшин С. Д., ЖАХ, 15,
36 (1960).
60 (1991 Datta S. К., J. Inst. Ind. Res. (India), 19В, 168 (1960).
60 (193) Beck T„ Gorog S., Acta chim. Hung., 22, 159 (1960)
60 (191) Leonard M. A., West T. S„ J. Chem. Soc., 1960, 866, 4477.
60 (195) Коренман И. M., Шеянова Ф. Р., Кунш ин С. Д., ЖАХ, 15, 36 (I960).
60 (196) Giogolea G., Morait G., Teodorescu N„ Farmacia (Bukarest), 8, 105 (1960).
60 (197) Anderson E., Fors M., Lindgren J. E., Acta chim. scand., 14, 1957 (1960).
60 (198) Holloway J. H., Reilley C. N., Anal. Chem., 32, 249 (1960).
1961
61 (1) Kun du P. C„ Z. anal. Chem., 184, 255 (1961)
61 (2) К u n d u P. C., Naturwiss., 48, 644 (1961).
61 (3) Lada Z., Mlodecka J., Chem. analit. (Warszava), 6, 95 (1961).
61 (4) I v а п о v a L., S i mo v a L., Godischnik Nauchniizled. Inst. Metal. Obogat, 2, 181 (1961).
61 (5) Кручкова E. С., M у с т а ф и н И. С., Зав. лаб., 27, 668 (1961).
61 (6) Schmitz B„ Dtsch. Apoth. Ztg., 101, 1673 (1961).
61 (7) Olsen R. L„ Diehl H., Collins P. E., Ellestad R. B., Taianta, 7, 287 (1961).
61 (8) S c h e i d h a u e r G., Chem. Techn. (Berlin), 13, 93 (1961).
61 (9) S c h e i d h a u e r G.. Jena Rundschau, 4, 147 (1961).
61 (10) Соломин T. А., Фесенко H. Г., Гидрохим. материалы, 33, 128 (1961).
61 (11) Softer N., Analyst, 86, 843 (1961).
61 (12) W iinsch L„ Coll. Czech. Chem. Comm., 26, 1886 (1961).
61 (13) Khalifa H„ Khater M. M„ Z. anal. Clem., 178, 260 (1961).
61 (14) Khalifa H., Khater M. M., Z. anal. Chem., 184, 92 (1961).
61 (15) Sawyer W., Hayes J. F., Austral. J. Dairy Technol. 16, 108 (1961).
61 (16) К a k a b a d s e G., Wilson H. J., Analyst, 86, 402 (1961).
61 (17) Камарицкая И. Д., Фармацевт, журн. (Киев), 16, 31 (1961).
61 (18) Кабанова О. И., ЖНХ, 6, 786 (1961).
61 (19) Pande С S., Sr 'vast a va Т. S., Z. anal. Chem., 184, 248 (1961).
61 (20) St relow F. W. E., Anal. Chem., 33, 1648 (1961).
61 (21) Pribil R., Koros E., Barcza L., Acta Pharm. Hung., 100, 522
(1961).
61 (22) Jenik J., Chem. Prum., 11, 189 (1961).
61 (23) Та на паев И. В., Шевченко Т. В., ЖНХ, 6, 1909 (1961).
61 (24) Veda S., Yamamoto Y.. Wakizaka H., Nippon Kagaku Zasshi, 82, 873 (1961).
23 Зек. 553
345
61 (25) de Sousa A., Chem. Anal., 50, 9 (1961)
61 (26) de Sousa A., Chem. Anal., 50, 76 (1961).
61 (27) de Sousa A., Inf. Quim. Anal., 15, 91 (1961).
61 (28) de Sousa A., Taianta, 8, 686 (1961).
61 (29) de Sousa A., Taianta, 8, 782 (1961).
61 (30) S u n P. J., J. Chinese Chem. Soc. Formosa, 8, 71 (1961).
61 (31) S u n P. J., J. Chinese Chem. Soc. Formosa, 8, 181 (1961).
61 (32) S u n P. J., J. Chinese Chem. Soc. Formosa, 8, 314 (1961).
61 (331 Holasek A., Pecar M.. Clin. chim. acta, 6, 125 (1961).
61 (34) Morris A. G. C„ Anal. Chem., 33, 599 (1961).
61 (35) Hall L. C., Flanigan D. A., Anal. Chem., 33, 1495 (1961).
61 (36) Korkisch J., Anal. chim. acta, 24, 306 (1961).
61 (37) Sangal S. P., Dey A. K., Z. anal. Chem., 183, 178 (1961).
61 (38) Ochynska J., Chem. analit. (Warszava), 6, 261 (1961).
61 (39) S m i t h T. D„ J. Chem. Soc., 1961, 2554
61 (40) Мельникова А. С., Черкесов А. И., Журн. ВХО им. Д. И. Менделеева, 6, 469 (1961).
61 (41) Калюжная Г. А, Халонин А. С., Зав. лаб., 27, 261 (1961).
61 (42) Wallraf М„ Zement-Kalk-Gips, 14, 504 (1961).
61 (43) Mi ch о d J, Ann. Agric. Suisse, 62, 273 (1961).
61 (44) Kristiansen H., Anal. chim. acta, 25, 513 (1961).
61 (45) Skri vanek V., Klein P., Z anal. Chem., 184, 360 (1961).
61 (46) Wakamatsu S., Tatso to Hayane, 42, 612 (1961).
61 (47) Matsui Y., Japan Analyst, 10, 183 (1961).
61 (48) Flaschka H., Taianta, 8, 381 (1961).
61 (49) Flaschka H., Sawyer P., Taianta, 8, 521 (1961).
61 (50) Flaschka H., Ganchoff J., Taianta, 8, 720 (1961).
61 (51) Flaschka H., Ganchoff J., Taianta, 8, 885 (1961).
61 (52) Odler I., Gebauer J., Chem. Zvesti, 15, 563 (1961).
61 (53) Miklos L, Szegedi R., Acta chim. Hung., 26, 365 (1961).
61 (54) Пешкова В. M., Громова М. И., Ефимов И. П., Исаченко А. В., Вестник МГУ, Сер. хим., вып. 59, 1961.
61 (55) Sand Н. F„ Acta Odontol. Scand., 19, 469 (1961).
61 (56) Simova L., Ivanova L., Godischnik Nauchnoizsled. Inst. Metal. Obogat, 2, 177 (1961).
61 (57) R о u s h d i I. M., Abdine H., A у a d A., J. Pharm. Pharmacol., 13, Suppl. 1535 (1961).
61 (58) Терёшин T. С., Тананаев И. В, ЖАХ, 16, 523 (1961).
61 (59) Verma М. R., Agarwal К. С., В ahi J. S., Electroplating, 14, 119 (1961).
61 (60) Rady G., Giimesi O., Erdey L., Acta chim. Hung., 28, 237 (1961).
61 (61) Hara S., Japan Analyst, 10, 629 (1961).
61 (62) Hara S., Japan Analyst, 10, 633 (1961).
61 (63) Liteanu C., Lukacs 1.. Strusivici C., Anal. chim. acta, 24, 200 (1961).
61 (64) Halasz A., J a n о s i A., V i 11 a n у i K-, Vesz. Vegyip. Egyet. Kozlemen,
5, 151 (1961).
61 (65) Palaty V., Chem. and Ind., 1961, 211.
61 (66) I w a m о t о T„ Japan Analyst, 10, 190 (1961).
61 (67) Lovasi J., Femipari Kutato Intezet Kozlemenyei, 4, 385 (1961).
61 (68) Lewis L. L., Nardozzi M. J., Melnick L. M., Anal. Chem., 33, 1351 (1961).
61 (69) Biirger K-, Z. Lebensm-Unters. u. Forsch., 114, 1 (1961).
61 (70) Kemula W., Bra j ter K., Rubel S., Chem. analit. (Warszava), 6, 331 (1961).
61 (71) Kemula W., Bra j ter K-, Chem. analit. (Warszava), 6, 343 (1961).
61 (72) Taka о H., Mush a S., Japan Analyst, 10, 160 (1961).
61 (73) Sangal S. P., Dey A. K., J- Indian Chem. Soc., 38, 75 (1961).
61 (74) Sangal S. P., Dey A. K-, Z. anal. Chem., 178, 415 (1961).
346
61 (75) Арбузов Г. А., Кузнецов А. Р., Павлов Н. Н., Зав. лаб, 27, 225 (1961).
61 (76) Rep as Р., Acta chiin. Hung., 28, 243 (1961).
61 (77) Радько В. А., Якимец Е. М., Зав. лаб., 27, 1464 (1961).
61 (78) Мее J. Е., Corbett J. D„ Chem. Anal., 50, 74 (1961).
61 (79) Палей П. Н„ Сюй Ли-юань, ЖАХ, 16, 51 (1961).
61 (80) Павлов Н. Н., Кузнецов А. Р., Арбузов Г. А., Изв. Высших технол. учебн. завед. легкой пром., 1961, 85.
61 (81) Р о von dr а Р., Pfibil R., Cell. Czech. Chem. Comm., 26, ЗП (1961).
61 (82) Bieber B., Vecera Z., Coll. Czech. Chem. Comm., 26, 2081 (1961).
61 (83) Budesinsky 6., Coll. Czech. Chern. Comm., 26, 781 (1961).
61 (84) Povondra P., Pribil R„ Coll. Czech. Chem. Comm., 26, 2164 (1961).
61 (85) Svoboda V., Chromy V., Korbl J., Dorazil L., Taianta, 8, 249 (1961).
61 (86) Hni lick ova M., Sommer L., Coll. Czech. Chem. Comm., 26, 2189 (ly V
61 (87) Bieber B., Vecera Z., Coll. Czecu. Chem. Comm., 26, 59 (1961).
61 (88) Bieber B., Vecera Z., Anal. Chem. (Czechosl.), 6, 17 (1961).
61 (89) Клыгин A. E., Никольская H. А., Коляда H. С., Завраж-нова Д. M., ЖАХ, 16, ПО (1961).
61 (90) Клыгин А. Е., Коляда Н. С., Завражнова Д. М., ЖАХ, 16, 442 (1961).
61 (91) Клыгин А. Е., Коляда Н. С., Зав. лаб., 27, 23 (1961).
61 (92) Pfibil R., Vesely V., Kratochvil М., Taianta, 8, 52 (1961).
61 (93) Pfibil R„ Vesely V., Taianta, 8, 271 (1961).
61 (94) Pfibil R„ Vesely V., Taianta, 8, 565 (1961).
61 (95) Pfibil R., V e s e 1 у V., Taianta, 8, 743 (1961).
61 (96) Pfibil R., Vesely V., Ta'.anta, 9, 880 (1961).
61 (97) Kratochvil M., В lech a J, Chem. Anal., 50, 11 (1961).
61 (98) P f i b i 1 R., Ve s e 1 у V., Chem. Anal., 50, 73 (1961).
61 (99) P fib il R„ Vesely V., Chem. Anal., 50, 100 (1961)'.
61 (100) Pfibil R., Vesely V., Chem. Anal., 50, 108 (1961).
61 (101) Malat M., M й ck a V., Chem. Anal., 50, 110 (1961).
61 (102) Malat M„ Holecek K-, Chem. Aial., 50, 115 (1961).
61 (103) Ал им арин И. П., Цзэ Ю и ь - с я н, Вестник МГУ, Сер. хим., вып. 59, (1961).
61 (104) Andrew Т. R., Nichols Р. N. R., Analyst, 86, 676 (1961).
61 (105) Bachmann С., Pharm. Praxis, Beilage Pharmazie, 1961, 112.
61 (106) Ashbrook A. W., Ritcey G. M., Analyst, 86, 740 (1961).
61 (107) Baugh C. A., Decker К- H., Palmer J. W., Anal. Chem., 33, 1804 (1961).
61 (108) Chetkowska M., Zosin Z„ Strzeszewska L., Chem. analit. (Warszava), 6, 309 (1961).
61 (109) Лысцова Г. Г., Зав. лаб., 27, 964 (1961).
61 (ПО) Cickers С., Wilkinson J. V., J. Pharm. Pharmacol., 13, 156 Suppl. (1961).
61 (111) Землянский H. И., Драч Б. С., ЖАХ, 16, 653 (1961).
61 (112) Fritz J. S., Abb ink J. E., Payne M. A., Anal. Chem., 33, 1381 (1961).
61 (113) Aikens D. A., S ch muckier G., Sadek F. S., Reilley C. N., Anal. Chem., 33, 1664 (1961).
61 (114) Berndt W. Sara J., Taianta, 8, 653 (1961).
61 (115) Singh B., Sahota S. S., Narang A. S., Z. anal. Chem., 182, 241 (1961).
61 (116) Singh B., Sahota S. S., Gupta M. P., Indian J. Appl. Chem., 24, 78 (1961).
61 (117) Thomann H., Z. anal. Chem., 184, 241 (1961).
61 (118) Hegemann F„ Thomann H., Ber. dtsch. keram. Ges., 38, 345 (1931).
61 (119) Beyermann K., Cretius K., Clin. chim. acta, 6, 113 (1961).
23:
347
61 (120) Brush J. S„ Anal. Chem., 33, 798 (1961).
61 (121) Денисова H. E., Цветкова E. В., Зав. лаб., 27, 656 (1961).
61 (122) Буданова Л. М., Матросова Т. В., Зав. лаб., 27, 661 (1961).
61. (123) Bruno М., Barbieri R., Gazz. chim. ital., 91, 1055 (1961).
61 (124) Borchert О., Pharmazie, 16, 181 (1961).
61 (125) Bachmann C., Pharm. Praxis, Beilage Pharmazie, 1961, 178.
61 (126) Abd-El Raheem A. A., Dokhana M. M., Z. anal. Chem., 180 339 (1961).
61 (127) Cheng K. L., Anal. Chem., 33, 761 (1961).
61 (128) Sajo I., Acta chim. Hung., 28, 253 (1961).
61 (129) Sajo I., Acta chim. Hung., 28, 259 (1961).
61 (130) Бусев А И., ТипцоваВ. Г., ЖАХ, 16, 275 (1961).
61 (131) Бусев А. И., Петренко А. Г., Быковская И. А., Зав. лаб 27, 659 (1961).
61 (132) Бусев А. И., Талипова Л. Л., Иванов В. М, Журн. ВХО им. Д. И. Менделеева, 6, 598 (1961).
61 (133) Sedlacek В. A. J., Fette und. Seifen, 63, 1053 (1961).
61 (134) Sedlacek В. A. J., Z. Lebensm. Unters. u. Forsch., 114, 127 (1961).
61 (135) Cameron A. J., Gibson N. A., Anal. chim. acta, 25, 24 (1961).
61 (136) Cameron A. J., Gibson N. A., Anal. chim. acta, 25, 429 (1961).
61 (137) Iwamoto T., Bull. Chem. Soc. Japan, 34, 605 (1961).
61 (138) Lassner E., Scharf R., Z. anal. Chem., 183, 187 (1961).
61 (139) Lassner E., Scharf R, Chem. Anal., 50, 6 (1961).
61 (140) F il s t i - Mo 1 n a r S., Legradi L., Mag. Kem. Fol., 67, 455 (1961).
61 (141) Legradi L., Analyst, 86, 54 (1961).
61 (142) Vrchlabsky M., Okac A., Coll. Czech. Chem. Comm., 26, 246 (1961).
61 (143) Graske A., Off. Dig. Fed. Soc. Paint. Technol., 33, 855 (1961).
61 (144) L a u x P. G., Chem. Anal., 50, 49 (1961).
61 (145) Dubsky L, Metalloberflache, 15, 13 (1961).
61 (146) Davis D. G., Anal. Chem., 33, 492 (1961).'
61 (147) Ditz J., Z. anal. Chem., 178, 274 (1961).
61 (148) Др агуш ин И., ЖАХ, 16, 611 (1961).
61 (149) Elofsson A., Glastech. Tidskr., 16, 171 (1961).
61 (150) Calle j a J., Fernandez-Paris J. M., Rev. Cienc. Appl., 15, 120 (1961).
61 (151) Wanninen E., Taianta, 8, 355 (1961).
61 (152) Иванова Л., Ежегодник НИИ обогащ. металлов, 2, 167 (1961).
61 (153) Н о z u m i К., М i z u п о К., Japan Analyst, 10, 453 (1961).
61 (154) Aseni-Mora G., Quim. e Ind. (Bilbao), 8, 132 (1961).
61 (155) Wakamatsu S., J. Japan Inst. Metal. Sendai, 25, 265 (1961).
61 (156) Roushdi I. M., Ab dine H., El. Sheltawy A. M., Egypt. Pharm. Bull., 42, 277 (1961).
61 (157) Бусев А. И., Талипова Л. Л., Иванов В. M., Журн. ВХО им. Д. И. Менделеева, 6, 598 (1961).
61 (158) Н е n п а г t С. et М е г 1 i n Е., Chim. analyt., 43, 28 (1961).
61 (159) Н е n n а г t С., Anal. chim. acta, 25, 150 (1961).
61 (160) Hennart C. et Lefevre Y., Taianta, 8, 273 (1961).
61 (161) Hennart C., Anal. chim. acta, 25, 201 (1961).
61 (162) Hennart C., Chim. analyt., 43, 402 (1961); 43, 447 (1961).
61 (163) Kurpiel L, Mojejko J., Przyborowsky L„ Acta Polon. Pharm. 18, 221 (1961).
61 (164) Holasek A., Flaschka H., Springer-Verlag, Wien, 1961.
61 (165) Адамович Л. П., Нападайло И. H., ЖАХ, 16, 158 (1961).
61 (166) В е с k М. Т., В а г d i L., Acta chim. Hung., 29, 283 (1961).
61 (167) Holasek A., Pecar M., Clin. chim. acta, 6, 125 (1961).
61 (168) Lassner E., Scharf R., Chem. Anal., 50, 69 (1961).
61 (169) К e n n e d у J. H., Anal. Chem., 33, 943 (1961).
61 (170) Spauszus S., Hupfer J., Chem. Techn. (Berlin), 13, 750 (1961).
61 (171) Kirby R. E., Freiser H., J. Am. Chem. Soc., 65, 191 (1961).
348
61 (172) Hamaguschi H., Sugisita R., Japan Analyst, 10, 1256 (1961).
61 (173) De S о u s a A., Microchim. acta, 1961, 732.
61 (174) Соломин Г. А., Фесенко H. T., Гидрохим. материалы, 33, 128 (1961).
61 (175) Димитрова М., Машиностроение, 10, 23 (1961).
61 (176) Пешкова В. М., Громова М. И., Ефимов И. П„ Исаченко А. В., Вестник МГУ, Сер. хим., 1961, 59.
61 (177) Hoard J. L., Lind М„ Silverton J. V., J. Am. Chem. Soc., 83, 2771 (1961).
61 (178) Yoshiwaka K-, Mitsui T., Japan Analyst, 10, 723 (1961).
61 (179) de Sousa A., Inf. Quim. Anal., 15, 121 (1961).
61 (180) Hegemann F., Thomann H., Ber. dtsch. keram. Ges., 38, 345 (1961).
61 (181) Полволоцкая T. Л., Мет. и хим. пром-сть Казахстана, Научнотехн. сб., 1961, стр. 64.
61 (182) Н о f m а п J., Casopis lekaru ceskych, 100, 1171 (1961).
61 (183) Cheng К. L„ Anal. Chem., 33, 783 (1961).
61 (184) F 1 a s c h k a H., Taianta, 8,342 (1961).
61 (185) Malat M., Anal. chim. acta 25, 289 (1961).
61 (186) Coates E., Rigg B., Trans. Farad. Soc., 57, 1088 (1961).
1962
62 (1) Phillips J. P., Crowley R. C., Taianta, 9, 178 (1962).
62 (2) Mori K-, Japan Analyst, 11, 689 (1962).
62 (3) Mori K., Japan Analyst, 11, 690 (1962).
62 (4) Wills V„ Stambaugh O. F., Proctor Z. G„ Anal. Chem., 34, 225 (1926).
62 (5) D a 11 a S. K-, S a h a S. N., Chem. Anal., 51, 49 (1962).
62 (6) О н о с о в а С. П., Зав. лаб., 28, 271 (1962).
52 (7) Brady G. W. F.', Gwilt J. R„ J. Appl. Chem. (London), 12, 75 (1962).
62 (8) Божевольнов E. А., Крейнгольд С. У., ЖАХ, 17, 291 (1962).
62 (9) Malissa H., Kotzian H., Anal. chim. acta, 26, 128 (1962).
62 (10) H о в а к о в с к а я Э. Г., Зав. лаб., 28, 30 (1962).
62 (11) С о г s i n i A., Y i h I. М. L., F е г n a n d о Q., F r e i s e r H., Anal. Chem., 34, 1090 (1962).
62 (12) Беликов В. В., Шрайбер М. С., Фармацев. Ж- (Киев), 15, 10, 25 (1961); 17, 7 (1962).
62 (13) Б е г е л ь ф е р К. И., Сазанова П. А., Ф у н т и к о в а К. М.. Стекло и керамика, 19, 30 (1962).
62 (14) Sierra F., Sanchez С., Inf. Quim. Anal., 14,91 (1960).
62 (15) Sierra F., Sanchez C., Anal. Real. Soc. Fis. Quim. B, 58, 223 (1962).
62 (16) Silverstone N. M., Metallurgia, 65, 99 (1962).
62 (17) S t r a f e 1 d a F., Coll. Czech. Chem. Comm., 27, 343 (1962).
62 (18) Cison D. C., Margerum D. W., Anal. Chem., 34, 1299 (1962).
62 (19) Пешкова В. M., Громова М. И., Александрова Н. М., ЖАХ, 17, 218 (1962).
62 (20) Gregory G. R. Е. С., Jefferey Р. G., Taianta, 9, 800 (1962).
62 (21) Geary W. J., Nickless G., Pollard F. H., Anal. chim. acta, 26, 575 (1962); 27, 71 (1962).
62 (22) Foley W. T., Osyany J. M., Chem. Anal., 51, 16 (1962).
62 (23) Doorn bos D. A., Faber J. S., Pharm. Weekbl., 97, 257 (1962).
62 (24) Lindsrtrom F., Stephens B. G., Anal. Chem., 34, 993 (1962).
62 (25) Monk R. G., Steed К. C., Anal. chim. acta, 26, 305 (1962).
62 (26) Flaschka H., Ganchoff J., Taianta, 9, 76 (1962).
62 (27) Flaschka H., Sawyer P., Taianta, 9, 249 (1962).
62 (28) Dixon M„ H e i n 1 e P. J., Humlicek D. E., Mi Iler R. L., Chem. Anal., 51, 42 (1962).
62 (29) Schmid R. W, Chem. Anal., 51, 56 (1962).
62 (30) S u n P. J., J. Chinese Chem. Soc., Formosa, 9, 37 (1962).
349
62 (31) S u n P. J., J. Chinese Chem. Soc. Formosa, 9, 41 (1962).
62 (32) Goldstein G., Manning D. L., Zittel H. E., Anal. Chem., 34, 358 (1962).
62 (33) C a m p b e 11 R. T., Reilley C. N., Taianta, 9, 153 (1962).
62 (34) Spauszus S., Schwarz C., Neue HOtte, 7, 180 (1962).
62 (35) S a n d e r s о n 1. P., W es t T. S., Talanta, 9, 71 (1962).
62 (36) Hamm R. E., Furse С. T., Anal. Chem., 34, 219 (1962).
62 (37) Krijn G. C„ Chem. Weekbl., 58, 127 (1962).
62 (38) Kraft G., Z. anal. Chem., 186, 187 (1962).
62 (39) Klass C. S., Techn. Bull. Reg. Med. Technol., 32, 77 (1962).
62 (40) Снешнова Л. П., Мед. пром-сть СССР, 16, 49 (1962).
62 (41) Kawanata М., Michizuki Н., Kajiyama R., Ishii M., Japan Analyst, 11, 748 (1962).
62 (42) Kawahata M., Michizuki H., Kajiyama R., Watanake M.( Ishii M., Kasaki K., Japan Analyst, 11, 192 (1962).
62 (43) Iwamoto T., Kanamori K„ Anal. chim. acta, 26, 167 (1962).
62 (44) Harmelin M., Chim. anal., 44, 153 (1962).
62 (45) Kitagawa H., Shibata N., Japan Analyst, 11, 358 (1962).
62 (46) Vrchlabsky M., О к a c A., Coll. Czech. Chem. Comm., 27, 492 (1962).
62 (47) J u n e к H., Wittmann H., Mikrochim. acta, 1962, 114.
62 (48) Бусев А. И., Талипова Л. Л., Скребкова Л. M., ЖАХ, 17, 180 (1962).
62 (49) Бусев А. И., Талипова Л. Л., Вестник МГУ, Сер. хим., 17, 63 (1962).
62 (50) Lassner Е., Scharf R., Chem. Anal., 51, 49 (1962).
62 (51) Cheng K. L„ Talanta, 9, 501 (1962).
62 (52) Cheng K. L., Goy dish B. L., Chem. Anal., 51, 45 (1962)
62 (53) Pribil R., Vesely V., Talanta, 9, 23 (1962).
62 (54) Arikawa Y., Kato T., Technol.' Rep. Tohoku Univ., 26, 205 (1962).
62 (55) Socolovschi R., Rev. Chim. (Bukarest), 13, 306 (1962).
62 (56) Giogolea G Morait G., Nguyen H. B., Farmacia (Bukarest), 10, 331 (1962).
62 (57) F it 1 о p J., Blazsek A., Farmacia (Bukarest), 10, 525 (1962).
62 (58) Stefa nat Z., Mikrochim. acta, 1962, 1115.
62 (59) Tsuchiya Y., Japan Analyst, 11, 1176 (1962).
62 (60) Кононенко Л. И., Полуэктов H. С., Зав. лаб.,'28, 794 (1962).
62 (61) Лукьянов В. Ф., Князева Е. М., Зав. лаб., 28, 804 (1962).
62 (62) Юрист И. М. Короткова О. И., Зав. лаб., 28, 660 (1962).
62 (63) Erdey L., Rady С., Gimesi О., Acta chim. Hung., 32, 151 (1962).
62 (64) Торопова В. Ф., Батыршина Ф. M.j Теория и практика полярографического анализа, Кишинев, АН Молд. ССР, 1962, стр. 352.
62 (65) Boase D. G., Foreman J. К-, Drummond J. L., Talanta, 9, 53 (1962).
62 (66) Szelag M., Kozlicka M., Chem. anal. (Warszava), 7, 815 (1962).
62 (67) M a j e r J., S p r i n ge г V., Chem. Zvesti, 16, 633 (1962).
62 (68) Бусев А. И., Типцов а В. Г., Узб. хим. ж., 6, № 3, 24 (1962).
62 (69) Henn art C., Chim. analyt., 44, 7, (1962).
62 (70) Henn art C., Chim. analyt., 44, 8 (1962).
62 (71) Henn art C., Talanta, 9, 97 (1962).
62 (72) Berka A., Busev A. I., Anal. chim. acta, 27, 493 (1962).
62 (73) Ceglarski R., Roman J., Farm. Polska, 18, 327 (1962).
62 (74) Aikens D. A., Reiley C. N., Anal. Chem., 34, 1707 (1962).
62 (75) Khalifa H., Roberts J. E., К h a t e r M. M., Z. anal. Chem., 156, 428 (1962).
62 (76) Даченко О. В., Зав. лаб., 28, 279 (1962).
62 (77) Lassner Е., Scharf R., Chem. Anal., 51, 14 (1962).
62 (78) Юрист Л. M„ Тюков а 3. В., Зав. лаб., 28, 798 (1962).
62 (79) Gimesi О., Rady G., Erdey L., Acta chim. Hung., 33, 381 (1962).
62 (80) Giuffre L. e Capizzi F. M., Ann. Chim. (Roma), 52, 398 (1962).
350
62 (81) Крот Н. Н., Ермолаев Н. П., Гельман А. Д., ЖНХ, 7, 2054 (1962),
62 (82) Gattow G., Schott D., Z. anal. Chem., 188, 10 (1962).
62 (83) Gattow G., Schott D., Z. anal. Chem., 188, 81 (1962).
62 (84) Белковская Ю. И., Труды Института металлургии им. А. А. Байкова, 1962, стр. 244.
62 (85) Elwell W. Т„ Wood D. F„ Metallurgy, 65, 308 (1962).
62 (86) Юрист И. М., Короткова О. И., Зав. лаб, 28, 660 (1962).
62 (87) Pfibil R., Vesely V., Taianta, 9, 23 (1962).
62 (88) Тихонов В. Н., ЖАХ, 17, 422 (1962).
62 (89) Кутейников А. Ф., Бродская В. М., Зав. лаб., 22, 792 (1962).
62 (90) Gimesi О., Rady G., Ei dey L., Period. Polytech., 6, 15 (1962).
62 (91) Терехин Г. С., Тананаев И. В., ЖАХ, 17, 526 (1962).
62 (92) Бусев А. И. Иванов В. М., Типцов а В. Г., Зав. лаб., 28, 799 (1962).
62 (93) Fritz J. S, Abbink J. Е„ Anal. Chem., 34, 1080 (1962).
62 (94) Sajo I., Z. anal. Chem., 188, 168 (1962).
62 (95) К a i m a 1 V. R. M., S h о m e S. C., Anal. chim. acta, 27, 594 (1962).
62 (96) Davies D. T„ White J. C. D., J. Dairy Res., 29, 285 (1962).
62 (97) De Sousa A., Microchem J. Symposium, Ser. 2, 821 (1962).
62 (98) Fabregas R., Prieto A., Garcia C., Chem. Anal., 51, 77 (1962).
62 (99) Johnson N. C. Clin. Chem., 8, 497 (1962).
62 (100) Langer h. G., Boguecki R. F., J. Chem. Soc., 1962, 375.
62 (101) Moeller T., Thompson L. C., J. Inorg. Nucl. Chem., 24, 499 (1962).
62 (102) Pfibil R., Vesely V., Taianta, 9, 939 (1962).
62 (103) Pechanec V., Coll, Czech. Chem. Comm., 27, 1817 (1962).
62 (104) Dragusin I., Rev. Chim. (Bukarest), 13, 103 (1962).
62 (105) De Sousa A., Inf. Quim. Anal., 16, 126 (1962).
62 (106) De Sousa A., Inf. Quim. Anal, 16, 177 (1962).
62 (107) Антонова А. А., Терентьева T. А., Стекло и керамика, 19, 23 (1962).
62 (108) Ueda S., Yamamoto Y., Mur ata K-, Nippon Kagaku Zasshi, 83, 1301 ,.962).
62 (109) Giogolea G., Morait G., Teodorescu N., Greanga S., N i-coara N., Farmacia (Bukarest), 10, 457 (1962).
62 (110) К у саки на Н. П., Якимец Е. М., Труды Уральского Политехнического института, сб. 121, 1962, стр. 91.
62(П1)Нарускевичус Л., Дауксас К., Труды Литовской с.-х. академии, хим. и хим. технол., 2, 5 (1962).
62 (112) Александрович-Мельникова А. С., Изв. вузов, Пищевая техн., 1962, 141.
62 (ИЗ) Гусев С. И., Соколова Е. В., Кожевникова И. А., ЖАХ, 17, 499 (1962).
62 (114) С а ю н М Т. Г и х а н и н а С. П., Зав. лаб., 28, 544 (1962).
62 (115) Бусев А. И., Скреб ков а Л. М., Талипова Л. Л., ЖАХ 17, 831 (1962).
62 (116) Kraft G., Z. anal. Chem., 186, 187 (1962).
62 (117) Ei dey L., Gegus E., Vandorffy M. T„ Mag. Kern. Lap., 17, 277 (19621.
62 (118) Ringbom A., Eklund B., Bergman L., Proc. Sympos. Microchem. Techniques 1961, Interscience Publ., New York, 1962, 797.
62 (119) Vishnu and Srivastava V. K- Current Sci. (India), 31, 330 (1962).
62 (120) Khalifa H., Khater M. M., Z. anal. Chem. 191, 339 (1962).
62 (121) Palacek M., Skalf. Keram., 12, 3 (1962).
62 (122) Dolezal J., Novozamsky I., Zyka J., Coll. Czech. Chem Comm 27, 1830 (1962).
62 (123) Klein P., Skrivanek V., Chem. Prum., 12, 359 (1962).
351
62 (124) Budesinsky В., Bezdekova A., Vrzalova D„ Coll. Czech. Chem Comm., 27, 1528 (1962).
62 (125) E n d о Y., T о m о r i T., Japan Analyst, 11, 1310 (1962).
62 (126) Юрист И. M., Шахова П. Г., Зав. лаб., 28, 1183 (1962).
62 (127) Wolfsberg К-, Anal. Chem., 34, 518 (1962).
62 (128) Hoshino Y., Japan Analyst, 11, 1032 (1962).
62 (129) Hahn R. B„ Ward! A. H., Abstracts, 10, Anachem Conference, Detroit, Oct. 1962.
62 (130) Кононенко Л. И., Полуэктов H. С., Зав. лаб., 28, 794 (1962).
62 (131) V е г е р h J., F fi 1 б р L., Orv. Szetnle, 8, 180 (1962).
62 (132) Omboly V., Derzsi E., Acta Pharm. Hung., 32, 246 (1962).
62 (133) Radovic G. et Blagojevic Z., Farmakefticon Deltion, 2, 187 (1962).
62 (134) Dick J., Ristici J., Acad. Rep. pupul. Romine, Ser. stiint. chim., 269 (1962).
62 (135) V a n d a e 1 C., Ind. chim. belg, 27, 932 (1962).
62 (136) Szekeres L., Kellner A., Pharm. Zentralhalle, 101, 700 (1962).
62 (137) Sen A. B., Srivastava T. S., Z. anal. Chem., 187, 401 (1962).
62 (138) Kiss T. A., Canic V. D., Glasn. Hem. Drustva, Beograd, 27, 5 (1962).
62 (139) H a b e r c e 11 M., Hutn. Listy, 18, 138 (1962).
62 (140) Langer H. G., Boguecki R. F., J. Chem. Soc. (London), 1962, 375.
62 (141) Smith T. D., Nature (London), 196, 1092 (1962).
62 (И2) О n u k i S., U k i g а у a K., Japan Analyst, 11, 1313 (1962).
62 (143) Konishi S., J. Metal Finish. Soc. Japan, 13, 159 (1962).
62 (144) W a k a m a t s u S., Japan Analyst, 11, 1151 (1962).
62 (145) van der Reyd er A. J., van Lingen R. L. M., Z. anal. Chem., 187, 241 (1962).
62 (146) Владимиров Л. В., Шульгина M. Н., Зав. лаб., 28, 548 (1962).
62 (147) Vishnu and Srivastava V. К., Current Sci. (India), 31, 330 (1962).
62 (148) Konrad H., Z. Lebensm.-Unters. u. Forsch., 118, 35 (1962).
62 (149) Божевольнов E. А., Крейнгольд С. У., ЖАХ, 17, 291 (1962).
62 (15C) Божевольнов E. А., Крейнгольд С. У., ЖАХ, 17, 560 (1962).
62 (151) Kirkbright G. F., Stephen W. I., Anal. chim. acta, 27, 294 (1962).
62 (152) Karanov R., Karolev A., Toschewa D., Taianta, 9, 409 (1962).
62 (153) Cheng K. L., Anal. Chem., 34, 1392 (1962).
62 (154) К i m J. H., Rim H. K., Chosum Kwahakwon Tongbo, 3, 13 (1962).
62 (155) Kirkbright G. F., Rees D. I., Stephen W. I., Anal. chim. acta, 27, 558 (1962).
62 (156) Baetsle L., Bengsch E., J. Chrom., 8, 265 (1962).
62 (157) Coates E., Rigg B., Trans. Farad. Soc., 58, 2058 (1962).
1963
63 (1) S a j б I., Taianta, 10, 493 (1963).
63 (2) Bizon P„ Stavino, 41, 223 (1963).
63 (3) Cheng K. L., Microchem. J., 7, 23 (1963).
63 (4) Старостин В. В., Спицын В. И., Силина Т. Ф., ЖНХ, 8 660 (1963).
63 (5) Р я б ч и к о в Д. И., Я о К э - м н и ь, 3 а р и н с к и й В. А., ЖНХ, 8, 338, 641 (1963).
63 (6) Brown W. В., Rogers D. R., Mershad Е. A., Amos W. R., Anal. Chem., 35, 1000 (1963).
63 (7) Blood F. H„ Neber gall W. H., Anal. Chem., 35, 1089 (1963).
63 (8) Володарская P. С., Деревянко Г. H., Зав. лаб., 29, 28 (1963).
63 (9) Flaschka Н., Speights R., Anal. chim. acta, 28, 433 (1963).
63 (10) Flaschka H., Garrett J., Chem. Anal., 52, 103 (1963).
63 (11) F 1 a sc h k a H., C a r 1 e у F. B., Taianta, 11, 423 (1963).
63 (12) К i r b у R. E., F r e i s e r H., Anal. Chem., 35, 122 (1963).
63 (13) Goldstein G., Manning D. L., Zittel H. E., Anal. Chem, 35, 17 (1963).
352
63 (14) Y a m a g u c h i К-, U е п о К., Japan Analyst, 12, 55 (1963).
63 (15) Щека 3. А., С и и я в с к а я Е. И., ЖАХ, 18, 460 (1963).
63 (16) Rogers J R., Brown W. В., Anal. Cliem., 35, 1261 (1963).
63 (17) Pribil R„ Vesely V., Talanta, 10,383 (1963).
63 (18) Datta S. K„ Z. anal. Chem., 195, 22 (1963).
63 (19) В i ech 1 er D. G., Anal., 52, 48 (1963).
63 (20) Ashton A. A., Chem. Anal., 52, 49 (1963).
63 (21) Ash ion A. A., Anal. chim. acta, 28, 296 (1963).
63 (22) Berka A., Z. anal. Chem., 195, 263 (1963).
63 (23) Chapman D., Lloyd D. R., Prince R. H., J. Chem. Soc., 1963, 3645.
63 (24) Kudrunovsk-Pavlikova E., Kvapil M., Weiss D., Rudy, 11, 9 (1963).
63 (25) Nakamoto K-, Morimoto Y., Martell A. E., J. Am. Chem. Soc., 85, 309 (1963).
63 (26) Sawyer D. T., Tackett J. E., J. Am. Chem. Soc., 85, 314 (1963).
63 (27) P f i b i 1 R., V e s e 1 у V., Talanta, 10, 899 (1963).
63 (28) Schwarzenbach G., Schwarzenbach K., Helv., 46, 1390 (1963).
63 (29) Wills V., Stambaugh O. F., Proctor Z. G., Anal. Chem., 35, 257 (1963).
63 (30) De Sousa A., Inf. Quim. Anal., 17, 51 (1963).
63 (31) De S о u s a A., Inf. Quim. Anal., 17 (1963).
63 (32) Poznanski S., Roczn. Technol. Chem. Zywnosci, 9, 17 (1963).
63 (33) T u r i n a S., К r a j о v a n - M a r j a n о v i с V., Z. anal. Chem., 196, 32 (1963).
63 (34) Vetter G., Chem. Techn. (Berlin), 15, 43 (1963).
63 (35) Berka A, Z. anal. Chem., 193, 276 (1963).
63 (36) Hensley A. L., Bergmann J. G., Anal. Chem., 35, 1318 (1963).
63 (37) Lassner E., Piischel R., Mikrochim. acta, 1963, 950.
63 (38) L a s s n e r E., Talanta, 10, 1229 (1963).
-63 (39) Cheng K- L., Goykisch B. L., Anal Chem., 35, 1965 (1963).
63 (40) Blood F. H., Neb er gall W. H„ Anal. Chem., 35, 1089 (1963).
63 (41) Гусев С. И., Кожевникова И. А., ЖАХ, 18, 366 (1963).
63 (42) Y a m a d a T., Japan Analyst, 12, 183 (1963).
63 (43) Конкин В. Д., Жихарева В. И., Зав. лаб., 29, 791 (1963).
63 (44) Кеа ttch C.-J., Talanta, 10, 1303 (1963).
63 (45) Miles Т. D., Hoffman F. A., D e 1 a s a n t a A. C., Am. Dyestuff Rep., 1963, 22.
63 (46) Lacy J., Talanta, 10, 1031 (1963).
63 (47) Scai fe D. B., Analyst, 88, 618 (1963).
63 (48) Рождественская 3. В., Сонгина О. А., Вариков В. Г., Зав. лаб., 29, 30 (1963).
63 (49) L у 1 е S. J., R a h m a n М. М., Talanta, 10, 1177 (1963).
63 (50) L у 1 е S. J., R a h m a n М. М., Talanta, 10, 1183 (1963).
63 (51) К у г s М., С а 1 е t k a R., Talanta, 10, 1115 (1963).
63 ( 52) S к г i v a n ек V., К 1 е i n Р., Rudy (Ргасе), 11, 89 (1963).
63 (53) Buss Н„ Kohlschiitter Н. W.. Preiss М., Z. anal. Chem., 193, 264 (1963).
63 (54) Buss Н„ Kohlschiitter Н. W., Preiss M., Z. anal. Chem., 193, 326 (1963).
63 (55) F u r u у a M., T a j i r i M., Japan Analyst, 12, 288 (1963).
63 (56) Солодовников П. П., ЖАХ, 18, 1026 (1963).
63 (57) В о 11 о n S., J. Pharm. Sci., 52, 858 (1963).
63 (58) P a r u s ch e v M., Khim. Ind. (Sofia), 35, 49 (1963/.
63 (59) Tamura Z., Miyazaki M., Japan Analyst, 12, 561 (1963).
63 (60) Weng Y. K-, L a n С. T., Yao Hsueh Hsueh Pao, 10, 303 (1963).
63 (61) Pribil R., Vesely V., Talanta, 10,233 (1963).
63 (62) Pfibil R., V e s e 1 у V., Chem. Anal., 52, 43 (1963).
63 (63) Елинсон С. В., Побед ина Л. И., Зав. лаб., 29, 139 (1963).
63 (64) Ringbom A., Complexation in Analytical Chemistry, Interscience Pub-lischers, New York, 1963.
353
63 (65) Thomas R. S., Chem. Anal., 52, 6 (1963).
63 (66) Priestley P. T, Analyst, 88, 194 (1963).
63 (67) Priestley P. T., S e b b о r n W. S., S e 1 ni a n R. F., Analyst. 88, 797 (1963).
63 (68) De Sousa A, Inf. Quim Anal., 17, (1963).
63 (69) De Sousa A., Inf. Quim. Anal., 17, (1963).
63 (70) Бусев А. И., Иванов В. M., Талипова Л. Л., ЖАХ, 18, 33 (1963).
63 (71) Ros kam R. Т., de Langen D, Anal. chim. acta, 28, 78 (1963).
63 ( 72) Fur u ya M, Tajiri M., Japan Analyst, 12, 59 (1963).
63 ( 73) R i c h a r d s о n M. L., Taianta, 10, 103 (1963).
63 (74) Toft R. J., E a s t m a n H. W., Me Ke n n у D. В., Chem. Ind. (London), 1963, 1030.
63 ( 75) Yamaguchi K-, Ueno K., Taianta, 10, 1041 (1963).
63 (76) Y a m a gu c h i К., U e n о K., Taianta, 10, 1195 (1963).
63 ( 77) Галактионов Ю. П., Лидин P. А., Астахов К.. В., ЖФХ, 37, 829 (1963).
63 (78) Jacobson Е., KailanO G., Anal. chim. acta, 29, 215 (1963).
63 (79) Strafelda F., Coll. Czech. Chem. Comm., 28, 3345 (1963).
63 (80) Anderegg G., Helv., 46, 1833 (1963).
63 (81) Flaschka H., В u t c h e r J., Microchem. J., 7, 407 (1963).
63 (82) Samuelson O., Ion Exchange Separations in Analytical Chemistry, New York, 1963.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Азин-бис-индандион 80
Азиндибарбитуровая кислота 80
Азокрасители 52 сл., 65
пиридиновые 55
Азокснны 55. 104
Азота соединения, определение 298 сл
Ализарин S 66, 67, 80
Ализаринкомплексон 66, 67, 80
Ализаринмегнлнмиподнуксусная кислота 80
Ализариновый красный S 80, 104
Ализариновый фтор синий 80
Ализариновый хром черный R 56, 80
Ализаринсульфокислота 80
Алкалиметрическое титрование 132
Алкалоиды, определение 286, 289
Алкоксисульфонаты, определение 285
Алый 3R 59, 80
Альдегиды, определение 287
Алюминий
маскирование 136, 138, 140
определение 104, 110, 113 сл., 143 сл., 163.
183 сл.
Алюминон 45, 48, 80, 160. 162
Амальгамные методы 130 сл.
Амидопирин, определение 284, 285, 287
Аминогруппы 52
Аминокислоты, определение 288
Аминополикарбоновая кислота 18 сл.
Э-Аминоэтилмеркаптан 139
Амины вторичные, определение 285
Аммиак, определение 298
Аммиачные комплексы 15
Аммониевые четвертичные основания, определение 285, 286
Аммоний, определение 156
Амперометрическое титрование 113
Аналерген, определение 286
Анализ косвенный 145
Анейрин, определение 286
Анеурнн, определение 286
Анизндинкомплексон 81
Анизидинкомплексон-З.З'-дикарбоновая кислота 81
Анизидинкомплексон-3,3'-дисульфокисло га 81
Антазолина хлоргидрат, определение 286
Антигистамины, определение 286
Антилюизнт, определение 284
Антиоксиданты, определение 287
Антипирин, определение 289
Антранол прочный черный SE 81
Ариназо 58, 71, 105. 143
Арсеназо I 81, 104, 160
Арсониевые основания, определение 286
Аскорбиновая кислота 139, 140, 154
определение 288
Аскорбинпальмитат, определение 287
Ауксохромные заместители 52
Ауринтрикарбоновая кислота 81
Ацетат-ионы 138
Ацетилацетон 138
Ацетилен, определение 284
о Ацил феноле н. определение 285
APANS, см. Торин
Барбитал, определение 285
Барбитураты, определение 285, 287
Барий
маскирование 136
определение 104, НО, 112, 116, 177 сл., 181 сл,
Бензаурин 44, 81
производные 50
Бензгидроиламид 81
Бензгидроксамовая кислота 41, 81
Бензидин 78 сл., 81
производные 74
Бензидиикомплексон-2,2'-дикарбоновая кислота 81
Бензо синий FBL 81
2-Бензотиазолтиол, определение 284
Бериллий, определение 158
Бериллон II (DSNADNS) 59, 81, 83
Биндшедлера зеленый 76 сл., 81, 143
продукт разложения 82
Ы,Ь1'-Бис-(2-оксиэтил)-дитиооксамид 70, 81
Ы,Ы'-Бис-оксиэтилрубеановая кислота 81
Бор, определение 182
Бриллиантовый ализариновый черный SN 81
Бриллиантовый конго синий 81
Бриллиантовый конго синий BFL 81
Бриллиантовый прочный синий FB 81
Бриллиантовый хром синий 8RL 81
Бромоформ, определение 285
Бромпирогаллоловый красный 50, 51, 81
Бромфеиоловый синий 45
Бруцин, определение 286
Бутилоксианизол, определение 287
Буферные смеси 153
ВТ, см. Эриохром черный Т
Ванадий
маскирование 140
определение 114, 142, 212 сл
Вариаминовый синий 76 сл., 81
Вариаминовый синий В-основание 79 81
Висмут, определение 104 сл., ПО, 114, 115, 122, 132, 142 сл., 307
Воды жесткость, определение 37, 104, 112, 170, 173
Вольфрам
маскирование 138, 140
определение 129, 225 сл.
Восстановители 154
Восстановление амальгамой 131
Высокочастотное титрование 112
Галлаты, определение 287
Галлеин 81, 142
Галлий, определение ПО, 114, 138, 273 сл.
Галлион 57, 81
Галоцианин 51, 81
Галогены, определение 129, 281, 319
Гафний, определение 202 сл.
Гексаметиленимин, определение 285
Гематоксилин 67, 81
Германий, определение 290
Гидразин, определение 287, 298, 299
Гидразин сернокислый 140
Гидроксил-ноиы 137
Гидроксиламин 139, 154
определение 287, 298
Гидроксокомплексы 29
Гидрон I 81
355
Гипофосфит, определение 303
Глпоксаль-бис-(2-оксианил) 70, 81, 162
Глициннафтоловый фиолетовый GNN 56, 81
Глицинтимоловый синий 48, 81
Глюкоза, определение 287
D-Глюкозамин, определение 288
Гриньяра^ соединение, определение 289
HHSNN, см 2-Окси-4-сульфо-(1-азо'1,)'2г’ окси-З'-нафтоймая кислота
Демаскирование 140
Демаскирующие вещества 154
Диазокрасители 54
Р,£'-Диамииодиэтилгликолевый эфир-
Ь^К.ЬГ.К'-тетрауксусная кислота 19
значение ctj-j 24
растворы 150
устойчивость комплексов 20
транс - 1,2 - Ди аминоциклогексантетрауксус -ная кислота 19
значение <Xpj 24
определение 115
растворы 150
устойчивость комплексов 20
о-Ди анизидинком плексон 74, 81
Диацетилен, определение 285
Д ибромпирогаллолсульфофта леин 81
Днваскол, определение 286
Днкетоны вицинальные, определение 285
Димеркаптопропанол 139, 154
Диметил а мино антипирин, определение 287
З.З'-Диметилнафтидин 78 сл., 81
О,ог-Диоксиазокрасители 52, 53
1,4-Диоксиантрахинон 81
1,2-Диоксибензол 4,6-днсульфокислота 81
Дноксимы, определение 285
3,3'-Диоксифлуоресценн 81
Дисульфонафтнл - азо - 8 - оксихинолинсульфокислота ((З-Нафтилазоксин 2S) 63, 82
Дитизон 65, 81, 154
растворы 152
Дитиооксальоксиэтиламид 81
Дифенгидрамина хлоргидрат, определение 286
Дифениламин, производные 76
Дифенилкарбазид 78, 81
Ди феи ил карбазон 78, 81
Дифенилтиокарбазои 81
Днфенилформазоны 65
Дихлордноксибензохинон 81
Диэтилдитиокарбамат 136, 154
Диэтилентриаминпентауксусная кислота 19
значение 24
растворы 150
устойчивость комплексов 20
DSNADNS, см Беррилои II
ЕВТ, см. Эриохром черный Т
Железо
демаскирование 141
маскировацие 137, 139
определение 104, 105, 114, 122, 138, 142, 143, 163, 223 сл.
Жирные кислоты, определение 284
Золото, определение 129, 259
Изоникотииовой кислоты гидразид, определение 287
4-Изопропилфеназон, определение 284
Индий
максирование 138
определение ПО, ИЗ, 115, 142, 275 сль
Н-Индикатор (Кальцихром) 81
Индикаторы 40 сл.
металлофлуоресцентные 71 металлохромные 43 сл., 84 номенклатура 79 сл.
образующие слабоокрашенные комплексы с металлами 40 сл.
окислительно-восстановительные 75 сл.
растворы 152
смешанные 96 сл.
флуоресцентные 70 сл.
чистота 79 сл.
рН-Индикаторы 84
рМ-Индикаторы 84
Индикация конечной точки 98 сл.
оптимальные условия 102
по наклону кривых титрования 99, 104
по ступеням 99, 105
с помощью внутреннего индикатора 99
----прибавленной самоинднцирующей системы 101
фотометрическая ЮЗ
Иодид-ионы 43. 81, 139
определение 320
Ионный обмен 135
Иттрий, определение 116, 193
Кадмий
демаскирование 141
маскирование 137, 138, 139
определение 104 сл., ПО. 112, 132, 139, 142, 268 сл.
Какотелин 77, 81
Калий, определение 156
Калмагит 54, 56, 81, 160, 168
константы 90
Калькой 54, 58, 81
константы 91
Кальконкарбоновая кислота 81
Калькохром черный 81
Кальцеин 51, 72, 80, 81, 83
Кальцеин синий 81
Кальцеин W 81
Кальцеиновый синий (4-Метилумбеллнферон) 73, 83
Кальций
маскирование 136
определение 103 сл., ПО, 112, 115, 116, 117, 129, 140, 142 сл., 144, 159 сл., 161 сл., 172, 174
Кальцихром 61, 80, 81
Кампеш, синий сандал 81
Каптакс, определение 284
Карбоксигруппа 45
определение 288
Карбон ат-ионы 137
определение 281
Карминовая кислота 66, 67, 81
Катехнновый фиолетовый 81
Кверцетин 67, 81, 106
Кислород, определение 311
Н-Кнслота 162
Кислотный ализариновый красный В 81
Кислотный ализариновый фиолетовый 81
Кислотный ализариновый черный R 81
Кислотный ализариновый черный SE 59, 81
Кислотный ализариновый черный SN 59’ 81,
162
Кислотный хром зеленый 81
Кислотный хром красный В 81
Кислотный хром сние-черный 81
Кислотный хром сииий 81
Кислотный хром синий К 57, 81
Кислотный хром синий 2R 81
Кислотный хром синий RRA 81
Кислотный хром темно-синий 57, 81
Кислотный хром фиолетовый 81
Кислотный хром фиолетовый В 57, 81
Кислотный хром черный NSA 81
356
Кислотный хром черный S 81
Кобальт
маскирование 139, 140
определение 105, ПО, 112, 113, 117, 122, 129, 138, 142, 240 сл.
Кодеин, определение 286
Кодеина фосфат, определение 289
Комплексонаты 23 сл.
растворы 151
Комплексообразование 13 сл.
Комплексообразующие вещества, вспомогательные 27
Кондуктометрическое титрование 111
Константа (ы)
индикатора 85, 88
концентрационные 19, 24
эффективная 24 сл., 32
Коринф С А 81
Кофеин, определение 285, 286
Кошениль 67
Красители
протравные 79
трифенилметановые 44
«экранирующие» 96
Краситель (реактив) Паттона и Ридера 81
о - Крезолсульфофталеин - бис - метнлими-нодиуксусная кислота 81
о - Крезолсульфофталеин - монометилимино-днуксусная кислота 81
Крезолфталеин 47
о-Крезолфталеннкомплексон 81
о-Крезолфталексон 81
Кремневая кислота, определение 289 сл.
Кремний, определение 289 сл.
Кривые
перехода окраски 92 сл.
титрования комплексонометрического 30 сл.
— кондуктометрического 111
— обратного 123
— термометрического 117
Ксантон, производные 73
Ксиленоловый оранжевый 46, 48, 81, 104, 143 растворы 152"
Кулонометрическое титрование 115
Кумарин, производные 73
Cai-Red 54, 58, 83
Лаковый алый (пурпуровый) С 56. 82, 160, 162
Лантан, определение ИО
Лантаноиды, определение 138, 139, 143, 193
Ларусан, определение 286
Лептазол, определение 284, 286
Литий, определение 154
Люмогаллнон 82
Магнезон 56, 82
Магний
маскирование 136, 138
определение 103 сл., ПО, 112 сл.» 117, 118, 140, 142 сл., 145, 159 сл., 171 сл.
Магнийгалоидорганические соединения, определение 289
Марганец
маскирование 138, 139
определение ПО, 112, 114, 138, 139, 142, 143, 145, 163, 229 сл.
Маскирование 135 сл.
кинетическое 140
комплексообразованием 136
окислительно-восстановительное 139
осаждением 136
Маскирующие вещества 154
Медь
демаскирование 141
маскирование 138, 139
определение 104, 105, 110, 112 сл., 116 сл.. 140, 142, 143, 251 сл.
Мезобарбитал, определение 285
З-Меркаптопропионовая кислота 139
Металлорганическне соединения, определение 289
Металлфталеин 47, 48, 50, 82, 87 сл.
интенсивность окраски 94
константы 90
растворы 152
Метасистокс-1, определение 289
Метафосфат, определение 302
Метахром бриллиантовый синий 8RL 82
Метиленглициновая группа 54
Метнленимннодиацетатная группа 45, 54, 79
Метилкальцеин 51, 72. 82
Метилкальцеии синий 74, 82
8-Метилкофеин, определение 285
5-М етил -4- (2-п и риди л а зо) - резорци н 82
Метнлтимоловый синий 48, 82, 143, константы 90
4-Метилумбеллиферон (Кальцеииовый синий) 73
Метилфталексон 82
4-Метоксн-4'-аминоднфениламин (Вариаминовый синий В-основанне) 76
Метомега хром синий 2RL 82
Метомега хром темный BLS 82
Метомега хромцианнн BLL 82
Миндальная кислота, производные 284
Молибден
маскирование 140
определение 104, 129, 222 сл.
Монооксимы, определение 285
Морин С 67, 71, 82
Морфин, определение 286
Муравьиная кислота 140
Мурексид 68, 82, 87 сл., 103, 104, 142
константы 91
переход окраски 93
растворы 152
Мышьяк, определение 304
Наркозин, определение 286
Натрий, определение 128, 154 сл.
Нафтарсон 82
Нафтидин 82
а-Нафтилазоксии 62, 82
р-Нафтилааоксин S 63, 82
Р-Нафтил азоксин 2S 63, 82
а-Нафтилазоксинсульфокислота 63, 82
а-На фтнл азоокси хинолин 82
Нафтоловый пурпуровый 66, 67, 82, 104
Нафтоловый фиолетовый 57, 82
Неодим, определение 116
Неоторин 82
Ниагара бриллиантовый синий BFL 82
Ннкель
маскирование 138 сл.
определение 104, ПО, 112, 113, 115 сл., 129,
140, 142, 244 сл.
Никотинамид, определение 284
Никотиновой кислоты эфиры, определение 284
Нингидриновый краситель 69, 82
Ниобий
маскирование 138
определение 215 сл.
Нитрилотриуксусная кислота 18
значение ctpj 24
растворы 150
устойчивость комплексов 20
Нитрогруппа, определение 288
Нитрозогруппа, определение 288
а-Нитрозо-Р-нафтол 68
Ннтрозо-Р-соль 68, 82
Нитрозофенолы 68
Нитрозо-хромотроповый 8В 82
Ннтрозо SNADNS 59, 82
Нордигидрогваяретовая кислота, определение 287
NAS(SNAZOXS) 63, 83
357
Окислители 154
Окраски переход 94
Оксиантрахиноны 67
2-Оксибензойная кислота 82
Оксигруппа 45, 52
о-Окси-о'-карбоксиазокраснтели 53
а-Оксикислоты, определение 288
Оксин, см, 8 Окснхинолин
З-Окси-2-нафтойная кислота 42, 72, 82, 143
Оксинсульфокислота 82
2-Окси-4-сульфо- (1-330-1') -2'-окси-3'-нафтой-ная кислота 80, 83
2-Окси-5-сульфобензойная кислота 82
Оксисульфо-к-нафтилазоксин 62, 82
8-Оксихинолин 55, 71 сл , 82
определение 287
8 Оксихинолнн-5-сульфокислота 71 сл., 82
Оксихиноны 66
Олеиновая кислота, определение 284
Олово
маскирование 137
определение 290
Омега хром зеленый F 82
Омега хром красный В 82
Омега хром прочный синий В 82
Омега хром прочный синнй 2G 58, 82
Омега хром сине-зеленый BL 162
Омега хром сине черный В 82
Омега хром синий GFS 82
Омега хром темно-красный (гранатовый) 56,
82
Омега хром темно-фиолетовый D 82
Омега хром фиолетовый В 82
Омега хром черный Р 82
Омега хром черный Т 82
Органические соединения, определение 282,
310
Осаждения реакции в сочетании с комплек-сонометрией 128
Ошибка титрования
обратного 123
прямого 123
селективного 127
Пал этиновый хром зеленый 82
Палатиновый хром фиолетовый 82
Палатиновый хром черный S 82
Палладий, определение НО, 129, 251
ПАН. см Пиридилазонафтол
ПАО, см Пиридилазоорсин
Папаве.рин, определение 286
ПАР, см. Пиридинайорезорцин
Паттона и Ридера краситель (реактив) 81
Пептиды, определение 288
Перекись водорода 139, 154
Пероксодисульфат калия 154
Перхлорат, определение 320
Пиперазин, определение 286
Пирамидон, определение 285, 287
П и ри ди л азодиокси на фт алинсул ьфокис лот а
(PADNS) 62, 82, 83
Пиридилазо-Н-кислота (РАНА) 62, 82 сл
Пиридил азо-Р-кислота 82
Пи риднлазоксин 63, 82
Пиридилазонафтол (ПАН) 54, 55, 82, 143, 144
константа 91
растворы 152
Пиридилазоорсин (ПАО) 61, 82, 83
Пиридилазорезорцин (ПАР) 55. 61. 82
константы 91
Пиридин, определение 286
Пнридиназохромогроповая кислота (РАСА)
62. 83
Пи рога л лол карбоновая кислота 162
Пирогаллоловый красный 50, 51, 82
Пирогаллолсульфофтзленн 82
Пнрогаллолфталеин 82
Пирокатехин, определение 287
Пирокатехнндисульфокислота 82
Пирокатехнновый фиолетовый 46, 48, 50, 89 104, 143
константы 90
растворы 152
Пирокатехннсульфофталеии 82
Пирофосфат-ионы, определение 128 302, 304
Плазмокоринф В 82
Платиновые металлы, определение 248
Плутоний, определение 197
Полиамины 16
комплексы 15
Потенциометрическое титрование 106
Поттннг черный PV 82
Пропилгаллат, определение 285
Прочный протравной синий 82
Прочный сульфоновый черный F 60. 82
Прочный темно-синий 2Р 82
6-Пуринтиол, определение 285
Пурпуреат аммония 82
Пурпуровая кислота 82
РАСА, см. Пиридиназохромотроповая кислота
PADNS, см. Пиридилазодноксинафталннсуль-фокислога
РАНА. см. Пиридилазо-Н-кислота
Радиометрическое титрование 117
Разделение 135
Распределения коэффициент 24, 27 сл.. 32 сл.
Редкоземельные элементы, определение 104. 105, 113
Рений, определение 233
Роданид-ионы 41, 82
определение 130, 316, 320
Роднзоновая кислота 66, 67, 82
Ртуть
демаскирование 141
маскирование 139, 140
определение ПО, 113 сл., 144, 270 сл.
Рубидий, определение 156
Салициловая кислота 41, 82, 143, 144
Самоинднкация 99 сл., 104
с помощью избытка индикатора 100
Сахара, определение 287
Свинец
маскирование 139
определение 104. НО, 113, 114, 116, 117,
129, 142 сл., 293
Связь двойная (С=С), определение 288 Селективность определения 34 сл , 134 сл.
Селен, определение 316
Семиксиленоловый оранжевый 48, 82
Сера и ее соединения, определение 311
Серебро, определение 129, 132, 257
Скандий, определение 105, ПО, 192
Соли металлов, растворы 151
Солохром прочный серый RA 82
Солохром прочный синий В 82
Солохром прочный темный 2R 82
Солохром прочный фиолетовый В 58, 82
Солохром темно-снний В 82
Солохром фиолетовый R 82
Солохром черный AS (илн А) 82
Солохром черный 6BN 82
Солохром черный RN 82
Солохром черный WDFA (или Т) 82
Спирт, определение 285, 288
Стильбазо (R) 60, 82
Стильбена производные 74
Стрихнин, определение 286
Стронций, определение 104, ПО, 112, 116, 118.
177 сл 179, 182
Сукцинилхолин, определение 286
Сульфаниловая азо хромотроповая кислота 82
Сульфат-ионы 136
определение 129, 312 сл.
Сульфид ионы 136
определение 312
Сульфид натрия 170
358
Сульфит натрия 154
Сульфогруппа 45
Сульфонамиды, определение 285
Сульфо- а -нафтилазооксихинолинсульфокис-лота 82
Сульфо- Р -нафтилазооксихинолинсульфокислота 82
Сульфонафтолазорезорцин 56, 82
Сульфосалициловая кислота 41, 82, 138, 143
Сульфофталеины 45
Сурьма, определение 306
SNADNS(SNADNS-4) 59, 83
SNADNS-4(SNADNS) 83
SNADNS-5 59, 83
SPADNS 57, 83, 104
SNAZOXS(NAS) 63, 83
Таллий
демаскирование 141
маскирование 140, 144
определение 277 сл.
Тантал
маскирование 138
определение 215 сл.
Тартрат-ион 138
Теобромин, определение 284
Теофиллин, определение 284, 286
Термометрическое титрование 117
N,N,N,N' -Тетра- ((3-аминоэтил) -этилендиамин 14
Тетраоксибензохинон 82
Тиозолилазокрезол (ТАС) 64, 82, 83
Тиазолилазонафтол (TAN) 64, 83
Тиазолил азонафтолсульфокислота (TAN 6-S) 55, 64, 83
Тиазолилазоорсин (ТАО) 64, 83
Тиазолилазорезорцин (TAR) 63, 83
Тиазолил азофенолы 55
Тиамин, определение 286
Тимоловый синий 45
Тимолсульфофталеин - бис - метилиминоди-уксусная кислота 83
Тимолфталеин 45, 47
Тимолфталеин - бис - метилиминодиуксусная кислота 83
Тимолфталеин комплексон 83
Тимзлфгалексон 48, 83
хиогликолевая кислота 139
Гиомочевина 43, 83, 138
Гиосалициловая кислота 83
Гиосемикарбазид 139
Гиоспазмин, определение 286
Гиосульфат-ионы 139
Гиоцнанат 83
Гирон 41, 83, 144, 154
растворы 152
"итан
маскирование 139
определение 104, 114, 145, 163, 198 сл.
итрование
обратное 121
по методу вытеснения 123
последовательное 141
прямое 119
селективное 125 сл.
суммы ионов 125 точность 119 сл. рий
демаскирование 141
маскирование 137, 138
определение 104. 105. ПО, 113 сл., 122, 143, 208 сл.
>рин (APANS) 56, 83
>рон 83
Зронол 83
Зчность методов титрования 119 сл.
Р '.(У'-Триаминотриэтиламин 14
Ттеленамина хлоргидрат, определение 286
Тшолифосфат, определение 302
Триазокрасители 54
Триэтаноламин 140, 154, 170
ТАС. см. Тиазолилазокрезол
TAN, см. Ти» юл ил 4 зои а фтол
TAN-6-S, см. Гиазолилйзо нафтсыц финне-лота
ТАО. см Тиазол ил дзоорсин
TAR, см Тиазолилазорезорцин
Углекислота, определение 281
Углерод и его соединения, определение 281 ел.
Умбелликомплексон 73, 83
Умбеллиферронметилимнноднуксусная кислота 83
Унитиол 139
Уран
маскирование 137
определение 114, 226 сл
Уротропин, определение 285, 287
Феназо черный SA 83
о-Фенантролин 138
Фенетидинкомплексон 74, 83
Фенетидинкомплексон- 3,3' -дисульфокисло га 83
Фенобарбитал, определение 285
Феноловый красный 45
Фенолсульфофталеин-3,3'-дикарбоновая кислота 83
Фенолфталеин 45
Флексацил, определение 287
Флуорексон, см. Кальцеин
Флуоресцеин 51, 106
Флуоресцеин-бис- метилиминодиуксусная кислота 83
Флуоресцеинком плексон, см. Кальцеии
Формазаны 65
Формальдегид 154
Фосфат ионы 136
определение 128, 299. 303
Фосфониевые основания, определение 285
Фосфор, определение 299
Фотометрическое титрование 98
Фталеннкомплексон 104, 162
Фталеиновый пурпуровый 83
Фталеины 45
Фтор, определение 317
Фторид-ион 136. 137
Фторнд натрия 154
Функциональные группы, определение 288
Хелидонин, определение 286
Хинизарин 66, 83
Хинин, определение 284, 286, 287
Хинин солянокислый, определение 286
Хлор алый драт 154
Хлораниловая кислота 66, 67, 83
Хлорат, определение 320
Хлорид, определение 319
Хлорпирамин. определение 286
Хлорпромазин, определение 287
Хронопотенциомегрическое титрование 116
Хром
маскирование 138, 140
определение НО, 122, 144, 217 сл.
Хром бордо В 56, 83
Хром коричневый BR 56, 83
Хром красный В 83
Хром прочный красный В 83
Хром прочный синий 2В 83
Хром прочный синий FB 83
Хром прочный синий RLL 57, 83
Хром прочный темно-синий R 83
Хром прочный фиолетовый 83
Хром прочный черный А 83
Хром прочный черный PY 83
Хром сине-черный В 83
Хром енннй 2R 83
359
Хром фиолетовый 56. 90
Хром черный Т 83
Хромазурол S 83, 104
Хромоген черный 83
Хромоген черный EAG (или ЕА) 83
Хромоксан зеленый 160
Хромоксан зеленый GG 48, 83
Хромотроп 8 В 83
Хромотроп 2С 57, 83
Хромотроп 2R 57, 83
Хромотроп красный 2R 83
Цезий, определение 156
Церий, определение 113
Цианид-ионы 139
определение 129, 281, 320
Цианид калия 154, 170
Цианидные методы 129
Циклобарбитал, определение 285
Цинк
демаскирование 141
маскирование 138, 139
определение 104 сл., ПО, 112 сл„ 139, 140, 142, 143, 259 сл.
Цинкон 65, 83
константы 91
Цирконий, определение 104, 114, 115, 143, 202 сл.
Цистеин 139, 140
Цитрат-ионы 138
Черный для шерсти N 83
Черный Т, см. Эриохром черный Т
Щавелевая кислота, эфиры и хлоргидраты, определение 284
Щелочноземельные металлы, определение 110, 139, 157
Экстракция 135
«Энтальпнческое» титрование 117
Эрио 80
Эрио А 54, 58, 83
константы 91
Эрио В 59, 83
константы 91
Эрио R 83
Эрио SE 54, 57, 83
Эрно Т, см. Эриохром черный Т
Эриохром SE, константы 90
Эриохром зеленый Н 57, 83
Эриохром красный В 55, 64, 83
Эриохром красный РЕ 83
Эриохром сине-черный В 83
Эриохром сине черный R 83
Эриохром сине черный RSS 83
Эриохром синий 2RL 83
Эриохром синий SE 83
Эриохром темно синий BRL 58, 83
Эриохром фиолетовый 57, 83
Эриохром фиолетовый В А 83
Эриохром черный А 83
Эриохром черный PW 58, 83
Эриохром черный SR 83
Эриохром черный Т 52 сл., 54, 59, 79, 80, 83,
85, 104, 143
константы 91
переход окраски 92
растворы 152
Эриохром азурол S 48, 83
константы 90
растворы 152
Эриохромцианин R 46, 48, 83
Этнлгаллат, определение 285
Этилендиамиитетрауксусная кислота 18
значение ац 24
определение 115
растворы 147
установка титра 148 сл.
устойчивость комплексов 20
Эуфиллнн, определение 286
Эффект комплексообразования 14 сл.
Яркий коиго синий 60, 83
ГЕРОЛЬД ШВАРЦЕНБАХ, ГЕРМАН ФЛАШКА
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Издательство „Химия", М., 1970 г.
360 с. УДК 543.244.6
Редактор О. И. Любомирова Технический редактор В. М. Скитина Художник Ю. М. Сигов Корректор М. С. Хрипунова
з. Подписано к печати 28/VIII 1970 г. Формат бумаги бОХЭО'/щ.
ПеЧ. л. 22,5. Уч.-изд. л. 27,54. Тираж 10000 экз. Типогр. бум. № 2.
Цена 1 р. 88 к. Тем. план 1970 г., № 14. Зак. № 553. »2
Ордена Трудового Красного Знамени
Ленинградская типография № 2 имени Евгении Соколовой Главполнграфпрома Комитета по печати при Совете
Министров СССР. Измайловский проспект, 29.