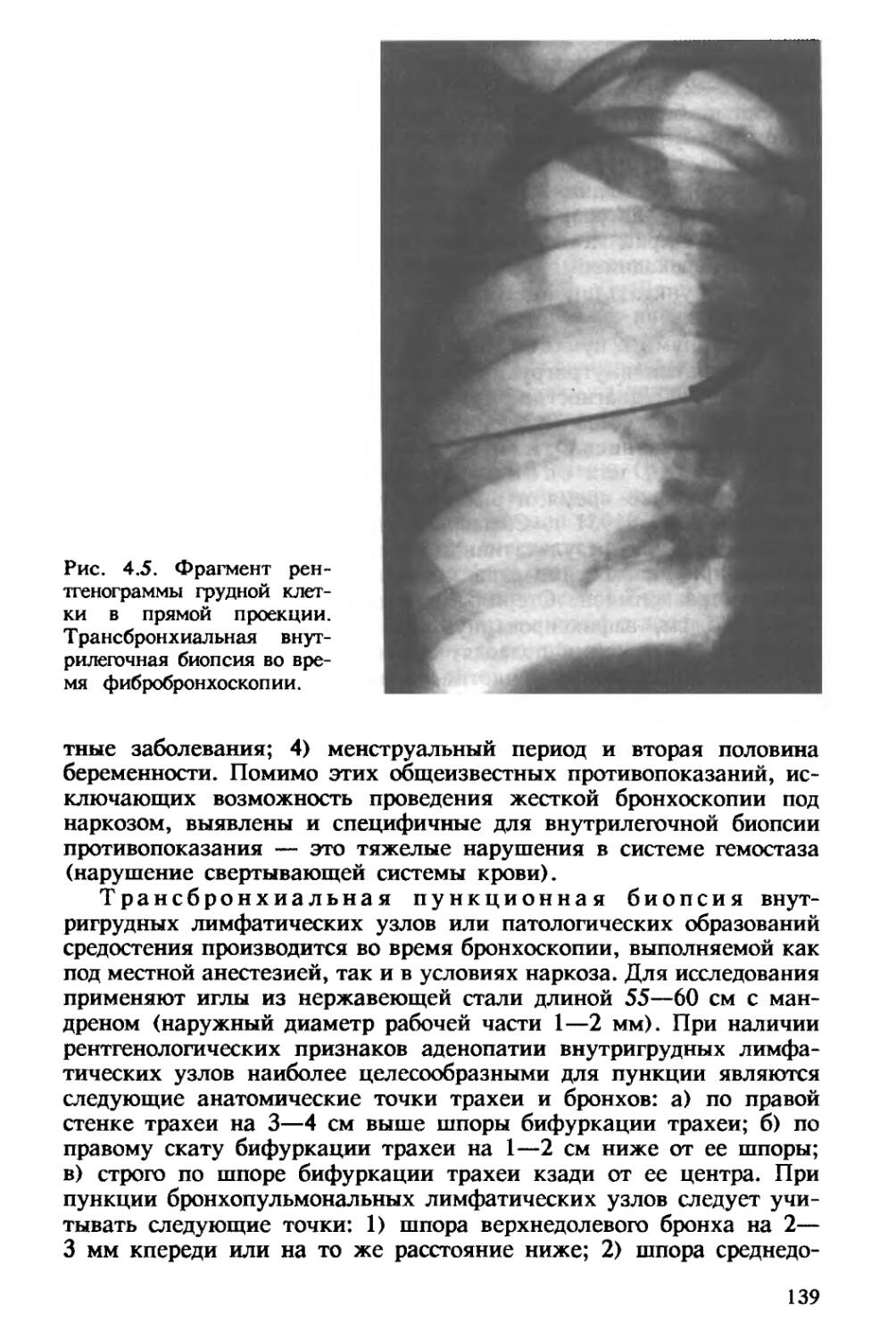
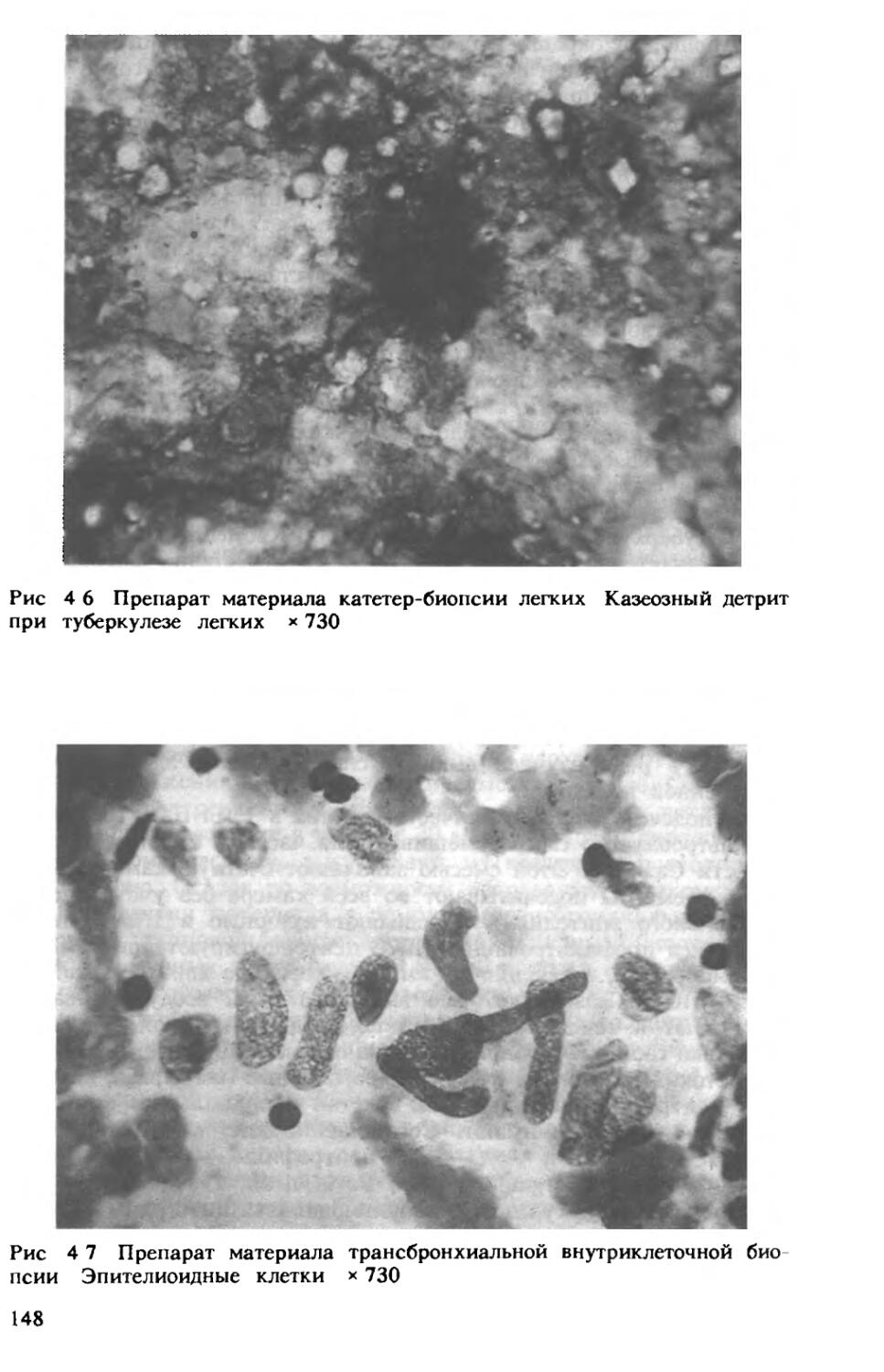
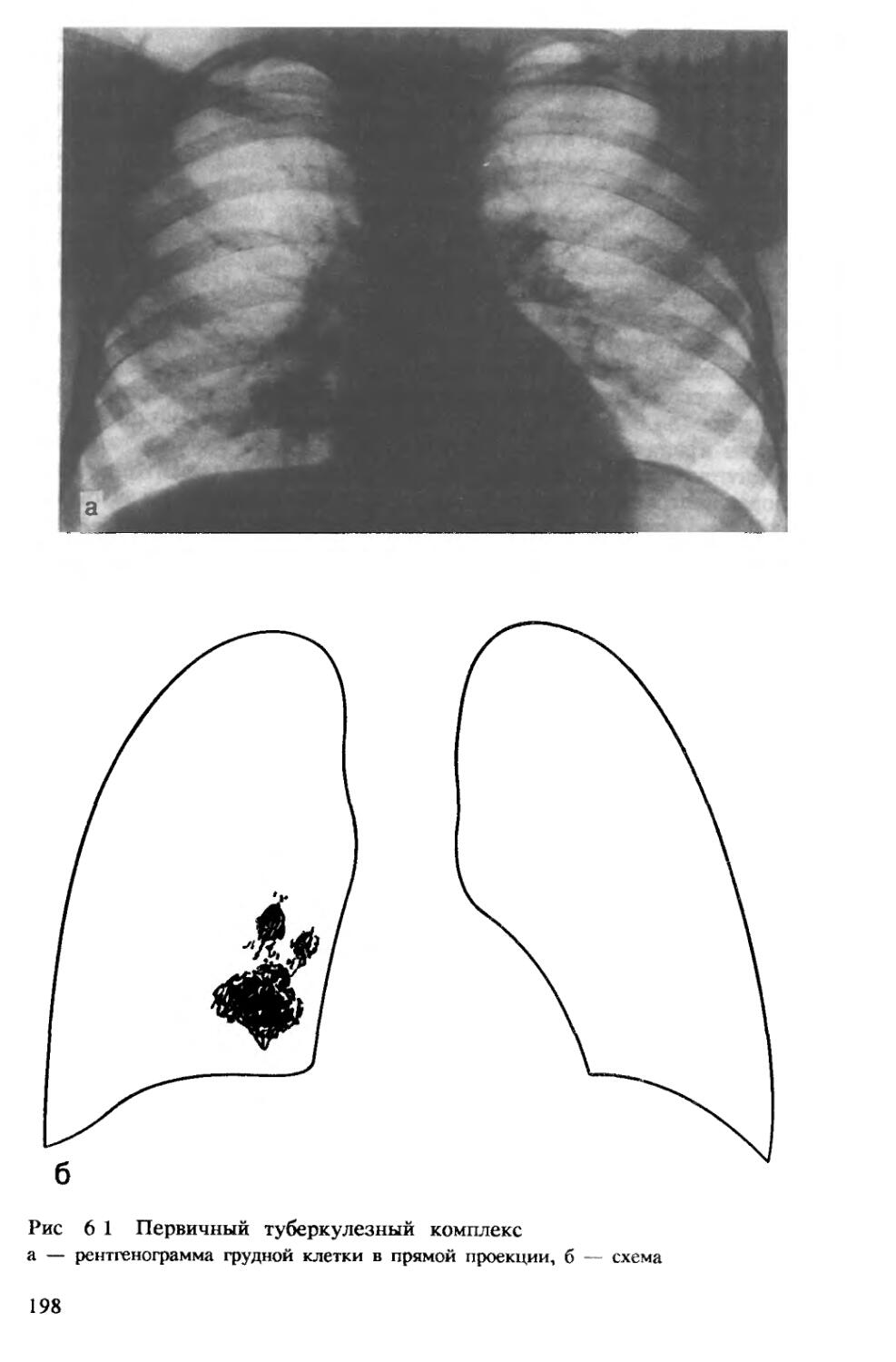
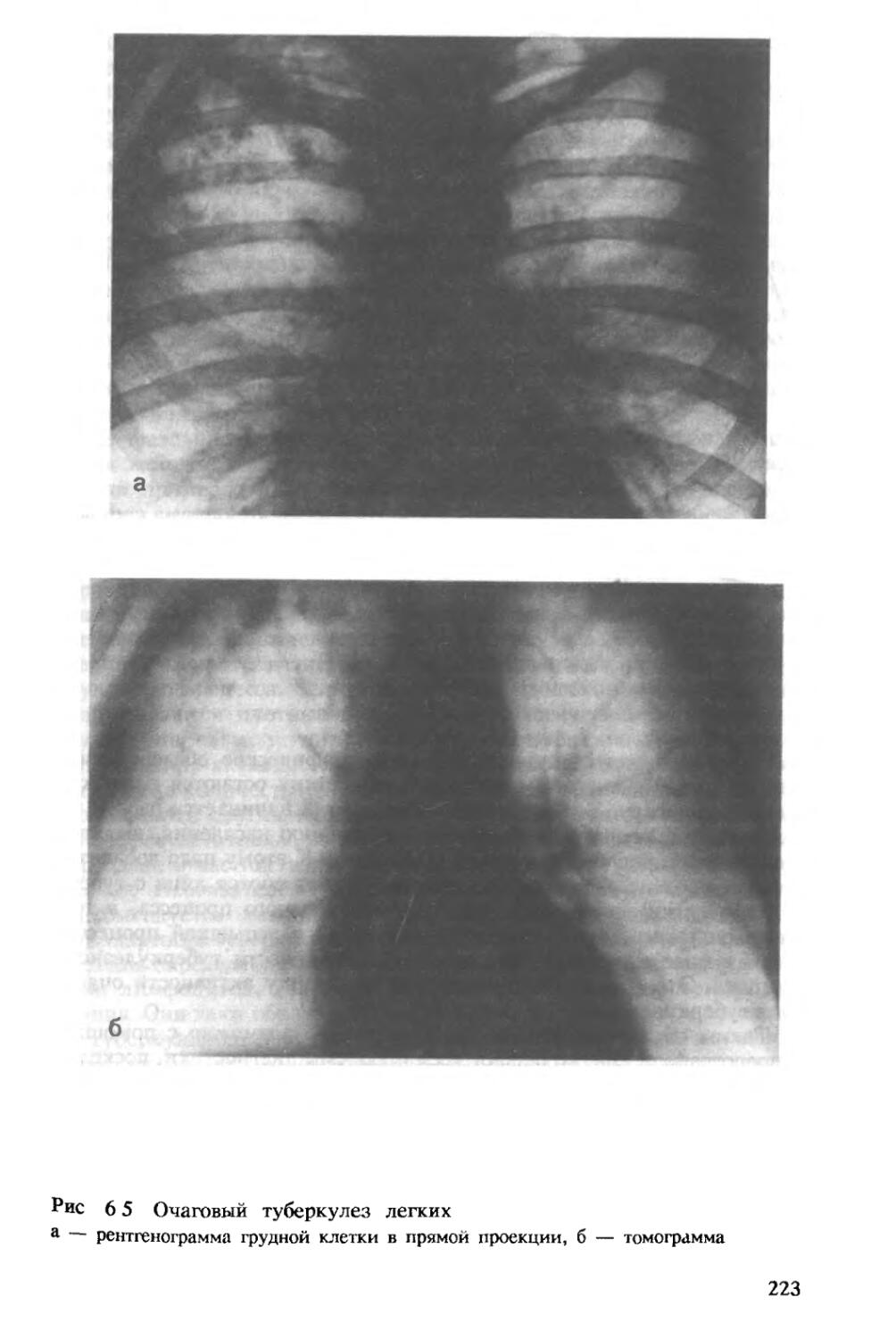
Author: Хоменко А.Г.
Tags: воспаление раздражение застойная гиперемия слизистая гиперемия здравоохранение медицинские науки руководство для врачей туберкулез
ISBN: 5-225-00967-0
Year: 1996
РУКОВОДСТВО ПО ВНУТРЕННИМ БОЛЕЗНЯМ
ББК 55.4 Т 81
УДК 616-002.5(035)
Акад. РАМН А. Г. Хоменко, чл.-корр. РАМН В. И. Литвинов, проф. И. Г. Маракуша, проф.[М. М. АвербадГ[, проф. В. В. Ерохин, канд. мед. наук Л. И. Дмитриева, д-р мед. наук А. Т. Сигаев, проф. Л. А. Митинская, проф. И. Р. Дорожкова, канд. мед. наук Е. Д. Тимашева, проф. В. П. Филиппов, проф. Г. О. Каминская, проф. В. Я. Гергерт, проф. В. Б. Нефедов, проф. Т. А. Худушина, канд. мед. наук М. И. Шаповал, д-р мед. наук Т. Е. Выренкова, канд. мед. наук А. И. Акуличева, канд. мед. наук В. Ф. Елуфимова, канд. мед. наук Н. В. Морозов, канд. мед. наук И. Т. Патрикян.
Составитель И. Э. Степанян, д-р мед. наук, вед. науч, сотрудник ЦНИИ туберкулеза РАМН.
Туберкулез. Руководство для врачей/Под ред. А. Г. Хомен-Т81 ко. — М.: Медицина, 1996. — 496 с. ISBN 5-225-00967-0
Издательство «Медицина* выпускает серию руководств по внутренним болезням под общей редакцией акад. РАН Е. И. Чазова.
В настоящем руководстве описаны этиология, патогенез, эпидемиология, клинические формы и варианты течения туберкулеза органов дыхания и внелегочного туберкулеза, а также современные методы диагностики, лечения и профилактики туберкулеза, организации противотуберкулезной работы. Освещены важные для практических врачей вопросы выявления больных туберкулезом в условиях амбулаторно-поликлинических учреждений и стационаров общей лечебной сети Проанализированы течение и лечение туберкулеза у лиц с сопутствующими заболеваниями внутренних органов.
4108070000—69 с ~ -- л
Т —039(01)__96— Бе3 °^ъявления ББК 55.4
ISBN 5-225-00967-0
© Коллектив авторов, 1996
4
ПРЕДИСЛОВИЕ
Очередной том серии «Руководства по внутренним болезням» посвящен проблеме туберкулеза. Естествен вопрос, почему мы решили вслед за томом, посвященным инфекционным болезням, выпустить руководство, посвященное проблеме, которая долгое время считалась второстепенной в деятельности врача общей практики, врача-терапевта и решенной как медицинской наукой, так и здравоохранением страны.
В связи с этим вспомним хотя бы дискуссию, которая велась в отношении целесообразности сохранения специализированной противотуберкулезной службы и ряда ее учреждений. К тому же туберкулез совершенно справедливо считался и считается в значительной степени социальной болезнью, которой не может быть в обществе социальной справедливости. И, вольно или невольно, на волне действительных успехов в борьбе с этим тяжелейшим забо
леванием и реального снижения его распространенности возникло неоправданно благодушное, оптимистическое отношение к проблеме туберкулеза. Причем это касалось врачей различных специальностей и различных уровней — от профессора до врача общей практики. Такое отношение сказалось на состоянии трех основных факторов борьбы с туберкулезом — ранней диагностики, профилактики за счет выявления очагов инфекции и наиболее раннего и рационального лечения. Не вызывает сомнений, что только знание и посто
янное внимание к этим вопросам лечащих врачей различных профилей могут обеспечить успехи в решении проблемы борьбы с туберкулезом.
Исходя из этих принципов, мы решили ознакомить широкий круг врачей-терапевтов, да и врачей других специальностей, с современными подходами в борьбе с туберкулезом, современными методами его диагностики и лечения. Есть еще один аспект в нашем решении. Он связан с той острейшей ситуацией, которая сложилась с заболеваемостью туберкулезом в нашей стране за последние годы. Мировой опыт показывает, что именно в период кризиса, который переживают государства и народы, период потрясений, обнищания народа, колоссальной миграции населения, упадка системы здравоохранения резко возрастают заболеваемость туберкулезом и смертность от него. Все это характерно для современной жизни нашей страны. Понятно, что борьба с туберкулезом становится для здравоохранения одной из наиболее актуальных проблем. В ее решении наряду с решением социальных вопросов, вопросов организации помощи больным, внедрением новых методов лечения и диагностики
5
большую роль призвано сыграть ознакомление широкого круга врачей с современными подходами к организации выявления больных туберкулезом, с современными методами лечения и диагностики (особенно ранних стадий заболевания).
Авторы «Руководства» — ведущие отечественные специалисты — на основании своего большого опыта излагают основные принципы
борьба с туберкулезом. Их заслугой является не только достаточно
полное и глубокое освещение современных подходов к профилактике,
диагностике и лечению этого тяжелейшего заболевания, но и четкое
выделение тех основных задач, которые стоят перед врачом общей практики в решении проблемы туберкулеза. Многие врачи забывают о том, что успех в решении этой непростой задачи зависит прежде всего от выявления в полном объеме очага туберкулезной инфекции
и организации его санации.
Другой, не менее важной задачей является ранняя диагностика заболевания. Заслуга авторов в том, что они четко определяют диагностические возможности обнаружения туберкулеза на различных уровнях оказания медицинской помощи. И наконец, авторы
дают конкретные предложения, касающиеся современных методов лечения. Это особенно важно сегодня, когда медицина располагает большой гаммой химиотерапевтических противотуберкулезных средств. Знание их возможностей, наиболее оптимальных и безопас
ных схем лечения позволит врачу четко ориентироваться в вопросах терапии больных с различными формами туберкулеза. Несомненно, что «Руководство» принесет большую пользу и врачам-специалистам,
Mlii,
учитывая фундаментальный характер изложения материала.
Мы надеемся, что данный том »Руководства», как и вся серия, станет спутником не только специалиста узкого профиля, но и широкого круга врачей. Еще М. Я. Мудров говорил: «Врач без книг, что рабочий без рук».
Академик РАН К И. Чазов
ОТ АВТОРА
К началу 60-х годов сложилась концепция о туберкулезе как об исчезающей болезни. Однако этот прогноз не оправдался. За последние 20 лет в мире не произошло существенного снижения заболеваемости. По-прежнему ежегодно 10 млн человек заболевают бациллярными формами туберкулеза и столько же — небациллярными, причем 60% случаев приходятся на развивающиеся страны. Ежегодно 3—4 млн человек умирают от туберкулеза. И эти цифры далеко не полные, так как не всюду налажен достоверный учет бальных.
В последние годы в США, ряде стран Европы и Африки отмечается увеличение заболеваемости туберкулезом, микобактериозами, а также легионеллезом и грибковыми поражениями. Большинство ученых связывают это с нарастающей эпидемией СПИД, иммунодефицитами другого происхождения и социальными проблемами: алкоголизмом, наркоманией, миграцией больших групп людей. Фактору миграции прежде не придавали большого значения, но оказалось, что в условиях неравномерной пораженности стран туберкулезом этот фактор может оказывать существенное влияние. Так, в США в 1985 г. при среднем уровне заболеваемости 9,3 на 100 000 населения заболеваемость туберкулезом среди иммигрантов из Вьетнама, Камбоджи, Лаоса, покинувших эти страны в 1984 г., составляла 310 на 100 000 населения. В России в последние годы отмечается повышение заболеваемости и смертности от туберкулеза. При этом сохраняются резко выраженные различия в разных регионах страны, в первую очередь в отношении туберкулеза органов
Mlii,
дыхания.
В этих условиях результативность противотуберкулезной работы зависит от организации профилактической работы диспансера и утвержденного комплексного плана на каждый год.
Анализ социального состава больных туберкулезом свидетельствует о том, что в основном заболевают люди с низким образовательным уровнем, без постоянного места работы и определенного места жительства, занимающиеся бродяжничеством и ведущие асоциальный образ жизни. Серьезную проблему представляет туберкулез у больных алкоголизмом и наркоманов, психически больных. Наконец, высокая пораженность туберкулезом лиц, находящихся в И ТУ, требует совместных усилий органов здравоохранения, противотуберкулезных учреждений и медицинской службы МВД.
Как ни важна профилактика туберкулеза, главное стратегическое Направление работы — это уменьшение резервуара инфекции, что
Mlii,
7
ведет к снижению риска первичного заражения, инфицированное™ населения и риска эндогенной реактивации туберкулезных изменений. На первом этапе диагностики, проводимой, например, с помощью флюорографии, осуществляется отбор лиц с легочной патологией, диагноз же по флюорограммам поставить невозможно. Для этого нужно использовать диагностический минимум, который «срабатывает» в 50—60% случаев. Нередко приходится прибегать к томографии, инструментальным и прецизионным лабораторным методам. Многие больные нуждаются в углубленном исследовании и проведении дифференциальной диагностики между туберкулезом и другими заболеваниями легких, которые могут иметь сходные клинические проявления.
Лечение больных туберкулезом — это прежде всего рациональная химиотерапия противотуберкулезными препаратами. Хороших терапевтических результатов — прекращения бактериовыделения и закрытия каверн — можно добиться даже у тяжелобольных при правильном лечении. Значительное число наших пациентов в течение 2 лет излечивается.
Впервые выявленные больные в основном излечиваются и переводятся в контрольные группы для наблюдения. У других (явное меньшинство) развивается хронический фиброзно-кавернозный туберкулез. Эта категория больных представляет эпидемиологическую опасность для людей, никогда не контактировавших с туберкулезом, и создает источник первичной инфекции. Такие больные нуждаются в хирургическом лечении, так как только с помощью химиопрепаратов добиться выздоровления невозможно. Чаще всего им делают различные виды резекции пораженных органов легкого вплоть до пульмонэктомии.
Следует подчеркнуть, что туберкулез продолжает оставаться важной проблемой национального здравоохранения для многих стран, а также международного сотрудничества в области медицины и охраны здоровья населения.
Академик РАМН А. Г, Хоменко
ГЛАВА 1
ЭТИОЛОГИЯ. ПАТОГЕНЕЗ. ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ
1.1. ВОЗБУДИТЕЛЬ ТУБЕРКУЛЕЗА, СТРОЕНИЕ, ИЗМЕНЧИВОСТЬ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА
Возбудители туберкулеза — кислотоустойчивые микобактерии, открытые Р. Кохом в 1882 г. Известно несколько видов микобактерий туберкулеза: Mycobacterium tuberculosis (человеческий вид), Mycobacterium africanum (промежуточный вид) и Mycobacterium bovis (бычий вид), которые относятся к роду Mycobacterium, семейству Mycobacteriacae, порядку Actinomycetalis. Возбудителями туберкулеза у человека наиболее часто (в 92% случаев) являются микобактерии туберкулеза человеческого вида, микобактерии бычь
его и промежуточного видов вызывают развитие туберкулеза у человека соответственно в 5 и 3% случаев. В современной мик-
робиологической классификации микобактерии птичьего вида (М. avium) относят к нетуберкулезным микобактериям комплекса avium — intracellulare, которые могут быть возбудителями мико
бактериоза у человека и животных.
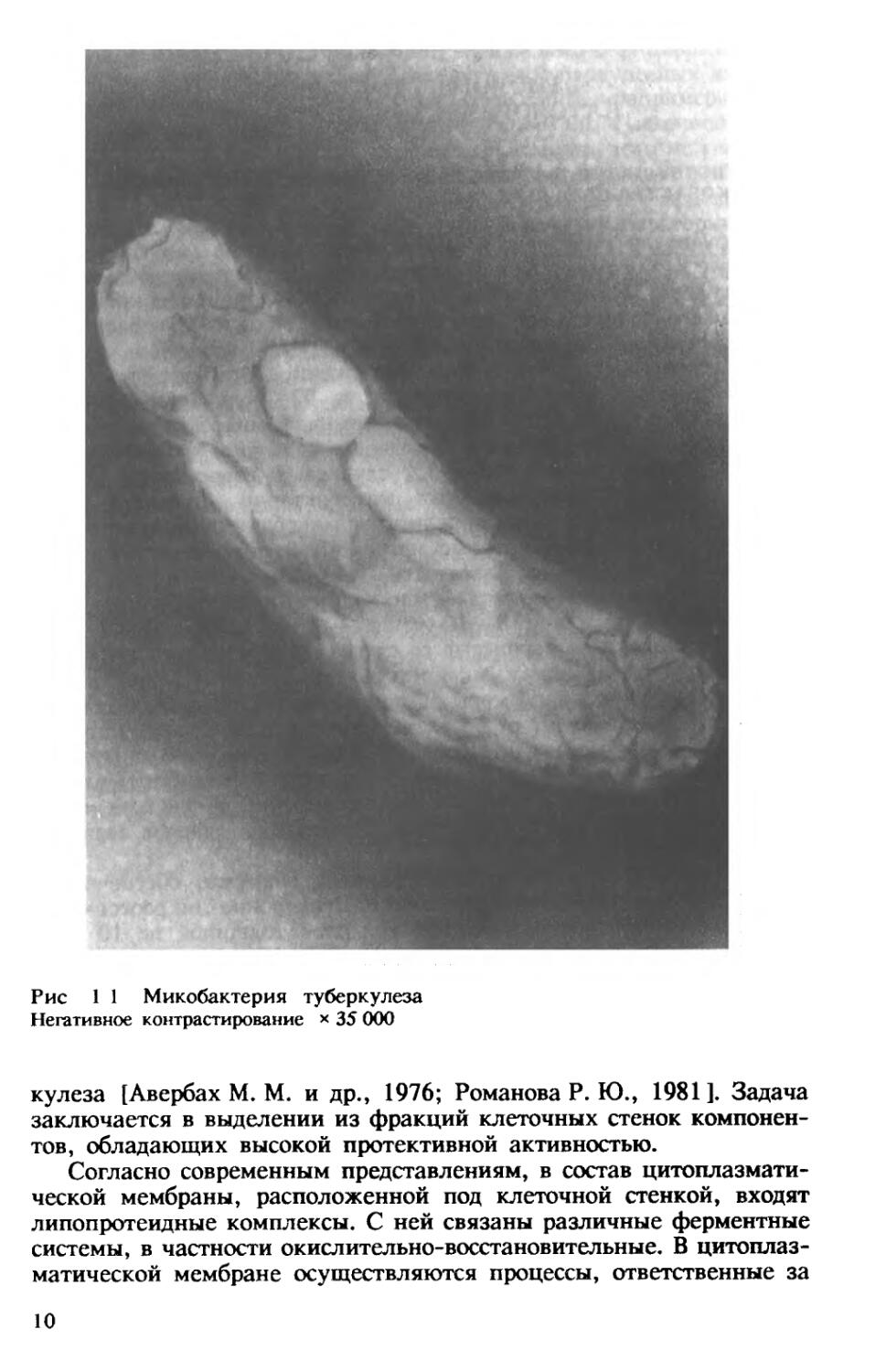
Микобактерии туберкулеза — тонкие, прямые или незначительно изогнутые палочки длиной 1—10 (чаще 1—4) мкм, шириной 0,2—0,6
мкм, гомогенные или зернистые со слегка закругленными концами (рис. 1.1). Они неподвижны, не образуют эндоспор, конидий и
логия и размеры бактериальных клеток значительно
капсул. Мор4
колеблются, что зависит от возраста клеток и особенно от условий
существования и состава питательной среды. С помощью электронной микроскопии выделены основные структурные элементы микобактерий туберкулеза: клеточная стенка, цитоплазматическая мембрана и ее производное — мезосома, цитоплазма, ядерное вещест
во — нуклеотид.
Клеточная стенка ограничивает клетку снаружи, обеспечивая механическую и осмотическую защиту. Электронно-микроскопически в клеточной стенке выделяют три слоя толщиной по 10 нм, поверхностный — микрокапсула — состоит из полисахаридов и играет важную роль в жизнедеятельности микобактерий, в том числе обеспечивает их устойчивость к неблагоприятным воздействиям. В клеточной стенке находятся видоспецифические антигены. Вакцины, приготовленные из клеточных стенок туберкулезных микобактерий, имеют разные вирулентность и иммуногенность. Наиболее выраженный иммунитет вызывают вакцины из клеточных стенок высоковирулентных микобатерий. Клеточные стенки вызывают в организме здоровых животных развитие повышенной чувствительности замедленного типа (ПЧЗТ), антителообразование. Однако их сильные сенсибилизирующие свойства и наличие в них токсического корд-фактора (фактора вирулентности) значительно осложняют гипериммунизацию этой фракцией микобактерий тубер-
9
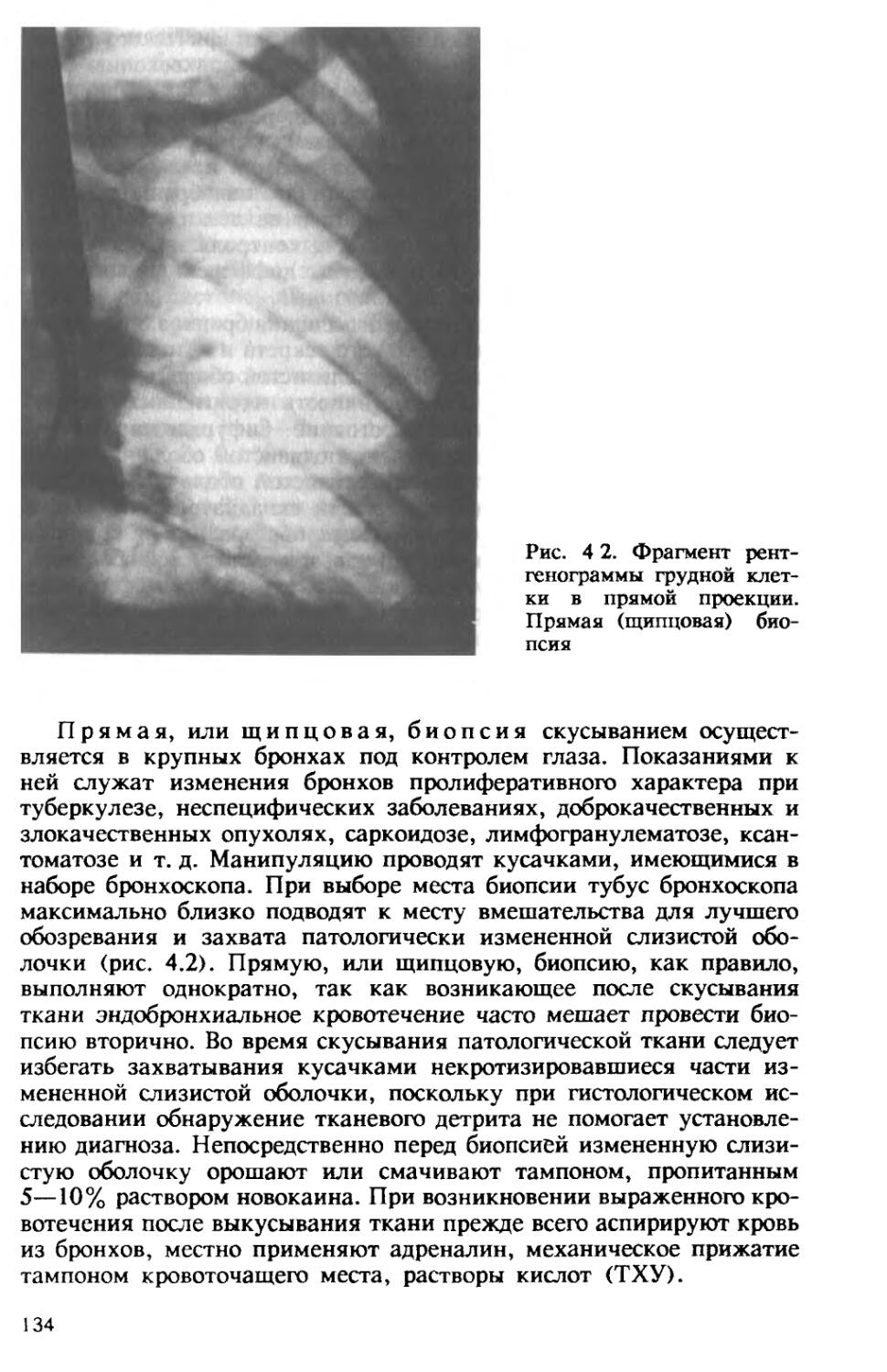
Рис 1 1 Микобактерия туберкулеза
Негативное контрастирование х 35 000
кулеза [Авербах М. М. и др., 1976; Романова Р. Ю., 1981]. Задача заключается в выделении из фракций клеточных стенок компонентов, обладающих высокой протективной активностью.
Согласно современным представлениям, в состав цитоплазматической мембраны, расположенной под клеточной стенкой, входят липопротеидные комплексы. С ней связаны различные ферментные системы, в частности окислительно-восстановительные. В цитоплазматической мембране осуществляются процессы, ответственные за
10
специфичность реакций микобактериальной клетки на окружающую
среду.
Цитоплазматическая мембрана микобактерий туберкулеза путем инвагинации в цитоплазму формирует внутрицитоплазмати-ческую мембранную систему, или мезосому. Мезосомы полифункционал ьны. С ними связана локализация многих ферментных систем, они участвуют в синтезе материала клеточной стенки, выполняют роль посредника между ядром и цитоплазмой. Отмечено слабое развитие или отсутствие мезосом у авирулентных штаммов микобактерий туберкулеза и их L-форм [Кац Л. Н., Волк А. В., 1974]. Цитоплазма микобактерий туберкулеза состоит из гранул и вакуолей различной величины. Основная часть мелкогранулярных включений представлена рибосомами, на которых синтезируется специфический белок.
Ядерная субстанция микобактерий туберкулеза определяет специфические свойства клетки, важнейшими из которых являются синтез белка и передача наследственных признаков потомству. Установлено, что основным способом размножения этих бактерий яв
ляется деление материнских клеток на две дочерние.
Установлено, что носителем генетической информации бактерий являются не только хромосомы, но и внехромосомные элементы — плазмиды. Основное различие между хромосомами и плазмидами заключается в их размерах. Хромосома во много раз крупнее плазмиды и соответственно несет большое количество генетической информации. Возможно взаимодействие плазмид с хромосомой. Плазмиды благодаря малому размеру хорошо приспособлены к переносу из клетки в клетку. Исследования плазмид имеют не только теоретическое, но и практическое значение. Существует мнение, что гены устойчивости микобактерий туберкулеза к химиопрепаратам локализованы как на хромосоме, так и на плазмиде [Коппу М., ParentiF., 1980].
Описаны многочисленные морфологические варианты микобактерий: гигантские формы с колбовидно утолщенными разветвлениями, нитевидные, мицелиеподобные и булавовидные, дифтероидные и актиномикотические формы. Микобактерии туберкулеза могут быть длиннее или короче, толще или тоньше обычных, гомогенны или зернисты. Иногда они представляют собой цепочки или отдельные скопления кокковидных зерен.
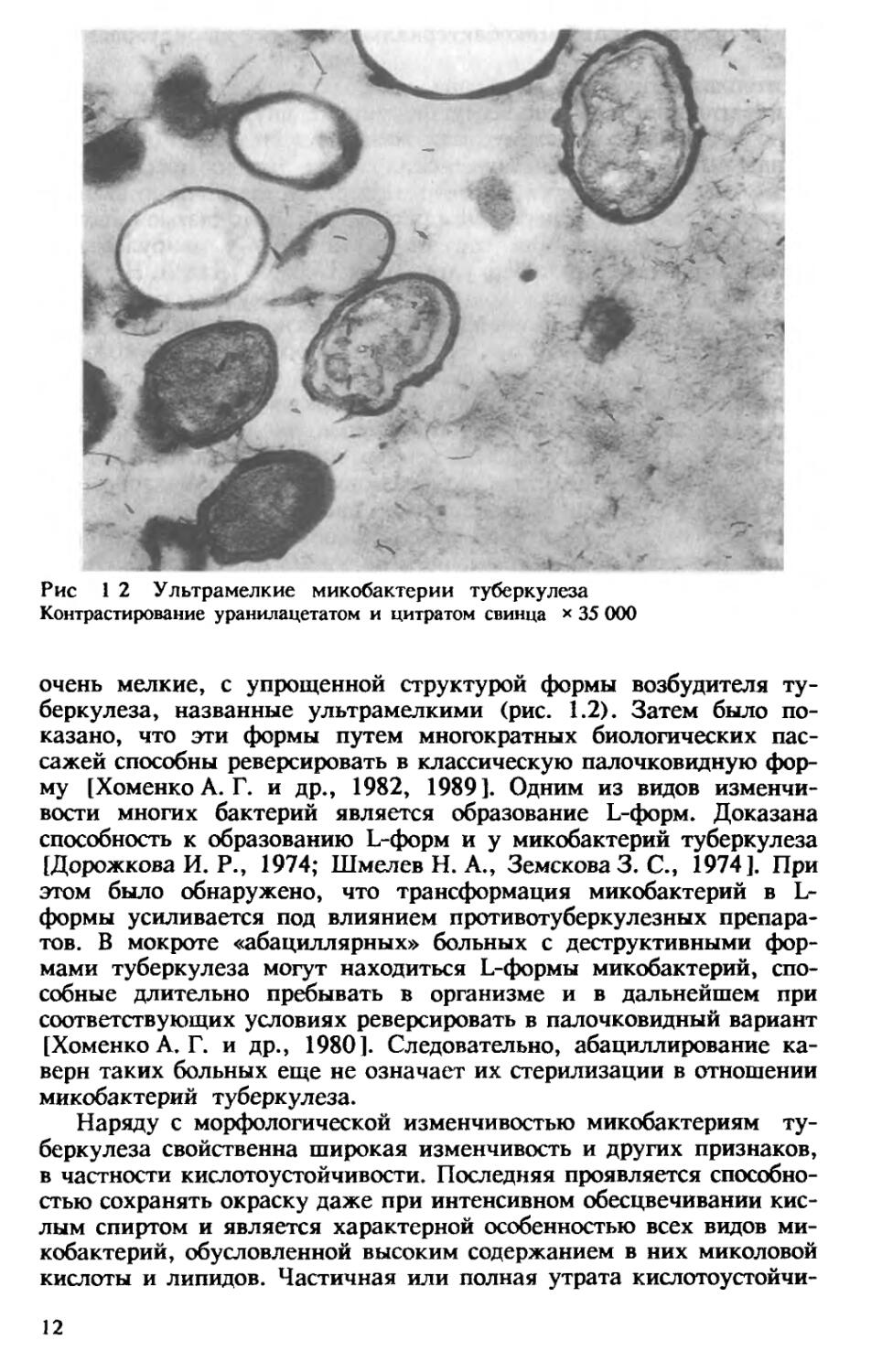
Явление изменчивости микобактерий туберкулеза было обнаружено вскоре после их открытия. Уже в 1888 г. И. И. Мечников сообщил, что в культурах, кроме типичных палочек Коха, встречаются полиморфные формы этих микроорганизмов в виде коротких, соединенных попарно звеньев и гигантских образований с колбовидными разветвлениями. Первое сообщение о возможности существования у микобактерий туберкулеза фильтрующихся форм относится к 1910 г. (A. Fontes). При химиотерапии экспериментального деструктивного туберкулеза, а также после ее прекращения в гомогенатах из стенки каверны, пропускаемых через бактериальные фильтры с размером пор 0,2 мкм, были обнаружены
11
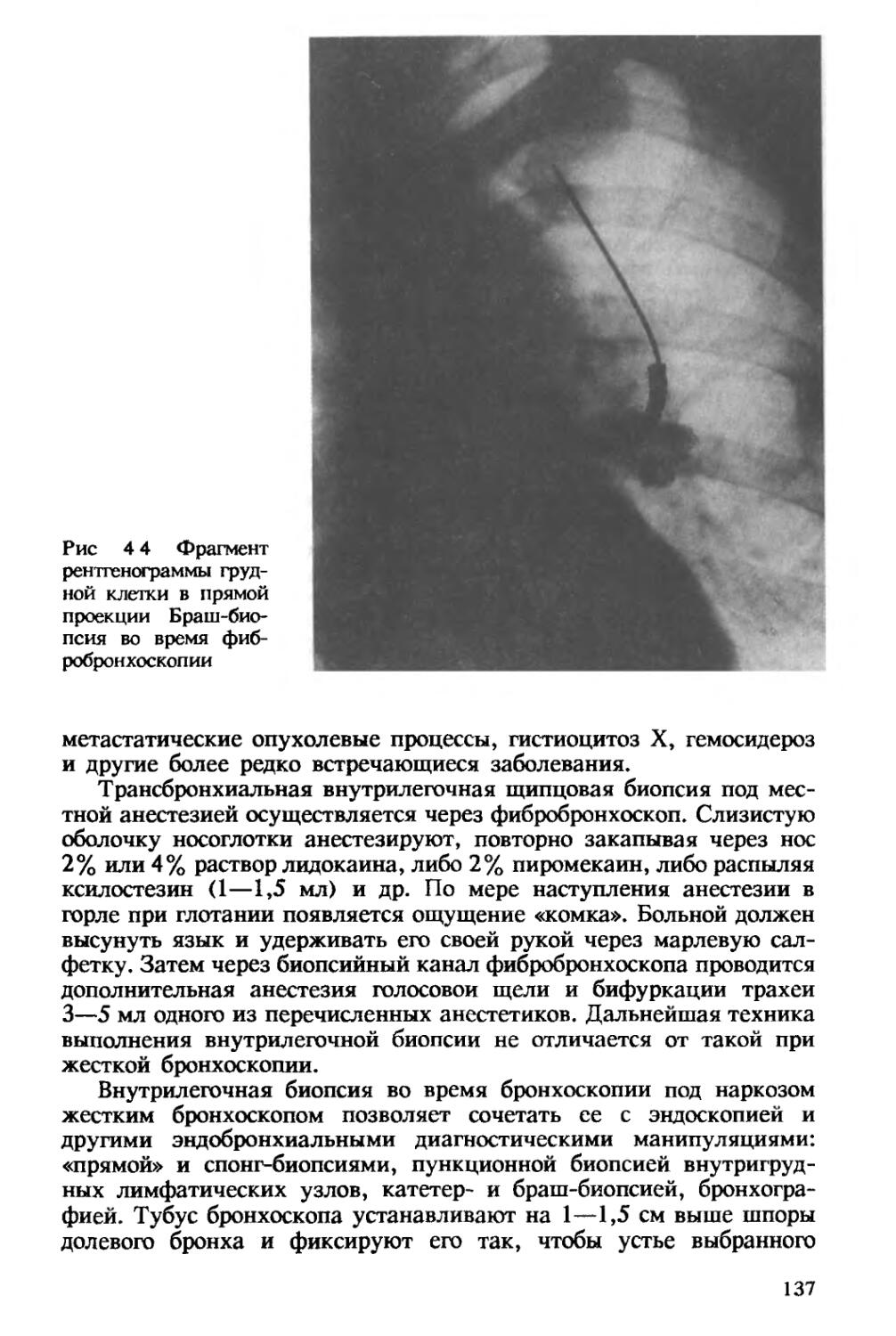
Рис 1 2 Ультрамелкие микобактерии туберкулеза
Контрастирование уранилацетатом и цитратом свинца х 35 000
очень мелкие, с упрощенной структурой формы возбудителя туберкулеза, названные ультрамелкими (рис. 1.2). Затем было показано, что эти формы путем многократных биологических пассажей способны реверсировать в классическую палочковидную форму [Хоменко А. Г. и др., 1982, 1989]. Одним из видов изменчивости многих бактерий является образование L-форм. Доказана способность к образованию L-форм и у микобактерий туберкулеза [Дорожкова И. Р., 1974; Шмелев Н. А., Земскова 3. С., 1974]. При этом было обнаружено, что трансформация микобактерий в L-формы усиливается под влиянием противотуберкулезных препаратов. В мокроте «абациллярных» больных с деструктивными формами туберкулеза могут находиться L-формы микобактерий, способные длительно пребывать в организме и в дальнейшем при
соответствующих условиях реверсировать в палочковидный вариант [Хоменко А. Г. и др., 1980]. Следовательно, абациллирование ка-
верн таких больных еще не означает их стерилизации в отношении
микобактерий туберкулеза.
логической изменчивостью микобактериям
Наряду с мор4
ту-
беркулеза свойственна широкая изменчивость и других признаков, в частности кислотоустойчивости. Последняя проявляется способностью сохранять окраску даже при интенсивном обесцвечивании кислым спиртом и является характерной особенностью всех видов микобактерий, обусловленной высоким содержанием в них миколовой кислоты и липидов. Частичная или полная утрата кислотоустойчи-
12
вости ведет к образованию смешанной, состоящей из кислотоустойчивых и некислотоустойчивых особей, или полностью некислотоустойчивой популяции.
Микобактерии туберкулеза весьма устойчивы к воздействию факторов окружающей среды. В естественных условиях при отсутствии солнечного света их жизнеспособность может сохраняться в течение нескольких месяцев, при рассеянном свете возбудители погибают через 1—Р/г мес. В уличной пыли микобактерии туберкулеза сохраняются до 10 дней, на страницах книг — до 3 мес, в воде — до 5 мес. В то же время облученная солнечным светом культура микроорганизмов погибает в течение Р/г ч, а под воздействием ультрафиолетовых лучей — через 2—3 мин. При кипячении влажной мокроты микобактерии погибают через 5 мин, высушенной мокроты — через 25 мин. Соединения, выделяющие свободный активный хлор (3—5% растворы хлорамина, 10—20% растворы хлорной извести и др.), вызывают гибель микобактерий туберкулеза в течение 3—5 ч.
Микобактерии туберкулеза считаются аэробами, хотя имеются сведения, что некоторые их виды можно рассматривать как факультативные анаэробы. Размножаются эти микобактерии очень медленно (одно деление клетки происходит за 14—18 ч). Микроскопически видимый рост микроколоний, культивируемых на жидких средах при температуре 37°С, выявляется на 5—7-е сутки, видимый рост колоний на плотных средах, культивируемых при той же температуре, — на 14—20-е сутки.
Для нормального развития микобактерий туберкулеза требуются специальные питательные среды, содержащие углерод, азот, кислород, водород, фосфор, магний, калий, натрий, железо, хлор и серу. Эти микроорганизмы нуждаются и в некоторых факторах роста, к
числу которых относятся соединения, родственные витаминам груп
пы В, биотин, никотин, ри
бофлавин и др. Все эти факторы входят
в состав применяемых для культивирования микобактерий тубер
кулеза специальных питательных сред, из них выделяют среды, содержащие глицерин, белковые (яичные, сывороточные, картофельные) и безбелковые (синтетические) среды, в состав которых входят минеральные соли. По консистенции различают плотные, полужидкие и жидкие среды. Наиболее широко применяются плотные яичные среды Левенштейна—Йенсена, Огавы, Петраньяни и Гельбера, разнообразные агаровые среды Миддбрука, синтетические и полусин-тетические среды Сотона, Дюбо, Проскауэра—Гека, Шулы, Школьниковой и др.
На жидких питательных средах микробактерии туберкулеза растут в виде сухой морщинистой пленки (P-форма) кремового цвета, поднимающейся на стенки сосуда, среда при этом остается прозрачной. При внутриклеточном развитии микобактерий, а также при культивировании их на жидких средах хорошо выделяется характерный корд-фактор (трегалоза-6,6-димиколат). Он обнаруживается на поверхности клеток многих микобактерий и, по мнению некоторых исследователей, имеет отношение к их вирулентности, спо
13
собствуя сближению микробных клеток и росту их в виде серпантинообразных кос.
На плотных средах микобактерии туберкулеза растут в виде светло-кремового морщинистого или суховатого чешуйчатого налета, образуют колонии с неровными краями, приподнятые в центре, по мере роста они приобретают бородавчатый вид, напоминающий цветную капусту.
Под влиянием антибактериальных веществ микобактерии туберкулеза могут приобретать лекарственную устойчивость. Культуры таких микобактерий не всегда типичны, они могут быть влажными, мягкими (S-вариант), иногда содержать отдельные гладкие или пигментированные колонии.
1.2. ПАТОГЕНЕЗ
Микобактерии туберкулеза могут попадать в организм различными путями: аэрогенно, энтерально (через желудочно-кишечный тракт), через поврежденную кожу и слизистые оболочки, через плаценту при развитии плода. Однако основным путем заражения является аэрогенный.
Определенную защитную роль при аэрогенном заражении иг
рает система мукоциллиарного клиренса, позволяющая частично вывести попавшие в бронхи частицы пыли, капли слизи, слюны и мокроты, содержащие микроорганизмы. При энтеральном заражении определенное значение может иметь всасывающая функция кишечника.
Локальные изменения в месте внедрения микобактерий обусловлены прежде всего реакцией полинуклеарных клеток, которая сменяется более совершенной формой защитной реакции с участием макрофагов, осуществляющих фагоцитоз и разрушение микобактерий. Процесс взаимодействия легочных макрофагов с различными микроорганизмами, в том числе микобактериями туберкулеза, сложен и до конца не изучен. Результат взаимодействия макрофагов и микобактерий определяется состоянием иммунитета, уровнем ПЧЗТ, развивающейся в процессе туберкулезной инфекции, а также рядом других факторов, в том числе обусловливающих переваривающую способность макрофагов.
Фагоцитоз состоит из трех фаз: фазы соприкосновения, когда макрофаги с помощью рецепторов на клеточной мембране фиксируют микобактерии; фазы проникновения микобактерий внутрь макрофага путем инвагинации стенки макрофага и «окутывания» микобактерии; фазы переваривания, когда лизосомы макрофагов сливаются с фагосомами, содержащими микобактерии. Выделяющиеся в фаголизосомы ферменты разрушают микобактерии. В процессе фагоцитоза важная роль принадлежит также механизмам перекисного окисления [Charaparas D., 1982; Collins F., 1982].
Микобактерии туберкулеза, как и некоторые другие микроорганизмы, попадая в макрофаги, могут сохраняться и даже продолжать размножение. В тех случаях, когда процесс переваривания мико
14
бактерий блокируется, происходят разрушение макрофагов и выход микобактерий из поглотивших их клеток.
Макрофаги, фагоцитировавшие микобактерии и осуществляющие их переваривание, выделяют во внеклеточное пространство фрагменты разрушенных микобактерий, протеолитические ферменты, медиаторы (в том числе интерлейкин-1), которые активируют Т-лимфоциты, в частности Т-хелперы. Активированные Т-хелперы выделяют медиаторы — лимфокины (в том числе интерлейкин-2), под влиянием которых происходит миграция новых макрофагов к месту локализации микобактерий. Одновременно подавляется синтез фактора угнетения миграции, возрастает ферментативная активность макрофагов под влиянием фактора активации макрофагов. Активированные лимфоциты выделяют также кожно-реактивный фактор, который обусловливает воспалительную реакцию, повышение сосудистой проницаемости. С этим фактором связывают подавление ПЧЗТ и положительной туберкулиновой реакции [Медуницын Н. В. и др., 1980]. Кроме Т-хелперов, на состояние иммунитета значительно влияют Т-супрессоры и супрессорные моноциты, которые угнетают иммунный ответ.
Помимо Т-лимфоцитов и макрофагов, важная роль в патогенезе туберкулезного процесса принадлежит веществам, освобождающимся при разрушении микобактерий. Эти вещества (фракции) подробно изучены [Seibert F. В., 1982; Goren М., 1982]. Доказано, что корд-фактор (фактор вирулентности микобактерий туберкулеза, обусловливающий их рост на плотной питательной среде в виде «кос»), провоцирует острый воспалительный процесс, а сульфатиды повышают токсичность корд-фактора и, главное, подавляют образование фаголизосом в макрофагах, что предохраняет внутриклеточно расположенные микобактерии от разрушения.
При интенсивном размножении микобактерий в организме человека вследствие малоэффективного фагоцитоза выделяется большое число токсичных веществ, индуцируется резко выраженная ПЧЗТ, которая способствует появлению экссудативного компонента воспаления с развитием казеозного некроза и его размножения. В этот период увеличивается число Т-супрессоров, снижается число Т-хелперов, что приводит к угнетению ПЧЗТ. Это обусловливает прогрессирование туберкулезного процесса.
При сравнительно небольшой бактериальной популяции в условиях ПЧЗТ и эффективного фагоцитоза отмечается образование туберкулезных гранулем. Такая гранулема развивается в результате реакций ПЧЗТ [Авербах М. М. и др., 1974]. Скопление мононук-леаров вокруг нейтрофилов, содержащих антиген, и их последующая трансформация происходят под регулирующим влиянием лимфоки-нов, вырабатываемых Т-лимфоцитами (в частности, Т-хелперами) и являющихся медиаторами гранулематозной реакции. Поскольку величина бактериальной популяции, а также характер течения иммунологических ракций на разных этапах туберкулезной инфекции меняются, морфологические реакции у заболевших туберкулезом характеризуются большим разнообразием.
IIML
15
В зависимости от места внедрения микобактерий туберкулеза воспалительный очаг, или первичный аффект, может образоваться в легких, ротовой полости, миндалинах, кишечнике и др. В ответ на образование первичного аффекта развивается специфический процесс в регионарных лимфатических узлах и формируется первичный туберкулезный комплекс. Установлено, что первичный туберкулез, развивающийся в результате первого контакта макроорганизма с возбудителем, может проявляться не только в виде первичного туберкулезного комплекса, как это считалось ранее. В результате первичного заражения возможно развитие туберкулеза внутригрудных лимфатических узлов, плеврита, туберкулемы, оча
гового процесса.
Первичный туберкулез в результате «свежего» заражения развивается лишь у 7—10% инфицированных лиц, остальные переносят первичную туберкулезную инфекцию без клинических проявлений. Наступившее заражение проявляется лишь в изменении туберку-
линовых реакций.
Еще В. И. Пузик (1946), А. И. Каграманов (1954) и др. установили, что формированию первичного комплекса нередко предшествует период «латентного микробизма», при котором микобактерии туберкулеза, попадая в организм, какое-то время находятся в нем, не вызывая воспалительной реакции. При этом микобактерии чаще обнаруживаются в лимфатических узлах, особенно внутригрудных.
В этих случаях локальные изменения в легких или других органах в виде очагов первичного туберкулеза возникают в поздний период первичной инфекции и не в месте проникновения микобактерий в организме, а в участках, наиболее благоприятных для развития туберкулезного воспаления.
Отсутствие клинико-мор4
Milt
логических проявлений первичной ту
беркулезной инфекции может быть объяснено высоким уровнем
естественной резистентности к туберкулезу, а также может быть следствием приобретенного в результате вакцинации БЦЖ имму
нитета.
При наличии локальных проявлений первичный туберкулез может протекать с развитием распространенного процесса по осложненному типу или, что в настоящее время наблюдается значительно чаще, по неосложненному типу с ограниченной воспалительной реакцией.
Как правило, первичный туберкулез заживает с небольшими остаточными изменениями, что, по-видимому, связано с высокой естественной резистентностью и проведением массовой вакцинации и ревакцинации БЦЖ.
Сохраняющиеся в остаточных очагах микобактерии или их измененные формы должны рассматриваться как туберкулезный антиген, наличие которого необходимо для поддержания сенсибилизированными лимфоцитами специфического иммунитета. Опреде
ленная, правда, еще малоизученная роль в поддержании противотуберкулезного иммунитета принадлежит В-клеточному иммунитету и генетическим механизмам.
16
Получены доказательства роли наследственности в течение ту беркулезного процесса. Генетические факторы влияют на ответ иммунной системы при размножении микобактерий туберкулеза в
организме человека и, в частности, определяют взаимодействие между макрофагами, Т- и В-лимфоцитами, продукцию лимфокинов, монокинов и других цитокинов Т- и В-лимфоцитами и макрофагами,
комплексный иммунный ответ, от которого зависит чувствительность или устойчивость к развитию туберкулеза. Выявлено сцепление HLA-генотипов с заболеванием туберкулезом в семьях, в которых больны туберкулезом родители и дети.
Накопление некоторых специфичных типов HLA в группах больных с неблагоприятным течением болезни свидетельствует об ассоциации определенных генов HLA-комплекса (преимущественно локусов В и DR с предрасположенностью к туберкулезу) [Хоменко А. Г., 1985].
Период первичного инфицирования может завершиться излечением с минимальными (малыми) или довольно выраженными остаточными изменениями. У таких людей развивается приобретенный иммунитет. Сохранение в остаточных очагах персистирующих микобактерий не только поддерживает приобретенный иммунитет, но и одновременно создает риск эндогенной реактивации туберкулезного процесса вследствие реверсии измененных форм возбудителя туберкулеза в бактериальную форму и размножения микобактериальной популяции.
Реверсия персистирующих форм микобактерий в размножающиеся происходит в условиях эндогенной реактивации туберкулезных очагов и других остаточных изменений. Механизм эндогенной реактивации, а также развитие туберкулезного процесса изучены не
достаточно.
В основе реактивации лежат прогрессирующее размножение бак
териальной популяции и увеличение количества микобактерий [Хоменко А. Г., 1986]. Однако до настоящего времени остается неизвестным, что именно и какие условия способствуют реверсии возбудителя туберкулеза, находившегося в персистирующем состоянии. Установлено, что реактивация туберкулеза и развитие различных его клинических форм чаще наблюдаются у лиц с остаточными
изменениями при наличии факторов, снижающих иммунитет.
Возможен и другой путь развития вторичного туберкулеза — экзогенный, связанный с новым (повторным) заражением микобактериями туберкулеза (суперинфекция). Но и при экзогенном пути развития вторичного туберкулеза недостаточно проникновения ми
кобактерий в уже инфицированный организм даже при массивной
повторной суперинфекции. Необходима совокупность ряда условий и факторов риска, снижающих иммунитет. Вторичный туберкулез характеризуется большим разнообразием клинических форм. Основ
ные разновидности патоморфологических изменении в легких и
других органах характеризуются: а) очагами с преимущественно продуктивной тканевой реакцией, благоприятным, хроническим течением и тенденцией к заживлению; б) инфильтративно-пневмо
17
ническими изменениями с преимущественно экссудативной тканевой реакцией и тенденцией к развитию казеозного некроза или рассасыванию возникшей воспалительной реакции; в) туберкулезной каверной — результатом разложения образовавшихся казеозных масс и их отторжения через дренажные бронхи с образованием полости
распада.
Различные сочетания основных патоморфологических измене-
ний туберкулеза создают предпосылки для чрезвычайно большого разнообразия туберкулезных изменений, особенно при хроническом течении болезни со сменой периодов обострения и затихания процесса. К этому нужно добавить, что из сформировавшихся зон поражения микобактерии могут распространяться с током лимфы
или крови в непораженные участки и различные органы. Исход болезни зависит от ее течения — прогрессирующего или регрессирующего, эффективности лечения и обратимости изменений, сформировавшихся в процессе болезни. Доказано, что в условиях голодания и даже при недостаточном питании, особенно когда в рационе недостаточное количество белков и витаминов, нередко возникает реактивация туберкулеза. К факторам, способствующим реактивации, относятся и различные заболевания: сахарный диабет, лимфогранулематоз, силикоз, язвенная болезнь желудка и двенадцатиперстной кишки, состояние после резекции желудка и двенадцатиперстной кишки, хронические воспалительные заболевания легких, психические заболевания, протекающие с депрессивным синдромом, алкоголизм, стрессовые ситуации, СПИД, дли
тельный прием глюкокортикоидов, цитостатиков и иммунодепрессантов. Течение и исходы туберкулеза следует рассматривать только в условиях проводящейся специфической химиотерапии, которая применяется всем больным активным туберкулезом. В процессе химиотерапии отмечается уменьшение популяции микобактерий вследствие разрушающего влияния химиопрепаратов на возбудителей туберкулеза. Вследствие этого резко снижается число микобактерий, создаются более благоприятные условия для репаративных процессов и саногенеза. Вместе с тем при применении самых эффективных комбинаций современных химиопрепаратов отмечается разное течение туберкулезного процесса: регрессия с последующим заживлением, стабилизация процесса без клинического излечения с сохранением каверны, туберкулемы или других изменений, временное затихание воспалительного процесса с последующим возникновением обострения, развитием хронического процесса или прогрессированием заболевания.
Таким образом, уменьшение популяции микобактерий под влиянием специфических химиопрепаратов далеко не всегда приводит к излечению. Прекращение туберкулезного процесса и последую
щее излечение зависят не только от уменьшения популяции микобактерий, но и от способности репаративных процессов организма обеспечить регрессию туберкулезного процесса и его пре
кращение.
18
1.3. ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ
1.3.1. Туберкулезное воспаление
ПатоморЛ
X X
логические изменения в органах и тканях при тубер-
кулезе многообразны и зависят от формы, стадии, локализации и
распространенности патологического процесса.
Общими для большинства форм туберкулеза являются специфические изменения в сочетании с неспецифическими или параспе-цифическими реакциями. К специфическим изменениям относится
туберкулезное воспаление, течение которого сопровождается фор-
мированием туберкулезного бугорка, или гранулемы, и более круп-
ного очага. Неспецифическими изменениями являются различные
реакции, обусловливающие так называемые маски туберкулеза.
Мор4
логия туберкулезного воспаления зависит от реактивности
организма и вирулентности возбудителя. В туберкулезном очаге могут преобладать явления экссудации, некроза или пролиферации,
и очаг в соответствии с этим может быть преимущественно экссудативным, некротическим или продуктивным. В развитии туберкулезного воспаления большая роль принадлежит иммунологическим процессам. В участке воспаления сначала развивается реакция, не имеющая признаков, типичных для туберкулеза. В ней в разной
степени выражены явления альтерации и экссудации. На первое место выступают нарушения в микроциркуляторном русле. Они за-
трагивают тонкую структуру стенки альвеолы, и механизмы их развития можно проследить на ультраструктурном уровне [Ерохин В. В., 1987]. На ранних стадиях воспаления изменения в субмикроскопической организации составных элементов стенки альвеолы связаны с повышением капиллярной проницаемости, развитием внутриклеточ
ного интерстициального и внутриальвеолярного отека с вымыванием отечной жидкостью альвеолярного сурфактанта.
В дальнейшем дистро4
ические изменения в альвеолярной ткани
нарастают, однако наряду с ними возникают и компенсаторно-восстановительные процессы, направленные на развитие внутриклеточной организации, повышение функциональной активности сохраняющихся клеток межальвеолярной перегородки. В следующей фазе воспаления — пролиферативной — появляются специфические для туберкулеза элементы (эпителиоидные и гигантские клетки Пирогова—Лангханса), формируются участки своеобразного гомогенного казеозного (творожистого) некроза в центре туберкулезного очага (рис. 1.3). На основании данных электронной микроскопии и авторадиографии о динамике клеточной трансформации установлена
генетическая связь клеток гранулемы по линии моноцит — гигантская клетка [Серов В. В., Шехтер А. Б., 1981; Ерохин В. В., 1978,
1982; Spector W.G., 1982]. Макрофаги ак-
1987; Danneberg А. М.,
тивно синтезируют и накапливают лизосомные ферменты, выпол
няют фагоцитарную функцию. Поглощенный материал, среди которого находятся и микобактерии туберкулеза, находится и переваривается в фагосомах и фаголизосомах. Эпителиоидные клетки
19
Рис 13 Туберкулезный бугорок с широкой зоной из эпителиоидных клеток и небольшим участком распада в центре
Окраска гематоксилином и эозином х 168
образуются из мононуклеаров и макрофагов,
скапливающихся в
очаге туберкулезного воспаления в первые фазы воспалительной реакции. Они имеют крупное ядро овальной формы, обычно с 1—2
ядрышками Цитоплазма этих клеток содержит митохондрии, гранулы, аппарат Гольджи, хорошо развитую систему канальцев и цистерны зернистой и незернистой цитоплазматической сети, единичные фагосомы небольших размеров. Число митохондрий, элементов ретикулума, лизосомных включений широко варьирует и определяется функциональным состоянием клетки.
Гигантские клетки Пирогова—Лангханса могут образовываться из эпителиоидных клеток или макрофагов при их пролиферации, а также в результате слияния эпителиоидных клеток. Цитоплазма гигантских клеток содержит большое число ядер, обычно располагающихся в виде кольца или подковы по периферии клеток, мно-
жество митохондрий, лизосом, элементов зернистой цитоплазмати-
ческой сети, хорошо развитый комплекс Гольджи. Гигантские клетки способны к фагоцитозу, в их цитоплазме обнаруживаются различные остаточные включения Они характеризуются высокой активностью
гидролитических и дыхательных ферментов.
Помимо эпителиоидных и гигантских клеток, туберкулезная грануляционная ткань обычно содержит значительное число лимфоид-
ных и плазматических клеток, а также неитрофильныи лейкоцитов
мГн:
В периферических отделах грануляционного слоя выявляются фиб-
20
робласты. Вокруг очага воспаления нередко имеется перифокальная
зона неспецифической воспалительной реакции. При прогрессировании процесса наблюдаются увеличение казеозного некроза, уси-
ление инфильтрации грануляционной ткани мононуклеарами и лим-
фоидными клетками, а также нейтро^
«из я
илами, расширение зоны пе-
рифокального воспаления. Специфический процесс распространяется
контактным и лимфатическим путем.
При заживлении туберкулезного очага массы казеозного некроза
уплотняются, в последних отмечается отложение мелких зерен солей кальция. В грануляционной ткани увеличивается количество фибробластов и фибрилл коллагена, объединяющихся в коллагеновые волокна, которые вокруг туберкулезного очага формируют соединительнотканную капсулу. В последующем специфическая грануляционная ткань все больше замещается фиброзной тканью. Число
клеточных элементов между коллагеновыми волокнами уменьшается, иногда коллагеновые волокна подвергаются гиалинозу. В подобных очагах и посттуберкулезных очагах обнаружены измененные формы микобактерий туберкулеза, в частности L-формы, что позволяет лучше понять роль старых туберкулезных очагов в патогенезе вторичных форм туберкулеза [Пузик В. И., Земскова 3. С., Дорожкова И. Р., 1981, 1984]. В основе реактивации туберкулеза и формирования различных форм вторичного туберкулеза легких лежат реверсия и размножение бактериальной популяции на фоне развития недостаточности специфической и неспецифической защи
ты микроорганизма.
Неспецифические или параспецифические реакции могут формироваться в различных органах и тканях: нервной и сердечно-сосудистой системе, кроветворных органах, суставах, серозных обо
лочках и др. В сердечно-сосудистой системе и паренхиматозных органах указанные реакции проявляются очаговой или диффузной
гистиоцитарной и лимфоцитарной инфильтрацией, в лимфатических узлах — пролиферацией ретикулярных и эндотелиальных клеток, в легких — образованием лимфоидных узелков. А. И. Струков (1959)
считает, что эти реакции имеют токсико-аллергическую природу. В. И. Пузик (1946) расценивает их как результат действия микобактерий туберкулеза в ранние периоды развития инфекционного процесса. Показана связь данных реакций с клеточным и гуморальным иммунитетом [Авербах М. М., 1976]
Благодаря профилактическим противотуберкулезным мероприятиям и специфическому лечению наблюдается значительный пато-морфоз туберкулеза. К истинному патоморфозу относят уменьшение числа казеозных пневмоний (что свидетельствует о повышении иммунитета), более частое образование туберкулем. Реже стали встречаться формы милиарного туберкулеза и туберкулезного менингита (особенно у детей). Проявлениями индуцированного патоморфоза, обусловленного специфическим лечением, являются изолированные каверны, вокруг которых быстро рассасывается перифокальное воспаление, полное рассасывание или развитие мелких звездчатых рубчиков при гематогенно-диссеминированном туберкулезе, оттор
21
жение казеозно-некротических масс с формированием на месте каверны кистоподобной полости при фиброзно-кавернозном туберкулезе.
Применение наиболее эффективных химиопрепаратов приводит к полному излечению от туберкулеза. Чаще наблюдается разное течение туберкулезного воспаления: стабилизация и обратное развитие, приобретение хронического характера с периодами затихания и обострения специфического процесса. Решающее значение принадлежит макроорганизму, состоянию его защитных механизмов, способности противостоять действию антигенного раздражителя, а также развитию полноценных репаративных процессов.
1.3.2. Первичный туберкулез
логические проявления первичного инфицирова-
ния микобактериями туберкулеза принято называть первичным туберкулезом. Первичный туберкулез развивается лишь у 7—10%
инфицированных лиц, чаще детей, у остальных же заражение проявляется лишь виражем туберкулиновых проб [Хоменко А. Г., 1989]. Отсутствие клинических проявлений первичного заражения объяс-
няется высоким уровнем неспецифической и специфической резистентности к туберкулезу, развившейся в результате противотуберкулезной вакцинации БЦЖ. Организм справляется с туберкулезной
инфекцией, пройдя период возникновения «малых» неспецифических и специфических реакций. В результате организм приобретает иммунитет к туберкулезу и болезнь не развивается. В настоящее время реже, чем раньше, наблюдается хроническое течение первичной туберкулезной инфекции в виде разнообразных параспеци-фических реакций, или «масок туберкулеза».
Наиболее частой формой первичного туберкулеза является бронхоаденит, нередко протекающий без казеинфикации лимфатических узлов и формирования очагов в легких. При снижении сопротивляемости организма и более массивного инфицирования в лимфатических узлах развивается специфическое воспаление с образованием очагов творожистого некроза. Изменения распространяются на капсулу и прилежащие участки легкого, при этом формируется прикорневой инфильтрат, как правило, неспецифической природы. Процесс может переходить на стенки бронхов с образованием мик-
ристул.
При заживлении в лимфатических узлах наблюдаются рассасы
вание перифокального воспаления, уплотнение казеоза, отложение солей кальция в казеозе, нарастание фиброзных изменений в капсуле
и окружающей прикорневой области.
Первичный туберкулез может проявляться формированием в легком первичного туберкулезного очага. Этот очаг имеет пневмонический характер с казеозом в центре и широкой перифокальной зоной воспаления снаружи. Вслед за формированием легочного
екта отмечается поражение регионарных лимфатических узлов
эки
с «дорожкой» из измененных лимфатических сосудов между ними.
22
Рис. 1.4. Первичный комплекс в легком ребенка.
Гистотопограмма. Окраска гематоксилином и эозином.
Это соответствует картине первичного комплекса с его тремя составными компонентами (рис. 1.4).
При заживлении перифокальное воспаление рассасывается, казеоз в очаге уплотняется, откладываются соли кальция, а вокруг очага формируется соединительнотканная капсула. Может произойти полное замещение казеозного очага фиброзом. В лимфатических узлах преобладают процессы инкапсуляции и обызвествления казеозных масс.
В случае прогрессирования первичного комплекса пневмонический фокус увеличивается в размерах, подвергается казеинфикации с формированием острых пневмониогенных каверн. Вокруг каверны затем формируется соединительнотканная капсула, и процесс переходит в фиброзно-кавернозный туберкулез.
Прогрессирующее течение первичного туберкулеза может проявиться в виде милиарного туберкулеза в результате «прорыва» инфекции в кровеносное русло. Важно помнить о возможности острой диссеминации инфекции; необходимо своевременно диагностировать подобные случаи, так как рано начатое лечение дает хороший эффект.
23
Следовательно, периоду первичного заражения наряду с распространением инфекции по лимфатическим путям присущи и гематогенные отсевы, характеризующие бациллемию с возникновением очагов специфического воспаления в различных органах и тканях. Очаги-отсевы в легких, формирующиеся в различные периоды первичного туберкулеза, нередко являются случайной находкой при рентгеноанатомическом обследовании людей, не страдающих активными формами туберкулеза. Такие очаги состоят из казеоза, окруженного фиброзной капсулой, бедной клеточными элементами. Очаги, как правило, множественные, располагаются в верхних сегментах легких под плеврой. С обострения процесса в этих очагах начинается вторичный туберкулез, характеризующийся локальным поражением органа. Таким образом, послепервичным очагам принадлежит большое значение в патогенезе вторичного туберкулеза.
1.3.3. Диссеминированный туберкулез
Кассификация диссеминированного туберкулеза легких объединяет диссеминации различного генеза: лимфогенные, гематогенные, бронхогенные.
Гематогенный и лимфогематогенный туберкулез по своему генезу занимают промежуточное положение между первичным и вторичным туберкулезом, часто возникая из различных очагов первичного комплекса. Для появления гематогенной диссеминации туберкулеза недостаточно попадания микобактерий туберкулеза в кровеносное русло, необходима еще сенсибилизация сосудистой стенки и всего организма. При острой гематогенной диссеминации, при милиарном туберкулезе наиболее распространенными являются продуктивные бугорки. Важное значение имеют и состояние возбудителя, появление различных форм его персистирования. Специфическая химиотерапия способствует быстрому рассасыванию воспалительных очагов, при этом на месте бугорков формируются звездчатые соединительные рубчики или незначительно утолщается строма легкого.
Хронические формы диссеминированного туберкулеза чаще встречаются у взрослых, и диссеминация имеет обычно лимфогематогенный характер. В генезе этих форм может быть туберкулезное поражение лимфатических узлов, из которых по лимфатическим путям ретроградно происходит рассеивание инфекции с последующим прорывом в сосудистое русло и формированием очагов в легких. Эти формы обычно ограничиваются поражением легочной ткани, хотя возможны и гематогенные отсевы в другие органы. Очаги, как правило, имеют продуктивный характер, локализуются преимущественно в верхушечных сегментах легкого, характеризуются значительным уменьшением диссеминации в нижних отделах легких. Очаги диссеминации обычно полиморфны: одни из них инкапсулированы, другие отличаются отсутствием хорошо выраженной капсулы, что свидетельствует о волнообразном течении процесса. Очаги локализуются по ходу утолщенной соединительнотканной стромы
24
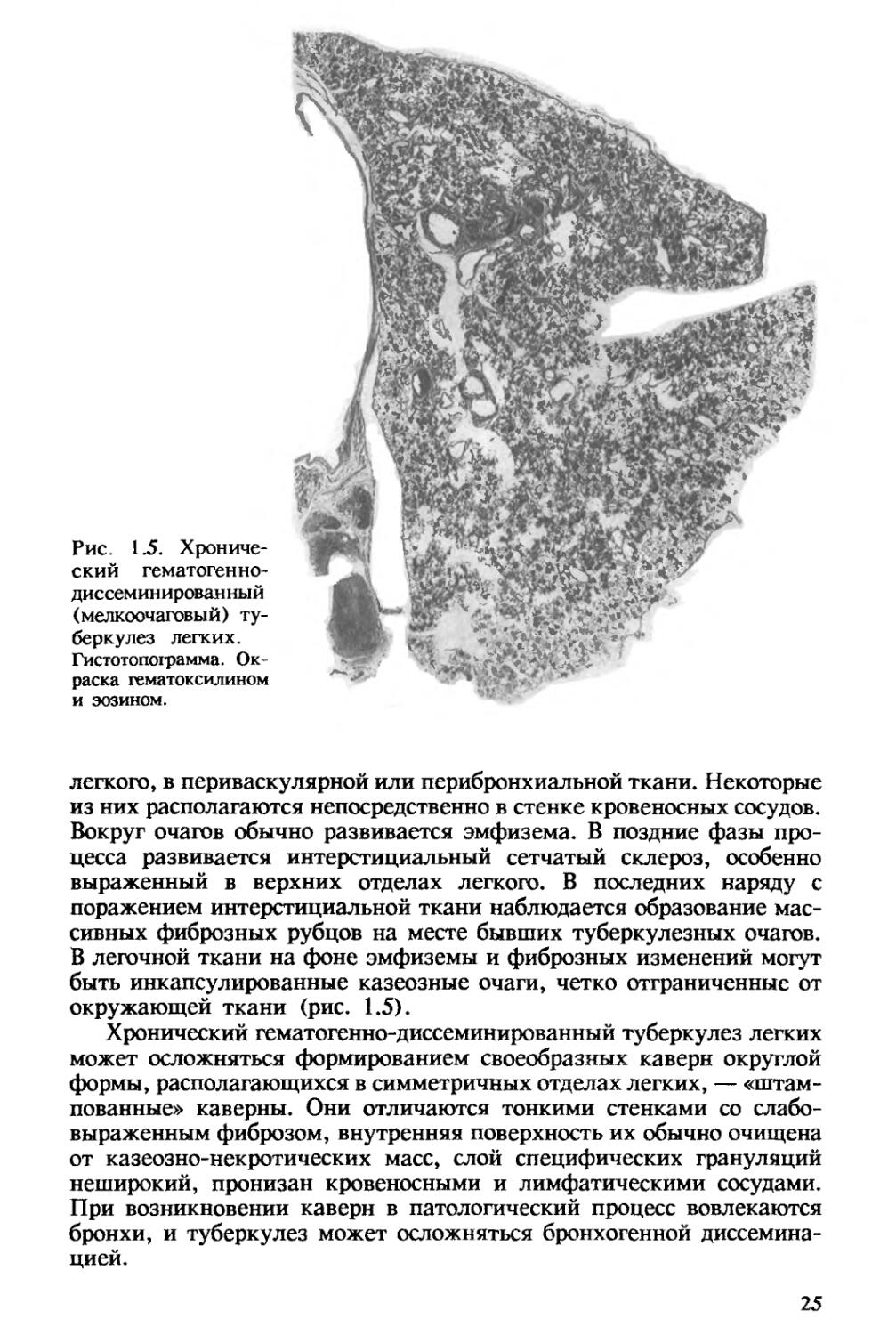
Рис. 1.5. Хронический гематогеннодиссеминированный (мелкоочаговый) туберкулез легких.
Гистотопограмма. Окраска гематоксилином и эозином.
легкого, в периваскулярной или перибронхиальной ткани. Некоторые из них располагаются непосредственно в стенке кровеносных сосудов. Вокруг очагов обычно развивается эмфизема. В поздние фазы процесса развивается интерстициальный сетчатый склероз, особенно выраженный в верхних отделах легкого. В последних наряду с поражением интерстициальной ткани наблюдается образование массивных фиброзных рубцов на месте бывших туберкулезных очагов. В легочной ткани на фоне эмфиземы и фиброзных изменений могут быть инкапсулированные казеозные очаги, четко отграниченные от окружающей ткани (рис. 1.5).
Хронический гематогенно-диссеминированный туберкулез легких может осложняться формированием своеобразных каверн округлой формы, располагающихся в симметричных отделах легких, — «штампованные» каверны. Они отличаются тонкими стенками со слабо-выраженным фиброзом, внутренняя поверхность их обычно очищена от казеозно-некротических масс, слой специфических грануляций неширокий, пронизан кровеносными и лимфатическими сосудами. При возникновении каверн в патологический процесс вовлекаются бронхи, и туберкулез может осложняться бронхогенной диссемина-цией.
25
Рис. 1.6. Очаговый туберкулез легких. Гистотопограмма. Окраска гематоксилином и эозином.
При развитии бронхогенного туберкулеза, локализующегося главным образом в нижних отделах легких, могут образоваться сливные очаги брояхолобулярной пневмонии. В последующем эти очаги распадаются и образуются острые бронхогенные каверны.
1.3.4. Очаговый туберкулез
Очаговый туберкулез является одной из наиболее распространенных форм туберкулеза. Эта форма связана с образованием очагов-отсевов или очагов реинфекта, возникающих чаще всего эндогенно при лимфогенном рассеивании туберкулезной инфекции из очагов первичного туберкулеза. В последующем очаги-отсевы ведут к образованию новых, более свежих очагов в непосредственной близости от ранее возникших. В связи с этим очаговый туберкулез характеризуется наличием целой группы очагов казеоза, локализующихся преимущественно односторонне, чаще справа в верхней доле субплеврально.
26
Очаги располагаются среди фиброзированной стромы легкого,
утолщенной плевры и междольковых перегородок, что указывает на их лимфогенный генез [Штефко В. Г., 1936; Иванова М. Г., 1939]
(рис. 1.6). Одни очаги характеризуются хорошо выраженной капсулой, бедной клеточными элементами, и уплотненным казеозом, иногда даже частично фиброзированным; другие очаги более «све
жие», казеоз в них окружен зоной из макрофагов, эпителиоидных
и лимфоидных клеток с гигантскими клетками между ними. Капсула вокруг таких очагов выражена слабо, фиброзные волокна в ней инфильтрированы лимфоидными клетками. Рядом могут распола
гаться совсем «свежие» казеозные очаги, окруженные широкой клеточной зоной. Лимфоцитарная инфильтрация в таких очагах без четкой границы переходит на окружающую ткань.
Распространение процесса чаще всего происходит по лимфатическим путям, реже контактным путем и еще реже — по бронхам и кровеносным сосудам [Ильина Т. Я., 1982). Заживление очагов происходит обычно посредством их инкапсуляции, уплотнения ка-зеоза и частичного его замещения соединительной тканью, врастающей в казеоз со стороны капсулы. Обострение процесса выражается в нарастании воспалительных изменений в капсуле очагов и окружающей их легочной ткани с образованием так называемого инфильтрата. Обострение процесса может проявляться расплавлением казеоза в одном из очагов с формированием вначале щелевидной, а затем и более крупной полости. Исходом очагового туберкулеза при благоприятном течении процесса является развитие фиброза
как в очагах, так и вокруг них.
1.3.5. Инфильтративный туберкулез
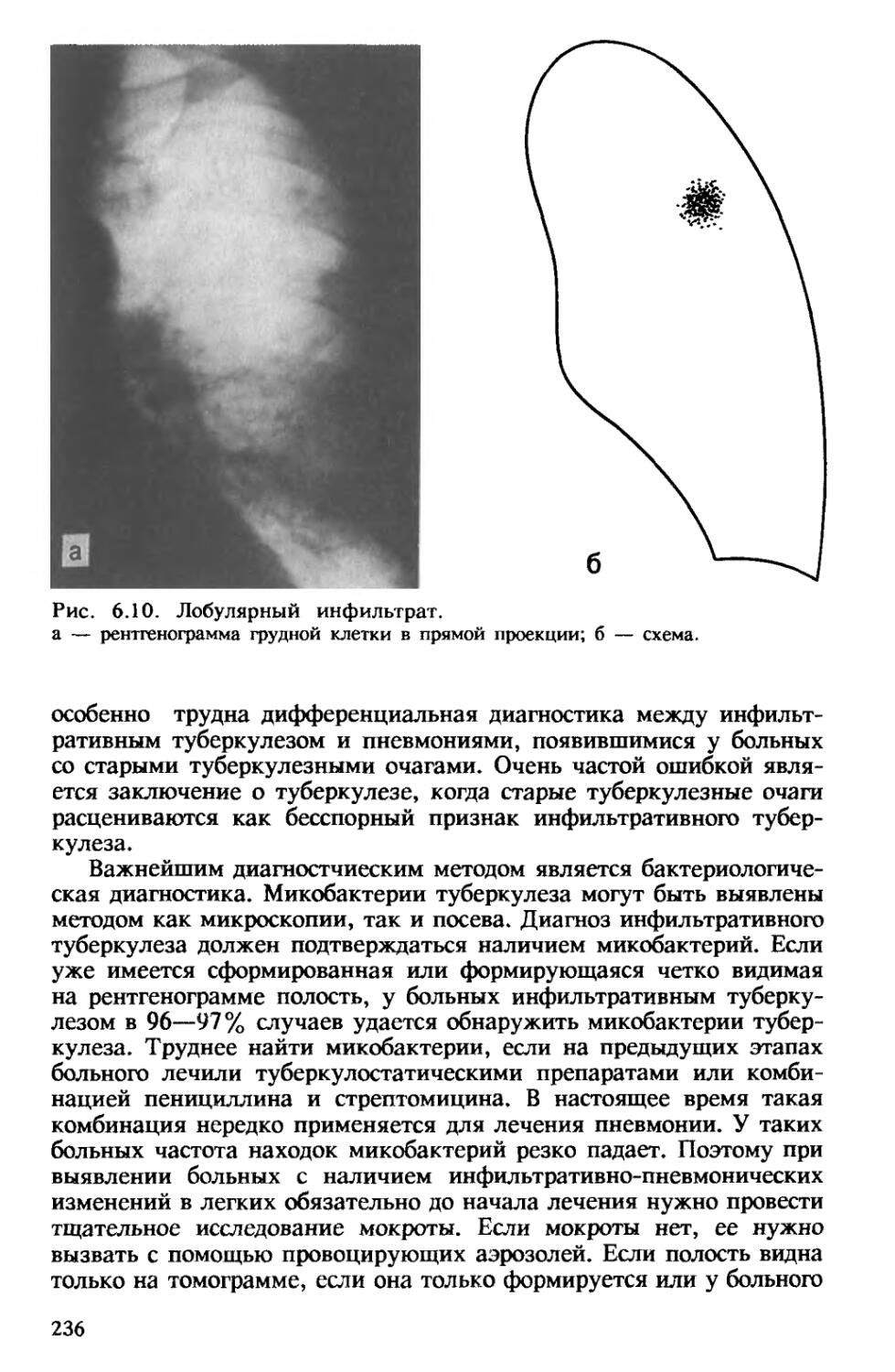
Инфильтративный туберкулез обычно возникает при обострении очагового туберкулеза. При этом чаще всего в I или II бронхолегочных сегментах появляется уплотнение с диаметром 2—3 см. В его центре определяются мелкие очаги казеоза, вокруг последних образуется зона перифокального воспаления. При благоприятном течении процесса происходят рассасывание перифокального, преимущественно неспецифического, воспаления, отграничение и уплотнение казеозных очагов, их инкапсуляция и обызвествление, фиброзные изменения в прилежащих участках легкого (рис. 1.7).
При прогрессировании инфильтративного туберкулеза очаги казеоза в его центральных отделах увеличиваются, так же как и зона перифокального воспаления, которая может занять всю долю легкого по типу лобита [Струков А. И., Соловьева И. П., 1976). Наряду с участками казеоза, окруженными эпителиоидными, лимфоидными
и гигантскими клетками, имеются участки воспаления, в которых просветы альвеол заполнены фибрином, клетками десквамирован-
ного альвеолярнго эпителия и альвеолярными макрофагами, а также
экссудатом. Расплавление казеоза в очаге и прорыв казеозных масс в бронхи ведут к образованию на месте инфильтрата острой каверны.
Наряду с патоморЗ
логической картиной инфильтрата представим
27
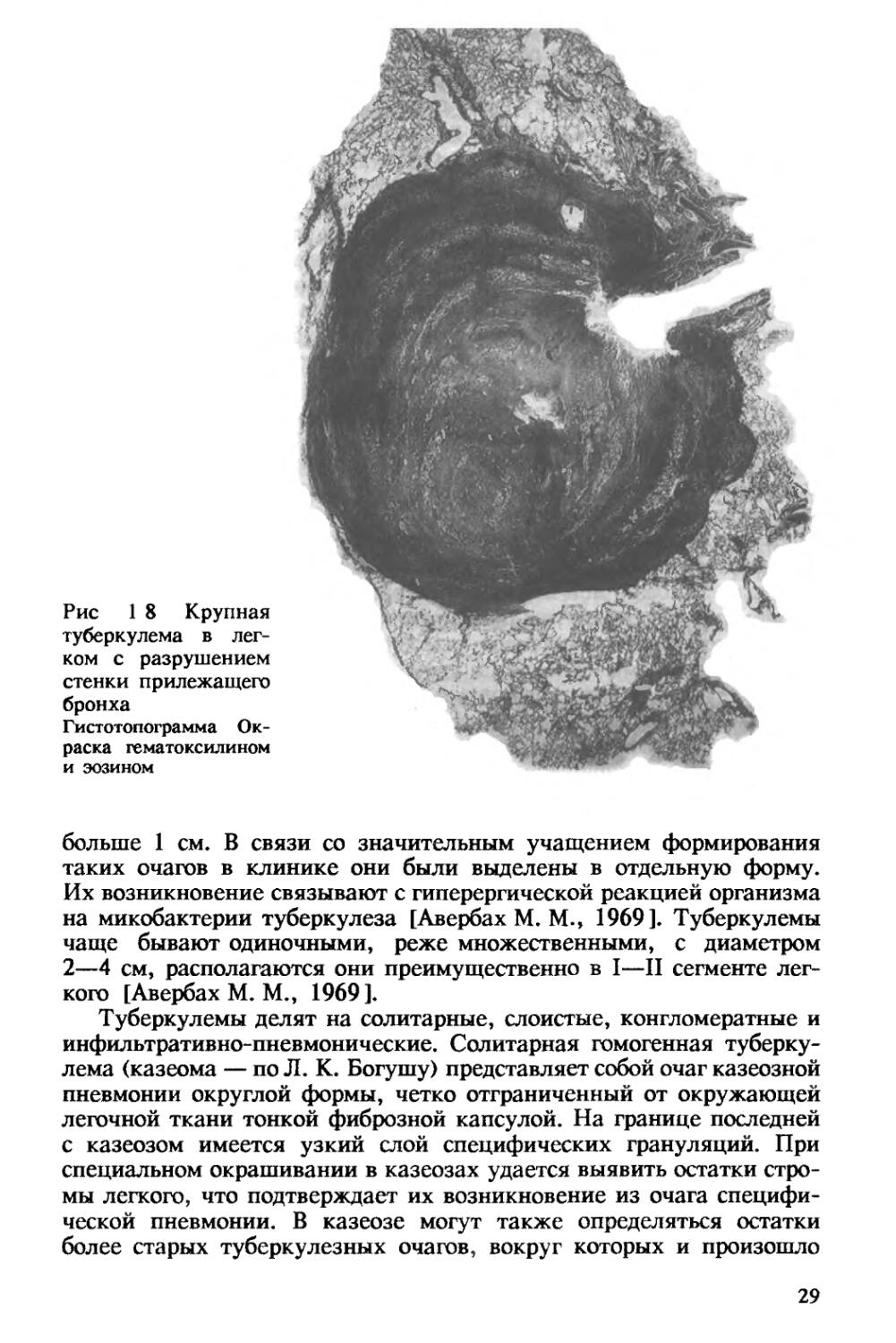
Рис 1 8 Крупная туберкулема в легком с разрушением стенки прилежащего бронха
Гистотопограмма Окраска гематоксилином и эозином
больше 1 см. В связи со значительным учащением формирования таких очагов в клинике они были выделены в отдельную форму. Их возникновение связывают с гиперергической реакцией организма на микобактерии туберкулеза [Авербах М. М., 1969]. Туберкулемы чаще бывают одиночными, реже множественными, с диаметром 2—4 см, располагаются они преимущественно в I—II сегменте легкого [Авербах М. М., 1969].
Туберкулемы делят на солитарные, слоистые, конгломератные и инфильтративно-пневмонические. Солитарная гомогенная туберкулема (казеома — по Л. К. Богушу) представляет собой очаг казеозной пневмонии округлой формы, четко отграниченный от окружающей легочной ткани тонкой фиброзной капсулой. На границе последней с казеозом имеется узкий слой специфических грануляций. При специальном окрашивании в казеозах удается выявить остатки стромы легкого, что подтверждает их возникновение из очага специфической пневмонии. В казеозе могут также определяться остатки более старых туберкулезных очагов, вокруг которых и произошло
29
Рис 17 Инфильтративный туберкулез легких В центре определяется казеоз Гистотопограмма Окраска гематоксилином и эозином
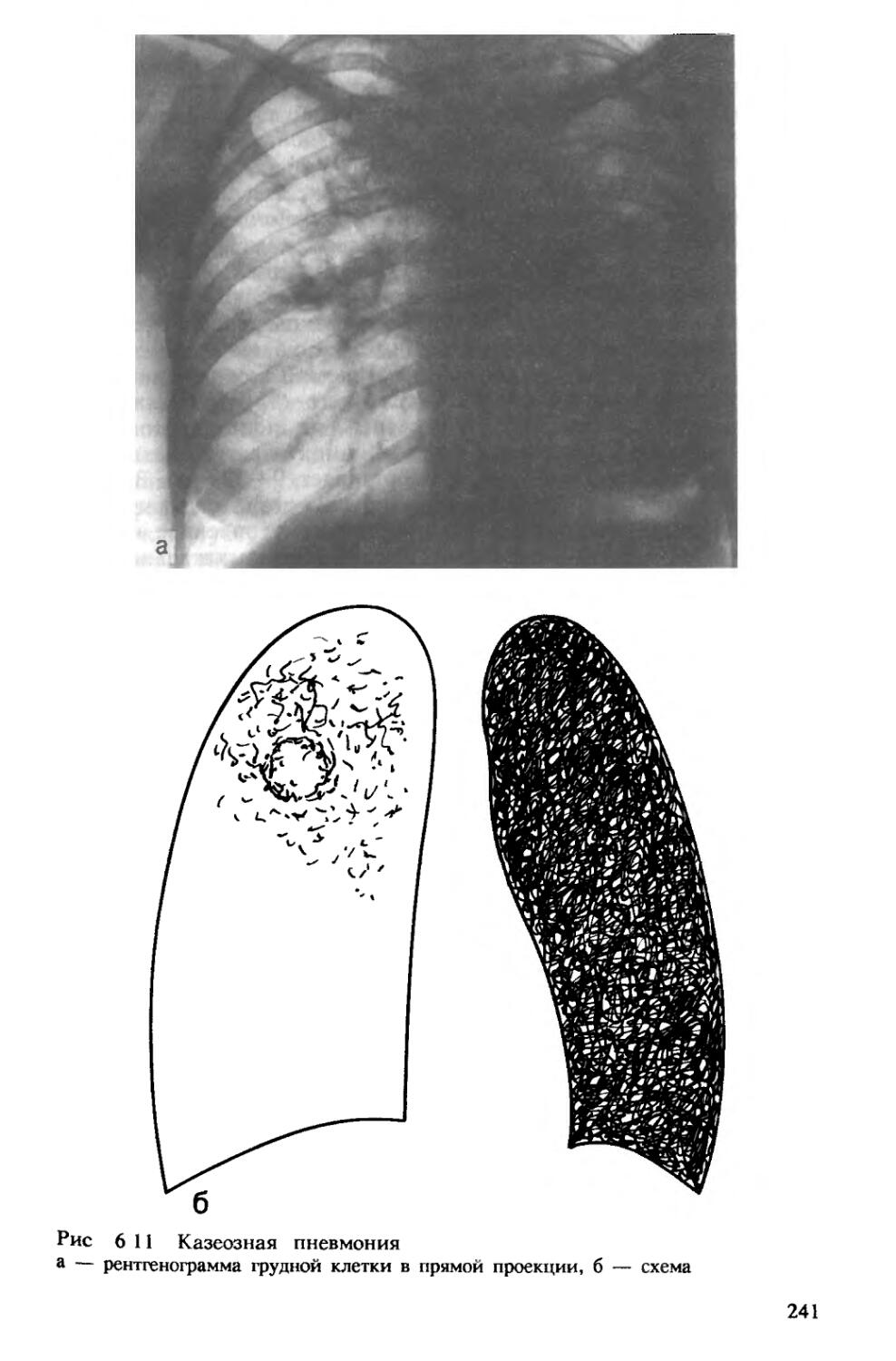
данные о казеозной пневмонии. Для такой пневмонии характерно преобладание острого казеозного распада. Различают ацинозную форму казеозной пневмонии, при которой поражение ограничивается пределами ацинуса, лобулярную казеозную пневмонию, когда процесс захватывает дольки легкого, и лобарную форму, когда в процесс вовлекается целая доля легкого. При лобулярной форме казеозно измененные дольки могут сливаться, формируя сегментарные, лобарные очаги и приводя к тотальной казеозной пневмонии. Лобарная казеозная пневмония является наиболее тяжелой формой туберкулеза. Большая часть пораженной доли в этих случаях оказывается занятой казеозом, в котором могут наблюдаться расплавление казеоза и образование острых полостей распада. В современных условиях казеозная пневмония отличается отграничением процесса по периферии казеозного фокуса или наоборот острым, обширным расплавлением казеоза с формированием множественных полостей распада.
1.3.6. Туберкулема
К этой форме туберкулеза относятся разнообразные по генезу инкапсулированные казеозные очаги округлой формы с диаметром
28
обострение процесса (рис. 1.8). На границе туберкулемы с окружающей легочной тканью обычно выявляются лимфоцитарные скопления, свидетельствующие о выраженности иммунных реакций в легких. Слоистые туберкулемы отличаются концентрическим расположением казеозных масс и коллагеновых волокон. Зона специфической грануляционной ткани очень узкая, местами отсутствует, фиброзная капсула тонкая, но выражена четко. Конгломератная туберкулема имеет обычно неправильно округлую форму и состоит из нескольких казеозных очагов различного размера, объединенных одной общей капсулой. Туберкулема инфильтративно-пневмонического типа представляет собой нечетко отграниченное округлое или неправильной овальной формы образование, в котором участки творожистого некроза чередуются с ^юкусами туберкулезного воспаления гранулематозного типа и участками пневмонии полиморфного типа.
К туберкулемам иногда относят заполненные каверны, в которых в связи с облитерацией дренирующего бронха происходит скопление казеозно-слизистых масс и они приобретают округлую форму. В отличие от истинных туберкулем в их казеозных массах отсутствуют элементы стромы легкого, капсула их значительно толще за счет более широкого слоя грануляционной ткани и фиброза.
При прогрессировании туберкулемы она может увеличиваться в размерах, казеоз в ней подвергается расплавлению, воспалительный инфильтрат переходит на прилежащие бронхи, в просвет которых выделяются расплавляющиеся казеозные массы. В этих случаях на месте туберкулемы образуется каверна.
При стабилизации туберкулемы или ее заживлении наблюдаются рассасывание перифокального воспаления, нарастание в капсуле процессов трансформации специфической грануляционной ткани в неспецифическую фиброзную ткань, проникающую в казеоз и его замещающую.
1.3.7. Деструктивный туберкулез легких
Любая форма туберкулеза может осложниться расплавлением казеоза, выделением казеозных масс через бронхи и формированием полости, т. е. переходом процесса в деструктивную 4юрму. Сфор-
мированная каверна характеризуется трехслойным строением сте-
нок: внутренний казеозно-некротический слой; слой специфических
грануляции, содержащий макрос;
аги, эпителиоидные, лимфоидные
и гигантские клетки Пирогова—Лангханса; наружный фиброзный
слой, граничащий с окружающей легочной тканью, состоящий из волокон соединительной ткани, инфильтрированных лимфоидными клетками, и содержащий в большем или меньшем количестве кровеносные и лимфатические сосуды. Казеозно-некротические массы и туберкулезные грануляции со стенок каверн переходят на стенки дренирующих бронхов.
По генезу каверны могут быть пневмониогенными, образующимися на месте очага туберкулезной пневмонии, бронхогенными,
30
формирующимися на месте пораженных туберкулезом бронхов, гематогенными, возникающими при гематогенно-диссеминированном туберкулезе [Штефко В. Г., 1938; СтруковА. И., 1948; Пузик В. И. и др., 1973]. По величине диаметра каверны различают: малые — до 2 см, средние — от 2 до 4 см, большие — от 4 до 6 см, гигантские — белее 6 см [Струков А. И., 1959]. При заживлении каверн наблюдаются отторжение казеозно-некротического слоя, уменьшение просвета полости за счет сморщивания стенок, разрастания грануляционной ткани и фиброза. В конечном итоге на месте каверны может образоваться рубец, в центре которого иногда имеется небольшая остаточная полость, выстланная эпителием и содержащая прозрачную жидкость.
В процессе заживления каверны просвет дренирующих бронхов может облитерироваться, и в таком случае на месте каверны образуется инкапсулированный очаг казеоза типа туберкулемы. При заживлении каверна может трансформироваться в кистоподобную полость.
Процесс этот длительный, и в стенках подобных каверн долгое время могут сохраняться участки специфической грануляционной ткани. При развитии в каверне процессов заживления большое значение имеет состояние крово- и лимфообращения, особенно в системе микроциркуляции — как в стенках каверны, так и окружающей ее легочной ткани [Штефко В. Г., 1938; Пузик В. И. и др., 1973; СтруковА. И., Соловьева И. П., 1976; Ерохин В. В., 1987, и др.].
При отграничении каверны, стабилизации патологического процесса (особенно при применении противотуберкулезных препаратов) полиморфные, пневмонические участки вокруг каверны рассасываются, нарастают фиброзные изменения, «тянущиеся» от фиброзного слоя стенки каверны в окружающую легочную ткань. В такой каверне обычно выявляется большое количество разной величины лимфоцитарных скоплений и узелков, располагающихся между соединительнотканными волокнами капсулы.
Прогрессирование деструктивного туберкулеза выражается в увеличении казеозно-некротического слоя, который может переходить на слой специфической грануляционной ткани и фиброза. В окружающей легочной ткани наблюдается перифокальное воспаление, формируются очаги специфической пневмонии. Прогрессируют изменения и в бронхах с появлением очагов острой бронхогенной диссеминации.
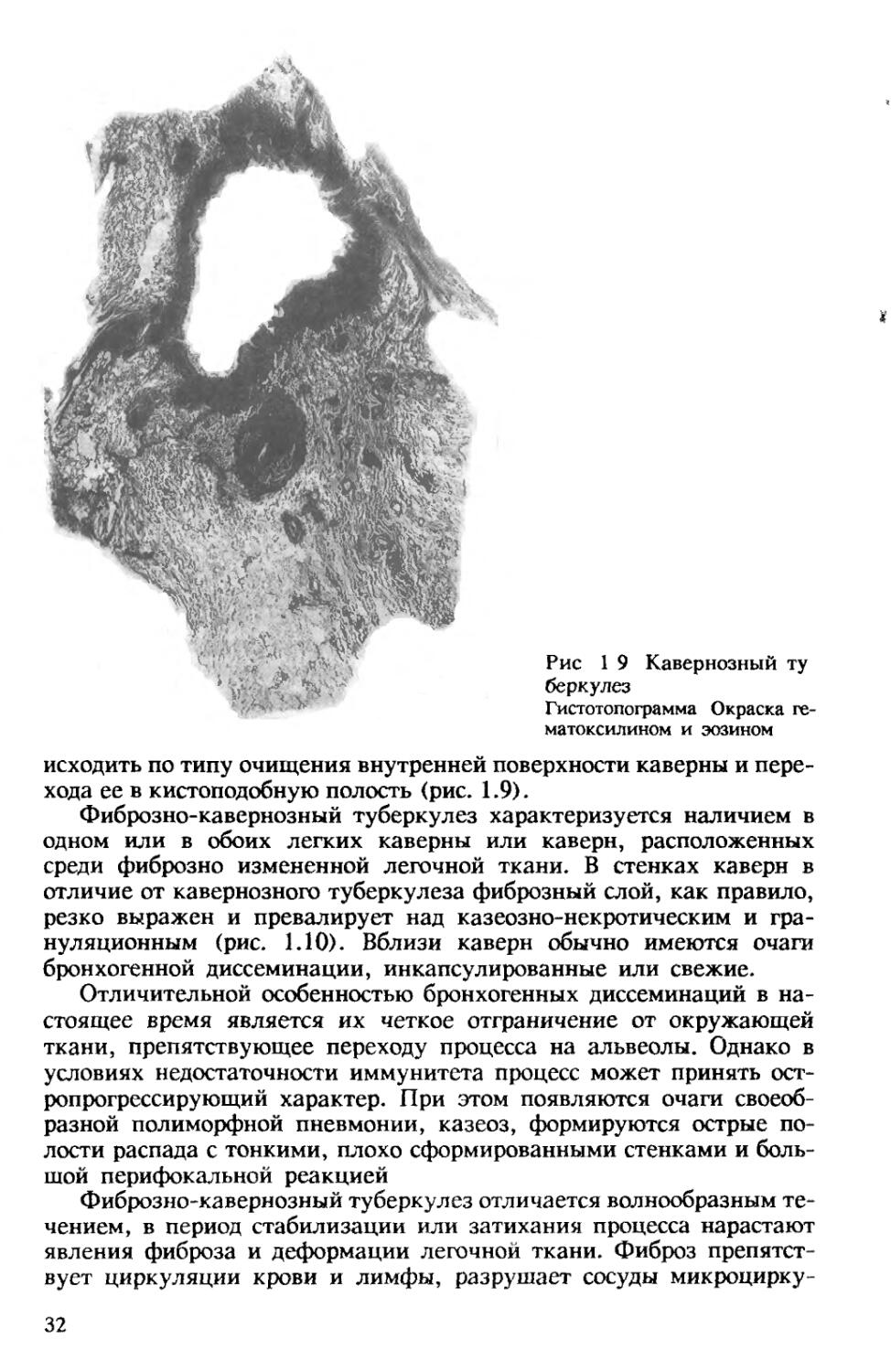
Кавернозный туберкулез легких выделен в отдельную форму. Он характеризуется наличием изолированной сформированной каверны без выраженных фиброзных изменений в ее стенках и окружающей легочной ткани. Чаще всего каверна располагается в одном бронхолегочном сегменте. Казеозно-некротический слой в ее стенках тонкий, а основную часть стенки составляет грануляционный слой, богатый лимфоидными клетками и микрососудами. В связи с отсутствием выраженного фиброза в стенках такой каверны она может под влиянием лечения спадаться и заживать рубцом. Заживление может также про-
31
Рис. 1.11. Цирротический туберкулез легких.
Гистотопограмма. Окраска гематоксилином и эозином.
(включая и измененные формы микобактерий туберкулеза), мор
фофункциональная неполноценность макрофагов и незавершенность фагоцитоза, нарушение процессов фибриллообразования, недоста
точность сурфактантной системы легких и др. [Ерохин В. В., Ель-шанская М. П., 1986].
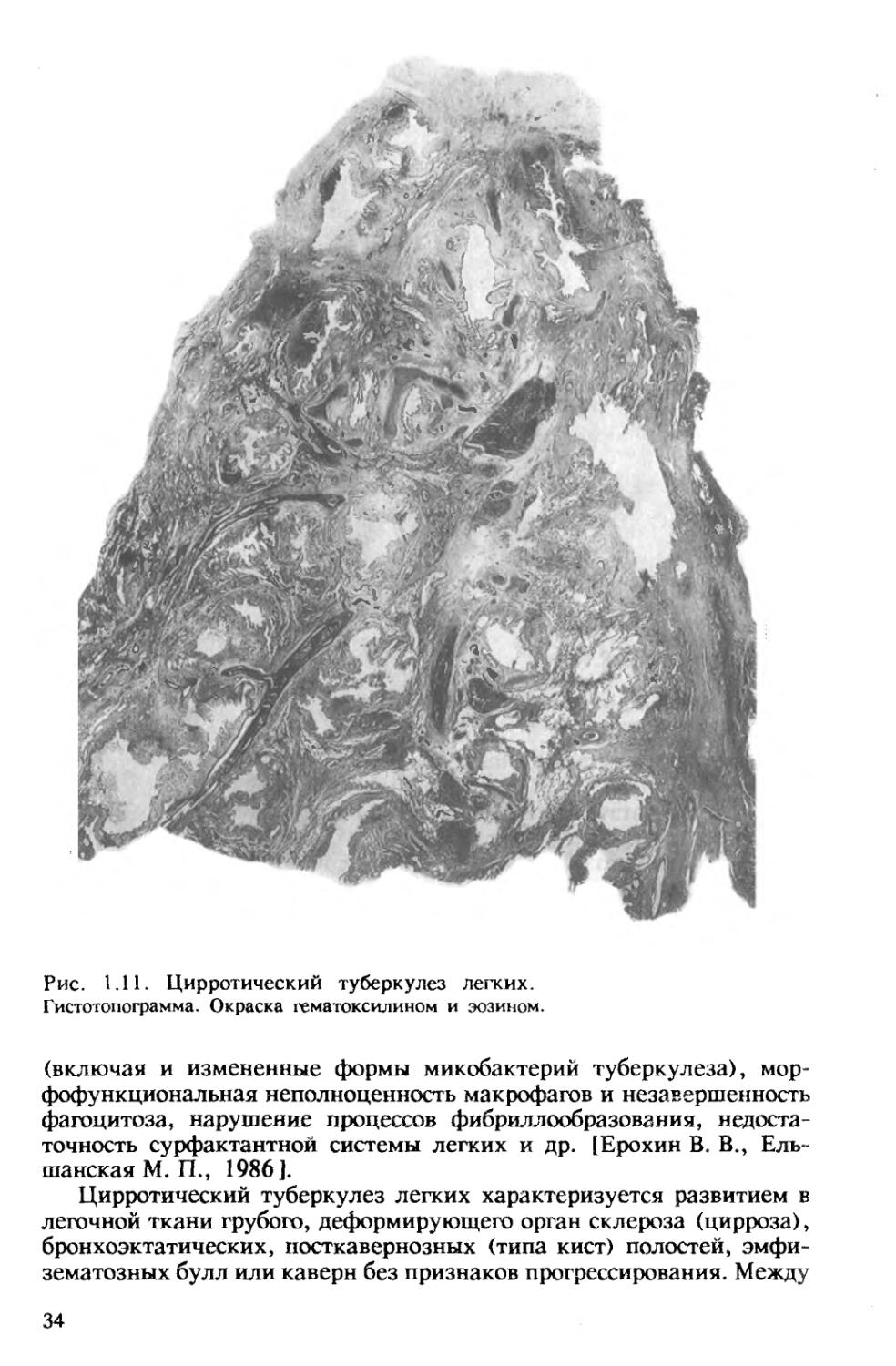
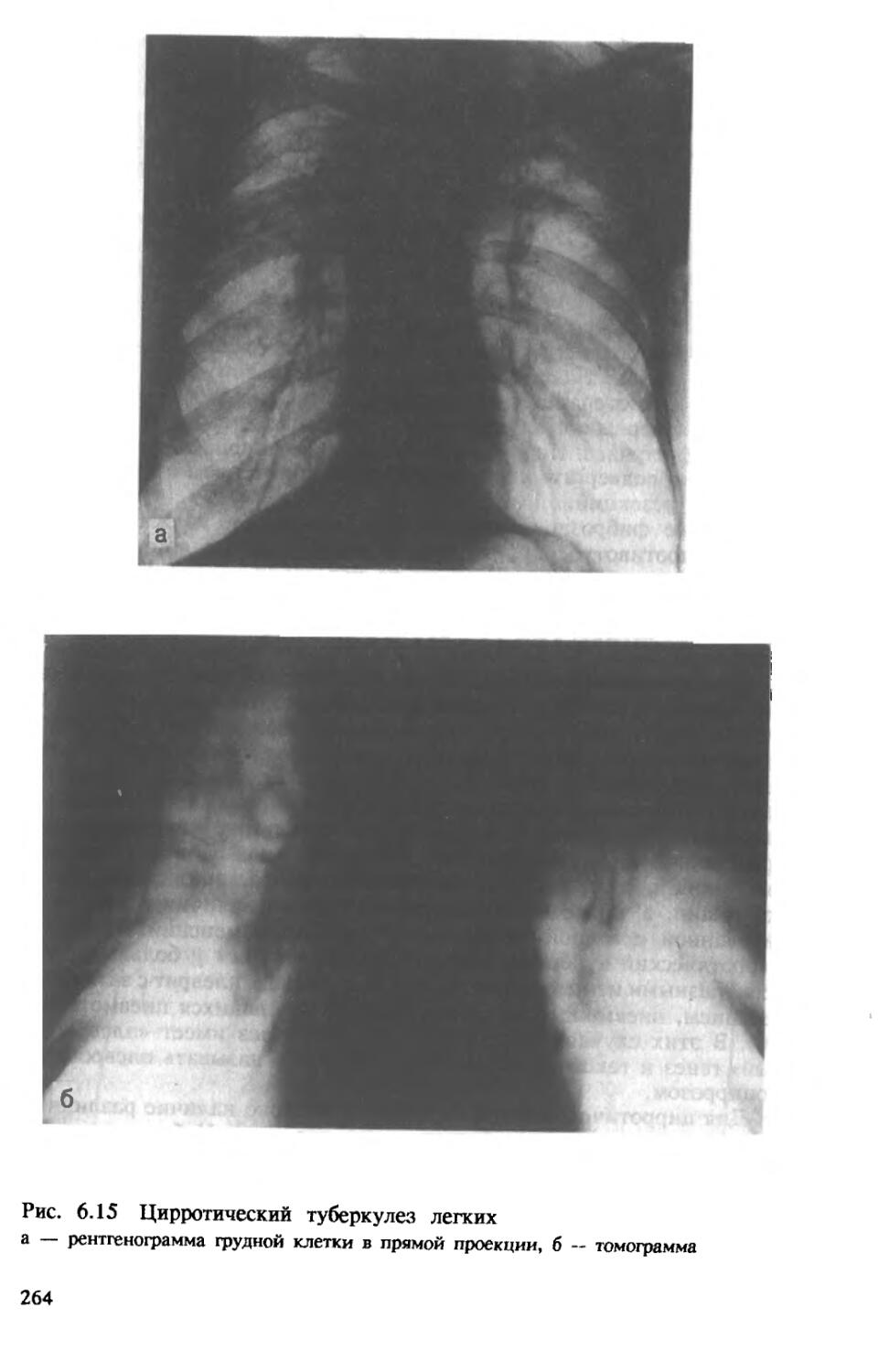
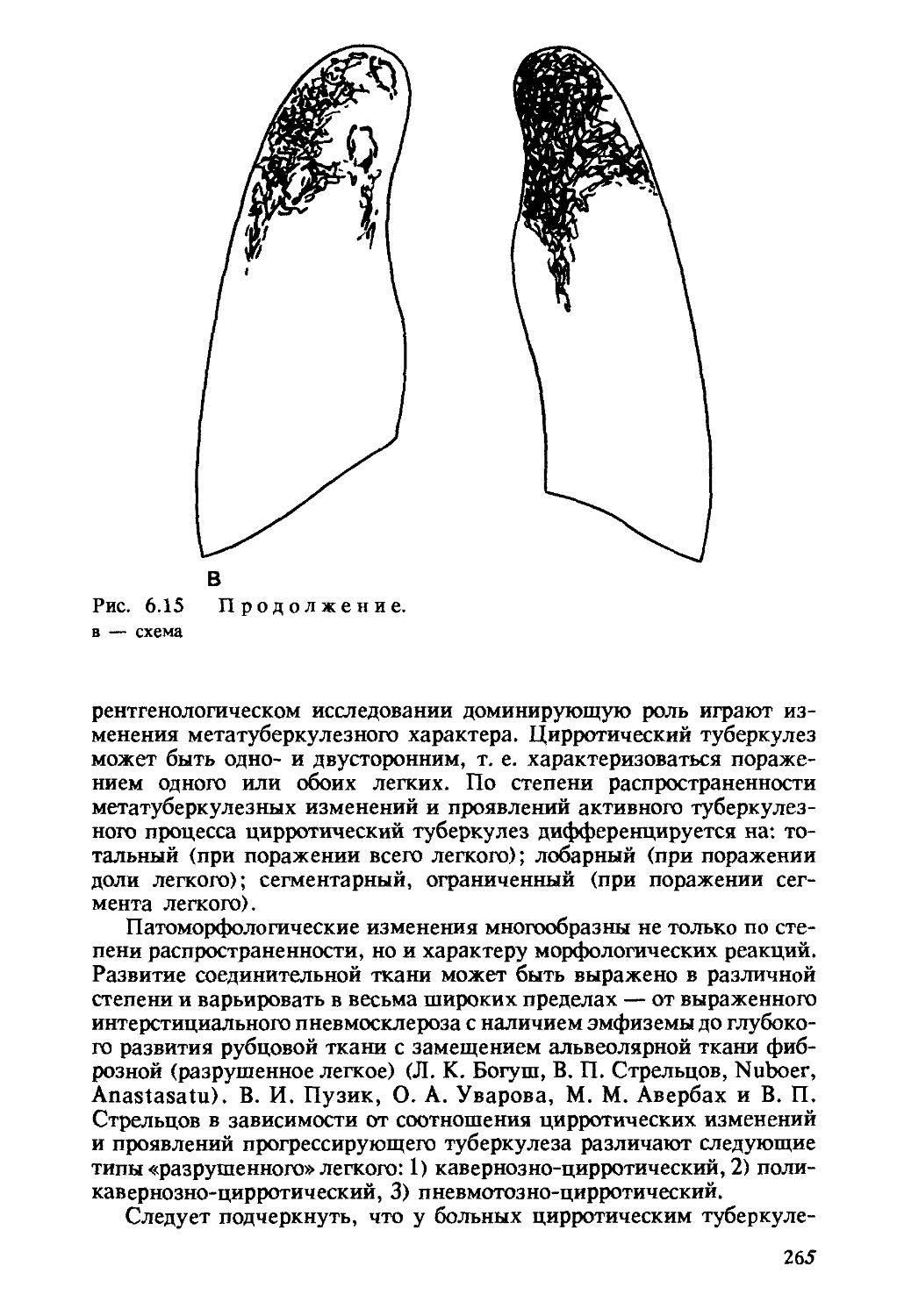
Цирротический туберкулез легких характеризуется развитием в легочной ткани грубого, деформирующего орган склероза (цирроза), бронхоэктатических, посткавернозных (типа кист) полостей, эмфизематозных булл или каверн без признаков прогрессирования. Между
34
Рис 1 9 Кавернозный ту беркулез
Гистотопограмма Окраска гематоксилином и эозином
исходить по типу очищения внутренней поверхности каверны и перехода ее в кистоподобную полость (рис. 1.9).
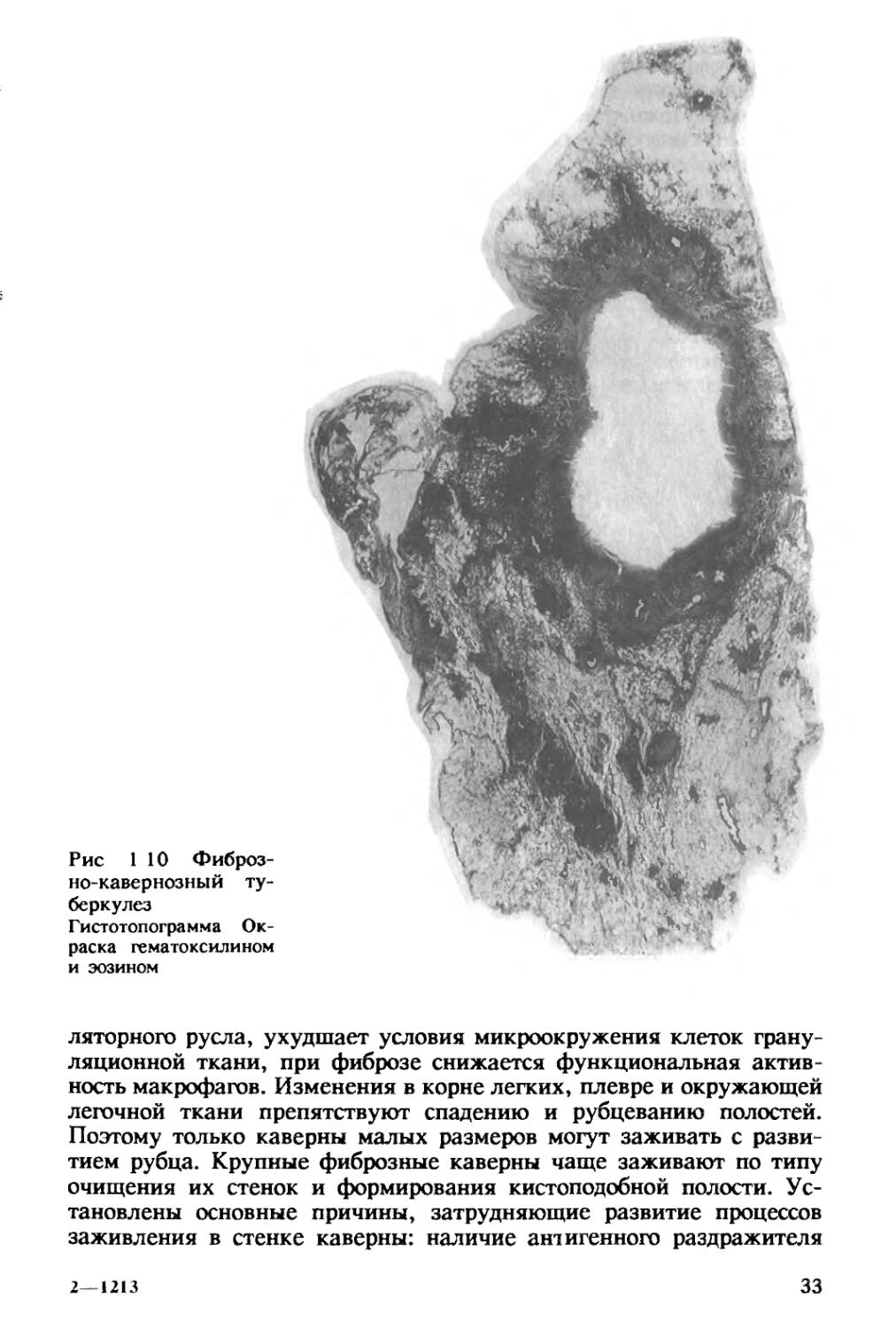
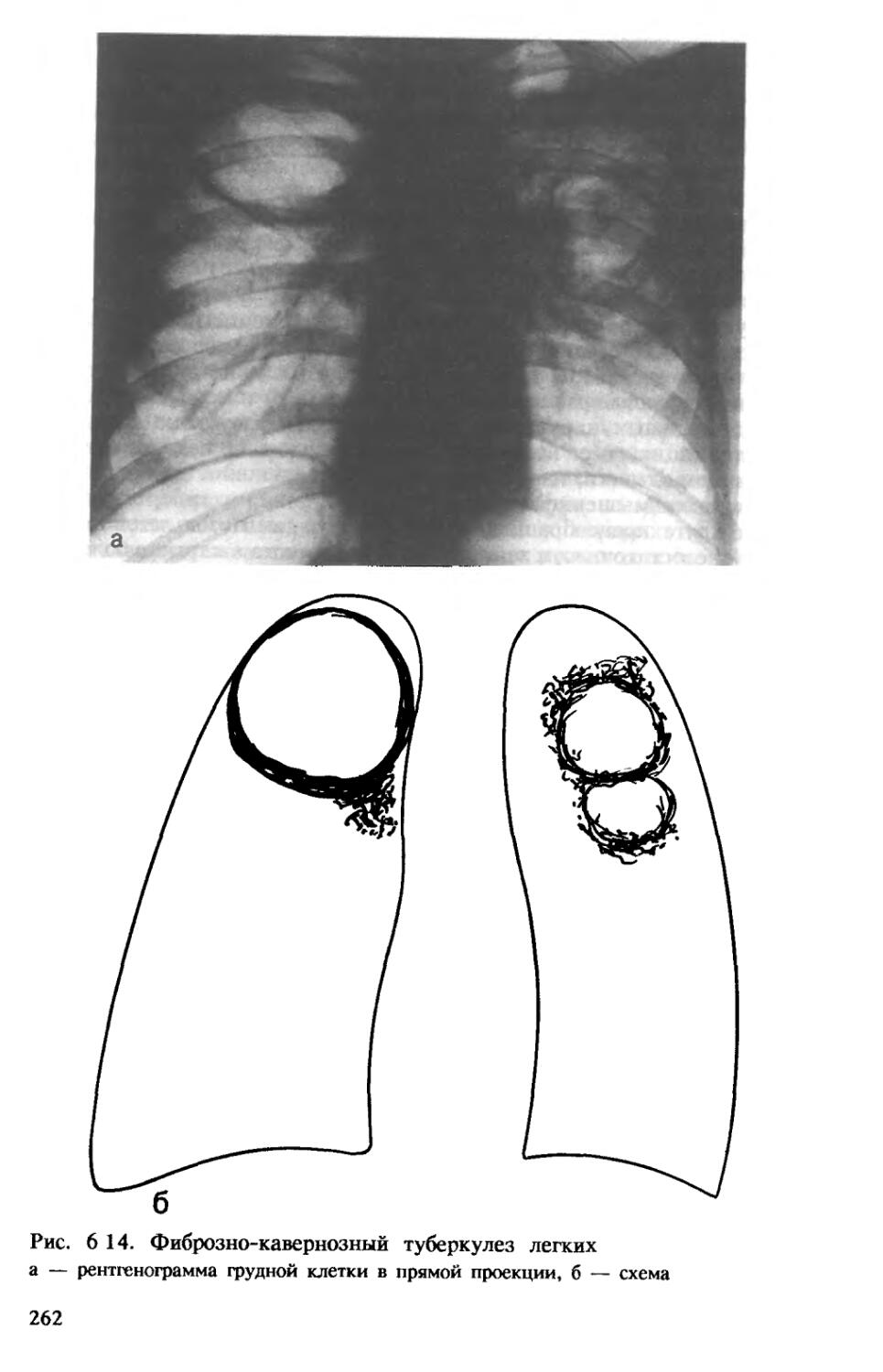
Фиброзно-кавернозный туберкулез характеризуется наличием в одном или в обоих легких каверны или каверн, расположенных среди фиброзно измененной легочной ткани. В стенках каверн в отличие от кавернозного туберкулеза фиброзный слой, как правило, резко выражен и превалирует над казеозно-некротическим и грануляционным (рис. 1.10). Вблизи каверн обычно имеются очаги бронхогенной диссеминации, инкапсулированные или свежие.
Отличительной особенностью бронхогенных диссеминаций в настоящее время является их четкое отграничение от окружающей ткани, препятствующее переходу процесса на альвеолы. Однако в условиях недостаточности иммунитета процесс может принять остропрогрессирующий характер. При этом появляются очаги своеобразной полиморфной пневмонии, казеоз, формируются острые полости распада с тонкими, плохо сформированными стенками и большой перифокальной реакцией
Фиброзно-кавернозный туберкулез отличается волнообразным течением, в период стабилизации или затихания процесса нарастают явления фиброза и деформации легочной ткани. Фиброз препятствует циркуляции крови и лимфы, разрушает сосуды микроцирку-
32
Рис 1 10 Фиброзно-кавернозный туберкулез Гистотопограмма Окраска гематоксилином и эозином
ляторного русла, ухудшает условия микроокружения клеток грануляционной ткани, при фиброзе снижается функциональная актив
агов. Изменения в корне легких, плевре и окружающей
ность мак
легочной ткани препятствуют спадению и рубцеванию полостей. Поэтому только каверны малых размеров могут заживать с развитием рубца. Крупные фиброзные каверны чаще заживают по типу очищения их стенок и формирования кистоподобной полости. Ус
тановлены основные причины, затрудняющие развитие процессов заживления в стенке каверны: наличие антигенного раздражителя
2 1213
33
рубцами могут определяться туберкулезные очаги разного размера и строения. Цирротически измененное легкое резко деформировано, уменьшено в объеме, плотное. Плевра утолщена, иногда значительно, панцирем покрывает все легкое, в ней может происходить окостенение. В связи с наличием массивных фиброзных тяжей воздушность легочной ткани резко снижена, участки ателектаза чередуются с участками эмфиземы. Резко деформировано бронхиальное дерево, имеются бронхоэктазы различных размеров и формы. В кровеносных сосудах наблюдаются перестройка с перекалибровкой их просвета, появление сосудов замыкающего типа и множества зияющих артериовенозных анастомозов.
В стенках расширенных бронхов, бронхоэктатических полостей и очищенных каверн обычно выражено неспецифическое воспаление. При значительном склерозе и отсутствии при нем активных туберкулезных изменений имеется цирроз легкого как последствие перенесенного туберкулеза (рис. 1.11).
2*
ГЛАВА 2
ИММУНОЛОГИЯ И ГЕНЕТИКА
Туберкулез — хроническое инфекционное заболевание, протека-
ющее с внутриклеточным (в макрофагах) паразитированием микобак
терий. Несмотря на самую современную химиотерапию, лечение туберкулеза, как правило, бывает длительным и не всегда эффективным. Одной из причин случаев безуспешного лечения по общепринятому
мнению является недостаточная эффективность защитных механизмов, в значительной мере генетически обусловленная.
Взаимодействие микроорганизма и возбудителя при туберкулезе — это классический пример внутриклеточной инфекции. Ее характерными чертами являются недостаточность собственных бактерицидных си-
стем макрофагов для элиминации микобактерий, необходимость им-
мунологического усиления активности макрофагов с помощью медиа
торов, синтезируемых Т-лимфоцитами, отсутствие прямого или опосредованного (через разные типы клеток) бактерицидного действия
антител. При этом существенные особенности инфекции связаны с пре
имущественно аэрогенным путем заражения и длительным течением заболевания, особенно при его хронических формах, сопровождаю
щихся антигенемией и интоксикацией.
Существует огромное число работ, в которых была изучена роль различных иммунологических феноменов при туберкулезе и их генетический контроль. Этому есть много объективных причин.
1. Туберкулез хорошо моделируется на экспериментальных жи
вотных (в том числе на линейных мышах).
2. Туберкулез у человека представляет собой хроническое инфекционное заболевание, имеющее, вероятно, самое широкое распространение в мире среди хронических бактериальных инфекций.
3. Клиническая и морфологическая картина туберкулеза полиморфна, и разным формам и особенностям его течения соответствуют
различные иммунологические характеристики.
4. Туберкулез является классической моделью, на которой уже в течение почти 100 лет изучают один из важнейших феноменов иммунитета — гиперчувствительность замедленного типа (ГЗТ).
5. Микобактерии туберкулеза обладают известным адъювантным действием, и при изучении иммунного ответа на те антигены, которые вводятся в адъюванте, как правило, исследуют и иммунный ответ на компоненты микобактерий. Этот как бы «побочный продукт» подобных исследований дал очень много для понимания природы иммунного ответа при туберкулезе.
2.1. ИММУНОЛОГИЧЕСКИЙ СТАТУС БОЛЬНЫХ ТУБЕРКУЛЕЗОМ, ВОПРОСЫ ПРОГНОЗА И ИММУНОДИАГНОСТИКИ
По аналогии со «спектром» лепры описан «спектр» проявлений туберкулеза у человека, определенный на основании клинических, бактериологических, иммунологических и гистологических данных
36
[Lenzini L., 1977; Turk J., 1979; Ellner J., 1986]. Этот «спектр» включает 4 формы.
1. Реактивная форма — микроочаговый, ограниченный туберкулез. При этой форме в 100% случаев определяются типичные реакции замедленного типа на туберкулин (ГЗТ) и отсутствуют ранние (РР) и смешанные (СР) реакции на туберкулин, наблюдается выраженное подавление миграции лейкоцитов (ПМЛ), гуморальные антитела к PPD выявляются редко (5% случаев). Микобактерии не определяются ни в мокроте, ни в тканях. Реакции в зародышевых центрах лимфатических узлов и в других регионах, где находятся плазматические клетки, слабые, а в паракортикальных зонах, где локализуются Т-лимфоциты, — выраженные. Эффект лечения этой формы достигает 100%.
2. Промежуточная реактивная форма — очаговый или микроочаговый, ограниченный кавернозный туберкулез, односторонняя или двусторонняя лимфоаденопатия, туберкулезный серозит. ГЗТ положительна в 30%, РР — в 10—15% и СР — в 50—60% случаев. ПМЛ выражено в меньшей степени, чем при реактивной форме, гуморальные антитела к PPD определяются в 70% случаев, микобактерии в мокроте не выявляются, а в тканях обнаруживаются редко. Реакция плазматических клеток слабая, а в пара-кортикальной зоне выраженная, но в меньшй степени, чем при реактивной форме. Антибактериальное лечение эффективно в 90%
случаев.
3. Промежуточная ареактивная форма — хронический распространенный фиброзно-кавернозный туберкулез, туберкулезная лимфоаденопатия, осложнения образованием свищей. ГЗТ положительна примерно в 5%, РР — в 15%, СР — в 80% случаев, ПМЛ положительна очень редко, гуморальные антитела против PPD определяются почти в 100% случаев, микобактерии в мокроте выявляются в большинстве случаев, а в тканях — всегда, реакция
плазматических клеток выраженная, а в паракортикальных зонах слабая. Эффективное излечение удается только в 30% случаев.
4. Ареактивная форма — острый милиарный туберкулез. Все виды туберкулиновых реакций отрицательные, как и ПМЛ, гуморальные антитела к PPD и микобактерии в мокроте и тканях обнаруживаются в 100% случаев, реакция плазматических клеток слабая, а в паракортикальных зонах отсутствует. Антибактериальное
лечение неэффективно.
Хотя эта классификация в принципе отражает соотношение раз
логических, микробиологических и имму-
ных клинических,
•И'А
нологических параметров, однако значительное число случаев туберкулеза в нее не укладывается. М. М. Авербах и соавт. (1990) на основании анализа результатов собственных исследований и данных литературы суммировали (разумеется, условно) спектр нарушений иммунитета при туберкулезе (табл. 2.1)
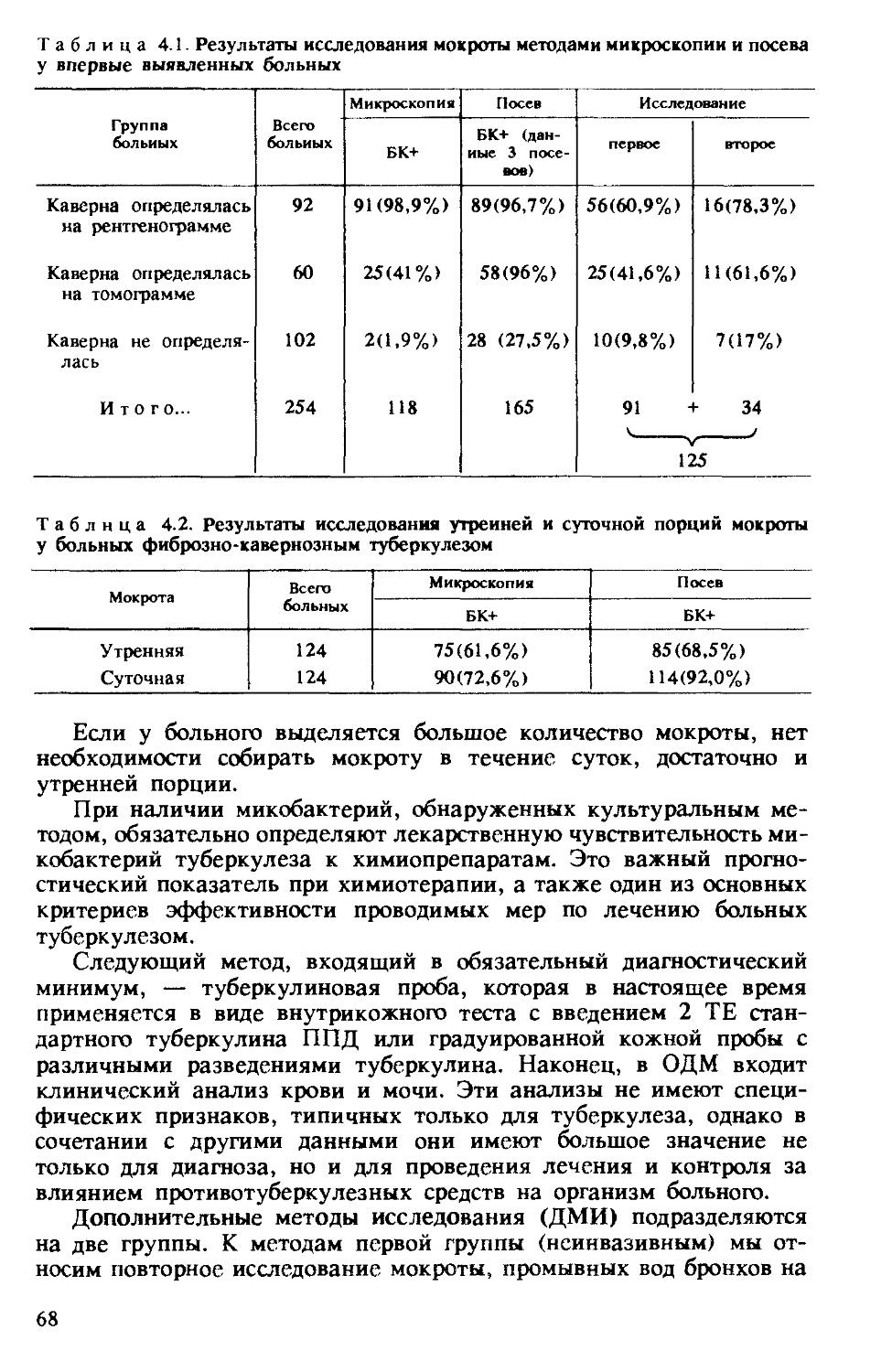
Изучение иммунологического статуса больных туберкулезом необходимо для решения ряда практических задач: 1) диагностики и дифференциальной диагностики туберкулеза; 2) выявления нару-
37
Таблица 2.1. Характеристика нарушений иммунологической реактивности у больных и влияние этих нарушений на течение туберкулезного процесса
Иммунологическая характеристика
1. Отсутствие изменения соотношения Т- и В-лимфоцитов, Тх/Тс и нарушений функции Т- и В-клеток (по их реакции иа митогены, кожным пробам, уровню иммуноглобулинов). Выраженная кожная ГЗТ и реакции in vitro на антигены микобактерий, противотуберкулезные антитела определяются в разных титрах. Уровень комплемента (С) в норме, число и функция нейтрофилов и макрофагов не изменены
2. Умеренные нарушения специфического клеточного иммунитета (подавление реакции in vitro иа фоне сниженной или отсутствия кожной ГЗТ на антигены микобактерий). Уровень противотуберкулезных антител может быть высоким или средним. Число Т-лимфоцитов и их функция умеренно снижены, число В-лимфоцитов и уровень иммуноглобулинов в норме или повышены. Функция макрофагов в норме или нарушена умеренно. Уровень С и число нейтрофилов в норме
3. а) выраженная супрессия Т-системы главным образом за счет Тх, соотношение Тх/Тс увеличено в сторону Тс. Функция Т-клеток существенно нарушена. На этом фоне специфический клеточный иммунитет может быть подавлен в большей или меньшей степени
б) выраженная депрессия специфического клеточного иммунитета (туберкулиновая анергия, определяемая in vivo и in vitro). На этом фоне изложенные выше (За) изменения Т-системы могут быть выражены в большей или меньшей степени
в) то же, что 36, плюс носительство DR2. Во всех подгруппах пункта 3 состояние В-системы может варьировать, могут определяться (или нет) макрофаги-супрессоры. Уровень С и число нейтрофилов нарушаются редко
Клинический статус
Чаще первичный ограниченный туберкулез у детей. Ограниченные формы (инфильтративный и очаговый туберкулез легких) у взрослых. Излечение практически в 100% случаев
Чаще относительно неблагоприятное течение инфильтративного или очагового туберкулеза, диссеминированный (ограниченный) туберкулез (у детей и взрослых), кавернозный и ограниченный фиброзно-кавернозный туберкулез. Но в конечном итоге удается практически во всех случаях добиться излечения
Неблагоприятное течение впервые выявленного и хронического туберкулеза у детей и взрослых. Плохая эффективность химиотерапии и необходимость иммунокоррекции
То же
Особенно неблагоприятное течение туберкулеза и устойчивость к химиотерапии даже при иммунокоррекции. Положительный эффект лечения временный и достигается не всегда
шений иммунитета, контроля за эффективностью лечения и прогноза заболевания; 3) определения показаний для применения иммунокорректоров и контроля за их эффектом. В частности, показано [Литвинов В. И. и др., 1976; Пахомов А. М., 1983], что наличие нарушений Т-клеточного и специфического клеточного противотуберкулезного иммунитета повышает риск развития послеоперационных осложнений, существенно увеличивает число случаев перехода впервые выявленного инфильтративного туберкулеза в
38
хронический фиброзно-кавернозный туберкулез. Установлено, что носительство HLA-DR2-антигена служит плохим прогностическим признаком: у таких впервые выявленных больных эффективность
химиотерапии низкая, а процент перехода впервые выявленного очагового или инфильтративного процесса в фиброзно-кавернозный — высокий [Поспелов Л. Е. и др., 1987].
Иммунологические исследования в клинике при туберкулезе используются не только для выявления нарушений иммунитета и соответственно прогноза заболевания. Они, в частности, служат для определения эффективности лечения по восстановлению иммунологической реактивности (наряду с улучшением клинического статуса) [Хоменко А. Г. и др., 1976, 1982]. Кроме того, результаты таких исследований служат основанием для назначения иммунокорригирующих средств. Учитывая, что в клинической картине туберкулеза доминируют нарушения Т-клеточного иммунитета, при этом заболевании чаще всего назначают Т-клеточные иммуностимуляторы, такие как диуцифон, тактивин, тимозин, тимостимулин, тималин и др. Эффективность использования этих препаратов продемонстрирована многократно в эксперименте и клинике. При применении иммунокорригирующих препаратов всегда необходимо помнить, что
эти средства действуют в первую очередь на иммунитет и критерии для их назначения должны быть иммунологическими — наличие
нарушений в соответствующих звеньях иммунитета.
И наконец, вероятно, не менее важная практическая проблема —
лема существует, во-пер-
вых, потому, что известен целый ряд заболеваний, имеющих сходную с туберкулезом клинико-рентгенологическую симптоматику, во-вторых, вакцинация BCG, а также инфицирование атипичными ми-
кобактериями, а возможно, и другими микроорганизмами, имеющими перекрестные антигены с микобактериями — возбудителями
туберкулеза, затрудняют изучение иммунного ответа на антигены микобактерий туберкулеза. Наиболее широко применяемая для ди
агностики туберкулеза туберкулиновая проба в настоящее время
мало пригодна для дифференциальной диагностики в силу указанных выше причин и низкой специфичности и активности препарата, с которым ставится эта проба, — туберкулина (PPD).
Возможно несколько подходов для решения этой сложной про-
блемы. Например, Е. Ф. Чернушенко и соавт. (1976, 1982) проводят дифференциальную диагностику туберкулеза и других болезней легких на основании результатов изучения соотношения специфического иммунитета и неспецифической реактивности. М. М. Авербах и соавт. (1982, 1986) для этого исследуют состояние Т- и В-кле-точного иммунитета, специфического клеточного и гуморального иммунитета и дополнительных факторов иммунитета (комплемент, фагоциты). Диагностика в этих случаях основывается на совокупности полученных данных. Однако идеальным было бы создание какого-либо специфического (для туберкулеза) теста, который по возможности давал бы 100% положительных результатов у больных туберкулезом (чувствительность) и 100% отрицательных результа
39
тов у больных с другой патологией и здоровых лиц, в том числе инфицированных атипичными микобактериями и вакцинированных БЦЖ (специфичность). Решение этой проблемы затрудняется тем, что для такой диагностики нужны антитела, реагирующие с уникальными антигенными детерминантами, а также антигены, реагирующие с такими антителами либо выявляющие ГЗТ, направленную против уникальных детерминант. Необходимо также применение высокочувствительных методов, поскольку такие антигены и антитела часто имеют низкую активность. Серологические тесты в этом отношении предпочтительней, чем тесты клеточного иммунитета in vitro, так как хотя антитела не играют защитной роли при туберкулезе, но они, как правило, синтезируются и стало быть присутствуют в крови, а их специфичность определения выше, чем ГЗТ [КнорингБ. Е. и др., 1985; DhandR., 1986].
В настоящее время имеются высокочувствительные и воспроизводимые микротесты определения антител с автоматизированным и компьютерным учетом результатов (РИА, ИФА). Для получения высокоспецифических реагентов существует несколько подходов: физические и химические методы фракционирования, получение моноклональных антител, выделение с помощью последних антигенов узкой специфичности, получение «генно-инженерных» белков и синтетических антигенов [Литвинов В. И. и др., 1988; Raheman S. et al., 1988; Ridell М., 1988].
Еще одним подходом в серодиагностике может быть определение различий антительного спектра сывороток — антител к разным антигенным детерминантам с помощью метода иммуноблоттинга или радиоиммунопреципитации. Получены данные о том, что у разных больных туберкулезом определяются антитела к различным антигенным компонентам комплексного микобактериального препарата [Литвинов В. И. и др., 1989].
И наконец, в будущем, вероятно, для целей иммунодиагностики будет использовано Т-клеточное клонирование, т. е. изучение Т-клеточных клонов, реагирующих на определенные антигены микобактерий.
2.2. МЕХАНИЗМЫ ПРОТИВОТУБЕРКУЛЕЗНОГО ИММУНИТЕТА
Огромное число исследований посвящено изучению роли факторов неспецифической реактивности и специфического противотуберкулезного иммунитета, а также механизмов индукции различных феноменов иммунитета при туберкулезе и их взаимосвязи с резистентностью к туберкулезной инфекции. Полученные результаты позволяют сформулировать ряд общих положений.
Установлено, что антигенным компонентом микобактерий, индуцирующим и обнаруживающим ГЗТ, являются белки; полисахариды и липиды таким действием не обладают. Вероятно, во всех работах, в которых сообщалось о роли в данном феномене небелковых препаратов, соответствующий эффект обусловлен присутствием примесей. Напротив, антителообразование могут стимулировать и вы
40
являть самые различные компоненты микобактерий [Литвинов В. И. и др., 1989; GrangeJ., 1989].
Микобактерии обладают мощным адъювантным действием, что
широко используется для усиления иммунного ответа на слабоиммунногенные антигены. Основной адъювантный эффект микобакте
рий осуществляется за счет гликолипидов (мурамиллипептид, ди-миколат трегалозы) клеточной стенки [Masihi К. et al., 1985].
Показано, что клеточный противотуберкулезный иммунитет, тестируемый как in vivo (туберкулиновые пробы), так и in vitro (как правило, реакция бласттрансформации), наиболее выражен в тех
ситуациях, когда можно говорить о высокой (относительно) резистентности к инфекции: у иммунизированных людей и животных, на ранних стадиях вирулентной инфекции у животных и при тех моделях (например, у кроликов), когда инфекция протекает благоприятно. У человека наиболее высокий клеточный противотуберкулезный иммунитет также обнаруживается при благоприятном течении процесса, успешном его лечении и ограниченных формах заболевания.
Что касается уровня антител, то такой четкой закономерности обнаружить не удается, поскольку антитела к разным антигенам микобактерий имеют неодинаковую динамику при туберкулезном процессе, а часто природа антигена, использованного теми или иными авторами, неясна. Например, PPD (очищенный белковый дериват туберкулина) на самом деле в основном состоит из полисахаридов и полипептидов. Можно отметить также, что, вероятно, концентрация антипротеиновых антител наиболее высокая при относительно неблагоприятном течении туберкулезного процесса, а антиполисахаридных, наоборот, — при благоприятном.
Установлено, что нет полного параллелизма между «общим» состоянием Т-системы иммунитета и специфическим клеточным иммунитетом, как и состоянием В-клеточного иммунитета и уровнем противотуберкулезных антител, хотя в обоих случаях отмечаются сходные тенденции в изменении соответствующих показателей. В частности, данные о количестве иммуноглобулинов при туберкулезе противоречивы, хотя многие авторы отмечают тенденцию (часто статистически недостоверную) к увеличению уровня IgG и IgA и противотуберкулезных антител соответствующего класса при активном процессе. При наиболее тяжелом течении туберкулеза имеется подавление как Т-клеточного (вообще), так и специфического клеточного противотуберкулезного иммунитета. Однако выраженная депрессия Т-клеточного иммунитета определяется лишь в редких случаях: при очень тяжелых распространенных формах заболевания, в ситуации, напоминающей таковую при лепроматозной лепре.
Гуморальный и клеточный противотуберкулезный иммунитет часто находится как бы в конкурентных взаимоотношениях при туберкулезе, точнее, возникновение высокого антителообразования может ингибировать клеточный иммунитет — феномен иммунологического отклонения, возможно подобный иммунологическому усилению роста опухоли. Механизмы этого явления изучены недоста
41
точно, однако, вероятно, данный феномен определяется действием Т-супрессоров.
Пока нет четких сведений о том, какие компоненты микобактерий индуцируют протективный эффект, направленный против этих микробов. Данные, полученные до последнего времени, не позволяют по крайней мере отвергнуть бытующее представление, что для проявления протективного эффекта нужно несколько антигенных детерминант (на белковых и полисахаридных молекулах), одна часть из которых уникальна, а другая часть является перекрестной с другими микобактериями, а возможно, и рядом других микроорганизмов. При этом, вероятно, необходимо предъявление иммуногенных детерминант таким образом, чтобы они были переработаны и предъявлены иммунокомпетентным клеткам (Т-лимфоцитам) макрофагами.
Для проявления протективного эффекта важны адъювантное действие микобактерий и длительное персистирование иммуногенных антигенов в организме.
Большая часть имеющихся данных свидетельствует о том, что иммунные противотуберкулезные сыворотки, как и В-лимфоциты, не оказывают прямого токсического действия на микобактерии и не усиливают бактерицидную активность макрофагов против этих микроорганизмов. Однако есть отдельные работы, в которых это положение оспаривается.
В настоящее время практически не вызывает сомнения, что центральным звеном в проявлении резистентности к микобактериям являются Т-клетки, специфически сенсибилизированные к микобактериальным антигенам. Они адоптивно переносят способность к протективному эффекту, такой перенос не удается с помощью взвеси лимфоцитов, обработанных анти-0- или анти-Thy-l-сывороткой (антисыворотками к антигенам Т-лимфоцитов).
Вместе с тем Т-лимфоциты непосредственно не действуют на микобактерии. Эффективным звеном противотуберкулезной резистентности служат макрофаги. Только в клетках этого типа размножаются и гибнут микобактерии туберкулеза. При этом защитные системы макрофагов, небактерицидные, обеспечивают лишь ингибицию размножения микроорганизмов. Ранее предполагалось, что за этот эффект ответственны ферменты лизосом, которые воздействуют на микроорганизмы после слияния лизосом с фагосомой. Так, Q. Myrvik и соавт. (1984), G. Frenkel и соавт. (1986) показали, что имеются существенные различия в судьбе фагосом, содержащих вирулентные и авирулентные микобактерии, поскольку только первые препятствуют их слиянию с лизосомами. Получены данные, свидетельствующие о том, что на микобактерии действуют перекиси. Так, показано повышенное высвобождение перекиси водорода альвеолярными и перитонеальными макрофагами у иммунных животных (морские свинки, мыши) в ответ на стимуляцию соответствующим видом микобактерий. Отмечено также резкое снижение содержания чувствительных к перекиси изониазидрезистентных микобактерий туберкулеза (мутантный штамм H37RV) в легких
42
иммунных животных. Однако в экспериментах, проведенных на мышах, не удалось обнаружить зависимости между клиренсом микобактерий макрофагами и непосредственным токсическим действием перекисей на бактерии. Эти данные свидетельствуют о том, что перекиси также не являются универсальным механизмом воздействия макрофагов на микобактерии и, вероятно, этот эффект обусловлен комплексом различных факторов.
Вместе с тем следует подчеркнуть, что взаимодействие макрофагов с микроорганизмами, в том числе с микобактериями, неспецифическое и требует иммунологического усиления. Таким усиливающим фактором для макрофагов, содержащих микобактерии, являются сенсибилизированные Т-лимфоциты, которые непосредственно, а скорее с помощью медиаторов (лимфокинов), стимулируют миграцию макрофагов в очаги воспаления (с помощью, в частности, факторов хемотаксиса), а также повышают фагоцитарную активность и ингибицию микобактерий внутри макрофагов. При этом действие сенсибилизированных Т-лимфоцитов на макрофаги в конечном итоге также оказывается неспецифическим. Т-клетки, иммунные к микобактериям, адоптивно переносят усиление протек-тивного эффекта против разных внутриклеточно паразитирующих микроорганизмов. Такие данные получены в исследованиях, выполненных как in vivo, так и in vitro. Например, Т-клетки, иммунные к микобактериям туберкулеза, приобретают способность защищать мышей от инфицирования и нетуберкулезными микобактериями, что I. Оппе и F. Collins (1986) связывают с наличием перекрестных антигенов. Однако, вероятно, более важным является неспецифическое усиление активности макрофагов.
Как отмечалось выше, противотуберкулезные антитела как непосредственно, так и при пассивном переносе, как правило, непосредственно не ингибируют размножение микобактерий и не повышают бактериостатическую активность макрофагов (хотя имеется небольшое число данных, оспаривающих это положение). Более
того, синтез антипротеиновых антител, которые выступают в качестве конкурирующих факторов с клеточным иммунитетом (феномен отклонения), отрицательно сказывается на течении туберкулезной инфекции. Такая ситуация была воспроизведена в экспериментальных условиях и наблюдалась (редко) в клинической картине туберкулеза.
Элиминация Т-клеток (например, тимэктомией, облучением), а также через длительные сроки после тимэктомии или при выраженной иммунодепрессии (у животных и людей) отрицательно влияет на течение туберкулезной инфекции. Аналогично сопротивляемость к туберкулезу снижена у мышей с врожденным дефектом Т-клеток (линии nu/nu, NZB) [Авербах М. М. и др., 1980, 1984; Lefford J. etal., 1982], что подтверждает роль Т-лимфоцитов в защите от этого заболевания. Подобным же образом индукция толерантности (иммунологической ареактивности) в тех случаях, когда она затрагивает специфический Т-клеточный иммунитет и независимо от того, страдает или нет гуморальный иммунитет, также является крайне неблагоприятным фак
43
тором для взаимодействия микобактерий туберкулеза и макроорганизма [Марков А. Н., 1980 ].
В тех случаях, когда имеются нарушения Т-клеточного иммунитета, введение иммунокорригирующих средств (Т-активин, лева-мизол, тимозин, диуцифон и др.), действующих преимущественно на Т-клеточный иммунитет, восстанавливает нормальное функционирование Т-системы и вместе с тем оказывает положительное действие на течение туберкулезной инфекции [Хоменко И. С. и др., 1986].
Учитывая роль Т-клеточного иммунитета в сопротивляемости к туберкулезной инфекции, необходимо понять, почему развивающийся Т-клеточный иммунитет оказывается не всегда эффективным несмотря на то, что общее число Т-лимфоцитов очень редко существенно уменьшается при этой патологии. В настоящее время имеются данные, позволяющие в определенной мере вскрывать причины этого явления. В частности, показано, что при тяжелом течении туберкулеза у людей уменьшается число лимфоцитов, несущих маркеры Т-хелперов (ОКТ-4 и Т/*), и изменяется соотношение Тх/Тс в сторону последних. Используя моноклональные антитела к поверхностным маркерам Т-лимфоцитов, J. Rook и соавт. (1985) установили, что у больных активным легочным туберкулезом в РЛ раза снижено число Т- и Т4-лимфоцитов, а число В- и Т8-клеток (супрессоров) не отличается у больных и здоровых лиц. Выраженность Т4-лимфоцитопении не зависела от тяжести туберкулезного процесса и интенсивности туберкулиновых проб. Авторы считают, что Т-лимфоцитопения — это не проявление приобретенного иммунодефицита, а результат иммунодепрессии. Действительно, при туберкулезе (однако, вероятно, только при его наиболее тяжелых формах) может развиваться иммунодепрессия, в первую очередь вследствие интоксикации. М. М. Авербах и соавт. (1986), В. В. Еремеев и соавт. (1986) установили, что уменьшение числа Т-хелперов и соотношения Тх/Тс в сторону последних более существенно при прогрессирующем течении туберкулеза, а также при распространенных деструктивных формах заболевания.
Количественные изменения субпопуляций Т-лимфоцитов могут определяться не только в периферической крови, но и в других органах и тканях. Так, у больных туберкулезным плевритом в плевральной полости увеличивается общее число Т-лимфоци-тов, число ОКТ-4-лимфоцитов (хелперов), а также соотношение ОКТ-4/ОКТ-8 по сравнению с таковым в периферической крови. При стимуляции PPD in vitro соотношение Т4/Т8 возрастает в культурах лимфоцитов плевральной полости в большей степени, чем в периферической крови. Показано, что на PPD реагировали Т4-(но не Т8)-лимфоциты. После стимуляции PPD увеличивалось также число DR-положительных лимфоцитов [Shiratsuhi Н., Tsuynguchi Т., 1984]. Это очень важно, так как для взаимодействия лимфоцитов с макрофагами, поглотившими микобактерии, необходима экспрессия таких антигенов.
Особенно актуальным является изучение механизмов супресии
Milt'
44
иммунного ответа при туберкулезе. И у людей, и у экспериментальных животных ареактивность (или гипореактивность) к микобактериальным антигенам ассоциируется, по-видимому, с активностью клеток-супрессоров. При этом обнаружены 2 типа супрессоров: Т-клетки — Tj+OKT8+ (у человека), Lytl+2+ (у мышей) и макрофаги-супрессоры. Механизмы супрессии хорошо изучены при системном (внутривенном) введении вакцинного штамма мышам. Показано, что в разных ситуациях могут стимулироваться антиген-специфические и антигеннеспецифические механизмы супрессии, опосредованные соответствующими супрессорными медиаторами, которые влияют на синтез и рецепцию интерлейкинов (ИЛ) [Campa М. et al., 1984; ColizziV. et al., 1985].
Одним из посредников активации лимфоцитов в реакции на митогены (как специфической, так и неспецифической) является ИЛ-2. В этом плане представляют интерес исследования Z. Toossi и соавт. (1986). Показано, что лимфоциты больных туберкулезом («свежевыявленным») в ответ на стимуляцию PPD вырабатывали ИЛ-2 на 81,2% меньше, чем лимфоциты здоровых туберкулинпо-ложительных доноров. У этих больных в 3 раза была снижена пролиферативная реакция на PPD в культурах лимфоцитов. Вместе с тем в таких культурах не содержались супрессивные факторы. Однако макрофаги были частично или полностью (у разных больных) ответственны за снижение синтеза ИЛ-2 и бластогенеза в культурах с PPD (макрофаги больных, в частности, подавляли синтез ИЛ-2 в культурах лимфоцитов здоровых людей). Экзогенный ИЛ-2 усиливает пролиферацию лимфоцитов как в присутствии PPD, так и без него. С помощью моноклональных антител было обнаружено снижение числа рецепторов для ИЛ-2 на лимфоцитах периферической крови больных. Следовательно, в данном случае супрессорный эффект был обусловлен как действием макрофагов-супрессоров, так и снижением реакции лимфоцитов на ИЛ-2. Все эти данные в целом свидетельствуют о том, что супрессия иммунного ответа при туберкулезе является сложным процессом, в котором участвуют макрофаги и Т-лимфоциты (вероятно, и В-лимфоциты, и иммунные комплексы), действующие в разных ситуациях на различные этапы иммуногенеза.
Интенсивно исследовалась роль в защите от туберкулеза «местных» факторов бронхиального эпителия, альвеол, так называемого сурфактанта. Имеются сведения (противоречивые) об определенном значении альвеолярных макрофагов и секреторного IgA, в одних работах отмечается дефект этих систем у больных туберкулезом, в других, наоборот, мобилизация данных защитных факторов в бронхоальвеолярном содержимом. То же самое относится и к соотношению в бронхоальвеолярном содержимом Т- и В-лимфоцитов, субпопуляций Т-лимфоцитов, к содержанию и роли опсонизирующих факторов (компонентов комплемента, IgG). Получены новые данные, в частности, о значении местных факторов супрессии противотуберкулезного иммунитета [МорозА. М и др., 1990]. Учитывая, что заражение туберкулезом в естественных условиях происходит,
45
как правило, аэрогенным путем, изучение тех защитных факторов (особенно выявление их дефекта), которые первыми контактируют с ннфектом, представляется весьма важным. В этом плане наши
знания пока менее совершенны, чем соответствующие представления о роли «местного» иммунитета, например, при кишечных инфекциях. Однако надо учитывать, что все защитные элементы, обнаруживаемые в бронхоальвеолярном содержимом, попадают туда из циркуляции (Т- и В-лимфоциты, и макрофаги, и иммуноглобулины, и компоненты комплемента). Кроме того, их количественная оценка затруднена, особенно у человека.
Считалось, что при туберкулезе существенную роль играет замедленная аллергия (ГЗТ), которую оценивали по кожным туберкулиновым пробам. Однако было показано, что кожная ГЗТ является одним из феноменов Т-клеточного иммунитета. Ранее предполагалось, что ГЗТ лежит в основе образования казеоза в туберкулезных
очагах (другие исследователи считали, что немедленная гиперчувствительность). Однако более вероятно, что казеоз образуется в
результате воздействия ферментов макрофагов, скапливающихся в
очагах туберкулезных поражений. Многие авторы пытались разде
лить ГЗТ (оцениваемую по кожным пробам) и иммунитет (так
называли повышение резистентности к туберкулезу). Такие попытки, осуществляемые с помощью десенсибилизации туберкулином или путем поиска фракций микобактерий, индуцировавших один из этих феноменов (без другого), чаще оказывались безуспешными.
Следует отметить, что пока не найден субстрат ГЗТ, который вызывал бы (подобно тому, как это происходит при немедленной аллергии) неспецифическое повреждение клеток в результате спе
цифического взаимодействия антител с антигенами (или иммуно-
компетентными клетками), и поэтому «место» замедленной аллергии (если такая существует) при туберкулезе не определено.
Что касается немедленной аллергии, обусловленной антителами-реагинами (IgE) и иммунными комплексами, то показано, что такие реакции при туберкулезной инфекции развиваются. Так, по данным Е. Gatner и соавт. (1983), содержание IgE-антител в сыворотках крови больных туберкулезом в ПЧг раза выше, чем у здоровых
доноров, однако эти антитела находятся в связанном (в иммунных комплексах) состоянии. В циркулирующих иммунных комплексах у больных туберкулезом содержатся иммуноглобулины (чаще IgG и IgA), компоненты комплемента (Cig, СЗ и С4) и антигены микобактерий. Не исключено, что в иммунных комплексах при туберкулезе могут быть обнаружены и другие антигены (тканевые, антигены других микроорганизмов у вторично инфицированных больных). Однако о том, какую роль в патогенезе туберкулеза играют эти медиаторы немедленной аллергии, пока неизвестно.
Многие годы дискутируется вопрос о том, развиваются ли при туберкулезе аутоиммунные реакции и если развиваются, то как это влияет на течение туберкулезной инфекции. Разумеется, коль скоро при данной инфекции происходит деструкция тканей и изменяется
химическая структура тканевых компонентов, могут открываться
46
детерминанты, с которыми иммунокомпетентные клетки организма в нормальных условиях не имеют контакта, то какая-то реакция иммунной системы на собственные (вероятно, измененные) ткани развивается. Учитывая сложный характер нарушений иммунитета при туберкулезе, адъювантное действие микобактерий, а также то, что толерантность «к своему» в значительной мере имеет активный характер, а не связана с элиминацией всех возможных реагирующих на «свое» клонов, вопрос о возникновении и роли аутоиммунных реакций при туберкулезе требует пересмотра.
В определении роли аутоиммунитета при туберкулезной инфекции важны данные, полученные в последнее десятилетие. Так, С. Thorns и J. Morris (1985) показали, что некоторые моноклональные антитела (см. ниже) к антигенам микобактерий реагировали и с тканевыми антигенами. Подобным же образом ИЛ-2 продуцирующие Т-клеточные клоны (см. ниже), полученные слиянием клеток лимфатических узлов мышей линии С57В1/6 и мышиной миеломы, реагировали как на микобактериальные, так и тканевые (свои) антигены [Miller I., 1986].
2.3. РОЛЬ НАСЛЕДСТВЕННОСТИ
Имеется много фактов, свидетельствующих о роли наследственности при туберкулезе у человека. Главные из них следующие.
1. Частота заболевания (конкордантность) туберкулеза у монози-готных (однояйцевых) близнецов выше, чем у дизиготных. 2. Зна-
чительно большая частота заболевания туберкулезом среди родст-
венников больного —
пробанда (больного туберкулезом, с которого
начинается такой анализ), даже в тех случаях, когда родственники не находятся в семейном контакте. 3. «Накопление» числа случаев заболевания туберкулезом в семьях с близкородственными браками.
В последнее десятилетие появились данные о роли восприимчивости к туберкулезу конкретных генетических систем. При этом, естественно, в первую очередь обращалось внимание на главный комплекс гистосовместимости человека — НLA-систему, в которой (в ее DR-локусе) локализуются гены иммунного ответа. Так, по
казано, что имеются выраженные и статистически достоверные ассоциации ряда антигенов HLA В-локуса с туберкулезом: В8 — у канадцев, В15 — у американских негров, В35 — у китайцев, В5 —
у египтян.
В исследованиях А. Г. Хоменко и соавт. (1981, 1985), В. И. Литвинова и соавт. (1982, 1985), Л. Е. Поспелова и соавт. (1982, 1985) установили, что в различных этнических группах заболевание туберкулезом ассоциируется с разными HLA-специфичностями: у туркменов и узбеков — В12, у армян — В5, у русских — В5, В14 и В17, у молдаван — В5 и В38. Вместе с тем этот же коллектив авторов [Поспелов Л. Е. и др., 1986; Литвинов В. И. и др., 1986] показал, что во всех обследованных популяциях (среди населения бывшего Советского Союза) заболевание туберкулезом ассоциируется с одним и тем же антигеном системы HLA DR-локуса — DR2.
47
С этим же антигеном заболевание ассоциируется у индусов, больных туберкулезом [Singh S. et al., 1983]. Прямые указания на роль генов HLA в патогенезе туберкулезной инфекции дали результаты семейного анализа наследования двух признаков — HLA-специфичностей и заболеваний туберкулезом: с помощью ряда моделей сцепление этих двух признаков в семьях было установлено бесспорно [Поспелов Л. Е. и др., 1986].
Кроме того, показано, что HLA-(b первую очередь DR)-фенотип отличается у больных разными формами туберкулеза (ограниченными, благоприятно протекающими, с одной стороны, и распространенными, хроническими, с другой). Это указывает на роль генов HLA в качестве факторов, влияющих на течение и форму туберкулеза у человека. Естественно возникает вопрос, через какие иммунологические (или неиммунологические) гены HLA-комплекса воздействуют на восприимчивость к туберкулезу и его течение.
Число исследований, посвященных изучению связи генетических маркеров при туберкулезе с иммунологическими параметрами, пока невелико.
В. И. Литвинов и соавт. (1986) показали, что у больных туберкулезом — носителей ПК2-антигена статистически достоверно повышен уровень противотуберкулезных IgG-антител (по данным ИФА) и снижена реакция in vitro лимфоцитов на микобактериальный белковый антиген. Исходя из этих результатов, можно предположить, что гены иммунного ответа (Ir-гены, предположительно находящиеся в DR-локусе) влияют на чувствительность к туберкулезу, регулируя силу иммунного ответа на микобактериальные антигены. Показано также, что неспособность к развитию клеточного противотуберкулезного иммунитета, в частности возникновение туберкулиновой анергии после ревакцинации БЦЖ, контролируется генами HLA (DR-локуса) [Поспелов Л. Е. и др., 1986].
Особенно четкие данные (наряду с результатами близнецовых исследований) о роли наследственных механизмов при туберкулезе получены в исследованиях на линейных мышах. При изучении чувствительности мышей к туберкулезной инфекции (как и к другим внутриклеточным инфекциям) используют, как правило, два основных критерия: 1) продолжительность жизни после заражения и 2) количество высеянных из органов (селезенка, легкие, печень) микобактерий, т. е. численность микобактериальной популяции, что отражает размножение микробов или его ингибицию.
Получены данные, свидетельствующие о том, что разные линии мышей неодинаково чувствительны к туберкулезной инфекции. Наиболее детально этот процесс изучали М. М. Авербах и соавт. (1980, 1985). Заражая разными дозами вирулентных микобактерий (Н37 Rv) мышей более 30 линий, авторы установили, что большинство линий мало различались по продолжительности жизни после заражения (в среднем 30—40 дней), однако между двумя линиями (чувствительной I/St и резистентной A2g), которые названы оппозитными, были существенные различия (соответственно 19 и 53 дня).
Динамический анализ высеваемости микобактерий из селезенки
48
и легких, морд
логическая характеристика легочных изменений, а
также оценка специфической иммунологической реактивности по
зволили цитируемым авторам установить принципиальные отличия большинства показателей у разных линий мышей, причем наибольшие различия касались бактериальной высеваемости и активности Т-клеток. Были также выявлены межлинейные различия в сопротивляемости к туберкулезу предварительно вакцинированных животных. Показано, что при введении стандартной дозы БЦЖ межлинейные различия были те же, что и при первичном заражении, но у высокочувствительных животных протективный эффект почти
отсутствовал, в то время как резистентные мыши после вакцинации
жили значительно дольше, чем после первичного заражения.
На гибридах первого поколения между оппозитными линиями и потомках возвратного скрещивания с родительскими линиями проанализированы особенности наследования восприимчивости к туберкулезу. Установлено, что доминантным признаком является резистентность к инфекции, а восприимчивость находится под полиген-ным контролем гена чувствительности и генов резистентности, причем ген чувствительности к туберкулезу не сцеплен с комплексом Н2 (главный комплекс гистосовместимости мышей) [Авербах М. М. и др., 1985]. Также показано, что ранняя фаза инфекции у мышей при заражении микобактериями туберкулеза штамма BCG находится под контролем одного гена (BCG), расположенного на хромосоме 1 и имеющего два аллеля — чувствительный и резистентный. Проявление этого гена осуществляется главным образом через систему макрофагов [Scamene Е. et al., 1980].
Изучены некоторые механизмы генетического контроля специфического противотуберкулезного иммунитета и межклеточного взаимодействия иммунокомпетентных клеток. Показано, что введение сыворотки против генетического маркера Т-супрессоров I-J приводит к увеличению срока жизни мышей и активации показателей специфического иммунного ответа [Алт А. С. и др., 1988].
2.4. НОВЫЕ НАПРАВЛЕНИЯ И ПЕРСПЕКТИВЫ ИССЛЕДОВАНИЙ
В последние десятилетия возник ряд новых подходов к изучению механизмов противотуберкулезного иммунитета. Эти подходы (точнее, полученные с их помощью вещества) могут использоваться и частично уже используются в практической фтизиатрии. Это гибридом-ная технология, генная инженерия и Т-клеточное клонирование. Так, с помощью гибридомной технологии получен большой набор моноклональных антител к разным антигенам микобактерий. Они синтезированы одним клоном В-лимфоцитов и направлены соответственно к одной антигенной детерминанте. Эти антитела с большим или меньшим успехом пытаются применить для решения следующих задач.
1. Оценка влияния in vivo и in vitro антител к разным компонентам микобактерий на течение туберкулезной инфекции. Такие исследования пока не дали реальных результатов.
2. Изучение антигенной структуры микобактерий, в частности
49
антигенных различий разных видов микобактерий. Получены моноклональные антитела, реагирующие как с уникальными (точнее, представленные с большей плотностью), так и с перекрестно реагирующими антигенами [Engers A. et al., 1986; Ljungavist L. et al., 1988 ].
3. Обнаружение микобактерий (например, в мокроте) и их видовая идентификация [Андросова М. В. и др., 1989].
4. Выявление антигенов микобактерий (например, в спинномозговой жидкости или в сыворотке крови в составе иммунных комплексов) [Литвинов В. И. и др., 1990].
5. Выделение отдельных антигенов из сложной антигенной смеси. Характеристика генно-инженерных белков (см. ниже) и антигенов, выделенных иммунохимическими методами [IvanyiJ. et al., 1985].
6. Обнаружение антител конкурентными методами [Ivanyi J. et al., 1989].
Т-клеточное клонирование (получение «потомков» одного Т-лимфоцита) используется для изучения: 1) спектра Т-клеток (хелперов или супрессоров), реагирующих на разные антигенные детерминанты при туберкулезе и вакцинации БЦЖ (такая работа только начинается); 2) роли Т-клеточных субпопуляций и клонов, реагирующих на определенные детерминанты, в протективном иммунитете и иммуносупрессии (в частности, получен ряд Т-клеточных клонов, индуцированных антигенами микобактерий, которые продуцируют супрессорные или хелперные медиаторы) [Miller I., KanfmamrS., 1986; Lam J. et al., 1989]; 3) использования Т-клонов для поиска протек-тивных антигенов в целях конструирования будущей противотуберкулезной вакцины.
Уже получена серия генно-инженерных белков, как общих, так и специфических для различных видов микобактерий. Эти белки используются или будут использоваться для стимуляции Т-клеточных клонов [Thole J. et al., 1988], серодиагностики (пока такие работы не опубликованы) и, вероятно, перспективными будут рекомбинантные белки при конструировании химической вакцины. Главные направления в исследованиях фундаментальных механизмов противотуберкулезного иммунитета и их генетического контроля связаны, вероятно, с определением локализации генов, ответственных за чувствительность и/или резистентность к туберкулезу и механизмов их действия, а также с изучением взаимного влияния процессов (опосредованных иммунологическими факторами) в органах иммунитета, циркуляции и в местах туберкулезных поражений.
50
ГЛАВА 3
ЭПИДЕМИОЛОГИЯ
Эпидемиология туберкулеза, являясь разделом, составной частью фтизиатрии, изучает источники заражения туберкулезом, пути передачи инфекции, распространенность туберкулеза как инфекционного заболевания среди населения и наиболее угрожаемые группы
населения, среди которых имеется наибольший риск заболевания туберкулезом. Необходимо учитывать, что туберкулез является не только медико-биологической проблемой, связанной с взаимодействием организма человека и возбудителя, но и проблемой социальной,
поскольку социальные факторы влияют на состояние здоровья на
селения в целом и отдельных его групп. В частности, большое значение имеют материальный уровень жизни, санитарная грамотность и культура, род занятий, жилищные условия, обеспеченность медицинской помощью и др. Демографические особенности также должны быть приняты во внимание при изучении туберкулеза с
эпидемиологических позиций: возрастной состав населения, в том числе удельный вес детей, распределение по полу, рождаемость,
плотность населения и т. д.
Основным источником заражения окружающих является больной туберкулезом, выделяющий микобактерии туберкулеза. Как правило, это больные туберкулезом легких. Наибольшую опасность представляют больные с обильным, постоянным бактериовыделением, которое выявляется с помощью микроскопии. Однако и при скудном бактериовыделении, обнаруживаемом только при посеве на питательные среды, больные также могут заражать окружающих, особенно при тесном контакте.
Больные в нелегочным и формами туберкулеза, выделяющие микобактерии туберкулеза (туберкулез почек и мочевыводящих путей, свищевые формы туберкулеза костей и суставов, периферических лимфатических узлов и других органов), считаются также опасными для окружающих из-за риска заражения последних.
Заражение туберкулезом может быть при наличии прямого контакта с больным, который рассеивает микобактерии при кашле, чиханье, с капельками слюны при разговоре, поцелуях и т. д. С давних пор основным путем заражения считался воздушно-капельный. Однако заражение возможно и без прямого контакта с больным — при соприкосновении с зараженными предметами, бельем, с пылевыми частицами, содержащими засохшую мокроту, другим материалом, содержащим микобактерии (воздушно-пылевой путь заражения). Естественно, что опасность воздушно-пылевого заражения возрастает при невыполнении больным правил личной гигиены, недостаточной дезинфекции или ее отсутствии, при некачественной уборке помещения. В связи с тем что микобактерии туберкулеза обладают высокой устойчивостью к воздействию внешних факторов, они длительное время (месяцы и годы) сохраняют жизнеспособность и патогенность в темноте в почве и сточных водах,
51
при низкой температуре и обработке многими дезинфицирующими средствами, — воздушно-пылевой путь заражения заслуживает особого внимания.
Заражение туберкулезом возможно также алиментарным путем при пользовании общей посудой.
Вторым по значимости источником заражения является крупный рогатый скот, больной туберкулезом. При этом наибольшая опасность создается для животноводов и других работников, контактирующих с животными. В этом случае заражение также чаще происходит воздушно-капельным или воздушно-пылевым путем. Возможен и алиментарный путь заражения — при потреблении неки
пяченого или непастеризованного молока, или приготовленных из него продуктов. Следовательно, алиментарный путь заражения может иметь место и при отсутствии прямого контакта с больными
животными.
Остальные источники заражения туберкулезом имеют меньшее эпидемиологическое значение, так как встречаются реже. Такими источниками могут быть куры (Р. В. Тузова), различные животные (свиньи, овцы, верблюды и др.), в том числе и домашние (кошки, собаки) (Я. А. Благодарный).
От больного туберкулезом человека заражение происходит обычно человеческим видом микобактерий туберкулеза. Для человека эпидемиологически опасным является не только этот вид микобактерий, но и бычий вид (Я. А. Благодарный, В. Devulder). Особенностью заболевания туберкулезом, вызванном бычьим видом микобактерий, является частое поражение мочеполовых органов и периферических лимфатических узлов (К. К. Курманбаев), лекарственная резистентность к изониазиду, что затрудняет химиотерапию. Легочный туберкулез иногда приобретает прогрессирующее течение, особенно в условиях позднего выявления заболевания.
Заражение человека может иногда вызываться птичьим видом микобактерий, которые обычно обладают полирезистентностью к химиопрепаратам. В случае возникновения заболевания (что отмечается весьма редко) оно, как правило, принимает прогрессирующий характер с образованием множественных деструкций в легких. У
отдельных лиц отмечается заражение различными атипичными микобактериями. Вызванное ими заболевание в настоящее время принято называть микобактериозом. По клинико-рентгенологическим
проявлениям и морц
логическим реакциям оно не отличается от
туберкулеза. Описаны случаи заболевания, вызванные М. Kansasii, М. Scrofulaceum, М. Xenopei, М. Fortuitum и др. (Н. М. Макаревич, J. Weiszfeller и др.). Пути заражения атипичными микобактериями
не описаны, хотя резервуар инфекции уже известен — почва, водоемы. Многие животные, в том числе крупный рогатый скот, могут быть заражены атипичными микобактериями, которые длительное время сохраняются в их организме. Заболевания микобактериозом носят спорадический характер, случаи передачи инфекции
от человека к человеку не описаны.
Как известно, инфекционный процесс является результатом вза
52
имодействия возбудителя (микобактерий туберкулеза) и организма, поэтому в эпидемиологических исследованиях важное место занимает изучение восприимчивости человека в туберкулезной инфекции. Наиболее опасно заражение туберкулезом в детском возрасте, особенно в раннем детском возрасте (до года и в 1—5 лет). В этот период естественная резистентность еще несовершенна и не совершенствуется из-за недостаточного развития иммунологических механизмов. Определенную роль играет наследственная предрасположенность или, наоборот, резистентность к туберкулезу. С возрастом эти механизмы совершенствуются, приобретают значение другие факторы, которые отрицательно влияют на восприимчивость: недостаточное питание, сопутствующие заболевания, тяжелая работа, приводящая к систематическому переутомлению, нервно-психические срывы (стрессовые состояния) и т. д.
Очень большое влияние на течение инфекционного процесса оказывает наличие или отсутствие приобретенного иммунитета у заразившихся туберкулезом людей. Как ни важны индивидуальные особенности каждого человека, эпидемиология туберкулеза изучает общие закономерности, определяющие распространение туберкулеза среди населения или его отдельных групп. Этим эпидемиологический подход к проблеме туберкулеза отличается от клинического, который изучает индивидуум. С данных позиций очень важно среди населения выделить группы с наибольшей восприимчивостью к туберкулезу. Такие группы принято называть группами населения с повышенным риском развития туберкулеза.
Принимая во внимание патогенез туберкулеза, повышенный риск развития первичных форм туберкулеза имеют неинфицированные лица, дети, подростки и взрослые до 30 лет, так как с увеличением возраста среди населения возрастает число инфицированных туберкулезом лиц: к 40 годам число таких случаев достигает 70—90%. Число инфицированных людей также рассматривается как эпидемиологический показатель — инфицированность, которая выражается в процентах, т. е. на 100 жителей. Часто инфицированность определяют применительно к различным возрастным группам. В странах, в которых проводятся противотуберкулезная иммунизация новорожденных, ревакцинация детей и подростков, определение показателя инфицированное™ населения сталкивается с большими трудностями из-за появления положительной туберкулиновой пробы после вакцинации и ревакцинации. Тем не менее разработана методика расчетов, позволяющая установить «риск заражения» и взаимосвязь между этим показателем и численностью больных заразными формами туберкулеза.
Вторичный туберкулез развивается у инфицированных лиц в любом возрасте, но чаще у мужчин в возрасте 49—50 лет. При эпидемиологических исследованиях нет возможности дифференцировать первичные и вторичные формы туберкулеза (в клинических условиях также далеко не всегда имеются данные, позволяющие различать эти формы), поэтому случаи заболевания, несмотря на их разный патогенез, регистрируются суммарно. Случаем заболе
53
вания туберкулезом считается развитие любой клинической формы при наличии клинико-лабораторных данных, свидетельствующих об активности заболевания.
Такой подход к определению случая заболевания туберкулезом признается далеко не во всех странах, хотя близкие к этому определению подходы существуют в Германии, Болгарии, Дании, США, Франции и ряде других экономически развитых стран. Для развивающихся стран Комитет экспертов ВОЗ и Международный противотуберкулезный союз рекомендовали другой подход: случаем заболевания туберкулезом считается заболевание, при котором микобактерии выделяются с помощью микроскопии (7—9-й доклад Комитета экспертов по туберкулезу ВОЗ), Всех остальных больных не рекомендовалось регистрировать, и для таких случаев было предложено определение «подозрение на туберкулез». Естественно, при таком определении учитывается примерно 30—50% заболевших туберкулезом. Ошибочность данного подхода была зафиксирована на Международной конференции по туберкулезу в 1982 г. (Аргентина), особенно применительно к больным детского возраста с наличием милиарного туберкулеза, менингита, туберкулеза внутригрудных и периферических лимфатических узлов, плеврита и полисерозита.
В настоящее время среди заболевших туберкулезом определяется численность больных с заразными формами.
Проведенные эпидемиологические исследования позволили рассчитать для целого ряда территорий и стран ежегодный риск заражения туберкулезом.
Анализ числа заболевших туберкулезом в различных группах населения еще в 1966 г. позволил Horwitz установить, что наибольший риск заболевания туберкулезом в экономически развитых странах, в которых в послевоенный период отмечается постепенное уменьшение распространенности туберкулеза, имеют инфицированные лица, а наименьший — неинфицированные, по иммунизированные вакциной БЦЖ. Оказалось также, что наибольший риск среди инфицированных имеется у лиц с наличием остаточных изменений излеченного туберкулеза (см. ниже), а также при наличии сопутствующих заболеваний (см. ниже).
О распространенности туберкулеза в стране или на какой-либо
территории принято судить по эпидемиологическим показателям. Наибольшее значение имеет показатель заболеваемости туберкуле-
зом, который определяется по числу впервые зарегистрированных
или 10
больных в течение текущего года на каждые 100
IIEI
населения. Более детальное представление о структуре заболеваемости могут дать показатели заболеваемости туберкулезом органов дыхания и внелегочных форм, заболеваемось бациллярными фор-
мами туберкулеза органов дыхания. В свою очередь последний показатель может быть еще более детализирован: бактериовыделение обнаружено методом микроскопии, а кроме того, при посеве материала на питательных средах. Часто выделяется заболеваемость деструктивными формами легочного туберкулеза и фиброзно-кавернозным туберкулезом. Совокупность перечисленных показателей, а
54
также удельный вес различных проявлений туберкулеза среди всех впервые зарегистрированных больных позволяют получить довольно детальное представление о заболеваемости туберкулезом. Например, высокий показатель заболеваемости фиброзно-кавернозным туберкулезом или его высокий удельный вес среди заболеваемости органов дыхания свидетельствует о большом резервуаре инфекции среди населения, плохо поставленной работе по раннему выявлению больных, а также о большом рассеивании туберкулезной инфекции среди окружающего населения.
Показатель заболеваемости может быть также рассчитан среди различных возрастных групп у мужчин и женщин. При этом очень важное эпидемиологическое значение имеет показатель заболеваемости туберкулезным менингитом среди детей, не менее важное значение имеет показатель заболеваемости детей от 0 до 1 года, особенно при высоком удельном весе детей среди всего населения. Последние два показателя свидетельствуют о наличии большого риска первичного заражения из-за наличия источников распространения и условий, способствующих рассеиванию инфекции, о восприимчивости коллектива и плохо поставленной работе по выявлению и профилактике туберкулеза.
Показатели заболеваемости туберкулезом должны анализироваться в совокупности с применением методики организации выявления больных. Это позволяет судить о степени осведомленности лечебно-профилактических учреждений и противотуберкулезных диспансеров о распространенности туберкулеза среди населения.
В большинстве стран Западной Европы, США, а также во всех развивающихся странах Азии, Африки и Латинской Америки выявление больных туберкулезом организовано среди лиц, обратившихся за медицинской помощью по поводу кашля с выделением мокроты и проявлением других грудных симптомов. Такой принцип, как правило, приводит к низкой степени осведомленности органов здравоохранения о распространенности туберкулеза, особенно при недостаточных санитарной грамотности населения и доступности медицинской помощи. Гораздо выше осведомленность при осуществлении массовых осмотров с максимально возможным охватом (90— 95%) населения. Поэтому в странах, в которых выяление больных туберкулезом основано на обращаемости за помощью лиц с грудными симптомами, периодически проводят осмотры населения на выбранных территориях. Это позволяет получить данные, которые можно будет распространить на всю территорию страны, региона и т. д. и рассчитать число имеющихся больных туберкулезом на соответствующее население.
Чем больше разница между данными о заболеваемости туберкулезом по материалам ежегодной регистрации и полученными при проведении массового осмотра населения, тем меньше осведомленность о распространении болезни.
Методика осмотров варьирует в зависимости от имеющихся возможностей. В развивающихся странах, как правило, это подворные обходы населения, выявление лиц с наличием кашля и выделений
55
мокроты, сбор мокроты и ее микроскопическое исследование или посев на питательные среды. Естественно, что при такой методике выявляются лишь бактерионосители. В экономически развитых странах применяют рентгенографическое исследование с последующим дообследованием лиц с изменениями в легких. Такие исследования
проводятся или на отдельных территориях, или на территории всей
страны (при этом последовательно проводят осмотры по графику), или среди отдельных групп населения с повышенным риском заболевания туберкулезом.
В нашей стране для выявления больных туберкулезом используются оба принципа: по обращаемости за медицинской помощью
и при проведении профилактических осмотров населения с приме-
нением флюорографии I раз в 3 года. Такая методика позволяет
противотуберкулезным диспансерам иметь высокую осведомленность о заболеваемости туберкулезом среди населения.
Вторыми важными эпидемиологическими показателями являются
болезненность и численность контингентов больных активным беркулезом легких. Этот показатель также вычисляется на 100
ту-
Ш
или 10
населения на конец каждого года. Состоит он из числа
m
впервые выявленных больных в данном году, а также всех ранее зарегистрированных за предыдущие годы больных с соханяющейся активностью туберкулезного процесса. Таким образом, число больных активным туберкулезом ежегодно пополняется за счет впервые выявленных больных и в то же время ежегодно уменьшается за счет умерших и излеченных от туберкулеза (заживление локальных очагов туберкулезного характера и потеря активности процесса).
Контингенты больных туберкулезом по составу неоднородны. Наиболее опасны для окружающих больные с постоянным или периодическим бактериовыделением. Поэтому дом, квартира или другое жилое помещение, в котором постоянно живет такой больной, расценивается как очаг туберкулезной инфекции. При большом
числе очагов создается эпидемиологическая опасность не только для
членов семьи (бытовой контакт), но и для всего окружающего населения, особенно для детей и подростков. В очагах туберкулезной
инфекции проводятся санитарно-про4
илактические мероприятия, а
все лица, контактирующие с больным-бактерионосителем, относятся к группе повышенного риска развития туберкулеза и подлежат диспансерному наблюдению в противотуберкулезных диспансерах.
Остальные больные активным туберкулезом без выделения микобактерий должны оцениваться как потенциально опасные в эпи
демиологическом отношении, так как у них в случае ухудшения в течении заболевания может появиться бактериовыделение, что создает опасность рассеивания туберкулезной инфекции.
Смертность — число умерших от туберкулеза в течение года на каждые 100 000 или 10 000 населения. Показатель смертности также весьма высок, хотя были высказывания о том, что его значение в современных условиях снижается. Однако с такой точкой зрения нельзя согласиться, поскольку уровень смертности прямо влияет на численность контингентов больных активным туберкулезом и без
56
учета показателя болезненности. Кроме того, показатель смертности характеризует качество лечения, а также эффективность раннего выявления и диагностики. В частности, состояние диагностики туберкулеза иллюстрируется показателем смертности, а также удельным весом лиц, у которых диагноз туберкулеза поставлен только после смерти, или у больных, наблюдавшихся врачом менее года.
С эпидемиологических позиций также важно выяснить, когда наступила смерть — при пребывании больного в больнице или дома. Последнее создает большой риск для окружающих из-за рассеивания микобактерий, трудностей при проведении уборки и ухода за таким больным в домашних условиях.
Таким образом, совокупность показателей заболеваемости, болезненности и смертности позволяет не только получить представление о распространенности туберкулеза, состоянии различных разделов противотуберкулезной работы, но и оценить закономерности, определяющие эпидемический процесс как в целом по стране, так и применительно к различным ее регионам и территориям. Естественно, что в современных условиях динамика распространенности туберкулеза оценивается в условиях осуществления программы противотуберкулезных мероприятий.
Программа борьбы с туберкулезом имеет конечной целью резкое уменьшение его распространенности среди населения.
Известно, что оценка эффективности противотуберкулезных мероприятий — сложная задача, так как эпидемический процесс является динамичным, изменяющимся как в естественных условиях, так и под влиянием специальных мероприятий социально-экономического и медицинского характера. В связи с этим появилась необходимость следить за динамикой распространенности различных инфекционных заболеваний не по отдельным, разрозненным эпидемиологическим показателям, а по их совокупности в сочетании с такими факторами, как массивность инфекции, характер и продолжительность экспозиции (контакта), состояние организма лиц, соприкасающихся с инфекционным агентом, характер и качество питания населения, экологические условия и др.
Изучение совокупности всех данных, определяющих течение, масштабы и скорость распространения эпидемического процесса, его тенденции к распространению, стабилизации или уменьшению в настоящее время принято обозначать термином «сервейланс». На русском языке, с нашей точки зрения, он может соответствовать термину «эпидемиологический надзор» или «контроль».
В нашей стране проводится работа по комплексному эпидемиологическому контролю за эффективностью противотуберкулезных мероприятий на некоторых территориях и в целом по стране. Предпосылкой для развертывания этой работы явились эпидемиологические исследования, в которых были использованы как отдельные параметры, так и их совокупность. Эти исследования проводились в различных республиках в городах, районах с ограниченным числом населения (г. Родники Ивановской обл., г. Салават Башкирии, г. Клин Московской обл. и др.). Накопленный опыт позволил рас
57
ширить масштабы последующих исследований, которые были проведены на 9 экспериментальных территориях.
Подведены итоги по специально разработанной единой программе. Эпидемиологический контроль предусматривал: 1) определение пораженности населения туберкулезом по данным сплошного флюорографического обследования с картотечным учетом результатов осмотра; 2) изучение контингентов больных, состоящих на учете в противотуберкулезных диспансерах, с вычислением таких показателей, как заболеваемость, болезненность и смертность; изучение их взаимосвязи с динамикой процесса на основе анализа первичной документации — карты диспансерного учета; 3) бактериологическую характеристику «резервуара инфекции» в плане как определения истинного числа больных туберкулезом, представляющих эпидеми
ологическую опасность для окружающих, так и оценки степени риска заражения в связи с массивностью бацилловыделения, типом микобактерий, их чувствительности к химиопрепаратам и др.; 4) анализ динамики распространенности тубекулеза в условиях применения комплекса противотуберкулезных мероприятий, проводящихся в соответствии с унифицированными программами по выявлению больных туберкулезом и их лечению. В связи с большими масштабами исследования и необходимостью обработки многочисленных результатов индивидуальных исследований, с их обобщением важное значение имело использование вычислительной техники.
Необходимость продолжения противотуберкулезных мероприятий в нашей стране диктуется сравнительно высокой заболеваемостью туберкулезом, а главное — еще большим резервуаром туберкулезной инфекции и большим числом инфицированных лиц с высоким риском развития заболевания.
В России и других странах, ранее входящих в состав СССР, после периода снижения заболеваемости и стабилизации этого показателя отмечается рост заболеваемости туберкулезом. В 1994 г. она составила в России 47,9 случая на 100 000 населения (рис. 3.1). Отмечаются резко выраженные различия в уровне заболеваемости в разных регионах. В Прибалтийских странах заболеваемость туберкулезом сравнительно низкая: в 1991 г. она достигла в Эстонии 26,4, Латвии — 35,9, Литве — 41,6 случая на 100 000 населения. Заболеваемость в Белоруссии составила 36,6, на Украине — 39,0, Молдавии — 46,4 случая на 100 000 населения. Наиболее высокие показатели заболеваемости в Казахстане (70,0), Туркмении (63,5), Киргизии (60,5), Узбекистане (48,2), Таджикистане (30,7). Столь значительные различия в показателях в разных регионах бывшего СССР требуют специального разъяснения причин сложившейся эпидемиологической ситуации.
Во-первых, уровень заболеваемости туберкулезом зависит от величины резервуара инфекции, т. е. числа больных с эпидемиологически опасными формами туберкулеза. В нашей стране сохраняется довольно большой резервуар инфекции, на учете в противотуберкулезных диспансерах состоит около 200 000 больных эпидемически опасными формами туребкулеза легких, выделяющих или выделяв-
58
Рис 3 1 Заболеваемость населения туберкупезом (все формы) в России в 1965—1994 гг (на 100 000 жителей)
ших в течение последних 2 лет микобактерии туберкулеза. Кроме этого, ежегодно выявляется около 30 000 больных туберкулезом органов дыхания с выделением микобактерий. Таким образом, в стране имеется 230 000 заразных больных туберкулезом, которые распределены неравномерно по всем регионам и создают «очаги» туберкулезной инфекции как в быту, так и на производстве. В ряде регионов есть дополнительный резервуар инфекции за счет пораженного туберкулезом крупного рогатого скота.
За последние несколько лет ситуация с заболеваемостью туберкулезом в России осложнилась. В целом по Российской Федерации этот показатель с 1991 г. (34,0 на 100 000 населения) увеличился на 5,3%. Увеличение заболеваемости городских жителей обусловлено неблагоприятной социально-экономической обстановкой, а также миграционными потоками. Подтверждением этому является продолжающийся уже второй год рост заболеваемости туберкулезом в таких городах, как Москва и Санкт-Петербург. Обращает на себя внимание рост на 52 территориях общего показателя заболеваемости, в 1991 г. таких территорий было всего 35. Наиболее значительное повышение этого показателя в Якутии (на 40,9%), Туве (на 38,8%), на Камчатке (на 31,6%), в республике Мари-Эл (на 30,7%), в Курганской области (на 43,5%). Уровень заболеваемости колеблется от 23,3 в Архангельской области до 59,4 случая на 100 000 населения в республике Дагестан (при крайних вариантах 16,6 и 17,5 в Мурманской и Вологодской областях и 111,2 случая на 100 000 населения в Туве). Наиболее высокая заболеваемость туберкулезом наблюдается в Поволжском, Северо-Кавказском и Западно-Сибирском регионах (табл. 3.1).Среди некоторых категорий наименее редко выявляются больные с тяжелыми, быстротекущими формами.
Стабилизация показателя заболеваемости и его рост в ряде регионов России наблюдаются при значительном и почти повсе-
59
Таблица 31. Заболеваемость всеми формами активного туберкулеза (впервые диагностированного) на 100 000 населения по регионам России в 1992—1994 гг.
Регион 1992 г. 1994 г.
Северный 23,3 35,0
Северо-Западный 29,4 43,7
Центральный 32,3 41,6
Волго-Вятский 34,4
Центрально-Черноземный 36,4 48,8
Поволжский 38,2 45,8
Северо-Кавказский 37,1 47,4
Уральский 32,9 46,1
Западно-Сибирский 42,2 61,0
Восточно-Сибирский 41,2 59,7
Дальневосточный 48,7 62,9
местном сокращении охвата населения профилактическими обсле
дованиями. Это в значительной мере объясняется дороговизной об-
следований и перебоями в снабжении рентгенофлюорографической пленкой, реактивами, бактериальными препаратами, медицинским инструментарием и рентгенодиагностической аппаратурой, отрицательным отношением населения к флюорографии и туберкулиноди-агностике. В 1992—1995 гг. положение с выявлением туберкулеза еще более усугубилось в связи с тем, что все виды профосмотров стали осуществляться на средства не госбюджета, а государственных, общественных организаций, предприятий, учреждений и личных
средств граждан.
В связи с несвоевременным выявлением туберуклеза ухудшилась клиническая структура форм туберкулеза у впервые выявленных больных, увеличилось число больных с далеко зашедшими формами, трудно поддающимися лечению. В результате социально-политической нестабильности, снижения уровня жизни населения и, соответственно, иммунной резистентности (особенно у социально дезадаптированных лиц, беженцев) в структуре заболеваемости тубер
кулезом увеличилось число остропрогрессирующих и локальных форм у детей. По указанным причинам, а также в связи с ростом дефицита противотуберкулезных препаратов снизилась эффективность лечения и увеличилась летальность больных туберкулезом. Вследствие недовыявления больных туберкулезом, в том числе бактериовыделителей, повысился риск заражения туберкулезом.
В условиях снижения уровня жизни населения, недостаточного вы
илактических мероприятий, миграции бе-
явления и проведения щ
женцев из стран с неблагоприятной эпидемической ситуацией по ту-
беркулезу возникает реальная угроза эпидемических вспышек туберкулеза на различных территориях нашей страны. Вместе с тем из-за
60
недостаточного финансирования четко отлаженная ранее система цен-
трализованного управления и контроля за деятельностью подведомственных учреждений практически перестает функционировать.
Большой резервуар инфекции приводит к ее распространению (особенно в «очагах») и первичному заражению или суперинфекции. Закономерным следствием большого резервуара инфекции должна
была бы быть высокая заболеваемость первичными формами тубер-
кулеза у детей, подростков и молодых людей. Вместе с тем в нашей
стране этого нет, и заболеваемость туберкулезом детей довольно
низкая (в 1993 г. — 10,2 на 100
населения),
что является
результатом в первую очередь массовой иммунизации БЦЖ новорожденных и последующей ревакцинации детей и подростков. Приобретенный иммунитет, развивающийся после противотуберкулезной иммунизации, позволяет детскому организму при первичном заражении (почти неизбежном при большом резервуаре инфекции), успешно справляться с первичной туберкулезной инфекцией, как правило, без развития локальных проявлений, характерных для первичного туберкулеза. Таким образом, в условиях массовой вакцинации новорожденных и ревакцинации детей удалось добиться резкого снижения заболеваемости туберкулезом у детей, но вакцинация и ревакцинация при наличии большого резервуара инфекции не позволяет снизить высокую инфицированность населения тубер-кузом. У лиц, перенесших первичную туберкулезную инфекцию даже без проявлений локального первичного туберкулеза (так называемые инфицированные, т. е. зараженные туберкулезом), в остаточных туберкулезных очагах разных органов сохраняются персистирующие неразмножающиеся микобактерии туберкулеза и их измененные формы (L-формы, ультрамелкие и др.). В условиях реверсии данных измененных форм это приводит к реактивации туберкулеза без повторного заражения, у таких лиц развивается реактивационный (вторичный) туберкулез. У подавляющего большинства взрослых людей (в том числе пожилого и старческого возраста) туберкулез развивается именно таким путем. Хотя в условиях тесного контакта с больными заразными формами заболе-
вание возможно в результате повторного заражения: в среднем на
здоровых лиц, находящихся в контакте с больными туберку-
лезом, ежегодно регистрируется 3 случая заболевания.
Научные исследования, проведенные в течение последних 10—15 лет, позволили установить среди инфицированных лиц так называемые группы повышенного риска развития туберкулеза (группы
риска). К группе риска прежде всего относятся лица с остаточными изменениями излеченного туберкулеза, или, как их иногда называют, остаточные туберкулезные изменения (ОТИ). Туберкулез у
этих лиц, как показали эпидемиологические исследования, возникает в 20—30 раз чаще, чем у тех, у кого такие изменения не определяются. Выявить ОТИ возможно, применяя флюорографическое исследование населения в порядке профилактических осмотров, или в поликлинике при обследовании всех лиц, обратившихся за медицинской помощью впервые в данном году.
61
В результате многолетних систематических флюорографических исследований удалось выявить довольно большую группу «рентген-положительных» лиц с наличием ОТИ. Эти люди были взяты под диспансерное наблюдение по VII группе диспансерного учета. Оказалось, что у некоторых из них было спонтанное излечение от туберкулеза, о наличии которого эти люди не подозревали. Другие носители ОТИ подвергались лечению и у них наступило излечение туберкулеза. Среди лиц со спонтанным выздоровлением повторное развитие туберкулеза наблюдается редко (0,2% случаев), а среди ранее лечившихся — чаще (0,6% случаев).
У инфицированных туберкулезом, особенно у лиц с наличием ОТИ, риск развития туберкулеза увеличивается при сахарном диабете, силикозе и других видах пневмокониоза, язвенной болезни желудка и двенадцатиперстной кишки, хронических воспалительных заболеваниях легких. Он возрастает у больных, длительно принимающих кортикостероидные препараты, при психических заболеваниях, алкоголизме, иммунодефицитах различного происхождения, в том числе врожденного генеза. Таким образом, туберкулез среди взрослых людей в настоящее время очень часто возникает у больных с различными заболеваниями, которые нередко имеют выраженную клиническую картину и тем самым затрудняют диагностику туберкулеза, особенно при малосимптомном, постепенном начале. Туберкулез довольно часто развивается у лиц пожилого и старческого возраста, для которого характерно наличие различных хронических заболеваний. Наряду с эндогенной реактивацией участилось развитие туберкулеза вследствие экзогенной суперинфекции в результате контакта с больными-бактериовыделителями.
К сожалению, в настоящее время далеко не все лица, относящиеся
к группам риска, находятся на диспансерном учете и, следовательно, под диспансерным наблюдением. Диспансерное наблюдение осуще
ствляется за всеми лицами, находящимися в контакте с заразными больными туберкулезом (IV группа диспансерного учета).
Как указывалось ранее, диспансерное наблюдение проводится за
всеми лицами с наличием выраженных ОТИ (VII группа диспансерного учета). При наличии сомнительной активности туберкулезного процесса лица с рентгенологическими изменениями берутся на учет по 0 группе диспансерного наблюдения и им проводится превентивное лечение противотуберкулезными препаратами в течение
6 мес. Остальные категории населения, относящиеся к группам риска, не состоят на диспансерном учете в противотуберкулезном
илактическая работа фтизиатра с этими
диспансере, поэтому щ
контингентами относятся к так называемой внедиспансерной и про
водится совместно с участковыми терапевтами поликлиники. Эта работа заключается в совместном обследовании больных сахарным диабетом, язвенной болезнью желудка и двенадцатиперстной кишки, лиц с хроническими заболеваниями легких, в том числе пневмокониозом, длительно получающих кортикостероиды (брохиальная астма, различные коллагенозы и др.). Выполнить эту работу сложно, потому что многие больные (например, сахарным диабетом, пнев
62
мокониозом и др.) нередко наблюдаются не участковым терапевтом,
а эндокринологом, гц
патологом и др. В таких условиях резуль
тативность зависит от организации внедиспансерной
илакти-
ческой работы диспансера и утвержденного комплексного плана на
каждый год.
Еще раз подчеркнем, что в последние годы в нашей стране появились социальные факторы, влияющие на заболеваемость туберкулезом. Изучение социального состава больных туберкулезом и различных групп населения свидетельствует о том, что туберкулезом заболевают социально «ущербные» люди с низким образованием, социально не устроенные, без постоянного места работы и определенного места жительства, занимающиеся бродяжничеством и ведущие асоциальный образ жизни. Серьезной проблемой является туберкулез у лиц, страдающих алкоголизмом и наркоманией, психическими заболеваниями. Высокая пораженность туберкулезом людей, находящихся в ИТУ, требует совместных усилий органов здравоохранения, противотуберкулезных учреждений и медицинской службы МВД. Решение комплекса социальных задач выходит за рамки компетенции работников здравоохранения и требует участия
административных органов.
В новых условиях меняются форма и содержание организаци-
онно-методической работы противотуберкулезных диспансеров, но сохраняется основной принцип: противотуберкулезные мероприя-
тия — это не только работа противотуберкулезных учреждений, но
и общее дело всех лечебно-профилактических учреждений, объеди-
нение усилий всей медицинской общественности.
В связи с тем что распространенность туберкулеза определяется не только медико-биологическими, но и социальными факторами,
а также принимая во внимание значительную пораженность населения туберкулезом, ВОЗ еще в 1948 г. объявила приоритетность проблемы туберкулеза для международного и национального здравоохранения. Если в странах Европы и Северной Америки уже давно налажена система регистрации и учета больных туберкулезом, то в странах Африки, Азии и Тихоокеанского бассейна данные о распространенности туберкулеза отсутствовали. Под руководством ВОЗ были организованы эпидемиологические исследования распространенности туберкулеза в разных странах, они помогли уточнить эпидемиологическую ситуацию по туберкулезу в региональных и глобальных масштабах. Суммируя полученные данные, а также с
помощью математических расчетов, установлено, что ежегодно на Земле заразными формами туберкулеза заболевают 8*106 человек, еще 10*106 заболевают туберкулезом без выделения микобактерий, 3*106 — 4*106 больных ежегодно умирают от туберкулеза (табл.
3.2). Заболеваемость туберкулезом в развивающихся странах со-
ставляет 136—240 случаев на 100
населения. В экономически
развитых странах этот показатель значительно меньше. Так, в 1992 г. заболеваемость туберкулезом в Германии составляла 17,4, во Франции — 15,2, Великобритании — 70,5, Нидерландах — 10,1,
населения. К сожалению,
США — 10,5, Канаде — 7,7 на 100
63
за последние 20 лет в мире не произошло существенного снижения числа заболевших туберкулезом.
Несмотря на большое число больных туберкулезом, особенно в развивающихся странах, в 1960—1965 гг. появились планы искоренения туберкулеза как болезни и, следовательно, возникли новые проблемы для здравоохранения. Назывались даже конкретные эпи
демиологические показатели, при достижении которых считалось возможным рассматривать туберкулез как искорененную болезнь.
В частности, считалось, что при уровне инфицированное™ населения в возрасте до 14 лет не выше 1% туберкулез можно вычеркнуть из списка приоритетных, т. е. главных проблем здравоохранения. Распространению представления о туберкулезе как об «исчезающей» болезни способствовало решение Комитета экспертов ВОЗ в 1960 и 1964 гг. о том, что ликвидация туберкулеза как массового заболевания и проблемы здравоохранения является реальной задачей и
может быть достигнута по крайней мере в экономически развитых странах в ближайшем будущем. Основанием для такого решения послужили накопленные к этому времени знания о туберкулезе. Как известно, возбудитель туберкулеза был открыт Р. Кохом еще в 1882 г. В 1921 г. Кальметтом и Гереном была предложена вакцина
БЦЖ, которая применяется для
В конце 40-х — начале 50-х годов появились эффективные химиопрепараты и антибиотики (стрептомицин, изониазид, а затем ри
фампицин и др.), с помощью которых стало возможно проводить специфическую противотуберкулезную химиотерапию. К этому следует добавить, что имевшиеся эпидемиологические исследования свидетельствовали о четко выраженной тенденции к снижению заболеваемости туберкулезом в странах Западной Европы, США и Канаде. Появились высказывания и о том, что наука о туберкулезе — фтизиатрия — не имеет будущего, является «исчезающей» и должна быть интегрирована с пульмонологией. Практически во всех европейских странах это и произошло, противотуберкулезные учреждения были трансформированы в стационары и амбулатории для больных как туберкулезом, так и другими заболеваниями легких. Объединились научные общества фтизиатров и пульмонологов, изменились названия научных медицинских журналов. Однако конкретная эпидемиологическая ситуация по туберкулезу за истекшие 30 лет практически не изменилась и прогнозы об искоренении или ликвидации туберкулеза как распространенного заболевания не
оправдались.
В последние годы в США, ряде стран Западной и Восточной Европы отмечается увеличение заболеваемости туберкулезом, микобактериозами и некоторыми другими заболеваниями (легионеллез, грибковые заболевания и др.). Повышение заболеваемости туберкулезом большинство ученых связывают с ВИЧ-инфекцией и нарастающей эпидемией СПИД, иммунодефицитами другого происхождения, рядом социальных проблем, алкоголизмом, наркоманией, миграцией больших групп населения. Фактору миграции раньше не придавали важного значения в распространении туберкулеза, но
64
Таблица 3.2. Заболеваемость и смертность от туберкулеза в мире в 1992 г.
Регион Абс. число пз Абс. число ПС
Юго-Западная Азия 3 263 000 240 1 142 000 84
Западно-Тихоокеанский 1 921 000 136 672 000 48
Африка Восточное 1 182 000 214 468 000 85
Средиземноморье 683 000 166 266 000 65
Америка 584 000 128 117 000 26
Восточная Европа 197 000 47 29 000 7
Индустриализованные страны (Зап. Европа, США, Канада, Япония, Австралия) 199 000 32 14 000 2
Все регионы... 8 029 000 146 2 708 000 49
Примечание. ПЗ и ПС — соответственно показатели заболеваемости и смертности на 100 000 населения.
оказалось, что в условиях неравномерной пораженности населения туберкулезом миграция (особенно больших групп населения) может оказывать существенное влияние на уровень заболеваемости. Так, в США при средней заболеваемости населения туберкулезом 9,3 на 100 000 населения заболеваемость иммигрантов из Вьетнама, Камбоджи и Лаоса, прибывших в США, составила 310 на 100 000 населения. В Великобритании заболеваемость иммигрантов в 8 раз выше, в ФРГ наблюдается та же тенденция.
Основные причины роста заболеваемости туберкулезом следующие.
1. Игнорирование болезни правительствами привело к тому, что системы борьбы с туберкулезом деградировали или вообще исчезли во многих частях мира.
2. Плохо управляемые и неправильно задуманные программы борьбы с туберкулезом способствовали росту «бремени» болезни, а также возникновению устойчивости микобактерий туберкулеза химиотерапии. Даже в промышленно развитых странах лечение устойчивого к комплексной химиотерапии туберкулеза затруднено, дорого и часто неэффективно.
3. Рост населения способствовал увеличению числа случаев туберкулеза. Дети, родившиеся за последние несколько десятилетий в районах с высокими показателями демографического роста, теперь достигают возраста, в котором высоки заболеваемость туберкулезом и смертность от него.
4. Связь между туберкулезной инфекцией и ВИЧ-инфекцией привела к взрывообразному росту случаев туберкулеза в эндемичных для ВИЧ зонах; ВИЧ активирует возбудителя туберкулеза у уже инфицированных микобактериями лиц, ускоряя переход инфекции к болезни.
Таким образом, туберкулез продолжает оставаться важной проблемой как международного, так и национального здравоохранения.
3—1213
65
ГЛАВА 4
МЕТОДЫ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА ОРГАНОВ ДЫХАНИЯ
4.1. ОСНОВНЫЕ ПРИНЦИПЫ ДИАГНОСТИКИ
Процесс диагностики включает несколько этапов. Первый — отбор лиц с различными заболеваниями легких среди больных, обратившихся за медицинской помощью. Этот отбор происходит, как правило, в поликлиниках и осуществляется врачами общей медицинской сети. Его рекомендуется проводить с помощью флюорографии. Последняя позволяет выявить даже незначительные по протяженности изменения, как свежие, так и старые. Рекомендуется применять флюорографию всем лицам, обратившимся в поликлинику впервые в данном году по любому поводу. Следует подчеркнуть, что указанный метод можно использовать как до, так и после клинического обследования у тех людей, у которых заподозрено легочное заболевание после проведенного отбора лиц с легочной патологией (с помощью флюорографии или рентгеноскопии); отобранным лицам назначают проведение других исследований.
Выявление больных легочным туберкулезом может также осуществляться с помощью исследования мокроты на наличие микобактерий, а применительно к детям и подросткам — туберкулино-
ряда
диагностики.
Этапы диагностического процесса. 1. Применение методов исследования у больного и накопление полученной информации.
2. Анализ полученной информации на достоверность, информативность и специфичность.
3. Построение диагностического симптомокомплекса на основе отобранных признаков.
Формулировка предположительного диагноза заболевания или заболеваний.
Проведение дифференциальной диагностики.
Формулировка клинического диагноза (в развернутой форме).
Проверка правильности установленного диагноза в процессе наблюдения за больным и его лечения.
Методы исследования при легочной патологии можно условно разделить на 3 группы. Обязательный диагностический минимум (ОДМ): изучение анамнеза, анализ жалоб, стетоакустической картины, рентгенография грудной клетки, микроскопия и посев мокроты для выявления микобактерий, клинические анализы крови и мочи. Задача клинического исследования — выявление не только ярких, но и маловыраженных симптомов заболевания легких. При изучении анамнеза нужно поставить ряд обязательных вопросов каждому больному с легочной патологией: о наличии или отсутствии туберкулеза в семье, профессии и профессиональных вредностях (особенно связанных с запылением, работой с агрессивными веществами), о перенесенных болезнях легких. При анализе жалоб задают серию
66
вопросов, фиксирующих внимание больного на так называемых легочных симптомах или «грудных» жалобах. И, наконец, при стетоакустическом исследовании нужно искать легочную патологию, и если перед клиническим исследованием получены данные о наличии каких-то изменений в том или ином легком при флюорографии, соответствующие участки легкого должны быть изучены очень тщательно, т. е. применяется не просто сравнительная, а целенаправленная тщательная перкуссия и аускультация. При выслушивании этих зон легкого больной должен дышать более глубоко, нужно просить больного покашлять в конце выдоха и слушать, нет ли хрипов после покашливания. Иначе говоря, ведется поиск микросимптоматики. И нередко именно такое исследование позволяет определить те или иные симптомы, которые могут быть использованы при уточнении диагноза.
При обследовании лиц с легочной патологией, кроме рентгенологического исследования в прямой проекции, многим больным должно быть произведено исследование в боковой и косой проекции, а также должен быть сделан прицельный или увеличенный снимок. Вопрос об этом решает рентгенолог нередко вместе с клиницистом. Иногда в качестве первого рентгенологического метода применяют крупнокадровую флюорографию, которая может в какой-то степени заменить рентгенограмму, но при наличии патологических изменений она должна дополняться рентгенограммой.
Следующий метод — исследование мокроты с целью обнаружения микобактерий туберкулеза. При отсутствии мокроты можно исследовать промывные воды бронхов. Раньше применялось исследование промывных вод желудка, но сравнительное изучение показало, что самый результативный метод при отсутствии мокроты — исследование промывных вод бронхов. Далеко не всегда микроскопия дает положительный ответ, о чем свидетельствуют данные табл. 4.1.
Результаты исследования мокроты во многом зависят от характера легочных изменений. Из табл. 4.1 видно, что при четко определенной на рентгенограмме каверне микроскопия мокроты выявила положительный результат у 98,9% больных, когда каверны определялись только на томограмме — у 41% больных, а у 96% выявлен рост микобактерий при посеве. При наличии инфильтрации без распада микроскопически микобактерии выявлены у 1,9% больных, а метод посева позволил выявить бацилловыделение у 27,5% больных. Высокая результативность исследования мокроты достигается тогда, когда оно проводится как минимум 3 раза. После первого исследования при наличии на рентгенограмме каверны микобактерии методом посева обнаружены у 60,9%, после второго исследования — у 78,3% больных и только после 3 посевов рост обнаружен у 96,7% больных. Еще более четко закономерность эта выражена при менее запущенных процессах. Применять микроскопическое исследование и посев надо до начала лечения, 3 посева или 3 микроскопии нужно провести в течение 3 дней. Результативность исследования возрастает при изучении мокроты, собранной в течение суток (табл. 4.2).
з*
67
Таблица 4.1. Результаты исследования мокроты методами микроскопии и посева у впервые выявленных больных
Группа больных Всего больных Микроскопия Посев Исследование
БК+ БК+ (данные 3 посевов) первое второе
Каверна определялась на рентгенограмме 92 91(98,9%) 89(96,7%) 56(60,9%) 16(78,3%)
Каверна определялась на томограмме 60 25(41%) 58(96%) 25(41,6%) 11(61,6%)
Каверна не определялась 102 2(1,9%) 28 (27,5%) 10(9,8%) 7(17%)
Итог о... 254 118 165 91 < li н 34 j 15
Таблица 4.2. Результаты исследования утренней и суточной порций мокроты у больных фиброзно-кавернозным туберкулезом
Мокрота Всего больных Микроскопия Посев
БК+ БК+
Утренняя 124 75(61,6%) 85(68,5%)
Суточная 124 90(72,6%) 114(92,0%)
Если у больного выделяется большое количество мокроты, нет необходимости собирать мокроту в течение суток, достаточно и утренней порции.
При наличии микобактерий, обнаруженных культуральным методом, обязательно определяют лекарственную чувствительность микобактерий туберкулеза к химиопрепаратам. Это важный прогностический показатель при химиотерапии, а также один из основных критериев эффективности проводимых мер по лечению больных туберкулезом.
Следующий метод, входящий в обязательный диагностический минимум, — туберкулиновая проба, которая в настоящее время применяется в виде внутрикожного теста с введением 2 ТЕ стандартного туберкулина ППД или градуированной кожной пробы с различными разведениями туберкулина. Наконец, в ОДМ входит клинический анализ крови и мочи. Эти анализы не имеют специфических признаков, типичных только для туберкулеза, однако в сочетании с другими данными они имеют большое значение не только для диагноза, но и для проведения лечения и контроля за влиянием противотуберкулезных средств на организм больного.
Дополнительные методы исследования (ДМИ) подразделяются на две группы. К методам первой группы (неинвазивным) мы относим повторное исследование мокроты, промывных вод бронхов на
68
наличие микобактерии туберкулеза методом флотации, томографию легких и средостения, белково-гемотуберкулиновые пробы, иммунологические исследования, протеинограмму, определение С-реак-тивного белка. В диагностике туберкулеза известное значение имеет углубленная туберкулинодиагностика — определение порога чувствительности к туберкулину, подкожному его введению с белково-и гемотуберкулиновыми пробами.
Суммарная оценка данных ОДМ и ДМИ первой группы позволяет врачу поставить диагноз или составить более глубокое и целостное представление о характере выявленного заболевания, значительно сузить дифференциально-диагностический ряд. Однако у определенного числа больных даже после такой оценки диагноз остается
неясным и возникает необходимость в морфологическом подтверж
дении предполагаемого диагноза.
Эта задача может быть осуществлена на этапе применения инвазивных дополнительных методов исследования — методы второй группы. К ним относятся: первый этап, инструментальные исследования, — бронхоскопия обзорная или в сочетании с катетерби-опсией, брашбиопсией, транстрахеальной и трансбронхиальной пункцией, прямой биопсией слизистой оболочки бронхов, патологических образований в них, трансторакальная аспирационная биопсия легкого, пункционная биопсия плевры, пункция периферического лимфатического узла. Применяют исследование бронхоальвеолярных смывов (БАС), позволяющее определить клеточный состав с помощью цитологического, иммунологического и электронно-микроскопического методов, а также содержание фосфолипидов, протеолитическую активность в жидкости. Бронхологические методы при необходимости могут сочетаться с бронхографией и, так же как и другие методы, со срочным лабораторным исследованием полученного материала. Второй этап, диагностические операции, — биопсия прескаленной клетчатки, медиастиноскопия, медиастинотомия, открытая биопсия легкого, плевроскопия. Конкретной задачей каждого метода должно быть получение патологического материала, при изучении которого (цитологическом, гистологическом, бактериологическом) возможно верифицирование диагноза. ДМИ доступны хорошо оснащенным дифференциально-диагностическим отделениям, функционирующим вместе с легочно-хирургическими отделениями и лабораториями.
Факультативные методы исследования (ФМИ) — третий этап в диагностике. На этом этапе изучаются функции различных органов и систем, а также обменные нарушения. Применяют такие методы исследования, которые помогают раскрыть механизмы появления различных функциональных нарушений. При заболеваниях органов дыхания наиболее важными ФМИ являются: исследование функции дыхания и кровообращения, состояния белкового и углеводного обмена, определение дефицита витаминов, углубленное изучение функции печени, при частых кровохарканьях и кровотечениях — ис-ледование свертывающей системы крови. ФМИ являются важным элементом диагностики, особенно у лиц с осложненным течением
69
заболевания и при сочетании нескольких болезней. ФМИ могут быть проведены в процессе выполнения дополнительных методов исследования или после них.
Следует отметить, что методы, применяемые на первом и втором этапах обследования, нередко позволяют получить достаточную информацию для построения диагностического симптомокомплекса, особенно если среди полученной информации имеются высокодостоверные признаки, свидетельствующие о том или ином заболева
нии.
ОДМ — это комплекс методов, который применяется всем обследуемым без исключения, кроме тех лиц, у кого есть противопоказания к использованию того или иного метода. Дополнительные и факультативные методы применяются только по показаниям. На основании данных, полученных с помощью ОДМ, если не хватает информации для формулировки диагноза, используют те или иные
дополнительные методы исследования, т. е. на весь комплекс дополнительных диагностических методов, а только тот метод, который нужен данному больному. Дополнительные и факультативные методы дают новую дополнительную информацию, которая позволяет или уточнить характер туберкулезного процесса, если диагноз поставлен, или провести дифференциальную диагностику, если диагноз был неясен и требовалось его уточнение. Факультативные методы позволяют изучить функцию различных органов и систем больного и получить представление о состоянии обменных процессов. Они нередко не только расширяют представления о характере заболевания и течении болезни, но и являются диагностическими методами. Надо иметь в виду, что при туберкулезе легких очень часто на высоте патологического процесса имеется нарушение функции многих органов и систем, развиваются обменные нарушения, поэтому диагноз и представление о характере заболевания должны отражать и эти изменения. Нельзя представлять туберкулез только как локальное поражение легких и лимфатических узлов. Локальное поражение легких вызывает различные нарушения в организме, и эти
нарушения должны по возможности отражаться в диагнозе.
Анамнез и физическое исследование. В клинической диагностике туберкулеза и других заболеваний легких анамнез болезни и жизни имеет очень важное значение. Обследование больного, который впервые в жизни направлен к врачу-фтизиатру, предпочтительнее начинать с изучения анамнеза болезни, а затем — жизни. Если же исследование проводится человеку с хроническим заболеванием легких, в том числе туберкулезом, следует начинать с анамнеза жизни, поскольку очень часто такой анамнез с длительным, многолетним течением легочного туберкулеза или неспецифическим заболеванием легких очень тесно переплетается с анамнезом болезни или нескольких заболеваний, развивающихся одно за другим либо соче
тающихся друг с другом.
При изучении анамнеза болезни необходимо прежде всего уточнить, как было выявлено заболевание легких — при обращении к
врачу по какому-то поводу или при проведении очередного профи
70
лактического обследования. При этом больного следует распросить о самочувствии, наличии или отсутствии таких симптомов, как повышение температуры тела, кашель, выделение мокроты, кровохарканье. Не менее важное значение имеет информация об общем состоянии больного, явлениях общей интоксикации о состоянии работоспособности. Эти данные, конечно, сами по себе не являются
основанием для диагноза, но в совокупности с результатами исследования, проведенного в поликлинике, больнице, или данных дополнительных и факультативных методов служат для постановки
диагноза.
При длительном течении туберкулеза и других легочных заболеваний очень важными являются сведения о применяемых методах лечения и их эффективности, эти данные могут дополняться из имеющихся медицинских документов. Естественно, сведения об эффективности лечения, полученные от больного, в большой мере отражают субъективное состояние. Данные различных методов исследования в интерпретации самого больного также должны быть критически проанализированы и сопоставлены с объективными данными обследования.
В анамнезе жизни большое внимание должно быть уделено про-
фессии больного в плане выявления возможных профессиональных
вредностей, которые могут привести к заболеванию профессиональ-
ного характера. Применительно к туберкулезу к такой группе риска
относятся и медицинские работники, имеющие постоянный
сиональный контакт с больными заразными формами или зараженным материалом (мокрота, белье, посуда и др.). Также важным является указание на контакт с больным туберкулезом, что увеличивает риск заболевания туберкулезом, особенно для лиц молодого
возраста, у которых в результате такого контакта могут наступить заражение туберкулезом и развиться одна из первичных форм туберкулезной инфекции. Заслуживает внимания туберкулез у родителей, близких и даже дальних родственников не только в аспекте возможного контакта, но и наследственной предрасположенности к туберкулезной инфекции.
Не меньшее значение имеют указания на болезни, перенесенные в прошлом, что позволяет составить мнение о состоянии здоровья обследуемого на протяжении его жизни. Наряду с заболеваниями легких могут быть данные о различных заболеваниях внутренних органов, некоторые из них часто обусловливают развитие туберкулеза (сахарный диабет, язвенная болезнь желудка и двенадцатиперстной кишки, особенно после хирургических вмешательств). Длительное применение кортикостероидных препаратов и гемодиализа может также способствовать развитию туберкулеза.
В последние годы доказано, что хронические неспецифические заболевания легких с частыми воспалительными реакциями, так же как и метатуберкулезный синдром, множественные очаговые изменения, возникшие при ранее перенесенном туберкулезном процессе, создают повышенный риск развития туберкулеза и требуют особого внимания (Н. М. Рудой, С. И. Ковалева, Е. В. Левтонова). Наконец,
71
нужно отметить, что при наличии выраженной клинической картины, обусловленной каким-либо заболеванием, при недостаточно полном обследовании больного можно пропустить и не выявить туберкулезный процесс в легких.
От изучения анамнеза следует переходить к более детальному расспросу о жалобах больного. Как правило, жалобы составляют как бы часть (раздел) анамнеза больного, завершая рассказ обследуемого о его состоянии.
Необходимо подчеркнуть, что, изучая анамнез, врач может получить весьма ценные данные об интеллекте и коммуникабельности больного, его отношении к имевшимся заболеваниям или развившейся болезни и, что очень важно, о том, в какой степени он выполнял указания, назначения и рекомендации врача. Эти данные необходимы для дальнейшей работы с обследуемым, поскольку для уточнения диагноза нередко необходимы применение различных (в том числе инвазивных) методов исследования и лечения, госпитализация.
При удовлетворительном субъективном ощущении иногда необходимо убедить больного в необходимости госпитализации и лечения, это требует умелого подхода с учетом характера и личностных особенностей.
Физическое исследование, включающее осмотр, перкуссию и аускультацию, также является обязательным элементом клинического обследования больного. Оно дает возможность врачу получить представление о физическом развитии обследуемого. Отклонения от нормы, свидетельствующие о наличии заболевания легких и перенесенных заболеваниях легких и плевры при туберкулезе, в первую очередь определяются клиническими формами и давностью заболевания, выраженностью клинической картины и степенью интоксикации.
У больных с малыми формами туберкулеза, ограниченным поражением в легких и постепенным развитием заболевания, как правило, физические методы исследования не могут выявить патологические изменения в легких. При распространенном процессе с наличием интоксикации и подострым началом болезни могут отмечаться бледность кожных покровов, потливость, тахикардия, кашель (сухой или с выделением мокроты), кровохарканье. При обширной воспалительной реакции в легком соответственно поражению отмечаются притупление перкуторного звука, лучше выявляющееся при тихой перкуссии, жесткое, реже бронхиальное дыхание, влажные хрипы (мелко- и среднепузырчатые), которые нередко лучше выслушиваются после покашливания, реже выслушиваются сухие хрипы на ограниченном пространстве. Характерны почти полное отсутствие изменений при свежих диссеминациях в легких и, наоборот, более выраженные изменения при инфильтративной воспалительной реакции.
Особая картина отмечается при развитии экссудативного плеврита, проявляющегося при большом накоплении экссудата притуплением и ослаблением дыхания. Менее выражены изменения при
72
серозно-фибринозном (пластическом) плеврите. У таких больных
может также выслушиваться шум трения плевры.
Более выраженные изменения могут быть у больных деструктивным туберкулезом легких. Если на ранних этапах деструктивного процесса можно обнаружить лишь сухие или влажные хрипы в области формирующейся каверны, то при хроническом, длительном процессе обращают на себя внимание нарастающая асимметрия грудной клетки, иногда выраженная весьма значительно в виде фиброторакса: уменьшение объема пораженной половины грудной
клетки, отставание ее в акте дыхания, западение над- и подключичных ямок, атрофия мышц. У таких больных могут быть потеря массы тела и даже явления истощения, обусловленные длительной, постоянной интоксикацией или периодическими, но часто повторяющимися вспышками заболевания. За счет развившегося фиброза определяется притупление перкуторного звука, а за счет эмфиземы — коробочный звук при перкуссии. Соответственно меняется и характер дыхания: оно становится жестким и бронхиальным, а над участками эмфиземы — ослабленным. Поскольку у таких больных, как правило, изменяются бронхи за счет развития цилиндрических или мешотчатых бронхоэктазов, в легких выслушиваются сухие и
влажные хрипы.
При двусторонних процессах, которые, как правило, развиваются при хроническом диссеминированном туберкулезе, могут со временем быть явления двустороннего пневмофиброза и эмфиземы без выраженной асимметрии грудной клетки.
Развитие осложнений легочного туберкулеза ведет к появлению различных клинических признаков и изменениям при физическом обследовании соответственно характеру этих осложнений. При легочном кровотечении и развитии аспирационной пневмонии появляются притупление, жесткое или бронхиальное дыхание, влажные и сухие хрипы в базальных сегментах одного или обоих легких. Спонтанный пневмоторакс характеризуется резко ослабленным дыханием над соответствующей половиной грудной клетки при наличии одышки, выраженной в разной степени в зависимости от величины коллапса легкого. При дыхательной недостаточности у больных постепенно развиваются цианоз слизистых оболочек, акроцианоз, а при появлении сердечной недостаточности — признаки декомпенсированного легочного сердца, отеки нижних конечностей, асцит, увеличение печени, анасарка. Отечным синдромом характеризуется также амилоидоз внутренних органов, развивающийся у некоторых больных с хроническими формами туберкулеза. При амилоидозе отеки стойкие, на терминальном этапе нарастает задержка жидкости с накоплением ее в брюшной полости, увеличением объема нижних конечностей, анасаркой.
Изменения внешнего вида и другие признаки, выявляемые при физическом обследовании, могут быть обусловлены не активным туберкулезным процессом, а его последствиями. Такие больные обследуются главным образом в плане определения активности туберкулезных изменений, а также выявления рецидивов туберкулеза.
73
Степень выраженности изменений зависит от протяженности остаточных изменений излеченного туберкулеза. После излечения ограниченного процесса могут остаться лишь западение над- и подключичных ямок, смещение трахеи, незначительное отставание в акте дыхания соответствующей половины грудной клетки. Более выраженные изменения в виде одно- или двустороннего пневмофиброза сохраняются после заживления более распространенных форм туберкулеза, плеврита с длительным сохранением экссудата и образованием плевральных шварт. Определение активности процесса у таких больных требует комплексного обследования больного, только физические исследования, как правило, не позволяют дать исчерпывающие данные.
В заключение необходимо подчеркнуть, что физическое обследование не должно ограничиваться органами дыхания, все органы и системы, доступные таким исследованиям, должны быть досконально проанализированы по следующим соображениям:
1. У больных туберкулезом органов дыхания может быть нарушена функция любого органа и системы.
2. В результате осложненного течения туберкулеза могут возникать изменения различных органов и систем: сердечно-сосудистой, желудочно-кишечного тракта, печени, почек, эндогенных органов и др.
3. В процессе лечения туберкулеза также может нарушаться функция различных органов.
4. Туберкулез органов дыхания может комбинироваться с другими заболеваниями с соответствующими клиническими проявлениями.
4. 2. ЛУЧЕВАЯ ДИАГНОСТИКА
Среди методов, используемых в диагностике туберкулеза ор
ганов дыхания, ведущая роль принадлежит рентгенологическому. Это объясняется его доступностью, высокой информативностью, способностью дать объективные данные об изменениях на ранних стадиях выявления и в процессе развития заболевания. Поэтому диагностика туберкулеза органов дыхания, уточнение его форм и активности, наблюдение за динамикой в результате проводимой
химиотерапии, а следовательно, и оценка ее эффективности, на-
блюдение за формированием остаточных изменений, а также про
ведение дифференциальной диагностики в значительной мере ба-
зируются на данных рентгенологического исследования. Вместе с тем признавая достоинства метода и его достижения, необходимо подчеркнуть и следовать основному принципу: рентгенологический
метод, являясь важнейшим методом диагностики, остается только составной частью общеклинического обследования больного туберкулезом [Прозоров А. Е., 1940; Пом ельцов К. В., 1971; Александрова А. В., 1983].
Совершенствование современной рентгеновской аппаратуры и создание новых видов лучевой диагностики обусловили возникновение
74
новой дисциплины, основанной на получении, передаче и анализе изображений, формируемых с помощью не только рентгеновского излучения, но и других электромагнитных, ультразвуковых и корпускулярных полей. Эту дисциплину наиболее точно определяет термин «лучевая диагностика». Она включает рентгенодиагностику, в том числе компьютерную томографию (КТ), радионуклидную диагностику, в том числе эмиссионную КТ, ультразвуковую диагностику, магнитно-резонансную интраскопию, медицинскую термографию, активационный анализ. Применение вычислительной техники позволяет дать математический анализ полученной информации. Дигитальные устройства обеспечивают компьютерную обработку изображения (сложение,
вычитание, сглаживание, контрастирование, выделение «зон интере
са», построение гистограмм и др.).
При обследовании больных туберкулезом органов дыхания (как и другими заболеваниями легких), целенаправленно используя богатый арсенал методик лучевой диагностики, необходимо получить максимум информации при определении рентгеноморфологического субстрата изменений. При этом необходимо руководствоваться пра-
вилом: минимальный комплекс рентгенологических методик должен дать максимум интересующей информации в каждом конкретном случае, т. е. исследование должно быть целенаправленным [Александрова А. В., 1982; Дмитриева Л. И. и др., 1984, 1987]. Такому требованию полностью отвечают возможности классического рент-
генологического метода, позволяющего не только оценить рентге-
логический субстрат изменений, но и определить функци-
номора Ж. *
ональную способность системы дыхания. Диапазон классического
рентгенологического метода в пульмонологии схематически представлен в табл. 4.3.
К принципиально новым видам получения и обработки изображения относятся магнитно-резонансная компьютерная томография (МРТ), ядерно-магнитно-резонансная томография (ЯМР).
Совершенствование современной рентгеновской аппаратуры значительно расширило возможности метода, повысило его информативность и позволило переставить акценты в оценке и использовании различных видов и способов рентгенологического метода. Некоторые способы рентгенографии и послойного исследования в настоящее время стали скорее историческими — как этап развития метода. В большей степени это относится к рентгенофункциональным исследованиям (щелевая кимография, электрорентгенокимо-графия, некоторые виды дыхательных функциональных проб), а также к некоторым способам томографии (симультанная, поперечная, с многонаправленным движением, ациклоидальное). Перечисленные методы не получили широкого признания из-за малой информативности, большой лучевой нагрузки на пациента и медицинский персонал. Не получили распространения в пульмонологии также электрорентгено- и томография (ксерорадиография). Появились более информативные (как КТ) или принципиально новые методы лучевой диагностики — радионуклидный и ультразвуковой.
75
Таблица 4.3. Характеристика рентгенологического метода исследования
Вид исследования Способы исследования
Флюорография а) диагностическая полипозиционна б) функциональная (флюоропневмополиграфия) в) томофлюорография
Рентгеноскопия а) полипозиционная многопроекциоиная б) функциональная
Рентгенография а) различное положение больного б) широкоформатная в) прицельная г) с увеличением д) функциональная рентгеноэлектрокимография рентгенокимография рентгенопневмополиграфия (РППГ) е) электрорентгенография (эРГА)
Томография: морфологический анализ а) различное положение больного горизонтальное вертикальное наклонное косое б) различный тип размазывания теней продольное поперечное ► линейная томография косое J в) с различными углами качания трубки (различная толщина выделения слоя легкого) г) электрорентгеиотомография д) поперечная
функциональный а) томопневмополиграфия (ТППГ)
анализ компьютерная томография (КТ) морфологически й анализ функциональный анализ б) зонопневмополиграфия (ЗППГ)
Рентгеноконтрастное исследование а) бронхография (томобронхография) б) ангиопул ьмонограф и я в) плеврография г) кавернография д) фистулография е) медиастинография ж) лимфография
76
При обследовании больных туберкулезом легких из всего многообразия видов и способов рентгенологического метода следует
выделить следующее.
1. Обязательный рентгенологический диагностический минимум; крупнокадровая флюорография и обзорная рентгенография.
2. Углубленное рентгенологическое исследование (рентгенография в двух взаимно перпендикулярных проекциях, рентгеноскопия и стандартная томография).
3. Дополнительное рентгенологическое исследование: различные способы рентгенографии и томографии, в том числе КТ и МРТ,
позволяющие дать мор4
логическую и функциональную характе-
ристику органа; способы контрастного рентгенологического иссле
дования и методы ультразвуковой и радионуклидной диагностики.
Рентгенологическое исследование должно проводиться строго по показаниям, а его объем определяется характером патологического процесса и поставленной задачей. При этом тщательно соблюдаются
все меры предосторожности для снижения лучевой нагрузки на больного и персонал рентгеновского кабинета.
Крупнокадровая флюорография и обзорная рентгенография являются важнейшими видами рентгенологического исследования не только у больных туберкулезом легких, но и в широкой пульмонологической практике.
Крупнокадровая флюорография (размеркадров 70x70, 100x100 и 110x110 мм) используется не только при массовых флюорографических обследованиях населения. Высокая разрешающая способность флюорографической пленки, выявление мелких структурных нарушений, полипозиционное исследование, возможность получения первичной объективной документации расширили гра
ницы этого вида рентгенологического исследования и позволили использовать его как диагностический. На флюорограммах наряду с изменениями бронхолегочной системы, плевральных оболочек можно оценить состояние средостения, сердечно-сосудистой системы, малого круга кровообращения.
При рентгенографии легких, физиологически динамичного органа, целесообразно использовать телерентгенографию (расстояние между фокусом трубки и пленкой 2 м) и технику жестких лучей [Зильбер Э. П., 1969]. Непременным условием являются наличие острого фокуса, напряжение на трубке 120 кВт, экспозиция менее 0,1 с (сотые доли секунды), использование алюминиевого или латунного фильтра и быстроходной отсеивающей решетки с растром 1:10 или 1:7. С помощью этой техники съемки можно получить формы и размеры тенеобразований, приближающиеся к истинным. Особенно важным является то, что использование острого фокуса и короткой экспозиции уменьшает динамическую нерезкость изображения, обусловленную пульсацией сердца, крупных сосудов, респираторной активностью самой легочной ткани и дыхательной мускулатуры.
При рентгенографии жесткими лучами плотность костных образований уменьшается, сквозь ребра хорошо прослеживается легоч
77
ный рисунок. Более отчетливо дифференцируется структура средо
стения и корней легких, лучше выявляется протяженность и повышается контрастность изображения очаговых теней, расположенных за ребрами, тенью сердца и в латеральных отделах. Уточняется не
только протяженность интерстициальных изменений, но и их характер, что позволяет говорить о степени поражения соединительной ткани интерстиция, без анализа которой невозможно на современном уровне интерпретировать изменения в легких. Bucket и соавт. на
звали рентгенограммы, выполненные такой техникой, «снимками легких», а рентгенограммы, сделанные обычным способом, «снимками грудной клетки». К недостаткам метода относятся трудность
выявления кальцинатов и некоторое снижение контрастности снимка, к чему глаз быстро привыкает.
Технику «жестких лучей» необходимо отличать от техники «жестких снимков». Техника жестких, суперэкспонированных, снимков используется при наличии массивных уплотнений в легочной ткани, различной природы массивных распространенных и локальных плевральных наслоений, при фиброзном медиастините, для изучения состояния трахеи и крупных бронхов — «воздушная бронхография». Для производства таких снимков наряду с увеличением жесткости рентгеновского излучения удлиняется и экспозиция.
Рентгенографию в прямой проекции иногда приходится дополнять исследованием в боковой проекции. При этом значительно расширяется представление о патологическом процессе. Уточняются топография последнего по отношению к долям и сегментам, протяженность, связь с плевральными оболочками и взаимоотношение с корнем легкого и средостением. В ряде случаев следует производить рентгенографию с прямым увеличением изображения. При этом коэффициент увеличения не должен превышать 1,5. При более высоком коэффициенте значительно нарастает нерезкость изображения и информативность снимка снижается.
При специфических процессах в легких на увеличенных рентгенограммах наиболее полно выявляются наличие и протяженность периб-ронхиальных изменений, в частности уплотнение стенок дренажных бронхов и вовлечение в процесс ближайщих к ним бронхов и сосудов. Уточняются характер и распространенность интерстициальных изменений, выявляются мелкие очаги, невидимые на обычных рентгенограммах, устанавливаются большая протяженность поражения как при мелких, так и крупных очаговых изменениях. Анализируются структура очагов, наличие кальцинатов, слоистости, каверны и туберкулем, выявляются дополнительные изменения окружающей легочной ткани, участки локальной буллезной эмфиземы, более четко документируется вовлечение в процесс плевральных оболочек.
Прицельная рентгенография позволяет целенаправленно под контролем экрана выбрать «зону интереса», вывести ее в оптимальную для патологического процесса плоскость и таким образом уточнить и детализировать характер изменений, дополняя результаты обзорного снимка, и фрагментарно документировать результаты рентге
носкопии.
78
Рентгеноскопия, сыгравшая большую роль на ранних эта-пах развития фтизиатрии, не потеряла актуальности. Однако из основного диагностического метода рентгеноскопия превращается в метод функциональный, поисковый, ориентировочный. Она должна производиться после получения объективной документации рентгенографии в двух взаимно перпендикулярных проекциях.
Возможность полипозиционного и многопроекционного исследования у больного, производимого за экраном при непосредственном контакте с врачом, помогает уточнить топографию патологических образований и оценить функцию органов. При рентгеноскопии определяется отношение патологических тканей к костным образованиям грудной стенки, плевральным оболочкам, легочной ткани или органам средостения. В ряде случаев можно вывести патологическое образование на контур, выявить небольшое скопление жидкости или воздуха в плевральной полости и уточнить их локализацию.
Наряду с этим дается первая качественная оценка функциональной способности органов дыхания: воздухонаполнение респираторных отделов легких, подвижность ребер и динамическая активность такой важной дыхательной мускулатуры, как диафрагма. Изучаются подвижность органов средостения, пульсация крупных сосудов и
сердца.
Однако кратковременность исследования вследствие большой лу
чевой нагрузки, небольшая разрешающая способность в морфоло-
гической интерпретации деталей изображения вследствие их нерез-кости и малоструктурности, а также отсутствие объективной документации снижают достоинства указанного метода. Этим объясняется
значительное уменьшение проведения рентгеноскопии в противотуберкулезных учреждениях. Вместе с тем использование телевизионной аппаратуры, дистанционного управления, видеомагнитной за-
писи предполагает новую качественную оценку рентгеноскопии,
повышает эффективность последней в толковании морфологических
и функциональных отклонений, а также возможность динамического наблюдения за больными. Поэтому дальнейшее совершенствование рентгеновской аппаратуры, возможно, реабилитирует этот метод рентгенологического исследования, тем более, что при наличии электронно-оптического преобразователя лучевая нагрузка на больного ниже на 30—40%, чем при обычной рентгеноскопии.
При электрорентгенографии (ксерорадиографии) изображение получается на бумаге с помощью электрорентгеногра-фической приставки, подключенной к любому рентгенодиагностическому аппарату. Происходит экспонирование заряженной селеновой пластины рентгеновскими лучами без отсеивающих решеток. При проявлении полученное изображение переносится с селеновой пластины на бумагу и закрепляется в камере парами растворителя
(ацетона).
Полученное таким образом изображение структурных элементов имеет свои особенности, которые необходимо учитывать при анализе электрорентгенограмм, в которых одновременно сочетается информация, содержащаяся на обычном и суперэкспонированном снимках.
79
Такое сочетание объясняется наличием так называемого краевого эффекта, обусловленного отложением проявляющего вещества на границах уплотнений. Таким образом достигается высокая контрастность отображения контуров каверн, округлых образований (туберкулем), стенок трахеи и крупных бронхов, контура сердца. Получает отображение большое число деталей и очагов различной плот-
ности с подчеркнутостью их контуров, что создает трудности в дифференциации уплотненных очаговых образований и очагов с
перифокальной реакцией или вновь образованных. На электротомограммах хорошо «прорабатываются» слои, проходящие через пло-
скость средостения. Сосудистый рисунок по своей контрастности
имеет вид ангиограмм.
В настоящее время применение электрорентгенографии во фтизиатрии ограничено. Этот способ может быть использован как ориентировочный и как промежуточное исследование при динамическом наблюдении за патологическим процессом в легких.
Совершенствование аппаратуры (прежде всего снижение лучевой нагрузки), улучшение качества селеновых пластин, уменьшение их «утомляемости» и зависимости их качества от атмосферных и температурных условий при хранении, более четкое и равномерное изображение на бумаге, несомненно, расширят область применения электрорентгено- и томографии, в том числе и во фтизиатрии.
Рентгенологический метод оказывает весьма существенную помощь при оценке функциональной способности системы дыхания. Для этой цели используется наиболее информативный метод пневмополиграфии (РППГ) [Амосов И. С., 1961 ]. Физиологичность,
простота и доступность делают его тем ранним специальным, уточняющим методом, к которому обращаются клиницисты при необходимости дать первую объективную оценку состояния функциональных нарушений по общеклиническим данным.
РППГ заключается в совмещении двух снимков, выполненных в завершенные противоположные фазы дыхания на одной пленке с помощью рентгенологического растра шахматного типа, последний изготовлен из свинцовых квадратов размером 2x2 см. РППГ позволяет дать качественную и количественную характеристику респираторной активности легочной ткани, ее воздухонаполнения и распределения, т. е. провести денситометрический анализ.
Планиметрическая оценка дает представление о площадях легких и средостения на вдохе и выдохе, об амплитуде подвижности ребер, диафрагмы, позволяет оценить функциональное состояние дыхательной мускулатуры, определить коэффициент респираторного расширения (КРР), жизненную емкость легких (ЖЕЛ), а также, пользуясь коэффициентом пересчета, — дополнительный и резервный дыхательный воздух. Таким образом, РППГ дает не только качественную, но и объективную количественную характеристику функциональной способности системы дыхания. Проведение РППГ не утомляет больного, а лучевая нагрузка не превышает допустимых доз.
При туберкулезе органов дыхания РППГ дает возможность оп
80
ределить закономерности функциональных нарушений в зависимости от генеза туберкулезного процесса, давности заболевания, про-
тяженности поражения, уровня и характера поражения легочных структур, а также от наличия сопутствующих заболеваний (сахарный диабет и др.) [Гапонько Г. А., 1987, 1990]. У больных туберкулезом, по данным РППГ, отмечается неравномерность воздухонаполнения,
проявляющаяся в виде участков гиповентиляции, эмфиземы, пара-
доксальной вентиляции, «мраморности» квадратов вдоха и выдоха.
Это обусловлено определенным рентгеноморфологическим субстра
том, выявляемым классическим рентгенологическим исследованием.
В ряде случаев РППГ может уточнить протяженность видимых
рентгеноморд:
логических изменений.
РППГ является важным дополнительным способом рентгеноло-
гического исследования в предоперационном периоде у больных туберкулезом. На основании анализа результатов РППГ можно уточнить объем оперативного вмешательства, определить опера-
тивный доступ. Кроме того, можно изучить механизмы компен-
сации функциональных нарушений как в раннем послеоперационном периоде, так и в отдаленные сроки, и при необходимости корригировать терапию, решать вопросы функциональной реабилитации больных.
Основой рентгенодиагностики было и остается определение па-
томорд л. л
логического субстрата заболевания.
Опыт сравнительного изучения данных различных методов рент-
генологического исследования и рентгеноанатомических сопоставлений позволяет признать, что первостепенное значение в устанавливающей, качественной диагностике заболеваний органов дыхания принадлежит рентгенологическому исследованию — томографии, и возможности метода еще не исчерпаны. Эффективность метода исследования при туберкулезе легких все время повышается благодаря усовершенствованию техники, расширению диапазона послойного рентгенологического исследования и применению новых видов томографии. Помимо линейной томографии с продольным типом размазывания теней, успешно применяется томография с поперечным и косым направлением, в различных проекциях, при вертикальном положении больного, в положении грудного лордоза с изменением угла качания трубки (тонкие, толстые срезы), с выделением широкой зоны изображения (зонография), а также лучами повышенной жесткости, в различные фазы дыхания. Применение указанных способов томографии как дополняющих и уточняющих данные обычного рентгенологического исследования и обычной томографии вносит коренное улучшение в распознавание и дифференциальную диагностику легочных процессов.
Как правило, тактика рентгенологического исследования и применение соответствующих способов томографии должны определяться клиническими данными, индивидуальными особенностями пора
жения.
Говоря о практике выполнения томографических исследований и оценке их данных, следует признать, что томография не получила
81
еще должного распространения и признания не только среди вра чей-клиницистов, но и рентгенологов. Так, томография еще не
используется для диагностики и определения показаний к тому или иному методу лечения с той регулярностью, которая соответствовала бы диагностическим возможностям метода. Производятся и подвергаются анализу только те срезы, на которых есть наиболее убедительные изменения. Изучению же подлежит весь больной орган. При послойном рентгенологическом исследовании органов дыхания необходимо соблюдать классическое требование рентгенологии: иметь изображение исследуемого органа (патологического образования) в двух стандартных проекциях — прямой и боковой; по показаниям необходимо прибегать к исследованию в нестандартных проекциях — косой, в положении грудного лордоза, латеропозиции. Большое и все чаще предпочительное значение мы придаем обследованию больного в вертикальном положении, являющемся физиологичным для системы дыхания и кровообращения. При перемещении положения тела больного в пространстве изменяются вентиляция
и кровенаполнение легких в результате законов гравитации [Галу-
стан М. В., 1987]. При некоторых видах патологии (диссеминиро-
ванный туберкулез, вся группа диффузных гранулематозов легких)
влияние гравитации настолько видоизменяет рентгеносемиотику легочного рисунка, что затрудняет диагностику заболеваний легких и сердечно-сосудистой системы.
Вертикальное положение больного обеспечивает более полное и равномерное расправление легкого, особенно в нижних и дорсальных отделах, физиологическое воздухе- и кровенаполнение сосудов легкого, взаимоотношение топографоанатомических структур и органов грудной клетки. Анализ данных, полученных при послойном рентгенологическом исследовании в вертикальном положении больных, свидетельствует, что послойная рентгенография позволяет получить «физиологическое» представление о состоянии бронхиального дерева, крупных сосудов, органов средостения, корней легких. В ряде случаев только томография в вертикальном положении больного помогает отличить увеличение лимфатических узлов средостения, корней легких и бифуркационные от сосудистых изменений, а также не только выявить, но и точно локализовать скопления экссудата в плевральной
полости, установить их взаимосвязь с изменениями в оперированном легком [Александрова А. В., 1983; Дмитриева Л. И., 1987; Фомин Ю.А., 1990].
Томография в вертикальном положении больного, выполненная в косой проекции, при повороте тела больного вокруг фронтальной оси на 50—55° имеет большое значение для выявления изменений лимфатических узлов средостения, уточнения их величины, структуры, распространенности поражения, заинтересованности преимущественных групп. Уточняется связь этих узлов со стенкой трахеи и бронхов. В левой косой проекции получают прямое отображение лимфатические узлы артериального протока и парааортальные узлы. Именно при таком исследовании нередко удается отличить сосудистую патологию от изменений лимфатического аппарата сре
82
достения без использования более сложных способов томографии — КТ.
Опыт применения томографии и рентгеноанатомические сопоставления при различных формах туберкулеза легких свидетельствуют, что информативная ценность томографии в распознавании характера специфического процесса и в отличительной диагностике специфических и неспецифических изменений в легких повышается при использовании различных дополнительных, модифицированных способов послойной рентгенографии. Среди них основное значение имеют следующие.
Способ послойной рентгенографии с выделением различной толщины выделяемого слоя. При томографии толщина выделяемого слоя зависит от угла поворота трубки. Конструкция современных томографов обеспечивает диапазон ее вращения от 6° до 70°. Стандартным рабочим является угол качания 30—40°. При угле поворота трубки больше 50° выделяются «тонкие срезы», от 30° до 15° — «толстые срезы». Углы поворота 10° и ниже позволяют получить изображение широкой зоны легкого — «зонограммы». Этот способ томографии получил признание и широко используется при туберкулезе и других заболеваниях легких.
Анализ данных зонографического исследования показывает, что зонография является «промежуточным» методом между рентгенографией и томографией. В отличие от обычного рентгеновского снимка суммационный эффект при зонографии значительно меньше: а) в силу устранения костных структур, мягких тканей; б) выделение в слое части легкого, его зоны. В то же время при зонографии из-за большей толщины выделяемого слоя теряется плоскость изображения, чему способствует возрастание глубины резкости, поскольку с использованием острого фокуса уменьшается полутень, являющаяся следствием геометрической нерезкости.
На зонограмме большее число выявляемых структур и их взаиморасположение по отношению друг к другу на разных глубинах и плоскостях дает изображение, сходное с объемным [Дынник И. Б., 1972], Объемный эффект усиливается при зонографии с прямым увеличением изображения. По этой же причине на зонограмме не получается конгломератности изображения легочных структур и патологических изменений. Более достоверное отображение находят мелкие очаги, каверны, полости распада, так как они в полном «объеме» входят в выделяемый слой. В то же время уточняется структура более крупных конгломерирующихся очаговых теней.
На зонограммах можно проследить ход сосудов до VII—VIII порядка, а при томографии — только до IV—V порядка.
Вследствие большей толщины выдялемого слоя на зонограммах устанавливается топографическая взаимосвязь патологических образований с бронхососудистыми пучками сегментов, с корнем легкого. Повышается вероятность изображения «областей интереса», так как уменьшается вероятность непопадания в интересующий слой. Практически не получается так называемых неавторитетных снимков. Зонография способствует стандартизации исследования,
83
позволяет иногда отказываться от дополнительных проекций и от малооправдывающей себя симультанной томографии.
«Тонкие срезы» томограмм позволяют получить более четкое структурное отображение стенок каверны, округлых образований, очагов, туберкулом, кист, опухолей, выявить эмфизематозные буллы и провести их дифференциальный диагноз с тонкостенными кавернами. Однако отображение структурных элементов легочного рисунка при этом в значительной мере теряется. Для изучения легочного рисунка, а именно его сосудистого компонента, лучше использовать «толстые срезы» томограмм, получаемые при угле качания трубки 15—30°.
При туберкулезе легких успешно используется томография (зо-нография) с разным направлением (относительно продольной оси тела обследуемого) размазывания теней, находящихся вне исследуемого слоя (зоны).
Проведенное сравнительное изучение данных продольного, поперечного и косого типов размазывания теней, находящихся вне исследуемого слоя, позволило прийти к следующим важным для
практики выводам.
1. Применение поперечного типа размазывания теней является оптимальным для получения изображения и соответственно патологических изменений, трахеобронхиального дерева и области корней легких.
2. Вследствие преимущественной локализации специфических изменений в верхних и дорсальных отделах легких, прикрытых на обзорных снимках и томограммах в боковой проекции массивными тенями плечевого скелета позвоночника и средостения, при производстве послойных рентгенограмм в боковой проекции методом выбора является поперечное размазывание, так как только оно позволяет устранить мешающие тени указанных тканей. При этом «раскрываются» дорсальные отделы и купол легкого. Более достоверно (а иногда дополнительно) получают отображение патологические
изменения, расположенные в этих зонах.
Для выполнения томограмм (зонограмм) этим способом необходимо лишь иметь приставной столик для укладки больного поперек (или косо) томографического стола.
Томография в положении грудного лордоза может быть использована для уточнения изменений, локализующихся в I—II сегменте легкого. Для выполнения ее под спину больного подкладывают
треугольную плоскость из пенопласта (или другого рентгенотрица-тельного материала), угол которой в 25—30° находится на уровне
углов лопаток, а широкое основание — на уровне поясницы. Руки
поднимаются за голову. Такая укладка способствует веерообразной
передислокации относительно друг друга топографоанатомических структур I—II—III сегмента и уменьшает суперпозицию теней. Лучше дифференцируются интерстициальные изменения, уточняется структура очаговых и конгломератных образований; метод нередко способствует выявлению мелких каверн или полостей распада, булл [Гапонько Г. А., 1973]. Срезы томограмм определяют как и при
84
стандартном исследовании в прямой проекции. Недостатком этого способа исследования является невозможность его использования у лиц пожилого возраста. Томография в положении грудного лордоза часто сочетается с увеличением изображения. При томографии с прямым (геометрическим) увеличением изображения изменяется фокусное расстояние трубка — объект — пленка. Для этого каретку кассетодержателя опускают вниз параллельно плоскости стола на расстояние 34 см, а фокус трубки перемещают на высоту 66 см. Такие параметры дают наиболее оптимальный коэффициент увеличения — 1,5.
Послойное исследование с прямым увеличением изображения позволяет детализировать не только структуры фокусных, конгломератных и полостных образований, но, что очень важно при туберкулезном поражении, анализировать элементы дренажной системы, взаимосвязь этой системы с корнем, с плевральными оболочками [Погодаева Н. П., 1975]. Уточняются состояние бронхов среднего и крупного калибра, симптомы вовлечения их в туберкулезный процесс, структура лимфатических узлов. Томографию можно производить в прямой и боковой проекции, глубина срезов соответствует таковой при стандартных исследованиях.
Томографию лучами повышенной жесткости (напряжение на трубке повышается на 15—20 кВ от стандартных условий) применяются для исследования трахеобронхиального слоя при наличии фиброзного медиастинита, при массивном уплотнении легочной ткани, обусловленном плевропневмоциррозом, ателектазом (дистелек-тазом), а также после оперативных вмешательств, торакопластики различной протяженности, формирования фиброторакса.
При обследовании больных туберкулезом органов дыхания в ряде случаев для уточненной диагностики используют рентгеноконтрастные способы исследования: бронхографию (томо-бронхографию), фистулографию, ангиопульмонографию, плеврографию. Для проведения такого исследования применяют в основном водорастворимые контрастные вещества. Рентгеноконтрастные исс
ледования производятся, как правило, в двух взаимно перпендикулярных проекциях. Бронхография может быть общей или выполняться направленно (селективно). Этот способ помогает уточнить топографию и состояние бронхиального дерева до деления IV—V
порядка, выявить их деформацию в виде сужения, расширения или
ампутацию. Уточняется наличие полостных образований и связь их
с дренажными бронхами. Сочетание с томографией значительно
повышает информативность оценки мо
шея
логического субстрата из-
менений.
Фистулография и плеврография в сочетании с томографией применяются в хирургической клинике при возникновении осложнений в послеоперационном периоде после различного объема резекции легких (бронхоторакальный, бронхоплевроторакальный свищ, остаточная плевральная полость, бронхо- и плевропищеводный свищ).
Разрабатываются теоретические и практические обоснования для
использования в пульмонологии методики контрастирования лим-
85
фатической системы легких — лимфографии. Для успешного лечения туберкулезного процесса очень важно оценить функцио-
нальное и
мо
логическое состояние лимфатических сосудов глу-
бокой и поверхностной сети легких. Иногда такие данные могут
служить «ключом» в дифференциальной диагностике.
Ангиопульмонография в клинике туберкулеза наиболь-
шее значение имеет при так называемом разрушенном легком, фиброзно-кавернозном и цирротическом туберкулезе. Ее применяют
для уточнения мо
логии и функции сосудов малого круга, вы
явления артериовенозных аневризм, варикозного расширения легочных вен и бронхиальных артерий, определения источника кро
вохарканья.
Учитывая быструю смену фаз при рентгеноконтрастных иссле
дованиях, их нередко сочетают с видеомагнитной записью или с киносъемкой — рентгенокинематографией. Это дает воз-
можность изучить характер не только морфологических, но и функ-
циональных изменений бронхов, сосудов легких.
Рентгенологическое исследование с использованием в виде конт
растного вещества воздуха (пневмомедиастинография) производится для диагностики поражений средостения (опухоли, кисты) или для уточнения отношения патологического образования к легочной ткани, грудной клетке, диафрагме (диагностический пневмоторакс).
К принципиально новым видам получения и обработки изображения относится рентгеновская компьютерная томография (КТ). Аппарат работает по принципу сканирования как аксиальный томограф и производит поперечные срезы. Полученный массив информации, состоящий из суммы коэффициентов поглощения лучей тканями, улавливается детекторами, поступает в систему сбора данных, оцифровывается и затем обрабатывается быстрым процессором методом обратных проекций. Все полученные в числовом виде поперечные изображения поступают на «основную» матрицу компьютера. Обработанное для каждой точки среза абстрактное число переводится в условную шкалу поглощения (шкала Хаунсфилда) и подается на графический дисплей в виде черно-белого изображения с большой градацией серой шкалы (от +1000 — плотность компактного вещества кости, до —1000 — плотность воздуха). Все ткани
организма имеют условные денситометрические показатели, лежащие в границах этой шкалы (для легких на КТ Somotom DR-2 она равна 860± 35Н) [Hiekei Н. G., 1987].
В диагностике заболеваний органов дыхания КТ применяется для оценки субплевральных изменений, плевральных поражений при легочных процессах, первичных поражений плевры, а также для выявления скрытых эмфизематозно-буллезных образований. Иногда с помощью КТ можно обнаружить интерстициальные и паренхиматозные диффузные или локальные изменения, не получившие отображения на обычных рентгенограммах. При уточнении медиастинальных изменений, определении топографии различных патологических образований и выяснении их взаимосвязи с соседними органами КТ превосходит все другие методы исследования.
86
Вместе с тем структуры корня легкого вследствие особенностей их анатомического строения более достоверно отображаются при обычной томографии.
При КТ 3—4-го поколения, как и на обычной рентгенограмме, выявляются главным образом сосудистые структуры паренхимы легкого. КТ 5-го поколения с принципиально новым мощным источ-
ником рентгеновского излучения позволяет дать оценку тонким
изменениям паренхимы на уровне дольковых и внутридольковых
структур. Получение срезов по спирали (Slipring-эффект) дает трехмерное объемное изображение органа и приближает его изучение
к реальному морфофункциональному состоянию.
Принципиально новым методом лучевой диагностики является магнитно-резонансная компьютерная томография (МРТ). Обработка изображения такая же, как и при КТ. Однако изображение получается при воздействии на пациента радиочастот
ных импульсов в постоянном магнитном поле. В настоящее время в клинической практике используются МРТ со средне- и высоконапряженными магнитными полями мощностью соответственно в 0,3—0,5 и 1,5—2 Т.
Важным достоинством МРТ является возможность получать срезы не только в аксиальной, но и во фронтальной и сагиттальной плоскостях. В настоящее время МРТ не имеет преимуществ перед КТ при исследовании системы дыхания. С помощью МРТ можно
проводить спектроскопию тканей.
В ряд ведущих способов визуализации в клинике туберкулеза выдвинулось ультразвуковое исследование. И хотя диа-
пазон применения его невелик, в ряде случаев он с успехом дополняет, а иногда и заменяет рентгенологическое обследование.
Этот метод эффективен при проведении дифференциального диаг-
ноза округлых образований, расположенных субплеврально, при определении жидкости в плевральной полости, наблюдении за формированием фиброторакса в послеоперационном периоде. Применение его ограничивается небольшой глубиной проникновения луча
и наличием «немых зон», обусловленных костными структурами.
Функциональное состояние органов дыхания, их вентиляцию и кровенаполнение можно изучать радионуклидными методами. Основным прибором радионуклидной диагностики стала гамма-камера, а ведущим методом визуализации — гамма-сцинтиграфия. С по-
мощью последней исследуют функциональную активность органа и выявляют в нем закономерности распределения РФП.
Относительно новым способом радионуклидного исследования является эмиссионная КТ. Этот метод позволяет
более точно, чем обычная сцинтиграфия, определить равномерность распределения РФП в разных слоях исследуемого органа.
В рамках лучевой диагностики складывается новое перспективное направление — клиническая радиологическая биохимия. Она позволяет провести лучевое исследование процессов накопления
и перемещения веществ в организме человека.
В процессе развития находится метод термографии, который
87
регистрирует естественное тепловое излучение поверхности тела человека. Приборы для регистрации радиоизлучения человека в миллиметровом и дециметровом диапазоне волн позволяет определить температуру образований, глубоко расположенных в органе, что может расширить диапазон применения метода, в том числе и в пульмонологии.
В связи с наличием большого арсенала средств лучевой диагностики нередко возникают серьезные трудности при выборе наиболее информативных лучевых исследований. Их рациональное использование возможно лишь при условии алгоритмического подхода, наличия тесного контакта больного с лечащим врачом и четкой регламентации показаний к назначению адекватных данных клинической картины лучевых методов. Только такой подход позволит отойти от принципа последовательного применения методов и способов лучевой диагностики от «простого к сложному» и руководствоваться законом целенаправленного использования лучших и наиболее диагностически информативных методов. г
4.3. РАДИОНУКЛИДНЫЕ МЕТОДЫ
Для определения функционального состояния легких во фтизиатрии и пульмонологии широко применяются радионуклидные методы исследования — комплексная пневмосцинтиграфия. Она состоит из динамической сцинтиграфии, включая исследования с газообразным и водным раствором 133Хе, а также статической сцинтиграфии, включая исследования регионарного кровотока легких, основанные на микроэмболизации капилляров макроагрегированными частицами человеческой сыворотки (МАА), меченных "“Тс, 1311, 113mIn. Эти методы позволяют детально изучить функциональное состояние регионарного кровотока и вентиляции легких у больных с различной легочной патологией.
Радионуклидная пнемосцинтиграфия применяется в основном у взрослых пациентов для выявления функциональных нарушений регионарного капиллярного кровотока и вентиляции легких. Она необходима: 1) для контроля за эффективностью антибактериальной и патогенетической терапии; 2) для определения объема хирургического лечения; 3) для определения степени оперативного риска; 4) для определения восстановления функционального состояния легочной ткани в послеоперационном периоде и т. д. Радионуклидные исследования противопоказаны лицам с кровохарканьем, кровотечением из легких, больным с высокой температурой тела и беременным женщинам.
При исследовании регионарного капиллярного кровотока легких с помощью МАА 1311 (перфузионно) вводимая активность составляет 250—300 мкКи (9—12 МБк) из расчета 4—5 мкКи на 1 кг массы тела. Однако метод МАА 1331 имеет недостатки, заключающиеся в обязательной предварительной блокаде щитовидной железы йодистыми препаратами (по одной десертной ложке 3 раза в день за 2 дня до введения РФП и после него). Лучевая нагрузка на легкие 88
при введении МАА 1311 составляет, по данным Н. Wagner и соавт. (1965), от 0,1 до 0,3 рад.
В последнее время в медицинской практике чаще применяют короткоживущие и радионуклидные элементы "тТс и 113mIn, получаемые из генератора. В частности, "тТс получают из молибденового
генератора в виде элюата пертехнетата натрия, используемого в качестве самостоятельного фармацевтического препарата и для приготовления специальных реагентов. Отфасованная удельная активность "“Тс с помощью шприца переносится в специальный реагент с микросферами альбумина — набор «ТСК-8». Флакон с набором реагента "“Те встряхивают 2—3 раза (в руках), и взвесь готова к применению. Препарат вводят внутривенно из расчета 6—8 мкКи на 1 кг массы тела. Энергия излучения гамма-квантов равна 140 кэВ, период полураспада составляет 6 ч.
Вентиляционная сцинтиграфия легких с применением 133Хе («по-
люсным методом») основана на ингаляционном введении радиоак-
тивного газа с помощью резинового загубника, подключенного к
спирографу СГ-1м или Метотесту I-II, т. е. создается замкнутая система «пациент — спирограф». Этим методом определяется состояние проходимости трахеобронхиальных путей до альвеол легких, изучается время заполнения, смешивания и полувыведения газообразного 133Хе из трахеобронхиального пространства. Радиоактивный 133Хе поставляется во флаконе, упакован в свинцовый контейнер и состоит из газообразного и водного раствора. Он не имеет цвета, вкуса, запаха, в 17г раза тяжелее воздуха, мало растворим в воде.
Энергия излучения гамма-квантов равна 80 кэВ, период полурас-
пада — 5,3 дня.
Пневмосцинтиграфия с использованием водного раствора 133Хе
основана на внутривенном введении РФП на глубоком вдохе паци-
ента. Данная методика характеризует скорость «диффундирования»,
или проникновения, РФП через мембраны капиллярного русла в альвеолы легкого, бронхи и далее в трахею.
Для осуществления радионуклидной пневмосцинтиграфии у больных туберкулезом легких применяют радиометрические приборы с подвижным (сканеры) и неподвижным (сцинтилляционная гамма-камера) детектором. Наиболее известные модели сканеров отечественного и зарубежного производства («ГТ-1» и «ГТ-2» «Магноска-нер-500» фирмы «Пиккер», «Планисканер-СС-16-ДЗ-90» фирмы «Делтроникс»; «Мемодат-М-8100» фирмы «Гамма» и др.), как правило, имеют скорость сканирования 2—50 мм/с. С помощью сканеров получают штриховое изображение органа на писчей бумаге в масштабе 1:1, время исследования в одной проекции составляет 20—25
мин. От сканера существенно отличается сцинтилляционная гамма-камера типа «Энжера». Последняя снабжена системами видеозаписи
и компьютерного анализа, с помощью которых можно получить распределение РФП в легких, выбрать зоны «интереса», дать динамическую характеристику визуализации органа в виде графического изображения. Распределение сигналов на экране осциллоскопа регистрируется на поляроидной пленке в масштабе 1:5 или с по
89
мощью «стоп»-камеры на роликовую фотопленку 36 мм в уменьшенном масштабе. Таким образом, сцинтилляционная гамма-камера является универсальным прибором, позволяющим получить данные не только статического, но и динамического распределения РФП в организме больного. Исследование легких на гамма-камере производится полипозиционно в зависимости от предложенной программы и выбора положения пациента (лежа, сидя или стоя). Время ис
следования зависит от поставленных клиницистом задач и составляет
от 1 до 10—15 мин.
В большинстве медицинских учреждений нашей страны для изу-
чения альвеолярной вентиляции и «диффузии газов» с использова
нием 133Хе в регионарных зонах легких применяется отечественная
8-детекторная установка «Ксенон-1» или «УР-1-8». Одной из по
следних моделей многодетекторных систем является сцинтилляционная установка «Кефут В-1-1200» фирмы «Медивалмет» (Финляндия). Она имеет 16 детекторов — 8 сзади и 8 спереди. В комплект прибора входят спирограф емкостью 80 л и медицинский компьютер «НОВА-2», исключающий необходимость ручной обработки получаемых данных и тем самым повышающий надежность и объективность информации.
Интерпретация полученных результатов. Капиллярный кровоток
и вентиляцию легких оценивают путем как получения аналогового изображения органа, так и количественной регистрации излучения в каждом легком в отдельности и выборных зонах «интереса». Результаты радионуклидных изменений, полученных на сканограммах и поляроидах, выражаются в виде трех основных характеристик — ограниченные, выраженные и резко выраженные. Относительное содержание РФП в регионах каждого легкого определяют по специальной программе. Каждое легкое после установления его границ симметрично делится на три зоны, в каждой из которых определяется число импульсов и относительная активность по отношению ко всем 6 зонам. Суммируя три зоны каждого легкого, определяют активность органа, можно вычислить процентный «вклад» импульсов в каждой зоне легкого. Все цифровые данные получают в передней и задней проекциях, в виде их среднеарифметического значения. При необходимости световым карандашом выбирают «зоны интереса» и обрабатывают их.
Сцинтиграфическое описание легких. Изображения легких, полученные на поляроидах и сканограммах, имеют ряд особенностей и общих характеристик. На передней проекции сцинтиграммы интенсивность включения РФП равномерно понижается к периферии. В области верхушек обоих легких наблюдается некоторое снижение накопления РФП. Между обоими легкими имеется зона арадиоактивности, обра
зуемая средостением и располагающимися в нем крупными сосудами, трахеей и пищеводом. Левое легкое несколько сужено, преимущественно в средненижних отделах за счет суперпозиции сердца. В задней проекции оба легких выглядят практически одинаковыми. Размер их заметно больше, чем в передней проекции, за счет визуализации легочной ткани, находящейся в заднем диафрагмальном синусе. Видна
90
зона арадиоактивности, образуемая за счет позвоночника и прилегающих к ним мышц спины. В передней проекции лучше определяются верхние, а в задней — нижние зоны легких.
На сцинтиграммах боковой проекции легких отмечается снижение интенсивности включения РФП в области верхушек из-за удаленности их от детектора во время исследования. В левом легком в данной проекции в нижнепереднем отделе выявляется более или менее выраженный краевой дефект за счет тени сердца. Иногда на границе верхней и средней третей легких наблюдается круглый дефект накопления, возникающий в результате проекции корня с его сосудами и бронхами. Чаще это наблюдается у пациентов астенического типа сложения.
В задних косых проекциях лучше определяются заднемедиальные и переднебоковые отделы легких, которые в прямых проекциях накладываются и не позволяют более точно выявить положение
очагов поражения.
Степень и выраженность функциональных нарушений вентиляции и кровотока легких зависят от распространенности патологи-
ческого процесса, давности его существования и имеющихся пато-
логических изменений. В результате этого варьирует и сцин-
мо
тиграфическая картина, нередко превышающая рентгенологически
определяемые изменения в легких.
4.4. УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА
Ультразвуковое исследование (УЗИ) относится к одному из сравнительно новых информативных методов диагностики различных заболеваний. Возможность получения ценной информации бескровным путем, безопасность, возможность многократно обследовать больного, высокая разрешающая способность ультразвуковой аппаратуры, необременительность исследования для больного, относительная частота и быстрота исследования привели к быстрому внедрению метода в различные области медицины, в том числе и во фтизиатрию. В настоящее время интенсивно разрабатываются методические аспекты эхографии при различных поражениях органов у больных туберкулезом.
При УЗИ-диагностике изучают специфические проявления неизмененных и патологически измененных органов и тканей с помощью упругих механических волн, которые не оказывают ионизирующего воздействия на организм больного. Этот метод во фтизиатрии применяют для:
— выявления плевритов и эмпием плевры, коррекции лечения;
— дифференциальной диагностики новообразований от неопухолевых изменений, расположенных субплеврально и в паренхиматозных органах;
— оценки эффективности хирургического лечения при пульмон-эктомии в организации фиброторакса;
— топической диагностики туберкулеза при внелегочных поражениях;
91
— диагностики поражений сердца и перикарда;
— обеспечения безопасности диагностических и лечебных пункций;
— метрологического обеспечения визуально неконтролируемых методов лечения;
— оценки состояния различных органов и систем у больных туберкулезом.
Немаловажное значение для эффективности ультразвуковой диагностики имеют методологические подходы к анализу результатов исследования и формированию заключения.
Патологические процессы в плевре и плевральной полости обычно вторичные, и симптоматика плеврального выпота является ведущей в клинической картине заболевания. Вместе с тем в ряде случаев широко применяющийся рентгенологический метод оказывается неэффективным. Для диагностики осумкованного выпота, при небольшом количестве свободной жидкости в плевральной полости лучшим методом диагностики является эхография. Эхография проводится в положении больного сидя, исследуются симметричные зоны при продольном, поперечном и косонаправленных сечениях. Предпочтение необходимо отдавать приборам, работающим в реальном масштабе времени. При УЗИ у больных с экссудативным плевритом в плевральной полости выявляется жидкость без тканевых включений, что на эхограмме визуализируется как эхонегативная зона. В зависимости от количества жидкости эта зона может быть различной. Данный метод позволяет обнаруживать небольшое количество плевральной жидкости (до 10 мл). Толщина плевральных листков зависит от стадии заболевания.
Эмпиема плевры при УЗИ в зависимости от сроков имеет свои эхографические признаки: для субтотальной эмпиемы давностью до 1 года — наличие большого количества жидкости, которая на эхограмме представлена как эхонегативное пространство, ограниченное с одной стороны легкими и висцеральной плеврой, а с другой стороны — париетальной плеврой, диафрагмой и верхней поверхностью печени или селезенки. При УЗИ в зоне эхонегативного пространства визуализируются сигналы средней амплитуды, которые расценены как тканевые включения. По сравнению с эхограммой, полученной при диагностике экссудативного плеврита, УЗИ-картина до верификации диагноза на цитологическом уровне позволяет думать о присоединении бактериальной флоры.
При давности эмпиемы до 3 лет субтотальная эмпиема плевры на эхограмме отличается от ограниченной эмпиемы только количеством содержащейся в ней жидкости. В остальном характер эмпиемы плевры по данным УЗИ совпадает: толщина стенки эмпиемы составляет 0,2—0,7 см, отмечается нарастание тканевых включений. При визуализации на эхограмме наблюдается расслоение как висцерального, так и париетального листков плевры, ограничивающих полость эмпиемы, причем наружный слой более акустически плотный, чем внутренний. При давности эмпиемы более 3 лет характерно наличие небольшой эхонегативной зоны плевральной полости, но
92
значительно утолщены плевральные листки, ограничивающие эмпиему (толщина 0,7—2 см). Отмечается большое число высокоамплитудных эхосигналов как от стенок эмпиемы, так и от ее содержимого. Такую эхографическую картину расценивали как эмпиему, содержащую казеозные массы.
Описанные эхографические картины эмпиемы плевры в зависимости от давности процесса не являются постоянными. У одного и того же больного на разных уровнях плевральной полости можно одновременно наблюдать все три описанных выше типа.
Применение ультразвукового контроля за состоянием гемиторакса после пульмонэктомии позволяет своевременно корригировать накопление жидкости в полости и предупреждать возможные осложнения.
При ультразвуковом сканировании оперированного гемиторакса обнаруживалось 4 типа картин. Первый тип: визуализировались обширные зоны свободной жидкости с регистрацией фибриновых отложений на стенках полости в виде «ворсинок», одним концом
плавающих в жидкости, с четкими контурами зон и границами средостения. Второй тип: обнаруживались осумкованные участки жидкости различной величины, ячеистой структуры. Третий тип: на фоне участков сформированного фиброза (фиброторакса) определялись участки свободной жидкости без наличия ячеистой структуры. Четвертый тип представлял собой эхогенные зоны различной плотности, соответствующие солидной структуре без четких границ
с органами средостения.
Такие различные типы эхограмм после пульмонэктомии позволяют заключить, что применение УЗИ полости оперированного гемиторакса дает качественно новую информацию, позволяющую, с одной стороны, прослеживать этапы эволюции фиброторакса, а с другой — проводить пункции полости гемиторакса под эхографи
ческим контролем.
Дифференциальная диагностика субплеврально расположенных округлых образований легких в современных условиях представляет определенные трудности в связи с патоморфозом туберкулеза и неспецифических заболеваний легких. Однако УЗИ в комплексе с
другими методами позволяет установить истинную природу округлых образований легких и сравнительно рано ставить вопрос о хирургическом вмешательстве. Наиболее часто встречаются круглые туберкулезные фокусы (туберкулемы и круглые инфильтраты), периферический рак и эхинококковые кисты.
Субплеврально расположенный круглый инфильтрат на эхограмме выглядит как неоднородная эхоструктура, образованная различными по плотности включениями, между которыми регистрируются эхонегативные участки — просветы сосудов. Такой инфильтрат имеет неправильные форму и очертания. Туберкулема на эхограмме имеет более округлую и правильную форму. Структура ее неоднородна из-за множественных включений, туберкулема имеет четко выраженную капсулу, что и является отличительным признаком этой формы туберкулеза. Периферический рак выглядит как округ
93
лое неправильной формы образование с неоднородной структурой. Характерным признаком являются способность поглощать ультразвук тканью этого образования и появление эхонегативной тени за ним. Эхинококкоз легких характеризуется как эхонегативное образование округлой или овальной формы с четкими и ровными контурами, тонкими стенками, с дистальным эффектом усиления. Структура неоднородна, но при наличии дочерних клеток определяются эхографически плотные включения.
Туберкулез печени может протекать по типу диффузного поражения печени и как очаговое поражение. В свою очередь очаговые поражения сопровождаются образованием солитарных и множественных туберкулем (фокального или узловатого очага или очагов), окруженных фиброзной капсулой. При возникновении некроза возможно формирование каверны. Изолированные туберкулемы печени могут долго оставаться бессимптомными. УЗИ печени у бальных туберкулезом значительно расширило прижизненную диагностику поражений печени, явилось методом контроля при пункционной биопсии для верификации диагноза на цитологическом уровне. Эхографическими критериями нормального состояния печени являются: четкий контур границ, за исключением анатомических изгибов; острые краевые углы печени; гомогенная паренхима с низкоамплитудными эхосигналами; визуализация воротной вены, печеночных вен и их впадение в нижнюю полую вену; отсутствие эффекта поглощения ультразвука паренхимой печени; эхографическая плотность паренхимы не должна превышать 19 усл. ед. по гистограмме.
Диффузные поражения печени характеризуются ультразвуковыми критериями: увеличение органа при сохранении четких контуров границ; сглаживание углов печени; изменение эхогенности паренхимы печени в «серой шкале» от светло-серого до черного, чаще определяется большим количеством импульсов различной амплитуды и формы (3-й тип при «А»-сканировании по И. В. Дворяковскому); визуализация утолщенных стенок ветвей воротной и печеночных вен, что на эхограмме выявляется как усиление сигналов от стенок сосудов в виде поперечной исчерченности; зависимость эффекта поглощения ультразвука от степени выраженности изменений в паренхиме; эхографическая плотность паренхимы 20—26 усл. ед. по гистограмме.
Очаговые поражения печени характеризуются ультразвуковыми критериями: нарушение эхоструктуры паренхимы печени из-за округлых образований различного диаметра с четкими границами и разной степени эхогенности в зависимости от стадии заболевания; гистографическая плотность образований — очагового туберкулеза (20—26 усл. ед.), туберкулемы (28—30 усл. ед.), каверны (13—15 усл. ед.), кальцината (более 32 усл. ед.); усиление эхосигнала от места расположения каверны или туберкулемы с распадом, появление дорожки из резко ослабленных эхосигналов за кальцинатом.
Широкое распространение получила ультразвуковая диагностика изменений сердца и перикарда у больных туберкулезом. Эхокардиография позволяет определить размеры и взаимоположение сердеч-
94
ных структур и камер, исследовать кинетику отдельных элементов
сердца, изучить морд
логическую структуру элементов клапанного
аппарата, миокарда и перикарда. Ультразвуковая диагностика по-
ражения сердца не только используется для распознавания отдельных нозологических форм, но и способствует уточнению степени выраженности патологического процесса. Эхографически удается выявить даже минимальное количество выпота в полости перикарда по сепарации эхосигналов от эпикарда и перикарда с определением эхосвободного пространства между ними в задней и передней камерах перикарда. При значительных выпотах отмечается избыточная экскурсия задней стенки левого желудочка и межжелудочковой пере
городки.
В последние годы, несмотря на определенные трудности, ультразвуковые методы (эхокардиография и допплер-эхокардиография) широко применяются для диагностики легочной гипертензии. К эхокардиографическим признакам легочной гипертензии относятся гипертрофия стенки правого желудочка, дилатация правых отделов сердца, гипертрофия межжелудочковой перегородки и ее парадок
сальное движение, изменения со стороны клапана легочной артерии, нарушение потоков в области клапана легочной артерии и трикуспидального клапана. Ультразвуковой метод позволяет вычислить показатели центральной гемодинамики, индексы насосной и сократительной функции миокарда, коэффициенты взаимоотношения ряда
структур сердца.
4.5. ТУБЕРКУЛИНОДИАГНОСТИКА
Туберкулинодиагностика основана на определении туберкулиновой аллергии — повышенной чувствительности организма к туберкулину, наступившей вследствие заражения вирулентными микобактериями туберкулеза или вакцинации БЦЖ. Туберкулиновая аллергия относится к феномену повышенной чувствительности замедленного типа (ПЧЗТ) и является иммунологически специфичной.
Туберкулиновые пробы используются для диагностики и дифференциальной диагностики туберкулеза, определения инфицированное™ и первичного инфицирования микобактериями туберкулеза, а также отбора лиц для ревакцинации БЦЖ (особенно среди детей и подростков).
Патоморфологически туберкулиновая реакция в первые 24 ч характеризуется отеком, экссудацией всех слоев кожи, а в более поздние сроки (72 ч) — мононуклеарной реакцией с большим числом гистиоцитов. При гиперергических реакциях с выраженным некрозом ткани обнаруживаются элементы специфического воспаления с эпителиоидными клетками.
Туберкулин был впервые получен R. Koch в 1890 г. Старый туберкулин Коха — АТК (Alt Tuberculin Koch) представляет собой фильтрат 6—9-недельной культуры микобактерий туберкулеза на мясопептонном 5% глицериновом бульоне, простерилизованной текучим паром в течение 1 ч и сгущенной до 1/ю объема при 90°С.
95
В качестве консерванта применяют изотонический раствор NaCl с 0,25% карболовой кислотой. Туберкулин изготовляется из микобактерий человеческого, бычьего или птичьего типов, а также штамма БЦЖ.
Специфически активное начало АТК составляет лишь 1% всей смеси, а остальные 99% — это инертные вещества [Long Е., 1934]. Более специфичным препаратом является очищенный от белков среды сухой туберкулин — PPD (Purified Protein Derivative). Такой тип препарата впервые был получен F. Seibert в 1934 г., а в 1939 г. М. А. Линниковой в Ленинградском институте вакцин и сывороток.
Отечественный очищенный туберкулин в стандартном разведении с добавлением в качестве стабилизатора 0,005% Твин-80, а в качестве консерванта — 0,01% хинозола представляет собой прозрачную бесцветную жидкость (допускается легкая опалесценция), приготовленную путем разведения очищенного порошка туберкулина в стабилизирующем растворителе. Очищенный порошок туберкулина готовят при ультрафильтрации или суперцентрифугировании с трихлоруксусной кислотой, обработке спиртом и эфиром фильтрата убитой нагреванием культуры микобактерий туберкулеза человеческого и бычьего типов. Препарат выпускается во флаконах емкостью 5 мл (50 доз) или в ампулах емкостью 3 мл (30 доз). В 0,1 мл содержится одна доза (2 ТЕ). Один флакон используется примерно для 25 проб Манту с 2 ТЕ, а одна ампула — для 15 проб. Срок годности препарата составляет 12 мес. Препарат хранят в темном месте при температуре от 0 до +4°С.
Существуют следующие туберкулиновые пробы: накожные (перкутанные) — Пирке, Моро, Петрушки, градуированная проба Грин-чара — Карпиловского, внутрикожные, подкожные, уколочная проба Гиффа. Наиболее широко применяются внутрикожная проба Манту и накожная градуированная проба Гринчара — Карпиловского или градуированная скарификационная проба в модификации Н. А. Шмелева (1952).
Ценным свойством туберкулина является его специфичность. Специфичность обусловлена тем, что белковые молекулы, содержащиеся в туберкулине, не обладают свойством полноценного антигена и не могут сенсибилизировать не инфицированный микобактериями туберкулеза организм и вызывать в нем образование антител. Поэтому при нанесении туберкулина на кожу или введении его внутрикожно (подкожно) человеку, не зараженному туберкулезом (не иммунизированному вакциной БЦЖ), туберкулин не вызывает реакции. Зараженный туберкулезом или вакцинированный БЦЖ организм в ответ на введение туберкулина может ответить реакцией: 1) местной — туберкулиновая реакция на месте введения; 2) общей — повышение температуры тела и общие функциональные расстройства (туберкулиновый шок); 3) очаговой — воспалительная реакция вокруг туберкулезных очагов.
Чувствительность организма человека, зараженного или больного туберкулезом, может быть различной: от резко выраженной (гипер-ергия) до отрицательной (анергия), когда организм не реагирует на 96
туберкулин. Интенсивность реакций на туберкулин зависит от массивности и вирулентности инфекции, чувствительности и реактивности организма. При этом определенное значение имеют доза туберкулина, метод и частота его повторного введения. Если туберкулин применяют в больших дозах и через короткие промежутки времени, чувствительность организма повышается. Под влиянием постепенно нарастающих доз туберкулина, применяемых через значительные промежутки времени, чаще происходят десенсибилизация и снижение туберкулиновой чувствительности.
Повышение чувствительности к туберкулину отмечается при бронхиальной астме, базедовой болезни, ревматизме, гриппе, бруцеллезе, обострении хронических болезней (тонзиллита, бронхита, гепатохолецистита и т. д.). При осложнениях после вакцинации туберкулиновые реакции усиливаются. Снижение или полное угасание чувствительности к туберкулину отмечается во время кори,
коклюша, скарлатины, малярии, при вирусном гепатите, раке, лимфогранулематозе, саркоидозе, микседеме, белковом голодании. Специфическая кожная аллергия может снижаться при применении антигистаминных препаратов, гормонов, витаминов А, С и D, специфических антибактериальных препаратов, а также после иммунизации против полиомиелита и кори [РабухинА. Е., 1976, и др.].
В весенние месяцы чувствительность к туберкулину повышается, а в осенние понижается. Для исключения влияния сезонности и других факторов на этот показатель при постановке туберкулиновых проб детям и подросткам с целью выявления виража туберкулиновых реакций и гиперчувствительности к туберкулину повторное исследование должно проводиться в одно и то же время и через 4—6 нед после проведенной иммунизации или после перенесенного заболевания.
В большинстве стран мира для массовых исследований используют пробу Манту с низкими концентрациями туберкулина (1, 2, 5 и 10 ТЕ). Применение более высоких концентраций (доз) нецелесообразно, так как определение инфицированных контингентов в странах, где проводится массовая иммунизация вакциной БЦЖ, затруднено наличием поствакцинальной аллергии.
В нашей стране при массовых обследованиях населения на туберкулез один раз в год применяют единую пробу Манту с 2 ТЕ с целью своевременного выявления первичного инфицирования детей и подростков. Последнее определяется по виражу туберкулиновых
реакций (переход ранее отрицательной в положительную или резкое
усиление предыдущей реакции). Указанную пробу применяют также
для обнаружения гиперергических реакций у детей, подростков и взрослых (везикулонекротические реакции с инфильтратом 17 мм и более) и отбора для ревакцинации БЦЖ неинфицированных туберкулезом лиц декретированного возраста. Проба Манту с 2 ТЕ позволяет в условиях массовой внутрикожной вакцинации БЦЖ
вполне надежно определить основные контингенты детей и подро-
стков с виражом реакций для проведения целенаправленных лечеб-
но-п
илактических мероприятии.
4—1213
97
Для правильной интерпретации положительных реакций Манту с 2 ТЕ с целью дифференциальной диагностики инфекционной и поствакцинальной аллергии у иммунизированных БЦЖ детей и подростков необходимо учитывать интенсивность положительной туберкулиновой реакции: число прививок БЦЖ, наличие и размер поствакцинальных рубчиков, срок, прошедший после прививки, наличие или отсутствие контакта с больным туберкулезом, наличие клинических признаков заболевания.
Формирование специальных бригад (две медицинские сестры и врач) для проведения массовой туберкулинодиагностики в детских коллективах (детские ясли, сады, школы) и ревакцинации БЦЖ в декретированных возрастных группах школьников возлагается на детские поликлиники, которые из имеющихся штатов поликлиник и детских учреждений специальным приказом выделяют медицинский персонал, а также утверждают график его работы в детских коллективах. «Неорганизованным» детям раннего и дошкольного возраста пробы Манту с 2 ТЕ ставят в детской поликлинике. Ежегодно туберкулинодиагностикой должно охватываться 95—100% детского и подросткового населения данного района (города, области, края и т. д.). В случае возникновения временных медицинских противопоказаний для постановки пробы Манту с 2 ТЕ, указанных в инструкции по применению туберкулиновых проб, все дети и подростки должны охватываться туберкулинодиагностикой после снятия временных противопоказаний.
Пробу Манту ставят строго асептически. В кожу средней трети внутренней поверхности предплечья вводят «однограммовым» (туберкулиновым) шприцем 0,1 мл препарата. Требуемое количество туберкулина набирают одноразовым шприцем с длинной иглой. Затем на шприц надевают другую тонкую короткую иглу. Для каждого обследуемого употребляют отдельные шприц и иглу. Постановку и оценку пробы Манту производит врач или специально обученная медицинская сестра под наблюдением врача. Результаты пробы Манту оценивают через 72 ч. Величину папулы измеряют при помощи прозрачной миллиметровой линейки. Регистрируют поперечный (по отношению к оси руки) диаметр папулы: при диаметре папулы от 0 до 1 мм реакция считается отрицательной, от 2 до 4 мм — сомнительной, от 5 мм и более — положительной. Гиперергическими у детей и подростков считают реакции с диаметром инфильтрата 17 мм и более, у взрослых — 21 мм и более, а также везикуло-некротические реакции независимо от размера инфильтрата с лимфангоитом или без него.
Частота виража туберкулиновых реакций и гиперергии у детей и подростков (до 17 лет) зависит от эпидемиологической ситуации по туберкулезу в том или ином районе, от качества иммунизации БЦЖ и туберкулинодиагностики, а также возраста детей. При качественно проводимых вакцинации и ревакцинации БЦЖ и туберкул инод иагностике первичное инфицирование (вираж) отмечается в среднем у 0,3—1,5%, а гиперергия — у 0,5—3,0% всех обследованных детей и подростков, у детей раннего возраста вираж
98
туберкулиновых реакций наблюдается в 0,05—0,3%, а гиперергия — в 0—0,25% случаев. Показатели первичного виража туберкулиновых реакций ориентировочные, так как их определяют по отношению не к числу неинфицированных, а к числу обследованных детей и
подростков.
Первичное инфицирование туберкулезом чаще наступает у детей, не имеющих или имеющих маленькие (2—3 мм) послепрививочные кожные знаки и у которых менее выражен прививочный иммунитет. Поэтому вираж туберкулиновых реакций в 85—90% случаев наступает у детей и подростков, имевших в предшествующем году отрицательную реакцию Манту с 2 ТЕ. Определению впервые положительных реакций у этих детей и подростков не мешает после-
вакцинная аллергия, и при систематическом ежегодном повторении
•SS
ы Манту с 2 ТЕ легко выявить переход отрицательной реакции
в положительную (папула 5 мм и более).
При качественно проведенных противотуберкулезных иммунизациях и туберкулинодиагностике процент отрицательно реагирующих детей и подростков может колебаться в среднем от 35 до 45.
У детей раннего и дошкольного возраста отрицательная реакция Манту с 2 ТЕ отмечается чаще (60—50%), чем у школьников (у 40—30%). Однако эти дети и подростки в 87—90% случаев реагируют на большие дозы туберкулина проявлением послевакционной
аллергии, что свидетельствует о сохранении у них постепенно ослабевающего прививочного иммунитета.
Первое сплошное обследование детей и подростков проводят в
1, 5 и 9 классах, т. е. перед очередной ревакцинацией БЦЖ, когда
у многих иммунизированных отмечается угасание или резкое ослабление послевакцинной аллергии. Второе обследование тех же детей и подростков по пробе Манту с 2 ТЕ осуществляют во 2, 6 и 10 классах в то же время года, что и первое.
К неинфицированным микобактериями туберкулеза детям и подросткам относятся: все лица с отрицательными реакциями Манту с 2 ТЕ; все лица, которым после установления отрицательной реакции в 1-й год обследования была проведена ревакцинация БЦЖ и во 2-й год обследования все сомнительные и положительные реакции у них расцениваются как проявление послевакцинной аллергии — лица, у которых на 2-м году обследования отмечалось ослабление реакции (уменьшение диаметра инфильтрата на 6 мм и более).
К инфицированным по пробе Манту с 2 ТЕ относятся лица, у которых при наблюдении в динамике: 1) стойко сохраняется реакция с инфильтратом 12 мм в диаметре и более; 2) отмечается усиление предыдущей сомнительной или положительной реакции — диаметр инфильтрата увеличивается на 6 мм и более (например, диаметр был 2 мм — стал 8 мм, был 3 мм — стал 9 мм, был 4 мм — стал 10 мм, был 5 мм — стал 11 мм, был 6 мм — стал 12 мм и т. д.); 3) отмечается усиление положительной реакции — увеличение диаметра инфильтрата менее чем на 6 мм, но с образованием инфильтрата, характерного для инфекционной аллергии (на-
4*
99
пример, диаметр был 8 мм — стал 12 мм, был 9 мм — стал 12 мм и более, был 10 мм — стал 12 мм и более и т. д.).
Особенностями послевакцинной аллергии являются: а) ее меньшая интенсивность по сравнению с инфекционной аллергией, наличие отрицательных, сомнительных и нерезко выраженных положительных внутрикожных реакций с диаметром инфильтрата до 11 мм (у 90,6% иммунизированных); только у 9,4% детей и подростков диаметр инфильтратов при постановке туберкулиновых реакций достигает 12—16 мм, что может имитировать инфекционную аллергию; гиперергические реакции (диаметр инфильтрата 17 мм и более) нехарактерны для поствакцинальной аллергии, а свойственны инфекционной; б) ослабление реакции при наблюдении в динамике, наибольшая интенсивность поствакцинальной аллергии отмечается в первые 1—Р/2 года после иммунизации, в дальнейшем — снижение ее интенсивности. Однако все эти признаки относительны, и в каждом отдельном случае вопрос о наличии послевакцинной или инфекционной аллергии должен решаться индивидуально.
Еще несколько десятков лет назад считалось, что неинфициро-ванные микобактериями туберкулеза лица, не обладая иммунитетом против туберкулеза, заболевают значительно чаще, чем инфицированные. В современных более благоприятных эпидемиологических условиях, наоборот, инфицированные лица заболевают туберкулезом в 2—4 раза чаще, чем неинфицированные. При этом среди всех инфицированных группой наибольшего риска являются люди с гиперчувствительностью к туберкулину — они заболевают туберкулезом в 2—7 раз чаще, чем лица со слабой и умеренной чувствительностью к туберкулину [Гинзбург Е. А., 1965; Меве Е. Б., 1970, и др.].
В целях клинической диагностики, кроме пробы Манту с 2 ТЕ, в противотуберкулезных диспансерах и стационарах может применяться проба Манту с различными дозами туберкулина и другие методы исследования чувствительности к туберкулину: градуированная накожная проба, подвижная проба Коха, определение туберкулинового титра, эозинофильно-туберкулиновая, гемо- и белково-туберкулиновые пробы и др.
В клинических условиях часто применяют градуированную накожную пробу, являющуюся модификацией пробы Пирке. В отличие от последней, которую ставят с отдельным цельным туберкулином Коха, при проведении градуированной накожной пробы используют растворы туберкулина различной крепости. По методике, предложенной Н. Н. Гринчаром и Д. А. Карпиловским (1935), на кожу внутренней поверхности предплечья или передней поверхности бедра наносят по каплям 4 различных раствора туберкулина: 100%, 25%, 5% и 1% и в качестве контроля пятую каплю — 0,25% раствора карболовой кислоты в изотоническом растворе NaCl, на котором готовят растворы туберкулина. Предварительно кожу обрабатывают эфиром или 0,25% раствором карболовой кислоты. Скарификацию кожи через нанесенные капли производят, начиная с контрольного раствора, снизу вверх, и постепенно «подходят» к цельному тубер-100
кулину. Появление белых валиков вокруг скарификации свидетельствует о том, что туберкулин всосался. Реакцию проверяют через 24, 48 и 72 ч, измеряя поперечный размер инфильтрата.
Реакция на 4 разведения туберкулина может быть различной как по величине инфильтрата, так и соответствию степени реакции силе раствора. По мнению Н. А. Шмелева (1952), эта проба характеризует фазовые состояния нервной системы. У здоровых, но уже инфицированных лиц градуированная накожная проба бывает адекватной, т. е. с уменьшением концентрации туберкулина снижается интенсивность реакции. У больных туберкулезом (особенно хронически текущими формами) могут отмечаться неадекватные реакции, т. е. на менее концентрированные растворы туберкулина появляются более выраженные реакции (парадоксальная реакция) или реакции одинаковой интенсивности (уравнительная реакция).
В детской практике обследование ребенка в стационаре или диспансере часто начинают с постановки градуированной накожной пробы. При отрицательном ее результате необходимо применять пробу Манту, начиная с дозы 2 ТЕ, а при отрицательном результате применять 100 ТЕ. Обычно при отрицательной реакции Манту с дозой 100 ТЕ можно думать об отсутствии туберкулезной реакции. Пробы Манту с более низкой концентрацией (дозой) туберкулина
применяются в основном для определения порога чувствительности организма к туберкулину с целью дифференциальной диагностики и проведения туберкулинотерапии.
Подкожная проба Коха более чувствительна, чем проба Манту. Применение ее показано в случаях дифференциально-диагностических затруднений главным образом у взрослых, при этом используют 10 — 20 — 50 ТЕ (0,5 — 1 — 2,5 мл очищенного туберкулина в стандартном разведении 2 ТЕ). У детей она применяется реже в дозе 10—20 ТЕ только после отрицательной реакции Манту с 2 ТЕ. Подкожная проба может вызвать реакцию как на месте введения туберкулина, так и очаговую и общую. Эта проба ценна при дифференциальной диагностике. При наличии очаговой реакции в месте
поражения легочной ткани можно думать о специфической этиологии заболевания. Во всех случаях учитывают не только местную, очаговую и общую реакцию, но и сдвиги в СОЭ, формуле крови и белковых фракциях сывороток крови (гемо- и белково-туберкулиновые пробы). Эти показатели определяют предварительно, до введения туберкулина и спустя 24—48 ч.
Гемотуберкулиновая проба считается положительной, если отмечаются изменения 3 компонентов гемограммы: увеличение СОЭ на 3 мм/ч и более; увеличение числа лейкоцитов на 1*109/л и более; увеличение в 2 раза палочкоядерного сдвига, уменьшение количества лимфоцитов на 10% и более. Белково-туберкулиновая проба считается положительной, если отмечается снижение количества альбуминов, повышение уровня аа- и y-глобулинов не менее чем на 10%. Эта проба бывает положительной у 75—80% детей и подростков с локальными формами активного туберкулеза, туберкулезной интоксикацией. Несколько реже (50—60%) она положи
101
тельна при вираже туберкулиновых реакций и гиперчувствительности к туберкулину. В последнее время пробы Коха используются также для выявления сдвигов в реакциях Т- и В-систем иммунитета (бласттрансформация, миграция лимфоцитов и др.) с целью дифференциальной диагностики и определения активности процесса.
4.6. МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ТУБЕРКУЛЕЗА И МИКОБАКТЕРИОЗОВ
Выявление микобактерий туберкулеза в различном патологическом материале от больных имеет решающее значение для постановки диагноза туберкулезной инфекции. Именно обнаружение возбудителя туберкулеза является основным и бесспорным критерием, свидетельствующим о специфической природе заболевания. Обнаружение микобактерий имеет решающее значение не только для диагностики туберкулеза, оно чрезвычайно важно при прогнозировании течения процесса, выборе рациональной схемы лечения и правильной оценке его эффективности.
Вследствие широкого применения химиотерапевтических препа
ратов в последние десятилетия отмечаются существенные изменения многих свойств микобактерий туберкулеза: морфологии самого возбудителя и его колоний на питательных средах, тинкториальных свойств, лекарственной чувствительности, вирулентности для определенных видов животных. В то же время существенно расширились знания о разнообразных формах существования возбудителя («видимые, но не растущие», L-трансформированные, ультрамелкие ави-зуальные) и их патогенетической роли; увеличился удельный вес микобактериозов, вызываемых нетуберкулезными (атипичными, оппортунистическими, анонимными) кислотоустойчивыми микобактериями. Это значительно затрудняет и усложняет микробиологическую диагностику туберкулеза и требует комплексного подхода к
оценке ее результатов.
Микобактерии туберкулеза — тонкие, прямые или слегка изогнутые палочки длиной 1 —10 (чаще 1—4) мкм, шириной 0,2—0,6
мкм, гомогенные или зернистые с незначительно закругленными
концами. Они неподвижны, не образуют эндоспор, конидий и капсул.
Mood
логия и размеры бактериальных клеток подвержены значи
тельным колебаниям и во многом зависят от возраста микроорга-
низма и особенно от условий его существования и состава питательной среды.
Микобактерии характеризуются выраженным многообразием форм существования, большим полиморфизмом и широким диапазоном изменчивости биологических свойств (плеоморфизмом). Описаны многочисленные морфологические варианты микобактерий: гигантские формы с колбовидно утолщенными разветвлениями, нитевидные, мицелиеподобные и булавовидные, дифтероидные и антимикотические формы. На основании указанного морфологического многообразия в современной микробиологической классификации признана установленной филогенетическая связь возбудителя ту
102
беркулеза с лучистыми грибами, что получило отражение в названии вида, рода и семейства — микобактерии. Учитывая, что возбудитель туберкулеза является неспороносным, имеет палочковидную форму и принадлежит к низшим грибам, VI Всесоюзный съезд фтизиатров рекомендовал придерживаться термина «микобактерии туберкулеза» (mycos — гриб, bacterium — палочка). В связи с этим не следует называть возбудитель туберкулеза бациллой, так как бациллами называются микроорганизмы, способные образовывать споры.
Многочисленными исследованиями доказана способность микобактерий образовывать фильтрующиеся формы, «видимые, но не растущие» формы с ослабленной жизнеспособностью, некислотоустойчивые формы. Однако биологическая и патогенетическая роль этих форм окончательно не выяснена. Получено много новых данных о дефектных по клеточной стенке L-формах микобактерий, описаны их биологические свойства и изучена патогенетическая роль при различных клинических проявлениях процесса и в эксперименте [Хоменко А. Г., Дорожкова И. Р., Земскова 3. С., Карачунский М. А., 1968—1990].
Наряду с изменчивостью морфологии микобактериям туберкулеза свойственна широкая изменчивость и других признаков, в частности весьма характерного для них признака кислотоустойчивое™. Кислотоустойчивое™ слагается из двух свойств: плохого восприятия окраски и ее сохранения при обесцвечивающем действии кислот, оснований и спиртов. Это характерная особенность всех видов микобактерий, за которую они получили название кислого-, спирто-и щелочеустойчивых. Данное свойство имеет первостепенное значение для микобактерий, так как на нем основаны практически все методы бактериоскопического и культурального выявления и иден-тафикации микроорганизма. Кислотоустойчивое™ обусловлена высоким содержанием в микробной клетке миколовой кислоты, входящей в состав липидных комплексов и находящейся в соединении с высокомолекулярным спиртом — фтиоциролем. Последний является составной частью восковых субстанций микобактерии. Кислотоустойчивое™ выявляется с помощью только специальных методов окраски, основным из которых является метод Циля — Нильсена.
При окраске по Цилю — Нильсену кислотоустойчивые микобактерии туберкулеза выглядят ярко-красными на синем фоне препарата. В результате воздействия неблагоприятных условий существования, а также ряда лекарственных веществ и химиотерапевта-ческих средств микобактерий могут полностью или частично утрачивать свойство кислотоустойчивое™. Это ведет к образованию смешанной, состоящей из кислого- и некислотоустойчивых особей или полностью некислотоустойчивой популяции. Такие танктори-ально измененные микобактерии не обнаруживаются обычными бак-териоскопическими методами (при окраске мазков по Цилю — Нильсену), но выявляются другими специальными способами. Поэтому на современном этапе вопрос о прекращении бактериовыделения у больных туберкулезом, леченных противотуберкулезными препаратами, должен решаться только на основании данных, полученных
103
комплексными бактериоскопическими и бактериологическими мето
дами.
Ранее род Mycobacterium формально подразделялся на подроды и типы, однако согласно последним таксономическим исследованиям и заключению Международной рабочей группы по таксономии микобактерий, род Mycobacterium в практических целях подразделяется на 3 большие группы: I — медленно растущие, II — быстро растущие и III — организмы, предъявляющие особые требования к питательным средам, но не культивирующиеся in vitro [Runyon Е. Н. et al., 1974; Runyon Е. Н., 1987]. К I группе относятся микобактерии,
которые при оптимальных условиях питания и температуры дают
на плотных средах рост макроскопически видимых колоний через 7 дней и более. К этой группе относятся виды Mycobacterium tuberculosis, М. bovis, М. africanum, М. microti, а также ряд видов медленно растущих микобактерий, которые классифицируются как нетуберкулезные: М. kansasii, М. marinum, М. simiae, М. gastri и др. Ко II группе относятся микобактерии, дающие на плотных средах
рост видимых невооруженным глазом колоний в течение менее 7
дней. К ним относятся виды М. phlei, М. vaccae, М. diernhoferi, М.
smegmatis, М. fortuitum и др. К III группе относятся не растущие на питательных средах возбудители проказы М. leprae, М. lepraemurium, М. haemophilum.
Основными методами лабораторной диагностики туберкулеза являются классические микробиологические методы: бактериоскопия; культуральное исследование, или посев; биологичная проба на чувствительных к туберкулезной инфекции лабораторных животных. Каждый из указанных методов имеет определенные достоинства и
недостатки, что позволяет в каждом конкретном случае дифферен
цированно подходить к их применению.
Сбор материала для исследования. Соблюдение правил сбора,
хранения и транспортировки диагностического материала имеет очень важное значение, так как от этого зависит не только достоверность получаемых результатов, но и эпидемиологическая без
опасность окружающих.
Материал для исследования на наличие микобактерий туберкулеза собирают в стерильные контейнеры (стеклянные банки) с плотно завинчивающимися крышками. Применение герметизированных контейнеров преследует двоякую цель: предотвращение просачивания содержимого и загрязнения окружающей больного среды чрезвычайно стойкими к физическим воздействиям микобактериям и изоляцию сохраняющегося в контейнере исследуемого материала от широко распространенных вегетирующих в окружающей среде кислотоустойчивых бактерий. Для исследования может быть использован разнообразный патологический материал: мокрота, аспират, содержимое бронхов и другие материалы, получаемые при бронхоскопическом исследовании, промывные воды бронхов и желудка, экссудаты, гной, отделяемое ран, спинномозговая жидкость, кровь, моча, операционный материал, смывы с предметов, органы экспериментальных животных и пр.
104
У больных с легочными формами процесса объектом исследования чаще служит мокрота. Сбор мокроты — весьма ответственный этап диагностической процедуры, от четкого проведения которого во многом зависит результат исследования. Кроме того, в момент откашливания мокроты создается очень высокий риск воздушно-капельного распространения инфекции. В связи с этим желательно, чтобы сбор
мокроты производился по возможности в отдалении от других людей — на открытом воздухе или в отдельной, хорошо вентилируемой комнате. Обычно у больных, выделяющих мокроту в достаточном количестве, для исследования собирают утреннюю порцию. Если бальной выделяет мало мокроты, ее следует собирать в течение суток, при этом обязательно собранный материал хранить в холодильнике. Если исследование производится на фоне лечения, за 2 сут до сбора мокроты прием противотуберкулезных препаратов от
меняется.
Согласно рекомендациям, разработанным Международным союзом по борьбе с туберкулезом (1976), сбор мокроты должен произ
водиться в присутствии и при непосредственном участии среднего медицинского персонала. При этом лицам, ответственным за сбор
мокроты, следует руководствоваться следующими правилами.
1. Объяснить больному причины исследования и необходимость откашливать содержимое глубоких отделов дыхательных путей, а не собирать в контейнер слюну или носоглоточную слизь. Необходимо также предупредить больного, что он должен предварительно почистить зубы и прополоскать полость рта кипяченой водой, что
позволяет механически удалить основную часть микрофлоры, веге
тирующей в ротовой полости.
2. Присутствующий при сборе мокроты медицинский работник должен открыть стерильный контейнер, снять с него крышку и передать больному только донную часть контейнера.
3. Стоя позади больного, следует рекомендовать ему держать конктейнер как можно ближе к губам и сразу же сплевывать в
него мокроту по мере ее откашливания.
4. По завершении сбора мокроты медицинский работник должен оценить ее количество и качество; контейнер с порцией мокроты достаточного объема (не менее 3—5 мл), содержащей уплотненные или гнойные комочки без слюны, тщательно закрывают завинчивающейся крышкой, маркируют и помещают в специальный ящик для транспортировки в лабораторию.
В том случае, если больному не удается сразу выделить необходимое количество мокроты, следует ободрить его и посоветовать сделать повторные кашлевые попытки, так как многие больные не могут сразу в течение нескольких минут выделить мокроту из глубоких отделов дыхательного тракта. В случае, если и отсроченная попытка получить мокроту оказывается неудачной, необходимо удалить контейнер и подвергнуть его обеззараживанию; вымыть руки с мылом и выдать больному новый стерильный контейнер для сбора утренней порции мокроты. Предварительно надо убедиться в том, что больной правильно понял все требования и правила сбора мок
105
роты и пользования контейнером, а также проинструктировать больного, что он должен как можно раньше доставить мокроту в лабораторию — немедленно после ее сбора.
Если же больной не выделяет мокроту или выделяет ее только эпизодически и в скудном количестве, то накануне и рано утром в день сбора мокроты больному следует дать отхаркивающее средство или применить раздражающие аэрозольные ингаляции. Последние провоцируют усиление секреции бронхов, кашель и отделение мокроты. Для аэрозольных ингаляций пользуются портативными аэрозольными ингаляторами типа АИ-1. В качестве ингалируемой смеси рекомендуется 15% раствор хлорида натрия в 1% растворе бикарбоната натрия (150 г NaCl и 10 г NaHCCh на 1 л дистиллированной воды). Поскольку ингалируемый раствор вызывает усиленную саливацию еще до появления кашля с мокротой, то больной должен удалить слюну в специально приготовленную посуду с хлорамином и только после этого собрать мокроту для микробиологического исследования. Гиперсекреция бронхиального содержимого у большинства больных наблюдается еще в течение суток после аэрозольной ингаляции, что должно быть использовано с целью получения материала для обнаружения микобактерий туберкулеза. Поэтому больному рекомендуют собрать мокроту для второго исследования в течение суток после ингаляции.
Если при раздражающей ингаляции почему-либо не удается получить мокроту, то используют промывные воды бронхов или желудка. Последний метод применяется преимущественно у детей младшего возраста, которые плохо откашливают мокроту и часто заглатывают ее. Данный метод может оказаться полезным также у больных с подавленным кашлевым рефлексом, у которых не удается получить материал даже при провоцирующих ингаляциях.
Сбор промывных вод бронхов производится врачом-отоларингологом. Промывные воды желудка берут натощак с помощью толстого зонда, предварительно дав больному выпить или введя через зонд 100—150 мл раствора бикарбоната натрия (питьевой соды) в целях нейтрализации кислой реакции желудочного содержимого. Промывные воды желудка должны исследоваться немедленно, чтобы исключить повреждающее воздействие на возбудителя желудочных ферментов.
Более ценным материалом для исследования при отсутствии мокроты являются аспираты из трахеи и бронхов, бронхоальвеолярная лаважая жидкость, а также материалы прицельной катетер-и щеточной биопсии, получаемые при бронхологических исследованиях.
Экссудаты из плевральной полости, отделяемое ран, аспираты и пунктаты из закрытых натечников, гнойных очагов, асцитическая жидкость и другие материалы должны быть взяты у больного с соблюдением всех правил асептики, помещены в стерильную посуду и доставлены в лабораторию. В отношении этих материалов практикуется двоякий подход. В большинстве лабораторий применяется стандартная техника обеззараживания, что подразумевает загряз
106
нение указанных материалов неспецифической гноеродной флорой. Наряду с этим в некоторых лабораториях практикуют предварительные посевы на бульон Хоттингера с 0,5% глюкозы, агаризо-ванную среду Тароцци (0,15%) и кровяной агар для того, чтобы определить сопутствующую флору и, следовательно, необходимость специальной обработки.
Особого методического подхода требует исследование менструальной крови. Наличие в этом материале большого количества протеолитических, фибринолитических и других ферментов требует незамедлительной доставки материала в лабораторию и тщательной его обработки, так как менструальная кровь является весьма благоприятной средой для микробной флоры.
Особого внимания требует сбор мочи. Для исследования используют обычно среднюю порцию утренней мочи, полученной после
тщательного туалета наружных половых органов растворами антисептиков (слабый раствор перманганата калия, риванола и пр.). Мочу центрифугируют, осадок используют для микроскопии и об-рабатываают 3—5% раствором серной кислоты, но не щелочью. Сбор суточной мочи для бактериологического исследования малорационален. При накоплении мочи в течение суток невозможно
сохранить ее стерильность. Хранение емкости с мочой в холодном месте может привести к выпадению солей, что неблагоприятно отражается на последующей обработке осадка. Кроме того, в моче содержатся бактерицидные продукты, которые могут не только угнетать жизнеспособность микобактерий, но в течение суток даже разрушить микробные клетки. Установлено, что при хранении мочи после сбора более 1 ч число микробных клеток неспецифической
микрофлоры увеличивается в несколько раз. Ферменты жизнедея-
тельности этой флоры могут угнетать рост микобактерий. И, наконец, при сборе мочи в течение длительного времени следует иметь
cot
в виду возможность попадания в нее кислотоустойчивых сапрофитов, что может привести к диагностическим ошибкам. В этом отношении
особенно осторожно должны оцениваться результаты исследования мочи, полученной от мужчин, так как в ней могут обнаруживаться Mycobacterium smegmatis и другие атипичные микобактерии, которые ошибочно могут быть приняты за микобактерии туберкулеза.
Объектом исследования могут служить также кусочки тканей,
полученных во время операции, или органы экспериментальных животных. Такой материал, взятый стерильно, помещают в ступку, тщательно измельчают с помощью стерильных ножниц, затем растирают пестиком, постепенно добавляя 5—7 мл стерильного изотонического раствора NaCl, а затем обрабатывают 3—5 % серной кислотой. Обработка кусочков тканей щелочью не рекомендуется, так как она менее эффективна и вызывает, кроме того, разжижение тканевых структур с образованием густой тянущейся смеси, плохо поддающейся центрифугированию и другим последующим манипу
ляциям.
Хранение, консервация и транспортировка диагностического материала. В противотуберкулезных учреждениях функционируют
107
специализированные лаборатории, производящие бактериологические исследования. В стационарах стерильные контейнеры с мокротой или другим патологическим материалом доставляются непосредственно в лабораторию. Сбор материала от амбулаторных больных производится, как указано выше, под непосредственным наблюдением среднего медицинского работника. В случае неудачи такого сбора больному выдают стерильную посуду, проводят инструктаж, и на следующий день утром больные доставляют собранный ими за сутки материал в лабораторию.
Если в лечебном учреждении не проводятся исследования для выявления кислотоустойчивых микобактерий, собранный диагностический материал должен централизованно доставляться в лабораторию, где он будет исследоваться. Обычно такая доставка осуществляется 1 или 2 раза в неделю. Следовательно, материал должен накапливаться в течение нескольких дней. Для этого используют биксы или специальные транспортировочные ящики, вмещающие 10—20 контейнеров, которые хранятся в холодильнике.
Во время транспортировки материал должен предохраняться от воздействия прямых солнечных лучей и тепла. Если транспортировка и хранение занимают не более 48 ч, материал можно пересылать без консерванта. В летний период и в районах с теплым климатом необходима консервация, если транспортировка занимает более 24 ч. С этой целью можно применять 2—3% раствор борной кислоты в соотношении 1 : 1 или глицерин. В качестве консерванта можно также использовать 10% раствор трехзамещенного фосфата натрия или 0,05—0,1% раствор хлоргексидин биглюконата в соотношении 1 : 1; в этих случаях посев материала производят без последующей обработки. Рост микобактерий может быть получен даже после хранения мокроты с консервантом при 30°С в течение 10—12 дней.
В условиях Крайнего Севера диагностический материал при длительной транспортировке может подвергаться воздействию значительных колебаний температуры. При этом необходимо учитывать, что допускается пересылка материала в замороженном состоянии без консерванта. Это обеспечивает сохранение жизнеспособности микобактерий в течение 8—15 дней, однако ни в коем случае нельзя допускать повторное оттаивание и замораживание материала, которые способствуют снижению жизнеспособности микобактерий.
Режимы и кратность обследования больных. Режимы и кратность лабораторного исследования для выявления микобактерий туберкулеза могут значительно варьировать не только в зависимости от разных подходов и точек зрения клиницистов и бактериологов, но (в большей степени) и от клинического состояния и формы процесса, этапа наблюдения больного и, наконец, целей самого исследования (верификация специфической природы заболевания, определение степени активности процесса, динамическое наблюдение за эффективностью лечения, этапная проверка групп диспансерного наблюдения и др.). Тем не менее, согласно рекомендациям Международного союза по борьбе с туберкулезом (1976), при первом обращении больного к врачу и подозрении на туберкулезную инфекцию необ
108
ходимо исследовать не менее 3 порций мокроты: порции, полученной при первом обращении больного в лечебное учреждение; ранней утренней порции мокроты, собранной больным на следующий день в течении первых 1—2 ч после пробуждения и подъема; второй порции, собранной утром того же дня, но позднее — в период доставки в клинику первой утренней порции.
В нашей стране большее распространение получила другая схема, предусматривающая не менее чем 3-кратное в течение 3 последовательных дней исследование мокроты или другого патологического материала. У впервые выявленных больных (особенно с малыми клиническими формами процесса) желательно повысить кратность исследования до 4—6, так как подобная практика существенно увеличивает число положительных результатов. Такой комплекс исследований производится при поступлении больного в стационар или же при взятии на диспансерный учет. В последующем, в процессе лечения микробиологические исследования проводят регулярно, не реже 1—2 раз в месяц с целью определения динамических изменений состава и массивности микобактериальной популяции, степени активности процесса, эффективности лечения и прогностических критериев.
Особенно тщательно следует проводить исследования при решении вопроса об абациллировании больного перед переводом его в III группу диспансерного учета (неактивный туберкулез органов дыхания) и перед снятием с учета. Порядок, сроки и кратность бактериологических обследований лиц, состоящих на учете противотуберкулезных диспансерных учреждений, регламентируются специальными методическими документами и приказами М3 РФ.
Бактериоскопическое исследование. Оно является одним из основных и наиболее распространенных методов. Преимущества его заключаются в простоте, дешевизне и быстроте получения результатов. Однако возможности метода ограничены. В препарате можно обнаружить единичные микобактерии, если в 1 мл материала содержится не менее 10 000—100 000 бактериальных клеток (предел метода). При меньшем числе клеток бактериоскопия может оказаться недостаточно чувствительной для их выявления. В таких случаях применяют различные методы «обогащения» или «накопления» микобактерий. Наибольшее распространение из них получил метод флотации, при котором микобактерии извлекают из водной суспензии исследуемого материала с помощью углеводородов или других жидкостей с меньшей, чем у воды, относительной плотностью (ксилол, толуол, бензин, бензол). Этот метод повышает частоту обнаружения микобактерий более чем на 10% по сравнению с обычной прямой бактериоскопией.
Приготовление мазков для бактериоскопического исследования является весьма ответственной процедурой, во многом предопределяющей успех исследования. При этом необходимо иметь в виду, что это одна из самых опасных процедур. Туберкулез распространяется воздушно-капельным путем через мельчайшие капельки размером около 5 мкм, содержащие возбудитель, которые при вдыхании
109
в легких могут достигать альвеол и оседать в них, формируя очаг инфекции. В лабораторной работе усилия должны быть направлены на то, чтобы избежать или свести к минимуму опасность заражения при тех манипуляциях, при выполнении которых наблюдается наибольшая опасность рассеивания потенциально инфекционных аэрозолей. Основными источниками образования таких аэрозолей в лабораториях являются манипуляции, которые связаны с приготовлением мазков для бактериоскопии: 1) открывание контейнеров с материалом; эта манипуляция особенно опасна, если между наружной стенкой горлышка контейнера и внутренней поверхностью крышки находятся частицы высохшей мокроты или если непосредственно перед открыванием контейнер подвергался встряхиванию; 2) приготовление мазков путем нанесения материала на предметное стекло и распределение его по поверхности стекла; 3) прожигание бактериологических петель, используемых для переноса материала на стекло. При выполнении этих манипуляций следует соблюдать особую осторожность.
Мазки для бактериоскопического исследования готовят из нативной необработанной мокроты. Для этого мокроту переливают в чашку Петри, под дно которой подложена черная бумага. Рядом с чашкой помещают два чистых (ранее не бывших в употреблении) и заранее промаркированных предметных стекла. С помощью двух препаровальных игл, бактериологических петель или хорошо заостренных деревянных палочек (для каждой пробы мокроты — новых) выбирают 5—6 наиболее плотных гнойных комочков мокроты, переносят их на стекло, покрывают сверху вторым стеклом, слегка придавливают и, раздвигая стекла в разные стороны, растирают до получения равномерного тонкого слоя. Мазок должен занимать 2/з— 3Л стекла.
Во время приготовления мазков следует соблюдать максимальную осторожность, чтобы избежать образования брызг и выхода материала за края стекла.
Приготовленные мазки помещают на 15—30 мин на фильтровальную бумагу для просушки при комнатной температуре. Поскольку не всегда удается избежать попадания материала на края стекла, то бумагу, на которой для просушки раскладывают мазки, следует считать зараженной. Высохшие стекла пинцетом или специальными щипцами берут за конец, на котором нанесена маркировка, и 3 раза проводят через пламя спиртовки или газовой горелки (общая продолжительность пребывания мазка в пламени не должна превышать 3—5 с), а затем помещают на чистую бумагу или специальный поднос.
Целесообразным и в плане охраны труда, особенно рекомендуемым является метод, предложенный Hain. Предметные стекла с мазками, расположенные на жестяных подносах, помещают в стерилизатор и прежде всего высушивают при 37°С. Затем температуру повышают до 105°С и спустя 10 мин стерилизатор выключают. Этим достигаются надежное прикрепление мазка к стеклу и гибель микобактерий, как находящихся в материале и по краям стекол, так 110
и попавших на поднос. Температура не должна превышать 105°С, чтобы не изменить тинкториальные свойства микобактерий.
В целях большей безопасности мазки из мокроты можно делать из осадка после обработки материала.
Мазки из жидкого патологического материала (бронхоальвеолярные смывы, промывные воды бронхов или желудка, моча, пунктаты из закрытых полостей, экссудаты и др.) готовят из осадка материала, полученного после обработки его кислотой или щелочью с последующим отмыванием либо нейтрализацией и центрифугированием. Высушенные и фиксированные мазки окрашивают. При выборе окраски учитывают метод микроскопии, с помощью которого будет осуществляться бактериоскопическое исследование: обычный световой (масляная иммерсия) или люминесцентный (флюоресцентная микроскопия) микроскоп.
Наиболее употребляемым и распространенным методом окраски для выявления кислотоустойчивых микобактерий является способ Циля — Нильсена. При одновременном воздействии нагревания и сильного протравливающего вещества фенола (карболовой кислоты), на котором готовится основное красящее вещество фуксин, облегчается проникновение анилинового красителя в микробную клетку и особенно в структуры ее клеточной стенки, состоящей из липидов и миколовых кислот. Обычные анилиновые красители не воспринимаются микобактериями, и последние не окрашиваются. Последующее обесцвечивание мазка в 29% растворе серной кислоты или 3% растворе солянокислого спирта приводит к обесцвечиванию всех некислотоустойчивых структур. Только микобактерии, обладающие выраженной кислото- и спиртоустойчивостью, стойко удерживают краситель и остаются окрашенными в красный цвет. Обесцвеченные элементы мазка докрашивают метиленовым синим. Микобактерии обнаруживаются в препарате в виде тонких, прямых или слегка
м ГТ
изогнутых ярко-красных палочек, иногда расположенных под углом в виде римской цифры V, часто кучками или небольшими скоплениями. Нередко в теле палочек или отдельно от них выделяются единичные более темные зерна или их скопления (зернистые формы).
При микроскопии мазков следует учитывать широкий полиморфизм микобактерий туберкулеза, особенно при исследовании материала от больных, получающих противотуберкулезные препараты. В связи с тем что широкое применение химиопрепаратов меняет морфологию микобактерий, в ряде случаев при исследовании препаратов могут обнаруживаться и ветвистые формы неравномерной ширины, и бледноокрашенные палочки, и осколки микобактерий, и отдельные кислотоустойчивые зерна или их скопления.
Кроме того, в мазках из осадка мочи, промывных вод желудка и другого материала наряду с микобактериями туберкулеза могут обнаруживаться и кислотоустойчивые сапрофиты, в частности в моче — микобактерии спермы, которые легко спутать с микобактериями туберкулеза. В сомнительных случаях рекомендуется мазок длительно (45—60 мин) обесцвечивать в солянокислом спирте или жавеловой воде. При таком методе обесцвечивания сапрофиты те
111
ряют свою окраску и выгладят в виде палочек голубого цвета (в результате докрашивания мазка после обесцвечивания метиленовым синим).
Правильная микроскопия препаратов является ответственной процедурой и требует высокой квалификации и большого опыта микро
скописта, так как на основании результатов микроскопии ставится диагноз, уточняются эффективность лечения и прогноз заболевания.
Микроскопию окрашенных препаратов производят в световом микроскопе с иммерсионным объективом *90 и окуляром х10 (увеличение *900). Желательно использовать бинокулярный микроскоп с объективом *100. На просмотр обычно требуется в среднем около 5 мин. Этого времени достаточно, чтобы просмотреть не менее 100 полей зрения и обнаружить единичные микобактерии. Согласно рекомендациям Международного союза по борьбе с туберкулезом (1976), просмотр препарата следует начинать в центральной части левого края мазка, постепенно передвигаясь вправо вдоль длинной оси мазка. Подсчитано, что просмотрев последовательно в этом направлении 100 полей зрения, микроскопист продвинется на 2 см. В некоторых случаях бактериоскопическое исследование 100 полей зрения оказывается недостаточным (см. ниже) для обоснованного заключения о количестве возбудителей, выделяемых больным. В таких случаях рекомендуется исследовать не менее 300 полей зрения по схеме, приведенной на рис. 4.1.
В последние годы довольно широкое распространение получил метод люминесцентной микроскопии. Он основан на различии свечения микроскопируемого объекта в ультрафиолетовом или коротковолновом спектре видимого света. В основе применения этого
метода для дифференциации микобактерий туберкулеза лежит спо-
собность липидов этих бактерий воспринимать люминесцентные красители и затем светиться при облучении ультрафиолетовыми лучами.
В зависимости от применяемых красителей микобактерии туберкулеза дают четкое ярко-красное свечение на зеленом фоне или
золотисто-желтое — на темно-зеленом фоне. Этим методом можно
исследовать любой материал, кроме мочи, в которой могут быть
сапрофиты, трудно дифференцируемые при такой окраске. Послед-
ние имеют зеленоватый или апельсиновый оттенок. Наиболее широко
распространены методы окраски акридиновым оранжевым по Адам
чику и окраски аурамином-родамином.
При микроскопии мазков по люминесцентному методу высокая контрастность микроскопической картины дает возможность проводить исследования при малых увеличениях (объектив х40, окуляр хЮ). При такой микроскопической системе увеличивается одномоментно просматриваемое поле зрения (по сравнению с иммерсионной микроскопией). Это позволяет выявлять единичные микобактерии и делает люминесцентный метод особенно ценным при исследовании олигобациллярного материала. Люминесцентная микроскопия зна
чительно сокращает время, затрачиваемое на нахождение единичных микобактерий туберкулеза, позволяет быстро просмотреть весь препарат и, следовательно, повысить число находок.
112
Рис. 4.1. Схема бактериоскопии.
Сравнительные исследования одних и тех же препаратов, окрашенных по методу Циля — Нильсена и люминесцентными красителями, показали значительно более высокую информативность люминесцентного метода, которая, по данным различных авторов, колеблется от 9—10 до 19%.
Положительный неколичественный ответ микроскопии обычно дается в том случае, если в препарате обнаруживается не менее 3 микобактерий. Однако в случае положительного результата однозначного ответа «положительный» или «отрицательный» в настоящее время для клинических целей недостаточно. Применяется количественная оценка массивности бактериовыделения.
Количество обнаруженных в мазках микобактерий является весьма важным показателем, отражающим степень заразности больного. В современной химиотерапии легочного туберкулеза количественная оценка бактериовыделения служит одним из методов определения эффективности лечебных мероприятий. Уменьшение в процессе химиотерапии вегетирующей микобактериальной популяции трактуется как хороший прогностический признак, тогда как длительное стабильное бактериовыделение или тенденция к его увеличению рассматривается как неудачи лечения и требует незамедлительной смены лечебной тактики.
Для количественной оценки микобактериальной популяции используют бактериоскопический и культуральный методы. Результативность этих методов близка, но неравнозначна. Быстрота получения информации при применении бактериоскопического метода составляет его неоспоримую ценность по сравнению с культуральным методом. Однако последний более полноценно характеризует микробную популяцию не только с количественной, но и с качественной стороны.
Установлено, что результаты многократных бактериоскопических исследований патологического материала приближаются к результативности метода посева, особенно у больных с хроническими деструктивными формами туберкулеза. Применение двух методов в совокупности позволяет более точно количественно оценить степень бактериовыделения.
В основу применяемых в настоящее время методов количественного
113
учета микобактерий в препарате положен метод, предложенный учениками Коха — Гаффкой и Стинкеным. Этот метод вошел в литературу как метод Гаффки в модификации Стинкена. Собирается мокрота, выделяемая больным за 24 ч. После измерения ее количества мокрота подвергается обработке и засевается на питательные среды с помощью
количественного метода, а из осадка, кроме того, приготавливается мазок. Для этого на предметное стекло наносят 0,05 мл осадка мокроты, и это количество распределяют в виде мазка диаметром 15 мм на заранее откалиброванном на стекле участке. Мазок окрашивают по Цилю — Нильсену и просматривают в микроскопе не менее 100 полей зрения. Число микобактерий в каждом поле зрения записывают в специальной сетке. Затем подсчитывают среднее число микобактерий в одном поле зрения. Японскими авторами установлено, что при диаметре мазка 15 мм и увеличении микроскопа 630 раз (окуляр *7, объектив х90) в таком мазке содержится постоянное число полей зрения, соответствующее 10 000. Для определения числа микобактерий предложена специальная формула Берче (1969). Путем сравнительно несложных расчетов по ней можно определить общее число микобактерий, выделяемых больным с мокротой ежесуточно в зависимости от
количества мокроты.
Однако следует признать, что метод Гаффки — Стинкена до-
вольно сложен, требует много времени и большой точности. Поэтому
предложены различные модификации этого метода, облегчающие
его выполнение и ускоряющие исследование. Так, в Центральном НИИ туберкулеза РАМН разработана комплексная методика количественного определения массивности бактериовыделения (КОМБ), которая предусматривает одновременное использование бактериоско-пического и культурального методов. В схему исследования входит бактериоскопия дозированного мазка из осадка мокроты, окрашенного по Цилю — Нильсену, определение числа микобактерий в 100 полях зрения, посев материала на питательные среды Левенштей-на — Йенсена и Финна-П с последующим подсчетом выросших колоний. Массивность микробной популяции при баатериоскопии оценивают по двум степеням: 1) скудное бактериовыделение — в дозированном мазке обнаруживается 1—9 микобактерий в 100 полях зрения; 2) обильное — от 10 до 100 микобактерий в 100 полях
зрения.
Существуют и другие схемы оценки массивности бактериовыделения. Международный союз по борьбе с туберкулезом придерживается следующей схемы количественной оценки. Подсчет выявляемых кислотоустойчивых микобактерий производят в пределах до 50 микробных особей при микроскопии по схеме, приведенной на рис. 4.1. При этом могут наблюдаться следующие варианты.
1. Обнаружено 50 микобактерий менее чем в 100 полях зрения, т. е. раньше, чем микроскопист завершил просмотр одной длины мазка. Запись: более 50 в 1 длине — >50/100 в поле зрения;
2. От 10 до 50 микобактерий обнаружено в 1 длине мазка. Указывается абсолютное число: 36/100 в поле зрения.
3. От 0 до 10 микобактерий обнаружено в 1 длине мазка.
114
В этом случае необходимо продолжить исследование и просмотреть 3 длины (300 полей зрения). Возможны 3 варианта:
а) обнаружено 50 микобактерий; запись 50/>100 в поле зрения;
б) обнаружено менее 50 микобактерий; указывается их количество: 29/300 в поле зрения;
в) не обнаружено микобактерий; запись: 0/300 в поле зрения.
Можно провести аналогию этих результатов с более привычными для нас понятиями обильного (массивного), умеренного и скудного бактериовыделения:
>50/100 в поле зрения — соответствует обильному, 10—50/100 в поле зрения — умеренному и 50/300 в поле зрения — скудному бактериовыделению. Клиническое значение определения массивности бактериовыделения не вызывает сомнений. Установлена прямая корреляция между массивностью микобактериальной популяции, частотой развития лекарственной устойчивости микобактерий и объемом деструктивного процесса у больных туберкулезом. У лиц с хроническими формами туберкулеза легких при ограниченных деструктивных поражениях отмечается менее интенсивное бактериовыделение (у 50% больных наблюдается отсутствие или небольшое число микобактерий в мокроте), более редкое развитие лекарственной устойчивости к противотуберкулезным препаратам и более частое прекращение бактериовыделения в процессе лечения. При распространенном деструктивном туберкулезе легких большинство больных выделяют массивную бактериальную популяцию, содержащую в 63—78% случаев устойчивых в противотуберкулезным препаратам микобактерий. У этих больных в 2 раза реже наступает прекращение бактериовыделения в результате химиотерапии. Сроки исчезновения микобактерий туберкулеза из мокроты в определенной степени коррелируют с массивностью бактериовыделения до начала химиотерапии.
Отмечено, что положительная бактериологическая динамика, проявляющаяся в резком снижении микобактериальной популяции
и полном ее исчезновении из мокроты, несколько опережает рент-
логические признаки инволюции процесса. Именно в этот
геномо
период на фоне исчезновения типичных бактериальных форм возбудителя наиболее легко и демонстративно выявляются разнообраз
ные качественные изменения микобактерий, проявляющиеся в воз-
никновении различных форм биологической изменчивости микроба.
Следует отметить также, что на фоне интенсивной противотуберкулезной химиотерапии (особенно с включением в состав лечебных комбинаций рифампицина) в последние годы отмечается феномен появления в мазках из разнообразного патологического ма
териала видимых под микроскопом и хорошо окрашивающихся по Цилю — Нильсену микобактерий, которые под влиянием лечебных препаратов на самом деле утратили жизнеспособность и способность размножаться на питательных средах. Этот феномен получил в литературе название «видимые, но нерастущие микобактерии». Для выявления этих микроорганизмов японские исследователи Murohashi и Yoshida (1957) предложили метод окраски «на живые и мертвые».
115
Метод основан на различной окраске ДНК микробной клетки у живых и погибших микобактерий. В последних она находится в деполимеризованном состоянии и теряет способность окрашиваться некоторыми анилиновыми основными красителями (в частности, метиленовым зеленым), однако воспринимает дополнительную окраску пиронином, сафронином или карболовым фуксином. На окрашенном препарате живые жизнеспособные микобактерии зеленые, а погибшие, не способные к размножению, — красные.
Таким образом, для обнаружения микобактерий имеется несколько бактериоскопических мазков. Они достаточно просты, общедоступны и позволяют получить ответ в максимально короткий срок. Однако они не дают полной уверенности ни при положительном, ни при отрицательном результате бактериоскопии и потому, как правило, сопровождаются более чувствительным и результативным методом исследования — методом посева.
Метод посева, или культуральный метод выявления микобактерий. Этот метод отличается большой чувствительностью и имеет ряд преимуществ перед методом микроскопии. Он позволяет выявить микобактерии туберкулеза при наличии в исследуемом патологическом материале нескольких десятков жизнеспособных особей. Если сопоставить эту цифру с 10 000—100 000 микробных тел, присутствие которых необходимо в 1 мл материала для бактериоскопиче-ского выявления, то станет ясна значительно более высокая чувствительность метода посева. Это особенно важно при исследовании материала от впервые выявленных или уже леченных больных, выделяющих малые количества микобактерий.
Очень важным преимуществом метода культурального исследования является возможность получения культуры возбудителя, которая может быть подробно исследована, идентифицирована и изучена в отношении ее лекарственной чувствительности, вирулентности и других свойств. Однако необходимо отметить, что существует ряд факторов, ограничивающих широкое применение метода культивирования, в частности его высокая стоимость, известные ограничения, связанные со сложностью обработки патологического материала, медленным размножением микобактерий туберкулеза и, следовательно, необходимостью долго ждать результатов исследования. Все это снижает ценность метода, не дает возможности оперативно использовать полученные результаты в клинике и диктует необходимость проведения широкого поиска как более совершенных методов, так и более совершенных питательных сред, которые позволили бы ускорить получение результатов и повысить эффективность и чувствительность метода.
Бактериологическому исследованию подвергается самый разнообразный материал: мокрота, промывные воды бронхов и желудка, экссудаты, отделяемое ран и свищей, моча, спинномозговая жидкость, материалы биопсии и бронхоальвеолярного лаважа, органы экспериментальных животных и патологоанатомический материал. Материал для исследования должен доставляться в лабораторию в стерильной хорошо закрытой посуде. Перед посевом на питательные 116
среды материал предварительно обрабатывают, что преследует двоякую цель: 1) максимально гомогенизировать материал, подлежащий исследованию, с тем чтобы содержащиеся в нем микобактерии равномерно распределились в его объеме, чем облегчается их выделение; 2) необходимо «подавить» все другие микроорганизмы (гноеродные и гнилостные), содержащиеся в материале исследования, с тем чтобы в дальнейшем они как более быстро растущие не мешали росту микобактерий и не использовали приготовленные для микобактерий
питательные вещества среды.
С этой целью для обработки патологического материала перед
посевом на питательные среды используют различные реактивы.
Это должно обеспечивать гомогенизацию материала, полностью по-
давлять рост неспецифической гноеродной и гнилостной микрофло
ры, которая может находиться в исследуемом материале, и максимально сохранять жизнеспособность присутствующих в материале микобактерий. Перед посевом исследуемый материал нужно сконцентрировать и освободить от сопутствующей гноеродной микрофлоры. Для этого мокроту, экссудаты и другой материал помещают в стерильную склянку с бусами или битым стеклом и обрабатывают щелочью или кислотой. Жидкие материалы предварительно центрифугируют, и дальнейшей обработке подвергают только осадок. В настоящее время для обработки патологического материала
применяют следующие методы и детергенты.
1. Метод Гона — обработка растворами серной кислоты (2—6%) в зависимости от характера материала и степени его загрязненности неспецифической микрофлорой с последующим центрифугированием
и отмыванием.
2. Метод Петрова — обработка 4% раствором NaOH с последующим центрифугированием и нейтрализацией осадка перед посевом; этот метод удобно использовать при одновременной обработке большого количества посевов. Щелочь растворяет белковые частицы, что способствует быстрой гомогенизации мокроты и других материалов, содержащих гной и слизь, и высвобождению из этих белковых частиц микобактерий туберкулеза.
3. Обработка 3% раствором серной кислоты в течение 20 мин (10 мин в спокойном состоянии, 10 мин при центрифугировании) с последующим 3-кратным отмыванием осадка стерильным изото
ническим раствором.
4. Обработка 1% раствором серной кислоты после тщательной гомогенизации в течение 18—20 ч при комнатной температуре (метод Б. Я. Циммер).
5. Обработка 10% раствором трехзамещенного фосфата натрия. Это широко распространенный в нашей стране метод, допускающий длительную экспозицию материала с фосфатом натрия без нарушения жизнеспособности микобактерий, что особенно ценно в тех случаях, когда доставка материала затруднена. Трехзамещенный фосфат натрия хорошо угнетает сопутствующую флору и даже при 2—3-дневном хранении материала не повреждает микобактерии и мало влияет на их способность к росту на питательных средах.
117
Метод можно применять в двух модификациях: с нейтрализацией материала или без нейтрализации. В последнем случае к осадку после центрифугирования добавляют 1 мл жидкой среды Школьниковой и полученную смесь полностью засевают на питательные среды.
6. При посеве сильно загрязненного материала используют более концентрированные растворы серной кислоты (5%).
Следует отметить, что поиски веществ, подходящих для обработки материала перед посевом, ведутся постоянно. Так, несколько лет назад было закончено коллективное исследование стран СЭВ по сравнительному испытанию подобных веществ. В качестве детергентов испытывались различные соединения: лауросепт X, некал ВХ, лаурилсульфат, хлоргексидин биглюконат и др. Оптимальные результаты были получены при применении лауросепта, который повысил на 16 % частоту выделения микобактерий туберкулеза. Однако отсутствие этого детергента ограничивает возможности его широкого применения на практике.
Для культивирования микобактерий туберкулеза используют различные питательные среды: плотные, полужидкие, жидкие (синтетические и полусинтетические). Однако ни одна из них не обладает качествами, предъявляемыми к ним современной бактериологической диагностикой туберкулеза. В связи с этим для повышения результативности культурального метода рекомендуется применять посев патологического материала одновременно на несколько (2—3) питательных сред. Для выделения чистых культур микобактерий туберкулеза чаще всего применяют различные по составу плотные питательные среды. В качестве стандартной среды для первичного выделения возбудителя и определения его лекарственной чувствительности ВОЗ рекомендована среда Левенштейна — Йенсена. Это плотная яичная среда, на которой хороший рост микобактерий туберкулеза получают на 15—25-й день после посева бактериоско-пически положительного материала.
В последние годы широкое распространение в нашей стране получила яичная среда II, предложенная Э. Р. Финном (среда Финна-11). Она отличается от среды Левенштейна — Йенсена тем, что вместо L-аспарагина в ней используется глутамат натрия. На этой среде рост микобайтерий туберкулеза появляется на несколько дней раньше, чем на среде Левенштейна — Йенсена. Процент выделения культур на этой среде на 6—8% выше, чем на среде Левенштейна — Йенсена.
Для повышения вероятности получения роста микобактерий рекомендуется засевать патологический материал на 2—3 различные по составу питательные среды одновременно. В настоящее время, кроме безаспарагиновой среды Финна-И, в практику внедряется еще одна безаспарагиновая среда, разработанная В. А. Аникиным. По данным Московского НИИ туберкулеза, применение сред, сбалансированных по солевому составу и источникам азотистого питания иначе, чем среда Левенштейна — Йенсена, культуральная диагностика туберкулеза улучшается в среднем на 6,7%. Это особенно 118
важно при таких формах туберкулеза, при которых возбудитель паразитирует в условиях ацидоза и анаэробиоза, в частности, при туберкулезе мочеполовых органов.
Для повышения результативности культурального метода наряду с применением одновременно нескольких различных по составу питательных сред для посева рекомендуется повторное многократное исследование материала, так как в настоящее время отмечается состояние олигобациллярности у большинства больных даже со све-жевыявленными деструктивными поражениями в легких. Олигоба-циллярность проявляется не только малым количеством возбудителей в диагностическом материале, но и транзиторностью, эпизодичностью их выделения. Поэтому часто посев даже на 3 различные питательные среды не обеспечивает полной информации о состоянии бактериовыделения.
Для повышения информативности культурального метода практикуется повторное многократное исследование материала от больных. По данным Центрального НИИ туберкулеза, методика 3-крат-ного первичного комплексного исследования бактериоскопическими и культуральными методами у впервые выявленных больных деструктивным туберкулезом легких дает дополнительно 3,4% положительных результатов, а у больных хроническим деструктивным туберкулезом, лечившихся до поступления в стационар, — 5,8% по сравнению с данными одноразового исследования. Однако, по данным ряда авторов, и 3-кратные посевы недостаточны для выявления истинной картины бактериовыделения. Так, установлено, что при обследовании нелечившихся больных максимальный прирост информации о бактериовыделении можно получить при 6-кратных повторных посевах материала, при этом количество положительных результатов возрастает на 36—37% по сравнению с данными 3-кратного посева. У больных после 3-месячного лечения ценность многократного исследования патологического материала методом посева возрастает и при 6-кратном исследовании показатель прироста положительных результатов может достигать 70%, а после 6 мес лечения он возрастает до 82%.
Таким образом, кратность исследования и состав питательных сред имеют важное значение для культуральной диагностики туберкулеза.
В связи с тем что в процессе интенсивной химиотерапии происходит повреждение различных метаболических систем микробной клетки, ряд микроорганизмов в микобактериальной популяции утрачивает способность нормально развиваться на питательных средах. Отмечается снижение жизнеспособности микобактерий, что может проявляться отсутствием роста на общепринятых питательных средах, а также возникновением способности расти только на осмотически сбалансированных (полужидкие или даже жидкие) питательных средах. Так, по данным И. Р. До рожковой, в процессе интенсивной противотуберкулезной химиотерапии часть микобактериальной популяции, утрачивая способность расти на плотных питательных средах, в то же время приобретает свойство расти на полужидких питательных
119
средах, образуя микроколонии в верхнем наиболее аэрируемом участке питательной среды. Эта потребность в повышенной аэрации четко проявляется также при культивировании микобактерий в жидких питательных средах с увеличенной аэрацией, которая достигается при культивировании посевов во вращающемся термостате (Н. М. Макаревич).
После посева и закрытия пробирок материал должен быть распределен по всей поверхности питательной среды, для этого пробирки наклоняют. Пробирки должны находиться в горизонтальном положении в течение 24—48 ч, после чего их следует перевести в
вертикальное положение.
Посевы нужно просматривать еженедельно. При этом обязательно
регистрируются параметры: а) появление роста — срок появления, начиная со дня посева; б) интенсивность роста — число колоний,
этот показатель имеет большое диагностическое и прогностическое
значение, особенно если посевы производятся в динамике; в) за-
грязнение посева посторонней микрофлорой или грибами; г) отсут
ствие роста.
При первичном посеве бактериоскопически отрицательного материала на плотные среды средняя продолжительность роста составляет 20—46 дней. Отдельные штаммы растут 60 и даже 90 дней. Это заставляет выдерживать посевы в термостате в течение 3 мес,
еженедельно проверяя появление роста.
Обычно вирулентные культуры микобактерий туберкулеза растут на плотных питательных средах в виде R-форм колоний различной величины и вида. Колонии сухие, морщинистые, цвета слоновой
кости, но в случае диссоциации могут встречаться и влажные, слегка
пигментированные колонии, розовато-желтый пигмент которых рез-
ко отличается от оранжевого или желтого пигмента сапрофитных или атипичных микобактерий. Последние обычно растут в S-форме.
Следует отметить, что на среде Финна-П колонии микобактерий туберкулеза могут быть более влажными.
После курса химиотерапии от больных туберкулезом могут выделяться гладкие колонии с влажным ростом (S-формы). Гладкие колонии характерны также для Mycobacterium bovis, которые также
патогенны для человека.
Положительный ответ дают только после микроскопии мазка из выросших колоний, окрашенного по Цилю — Нильсену. В мазках обнаруживаются ярко- и темно-красные палочки, лежащие одиночно или группами, образующие переплетения в виде «войлока» или «кос», часто видны темные зерна, особенно в длительно растущих культурах. В молодых культурах микобактерии туберкулеза (особенно выделенные от больных, длительно леченных химиопрепаратами) часто отличаются большим полиморфизмом, вплоть до появления коротких, почти кокковидных форм.
Интенсивность роста обозначают по 4-балльной системе: + единичные колонии; ++ от 20 до 100 колоний; +++ от 100 до 200 колоний; ++++ несосчитываемое число колоний (сливной рост). В двух последних случаях имеется обильное бактериовыделение,
120
которое является показателем активности процесса и/или неэффек тивности лечения.
Если морфология колоний или палочек вызывает сомнения в их туберкулезной природе или культуры выделены из материала, который может содержать кислотоустойчивые сапрофиты (моча, гной из ушей и др.), мазки дополнительно обесцвечивают спиртом (в течение 45—60 мин) или жавелевой водой (в течение 1—2 ч). Следует учитывать, что молодые культуры микобактерий туберкулеза могут обесцвечиваться спиртом и жавелевой водой, так как они еще слабо кислотоустойчивы. В таких случаях культуры следует выдержать еще несколько дней (5—10) в термостате и вновь повторить микроскопическое исследование, чтобы убедиться в их кис-лотоустойчивости.
Авирулентные сапрофитные и атипичные микобактерии обычно грубее, толще, иногда менее интенсивно окрашены и, как правило, не образуют жгутообразных сплетений (корд-фактор отсутствует). Однако некоторые виды атипичных микобактерий (фотохромогенные) могут расти в R-форме. Многие атипичные и сапрофитные микобактерии имеют кислотоустойчивые зерна, весьма сходные с таковыми у вирулентных микобактерий туберкулеза.
В тех случаях, когда выделяются культуры, вызывающие сомнения в плане их принадлежности к микобактериям туберкулеза, их изучают, используя комплекс специальных исследований, позволяющих дифференцировать типичные микобактерии туберкулеза от нетуберкулезных (атипичных) микобактерий и кислотоустойчивых сапрофитов.
Как отмечалось выше, в случае появления на питательных средах роста колоний и установления с помощью микроскопии окрашенных по Цилю — Нильсену мазков факта, что выросшая культура относится к кислотоустойчивым микобактериям, производится количественная оценка результатов посева. С этой целью применяют различные схемы оценки (одна из них приведена выше). В Центральном НИИ туберкулеза используют количественную оценку бактериовыделения методом посева по 3 степеням: 1) скудное — на плотных питательных средах вырастает 1—20 колоний во всех пробирках, использованных для данного посева; 2) умеренное — от 21 до 100 колоний во всех пробирках; 3) обильное — обнаруживается рост более 100 колоний во всех пробирках.
При лабораторной диагностике туберкулеза недостаточно дать ответ, констатирующий, обнаружены или нет тем или иным методом микобактерии туберкулеза. Для клиники туберкулеза, детального представления о характере микобактериальной популяции и определения прогноза заболевания необходимо изучение различных свойств культур, выделенных от больного: лекарственной чувствительности, ферментативной активности, вирулентности, видовой принадлежности. В некоторых случаях необходимо дифференцировать выделенные культуры и установить характер атипичных культур. Все это обусловливает то разнообразие исследований, которые необходимо проводить при лабораторной диагностике туберкулеза.
121
Определение лекарственной чувствительности выделенных штаммов микобактерий является необходимым и весьма важным этапом микробиологических исследований. Развитие лекарственной устойчивости обусловлено многими факторами: селекцией устойчивых вариантов в микобактериальной популяции, вегетирующей в организме больного; индукцией противотуберкулезными препаратами или антибиотиками, применяемыми в процессе химиотерапии; передачей эписомного R-фактора чувствительным особям (нехромосомная устойчивость) и др. Следует отметить, что снижение чувствительности микобактерий туберкулеза отмечается ко всем противотуберкулезным препаратам, однако оно может отличаться по степени, характеру, частоте и скорости появления. Известно, что из патологического материала от больных туберкулезом выделяются неоднородные по лекарственной чувствительности микобактерии: устойчивые к одному лекарственному препарату, или моноустойчи-вые, варианты с истинной двойной или полиустойчивостью, а также смесь вариантов, устойчивых к различным препаратам.
Определение спектра и степени чувствительности микобактерий туберкулеза к противотуберкулезным препаратам имеет важное значение для тактики химиотерапии больных, контроля за эффективностью лечения и определения прогноза заболевания. Степень лекарственной чувствительности микобактерий туберкулеза определя
ется в соответствии с установленными критериями, которые зависят как от противотуберкулезной активности лекарственного препарата, так и его концентрации в очаге поражения, величины максимальной
терапевтической дозы, фармакокинетики препарата и др.
Определение лекарственной чувствительности в настоящее время проводится бактериологическими методами — методом разве-
дений на плотной питательной среде и методом разведений (или абсолютных концентраций) на жидких питательных средах. Име
ется много модификаций обоих методов. В качестве унифициро-
ванного в России применяют рекомендованный Комитетом по химиотерапии ВОЗ метод определения лекарственной чувствительности микобактерий на плотной среде Левенштейна — Йенсена (без крахмала), в которую перед свертыванием добавляют раз-
личные концентрации препаратов. Минимальный набор состоит из 2—3 пробирок с разными концентрациями каждого из используемых в данной клинике препаратов, одной контрольной пробирки со средой без препарата.
Этот метод достаточно точен. Он позволяет применять патологический материал, содержащий любое количество микобактерий,
поскольку для определения лекарственной чувствительности используются микобактерии, предварительно выделенные из патологического материала. Поскольку сроки выделения возбудителя на питательных средах составляют не менее 1—1,5 мес, результаты оп
ределения лекарственной чувствительности указанным методом можно получить не ранее чем через 2—2,5 мес после забора материала. В этом заключается один из основных недостатков метода. Описанный метод определения лекарственной чувствительности ми
122
кобактерий после выделения их чистой культуры получил название непрямого метода.
При массивном бактериовыделении (не менее 1—5 микобактерий в каждом поле зрения) применяют прямое определение лекарственной чувствительности при выделении возбудителя непосредственно из патологического материала. Для этого используют метод глубинного посева и метод культивирования на стеклах в жидких питательных средах. Эти методы более трудоемки, требуют дополнительного приготовления мазков, окраски и микроскопирования последних и, кроме того, менее точны, так как невозможно дозировать засев микобактерий. Однако результаты можно получить в более короткие сроки (через 12 дней). Практикуется также прямое определение лекарственной устойчивости на плотных средах, в этом случае результаты можно получить через 3 нед.
Лекарственно-чувствительные штаммы дают рост на средах с препаратами в пределах определенной концентрации, различной для каждого препарата. Штаммы, которые растут при соответственно более высоком содержании этих препаратов в питательной среде, относят к лекарственно-устойчивым. Устойчивость определяют по наличию макроскопически видимого роста на плотных и микроскопического роста — на жидких средах.
Устойчивость данного штамма в целом выражается той максимальной концентрацией препарата (количество микрограмм в 1 мл питательной среды), при которой еще наблюдается размножение микобактерий (по числу макроколоний при посеве на плотные среды и микроколоний при посеве на жидкие среды). Лекарственно-устойчивые микроорганизмы способны размножаться при таком содержании препарата в среде, которое оказывает на чувствительные особи бактериостатическое или бактерицидное воздействие. При определении лекарственной устойчивости микобактерий на плотных средах культура считается чувствительной к той концентрации препарата, которая содержится в среде, если число колоний микобактерий, выросших на одной пробирке с препаратом, не превышает 20. Только при наличии более 20 колоний культура расценивается как устойчивая.
Для различных препаратов установлена определенная предельная концентрация, при которой еще наблюдается размножение чувствительных к этому препарату микобактерий. Границей, или критерием устойчивости, называют те первые концентрации препарата в питательной среде, выраженные в микрограммах на 1 мл, при которых начинают размножаться устойчивые особи. Для плотной среды Левенштейна — Йенсена установлены следующие концентрации (мкг/мл): стрептомицин — 5; изониазид — 1; этионамид — 30; протионамид — 30; циклосерин — 50; канамицин — 30; фло-римицин (биомицин) — 30; тиоацетазон (тибон) — 2; этамбутол — 2; рифампицин — 20.
Наряду с анализом лекарственной чувствительности все выделенные при посеве медленно растущие штаммы микобактерий подлежат первичной идентификации для определения их видовой при-
123
надлежности (М. tuberculosis, М. bovis, М. africanum, М. microti), так
как принадлежность возбудителя к тому или иному виду существенно
влияет на тактику химиотерапии, прогноз заболевания и др. Одним
из основных лабораторных тестов, позволяющих дифференцировать
М. tuberculosis и М. bovis и микобактерии всех других видов, служит ниациновый тест. Он основан на уникальной способности микобак-
терий человеческого типа синтезировать ниацин (никотиновую кислоту) в значительно больших количествах, чем микобактерии бычьего типа и нетуберкулезные микобактерии.
В случае выделения нетуберкулезных (атипичных) микобактерий, как медленно, так и быстро растущих, необходимо прежде всего правильно оценить их роль в заболевании, а затем идентифицировать их. Для установления диагноза микобактериоза надо многократно повторно выделить один и тот же вид микобактерий. Все туберкулезные микобактерии подлежат специальному изучению с помощью бактериологических и биохимических методов идентификации. Порядок и основные методы идентификации определены приказом М3 СССР № 558 от 8 июня 1978 г. «Об унификации микробиологических методов исследования при туберкулезе», а также изложены в методических рекомендациях «Бактериологическая и биохимическая идентификация микобактерий» (Л., 1980).
Биологическая проба. При отрицательных результатах бактериоскопии и посева материала, исследуемого на микобактерии туберкулеза, если все же подозревается туберкулез, ставят опыты на животных (так называемая биологическая проба). Это наиболее чувствительный метод выявления возбудителя туберкулеза. Самым чувствительным к туберкулезной инфекции лабораторным животным является морская свинка. Считается, что заражение морской свинки позволяет диагностировать туберкулез даже при наличии в материале, использованном для заражения, 1—5 микробных клеток.
Биологический метод широко применяется в диагностике туберкулеза со времени открытия возбудителя этой инфекции. Он не потерял своей ценности и в настоящее время. Более того, сейчас
этот метод с успехом применяется для выявления не только типичных неизмененных, но и разнообразных биологически измененных форм возбудителя, в частности L-трансформированных и фильтрующихся форм. Кроме того, этот метод является основным при определении видовой принадлежности микобактерий, их вирулентности, изучении патогенности атипичных культур. Он широко используется для воспроизведения туберкулеза отдельных органов, исследования аллергических реакций, иммунитета и эффективности химиотерапии при туберкулезе. В последние годы метод применяется при проведении биологических пассажей в процессе изучения биологически измененных форм возбудителя в целях получения биологической реверсии.
При любом методе заражения морских свинок микобактериями туберкулеза у животных развивается генерализованный туберкулезный процесс, заканчивающийся гибелью. Однако следует иметь в виду, что возбудители туберкулеза, устойчивые к препаратам
124
изоникотиновои кислоты, вследствие снижения или потери вирулентности могут не вызывать заболевание у морских свинок и дать отрицательные результаты биологической пробы при одновременном
наличии роста на питательных средах при посеве. Это обстоятельство диктует необходимость дифференцированного подхода к результатам биологической пробы и одновременного использования метода посева
при проведении заражения животного в диагностических целях.
Для повышения частоты обнаружения микобактерий туберкулеза в патологическом материале многие авторы используют, помимо подкожного, интратестикулярное заражение. При этом в патологическом материале удается чаще выявлять изониазидоустойчивые слабовирулентные микобактерии. Кроме того, для повышения чувствительности биологического метода рекомендуется искусственно снижать естественную резистентность морских свинок ежедневным введением больших доз кортизона (12,5 мг), что позволяет повысить результативность биологической пробы на 15—29% (по данным разных исследователей). Наконец, результативность биологической пробы можно повысить, применяя метод последовательных биологических пассажей. Для этого заражение каждой последующей морской свинки производится гомогенатом органов от предыдущего животного, использованного в биологической пробе. По мере увеличения числа пассажей нарастает выраженность специфических изменений в органах.
Следует подчеркнуть, что особую ценность биологическая проба представляет для диагностического исследования олигобациллярного
материала.
Перед заражением морским свинкам с массой 200—250 г ставят реакцию Манту, вводя 0,02 мл алытуберкулина Коха внутрикожно в наружную поверхность бедра, освобожденную от волосяного покрова; контроль — введение такого же количества бульона в другую лапку. При отрицательной реакции через 48 ч свинку можно брать в опыт. Для заражения в диагностических целях можно использовать различный патологический материал: мокроту, мочу, промывные воды, отделяемое ран и др. Исследуемый материал обычно обрабатывают 3% раствором серной кислоты так же, как и для посева. Затем осадок 2 или (лучше) 3 раза отмывают стерильным изотоническим раствором NaCl и центрифугируют. Такое отмывание является обязательной процедурой,
поскольку при попадании кислоты животному под кожу может развиться некроз. К отмытому осадку добавляют изотонический раствор NaCl и вводят эту смесь под кожу правой паховой области. За свинками проводят систематическое наблюдение, проверяя появление местного инфильтрата в месте введения материала, изъязвление этого инфильтрата, состояние регионарных лимфатиче-
ских узлов и места введения материала; повторно ставят реакцию
Манту. То же повторяют через 6 нед и далее. При положительных туберкулиновых пробах и наличии местных изменений свинок
забивают через 1—1,5 мес, при отсутствии признаков развивающегося туберкулеза — через 3 мес.
125
Туберкулиновые пробы при наличии туберкулезного процесса становятся положительными через 2 нед — 1 мес после заражения.
На вскрытии свинок, погибших от туберкулеза, наблюдается картина генерализованного туберкулеза. Если при заражении в материале были слабовирулентные микобактерии туберкулеза, то развитие процесса может ограничиться увеличением лимфатических узлов и единичными очажками в органах. Во время вскрытия делают мазки-отпечатки из органов для бактериоскопических исследований. Кроме того, кусочки лимфатических узлов, селезенки, печени и легких вырезают стерильным инструментом, помещают в стериль
ную ступку, гомогенизируют и засевают на плотные питательные среды. Посевы производят обязательно при отсутствии в органах макроскопически видимых изменений туберкулезного характера. Кроме того, в сомнительных случаях проводят гистологическое исследование тканей.
Для оценки распространенности и характера туберкулезного по
ражения у морских свинок предложено несколько схем учета макроскопических изменений в органах. Наибольшее распространение в нашей стране получили схемы, разработанные М. В. Триус и Ю. К. Вейсфейлером. По этим схемам специфические изменения в органах и лимфатических узлах оцениваются в зависимости от
степени их выраженности плюсами, которые затем переводятся в
цифровые показатели.
Микробиологическая диагностика L-трансформированных и фильтрующихся вариантов микобактерий. Все изложенное выше касается разнообразных методов выявления и идентификации клас-
сических бактериальных форм возбудителя туберкулеза, не учитывая многообразные формы, возникшие в результате морфологической, тинкториальной и биологической изменчивости микобактерий.
В настоящее время традиционные методы выделения микобак
терий туберкулеза все меньше удовлетворяют нужды клиники, так как информативность микробиологических исследований явно недостаточна. Применяемые методы малоэффективны и не позволяют составить представление об истинном состоянии микобактериальной популяции, вегетирующей в организме больного. Это объясняется,
с одной стороны, недостаточной чувствительностью ряда методов, а с другой (в значительно большей степени), тем, что большинство таких методов не позволяет выявить возбудитель, находящийся в L-трансформированном состоянии.
L-трансформация — закономерный этап жизненного цикла микобактерий. L-формы — это варианты бактерий с дефектом клеточной стенки. Им придают особое значение в патологии человека и животных в связи с их способностью длительно существовать в макроорганизме и реверсировать в исходный вид с восстановлением свойственной ему вирулентности. Возможность попеременного или одновременного существования возбудителя в бактериальной и L-форме не только значительно затрудняет диагностику, но и влияет
на развитие эпидемического процесса, создавая ложное впечатление об абациллировании источников и стерилизации очагов инфекции.
126
Таким образом, результаты бактериологических исследований, рассчитанных на выделение только бактериальных форм возбудителя, не могут служить основанием для исключения туберкулезной инфек
ции и должны дополняться данными, полученными специальными методами, которые направлены на выявление L-форм микобактерий. Последние, как известно, являются закономерно существующей формой возбудителя при разных клинических проявлениях туберкулезного процесса, а также основной формой персистирования микобактерий.
Установлено, что L-трансформация микобактерий закономерна
и при использовании специальных методов исследования она может быть выявлена. Из-за биологических особенностей L-форм, для ко-
торых характерны резко измененная морфология бактериальных клеток и сниженный метаболизм, выделение их требует специальных методов культивирования и идентификации. L-формы могут обнаруживаться в виде гигантских зернистых тел, скоплений различных
по размеру, гомогенности и оптической плотности шаров, гранул, сферопластоподобных образований, светопреломляющих тел и др. L-формы и близкие к ним варианты возбудителя туберкулеза характеризуются повышенной хрупкостью и требуют применения особых методов выделения и условий культивирования: щадящих методов обработки материала, элективных питательных сред, наличия нативных белков и осмотических стабилизаторов.
L-формы выделяются преимущественно у больных, недавно прекративших выделять бактериальные формы. У данного контингента больных с сохранившимися полостями деструкции и воспалительными изменениями в легочной ткани выделение L-форм продолжается еще в течение 3—4 мес и более после прекращения выделения бактериальных форм. Таким образом, целенаправленные поиски L-форм микобактерий показаны у больных, не выделявших или прекративших выделять бактериальные формы, но имеющих явные клинические признаки активного туберкулезного процесса. К таким признакам относится наличие участков деструкции легочной ткани,
каверн с неравномерно широкими стенками и с эволютивными воспалительными изменениями в окружающей легочной ткани.
Поиски L-форм микобактерий туберкулеза должны проводиться повторно, многократно, так как выделение их носит периодический характер. В настоящее время разработаны и применяются разнообразные методы микробиологической диагностики L-трансформиро-ванных вариантов: бактериоскопические, культуральные, биологические, серологические, иммунофлюоресцентные, гистологические. Разработаны методические основы культурального выделения L-форм, сконструированы элективные питательные среды, предложены методы обработки материала, подобраны адекватные детергенты и осмотические стабилизаторы, разработана схема посева и контролей. Предложены методы окраски L-форм в чистой культуре и патологическом материале; разработаны стандартные и ускоренные методы реверсии и др. Все это позволяет выделять L-формы из разнообразного патологического материала и устанавливать их видовую специфичность.
127
Основные принципы выделения и идентификации L-форм изложены в методических рекомендациях «Выделение L-форм микобактерий туберкулеза из патологического материала» (М., 1984) и «Экспресс-индикация L-форм микобактерий туберкулеза методом иммунофлюоресценции» (Минск, 1981).
Исследованиями последних лет (А. Г. Хоменко, В. И. Голышев-ская) установлено, что при многих клинических проявлениях туберкулеза (особенно на фоне длительной комбинированной химиотерапии) в организме больных и экспериментальных животных обнаруживаются и ультрамелкие формы возбудителя, проходящие через бактериальные фильтры. Частота обнаружения этих микроорганизмов варьирует в зависимости от формы процесса и особенно от лекарственного режима.
Для выделения ультрамелких форм разработаны культуральный и биологический методы. Основной принцип этих методов заклю-
чается в том, что исследованию подвергается материал, последова-
тельно профильтрованный через мембранные фильтры с размером
пор 0,65; 0,45 и 0,22 мкм. При этом исследуемый субстрат полностью
очищается от бактериальных форм возбудителя, осколков микобак
терий и других вариантов изменчивости, в материале остаются только фильтрующиеся формы. Полученный фильтрат засевают на специальные питательные среды или вводят морской свинке. Результаты оценивают по данным бактериоскопии мазков, приготовленных из культивированного фильтрата или в результате реверсии возбудителя в бактериальную форму.
4.7. МОРФОЛОГИЯ КРОВИ ПРИ ТУБЕРКУЛЕЗЕ
Различные формы туберкулеза при разной реактивности организма вызывают значительные отклонения в лейкоцитарной формуле и количестве лейкоцитов. Поданным Н. А. Шмелева (1959), число лейкоцитов у больных туберкулезом чаще (58%) достигает 6*109/л, при острых и тяжелых формах процесса — 12—15*109/л (35% случаев). Число лейкоцитов более 15*109/л встречается редко (3% больных), и в этих случаях надо искать другое заболевание или сочетание его с туберкулезом. По числу лейкоцитов можно судить о степени реакции отдельных частей кроветворной системы, поэтому при туберкулезе, как и при других заболеваниях, этот показатель не следует оценивать «оторванно» от лейкоцитарной формулы.
У взрослых туберкулезный процесс обычно вызывает увеличение числа палочкоядерных нейтрофилов. У больных с инфильтративными и очаговыми формами без распада отмечается палочкоядерный сдвиг (7—10%). При наличии деструкции легочной ткани количество палочкоядерных нейтрофилов может доходить до 10—20%. Значительное увеличение сдвига влево отмечается при обострении фиброзно-кавернозного туберкулеза, а также при распространенных процессах с явлениями распада. В этих случаях процент палочкоядерных может достигать 20—30, иногда появляются мета- и промиелоциты (0,5—0,25%).
128
При туберкулезе изменяется и характер зернистости нейтрофилов. Вместо обычной тонкой может появиться грубая патологическая зернистость, которая имеет не меньшее значение, чем изменение ядра. Для определения числа нейтрофилов с патологической зернистостью мазки крови надо окрашивать в буферном растворе. В норме до 6% нейтрофилов имеет патологическую зернистость. Увеличение в периферической крови числа нейтрофилов с патологической зернистостью указывает на истощение пула миелоцитов нейтрофильного ряда и образование из них менее дифференцированных клеток костного мозга. У больных с тяжелыми формами туберкулеза почти все нейтрофилы (80—90%) могут содержать патологическую зернистость, которая при затихании патологического процесса обычно сохраняется дольше других изменений гемограммы, свидетельствуя о неполном восстановлении функции костного мозга.
Клинически выраженный туберкулез протекает с нормальным числом эозинофилов в крови. Небольшая эозинофилия при отсутствии сдвига влево в сочетании с лимфоцитозом сопровождает благоприятно протекающие туберкулезные процессы. Гипоэозинофилия и особенно анэозинофилия отмечаются при тяжелом состоянии баль
ных.
Число узкоплазменных лимфоцитов повышается в период ранней туберкулезной интоксикации, в начальный период первичного туберкулеза. Высокое число лимфоцитов Н. А. Шмелев (1959) связывает с реактивностью раннего периода первичной инфекции. Увеличение данного показателя в крови наблюдается и при затихании вспышки, инфильтративном и очаговом туберкулезе легких. При прогрессировании болезни он снижается вплоть до выраженной лимфопении (10% и менее). Это закономерное явление, связанное с угнетением лимфопоэза.
Нормальное количество моноцитов отмечается у 66% больных туберкулезом, ниже нормы — у 22%. Стойкое увеличение показателя бывает при свежей гематогенной диссеминации, которая может иметь место во всех фазах туберкулезного воспаления. В этих случаях определяется от 10 до 20% моноцитов при повторных анализах крови. Резкое снижение количества моноцитов может быть при тяжелом течении первичного туберкулеза и казеозной пневмонии [Тимашева Е. Д., 1947]. Колебания в содержании этих клеток
зависят и от других агентов, вызывающих раздражение ретикуло-гистиоцитарной системы. Некоторую роль в данном процессе может
играть также непереносимость химиопрепаратов, вызывающих побочные реакции, которые протекают с увеличением количества аг-ранулоцитарных форм, в том числе моноцитов [Ковязина А. И., 1970].
При обычном исследовании крови базофилы встречаются у 0,5— 1,8% больных. Н. А. Шмелев и А. И. Ковязина (1971), А. К. Герман и Б. П. Ли (1970) отметили увеличение абсолютного числа базофилов у 30% больных с активной формой туберкулеза легких. Способность
базофильных лейкоцитов изменять свои морфологические свойства
при реакции антиген — антитело широко используется в серологи
5—1213
129
ческом тесте Шелли для выявления антител к различным (в первую очередь лекарственным) антигенам [Тимашева Е. Д., Ковязина А. И., 1969, и др.].
Состав красной крови у большинства больных туберкулезом остается в пределах нормы. Анемии отмечаются при первичной казеозной пневмонии, милиарном туберкулезе [Alterescu R. et al., 1975; Payl J. et al., 1977] и некоторых формах диссеминированного туберкулеза [Тимашева Е. Д., 1963]. Число эритроцитов при этих формах падает до 1—2,5*1012/л, уровень гемоглобина — до 50 — 60 г/л.
В процессе химиотерапии могут возникать разнообразные изменения показателей крови, обусловленные токсическим и аллергическим воздействием препаратов на организм больного. Наиболее часто наблюдается реакция эозинофилов. Их число возрастает при лечении антибиотиками (стрептомицин, биомицин и канамицин, реже циклосерин и рифампицин). Гиперэозинофилия иногда может служить предшественником агранулоцитарных реакций, проявляю
щихся уменьшением числа гранулоцитов, нарастающим падением числа лейкоцитов, относительным повышением числа лимфоцитов
и моноцитов и появлением в гемограмме плазматических и рети-кулогистиоцитарных элементов. При использовании рифампицина, протионамида, этионамида и ПАСК наблюдается повышение процента моноцитов (до 10—18). При применении изониазида, ПАСК, стрептомицина, циклосерина и рифампицина описаны тяжелые осложнения в виде гемолитических и апластических анемий [Аркавина Э. А., Берлинер А. А., 1971]. Гемолитические анемии могут развиваться при повторном и интермиттирующем приемах рифампицина,
протекать с острой почечной и печеночной недостаточностью [Nastase М. et al., 1975; Miyachi S. et al., 1982]. Кроме того, из гематологических осложнений при лечении рифампицином и этам-бутолом описаны тромбоцитопении [Calietti F. et al., 1978; Rabinovitz M. et al., 1982].
Лейкемоидные реакции, связанные с туберкулезной инфекцией, встречаются редко и наблюдаются преимущественно при диссеминированных формах в фазе острой диссеминации, протекающей с поражением костного мозга, селезенки и печени, лимфатических узлов, брюшной полости, и при остром туберкулезном сепсисе. В нашей стране они описаны Е. М. Тареевым (1948), Е. Д. Тимашевой (1963), за рубежом — Н. Reinwein. W. Rosing (1938), J. Tripatti и
соавт. (1984).
Различают два типа реакций: гиперпластические (собственно лейкемоидные) и гипопластические. При первом типе число лейкоцитов может достигать 20—30*109/л. Наряду с моноцитозом выяв-
ляются лимфопения, резкий сдвиг влево нейтрофилов с появлением
единичных миелоцитов и промиелоцитов. Со стороны красной крови
отмечается гипохромная анемия с уменьшением числа эритроцитов до 2—2,5*1012/л. Лейкемоидные реакции гиперпластического типа большей частью преходящи, иногда наблюдается цикличность в их течении, которую можно связать с волнами гематогенной диссеми-
130
нации. Гипопластический тип реакции наблюдается преимущественно при остром туберкулезном сепсисе, но иногда может возникать и у больных с диссеминированной формой, милиарным туберкулезом [Cordier J. Е. et al., 1978]. В этих случаях для гемограммы характерна стойко выраженная тромбоцитопения 20,0—30,0*109/л, лейкопения 1—2*109/л с нейтропенией и относительным лимфоцитозом, иногда граничащие с агранулоцитозом, в красной крови — резко выраженная анемия: эритроциты до 1,5—2*1012/л, количество гемоглобина падает до 40,0—50,0—60,0 г/л.
С целью уточнения характера реакции крови и для ранней диагностики милиарного туберкулеза (протекающего с поражением гемопоэтической системы) рекомендуется производить цитологическое исследование костного мозга, лимфатических узлов. Это дает возможность в случаях туберкулезной этиологии процесса обнаружить специфические элементы туберкулезной гранулемы и микобактерии туберкулеза.
4.8. ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ
Инструментальные методы исследования находят все большее распространение в диагностике и дифференциальной диагностике туберкулеза. Среди них эндоскопические исследования бронхов занимают ведущее место, так как в большинстве случаев они соче
таются с комплексом дополнительных микрохирургических вмешательств биопсийного характера. Современная бронхология располагает большим числом разнообразных эндобронхиальных диагности
ческих манипуляций для своевременного распознавания различных патологических процессов как в бронхах, так и непосредственно в легочной ткани. С помощью этих методов можно достаточно эф-
фективно оценивать визуально изменения как в крупных, так и в более мелких бронхах, а также получить биопсийный материал для
логического и бактериологического исследования по существу
из любого участка терминальных бронхов или легкого.
Успех инструментальной диагностики заболеваний органов ды
хания и средостения в каждом конкретном случае зависит от правильного выбора метода исследования. При этом необходимо помнить, что инструментальные методы диагностики не всегда являются безобидными и нетравматичными для больного, поэтому всегда
следует руководствоваться принципом — от простого диагностического вмешательства к сложному.
Бронхоскопия. Этот метод позволяет осмотреть внутреннюю поверхность бронхов, изучить состояние слизистых оболочек крупных бронхов, определить в них патологические изменения. Успешное проведение брохоскопии в значительной степени зависит от того, насколько хорошо проведено обезболивание. Выбор последнего обусловливается общим состоянием больного, наличием сопутствующих заболеваний, характером и продолжительность эндоскопического вмешательства, арсеналом необходимой аппаратуры и инструментария, опытом эндоскописта и анестезиолога.
5*
131
Для местной анестезии слизистой оболочки глотки, гортани, трахеи и бронхов используют 2—3% раствор дикаина, 5—10% раствор новокаина, смесь Гирша и др. Местная анестезия не может полностью снять болевые ощущения, кашлевой рефлекс, а также психические переживания, связанные с бронхоскопией, особенно если эндоскопия бронхов сочетается с различными эндобронхиальными манипуляциями биопсийного характера. Для проведения общего обезболивания широко используют соли барбитуровой кислоты: гексенал, тиопентал-натрий или небарбитуровый кратковременный анестетик сомбревин (эпонтол). Из мышечных релаксантов чаще применяют листенон, миорелаксин, дитилин. Для проведения поднаркозной бронхоскопии необходим дыхательный бронхоскоп системы Фриделя.
Бронхоскопическое исследование производят натощак. Премедикация обычно состоит из внутримышечного (за 20—40 мин) или внутривенного (за 5—7 мин) введения атропина или метацина в дозе 0,5—1 мл 0,1% раствора. Введение в наркоз осуществляется 1—2,5% раствором гексенала и тиопентал-натрия в дозе 150—300 мл ребенку и 500—700 мл взрослому. Сомбревин вводят внутривенно в дозе 10—15 мл. В период введения анестетиков больные дышат чистым кислородом через маску. Анестетики вводят медленно до наступления наркоза стадии 1з—Illi, что характеризуется потерей сознания и сохранением ровного дыхания. Для предотвращения мышечных болей после исследования внутривенно вводят 3—5 мл антидеполяризующего релаксанта тубокурарина хлорида (тубарин), а затем через 30—50 с инъекцируют 100—120 мл дитилина (сук-цинилхолин, листенон, миорелаксин и др.). После наступления мышечной релаксации через наркозную маску в течение 5—10 с больного насыщают кислородом и с помощью ларингоскопа через голосовую щель в трахею вводят тубус дыхательного бронхоскопа. Искусственная вентиляция легких поддерживается в течение всего исследования ритмичным сокращением дыхательного мешка, соединенного с баллоном кислорода, или методом эжекционной подачи кислородно-воздушной смеси через специальную иглу, вмонтированную в головку бронхоскопа. Бронхоскоп удаляют после восстановления у больного самостоятельного дыхания.
Фибробронхоскопия как самостоятельное исследование может проводиться в условиях местной анестезии с введением самого фиброскопа через нос, рот, через интубационную трубку [Лукомский Г. И., 1971; Cackner М., 1975; Nalan А., 1975]. Фибробронхоскопы часто применяют во время проведения бронхоскопии жестким тубусом для более детального и глубокого осмотра мелких бронхов зоны бронхолегочного поражения. Наши наблюдения показывают, что фибробронхоскопия позволяет получать дополнительную информацию (по сравнению с обычной оптической эндоскопией бронхов) в 52% случаев.
Бронхоскопия в практике фтизиатрии показана при наличии симптомов туберкулеза бронхов (упорном кашле, болях в груди, одышке, ателектазе части легкого и др.). Учитывая современный 132
патоморд:
з туберкулеза и бессимптомность специфического пора
жения крупных бронхов (до 20—40% случаев), бронхоскопию сле-
дует считать показанной при всех деструктивных формах вторичного туберкулеза легких, первичном туберкулезе, реактивации внутри-грудного туберкулеза. Бронхоскопия показана при кровохарканьях
и легочных кровотечениях неясной этиологии или неясной локали
зации источника геморрагии, при выкашливании бронхолитов и аспирации инородных тел, перед операцией на легких и бронхах, а также в послеоперационном периоде (для контроля за состоянием культи резецированного бронха) и в целях дифференциальной ди
агностики.
Во время бронхоскопии различные изменения бронхов оценивают по признакам: 1) характер бронхиального секрета и патологического
отделяемого в трахее и бронхах; 2) вид слизистой оболочки, степень воспалительных изменений; 3) эластичность и ригидность стенок
крупных бронхов и трахеи; 4) состояние бифуркации трахеи; 5) наличие пролиферативных изменений слизистой оболочки крупных бронхов; 6) сосудистый рисунок слизистой оболочки с учетом
его локализации; 7) характер продольной складчатости слизистой оболочки; 8) вид и характер опухолевых образований в крупных бронхах; 9) другие изменения как бронхов, так и слизистой оболочки.
Бронхоскопия высокорезультативна при туберкулезных изменениях слизистой оболочки крупных бронхов, при проведении мас
сивной химиотерапии, большом патоморфозе туберкулеза. С по-
мощью этого метода выявляются специфические изменения слизистой оболочки крупных бронхов в 16,6% случаев при первичном туберкулезе, в 13,6% — при фиброзно-кавернозном, в 9,2% — при диссеминированном, в 8,4% — при кавернозном, в 6% — при очаговом и в 4,1% случаев — при инфильтративном туберкулезе [Шестерина М. В., 1976].
Условия внутривенного наркоза с управляемым дыханием позволяют одновременно с бронхоскопией выполнять и тотальную двустороннюю или селективную бронхографию. Целесообразность одномоментного исследования оправдывается следующими факторами: а) предварительная бронхоскопия иногда дает важную диагностическую информацию, влияющую на дальнейший ход исследования; б) бронхографии предшествует тщательный туалет бронхиального дерева с удалением слизи, гноя и др., что имеет большое значение при контрастном изучении бронхов; в) после бронхографии контрастное вещество максимально удаляется из бронхов.
Эндотрансбронхиальные методы биопсии. Бронхологическое исследование предусматривает комплекс различных эндобронхиальных и трансбронхиальных микрохирургических вмешательств биопсийного характера. Методы катетеризационной, щеточной, или браш-биопсии, прямой или трансбронхиальной внутрилегочной биопсии, трансбронхиальной пункционной биопсии лимфатических узлов средостения, губчатой, или спонг-биопсии предназначены для биопсии патологического очага, расположенного в бронхах, легочной ткани
или в средостении.
133
Рис. 4 2. Фрагмент рентгенограммы грудной клетки в прямой проекции. Прямая (щипцовая) биопсия
Прямая, или щипцовая, биопсия скусыванием осуществляется в крупных бронхах под контролем глаза. Показаниями к ней служат изменения бронхов пролиферативного характера при туберкулезе, неспецифических заболеваниях, доброкачественных и злокачественных опухолях, саркоидозе, лимфогранулематозе, ксантоматозе и т. д. Манипуляцию проводят кусачками, имеющимися в наборе бронхоскопа. При выборе места биопсии тубус бронхоскопа максимально близко подводят к месту вмешательства для лучшего обозревания и захвата патологически измененной слизистой оболочки (рис. 4.2). Прямую, или щипцовую, биопсию, как правило, выполняют однократно, так как возникающее после скусывания ткани эндобронхиальное кровотечение часто мешает провести биопсию вторично. Во время скусывания патологической ткани следует избегать захватывания кусачками некротизировавшиеся части измененной слизистой оболочки, поскольку при гистологическом исследовании обнаружение тканевого детрита не помогает установлению диагноза. Непосредственно перед биопсией измененную слизистую оболочку орошают или смачивают тампоном, пропитанным 5—10% раствором новокаина. При возникновении выраженного кровотечения после выкусывания ткани прежде всего аспирируют кровь из бронхов, местно применяют адреналин, механическое прижатие тампоном кровоточащего места, растворы кислот (ТХУ).
134
Катетериза ц ион на я биопсия легких выполняется в диагностических целях при биопсии периферически расположенного очага бронхолегочного поражения. Показанием к ней являются периферически расположенные солитарные патологические образования неясной природы, в частности, округлые и шаровидные, очаговые и инфильтративные, полостные изменения в легких, легочные диссеминации пролиферативного характера, сегментарные и долевые ателектазы и т. д. [Климанский В. А. и др., 1967; Fnedel, 1961, и др. ]. Исследование можно проводить самостоятельно под местной анестезией с использованием управляемых резиновых катетеров типа Метра и сердечного катетера. Чаще катетеризационную биопсию проводят при бронхоскопии под наркозом. Инструментом служат рентгеноконтрастные сердечные катетеры от № 6 до № 8 и металлические проводники-направители с углом изгиба дистального конца 20° и 45°. Проводник с углом 45° позволяет направить сердечный катетер в устья I—II—VI сегментарных бронхов как правого, так и левого легкого, проводник с углом 20° способствует продвижению катетера в III—V, VII—X сегментарные бронхи. Исследование осуществляют в рентгеновском кабинете.
Предварительная бронхоскопия позволяет оценивать состояние бронхов и прежде всего того сегментарного бронха, который предстоит катетеризировать. Клюв тубуса бронхоскопа устанавливают непосредственно над устьем или вблизи долевого бронха. Затем, сохраняя искусственную вентиляцию легких (лучше методом эжек-ции), визирную планку смещают и металлический проводник с введением в него сердечным катетером под контролем глаза вводят непосредственно в искомое устье сегментарного бронха. С этого момента контроль за последующим продвижением катетера по более мелким бронхам осуществляется через рентгенотелевизионный экран. Поиск необходимого сегментарного, субсегментарного бронха проводят при постоянной коррекции положения как металлического проводника, так и сердечного катетера (рис. 4.3).
По достижении патологического очага кончиком катетера производят травматизацию очага путем маятникообразных движений (назад — вперед несколько раз). Одновременно канюлю катетера присоединяют к ловушке, соединенной с электрическим аспиратором. После выполнения поставленной задачи катетер извлекают и промывают таким же путем стерильным раствором натрия хлорида. Полученный материал почти всегда окрашен кровью, поэтому необходимо оценить опасность геморрагии. Кровь, излившуюся в крупные бронхи, немедленно аспирируют до тех пор, пока ее выделение из исследуемого бронха прекратится. Только после этого при восстановлении самостоятельного дыхания бронхоскоп извлекают из трахеи.
Щеточная, или браш-биопсия, может рассматриваться как один из вариантов катетеризационного зондирования легких. Исследование выполняют также во время бронхоскопии. Вводят металлический направитель с сердечным катетером № 8, в просвете которого находится струна с нейлоновой или капроновой щеточкой на конце.
135
Рис 4 4 Фрагмент рентгенограммы грудной клетки в прямой проекции Браш-биопсия во время фиб-робронхоскопии
метастатические опухолевые процессы, гистиоцитоз X, гемосидероз и другие более редко встречающиеся заболевания.
Трансбронхиальная внутрилегочная щипцовая биопсия под местной анестезией осуществляется через фибробронхоскоп. Слизистую оболочку носоглотки анестезируют, повторно закапывая через нос 2% или 4% раствор лидокаина, либо 2% пиромекаин, либо распыляя ксилостезин (1—1,5 мл) и др. По мере наступления анестезии в горле при глотании появляется ощущение «комка». Больной должен высунуть язык и удерживать его своей рукой через марлевую салфетку. Затем через биопсийный канал фибробронхоскопа проводится дополнительная анестезия голосовой щели и бифуркации трахеи 3—5 мл одного из перечисленных анестетиков. Дальнейшая техника выполнения внутрилегочной биопсии не отличается от такой при жесткой бронхоскопии.
Внутрилегочная биопсия во время бронхоскопии под наркозом жестким бронхоскопом позволяет сочетать ее с эндоскопией и другими эндобронхиальными диагностическими манипуляциями: «прямой» и спонг-биопсиями, пункционной биопсией внутригруд-ных лимфатических узлов, катетер- и браш-биопсией, бронхографией. Тубус бронхоскопа устанавливают на 1—1,5 см выше шпоры долевого бронха и фиксируют его так, чтобы устье выбранного
137
Рис 4 3 Фрагмент рентгенограммы грудной клетки в прямой проекции Катетеризацией ная биопсия при поднаркозной бронхоскопии
Очаг бронхолегочного поражения зондируют под контролем рентгенотелевизионного экрана. По достижении катетером периферического патологического образования щеточку выдвигают на 1—2 см из катетера, при этом она оказывается в центре очага поражения (рис 4 4) После выполнения биопсии щеточку вновь погружают в катетер, как бы в футляр, и извлекают ее вместе с катетером. Для приготовления цитологического препарата щеточку выдвигают из дистального конца катетера и полученный материал наносят на предметные стекла Материал щеточной биопсии представляет собой как бы соскоб (или отпечаток) с очага поражения с минимальным содержанием различных примесей, которые иногда мешают изучению цитологического препарата
Трансбронхи альна я внутрилегочная биопсия предназначена для получения непосредственно легочной ткани через бронхи Показаниями к ней служат диссеминированные легочные процессы неясной природы, саркоидоз органов дыхания (включая и медиастинальную форму заболевания с отсутствием рентгенологических изменений в легких), диссеминированный туберкулез легких,
136
бронха находилось в зоне видимости. После этого под контролем глаза в долевой бронх вводят направитель микрокусачек. Наилучшим вариантом при этом является использование в качестве направителя фибробронхоскопа, гибкий конец которого сгибается на 65° вверх и 35° вниз и может быть введен практически в любой субсегментарный бронх, обеспечивая дополнительную визуальную информацию о состоянии бронхов. Применение в качестве направителей металлических полых трубок из набора дыхательного бронхоскопа Фриделя позволяет проводить исследование с наименьшей эффективностью. Рентгеноконтрастный гибкий сердечный катетер № 12 как направитель более приспособлен для управляемой биопсии за счет определенной упругости и небольшого изгиба дистального конца.
Микрокусачки в кортикальную зону легкого выбранного сегмента направляют под контролем уже рентгенотелевизионного экрана. Не доходя до висцеральной плевры 1—1,5 см и убедившись в правильном положении щипцов, их на вдохе открывают, разрушая при этом бронхиолы, продвигают немного вперед (в пределах 0,5 см) и на выдохе закрывают бранши щипцов, захватывая легочную ткань (рис. 4.5). При извлечении микрокусачек рентгенотелевизионный экран позволяет зафиксировать эффективность проведенной биопсии по смещению легочного рисунка в момент отрыва кусочка паренхимы
легкого.
Биопсия легочной ткани осуществляется многократно (2—4—5 раз) за одну бронхоскопию из разных (предпочтительно III—V, VIII и IX) сегментов только одного легкого. В силу анатомических особенностей отхождения крупных бронхов предпочтительно производить внутрилегочную биопсию из правого легкого.
Сразу по окончании биопсии и через 24—48 ч после исследования необходим рентгенотелевизионный контроль для выявления возмож
ного травматического пневмоторакса.
С полученного в результате биопсии кусочка легочной ткани (размером не более 3*2 мм) снимают отпечатки на предметное
стекло для цитологического исследования, а сам кусочек погружают в формалин и направляют для гистологического исследования. Цитологическое изучение материала повышает эффективность трансбронхиальной внутрилегочной биопсии.
Использование комплексного Mopd ж *
•5CS
логического исследования с
включением гистологических окрасок, гистохимических методов, люминесцентной и электронной микроскопии позволяет снизить число случаев нераспознанной патологии при выполнении внутрилегочной биопсии.
При определении противопоказаний следует исходить из того, что риск исследования не должен превышать его необходимость для верификации диагноза. К противопоказаниям к жесткой бронхоскопии относятся: 1) заболевания сердечно-сосудистой системы (аневризма аорты, декомпенсированный порок сердца, недавно — 6 мес — перенесенный инфаркт миокарда, тяжелые формы гипертонической болезни); 2) активный туберкулез гортани; 3) острые интеркуррен-
138
Рис. 4.5. Фрагмент рентгенограммы грудной клетки в прямой проекции. Трансбронхиальная внутрилегочная биопсия во время фибробронхоскоп ии.
тные заболевания; 4) менструальный период и вторая половина беременности. Помимо этих общеизвестных противопоказаний, исключающих возможность проведения жесткой бронхоскопии под наркозом, выявлены и специфичные для внутрилегочной биопсии противопоказания — это тяжелые нарушения в системе гемостаза (нарушение свертывающей системы крови).
Трансбронхиальная пункционная биопсия внут-ригрудных лимфатических узлов или патологических образований средостения производится во время бронхоскопии, выполняемой как под местной анестезией, так и в условиях наркоза. Для исследования применяют иглы из нержавеющей стали длиной 55—60 см с ман-дреном (наружный диаметр рабочей части 1—2 мм). При наличии рентгенологических признаков аденопатии внутригрудных лимфатических узлов наиболее целесообразными для пункции являются следующие анатомические точки трахеи и бронхов: а) по правой стенке трахеи на 3—4 см выше шпоры бифуркации трахеи; б) по правому скату бифуркации трахеи на 1—2 см ниже от ее шпоры; в) строго по шпоре бифуркации трахеи кзади от ее центра. При пункции бронхопульмональных лимфатических узлов следует учитывать следующие точки: 1) шпора верхнедолевого бронха на 2— 3 мм кпереди или на то же расстояние ниже; 2) шпора среднедо
139
левого бронха. При пункции бифуркационных лимфатических узлов глубина прокола не должна превышать 3—4 см, оптимальная глубина — 2—2,5 см. Бронхопульмональные лимфатические узлы пунктируют не более чем на 0,5—1 см. Бифуркационную группу лимфатических узлов пунктируют 2—3, реже 3—4 раза, бронхопульмональные, как правило, — 1 раз. После извлечения иглы место пункции обрабатывают 20% раствором нитрата серебра.
Для получения разрежения в игле используют шприц емкостью 20 мл или шприц Жане емкостью 100 мл с соответствующим резиновым переходником. Полученный при пункции патологический материал (пунктат) шприцем выдувают на предметные стекла, затем
готовят мазки.
Показаниями к пункции лимфатических узлов средостения служат аденопатии внутригрудных узлов неясной природы при дифференциальной диагностике туберкулеза, саркоидоза I—II стадии, опухолевых процессов в средостении, определении метастазов рака легкого [Астраханцев Ф. А. и др., 1971; Борисов В. В. и др., 1976].
Губчатая, или спонг-биопсия — наименее травматичный, но в то же время и высокорезультативный метод биопсии. Он предложен в 1951 г. Carter, Nesbit и Piper. Авторы считают, что этот метод по результативности не уступает методу щипцовой биопсии при диагностике рака крупных бронхов. Метод довольно прост, нетравматичен. Стерильную поролоновую губку размером 0,5*0,5*0,5 см, зафиксированную бронхоскопическими щипцами, во время бронхоскопии подводят к месту патологически измененной слизистой оболочки и плотно удерживают в течение 30—45 с. Затем щипцы извлекают, и губку, впитавшую в себя клеточный субстрат бронхов, помещают в формалин, далее ее обрабатывают как гистологический препарат: блоки заливают в парафин и из них в необходимом количестве готовят среды. Материал окрашивают гематоксилином и эозином. В препаратах, как правило, определяются комплексы клеток, что способствует лучшей верификации процесса.
При проведении губчатой, или спонг-биопсии, кровотечение в бронхах не возникает, поэтому этот метод можно использовать в детской клинике — при бронхоскопии у детей, у которых другие виды биопсии применять нельзя из-за опасности повреждения нежной структуры бронхов.
Введение в комплекс бронхологического обследования различных дополнительных эндобронхиальных и трансбронхиальных манипуляций и исследований значительно повышает общую диагностическую ценность бронхоскопии при дифференциальной диагностике различных заболеваний легких и бронхов. Так, метод прямой, или щипцовой, биопсии патологически измененной ткани и крупных бронхов позволяет морфологически верифицировать туберкулезные изменения в 45—53%, неспецифические поражения бронхов — в 70—90% и опухолей крупных бронхов — в 86—91% случаев [Вознесенский А. Н. и др., 1968; Филиппов В. П., 1970, и др.].
Метод диагностического зондирования легких, или катетериза-
140
ционная биопсия, эффективен при трудно диагностируемом туберкулезе в 47%, при хронических неспецифических заболеваниях легких — в 60 %, периферическом раке легкого — в 86—91 % случаев. Этот метод позволяет диагностировать поражения легких при лимфогранулематозе, ксантоматозе, аденоматозе, гемосидерозе, карциноматозе у большинства обследуемых больных.
Метод трансбронхиальной внутрилегочной биопсии позволяет получать для цитологического, бактериологического и гистохимического исследования непосредственно легочную ткань. Эффективность этого метода колеблется от 55,8 до 79% [Филиппов В. П. и др., 1982; Крюков В. Л., 1983; Andersen Н., 1972; Grollmuss Н. et al., 1976, и др.] при дифференциальной диагностике диффузных диссеминированных процессов, а при пункционной биопсии лимфатических узлов средостения — от 15 до 94% в зависимости от техники выполнения игловой пункции, диаметра иглы, а также показаний и кратности выполнения самого исследования [Астраханцев Ф. А., 1971; Борисов В. В., 1973, и др.].
Диагностический бронхоальвеолярный лаваж (БАЛ). В 1961 г. Myrvik и соавт. посредством лаважа получили от кроликов альвеолярные макрофаги, чем положили начало новой эры в изучении биологии легочных клеток. Метод диагностического БАЛ с усовершенствованием бронхологической техники позволил получать клеточные элементы и ряд жидких компонентов бронхоальвеолярной жидкости от человека. Клетки из нижних отделов дыхательного тракта у человека извлекают с помощью ригидного бронхоскопа [Keimonitz, 1964; Tegner et al., 1977] или большого баллонного катетера, направленного в бронхи I—II порядка [Finley et al., 1981]. В настоящее время БАЛ чаще проводят с применением фибробронхоскопа, что делает эту процедуру менее инвазивной [Jager, 1977 ].
Обычно БАЛ осуществляют при фибробронхоскопия на уровне сегментарных и субсегментарных бронхов средней доли или SIII — справа. Возможно вмешательство и в другие доли, но проведение лаважа верхних сегментов SI, II более сложное из-за анатомического положения этих структур, затрудняющего введение катетера и ас
пирацию жидкости.
Общее число получаемых клеток составляет 5—10е 106 на 100 мл
лаважа. Через катетер в 5—8 приемов под давлением струйно инсталлируют по 20 мл (в общем объеме 100—150 мл) стерильный изотонический раствор NaCl, подогретый до 37 °C, pH 7,0—7,2. Бронхоальвеолярный смыв (БАС) аспирируют в силиконированную
емкость. Количество аспирируемой жидкости при этом достигает
40—60% от вводимого. Подсчет клеточных элементов производят
в камере Фукса—Розенталя. Полученный смыв центрифугируют, из осадка делают мазки, которые окрашивают по методу Райта— Романовского. Клеточный состав бронхоальвеолярного содержимого
определяют на основании подсчета не менее 500 клеток с иммер
сионной системой, при этом учитывают альвеолярные макрофаги,
лимфоциты, нейтрофилы и эозинофилы. Клетки бронхиального эпи
141
телия не учитывают в связи с их незначительным количеством (не более 2—4%, по нашим данным).
Исследование липидного спектра бронхоальвеолярных смывов у больных туберкулезом легких может служить дополнительным тестом при определении активности специфических изменений в легких в случае малых форм. Тонкослойная хроматография является достаточно информативным методом для выявления характера и степени диспропорций липидного спектра при легочном туберкулезе и хроническом бронхите.
По Voisin (1975), в БАС у здоровых некурящих содержится в среднем: альвеолярных макрофагов 93± 5%, лимфоцитов 7± 1 %, нейтрофилов, эозинофилов и базофилов менее 1%. При анализе данных исследования клеточного состава БАС обнаружено, что для многих заболеваний характерна вполне определенная эндопульмо-нальная цитограмма.
При легочном туберкулезе содержание лимфоцитов колеблется от 3 до 40%, но для абсолютного большинства больных с неактивным процессом или в фазе обратного развития специфического процесса характерна лимфопения с возрастанием до 61% среднего уровня нейтрофилов. Следует отметить, что у больных с малыми формами туберкулеза может наблюдаться нормальная эндопульмональная цитограмма. У больных саркоидозом отмечено значительное повышение количества лимфоцитов, причем в активной фазе заболевания оно увеличивалось до 47%. При обратном развитии процесса и под влиянием кортикостероидной терапии этот показатель снижается. В цитограмме БАС больных хроническим бронхитом отмечается увеличение в среднем до 33,8% количества нейтрофилов при снижении до 56,2% содержания альвеолярных макрофагов. При обострении хронического воспалительного процесса наблюдаются повышение в среднем до 42,1 % уровня нейтрофилов, невысокое (19,5%) число нейтрофилов при начинающейся ремиссии. У больных гнойным бронхитом резко возрастает, в среднем до 76%, количество нейтрофилов, а содержание альвеолярных макрофагов снижается до 16,8%. Выраженная эозинофилия (до 37—55%) БАС отмечается у больных бронхиальной астмой. У больных экзогенным аллергическим альвеолитом птицеводов определялись альвеолярные макрофаги (50,5%), лимфоциты (15,8%), нейтрофилы (25,7%), эозинофилы (2%).
Переносимость БАЛ, как правило, хорошая: пневмопатические осложнения наблюдаются очень редко (0,17% случаев), бронхоспастические— в0,6% случаев. Повышение до 37,5—38°С температуры тела в день комплексного бронхологического обследования и производства БАЛ наблюдалось у 19% больных [Хоменко А. Г. и др., 1983].
Хирургические методы биопсии. Трансторакальная игловая биопсия легких была описана еще в конце прошлого столетия. Различают две методики игловой биопсии легкого — аспирационную и пункционную. Первая позволяет получать материал для цитологического изучения, вторая — по существу истинная биопсия легочной ткани.
142
Показаниями к игловой биопсии легкого являются периферически
расположенные патологические образования опухолевого или вос
палительного характера, которые требуют морфологической иден-
тификации и которые не удается диагностировать при комплексном обследовании. Противопоказаниями служат сосудистые образования, эхинококк, легочно-сердечная недостаточность, эмфизема, наличие
одного легкого.
Для пункции легкого используют иглы Дальгрена и Сильвермена. Наружный диаметр иглы для пункционно-аспирационной биопсии легкого составляет 0,9—1,1 мм, длина — 20—25 см, но не менее 10—15 см. Специальная игла Сильвермена имеет направляющий троакар — иглу диаметром 1,5—2,5 см, через канал которой и производится биопсия. Пункционную биопсию выполняют под местной анестезией 0,25% раствором новокаина в положении больного лежа. Предварительно подкожно вводят 1 мл 2% раствора промедола или пантопона и 0,8—1 мл атропина. Исследование проводят под постоянным контролем на рентгенотелевизионном экране. Кожу, подкожную клетчатку, мышцы и межреберные мышцы анестезируют последовательно. Прокол иглой осуществляют медленно по верхнему краю нижележащего ребра. По достижении очага поражения, что документируется на телеэкране, очаг прокалывают, мандрен извлекают, подсоединяют шприц и производят неоднократную аспирацию. Иглу извлекают при сохранении небольшого разрежения. Полученный материал выдувают на предметные стекла.
При пункционной биопсии иглой Сильвермена после введения в легочную ткань иглы-троакара производят сначала аспирационную, а затем пункционную биопсию. В троакар вводят специальную расщепленную иглу, при поворачивании которой в очаге удается взять материал для гистологического изучения.
Эффективность метода трансторакальной игловой биопсии легкого колеблется, по данным различных авторов, от 60 до 96,1% в зависимости от характера легочной патологии [Шмелев Н. А., 1948; Голицина Л. В., Тимашева Е. Д., 1966; Коробов В. И. и др., 1972, и ДР-].
После проведения пункционной биопсии легкого могут наблюдаться различные осложнения: кровохарканье, травматический пневмоторакс, эмболия, легочное кровотечение и др. Описаны и леталь
ные исходы.
Медиастиноскопия была разработана в 1959 г. Carlens. В дальнейшем это диагностическое исследование получило развитие благодаря работам как зарубежных, так и отечественных авторов [Лукомский Г. И. и др., 1967; Knoche Е., Rink Н., 1964]. Показанием к этой операции служат медиастинальные аденопатии неясной природы при самых различных бронхолегочных заболеваниях: раке, саркоидозе, туберкулезе и др. Медиастиноскопия производится самостоятельно и в тех случаях, когда предшествующая бронхоскопия с транстрахеобронхиальной пункцией оказалась безрезультатной.
Операцию осуществляют под интубационным газовым наркозом. Через небольшой разрез на шее над яремной вырезкой после пе
143
ресечения platisma, подкожных вен тупым путем (пальцем) проникают до трахеи, образуя таким образом канал. В последний вводят медиастиноскоп, через который осматривают клетчатку и лимфатические узлы переднего средостения. При необходимости на исследование берут не только лимфатические узлы, но и клетчатку средостения. После операции в рану вводят антибиотики и дренаж на 1 сут.
Результативность медиастиноскопии очень высокая, однако операция требует особой осторожности при манипулировании в средостении, так как повреждение крупных сосудов весьма опасно.
Медиастинотомия — диагностическая операция, применя
емая по тем же показаниям, что и медиастиноскопия — оценка состояния лимфатического аппарата средостения. Доступ к средостению осуществляется через иссечение кусочков хряща до 2,5—3 см II или III ребра как справа, так и слева. При необходимости через этот подход возможно сделать и биопсию легкого.
Медиастиноскопия и медиастинотомия дают возможность определить характер внутригрудных аденопатий различной природы: при туберкулезе, саркоидозе, раке и других заболеваниях органов дыхания, сопровождающихся увеличением лимфатических узлов средостения [Роданов Р. и др., 1974; Лукомский Г. И., 1976, и др.].
Прескаленная биопсия по Даниельсу показана при увеличении лимфатических узлов, расположенных в прескаленной клетчатке, при саркоидозе, раке, лимфогранулематозе. Прескаленная биопсия лимфатических узлов и клетчатки производится и при наличии противопоказаний к медиастиноскопии и бронхоскопии. Операцию осуществляют, как правило, под местной анестезией. Разрез кожи 3—4 см делают параллельно ключице и несколько выше ее. Дальнейшее разделение тканей производят тупо и остро до появления жирокой клетчатки, в которой расположены увеличенные лимфатические узлы. Последние иссекают вместе с клетчаткой. При выполнении этой операции следует помнить, что правые надключичные лимфатические узлы являются коллектором лимфатических сосудов, идущих от правого легкого, а также нижней доли левого легкого; левые надключичные лимфатические узлы собирают приток лимфы от верхней доли слева.
Результативность операции по Даниельсу ниже, чем при других диагностических операциях, и колеблется от 14,5 до 70% в зави
симости от характера патологии и пальпации надключичных лимфа-
тических узлов. Наиболее результативна эта операция при саркоидозе
и определении метастазов рака
д. д.
и др., 1969, и др.].
Открытая биопсия легкого заключается в торакотомии и биопсии легочной ткани для последующего цитологического, бак-
териологического, гистохимического и электронно-микроскопического исследования. Показанием чаще служат диссеминированные легочные процессы неясной природы. Открытую биопсию выполняют под интубационным наркозом из бокового доступа справа в III, слева — в IV межреберье. Легочную ткань иссекают с применением
144
механического танталового шва аппаратом УКЛ-40 или других [Ор-жешковский О. В., 1983]. После интраплеврального введения антибиотиков рану грудной стенки ушивают послойно, иногда на не
сколько дней в плевральной полости оставляют дренаж. Возможности этой диагностической операции довольно высокие при саркоидозе, канцероматозе, атипично протекающем туберкулезе, альвеолярном протеинозе и многих других заболеваниях легких, характеризующихся диссеминированным поражением легочной ткани. По данным Ю. Н. Левашова и соавт. (1983), диагностическая информативность открытой биопсии легких при диссеминированных процессах приближается к 100%. Авторы, применив этот вид биопсии у 106
пациентов с диссеминированными процессами в легких, морфологически верифицировали диагноз заболевания у 104 больных.
Плевроскопия. Операция торакоскопии, предложенная Jacobeus в
1910 г. для пережигания спаек у больных туберкулезом, в настоящее
время модернизирована и рассматривается как диагностическое вмешательство с целью осмотра плевральной полости, легкого и выполнения биопсии. Плевроскопию проводят как при местном, так и общем обезболивании. Предварительно, за 1—2 дня, накладывают искусственный пневмоторакс, а при наличии плеврита экссудат заменяют воздухом. Торакоскоп вводят, как правило, в положении больного на здоровом боку в IV или V межреберье. Для выполнения биопсии измененной плевры или легкого вводят второй торакоскоп. При наличии фиб-робронхоскопа биопсию можно выполнить через один торакоскоп, так как фиброскоп имеет внутренний канал для проведения биопсийных щипцов. После осмотра плевры и легкого, а также выполнения биопсии
торакоскоп извлекают, предварительно максимально удалив воздух из плевральной полости. Рану ушивают послойно. Диагностическая ценность плевроскопии при экссудативных плевритах неясной природы, рецидивирующих спонтанных пневмотораксах, саркоидозе и других поражениях как плевры, так и легочной ткани довольно высокая [Алиев М. А. и др., 1982 ].
4.9. ЦИТОЛОГИЧЕСКИЕ МЕТОДЫ
Для проведения дифференциальной диагностики туберкулеза и
других заболеваний легких в клинической практике используют
методику цитологического исследования мокроты.
У больных (особенно при активном процессе) мокрота гнойнослизистая или слизисто-гнойная.
При цитологическом исследовании мазков весьма небольшое ко-
личество неитр
илов выявляется в стадии выраженной дегенерации
на фоне детрита типа казеозного, имеющего вид крупинок и окрашенного в темно-фиолетовый цвет. Характерны также скопления
моноцитоидных монону клеаров, крупных клеток с ядром неправильной формы и бледно-голубой протоплазмой. Среди них отмечаются формы, переходные к эпителиоидным.
Мононуклеарные клетки рассматривают как исходные элементы, из которых формируются эпителиоидные бугорки. Кроме того, в
145
препаратах часто обнаруживают эозинофилы в значительных скоплениях. Увеличение количества эозинофилов у одних больных можно связать с приемом химиопрепаратов, обусловливающих эозинофилию в периферической крови и соответственно в мокроте, у других — с проявлением местных аллергических реакций на туберкулезную инфекцию. Наиболее характерными элементами туберкулезного воспаления в препаратах являются элементы туберкулезной гранулемы — эпителиоидные и гигантские клетки Пирогова — Лангханса. Чаще они обнаруживаются у больных с активной формой процесса, протекающего с распадом и выделением микобактерий туберкулеза.
Элементы специфического воспаления в мокроте выявляются в 14—32% наблюдений. Нередко при распаде обызвествленных очагов в легком можно обнаружить аморфные фосфаты в виде кристаллов желтоватого цвета различной величины. Учитывая дифференциально-диагностическое значение анализа мокроты, следует отметить, что цитология мокроты имеет существенное значение в диагностике бластоматозных процессов, некоторых диссеминированных поражений легких, симулирующих туберкулез (как канцероматоз), медиастинальной легочной форме лимфогранулематоза, гемосидероза и др.
С целью дифференциальной диагностики туберкулеза легких анализируют тканевый субстрат, аспирируемый эндобронхиальным методом и аспирационной биопсией легких. В случаях же поражений внутригрудных лимфатических узлов применяют метод трансбронхиальной пункционной игловой биопсии.
При катетеризационной биопсии материал представляет собой взвесь клеточных элементов в изотоническом растворе NaCl. Прежде чем исследовать этот материал, содержимое пробирки предварительно центрифугируют. Затем жидкость из пробирки сливают, а из осадка приготовляют мазки. Препараты изготовляют при вращательном движении по поверхности предметного стекла. С этой целью используют деревянные палочки либо пластиковые петли. После высыхания на воздухе в течение 30 мин препараты окрашивают по Райту—Романовскому, высушивают на воздухе и подвергают исследованию. Осадок по возможности используют целиком.
При взятии материала с помощью трансбронхиальной внутри-легочной щипцовой биопсии, игловой пункционной биопсии легких и внутригрудных лимфатических узлов, а также щеточной биопсии препараты готовит врач-бронхолог. При использовании щеточной биопсии, осторожно сняв полученный материал со щеточки иглой, размазывают его шлифованным стеклом по предметному стеклу. Так же приготовляют мазки из материала, полученного с помощью внутрилегочной щипцовой биопсии. При трансбронхиальной пункционной биопсии внутригрудных лимфатических узлов и аспирационной игловой биопсии легких материал выдувают из иглы при помощи поршня шприца на стекло, размазывают, высушивают на воздухе и окрашивают по Райту—Романовскому.
При исследовании соскоба со слизистой оболочки бронхов полученный материал снимают с кусачек и на месте приготовляют препараты-мазки. После высушивания на воздухе их направляют в
146
лабораторию, где окрашивают и затем исследуют. Метод отпечатков мазков применяют при исследовании резецированного кусочка ткани. Такие мазки приготовляют путем осторожного прикладывания предметного стекла к материалу. Для получения более качественного препарата мы рекомендуем производить соскоб скальпелем, затем его размазывать на предметном стекле.
При обработке препаратов-отпечатков со слизистой оболочки бронхов материал, полученный с помощью ватных тампонов при бронхоскопии, тотчас размазывают на предметном стекле. В течение 5—10 мин препараты высушивают на воздухе и доставляют в лабораторию.
При исследовании биоптатов и аспиратов в случае туберкулезного процесса с творожистым перерождением выявляется характерный признак — наличие казеозного детрита, располагающегося в виде аморфных масс темно-фиолетового цвета. В детрите часто обнаруживаются соли извести в виде кристаллов различной величины, слегка опалесцирующих, с бледновато-желтоватым оттенком. При разжижении казеозных масс отмечается детрит с наличием небольшого количества нейтрофилов в стадии дегенерации. Казеозный детрит чаще наблюдается при туберкулемах в фазе распада, первичном туберкулезе и натечных абсцессах. Кроме того, для туберкулеза характерно наличие неизмененных и в стадии фиброзирования эпителиоидных бугорков и гигантских клеток типа клеток Пирогова—Лангханса (рис. 4.6, 4.7).
Все большее распространение получают исследования бронхоальвеолярных смывов (БАС). На основании цитограммы БАС можно установить степень активности процесса, провести коррекцию терапии и уточнить характер заболевания. Рекомендуется одновременно производить обзорный просмотр препаратов, что дает возможность в ряде случаев выявить специфические элементы для определенной нозологии.
Для подсчета общего количества клеток в 1 мл БАС 10 капель профильтрованного смыва смешивают на часовом стекле с каплей жидкости Самсона. Этой смесью заполняют счетную камеру. Клеточные элементы подсчитывают во всей камере без учета клеток бронхиального эпителия и определяют их число в 1 мл смыва. Оставшийся профильтрованный БАС центрифугируют при комнатной температуре в течение 10 мин со скоростью 1500 об/мин. Из осадка готовят мазки, которые высушивают на воздухе и затем окрашивают в течение 4—5 мин по гематологической методике. Клеточный состав БАС определяют на основании подсчета не менее 500 клеток. При этом учитывают альвеолярные макрофаги, лимфоциты, нейтрофилы, эозинофилы. Клетки бронхиального эпителия во внимание не принимают. Соотношение клеток БАС в норме составляет: макрофаги — 90—93%, нейтрофилы — 0—1%, лимфоциты — 5—10% [Bergmann, 1981; Davis et al., 1982].
У больных туберкулезом эндопульмональная цитограмма характеризуется преимущественно повышенным уровнем нейтрофилов, а при саркоидозе имеет место лимфоцитарный тип. При этом высокое содержание лимфоцитов отмечается в активной фазе процесса.
ilW
ilW
147
Рис 4 6 Препарат материала катетер-биопсии легких Казеозный детрит при туберкулезе легких * 730
Рис 4 7 Препарат материала трансбронхиальной внутриклеточной био псии Эпителиоидные клетки * 730
148
4.10. БИОХИМИЧЕСКИЕ МЕТОДЫ
Биохимические методы позволяют оценить состояние систем гуморальной регуляции и отдельных звеньев обменных процессов, функциональное состояние эндокринных и паренхиматозных органов. Из сочетания этих компонентов складывается индивидуальное состояние неспецифической реактивности организма больного, которое определяется генетическими факторами, возрастом, наличием сопутствующих заболеваний, аллергией, а также фазой, длительностью и распространенностью туберкулезного процесса в легких.
Биохимические исследования, проводимые в разные периоды наблюдения за больными, имеют различные задачи. При первом контакте больного с врачом решаются вопросы установления диагноза, определения активности и остроты туберкулезных изменений в легких, выбора оптимальных методов специфической и патогенетической терапии. Биохимические сдвиги при развитии любого воспалительного процесса по своей природе неспецифичны, ни один из биохимических тестов не может служить абсолютным диагностическим критерием.
Для оценки наличия и остроты воспалительного процесса в минимальный комплекс исследований целесообразно включить определение количества гаптоглобина, церулоплазмина, С-реактивного белка (СРБ). С целью выявления скрытой реактивности туберкулезного процесса А. Е. Рабухин и Р. А. Иоффе предложили белковотуберкулиновую пробу. Белковые фракции сыворотки крови определяют до подкожного введения 20 ТЕ ППД-Л и через 48 ч после введения. При наличии скрытой активности под влиянием туберкулина воспаление в очагах «оживляется», что отражается в увеличении количества а2-глобулиновой фракции; проба считается положительной при увеличении а2-глобулинов более чем на 10% от исходного уровня. Чувствительность пробы умеренная, особенно у взрослых больных. Более чувствительным туберкулино-провокационный тест оказывается при использовании в качестве контрольного показателя содержания гаптоглобина. Оценка результатов аналогична приведенной выше. При увеличении содержания гаптоглобина не менее чем на 10% проба считается положительной.
Поскольку в последние годы наблюдается тенденция к нарастанию частоты сочетания туберкулеза с сахарным диабетом, у всех больных при поступлении в стационар необходимо определять содержание глюкозы в крови. При пограничных значениях, превышающих 5,55 ммоль/л (верхняя граница нормы), необходимо проводить пробу на толерантность к глюкозе (нагрузка 50 г глюкозы с последующим определением уровня ее в крови через 1 и 2 ч). Для оценки состояния печени необходимо иметь представление о целостности ее паренхимы, а также о состоянии желчевыделительной, антитоксической и синтетической функций.
Наиболее широкое распространение для диагностики паренхиматозных повреждений печени получило определение активности аланин- и аспартатаминотрансфераз (АЛаТ и АСаТ). АСаТ содер
149
жится не только в гепатоцитах, но и в клетках миокарда и поперечнополосатых мышц. Поэтому при инфаркте миокарда и массивной травме мышечной ткани (например, при операции) активность этого фермента в крови может кратковременно нарастать у больных с неповрежденной печенью. Значительно более специфичным для паренхиматозных повреждений печени является повышение активности АЛаТ и отношения АСаТ/АЛаТ, которое в норме колеблется в пределах 1. Возрастание активности аминотрансфераз в пределах удвоенной нормы обычно свидетельствует об умеренно выраженных повреждениях, а выше удвоенной и тем более утроенной нормы — о развернутой картине паренхиматозного гепатита. Увеличение активности лактатдегидрогеназы-5 (ЛДГ5) на фоне положительной динамики легочного процесса и субъективно хорошей переносимости
лечения служит ранним признаком начальных лекарственных повреждений гепатоцитов до их клинического проявления. Определяют
активность и других ферментов, органоспецифических исключитель-
но для печени (фруктозо-1-монофосфатальдолаза, урокининаза).
Определенное представление об антитоксической функции печени
дает фракционное исследование билирубина крови. Если процесс связывания билирубина в печени нарушен, то в крови умеренно повышается содержание непрямого (свободного) билирубина, тогда
как прямая реакция остается отрицательной. Аналогичная ситуация
может сложиться при значительном гемолизе, когда печень не успевает «справляться» с большим количеством поступающего свободного билирубина (гемолитическая желтуха). Однако значительный гемолиз обычно имеет и другие проявления (анемия, возникновение молодых форм эритроцитов). Вне гемолиза увеличение уровня непрямого билирубина при отрицательной прямой реакции свидетельствует о нарушении антитоксической функции печени (способность образовывать парные соединения) и часто сопутствует (а иногда и предшествует) развитию побочных реакций на противотуберкулезные препараты.
Вариантом оценки антитоксической функции печени служит изучение ее экскреторной функции, которое проводят при помощи бромсульфалеиновой пробы. Эта проба очень чувствительна, проста в исполнении и позволяет получить достоверные данные для прогноза и раннего выявления побочного действия лекарств.
О нарушении желчевыделительной функции печени (холестаз) свидетельствует повышение в крови содержания тех соединений, которые являются нормальными компонентами желчи (прямой билирубин, щелочная фосфатаза, у-глутамилтранспептидаза, /?-липо-п роте иды). Если количество этих соединений возрастает, а активность аминотрансфераз остается в пределах нормы, то следует думать о холестазе, если имеется одновременное повышение обоих показателей — о паренхиматозном гепатите.
Паренхиматозные изменения чаще возникают в результате применения гепатотоксичных лекарств, а явления холестаза — при развитии токсико-аллергических реакций на любые препараты.
Пробы на коллоидную устойчивость сывороточных белков помо
150
гают выявить как паренхиматозный, так и интерстициальный (па-распецифический, токсико-аллергический) гепатит. Вариантами этих проб являются сулемовая, проба Вельтмана, реакция Таката — Ара, тимоловая проба.
При развитии лекарственной аллергии к любым препаратам нередко в процесс вовлекаются почки, развиваются аллергические гломерулиты и васкулиты. Поэтому функциональное исследование почек необходимо не только до начала лечения, но и в процессе его. Показаниями к таким повторным исследованиям служат применение потенциально нефротоксичных антибиотиков (через 2 мес после начала лечения и затем ежемесячно) и развитие выраженных аллергических реакций на любые препараты (в ближайшие 1—2 дня после реакции).
Минимальную и в то же время достаточную для оценки состояния почек информацию дает определение их фильтрационной, концентрационной и азотовыделительной функций. Всем этим требованиям отвечает проба Реберга—Тареева, дополненная определением уровня мочевины или остаточного азота крови.
При первом исследовании умеренное снижение примерно до 60 мл/мин начального процесса мочеобразования — клубочковой фильтрации — может сопутствовать инфильтративной фазе туберкулезного процесса (токсико-инфекционная почка). Такое снижение не является противопоказанием к применению потенциально нефротоксичных антибиотиков, а по мере снятия явлений туберкулезной интоксикации величина клубочковой фильтрации нередко нарастает. Снижение фильтрации в процессе лечения следует рассматривать как проявление побочного действия лекарств. Исходная клубочковая фильтрация ниже 60 мл/мин отражает наличие осложнений туберкулеза (амилоидоз, сердечная недостаточность) или сопутствующих почечных заболеваний. Во всех этих случаях, кроме сердечной недостаточности, назначение потенциально нефротоксичных антибиотиков нежелательно, так как, во-первых, при исходной почечной патологии чаще выявляется их нефротоксическое действие, а во-вторых, указанные антибиотики выделяются из организма преимущественно по механизму клубочковой фильтрации и при значительном снижении последней возможна кумуляция препаратов в организме с нарастанием их ототоксического эффекта. При развитии лекарственной аллергии, а также в ранних стадиях амилоидаза (в обоих случаях за счет повышения проницаемости клубочкового фильтра) иногда наблюдается патологическое увеличение клубочковой фильтрации — более 150 мл/мин.
Снижение концентрационной способности почек, о чем свидетельствует уменьшение реабсорбции воды в канальцах ниже 97% и концентрационного индекса эндогенного креатинина ниже 40, всегда говорит о значительной давности и распространенности патологического процесса в почках и функциональной неполноценности почек.
Азотовыделительная функция почек не нарушается длительно, пока сохраняется не менее 30% почечной паренхимы. Поэтому
151
увеличение количества азотистых шлаков крови в процессе лечения (и даже в пределах нормы) должно привлекать внимание, а превышение верхней границы нормы всегда свидетельствует о почечной недостаточности*
Следующим аспектом исходного биохимического исследования является оценка способности организма больного метаболизировать лекарства. Как эффект лечения, так и частота и выраженность побочных реакций токсического характера в значительной степени определяются «высотой» максимальных концентраций и длительностью циркуляции лекарственных препаратов в крови, а также путями их обезвреживания (инактивации). Так, темп ацетилирования ГИНК в организме при полноценном функционировании печени генетически детерминирован, не изменяется с возрастом и в процессе лечения. Все люди по скорости, с которой у них происходит ацетилирование ГИНК, делятся на быстрых и медленных инактиваторов (ацетиляторов). У медленных инактиваторов в метаболизм ГИНК
включаются процессы микросомного окисления в печени, при этом образуются продукты, более токсичные, чем ацетилизониазид. Свободный ГИНК и продукты его метаболизма выводятся почками, поэтому по содержанию этих соединений в моче (суточной или порционной) можно судить о характере инактивации препарата в организме. Установление типа инактивации целесообразно проводить
в самом начале для определения режима лечения (дозы, ритм).
Среди систем гуморальной регуляции большое внимание на формирование неспецифической реактивности оказывает состояние кал-
ликреин-кининовой системы крови (КС). КС в организме выполняет функцию физиологической адаптации кровообращения к изменяющимся условиям внешней и внутренней среды. Локальная активация КС обусловливает местную гиперемию, повышение сосудистой проницаемости, хемотаксис нейтрофилов. По сути это является защитной реакцией при повреждении тканей, но при нарушении физио
логического контроля внутри системы может выступить в качестве неуправляемого фактора воспаления. При аллергических реакциях образование комплексов антиген—антитело приводит к генерализованной активации КС с тотальным повышением сосудистой прони
цаемости и снижением артериального давления.
Ранним фазам активного туберкулезного процесса в легких сопутствует адаптивная компенсированная активация КС, что проявляется в равномерном сбалансированном увеличении содержания всех ее компонентов (предшественников, кининообразующего фермента калл ик реина, кинин разрушающих ферментов). У лиц с сомнительной активностью патологического процесса при подкожном введении 20 ТЕ ППД-Л через 24 ч наблюдается отчетливое повышение уровня калликреина, а через 48 ч увеличивается активность кининразрушающей кининазы I, что позволяет использовать этот тест как один из вариантов туберкулинпровокационных проб. При развитии деструкции, выраженной интоксикации, генерализации
процесса, на высоте аллергических и токсико-аллергических лекарственных реакций КС активируется из-за высокого уровня калл и-
152
креина при подавлении активности кининразрушающих ферментов (иногда с истощением предшественников). Такое состояние КС служит патогенетическим фактором в развитии указанных состояний и требует лекарственной коррекции антикининовыми препаратами [Каминская Г. О. и др., 1979; Свистунова А. С., 1980; Макинский А. И., 1981; Келеберда К. Я. и др., 1982].
Не меньшее значение в формировании характера ответной реакции организма на внедрение возбудителя туберкулеза имеет система универсальных биорегуляторов простагландинов (ПГ) и «сопряженных» с ними внутриклеточных посредников в действии на клетки гормонов и биологически активных веществ — циклических нуклеотидов (цАМФ и цГМФ). ПГ различных классов (Е и оказывают сильное и разнонаправленное действие как на состояние сосудистой проницаемости и хемотаксис фагоцитирующих клеток, так и на реакции клеточного иммунитета. Благоприятному течению туберкулезного процесса сопутствует сбалансированный рост уровня ПГ Е и При прогрессировании процесса физиологические соотношения между обоими классами ПГ нарушаются [Сокол Т. В., 1984].
Существенное влияние на состояние неспефической реактивности оказывает усиление процессов перекисного окисления липидов (ПОЛ). При туберкулезной интоксикации такое усиление приобретает универсальный характер, отрицательно влияя на течение локального процесса, толерантность к туберкулостатикам и выраженность остаточных фиброзных изменений. Биохимические методы позволяют оценить интенсивность ПОЛ по количеству начальных и конечных продуктов этого процесса (диеновые конъюгаты, малоновый диальдегид) и степень эндогенной антиоксидантной защиты (антиокислительная активность, содержание в крови естественного антиоксиданта а-токоферола). Выраженность и сбалансированность процессов ПОЛ четко коррелируют с фазой туберкулезного процесса и степенью интоксикации и вместе с тем служат обоснованием и критерием для применения антиоксидантной терапии.
Деятельность систем гуморальной регуляции в значительной степени детерминирована функциональным состоянием коры надпочечников. Вследствие адаптивной природы деятельности данного органа при свежих формах туберкулеза легких функция коры надпочечников «возбуждается», что увеличивает продукцию как противовоспалительных глюкокортикоидов, так и провоспалительных минералокортикоидов. Соотношение между выделением этих двух классов гормонов у различных больных может сильно варьировать. При относительном преобладании противовоспалительных глюкокортикоидов создаются предпосылки для отграничения процесса и торпидного его течения, а избыток минералокортикоидов (дискор-тицизм), напротив, обусловливает экссудативный характер процесса, склонного к прогрессированию. Кроме того, при последнем варианте соотношений кортикостероидов значительно выше возможность развития побочных реакций на противотуберкулезные препараты [Гурьева И. Г., 1974].
153
При известной продолжительности процесса и выраженности интоксикации функциональные резервы коры надпочечников постепенно истощаются. Вначале это истощение носит латентный характер: содержание гормонов в крови и экскреция их с мочой повышены. Однако такой уровень предельный, и при нагрузке АКТГ функция коры надпочечников не усиливается, иногда наблюдается парадоксальный эффект. При стрессе (операция) может развиться острая сердечно-сосудистая недостаточность вплоть до коллапса и шока.
У больных с хроническими формами туберкулеза легких при большой продолжительности заболевания полностью истощаются функциональные резервы коры надпочечников, и орган уже не может не только адекватно ответить на дополнительную нагрузку, но и обеспечить стабильный физиологический уровень гормонов в крови. В таких условиях возникает состояние гипофункции коры надпочечников (гипокортицизм, «малый аддисонизм»), выявляемое клинически и создающее предпосылки к острому прогрессирующему течению туберкулезного процесса в легких и низкой толерантности к туберкулостатикам. Если состояние латентной гипофункции надпочечников приобретает большое значение в хирургической практике, то клинически выявляемый гипокортицизм предопределяет необходимость в гормонотерапии у терапевтических больных.
Биологическим материалом для исследования функционального состояния коры надпочечников служат кровь и моча. Поскольку у человека кортикостероидные гормоны и их метаболиты выделяются почками, по их содержанию в суточной моче можно оценить уровень экскреции (и соответственно, секреции). С мочой выделяются как продукты полного метаболизма гормонов 17-кетосте-роиды (17-КС), так и неизмененные гормоны или метаболизированные частично с сохранением их биологических свойств — 17-оксикортикостероиды (17-ОКС). Определение только суточной экскреции 17-КС, нередко рекомендуемое для оценки функционального состояния коры надпочечников у больных туберкулезом, недостаточно информативно, поскольку 17-КС образуются в печени, а при ее недостаточности синтез и выделение гормонов могут падать, количество же неметаболизированных активных гормонов, циркулирующих в крови, напротив, увеличивается. Кроме того, 17-КС являются продуктами метаболизма не только кортикостероидов, но и мужских половых гормонов. Поэтому полное представление о «размерах» секреции гормонов корой надпочечников дает лишь определение суточной экскреции одновременно 17-КС и 17-ОКС. При этом высокий уровень экскреции данных соединений может маскировать состояние латентной недостаточности, которое выявляется только путем двукратных исследований до и после 3-дневной нагрузки АКТГ. Определение в крови суммарного содержания 17-ОКС, их свободных и белковосвязанных форм, а также концентраций гидрокортизона и кортикостерона (или альдостерона) позволяет определять биологическую активность циркулирующих гормонов и взаимоотношение между их глюкокортикоидным и минералокортикоидным компонентами.
154
4.11. ИММУНОЛОГИЧЕСКИЕ МЕТОДЫ
Оценка состояния основных систем иммунитета, определение их
клеточных структур, а также степени развития специфических им-
мунологических реакций могут помогать в решении ряда задач в клинике туберкулеза: активность процесса, характер течения забо
левания, дифференциальная диагностика. Уточнение иммунологи-
ческого статуса больного важно перед оперативным вмешательством,
а также при определении показаний к назначению иммуномодуляторов. Иммунологические методы применяют для диагностики ле
карственной непереносимости, возникающей в процессе химиотерапии. Для оценки иммунного статуса больных используют набор иммунологических методов: тесты оценки состояния Т- и В-лимфо-цитов и их субпопуляций (особенно регуляторных) с количественной характеристикой и определением функциональной активности иммунокомпетентных клеток, определение сенсибилизированных к соответствующим антигенам Т- и В-лимфоцитов или их продуктов (медиаторов и антител).
Ценную информацию могут дать исследования, направленные на обнаружение антигенов микобактерий или других микроорганизмов в таком наиболее доступном материале, как кровь [Авербах М. М. и др., 1984]. Важное значение имеет определение факторов неспеци-
фической реактивности, к которым относятся, например, различные
компоненты системы комплемента. Широко используются также
реакции для определения функции фагоцитов (полинуклеаров и
макрофагов, особенно альвеолярных) при легочных заболеваниях
а также различных сывороточных белков, гормонов и др.
Тесты количественной и функциональной оценки Т-лимфоцитов и их субпопуляций. Ро з етко обра зов а ни е с бараньими эритроцитами. Установлено, что розетки с эритроцитами ба
рана образуют Т-лимфоциты [Чередеев А. Н., 1976; Jondal М. et al.,
1972 ]. Для постановки данного теста выделяют лейкоцитарную массу путем отстаивания гепаринизированной или дефибринированной крови (спонтанное отстаивание или с добавлением желатина), затем лейкоциты осаждают центрифугированием либо лимфоциты выделяют из цельной крови центрифугированием в градиенте фиколл/ге-пак (уротраст, изопак, верографин). После этого лимфоциты соединяют с эритроцитами барана и через определенный срок инкубации готовят мазки, которые фиксируют глутаровым альдегидом и окрашивают азур-эозином (или просматривают в камере Горяева нативные препараты). В препаратах определяют процент лимфоцитов, образовавших розетки с эритроцитами (не менее 3 эритроцитов, прикрепившихся к одному лимфоциту). Рекомендуется также пересчет количества розеткообразующих клеток в абсолютных показателях (так как число лимфоцитов в крови при различной патологии, естественно, имеет большие колебания). В норме в крови обнаруживается 50—70% розеткообразующих Т-клеток.
Для определения и подсчета Т-лимфоцитов используют моноклональные антитела (ОКТ или других серий) против маркеров
155
Т-лимфоцитов. Проба состоит из этапов добавления моноклональных антител к взвеси лимфоцитов, антисыворотки против иммуноглобулинов, включающей, например, радиоактивную или флюоресцирующую метку, с последующей ее регистрацией.
Реакция стимуляции Т-лимфоцитов митогенами. Показано, что ряд митогенов, в первую очередь таких, как фитогемагглютинин (ФГА) и конканавалин А (кон-А), вызывают бласттрансформацию и митозы Т-лимфоцитов [Ling М., 1975]. Для постановки теста с ФГА лейкоциты или лимфоциты выделяют описанным выше способом и затем культивируют в присутствии митогена в течение 72 ч. По окончании культивирования готовят мазки, которые окрашивают азур-эозином или другим методом и определяют процент бластных клеток (молодых клеточных форм) и/или митозы. В норме в культурах с ФГА обнаруживается 60—95% бластных клеток.
Другим способом оценки активации лимфоцитов под действием митогенов является определение включения 3Н-тимидина (или других меченых предшественников нуклеиновых кислот или аминокислот) в ДНК. 3Н-тимин добавляют в культуры лимфоцитов за 2—12 ч до конца культивирования. После инкубации клеточную массу отмывают, лизируют NaOH, гиамином или растворителем NCS (для выхода включенной радиоактивности в жидкость), помещают в сцин
тилляционную жидкость и определяют число импульсов в опыте (культура с ФГА) и контроле (без ФГА) в жидкостном сцинтилляционном счетчике (например, отечественный счетчик СБС).
Определение субпопуляций Т-лимфоцитов производят различными способами. Существуют способы определения по степени связывания этих клеток с эритроцитами барана (активное, авидное, стабильное, аффинное розеткообразование, гигантские розетки и т. д.), по чувствительности к теофиллину и др. Наиболее признанным и распространенным методом является определение количества Т-хелперов (индукторов и Т-супрессоров) цитотоксических лимфоцитов по наличию на их поверхности рецепторов для Fc-фрагментов IgM и IgG (Т^ и Ту-лимфоциты) [Петров Р. В. и др., 1980; Moretta A. et al., 1977].
Для постановки данного теста используют эритроциты быка, покрытые кроличьими антителами класса IgM (для определения Т-хелперов) и IgG (для определения Т-супрессоров). Реакция состоит из нескольких этапов. Вначале выделяют лимфоциты на градиенте фиколл/верографин, от макрофагоподобных примесей освобождаются при инкубации клеток на пластиковых чашках Петри. Неприлипшие лимфоциты смешивают с эритроцитами барана, обработанными нейраминидазой. После инкубации вновь отделяют на градиенте Т-лимфоциты, образовавшие розетки с эритроцитами (в осадке при центрифугировании), от В-лимфоцитов (в интерфазе). Этот этап можно повторить для лучшей очистки. Розетки разделяют хлоридом аммония или дистиллированной водой, и освобожденные Т-лимфоциты используют в реакции розеткообразования с эритроцитами быка с IgG-антителами для определения Ту-лимфоцитов
156
(супрессоров). После 12-часовой инкубации в термостате в культуральной среде, содержащей 15—20% телячьей эмбриональной сыворотки и некоторые добавки, для восстановления IgM-рецепторов Т-клетки используют в реакции розеткообразования с эритроцитами быка, покрытыми IgM-антителами для определения Т^-лимфоцитов (хелперов).
Для функциональной оценки субпопуляций Т-хелперов и Т-суп-рессоров можно разделить эти клетки (после постановки реакций розеткообразования) центрифугированием в том же градиенте фи-колл/верографин как это описано выше (см. выделение чистой взвеси Т-лимфоцитов).
Получены моноклональные антитела (например, ОКТ4 и ОКТ8 или других серий) для определения Т-хелперов или Т-супрессоров.
Определение супрессорной активности лимфоцитов (мононукле-аров) [по Петрову Р. В. и др., 1980]. Супрессивная активность моно-нуклеаров может быть определена при активации кон-А, используемого в относительно высокой концентрации или в так называемом спонтанном варианте. В первом случае испытывается действие на реакцию стимуляции тест-лимфоцитов в культуре с ФГА. Лимфоциты выделяют из крови больного (в градиенте фиколл/верографин), инкубируют в течение 24 ч в культуральной среде в присутствии кон-А, затем их рост останавливают митомицином С. Во втором случае применяют свежевыделенные лимфоциты больного, обработанные митомицином С и предварительно неинкубированные.
Тест-лимфоцитами могут служить аутолимфоциты, свежевыделенные из крови больного, либо лимфоциты донора. В разных количествах их смешивают с лимфоцитами, супрессивное действие которых используется, и определяют их активность в стимуляции бласттрансформации или синтеза ДНК в стандартной реакции с ФГА. Контролями служат: 1) реакция тест-лимфоцитов в «чистой популяции» в присутствии ФГА; 2) то же без ФГА; 3) тест-лим-фоциты с ФГА+лимфоциты больного, инкубируемые в культуральной среде в течение того же времени, но в отсутствие кон-А этот этап инкубации занимает 72 ч. О степени активирующего или спонтанного супрессивного действия судят по величине снижения (подавления) реакции стимуляции тест-лимфоцитов в культуре с ФГА. Показателем супрессии служит индекс, вычисляемый разными способами.
По данным Р. В. Петрова и соавт. (1980), у здоровых людей примерно в 13% случаев может быть обнаружена не супрессия, а активация пролиферации тест-лимфоцитов в указанных условиях. Mizarski и соавт. (1981) указывают, что активация чаще происходит при использовании низких концентраций кон-А (5 мкг/мл), при повышении дозы (до 20 мкг/мл) активация может проявляться только при уменьшении (до 24 ч) времени инкубации. Czernicki и соавт. (1981) при обработке мононуклеаров 40 мкг/мл кон-А ни в одном случае не обнаружили активацию.
Для оценки специфического клеточного противотуберкулезного иммунитета чаще используют реакции стимуляции лимфоцитов ту-
157
беркулином (ППД) и торможения миграции лейкоцитов с тем же
антигеном.
Реакция стимуляции лимфоцитов с ППД служит для определения степени сенсибилизации к микобактериальным антигенам (реакция обусловлена взаимодействием Т-клеток с ППД).
Методика постановки реакции при морфологическом учете бласт-
трансформации или при оценке степени синтеза ДНК не отличается
от учета реакции с ФГА (срок культивирования 96 ч, доза ППД
варьирует от 10 до 200 мкг). У здоровых туберкулинотрицательных
людей показатель реакции обычно не превышает 1 %
(при морфо-
логическом учете).
Реакция торможения миграции с ППД предназначена для тех же целей, что реакция бласттрансформации. Лейкоциты получают, центрифугируя плазму, выделенную из крови одним из описанных выше методов (см. постановку реакции бласттрансформации с ФГА). Осадок лейкоцитов набирают в стеклянные капилляры диаметром 1 мм, центрифугируют в них и помещают в культуральные камеры, содержащие питательную среду (контроль) и ППД (опыт). Результат реакции оценивают через 24 ч по соотношению площадей, занимаемых мигрирующими клетками в опыте и контроле. ППД применяют в концентрации 100—200 мкг/мл. У здоровых людей индекс реакции обычно варьирует от 0,8 до 1,2 (в зависимости от дозы антигена и наличия сенсибилизации клеток). Применяют также иные варианты метода, например миграцию лейкоцитов в агарозе [Стрельцов В. П., Владимирский М. А., 1977].
Тесты оценки количества и реактивности В-клеток. Комплементарные розетки. Установлено, что в присутствии комп
лекса эритроциты — антисыворотка и комплемент розетки с эритроцитами (например, человека) образуют В-лимфоциты [Mendes М. et al., 1973]. Для постановки данного теста лимфоциты выделяют теми же способами, которые описаны выше. Затем тест-эритроциты человека (лучше с кровью группы 0) инкубируют с антиэритроци-тарной сывороткой (получаемой от кроликов, иммунизированных эритроцитами человека). Следующий этап — инкубация эритроцитов, нагруженных антиэритроцитарными антителами, с комплементом (источник комплемента — донорская сыворотка крови человека). После этого готовую систему эритроциты — антитела к ним и комплемент соединяют с испытуемыми лимфоцитами, фиксируют их глутаровым альдегидом, делают мазки. Последний этап — окраска и подсчет розеткообразующих лимфоцитов — осуществляют тем же способом, что и при определении Т-розеток. В норме в периферической крови обнаруживают 10—20% комплементарных розеток.
Существуют и другие способы определения и подсчета В-лим-фоцитов, основанные на выявлении поверхностных маркеров этих клеток, например по наличию иммуноглобулиновых рецепторов с использованием системы эритроциты + антитела в методе розетко-образования. В-лимфоциты также могут образовывать розетки с эритроцитами мышей, в норме обнаруживается примерно 15—20% таких В-клеток. В последние годы появилась возможность определять
158
количество В-клеток с помощью моноклональных антител, получен
ных против их маркеров, аналогично определению других популяций и субпопуляций иммунокомпетентных клеток.
Определение иммуноглобулинов сыворотки крови методом им-
мунодиффузии по Mancini и соавт. (1965). Содержание иммуно-
глобулина в периферической крови отражает функцию В-клеток,
поскольку данные белки являются продуктами клеток этой популяции. Для постановки теста исследуемые сыворотки помещают в лунки в агаровом геле, содержащем антииммуноглобулиновые сыворотки (анти-IgG, IgM, IgA). Результат реакции оценивают, из
меряя диаметр колец преципитации, после чего вычерчивают график
зависимости квадратов радиусов колец преципитации от концентрации исследуемого иммуноглобулина в стандартной сыворотке. Вычислив квадрат радиуса кольца преципитации исследуемой сыворотки и антисыворотки и отложив это значение на графике, можно узнать количество иммуноглобулина в каждой исследуемой сыворотке. Необходимо помнить, что нормальное количество иммуноглобулинов различных классов у здоровых людей варьирует в зависимости от возраста.
Реакция стимуляции В-лимфоцитов липополисахаридом (ЛПС). Известно, что существует ряд митогенов, которые вызывают трансформацию В-клетки (например, ЛПС Е. coli, S. marcesscens, декстрансульфат).
Для постановки этого теста лейкоциты и лимфоциты получают описанным выше способом, затем их инкубируют с ЛПС в течение 72—96 ч и готовят мазки, в которых определяют число бластных клеток. Можно также учитывать активность В-лимфоцитов по степени включения 3Н-тимидина, как это описано для постановки РБТ с ФГА.
Специфический гуморальный иммунитет можно оценить по количеству антител к антигенам микобактерий, выявляемых в сыворотке крови больных с помощью различных сывороточных тестов.
Реакция агрегатгемагглютинации. Данная реакция является высокочувствительным вариантом реакции пассивной (непрямой) гемагглютинации. Эритроциты обрабатывают глутаровым альдегидом, затем нагружают туберкулином (ППД). В модификации реакции гемагглютинации Миддлбрука — Дюбо туберкулином нагружают нативные, а в модификации Бойдена — обработанные таннином эритроциты. Затем эритроциты соединяют с сывороткой, в которой выявляют противотуберкулиновые антитела. Диагностическим титром, по данным разных авторов, считается 1:8—1:16.
Реакция потребления комплемента (РПК) является модификацией реакции связывания комплемента. В отличие от последней в ней используют комплемент, имеющийся в сыворотке, в связи с чем сыворотки не подвергаются температурной инактивации. Это выгодно отличает данную реакцию от ее прототипа, поскольку температурная обработка нередко снижает титр антител.
РПК проводят в два этапа. Первый — взаимодействие антител, имеющихся в сыворотке крови больного, и антигена (например,
159
ППД) и присоединения к комплексу антиген — антитело комплемента, содержащегося в исследуемой сыворотке. Второй этап — добавление гемолитической системы (эритроциты барана + антисыворотка против эритроцитов барана), с помощью которой регистрируют степень потребления комплемента при первом этапе реакции. Следовательно, чем выше титр специфических антител, тем больше связалось комплемента комплексом антиген — антитело, меньше его осталось в сыворотке и тем в меньшей степени произошел гемолиз бараньих эритроцитов, а следовательно, слабее окраска надосадочной жидкости (интенсивность окраски регистрируют на ФЭК). Титр антител выражают в условных единицах (экстинкциях), соответствующих показаниям ФЭК, он равен разнице интенсивности окраски в контроле (к сыворотке вместо антигена добавлен изотонический раствор NaCl и, следовательно, гемолиз наиболее полный) и в опыте. Диагностическим титром считается показатель, равный 0,07.
Определение иммунных розеткообразующих лимфоцитов. Эта методика служит для количественного определения В-лимфоцитов, специфически сенсибилизированных к антигенам микобактерий. Лимфоциты выделяют обычным способом. Эритроциты человека (лучше с кровью группы 0) обрабатывают таннином и ППД. Как и в описанных выше других модификациях теста розеткообразова-ния, эритроциты соединяют с лимфоцитами и определяют число розеток в окрашенных препаратах [Вахидова Г. А., 1977]. У здоровых людей обнаруживается 1—3% таких розеток.
Туберкулинпровокационные тесты. Информативность различных иммунологических методов в значительной степени повышается, если постановку тестов на специфический гуморальный (например, РАГА) и/или клеточный (например, РБТ и РТМ) иммунитет сочетать с подкожным введением ППД (провокация). Иммунологические реакции ставят до и через 48 ч после подкожного введения ППД (в среднем 20 ТЕ детям и 50—100 ТЕ взрослым) [Гергерт В. Я., Борзенко А. С., 1973; Гергерт В. Я., 1984].
А. Е. Рабухин и соавт. (1980), С. М. Лобанова (1982) успешно применили иммуноглобулино-туберкулиновую пробу. Авторы определяли количество иммуноглобулинов классов G, А и М до подкожной провокации ППД, через 48 ч после нее и повторно через 7 дней. Также определяют число иммунных розеткообразующих лимфоцитов в сочетании с подкожной провокацией ППД.
Интерпретация результатов иммунологического исследования при туберкулезе приносит наибольшую пользу, если она осуществляется в сопоставлении с клинической характеристикой.
При активном туберкулезе показатели специфических иммунологических тестов обычно бывают положительными. В различные фазы течения активного туберкулеза эти показатели могут значительно варьировать. Так, по результатам, полученным при использовании реакций бласттрансформации и торможения миграции с ППД, первая реакция наиболее выражена при благоприятном течении процесса с быстрым рассасыванием специфических поражений
160
(показатели более 10% бластных клеток), а вторая — при прогрессировании процесса (индекс ниже 0,4—0,5) и наоборот. Наиболее высокие титры противотуберкулезных антител (1:256—1:1024) встре-
чаются при выраженной активности процесса и начавшейся поло-
жительной динамике. В эти же сроки можно отметить и самый
высокий процент (5—10) обнаружения иммунных розеткообразующих лимфоцитов. По данным В. Я. Гергерта (1984), при вспышке
заболевания уровень бласт
бразования в ответ на ФГА и число
Т-розеткообразующих лимфоцитов оказываются сниженными (соответственно 45—60% и 35—50%). В активной фазе туберкулеза несколько повышены (15—25%) содержание В-розеткообразующих лимфоцитов и уровень иммуноглобулинов некоторых классов (чаще IgA и IgG).
Выявление скрытой активности. При минимальной активности туберкулезного процесса показатели иммунитета в основном нормализуются и приближаются по своим значениям к значениям,
характерным для лиц с неактивными изменениями или для здоровых людей. В указанный период патологического процесса обычно не отмечается нарушений общих механизмов клеточного и гуморального иммунитета по количественным и функциональным характеристикам, показатели специфических тестов могут быть незначительно более выраженными (РБТ и уровень противотуберкулезных антител) по сравнению с таковыми при неактивном процессе или отрицательными (РТМ).
С помощью так называемых туберкулинпровокационных иммунологических тестов минимальную активность можно установить быстро и в достаточно высоком проценте случаев (75—90, по данным разных авторов). Обычно для этого применяют специфические клеточные иммунологические реакции в сочетании с подкожным введением ППД [Гергерт В. Я., Борзенко А. С., 1973; Рудой Н. М. и др., 1979; Гергерт В. Я., 1984]. Через 48 ч после такой провокации изменение показателей РБТ с ППД в сторону снижения не менее чем на 20% от первоначального уровня и уменьшение индекса РТМ с ППД не менее чем на 0,11 и ниже 0,8 указывают на наличие такой активности.
Результаты подобного исследования могут служить основанием для назначения специфического лечения, его окончания, а также могут быть полезными при дифференциальной диагностике тубер
кулеза.
В комплексе с указанными иммунологическими тестами в сочетании с подкожной туберкулиновой провокацией можно использовать сведения об изменении показателей и других специфических реакций, например таких, как РПГА или определение «иммунных» (к ППД) розеткообразующих лимфоцитов. Иммуноглобулино-ту-беркулинпровокационный тест применялся [Лобанова С. М., 1982] для оценки активности туберкулеза легких, при этом учитывались изменения уровня иммуноглобулинов, особенно через 2 сут и неделю после провокации. Постепенное нарастание количества этих белков свидетельствует об отсутствии активности патологического процесса,
6—1213
161
а резкое повышение (через 48 ч) с последующим снижением (через 7 дней) — о ее наличии.
Оценка эффективности лечения. Оценка иммунологического статуса больных туберкулезом перед лечением может способствовать анализу течения болезни в процессе терапии. Обычно нарушения показателей иммунитета (особенно специфического) соответствуют «протяженности» инфильтрации, распространенности поражений и массивности бактериовыделения [Хоменко А. Г. и др., 1969, 1981, 1982, 1984]. При этом чем меньше выражены нарушения в системе клеточного иммунитета, чем выше показатели специфического бластообразования и индексы реакции торможения миграции лейкоцитов при невысоком специфическом антителообразовании, тем благоприятнее протекает заболевание, быстрее прекращается бактерио-выделение, рассасывание инфильтрации и закрытие полостей распада.
При успешной химиотерапии нарушения характеристик различных систем иммунокомпетентных клеток, как правило, быстро ликвидируются, а показатели специфических иммунологических тестов претерпевают описанные выше изменения, соответствующие благоприятному течению туберкулеза. Наблюдение в динамике позволяет контролировать эффективность лечения. Быстрое и эффективное восстановление показателей иммунитета совпадает по срокам (а иногда и предшествует) с быстро наступающей положительной динамикой. Сохранение нарушений иммунитета, как правило, наблюдается при торпидном, затяжном течении туберкулеза и неэффективной химиотерапии. Так, если в процессе лечения не восстанавливаются до нормы количество и функциональная активность Т-лимфоцитов, у таких больных возможны обострения. Стойкое сохранение подобных дефектов после окончания основного курса лечения должно настораживать клинициста в отношении появления рецидивов.
Иммунологическое исследование, безусловно, необходимо для определения показаний к назначению различных иммуномодуляторов (левамизол, диуцифон, тималин, Т-активин и др.) в комплексном лечении туберкулеза легких, а также в процессе этого лечения с целью контроля эффективности подобной терапии [Хоменко А. Г. и др., 1984; КнорингБ. Е. и др., 1984; Гергерт В. Я. и др., 1986].
4.12. ИССЛЕДОВАНИЕ ФУНКЦИИ ВНЕШНЕГО ДЫХАНИЯ
Исследование функционального состояния легких является одним из основных направлений функционального обследования больных туберкулезом. Выполняемое на различных этапах развития специфического процесса, оно способствует обнаружению начальных проявлений нарушений дыхательной функции легких, уточнению ка
чественной и количественной характеристики клинически выражен
ных функциональных нарушений, раскрытию патогенетических механизмов таких расстройств. Результаты указанного исследования
широко используются при оценке физической и профессиональной
162
работоспособности, отборе больных для хирургических вмешательств и определения показаний к проведению функционально-восстановительной терапии.
К простым высокоинформативным методам исследования прежде всего следует отнести спирометрию и спирографию, использование которых обязательно для всех противотуберкулезных учреждений. Самого широкого применения заслуживает изучение кривой поток — объем форсированного выдоха, а также газов и кислотно-основного
равновесия артериальной и артериализованной капиллярной крови. При проведении углубленного комплексного функционального об-
следования крайне желательно определение общей емкости легких
и ее компонентов, а также общего бронхиального сопротивления.
Нередко возникает потребность в исследовании диффузионной спо-
собности легких, при наличии показаний ставят фармакологические пробы с бронхорасширяющими и бронхосуживающими средствами, изучают эластичность легких и работу дыхания.
Спирометрия и спирография — наиболее часто применяемые
методы исследования функционального состояния легких.
Из регистрируемых спирометрических и спирографических показателей основными являются объем форсированного выдоха в 1 с (ОФВ1), жизненная емкость легких (ЖЕЛ) и индекс Тиффно (ОФВ1/ЖЕЛ). Остальные спирометрические и спирографические по
казатели (максимальная вентиляция, частота дыхания — ЧД, дыхательный объем — ДО, минутный объем дыхания — МОД, потребление кислорода в 1 мин — ПОг, коэффициент использования кислорода — КИОг и др.) следует рассматривать как дополнительные.
Применяют спирометры и спирографы открытого и закрытого типов. Среди аппаратов отечественного производства преобладают спирографы закрытого типа с компенсацией и без компенсации потребляемого кислорода (СГ-1М, СГ-2М, «Метатест 1», «Метатест 2» и др.).
Спирометрическое и спирографическое исследования проводят в первой половине дня в положении больного сидя, не ранее чем через 1—IV2 ч после еды. Краткий инструктаж непосредственно перед исследованием дает больному представление о сути предсто
ящей процедуры и дыхательных маневрах, которые ему предстоит выполнить. Подключение к спирометру или спирографу осуществляют с помощью загубника или мундштука. На нос обязательно накладывают зажим. Подключение к аппаратам открытого типа производят без учета положения легких и грудной клетки. Подключение к аппаратам закрытого типа делают на уровне спокойного
выдоха.
Спирометрическое и спирографическое исследование в полном объеме начинают с регистрации ЧД, ДО и ПОг, в состоянии покоя в течение 3—5 мин. Затем после перерыва (1—2 мин) с отключением от аппарата определяют ЖЕЛ, ОФВ1 или кривую форсированного выдоха (ФЖЕЛ) и МВЛ, Каждый из этих показателей регистрируют на менее 3 раз. При регистрации ЧД, ДО и ПОг обследуемому предлагают дышать спокойно, не фиксируя внимания на дыхании.
6*
163
При регистрации ЖЕЛ по команде больной делает максимально глубоких вдох и максимально полный спокойный выдох. При регистрации ОФВ1 и ФЖЕЛ рекомендуют как можно глубже вдохнуть и после небольшой паузы произвести максимально быстрый и максимально полный выдох, при регистрации МВЛ — дышать как можно чаще и в то же время как можно глубже. Время регистрации МВЛ не должно превышать 10—15 с. Продолжительность интервалов между отдельными измерениями ЖЕЛ, ФЖЕЛ и МВЛ, если больной легко справляется с дыхательными маневрами, не превышает 1 мин. При появлении усталости и одышки, что чаще наблюдается после регистрации МВЛ, интервалы между отдельными измерениями увеличиваются до 2—3 мин и более.
При сокращенном варианте спирометрии и спирографии последовательность и методика выполнения отдельных измерений те же, что и при расширенном исследовании. Если выполнение маневра ОФВ1, следовательно, определение ОФВ1/ЖЕЛ невозможны, определяют МВЛ и ПСДВ. Использование МВЛ и ПСДВ как показателей вентиляционной способности легких и бронхиальной проходимости полезно также в случаях отсутствия уверенности в правильности выполнения маневра ФЖЕЛ. ОФВ1, ЖЕЛ и МВЛ оценивают по должным величинам, рассчитанным с учетом пола, возраста, роста и площади поверхности тела. Нижней границей нормы ОФВ1, ЖЕЛ и МВЛ следует считать 80% должной величины, нижней границей нормы ОФВ1 в ЖЕЛ — 70%, нижней границей КИОг — 33,3. Снижение ОФВ1, ЖЕЛ и МВЛ до 50% должной величины квалифицируют как умеренное, снижение до 49—30% как значительное, а до 29% и более — как резкое.
Основанием для заключения о снижении вентиляционной способности легких является уменьшение ОФВ1 и МВЛ относительно должной величины. Падение ОФВ1 в ЖЕЛ интерпретируют как доказательство наличия бронхиальной обструкции, а снижение ЖЕЛ при отсутствии уменьшения ОФВ1/ЖЕЛ(%) — как диагностический признак рестриктивных изменений. Одновременное снижение ЖЕЛ и ОФВ1/ЖЕЛ(%) может быть обусловлено наличием сочетанных обструктивно-рестриктивных нарушений и проявлением выраженной бронхиальной обструкции. В такой ситуации заключение о наличии рестрикции, точное, о развитии смешанной обструктивно-рестриктивной патологии, правомерно при преобладании выраженности снижения ЖЕЛ над выраженностью снижения ОФВ1/ЖЕЛ(%) и одинаковой выраженности падения ЖЕЛ и ОФВ1/ЖЕЛ (%). При меньшей выраженности снижения ЖЕЛ заключение о наличии смешанных обструктивных нарушений недостаточно обосновано. Окончательное заключение формируется с учетом результатов исследования общей емкости легких и ее компонентов.
Исследование скоростных показателей форсированного выдоха в клинической практике способствует выявлению и уточнению степени бронхиальной обструкции. В ходе исследования измеряют средние и мгновенные скорости начальной, средней и конечной частей выдоха. Из регистрируемых функциональных величин чаще других 164
определяют средние максимальные скорости выдоха на уровне 25— 75% и 75—85% ЖЕЛ (МСВ25-75, MCB7s^s) и мгновенные пиковая и максимальные скорости выдоха на уровне 75; 50 и 25% ЖЕЛ/ПСВ, МСВ75, MCBso и МСВ25.
Средние и мгновенные скорости форсированного выдоха измеряют с помощью малоинерционных спирографов открытого и закрытого типа и пневмотахографов с интеграторами объема. Обязательным требованием к применяемым спирографам является возможность развернутой записи кривой форсированного выдоха со скоростью движения бумаги не менее 1200 мм/с. Пневмотахографы должны быть снабжены малоинерционным записывающим или запоминающим устройством с выходом на цифропечать, осциллоскоп или двухкоординатный самописец. Для автоматизации желательно наличие микропроцессора.
Условия исследования те же, что при спирометрии и спирографии. Нос зажат носовым зажимом. Дыхательный маневр ФЖЕЛ выполняется, как при спирометрии и спирографии. Повторяют его не менее 3 раз. Особое внимание уделяют регистрации показателей начальной и конечной частей форсированного выдоха, значения которых больше, чем показатели средней части форсированного выдоха, зависят от прилагаемого физического усилия.
Для оценки средних скоростей средней и конечной частей форсированного выдоха (МСВ25-75, MCB7s^s) при применении спирографов закрытого типа могут быть рекомендованы формулы J. Morris и соавт. (1975). При оценке мгновенных скоростей, полученных на аппаратах открытого и закрытого типов, целесообразно использовать показатели R. Knudson и соавт. (1976) для женщин в возрасте 16—20 и старше 20 лет и мужчин в возрасте 16—25 и старше 25 лет. Нижней границей нормы для большинства мгновенных скоростей форсированного выдоха (ПСВ, МСВ75 и МСВ25) у женщин следует считать 50%, а у мужчин — 55% должной величины.
Количественная оценка изменений скоростных показателей затруднительна. В качестве временной рабочей схемы снижение до 40% должной величины можно расценивать как небольшое, до 39—20% — как значительное, до 19% и менее — как резкое.
Снижение максимальных скоростей выдоха — объективный признак наличия препятствий току воздуха в бронхах. Этот метод более чувствительный и специфичный, чем тест Тиффно, который в значительной мере утрачивает диагностическую ценность как показатель обструкции в случаях снижения ЖЕЛ и не в состоянии обеспечить диагностику так называемой патологии мелких бронхов.
Заключение об уровне бронхиальной обструкции дают с учетом результатов измерения ОФВ1. Снижение ОФВ1, ПСВ и МСВ75 при нормальных значениях MCBso, МСВ2545 позволяет предположить наличие препятствия в верхних дыхательных путях — в трахее и гортани. Уменьшение MCBso и МСВ25-75 при нормальных величинах ОФВ1, ПСВ и МСВ75 свидетельствует о нарушениях, локализующихся дистально от долевых бронхов, а уменьшение МСВ25 и MCBzs-ss при
165
нормальных уровнях ОФВ1, ПСВ, МСВ75, МСВ50 и MCB2S-75 — об обструкции мелких бронхов диаметром меньше 2 мм.
Исследование общей емкости легких (ОЕЛ) и ее компонентов, не доступное прямой спирометрии и спирографии, является обязательным элементом комплексного исследования функционального состояния легких. В его задачи входит уточнение типа вентиляционных нарушений. Наибольшую диагностическую ценность представляет определение ОЕЛ, остаточного объема легких (ООЛ), функциональной остаточной емкости (ФОЕ) и близкого к ней по физиологической сущности внутригрудного объема (ВГО). Исследование проводят с помощью конвекционного и барометрического методов. Конвекционные методы подразделяются на открытые и закрытые, при открытых и закрытых определяют ОЕЛ, ООЛ и ФОЕ, при барометрическом — ОЕЛ, ООЛ и ВГО.
Для определения ОЕЛ и ее компонентов конвекционными методами с применением открытой системы нужны азограф (или азотометр), устройства для сбора и измерения объема выдыхаемого воздуха и источник кислорода. При исследовании с использованием закрытой системы применяют регистратор концентрации гелия или другого применяемого индикаторного газа, спирограф с автоматической компенсацией потребляемого кислорода, гелий или другой индикаторный газ. При барометрическом методе измерительным устройством служит плетизмограф тела. Исследование проводят в течение первой половины дня в положении больного сидя не ранее чем через Р/2-2 ч после последнего приема пищи. Подключение к аппарату при конвекционных методах производят с помощью загубника на уровне спокойного выдоха. При общей плетизмографии подключение через загубник осуществляется после стабилизации давления в кабине плетизмографа.
В ходе исследования конвекционным методом с применением открытой системы регистрируют количество азота, вымытого из легких. При исследованиях по закрытой системе измеряют количество гелия или другого индикаторного газа, перешедшего из спирографа в легкие. При общей плетизмографии определяют измерение давления в альвеолах в кабине плетизмографа во время попыток вдоха и выдоха при перекрытой дыхательной трубке. Вымывание азота проводится до падения его концентрации до 2% в выдыхаемом воздухе. Переход индикаторного газа из спирографа в легкие прослеживают до полного уравнения его концентрации в спирографе и легких. Попытки вдоха и выдоха при перекрытой дыхательной трубке плетизмографа повторяют в зависимости от четкости выполнения дыхательных маневров 3—5 раз и более.
Конвекционными методами непосредственно определяют ФОЕ — объем газа в вентилируемых альвеолах в положении спокойного выдоха. Барометрическим методом измеряют ВГО — весь внутри-грудной объем газа, включая объем газа невентилируемых и не связанных с атмосферой внутригрудных пространств.
Величину ОЕЛ, ФОЕ, ВГО и ООЛ оценивают в основном по должным величинам. Для их расчета могут быть использованы 166
формулы Р. Kristufek и соавт. (1979). Учитывают верхнюю и нижнюю границу нормы. Пределами нормальных колебаний ОЕЛ являются 120—80% должной величины, ФОЕ и ВГО — 130—80% и ООЛ — 140—80% должной величины; ООЛ/ОЕЛ — от 30% в возрасте 20 лет до 50% в возрасте 70 лет. Снижение ОЕЛ в сочетании с нормальной скоростью форсированного выдоха является наиболее надежным критерием рестриктивных нарушений вентиляции. Падение ОЕЛ до 79—60% должной указывает на умеренную степень рестрикции, до 59—40% — на среднюю выраженность рестрикции, до 39% и ниже — на резкую рестрикцию. При сочетанном обструктивно-рестриктивном варианте вентиляционных нарушений снижение ОЕЛ сочетается с уменьшением ОФВ1/ЖЕЛ и, главное, с падением средних и мгновенных максимальных скоростей форсированного выдоха. Увеличение ООЛ и ООЛ/ОЕЛ свидетельствует о гиперинфляции легких. Как проявление умеренной гиперинфляции рассматривается увеличение ООЛ до 175% должной величины и отношения ООЛ/ОЕЛ до 50%, как признак значительной гиперинфляции — повышение ООЛ до 176—250% должной величины и ООЛ/ОЕЛ до 51—65%, как показатель резкой гиперинфляции — увеличение ООЛ до 251% должной величины и больше, отношения ООЛ/ОЕЛ до 66% и выше.
Термин «гиперинфляция» не идентичен термину «эмфизема». Возрастание ФОЕ, ВГО и ООЛ может быть проявлением повышенной воздушности легких вследствие обструкции дыхательных путей. В норме ФОЕ и ВГО примерно равны. Преобладание ВГО, измененного барометрическим методом, над ФОЕ, определенного конвекционным способом, документирует развитие распределительных нарушений с наличием плохо вентилируемых зон легких.
Исследование общего сопротивления дыхательных путей, или общего бронхиального сопротивления (Raw), обязательно для квалифицированной оценки функционального состояния бронхиальной системы, точнее, ее первых 8—10 генераций. В процессе исследования, помимо Raw, определяют специфическое сопротивление дыхательных путей (SRaw), представляющее собой произведение Raw на ВГО, и специфическую проводимость дыхательных путей (SGaw),
рассчитываемую как частное от деления проводимости дыхательных путей (Gav) на ВГО. Проводимость дыхательных путей является величиной, обратной Raw.
Исследование проводят в первой половине дня с помощью плетизмографа тела с постоянным объемом или постоянным давлением. Условия выполнения те же, что при барометрическом методе определения ОЕЛ и ее компонентов. Регистрируют петли бронхиального сопротивления, коэффициент пропорциональности изменений альвеолярного давления и давление в кабине плетизмографа. Для устранения влияния тепло- и влагообмена между выдыхаемым воздухом и воздухом внутри кабины на колебания давления в кабине испытуемый во время записи петель бронхиального сопротивления производит возвратное дыхание в дыхательный мешок, содержащий воздух, полностью насыщенный водяными парами и нагретый до
167
37°С. Запись петель бронхиального сопротивления осуществляется в условиях спокойного дыхания. Коэффициент пропорциональности изменений альвеолярного дыхания и давления в кабине плетизмографа определяют в конце выдоха по колебаниям ротового давления и давления в кабине при попытках испытуемого произвести вдох и выдох в момент кратковременного перекрытия дыхательной трубки.
Результаты оценивают по нормативам, полученным на основании обследования здоровых лиц. У здоровых женщин показатель Raw не превышает 0,32, у здоровых мужчин — 0,29 кПа^л*1 с [Кузнецова В. В., 1980]. Верхней границей нормы SRaw у женщин и мужчин считают 1,0 кПа*с [Kristufek Р. et al., 1982], нижней границей нормы SGaw 0,008 кПа-^с*1 [Кузнецова В. К., 1980].
Повышенное Raw и нормальная МСВ25 указывают на обструкцию преимущественно в области крупных бронхов. Нормальное Raw и сниженная МСВ25 свидетельствуют о нарушениях проходимости бронхов диаметром менее 2 мм.
Существенное диагностическое значение имеет анализ формы петли поток—давление. У здоровых лиц петли бронхиального сопротивления узкие. Их положение близко к вертикальному. При развитии бронхиальной обструкции наклон петель к оси давления увеличивается, появляются изогнутости, пересечения, расширения в области 0-потока и булавовидные расширения в области выдоха. Степень наклона петель отражает уровень общего бронхиального сопротивления. Пересечения указывают на неоднородность обструкции. Расширение петли в области 0-потока свидетельствует о наличии зон, не имеющих связи с воздухопроводящими путями. Булавовидные расширения в области выдоха возникают при снижении эластических свойств легких.
Исследование эластичности и механической гомогенности легких и работы дыхания проводят в рамках комплексного клиникофизиологического обследования с целью диагностики эмфиземы легких, пневмосклероза, распознавания начальных проявлений легочных заболеваний и объективизации жалоб больных на одышку. В ходе исследования определяют статическую и динамическую растяжимость легких (Cet, Cdyn), эластическое давление на уровне 100; 90; 80; 70; 60 и 50% ОЕЛ (Р100%1ЪС, Р80%тъс, P90%Tbc, Р70%1ЪС, E60%tlc, P50%tlc), коэффициент ретракции (CR), общую и удельную работу дыхания (А^щ, Ау„).
Для проведения исследования необходимы пневмотахограф с интегратором, дифференциальный манометр для измерения транспульмонального давления, трехканальный или двухкоординатный регистратор. Пневмотахограф и дифференциальный манометр должны обеспечивать изменение широкого диапазона скоростей воздушного потока и перепадов транспульмонального давления. В качестве двухкоординатного регистратора можно применять электронные осциллографы и двухкоординатные самописцы.
Исследование проводят в первой половине дня в положении больного сидя, натощак или не менее чем через 2 ч после еды.
168
Регистрируют изменения объема легких и транспульмонального давления при медленном выдохе из положения максимального вдоха, при спокойном и форсированном дыхании. Изменения объема легких определяют путем интегрирования пневмотахограммы, регистрацию транспульмонального давления — с помощью пищеводного катетера. К пневмотахографу больного подсоединяют с помощью загубника. Катетер проводят в пищевод через нижний носовой ход. Его нижний конец с тонкостенным латексным баллоном устанавливают в нижней трети пищевода. Катетеризацию выполняют после анестезии слизистой оболочки носа 0,1% раствором дикаина, 1% раствором лидокаина, у детей — 5—10% раствором новокаина. Правильное положение катетера в пищеводе достигается проведением его нижнего конца в желудок (до получения положительного давления на вдохе) с последующим подтягиванием до появления отрицательных значений давления на вдохе и дополнительно от этого уровня еще на 10 см. Катетер к манометру подключают в момент завершения максимального выдоха. Продвижение катетера по пищеводу облегчает проглатывание воды, засасываемой через тонкую трубку длиной 20—25 см.
Дыхательные маневры больной выполняет под команду. Показатели эластических свойств легких исследуют после 3—4 медленных и глубоких вдохов и выдохов во время медленного полного выдоха из положения максимального вдоха. Динамическую растяжимость легких определяют при спокойном произвольном дыхании и при дыхании под метроном с частотой 60 в 1 мин. Общую и удельную работу дыхания исследуют при спокойном дыхании и навязанных бальному форсированных режимах вентиляции, интенсивность которых может достигать уровня максимальной вентиляции легких. Для получения истинных значений и исключения возможных артефактов дыхательные маневры целесообразно повторять не менее 3 раз.
Для оценки величины Cst могут быть рекомендованы должные величины Н. Н. Канаева и В. В. Кузнецовой (1976), для интерпретации результатов измерений Pst при различных уровнях воздухо-наполнения легких у детей и подростков — должные величины A. Zapletal и соавт. (1976) и у взрослых — должные величины рабочей группы Европейского общества угля и стали (1983). Верхней границей нормы Cst считают 150% должной величины, нижней — 50% должной величины [Кузнецова В. В., 1980]. Результаты измерения Cdyn оценивают путем сопоставления с величиной Cst. У здоровых людей Cdyn составляет не менее 80% Cst. Полученные значения CR и работы дыхания сопоставляют с нормативами, полученными при обследовании здоровых лиц. К вариантам нормы относят величину CR в пределах 0,2—0,8 кПа^л’1 и удельную работу дыхания, не превышающую 0,04 кгм^л"1.
Увеличение Cst, снижение CR и эластического давления (особенно при высокой степени воздухонаполнения легких) указывают на развитие эмфиземы. Падение Cst, повышение CR и эластического давления свидетельствуют о развитии диффузного пневмоскле
169
роза. Патологические значения Qyn являются объективным показателем механической неоднородности легких, в генезе которой ведущая роль принадлежит нарушениям проходимости мелких бронхов. Высокая чувствительность Cdyn как диагностического признака распределительных нарушений, обусловленных поражением бронхов и легочной паренхимы, служит основанием для использования этого показателя с целью обнаружения ранних проявлений легочных заболеваний, включая начальные проявления хронического бронхита в виде патологии мелких бронхов.
Увеличение работы дыхания — объективное доказательство по
вышения энергетических затрат на осуществление легочной вентиляции. Констатация этого патологического феномена особенно важна в экспертной практике как подтверждение обоснованности жалоб больных на одышку.
Исследование диффузионной способности легких (DL) в кли-
нической практике применяют для выявления одного из основных механизмов нарушения легочного газообмена и для косвенной оценки объема и характера легочного поражения. Исследование проводят
в двух вариантах — методом устойчивого состояния (SS) и однократного вдоха (SB). В качестве тест-газа используют окись углерода (СО). Диффузионная способность легких для СО, определенная методом устойчивого состояния (DLCOss) в большей мере, чем диффузная способность легких для СО, определенная методом однократного вдоха (DLCOsb), зависит от состояния распределительной функции легких. Это несколько снижает информативность DLCOss как показателя диффузионной способности альвеолярно-капиллярной мембраны и одновременно повышает чувствительность DLCOss как показателя нарушения внутрилегочного газообмена.
Исследование проводят с помощью диффузиометров, важнейшими составными частями которых являются инфракрасные газоанализаторы СО и система магнитных клапанов для автоматизированного забора проб альвеолярного воздуха. Исследование проводят в положении больного сидя, в первой половине дня. Больного подключают к аппарату с помощью загубника. При методе устойчивого состояния обследуемый дышит воздухом, содержащим 0,035— 0,045% СО. Через Р/г—2 мин от начала дыхания в течение 2—3 мин определяют МОД и концентрацию СО во вдыхаемом и выдыхаемом воздухе, что необходимо для расчета минутного поглощения тест-газа. Исследование завершается забором пробы альвеолярного газа и определением содержания СО. При методе однократного вдоха после максимального выдоха обследуемый делает максимально глубокий вдох газовой смеси, содержащей 0,2—0,3% СО, 10,0—15% гелия, и задерживает дыхание на 10 с. Затем больной делает максимально полный выдох, во время которого берут пробу альвеолярного газа для определения начальной и конечной концентрации СО в альвеолярном воздухе. Начальная концентрация СО устанавли
вается расчетным путем по разведению гелия в альвеолярном газе.
Для оценки результатов измерения DLCOss могут быть применены должные величины Р. Bates и соавт. (1971), для оценки ре
170
зультатов измерения DLCOss и отношения DLCOss/VA — должные величины A. Salborinne (1976). У здоровых людей абсолютные величины DLCOss, DLCOsb и DLCOsb/VA составляют не менее 80% должной величины. DLCOSb/DLCOss в норме составляет 1,3—1,6. Снижение DLCOss указывает на нарушение диффузии газов в легких и распределения вдыхаемого воздуха, a DLCOsb — в основном на нарушение диффузии. Уменьшение DLCOss/VA рассматривают как признак альвеоло-капиллярного блока. Увеличение DLCOsb/DLCOss служит объективным доказательством наличия распределительных нарушений.
Сочетание гиперинфляции легких, снижения DLCOsb и DLCOsb/VA относят к характерным проявлениям эмфиземы легких. Гиперинфляцию без уменьшения DLCOsb и DLCOsb/VA рассматривают как проявление повышенной воздушности легочной ткани без выраженных структурных изменений межальвеолярных перегородок. Снижение DLCOsb при рентгенологически ограниченных легочных процессах свидетельствует о наличии рентгенологически не обнаруживаемых участков патологически измененной легочной ткани.
Исследование газов и кислотно-основного равновесия (КОР) артериальной крови является обязательным элементом комплексного исследования функционального состояния легких. Его результаты имеют большое значение в диагностике дыхательной недостаточности, определении выраженности и патогенетических механизмов последней. На основании результатов исследования газов и КОР крови квалифицированно решают многие вопросы анестезиологического обеспечения торакальных операций, определяют показания и сроки прекращения интенсивной терапии острых проявлений дыхательной недостаточности. Из показателей газового состава артериальной крови наиболее часто регистрируют РаОа и РаСОа. Из показателей КОР ведущая роль принадлежит pH, РаСОа и BE. Насыщение артериальной крови кислородом (SaOa) как показатель легочного газообмена по чувствительности значительно уступает РаОг. Истинный бикарбонат крови (SB), буферные основания (ВВ) и общее содержание СОа (ТСОа) мало что добавляют к оценке КОР по pH, РаСОа и BE.
Для исследования РаОа, РаСОа, pH, BE и других показателей газов и КОР крови применяют микроанализаторы крови с прямым измерением РаОа комбинированным платино-серебряным электродом Кларка, РаСОа — комбинированным стеклянно-серебряным электродом Северинхауза. Из отечественных аппаратов могут быть рекомендованы АКОР-1 и АКОР-2. Из зарубежных образцов хорошо себя зарекомендовали микроанализаторы фирмы «Радиометр» (Дания) и «AVL» (Швейцария). Для определения SaOa используют абсолютные и относительные оксигемометры (оксиметры), мономет-рические аппараты Ван-Слайка или определяют SaOa расчетным путем и с помощью номограмм по результатам измерения РаОа, pH крови и температуры тела.
Для характеристики газов и КОР артериальной крови исследуют пробы артериальной и артериализованной капиллярной крови. Для
171
получения артериальной крови пунктируют локтевую, лучевую или бедренную артерии. Оптимальным местом забора артериализованной капиллярной крови является гиперемированная мочка уха. Гиперемия достигается механическим воздействием (массированием) или втиранием мазей, вызывающих местную гиперемию. При невозможности взятия артериализованной капиллярной крови из мочки уха кровь получают из пальца предварительно прогретой при 40—45°С
руки.
Артеризованная капиллярная кровь из пальца отличается от артериальной более низким уровнем PaCh.
При заборе капиллярной крови из прокола (надреза) кровь должна вытекать самопроизвольно. Надавливание увеличивает примесь венозной крови. В капиллярах не должно быть пузырьков воздуха, наличие которых снижает точность измерений. Анализ крови лучше всего проводить сразу после ее забора или в течение ближайших 10— 15 мин после забора. Даже при 10— 15-минутной задержке
исследования нужно предпринять меры по предотвращению контакта крови с атмосферным воздухом, «запаяв» капилляр индифферентной
смазкой или надев (натянув) на капилляр тонкую резиновую ленту, вырезанную из тонкой резиновой перчатки.
Более длительное хранение крови до исследования допустимо только в холодильнике при 0—4°С, длительность хранения не должна превышать 3—4 ч.
Для оценки PaCh при исследовании проб артериальной крови могут быть использованы должные величины К. Mellemgarrd (1966), при ис
следовании капиллярной крови — должные величины W. Petro и соавт. (1975): PaCh артериальной крови — 104,2—0,27 В, PaCh артериализованной капиллярной крови — 94,2—0,27 В. Допустимым упрощением является использование фиксированных нижних границ нормы PaCh: у лиц в возрасте до 40 лет — 80 мм рт. ст. (10,7 кПа), старше 40 лет — 75 мм рт. ст. (10,0 кПа). Для определения выраженности артериальной гипоксемии в клинической практике удобна классификация Р. Kristufek и К. Slavkovska (1982): снижение РаОа до 60 мм рт. ст. (8,0 кПа) расценивается как проявление умеренной гипоксемии, до 59—50 мм рт. ст. (7,9—6,7 кПа) — как значительная гипоксемия и более 50 мм рт. ст. (6,7 кПа) — как резко выраженная гипоксемия. Гиперкапния диагностируется, когда РаСОа превышает 45 мм рг. ст. (6,0 кПа), гипокапния — при РаСОа меньше 35 мм рг. ст. (4,7 кПа).
Выявление гипоксемии при дыхании воздухом и ее ликвидация
при переводе на дыхание кислородом указывают на относительное шунтирование венозной крови. Сохранение гипоксемии при дыхании кислородом — объективное доказательство наличия абсолютного
шунта.
Обнаружение артериальной гиперкапнии является наиболее достоверным признаком несостоятельности легочной вентиляции в виде тотальной гиповентиляции легочных альвеол.
Встречающиеся в клинике нарушения КОР достаточно хорошо документируются изменениями трех основных показателей КОР — pH,
172
РаСОг и BE. Снижение pH, выходящее за нижнюю границу нормы (рН< 7,34), свидетельствует о развитии декомпенсированного алкалоза. Если смещение pH в сторону понижения и повышения происходит в пределах нормальных колебаний, выявляемые изменения рассматриваются как компенсированные. Дыхательный ацидоз диагностируют, если РаСОа больше 45 мм рт. ст. (6,0 кПа), дыхательный алкалоз — при снижении РаСОа до 34 мм рт. ст. (4,5 кПа) и более. Показателем метаболического ацидоза служит уменьшение BE, показателем метаболического алкалоза — увеличение BE. За границу нормы BE принимают верхнюю: +2,5, нижнюю — 2,5 ммоль^л"1. При разграничении первичных (причинных) и вторичных (компенсаторных) сдвигов учитывают клиническую картину заболевания и выраженность наблюдаемых изменений. Первичные (причинные) сдвиги выражены больше, чем ответная компенсаторная реакция.
ГЛАВА 5
ВЫЯВЛЕНИЕ БОЛЬНЫХ ТУБЕРКУЛЕЗОМ СРЕДИ НАСЕЛЕНИЯ
Выявление больных туберкулезом должно быть ранним или по крайней мере своевременным. Выявление больных с запущенным туберкулезным процессом создает большие трудности в лечении, так как добиться заживления туберкулезного очага трудно даже при современных методах лечения. Кроме того, длительное течение туберкулеза у больных, не известных диспансеру, представляет большую эпидемиологическую опасность для окружающего населения, особенно при обильном выделении микобактерий туберкулеза.
Выявление больных туберкулезом может осуществляться среди лиц с наличием грудных жалоб и симптомов, свидетельствующих о наличии заболевания легких. Обычно это больные, обратившиеся за медицинской помощью в поликлиники или другие лечебно-профилактические учреждения, а также поступившие в больницы,
прежде всего в терапевтические или пульмонологические отделения с различными заболеваниями легких. Нередко туберкулез протекает без выраженных клинических проявлений, такие лица не обращаются за медицинской помощью, поскольку чувствуют себя хорошо или не обращают внимания на изменившееся самочувствие и появившиеся симптомы. Это служит основанием для активного выявления больных туберкулезом путем массовых осмотров всего населения или отдельных групп. В настоящее время выявление больных туберкулезом осуществляется с помощью трех основных методов: 1) флюорография; 2) туберкулинодиагностика; 3) исследование мокроты или другого материала на наличие микобактерий тубер
кулеза (микроскопия и посев).
В выявлении больных туберкулезом важнейшее место принад
лежит флюорографическим осмотрам, которые осуществляются:
1) передвижными флюорографами, обеспечивающими плановые
профилактические осмотры населения в городах и сельской местности, в первую очередь рабочих и служащих крупных предприятий, работников отдельных профессий (механизаторов, животноводов и
др.); 2) стационарными флюорографами, как правило, в поликлиниках, что обеспечивает осмотр всех лиц, впервые обратившихся в
данному году в поликлинику за медицинской помощью, а также
некоторых контингентов населения в порядке плановых осмотров (школьники, лица призывного возраста, люди, подлежащие ежегодному обязательному профосмотру, рабочие и служащие мелких предприятий и др.).
Среди поликлинических контингентов следует, помимо лиц со «следами» спонтанного излеченного туберкулеза и лиц, снятых с диспансерного учета, выделить также следующие категории: 1) лица с многократно повторяющимися заболеваниями верхних дыхательных путей; 2) больные с повторными, атипично протекающими или медленно рассасывающимися пневмониями; 3) больные с хрониче-
174
скими воспалительными заболеваниями легких; 4) лица, перенес
шие экссудативный плеврит; 5) больные пылевыми
ессиональ-
ными заболеваниями легких; 6) больные с язвенной болезнью же
лудка и двенадцатиперстной кишки или оперированные по поводу этих заболеваний; 7) больные сахарным диабетом или с хронической недостаточностью надпочечников; 8) больные, подлежащие длительной гормональной или лучевой терапии. Выделение указанных групп и систематические их обследования считаются одним из непременных условий своевременного обнаружения туберкулеза, так как 60—68% больных с распространенными и деструктивными формами выявляются при обращении за медицинской помощью в поликли-
ники.
Основным методом
илактического осмотра населения явля-
ется флюорография. При помощи флюорогафии можно своевременно обнаружить туберкулез легких у взрослых людей, так как некоторым его формам, даже сопровождающимся бактериовыделением, и тем более малым формам нередко присуще бессимптомное течение. В последние годы флюорографическим методом выявляется около 40— 50% взрослых лиц, заболевших туберкулезом легких. Что же касается больных, у которых микобактерии туберкулеза обнаруживают методом бактериоскопии, т. е. лиц с обильным бактериовыделением,
то они выявляются рентгенофлюорогафическим методом только в
15% случаев, так как это происходит преимущественно за счет обращения к врачу уже с симптомами болезни.
Профилактические флюорографические обследования населения
проводит рентгенофлюорографическое отделение (группа, кабинет),
которое входит в состав рентгенологического отделения городской, областной, центральной районной больницы (поликлиники) и противотуберкулезного диспансера. Организационно-методическое ру-
ководство осуществляется в городах — городским (районным, меж-
районным) рентгенофлюорографическим отделением, а в сельской местности — областным (межрайонным) рентгенофлюорографическим отделением, входящим в состав противотуберкулезного дис-
пансера или другого лечебно-профилактического учреждения. За организацию профилактических флюорографических обследований
Mill.
и привлечение населения отвечают главные врачи поликлиник,
медико-санитарных частей, здравпунктов, центральных районных больниц, участковых больниц, фельдшера фельдшерско-акушерских
пунктов, санитарно-эпидемиологических станций. Планирование
илактических обследований проводится в соответствии с соста-
Mill
вом контингентов в населении, которое подлежит флюорографии, и необходимой периодичности обследований. В городах эти контин
генты распределяются по территориально-производственному принципу, среди них различают следующие.
1. Контингенты, подлежащие обязательному ежегодному (или 1 раз в 6 мес) обследованию на туберкулез по эпидемиологическим показаниям в соответствии с Методическими указаниями № 870-70 и инструкцией № 1142«а»-73. Их обследуют в поликлиниках, флюорографических отделениях или на производстве. Каждый обследо
175
ванный, подлежащий регулярным осмотрам по эпидемиологическим показаниям, должен в соответствии с названной инструкцией иметь личную медицинскую книжку установленного образца, в которую наряду с результатами других обследований заносят данные о туберкулиновых реакциях, ревакцинации БЦЖ и данные флюорографического обследования. Контроль за полнотой охвата осмотрами этих контингентов возлагается на санитарно-эпидемиологические станции.
2. Организованное население, этим термином условно обозначают работников производств, учреждений, учебных заведений, куда выезжают передвижные флюорографы при отсутствии собственных стационарных флюорографических установок.
3. Работники мелких предприятий — условное обозначение работников учреждений, артелей, производств, куда не выезжают передвижные флюорографические бригады и которые не имеют своих медико-санитарных частей. Эти контингенты обследуются в ближайших поликлиниках или флюорографических отделениях.
4. Неорганизованное население — условное обозначение неработающих лиц (пенсионный возраст, инвалидность и др.). Проживающих в городе обследуют в поликлинике по месту жительства.
Следует также различать «угрожаемую группу» — группу повышенного риска заболевания туберкулезом вследствие наличия остаточных изменений в легких после перенесенного туберкулеза, а также имеющих контакт с производственными вредностями и некоторые сопутствующие заболевания, которые снижают резистентность к туберкулезу (сахарный диабет, язвенная болезнь желудка и двенадцатиперстной кишки, психические заболевания и др.). «Угрожаемые группы» формируются среди всех контингентов после проведенных обследований и создания учетной картотеки. Сведения о лицах, имеющих отягощающие заболевания, можно получить в поликлиниках и соответствующих специализированных учреждениях.
В сельских районах обследование проводят в основном по территориальному признаку. Контингент сельского населения, подлежащий обследованию, планируется на основании данных переписи населения и списков, имеющихся в центральных районных больницах и на фельдшерско-акушерских пунктах. После создания картотеки в ней также формируются (выделяются) «угрожаемые группы». Обследование населения сельской местности, которая отдалена от городских и районных центров и где нет флюорографов, может проводиться при выезде флюорографических бригад областных рентгенофлюорографических отделений или с использованием передвижных флюорографических установок центральной районной больницы либо районного противотуберкулезного диспансера. Основная масса населения должна обследоваться 1 раз в 3 года, обязательные контингенты и «угрожаемые группы» — 1 раз в год и чаще.
Ежегодным флюорографическим обследованием подлежат также лица старше 15 лет, подростки (учащиеся и рабочие), учащиеся 176
специальных школ, техникумов и вузов старше 18 лет. В зависимости от эпидемиологической ситуации на данной территории этот возрастной критерий может быть изменен: при менее благополучной ситуации следует начинать обследование лиц более молодого возраста, а при благополучной — более старшего.
Для полного и систематического охвата населения флюорографическими обследованиями и во избежание неоправданно частых повторных осмотров одних и тех же лиц большое значение имеют точный учет населения, подлежащего обследованию, и контроль за прохождением флюорографических осмотров. Учет по спискам мало оправдан. Несравненно лучшей формой учета является картотека по числу подлежащих обследованию жителей, а наиболее совершенной — флюорокартотека. Форма организации картотеки может быть различной. В городах она может быть единой (централизованная или рассредоточенная) в поликлиниках либо в поликлиниках и на крупных предприятиях отдельно. В сельской местности кар
тотеку создают по единому территориальному принципу при центральных районных больницах и фельдшерско-акушерских пунктах.
Календарный план составляют исходя из численности населения, периодичности обследования и оптимального использования флюорографической аппаратуры и кадров. При этом следует учитывать
распределение населения по указанным выше контингентам, количество флюорографической аппаратуры (подвижной или стационар
ной), нормы нагрузки на аппарат, местные условия (расстояния, дороги). Учреждения, осуществляющие обследования, составляют,
кроме календарного, план-график осмотров на каждый месяц и на каждую установку. При его составлении учитывают среднюю норму нагрузки, время, необходимое на передислокацию, монтаж и демонтаж (для передвижных аппаратов), профилактический ремонт,
а также техническое состояние аппаратуры и транспорта. Важно предусмотреть наиболее удобное время года для осмотра той или иной группы населения. Данные о выполнении плана сообщаются
главному врачу учреждения, в состав которого входит рентгенофлюорографическое отделение.
Для избежания пропусков патологии и неправильной интерпретации теней необходимо применять двойную независимую расшифровку пленки двумя врачами или повторную одним врачом (через день).
Велико значение контрольного рентгенологического дообследования в рентгенофлюорографическом отделении (кабинете) лиц, у которых обнаружены несомненные патологические тенеобразования в легких, или лиц с изменениями, подозрительными на наличие патологии, либо с изменениями, активность которых неясна. Вызов таких людей производится сотрудниками рентгенофлюорографического отделения (кабинета) не позднее 48 ч после прохождения флюорографии. В случае неявки на обследование даже после повторного вызова об этом сообщают в поликлинику, противотуберкулезный диспансер и т. д. для вызова пациента участковой медицинской сестрой.
177
Целью дообследования являются определение характера выявленных при флюорографии отклонений от нормы и в случае под
тверждения наличия патологического процесса установление окончательного диагноза в оптимально короткие сроки. Дообследование может состоять из двух этапов: первый — в рентгенофлюорографическом отделении и второй — в специализированном учреждении,
в котором можно уточнить диагноз при использовании широкого
комплекса современных методов.
Рентгенологическое дообследование начинают с рентгенографии, в показанных случаях проводят томографию, бронхографию и др. Лица, у которых при дообследовании во флюорографических отделениях (кабинетах) заподозрен туберкулез легких, направляются для детального обследования в противотуберкулезный диспансер по месту жительства. Дообследование с использованием рентгеновских
и клинических методов в сельской местности осуществляют в районном противотуберкулезном диспансере или в туберкулезном кабинете районной больницы.
Число заболевших туберкулезом — это сумма больных, выяв-
ленных при профилактических осмотрах и обратившихся в лечебное
Mill.
учреждение с жалобами в связи с появившимися у них симптомами заболевания.
Д. 3. Ворохов (1967) указывает, что повторные ежегодные сплошные флюорографические обследования позволяют выявить истинную заболеваемость туберкулезом. В то же время при неудовлетворительно поставленной работе по выявлению туберкулеза легких среди населения накапливается группа больных, длительное время неизвестных органам здравоохранения. К аналогичному выводу приходят и другие авторы [Колесников М. Ф. и др., 1971; Кобзев В. IL, 1971; Мижирицкий Ю. М. и др., 1973; Чагин В. В. и др., 1973; Пинхосевич Е. Г., 1973, и др.]. Вследствие того, что сплошные флюорографические обследования на территориях проводятся обычно не ежегодно, а лишь по специальной программе, среди больных туберкулезом, выявленных при флюорографическом обследовании, имеются лица с различными сроками заболевания, чаще всего протекающего ма-лосимптомно или бессимптомно. У некоторых из них из-за насту
пившего самоизлечения процесс потерял черты активности.
Как указывают Е. А. Гинзбург и П. И. Жукова (1971), только при высоком качестве диагностики показатели заболеваемости объективно характеризуют численность впервые выявленных больных. Областные противотуберкулезные диспансеры в современных условиях должны обеспечить высокое качество диагностики в самых отдаленных районах. Выполнению этой задачи способствует введение централизованного контроля за правильностью диагностики у вновь выявленных больных. Следует подчеркнуть, что нельзя смешивать два понятия — «централизованная диагностика» и «централизованный контроль за правильностью диагностики».
Вторым, не менее важным показателем, позволяющим оценить результативность флюорографии, является своевременность обнаружения туберкулеза легких. Д. 3. Ворохов (1967) отмечал, что в
178
результате проведения 4 сплошных ежегодных обследований удельный вес запущенных процессов уменьшился с 15,6 до 0,8%. Аналогичные данные приводит М. И. Васильев (1971): после 3 таких осмотров удельный вес фиброзно-кавернозного туберкулеза снизился почти в 5 раз (с 9,3 до 1,9%). А. Кршивинка и соавт. (1975) показали, что при осуществлении всех мероприятий по борьбе с туберкулезом, в том числе и сплошных флюорографических осмотров с интервалом в 3 года, темп снижения заболеваемости составил 9,4% в год, а заболеваемость бациллярным туберкулезом снизилась с 142 в 1961 г. до 52,0 в 1972 г.; с 1972 г. хронические формы туберкулеза в г. Колин не выявлялись — в этом городе был развернут комплекс противотуберкулезных мероприятий и в первую очередь сплошное флюорографическое обследование.
Однако указанные исследования проведены на ограниченной территории с небольшим числом жителей — 50 000. Между тем целесообразно проанализировать факторы, влияющие на эффективность осмотров в масштабе страны (зависимость частоты фиброзно-кавернозного туберкулеза от охвата осмотрами населения, а также вза-
имосвязь охвата осмотрами и удельного веса впервые выявленных
при профилактических осмотрах больных). Полученные данные по-
зволят оценить рентабельность использования флюорографической
техники в настоящее время, а также наметить пути повышения эффективности массовых осмотров с целью обнаружения туберкулеза (рациональность отбора лиц с подозрением на неспецифические заболевания органов грудной клетки в зависимости от распространенности туберкулезной инфекции). Результативность осмотров в значительной мере определяет величину одного из основных показателей распространенности туберкулеза — заболеваемости. Так, в США вследствие нерентабельности все департаменты здравоохранения прекращают массовые флюорографические обследования населения в связи с высокой стоимостью выявления каждого нового случая заболевания активным туберкулезом [Moulding Т. S., SbarbaroJ. А., 1974].
Однако независимо от того, проводится ли флюорографическое обследование в виде сплошного массового осмотра или обследуются только контингенты повышенного риска заболевания туберкулезом, оценка метода производится по числу вновь выявленных больных.
Из факторов, влияющих на эффективность флюорографических
осмотров, в первую очередь следует считать охват подлежащего обследованию населения. М. И. Васильев (1971) подробно проанализировал аспекты привлечения к осмотрам населения и показал, что 44,7% населения охотно взаимодействует с медицинскими работниками и приходит на осмотры при первом приглашении. Вторую группу составляют неосмотренные лица, которые уклоняются от обследования даже в тех случаях, когда флюорограф очень длительное время работает в населенном пункте (3 раза и более в год), а люди очень настойчиво привлекаются к осмотрам. Размер этой группы варьирует в пределах 24,8—38,9%. Промежуточное положение занимает 18—22% населения, для которых необходимо флю
179
орографическую технику помещать вблизи от места жительства, либо проводить повторную работу в том же населенном пункте.
Следовательно, если из года в год осматриваются одни и те же контингенты, охотно кооперирующие с медиками, то число выявленных больных будет систематически уменьшаться и эффективность флюорографических осмотров будет очень низкой. Основным показателем оценки результативности обследования является число неосмотренных лиц, которые могут быть учтены только при наличии картотеки на все население [Рыккель Е. М., Лернер С. А., 1973; Власова М. В., Шульгина 3. Л., 1973, и др.].
Флюорографический метод применяется также для отбора лиц с подозрением не только на туберкулез, но и неспецифические заболевания легких [Адамович В. Н., 1975]. При этом отношение числа больных со всеми формами туберкулеза, выявленных при данном осмотре, к числу больных неспецифическими заболеваниями легких в 1975 г. составило 1:25 [Левтонова Е. В. и др., 1975]. По данным Ленинградской противотуберкулезной организации, на 1000 обследованных флюорографическим методом выявляются 11,9 лиц с неспецифическими заболеваниями легких [Непомнящая А. А., 1975].
Таким образом, в связи со значительным снижением показателей распространенности туберкулеза рентабельное использование флюорографической техники может быть обеспечено выявлением лиц с подозрением на туберкулез с остаточными изменениями в легких, т. е. групп повышенного риска заболевания туберкулезом, а также неспецифическими заболеваниями легких.
Многие исследователи предлагают отказаться от проведения сплошных флюорографических осмотров и перейти к обследованию населения с повышенным риском заболевания туберкулезом.
Эффективность раннего выявления туберкулеза определяется рядом факторов, ритмичностью, качеством флюорографической пленки и др. [Гинзбург Е. А., 1973]. Наряду с выявлением больных туберкулезом очень важное значение имеет выявление лиц с повышенным риском заболевания туберкулезом [Страхов Н. С., 1969; Гинзбург Е. А. и др., 1971, и др. ], поскольку своевременно проведенные среди них мероприятия в значительной мере уменьшают риск такого заболевания у лиц из «рентгенположительных» и других угрожаемых групп.
Среди детей раннее выявление туберкулеза проводится повторным определением чувствительности к туберкулину, при этом выявляются лица с первичным инфицированием (вираж туберкулиновой пробы), а также с гиперергическими реакциями. В условиях широкого применения вакцинации БЦЖ трудности дифференциации поствакцинной и инфекционной аллергии в значительной мере осложняют диагностику виража. Тем не менее изучение туберкулиновых реакций в динамике при ежегодном применении туберкулиновых проб, учет времени вакцинации и ревакцинации, а также клинических данных позволяют обнаружить вираж [Шульгина 3. Л., 1969; Митинская Л. А., 1971] .
180
Исследование мокроты или другого материала на микобактерии туберкулеза и в настоящее время сохраняет свое значение в диагностике туберкулеза и выявлении наиболее эпидемиологически опасных его форм. Выявляемость микобактерий зависит в первую очередь от характера туберкулезного процесса в легких и наличия или отсутствия деструктивных изменений. Не меньшее значение имеют метод исследования (бактериоскопия или посев), число проведенных исследований и соблюдение всех технических требований (особенно применительно к методу посева). Посев на питательные среды позволяет обнаружить микобактерии у больных с начальными проявлениями распада, а также у больных без деструктивных изменений [Рабухин А. Е., 1957; Рудой Н. М., 1975]. Бактериологические исследования имеют не только диагностическое, но и эпидемиологическое значение, так как позволяют дать количественную оценку резервуара инфекции, т. е. численности больных, выделяющих микобактерии туберкулеза, а также выявить взаимосвязь туберкулеза животных и человека на ряде территорий [Благодарный Я. А., 1972; Тузова Р.П., 1975].
В отечественной фтизиатрии постоянно разрабатываются диагностические методы, позволяющие диагностировать туберкулез на ранних этапах, т. е. так называемые ранние и малые формы туберкулеза не только у детей, но и у взрослых (Г. Р. Рубинштейн, Б. М. Хмельницкий, Ф. А. Михайлов, И. Е. Кочнова, Е. Б. Меве). В связи с этим особо нужно отметить учение об инфильтративном туберкулезе, основоположниками которого в нашей стране являются Г. Р. Рубинштейн и Б. М. Хмельницкий. Большое внимание на протяжении длительного времени уделялось очаговому туберкулезу легких как начальной форме туберкулеза (Г. Р. Рубинштейн, И. Е. Кочнова, Б. М. Хмельницкий, И. И. Берлин, А. Е. Рабухин) , а также исходу других более распространенных процессов (В. Л. Эйнис, М. И. Ойфебах). В связи с широким проведением флюорографических обследований населения и выявлением лиц с рентгенологически определяемыми очаговыми изменениями в легких особую актуальность приобретает определение активности туберкулезных изменений.
Взятие на диспансерный учет, а следовательно, и численность контингентов больных туберкулезом, ее динамика находятся в прямой зависимости от того, как определяется выявленный «случай» заболевания туберкулезом, подлежащий регистрации.
В соответствии с методическими указаниями по группировке контингентов, обслуживаемых противотуберкулезными учреждениями, больными активными формами внутригрудного туберкулеза считаются лица с наличием клинико-рентгенологических признаков заболевания и требующие проведения лечебных мероприятий.
Больные активным туберкулезом не представляют собой однородной группы. Среди них в первую очередь нужно выделить лиц, у которых диагноз подтвержден выявлением микобактерий туберкулеза методом микроскопии или посева. У большинства больных, выделяющих микобактерии, имеется деструктивный легочный про
181
цесс, однако метод посева позволяет обнаружить микобактерии у определенного числа больных без распада легочной ткани.
Вторую группу впервые выявленных больных туберкулезом, подлежащих регистрации, составляют лица с четкими клинико-рентгенологическими признаками активного туберкулеза, но без бактериовыделения. По мере совершенствования бактериологических и других методов исследования, включая инструментально-лабораторные, уменьшается число лиц, у которых обнаружены микобактерии. Правильность диагноза у этих больных подтверждается совокупностью клинико-лабораторных, инструментальных методов и динамикой изменений в легких в процессе лечения туберкулостатическими
препаратами.
Третью группу впервые выявленных больных составляют лица с ограниченными, малыми формами туберкулеза, при которых часто трудно даже сделать заключение об активности туберкулезного процесса и необходимости лечения.
По мере снижения заболеваемости туберкулезом возрастают труд-
ности установления специфичности изменений в легких и активности
такого процесса. Это в значительной мере обусловлено увеличением
удельного веса больных туберкулезом, выявленных при профилак-
тических осмотрах, нередко с отсутствием жалоб и скудной клинической симптоматикой. Применительно к этой группе должны быть
приняты все меры для установления четкости контуров очагов и интенсивности тени самих очагов. С этой целью необходимо, чтобы рентгенограммы производились только с должного фокусного расстояния (2 м). Уменьшение последнего может повлечь за собой нечеткость контуров очагов. Во всех случаях, когда на обычной дорсовентральной рентгенограмме очертания очагов представляются нечеткими, необходимо производить рентгенограммы при вентродорсальном ходе лучей.
Известное значение в определении активности туберкулезного процесса имеет всестороннее обследование таких больных с применением углубленной туберкулинодиагностики (проба Коха, гемотуберкулиновые пробы, определение уровня С-реактивного белка, сиаловой кислоты и др.). Для проведения такого обследования отдельных лиц приходится госпитализировать с целью углубленной диагностики степени активности туберкулезного процесса в условиях стационара.
Наконец, у этой группы больных может быть применено тест-лечение в течение 3 мес и более с контролем рентгенологических данных в динамике. На период обследования и проведения тест-ле-чения такие лица наблюдаются по «0»-группе диспансерного учета.
Необходимость принятия окончательного диагностического решения потребовала введения централизованного контроля за этим разделом работы силами небольшой группы специалистов обсласт-ного диспансера. Необходимость централизованного контроля за правильностью диагностики новых случаев заболевания диктуется не столько квалификацией таких специалистов, сколько возможностью устранения при подобной тактике субъективного влияния мнений отдельных врачей на установление диагноза.
182
Разнообразие проявлений туберкулеза у больных привело к необходимости не только учета выявленных больных, но и «качественной» их характеристики, т. е. структуры.
Организационные формы проведения лечения, а также методика диспансерного учета зависят от характера туберкулезного процесса у больного. Кроме того, анализ структуры впервые выявленных больных помогает судить о качестве проводимой работы по обнаружению туберкулеза, в частности охарактеризовать уровень раннего выявления туберкулеза.
Структура впервые выявленных больных может быть охарактеризована по трем основным признакам.
1. Эпидемиологическая опасность. В этом плане все больные могут быть разделены на 2 группы: 1) бациллярные (БК+) и 2) абациллярные (БК-). Такой принцип характеристики больных имеет международное признание.
2. Характер туберкулезного процесса. По этому признаку принято выделять 3 группы больных: 1) с наличием деструктивных форм туберкулеза (CV+); 2) с наличием распространенных проявлений (диссеминация, множественные проявления туберкулеза и др.); 3) с малыми формами туберкулеза.
3. Оценка современности выявления больного, учитывая характер процесса и его эпидемиологическую опасность для окружающих.
Ранняя диагностика туберкулеза заключается в выявлении начальных форм туберкулеза. По современным представлениям о патогенезе туберкулеза, к таким формам относят ранние проявления первичного туберкулеза, возникшие в результате «свежего» заражения, проявления, развивающиеся у взрослых преимущественно за счет эндогенной реактивации, а также вторичные формы туберкулеза на ранних этапах их развития. Естественно, что к ранней диагностике туберкулеза возможно относить выявление лишь ограниченных, малых форм заболевания, развивающихся на начальном этапе появившейся болезни.
В связи с малосимптомным течением туберкулеза (особенно на ранних этапах заболевания) выявление больных нередко производится на более позднем этапе, когда уже в полной мере появились клинико-рентгенологические признаки той или иной клинической формы, но заболевание еще не приняло необратимого запущенного характера. Больных, выявленных с такими формами туберкулеза, принято характеризовать как выявленных своевременно.
Критериями своевременного выявления до настоящего времени по традиции считают: отсутствие признаков распада легочной ткани или начальный деструктивный процесс, обратимость туберкулезного процесса под влиянием лечения (очаговый, инфильтративный, ограниченный, диссеминированный туберкулез в фазе инфильтрации, без распада, а также ограниченные проявления первичного туберкулеза, экссудативный плеврит и др.).
Организация раннего и своевременного выявления туберкулеза вполне может быть охарактеризована как количественными, так и сохраняющими свое значение качественными критериями. Количественные критерии: полнота охвата населения флюорографическим и
183
бактериологическим исследованиями, выявляемость больных туберкулезом по обращаемости и при профосмотрах, выявляемость больных туберкулезом на 1000 обследованных и др. Качественные критерии характеризуют состав выявленных больных, для этой цели можно пользоваться официальной классификацией туберкулеза. С эпидемиологических позиций среди выявленных больных должны быть выделены бактериовыделители при обязательном указании, каким методом обнаружены микобактерии. Не вызывает возражений выделение по характеру туберкулезного процесса малых, распространенных и деструктивных форм; сопоставление численности различных групп может характеризовать качество диагностической работы.
Кроме того, для борьбы с туберкулезом целесообразно характеризовать выявленных больных в плане своевременности установления диагноза туберкулеза, что важно не только для оценки качества диагностической работы, но и организации мероприятий по осуществлению ранней диагностики туберкулеза. Предлагается выделить больных, выявленных своевременно, и с запущенными процессами. К первой группе можно отнести больных с малыми и незапущенными формами, развившимися в результате острого или подострого процесса (инфильтраты, диссеминированный туберкулез, плеврит и др.). Бактериовыделение, обнаруженное методом посева и даже методом микроскопии, не исключает своевременности диагностики заболевания, так же как и наличие начального деструктивного процесса. Ко второй группе — лица с запущенным процессом — следует отнести больных фиброзно-кавернозным и кавернозным, хроническим диссеминированным (особенно в фазе распада) и цирротическим туберкулезом. У таких больных, как правило, выявляется бактериовыделение, эти лица представляют наибольшую эпидемиологическую опасность для окружающих.
Уменьшение распространенности туберкулеза свидетельствует об эффективности системы противотуберкулезных мероприятий, разработанных и применяемых в нашей стране. Подтверждена и высокая эффективность сплошных флюорографических осмотров населения с картотечным учетом всех обследованных лиц. Сплошное флюорографическое обследование позволило выявить значительную часть больных туберкулезом, остававшихся неизвестными диспансерам из-за малосимптомного течения заболевания (особенно среди сельских жителей). Доказана необходимость 2—3-кратных сплошных флюорографических обследований населения для полного выявления неизвестных диспансеру больных туберкулезом с последующими осмотрами населения 1 раз в 2 года при ежегодном флюорографическом контроле лиц с повышенным риском заболевания туберкулезом. Разработанная методика проведения флюорографических осмотров с картотечным учетом распространяется на все территории страны, что имеет особо важное значение для выявления туберкулеза среди сельских жителей и улучшения структуры заболеваемости. После первоначального подъема показателя заболеваемости, наблюдающегося при организации сплошного флюорографического осмотра населения, в последующем отмечаются его снижение, а также резкое
184
уменьшение заболеваемости фиброзно-кавернозным туберкулезом за счет активного раннего выявления больных.
Полностью оправдали себя система централизации бактериологических лабораторий, а также использование стандартной лиофилизированной среды, изготавливаемой заводским методом. Выполнение этой программы позволило улучшить соотношение числа больных деструктивными формами туберкулеза легких и числа бактериовыделителей. За счет широкого использования метода посева значительно увеличилось обнаружение микобактерий у впервые выявленных больных не только с деструктивными изменениями в легких, но и без них. Установлена целесообразность повторного бактериологического исследования у лиц с неспецифическими заболеваниями легких (затянувшаяся пневмония, хронический бронхит и др.), у 2,5% которых удается обнаружить рост микобактерий.
Важное значение в повышении эффективности лечения и в последующем уменьшении числа пациентов противотуберкулезных диспансеров имеет разработанный и проверенный на экспериментальных территориях метод централизованного контроля за правильностью диагностики и эффективности лечения. Основой для централизованного контроля служит дублирующая картотека в областном (республиканском) противотуберкулезном диспансере, составленная для некоторых контингентов больных туберкулезом (впервые выявленные, «О»-группа, больных с хроническими формами и др.). Картотека включает дублирующие карты учета этих диспансерных контингентов, состоящих на учете в районных, городских противотуберкулезных диспансерах.
Централизованный контроль осуществляется путем повторной коллегиальной оценки данных обследования больного и результатов его лечения для своевременного внесения корректив в проводимое лечение. Суть этого мероприятия заключается в том, что наиболее квалифицированные специалисты областного противотуберкулезного диспансера комиссионно осуществляют контроль за качеством диагностики у всех вновь выявленных больных в области, а также периодически «пересматривают» контингенты противотуберкулезных учреждений. Это позволило более чем в 2 раза уменьшить число диагностических ошибок, особенно при определении активности туберкулезного процесса. Централизованный пересмотр контингентов больных туберкулезом позволил оценить качество проводимого лечения, уточнить диагноз и группу диспансерного учета и более правильно перераспределить контингенты больных по группам наблюдения в соответствии с утвержденной группировкой диспансерных контингентов. Организация централизованного контроля в сочетании с рациональным использованием коечного фонда и применением более совершенных схем химиотерапии на больничном и амбулаторном этапе позволила повысить эффективность лечения и добиться закрытия каверн у 86% и прекращения бактериовыделения у 96% впервые выявленных больных. Использование рифампицина и этамбутола позволило добиться прекращения бацилловы-деления у 60% повторно лечившихся больных.
185
ГЛАВА 6
КЛИНИЧЕСКИЕ ФОРМЫ ТУБЕРКУЛЕЗА ОРГАНОВ ДЫХАНИЯ
6.1. КЛАССИФИКАЦИЯ ТУБЕРКУЛЕЗА
Современная клиническая классификация туберкулеза в нашей стране, впервые утвержденная на совещании директоров институтов туберкулеза в 1938 г., существует уже более 50 лет. Она начала разрабатываться комиссией по классификации в 1934 г. под председательством В. А. Воробьева, а в последующем Г. Р. Рубинштейна и М. А. Ойфебаха.
Результатом работы комиссии было составление единой клинической классификации туберкулеза. Основной ее принцип заключается в том, что она построена не на основании одного признака, а нескольких. В основу клинической классификации туберкулеза были взяты признаки: клинико-рентгенологические особенности клинических форм туберкулеза, его течение, т. е. фазы, бактериовыделение, протяженность (локализация) процесса.
В клиническую классификацию туберкулеза неоднократно вносились поправки и изменения, весьма существенный пересмотр состоялся в 1973 г. на 8-м Всесоюзном съезде фтизиатров. Классификация является обязательной для всех лечебно-профилактических учреждений страны. Она состоит из 4 основных разделов: клинические формы туберкулеза;
характеристика туберкулезного процесса;
перечень основных осложнений;
формулировка остаточных изменений излеченного туберку-
2)
4) леза.
Первая и основная часть клинической классфикации — клинические формы туберкулеза. Они различаются в основном по локализации и клинико-рентгенологическим признакам с использованием патогенетической и частично патоморфологической характеристики туберкулезного процесса. Вторая часть представляет собой характеристику туберкулезного процесса. Все клинические формы болезни объединены в 3 группы: туберкулезная интоксикация у детей и подростков, туберкулез органов дыхания, туберкулез других органов и систем. Вторая часть классификации включает локализацию процесса в легких, характеристику туберкулезного процесса на основании клинико-рентгенологических признаков (инфильтрация, распад, обсеменение, рассасывание и уплотнение и др.) и наличие или отсутствие в материале, полученном от больного, микобактерий туберкулеза (БК+ или БК.), Третья часть характеризует возможные осложнения. Эта часть классификации основывается на клинических проявлениях, например спонтанный пневмоторакс, кровотечение или кровохарканье, амилоидоз и др. Четвертая часть, появившаяся впервые в 1973 г., — остаточные изменения после излеченного туберкулеза.
186
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ ТУБЕРКУЛЕЗА
А. Основные клинические формы
Группа L Туберкулезная интоксикация у детей и подростков
Группа II. Туберкулез органов дыхания
Первичный туберкулезный комплекс
Туберкулез внутригрудных лимфатических узлов
Милиарный туберкулез
Диссеминированный туберкулез легких
Очаговый туберкулез легких
Инфильтративный туберкулез легких
Казеозная пневмония
Туберкулема легких
Кавернозный туберкулез легких
Фиброзно-кавернозный туберкулез легких
Цирротический туберкулез легких
Туберкулезный плеврит (в том числе эмпиема)
Туберкулез верхних дыхательных путей, трахеи бронхов и др.
Туберкулез органов дыхания, комбинированный с пылевыми профессиональными заболеваниями легких
Группа III. Туберкулез других органов и систем
Туберкулез мозговых оболочек и центральной нервной системы
Туберкулез кишечника, брюшины и брыжеечных лимфатических узлов
Туберкулез костей и суставов
Туберкулез мочевых, половых органов
Туберкулез кожи и подкожной клетчатки
Туберкулез периферических лимфатических узлов
Туберкулез глаз
Туберкулез прочих органов
Б. Характеристика туберкулезного процесса
Локализация и протяженность в легких по долям, а в других системах — по локализации поражения
Фаза
а) инфильтрация, распад, обсеменение
б) рассасывание, уплотнение, рубцевание, обызвествление Бактериовмделение
а) с выделением микобактерий туберкулеза (БК+)
б) без выделения микобактерий туберкулеза (БК-)
В. Осложнения
Легочное кровотечение, спонтанный пневмоторакс, легочно-сердечная недостаточность, ателектаз, амилоидоз, почечная недостаточность, свищи бронхиальные, торакальные и др.
Г. Остаточные изменения после излечения туберкулеза
а) Органов дыхания
187
Фиброзные, фиброзно-очаговые, буллезные изменения, кальцинаты в легких и лимфоузлах, плевро-пневмосклероз, цирроз, брохоэктазы, состояния после хирургического вмешательства и др.
б) Других органов
Рубцовые изменения в различных органах и их последствия, обызвествления, состояние после оперативных вмешательств.
Классификация — едина для всех проявлений туберкулеза органов дыхания, а также других органов и систем. Очень большие споры на последнем съезде были по поводу туберкулезной интоксикации. История этого вопроса давняя. Термин «туберкулезная
интоксикация» предложил выдающийся русский клиницист, педиатр и фтизиатр А. А. Кисель. Туберкулезная интоксикация характери-
зуется наличием клинических проявлений туберкулеза, выражающихся синдромом общей интоксикации, но при этом локальных
проявлений туберкулеза обнаружить не удается. Морфологическим
субстратом туберкулезной интоксикации чаще всего являются по-
раженные лимфатические узлы средостения. Если воспалительная реакция небольшая и лимфатические узлы значительно не увеличиваются, обнаружить их с помощью клинических и рентгенологических методов очень трудно. Во времена А. А. Киселя это было
просто невозможно, потому что не существовало таких методов,
которые могли выявить незначительно увеличенные внутригрудные
лимфатические узлы и ограниченный воспалительный процесс в легком или других органах. Источником туберкулезной интоксикации могут быть очаги первичной туберкулезной инфекции в разных
органах и тканях, в частности костях, миндалинах и др. Поэтому
при настойчивом поиске морд
логические изменения при туберку-
лезной интоксикации с помощью современных методов сейчас обнаружить можно, если не у всех больных, то у значительного числа. Однако далеко не во всех больницах, диспансерах можно применять
все современные
4
логические
интоксикации, и
тонкие методы исследования, которые выявляют изменения, составляющие причину туберкулезной не всегда это абсолютно необходимо, поскольку
это довольно точно отражает состояние после заражения туберку-
лезом. Данный диагноз можно ставить только детям и подросткам, т. е. лицам моложе 18 лет. Если больной старше, такой диагноз поставить нельзя, и необходимо выявить локальные изменения.
Следующие клинические формы уже относятся ко II группе — туберкулеза органов дыхания. Первичный туберкулезный комплекс и туберкулез внутригрудных лимфатических узлов в основном относятся к первичному туберкулезу, но следует помнить, что первичный туберкулез может проявляться не только в виде этих двух клинических форм.
В настоящее время первичный туберкулез с локальными проявлениями чаще характеризуется развитием туберкулеза внутригрудных лимфатических узлов, а первичный комплекс встречается гораздо реже. Для последнего характерны поражения как лимфатических узлов средостения, так и легочной ткани. Кроме этих двух
188
признаков, при первичном комплексе часто бывают плеврит, эндобронхит, диссеминация. Но для того, чтобы поставить диагноз данной клинической формы, нужно доказать, что эти изменения туберкулезного генеза связаны с первичным заражением. Поэтому диагноз «первичный комплекс» ставится чаще подросткам, детям. Первичный комплекс может быть у человека молодого возраста, но уже гораздо реже.
Бронхоаденит наблюдается в двух основных вариантах — опухолевидном и инфильтративном. Но практика последних лет показывает, что, кроме этих вариантов, описанных в прежние годы, сейчас существуют такие формы бронхоаденита, которые не укладываются ни в признаки опухолевидного бронхоаденита, ни в признаки инфильтративного бронхоаденита. Это минимальные поражения лимфатических узлов средостения, поражения, которые выявляются лишь с помощью специальных методов, в частности и бронхологических методов. Поэтому в настоящее время выделяют третий вариант бронхоаденита — бронхоаденит с минимальным увеличением лимфатических узлов. Это пока условное название, другой термин не предложен.
При туберкулезе внутригрудных лимфатических узлов могут быть и другие изменения: очень часто поражаются бронхи, изменяются серозные оболочки, в частности плевра (особенно междолевая плевра), может быть диссеминация в легочную ткань и в другие органы. Однако главным признаком этой клинической формы является поражение лимфатических узлов средостения. Надо отметить, что такое поражение туберкулезного генеза бывает не только в результате свежего первичного заражения. Бронхоаденит может возникнуть в результате реактивации заживших очагов в лимфатических узлах средостения. Это бывает в основном у лиц пожилого возраста, встречается не очень часто.
Следующая форма — диссеминированный туберкулез легких, ранее она называлась гематогенно-дессиминированной формой туберкулеза. Дело в том, что диссеминированный туберкулез может быть разного генеза. Дессеминация, действительно, чаще всего встре-
чается при гематогенном распространении процесса, но в последнее
время описаны лимц
ронхогенные диссеминации с развитием оча-
гов преимущественно в средних и нижних отделах легких. Эта диссеминация чаще связана с активным процессом в лимфатических узлах средостения. Если говорить о группе больных с гематогенной
диссеминацией, то нужно подчеркнуть, что по клиническому течению гематогенно-диссеминированный туберкулез может быть острым (в том числе милиарным), подострым и хроническим. Сейчас чаще всего мы наблюдаем хроническое течение диссеминированного туберкулезного процесса гематогенного генеза. Для этой формы ха
рактерны не только поражения легких, но и частое развитие очагов в других органах и тканях: костях, коже, гортани и др. При диссеминированном туберкулезе гематогенного генеза требуется очень тщательное и всестороннее обследование больного из-за возможности развития экстраторакальных проявлений туберкулеза. Часто при
189
этой форме поражаются серозные оболочки (плевра, брюшина, пе-
рикард) .
Следующая форма туберкулеза — очаговый туберкулез легких,
он также характеризуется развитием очагов. Это ограниченный воспалительный процесс разного генеза. Различаются несколько вариантов очагового туберкулеза — и по генезу, и по клиническим проявлениям. Во-первых, очаговый туберкулез может возникать в
результате эндогенной реактивации старых верхушечных очаговых
отсевов. Во-вторых, он может возникать в результате суперинфекции, это также доказано. В-третьих, очаговый туберкулез легких
может возникать в результате распространения инфекции из бронха или лимфатических узлов средостения лимфобронхогенным путем,
и тогда очаговый процесс локализуется или в нижних, или в средних отделах легких, что необычно для туберкулеза. Далее, очаговый туберкулез в виде исключения может возникать гематогенным путем. Имеется поражение сустава или другая локализация процесса — и
гематогенным путем может возникнуть ограниченный очаговый процесс. Чаще всего у таких больных мы ожидаем развития диссеми-нации, диссеминированного туберкулеза, но иногда возникает ог
раниченная диссеминация, и тогда мы ставим диагноз очагового туберкулеза легких. Пятый вариант — очаговый туберкулез легких может быть не началом туберкулеза, а исходом другой какой-то клинической формы. Очаговый туберкулез легких может образо-
ваться в результате инволюции кавернозного процесса — на месте каверны может остаться очаг. Очаговый туберкулез может остаться после рассасывания диссеминации, на месте туберкулемы может остаться очаг. Значит, очаговый туберкулез легких может быть не только началом, но и исходом туберкулезного процесса. Поэтому
очень важно не только поставить формальный диагноз «очаговый
туберкулез легких», но и определить вариант этого туберкулеза.
Инфильтративно-пневмонический туберкулез легких встречается также в виде различных вариантов: облаковидный инфильтрат, круг-
лый инфильтрат, перисциссурит. Такой туберкулез требует очень раннего лечения, иначе может быстро образоваться каверна.
Туберкулема — это клиническая форма туберкулеза — «появи-
лась» недаво, описана Л. К. Богушем, М. М. Авербахом и другими авторами. Туберкулема — совершенно своеобразная клиническая форма туберкулеза. Раньше таких больных относили к группе лиц
с инфильтративным туберкулезом, имеющих круглые инфильтраты.
Но морфологические особенности и течение болезни совершенно
иное: туберкулема течет торпидно, характеризуется хроническим течением. Годами это образование может не меняться, поэтому и появилась необходимость выделения данной формы в самостоятельную клиническую форму туберкулеза.
Кавернозный туберкулез легких тоже появился в нашей классификации недавно. Кавернозный туберкулез — промежуточная переходная форма между фазой распада в той или иной клинической форме и фиброзно-кавернозным туберкулезом. Кавернозный туберкулез легких характеризуется тем, что на первый план у больного
190
выступает каверна. Признаки той формы туберкулеза, которая привела к образованию каверны, уже уходят на второй план, их уже не видно или почти не видно, а доминирующую роль начинает играть каверна. Но эта каверна еще не привела к тем последствиям, которые возникают у больных фиброзно-кавернозным туберкулезом. Для последнего характерно наличие особой каверны, как правило, фиброзной. И самое главное для этой формы туберкулеза — наличие фиброза в окружающей ткани. Вот этим фиброзно-кавернозный туберкулез отличается от кавернозного туберкулеза. Он отличается и наличием в стенке каверны и в окружающей каверну легочной ткани фиброза, элементов эмфиземы, брохоэктазов. У таких больных
со временем развиваются и различные осложнения.
Следующая клиническая форма — цирротический туберкулез легких. Раньше он назывался циррозом легких, а сейчас диагноз цирротического туберкулеза ставят больным, у которых имеются
не только цирротические изменения в легких, но и сохраняющиеся туберкулезные изменения в виде воспалительных фокусов, других морфологических образований и даже иногда в виде бронхоэктати-
ческой каверны. Диагноз «цирротический туберкулез» подчеркивает, что, во-первых, у больного имеется цирроз на почве туберкулеза, во-вторых, туберкулезный процесс сохраняет свою активность. Периодически возникают вспышки туберкулеза, это незакончившийся туберкулез, это продолжающийся активный туберкулез.
Далее в классификации указан туберкулезный плеврит, в том числе и эмпиема, прежде эта форма называлась туберкулезом плевры. Наконец, выделен туберкулез верхних дыхательных путей, трахеи и бронхов как самостоятельная клиническая форма, не сопровождающаяся поражением легочной ткани. Это туберкулез или трахеи, или бронхов, или каких-то других отделов в области верхних дыхательных путей. Подчеркивается, что именно такая локализация туберкулеза является ведущей. Чаще всего туберкулез верхних ды-
хательных путей существует наряду с какой-то другой клинической формой — с кавернозным туберкулезом, брохоаденитом, первичным комплексом и др. Чаще у таких больных имеется невыявленный туберкулез внутригрудных лимфатических узлов. Эти изменения
настолько незначительны, что выявить их трудно. Можно допустить поражение слизистой бронхов в результате эндогенного попадания
микобактерий туберкулеза, но это бывает редко. Наконец, следу-
ющая форма — туберкулез органов дыхания, комбинированный с
профессиональными заболеваниями легких. Итак, обращает на себя
внимание многообразие клинических форм туберкулеза и вариантов каждой из них, это наглядно подтверждает тезис и о многообразии
проявления туберкулеза.
Следующий раздел классификации — характеристика туберкулезного процесса. Во-первых, туберкулезный процесс характеризуется по локализации (протяженности). Локализация туберкулезного
процесса по долям, а при ограниченных процессах по сегментам дается в виде словесного описания. Далее указывается фаза процесса: I группа — инфильтрация, распад, обсеменение — характеризует
191
активный, прогрессирующий туберкулез; II группа — рассасывание и уплотнение — затихающий туберкулез, а рубцевание и обызвествление свидетельствуют о наступившем заживлении. Наконец, бактериовыделение обозначается БК+, а невыделение — БК- Для того чтобы написать, что у больного БК+, нужно обнаружить микобактерии туберкулеза и с помощью разных методов выявить источник бацилловыделения, т. е. сам туберкулезный процесс в каком-либо органе. Если обнаружены мико&ктерии и нет никаких клинико-рентгенологических проявлений туберкулеза, надо повторно исследовать материал. Если повторно выявляется бацилловыде-ление, тогда считается, что больной бактериовыделитель, и задача врача найти источник бактерий.
Третья часть классификации — осложнения. Осложнения — это те проявления болезни, которые связаны или с самим туберкулезом, или с метатуберкулезными изменениями. Осложнениями могут быть кровотечение, спонтанный пневмоторакс, легочно-сердечная недостаточность, ателектаз, амилоидоз, почечная недостаточность, свищи бронхиальные, торакальные и другие» все прочие осложнения туберкулеза или осложнения, связанные с метатуберкулезными изменениями. Раньше этой части в нашей классификации не было. Это приводило к тому, что осложнения туберкулезного процесса далеко не всегда выносились в диагноз, поэтому в какой-то степени характеристика туберкулезного процесса обеднялась. Сейчас осложнения являются обязательной частью диагноза. Если есть осложнения, они должны быть вынесены в диагноз.
И, наконец, последняя часть классификации — остаточные изменения излеченного туберкулеза. Все клинические формы, которые перечислены выше, характеризуют активный туберкулез, а вот то, что описано в этой части классификации, относится к лицам, у которых уже имеется излеченный туберкулез, и в настоящее время нет никаких признаков активной болезни. В прежние годы больные туберкулезом не очень часто выздоравливали, и даже тогда, когда наступал благоприятный исход, трудно было доказать излечение. В настоящее время излечение как исход туберкулезного процесса закономерно, и подавляющее большинство выявленных больных излечивается, поэтому появилась необходимость узаконить формулировки остаточных изменений после излеченного туберкулеза. В прошлом в таких случаях делали самые разнообразные заключения, которые не имели никакой общей основы и не были предусмотрены в классификации. Остаточные изменения могут быть охарактеризованы как наличие фиброзных, фиброзно-очаговых и буллезных изменений, кальцинатов в легких и лимфатических узлах, плевропневмосклероз, цирроз, бронхоэктаз, состояние после хирургического вмешательства. Излечение не всегда бывает стойким, у некоторых лиц развиваются рецидивы болезни. И вот эта категория пациентов с остаточными изменениями в какой-то степени является угрожаемой группой в плане реактивации туберкулеза. В настоящее время лица с остаточными изменениями туберкулезного генеза продолжают наблюдаться в противотуберкулезных диспансерах по VII группе диспансерного учета.
192
Таким образом, классификация характеризует не только активный туберкулез, но и последствия излеченного туберкулеза для того, чтобы за такими людьми вести диспансерное наблюдение. При возникновении различных неблагоприятных ситуаций, таких заболеваний, как острая пневмония, грипп с осложнениями, язвенная болезнь желудка (в том числе потребовавшая резекции части желудка), риск реактивации повышается. Таким лицам показано не только диспансерное наблюдение, но и при неблагоприятных ситуациях химиопрофилактика.
Естественно, классификация не отражает в полной мере многообразие туберкулеза, в том числе его патогенез: первичный, вторичный, связанный с заражением или реактивацией. Хотелось бы, чтобы классификация была в большей степени патогенетической, но пока еще не удалось найти подходящих формулировок. Для лечения больных ту-бекулезом очень важно, чтобы врач знал, впервые выявлен больной или он уже лечился ранее. В классификации это также не отражено. Если выставлен диагноз «очаговый туберкулез легких», неизвестно, больной впервые выявлен или уже наблюдался в течение 5—6 лет и лечился. Неизвестно, у больного рецидив или первое проявление болезни, или очередная вспышка при хроническом течении болезни. При выделении микобактерий туберкулеза очень важно знать, как обнаружены микобактерии — бактериоскопическим методом или посевом. В классификации это не отражается. Если обнаружены микобактерии и получен рост микобактерий, очень важно знать, какого типа микобактерии — человеческого, бычьего или птичьего. Очень важно знать, какова чувствительность этих микобактерий к химиопрепаратам. Классификация этого также не отражает. Иными словами, самая совершенная классификация по мере прогресса, по мере накопления новых сведений о том или ином заболевании постепенно устаревает, поэтому в классификацию все время вносят поправки и параллельно создают различные группировки с использованием различных признаков. Так, структура впервые выявленных лиц с наличием туберкулезных изменений выглядит следующим образом.
Больные с наличием бактериовыделения
Больные с четкими клинике- рентгенологическими признаками туберкулеза
Лица с малыми формами сомнительной активности
Бактерии обнаружены методом бактериоскопии
Бактерии обнаружены методом посева
а) активный процесс
б) неактивный процесс
Признаков, содержащихся в классификации, оказалось недостаточно для построения достаточно подробной диспансерной группировки, которая удовлетворяла бы потребности и клиницистов, и патоморфологов, и эпидемиологов, организаторов здравоохранения и диспансерных врачей. Поэтому появились предложения увеличить число признаков, по которым строится классификация, и больше
7—1213
193
всего на этом настаивали диспансерные врачи. По мере накопления опыта диспансерной работы стало ясно, что в плане диспансерного наблюдения больных нужно также разделять на определенные группы. Но эти группы формируются на основании уже не клинических, а эпидемиологических признаков — признаков, которые важны для проведения именно диспансерного наблюдения. В связи с этим были сделаны попытки как-то приспособить клиническую классификацию туберкулеза к ее использованию в диспансерной практике, для диспансерного наблюдения за больными. Все эти попытки будут безуспешными, пока не удастся создать единую классификацию туберкулеза, которая может использоваться и в клинике, и в диспансерной практике.
В настоящее время в нашей стране и за рубежом существует по две классификации: классификация клиническая, которая используется в клинической практике для формулировки диагноза, и классификация для диспансерного наблюдения — диспансерная и классификация статистическая, т. е. классификация, которая группирует больных туберкулезом для медицинской статистики. Международная классификация болезней — классификация статистическая, которой пользуются только для целей медицинской статистики. В международной классификации каждой болезни присвоен номер. И диагноз звучит только как номер. Международная классификация болезней шифрует все заболевания, присваивает каждому заболеванию свой номер, разновидности того или иного заболевания присваивается дополнительный номер, который указывается после номера данного заболевания. Эта классификация используется в основном для регистрации заболевания и причин смерти. В клинической практике она не применяется. Более того, даже для диспансерного наблюдения эта классификация непригодна. Поэтому, кроме этой международной статистической классификации болезней и клинической классификации, применительно к туберкулезу существует так называемая диспансерная группировка. Это тоже классификация больных туберкулезом и групп риска, она изложена в разделе, посвященном диспансерным методам работы.
6.2. ТУБЕРКУЛЕЗНАЯ ИНТОКСИКАЦИЯ
Туберкулезная интоксикация — клинический синдром у детей и подростков, обусловленный функциональными нарушениями без поражений, определяемых рентгенологическими и другими методами вследствие первичной туберкулезной инфекции. Такая интоксикация развивается при свежем заражении, реже при хроническом течении; в первом случае интоксикацию называют ранней, во втором — хронической. У больных отмечаются быстрая утомляемость, слабость, снижение аппетита, прекращение прибавления массы тела, постоянная субфебрильная температура или периодическое ее повышение до 37,1—37,5 °C. Иногда наблюдается бледность кожи, особенно при хроническом течении заболевания (слегка увеличиваются лимфатические узлы — шейные, подмышечные, локтевые,
194
паховые). Может также незначительно увеличиваться печень, реже селезенка. В крови отмечаются лимфоцитоз, повышение СОЭ, периодически могут развиваться сдвиг влево, моноцитоз. Ранняя туберкулезная интоксикация совпадает с первичным инфицированием микобактериями туберкулеза, поэтому у больных наблюдается вираж туберкулиновых реакций. Хроническая интоксикация бывает при затяжном течении первичного туберкулеза без четких локальных поражений. У таких больных обычно наблюдается выраженная реакция на внутрикожное или накожное введение туберкулина.
Важное значение для диагноза имеет указание на контакт с больным туберкулезом или животными. В трудных случаях для диагностики можно прибегнуть к подкожному введению туберкулина с одновременной оценкой иммунологических тестов, гемограммы, белковых фракций крови до и после введения туберкулина. При проведении диагностики туберкулезной интоксикации большое значение имеет всестороннее обследование ребенка или подростка с целью исключения заболеваний, которые могут вызвать подобный синдром: хронический тонзиллит, холецистит, аппендицит и др. В необходимых случаях могут быть применены различные рентгенологические и инструментальные методы, в том числе компьютерная томография и бронхоскопия. Иногда эти методы позволяют выявить ограниченные локальные изменения, что помогает установить локализацию процесса и сократить число больных с диагнозом туберкулезной интоксикации. Применяют химиотерапию изониазидом, лучше в комбинации с этамбутолом или этионамидом (протиона-мидом). Улучшение состояния наблюдается через 3—4 нед после начала химиотерапии, что свидетельствует в пользу диагноза «туберкулезная интоксикация»; общая продолжительность лечения составляет 6 мес. Большое значение имеют также санаторное лечение, полноценное питание, соответствующая нагрузка (шадящий режим), а в последующем — тренирующий режим. Дети и подростки с туберкулезной интоксикацией подлежат диспансерному наблюдению по III группе учета.
При неудовлетворительных домашних условиях или постоянном контакте с больным туберкулезом детей с туберкулезной интоксикацией помещают в специальные ясли, детский сад, школу-интернат, а также в специализированные санатории.
6.3. ПЕРВИЧНЫЙ ТУБЕРКУЛЕЗНЫЙ КОМПЛЕКС
Первичный туберкулезный комплекс — это клиническая форма туберкулеза, характеризующаяся наличием пневмонического очага и лимфангоита в легком, поражением региональных внутригрудных лимфатических узлов. Кроме этих изменений, нередко отмечаются специфический эндобронхит, междолевой или костальный плеврит, очаги отсева в верхушках легких. Различают осложненное и неосложненное течение первичного комплекса. Множественные поражения или обширная воспалительная реакция характерны для осложненного первичного комплекса. Неосложненное течение ха
7*
195
рактеризуется ограниченными изменениями (очаг 2—3 см в диаметре) в легких, незначительным увеличением внутригрудных лимфатических узлов и слабовыраженным лимфангоитом. Изредка наблюдается прогрессирующее течение, что проявляется образова
нием каверны в легком, развитием казеозно-некротических реакций в легком (казеозная пневмония) и внутригрудных лимфатических узлах. Другим вариантом прогрессирующего течения пер
вичного комплекса является развитие генерализованного милиарного туберкулеза и менингита (менингоэнцефалита). Первичный
комплекс развивается только вследствие первичного заражения туберкулезом. Наблюдается он в основном у детей и подростков, значительно реже у лиц молодого возраста. Типичным признаком наступившего первичного заражения туберкулезом служит вираж туберкулиновой реакции, т. е. впервые в жизни установленная положительная туберкулиновая реакция.
Клиническая картина первичного туберкулезного комплекса зависит от распространенности туберкулезных изменений и течения болезни. Неосложненный первичный комплекс, особенно у детей
старшего возраста, подростков и взрослых, может протекать с минимальными клиническими проявлениями. В таком случае заболе-
вание выявляется при рентгенофлюорографическом исследовании,
которое осуществляется при проведении профилактических осмотров
населения, а также при обследовании лиц с виражом туберкулиновых
реакций, выявленным при проведении ежегодных туберкулиновых проб детям и подросткам. Осложненное и прогрессирующее течение
проявляется клиническими симптомами, тяжесть которых зависит от локализации туберкулезных изменений, степени их выраженности, возраста и сопротивляемости организма больного. Наиболее тяжелая клиническая картина отмечается у детей младшего возраста,
у которых имеются синдром интоксикации и «грудные» симптомы за счет поражения органов дыхания. В более старшем возрасте также есть сочетание этих двух синдромов. При несвоевременной диагностике и более давнем туберкулезном процессе отмечается более выраженная симптоматика.
При клиническом обследовании большое значение имеет тщательно собранный анамнез жизни и болезни. При этом особое вни-
мание следует уделить возможным источникам заражения или су-
перинфекции (контакт с больными туберкулезом, больными туберкулезом животными), а также указаниям на заболевание туберкулезом близких родственников. Особую важность имеют сведения о
результатах ежегодно применяющихся туберкулиновых проб, а так-
же анализ данных о перенесенных заболеваниях. При осмотре боль
ного ребенка, подростка или человека молодого возраста необходимо
обратить внимание на наличие или отсутствие поствакцинальных знаков (рубчиков в месте введения вакцины БЦЖ). Внешний вид больного зависит от тяжести заболевания и продолжительности синдрома интоксикации. При ограниченных изменениях и слабовыра-женной интоксикации внешний вид может не меняться. При ос
ложненном течении и длительной интоксикации снижается масса
196
тела, отмечаются бледность и снижение эластичности кожи, тургора кожи. Периферические лимфатические узлы могут несколько увеличиться и прощупываться при пальпации. При обширной воспалительной реакции в легком определяется притупление перкуторного звука, дыхание над зоной поражения становится жестким, могут выслушиваться мелко- и среднепузырчатые хрипы, особенно при форсированном вдохе и после покашливания. Эти изменения более выражены при формировании деструктивных изменений. В этом случае, как правило, отмечается кашель, у детей старшего возраста и у подростков кашель может быть с мокротой, возможно кровохарканье.
Больным, кроме клинического, проводят рентгенологическое исследование, туберкулиновые пробы, исследование мокроты или промывных вод бронхов на наличие микобактерий туберкулеза (микроскопическое исследование и посев на питательные среды), по показаниям — бронхологические исследования, а также клинические
анализы крови и мочи.
Рентгенологическое исследование включает анализ рентгенограммы органов грудной клетки в прямой и боковой проекциях, а также томограммы легких и их корней для выявления увеличенных лимфатических узлов, что имеет большое значение для постановки диагноза. Первичный туберкулезный комплекс дает весьма типич
ную рентгенологическую картину за счет пневмонического очага в легком, лимфангоита и увеличенных внутригрудных лимфатических узлов (рис. 6.1). Появление плеврита, очагов отсевов также четко проявляется соответствующими рентгенологическими изменениями. Микобактерии туберкулеза в мокроте редко обнаруживаются у детей, чаще — у подростков, особенно при появлении признаков распада и формировании каверны. Микобактерии методом микроскопии и посева могут быть выявлены в аспирате из бронхов, полученном при бронхоскопии. Бронхоскопия позволяет также обнаружить специфическое поражение бронха, которое иногда развивается у боль
ных первичным комплексом.
Для постановки диагноза важное значение имеют результаты
туберкулиновых проб Манту или градуированной накожной пробы
Пирке. Положительная реакция свидетельствует о наличии сенсибилизации к туберкулину, т. е. о наступившем заражении. Особое
значение, как указывалось, имеет впервые появившаяся положи-
тельная туберкулиновая реакция (вираж туберкулиновой пробы).
Следует отметить, что положительные туберкулиновые реакции мо-
гут быть обусловлены проведенной вакцинацией или ревакцинацией БЦЖ, особенно если одновременно определяются поствакцинальные рубчики на плече. Поэтому у каждого больного необходимо по мере
возможности дифференцированно оценивать значение положитель-
ной туберкулиновой реакции и дифференцировать положительную
реакцию — вследствие заражения туберкулезом или проведенной вакцинации или ревакцинации БЦЖ. В крови у таких больных
изменения лейкограммы чаще всего ограничиваются лимфоцитозом, сдвигом влево и увеличением СОЭ до 20—30 мм/ч. Основной вид
197
Рис. 6 1. Продолжение.
в — рентгенограмма грудной клетки в боковой проекции, г — схема
199
Рис 6 1 Первичный туберкулезный комплекс
а — рентгенограмма грудной клетки в прямой проекции, б — схема
198
лечения — химиотерапия и патогенетические средства. На первом этапе лечения обязательна госпитализация, затем проводится санаторное и амбулаторное лечение. Больные наблюдаются по I группе диспансерного учета.
Репаративные процессы наступают медленно, особенно при прогрессирующем или осложненном первичном комплексе, заживление наступает через 3—4 года после начала болезни. Обратному развитию прежде всего подвергается очаг в легком, исчезает выпот в плевральной полости, заживают очаги отсева в легком. Дольше сохраняется активность туберкулезного процесса во внутригрудных лимфатических узлах, особенно при наличии казеозных изменений. У отдельных больных могут развиваться хронические формы туберкулеза, при прогрессирующем течении и таких проявлениях, как милиарный туберкулез, менингит и казеозная пневмония, может наступить летальный исход в случае запоздалой диагностики и недостаточно эффективном лечении.
6.4. ТУБЕРКУЛЕЗ ВНУТРИГРУДНЫХ ЛИМФАТИЧЕСКИХ УЗЛОВ
Этот вид туберкулеза развивается в результате первичного заражения у детей, подростков и лиц молодого возраста. Реже он возникает вследствие эндогенной реактивации имевшихся туберкулезных изменений в бронхиальных, медиастинальных, бронхопульмональных, паратрахеальных и трахеобронхиальных лимфатических узлах.
Различают инфильтративный, опухолевидный и малые формы туберкулеза внутригрудных лимфатических узлов. Опухолевидная форма проявляется увеличением размеров лимфатических узлов в результате воспалительной гиперплазии, что обнаруживается при рентгенологическом исследовании. Контуры лимфатических узлов на рентгенограмме и томограммах четкие. Инфильтративный туберкулез внутригрудных лимфатических узлов характеризуется не только увеличением узлов, но и развитием инфильтративных изменений в легочной ткани, в прикорневых ее отделах. Малые формы проявляются незначительным увеличением внутригрудных лимфатических узлов, что выявляется главным образом на томограммах с поперечным размазыванием в прямой или боковой проекциях. Этот вариант заболевания в последнее время встречается чаще, чем
в прежние годы.
В диагностике туберкулеза внутригрудных лимфатических узлов, кроме рентгенологического исследования, большое значение имеют туберкулиновые пробы. При свежем заражении выявляется вираж туберкулиновых реакций, при длительном течении заболевания нередко отмечается высокая чувствительность к туберкулину, что проявляется «пышными» туберкулиновыми реакциями. Отрицательная реакция на туберкулин при увеличенных внутригрудных лимфатических узлах нехарактерна для туберкулеза и требует тщательной дифференциальной диагностики с другими заболеваниями (саркоидоз, лимфогранулематоз и др.).
200
В клинической картине преобладают симптомы, обусловленные интоксикацией, реже отмечаются «грудные» жалобы и симптомы, которые могут появиться при осложненном течении заболевания. Наиболее частыми осложнениями являются эндобронхит (иногда с нарушениями бронхиальной проходимости вплоть до ателектаза сегмента или доли), междолевой или костальный плеврит. Возможны также поражение периферических лимфатических узлов и развитие наряду с туберкулезом внутригрудных лимфатических узлов различных клинических форм легочного туберкулеза. Можно выделить несколько вариантов течения патологического процесса: постепенная инволюция и быстрая регрессия, которая отмечается при ограниченных формах, инфильтративном бронхоадените в условиях рационального лечения, в том числе у лиц, иммунизированных против туберкулеза; осложненное течение, когда при затяжном течении болезни развиваются различные осложнения (эндобронхит, плеврит, различные поражения легких и др.); прогрессирующее течение,
развивающееся при казеозном перерождении и разжижении казеозных масс в лимфатических узлах. В этих случаях, к счастью
редко встречающихся в настоящее время, возможна перфорация в
бронх или пищевод с последующим развитием медиастинита. Такое
развитие заболевания может привести к быстрому летальному исходу, иногда при этом развивается обильное кровотечение, которое также может вызвать смерть. Заболевание может принять хрони
ческое течение, в таких случаях периодически появляются различные клинические проявления гиперсенсибилизации, описанные Б. М. Хмельницким как «маски» хронического первичного туберкулеза: гепатит, неврит, фликтены, полиартрит, периферический лимфаденит, узловатая эритема и др.
Диагностика туберкулеза внутригрудных лимфатических узлов основывается прежде всего на тщательно собранном анамнезе, в частности на сведениях о контакте с больными туберкулезом, о родственниках, больных туберкулезом, на сведениях о перенесенных заболеваниях, среди последних особое внимание должны привлечь те из них, которые могли бы быть обусловлены туберкулезом (плеврит, эритемы и др.). Внешний вид больных обычно не меняется. При физическом исследовании редко удается найти отклонения. При неосложненном бронхоадените имеющиеся изменения, как правило, обусловлены различными осложнениями. Решающее значение имеет рентгенологическое исследование, включающее рентгенографию в прямой и боковой проекциях, томографию и зонографию на уровне корней, при необходимости сделанные в «косых» проекциях. Важную роль играет бронхологическое исследование, которое позволяет выявить туберкулезный эндобронхит, произвести при необходимости трансбронхиальную пункцию лимфатических узлов или взять аспират (т. е. содержимое бронхов) для исследования на наличие микобактерий туберкулеза. Как указывалось выше, обязательным методом является туберкулиновый тест, при необходимости определение степени чувствительности к туберкулину, а при отрицательных туберкулиновых реакциях может быть произведена под
201
кожная туберкулиновая проба. При подозрении на саркоидоз внутригрудных лимфатических узлов можно провести радионуклидное исследование с 67С, который накапливается в саркоидной ткани лимфатических узлов и легких. Известное значение имеют лабораторные исследования: анализ крови, иммунологические исследования клеток крови, бронхоальвеолярный лаваж и др.
Химиотерапию проводят длительное время, при высокой чувствительности к туберкулину применяют десенсибилизирующие средства, в том числе кортикостероиды. При казеозном перерождении хирургическим путем удаляют внутригрудные лимфатические узлы. После первого (основного) курса лечения, который проводится, как правило, в больничных условиях, рекомендуется санаторное лечение с последующим пребыванием детей и подростков в специализированных учреждениях (детские ясли, сады, школы-интернаты). Все больные туберкулезом внутригрудных лимфатических узлов наблюдаются по I группе учета в противотуберкулезном диспансере с последующим переводом во II, III и VII группы.
6.5. ДИССЕМИНИРОВАННЫЙ ТУБЕРКУЛЕЗ ЛЕГКИХ
Диссеминированный туберкулез легких — клиническая форма, которая характеризуется образованием множественных туберкулезных очагов (диссеминации) с последующей инволюцией или прогрессированием. При диссеминированном туберкулезе сначала воз
никает преимущественно экссудативно-некротическая реакция типа альвеолита, а затем образуются гранулемы в связи с развитием продуктивного воспаления. При длительном течении заболевания возникают пневмосклероз, эмфизема, бронхоэктазы. Надо добавить,
что при этой форме нередко развивается также распад, т. е. разжижение казеозных масс с образованием полостей. Это может быть
как на ранних, так и поздних этапах болезни.
Под названием «диссеминированный туберкулез легких» объединяется довольно разнообразная группа проявлений, и можно выделить несколько клинических вариантов данной формы туберкулеза.
По патогенезу можно выделить гематогенно-диссеминированный ту-
беркулез и диссеминированный туберкулез, развивающийся вслед-
ствие лимфобронхогенного распространения микобактерий. При ге-
матогенно-диссеминированном туберкулезе очаги образуются в ре-
зультате распространения возбудителей с током крови. Для этой формы характерно наличие бактериемии, т. е. проникновение микобактерий в кровеносное русло. Микобактерии в кровеносное русло попадают, как правило, в результате обострения и активации туберкулезного процесса в каком-либо органе. В кровеносное русло микобактерии проникают различными путями. Чаще всего источником их распространения является активный процесс в лимфати
ческих узлах, в частности в узлах средостения. Поражение последних может быть проявлением свежего или хронического первичного
туберкулеза.
У людей пожилого возраста может быть экзацербация туберку
202
лезного процесса в лимфатических узлах. В этом случае туберкулезный процесс в узлах уже трудно связать с первичной туберкулезной инфекцией. Тем не менее Б. М. Хмельницкий и М. Г. Иванова обострение туберкулезного процесса в лимфатических узлах средостения у лиц пожилого возраста называли рецидивирующим первичным туберкулезом. Последний свидетельствует о том, что болезнь развивается вследствие экзацербации, рецидива старых изменений в лимфатических узлах. А. Е. Рабухин более правильно эти процессы относит к вторичному туберкулезу, поскольку экза-цербация туберкулезного процесса в лимфатических узлах уже не связана с периодом первичного туберкулеза и обострение обычно отмечается спустя несколько десятков лет после перенесенного первичного туберкулеза.
Известно, что обострение процесса в лимфатических узлах может быть не только у лиц пожилого возраста, но и молодых людей. Это бывает при исключительных обстоятельствах. Довольно часто такие обострения отмечались во время войн или у людей, находившихся в условиях голодания, у солдат, подвергавшихся всем лишениям военной жизни. В мирное время такие процессы могут быть у лиц, находящихся в районах стихийных бедствий, в развивающихся странах у населения, испытывающего резкое голодание. Но, по-видимому, не только недостаток питания, стрессовые ситуации, требующие огромного напряжения нервной системы и всех компенсаторных реакций организма, могут приводить к срыву противотуберкулезного иммунитета и обострению туберкулезного процесса в лимфатических узлах средостения, приводящему у ряда больных к бактериемии и развитию гематогенно-диссеминированного туберкулеза. Не только процесс в лимфатических узлах может быть причиной бактериемии — экстраторакальные очаги (особенно в костной системе, мочеполовых органах) при прогрессировании процесса и активной воспалительной реакции, а также легочный очаг могут приводить к попаданию микобактерий туберкулеза в кровяное русло.
Процесс проникновения микобактерий в кровеносное русло очень хорошо описал В. Г. Штефко. Он отмечал, что при гематогенно-диссеминированном процессе всегда имеется лимфогенная фаза, поскольку на ранних этапах вследствие воспалительного процесса в лимфатических узлах, при экстраторакальных очагах или очагах в легком микобактерии с током лимфы распространяются по лимфатическим путям, вызывая специфический туберкулезный лимфангоит. При этом в воспалительный процесс, как правило, вовлекаются и кровеносные сосуды, образуется васкулит. Специфические васкулиты были описаны еще в 1897 г. Weigert, который считал их источником бактериемии. Однако впоследствии Ribert, Huebschmann и многие другие авторы доказали, что специфические васкулиты, наоборот, являются следствием бактериемии с последующим поражением интерстициальной ткани, в которой периваскулярно образуются туберкулезные бугорки (гранулемы); специфический процесс ведет к поражению и паренхимы легких с образованием ацинозных и ацинозно-нодозных очагов.
203
Туберкулезный бугорок на ранних этапах формирования представляет собой воспалительный фокус с типичной клеточной реакцией. Среди различных клеток выявляются гигантские клетки Пирогова — Лангханса, клетки с округлыми ядрами (так называемые лимфоидные клетки), а также клетки вытянутой формы — эпителиоидные клетки. Туберкулезные бугорки, сливаясь, образуют более крупное формирование — туберкулезный очаг. Очаги могут быть ацинозными и аци-нозно-нодозными. Если поражается один ацинус, развивается ацинозный очаг, если несколько ацинусов — ацинозно-нодонозный бугорок, если имеется более обширный процесс и поражается вся долька легкого, тогда уже формируется очаг пневмонического типа. Периодически возникающая бактериемия может приводить к появлению новых очагов и другим специфическим поражениям в том же органе или в других органах. Кроме легких, чаще поражаются почки, гениталии, глаза, опорно-двигательный аппарат.
Чем чаще отмечаются волны бактериемии, тем больше вероятность развития гематогенно-диссеминированного туберкулеза. Для того чтобы появились очаги в результате бактериемии, нужно, чтобы микобактерии, попавшие в кровеносное русло, фиксировались в каком-то органе. При бактериемии микобактерии довольно часто фиксируются в таких органах, как печень, селезенка, верхние отделы легких. Конечно, фиксация может быть и в других органах и тканях — костной, в мочеполовой системе и др. Для возникновения воспалительного процесса и развития очагов, т. е. развития гематогенно-диссеминированного туберкулеза, нужно еще одно условие. Нужно чтобы в органе, в котором фиксировались микобактерии, было состояние местной сенсибилизации, поскольку без местной сенсибилизации с участием бактериальных антигенов и специфических систем воспалительная реакция с образованием гранулем не возникает. Таким образом, реализация бактериемии в виде образования очагов происходит в том случае, когда микобактерии туберкулеза фиксируются в органах, обладающих местной сенсибилизацией к туберкулезной инфекции. В этом случае возникают воспалительный процесс и очаг.
У отдельных лиц имеет место множественная сенсибилизация разных органов и систем. При наличии бактериемии у таких больных возникает генерализованный диссеминированный процесс. Очаги можно найти и в легких, и в селезенке, и в печени, и в костях, и в мозговых оболочках, и в других органах. Указанный процесс чаще развивается как острое заболевание. В этом случае имеет место острый диссеминированный туберкулез. У большинства больных острым гематогенно-диссеминированным туберкулезом возникает множественное поражение, т. е. одновременное поражение многих органов и систем. Генерализованный диссеминированный туберкулез может быть в результате острого заболевания, а также может возникнуть при последовательном поражении различных органов и систем. Такое течение, как правило, имеет место при другом клиническом варианте гематогенно-диссеминированного туберкулеза — при хроническом гематогенно-диссеминированном туберкуле
204
зе. Иногда генерализация процесса бывает у больных, которые плохо лечатся, или у больных, у которых не удается получить терапевтический результат. У этих пациентов появляются все новые и новые волны бактериемии и каждая новая волна приводит к появлению новых очагов; при этом могут последовательно поражаться разные органы и системы. Между острым и хроническим гематогенно-диссеминированным туберкулезом имеется промежуточный вариант. Это так называемый подострый диссеминированный туберкулез, при котором развитие болезни носит цодострый характер.
Для всех перечисленных трех клинических вариантов гемато-генно-диссеминированного туберкулеза характерна лимфогенная фаза: распространение микобактерий с током лимфы, развитие специфических лимфангоитов и последующее развитие специфического процесса в интерстициальной ткани органов, что наблюдается уже на самых ранних этапах туберкулеза. При гематогенно-диссеминированном процессе отмечается также довольно быстрый переход экссудативно-некротической реакции в продуктивное воспаление, что при затяжном течении болезни приводит к развитию интерстициального склероза. А это ведет к постепенному появлению фиброзной ткани и эмфиземы. Фиброз и эмфизема, как правило, обусловливают также деформацию бронхиального дерева, в результате возникают бронхоэктазы цилиндрического или мешотчатого типа. К этому нужно добавить, что обычно у таких больных имеется специфическое поражение сосудистой системы: сначала это васку
литы, в последующем наступают сужение кровеносных сосудов, их облитерация. Это ведет к грубому изменению сосудов и всей системы малого круга кровообращения. У таких больных постепенно разви
вается легочное сердце, отмечаются гипертрофия миокарда, затем
дилатация полостей сердца и все другие изменения, присущие ле
гочному сердцу.
Подобные изменения появляются не сразу. Они развиваются при многолетнем хроническом, волнообразном течении процесса и имеются у больных хроническим диссеминированным туберкулезом легких. Перечисленные изменения при данном туберкулезе возникают тогда, когда на ранних этапах не проводится специфическое лечение, больной предоставлен самому себе, не лечится, имеется постепенное периодическое нарастание фиброза, обусловленное периодическими вспышками туберкулезного процесса. Естественно, гематогенно-диссеминированный туберкулез характеризуется не только поражением интерстициальной, но и паренхиматозной части органов и, в частности, легких. Кроме очагов в паренхиме различных органов и легких, в первую очередь при разжижении образовавшегося казеоза может образоваться каверна. В этом случае меняется течение болезни, кроме бугорков, развивается деструктивный процесс.
Гематогенно-диссеминированный туберкулез встречается у 5— 6% всех впервые выявленных больных. Поэтому в настоящее время это не очень частая форма туберкулеза. В тех случаях, когда отмечается высокая частота гематогенно-диссеминированного тубер
кулеза, по-видимому, надо думать, что на этих территориях не
205
налажено выявление больных туберкулезом и, в частности, их выявление на более ранних этапах болезни. Надо сказать, что выявить больного гематогенно-диссеминированным туберкулезом довольно трудно. Во-первых, если имеется острый диссеминированный туберкулез в виде тифоидной формы, приходится проводить дифференциальную диагностику между туберкулезом и острыми инфекционными заболеваниями. Чаще всего это заболевание типа тифозной или паратифозной инфекции. На первых этапах при остром диссеминированном процессе преобладают явления общей интоксикации: высокая температура тела, резко выраженная слабость, головные боли, развивается адинамия. И, действительно, это больные, которые находятся в тяжелом состоянии. Иногда у таких больных, кроме общих явлений интоксикации, отмечаются менингеальные знаки в виде менингизма или клинических проявлений менингита и менингоэнцефалита.
Менингизм, т. е. легкие менингеальные знаки, могут отмечаться как проявление общей интоксикации в результате отека мозговых оболочек. Однако если имеются специфическое поражение мозговых оболочек и образование бугорков в них, тогда, как правило, развивается картина менингита или менингоэнцефалита. Клиническая картина менингита может быть стертой, что требует целенаправленного обследования больного. Кроме клинической картины, большое значение имеет исследование спинномозговой жидкости, поэтому при подозрении на туберкулезный менингит люмбальная пункция и последующее исследование спинномозговой жидкости обязательны.
Иногда при остром диссеминированном туберкулезе отмечаются выраженные признаки легочной недостаточности, на первый план в клинической картине выступает одышка, появляется цианоз. Одышка и цианоз развиваются на фоне высокой температуры тела и общего токсикоза, в таком случае выделяют так называемую легочную форму заболевания. Выделение менингеальной, тифоидной, легочной формы острого диссеминированного туберкулеза условно, поскольку, как правило, имеется генерализованный процесс, хотя бывают и локальные диссеминации. Поэтому какие-то формы дифференцировать трудно, это скорее клинические проявления, варианты течения болезни.
Постановку диагноза очень облегчает рентгенологическое исследование, при котором наблюдается характерная рентгенологическая картина. В легких определяются очаговые тени, равномерно распределяющиеся от верхушек до диафрагмы. На рентгенограмме это густая, монотонная, однотипная диссеминация в виде мелких и средней величины мягких очагов.
При остром диссеминированном туберкулезе на рентгенограмме (рис. 6.2) видна диссеминация, но нужно доказать ее этиологию. Иногда у таких больных определяются внелегочные очаги, туберкулез гортани, костей и суставов. А. И. Струков выделяет особую форму острого гематогенно-диссеминированного туберкулеза — это крупноочаговая диссеминация, проявляющаяся крупными очагами
206
Рис 6 2 Острый гематогенно-диссеминированный туберкулез легких а — рентгенограмма грудной (слетки в прямой проекции, б — схема.
207
с размытыми контурами по типу лобулярной казеозной пневмонии. Иногда такую картину называют «снежная буря» — на рентгенограмме очаги выглядят как хлопья снега. Такие варианты в настоящее время встречаются редко.
Большое значение для постановки правильного диагноза имеет
привлечение разных специалистов для выявления экстраторакаль-ных очагов, которые могли быть источником гематогенной диссеминации. Поэтому у таких больных, кроме обзорной рентгенограм
мы, важно сделать и томограммы, в частности томограммы на уровне корней для обнаружения увеличенных лимфатических узлов средостения. Подобных пациентов должен обследовать ортопед для выявления поражений суставов, обязательны обследование гортани ларингологом и консультация невропатолога. При тяжелом состоянии, при выраженной интоксикации туберкулиновая реакция может быть отрицательной, что затрудняет диагностику туберкулеза. У таких больных реакция может быть положительной, а если больного с отрицательной туберкулиновой реакцией начинают лечить специфическими средствами, уже через Р/г—2 мес отрицательная реакция может стать положительной, т. е. положительная реакция может быть не в первые дни болезни, а спустя некоторое время, когда улучшается состояние больного. Нужно также подчеркнуть, что иногда при остром гематогенно-диссеминированном туберкулезе одновременно отмечается поражение серозных оболочек. Может быть
плеврит костальной или междолевой оболочки. Это симптом, который также в какой-то степени облегчает диагностику.
Подострый диссеминированный туберкулез развивается более постепенно, но также характеризуется довольно выраженной интоксикацией. У таких больных также может быть гематогенная диссе-
минация, но возможен и другой генез образования очагов — аде-
ронхогенной диссеминацией. Источником послед-
ногенный с лим
|>;О
ней является, как правило, туберкулез трахеобронхиальных лимфатических узлов, из которых микобактерии туберкулеза рас
пространяются с током лимфы. Возможен также интраканаликуляр-
ный путь, т. е. бронхолегочное распространение микобактерий (особенно при развитии специфического эндобронхита). Легочная дис
семинация, возникающая лимфооронхогенным путем, характеризу-
ется поражением одного легкого и, как правило, локализуется в прикорневых и нижних отделах. В случае гематогенного генеза подострого диссеминированного туберкулеза диссеминация наблюдается в верхних отделах обоих легких. Нужно отметить, что в
клинике далеко не всегда удается определить патогенез диссемини-
рованного туберкулеза, так как признаки гематогенной или лим-
^обронхогенной диссеминации у некоторых больных могут быть
выражены нечетко, а иногда отмечается смещенный тип, когда у одного и того же больного имеются признаки гематогенной и лим-
|>;О
ронхогенной диссеминации.
Для подострого диссеминированного туберкулеза характерно на-
личие уже более крупных мягких очагов, причем очаги сливаются друг с другом. Это очаги с выраженной экссудативно-некротической
208
реакцией, вследствие чего имеется склонность к распаду, быстрому образованию каверны. Полости, образующиеся у таких больных, иногда бывают в одном легком, иногда в обоих на симметричных участках. Вокруг этих полостей может отсутствовать выраженная перифокальная реакция, поэтому такие полости называют штампованными кавернами (это специальное название). Картина болезни при подостром диссеминированном туберкулезе во многом укладывается в картину, которая отмечается при тяжелом течении пневмонии. У некоторых больных она не выражена, это так называемая амбулаторная форма подострого диссеминированного туберкулеза, т. е. вариант, протекающий со слабовыраженной общей интоксикацией. При подостром диссеминированном туберкулезе отмечаются довольно выраженные грудные симптомы. У больных могут быть
кашель, выделение мокроты, при выслушивании можно определить хрипы в легком. Нередко отмечается одновременное поражение серозных оболочек в виде костального или междолевого плеврита.
Существенное значение для диагностики подострого диссеминированного туберкулеза имеет сопоставление клинических проявлений заболевания с данными рентгенологического исследования лег-
ких и в первую очередь с характером очагов, их локализацией.
Особую ценность имеют данные, указывающие на наличие полости
распада, увеличение внутригрудных лимфатических узлов и поражение плевры. При этом следует учитывать, что у больных подострым диссеминированным туберкулезом большое диагностическое значение имеет положительная туберкулиновая реакция. У некоторых больных повышается чувствительность к туберкулину, микобактерии туберкулеза в мокроте особенно часто выявляются при
формировании полостей распада в легких. При бронхоскопии иногда,
ронхогенных диссеминациях, наблюдаются
различные проявления туберкулеза бронхов вплоть до образования свищевых форм. У больных подострым диссеминированным туберкулезом (особенно при гематогенном его генезе) могут быть экс-траторакальные поражения: туберкулез глаз, костей, суставов, мо-
чеполовых органов и др.
Наконец, третий клинический вариант диссеминированного ту-
беркулеза — хронический диссеминированный туберкулез гемато
ронхогенного генеза. На самых ранних этапах
генного или лима л
этого варианта появляются очаги в верхушках легких, нередко эти очаги немногочисленны, характерно апикокаудальнее распространение процесса, т. е. начинается диссеминация в верхних отделах легких, сначала появляются немногочисленные очаги в периферических отделах обоих легких. На этом этапе иногда даже трудно провести грань между очаговым и гематогенным диссеминированным туберкулезом. Двусторонний очаговый туберкулез в отдельных случаях может быть результатом гематогенной диссеминации. Но вследствие повторных волн бактериемии в легких появляются новые и новые очаги. Процесс становится более распространенным и полиморфным. Со временем появляются тяжистые тени за счет развивающегося интерстициального фиброза, что свидетельствует о дав-
209
ности заболевания. При долго длящемся (многолетнем) гематогенно-диссеминированном процессе обращают на себя внимание поражение обоих легких, симметричность поражения, резко выраженная полиморфность очагов, что отражает неодновременность их появления. Очаги разные по величине и по плотности. Старые очаги угасают, увеличиваются в размерах, сливаются, появляются новые очаги, затем они уплотняются или рассасываются. Развивается эмфизема как результат интерстициального склероза.
У таких больных, как правило, имеются бронхоэктазы и отмечаются признаки легочного сердца. С одной стороны, это результат фиброза, эмфиземы, с другой — поражения сосудистой системы легких. На первом этапе легочное сердце компенсированное, а затем с возрастом и по мере прогрессирования процесса наступает суб- и декомпенсация, развивается легочная и легочно-сердечная недостаточность.
Кроме поражения легких, нередко отмечается поражение и других органов. В прежние годы у таких больных, как правило, отмечалось поражение кишечника. Сейчас эта локализация встречается редко, но туберкулез гортани, мочеполовых органов, костей и суставов выявляется довольно часто. Как же протекает хронический гематогенно-диссеминированный процесс? Клинически для такого процесса характерно волнообразное течение, со сменой периодов обострений и интервалов между ними. Надо отметить, что при хроническом диссеминированном туберкулезе даже в период вспышки клинические проявления болезни в настоящее время выражены слабо. В указанном периоде симптомы интоксикации не выражены. У таких больных могут быть повышение температуры тела, утомляемость, слабость, вазомоторная лабильность, т. е. все те признаки, которые укладываются в понятие туберкулезной интоксикации. Период, в течение которого отмечаются проявления интоксикации, сравнительно короткий (2—3 нед), а у некоторых больных значительно меньше. Симптомы интоксикации постепенно угасают, состояние больных становится лучше, и они приступают к обычной деятельности. Если такие больные обращаются к врачу при отсутствии хорошо организованной системы обследования, очаги, особенно немногочисленные на ранних этапах в верхних отделах, очень легко можно «просмотреть». Правильный диагноз может быть и не установлен. Заболевание, если оно фиксируется, трактуется чаще всего как интеркуррентное. Нужно добавить, что, кроме общей интоксикации, у таких больных бывают покашливание, иногда хрипы в межлопаточном пространстве, очень скудные стетакустические изменения в виде притупления обычно отсутствуют. Последние могут быть только тогда, когда есть сопутствующий плеврит, тогда притупление четко определяется.
Выявить диссеминированный туберкулез на ранних этапах можно в основном лишь с помощью рентгенологических методов — с помощью флюорографии или при рентгенологическом обследовании лиц, обратившихся за медицинской помощью. Без рентгенологического исследования диагноз на ранних этапах болезни поставить 210
невозможно. Но если заболевание своевременно не выявляется, клинические проявления уже более выраженные. На этом этапе к явлениям интоксикации, покашливанию присоединяются симптомы, обусловленные эмфиземой, хроническим бронхитом и развивающимися бронхоэктазами. У таких больных постепенно появляется одышка, которая медленно, но неуклонно нарастает, усиливается кашель, увеличивается выделение мокроты, может быть кровохарканье. Натолкнуть мысль врача на наличие туберкулеза может появление внелегочных очагов, которые могут образоваться на любом этапе заболевания. При туберкулезе гортани появляются боли при глотании, изменяется голос и, если больной обращается к врачу, то сначала может быть выявлен специфический процесс в гортани, а затем гематогенно-диссеминированный туберкулез легких. Если появляются боли в каком-либо суставе (особенно при нагрузке, быстрой ходьбе), это влечет за собой, как правило, обращение больного к соответствующему специалисту, чаще к ортопеду, и при обследовании также может выявляться поражение кости. Наличие лейкоцитов в моче, гематурия обычно заставляют любого врача задуматься над теми причинами, которые могут вызвать изменения, и подобных данных достаточно для проведения инструментального исследования.
Иногда специфический процесс в мочеполовых органах может быть выявлен при обнаружении в моче микобактерий туберкулеза. Но надо сказать, что при бактериоскопическом исследовании микобактерии в моче выявляются редко, поэтому чаще требуется посев. Наличие микобактерий — это бактериологическое подтверждение диагноза мочеполового туберкулеза, который выявляется в процессе инструментального или рентгенологического исследования.
На том или ином этапе течения хронического туберкулеза в легком может появиться распад, так же как и при подостром диссеминированном туберкулезе. Распад и формирование каверны характеризуются определенным синдромом, четырьмя признаками: кашель с выделением мокроты, хрипы, кровохарканье и микобактерии в мокроте. Правда, не всегда у больных диссеминированным туберкулезом имеются все признаки распада, но достаточно появления хотя бы одного из них, чтобы провести рентгенологическое исследование, включая и томографию (на ранних этапах распад выявляется только томографическим методом). Следует иметь в виду, что при диссеминированном туберкулезе не всегда даже при томографии обнаруживается распад, так как сетчатый рисунок за счет фиброза, наличие эмфиземы, слившиеся очаги затрудняют выявление небольших участков распада. Но о наличии распада можно судить по бактерио выделению, кровохарканью, хрипам, и только на более поздних этапах, когда формируется полость, ее можно выявить.
При рентгеноскопии и на рентгенограмме хорошо видны пневмосклероз, эмфизема и на фоне эмфизематозных участков тяжистые и очаговые тени, которые свидетельствуют о перенесенном заболевании, у таких больных определяются остаточные изменения. При
211
более запущенном процессе наблюдается полость. Хронический диссеминированный процесс может характеризоваться двумя кавернами, расположенными симметрично в верхних отделах обоих легких. Очагов довольно много, кроме того, обнаруживаются плевральные наслоения за счет адгезивного плеврита. Вот такая рентгенологическая картина без бактериологического подтверждения свидетельствует о хроническом диссеминированном процессе (рис. 6.3).
В последнее время по мере уменьшения числа больных диссеминированным туберкулезом легких в противотуберкулезные уч
реждения все чаще попадают лица, у которых отмечается диссеми-
нация нетуберкулезного происхождения. Поэтому диссеминированный туберкулез легких приходится дифференцировать с большой группой заболеваний, которые проявляются диссеминацией. Чаще ошибочный диагноз диссеминированного туберкулеза ставят пациентам с наличием саркоидоза легких (тем более что при саркоидозе
бывают увеличенные лимфатические узлы). Кроме саркоидоза, очень часто диссеминированный туберкулез легких приходится дифференцировать с различными видами пылевых заболеваний легких — с
силикозом, асбестозом и другими пневмокониозами. Правда, нужно оговориться, что нередко силикоз и другие пылевые заболевания комбинируются с туберкулезом и поэтому в этих случаях приходится
не столько проводить дифференциальную диагностику между ту-
беркулезом и силикозом, сколько решить вопрос, имеется ли только
профессиональная болезнь в виде силикоза или какого-либо другого
вида кониоза или же имеется кониоз, сочетающийся с туберкулезом. Особенно часто эти проблемы возникают у врачей, которые работают
в промышленных зонах, у которых встречается силикоз. Это районы
различных шахт, это районы металлургической промышленности, это районы с развитой цементной, кирпичной промышленностью, стекольными заводами, кониоз бывает у электросварщиков.
Наконец, при проведении дифференциальной диагностики приходится сталкиваться с довольно большой группой заболеваний, которые проявляются диссеминациями; существует большое число различных болезней, которые могут приводить к диссеминированным процессам. Кроме тех болезней, которые уже названы, диссеминация может быть обусловлена пневмонией бактериального, грибкового и вирусного происхождения, васкулитами. Диссеминация может быть
вызвана аллергическим альвеолитом и гранулематозом экзогенного или идиопатического характера, гранулематозом Вегенера, Гудпас-чера, узелковым периартритом и другими васкулитами, канцеро-матозом метастатического или первичного ракового происхождения. Медиастинально-легочная форма лимфогранулематоза может давать диссеминацию. Более редкие болезни легких также могут приводить к диссеминации (протеиноз легких, альвеолярный микролитиаз, легочный амилоидоз, гистиоцитоз и др.).
Перед врачом, когда он обнаружил диссеминацию в легких, прежде всего стоит задача выявить или отвергнуть туберкулез. Надо сказать, что при типичной картине гематогенно-диссеминированного туберкулеза особых трудностей в диагностике нет при наличии
212
Рис. 6.3. Хронический диссеминированный туберкулез легких а — рентгенограмма грудной клетки в прямой проекции, б — схема.
213
положительной туберкулиновой реакции. Труднее бывает тогда, когда мы видим не полиморфную, а однотипную диссеминацию у больных с отрицательной туберкулиновой реакцией и развивающимся пневмосклерозом и эмфиземой, когда с большими или меньшими трудностями снимается диагноз туберкулеза и стоит вопрос, а какое же заболевание привело к появлению диссеминации. Подтвердить или отвергнуть туберкулез при наличии диссеминированных процессов не так уж трудно, это в большинстве случаев удается,
правда, на это иногда приходится тратить довольно много времени, применить не только обязательный диагностический минимум, но и дополнительные, факультативные методы, а иногда и метод ди
агностики ex juvantibus, проведя специфическое противотуберкулезное лечение и наблюдая за больными в динамике. Гораздо трудней второй этап диагностики, когда нужно определить природу нетуберкулезного заболевания, приведшего к диссеминации. В этом случае чаще приходится пользоваться методом биопсии. В этом случае
морфологическое и цитологическое исследования играют решающую роль в дифференциальной диагностике. Последней могут помочь и некоторые другие методы, в частности бактериологический и им
мунологический .
Возвращаясь к диссеминированному туберкулезу, нужно подчеркнуть, что нельзя ограничиваться формальным диагнозом, нужно разбираться в патогенезе этой клинической формы и, разобравшись в нем, надо попытаться выявить источник диссеминации. Обнаружив последний, нужно добиваться не только рассасывания очагов в лег-
ких, но и заживления тех очагов, которые привели к появлению
бактериемии и гематогенному диссеминированному процессу или
лимфобронхогенному обсеменению. Только после заживления ис-
точника обсеменения можно быть уверенным, что наступает изле-
чение. Если этого не происходит, то имеется опасность повторной вспышки, повторного обсеменения, поэтому больные диссеминированными формами наблюдаются в группах диспансерного учета несколько дольше, чем больные очаговым или инфильтративным туберкулезом легких, и даже несколько дольше, чем больные с затихающим, заживающим кавернозным туберкулезом легких. Таким образом, рассасывание очагов у больных диссеминированным туберкулезом еще не означает полного излечения. Длительность наблюдения играет очень большую роль. Именно при этой форме туберкулеза особенно важное значение имеют противорецидивные курсы лечения, которые проводятся лицам, наблюдающимся по II
группе диспансерного учета. Даже III группа учета иногда по ин-
дивидуальным показаниям подвергается противорецидивному лечению: если возникает риск рецидива, если лица, наблюдающиеся по III группе, вдруг переносят какие-то заболевания, которые создают риск появления туберкулеза. Больным, перенесшим гематогенно-
диссеминированный туберкулез, по индивидуальным показаниям
приходится проводить химиопроц:
илактику не только в период, когда
они наблюдаются по III группе, но и тогда, когда они переведены в VII группу. Если больной, перенесший диссеминированный про-
214
цесс, заболеет диабетом или перенесет тяжелую пневмонию (особенно с абсцедированием и однократным бацилловыделением), не
обходим курс химиопрофилактики.
Таким образом, диссеминиро-
ванный туберкулез требует большой настороженности врача не толь
ко в период, когда имеются активные изменения, и не только в ближайший период после выздоровления, но в последующем.
6.6. МИЛИАРНЫЙ ТУБЕРКУЛЕЗ
Клиническая форма — милиарный туберкулез — восстановлена в клинической классификации туберкулеза только в сентябре 1994 г. на II (XII) съезде фтизиатров в Саратове. Это было сделано в связи с более частым появлением тяжелых, остро прогрессирующих форм туберкулеза в последние 2—3 года. Вместе с тем милиарный туберкулез известен с давних времен и описан по данным вскрытий умерших Лаэннеком. В 1842—1848 гг. Н. И. Пирогов описал клиническую картину милиарного туберкулеза с генерализованным поражением различных органов, протекающую с тяжелейшей интоксикацией и напоминающую брюшной тиф, что послужило основанием для выделения «тифоидного» варианта милиарного туберкулеза.
При милиарном туберкулезе возникает диссеминация, формируются мелкие (1—2 мм) очаги с преимущественно продуктивной тканевой реакцией, хотя не исключаются и казеозно-некротические изменения. Очаговые изменения развиваются в первую очередь в интерстициальной ткани, затем поражается и паренхима органов.
Милиарный туберкулез представляет собой, как правило, генерализованную форму туберкулеза, характеризующуюся поражением легких, серозных оболочек, печени, селезенки, кишечника и других внутренних органов. Чаще он встречается у детей и подростков, не иммунизированных против туберкулеза вакциной БЦЖ в связи со свежим заражением туберкулезом и развитием бактериемии при прогрессирующем течении первичной туберкулезной инфекции. Источником бактериемии и милиарного туберкулеза может быть развившийся в результате первичного заражения туберкулез внутригрудных лимфатических узлов. Микобактерии туберкулеза, попавшие в кровяное русло, вызывают специфический воспалительный процесс в стенке кровеносных сосудов, проникают в прилежащие ткани. В результате формируются мелкие туберкулезные очаги, напоминающие просяные зерна, что и послужило основанием для названия этой формы туберкулеза. Диссеминация может появиться вскоре после заражения туберкулезом (4—6 нед), но может быть и отсроченной и возникнуть в более поздние сроки после формирования бронхоаденита или первичного комплекса. У взрослых милиарный туберкулез возникает также в результате бактериемии, источником которой может быть активный туберкулезный очаг в кости, почках, половых органах, реже в легочной ткани. Источником бактериемии может служить хронический или обострившийся туберкулезный процесс во внутригрудных лимфатических узлах.
Обычно болезнь начинается остро: повышение температуры тела
215
до 39—40°С, резко выраженная интоксикация, слабость, потеря аппетита, потливость, приобретающая у некоторых больных характер ночных потов, потеря массы тела, у ряда больных резко выраженные головные боли. При появлении диссеминации в мозговых оболочках и веществе мозга развиваются признаки менингита и менингоэнцефалита: ригидность затылка, симптомы Кернига и Бабинского. В таких случаях необходима люмбальная пункция и исследование спинномозговой жидкости. В клинической картине заболевания обращают на себя внимание одышка, упорный сухой кашель, цианоз слизистых оболочек губ. В легких изменения при перкуссии и аускультации незначительные, может выслушиваться небольшое число сухих хрипов за счет развивающегося бронхиолита [Рубинштейн Г. Р., 1948 ]. Как правило, отмечается тахикардия.
Диагноз в значительной степени облегчается после рентгенографии легких и выявления множественных мелких очагов на всем протяжении легочных полей, расположенных симметрично (рис. 6.4).
У некоторых больных можно обнаружить увеличение внутригрудных лимфатических узлов, печени и селезенки. В процессе наблюдения могут выявляться экстрапульмональные очаги в костной системе, почках и других органах. Иногда наблюдается плеврит с накоплением серозного лимфоцитарного экссудата, который можно выявить при физическом и ультразвуковом исследовании. Поражение различных внутренних органов (печень, селезенка и др.) обнаруживается с помощью компьютерной томографии или ультразвукового исследования.
Туберкулезная реакция обычно положительная, но при очень тяжелом состоянии больных может быть отрицательной. Интоксикация проявляется также резко выраженными изменениями в лей-кограмме: лимфопения, сдвиг влево, увеличение СОЭ, лейкоцитоз.
В доантибактериальный период милиарный туберкулез (особенно с развившимся менингитом) неизбежно вызывал смертельный исход как у детей, так и взрослых. Противотуберкулезные препараты дали возможность лечить таких больных и добиваться выздоровления. Успех лечения зависит от своеобразной диагностики милиарного туберкулеза, которая должна проводиться в условиях специализированного стационара, поскольку у таких больных необходимо применять различные (в том числе инвазивные) методы диагностики при наличии очень тяжелого общего состояния. Кроме химиотерапии, которая должна проводиться на ранних этапах заболевания, необходима дезинтоксикационная терапия, а при появлении выраженной дыхательной недостаточности применяют меры, направленные на ее ликвидацию (длительная кислородная терапия, сердечные средства, кортикостероиды, иммуномодуляторы). Лечение направлено на подавление бактериальной популяции в крови и тканях разных органов, ликвидацию проявлений интоксикации, борьбу с дыхательной недостаточностью. Под влиянием лечения обычно наступает регрессия указанных выше проявлений болезни; такая регрессия может быть сравнительно быстрой, но может быть и замедленной.
216
Рис. 6.4. Милиарный туберкулез легких. а — рентгенограмма; б — схема.
217
Заболевание может принимать затяжное течение с периодическими обострениями. При поздней диагностике и неэффективном лечении возможно ее прогрессирование и летальный исход.
6.7. ОЧАГОВЫЙ ТУБЕРКУЛЕЗ ЛЕГКИХ
Очаговый туберкулез легких — это клиническая форма, которая характеризуется ограниченным, преимущественно продуктивным
воспалительным процессом и малосимптомным клиническим тече-
нием. При этой форме имеется прямая зависимость между харак-
тером морц
логической реакции и клиническим течением болезни.
До последнего времени очаговый туберкулез легких считался самым частым проявлением легочного туберкулеза у взрослых. И сейчас на многих территориях нашей страны очаговый туберкулез легких составляет 40—50% среди всех впервые выявленных случаев. Особенно много больных очаговым туберкулезом выявляется в тех
регионах, в которых начато массовое сплошное флюорографическое обследование населения. До последнего времени считалось, что наличие большого числа больных очаговым туберкулезом легких — хороший показатель выявления туберкулеза и свидетельство хорошей организации выявления. Но последние данные показывают, что
на тех территориях, где флюорография систематически проводится уже несколько лет, удельный вес очагового туберкулеза легких среди всех впервые выявленных снижается до 40—30%. Это объясняется более полной осведомленностью противотуберкулезных диспансеров о всех лицах, имеющих в легких изменения туберкулезного характера, которые слабо выражены клинически и протекают часто незаметно для больного.
Mop<t
логические изменения, характерные для очагового тубер-
кулеза легких, были описаны еще в начале столетия А. И. Абрикосовым, который считал, что у взрослого инфицированного туберкулезом человека очаговый туберкулез возникает вследствие экзоген-
ной суперинфекции. Характеризуя очаги в верхушках, ученый от-
мечал, что, кроме поражения паренхимы легкого, отмечается поражение и концевых отделов бронхиальной системы. И, собственно говоря, очаг начинается прежде всего с эндобронхита. В последующем об этом писал крупный российский фтизиатр А. Н. Рубель. Он утверждал, что, прежде чем появится очаг, возникает эндобронхит в концевом отделе бронха. Бронхи и бронхиолы поражаются вследствие экзогенной суперинфекции, вслед за этим возникает и очаг пневмонии с быстрым переходом воспалительной реакции из экссудативной в продуктивную. Большим приверженцем экзогенного развития туберкулеза был Г. Р. Рубенштейн. Он считал, что очаговый туберкулез всегда возникает в связи с суперинфекцией. Однако были и другие представления о патогенезе очагового туберкулеза. Б. М. Хмельницкий и М. Г. Иванова считали, что он развивается, как правило, в результате эндогенной реактивации старых очагов. В настоящее время принято считать, что хотя экзогенный механизм возникновения очагового туберкулеза возможен, чаще очаговый
218
туберкулез возникает в результате не суперинфекции, а реактивации старых остаточных туберкулезного происхождения изменений. Какие же остаточные изменения, в каком органе очаги дают начало очаговому процессу? Наиболее частым источником очагового туберкулеза легких являются остаточные очаги, образовавшиеся в период первичной туберкулезной инфекции. Как правило, они локализуются в верхушках легких, иногда выявляются на рентгенограммах в виде мелких кальцинатов. Это так называемые очаги Симона. Источником очагового туберкулеза могут быть и другие остаточные изменения туберкулезного происхождения.
В течение длительного времени не удавалось раскрыть механизма развития очагового туберкулеза вследствие эндогенной реактивации старых остаточных изменений, хотя имелись четкие данные морфологических исследований, доказывающих взаимосвязь между обострившимися старыми и новыми, свежими очагами. Были получены данные бактериологических исследований резецированных участков легких (по поводу туберкулеза и нетуберкулезных заболеваний), свидетельствовавшие о том, что из старых туберкулезных очагов (в том числе верхушечных очагов) высеять микобактерии туберкулеза, как правило, не удается. Как микобактерии, которые не растут даже на питательных средах, вызывают реактивацию очагов?
Этот вопрос длительное время не имел ответа. Современные работы, проведенные в Центральном институте туберкулеза Н. А. Шмелевым, 3. С. Земсковой и И. Р. Дорожковой, показали, что в
старых очагах могут сохраняться так называемые персистирующие формы микобактерий туберкулеза, которые не размножаются, нередко меняют свои морфологические свойства, они могут быть в
виде зерен, ультрамелких, L-трансформированных форм. При соответствующих условиях и благоприятной ситуации персистирующие микобактерии могут превращаться в жизнеспособные ревертанты, т. е. происходит их реверсия. Реверсия — это превращение персистирующих микобактерий в обычные жизнеспособные, размножающиеся формы; ревертанты могут дать вспышку туберкулеза. В на
стоящее время реактивация старых очагов и развитие очагового туберкулеза нередко наблюдаются у лиц пожилого возраста, у лиц, у которых период между возникновением очагового туберкулеза и первичным заражением измеряется десятками лет. Это значит, что в течение всего этого периода в организме таких людей в старых, остаточных очагах находились персистирующие формы микобактерий, наступила реверсия этих микобактерий и ревертанты дали
начало очаговому процессу.
Очаговый туберкулез легких может возникать также при хроническом первичном туберкулезе легких. В настоящее время таких больных мало, но все-таки они есть, и если длительное время сохраняется активный процесс в лимфатических узлах средостения, У таких больных может на том или ином этапе туберкулеза возникнуть очаговый процесс. Если имеется гематогенная диссемина
ция, то очаги появляются в верхушках легких, если возникает лимфобронхогенное обсеменение, то очаги формируются в средних
219
и нижних отделах легких. Особенно часто в средних и нижних отделах легких очаги возникают при наличии бронхоаденита и эндобронхита. Если наряду с хроническим воспалительным процессом в лимфатических узлах средостения имеется туберкулез крупных бронхов или трахеи, именно в том случае свежий очаговый процесс особенно часто возникает в средних или нижних отделах легких. Наконец, очаговый туберкулез может появиться как исключение в результате гематогенной диссеминации из экстрапульмональных активных туберкулезных очагов. Чаще в этих случаях возникает другая клиническая форма — гематогенный диссеминированный туберкулез легких, но все-таки иногда у отдельных больных туберкулез костей, суставов, почек, гениталий и других локализаций может привести к появлению свежих очагов в легких. Но чаще всего, как правило, у взрослых людей очаговый процесс развивается в результате обострения верхушечных очагов, поэтому чаще очаговый туберкулез у взрослых локализуется в верхушках легких. Как правило, очаговый туберкулез относится к ранним проявлениям туберкулеза. К ранним формам очаговый туберкулез может относиться только тогда, когда видны очаговые изменения как ранние проявления болезни, как ее начало. Это действительно самые ранние, самые первые проявления легочного туберкулеза. Однако далеко не всегда очаговый туберкулез может быть отнесен к ранним формам.
Очаговый туберкулез легких может протекать хронически, незаметно для больного, и такие больные могут быть выявлены спустя много лет после начала болезни, когда уже нельзя говорить о туберкулезе как о ранней форме. Поэтому последнее время очаговый туберкулез легких стали относить к разряду не ранних, а малых форм. Малые формы туберкулеза — это проявления болезни, которые характеризуются ограниченным воспалительным туберкулезным процессом и отсутствием распада. Исходя из этих позиций, очаговый туберкулез легких действительно можно отнести к категории малых форм. Следует также подчеркнуть, что не всегда очаговый туберкулез является началом легочного процесса. Это справедливо для многих больных, но не для всех.
Очаговый туберкулез легких может быть не только началом легочного процесса, но и исходом других клинических форм легочного туберкулеза. Раньше о таком механизме очагового туберкулеза легких почти не писали, и он почти не упоминался применительно к данной клинической форме. В настоящее время, когда имеется возможность излечивать подавляющее большинство впервые выявленных больных, такой генез очагового туберкулеза встречается не так уж редко. У больных очаговые изменения — не начало туберкулезного процесса, а результат инволюции, результат заживления инфильтративного, кавернозного, диссеминированного туберкулеза легких. Практически любая форма легочного туберкулеза при процессах заживления, инволюции может трансформироваться в очаговые изменения. В этом случае диагноз очагового туберкулеза легких ставится на этапе заживления. Если заживление продолжается дальше и постепенно исчезают признаки активности очаговых 220
изменений, сформировавшихся в результате инволюции других форм туберкулеза, со временем диагноз меняется и фиброзно-очаговые изменения трактуются как остаточные изменения излеченного туберкулеза. Конечно, необязательно, чтобы в результате излечения очагового туберкулеза появлялись фиброзно-очаговые изменения, очаги могут рассасываться, на их месте могут образоваться незначительные рубцовые изменения.
Не всегда очаговый туберкулез подвергается инволюции. Сохраняющиеся микобактерии туберкулеза в остаточных очагах могут быть причиной вспышки очагового процесса и его прогрессирования с образованием инфильтратов и даже распада. Гораздо чаще обострения встречаются при множественных очаговых изменениях, когда не происходит полного рассасывания очагов и очаги инкапсулируются. В этих случаях очаговый туберкулез легких может дать начало и деструктивному процессу.
В 50-х годах распад находили у 11—14% всех выявленных больных очаговым туберкулезом [Хоменко А. Г., 1964]. По данным Т. Я. Ильиной (1967), фаза распада наблюдалась у 4—8% больных с таким диагнозом. По-видимому, в настоящее время больные очаговым туберкулезом легких более тщательно обследуются (в том числе на предмет активности туберкулезного процесса) и лечатся.
Очаговый туберкулез легких характеризуется малосимптомным клиническим течением. Это не значит, что клиническая симптоматика при этой форме вовсе отсутствует, просто она не настолько выражена, чтобы создать субъективное ощущение болезни. Все клинические проявления очагового туберкулеза можно разделить на две группы: синдром общей интоксикации и грудные симптомы, т. е. симптомы, обусловленные поражением органов дыхания. При очаговом туберкулезе синдром интоксикации и грудные симптомы, как правило, чаще всего встречаются у больных в период обострения, в фазе инфильтрации или фазе распада. Но есть лица, у которых синдром интоксикации сохраняется длительно — не только в период обострения, но и в период затихания. Фаза уплотнения не исключает наличия указанного синдрома, хотя проявления интоксикации, как правило, выражены нерезко: у многих больных субфебрильная температура тела, слабость, потливость, снижение аппетита. В период вспышки повышение температуры тела непродолжительное и продолжается в течение 10—12 дней, иногда меньше. Только лишь у некоторых пациентов отмечается длительный субфебрилитет даже после того, как вспышка затихает, исчезает инфильтрация при сохраняющейся активности туберкулезного процесса. Кроме повышения температуры тела, интоксикация проявляется в вегетодистонических симптомах, повышенной потливости, иногда отмечается тахикардия. Наблюдаются пониженная работоспособность, усталость — это уже субъективное ощущение больного, что можно выявить со слов пациента.
Возвращаясь к клинике очагового туберкулеза, можно сказать, что, кроме симптомов интоксикации, в настоящее время редко можно наблюдать исхудание. Грудные симптомы не бросаются в глаза и
221
не привлекают к себе даже внимание больного, искать их надо путем целенаправленного исследования. Может быть покашливание или кашель без выделения мокроты, иногда с выделением небольшого количества мокроты. Этот симптом не привлекает к себе большого внимания, в основном он характерен для курильщиков. Кашель — типичное состояние для курильщиков. Почти все курящие люди покашливают из-за имеющегося у них бронхита и если у такого человека появляется очаговый туберкулез, кашель не привлекает внимания больного и окружающих. При распаде очага может быть кровохарканье, это, конечно, яркий симптом, который привлекает внимание врача и не проходит незаметно.
Далее, при стетоакустическом исследовании у больных очаговым туберкулезом в период обострения иногда можно выслушать хрипы. Правда, они выслушиваются только в ограниченном месте и после покашливания. Чаще порядок обследования следующий. Сначала нужно собрать анамнез, изучить жалобы больного, применить стетоакустические методы, а потом провести рентгенологическое исследование. Если обследовать таким образом больного очаговым туберкулезом, патологию в легких обнаружить, как правило, не удается, поскольку неизвестно, в каком месте надо искать хрипы, измененное дыхание и в каком случае нужно просить больного покашлять для выявления массивных хрипов. Поэтому мы сейчас говорим, что, конечно, до рентгенологического исследования надо провести физическое исследование, включая перкуссию, аускультацию. Но если при рентгенологическом исследовании выявляются очаги, необходима целенаправленная аускультация именно в том месте, где располагаются очаги, где имеется воспалительная реакция. Если больной не лечился, иногда даже без распада можно выслушивать хрипы, а при распаде они выявляются как правило. Кроме того, хрипы выслушиваются в течение всего нескольких дней и, если больной не попадет к врачу в это время, то потом уже хрипы прослушать не удается. Поэтому целенаправленная аускультация должна проводиться после рентгенологического исследования и если обнаружены очаги, не следует спешить начинать химиотерапию. Нужно дообследовать больного полностью, тем более, что при очаговом туберкулезе процесс не характеризуется бурным, быстро прогрессирующим течением. Это медленно развивающийся процесс, и если 2—3 дня больного не лечить, опасности он не представляет, зато можно получить много ценных данных, которые характеризуют активность патологического процесса.
Очаговый туберкулез легких характеризуется, как правило, длительным, хроническим, волнообразным течением со сменой фаз обострения, затихания, интервалами между ними, но даже в период вспышки данной форме туберкулеза присуще отсутствие ярких клинических проявлений. Это значит, что больные очаговым туберкулезом легких могут не знать о своей болезни, могут не чувствовать того, что они больны, и, естественно, такие люди за медицинской помощью могут не обращаться. Такие люди могут оставаться неизвестными и фтизиатрам, терапевтам. Поэтому, если среди насе-
222
Рис 6 5 Очаговый туберкулез легких
а — рентгенограмма грудной клетки в прямой проекции, б — томограмма
223
в
Рис. 6.5. Продолжение, в — схема.
ления не проводится сплошное флюорографическое обследование, многие больные очаговым туберкулезом легких остаются неизвестными диспансеру. Вот именно поэтому, когда начинается работа по сплошному флюорографическому обследованию населения, выявляется большое число лиц с очагами в легких. К этому надо добавить, что при проведении такого обследования выявляются лица с туберкулезом легких на разных этапах туберкулезного процесса, в том числе очагового, выявляются больные как со вспышкой процесса, так и в фазе интервала, без признаков активности туберкулезного процесса. Это обстоятельство затрудняет оценку активности очагового туберкулеза.
Таким образом, обнаружение очагов, что возможно с помощью флюорографии, еще не решает всей проблемы диагностики, поскольку, выявив у человека очаги, нужно определить активность и фазу (инфильтрация, уплотнение, рассасывание или распад) очагового туберкулезного процесса. Проблема диагностики данного заболевания является одной из самых важных, но в то же время одной из самых трудных во фтизиатрии. Даже сейчас, когда в диспансерную группировку введена новая — нулевая — группа учета, трудности определения активности плотных очагов сохраняются. В эту группу
224
включаются лица, у которых трудно определить активность туберкулезного процесса. Основную массу лиц, наблюдающихся по группе О учета, составляют лица с очаговым туберкулезом легких в фазе уплотнения.
В диагностике очагового туберкулеза наиболее информативным методом является рентгенологическое исследование. Можно утверждать, что без такого исследования нельзя поставить диагноз очагового туберкулеза легких. Без рентгенологического метода нельзя определить локализацию очагов, их число, плотность и характер контуров (рис. 6.5). Большое значение в диагностике очагового туберкулеза легких имеет обнаружение микобактерий в мокроте. При отсутствии последней следует прибегать к провоцирующим кашель ингаляциям раствором NaCl и затем исследовать мокроту. Необходимы микроскопическое исследование не менее 3 ежедневно собираемых порций мокроты и 2—3-кратный посев материала на питательные среды.
В фазе инфильтрации микобактерии туберкулеза обнаруживаются методом микроскопии даже при самом тщательном исследовании примерно в 3% случаев. Если применить метод посева, то частота выявления микобактерий у больных активным туберкулезом легких в фазе инфильтрации без распада достигает, по данным В. П. Шаенко, 30%, по данным Н. М. Рудого — 50%. Как правило, бактериовыделение скудное, что не представляет большой эпидемической опасности, но имеет большое диагностическое значение для подтверждения диагноза туберкулеза. Наличие микобактерий в мокроте является надежным признаком активного туберкулезного процесса. Если при рентгенологическом исследовании обнаруживаются плотные очаги, бактериологический метод малорезультативен, и у таких больных применяют другие методы определения активности процесса, в частности биохимические (определение количества сиаловой кислоты, С-реактивного белка, гаптоглобина и других маркеров активности). Биохимические методы более результативны, когда их применяют вместе с туберкулиновыми пробами, в частности при подкожном введении туберкулина (проба Коха). Необязательно вводить большие количества туберкулина, рекомендуется доза 20 ТЕ, а при отсутствии реакции — 50 ТЕ стандартного туберкулина ППД-Л. Существуют и иммунологические методы определения активности процесса: оценка бласттрансформа-ции лимфоцитов, торможения их миграции, метод розеткообразо-вания. Они дают обнадеживающие результаты (особенно в сочетании с туберкулинодиагностикой) и позволяют подтвердить активность туберкулезного процесса при наличии фазы уплотнения у значительного числа обследуемых.
Если указанные методы не помогают установить активность туберкулезного процесса, приходится прибегать к так называемому тест-лечению. Таким больным в течение 2—3 мес проводят химиотерапию и изучают рентгенологическую динамику процесса с учетом субъективного состояния, картины крови в динамике и др. Надо отметить, что при очаговом туберкулезе легких лейкограмма может
8—1213
225
изменяться, повышается СОЭ (но этот метод не очень надежен), наблюдаются лимфоцитоз и сдвиг влево* Эти сдвиги могут быть обусловлены интеркуррентными заболеваниями, поэтому очень трудно трактовать данные изменения как результат туберкулеза. Следует исключить все интеркуррентные заболевания, тогда все сдвиги в лейкограмме могут быть использованы как показатель интоксика
ции, и если в процессе химиотерапии состав крови нормализуется, это будет подтверждением предположения об активности туберкулезных очагов. Поэтому наиболее надежным критерием является динамика рентгенологической картины — рассасывание (полное или частичное) очагов. Иногда при очаговом туберкулезе, кроме очаговых изменений, определяются плевральные изменения, что является важным косвенным доказательством активности процесса.
Очаговый туберкулез легких может быть одно- и двусторонним. Если очаг располагается так, что на обзорной рентгенограмме он плохо виден, то делают прицельную рентгенограмму; выбор наиболее целесообразной позиции больного производится с помощью многоосевого просвечивания. Иногда применяют специальное томографи-
ческое исследование, при котором томограмму делают в положении
лордоза, т. е. по существу делается прицельная томограмма. Активность очагового туберкулеза может быть определена также с помощью бронхоскопии, если обнаруживается свежий или перенесенный прежде эндобронхит. В аспирате, полученном при бронхологическом исследовании, или в бронхоальвеолярных смывах могут быть выявлены микобактерии туберкулеза. Иногда очаги локализуются
в нижних отделах, но это бывает довольно редко. В этих случаях
очаговый туберкулез приходится дифференцировать с очаговой пневмонией. При этом дифференциальная диагностика существенно об
легчается применением бронхоскопии, которая при туберкулезе позволяет объективно оценить состояние бронхиального дерева и взять
материал для лабораторного исследования.
Больные активным очаговым туберкулезом легких наблюдаются по I группе диспансерного учета и нуждаются в лечении, в первую очередь — химиотерапии, которая проводится в больничных условиях, по крайней мере в течение первых Р/2—2 мес с последующим амбулаторным и санаторным лечением. По мере выздоровления больные переводятся во II и III (контрольную) группу
учета.
6.8. ИНФИЛЬТРАТИВНЫЙ ТУБЕРКУЛЕЗ ЛЕГКИХ
Эта клиническая форма туберкулеза характеризуется преимущественно экссудативным типом воспаления со склонностью к быстрому образованию казеозного некроза и деструкции. Следует подчеркнуть, что инфильтративному туберкулезу легких свойственна относительно быстрая динамика. Если очаговый туберкулез протекает хронически и волнообразно, то инфильтративная форма характеризуется или быстрым развитием распада, или же при своевременной диагностике и правильном лечении инфильтрат подвер-
226
гается инволюции и рассасыванию. На месте инфильтрата остаются более или менее выраженные остаточные изменения.
Каков же механизм возникновения инфильтративного туберкулеза? Учение об инфильтратах появилось в связи с широким внедрением в практику рентгенологического метода, и один из создателей учения об инфильтративном туберкулезе Assmann с помощью этого метода одним из первых выявил округлую тень в подключичном отделе легкого, до сих пор такой инфильтрат называют ранним подключичным инфильтратом типа Ассмана. Assmann и его современники считали, что инфильтрат — это воспалительный процессе, появляющийся в результате экзогенной суперинфекции. Однако очень скоро после появления работ Assmann о патогенезе инфильтративного туберкулеза возникли и другие мнения. В частности, Redeker одним из первых нашел, что инфильтрат не всегда возникает в результате экзогенной суперинфекции, он заметил, что иногда инфильтративная тень образуется в зоне легких с наличием старых туберкулезных очагов в результате их реактивации. Если Assmann видел инфильтративный процесс в основном в участках легкого без старых изменений туберкулезного характера, в интактном легком, Redeker, наоборот, наблюдал инфильтративный процесс у лиц, имевших старые туберкулезные очаги. Для того чтобы найти выход из создавшегося положения, противоречащего теории Assmann, в качестве компромисса Redeker предложил новый термин для описанных им изменений — «инфильтрирование». Предлагая этот термин, Redeker и его последователи подчеркивали принципиальное отличие инфильтрирования от инфильтрата — эндогенное происхождение в результате реактивации старых очагов с последующим образованием инфильтрата. Очень скоро в клинике было отмечено, что существенной разницы между так называемым инфильтратом Ассмана и инфильтрированием Редекера нет. В клинике туберкулеза взрослых от термина «инфильтрирование» быстро отказались, он сохранялся дольше в детской практике и им обозначали перифокальное воспаление вокруг лимфатических узлов средостения.
В 30-х годах Б. М. Хмельницкому удалось провести очень интересные клинико-лабораторные сопоставления. У больных с так называемыми ранними инфильтратами типа Ассмана в мокроте были обнаружены не только микобактерии, но и тетрада Эрлиха (кристаллы холестерина, известь, обызвествленные эластические волокна и измененные микобактерии). Надо сказать, что тетрада Эрлиха и ранее выявлялась у больных туберкулезом и наличие этой тетрады у больных с различными формами туберкулеза свидетельствует о распаде старых туберкулезных очагов. Если эти старые очаги хорошо определяются на рентгенограмме и наряду с этим видны свежие инфильтрированные изменения типа инфильтрирования Редекера, тетрада доказывает генетическую связь инфильтративного процесса со старыми «обострившимися» очагами. Б. М. Хмельницкому и его сотрудникам удалось доказать, что тетрада Эрлиха выявляется не только у больных с видимыми на рентгенограммах старыми туберкулезными очагами и развившимся инфильтратом, но и у больных
8*
227
с так называемыми подключичными инфильтратами типа Ассмана, т. е. у больных без видимых старых изменений. Это заставило Б. М. Хмельницкого и его сотрудников высказать положение о том, что инфильтрат — не самое раннее проявление туберкулеза, возникающее в результате суперинфекции, а следствие эндогенной реактивации старых туберкулезных очагов.
В течение длительного времени Г. Р. Рубинштейн строго придерживался экзогенного механизма развития инфильтративного тубер-
кулеза и считал, что он возникает в результате суперинфекции как самое раннее проявление вторичного туберкулеза. В последующем М. Г. Иванова и Б. М. Хмельницкий провели клинико-анатомиче-
ские сопоставления. Среди погибших от случайных причин были
отобраны лица с наличием инфильтративного туберкулеза легких.
У них были изучены легкие — проведено последовательное мор$
логическое исследование серийных срезов легкого. Полученные дан
ные позволили доказать взаимосвязь между инфильтратом и экза-цербированными старыми очагами. В последующие годы Г. Р. Рубинштейн и И. Е. Кочнова провели очень большую работу и показали, что у многих больных без видимых остаточных изменений в легких до появления инфильтрата возникает свежий очаговый процесс. Таким образом, инфильтративный туберкулез может возникать в результате как экзацербации старых туберкулезных изменений,
так и прогрессирования свежего очагового процесса. В этом случае инфильтрату предшествует свежий очаговый туберкулез.
Инфильтративный туберкулез может возникать и возникает не только в результате прогрессирования свежего очагового туберкулеза и не только в результате обострения старых очаговых процессов, он может возникать в результате лимфобронхогенного распространения микобактерий из казеозно измененных лимфатических узлов средостения. Нередко у таких больных отмечается и эндобронхит. Причем инфильтративный процесс, возникающий в результате лимфобронхогенного распространения микобактерий из казеозно изме
ненных лимфатических узлов средостения, нередко локализуется в средних и нижних отделах легких. Если сравнить источники возникновения очагового туберкулеза и инфильтративного туберкулеза, то по существу они одни и те же, но у одних больных возникает очаговая форма заболевания, т. е. ограниченный преимущественно продуктивный воспалительный процесс с хроническим течением и
склонностью к заживлению, а у других из тех же самых источников возникает инфильтративная форма, т. е. преимущественно экссудативный воспалительный процесс со склонностью к распаду (В. А. Равич-Щербо).
Развитие инфильтрата объясняется наличием зон гиперсенсибилизации в легком. В. А. Равич-Щербо подчеркивает, что инфильтративный туберкулез не возникает в интактных зонах, а развивается, как правило, в тех участках легких, в которых уже «побывала» туберкулезная инфекция. Инфильтративный туберкулез возникает в тех зонах легких, которые способны ответить бурной гиперерги-ческой реакцией на наличие микобактерий, вызывающих воспали-
228
тельный процесс. Инфильтративный туберкулез — это гиперерги-
ческое воспаление легочной ткани. Rich (1944) писал, что гиперсенсибилизация легочной ткани не предопределяется анатомически
ми особенностями, хотя они могут играть определенную роль, а также врожденными качествами, это приобретенное свойство легочной ткани, возникающее в течение туберкулезного процесса. Ги-
перергия обычно создается в том случае, если легочная ткань «наводняется» очень большим количеством микобактерий при быстром размножении бактериальной популяции. Гипотеза Rich о возникновении гиперергического воспаления, обусловленного большим количеством микобактерий в условиях быстро размножающейся бактериальной популяции, имеет важное значение, особенно в связи с применяющейся химиотерапией.
Хотя все механизмы, обусловливающие развитие инфильтратив
ного туберкулеза, полностью не раскрыты, морфологические реакции
у больных инфильтративным туберкулезом и клинико-рентгенологические варианты инфильтративного туберкулеза описаны довольно
подробно. Инфильтрат в плане морфологических реакций — это
преимущественно экссудативное воспаление с пропитыванием (имбибицией) легочной ткани экссудатом, вышедшим из сосудов, с быстрым образованием участков казеозного некроза и последующим разжижением сухого казеоза. Разжиженные казеозные массы выделяются с мокротой, и образуется полость распада. Как правило, у таких больных имеется также поражение концевых отделов бронхов. На более поздних этапах вокруг пневмонического фокуса начинает
появляться продуктивная тканевая реакция, которая ограничивает имеющийся воспалительный фокус от окружающей ткани. По характеру рентгенологических данных и отчасти в связи с особенностями клинической картины и течения заболевания выделяется несколько клинико-рентгенологических вариантов инфильтративного туберкулеза.
1. Облаковидный вариант впервые описан Г. Р. Рубинштейном, характеризуется наличием нежной, не очень интенсивной гомогенной тени с нечеткими, размытыми контурами. Часто отмечается быстрое формирование распада и свежей каверны (рис. 6.6).
2. Круглый вариант характеризуется округлой гомогенной тенью слабой интенсивности с четкими контурами (рис. 6.7). Также возможно образование распада, определяемого в виде просветления (типа Ассмана) на ранних этапах только при томографическом исследовании.
3. Лобит — обширный инфильтративный процесс, захватывающий целую долю легкого. Тень чаще негомогенная с наличием одиночных или множественных полостей распада (рис. 6.8). У отдельных больных возможно формирование полости больших и гигантских размеров.
4. Перисциссурит — обширная инфильтративная тень с наличием с одной стороны четкого края, с другой — размытого. Такой характер тени определяется поражением 1—2 сегментов, располагающихся вдоль междолевой борозды (рис. 6.9). Нередко отмечается также
229
Рис а —
6 6 Облаковидный инфильтрат
рентгенограмма грудной клетки в прямой проекции, б — схема
230
б
Рис 6 7 Круглый инфильтрат (типа Ассмана)
а — рентгенограмма грудной клетки в прямой проекции, б — схема
231
Рис 6 8 Лобит
а рентгенограмма грудной клетки в прямой проекции, б — в боковой проекции
232
Рис. 6 8. Продолжение в — схема
поражение междолевой плевры, иногда с накоплением выпота. Так же как и при других вариантах, может быть распад.
5. Лобулярный вариант характеризуется негомогенной тенью, представляющей собой слившиеся в один или несколько конгломератов крупные и мелкие очаги. В центре некоторых конгломератов выявляется распад (рис. 6.10).
Для всех клинико-рентгенологических вариантов характерно наличие не только инфильтративной тени (часто с распадом), но и бронхогенного обсеменения как в легком, в котором имеется инфильтрат, так и в противоположном легком. Часто у больных инфильтративным туберкулезом имеются различные виды эндобронхита. Диагноз инфильтративного туберкулеза легких еще не определяет всего многообразия патологических изменений при этой форме туберкулеза, в эпикризе желательно выделить клинико-рентгенслогический вариант заболевания: круглый, облаковидный, лобит, перисциссурит, лобулярный.
Очень редко инфильтративный туберкулез протекает бессимптомно и малосимптомно, хотя такое течение возможно. В прежние годы у 25% больных инфильтративным туберкулезом наблюдалось малосимптомное течение. У подавляющего большинства лиц с инфильтративным туберкулезом клиническая картина заболевания характеризуется повышением до 38—38,5°С температуры тела, правда,
233
такое повышение может держаться не очень долго — 5—6—10 дней. Отмечаются и другие симптомы интоксикации. Может появиться потливость, снижается работоспособность, появляется кашель, который не носит мучительного характера и не всегда привлекает внимание больного, как и при очаговом туберкулезе легких, но в основном сопровождается выделением мокроты, особенно если развивается деструктивный процесс. Иногда возникает кровохарканье. Этот симптом при инфильтративном туберкулезе встречается чаще, чем при очаговом. При выслушивании больных инфильтративным туберкулезом (особенно при наличии распада) слышны хрипы. Можно сказать, что чем обширнее инфильтративный процесс, тем чаще выявляются хрипы. Хрипы выслушиваются на протяжении всего нескольких дней, после начала лечения они исчезают особенно быстро. При пневмонии хрипы выслушиваются несколько дольше. При обширных инфильтратах может быть и притупление в соответствующих областях легких. Может быть измененное дыхание, но все-таки надо сказать, что эти проявления инфильтративного туберкулеза выражены не так ярко, как при банальной пневмонии. У больных с инфильтративным туберкулезом легких даже при лобите не встречается резко выраженного бронхиального дыхания, которое наблюдается при пневмонии. Однако отметим, что стетоакустическая картина при банальных пневмониях в настоящее время тоже нередко
характеризуется стертостью, малосимптомностью.
Клинические проявления, отмечающиеся у больных инфильтративным туберкулезом и пневмонией, все больше и больше сближаются, и все труднее проводить дифференциальную диагностику между этими заболеваниями только по клиническим проявлениям. Даже
при типичной крупозной пневмонии настоящая, классическая клиническая картина встречается далеко нечасто. Наоборот, это скорее исключение. В настоящее время по клинической симптоматологии дифференциальную диагностику провести трудно. Клинические про
явления настолько подвержены индивидуальным различиям, что
строить дифференциальную диагностику на этих признаках просто
невозможно. Но тем не менее стетоакустические данные позволяют (особенно при обширных инфильтратах) сделать заключение о на
личии легочной патологии и какого-то воспалительного процесса в легких. При ограниченных инфильтратах, особенно при круглых, облаковидных и небольших перисциссуритах при стетоакустическом исследовании патологических проявлений может не быть. Выявить инфильтрат в этом случае возможно только рентгенологическим
методом.
Рентгенодиагностика инфильтративного туберкулеза легких — важный этап при обследовании больного, особенно с учетом вариантов инфильтративного туберкулеза. Однако ряд других заболеваний легких имеет сходную рентгенологическую картину, поэтому на основании только клинико-рентгенологических данных диагноз туберкулеза все-таки ставить нельзя. Подобная рентгенологическая картина может быть при затянувшихся пневмониях, пневмониях с явлениями распада, т. е. абсцедирования, при опухолях легких, и
234
Рис 6 9 Перисциссурит а — рентгенограмма грудной клетки в боковой проекции; б — схема.
235
Рис. 6.10. Лобулярный инфильтрат.
а — рентгенограмма грудной клетки в прямой проекции; б — схема.
особенно трудна дифференциальная диагностика между инфильт
ративным туберкулезом и пневмониями, появившимися у больных со старыми туберкулезными очагами. Очень частой ошибкой явля-
ется заключение о туберкулезе, когда старые туберкулезные очаги расцениваются как бесспорный признак инфильтративного тубер
кулеза.
Важнейшим диагностчиеским методом является бактериологическая диагностика. Микобактерии туберкулеза могут быть выявлены методом как микроскопии, так и посева. Диагноз инфильтративного туберкулеза должен подтверждаться наличием микобактерий. Если уже имеется сформированная или формирующаяся четко видимая на рентгенограмме полость, у больных инфильтративным туберкулезом в 96—97% случаев удается обнаружить микобактерии туберкулеза. Труднее найти микобактерии, если на предыдущих этапах больного лечили туберкулостатическими препаратами или комбинацией пенициллина и стрептомицина. В настоящее время такая комбинация нередко применяется для лечения пневмонии. У таких больных частота находок микобактерий резко падает. Поэтому при выявлении больных с наличием инфильтративно-пневмонических изменений в легких обязательно до начала лечения нужно провести тщательное исследование мокроты. Если мокроты нет, ее нужно вызвать с помощью провоцирующих аэрозолей. Если полость видна только на томограмме, если она только формируется или у больного
236
только фаза распада, простая микроскопия позволяет найти микобактерии примерно у 30% больных, у остальных 60% возбудителя можно выявить методом посева. И опять-таки посев нужно делать в течение 3 дней подряд и до применения химиотерапевтических средств, подавляющих размножение микобактерий. Наши данные позволяют утверждать, что можно верифицировать диагноз туберкулеза, применяя метод микроскопии и посева. При этом результативность исследования зависит, во-первых, от многократности (не менее 3 раз) исследования, во-вторых, исследование нужно провести до лечения и, в-третьих, обязательно проследить, какой материал направляется в лабораторию для этой цели. Это очень существенный момент. Если мокроты мало, рекомендуется собирать ее в течение суток или начать сбор хотя бы после обеда, продолжить его в вечернее время, ночью и утром.
Иногда результаты анализа мокроты могут ввести врача в заблуждение: у больных с развившейся пневмонией может быть однократное или повторяющееся несколько раз бактериовыделение за счет разрушения старых туберкулезных очагов, попавших в зону пневмонического воспаления. В данном случае инфильтративнопневмонические изменения в легких исчезают довольно быстро под влиянием лечения антибиотиками широкого спектра действия. Такие больные в длительной противотуберкулезной химиотерапии не нуждаются, достаточно провести 2—3-месячный курс превентивной химиотерапии изониазидом. Факт обнаружения микобактерий должен
рассматриваться в сочетании с другими признаками как один из элементов диагностического симптомокомплекса. Один из важных признаков инфильтративного туберкулеза — довольно характерная картина крови. У больных инфильтративным туберкулезом легких, как правило, не бывает высокого лейкоцитоза при наличии повышенной СОЭ, а у больных пневмонией лейкоцитоз и сдвиг влево являются типичными признаками. Если в крови выявляются лей-
коцитоз и сдвиг влево, которые вызывают подозрение о возможном
участии в воспалительном процессе смешанной флоры, нужно сде-
лать анализ мокроты на такую флору, что помогает дифференци
альной диагностике, особенно если наряду с этим проводится серо
логическое исследование на наличие специфических антител. Определяют антитела к микобактериям туберкулеза и неспецифической флоре.
У больных инфильтративным туберкулезом, как правило, имеются сочетание микобактерий в мокроте и высокий титр туберку
лезных антител при наличии характерной рентгенологической картины. У больных пневмонией обнаруживаются неспецифическая флора и высокий титр антител к этой флоре. Особое значение имеет такая сочетанная бактериологическая и иммунологическая диагностика у больных с развившейся пневмонией на фоне метатуберкулезных изменений, в том числе старых очагов. Особо трудна дифференциальная диагностика туберкулеза и пневмонии при локализации воспалительного процесса в средней (язычковой) доле легкого.
Бронхоскопия является важным методом диагностики, хотя да-
237
леко не всегда при инфильтративном туберкулезе легких отмечается сопутствующий специфический эндобронхит. Но такая находка, конечно, облегчает диагностику. Разлитой базальный эндобронхит,
большое количество гноя в основном свидетельствуют о пневмоническом процессе. Правда, нужно быть очень осторожным, надо
выяснить, не является ли больной курильщиком, нет ли у больного эмфиземы, бронхоэктазов, так как инфильтративный процесс туберкулеза может возникнуть у больного хроническим бронхитом, с
бронхоэктазами, эмфиземой. Поэтому сама по себе указанная находка при бронхологическом исследовании не имеет решающего
значения для диагностики, но в общем комплексе эти данные могут
существенно ее облегчить. Туберкулиновые пробы у больных ин-
фильтративным туберкулезом положительны, однако это дифферен-
циально-диагностического значения не имеет. С этой целью проводят более углубленную туберкулинодиагностику — подкожное введение туберкулина с соответствующими лабораторными исследованиями (гемотуберкулиновые пробы). Гемотуберкулиновые пробы применяются при дифференциальной диагностике туберкулеза и опухолей легкого, когда нужно отвергнуть туберкулезную этиологию изме-
нений, имеющихся в легких.
Для дифференциальной диагностики и последующего наблюдения
за больными инфильтративным туберкулезом большое значение име-
ет анализ течения заболевания, в том числе в процессе лечения.
Можно выделить два основных варианта течения инфильтративного туберкулеза легких.
1. Прогрессирующее течение характеризуется образованием деструкции, формирующейся очень быстро, как это уже подчеркивалось. При этом обращает на себя внимание диссоциация между
клиническими проявлениями заболевания и динамикой морфологи-
ческих изменений в легких. Повышенная температура тела, характерная для начала инфильтративного туберкулеза, постепенно снижается через 10—15 дней после начала болезни. К этому времени
уменьшается выраженность «грудных» симптомов или они исчезают (кашель, выделение мокроты, определявшиеся ранее хрипы). Это улучшение в состоянии больного В. А. Равич-Щербо называл мнимым выздоровлением, так как у таких больных инфильтративным туберкулезом формировалась деструкция. При отсутствии лечения через некоторое время вновь возобновлялись «грудные» симптомы и интоксикация, т. е. развивалась вспышка. Затихание ее закономерно сменяется очередной вспышкой, и весь этот волнообразный
процесс сопровождается постепенным развитием кавернозного туберкулеза с продолжающимся бактериовыделением.
2. Инволютивное течение имеет место при рациональном лече
нии. Для него характерно постепенное исчезновение клинических проявлений заболевания; раньше исчезают «грудные» симптомы, затем интоксикация, восстанавливается субъективное ощущение здоровья, как правило, в течение первых 3 мес прекращается выделение с мокротой микобактерий туберкулеза. Медленнее подвергаются
инволюции морд
логические изменения в легких, они характери
238
зуются рассасыванием воспалительных очагов и закрытием деструкции, если она успела сформироваться. Инфильтративные процессы могут полностью прекратиться без видимых изменений, на месте инфильтрата могут оставаться очаги фиброзных изменений, выраженные в разной степени. У некоторых больных воспалительные и казеозные очаги могут осумковываться, и у таких больных формируется туберкулема. Этот вариант инволюции инфильтративного туберкулеза, так же как и формирование выраженного метатуберкулезного синдрома в виде цирроза доли или сегмента, не может считаться благоприятным исходом.
Нужно подчеркнуть, что исход инфильтративного туберкулеза во многом зависит от своевременного выявления больных, эффективности лечения, которое проводится в условиях стационара, а затем санатория. Больные находятся под диспансерным наблюдением сначала по I, а затем последовательно II, III и VII группе учета.
6.9. КАЗЕОЗНАЯ ПНЕВМОНИЯ
Казеозная (творожная) пневмония была введена в клиническую классификацию туберкулеза еще в 1938 г., хотя была известна давно и описана в отечественной и зарубежной литературе. В 1923 г. Ф. Г. Яновский описал клиническую картину заболевания, ее дополнили Н. Н. Гринчар (1940), Г. Р. Рубинштейн (1948) и Н. А. Шмелев (1953). Впоследствии из-за небольшого числа таких больных
эта клиническая форма туберкулеза была исключена из классификации в 1965 г. и восстановлена в ней в 1994 г., так как число
больных казеозной пневмонией резко увеличилось.
логические изменения при этой клинической форме
ПатоморЛ ж *
туберкулеза характеризуются развитием резко выраженного экссудативного воспаления, захватывающего большую часть доли легкого
или всю долю целиком, иногда с поражением соседних отделов, что может обусловить тотальное поражение легкого. Экссудативная реакция быстро сменяется казеозно-некротическими изменениями с последующим разжижением казеозных масс и образованием гигантской каверны или множественных каверн меньшего размера. Заболевание может характеризоваться перманентным прогрессирующим течением и смертельным исходом по типу «скоротечной чахотки». Наблюдается и волнообразное течение с периодически возникающими вспышками специфического процесса после некоторого затихания болезни; при таком течении довольно быстро развивается фиброзно-кавернозный туберкулез.
Возникновение казеозной пневмонии может быть связано с первичным заражением туберкулезом детей, особенно не иммунизированных вакциной БЦЖ. У взрослых эта пневмония развивается в результате эндогенной реактивации старых туберкулезных очагов при резком снижении иммунитета, обусловленном стрессовыми ситуациями, сопутствующими заболеваниями, голоданием, иногда длительным применением кортикостероидов. В последние годы выявляются больные, у которых казеозная пневмония возникла в ре
239
зультате суперинфекции. Особую опасность для жизни больного представляет заражение (первичное или повторное, т. е. суперинфекция) лекарственно-устойчивыми микобактериями с повышенной вирулентностью (Morse D., Crofton J., Cole S., 1993].
Чаще всего казеозная пневмония имеет острое начало, реже подострое. Температура тела повышается и вскоре достигает 39— 40°С, появляются резко выраженная слабость, одышка, тахикардия, ночные поты и кашель. Сначала кашель сухой, часто повторяется и мучителен для больного, через несколько дней в небольшом количестве появляется мокрота, а затем объем мокроты увеличивается до 200—500 мл в сутки. Возможно появление кровохарканья или даже легочного кровотечения, особенно при разрушении стенки кровеносного сосуда, попавшего в зону развития деструктивного процесса. У больных сравнительно быстро снижается масса тела, похудание достигает степени истощения. Кожа бледная, обращает на себя внимание румянец на щеках, при дыхательной недостаточности появляются цианоз губ и акроцианоз. Соответственно развившемуся локальному процессу при перкуссии определяется притупление, дыхание в этой области жесткое, может быть бронхиальным. На более поздних этапах, после образования большой каверны, дыхание может быть амфорическим с наличием разнокалиберных влажных хрипов. При задержке в бронхах мокроты выслушивается большое число сухих хрипов.
Рентгенологические изменения зависят от времени обследования. На ранних этапах заболевания определяется инфильтрация легочной ткани типа лобита, т. е. лобарного характера. При развитии деструктивного процесса выявляется полость — каверна больших размеров, окруженная инфильтративными очагами, может определяться несколько полостей меньшего размера. После возникновения кавернозных изменений обычно наблюдается бронхогенная диссеминация в том же и противоположном легком. Очаги обычно крупные, с размытыми контурами, сливающиеся в конгломераты различного размера, иногда с развитием так называемых дочерних каверн (рис. 6.11). При выраженной бронхогенной диссеминации, которая доминирует в рентгенологической картине, может быть выделена «лобулярная казеозная пневмония» как вариант этой формы [Шмелев Н.А., 1953].
Важным диагностическим методом является микроскопическое исследование мокроты на наличие микобактерий туберкулеза, которые, как правило, обнаруживаются в большом количестве, особенно при развитии деструктивного процесса. При небольшом количестве мокроты в начале заболевания надо повторно не менее 3—5 раз исследовать мокроту на наличие микобактерий. При установленном выделении возбудителя необходимо также сделать посев и определить чувствительность микобактерий к противотуберкулезным химиопрепаратам. Следует иметь в виду, что у больных в крови могут быть выявлены лейкоцитоз, лимфопения, сдвиг влево с увеличением числа палочкоядерных клеток, увеличение СОЭ до 30—40 мм/ч. Такого рода изменения в лейкограмме могут свиде-
240
Рис а —
6 11 Казеозная пневмония
рентгенограмма грудной клетки в прямой проекции, б — схема
241
тельствовать о крупозной пневмонии (особенно на ее ранних этапах). Такие диагностические ошибки нередки, они часто возникают, когда в мокроте еще не обнаружены микобактерии туберкулеза.
Туберкулиновая реакция при выраженной интоксикации может быть отрицательной или слабоположительной, что также может приводить к диагностическим ошибкам.
Правильная интерпретация рентгенологических данных, особенно выявление деструктивных изменений и бронхогенной диссеминации в сочетании с обнаружением микобактерий в мокроте позволяют установить правильный диагноз и начать лечение.
Лечение больных с развившейся казеозной пневмонией — сложная задача. После подтверждения диагноза назначают противотуберкулезные химиопрепараты в комбинации с изониазидом, рифампицином, пиразинамидом и стрептомицином. Такое лечение проводят в течение не менее 3 мес, после чего стрептомицин можно заменить этамбутолом. Через 3 мес число химиопрепаратов можно уменьшить до 2—3 (изониазид, рифампицин и пиразинамид). Общая продолжительность химиотерапии составляет 9—12 мес. В начале лечения, кроме химиотерапии, применяют дезинтоксикационную терапию: вливание гемодеза, плазмаферез, внутривенное или экстракорпоральное облучение крови лазером. При дыхательной недостаточности показано лечение кислородом — ингаляции в течение 6—12 ч в сутки. Применение комплексной терапии позволяет добиться клинического улучшения и постепенного улучшения состояния больного. Однако приостановить деструктивный процесс обычно не удается, особенно при формировании гигантских каверн, при этом постепенно развивается фиброзно-кавернозный туберкулез со всеми особенностями его течения. У ряда больных с разрушающимся легким не удается добиться клинического улучшения, и в таких случаях единственным методом, который может помочь больному, является резекция легкого. Естественно, операция возможна при удовлетворительном состоянии второго легкого. Такое хирургическое вмешательство представляет высокий риск для жизни больного, но в то же время является единственным шансом для спасения жизни. Операцию проводят по жизненным показаниям.
6.10. ТУБЕРКУЛЕМА ЛЕГКИХ
Туберкулема — клиническая форма туберкулеза, которая характеризуется наличием округлого образования в легком. Это образование представляет собой продуктивный воспалительный очаг с казеозными изменениями и фиброзом. Для туберкулемы характерно малосимптомное торпедное течение, иногда с прогрессированием и образованием деструкции.
Группа больных, которым ставят диагноз туберкулемы, неоднородна по составу, и уже много лет назад были выделены три основных клинических варианта туберкулемы. Классификация туберкулем, которая была предложена М. М. Авербахом, предусматривает следующие варианты: инфильтративно-пневмонического ти-
242
па, казеома (термин «казеома» был предложен Л. К. Богушем и вошел в литературу для обозначения одного из вариантов туберкулемы) и заполненная или блокированная каверна. Эта классифи-
кация основана, с одной стороны, на морфологических особенностях, с другой стороны — на патогенезе этой формы туберкулеза.
Туберкулема инфильтративно-пневмонического типа представляет собой результат инволюции инфильтративного туберкулеза легких. По морфологическим особенностям этот тип характеризуется
продуктивно-казеозной тканевой реакцией. Казеомы по морфоло-
гическому строению разные, казеомы бывают гомогенные и слоистые.
Гомогенные и слоистые туберкулемы в свою очередь делятся на
солитарные и конгломератные. Гомогенные туберкулемы характеризуются наличием осумкованного казеоза. Причем казеоз может быть в виде одного фокуса (солитарная туберкулема) и нескольких фокусов с общей оболочкой (конгломератная туберкулема). Чаще
такие гомогенные казеомы являются результатом инволюции инфильтративного или кавернозного туберкулеза. Слоистые туберкулемы, как правило, характеризуются аппозиционным ростом — это такая форма туберкулемы, которая с самого начала болезни начинается как туберкулема. Поэтому солитарную слоистую казеому называют истинной туберкулемой, т. е. этим самым подчеркивается, что в этом случае туберкулемы — не результат инволюции или наоборот эволюции каких-либо других клинических форм туберкулеза, а с самого начала туберкулема как клиническая форма. Заполненная каверна, как следует из названия, является результатом нарушения проходимости бронхов, дренирующих каверну, и как следствие заполнения ее казеозным содержимым и образования осумкованного фокуса.
Изменения в окружающей легочной ткани при всех видах туберкулем выражены незначительно, самым типичным является поражение бронхов, т. е. выраженный специфический, иногда казеозный бронхит с поражением всех стенок бронха, заполненного казеозными массами. Для всех туберкулем типично обеднение легочной ткани кровеносными сосудами в зоне, в которой расположены туберкулемы. Ангиографические исследования, которые были проведены во многих клиниках, показали, что, как правило, при тубер
кулеме имеется запустевание кровеносных сосудов в зоне, прилежащей к туберкулеме. Вследствие этого, по-видимому, химиопрепараты плохо проникают в зону туберкулемы из-за недостаточного кровос набж е ния.
Применять классификацию, изложенную выше, можно по ре
логических исследований, а в клинике ее исполь-
зультатам мор4
зовать трудно, поскольку порой невозможно определить вариант туберкулемы, имеющейся у больного, на основании данных клинико-рентгенологических исследований.
В клинике выделяют туберкулемы со стабильным течением, т. е. туберкулемы, которые длительно имеются у больного, не подвергаясь
никаким изменениям.
Если внимательно изучить клиническую картину болезни, то
243
Рис 6 12 Множественные туберкулемы в правом легком а — рентгенограмма грудной клетки в прямой проекции, б — томограмма
244
в
Рис 6 12 Продолжение в — схема
при так называемом стабильном течении туберкулем стабильность течения болезни относительна у значительного числа больных. У этих больных, несмотря на то что рентгенологическая картина существенно не меняется, периодически отмечаются симптомы интоксикации, могут появляться новые немногочисленные единичные очаги, размеры туберкулемы могут увеличиваться, т. е. имеет место аппозиционный ее рост, у некоторых больных можно видеть, как появляется центральный или краевой распад. При возникновении распада отмечается кашель, может выделяться мокрота, появиться кровохарканье, в мокроте могут быть обнаружены микобактерии. Все эти явления постепенно исчезают, и опять наступает период стабилизации до очередной вспышки. Надо согласиться, что при таком течении болезни трудно говорить о стабильности туберкулем. Поэтому больных со стабильным течением туберкулем (первый вариант) можно разделить на 2 подгруппы: а) с действительно стабильным течением, т. е. с отсутствием всяких клинических проявлений болезни и рентгенологических изменений в процессе наблюдения за больными; б) с периодическими обострениями, несмотря на отсутствие явного прогрессирования. Второй вариант — регрес
245
сирующие туберкулемы, которые медленно уменьшаются в размерах, и постепенно на их месте образуются очаг, фиброзное поле или наблюдается сочетание этих изменений. Чаще всего регрессии подвергаются туберкулемы инфильтративно-пневмонического типа. Третий клинический вариант — туберкулемы с прогрессирующим течением — это туберкулемы, которые характеризуются появлением на каком-то этапе болезни распада. Распад прогрессирует, увеличивается и в конечном счете образуется каверна. Нередко у таких больных вокруг прогрессирующей туберкулемы возникает выраженная перифокальная воспалительная реакция, появляется лимфоген
ная диссеминация в окружающей ткани.
Диагностика туберкулемы вызывает затруднение, поскольку клинические проявления болезни крайне скудные. При рентгенологическом исследовании стабильных туберкулем определяется округлый фокус с четкими контурами, иногда с просветлением по краям или
в центре (рис. 6.12). Аналогичными признаками могут проявляться
и другие заболевания, поэтому для доказательства диагноза тубер-
кулемы необходимо прежде всего проводить дифференциальную ди-
агностику между туберкулемой и периферическим раком легкого,
который тоже чаще проявляется округлой тканью. Наличие серповидного или щелевидного распада в округлой тени может быть у больных аспергилломой. В мокроте при туберкулемах очень редко удается найти микобактерии, они выявляются при явно прогрессирующем течении, когда возникает сообщение между туберкулемой и дренирующими бронхами, имеется поражение концевых отделов бронхов и при кашле появляется мокрота. Наиболее результативным и достоверным методом диагностики туберкулем является бронхологическое исследование с катетеризацией и взятием биоптата для
бактериологического и цитологического исследования. В тех случаях, когда бронхологическое исследование не помогает дифференциальной диагностике и диагноз остается неясным, показана пробная
торакотомия. В отдельных случаях может помочь трансторакальная пункция, если туберкулема расположена пристеночно, субплевраль-но. В последнее время в литературе красной нитью проходит мысль: если проводится дифференциальная диагностика между туберкулезом, т. е. туберкулемой, и раком легкого, выжидательная тактика
недопустима.
Естественно, нужно проводить дифференциальную диагностику не только между туберкулемой и раком легкого при округлых фокусах в легких (особенно у лиц более молодого возраста). Округлая тень может быть опухолевого происхождения, но не злокачественного, а так называемого доброкачественного. В частности, к таким опухолям относятся невринома, гемангиома. Ангиовенозные анастомозы, аневризмы артерий, варикозное расширение вен, т. е. сосудистые заболевания легких, могут симулировать туберкулез. Таким больным для дифференциальной диагностики сосудистых опухолей и заболеваний показана ангиография. Иногда диагноз без
логической верификации поставить невозможно, в частности,
при доброкачественных опухолях типа гамартомы или остеохонд
246
ромы. Это врожденные опухоли, которые «ведут себя» очень спокойно, обычно не дают роста, но всякая опухоль подлежит хирургическому удалению. Поэтому если ставится вопрос о наличии доброкачественной опухоли, надо использовать все диагностические возможности, включая пробную торакотомию, не только для диагностики, но и лечения.
Следует назвать еще одну опухоль — аденому бронха или аде-номатоз; аденома — одиночная опухоль бронха, аденоматоз — множественные опухоли. Аденома — доброкачественная опухоль, но при этой опухоли возможно метастазирование. Это единственная доброкачественная опухоль, которая может характеризоваться метастазированием, появлением новых участков поражения. Поэтому одиночные аденомы нужно удалять. Округлые тени могут быть не только опухолевого происхождения. Округлую тень типа туберкулемы иногда нужно дифференцировать с ретенционными кистами, т. е. заполненными кистами легких. Кистозное перерождение — известное врожденное заболевание, кисты бывают приобретенными реже. Если нарушается сообщение между кистой и окружающей бронхиальной системой, кисты могут заполняться, тогда образуется так называемая заполненная, или ретенционная, киста. Часто киста заполняется тканевой жидкостью, что не сопровождается какой-то клинической картиной. Однако иногда киста может нагнаиваться, тогда у больного наблюдается картина нагноительного заболевания легких со всеми клиническими проявлениями, которые, с одной стороны, ухудшают состояние больного, а с другой — облегчают дифференциальную диагностику. Кисты могут инфицироваться ас-пергиллами, и тогда развивается аспергиллома. Клиническая картина аспергилломы может быть очень похожа на картину туберкулемы. При аспергилломах нередко отмечаются секвестрация, серповидный распад, т. е. картина, которая часто бывает и при туберкулеме. Выявление аспергилл микроскопическим методом и бактериологическая серодиагностика, т. е. применение иммунологических методов, облегчают постановку диагноза.
При дифференциальной диагностике туберкулем на первом этапе нужно провести дифференциальную диагностику между туберкулезом и нетуберкулезными заболеваниями. Затем, на втором этапе (если нужно) проводят дифференциальную диагностику между туберкулемой и другими вариантами туберкулеза, в том числе инфильтративным туберкулезом легких. На втором этапе дифференциальная диагностика опирается в основном на косвенные признаки и динамику заболевания в процессе химиотерапии. Лечебная тактика при этой форме своеобразна. Имеются различные подходы к лечению туберкулем. Первый — туберкулему надо удалять хирургически, если она больших размеров, особенно если отмечается прогрессирующий распад, имеется прогрессирование, если при стабильном течении отмечаются вспышки, проявляющиеся щелевидным распадом, бактериовыделением, кратковременным кровохарканьем, кашлем и др. Второй подход заключается в длительной химиотерапии с применением различных стимуляторов (ультразвук, лидаза, ту
247
беркулин, БЦЖ, продигиозан). Этот подход характеризуется стремлением во что бы то ни стало вылечить больного с помощью химиопрепаратов и стимуляторов, без операции. Сторонниками такой точки зрения операция рассматривается как крайняя мера.
Третий подход к лечению туберкулем — дифференцированный выбор метода лечения в зависимости от типа течения туберкулемы (прогрессирующее, регрессирующее, стабильное). При стабильном течении туберкулемы у большинства больных прогрессирование процесса не происходит, таких больных оперировать не рекомендуется, особенно при туберкулемах малых размеров. Это очень важное положение: не всякая туберкулема представляет опасность в плане прогрессирования и создания опасности для здоровья больного. Если у больного имеется прогрессирующая туберкулема, которая приводит к формированию полости и не заживает под влиянием химиотерапии, надо пациента оперировать, как всякого другого больного с незаживающим деструктивным процессом, воздержаться от операции может заставить только ряд каких-то обстоятельств. Хирургическое вмешательство по поводу туберкулемы следует осуществлять также в том случае, когда у больного имеется туберкулема с признаками периодического обострения, хотя и без явного прогрессирования. Лечение химиопрепаратами в сочетании с применением патогенетических методов не приводит к положительному результату, особенно если туберкулема больших размеров.
Итак, туберкулему следует расценивать как активную форму туберкулеза, подлежащую лечению и по показаниям — операции. Все больные туберкулемой нуждаются в диспансерном наблюдении, группа диспансерного учета зависит от клинического варианта болезни и ее течения. Больные со стабильными туберкулемами, так же как и с регрессирующими, наблюдаются по II и III, затем VII группам, а с прогрессирующими туберкулемами — по I группе учета. Последняя группа больных нуждается в стационарном лечении.
6.11. КАВЕРНОЗНЫЙ ТУБЕРКУЛЕЗ ЛЕГКИХ
Кавернозный туберкулез легких характеризуется наличием сформированной каверны. Это основной его отличительный признак. Кавернозный туберкулез легких представляет собой по существу промежуточный этап в прогрессирующем течении деструктивного туберкулеза. Этот этап занимает место между фазой распада при той или иной клинической форме туберкулеза и фиброзно-кавернозным туберкулезом. Фаза распада при любой клинической форме туберкулеза легких — это начало деструктивного процесса, при прогрессирующем его течении постепенно признаки исходной клинической формы исчезают особенно под влиянием химиотерапии по мере инволюции воспалительного процесса. Особенности заболевания, обусловленные наличием формирующейся или уже сформированной каверны, выступают на первый план.
В прежние годы у большинства больных туберкулезом начав
248
шийся деструктивный процесс очень быстро прогрессировал, и такое течение чаще всего называли скоротечной чахоткой. «Скоротечная чахотка» соответствует инфильтративно-казеозной или просто казеозной пневмонии. В этих случаях довольно быстро формировались гигантская или множественные полости и наступал летальный исход. Но не всегда деструктивный процесс развивался так бурно и быстро, иногда, начавшись, он не приводил к быстрому летальному исходу, а характеризовался длительным хроническом течением и превращался в фиброзно-кавернозный туберкулез. Этап, соответствующий кавернозному туберкулезу, в те времена, когда не было химиопрепаратов и не применялась коллапсотерапия, имел очень короткое течение. Очень трудно было выявить больных именно на этом этапе деструктивного процесса. В настоящее время данный промежуточный этап между фазой распада и фиброзно-кавернозным туберкулезом может продолжаться месяцы и даже годы. Такое течение деструктивного процесса обусловлено применением химиотерапевтических препаратов.
Деструктивный процесс возникает вследствие того, что в воспалительном очаге образуется особый вид некротической ткани, появляется так называемый казеоз или казеозный некроз. У многих больных под влиянием протеолитических ферментов образовавшийся казеоз разжижается, сухие казеозные массы становятся жидкими. При наличии сообщений с бронхиальной системой такой разжиженный казеоз постепенно отторгается, образуя полость. Механизм разжижения казеозных масс и образования полости в настоящее время интенсивно изучается. Хотя этот вопрос «старый», появились работы, в которых подчеркивается, что разжижение казеозных масс — это не просто результат действия протеолитических ферментов, образование деструкции, а сложный иммунобиологический процесс с элементами аутоагрессии (Е. Ф. Чернушенко). До настоящего времени нет ответа на вопрос, почему у одних больных в результате возникшей воспалительной реакции происходит преимущественно экссудативный процесс, иногда очень обширный, имеющий склонность к рассасыванию и исчезающий почти без следа или с минимальными остаточными изменениями, а у других больных при таком же процессе очень быстро развивается казеозный некроз и наступает распад. В современных условиях у большинства больных деструктивный процесс имеет ограниченную протяженность, по крайней мере на начальных этапах развития. При иной форме туберкулеза, при которой тоже может быть деструкция — при диссеминированном процессе, у одних больных годами одна вспышка сменяет другую, между вспышками могут быть интервалы различной длительности, иногда поражаются не только легкие, но и серозные оболочки, гортань, почки, кости, кожа, а деструкции в легочной ткани нет, каверна не образуется. У других больных вскоре после развития диссеминированного процесса появляются распад, деструкция и каверна. Туберкулема может годами существовать у больного, не давая явных клинических проявлений, у некоторых больных туберкулемы распадаются, и в результате ее распада течение туберкулеза
249
прогрессирует, образуется каверна. Наконец, при очаговом туберкулезе легких, характеризующемся ограниченным процессом, склонным к «самоизлечению» и по крайней мере к затиханию, у некоторых больных уже на самых ранних этапах болезни, вскоре после возникновения очагов развивается распад.
Почему же имеет место такое течение туберкулеза? По-видимому, воспалительная реакция при туберкулезе может быть у отдельных больных или у отдельной группы больных классифицирована как гиперергическая реакция, как воспалительная реакция, возникающая на фоне резко выраженной местной локальной сенсибилизации. Чаще деструктивный процесс наблюдается при инфильтративном туберкулезе легких. Более 40% впервые выявленных больных с этой формой туберкулеза уже имеют распад, причем этот процент держится стойко и никакой тенденции к его снижению нет. Довольно часто деструктивный процесс выявляется у больных диссеминированным туберкулезом легких, правда, удельный вес этой формы в общей структуре заболеваемости не очень большой, но среди всех впервые выявленных больных диссеминированным туберкулезом у 40% лиц обнаруживается распад на разных этапах развития. Очаговый туберкулез также может приводить к образованию деструктивных форм. Как же выявить деструктивный процесс? Как его обнаружить на ранних этапах до того, как образовался кавернозный туберкулез легких?
Фаза распада вносит новые симптомы в клиническое течение любой формы туберкулеза. Для фазы распада характерен «синдром фазы распада»: кашель с наличием мокроты, хрипы в легких, кровохарканье, бактериовыделение. Эти же симптомы характерны и для кавернозного туберкулеза. Основные признаки распада и формирующейся каверны в доантибактериальный период были очень яркими, занимали ведущее место в симптоматике болезни. В лекциях Остроумова и Соколовского можно найти указания на то, что кашель с выделением мокроты — ведущий симптом туберкулеза, симптом, который мучает больного, симптом, который заставляет врача принимать всевозможные меры, чтобы как-то успокоить больного, дать ему уснуть ночью, хотя бы на короткий период. В настоящее время кашель носит совсем иной характер, этот симптом настолько не выражен, что больной даже может не обратить внимание на кашель, особенно если он курит. Человек с привычным кашлем не обращает никакого внимания на этот симптом. Кроме того, в настоящее время кашель продолжается сравнительно короткое время. Поэтому необходимо настойчиво расспрашивать больного о кашле. Это — особенность клиники деструктивного процесса на современном этапе. Мокроты у больного туберкулезом не бывает в большом количестве, при наличии фазы распада и при образовании каверны этот симптом нужно настойчиво искать. Хрипы выслушиваются в фазе распада и при наличии каверны, но услышать их трудно. Для того чтобы их выявить, нужно попросить больного покашлять и после этого глубоко вздохнуть — нужно выслушивать именно в том месте, где локализуются воспалительный процесс, каверна.
250
Следующий симптом — кровохарканье. Оно, конечно, бывает не у всех больных; приводятся разные цифры частоты кровохарканья при деструктивном процессе. У 12—16% больных (Д. Д. Яблоков) этот симптом довольно яркий, и если у больного кровохарканье, он, как правило, обращается к врачу, если кровь выделяется в большом количестве и появляется кровотечение, то такого больного госпитализируют. Кровохарканье и кровотечение помогают выявить скрытый туберкулезный процесс. Г. Р. Рубинштейн писал, что кровохарканье на фоне кажущегося здоровья, «гром среди ясного неба», — это симптом, который часто свидетельствует о наличии деструктивного прогрессирующего туберкулезного процесса. Наконец, бактериовыделение может быть выявлено методом как микроскопии, так и посева. У некоторых больных с наличием фазы распада и кавернозного туберкулеза можно обнаружить синдром распада в полном объеме, т. е. все его элементы. Это наблюдается менее чем у 50% таких больных, чаще имеются не все симптомы синдрома, а только его отдельные элементы.
Ведущее значение в выявлении каверны принадлежит рентгенологическому методу, в частности томографии (рис. 6.13). Кавернозный туберкулез легких может характеризоваться наличием: а) эластической каверны, б) ригидной каверны, в) фиброзной каверны. Чаще всего наблюдаются эластическая и ригидная каверны. Фиброзная полость может быть лишь у некоторой группы больных, систематически подвергающихся химиотерапии, когда сохраняется каверна, но нет тех признаков, которые типичны для фиброзно-кавернозного туберкулеза. В современных условиях кавернозный туберкулез характеризуется сравнительно малосимптомным течением. Ярко выраженного течения, которое имело место при наличии каверны в прошлом, как правило, не наблюдается. Это несомненное доказательство изменившейся клинической картины кавернозного туберкулеза. С одной стороны, клиническая картина стала менее выраженная, она сопровождается не такими яркими клиническими симптомами, как в прошлом, с другой стороны, течение кавернозного туберкулеза стало более продолжительным. Если в прошлом можно было бы уловить эту фазу кавернозного процесса, но она была сравнительно короткой и не у всех больных, то с появлением химиопрепаратов сложилась иная ситуация. У одних больных образовавшаяся каверна закрывается (чаще это бывает тогда, когда каверна эластическая, в этом случае каверна может сравнительно быстро зажить с образованием рубца), у других больных с ригидной или фиброзной каверной даже в условиях длительной, настойчивой химиотерапии не всегда удается добиться заживления каверны. Наоборот, такая каверна может заживать очень медленно за счет постепенного уменьшения размеров полости, очищения стенок, гранулирования, такой процесс может растягиваться на месяцы.
И вот у тех больных, у которых каверна в процессе химиотерапии не заживает, сохраняется кавернозный туберкулез. Он характеризуется волнообразным течением, т. е. появлением периодических вспышек, обострений. Частота вспышек зависит от методики, дли-
251
Рис. 6.13. Кавернозный туберкулез легких.
а — рентгенограмма грудной клетки в прямой проекции, б — томограмма
252
Рис. 6.13. Продолжение, в — схема
тельности и эффективности химиотерапии. При более успешном лечении обострений может не быть долго, длительно может сохраняться стабилизация процесса. При химиотерапии менее эффективной, особенно при беспорядочном лечении или его отсутствии, у больных появляются периодические вспышки. В период вспышки отмечается синдром интоксикации: повышается температура тела, возникают слабость, снижение аппетита. Можно сказать, что этот синдром выражен не очень резко и может исчезать довольно быстро, особенно при удачно подобранной комбинации химиопрепаратов. В период вспышки у больного появляются грудные симптомы: кашель, выделение небольшого количества мокроты. Может быть кровохарканье (у некоторых больных периодически бывают кровохарканья даже в период интервалов). Чаще всего это связано или с сосудистыми изменениями типа аневризмы небольших артерий или варикозно расширенных вен в стенках бронхов. Кроме того, кровохарканье может быть результатом разрушения сосудистой стенки, расположенной в стенке каверны.
Бактериовыделение у больных кавернозным туберкулезом зависит от эффективности химиотерапии. Если больной только выявлен и не лечился, у него в мокроте, конечно, обнаруживаются микобактерии, а вот в процессе лечения химиопрепаратами и если химиотерапия неэффективна, в дальнейшем бактериовыделение мо-
253
жег быть постоянным. Постоянное бактериовыделение даже при клиническом благополучии, при отсутствии клинически выраженных вспышек должно расцениваться как признак активного туберкулеза. Продолжающееся бактериовыделение — чаще всего результат неадекватной химиотерапии или результат лекарственной резистентности микобактерий. Бактериовыделение может быть периодическим. Это тоже надо считать признаком активного туберкулеза, признаком продолжающегося туберкулезного процесса. И наконец, у больных может быть синдром «падения — подъема бактериальной популяции», т. е. наступает прекращение бактерйовыделения, но через какое-то время, чаще через 4—6—8 мес после начала химиотерапии оно возобновляется. Как правило, синдром «падения — подъема» связан с развитием лекарственной резистентности и является весьма неблагоприятным признаком.
Большое значение при обследовании больного кавернозным туберкулезом имеет изучение в динамике лейкограмм. Такие признаки, как увеличение СОЭ, сдвиг влево, лимфопения, даже при клиническом благополучии являются признаками активного туберкулеза, обострения болезни, поэтому повторное исследование крови имеет большое значение.
Всем больным с кавернозным процессом нужно проводить бронхоскопию из-за того, что нередко такой процесс сопровождается эндобронхитом, а сопутствующий эндобронхит может препятствовать заживлению каверны даже при наличии эластической полости. Кроме того, при эндобронхите тактика лечения несколько меняется. У таких больных, помимо обычной химиотерапии, рекомендуется применение аэрозолей, эндобронхиальных вливаний. Эндобронхит может быть причиной феномена «раздувания каверны» или «растяжения каверны» (есть два термина — «раздутая» и «растянутая» каверна). Из-за эндобронхита может нарушаться проходимость бронха, и при нарушении последней по вентильному типу размеры каверн могут быть значительно больше, чем площадь деструкции. Легкое — орган эластичный, и далеко не всегда размер округлой тени каверны точно соответствует величине деструкции. Если при соответствующем лечении эндобронхита больного с раздутой или растянутой каверной восстанавливается дренирующая функция бронха, размер каверны резко уменьшается. Иногда такое уменьшение происходит сразу после бронхоскопии, потому что сама по себе бронхоскопия — мощный раздражитель бронхов и после нее иногда восстанавливается дренирующая функция, особенно, если отсасывается секрет, если в просвет бронха вводятся противовоспалительные средства. Феномен растянутой или раздутой каверны бывает только при эластических полостях. Поэтому если размеры полости быстро изменяются — это признак эластической каверны. Нужно обращать внимание не только на величину каверны, но и на ее локализацию, и нужно иметь в виду, что субплевральная локализация каверны создает крайне неблагоприятные условия для заживления. Субплевральные полости редко заживают даже при эластической каверне.
254
При оценке рентгенограмм и томограмм необходимо обращать внимание на наружные и внутренние контуры кольцевидной тени каверны, а также на состояние окружающей легочной ткани. Есть методы, которые позволяют изучать эластичность легочной ткани, что иногда очень важно при определении прогноза в плане возможности заживления каверны или отсутствия такой возможности. Кавернозный туберкулез требует того, чтобы больной был прежде всего госпитализирован. В условиях стационара после обследования необходимо начать химиотерапию, эта химиотерапия должна быть направлена на заживление каверны. Если не удается добиться заживления каверны, надо считать, что химиотерапия неэффективна, и таким больным показано хирургическое вмешательство.
Сколько же времени можно лечить больного химиопрепаратами? Сколько времени нужно добиваться заживления каверны? Инструкцией на это отводится 6 мес. В отдельных случаях можно ставить вопрос об операции раньше: если у больного имеется фиброзная или ригидная полость и ясно, что заживления не будет, если больной с трудом переносит пребывание в стационаре, если больной недисциплинирован, неаккуратно лечится химиопрепаратами и нет никакой надежды на то, что он получит курс химиотерапии в течение всего необходимого времени. Наконец, вопрос об операции может стоять тогда, когда химиотерапия неэффективна, продолжается бактериовыделение и, особенно, если выявляется лекарственная резистентность микобактерий. Последнее обстоятельство — плохая переносимость химиотерапевтических средств. Очень часто вопрос о хирургическом лечении кавернозного туберкулеза мы рассматриваем через 6 мес лечения, но операцию отодвигаем на более поздний срок. В каких случаях? Во-первых, если отмечается положительная динамика и уменьшаются размеры каверны. Сначала рассасывается перифокальное воспаление, заживают очаги, размер полости уменьшается. Если мы видим уменьшение размера полости, спешить с операцией не нужно. В одних случаях полость закрывается рубцом быстро, в других каверна медленно, постепенно уменьшается в размерах. У больных с заживающими кавернами нередко, кроме химиотерапии, приходится проводить патогенетическое лечение: ту-беркулинотерапия, введение БЦЖ, применение ультразвука, ин-дуктотермии, лазерного облучения.
При кавернозном туберкулезе может сохраняться бактериальная популяция в каверне и может возникать феномен «скрытой лекарственной устойчивости». Этот феномен мы описали вместе с сотрудниками кафедры Харьковского института усовершенствования врачей, в частности с О. И. Чесак, которая много занималась этим вопросом. Этот феномен заключается в следующем. Принято считать, что анализ мокроты дает почти точное представление о бактериальной популяции в каверне, т. е. он должен отражать характер бактериальной популяции, находящейся в каверне. Однако при кавернозном туберкулезе легких и отчасти при фиброзно-кавернозном туберкулезе такой параллелизм бывает далеко не всегда, особенно, если в процессе химиотерапии становится меньше мокроты или она
255
вовсе исчезает. В таком случае в мокроте микобактерий нет. А если удается выявить возбудителей, то они оказываются чувствительными к химиопрепаратам. При отсутствии заживления каверн таких больных мы подвергали хирургическому лечению и в резецированном материале из стенки каверны изучали бактериальную популяцию. Во-первых, оказалось, что у больных с прекратившимся бактериовыделением в стенке каверны микобактерий очень много, т. е. имеется различие между результатами анализа мокроты и тем, что на самом деле происходит в каверне. Иногда это следствие того, что прекращается общение между каверной и бронхиальным деревом, а чаще всего это результат отсутствия мокроты: отсутствует секрет, осушается слизистая оболочка бронха, нет воспалительной реакции, при которой образуется слизь, вызывающая кашель. Поэтому в каверне микобактерии имеются, а в мокроте их нет. Более того, оказывается, что эта сохраняющаяся популяция устойчива к тем химиопрепаратам, которые применяются. Вот поэтому мы и назвали этот феномен скрытой лекарственной устойчивостью, или, что более правильно, невыявленной лекарственной устойчивостью.
Скрытая, невыявленная лекарственная устойчивость — одна из причин незаживления каверны у таких больных. Поэтому при отсутствии заживления каверны, при отсутствии динамики есть смысл не только применять патогенетические средства, но и в процессе лечения менять химиопрепараты. Если с помощью химиотерапии не удается добиться заживления каверны, таким больным нужно делать операцию. С одной стороны, воздержаться от операции можно лишь в том случае, если имеются прямые противопоказания. С другой стороны, вопрос об операции можно отложить, если формируется абациллированная каверна, т. е. если стойко прекращается бацилловыделение — имеет место процесс, который приближается к так называемому открытому заживлению каверны, когда внутренняя стенка каверны очищается, подвергается эпителизации и каверна превращается в кисту. Правда, исходы болезни у некоторых больных не очень хорошие: может быть нагноение, может развиться аспергиллез, наступить заполнение кисты.
6.12. ФИБРОЗНО КАВЕРНОЗНЫЙ ТУБЕРКУЛЕЗ ЛЕГКИХ
Фиброзно-кавернозный туберкулез — завершающий этап в прогрессирующем течении деструктивного туберкулезного процесса. Для всех больных фиброзно-кавернозным туберкулезом, несмотря на все разнообразие клинических и патоморфологических проявлений болезни, общим признаком являются наличие фиброзной каверны, развитие фиброзных изменений в окружающей каверну легочной ткани. Наряду с фиброзом появляются эмфизема, бронхоэктатические изменения, изменения кровеносных сосудов, развивается комплекс морфологических изменений, который можно назвать дезорганизацией легочной ткани. Стенка фиброзной каверны представляет собой очень сложное образование: внутренний слой — это казеоз, неотторгшиеся казеозные массы, далее располагается довольно ши-256
рокий слой специфической грануляционной ткани, следующий слой — неспецифическая грануляционная ткань с наличием фиброзных изменений. Такая трехслойная каверна имеет мощную фиброзную капсулу, вокруг последней часто отмечается перифокальное воспаление, которое особенно резко выражено в период обострения. Каверна, особенно фиброзная, всегда сообщается с бронхиальным деревом, обычно имеется несколько дренирующих каверну бронхов, вот устья бронхов и составляют один из элементов стенки каверны. Дренирование каверны бронхами создает условия для бронхогенного обсеменения легочной ткани. При фиброзно-кавернозном туберкулезе иногда имеется довольно выраженное поражение сосудов и, в частности, сосудов, залегающих в стенке каверны. Вследствие разрушения кровеносного сосуда может быть легочное кровотечение, которое может обусловить развитие аспирационной пневмонии и даже летальный исход.
Каверна — это огромный резервуар для микобактерий. Подсчитано, что в ней находится Ю10—1012 микобактерий — это огромная бактериальная популяция, которая находится в нестабильном состоянии, размножается и все время поддерживает воспалительный процесс с наличием некроза в стенке каверны. Но воспалительный процесс при фиброзно-кавернозном туберкулезе ограничивается не только каверной. В результате наличия секрета в просвете каверны, поражения дренирующих каверну бронхов специфическим процессом у больных всегда имеется мокрота, которая содержит большое количество микобактерий. Капли мокроты, ее «комки» при кашле и глубоком дыхании проникают в дыхательные пути, могут попадать в окружающие участки легкого, противоположное легкое. Таким «спутогенным» путем могут возникать очаги бронхогенной диссеминации. В период вспышки вокруг каверны развивается довольно выраженная перифокальная воспалительная реакция. Периодически появляющаяся бронхогенная диссеминация приводит к тому, что патологический процесс при фиброзно-кавернозном туберкулезе не ограничивается только зоной, в которой расположена каверна. Туберкулезный процесс становится более обширным.
Очаги бронхогенной диссеминации по мере затихания вспышки
могут частично рассасываться, частично уплотняться, но при новом обострении появляются и новые очаги диссеминации, процесс становится еще более распространенным. В период обострения отдельные очаги диссеминации могут сливаться в более крупные конгло
мераты и эти конгломераты также могут подвергаться деструкции, разрушению. Так появляются новые каверны или, как говорят, дочерние каверны. Сейчас этот термин применяется не очень широко, но тем не менее в литературе его можно встретить. Таким образом, при фиброзно-кавернозном туберкулезе имеется угроза не только перифокального воспаления, не только бронхогенной диссеминации, но и появления новых каверн как в том же, так и в
противоположном легком.
Наряду с бронхогенной диссеминацией в отдаленных участках
легкого, в противоположном легком развиваются другие морфоло
9—1213
257
гические изменения: пневмосклероз, эмфизема, У таких больных постепенно появляются бронхоэктазы. Морфологическая картина фиброзно-кавернозного туберкулеза, таким образом, становится довольно разнообразной. Она характеризуется не только развитием изменений, обусловленных фиброзной каверной и дезорганизацией легочной ткани вокруг каверны, изменения имеют и метатуберкулезный характер. При очень давнем, длительном течении фиброзно-кавернозного туберкулеза легких может наступить полное разрушение легкого, чаще такое легкое характеризуется довольно тяжелой клинической картиной (это, пожалуй, самое тяжелое течение фиброзно-кавернозного туберкулеза). Фиброзно-кавернозный туберкулез иногда характеризуется развитием внелегочных поражений. Правда, в настоящее время это встречается не так уж часто, но тем не менее могут быть туберкулез гортани, туберкулез кишечника. Следует отметить, что у больных фиброзно-кавернозным туберкулезом, как правило, отмечается нарушение обменных процессов. Однако трудно сказать, какой вид обмена веществ не нарушается у больных фиброзно-кавернозным туберкулезом — углеводный, белковый или возникает дефицит витаминов.
При фиброзно-кавернозном туберкулезе отмечается выраженное нарушение функции различных органов и систем. Как правило нарушаются моторная и секреторная функция желудка, функция дыхания и кровообращения. Отмечаются гормональные нарушения. Иногда нарушения функций щитовидной железы и коры надпочечников носят плюригландулярный характер. Очень важно отметить, что в результате этих обменных нарушений, сохраняющихся длительное время, со временем развиваются морфологические изменения не только в легких, но и других органах. И, пожалуй, одним из самых типичных проявлений данного процесса является амилоидоз внутренних органов, который довольно часто развивается при фиброзно-кавернозном туберкулезе. Чаще амилоидоз развивается в печени, почках, кишечнике, железах внутренней секреции и в других органах, в результате у больных фиброзно-кавернозным туберкулезом могут наблюдаться очень тяжелые клинические проявления болезни вплоть до печеночной комы, почечной недостаточности и уремии, может развиваться адиссонизм или просто адиссо-нова болезнь в результате развившейся дистрофии коры надпочечников и т. д. Из-за обменных нарушений может поражаться опорно-двигательный аппарат, могут появляться полиартриты типа инфекционных с развитием грубых дистрофических изменений и даже контрактур. Может возникнуть универсальный гиперпластический периостит, при котором периост длинных трубчатых костей становится очень толстым, вследствие этого нарушаются питание костей и функция опорно-двигательного аппарата.
Клиническая картина фиброзно-кавернозного туберкулеза очень разнообразна, обусловлена многочисленными морфологическими и функциональными изменениями. Для того чтобы как-то систематизировать клинические проявления фиброзно-кавернозного туберкулеза, более правильно подойти к вопросам лечения и более четко
258
систематизировать все мног
разие клинической симптоматики, все
больные по варианту течения фиброзно-кавернозного туберкулеза были разделены на 4 клинические группы.
1. Ограниченный и относительно стабильный фиброзно-кавернозный процесс. Это фиброзно-кавернозный туберкулез с ограниченным поражением и стабильным течением болезни, редкими вспышками; у таких больных часто отсутствует выделение микобактерий или оно изредка появляется в период редких обострений.
2. Медленно прогрессирующий фиброзно-кавернозный тубер
кулез.
3. Быстро прогрессирующий фиброзно-кавернозный туберкулез.
4. Фиброзно-кавернозный туберкулез с наличием различных осложнений. Чаще всего этот вариант характеризуется тоже прогрес
сирующим течением.
В основном фиброзно-кавернозный туберкулез развивается из
кавернозного и диссеминированного туберкулеза легких. Первый
вариант представляет с
ил
й переход кавернозного процесса в фиб-
розно-кавернозный. Чаще всего это наблюдается у больных, отка
завшихся от операции, но подвергшихся длительной химиотерапии, и именно благодаря химиотерапии у них наступила стабилизация процесса. Длительная химиотерапия может способствовать некоторому угасанию воспалительной реакции в стенке самой каверны. Вследствие этого могут быть некоторое очищение внутренней стенки каверны от слоя казеоза и некоторое уменьшение бактериальной популяции. И вот по этим причинам, а прежде всего из-за дли
тельной химиотерапии могут отсутствовать вспышки, т. е. периоды обострения. Интервал между обострениями растягивается на несколько месяцев, а иногда даже на несколько лет. Такие лица в общем-то не очень страдают и не очень чувствуют свое заболевание. Создается даже ощущение наступившего выздоровления. Больные
говорят, что имеющиеся у них каверны мало им мешают. У некоторых таких лиц бактериовыделение может отсутствовать на протяжении длительного времени или может быть лишь периодическим, скудным. У части больных выделяются микобактерии лишь методом микроскопии — на первый взгляд это парадокс: микроскопическое исследование выявляет микобактерии, а при посеве роста нет. Это обусловлено изменением жизнедеятельности микобактерий, их культуральных свойств под влиянием химиотерапии.
Однако такое состояние, такая стабильность туберкулезного процесса отмечаются главным образом у больных, которые строго соблюдают режим и приспосабливают свою жизнедеятельность к новым условиям — к наличию у них туберкулезного процесса. Если больные не соблюдают этих правил, особенно если они ведут беспорядочный образ жизни, злоупотребляют алкоголем, подвергаются гиперинсоляции и другим неблагоприятным внешним воздействиям, наступают обострение и прогрессирование туберкулезного процесса. Кроме того, стабильность фиброзно-кавернозного процесса зависит от регулярности приема химиопрепаратов. Указанный вариант течения болезни отмечается лишь у больных, которые регулярно и длительно при
9*
259
нимают химиопрепараты. При «хаотическом» использовании терапевтических средств не удается добиться стабилизации фибрознокавернозного процесса. В силу того что больные длительно лечатся химиопрепаратами, адекватной химиотерапии чаще всего мешают два фактора — лекарственная резистентность микобактерий и плохая переносимость химиотерапевтических средств. Вот из-за этих двух моментов, даже при желании врача назначить адекватное лечение, терапию провести не удается, что нарушает стабильность фиброзно-кавернозного процесса и приводит к вспышке.
Длительная химиотерапия имеет свои пределы, она действенна небесконечно, и рано или поздно влияние химиопрепаратов прекращается. Тогда фиброзно-кавернозный туберкулез течет уже совсем по-другому — по прогрессирующему типу. Второй и третий варианты — прогрессирующее течение фиброзно-кавернозногго туберкулеза — может развиваться с самого начала болезни. Вовсе не обязательно, чтобы прогрессирующему течению предшествовал какой-то период стабильности. С самого начала, с начала деструктивного процесса заболевания может характеризоваться быстрым или медленно прогрессирующим течением, несмотря на химиотерапию. Чаще всего оно наблюдается у больных, у которых не удается эффективно применить химиотерапию. Это происходит из-за нарушения больными предписанного режима, по каким-то внешним причинам наступает такое состояние, когда не удается остановить прогрессирование болезни. Наконец, эффект от химиотерапии может быть очень кратковременным, и вслед за интервалом, наступившим под влиянием лечения химиопрепаратами, снова возникает вспышка. Такой процесс в настоящее время наблюдается часто.
Клинически прогрессирующий фиброзно-кавернозный туберкулез характеризуется сменой вспышек и интервалов между ними, причем длительность периода между вспышками может быть разной (короткой, длинной), но для прогрессирующего течения (особенно быстро прогрессирующего) характерна волнообразность, т. е. частая смена вспышек и интервалов. Надо подчеркнуть, что в период вспышки выражена интоксикация, которая может сохраняться и в период интервала. При фиброзно-кавернозном туберкулезе имеются грудные симптомы: это кашель, выделение мокроты, кровохарканье, боли в груди, со временем и одышка. Этим клиническим проявлениям в период обострения соответствуют развитие перифокального воспаления вокруг каверны, бронхогенная диссеминация, развитие сопутствующего эндобронхита. Иногда может быть поражение плевры, развивается плеврит. Иногда каверна прорывается в плевральную полость, тогда возникает спонтанный пневмоторакс, тоже нередко сопровождающийся гнойным плевритом. В результате прогрессирующего течения туберкулеза у некоторых больных наступает мили-аризация, даже с развитием менингита, однако в настоящее время это наблюдается нечасто.
У некоторых больных прогрессирующее течение фиброзно-кавернозного туберкулеза завершается развитием инфильтративно-казеозной или казеозной пневмонии. Такой больной по существу не
260
выходит из состояния вспышки, несмотря на примененное лечение не удается добиться «перелома» процесса, крайне выражена интоксикация, вспышка принимает перманентный характер, т. е. она становится непрерывной. У такого больного порой появляются новые каверны, иногда они гигантские (рис. 6.14). Часто развивается лекарственная устойчивость микобактерий, что препятствует стабилизации туберкулезного процесса, и болезнь течет так, как она протекала в антибактериальный период. Лекарственная устойчивость микобактерий — самая частая причина неэффективности химиоте
рапии.
Четвертый вариант фиброзно-кавернозного туберкулеза характеризуется осложнениями и волнообразным течением. Чаще развиваются легочно-сердечная недостаточность, легочное сердце (особенно при длительном течении болезни). И если на первых этапах легочное сердце характеризуется компенсацией и тем, что еще нет функциональных нарушений, затем наступают субкомпенсация и
декомпенсация, т. е. возникает легочно-сердечная недостаточность
с наличием одышки, нарушениями кровообращения в последующем, с развитием мышечной дистрофии и аритмий, с гипертензией в малом круге кровообращения. Именно эти симптомы легочно-сер-
дечной недостаточности занимают ведущее место в картине болезни, все остальные признаки уходят на второй план. Второе осложнение —
это амилоидоз внутренних органов, в том числе почек, развитием почечной недостаточности, хронической уремии.
У больных фиброзно-кавернозным туберкулезом ведущим симптомом может быть кровотечение, которое повторяется много раз. Повторные легочные кровотечения и кровохарканья иногда называют гемофтизой (кровяная чахотка). Этот вариант фиброзно-кавернозного туберкулеза очень опасен для жизни больного, поскольку при обширном легочном кровотечении может наступить смерть от удушья (утопление в собственной крови). Асфиксия возникает из-за закупорки излившейся кровью дыхательных путей, смерть наступает мгновенно. Но если даже это не происходит, кровотечение и кровохарканье ведут к аспирационной пневмонии, утяжелению туберкулезного процесса, поэтому это крайне тяжелый вариант, который приносит массу мучений больному. Какие еще могут быть осложнения у больного фиброзно-кавернозным туберкулезом? Вспышки, обусловленные смешанной инфекцией с развитием пневмонической реакции, артропатии, артралгии (и даже полиартрит, типа универсального гиперпластического периостита), эндокринопатии по типу синдрома Кушинга или гипофизарной кахексии, адиссонизм, нарушение функции щитовидной железы — все это можно видеть у больного фиброзно-кавернозным туберкулезом.
Выявление фиброзно-кавернозного туберкулеза — очень важный показатель качества диагностики. Если среди впервые выявленных больных много лиц с фиброзно-кавернозным туберкулезом, качество раннего выявления и диагностики плохое. Если у впервые выявленных больных формируется деструктивный туберкулезный процесс и в результате проведенного лечения каверна не закрывается, а
261
Рис. 6 14. Фиброзно-кавернозный туберкулез легких а — рентгенограмма грудной клетки в прямой проекции, б — схема
262
развивается фиброзно-кавернозный туберкулез — это свидетельствует о плохой организации лечения, о его низком качестве и эффективности. Если среди контингентов противотуберкулезного диспансера большой удельный вес составляют больные фиброзно-кавернозным туберкулезом — это показатель большого резервуара инфекции, значительного рассеивания туберкулезной инфекции.
Основной причиной смерти от туберкулеза в настоящее время является фиброзно-кавернозный туберкулез легких. Исходя из этого, можно отметить, что, осуществляя выявление и диагностику туберкулеза, нужно организовать эту работу так, чтобы обнаружить больных туберкулезом до развития фиброзно-кавернозного процесса, а проводя лечение выявленных больных, добиться излечения и не допустить развития фиброзно-кавернозного туберкулеза. Основными методами лечения больных фиброзно-кавернозным туберкулезом являются химиотерапия и хирургические вмешательства, поскольку закрытие каверны под влиянием химиопрепаратов наблюдается всего в 20—30% случаев. Поэтому больных с незакрывшимися кавернами необходимо подвергать операции, основное Значение имеют различные виды резекций.
Больные фиброзно-кавернозным туберкулезом должны наблюдаться в противотуберкулезном диспансере пожизненно по I группе учета, в другие группы учета их не переводят.
6.13. ЦИРРОТИЧЕСКИЙ ТУБЕРКУЛЕЗ ЛЕГКИХ
Цирротический туберкулез — клиническая форма, которая характеризуется развитием выраженных фиброзных изменений в легких, наличием эмфиземы и бронхоэктазов при сохранении клинико-рентгенологических проявлений активного туберкулезного процесса. Цирротический туберкулез развивается при длительном течении фиброзно-кавернозного, диссеминированного процесса. Указанная форма может возникнуть в результате инволюции распространенного инфильтративного процесса типа лобита, из-за рассасывания инфильтративных изменений и разрастания соединительной ткани, а также на почве ателектаза при наличии в ателекта-зированной легочной ткани туберкулезных изменений. Наконец, цирротический туберкулез может сформироваться у больных с туберкулезными изменениями легких, перенесших плеврит с затяжным
течением, пневмоплеврит или длительно лечившихся пневмотораксом. В этих случаях цирротический туберкулез имеет «плеврогенный» генез и такого рода изменения принято называть плевропнев
моциррозом.
Для цирротического туберкулеза характерно наличие различных проявлений активного туберкулезного процесса. У больных могут выявляться каверны, обычно в виде щелевидных, деформированных
полостей, единичные или множественные крупные очаговые изме-
нения, диссеминация в одном или
МА
их легких (рис. 6.15). Обна-
ружить проявления активного туберкулеза в таких случаях нелегко вследствие того, что в клинической картине заболевания и при
263
Рис. 6.15 Цирротический туберкулез легких
а — рентгенограмма грудной клетки в прямой проекции, б — томограмма
264
в
Рис. 6.15 Продолжение, в — схема
рентгенологическом исследовании доминирующую роль играют изменения метатуберкулезного характера. Цирротический туберкулез может быть одно- и двусторонним, т. е. характеризоваться поражением одного или обоих легких. По степени распространенности
метатуберкулезных изменений и проявлений активного туберкулез-
ного процесса цирротический туберкулез дифференцируется на: то-
тальный (при поражении всего легкого); лобарный (при поражении
доли легкого); сегментарный, ограниченный (при поражении сег
мента легкого).
Патоморфологические изменения многообразны не только по степени распространенности, но и характеру морфологических реакций. Развитие соединительной ткани может быть выражено в различной
степени и варьировать в весьма широких пределах — от выраженного интерстициального пневмосклероза с наличием эмфиземы до глубокого развития рубцовой ткани с замещением альвеолярной ткани фиброзной (разрушенное легкое) (Л. К. Богуш, В. П. Стрельцов, Nuboer, Anastasatu). В. И. Пузик, О. А. Уварова, М. М. Авербах и В. П. Стрельцов в зависимости от соотношения цирротических изменений и проявлений прогрессирующего туберкулеза различают следующие типы «разрушенного» легкого: 1) кавернозно-цирротический, 2) поли-кавернозно-цирротический, 3) пневмотозно-цирротический.
Следует подчеркнуть, что у больных цирротическим туберкуле
265
зом часто возникают бронхоэктатические изменения, также выраженные в различной степени и выявляющиеся как при патоморфо-логическом исследовании рецецированных участков легких. Такие изменения обнаруживаются при бронхографии.
Выраженные бронхоэктатические изменения значительно влияют
на клиническую картину, а иногда доминируют в течение болезни. Наконец, следует отметить значительную редукцию кровообращения в легком в результате поражения легочных артерий, запустевания мелких сосудов и капиллярной сети, развития артериовенозных анастомозов и различных изменений бронхиальных кровеносных сосудов, особенно при развитии бронхоэктазов (В. И. Пузик, О. А. Уварова, М. М. Авербах). Эти проявления в сочетании с эмфиземой, цирротическими изменениями (особенно при большой их распрост
раненности) ведут как к легочной, так и легочно-сердечной недостаточности. У таких больных постепенно формируются нарушения, которые принято называть легочным сердцем. При снижении компенсаторных механизмов развиваются субкомпенсация, а затем и декомпенсация, проявляющаяся как в клинической картине болезни,
так и по соответствующим данным функционального исследования дыхания и кровообращения. Многообразие морфологических изме
нений, их распространенности, а также различная степень функциональных нарушений различных органов и систем (в первую очередь дыхательной и сердечно-сосудистой) в зависимости от компенсаторных возможностей организма больного создают весьма многообразную клиническую картину цирротического туберкулеза. Представляется возможным выделить следующие 5 клинических вариантов заболевания.
1. Ограниченный цирротический туберкулез с малосимптомным
течением.
2. Ограниченный или распространенный цирротический туберкулез с частыми обострениями.
3. Цирротический туберкулез с бронхоэктазами и периодическим кровохарканьем или легочными кровотечениями.
4. Цирротический туберкулез с наличием «легочного сердца» и различных проявлений легочной и легочно-сердечной недостаточ
ности.
5. «Разрушенное» легкое с прогрессированием туберкулезного процесса и различными проявлениями метатуберкулезного синдрома.
Ограниченный цирротический туберкулез с малосимптомным течением характеризуется ограниченными изменениями сегментарного или лобарного типа, формируется в результате перенесенного инфильтративного туберкулеза или ателектаза в связи со специфическим эндобронхитом, бронхиолитом, рубцовыми изменениями бронха. Кроме изменений рубцового характера, в пораженном участке могут быть туберкулезные очаги, туберкулема или небольшая остаточная каверна. При физическом исследовании в области пораженной доли отмечаются притупление, жесткое дыхание, иногда бронхиальное. Часто выслушиваются постоянные влажные мелкопузырчатые хрипы. Клинические проявле-
266
ния незначительные, лишь периодически возможны нерезко выраженные обострения с небольшим повышением температуры тела, кашлем и выделением мокроты. Изредка бывает кровохарканье. В мокроте микобактерии туберкулеза обнаруживаются непостоянно, особенно при наличии полостных изменений.
Ограниченный или распространенный цирротический туберкулез с частыми обострениями характеризуется обострениями, которые могут вызываться как смешанной, вторичной флорой, так и туберкулезной инфекцией. Обострения
не случайные, спорадические, а закономерные, возникают после более или менее длительного интервала. Заболевание течет волнообразно, со сменой обострений и интервалами между ними. При неблагоприятном течении обострения затяжные, а интервалы весьма короткие. Возможно развитие обострений, обусловленных сочетанием влияния вторичной, смешанной флоры и микобактерий туберкулеза. Такое течение чаще отмечается при тотальном, реже — при лобарном поражении одного легкого или двустороннем цирротическом туберкулезе с наличием различного бронхита (Г. Р. Рубинштейн).
Клиническая картина заболевания в значительной степени определяется фазой процесса. В период обострения отмечаются повышение до 38°С и более температуры тела, потливость, выраженные ночные поты, слабость, лейкоцитоз, нейтрофильный сдвиг влево, повышение СОЭ. Как правило, имеются грудные симптомы: кашель,
выделение мокроты, одышка. В легких выслушивается много хрипов сухих и влажных. При двустороннем цирротическом туберкулезе выражена эмфизема, а при одностороннем отмечаются проявления фиброторакса, притупление, бронхиальное дыхание, иногда ослаб
ленное (при наличии значительных плевральных изменений). В период интервала по мере затихания вспышки симптомы инток
сикации постепенно уменьшаются и могут даже полностью ликвидироваться, исчезают или уменьшаются кашель и выделение мокроты. Следует подчеркнуть, что хрипы в легких у таких больных иногда стойкие. Наряду с рубцовыми изменениями, эмфиземой, бронхитом и другими проявлениями метатуберкулезного синдрома наблюдаются изменения туберкулезного характера, главным образом в виде диссеминации (полиморфные очаги). Могут быть и более ограниченные изменения за счет инволюции туберкулезного процесса в виде ограниченных очагов или одиночной или множественных туберкулем. Среди рубцовых изменений могут выявляться каверны.
Цирротический туберкулез с бронхоэктазами и
периодическим кровохарканьем или легочным кровотечением. При длительном течении заболевания, в результате развившегося фиброза, бронхита (особенно при волнообразном течении болезни и частых пневмонических вспышках) постепенно образуются бронхоэктатические изменения цилиндрического и мешотчатого типа. У таких больных обычно выделяется большое количество мокроты, которая становится гнойной. Хрипы, определявшиеся ранее в период обострений, становятся стойкими, сохраняются в период интервала, а если исчезают, то на короткое
267
время, возобновляясь при усилении бронхоспазма и задержке мокроты. Наиболее ярким клиническим проявлением при развитии бронхоэктазов у ряда больных служат повторные кровохарканья и легочные кровотечения. Эти явления могут быть весьма тягостными для больного, особенно при повторных, частых легочных кровотечениях, что вынуждает лечить длительное время таких лиц в больницах. Иногда такие явления принимают угрожающий для жизни характер. Кровохарканье и особенно кровотечение могут сопровождаться явлениями аспирации, что часто ведет к развитию аспирационной пневмонии.
Таким образом, при данном варианте цирротического туберкулеза с наличием бронхоэктатических изменений отмечается клиническая картина, обусловленная тремя основными синдромами: 1) развитие повторных пневмонических вспышек, обусловленных смешанной флорой; 2) повторные кровохарканья и легочные кровотечения с последующими аспирационными явлениями; 3) клинические проявления периодически обостряющегося туберкулеза. У отдельных больных эти составляющие клиническую картину синдромы могут сочетаться различным образом:
— все имеющиеся синдромы достаточно выражены и отмечается наличие сложного симптомокомплекса;
— один из синдромов стойко доминирует длительное время;
— на разных этапах заболевания меняется клиническая картина за счет того, что периодически то один, то другой синдром становится ведущим.
Частота, опасность, клиническое течение заболевания при кровохарканьях и легочных кровотечениях, вызванных туберкулезом, наиболее подробно описаны Д. Д. Яблоковым.
Цирротический туберкулез с наличием «легочного сердца» и различных проявлений легочной и легочно-сердечной недостаточности. Легочное сердце, легочная и легочно-сердечная недостаточность возникают при распространенном цирротическом туберкулезе и двустороннем поражении с развитием эмфиземы, а также тотальном одностороннем процессе. На первый план выступает одышка, степень выраженности которой может быть различной при физической нагрузке, небольшом физическом напряжении и в состоянии покоя. Помимо этого, отмечаются изменения показателей вентиляции легких и резко выраженное снижение дыхательных объемов, в первую очередь жизненной емкости легких. В тяжелых случаях развиваются гиперкапния и гипоксемия. Нарушения газового состава крови свидетельствуют уже о выраженных функциональных расстройствах и легочной недостаточности. Постепенно состояние компенсации, которое может сохраняться длительное время, нарушается, развивается синдром субкомпенсированного и декомпенсированного легочного сердца. Клинические проявления, данные различных инструментальных и лабораторных исследований при хронической легочной и легочносердечной недостаточности у больных цирротическим туберкулезом хорошо известны и описаны в литературе (Л. Т. Малая, Ю. В. Ку-
268
лачковский, Э. С. Степанян, В. Ф. Подусовский, Р. И. Кене, В. Б. Нефедов, И. И. Крыжановская и др.).
Большое значение в возникновении перечисленных проявлений
принадлежит не только анатомическим изменениям, характерным для цирротического туберкулеза, но и обструктивно-рестриктивному состоянию бронхов (особенно при длительном течении бронхита), а также явлениям интоксикации, обусловленной обострением неспецифического и туберкулезного характера. У больных с развившейся легочной и легочно-сердечной недостаточностью, помимо
одышки, отмечаются цианоз, тахикардия, приглушенные или глухие тоны сердца, иногда выслушивается систолический шум у мечевидного отростка (особенно в горизонтальном положении). При развивающейся легочно-сердечной недостаточности постепенно возникают
застойные явления: отеки, увеличение печени, асцит. Следует подчеркнуть, что у подавляющего большинства больных цирротическим туберкулезом наблюдается преимущественно легочная недостаточность — хроническое легочное сердце. Лишь у сравнительно небольшого числа больных развивается легочно-сердечная недостаточность правожелудочкового типа с застойными явлениями, периферическими отеками и асцитом. Несмотря на то что в клинической картине цирротического туберкулеза, как правило, преобладают признаки хронической легочной недостаточности, у таких больных часто обнаруживаются и нарушения функции сердечно-сосудистой системы: на ЭКГ имеются признаки правограммы за счет гипертрофии правого желудочка и легочной гипертензии. В результате длительной гипоксемии усиливается эритропоэз и возникает полигло-булия (полицитемия), что проявляется увеличением числа эритроцитов, уровня гемоглобина и цветового показателя. Естественно,
при таких состояниях отмечаются уменьшение жизненной емкости
легких и выраженные изменения показателей вентиляции легких. Течение болезни волнообразное, т. е. периодически усиливаются и снижаются клинические проявления хронической легочной недостаточности. Симптомы легочной недостаточности нередко усиливаются в период обострения в связи со вспышкой туберкулезного процесса или процесса, вызванного смешанной вторичной флорой. Физические нагрузки, астматоидные состояния также могут усугублять одышку.
Легочная и легочно-сердечная недостаточность может обусловить снижение работоспособности и быть причиной инвалидности.
«Разрушенное» легкое с прогрессированием туберкулеза и другими проявлениями цирротического туберкулеза. При этом варианте цирротического тубер
кулеза тотально поражается одно легкое. Клинические проявления характеризуются длительным, волнообразным течением заболева-
ния, почти постоянной интоксикацией. Периодически возникают обострения, обусловленные в равной степени вторичной микрофлорой и микобактериями туберкулеза. Возможно проявление крово-
харканий и легочных кровотечений. При физическом исследовании обращает внимание резко выраженная асимметрия грудной клетки за счет фиброторакса, отмечаются перетяжка органов средостения
269
в пораженную сторону, ограничение подвижности диафрагмы; купол диафрагмы подтянут. Дыхание бронхиальное, иногда с амфориче
ским оттенком, при массивных плевральных изменениях оно может быть ослабленным. У некоторых больных (особенно при наличии бронхоэктатических изменений) выслушиваются влажные и сухие хрипы. Хрипы могут быть также обусловлены кавернозными изменениями в виде одиночных больших или множественных более мелких полостей. У больных данной группы выделение микобактерий может быть постоянным или периодическим в период вспышки. Как правило, цирротический туберкулез, проявляющийся «разрушенным» легким, сопровождается хронической легочной недостаточно-
стью, одышкой, выраженной в различной степени. При длительном течении болезни возможно развитие легочно-сердечной недостаточности с нарушениями кровообращения.
В результате длительной интоксикации могут возникнуть дист-
рофические изменения в легких и амилоидоз внутренних органов.
Амилоидоз проявляется на ранних стадиях: в моче обнаруживается белок, снижается относительная плотность мочи, наблюдается изо-
стенурия, затем выявляются цилиндры различного типа. В после
дующем явления амилоидоза прогрессируют, развиваются изменения
в печени, селезенке, кишечнике, железах внутренней секреции и
др. Параллельно с нарастанием морфологических изменений кли-
нические проявления амилоидоза становятся более значительными,
постепенно усиливается хроническая почечная недостаточность с постепенным развитием явлений уремии.
Несмотря на разнообразие клинических вариантов цирротического туберкулеза, имеются общие признаки, типичные для этой формы туберкулеза, что объединяет все варианты цирротического туберкулеза в одну клиническую форму. Общим признаком служит наличие клинических проявлений, обусловленных как активным туберкулезным процессом, так и метатуберкулезными изменениями, связанными с развитием рубцовой ткани, а также вызванными различными осложнениями. При этом доминирующую роль играют проявления, обусловленные метатуберкулезным синдромом и его осложнениями. Симптомы, связанные с туберкулезным процессом, более стертые и не выступают на первый план. Исключение составляют лишь больные с «разрушенным» легким, у которых туберкулезный процесс носит прогрессирующий характер, напоминая фиброзно-кавернозный туберкулез, что отмечал, в частности, А. Е. Рабухин. Основным отличием цирротического от фиброзно-кавернозного туберкулеза является диффузное развитие цирроза всего легкого за счет прорастания соединительной тканью, а при фиброзно-кавернозном процессе основное значение имеют проявления прогрессирующего туберкулеза в виде деструктивных изменений, диссеминации, перифокального воспаления вокруг каверны и др. Сходство целого ряда клинических проявлений цирротического и фиброзно-кавернозного туберкулеза действительно вызывает определенные затруднения в диагностике этих клинических форм. Цирротический туберкулез нужно отличать и от цирроза
270
легких нетуберкулезной этиологии. Эти трудности усугубляются
отсутствием возможности получить достоверную информацию о характере морфологических изменений в легких. О морфологиче
ских реакциях в клинике можно судить лишь по косвенным признакам с учетом клинического течения заболевания, рентгенологической картины и данных лабораторного исследования. В
частности, определенное значение имеют данные о массивности бактериовыделения, патогенности смешанной, вторичной флоры в
сопоставлении с титром антител в сыворотке крови.
Цирротический туберкулез является уже необратимым процессом, поэтому при выборе лечебной тактики руководствуются дан-
ными о распространенности морд
логических изменений, выражен
ности клинических проявлений и их опасности для здоровья и жизни бального. Лишь при ограниченном цирротическом туберкулезе без клинических проявлений или спорадических обострениях можно ограничиться медикаментозным и санаторным лечением. При всех остальных клинических вариантах требуются длительное, настойчивое лечение и решение вопроса о необходимости, а также воз
можности удаления патологических очагов хирургическим путем. Прогресс в области легочной хирургии дал возможность проводить операции даже при «разрушенном» легком. При двустороннем цирротическом туберкулезе, особенно с наличием хронического бронхита и эмфиземы, хирургическое лечение значительно ограничивается, так же как при возникновении таких явлений, как выраженная легочная и легочно-сердечная недостаточность, запущенный амилоидоз внутренних органов, различные тяжелые сопутствующие заболевания. Поэтому вопрос о хирургическом вмешательстве должен быть решен своевременно, до развития такого состояния, которое препятствует выполнению операции. Наряду с хирургическим вмешательством большое значение в лечении цирротического туберкулеза имеет медикаментозная терапия, направленная на ликвидацию разнообразных клинических проявлений болезни.
6.14. ТУБЕРКУЛЕЗНЫЙ ПЛЕВРИТ
Туберкулезный плеврит встречается как самостоятельная кли-
ническая форма, а также при очаговом, диссеминированном, инфильтративном туберкулезе легких, туберкулезе внутригрудных
лимфатических узлов и других проявлениях туберкулезной инфек-
ции. Сравнительно редко в настоящее время плеврит представляет
собой одно из проявлений системного поражения серозных оболочек
(полисерозит). Плеврит может возникать как осложнение искусственного пневмоторакса, спонтанный пневмоторакс у больного туберкулезом легких также может осложниться плевритом. В этом случае при наличии экссудата и воздуха в плевральной полости заболевание принято называть пневмоплевритом. В связи со значительным сокращением числа больных туберкулезом, которые лечатся
с помощью искусственного пневмоторакса, резко снизилась численность больных пневмоплевритом.
271
Воспалительная реакция плевры вызывается микобактериями туберкулеза, проникающими в организм лимфогенным или гематогенным путем. При этом большое значение имеет состояние гиперсенсибилизации плевры (В. А. Равич-Щербо, Ф. В. Шебанов, П. А. Теппер, А. С. Фомина). Чаще наблюдается костальный и междолевой плеврит, реже развивается наддиафрагмальный верхушечный парамедиасти-нальный плеврит. Туберкулезный плеврит чаще возникает у лиц молодого возраста. Анатомическая и функциональная связь между плевральными листками, лимфатическими узлами и лимфатической системой легких обусловливает частое поражение плевры с образованием выпота в плевральной полости у больных с различными формами туберкулеза легких и внутригрудных лимфатических узлов. Появление экссудата в плевральной полости может быть также обусловлено воспалительной реакцией в плевре, вызванной микобактериями, проникшими в плевру, с током лимфы из очагов или инфильтратов в легких, особенно при субплевральном их расположении. Микобактерии могут попасть в плевру гематогенным путем при наличии бактериемии. Па-томорфологические изменения в плевре характеризуются большим многообразием: обсеменение с образованием множественных бугорков, формирование более крупных очагов (одиночных или множественных), развитие казеозного некроза в образовавшихся очагах. При
всех указанных изменениях в плевре имеется выраженная экссудатив-
ная реакция, следствием которой является накопление экссудата в плевральной полости. Вид экссудата, количество содержащегося в нем белка и фибрина и клеточный состав зависят и определяются харак
тером морц
логических изменений в плевре. По внешнему виду раз-
личают следующие виды экссудата: фибринозный и серозно-фибри-
нозный, серозный, серозно-геморрагический и геморрагический серозно-гнойный, гнойный.
Фибринозный и серозно-фибринозный экссудат содержит большое количество фибрина, вследствие чего количество свободной жидкости в плевральной полости небольшое, экссудат быстро организуется и отлагается на плевральных листках в виде плевральных наслоений (шварт). Такой плеврит называют сухим, а при образовании обширных плевральных наслоений — пластическим (адгезивным) или панцирным. Самым частым вариантом туберкулезного плеврита является
экссудативный с наличием серозного или серозно-геморрагического (с примесью крови) выпота. Серозно-гнойный и гнойный экссудат характерен для гнойного туберкулезного плеврита (эмпиемы). Геморрагический выпот редко наблюдается при туберкулезном плеврите, он больше характерен для плеврита раковой этиологии. По клеточному составу экссудат может быть лимфоцитарным, когда в нем явно преобладают лимфоциты, эозинофильным — при наличии в клеточном составе 10—20% и более эозинофилов, нейтрофильным — если их число превышает 20% клеточного состава. При указанном клеточном составе экссудат обычно серозный, при большем количестве нейтрофилов экссудат становится серозно-гнойным и гнойным. В плевральном выпоте могут обнаруживаться микобактерии туберкулеза как
методом микроскопии, так и при посеве на питательные среды.
272
Лимфоцитарный по клеточному составу экссудат наблюдается при преимущественно экссудативном воспалении плевры без казеозных изменений, но нередко встречается и при обсеменении плевры или образовании отдельных очагов. Эозинофильный выпот отмечается у больных с резко выраженным гиперергическим типом воспаления плевры. Серозно-геморрагический и геморрагический экссудат при туберкулезном плеврите наблюдается при резко выра-
женном повышении проницаемости капилляров плевры и выхожде-
нии большого количества эритроцитов. Нейтрофильный экссудат
характерен для казеозно-некротической реакции. При обширных
казеозно-некротических изменениях экссудат становится серозногнойным и гнойным. Иногда при туберкулезном поражении плевры имеются холестериновые выпоты. Холестериновый экссудат — густой выпот желтого цвета с большим количеством холестерина в растворенном виде и в виде кристаллов. Он наблюдается у больных, у которых выпот в плевральной полости сохраняется в течение очень
длительного времени.
Диагностика туберкулезных плевритов основывается прежде всего на клинической картине заболевания, данных рентгенологического
и лабораторного исследований. Клиническая картина очень разно-
образна, что зависит от многих условий: возраста и общего состояния организма больного, степени сенсибилизации, наличия или отсут-
ствия других проявлений туберкулеза, характера морфологических
изменений в плевре, разновидности экссудата, его количества, локализации плеврита. Наряду с особенностями клинической картины, позволяющими выделить ряд клинических вариантов заболевания, имеются также симптомы, которые являются общими для всех или по крайней мере для большинства больных туберкулезным плеври
том.
Как правило, экссудативный плеврит характеризуется острым или подострым началом после короткого периода недомогания или без всяких предвестников. Температура тела достигает 38—39°С, появляются боли в боку, сухой кашель, тахикардия, постепенно развивается одышка. В начальном периоде при костальном плеврите может прослушиваться шум трения плевры, который затем исчезает по мере накопления экссудата. Появляется притупление перкуторного тона с верхней границей в виде параболической кривой (линия Эллиса—Дамуазо—Соколова). Между позвоночником и восходящей линией тупости определяется пространство с более ясным перкуторным звуком (треугольник Гарланда), на противоположной стороне также у позвоночника отмечается участок притупления (треугольник Раухфуса—Грокко). Дыхание при накоплении жидкости в плевральной полости становится ослабленным и при большом количестве экссудата может вовсе не выслушиваться.
В течение плеврита можно выделить 3 периода: 1) нарастание клинических проявлений болезни и накопления экссудата, 2) стабилизация, 3) резорбция выпота и исчезновение клинических проявлений. Длительность этих периодов зависит от клинического варианта плеврита и эффективности лечения. Чаще развивается ко-
273
стильный или междолевой плеврит, но возможны и другие локализации плеврита. Следует иметь в виду, что при более редких локализациях плеврита бывают симптомы, которые могут усложнить
диагностику.
При верхушечных плевритах в воспалительный и рубцовый процесс могут вовлекаться веточки шейно-симпатического сплетения и в результате может появиться триада Горнера (экзофтальм, сужение зрачка и глазной щели), при поражении плечевого сплетения могут возникнуть признаки плексита (В. А. Равич-Щербо, В. Н. Гольд-фельд). При парамедиастинальной локализации плеврита и развитии слипчивого медиастинита возможно вовлечение в спаечный процесс веточек блуждающего нерва с последующим развитием сердцебиений, нарушений моторной и секреторной функции желудка и даже возникновением язвы желудка (В. А. Равич-Щербо). При наддиаф
рагмальном плеврите иногда может появиться симптомокомплекс, симулирующий картину «острого живота».
Всестороннее изучение всех клинических проявлений заболевания — важное условие для правильной диагностики плеврита. В диагностике туберкулезного плеврита большое значение, кроме изучения клиники и данных физических методов, имеет рентгенологическое исследование. Данные этого исследования зависят от локализации плеврита, количества выпота, легочных изменений. Выявить наличие жидкости в плевральной полости можно при рентгенологическом или ультразвуковом исследовании. Решающее значение для постановки диагноза имеет плевральная пункция, позволяющая доказать наличие экссудата, исследовать его свойства и клеточный состав. Туберкулиновая реакция у больных туберкулезным плевритом положительная и резко положительная. По патогенезу экссудативного плеврита, характеру воспалительных изменений в плевре и в определенной степени в связи с особенностями клинических проявлений можно выделить три основных клинических варианта туберкулезного плеврита: аллергический, перифокальный и туберкулез плевры.
Аллергический плеврит возникает у больных с выраженной гиперергией, характеризуется острым началом с повышением до 38°С и более температуры тела, абортивным течением. Даже при отсутствии лечения специфическими препаратами повышенная температура тела удерживается в течение 10—15 дней. В этот период отмечается быстрое накопление экссудата, вследствие чего появляются тахикардия и одышка, отмечаются боли в боку, однако эти явления также сравнительно быстро уменьшаются, затем исчезают. Рассасывание экссудата может произойти в течение месяца и даже раньше. При накоплении большого количества жидкости в плевральной полости может быть и замедленная резорбция жидкости. Аллергический плеврит возникает у больных первичным туберкулезом при свежем заражении или хроническом течении первичной туберкулезной инфекции. Как правило, у таких лиц отмечается повышенная чувствительность к туберкулину, проявляющаяся выраженными туберкулиновыми реакциями. Поэтому правильнее счи
274
тать этот вариант плеврита гиперергическим. В крови нередко отмечаются эозинофилия, увеличение СОЭ. Экссудат серозный, на ранних этапах иногда серозно-геморрагический, иногда может быть эозинофильным, но чаще всего лимфоцитарный. Микобактерии в экссудате, как правило, не обнаруживаются.
Кроме экссудативного плеврита, при первичном туберкулезе могут отмечаться и другие проявления, связанные с гиперергической реактивностью: фликтены, узловатая эритема, полиартрит. Они могут предшествовать плевриту, появляться одновременно с ним или развиваться после рассасывания экссудата, спустя несколько дней или в более отдаленном периоде (Б. М. Хмельницкий, М. Г. Иванова и Б. М. Хмельницкий, А. Е. Рабухин). В прошлом такой плеврит
назывался идиопатическим, эссенциальным вследствие того, что туберкулезная этиология плеврита подвергалась сомнению и выдвигалась теория о «простудном» характере заболевания (А. Соколовский) .
Иногда аллергический плеврит возникает при поражении трахеобронхиальных лимфатических узлов или при первичном туберкулезном комплексе. В этих случаях клиническая картина определя
ется не только самим плевритом, но и другими проявлениями первичного туберкулеза, протекающего по осложненному типу. Естественно, в период появления плеврита картина заболевания в
значительной степени утяжеляется за счет симптомокомплекса, свя
занного с воспалением плевры и накоплением экссудата. По мере ликвидации плеврита, протекающего абортивно, состояние больных улучшается, в клинической картине болезни продолжают сохраняться клинико-рентгенологические признаки имеющегося туберкулезного процесса. У больных с малосимптомно протекавшим туберкулезом трахеобронхиальных лимфатических узлов экссудативный плеврит служит наиболее ярким клиническим проявлением болезни.
Перифокальный плеврит, как правило, является резуль
татом вовлечения в воспалительный процесс плевральных листков при наличии легочного туберкулеза — очагового, инфильтративного или даже кавернозного. Особо важным фактором, способствующим поражению плевры, служит субплевральное расположение легочного туберкулезного процесса. В. А. Равич-Щербо к перифокальному типу относит также плевриты с более затяжным течением, возникшие у больных туберкулезом трахеобронхиальных лимфатических узлов. Этот вариант плеврита характеризуется и преимущественно экссу
дативной воспалительной реакцией плевры.
В отличие от аллергического перифокальный плеврит протекает на фоне умеренной общей сенсибилизации, но при этом имеется «местная гиперергия» плевры, обусловливающая развитие плеврита. Характер экссудата у больных перифокальным плевритом может быть различным. У многих больных экссудат фибринозный и серозно-фибринозный. В этом случае накопление большого количества экссудата в плевральной полости не происходит. Плеврит протекает как слипчивый, пластический процесс с образованием плевральных
наслоений (шварт). Клинические проявления такого плеврита скуд
275
ные, отмечаются боли в груди, может определяться укорочение перкуторного тона или более выраженное притупление, может выслушиваться шум трения плевры. При рентгенологическом иссле
довании выявляются плевральные наслоения в соответствующем отделе плевральной полости. При плевральной пункции экссудат извлечь не удается, иногда может быть аспирировано небольшое количество серозной жидкости. Течение такого плеврита торпидное и длительное, у некоторых больных процесс может носить рецидивирующий характер.
Наряду с описанным течением перифокальный плеврит может протекать с накоплением экссудата. Клиническая картина заболевания характеризуется острым или подострым началом. Отмечается развитие симптомокомплекса, типичного для экссудативного плеврита, однако обращает на себя внимание более затяжное течение. Повышенная тем
пература тела, потливость, тахикардия и другие явления интоксикации удерживаются более длительное время, чем у больных аллергическим плевритом (3—4 нед и более). Экссудат в плевральной полости сохраняется в течение более длительного времени; несмотря на периодические аспирации, обычно прослеживается тенденция к его накоплению в плевральной полости. Экссудат серозный, в клеточном составе преобладают лимфоциты. Микобактерии, как правило, не выявляются. Период стабилизации процесса при сохранении экссудата в плевральной полости или его накоплении после эвакуации может продолжаться 4—6 нед с последующей резорбцией выпота и образованием плевральных наслоений. Последние могут длительно сохраняться, вызывать ограничение подвижности диафрагмы и формирование элементов фиброторакса в виде уменьшения объема грудной клетки, сужения межреберных промежутков, западения над- и подключичных ямок, перетяжки трахеи в пораженную сторону. Все это приводит к нарушению функции дыхания, выраженному обычно нерезко (умеренная одышка при физическом напряжении).
Следует иметь в виду, что у больных перифокальным плевритом одновременно имеется туберкулез органов дыхания. Выявить изменения в легких при наличии плеврита трудно. В таких случаях
рекомендуется рентгенологическое исследование органов дыхания производить немедленно после полной эвакуации жидкости. Если этого трудно добиться при однократной плевральной пункции с аспирацией экссудата, манипуляцию следует повторить на следующий день. При ограниченном легочном процессе, локализующемся субплеврально, в кортикальных отделах легкого, выявление экссу-
дата даже при тщательном рентгенологическом исследовании с при-
менением томографии может быть затруднительным.
Туберкулез плевры характеризуется следующими морфо-
логическими изменениями в плевре: 1) множественная диссеминация с образованием мелких очагов, иногда милиарного типа, 2) одиночные крупные очаги с элементами казеозного некроза, 3) обширная
казеозно-некротическая реакция. Наряду с указанными изменениями в плевре выражена экссудативная реакция, обусловливающая
накопление выпота.
276
Туберкулез плевры может быть единственным проявлением заболевания, но возможно и сочетание его с другими признаками туберкулеза и в первую очередь туберкулеза легких. Диссеминированный туберкулез гематогенного происхождения может сопровождаться экссудативным плевритом, возникшим в результате обсеменения. Туберкулезные очаги и каверна при прогрессирующем туберкулезном процессе и их субплевральном расположении могут прорваться в плевральную полость и вызвать казеозный некроз, сопровождающийся также экссудативной воспалительной реакцией плевры и накоплением выпота. Старые туберкулезные очаги на плевре, а также очаги, расположенные в кортикальных отделах легкого, при их реактивации обусловливают обширную воспалительную реакцию плевры и образование очагов с казеозным некрозом. Экссудат при туберкулезе плевры может быть серозным, лимфоцитарным при развитии плеврита вследствие обсеменения плевры и образования множественных мелких очагов. При казеозном некрозе отдельных крупных очагов экссудат также может быть серозным, но в клеточном составе преобладают нейтрофилы. При более распространенном казеозном поражении плевры экссудат становится серозно-гнойным, а при обширных поражениях —- гнойным. Следует подчеркнуть, что характер экссудата на разных этапах туберкулеза плевры может меняться. При частых аспирациях гнойный экссудат становится серозным нейтрофильным, иногда — геморрагическим при создании вакуума в плевральной полости, а при более редких эвакуациях жидкости или прекращении их на короткое время ранее отмечавшийся серозный нейтрофильный экссудат становится гнойным. В выпоте микобактерии туберкулеза иногда выявляются как методом микроскопии, так и при посеве экссудата.
При серозном нейтрофильном экссудате характерно длительное течение заболевания с упорным накоплением выпота. Заболевание, как правило, начинается остро или подостро, повышается температура тела, хотя у отдельных лиц возможно малосимптомное развитие болезни. Интоксикация проявляется также изменениями в составе крови: увеличивается СОЭ, появляются сдвиг нейтрофилов влево, лимфопения и иногда умеренный лейкоцитоз. Симптомы интоксикации у больных удерживаются долго, постепенно их интенсивность снижается, в процессе лечения они исчезают в среднем через 2—3 мес при «изолированном» плеврите. В случаях сочетания последнего с другими проявлениями туберкулеза длительность болезни определяется динамикой клинической формы.
Длительность накопления экссудата зависит от состояния плевральной полости: при сравнительно быстрой облитерации плевральной полости накопление жидкости прекращается, происходит ее постепенная резорбция, на плевре остаются наслоения за счет выпавшего из экссудата фибрина. При большем количестве накопившегося в плевральной полости экссудата и прогрессировании на плевре казеозного некроза возможно превращение серозного нейтрофильного выпота в гнойный.
Гнойный
плеврит (эмпиема) —
277
туберкулез плевры, сопровождающийся накоплением гнойного экс-
судата, представляет собой особую форму экссудативного плеврита.
Эта болезнь развивается при распространенном казеозном некрозе
плевры вследствие распада и прогрессирования крупных очагов на плевре или очагов, располагающихся субплеврально, при вовлечении плевры в воспалительный процесс при субплевральном рас
положении каверны.
Клиническая картина заболевания у большинства больных ха
рактеризуется тяжелой интоксикацией: температура тела достигает 38—39 °C и более, появляются ночные поты, снижается масса тела, развиваются бледность, слабость и тахикардия. Постепенно появляется одышка, могут быть сухой кашель, боли в боку. В крови отмечаются резко повышенная СОЭ (до 40—60 мм/ч), лимфопения,
нейтрофильный сдвиг влево, умеренный или даже высокий лейко
цитоз. Гнойный плеврит может протекать и без выраженной ин-
токсикации, т. е. характеризоваться «холодным» течением. Внимание больного и окружающих обращает на себя лишь усиливающаяся одышка* Появляются цианоз и тахикардия. Диагноз плеврита подтверждается данными физического исследования, а выявление гнойного экссудата возможно путем плевральной пункции и эвакуации жидкости. Если своевременно не сделать эвакуацию гнойного экссудата, могут быть осложнения — образование бронхоплеврального
или торакального свища.
При появлении бронхоплеврального свища возникает сообщение между плевральной полостью и бронхиальной системой, через бронх
в плевральную полость попадает воздух и плеврит превращается в пневмоплеврит. О наличии воздуха в плевральной полости можно
судить по характерной рентгенологической картине: легкое полностью или частично коллабируется, появляется горизонтальный уровень жидкости. При распространенных плевральных сращениях газовый пузырь за счет проникшего воздуха небольшой, обнаружить его трудно, особенно при выраженных плевральных наслоениях. Имеются клинические признаки появившегося бронхиального свища,
плевральный экссудат при кашле выделяется через рот, иногда экссудат с небольшой примесью крови. При эвакуации жидкости отсутствуют тянущие боли в боку, появление которых характерно в случае создания отрицательного давления в плевральной полости
при эвакуации экссудата. Если в плевральную полость ввести красящие или ароматические вещества, у больного появляется ощуще
ние их во рту, с кашлем выделяется окрашенный плевральный экссудат (Ф. В. Шебанов). При достаточно большом и постоянном сообщении плевральной полости с бронхом весь накопившийся экссудат может постепенно удаляться через рот при кашле, особенно в наиболее благоприятной для этого позе больного (постуральный
дренаж). Возможно инфицирование плевральной полости вторичной смешанной микрофлорой через бронхиальный свищ, что еще более отягощает клиническую картину болезни.
Гнойный туберкулезный плеврит может начаться из-за прорыва каверны в плевральную полость и образования бронхоплеврального
278
свища. В этом случае заболевание проявляется клиническими симптомами спонтанного пневмоторакса с признаками острой дыхательной недостаточности. Лишь через несколько дней у таких больных развертывается симптоматика гнойного плеврита, осложненного бронхоплевральным свищом.
При длительном сохранении гнойного экссудата в плевральной полости, если он не эвакуируется путем пункций или эвакуируется не полностью (что бывает при бронхоплевральном свище), специфический воспалительный процесс вызывает флегмонозную инфильтрацию клетчатки и межреберных мышц. В конечном счете образуется торакальный свищ (empyema necessitatis). У больных с хронической эмпиемой, особенно осложненной бронхиальным или торакальным свищом, необходимо тщательно исследовать внутренние органы (почки, печень, селезенку, кишечник), поскольку при длительном гнойном процессе может развиться амилоидоз. Лечение экссудативных плевритов имеет свои особенности. При любом клиническом варианте показано лечение противотуберкулезными препаратами, длительность химиотерапии должна быть не менее 9 мес, а при сочетании плеврита с другими проявлениям туберкулеза она может быть и больше.
При аллергическом и перифокальном плевритах, протекающих на фоне общей или местной гиперергии (особенно при выраженной экссудации и наличии различных клинических проявлений гиперергии, плохой переносимости химиопрепаратов), показано также лечение кортикостероидами. Чаще применяют сравнительно короткий курс терапии преднизолоном. Включение в комплекс химиотерапии кортикостероидов у многих больных позволяет добиться редукции экссудативной фазы воспаления, вследствие чего прекраща
ется дальнейшее накопление экссудата и наступает его постепенное рассасывание. Длительность лечения составляет не менее 6 мес.
При накоплении большого количества жидкости рекомендуется эвакуация, при дальнейшем накоплении аспирацию выпота следует повторять. Решение вопроса об эвакуации жидкости затягивать не
следует, так как при длительном сохранении выпота в плевральной полости на плевре образуются плевральные наслоения, которые в
последующем рассасываются очень медленно и формируют сращения, ограничивающие подвижность диафрагмы.
При туберкулезе плевры, особенно при накоплении серозного
неит
ильного или гнойного экссудата
помимо химиотерапии,
основным методом лечения являются повторные аспирации экссудата с созданием отрицательного давления в плевральной полости для быстрейшего расправления легкого и облитерации плевральных листков. При гнойном выпоте аспирации должны производиться ежедневно (Б. М. Городецкий). При систематических аспирациях гнойный экссудат постепенно превращается в серозный и геморрагический. Аспирации необходимо продолжать до полного расправления легкого и облитерации плевральной полости. Однако далеко не у всех больных эмпиема ликвидируется под влиянием систематических аспираций, особенно при наличии бронхоплеврального свища. При
279
наличии такого свища создать отрицательное давление в плевральной полости невозможно, поэтому обычно у таких больных легкое не расправляется, нужно хирургическое вмешательство.
6.15. ТУБЕРКУЛЕЗ ГОРТАНИ, ТРАХЕИ И БРОНХОВ
Все проявления, относящиеся к этой клинической форме, чаще встречаются как осложнения туберкулеза легких или гематогенного диссеминированного процесса внелегочной локализации, развивающегося при наличии туберкулезных изменений в легких или во внутригрудных лимфатических узлах. Вместе с тем у ряда больных поражение гортани, трахеи и бронхов может быть единственным проявлением активного туберкулеза, тогда как изменения в других органах не определяются или зажили и могут быть выявлены как остаточные (фиброзно-очаговые изменения в легких, петрификаты в легком и внутригрудных лимфатических узлах, плевральные наложения и др.).
Туберкулез гортани проявляется изменением голоса, болями при глотании, затрудненным дыханием при выраженной экссудативной реакции. Ведущий метод диагностики — ларингоскопия, а в необходимых случаях — биопсия. Различают инфильтративную, продуктивную и язвенную формы. Поражаются истинные голосовые связки, межчерпаловидное пространство, ложные голосовые связки, надгортанник, черпаловидные хрящи. При цитологическом исследовании биоптата могут быть обнаружены эпителиоидные, гигантские клетки и другие элементы туберкулезного воспаления, в том числе казеозные.
Туберкулез трахеи встречается редко, наблюдается у больных фиброзно-кавернозным и цирротическим туберкулезом легких. Возможно поражение трахеи при туберкулезе паратрахеальных лимфатических узлов в случае распространения процесса на стенку трахеи. В клинической картине заболевания ведущим симптомом является кашель, который может быть сильным, иногда «лающим». У большинства больных фиброзно-кавернозным и цирротическим туберкулезом имеется постоянный или периодический кашель, поэтому туберкулезное поражение трахеи может быть выявлено и объективно доказано с помощью бронхоскопии, которая позволяет также выделить инфильтративную, продуктивную и изредка свищевую форму. Последняя может привести к тяжелому осложнению — трахеопищеводному свищу с постоянной аспирацией пищи; реже встречается обильное кровотечение при разрушении крупного кровеносного сосуда.
Туберкулез бронхов встречается более часто при туберкулезе внутригрудных лимфатических узлов, а также при любой форме легочного туберкулеза, чаще при инфильтративном, кавернозном и фиброзно-кавернозном туберкулезе. Клинические проявления не позволяют выявить туберкулез бронхов, хотя при отсутствии легочного процесса определенное диагностическое значение имеют такие симптомы, как кашель, выделение небольшого коли
280
чества мокроты, кровохарканье, выявление в мокроте микобактерий туберкулеза. Осложнения в виде гипопневматоза или ателектаза, возникших в результате бронхиальной проходимости, проявляются четкими рентгенологическими изменениями. Решающее значение для постановки диагноза имеет бронхологическое исследование, которое не только выявляет туберкулез бронхов, но и позволяет установить характер имеющихся изменений: инфильтративный, продуктивный, язвенный эндобронхит со свищом или без него.
Лечение всех проявлений туберкулеза верхних дыхательных путей заключается в длительной химиотерапии, в том числе с применением аэрозольного метода введения химиопрепаратов. Отдельным больным проводят местное лечение — прижигания при продуктивном процессе, который не поддается химиотерапии.
6.16. ТУБЕРКУЛЕЗ ОРГАНОВ ДЫХАНИЯ, КОМБИНИРОВАННЫЙ С ПЫЛЕВЫМИ ПРОФЕССИОНАЛЬНЫМИ ЗАБОЛЕВАНИЯМИ ЛЕГКИХ
Пылевые npocf
ессиональные заболевания легких силикоз,
алю-
миноз, асбестоз и другие могут комбинироваться с любой клинической формой туберкулеза. Наиболее часто встречаются очаговый, диссеминированный туберкулез легких, туберкулема. При несвоевременной диагностике туберкулез может прогрессировать, в результате чего может образоваться каверна и возникнуть кавернозный, а в последующем фиброзно-кавернозный туберкулез. Образованию каверны предшествует фаза распада.
Клиническая картина заболевания зависит от стадии пневмоко
ниоза и клинической формы туберкулеза. Ведущим симптомом, особенно при выраженной эмфиземе и пневмосклерозе, являются
одышка и другие проявления дыхательной недостаточности. Могут быть кашель и выделение мокроты при наличии бронхоэктазов или деструктивного туберкулезного процесса. При рентгенологическом исследовании выявить туберкулезные очаги на фоне изменений
пневмокониотического происхождения трудно, поскольку на рентгенограмме они одинаковы. Имеется также сходство рентгенологических проявлений туберкулемы и силикомы (т. е. конгломерата силикотических узелков), а также туберкулезной каверны и распавшейся силикомы. Вместе с тем определенное значение для диагноза имеет локализация рентгенологических изменений: туберкулезные очаги располагаются главным образом в верхних отделах легких, а пневмокониотические очаги — в средних и нижних отделах. Для туберкулеза более характерно наличие инфильтративных изменений в виде круглой тени с размытыми контурами, «облаковидного» инфильтрата, перисциссурита и лобита. Для туберкулезной
каверны характерна перикавернозная воспалительная реакция.
Главным отличительным признаком туберкулезных изменений является их инволюция под влиянием химиотерапии. Поэтому при подозрении на туберкулез у больных пневмокониозом и при отсутствии четких диагностических признаков назначают противотуберкулезные препараты, чаще изониазид и этамбутол. Лечение про
281
должается 4—6 мес под ежемесячным рентгенологическим контролем, который помогает установить наличие или отсутствие динамики рентгенологических изменений. Важный диагностический признак туберкулеза — выявление микобактерий туберкулеза в мокроте или промывных водах бронхов и материале, полученном при бронхологическом исследовании. При этом должны использоваться микроскопический метод и обязательно посев материала на питательные среды. При отрицательных результатах установить диагноз помогают внутрилегочная биопсия и последующее цитологическое исследование биоптата. В пользу туберкулеза свидетельствуют обнаружение эпителиоидных клеток, других элементов туберкулезной гранулемы и казеозный некроз. Лечат больных противотуберкулезными препаратами в соответствии с общими принципами химиотерапии туберкулеза. Больные наблюдаются в противотуберкулезных диспансерах по установленным правилам для бальных туберкулезом.
ГЛАВА 7
ОСОБЕННОСТИ ТЕЧЕНИЯ ТУБЕРКУЛЕЗА ОРГАНОВ ДЫХАНИЯ У БОЛЬНЫХ СТАРШИХ ВОЗРАСТНЫХ ГРУПП
И С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
7.1. ТУБЕРКУЛЕЗ У ЛИЦ ПОЖИЛОГО И СТАРЧЕСКОГО ВОЗРАСТА
В соответствии с современной классификацией возрастных групп населения пожилым считают возраст от 65 до 75 лет, старческим — от 75 до 85, лиц старше 85 лет называют долгожителями. Результаты анализа заболеваемости туберкулезом свидетельствуют о том, что туберкулез может развиться в любом возрасте. В экономически развитых странах, в том числе в нашей стране, туберкулезом нередко заболевают лица пожилого и старческого возраста. Этому способствует ряд биологических и социальных факторов, из которых прежде всего необходимо отметить высокий уровень инфицированное™ туберкулезом лиц, относящихся к этим возрастным группам, вследствие перенесенной в детском или юношеском возрасте туберкулезной инфекции.
У многих из перенесших первичную туберкулезную инфекцию или обострение туберкулезного процесса в последующем выявляют остаточные изменения в виде очагов более выраженной диссеминации, кальцинатов в лимфатических узлах средостения, обызвествления плевры и плевральных шварт. В этих остаточных очагах, как известно, сохраняется персистирующий возбудитель туберкулеза, который при начавшейся репликации может вызвать реактивацию туберкулеза. У лиц пожилого и старческого возраста возникновению реактивации могут способствовать процессы возрастной инволюции (плюригландулярная эндокринная недостаточность, приводящая к снижению интенсивности самообновления белков, ослаблению контроля за синтезом белка, в частности ДНК и РНК, и другие процессы, в том числе иммунодефицитных состояний), сопутствующие заболевания, социально-психологическая дезадаптация вследствие изменения условий жизни и семейного уклада и т. д. Как и у лиц более молодого возраста, у них в результате реактивации может развиться очаговый, инфильтративный туберкулез легких с последующим прогрессированием или регрессией в зависимости от характера течения болезни, своевременности ее выявления и лечения.
Вместе с тем у лиц пожилого и старческого возраста может произойти реактивация туберкулезного процесса в лимфатических узлах, как периферических, так и расположенных в средостении. Такой тип реактивации развивается преимущественно у лиц, у которых имеются массивные или множественные петрификаты, определенное значение придают также процессам деминерализации, в частности рассасыванию солей кальция. В этих случаях туберкулезный процесс развивается по типу первичного туберкулеза: образуется казеозный некроз в ткани лимфатических узлов, появля-
283
юге я фистулезные формы эндобронхита с последующим развитием воспалительной реакции в легочной ткани и поражением серозных оболочек. У таких больных нередко отмечается увеличение периферических лимфатических узлов, казеозный некроз в ткани которых может привести к образованию свищей и специфическому поражению кожи. Гораздо опаснее для жизни больного ситуация, когда разжижаются казеозные массы в лимфатических узлах средостения, так как в этом случае может произойти их прорыв в средостение, в результате чего возникают медиастинит и перикардит, в пищевод с образованием бронхопищеводного свища и даже в аорту с последующим смертельным кровотечением. При таком течении заболевания с признаками первичного туберкулеза могут отмечаться выраженные кожные реакции на туберкулин, но возможно также угнетение туберкулиновых реакций, особенно при тяжелом течении болезни.
У лиц пожилого и старческого возраста клинические проявления туберкулеза могут быть выражены в различной степени. Схематично можно выделить два основных варианта течения заболевания:
1) с выраженными проявлениями общей интоксикации, кашлем с выделением мокроты, иногда кровохарканьем, болевыми ощущениями в груди;
2) со скудными клиническими проявлениями у больных с малыми формами туберкулеза и даже прогрессирующим туберкулезным процессом, чаще всего сочетающимся в таких случаях с другими заболеваниями, характеризующимися довольно выраженной клинической картиной.
Следует подчеркнуть, что при обоих вариантах возможны диагностические ошибки, обусловленные прежде всего неправильным представлением о том, что туберкулез у лиц пожилого и старческого возраста встречается редко.
При диагностике туберкулеза у лиц пожилого и старческого возраста так же, как и у молодых людей, могут быть применены два организационных подхода: активное выявление путем проведения флюорографии лиц, находящихся в домах для престарелых, инвалидов, ветеранов труда и т. д., и клиническое обследование лиц, обратившихся за медицинской помощью; если больные обращаются в поликлинику, в которой имеется флюорограф, то до клинического обследования может быть проведена флюорография.
Флюорография позволяет выявить локальные изменения в легких у лиц, заболевших туберкулезом, что дает возможность провести углубленное исследование с целью установления этиологии заболевания. Наиболее простой метод уточнения этиологии — микроскопическое исследование мокроты для выявления в ней микобактерий туберкулеза. Если при этом возбудители туберкулеза не обнаружены, то производят посев мокроты для определения роста культуры микобактерий.
Как известно, микобактерии туберкулеза обнаруживают не у всех больных туберкулезом, особенно в отсутствие деструктивного процесса в легких. В этих случаях нередко приходится применять
284
бронхологические методы с последующим исследованием бронхоаль-веолярных смывов или биоптата, а также бактериологические методы для выявления микобактерий туберкулеза и гистологическое исследование материала, полученного при биопсии легкого. К сожалению, не у всех больных, у которых имеются локальные изменения в легких, можно применить эти методы. У лиц с высоким артериальным давлением, перенесших инфаркт миокарда и инсульт, больных,
у которых отмечаются аритмии разного происхождения, чаще воз-
никающие вследствие атеросклероза коронарных сосудов с признаками ишемической болезни сердца, трудно применять инвазивные
методы исследования, в том числе бронхологические, а некоторым
из названных выше больных они противопоказаны. В таких случаях диагностику туберкулеза проводят по совокупности косвенных признаков и путем исключения других заболеваний легких, в том числе
методом ex juvantibus, т. е. в процессе пробного лечения.
Клинические проявления заболевания зависят от формы туберкулеза. Нередко в клинической картине заболевания, помимо симптомов, обусловленных той или иной формой туберкулеза, наблюдаются объективные проявления заболеваний, сочетающихся с туберкулезом. В связи с этим в диагностике туберкулеза важное
значение имеют результаты комплексного рентгенологического исследования (томограммы, боковые рентгенограммы, зонограммы и др.). В сочетании с положительной туберкулиновой реакцией и признаками инволюции локальных изменений в процессе противотуберкулезной химиотерапии анализ динамики состояния больного позволяет подтвердить диагноз туберкулеза.
Лечение больных туберкулезом пожилого и старческого возраста проводят в соответствии с общими принципами лечения всех больных туберкулезом. Основную роль играет химиотерапия, при этом следует иметь в виду, что у лиц, относящихся к этим возрастным группам, нередко отмечается плохая переносимость противотуберкулезных препаратов. В связи с этим следует применять минимальные терапевтические дозы химиопрепаратов, а также различные прерывистые режимы химиотерапии (через день, 2 раза в неделю и др.). Наряду с химиотерапией при лечении бальных пожилого и старческого возраста часто приходится ис
пользовать различные патогенетические средства: витамины, в небольших дозах кортикостероидные препараты, анаболические средства, иммуномодуляторы. При своевременно начатом лечении, особенно больных с начальными проявлениями туберкулеза, можно получить выраженный терапевтический эффект: закрытие каверны, рассасывание очагов воспаления, стойкое прекращение выделения микобактерий туберкулеза.
Применение хирургических методов лечения в принципе возможно, но при этом требуется индивидуальный подход к решению вопроса о необходимости операции. Так, сопутствующие заболевания, функциональное состояние различных органов и систем могут послужить причинами отказа от операции из-за ее большого риска.
285
7.2. ТУБЕРКУЛЕЗ И САХАРНЫЙ ДИАБЕТ
При сочетании туберкулеза и сахарного диабета часто резко ухудшается течение этих заболеваний. Результаты эпидемиологических исследований показывают, что сочетание туберкулеза и диабета и в настоящее время нередко приводит к прогрессированию заболевания, которое заканчивается смертью больного. По данным С. И. Ковалевой (1975), среднегодовая смертность больных туберкулезом и диабетом в Москве превышала смертность от туберкулеза в 8,8 раза.
Результаты анализа причин тяжелого и нередко прогрессирующего течения туберкулеза у больных сахарным диабетом свидетельствуют о том, что, помимо отрицательного влияния диабета на течение туберкулеза, большое значение имеют нарушения режима и ошибки в лечении больных с нераспознанным заболеванием. Отрицательное влияние диабета, в частности, может быть компенси-
ровано правильным режимом и лечением, если у больного еще не развились необратимые изменения. В связи с этим в программах
снованной медицинской помощи таким боль-
организации научно
£•3
ным основное место занимают мероприятия, проводимые с целью раннего выявления и лечения как диабета, так и туберкулеза.
В зависимости от времени возникновения туберкулеза и диабета больные могут быть разделены на три группы:
1) оба заболевания обнаруживают одновременно или в течение очень короткого периода времени с интервалом в 1—2 мес;
2) туберкулез выявляют у больных диабетом, протекающим как в тяжелой, так и в легкой форме;
3) у больных туберкулезом диагностируют сахарный диабет разной степени тяжести, в том числе так называемые нарушения толерантности к глюкозе и «асимптоматический» диабет.
Туберкулез и сахарный диабет одновременно выявлены у 25— 27% больных с сочетанием этих болезней. Наиболее часто сочетанные заболевания диагностировали одновременно при сравнительно небольшой продолжительности диабета — не более I года. С увеличением длительности заболевания диабетом число таких больных заметно уменьшалось. При большой длительности диабета туберкулез развивался у больных при наличии нарушений углеводного обмена, т. е. некомпенсированном сахарном диабете.
Установлено, что заболеваемость туберкулезом больных с тяжелой, средней тяжести и легкой формами сахарного диабета составляла 5,6, 2 и 0,9%, что превышало заболеваемость туберкулезом всего населения Москвы в 13, 5,2 и 2 раза соответственно. Таким образом, результаты эпидемиологических исследований, проведенных С. И. Ковалевой, свидетельствуют о большом риске развития туберкулеза у больных некомпенсированным сахарным диабетом.
Возникновение туберкулеза может быть связано со свежим заражением (суперинфекция) или реактивацией старых туберкулезных очагов, сохраняющихся после первичного заражения в детстве или юношеские годы. Развитие туберкулеза в результате свежего
286
заражения, или суперинфекции, может быть доказано при изучении заболеваемости туберкулезом в условиях внутрисемейного контакта. Заболеваемость туберкулезом среди больных диабетом в 7,1 раза
выше при установленном внутрисемейном контакте, чем вне его.
Роль старых туберкулезных очагов в реактивации туберкулеза была доказана Б. М. Хмельницким и М. Г. Ивановой, а у больных сахарным диабетом — Л. И. Вильнянским еще в 1966 г. При обследовании 600 больных диабетом в Харькове у 48,8% из них были обнаружены элементы зажившего первичного комплекса, преимущественно в виде прикорневых лимфатических узлов, у 16,5% — плотные и обызвествленные очаги различных размеров и только у 25,4% остаточных изменений, свидетельствующих о ранее перенесенном туберкулезе, не было.
До настоящего времени у значительного числа больных сахарным диабетом, особенно старше 50 лет, отмечаются рентгенологически
определяемые остаточные изменения, обусловленные ранее перенесенным туберкулезом. Успехи, достигнутые в лечении диабета, а
также проведение противотуберкулезных профилактических мероп
риятий, главным образом химиопрофилактики, позволили снизить
заболеваемость туберкулезом среди больных сахарным диабетом. Вместе с тем отмечается увеличение числа больных сахарным диабетом, в том числе асимптоматическим и латентным, среди больных
туберкулезом. Темпы роста заболеваемости диабетом среди больных туберкулезом были в 5 раз выше, чем среди населения в целом.
Среди больных туберкулезом отмечается большое число лиц с нарушением углеводного обмена и скрытой инсулярной недостаточностью поджелудочной железы. Нарушенная толерантность к глюкозе нами совместно с И. А. Кольцовой (1974) была обнаружена у 62% больных туберкулезом, в том числе у 17% установлен асим-птоматический сахарный диабет. Частота выявления этой формы сахарного диабета зависит от тяжести и распространенности тубер
кулезного процесса, наличия или отсутствия прогрессирующих деструктивных изменений с образованием каверны. Наиболее часто нарушения углеводного обмена и асимптоматический сахарный диабет диагностировали у больных фиброзно-кавернозным, распространенным инфильтративным и диссеминированным туберкулезом легких с наличием сформировавшейся каверны. Асимптоматический диабет чаще всего выявляли в течение первых месяцев после возникновения туберкулеза, тогда как на последующих этапах по мере угасания туберкулезного процесса частота его обнаружения уменьшалась.
Течение болезни у больных туберкулезом и сахарным диабетом характеризуется некоторыми особенностями, наиболее значимым из которых является прогрессирующее течение с выраженными инфильтративными изменениями в легких и быстрым образованием деструкции.
У больных инсулинзависимым диабетом, особенно при его тяжелом течении, чаще всего возникает инфильтративный туберкулез, характеризующийся обширной экссудативной воспалительной реак-
287
цией и быстрым развитием казеозного некроза с последующим быстрым образованием больших каверн. У некоторых больных наблюдается очень тяжелое течение туберкулеза по типу казеозной и инфильтративно казеозной пневмонии.
Лечение больных при сочетании туберкулеза и диабета — очень трудная задача и как с точки зрения компенсации сахарного диабета, течение которого, как правило, становится более тяжелым при наличии туберкулеза, так и с точки зрения лечения туберкулеза химиотерапевтическими препаратами. Нередко у таких больных с большим трудом удается добиться компенсации диабета и снижения уровня сахара в крови, у них нередко развивается гипогликемия при увеличении дозы средств, уменьшающих содержание сахара в крови. Применение комбинированной противотуберкулезной терапии затруднено из-за наличия различных осложнений и нарушений функции печени.
Клинические проявления туберкулеза у больных сахарным диабетом многообразны и в значительной степени зависят от формы и тяжести диабета. У больных инсулиннезависимым диабетом, прежде всего при легкой форме и течении средней тяжести, как правило, наблюдаются более ограниченные формы туберкулеза (инфильтраты небольших размеров, туберкулемы и очаговые изменения) без распада или с наличием ограниченных деструктивных изменений.
Характер туберкулезных изменений, естественно, в большой мере зависит от своевременности диагностики туберкулеза. При раннем выявлении заболевания, на начальном этапе развития, оно характеризуется относительно ограниченным поражением. При поздней диагностике и, следовательно, значительной длительности туберкулеза изменения могут быть более выраженными — в виде уже сформировавшихся каверн, иногда с бронхогенной диссеминацией и перифокальным воспалением вокруг них.
Современные методы бактериологической диагностики (микроскопия мокроты, посев ее на питательные среды), исследование бронхоальвеолярных аспиратов и смывов, как правило, позволяют обнаружить микобактерии туберкулеза, особенно при наличии деструктивных изменений. У тех больных, у которых с помощью этих методов микобактерии туберкулеза обнаружить не удается, выполнять диагностическую бронхоскопию, цитологическое и гистологическое исследования биоптата, результаты которых достоверно подтверждают диагноз туберкулеза.
У 30—40% впервые выявленных больных туберкулезом и диабетом не удается диагностировать туберкулез на основании данных, полученных при бактериологическом, цитологическом и гистологическом исследованиях. У таких больных диагноз туберкулеза устанавливают по результатам клинико-рентгенологического исследования, причем нередко требуется довольно длительное наблюдение за больными в процессе этиотропного лечения. Наиболее перспективный метод выявления туберкулеза у таких больных — иммунологическое исследование, направленное на обнаружение специфических противотуберкулезных антител или антигенов в сыворотке 288
крови. В настоящее время в нашей стране и за рубежом проводят разработку подобных методов, в том числе с использованием им-
муноферментного анализа.
Необходимость разработки современных методов диагностики туберкулеза обусловлена сходством клинико-рентгенологических проявлений легочного туберкулеза и других заболеваний легких, в связи
с чем нередко требуется проведение дифференциальной диагностики.
Кроме признаков туберкулеза, в симптомокомплексе, обнаруженном у больного, иногда отмечаются явления, обусловленные присоединившейся смешанной инфекцией. При интоксикации у некоторых больных отмечаются выраженные симптомы декомпенси-
рованного диабета (слабость, похудание, жажда, сухость во рту и др.), которые доминируют в клинической картине болезни.
Следует подчеркнуть, что клиническая картина сочетанного заболевания может определяться наличием осложнений сахарного диабета, из которых клинически чаще всего проявляются поражения сосудов нижних конечностей (диабетический артериит), ретинопатия, нефропатия, остеоартропатия. При тяжелом течении диабета мы наблюдали также гепатомегалию, которая не столько влияет на клиническое течение заболевания, сколько в значительной степени
затрудняет проведение химиотерапии противотуберкулезными антибактериальными препаратами, особенно дающими побочный ге-патотропный эффект.
В связи с наличием сложного комплекса патологических проявлений у больных туберкулезом и сахарным диабетом лечение их должно быть многоплановым. При тяжелом или средней тяжести течении диабета необходимо применять антидиабетические препараты, прежде всего инсулин, для компенсации состояния больного и снижения уровня сахара в крови. Одновременно проводят противотуберкулезную терапию, в первую очередь химиотерапию.
В настоящее время доказано, что для проведения химиотерапии у больных туберкулезом и диабетом предпочтительны наиболее эффективные химиотерапевтические противотуберкулезные препараты: изониазид, рифампицин, этамбутол и др.
При лечении больных, у которых сочетаются диабет и туберкулез,
кроме химиопрепаратов, как правило, применяют другие медикаментозные средства патогенетического воздействия, чаще всего иммуностимуляторы (левамизол, нуклеинат натрия и тактивин) и антиоксиданты (а-токоферол, тиосульфат натрия и др.). При легком и средней тяжести течении диабета можно использовать кортикостероиды при условии проведения контроля за уровнем сахара в крови и увеличении дозы антидиабетических средств в тех случаях, когда под влиянием кортикостероидов увеличивается выраженность
гипергликемии.
При замедленной регрессии туберкулезного процесса можно применять различные стимуляторы, предпочтительнее немедикаментозные: ультразвук, индуктотерапию, лазерную терапию, в соответствии с выработанными показаниями к применению этих методов, дополняющих противотуберкулезную терапию.
10—1213
289
Большим достижением последних лет в лечении больных диабетом и туберкулезом является разработка лечебной тактики, позволяющей в случае необходимости проводить хирургическое лечение туберкулеза. Из 1 23 больных диабетом и туберкулезом, леченных в Центральном научно-исследовательском институте туберкулеза РФ, различные операции были произведены 41. Летальность в связи с операцией составила 3,7 % (3 больных), ухудшение течения туберкулеза после операции наступило у 2 больных, у остальных получен клинический эффект [Назаров Ч., 1989]. Важными методами подготовки больных к операции стали гемосорбция и плазмаферез, позволяющие не только добиться улучшения течения диабета, но также уменьшить побочное действие химиопрепаратов, устранить явления туберкулезной интоксикации и лекарственной сенсибилизации.
В целом эффективность лечения туберкулеза у больных диабетом значительно ниже, чем у больных без него. Как отмечалось выше, у части больных туберкулезом и диабетом даже при благоприятных результатах лечения формируются выраженные остаточные изменения типа туберкулем, что обусловливает высокий риск рецидива туберкулеза. В связи с этим при лечении больных диабетом, у которых велика вероятность развития туберкулеза (тяжелые формы, наличие остаточных туберкулезных изменений, высокая чувствительность к туберкулину, контакт с заразным больным туберкулезом и др.), а также больных туберкулезом, у которых нарушена толерантность к глюкозе, необходимо применять меры, позволяющие предотвратить возникновение туберкулеза, в частности провести
химиопрофилактику и санаторное лечение, а главное — тщательный
контроль за течением диабета и выраженностью нарушений толе
рантности к глюкозе.
7.3. ТУБЕРКУЛЕЗ И НЕСПЕЦИФИЧЕСКИЕ ЗАБОЛЕВАНИЯ
ЛЕГКИХ
Сочетание туберкулеза и неспецифических заболеваний легких (НЗЛ) в клинической практике встречается довольно часто. После излечения туберкулеза легких могут остаться бронхоэктазы, в результате чего развивается бронхоэктатическая болезнь с периодически возникающими обострениями по типу рецидивирующей пневмонии с острым течением, а иногда хроническим воспалительным процессом. Возникновение неспецифического воспалительного процесса связано с нарушениями проходимости бронхов, мукоцилиарного клиренса, а также наличием в содержимом бронхов различной условно-патогенной флоры.
У большинства больных, у которых удалось добиться стойкого излечения туберкулеза, такое заболевание развивается в результате размножения микробной флоры и протекает со всеми признаками пневмонии (повышение температуры тела, иногда озноб, ночной пот, кашель с выделением мокроты). В легких соответственно развившемуся воспалительному процессу выслушиваются сухие и влажные хрипы, рентгенологически выявляется затемнение.
290
Основной метод выявления пневмонического процесса — бактериологическое исследование мокроты путем посева ее на питательные среды. У некоторых больных вследствие реактивации остаточных изменений после излечения туберкулеза в виде очагов более крупных фокусов — индуратов, а также туберкулем развивается рецидивный туберкулезный процесс с формированием какой-либо клинической формы туберкулеза. В этих случаях имеет место сочетание туберкулеза и неспецифического воспалительного заболевания легких.
Лица с выраженными метатуберкулезными изменениями находятся под наблюдением в противотуберкулезном диспансере по VII группе учета, но при выявлении не только НЗЛ, но и рецидивного туберкулеза их переводят в I группу диспансерного учета.
Следует подчеркнуть, что рецидивный туберкулез, как правило, протекает более тяжело, чем впервые выявленный туберкулезный процесс, и лечение его менее эффективно (А. Е. Рабу-хин, А. Г. Хоменко, В. В. Поспелов). При сочетании рецидивного туберкулеза с НЗЛ отмечаются выраженные клинические проявления обоих заболеваний.
Более редкими являются случаи развития свежего туберкулезного процесса у больных затяжной пневмонией и с бронхоэктазами. Прогноз у таких больных более благоприятный, так как впервые развившийся туберкулез лучше поддается лечению противотуберкулезными препаратами, чем рецидивный.
Весьма близка по характеру изменений в легких к описанной выше группе больных с впервые выявленным туберкулезом при наличии кистозной гипоплазии и эмфиземы легких. Диагноз при таком сочетании обычно удается установить лишь при наблюдении за больными в динамике в процессе лечения. Таким больным, как правило, устанавливают диагноз фиброзно-кавернозного или цирротического туберкулеза, и только динамическое наблюдение позволяет уточнить характер заболевания и доказать, что кистозные изменения и эмфизема не связаны с запущенным туберкулезным процессом.
В последние годы получены данные об обнаружении с помощью специальной аппаратуры у впервые выявленных больных с различными формами туберкулеза легких признаков хронической обструктивной бронхопатии без выраженных клинических проявлений. По-видимому, в определенных условиях у этих больных могут появляться и клинические симптомы бронхиальной обструкции, что подтверждается сообщениями ряда авторов о наблюдавшихся ими больных туберкулезом с явлениями обструктивного бронхита или даже бронхиальной астмы. До настоящего времени не установлено, имеется ли у этих больных патогенетическая связь между туберкулезом и бронхиальной обструкцией или у них наблюдаются два независимых друг от друга заболевания.
Особую группу составляют больные хроническим первичным туберкулезом, у которых возникают приступы бронхиальной астмы. Некоторые авторы полагали, что приступы бронхиальной астмы связаны со специфическим медиастинитом, развивающимся вслед-10*
291
ствие хронического туберкулезного процесса в лимфатических узлах
средостения (Б. М. Хмельницкий, В. А. Равич-Ще
и др.). На этом
со
основании таким больным с целью лечения проводили туберкули-нотерапию с определенным клиническим эффектом (Б. 3. Букина). У некоторых больных удавалось добиться стойкого прекращения приступов бронхиальной астмы после удаления хирургическим путем казеозных лимфатических узлов в средостении и участков легкого с наличием туберкулезных очагов или даже каверны (Л. К. Богуш).
У больных бронхиальной астмой, длительно получающих кортикостероиды, иногда развивается «стероидный» туберкулез, уже давно описанный в литературе (А. Е. Рабухин).
В последние годы все чаще приходится наблюдать больных с
альвеолитами эндогенного (идиопатического) и экзогенного происхождения, системными заболеваниями, в частности коллагенозами
(дерматомиозит, ревматоидный артрит, склеродермия, красная волчанка и др.), хроническим активным гепатитом, т. е. заболеваниями, при которых многим больным проводят лечение кортикостероидными препаратами, в результате чего у них развивается стероидный туберкулез. Если в период появления первых сведений о стероидном туберкулезе таких больных было немного, то по мере увеличения количества заболеваний, при которых длительно применяют корти
костероиды, число их увеличилось.
Легочный туберкулез описан у больных, которым была произведена пересадка почки, и у лиц с различными иммунодефицитными состояниями. Несомненно, для установления правильного диагноза у таких больных необходимо применить разнообразные методы об-
следования, используемые в специализированных диагностических отделениях, а также особую терапевтическую тактику, направленную на лечение туберкулеза и сочетающегося с ним заболевания. В случае возникновения пневмонии необходимо лечение антибио-
тиками широкого спектра действия с учетом чувствительности к
ним микробной флоры. Большое значение имеют также лечебный
лаваж бронхов и эндобронхиальное введение лекарственных средств.
Если выявлена грибковая флора (кандиды, аспергиллы и др.), то хороший эффект дают противогрибковые препараты: амфоглюкамин, амфотерицин В, низорал и др. После излечения туберкулеза рекомендуется проведение превентивной противотуберкулезной терапии изониазидом в течение 3 мес. При сочетании туберкулеза с обструктивным бронхитом и бронхиальной астмой наряду с противотуберкулезной терапией необходимо проводить длительное, систематическое лечение бронхообструктивных заболеваний имеющимися в настоящее время средствами. Туберкулез не является противопо
казанием к применению лекарственных средств, используемых при лечении обструктивного бронхита и бронхиальной астмы, а также физиотерапевтических процедур и экстракорпоральных методов (плазмаферез, гемосорбция и др.).
При сочетании туберкулеза и кистозной гипоплазии легких, особенно осложнившейся нагноительным процессом, кроме медика
ментозного лечения, применяют оперативные вмешательства, при
292
этом объем резекции пораженного участка зависит от протяженности
патологического процесса: от удаления доли до пневмонэкто
мии. В последние годы накоплен опыт хирургического лечения (пневмонэктомия) больных, у которых туберкулез сочетается с син-
дромом Картагенера. При сочетанных заболеваниях перед операцией, а также в ближайшем и отдаленном послеоперационном периоде нередко требуется проведение противотуберкулезной химиотерапии с лечебной и профилактической целью.
7.4. ТУБЕРКУЛЕЗ И РАК ЛЕГКОГО
Сочетание туберкулеза и рака легкого встречается нередко, особенно у мужчин старше 40 лет. Существовавшее ранее представление об антагонизме этих заболеваний не подтвердилось, наоборот, установлено, что рак легкого у больных туберкулезом и лиц с остаточными изменениями после излеченного туберкулеза встречается чаще, чем среди всего населения. По данным А. Е. Рабухина (1976), среди больных туберкулезом частота выявления рака легкого была в 4—4,5 раза выше, чем в соответствующей возрастно-половой группе всего населения, при этом в более старшей возрастной группе это различие увеличивалось в 6,6 раза и более.
У больных туберкулезом может развиться как периферическая, так и центральная форма рака легкого; формы туберкулеза, при которых развивается рак легкого, разнообразны. По данным А. Е. Рабухина, рак легкого чаще всего обнаруживали у больных очаговым туберкулезом легких, фиброзно-кавернозным и цирротическим туберкулезом, т. е. при хронических формах, протекающих с развитием фиброзных изменений в легких. На основании результатов детального обследования большого числа больных туберкулезом и раком легкого А. Е. Рабухин выделил 4 типа проявлений сочетанного заболевания:
I тип — появление в зоне стационарных, или регрессирующих, туберкулезных изменений новой одиночной изолированной крупноочаговой или фокусной тени неправильно округлой формы;
II тип — возникновение в зоне активного туберкулезного процесса или вне его на неизмененном участке легкого тени округлой формы или участка апневматоза, которая, несмотря на противотуберкулезную химиотерапию, не уменьшается в размерах, хотя туберкулезные изменения при этом регрессируют;
III тип — присоединение к неактивным, метатуберкулезным изменениям или активному туберкулезу пневмонита, гипопневматоза или ателектаза сегмента, доли либо всего легкого; нарастающих перибронхиальных, интерстициальных уплотнений, исходящих из корня легкого; одностороннего увеличения и уплотнения корня легкого, главным образом за счет внутригрудных лимфатических узлов;
IV тип — появление выраженного асимметричного утолщения стенки туберкулезной каверны с полипообразными бугристыми разрастаниями в просвете или в перикавернозной зоне в отсутствие выраженного перифокального воспаления и диссеминации.
293
Диагностика рака легкого у больных туберкулезом и у лиц с остаточными изменениями после излеченного туберкулеза — трудная задача. Чрезвычайно ценным методом диагностики является рентгенологическое исследование с применением томографии, позволяющее обнаружить изменения, обусловленные раком легкого. Тем не менее решающее значение имеет цитологическое или гистологическое исследование биоптата легкого и лимфатических узлов. Естественно, инвазивные методы исследования (эндобронхиальное исследование, трансторакальная пункция) следует применять по четким показаниям, когда клинические симптомы и рентгенологическая картина позволяют заподозрить рак легкого. Необходимо подчеркнуть, что хорошо известные клинические симптомы рака легкого: уменьшение массы тела, боли в груди, кашель, кровохарканье, могут быть обусловлены туберкулезом, поэтому иногда даже их появление не настораживает больного и не служит для врача поводом для проведения целенаправленной диагностики рака легкого. Именно поэтому тщательный анализ рентгенологических изменений в динамике при появлении признаков, не укладывающихся в клиническую картину туберкулеза, требует уточнения этиологии этих изменений.
Наиболее эффективными методами диагностики рака легкого, особенно на ранних этапах его развития, являются цитологическое и гистологическое исследования патологического материала из пораженного отдела легкого, полученного разными путями. Наиболее часто выполняют внутрилегочную эндобронхиальную биопсию, которая наиболее результативна. Возможно применение и других эндобронхиальных методик — щеточной, катетеризационной, губчатой биопсии, которые менее травматичны, но в то же время менее результативны. Высокоэффективны трансбронхиальные игловые методы получения материала, особенно под визуальным рентгенологическим контролем. Также может быть проведено цитологическое исследование мокроты для выявления в ней атипических клеток, хотя этот метод нередко результативен на более поздних этапах развития болезни.
В том случае, если с помощью указанных методов не удается уточнить диагноз заболевания, могут быть применены хирургические методы получения материала — медиастиноскопия и медиастино-томия, прескаленная биопсия лимфатических узлов, открытая биопсия легкого путем торакотомии.
В отсутствие возможности применить инвазивные методы исследования из-за тяжелого состояния больного, его преклонного возраста или сопутствующих заболеваний можно провести радиоизотопное исследование с 67Ga, который способен накапливаться в участках легкого с бластоматозными изменениями. Наличие активного туберкулеза или остаточных изменений после излеченного туберкулеза в виде очагов, туберкулемы, фиброзных изменений, как правило, не является препятствием для применения хирургического лечения рака легкого, если заболевание выявлено на ранних этапах или по крайней мере опухоль операбельна. Сложнее провести таким боль
294
ным лучевую терапию и химиотерапию цитостатическими средствами. При активном туберкулезе обычно не удается применить эти виды лечения. В связи с этим при осуществлении диспансерного наблюдения за больными туберкулезом органов дыхания и лицами с остаточными изменениями после излеченного туберкулеза должна быть определенная онкологическая настороженность, особенно при
менительно к лицам, у которых повышен риск развития рака легкого: курящим сиграреты по 30—40 штук в день, мужчинам старше 40 лет, лицам, у которых выявлен метатуберкулезный синдром, на фоне которого часто развиваются воспалительные заболевания лег
ких, а также группам населения, в течение длительного времени подвергавшимся воздействию профессиональных или природных канцерогенных факторов.
В обследовании групп риска, как уже отмечалось ранее, большое
значение имеют рентгенологические методы исследования, в част-
ности флюорография, особенно в случае отсутствия выраженных
клинических проявлений. Проведение п
илактических флюоро-
графических исследований с последующей сравнительной оценкой флюорограмм позволяет применить другие необходимые исследования при появлении тенеобразований, не определявшихся при пре
дыдущих исследованиях.
У лиц, у которых часто возникают обострения хронических легочных заболеваний, также необходимо ежегодно проводить рентгенологическое исследование, так как оно дает врачу очень ценную информацию. Следует избегать доминирующего влияния ранее установленного диагноза, в том числе среди лиц, находящихся под диспансерным наблюдением по поводу активного туберкулеза легких, остаточных изменений после излеченного туберкулеза или других болезней.
7.5. ТУБЕРКУЛЕЗ И СПИД
СПИД — синдром приобретенного иммунодефицита — представляет собой терминальную стадию заболевания, вызванного вирусами иммунодефицита человека (ВИЧ). Наиболее часто клиническое проявление СПИД — инфекционные заболевания, вызванные «оппортунистической» микробной и грибковой флорой. Среди них туберкулез и микобактериозы, чаще всего обусловленные М. tuberculosis avium, intercellularae и другими «атипичными» микобактериями, служат характерными проявлениями в странах, где широко распространены туберкулез и ВИЧ-инфекция (число инфицированых ВИЧ уже в 1987 г. достигло 5—10 млн человек). По данным ВОЗ, на 1 мая 1990 г. было зарегистрировано 254 078 больных СПИД, по расчетным данным, число заболевших не менее 600 тыс. О наличии заболевших СПИД сообщили уже 156 стран. Болезнь получила наибольшее распространение в Америке, Европе и Африке, хотя в Азии и регионе Тихого океана также имеются случаи заболевания СПИД (2357). Из стран американского континента наибольшее количество случаев зарегистрировано в США (126 127), в Африке
295
предполагаемое число больных СПИД не менее 300 тыс. Из стран Европы больше всего больных выявлено во Франции (8883), Италии (6068), Испании (5995), Великобритании (3157).
Распространение ВИЧ-инфекции привело не только к увеличению числа заболевших СПИД, но и к быстрому увеличению заболеваемости СПИД и туберкулезом в развивающихся странах, а в экономически высокоразвитых странах, в том числе в США, впервые за много лет зафиксировано увеличение заболеваемости туберкулезом вследствие распространения ВИЧ-инфекции. Установлено, что риск развития туберкулеза у ВИЧ-инфицированных в 6 раз выше, чем у тех, у кого эта инфекция отсутствует. В США туберкулез диагностирован у 4% ВИЧ-инфицированных лиц, что во много раз превышает заболеваемость туберкулезом среди всего населения; среди ВИЧ-инфицированных наркоманов туберкулез выявлен у 24%. Во Флориде (США) туберкулез обнаружен у 10% заболевших СПИД негаитян и 60% гаитян.
В исследованиях, проведенных в африканских странах, выявлено большое число ВИЧ-инфицированных среди больных туберкулезом — от 11 до 30%, а в отдельных группах обследованных — 54% и более. В нашей стране распространенность ВИЧ-инфекции значительно меньше, чем в других странах: в 1990 г. число ВИЧ-инфицированных составило 600 человек, а число больных СПИД — 37, из них лишь у одного выявлено сочетание туберкулеза и СПИД. Тем не менее эпидемиологические исследования, проводящиеся в нашей стране, свидетельствуют о неизбежном увеличении распространенности ВИЧ-инфекции, что может происходить в соответствии с одной или несколькими эпидемиологическими моделями.
1-я модель — распространение ВИЧ-иифекции среди гомосексуалистов.
2-я модель — распространение ВИЧ-инфекции при переливании крови, взятой у ВИЧ-инфицированных лиц, а также при пользовании общими шприцами и иглами (преимущественно наркоманами).
3-я модель — заражение происходит в других странах или от лиц, прибывших из стран, где широко распространена ВИЧ-инфекция.
Следовательно, в ближайшем будущем в нашей стране следует ожидать увеличения числа не только ВИЧ-инфицированных и больных СПИД, но и больных, у которых СПИД сочетается с туберкулезом.
По данным литературы, ВИЧ-инфекция приводит к разрушению клеточного иммунитета и иммунодепрессии. В этих условиях заражение туберкулезом закономерно завершается прогрессирующим течением первичной туберкулезной инфекции. При заражении ВИЧ-инфицированных лиц туберкулезом часто происходит эндогенная реактивация туберкулеза. Клинические проявления туберкулеза у ВИЧ-инфицированных и больных СПИД характеризуются рядом особенностей. Все исследователи отмечают частое поражение внутригрудных лимфатических узлов в виде двусторонней лимфадено-
296
патии. Иногда прогрессирующее течение заболевания обусловливает казеозный некроз и разжижение образовавшихся во внутригрудных лимфатических узлах казеозных некротических масс, что может
привести к тяжелым осложнениям, связанным с перфорацией и
развитием гнойного медиастинита, перикардита. У таких больных может образоваться бронхопищеводный свищ, а также бывают смер
тельные кровотечения из-за разрушения стенки крупного кровеносного сосуда. Больные, у которых наблюдается такое течение туберкулеза, находятся в крайне тяжелом состоянии, у них отмечаются резко выраженная интоксикация и тяжелые локальные изменения, обусловленные гнойной инфекцией.
Значительно чаще встречаются генерализация туберкулезной инфекции в связи с развившейся бактериемией и разнообразные вне-легочные формы туберкулеза, чаще всего туберкулез периферических лимфатических узлов, поражения серозных оболочек (плеврит, перикардит, полисерозит) и висцеральных органов (печень, селезенка). У таких больных нередко диагностируют также поражение легких, чаще всего в виде инфильтративного процесса значительной протяженности с образованием каверн.
У больных, у которых наблюдаются бактериемия и генерализация туберкулеза, а также при инфильтративном типе изменений в легких заболевание характеризуется волнообразным течением со сменой фаз обострения и затихания, продолжительность которых
зависит от степени иммуносупрессии и характера локальных изменений, длительности инволюции, образовавшихся изменений. Необходима ранняя диагностика туберкулеза у ВИЧ-инфициро
ванных, так как при выраженных изменениях и запущенном туберкулезе в условиях иммунодефицита добиться положительных результатов лечения трудно, вследствие чего заболевание принимает хроническое течение с выраженной тенденцией к прогрессированию. Затруднения, возникающие при диагностике туберкулеза, обусловлены большим сходством клинических проявлений СПИД и туберкулеза, частыми ложноотрицательными туберкулиновыми реакциями из-за иммунодепрессии. Диагноз туберкулеза должен быть подтвержден обнаружением микобактерий туберкулеза с помощью микроскопии или посева. В отсутствие микобактерий определенное значение имеют результаты исследования материала, полученного при биопсии пораженного органа, а также иммунологического исследования, в основном обнаружение специфических противотуберкулезных антител в сыворотке крови или бронхоальвеолярных смывах.
Лечение туберкулеза у ВИЧ-инфицированных лиц заключается в применении эффективных противотуберкулезных препаратов: изониазида, рифампицина и пиразинамида, иногда добавляют этамбутол или им заменяют другой препарат при лекарственной резистентности микобактерий туберкулеза. Химиотерапию проводят в течение не менее 9—12 мес. При наличии показаний может быть проведено хирургическое лечение. В случае сочетания туберкулеза и СПИД одновременно проводят лечение обоих заболеваний.
297
7.6. АЛКОГОЛИЗМ, ТУБЕРКУЛЕЗ И ДРУГИЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ
Наблюдения, проведенные в последние годы, показывают, что проблема алкоголизма и сопутствующего ему туберкулеза легких очень актуальна. Еще в начале текущего столетия было доказано, что по
мере увеличения распространенности алкоголизма и увеличения продукции алкоголя увеличивается заболеваемость туберкулезом. Значительное увеличение количества научных исследований, посвященных изучению проблемы алкоголизма и туберкулеза, отмечается с конца 50~х годов, а в нашей стране — в последние 5 лет.
Несмотря на длительное изучение этого вопроса, он до настоящего времени еще полностью не изучен, а имеющиеся данные противоречивы. Наиболее старая концепция заключается в том, что алкоголизм приводит к развитию туберкулеза из-за плохих условий жизни больных алкоголизмом. Наряду с этим придают значение
подавлению мукоцилиарного клиренса и токсическому поражению печени у больных алкоголизмом, что затрудняет проведение химиопрофилактики и химиотерапии. Нарушение обмена веществ и де
прессивное состояние также играют определенную роль в угнетении реакций иммунитета и развитии туберкулеза, а также других заболеваний, обусловленных микробной флорой, находящейся в организме человека. В настоящее время большинство специалистов в этой области придают значение комплексу перечисленных выше биологических и социальных факторов. Немаловажное значение имеет еще одна особенность — более половины заболевших тубер-
кулезом уклонялись от проведения профилактических мероприятии.
Лица с сочетанной патологией представляют большую эпидемио-
логическую опасность не только из-за часто встречающихся у них тяжелых деструктивных форм туберкулеза с массивным бактериовыделением. Эти больные вследствие деградации личности, низкого уровня санитарной грамотности не соблюдают элементарных правил гигиены, поздно обращаются за медицинской помощью, пренебрегают рекомендациями врачей, отказываются от радикальной терапии. Тем самым они становятся особо опасными для окружающих, распространяя микобактерии туберкулеза, часто полирезистентные к противотуберкулезным препаратам. По нашим данным, среди больных туберкулезом и алкоголизмом лекарственная устойчивость микобактерий туберкулеза наблюдается в 1,2 раза чаще, а полирезистентность — в 6 раз чаще, чем у больных, не страдающих алкоголизмом.
По мере уменьшения заболеваемости туберкулезом легких увеличивается число больных алкоголизмом среди контингентов противотуберкулезных диспансеров, особенно в группе больных с хроническими процессами. Мы установили, что злоупотребляющих алкоголем в 3—5 раз больше среди больных, длительно состоящих на диспансерном учете, чем среди впервые заболевших туберкулезом легких. Причиной этого является «оседание» в диспансере лиц, злоупотребляющих алкоголем, из-за низкой эффективности лечения.
Согласно результатам исследований, среди больных туберкулезом
298
легких много злоупотребляющих алкоголем и страдающих алкоголизмом. Число злоупотребляющих алкоголем среди лиц, заболевших туберкулезом, возросло с 16,1% в 1956—1969 гг. до 61,2% в 1966— 1970 гг. Тенденцию к увеличению заболеваемости алкоголизмом среди больных туберкулезом легких обнаружили также итальянские исследователи: в 1952 г. им страдали 5% больных, в 1961 г. — 26%, в 1970 г. — 50—60%. Удельный вес больных алкоголизмом среди впервые заболевших туберкулезом легких составляет 12,3— 14,1%, среди контингентов диспансеров — 14—30%. Алкоголизм и бытовое пьянство наблюдаются у 47,5% больных активным туберкулезом легких, причем среди мужчин — у 60,8%. Участие нарколога в исследовании позволило В. В. Уткину и соавт. (1981) выявить алкоголизм у 43,9% и бытовое пьянство у 25% больных, лечившихся в туберкулезной больнице, причем суммарно их было в 15,7 раза больше среди мужчин. Особенно велика распространенность алкоголизма среди больных хроническим деструктивным туберкулезом легких.
Таким образом, многими исследователями отмечено большое число больных туберкулезом и алкоголизмом. Часть из них состоят на учете в психоневрологических диспансерах как больные алкоголизмом (в основном с тяжелыми формами), однако истинная распространенность алкоголизма среди больных туберкулезом легких не установлена, так как большинство из них, особенно лица с алкоголизмом в начальной стадии, уклоняются от обследования у нарколога. Между тем именно у этих лиц наиболее перспективно комплексное лечение обоих заболеваний. При сплошном обследовании наркологом больных туберкулезом, находящихся на диспансерном учете, нами было установлено, что больных алкоголизмом в данной группе оказалось в 10 раз больше, чем по первоначальным сведениям, полученным из историй болезни. Среди больных туберкулезом и алкоголизмом преобладали мужчины (93,6%), в основном трудоспособного возраста. Более 40% из этих больных были инвалидами, а каждый 5-й не работал из-за алкоголизма. Задача противотуберкулезных учреждений состоит в улучшении осведомленности о всех больных алкоголизмом, для чего необходима тесная взаимосвязь с психоневрологическими диспансерами.
Туберкулез легких у подавляющего большинства больных развивается на фоне алкоголизма, реже предшествует ему. Согласно нашим данным, алкоголизм у 86,7—88,3% больных является первичным заболеванием и лишь у 11,7—13,3% развивается на фоне туберкулеза. Это позволяет характеризовать большинство лиц с сочетанной патологией как больных алкоголизмом с сопутствующим ему туберкулезом.
Причинная взаимосвязь туберкулеза и алкоголизма мало изучена. Хроническая алкогольная интоксикация даже в ранних стадиях болезни способствует возникновению расстройств функций и органическим поражениям различных органов и систем, которые могут достигать значительной степени выраженности. По нашим данным, сопутствующие хронические заболевания у больных туберкулезом
299
и алкоголизмом встречаются в 2 раза чаще, чем у не страдающих им. При II—III и III стадиях алкоголизма сопутствующую патологию выявляют в 1,6 раза чаще, чем при I и I—II. Нервно-психические и соматические заболевания при алкоголизме создают предпосылки для возникновения обострения, неблагоприятного течения и исхода туберкулеза легких. Особенно сильное отрицательное влияние на течение туберкулеза оказывают хронические заболевания печени, которые мы наблюдали в 5,4 раза чаще у больных с комбинированной патологией, чем без нее. Важное значение в увеличении заболеваемости туберкулезом больных алкоголизмом имеет резкое снижение общей и специфической реактивности организма под влиянием длительной алкогольной интоксикации. Наряду с этим нарушается локальная защита легких. Поражение бронхолегочной системы при алкоголизме обусловлено непосредственным токсическим действием
выделяющегося через дыхательные пути алкоголя и продуктов его распада на эпителий бронхов, в результате чего нарушается функция
мукоцилиарного аппарата. Доказано разрушающее воздействие ал
коголя и на другие компоненты местной защиты легких: растворение
сурфактанта, угнетение функции альвеолярных макрофагов.
Иногда туберкулез легких создает условия для развития алкого-
лизма. Одной из причин присоединения алкоголизма к туберкулезу является астенизация нервной системы при туберкулезе, что может
вызвать стойкое влечение к алкоголю. Важную роль играет также от-
сутствие трудовой занятости вследствие длительной госпитализации больных туберкулезом или их инвалидизации. Следовательно, каждое из этих заболеваний способствует возникновению другого, а при их
сочетании они оказывают отягощающее влияние друг на друга.
У больных алкоголизмом чаще встречаются далеко зашедшие деструктивные формы туберкулеза легких с бактериовыделением: деструкция легочной ткани выявлена у 72,9% и бактериовыделение — у 82,9%. Эти симптомы у вновь выявленных больных туберкулезом легких, не страдающих алкоголизмом, не отмечены. У большинства больных алкоголизмом (81,6%) размеры каверн были средними, большими и гигантскими, при которых наблюдается наиболее обильное бактериовыделение. Туберкулез бронхов у больных алкоголизмом выявляли в 3,2 раза чаще, а неспецифические изменения в бронхах — в
2 раза чаще, чем у лиц, не страдающих алкоголизмом.
Высокая частота деструктивных форм туберкулеза у больных
алкоголизмом обусловлена тем, что они поздно обращаются за ме-
дицинской помощью, а также слабой
профилактической работой по
выявлению туберкулеза среди лиц, злоупотребляющих алкоголем. Так, более половины наблюдавшихся нами больных уклонялись от
регулярных профилактических осмотров. У половины больных, у
которых туберкулез выявлен при проведении флюорографии, при клиническом обследовании обнаружена туберкулезная интоксикация. Однако эти лица не обращались за врачебной помощью в
течение последних 3—6 мес, что, по-видимому, связано с неадекватной оценкой больными алкоголизмом своего состояния. Кроме того, обострение туберкулеза у больных алкоголизмом нередко про
300
текает под маской неврастенических или психических расстройств, которые часто расценивают как проявления алкоголизма.
Нами установлен параллелизм между характером туберкулезного процесса, его распространенностью, частотой деструктивных изменений и бактериовыделения (в том числе обильного), максимальным размером каверн, частотой и характером поражения бронхов и степенью выраженности алкоголизма. По мере его прогрессирования нарастала тяжесть туберкулезного процесса. Так, казеозная пневмония обнаружена у 2/з больных алкоголизмом III стадии и ни у одного — I стадии.
Клинические проявления и течение туберкулеза легких при алкоголизме могут быть различными. Процесс в легких у больных алкоголизмом иногда приобретает бурное течение и приводит к летальному исходу. Другие авторы также указывают на острое и подострое начало туберкулеза у многих больных алкоголизмом, хотя оно может быть и малосимптомным. Мы наблюдали острое начало впервые выявленного туберкулеза легких у 23,9% больных алкоголизмом, подострое — у 48,3% и бессимптомное — у 27,9%. Частым осложнением туберкулеза легких при сочетании его с алкоголизмом являются легочные кровотечения и кровохарканье, которое связывают с пневмосклерозом и повышенной проницаемостью сосудов под влиянием алкоголя. По нашим данным, кровохарканье и легочное кровотечение были первым симптомом впервые выявленного туберкулеза у 9,7% больных алкоголизмом, кашель с мокротой — у 73,6%, температурная реакция — у 47,9%. После излечения туберкулеза у больных алкоголизмом наблюдаются выраженные остаточные изменения в легких, что создает условия для возникновения рецидивов туберкулеза. Главной причиной их развития является недостаточное лечение больных в период проведения основного курса химиотерапии в стационаре из-за досрочной выписки за нарушение режима. У больных алкоголизмом туберкулезный процесс при его рецидивах протекал тяжелее, чем при первоначальном заболевании.
Проведенный нами анализ причин смерти больных туберкулезом легких и алкоголизмом показал, что большинство из них (72,2%А умерли от прогрессирования туберкулеза (часто от казеозной пневмонии) и его осложнений в возрасте 40—49 лет, 73,3% больных — в сроки до 10 лет от момента выявления у них туберкулеза легких. Средняя продолжительность жизни больных от момента обнаружения туберкулеза до смерти составила 6,7 года, что намного меньше, чем у лиц, не злоупотреблявших алкоголем. Среди причин смерти значительное место занимали заболевания печени и пищеварительного тракта алкогольной этиологии.
Особенности клинических проявлений и течения алкоголизма у больных туберкулезом легких освещены в литературе. Приведены данные о том, что при возникновении туберкулеза резко ухудшается течение алкоголизма, быстро формируются его тяжелые стадии с выраженной психопатизацией, деградацией личности и социальной запущенностью. Запои принимают упорный характер, более тяже
301
лым становится синдром похмелья. Наряду с этим снижается толерантность к алкоголю. Большинство больных туберкулезом и алкоголизмом (74,8%) начали злоупотреблять алкоголем в возрасте от 20 лет до 31 года. Многие больные имели длительный алкогольный
анамнез, и только у 10,3% его продолжительность была менее 5 лет. У большинства больных диагностированы II (51,7%), II—III (16,9%) и III (21,1%) стадии алкоголизма. У многих больных
снижалась толерантность к алкоголю при I и II стадиях заболевания. В клинической картине синдрома абстиненции наряду с соматове-гетативными расстройствами наблюдались психопатологические на-
рушения. Для больных туберкулезом и алкоголизмом была харак-
терна депрессия с дистрофическим оттенком, способствовавшая уве-
личению влечения к алкоголю. Некоторые больные алкоголизмом
III стадии временно прекращали употребление алкоголя из-за тяжелого общего состояния и снижения толерантности к алкоголю,
однако после улучшения самочувствия влечение к алкоголю становилось более стойким. Туберкулезная инфекция является дополнительным отягощающим фактором, способствующим возникновению алкогольных психозов со своеобразными клиническими проявлениями. Основную роль в их развитии играют обострения специфического процесса. Алкогольный делирий у больных туберкулезом характеризовался атипичностью клинических проявлений, обусловленных туберкулезной интоксикацией.
В последние десятилетия во многих экономически развитых странах наблюдается быстрое распространение алкоголизма среди женщин, опережающее в некоторых из них рост алкоголизма среди мужчин. Многие исследователи отмечают ускоренное развитие и тяжелое течение алкоголизма у женщин из-за упорного нежелания обращаться к наркологу. Среди женщин, находившихся в туберкулезных больницах, обследованных нами совместно с наркологами, у 9,3% процесс в легких сочетался с алкоголизмом (1-я группа), 6,3%, не являясь больными алкоголизмом, систематически злоупотребляли спиртными напитками (2-я группа), 84,4% употребляли их эпизодически или совсем не принимали (3-я группа). В 1-й и 2-й группах преобладали женщины наиболее трудоспособного возраста — до 49 лет, в 3-й — старше 60 лет. У больных 1-й группы по сравнению с женщинами 3-й группы в 2,5 раза чаще выявляли фиброзно-кавернозный и в 1,3 раза — инфильтративный процессы, в 2,5 раза — каверны и бактериовыделение. Из осложнений туберкулеза кровохарканье, легочно-сердечная недостаточность III степени и амилоидоз внутренних органов наблюдались только у женщин, больных алкоголизмом. Сопутствующие соматические заболевания у них нередко были сочетанными и более тяжелыми. У больных этой группы хронические заболевания печени встречались в 13 раз чаще, чем в 3-й группе.
Женщины болели алкоголизмом в 5,4 раза реже, чем мужчины, у которых он протекал тяжелее, иногда с алкогольными психозами при заболевании I и II стадий. У женщин алкогольные психозы не наблюдались, но снижалась толерантность к алкоголю даже при I
302
стадии алкоголизма. С присоединением туберкулеза алкоголизм у женщин прогрессировал, нарастала деградация личности, запои становились постоянными. В период абстиненции преобладали выраженные соматовегетативные и психические расстройства. У женщин с сочетанными заболеваниями в 2 раза чаще наблюдались впервые выявленные формы туберкулеза (преимущественно инфильтративные), среди мужчин — хронические (фиброзно-кавернозные). Женщин в 2 раза реже выписывали из стационаров за употребление алкоголя, они получали более длительную химиотерапию, результаты которой у них были лучше, чем у мужчин.
Одна из основных причин неблагоприятного течения туберкулеза легких при алкоголизме — неполноценное лечение из-за недисциплинированности больных. Мнение о том, что активную противоалкогольную терапию нельзя проводить больным с активным легочным процессом, опровергнуто многими исследователями. Более того, доказано, что без активной антиалкогольной терапии лечение больных алкоголизмом и туберкулезом не может быть успешным. В связи с взаимноотягощающим влиянием алкоголизма и туберкулеза при их сочетании этим больным необходимо проводить комплексную антиалкогольную и антибактериальную терапию. Использование высокоэффективных, адекватно подобранных комбинаций туберкулостатических препаратов позволяет одновременно осуществлять активную противоалкогольную терапию без серьезных осложнений. Последняя позволяет продлить сроки пребывания больных в стационаре за счет ремиссии алкоголизма и тем самым повысить эффективность химиотерапии туберкулеза.
Взгляды фтизиатров на формы организации комплексного лечения больных с сочетанной патологией противоречивы. Некоторые исследователи считают возможным проводить лечение в обычном противотуберкулезном или психиатрическом стационаре. Повышение эффективности комплексной терапии возможно здесь при совместной работе фтизиатра и нарколога. В настоящее время проводят комплексное лечение больных туберкулезом и алкоголизмом в обычных противотуберкулезных стационарах. С этой целью в некоторых из них выделены койки для больных с комбинированной патологией, открываются наркологические кабинеты с введением в штат нарколога или привлечением к работе фтизиатра, прошедшего подготовку по наркологии. Однако трудно обеспечить длительное пребывание больных туберкулезом и алкоголизмом в противотуберкулезных и психиатрических стационарах с открытым режимом, необходимое для успешного лечения у них обоих заболеваний, в связи с отказом от антиалкогольной терапии и часто досрочной выпиской за употребление алкоголя. В связи с этим многие авторы утверждают, что лечение больных с сочетанной патологией может быть эффективным только при проведении его в специализированных больницах закрытого типа при тесном контакте фтизиатра и нарколога.
Лечение алкоголизма у больных туберкулезом легких мы проводили в обычных противотуберкулезных стационарах в три этапа с соблюдением принципа преемственности. На I этапе, учитывая
303
сочетание алкогольной и туберкулезной интоксикаций, осуществляли интенсивную дезинтоксикационную, общеукрепляющую и симптоматическую терапию. Для купирования запоев и абстинентного синдрома одновременно с антибактериальными средствами использовали препараты пирогенного действия — сульфозин или пирогенал. С этой же целью, а также для ослабления нервно-психического возбуждения и подавления патологического влечения к алкоголю дифференцированно применяли психофармакологические средства: седативные, психотропные и др. На II этапе проводили активную противоалкогольную терапию — сенсибилизирующую, вызывающую непереносимость алкоголя. В качестве средств, вызывающих сенсибилизацию к алкоголю, при наличии у больных тяжелых форм туберкулеза легких, осложнений и сопутствующих заболеваний использовали малотоксичные препараты — метронидазол (трихопол) и фуразолидол. Сенсибилизацию организма к алкоголю осуществляли также тетурамом (антабусом). Перед его назначением больных предупреждали о тяжелых осложнениях, возникающих при приеме алкоголя. Алкогольные пробы с тетурамом и метронидазолом не проводили. При неэффективности указанных терапевтических мероприятий применяли сенсибилизирующий к алкоголю препарат пролонгированного действия — эспераль (радотер), представляющий собой стерильный тетурам, таблетки которого имплантировали внутримышечно. Перед имплантацией от больного и его родственников получали расписку о том, что они ознакомлены с опасными для жизни больного последствиями в случае употребления алкоголя. На III этапе осуществляли длительное поддерживающее лечение, закрепляющее достигнутые благоприятные результаты и предупреждающее срывы в ремиссии алкоголизма и рецидивы.
На всех этапах активно и дифференцированно применяли все современные методы индивидуальной и коллективной психотерапии, в том числе эмоционально-стрессовую психотерапию по Рожнову (в период бодрствования и в состоянии гипноза) с учетом личностных особенностей больного, аутотренинг. Важное место в комплексном лечении больных с сочетанной патологией занимала дозированная трудотерапия, раннее включение которой в общий комплекс стационарного лечения удлиняло его сроки и способствовало положительной динамике легочного процесса.
Химиотерапию туберкулеза легких у больных алкоголизмом проводили в стационарах в соответствии с общепринятыми принципами. Больные часто уклоняются от приема препаратов, поэтому осуществляли строгий контроль за регулярностью химиотерапии: препараты вводили парентерально, а если внутрь, то однократно в суточных дозах. Методом выбора лечения больных хроническим деструктивным туберкулезом легких (особенно пожилого возраста) при сочетании его с алкоголизмом и соматическими заболеваниями является контролируемая интермиттирующая химиотерапия с однократным приемом препаратов. При данном методе, не уступающем по эффективности непрерывному, снижается частота преобладающих у больных алкоголизмом токсических побочных реакций. При ком
304
бинированной патологии применяли капельное внутривенное и ректальное введение туберкулостатиков. По показаниям назначали патогенетические средства, накладывали краткосрочный пневмопери-тонеум (Н. М. Рудой).
В работах некоторых исследователей указано, что применение рифампицина больным туберкулезом легких, страдающим алкоголизмом, противопоказано. Другие авторы придерживаются иного мнения и рекомендуют проводить лечение рифампицином под строгим контролем функции печени или в небольших дозах. Мы не назначали рифампицин при заболеваниях печени в стадии обострения с выраженными функциональными нарушениями, но применяли его на фоне гепатотропной терапии при хронической патологии печени в стадии ремиссии под регулярным контролем функций печени. Нужно соблюдать осторожность при назначении оказывающих гепатотоксическое действие рифампицина (особенно совместно с изониазидом), пиразинамида, этионамида, протионамида и тио-ацетазона больным алкоголизмом, алкогольным циррозом печени, перенесшим болезнь Боткина и продолжающих злоупотреблять алкоголем. Больные с сочетанной патологией лучше переносят фти-вазид и метазид, хуже — изониазид, особенно при экспрессном внутривенном введении. Изониазид, оказывающий тетурамподобное действие, вызывал у некоторых наблюдавшихся нами больных при приеме алкоголя такие же реакции, как при алкогольно-тетурамовой провокации (гиперемия кожи, тахикардия, затрудненное дыхание и пр.). Множественные соматические заболевания при алкоголизме ограничивают выбор оптимальных комбинаций туберкулостатиков из-за противопоказаний к их применению, поэтому при комбинированном заболевании необходима индивидуализация химиотерапии с учетом характера сопутствующей соматической патологии. Мы установили у 2/з больных туберкулезом и алкоголизмом плохую переносимость химиотерапии. Побочные реакции возникали у них в 1,6 раза чаще, чем у больных, не страдающих алкоголизмом. Токсические реакции на препараты среди больных туберкулезом, не отягощенным алкоголизмом, наблюдались в 2 раза реже, чем у больных с сочетанной патологией, а аллергические и токсико-аллергические — с одинаковой частотой. Мы рекомендуем обследовать больных туберкулезом и алкоголизмом для выявления лекарственной непереносимости вне состояния абстиненции ввиду сходства ее симптомов с токсическими проявлениями побочного действия химио
препаратов.
Как показал наш опыт, в обычной туберкулезной больнице комплексная терапия обоих заболеваний может быть успешно проведена при I и II стадиях алкоголизма у больных с астеническим, возбу
димым и синтонным типами личности в случае отсутствия в пре-морбидном периоде психопатии, наличии длительно сохраняющейся социальной стабильности личности с установкой на противоалко-
гольное лечение. Осуществление в стационаре с открытым режимом
противоалкогольных лечебно-профилактических мероприятий спо-
•351
собствуют снижению частоты досрочных выписок за употребление
305
алкоголя среди больных алкоголизмом. Согласно нашим данным, комплексное лечение больных с впервые выявленным деструктивным туберкулезом легких, страдающих алкоголизмом, повышает частоту заживления каверн на 38,1—43,6%, прекращение бактериовыделения на 44,1—52,3%, а у больных хроническим деструктивным туберкулезом и алкоголизмом — соответственно на 16,6 и 27%. Таким образом, излечения части больных от туберкулеза при сочетании его с алкоголизмом удается достигнуть в обычном противотуберкулезном стационаре.
Среди других легочных заболеваний, которые могут развиваться у больных алкоголизмом, следует назвать острую пневмонию и гнойные процессы (абсцесс и гангрена легкого), хотя, конечно, у этих больных может быть любое легочное заболевание.
Острая пневмония развивается чаще всего в связи с переохлажде
нием, которое нередко имеет место у лиц в состоянии опьянения, особенно в холодную и сырую погоду. Возбудителями острой пневмонии может быть бактериальная флора, постоянно находящаяся в дыхательных путях. Переохлаждение, снижение способности к выделению бронхиального секрета, подавление иммунологических механизмов
защиты приводят к развитию воспалительного процесса в легких, вы
званного сапрофитирующей флорой. При особо неблагоприятных об-
стоятельствах острый воспалительный процесс принимает прогресси
рующее течение и ведет к развитию нагноения в легких, что проявляется в виде абсцесса или гангрены легкого. Определяющую роль в таком течении воспалительного процесса играет характер бактериальной флоры: стафилококки, синегнойная палочка, анаэробная инфекция. В этих случаях заболевание характеризуется тяжелым течением с высокой температурой тела, резко выраженной интоксикацией,
•351
профузным потом, а также «грудными» симптомами в виде одышки, болей в груди и кашля с выделением большого количества мокроты,
при гангрене с крайне неприятным зловонным запахом. Иногда у таких больных наблюдается кровохарканье или легочное кровотечение. Ле-
чение острых пневмоний заключается в применении антибактериаль-
ных средств, а при нагноительных процессах нередко возникает необ
ходимость оперативного вмешательства.
Нередко воспалительный процесс связан с аспирацией рвотных масс или желудочного содержимого при наличии рефлюкса. У таких больных воспалительный процесс носит не острый характер, а развивается постепенно, принимая хроническое волнообразное течение с последующим развитием фиброза и бронхоэктазов. Развитие хронического воспалительного процесса приводит к снижению трудоспособности, а иногда к ее потере, т. е. инвалидизации.
Таким образом, у значительного числа больных алкоголизмом можно проследить взаимосвязь его с развитием острой пневмонии, гнойных воспалительных процессов в легких вследствие аспирации содержимого желудка или рвотных масс. В связи с этим требуются своевременная диагностика легочных заболеваний и адекватное лечение, а при наличии показаний — выполнение оперативных вме
шательств.
306
ГЛАВА 8
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ТУБЕРКУЛЕЗА ОРГАНОВ ДЫХАНИЯ
Дифференциальная диагностика — это распознавание заболевания, имеющегося у больного, несмотря на сходство его клинических проявлений с симптомами других заболеваний.
В настоящее время многие заболевания, в том числе туберкулез легких, имеют сходные клинические проявления и рентгенологические изменения в легких. В связи с этим возникает необходимость в расширении арсенала диагностических методов, для того чтобы получить более полную информацию о больном и имеющемся у него заболевании. Если в процессе обследования больного с помощью методов, входящих в обязательный диагностический минимум (ОДМ), удается выявить достоверные специфические признаки определенного заболевания, то часто нет необходимости в проведении дифференциальной диагностики, так как диагноз ясен.
В таких случаях диагноз устанавливают быстро, иногда до того, как осмысливают всю имеющуюся информацию о больном, так как в результате ознакомления с историей болезни и ее проявлениями у врача формируется представление об этом заболевании по сходству его симптомов с клинической картиной хорошо известного заболевания. Сохранение в памяти врача клинических проявлений различных заболеваний обеспечивается постоянной тренировкой в процессе клинической практики, т. е. при наблюдении за больными и фиксировании в памяти врача «моделей» различных заболеваний и поддерживается благодаря постоянному чтению медицинской литературы, в которой отражены коллективная память врачей и опыт лечения. Иногда говорят и пишут о врачебной интуиции при «быстрой» («с первого взгляда») диагностике; врачебная интуиция — это способность благодаря опыту и ранее приобретенным знаниям распознать имеющееся у больного заболевание по сходству с фиксированной в памяти моделью.
Этот процесс напоминает узнавание хорошо известных людей, предметов, местности еще до того, как осмысливаются все «детали» хорошо знакомого человека или предмета, например цвет глаз, волос, одежда.
Далеко не всегда удается быстро установить диагноз на основании признаков, полученных с помощью методов, входящих в ОДМ, если не выявлены специфические признаки какого-то определенного заболевания. В таких случаях необходима дифференциальная диагностика, которую проводят в следующей последовательности.
1. Оценка обнаруженных признаков заболевания и выделение наиболее важной информации о больном с точки зрения ее достоверности, информативности и специфичности.
2. Выделение симптомокомплекса, состоящего из достоверных, информативных и, по возможности, специфических признаков. Сим-птомокомплекс может быть расширенным, если включает большое
307
количество признаков (чаще наблюдается при недостаточной специфичности признаков), и суженным при наличии количества признаков, из которых один или несколько высокоспецифичны для определенного заболевания.
3. Составление перечня заболеваний, имеющих сходные симптомы, с которыми необходимо дифференцировать имеющееся у больного заболевание, и построение «модели» альтернативных, т. е. взаимоисключающих, симптомокомплексов.
4. Сопоставление симптомокомплекса, выявленного у больного, с альтернативными симптомокомплексами путем сравнения имеющихся и отсутствующих признаков, входящих в симптомокомплексы. При этом решающее значение имеют признаки, наиболее специфичные для определенного заболевания: наличие одного или не
скольких таких признаков в симптомокомплексе, характерном для того или иного заболевания, позволяет установить диагноз.
В том случае, если информации недостаточно для проведения дифференциальной диагностики, необходимо дообследовать больного, для того чтобы получить дополнительные данные, необходимые
для построения альтернативного симптомокомплекса и последующего повторного проведения дифференциальной диагностики.
В последние годы в противотуберкулезные учреждения направляют не только больных, у которых выявлены четкие признаки туберкулеза; значительно возросло число больных с заболеваниями легких, характеризующимися разнообразными клиническими про-
явлениями и рентгенологическими изменениями в легких и внут-
ригрудных лимфатических узлах. Это обусловлено в первую очередь увеличением потока лиц, нуждающихся в дообследовании, выяв-
ленных при профилактической флюорографии. Кроме того, из-за
м51
сходства клинических и рентгенологических проявлений туберкулеза
и других заболеваний органов дыхания потребовалось проведение
у таких больных целенаправленной диагностики с использованием лабораторных и инструментальных методов исследования.
Результаты анализа клинических проявлений различных форм туберкулеза органов дыхания свидетельствуют о том, что имеющиеся достоверные и информативные симптомы, обусловленные как общей
интоксикацией, так и легочным процессом, нельзя расценивать как строго специфичные, характерны^ только для туберкулеза. В равной мере это относится и к изменениям, обнаруженным при физическом и рентгенологическом исследованиях. Именно поэтому дифференциальную диагностику туберкулеза и других заболеваний органов дыхания проводят не путем сравнения отдельных симптомов (признаков), а на основе сопоставления альтернативных симптомокомплексов. Наиболее специфические признаки туберкулеза в симптомокомплексе — выявление микобактерий туберкулеза и наличие казеоза, эпителиоидных, гигантских клеток Пирогова — Лангханса и других признаков туберкулезного бугорка, обнаруженных при гистологическом исследовании различных биоптатов.
В Международной классификации болезней (проект 10-го пересмотра) предусматривается подтверждение диагноза туберкулеза ре
308
зультатами бактериологического или гистологического исследования. В отдельную группу выделяют больных, у которых диагноз туберкулеза не подтвержден результатами этих исследований, а установлен на основании данных, полученных с помощью других методов исследования. Наиболее важными из них являются рентгенологические методы и туберкулинодиагностика: большое число больных взрослых и детей выявляются с их помощью при проведении профилактических осмотров. Характер рентгенологических изменений органов дыхания и результаты туберкулиновых реакций обусловливают особенности дальнейшего обследования таких лиц в процессе дифференциальной диагностики.
Выявленные у больных рентгенологические изменения можно разделить на несколько групп:
1) немногочисленные очаговые изменения различной плотности;
2) долевые, сегментарные и субсегментарные затемнения;
3) округлые и шаровидные тени;
4) кольцевидные, полостные изменения;
5) диссеминированные поражения легких;
6) увеличение внутригрудных лимфатических узлов;
7) изменения, обусловленные скоплением выпота в плевральной полости, и их последствия.
Естественно, далеко не все заболевания органов дыхания сопровождаются описанными выше рентгенологическими изменениями; некоторые из них, например обструктивный бронхит, бронхиальная астма и др., характеризуются другими изменениями, которые имеют диффузный характер и в значительной мере зависят от длительности заболевания. Особенностью работы диагностических отделений в противотуберкулезных учреждениях является то обстоятельство, что у подавляющего большинства направляемых в них больных имеются четкие рентгенологически выявляемые изменения в легких; вторая особенность заключается в том, что у подавляющего большинства больных, направляемых на обследование, предположительно устанавливают диагноз туберкулеза. Например, 70% больных были направлены в диагностическое отделение Центрального НИИ туберкулеза РАМН с диагнозом туберкулеза органов дыхания, хотя этот диагноз подтвержден всего у 23% поступивших больных. Такой состав больных в настоящее время характерен для противотуберкулезных учреждений, в другие учреждения не направляется такое большое число больных, у которых необходимо подтвердить или исключить наличие туберкулеза.
Значительную часть амбулаторных больных составляют лица с очаговыми изменениями в легких. Первая задача при обследовании таких лиц — определение этиологии заболевания, что нередко представляет собой трудную задачу. При наличии свежих очаговых изменений проводят дифференциальную диагностику туберкулеза и бронхопневмонии с учетом клинической картины заболевания, которая неодинакова при бронхопневмонии и очаговом туберкулезе. Важное значение имеют результаты бактериологического исследования и динамика течения болезни: сравнительно быстрое рассасы
309
вание очаговых теней, особенно в процессе применения антибиотиков широкого спектра действия, свидетельствует в пользу бронхопневмонии и, наоборот, торпидное течение и медленная инволюция очагов даже при использовании противотуберкулезных препаратов подтверждают туберкулезную этиологию заболевания.
У больных хроническим очаговым туберкулезом часто возникает необходимость в определении активности туберкулезного процесса. По результатам обследования устанавливают вариант очаговых процессов: активный, реактивный и сомнительной активности. По данным Т. Я. Ильиной, у 8% лиц с очаговыми изменениями туберкулезной этиологии выявляют свежий очаговый туберкулез, у 35,4% — хронический, волнообразно протекающий туберкулез, у 54,1% — процесс сомнительной активности и у 2,5% — неактивный. В данном случае по существу проводят не дифференциальную диагностику различных заболеваний, а определение активности процесса.
У некоторых больных плотные очаговоподобные тени при наличии фиброзных изменений могут быть нетуберкулезного происхождения. Это наблюдается после перенесенных воспалительных процессов с образованием ограниченного фиброза, который при наличии узелковых теней в сочетании с тяжистыми и перибронхиальными изменениями может быть ошибочно расценен как очаговый туберкулез. Значительную помощь может оказать дополнительное детальное рентгенологическое исследоваие, в том числе получение увеличенных прицельных снимков (А. В. Александрова). Целенаправленный и подробный анамнез имеет очень важное, а порой решающее
значение для установления правильного диагноза.
Большую группу составляют больные с наличием в легких затемнений долевого, сегментарного и субсегментарного характера. Чаще всего такие изменения вызваны воспалительным процессом различной этиологии, в том числе туберкулезом или ателектазом, обусловленным в большинстве случаев центральным раком с эндобронхиальным ростом опухоли. Важную роль в диагностике при таких изменениях в легких играет клиническая картина заболевания; острое начало заболевания характерно для воспалительных
процессов, хотя ателектаз также может сопровождаться воспалением и в таких случаях на первых этапах развития заболевания расценивается как пневмония. В дифференциальной диагностике решающее значение имеют два направления: микробиологические исследования, проводимые с целью обнаружения инфекционного агента — возбудителя заболевания, и применение инструментальных
методов с последующим цитологическим и гистологическим исследованием материала, полученного при биопсии.
По нашим данным, при наличии у больных инфильтративнопневмонических изменений опухоли легкого обнаружены в 44% из
них, пневмонии — у 39%, инфильтративный туберкулез — у 17%. При этом следует подчеркнуть, что у всех этих больных не обнаружены характерные клинические проявления указанных заболева-
ний, иначе они были бы госпитализированы в соответствующие
iXii,
ильные клиники. До наступления в нашу клинику ошибочный
310
диагноз был установлен у 84% больных раком легкого. Это было обусловлено тем, что до поступления в диагностическое отделение инструментальные методы с последующим цитологическим исследованием биоптата не применялись. При раке легкого наиболее часто устанавливали неправильный диагноз хронической и реже — затяжной пневмонии. Ошибочный диагноз, установленный до поступления в диагностическое отделение у 64% больных инфильтративным туберкулезом и 9% больных пневмониями, был обусловлен недостаточно тщательным и полным бактериологическим исследованием. Если в настоящее время методики обнаружения возбудителя туберкулеза хорошо разработаны и внедрены в практику, выявление этиологического фактора при неспецифических воспалительных заболеваниях, в том числе затяжных пневмониях, сопряжено с большими трудностями и применяемые методики нельзя считать вполне разработанными.
Особую группу составляют больные с поражением IV и V сегментов легкого, которым раньше устанавливали диагноз «синдром средней доли». Понятно, что этот термин собирательный и не отражает этиологию заболевания.
В специальном исследовании, выполненном под нашим руководством, А. Б. Инсанов установил, что у 40% больных с поражением легкого был диагностирован туберкулез, у 32% — затянувшаяся или хроническая пневмония, у 23,5% — опухоли и у 3,9% — саркоидоз. При этом, как правило, развивался бронхостенотический синдром при различной этиологии заболевания с локализацией поражения в этих сегментах.
У больных с округлыми образованиями в легких диагностировали туберкулемы, периферический рак, значительно реже — доброкачественные опухоли легкого.
В диагностике туберкулем важное значение придавали анамнезу, наличию контакта с больными туберкулезом, перенесенному плевриту, наличию старых очагов в легких, положительной подкожной туберкулиновой пробе. Специфический или рубцовый эндобронхит, микобактерии туберкулеза и казеозный некроз в материале, полученном при бронхологическом исследовании, обнаружены у единичных больных. Методика, применяемая для установления диагноза у больных с округлыми образованиями в легких, подробно описана в литературе. Чаще всего округлые и шаровидные образования расположены в периферических отделах легкого. Решающее значение в диагностике таких образований имеют инструментальные методы — эндобронхиальная катетеризация или трансторакальная пункция при субплевральном расположении образования. Если при цитологическом и гистологическом исследованиях материала, полученного при биопсии, не удается получить четкий ответ, то, как правило, приходится выполнять открытую биопсию легкого и удаление пораженных участков легкого. По данным М. Г. Виннера и М. Л. Шулутко, при обследовании 2928 больных чаще всего обнаруживали туберкулемы (у 1793), периферический рак (у 779), доброкачественные опухоли (у 130), заполненные кисты (у 154) и др.
311
При определении этиологии полостных изменений в легких и дифференциальной диагностике каверны и полости абсцесса, реже распадающегося рака легкого, наиболее важную роль играют бактериологическое исследование мокроты, позволяющее определить инфекционный агент (микобактерии туберкулеза, вторичная флора), а также цитологическое исследование биоптата, в частности при распавшемся раке. Определенное значение имеют рентгеноконтрастные методы (селективная бронхография), особенно при врожденных кистах и бронхоэктатической болезни, которые при рентгенологическом исследовании могут «симулировать» полость распада — каверну. Исследование аспирационного материала, полученного путем направленной катетеризации бронхов в зоне поражения, увеличивает возможность определения этиологии заболевания; методика комплексного бронхологического исследования, в том числе при полостных изменениях в легких, хорошо разработана, результаты такого инструментального исследования в сочетании с данными, полученными при бактериологическом или цитологическом исследовании, имеют решающее значение в диагностике. И. П. Жингель при пристеночно расположенных полостях рекомендует производить трансторакальную пункцию с введением небольшого количества жидкости в полость, которую после извлечения подвергают лабораторному исследованию.
Диагностика диссеминированных поражений легких с последующим развитием диффузного пневмосклероза и эмфиземы сопряжена с большими трудностями. Несмотря на некоторое сходство рентгенологически выявляемых изменений в легких, у больных этой группы наблюдаются разнообразные заболевания, дифференциальная диагностика которых разработана недостаточно хорошо.
Диссеминированный туберкулез, который встречается в настоящее время не так часто, как раньше, характеризуется, как правило, хроническим течением, диагностика его обычно не вызывает затруднений. Вместе с тем при диагностике туберкулеза у некоторых больных возникают значительные затруднения. Это больные, у которых не обнаружены деструкция в легких, микобактерии туберкулеза и эндобронхит в крупных бронхах, туберкулиновые реакции у этих больных часто отрицательные. Диагноз у них может быть установлен на основании результатов цитологического и гистологического исследований биопсийного материала, иммунологических исследований, в том числе с применением провокационных туберкулиновых проб с подкожным введением туберкулина, а также «тест-лечения», т. е. химиотерапии с оценкой динамики изменений в легких на сериях рентгенограмм и томограмм.
В диагностике заболевания неопластического характера решающее значение имеют цитологическое и гистологическое исследования биопсийного материала, полученного при бронхологическом исследовании или путем игловой трансторакальной пункции. К этой группе относятся такие заболевания, как канцероматоз, альвеолярно-бронхиальный рак, метастазы аденомы щитовидной железы, медиастинально-легочная форма лимфогранулематоза.
312
Применяемые методы биопсий многочисленны и разнообразны. Высокоэффективными оказались эндобронхиально производимые внутриклеточные биопсии, трансбронхиальные и трансторакальные
пункции, что позволило значительно уменьшить частоту выполнения открытых биопсий легкого, которые в настоящее время производят
редко, так же как и диагностическую медианоскопию.
Так называемые редкие заболевания легких неизвестной этиологии также могут быть выявлены только на основании результатов цитологического и гистологического исследований биопсийного материала. К этой группе относятся эссенциальный гемосидероз, гистиоцитоз X, альвеолярный протеиноз, первичный легочный амилоидоз, альвеолярный микролитиаз и др.
Придавая большое значение биопсии в диагностике различных, в том числе редких заболеваний легких, мы считаем, что ее следует применять по строгим показаниям, отводя ей определенное место в схеме современного обследования больных. Результаты проведенных наблюдений позволяют считать наиболее результативными биопсии, выполняемые при заболеваниях неопластического характера и некоторых других, что подтверждается сопоставлением эффективности биопсий у наблюдавшихся больных. При подозрении на наличие заболеваний, отнесенных к этим группам, необходимо без промедления приступить к получению биопсийного материала и не
загружать диагностический процесс последовательным применением малоинформативных методов.
Дифференциальная диагностика гранулематозов и иммунопатологии основывается на результатах комплексного обследования больного. Чаще всего решающее значение имеют цитологическое и
гистологическое исследования биопсийного материала, а также иммунологические методы исследования. Наиболее изученное заболевание этой группы — саркоидоз органов дыхания. Число таких больных увеличивается: за сравнительно короткий отрезок времени
в нашей клинике диагноз саркоидоза органов дыхания установлен у 400 больных. Диагностика у части больных возможна при наличии ярких клинических проявлений заболевания, в том числе синдроме
Лефгрена, увеличения внутригрудных лимфатических узлов и дис-семинации в легких, при отрицательных или слабоположительных туберкулиновых реакциях. У 86% больных диагноз был верифици-
рован с помощью цитологического и гистологического исследований
биопсийного материала.
Вместе с тем мо
логическая верификация саркоидоза сопря
жена с определенными трудностями. Эпителиально-клеточные гра
нулемы, характерные для саркоидоза, встречаются при многих заболеваниях: туберкулезе, альвеолитах и др. Количество подобных заболеваний увеличивается. Кроме того, у 10 из 400 наблюдавшихся нами больных саркоидозом в эпителиально-клеточных гранулемах был обнаружен казеоз, у 8 — фибриноидный некроз гранулем, у 5 — микобактерии туберкулеза без каких-либо других признаков туберкулезного поражения. Такие находки усложняют диагностику, в связи с чем необходимо применять другие методы.
313
Сходство результатов цитологического исследования затрудняет дифференциальную диагностику саркоидоза легких и таких заболеваний, как идиопатический фиброзирующий альвеолит, группа интерстициальных пневмоний, или «пневмопатий», с различной клеточной реакцией: десквамативная интерстициальная пневмония, лимфоидная и гигантоклеточная интерстициальная пневмония, гранулематоз Вегенера, синдром Гудпасчера, фиброзирующий альвеолит при различных коллагенозах, например «ревматоидное легкое», а также хронический активный гепатит, токсический фиброзирующий альвеолит, развивающийся вследствие воздействия в легочную паренхиму различных токсичных веществ, в том числе различных лекарственных препаратов. Общий симптом этих заболеваний — появление легочной диссеминации или очаговоподобных изменений с последующим развитием пневмосклероза, эмфиземы и других изменений. При исследовании материала, полученного при биопсии легких, у таких больных нередко выявляют лимфоидно-плазмоцитарную инфильтрацию, эпителиоидные клетки, клетки типа Пирогова — Лангханса и другие элементы гранулемы, иногда с наличием
некроза.
Большое значение имеют данные иммунологического исследования (реакция бласттрансформации лимфоцитов с PPD и ФГА, а также исследование активности В-лимфоцитов, выявление антигенов и антител).
Наиболее разработана иммунодиагностика экзогенных аллергических альвеолитов, токсических, в том числе лекарственных, альвеолитов. Нам удалось получить специфические антигены, что позволяет установить диагноз и выделить клинические варианты заболеваний. Разработанные методы иммунологической диагностики аллергических (экстринсивных) альвеолитов — болезней голубево
дов и птицеводов — позволили организовать активное выявление альвеолита путем массовых обследований работников птицефабрик с применением комплексного метода, флюорографии, функционального исследования легких (скорость форсированного выдоха) и им-
мунологических методов (определение специфических антител ме-
тодом контриммуноэлект
ТаЛГл.
реза, реакции преципитации в геле по
Оухтерлони). Эта методика позволила выявить среди обследованных как больных, так и носителей антигена и антител группы риска.
Иммунодиагностика других заболеваний этой группы изучена недостаточно, поэтому необходима ее дальнейшая разработка с использованием более современных методик. В настоящее время про
водят интенсивное изучение диагностической ценности исследования бронхоальвеолярных смывов (БАС). Анализ цитологического состава БАС дает обнадеживающие результаты при таком заболевании, как саркоидоз, при котором в клеточном составе преобладают лимфоциты, в основном Т-клетки. Исследовательская работа в этом направлении продолжается с использованием электронной микроскопии, биохимических и иммунологических методов.
При обследовании больных с поражением внутригрудных лимфатических узлов (ВГЛУ) у большинства из них выявлены сарко
314
идоз, мелкие петрификаты в лимфатических узлах без признаков активности, свежие туберкулезные бронхоадениты, хронически текущий первичный туберкулез, адентогенный туберкулез как следствие реактивации с поражением легочной паренхимы.
В диагностике туберкулезного поражения ВГЛУ большое значение имели резко выраженные туберкулиновые реакции, выявление микобактерий туберкулеза в мокроте и материале, полученном при бронхологическом исследовании казеоза. Увеличение ВГЛУ может наблюдаться у больных с заболеваниями крови, например лимфо-лейкозом, злокачественными и доброкачественными опухолями, лимфогранулематозом.
При диагностике туберкулеза и других заболеваний легких со сходными клинико-рентгенологическими проявлениями, как правило, необходимо применить дополнительные и факультативные методы исследования. Выбор наиболее информативного из них опре
деляется в первую очередь клинико-рентгенологическими симпто-
мами: диссеминацией, инфильтративно-пневмоническими изменениями, округлыми и полостными образованиями, увеличением
ВГЛУ, наличием полостей в легких и др. Без применения инструментальных методов, исследования биопсийного материала, лабора-
торных методов (цитологического, бактериологического, иммуноло
гического, морфологического) дифференциальная диагностика и ус-
тановление диагноза на ранних этапах развития заболевания не-
возможны.
Крупные противотуберкулезные диспансеры в последние годы
стали консультативными лечебно-диагностическими центрами для многих амбулаторных больных с разной легочной патологией, на-
правляемых из лечебно-про4
илактических учреждений. В первую
очередь это больные, у которых заподозрен туберкулез, а также нуждающиеся в углубленном обследовании и дифференциальной
диагностике. В таких случаях нередко возникает необходимость в их госпитализации для проведения обследования в больничных ус-
ловиях. С этой целью в областных и крупных городских противотуберкулезных диспансерах созданы диагностические отделения, в которых могут быть применены дополнительные, в том числе инс
трументальные и факультативные, методы исследования.
В диагностическом отделении, кроме обследования с целью установления диагноза, значительной части больных проводят лечение. Исключение составляют больные, которым необходимы хирургиче
ское лечение, рентгено- и радиотерапия, а также некоторые другие категории больных, которым требуется проведение лечебных мероприятий в условиях специализированных учреждений онкологического, гематологического, ревматологического, аллергологического
оси
Накопленный опыт свидетельствует о том, что даже больным, которые должны быть переведены в хирургические, онкологические и другие учреждения, в период пребывания в диагностическом отделении необходимо провести симптоматическую, а иногда этиоло
гическую или патогенетическую терапию.
315
ГЛАВА 9
ЛЕЧЕНИЕ ТУБЕРКУЛЕЗА
9.1. ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ
Лечение больного туберкулезом — один из основных разделов фтизиатрии. Прогресс в этой области очевиден и проявляется в том* что в настоящее время удается добиться излечения не отдельных больных, а подавляющего большинства, особенно из впервые выявленных. Совершенствование терапевтической тактики можно проследить, рассмотрев развитие различных методов лечения больных туберкулезом.
Раньше всего получили признание такие методы лечения больных туберкулезом, как лечебное питание и общеукрепляющие процедуры
в виде рационально построенного режима труда и отдыха, в том числе санаторное и климатическое лечение. Эти методы были разработаны в конце прошлого и начале текущего столетия и в течение длительного периода времени были единственными в лечении больного туберкулезом. 3. П. Соловьев писал в 1924 г., что основой лечения туберкулеза являются улучшение условий труда, жилищных условий и питания, предоставление дополнительного отпуска. Если в западных странах диспансер существует на благотворительные средства, то в нашей стране он работает на государственной основе. В дополнение к диспансерам и ночным или дневным профилакториям
при промышленных предприятиях, осуществляющим лечение больных без отрыва от трудовой деятельности, была создана широкая сеть санаториев, в том числе в благоприятных климатических зонах,
в которых в полной мере осуществляли гигиено-диетическое лечение с использованием естественных климатических факторов.
Если в 20-е годы в санаториях применяли в основном режим покоя с максимальным щажением больного, то в последующем был разработан режим, предусматривающий постепенное увеличение на
грузки, использование элементов тренировки, включение гимнастики, спортивных игр и прогулок. В сочетании с рациональным пищевым рационом санаторное лечение и последующий гигиено-диетический режим позволяли добиваться излечения больных с ранними формами туберкулеза и стабилизации процесса у части больных с прогрессирующими формами заболевания (Н. Н. Гринчар, Ф. Г. Яновский, Л. И. Лапшин, В. Л. Эйнис, Л. В. Овсянников, Е. Д. Петров, И.
3. Собельман). В современных условиях санаторное лечение используют в основном при реабилитации больных туберкулезом, а также как метод, позволяющий сохранить трудоспособность у выздоравли
тпп
вающих и больных, у которых наступила стабилизация хронического процесса. С целью более быстрой и полной реабилитации в условиях
санатория разработаны режимы с включением трудовых процессов (III. А. Алимов).
В течение длительного периода времени — около 50 лет — основным методом лечения легочного туберкулеза была коллапсо-
316
терапия, т. е. лечебный пневмоторакс в сочетании с пневмоперито-неумом. В нашей стране внедрение в практику пневмоторакса связано с именами А. Н. Рубеля и А. Я. Штернберга — авторов первых руководств по искусственному пневмотораксу. Если на первом этапе
применение этого метода коллапса легкого достигали путем его сдавления введенным воздухом, то в последующем методика была
усовершенствована: стали вводить меньшее количество воздуха и
коллапс создавался путем активного сокращения эластического аппарата легкого (А. Е. Рабухин, В. А. Равич-Щербо, Ф. А. Михайлов, ф. В. Шебанов, А. С. Фурман). Лечение пневмотораксом проводили
в сочетании с мерами по профилактике осложнении и устранению
причин, препятствующих спадению легкого. Спадению легкого и
заживлению легочного процесса чаще всего мешали плевральные сращения, поэтому большинству больных, которым накладывали пневмоторакс, были необходимы плевроскопия и в последующем пережигание плевральных сращений (А. И. Лапшин, Л. К. Богуш, А. Г. Киселев, А. Н. Розанов). Наиболее частым осложнением пневмоторакса был пневмоплеврит с серозным и гнойным выпотом.
Профилактика и лечение пневмоплеврита являлись составной частью коллапсотерапии, и этому вопросу, а также лечебной тактике при
появлении пневмоплеврита было посвящено большое количество специальных работ (Ф. В. Шебанов, Б. М. Городецкий, А. Е. Рабу-
хин, А. Г. Хоменко). Следует отметить, что по мере совершенство
вания методики лечения пневмотораксом уменьшалась частота осложнений и нежелательных последствий коллапса. Особенно четко
это выявилось после внедрения в практику химиотерапии, что в конечном счете привело к значительному уменьшению числа больных, которым был необходим лечебный пневмоторакс.
Пневмоперитонеум в широкой практике стали применять значительно позже пневмоторакса. Разработка методики лечения этим методом в значительной степени связана с работами И. А. Шакленна, Ф. В. Шебанова и др. Применение щадящей методики, обеспечивающей избирательный коллапс благодаря активному сокращению легочной ткани, позволило комбинировать различные методы коллапсотерапии. В случае необходимости больным накладывали двусторонний пневмоторакс и комбинировали его с пневмоперитонеу-мом, что было возможно в основном при свежих формах туберкулеза, сохранении эластичности легочной ткани, а также у больных молодого возраста.
Наконец, необходимо отметить значение медикаментозной терапии туберкулеза, которая на разных этапах носила суженный или, наоборот, расширенный характер (по количеству применяемых медикаментов). Большую популярноть и распространение получило лечение раствором хлорида кальция (внутрь, внутривенно и подкожно) в сочетании с салицилатами или пирамидоном (амидопирином) и аскорбиновой кислотой. Как противовоспалительное и десенсибилизирующее средство эту комбинацию медикаментов применяли в течение длительного периода времени (в том числе по схеме, предложенной В. А. Воробьевым). Появление более мощных противовоспалительных
317
средств, в частности кортикостероидов, создало предпосылки для их применения у больных туберкулезом. Результаты экспериментальных исследований, проведенных Н. А. Шмелевым и О. А. Уваровой, а также клинических наблюдений показали, что кортикостероиды в сочетании с химиопрепаратами способствуют уменьшению экссудативного элемента воспаления.
Более длительную историю имеет туберкулинотерапия. Ни один метод лечения туберкулеза не сопровождался такими оптимистическими надеждами и разочарованиями, как туберкулинотерапия, впервые предложенная Р. Кохом. Д. А. Карпиловский, Ю. П. Коровина, Л. М. Яновская, Б. 3. Бунина рекомендовали использовать небольшие дозы туберкулина в качестве десенсибилизирующего и стимулирующего средства. В последующем Э. 3. Мирзоян предложил применять большие дозы препарата в сочетании с химиотерапией. Туберкулинотерапию с успехом применяют при торпидном течении туберкулезного процесса, замедленной регрессии и медленном развитии репаративных процессов, особенно при выраженной чувствительности к туберкулину. Многие стимулирующие средства (криза-нол, лимфа и др.) потеряли свое значение: в течение последних 30 лет их не применяют. В то же время появились другие стимулирующие средства — вакцина БЦЖ, тканевые препараты, АЦС, лидаза, продигиозан, ультразвук и др. (Ф. Л. Элинсон, К. Я. Келе-берда, М. И. Тараненко и др.). Арсенал медикаментов, которые рекомендуют применять как противовоспалительные и стимулирующие средства, непрерывно расширяется.
Наиболее важные достижения в лечении больных туберкулезом связаны с химиотерапией. Несомненно, получены положительные результаты в процессе поиска, испытания и внедрения в практику химиотерапевтических средств. Первые химиопрепараты появились в конце 40-х годов (стрептомицин, ПАСК, тибон). Затем были созданы фтивазид, изониазид и новые эффективные химиопрепараты — этионамид, канамицин, флоримицин, циклосерин, их гомологи (протионамид и др.). Внедрение этих средств в клиническую практику расширило возможности химиотерапии туберкулеза и позволило осуществлять выбор химиопрепаратов, наиболее показанных для лечения конкретных больных. Наконец, появились рифампицин и этамбутол — высокоэффективные препараты, позволяющие добиться терапевтического эффекта у наиболее тяжелобольных. Развитие химиотерапии туберкулеза в нашей стране связано прежде всего с работами Н. А. Шмелева и других сотрудников Центрального НИИ туберкулеза, а также с исследованиями других коллективов. Подробно изучены действие отдельных туберкулостатических препаратов на микобактерии туберкулеза в эксперименте и клинике, концентрации этих препаратов в сыворотке крови больных, динамика процессов заживления и терапевтический эффект (А. Е. Ра-бухин, В. И. Пузик, О. К. Уварова, Т. И. Козулицына, Г. А. Коротаев, В. В. Уткин, И. А. Смирнов, А. С. Мамолат и др.). Были разработаны наиболее рациональные схемы химиотерапии, получившие отражение в методических указаниях по химиотерапии туберкулеза.
318
Современная химиотерапия создала возможность лечения больных не только с ограниченными, свежими формами туберкулеза, но и с тяжело протекающим, распространенным процессом, рецидивами заболевания, а также туберкулезом в сочетании с другими заболеваниями, в том числе у лиц пожилого и старческого возраста.
Следует подчеркнуть, что лечение больного туберкулезом остается сложной проблемой, несмотря на несомненный прогресс в этой области. Очевидна необходимость применения комплекса лечебных методов, что позволяет использовать все существующие возможности для излечения больных туберкулезом. Если имеются методы, которые позволяют добиваться излечения, значит, не только в клиниках, но и во всех учреждениях здравоохранения должна быть использована лечебная тактика, приводящая к закономерному излечению подавляющего большинства больных туберкулезом. Это — доктрина, которая широко проводится в жизнь, и в связи с этим важно определить понятие «излечение». От определения этого понятия зависит цель, которой добиваются при лечении больного. Прежде всего нужно отметить принципиально разный подход к этому понятию разных специалистов. Определение этого состояния возможно с клинических и бактериологических позиций. В нашей стране используется клинический подход к определению понятия «излечения» (В. Л.Эйнис, А. Е. Рабухин, Н. А. Шмелев). С клинических позиций понятие «излечение» можно определить как стойкое заживление туберкулезных изменений благодаря развитию репаративных процессов, сопровождающееся полной ликвидацией всех клинических проявлений заболеваний. К этому нужно добавить, что возможно излечение без выраженного анатомического дефекта и с наличием определенного дефекта. Очень важно также подчеркнуть, что излечение может не сопровождаться нарушениями функциональных и обменных процессов, но у отдельных больных, несмотря на наступившее заживление, возможно снижение функциональных показателей. Чаще всего функциональные нарушения после излечения наблюдаются у больных, у которых заживление происходило при наличии выраженных анатомических дефектов.
За рубежом многие ученые применительно к больным из развивающихся стран, а в последнее время и к больным из экономически высокоразвитых стран при характеристике эффективности лечения и при определении понятия «излечение» используют не клинические, а бактериологические критерии. К излеченным больным они относят лиц, у которых полностью прекращается бактериовыделение (W. Fox, Bignail, Ziersky).
Изучение материалов международных конгрессов показывает, что в течение последних 5 лет почти во всех докладах зарубежных специалистов в качестве основного критерия оценки эффективности лечения используют стойкое прекращение бактериовыделения, подтвержденное результатами серии микроскопических исследований и посевов мокроты, проведенных в течение всего периода лечения. Этот критерий, несомненно, имеет большое значение при оценке эффективности лечения, но, к сожалению, у многих больных, у
319
которых перестали выделяться микобактерии туберкулеза, может сохраняться активный, в том числе деструктивный, туберкулезный процесс.
В связи с использованием разных критериев излечения принципиально различаются цели лечения. При клиническом подходе к оценке эффективности лечения больного или какой-то группы больных основная задача врача — добиться полной ликвидации клинических проявлений болезни, стойкого заживления туберкулезных изменений в пораженном органе благодаря развитию репаративных процессов и способствовать максимальному восстановлению нарушенных функций организма больного. За рубежом многие фтизиатры, особенно в развивающихся странах, при лечении больных туберкулезом ставят только одну задачу — добиться стойкого прекращения выделения микобактерий.
Для того чтобы добиться клинико-анатомического излечения, нужно применить комплекс методов, при этом очень важно соблюдать основные принципы лечения, чтобы использовать их наиболее рационально. Основные принципы лечения больного туберкулезом заключаются в следующем.
1. Лечение должно быть ранним или по крайней мере своевременным. В последние годы возникли сомнения в справедливости этого положения. В связи с прогрессом в области разработки различных методов лечения появилось мнение о возможности вылечить от туберкулеза любого больного. Это ошибочное мнение. Еще в 1964 г. мы отмечали, что хронический фиброзно-кавернозный туберкулез — это по существу необратимая форма туберкулеза, которая очень плохо поддается химиотерапии, и больные с данной формой заболевания могут быть излечены в основном с помощью хирургических методов. Это положение справедливо и в настоящее время, так как далеко не всех больных фиброзно-кавернозным туберкулезом можно вылечить с помощью химиопрепаратов, если излечением считать не только прекращение выделения микобактерий, но и ликвидацию туберкулезного процесса.
При проведении лечения в течение более чем 1 года у некоторых больных не удается добиться даже ликвидации бактериовыделения, в основном вследствие прогрессивно нарастающей лекарственной резистентности ко многим препаратам, т. е. полирезистентности.
Цирротический туберкулез также является необратимой формой; вылечить такого больного можно при наличии у него цирроза одного легкого или доли, если имеется возможность удалить пораженное легкое или долю. Это излечение с анатомическим дефектом. Следовательно, принцип раннего и своевременного лечения сохраняет свое значение и в настоящее время. Необходимо выявлять больных туберкулезом на ранних этапах туберкулезного процесса, когда их можно вылечить: чем позже установлен диагноз, тем меньше шансов на излечение.
2. Лечение больного туберкулезом должно быть длительным, так как в настоящее время еще не удалось разработать такие методы, которые позволили бы добиться излечения в короткие сроки. При
320
успешном лечении больной туберкулезом выздоравливает в среднем через 1 год после начала терапии. Излечение некоторых больных наступает раньше, особенно при ограниченных, малых формах туберкулеза, но есть больные, которых нужно лечить 2—3 года, прежде чем наступит выздоровление. При этом можно проследить четкую связь между степенью запущенности туберкулезного процесса и длительностью лечения: чем больше запущен туберкулезный процесс, тем более длительным должно быть лечение. Уменьшение продолжительности лечения больных туберкулезом — актуальная научная проблема, но решить ее пока не удается.
3. Необходима преемственность в лечении больных туберкулезом, связанная с необходимостью его длительного проведения. Почти каждому больному туберкулезом приходится проходить лечение в нескольких лечебных учреждениях: 1) лечение в диспансере в период выявления туберкулезного процесса, когда устанавливают диагноз и разрабатывают программу лечения; 2) больнично-санаторное лечение; 3) амбулаторное лечение в течение первых лет наблюдения в противотуберкулезном диспансере.
Преемственное лечение должно основываться на двух принципах. Во-первых, необходимо соблюдать принцип врачебной деонтологии; в присутствии больного не допускаются критические замечания в адрес врачей или учреждений, в которых ранее проводилось лечение, и обеспечивается полный контакт с больным (с этих позиций всех больных условно можно разделить на контактирующих и не контактирующих с врачами). Во-вторых, лечение необходимо проводить в соответствии с определенной доктриной. Соблюдение основных принципов лечения в соответствии с составленной программой или планом и необходимой индивидуализацией лечебной тактики составляет доктрину лечения больных туберкулезом.
4. Лечение больного туберкулезом должно быть комплексным, т. е. предусматривать применение сочетания различных методов, необходимых для достижения излечения. В комплекс лечебных методов входит прежде всего химиотерапия — основной метод лечения больных туберкулезом. На втором месте — патогенетические медикаментозные методы, применяемые с целью нормализации нарушенных функций макроорганизма: уменьшения степени выраженности воспалительной реакции, стимулирования процессов заживления, устранения обменных нарушений. В связи с этим почти каждому больному, которому проводят химиотерапию, приходится назначать патогенетическое лечение.
Для осуществления патогенетической терапии применяют различные средства, прежде всего противовоспалительные, т. е. средства, способствующие уменьшению воспалительного процесса и ликвидации экссудативной фазы воспаления. К противовоспалительным средствам относятся кортикостероиды и ряд других лекарственных препаратов, уменьшающих воспаление. Вторая группа — препараты, стимулирующие процессы репарации (туберкулин, БЦЖ, лидаза, пирогенал и др.). Третья группа средств направлена на устранение обменных нарушений: проводят витаминотерапию, так как в связи
11—1213
321
с лечением химиопрепаратами иногда усугубляются нарушения витаминного баланса и даже наблюдаются клинические проявления гиповитаминоза. Кроме витаминов, широко применяют анаболические гормоны и другие лекарственные средства, способствующие нормализации обменных процессов1. Наконец, к патогенетическим относятся средства, устраняющие различные функциональные нарушения (нарушения дыхания, функций сердца, почек, печени и т. д.), приводящие к прекращению кровохарканья и других проявлений туберкулеза. Словом, это большая группа лекарственных средств, используемых в клинике туберкулеза.
В комплекс методов лечения туберкулеза входит также коллап-сотерапия, т. е. лечебный пневмоторакс и пневмоперитонеум. В настоящее время коллапсотерапию применяют очень редко и у сравнительно ограниченной группы больных. Ее используют как дополнение к химиотерапии в тех случаях, когда имеются все основания считать, что она окажется неэффективной: при лекарственной резистентности, полной непереносимости химиопрепаратов, а также при каких-то особых обстоятельствах, например беременности, когда нет возможности применить необходимые химиопрепараты из-за возможного тератогенного действия. Коллапсотерапию можно применить для остановки кровохарканья, если другой метод не дает эффекта. Однако число лиц, которым показана коллапсотерапия, очень ограничено, так как тех, кого можно было вылечить с помощью коллапсотерапии, мы излечиваем с помощью химиотерапевтических
средств.
Наконец, последняя группа методов — оперативные вмешательства, которые производят, естественно, не всем больным, а только по соответствующим показаниям. Следует подчеркнуть важность этих методов при некоторых, особенно хронических деструктивных, формах туберкулеза, эмпиемах, разрушенном легком и ряде других проявлений туберкулеза.
В лечении больного туберкулезом большое значение имеет гигиено-диетический режим. Режим назначают в соответствии с состоянием больного и изменяют по мере его улучшения и ухудшения. Неправильно считать, что вылечить больного туберкулезом можно только с помощью медикаментов и патогенетических средств. Образ жизни и характер питания больного играют очень важную роль в
процессе излечения.
Проводя лечение больного туберкулезом, нужно не только выбирать необходимые методы лечения в соответствии с показаниями, но и применять их в наиболее рациональных организационных формах. Стратегия лечения определяется не только существующими
методами лечения, но и возможностями для их применения.
Одна из наиболее важных п{
лем организации лечебной помощи
больным туберкулезом — решение вопроса о том, госпитализировать
Четвертую группу составляют иммуномодуляторы (тактивин, тимолин, ри-бомунил и др.) — средства, устраняющие иммунологические нарушения и стимулирующие функцию макрофагов.
322
ли больного и проводить лечение в больничных условиях или осуществлять терапевтические мероприятия только в порядке амбулаторной помощи. За рубежом, в развивающихся странах, проводят в основном амбулаторное лечение. В последние годы такую тактику начали применять и в экономически высокоразвитых странах Западной Европы. В 9-м докладе Комитета экспертов ВОЗ по туберкулезу рекомендуется проведение лечебной помощи только в амбулаторных условиях. Такая практика не поддерживается в нашей стране, так как, согласно принятой доктрине, стационарное и амбулаторное лечение не противопоставляются друг другу, а являются этапами длительного процесса лечения больных туберкулезом.
Наиболее важно не допустить, чтобы больные преждевременно прекратили лечение (при проведении его как в условиях больницы, так и амбулаторно), поскольку это может привести к обострению и прогрессированию туберкулезного процесса.
Для применения рациональных организационных форм лечения необходимы наличие сети противотуберкулезных учреждений, современный уровень их материально-технического оснащения и лечебно-диагностического оборудования, укомплектованность этих учреждений хорошо подготовленным персоналом, проведение всего комплекса лечебных мероприятий в соответствии с основными принципами лечения, т. е. принятой доктриной. Нужно подчеркнуть, что лечение больных туберкулезом может быть организовано со
гласно унитарной программе, когда существует единственная форма проведения лечения и медицинский персонал, больные не имеют
возможности проводить лечение по какой-либо другой организационной форме. Трудно принять такой принцип, мы — противники применения унитарной тактики при лечении всех больных туберкулезом. Общие принципы лечения универсальны, они могут и должны быть применены при лечении любого больного туберкулезом, но конкретно лечебную тактику нужно использовать дифференцированно. Девятый комитет экспертов ВОЗ по туберкулезу, так же
как и 8-й, вновь провозгласил принцип унитарного подхода и ре-
комендует амбулаторное лечение в качестве единственной рациональной организационной формы лечения. Однако, по нашему мне
нию, более правильным нужно считать дифференцированный подход
к выбору методики и организации лечения. Среди всех больных,
нуждающихся в лечении, выделяют группу впервые выявленных, ранее не леченных больных и группу больных, уже получавших лечение по поводу туберкулеза, в которую входят больные с рецидивами и хроническими формами туберкулеза. Конкретная лечебная
тактика должна быть дифференцированной прежде всего примени-
тельно к этим группам. Внутри этих групп также необходим индивидуальный подход к выбору как методики, так и организационных форм лечения в соответствии с конкретно существующими
условиями.
Таким образом, излечение больных туберкулезом — сложная задача, для решения которой требуются соблюдение основных принципов лечения и длительный период времени. Процесс заживления
11*
323
можно разделить на определенные этапы. Первый этап — ликвидация клинических проявлений заболевания в процессе лечения. В современных условиях, когда у подавляющего большинства больных туберкулезом клинические проявления болезни весьма скудные, слабовыраженные, ликвидировать их удается, как правило, быстро. Под влиянием лечения сравнительно быстро восстанавливается субъективное ощущение здоровья, и буквально через несколько недель после начала лечения у больных может создаться впечатление, что наступило выздоровление. Быстрая ликвидация клинических проявлений болезни, с одной стороны, фактор благоприятный, но, с другой стороны, при этом затрудняется продолжение лечения, так как его следует проводить при субъективно хорошем состоянии. Однако при субъективно хорошем или удовлетворительном состоянии больные иногда отказываются от дальнейшего лечения, особенно если это оперативное вмешательство, и применения сложных диагностических методов. Некоторые больные прекращают лечение, уходят из больниц и санаториев, не посещают поликлиники. В такой ситуации требуется, чтобы врач сумел убедить больного в том, что, несмотря на хорошее самочувствие, необходимо продолжать лечение, а это сложно, и в этом одна из трудностей лечения больных туберкулезом в современных условиях.
Второй этап процесса излечения заключается в инволюции развившихся воспалительных изменений. Естественно, при успешном лечении инволюция туберкулезного процесса начинается сравнительно быстро, но сам процесс инволюции и развития репаративных изменений длительный — несколько месяцев, а иногда и несколько лет. Именно вследствие того, что процесс инволюции развивается медленно, а клинические симптомы болезни исчезают быстро, создается противоречивая ситуация: с одной стороны, ликвидируются клинические проявления заболевания, а с другой — у больного сохраняется активный туберкулезный процесс. Процесс инволюции характеризуется прежде всего ликвидацией воспалительного процесса и постепенным развитием репаративных изменений. Так, второй этап процесса заживления постепенно переходит в третий — этап развития репаративных процессов, или иначе говоря, заживления.
Заживление характеризуется тем, что полностью исчезают или значительно уменьшаются воспалительные изменения, ликвидируются деструктивные изменения, образовавшийся казеоз или частично рассасывается, или инкапсулируется, т. е. иными словами, на третьем этапе ликвидируется туберкулезный процесс и развиваются различные остаточные изменения. Характер этих изменений очень важен для процесса заживления, так как стойкость результатов лечения в значительной мере зависит от того, что осталось у больного после лечения. Самым благоприятным исходом является полное рассасывание, по терминологии В. Л. Эйниса, restituio ad integrum, заживление без следа, правильнее, заживление без видимого следа, т. е. без видимых остаточных изменений, так как если исследовать участки легкого или другого органа, в котором имелся туберкулезный
324
процесс, под микроскопом, то можно обнаружить остаточные изменения, но в клинике у больных, перенесших туберкулез, порой действительно не удается выявить никаких остаточных изменений.
На месте туберкулезного процесса могут остаться линейные или звездчатые рубцы, а также более выраженные фиброзные изменения. Это второй тип остаточных изменений. Третий тип — наличие одиночных или множественных остаточных очагов. Данный тип заживления менее благоприятный, потому что в этих очагах могут сохраняться казеоз, остаточная воспалительная реакция и микобактерии. При наличии подобных остаточных изменений обострения и
рецидивы возникают чаще, чем при первом и втором типах остаточных изменений.
Остаточные изменения могут быть более грубыми, более выра
женными, они выражаются в развитии индуративных полей, инду-ратов, фиброза, деформации и дезорганизации легочной ткани, эм
физемы. Это уже выраженные остаточные изменения, причем у отдельных больных они не сопровождаются никакими клиническими
проявлениями, т. е. имеются морд:
ОСЕ
логические изменения без кли-
нических проявлений. Наконец, остаточные изменения могут быть настолько выраженными, что проявляются клинически. Это так называемый метатуберкулезный синдром. У больного могут остаться бронхоэктатические изменения, вследствие чего сохраняются ка
шель, выделение мокроты, периодически отмечается кровохарканье, при выраженных цирротических изменениях могут быть периодические вспышки, обусловленные смешанной инфекцией, может со
храняться интоксикация как следствие длительно протекающего воспалительного процесса. При наличии остаточных полостей возможны их нагноение, аспергиллез. Все это — метатуберкулезный синдром, т. е. сочетание морфологических изменений и клинических проявлений, обусловленных этими остаточными изменениями.
Таким образом, для больного совсем не безразлично, как будут
развиваться репаративные процессы, чем они закончатся, останутся на месте патологического процесса незначительные или грубые изменения. Течение репаративных процессов и характер остаточных изменений влияют на состояние здоровья лиц, болевших туберкулезом, в дальнейшем, однако, следует подчеркнуть, что заживление или развитие репаративных процессов еще не означает излечения больного туберкулезом легких. Туберкулезный процесс — это не болезнь какого-то одного органа, а общее заболевание, характеризующееся не только развитием воспалительных изменений в том или ином органе, но и нарушениями обменных процессов, функций различных органов и систем, поэтому об излечении можно говорить лишь в том случае, если не только развивается репаративный процесс, но и восстанавливаются нарушенные функции. Это четвертый этап — нормализация нарушенных функций организма бального.
Нужно отметить, что это длительный процесс: после того как ликвидирован воспалительный процесс, развились репаративные изменения, нарушения функций еще сохраняются в течение некоторого времени. Еще на 5-м Всесоюзном съезде врачей-фтизиатров, на
325
котором обсуждалась проблема излечения туберкулеза, В. Л, Эйнис подчеркивал, что эти нарушения функций у больного туберкулезом иногда могут сохраняться довольно долго. У многих больных нарушенные функции в конце концов восстанавливаются, а у некоторых — нет. У кого же не удается ликвидировать нарушения функций? Главным образом у больных, у которых сохраняются выраженные остаточные изменения. Например, у таких больных могут сохраниться легочное сердце, эндокринопатия, стойкое нарушение функции почек, особенно если на высоте болезни развился нефрит,
или амилоидоз внутренних органов, т. е. сохраняющиеся остаточные
МО
логические изменения поддерживают такое состояние, когда
функции уже не нормализуются. Вследствие этого у некоторых больных действительно так и не происходит полное восстановление нарушенных функций, но у многих больных со временем наступает
излечение, которое характеризуется как заживлением местного воспалительного процесса, так и нормализацией функций организма.
Как правило, у подавляющего большинства больных, перенесших туберкулез, сохраняются аллергия и состояние сенсибилизации. Иными словами, изменившаяся в процессе заболевания реактивность почти никогда не возвращается в исходное состояние. Из этого не следует делать вывод, что состояние иммунобиологической реактивности у больных туберкулезом не меняется. У них изменяется иммунитет: перед возникновением заболевания, естественно, иммунитет снижается, поэтому развивается туберкулез, по мере же выздоровления, особенно после того, как наступает инволюция тубер
кулезного процесса и развиваются репаративные процессы, иммунитет повышается, и в последующем такой человек туберкулезом не болеет. После перенесенного туберкулеза иммунитет повышается и реактивация остаточных изменений не происходит. В случае повторного попадания микобактерий в организм человека извне, при суперинфекции, туберкулез у большинства инфицированных не развивается. Чем это обусловлено? Это обусловлено высоким уровнем иммунитета после перенесенного туберкулеза.
Кроме иммунитета, важную роль в иммунобиологической реактивности играет специфическая сенсибилизация, или, как теперь
ее принято называть, повышенная чувствительность замедленного типа (ПЧЗТ). У больных туберкулезом уровень специфической сенсибилизации тоже меняется как на высоте заболевания, так и в последующем, после развития репаративных процессов. У одних больных, перенесших туберкулез, надолго сохраняется гиперергия, общая гиперсенсибилизация, которая проявляется или высокой чувствительностью к туберкулину, или другими признаками, характеризующими иммунобиологическую реактивность.
В настоящее время существует много тестов, которые характеризуют реактивность. Это комплекс исследований, которые пока применяют лишь в условиях клиники. Если применить этот комплекс исследований, то у некоторых излеченных от туберкулеза можно констатировать сохранение гиперергии. Это бывает нечасто, лишь у части больных туберкулезом легких, но врач должен обратить
326
внимание на сохраняющуюся гиперергию. Почему? Потому что состояние гиперергии может привести к возникновению различных клинических проявлений у лиц, перенесших туберкулез. У них может развиться бронхиальная астма, а впоследствии наблюдаться плохая переносимость разных лекарственных препаратов. У таких лиц периодически могут возникать клинические проявления гиперергии в виде отека Квинке, кожных высыпаний, блефарита, конъюнктивита, аллергического насморка и т. д. К счастью, у подавляющего большинства лиц, перенесших туберкулез, уровень гиперергии невысокий и мы обозначаем его термином «нормергия», т. е. это аллергическое состояние, измененная иммунобиологическая реактивность, но проявляющаяся на более низком уровне, в частности положительной туберкулиновой реакцией. У каждого больного, перенесшего туберкулез, как правило, почти в течение всей жизни сохраняется положительная туберкулиновая реакция.
У некоторых больных может наступить так называемое биологическое излечение, которое характеризуется тем, что исчезает специфическая сенсибилизация, туберкулиновая реакция становится отрицательной. Такой исход наблюдается пока еще очень редко, как правило, только у лиц, переносящих первичную туберкулезную инфекцию, вторичный туберкулез обычно так не завершается. Этот исход отмечается главным образом у тех больных, лечение которых начато на самых ранних этапах туберкулезного процесса. О биологическом излечении мы говорим в тех случаях, когда не только исчезают клинические проявления заболевания, наступает заживление местных изменений, происходит нормализация нарушенных функций, но и наступает так называемая реверсия туберкулиновых реакций, т. е. туберкулиновая реакция, которая в процессе болезни стала положительной, становится отрицательной. Биологическое излечение описано и у отдельных больных, перенесших вторичный туберкулез, но это единичные случаи,
В том случае, если после биологического излечения происходит заражение туберкулезом, то снова развивается первичный туберкулез, который в настоящее время принято называть реинфекционным (новое звучание старого термина). Реинфекционный туберкулез — термин, который был предложен очень давно, но от него отказались, потому что в прежние годы не наступало биологического излечения. Возникает вопрос, почему в настоящее время так редко наступает биологическое излечение, почему излечение туберкулезного процесса в основном характеризуется лишь развитием репаративных изменений, исчезновением клинических проявлений, нормализацией нарушенных функций. На этот вопрос удалось получить ответ. Дело в том, что состояние сенсибилизации поддерживается персистирующими микобактериями. Это микобактерии, которые сохранялись, выжили в организме человека, несмотря на все те неблагоприятные условия для их жизнедеятельности, которые создавались в процессе лечения. Персистирующие микобактерии, т. е. переживающие, сохраняющиеся в организме человека, находятся в остаточных очагах. В одних случаях это обычные микобактерии, в других — L-формы
327
микобактерии, иногда «обломки микробных клеток», т. е. по суще* ству антиген, оставшийся вследствие разрушения микобактерий. Микобактерии могут находиться в дремлющем состоянии, т. е. не размножаются, пребывают как бы в состоянии парабиоза на грани жизни и смерти, но тем не менее все, что остается от бактериальной популяции, вызвавшей туберкулез, поддерживает иммунобиологическое состояние сенсибилизации.
Процесс излечения больных туберкулезом непростой, он характеризуется очень сложными изменениями как в организме больного, так и в бактериальной популяции. Два эти элемента, изменяющиеся в процессе излечения, нельзя рассматривать в отрыве друг от друга. В 50-х годах А. Д. Сперанский и многие другие специалисты в области патологии считали, что микробный фактор — это лишь пусковой механизм, который вызывает заболевание, а затем уже не играет важной роли; в дальнейшем наблюдается цепь причин и следствий, микробный фактор отступает на второй план, поэтому лечение должно быть только патогенетическим, направленным на нормализацию функций организма, нарушенных в процессе болезни. Оказалось, что эта концепция ошибочна, микробный фактор, бактериальная популяция играют важную роль в течение всего заболевания и даже после ликвидации заболевания. После того как развиваются репаративные процессы, сохраняющиеся антиген и персистирующие формы микобактерий поддерживают состояние гипер-ергии или сенсибилизации у большинства лиц, излеченных от туберкулеза.
В настоящее время проблему излечения обычно рассматривают с двух точек зрения, говорят о двух аспектах проблемы излечения: первый аспект — клинический, второй — эпидемиологический. Клинический аспект проблемы излечения предусматривает выбор методики лечения и показаний к применению тех или иных методов, прогнозирование исхода туберкулезного процесса и в какой-то степени решение вопроса об организации лечения больных туберкулезом. Эпидемиологический аспект проблемы излечения рассматривается главным образом с точки зрения эпидемиологического эффекта от проводящихся лечебных мероприятий, а именно: как проводимое лечение влияет на распространенность туберкулеза среди населения, в том числе на уменьшение числа больных туберкулезом. Для осуществления лечения больных туберкулезом в широких масштабах, учитывая клинические и эпидемиологические аспекты этой проблемы, в последнее время принято проводить лечебные мероприятия в соответствии с заранее составленной программой. Таким образом, программа лечения больных туберкулезом представляет собой часть, раздел национальной программы борьбы с туберкулезом. Программу лечения больных туберкулезом строят прежде всего по целевому принципу, следовательно, должна быть сформулирована основная цель проведения лечебных мероприятий.
Основной целью лечебной программы, как отмечалось ранее, является клиническое излечение больных с обратимыми формами туберкулеза, а в случае отсутствия возможности достичь этого при 328
далеко зашедших, запущенных процессах — стабилизация процесса и прекращение выделения микобактерий.
Показания. Лечение должно быть проведено всем нуждающимся в этом больным туберкулезом. В первую очередь лечебной помощью должны быть обеспечены три основные группы больных: 1) впервые выявленные; 2) с наличием рецидива; 3) с хроническими формами туберкулеза, находящиеся под наблюдением противотуберкулезных диспансеров.
Проведение лечебных мероприятий всем нуждающимся, в первую очередь указанным выше контингентам, должно быть обеспечено системой контроля на всех этапах лечения.
Методика лечения. В программе этот раздел имеет особое значение. Он должен представлять собой набор методических документов, содержащих рекомендации по применению основных методов лечения.
Организационные формы лечения. С целью максимально рационального использования существующих лечебных учреждений должна быть составлена рабочая инструкция с учетом местных возможностей, в которой указывают порядок направления больных в соответствующие лечебные учреждения с учетом преемственности в проведении больнично-санаторного и амбулаторного лечения. При этом в рабочей инструкции должны быть предусмотрены контингенты больных, направляемых в те или иные учреждения и получающих лечение по месту жительства с учетом необходимых организационных форм. Следует также рассчитать нагрузку каждого лечебного учреждения с целью наиболее рентабельного их использования в соответствии с существующими нормативами.
Осуществляют расчет, подготовку и обеспечение длительности материально-технической базы, т. е. всех лечебных учреждений, осуществляющих лечение больных туберкулезом, как всеми материалами и средствами для их работы, так и медикаментами, рентгеновскими пленками, реактивами и др., необходимыми для диагностической и лечебной работы. Кроме того, должны быть предусмотрены мероприятия по обеспечению лечебных учреждений кадрами, а также их подготовке и повышению квалификации.
Необходим примерный расчет результатов всех лечебных мероприятий, т. е. прогноз терапевтической эффективности и влияния проводящегося лечения на численность контингентов, состоящих на учете в противотуберкулезных диспансерах, их движение в связи с переводом из одной группы в другую, а также показатели смертности и летальности.
Система отчетности. При оценке фактически достигнутых результатов лечения и их влияния на эпидемиологические показатели очень важно предусмотреть использование объективных, стандартных показателей, отражающих как результаты лечения, так и эпидемиологические аспекты влияния проводящихся лечебных мероприятий на распространенность туберкулеза. Следует подчеркнуть, что программа лечения больных туберкулезом может быть унитарной, т. е. жесткой, не допускающей отклонения от запрограммиро
329
ванного метода лечения и организационных форм. Такого рода унитарные программы осуществляют в развивающихся странах. В этих программах предусматривается, например, только амбулаторная химиотерапия, а часто и единственно возможная комбинация химиопрепаратов — изониазид и тиоацетазон.
В отличие от унитарной может быть использована и более гибкая программа, предусматривающая различные методы и организационные формы лечения разных контингентов больных. В каждой стране даже при наличии одного и того же контингента больных возможно применение разнообразных методов и организационных форм в зависимости от индивидуальных особенностей течения туберкулезного процесса, личности больного, служебных и домашних обстоятельств и других факторов.
9.2. ОСНОВНЫЕ ПРИНЦИПЫ ХИМИОТЕРАПИИ
Химиотерапия заняла основное место в лечении больных туберкулезом. Накоплен большой опыт применения химиотерапевтических препаратов, который позволил разработать основные принципы химиотерапии больных туберкулезом.
Терапевтический эффект химиотерапии обусловлен антибактериальным действием химиотерапевтических препаратов на микобактерии туберкулеза. Выраженность терапевтического эффекта зависит, с одной стороны, от свойств применяемых химиотерапевтических средств, в первую очередь от их туберкулостатической активности, а с другой — от состояния бактериальной популяции, находящейся в состоянии взаимодействия с макроорганизмом, различных свойств микобактерий, в том числе от их чувствительности к химиопрепаратам. Необходимо подчеркнуть, что при проведении химиотерапии бактериостатическое воздействие химиотерапевтических препаратов на микобактерии туберкулеза происходит в организме больного человека, и в этих условиях отмечается влияние химиопрепаратов не только на микобактерии туберкулеза, но также на различные органы и системы больного человека.
Таким образом, терапевтический эффект прежде всего зависит от бактериостатической активности применяемых химиопрепаратов. Наиболее высокой бактериостатической активностью обладает изониазид, который в настоящее время является основным химиотерапевтическим средством при лечении больных туберкулезом, особенно впервые выявленных.
Второе место по бактериостатической активности занимает рифампицин, остальные химиотерапевтические препараты располагаются следующим образом: стрептомицин, канамицин, пиразинамид, этионамид (протионамид), этамбутол, флоримицин (биомицин), ПАСК. При применении туберкулостатических препаратов в клинической практике следует иметь в виду, что уровень бактериостатической концентрации препарата в значительной степени зависит от вводимой в организм больного дозы. В связи с этим при проведении химиотерапии большое значение имеют правильный выбор химио
330
препаратов с учетом их туберкулостатической активности и применение их в оптимальной суточной дозе.
Суточную дозу химиопрепаратов можно вводить в один прием или разделить на несколько приемов, например, так применяют ПАСК, тиоацетазон, пиразинамид. Суточную дозу таких средств, как этионамид (протионамид) и циклосерин, вводят в основном по частям — 2 или 3 раза в сутки из-за их токсичности. Ряд препаратов, таких как изониазид, рифампицин, стрептомицин, канамицин, этам-бутол, биомицин (флоримицин), применяют однократно в течение суток, т. е. всю суточную дозу вводят в один прием. Это позволяет медицинскому персоналу лучше контролировать прием химиопрепаратов, а главное, при этом создается высокая концентрация химиопрепарата в сыворотке крови.
Следует отметить, что отдельные химиопрепараты можно вводить
не только внутрь или внутримышечно, но и внутривенно в виде капельных вливаний или струйно шприцем. Возможно введение растворов химиопрепаратов в виде внутрибронхиальных вливаний или ингаляций аэрозолей, а также ректальное введение в виде
медикаментозных клизм или свечей.
НМ
ективность химиотерапии во многом зависит от ее длитель
ности. Если в период появления первых химиопрепаратов продолжительность лечения была сравнительно небольшой — 1—3 мес,
то в последующем длительность химиотерапии постепенно увеличивалась и достигла 9—12 мес.
Подходы к лечению больных туберкулезом в последние годы претерпели некоторые изменения. Была научно обоснована возможность краткосрочной (6 мес) программной химиотерапии, менее дорогостоящей и по эффективности не уступающей использовавшейся ранее более длительной (9—12 мес) химиотерапии.
В соответствии с Руководящими принципами для национальных программ по лечению туберкулеза, предложенными ВОЗ, выделяют следующие четыре категории больных.
К первой относят больных с впервые выявленным легочным туберкулезом с положительными результатами исследования на микобактерии и вновь выявленные больные с тяжелыми формами туберкулеза.
Вторая категория — лица с рецидивом болезни и те, у кого лечение на первом этапе не дало ожидаемого эффекта сохраняющееся бактериовыделение.
К третьей категории могут быть отнесены больные, страдающие легочным туберкулезом с ограниченным поражением и имеющие отрицательные мазки мокроты, а также больные с внелегочным туберкулезом, не отнесенные к категории I.
К четвертой категории отнесены больные хроническим туберкулезом.
Режимы химиотерапии определяются в зависимости от принадлежности больных к той или иной категории.
Необходимо подчеркнуть, что в течение всего лечения больные должны регулярно принимать химиопрепараты. Их вводят больному
331
ежедневно, особенно на первых этапах лечения, а затем можно применить интермиттирующий метод — 2 раза или даже 1 раз в неделю. Этот принцип основывается на последействии ряда химиопрепаратов, которые оказывают сильное бактериостатическое действие на микобактерии не только при их высокой концентрации в сыворотке крови, но и в течение 2 дней и более после их выведения
из организма.
В последние годы введено понятие «режим химиотерапии»; под ним подразумевают выбор определенной комбинации химиопрепаратов, их дозы, кратность введения в организм больного (суточную дозу вводят 1 раз или в 2—3 приема), пути введения (внутрь, внутримышечно, внутривенно, в виде аэрозолей, эндобронхиальных вливаний, ректально), определенную оптимальную продолжительность химиотерапии, ежедневный или интермиттирующий ритм при
менения химиопрепаратов.
При всей важности правильного выбора всех элементов, составляющих режим химиотерапии, наиболее трудной задачей является выбор препаратов для применения на разных этапах химиотерапии.
В настоящее время хорошо известно, что химиотерапию больных туберкулезом необходимо проводить комбинацией химиопрепаратов, применение одного препарата недопустимо. Еще в 1950 г. в Центре по химиотерапии туберкулеза в г. Мадрасе (Индия) были проведены
контролируемые клинические испытания оценки эфективности лечения одним изониазидом и комбинацией изониазида и ПАСК.
Эффективность лечения с помощью изониазида и ПАСК была явно
выше, а главное, у всех больных, леченных только изониазидом, сохранилось бактериовыделение и развилась лекарственная устойчивость микобактерий туберкулеза. Таким образом, комбинированная химиотерапия необходима для эффективного воздействия на бактериальную популяцию, состоящую из микобактерий, чувствительных к отдельным химиопрепаратам, и устойчивых мутантов.
Кроме того, при рациональных комбинациях химиопрепаратов возможно потенцирование их туберкулостатического действия на бактериальную популяцию.
При выборе препаратов для применения на разных этапах хи
миотерапии следует учитывать также разное влияние отдельных
химиопрепаратов на внеклеточно и внутриклеточно располагающиеся микобактерии. Как известно, при прогрессировании туберкулеза происходит интенсивное размножение бактериальной популяции в организме человека. На этом этапе наблюдаются интенсивный выход микобактерий в ткани пораженных органов, их распространение
лимфогенным и гематогенным путем, в результате чего появляются новые участки воспаления, развивается казеозный некроз. Большинство микобактерий в этот период располагается внеклеточно, а та часть бактериальной популяции, которая оказалась фагоцитиро-
ванной макг л.
ixn;
агами в процессе воспалительной реакции, вследствие
интенсивного внутриклеточного размножения обусловливает разру-
шение фагоцитов и вновь оказывается расположенной внеклеточно. Таким образом, внутриклеточная локализация микобактерий на
332
этом этапе является сравнительно кратковременным периодом в процессе жизнедеятельности размножающейся бактериальной популяции.
При вспышке и прогрессировании туберкулезного процесса выделяют три фазы развития бактериальной популяции: латентную, экспоненциальную и стационарную. Все противотуберкулезные препараты оказывают наиболее выраженное антибактериальное действие на активно размножающуюся бактериальную популяцию, т. е. находящуюся в экспоненциальной фазе развития.
По мере затихания туберкулезного процесса, особенно в процессе химиотерапии, величина бактериальной популяции уменьшается; в частности, эта динамика бактериальной популяции проявляется в уменьшении количества выделяемых больным микобактерий в мокроте, а затем и прекращении бактериовыделения (Н. М. Рудой, В. И. Кузнецова). В условиях продолжающейся химиотерапии и уменьшения бактериальной популяции вследствие подавления размножения микобактерий в организме больного сохраняется часть микобактерий, которые находятся в состоянии персистирования. Наличие персистирующих микобактерий было доказано результатами серии бактериологических исследований материала из разных участков, резецированных по поводу туберкулеза легких. Персистирующие микобактерии нередко выявляли только при микроскопиче
ском исследовании, так как при посеве на питательные среды они не давали роста или требовались специальные питательные среды
с наличием стимуляторов роста из-за резкого изменения культуральных свойств. Такие микобактерии называли спящими или дремлющими, иногда — убитыми. В качестве одного из вариантов персистирования микобактерий возможна их трансформация в L-формы, ультрамелкие, фильтрующиеся формы. На этом этапе, когда интенсивное размножение бактериальной популяции сменяется состоянием персистирования остающейся ее части, нередко микобактерии находятся главным образом внутриклеточно (внутри фагоцитов).
Доказано, что внутриклеточно расположенные микобактерии мо
гут даже размножаться. Подавить с помощью химиопрепаратов жизнедеятельность внутриклеточно расположенных микобактерий, даже не потерявших способность к размножению, — очень трудная задача.
Трудности увеличиваются также из-за того, что некоторые препараты оказывают значительно более слабое бактериостатическое дей
ствие на внутриклеточно расположенные микобактерии, чем на
находящиеся вне клеток — макрофаги. Наиболее сильное бактерио-
о: и:
статическое действие на внутриклеточно расположенные микобактерии оказывают рифампицин, изониазид, этионамид и этамбутол.
Пиразинамид отличается преимущественно внутриклеточной актив
ностью.
В связи с неодинаковым состоянием бактериальной популяции на разных этапах болезни в процессе химиотерапии в последние годы принято делить весь период лечения химиопрепаратами на две фазы, или этапа. На первом этапе проводят интенсивную химиотерапию с целью подавить размножение бактериальной популяции,
333
добиться уменьшения ее количества. Второй этап — этап проведения менее интенсивной химиотерапии (фаза долечивания) с целью воздействия на оставшуюся бактериальную популяцию, главным образом персистирующие формы микобактерий. На этом этапе главная задача — предупредить размножение оставшихся микобактерий.
Интенсивность химиотерапии достигается применением как минимум трех химиопрепаратов, а иногда в комбинацию могут входить 4 химиопрепарата и более. Интенсивность химиотерапии, по мнению ряда авторов, можно обеспечить путем внутривенного введения химиотерапевтических препаратов. Наконец, в определенной степени интенсивность химиотерапии можно повысить, увеличив дозу изониазида до 15 мг/кг, дальнейшее повышение ее не сопровождается увеличением терапевтического эффекта и запрещено Фармко-митетом, а также методическими указаниями по химиотерапии.
Как известно, с состоянием бактериальной популяции тесно связан феномен лекарственной устойчивости микобактерий, имеющий большое клиническое значение при проведении химиотерапии. Существует тесная связь количественных изменений бактериальной популяции с изменением ряда биологических свойств микобактерий, одним из которых является лекарственная резистентность. В большой размножающейся бактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых мутантов.
В туберкулезной каверне величина бактериальной популяции 108—1011, в очагах, осумкованных казеозных фокусах 102—105. Наличие в большой размножающейся бактериальной популяции незначительного количества устойчивых мутантов практического значения не имеет, но по мере уменьшения величины бактериальной популяции изменяются соотношения между количеством лекарственно-чувствительных и устойчивых микобактерий. В этих условиях происходит размножение главным образом устойчивых микобактерий, и эта часть бактериальной популяции увеличивается, достигая критической пропорции, и даже может ее превышать.
Следовательно, в клинической практике результаты бактериологического исследования чувствительности микобактерий всегда нужно сопоставлять с данными, отражающими характер и динамику туберкулезного процесса, в сочетании с результатами исследований мокроты или другого материала на наличие микобактерий. Химиопрепарат, к которому выявлена лекарственная устойчивость микобактерий, отменяют при наличии данных, свидетельствующих о неэффективности химиотерапии или снижении ее эффекта в процессе лечения, в частности при продолжающемся выделении микобактерий.
Выбор химиопрепаратов и частота их замены в значительной степени зависят также от переносимости (толерантности) их больными. Оказывая токсическое, сенсибилизирующее действие на организм больного, химиопрепараты могут вызывать побочное действие, проявляющееся различными клиническими симптомами. Особенно часто они возникают при наличии сопутствующих заболеваний печени, желудка, почек, сердечно-сосудистой системы и др. В связи 334
с этим при выборе химиопрепаратов по возможности следует избегать назначения таких средств, которые при имеющемся состоянии различных органов и систем больного могут вызвать побочные реакции или противопоказаны. При этом следует иметь в виду, что побочное действие скорее выявляется при применении максимальных терапевтических доз.
Начиная лечение химиопрепаратами, в первые дни назначают небольшие дозы, а затем быстро повышают их до терапевтических, оптимальных. При одновременном назначении различных патоге
нетических средств можно предупредить или ликвидировать имеющиеся клинические проявления побочного действия химиопрепаратов. Их отменяют только при явлениях полной непереносимости
или существовании опасности вызвать тяжелые проявления лекарственной болезни, которые могут нанести серьезный ущерб здоровью больного. Проявления побочного действия туберкулостатических препаратов, применяемых в настоящее время для лечения туберкулеза, могут быть различными — от полного отсутствия видимых
клинических признаков или минимально выраженных, стертых сим-
птомов до катастрофической картины угрожающего жизни больного
состояния, к счастью, весьма редко встречающегося в клинике туберкулеза.
Знание клинических проявлений побочного действия туберкуло-
статических средств — одно из основных условий проведения ра-
профилактики и устранения побочных
циональной химиотерапии,
реакций. Часто тяжелые лекарственные осложнения возникают вследствие неправильного проведения терапии, неполного обследования больного и недостаточного наблюдения в процессе лечения.
Частота побочных реакций зависит также от выбора препаратов. При проведении комбинированной химиотерапии побочное действие чаще наблюдается при назначении этионамида, флоримицина, цик
лосерина, стрептомицина и канамицина.
Серьезную опасность для больных представляют гематологические реакции, особенно агранулоцитоз.
Тяжелыми могут быть нарушения функций печени у больных туберкулезом при лечении пиразинамидом, рифампицином, этионами-дом, реже изониазидом. Описаны случаи возникновения острой почечной недостаточности при прерывистом применении рифампицина.
Сходство ряда побочных реакций с явлениями гиповитаминоза, особенно группы В, позволило установить определенную связь между нарушением витаминного баланса и развитием побочных реакций в процессе химиотерапии препаратами ГИНК, особенно при развитии явлений полиартрита.
Хорошо известно токсическое действие ряда препаратов (стрептомицин, флоримицин, канамицин и капреомицин) на VIII пару черепных нервов, описано нефротоксическое влияние этих препаратов, но самыми опасными являются анафилактический шок и тромбоцитопеническая пурпура; имеются данные о токсическом влиянии этамбутола на зрительный нерв [Адамович В. Н. и др., 1973; Шмелев Н. А., Степанян Э. С., 1977].
335
По механизму возникновения побочные реакции, вызываемые действием химиопрепаратов, в том числе противотуберкулезных средств, принято классифицировать как токсические и аллергические. Нельзя не отметить условность этого разделения. В настоящее время доказано наличие в сыворотке крови больных антител практически ко всем туберкулостатическим средствам. В клинике у одних и тех же больных, у которых наблюдается плохая переносимость химиопрепаратов, нередко отмечаются как токсические, так и аллергические побочные реакции, развивающиеся последовательно или даже одновременно [Мамолат А. С., Чернушенко Е. Ф., 1975].
Не менее важной задачей, чем выбор режима химиотерапии, являются обеспечение регулярного приема больным назначенных химиопрепаратов в течение всего периода лечения. Методы, обеспечивающие регулярность химиотерапии, тесно связаны с организационными формами лечения в больничных, санаторных и амбулаторных условиях. В больничных и санаторных условиях назначенные химиопрепараты больной должен принимать только в присутствии медицинского персонала с точным учетом принятых медикаментов. В амбулаторных условиях применяют несколько методов.
1. Прием химиопрепаратов в присутствии медицинского персонала, который осуществляется: а) в лечебных учреждениях (противотуберкулезных диспансерах, здравпунктах на промышленных предприятиях), б) на дому у больного. Контроль за употреблением химиопрепаратов облегчается при однократном приеме всей суточной дозы ежедневно, а также интермиттирующем ритме (2 раза в неделю) .
2. Самостоятельный прием больным химиопрепаратов, выданных диспансером на определенный срок, чаще на 10 дней, с периодическим анализом мочи на наличие химиопрепаратов, а также контролем за расходованием медикаментов.
Кроме индивидуального контроля за ходом лечения, может быть использован также групповой принцип с использованием когортного метода наблюдения за больными. Когортный принцип заключается в том, что осуществляется наблюдение за группой больных с одинаковой продолжительностью лечения. В течение первого квартала каждого года формируют первую когорту, за которой ведут наблюдение в течение всего периода лечения. В течение второго квартала формируют вторую когорту больных, за которой также наблюдают. В течение года набирают 4 когорты больных. Такой подход позволяет ежемесячно и ежеквартально проводить оценку результатов химиотерапии как для контроля за регулярностью приема химиопрепаратов, так и для выявления больных, которым требуется индивидуализация лечебной тактики в период больничного или амбулаторного лечения. Этот метод также позволяет отбирать больных для оперативного вмешательства, которое производят в том случае, если каверна длительное время не закрывается.
Большое внимание к проведению химиотерапии в течение необходимого времени и регулярности приема химиопрепаратов обус-336
ловлено имеющимися данными о том, что преждевременное прекращение приема химиопрепаратов может привести к обострению туберкулезного процесса.
9.3. ПРОТИВОТУБЕРКУЛЕЗНЫЕ ПРЕПАРАТЫ
В зависимости от способа производства различают синтетические противотуберкулезные препараты и антибиотики. Средства, относящиеся к этим двум группам, называют химиопрепаратами. Они обладают свойством подавлять размножение микобактерий туберкулеза, а некоторые из этих препаратов оказывают разрушающее действие на микробную клетку. По антибактериальной активности основные химиопрепараты делят на три группы: 1.) изониазид и рифампицин; 2) стрептомицин, канамицин, флоримицин, этамбутол, этионамид и его гомолог протионамид, пиразинамид; 3) парааминосалициловая кислота (ПАСК).
Помимо антибактериального действия, противотуберкулезные препараты оказывают влияние на организм человека, изменяя функцию отдельных органов и систем, нарушая обменные процессы. Вследствие этого у отдельных больных в процессе химиотерапии развиваются побочные реакции, а иногда и полная непереносимость препарата. В процессе лечения всегда нужно учитывать возможность возникновения побочных реакций.
Изониазид (тубазид), средняя суточная доза которого для взрослого составляет 600 мг, оказывает наиболее выраженное, строго специфическое действие на микобактерии туберкулеза, поэтому является основным противотуберкулезным препаратом. Препарат выпускают в виде таблеток, порошка для приготовления стерильных растворов и готового 10% раствора в ампулах. Изониазид применяют в течение всего периода лечения. При непереносимости препарата назначают фтивазид — химиопрепарат из той же группы.
Рифампицин (суточная доза для взрослого 600 мг) также оказывает выраженное антибактериальное действие, наряду с микобактериями туберкулеза подавляет жизнедеятельность грамположитель-ной флоры. Препарат выпускают в виде капсул. Рифампицин назначают при выраженных формах туберкулеза.
Стрептомицин (суточная доза 1 мл) оказывает выраженное действие на размножающуюся бактериальную популяцию. Препарат применяют в начале лечения в течение 2—3 мес и более ежедневно или 2 раза в неделю внутримышечно или в виде аэрозолей.
Канамицин (суточная доза 1 мл) — антибиотик с широким спектром антимикробного действия, в частности подавляет размножение микобактерий туберкулеза. Препарат применяют при лекарственной устойчивости микобактерий к стрептомицину или его непереносимости, вводят внутримышечно или в виде аэрозолей.
Этамбутол (суточная доза 25 мг на 1 кг массы тела) оказывает специфическое действие на микобактерии туберкулеза. Его применяют внутрь ежедневно или 2 раза в неделю на втором этапе лечения.
Этионамид (суточная доза 1 мл) оказывает специфическое дей-
337
ствие на микобактерии туберкулеза. Препарат применяют внутрь ежедневно.
Протионамид, гомолог этионамвда, применяют в тех же дозах и по тем же показаниям, что и этионамвд. Препарат назначают при плохой непереносимости этионамвда.
Пиразинамид (суточная доза 1—2 г) в отличие от других химиопрепаратов оказывает антибактериальное действие на микобактерии туберкулеза в кислой среде, казеозных массах. Препарат применяют ежедневно.
ПАСК (суточная доза 6—12 г), препарат со слабовыраженными антибактериальными свойствами, применяют только в комбинации с более сильными антибактериальными средствами ежедневно. Его назначают внутрь или в виде внутривенных вливаний 3 % раствора, который готовят со стабилизатором — ронголитом (0,5 г на 100 мл раствора).
9.4. МЕТОДИКА ХИМИОТЕРАПИИ У ВПЕРВЫЕ ВЫЯВЛЕННЫХ БОЛЬНЫХ
Впервые выявленные больные туберкулезом, в соответствии с приведенной выше классификацией ВОЗ, составляют первую и третью категории.
Стандартные режимы химиотерапии, применяемые у больных разных категорий, представлены в табл. 9.1.
Как видно из данных табл. 9.1, на первом этапе лечения впервые выявленным больным с деструкцией, выделяющим микобактерии туберкулеза, рекомендуется в течение 2 мес применять четыре противотуберкулезных препарата (изониазид, рифампицин, пиразинамид, стрептомицин или этамбутол). На втором этапе больные в течение 4 мес ежедневно применяют изониазид и рифампицин, лечение которыми можно проводить интермиттирующим методом — 3 раза в неделю.
Таблица 9.1. Комбинации химиопрепаратов для разных категорий больных туберкулезом
Категории больных Этапы
1-й 2-й
Первая 2HRZSCE) 4 HR 4H3R3
Вторая 2 HRZE/1 HRZE 5 H3R3E3 5HRE
Третья 2HRZ 2 H2P2Z2 2 HR 2H3R3 2 НЕ
Четвертая Индивидуализированная терапия с учетом чувствительности возбудителя
Условные обозначения: Н — изониазид, R — рифампицин, Z — пиразинамид, S — стрептомицин, Е — этамбутол. Цифрами в начале формул обозначена длительность этапа в 1 мес; подстрочными знаками обозначена кратность приема препаратов в течение недели.
338
Для больных с ограниченными формами туберкулеза стандартный режим химиотерапии состоит в применении трех противотуберкулезных препаратов (изониазид, рифампицин, пиразинамид) в течение 2 мес, причем принимать их можно ежедневно или 2 раза в неделю. На втором этапе в течение 2 мес проводят лечение изониазидом и рифампицином, принимая его или 3 раза в неделю, или изониазидом и этамбу толом в течение 6 мес ежедневно.
Лицам, у которых выявлены ограниченные изменения в легких сомнительной активности, рекомендуются в течение 3 мес принимать изониазид, рифампицин и этамбутол. В случае отсутствия клинико-рентгенологической динамики в этот период процесс расценивают как неактивный. При положительной рентгенологической динамике еще в течение 2 мес продолжают лечение изониазидом и рифампицином.
Следует иметь в виду, что не у всех больных удается выдержать стандартный режим в течение указанного периода времени, причем основными причинами отмены одного или нескольких препаратов являются их непереносимость, устойчивость микобактерий к этим препаратам, отсутствие динамики процесса, продолжающееся бактериовыделение. В связи с этим в настоящее время на начальном этапе лечения принято использовать стандартный режим с последующей коррекцией его в зависимости от динамики процесса в легких. Если к моменту окончания первой фазы лечения наблюдается положительная рентгенологическая динамика процесса (значительное или частичное рассасывание инфильтратов в легких, уменьшение популяции микобактерий согласно результатам количественной оценки с учетом хорошей переносимости всех химиопрепаратов), то лечение продолжают по указанной схеме. В отсутствие эффекта в течение первой фазы лечения необходимо уточнить причину этого. При развитии устойчивости микобактерий туберкулеза к препарату (препаратам) необходимо его заменить. В случае возникновения побочных реакций также следует изменить метод введения препарата или заменить его другим.
Коррекция химиотерапии обусловливает индивидуальный подход к больному и всецело зависит от конкретных условий.
9.5. МЕТОДИКА ХИМИОТЕРАПИИ У БОЛЬНЫХ, РАНЕЕ ЛЕЧЕННЫХ ХИМИОПРЕПАРАТАМИ
Больные, ранее получавшие химиотерапию, по приведенной выше группировке ВОЗ, составляют вторую и четвертую категории. У таких пациентов более вероятно наличие устойчивости возбудителя к одному или нескольким противотуберкулезным препаратам, поэтому на первом этапе до получения сведений о лекарственной устойчивости им назначают более интенсивное лечение, которое в дальнейшем индивидуализируют с учетом лекарственной чувствительности выделенных микобактерий (см. табл. 9.1).
Ко второй категории отнесены больные, у которых возник рецидив туберкулеза легких.
339
Рецидивом называют активный туберкулезный процесс, развивающийся у больного, перенесшего туберкулез и состоящего на учете в диспансере по III или VII группе учета, а также снятого с диспансерного учета.
К этой же категории относят больных, у которых первый этап лечения оказался неэффективным и сохраняется бактериовыделение.
Для лечения таких больных рекомендуется в течение 2 мес использовать пять химиопрепаратов изониазид, рифампицин, пира-зинамид, стрептомицин, этамбутол, после чего отменяют стрептомицин и продолжают лечение четырьмя препаратами еще в течение 1 мес. На втором этапе рекомендуется продолжить лечение в течение 5 мес тремя препаратами: изониазидом, рифампицином и этамбутол ом, которые применяют ежедневно или 3 раза в неделю.
Наконец, третью подгруппу составляют больные с хроническими формами туберкулеза, но без деструкции и бактериовыделения. Это чаще всего больные с крупными множественными очагами, которые на рентгенограмме выглядят плотными, но у таких больных периодически возникают вспышки. К этой же группе относятся больные хроническим диссеминированным туберкулезом легких без деструкций. Часто, кроме специфического процесса и эмфиземы, у этих больных имеется легочное сердце, а в последующем развивается декомпенсация. Туберкулема тоже может характеризоваться длительным хроническим течением с периодическими обострениями, и такие больные нуждаются в лечении. У небольшой части больных имеется хронический первичный туберкулез, чаще всего туберкулез трахеобронхиальных и периферических лимфатических узлов, полисерозит пластического типа без выраженного скопления экссудата. У этих больных отмечается хроническое, иногда волнообразное течение заболевания, и они, несомненно, нуждаются в лечении химиотерапевтическими препаратами.
Самый тяжелый контингент относят к четвертой категории, это больные с хроническими формами туберкулеза, у которых наблюдается бактериовыделение. Подавляющее большинство их составляют больные фиброзно-кавернозным туберкулезом и хроническим диссеминированным туберкулезом с наличием деструктивных изменений, сравнительно небольшую часть составляют больные с цирротическим туберкулезом легких и наличием деструкции.
У этих больных имеется прогрессирующий туберкулезный процесс, представляющий опасность прежде всего для самих больных. Кроме того, эти больные представляют большую эпидемиологическую опасность для окружающих. У больных фиброзно-кавернозным туберкулезом, ранее леченных химиопрепаратами, не только часто отмечается бактериовыделение, но и может быть лекарственная устойчивость микобактерий, поэтому лечебная тактика у этих больных определяется прежде всего наличием или отсутствием лекарственной устойчивости к тем или иным химиопрепаратам. Среди больных прогрессирующим фиброзно-кавернозным туберкулезом вторичная лекарственная устойчивость — весьма частое явление; частота ее среди контингентов диспансера достигает 80% (А. С. Мамолат).
340
При наличии вторичной лекарственной устойчивости микобактерий можно применять только те химиопрепараты, к которым они чувствительны. Как известно, данные о лекарственной чувствительности можно получить в среднем через 2—3 мес после того, как сделан посев мокроты, так как выросшая культура микобактерий должна быть перенесена на питательную среду с химиопрепаратами, и на это исследование уходит 2—3 мес. В этом случае приходится начинать лечение больного, не получив данных о лекарственной чувствительности микобактерий, ориентируясь на сведения о ранее применявшихся химиопрепаратах. Ускорить определение лекарственной чувствительности можно, применив прямой метод ее выявления, но его можно использовать только при массивном бацилло-выделении, и тем не менее результаты прямого определения лекарственной чувствительности имеют относительное значение из-за неточности. В связи с этим данные, полученные при использовании прямого метода, имеют приблизительный, чисто ориентировочный характер и в последующем их необходимо сравнить с результатами непрямого определения лекарственной чувствительности. После сравнения результатов, полученных с помощью каждого метода, вносят поправку в сделанное заключение и корректируют лечебную тактику. Эффективность химиотерапии при наличии резистентности микобактерий снижается, особенно при полирезистентности, т. е. устойчивости к нескольким химиопрепаратам (табл. 9.2).
Таблица 9.2. Прекращение выделения микобактерий туберкулеза в зависимости от их чувствительности к химиопрепаратам
Чувствительность микобактерий Число больных, выделяющих микобактерии (результаты посева)
до лечения после лечения
БК- БК+
Чувствительные Устойчивые к: 11 5 (45,5%) 6
1 препарату 28 П (39,1%) 17
2 препаратам 18 7 (38,8%) 11
3 * 57 16 (28,2%) 41
Всего... 114 39 (34,2%) 75
В связи с этим рекомендуется иметь картотеку на всех больных с хроническими формами туберкулеза, выделяющих микобактерии, в которой фиксируют результаты исследований мокроты и данные о чувствительности микобактерий к химиопрепаратам. Такая картотека может быть в областном диспансере, а также в крупной областной или межрайонной бактериологической лаборатории. При поступлении больного в стационар, санаторий либо в случае необходимости провести лечение в амбулаторных условиях из этого учреждения нужно запросить сведения о чувствительности микобактерий, выделенных больным. На основании этих данных составляют комбинацию химиопрепаратов для лечения больных. Химио
341
терапия больных, ранее получавших ее, должна начинаться с назначения 5 противотуберкулезных препаратов с последующим индивидуальным подбором в зависимости от лекарственной резистентности. Назначают изониазид, рифампицин, пиразинамид, этамбу -тол и стрептомицин. Через 2 мес отменяют стрептомицин. После установления лекарственной чувствительности микобактерий лечение данной группы больных проводят путем индивидуального подбора химиотерапевтических средств. При этом нужно учитывать, во-первых, лекарственную чувствительность микобактерий, во-вторых, переносимость химиопрепаратов. Больные, ранее получавшие химиопрепараты, переносят их значительно хуже, чем впервые выявленные. Лица с хроническими формами туберкулеза, особенно больные хроническим фиброзно-кавернозным туберкулезом, у которых возникли осложнения, плохо переносят химиопрепараты. С этим следует считаться, подбирая необходимую для больного комбинацию химиопрепаратов, по крайней мере из двух—трех препаратов с выраженными туберкулостатическими свойствами, к которым чувствительны микобактерии и которые удовлетворительно переносят больные. Нередко таким больным назначают и третий препарат, который может обладать выраженными туберкулостатическими свойствами, особенно при активном прогрессирующем процессе, когда нужно ликвидировать вспышку. Кроме уже указанных препаратов, могут применяться: этионамид или протионамид, канамицин, фло-римицин, а также офлоксацин (таривид) и ломефлоксацин (мак-саквин). Последние два препарата особенно целесообразно применять при присоединении вторичной флоры.
При лечении больных фиброзно-кавернозным туберкулезом важное значение имеет наличие сопутствующих заболеваний, в связи с чем может быть ограничен выбор химиопрепаратов, особенно при заболеваниях печени и почек, развившейся лекарственной аллергии и др.
В процессе лечения побочные реакции отмечены у 56% больных фиброзно-кавернозным туберкулезом, причем у подавляющего большинства (70%) они носили токсический характер. Таким образом, у больных фиброзно-кавернозным туберкулезом выбор методики химиотерапии должен определяться прежде всего особенностями клинико-рентгенологической картины заболевания. В химиотерапии в первую очередь нуждаются больные с прогрессирующим течением заболевания, в то время как при ограниченном и туберкулезном процессе и относительно стабильном течении фиброзно-кавернозного туберкулеза лечение химиопрепаратами проводят при появлении клинико-рентгенологических признаков прогрессирования болезни. Как уже отмечалось, при выборе химиопрепаратов необходимо учитывать лекарственную чувствительность микобактерий туберкулеза, а также переносимость химиопрепаратов больными и наличие у них сопутствующих заболеваний.
В течение последних 10 лет в качестве эффективной рекомендовалась комбинация химиопрепаратов, включающая этионамид, биомицин и пиразинамид. Именно эта комбинация составляла основу
342
лечения больных с хроническими формами туберкулеза, получавших ранее туберкулостатические средства. Вследствие плохой переносимости вместо этионамида назначали протионамид, а вместе Биомицина — флоримицин или канамицин. Флоримицин и канамицин вместе применять нельзя из-за их токсичности. При таких заменах комбинация состоит из протионамида, флоримицина, пиразинамида, или протионамида, канамицина, пиразинамида. Если у больного сохранилась чувствительность к изониазиду, то его можно присоединить к этой комбинации в качестве четвертого препарата. Прием изониазида внутрь может быть заменен внутривенным экспрессным методом, когда шприцем вводят 10% раствор изониазида в дозе 10—15 мг/кг, которая значительно меньше, чем при приеме внутрь.
Возможности химиотерапии больных с хроническими формами туберкулеза значительно расширились благодаря этамбутолу и рифампицину, которые включают в комбинации с этионамидом, фло-римицином или канамицином. Возможна также комбинация рифампицина с этамбутолом в сочетании с другими химиопрепаратами. Рифампицин или этамбутол можно комбинировать с одним или двумя химиопрепаратами, к которым сохранилась чувствительность микобактерий. Возможно также одновременное применение рифампицина и этамбутола в комбинации с третьим препаратом.
Для лечения больных с хроническими формами туберкулеза используют следующие комбинации, включающие три препарата (А. С. Мамолат, И. Б. Бялик):
этионамид + канамицин + пиразинамид, этионамид + флоримицин + пиразинамид, этамбутол + канамицин + этионамид, этамбутол + флоримицин + этионамид, рифампицин + канамицин + этионамид, рифампицин + флоримицин + этионамид, рифампицин + этамбутол + этионамид, рифампицин + этамбутол + канамицин, рифампицин + этамбутол + флоримицин.
Помимо комбинаций, состоящих из трех препаратов, можно применять комбинации, включающие два из трех препаратов. На лечение двумя препаратами переходят в связи с достигнутым клиническим эффектом или плохой переносимостью трех препаратов, а также при появлении лекарственной устойчивости микобактерий к одному из применяемых препаратов и невозможности заменить его другим. Указанные комбинации можно применять ежедневно, а при плохой переносимости химиопрепаратов — через день (В. В. Уткин). Нередко после ежедневного приема препаратов в течение 2—3 мес в последующем переходят на интермиттирующий прием 2 раза в неделю (Zierski).
При хронических формах туберкулеза необходимо длительное лечение больного — не менее 12 мес. Если ранее ставили задачу ликвидировать вспышку и для этого было достаточно 2—3 мес, то
343
в настоящее время принцип лечения этих больных резко изменился: была поставлена задача добиваться стабилизации туберкулезного процесса и ликвидации бацилловыделения у больных фиброзно-кавернозным туберкулезом. Для того чтобы добиться стойкой стабилизации процесса и остановить прогрессирование туберкулеза, очень важно обеспечить длительное лечение таких больных химиопрепаратами. Во избежание их побочного действия с этой целью можно использовать не только ежедневный прием химиопрепаратов, но и прерывистый. Складывается впечатление, что при прерывистом лечении переносимость химиопрепаратов лучше, а значит лучше и терапевтический эффект, так как удается применять химиопрепараты длительное время без перерывов. Хорошие результаты наблюдаются при приеме химиопрепаратов через день. Второй тип прерывистого лечения — препараты применяют 3 дня подряд, а затем 4 дня перерыв, или наоборот, — 4 дня принимают и 3 дня перерыв. Третий вид интермиттирующего лечения — применять препараты 2 раза в неделю, широко используют в Польше и Румынии.
В связи с появлением рифампицина и этамбутола эффективность химиотерапии, несомненно, возросла, особенно у больных, выделяющих лекарственно-устойчивые микобактерии. По данным Н. А. Шмелева, Г. А. Коротаева и А. А. Каминской, включение в комбинации химиопрепаратов рифампицина и этамбутола позволило добиться прекращения выделения микобактерий туберкулеза у 57% больных распространенным фиброзно-кавернозным туберкулезом, клинико-рентгенологического эффекта у 74%, закрытия каверны у 6% больных, при ограниченном фиброзно-кавернозном туберкулезе — у 94, 54 и 44% больных соответственно.
На высокий терапевтический эффект комбинаций, включающий рифампицин и этамбутол, указывают также А. С. Мамолат, А. Е. Рабухин, И. Б. Бялик. При проведении химиотерапии у больных фиброзно-кавернозным туберкулезом в широких масштабах по единой программе контролируемого клинического испытания прекращение выделения микобактерий и стабилизация процесса отмечены у 77% больных, закрытие каверн — у 12,5% (Г. А. Коротаев, Н. Ю. Маргулис).
Так же как и у впервые выявленных больных, важным критерием эффективности химиотерапии у больных фиброзно-кавернозным туберкулезом и у тех, у кого возник рецидив туберкулезного процесса, является динамика бацилловыделения с учетом известного факта о более длительном выделении микобактерий этими больными и чаще наблюдающемся у них синдроме уменьшения и увеличения бактериальной популяции. Однако следует иметь в виду, что у больных, ранее принимавших химиопрепараты, в процессе проводящейся химиотерапии возможно выделение микобактерий, не растущих на питательных средах. В таком случае микобактерии выявляют лишь с помощью микроскопии, при этом часто отмечается наличие измененных форм микобактерий — в виде толстых коротких палочек, зернистых форм, «синих» вариантов, потерявших свойство кисло-тоустойчивости.
344
У многих больных, выделяющих такие L-трансформированные формы микобактерий, отмечается прогрессирующее течение заболевания, т. е. имеет место несоответствие результатов бактериологического и клинико-рентгенологических исследований. У таких больных результаты бактериологического исследования не являются показателем терапевтического эффекта и в последующем, как правило, возникает обильное бацилловыделение. В связи с этим данные, полученные при бактериологическом исследовании (микроскопия, посев, определение лекарственной чувствительности микобактерий), необходимо рассматривать в сочетании с результатами клиникорентгенологического исследования, проводящегося в процессе лечения. При этом следует учитывать, что, несмотря на комбинированное применение химиопрепаратов, у больных, ранее леченных с помощью туберкулостатических средств, в процессе химиотерапии не удается избежать развития лекарственной резистентности. Химиотерапию у таких больных, как правило, начинают в стационаре, продолжительность лечения в котором зависит от его эффективности и состояния больного. При благоприятных результатах больной должен находиться в клинике до стойкого прекращения бацилловыде-ления, а в последующем химиотерапию можно проводить амбулаторно. Амбулаторно можно лечить и больных, у которых бацилловыделение не прекратилось, если по каким-либо причинам их лечение в стационаре затруднительно.
Подводя итоги, следует подчеркнуть следующее.
1. Химиотерапия у больных с хроническими формами туберкулеза, несомненно, дает эффект при ее рациональном проведении и позволяет сохранить жизнь многих из них. В настоящее время такие больные живут дольше: если раньше продолжительность жизни больного фиброзно-кавернозным туберкулезом составляла 3 года, то сейчас она равняется 6—10 годам и более.
2. У некоторых из этих больных с помощью химиотерапии удается добиться стабилизации процесса и стойкого прекращения ба-цилловыделения, что принято называть абациллированием каверны или открыто-отрицательным синдромом. Химиотерапия позволяет приостановить прогрессирующий туберкулезный процесс и добиться его относительной стабилизации с редкими вспышками даже без бацилловыделения или его спорадическим бацилловыделением. С помощью химиотерапии можно задержать развитие осложнений фиброзно-кавернозного туберкулеза, но пока не удается добиться излечения больных с хроническими формами туберкулеза. Вследствие этого больным с хроническими формами туберкулеза и бацилловыделением показано хирургическое лечение.
Очень важно подчеркнуть, что оперативное вмешательство необходимо производить до развития осложнений, до того, как развилось состояние, препятствующее проведению хирургического лечения. Роль химиопрепаратов при лечении больных с этими формами туберкулеза переоценена, и мы категорически не согласны с теми зарубежными авторами, которые до сих пор считают, что больных туберкулезом можно не оперировать. При развитии хронического
345
деструктивного процесса с бацилловыделением, если не удается добиться излечения больных с помощью химиопрепаратов, то необходимо произвести оперативное вмешательство, иначе говоря, нужно предотвращать развитие хронических форм туберкулеза с помощью своевременно выполненной операции как у впервые выявленных больных с деструкцией, так и у больных фиброзно-кавернозным туберкулезом. Оперировать нужно тогда, когда процесс ограничен, операция может быть экономной, последующая химиотерапия позволит сохранить здоровье и можно добиться излечения при наличии небольшого анатомического дефекта. Если вовремя не сделать операцию, то приходится выполнять обширные вмешательства, которые приводят к выраженным анатомическим дефектам и функциональным нарушениям: это уже менее совершенный тип заживления, со значительным ущербом для здоровья больного, поэтому задача врача в своевременном выполнении оперативного вмешательства.
9.6. ПАТОГЕНЕТИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ
В практике лечения больных туберкулезом широко используют средства патогенетической терапии, количество которых в последние годы заметно увеличилось. Особое место среди них занимают кортикостероиды: преднизолон, гидрокортизон, триамцинолон и др., которые больным туберкулезом всегда назначают вместе с химиопрепаратами. Показанием к назначению кортикостероидов являются формы туберкулеза с выраженной экссудативной реакцией — инфильтративный туберкулез типа лобита, острый милиарный туберкулез, туберкулезный менингит, экссудативный плеврит, перитонит, перикардит, полисерозит. Их можно применять при туберкулезном эндобронхите и гиперергической реактивности организма, обусловленной особенностями течения туберкулезного процесса или аллер-гизирующим влиянием туберкулостатических средств.
Преднизолон назначают в дозе 20 мг/сут; средняя продолжительность лечения кортикостероидами от 3 до 8 нед. Отмену этих препаратов проводят путем постепенного снижения суточной дозы в течение 3 нед, поскольку именно за этот период в основном восстанавливается функция надпочечников, заторможенная вследствие введения добавочных гормонов. Быстрая отмена препарата может вызвать «синдром отмены» — недомогание, слабость, снижение артериального давления, головную боль, тошноту, рвоту, которые, как правило, проходят в течение ближайших дней. В период отмены гормонов целесообразно назначать резохин или делагил по 0,25 г один раз в день после еды.
Кортикостероиды противопоказаны при беременности, язвенной болезни желудка и двенадцатиперстной кишки, психозе, болезни Иценко—Кушинга, сердечной недостаточности, тяжелых формах гипертонической болезни, сифилисе, хроническом алкоголизме и т. д. Лечение кортикостероидами больных туберкулезом и сахарным диабетом возможно, но при условии проведения полноценной химио-
346
и инсулинотерапии. В связи с выраженным иммунодепрессивным действием преднизолона и других кортикостероидов рекомендуется
применять их в сочетании с иммуномодуляторами (тактивин, ти-
малин и др.).
Клинические наблюдения и экспериментальные исследования способствовали широкому использованию туберкулина в лечебной практике. Являясь специфическим аллергеном, туберкулин в зависимости от способа применения оказывает как десенсибилизирую
щее, так и стимулирующее действие. Механизмы действия препарата многообразны, и в общих чертах они сводятся к усилению лимфо-
обращения, расширению капилляров в зоне поражения, повышению
проницаемости их стенки, повышению фагоцитарной функции ретикулоэндотелиальной системы, что в конечном счете обеспечивает
лучшее проникновение лекарственных препаратов в очаг поражения и стимуляцию процессов репарации. Непременным условием тубер-кулинотерапии является ее проведение на фоне полноценной хи
миотерапии.
Туберкулин показан при замедленной инволюции специфических изменений в легких, наклонности к осумкованию при очаговом, инфильтративном, диссеминированном туберкулезе. Препарат целесообразно применять с целью десенсибилизации при некоторых формах первичного туберкулеза, протекающего на фоне гиперсенсибилизации организма. Возможно, применение туберкулина при торпедном течении хронического деструктивного туберкулеза легких вне фазы обострения.
Пирогенал — липополисахарид, выделенный из непатогенного штамма синегнойной палочки. Механизм действия препарата изучен недостаточно, однако установлено, что он способствует активизации гипофизарно-надпочечниковой и ретикулоэндотелиальной систем, оказывает противоаллергическое и стимулирующее действие. При туберкулезе пирогенал улучшает переносимость антибактериальных препаратов, повышает эффективность лечения. Пирогенал вводят внутримышечно, начиная с дозы 25—50 МПД; курс лечения 20—25 инъекций; последняя доза — 1000 МПД. Поскольку переносимость пирогенала различна, подбор должен быть строго индивидуальным. При значительной выраженности лихорадки, мышечных и суставных болей дозу препарата целесообразно уменьшить. Пирогенная реакция возникает обычно через 3—4 ч после введения препарата и самостоятельно проходит через 12—24 ч, не требуя дополнительных вмешательств.
Показаниями к применению пирогенала служат деструктивные формы туберкулеза легких в отсутствие эффекта от антибактериальной терапии, а также склонность специфического процесса в легких к фиброзированию или осумкованию. Противопоказано лечение пирогеналом в остром периоде туберкулеза легких всех форм при наличии выраженных инфильтративных изменений, при крупных туберкулемах, хроническом деструктивном процессе, циррозе, наличии легочно-сердечной недостаточности II—III степени, кровохарканье, сопутствующих заболеваниях — гипертонической болезни
347
II—III стадии, сахарном диабете. Не следует назначать препарат при беременности, с осторожностью нужно применять его при лечении лиц старше 60 лет. В процессе терапии может возникнуть очаговая реакция, однако, как правило, она ликвидируется под влиянием продолжающейся антибактериальной терапии.
Продигиозан — липополисахаридный комплекс, выделенный из гепатогенного микроба Вас. Prodigiosum. Препарат показан при торпидно текущих процессах в легких, полостных изменениях в них без выраженной воспалительной реакции и фиброза, инфильтративном процессе с наличием казеозно-некротических фокусов. Противопоказания — недостаточность сердечной деятельности, нарушение коронарного кровообращения.
С целью десенсибилизации рекомендуют использовать гепарин в суточной дозе 10 000—20 000 ЕД внутримышечно в течение 10 дней и более с исследованием коагулограммы до и в процессе лечения. Установлено положительное влияние гепарина в сочетании с антибактериальной терапией на течение репаративных процессов при различных формах туберкулеза легких.
В клинической практике в качестве средств патогенетической
терапии применяют препараты, содержащие гиалуронидазу, в частности лидазу. Взрослым препарат вводят через день в дозе 64 УЕ
внутримышечно, перед введением растворяя содержимое ампулы в 1 мл 0,5% раствора новокаина. Курс — 30 инъекций. Возможны повторные курсы с перерывом 1—1,5 мес. Показания к назначению лидазы: очаговый, диссеминированный туберкулез легких, а также первичный туберкулез без выраженного казеозного поражения лимфатических узлов.
В качестве стимулирующей терапии используют ультразвук или
индуктотермию. Возникающее при этом рефлекторное усиление кро-
во- и лимфообращения в легких способствует активизации репара
тивных процессов. При таком лечении возможно усиление воспалительной реакции в очаге поражения, что способствует лучшему проникновению лекарственных препаратов и повышению эффектив
ности терапии.
Ультразвук и индуктотермия показаны больным очаговым, инфильтративным, ограниченным диссеминированным туберкулезом легких, с туберкулемой с деструкцией после рассасывания инфильтративных изменений, кавернозным туберкулезом в случае недостаточной эффективности предшествующей терапии, при ограниченных формах туберкулезного процесса в легких с торпидным течением и наклонностью к отграничению.
Противопоказания к применению стимулирующей терапии: острое течение туберкулезного процесса в легких, обширный фиброзно-кавернозный и цирротический туберкулез, склонность к кровохарканью, сочетание туберкулеза легких с ишемической болезнью сердца, тиреотоксикозом, опухолевым процессом, легочно-сердечная недостаточность II—III степени.
Умелое использование патогенетических средств на разных этапах комплексной антибактериальной терапии создает предпосылки
348
для повышения эффективности лечения больных туберкулезом. В связи с выявленными в последние годы признаками иммунодефицита у больных туберкулезом, особенно при развитии тяжелых форм заболевания, в качестве патогенетического средства все шире применяют иммуномодуляторы (тактивин, тималин, левами-зол, нуклеинат натрия и др.). Их применяют одновременно со специфическими противотуберкулезными препаратами на ранних этапах лечения больным инфильтративно-казеозной пневмонией, при прогрессирующем течении других форм туберкулеза, а также на 4—5-м месяце химиотерапии при недостаточной эффективности лечения. Иммуномодуляторы повышают терапевтический эффект, если с их помощью удается уменьшить выраженность или устранить явления иммунодефицита, о чем свидетельствуют результаты иммунологических исследований. Следует обратить внимание на то, что, как правило, выраженные явления иммунодефицита сочетаются с лимфопенией. В связи с этим в случае отсутствия возможности исследовать иммунологические тесты (количество Т-лимфоцитов по результатам Е-РОК, их функцию с помощью реакции бласттранс-формации с ФГА и PPD, результатам исследования субпопуляций Т-лимфоцитов), при назначении иммуномодуляторов можно ориентироваться не только на клинические проявления туберкулеза, но и на наличие лимфопении, выявляемой при анализе лейкограммы
крови.
Патогенетические средства можно применять с целью нормализации стойко сохраняющихся обменных нарушений. Наиболее часто
используют витамины для уменьшения выраженности гиповитаминоза, часто возникающего у больных туберкулезом и усиливающегося у некоторых из них в процессе химиотерапии. Аскорбиновую кислоту (600—800 мг/сут), иногда в сочетании с рутином (витамин Р) и пиридоксин (витамин Вб) применяют внутрь или чаще парен-
терально в виде инъекций (1—2 мл 5% или 2,5% раствора внутримышечно), витамин Bi (1—2 мл 6% раствора внутримышечно).
Естественно, что больные туберкулезом могут принимать и поливи-
тамины (ундевит, декамевит, гексавит, пангексавит). Длительность лечения 3—6 нед. Особенно важное значение витаминотерапия имеет при клинических проявлениях побочного действия химиопрепаратов, так как способствует их ликвидации.
Больным, у которых нарушен белковый обмен, особенно при
значительном уменьшении массы тела и истощении (у таких больных отмечается, как правило, гипоальбуминемия, а иногда и
снижение уровня общего белка крови), назначают анаболические
стероиды: неробол, ретаболил и др. Эффективность лечения таких
больных повышается при одновременном применении энтерального
и парентерального питания. При нарушениях углеводного обмена,
а также при выраженном похудании и потере аппетита можно применить инсулин в небольших дозах (6—8 ЕД подкожно за 30 мин до еды).
В последние годы появились предложения применять при лечении больных туберкулезом антиоксидантные препараты: а-токо-
349
ферол (50—100 мг/сут внутрь), тиосульфат натрия (по 10 мл 30% раствор внутривенно) и др. Воздействуя на интенсивность перекисного окисления липидов, они снижают выраженность воспалительной реакции и способствуют ее угасанию, задерживают чрезмерное развитие соединительной ткани. Антиоксиданты применяют при лечении больных туберкулезом, у которых отмечается выраженная экссудативная реакция в легких, одновременно с химиопрепаратами.
Антикининовые и прокининовые препараты также назначают больным туберкулезом на разных этапах лечения. Антикининовые средства (ингибиторы протеиназ и специфические антикининовые препараты) применяют в качестве противовоспалительных и ан-тиаллергических средств вместе со специфическими химиопрепаратами для более быстрого уменьшения выраженности и рассасывания воспалительной реакции. Из группы ингибиторов протеаз применяют трасилол, гордокс, ингитрил в виде капельных внутривенных вливаний. Из специфических антикининовых препаратов при туберкулезе испытан пармидин (К. Я. Келеберда, А. С. Свистунова). Препарат назначают по 0,5 г 3 раза в сутки в течение 1-го месяца лечения и по 0,75 г в остальные 2 мес. В качестве стимулятора процессов заживления после 4—6 мес химиотерапии можно применить прокининовый препарат андекалин, который вводят внутримышечно в дозе 40 ЕД ежедневно в течение 1 мес. При торпедном течении очагового, диссеминированного туберкулеза легких, туберкулезе внутригрудных лимфатических узлов, а также периферических лимфатических узлов без казеозной реакции в качестве патогенетического средства может быть применена лидаза — внутримышечно в дозе 64 ЕД через день в течение 1 — l1/? мес на фоне продолжающейся специфической химиотерапии.
В связи с большим разнообразием патогенетических средств в процессе химиотерапии необходимо проводить тщательное обследование больного как с целью выявления динамики туберкулезного процесса, так и для оценки общего состояния больного с применением соответствующих лабораторных методов, позволяющих определить функциональное состояние различных органов и систем. Это необходимо для обоснованного выбора наиболее эффективного для лечения больного патогенетического средства. Как перед началом, так и в процессе химиотерапии больным проводят факультативные исследования, особенно при замедленной регрессии туберкулезного процесса (иммунологические тесты, активность антипротеаз и другие показатели активности туберкулезного процесса, состояние углеводного, белкового, витаминного обмена, кровообращение в зоне патологического процесса, функция различных органов, в первую очередь печени, почек и др.). Полученные данные в сочетании с динамикой клинических проявлений, результатами рентгенологических исследований позволят врачу из большого количества патогенетических средств выбрать необходимые для конкретного больного и избежать полипрагмазии.
350
9.7. КОЛЛАПС ОТЕРАПИЯ
Искусственный, или лечебный, пневмоторакс — один из методов коллапсотерапии, заключающийся во введении воздуха в плевраль-
ную полость с помощью специального аппарата для создания коллапса легкого. Этот метод используют для лечения больных со
свежими деструктивными формами.
Впервые искусственный пневмоторакс (ИП) был применен для лечения больных туберкулезом легких итальянским врачом Форла-нини (Forlanini) в 1882 г., затем в 1883 г. в США Murphy. Во Франции Toussaint в 1880 г. и Potain в 1888 г. создавали ИП,
аспирируя экссудат из плевральной полости у больных плевритом и вводя взамен него воздух. В России первые сообщения о ИП
сделаны А. П. Рубелем (1912) и А. Я. Штернбергом (1921). В последующем метод лечения с помощью ИП был детально разработан
Ф. А. Михайловым и соавт., В. А. Равич-Щербо.
Механизм лечебного действия ИП связан прежде всего с кол
лапсом, т. е. спадением легкого. В самом начале применяли так называемый гипертензивный ИП, при котором легкое механически сдавливалось большим количеством воздуха, введенного в плевраль-
ную полость. Давление в плевральной полости при гипертензивном пневмотораксе было положительным, т. е. выше атмосферного. Гипертензивный ИП применяли Saugmann (1914) и Muralt (1914). В последующем, после появления работ Morgan (1913), Parodi (1935), Askoli (1932), Dumarest и соавт. (1945), коллапс легкого
стали вызывать с помощью значительно меньшего количества воздуха при давлении в плевральной полости ниже атмосферного. Такой ИП называется гипотензивным. При нем коллапс легкого обусловлен не механическим сдавлением легкого, а активным сокращением эластичной легочной ткани, поэтому обязательным условием создания гипотензивного ИП является сохранение эластичности легочной ткани. В сократившемся легком спадается эластическая каверна, что приводит к уменьшению дефекта легкого и сближению краев полости, в результате чего создаются благоприятные условия для заживления каверны. Заживлению способствуют также развивающееся в коллабированном легком уменьшение вентиляции, лимфостаз и уменьшение кровообращения в пораженных
участках.
Некоторые исследователи не разделяют точку зрения о целебном значении иммобилизации коллабированного легкого и «покое» лег
А. Е. Рабухин, И. А. Щак-
кого в условиях ИП (В. А. Равич-Щерб
леин). Согласно мнению этих ученых, в условиях ИП не происходит
уменьшения вентиляции, коллабированное легкое экскурсирует, рас
ширяясь при вдохе и спадаясь при выдохе, в легком усиливается лимфоообращение и возникает гиперемия вследствие усиления кровообращения, что способствует заживлению. Эти представления получили широкое распространение и признание. В процессах за
живления известное значение имеют также развивающиеся ателектазы — чаще мелкие, а иногда более обширные.
351
Сложившиеся представления о механизме действия ИП определили показания к его применению. Следует отметить, что в условиях широкого использования химиотерапии при лечении больных туберкулезом показания к ИП значительно сузились, и этот метод в настоящее время применяют у ограниченного числа больных, тогда как в доантибактериальный период ИП и другие методы коллапсо-терапии были наиболее распространенными методами лечения больных туберкулезом легких. Применение сочетания химиотерапии и ИП возможно и целесообразно, но следует иметь в виду, что больные, излечения которых в прошлые годы добивались с помощью ИП, в настоящее время могут быть излечены благодаря проведению химиотерапии. В связи с этим в современных условиях ИП применяют при лечении больных туберкулезом легких только в тех случаях, когда химиотерапия не может быть «развернута» в полной мере или проведение ее сопряжено с большими трудностями.
ИП может быть использован при плохой переносимости противотуберкулезных препаратов, а также в тех случаях, когда невозможно их применить из-за непереносимости или нельзя провести длительную химиотерапию в связи с особенностями работы больного или его личностными качествами, при беременности, когда длительное применение химиопрепаратов нежелательно или затруднено из-за ограниченного выбора химиопрепаратов. ИП может быть наложен с гемостатической целью, если медикаментозные средства оказались малоэфффективными, а также при наличии сопутствующих заболеваний, отягощающих течение туберкулеза и исключающих лечение химиопрепаратами. ИП применяют при лечении больных очаговым и инфильтративным туберкулезом легких в фазе распада, при кавернозном туберкулезе и наличии эластической каверны, реже — при ограниченном диссеминированном (преимущественно одностороннем) процессе в фазе распада.
Обязательными условиями для применения ИП являются сохранение эластичности легочной ткани, отсутствие пневмосклероза и эмфиземы, а также фиброзных изменений в стенках каверны при кавернозном туберкулезе. Перед наложением ИП следует убедиться в том, что крупные бронхи не поражены туберкулезным процессом, так как специфический эндобронхит является противопоказанием к применению ИП. Противопоказаниями к наложению ИП также служат выраженные явления легочно-сердечной недостаточности и нарушения кровообращения, сильная одышка, непрекращающийся кашель, эпилепсия, краевое, т. е. субплевральное, расположение деструктивного процесса, что может помешать спадению полости, а также создавать угрозу прорыва каверны в плевральную полость с образованием спонтанного пневмоторакса и эмпиемы. При наличии массивных плевральных наслоений у больных, перенесших экссудативный плеврит, врач также должен воздержаться от применения ИП.
Техника наложения ИП сравнительно проста. Больного укладывают на здоровый бок, при этом рука, согнутая в локтевом суставе, поднята и закинута за голову. Под здоровый бок подкладывают 352
упругий валик. Место для прокола грудной стенки выбирают индивидуально. Чаще всего прокол производят в подмышечной области на уровне верхнего края ребра в четвертом—пятом межреберье. Для прокола грудной клетки используют стерильные платиновые или стальные иглы. При проколе быстро проходят иглой кожу, подкожную жировую клетчатку и более медленно — плевру, при
этом возникает ощущение преодоления препятствия, а затем игла
«проваливается» в свободное пространство. Если просвет иглы на-
ходится в плевральной полости, то появляются колебания манометра, соединенного с иглой. Наличие отрицательных показаний маномет-
ра, синхронных акту дыхания, свидетельствует о нахождении про-
света иглы в плевральной полости, в этом случае можно вводить
воздух (в первый раз 200—300 мл). Для введения воздуха исполь
зуют специальные аппараты, представляющие собой сообщающиеся
сосуды, снабженные водяным манометром. В тех случаях, когда отсутствуют ясные отрицательные колебания манометра, воздух
вводить нельзя, так как просвет иглы находится не в плевральной полости; может быть она еще не прошла плевру или находится в легком. Просвет иглы может закупориться кусочком кожи, жира,
в этом случае для восстановления проходимости его можно прочистить мандреном. Если из просвета иглы покажется кровь, то ее нужно немедленно извлечь во избежание воздушной эмболии. При небольших колебаниях манометра вокруг нуля воздух также вводить нельзя, так как игла находится в просвете бронха. Таким образом, манометр помогает врачу определить местонахождение просвета
иглы и возможность введения воздуха.
С точки зрения методики можно выделить три периода лечения с помощью ИП: 1) формирование газового пузыря, т. е. создание коллапса легкого; 2) сохранение ИП путем периодических вдуваний воздуха; 3) прекращение ИП и расправление легкого.
В периоде формирования ИП основной задачей является создание оптимального коллапса легкого. С этой целью проводят частые вдувания воздуха, так как легкое расправляется. Обычно сначала вдувают по 200—300 мл воздуха через день (2—3 раза), затем по 300—400 мл 2 раза в неделю в течение 1—2 нед, постепенно, промежутки между вдуваниями увеличивают до 5—7 дней, количество вводимого воздуха — до 400—500 мл в зависимости от показаний манометра: в плевральной полости после введения воздуха должно оставаться отрицательное давление. Для создания оптимального пневмоторакса в общей сложности необходим 1 мес. Период формирования ИП завершается оценкой его эффективности. Достижению терапевтического эффекта могут препятствовать в первую очередь плевральные сращения, особенно если они не позволяют спадаться каверне, расположенной в зоне плевральных сращений. В таких случаях производят торакоскопию и по возможности пережигание спаек (операция Якубеуса). После их пережигания легкое спадается и в коллабированном легком закрывается полость деструкции. Сращения могут быть массивными, и в этих случаях удается создать лишь частичный, т. е. избирательный (селективный), ИП.
12—1213
353
Иногда он оказывается эффективным (селективно-положительным) и приводит к закрытию очага деструкции. Если патологические изменения располагаются в неколлабированном участке легкого (селективно-отрицательный ИП), то эффекта не отмечается, и ИП должен быть прекращен.
Иногда при полном спадении легкого также не отмечается спадения каверны, в частности это бывает при туберкулезном эндобронхите, когда в пораженном бронхе возникает клапанный механизм (феномен раздувания или растяжения каверны). При этом периодически происходит изменение размеров каверны — ее увеличение и уменьшение. Каверна может не спадаться при ригидности ее стенок вследствие фиброза. В отсутствие закрытия каверны ИП должен быть прекращен из-за неэффективности и для лечения больного применяют другие методы. Переходить ко второму периоду лечения с помощью ИП можно только в том случае, если удалось сформировать эффективный ИП.
Основная задача во втором периоде — удержать легкое в состоянии коллапса. С этой целью проводят периодические вдувания воздуха в плевральную полость, чаще всего 1 раз в неделю, иногда, при замедленном рассасывании воздуха, реже — 1 раз в 10—14 дней. В условиях химиотерапии продолжительность лечения ИП уменьшается до 3—6 мес (А. Е. Рабухин, И. Г. Урсов и соавт.).
В периоде прекращения ИП добиваются расправления спавшегося легкого путем постепенного уменьшения количества воздуха, вводимого в плевральную полость, и некоторого увеличения интервалов между вдуваниями. При развитии ригидности легкого, что проявляется утолщением плевры и сохранением коллапса легкого, несмотря на рассасывание воздуха, о чем свидетельствует высокое отрицательное давление в плевральной полости, расправление легкого может происходить очень медленно. В связи с этим необходимо избегать развития ригидности ИП и при появлении первых признаков его рекомендуется прекращать вдувания; по этой же причине не следует поддерживать ИП более 1 года.
Осложнения ИП могут быть обусловлены погрешностями в технике выполнения прокола и вдувания, а также другими причинами. Наиболее тяжелым осложнением является воздушная эмболия, возникающая вследствие попадания воздуха в кровеносный сосуд при попадании иглы в легкое и его ранении, особенно если в это время врач вводит воздух из пневмотораксного аппарата. Воздушная эмболия проявляется внезапно наступающей бледностью, судорогами, потерей сознания. Если немедленно не наступает смерть, то у больного иногда развивается гемиплегия или гемипарез, возможны расстройства речи, амнезия. Для оказания первой помощи необходимо уложить больного в положение Тренд ел енбурга, ввести кофеин, при расстройствах дыхания — лобелии, цититон, сульфокамфокаин, провести искусственное дыхание, ингаляции кислорода.
При повышенной чувствительности больного, а особенно при грубом выполнении манипуляции может развиться плевральный шок, проявляющийся резко выраженными болевыми ощущениями 354
в месте прокола и кратковременной потерей сознания. В этих случаях больному вводят кофеин или кордиамин, при продолжающихся болях — анальгин и другие обезболивающие средства.
Травматический (уколочный) пневмоторакс (ТП) возникает при проколе иглой висцеральной плевры и ранении легкого. Он может сформироваться при первичном наложении ИП, тогда и без введения воздуха происходит спадение легкого или возникает неадекватно большой коллапс легкого при введении небольших количеств воздуха (50—200 мл), ТП может возникать и при повторных вдуваниях воздуха, небольшом газовом пузыре и прилежащем к париетальной плевре легком. Он проявляется одышкой, тахикардией, могут отмечаться боли в боку, часто возникают кровохарканья, которые могут продолжаться 2—3 дня. Иногда ТП протекает бессимптомно, проявляясь лишь усилением коллапса легкого. Специальное лечение не требуется, назначают покой на 2—4 дня, симптоматические средства.
Иногда, при обрыве тонкого плеврального сращения или суб-плеврально расположенной каверны, а также воздушной буллы, к ИП может присоединиться спонтанный пневмоторакс, клинические проявления которого такие же, как при ТП. В таких случаях ИП дальше не продолжают, вдувания прекращают.
В периоде формирования газового пузыря воздух может попасть под кожу, в этом случае возникает подкожная эмфизема, воздух может расположиться парамедиастинально, т.е. между париетальной и висцеральной плеврой, выстилающей средостение. Это осложнение может быть выявлено при рентгенологическом исследовании, клинически у таких больных отмечаются боли в области сердца, чувство тяжести за грудиной, тахикардия. Постепенно эти явления ликвидируются, лишь изредка осложнение носит стойкий характер и усугубляется, иногда может сформироваться грыжа средостения.
На любом этапе лечения с помощью ИП может развиться пневмоплеврит, который часто встречался в доантибактериальный период — более 40% больных, леченных этим методом. Чаще пневмоплеврит развивался у больных, у которых ИП формировали при наличии спаек, особенно при недостаточно эффективном лечении, неспавшейся каверне в легком, продолжающемся бактериовыделении. У таких больных пневмоплеврит возникал в первые месяцы после начала лечения. Встречались и поздние пневмоплевриты, развивавшиеся уже после заживления деструктивного процесса в легком. При сочетанном применении химиопрепаратов и ИП частота пневмоплеврита значительно уменьшалась: по данным А. Г. Хоменко, — до 11%, согласно сведениям Л. С. Картозия, — до 11,3%, по материалам Л. А. Винник, — до 6,6%.
На любом этапе лечения ИП пневмоплеврит является признаком активности туберкулеза и развивается вследствие возникновения в плевре воспалительного процесса. Источниками его могут быть сохраняющийся туберкулезный процесс в легком, субплеврально расположенные очаги и поражение самой плевры. Экссудат при этом может быть серозным или гнойным в зависимости от характера
12*
355
морфологических изменений. При возникновении пневмоплеврита
ИП прекращают, экссудат следует повторно аспирировать, добиваясь активного расправления легкого и облитерации плевральной полости. В случае развития пневмоплеврита показано лечение противотуберкулезными препаратами, а при серозном лимфоцитарном и особенно эозинофильном выпоте назначают также кортикостероидные гормо
ны.
В доантибактериальный период ИП, как и другие методы кол-лапсотерапии, был одним из ведущих в лечении больных туберкулезом легких. Появление и внедрение в практику противотуберкулезных препаратов привело к тому, что ИП перестали использовать при лечении у больных свежим, активным туберкулезом без деструктивных изменений в легких. По мере увеличения количества противотуберкулезных препаратов, когда появилась возможность индивидуального подбора различных комбинаций химиопрепаратов, значительно уменьшилось число больных, которым показано лечение с помощью ИП.
До настоящего времени под диспансерным наблюдением находятся больные, леченные в прошлом с помощью ИП. У части из них выраженных остаточных явлений не наблюдается. Вместе с тем у некоторых больных, леченных с применением этого метода, особенно длительно, или перенесших пневмоплеврит, отмечаются плевральные наслоения, ограничение подвижности диафрагмы, а также остаточные признаки излеченного туберкулеза в виде очагов фиброза в легочной ткани и др. Эти изменения в сочетании с плевральными наслоениями и ограниченной подвижностью диафрагмы могут вызвать нарушения функции дыхания, выраженные в разной степени в зависимости от протяженности анатомических изменений — последствий ИП и самого туберкулезного процесса.
Пневмоперитонеум — метод коллапсотерапии туберкулеза легких, заключающийся во введении в брюшную полость воздуха из пневмотораксного аппарата с помощью прокола брюшной стенки иглой. При этом вводят 600—800 мл воздуха один раз в 7—10 дней. Длительность лечения 3—6 мес, иногда до 1 года. При введении воздуха в брюшную полость отмечается высокое стояние диафрагмы и коллапс преимущественно нижних отделов легкого. Пневмоперитонеум применяют в тех случаях, когда нет возможности провести полноценную химиотерапию. Пневмоперитонеум используют для остановки легочного кровотечения, ликвидации остаточной плевральной полости после резекции доли и нескольких сегментов лег
кого.
Первое сообщение о применении пневмоперитонеума относится к 1893 г. Вначале его использовали для лечения экссудативного перитонита, а затем туберкулеза кишечника, а в 1930 г. пневмоперитонеум был применен для лечения легочного туберкулеза (A. Benyai).
Сравнительная простота метода и редкое развитие осложнений способствовали широкому внедрению его в лечебную практику в доантибактериальную эру. Считали, что введенный в брюшную
356
полость воздух оказывает многообразное влияние на легочный процесс вследствие ограничения движений диафрагмы и иммобилизации пораженного легкого. Некоторые авторы придавали значение уменьшению объема и расслаблению легочной ткани, обусловленным подъемом диафрагмы, а также уменьшению эластического натяжения легкого. Однако большинство авторов считали и считают в настоящее время, что основную роль играют рефлекторные воздействия на легкое воздуха, вводимого в брюшную полость (И. А. Шаклеин). Воздух вызывает висцеро-висцеральный рефлекс, легкое спадается, и это вызывает подъем диафрагмы. Именно действием такого механизма можно объяснить тот факт, что на стороне более выраженных и свежих изменений в легких подъем диафрагмы обычно более значителен.
Техника наложения пневмоперитонеума несложна, но при этом необходимо соблюдать ряд условий. Перед поддуванием больному предлагают опорожнить мочевой пузырь, укладывают его на кушетку в положении на спине, под нижние отделы грудной клетки подкладывают валик. Воздух в брюшную полость вводят с помощью иглы, соединенной с пневмотораксным аппаратом.
Прокол брюшной стенки делают, как правило, по левому краю прямой мышцы на уровне пупка или на 2—3 см ниже. Показания
манометра помогают определить место нахождения иглы, величина давления колеблется от +2 до +10 мм рт. ст. В случае отсутствия колебаний манометра о правильном положении иглы свидетельствуют свободное поступление воздуха в брюшную полость, появление тимпанита на месте печеночной тупости, быстрое выравнивание жидкости в манометре после прекращения поступления газа в брюш-
ную полость. При первичном вдувании в брюшную полость вводят 400—500 см3 воздуха, при повторных инсуффляциях, производимых через 2—10 дней, — 600—800 см3. Обычно после первичного вду-
вания больной испытывает боль в подреберье, нередко иррадиирующую в подлопаточную область или область ключицы.
В то время как происходит подъем диафрагмы, печень, селезенка,
желудок опускаются и поддерживаются связочным аппаратом. У больных со слабым брюшным прессом в вертикальном положении введенный воздух оттесняет органы, находящиеся в брюшной полости, книзу, но подъема диафрагмы не происходит. Такой пнев-моперитонеум неэффективен, и от него следует отказаться.
Погрешности в технике наложения пневмоперитонеума могут повлечь за собой развитие осложнений, наиболее частым из которых является подкожная эмфизема. При этом воздух проникает в подкожную клетчатку, распространяется на туловище, шею, нередко — в мошонку, малый таз у женщин. Признак подкожной эмфиземы — «хруст», определяемый при пальпации. В течение 2—5 дней воздух, как правило, рассасывается. Реже наблюдается медиастинальная эмфизема, развивающаяся в результате введения воздуха между париетальным листком брюшины и фасцией, покрывающей мышцы живота. Характерные признаки — боли за грудиной, в области шеи, хриплый голос, иногда нарастающее чувство удушья, «хруст» в
357
области шеи и яремной ямки. При введении небольшого количества
воздуха указанные симптомы исчезают в течение 2 дней при условии соблюдения постельного режима. Перфорации органов брюшной по
лости встречаются очень редко, из них чаще выявляют прокол стенки толстой кишки с введением в нее воздуха, хорошо определяемого рентгенологически. Специальных мероприятий для ликвидации этого осложнения не требуется.
Серозные пневмоперитониты развиваются примерно у 4% больных, протекают, как правило, бессимптомно, уровень жидкости редко достигает пупка. После некоторого перерыва в поддуваниях пневмоперитониты рассасываются и в дальнейшем не являются препятствием к продолжению лечения.
В литературе приводятся сообщения о развитии ателектаза легкого при коллапсотерапии. Частота возникновения ателектаза при лечении с помощью пневмоторакса колеблется от 2,1 до 38%, при использовании пневмоперитонеума она составляет 2—6%. Установлена роль нервно-рефлекторного фактора в развитии ателектаза. Рефлекторного спадения легкого в зоне поражения достаточно для спастического сокращения паренхимы легкого, т. е. для формирования ателектаза. Поражение бронхов — благоприятная почва для возникновения бронхоспазма, что также имеет значение в механизме развития ателектаза. Перикавернозные ателектазы также могут явиться причиной неэффективности коллапсотерапии. При нерасп-равляющихся ателектазах искусственный пневмоторакс и пневмо-перитонеум должны быть прекращены.
В доантибактериальный период пневмоперитонеум широко использовали как при ограниченных, так и при распространенных процессах в легких. Установлено его положительное влияние на проявления туберкулезной интоксикации, характер кашля, количество мокроты, одышку, отмечавшееся уже после 3—4 нед лечения. Через Р/г—2 мес обычно наступали изменения температурной реакции и картины крови, через 3—4 мес развивались рентгенологи
чески определяемые изменения в легких в виде рассасывания инфильтративных очагов. Наиболее выраженным было влияние пневмоперитонеума на инфильтративный процесс различной протяженности. Кроме того, пневмоперитонеум с успехом применяли при кровохарканье и кровотечениях, особенно в тех случаях, когда не был установлен их источник или искусственный пневмоторакс и медикаментозные средства были недостаточно эффективными. Нарушения функции органов дыхания и кровообращения под влиянием пневмоперитонеума, как правило, нерезко выражены и не являются препятствием к продолжению лечения [Харчева К. Н., 1972].
В современных условиях использования туберкулостатических препаратов показания к применению пневмоперитонеума ограничены, хотя сторонники метода настаивают на его значении. В литературе подчеркивается, что пневмоперитонеум усиливает действие химиопрепаратов, способствует увеличению частоты закрытия полостей с эластичными стенками, особенно в средних и нижних отделах легких, ускоряет рассасывание обширных инфильтративных
358
очагов, диссеминированных поражении, аспирационных пневмонии, свежих бронхогенных засевов, помогает устранить вспышку и предупредить прогрессирование хронических, кавернозных форм туберкулеза. Пневмоперитонеум с успехом применяют после родов и абортов, в тех случаях, когда возникает опасность обострения и прогрессирования туберкулеза легких. Пневмоперитонеум может быть использован как дополнение к резекции легкого.
Наложение пневмоперитонеума в дополнение к специфической химиотерапии показано при инфильтративном туберкулезе легких, в том числе при лобитах, диссеминированном процессе, кавернозном туберкулезе независимо от локализации каверны. Относительными показаниями к его применению являются распространенный туберкулез легких, безуспешно леченный химиопрепаратами; невозможность осуществить оперативное вмешательство или полноценное антибактериальное лечение в связи с непереносимостью химиопрепаратов или лекарственной устойчивостью микобактерий туберкулеза; легочное кровотечение, источник которого не установлен; сочетание указанных выше форм легочного туберкулеза с сахарным диабетом.
Пневмоперитонеум противопоказан больным фиброзно-кавернозным туберкулезом с обширным поражением легких, цирротическим туберкулезом легких, подострым и хроническим диссеминированным туберкулезом легких с тотальным распространением процесса, казеозной пневмонией. Кроме того, противопоказаниями к применению пневмоперитонеума являются острые и хронические воспалительные процессы в органах брюшной полости и малого таза, выраженные нарушения функции сердечно-сосудистой системы, амилоидоз, обширные плевродиафрагмальные сращения. Пневмоперитонеум рекомендуют накладывать после предварительной 2—3-недельной туберкулостатической терапии, после родов и абортов (на 5—10-й день).
Продолжительность лечения с помощью пневмоперитонеума в сочетании с антибактериальными противотуберкулезными препаратами 6—12 мес. Поводом для прекращения пневмоперитонеума может служить не только эффективность комплексной терапии, но и отсутствие благоприятной динамики на этапе неполного излечения. В таких случаях следует решать вопрос об использовании других методов лечения, в частности хирургического.
Период прекращения пневмоперитонеума обычно протекает без особых затруднений. Постепенно уменьшают дозы вводимого газа, и в течение 2—3 нед газовый пузырь полностью рассасывается, легкие расправляются. Ригидность легких при лечении с помощью пневмоперитонеума обычно не развивается.
Поданным К. А. Харчевой (1972), под влиянием коллапсотерапии в сочетании с антибактериальными препаратами стойкое клиническое излечение наступает у 90—95% больных, при этом остаточные изменения в легких минимальны, трудоспособность больных сохраняется. Вместе с тем после окончания клинически эффективного пневмоторакса или пневмоперитонеума, преимущественно в течение
359
первых 2 лет, у 5—8% больных возникает обострение или рецидив туберкулезного процесса.
Исходя из этого, автор считает, что после окончания эффективной коллапсотерапии больные должны находиться под наблюдением противотуберкулезного диспансера в группах для больных активным туберкулезом не менее 2 лет и только по истечении этого срока можно решать вопрос о переводе их в III группу диспансерного учета. Больные, у которых после окончания коллапсотерапии патологические изменения не выявляются или минимальны и представляют собой ограниченные участки фиброза или единичные мелкие индурированные туберкулезные очаги и отсутствуют клинические проявления болезни, могут быть сняты с учета через 3 года после окончания лечения.
9.8. ОПЕРАТИВНЫЕ ВМЕШАТЕЛЬСТВА ПРИ ТУБЕРКУЛЕЗЕ ОРГАНОВ ДЫХАНИЯ
Оперативные вмешательства — основной метод лечения больных кавернозным туберкулезом с наличием фиброзной каверны, фиброзно-кавернозным и цирротическим туберкулезом, с крупными туберкулемами, эмпиемой, казеозным туберкулезом внутригрудных лимфатических узлов. Легочное кровотечение, которое не удается остановить с помощью других методов лечения, бронхиальный свищ и эмпиема остаточной полости после резекции легкого также могут быть показаниями к выполнению операции, в том числе по жизненным показаниям.
Основной вид оперативных вмешательств — резекция (удаление) пораженного сегмента, доли легкого или всего легкого. Чаще производят резекцию одного легкого или его пораженных отделов. При двустороннем туберкулезном процессе выполняют частичную резекцию обоих легких, чаще последовательную с интервалом от 2 до 4—6 мес, а иногда и одномоментно. При туберкулезе или циррозе легкого и легочном кровотечении чаще производят резекцию легкого или доли, реже — перевязку бронхососудистого пучка в условиях торакотомии.
Реже производят торакопластику, сущность которой заключается в резекции паравертебральных участков 6, 8 или 10 ребер в зависимости от протяженности процесса. Торакопластику применяют при фиброзно-кавернозном туберкулезе и в тех случаях, когда невозможно выполнить радикальную резекцию. Ограниченную шестиреберную торакопластику производят в один этап (темп), более расширенную операцию выполняют в два или три этапа. Торакопластика может быть применена в качестве дополнительной операции для закрытия остаточной плевральной полости после резекции легкого или доли, а также при эмпиеме после торакотомии и плевр-эктомии.
Возможна комбинация торакопластики с кавернотомией, когда дополнительно вскрывают полость каверны, санируют ее путем длительных перевязок, а остаточную полость, как правило, с брохи-
360
альным свищом закрывают мышечным лоскутом. Перевязку бронха по поводу свища, образовавшегося после операции, и удаление казеозных лимфатических узлов производят трансстернальным и трансперикардиальным доступом.
Ранее применявшиеся операция Якубеуса (пережигание спаек), френикоалкоголизация, пневмолиз с последующим экстраплевральным пневмотораксом в настоящее время не производят.
Необходимо подчеркнуть, что оперативное вмешательство является этапом комплексного лечения больных туберкулезом; обязательным условием для осуществления операции является проведение химиотерапии до нее в ближайшем послеоперационном периоде и в последующем. Отказ от химиотерапии или преждевременное ее прекращение после операции может привести к тяжелым осложнениям в послеоперационном периоде и рецидивам туберкулеза через 1—5 лет. Спустя 2—3 мес после операции показано санаторное лечение для продолжения химиотерапии и проведения реабилитационных мероприятий.
9.9. ЭКСТРЕННАЯ МЕДИЦИНСКАЯ ПОМОЩЬ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ И ОСЛОЖНЕНИЯХ
Лекарственный анафилактический шок вызывается, как правило, антибиотиками, чаще всего пенициллином, бициллином и стрептомицином, но может быть вызван и химиопрепаратами, другими лекарственными средствами, преимущественно при их парентеральном введении. Типичная клиническая картина анафилактического шока включает следующие основные признаки: артериальную гипотензию, нарушение сознания вплоть до его потери, дыхательную недостаточность, судорожный синдром и кожные вегетативно-сосудистые реакции. Клинические проявления развиваются остро во время или вскоре после введения препарата: возникают сильная слабость, ощущение прилива крови к голове, покалывание и зуд кожи, боли в области сердца, отмечаются затрудненное частое дыхание с хрипами и пеной изо рта, потеря сознания, судороги, частый нитевидный пульс, резкое снижение артериального давления.
По данным А. С. Лопатина, кроме такой типичной симптоматики, анафилактический шок может характеризоваться в основном симптомами нарушения сердечно-сосудистой деятельности: боли в области сердца, слабый пульс или его отсутствие, значительное снижение артериального давления, нарушения ритма сердца (гемодинамический вариант), возможен также асфиксический, церебральный и абдоминальный варианты. При асфиксическом варианте развиваются отек гортани, приводящий к сужению или полному закрытию ее просвета, и бронхоспазм, которые обусловливают острую дыхательную недостаточность. Церебральный вариант характеризуется симптомами психомоторного возбуждения, судорогами, потерей сознания. Для абдоминального варианта характерно появление синдрома «острого живота» с выраженными болевыми ощу
361
щениями, напряжением мышц живота, признаками раздражения брюшины.
Медицинская помощь при анафилактическом шоке должна быть оказана немедленно: необходимо прекратить введение препарата, вызвавшего шок, положить больного на спину, опустить и запрокинуть голову, повернуть ее в сторону, выдвинуть нижнюю челюсть, чтобы предотвратить западение языка, приподнять ноги, очистить верхние дыхательные пути. При остановке дыхания — искусственное дыхание (рот в рот), при остановке сердца — наружный массаж сердца. Необходимо внутримышечно ввести адреналин (1 мл 0,1% раствора); если артериальное давление остается низким, то адреналин или норадреналин нужно ввести внутривенно, как и преднизолон. Ориентируясь на клинические проявления, следует также ввести 2—4 мл 2,5% раствора пипольфена или 2% раствора супрастина либо 5 мл 1% раствора димедрола. Вводят также кордиамин, кофеин, при бронхоспазме — эуфиллин внутривенно (1—2 мл 24% раствора или 20 мл 2,4% раствора). Порядок введения указанных выше лекарственных средств имеет не столь уж важное значение, главное — немедленно оказать больному неотложную помощь, применив имеющиеся в наличии средства.
Ввиду тяжести данного осложнения перед началом химиотерапии необходимо расспросить больного о том, как он переносит различные лекарства, не наблюдались ли у него аллергические симптомы типа поллинозов, пищевой аллергии или заболевания, проявляющегося аллергическим насморком, отеком и т. д. Больным, у которых ранее отмечался лекарственный аллергический шок, нельзя назначать антибиотики или другие лекарственные средства, которые вызвали это тяжелое осложнение.
Легочное кровотечение и кровохарканье —очень тяжелые осложнения многих легочных заболеваний: туберкулеза, бронхоэктазов, рака легкого, пневмонии, бронхита и др. Сильное легочное кровотечение возникает при нарушении целости сосудистой стенки, которая разрушается при вовлечении ее в зону некроза; причиной кровотечения может быть также разрыв варикозно расширенных вен и аневризмы артерий в бронхоэктатически измененной бронхиальной системе.
Кровохарканье может возникать и в отсутствие разрывов сосудистой стенки вследствие повышения ее проницаемости. Клинические проявления кровохарканья довольно яркие; при кашле выделяется мокрота с прожилками крови или сгусток мокроты весь окрашен кровью, кровь — ярко-красная, пенистая. Еще более яркая симптоматика легочного кровотечения отмечается в тех случаях, когда при кашле выделяется жидкая кровь, количество которой варьирует в очень широких пределах — от 30—50 до 200—400 мл и более. При закупорке дыхательных путей кровью может наступить мгновенная смерть от асфиксии, поэтому при появлении первых признаков легочного кровотечения нужно принять меры для ее предупреждения. С этой целью необходимо отсосать все доступное удалению содержимое бронхов через эндотрахеальную трубку с
362
помощью вакуумного насоса. Затем больного нужно успокоить и усадить в положение полусидя.
Для того чтобы устранить кровохарканье или небольшое легочное кровотечение, применяют кровоостанавливающие средства: аминокапроновую кислоту по 2 г 3—4 раза в день, аскорбиновую кислоту по 0,1 г 3—5 раз в день, глюконат кальция по 10 мл 10% раствора внутривенно. При большой кровопотере — до 400 мл — рекомендуется переливание крови или эритроцитной массы. Внутривенно вводят 10 мл 2,4% раствора эуфиллина, назначают также пирилен по 0,01 г или бензогексоний 0,1—0,2 г 2 раза в сутки (И. С. Пилипчук). Если кровотечение не прекращается, то с гемостатической целью может быть наложен пневмоперитонеум. Некоторым больным фиброзно-кавернозным туберкулезом по срочным и жизненным показаниям производят оперативное вмешательство. Для выявления источника кровотечения может быть выполнена бронхоскопия.
При начальных формах туберкулеза с помощью гемостатических средств, как правило, удается остановить легочное кровотечение и тем более кровохарканье. Однако следует иметь в виду, что излившаяся кровь, попавшая в дыхательные пути, может вызвать аспирационную пневмонию, поэтому при повышении температуры тела, развитии лейкоцитоза, появлении стойких хрипов необходимо провести рентгенологическое исследование. В случае обнаружения пневмонии необходимо провести лечение антибиотиками (пенициллин, линкомицин, гентамицин и др.). Следует добавить, что у больных туберкулезом неспецифическая аспирационная пневмония может перейти в прогрессирующий туберкулезный процесс, сопровождающийся образованием каверн. Такие больные также нуждаются в противотуберкулезной химиотерапии.
Спонтанный (самопроизвольный) пневмоторакс характеризуется развитием коллапса легкого. Степень выраженности коллапса может быть разной: от тотального сжатия легкого вследствие проникновения большого количества воздуха в плевральную полость, сопровождающегося повышением положительного давления, до частичного коллапса и образования сравнительно небольшого газового пузыря. Причины спонтанного пневмоторакса разные: прорыв пристеночной, субплевральной, туберкулезной каверны в плевральную полость или разрыв буллы. Спонтанный пневмоторакс может образоваться при выполнении бронхологического исследования и плевральной пункции (уколочный пневмоторакс).
В зависимости от причины спонтанного пневмоторакса следует выделить две группы больных: больные туберкулезом и больные с образовавшимся спонтанным пневмотораксом нетуберкулезной этиологии. Первая группа характеризуется тем, что вскоре после возникновения спонтанного пневмоторакса вследствие прорыва в плевральную полость туберкулезной каверны у больных развиваются пневмоплеврит и эмпиема. Клиническая картина спонтанного пневмоторакса многообразна. Он может развиваться постепенно без выраженных клинических проявлений, и только при увеличении кол
363
лапса легкого возникает одышка. Возможно быстрое развитие коллапса легкого с выраженными клиническими проявлениями: возникают сильная боль в соответствующей половине грудной клетки и одышка, отмечаются цианоз и тахикардия. Дальнейшее течение болезни зависит от механизмов сообщения плевральной полости с атмосферным воздухом через систему дренирующих бронхов.
Различают открытый спонтанный пневмоторакс, при котором сохраняется постоянное сообщение с атмосферным воздухом; клапанный (наиболее тяжелый), когда вследствие действия «клапанного механизма» в плевральной полости увеличивается количество воз
духа, повышается положительное давление, органы средостения смещаются в противоположную сторону; закрытый, при котором после проникновения воздуха в плевральную полость сообщение между ней и атмосферным воздухом прекращается.
Диагностика спонтанного пневмоторакса несложна, кроме клинических симптомов дыхательной недостаточности, у больных отмечаются тимпанический звук при перкуссии, ослабленное дыхание над соответствующей половиной грудной клетки. Наличие газового
пузыря и коллапса легкого подтверждается при рентгенологическом
исследовании.
Лечение заключается в оказании неотложной помощи при резко выраженной дыхательной недостаточности в случае формирования коллапса легкого: кордиамин, сульфокамфокаин, ингаляции кислорода. Необходимо уложить больного в постель, так как физическое напряжение противопоказано. Часто этого бывает достаточно и кол-лабированное легкое постепенно расправляется. Некоторым больным необходимо произвести плевральную пункцию и аспирацию воздуха, если в плевральной полости создается высокое положительное дав
ление. Иногда такие аспирации нужно делать повторно или можно поставить подводный дренаж. Больным с открытым или клапанным
пневмотораксом в случае отсутствия эффекта от консервативного
лечения нужно выполнить операцию (В. А. Равич-Щер
вельев и Ч. Д. Константинова).
Острая дыхательная недостаточность развивается у больных в случае недостаточного поступления кислорода в организм и задержки в нем углекислоты. При этом Р02 снижается до 55 мм рт. ст., а Расог составляет 50 мм рт. ст. и выше. Причины возникновения острой дыхательной недостаточности разнообразные, она может наблюдаться при многих заболеваниях. У больных туберкулезом острая дыхательная недостаточность может развиться
во время и после оперативных вмешательств, при возникновении таких осложнений, как спонтанный пневмоторакс, быстро образовавшийся ателектаз, быстрое накопление жидкости в плевральной полости, анафилактический шок, асфиксия, обусловленная легочным кровотечением, ДВС-синдром, а также при декомпенсации легочного сердца. Клиническая картина характеризуется многообразием симптомов: одышка, тахикардия, аритмия, снижение артериального давления, цианоз. В таких случаях необходимо провести срочное ис
следование газового состава крови, позволяющее с достоверностью
364
установить наличие острой дыхательной недостаточности. В связи с этим в первую очередь проводят лечебные мероприятия по оказанию неотложной помощи, из которых основным является длительное (10—12 ч, а иногда постоянно в течение 1 сут) применение кислорода, который подают больному с помощью носовых катетеров или маски. Длительное применение кислорода дает положительный эффект при гипоксемической форме острой дыхательной недостаточности.
Часто для снижения уровня углекислоты в крови применяют дополнительные методы, в частности положительное давление в конце выдоха, а в отсутствие эффекта — экстракорпоральную мембранную оксигенацию и элиминацию углекислоты. При появлении апноэ производят интубацию или искусственную вентиляцию легких через трахеостому с помощью дыхательных аппаратов различных систем. При небольшой экскурсии диафрагмы можно осуществить ее электростимуляцию. Больных, у которых возникла острая дыхательная недостаточность, необходимо срочно госпитализировать в отделения (палаты) интенсивной терапии или отделения реанимации. Кроме указанных мероприятий, по показаниям проводят медикаментозную терапию.
Отек легких — патологическое накопление внесосудистой жидкости в ткани легкого. Осложнение развивается в тех случаях, когда количество жидкости, фильтруемое через артериальные отделы капилляров легкого, превышает ее количество, способное резорби
роваться через венозные отделы капилляров и дренироваться лимфатическими сосудами (R. R. Albert).
Наиболее частая причина отека легкого — нарушение кровооб
ращения по левожелудочковому типу, которое может возникать как следствие хронических заболеваний и остро возникающих состояний. У больных туберкулезом отек легких развивается при декомпенсации легочного сердца с нарушением кровообращения по левожелудочковому типу. Отек легкого возникает при осложнении туберкулеза
амилоидозом почек и развитии уремии, а также при вдыхании
различных химических веществ (химические отравляющие вещества, пары бензина) в высокой концентрации при достаточно длительной экспозиции.
Клиническая картина характеризуется резко выраженной одыш-
кой, принимающей характер «сердечной астмы», клокочущим дыханием, большим количеством влажных хрипов в легких, которые
выслушиваются преимущественно в нижних отделах. Неотложная
помощь заключается в применении мочегонных средств (лазикс, фуросемид и др.), для разгрузки малого круга кровообращения применяют внутривенные вливания эуфиллина по 10 мл 2,4% рас-
твора, а также сердечные средства
антин, коргликон и др.
9.10. САНАТОРНО-КЛИМАТИЧЕСКОЕ ЛЕЧЕНИЕ
Санаторно-климатическое лечение применяется на разных этапах лечения больных туберкулезом с целью восстановления нарушенных функций организма, восстановления трудоспособности (реабилита
365
ции), а также патогенетического воздействия при замедленной регрессии туберкулезного процесса, побочных реакциях, возникающих в процессе химиотерапии и затрудняющих полноценное лечение. Санаторное лечение можно назначать впервые выявленным больным после лечения в больнице, а также больным хроническим туберкулезом в отсутствие противопоказаний и лицам с затихающим туберкулезным процессом, находящимся под наблюдением в противотуберкулезных диспансерах по второй и третьей группам учета. При выборе санатория для больного необходимо также учитывать имеющиеся у него сопутствующие заболевания.
Санатории, расположенные в тех же регионах, в которых проводят лечение больных по их месту жительства, в больницах и диспансерах, называют местными. Их используют главным образом для проведения реабилитации впервые выявленных больных, выздоравливающих и больных с хроническими процессами. Климатические санатории — курорты предназначены для лечения больных с замедленной регрессией, при плохой переносимости химиопрепаратов, наличии сопутствующих туберкулезу заболеваний. Для санаторно-курортного лечения больных туберкулезом используют санатории, находящиеся в разных климато-географических зонах.
В приморской зоне: Южный берег Крыма (Симеиз, Алупка), районы Одессы и Белгород-Днестровского, побережье Кавказа (Гуль-рипши, Геленджик). В среднегорной зоне: в Крыму (Долоссы), на Северном Кавказе — Теберда, в Закавказье — Абастумани. В степной зоне Шафраново (Башкирия), Боровое (Казахстан). В последних двух санаториях для лечения применяют также кумыс.
В санаторных условиях широко используют лечебную физкультуру и спортивные игры, дозированные прогулки (теренкур), максимально длительное пребывание на открытом воздухе (аэротерапия), воздушные и солнечные ванны, купание в море (талассотерапия). В качестве тренирующего метода реабилитации используют также трудовые процессы. Важное значение при санаторном лечении имеет также рациональное питание. Все санатории для больных туберкулезом находятся на государственном бюджете. Путевки для санаторного лечения выдают больным санаторно-курортные комиссии при городских и областных противотуберкулезных диспансерах бесплатно. Продолжительность лечения предположительно устанавливает санаторно-курортная комиссия, окончательно — врачебная комиссия санатория, в среднем она составляет от Р/2 до 6 мес и более в зависимости от результатов лечения. На все время лечения в санатории выдается больничный лист за вычетом времени неиспользованного тарифного отпуска.
ГЛАВА 10
ПРОГНОЗ, РЕАБИЛИТАЦИЯ И ЭКСПЕРТИЗА ТРУДОСПОСОБНОСТИ БОЛЬНЫХ ТУБЕРКУЛЕЗОМ
Прогноз зависит от многих обстоятельств, в первую очередь от длительности заболевания и степени запущенности туберкулезного процесса. Естественно, при выявлении заболевания на ранних этапах
его развития, до появления необратимых изменений в пораженных органах, прогноз более благоприятный, чем у больных запущенным, например фиброзно-кавернозным туберкулезом с осложнениями. По
скольку различным формам туберкулеза соответствуют разные па-
томорфологические изменения, зависящие от длительности тубер
кулезного процесса, его прогрессирования или регрессии, представляется возможным ориентировочно сформулировать прогноз при каждой клинической форме.
Туберкулез внутригрудных лимфатических узлов и первичный комплекс при раннем выявлении и своевременно начатом лечении характеризуются благоприятным прогнозом. В то же время при развитии казеозного некроза в лимфатических узлах или легочной ткани прогноз менее благоприятный, особенно при разжижении казеозных масс и опорожнении через бронхиальное дерево или фистулу в стенке бронха, что может привести к образованию каверны и хронизации процесса. Реже в настоящее время наблюдается развитие хронического первичного туберкулеза при длительном сохранении активности процесса из-за осумковавшегося казеоза.
При острых диссеминированных формах прогноз серьезный, но при своевременно начатом лечении, как правило, наступает излечение. При хроническом диссеминированном туберкулезе прогноз зависит от распространенности процесса и его длительности, наличия сформировавшихся полостей распада: в этих случаях прогноз благоприятный, особенно при периодически возникающих вспышках или прогрессировании. На ранних этапах, при свежей диссеминации, прогноз благоприятный и, как правило, удается добиться излечения.
У подавляющего большинства больных очаговым туберкулезом легких прогноз благоприятный, за исключением небольшой группы больных, у которых наблюдается прогрессирование процесса и об
разование каверн.
У больных инфильтративным туберкулезом при ограниченных процессах без распада прогноз благоприятный; обширный казеозный некроз и деструктивные изменения опасны тем, что ведут к формированию каверны и хронизации заболевания, при этом в том случае, если не будет проведено соответствующее лечение, прогноз неблагоприятный.
Прогноз при туберкулемах зависит от их размеров, течения, наличия распада. В большинстве случаев при значительных размерах туберкулем (более 2 см) и их прогрессирующем течении требуется хирургическое лечение — удаление пораженных участков легкого, после чего прогноз вполне благоприятный.
367
У больных фиброзно-кавернозным и цирротическим туберкулезом прогноз неблагопрятный из-за прогрессирования заболевания и осложнений; лишь после хирургического лечения у больных отмечается улучшение состояния и прогноза.
Прогноз при плевритах зависит от характера экссудата, течения заболевания и его исхода, серьезный прогноз при гнойных плевритах, панцирном легком и др.
Не менее важное значение имеет состояние неспецифической резистентности и специфического иммунитета: в случае развития вторичного иммунодефицита при низкой врожденной сопротивляемости прогноз заболевания неблагоприятный, особенно если это
состояние не поддается коррекции с помощью иммуномодуляторов.
Наконец, прогноз зависит от правильности выбора методов ле
чения, так как даже при ранних, ограниченных проявлениях туберкулеза он может прогрессировать в случае проведения непра
вильного лечения, например применения химиопрепаратов, к которым устойчивы микобактерии туберкулеза.
Принимая во внимание важное значение образа жизни, характера
и регулярности питания, полноценности рациона с точки зрения достаточного количества калорий и обеспеченности животными белками, витаминами, необходимо подчеркнуть, что образ жизни и
полноценность питания играют важную роль при определении прогноза у больных туберкулезом. Доказано, что неполноценное питание, особенно голодание, создает крайне сложные условия для инволюции туберкулезного процесса и его ликвидации. Изнуритель
ный труд, перегрузки и неполноценное питание, вредные привычки — курение и употребление алкоголя — все это предпосылки для неблагоприятного прогноза. Именно поэтому в нашей стране так много сделано в социальном плане, для того чтобы создать
благоприятные условия для лечения больных и профилактики ту
беркулеза: сохраняется место работы больного в течение 12 мес, выплачиваются пособие в связи с временной утратой трудоспособности и пенсия при инвалидности, бесплатно предоставляется до-
полнительная жилая площадь семьям, в которых имеется больной с заразной формой туберкулеза.
Определенное влияние на исход заболевания и, следовательно, на прогноз оказывает психическое состояние больного. Угнетенное состояние, навязчивые мысли о тяжести заболевания, фиксированное
внимание на его отдельных клинических проявлениях, часто не-
адекватная оценка состояния (гипер
лизация или недооценка его
тяжести и нежелание лечиться предложенными методами) ухудшают прогноз. Особо плохой прогноз при психических заболеваниях с преобладанием тормозных процессов и адинамии.
Важное значение имеет готовность больного выполнять рекомендации врача, следовать его советам, особенно в отношении регу
лярного приема назначенных лекарственных препаратов, периодических исследований, адекватного образа жизни и трудовой дея
тельности.
Возрастные особенности больных также влияют на прогноз за
368
болевания. Неблагоприятный прогноз отмечается при первичном
заражении в раннем детском возрасте и развитии распространенных или прогрессирующих форм первичного туберкулеза. Также неблагоприятное течение туберкулеза отмечается при его развитии в подростковом возрасте, особенно в период полового созревания. У женщин наиболее неблагоприятный прогноз в период беременности и особенно после родов, а у мужчин — в возрасте 49 лет и старше. Причины часто наблюдающегося прогрессирующего течения тубер
кулеза у мужчин этого возраста не установлены.
Реабилитация больных туберкулезом — важная медико-социальная проблема, в которой более тесно, чем при других заболеваниях, переплетаются вопросы медицинской и социально-трудовой реаби
литации.
Современное лечение туберкулеза в комплексе с другими реабилитационными мероприятиями, проводимыми в противотуберкулезных стационарах, санаториях и диспансерах, позволяет добиться медицинской реабилитации большинства больных туберкулезом, особенно впервые заболевших — до 95—99% [Хоменко А. Г., 1980]. Однако у части больных остаются нарушения функции дыхания разной степени выраженности вследствие развития значительных остаточных посттуберкулезных изменений в легких [Нефедов В. Б., 1980], что нередко является основанием для признания инвалидом человека, излеченного от туберкулеза. В связи с этим нет полного соответствия между медицинской и социально-трудовой реабилитацией больных туберкулезом. Особенно затруднена социально-трудовая реабилитация тех больных, которые в течение ряда лет являлись инвалидами по туберкулезу. Показатель полного восстановления трудоспособности таких больных, по данным литературы, не превышает 10%.
Медицинская реабилитация больных туберкулезом определяется, как правило, двумя основными показателями: прекращением выделения микобактерий туберкулеза и закрытием полостей распада (каверн) на фоне рассасывания и уплотнения других рентгенологически определяемых патологических специфических изменений (инфильтративных, очаговых). Нередко недооценивают такой показатель, как восстановление функций, нарушенных вследствие заболевания туберкулезом. Нормализация этого показателя идет медленно и не всегда полноценно, особенно у бальных с распространенным процессом, поэтому для больных туберкулезом в понятие «медицинская реабилитация» необходимо включить показатель «функциональная реабилитация».
Социально-трудовая реабилитация предусматривает восстановление не только трудоспособности, но и социального статуса переболевшего туберкулезом человека: возобновление работы в прежней должности, восстановление прежнего отношения к нему сотрудников
и членов семьи.
С целью оценки эффективности реабилитационных мероприятий, проводимых больным туберкулезом, Л. В. Макаровой (1987) за период с 1978 по 1983 г. обследованы 300 больных, бывших инвалидами
369
вследствие туберкулеза органов дыхания и при очередном переосвидетельствовании признанных ВТЭК трудоспособными.
Анализ трудовой деятельности изучаемого контингента показал, что большинство обследованных после признания их трудоспособными приступили к работе в прежней (35,6%) или равноценной (21,3%) должности, 6% повысили свою квалификацию, 12,7% снизили, 9% не работали, 2,3% умерли от различных заболеваний. Все лица, не имевшие до заболевания трудового стажа (13,1%), приступили к работе или продолжали обучение в учебных заведениях.
Таким образом, полная социально-трудовая реабилитация достигнута у 76% обследованных. Четвертая часть из них либо занимались менее квалифицированной работой, либо в социально-трудовом плане не были реабилитированы. Среди лиц, не приступивших к общественно полезному труду после восстановления трудоспособности, объективные причины для этого были у 3,3% (достижение пенсионного возраста, признание инвалидом повторно и др.). Не работали, являясь трудоспособными, 5,7% обследован
ных.
В группе лиц, у которых не была достигнута социально-трудовая реабилитация или она была частичной, по сравнению с группой полностью реабилитированных преобладали люди более старшего возраста, имевшие более низкий образовательный уровень и в силу этого занятые преимущественно физическим трудом. Туберкулезный процесс у них был более распространенным, преобладали деструктивные формы, что обусловливало низкую эффективность лечения.
Основными препятствиями для полной медицинской и социально-трудовой реабилитации больных туберкулезом являются:
1) недостаточно эффективное лечение больных, что может быть обусловлено разными причинами (позднее выявление заболевания, непереносимость лекарств, устойчивость микобактерий туберкулеза к противотуберкулезным препаратам, особенности течения процесса и др.);
2) недооценка методов лечения, способствующих восстановлению функций, нарушенных вследствие заболевания (лечебная гимнастика, массаж, физиотерапия, курортное лечение и т. д.);
3) наличие у больных туберкулезом тяжелых сопутствующих заболеваний внутренних органов, отягощающих его течение и затрудняющих лечение (хронический алкоголизм, хронические неспецифические заболевания органов дыхания, язвенная болезнь желудка и двенадцатиперстной кишки и др.). Частота их выявления у больных туберкулезом высока (около 50%) и имеет тенденцию
к увеличению;
4) недостаточное внимание к организации трудоустройства и переобучения больных туберкулезом, которым противопоказана работа по их прежней специальности. Эта проблема может быть частично решена при лечении больных в санаториях, о чем свидетельствует опыт некоторых учреждений;
5) значительный удельный вес среди больных туберкулезом лиц
370
асоциального поведения и образа жизни (БОМЖи), имеющих отрицательную установку на работу.
Таким образом, усовершенствование системы реабилитации больных туберкулезом зависит от решения не только медицинских, но и социальных проблем. Мероприятия по восстановлению трудоспособности и социального статуса больных туберкулезом тесно связаны с решением общегосударственных проблем: усовершенствованием трудовых процессов, улучшением условий труда и быта, повышением материальной заинтересованности в труде, повышением профессиональных знаний и т. д. Только медицинская реабилитация не позволяет добиться полной реабилитации больных туберкулезом. Большую помощь врачам в их реабилитации оказывает внедренная Е. М. Куницким (1985) схема экспертной оценки трудоспособности диспансерных контингентов больных туберкулезом органов дыхания, позволяющая в период наблюдения за больными систематически осуществлять контроль за процессом их реабилитации.
Экспертиза трудоспособности больных туберкулезом основана на общих принципах, предусматривающих учет имеющихся проявлений заболевания, прежде всего степени нарушения функций всего организма (в результате интоксикации) или пораженного специфическим процессом органа либо системы.
Эти сведения получают при всестороннем обследовании больного с использованием разнообразных методов: клинических, рентгенологических, физиологических, микробиологических, биохимических, иммунологических и др. Необходимо учитывать тот факт, что туберкулезный процесс может развиться практически в любом органе или системе, но чаще всего он локализуется в бронхолегочной системе. Из внелегочных локализаций чаще встречается туберкулез мочеполовой и костно-суставной системы.
Кроме того, учитывают факторы, свидетельствующие о том, что больной не может выполнять работу по основной профессии в полном объеме. Поскольку туберкулез относится к инфекционным заболеваниям, то список указанных факторов для больных туберкулезом расширен в связи с эпидемиологическими противопоказаниями к выполнению определенных работ, в частности в детских учреждениях, пищеблоках, продовольственных магазинах и т. п. Подробный список профессий и должностей, противопоказанных больным туберкулезом в зависимости от формы заболевания и группы учета в противотуберкулезном диспансере, имеется в соответствующей инструкции.
Экспертизу трудоспособности больных туберкулезом проводит врачебно-консультационная комиссия (ВКК) противотуберкулезных учреждений или врачебно-трудовая экспертная комиссия (ВТЭК), состоящая, как правило, из трех фтизиатров (один из них председатель) и невропатолога. Эти комиссии выносят экспертные решения, которые могут быть следующими: признание больного трудоспособным, временно нетрудоспособным или инвалидом в связи с туберкулезом или его последствиями.
Трудоспособными признают больных, у которых после проведен-
iXuj
371
ного лечения отсутствуют или имеются незначительные нарушения
функций пораженного органа, позволяющие выполнять работу по
основной профессии в полном объеме и в обычных для данной
профессии условиях производства. Например, такое решение может быть принято в отношении больного туберкулезом (по профессии инженер, работает в «кабинетных» условиях), прошедшего курс лечения в стационаре в течение 6 мес, у которого в момент проведения экспертизы трудоспособности имеется очаговый туберкулез в фазе рассасывания инфильтративных изменений и рубцевания полости распада. Данное решение может быть вынесено ВКК противотуберкулезного учреждения.
Временно нетрудоспособными признают больных, у которых имеются такие проявления заболевания и нарушения функций, которые препятствуют выполнению работы по профессии, но носят временный характер и могут быть устранены с помощью проводимого лечения. Такое решение может вынести ВКК, если больной освобожден от работы на период продолжительностью не более 10 мес, и ВТЭК, если необходимо освобождение на более длительный срок1, в тех случаях, когда имеется явная тенденция к излечению туберкулеза. Например, больной туберкулезом, у которого нет противопоказаний к работе, выполнявшейся им до развития заболевания, может быть освобожден от работы более чем на 10 мес.
Инвалидность — это стойкая утрата трудоспособности. Она характеризуется таким состоянием туберкулезного процесса, особенно нарушениями функций пораженного органа, которое не позволяет больному выполнять работу по специальности в обычных условиях
производства и носит устойчивый характер, несмотря на проведенное
лечение, и наличием эпидемиологических противопоказаний к вы-
полнению этой работы в связи с возрастом. Инвалидность III (при частичной стойкой утрате трудоспособности) или II и I (при полной стойкой утрате трудоспособности) групп устанавливает только ВТЭК. Одновременно ВТЭК указывает причину инвалидности, дает
трудовые рекомендации, при необходимости — рекомендации по
£ессиональному обучению или переквалификации инвалида, а
также по проведению лечения с целью восстановления трудоспо-
собности. Комиссия указывает срок очередного освидетельствования в том случае, если группа инвалидности не устанавливается бес
срочно. Подробные сведения об установлении групп инвалидности
можно получить из еще действующей в настоящее время «Инструкции по определению групп инвалидности»2. В последние годы работники системы социального обеспечения ведут большую работу
по усовершенствованию этой инструкции.
Таким образом, временная и стойкая утрата трудоспособности больными туберкулезом определяется комплексом факторов как ме-
1 Постановление Совета Министров СССР от 1 сентября 1960 г. № 972 «О сроках выдачи больничных листов».
Инструкция по определению групп инвалидности. Утв. Минздравом и ВЦСПС и Минсобесом РСФСР 2.08.1956 г.
372
дицинских, так и социальных. К медицинским факторам относится характеристика туберкулезного процесса с учетом формы и фазы, локализации, распространенности и особенностей течения туберку-
лезного процесса, нарушений функций всего организма и пораженного туберкулезом органа, эффективности проводимого лечения, особенно специфической химиотерапии, клинического прогноза.
M1U
Основными социальными факторами являются профессия, образование, квалификация, производственный опыт больного, характер и условия выполнения работы по основной профессии, а также возраст больного, условия, в которых он живет, и материальное обеспечение. Большое значение имеет трудовой прогноз, который
определяется как клиническими, так и социальными факторами, поэтому врачи ВТЭК должны иметь определенные знания об отдельных видах производств. Конкретные сведения о характере и условиях труда врачи-эксперты получают при опросе больного, а также из присланной по запросу ВТЭК (в случае необходимости)
производственной характеристики, заполненной по определенной форме в учреждении.
Нередко инвалидность устанавливают больным, не имеющим права на получение оплачиваемого больничного листа, с целью получения социального пособия. К ним относятся лица, временно не работающие в период выявления заболевания (уволенные из рядов Российской Армии, при смене работы, прибывшие из мест заключения).
Среди больных, находящихся под наблюдением в противотуберкулезных диспансерах, удельный вес инвалидов вследствие туберкулеза небольшой — в среднем около 8%, из них 19,3% среди больных активным туберкулезом (I—II, Va, б группы учета) и 16,2% среди излеченных от этого заболевания (III—Vila, б, Vb группы).
В структуре первичной инвалидности вследствие туберкулеза как среди рабочих и служащих, так и среди колхозников высокий удельный вес (в среднем 75—80%) инвалидов I—II групп, т. е. больных, полностью утративших трудоспособность. Такая же закономерность
выявлена и при изучении структуры инвалидности среди всего контингента инвалидов, состоящих на учете в противотуберкулезных учреждениях. Это оказывает влияние на процессы восстановления трудоспособности больных туберкулезом, нередко являясь тормозящим фактором.
ГЛАВА 11
ПРОФИЛАКТИКА ТУБЕРКУЛЕЗА
м.«».
Профилактика туберкулеза на всех этапах борьбы с туберкулезом была одним из основных противотуберкулезных мероприятий. В зависимости от объекта профилактических мер и масштабов их можно разделить на три большие группы.
1. Мероприятия, проводимые среди всего населения (вакцинация и ревакцинация БЦЖ, санитарные меры по ограждению наиболее угрожаемых контингентов от инфекции и суперинфекции).
2. Мероприятия, осуществляемые в группах населения с повышенным риском развития туберкулеза (учет и диспансерное наблюдение, оздоровление, химиопрофилактика).
3. Меры, предпринимаемые в очагах инфекции (оздоровление очага, дезинфекция, изоляция больного, наблюдение за контактами, химиопрофилактика).
Следует подчеркнуть, что для проведения профилактических мероприятий, в том числе санитарной и специфической профилактики, требуются четко разработанные организационные формы, и в случае игнорирования этого положения профилактические меры могут оказаться неэффективными.
Все профилактические мероприятия должны осуществляться с учетом величины резервуара инфекции и возможных путей ее передачи. Основным резервуаром инфекции являются больные туберкулезом, на ряде территорий нельзя сбрасывать со счета больной туберкулезом крупный рогатый скот, другие животные представляют меньшую эпидемическую опасность.
Конкретные профилактические меры по каждому из трех главных направлений нужно вносить в ежегодный план противотуберкулезной работы. Это необходимо в связи с тем, что в проведении профилактических мероприятий и обеспечении их выполнения участвуют не только медицинские работники, но и руководители трудовых коллективов, административных и других органов.
11 .1. ВАКЦИНАЦИЯ НОВОРОЖДЕННЫХ И РЕВАКЦИНАЦИЯ БЦЖ
При разработке и внедрении в практику вакцинации и ревакцинации большую роль сыграли исследования, проведенные Б. Л. Ях-нисом (1927), М. П. Похитоновой (1931), Е. П. Шурыгиной (1933), А. В. Цимблер (1939), А. И. Кудрявцевой и соавт. (1945), Р. А. Каменецкой (1948). Вакцинацию новорожденных как в городах, так и в сельской местности начали широко применять с 1954 г.
Накопленный опыт массовой вакцинации, проводившейся сначала энтеральным методом, а затем накожным и внутрикожным, был отражен в монографиях А. А. Ефимовой (1968) и Л. А. Митинской (1975). Эффективность внутрикожной вакцинации и ревакцинации достигает 80% при точном соблюдении методики выполнения вакцинации и использовании высококачественной вакцины БЦЖ.
374
В нашей стране в родильных домах проводят обязательную вакцинацию БЦЖ всех новорожденных, кроме тех, у кого имеются противопоказания* Вакцинацию осуществляет специально обученный средний медицинский персонал, имеющий соответствующее удостоверение. Вакцинируют здоровых новорожденных на 4-7-й
день жизни.
Противопоказаниями к вакцинации являются: недостаточная масса тела при рождении — менее 2000 г, внутриутробная инфекция, гнойно-септические заболевания, гемолитическая болезнь новорожденных (формы средней тяжести и тяжелая), тяжелая родовая травма
с неврологическими симптомами, генерализованные кожные проявления, острые заболевания, генерализованная инфекция БЦЖ, выявленная у других детей в семье.
Вакцинацию новорожденных с массой тела 2000 г проводят вакциной БЦЖ-М в родильном доме в те же сроки, недоношенных и
родившихся с низкой массой тела — в отделениях выхаживания недоношенных новорожденных по достижении массы тела 2300 г
перед выпиской из стационара.
Дети, не вакцинированные против туберкулеза в родильном доме, должны быть привиты вакциной БЦЖ-М в течение 1—6 мес жизни после выздоровления. Детям в возрасте 2 мес и старше перед вакцинацией производят туберкулиновую пробу и прививки делают
только при ее отрицательных результатах.
Вакцина БЦЖ (BCG) была получена Calmette и Guerin в 1919 г. в результате многократных пассажей Mycobacterium bovis, изолированных в 1902 г. во Франции Nocard. Вакцина не вызывает у человека прогрессирующего туберкулеза, но способствует развитию приобретенного иммунитета.
Вакцина БЦЖ — живая вакцина, и ее протективный эффект зависит от достаточного количества живых микобактерий, которые размножаются в организме привитого человека. При выраженном иммунодефиците может развиться генерализованная инфекция БЦЖ с различными проявлениями болезни, но это встречается очень редко.
Таким образом, препарат представляет собой лиофилизированные живые микобактерии штамма БЦЖ-1, имеющие вид высушенной массы белого цвета. Одна ампула содержит 1 ± 0,01 мг вакцины БЦЖ, т. е. 20 доз по 0,05 мг.
Препарат вакцины БЦЖ-М — это также живые лиофилизированные микобактерии штамма БЦЖ-1, но в 1 ампуле содержится 0,5±0,01 мг вакцины, что составляет 20 доз по 0,025 мг. Для поддержания жизнеспособности микобактерий вакцину необходимо хранить в холодильнике при температуре не выше +4°С, срок годности 1 год.
Для осуществления вакцинации необходимо сухую вакцину развести изотоническим (0,9%) раствором натрия хлорида. В ампулу с вакциной вводят 2 мл этого раствора, что позволяет получить в объеме 0,1 мл раствора дозу вакцины БЦЖ 0,05 мг. Разведенная вакцина сразу же должна быть использована по назначению.
375
В исключительных случаях разведенную вакцину можно использовать в течение 2—3 ч при условии строгого соблюдения стерильности и защиты от солнечного или дневного света. Вакцину БЦЖ вводят внутрикожно в дозе ОД мл в область плеча на границе верхней и средней третей, при этом образуется папула диаметром 5—6 мм, которая через 15—20 мин исчезает. Спустя 4—6 нед у ребенка в месте введения вакцины появляется прививочная реакция в виде инфильтрата диаметром 5—10 мм с небольшим узелком в центре, покрытого корочкой; у некоторых привитых образуется пустула с последующим некрозом и незначительным серозным отделяемым. В течение 2—4 мес происходит постепенная инволюция пустулы с образованием рубца округлой формы диаметром 2—10 мм. Осложнения после вакцинации БЦЖ отмечаются сравнительно редко (0,02% случаев). К ним относятся: образование подкожных холодных абсцессов при попадании вакцины под кожу и язв величиной 10 мм и более, лимфадениты региональных лимфатических узлов (подмышечные, шейные, над- и подключичные), келлоидные рубцы. При возникновении осложнений требуется специальное лечение, которое, как правило, позволяет добиться их ликвидации.
Иммунитет, приобретенный после вакцинации, развивается в течение 6—8 нед, в этот же период появляется поствакцинальная сенсибилизация к туберкулину, проявляющаяся положительной туберкулиновой реакцией. Наличие поствакцинального рубчика и положительная туберкулиновая реакция у привитых свидетельствуют о технически правильно выполненной вакцинации. Протективный эффект противотуберкулезной вакцинации — 80%, т. е. из каждых 100 привитых у 80 локальные проявления туберкулеза при заражении не развиваются.
Протективный эффект после вакцинации сохраняется в среднем в течение 10 лет, поэтому в нашей стране принято, кроме вакцинации новорожденных, проводить ревакцинацию детей и подростков.
Первую ревакцинацию проводят в возрасте 6—7 лет (учащиеся 1-го класса школы), вторую — в возрасте 11—12 лет (учащиеся 5-го класса), третью ревакцинацию — в возрасте 16—17 лет (учащиеся перед окончанием школы).
На территориях, на которых практически ликвидирована заболеваемость туберкулезом детей, при наличии специального приказа местных органов здравоохранения разрешается осуществлять только две ревакцинации: первую — детям в возрасте 7 лет (учащиеся 1—2-го класса), вторую — в возрасте 14—15 лет (учащиеся 8-го класса).
Ревакцинацию проводят также взрослым лицам до 30 лет. Чаще всего это удается в организованных коллективах: студенты высших учебных заведений, допризывники и призванные на службу в вооруженных силах, внутренних войсках, милиции, рабочие крупных заводов и т. д. Перед ревакцинацией осуществляют туберкулиноди-агностику — внутрикожный туберкулиновый тест (реакция Манту) с 2 ТЕ — ППД-Л. Ревакцинацию производят только лицам, у которых получены отрицательные результаты туберкулиновой ре-
376
акции. В сложной эпидемической обстановке, при наличии большого
резервуара инфекции и высокой заболеваемости ревакцинация воз-
можна при сомнительных результатах туберкулиновой
прооы и даже
без предварительной туберкулинодиагностики — «прямая» ревак-
цинация.
Противопоказаниями к ревакцинации БЦЖ являются: инфицирование или туберкулез в прошлом, положительная реакция Манту с 2 ТЕ ППД-Л, осложненные реакции на предыдущее введение вакцины БЦЖ, острые заболевания, в том числе инфекционные, аллергические болезни (кожные и респираторные), злокачественные
болезни крови и нов
разования, иммунодефицитные состояния
лечение иммунодепрессантами, беременность (все сроки).
Организация вакцинации новорожденных и ревакцинации является одной из основных задач противотуберкулезного диспансера и
связана с планированием всего комплекса мероприятий, подготовкой медицинского персонала и обеспечением необходимым инструментарием, вакциной, туберкулином и т. д.
При планировании вакцинации следует предусмотреть вакцинацию 96—97% новорожденных благодаря рациональному использованию вакцины БЦЖ и БЦЖ-М. На ряде территорий вакцинацию
новорожденных проводят только вакциной БЦЖ-М.
Ревакцинация требует тщательной организационной подготовки, так как она включает проведение массовой туберкулинодиагностики,
регистрацию результатов туберкулиновых реакций через 48 ч после
туберкулиновой пр
ы, отбор контингентов для ревакцинации и ее
проведение. Этот комплекс мероприятий целее
•in»
разнее проводить
силами специально подготовленных бригад, состоящих из средних
медицинских работников детских городских, городских и центральных районных поликлиник. В состав бригады должны входить не менее двух медицинских сестер, регистратор и другой дополнительный персонал; как правило, в состав бригады включают медицинского работника учреждения, в котором проводят ревакцинацию. Если вакцинацию новорожденных осуществляют постоянно в родильных домах, то бригады по ревакцинации работают по заранее составленному плану-графику, в котором указано время выхода в каждый конкретный детский и подростковый коллектив.
За полный охват контингентов, которым необходимо сделать противотуберкулезные прививки, качество и эффективность противотуберкулезной вакцинации и ревакцинации детей, подростков и взрослых несут ответственность главные врачи противотуберкулезного диспансера, санитарно-эпидемиологической станции, центральной и районной поликлиник. Основными документами, которыми необходимо руководствоваться при проведении противотуберкулезных прививок, являются «Инструкция по применению вакцины туберкулезной (БЦЖ) сухой для внутрикожного введения при массовой вакцинации и ревакцинации против туберкулеза» (приложение № 6 к приказу Минздрава СССР от 5.07.1988 г.) и аналогичная инструкция по применению вакцины туберкулезной БЦЖ-М (приложение № 7 к тому же приказу).
377
Одним из основных методов специфической профилактики является вакцинация БЦЖ. Оценку ее проводят по трем аспектам:
а) оперативная — охват вакцинацией и ревакцинацией подлежащих ей лиц; б) техническая — качество вакцины, соблюдение правил
ее хранения, правильность техники разведения и выполнения самой инъекции. Именно этими условиями определяется качество вакцинации [Mokhtati et al., 1970]; в) эпидемиологическая — уровень заболеваемости туберкулезом среди вакцинированных.
При определении эффективности вакцинации наиболее точной является эпидемиологическая оценка, однако для этого необходимо
проводить специально организованные контролируемые испытания, что требует много времени и специально разработанной программы. В связи с этим для оценки качества противотуберкулезных прививок принято использовать степень выраженности аллергической реакции после вакцинации, а также величину рубчика, образующегося на месте введения вакцины [Яблокова Т. Б. и др., 1967; Ефимова А А., 1968; Митинская Л. А., Лебедева Л. В., 1972, и др.].
Изучение этой реакции в различные сроки после прививки свидетельствует о том, что 73—95% детей положительно реагируют на введение 5 ТЕ ППД-Л [Плотникова М. П., 1971; Гинзбург Е. А. и др., 1974, и др.]. Только И. Г. Урсов и Т. Г. Теньковская (1971) указывают, что преобладающее большинство детей дошкольного возраста в городах через 4—5 лет после прививки не реагируют на пробу Манту и с 1 или 5 ТЕ ППД-Л. Следовательно, уровень поствакцинальной аллергии является одним из основных критериев оценки качества прививки, особенно в первые годы после иммунизации БЦЖ.
Е. А. Гинзбургом и соавт. (1972) показано, что интенсивность поствакцинальной аллергии находится в прямой зависимости от интенсивности реакций на месте введения вакцины. В связи с этим по величине образующегося рубца можно предполагать, какой будет интенсивность аллергии. Частота формирования рубцов на месте введения вакцины варьирует от 62 до 98% [Гинзбург Е. А. и др., 1970].
Значительно больше внимания было уделено развитию реакций на месте введения вакцины БЦЖ, которые наблюдаются более чем у 90% привитых против туберкулеза [Ефимова А. А., 1968; Митинская Л. А. и др., 1970, и др].
Приведенные наблюдения явились основанием для повсеместной проверки качества противотуберкулезной вакцинации, предусмотренной методическими указаниями по организации противотуберкулезной помощи детям (М., 1974), которая осуществляется путем контроля за состоянием рубца и выраженностью поствакцинальной аллергии.
Hitze (1972) в своем докладе на XXI Международной конференции по туберкулезу, проходившей в Москве в 1971 г., подчеркнул, что результаты проведенных в последние годы эпидемиологических и экспериментальных исследований свидетельствуют о том, что вакцинация БЦЖ является одним из наиболее эффективных ме
378
роприятий в борьбе с туберкулезом как в развивающихся странах, так и в развитых, в которых распространенность туберкулеза невысока»
Е. А» Гинзбург и соавт. (1973) при наблюдении за 130 000 детей, вакцинированных БЦЖ внутрикожным методом, показали, что вакцинация приводит к снижению заболеваемости туберкулезом по сравнению с контрольной группой на 58—65%. Аналогичные данные получены Р. И. Захаровой (1970), Rozenthal (1964), Andelman (1966), Springett (1966) и др. Frimond-Moller и соавт. (1964) также указывают на значительно выраженный эпидемический эффект вакцинации БЦЖ и снижение заболеваемости на 56—60% среди вакцинированного населения южных районов Индии.
11 .2. МЕРЫ ПО ОГРАЖДЕНИЮ НАИБОЛЕЕ УГРОЖАЕМЫХ КОНТИНГЕНТОВ ОТ БОЛЬНЫХ С ЗАРАЗНЫМИ ФОРМАМИ ТУБЕРКУЛЕЗА И НЕДОПУЩЕНИЮ БОЛЬНЫХ К РАБОТЕ В НЕКОТОРЫХ ПРОФЕССИЯХ
В связи с тем что среди населения имеются отдельные группы и лица с повышенной восприимчивостью к туберкулезной инфекции, эти контингенты по возможности ограждают от больных туберкулезом. К ним относятся дети и подростки в возрасте до 18 лет. Нельзя также исключить наличие лиц с повышенной восприимчивостью к туберкулезу среди населения старше 18 лет, поэтому специальной инструкцией утвержден список профессий, к работе по которым не допускаются больные туберкулезом. При развитии туберкулеза у лиц этой профессии они не могут продолжать свою профессиональную деятельность в период болезни, а при некоторых профессиях и после выздоровления («Инструкция о проведении обязательных профилактических медицинских осмотров на туберкулез и порядке допуска к работе в некоторых профессиях лиц, больных туберкулезом», утвержденная 27.12.1973 г. и согласованная с Секретариатом ВЦСПС 25.12.1973 г.). В соответствии с этой инструкцией больные с острыми (заразными) формами туберкулеза не допускаются к работе в родильных домах, лечебно-профилактических и воспитательных учреждениях для детей, школах, оздоровительных и спортивных учреждениях для детей и подростков. Таким образом, первая группа профессий связана с работой в различных учреждениях для детей и подростков. Самый многочисленный контингент в этой группе — педагоги. Вторая группа — это профессии, связанные с изготовлением пищевых продуктов и их продажей в магазинах, ресторанах, столовых и т. д. Третья группа — работники коммунального хозяйства и общественного транспорта, непосредственно соприкасающиеся с населением: парикмахеры, работники прачечных, плавательных бассейнов, проводники вагонов на железной дороге, бортпроводники пассажирских самолетов, водители легковых такси, обслуживающий персонал гостиниц, детских ателье, водопроводных станций, библиотекари, лица, изготавлива
379
ющие и продающие детские игрушки, домашние работницы, плав
состав на судах морского и речного флота.
Для практического осуществления мероприятий, предусмотренных инструкцией, требуется тщательно отработанная система. Прежде всего лица, поступающие на работу по перечисленным профессиям, должны проходить медицинский осмотр, при выявлении туберкулеза эти лица к работе не допускаются. Ежегодно все работники по указанным в инструкции специальностям также должны проходить медицинский осмотр с обязательной флюорографией легких. Медицинские осмотры могут быть организованы по комплексному принципу, когда в течение 1—3 дней проходящего обследование осматривают все специалисты, а также проводят все необходимые лабораторные и рентгенологические исследования.
Часто такие осмотры осуществляют на хозрасчетной основе и в
специально выделенном для этой цели лечебно-
илактическом
учреждении. Флюорографию и осмотр фтизиатра можно провести в противотуберкулезном диспансере, а обследование у других специалистов — в соответствующих учреждениях, что занимает больше времени и сопряжено с многократным отрывом обследуемых от работы.
Периодически, в соответствии с графиком работы, фтизиатр
проводит проверку выполнения медицинских осмотров во всех учреждениях, предусмотренных инструкцией, находящихся в районе обслуживания. При проверке просматривают журнал, в котором фиксируют данные о проделанной работе, и индивидуальные санитарные книжки каждого работающего, в которых должны быть отмечены даты проведения медицинских осмотров. Следует подчеркнуть большое значение этой работы, особенно в детских учреждениях и школах. При выявлении больного туберкулезом среди лиц указанных в инструкции профессий, особенно в детских уч-
реждениях, школах и других так называемых закрытых коллек-
тивах (учащиеся интернатов, лица, живущие в
должен быть проведен комплекс проф
м.«».
илактических мероприятий*, все
лица, контактировавшие с бальным туберкулезом, должны быть тщательно обследованы фтизиатром с применением рентгенологи-
ческих и лабораторных методов, за ними устанавливают диспансерное наблюдение в течение 4—6 мес, в случае необходимости
всем имевшим контакт с больным или выборочно (по показаниям)
проводят химиопрофилактику, а в помещениях — дезинфекцию
силами районной дезинфекционной станции. Известны случаи развития эндемических вспышек туберкулеза при контакте с
больным в закрытых коллективах (команда морских судов, учащиеся гимназий, техникумов, училищ, лица, живущие в обще-
житиях, и т. д.). В связи с этим такие молодежные коллективы всегда должны быть в сфере наблюдения медицинского персонала, и при возникновении подобных ситуаций необходимо немедленно привлекать фтизиатра районного противотуберкулез-
ного диспансера.
380
11 .3. ПРОФИЛАКТИКА ТУБЕРКУЛЕЗА СРЕДИ ЛИЦ С ПОВЫШЕННЫМ РИСКОМ ВОЗНИКНОВЕНИЯ ЗАБОЛЕВАНИЯ
К лицам с повышенным риском заболеть туберкулезом относятся
здоровые лица, у которых имеются рентгенологические признаки излеченного туберкулеза в виде плотных очаговых изменений с четкими контурами и тяжистого фиброза на ограниченной площади. Иногда их называют остаточными туберкулезными изменениями (ОТИ). Лиц с ОТИ делят на две подгруппы: А — переведенные в VII группу диспансерного учета из III группы в связи с выздоровлением в результате ранее проведенного лечения; Б — лица, у которых выявлены ОТИ в виде фиброзно-очаговых и цирротических изменений, множественные кальцинаты. Как правило, этих лиц выявляют при массовых профилактических осмотрах населения и, если при дополнительном обследовании признаков активности туберкулезного процесса не обнаруживают, берут на учет в группу VIIB.
Следует подчеркнуть, что в VII группе выделяют лиц, у которых, кроме остаточных изменений, имеются сопутствующие заболевания (сахарный диабет, язвенная болезнь желудка и двенадцатиперстной кишки, неспецифические заболевания легких и др.). У этого контингента особенно высок риск развития туберкулеза.
В соответствии с «Методическими указаниями по группировке контингентов противотуберкулезных диспансерных учреждений», утвержденными Минздравом СССР 5.03.1988 г., лица, состоящие на диспансерном учете по VII группе, при наличии больших остаточных изменений должны находиться под наблюдением в течение всей жизни. Они подлежат обследованию в противотуберкулезном диспансере не реже 1 раза в год, а при наличии хронических заболеваний внутренних органов, в первую очередь хронических неспецифических заболеваний легких, частота посещений диспансера определяется медицинскими показаниями и необходимостью проведения лечебно-оздоровительных мероприятий. Эти лица могут быть направлены в противотуберкулезные санатории для реабилитационного лечения, в том числе заболеваний внутренних органов,
проведения превентивной химиотерапии.
Под диспансерным наблюдением находятся также лица, выздоравливающие от туберкулеза, так как у них имеется риск обострения и рецидива заболеваний (II и IV группы диспансерного учета). Лица, у которых выявлены туберкулезные изменения в легких или
внутригрудных лимфатических узлах, наблюдаются по группе дис-
пансерного учета 0, в этот период им проводят «пробное» лечение
химиопрепаратами.
В связи с тем что лиц, у которых при флюорографии выявлены малые остаточные изменения после излеченного туберкулеза, на учет в противотуберкулезный диспансер не ставят, документация на них хранится во флюоротеке поликлиники в отдельной группе «рентгеноположительных». К малым остаточным изменениям относятся единичные (не более 5) компоненты первичного комплекса
381
МГН
(очаг Гона и кальцинированные лимфатические узлы) размером не более 1 см, единичные плотные, четко очерченные очаги размером не более 1 см, ограниченный фиброз в пределах одного сегмента легкого, запаянные синусы и междолевые шварты. При наличии у этих лиц сопутствующих заболеваний внутренних органов их должны обследовать участковый терапевт совместно с фтизиатром не реже 1 раза в год.
Дополнительными факторами риска у лиц, у которых имеются остаточные изменения после излеченного туберкулеза, являются алкоголизм, наркомания, а также социальные факторы, обусловливающие их социальную ущербность, низкий доход, не обеспечивающий прожиточный минимум, бродяжничество и другие формы миграции, плохие жилищные условия и т. д. Указанная группа также должна быть охвачена профилактическими мероприятиями (периодические медицинские обследования, в случае необходимости химиопрофилактика). В последние годы к группам риска принято относить также лиц, у которых имеются ближайшие родственники, которые переболели или больны туберкулезом. В данном случае риск связан не только с возможным контактом, но и с генетическими факторами и наследственной предрасположенностью к туберкулезу, существование которой доказано В. П. Чукановой.
Диспансерное наблюдение за контингентами противотуберкулезных диспансеров и группами риска, не состоящими на диспансерном учете, включает:
1) получение точных сведений о лицах, относящихся к группам риска: адрес, место работы, состояние здоровья, вредные привычки, экологические, профессиональные и социальные факторы, оказывающие неблагоприятное влияние на состояние здоровья;
2) проведение периодических медицинских обследований, включающих необходимые рентгенологические, лабораторные и другие исследования. При наличии у этих лиц кашля с выделением мокроты, особенно у больных острыми и хроническими заболеваниями легких, обязательно проводят исследование мокроты на наличие микобактерий туберкулеза и посев мокроты на питательные среды;
3) осуществление оздоровительных мероприятий и рациональное трудоустройство, при наличии показаний проведение в период отпуска санаторного и санаторно-климатического лечения, периодическое оздоровление в дневных и ночных санаториях;
4) лечение острых и хронических заболеваний внутренних органов;
5) проведение специфической (превентивной) химиопрофилактики тубазидом в дозе 0,45—0,6 г в сутки либо двумя химиопрепаратами — комбинацией тубазида и этамбутола или пиразинамида, или ПАСК. Длительность курса химиопрофилактики 3—6 мес, можно провести два курса по 3 мес.
Химиопрофилактику двумя химиопрепаратами проводят лицам, включенным в 0 и II группы диспансерного учета. В 0 группе химиопрофилактику осуществляют при выявлении заболевания, во II — 2 раза в год по 3 мес.
МГН
382
Лицам VII группы и относящимся к группам риска, не состоящим на учете в противотуберкулезном диспансере, проводят химиопрофилактику тубазидом по индивидуальным показаниям после предварительного исследования. В тех случаях, когда возникает опасность реактивации туберкулеза (вокруг старых очагов в легких появляются ранее отсутствовавшие изменения), обнаружено однократное выделение микобактерий туберкулеза вследствие попадания очагов в
зону воспалительного процесса, после ликвидации интеркуррентных заболеваний или обострения хронического заболевания сохраняются неудовлетворительное самочувствие, субфебрильная температура тела, стойкие изменения в лейкограмме.
Химиопрепараты применяют ежедневно 1 раз в день, возможен
интермиттирующий прием — через день или 2 раза в неделю.
При проведении химиопрофилактики важно обеспечить регулярный
прием лекарственных средств, поэтому наибольшее распростране
М1Н
ние получила методика контролируемого приема химиопрепаратов, т. е. в присутствии медперсонала. Прежде всего контролируемую химиопрофилактику осуществляют в условиях стационара, санатория, дневного или ночного санатория, профилактория. Вместе с тем ее чаще проводят в амбулаторных условиях, в которых также может быть организован контролируемый прием химиопрепаратов, особенно в организованных коллективах: на предприятиях, в школах и т. д. Для населения, живущего недалеко от медицинских учреждений (диспансеров, поликлиник, фельдшерско-акушерских пунктов, врачебных участков), химиопрофилактика может быть организована путем доставки химиопрепаратов на дом. Наряду с этим химиопрофилактика может быть проведена с помощью не
контролируемого метода путем выдачи препаратов на руки, в этом случае периодически осуществляют контроль за приемом таблеток путем их подсчета, а также по анализам мочи на наличие
химиопрепарата.
За время, прошедшее после первых предложений о проведении химиопрофилактики (Н. А. Шмелев, О. Zorini), накоплен большой опыт, свидетельствующий о ее эффективности. По данным Ю. Л. Гампериса, заболеваемость туберкулезом в Литве за 12 лет в условиях широкого применения химиопрофилактики снизилась в 20 раз. О высокой эффективности химиопрофилактики свидетельствуют данные О. Г. Батиашвили, М. А. Клебанова, В. М. Страхова и др. Заслуживают внимания результаты большого кооперативного исследования по изучению эффективности химиопрофилактики в 7 странах Европы, проведенной у 28 594 человек в течение 12, 24 и 52 нед. Это исследование выполнено под руководством ВОЗ. Под влиянием химиопрофилактики заболеваемость туберкулезом в течение 2 лет снизилась на 70%. При выраженных остаточных изменениях более эффективной оказалась
химиоп
он г
илактика, проведенная в течение года, тем не менее
такая методика не нашла большого числа сторонников. Большое
распространение получила практика осуществления более коротких курсов — продолжительностью не более 6 мес; в нашей стране
383
применяют также 2—3-месячные курсы химиопрофилактики, которые проводят 2 раза в течение года.
Профилактика в очагах туберкулезной инфекции включает боль-
шои комплекс профилактических мероприятии, содержание и мас
штабы которых определяются конкретной ситуацией в очаге. Очагом
туберкулезной инфекции принято считать жилище больного с заразными формами туберкулеза, представляющего эпидемиологиче
скую опасность для окружающих, прежде всего для его семьи (квартира, дом и др.). В последнее время понятие об очаге туберкулезной инфекции расширилось. Очагом туберкулезной инфекции можно считать небольшие поселки со значительным поражением населения
в условиях эндемической вспышки, молочно-товарные фермы, в которых содержится больной туберкулезом крупный рогатый скот. К очагам могут быть отнесены небольшие коллективы — команда судов, учебные группы, лица, живущие в общежитии или комнате в общежитии, воинские или другие закрытые коллективы, находящиеся в одном помещении (учебные классы, казармы и т. д.) в
условиях эндемической вспышки туберкулеза.
Большое внимание необходимо уделять про4
илактическим мерам
в очагах туберкулезной инфекции, конечно, с учетом характера контакта, степени заразности больного, а также степени восприим
чивости к туберкулезу лиц, находившихся в контакте. Профилак-
тические меры по отношению к лицам, контактировавшим с боль
ным, являются частью комплекса мероприятий, проводящихся в
очаге.
С точки зрения эпидемической опасности все очаги туберкулезной инфекции делят на три группы:
1) наиболее опасные, в которых имеются больной, выделяющий большое количество микобактерий туберкулеза, определяемое с помощью микроскопии или посева (при росте более 20 колоний), или дети и подростки, а также отмечаются неблагоприятные жилищные
условия;
2) менее опасные, когда больной выделяет микобактерии, выявляемые только методом посева при росте менее 20 колоний, а также при наличии детей и подростков, плохих жилищных условий;
3) «условные» — при прекращении выделения больным микобактерий под влиянием лечения, но до истечения 2 лет, в течение которых больной, выделявший микобактерии, считается бактерио-
выделителем.
Комплекс
илактических мер проводят во всех очагах, но в
первую очередь в наиболее опасных для заражения окружающих. Первоочередным мероприятием является госпитализация больного,
что позволяет не только изолировать его от окружающих, но и применить эффективные методы лечения, добиться прекращения выделения микобактерий и излечения подавляющего большинства больных. Этому способствуют длительное лечение, выплата пособия в связи с временной потерей трудоспособности в течение всего периода лечения (10 мес и больше). После лечения в стационаре больных и выздоравливающих направляют в санатории (бесплатно),
384
в том числе для климатического лечения. При заразных формах заболевания больных вместе с семьей переселяют из общежития и густонаселенных квартир вне очереди (в течение года).
Лица, находившиеся в контакте с больными, наблюдаются в противотуберкулезном диспансере по IV группе диспансерного учета. Им проводят химиопрофилактику, при необходимости — вакцинацию или ревакцинацию БЦЖ, если при обследовании обнаруживается отрицательная туберкулиновая реакция. Под контролем диспансера осуществляют текущую дезинфекцию, необходимые гигиенические мероприятия, а при госпитализации больного, направлении его в санаторий и в случае смерти санэпидстанция проводит заключительную дезинфекцию жилища и вещей больного.
Следует подчеркнуть, что при выявлении очага туберкулезной инфекции составляется план его оздоровления, в который вносят указанные выше мероприятия. Если в результате лечения больной выздоравливает, то после выполнения плана оздоровления очаг по степени эпидемической опасности относят к 3-й категории. Совер
шенно другая ситуация создается, если в очаге сохраняется источник или источники распространения туберкулезной инфекции. В этом
случае очаг сохраняется, и степень его опасности определяется
конкретными обстоятельствами. В этом случае устанавливают дли-
тельное наблюдение за очагом и осуществляют профилактические
мероприятия, предусмотренные планом.
ГЛАВА 12
ОРГАНИЗАЦИЯ ПРОТИВОТУБЕРКУЛЕЗНОЙ РАБОТЫ
После открытия Р. Кохом в 1882 г. возбудителя туберкулеза была создана научная основа для разработки методов его профилактики, диагностики, а впоследствии и лечения. Потребность в этом была обусловлена необходимостью создать систему мер борьбы с туберкулезом в связи с его широким распространением в странах Европы и Северной Америки, особенно среди беднейших слоев населения. В эпоху развития капитализма и притока разорившихся крестьян в порода на заводы, фабрики, шахты тяжелый труд, крайне неблагоприятные бытовые условия, скученность создавали предпосылки к заражению туберкулезом больших групп населения и дальнейшему его распространению. Именно в этот период туберкулез получил название «пролетарская болезнь», хотя, конечно, случаи заболевания туберкулезом отмечались не только среди рабочих, но и среди других слоев населения. В России, которая позже других стран Европы вступила на путь капиталистического развития, к концу XIX столетия туберкулез получил очень широкое распространение, особенно высокая заболеваемость им была в Петербурге, Москве, Одессе и других крупных городах. Несмотря на это, государственные мероприятия по борьбе с этим заболеванием не проводили, поэтому в разных городах России по инициативе передовой общественности стали возникать местные общества по борьбе с туберкулезом.
Улучшение условий труда и быта, введение социального страхования, развитие сети больниц, противотуберкулезных диспансе-
ров, санаториев, организация научно-исследовательских учреждений, подготовка врачей-фтизиатров, широкое участие в борьбе с
туберкулезом общественности привели к созданию условий для снижения заболеваемости и смертности от туберкулеза.
15 августа 1918 г. по инициативе Н. А. Семашко при Народном Комиссариате здравоохранения РСФСР была создана Центральная комиссия по борьбе с эпидемическими болезнями, а в последующем организована секция по борьбе с туберкулезом. Для изучения проблемы туберкулеза, разработки организационных форм борьбы с
ним, методов диагностики, лечения и
специализированные научно-исследовательские институты. Первый такой институт был открыт в Москве в 1918 г. (в настоящее время Московский научно-исследовательский институт туберкулеза М3
РФР), в 1921 г. создан Центральный научно-исследовательский
институт туберкулеза, а затем были организованы институты в
Ленинграде, Харькове, Киеве и других городах страны.
Если первым принципом борьбы с туберкулезом в нашей стране является ее государственный характер, то вторым принципом*, оп
ределяющим направление работы противотуберкулезных учрежде-
ний, может быть назван лечебно-профилактический. Третий, не
386
менее важный принцип — организация противотуберкулезной работы силами специализированных противотуберкулезных учреждений и широкое участие в этой работе всех лечебно-профилактических учреждений под руководством и при полной ответственности органов здравоохранения. Эти основные принципы борьбы с туберкулезом сохраняют свое значение до настоящего времени. Именно они послужили основой диспансерного метода, сущность которого состоит в гармоничном сочетании лечебно-диагностической работы среди больных и профилактической — среди различных групп на
селения.
Организация противотуберкулезных диспансеров, больниц и санаториев в нашей стране была одним из наиболее важных направлений в создании материально-технической базы для борьбы с туберкулезом. Не менее важной задачей была разработка организационных принципов этой борьбы, методологии и форм основных противотуберкулезных мероприятий, в частности диспансерного наблюдения за специально отобранными контингентами населения и больными туберкулезом. Эти вопросы были основной темой дискуссии на III съезде фтизиатров, состоявшемся в 1926 г. Основополагающими работами, послужившими научной базой для развития теории и практики борьбы с туберкулезом, явились исследования 3. П. Соловьева, Е. Г. Мунблита, С. М. Швайцера, а в последующие годы — С. В. Массино, С. Е. Незлина, М. И. Ойфе-баха, Н. С. Морозовского, Н. Г. Авгушевича. Диспансерный метод работы, составляющий основу борьбы с туберкулезом, непрерывно
совершенствовался, это направление сохраняет свое значение и в
настоящее время.
Изменившаяся в последние годы эпидемическая обстановка в отношении туберкулеза, характеризующаяся уменьшением числа больных, снижением заболеваемости и смертности, позволила сформулировать основные направления борьбы с туберкулезом и содержание противотуберкулезных мероприятий в настоящий период. Их главная цель — дальнейшее снижение заболеваемости туберкулезом, что может быть осуществлено только путем проведения комплекса противотуберкулезных мероприятий применительно к конкретным условиям на каждой территории по разработанной программе, которую обычно называют комплексным планом борьбы с туберкулезом. Комплексный план составляют на каждый год и на более
длительные сроки в соответствии с перспективными планами.
Программа борьбы с туберкулезом включает следующие основные разделы: укрепление материально-технической базы, в том числе оснащение лечебных учреждений, обеспечение необходимыми кадрами и повышение их квалификации, проведение мероприятий, направленных на уменьшение резервуара туберкулезной инфекции и предупреждение ее распространения среди здорового населения, выявление больных туберкулезом и их лечение.
Материально-техническую базу составляют районные, городские, областные и республиканские диспансеры или республиканские институты туберкулеза, функционирующие по единой программе под
13*
387
руководством органов здравоохранения. В эту систему входят также другие противотуберкулезные учреждения: больницы, санатории, детские учреждения. Противотуберкулезные диспансеры играют ведущую роль среди других учреждений, так как именно они планируют противотуберкулезные мероприятия и обеспечивают их проведение в жизнь в широких масштабах.
В комплексном плане должно быть предусмотрено все необходимое для успешной работы противотуберкулезных учреждений, отражены меры по оптимизации работы и постепенному укреплению мелких, малорентабельных больниц и других учреждений. Он также должен включать рекомендации относительно подбора, расстановки медицинских и других кадров, повышения квалификации врачей, медицинских сестер и лаборантов с использованием различных форм проведения занятий (курсы, семинары, декадники, конференции и т. д.).
Противотуберкулезный диспансер (кабинет) является методиче-
ским и оперативным центром по организации борьбы с туберкулезом, а также привлечению общемедицинской сети и ее различных служб
к планированию и проведению основных противотуберкулезных мероприятий. Основными задачами диспансера являются: планирование и организация борьбы с туберкулезом в районе обслуживания, организация и проведение профилактических мероприятий, выяв-
ление больных туберкулезом, регистрация и учет всех больных туберкулезом, а также всех лиц, относящихся к группам повышенного риска его развития, осуществление диспансерного наблюдения
за всеми контингентами, состоящими на учете в диспансере, организация лечения больных туберкулезом, в том числе проведение амбулаторной химиотерапии. Аналогичные функции выполняют противотуберкулезные кабинеты и диспансерные отделения поликлиник
в тех местностях, где отсутствуют диспансеры.
В структуре противотуберкулезного диспансера имеются: диспансерное отделение, стационар, санаторий-профилакторий, лечебнотрудовые мастерские, клинико-диагностическая и бактериологиче-
ская лаборатории, рентгеновский, физиотерапевтический, функциональной диагностики и другие кабинеты, в областном (республиканском, краевом) противотуберкулезном диспансере — эндоскопический кабинет. В стационаре областного (республиканского, краевого) диспансера могут быть организованы хирургическое и реанимационное
отделения.
Противотуберкулезный диспансер областного (республиканского, краевого) подчинения также осуществляет организационно-методическое руководство противотуберкулезными учреждениями и проведением противотуберкулезных мероприятий другими лечебно-профилактическими учреждениями, консультации больных, отбор и направление больных с санатории, экспертизу трудоспособности и направление на ВТЭК, планирование выездов врачей-фтизиатров и других специалистов в другие учреждения, определение потребности в койках, противотуберкулезных препаратах, флюорографической и рентгеновской пленке, а также совместно с СЭС — в вакцине
388
БЦЖ и туберкулине, систематический контроль за расходом и
хранением химиопрепаратов в подведомственных учреждениях, проведение занятий для подготовки специалистов по туберкулезу, сбор и анализ материалов по эпидемиологии туберкулеза, пропаганду
передового опыта.
Противотуберкулезные диспансеры районного и городского подчинения выполняют свои задачи в районе обслуживания. Лечебнопрофилактические учреждения общего профиля должны участвовать в таких мероприятиях, как выявление и лечение больных туберкулезом, проведение профилактических мероприятий. Накопленный
опыт свидетельствует о том, что успешное осуществление основных противотуберкулезных мероприятий без активного участия специалистов общемедицинской сети невозможно.
Противотуберкулезный диспансер — не только организационно-методический центр по борьбе с туберкулезом. Он должен быть высококвалифицированным диагностическим и лечебным учреждением, в котором больному можно было бы провести необходимые исследования, а также применить основные виды лечения больных в стационаре диспансера и амбулаторных больных, а также лиц, направленных на обследование по поводу имеющейся у них легочной патологии. Высококвалифицированная диагностическая и лечебная помощь в настоящее время может быть оказана в достаточно крупных
учреждениях, хорошо укомплектованных кадрами (фтизиатр, рен-
тгенолог, бронхолог, бактериолог и другие специалисты) и осна-
щенных необходимым
рудованием и аппаратурой. Больным, на-
блюдающимся в противотуберкулезных кабинетах и диспансерах, недостаточно оснащенных, необходимые исследования могут быть проведены в областных противотуберкулезных диспансерах, а также
в специально выделенных для этой цели городских и районных диспансерах, выполняющих функции консультативного лечебно-диагностического центра для больных из прикрепленных районов. Стационары таких учреждений осуществляют госпитализацию боль-
ных из этих районов.
Лечение больных туберкулезом проводят в основном в специа-
лизированных больницах и отделениях многопрофильных больниц
а также в стационарах диспансеров. В противотуберкулезных санаториях наряду с диагностической и лечебной помощью больным осуществляют климатотерапию, в том числе в благоприятных кли-
матических зонах Южного берега Крыма, горной местности, лесостепной зоне и др. Основной задачей санаториев является медицинская и трудовая реабилитация больных туберкулезом.
Научно-исследовательские институты туберкулеза — республи-
канские и центральный — проводят научно-исследовательскую работу, в том числе научно-методические разработки организационных принципов борьбы с туберкулезом.
Весь комплекс противотуберкулезных мероприятий, в том числе клинико-диагностическая работа и лечение, должен осуществляться в условиях непрерывного эпидемиологического контроля. Туберкулез относится к контролируемым, т. е. управляемым, инфекционным
389
заболеваниям, поэтому противотуберкулезные диспансеры могут в полной мере использовать методику эпидемиологического контроля с современными критериями оценки эффективности как отдельных методов и организационых форм, так и в целом борьбы с туберкулезом, определения тенденций в динамике его распространенности среди населения и прогнозирования на будущее.
Оценку эффективности всех противотуберкулезных мероприятий должны осуществлять в диспансерных учреждениях в первую очередь по динамике эпидемиологических показателей, поэтому в работе противотуберкулезного диспансера большое значение имеет правильное ведение у четно-отчетной документации, системы учета диспансерных контингентов и отчетности. Учет больных туберкулезом и всех контингентов диспансера проводят по группам диспансерного наблюдения, что обеспечивает дифференцированный подход к различным контингентам: больным, выздоравливающим, излеченным от туберкулеза, находящимся в контакте с больными и т. д.
Диспансерное наблюдение за контингентами противотуберкулезного диспансера осуществляют в соответствии с методическими указаниями по группировке этих контингентов. Контингенты взрослых, подлежащих учету в диспансере, подразделяют на следующие группы: О (нулевая) — лица с туберкулезом сомнительной активности; I — больные активным туберкулезом органов дыхания, которых делят на две подгруппы: А — впервые выявленные, Б — с хроническим процессом, развившимся вследствие неэффективности лечения. В обеих подгруппах выделяют больных, выделяющих и не выделяющих микобактерии туберкулеза;
II — больные с затухающим активным туберкулезом, которым необходимо провести курсы противорецидивной химиотерапии;
Ш — лица с клинически излеченным туберкулезом органов дыхания;
IV — лица, находящиеся в контакте с больными, выделяющими микобактерии туберкулеза, или больными туберкулезом сельскохозяйственными животными;
V — больные внелегочным туберкулезом и излеченные от него, которых делят на четыре подгруппы:
А — больные активным внелегочным туберкулезом,
Б — затихающий внелегочный туберкулез,
В — неактивный внелегочный туберкулез, Г — лица, излеченные от внелегочного туберкулеза, у которых наблюдаются выраженные остаточные явления;
VI (только для детей) — инфицированные туберкулезом (виражные), а также не привитые БЦЖ в период новорожденное™ и дети с поствакцинальными осложнениями;
VII — лица с остаточными изменениями после излеченного (в том числе спонтанно) туберкулеза органов дыхания с повышенным риском реактивации. В эту группу включают только лиц с выраженными остаточными изменениями, которых делят на две подгруппы:
390
A — лечившиеся от туберкулеза и переведенные из III подгруппы,
Б — переведенные из нулевой группы, выявленные при профосмотрах и медицинском обследовании других видов.
Принцип диспансерного наблюдения заключается в периодическом обследовании и применении при наличии показаний различных методов лечения, оздоровления и трудоустройства. Периодичность обследования определяется состоянием здоровья и группой диспансерного наблюдения:
О — не менее 1 раза в месяц,
IA — не менее 1 раза в месяц,
1Б — при лечении — 1 раз в месяц, при ремиссии — 1 раз в 3—6 мес,
II — 1 раз в 3—6 мес (при проведении превентивной химиотерапии по показаниям),
III — 1 раз в 6 мес,
IV — 1 раз в 6 мес,
V — по показаниям,
VI — по показаниям,
VII — 1 раз в год (при наличии сопутствующих заболеваний внутренних органов по показаниям).
Для проведения периодических исследований больных и лиц, подлежащих обследованию, приглашают в противотуберкулезный диспансер или посещают их на дому.
В случае необходимости больных и лиц, подлежащих обследованию, направляют на консультацию и для выполнения показанных исследований в областной (республиканский, краевой) противотуберкулезный диспансер. Длительность наблюдения в каждой группе диспансерного учета зависит от динамики туберкулезного процесса: О — 6 мес, IA — 12—24 мес с дальнейшим переводом в случае неэффективности лечения во II или 1Б группу, II — до 2 лет, III — 3 года, после чего переводят в VII группу, IV — в течение всего времени контакта, V — не менее 12 мес, VI — 12 мес, VII — пожизненно при наличии отягчающих факторов, сопутствующих заболеваний, остальные — 10 лет.
Перевод из одной группы диспансерного наблюдения в другую осуществляет комиссия по данным, отражающим динамику туберкулезного процесса, не чаще 1 раза в год, руководствуясь указанными выше примерными сроками.
В каждом противотуберкулезном диспансере на все контингенты, за которыми ведется диспансерное наблюдение, имеются учетные формы, в которых регистрируют данные о состоянии здоровья, изменение диагноза, группу диспансерного учета, результаты лечения и т. д.
Накопленный в течение последних лет опыт позволил заменить существовавшую ранее карту диспансерного наблюдения, с помощью которой ведется учет всех диспансерных контингентов. Новая карта (форма У-30-4) расширена, содержит данные о динамике туберку-
391
лезного процесса, проведенном лечении, его эффективности, т. е. все, что врач должен знать о больном. В ней фиксируют все сведения, необходимые для составления годового отчета.
Для того чтобы обеспечить дальнейшее снижение заболеваемости туберкулезом и разработать наиболее рациональные формы и методы борьбы с ним, были созданы экспериментальные базы на 8 территориях страны. За годы работы на этих базах были разработаны и внедрены в практику следующие мероприятия, направленные на совершенствование противотуберкулезной помощи в стране.
1. Создана методика раннего выявления туберкулеза путем проведения повторных сплошных флюорографических осмотров населения, результаты которых заносят в картотеку. Установлено, что осуществление таких осмотров возможно только при введении картотечного учета, причем картотеки должны быть созданы до начала осмотра по территориальному принципу, по врачебным участкам.
Об эффективности предложенной методики организации раннего выявления туберкулеза свидетельствует в первую очередь значительное уменьшение (до единичных случаев) выявления больных фиброзно-кавернозным и активным туберкулезом, особенно при профилактических осмотрах, а также снижение заболеваемости последним.
На экспериментальных базах удалось добитья повышения рентабельности флюорографических исследований благодаря выявлению всех болезней органов дыхания.
2. Предложена методика централизации бактериологической службы, обеспечивающая максимальную унификацию используемых методов исследования.
Благодаря совершенствованию клинической, рентгенологической и бактериологической диагностики значительно возросла частота бактериологической верификации диагноза впервые выявленного туберкулеза.
3. Разработан и внедрен в практику противотуберкулезных учреждений централизованный контроль областного (республиканского, краевого) диспансера за проведением основных противотуберкулезных мероприятий. Введение централизованного контроля обеспечивает унификацию диагностических установок на территории, контроль за организацией и эффективностью лечения впервые выявленных больных позволяет управлять процессом лечения. Централизованный контроль в сочетании с рациональным использованием коечного фонда и применением современных схем контролируемой химиотерапии на стационарном и амбулаторном этапах позволил значительно повысить эффективность лечения.
Централизованный контроль осуществляют путем повторной коллегиальной оценки результатов обследования больного и его лечения с целью своевременного внесения коррективов в проводимое лечение. Суть этого мероприятия заключается в том, что наиболее квалифицированные специалисты областного противотуберкулезного дис-392
пансера проводят контроль за правильностью диагнозов, установленных всем вновь выявленным больным в области, а также периодический пересмотр контингентов противотуберкулезных учреждении. Благодаря этому более чем в 2 раза уменьшилось количество диагностических ошибок, особенно при определении активности туберкулезного процесса.
Централизованный пересмотр контингентов больных туберкулезом позволил оценить качество проводимого лечния, уточнить диагноз и группу диспансерного учета, более правильно перераспределить контингенты больных по группам наблюдения в соответствии с утвержденной группировкой диспансерных контингентов.
Организация централизованного контроля в сочетании с рациональным использованием коечного фонда и применением более совершенных схем химиотерапии на больничном и амбулаторном этапах лечения позволила повысить эффективность лечения и добиться закрытия каверн у 86% и прекращения бактериовыделения у 96% впервые выявленных больных. Использование рифампицина и этамбутола привело к прекращению бактериовыделения у 60% повторно леченных больных. Подтверждена целесообразность уменьшения продолжительности больнично-санаторного лечения больных с малыми формами туберкулеза до 2—3 мес с последующим контролируемым амбулаторным лечением, в том числе интермиттирующей химиотерапией. Основой для централизованного контроля является имеющаяся в областном (республиканском) противотуберкулезном диспансере дублирующая картотека на некоторые контингенты больных туберкулезом (впервые выявленные, нулевая группа учета, больные с хроническими формами и др.). Картотека состоит из дубликатов карт учета диспансерных контингентов, находящихся в районных и городских противотуберкулезных диспансерах.
4. Расширена работа по дифференциальной диагностике туберкулеза и других болезней органов дыхания, что обеспечило более рациональное использование коек в отделениях дифференциальной диагностики.
Опыт работы на экспериментальных базах по созданию рациональной системы оказания пульмонологической помощи населению специалистами противотуберкулезных учреждений свидетельствует о том, что в современной эпидемиологической ситуации на территориях, где отмечаются низкие заболеваемость, болезненность и смертность от туберкулеза, фтизиатры могут включиться в оказание пульмонологической помощи определенным группам больных с хроническими болезнями органов дыхания.
Оценивая результаты проведенной работы и динамику эпидемиологических показателей, следует отметить, что на экспериментальных территориях удалось добиться существенного улучшения эпидемической обстановки по туберкулезу.
В различных регионах страны существуют социальные, демографические, климатогеографические и, наконец, «чисто» территориальные особенности, которые определяют специфические черты
393
работы противотуберкулезных диспансеров. В последнее время боль-
шое распространение получила практика использования экспедиционных выездных бригад для проведения как отдельных противоту-
беркулезных меропиятий (туберкулинодиагностика, ревакцинация,
флюорография и дообследование и др.), так и всей лечебно-профи-
лактической работы. Все шире используют опыт работы комплексных
бригад при проведении массовых обследований с участием фтизиатра.
Методика централизованного контроля за качеством диагностики и лечения, централизованной организации бактериологических иссле
дований позволяет планировать целенаправленные выезды и проводить с их помощью противотуберкулезные мероприятия по заранее разработанной программе.
ГЛАВА 13
ВНЕЛЕГОЧНЫЙ ТУБЕРКУЛЕЗ
13.1. ОБЩИЕ ПРИНЦИПЫ ДИАГНОСТИКИ, ЛЕЧЕНИЯ И НАБЛЮДЕНИЯ ЗА БОЛЬНЫМИ
В комплексе мероприятий, проводимых с целью совершенствования и повышения качества противотуберкулезной помощи населению, важное место занимает решение проблем, связанных со своевременным выявлением, диагностикой и лечением внелегочного туберкулеза. В течение длительного времени диагностика и лечение туберкулеза почти всех внелегочных локализаций, за исключением
костно-суставного, находились в ведении специалистов соответствующего профиля общей лечебной сети. Сравнительно недавно, в
Mliij
1968 г., в структуре областных краевых и республиканских противотуберкулезных диспансеров появились отделения внелегочного туберкулеза. Таким образом была создана широкая сеть специализированных служб по борьбе с внелегочным туберкулезом, что в дальнейшем привело к положительной динамике показателей забо-
леваемости и болезненности [Васильев А. В., Петров И. Н., 1987].
Вместе с тем и в настоящее время еще сохраняется много нерешенных проблем, что связано с медленной разработкой и внедрением в практику эффективных методов ранней диагностики и восстановительного хирургического лечения больных внелегочным туберкуле
зом, а также недостаточным вниманием к организационным вопросам, что справедливо отмечается в приказе М3 СССР от 05.07.88 «О совершенствовании противотуберкулезной помощи в стране». До сих пор у значительной части впервые выявленных больных диаг
ностируют распространенные, запущенные и осложненные клинические формы внелегочного туберкулеза, нередко приводящего к потере трудоспособности.
Одна из важных причин запоздалого выявления больных — это то, что еще в период обучения студенты медицинских институтов не получают практически никакой информации о внелегочном туберкулезе, в частности о методах его диагностики. В дальнейшем как следствие обнаруживается крайне недостаточная осведомленность врачей общей лечебной сети об этой патологии, а без их
активного участия невозможно организовать профилактические ос
мотры и своевременное выявление заболевания специалистами про-
тивотуберкулезных диспансеров.
В структуре заболеваемости внелегочным туберкулезом преобладает мочеполовой туберкулез. Распространенность туберкулеза
других локализаций в различных регионах неодинакова.
В связи с известными диагностическими и организационными проблемами у многих больных внелегочным туберкулезом он оста
ется невыявленным, поэтому можно полагать, что реально существующее число больных на порядок больше, чем зарегистрировано в противотуберкулезных диспансерах.
395
Внелегочный туберкулез, как правило, развивается вторично, в результате распространения туберкулезной инфекции из первичного очага, локализующегося обычно в органах дыхания. Единство патогенеза внелегочного туберкулеза почти всех локализаций предопределяет и некоторые общие принципы диагностики, лечения и профилактики заболевания.
Первоочередной задачей является правильный и целенаправленный отбор лиц, подвергшихся влиянию факторов риска, у которых потенциальна высока вероятность развития внелегочного туберкулеза. Это касается не только взрослых, но и прежде всего детей, поскольку период первичной диссеминации туберкулеза наиболее часто приходится на первые два десятилетия жизни.
Исходя из этого, специалисты внелегочных отделений противотуберкулезных диспансеров совместно с врачами общей лечебной
сети должны проводить в плановом порядке — не реже одного раза
в год — профилактические осмотры с целью выявления больных
экстрапульмональным туберкулезом в определенных группах населения. К ним относятся: а) дети и подростки в период «виража» туберкулиновых реакций; б) лица, у которых отмечены гиперерги-ческие реакции на туберкулин; в) лица, находившиеся в контакте с больными туберкулезом, а также работающие в хозяйствах, неблагополучных в эпидемическом плане по заболеваемости туберкулезом крупного рогатого скота и птиц, либо проживающие на территории этих хозяйств; г) больные как с активными, так и с
неактивными формами туберкулеза органов дыхания.
В связи с этим одним из важнейших общих принципов свое-временой диагностики внелегочного туберкулеза является тщательное изучение анамнеза, при этом особое внимание необходимо обращать на приведенные выше факторы риска. Помимо этого, необходима подробная информация наблюдавшихся в прошлом, особенно в детском и подростковом возрасте, симптомах ранней туберкулезной интоксикации, плеврите, перитоните, периферическом лимфадените, затяжных пневмониях, частых простудных заболеваниях, протекающих под видом гриппа. Особую важность для диагностики внелегочных локализаций туберкулеза представляют сведения о болезнях опорно-двигательного аппарата и различных органных заболеваниях, за которыми в связи со сходством клинических проявлений может скрываться туберкулез.
Внутрикожная проба Манту с 2 ТЕ, предусмотренная для выявления инфицированное™ туберкулезом, входит в обязательный комплекс методов исследования и при отборе групп риска заболевания внелегочным туберкулезом. С целью же клинической диагностики туберкулеза различных локализаций с учетом показаний
и противопоказаний применяют и другие методы определения чувствительности к туберкулину. К ним относятся, в частности, проба Манту с применением различных доз туберкулина, провокационная туберкулиновая проба с определением гемотуберкулиновой, протеинтуберкулиновой и иммунотуберкулиновой реакций. Диагностическая эффективность указанных проб при различных
396
локализациях внелегочного туберкулеза во многом зависит от особенностей каждой из них, поэтому может быть неодинаковой.
Важную роль в диагностике играют результаты флюорографических и рентгенографических исследований легких. Обнаружение в них даже старых петрификатов, которые уже не представляют опасности для больных, может иметь большое дифференциальнодиагностическое значение и способствовать распознаванию внеле-
гочного туберкулеза.
Установление окончательного диагноза внелегочного туберкулеза
отдельных локализаций является прерогативой специалистов соот-
ветствующего профиля, поскольку для этого требуется применение
специальных диагностических приемов.
Лечение внелегочного туберкулеза — прежде всего фтизиатрическая проблема, поэтому консервативную антибактериальную терапию внелегочного туберкулеза проводят в соответствии с общепринятыми принципами противотуберкулезной химиотерапии. Некоторые частные различия определяются особенностями клинической картины каждой из в нелегочных локализаций. При некоторых основных локализациях необходимо широко использовать хирургические методы лечения. Это в первую очередь относится к костно-суставному туберкулезу, при котором операция является основным методом комплексного лечения заболевания, а также к мочеполовому туберкулезу, туберкулезу периферических лимфатических узлов, абдоминальному туберкулезу и туберкулезу женских половых органов.
Для динамического диспансерного наблюдения за больными внелегочным туберкулезом выделена V группа учета, которая разделена
на пять подгрупп.
Подгруппа V-0. В нее входят больные с внелегочным туберкулезом сомнительной активности, в случае установления которой их переводят в активную подгруппу А.
Подгруппа V-A. В эту подгруппу включают больных активным внелегочным туберкулезом (впервые выявленных, с обострением, рецидивом и хроническими формами). Лица, выделяющие МБ, подлежат специальному учету как бактериовыделит^ли. После затихания процесса больных переводят в подгруппу Б.
Подгруппа V-Б. Эта подгруппа состоит из больных затихающим активным туберкулезом, переведенных из подгруппы А. После полного устранения признаков активности заболевания больных переводят в подгруппу В.
Подгруппа V-В. В ней под наблюдением находятся лица с неактивным внелегочным туберкулезом. Как правило, это больные, переведенные из подгруппы Б, которых при благоприятных показателях затем снимают с учета.
Подгруппа V-Г. Наблюдению в этой подгруппе подлежат три категории лиц с выраженными остаточными проявлениями перенесенного внелегочного туберкуле-
397
за: переведенные из подгруппы В, ранее снятые с учета (в связи с риском возникновения рецидива)
и впервые выявленные при констатации спонтан-
ного излечения (риск развития заболевания).
Сроки наблюдения в каждой из подгрупп определяют соответ-
ствующие специалисты в зависимости от динамики туберкулезного
процесса и показанных лечебно-
илактических мероприятий.
13.2. ТУБЕРКУЛЕЗ ГЛАЗ
Туберкулез глаз — одна из форм внелегочного туберкулеза,
характеризующаяся длительным, нередко рецидивирующим течением процесса, разнообразием клинических проявлений, снижением зрительных функций и длительной потерей трудоспособности.
В настоящее время туберкулезные поражения глаз занимают 2—3-е место в структуре внелегочного туберкулеза, однако в последние годы наметилась тенденция к снижению числа больных туберкулезом глаз. Необходимо отметить, что снижение заболеваемости туберкулезом глаз происходит неравномерно в разных воз
растных группах.
Доля впервые выявленных туберкулезных заболеваний глаз среди
впервые выявленных внелегочных форм туберкулеза уменьшается,
но медленно. Это связано с плохой организацией фтизи
со с
тальмо-
логической службы, недостаточной оснащенностью кабинетов глазного туберкулеза современным оборудованием, отсутствием соот-
ветствующих штатов.
В настоящее время отмечается рост удельного веса больных глазным туберкулезом среди больных как всеми формами внелегочного, так и активного туберкулеза. Ввиду того что это происходит на фоне снижения впервые выявленных больных туберкулезом глаз и контингентов глазного туберкулеза, вероятнее всего, этот рост связан с недостатками в диспансерном обслуживании в городе и на
селе.
Этиология и патогенез. В зависимости от клинической картины и течения заболевания выделяют две самостоятельные группы — метастатический (гематогенно-диссеминированный) туберкулез глаз и туберкулезно-аллергические поражения глаз. Первая группа — это метастатический туберкулез глаз, при котором в сосудистом тракте глаза образуется туберкулезная гранулема. Вторая группа — это туберкулезно-аллергические, параспецифические реакции оболочек глазного яблока, возникающие вследствие наличия в организме туберкулезной инфекции, приводящей к резкому повышению специфической чувствительности тканей глаза и развитию в них неспецифического аллергического воспалительного процесса.
При метастатическом туберкулезе глаз основной путь распространения возбудителей туберкулеза гематогенный. Циркулирующие в кровеносном русле микобактерии могут быть занесены в ткани глаза в любом периоде развития туберкулезной инфекции, чаще во вторичном. Микобактерии туберкулеза первоначально оседают, как
398
правило, в слое сосудов среднего калибра хориоидеи (собственно
ломка глаза), где они могут вызвать не заболевания,
сосудистая
а абортивное латентно протекающее воспаление. Из этого слоя
сосудов воспаление может распространяться на хориокапиллярный слой хориоидеи, сетчатку, другие ткани и среды глаза. Форма метастатического туберкулеза глаза зависит от локализации туберкулезного процесса в глазном яблоке, степени его выраженности и проявлений сопутствующего перифокального воспаления, обусловленных состоянием общего и специфического иммунитета и уровнем сенсибилизации тканей глаза.
При туберкулезно-аллергических поражениях глаз заболевание развивается у больных, организм и ткани глаза которых сенсибилизированы к туберкулезному антигену. Антиген попадает в сенсибилизи
рованные ткани глаза гематогенным путем, как правило, из отдаленных, не потерявших активности очагов туберкулезной инфекции, име-
ющихся в организме (чаще всего из лимфатических узлов).
Патологическая анатомия. При метастатическом туберкулезе
характер морц
логических изменений зависит от периода развития
туберкулезной инфекции, в котором возник туберкулезный процесс в тканях глаза. При первичном туберкулезе воспаление в сосудистом
тракте глаза может протекать по экссудативному типу. При вто-
ричном туберкулезе в морф
логической картине преобладает про-
дуктивный тип воспаления с формированием типичных туберкулезных гранулем, в центре которых может образовываться казеозный
некроз.
При туберкулезно-аллергическом поражении на фоне отека тканей в них наряду с гистиоцитарной реакцией наблюдается лимфоплазматическая инфильтрация с преобладанием лимфатической. Довольно часто в инфильтрате обнаруживают эозинофилы.
Классификация. В основу классификации метастатического туберкулеза глаз положены локализация и клиническая форма процесса. Различают следующие метастатические туберкулезные забо
левания глаз:
1) туберкулез конъюнктивы;
2) туберкулез роговицы: очаговый, диффузный, склерозирующий;
3) туберкулез склеры;
4) туберкулезные ириты: серозный, серозно-пластический, бугорковый, конглобированный туберкулез радужки;
5) передние увеиты: серозный, серозно-пластический, гнойный;
6) туберкулезные хориоидиты: центральный, очаговый, диссеминированный;
7) туберкулезные хориоретиниты: геморрагический, отечный (в зависимости от характера выпота).
В связи с изменениями клинической картины и характера течения метастатического туберкулеза глаз (туберкулезных увеитов) эта классификация в настоящее время во многом устарела. К туберкулезно-аллергическим заболеваниям глаз относят фликтенулезные конъюнктивиты, кератиты, кератоконъюнктивиты, эписклериты, иридоциклиты, хориоидиты.
399
Диагностика. Трудности, возникающие при диагностике туберкулезных заболеваний глаз, связаны с отсутствием симптомов, ха
рактерных для данного вида патологии органа зрения, изменившимся
характером течения клинических форм, а также с анатомическими особенностями строения глаза, в связи с чем невозможно получить
материал для mhkj
иологических и гистологических исследований.
Диагностика двух основных клинических форм туберкулеза глаз — туберкулезно-аллергических и метастатических, различна.
Диагностика туберкулезно-аллергических заболеваний глаз. По клинической картине и течению процесса туберкулезно-аллергические заболевания глаз отличаются от гематогенных форм туберкулеза глаз. Для всех туберкулезно-аллергических заболеваний глаз характерны быстрое и бурное начало и
течение, резко выраженные воспалительные изменения, склонность к обострениям, быстрое стихание острых воспалительных процессов, отсутствие выраженных остаточных изменений. Обострения могут возникать даже на фоне специфического лечения и десенсибилизирующей терапии, нередко их вызывают и поддерживают хронические заболевания ЛОР-органов.
Решающим фактором при установлении туберкулезно-аллергической этиологии заболевания глаз служит наличие в организме больного активного внелегочного туберкулезного процесса. В связи с этим больные, у которых заподозрена туберкулезно-аллергическая этиология заболевания, должны быть тщательно обследованы фтизиатром после предварительно проведенных рентгенографии грудной клетки и томографии средостения. Томография средостения имеет большое значение, так как с ее помощью выявляют те минимальные
изменения в лимфатических узлах средостения, которые могут играть важную роль в возникновении аллергических реакций оболочек глазного яблока. Кроме фтизиатра, этих больных должны обследо
вать фтизиоуролог и фтизиогинеколог для исключения специфического процесса в мочеполовой системе. Обязательно производят снимок брюшной полости, чтобы исключить туберкулез мезентери
альных желез.
Туберкулезно-аллергические заболевания глаз могут возникать и поддерживаться также у лиц, контактирующих с массивной туберкулезной инфекцией, т. е. работающих в противотуберкулезных учреждениях. У части этих больных наблюдаются прерывистые обострения процесса даже на фоне лечения, и только смена работы, исключение контакта с туберкулезной инфекцией помогают избавиться от обострений.
Туберкулинодиагностика не является основным и решающим методом распознавания туберкулезно-аллергических заболеваний глаз. Вследствие этого и очаговая реакция в глазу после введения туберкулина не имеет значения при уточнении туберкулезно-аллергической этиологии заболеваний глаз. Однако если говорить о характере очаговых туберкулиновых реакций в глазу при туберкулезно-аллергических заболеваниях глаз, то необходимо отметить, что у 65% больных они возникают через 24 ч после введения
400
туберкулина, а уже через 48 или 72 ч угасают. Кроме того, чаще всего у 75% больных они протекают по обратному типу (улучшение течения воспалительного процесса).
В отсутствие внеглазного специфического процесса туберкулезно-аллергическая этиология заболевания глаз должна быть исключена. Часть этих больных в дальнейшем должны быть обследованы
в аллергологических центрах. Выявляемые при обследовании в легких или брюшной полости выраженные остаточные изменения после
перенесенного специфического процесса могут служить источником
специфической аллергии в
лочках глазного яблока. Обострения
процесса у этих больных должны настораживать фтизиатров, так
как это свидетельствует об активности основного внеглазного туберкулезного процесса и о необходимости проведения специфиче
ского лечения.
Больных с туберкулезно-аллергическими заболеваниями глаз ставят на учет в противотуберкулезные диспансеры по локализации основного внеглазного специфического процесса. При наличии или возникновении у этих больных острых воспалительных изменений их осматривают окулисты. Фтизиоокулисты назначают десенсибилизирующее, местное специфическое и симптоматическое лечение. Общее специфическое лечение обычно проводит врач, специализирующийся на лечении заболеваний, одно из которых послужило основанием для взятия больного на учет в противотуберкулезном
диспансере.
Диагностика метастатического туберкулеза глаз. Для выявления метастатического туберкулеза глаз проводят комплексное клиническое обследование.
1. Тщательный сбор анамнеза (контакт с больными туберкулезом, перенесенный в прошлом внеглазной туберкулез, золотуха и т. д.).
2. Детальное офтальмологическое исследование: определение остроты зрения, полей зрения, кампиметрия, тонометрия, биомикроскопия, обратная и прямая офтальмоскопия с широким зрачком,
офтальмохромоскопия, при наличии показаний ультразвуковое,
электрофизиологическое исследование и флюоресцентная ангиогра-
фия.
3. Рентгенологическое исследование грудной клетки. У всех больных, у которых заподозрен туберкулез глаз, необходимо выполнить
рентгенограммы легких и по показаниям томограммы средостения. У 51% больных при тщательном рентгенотомографическом иссле
довании легких выявляют разные по характеру и активности изменения в легких, интраторакальных лимфатических узлах или одновременно в легких и лимфатических узлах. У 40% больных эти изменения носят остаточный характер, их обнаруживают после перенесенного в прошлом туберкулеза в виде кальцинатов, прикорневого склероза, плевропневмосклероза и т.д. Наличие остаточных интраторакальных изменений имеет определенную диагностическую ценность, но только в сочетании с характерной клинической картиной заболевания и соответствующими результатами лабораторных
14—1213
401
обследований. При активном туберкулезе глаз выраженные изменения в легких и лимфатических узлах (первичный комплекс, бронхоадениты и очаговый туберкулез в фазе неполного уплотнения) встречаются у 10% больных. У 40—50% больных, у которых заподозрено туберкулезное заболевание глаз, при тщательном рентгенотомографическом исследовании легких не обнаруживают никаких интраторакальных изменений, даже следов после перенесенного в детстве заболевания. Однако при положительных результатах других исследований это ни в коем случае не дает права полностью отрицать туберкулезную этиологию заболевания глаз.
4. Бронхоскопическое исследование, которое проводят строго по показаниям и только фтизиатры.
5. При наличии показаний: а) рентгенологическое исследование брюшной полости для выявления изменений в мезентериальных лимфатических узлах; б) консультацию фтизиоуролога; в) осмотр фтизиогинеколога.
6. Бактериологическое исследование мокроты. В Научно-исследовательском институте туберкулеза М3 РФ [Выренкова Т. Е., Не-мсадзе М. Н., 1984, 1985] разработан новый способ повышения эффективности микробиологического исследования мокроты у больных, у которых заподозрен туберкулез глаз — исследование суточной мокроты, собираемой в течение 3 дней, с использованием аэрозольных ингаляций. Исследование мокроты этим способом у больных туберкулезом глаз позволяет выявить бактериовыделение у 11 % из них. Во всех случаях микобактерии туберкулеза обнаруживают с помощью культурального метода. При количественной оценке их роста определяют олигобациллярность, т. е. на газоне питательных сред обнаруживают от 1—2 до 50 колоний. Следует учитывать, что больные с олигобациллярностью являются источником инфекции, поэтому необходимо проводить их активное лечение. Зависимости между характером бактериовыделения и клинической формой заболевания глаз не установлено. Однако микобактерии туберкулеза выявляют только у больных с туберкулезными изменениями в легких, часть из которых фтизиатры расценивают как старые, не требующие специфического лечения.
7. Бактериологическое исследование мочи. Этот метод малоинформативен при диагностике туберкулеза глаз.
8. Ввиду многообразия клинических форм и хронического течения заболевания при подозрении на туберкулезе глаз у больных необходимо исключить такие хронические заболевания, как сифилис, ревматизм, токсоплазмоз, бруцеллез, саркоидоз, вирусные инфекции и т. д. Всем больным с подозрением на туберкулез глаз проводят реакции Вассермана, Райта—Хеддельсона, Бюрне, РСК с токсоплазмином и внутрикожную пробу (ВКП) с токсоплазмином и т. д. Больные обязательно должны быть обследованы отоларингологом и терапевтом.
9. Иммунодиагностика. В Московском научно-исследовательском институте глазных болезней им. Гельмгольца, Московском научно-исследовательском институте туберкулеза и Центре глазного тубер-402
кулеза Москвы [Зайцева Н. С. и др., 1985, 1986, 1988] проведено изучение реакции бласттрансформации лимфоцитов (РБТЛ) со специфическими и неспецифическими антигенами с целью ранней диагностики туберкулеза глаз. Выявлены различия в чувствительности лимфоцитов больных туберкулезными и нетуберкулезными увеитами к разным дозам ППД-Л. Среди лиц, у которых туберкулез глаз был исключен, более половины не реагировали в РБТЛ ни на одну из использованных доз ППД-Л. Остальные отвечали преимущественно на высокие дозы — 30, 60, 150 мкг.
У больных с туберкулезными увеитами положительная РБТЛ на все исследованные дозы ППД-Л, за исключением минимальной — 0,3 мкг, выявляется достаточно часто и более выражена, чем при увеитах нетуберкулезной этиологии. Важна способность реагировать на дозу 3 мкг ППД-Л. У больных, отвечающих на эту дозу, как правило, наблюдаются положительные очаговые реакции в глазу, особенно в случаях одновременного выявления бласттрансформации и на более высокие дозы — 30, 60, 150 мкг. Отмечено, что чем более выражена туберкулезная сенсибилизация больного, тем на меньшую дозу ППД-Л может быть получена очаговая реакция в глазу. Как правило, у высокореагирующих в РБТЛ лиц, т. е. с уровнем бласттрансформации более 5% на все использованные дозы от 3 до 150 мкг, очаговую реакцию удается выявить в ответ на внутрикожное введение 2 ТЕ ППД-Л. При низком уровне РБТЛ — до 3—4%, положительная очаговая реакция наблюдается лишь при подкожном введении 10, 20 или 50 ТЕ ППД-Л.
Для вялотекущих туберкулезных увеитов характерна положительная РБТЛ на дозу 3 мкг ППД-Л в сочетании с отрицательными показателями на более высокие дозы 30, 60, 150 мкг. У этих больных
очаговые реакции на введение 2 ТЕ, как правило, слабовыраженные. При отрицательной РБТЛ на дозу 3 мкг независимо от результатов реакции на другие дозы и количества ППД-Л очаговая реакция в глазу развивается значительно реже. В связи с этим при использовании РБТЛ в качестве теста иммунодиагностики глазного туберкулеза целесообразно проводить титрование туберкулина, начиная с дозы 3 мкг до 150 мкг ППД-Л.
Кроме РБТЛ, изучена патогенетическая роль противотуберку
лезных гемагглютинирующих антител, выявляемых в крови и слезной жидкости больных с туберкулезными увеитами, и на этой основе определены диагностические возможности реакции пассивной гемагглютинации эритроцитов (РПГА) с сухим очищенным туберкулином — ППД-Л. Получено авторское свидетельство на новый метод диагностики туберкулезных увеитов. Проведенное исследование показало, что у больных с туберкулезными увеитами специфические антитела выявляют как в сыворотке крови, так и в слезной жидкости, а при односторонних увеитах — ив слезной жидкости парного здорового глаза. При динамическом наблюдении антитела в слезной жидкости больного глаза обнаруживают практически у всех больных (100%), в крови — у 75%. Частота выявления и уровень гемагглютининов в активный период заболевания и при хронических
14*
403
вялотекущих процессах достоверно превышают показатели в контрольных группах. При этом в слезной жидкости антитела выявляют чаще и в более высоких титрах, чем в крови.
10. Биохимические исследования крови. В Московском научно-исследовательском институте туберкулеза [Выренкова Т. Е., Фар-ниева М. А., 1986] разработан новый способ ранней диагностики туберкулезных заболеваний глаз — исследование биогенных аминов крови до и через 48 ч после введения туберкулина. У всех больных с туберкулезными заболеваниями глаз выявлено достоверное повышение исходных уровней гистамина и серотонина при одновременном снижении гистаминопексического индекса (ГПИ).
У 89,1% больных с активным туберкулезным процессом в глазу наиболее выражены изменения ГПИ: в ответ на введение туберкулина происходит достоверное снижение этого показателя более чем на 5,4%. У больных с экссудативными формами процесса в глазу (I тип течения) после введения туберкулина отмечается достоверное повышение уровня гистамина и снижение ГПИ. У больных с продуктивными формами процесса (II тип течения) — достоверное увеличение концентрации серотонина и снижение ГПИ.
11. Туберкулинодиагностика. При диагностике туберкулеза глаз всегда использовали высокую чувствительность больных к туберкулину. Однако необходимо отметить, что за последние годы чувствительность к туберкулину у этих больных изменилась: туберкулиновые реакции стали волнообразными, изменяясь в зависимости от активности процесса, длительности заболевания, предшествующего “лечения и т. д. Иногда при заведомо туберкулезном поражении глаз наблюдаются отрицательные туберкулиновые пробы. Однако это обстоятельство при положительных результатах других исследований не дает права отвергать туберкулезную этиологию заболевания глаз, тем более что в процессе лечения отрицательные туберкулиновые пробы должны становиться положительными. Туберкулинодиагностика была и остается одним из основных методов, подтверждающих специфическую этиологию процесса в глазу, но при ее проведении решающее значение в установлении этиологического диагноза глаз имеет только очаговая реакция в глазу на введение в организм туберкулина, причем получить эту очаговую реакцию можно на введение туберкулина любым методом: накожным, внутрикожным, подкожным, путем электрофореза и под конъюнктиву глазного яблока. Очаговые реакции в оболочках глазного яблока при правильно проведенной туберкулинодиагностике являются доброкачественными и кратковременными.
При оценке этих реакций необходимо различать истинные очаговые реакции и сосудистые реакции на введение туберкулина. Расширение сосудов, изменение кровотока, появление кровоизлияний, от микроскопических до обширных, нередко являются следствием неспецифических реакций и частично основаны на рефлекторном расширении сосудов глазного яблока под влиянием туберкулина. Только истинная очаговая реакция является бесспорным подтверждением специфического процесса в глазу. Ввиду этого по
404
казанным и обоснованным является проведение туберкулинодиаг-ностики вплоть до подкожного введения 50 ТЕ.
Туберкулинодиагностику можно и следует проводить всем нуждающимся в этом больным в самом начале заболевания, но при этом необходимо учитывать форму, фазу и степень активности процесса в глазу.
В Московском научно-исследовательском институте туберкулеза разработан и применяется с 1972 г. метод туберкулинодиагностики, основанный на современных требованиях ^йизиатрии, который используют в различных вариантах при диагностике и определении активности различных форм легочного и внелегочного туберкулеза. Этот метод был модифицирован, и с 1984 г. его применяют в амбулаторных условиях.
Туберкулинодиагностику начинают с пробы Манту, причем при свежих активных нелеченых процессах центральной локализации — с пробы Манту 5-го или 4-го разведения. При свежих активных нелеченых процессах любой локализации туберкулинодиагностику начинают с пробы Манту 4-го разведения или пробы Манту с 2 ТЕ. Независимо от разведения туберкулина, с которого начата туберкулинодиагностика, ее обязательно продолжают до пробы Манту с 2 ТЕ или пробы Манту 3-го разведения. Отрицательные общие местные и очаговые реакции после пробы Манту с 2 ТЕ или пробы Манту 3-го разведения в совокупности с другими отрицательными результатами обследования больных со свежими активными нелечеными процессами позволяют полностью исключить специфическую этиологию заболевания глаз. При положительных общих и местных реакциях и отрицательной очаговой реакции после пробы Манту с 2 ТЕ показано подкожное введение 10, 20 и 50 ТЕ. В случае отсутствия очаговой реакции после подкожного введения 50 ТЕ специфическая этиология процесса у этих больных может быть исключена.
Очаговые реакции в глазу определяют через 24, 48 и 72 ч после введения туберкулина с помощью следующих проб: биомикроско-пической и офтальмоскопической проб Самойлова; тонометрической пробы Мексиной; кампиметрической пробы Орадовской. Кроме того, существуют адаптометрическая проба Тихомирова, автокампигра-фическая проба Глезера и др., которые не нашли широкого применения во фгизиоофтальмологической практике.
Данные, полученные при туберкулинодиагностике, подтверждаются результатами лабораторного и биохимического исследований. У всех больных до и через 48 ч после введения туберкулина проводят лейкоцитарно-туберкулиновые и белково-туберкулиновые реакции, пробу Михайлова, исследование биогенных аминов и гаптоглобина крови.
12. Метод пробного специфического лечения. Пробное специфическое лечение проводят двумя препаратами узкого спектра действия в течение 2 мес. Стрептомицин и рифадин для пробного лечения не показаны, так как это антибиотики широкого спектра действия. С этой целью должен быть использован один из препаратов группы
405
ГИНК плюс ПАСК или протионамид, или этионамид и т. д. Никакого
другого лечения, кроме противотуберкулезного, больному в этот
период назначать нельзя. Местное применение кортикостероидов
также противопоказано. О результатах пробного лечения можно
судить не раньше чем через 4—5 нед после его начала.
Лечение. Принципы лечения больных туберкулезом глаз такие же, как при лечении больного туберкулезом других локализаций. Однако с учетом многообразия клинических проявлений туберкулезных заболеваний глаз лечение этих больных проводят строго индивидуально в зависимости от формы, характера, локализации и распространенности туберкулезного процесса в глазу, а также эффекта от предшествующего лечения.
Основной курс антибактериального лечения туберкулезных заболеваний глаз непрерывный, длительный — в зависимости от активности процесса от 10 мес до 1—1,5 лет. В начале лечения в течение 2—2,5 мес применяют одновременно три химиопрепарата, затем — два. При проведении основного курса антибактериального лечения рекомендуется каждые 2—3 мес менять специфические
препараты, даже при наличии выраженного эффекта от лечения. Это связано с тем, что у большинства больных туберкулезом глаз
нельзя проверить устойчивость к препаратам.
После окончания основного курса лечения в течение 2—2,5 лет в весенний и осенний период больных необходимо проводить противорецидивные курсы двумя антибактериальными препаратами.
При лечении больных туберкулезом глаз применяют все химиопрепараты в общепринятых дозах, за исключением этамбутола. Наиболее эффективными сочетаниями антибактериальных препаратов при лечении туберкулеза глаз являются:
1) рифадин + тубазид + этионамид или протионамид или пира-
зинамид;
2) рифадин + тубазид;
3) рифадин + один из препаратов группы ГИНК;
4) стрептомицин + тубазид + рифадин;
5) стрептомицин + тубазид + ПАСК;
6) один из препаратов ГИНК + протионамид;
7) ГИНК + этионамид;
8) ГИНК + пиразинамид.
При лечении туберкулезных заболеваний глаз препараты вводят
ными дозами и однократно. Опыт использования других способов
введения препаратов, в частности внутривенно, во фтизи
таль-
мол оги и очень небольшой, что связано с небольшим количеством
стационарных фтизи
тальмологических коек.
Кроме общей антибактериальной терапии, больным туберкулезом глаз обязательно назначают местное лечение — вводят туберкуло
статические препараты непосредственно в больной глаз. В зависи-
мости от тяжести, распространенности и локализации процесса их
применяют в виде капель, мазей, растворов для подконъюнктиваль-
ных, пара- и ретробульбарных инъекций с помощью электрофоре-
за — ванночкового и эндонозального по Бургиньону.
406
В конъюнктивальный мешок закапывают стрептомицин (50 000
ЕД в 0,5 мл изотонического раствора натрия хлорида), 5% раствор салюзида, 3% раствор тубазида, 10% раствор ПАСК, закладывают
5—10% мазь ПАСК. Подконъюнктивально, пара- и ретробульбарно вводят стрептомицин по 50 000 ЕД в 0,5 мл изотонического раствора
натрия хлорида, 0,5—1 мл 5% раствора салюзида (на курс — 20—25
инъекций), 0,3—0,5 мл 10% раствора тубазида (10—12 инъекций).
Путем электро^
реза вводят 150 000 ЕД стрептомицина с анода,
3% раствор тубазида с анода, 5% раствор ПАСК с катода, 5% раствор салюзида с анода и т. д. Для получения максимального терапевтического эффекта часто объединяют специфические проти
вовоспалительные и мидриатические средства в лекарственные комплексы. Так, при ванночковом электрофорезе в глаз одновременно
вводят стрептомицин и хлорид кальция, стрептомицин с кальцием и мидриатиками и т. д., на курс 30—40 ванночек. Кроме того, проводят местное симптоматическое лечение мидриатиками, мио-тиками, витаминами, кортикостероидами, которые применяют в виде капель или растворов, вводимых под конъюнктиву, пара- и ретробульбарно в зависимости от локализации и тяжести процесса в глазу.
Антибактериальное лечение проводят на фоне активной десенсибилизирующей терапии, которая способствует нормализации иммунобиологической реактивности организма, а также уменьшению выраженности отечных и воспалительных реакций в тканях глаза. Из десенсибилизирующих средств большое значение имеют препараты кальция и антигистаминные препараты — димедрол, пиполь-фен, супрастин и др., которые назначают в сочетании с препаратами
кальция.
При антибактериальном лечении широко применяют витамины Bi, Be, Ви, С и Р (рутин), которые способствуют лучшему усвоению препаратов и устранению ряда побочных явлений. Витамины В12 и рутин с аскорбиновой кислотой особенно показаны при геморраги-
ческих формах туберкулеза глаз.
В ряде случаев при лечении туберкулеза глаз антибактериальные препараты не дают необходимого эффекта и не предотвращают возникновение рецидивов заболевания, под влиянием которых все больше снижается функция органа зрения. В этих случаях к анти-
бактериальному лечению добавляют патогенетическую терапию. К неспецифическим патогенетическим средствам относят дробное пе-
реливание одногруппной крови — по 50, 100, 150 мл через каждые
6—7 дней до 5—6 раз; оксигенотерапию, введение лидазы по 1 мл
(64 УЕ) подкожно через день, всего 15 инъекций кокарбоксилазы,
улучшающей углеводный обмен, внутримышечно по 0,05—0,1 г
15—30 инъекций на курс; энзимотерапию (трипсин, террилитин, ликозим, коллализим, тканевую терапию (ФиБС, стекловидное тело,
алоэ), которые желательно применять только при неактивных формах процесса, а-токоферол, 30% раствор тиосульфата натрия, который вводят по 5—10 мл внутривенно, всего 20—30 инъекций, и через неделю повторяют курс; 5% раствор тиосульфат натрия вводят
407
также под конъюнктиву по 0,5 г, на курс 15—20 инъекций, 5—10%
раствор тиосульфата натрия — с помощью электрофореза; «-токоферол применяют по 1 капсуле 2—3 раза в день в течение 2 мес.
Специфическое патогенетическое лечение осуществляют с помощью туберкулинотерапии. Метод туберкулинотерапии для использования во фтизиоофтальмологии был разработан А. Я. Самойловым,
Н. С. Азаровой и Г. Ф. Тэтиной. В настоящее время эту методику применяют только в клинике глазных болезней Симферопольского медицинского института, где имеются необходимые для такого лечения стационарные койки.
При лечении туберкулеза глаз также очень широко применяют кортикостероидные гормоны, способные уменьшать выраженность воспалительных реакций в глазу, особенно при экссудативных процессах, снижать аллергические реакции и устранять побочные явления, вызванные антибактериальными препаратами. Кортикосте
роиды не показаны при вялотекущих процессах в глазу и сниженной
реактивности организма, так как еще больше подавляют защитные
реакции глаза. Из кортикостероидов во фтизи
Oil»
тальмологии при-
меняют: преднизолон внутрь по схеме (5 дней по 0,005 г 4 раза в день, 5 дней по 0,005 г 3 раза в день, 5 дней по 0,005 г 2 раза в день и 5 дней по 0,005 г 1 раз в день); АКТГ, стимулирующий кору надпочечников и уменьшающий проницаемость капилляров, по 5—10 ЕД 2 раза в день внутримышечно; дексаметазон. Внутрь кортикостероиды всегда принимают на фоне применения трех антибактериальных препаратов.
Гидрокортизон (1% раствор), дексазон (0,4% раствор), дексаметазон (0,4% раствор), кеналог-40 применяют местно в виде подконъюнктивальных, парабульбарных и ретробульбарных инъекций. В виде капель применяется 1% раствор гидрокортизона, 0,1% раствор дексаметазона и 0,1% раствор дексазона.
Некоторым больным туберкулезом глаз в связи с развитием осложнений показаны оперативные вмешательства — экстракция
катаракты, антиглаукоматозные операции, пересадка роговицы и т. д. Операции обязательно выполняют на фоне антибактериальной терапии, которую проводят в до- и послеоперационном периодах.
Диспансерное наблюдение. Все больные туберкулезом глаз должны находиться под диспансерным наблюдением. Они относятся к V группе диспансерного учета, и в зависимости от степени активности процесса их включают в следующие подгруппы: 0, VA, VB, VB.
1. В подгруппу 0 входят все больные с сомнительной активностью туберкулезного процесса в глазу. Продолжительность наблюдения в этой подгруппе 6 мес, в течение которых больным должно быть проведено необходимое диагностическое обследование, позволяющее подтвердить специфическую этиологию процесса в глазу и определить степень его активности.
2. В подгруппу VA включают больных с активным туберкулезом глаз, нуждающихся в длительном антибактериальном лечении. Эту подгруппу составляют все впервые выявленные больные со свежими
408
процессами, а также больные с хроническими рецидивирующими процессами в период обострения. Продолжительность наблюдения в этой подгруппе от 10 мес до 1—1,5 лет. В течение этого периода больные получают основной курс антибактериального лечения либо в стационаре, либо в специализированном санатории, либо в диспансере под систематическим наблюдением врача кабинета глазного туберкулеза, который осматривает больного при наличии острых воспалительных изменений не реже 1 раза в 5—7 дней, а после стихания острых воспалительных изменений — 1 раз в 10—14 дней.
3. К подгруппе УБ относятся все больные затихающим активным туберкулезом глаз. В нее входят больные туберкулезом глаз, переведенные из подгруппы VA после окончания основного курса антибактериальной терапии, и больные с хроническими рецидивирующими формами туберкулеза глаз в период ремиссии. Продолжительность наблюдения в этой подгруппе 2—3 года, а больные с хроническими формами туберкулеза глаз находятся под наблюдением до 3—5 лет. Всем больным этой подгруппы необходимо проводить противорецидивное лечение весной и осенью по 2 мес. Больных должен осматривать окулист в кабинетах глазного туберкулеза не реже 1 раза в 2—2,5 мес.
4. В подгруппу VB входят больные с неактивными туберкулезными заболеваниями глаз (клиническое излечение), переведенные из подгруппы VB или впервые выявленные больные с неактивным туберкулезом и со стойкими остаточными изменениями. Эти больные должны находиться под наблюдением в кабинетах глазного туберкулеза еще в течение 2—2,5 лет, а лица со стойкими обширными остаточными изменениями — 5—7 лет. Фтизиоокулисты должны осматривать больных этой подгруппы не реже 2—3 раз в год, преимущественно в осенний и весенний периоды.
5. В подгруппу VT входят больные с неактивными туберкулезными заболеваниями глаз, обширными остаточными изменениями в оболочках глазного яблока и резким снижением зрительных функций. В этой группе они находятся под наблюдением в течение всей жизни. Осмотры больных проводят 1—2 раза в год.
Продолжительность наблюдения в подгруппах диспансерного учета для больных туберкулезом глаз должна быть строго индивидуальной и устанавливаться лечащим врачом с учетом всех данных, полученных при клиническом обследовании и наблюдении.
Показаниями к снятию с диспансерного учета больных туберкулезом глаз являются отсутствие обострений процесса у впервые выявленных больных в течение 5 лет, признаков интоксикации и болевого синдрома, стабилизация или повышение зрительных функций, отсутствие клинических признаков активности воспалительного процесса в оболочках глазного яблока и очаговой реакции при подкожном введении 50 ТЕ туберкулина.
Раннее выявление. Раннее выявление больных туберкулезом глаз проводят во время амбулаторных приемов, при этом особое внимание необходимо обращать на наличие контактов с туберкулезными больными, перенесенные в прошлом лимфадениты, плевриты и т. д. При
409
малейшем подозрении на специфическую этиологию глазного заболевания такого больного необходимо направлять на консультацию в кабинеты глазного туберкулеза противотуберкулезных диспансеров. Кроме того, выявление больных туберкулезом глаз в ранних стадиях следует осуществлять в процессе офтальмологических ос-
мотров здорового населения, которые организует медицинская служба края, области или республики для выявления других заболеваний.
Наконец, необходимо подвергать тщательному офтальмологическому
обследованию больных активным туберкулезом легких при наличии
тех или иных проявлений заболеваний глаз. При этом особое вни-
мание нужно обращать на больных хроническим первичным туберкулезом, гематогенно-диссеминированным и очаговым туберкулезом
легких.
Врачи кабинетов глазного туберкулеза должны уделять много
внимания профилактической работе по раннему выявлению больных
туберкулезом глаз и работать с группами риска, в которые входят:
1) больные с хроническими рецидивирующими заболеваниями
глаз — эписклеритами, кератитами, иритами, иридоциклитами, передними и задними увеитами, хориоретинитами; 2) больные с хро
ническим первичным гематогенно-диссеминированным и очаговым туберкулезом легких; 3) больные с внелегочными формами туберкулеза — туберкулезными менингитами и мочеполовым туберку
лезом.
Прогноз. В отношении функций органа зрения прогноз при туберкулезе глаз всегда серьезный и зависит от локализации, степени распространенности и тяжести процесса. Так, при локализации воспаления в области желтого пятна, даже при самом благоприятном
течении и исходе процесса, острота зрения всегда резко снижается.
При ранней диагностике, своевременно проведенном полноценном лечении удается добиться клинического излечения большинства
больных, которые возвращаются к труду.
Профилактика. Профилактика туберкулеза глаз заключается в
своевременной вакцинации и ревакцинации населения, раннем выявлении и полноценном лечении больных туберкулезом.
13.3 ТУБЕРКУЛЕЗ КОЖИ И ПОДКОЖНОЙ ЖИРОВОЙ КЛЕТЧАТКИ
Одно из проявлений туберкулезной инфекции в организме —
поражение кожи и подкожной жировой клетчатки. В доантибакте-риальный период это заболевание встречалось довольно часто: по
материалам I медицинского института (1966 г.), в 20-е годы количество больных туберкулезом кожи по отношению к общему числу
больных различными дерматозами составляло 7,2—23,9%. Начиная
с 50—60-х годов произошло значительное снижение заболеваемости
и болезненности туберкулезом кожи, в основном скрофулодермой
и туберкулезной волчанкой, исчезли их тяжелые, уродующие формы, уменьшилось число детей среди больных с этой патологией.
Однако в последние годы отмечается замедление темпов уменьшения числа больных туберкулезом кожи или его увеличение, что
410
согласуется с особенностями этиологии и патогенеза заболевания и обусловлено значительным числом лиц, ранее болевших туберкулезом и не получивших полноценного лечения. В настоящее время доля туберкулеза кожи среди дерматозов различной этиологии не превышает 1,2%, однако особенности его современного течения
заслуживают внимания.
Классификация туберкулеза кожи и подкожной жировой клетчатки основана на особенностях клинической картины и отражает его связь с течением общей туберкулезной инфекции:
I. Первичный туберкулез
А. Острый первичный туберкулез
1. Первичный туберкулезный аффект
2. Острый милиарный туберкулез
3.
Б.
улодерма первичная (гематогенная)
Хронически текущий первичный туберкулез
улодерма вторичная
2. Фунгозный туберкулез
3. Рассеянные формы туберкулеза кожи:
а) уплотненная эритема;
б) папулонекротический туберкулез (разновидности: рассеянный милиарный туберкулез лица, розацеопо-добный туберкулез Левандовского);
в) лишай золотушный
II. Вторичный туберкулез
1. Туберкулезная волчанка
2. Экзогенные формы туберкулеза кожи:
а) бородавчатый туберкулез;
б) милиарно-язвенный туберкулез
Этиология и патогенез. Туберкулез кожи и подкожной жировой клетчатки возникает вследствие лимфогематогенного распространения туберкулезной инфекции. Попадая в кожу и подкожную жировую клетчатку, микобактерии туберкулеза вызывают различные проявления заболевания в зависимости от иммунологического со
стояния организма, степени его аллергизации, нейроэндокринного статуса. В основе возникновения и рецидивирования туберкулеза кожи часто лежит активация очагов скрытой туберкулезной инфекции в организме, причем особенно велика роль казеозно измененных лимфатических узлов как источника бациллемии и сенсибилизирующего фактора.
Заболевание вызывается микобактериями туберкулеза как человеческого, так и бычьего (реже птичьего) типа. Инфицирование
происходит чаще в детском возрасте экзогенным или эндогенным путем. Поскольку кожа является средой, неблагоприятной для роста и размножения возбудителя, экзогенное заражение возможно лишь при массивном инфицировании через поврежденную кожу. В таких случаях на месте проникновения микобактерий возникает банальный инфильтрат, схожий с очагом Гона, сопровождающийся регионарным лимфангитом и лимфаденитом, — так называемый первичный аффект.
411
Острый милиарный туберкулез — проявление милиарного туберкулеза на коже. Первичная скрофулодерма развивается вследствие гематогенного рассеивания микобактерий на фоне формирующегося иммунитета. При недостаточно выраженных защищенных реакциях процесс приобретает хроническое течение (хронически текущий первичный туберкулез), при котором в патологический процесс вовлекаются периферические лимфатические узлы, откуда инфекция по протяжению распространяется на окружающие ткани — вторичная скрофулодерма. Иногда первичную и вторичную скрофулодерму объединяют термином «кол-ликвативный (расплавляющий) туберкулез». При переходе инфекции из свищей у больных костным туберкулезом в коже и подкожной жировой клетчатке формируется фунгозный туберкулез.
Рассеянные формы возникают вследствие персистирующей микробациллемии, приводящей к сенсибилизации сосудистых стенок и формированию специфического васкулита. Вторичные формы туберкулеза кожи развиваются на фоне не полностью сформированного иммунитета у лиц, перенесших туберкулез разных локализаций: туберкулезная волчанка вследствие лимфогематогенного заноса инфекции, экзогенные формы — милиарноязвенный и бородавчатый туберкулез — в результате аутоинокуляции микобактерий у бацилловыделителей.
Патологическая анатомия. Первичный аффект морфологически проявляется банальным воспалительным инфильтратом, содержащим большое количество микобактерий туберкулеза и склонным к казеозному некрозу. Острый милиарный туберкулез характеризуется воспалительной инфильтрацией, носящей характер экссудативного или некротического процесса без продуктивной туберкулоидной реакции. При гематогенной склофулодерме в первые 2 мес также чаще наблюдаются неспецифические изменения, в дальнейшем же могут формироваться туберкулоидные структуры. Вторичная скрофулодерма отличается более глубоким залеганием инфильтрата, более частым наличием специфических изменений и казеозного некроза. Классическая картина колликвативного туберкулеза — ограниченный туберкулоидный инфильтрат с размягчением в центре. В размягченной зоне наблюдаются скопления полинуклеаров и лимфоцитов, а также клеточный распад (некроз). В окружности некроза располагается инфильтрат, состоящий из эпителиоидных, гигантских и лимфоидных клеток, в периферической зоне имеется множество расширенных и новообразованных кровеносных сосудов, расположенных среди фибробластов, плазматических, тучных (лаброциты) и редких эпителиоидных клеток. При фунгозном туберкулезе наблюдаются аналогичные изменения, сопровождающиеся явлениями акантоза и гиперкератоза в дерме.
Рассеянные формы — индуративный и папулонекротический туберкулез — в свежих случаях проявляются нарушением проницаемости и набуханием стенки сосудов. В дальнейшем к ним присоединяется клеточная инфильтрация из лимфоцитов и макрофагов, формируется картина продуктивного васкулита с перифаскулярной
412
лимфогистиоцитарнй «муфтой», в раде случаев содержащей туберкулезные гранулемы и казеоз. Некроз папул и узлов возникает первично вследствие облитерации патологически измененных сосудов. Лишай золотушных характеризуется наличием в верхней части дермы туберкулезных гранулем, вокруг которых иногда располагаются очаги казеозного некроза и неспецифической воспалительной инфильтрации. При туберкулезной волчанке в верхних слоях дермы обнаруживают типичные туберкулезные эпителиально-клеточные бугорки с гигантскими клетками Пирогова—Лангханса, окруженные зоной, состоящей из лимфоцитов, иногда с участками изъязвления эпидермиса. При плоской форме эти изменения выражены нерезко, не наблюдается значительных изменений сосудов, чем объясняется отсутствие наклонности бугорков к некрозу.
В элементах экссудативных форм (ранняя инфильтративная, экссудативно-некротическая) инфильтрат состоит преимущественно из лимфоцитов и плазматических клеток с незначительным количеством бугорков и сопровождается выраженным отеком тканей. В некоторых случаях в инфильтрате обнаруживают значительное количество полинуклеаров, гистологическая картина при этом имеет вид неспецифического воспаления. Характерным признаком таких изменений является большое количество расширенных и новообразованных сосудов наряду с облитерированными и разрушенными кровеносными и лимфатическими сосудами, что приводит к размягчению, изъязвлению или отторжению тканей. Выраженные явления акантоза и гиперкератоза наблюдаются при эксфолиативных и псо-риазиформных разновидностях туберкулеза, папилломатоз — при веррукозной форме. Для бородавчатого туберкулеза характерны акантоз, гиперкератоз и папилломатоз в эпидермисе. Под эпидермисом имеется острый воспалительный инфильтрат из полиморфно-ядерных лейкоцитов и лимфоцитов. Отмечается образование абсцессов. В средней части дермы обнаруживают типичные бугорки с умеренно выраженным казеозом. Иногда при гистологическом исследовании выявляют микобактерии туберкулеза. Патогистологи-ческая картина милиарно-язвенного туберкулеза обычно представлена инфильтратом, располагающимся главным образом в дерме и состоящим из лимфоцитов с незначительным количеством эпителиоидных клеток и единичными гигантскими клетками. В поверхностных слоях дермы имеются мельчайшие абсцессы, образованные полинуклеарами.
Клиническая картина. Первичный туберкулезный аффект (Primaria affect, Tub. cutis primaria; син.: туберкулезный шанкр) — редко встречающаяся в настоящее время форма, возникающая в основном у детей. На коже появляются единичные узелки, пустулы, эрозии или язвы с уплотненным основанием и воспалительной реакцией окружающих тканей, сопровождающиеся регионарным лимфангитом и лимфаденитом. В отделяемом язв и пунктате лимфатических узлов обнаруживают микобактерии туберкулеза. При полноценном лечении наступает заживление, в случае изъязвления формируется рубец. Рецидивов обычно не бывает.
413
Острый милиарный туберкулез (Tub. cutis miliaris acuta) — кожное проявление тяжело протекающего туберкулеза, часто с ле-
тальным исходом, в настоящее время практически не встречается. Процесс характеризуется высыпанием на коже туловища и конечностей розоватых папул с цианотичным оттенком, в центре которых
иногда появляются поверхностные язвочки, покрытые кровянистой
корочкой; могут формироваться локальные некрозы кожи без вос-
палительных реакций. Из элементов сыпи выделяют микобактерии туберкулеза.
Скрофулодерма первичная (Scrofuloderma primaria; син.: скро-
фулезные гуммы, туберкулезные гуммы, гематогенная ск
рофуло-
дерма, колликвативный туберкулез) возникает преимущественно у
детей, в последние годы отмечается и у пожилых, а также у лиц, длительно принимающих глюкокортикоидные препараты. Первоначально в глубоких слоях дермы появляется один или несколько плотноватых, безболезненных углов диаметров 1—3 см без признаков воспаления окружающих тканей. В дальнейшем узел увеличивается в диаметре, кожа над ним приобретает розовато-синюшную окраску,
спаивается, в ряде случаев наступает расплавление узла по типу холодного абсцесса; он вскрывается с образованием свищей, из
которых выходит кровянистое отделяемое с примесью некротических масс. Иногда образуется вялая язва, дно которой покрыто некро-
тическими массами и вялыми, мягкими, нависающими краями. При
заживлении вскрывшихся узлов образуются грубые «мостикообразные», «звездчатые» рубцы.
Скрофулодерма вторичная (Scrofuloderma secundaria; син.: кол-
ликвативный туберкулез) отличается от первичной локализацией,
топически связанной с расположением пораженных лимфатических
узлов, а также более глубокими (вследствие расплавления всего подлежащего лимфатического узла) язвами и более грубыми руб-
цами.
Фунгозный туберкулез (Tub. cutis fungosa) обычно возникает в области свищей и язв у больных костным туберкулезом, проявляется образованием розовато-синюшных довольно плотных малоболезненных инфильтратов, которые вследствие присоединения вторичной инфекции и периферического роста приобретают грибовидную форму, покрываются серозно-геморрагическими и гнойными корками. Исход заболевания во многом зависит от эффективности лечения
костного процесса. На месте очага формируется втянутый рубец. В настоящее время эта форма встречается крайне редко.
Уплотненная эритема (Erythema induratum), встречающаяся в двух разновидностях: узловатой Базена и язвенной Гетчинсона, в настоящее время является наиболее распространенной формой ту-
беркулеза кожи. На сгибательных поверхностях голеней часто сим-
метрично располагаются единичные мал
лезненные узлы диамет-
ром 1—5 см и больше правильной полу шаровидной формы, плот-
ноэластической консистенции. По мере увеличения узлов кожа над
ними приобретает розовато-синюшный оттенок. В дальнейшем в ряде случаев узлы размягчаются в центре, в результате чего обра-
414
зуются поверхностные вялотекущие болезненные язвы с инфильтрированными плотными краями и дном, покрытым вялыми грануляциями. Заживление язв обычно начинается с центра, инфильтрат рассасывается более медленно. Разрешение узлов может происходить бесследно или с западением кожи; при язвенных формах формируется втянутый рубец. Особенностью уплотненной эритемы является выраженный фиброз, при разрешении очага приводящий к образованию плотного узелка, на месте которого впоследствии может возникнуть рецидив.
Папулонекротический туберкулез (Tub. cutis papulonecrotica) проявляется симметрично расположенными на коже лица, ушных раковин, грудной клетки, живота, разгибательных поверхностей конечностей, ягодиц полушаровидных безболезненных плотноватых рассеянных розовато-синюшных папул диаметром 2—3 см. В центре папул часто образуются своеобразные псевдопустулы, содержащие
некротические массы, подсыхающие в плотно сидящую сероватобелую корочку, после отторжения которой остается поверхностный депигментированный «штампованный» рубчик с правильными округлыми очертаниями, иногда папулы разрешаются без рубцов. Разновидностями папулонекротического туберкулеза являются диссеминированный туберкулез лица, излюбленная локализация проявлений которого — область лица и шеи, а также розацеоподобный туберкулез Левандовского, характеризующийся тем, что на фоне розацеоподобной гиперемии и телеангиэктазий располагаются розовато-бурые папулы, иногда с пустулами в центре, подсыхающими в корочку, после отторжения которой остается рубчик.
Лишай золотушных (Lichen scrofulosorum) наблюдается в основ
ном у детей и подростков, в настоящее время встречается нечасто. Заболевание характеризуется появлением симметрично, преимущественно перифолликулярно расположенных на коже боковых поверхностей груди и живота, верхних и нижних конечностей мелких безболезненных узелков эластической консистенции округлой, овальной или полигональной формы с чешуйкой на поверхности. Эти узелки цвета нормальной кожи или желтовато-серого, склонны к группировке, разрешаются, не оставляя следа или с образованием поверхностного рубчика.
Туберкулезная волчанка (Lupus vulgaris) локализуется преимущественно на коже лица. Первичным элементом является бугорок— люпома—полушаровидной формы, буровато-розового цвета, мягкой консистенции, безболезненный при пальпации. При надавливании стеклом (диаскопия) выявляется патогномоничный симптом «яблочного желе» — просвечивание на желтоватом фоне более ярких буроватых инфильтратов. При надавливании пуговчатым зондом он легко проникает в ткань люпомы, образуя вдавление (симптом
Поспелова). Бугорки располагаются поверхностно, склонны к сли-
янию с образованием поверхностного волчаночного инфильтрата буровато-розового цвета, в ряде случаев изъязвляющегося — так называемая плоская форма. Нередко элементы возвышаются над
кожей, образуя гипертрофические и опухолевидные разновидности
415
при наслоении чешуек — эксфолиативные и псориазиформные; наличие многочисленных разрастаний эпидермиса в виде выростов и бородавок характерно для бородавчатых форм, выраженной экссудации и некроза — для экссудативно-некротических. Ранняя инфильтративная форма, описанная Подвысоцкой, проявляется розовато-синюшным воспалительным инфильтратом с нечеткими границами и шелушением на поверхности, локализующимся в области мягких тканей носа, при этом с помощью диаскопии выявляют феномен «яблочного желе». Раньше эта форма сопровождалась отторжением мягких тканей носа, что приводило к уродствам, в настоящее время она встречается редко и протекает более добро-
качественно.
Патологический процесс при туберкулезной волчанке всегда за-
канчивается рубцеванием, причем при плоской форме в виде по
верхностной нежной рубцовой атрофии: кожа собирается в складки
наподобие папиросной бумаги. Характерна способность люпом рецидивировать на рубцах. На месте очагов опухолевидной и ранней инфильтративной волчанки могут остаться грубые, уродующие рубцы. Иногда на волчаночных рубцах, чаще после применения местных
раздражающих средств, возникает рак — люпус-карцинома.
Бородавчатый туберкулез кожи (Tub. cutis verrucosa) возникает в результате суперинфекции или аутоинокуляции, например у ба-цилловыделителей при постоянном соприкосновении кожи с инфицированной мокротой, хирургов, прозекторов, ветеринарных врачей при повреждении кожи рук во время работы с заразным материалом (трупный бугорок, бугорок анатомов). В настоящее время заболевание встречается очень редко. Процесс начинается с появления небольшого плотного безболезненного розовато-синюшного узелка, который увеличивается в результате периферического роста, в его центре появляются маленькие шипики или роговые чешуйки. В дальнейшем узелок превращается в плотный инфильтрат, покрытый в центре бородавчатыми разрастаниями, с трещинами и бороздками между сосочками и плотными роговыми чешуйками, окруженный широким периферическим синевато-красным валом. Эта периферическая часть бывает покрыта серыми плотными чешуйками, за ней расположена третья зона красной гладкой блестящей кожи с круговидными и полициклическими краями; при надавливании стеклом средняя зона приобретает желтоватый цвет, из-под ее края выделяются капельки гноя. Иногда вся поверхность очага покрыта чешуйками. Бородавчатый туберкулез локализуется преимущественно на конечностях, обычно в виде единичного очага, который долго сохраняется, склонен к самопроизвольному заживлению с образованием гладкого ровного рубца, не дает рецидивов.
«Бугорок анатомов» чаще располагается на кистях, в месте проникновения инфекции, где через 8—10 дней появляется маленький плотный безболезненный узелок красного цвета, быстро увеличивающийся и покрывающийся чешуйками, маленькими возвышающимися сосочками, на поверхности которых имеются плотно сидящие корки. В окружности инфильтрата появляется бурая кайма. В даль
416
нейшем очаг поражения приобретает округлую или серпигинозную форму, центральная часть его западает и изъязвляется вследствие вскрытия мелких подлежащих абсцессов, в результате чего образуется небольшая язва, покрытая плотной коркой и окруженная про
должающими увеличиваться папилломатозными разрастаниями, появляется болезненность при пальпации. Довольно часто процесс осложняется лимфангитом, который в некоторых случаях сопровождается явлениями генерализации туберкулезной инфекции.
Милиарно-язвенный (Tub. miliaris ulcerosa cutis) туберкулез возникает у бацилловыделителей на слизистых оболочках или в местах перехода кожи в слизистую оболочку, вокруг естественных отверстий, реже — в области операционных ран. Заболевание начинается
с появления плотного узелка розового цвета диаметром около 1 мм, быстро увеличивающегося по периферии, нагнаивающегося, изъязвляющегося. Резко болезненная язва увеличивается в глубину и по периферии до 1—1,5 см в результате слияния с соседними язвами, имеет округлую или овальную форму, мягкие подрытые края, не-
ровное зернистое дно, отграничена от здоровых тканей воспалительным бледно-красным ободком. На дне язвы иногда определяются желтые или серовато-желтые зерна Треля, представляющие собой мельчайшие абсцессы. Иногда отмечаются увеличение и болезненность регионарных лимфатических узлов. Течение заболевания длительное, самопроизвольного рубцевания не отмечается.
Диагностика, дифференциальная диагностика. При установлении диагноза следует учитывать контакт с больным туберкулезом, перенесенный в прошлом туберкулез разных локализаций; заболевания, под маской которых может протекать туберкулез (пневмония,
пиелонефрит, аднексит, остеомиелит, строфулюс — «золотуха», эк-
зема, васкулиты, микозы и т. д.). В ряде случаев помогает обнаружение активного туберкулеза, в основном внелегочного, с которым чаще сочетается туберкулез кожи, однако имеют значение также признаки перенесенного туберкулеза легких и внутригрудных лимфатических узлов, поэтому необходимо проводить рентгенологиче
ское исследование органов грудной клетки. Во время осмотра больного можно обнаружить рубцы на коже, оставшиеся после перенесенного туберкулеза, учитывая возможность возникновения туберкулеза кожи у лиц, уже переболевших одной из его форм.
Туберкулинодиагностику следует начинать с выполнения градуированной накожной пробы Пирке, при отрицательном ответе ставят пробу Манту с 5 ТЕ. Проба Коха при туберкулезе кожи не показана ввиду возможности возникновения тяжелых общих реакций, поскольку в данном случае кожа является «шоковым» органом. Оценку результатов туберкулиновых проб осуществляют в соответствии с общепринятыми инструкциями, однако следует помнить, что при туберкулезе кожи максимальные проявления наблюдаются через 48 ч.
Бактериологическую диагностику проводят у больных со скро-фулодермией, с язвенными формами уплотненной эритемы и волчанки. Для исследования берут гной из язв, пунктат узлов. Диагностическую биопсию целесообразно выполнять не ранее чем через
417
1,5—2 мес от начала заболевания, так как к этому времени обычно формируются туберкулезные структуры. На ранних этапах обнаруживают в основном неспецифические изменения. В случае отсутствия достоверной информации после комплексного обследования назначают пробное лечение двумя противотуберкулезными препаратами (ГИНК и ПАСК) в течение 2—3 мес.
Дифференциальная диагностика различных форм туберкулеза кожи основана на особенностях клинической картины и информативности диагностических комплексов. Первичный аффект клинически сходен с твердым шанкром, иногда — с эпителиомой. Отрицательные результаты серологических реакций на сифилис, наличие казеоза и микобактерий туберкулеза в очагах свидетельствуют о первичном аффекте, длительное течение заболевания и отсутствие регионарного лимфаденита — об эпителиоме. При остром милиарном туберкулезе в элементах сыпи содержатся микобактерии туберкулеза, что позволяет отличить его от сифилиса детей грудного возраста, для которого характерен полиморфизм, сифилитические изменения в костях и другие проявления сифилитической инфекции. Скрофулодерму следует дифференцировать от гуммозного сифилиса, хронической вегетирующей пиодермии, глубоких микозов. Наличие кратерообразной язвы с плотными краями характерно для сифилиса, склонность к периферическому росту — для пиодермии, доскообразная плотность — для актиномикоза, множественность узлов, расположенных по ходу лимфатических сосудов, — для споротрихоза.
В дифференциальной диагностике имеют значение положительные туберкулиновые пробы, обнаружение микобактерий туберкулеза и результаты гистологического исследования. При фунгозном туберкулезе сочетание с костным туберкулезом, специфическая картина, гистологическая картина, обнаружение возбудителя позволяют отличить его от сходной вегетирующей пиодермии и рака кожи. Уплотненную эритему дифференцируют от мигрирующего тромбофлебита, узловатой эритемы, узловатых аллергических васкулитов. В диагностике имеют значение все методы, так как в ряде случаев имеется не только клиническое, но и морфологическое сходство заболеваний. Папулонекротический туберкулез схож с мелкоузелковой формой саркоидоза Бека, парапсориазом и особенно с папулонекротическим типом аллергического артериолита Рюйтера. Опорным диагностическим признаком является высокая чувствительность к туберкулину у больных папулонекротическим туберкулезом. Диссеминированный милиарный туберкулез лица отличается от вульгарных угрей отсутствием пустулизации и выраженных воспалительных явлений. Туберкулинодиагностику и биопсию целесообразно проводить при розацеоподобном туберкулезе Левандовского, имеющем большое клиническое сходство с розовыми угрями. Признаками, на основании которых лишай золотушных дифференцируют от лихеноидного сифилиса, себорейной экземы и фолликулярных дерматозов, являются меньшая плотность папул, их склонность к группировке, выраженность туберкулиновых реакций, наличие других
418
проявлений туберкулеза в организме. Туберкулезная волчанка может иметь сходство с бугорковым сифилисом, в этом случае различить их помогает типичная гистологическая картина. Ввиду возможного большого не только клинического, но и морфологического сходства туберкулезной волчанки с саркоидозом для того, чтобы их дифференцировать, целесообразно использовать весь арсенал диагностических средств. Милиарно-язвенный туберкулез от воспалительно-эрозивных неспецифических процессов отличают наличие возбудителя в отделяемом язв, мокроте, моче, кале, положительные туберкулиновые пробы и специфическая картина. Дифференцировать бородавчатый туберкулез от вульгарных бородавок и неспецифических гнойных процессов позволяют наличие в очагах микобактерий туберкулеза и специфические гистологические изменения.
Лечение. Лечение больных туберкулезом кожи должно быть длительным, комбинированным, непрерывным, и проводить его следует в соответствии с общими принципами лечения туберкулеза. Обычная схема включает три препарата: стрептомицин 0,5 г 1 раз в сутки внутримышечно; фтивазид по 0,5 г 3 раза; ПАСК по 2 г 4 раза в сутки внутрь. Через 3 мес стрептомицин отменяют, фтивазид заменяют тубазидом, ПАСК в случае хорошей переносимости применяют до окончания основного курса лечения (не менее 10 мес). Противорецидивное лечение проводят в течение 2 лет по 2 мес весной и осенью двумя препаратами (ГИНК и ПАСК) с учетом их эффективности и переносимости. Специфическое лечение осуществляют в комплексе с общеукрепляющим и десенсибилизирующим. Оперативные вмешательства производят с целью удаления пораженных лимфатических узлов, обеспечения оттока гноя, иссечения грубых рубцов под прикрытием специфических препаратов. Из физиотерапевтических процедур применяют электрофорез противотуберкулезными препаратами, а в случае выраженной плотности узлов уплотненной эритемы — 10% раствором тиосульфата натрия. Местная терапия включает обкалывание единичных очагов стрептомицином (общая доза препарата при одновременном внутримышечном введении не должна превышать 1 г в сутки) и симптоматическое лечение.
Во время проведения основного курса больные находятся в VA группе диспансерного учета, противорецидивного лечения — в VB, затем в течение 5 лет — в VB, после чего их снимают с учета. Санаторно-курортное лечение целесообразно проводить в специализированных санаториях для больных туберкулезом кожи или с вне-легочными формами туберкулеза, так как в случае пребывания больных туберкулезом кожи вместе с больными туберкулезом легких, среди которых могут быть бацилловыделители, не исключена возможность реинфекции или суперинфекции.
Профилактика. Мероприятия по предотвращению туберкулеза кожи не отличаются от тех, которые проводят при общей профилактике туберкулеза, но их должны осуществлять фтизиатры совместно с дерматологами с целью более раннего выявления заболевания.
419
13.4. ТУБЕРКУЛЕЗ КОСТЕЙ И СУСТАВОВ
Костно-суставной туберкулез является одной из наиболее распространенных локализаций внелегочного туберкулеза: частота его составляет более 20% по отношению к другим проявлениям экс-трапульмонального туберкулеза [Васильев А. В., Петров И. Н., 1987]. Туберкулез костей и суставов встречается в любом возрасте, но преимущественно у взрослых. У больных поражаются разные отделы скелета, однако чаще всего позвоночник, тазобедренный и коленный суставы. Развитию заболевания способствуют травмы и частые перегрузки опорно-двигательного аппарата, переохлаждение, повторяющиеся общие заболевания, в том числе инфекционные, а также неблагоприятные условия труда и быта. В настоящее время смертность от костно-суставного туберкулеза близка к нулю. Однако вследствие тяжести болезни и ее несвоевременного выявления частота инвалидизации этих больных с длительной утратой трудоспособности составляет более 50%, что превышает указанный показатель при всех других локализациях внелегочного туберкулеза [Не-доспасова Е. А., 1979, и др.].
В последние годы в противотуберкулезных учреждениях наиболее широко применяют эволюционную, патогенетическую классификацию костно-суставного туберкулеза, предложенную П. Г. Корневым, в основу которой положены закономерности развития патологического процесса.
Первая фаза — преспондилитическая, преартритическая — характеризуется наличием первичного туберкулезного остита (его образование и развитие). Вторая фаза — спондилитическая, артритическая — патогенетически соответствует возникновению и развитию прогрессирующего специфического спондилита и артрита. В этой фазе различают две стадии: начала и разгара. Третья фаза — постспондилитическая, постартритическая — характеризуется временной или устойчивой ликвидацией туберкулезного процесса с сохранением или усилением анатомо-функциональных нарушений, возникших в течении болезни.
В каждой из названных фаз заболевания степень активности специфического воспаления может быть различная. С этой точки зрения туберкулезный процесс характеризуют как активный, тор-пидно-текущий, потерявший активность и излеченный. Кроме того, классификация костно-суставного туберкулеза включает туберкулезно-аллергические синовиты и артриты, являющиеся следствием аллергических поражений синовиальной оболочки суставов.
Этиология и патогенез. Заражение туберкулезом костей и суставов происходит в результате проникновения микобактерий туберкулеза по кровеносным сосудам и лимфатическим путям в костную ткань из пораженного специфическим процессом мягкотканного органа, чаще всего из легких. Это наблюдается в период первичной или реже вторичной генерализации туберкулезной инфекции. Источник гематогенной диссеминации, вызвавшей специфическое по
420
ражение костной ткани, не всегда удается распознать, так как туберкулезные очаги в костях нередко развиваются медленно и к моменту их выявления исходный очаг в другом органе может подвергнуться рубцеванию. Вследствие этого возникают изолированные костные поражения — первичные туберкулезные оститы, которые
играют главную роль в последующем развитии костно-суставного туберкулеза [Чистович А. Н., 1973, и др.].
Специфический прогресс развивается в костях, имеющих хорошее кровоснабжение и богатых губчатым веществом, содержащим миелоидную ткань. Такими отделами скелета являются преимущественно тела позвонков, а также метафизы и эпифизы длинных трубчатых костей. Избирательная локализация туберкулезных очагов в названных тканях связана также с особенностями их местной
микроциркуляции: обширность микроциркуляторного бассейна, за
медленный кровоток и интимный контакт кровеносного русла с тканями [Беллендир Э. Н., 1986]. Туберкулез костей и суставов может сочетаться с туберкулезом легких, а также других органов [Корнев П. Г., 1971; Будилина Ю. Д., 1976; Пикулева Ю. Д., 1983,
и др.].
Патологическая анатомия и патологическая физиология. Спе-
цифический процесс возникает в красном миелоидном костном мозге, где формируются эпителиоидные бугорки, которые, сливаясь между собой, образуют продуктивные конгломератные бугорки, подверга
ющиеся творожистому некрозу. Диффузное разрастание туберку-
лезной гранулемы вызывает рассасывание костного вещества, сопровождающееся образованием секвестров, натечных абсцессов и
свищей [Грацианский В. П., Хохлов Д. К., 1966, и др.].
При туберкулезе позвоночника первичные оститы возникают в толще губчатой ткани тел позвонков, значительно реже наблюдается поражение дужек и отростков позвонков. Развитие туберкулезного спондилита начинается с момента выхода первичного туберкулезного очага за пределы тела позвонка на соседние мягкие ткани. Распространение специфического процесса на здоровые по
звонки происходят двумя путями: внутридисковым и внедисковым. При внутридисковом пути прогрессирование воспалительного про-
цесса приводит к дистр
ическим изменениям в межпозвонковом
диске, затем происходит его частичное или полное разрушение и в специфический процесс вовлекается позвонок. Между пораженными позвонками образуется контактная деструкция. При внеди-сковом пути развития первичный остит разрушает кортикальный слой вертикальных поверхностей тел позвонков с образованием пре-вертебральных, паравертебральных или эпидуральных натечных абсцессов. Переход туберкулезного процесса на соседние позвонки в указанных случаях происходит вследствие их контактного инфицирования туберкулезной грануляционной тканью. Разрушение тел позвонков и межпозвонковых дисков вызывает деформацию позвоночника, преимущественно кифотическую. Степень ее выраженности зависит от размеров деструкции. Развитие туберкулезного процесса сопровождается образованием натечных абсцессов, которые имеют
421
типичную локализацию. Распространение туберкулезного процесса на задние отделы тел позвонков приводит к развитию спинномозговых расстройств, которые наблюдаются преимущественно при туберкулезе грудного отдела позвоночника. Вследствие разрушения кожных покровов грануляционной тканью образуются наружные свищевые отверстия.
При туберкулезных артритах распространение специфического воспаления из первичного очага на сустав чаще всего происходит путем постепенного прорастания грануляционной ткани в синовиальную оболочку сустава. Значительно реже, главным образом при субхондральных оститах, туберкулезный артрит может возникнуть вследствие разрушения специфическим процессом покровного суставного хряща и прорыва в полость сустава туберкулезной грануляционной ткани. Последующие изменения состоят в том, что туберкулезный процесс с синовиальной оболочки переходит на суставные концы костей, вызывая их разрушение, которое носит очаговый характер. Описанные выше изменения приводят к нарушению анатомических соотношений в суставе и утрате его функции.
Клиническая картина. В преспондилитической фазе туберкулеза позвоночника общие и местные проявления заболевания выражены слабо. Они характеризуются симптомами туберкулезной интоксикации, наиболее заметной у детей. Температура тела нормальная. Ребенок становится менее подвижным, взрослые жалуются на пониженную работоспособность, чувство тяжести в позвоночнике. У некоторых больных к концу дня появляются нелокализованные боли в спине, которые после отдыха проходят. В связи со слабой выраженностью клинических и рентгенологических симптомов заболевания у большинства больных туберкулез позвоночника диагностируют в следующей, спондилитической, фазе. Стадия начала этой фазы соответствует выходу туберкулезного процесса за пределы костного очага, что сопровождается усилением туберкулезной интоксикации. Важнейшими местными симптомами являются боли в позвоночнике и ограничение его подвижности. Боли могут быть схожи с болями при межреберной невралгии, радикулите, ишиасе, иногда они иррадиируют во внутренние органы. В ответ на появление болей мышцы спины становятся ригидными, в связи с чем происходит ограничение движений в позвоночнике; возникает симптом «вожжей» П. Г. Корнева, который состоит в том, что при активном переразгибании позвоночника (больной из положения лежа на животе должен приподняться и лежать, опираясь на локти) появляются ригидные мышечные пучки, которые в виде валиков, приподнимающих кожу, располагаются между пораженными позвонками и верхними внутренними краями лопаток. У больных изменяются походка и осанка.
Стадия разгара спондилитической фазы соответствует переходу туберкулезного процесса на соседние позвонки. В этой стадии общее состояние больного ухудшается, температура тела субфебрильная или высокая, увеличивается выраженность симптомов туберкулезной интоксикации. Боли в позвоночнике сильные, постоянные, в покое
422
стихают. Из-за выраженной ригидности мышц движения в позво-
ночнике невозможны, выявляется атрофия мышц спины
В постспондилитической фазе общие и местные симптомы спе-
цифического воспаления не выявляются, но сохраняются все ана
томо-функциональные изменения, возникшие в течение болезни:
атрофия мышц, кифозы, сколиозы, вторичные деформации грудной клетки. Больные обычно жалуются на неустойчивость позвоночника, ограничение движений в нем и боли в области парагиббарных (окологорбных) лордозов, где развиваются дегенеративно-дистрофи-
ческие изменения: деформирующий спондилоз и спондилоартроз. Нередко у этих больных возникают рецидивы и обострения туберкулезного процесса, которые обычно протекают тяжело.
К осложнениям туберкулезного спондилита относятся деформации позвоночника, натечные абсцессы, свищи, параличи, амилоидоз внутренних органов. Начальное проявление деформации позвоноч
ника — пуговчатое выстояние остистого отростка одного позвонка. Этот вид деформации, имеющий важное диагностические значение, обнаруживают при пальпации. По мере развития заболевания выраженность деформации увеличивается. На уровне пораженных позвонков образуется кифотическое искривление позвоночника — горб разной величины. Кифозы часто сочетаются со сколиозами и вторичной деформацией грудной клетки. Натечные абсцессы у половины больных выявляют при рентгенологическом исследовании. При кли-ническом исследовании их чаще всего обнаруживают в следующих областях: при поражении шейных позвонков — в заглоточном пространстве и в области шеи, при туберкулезе грудного отдела позвоночника — в надключичной и подмышечной областях, по ходу межреберий, в пояснично-реберном треугольнике, при туберкулезе поясничного отдела позвоночника — в подвздошных областях и поясничном треугольнике, а также на внутренней или передней поверхностях бедра, при туберкулезе пояснично-крестцового отдела позвоночника — в ягодичной области, на задней поверхности крестца и в области задней промежности. Клинические проявления натечных абсцессов обычно не сопровождаются усилением симптомов тубер
кулезного воспаления.
Параличи осложняют туберкулезный спондилит у 12% больных — однако неврологические расстройства разной степени выраженности наблюдаются почти у каждого больного.
Другие осложнения — свищи и амилоидоз внутренних органов — в настоящее время встречаются редко.
Преартритическая фаза туберкулеза суставов, так же как и преспондилитическая, характеризуется наличием слабовыра-женных симптомов туберкулезной интоксикации. Больные жалуются на быструю утомляемость и неустойчивость конечности. Иногда больных беспокоят боли в суставе, возникающие при длительной нагрузке и прекращающиеся в покое. В этой фазе определяются следующие симптомы заболевания: локализованные боли, которые выявляются при глубокой пальпации элементов сустава; ограничение переразгибания конечности; симптом «мышечной бдительности», за
423
ключающийся в том, что при исследовании пассивных движений в суставе обнаруживают отсутствие их пластичности, они становятся ступенчатыми. Нередко возникает реактивное неспецифическое воспаление синовиальной оболочки, проявляющееся болями в суставе, его припухлостью, хромотой. Указаннные явления сравнительно быстро проходят, а затем могут возникнуть вновь. При первичных оститах, локализующихся в краевых отделах кости, в ряде случаев образуются клинически определяемые натечные абсцессы, а иногда и свищи. Первичные оститы могут оказывать нейротрофическое воздействие на сустав и всю конечность, вызывая деформацию суставных концов костей, тугоподвижность в суставе, атрофию и порочную установку конечности, а также хромоту, наблюдающиеся в основном у детей, у которых первичные оститы возникли давно [Уханов Н. Ю., 1989, и др.].
Стадия начала артритической фазы соответствует переходу туберкулезного процесса на сустав и развитию туберкулезного синовита. В этот период постепенно нарастают симптомы туберкулезной интоксикации и местные проявления заболевания: несильные, но постоянные боли, ригидность мышц, сглаженность контуров сустава, ограничение движений, хромота. Также определяются слабовыра-женные трофические расстройства: гипотония — ослабление тонуса мышц, атрофия мягких тканей, утолщение кожной складки на стороне поражения (симптом Александрова). При расположении туберкулезного очага вблизи ростковых зон у детей иногда наблюдается небольшое (на 2—5 см) удлинение конечности. При переходе туберкулезного процесса на сустав путем прорыва через суставной хрящ клиническая картина у отдельных больных может существенно не отличаться от описанной выше: у других больных наблюдаются более выраженные симптомы воспаления: высокая температура тела, быстро развившийся отек параартикулярных мягких тканей, более редкое ограничение движений, блокада сустава.
В стадии разгара артритической фазы прогрессирует деструкция суставных концов костей, что проявляется ухудшением общего состояния больного, резко выраженной туберкулезной интоксикацией, повышением температуры тела. При этом более выражены симптомы туберкулезного артрита: усиливаются боли в суставе, стихающие после иммобилизации конечности, повышается местная температура, значительно ограничиваются движения в суставе, который кажется увеличенным в объеме вследствие припухлости мягких тканей. Определяются порочная установка конечности и ее укорочение, могут наблюдаться смещения суставных концов костей. Более отчетливо выражены атрофия мягких тканей и другие трофические расстройства, возникшие в более ранней стадии.
Постартритическая фаза характеризуется хорошим общим состоянием больного и отсутствием симптомов туберкулезного артрита. Однако в этой фазе сохраняются и могут усиливаться укорочения и порочные установки конечности, деформации суставов, смещения суставных концов костей, атрофия мягких тканей. Больных беспокоят боли в суставе, связанные с его функциональной неполноцен
424
ностью. В этой фазе могут возникать вспышки туберкулезного процесса.
Туберкулезно-аллергические синовиты и артриты — следствие параспецифических аллергических поражений синовиальной оболочки сустава, проявляющихся ее иммунным воспалением, вызванным отдаленным туберкулезным очагом [Струков А. И., Соловьева И. П., 1986]. К туберкулезно-аллергическим синовитам относится прежде всего болезнь Понсе в различных ее проявлениях. Заболевание развивается на фоне туберкулеза внутренних органов, однако источник инфекции может быть скрытым. Клиническая картина схожа с проявлениями реактивного вос-
паления сустава, возникающего при первичных оститах, но отли-
чается упорным волн
разным течением с ремиссиями и сезонными
обострениями. В классической форме болезнь Понсе протекает в
виде полиартрита, причем чаще поражаются мелкие суставы. Однако в последние годы заболевание нередко начинается с поражения
одного крупного сустава и моноартрит в течение длительного периода времени может быть единственным проявлением болезни. Это рассматривают как следствие выраженного патоморфоза болезни Понсе, наблюдаемого в последние десятилетия [Тареев Е. М., 1976; Уткина Н. М., Курмаева М. Е., 1981; Беллендир Э. Н., Садовой М. Я., 1988]. Высказано мнение о том, что первичных синовиальных форм туберкулеза суставов не существует, так как возможность первичного поражения туберкулезом синовиальной оболочки сустава не доказана [Тареев Е. М., 1976; Струков А. И., Соловьева И. П., 1986]. Первичные синовиальные формы туберкулеза суставов на самом деле являются либо вторичными синовитами, характеризующимися клинической картиной, схожей с наблюдаемой в стадии начала артритической фазы, либо относятся к туберкулезно-аллергическим артритам — атипично протекающая болезнь Понсе [Беллендир Э. Н., 1987, 1988]. Осложнения туберкулеза суставов — деформации, натечные абсцессы, свищи, амилоидоз внутренних органов — возникают в разные периоды развития болезни, но чаще
всего — в артритической фазе.
Диагностика, дифференциальная диагностика. Всем больным проводят обзорную рентгенографию и томографию пораженного отдела скелета в двух проекциях. Для определения распространенности натечных абсцессов и свищей выполняют контрастные исследования:
абсцессографию или стереофистулографию. В качестве контрастного
вещества используют йодолипол, верографин, урографин. Для оп
ределения уровня и степени распространенности сдавления спинного мозга применяют пневмомиелографию с контрастированием субарахноидального пространства кислородом, введенным при люмбальной пункции. С этой же целью проводят веноспондилографию позвоночника, позволяющую уточнить протяженность сосудистых расстройств при туберкулезном спондилите. Эффективность диагностики во многом зависит от качества рентгеновских снимков.
Динамика рентгенологических изменений при туберкулезе позвоночника: в преартритической фазе в теле позвонка определяется
425
очаг деструкции с нечеткими контурами, содержащий секвестр. Однако указанные изменения в этот период болезни выявляют не у всех больных. В начальном периоде спондилитической фазы очаг деструкции выражен отчетливо, наблюдаются снижение высоты межпозвонкового диска и контактная деструкция в соседних позвонках. У отдельных больных на уровне пораженных позвонков определяются тени натечных абсцессов. У детей нарастание деструкции сопровождается усилением остеопороза, тогда как у взрослых плотность и структура костной ткани могут быть малоизмененными.
В наиболее активный период болезни видна деструкция тел 2—3 позвонков с разрушением межпозвонкового диска. Контуры позвонков нечеткие, смазанные, выявляется нерезко выраженная деформация позвоночника, преимущественно кифотическая. У большинства больных обнаруживают тени натечных абсцессов, которые в
грудном отделе позвоночника определяются по наличию уплотнения
пре- и паравертебральных мягких тканей, имеющих веретен
см
раз-
ную, треугольную или шаровидную форму. Чаще эти изменения симметричные. В поясничном отделе позвоночника о наличии натечного абсцесса свидетельствует изменение контуров подвздошно
поясничной мышцы, их расширение или исчезновение с одной сто
роны.
В постспондилитической фазе контуры пораженных позвонков
четкие, склерозированные; определяются частичное заполнение дефектов в позвонках новообразованными костными трабекулами, деформация позвоночника, костно-хрящевые разрастания, дистрофи
ческие и склеротические изменения в костной ткани.
Динамика рентгенологических изменений при туберкулезе суставов: в преартритической фазе вблизи сустава, чаще в метафизар-ном отделе кости, выявляют участок измененной разреженной костной структуры, а в последующем — очаг деструкции, содержащий включения разной плотности (секвестр). Эти изменения наблюдаются на фоне неизмененной костной ткани или остеопороза. В стадии начала артритической фазы костный очаг увели
чивается в размерах, характерными симптомами являются остеопороз и изменение величины суставной щели: вначале ее расширение, а затем сужение. Выявляется расширение теней капсулы сустава. У детей может наблюдаться увеличение эпифизов.
В стадии разгара нарастает остеопороз, увеличивается сужение суставной щели, определяется разрушение суставных концов костей. Деструкция носит очаговый характер, степень ее выраженности в разных отделах сустава неодинаковая. Контуры деструктивных полостей нечеткие. Уплотнение и расширение тени капсулы сустава увеличиваются, выявляются ограниченные плотные тени в толще мягких тканей конечности (абсцессы). Нарушаются анатомические соотношения в суставе: подвывихи и вывихи суставных концов костей.
В постартритической фазе выявляют уменьшение остеопороза, появление грубой балочной сети, расположенной по ходу силовых линий, уменьшение размеров костных полостей в результате запол
426
нения их новообразованной костной тканью. Суставные концы костей представляются умеренно склерозированными и деформированными, отмечается их атрофия, в краевых отделах сустава обнаруживают костно-хрящевые разрастания. Суставная щель сужена.
Важное значение в диагностике костно-суставного туберкулеза имеют бактериологические, цитологические и гистологические исследования патологического материала, полученного из костных очагов (трепанобиопсия), суставных выпадов и абсцессов (пункционная биопсия), свищевых ходов. Этим исследованиям в обязательном порядке подвергают нежизнеспособные ткани, удаленные во время операций, произведенных больным костно-суставным туберкулезом. Определенное значение в диагностике заболевания имеют также результаты других лабораторных исследований. В активный период болезни при анализе крови определяют высокую СОЭ, лейкоцитоз и нейтрофилез, снижение уровня кальция в крови, нарушение белкового обмена (снижение уровня альбуминов и повышение глобулиновых фракций — «2- и у-фракций). О прогрессировании специфического процесса свидетельствует увеличение содержания сиаловой кислоты, гаптоглобина и появление С-реактивного белка. С диагностической целью используют также провокационные туберкулиновые пробы (туберкулино-иммунологические, туберкулино-биохимические) , микроциркуляторные исследования, термографию, реографию [Беллендир Э. Н., 1988], радиоизотопные исследования, артроскопию [Бараш Л. И. и др., 1984 ] и другие методы.
При установлении диагноза костно-суставного туберкулеза важно учитывать патогенетическую связь этого заболевания с первичным туберкулезным очагом в другом органе. Большое значение имеют данные анамнеза; наличие контакта с больными туберкулезом, характерное начало болезни, его связь с травмой или другими факторами риска, неэффективность неспецифического лечения. Значительно облегчают диагностику постановка туберкулиновых проб, а также специальное комплексное лабораторное исследование. Необходимо также учитывать следующие наиболее характерные клинические проявления заболевания: медленное развитие процесса, сопровождающегося субфебрильной температурой тела; нарастающий характер заболевания; моноартикулярный тип поражения; наличие локализованных или иррадиирующих болей, стихающих в покое; изменение походки и осанки; ригидность мышц; ограничения подвижности в позвоночнике и суставах; атрофия мышц; деформация позвоночника и суставов; образование натечных абсцессов, имеющих типичную локализацию; опоясывающие корешковые боли и другие более выраженные неврологические расстройства.
Наиболее характерными рентгенологическими признаками являются наличие в толще кости, ее губчатом веществе, очага деструкции, содержащего секвестр и выявляемого на фоне нормальной костной ткани или остеопороза; уменьшение высоты межпозвонкового диска, непродолжительное расширение суставной щели в начале болезни, а затем ее стойкое сужение; утолщение пре- и параарти-кулярных мягких тканей; расширение тени капсулы сустава; нали
427
чие ограниченных плотных теней в толще мягких тканей конечности; контактная деструкция в телах 2—3 позвонков с разрушением межпозвонкового диска; очаговая деструкция в суставных концах костей с разрушением покровного суставного хряща; деформация позвоночника и суставов; атрофия костной ткани.
В настоящее время у большинства больных проявления костносуставного туберкулеза в основном соответствуют описанным выше. Однако в последние годы нередко наблюдается атипичное течение туберкулезного поражения костей и суставов, что обусловлено главным образом патоморфозом этого заболевания, а также более углубленным его изучением. Отклонения от типичного течения костно-суставного туберкулеза наиболее часто наблюдаются у детей до 3 лет, а также больных пожилого и старческого возраста.
У детей младшего возраста заболевания протекает особенно тяжело. Оно проявляется клиническими и рентгенологическими симптомами, схожими с таковыми при гематогенном остеомиелите или
идентичными им: острое начало, высокая температура тела, септическое состояние, значительные изменения в периферической крови. При рентгенологическом исследовании обнаруживают обширную костную полость, окруженную зоной склероза костной ткани. Разрушительный процесс у таких больных быстро прогрессирует, у некоторых из них образуется несколько костных очагов. У них рано выявляются натечные абсцессы и выраженные деформации в пораженных отделах скелета [РольеЗ. Ю. и др., 1975; Коваленко К. Н., 1987, и др.]. Такое течение костно-суставного туберкулеза наблюдается у 20—25% больных младшего возраста [Коваленко К. Н., 1987].
У большинства больных пожилого и старческого возраста клиническая картина заболевания в общем не отличается от типичной, однако у них отмечено относительно быстрое распространение туберкулезного процесса в первые 3—6 мес болезни. При этом СОЭ может достигать 60—65 мм/ч [Пикулева Ю. В., 1983]. Клиническая диагностика костно-суставного туберкулеза у пожилых людей значительно затруднена, главным образом из-за наличия у них сопутствующих заболеваний, клинические симптомы которых схожи с наблюдаемыми при туберкулезе костей и суставов.
Трудности рентгенологической диагностики связаны с наличием у этих больных возрастных инволютивных изменений опорно-двигательного аппарата, на фоне которых костно-суставной туберкулез проявляется отдельными признаками, нехарактерными для него. Атипичная рентгенологическая картина чаще всего наблюдается при туберкулезном спондилите. У этих больных особенности рентгенологических проявлений болезни зависят от характера возрастных изменений в позвоночнике: гиперпластические или остеопоротиче-ские. При гиперпластических процессах туберкулезные очаги выявляются на фоне деформирующего спондилоза, остеохондроза и спондилоартроза, на всех этапах развития туберкулеза выраженный локальный остеопороз тел позвонков отсутствует. У другой группы больных туберкулезный процесс развивается на фоне синильного
428
остеопороза с выраженными признаками позвоночно-дисковой диссоциации: тела многих позвонков деформированы, их форма напоминает рыбьи позвонки, характерные для гормональных спондило-патий, высота межпозвонковых дисков увеличена. На указанном исходном фоне тела пораженных туберкулезом позвонков представляются уплотненными. Высота межпозвонкового диска длительное время не уменьшается. В туберкулезный процесс вовлекаются, как обычно, 2—3 позвонка, однако наблюдается их обширная деструкция с образованием множественных крупных секвестров. У этих больных часто встречаются осложнения туберкулезного спондилита [Сове-това Н.А., МальченкоО. В., 1985].
Атипично протекает костно-суставной туберкулез любой локализации при эндогенном и экзогенном инфицировании костных очагов кокковой флорой. В этих случаях в клинической и рентгенологической картинах преобладают признаки острого воспаления: внезапное начало, повышение температуры тела до 39 °C, острое нарастание симптомов неспецифического спондилита или артрита. В крови обнаруживают увеличение СОЭ и лейкоцитоз. К концу первого месяца заболевания образуются абсцессы, что сопровождается ухудшением общего состояния больного и усилением болей. Рентгенологически на фоне склероза костной ткани выявляют очаг деструкции, а также эндостальную и периостальную реакции. Указанные формы туберкулеза костей и суставов встречаются у 10—14% больных [Станиславлева Е. Н. и др., 1973; Шатилова Ю. С., 1973; РольеЗ. Ю. и др., 1975; Будилина Ю. Д., 1979].
Клинические и рентгенологические проявления костно-суставного туберкулеза зависят также от вида возбудителя заболевания. При заражении микобактериями бычьего вида, а также L-формой микобактерий в костях и суставах нередко образуется несколько туберкулезных очагов. Клиническая картина характеризуется призна
ками торпидного течения процесса с выраженными симптомами туберкулезной интоксикации и большим количеством осложнений: натечных абсцессов, деформаций, свищей и др. У этих больных по сравнению с зараженными человеческим видом микобактерий чаще наблюдаются специфические изменения в других органах. Рентгенологическая картина при указанных формах туберкулеза отличается от типичной преобладанием признаков неспецифического вос
паления: отсутствием остеопороза и наличием выраженного остеосклероза в зоне поражения, а также костных разрастаний в виде шипов [Ченских Е. П., Маженова С. А., 1987].
При атипичных формах костно-суставного туберкулеза диагностику проводят специалисты противотуберкулезных учреждений. Прежде всего используют общефтизиатрические методы исследова-
ния, позволяющие подтвердить или исключить туберкулез, исследуют внутренние органы больного с целью обнаружения в них
туберкулезных очагов, применяют туберкулиновую пробу Манту с
разными дозами туберкулина, а также другие методы определения
чувствительности к туберкулину. Прямые доказательства этиологической принадлежности заболевания получают при бактериологи-
429
чес к ом, цитологическом и гистологическом исследованиях пунктатов костных очагов и мягкотканных образований, а также патологически измененных тканей, удаленных во время операций. Используют и
другие описанные выше методы диагностических исследований.
Костно-суставной туберкулез необходимо дифференцировать от следующих заболеваний опорно-двигательного аппарата: воспалительных — остеомиелита, инфекционных артритов, анкилозирующего спондилоартрита (болезнь Бехтерева), сифилиса, актиномикоза
и др., невоспалительных — врожденных пороков развития, доброкачественных опухолей (остеоид-остеома, эозинофильная гранулема, гемангиома, остеобластокластома, хондрома и др.); фиброзных дистрофий (киста и др.); остеохондропатий (болезни Кальве, Кенига,
Шлаттера, Легга—Кальве—Пертеса, частичный асептический не-
кроз головки бедренной кости и др.); дистрофических (деформиру
ющий артроз, гемофилический артроз, хондроматоз и др.); посттрав-
матических; злокачественных опухолей (остеогенная саркома, сим-патогониома и др.).
Лечение. В комплексном лечении костно-суставного туберкулеза основным методом является хирургический в сочетании со специфической антибактериальной терапией, которую проводят до и после операции. Широко используют также ортопедические, функциональные, физические и другие методы лечения. Их применяют в период пребывания больных не только в хирургическом стационаре, но и в специализированных костнотуберкулезных санаториях, куда их направляют для проведения общеукрепляющего и восстановительного лечения, а в случае необходимости и для продолжения антибактериальной терапии. Объем оперативных вмешательств зависит от степени деструкции пораженного отдела скелета. В ранний период болезни производят радикальное удаление первичных туберкулезных оститов, что позволяет добиться излечения. В более поздних фазах костно-суставного туберкулеза выполняют более сложные операции. Это связано с необходимостью ликвидировать обширные дефекты в суставных концах костей и телах позвонков,
произвести удлинение конечности, осуществить декомпрессию спинного мозга и т. п. Тем не менее при выполнении указанных опе
ративных вмешательств в хорошо оснащенных специализированных стационарах высококвалифицированными хирургами может быть достигнут высокий уровень излечения — более 90% [Салмагамбе-тов И. У., 1986; Коваленко К. Н., 1987, 1988; ГарбузА. Е., 1988, и др. ]. Более сложная задача — устранение наиболее тяжелых последствий костно-суставного туберкулеза: грубых анатомических нарушений, сопровождающихся полным разрушением суставных концов костей и большого количества тел позвонков, значительных деформаций, спинномозговых расстройств. Оперативные вмешательства, производимые этим больным, не устраняют инвалидизацию, а главным образом уменьшают ее тяжесть [Коваленко Д. Г., 1976; Станиславлева Е. Н., 1976, и др.].
Прогноз. Современные возможности лечения костно-суставного туберкулеза обеспечивают благоприятный прогноз болезни при ус
430
ловии своевременного выявления заболевания и его раннего хирур-
гического лечения.
Профилактика.
илактическую
работу
проводят с целью
снижения заболеваемости костно-суставным туберкулезом, предупреждения и устранения инвалидизации больных. Для этого осу-
ществляют комплекс мероприятий, направленных на раннее выявление больных туберкулезом костей и суставов с последующим
направлением их в специализированные стационары для хирургического лечения. Выявление больных проводит специалист по костно-суставному туберкулезу противотуберкулезного диспансера совместно с фтизиатрами и врачами общей лечебной сети. Задача терапевтов состоит в том, чтобы своевременно заподозрить костно-суставной туберкулез у больных, находящихся под их наблюдением, и обоснованно направить их на консультацию в противотуберкулезный диспансер. Больных, у которых может быть заподозрен костно-суставной туберкулез, выявляют среди пациентов с хроническими заболеваниями опорно-двигательного аппарата не-
достаточно точно установленного происхождения (артриты, артро-
зы, спондилозы, деформации); больных, у которых наблюдаются
упорные боли неясной этиологии в грудной клетке, животе, по-
яснице, нижних конечностях; больных с нарушением движений и осанки неустановленного происхождения. Повышенная настороженность в отношении костно-суставного туберкулеза должна быть в
тех случаях, когда указанную выше патологию выявляют у инфицированных туберкулезом больных или пациентов, контактирующих с больными активным туберкулезом. Особенно это касается детей; даже небольшие изменения в опорно-двигательном аппарате служат основанием для их направления в противотуберкулезный диспансер на консультацию к специалисту по костносуставному туберкулезу.
13.5. ТУБЕРКУЛЕЗ ПЕРИФЕРИЧЕСКИХ ЛИМФАТИЧЕСКИХ УЗЛОВ
Туберкулез периферических лимфатических узлов — это проявление общего заболевания. По своему генезу он в большинстве случаев относится к первичному периоду туберкулеза, т. е. является самостоятельным заболеванием. Однако могут встречаться и вторичные туберкулезные лимфадениты, в частности при обострении процесса в других органах. Вторичный туберкулез периферических лимфатических узлов чаще всего развивается в результате эндогенной реактивации очагов любой локализации при низкой сопротивляемости организма; доказана роль лимфатических узлов как депо микобактерий в организме, источника их диссеминации и развития рецидива. Представление о том, что возможно «мирное» существование микобактерий туберкулеза в организме человека, не выдерживает критики [Чистович А. Н., 1973 ]. Нахождение микобактерий туберкулеза в инкапсулированном очаге творожистого некроза свидетельствует не о том, что они утратили вирулентность, а о доминирующем в данное время состоянии
431
защитных сил организма. Спровоцировать обострение могут переохлаждение, нервный стресс, интеркуррентные заболевания.
В общей структуре внелегочного туберкулеза у впервые выявленных больных эта локализация занимает одно из первых мест. Чаще туберкулезом поражаются шейные лимфатические узлы (75— 80%), реже — подмышечные (15—20%) и паховые (5%). Это объясняется не только тем, что микобактерии туберкулеза попадают в организм через рот и верхние дыхательные пути, для которых шейные лимфатические узлы являются регионарными, но и тем, что эти узлы создают мощный биологический фильтровальный коллектор, предназначенный для того, чтобы задерживать инфекцию и раковые клетки. В область шеи оттекает лимфа не только от органов головы и шеи, но и от верхних конечностей, а через грудной проток — и от органов грудной и брюшной полости, забрюшинного пространства и нижних конечностей. Таким образом, через область шеи полностью или частично проходит лимфа со всех областей тела. Очевидно, в процессе филогенеза создались такие анатомические условия, в которых лимфатические узлы шеи должны были выполнять функцию главного барьера: и первого, и последнего; первого — для органов головы и собственно шеи, последнего — для органов грудной и брюшной полости.
Этиология и патогенез. Возбудителем туберкулеза лимфатических узлов чаще всего является человеческий вид микобактерий туберкулеза, но в тех местах, где неблагополучная эпизоотическая ситуация по туберкулезу, значительное место занимают микобактерии бычьего вида. Заражение туберкулезом лимфатических узлов происходит лимфогематогенным путем.
Патологическая анатомия. Микобактерии туберкулеза, попадая в ткань лимфатического узла, вызывают в ней воспалительный процесс. Последовательное развитие трех компонентов воспаления (альтерация, экссудация и пролиферация) наблюдается и при туберкулезе, но только в первые дни после инфицирования макроорганизма. Затем начинается период борьбы паразита и хозяина. На ранних этапах заболевания изменения в лимфатическом узле неспецифичны и характеризуются диффузной лимфоидной гиперплазией. Вероятнее всего, речь идет лишь об антигенной стимуляции. На последующих этапах происходят лейкоцитарная и фибринозная
экссудация, накопление эпителиоидных клеток, появляются гиган
тские клетки Пирогова—Лангханса. Эпителиоидные клетки вместе
с гигантскими образуют бугорки с полисад
•ж»
разными структурами
из лимфоцитов и очагами некроза в центре.
Казеозному некрозу может подвергнуться часть лимфатического
узла или весь узел. В дальнейшем казеозные места кальцинируются либо нагнаиваются и в результате этого образуются свищи. В других случаях обнаруживают большое количество эпителиоидных клеток и клетки Пирогова—Лангханса со слабой наклонностью к казеозному некрозу. Подобная картина может сохраняться долго, несмотря на большие размеры лимфатического узла. Постепенно туберкулезные бугорки подвергаются фибропластическому превращению и разви-
432
вается склероз. Последовательность изменений в ткани лимфатического узла при туберкулезе положена в основу морфологической классификации, предложенной А. И. Абрикосовым, по которой выделены диффузная лимфоидная гиперплазия, милиарный туберкулез, казеозный туберкулез, крупноклеточный туберкулезный лимфаденит и индуративный туберкулезный лимфаденит. Согласно кли
нико-морфологической классификации, различают инфильтратив-
ную, казеозную и индуративную формы.
Клиническая картина. Клинические наблюдения показывают, что чаще всего туберкулез периферических лимфатических узлов протекает хронически и начинается с их увеличения в какой-либо
одной группе или смежных группах. При таком течении обычно выражены явления специфической интоксикации, выражающиеся в повышении температуры тела, бледности кожных покровов, быстрой утомляемости, потливости, снижении аппетита. Многолетнее течение заболевания и стойкая интоксикация в большинстве случаев
приводит к выраженным нарушениям деятельности сердечно-сосудистой и вегетативной нервной системы и белкового обмена. В начале заболевания лимфатические узлы увеличены до 0,5—1,5 см, мягкие, безболезненные при пальпации, не спаянные между собой и с окружающими тканями. Ино1да же ткань лимфатического узла подвергается казеозному перерождению и гнойному расправлению, при этом в неспецифический воспалительный процесс вовлекается капсула лимфатического узла и формируется единый конгломерат, спаянный с кожей и окружающими тканями. В таких случаях при пальпации отмечаются болезненность и флюктуация. Кожа над конгломератом увеличенных лимфатических узлов гиперемируется и вскрывается, в результате чего формируется свищ, имеющий бледные отечные края.
По затихании процесса воспалительные изменения исчезают, свищи закрываются и на их месте формируются обезображивающие рубцы. Лимфатические узлы уменьшаются в размерах и вовлекаются в рубцы. Признаки туберкулезной интоксикации постепенно исчезают. Больные чувствуют себя практически здоровыми до нового обострения.
Для туберкулеза характерна сезонность обострений (весна и осень). Спровоцировать обострение могут переохлаждение, нервный стресс, интеркуррентные заболевания.
Атипично протекает туберкулез периферических лимфатических узлов у детей, беременных и стариков. Для них характерно острое начало заболевания, ярко выраженные симптомы туберкулезной интоксикации. Температура тела повышается до 38—39 °C, сопровождается слабостью, сильной головной болью. Увеличенные лимфатические узлы подвергаются казеозному перерождению и гнойному расплавлению, спаиваются с окружающими тканями и кожей, резко болезненны при пальпации, при которой определяется флюктуация, а затем открываются свищи. При остром течении туберкулеза период времени от начала заболевания до появления свищей составляет от 1 до 3 мес. Осложнения туберкулеза периферических
15—1213
433
лимфатических узлов — свищи, кровотечения, амилоидоз внутренних органов.
Диагностика, дифференциальная диагностика. При исследовании крови в период обострения выявляют лейкоцитоз с выраженным нейтрофильным сдвигом влево, моноцитоз, лимфоцитоз. У больных, у которых отмечается значительное распространение процесса, может наблюдаться лимфопения. СОЭ у большей половины больных увеличена, но, за редким исключением, не достигает высоких цифр.
При исследовании сыворотки крови обнаруживают нарушение белкового обмена (снижение уровня альбуминов и повышение глобулинов за счет аг- и у-фракций), увеличение содержания фибриногена и сиаловой кислоты, С-реактивный белок. Эти изменения наиболее выражены при казеозных лимфаденитах. Для установления диагноза проводят иммунологическое исследование, в частности реакцию непрямой гемагглюцинации, серологическое и радионуклидное исследования.
В диагностике туберкулеза широкое применение нашли туберкулиновые пробы. Наиболее распространенным методом туберкулинодиагностики является внутрикожная реакция Манту с 2 ТЕ. В сложных диагностических случаях применяют более чувствительную подкожную пробу Коха. Показатели крови и плазмы определяют до введения туберкулина и через 48 ч после него.
Также проводят системное рентгенологическое исследование (рентгенография мягких тканей в области увеличенных лимфатических узлов, грудной и брюшной полости), при котором выявляют кальцинированные лимфатические узлы. Для туберкулеза характерно обызвествление в центре лимфатического узла и сохранение необызвествленной капсулы. Большое значение в диагностике туберкулеза периферических лимфатических узлов имеют гистологическое, цитологическое и бактериологическое исследования патологического материала, полученного во время пункции лимфатического узла или после его удаления.
Для диагностики туберкулеза периферических лимфатических узлов важен детальный анамнез. Важно уточнить начальную картину заболевания, длительность процесса, наличие рецидивов, туберкулеза другой локализации, контакта больного с источником туберкулезной инфекции. Необходимо обратить внимание на локализацию увеличенных лимфатических узлов, их размеры, консистенцию, спаянность между собой и с окружающей подкожной жировой клетчаткой, распространенность. Для туберкулеза характерны полиморфизм лимфатических узлов по консистенции, образование из них конгломерата. Необходимо учитывать также результаты лабораторного и рентгенологического исследований, туберкулиновых проб. Наиболее точные данные дают биопсия лимфатического узла, гистологическое и бактериологическое исследования.
Туберкулез лимфатических узлов необходимо дифференцировать от их воспалительных заболеваний, гемобластозов и доброкачественных новообразований.
Особенностями неспецифического лимфаденита яв
434
ляются короткий инкубационный период, наличие в анамнезе недавно перенесенного простудного заболевания, ссадин, кариозных зубов, хронического тонзиллита. Неспецифический лимфаденит может быть острым и хроническим. При остром течении лимфатические узлы увеличиваются до 1,5—2 см в диаметре, иногда больше, резко болезненны при пальпации. Если в воспалительный процесс вовлечены несколько близлежащих узлов, то они спаиваются в конгломерат. В течение непродолжительного периода либо воспалительные изменения стихают, либо появляются гиперемия кожи, флюктуация и открывается свищ с гнойным отделяемым. Под действием консервативной терапии (антибиотики, перевязки) свищ быстро опорож
няется и закрывается.
Хронический неспецифический лимфаденит чаще встречается у
детей при хронических заболеваниях слизистой
дочки полости
рта и дыхательных путей, хроническом тонзиллите. Лимфатические узлы обычно множественные, плотные, безболезненные, не спаянные
между собой. При обострении в хроническом очаге воспаления
лимфатические узлы увеличиваются в размере, появляется умеренная болезненность при пальпации.
При болезни кошачьей царапины (доброкачественный вирусный лимфаденит) длительность инкубационного периода от момента нанесения царапины 2—28 дней. На месте царапины фор
мируется папула, а через несколько дней — везикула; ухудшается общее состояние, появляются лихорадка, боли в мышцах, головная боль, тахикардия, на туловище и конечностях — коревидные или скарлатиноподобные высыпания, а иногда высыпания типа узловатой эритемы, уменьшается аппетит. Описанные проявления болезни часто носят циклический характер, длительностью отдельных рецидивов от нескольких дней до 3—4 мес. В воспалительный процесс вовлекаются регионарные лимфатические узлы, расположенные вблизи первичного аффекта, которые у 50% больных нагнаиваются, а затем открывается свищ. Лечение — противовоспалительная те
рапия и перевязки.
Инфекционный мононуклеоз начинается остро, но может также развиваться постепенно. Температура тела повышается до 38 °C, держится на этом уровне 6—10 дней; наблюдаются умеренная интоксикация, познабливание, потливость. Одновременно с
лихорадкой, а иногда до повышения температуры отмечается уве
личение лимфатических узлов на задней поверхности шеи и в области сосцевидных отростков. Лимфатические узлы 0,5—5 см в диаметре, обычно безболезненные или слабочувствительные при пальпации, без явлений периаденита, никогда не спаиваются между
й,
не нагнаиваются и не вскрываются. Нередко отмечаются
одутловатость лица и пастозность век. При инфекционном мононуклеозе могут увеличиваться и другие группы лимфатических узлов. С первых дней заболевания наблюдаются гиперемия зева и гиперплазия миндалин. У большинства больных выявляют гепато-спленомегалию. В начале болезни характерных изменений в крови нет, в разгар ее обнаруживают лейкоцитоз (количество лейкоцитов
15*
435
10—20*109/л), нейтропению и, что характерно для мононуклеоза, — выраженный моноцитоз, отмечается также увеличение количества лимфоцитов и плазматических клеток. СОЭ может быть нормальной или умеренно повышенной.
Бруцеллез, может начаться остро, когда иа 2—3-й день болезни температура тела достигает высоких цифр, или развиваться постепенно с продромальными явлениями в виде общей слабости, потливости, субфебрильной температуры, сохраняющимися в течение 1—2 иед. Клиническая картина бруцеллеза полиморфна. Для этого заболевания характерны функциональные расстройства центральной нервной системы типа неврастении: слабость, утомляемость, раздражительность, нарушение памяти, бессонница. Часто наблюдаются поражения центральной нервной системы в виде энцефалитов и арахноидитов. Поражения периферических нервов носят характер невралгий либо выраженных невритов, радикулитов. Часто отмечаются поражения опорно-двигательного аппарата. Лимфатические узлы увеличены у 6% больных. Они эластической консистенции, подвижные, безболезненные. Для бруцеллеза характерна спленомегалия.
Сочетание таких симптомов, как субфебрильная температура тела, увеличение печени и селезенки, артрит, свидетельствует в пользу бруцелеза. Большое значение в диагностике имеют анамнестические данные, эпидемиологический анамнез. При исследовании крови выявляют лейкопению и лимфоцитоз и умеренно повышенную СОЭ. Важную роль играют реакции Бюрне, Райта и Хаддлсона.
Токсоплазмоз — паразитарное заболевание, при котором часто увеличиваются лимфатические узлы (от 0,5 до 3—4 см в диаметре), спаивающиеся между собой. При пальпации они плотные, безболезненные. Одновременно увеличиваются лимфатические узлы (шейные, подмышечные, паховые и т. д.). Больные жалуются на слабость, головную роль, раздражительность, субфебрильную температуру тела. Диагноз токсоплазмоза устанавливают только после исключения других заболеваний, в том числе туберкулеза. В диагностике имеют значение длительно сохраняющаяся субфебрильная температура тела, лимфаденопатия, увеличение печени и селезенки, поражение глаз, множественные кальцинаты (1,5—1 см) в головном мозге, выявляемые на рентгенограммах черепа. Все больные, у которых отмечаются лимфаденопатия, субфебрильная температура тела, нарушение общего состояния, должны быть обследованы на СПИД.
Саркоидоз может проявляться как самостоятельная нозологическая форма или своеобразная реакция при метастазах рака, бруцеллезе, бецежитах. Основное значение в диагностике имеет гистологическое исследование.
Из гемобластозов наиболее часто встречаются метастазы рака, на втором месте — системные заболевания (лимфагранулематоз), на третьем — первичные опухоли (саркомы).
При метастазе рака в лимфатическом узле он приобретает округлую форму, плотную консистенцию, бугристую поверхность.
436
Лим ф огранулем атоз начинается с увеличения узлов одной группы, чаще на шее слева. В развитой стадии заболевания отмечается тенденция к образованию конгломератов лимфатических
узлов, в которых определяются границы каждого узла. Обычно
процесс в них не выходит за пределы капсулы. В начале заболевания
общее состояние больных не изменяется. Температура тела чаще всего субфебрильная. У больных появляется кожный зуд, который бывает местным или генерализованным, локализуется на медиальных поверхностях предплечий, бедер, волосистой части головы и
поддается воздействию только специфической терапии. Кожа сухая,
появляются участки гиперпигментации. Характерный признак —
повышенное потоотделение ночью, которому предшествует озноб. В крови изменений не обнаруживают, но многие авторы отмечают
нейтрофильный лейкоцитоз, лимфопению, увеличение СОЭ. В сы-
воротке крови выявляют высокий уровень фибриногена, увеличение содержания и уменьшение y-глобулина. На рентгенограмме органов
грудной клетки может определяться расширение средостения вследствие трахеобронхиальных и бронхопульмональных узлов. При гистологическом исследовании выявляют клеточный полиморфизм и клетки Березовского—Штернберга. У 70% больных заболевание сопровождается спленомегалией.
Лимфосаркома — опухоль, происходящая из паренхимы лимфатического узла. Это наиболее злокачественная из всех существующих опухолей, она характеризуется быстрым ростом, прорастанием капсулы узла окружающих тканей и кожи. У некоторых больных диагностируют лимфосаркоматоз — образование множест
венных очагов.
Ретикулосаркома — опухоль стромы лимфатического узла, характеризующаяся более доброкачественным течением и равномерным ростом. Лимфатические узлы могут достигать больших размеров, но сохраняется их гладкая поверхность. Нередко ретикулосар-кому приходится дифференцировать от боковой кисты шеи, атеромы.
Образование боковой кисты шеи связано с эмбриональным не-заращением жаберных щелей. Заболевание начинается в период полового созревания. Обычно это одностороннее и очень редко двустороннее образование, ограниченно подвижное, с четкими контурами, безболезненное, флюктуирующее, локализующееся в области верхней или средней части шеи впереди кивательной мышцы. Содержимое кисты может нагноиться, воспаление переходит на капсулу кисты, кожу, в результате чего образуется свищ. При цитологическом исследовании содержимого кисты выявляют клетки плоского эпителия и кристаллы холестерина.
Атерома — киста сальной железы, образующаяся в результате закупорки протока и растяжения капсулы сальной железы ее содержимым. Атеромы, диаметры которых от 0,5 до 3—5 см, бывают одиночными и множественными, располагаются в толще кожи, нередко возвышаются под ее поверхностью, имеют тонкую стенку и плотную соединительнотканную капсулу. Они формируются в местах, где имеется много сальных желез. Кожа над атеромой непод
437
вижна, сама же атерома вместе с кожей относительно подвижна, безболезненна, имеет эластическую консистенцию. Боли появляются только при нагноении, после самостоятельного опорожнения нагноившейся атеромы может образоваться долго незаживающий свищ.
Лечение. При туберкулезе периферических лимфатических узлов проводят комплексное лечение. Больным назначают туберкулостатические препараты, климато- и физиотерапию.
Показаниями к хирургическому лечению, которое осуществляют на фоне антибактериальной терапии, являются: абсцедирование лимфатических узлов, длительно незаживающие свищи, вовлечение пораженных лимфатических узлов в рубцы, отсутствие эффекта от консервативной терапии в течение 1,5—2 мес. Антибактериальную терапию проводят и в послеоперационном периоде в диспансере или
санатории.
Прогноз зависит от распространенности туберкулезного процесса. При своевременной диагностике и правильном лечении прогноз благоприятный.
Профилактика заключается в борьбе с туберкулезом крупного рогатого скота и профилактике туберкулеза как инфекции.
13.6. ТУБЕРКУЛЕЗ МОЗГОВЫХ ОБОЛОЧЕК И ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Туберкулез центральной нервной системы имеет значительный удельный вес среди всех форм туберкулеза и других заболеваний нервной системы. Он включает в себя туберкулез мозговых оболочек, туберкулему мозга и поражение центральной нервной системы при туберкулезном спондилите.
До введения в клиническую практику стрептомицина туберкулез
центральной нервной системы обнаруживали на вскрытии в 3,4%
случаев [Ерофеев П. П., 1947], на его долю приходилось 23% всех
заболеваний нервной системы [Давыдовский И. В., 1940]. К началу антибактериального периода туберкулезный менингит составлял
26—37% всех форм туберкулеза и наблюдался преимущественно у
детей.
Летальность от туберкулеза центральной нервной системы достигала 20% общей летальности от туберкулеза, а от туберкулезного
менингита — 100%. В настоящее время в результате широко про-
водимых в нашей стране профилактических и лечебных мероприятий
значительно уменьшилась частота туберкулеза центральной нервной системы, особенно туберкулезного менингита, удельный вес которого составляет у детей 0,3%, у взрослых 3%, а выздоровление от последнего при своевременно начатом лечении достигает 100%.
13.6.1. Туберкулезный менингит
Этиология и патогенез. Туберкулез мозговых оболочек, или туберкулезный менингит, — преимущественно вторичное туберкулезное поражение (воспаление) оболочек (мягкой, паутинной и
438
меньше твердой), возникающее у больных с различными, чаще активными и распространенными, формами туберкулеза. Туберкулез этой локализации протекает наиболее тяжело. У взрослых туберкулезный менингит часто служит проявлением обострения туберкулеза и может быть его единственной установленной локализацией. Локализация и характер основного туберкулезного процесса влияют на патогенез туберкулезного менингита. При первичном диссеминированном туберкулезе легких микобактерии туберкулеза проникают в центральную нервную систему лимфогематогенным путем, так как лимфатическая система связана с кровяным руслом. Туберкулезное воспаление мозговых оболочек возникает при непосредственном проникновении микобактерий в нервную систему вследствие нарушения сосудистого барьера. Это происходит при гипер-ергическом состоянии сосудов мозга, оболочек, сосудистых сплетений, вызванном неспецифической и специфической (микобактерии) сенсибилизацией. Морфологически это выражается фибриноидным некрозом стенки сосудов, а также их повышенной проницаемостью. Разрешающим фактором являются туберкулезные микобактерии, которые, существуя в очаге поражения, обусловливают повышенную чувствительность организма к туберкулезной инфекции и, проникая через измененные сосуды сосудистых сплетений желудочков мозга, приводят к их специфическому поражению. Инфицируются главным образом мягкие мозговые оболочки основания мозга, где развивается туберкулезное воспаление. Отсюда процесс по сильвиевой цистерне распространяется на оболочки полушарий мозга, оболочки продолговатого и спинного мозга.
При локализации туберкулезного процесса в позвоночнике, костях черепа, внутреннем узле перенос инфекции на мозговые оболочки происходит ликворогенным и контактным путем. Мозговые оболочки могут инфицироваться также из ранее существовавших туберкулезных очагов (туберкулем) в мозге вследствие активации в них туберкулеза.
М. В. Ищенко (1969) доказал существование и лимфогенного пути инфицирования мозговых оболочек, который он наблюдал у 17,4% больных. При этом микобактерии туберкулеза с пораженного туберкулезом верхнешейного фрагмента яремной цепочки лимфатических узлов по периваскулярным и периневральным лимфатическим сосудам попадают на мозговые оболочки. Распространение процесса в ткани мозга и оболочек по ходу сосудов может происходить без фибринозного некроза и в отсутствие или при малой выраженности изменений эпендимы и сосудистых сплетений. В патогенезе туберкулезного менингита имеют значение климатические, метеорологические факторы, время года, пересененные инфекции, физическая и психическая травмы, инсоляция, тесный и длительный контакт с больным туберкулезом. Эти факторы вызывают сенсибилизацию организма и снижение иммунитета.
Патологическая анатомия. Для патологической анатомии туберкулезного менингита характерны различия в характере и распространенности воспалительной реакции и своеобразие, выражающееся
439
в возникновении разлитого серозно-фиброзного воспаления мягкой мозговой оболочки, преимущественно основания мозга: орбитальной поверхности лобных долей, области перекреста зрительных нервов, переднего и заднего подбугорья (гипоталамус), дна III желудочка и его боковых стенок с вегетативными центрами, латеральной (сильвиевой) борозды, оболочек моста головного мозга (варолиев мост),
продолговатого мозга с прилежащими отделами мозжечка. В госпитальный процесс вовлекаются также вещество головного и спинного мозга, его оболочки, эпендима желудочков мозга. Характерные признаки заболевания — высыпание туберкулезных бугорков на обо-
лочках, эпендиме и альтеративное поражение сосудов, главным образом артерий мягких мозговых оболочек и сосудистых сплетений, типа периартериита и эндартериита. Туберкулезному менингиту свойственна выраженная гидроцефалия, возникающая вследствие поражения сосудистых сплетений и эпендимы, нарушения всасывания цереброспинальной жидкости и окклюзии путей ее циркуляции. Переход процесса на сильвиеву борозду и находящуюся в ней мозговую артерию приводит к образованию очагов размягчения коры мозга, подкорковых узлов и внутренней капсулы.
Полиморфизм патологических изменений и распространенность процесса обусловливают многообразие клинических проявлений туберкулезного менингита; помимо менингеальных симптомов, наблюдаются расстройства жизненно важных функций и вегетативные расстройства, нарушения черепно-мозговой иннервации и двигательных функций с изменением тонуса в виде децеребрационной ригидности и расстройства сознания. В случаях поздней диагностики туберкулезного менингита и неэффективности лечения вследствие
прогрессирования процесса и перехода его на сосуды и вещество мозга возникают патологические изменения в полушариях мозга, бульбарных центрах, спинном мозге, его корешках, оболочках ствола и спинного мозга (диффузные лептопахименингиты). В том случае, если лечение оказывается эффективным, ограничивается распространенность воспалительного процесса, уменьшается экссудативный и альтеративный компоненты воспаления, преобладают продуктивная реакция и репаративные процессы, выражающиеся в почти полном исчезновении патологических изменений, особенно при рано
начатом лечении.
Клиническая картина и характер течения туберкулезного менингита многообразны вследствие полиморфизма патоморфологиче-
ских изменений и зависят от многих причин: длительности болезни к началу лечения, возраста больного, характера основного тубер-
кулезного процесса, преморбидного фона. При поздней диагностике менингита, у больных раннего возраста и в случае значительного распространения туберкулезного процесса наблюдается более тяжелое течение заболевания.
Клиническая картина. У большинства больных туберкулезный менингит начинается постепенно, но в последние 15—20 лет участились случаи острого начала заболевания (у 40% больных), чаще наблюдающиеся у детей раннего возраста.
440
Заболевание начинается с продромального периода, продолжительность которого составляет 1—3 нед. В этот период у больных отмечаются общее недомогание, непостоянная, несильная головная боль, периодически возникающее повышение температуры тела (до субфебрильной), ухудшение настроения у детей, уменьшение интереса к окружающему. В дальнейшем (в течение первых 7—10 дней болезни) появляется вялость, температура повышена, аппетит снижен, головная боль более постоянна. В последующем (с 10-го по 15-й день болезни) головная боль становится более интенсивной, появляется рвота, усиливается вялость, отмечаются повышенная возбудимость, беспокойство, анорексия, задержка стула. Больные быстро худеют. Температура тела повышается до 38—39 °C, появляются менингеальные симптомы, сухожильные рефлексы повышены, обнаруживаются патологические рефлексы и расстройства черепно-мозговой иннервации, парезы лицевого, глазодвигательного и отводящего нервов (сглаженность носогубной складки, сужение глазной щели, птоз, косоглазие, анизокория) и вегетативно-сосудистые расстройства: красный дермографизм, брадикардия, аритмия, а также гиперестезия, светобоязнь. При исследовании глазного дна обнаруживают застойные соски дисков или неврит зрительных нервов, туберкулезные бугорки на сосудистой оболочке.
В том случае, если на 3-й неделе (15—21-й день) лечение не начато, болезнь прогрессирует. Температура тела повышается до 39—40 °C, становятся резко выраженными головная боль и менингеальные симптомы; появляются вынужденная поза и децеребрационная ригидность, сознание затемнено, а в конце 3-й недели отсутствует. Расстройства черепно-мозговой иннервации усиливаются, появляются очаговые симптомы — парезы, параличи конечностей, гиперкинезы, автоматические движения, судороги, усиливаются трофические и вегетативные расстройства, отмечаются резкая потливость или сухость кожи, пятна Труссо, тахикардия, развивается кахексия. Перед смертью, которая наступает через 3—5 нед от начала заболевания, температура тела достигает 41—42 °C или снижается до 35 °C, пульс учащается до 160—200 в 1 мин, дыхание становится аритмичным, типа дыхания Чейна—Стокса. Больные умирают в результате паралича дыхательного и сосудодвигательного центров.
Острое начало болезни чаще отмечается у детей раннего возраста, у которых наиболее постоянные и ранние симптомы — головная боль, рвота и повышение температуры тела до 38—39 °C, появляющиеся в первые дни заболевания. В последующем температура тела становится более высокой, головная боль усиливается, появляются вялость, сонливость, анорексия, менингеальные симптомы и расстройства черепно-мозговой иннервации. В конце 2-й недели у части больных отмечаются расстройства сознания, двигательные нарушения и расстройства жизненно важных функций — дыхания и кровообращения.
Состав цереброспинальной жидкости на 1-й неделе заболевания изменен. Давление ее повышено, она прозрачная, бесцветная. Уро
441
вень белка повышен до 0,5—0,6%о> глобулиновые реакции слабоположительные, сетка фибрина выпадает не всегда. Плеоцитоз лимфоцитарный, 100—150 клеток в 1 мл. Количество сахара и хлоридов нормальное или немного уменьшено (норма 2,2—3,8 и 120— 128 ммоль/л соответственно). Микобактерии туберкулеза обнаруживают у небольшого (5—10%) числа больных.
На 2-й неделе болезни изменения состава цереброспинальной жидкости более выраженные. Давление ее более высокое (300—
500 мм вод. ст.) вследствие нарастающей гидроцефалии. Жидкость становится опалесцирующей, содержание белка увеличивается до 1—2%о и более, глобулиновые реакции резко положительны, выпадает сетка фибрина, плеоцитоз достигает 200—700 клеток в 1 мл,
имеет лимфоцитарно-нейтрофильный характер, реже нейтрофиль-
но-лимфоцитарный. Уровень сахара снижен до 1,5—1,6 ммоль/л, хлоридов — до 100 ммоль/л, микобактерии туберкулеза обнаруживают у 10—20% больных.
Состав цереброспинальной жидкости в последней стадии болезни (3—4-я неделя) изменяется еще больше: увеличиваются содержание белка и плеоцитоз, снижается уровень сахара (иногда до 0) и хлоридов. Цитограмма приобретает нейтрофильно-лимфоцитарный
ильный характер. Нередко появляются ксантохромия
(вследствие нарушения циркуляции цереброспинальной жидкости) и белково-клеточная диссоциация: очень высокий уровень белка —
до 3—5 и даже 300%о> при менее высоком плеоцитозе — до 2
[QIC
[QIC
клеток в 1 мл. При очень высоком содержании белка отме-
чается желеобразная консистенция цереброспинальной жидкости по-
сле ее извлечения через пункционную иглу.
Картина крови в значительной степени зависит от характера
туберкулезного процесса в легких или других органах. Наиболее характерные изменения — снижение уровня гемоглобина и эрит-
роцитов, увеличение СОЭ, умеренные лейкоцитоз и сдвиг лейко-
цитарной формулы влево, лимфоцитопения, моноцитоз. В связи с внедрением в практику противотуберкулезных препаратов резко
изменились течение туберкулезного менингита и его исход. Клиническая картина заболевания стала более многообразной, увеличилась
длительность болезни и совершенно изменился прогноз. В настоящее время при своевременной диагностике заболевания удается добиться выздоровления всех больных.
Клиническая картина туберкулезного менингита при лечении его противотуберкулезными препаратами в наибольшей степени зависит от периода времени, прошедшего от начала болезни до лечения. В зависимости от преимущественной локализации патологического процесса и его распространенности различают три наиболее типичные клинические формы туберкулеза оболочек мозга: базальный (базилярный) туберкулезный менингит, туберкулезный менингоэнцефалит и туберкулезный цереброспинальный лептопахименингит (туберкулезный менингоэнцефаломиелит). При прогрессировании процесса возможен переход одной формы в другую — базальной в менингоэнцефалитическую или цереброспинальную. Некоторые ав
442
торы выделяют конвекситальную форму, при которой процесс локализуется преимущественно на оболочках выпуклой части мозга и наиболее выражен в области центральных извилин. Описаны более редкие атипичные формы туберкулезного менингита.
Базальный туберкулезный менингит — наиболее часто встречающаяся форма туберкулезного менингита (составляет около 60%). Воспалительный процесс локализуется преимущественно на оболочках основания мозга. Клиническая картина характеризуется выра-
женными мозговыми менингеальными симптомами, нарушениями черепно-мозговой иннервации и сухожильных рефлексов, умеренно выраженными явлениями гидроцефалии и изменениями состава цереброспинальной жидкости: уровень белка повышен до 0,5—0,6%о, плеоцитоз 100—150 клеток в 1 мл, содержание сахара, хлоридов незначительно уменьшено или нормальное. Микобактерии обнаруживают у 5—10% больных. Течение болезни (при лечении) преимущественно гладкое, без обострений, изредка затяжное, исход благоприятный — полное выздоровление без осложнений. Улучшение общего состояния и исчезновение мозговых симптомов, снижение температуры тела отмечается в течение 3—4 нед. Менингеальные симптомы исчезают через 2—3 мес, а санация цереброспинальной жидкости происходит через 4—5 мес. Необходимо длительное лечение (10—12 мес), поскольку клиническое выздоровление значительно опережает анатомическое, а также вследствие того, что менингит обычно сочетается с активным туберкулезом внутренних
органов.
Туберкулезный менингоэнцефалит — наиболее тяжелая форма туберкулезного менингита, наблюдающаяся, как правило, при поздней
диагностике заболевания. Специфическое воспаление локализуется на
•ж
лочках основания мозга, а также распространяется на его вещество
и сосуды. При менингоэнцефалите значительно выраженные воспалительные изменения и высыпания бугорков отмечаются в эпендиме же-
лудочков мозга, на сосудистых сплетениях, в подкорковых ганглиях. Для клинической картины, помимо выраженных мозговых и
менингеальных расстройств, характерны очаговые симптомы: дви
гательные расстройства — парезы или параличи конечностей, ги-
перкинезы, судороги, а также выраженные расстройства черепномозговой иннервации, сознания, вегетативные расстройства, гидроцефалия. Изменение состава цереброспинальной жидкости более выраженное, чем при базилярной форме: содержание белка достигает 1,5—2%0 и более, плеоцитоз 500—700 клеток в 1 мл и более, имеет
лимфоцитарно-нейтрофильный характер, иногда нейтрофильно-лим-
фоцитарный. Содержание сахара и хлоридов значительно уменьшено. Туберкулезные микобактерии обнаруживают у 20—25% больных. Течение болезни более тяжелое, иногда с обострениями и затяжное, несмотря на полноценное лечение. Улучшение общего
состояния и исчезновение менингеальных симптомов отмечаются на 1,5—2—3 мес позже, чем при базилярной форме менингита. Санация цереброспинальной жидкости также происходит в более поздние сроки — через 5—6 мес и позже. После выздоровления наблюдаются
443
остаточные явления, иногда выражены парезы черепных нервов,
парезы или параличи конечностей, изменения психики в виде повышенной возбудимости, расторможенности, снижения памяти, а иногда и интеллекта. Редко в отдаленном периоде развивается эпилепсия. Летальность достигает 30% и более. Обычно необходимо более длительное лечение, чем при базилярной форме, — 12—14 мес, а иногда и дольше. Помимо антибактериальной и патогенетически обоснованной терапии, большую роль играет лечение с целью
устранения резидуальных явлений.
Туберкулезный цереброспинальный лептопахименингит встречается относительно редко — у 5—10% больных. При этой форме
воспалительный процесс имеет преимущественно продуктивный ха-
рактер, локализуется на
лочках основания мозга, а также рас
пространяется на
лочки продолговатого и спинного мозга. Может
осложнять базилярную и менингоэнцефалитическую формы. Чаще наблюдается у детей старшего возраста и взрослых. Характерно постепенное малосимптомное начало, что нередко обусловливает позднюю диагностику этой формы менингита. Менингеальный синдром резко выражен, часто отмечаются корешковые боли. Нарушения черепно-мозговой иннервации и мозговые синдромы умеренно выражены. Изменения состава цереброспинальной жидкости наиболее значительны. Характерна белково-клеточная диссоциация, при этом содержание белка может достигать 3—330%о, плеоцитоз 1000— 1500 клеток в 1 мл и более. Цереброспинальная жидкость нексан-тохромна и может свертываться в пробирке после выпускания ее из спинномозгового (центрального) канала. Эти изменения связаны с частичной блокадой субарахноидального пространства воспалительными изменениями и спайками, а также с застоем цереброспинальной жидкости. Заболевание обычно протекает менее тяжело, чем менингоэнцефалит, с медленной санацией цереброспинальной жидкости — в течение 5—15 мес. Необходима длительная химио
терапия (12—15 мес) с применением кортикостероидных гормонов
внутрь, а иногда эндолюмбально. В редких случаях при переходе
воспалительного процесса с
лочек на вещество спинного мозга
при его сильном сдавлении спайками возможны тяжелые осложне
ния: параличи, парезы конечностей, развитие полного ликворного блока, гидроцефалии и неблагоприятный исход. Благодаря современным методам лечения в большинстве случаев наступает выздоровление без осложнений.
Особенностями течения туберкулезного менингита являются: более часто ( у 40% больных) встречающиеся острое начало заболе
вания и его менее тяжелое течение во всех возрастных группах, что проявляется уменьшением частоты менингоэнцефалитической и увеличением частоты базилярной форм; увеличением продолжительности жизни больных до и после начала лечения при поздней диагностике заболевания в случаях его неблагоприятного исхода; реже встречающееся волнообразное и затяжное течение болезни; отсутствие рецидивов после лечения; более ранние сроки выздоровления и более благоприятные исходы заболевания при лечении;
444
менее выраженные осложнения, такие как гемипарез, гидроцефалия, снижение интеллекта и зрения, а также очень редкие случаи образования кальцинатов в веществе мозга и мозговых оболочках и развития несахарного диабета, которые ранее отмечались как осложнения менингита.
Диагностика, дифференциальная диагностика. При диагностике туберкулезного менингита следует учитывать: 1) что заболевание чаще развивается постепенно, начинаясь с появления вялости, заторможенности, повышения температуры тела, на фоне которых возникает менингеальный синдром, а затем — поражение черепных нервов (III, IV, VII пар). Характерен состав цереброспинальной жидкости: она прозрачна, в ней отмечаются умеренное повышение уровня белка и плеоцитоз до нескольких сотен клеток, преимущественно лимфоцитарного характера, уменьшение содержания сахара и хлоридов, выпадение сетки фибрина, нередко обнаруживают микобактерии туберкулеза с помощью бактериоскопии и флюоресцентной микроскопии; 2) хотя туберкулезный менингит нередко является первым клиническим симптомом туберкулеза, он представляет собой вторичное поражение, т. е. развивается у больных туберкулезом разных локализаций, лиц, перенесших туберкулез или инфицированных туберкулезом.
В связи с этим при обнаружении у больных указанных выше симптомов необходимо провести обследование на туберкулез, которое включает: а) изучение анамнеза, т. е. выяснение наличия контакта с больным туберкулезом, положительных туберкулиновых реакций, особенно тех, выраженность которых увеличивается, указания на перенесенный туберкулез, плеврит, фликтенулезный кератит, наличие симптомов, подозрительных на туберкулез; б) рентгенографию грудной клетки и томографию; в) проведение туберкулиновой пробы Манту; г) осмотр больного фтизиатром, невропатологом, окулистом, а взрослых — гинекологом или урологом. Обнаружение у больных активного или перенесенного туберкулеза в большинстве случаев свидетельствует о туберкулезной этиологии менингита. Во всех случаях при наличии менингеальных симптомов необходимо выполнить диагностическую люмбальную пункцию.
Туберкулезный менингит следует дифференцировать от соматических заболеваний, при которых могут наблюдаться явления ме-нингизма — раздражение мозговых оболочек с менингеальным синдромом: пневмонии, гриппа, дизентерии, тифа и др., серозных менингитов, эпидемического цереброспинального менингита и других гнойных менингитов, полиомиелита, острого эпидемического энцефалита, абсцесса и туберкулемы мозга.
Менингеальные симптомы при менингизме могут быть резко выраженными и скрывать картину основного заболевания; при этом определяющим фактором при установлении диагноза является характер цереброспинальной жидкости — ее нормальный состав при менингизме и быстрое исчезновение менингеального синдрома при дальнейшем наблюдении.
Для серозных менингитов в отличие от туберкулезного харак
445
терно острое начало с высокой температурой тела и головной болью, рано (в первые дни) появляющимся и выраженным менингеальным синдромом. Цереброспинальная жидкость прозрачная, бесцветная, содержит небольшое количество белка (до 1%о) и клеток (до 100—200 в 1 мл), лимфоцитарного характера, содержание сахара и хлоридов нормальное, сетка фибрина не образуется. Общее состояние больных менее тяжелое, чем при туберкулезном менингите, быстро улучшается, менингеальные симптомы исчезают. При симптоматическом лечении выздоровление наступает через 2—5 нед.
Эпидемический цереброспинальный менингит начинается также
остро с подъема температуры тела до высокой, появления резкой головной боли, рвоты и менингеальных симптомов в первые 2 дня болезни. Общее состояние больных тяжелое. Нередко у них на теле отмечается сыпь петехиально-герпетического характера. Церебро
спинальная жидкость мутная, повышение белка умеренное (0,4—
плеоцитоз 1000—2000 клеток в 1 мл и более нейтрофильного
характера. Содержание сахара и хлоридов значительно уменьшено. При микроскопическом исследовании обнаруживают менингококк. В крови отмечаются лейкоцитоз, увеличение СОЭ, сдвиг лейкоцитарной формулы влево. Гнойные менингиты другой этиологии имеют
сходную клиническую картину.
Полиомиелит (менингеальная форма) обычно развивается остро, часто начинается с появления признаков назофарингита или желудочно-кишечных расстройств, значительного повышения температуры тела, которая через 2 дня может снизиться и затем вновь подняться. Менингеальные симптомы появляются через 2—3 дня от начала заболевания, отмечается потливость головы, болезненность
при надавливании на нервные стволы. Через несколько дней менингеальные симптомы исчезают и возникает арефлексия, наблю
даются снижение тонуса мышц и вялые параличи конечностей,
скованность позвоночника и
жидкости отмечают умеренный, преимущественно лимфоцитарный плеоцитоз (до 100 клеток в 1 мл) и небольшое увеличение содержания белка (0,45—0,6%о), содержание сахара в норме или немного
уменьшено.
Острый эпидемический энцефалит начинается остро с повышения температуры тела до 38°C и выше, возникновения головной боли, раздражительности, разбитости. Затем появляется сонливость, нередко наблюдаются психосенсорные расстройства, атаксия. Менингеальные симптомы выражены нерезко. Рано возникают очаговые церебральные симптомы, глазодвигательные расстройства (ослабление конвергенции). В цереброспинальной жидкости содержание белка не увеличено, плеоцитоз лимфоцитарный умеренный или количество клеток нормальное, содержание сахара в норме или повышено, пленка не выпадает. Помимо перечисленных выше заболеваний, при дифференциальной диагностике следует иметь в виду туберкулемы и абсцессы мозга, при которых могут наблюдаться менингеальные симптомы.
Лечение. Лечение больных туберкулезным менингитом должно
446
быть направлено на ликвидацию воспаления мозговых оболочек как
осложнения, угрожающего жизни больного, и излечение основного туберкулезного процесса. Этого достигают с помощью противотуберкулезных препаратов, общеукрепляющих и симптоматических
лекарственных средств, санаторно-диетических мероприятий.
Больных туберкулезом мозговых оболочек и центральной нервной
системы необходимо срочно госпитализировать в специализирован
ные отделения. Основными препаратами в лечении больных тубер-
кулезом мозговых
лочек являются производные гидразида изо-
никотиновой кислоты (ГИНК) — изониазид, фтивазид или метазид, накапливающиеся в цереброспинальной жидкости в бактериостати
ческих концентрациях. Изониазид назначают внутрь в дозе 15— 20 мг на 1 кг массы тела в сутки в три приема (дозу 20 мг/кг применяют при лечении детей раннего возраста и больных, находящихся в тяжелом состоянии), фтивазид (метазид) — по 30— 40 мг/кг в сутки взрослым и 50—60 мг/кг в сутки детям.
Высокоэффективным методом лечения является внутривенное
капельное или внутримышечное введение изониазида, которое применяют при поздней диагностике и тяжелом течении менингита 1—3 мес до заметного улучшения состояния больного, а затем продолжают принимать изониазид внутрь. Внутривенно и внутримышечно вводят изониазид также при затруднении глотания и упорной рвоте.
Изониазид применяют в сочетании со стрептомицином, который в отсутствие противопоказаний (плохая переносимость, высокая устойчивость микобактерий туберкулеза к препарату, снижение слуха, нарушение выделительной функции почек, стенокардия и др.) вводят внутримышечно 1 раз в сутки в дозе 15—20 мг/кг в сутки детям и по 1 г в сутки взрослым. Стрептомицин может быть заменен канамицином, а у взрослых — виомицином (флоримицин), которые вводят в той же дозе.
Ввиду высокой бактериостатической активности рифампицина и этамбутола и хорошей проходимости их через гематоэнцефалический барьер рационально назначать препараты больным туберкулезным менингитом с начала курса лечения. Особенно показано лечение этими препаратами при наличии устойчивости микобактерий к другим противотуберкулезным препаратам или плохой их переносимости и недостаточной эффективности, распространенности основного туберкулезного процесса, поздней диагностике менингита и выраженности воспалительного процесса в мозговых оболочках.
Этамбутол назначают по 20—25 мг/кг в сутки в один прием (у взрослых 1200—1500 мг в сутки, у детей и подростков не более 1 г). В процессе лечения необходим контроль окулиста (осмотр не реже 1 раза в месяц). Рифампицин применяют по 8—10 мг/кг у детей и подростков (не более 0,45 г в сутки) и по 600 мг (0,6 г) в сутки у взрослых в один прием. При плохой переносимости и противопоказаниях к назначению этамбутола и рифампицина больным туберкулезным менингитом могут быть назначены другие противотуберкулезные препараты: ПАСК (парааминосалициловая кис
447
лота), этионамид или протионамид в общепринятых дозах, применяемых для лечения других форм туберкулеза. Введение стрептомицина субарахноидально нежелательно ввиду раздражающего действия его на оболочки и слуховой нерв, способности вызывать пролиферативную реакцию и ангиоспазмы.
При поздней диагностике туберкулезного менингита, тяжелом состоянии больных, выраженных патологических изменениях в цереброспинальной жидкости показаны кортикостероидные гормоны. Преднизолон назначают по 0,5 мг/кг в сутки детям и 25—30 мг в сутки взрослым в два приема в течение 4 нед — 2 мес (при блокаде ликворных путей — до 3 мес). В последние 2 нед лечения суточную дозу постепенно снижают.
Длительность туберкулостатической терапии зависит от характера течения менингита и основного туберкулезного процесса во внутренних органах, но не должна быть менее 6 мес от момента нормализации состава цереброспинальной жидкости, т. е. при легком лечении менингита в среднем 10 мес, при среднетяжелом — 12 мес, при тяжелом — 14—15 мес и более. Стрептомицин вводят внутримышечно в течение 3—4 мес при неактивных изменениях во внутренних органах и 5—6 мес при распространенных формах туберкулеза, препараты ГИНК назначают на весь курс лечения. Этам-бутол или ПАСК при хорошей переносимости также можно принимать длительно, в течение всего основного курса лечения. Рифампицин следует применять до выраженной благоприятной ди
намики менингеального и основного процесса и появления тенденции к нормализации состава цереброспинальной жидкости (4—6 мес и более).
Большое значение в лечении больных туберкулезным менингитом
имеют санаторный режим, полноценное питание, витаминотерапия: витамины Bi и Вб внутримышечно, аскорбиновая и глутаминовая кислоты внутрь. Очень важное значение имеют борьба с гидроцефалией (лазикс, фуросемид, диакарб, гипотиазид, маннитол, мочевина, сульфат магния) и разгрузочные люмбальные пункции 2 раза в неделю. Контрольные люмбальные пункции производят в 1-ю неделю лечения 2 раза, а затем 1 раз в неделю, со 2-го месяца 1 раз в месяц до нормализации состава цереброспинальной жидкости,
после чего — по показаниям. При наличии парезов и параличей
конечностей после улучшения общего состояния и уменьшения вы-
раженности менингеального синдрома, в среднем через 4—5 нед, рекомендуют проводить массаж конечностей и спины, лечебную
физкультуру, инъекции прозерина (20 через день), а затем дибазол
внутрь. В подостром периоде болезни применяют электрофорез 5%
раствора кальция или 2% раствора йодида калия, 5% раствора
витамина В.
При наличии застойных сосков дисков зрительных нервов необходимы дегидратационная терапия и витаминотерапия (витамины Bi, Вб, Ви внутримышечно), сосудорасширяющие средства (никотиновая кислота внутрь, но-шпа внутрь или внутримышечно), при неврите зрительных нервов также показаны витамины группы В
448
внутримышечно и сосудорасширяющие препараты: дибазол внутрь
или под кожу, нитрит натрия под кожу, атропин под кожу, но-шпа
внутримышечно, стрихнин под кожу виска (0,5 мг 0,1% раствора),
Прозерпин под кожу (1 мл 0,05% раствора). При атрофии зрительных
нервов — курсы витаминотерапии и тканевой терапии (алоэ под кожу по 1 мл, всего 30 инъекций; ФиБС под кожу по 1 мл, на курс 30 инъекций).
Больные туберкулезным менингитом дети до нормализации состава цереброспинальной жидкости, а взрослые до исчезновения
менингеальных симптомов и значительного улучшения состава цереброспинальной жидкости должны находиться на постельном режиме. Детям разрешают сидеть после исчезновения менингеальных симптомов, т. е. через 2—3 мес, а взрослым через 1,5—2 мес при значительном улучшении общего состояния, уменьшении выраженности менингеального синдрома и улучшении состава цереброспинальной жидкости. Активизацию режима осуществляют постепенно. Реконвалесцентов выписывают из стационара в противотуберкулезный санаторий после полного излечения менингита с нормализацией состава цереброспинальной жидкости и ликвидации или значительного снижения выраженности туберкулезного процесса в других органах. Длительность пребывания в санатории и антибактериального лечения устанавливают индивидуально в зависимости от тя
жести перенесенного менингита и основного процесса, наличия остаточных явлений, обычно она составляет 3—4 мес и более. В дальнейшем перенесшие туберкулезный менингит находятся под наблюдением в противотуберкулезном диспансере: взрослые в течение 2 лет, дети 1 год в группе VA, затем 2 года в УБ и до 17 лет в группе VB. В первые 2—3 года после выписки проводят
илактические курсы лечения изониазидом в сочетании с этам-
бутолом или протионамидом 2 раза в год по 3 мес, как правило,
в условиях санатория. Лица, у которых имеются остаточные явления
перенесенного менингита, не только состоят на диспансерном учете, но и наблюдаются и лечатся у невропатолога, окулиста или психиатра. Вопрос о трудоспособности решает индивидуально ВКК.
13.6.2. Туберкулема мозга
Этиология и патогенез. Туберкулема мозга — одна из форм туберкулеза центральной нервной системы. Она представляет собой ограниченное опухолевидное образование различной величины, состоящее из гранулематозной ткани с лимфоидными, эпителиоидными и гигантскими клетками, измененными клетками ткани мозга и творожистым некрозом в центре, снаружи окруженное соединительнотканной капсулой. Вследствие роста туберкулемы в центральной нервной системе возникают тяжелые расстройства, для устранения которых требуется хирургическое лечение, а некроз периферических участков и капсулы приводит к прорыву туберкулемы в субарахноидальное пространство и развитию туберкулезного менингита или хронического ограниченного лептопахименингита. Туберкулемы со
449
ставляют 2—12% всех внутримозговых опухолей. Количество их может быть разным: от одной до нескольких. В 2/з случаев встречаются солитарные туберкулемы. Туберкулемы наиболее часто наблюдаются у детей (более 50%), но у взрослых они чаще служат источником менингита. Преимущественная локализация туберкулем (более 80%) субтенториальная, т. е. в области задней черепной ямки — в стволовой части головного мозга и мозжечка, реже супратенториальная и в спинном мозге. Значительно чаще (в 2 раза) болеют мужчины. Заболевание является вторичным, т. е. возникает при наличии туберкулеза легких, внутригрудных лимфатических узлов или других органов, наиболее часто в фазе диссеминации. Инфекция проникает в центральную нервную систему гематогенным путем, чем объясняется возможность множественной локализации туберкулем в различных отделах мозга.
Клиническая картина. Клинические проявления туберкулемы сходны с таковыми при опухолях центральной нервной системы. Иногда течение туберкулем бессимптомное и их обнаруживают лишь на вскрытии (при супратенториальной локализации). Продолжительность заболевания от нескольких месяцев до 2—3 лет.
Встречаются два типа развития болезни. Первый тип — забо-
левание начинается остро с подъема температуры и напоминает инфекционное заболевание с быстрым развитием симптомов пора
жения мозга, последующим волнообразным течением и длительно
сохраняющейся субфебрильной температурой. При таком течении
часто диагностируют менингит и менингоэнцефалит. Второй тип — постепенное начало и медленное развитие болезни с ремиссиями. Течение болезни при этом сходно с таковым при опухолях головного мозга. Для клинической картины туберкулем свойственны мозговые
и очаговые симптомы, характер которых зависит от локализации туберкулемы. Повышение внутричерепного давления, возникающее при росте туберкулемы, приводит к появлению вялости, заторможенности, головной боли, тошноты и рвоты. На дне глаза определяются застойные соски дисков зрительных нервов. При локализации туберкулемы на путях циркуляции цереброспинальной жидкости, чаще в задней черепной ямке, гидроцефалия и мозговые симптомы появляются рано. Обычно наряду с ними отмечаются нерезко выраженные менингеальные симптомы. Очаговые симптомы развива
ются постепенно.
В случае локализации туберкулем в лобной области возникают расстройства психики: нарушения памяти, изменения настроения, атактические явления. При заднелобной локализации слева наблюдается моторная афазия. Для туберкулем центральных извилин характерны двигательные расстройства и нарушения чувствительности. Развитию паралича и пареза предшествуют парестезии, явления раздражения, судороги в конечностях, эпилептоформные судороги. Судороги могут принимать характер децеребрационной ригидности, особенно при выраженной гидроцефалии. При туберкулемах, локализующихся в области подкорковых ганглиев, наблюдаются гиперкинезы: хореиформные, атетозные. При часто встречающейся
450
локализации туберкулем в варолиевом мосту (мост мозга) и продолговатом мозге рано появляется парез отводящего и лицевого нервов, к которому присоединяется парез руки и ноги на противоположной стороне. По мере роста туберкулемы при поражении продолговатого мозга появляются бульбарные симптомы, а при повреждении ножек мозжечка развивается атаксия.
Туберкулемы мозжечка в течение некоторого времени могут протекать бессимптомно, в дальнейшем при их росте появляется типичный симптомокомплекс: односторонняя атаксия конечностей, а затем нарушение тонуса, рефлексов и двигательной сферы. При двусторонней локализации возникают симптомы поражения обоих полушарий мозжечка. Течение болезни прогрессирующее. При отграничении и обызвествлении туберкулемы наступает ремиссия и клиническая картина в течение некоторого времени не изменяется. Затем, при дальнейшем росте туберкулемы, болезнь прогрессирует и без лечения больные умирают вследствие нарушения функций жизненно важных отделов мозга, гидроцефалии или присоединения туберкулезного менингита.
Для определения локализации туберкулемы в мозге, помимо клинико-неврологического обследования больного, проводят ангиографию, электроэнцефалографию, эхоэнцефалографию и компьютерную томографию, позволяющие с большой точностью установить локализацию и размеры туберкулемы. С помощью рентгенографии черепа при туберкулемах выявляют признаки повышенного внутричерепного давления: расхождение швов, пальцевые вдавления по своду черепа, порозность кости в области турецкого седла, а в случаях обызвествления — тени кальцинатов различной величины (встречаются у 1—6% больных). Картина крови при туберкулеме свидетельствует о воспалительном процессе: умеренный лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ. В цереброспинальной жидкости отмечаются увеличение содержания белка до 0,4—1 % и небольшой плеоцитоз, иногда выпадает сетка фибрина и обнаруживают микобактерии туберкулеза.
Диагностика, дифференциальная диагностика. Диагностика туберкулем мозга сопряжена с трудностями. По сводным данным А. И. Арутюнова, при жизни диагноз туберкулемы установлен у 17,6% больных. Следует стремиться к ранней диагностике туберкулем мозга и своевременно направлять больных на хирургическое лечение. Туберкулему следует дифференцировать от опухолей мозга. Последние чаще встречаются у взрослых, туберкулемы — преимущественно у детей и подростков. В анамнезе больных с туберкулемами отмечаются контакт с больным туберкулезом, положительные туберкулиновые пробы, перенесенный локальный туберкулез и плеврит, а при обследовании больных обнаруживают симптомы активного или перенесенного туберкулеза внутренних органов. Туберкулемы чаще (у 80% больных) локализуются в задней черепной ямке. Наличие обызвествлений в мозге должно настораживать в отношении наличия туберкулем. Повышение внутричерепного давления больше выражено при опухолях мозга.
451
Лечение. Лечение туберкулем — оперативное удаление, техника которого такая же, как и при удалении опухолей мозга. Туберкулему удаляют полностью, вылущивая ее в пределах здоровой ткани. Операционное поле тщательно изолируют во избежание попадания частиц туберкулемы в окружающее субарахноидальное пространство. Хирургическое лечение туберкулем проводят в сочетании с туберкулостатической терапией препаратами ГИНК, стрептомицином, рифампицином и др., дегидратационной терапией, общеукрепляющим и последующим санаторным лечением. Длительность лечения определяется течением послеоперационного периода, характером неврологических расстройств и туберкулезного процесса во внутренних органах. Исход операции у большинства больных благоприятный благодаря усовершенствованной хирургической и анестезиологической технике, применению туберкулостатических препаратов, кортикостероидов и диуретиков.
13.6.3. Поражения нервной системы при туберкулезном спондилите
Туберкулез позвоночника (туберкулезный спондилит) — наиболее тяжелая и часто наблюдающаяся локализация костно-суставного туберкулеза. Заболевание чаще встречается в детском возрасте, особенно в первые 5 лет. Клиническая картина туберкулезного спондилита, включающая гиббус, натечный абсцесс и паралич ног, впервые была описана Pott в 1779 г., поэтому туберкулезный спондилит был назван болезнью Потта, а спинальные осложнения — параплегией Потта.
При прогрессировании туберкулезного процесса в позвонках они разрушаются и образуется горб, главным образом у детей. Вследствие разрушения и смещения позвонков, давления грануляционной ткани и казеозных масс на спинной мозг могут возникнуть его сдавление, сдавление сосудов, расстройства кровообращения, эндофлебиты, тромбозы, а также специфические васкулиты, что вызывает отек спинного мозга и компрессионный миелит. Структура спинного моз
га: его клетки и нервные волокна изменяются, появляются участки размягчения, а при более длительном течении болезни развиваются
необратимые дегенеративные и рубцовые изменения.
Твердая мозговая
со.
лочка препятствует распространению ту-
беркулезного процесса с кости на вещество спинного мозга. В очень
редких случаях возможен непосредственный переход его на твердую
мозговую
лочку с развитием эпидурита и пахименингита.
По-
ражение спинного мозга часто возникает и вследствие распространения натечного абсцесса, располагающегося под задней продольной связкой позвоночника. В позвоночном канале в этих случаях обнаруживают конгломерат казеозных масс и гноя с остатками разрушенных позвонков, что приводит к сужению полости канала и
сдавлению спинного мозга.
Спинномозговые расстройства одинаково часто встречаются у детей и взрослых (у 12—15%). Обычно им предшествуют локальные
452
боли, возникающие спонтанно или при нагрузке и надавливании на пораженные позвонки. Затем появляются корешковые, опоясывающие боли соответственно уровню пораженных позвонков: в затылочной, плечевой или пояснично-крестцовой области. Для локальных и радикулярных болей характерно уменьшение их интенсивности или исчезновение в горизонтальном положении больного в связи с разгрузкой пораженного отдела позвоночника. В дальнейшем может появиться корешковый радикулоневрит, сопровождающийся нарушениями чувствительности, двигательными и рефлекторными расстройствами, затем развивается паралич конечностей, обычно двусторонний.
По степени поражения выделяют четыре фазы параплегии. Первая характеризуется экстензорным парапарезом при сохранении некоторых активных движений в ногах. Для второй фазы характерен глубокий спастический паралич с экстензорным распределением мышечного тонуса. При усилении сдавления спинного мозга развивается третья фаза — экстензорная параплегия переходит во флексорную. При неблагоприятном течении болезни наступает четвертая фаза — спастический паралич переходит в вялый. Параличи, возникающие в разгар болезни, называют ранними. При своевременной ликвидации абсцесса прогноз в отношении их благоприятный. Поз
дние параличи развиваются через несколько лет от начала спондилита. Причинами их являются абсцесс, длительно существующий в
рубцовой ткани, сдавление мозга разрушенными позвонками и фиб-розно измененной твердой мозговой оболочкой. Прогноз при поздних параличах неблагоприятный.
Клиническая картина неврологических расстройств зависит не
только от степени поражения позвонков, распространенности процесса и его длительности, но и от локализации процесса. При поражении первых двух шейных позвонков и их сочленений возникают боли при движении головы, что приводит к спазму шейных мышц. При движении больной щадит шейный отдел позвоночника (поворачивается в стороны и наклоняется всем туловищем). При этом в процесс могут вовлекаться черепные нервы, шейные корешки и верхний симпатический узел, вследствие чего появляются боли,
иррадиирующие в затылок и лицо, расширение зрачка.
В случае поражения сочленений возникает опасность вывиха первых двух позвонков, сдавления ствола мозга и спинного мозга, в результате чего наступает мгновенная смерть. При этой локализации возможно сдавление спинного мозга и натечным абсцессом. У больных туберкулезом Сш и Ti отмечаются боли в руках и при прогрессировании процесса развивается тетраплегия: вялая в руках и спастическая в ногах. Наиболее часто спинальные расстройства возникают при поражении грудного отдела позвоночника. Физиологический кифоз этого отдела предрасполагает к развитию угловых искривлений при туберкулезе грудных позвонков. В этом отделе нет условий для дренирования абсцесса, поэтому он чаще проникает в полость позвоночного канала.
Неврологические расстройства проявляются межреберными и аб-
453
номинальными невралгиями и спастическим парезом ног. Локализация спондилита в Тхп и ниже приводит к развитию парапареза (параплегии) ног и мышц живота, появляются боли в пояснице и ногах. При вовлечении в патологический процесс центров, расположенных в сакральных сегментах (S2—S4) спинного мозга, появ-
ляются расстройства мочеиспускания и дефекации. Для поясничного спондилита характерны главным образом корешковые боли. Про
грессирование параличей сопровождается атрофией мышц и появ-
лением пролежней, которые могут стать причиной развития сепсиса. Одновременно с двигательными расстройствами наблюдаются нарушения чувствительности, боли, парестезии, а позднее — выпадение тактильной и болевой чувствительности. Однако нарушения чувст
вительности менее выражены и встречаются реже.
При неврологических осложнениях спондилита наблюдаются так
же висцеральные сенсомоторные нарушения, возникающие при вовлечении в процесс симпатических узлов и проявляющиеся болями в грудной клетке или брюшной полости (дисфункция пищеварительного тракта). Тяжесть спондилита не всегда соответствует тяжести поражений нервной системы, но имеется корреляция между выраженностью параличей и степенью нарушения проходимости субарахноидального пространства. В острой стадии при полном параличе определяются симптомы блокады ликворных путей. В настоящее время благодаря ранней диагностике неврологические на
рушения при спондилите встречаются все реже.
Диагностика корешково-медуллярных осложнений туберкулезного спондилита у взрослых затруднена, так как спондилит считают болезнью детского возраста, у взрослых отсутствует горб и особенно потому, что у них часто спинальные осложнения возникают раньше, чем клинические симптомы поражения позвоночника. Поскольку при этом рентгенологические изменения или появляются поздно, или оказываются нетипичными, или остаются незамеченными, у больных диагностируют спинальную опухоль или менингомиелит, а при общем тяжелом состоянии, истощении, повышенной температуре тела, изменениях в крови — метастаз рака.
При поражении спинного мозга в любом возрасте следует прежде всего дифференцировать туберкулезный спондилит, опухоль и миелит, а также дископатию, спинальный инсульт, эпидурит и рассеянный склероз, поскольку параплегия при туберкулезном спондилите может рецидивировать. При люмбосакральной локализации спондилита единственным клиническим проявлением заболевания является люмбоишиалгический синдром, поэтому очень часто и в течение длительного времени у этих больных диагностируют дископатию, ишиас, ревматизм. В этих случаях решающим в диагностике являются результаты томографического исследования позвоночника.
Очень большие затруднения возникают при диагностике заднего спондилита, когда поражаются только дужки позвонков. В этих случаях обычно диагностируют опухоль и только при операции и гистологическом исследовании устанавливают истинную природу бо
454
лезни. В диагностике туберкулезного спондилита большое значение имеет обнаружение активного или перенесенного туберкулеза легких, лимфатических узлов и других органов, а у детей также положительные туберкулиновые реакции и наличие контакта с больным туберкулезом.
Лечение туберкулезного спондилита заключается в иммобилизации в гипсовой кроватке, широком использовании туберкулостатических препаратов и выполнении оперативного вмешательства, которое особенно важно при наличии спинальных осложнений. Основными видами операций являются некрэктомия и абсцессэктомия, позволяющие устранить сдавление спинного мозга, наиболее важным показанием к которым служит блокада субарахноидального пространства. Операция наиболее эффективна в ранней стадии параличей — в первые 6—12 мес после их возникновения: с ее помощью удается добиться выздоровления почти у всех больных; в случае выполнения операции через 2 года выздоравливают половина больных, после 3 лет она не дает положительных результатов.
13.7. ТУБЕРКУЛЕЗ МОЧЕВЫХ И ПОЛОВЫХ ОРГАНОВ
13.7.1. Туберкулез мочевых органов
Туберкулез органов мочевой системы — одно из наиболее распространенных урологических заболеваний, уступающее по частоте лишь неспецифическим воспалительным процессам, мочекаменной болезни и новообразованиям. В структуре заболеваемости и болезненности данная патология в сочетании с туберкулезом половых органов (урогенитальный туберкулез) занимает первое место среди локализаций внелегочного туберкулеза, составляя 30—43% [Мочалова Т. П. и др., 1973; Камышан И. С., Погребинский В. М., 1987], в структуре инвалидности — второе место после костно-суставного туберкулеза. Одну треть всех нефрэктомий выполняют по поводу туберкулеза; хирургическая активность при туберкулезе мочевых органов вследствие поздней диагностики составляет 60—80% [Шабад А. Л., 1978; Мочалова Т. П., Волович Л. Я., 1983].
Основные причины поздней диагностики туберкулеза мочевых органов — отсутствие настороженности, незнание особенностей его клинического течения и в связи с этим неправильная интерпретация как клинических симптомов, так и результатов лабораторных, рентгенологических и других исследований.
До настоящего времени не существует общепринятой клинической классификации туберкулеза мочевой (мочеполовой) системы. Однако большинство клиницистов при формулировке диагноза учитывают стадию (степень рентгенологической деструкции), фазу, распространенность и активность специфического процесса, бацил-л яркость. К ранним стадиям относят субклинический (инфильтративный, туберкулез почечной паренхимы) и начальный деструктивный (папиллит, небольшие одиночные каверны) нефротуберкулез, к поздним — кавернозный нефротуберкулез, пионефроз.
455
Этиология, патогенез, патологическая анатомия. Заболевание вызывается микобактериями туберкулеза. Из всех мочевых органов в первую очередь поражаются почки. Гематогенный путь инфицирования (при первичной либо вторичной гематогенной диссемина-ции) признан основным. Нарушение равновесия в системе взаимоотношений макроорганизм—возбудитель играет важную роль в развитии заболевания. Этому способствуют факторы риска: общие — переохлаждение, голодание, профессиональные вредности, респираторная инфекция, эндокринные заболевания, местные — травматические повреждения органов забрюшинного пространства, сопутствующие урологические заболевания [Камышан И. С., Погребинский В. М., 1987].
Развитие специфического процесса проходит все этапы морфологической эволюции — от гематогенных очагов, окруженных элементами туберкулезной гранулемы с казеозным некрозом в центре, сливающихся в ограниченные инфильтраты (казеомы), локализующиеся главным образом в корковом веществе, до полного разрушения почки и мочевых путей. Возможны различные сочетания экссудативных, альтернативных и продуктивных изменений в тканях этих органов. Важным этапом в развитии специфического поражения почки, во многом определяющим его прогноз, является переход туберкулезного процесса на мочевые пути. Первоначально возникает инфильтрация в подслизистом слое лоханки и мочеточника, затем на слизистой оболочке туберкулезные бугорки изъязвляются и рубцуются. Туберкулез мочевого пузыря всегда является вторичным по отношению к поражению почки и мочеточника; изменения слизистой оболочки мочевого пузыря аналогичны описанным выше. Репаративные процессы несовершенны, рубцевание специфических туберкулезных очагов приводит к тяжелым посттуберкулезным изменениям в мочевой системе — уретерогидронефротической трансформации и прогрессированию неспецифического воспалительного процесса с выраженным нарушением (либо потерей) функции почки.
Клиническая картина. Отсутствие патогномоничных симптомов туберкулеза мочевых органов и сходство его со многими урологическими заболеваниями — характерная особенность данной патологии. Изменчивость и непостоянство отдельных симптомов затрудняют диагностику. Клинические проявления туберкулеза мочевой системы во многом зависят от глубины и распространенности па-томорфологических изменений в ее органах, а также от ранее проведенного лечения препаратами широкого спектра действия. При субклинических формах отмечаются явления интоксикации (субфебрильная температура тела, общая слабость, недомогание и т. п.), умеренные боли в поясничной области, отсутствие изменений в моче и отклонений на урограмме. Объективным подтверждением наличия интоксикационного синдрома и данной формы нефротубер-кулеза является бациллурия. Начальная минимальная деструкция (не всегда улавливаемая рентгенологически) клинически проявляется гематурией, первоисточником которой является почка; гематурия может быть значительно выраженной, безболезненной, вне-456
запно появляться и исчезать. Она чаще встречается при папиллитах, чем при кавернозных формах нефротуберкулеза [Шабад А. Л., 1978 ]. В клинической практике таких больных наблюдают по поводу так называемой эссенциальной гематурии. Лейкоцитурия (пиурия) при туберкулезе мочевой системы может быть ранним и поздним проявлением заболевания, ее интенсивность (выраженность) зависит
от величины и локализации очага воспаления,
его с
См
щения с
чашечно-лоханочной системой; при «выключении» очага исчезает
лейкоцитурия («ложный» нормальный анализ мочи).
О вовлечении в специфический процесс мочевых путей свидетельствуют приступы почечной колики (нарушение уродинамики) и дизурия (учащенное болезненное мочеиспускание, императивные позывы, недержание мочи и т. п.). Таким больным, у которых уже имеется запущенный туберкулез мочевой системы, обычно устанавливают диагноз мочекислого диатеза (мочекаменная болезнь), ци-
стита. Неудивительно, что в последующем они составляют тяжелый
контингент фтизиоурологических больных (двусторонний кавернозный нефротуберкулез, микроцистис, пузырно-мочеточниковый рефлюкс и т. п.). Благодаря применению антибиотиков и химиопре
паратов широкого спектра действия изменились патоморфоз [Стру-
ков А. И., Соловьева И. IL, 1986] и соответственно клиническая
картина заболевания: участились приступы почечной колики (в связи с преобладанием фибропластических процессов), изменился
характер дизурии, она стала менее мучительной, а интервалы между актами мочеиспускания доходят до 1,5—3 ч (вследствие более позднего формирования истинно малого мочевого пузыря). При переходе процесса на паранефральную клетчатку возникает паранефрит и образуется свищ в поясничной области.
Особенности клинического течения туберкулеза мочевой системы у детей обусловлены частым сочетанием его с легочным и внелегочным туберкулезом других локализаций у лиц пожилого возраста — наличием тяжелых сопутствующих соматических заболева
ний.
К осложнениям туберкулеза мочевой системы относят неспецифический воспалительный процесс, ретенционные изменения, реже нефролитиаз, являющиеся причиной нефрогенной гипертензии и хронической почечной недостаточности с соответствующей клинической симптоматикой (головная боль, головокружение, повышение температуры тела, интоксикационный синдром и т. п.) и приводящие к инвалидизации больных.
Диагностика, дифференциальная диагностика. При диагностике туберкулеза мочевой системы учитывают данные анамнеза (туберкулезного, урологического, соматического) и особенности клинического течения в сопоставлении с результатами комплексного обследования. В диагностике туберкулеза мочевой системы применяют различные методы исследования.
Лабораторные методы. Исследование мочи: общий анализ (протеинурия, лейкоцитурия, эритроцитурия и т. п.); трехстаканная проба, которую проводят с целью выявления источника лейкоци-
457
турии (мочевые, половые органы); при нормальном общем анализе мочи — проба Нечипоренко (на скрытую лейкоцитурию); посев мочи на вторичную флору с определением чувствительности к антибиотикам; бактериоскопическое и бактериологическое исследования мочи. Исследование крови: клинический анализ (лейкоцитоз, увеличение СОЭ, лимфоцитоз и т.п.); биохимические исследова-
ния — протеинограмма (диспротеинемия с увеличением содержания глобулинов, особенно «2- и /-фракций), сиаловая кислота, гаптоглобин, церулоплазмин, С-реактивный белок (повышение их показателей и появление С-реактивного белка); иммунологические —
ППН; реакция непрямой гемагглютинации (РИГА), реакция свя-
зывания комплемента (РСК), РПК (повышение титра противоту-
беркулезных антител); функциональные исследования —
а Зим-
ницкого, пр
а Реберга с определением клубочковой фильтрации
(ее снижение) и содержания креатинина в сыворотке крови (увеличение при почечной недостаточности). Наиболее информативны результаты лабораторных исследований при проведении провокационного теста: определение показателей до и после введения тубер
кулина под кожу.
Инструментальные методы исследования (цисто-
скопия, хромоцистоскопия, катетеризация мочеточников, эндовези-кальная биопсия) позволяют выявить уменьшение емкости мочевого пузыря, специфические изменения слизистой оболочки — туберкулезные бугорки, язвы, гиперпластические разрастания, буллезный отек, деформацию и зияние устьев мочеточников, проходимость мочеточников и осуществить забор мочи для исследований и определения раздельной функции почек. Бактериологическое исследо
вание гнойного отделяемого, послеоперационного, резекционного,
биопсийного материала с одновременным проведением патоморфо-
логических исследований имеют большое значение в диагностике
туберкулеза мочевой системы.
Рентгенологические методы исследования: флюорография (рентгенография) легких, обзорная и внутривенная урография в различных модификациях, томография почек, ретроградная пиелография, цистография, уретроцистопростатография, ангиография и др. Обзорный снимок мочевых путей позволяет обнаружить обызвествления в органах мочеполовой и других систем, изменения опорно-двигательного аппарата (туберкулезный спондилит, метастазы при раке почки и т. п.), определить контуры и размеры почек (увеличение или уменьшение, выбухания, втяжения). По внутривенной урограмме оцениваются функциональное состояние почек и анатомические особенности чашечно-лоханочной системы, мочеточников, мочевого пузыря; урография — основной рентгенологический метод исследования. Соответственно форме и стадии нефротубер-кулеза могут быть выявлены: при субклиническом нефротуберку-лезе — слабое контрастирование чашечно-лоханочной системы, хаотичное расположение чашечек, их деформация, при папиллите («начальном» деструктивном нефротуберкулезе) — неровность, сту-
шеванность, нечеткость контуров чашечки ввиду наличия признака
458
деструкции, при кавернозном туберкулезе — наличие полостей как в корковом, так и в мозговом слое с неровными, фестончатыми краями; при туберкулезном пионефрозе — изображение увеличенной почки с выбухающими неровными контурами, наличием больших полостей распада, нередко сливающихся между собой, резким снижением либо потерей функции (выключение — аутонефрэктомия); при нефросклерозе (вторично-сморщенная почка) — почка небольших размеров.
Начальный признак специфического поражения мочевых путей — расширение чашечно-лоханочной системы и мочеточника (снижение их сократительной способности в результате токсического воздействия, изменения функционального характера). Во всех случаях «неясной» уретерогидронефротической трансформации врач должен предположить наличие туберкулеза мочевой системы. В дальнейшем обнаруживают различные деформации чашечно-лоханочной системы (с уменьшением ее емкости) с явлениями гидрокаликоза; сужения мочеточника с расширением его выше стеноза; натянутость, четкообразную форму мочеточника; симптом подтянутости стенки мочевого пузыря; уменьшение емкости и различные деформации его контуров вплоть до появления двойного контура — симптома «песочных часов». При восходящей или микционной цистографии, урет-роцистопростатографии выявляют пузырно-мочеточниковый рефлюкс, а при последней — сужения уретры и затекание контрастного вещества в полости предстательной железы. Томографию почек применяют для уточнения контуров почки. Ретроградную пиелографию выполняют при неинформативности внутривенной урографии и для выяснения характера выключения туберкулезного очага (сопоставление пиело- и урографических данных). Ангиография позволяет получить представление об ангиоархитектонике пораженной почки, что важно при определении хирургической тактики.
Радиоизотопные методы исследования (ренография, сканирование, сцинтиграфия почек) — вспомогательные, они позволяют оценить функциональную способность почек и анатомические нарушения в мочевой системе. Применение в последнее время урокимографии, урокинематографии, электронно-оптического преобразователя ООП) позволило точнее определить и оценить уродинамику, а использование эхографии, компьютерной томографии — объем и характер полостных образований в почечной паренхиме.
Туберкулез мочевой системы чаще дифференцируют от ее неспецифических воспалительных заболеваний (пиелонефрит, цистит и др.) и новообразований. Особенности клинического течения современного уротуберкулеза, характерные специфические изменения мужских половых органов, рентгенологические изменения, неэффективность ранее проводимой терапии, динамический фактор, результаты комплексного обследования, а главное — положительные результаты бактериологического исследования мочи на ВК позволяют правильно провести дифференциальную диагностику. При онкологической настороженности, помимо указанных выше методов,
459
важную роль играют ангиография, биопсия и определение атипических клеток в моче, в трудных случаях выполняют диагностическую операцию.
Лечение. Больным проводят комплексную патогенетически обусловленную адекватную терапию с применением препаратов специфического, неспецифического, рассасывающего, стимулирующего и общеукрепляющего действия. Консервативную терапию как самостоятельный метод используют в ранних стадиях нефротуберкулеза. При кавернозных формах, особенно осложненных поражением мочевых путей, основным методом является хирургический; специфическую химиотерапию проводят в до- и послеоперационном периодах (с учетом функциональной способности почек или почки). При нефротуберкулезе используют следующие виды операций: 1) органоуносящие — нефрэктомия, нефруретерэктомия; 2) органосохраняющие — кавернотомия, кавернэктомия, резекция почки; 3) ре-конструктивно-восстановительные — уретероцистонеоанастомоз прямой и непрямой (Боари, Демель), уретеропиелоанастомоз, уре-терокаликоанастомоз; 4) пластические (кишечная пластика) — уре-тероилеоцистопластика, сигмо(илео)цистопластика; 5) паллиативные — нефропиелостомия, уретерокутанеостомия. Санаторно-курортное лечение проводят в специализированных санаториях с целью продолжения основного курса и проведения терапии, закрепляющей
результаты консервативного и хирургического лечения.
Прогноз. Прогноз зависит от стадии заболевания и распространенности поражения органов мочевой системы. В ранних стадиях нефротуберкулеза удается добиться выздоровления почти всех больных. При выраженных деструктивных формах нефротуберкулеза, особенно осложненных поражением мочевых путей, несмотря на выполнение оперативных вмешательств (нередко повторных), более 30% больных остаются стойкими инвалидами.
Профилактика. Про4
илактика заключается в активном выявле
нии больных уротуберкулезом в группах повышенного риска. К ним относятся больные с хроническими воспалительными заболеваниями
мочевых путей (хронический пиелонефрит, хронический цистит), мочекаменной болезнью; общеинтоксикационным синдромом, пояс
нично-крестцовым радикулитом неясной этиологии; лица, у которых отмечаются приступы почечной колики, гематурия, гипертензия; работники животноводческих ферм, неблагополучных по туберкулезу крупного рогатого скота. Особое внимание должно быть уделено пациентам, состоящим на учете в противотуберкулезных диспансерах в связи с туберкулезом различных локализаций; лицам, находящимся в контакте с бациллярными больными, а также пациентам, перенесшим ранее туберкулез различных органов или систем при наличии у них жалоб на заболевания органов мочевой системы или патологические изменения осадка мочи. Эффективность этой работы зависит от тесной связи фтизиоуролога противотуберкулезного диспансера с врачами общей леченой сети и фтизиатрами. Раннее выявление заболевания предусматривает выполнение у данного контингента минимального обследования с обязательным проведением
460
бактериоскопических и бактериологических исследований мочи на ВК, при подозрении на наличие туберкулеза проводят детальное обследование в специализированном стационаре.
13.7.2. Туберкулез половых органов у мужчин
Больные туберкулезом половых органов составляют 1,5—2,5% урологических больных и 30—50% мужчин с туберкулезом мочевой системы [Резник Б. М., 1972]. Туберкулез наружных половых органов встречается у каждого четвертого или пятого больного с заболеваниями органов мошонки. Согласно результатам вскрытий, туберкулез половой системы обнаруживают примерно у 0,4% умерших и 5—10% мужчин, умерших от туберкулеза. Поражения половой системы у мужчин и женщин встречаются практически с одинаковой частотой, но у мужчин значительно чаще (у 50%) отмечается их сочетание с туберкулезом почек [Резник Б. М., 1972] в связи с анатомическими особенностями мочеполовой системы («мочеполовой перекрест» в задней уретре). Возраст больных колеблется в пределах от 20 до 50 лет, но в последние годы туберкулез половой системы стал чаще наблюдаться у лиц более старшего возраста. У детей данная патология встречается крайне редко. Клинические наблюдения подтверждают большую частоту поражения туберкулезом наружных половых органов, но в настоящее время в связи с усовершенствованием методики и увеличением полноты обследования стали чаще диагностировать туберкулез внутренних половых желез.
Этиология, патогенез, патологическая анатомия. Возбудитель заболевания — микобактерии туберкулеза. Пути их проникновения в половую систему различны, но основным является гематогенный. Экзогенный, лимфатический, контактный (переход с соседних органов) пути распространения инфекции возможны, хотя убедительных клинических данных, подтверждающих это, нет. Особое значение придают уриногенному пути проникновения туберкулезной инфекции из мочевой системы в половую. Развитие туберкулезного процесса определяется свойствами возбудителя, иммунобиологическим состоянием организма, предшествующей терапией, местными факторами риска (травма половых органов, конгестивные состояния, половые излишества, предшествующие заболевания и т. п.). В связи с этим возможно различное сочетание экссудативных, альтеративных и продуктивных тканевых реакций. Гистологическая картина при туберкулезе половых органов принципиально не отличается от таковой при туберкулезе других органов. Для туберкулеза наружных половых органов (придаток яичка, яичко, семявыносящий проток) характерна склонность к гнойному расплавлению и казеозному перерождению возникших туберкулезных фокусов с образованием полостей распада (каверн). Процесс всегда первоначально возникает в придатке, часто локализуясь в хвостовом отделе, яичко и семявыносящий проток поражаются вторично. При преимущественно продуктивных формах туберкулезных эпидидимитов обнаруживают
461
обильное разрастание соединительной ткани (при гистологическом исследовании специфические изменения могут отсутствовать). Туберкулезный процесс во внутренних половых органах (предстательная железа и семенные пузырьки) характеризуется менее выраженной склонностью к экссудативным реакциям ткани, но при этом нередко обнаруживают альтеративные изменения в виде казеознокавернозных очагов с элементами фибротизации.
Как отмечалось выше, единой клинической классификации туберкулеза мочеполовой системы не существует, но при формулировке диагноза учитывают локализацию процесса (придаток яичка, яичко, семявыносящий проток, предстательная железа, семенные пузырьки, мочеиспускательный канал, половой член), фазу процесса, бациллярност ь.
Клиническая картина. Больные туберкулезом половой системы жалуются на болн, изменения наружных половых органов (припухлость, покраснение кожи, наличие свища мошонки или промежности, появление язвы на головке полового члена), дизурию, нарушение половой функции (снижение половой потенции, болезненный оргазм, уменьшение объема эякулята, примесь крови или гноя в сперме, бесплодие). У большинства больных отмечаются тупые боли, локализующиеся в мошонке, промежности, поясничной области, у х/з пациентов — острые боли, соответствующие острой форме туберкулезного эпидидимита. Часто больные туберкулезом предстательной железы и семенных пузырьков отмечают ощущение тяжести в заднем проходе, тенезмы и затруднения при дефекации, усиление болей при половых сношениях в момент эякуляции.
При туберкулезе наружных половых органов выделяют две основные клинические формы: 1) острая форма (до 30% больных) характеризуется сильными болями, внезапно появляющейся выраженной припухлостью придатка яичка, покраснением кожи мошонки на фоне высокой температуры тела (38—40°C), озноба, плохого общего самочувствия и напоминает неспецифический (банальный) эпидидимит, но после исчезновения острых явлений (в течение 5—7 дней) пальпируется очень плотный придаток, что не соответствует динамике течения неспецифического эпидидимита; 2) хронической форме (до 70%) свойственны медленное, вялое начало и течение заболевания с нормальной или субфебрильной температурой тела, незначительные тянущие боли, умеренное покраснение кожи мошонки, а нередко изменения в придатке оказываются случайной находкой при прохождении медицинской комиссии. Придатки яичек плотные, бугристые, неравномерной консистенции, нередко спаяны с кожей мошонки или осложнены свищом, исходящим из придатка. Если острая форма коварна из-за сходства с неспецифическим эпидидимитом, то хроническая — вследствие слабой выраженности симптомов является причиной поздней обращаемости больных к врачу, который в свою очередь не уделяет ему должного внимания. Вместе с тем хроническая форма туберкулезного эпидидимита чаще встречается у больных, у которых имеются поражения тазовых половых желез и органов мочевой системы.
462
Данные осмотра и пальпации половых тельную роль при установлении диагноза.
органов играют значи-Выявляемые при паль-
пации изменения семявыносящего протока выражаются в его равномерном или «четкообразном» утолщении (патогномоничный признак туберкулеза). Пальцевое ректальное исследование позволяет
обнаружить диффузное уплотнение предстательной железы, наличие
узлов в ее боковых долях, участки размягчения, соответствующие каверне; семенные пузырьки при пальпации бугристые, болезненные, увеличены в объеме, а мягкая консистенция подтверждает их казеозное перерождение. В большинстве случаев поражения наруж
ных половых органов и тазовых половых желез локализуются на
одной стороне.
В последнее время отмечаются следующие особенности течения туберкулеза половой системы у мужчин: заболевание возникает у лиц более старшего возраста; чаще наблюдается острая форма туберкулезного эпидидимита; реже встречаются такие ранее характерные для туберкулеза симптомы, как свищи, бугристость и тотальное поражение придатка яичка, четкообразность семявынося
щего протока; ввиду изменившегося патоморфоза клиническии ди
агноз не всегда подтверждается гистологическим заключением (отсутствуют специфические изменения при продуктивных формах эпидидимитов). Осложнением туберкулеза половой системы является бесплодие.
Диагностика, дифференциальная диагностика. Диагностика туберкулеза половых органов у мужчин предусматривает фтизиоуро-логическую настороженность врача, знание особенностей клинического течения заболевания, учет анамнестических данных и правильную интерпретацию результатов комплексного обследования. Больным туберкулезом половых органов необходимо провести весь комплекс лабораторных, инструментальных, рентгенологических и радиоизотопных исследований, используемых в диагностике туберкулеза мочевой системы, дополнив его клиническим и бактериологическим исследованием эякулята, секрета предстательной железы, гнойного отделяемого свищей, материала, полученного при биопсии и операции, генито- и уретроцистопростатографией. При исследовании эякулята выявляют уменьшение его объема, количества сперматозоидов (вплоть до их исчезновения), снижение их подвижности, увеличение деформированных форм, гемо- и пиоспермию. На ге-нитограммах обнаруживают различные деформации семенных пузырьков, четкообразный семявыносящий проток, затекание контрастного вещества в полости предстательной железы и придатка яичка.
Дифференциальную диагностику чаще приходится проводить с неспецифическими воспалительными и онкологическими заболеваниями половых органов. Обычно при неспецифическом эпидидимите
отмечаются гладкая поверхность придатка, четкая граница между ним и яичком, отсутствие спаянности с кожей мошонки, редкое возникновение свищей. Уретрит при туберкулезе встречается редко, что является одним из дифференциально-диагностических признаков. Проведение различных провокационных тестов, в том числе
463
туберкулинового, с последующим исследованием выделений из мочеиспускательного канала, мочи, эякулята, секрета предстательной железы играет важную роль в дифференциальной диагностике. Для гонореи характерны уретрит, поражение головки придатка, положительная реакция Борде—Жангу (реакция связывания комплемента); обнаружение гонококков в моче, эякуляте, секрете предстательной железы, положительные результаты провокации гоновак-циной. При сифилисе чаще возникает орхит, придаток яичка остается интактным, редко поражаются предстательная железа и семенные пузырьки. Бруцеллез имеет характерную клиническую картину, осложняется орхитом, придаток яичка и семявыносящий проток не изменены. Нахождение бруцелл в водяночной жидкости и положительные серологические реакции уточняют диагноз.
В дифференциальной диагностике туберкулеза и онкологических заболеваний половых органов учитывают следующие моменты: относительная доброкачественность опухолей придатка яичка (рак встречается редко) и высокая злокачественность опухолей яичка (до 95%). При семиноме яичка отмечаются интактность придатка и семявыносящего протока, отсутствие изменений в предстательной железе. Аденома предстательной железы чаще встречается в пожилом возрасте. При дифференциации с саркомой и раком предстательной железы необходимо учитывать тот факт, что при туберкулезе редко встречается изолированное поражение этого органа. В трудных случаях дифференциальной диагностики опухолей тазовых половых желез могут быть использованы биопсия и вазовези-кулография. При туберкулезе полового члена язвы располагаются вблизи наружного отверстия мочеиспускательного канала, при раке — в области венечной борозды; при туберкулезе отмечается торпидное течение язв с потерей тканей, при раке — новообразование ткани. Решающее значение в уточнении диагноза имеют результаты гистологического исследования материала, полученного при биопсии.
Лечение* При туберкулезе тазовых половых желез ограничиваются проведением специфической консервативной терапии (за исключением редких случаев абсцедирования). При туберкулезе наружных половых органов основным методом лечения остается хирургический, однако применение специфических препаратов позволило снизить хирургическую активность до 50% и повлиять на характер и объем оперативных вмешательств. Виды операций: кавернотомия придатка яичка и яичка, резекция придатка яичка, эпидидимэктомия с резекцией яичка, орхиэктомия, кастрация, вазорезекция, операции на семявыносящих путях. Санаторно-курортное лечение проводят в специализированных санаториях для больных туберкулезом мочеполовой системы.
Прогноз. Прогноз в отношении жизни больных туберкулезом половой системы благоприятный. При двустороннем поражении придатков в большинстве случаев отмечается бесплодие. Инвалидизация наступает лишь у больных с тяжелыми формами урогенитального туберкулеза.
464
Профилактика, Активное выявление больных туберкулезом по-
ловой системы проводит фтизиуролог противотуберкулезного диспансера совместно с врачами общей лечебной сети среди лиц из группы повышенного риска, к которым относятся: больные хроническими орхоэпидидимитами, особенно двусторонними, с частыми обострениями, образованием сращений органов мошонки с ее покровами и свищей; больные с хроническими простатитами, особенно
при их сочетании с поражением органов мошонки и осложненных импотенцией, бесплодием, образованием камней в предстательной железе; пациенты с рубцовыми поражениями мочеиспускательного канала нетравматической и негонорейной этиологии; больные с хроническими воспалительными и рубцовыми процессами в области промежности, осложненными свищами; больные с так называемыми нейрогенными формами импотенции и недержания мочи, у которых не отмечается должного эффекта от длительно проводимого лечения. После консультации фтизиоуролога проводят детальное обследование этих больных в специализированном стационаре.
13.7.3. Туберкулез половых органов у женщин
В структуре мочеполового туберкулеза поражение женских половых органов составляет в среднем 25% [Колачевская Е. Н., 1975]. Истинную распространенность заболевания установить практически невозможно, поскольку оно часто остается невыявленным. Достаточно сослаться на результаты многочисленных патологоанатомических исследований, при проведении которых был обнаружен генитальный туберкулез, диагностированный при жизни лишь у 10— 25 % женщин, а также на весьма частые еще «случайные находки» — выявление заболевания во время операций.
Туберкулез женских половых органов может возникнуть в любом возрасте, но чаще всего начало его связано с периодом диссеминации первичного туберкулеза в детстве или юности. Незамеченный на ранних стадиях развития генитальный туберкулез чаще всего обнаруживают у женщин в возрасте 20—40 лет, которые и составляют основной контингент противотуберкулезных диспансеров.
Клиническая картина. В результате гематогенного и, реже, лимфогенного распространения туберкулезного процесса на внутренние половые органы в первую очередь и наиболее часто (практически у 100% населения) поражаются маточные трубы, что связано с особенностями местной микроциркуляции. Сравнительно быстро наступающая окклюзия яйцеводов приводит к утрате их основных функций и бесплодию. Ввиду анатомической близости к маточным трубам в воспаление вовлекается яичник, однако туберкулезные очаги в этом органе обнаруживают только у 5—15% больных и патологические изменения в нем чаще имеют параспецифический характер. В дальнейшем процесс развивается в нисходящем направлении, распространяясь у 25—40% больных на тело матки. Поражения шейки, влагалища и вульвы в последнее время наблюдаются очень редко и являются признаком запущенности заболевания.
16—1213
465
Специалисты признают также и иную возможность развития генитального туберкулеза — путем перехода с брюшины на серозные покровы матки и придатков. При этом проходимость труб может сохраняться довольно долго, до тех пор, пока внутренняя поверхность остается интактной [Мандельштам А. Э., 1964].
В зависимости от патологоанатомических признаков различают продуктивную, инфильтративную, экссудативную, казеозную и рубцово-спаечную формы поражения. Многовариантность специфических изменений во внутренних половых органах, смена фаз туберкулеза при индивидуальных различиях создают предпосылки для большого разнообразия клинических проявлений заболеваний. В связи с этим классификация туберкулеза женских половых органов, необходимая клиницисту в практической деятельности, требует расширенной формулировки диагноза. Она должна содержать информацию о локализации, распространенности, клинической форме, активности и фазе процесса, его осложнениях, бактериовыделении, а также сопутствующих заболеваниях как туберкулезной, так и неспецифической природы.
Острое течение генитального туберкулеза у женщин отмечается очень редко и обычно связано с присоединением вторичной инфекции. Сравнительно нечасто — в среднем у 15—17% больных —-наблюдается и подострое течение. У значительного же большинства женщин медленно развивающееся заболевание приобретает затем хронический характер, длительно протекает латентно либо с очень скудными симптомами, что является одной из основных причин запоздалого выявления больных.
Общая тенденция к торпидному течению заболевания объясняет относительно нечастые проявления признаков туберкулезной интоксикации. Не более чем у 25% больных генитальным туберкулезом отмечаются повышение температуры тела, изменения в периферической крови, общая слабость, ночные поты и т. д. Значительная часть больных жалуются на боли в нижних отделах живота, которые имеют постоянный характер, но сравнительно редко бывают интенсивными. Характерно усиление болей в связи с непатогномоничным применением физиотерапевтических процедур. Болевой синдром может быть обусловлен не только текущим процессом, но и посттуберкулезными рубцово-спаечными изменениями в малом тазе, поэтому не всегда является признаком активности туберкулеза.
Наиболее постоянный симптом генитального туберкулеза — бесплодие, диагностируемое более чем у 90% больных. При стертых клинических формах именно бесплодие оказывается основной и нередко единственной причиной обращения женщин к врачу. Естественно, нарушение детородной функции может сопутствовать многим гинекологическим заболеваниям, однако для туберкулеза вследствие частого его развития в довольно раннем возрасте характерно значительное преобладание трубных форм первичного бесплодия над вторичным (соответственно 85—90 и 10—15%).
Нарушения менструальной функции наблюдаются примерно у половины больных генитальным туберкулезом. Если процесс огра-466
ничивается поражением придатков, то ритм менструаций и количество выделяющейся крови обычно сохраняются, но чаще, чем в норме, отмечаются ановуляторные циклы и недостаточность лютеиновой фазы. Распространение же туберкулезного процесса на матку может привести к клинически выраженным расстройствам менструальной функции, преимущественно в виде гипоменореи, опсоме-но^реи, а в ряде случаев первичной и вторичной аменореи. Такой характер расстройств характерен как для активного, так и для перенесенного туберкулеза матки. Степень выраженности при морфологически активном процессе зависит от обширности поражения слизистой оболочки (очаговый или тотальный эндометрит), а при посттуберкулезных изменениях — от площади эндометрия, подвергшегося рубцеванию (частичная либо полная облитерация полости матки). Склонность к маточным кровотечениям при туберкулезе отмечается редко.
При влагалищном исследовании у больных генитальным туберкулезом обнаруживают в различной степени увеличенные и болезненные придатки, в фазе инфильтрации содержащие плотные но-
дозные участки, а при наличии экссудата имеющие эластическую консистенцию. При прогрессировании и большой распространенности
процесса определяются воспалительные конгломераты придатков и тела матки, спаянных с окружающими органами и тканями. Матка при туберкулезе может иметь нормальные размеры, но чаще, чем обычно, бывает гипопластична, ограничена в движениях и фиксирована в ретрофлексии. Результаты бимануального исследования
помогают установить фазу процесса и позволяют условно выделить клинические формы туберкулеза придатков матки с незначительными либо выраженными воспалительными изменениями, что важно для последующего выбора тактики лечения.
Диагностика и дифференциальная диагностика. Несмотря на некоторые особенности, клиническая картина генитального туберкулеза имеет много общего с симптоматикой неспецифического ад-нексита, что наряду с малосимптомностью специфического воспаления создает большие трудности в распознавании заболевания. В связи с этим диагноз туберкулеза женских половых органов может быть установлен только на основании результатов комплексного целенаправленного обследования.
Прежде всего необходимо тщательно изучить гинекологический и общий анамнез с акцентированием внимания на перенесенных заболеваниях туберкулезной природы и контактах с больными туберкулезом. Среди методов специального обследования наиболее убедительны в диагностическом отношении гистологические и бак
териологические исследования.
Легкодоступны биопсии туберкулезные язвы шейки, влагалища и вульвы, однако эти локализации процесса в настоящее время казуистически редки. Придатки могут быть подвергнуты гистологическому исследованию лишь после оперативного вмешательства, но круг показаний к чревосечению, естественно, ограничен. Наиболее широко применяют гистологическое исследование эндометрия, по
16*
467
лучаемого путем диагностического выскабливания, входящего в отсутствие противопоказаний в число обязательных диагностических мероприятий. Однако и в этом случае информативность метода ограничена тем, что специфические эндометриты выявляют не более чем у 30—40% больных генитальным туберкулезом.
Еще реже диагноз удается подтвердить с помощью бактериологического метода. Высеваемость МТ при генитальном туберкулезе очень низка (в пределах 10%), несмотря на то что для посева могут быть направлены менструальная кровь, соскобы и аспираты из полости матки, выделения и смывы из половых путей, пунктаты из придатковых образований. Это объясняется несовершенством мето
дик получения нужного количества материала, ограниченными возможностями проведения частых и многократных посевов и т. д. Истинное число лиц, выделяющих возбудителей туберкулеза, вероятно, больше, о чем свидетельствуют данные Т. В. Борима (1964) и Е. Н. Колачевской (1983), получивших положительные результаты посевов на МТ соответственно в 33 и 27,4%.
В случае отсутствия гистологического и бактериологического под
тверждения диагноз устанавливают по совокупности результатов клинического обследования. Ведущую роль при этом играет рент
генологическое исследование.
Некоторые признаки генитального туберкулеза можно выявить уже на обзорных рентгенограммах малого таза в виде кальцинированных участков и теней казеом. Основную же информацию дает гистеросальпингография (ГСГ), при выполнении которой следует использовать только водорастворимые контрастные вещества (веро-графин или его аналоги). Современный уровень развития рентгеновской техники позволяет широко применять рентгенотелевизионную ГСГ, позволяющую получить наиболее полную информацию и максимально избежать диагностических ошибок, еще столь часто допускаемых при интерпретации рентгенограмм. К очевидным достоинствам телевизионного метода следует отнести возможность ви-
зуалъного контроля за прохождением контрастного вещества, съемки
исследуемого объекта в оптимальном ракурсе, дифференциации
контрастных теней, имеющих и не имеющих отношения к внутренним половым органам, выявления некоторых нарушений функций маточных труб.
Патогномоничными рентгенологическими признаками заболева-
ния принято считать ригидные, нередко с расширенным просветом маточные трубы, имеющие форму дубинки, курительной трубки, булавы, а иногда в связи со стриктурами, приобретающие вид бус или четок. Дистальные отделы труб могут быть расширены в виде
луковицы либо ватного тампона. В более запущенных случаях на-
блюдается рубцовая деформация полости матки с частичной или
полной ее облитерацией, иногда с характерной формой «трилист-
ника» и концевой фаланги пальца. В ряде случаев претерпевает изменения и канал шейки матки, приобретающий веретенообразную либо колбовидную форму с зазубренными контурами.
Приведенные выше характерные признаки формируются в ре
468
зультате длительно существующего, а иногда и закончившегося туберкулезного процесса.
При их выявлении обычно не остается сомнений в специфической этиологии заболевания, хотя и не удается установить активность процесса.
Далеко не всегда, однако, рентгенологическая картина при генитальном туберкулезе соответствует привычным представлениям. Так, например, на ранних стадиях заболевания сохранена проходимость маточных труб и не удается обнаружить четкие патогномоничные признаки заболевания на рентгенограммах. В других случаях атипичные варианты могут быть обусловлены присоединением вторичной инфекции, сочетанием туберкулеза с другими гинекологическими заболеваниями, ранее проведенными курсами лечения бесплодия нераспознанной туберкулезной этиологии с применением гидротубаций, перенесенными оперативными вмешательствами на
внутренних половых или соседних органах.
К широко применяемым во фтизиогинекологии диагностическим тестам относится провокационная туберкулиновая проба (ПТП). При оценке ее результатов основное значение придают очаговой
реакции, которую определяют путем сравнения гинекологического статуса больной до и через 2 сут после подкожного введения туберкулина. Появление после пробы признаков обострения воспале
ния расценивают как положительную очаговую реакцию, свидетельствующую об активном туберкулезе. Если изменения выражены нечетко, то реакцию считают сомнительной. Сохранение исходных данных — признак отрицательной реакции. Несмотря на специфичность теста, при ПТП весьма часты сомнительные оценки, а в 30% случаев наблюдаются ложноположительные либо ложноотрицательные результаты. В связи с этим применение ПТП более оправданно при выявлении скрытой активности туберкулеза, установленного по
клинико-рентгенологическим показателям, чем при определении этиологии заболевания.
В некоторых сомнительных случаях проводят пробную противотуберкулезную химиотерапию. Обычно используют двойную комбинацию туберкулостатиков на протяжении 2—4 мес. Положительная динамика исходных воспалительных проявлений и общее клиническое улучшение могут служить признаком туберкулеза.
В последние годы арсенал фтизиогинекологических диагностиче
ских средств пополнился лапароскопией. К сожалению, спаечный процесс, сопутствующий специфическому воспалению, ограничивает
возможности проведения эндоскопических исследовании и снижает их информативность. Диагностическую лапаротомию в настоящее время применяют сравнительно редко, главным образом по показаниям, связанным с сопутствующими гинекологическими заболеваниями, которые усложняют распознавание туберкулеза.
Круг заболеваний, от которых следует дифференцировать тубер
кулез женских половых органов, достаточно широк, но в первую очередь и наиболее часто это касается хронических аднекситов неспецифической и гонорейной этиологии, а также эндометриозов.
469
Дифференциальную диагностику проводят по совокупности данных анамнеза, результатов клинических наблюдений и специальных ди
агностических исследований.
Лечение. В настоящее время в лечении туберкулеза женских половых органов преобладает специфическая консервативная химиотерапия, интенсивность и длительность которой определяются клинической формой заболевания, распространенностью и фазой процесса. В комплексе с различными комбинациями туберкулостатиков используют и методы патогенетической терапии, способствующие повышению эффективности лечения.
Хирургическое лечение генитального туберкулеза проводят в среднем 20—30% бальных [Колачевская Е. Н., 1983; Патрикян И. Т. и др., 1983] по следующим основным показаниям: неэффективность консервативной терапии в течение 1—2 лет, казеозные формы по
ражения придатков матки, наличие крупных воспалительных ад-некстуморов, сочетание с другими гинекологическими заболевани-
ями. При выполнении операций молодым женщинам хирург должен стремиться к максимальному уменьшению объема, по возможности производя органосохраняющие вмешательства [Абурел Е. И., Петреску В. Д., 1975].
Прогноз. В отношении клинического излечения прогноз туберкулеза женских половых органов вполне благоприятный. Значительно хуже обстоит дело с реабилитацией детородной функции, так как заболевание диагностируют поздно, когда, как правило, уже имеются практически необратимые анатомо-функциональные изменения в маточных трубах.
Профилактика. Среди мероприятий, выполняемых с целью свое-
временного выявления больных генитальным туберкулезом, важное
место занимают профилактические осмотры. Их проводят фтизио-
гинеколог противотуберкулезного диспансера совместно с врачами общей лечебной сети для определения групп повышенного риска заболевания туберкулезом. В специализированные учреждения для целенаправленного обследования направляют женщин с трубной формой первичного и, реже, вторичного бесплодия, хроническими
аднекситами, не поддающимися традиционному противовоспалительному лечению, а также с менструальными расстройствами, преимущественно по типу гипоменореи, опсоменореи и аменореи.
Осведомленность врачей общей лечебной сети в вопросах клинического течения и диагностики генитального туберкулеза является необходимым условием их участия в активном выявлении заболе
вания.
13.8. АБДОМИНАЛЬНЫЙ ТУБЕРКУЛЕЗ
Абдоминальный туберкулез — специфическое поражение органов пищеварения, брюшины, лимфатических узлов брыжейки тонкой кишки и забрюшинного пространства. Среди других локализаций туберкулеза абдоминальный занимает особое место и является одним из наиболее сложных разделов фтизиатрии. Клиническая картина 470
абдоминального туберкулеза полиморфна, патогномоничные симп-
томы и четкие диагностические критерии отсутствуют, поэтому, как правило, он протекает под маской других заболеваний органов брюшной полости и выявляется лишь у небольшой части больных, у большинства же остается недиагностированным.
Согласно статистическим данным, в структуре внелегочного туберкулеза абдоминальный составляет всего 2—3%. Частота поражения туберкулезом органов брюшной полости различна. Чаще (у 70%
бальных) поражаются мезентериальные лимфатические узлы, реже —
брю
ши
яа (12%). Изолированное положение одного органа встречается
редко, чаще в специфический процесс вовлекается одновременно несколько анатомических образований.
Наибольшее признание получила классификация туберкулезного мезаденита, предложенная В. Г. Штефко (1937), согласно которой различают казеозную, фиброзно-продуктивную и индуративную формы заболевания. Самая удачная систематизация туберкулеза кишечника — классификация, разработанная М. М. Альпериным (1950), в которой выделены бессимптомная, диарейная, алгическая, диспепсиче-
ская и общеинтоксикационная формы заболевания. Общепризнанной
является клинико-
мо
логическая классификация туберкулезного
перитонита, включающая бугорковую, экссудативную, слипчивую,
экссудативно-слипчивую и казеозно-язвенную формы.
Этиология и патогенез. Общеизвестно, что абдоминальный туберкулез чаще всего (у 70% больных) развивается вторично в результате лимфогематогенного заноса микобактерий туберкулеза
из других органов, прежде всего из легких. Как первичное поражение он возникает при алиментарном пути распространения инфекции. Опасность заражения в этих случаях находится в полной зависимости от эпизоотической обстановки и оно происходит довольно редко. В случае развития туберкулеза кишечника при алиментарном заражении в специфический воспалительный процесс вовлекаются регионарные лимфатические узлы, лимфатические узлы корня брыжейки тонкой кишки и брюшина. Возникновению и распространению абдоминального туберкулеза способствуют общее ослабление организма, цеспецифические заболевания органов пищеварения, снижа-
ющие местную резистентность, неполноценное и нерегулярное питание, эндокринные расстройства, беременность, роды, аборты.
Патологическая анатомия. В основе морфологических изменений
лежит специфическая гранулема с перифокальной неспецифической
логические изменения при тубер-
воспалительной реакцией. Мор4
QCS
кулезном мезадените такие же, как при туберкулезе периферических лимфатических узлов. При туберкулезе кишечника они характеризуются инфильтрацией, изъязвлением и рубцеванием. Язвы распространяются по ходу кровеносных и лимфатических сосудов, начиная с брыжеечного края и опоясывая всю окружность кишечного про
света. На серозном покрове соответственно локализации язв нередко имеются бугорковые высыпания. Язвы чаще неглубокие. Первоначально разрушаются только слизистая оболочка и подслизистый слой, затем в специфический процесс вовлекается мышечный слой
471
и язвы доходят до серозной оболочки. Туберкулезные язвы редко
перфорируют, чаще рубцуются, в результате чего образуются стриктуры, которые могут быть единичными и множественными. Кроме
язвенной формы, может развиться опухолевидная, при которой происходит утолщение кишечной стенки, слизистая оболочка при этом
не нарушается.
Изменения в брюшине зависят от глубины ее поражения. Различают бугорковую, экссудативную, слипчивую, экссудативно-слипчивую и язвенно-казеозную формы. Для туберкулезного перитонита характерны утолщение брюшины и образование спаек.
Клиническая картина. При туберкулезе любой локализации клиническая картина складывается из общих симптомов, обусловленных специфической интоксикацией, и местных.
При любой локализации абдоминального туберкулеза в неспецифический процесс вовлекается пищеварительный тракт, нарушаются пищеварение и всасывание. Один из характерных признаков заболевания — уменьшение массы тела. В большей степени, чем при других локализациях туберкулеза, выражены и другие признаки интоксикации: слабость, быстрая утомляемость, головная боль, раздражительность, ночные поты, плохой сон и аппетит вплоть до полной анорексии, субфебрильная температура тела, боли в области
сердца от несильных и непродолжительных до интенсивных и упорных, тахикардия, снижение артериального кровяного давления. Аус-культативно при приступе болей регистрируют приглушение тонов сердца и нарушение ритма. Часто отмечаются психоневрологические расстройства: депрессия, чувство страха.
Туберкулезный мезаденит. Течение туберкулезного мезаденита может быть острым и хроническим. При остром течении появляются боли в животе различной локализации, но чаще в области пупка и правой подвздошной области. Продолжительность приступа болей от 2—3 ч до 2—3 сут, при этом боли
настолько интенсивные, что напоминают картину острого живота. Живот равномерно вздут, передняя брюшная стенка участвует в акте дыхания. Пальпация живота умеренно болезненна, напряжение мышц передней брюшной стенки отсутствует, симптомы раздражения брюшины слабоположительны. Следует иметь в виду,
что увеличенные лимфатические узлы могут вызвать изменения
в трофике червеобразного отростка и быть причиной развития
вторичного аппендицита.
Хронический туберкулезный мезаденит протекает волнообразно: периоды обострений сменяются ремиссиями. Самым частым симптомом являются боли в животе, локализация которых чаще всего соответствует локализации патологического процесса. Характер болей различный: от тупых ноющих до приступообразных типа колик. Они усиливаются при ходьбе, физическом напряжении, метеоризме, а иногда после клизмы, что связано с наличием спаек в брюшной полости. Характерно вздутие живота, нарастающее к концу дня и вызывающее тупые ноющие боли. Боли могут быть обусловлены давлением кальцинированных лимфатических узлов. В воспалитель
472
ный процесс вовлекается брюшина (местный перитонит), что также является причиной развития болевого синдрома.
Поверхностная пальпация живота безболезненна, при глубокой отмечается болезненность в области пупка, особенно в точках Штернберга (слева на уровне Ln и справа на 1 см выше точки Мак-Бернея). Для туберкулезного мезаденита характерны симптомы Мак-Фендена (болезненность в области пупка) и Клинна (смещение болей в животе при перемещении больного на левый бок). Иногда при пальпации в брюшной полости удается обнаружить конгломераты увеличенных лимфатических узлов в виде опухолевидных образований, умеренно болезненных при пальпации. При перкуссии над конгломератом определяется притупление перкуторного звука. Обследование больного следует проводить натощак после предварительного опорожнения кишечника (очистительной клизмы).
Туберкулез кишечника. Туберкулез кишечника издавна считали тяжелым осложнением туберкулеза легких. Еще Гиппократ говорил: «...туберкулезные больные умирают, если присоединяется диарея». Боли при туберкулезе кишечника локализуются в правой подвздошной области и характеризуются постоянством. Онй различны по интенсивности и длительности, могут появляться самостоятельно или в связи с приемом пищи и дефекацией. Неустойчивый стул (до 2—4 раз в сутки) и вздутие живота — характерные симптомы туберкулеза кишечника. Гной, слизь и кровь в кале обнаруживают редко. Живот равномерно вздут, при пальпации мягкий, болезненный в правой подвздошной области, при этом нередко пальпация вызывает негромкое урчание в илеоцекальной области. Слепая кишка может быть раздутой или уплотненной. Терминальная петля подвздошной кишки пальпируется в виде шнура.
Туберкулезный перитонит. По мнению Р. Seth и соавт. (1974), туберкулезный перитонит следует заподозрить у любого пациента с неясными абдоминальными симптомами. По своему течению это хроническое заболевание, но оно может быть и острым. Острое течение характерно для бугоркового туберкулезного перитонита. Заболевание начинается со значительного повышения температуры тела, появления озноба и болей в животе, напоминая острое инфекционное заболевание — брюшной тиф или паратиф, либо его принимают за острый живот. Передняя брюшная стенка напряжена, положительны симптомы раздражения брюшины. Таким больным чаще всего производят оперативное вмешательство, во время которого обнаруживают бугорковые высыпания на брюшине. При гистологическом исследовании брюшины находят эпителиоидные клетки и клетки Пирогова—Лангханса.
Экссудативный туберкулезный перитонит может быть исходом бугоркового либо параспецифической реакцией на токсины микобактерий туберкулеза при любой его локализации и характеризуется наличием экссудата в брюшной полости. Заболевание обычно начинается с появления неопределенных, приступообразных болей в животе, неустойчивого стула, тошноты и рвоты, субфебрильной температуры. На этом фоне начинает увеличиваться
473
живот, появляется чувство распирания. По мере накопления жидкости живот может достигать огромных размеров. При этом пупок сглаживается, затем выпячивается, кожа на животе становится сухой, на ней появляется расширенная венозная сеть.
Слипчивый перитонит чаще бывает исходом экссудативного и развивается в результате организации фибрина, но он изначально может иметь пластический характер. При этой форме перитонита брюшина покрывается фиброзными наложениями в виде тяжей и нитей. Эти наложения вначала рыхлые, затем прорастают соединительной тканью, рубцуются, в результате чего образуются сращения с соседними органами. Симптомы слипчивого перитонита разнообразны и зависят от степени выраженности слипчивого процесса, рубцовых изменений, нарушения функции кишечника. Больные жалуются на общую слабость, боли в животе различной интенсивности, неопределенной локализации или локализованные, иногда они бывают схваткообразными. У больных уменьшается аппетит, нередко появляются рвота, запор или понос. Живот увеличен в объеме, но может быть и втянут (панцирный живот), иногда асимметричен. Передняя брюшная стенка нередко отечна. При пальпации живота иногда отмечаются шум трения брюшины и болезненность. Слипчивый процесс может ограничиться образованием фибринозных наложений на желудке (перигастрит) или кишечнике (периколит). При сморщивании брыжейки, сальника, сращении петель кишечника между собой и с другими органами в брюшной полости возникают опухолевидные образования.
При экссудативно-слипчивой форме туберкулезного перитонита в брюшной полости обнаруживают флюктуирующие опухоли — осумкованный экссудат. При перкуссии живота выявляют симптом «шахматной доски» (чередование тимпанического и перкуторного звука с тупым). Общее состояние больных, несмотря на такие изменения в брюшной полости, длительное время остается
удовлетворительным.
Казеозно-язвенная форма туберкулезного перитонита
характеризуется наличием участков творожистого некроза на париетальной и висцеральной брюшине среди спаек и сращений.
Нередко отмечается склонность к распаду казеозных масс. Это самая тяжелая форма туберкулезного перитонита, чаще наблюдающаяся у детей, при которой резко выражены симптомы туберкулезной интоксикации. Общее состояние больных крайне тяжелое. Температура тела повышается до 39 °C. Часто наблюдаются проф
узные поты. При кишечной непроходимости появляются приступообразные боли, вздутие живота. Больные истощены, черты лица заострены. Кожа сухая, иногда отечна. Нередко наблюда
ется анасарка. При пальпации живота определяются урчание в кишечнике и крепитация, особенно выраженная в области пупка, а также опухолевидные образования в разных отделах брюшной
полости.
Из осложнений абдоминального туберкулеза необходимо отметить кровотечения, образование наружных и внутренних свищей,
474
перфорацию кишечника, каловый перитонит, кишечную непрохо
димость, амилоидоз внутренних органов.
Диагностика, дифференциальная диагностика. Диагноз абдоминального туберкулеза устанавливают на основании данных анамнеза (учитывают связь заболевания с туберкулезной инфекцией, волнообразное течение и сезонность обострений), результатов объективного исследования (осмотр, пальпация, перкуссия), лабораторного и инструментального исследований, туберкулинодиагностики, рентгенологического исследования, лапароскопии, лапаротомии, гистологического и бактериологического исследования материала, полученного во время операции. При перитоните учитывают сочетание поражения брюшины с другими проявлениями туберкулеза и состав экссудата. В диагностике имеет значение пробное лечение с помощью двух противотуберкулезных препаратов в течение 1,5— 2 мес. При положительной динамике процесс расценивать как специфический.
При абдоминальном туберкулезе наблюдаются характерные изменения в крови. Редко развивается лейкоцитоз, но отмечается сдвиг лейкоцитарной формулы влево, умеренно увеличена СОЭ, уровень гемоглобина снижается до 50—65 ед. В сыворотке крови уменьшается содержание альбуминов и холестерина, а также повышается уровень Л2- и y-глобулинов. При активном туберкулезном процессе положительна реакция на С-реактивный белок.
С диагностической целью проводят иммунологические исследования: противотуберкулезный иммунитет изучают в серологических реакциях и РБТЛ с туберкулином; используют также реакцию неспецифической гемагглютинации.
При экссудативной форме туберкулезного перитонита производят пункцию брюшной полости и исследование экссудата, который у подавляющего большинства больных серозный, но может быть хилезный и геморрагический, последний обычно у больных, у которых наблюдается тяжелое течение заболевания. При туберкулезном перитоните содержание белка в экссудате от 3 до 7%; чем выше уровень белка в экссудате, тем тяжелее состояние больного. При цитологическом исследовании обнаруживают лимфоциты, эритроциты и клетки эндотелия, иногда микобактерии туберкулеза, что является подтверждением специфического процесса в брюшной по
лости.
Большое значение в диагностике абдоминального туберкулеза имеют туберкулиновые пробы Манту с 2 ТЕ и Коха с 20 ТЕ, тепловизионное и радионуклидное исследования. Тепловизионное исследование проводят до пробы Коха и через 48 ч после нее. Усиление свечения на 1,5° и более характерно для абдоминального туберкулеза. Радионуклидное исследование информативно в основном при поражении забрюшинных лимфатических узлов. При исследовании желудочного содержимого выявляют снижение общей и свободной кислотности. Анализ дуоденального содержимого проводят для исключения патологии желчного пузыря. Анализ кала на скрытую кровь (реакция Грегерсена) при абдоминальном туберкулезе
475
дает отрицательные результаты, и только при язвенном туберкулезном колите, сопровождающемся вторичным неспецифическим воспалением, реакция может быть положительной. Изучение коп
рограммы позволяет установить характер нарушения пищеварения, этиологию и патогенез заболевания, локализацию и протяженность
процесса. При туберкулезе кишечника процесс чаще всего локализуется в илеоцекальной области. Кал золотисто-желтого цвета, ие оформлен, реакция его кислая, запах — резкий, кислый или про
горклого масла, перевариваемая клетчатка и внутриклеточный крахмал содержатся в большом количестве, измененные мышечные волокна и расщепленный жир — в незначительном, выявляется обиль
ная йодофильная флора.
По данным Н. В. Самохиной (1985), у 80% больных диагноз абдоминального туберкулеза устанавливают на основании результатов рентгенологического исследования. Выявление кальцинированных лимфатических узлов в брюшной полости почти всегда является признаком, свидетельствующим о наличии туберкулезного мезадеиита. К косвенным рентгенологическим признакам относятся
висцероптоз, нарушение моторной функции желудка и кишечника, чаще по гипомоторному типу, смещение и фиксация петель тонкой кишки, обусловленные функциональными расстройствами, спаечным процессом либо конгломератами увеличенных лимфатических узлов и скоплением газа в селезеночном углу ободочной кишки.
Рентгенологические изменения при туберкулезе кишечника делят
на функциональные и мор$
логические и выявляют как при перо
ральном, так и при ректальном введении контрастного вещества. К наиболее часто встречающимся функциональным признакам относятся сегментарная гиперперистальтика, локальный спазм, спастический дефект наполнения (симптом Штирлина), ранний и поздний тифлоспазм, задержка бариевой взвеси в слепой либо подвздошной кишке, выпрямление и «вздыбление» петель тонкой киш-
ки, гиперперистальтика со спастическими сокращениями терминального отдела подвздошной кишки или илеоцекальной области,
сегментарные расширения петель кишечника.
логические из-
менения — это зубчатость контуров слепой кишки, ее укорочение и деформация, утолщение илеоцекального клапана (баугиниева заслонка), отсутствие гаустрации в области брыжеечного края слепой
кишки, кольцевидность, утолщение продольных складок слизистой оболочки терминального отдела подвздошной кишки и участки спа-
стического сокращения, укорочение восходящей кишки вследствие фиброза и обтурация аппендикса, несостоятельность илеоцекального клапана (заброс бариевой взвеси в подвздошную кишку при ирри-госкопии), обусловленная его фиброзом, стриктуры, дефект наполнения при опухолевидной форме туберкулеза и внутренние свищи. Некоторые авторы рекомендуют перед рентгенологическим исследованием вводить в брюшную полость кислород, который разъединяет органы, позволяет обнаружить тяжи и фиксацию петель ки
шечника.
Для уточнения изменений в просвете кишки производят коло
476
носкопию с биопсией измененного участка слизистой оболочки. Ценную информацию можно получить при лапароскопии (бугорковые высыпания на брюшине, спаечный процесс). Показанием к выполнению лапаротомии является стойкий болевой синдром. Материал, полученный во время операции, направляют на гистологическое и бактериологическое исследование. Необходимо отметить, что и с помощью лапаротомии не всегда удается уточнить диагноз.
Клиническая картина абдоминального туберкулеза не имеет специфических признаков, поэтому его необходимо дифференцировать от некоторых заболеваний органов брюшной полости.
Острые формы абдоминального туберкулеза следует отличать от острого аппендицита, острого неспецифического мезаденита, острого холецистита и панкреатита, острой кишечной непроходимости. При этом обязательно учитывают наличие признаков туберкулезной интоксикации до появления острых болей в животе.
При хроническом течении абдоминального туберкулеза его дифференцируют от хронического гастрита, холецистита, панкреатита, язвенной болезни, хронического неспецифического мезаденита, энтероколита, хронических гинекологических заболеваний, эндометриоза, болезни Крона, злокачественных опухолей, красной системной волчанки. Определенные затруднения возникают при проведении дифференциальной диагностики с хроническим неспецифическим мезаденитом. Диагноз уточняют на операционном столе и при гистологическом исследовании материала, полученного во время операции. При дифференциации абдоминального туберкулеза и хронического энтероколита необходимо учитывать, что общие симптомы встречаются только при поражении тонкой кишки, когда нарушается обмен витаминов, белков, жиров и углеводов. При прогрессировании процесса страдает и минеральный обмен. Диагноз уточняют на основании результатов рентгенологического исследования, при котором выявляют отек слизистой оболочки тонкой и толстой кишки, в то время как при туберкулезе имеется сегментарное поражение.
При болезни Крона поражается терминальный отдел подвздошной кишки (регионарный илеит), как и при туберкулезе, наблюдается тенденция к вовлечению в патологический процесс ее более проксимально расположенных отделов. Терминальный отдел подвздошной кишки пальпируется в виде тяжа. В некоторых случаях единственным проявлением заболевания могут быть наружные или внутренние свищи. Иногда анальные изменения (трещины прямой кишки, отек перианальной ткани, изъязвление и свищи) являются первыми симптомами болезни Крона. Характерные изменения выявляют при рентгеноскопии кишечника: слепая кишка и илеоцекальный клапан не изменены, подвздошная кишка поражается на большем протяжении, чем при туберкулезе, и представляет собой ригидную трубку.
Дифференциальную диагностику проводят также со спаечной болезнью и злокачественными новообразованиями. Диагноз уточняют при рентгенологическом исследовании пищеварительного тракта. Обязательно выполняют исследование тонкой кишки, обращая при
477
этом внимание на расположение ее петель и рельеф слизистой оболочки. При дифференциации абдоминального туберкулеза и злокачественных новообразований необходимо учитывать прогрессирующее ухудшение состояния больных, усиление болей, уменьшение массы тела, снижение уровня гемоглобина. При наличии экссудата в брюшной полости после пункции происходит быстрое накопление его, при туберкулезе же после 2—3 пункций накопление жидкости прекращается.
Дифференциальная диагностика с красной системной волчанкой не вызывает затруднений у больных, у которых обнаруживают типичную «бабочку» на лице, сочетание артрита и нефрита, LE-клеток в крови и отсутствует эффект от антибактериальной терапии.
Лечение. Лечение абдоминального туберкулеза проводят в соответствии с общими принципами лечения туберкулеза. Основной метод — химиотерапия. Одновременно со специфическим лечением назначают патогенетическую и симптоматическую терапию, полноценную диету, предусматривающую употребление продуктов, богатых витаминами, и исключающую трудноусваиваемые продукты. При экссудативном туберкулезном перитоните показана пункция брюшной полости. Показанием к хирургическому лечению служат осложнения абдоминального туберкулеза и упорные боли в животе. Санаторно-курортное лечение больных абдоминальным туберкулезом проводят в основном в местных санаториях.
Прогноз зависит от своевременного распознавания и эффективности лечения.
Профилактика абдоминального туберкулеза заключается в активном выявлении больных группы риска, в которую входят все пациенты с хроническими заболеваниями пищеварительного тракта (хронический гастрит, энтероколит, колит, холецистит, панкреатит, аппендицит, амебиаз), лица, перенесшие в прошлом туберкулез любой локализации, а также контактировавшие с больными туберкулезом.
ГЛАВА 14
ТУБЕРКУЛЕЗ КАК ГЛОБАЛЬНАЯ
И НАЦИОНАЛЬНАЯ ПРОБЛЕМА ЗДРАВООХРАНЕНИЯ
Проблема туберкулеза после периода потери к ней интереса с каждым годом привлекает все большее внимание. Это связано с ростом заболеваемости, появлением тяжелых форм заболевания со смертельным исходом в странах Западной Европы, США и России, тогда как еще совсем недавно туберкулез рассматривали как исчезающую болезнь. Проведены расчеты, чтобы установить, когда он будет искоренен на Земле, в первую очередь в экономически развитых странах; были даже определены эпидемиологические показатели, характеризующие степень искоренения туберкулеза. Сначала это был уровень инфицированности не выше 1 % в возрастной группе до 14 лет, затем другие критерии, в том числе годичный риск инфицирования, и, наконец, уровень заболеваемости: выявление одного больного туберкулезом легких, выделяющего микобактерии туберкулеза, в течение календарного года на 1 млн, а затем — на 10 млн населения.
Ежегодное снижение заболеваемости туберкулезом в экономически высокоразвитых странах в какой-то степени поддерживало представление о процессе ликвидации туберкулеза как массового заболевания, хотя в странах Азии, Африки, Тихоокеанского бассейна, Южной Америки сохранялась высокая заболеваемость и смертность. Далее сформулировано положение о том, что туберкулез — это проблема для развивающихся стран, а в Европе и Северной Америке она потеряла важное значение для здравоохранения. Почти во всех странах Европы фтизиатрия как научная дисциплина и врачебная специальность трансформировалась и слилась с пульмонологией в качестве одного из ее разделов.
В Западной, а затем и в Восточной Европе специализированные противотуберкулезные учреждения были ликвидированы или преобразованы в учреждения, предназначенные для диспансерного наблюдения за больными с нетуберкулезными заболеваниями легких и их лечения, а также для других целей. К счастью, в нашей стране подобные предложения не были реализованы в полной мере, так, как это произошло в странах Европы и Северной Америки.
После долгих лет существования представлений о продолжающемся процессе ликвидации и даже искоренения туберкулеза, по крайней мере в экономически высокоразвитых странах, в 1982 г. на Международном конгрессе, проходившем в Буэнос-Айресе (Аргентина), было высказано сомнение относительно того, что идет поступательный процесс ликвидации туберкулеза, а также было отмечено, что в развивающихся странах никакого улучшения эпидемиологических показателей, характеризующих распространенность туберкулеза, не отмечается.
В 1991 г. Генеральная Ассамблея Всемирной организации здравоохранения (ВОЗ) была вынуждена констатировать, что туберкулез
479
все еще является приоритетной международной и национальной проблемой здравоохранения не только в развивающихся, но и в экономически высокоразвитых странах. В мире ежегодно заболевают туберкулезом более 8 млн человек, 95% из них — жители развивающихся стран; 3 млн человек ежегодно умирают от туберкулеза, поэтому можно ожидать, что в ближайшие 10 лет от него погибнут 30 млн больных. Вместе с тем жизни 12 млн человек из этого числа могли бы быть спасены при хорошей организации раннего выявления и лечения больных. Сложившаяся ситуация в ВОЗ охарактеризована как кризис глобальной политики в области туберкулеза.
Внимание к туберкулезу как инфекционному заболеванию и проблеме здравоохранения резко возросло в связи с сообщениями о значительном росте заболеваемости в странах Западной и Восточной Европы, а также в США. В США, например, число зарегистрированных больных с 1983 по 1993 г. увеличилось на 14%. Из 25 313 впервые выявленных больных туберкулезом большинство составляли лица в возрасте 25—44 лет, на 19% увеличилась заболеваемость в возрастной группе от 0 до 4 лет и на 40% — среди детей в возрасте от 5 до 14 лет. В странах Центральной и Восточной Европы, кроме увеличения заболеваемости, отмечается рост смертности от туберкулеза, которая составляет в среднем 7 случаев на 100 000 населения, что значительно выше, чем в странах Западной Европы, где смертность в каждой отдельно взятой стране равняется 0,3—2,8 случая на 100 000 населения.
В России самая низкая заболеваемость туберкулезом была в 1991 г. — 34,0 случая на 100 000 населения, из них 30,8 случая приходилось на туберкулез органов дыхания, что в абсолютных цифрах составило 21 553 больных. В этот же год от туберкулеза умерло 11 990 больных, что соответствовало показателю смертности 8,1 на 100 000 населения. В 1995 г. этот показатель увеличился до 15,4, что свидетельствует о низкой эффективности лечения больных, подтвержденной статистическими данными. Заболеваемость туберкулезом в России в 1995 г. увеличилась и достигла 57,4 случая на 100 000 населения, при этом заболеваемость бациллярными формами туберкулеза составила 25,4 случая на 100 000 населения. Прекращение выделения микобактерий туберкулеза было достигнуто лишь у 65,5% впервые выявленных больных, не получали лечения 20,3%. Такая низкая эффективность лечения свидетельствует как о его плохой организации, так и о выявлении значительного числа больных с тяжелыми, необратимыми формами туберкулеза. Оценивая реальную эпидемиологическую ситуацию в экономически развитых странах, в том числе в странах Центральной и Восточной Европы, а также бывшем СССР, представляется возможным сформулировать следующие причины увеличения заболеваемости туберкулезом и смертности от него:
1) снижение жизненного уровня большой группы населения, в частности ухудшение питания со значительным уменьшением потребления белковых продуктов, а также возникновение стрессовых ситуаций в связи с неустойчивым положением в стране, военными столкновениями и войнами в ряде регионов;
480
2) резко увеличившаяся миграция больших групп населения,
практически выпадающих из поля зрения лечебно-
илактиче-
ских учреждений, вследствие чего в отношении них не могут быть
проведены оздоровительные мероприятия, в частности противотуберкулезные;
3) ухудшение проведения комплекса противотуберкулезных мероприятий, особенно направленных на профилактику и раннее выявление туберкулеза у взрослого населения, в частности у беженцев,
социально дезадаптированных групп и групп высокого риска развития туберкулеза;
4) увеличение числа больных с тяжелыми формами заболевания, особенно вызванными лекарственно-устойчивыми микобактериями, что затрудняет проведение эффективного лечения, способствует развитию необратимых хронических форм и обусловливает высокую летальность.
Указанные причины привели к «неуправляемости» туберкулеза в условиях большого резервуара туберкулезной инфекции и высокой инфицированности населения, т. е. наличия носителей персистирующих вариантов возбудителя, образовавшихся в результате перенесенной туберкулезной инфекции и способных в соответствующих условиях вызвать реактивацию остаточных очагов туберкулеза. Уровень инфицированности, как известно, зависит от величины резервуара инфекции. Основной резервуар туберкулезной инфекции — это больные, представляющие эпидемическую опасность, т. е. распространяющие микобактерии туберкулеза среди окружающего населения. В ряде регионов имеется дополнительный резервуар инфекции — пораженный туберкулезом крупный рогатый скот. Кроме того, следует иметь в виду большое число больных с заразными формами туберкулеза в странах ближнего зарубежья, окружающих Россию, а также в развивающихся странах, что при высоком уровне миграции создает условия для заражения туберкулезом мигрантов и передачи инфекции окружающим. В настоящее время, несомненно, увеличилось число взрослых больных, у которых туберкулез развился как следствие экзогенной инфекции и суперинфекции. Это подтверждается увеличением числа больных, у которых отмечается начальная устойчивость микобактерий туберкулеза к химиопрепаратам, среди впервые выявленных больных.
В сложившейся ситуации неотложной задачей является усиление и расширение противотуберкулезных мероприятий в условиях ограниченного и даже недостаточного их финансирования. В связи с этим особое значение имеет определение приоритетности противотуберкулезных мероприятий с учетом их эффективности и способ
ности повлиять на эпидемиологическую ситуацию, вернуть утерянные возможности «управления» туберкулезной инфекцией.
В рекомендациях Международного союза борьбы с туберкулезом
и болезнями легких ВОЗ в качестве основных направлений проти-
вотуберкулезной работы называются выявление бациллярных бальных, у которых микобактерии обнаруживают в мокроте при мик
роскопическом исследовании, и их химиотерапия. Эффективное ле-
481
чение таких больных позволяет предотвратить их смерть вследствие прогрессирования заболевания, что приводит к уменьшению смертности; прекратить распространение туберкулезной инфекции; предупредить развитие хронического туберкулезного процесса с постоянным выделением микобактерий, часто обладающих лекарственной устойчивостью, и, наконец, добиться излечения.
Международные организации рекомендуют выявлять бациллярных больных среди лиц, обратившихся за медицинской помощью в связи с наличием «грудных» симптомов: кашля с выделением мокроты, одышки, кровохарканья, синдрома интоксикации с повышением температуры тела, а также потерей массы тела. Эти рекомендации вполне приемлемы. В нашей стране принято одновременно с исследованием мокроты проводить больным рентгенофлюорографическое исследование, что при наличии туберкулеза огранов дыхания дает возможность определить локализацию и протяженность процесса, а также характер морфологических изменений в рентгенологическом отображении (очаги, диссеминация, инфильтраты, каверны и т. д.). Рентгенофлюорографическое исследование позволяет выявить лиц с изменениями в легких, не сопровождающимися, по крайней мере в момент исследования, «грудными» или другими симптомами, а также выделением микобактерий.
В литературе появились сообщения о развитии туберкулеза у взрослых и детей вследствие заражения полирезистентными микобактериями. Получены данные об увеличении распространенности начальной, в том числе первичной, лекарственной устойчивости микобактерий в США и ряде других стран. Заражение (суперинфекция) лекарственно-устойчивыми микобактериями, как правило, приводит к развитию остропрогрессирующих форм туберкулеза, лечение которых химиопрепаратами очень затруднено из-за размножения этих микобактерий в организме заболевших, а также в связи с тем, что для их разрушения или подавления репликации трудно подобрать соответствующие химиопрепараты.
В последние 2—3 года вновь появились такие формы туберкулеза, как казеозная пневмония, милиарный туберкулез, полисерозит, наблюдавшиеся в нашей стране в период Великой Отечественной войны и в послевоенные годы, а затем практически исчезнувшие. В связи с этим возникла необходимость восстановить эти клинические формы в клинической классификации туберкулеза, из которой они были исключены более 10 лет назад.
Резко изменилась структура впервые выявленных больных. Если в течение длительного периода времени наиболее частой формой туберкулеза в России был очаговый туберкулез легких, то благодаря активному выявлению таких больных с помощью флюорографических исследований населения в настоящее время число больных с подобной формой уменьшилось, но увеличилось число больных инфильтративным, диссеминированным и фиброзно-кавернозным туберкулезом.
Более частое развитие остропрогрессирующих форм туберкулеза в США и странах Западной Европы нередко связывают с ВИЧ-ин-
482
фекцией у заболевших туберкулезом. Для нашей страны такое объяснение развития тяжелых форм туберкулеза неприемлемо из-за еще сравнительно небольшого числа ВИЧ-инфицированных.
Имеющиеся публикации в нашей стране и за рубежом свидетельствуют о благоприятном исходе заболевания у впервые выявленных больных туберкулезом. В материалах ВОЗ отмечается, что к 2000 году во всех странах или в большинстве из них как результат лечения впервые выявленных больных можно ожидать прекращения выделения микобактерий туберкулеза у 85% из них. На основании результатов наблюдения за лечеными больными туберкулезом была сформулирована концепция о его излечении как закономерном исходе у впервые выявленных больных. Эффективность лечения больных туберкулезом зависит от распространенности воспалительных изменений, величины каверны при деструктивных формах, ее локализации, степени выраженности образующихся фиброзных изменений. Это было доказано в проведенных нами исследованиях и подтверждено другими авторами. При своевременном выявлении туберкулеза у 80—90% больных удается добиться прекращения выделения микобактерий и у 85— 87% — закрытия каверн.
Появление тяжелых форм туберкулеза вносит существенные поправки в эту концепцию. Прежде всего при обильном выделении микобактерий больными замедляется процесс уменьшения бактериальной популяции; даже при сохранении чувствительности микобактерий туберкулеза к химиопрепаратам требуется более длительный период для прекращения их выделения — до 5—6 мес. При наличии лекарственной резистентности, особенно к двум и более химиопрепаратам, процесс подавления размножения микобактерий еще более продолжительный, а у ряда больных после короткого перерыва выделение микобактерий возобновляется.
В последние годы появилось ошибочное мнение, согласно которому можно добиться излечения каждого больного туберкулезом, даже с тяжелыми, запущенными формами заболевания. Естественно, в настоящее время возможностей добиться этого значительно больше, чем в прежние годы, но они не безграничны, и при необратимых формах заболевания наступает смертельный исход, который в лучшем случае удается отсрочить на некоторое время.
Раннее выявление больных туберкулезом и проведение химиотерапии позволяют предотвратить развитие у них распространенных, прогрессирующих форм с выделением микобактерий и тем самым не допустить увеличения «резервуара» инфекции. Больного с начальными проявлениями заболевания проще лечить и гораздо легче добиться его излечения. При проведении среди населения или отдельных групп повышенного риска развития туберкулеза мероприятий с целью его ранней диагностики удается выявить больных активным туберкулезом; лиц с сомнительной активностью обнаруженных изменений; лиц с остаточными признаками излеченного туберкулеза; лиц с положительной туберкулиновой реакцией, в том числе «виражных»; больных, у которых выявляемые при рентгено
483
логическом исследовании изменения обусловлены нетуберкулезными заболеваниями (рак, пневмония, пневмокониозы и др.).
Для успешного осуществления комплекса противотуберкулезных мероприятий в федеральной программе борьбы с туберкулезом и на региональном уровне должны быть предусмотрены 9 ключевых позиций, как это рекомендует ВОЗ:
1) создание национального центра для руководства работой по осуществлению программы борьбы с туберкулезом;
2) обеспечение организационно-методического руководства всеми противотуберкулезными мероприятиями с разработкой необходимых
нормативных документов;
3) четкая регистрация больных туберкулезом и создание системы диспансерного наблюдения с использованием учетных и отчетных документов, в которых должны быть отражены результаты противотуберкулезной работы;
4) достаточное обеспечение подготовленными кадрами, осуществляющими противотуберкулезные мероприятия, и создание дейст
венной системы их подготовки и переподготовки;
5) создание системы учреждений, осуществляющих выявление больных туберкулезом, которые должны быть оснащены табельным
рудованием, обеспечивающим в первую очередь проведение эф-
фективного микроскопического и бактериологического исследований
материала;
6) организация лечебной службы, приоритетным направлением деятельности которой являлось бы проведение коротких курсов химиотерапии под контролем медицинского персонала. Для этой цели больше всего подходят отделения для лечения впервые выявленных больных в противотуберкулезных стационарах;
7) обеспечение регулярных поставок химиопрепаратов и диагностических средств для проведения химиотерапии зарегистрированным больным; организация материально-технической поддержки через систему распределения, чтобы гарантировать прием лекарств больными без перерыва в течение всего курса лечения;
8) разработка плана управления ключевыми операциями на промежуточном и районном уровнях и контроля за их проведением, который необходимо осуществлять с самого начала программы в виде системы мониторинга и оценки программных мероприятий;
9) подготовка плана развития для национальной (федеральной) программы борьбы с туберкулезом с подробными данными о бюджетном финансировании, его источниках и распределении ответст
венности.
Все девять ключевых позиций в России давно имеются и используются в борьбе с туберкулезом (возможны лишь некоторые терминологические различия). Таким образом, в России существуют реальные условия и возможности для усиления противотуберкулезной работы по трем основным направлениям.
I. Выявление бациллярных больных (с помощью микроскопического исследования мазка) и проведение их химиотерапии.
484
II. Раннее выявление больных (туберкулинодиагностика у детей и подростков, флюорография у взрослых) и проведение химиотера-
пии.
III. Профилактика туберкулеза (вакцинация и ревакцинация
детей и подростков, противоэпидемические меры в очагах инфекции, запрет на работу больных туберкулезом в тех сферах деятельности, где они будут представлять эпидемическую опасность, химиопро
филактика) .
Наконец, в нашей стране имеется разветвленная система науч-
но-исследовательских институтов, в которых проводят научные раз
работки по совершенствованию методов профилактики, диагностики
и лечения туберкулеза и их внедрению в практику с учетом региональных особенностей.
СПИСОК ЛИТЕРАТУРЫ
Авербах М. М. Туберкулемы легкого. — М.: Медицина, 1969.
Авербах М. М., Литвинов В. И.> Гергерт В. Я. и др. Иммунологические аспекты легочной патологии. — М.: Медицина, 1980.
Авербах М. М., Литвинов В. И. Иммунология и иммуногенетика туберкулеза: состояние и перспективы развития исследований//Пробл. туб. — 1989. — №2. — С. 65—69.
Авербах М. М., МорозА. М., АптА. С., Никоненко Б. В. Иммуногенетика инфекционных заболеваний. — М.: Медицина, 1985.
Агейченко Ф. С. Патологическая анатомия, патогенез и возрастные особенности туберкулеза центральной нервной системы. — Кишинев: Медицина, 1948.
Агейченко Ф. Е. Первичный туберкулез кишечника. — Кишинев: Медицина, 1960.
Александрова А. В. Рентгенологическая диагностика туберкулеза органов дыхания. — М.: Медицина, 1983.
Альперин М. М. Туберкулез пищеварительного тракта. — Киев: Здоров’я, 1950.
Андросова М. В., Владимирский М. А., Алексеев Г. И. Иммунологический метод идентификации М. tuberculosis и М. bovis (БЦЖ) на основе примеения моноклональных антител//Пробл. туб. — 1989. — № 5. — С. 43—46.
Аренский В. А., Самусевич Л. И. Эпидемиологическая опасность бальных активным туберкулезом легких с неустановленным бактериовыделением//Пробл. туб. — 1989. — № 12. — С. 12—14.
Арутюнов А. И., Зозуля А. И., Оганесян С. С. Туберкулемы головного мозга. — Киев: Здоровья, 1959.
Барас Э. С. Причины несвоевременной диагностики туберкулеза легких в амбулаторно-поликлинической сети//Пробл. туб. — 1989. — №9. — С. 14—16.
Батиаш.вили О. Г. Химиопрофилактика туберкулеза. — Тбилиси: Сабчота Сакарт-вело. — 1980.
Биохимия во фтизиатрии/Под ред. Г. О. Каминской//Сб. тр. ЦНИИТ М3 СССР. — М., 1982. — Т. 34.
Бронхолегочный туберкулез у детей раннего возраста/Под ред. С. В. Рачинского. — М.: Медицина, 1970.
Васильев А. В., Петров И. Н. Состояние и перспективы борьбы с внелегочным ту-беркулезом//Пробл. туб. — 1987. — № 2. — С. 10—12.
Васильев М. И., Федоров В. К, Бодров А. А. и др. Методы повышения бактериологического подтверждения туберкулеза органов дыхания//Пробл. туб. — 1989- — № 3. — С. 55-57.
Вильдерман А. М., Евграфова 3. А., Бусыгина Р. Н. Поражение печени у больных туберкулезом. — Кишинев: Штиинца, 1977.
Вопросы организации лечебно-диагностической помощи больным внелегочным туберкулезом. — Л.: Медицина, 1979.
Грацианский В. П., Хохлов Д. К Диагностика начальных форм костно-суставного туберкулеза. — Л.: Медицина, 1965.
Греймер М. С., Коровина О. В., Соболева Л. Г. и др. Хронические неспецифические заболевания легких у больных туберкулезом органов дыхания//Пробл. туб. — 1989. — № 10. — С. 56—59.
486
Греймер М. С., Штейнцайг А. И., Корелин В, К, СтрепетоваТ. Н. Причины формирования деструктивного туберкулеза легких//Пробл. туб. — 1989. — №7. — С. 3—5.
Двойрин М, С., Лаптева Я. А., Кучер Т, С., Поповская А. Д Эволюция заболеваемости туберкулезом и определяющие ее факторы на различных этапах борьбы с этим заболеванием//Пробл. туб. — 1989. — № 1. — С. 5—7.
Дифференциальная туберкулеза. — Минск, 1984.
Ерофеев П. П. Туберкулез головного, спинного мозга и мозговых оболочек. — М.: Медицина, 1962.
Ерохин В. В., Ельшанская М. П СПИД и его проявления в виде туберкулеза и другой патологии легких//Пробл. туб. — 1989. — № 1. — С. 67—70.
Есипова И. К Патологическая анатомия легких. — М.: Медицина, 1976.
ЗахароваР. И., Рахимов А. X, МорозъкоЕ.Б. Организация профилактических мероприятий среди детей, проживающих в очагах туберкулезной инфекции на селе//Пробл. туб. — 1989. — № 12. — С. 16—19.
Земскова 3. С., Дорожкова И, Р. Скрыто протекающая туберкулезная инфекция. — М.: Медицина, 1984.
Инструкция по применению вакцины туберкулезной (БЦЖ) сухой для внутрикожного введения при массовой вакцинации и ревакцинации против туберкуле-за//Пробл. туб. — 1989. — № 8. — С. 66—68.
Инструкция по применению вакцины туберкулезной (БЦЖ-М) сухой для внутрикожного введения недоношенным новорожденным с массой тела 2000 г и выше, а также детям, не получившим вакцинацию в роддоме по медицинским противопоказаниям и подлежащим вакцинации в детских поликлиниках//Пробл. туб. — 1989. — №8. — С. 64—66.
Инструкция по применению туберкулиновых проб//Пробл. туб. — 1989. — № 10. — С. 49—51.
Калечиц О. М., Алъхимович В. А, Туберкулез и Чернобыльская трагедия: состояние и прогноз//Пробл. туб. — 1990. — № 11. — С. 14—16.
Камышан И, С., Погребинский В. М. Туберкулез мочевых органов. — Киев: Здоровье, 1987.
Каминская Г. О.> Келеберда К Я,, Ходжаева Р. А. Генетические детерминированные типы гаптоглобина у больных туберкулезом легких//Пробл. туб. — 1986. — № 2. — С. 50—52.
Каневская С. С., Смирнов Е. А., Красотченко Л, К, Сахарова О. П. Первичная инвалидность вследствие туберкулеза//Пробл. туб. — 1990. — № 12. — С. 16—19.
Карачунекий М. А. Туберкулез легких и сахарный диабет//Пробл. туб. — 1990. — № 4. — С. 60—63.
Ковалева С. Я., Моделевский Б. С., Новожилова И. А. Формирование VII группы диспансерного наблюдения с учетом больных хроническими неспецифическими болезнями органов дыхания//Пробл. туб. — 1989. — № 11. — С. 14—16.
Коваленко К Я. Туберкулез костей и суставов у детей и подростков//Туберкулез у детей и подростков (руководство для врачей). — Л.: Медицина, 1987. — С. 170—178.
Колачевская Е. Я. Туберкулез женских половых органов. — М.: Медицина, 1975. Корнев П Г. Хирургия костно-суставного туберкулеза. — Л.: Медицина, 1971. Корякин В. А., Ржавсков Ю. В, Лечение легочных кровотечений у больных туберкулезом органов дыхания//Пробл. туб. — 1990. — № 2. — С. 51—54.
КостюринаГ. Н. Особенности течения заболеваний у подростков//Актуальные проблемы медицинского обеспечения подростков. — М.: Медицина, 1983. — С. 14—16.
Кунлщкий Е. М. Медицинская и социально-трудовая реабилитация при туберкулезе органов дыхания. — Кишинев: Штиинца, 1985.
Кучеров А Л., Рыбкина Т. А., Матвеева Т. И. Формирование групп населения с по-
487
вишенным риском заболевания туберкулезом//Пробл. туб. — 1990. — № 10. — С. 14—16.
Лечение туберкулеза//Руководящие принципы для национальных программ. — Всемирная организация здравоохранения. — Женева, 1994.
Лешукович Ю. В,, Фейгин М. И. Противотуберкулезная работа на селе. — Л.: Медицина, 1976.
Литвинов В. И., ГильбурдБ. Ш., Черноусова Л. Я., Романова Р. Ю. Антигены микобактерий туберкулеза//Пробл. туб. — 1989. — № 10. — С. 68—72.
Лукомский Г. И., Шулутко М. П., Виннер М. Г., Овчинников А. А. Бронхопульмонология, — М.: Медицина, 1982.
Любкина Н. И. Пути выявления больных туберкулезом//Пробл. туб. — 1990. — № 2. — С. 15—17.
Магзумов Б. X. Клинико-рентгенологическая диагностика туберкулеза кишечника. — Ташкент: Медицина, 1965.
Методические рекомендации по диагностике маловыраженных форм туберкулеза внутригрудных лимфатических узлов у детей. — Минздрав СССР. — М., 1983.
Методические указания по группировке контингентов противотуберкулезных диспансерных учреждений//Пробл. туб. — 1996. — № 2. — С. 51—56.
Мирзоян Э. Э. Туберкулезный илеотифлит. — М.: Медгиз, 1958.
Мирзоян Э. 3. Теория и практика туберкулинотерапни туберкулеза. — М.: Медицина, 1970.
Митинская Л, А., Де мешка Я. Д.г Ефимова А. А, н др. Сравнительная оценка эффективности вакцинации новорожденных вакцинами БЦЖ и БЦЖ-М//Пробл. туб. — 1990. — № 12. — С. 3—5.
Мочалова Т. П., Волович Л. Я. Хирургическое лечение больных туберкулезом мочевых органов. — Киев: Здоровье, 1983.
Организация активного выявления и современные методы диагностики туберкулеза глаз: Методическое письмо. — М., 1988.
Положение о противотуберкулезном диспансере, диспансерном отделении, кабинете поликлиники (больницы)//Пробл. туб. — 1989. — № 7. — С. 62—64.
Помельцов К. В. Рентгенологическая диагностика туберкулеза легких, — М.: Медицина, 1971.
Поражения спинного мозга при заболеваниях позвоночника. — М.: Медицина, 1972.
Проблемы наел ественн ости при болезнях легких. — М.: Медицина, 1990.
Прозоров А. Е . Рентгенодиагностика туберкулеза легких. — М. — Л.: Медгиз, 1940.
Пузик В. Я., Уварова О. А., Авербах М. М. Патоморфология современных форм легочного туберкулеза. — М.: Медицина, 1973.
Рабухин А. Е. Туберкулез органов дыхания у взрослых. — М.: Медицина, 1976.
Рабухин А. Е, Уnumep М. 3. О взаимоотношении рака с туберкулезом легких//Вопр. онкол. — 1971. — С. 24—32.
Раннее выявление, диагностика, клиника и лечение туберкулеза мочеполовой системы: Метод, рекомендации. — М., 1976.
Резник Б. М. Туберкулез мужских половых органов. — М.: Медицина, 1972.
Репин Ю. М. Патогенез и классификация вне легочных форм туберкулеза//Пробл. туб. — 1989. — № 4. — С. 65—68.
Рудой Я. М. О классификации очагов туберкулезной инфекции//Пробл. туб. — 1978. — № 1. — С. 15—18.
Рудой Я. М., Чубаков Т. Ч. Туберкулез легких и алкоголизм. — М.: Медицина, 1985.
Рудой Я. М., Худушина Т. А., Абрамовская А. К. и др. Организация ревакцинации БЦЖ лиц молодого возраста//Пробл. туб. — 1990. — № 3. — С. 3—5.
Рудченко Ю. А. Критерии излеченности, латентности и активности туберкулезных поражений кожн//Туберкулез. — Киев, 1978. — С. 100—102.
Руководство по клинической физиологии дыхания. — Л.: Медицина, 1990.
488
Савенков Д И., Олиферовская Р. П., Андрюшина К. М. и др. Патоморфоз кониоту-беркулеза//Пробл. туб. — 1989. — № 2. — С. 29—31.
Синакевич Н. А. Туберкулезный перитонит и мезаденит. — М.: Медгиз, 1959.
Соколов В. А., Егоров Е. A.t Фадина О. В., Халикова И. В. Диагностика активности силикотуберкулеза//Пробл. туб. — 1989. — № 10. — С. 33—35.
Справочник по пульмонологии. — Л.: Медицина, 1988. — 224 с.
Струков А. И., Соловьева И. П. Морфология туберкулеза в современных условиях. — М.: Медицина, 1976.
Стручков В. И., Лохвицкий С. В. Бронхологические методы при заболеваниях легких. — М.: Медицина, 1972.
Тарасова Е. Ф. Туберкулез мозговых оболочек в последние годы//Пробл. туб. — 1990. - № 1. - С. 71—73.
Тареев Е. М. Ревматизм Понсе//Тер. арх. — 1976. — № 1. — С. 71—78.
Туберкулез у детей. — М.: Медицина, 1976.
Туберкулез легких и сопутствующие заболевания. — М.: Медицина, 1977.
Туберкулез мочеполовой системы: Руководство для врачей/Под ред. Т. П. Мочаловой. — М.: Медицина, 1993.
Туберкулез органов дыхания/Под ред. А. Г. Хоменко. — М.: Медицина, 1988.
Федотова 3. Я. Лечение туберкулеза легких у беременных. — М.: Медицина, 1969.
Филиппов В. П. Броихологические методы исследования в дифференциальной диагностике туберкулеза. — М.: Медицина, 1979.
Футер Д С. Дифференциальная диагностика и лечение туберкулезного менингита. — М.: Медицина, 1964.
Харчева К. А. Коллапсотерапия в комплексном лечении больных туберкулезом легких. — Л.: Медицина, 1972.
Харчева К. А., Ермолаева С. П. Диагностика туберкулеза мезентериальных лимфатических узлов. — Л.*. Медицина, 1975.
Химиопрофилактика туберкулеза: Инструкция//Пробл. туб. — 1989. — N° 4. — С. 54—57.
Химиотерапия больных туберкулезом легких: Методические указания. — М., 1983.
Химиотерапия туберкулеза легких/Под ред. А. Г. Хоменко. — М.: Медицина, 1980.
Хирургия внелегочного туберкулеза. — Л.: Медицина, 1983.
Хирургическое лечение туберкулеза легких/Под ред. Л. К. Богуша. — М.: Медицина, 1979.
Хмельницкий О. К. Патология лимфатических узлов. — Л.: Медицина, 1980.
Ченцова О. Б. Туберкулез глаз. — М.: Медицина, 1990.
Чистович А. Я. Патологическая анатомия и патогенез туберкулеза. — Л.: Медицина, 1973.
Чумаков Ф. И., Лукьянова М. А. Туберкулез гортани в настоящее время//Пробл. туб. — 1989. — № 4. — С. 58—60.
Шабад А. Л. Туберкулез почки. — Ташкент: Медицина, 1978.
ШестеринаМ. В. Изменения бронхов при туберкулезе легких. — М.: Медицина, 1976.
Шмелев Н. А., Степанян Э. С. Побочное действие противотуберкулезных препаратов. — М.: Медицина, 1977.
Шнипас П. А., Плаушинене Т. А., Мешкинис В. Й. Поражение серозных оболочек при туберкулезе у взрослых//Пробл. туб. — 1990. — №8. — С. 54—56.
ЮкелисЛ.И. Раннее выявление туберкулеза с помощью флюорографических ис-следований//Пробл. туб. — 1990. — №5. — С. 61—64.
Яблоков Д. Д, Галибина А. И. Туберкулез легких в сочетании с внутренними болезнями. — Томск: Изд~во Томск, ун-та, 1976.
Ященко Б. П. Туберкулез легких у лип пожилого и старческого возраста. — Киев: Здоров’я 1969.
489
Cordier Y. F. Fievre proIongee par tuberculose miliaire hepatique medullaire//Lyon Med. — 1978. — Vol. 240, N 16. — P. 239—242.
Crofton J., Horne N., Miller F. Clinical Tuberculosis. — Macmillan, 1992.
Damato J. J.t Collins M. T., Rothlauf M. V. et al Detection of mycobacteria by radiometric and standard plate procedures//}. Clin. Microbiol. — 1983. — Vol. 17, N 6. — P. 1066—1073.
Danneberg A. M. Pathogenesis of Pulmonary Tuberculosis//Amer. Rev. resp. Dis. — 1982. — Vol. 125, N 3. — P. 25—29.
Hazama 5. Hematological Abnormalities in miliary Tuberculosis//Kekkaku. — 1978. — Vol. 58, N 22. — P. 1525—1531.
Krebs A., Steinbriick A, PengerF., Weise L. Perspektiven der Tuberkulosebekampfung — Rolle der praventiven Chemotherapie//Z. Erkr. Atm. — 1979. — Bd 153, H. 1. — S. 60—65.
LaszloA., Michaud R. Primary isolation, preliminary identification and drug susceptibility testing of the M. tuberculosis complex by a rapid radiometris method//Bull. Int. Un. Tuberc. — 1982 — Vol. 57, N 1 — P. 54.
Miyazaki W. Clinicopathological and immunological studies of pulmonary tuberculosis in the aged//Kekkaku. — 1983. — Vol. 58, N 8. — P. 427—433.
PetersenKF. Empfindlichkeitsprufiingen von Tuberkulosebakterien: Eine Verlaufsbeobachtung//Prax. Pneumol. — 1983. — Bd 37, H. 9- — S. 385—389
Raviglione M. C., Rieder H. Л, StybloK et al. Tuberculosis Trends in Eastern Europe and the Former USSR//Tubercle and Lung Disease. — 1994. — Vol. 75. — P. 400—416.
Roberts G., Goodman N. L, Heifets Л et al. Evaluation of the BACTEC radiomatric method for recovery of mycobacteria and drug susceptibility testing of M. tuberculosis from acid-fast smear positive specimens//}. Clin. Microbiol. — 1983. — Vol. 18, N 3. — P. 689—696.
Snider D. E., LaydeP.M., Johnson M. W. et al. Treatment of tuberculosis during pregnancy//Amer. Rev. Resp. Dis. — 1980. — Vol. 122, N 1. — P. 65—79.
Toldisan V., Didilescu C.t Filip G. Aspecte ale chimiorezistentei bacilului Koch in perioada 1971 —1980//Pneumoftiziologia. — 1983. — Vol. 32, N 1. — P. 53—57.
Toman К Tuberculosis. Case Finding and Chemotherapy//Questions and answers. — World Health Organization. — Geneva, 1979.
Tripathi К Leukemoid Reaction in Tuberculosis//}. Indian med. ass. — 1984. — Vol. 82, N 2. — P. 42—48.
Tuberculosis. Back to the Future/Ed. }. Porter, K. McAdam. — Chichester, 1994.
Tuberculosus!Guide for Low Income Countries. — International Union Against Tuberculosis and Lung Disease, 1994.
Tuberculosis Control/A Manual on Methods Procedures for Integrated Programs. — Pan American Health Organization, 1986.
Van der Kuyp F. Me., Coklough G. P., Daniel T. M. Preventive treatment of tuberculosis//Bull. Int. Un. Tuberc. — 1982. — Vol. 57, N 1. — P. 81—81.
ОГЛАВЛЕНИЕ
Предисловие. К И. Чазов........................................ 5
От автора А. Г. Хоменко..........................................7
Глава 1. Этиология. Патогенез. Патологическая анатомия. М М. Авербах, В. В. Ерохин..................................... 9
1.1. Возбудитель туберкулеза, строение, изменчивость микобактерий туберкулеза ............................................... 9
1.2. Патогенез................................................ 14
1.3. Патологическая анатомия................................ 19
1.3.1. Туберкулезное воспаление.............................19
1.3.2. Первичный туберкулез.................................22
1.3.3. Диссеминированный туберкулез ........................24
1.3.4. Очаговый туберкулез ............................... 26
1.3.5. Инфильтративный туберкулез ..........................27
1.3.6. Туберкулема..........................................28
1.3.7. Деструктивный туберкулез легких......................30
Глава 2. Иммунология и генетика. В, И. Литвинов.................36
2.1. Иммунологический статус больных туберкулезом, вопросы прогноза и иммунодиагностики ...................................36
2.2. Механизмы противотуберкулезного иммунитета ................40
2.3. Роль наследственности .....................................47
2.4. Новые направления и перспективы исследований...............49
Глава 3. Эпидемиология. А. Г. Хоменко...........................51
Глава 4. Методы диагностики туберкулеза органов дыхания ........................................................66
4.1. Основные принципы диагностики. А. Г. Хоменко ..............66
4.2. Лучевая диагностика. Л. И. Дмитриева ......................74
4.3. Радионуклидные методы. А. Т. Сигаев........................88
4.4. Ультразвуковая диагностика. Т. В. Мацулевич ...............91
4.5. Туберкулинодиагностика. Л. А. Митинская....................95
4.6. Микробиологическая диагностика туберкулеза и микобактериозов. И. В. Дорожкова........................................102
4.7. Морфология крови при туберкулезе. Е. Д. Тимашева..........128
4.8. Инструментальные методы. В. П. Филиппов ..................131
4.9. Цитологические методы. Е. Д. Тимашева ....................145
4.10. Биохимические методы. Г. О. Каминская....................149
4.11. Иммунологические методы. В. Я. Гергерт ..................155
4.12. Исследование функции внешнего дыхания. В. В. Нефедов . . 162
Глава 5. Выявление больных туберкулезом среди населения. А, Г Хоменко ........................................... 174
491
Глава 6. Клинические формы туберкулеза органов дыхания. А. Г. Хоменко ......................................186
6.1. Классификация туберкулеза..............................186
6.2. Туберкулезная интоксикация ............................194
6.3. Первичный туберкулезный комплекс ......................195
6.4. Туберкулез внутригрудных лимфатических узлов...........200
6.5. Диссеминированный туберкулез легких....................202
6.6. Милиарный туберкулез ..................................215
6.7. Очаговый туберкулез легких .......................... 218
6.8. Инфильтративный туберкулез легких ................. 226
6.9. Казеозная пневмония............................... . 239
6.10. Туберкулема легких ...................................242
6.11. Кавернозный туберкулез легких.........................248
6.12. Фиброзно-кавернозный туберкулез легких................256
6.13. Цирротический туберкулез легких.......................263
6.14. Туберкулезный плеврит ................................271
6.15. Туберкулез гортани, трахеи и бронхов .................280
6.16. Туберкулез органов дыхания, комбинированный с пылевыми профессиональными заболеваниями легких...................281
Глава 7. Особенности течения туберкулеза органов дыхания у больных старших возрастных групп и с сопутствующими заболеваниями. А. Г. Хоменко.........................283
7.1. Туберкулез у лиц пожилого и старческого возраста.......283
7.2. Туберкулез и сахарный диабет ..........................286
7.3. Туберкулез и неспецифические заболевания легких .......290
7.4. Туберкулез и рак легкого ..............................293
7.5. Туберкулез и СПИД .....................................295
7.6. Алкоголизм, туберкулез и другие заболевания легких .... 298
Глава 8. Дифференциальная диагностика туберкулеза органов дыхания. А. Г, Хоменко............................ . . 307
Глава 9. Лечение туберкулеза. А. Г. Хоменко.................316
9.1. Общие принципы лечения ................................316
9.2. Основные принципы химиотерапии ........................330
9.3. Противотуберкулезные препараты.........................337
9.4. Методика химиотерапии у впервые выявленных больных . . . 338
9.5. Методика химиотерапии у больных, ранее леченных химиопрепаратами ................................................339
9.6. Патогенетические методы лечения .......................346
9.7. Коллапсотерапии........................................351
9.8. Оперативные вмешательства при туберкулезе органов дыхания................................................... 360
9.9. Экстренная медицинская помощь при неотложных состояниях и осложнениях .........................................361
9.10. Санаторно-климатическое лечение ......................365
Глава 10. Прогноз, реабилитация и экспертиза трудоспособности больных туберкулезом. А. Г. Хоменко, Т.А. Худушина ..................... 367
Глава 11. Профилактика туберкулеза. А. Г. Хоменко ...... 374
11.1. Вакцинация новорожденных и ревакцинация БЦЖ...........374
492
11.2. Меры по ограждению наиболее угрожаемых контингентов от больных заразными формами туберкулеза и недопущению больных к работе в некоторых профессиях ....................379
11.3. Профилактика туберкулеза среди лиц с повышенным риском возникновения заболевания................................381
Глава 12. Организация противотуберкулезной работы. А. Г. Хоменко .................................................386
Глава 13. Внелегочный туберкулез ..............................395
13.1. Общие принципы диагностики, лечения и наблюдения за больными. И. Г, Маракуша.....................................395
13.2. Туберкулез глаз. Т. Е. Выренкова ........................398
13.3. Туберкулез кожи и подкожной жировой клетчатки. М. И. Шаповал ..................................................410
13.4. Туберкулез костей и суставов. И. Г. Маракуша ............420
13.5. Туберкулез периферических лимфатических узлов. А. И. Акуличева.................................................431
13.6. Туберкулез мозговых оболочек и центральной нервной системы. В. Ф. Елуфимова .......................................438
13.6.1. Туберкулезный менингит............................438
13.6.2. Туберкулема мозга ................................449
13.6.3. Поражения нервной системы при туберкулезном спондилите ...............................................452
13.7. Туберкулез мочевых и половых органов. Н. В. Морозов, И. Т. Патрикян..................................................455
13.7.1. Туберкулез мочевых органов ..................455
13.7.2. Туберкулез половых органов у мужчин...............461
13.7.3. Туберкулез половых органов у женщин ..............465
13.8. Абдоминальный туберкулез. А. И. Акуличева ...............470
Глава 14. Туберкулез как глобальная и национальная проблема здравоохранения. А. Г. Хоменко .......................479
Список литературы .............................................486
Руководство по внутренним болезням
ТУБЕРКУЛЕЗ
Зав. редакцией А. К. Владимирова Научный редактор Е. А. Гоголина Редактор издательства Н. В. Кирсанова Редактор Н. И. Чуканова Художественный редактор Т С. Тихомирова Технический редактор В. И. Табенская Корректор М П. Молокова
ЛР № 010215 от 11.03.92.
Сдано в набор 09.04.96.
Подписано к печати 14.08.96.
Формат бумаги 60><901/1б*
Бумага офсетная № 1 Гарнитура тайме. Печать офсетная. Усл. печ. л. 31,0. Усл. кр.-отт. 31,0.
Уч.-изд. л. 35,87. Тираж 5000 экз.
Заказ № 1213. «С» 069.
Ордена Трудового Красного Знамени издательство «Медицина»
101000, Москва, Петроверигский пер., 6/8
ОАО «Ярославский полиграфкомбинат» 150049, г. Ярославль, ул. Свободы, 97.