Author: Мак-Мюррей У.
Tags: материальные основы жизни биохимия молекулярная биология биофизика физиология человека
Year: 1980
Text
У Мак -Мюррей
ОБМЕН ВЕЩЕСТВ
У ЧЕЛОВЕКА
ESSENTIALS OF HUMAN
METABOLISM
The Relationship of Biochemistry to
Human Physiology and Disease
w. c. McMurray Ph. d.
Professor, Department of Biochemistry,
Faculties of Medicine and Dentistry,
University of Western Ontario, London, Ontario
Medical Department Harper and Row,
Publishers Hegerstown, Maryland
New York, San Francisco, London
У. Мак-Мюррей
ОБМЕН ВЕЩЕСТВ
У ЧЕЛОВЕКА
Основы учения о взаимосвязи биохимии
с физиологией и патологией
Перевод с английского
проф. В. 3. Горкина
МОСКВА
ИЗДАТЕЛЬСТВО «МИР»
980
УДК 577.1
Книга представляет собой сводку современных данных
о метаболических процессах и их регуляции в организме чело-
века. Вначале приведены краткие общие сведения о биополи-
мерах, в том числе о ферментах, затем рассмотрены передача
генетической информации, биосинтез белка, энергетика метабо-
лизма, пути превращений основных биологических молекул.
Далее описаны особенности течения биохимических реакций
у человека, которые сопоставлены с физиологическими процес-
сами и их нарушениями, приводящими к патологии.
Предназначена для биохимиков, физиологов, гепетиков,
цитологов, врачей и для студентов и аспирантов биологических
и медицинских специальностей.
Редакция литературы по биологии
2007000000
21005-126
М 041 (01)-80 126-8°
© 1977, by Harper and Row, Publishers
© Перевод на русский язык, «Мир», 1980
ОТ ПЕРЕВОДЧИКА
В предлагаемой вниманию читателей книге «Обмен веществ у
человека. Основы учения о взаимосвязи биохимии с физиологией
и патологией» профессор У. Мак-Мюррей талантливо решает труд-
ную задачу: объяснить простыми словами, какую пользу приносит
медицине биохимия. Стремясь сделать изложение легко понятным
каждому человеку со средним образованием, автор ограничивает
число используемых в книге специальных терминов лишь самыми
необходимыми. При первом упоминании приводится объяснение
каждого термина, и, кроме того, тексту предпослан специальный
словарь, в котором дается краткое определение основных понятий.
Автор стремится не только преподать читателю основы биохи-
мии или вооружить его кратким справочно-библиографическим по-
собием по этой науке. Он надеется увлечь своих читателей захваты-
вающе интересными проблемами биохимии, рассказав живым, пре-
дельно ясным языком о том, какие фундаментальные проблемы со-
временной биологической науки решает биохимия и какое первосте-
пенное значение имеют научные работы в области биохимии для
клинической медицины.
Для того чтобы создать краткую, легко читаемую и запоминаю-
щуюся книгу, У. Мак-Мюррей решил не излагать в ней обширного
описательного материала современной биологической химии, кото-
рый можно найти во всех учебниках и специальных монографиях.
Он уделил основное внимание тем актуальным проблемам биохи-
мии, которые, во-первых, можно легко изложить интересно и ясно
(порой за счет некоторого упрощения или отказа от изложения
спорных вопросов) и, во-вторых, значение которых для физиологии
и патологии человека хорошо понятно уже в наши дни (возможно, в
будущем оценка актуальности тех или иных разделов биохимии и
их влияния на решение практических задач медицины изменится).
Уделяя много внимания обсуждению биохимических механизмов
возникновения и развития патологических состояний у человека,
Мак-Мюррей приводит также примеры, демонстрирующие вклад
биохимии в создание новых методов терапии при помощи химичес-
ких соединений.
В конце каждой главы автор приводит рекомендуемую литера-
туру — главным образом обзорные статьи, опубликованные в США
6
ОТ ПЕРЕВОДЧИКА
за последние годы. Читателю полезно знать о том, что обзорные
статьи по всем обсуждаемым в книге проблемам регулярно публи-
куются на русском языке. Эти статьи легко найти в журналах «Ус-
пехи современной биологии», «Вопросы медицинской химии», «Био-
химия», «Молекулярная биология», в ежегоднике «Успехи биологи-
ческой химии». В последние годы вышли в свет специальные тема-
тические номера «Журнала Всесоюзного химического общества им.
Д. И. Менделеева», посвященные актуальным проблемам биологи-
ческой и медицинской химии. Много ценной информации обобщено
в изданных за последние 10—15 лет монографиях отечественных
авторов по проблемам биологической и медицинской химии, таких,
как Арчаков А. И. Микросомальное окисление.— М.: Наука, 1975;
Березов Т. Т. Обмен аминокислот нормальных тканей и злокаче-
ственных опухолей.— М.: Медицина, 1969; Владимиров Ю. А.,
Арчаков А. И. Перекисное окисление липидов в биологических
мембранах.— М.: Наука, 1979; Мазуров В. И. Биохимия коллаге-
новых белков.— М.: Медицина, 1974; Матлина Э. Ш., Меньши-
ков В. В. Клиническая биохимия катехоламинов.— М.: Медицина,
1967; Овчинников Ю. А., Иванов В. Т., Шкроб А. М.— Мембрано-
активные комплексы.— М.: Наука, 1974; Молекулярные основы па-
тологии./Под ред. В. Н. Ореховича.— М.: Медицина, 1966; Хими-
ческие факторы регуляции активности и биосинтеза ферментов./
Под ред. В. Н. Ореховича.— М.: Медицина, 1969; Протасова Т. Н.
Гормональная регуляция активности ферментов.— М.: Медицина,
1975; Скулачев В. П. Аккумуляция энергии в клетке.— М.: Наука,
1969; Спирин А. С., Гаврилова Л. П. Рибосома.— 2-е изд.— М.:
Наука, 1971; Торчинский Ю. М. Сера в белках.— М.: Наука,
1977; Шапот В. С. Нуклеазы.— М.: Медицина, 1968 и др.
В перечисленных монографиях можно почерпнуть материалы,
дополняющие и детализирующие основные положения, излагаемые
Мак-Мюрреем.
Есть все основания надеяться, что книга найдет своего читателя
и будет встречена с большим удовлетворением.
В. 3. Горкин
Памяти Роджера Д. Росситера
(1913—1976),
Наставника и Вдохновителя,
Пионера нейрохимии,
Энергичного руководителя,
Человека, талантливого во всем
ПРЕДИСЛОВИЕ
Как-то при мне молодой человек с выражением крайней озабо-
ченности на лице, характерным для студента-медика перед экза-
меном, обратился к библиотекарю: «Нет ли у Вас чего-нибудь попро-
ще по акушерству?» Для такого же студента младшего курса, кото-
рый ищет для себя «чего-нибудь попроще» по биохимии, я и написал
эту книгу.
Моя цель — объяснить сущность процессов обмена веществ и
их регуляции в организме человека. Я особенно стремился под-
черкнуть связь биохимии с физиологией и патологией человека.
Обсуждение особенностей обмена веществ в отдельных органах и
тканях представлено не в виде приложения к основному материа-
лу, а составляет его неотъемлемую часть.
Поставив перед собой в качестве основной задачи объяснение
взаимопревращений химических компонентов в организме человека,
я опустил детали, касающиеся структуры и свойств этих компо-
нентов. Сосредоточив внимание на наиболее общих проблемах об-
мена веществ, как бы глядя в перевернутый бинокль и сознательно
не рассматривая отдельных деревьев, я хотел сделать лес метаболи-
ческих процессов проходимым для будущего клинициста. Зная, что
специальная терминология создает для студента дополнительные
трудности, я пытался ограничить число используемых в книге
терминов самыми необходимыми и дать точное определение каждого
нового термина (они выделяются курсивом) при первом его упоми-
нании в тексте. Определения, раскрывающие смысл большинства
обычных биохимических терминов, собраны в отдельный раздел
(Словарь терминов), который предпослан основному тексту.
Глава 1, открывающаяся описанием простых молекулярных
структур, характеризует принципы построения гигантских полиме-
ров и мембранных структур клеток. В главе 2 обсуждаются общие
свойства ферментов, а также генетические и физиологические фак-
торы, модифицирующие их активность. Сведения о важнейших си-
стемах переноса энергии при биологическом окислении и процессах
активного транспорта продуктов обмена суммированы в главе 3.
В последующих трех главах рассматриваются углеводы, липиды и
азотистые соединения — процессы переваривания, всасывания,
переноса и регуляции постоянства концентрации важнейших биохи-
8
ПРЕДИСЛОВИЕ
мических компонентов в системах органов, отдельных органах и
тканях —в желудочно-кишечном тракте, печени, мышцах, жировой
ткани, мозге, почках и эритроцитах. Подробно рассматриваются
особенности метаболических путей и механйзмов их регуляции в
отдельных тканях, а также нарушения реакций обмена при пато-
логических состояниях с поражением этих тканей.. Наконец, в гла-
ве 7 сделана попытка обобщить представления о биохимических
взаимосвязях между системами органов, приведены примеры нару-
шений взаимосвязи процессов обмена веществ и явлений адаптации
организма в условиях голодания и избыточного питания.
Сумма наших знаний о процессах обмена у человека и понима-
ние их сущности растут с каждым днем благодаря усилиям исследо-
вателей, разрабатывающих клинические и теоретические проблемы.
Серьезные успехи часто бывают неожиданным результатом изуче-
ния млекопитающих, позвоночных вообще и даже насекомых и дру-
гих беспозвоночных, дрожжей, растений и микроорганизмов. Нам
следовало бы иметь в виду и высоко ценить тот вклад в медицинскую
науку, который связан с изучением этих, так называемых «низших»,
форм жизни. Сосредоточив свое внимание на проблеме обмена ве-
ществ у человека, я опустил для краткости описание отдельных
исследований, проведенных на самых разнообразных живых орга-
низмах. Отдавая должное как исследователям, так и объектам их
биохимических исследований, я должен подчеркнуть, что данная
книга предназначена в первую очередь для будущего клинициста,
но не для биохимика или знатока Escherichia coli.
Многие из моих сотрудников проявили интерес к этой книге,
высказали одобрение и дали советы, касающиеся характера изло-
жения. В особенности мне хотелось бы с благодарностью отметить
помощь двух коллег — Билла Мэджи и Валентины Дониш, которые
прочитали всю рукопись «от корки до корки», не пожалев времени
и сил при формулировании конкретных предложений по улучшению
текста. Я благодарен г-же Дорис Лессер, отпечатавшей рукопись,
а также сотрудникам издательства «Харпер энд Роу», оказавшим
очень большую помощь в осуществлений замысла этой книги.
У. Мак-Мюррей
СЛОВАРЬ ТЕРМИНОВ
АДЕНИЛЦИКЛАЗА (синоним: аденилатциклаза) (см. также цик-
лический АМФ) — фермент, локализованный в плазматической мем-
бране клеток, имеющий регуляторную субъединицу на наружной
и каталитическую субъединицу на внутренней поверхности этой
мембраны. Взаимодействие регуляторной субъединицы с соответ-
ствующими внеклеточными гормонами стимулирует или подавляет
активность каталитической субъединицы, которая превращает АТФ
во внутриклеточный циклический АМФ.
АДЕНОЗИНТРИФОСФАТ (АТФ) — нуклеотид, в молекуле которого
имеется пуриновое основание аденин, связанное через рибозу с
тремя фосфатными группами, соединенными последовательно друг
с другом. АТФ служит главным химическим переносчиком энергии
при биохимических реакциях в клетке и образуется путем фосфо-
рилирования аденозиндифосфата (АДФ).
АДРЕНАЛИН — гормон мозгового слоя надпочечников, действу-
ющий на ткани-мишени, повышая концентрацию циклического
АМФ в клетках; ускоряет гликогенолиз в мышцах и в печени,
повышает содержание глюкозы в крови и активирует липолиз
в жировой ткани, повышая содержание жирных кислот в крови
(см. Катехоламины; синоним: эпинефрин).
АЗОТИСТЫЕ ЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ — группа гетеро-
циклических соединений, к которой относятся пиридин (C6H6N),
имеющийся в составе никотинамидных коферментов, пиримидин
(C4H4N2) и пурин (C5H4N4), обнаруживаемые в нуклеиновых ки-
слотах и нуклеотидах.
АКТИВНЫЙ ПЕРЕНОС — процесс, в котором используется энер-
гия для переноса того или иного вещества через мембрану из раст-
вора с более низкой концентрацией в раствор с более высокой кон-
центрацией (т. е. против градиента концентраций этого вещества).
АКТИВНЫЙ ЦЕНТР — область на поверхности молекулы фер-
мента, участвующая в связывании и активировании субстрата,
вступающего в реакцию (синоним: каталитический центр).
10
СЛОВАРЬ ТЕРМИНОВ
АМИНОКИСЛОТА — органическое соединение (мономерный ком-
понент молекулы белка), в молекуле которого углеводородный
остаток соединен с амино-(МН2) и карбоксильной-(СООН) группами.
АМИНОКИСЛОТЫ ЗАМЕНИМЫЕ — синтезируются в организме
в количествах, достаточных для обеспечения синтеза белка. В ор-
ганизме человека к числу заменимых аминокислот относятся ала-
нин, аспарагиновая кислота, аспарагин, цистеин, глутаминовая
кислота, глутамин, глицин, пролин, серин, тирозин.
АМИНОКИСЛОТЫ НЕЗАМЕНИМЫЕ — вообще не синтезируются
в организме или синтезируются недостаточно быстро и поэтому
должны доставляться извне в составе пищи. Для человека неза-
менимыми аминокислотами являются: аргинин, гистидин, изолей-
цин. лейцин, лизин, метионин, фенилаланин, треонин, триптофан,
еалин.
АМИНОТРАНСФЕРАЗА (синоним: трансаминаза) — один из пред-
ставителей группы ферментов, катализирующих отделение амино-
групп от аминокислоты, превращающейся в а-кетокислоту, с по-
следующим обратимым переносом —NH2 на вторую а-кетокислоту,
в результате чего образуется новая аминокислота.
АМФИПАТИЧЕСКОЕ СВОЙСТВО — особенность молекулы, в струк-
туре которой имеются зоны, значительно отличающиеся друг от
друга по растворимости, в результате чего одна часть молекулы
легко растворяется в воде (гидрофильная область), тогда как дру-
гая часть молекулы (гидрофобная область) мало растворяется
в воде.
АНАБОЛИЗМ — процессы биосинтетических превращений, тре-
бующие затраты энергии (например, образование макромолекул
из низкомолекулярных предшественников) (противоположное по-
нятие — катаболизм).
АНТАГОНИЗМ МЕТАБОЛИЧЕСКИЙ — противодействие эффекту
вещества под влиянием его структурного аналога, настолько сход-
ного с ним, что при реакциях обмена веществ между ними возникает
конкуренция (см. также Антиметаболит).
АНТИГЕН — вещество, встречающееся либо в свободном, либо в
связанном виде на поверхности клеток бактерий или тканей других
организмов, обладающее свойством вызывать образование специ-
фического белка — антител, а также способностью жадно и изби-
рательно связывать образующиеся антитела (см. также Иммуно-
протеин).
АНТИКОДОН — последовательность трех азотистых оснований в
транспортной РНК, комплементарная по отношению к триплету
кодона информационной РНК (см. также кодон, транспортная РНК).
АНТИМЕТАБОЛИТ — вещество, сходное по структуре с обычными
субстратами или коферментами и поэтому вступающее в конкурент-
СЛОВАРЬ ТЕРМИНОВ
11
ные взаимоотношения с ними в процессах обмена веществ, а также
противодействующее их биологическим эффектам.
АНТИТЕЛО — белок сыворотки крови, синтезируемый в ответ на
проникновение в организм чужеродного вещества (антигена).
Антитела избирательно связываются с агентами, обладающими
антигенными свойствами, нейтрализуя их токсичность или инфек-
ционность (см. также Иммунопротеин).
АПОФЕРМЕНТ — лишенный активности белковый компонент фер-
мента, остающийся после отделения кофактора или кофермента,
необходимых для каталитического действия. Апофермент способен
вновь приобретать каталитическую активность после присоеди-
нения простетической группы с образованием холофермента (см.
также Простетическая группа, Холофермент).
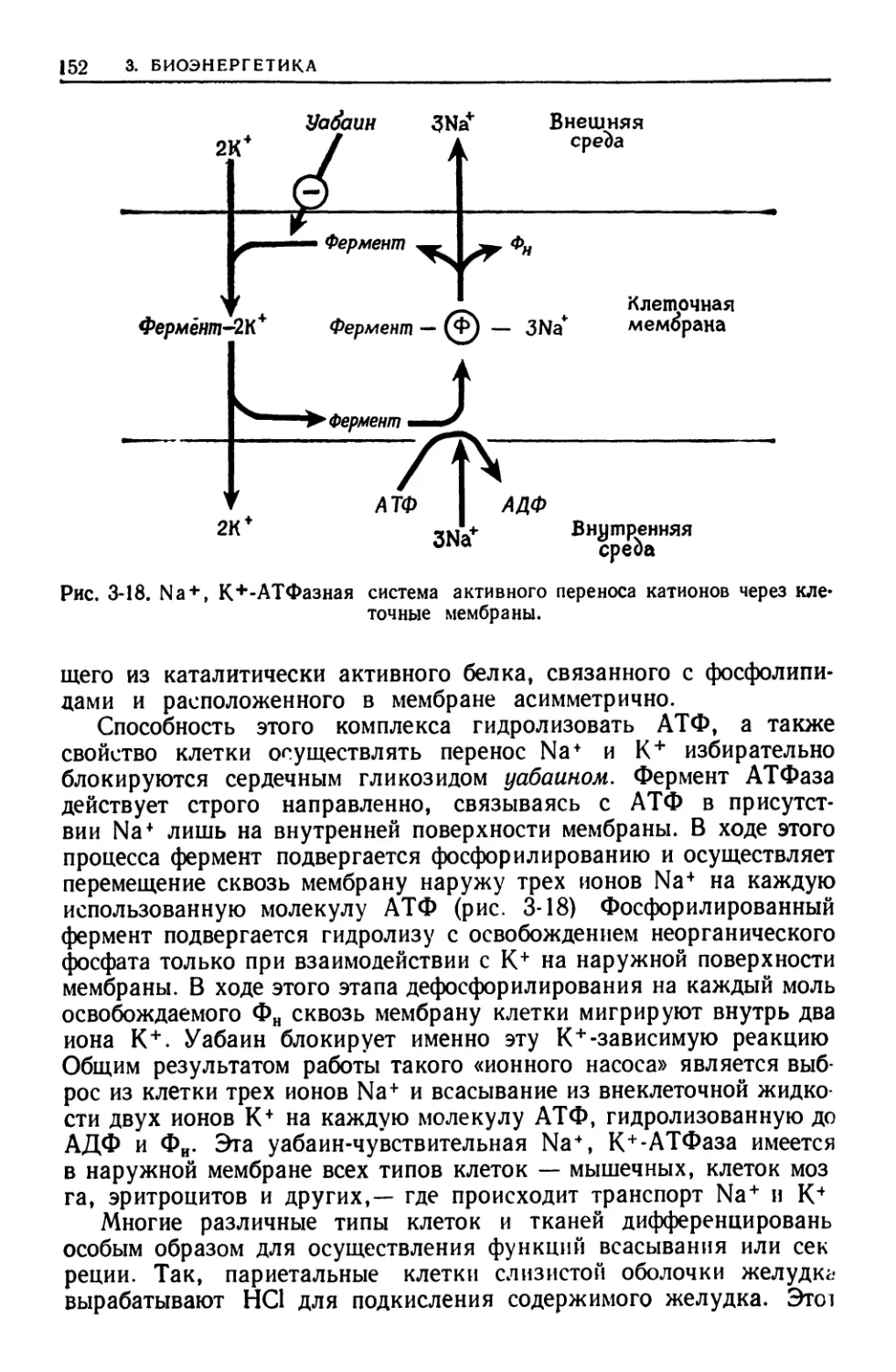
АТФаза Na+, К+-зависимая — система активного переноса, ис-
пользующая энергию гидролиза АТФ для переноса ионов натрия
через плазматическую мембрану из клетки с одновременным пере-
носом ионов калия в обратном направлении, т. е. в клетку.
АЦИДОЗ ДЫХАТЕЛЬНЫЙ (синоним: гиперкапнический ацидоз) —
снижение величины pH биологических жидкостей, обусловленное
накоплением избытка двуокиси углерода в организме.
АЦИЛ-ПЕРЕНОСЯЩИЙ БЕЛОК — полипептид, простетическая
группа которого — пантетеин — переносит обладающие тиоэфир-
ной связью промежуточные продукты биосинтеза жирных кислот
в цепи реакций, катализируемых синтетазой жирных кислот.
БЕЛОК — полимер, состоящий из аминокислот, соединенных пеп-
тидными (СО—NH) связями.
БЕТА (Р)-ОКИСЛЕНИЕ — протекающий в митохондриях фермен-
тативный процесс, посредством которого жирные кислоты подвер-
гаются окислительному распаду в ^-положении (второй углеродный
атом от карбоксильной группы). При этом последовательно осво-
бождаются двухуглеродные фрагменты (в виде ацетил-КоА), что
приводит к последовательному укорочению углеводородной цепи
в молекуле жирной кислоты.
БИЛИРУБИН (желчный пигмент) — продукт распада, образую-
щийся при размыкании порфиринового кольца в соединениях,
накапливающихся при распаде гема. В молекуле билирубина име-
ется четыре пиррольных кольца, соединенных между собой в пря-
мую цепь.
БИОЛОГИЧЕСКИЙ ПЕРИОД ПОЛУЖИЗНИ — время, необходи-
мое для обновления половины одного из нормальных биохимических
компонентов либо для выведения половины чужеродного вещества,
проникшего в организм.
12
СЛОВАРЬ ТЕРМИНОВ
БИСЛОЙ — двойной слой, образующийся в результате взаимодей-
ствия гидрофобных поверхностей двух липидных монослоев с
возникновением как бы «бутерброда» (сэндвича) толщиной в две
молекулы, в котором каждая из внешних сторон образована гид-
рофильными поверхностями (см. также Монослой).
ВИТАМИН — органическое соединение, встречающееся в следо-
вых количествах в пищевых продуктах, но не синтезируемое с
достаточной быстротой в организме и поэтому являющееся необ-
ходимым компонентом пищи. Витамины часто представляют собой
функциональные группы коферментов.
ВОЗБУЖДЕНИЕ НЕЙРОНОВ И МЫШЦ — изменение проница-
емости мембран в ответ на внешний стимул, который вызывает из-
менение мембранного потенциала благодаря перемещению катионов
(К+ и Na+) через клеточную мембрану (синоним: деполяризация).
ВОССТАНОВИТЕЛЬНОЕ АМИНИРОВАНИЕ — присоединение мо-
лекулы аммиака к а-кетокислоте с образованием а-аминокислоты
за счет энергии восстановления, поставляемой НАД • Н или НАДФ • Н
(противоположное понятие: окислительное дезаминирование).
ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ (Е„) — мера сродства того
или иного вещества к электронам; при стандартных условиях равен
электродвижущей силе (в вольтах) при наличии восстановленной
и окисленной форм исследуемого вещества в одномолярных кон-
центрациях.
ВРОЖДЕННОЕ НАРУШЕНИЕ ОБМЕНА ВЕЩЕСТВ — наследст-
венное заболевание, при котором дефект гена приводит к нарушению
синтеза фермента, обладающего нормальной каталитической ак-
тивностью.
ВТОРОЙ ПОСРЕДНИК — циклический нуклеотид (циклический
АМФ или циклический ГМФ), образующийся в эффекторной клетке
в результате взаимодействия не проникающего в клетку гормона
с наружной поверхностью клетки. Образование циклических нук-
леотидов способствует изменению внутриклеточных процессов под
влиянием гормона (первый посредник).
ГЕМ — комплексное (клешневидное) соединение двухвалентного
железа с протопорфириновым кольцом; производные гема являются
простетическими группами кислород-переносящих белков (Гемо-
глобин, миоглобин) и белков дыхательной цепи (Цитохромы).
ГЕМОГЛОБИН — окрашенный белок эритроцитов, обратимо при-
соединяющий кислород к своей простетической группе (производ-
ному гема) и переносящий его от легких к периферическим тканям.
ГЕН — фактор наследственности — участок молекулы ДНК, оп-
ределяющий последовательность аминокислот в полипептидной цепи
(синоним: цистрон).
СЛОВАРЬ ТЕРМИНОВ
13
ГЕНОТИП — генетическая конституция индивидуума.
ГИДРОФИЛЬНОСТЬ — свойство молекул или их частей, имеющих
полярную природу, легко взаимодействовать с молекулами воды
(противоположное понятие: Гидрофобность).
ГИДРОФОБНОСТЬ — свойство молекул или их частей, имеющих
неполярную природу, преимущественно взаимодействовать с не-
водными молекулами (противоположное понятие: Гидрофильность).
ГИСТОНЫ — основные белки, богатые остатками аргинина и
лизина, образующие комплекс с ДНК в хромосомах эукариоти-
ческих клеток.
ГЛИКОГЕН — резервный углевод в печени, мышцах и других
тканях. В молекуле гликогена, состоящей из глюкозных мономеров,
полисахаридные цепи сильно разветвлены.
ГЛИКОГЕНЕЗ — синтез гликогена путем полимеризации глюкоз-
ных мономеров.
ГЛИКОГЕНОЗ — один из видов врожденного нарушения обмена
веществ. При всех гликогенозах происходит накопление избытка
гликогена в клетках, но при различных гликогенозах могут бьпь
поражены разные ткани и структура накапливающегося полисаха-
рида бывает различной.
ГЛИКОГЕНОЛИЗ — расщепление полимерных полисахаридных це-
пей в молекуле гликогена с образованием свободной глюкозы или
фосфорных эфиров глюкозы.
ГЛИКОГЕН-СИНТЕТАЗА — фермент, катализирующий удлинение
линейных полисахаридных цепей в молекуле гликогена путем
последовательного присоединения глюкозы (в форме УДФ-глю-
козы) к 4-гидроксигруппе концевого остатка глюкозы в растущей
полисахаридной цепи.
ГЛИКОЛИЗ — распад таких сахаров, как глюкоза, до кислот,
имеющих по три углеродных атома в молекуле (например, пируват
или лактат) с накоплением энергии в АТФ. В отсутствие кислорода
в качестве преобладающего углеродсодержащего продукта глико-
лиза образуется лактат (анаэробный гликолиз).
ГЛИКОЛИПИДЫ — липидные соединения, в составе которых
имеется один или несколько сахаров или производных углеводов.
Обычно гликолипиды содержат также основание с длинной цепью
углеродных атомов в молекуле — сфингозин (см. также Сфинго-
липиды).
ГЛИКОЛИТИЧЕСКИЙ ПУТЬ — цепь реакций, посредством кото-
рых глюкоза превращается в пируват или лактат (см. также Гли-
колиз).
ГЛИКОПРОТЕИДЫ — полипептиды, содержащие один или не-
сколько сахаров или углеводных производных в качестве простети-
14
СЛОВАРЬ ТЕРМИНОВ
ческих групп. Гликопротеиды часто являются компонентами кле-
точных мембран, в которых остатки углеводов выполняют функцию
антигенных детерминант или других центров восприятия инфор-
мации на наружной поверхности мембран.
ГЛОБУЛИНЫ — одна из групп белков плазмы крови. Глобулины
осаждаются сульфатом аммония при полунасыщении. Различные
глобулины отличаются друг от друга липидными и углеводными
компонентами; их удается разделить путем ультрацентрифугиро-
вания и электрофореза.
ГЛУТАМИНОВАЯ КИСЛОТА — дикарбоновая аминокислота (а-
аминоглутаровая кислота), в молекуле которой имеется цепь из
5 углеродных атомов. В процессах обмена веществ образуется
путем переноса аминогрупп или путем восстановительного амини-
рования промежуточного продукта реакций цикла Кребса — а-
кетоглутаровой кислоты.
ГЛЮКАГОН — гормон полипептидной природы, секретируемый
а-клетками островков поджелудочной железы. Глюкагон специ-
фически активирует образование циклического АМФ в клетках
печени, повышая таким образом содержание глюкозы в крови в
результате стимуляции гликогенолиза и глюконеогенеза в печени.
ГЛЮКОЗА — сахар, содержащий альдегидную группу и цепь из
6 углеродных атомов (альдогексоза), наиболее важный и количест-
венно преобладающий моносахарид в жидкостях тела; мономерная
единица структуры резервного полисахарида тканей — гликогена.
ГЛ ЮКОКОРТИ коиды — стероидные гормоны, синтезируемые
клетками коры надпочечника, которые усиливают синтез глюкозы
путем глюконеогенеза и, следовательно, повышают концентрацию
гликогена в печени и сахара в крови.
ГЛЮКОНЕОГЕНЕЗ — биосинтез глюкозы из лактата, пирувата
или оксалоацетата или из неуглеводных компонентов, которые
служат предшественниками этих соединений или других промежу-
точных продуктов гликолиза.
ГОЛЬДЖИ АППАРАТ — система уложенных стопками, уплощен-
ных трубочек, расположенных в клетке между ядром и плазмати-
ческой мембраной. Внутрицистернальные полости аппарата Голь-
джи содержат секретируемые белки, которые подвергаются изме-
нениям перед выделением из клетки «на экспорт».
ГОРМОНЫ АНАБОЛИЧЕСКИЕ — продукты внутренней секреции,
воздействие которых на обмен веществ эффекторной ткани-мишени
заключается прежде всего либо в стимуляции процессов синтеза
белков, жиров и углеводов, либо в подавлении процессов распада
этих соединений (противоположное понятие: Гормоны катаболи-
ческие).
СЛОВАРЬ ТЕРМИНОВ
15
ГОРМОНЫ КАТАБОЛИЧЕСКИЕ — продукты внутренней секре-
ции, воздействие которых на обмен веществ ткани-мишени заклю-
чается прежде всего либо в ускорении распада белков, жиров или
полисахаридов, либо в подавлении их синтеза (противоположное
понятие: Гормоны анаболические).
ГРАНУЛЫ ХРОМАФФИННЫЕ — секреторные везикулы, содер-
жащие катехоламины в высоких концентрациях. Локализованы
преимущественно в мозговом слое надпочечников и в нейронах
симпатического отдела вегетативной нервной системы.
ДЕГИДРОГЕНИРОВАНИЕ — окислительная реакция, при кото-
рой от субстрата отделяются атомы водорода.
ДЕЗОКСИРИБОНУКЛЕИНОВАЯ КИСЛОТА (ДНК) — полимер,
образованный нуклеотидами, содержащими дезоксирибозу (дАМФ,
дЦМФ, дГМФ, дТМФ). ДНК, составляющая химическую основу
гена, образована двумя закрученными одна вокруг другой ком-
плементарными нитями (двойная спираль).
ДЕНАТУРАЦИЯ БЕЛКОВ — развертывание полипептидных цепей
молекулы, имеющих исходно складчатую конформацию. Денату-
рация белков обычно сопровождается необратимым уменьшением
их растворимости и утратой биологической активности.
ДЕРЕПРЕССИЯ — устранение или нейтрализация действия моле-
кулы репрессора, блокирующего биосинтез ферментов (см. также
Индукция, Репрессия).
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ КОМПОНЕНТОВ ОРГАНИЗМА —
состояние постоянного обновления белков и других биохимиче-
ских компонентов тканей, находящихся даже в отсутствие роста не
в статическом равновесии, а в равновесии динамическом, обуслов-
ленном постоянным соотношением процессов биосинтеза и распада
при непрерывной взаимосвязи с биохимическими компонентами
пищи (см. также Стационарное состояние).
ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ — возникающие при окислительном
фосфорилировании условия, при которых к митохондриям не предъ-
являются высокие энергетические требования и скорость переноса
электронов по дыхательной цепи непосредственно определяется
концентрацией АДФ (синоним: акцепторный контроль).
ДЫХАТЕЛЬНАЯ ЦЕПЬ — локализованная в митохондриях по-
следовательность флавопротеидов, гемопротеидов (цитохромов) и
негеминовых железопротеидов, осуществляющая перенос электро-
нов от субстратов на кислород.
ЖЕЛЧНЫХ кислот СОЛИ — соли кислот, близких по хими-
ческой структуре к стероидам, обычно конъюгированных с такими
аминокислотами, как глиций; образуются в печени путем окис-
16
СЛОВАРЬ ТЕРМИНОВ
ления холестерина и выделяются с желчью в кишечник, где они
способствуют эмульгированию жиров, их перевариванию и вса-
сыванию.
ЖЕЛЧНЫЙ ПИГМЕНТ — продукт распада гемоглобина (см. Би-
лирубин).
ЖИРНАЯ КИСЛОТА — алифатическая карбоновая кислота, имею-
щая обычно одну карбоксильную группу, присоединенную к длин-
ной, неразветвленной углеводородной цепи с четным числом атомов
углерода (от 14 до 24) и различным числом двойных связей (от О
до 6).
ЖИРНЫЕ КИСЛОТЫ НЕЗАМЕНИМЫЕ — высшие полиненасы-
щенные жирные кислоты, которые не синтезируются в организме
и поэтому должны доставляться извне, в составе пищи. К числу
незаменимых жирных кислот относятся: линолевая кислота (С18 : 2),
линоленовая кислота (С18 : 3), арахидоновая кислота (С20 : 4).
ЗИМОГЕН — неактивный предшественник фермента, приобрета-
ющий каталитическую активность в результате ковалентного мо-
дифицирования путем удаления блокирующей группы из области
активного центра.
ЗИМОГЕННЫЕ ГРАНУЛЫ—форма безопасного хранения в
клетках неактивных предшественников некоторых ферментов, ка-
тализирующих реакции распада биохимических компонентов тка-
ней.
ИЗОФЕРМЕНТЫ — вариантные формы фермента, которые встре-
чаются у одного биологического вида. Различные изоферменты
катализируют одну и ту же биохимическую реакцию, но отлича-
ются друг от друга своими кинетическими свойствами и электро-
форетической подвижностью.
ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА — величина pH раствора, при
которой белок обладает равным числом положительно и отрица-
тельно заряженных групп, т. е. не имеет электрического заряда.
ИММУНОПРОТЕИН — белок, обычно находящийся в глобули-
новой фракции плазмы, создающий иммунитет к тому или иному
заболеванию и способный выводить из организма чужеродные
молекулы благодаря специфическому связыванию в ответ на вве-
дение антигена (синонимы: антитела, иммуноглобулины}.
ИНГИБИРОВАНИЕ КОНЕЧНЫМ ПРОДУКТОМ — разновидность
регуляции промежуточными продуктами обмена веществ, заклю-
чающаяся в том, что конечный продукт цепи метаболических ре-
акций действует по принципу отрицательной обратной связи на
всю цепь соответствующих ферментативных реакций, подавляя
активность ключевого регуляторного фермента, обычно катализи-
рующего одну из первых реакций в данной метаболической цепи.
СЛОВАРЬ ТЕРМИНОВ
17
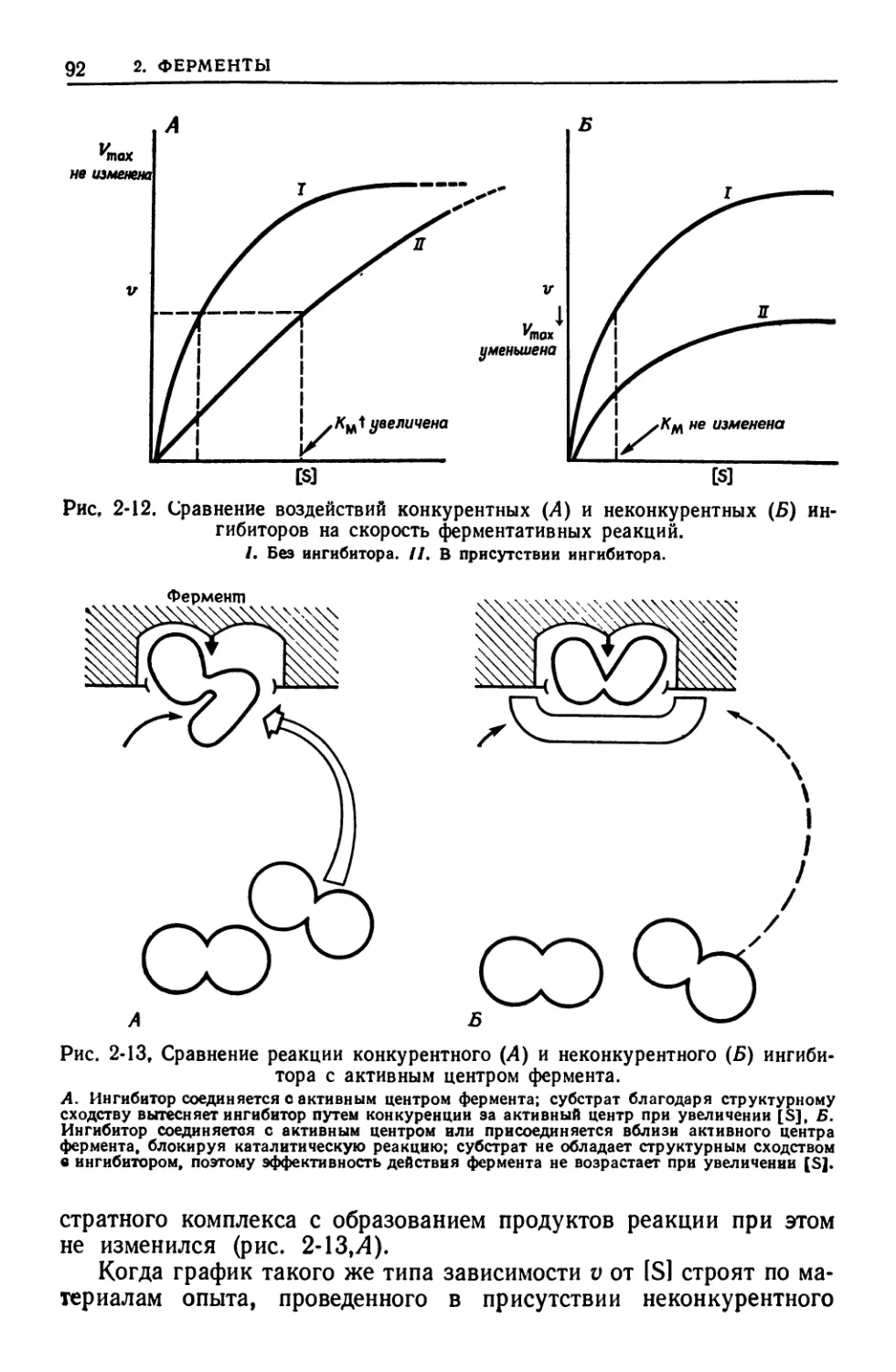
ИНГИБИРОВАНИЕ КОНКУРЕНТНОЕ — действие ингибитора, ко-
торый настолько близок по химической структуре к субстрату,
что конкурирует с ним за центр связывания в ферменте. (В присут-
ствии конкурентного ингибитора величина Уюах не изменяется,
но Км возрастает.)
ИНГИБИРОВАНИЕ НЕКОНКУРЕНТНОЕ — действие ингибитора,
взаимодействующего с группами, необходимыми для реакций, ка-
тализируемых активным центром фермента, но не влияющего на
связывание субстрата. (В этом случае Ушах снижается, но Км не
изменяется.)
ИНГИБИТОР АКТИВНОСТИ ФЕРМЕНТА — вещество, избира-
тельно взаимодействующее с ферментом, путем блокады активного
центра или изменения его конформации, в результате чего катали-
тическое действие фермента на субстрат замедляется или вообще
не проявляется.
ИНГИБИТОР ДЫХАНИЯ — соединение, специфически блокиру-
ющее одну из реакций переноса электронов в процессах окисления
субстратов или в дыхательной цепи.
ИНДУКЦИЯ — усиление синтеза фермента под влиянием мета-
болита (молекула-индуктор), часто являющегося субстратом этого
фермента (синоним: дерепрессия).
ИНДУЦИБЕЛЬНЫЙ ФЕРМЕНТ — фермент, обычно присутству-
ющий в небольших количествах, синтезирующийся более интенсивно
при увеличении концентрации индуцирующих молекул (метабо-
литов или гормонов) (синоним: адаптивный фермент).
ИНСУЛИН — гормон полипептидной природы, секретируемый 0-
клетками островков поджелудочной железы. Инсулин снижает
содержание глюкозы в крови, стимулируя поглощение и исполь-
зование глюкозы клетками и блокируя синтез глюкозы путем глю-
конеогенеза.
ИНФОРМАЦИОННАЯ РНК — однонитевая молекула рибонукле-
иновой кислоты, транскрибированная с участка ДНК, кодирующего
построение той или иной белковой молекулы. Информационная
РНК переносит генетическую информацию от клеточного ядра на
рибосомы и определяет последовательность аминокислотных ос-
татков в полипептидной цепи при биосинтезе белка.
ИОНОФОРЫ — вещества, образующие жирорастворимые комплек-
сы со специфическими ионами и обладающие поэтому способностью
переносить эти ионы через гидрофобный бислой мембран.
КАРНИТИН — родственная холину карбоновая оксикислота, об-
наруживаемая в больших концентрациях в мышцах; участвует
в переносе через внутреннюю мембрану митохондрий КоА-произ-
водных жирных кислот.
18
СЛОВАРЬ ТЕРМИНОВ
КАТАБОЛИЗМ — процессы распада, при которых освобождается
свободная энергия и выделяется тепло, например окисление орга-
нических соединений до двуокиси углерода и воды (противополож-
ное понятие: Анаболизм).
КАТЕХОЛАМИНЫ — группа ароматических соединений, облада-
ющих симпатомиметической активностью. В молекулах катехо-
ламинов имеется о-диоксибензольное (катехиновое) кольцо, соеди-
ненное с алифатической, несущей аминогруппу, боковой цепью.
КЕТОНОВЫЕ ТЕЛА — продукты неполного окисления жирных
кислот — ацетон, ацетоуксусная кислота и р-оксимасляная кислота.
КИНАЗЫ — ферменты, катализирующие перенос концевой фос-
фатной группы от нуклеозидтрифосфата (обычно от АТФ) на моле-
кулу акцептора (обычно спирта) с образованием сложных эфиров
фосфорной кислоты (синоним: фосфотрансфераза).
кодон — последовательность трех азотистых оснований (триплет)
в информационной РНК, которая в процессе синтеза белка опре-
деляет последовательность расположения определенных амино-
кислот при участии комплементарного триплета транспортной
РНК — антикодона. Инициирующие и терминирующие кодоны
определяют начало и прекращение трансляции.
КОМПЛЕМЕНТАРНЫЕ ОСНОВАНИЯ — основания нуклеиновых
кислот, способные к образованию пар в двойной спирали посред-
ством водородных связей между пуриновыми основаниями одной
нити и пиримидиновыми основаниями другой; аденин (А) всегда
фигурирует в паре с тимином (Т) или уридином (У), а гуанин (Г) —
с цитозином (Ц).
КОФАКТОР — вещество небелковой природы, необходимое для
действия фермента. Кофакторами могут быть неорганические
(например, ионы металлов) или органические (например, кофер-
менты) вещества.
КОФЕРМЕНТ — органический кофактор, участвующий в фермен-
тативном катализе; реагирующую группировку, как правило,
представляет витамин.
КОФЕРМЕНТ А (КоА) — соединение нуклеотидной природы, в
молекулу которого входит витамин — пантотеновая кислота. Участ-
вующая в биохимических реакциях тиоловая (—SH) группа кофер-
мента А образует тиоэфирные связи с ацильными группировками
важных промежуточных продуктов обмена веществ в организме
(например, ацетил-Ко А).
КОФЕРМЕНТ Q (KoQ) — жирорастворимое производное бензо-
хинона, функционирующее как переносчик электронов между
флавопротеидами и цитохромами дыхательной цепи.
КРЕБСА ЦИКЛ — (см. Цикл лимонной кислоты).
КРЕБСА — ХЕНСЕЛАЙТА ЦИКЛ — (см. Мочевины цикл).
СЛОВАРЬ ТЕРМИНОВ
19
ЛИЗОСОМЫ — везикулы, содержащие гидролитические ферменты,
необходимые для осуществления функции внутриклеточного пе-
реваривания.
ЛИПАЗЫ — ферменты из группы эстераз, встречающиеся в сек-
рете поджелудочной железы, выделяемом в просвет кишечника, в
клетках жировой ткани, в мембранах клеток печени и других тка-
ней. Липазы катализируют гидролиз эфирных связей между гли-
церином и жирными кислотами в нейтральных жирах и фосфоли-
пидах.
ЛИПИДОЗЫ — группа врожденных нарушений обмена веществ,
для которых характерно избыточное накопление липидов в тканях.
ЛИПИДЫ — природные органические соединения, растворимые
в таких неполярных реагентах, как хлороформ, серный эфир и
этиловый спирт, но нерастворимые в воде. В молекулах липидов
обычно имеется длинная углеводородная цепь или стерин.
ЛИПОГЕНЕЗ — синтез липидов путем конденсации молекул аце-
тил-КоА с дальнейшим восстановлением до жирных кислот и эте-
рификации последних с образованием триацилглицеринов.
ЛИПОЛИЗ — гидролитический распад липидов, протекающий обыч-
но с образованием (после гидролиза жиров) глицерина или частично
ацилированного глицерина, а также свободных жирных кислот.
ЛИПОПРОТЕИДЛИПАЗА — эстераза, встречающаяся во многих
тканях (особенно в печени и в жировой ткани); действуя на хило-
микроны, гидролизует триацилглицерины и таким образом уст-
раняет наступающее после приема пищи (жирной) помутнение
плазмы крови (синоним: фактор просветления, клиринг-фактор).
ЛИПОПРОТЕИДЫ — водорастворимые продукты соединения ли-
пида (или нескольких различных липидов) с белками. (Жирораст-
воримые продукты соединения липидов с белками обычно назы-
вают протеолипидами.)
МАКРОМОЛЕКУЛЫ — полимерные молекулы с большим моле-
кулярным весом (например, белки или нуклеиновые кислоты).
МАКРОЭРГИЧЕСКОЕ СОЕДИНЕНИЕ — вещество, гидролиз кото-
рого приводит к высвобождению большого количества энергии,
т. е. к уменьшению свободной энергии на величину, превышающую
5 ккал/моль (при стандартных условиях).
МЕТАБОЛИЗМ — химические превращения молекул, протекающие
в живом организме под влиянием ферментов, действие которых
контролируется генами, гормонами, состоянием энергетических
запасов и концентрацией конечных продуктов биохимических
реакций (синоним: обмен веществ).
МЕТАБОЛИЧЕСКАЯ ЗАДОЛЖЕННОСТЬ (мышц) — состояние, воз-
никающее после длительной работы мышц, когда запасы макро-
20
СЛОВАРЬ ТЕРМИНОВ
эргических соединений истощены и требуют возобновления в даль-
нейшем при отдыхе мышечной системы.
МЕТИЛТРАНСФЕРАЗЫ — группа ферментов, катализирующих пе-
ренос метильной группы от активированного донора метильных
групп S-аденозилметионина на специфический акцептор (синоним:
трансметилазы).
МИЕЛИН — многослойная система мембран, особенно богатых
сфинголипидами; образует футляр для нервного волокна.
МИКРОНИТИ — тончайшие нитевидные сократительные струк-
туры, которых особенно много в цитоплазме подвижных клеток;
участвуют в движениях и в изменениях формы клеток (синоним:
микрофиламенты).
МИКРОТРУБОЧКИ — полые цилиндрические структуры, участ-
вующие в создании и поддержании определенной формы клеток и
образующие при делении митотическое веретено.
МИТОХОНДРИИ — имеющие двойную мембранную оболочку ор-
ганеллы эукариотических клеток. В митохондриях протекают про-
цессы клеточного дыхания, окисление пирувата и жирных кислот,
реакции цикла Кребса, образование АТФ в аэробных условиях
путем окислительного фосфорилирования.
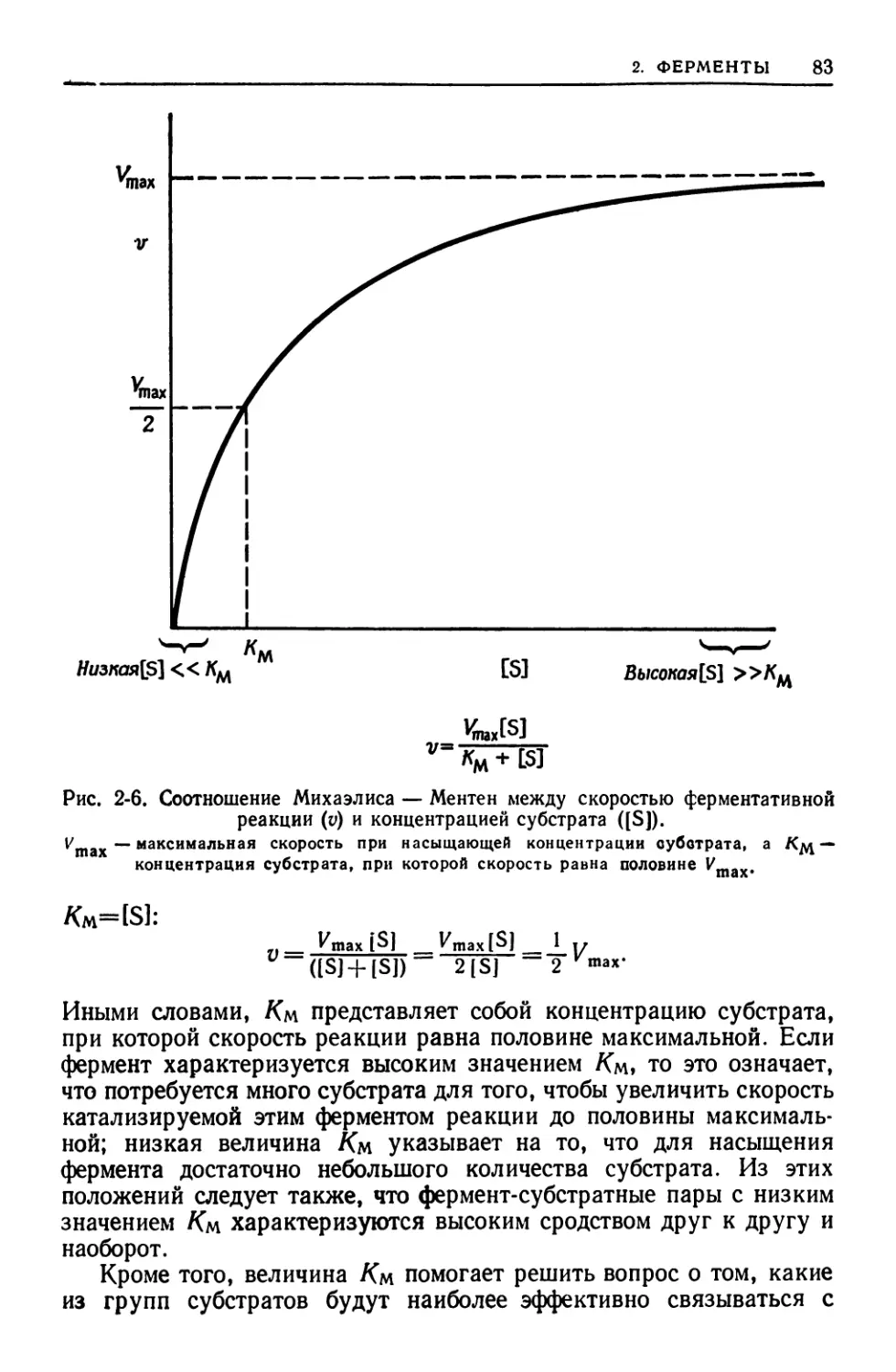
МИХАЭЛИСА — МЕНТЕН КОНСТАНТА (Км) — концентрация суб-
страта, при которой скорость ферментативной реакции равна поло-
вине максимальной. Величина, характерная для каждого фермент-
субстратного взаимодействия, отражающая сродство субстрата к
ферменту.
МИХАЭЛИСА — МЕНТЕН УРАВНЕНИЕ — кинетическое выраже-
ние зависимости скорости ферментативной реакции (v) от кон-
центрации субстрата [S]:
V = ^nax[S]/[Sl+KM,
где Vmax обозначает максимальную скорость реакции в условиях
насыщения, а Лм — константа Михаэлиса — Ментен.
МИЦЕЛЛЫ — мельчайшие частицы коллоидальной дисперсии мо-
лекул, сгруппированные параллельно друг другу в жидкой фазе,
в которой образование истинного раствора невозможно.
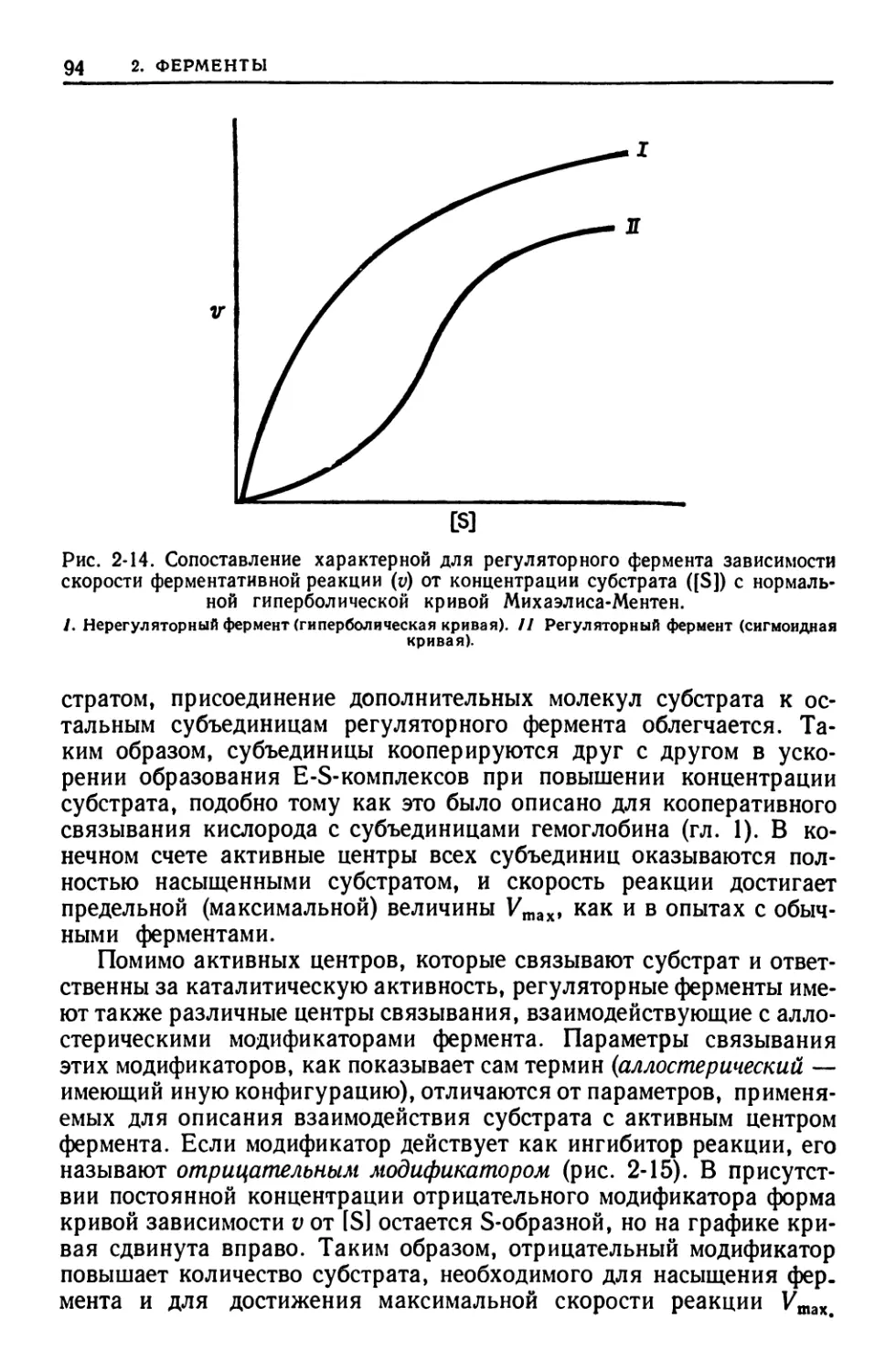
МОДИФИКАТОР АЛЛОСТЕРИЧЕСКИЙ — вещество, связывающее-
ся с определенной областью на поверхности молекулы (аллосте-
рический центр) фермента и изменяющее активность каталитиче-
ского центра, либо усиливая ее (положительный модификатор),
либо подавляя (отрицательный модификатор).
МОНОАМИНОКСИДАЗА — фермент флавопротеидной природы, ка-
тализирующий окисление аминов с образованием соответствующих
альдегидов, аммиака и перекиси водорода.
СЛОВАРЬ ТЕРМИНОВ
21
МОНОМЕР — элементарная единица, участвующая в построении
молекулы полимера.
МОНОСЛОЙ — поверхностная пленка толщиной в одну молекулу,
образующаяся при группировке молекул липидов «бок в бок»
на поверхности, разделяющей две несмешивающиеся жидкости (на-
пример, масло — вода) или жидкости и газа (например, воздух —
вода).
МОЧЕВИНЫ ЦИКЛ — цепь биохимических реакций, посредством
которых карбамоилфосфат и аспартат последовательно связыва-
ются с орнитином, образуя сначала цитруллин, а затем аргинин,
который подвергается гидролизу, вновь образуя орнитин и осво-
бождая мочевину (синонимы: цикл Кребса — Хенселайта, орнити-
новый цикл).
МУТАЦИЯ — химическое изменение гена, в результате которого
одно или несколько азотистых оснований ДНК изменены, отсутст-
вуют или замещены другими; в результате такого изменения после-
довательности оснований белок, синтез которого кодируется дан-
ным геном, либо изменен, либо не синтезируется вовсе.
НЕЙРОМЕДИАТОР — химический передатчик нервного импульса
через синапс или нервно-мышечное соединение. К числу таких
медиаторов относятся ацетилхолин и целый ряд ароматических
аминов.
НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД (НАД) — кофермент
окислительно-восстановительных реакций, функциональной груп-
пой которого является витамин никотинамид. Окисленная форма
(НАД+) восстанавливается до НАД-Н, присоединяя два электрона
в виде гидр ид-иона (Н_).
НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ (НАДФ) —
этот кофермент отличается от НАД наличием дополнительной фос-
фатной группы. Аналогично соответствующим формам НАД он
имеет окисленную (НАДФ+) и восстановленную (НАДФ-Н) формы,
но отличается от НАД способностью взаимодействовать с дегидро-
геназами.
НОРАДРЕНАЛИН — нейромедиатор, образующийся в синаптиче-
ских нервах и выделяемый под влиянием нервных импульсов. Дей-
ствие норадреналина на процессы обмена веществ в периферических
тканях сходно с действием адреналина (см. также: Катехоламины)
(синонимы: норэпинефрин, 3,4-диоксифенилэтаноламин).
НУКЛЕИНОВАЯ КИСЛОТА — полимер, состоящий из нуклео-
тидов, соединенных фосфодиэфирными связями (синоним: полинук-
леотид) (см. также Дезоксирибонуклеиновая кислота, Рибонуклеи-
новая кислота).
22
СЛОВАРЬ ТЕРМИНОВ
НУКЛЕОЗИД — соединение, в молекуле которого имеется азо-
тистое основание (пурин или пиримидин), связанное с остатком
сахара пентозы.
НУКЛЕОПРОТЕИД — комплекс, образованный нуклеиновой кис-
лотой и белком. В состав нуклеопротеидов обычно входят основ-
ные белки (такие, как гистоны).
НУКЛЕОТИД — соединение, в молекуле которого имеется азоти-
стое основание (пурин или пиримидин), связанное через сахар
пентозу с одной или несколькими фосфатными группами. Нуклео-
тиды могут функционировать в качестве коферментов, а также
могут подвергаться полимеризации с образованием нуклеиновых
кислот (ДНК и РНК).
ОБРАТНОЕ ВСАСЫВАНИЕ В ПОЧКАХ — захват веществ, про-
шедших в клубочковый фильтрат, но подлежащих удержанию в
кровотоке. Процесс осуществляется в почечных канальцах при
помощи механизмов активного переноса.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ РЕАКЦИЯ — химиче-
ский процесс, при котором один (или более) электрон переходит
от окисляемого вещества к веществу, которое подвергается вос-
становлению.
ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ — отщепление амино-
группы с освобождением аммиака и переносом атомов водорода от
окисляемого соединения на кофермент НАД или ФАД (противопо-
ложное понятие: восстановительное аминирование).
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ — протекающий в
митохондриях процесс, при котором энергия, освобождаемая в
процессе переноса электронов по дыхательной цепи, частично
используется для сопряженного с тканевым дыханием синтеза
АТФ из АДФ и неорганического фосфата.
ОРНИТИНОВЫЙ ЦИКЛ — (см. Мочевины цикл).
ОТНОШЕНИЕ Р : О — мера стехиометрических соотношений в
процессах фосфорилирования, сопряженного с переносом элект-
ронов по дыхательной цепи; коэффициент, находимый путем де-
ления числа молей фосфата, этерифицируемого при синтезе АТФ,
на число атомов кислорода, поглощаемого в процессе дыхания.
ОТРИЦАТЕЛЬНАЯ ОБРАТНАЯ СВЯЗЬ — система ауторегуляции,
при которой увеличение концентрации конечного продукта метабо-
лической реакции подавляет активность одного из ферментов в
цепи реакций, ведущих к образованию этого продукта обмена (см.
Ингибирование конечным продуктом).
ПЕПТИДАЗА — фермент из группы гидролитических; гидролизует
пептидные связи в низкомолекулярных пептидах, образующихся
при переваривании белков.
СЛОВАРЬ ТЕРМИНОВ
23
ПЕРЕНОСЧИК ЭЛЕКТРОНОВ — вещество, которое, попеременно
подвергаясь окислению и восстановлению, служит промежуточным
продуктом при переносе электронов от субстратов к кислороду
вдоль дыхательной цепи (см. также Цитохромы).
ПИРИМИДИН — гетероциклическое шестичленное соединение с
двумя атомами азота в первом и третьем положениях (синоним:
1,3-диазиновое кольцо).
ПЛАЗМАТИЧЕСКАЯ МЕМБРАНА — наружная, пограничная обо-
лочка животной клетки; состоит из липидного бислоя и белков,
представленных примерно в таком же количестве, как и липиды.
В плазматической мембране белки либо заключены в липидный
бислой, либо присоединены к нему.
ПОЛИМЕР — большая молекула, образованная путем соединения
элементарных молекулярных звеньев (мономеров).
ПОЛИМЕРИЗАЦИЯ — последовательное соединение («голова к
хвосту») многих элементарных молекулярных звеньев (мономеров)
с образованием длинных цепей (полимеров); если мономеры —
сахара, то полимеры называются полисахаридами; из аминокислот
образуются полипептиды или белки; из нуклеотидов — полинук-
леотиды или нуклеиновые кислоты.
ПОЛИНУКЛЕОТИД — длинная цепь или полимер, состоящий из
нуклеотидов (см. также Нуклеиновая кислота).
ПОЛИПЕПТИД — длинная цепь или полимер, состоящий из
аминокислот (см. также Белки).
ПОЛИРИБОСОМЫ — совокупность рибосом, присоединенных к
нити информационной РНК (синоним: полисомы) (см. также Ри-
босомы).
ПОЛИСАХАРИД — длинная цепь или полимер, состоящий из
молекул сахаров (моносахаридов).
ПОЛОЖИТЕЛЬНАЯ ПРЯМАЯ СВЯЗЬ — система ауторегуляции,
посредством которой предшественник цепи последовательных ме-
таболических реакций усиливает активность одного из ферментов,
ответственных за потребление этого соединения-предшественника
(противоположное понятие: отрицательная обратная связь).
ПОРФИРИНЫ — класс соединений, в молекуле которых имеется
четыре пиррольных кольца, соединенных между собой метильными
мостиками с образованием плоской циклической структуры (сино-
ним: циклический тетрапиррол).
ПРОДУКТ РЕАКЦИИ — соединение, образующееся в результате
каталитического действия фермента на соответствующий субстрат.
ПРОСТАГЛАНДИН — представитель семейства 20-углеродных жир-
ных кислот, в молекуле которых центральная часть углеводородной
цепи замкнута в циклопентановое кольцо. Простагландины по-
24
СЛОВАРЬ ТЕРМИНОВ
разному действуют на процессы обмена веществ в различных ор-
ганах и тканях, но все эти воздействия опосредованы через цик-
лический АМФ.
ПРОСТЕТИЧЕСКАЯ ГРУППА — соединенный с белком небелко-
вый компонент, который обычно необходим для проявления био-
логической активности белка. (Удаление простатической группы
ведет к получению апопротеина.)
ПРОТЕАЗЫ — гидролитические ферменты, действующие на оп-
ределенные пептидные связи в высокомолекулярных полипептидах,
т. е. в нативных белках.
ПРОТЕИНКИНАЗА — фермент, катализирующий перенос фос-
фатной группы от АТФ на гидроксильную группу серина в моле-
куле белка-акцептора.
ПРОТЕОЛИЗ — гидролитическое расщепление в белках опреде-
ленных пептидных связей с образованием меньших полипептидных
фрагментов. При полном протеолизе образуются свободные амино-
кислоты.
ПРОТОН-ДВИЖУЩАЯ СИЛА — электрохимический градиент кон-
центраций ионов водорода, возникающий на внутренней мембране
митохондрий при процессах тканевого дыхания. Согласно химио-
осмотической гипотезе сопряжения тканевого дыхания с окисли-
тельным фосфорилированием, этот градиент необходим для обра-
зования АТФ или перемещения катионов при окислительном фос-
форилировании.
ПУРИН — гетероциклическое вещество, в молекуле которого де
вять атомов соединены в имидазольное и пиримидиновое кольца.
РАЗОБЩАЮЩИЙ АГЕНТ — соединение, которое нарушает со-
пряжение фосфорилирования с дыханием, но не подавляет пере-
носа электронов.
РЕГУЛЯТОРНЫЙ ФЕРМЕНТ — фермент, активность которого
контролируется взаимодействием с аллостерическим модифика-
тором или в результате ковалентного модифицирования фермент-
ного белка. Регуляторные ферменты обычно катализируют началь-
ные этапы в цепи метаболических реакций.
РЕПЛИКАЦИЯ — образование точной копии двухнитевой моле
кулы ДНК при дупликации генов в процессе клеточного деления.
РЕПРЕССИЯ — подавление синтеза фермента, часто обусловлен-
ное накоплением конечного продукта цепи биохимических превра-
щений, в которых участвует данный фермент.
РЕЦЕПТОРЫ ГОРМОНОВ — белковые молекулы, имеющие спе
цифические центры связывания, обладающие высоким сродством к
гормонам; рецепторы располагаются на наружной поверхности
эффекторных клеток-мишеней.
СЛОВАРЬ ТЕРМИНОВ
25
РИБОНУКЛЕИНОВАЯ КИСЛОТА (РНК) — полимер, образован-
ный из содержащих рибозу нуклеотидов (АМФ, ЦМФ, ГМФ, УМФ);
осуществляет ключевые функции в биосинтезе белка на рибосомах.
РИБОСОМЫ — состоящий нз молекул РНК и белка агрегат, функ-
ция которого в процессе биосинтеза белка — присоединять друг к
другу остатки аминокислот в последовательности, определяемой
информационной РНК. Несколько рибосом, соединенные с одной
нитью информационной РНК, образуют полирибосому, или поли-
сому.
САХАР — соединение, в молекуле которого имеется много гидро-
ксильных групп, а также альдегидная или кетонная группа при
одном из углеродных атомов (синоним: моносахарид).
СВОБОДНАЯ ЭНЕРГИЯ (F) — энергия, используемая для совер-
шения работы системой при переходе ее к равновесию; подобные
процессы в природе протекают самопроизвольно только в тех слу-
чаях, когда изменение свободной энергии (AF) меньше нуля (си-
ноним: свободная энергия Гиббса [G]).
СИНАПТИЧЕСКИЕ ПУЗЫРЬКИ — находящиеся в цитоплазме
пресинаптических нервов окруженные мембраной структуры, со-
держащие нейромедиаторы в высокой концентрации.
СИНТЕТАЗА ЖИРНЫХ КИСЛОТ — многоферментная система,
катализирующая поэтапное конденсирование одной молекулы аце-
тил- КоА и 7 молекул малонил-КоА с восстановлением промежу-
точных продуктов при участии НАДФ-Н до пальмитоил-КоА.
СТАЦИОНАРНОЕ СОСТОЯНИЕ — состояние динамического рав-
новесия, при котором биохимические компоненты организма быстро
синтезируются и одновременно с одинаковой скоростью подвер-
гаются распаду, в результате чего изменения абсолютного коли-
чества этих компонентов не происходит (см. также Динамическое
состояние компонентов организма).
СТЕРИНЫ — группа спиртов, в основе строения которых лежит
стероидная циклическая структура. Важнейшим стерином в тканях
и жидкостях организма является холестерин.
СТЕРОИДЫ — группа соединений, в молекулах которых имеется
сложная циклопентано-пергидрофенантреновая циклическая си-
стема.
СУБСТРАТ — вещество, которое подвергается каталитическому
воздействию фермента.
СФИНГОЛИПИДЫ — класс липидов, в молекуле которых содер-
жится высокомолекулярный аминоспирт сфингозин. К числу сфин-
голипидов относится фосфолипид сфингомиелин и гликолипиды —
Цереброзиды или ганглиозиды.
26
СЛОВАРЬ ТЕРМИНОВ
ТРАНСКРИПЦИЯ — образование нити РНК, комплементарной
по отношению к одной из нитей молекулы ДНК.
ТРАНСЛЯЦИЯ — образование белка на рибосоме. При этом
генетическая информация, заключенная в последовательности нук-
леотидов информационной РНК, декодируется, определяя последо-
вательность аминокислот в полипептидной цепи.
ТРАНСПОРТНАЯ РНК — небольшая молекула нуклеиновой ки-
слоты, которая избирательно связывает определенную аминоки-
слоту; благодаря специфическому присоединению комплементарных
азотистых оснований образует пары при участии трех своих азо-
тистых оснований (антикодон) и трех азотистых оснований инфор-
мационной РНК (кодон); переносит присоединенную к ней амино-
кислоту в нужное положение в процессе биосинтеза белка.
ТРИ КАРБОНОВЫХ КИСЛОТ ЦИКЛ — (см. Цикл лимонной ки-
слоты).
УГЛЕВОДЫ — богатые гидроксильными группами соединения,
содержащие атомы углерода, водорода и кислорода. К числу угле-
водов относятся как простые сахара (моносахариды), так и соеди-
нения, в молекулах которых имеется небольшое (олигосахариды)
или весьма значительное (полисахариды) число остатков сахаров,
соединенных между собой.
УЧАСТКИ СОПРЯЖЕНИЯ — те окислительные реакции в дыха-
тельной цепи, которые сопровождаются значительным выделением
свободной энергии, доступной для использования при сопряжении
с процессом образования АТФ из АДФ и неорганического фосфата
(Ф) (см. также Окислительное фосфорилирование).
ФЕНОТИП — совокупность характерных признаков индивидуума,
возникающих в результате взаимодействия генетических факторов
и факторов внешней среды.
ФЕРМЕНТ — белковая молекула, которая избирательно связы-
вает другую молекулу (субстрат), специфически воздействует на
нее, катализируя превращение субстрата в продукт реакции.
ФЕРМЕНТ КОНСТИТУТИВНЫЙ—фермент, концентрация ко-
торого постоянна. Процессы биосинтеза конститутивных ферментов
не претерпевают стимуляции (индукции) или подавления (репрес-
сии) под влиянием регуляторных факторов.
ФЕРМЕНТ-СУ БСТРАТНЫЙ КОМПЛЕКС — промежуточное акти-
вированное соединение, образующееся при связывании субстрата
с активным центром фермента в процессах ферментативного ката-
лиза.
ФЛАВОПРОТЕИД — белок, содержащий рибофлавиновый ко-
фермент (ФМН или ФАД) в качестве простетической группы.
СЛОВАРЬ ТЕРМИНОВ
27
ФОСФАГЕН — соединение, которое служит источником макро-
эргических фосфатов при ресинтезе АТФ из АДФ (например, фос-
фокреатин).
ФОСФАТАЗА — фермент, катализирующий гидролитическое рас-
щепление эфира фосфорной кислоты с освобождением неоргани-
ческого фосфата (синоним: фосфогидролаза).
ФОСФАТИДНАЯ КИСЛОТА — фосфолипид, образующийся путем
ацилирования а-глицерофосфата двумя молями ацил-КоА-произ-
водного жирной кислоты; служит предшественником других фос-
фоглицеридов и триацилглицеринов.
ФОСФОГЛИЦЕРИД — липид, в молекуле которого имеется гли-
церин, связанный эфирными связями с фосфатной группой, а также
с одной или двумя ацильными производными жирной кислоты
(синоним: глицерофосфатид).
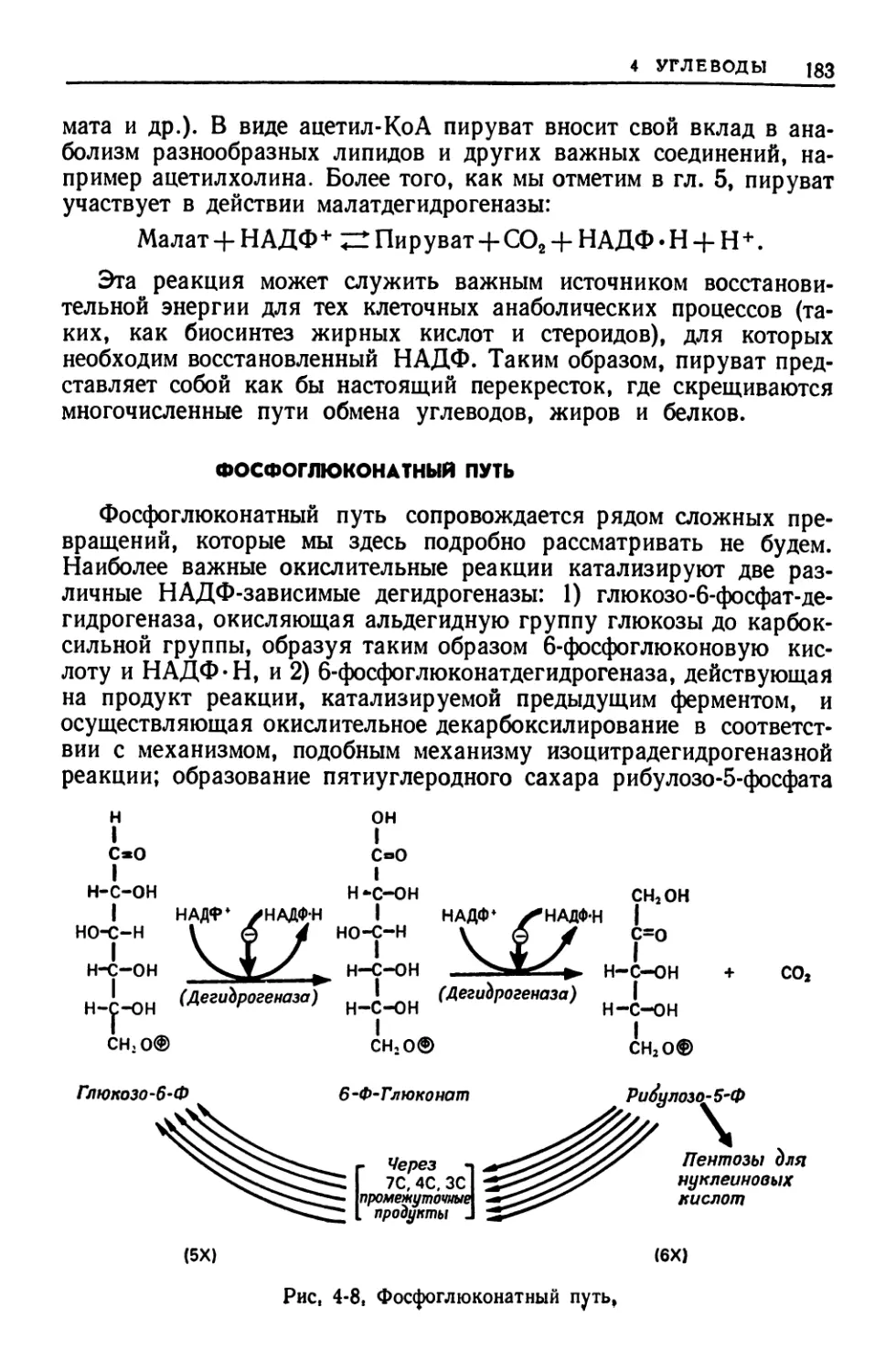
ФОСФОГЛЮКОНАТНЫЙ ПУТЬ — последовательность реакций,
участвующих в окислении глюкозо-6-фосфата с образованием
НАДФ-Н и либо сахаров пентоз, либо двуокиси углерода (си-
нонимы: пентозофосфатный путь, гексозомонофосфатный путь).
ФОСФОЛИПИД — одно из соединений, относящихся к числу ли-
пидных, в молекуле которого имеется фосфатная группа и либо
глицерин, либо сфингозин, соединенные с высшими жирными кис-
лотами (синоним: фосфатид).
ФОСФОРИЛАЗА — фермент, катализирующий распад линейных
цепей молекулы гликогена путем присоединения неорганического
фосфата при последовательном расщеплении гликозидных связей,
начиная от концевой 4-гидроксильной группы, с образованием
глюкозо-1 -фосфата.
ФОСФОРИЛИРОВАНИЕ — перенос фосфильной (РО) группы от
одного соединения на другое.
ХИЛОМИКРОНЫ — крошечные липидные капли, состоящие глав-
ным образом из нейтральных жиров, небольшого количества хо-
лестерина и фосфолипидов, окруженные тонкой белковой оболоч-
кой; синтезируются в клетках слизистой оболочки кишечника из
продуктов переваривания липидов и выделяются в лимфатические
сосуды.
ХОЛЕСТЕРИН — важнейший стероид организма. В виде свобод-
ного спирта холестерин входит в состав клеточных мембран. Слож-
ные эфиры холестерина и жирных кислот обнаружены в липопро-
теидах плазмы крови. Холестерин служит в организме предшест-
венником других важных стероидных соединений, таких, как поло-
вые гормоны, соли желчных кислот и т. д.
28
СЛОВАРЬ ТЕРМИНОВ
ХОЛОФЕРМЕНТ — сложный белок, содержащий простетическую
группу, необходимую для каталитического действия фермента
(см. также Простетическая группа, апофермент).
ХРОМОСОМЫ — структуры клеточного ядра, содержащие ДНК,
связанные с ней гистоны и другие белки, а также РНК.
ЦИКЛ КОРИ — процесс обмена углеводов, посредством которого
молочная кислота, образующаяся в мышцах при гликолизе и по-
падающая в кровоток, вовлекается в печени в реакции глюконео-
генеза с образованием глюкозы, вновь поступающей с током крови
в мышцы (синоним: глюкозо-лактатный цикл).
цикл лимонной кислоты — цепь протекающих в митохонд-
риях биохимических реакций, посредством которых двухуглерод-
ный фрагмент (ацетил-КоА), соединяясь со щавелевоуксусной кис-
лотой, полностью окисляется и образует лимонную кислоту, ко-
торая затем распадается до 2 молей СО2 с регенерацией щавелево-
уксусной кислоты (синонимы: цикл Кребса, цикл трикарбоновых
кислот).
ЦИКЛИЧЕСКИЙ АМФ — нуклеотид, действующий как внутри-
клеточный посредник в тканях-мишенях после их взаимодействия
с гормонами, для которых мембраны непроницаемы (синонимы:
аденозин-31, 5'-циклофосфат] второй посредник).
ЦИТОХРОМОКСИДАЗА — переносчик электронов, функциониру-
ющий в заключительном звене дыхательной цепи; единственный
(среди цитохромных компонентов) переносчик электронов, взаимо-
действующий непосредственно с кислородом (синоним: цитохром
а~а^).
ЦИТОХРОМЫ — один из классов гемсодержащих белков, встре-
чающихся в мембранах митохондрий и эндоплазматического ре-
тикулума. Атомы железа в молекулах цитохромов претерпевают
многократное обратимое восстановление и окисление при следующих
друг за другом переносах электронов в дыхательной цепи (в про-
цессах тканевого дыхания).
ЭМУЛЬСИЯ — жидко-дисперсная система (типа молока), в кото-
рой мельчайшие капли одной жидкости не смешиваются с основной
массой другой.
ЭНДОПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ — находящаяся в ци-
топлазме сетевидная структура, состоящая из взаимосвязанных уп-
лощенных трубочек. Области ретикулума, содержащие рибосомы,
прикрепленные к обращенным в сторону цитоплазмы поверхностям
трубочек и обозначаемые термином «шероховатый эндоплазмати-
ческий ретикулум», участвуют в биосинтезе белка, особенно сек-
ретируемого. Свободные от рибосом области, обозначаемые терми-
ном «гладкий эндоплазматический ретикулум», участвуют в даль-
СЛОВАРЬ ТЕРМИНОВ 29
нейших превращениях секретируемых белков, а также в детокси-
кации лекарственных веществ.
ЭНЕРГИЯ АКТИВАЦИИ — количество энергии, необходимой для
перевода молекулы в промежуточное состояние возбуждения, оп-
ределяющее возможность протекания реакции.
ЯДРО — самая большая из органелл эукариотической клетки.
В пространстве, ограниченном ядер ной мембраной, содержится
ДНК генов, связанная с гистонами в хромосомах, и богатое РНК
образование, называемое ядрышком.
ЯДРЫШКО — находящееся в ядре образование, богатое ядерной
РНК. Ядрышко участвует в синтезе рибосомной РНК.
СПИСОК СОКРАЩЕНИЙ
А — аденин
SAM — S-аденозилметионин
АДФ — аденозиндифосфат
АКТГ — адренокортикотропный гормон
АЛК — б-аминолевулиновая кислота
АМФ — аденозинмонофосфат=адениловая кислота
АПБ — ацил-переносящий белок
АПБ-SH — ацил-переносящий белок, сульфгидрильная
форма
АТФ — аденозинтрифосфат
Na+, К+-АТФаза — натрий-калий-зависимая аденозинтрифосфата*
за
Г — гуанин
ГАМК — у-аминомасляная кислота
ГДФ — гуанозиндифосфат
ГМГ-КоА — р-окси-0-метилглутарил-КоА
ГМФ — гуанозинмонофосфат=гуаниловая кислота
ГТФ — гуанозинтрифосфат
ДНК — дезоксирибонуклеиновая кислота
ДНФ — 2,4-динитрофенол
ДОФА — диоксифенилаланин
Дофамин — диоксифенилэтиламин
ДФГ — 1,3-дифосфоглицерат
жк — жирная кислота
ИМФ — инозинмонофосфат=инозиновая кислота
КоА — кофермент А
KoASH — кофермент А, сульфгидрильная форма
KoQ — кофермент Q
KoQH2 — кофермент Q, восстановленная форма
ЛВП — липопротеид высокой плотности
ЛНП — липопротеид низкой плотности
ЛОВП — липопротеид очень высокой плотности
ЛОНП — липопротеид очень низкой плотности
СПИСОК СОКРАЩЕНИЙ 31
НАД НАД-Н — никотинамидадениндинуклеотид — никотинамидадениндинуклеотид, восстанов- ленная форма
НАДФ НАДФ»Н — никотинамидадениндинуклеотидфосфат — никотинамидадениндинуклеотидфосфат, вос- становленная форма
ПБГ ПГФ-2 — порфобилиноген — простагландин, тип Ф-2
РНК Т ТПФ ТСГ ТТФ — рибонуклеиновая кислота — тимин — тиаминпирофосфат — тироидстимулирующий гормон — тимидинтрифосфат
У УГВ УДФ УМФ УТФ — урацил — углеводород — уридиндифосфат — уридинмонофосфат=уридиловая кислота — уридинтрифосфат
фи ф-ф„ ФАД ФАД.Н — неорганический фосфат — неорганический пирофосфат — флавинадениндинуклеотид — флавинадениндинуклеотид, восстановленная
ФЕП ФМН ФРПФ Ц ЦДФ ЦМФ ЦТФ форма — фосфоенолпируват — флавинмононуклеотид — фосфорибозилпирофосфат — цитозин — цитидиндифосфат — цитидинмонофосфат=цитидиловая кислота — цитидинтрифосфат
дЦТФ, дАТФ, дГТФ и т. д. дезоксиформы нуклеотидов
ВВЕДЕНИЕ
Студенты, изучающие медицину, стоматологию, фармацию, ве-
теринарию, часто спрашивали меня как преподавателя и члена спе-
циальных комиссий по составлению учебных планов: какое отноше-
ние имеет биохимия к основным предметам их занятий? Должен
признаться с самого начала, что вся моя подготовка и знания,
которыми я располагаю, в большей мере позволяют мне объяснять
сущность предмета биохимии, чем выступать в качестве апологета
этой науки. Действительно, крайне трудно точно установить, в
какой мере и в каком объеме в программу подготовки специалис-
тов должны быть включены те или иные разделы фундаментальных
наук. Однако тот факт, что эти вопросы упорно продолжают зада-
вать, заставляет признать их важность. Преподавателям следует
еще раз подумать над тем, чтобы привести в соответствие основное
содержание и направленность читаемых ими курсов с теми главными
задачами, которые возникнут перед студентами в предстоящей им
деятельности.
Несомненно, найдутся студенты, для которых изучение биохи-
мии или другой фундаментальной науки представит большой инте-
рес, и в будущем они, возможно, изберут профессию исследова-
теля. Однако большинство учащихся, цель которых — овладеть
той или иной узкой специальностью, воспримут перспективу под-
робного изучения фундаментальных наук с меньшим энтузиазмом;
у таких студентов возникнет резонный вопрос: в какой мере от
них требуется усвоение этих наук? Если исходить из того, что у
среднего студента способность разума поглощать идеи и факти-
ческий материал в отведенное для этого время не беспредельна,
то приходится устанавливать некоторый приемлемый и реально
возможный объем материала, подлежащего усвоению.
Рассматривая критерии отбора главного в биохимии, я оста-
новлюсь прежде всего на двух взаимосвязанных моментах: посте-
пенная убыль усвоенных знаний после окончания курса обучения и
быстрое накопление новых данных, что делает некоторые научные
представления устаревшими уже в момент обучения. По моему мне-
нию, недостаток информации менее опасен, чем непонимание огра-
ниченности наших знаний. Однажды профессор биохимии разбудил
одного из дремавших на лекции студентов вопросом: «Каков меха-
ВВЕДЕНИЕ 33
низм окислительного фосфорилирования, Джонс?», на что Джонс,
едва проснувшись, ответил: «Извините, сэр Я забыл». Огорчение
профессора понятно: «Это трагедия,— простонал он.— Лишь один
человек на свете знал механизм окислительного фосфорилирования,
и тот его забыл!» Большинство наших студентов в дальнейшем за-
будут второстепенные сведения из области фундаментальных наук,
которым мы их обучали. Если же будет достигнуто понимание основ,
то, хотя подробности со временем и забудутся, прочный фундамент
сохранится: останется способность восприятия научных концеп-
ций, освежения в памяти вопросов, непосредственно нужных в
практической работе, а также понимание новейших достижений
науки. Именно по этим соображениям я в последующих разделах
этой книги уделяю столь большое внимание объяснению сущности
процессов обмена веществ, опуская многие подробности.
«В какой именно мере знание биохимии будет мне необходимо
для работы по избранной мною специальности?» Допустим, что вы
желаете стать моряком и хотите знать, в какой мере от вас потре-
буются знания теории навигации. Ответить на подобный вопрос
было бы не менее трудно. Если вы собираетесь плавать, не выходя
в открытое море, по маленьким озерам в шлюпке-плоскодонке, то
простого понимания карты, умения пользоваться компасом и зна-
ния правил плавания будет вполне достаточно. Если вы отважитесь
выйти в прибрежные воды или будете плавать по большим озерам,
то вам потребуются, кроме того, знания в области лоцманского
дела, знание особенностей морских приливов и отливов и так далее.
Для плавания в океане вам потребуется владение секстантом и
астролябией, знание теории и практики судовождения с ориенти-
ровкой по звездам, умение определять путь, знание законов дрейфа
и так далее. К сожалению, мало вероятно, чтобы вы или я смогли с
большой уверенностью предсказать, будет ли ваш курс в жизни ог-
раничен прогулками по мельничному пруду при попутных ветерках.
Как в морском деле, так и в медицине, стоматологии и других по-
добных профессиях, безусловно, лучше быть снаряженным с неко-
торым запасом и быть готовым к тому, что вас вынесет в более глу-
бокие и бурные воды, чем это первоначально предполагалось.
Даже среди мор я ков-любителей были люди, подобные Чичестеру и
Бантингу, которые обладали изобретательностью, умением логи-
чески мыслить и настойчиво добиваться выполнения задуманного,
что позволило им обоснованно рискнуть выйти в открытое море и
добиться полного успеха своими собственными силами.
Мою аналогию с мореплаванием могут понять ошибочно в том
смысле, что осведомленность о достижениях современных медицин-
ских наук нужна лишь столичным клиницистам; их же коллегам
на периферии, не пользующимся в полной мере благами достижений
науки и техники, следует интересоваться более земными проблемами
в искусстве врачевания. А между тем перечень заболеваний чело-
34 ВВЕДЕНИЕ
века, биохимические основы которых уже выяснены, показывает,
что такая «молекулярная болезнь», как серповидноклеточная ане-
мия, чаще всего встречается в Западной Африке, а повышенная
чувствительность к противомалярийному препарату примахину
(в основе которой лежит генетический дефект фермента) особенно
часто наблюдается у жителей Средиземноморья. И наконец, многие
генетически обусловленные нарушения обмена концентрируются
практически в замкнутых инбредных популяциях географических
изолятов. Кроме того, при рассмотрении проблем здравоохранения
в глобальном масштабе приходится учитывать те изнурительные
болезни, которые обусловлены дефицитом белка, витаминов и дру-
гих необходимых веществ в рационе значительной части населения
тех уголков земного шара, которые мы называем отдаленными и
малоразвитыми. Таким образом, вполне возможно, что именно тот,
кто будет работать в отдаленных районах, столкнется с необходи-
мостью применить последние достижения фундаментальных наук в
практике медицины и здравоохранения.
Рассмотрим теперь цели и задачи изучения биохимии человека.
Для удобства можно подразделить их на теоретические и практи-
ческие, или прикладные. Между этими категориями существует по-
стоянная взаимосвязь и взаимопроникновение. В биохимии, как
и в других областях науки, существуют хорошо документированные
примеры удачного использования достижений теоретической науки
в разработке практических вопросов и в равной мере замечатель-
ных научных открытий, сделанных на основе обобщения результа-
тов прикладных исследований. Поэтому принятое здесь подразделе-
ние в какой-то мере условно, и мы должны признать отсутствие
четкой границы между указанными целями и задачами.
Теоретические задачи биохимии сводятся к тому, чтобы на мо-
лекулярном уровне описать состав, строение и функции компонен-
тов клетки и осознать их значение для организма в норме и па-
тологии. Практические задачи биохимии человека заключаются,
в частности, в том, чтобы диагностировать болезни и следить за
их течением, наблюдая за изменениями химического состава крови,
мочи и других биологических жидкостей, чтобы создать научную
основу химиотерапии, обеспечив избирательное разрушение клеток
возбудителей, нейтрализацию токсинов или замещение необходимых
компонентов в случаях их недостаточности, чтобы изыскать рацио-
нальные основы питания для соответствующих стадий роста и
дифференцировки.
Совершенно независимо от этих целей, связанных с задачами
профессиональной подготовки, существуют два довода философ-
ского характера в пользу обстоятельного изучения фундаменталь-
ных биологических дисциплин будущими медиками. Первый довод
основан на предположении о том, что обстоятельное ознакомление с
научными идеями и достижениями в изучении человека в норме и
ВВЕДЕНИЕ 35
патологии будет способствовать более рациональному, критическо-
му подходу к последующей работе в клинике. Второй довод выте-
кает из опыта нашей работы: студент, приобщенный к познанию
таинственных и прекрасных в своей сложности молекулярных ме-
ханизмов, став врачом, будет испытывать большее почтение к чело-
веческой жизни.
В заключение оговорка и призыв: пытаясь охарактеризовать
особенности обмена веществ у человека, мы слишком часто вынуж-
дены восполнять пробелы в наших знаниях путем экстраполяций,
используя не только результаты изучения других, более доступ-
ных исследователям живых существ, но также данные опытов, про-
веденных с различными клеточными или тканевыми препаратами,
которые позволяют изучать метаболические реакции in vitro. По-
этому во многих случаях наши сведения о механизмах регуляции
метаболических реакций представляют собой лишь контуры истин-
ной картины. Постепенно мы убеждаемся в том, что единственным
адекватным объектом для изучения обмена веществ у человека
является сам человек, т. е. организм человека как единое целое.
Мы надеемся, что некоторые из читателей этой книги будут в даль-
нейшем стремиться применить в своих клинических исследованиях
ряд фундаментальных биохимических концепций, с тем чтобы
заполнить пробелы в наших знаниях, касающихся обмена веществ у
человека, и пролить свет на те химические превращения в орга-
низме, которые имеют отношение к процессам развития, жизнедея-
тельности и поведения в норме и патологии.
Рекомендуемая
литература
Bondy Р. K.t Rosenberg L. Е. (eds.), Diseases of Metabolism, W. В. Saunders, Phi-
ladelphia, 1974.
Calvin M.t Pryor W. A. (eds.), Organic Chemistry of Life, W. H. Freeman, San
Francisco, 1973.
Handler P. W. (ed.), Biology and the Future of Man, Oxford University Press,
London, 1970.
Hoffman W. $., The Biochemistry of Clinical Medicine, Year Book Medical, Chi-
cago, 1970.
Latner A. L., Clinical Biochemistry, W. B. Saunders, Philadelphia, 1975.
Lehnin'ger A. L., Biochemistry, Worth, New York, 1975. [Имеется перевод: Ленин-
джер А. Биохимия.— М.: Мир, 1976.]
McGilvery R. №., Biochemistry. A Functional Approach, W. В. Saunders, Phila-
delphia, 1970.
Stanbury J. B., Wyngaarden J, B.t Fredrickson D. S. (eds.), The Metabolic Basis
of Inherited Disease, McGraw-Hill, New York, 1972.
Stryer L., Biochemistry, W. H. Freeman, San Francisco, 1975.
Thompson R. H. S., Wooton /. D. P. (eds.), Biochemical Disorders in Human Di-
sease, J. and A. Churchill, London, 1970.
White A., Handler P.t Smith E. L., Principles of Biochemistry, McGraw-Hill,
New York, 1973,
1
жизнь
КАК МОЛЕКУЛЯРНЫЙ
ПРОЦЕСС
В составе живой клетки, как и любого объекта материального
мира, нет ничего, кроме атомов и молекул. На протяжении столетий
люди пытались обнаружить какую-то жизненную силу, которая
могла бы вдохнуть в неодушевленное, безжизненное вещество те
удивительные «волшебные» свойства, которыми живые существа от-
личаются от окружающей их среды. Как же иначе мог натурфилософ
объяснить динамизм жизни, то, что живые организмы способны
воспринимать раздражения и отвечать на них, двигаться и целе-
сообразно приспосабливаться к изменениям окружающей среды,
приобретать специализированные органы и системы, обеспечиваю-
щие функции, необходимые для выживания, воспроизводить в по-
следующих поколениях почти точные копии этих высокодифферен-
цированных систем и, наконец, приобретать — когда процесс эво-
люции жизни, казалось бы, достиг вершины — способность к мыш-
лению, которая сделала возможной и даже неизбежной постановку
этих вопросов? Едва ли следует считать проявлением чрезмерной
самоуверенности со стороны человека то, что, размышляя о своих
собственных удивительных способностях, он приписал себе, а также
(в меньшей мере) низшим формам жизни некое жизненное начало
божественного происхождения, которое позволило его слишком
земной плоти выйти за рамки, якобы предопределенные происхож-
дением от инертной глины.
В наше время, однако, ясно, что жизненная сила («жизненный
порыв», душа, архей) или другой нематериальный жизненный фак-
тор в такой же мере иллюзорны и не поддаются конкретному изу-
чению, как и философский камень. Современные научные подходы
к изучению процессов жизнедеятельности вытекают из принципов,
сформулированных натурфилософами в конце XIX и начале XX сто-
летия: 1) «... Живое тело состоит из таких же веществ, которые
мы находим в неживой природе, эти вещества не только не имеют
иных свойств или возможностей в живом организме, но они даже не
утрачивают ни одного из своих свойств» (Virchow R. L. К., цит. по
Merz J. Т.: History of European Thought in the Nineteenth Century,
Vol. II, Edinburgh Blackwood and Sons, 1912, p. 377). 2) «... Мас-
са живой протоплазмы представляет собой фактически молекуляр-
ную машину исключительной сложности, общие результаты работы
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 37
которой, или процессы жизнедеятельности, зависят, с одной сторо-
ны, от ее устройства, а с другой — от поступающей к ней энергии»
(Huxley Т. Н., цит. по Merz J. Т.: History of European Thought in
the Nineteenth Century, Vol. II, Edinburgh Blackwood and Sons,
1912, p. 377). 3) «. . . Основное различие между живым и неживым
проявляется только после того, как мы вместо изолированных
явлений начинаем рассматривать совокупность всех протекающих в
организме процессов. Мы находим тогда, что эти процессы не проис-
ходят случайно и независимо, но определенным образом организо-
ваны и гармонируют друг с другом. Такая организация этих про-
цессов является наиболее ясной и фактически единственной чертой
различия между процессами жизнедеятельности и обычными физи-
ко-химическими процессами» (van Bertalanffy L., цит. по McDougall
W.: The Riddle of Life, London, Methuen, 1938, p. 161).
Таким образом, в основе процессов жизнедеятельности лежат
реакции атомов и молекул, протекающие в соответствии с теми же
фундаментальными законами, которые управляют их реакциями
вне организма. Уникальные свойства той «молекулярной машины»,
какой является живая клетка, определяются ее сложностью и
ее организацией. Логический анализ, разлагающий концепции на
их компоненты, может поэтому лишь в самых общих чертах охарак-
теризовать природу живого. Так, например, металлург, сообщая о
результатах анализа часов, укажет, что они содержат 59,82% Fe,
11,97% Си, 7,21% Zn и так далее. Понимание механизма, однако,
требует знания сложных особенностей его структуры и законов
механики, которые позволяют деталям работать согласованно.
Следовательно, нам необходимы фундаментальные сведения об
устройстве как составных частей, так и всего механизма в целом.
Очевидно, нам следует знать, как изменяются во времени соотно-
шения между составными частями и целым механизмом; мы должны
выяснить, какой энергией снабжается система и как механизм ис-
пользует эту энергию для выполнения работы; наконец, мы должны
понять, каким образом достигается гармоническое и бесперебойное
сочетание работы составных частей, так что работа всего механизма
оказывается целесообразной и регулируемой. Такой подход к изу-
чению часов заключается в рациональном сочетании синтеза и ана-
лиза. Подобно этому, изучение организма требует как аналитичес-
кого, так и синтетического подхода к характеристике составных час-
тей живой «машины» и к пониманию взаимодействия этих частей
в связи с проблемой возникновения более высоких форм сущест-
вования по сравнению с теми, которые были бы свойственны каж-
дой из составных частей в отдельности. Поэтому остановимся прежде
всего на результатах анализа компонентов организма, начиная с
наиболее простых, надеясь постепенно понять и более сложные и
наконец приступить к синтетическому рассмотрению картины в
целом.
38
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
ПРОСТЫЕ МОЛЕКУЛЫ
Все клетки содержат в избытке неорганические вещества. Моле-
кулы газов О2 и СО2 участвуют в окислительных процессах, проте-
кающих в клетке. Растворимые соли, особенно соли К+ и Na+,
определяют возбудимость и электрические свойства клеток. Нераст-
воримые соли, главным образом фосфаты кальция, придают устой-
чивость и прочность таким структурам, как кость. Наконец (и это,
вероятно, самое важное) универсальный растворитель — вода —
является той общей средой, в которой растворены все компоненты
происходящих в клетке химических реакций и при участии которой
в клетку поступают питательные вещества и выводятся конечные
продукты обмена.
Для живого, несомненно, характерны те молекулы, которые мы
называем органическими. Все эти молекулы богаты углеродом и
содержат также различные количества водорода, кислорода, азота
и в меньшей мере фосфора, серы, а также железа и других металлов.
Во всех известных нам живых системах наиболее важным элементом
является углерод. Это объясняется исключительной маневренно-
стью, с которой атом углерода способен делиться своими восемью
электронами, находящимися на его наружной орбите. Образующие-
ся при этом структуры могут быть в значительной степени восста-
новлены (содержать водород) или окислены (содержать кислород);
энергия, освобождаемая при переходе от первого из этих состояний
ко второму, и составляет ту энергию, которая поддерживает жизнь.
В последующих разделах мы рассмотрим углеводы, жиры и другие
липиды, а также азотистые соединения, встречающиеся в организ-
ме, с точки зрения их изменений и взаимопревращений в процес-
сах, совокупность которых называется обменом веществ. В целях
подготовки к обсуждению этих проблем мы остановимся лишь на
некоторых примерах низкомолекулярных простых органических
соединений. Мы увидим, что эти соединения используются как эле-
менты, или кирпичики, которые, соединяясь друг с другом, обра-
зуют большие сложные здания клеток и тканей.
К числу таких простых химических компонентов организма от-
носятся сахара, органические кислоты, аминокислоты и азотсо-
держащие циклические соединения (рис. 1-1). Сахара, такие, на-
пример, как глюкоза, служат основным „топливом", удовлетворяю-
щим потребности клетки в энергии. Они свободно диффундируют
от клетки к клетке через жидкости тела. Для того чтобы клетки
могли использовать сахара, последние должны быть превращены в
сложные эфиры фосфорной кислоты, такие, как глюкозо-6-фосфат.
Органические кислоты, например уксусная кислота, являются про-
межуточными продуктами распада и синтеза множества других
соединений. Такие кислоты могут содержать более одной карбок-
сильной группы, как, например, янтарная и лимонная кислоты, или
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
39
Сахара
СН2ОН
Глюкоза
(гексоза)
Глюкоза-6-фосфат
(фосфорный эфир)
СН2ОН
Рибоза
(пентоза)
органические сн3соон
кислоты Уксусная
кислота
(монокарбоновая)
СНдСООН
СН2СООН
Янтарная
кислота
(Ъикарбоновая)
СН2СООН
но-снсоон
6н2соон
Лимонная кислота
( трикарбоновая)
сн3 сн2 сн2 сн2 сн2 сн2 сн2 сн2 сн2 сн2 сн2 сн2 сн2 сн2 сн2 сн2 сн2 соон
Стеариновая кислота
(жирная кислота с длинной цепью)
Аминокислоты
nh2
сн3-(!:нсоон
Аланин
NHr
££>СНСНг6нСООН
Лейцин (алифатическая
аминокислота)
nh2
СНуСНСООН
Фенилаланин
Азотистые
основания
Урацил
( пиримидин)
Аденин
(пурин)
(ароматическая
аминокислота)
Аденозинтрифосфат
(нуклеотид)
Рис, 1-1. Некоторые из наиболее важных низкомолекулярных органических сое-
динений, участвующих в процессах обмена веществ.
в составе их молекулы может присутствовать длинная цепь атомов
углерода, соединенная с карбоксильной группой, как в случае
углеводородов, входящих в состав жиров и других липидов. Ами-
нокислоты, например аланин, являются компонентами, из которых
построены белки. Все аминокислоты содержат по крайней мере
одну аминогруппу и одну карбоксильную группу, но к атому уг-
лерода, удерживающему эти две группы, могут быть присоединены
и другие группы; в молекуле лейцина, например, имеется алифати-
ческая группа, а фенилаланин содержит ароматический заместитель.
Азотсодержащие циклические соединения, такие, как урацил и аде-
нин, представляют собой азотистые основания, входящие в состав
40 ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
Мономеры
Рис. 1-2. Образование полимеров из небольших молекул,
—NHCHCO-NHCHCO-NHCHCO-
I I I
Остаток! Остаток2 Остаток3
Б. Полипептид или волок
В. Полинуклеотид или нуклеиновая
кислота
Рис. 1-3. Макромолекулы,
нуклеиновых кислот. Они обычно соединены с фосфатами сахаров,
образуя так называемые нуклеотиды, в молекулах которых имеются
также одна, две или три фосфатные группы. Фактически все много-
численные сложные молекулы, встречающиеся в клетках, построе-
ны из этих немногих относительно простых исходных веществ.
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 41
МАКРОМОЛЕКУЛЫ
Для того чтобы понять природу и значение этих сложных ги-
гантских молекул, необходимо хотя бы кратко остановиться на
процессе полимеризации. Этим термином обозначают явление при-
соединения отдельных молекул друг к другу с образованием длин-
ных цепей, подобно тому как из отдельных бусинок составляется
ожерелье (рис. 1-2). Отдельные молекулы-бусинки называют моно-
мерами. Они должны обладать свойством образовывать связи, со-
единяющие «голову» одной молекулы с «хвостом» другой таким
образом, чтобы возникала линейная последовательность множест-
ва звеньев, именуемая полимером. Из-за очень большого молекуляр-
ного веса, исчисляемого миллионами, биологические полимеры
часто называют макромолекулами.
К числу мономеров, способных к полимеризации, относятся:
сахара, которые образуют полисахариды (рис. 1-3, Л), аминокисло-
ты, образующие полипептиды или белки (рис. 1-3, Б), а также
нуклеотиды, которые образуют полинуклеотиды или нуклеиновые
кислоты (рис. 1-3, В). В большинстве случаев все мономеры, из
которых построен данный полисахарид, идентичны. Так, например,
в молекулах крахмала, гликогена и целлюлозы все мономеры —
это остатки глюкозы. Для синтеза таких полисахаридов необходим
источник энергии, обеспечивающий образование связей, которые со-
единяют глюкозные мономеры друг с другом.
Белки и нуклеиновые кислоты, напротив, построены не из иден-
тичных мономеров; аминокислоты в полипептидных цепях и ну-
клеотиды в полинуклеотидных цепях соединены между собой с обра-
зованием уникальных последовательностей, характерных для каж-
дой макромолекулы. Поэтому процесс их биосинтеза требует не
только энергии для активации процесса образования связей между
мономерами, но и механизма, обеспечивающего точное воспроизве-
дение определенной последовательности звеньев в молекулах по-
лимеров. Выяснение механизмов сборки таких макромолекул было
одним из захватывающе интересных и плодотворных путей разви-
тия современной биологии, что привело к созданию обобщений,
которые явились революционными достижениями в генетике и хи-
мии живых организмов на молекулярном уровне. Кратко излагае-
мые ниже сведения должны послужить фундаментом для последую-
щего обсуждения вопросов генетического контроля процессов обме-
на веществ и природы его врожденных нарушений.
ПЕРЕДАЧА БИОЛОГИЧЕСКОЙ ИНФОРМАЦИИ
Подобно тому как лингвистическая информация передается
последовательностью напечатанных на странице букв, так пере-
дача биологической информации осуществляется путем изменения
42
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
последовательности мономерных звеньев в линейных макромоле-
кулах. Мы можем исключить полисахариды из числа возможных
носителей информации: их повторяющие друг друга последователь-
ности мономеров создают «скучный» материал для чтения, в ко-
тором невозможны изменения «содержания». Нуклеиновые кислоты
и белки, напротив, могут служить для клетки теми банками памяти,
в которых хранится информация. При этом каждая линейная
последовательность соответствует определенному набору инструк-
ций о том, каким образом клетка будет построена и по какой про-
грамме будут осуществляться ее функции.
Первоначальный толчок к составлению этих инструкций исходит
от предков каждого организма в форме генетической информации,
переданной ему каждым из родителей. Современная биология ус-
тановила, что сущность этой генетической информации заключена
в особых нуклеиновых кислотах яйцеклетки и сперматозоида, в
так называемых дезоксирибонуклеиновых кислотах — ДНК. Ясно
также, что окончательное выполнение этих инструкций, опреде-
ляемых нашими генами, находит отражение в последовательности
аминокислот, образующих структурные и функциональные белки
клеток. Посредниками между первоначальной формулировкой и
осуществлением этих инструкций, касающихся процесса жизне-
деятельности, служат рибонуклеиновые кислоты — РНК. действую-
щие не только как носители, но и как переводчики при передаче
генетического сообщения. Принято обозначать этот поток генети-
ческой информации следующей краткой записью:
ДНК—> РНКБелок.
Это простое положение — главное кредо каждого современного
молекулярного биолога.
ДНК И РЕПЛИКАЦИЯ
ГЕНЕТИЧЕСКОЙ информации
Оплодотворенная яйцеклетка в принципе содержит необходимую
информацию, определяющую развитие всех особенностей строения
и функций взрослого организма. Молекулярной основой этой ин-
формации, или генотипа, является единица наследственности —
ген, состоящий из макромолекулы ДНК. Характерные признаки ор-
ганизма, называемые фенотипом, отражаются в конечном счете
в особенностях функциональных и структурных белков клеток.
Молекула ДНК данного гена определяет форму каждого полипеп-
тида.
Таким образом, чтобы фенотипы в ряду поколений организмов
обладали одинаковыми основными признаками, должен существо-
вать механизм, обеспечивающий точность передачи генетической
информации. Более того, подобное точное копирование генетической
1. жизнь КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 43
Рис. 1-5. Повторяющиеся структурные единицы, образующие молекулу ДНК.
Ф — фосфат. Др — дезоксирибоза, А — аденин, Т — тимин, Г — гуанин, Ц — цитозин.
информации должно происходить при каждом клеточном делении,
чтобы последовательные поколения клеток в одном и том же рас-
тущем организме содержали инструкции, касающиеся их дифферен-
цировки. Этот процесс называется репликацией ДНК. Удивительная
надежность копирующей системы является неотъемлемым свойст-
вом молекулы ДНК. Чтобы понять, как эта информация переда-
ется, необходимо прежде всего рассмотреть ее уникальную струк-
турную основу.
Для того чтобы представить себе структуру ДНК, вообразите
лестницу с десятью жесткими ступеньками и очень гибкими опор-
ными стойками (как у морской веревочной лестницы). Затем, закре-
пив нижнюю ступеньку в определенном положении, поверните
верхнюю ступеньку против часовой стрелки на 360°, т. е. так, чтобы
она описала полную окружность (рис. 1-4). Эта модель точно пере-
дает характер скручивания двунитевой структуры ДНК, которую
называют двойной спиралью. В действительности, каждая нить,
которую в нашей модели изображает веревка, представляет собой
44
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
Рис. 1-6. Комплементарные пары оснований в молекуле ДНК.
цепь дезоксирибозных компонентов ДНК, соединенных между
собой фосфатными мостиками с образованием линейного скелета
полинуклеотида (рис. 1-5). К каждому остатку дезоксирибозы при-
соединен обращенный внутрь остаток одной из четырех азотсодер-
жащих циклических структур —аденин (А), гуанин (Г), цитозин
(Ц) или тимин (Т). Таково строение нуклеотидного мономера.
Ступеньки, соединяющие между собой (с образованием лестницы)
две полинуклеотидные нити, образуются двумя особыми путями:
в результате связывания аденина одной нити с тимином другой
(А—Т) или в результате избирательного связывания гуанина одной
нити с цитозином другой (Г — Ц). Хотя эти поперечные связи чрез-
вычайно специфичны (т. е. А или Т никогда не присоединяется к Ц
или Г), каждая из таких связей очень слаба по сравнению с проч-
ными фосфатными мостиками, располагающимися вдоль нитей.
Взаимное притяжение и сцепление между обеими нитями, состав-
ляющими двойную спираль, определяется суммой всех этих слабых
сил, подобно тому как благодаря множеству слабых взаимодейст-
вий между отдельными зубцами соединены друг с другом две поло-
винки застежки-молнии. Следовательно, хотя нарушение целост-
ности каждой из нитей ДНК в биологических объектах наблюда-
ется редко нити ДНК могут, иногда отделяться одна от другой на
уровне связей А — Т и Г — Ц, т. е. расстегиваться. Такие попереч-
ные связи, соединяющие эти нити, называются комплементарными
парами оснований (рис. 1-6). Ограничения, налагаемые безусловным
Нити родительской ДНК
расходятся
Присоединение
новых
оснований
-А .... Т- -А .... Т-
-А.... 7- -А .... Т-
-Г ....ц- -г.... ц-
-Ц .... г- -U.... г-
-Ц.... Г- - и .... Г-
-Т.... А- -т.... А-
-и.... г- -ц.... г-
-Т.... А- -Т....А-
-Т.... А- -Т... А-
-А .... Т- -А ....Т-
X. Но Poi вые m \цтелы ти гкие'
нити
Две дочерние молекулы, ж
идентичные родительской
Рис. 1-7. Репликация молекулы ДНК с образованием двух идентичных двунитевых молекул.
46
1. жизнь КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
исключением определенных вариантов попарных сочетаний, не
только необходимы для поддержания двунитевой структуры, но
также, что более важно, обеспечивают точное воспроизведение
копий последовательности нуклеотидов в ДНК при передаче гене-
тической ин4»рмации.
Клетки человеческого организма являются диплоидными. Это
значит, что, за исключением сперматозоидов и неоплодотворен-
ных яйцеклеток, каждая клетка содержит по два гена (по одному
от каждого из родителей), соответствующих каждому наследуемому
признаку. Количество ДНК в каждой клетке остается постоянным,
за исключением того периода времени, когда клетка делится.
Непосредственно перед клеточным делением каждая молекула ДНК
подвергается точной репликации, что дает два идентичных генети-
ческих сообщения — по одному для каждой из дочерних клеток.
В механизме репликации ДНК участвует особый фермент — ДНК-
полимераза, под влиянием которого происходит разъединение двух
нитей ДНК и замена вновь поступающими нуклеотидами тех нук-
леотидов, которые занимали соответствующие места в другой нити
ДНК (рис. 1-7). Поскольку составлением новых пар оснований уп-
равляют те же законы, согласно которым были образованы связи
между двумя исходными нитями, новые нити будут точными копиями
тех, которые ими замещены. Как было отмечено выше при рас-
смотрении образования полисахаридов, для соединения остатков
дезоксирибозы между собой путем образования фосфатных мостиков
вдоль новой цепи требуется внешний источник энергии. Информа-
ция же, определяющая последовательность мономеров в новых це-
пях, заложена в исходной молекуле, которая служит матрицей при
своем собственном обновлении.
Понятие о матрице (представление о комплементарности двух
нитей ДНК) позволяет понять механизм дупликации генов. Соеди-
ненные между собой нити двойной спирали можно сравнить с двумя
половинками формы для литья: если эти половинки разнять, то
новый материал, заполняющий одну из них, образует точную копию
другой, и наоборот. Противостоящие друг другу нити ДНК компле-
ментарны друг другу. Как только последовательность оснований в
одной нити установлена, другая нить следует шаблону, задаваемому
партнером. Таким образом, принцип матрицы позволяет точно пе-
редавать генетическую информацию от одного поколения клеток
другому. Более подробно это описано в следующих разделах.
РНК И ТРАНСКРИПЦИЯ
ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ
Хотя молекулы ДНК служат идеальными хранилищами гене-
тической информации благодаря их стабильности, сложности и ги-
гантским размерам, именно эти свойства не позволяют им непо-
-А Т- -А д- -А 7-
-А 7- -А ~7..... А- -А 7-
-г и- -Г -ц г- -г Ц-
-и г- РНК-полимераза -11 -г ц- -Ц....;Г-
-и г- -и -г и- -и г-
- и г- Рибонуклеотиды -7 -Ц Г- -А У- ц- \ -7. А-
-7..... А- -7 А- У-^ к -7......А-
-7 А- -7..... А- -7. А-
-А 7- -А..... Т- 1 -А 7-
Родительская Транскрибируемая Образующаяся Неизмененная ДНК нить ДНК нить родительская
РНК ДНК
Новая
однонитевая
РНК
чек аз sj а
Рис. 1-8, Транскрипция нити ДНК с образованием однонитевой РНК, идентичной по последовательности
оснований одной из нитей ДНК, но с заменой Т (тимина) на У (урацил).
48
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
средственно передавать информацию. Громадные молекулы ДНК
находятся в виде комплексов с основными белками в плотно скру-
ченных структурных образованиях, называемых хромосомами,
которые находятся в окруженном мембраной клеточном ядре.
Поскольку процессы считывания генетической информации проис-
ходят в цитоплазме (т. е. за пределами ядерной оболочки), должен
непременно существовать какой-то посредник, обеспечивающий пе-
ренос информации, заключенной в молекулах ДНК. Таким посред-
ником служит относительно короткоживущая РНК, которую и
называют РНК-посредник (синонимы: информационная или матрич-
ная РНК).
Образование информационной РНК представляет собой просто
способ превращения матрицы ДНК в мобильную форму. В ходе этого
процесса информация как бы переписывается в более удобную для
чтения, но написанную на том же языке (а именно на языке после-
довательности оснований нуклеотидов в цепи) форму. Такая тран-
скрипция гена в некоторых отношениях сходна с репликацией, но
существуют также принципиальные различия между этими процес-
сами (рис. 1-8). Во-первых, эту реакцию катализирует другой фер-
мент, ДНК-зависимая РНК-полимераза, использующая только те
нуклеотиды, которые содержат рибозу вместо дезоксирибозы. Во-
вторых, из двух отделяющихся друг от друга нитей ДНК лишь
одна служит матрицей для образования РНК; поэтому образующая-
ся информационная РНК является однонитевой. В-третьих, правила
попарного взаимодействия азотистых оснований в процессе присое-
динения новых нуклеотидов соблюдаются, но при этом урацил (У) —
встречающееся в РНК эквивалентное тимину азотистое основание —
занимает место Т в нуклеотидной цепи. Наконец, регуляция про-
цесса транскрипции и период времени, когда он осуществляется,
принципиально иные по сравнению с репликацией, которая проис-
ходит только во время деления клетки. Информационная РНК син-
тезируется на протяжении жизни клетки независимо от образова-
ния новых клеток в тех случаях, когда существующим клеткам
требуются новые белки. Кроме того, в отличие от репликации
ДНК, при которой происходит полная дупликация всех генов
одновременно, в процессе транскрипции образуется информационная
РНК, копирующая часто один ген, независимо от всей прочей ге-
нетической информации. По сравнению с заключенными в клеточ-
ном ядре молекулами ДНК жизнь информационной РНК представ-
ляется быстротечной. После прохождения через поры ядерной мем-
браны в цитоплазму к месту своего участия в биосинтезе белка ин-
формационная РНК завершает исполнение своей роли, а затем
подвергается распаду на составляющие ее нуклеотиды.
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
49
СИНТЕЗ БЕЛКА
И ТРАНСЛЯЦИЯ ГЕНЕТИЧЕСКОЙ
ИНФОРМАЦИИ
Если описания процессов репликации ДНК и транскрипции
можно назвать рассказом о функциях клеточного ядра, то изло-
жение представлений о трансляции — это сага о рибосоме. Эта
мельчайшая сферическая частица, обнаруживаемая с помощью элек-
тронного микроскопа в цитоплазме всех клеток (от примитивней-
ших бактерий до сложных нервных клеток), фактически представ-
ляет собой гигантский конгломерат молекул. Среди субклеточных
структурных элементов рибосомы занимают промежуточное поло-
жение между макромолекулами и органеллами. Рибосома содержит
несколько десятков макромолекул (белков и нуклеиновых кислот),
собранных вместе определенным образом, но не имеет мембранной
оболочки, столь характерной для таких органелл, как клеточное
ядро или митохондрии.
Рибосома, название которой отражает высокое содержание в
ней РНК, состоит из двух различных компонентов, или субъеди-
ниц, что соответствует двум выполняемым рибосомой функциям:
меньшая субъединица участвует в передаче информации путем рас-
шифровки генетических сообщений, поступающих из клеточного
ядра; большая субъединица участвует в передаче энергии, необхо-
димой для соединения между собой аминокислот при образовании
полипептидной цепи. Термин трансляция (перевод) удовлетвори-
тельно описывает этот процесс в целом, поскольку информация,
заключенная в информационной РНК и выраженная в последо-
вательности нуклеотидов полинуклеотидной цепи, переводится
рибосомой на другой язык, а именно на язык последовательности
аминокислот в синтезируемом белке. Как узнавание аминокислот
при передаче информации, так и их активация при переносе энергии
требуют участия растворимых компонентов цитоплазмы, которые
действуют совместно с рибосомой и информационной РНК.
Аминокислоты, которые представляют собой «строительные бло-
ки», используемые для синтеза белка, находятся в виде истинно-
го раствора в цитоплазме клетки. Этот запас строительного ма-
териала называется фондом свободных аминокислот клетки. Посколь-
ку аминокислоты выполняют много дополнительных функций в ор-
ганизме, помимо участия в образовании белков, синтез последних
зависит от общего соотношения поставляемых и потребляемых
аминокислот. Из этого следует, что те аминокислоты, которые
не синтезируются в организме (незаменимые), должны поступать
в достаточном количестве с пищей и что общее количество потреб-
ляемых с пищей белков должно быть достаточным для обеспечения
синтеза других аминокислот (заменимых). Кроме того, поскольку
процессы биосинтеза потребляют энергию и поскольку сами амино-
50
1.ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
Область
петли
NH, дтф NH,0 Транспортная NH,0
R-ёН-СООН Я-СН-С-ф-Лденозю/ R-CH-COA
Аминокислота Аминоациладенилат Транспортная
РНК
Рис. 1-9. Активация аминокислоты при участии АТФ и перенос на специфичес-
кую транспортную РНК.
кислоты будут использованы для получения энергии в отсутствие
других ее источников, необходимо обеспечивать поступление о
пищей достаточного количества калорий в виде углеводов и жиров,
так чтобы аминокислоты максимально использовались в процессах
биосинтеза белков.
При соблюдении всех этих необходимых условий отдельные ами-
нокислоты из цитоплазматического фонда активируются и перено-
сятся в рибосому для сборки (рис. 1-9). Эта активация происходит
в цитоплазме и требует присутствия каталитических количеств
избирательно действующего ферментного белка, а также стехиомет-
рических количеств источника энергии, каковым служит нуклеотид
аденозинтрифосфат (АТФ). Как будет отмечено в гл. 3, запас энер-
гии в молекуле АТФ может быть использован в организме для мно-
гих целей. При активации аминокислот энергия переносится через
весьма реакционноспособный промежуточный продукт, образуемый
при участии карбоксильной группы и называемый аминоациладе-
нилатом. Это крайне нестабильное соединение существует лишь
кратковременно, а затем связывается с ферментным белком. Пос-
ледний катализирует перенос активного аминоацильного остатка
на небольшую молекулу растворимой РНК, которая также встре-
чается в свободном виде в цитоплазме. Поскольку аминокислота,
все еще активированная по своей карбоксильной группе, именно
таким образом переносится на рибосому, молекула-переносчик полу-
чила название транспортной РНК. В этой же форме находятся ами-
нокислоты в ходе процессов их узнавания, а также размещения при
сборке полипептидов (в соответствии с полученной генетической
информацией).
Транспортная РНК обладает несколькими свойствами, которые
идеально обеспечивают выполнение ею функций переноса и узна-
вания: во-первых, ее молекула невелика; она построена всего
из 80 нуклеотидов (информационная РНК состоит из нескольких
сотен нуклеотидов) и поэтому очень подвижна; во-вторых, она
обладает настолько высокой степенью избирательности, что дан-
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 51
ная транспортная РНК может принять одну и только одну активи-
рованную аминокислоту (из этого следует, что для каждой амино-
кислоты, которая может быть включена в белковую молекулу, име-
ется особая молекула транспортной РНК); в-третьих, несмотря на
уникальность каждой транспортной РНК, все они имеют общее
строение в той их концевой части, где активированные аминокис-
лоты присоединяются через активированную карбоксильную груп-
пу к концевому аденозину, наконец (что является наиболее важным),
на сгибе в середине молекулы транспортной РНК, вдали от ами-
нокислоты, имеется область петли, обладающая особой последова-
тельностью нуклеотидов, которая составляет уникальный центр
узнавания для взаимодействия соответствующей аминокислоты с
предназначаемой для нее областью строчки генетического сообще-
ния.
КОДОНЫ И АНТИКОДОНЫ
Прежде чем продвинуться дальше в изучении механизма образо-
вания полипептидной цепи, необходимо рассмотреть способ записи
генетической информации, так называемый генетический код и
составляющие его «слова», или кодоны. Генетический язык, по су-
ществу, очень прост. Каждое слово, соответствующее отдельному
биту информации, состоит только из трех букв, каждая из которых
обозначает одно из четырех азотистых оснований, встречающихся в
нуклеотидах нити молекулы ДНК (т. е. А — аденин, Ц — цито-
зин, Г — гуанин, Т — тимин). При транскрипции нити ДНК обра-
зуется информационная РНК, которая представляет собой зеркаль-
ное отражение этой нити ДНК, но содержит «комплементарные»
азотистые основания, свойственные молекулам РНК (т. е. У —
урацил, Г — гуанин, Ц — цитозин, А — аденин соответственно).
Трехбуквенное слово, образованное той или иной последователь-
ностью азотистых оснований нуклеотидов информационной РНК,
определяет место той или иной аминокислоты при сборке на рибо-
соме; такой триплет азотистых оснований называется кодоном.
Определенную последовательность присоединения аминокислот к
растущей цепи обеспечивают транспортные РНК, специфичные для
отдельных аминокислот.
В центре узнавания, находящемся в молекуле транспортной
РНК в области петли, также имеются три азотистых основания,
которые комплементарны основаниям соответствующего кодона;
этот как бы противостоящий триплет азотистых оснований, способ-
ный избирательно соединяться с кодоном, называется антикодоном.
Таким образом, антикодон представляет собой точную копию трип-
летной последовательности нуклеотидов той нити ДНК, которая
была использована при транскрипции.
52
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
Ниже приведены примеры нескольких кодонов и соответствую-
щих им антикодонов:
Нетранскрибируемая нить ДНК —ТЦТ — ГЦТ —ГТА —ТЦЦ
Транскрибируемая нить ДНК —АГА —ЦГА —ЦАТ—АГГ
Кодоны информационной РНК—УЦУ— ГЦУ — ГУА—УЦЦ
Антикодоны транспортной РНК — АГИ—ЦГИ—ЦАИ — АГИ
Аминокислоты серин] аланин валин серин2
Этот пример иллюстрирует некоторые особенности системы кодиро-
вания. Обратите внимание прежде всего на то, что иная буква
(И — инозин) «пробралась» на последнее место многих антикодонов.
Такая неоднозначность (wobble — «люфт») придает некоторую гиб-
кость всей системе, поскольку инозин может образовывать пары
с несколькими азотистыми основаниями. Таким образом, два мало
отличающихся друг от друга кодона (— УЦУ и — УЦЦ) могут вза-
имодействовать с одной и той же транспортной РНК для серина,
как это и показано. Фактически существуют все 64 кодона, соот-
ветствующие всем возможным сочетаниям четырех нуклеотидов в
триплеты. Некоторые из 20 включающихся в белки аминокислот
могут использовать по два или более триплета (с учетом «люфта»),
что в совокупности составляет 61 различный кодон; три остающихся
кодона не используются для кодирования включения какой-либо
аминокислоты, а служат сигналами либо начала (инициация),
либо прекращения (терминация) считывания.
Второй важнейший вопрос, на котором следует остановиться,
касается последствий изменения буквы в одном из кодонов. По-
добное изменение может возникнуть в результате химического или
физического воздействия, которое приводит к замене одного из
азотистых оснований в ДНК другим основанием. Изменение подоб-
ного типа называют мутацией генетического материала. Если, на-
пример, мутация приведет к изменению триплета АГА в транскриби-
руемой нити на ДГА, то последовательность аминокислот в нашем
примере содержала бы два аланина вместо двух серинов. Последст-
вия замещения этой одной из нескольких сотен аминокислот син-
тезированной полипептидной цепи могут быть незначительными,
если та область белка, где произошла данная замена, не имеет
решающего функционального значения. Но если серин, например,
выполнял важную функцию, как это имеет место при каталитиче-
ском действии многих ферментных белков, или если он был необхо-
дим для обеспечения уникальной структуры и формы молекулы
белка, то последствия мутации были бы серьезными, возможно,
даже трагическими для ее носителя; более подробно это будет опи-
сано ниже.
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 53
ФОРМИРОВАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ
Механизм чтения генетического кода напоминает работу магни-
тофона, причем информационная РНК действует как лента, на ко-
торой сделана магнитофонная запись, а рибосома — как звукосни-
мающая головка магнитофона. В отсутствие записанного на пленку
материала рибосома, разумеется, будет «немой», но когда клеточное
ядро побуждается к транскрипции определенного участка ДНК,
образующаяся при этом нить информационной РНК выходит в ци-
топлазму и поступает в трансляционный механизм рибосомы,
находящийся на меньшей из ее двух субъединиц. Этот процесс про-
текает только в одном направлении; «проигрывание» в обратном
направлении, которое привело бы к искажению смысла записи,
невозможно. Самой записанной информации предшествует ини-
циирующий кодон. В правильной ориентировке и поступлении
информационной РНК в считывающий механизм участвуют также
другие находящиеся в цитоплазме факторы. Когда этот процесс
заканчивается, большая субъединица рибосомы может присоеди-
няться к ее малой субъединице, все еще взаимодействующей с ин
формационной лентой, образуя функционирующую как единый
механизм систему. Постепенно лента протягивается через рибосому,
которая последовательно считывает информацию, записанную в
виде кодонов (т. е. трех азотистых оснований нуклеотидов), добав-
ляя после прочтения каждого кодона по одной аминокислоте к
растущей полипептидной цепи (рис. 1-10).
Для того чтобы представить себе происходящие при этом про-
цессы, вообразите, как соответствующие нужным аминокислотам
транспортные РНК выстраиваются вдоль информационной РНК и
связываются с ней благодаря избирательным контактам антикодо-
нов с кодонами. Соединение соседних аминокислот друг с другом
пептидными связями ведет к образованию их линейной последова-
тельности, соответствующей закодированному сообщению. Факти-
чески, однако, рибосома и информационная РНК в одно и то же
время соединяются лишь с двумя транспортными РНК. Аминокис-
лота, присоединенная к первой транспортной РНК (серинх в нашем
примере) затем освобождается и взаимодействует своей карбокси-
льной группой со свободной аминогруппой той аминокислоты,
которая присоединена ко второй транспортной РНК (аланин на
нашей схеме). Первая транспортная РНК теперь имеет возможность
соскользнуть с информационной РНК, которая будет протягивать-
ся через рибосому далее, передвигая вторую транспортную РНК со
все еще присоединенным к ней серил-аланином на место, которое
занимала по отношению к рибосоме первая транспортная РНК.
Благодаря этому соседний кодон получает возможность взаимодей-
ствовать с антикодоном транспортной РНК для следующей ами-
нокислоты (т. е. валина) в синтезируемом полипептиде. Опять ами-
Малая
1. жизнь КАК молекулярный ПРОЦЕСС 55
ноацильный остаток, занимающий первое положение на рибосоме
(серил-аланин), будет присоединяться к свободной NH2-rpynne со-
седней аминокислоты (валина) при участии вновь присоединенной
транспортной РНК. Этот момент и изображен на рис. 1-10.
Таким образом, информационная РНК скользит через рибосому
шаг за шагом, кодон за кодоном, тогда как пептидная цепь, все
еще присоединенная к информационной РНК, растет в длину, при-
соединяя одну аминокислоту за другой. Когда запись генетической
информации заканчивается, на что указывает один из терминирую-
щих кодонов, полипептидная цепь освобождается и рибосома делится
на две составляющие ее субъединицы, готовясь к восприятию сле-
дующей порции генетической информации. На электронной микро-
фотографии работающие в клетке рибосомы можно узнать по тому,
что они соединены с нитью информационной РНК- Фактически
одна нить информационной РНК может считываться последователь-
но и одновременно многими рибосомами. Такое ожерелье из рибо-
сом, расположенных на равных расстояниях друг от друга вдоль
одной нити информационной РНК, называется полирибосомой или
полисомой. Полисомами изобилуют растущие клетки.
Синтез белка в клетке требует затраты значительного количе-
ства энергии. Как было отмечено выше, энергия, необходимая для
активации аминокислот, образующих белки, поставляется в виде
макроэргического соединения фосфора (АТФ) и сохраняется в ре-
акционноспособной ацильной связи с транспортной РНК. Таков
источник энергии, непосредственно используемой для образования
пептидной связи в белках; энергия необходима, кроме того, для
обеспечения механических процессов, сопряженных с функцией
рибосом, таких, как связывание приближающихся к рибосоме
транспортных РНК и движение цепи вдоль информационной РНК.
Тем метаболитом, от которого зависят эти процессы, является дру-
гое макроэргическое соединение — гуанозинтрифосфат (ГТФ).
Как будет отмечено в следующем разделе, источником энергии, за
счет которого пополняется расходуемый в этих процессах ГТФ,
служит в конечном счете АТФ, который представляет собой первич-
ную, наиболее универсальную движущую силу фактически для
всех реакций синтеза в организме.
БЕЛКИ И ИХ ФУНКЦИИ
В предыдущем разделе было отмечено, что молекулярная архи-
тектура живых клеток составляет ту основную черту, которая от-
личает их от неживой материи. Из всех макромолекул, участвую-
щих в создании этой уникальной биологической суперструктуры,
белки играют наиболее значительную роль. Они не только наиболее
щедро представлены в организме человека (составляют более поло-
вины растворимого содержимого большей части клеток), но и харак-
56
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
теризуются также наибольшим диапазоном вариаций размеров
(величины молекулярного веса варьируют от нескольких тысяч до
миллионов), формы (от длинных палочек до компактных шаров) и
физических свойств (от водорастворимых или жирорастворимых до
нерастворимых). Они значительно различаются также по физиоло-
гическим функциям, действуя в качестве катализаторов, подвижных
переносчиков или структурных компонентов. С точки зренйя био-
лога целесообразно классифицировать белки, основываясь на функ-
циях, которые они выполняют в организме, что и сделано при пос-
ледующем изложении.
Достаточно лишь назвать главнейшие функциональные группы
белков и кратко рассмотреть некоторые примеры для того, чтобы
осознать значение белков для организма человека в норме и пато-
логии. Первыми следует назвать многочисленные ферменты —
белковые молекулы, способные избирательно связываться с другими
молекулами в клетках и катализировать реакции, необходимые для
получения новых продуктов и энергии, поддерживающей процессы
жизнедеятельности. В конечном счете физиологические процессы,
протекающие в организме, невозможны без ферментов, обеспечиваю-
щих химические превращения при температуре, совместимой с ус-
ловиями существования живой материи. Ферменты, участвующие в
процессах переваривания пищи, расщепляют пищевые вещества в
желудочно-кишечном тракте до продуктов, подлежащих всасыва-
нию; если такие ферменты не образуются (например, при кистозном
фиброзе), то в результате нарушения переваривания пищи разви-
ваются серьезные патологические симптомы. Процесс свертывания
крови зависит от некоторых ферментов, инициирующих образова-
ние сгустка в ответ на повреждение; отсутствие одного из факторов
свертывания может привести к геморрагическому диатезу, извест-
ному под названием „гемофилия**. Процессы образования энергии в
тканях осуществляются благодаря специальным ферментам ткане-
вого дыхания; вдыхание ядовитых газов, таких, например, как си-
нильная кислота, которые нарушают действие этих ферментов,
может привести к гибели организма в результате недостатка энер-
гии в клетках. Другие ферменты обеспечивают присущие нервной и
мышечной ткани свойства возбудимости и раздражимости; яды или
фармакологические препараты, которые действуют на такие фермен-
ты, могут поэтому вызывать обезболивание, паралич или судороги.
Наконец (и это имеет отношение к клинической диагностике),
многие ферменты попадают в кровоток в результате повреждения
той или иной ткани или органа; например, обнаружение в пробе
крови больших количеств фермента, который в норме встречается
только в сердечной мышце, может быть использовано в кардиологии
для диагностики и наблюдения за течением болезни.
Второе место занимают гормоны полипептидной природы —
белки, которые обеспечивают регуляцию многих функций организ-
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 57
ма. Есть гормоны, которые управляют синтезом или активностью
ферментов, создавая тонко сбалансированную систему, позволяю-
щую организму реагировать на изменения условий окружающей
среды. Некоторые полипептидные гормоны, например секретируе-
мые в кровь поджелудочной железой, служат химическими сигна-
лами для других тканей, стимулируя образование или утилизацию
сахара и таким образом поддерживая его постоянный уровень в
крови. Отсутствие одного из таких гормонов, инсулина, приводит к
развитию сахарного диабета — заболевания, при котором проис-
ходит неконтролируемое повышение уровня сахара в крови после
приема богатой углеводами пищи.
Третье место занимают белки, играющие механическую, или
структурную, роль. К их числу относятся сократительные белки
мышц и прочные волокнистые белки эластического и костного кар-
каса организма; нарушение синтеза и целостности одного из таких
соединительнотканных белков — коллагена — отмечается при
недостаточности в организме витамина С, что приводит к развитию
характерных для цинги клинических симптомов, связанных с по-
вреждением стенок кровеносных сосудов.
Четвертую функцию выполняет группа разнообразных белков,
которые связываются с другими соединениями и служат для них
переносчиками. Важнейший из них — гемоглобин эритроцитов, кото-
рый переносит не только кислород от легких к тканям, но и дву-
окись углерода в обратном направлении. Недостаток железа,
необходимого для синтеза гемоглобина, приводит к анемии и умень-
шению способности крови поставлять тканям кислород, используе-
мый для выработки энергии. Существуют разнообразные типы бел-
ков, специально приспособленных для переноса нерастворимых
липидов, стероидных гормонов и металлов между тканями через
кровоток и в пределах клетки через водорастворимую часть цито-
плазмы. Обнаружение в крови аномальных концентраций таких
переносчиков, как липопротеиды, может служить ценным диагно-
стическим признаком, например, нарушений обмена липидов.
Пятую, и последнюю, группу составляют иммуноглобулины —
особые белки, которые образуют в организме первую «линию обо-
роны» против „нашествия извне". Чужеродные белки или организмы,
попадающие в кровоток, стимулируют лимфоидные ткани к образо-
ванию специфических антител, представляющих собой белки, кото-
рые обладают уникальным свойством связывать и инактивировать
проникшее в организм чужеродное вещество, или антиген. При
бактериальных инфекциях, например, резко возрастает количество
белков, относящихся к у-глобулиновой фракции, что имеет зна-
чение для успешного отражения угрозы со стороны «агрессора».
58
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
УРОВНИ ОРГАНИЗАЦИИ БЕЛКА
Можно ожидать, что найдется студент, который в этом месте
нетерпеливо воскликнет: «Достаточно! Я убежден в том, что белки —
важные соединения. Но избавьте меня, пожалуйста, от мучитель-
ных подробностей, касающихся их трехмерной извилистости.
Переходите к существу: что и почему они делают? Освободите меня
из плена этих водородных связей и пептидных цепей». Такому
трусу я могу предложить выход — пропустить следующий раздел,
в котором я хочу дать краткий набросок (только «скелет», без под-
робностей) основных черт структуры белков человека. Для того
чтобы разобраться в его физиологии и патологии, необходимо знать
хотя бы важнейшие особенности строения организма. Точно так же,
прежде чем рассматривать механизм и значение функций белка,
следует ознакомиться с основами его «анатомии». Существуют
четыре важнейших уровня организации белковых молекул; вполне
логично, что их называют соответственно первичной, вторичной,
третичной и четвертичной структурами.
Первичная структура
Этим термином обозначают линейную последовательность амино-
кислот в полипептидной цепи. Мы можем в определенной мере оха-
рактеризовать различные белки, указав общее содержание в них
каждого из аминокислотных компонентов, но, если речь идет о
чем-то большем, чем о питательной ценности белков, то такой под-
ход мало что даст. Известно, что действие ряда факторов, определяю-
щих форму и функцию белковых молекул, зависит от точной лока-
лизации определенных ключевых аминокислот в цепи. Недостаточ-
но указать, например, что для осуществления определенной ката-
литической функции в полипептидной цепи должен быть остаток
серина; этот ключевой серин должен быть именно 195-м, считая от
конца цепи. Дело в том, что сам способ укладки полипептидной
цепи при образовании белковых молекул зависит от точного вза-
иморасположения аминокислот в ней. Теоретически можно считать,
что если какая-то линейная последовательность аминокислот в
белке задана, то тем самым однозначно определены особенности
строения и функции белковой молекулы.
Подобно тому как все нуклеиновые кислоты имеют тот же остов,
образованный углеводно-фосфатными связями, так и все белки
обладают одинаковым пептидным остовом. Различия между белками
зависят от различий в природе боковых аминокислотных цепей,
которые отходят в стороны от линейной полипептидной цепи (рис. 1-
11). Вот почему эти остатки (R) называют боковыми цепями пептида.
Если большинство этих боковых цепей в белке составляют алифати-
ческие остатки (например, аланин, валин и лейцин), то белковая
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 59
Полипепгпи^ный остов
г
о
(-NH-CH-C-NH-CH-C-NH-CH-C-NH-CH-C-NH-CH-C-NH-
'•ill
сн
/ X
СНз СНз
Валин
о
II
о
II
о
II
о
II
сн2
СОО“
Аспартат
(СН.)4
I
NH,‘
Лизин
сн2
СН2ОН
серин
он
Остатки
боковых
цепей
1-1/ T.1J
Тирозин
Рис. 1-11. Первичная структура белка.
молекула в целом гидрофобия, т. е. она обладает свойством
взаимодействовать в клетках с липидами, образуя структурные
компоненты мембран, или, возможно, с циркулирующими в крови
переносчиками-липопротеидами. Если же в белке преобладают боко-
вые цепи, несущие свободные ионизированные группы, то белковая
молекула более гидрофильна и способна вступать в связь с другими
несущими противоположный заряд ионами, образуя соединения ти-
па солей.
Если в белке преобладают аминокислоты со свободным отрица-
тельным зарядом (например, аспартат или глутамат), то вся белко-
вая молекула при характерном для тканей человеческого тела нейт-
ральном значении pH будет иметь кислотный характер; если же
преобладают положительно заряженные боковые цепи (например,
лизин, аргинин и гистидин), то получаются основные белки, такие,
например, как гистоны, взаимодействующие с ДНК. Практически
подобные белки можно легко распознать по небольшим различиям в
их суммарном заряде. Метод электрофореза позволяет разделять
белки благодаря различной скорости их движения в электрическом
поле.
Изменение заряда определенных аминокислот в белках приво-
дит к глубоким изменениям биологической активности последних.
Наиболее ярким примером такого явления может служить воздей-
ствие присоединения фосфатной группы: в ядре, например, та-
ким путем может быть нарушено взаимодействие ДНК с гистонами
хроматина, что снимает ограничения процесса образования инфор-
мационной РНК, ускоряя тем самым синтез белков. В случае
гемоглобина замена одного отрицательно заряженного аминокис-
лотного остатка нейтральной аминокислотой может вызвать такое
резкое изменение структуры белковой молекулы, а затем и струк-
туры эритроцита, которое иногда несовместимо с жизнью; именно
так обстоит дело при наследственном заболевании, известном под
названием „серповидноклеточная анемия". В других случаях фос-
форилирование или дефосфорилирование некоторых регуляторных
ферментов может либо полностью нарушить их каталитическую
60
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
функцию, либо активировать ее. Подобные изменения занимают
центральное положение в регуляции процессов жизнедеятельности,
в их приспособлении к потребностям организма как целого.
Вторичная структура
Подобно нуклеиновым кислотам, полипептидные цепи склонны
скручиваться в спираль, наподобие штопора. Однако в отличие от
двойной спирали ДНК полипептидная спираль образуется в преде-
лах одной цепи благодаря взаимодействиям между Н-атомом одной
пептидной связи и атомом кислорода карбонильной группы четвер-
той по счету (вдоль цепи) пептидной связи. Такая компактная струк-
тура называется а-спиралью (рис. 1-12, А). Она в разной степени
степени представлена в различных белковых молекулах, придавая
полипептидным цепям большую жесткость по сравнению с менее
упорядоченной и не столь компактной формой, известной под назва-
нием статистический клубок". Наличие некоторых аминокислот,
боковые цепи которых мешают друг другу (либо в результате боль-
шого размера остатков, либо из-за отталкивания одноименных
зарядов), препятствует образованию спирали, благоприятствуя
возникновению беспорядочного клубка (рис. 1-12, Б). Иминокис-
лота пролин не участвует вместе с аминокислотами в образовании
а-спирали; там, где встречается пролин, полипептидная цепь обра-
зует изгиб, или петлю, что нарушает правильную спираль.
При другом типе расположения, называемом ^-структурой,
полипептидная цепь полностью вытянута, а боковые цепи ориенти-
рованы вверх или вниз от нее. Такая структура может обеспечить
укладку полипептидных цепей в складчатый слой (рис. 1-12, В).
Каждый из типов вторичных структур встречается в различных
белках в разных соотношениях. Следует отметить, что эти «-спи-
ральные и складчатые 0-конформации обеспечивают упорядочен-
ность и стабильность, имеющие важнейшее значение для прочности и
устойчивости структуры белков, в частности соединительноткан-
ных.
Третичная структура
Структура белковой молекулы в целом организме определя-
ется не только сильными ковалентными взаимодействиями за счет
пептидных связей (которыми определяется первичная структура) и
более слабыми, закономерно повторяющимися взаимодействиями
между соседними аминокислотами в полипептидных цепях (которые
определяют вторичную структуру), но также взаимодействиями меж-
ду остатками, находящимися в линейной последовательности на зна-
чительном расстоянии друг от друга. Возникающие в результате
этого сгибы и петли в структуре молекулы белка, придающие ей
62 1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
Скопление
гидрофобных
остатков
Электростатические
солевые
мостики
NH3*
Рис. 1-13. Третичная структура белка.
форму, напоминающую крендель, составляют третичную струк-
туру (рис. 1-13). Такая конфигурация сохраняется благодаря не-
скольким типам взаимодействий: во-первых, гидрофобные остатки,
«испытывая отвращение» к окружающей их воде, стремятся взаимо-
действовать друг с другом преимущественно внутри белковой мо-
лекулы; во-вторых, разноименно заряженные остатки в различной
степени электростатически притягивают друг друга в различных
участках полипептидной цепи; в-третьих, возможно очень сильное
взаимодействие при сближении —SH групп двух молекул цистеина
с последующим окислением и образованием —S—S—, или дисуль-
фидного мостика. Эти и другие, более слабые, взаимодействия между
боковыми цепями определенных аминокислот, часто находящихся
на большом расстоянии друг от друга в линейной последователь-
ности, определяют уникально свернутую трехмерную форму бел-
ковой молекулы. Эта особая форма, имеющая решающее значение
для осуществления присущих белковой молекуле функций, подобно
вторичной структуре, определяется в конечном счете первичной
структурой — последовательностью аминокислот в полипептидной
цепи.
Общая форма молекулы белка связана с его функциональной
и структурной ролью в клетке. Так, для молекул тех белков, ко-
торые образуют длинные волокна в структурах тканей, несущих
значительную механическую нагрузку, характерно относительно
малое число изгибов и петель; в этих случаях, наоборот, преобла-
дают те взаимодействия, которые укрепляют упорядоченные спи-
ральные формы, чем достигается повышение растяжимости в про-
дольном направлении и жесткости молекулы. Такие длинные и
тонкие молекулы обычно называют фибриллярными белками.
Более компактная, сфероидная форма других белков благопри-
ятствует их встраиванию в мембраны или их взаимодействию с не-
большими молекулами. В молекулах таких белков могут быть об-
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 63
ласти с упорядоченной структурой, представленной либо a-спира-
лями, либо 0-структурами, однако петли и изгибы, укрепленные
дисульфидными мостиками и другими поперечными связями, при-
дают таким молекулам форму запутанного клубка; подобные струк-
туры обычно называют глобулярными белками.
Значение и специфичность образования складок в молекулах
белков становятся очевидными при рассмотрении последствий
денатурации белков. Этим термином обозначают результаты воздей-
ствия высокой температуры или химических соединений, вызываю-
щих расправление складок природной третичной конформации моле-
кул белка. Обычно при денатурации белка утрачивается его нор-
мальная функциональная активность (гл. 2); часто денатурация
приводит к необратимой утрате растворимости белка в биологичес-
ких жидкостях; это происходит, например, при свертывании яич-
ного белка, когда яйцо варят. В некоторых случаях, если рас-
правление третичной структуры проводить мягко при тщательно
контролируемых условиях, денатурация бывает обратимой — сохра-
няется возможность возвращения к нормальной активной конфигу-
рации. Нагревание при стерилизации хирургических инструментов,
пастеризации молока и т. д. используют именно для денатурации
бактериальных белков. К числу более мощных денатурирующих
белки агентов относятся сильные кислоты или щелочи, окислители,
соединения, содержащие тяжелые металлы, а также мочевина,
спирты и фенолы.
Четвертичная структура
Высший уровень структурной организации белка — четвертич-
ная структура — имеет большое значение для регуляции активно-
сти ряда ферментов. Функциональная единица подобных белков
состоит не из одной, а из нескольких полипептидных цепей, собран-
ных вместе (рис. 1-14). Каждая полипептидная цепь называется
субъединицей. Эти субъединицы могут существенно различаться,
О;
О,
Две различные
субъединицы»
каждая из
которых имеет
центр связывания
кислорода
j °2
Тетрамер (гемоглобин)
Оа
Рис. 1-14. Четвертичная структура белка на примере гемоглобина,
64
1 ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
но, взаимодействуя в единой системе, они оказывают влияние друг
на друга; это будет показано при рассмотрении проблемы регу-
ляторных ферментов (гл. 2).
Другим примером может служить О2-переносящий белок крови
гемоглобин, состоящий из четырех полипептидных цепей, каждая
из которых связывает одну молекулу О2. При этом субъединицы
действуют не независимо — они кооперируются: взаимодействие с
кислородом одного центра связывания ведет к изменению конфор-
мации соседней полипептидной цепи, что облегчает связывание О2
соседней субъединицей. Таким образом, находясь в легких, где боль-
шая часть его центров связывания занята, гемоглобин обладает
повышенным сродством к О2, тогда как в периферических тканях,
по мере того как центры связывания постепенно освобождаются,
гемоглобин все более легко освобождает О2.
Не все белки обладают выраженной четвертичной структурой, а
те, которым она присуща, обычно обнаруживают кооперативные
взаимодействия между субъединицами, что имеет весьма важное
значение для регуляции процессов обмена веществ и физиологи-
ческих функций в организме.
МЕМБРАНЫ И ОРГАНЕЛЛЫ
Вся сложность, многообразие и динамизм проявлений жизнеде-
ятельности имеют в своей основе взаимодействия молекул, как
больших, так и малых. Из предыдущих разделов мы видели, какие
взаимодействия гигантских макромолекул возможны при дуплика-
ции живых систем. Следует иметь в виду, что взаимодействия, кото-
рые мы обсуждали до сих пор, имеют преимущественно линейный,
одномерный характер; мономеры ДНК образуют цепь, соответст-
вующую цепи информационной РНК, которая в свою очередь соот-
ветствует цепи аминокислот в белках клетки. Описывая эти соответ-
ствия указанных линейных макромолекул, можно отметить, что
ДНК, информационная РНК и полипептиды коллинеарны. Таким
образом, хотя и следует избегать чрезмерного упрощения, полагая,
что ширина, глубина и другие параметры конформации имеют вто-
ростепенное значение, все же наше основное внимание при рассмот-
рении проблем передачи информации, определяющей последова-
тельность мономеров в этих полимерах, обращено на одномерные
образования. Если же рассматриваются биологические мембраны,
основное внимание уделяется взаимодействиям относительно не-
больших молекул, которые придают организации клеточных струк-
тур двумерность. Благодаря своей двумерной природе биологиче-
ские мембраны изолируют и защищают клетку от факторов внешней
среды, создавая одновременно гигантский поверхностный слой,
на уровне которого осуществляются многие важные физиологиче-
ские процессы.
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 65
Рис. 1-15, Двойной липидный слой биологической мембраны, образованный фосфо-
глицеридами.
Структура и состав мембран различны и зависят от типа ткани
и от локализации мембран в клетке. Тем не менее все мембраны
имеют общие свойства. Во-первых, все они содержат в различных
соотношениях белки и липиды; во-вторых, именно липиды придают
структуре двумерную организацию; в-третьих, входящие в состав
мембраны компоненты расположены по отношению к двум ее по-
верхностям асимметрично; наконец, мембраны в клетках обладают
значительной степенью подвижности и гибкости, что позволяет им
растягиваться, отделяться от основной части мембраны и в ряде
случаев сливаться друг с другом. Для того чтобы понять эти осо-
бенности мембран, необходимо прежде всего рассмотреть некоторые
свойства входящих в их состав липидов и характер взаимодействия
липидов при образовании слоистых структур.
Важнейшие мембранные липиды, содержащие фосфор и глице-
рин, называются фосфоглицеридами. Хотя существуют некоторые
вариации в основном плане их строения (как отмечено в гл. 5), в
рамках данного рассмотрения достаточно отметить в самых общих
чертах, что принцип построения этих соединений определяется нали-
чием небольшой фосфоглицеридной части, к которой присоединены
две длинные углеводородные цепи молекул жирных кислот. Эти
жирные кислоты совершенно несовместимы с водой и не растворя-
ются в ней (гидрофобии), тогда как фосфоглицеридная часть «пре-
красно чувствует себя» в водных растворах (гидрофильна). Резуль-
татом такого необычного совмещения противоположных свойств в
одной молекуле является то, что при попадании фосфоглицеридов в
водную среду (т. е. в ту или иную биологическую жидкость) они
совершенно самопроизвольно группируются в две тонкие пленки,
«или бимолекулярные липидные слои» (рис. 1-15). Образование
66
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
Наружная
сторона.
Белок-?
Внутренняя
сторона
Рис. 1-16, Расположение белковых молекул в двухслойном остове клеточной мем*
браны.
такого биологического «сэндвича» начинается со стремления гид-
рофобного „хвоста“ молекулы жирной кислоты избежать взаимодей-
ствия с водой; алкильные цепи, предпочитая объединяться друг с
другом, но не с молекулами окружающей их воды, группируются в
продольном направлении, образуя монослой толщиной в одну моле-
кулу. Две половины такого сэндвича затем соединяются так, что
углеводородные цепи оказываются внутри, а гидрофильные «го-
ловы» составляют наружные поверхности, обращенные к окружаю-
щей водной среде. Такова основная двуслойная структура, состав-
ляющая главный каркас всех клеточных мембран. Благодаря гид-
рофобной сердцевине такие мембраны препятствуют движению мно-
гих водорастворимых соединений, что обеспечивает удерживание
таких жизненно важных веществ в клетке.
Прохождение веществ через мембраны — это процесс очень важ-
ный для живых систем. Наряду с ограничениями проницаемости,
которые создаются бимолекулярным липидным слоем, существует
целый ряд механизмов, обеспечивающих избирательное прохожде-
ние питательных веществ (например, сахаров и аминокислот) в
клетку и конечных продуктов обмена (СО2 и NH3) из клетки. Су-
ществуют аналогичные механизмы управления «воротами», через
которые проходят мелкие ионы (например, Н + , Na + , К+) в клетку
и из клетки, что поддерживает на определенном уровне электриче-
ский заряд тканей, в частности нервной и мышечной. Эта специфи-
ческая транспортная функция возможна благодаря наличию в
мембране определенных белков, пронизывающих липидный слой и
имеющих таким образом выход на обе стороны мембраны (рис. 1-16).
Другие белковые молекулы в зависимости от того, взаимодействуют
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 67
ли они с внеклеточными или с внутриклеточными компонентами,
располагаются только на одной стороне и связываются либо с
наружным, либо с внутренним монослоем. В других случаях, как
предполагают, некоторые белки либо поворачиваются, либо двига-
ются, подобно челноку, сквозь бимолекулярный слой, соприка-
саясь одной стороной то с наружной, то с внутренней поверхностью
клетки.
Другие мембранные белки «специально устроены» и расположе-
ны в клетке так, чтобы служить рецепторами для гормонов или
иных факторов, модифицирующих реакцию клетки на изменения
окружающей среды; имеются также мембранные белки, выполняю-
щие функции катализаторов реакций обмена веществ, протекающих
в узкоспециализированных мембранных структурах субклеточных
органелл. Хотя возможны некоторые вариации в липидном составе
(например, в соотношении различных фосфоглицеридов или в нали-
чии других липидов, таких, как стероиды), однако главные разли-
чия в свойствах между мембранами разных тканей и разных суб-
клеточных структур в пределах одной ткани обусловлены различи-
ями в составе и соотношениях характерных для них белков.
ПЛАЗМАТИЧЕСКАЯ МЕМБРАНА
Плазматическая мембрана представляет собой барьер, обеспе"
чивающий существование каждой клетки как самостоятельной
единицы, отделенной от соседних структур и защищенной от влия-
ния изменений окружающей среды. В некоторых случаях (например,
у эритроцита) плазматическая мембрана обращена в сторону окру-
жающей среды гладкой, недифференцированной поверхностью; в
других (например, у клеток почечных канальцев или у клеток
эпителия кишечника) плазматическая мембрана образует множество
ворсинок, чем достигается увеличение площади ее поверхности
и, следовательно, облегчается транспорт веществ в клетку и из
клетки (рис. 1-17). При других условиях, например в местах, где
соприкасаются две нервные клетки, в области контакта между
клеточными мембранами образуются различимые специализиро-
ванные структуры. За пределами разрешающей способности микро-
скопии лежат имеющиеся на наружной поверхности клеточных мем-
бран специфические молекулярные приспособления, позволяющие
определенным гормонам взаимодействовать с определенными клет-
ками-мишенями. Подобно тому как купальный костюм «бикини»
позволяет обнажить все, что можно, прикрывая все, что нужно,
так и плазматическая мембрана должна оптимальным образом
совмещать две противоположные функции: максимальный доступ в
клетку веществ из окружающей среды и вместе с тем надежную
защиту.
68 1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
Рис. 1-17. Мембраны и органеллы типичной клетки.
/ — межклеточный контакт, 2 — ворсинки, 3 — плазматическая мембрана, 4 — нуклеопро-
теид, 5 — пора, 6 — ядро, 7 — ядрышко, 8 — рибосомы,, 9 — микронити, 10 — микротру-
бочки, 11 — шероховатый эндоплазматический ретикулум, 12 — гладкий эндоплазматиче-
ский ретикулум, 13 — тельце Гольджи, 14 — секреторные гранулы, 15 — лизосома, 16 —
цитоплазма, 17 — митохондрия, 18 — кристы, 19 — матрикс.
Ниже будут рассмотрены потребности в энергии для движения
ионов (гл. 3), поглощения глюкозы (гл. 4) и аминокислот (гл. 6).
Каждый из этих транспортных процессов, по-видимому, зависит от
взаимодействия вещества, переносимого сквозь плазматическую
мембрану, с молекулой специфического белкового переносчика.
Это взаимодействие во многих отношениях напоминает реакцию
субстрата со специфическим ферментом (гл. 2). Возможно, что
энергия, необходимая для активного переноса веществ против гра-
диента концентраций, расходуется, в частности, либо при повороте
белка-переносчика с переменой его ориентации, либо при меньших
конформационных изменениях переносчика, в результате которых
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 69
последний приобретает способность связывать различные соедине-
ния по обе стороны мембраны. В тех случаях, когда соединения,
нерастворимые обычно в углеводородной средней части мембраны,
пассивно передвигаются сквозь нее в любом направлении, белок-
переносчик может просто участвовать в образовании пронизываю-
щей мембрану поры, т. е. гидрофильного канала сквозь гидрофоб-
ный барьер, окружающий клетку. Соотношение между размерами
этих пор, а также величиной и формой переносимых молекул опре-
деляет возможность переноса таким путем.
В построении центров узнавания на наружной поверхности плаз-
матической мембраны часто принимают участие остатки сахаров,
присоединенные к периферическим белкам (гликопротеидам) или
липидам (гликолипидам). Такие остатки сахаров всегда находятся
только на наружной поверхности клетки. Центры узнавания чрез-
вычайно важны для обнаружения иммунной системой чужеродных
клеток в организме, для узнавания отдельными клетками друг
друга при их соединении в процессе построения тканей, для так
называемого контактного торможения клеточной пролиферации.
Последняя из перечисленных регуляторных систем и факторы, на-
рушающие ее функцию, возможно, будут иметь решающее значение
для понимания процесса малигнизации.
У «входа» в клетку находится еще один важный «контролер» —
рецептор гормонов. Многие гормоны действуют как посредники при
передаче сигналов между клетками, не проникая внутрь той клетки,
которой адресованы сообщения. Вместо этого они передают сигнал
контролеру, который в свою очередь, не покидая поста, передает
информацию через второго посредника, передвигающегося только в
пределах данной клетки. Более подробно механизм действия второго
посредника и его роль в процессах обмена веществ описаны в гл. 2
в связи с проблемой регуляции активности ферментов. Здесь же
следует отметить, что полипептиды и другие гормоны, не проникаю-
щие сквозь клеточные мембраны, действуют на соответствующие
клетки-мишени путем весьма избирательного взаимодействия толь-
ко с теми клетками, которые снабжены комплементарными рецеп-
торами-контролерами, говорящими на том же языке и находящи-
мися на наружной поверхности мембраны. Второй посредник, дей-
ствующий внутри клетки, по-видимому, универсален для всех
клеток независимо от источника стимулов, воздействующих на на-
ружный рецептор.
КЛЕТОЧНОЕ ЯДРО
Несомненно, самой крупной органеллой клетки, видимой под
обычным световым микроскопом, является ядро; оно присутствует
во всех клетках организма, за исключением эритроцитов. (В эрит-
роцитах отсутствуют также другие органеллы — митохондрии и
70
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
эндоплазматический ретикулум.) В ядре содержится основная масса
ДНК клетки; здесь она связана с белками — гистонами. Эти белки
содержат избыток основных аминокислот (например, лизина и ар-
гинина) и поэтому имеют общий положительный заряд. Положи-
тельно заряженные гистоны легко образуют ионные связи с отри-
цательно заряженными фосфатными группами нуклеотидной цепи
молекулы ДНК. Возникающий таким образом нуклеопротеидный
комплекс обладает двумя важными особенностями: во-первых, он
способен регулировать активность ДНК в клетке (как отмечено в
гл. 2) и, во-вторых, способствует плотной упаковке длинных моле-
кул ДНК в компактные структуры — хромосомы. Сложность проб-
лемы хранения ДНК можно оценить, если учесть, что ядро клетки
в организме человека должно содержать в среднем примерно пять
миллиардов нуклеотидных пар в структуре ДНК. Длина этой
структуры в полностью растянутом виде составила бы примерно два
метра. Кроме белков, хромосомы содержат также значительные
количества РНК, аналогичной той, которая находится в рибосомах.
Ядерная РНК в основном сосредоточена в специальной области хро-
мосом, представляющей собой уплотненную структуру, называемую
ядрышком', последнее играет роль фабрики по производству рибосом-
ной РНК.
Ядро окружено характерной двойной мембраной. Внутренняя
мембрана относится к собственно ядру, иногда к ней присоеди-
нены нити ДНК. Наружная мембрана «усеяна» рибосомами и состав-
ляет часть единой системы эндоплазматического ретикулума. Об-
разованный двойной мембраной барьер пронизывают расположенные
на разном расстоянии друг от друга отверстия, или ядерные поры.
Эти поры достаточно велики, чтобы пропустить молекулы информа-
ционной РНК наружу, а молекулы белка — внутрь, по направле-
нию к ядерному пространству. Такая взаимосвязь между ядром и
цитоплазмой, очевидно, имеет большое значение для регуляции
процесса синтеза макромолекул.
МИТОХОНДРИИ
Подобно ядрам, митохондрии встречаются в клетках человече-
ского организма практически повсеместно. Обычно в клетке на
одно ядро приходится много (до нескольких сотен) митохондрий.
Митохондрии едва различимы под световым микроскопом; на элек-
тронных микрофотографиях видно, что размеры и форма митохон-
дрий в разных тканях различны. В секреторных клетках, таких,
как клетки почек, митохондрии длинные, нитевидные; они распо-
ложены вблизи секреторной мембраны. В мышечной ткани митохон-
дрии плотно упакованы в зоне расположения волокон сократитель-
ной системы. В других тканях, таких, как ткань печени, где струк-
турные ограничения выражены в меньшей мере, чем в тканях, упо-
1. жизнь КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС 71
мянутых выше, форма митохондрий приближается к сферической;
митохондрии свободно и быстро передвигаются в цитоплазме.
Митохондрии, как и ядра, окружены двойной мембраной, однако
здесь мембрана не имеет пор, соединяющих матрикс с цитоплазмой.
Все вещества, поступающие в митохондрии, должны вначале про-
никнуть сквозь гладкую наружную мембрану, относительно порис-
тую, а затем сквозь внутреннюю мембрану, которая служит барье-
ром, ограничивающим проницаемость. Внутренняя мембрана
является истинной функциональной мембраной митохондрий, содер-
жащей весьма сложно организованную систему белков, которые
участвуют в окислительных процессах, продуцирующих энергию.
Внутренняя мембрана митохондрий образует многочисленные,
обращенные внутрь складки, или кристы, что позволяет создать
максимальную площадь поверхности, на которой протекают осо-
бенно важные реакции. Суммарная площадь поверхности, создавае-
мой этими складками мембраны в клетках печени человека, в сред-
нем составляет величину, превышающую 10 000 квадратных метров.
Имеется соответствие между интенсивностью дыхания различных
типов клеток и числом митохондрий в них, а также числом крист в
митохондриях.
Митохондрии содержат небольшие количества ДНК, а также
рибосомы, отличающиеся от цитоплазматических. Однако они обла-
дают ограниченной способностью синтезировать лишь немногие из
числа митохондриальных белков и липидов, основная масса которых
поступает в митохондрии из мест синтеза этих соединений в цито-
плазме.
ЭНДОПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ
Эндоплазматический ретикулум представляет собой сеть обра-
зованных мембранными структурами трубочек, пронизывающих
цитоплазму и сливающихся в некоторых местах с ядром, плазмати-
ческой мембраной и аппаратом Гольджи. Аппарат Гольджи состоит
из целого ряда как бы сложенных стопкой канальцев, содержащих
секреторные белки. Во многих местах эндоплазматический ретику-
лум усеян рибосомами, прочно связанными с мембраной. Получены
данные, свидетельствующие о важном значении таких связанных
рибосом для синтеза белков, секретируемых клеткой, так сказать,
«на экспорт». Белки же, синтезируемые на свободных рибосомах,
находящихся в цитоплазме, предназначены для использования са-
мой клеткой. Белки, секретируемые из клетки или используемые
для образования новой плазматической мембраны, вероятно, по-
ступают в полости эндоплазматического ретикулума для переноса
во внеклеточное пространство; именно во время продвижения по
канальцам системы Гольджи происходит присоединение к белку
углеводных компонентов с образованием гликопротеидов.
72
I. жизнь КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
В системе гладкого эндоплазматического ретикулума, свободного
от рибосом, протекают окислительные процессы, необходимые,
например, для детоксикации некоторых лекарственных препаратов
(в частности, барбитуратов). При систематическом поступлении
таких веществ в организм в течение длительного периода времени
наблюдается адаптивное накопление гладкого эндоплазматического
ретикулума в клетках печени, что обусловлено индуцированным
синтезом новых мембран для повышения интенсивности процесса
детоксикации.
ЛИЗОСОМЫ
Лизосомы выполняют в клетке роль «мусорщиков». Они особен-
но активны при процессах фагоцитоза, в ходе которых происходит
переваривание захваченных клетками чужеродных веществ, а так-
же при аутолизе, происходящем в условиях переваривания внутри-
клеточных компонентов при дегенерации или гибели клетки. Лизо-
сома представляет собой, своего рода мешочек, образованный оди-
нарной мембраной и содержащий набор гидролитических ферментов,
способных расщеплять клеточные белки, нуклеиновые кислоты,
липиды и т. д. Лизосомы, вероятно, участвуют и в нормальной жизни
клетки, способствуя удалению изношенных или поврежденных ор-
ганелл. Так, в клетках печени нередко видны лизосомы, соединен-
ные с частично разрушенными митохондриальными структурами.
Известны патологические состояния, сопровождающиеся пролифе-
рацией лизосом, захватывающих и расщепляющих аномальные ли-
пиды, что имеет место в тканях нервной системы у больных с врож-
денными липоидозами (так называемые «лизосомные болезни»).
Неконтролируемое лизосомное переваривание достигает наибольшей
интенсивности при распаде тканей в условиях посмертного аутолиза.
ДРУГИЕ ВНУТРИКЛЕТОЧНЫЕ
ВКЛЮЧЕНИЯ
В предыдущих разделах были рассмотрены наиболее важные
мембраны и органеллы, встречающиеся в большинстве клеток орга-
низма. Другие мембранные структуры, специально приспособлен-
ные для выполнения самых разнообразных функций, распростра-
нены в разной мере в различных тканях. К числу подобных струк-
тур относятся такие секреторные образования, как синаптические
пузырьки нейронов, содержащие нейромедиаторы, хромаффинные
гранулы мозгового слоя надпочечника, содержащие катехоламины,
зимогенные гранулы поджелудочной железы, содержащие пищева-
рительные ферменты. Во всех этих случаях мембрана образует
своего рода футляр, благодаря которому реакционноспособные
1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
73
вещества сохраняются в цитоплазме в безопасной для клетки форме
до тех пор, пока в них не возникнет необходимость.
Помимо окруженных мембранами включений, многие клетки со-
держат фибриллы и трубочки, состоящие лишь из белков. Таковы
например, микротрубочки, придающие жесткость содержимому
клеток, направляющие поток компонентов цитоплазмы и участвую-
щие в движениях хромосом в процессах клеточного деления. Микро-
фибриллы, которые в поперечнике меньше микротрубочек, также
участвуют в движениях многих типов клеток аналогично их участию
в сокращении мышц. Такие микрофибриллы, по-видимому, содержат
белки, сходные с белками мышц.
Рекомендуемая
литература
Anfinsen С. В., Principles that Govern the Folding of Polypeptide Chains, Science#
181, 223—230 (1973).
В rawer man G., Eukaryotic Messenger RNA, Ann. Rev. Biochem., 43, 621—642
(1974).
Bretscher M.S., Membrane Structure. Some General Principles, Science, 181, 622—
629 (1973).
Capaldi R., A Dinamic Model of Cell Membranes, Sci. Am., 230, (3), 26—33 (1974).
Caskey С. T., Peptide Chain Termination, Advan. Prot. Chem., 27, 243—276 (1973).
Davidson J. N., The Biochemistry of Nucleic Acids, Academic Press, New York,
1972. [Имеется перевод: Дэвидсон Дж. Биохимия нуклеиновых кислот.—
М.: Мир, 1972.]
Farber Е. (ed.), The Pathology of Transcription and Translation, M. Dekker, New
York, 1972.
Finean J. B., Coleman R., Michell R. H., Membranes and Their Cellular Functions#
Blackwell Scientific, Oxford, 1974. [Имеется перевод: Финеан Дж., Колмэн Р.,
Мичелл Р. Мембраны и их функции в клетке.— М.: Мир, 1977.]
Frieden Е., The Chemical Elements of Life, Sci. Am., 227, (1), 52—64 (1972).
Gefter M. L., DNA Replication, Ann. Rev. Biochem., 44, 45—78 (1975).
Haselkorn R., Rothman-Denes L. B., Protein Synthesis, Ann. Rev. Biochem., 42,
397—438 (1973).
Klein A., Bonhoeffer F., DNA Replication, Ann. Rev. Biochem., 41, 301—332
(1972).
Kornberg A., DNA Synthesis, W. H. Freeman, San Francisco, 1974. [Имеется пере-
вод: Корнберг А. Синтез ДНК.—- M.: Мир, 1977.]
Leder Р., The Elongation Reaction in Protein Synthesis, Advan. Prot. Chem., 27,
213—242 (1973).
Light A., Proteins: Structure and Function, Prentice-Hall, Englewood Cliffs, 1974.
Losick R., In vitro Transcription, Ann. Rev. Biochem., 41, 409—446 (1972).
Miller 0. L., The Visualization of Genes in Action, Sci Am., 228, (3), 34—42 (1973).
Nomura M., Tissieres A., Lengyel P. (eds.), Ribosomes, Cold Spring Harbor Labo-
ratory, 1975.
Novikoff A. B., Holtzmann E., Cells and Organells, Holt, Rinehart and Winston,
New York, 1970.
Satir B., The Final Steps in Secretion, Sci. Am., 233, (4), 29—37 (1975).
Sharon N., Glycoproteins, Sci. Am., 230, (5), 78—86 (1974).
Singer S. J., Molecular Organization of Membranes, Ann. Rev. Biochem., 43, 805—
833 (1974).
Smith J. D., Genetic and Structural Analysis of Transfer RNA, Brit, Med. Bull,,
29, 220-225 (1973).
74 1. ЖИЗНЬ КАК МОЛЕКУЛЯРНЫЙ ПРОЦЕСС
Stein G. S., Stein J, S., Kleinsmith L. J., Chromosomal Proteins and Gene Regu-
lation, Sci. Am., 232 (2), 46—57 (1975).
Tanford C., The Hydrophobic Effect, Wiley-In terscience, New York, 1973.
Wainwright S. D., Control Mechanism and Protein Synthesis, Columbia Univer-
sity Press, New York, 1972.
Watson J. D., Molecular Biology of the Gene, V. Benjamin, Menlo Park, CA, 1975.
[Имеется перевод: Уотсон Дж. Молекулярная биология гена.— М.: Мир,
1978.]
Weissman S. M.t Brawerman G., Gene Structure and Function, In: Bondy P. К.»
Rosenberg L. E. (eds.), Dieases of Metabolism, W. B. Saunders, Philadelphia,
pp. 5—30, 1974.
Wetlaufer D. B.t Ristow S.t Acquisition of tree-dimensional Structure of Proteins,
Ann. Rev. Biochem., 42, 135—158 (1973).
2 ФЕРМЕНТЫ
Метаболизм, или обмен веществ, представляет собой процесс,
при котором, с одной стороны, из простых веществ строятся бо-
лее сложные, а с другой — происходит распад веществ до конечных
продуктов обмена, что сопровождается высвобождением энергии.
Процесс построения обозначают термином анаболизм, а распад на-
зывают катаболизмом (рис. 2.1). В основе «химической экономики»
организма в целом лежит тонко сбалансированное равновесие
между процессами анаболизма и катаболизма. Так, в норме в орга-
низме взрослого ткани находятся в стационарном состоянии; не-
прерывно происходит распад некоторых компонентов с выработкой
энергии и восполнение этих компонентов в процессе анаболизма с
использованием потребляемых пищевых веществ. В условиях пато-
логии — при лихорадочных состояниях, голодании или недоста-
точном питании — преобладают процессы катаболизма, что может
привести к истощению и смерти. В периоды выздоровления после
болезней, в процессе заживления ран, во время беременности,
лактации и роста преобладает анаболизм; патологически выражен-
ное преобладание анаболизма может привести к чрезмерному росту
(гигантизм) или ожирению. Нарушения обмена веществ в большин-
стве случаев обусловлены повреждением тех механизмов, которые
в норме регулируют скорость процессов анаболизма и катаболизма,
поддерживая определенные соотношении между ними, в различных
тканях тела.
Метаболизм
Анаболизм Катаболизм
Биосинтез Распад
Небольшие —► Большие молекулы Большие —► Небольшие молекулы
Энергия требуется (AF+) Энергия освобождается (AF~)
Неупорядоченность уменьшается Неупорядоченность возрастает
Часто имеет восстановительный характер Часто имеет окислительный характер
Примеры
Глюконеогенез
Синтез жиров
Синтез белков
—I
Гликолиз
Липолиз
Протеолиз
Рис. 2-1. Анаболизм и катаболизм,
76
2. ФЕРМЕНТЫ
Особенности ферментов
Как белков
Состоят из аминокислот (~|-простати-
ческие группы)
Имеют высокий молекулярный вес
Неустойчивы при нагревании
Инактивируются денатурирующими
агентами (тяжелые металлы и
анионы)
Как катализаторов
Активны в небольших количествах
Не изменяются в ходе реакции
Увеличивают только скорость реакции
Не изменяют положения равновесия
Чувствительны к действию ядов
Рис. 2-2. Общие свойства ферментов.
Скорость метаболических процессов определяется действием
многочисленных биологических катализаторов, ферментов. При
изучении обмена веществ особенно важно исследовать функции
ферментов и охарактеризовать факторы, воздействующие на эти
функции (рис. 2.2). Учение о ферментах (энзимология) составляет
основу познания на молекулярном уровне важнейших проблем фи-
зиологии и патологии человека. Переваривание пищевых веществ и
их использование для выработки энергии, образование структурных
и функциональных компонентов тканей, сокращение мышц, пере-
дача электрических сигналов по нервным волокнам, восприятие
света глазом, свертывание крови — каждый из этих физиологи-
ческих механизмов имеет в основе каталитическое действие опреде-
ленных ферментов. Было показано, что многочисленные заболевания
непосредственно вызываются нарушением ферментативного ката-
лиза; определение активности ферментов в крови и других тканях
дает сведения, ценность которых для медицинской диагностики не-
уклонно растет. Само собой разумеется, что знание некоторых
важнейших особенностей ферментов и катализируемых ими реакций
необходимо при рациональном подходе к изучению заболеваний
человека и их диагностике.
ПРИРОДА ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
Механизм действия ферментов сложен и до сих пор полностью
не понят. Важнейшие особенности процесса, катализируемого
ферментом, можно представить в виде следующих последовательных
этапов (рис. 2-3):
1. Фермент (enzyme, Е) соединяется с субстратом (S), т. е. с
веществом, на которое он действует:
E + SZ^E—S.
Как показывают стрелки, эта реакция обратима.
2. В результате э*гого соединения возникает Е-S, фермент-суб-
стратный комплекс.
2. ФЕРМЕНТЫ
77
комплекс
Рис. 2-3. Реакция фермента и его субстрата с образованием фермент-субстрат-
ного комплекса.
3. После соединения с ферментом субстрат активируется, в ре-
зультате чего входящие в молекулу субстрата атомы и электро-
ны легко перестраиваются, что приводит к образованию продукта
этой реакции (Р):
Е-S —Е-Р.
4. Этот комплекс затем подвергается диссоциации, освобождая
продукт реакции и свободный фермент:
Е-Р->Е + Р.
Следует отметить, что в ходе реакции химические превращения
претерпевает только субстрат; фермент, который действовал лишь
в качестве катализатора, остается неизменным. Такой неизменный
фермент может реагировать вновь и вновь с другими молекулами
субстрата. Поскольку эти реакции протекают очень быстро, неболь-
шое количество фермента катализирует превращение значительных
количеств субстрата в продукт реакции за короткое время.
В принципе все ферментативные реакции в какой-то мере обра-
тимы, т. е. фермент способен реагировать с продуктом катализи-
руемой им реакции, образуя субстрат. Скорость этой обратной
реакции в организме зависит от концентраций участвующих в
ней веществ. Накопление продукта может настолько замедлить
прямую реакцию, что начнет преобладать обратная. Однако, если
78
2. ФЕРМЕНТЫ
продукт реакции обладает значительно меньшим запасом энергии,
чем субстрат, обратная реакция становится совершенно невозмож-
ной, поскольку она соответствовала бы движению системы вверх
по термодинамической лестнице (против градиента энергии). Та-
кие реакции называют необратимыми. В этих случаях обратное
превращение продукта реакции в субстрат требует участия другого
фермента, который катализировал бы эту обратную реакцию.
Если субстраты и продукты реакции могут значительно разли-
чаться по химическому строению и размерам, то ферменты непремен-
но представляют собой белки с молекулярным весом от нескольких
тысяч до нескольких миллионов. Очевидно, небольшие молекулы та-
ких субстратов, как сахар, могут соединяться с огромной белковой
молекулой во многих точках вдоль полипептидной цепи. Фактически
в образовании комплекса с субстратом участвует лишь определенная
область поверхности молекулы фермента — активный центр.
Последний состоит либо из нескольких аминокислот, расположен-
ных последовательно в полипептидной цепи, либо образуется в
результате взаимодействия аминокислот, удаленных друг от друга
в полипептидной цепи. В последнем случае молекула фермента в
активной конфигурации сложена таким образом, чтобы сблизить
между собой аминокислоты, принимающие непосредственное уча-
стие в построении активного центра.
Помимо аминокислотных остатков, активный центр фермента
содержит обычно небелковую простетическую группу. Последняя
представляет собой либо молекулу органического соединения, либо
неорганический атом (обычно атом металла). Простетическая группа
играет важную роль в действии фермента, облегчая его связывание
с субстратом или осуществляя перенос электронов, атомов или ионов
между субстратом и продуктом реакции. В организме простети-
ческая группа прочно связана с ферментом. Когда фермент выде-
ляют из ткани и подвергают очистке, простетическая группа оста-
ется с ним связанной. Если простетическую группу отделяют при
помощи жестких методов от исходного фермента, или холофермента,
то остающийся белок лишается каталитической активности (апофер-
мент). Реконструкция структуры и функции холофермента может
быть достигнута путем воссоединения при соответствующих усло-
виях апофермента с его простатической группой, что свидетельст-
вует о важной роли последней.
Если связь между ферментами и их простатическими группами
отличается высокой прочностью, то комплекс, образуемый актив-
ным центром с субстратом, является рыхлым, слабым и существу-
ет лишь кратковременно. В большинстве случаев соединение суб-
страта с ферментом настолько лабильно и недолговечно, что вы-
делить фермент-субстратный комплекс не представляется возмож-
ным. Такие комплексы удается обнаружить при помощи физических
методов исследования быстрых реакций (таких, например, как ме-
2. ФЕРМЕНТЫ
79
Рис. 2-4. Реакция фермента со структурным аналогом субстрата, действующим в
качестве конкурентного ингибитора.
Продукты реакции
ле образуются
тод остановленной струи), позволяющих производить измерения,
с улавливанием короткоживущих соединений.
Второй важной особенностью фермент-субстратного комплекса
является высокая специфичность взаимодействия. Химические груп-
пировки субстрата должны точно соответствовать в пространстве
очертаниям активного центра фермента, подобно тому как рука со-
ответствует перчатке (рис. 2-3). Перчатка может быть достаточно
эластичной, так что фермент может реагировать и с другим вещест-
вом, аналогичным по структуре истинному субстрату, например с
молекулами разных, но близко родственных сахаров. Если это
различие минимально, то аналог может соответствовать активному
центру и подвергаться превращению в продукт реакции, хотя,
вероятно, и с меньшей эффективностью по сравнению с природным
субстратом. Если такое структурное различие несколько больше,
то аналог все же реагирует с ферментом, образуя комплекс, но из-за
его несоответствия активному центру, „один палец останется вне
перчатки, на морозе", что исключает возможность каталитического
действия. В последнем случае аналог не только сам не реагирует, но,
занимая «бесполезно» часть активных центров, мешает природным
субстратам участвовать в реакции. Такой аналог действует как
ингибитор нормальной ферментативной реакции (рис. 2-4). Добав-
ление большого избытка нормального субстрата вытеснило бы
ингибитор из активного центра с возвращением каталитической
активности фермента к исходному уровню. Поскольку такой аналог
конкурирует с субстратом в его реакции с ферментом, его действие
называют конкурентным торможением. Этот принцип составляет
основу понятия о метаболическом антагонизме, согласно которому
80
2. ФЕРМЕНТЫ
структурный аналог жизненно важного компонента реакций обмена
может действовать как избирательный яд для клеток определенного
типа. К числу примеров практического использования этого важ-
ного энзимологического феномена в клинической медицине отно-
сится применение многих антибиотиков, которые действуют исклю-
чительно на метаболизм у микроорганизмов, а также применение
для химиотерапии рака анпгиметаболитов, которые избирательно
блокируют рост быстро делящихся клеток.
Реакция фермента с соответствующим субстратом может быть
настолько избирательной, что ни одно другое вещество не может
вступать в эту реакцию. Например, уреаза действует только на
мочевину, т. е. обладает абсолютной специфичностью. Во многих
случаях фермент не реагирует с оптическим изомером соответствую-
щего ему субстрата; так, оксидаза D-аминокислот не окисляет их
L-изомеры. В таких случаях особенно уместна аналогия с рукой в
перчатке: перчатка, в совершенстве соответствующая одной руке,
будет соответствовать и другой руке, являющейся как бы зеркаль-
ным отражением первой, лишь в том случае, если будет существо-
вать механизм для выворачивания перчатки внутренней стороной
наружу.
ВЛИЯНИЕ КОНЦЕНТРАЦИИ СУБСТРАТА
На скорость взаимодействия фермента с субстратом влияют
самые разнообразные факторы. Влияние концентрации молекул
субстрата очень важно в той ситуации, которая типична для живой
клетки. В любой момент времени число ферментов и их концентра-
ции, имеющиеся в клетке, строго ограничены, поскольку крупные
белковые молекулы не могут свободно передвигаться из клетки в
клетку. Молекулы субстратов, с другой стороны, обычно достаточно
малы для того, чтобы свободно диффундировать сквозь клеточные
мембраны из крови и других внеклеточных жидкостей. В результате
этого концентрации субстратов в клетке могут колебаться в широких
пределах в зависимости от состояния питания организма в данный
момент времени, потребностей в субстратах в условиях физической
нагрузки разных органов и тканей и т. д. При малом количестве
субстрата в системе вероятность его столкновения с молекулой
соответствующего фермента совершенно ничтожна и образование
продукта реакции будет происходить очень медленно. С повыше-
нием концентрации субстрата возрастает вероятность столкнове-
ния с присутствующими в определенном постоянном количестве мо-
лекулами фермента; фактически на этой стадии процесса при удвое-
нии концентрации субстрата скорость образования продукта реак-
ции возрастает вдвое (рис. 2-5, Л). В клетке при таких условиях
процессы, описанные выше при рассмотрении ведущих к соединению
фермента и субстрата стадий (1) и (2), будут факторами, лимитирую-
2. ФЕРМЕНТЫ
81
Фермент
преимущественно
свободен
Рис. 2-5. Влияние концентрации субстрата на скорость ферментативной реакции
А. Скорость реакции ограничена содержанием субстрата.
Б. Фермент насыщен субстратом.
щими скорость реакции. Таким образом, график зависимости ско-
рости (о) ферментативной реакции от концентрации субстрата (S)
будет представлять собой восходящую прямую, описываемую урав-
нением
v = C-[S],
где С — константа. Однако такая линейная зависимость не может
продолжаться бесконечно.
Представим себе, например, человека, который блаженствует,
отдыхая после сытного обеда и ощущая во всем теле приятное теп-
ло. Пока он отдыхает душой, компоненты пищи всасываются из ки-
шечника и быстро переносятся кровью к тканям. В клетках тканей
приток субстратов вызывает прирост скоростей метаболических
реакций, однако степень этого прироста постепенно уменьшается и
наконец эти реакции достигают постоянных, или максимальных,
82
2. ФЕРМЕНТЫ
скоростей; после этого дальнейшее повышение концентраций суб-
стратов не вызывает дальнейшего увеличения скоростей реакций.
Этот феномен объясняется очень просто: число молекул фермента в
клетке ограничено и, когда в какой-то момент клетка переполняется
субстратом, все активные центры фермента оказываются занятыми.
Короче говоря, никакие факторы, способствующие столкновениям
фермента с субстратом, не способны стимулировать их соединение
друг с другом, поскольку фермент уже до предела насыщен субстра-
том (рис. 2-5, Б). При этом лимитировать скорость реакции в целом
будут процессы, соответствующие стадиям (3) и (4), в ходе которых
фермент-субстратный комплекс диссоциирует с образованием про-
дуктов реакции. Скорость реакции в этих условиях описывается
уравнением
= Утах»
где Vmax — постоянная максимальная скорость.
Математическое уравнение, описывающее зависимость скорости
от концентрации субстрата в присутствии постоянного количества
фермента на основе изложенных выше представлений о взаимодейст-
вии фермента и субстрата, было выведено Михаэлисом и Ментен в
самом начале нынешнего столетия:
и У max [S]
(Km+|S1)’
где Км — обобщенная константа скорости, называемая константой
Михаэлиса. Это уравнение выражает изменение скорости при всех
величинах концентрации субстрата и описывает кривую, имеющую
форму прямоугольной гиперболы на графике зависимости v от ISJ
(рис. 2-6). Можно видеть, что те два линейных участка этой кривой,
которые были описаны ранее, легко выводятся из этого уравнения.
В первом случае, когда концентрация субстрата очень мала, [S]
значительно меньше, чем Км- При этих крайних условиях знамена-
тель Км+tSl стремится к Км, поскольку [S] очень мала относи-
тельно Км- Уравнение при этом приобретает вид г»=Утах15]/Км,
что эквивалентно соотношению, приведенному ранее: t>=CxlS],
поскольку Утах и — постоянные величины. Во втором слу-
чае, когда концентрация субстрата очень велика, [S] значительно
больше, чем Км- При данных крайних условиях величина знамена-
теля Км+lSl стремится к [S], так как Км относительно [S] — столь
малая величина, что ею можно пренебречь. Уравнение приобретает
вид г»=Утах [S]/[Sl=ymax, как было отмечено выше.
Константа Михаэлиса Км — весьма удобный количественный
параметр, помогающий установить, каким образом данный фермент
будет реагировать при тех условиях, которые имеются в живой
клетке. Величину Км можно определить графически по кривой
зависимости v от [SJ, принимая в уравнении Михаэлиса — Ментен
2. ФЕРМЕНТЫ
83
WSJ
V-*M + LSI
Рис. 2-6. Соотношение Михаэлиса — Ментен между скоростью ферментативной
реакции (у) и концентрацией субстрата ([S J).
^тах максимальная СК°Р°СТЬ п₽и насыщающей концентрации субстрата, а Кдо—
концентрация субстрата, при которой скорость равна половине Утах.
Km=[S1:
__ Утах |S1 _Ущах[^]___ 1 у
(ISJ + [SJ) 2 [S]______2 И*пах-
Иными словами, Км представляет собой концентрацию субстрата,
при которой скорость реакции равна половине максимальной. Если
фермент характеризуется высоким значением Км, то это означает,
что потребуется много субстрата для того, чтобы увеличить скорость
катализируемой этим ферментом реакции до половины максималь-
ной; низкая величина Км указывает на то, что для насыщения
фермента достаточно небольшого количества субстрата. Из этих
положений следует также, что фермент-субстратные пары с низким
значением Км характеризуются высоким сродством друг к другу и
наоборот.
Кроме того, величина Км помогает решить вопрос о том, какие
из групп субстратов будут наиболее эффективно связываться с
84 2. ФЕРМЕНТЫ
данным ферментом. Если фермент не обладает строгой специфич
ностью, то в присутствии обычных концентраций реагентов, имею
щихся в клетке, он будет предпочтительно катализировать реак-
цию, протекающую при участии того субстрата, для которого ха-
рактерна наиболее низкая величина Км при взаимодействии с дан-
ным ферментом. Знание концентраций различных субстратов в
клетке и величин Км при взаимодействии этих субстратов с фер-
ментами позволяет оценить вклад отдельных реакций в процесс
обмена веществ в организме в целом, а также установить, какая из
этих реакций лимитирует скорость всего процесса. Выяснение этих
вопросов совершенно необходимо для понимания воздействия физи-
ологических регуляторных факторов, таких, как гормоны, на ско-
рость метаболических реакций.
ВЛИЯНИЕ КОНЦЕНТРАЦИИ ФЕРМЕНТА
Хотя величина Км характерна и постоянна для каждой фермент-
субстратной пары, величина Vmax прямо пропорциональна коли-
честву имеющегося в системе фермента (рис. 2-7). Действительно,
можно показать алгебраически, что Vmax=/s [Е], где [Е] — концент-
рация фермента, a k — константа скорости для реакций, описанных
выше при рассмотрении этапов (3) и (4). Измерение Vmax, или ско-
рости ферментативной реакции в присутствии насыщающей концент-
рации субстрата, фактически служит мерой числа имеющихся в
клетке молекул фермента. Хотя не всегда удается выразить [Е] в
молях на литр, поскольку величина k не всегда известна, можно
Рис, 2-7, Влияние концентрации фермента на скорость (Vmax) ферментативной ре-
акции при насыщении субстратом,
2. ФЕРМЕН1Ы
85
допустить, что измерение активности фермента при оптимальных
условиях дает истинное представление об относительных количе-
ствах фермента.
В число условий, оптимальных для действия фермента, вклю-
чают, кроме обеспечения достаточной для насыщения фермента кон-
центрации субстрата, соответствующие физические параметры (тем-
пература, pH среды, степень ионизации), а также наличие любых
дополнительных факторов, которые могли бы способствовать ката-
литическому процессу.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ
Скорость ферментативных реакций в живых системах возрастает
по мере повышения температуры, подобно тому как это бывает с
химическими реакциями, происходящими вне организма. В отличие
от обычных химических реакций ферментативные реакции, однако,
не обладают свойством отвечать неограниченным увеличением ско-
рости на повышение температуры. После достижения определенной
температуры дальнейшее ее повышение лишь подавляет активность
фермента (рис. 2-8). Та температура, при которой скорость фермен-
тативной реакции максимальна, называется оптимальной темпера-
турой для данного фермента. Объяснение этого феномена сообщает
нам много нового о природе фермента и о механизме его действия.
Рис. 2-8, Влияние температуры на ферментативную реакцию.
86
2. ФЕРМЕНТЫ
Рис. 2-9. Изменения энергии в ходе превращения субстрата (S) в продукт реакции
(Р) в отсутствие (Л) и в присутствии (Б) фермента (£).
Суммарная затрата энергии при переходе от S к Р одинакова в обоих элучаях. но образование
фермент-субстратного комплекса (Е — S*) приводит к снижению энергии активации в ката-
лизируемой реакции
Увеличение скорости, получаемое путем повышения температуры
в зоне, лежащей ниже оптимальной величины, имеет отношение к
энергетическим потребностям реакции. При этом должны быть
соблюдены две энергетические предпосылки: во-первых, запас энер-
гии в субстрате данной реакции должен быть больше, чем в ее
продуктах (иными словами, реакция в энергетическом смысле бу-
дет осуществляться лишь в направлении сверху вниз); во-вторых,
субстрат должен потребить часть энергии для достижения более вы-
сокого энергетического состояния прежде, чем атомы и электроны
молекулы субстрата подвергнутся перестройке с образованием про-
дукта реакции (иными словами, имеется определенный энергетиче-
ский барьер, предотвращающий самопроизвольное протекание ре-
акции в направлении сверху вниз).
Упомянутую потребляемую энергию называют энергией актива-
ции данной реакции. Доставку такой энергии обеспечивает, напри-
мер, нагревание системы. При реакциях, происходящих без катали-
затора, количество тепловой энергии, необходимой для того, чтобы
реакция началась, может быть значительным, и поэтому, если тем-
пературу значительно не повысить, лишь небольшая доля субстра-
та будет превращаться в продукты реакции (рис. 2-9, 4). В большин-
стве случаев повышение температуры на каждые 10°С приводит к
увеличению скорости реакции в два раза. Это правило соблюдается
также для большинства ферментативных реакций, при которых
существенная скорость превращений наблюдается уже при значи-
тельно более низких температурах, что объясняется свойством
ферментов снижать энергию активации для данной реакции (рис. 2-
9, Б). Не ясно, как это происходит, но возможно, что связанный с
2. ФЕРМЕНТЫ
87
Рис. 2-10. Влияние тепловой денатурации на ферментативную реакцию.
При чрезмерном нагревании молекула фермента развертывается, после чего субстрат (/)
уже не реагирует с активным центром. А. Свернутый фермент. Б Развернутый фермент
активным центром фермента субстрат уже в какой-то мере находится
в активированном состоянии. В результате этого ферментативные
реакции могут происходить с измеримыми скоростями при тем-
пературах, обычных для окружающей среды (0°—40°С), тогда как
в отсутствие фермента эти же химические реакции достигают су-
щественной скорости лишь при повышении температуры на несколь-
ко сотен градусов.
При превышении оптимальной температуры ферментативной реак-
ции начинает мешать противодействующий фактор. Как было отме-
чено выше, молекула фермента представляет собой длинную цепь
аминокислот. В активном состоянии эта линейная цепь свернута
в пространстве весьма специфическим образом, благодаря чему
аминокислоты, составляющие активный центр, сближены, что поз-
воляет им реагировать с субстратом (рио. 2-10, Л). Некоторые из
химических сил, удерживающих белковую молекулу в этой актив-
ной конфигурации, очень слабы и легко разрушаются при нагре-
вании (см. гл. 1). Следовательно, результатом повышения темпе-
ратуры будет разворачивание белковых молекул. Этот процесс
называют денатурацией (рис. 2-10, Б). Разрушительное влияние
чрезмерного нагревания на структуру активного центра фермента
объясняет, почему при повышенной температуре ферменты инакти-
вируются; в редких случаях при последующем охлаждении фер-
менты вновь обретают свою активность.
Температура, оптимальная для действия большинства ферментов,
близка к нормальной температуре тела — 37°С. У человека, кото-
рый относится к гомеотермным существам, система терморегуляции
88
2. ФЕРМЕНТЫ
обеспечивает совершенно точное поддержание температуры в этой
оптимальной зоне. Лихорадка, представляющая собой защитный
механизм, направленный против инфекционных агентов, способна
инактивировать ферменты последних, однако в конечном итоге она
порой оказывает повреждающее действие и на организм человека-
хозяина. Охлаждение изолированных органов применяют для подав-
ления в них процессов обмена; хранение тканей и жидкостей в замо-
роженном состоянии или при более низкой температуре стало обыч-
ным способом предотвращения аутокаталитического распада.
ВЛИЯНИЕ pH
Ферменты, подобно всем белковым молекулам, несут множество
заряженных групп — положительных и отрицательных. Общий
заряд молекулы фермента зависит от соотношения между этими
противоположно заряженными группами. Важнейшим изменяющим
это соотношение фактором является наличие в клетке водородных
ионов (Н+), которые нейтрализуют отрицательно заряженные груп-
пы:
—СОО_-4-Н+—►—СООН (нулевой заряд)
и образуют положительно заряженные группы:
—NH2 + H+->—NHs+.
Таким образом, увеличение положительного заряда (или уменьше-
ние отрицательного) на поверхности фермента обусловлено повы-
шением концентрации водородных ионов (т.е. уменьшением pH).
Наоборот, уменьшение концентрации водородных ионов (увеличение
pH) приводит к диссоциации этих протонированных форм:
-СООН ——соо-+ Н+
—NH3 ^-NH2 + H+.
В этом случае произойдет увеличение отрицательного заряда моле-
кулы фермента. При определенной величине концентрации водород-
ных ионов положительный и отрицательный заряды совершенно оди-
наковы и молекула фермента в целом не несет заряда, т. е. находит-
ся в изоэлектрической точке.
Большинство ферментов отличается наибольшей активностью и
стабильностью в области своей изоэлектрической точки или вблизи
нее. Подобно повышению температуры, резкие колебания pH (либо
высокая кислотность, либо высокая щелочность) способствуют
развертыванию молекулы, что ведет к денатурации и необратимой
инактивации. Заряжейные группы фермента, расположенные в
области активного центра, часто принимают участие либо в связы-
вании субстрата, либо в каталитическом действии фермента. Именно
поэтому ферменты обычно лучше всего функционируют в довольно
2. ФЕРМЕНТЫ
89
Рис. 2*11. Влияние pH на ферментативную реакцию.
Штриховая линия соответствует оптимальному pH.
ограниченном диапазоне концентрации водородных ионов. График
зависимости ферментативной активности от pH имеет, как правило,
колоколообразную форму (рис. 2-11). Точка, в которой фермента-
тивная активность максимальна, называется оптимальным pH,
который характерен для данного фермента, реагирующего с опре-
деленным субстратом.
Внутриклеточные ферменты обычно имеют рН-оптимумы, соот-
ветствующие нейтральной среде (pH 7,0), близкой к нормальному
значению pH для жидкостей тела. Внеклеточные ферменты, такие,
как пепсин, функционирующий в сильнокислой среде содержимого
желудка, могут иметь рН-оптимумы в области, значительно удален-
ной от нейтральной. Очевидно тем не менее, что, подобно темпера-
туре тела, регуляция pH в организме человека является непремен-
ным условием, обеспечивающим поддержание оптимального уровня
ферментативной активности. Сдвиги концентрации водородных
ионов — либо избыток (ацидоз), либо недостаток (алкалоз) — при-
водят к резким изменениям обмена веществ.
ВЛИЯНИЕ ИОНОВ
Кроме водородных ионов, важную роль в ферментативных реак-
циях играют другие ионы, находящиеся в клетке. Катионы кальция
(Са2+) и калия (К+) оказывают существенное влияние на процессы
90
2. ФЕРМЕНТЫ
метаболизма, особенно в таких тканях, обладающих выраженной
возбудимостью, как нервная и мышечная. Распространение нерв-
ного импульса, сокращение мышечного белка миозина, а также
активность ферментов, освобождающих необходимую для этих
процессов энергию, находятся под тщательным контролем благодаря
воздействиям различных концентраций ионов.
Во многих случаях катионы (+) или анионы (—) принимают не-
посредственное участие в катализируемой ферментом реакции.
О роли ионов металлов, присоединенных к ферментам в качестве
простатических групп, уже упоминалось. В других случаях ионы,
подобно субстратам, слабо или обратимо связываются с активными
центрами фермента, что приводит к активации каталитического
процесса. Катионы магния (Mg2+) часто именно таким образом уча-
ствуют в реакциях обмена веществ. Иногда ионы играют централь-
ную роль в реакции, будучи истинными субстратами. Участие
бикарбонатных (НСОг) анионов в реакциях карбоксилирования,
фосфатных (HPOJ") анионов в реакциях фосфорилирования или
катионов аммония (NHJ) в реакциях аминирования и амидирования
представляет примеры прямого вовлечения неорганических ионов
в качестве субстратов в ход ферментативных реакций. Избыток или
недостаток этих ионов приводит к тяжелым патологическим состоя-
ниям посредством воздействия на катализируемые ферментами ре-
акции обмена веществ.
КОФАКТОРЫ И КОФЕРМЕНТЫ
Для обозначения веществ, способствующих эффектам ферментов
и субстратов, применяют общий термин кофактор. К числу облег-
чающих ферментативный катализ кофакторов относят, таким обра-
зом, ионы, которые выполняют роль активаторов, или простати-
ческие группы ферментов. Другую важную группу относящихся к
этой категории веществ составляют коферменты. Эти вещества
в противоположность неорганическим кофакторам относятся к слож-
ным органическим веществам; их молекулы значительно меньше
по размеру, чем молекулы ферментов, так что они могут свободно
проникать сквозь мембраны; нагревание обычно не вызывает их
инактивации. Коферменты непосредственно участвуют в фермента-
тивном катализе, функционируя в качестве переносчиков электро-
нов, атомов или групп атомов.
В большинстве случаев часть структуры кофермента составляет
тот или иной из витаминов — органических веществ, которые не
синтезируются в организме человека и должны быть доставлены
ему в составе пищевого рациона. В молекуле кофермента активным
компонентом, соединяющимся с переносимой группой, служит имен-
но этот структурный компонент (витамин). Остальная часть моле-
кулы кофермента обеспечивает весьма специфическое связывание
2. ФЕРМЕНТЫ
91
таких групп в активном центре фермента при строго определенной
ориентации. Это связывание может быть слабым и обратимым, по-
добно тому как это имело место в рассмотренных выше примерах
связывания субстрата или некоторых ионных активаторов. В дру-
гих случаях такое связывание может быть исключительно прочным и
необратимым; кофермент при этом функционирует как составная
часть активного центра фермента, т. е. как простетическая группа.
Тяжелые болезни, возникающие у человека при недостатке витами-
нов в пище, служат непосредственным следствием нарушений обме-
на веществ в результате снижения концентрации коферментов спе-
цифических ферментативных реакций.
ИНГИБИТОРЫ ФЕРМЕНТОВ
Ранее уже упоминалось о том, что ферментативному катализу
могут препятствовать некоторые структурные аналоги субстрата.
Такие вещества называют конкурентными ингибиторами. Феномен
торможения активности ферментов, одним из примеров которого
является конкурентное торможение, имеет существенное значение
для понимания регуляции обмена веществ, а также действия многих
лекарственных средств и ядов на организм. Как было отмечено выше,
целый ряд физических факторов (включая высокие температуры,
крайние значения pH и другие) могут вызывать инактивацию фер-
мента в результате денатурации белка. Физическая денатурация ле-
жит в основе общего и неизбирательного типа торможения фермен-
тативной активности, хотя чувствительность различных ферментов
к таким воздействиям в какой-то мере варьирует. Существуют, одна-
ко, химические реагенты, действующие значительно более специфи-
чески в качестве ингибиторов активности определенных ферментов.
Для этой группы реагентов типичны конкурентные ингибиторы, а
также так называемые неконкурентные ингибиторы. Различие
между ингибиторами этих двух типов основано на экспериментально
наблюдаемом факте — преодолении конкурентного торможения по-
вышенной концентрацией субстрата.
Таким образом, графики зависимости скорости ферментативной
реакции vот [S1 в присутствии постоянной концентрации конкурент-
ного ингибитора дают такую же величину Vmax, как и в отсутствие
ингибитора, так как большой избыток субстрата успешно конку-
рирует с ингибитором за места связывания в активном центре и в
конечном счете субстрат вытесняет ингибитор. Величина Лм в
этом случае, однако, будет увеличена, поскольку для обеспечения
скорости, равной половине максимальной, в присутствии ингиби-
тора потребуется больше субстрата (рис. 2-12,Л). Отсюда следует,
что конкурентный ингибитор помешал образованию фермент-суб-
стратного комплекса и, таким образом, уменьшил «реальное»
сродство фермента к субстрату; процесс же распада фермент-суб-
92
2. ФЕРМЕНТЫ
Рис, 2-12. Сравнение воздействий конкурентных (Л) и неконкурентных (Б) ин-
гибиторов на скорость ферментативных реакций.
/. Без ингибитора. //.В присутствии ингибитора.
Рис. 2-13, Сравнение реакции конкурентного (Л) и неконкурентного (Б) ингиби-
тора с активным центром фермента.
А. Ингибитор соединяется с активным центром фермента; субстрат благодаря структурному
сходству вытесняет ингибитор путем конкуренции за активный центр при увеличении [S], Б.
Ингибитор соединяется с активным центром или присоединяется вблизи активного центра
фермента, блокируя каталитическую реакцию; субстрат не обладает структурным сходством
в ингибитором, поэтому эффективность действия фермента не возрастает при увеличении [S].
стратного комплекса с образованием продуктов реакции при этом
не изменился (рис. 2-13, Л).
Когда график такого же типа зависимости v от (S1 строят по ма-
териалам опыта, проведенного в присутствии неконкурентного
2, ФЕРМЕНТЫ
93
ингибитора, то величину Vmax находят сниженной (рис. 2-12, Б).
В присутствии постоянной концентрации ингибитора субстрат, в
каком бы количестве его ни добавляли, не может вытеснить инги-
битор из его соединения с ферментом. Эти данные указывают на
то, что субстрат и неконкурентный ингибитор должны связываться
с активным центром фермента по-разному. Ингибитор воздействует
только на собственно каталитическое действие фермента на стадии
распада Е-S- комплекса с образованием продуктов реакции, но не
влияет на связывание субстрата и фермента при образовании E-S-
комплекса (рис. 2-13, Б). Из этого последнего утверждения следует,
что величина Км в присутствии неконкурентного ингибитора не
изменяется.
Ингибиторы — как конкурентного, так и неконкурентного ти-
пов — связываются с ферментом обратимо. Реагенты третьего типа,
так называемые необратимые ингибиторы, образуют столь прочные
комплексы с ферментом, что не могут быть легко отделены от него.
Ингибиторы этого типа способны к образованию ковалентных свя-
зей с одним из аминокислотных остатков, входящих в активный
центр фермента. Это ведет к предотвращению любого каталитиче-
ского действия фермента.
РЕГУЛЯЦИЯ ДЕЙСТВИЯ ФЕРМЕНТОВ
АЛЛОСТЕРИЧЕСКИЕ МОДИФИКАТОРЫ
Феномен аллостерической модификации присущ некоторым клю-
чевым ферментам процессов обмена веществ. Такие ферменты имеют
важное значение в общей регуляции метаболических путей и поэто-
му их называют регуляторными. Под влиянием аллостерических мо-
дификаторов скорость ферментативной реакции либо замедляется,
либо ускоряется. Если для регуляторного фермента строят график
зависимости v от [S], то получаемая кривая отличается от кривой,
описываемой уравнением Михаэлиса — Ментен. Вместо прямо-
угольной гиперболы получают S-образную кривую, указывающую
на очень низкие скорости реакции в присутствии низкой концен-
трации субстрата (рис. 2-14). По мере увеличения [S1 нарастание
скорости реакции происходит резко и нелинейно, а затем посте-
пенно уменьшается; скорость достигает максимальной величины
при высоких насыщающих концентрациях субстрата, как это на-
блюдают и в опытах с обычными ферментами.
S-образная форма этой кривой объясняется тем, что регулятор-
ный фермент состоит не из одной цепи аминокислот, а из нескольких
белков, или субъединиц, соединенных друг с другом. Каждая из
этих субъединиц обладает свойством связывать молекулу субстрата
с образованием каталитически активных фермент-субстратных ком-
плексов. После того как одна из таких субъединиц свяжется с суб-
94
2. ФЕРМЕНТЫ
Рис. 2-14. Сопоставление характерной для регуляторного фермента зависимости
скорости ферментативной реакции (у) от концентрации субстрата ([S]) с нормаль-
ной гиперболической кривой Михаэлиса-Ментен.
/. Нерегуляторный фермент (гиперболическая кривая). 11 Регуляторный фермент (сигмоидная
кривая).
стратом, присоединение дополнительных молекул субстрата к ос-
тальным субъединицам регуляторного фермента облегчается. Та-
ким образом, субъединицы кооперируются друг с другом в уско-
рении образования E-S-комплексов при повышении концентрации
субстрата, подобно тому как это было описано для кооперативного
связывания кислорода с субъединицами гемоглобина (гл. 1). В ко-
нечном счете активные центры всех субъединиц оказываются пол-
ностью насыщенными субстратом, и скорость реакции достигает
предельной (максимальной) величины Vmax, как и в опытах с обыч-
ными ферментами.
Помимо активных центров, которые связывают субстрат и ответ-
ственны за каталитическую активность, регуляторные ферменты име-
ют также различные центры связывания, взаимодействующие с алло-
стерическими модификаторами фермента. Параметры связывания
этих модификаторов, как показывает сам термин (аллостерический —
имеющий иную конфигурацию), отличаются от параметров, применя-
емых для описания взаимодействия субстрата с активным центром
фермента. Если модификатор действует как ингибитор реакции, его
называют отрицательным модификатором (рис. 2-15). В присутст-
вии постоянной концентрации отрицательного модификатора форма
кривой зависимости v от [S1 остается S-образной, но на графике кри-
вая сдвинута вправо. Таким образом, отрицательный модификатор
повышает количество субстрата, необходимого для насыщения фер.
мента и для достижения максимальной скорости реакции VmaXe
2. ФЕРМЕНТЫ
9$
[S]
Рис. 2-15. Воздействия аллостерических модификаторов на реакцию, катализи-
руемую регуляторным ферментом.
Отрицательный модификатор может вызвать уменьшение Vmax или увеличение Км. тогда
как положительный модификатор — увеличение Vmax или уменьшение Кщ.
I- В присутствии положительного модификатора. II Регуляторный фермент (в отсутствие до-
бавок). Ill. В присутствии отрицательного модификатора.
Более важное значение имеет свойство отрицательного модификатора
вызывать значительное торможение ферментативной активности
в присутствии свойственных нормальной клетке низких концентра-
ций субстрата. Именно поэтому воздействие отрицательного моди-
фикатора представляет собой чрезвычайно чувствительный меха-
низм, контролирующий при физиологических условиях активность
регуляторных ферментов.
Воздействие положительного модификатора, который является
веществом, стимулирующим, или активирующим, действие регуля-
торного фермента, представляется совершенно противоположным.
В этом случае наблюдается дальнейшее усиление кооперативного
взаимодействия между субъединицами путем связывания модифи-
катора с аллостерическим центром. В присутствии постоянной кон-
центрации положительного модификатора S-образная кривая за-
висимости v от [S] сдвинута влево; степень этого сдвига зависит
от количества добавленного положительного модификатора, и в
присутствии достаточно большого количества такого модификатора
кривая приближается по форме к типичной гиперболе (рис. 2-15).
Значение аллостерического модифицирования регуляторных фер-
ментов явствует из рассмотрения механизмов приспособления обме-
на веществ в организме к изменениям условий питания и физиоло-
гической активности. Регуляторные ферменты обычно занимают
ключевое положение на путях обмена веществ, благодаря чему поло-
жительные и отрицательные модификаторы способны включать и
96
2. ФЕРМЕНТЫ
Рис. 2-16. Регуляция продуктами обмена путем отрицательной обратной или поло-
жительной прямой связи.
Регуляторный фермент катализирует ключевой этап Б-+В метаболического пути Л-> Г. Ко-
нечный продукт (Г) действует как отрицательный модификатор, ингибирующий этап В
и предотвращающий таким образом накопление избыточных количеств Г. Предшественник
(Л) действует как положительный модификатор, облегчающий протекание этапа Б-> В и,
следовательно, способствующий использованию избыточных количеств А.
выключать целые цепи реакций метаболизма. Соединения, действую-
щие как отрицательные модификаторы этих ключевых ферментов,
обычно являются конечными продуктами всей цепи реакций в це-
лом. Таким образом, если регуляторные ферменты катализируют
первые звенья в цепи реакций, существует возможность предотвра-
тить расточительное использование субстратов, вовлекаемых в ре-
акции, составляющие данную цепь.
Систему регуляции этого типа, когда продукты цепи реакции
обмена веществ тормозят реакции, составляющие первые звенья
этой цепи, называют ингибированием конечным продуктом или, по
аналогии с терминами, применяемыми в электронике, отрицатель-
ной обратной связью (рис. 2-16). Когда происходит накопление про-
дуктов обмена веществ, возникает ситуация, описанная выше. Про-
тивоположный эффект можно часто получить при воздействии суб-
страта или предшественника метаболической цепи, действующих в
качестве положительных модификаторов тех же ключевых регуля-
торных ферментов, определяющих скорость процесса в целом. Та-
кая система регуляции типа положительной прямой связи, которая
противодействует торможению конечным продуктом, лежит в основе
точно сбалансированного регуляторного механизма, обладающего
свойством реагировать на изменение физиологических параметров
весьма разнообразно: от «включения» («оп») на полную мощность
до «выключения» («off»), или полного прекращения действия.
2. ФЕРМЕНТЫ
97
Активация
в результате
протеолиза
Связи, которые атакует
протеолитический ферме
Маскированный
активный
центр
оо
Фрагменты,
освобожденные
при протеолизе
Субстрат
реагирует
обнаженный
активный центр
Субстрат не может
реагировать
Рис. 2-17. Активация зимогена.
Удаление части полипептидной цепи зимогена обнажает активный центр, и фермент стано-
вится активным.
АКТИВАЦИЯ ЗИМОГЕНОВ
Другие пути модифицирования структуры фермента также обес-
печивают управление ферментативным катализом по принципу
включено — выключено. Многие ферменты, участвующие в перева-
ривании пищи, образуются в клетках желез пищеварительного
тракта в неактивной форме, в форме так называемых зимогенов.
Последние активируются только после того, как попадают в желудоч-
но-кишечный тракт; благодаря этому не происходит переваривания
тех клеток, в которых образуются зимогены. В некоторых фермент-
ных системах зимогены неактивны потому, что их каталитическое
действие замаскировано присоединением дополнительного отрезка
пептидной цепи, что препятствует доступу субстратов к активному
центру фермента (рис.2 -17). Удаление этой блокирующей группы
ведет к необратимой активации зимогена; данная молекула фермента
в таких системах не может быть возвращена из положения «включе-
но» в положение «выключено».
98
2. ФЕРМЕНТЫ
РЕГУЛЯЦИЯ ПУТЕМ
ХИМИЧЕСКОГО МОДИФИЦИРОВАНИЯ
ФЕРМЕНТОВ
Существуют также обратимые системы регулирования активнос-
ти ферментов по принципу «включено-выключено», основанные на
изменении химической структуры активного центра фермента. В не-
которых случаях фермент может существовать в клетке в неактив-
ном или слабо активном состоянии, но присоединение фосфатной
группы при участии второго фосфорилирующего фермента, называе-
мого киназой, к аминокислоте, расположенной вблизи от активного
центра, может полностью активизировать присущие этому фермен-
ту свойства (рис. 2-18). Таким образом, воздействие фермента 2,
киназы, приводит к активированию (в результате химической мо-
дификации) фермента 1. Такая система может быть возвращена в
положение «выключено» под влиянием третьего фермента, фосфата-
зы, который отщепляет фосфатную группу от активированного
фермента. В контролирующих системах этого типа активность
фермента 1 будет, очевидно, обусловлена соотношением между ак-
тивностью киназы, которая присоединяет фосфатные группы, и ак-
тивностью фосфатазы, которая отщепляет эти группы. Такой меха-
низм регуляции имеет весьма важное значение, поскольку актив-
ности киназы и фосфатазы могут изменяться под влиянием гормонов.
АДАПТАЦИЯ ПУТЕМ
СИНТЕЗА ФЕРМЕНТОВ
Воздействия ингибиторов и активаторов, регулирующих процес-
сы обмена веществ, направлены на молекулы фермента, уже имею-
щиеся в клетке. Выше мы рассмотрели системы, в которых количе-
ство фермента остается относительно постоянным, а варьируют
концентрации низкомолекулярных продуктов обмена веществ и
другие условия, изменения которых возможны в организме взрос-
лого человека, находящемся в состоянии динамического равновесия.
Другой тип метаболической реакции на изменение потребностей ор-
ганизма сводится к изменению содержания фермента в клетке.
В ходе роста плода, например, и в особенности в первые дни жизни
новорожденного, когда организм после безопасного внутриутроб-
ного существования должен приспособиться к полной опасностей
окружающей среде, содержание ферментов в различных органах
и тканях резко изменяется, с тем чтобы дать возможность организму
встретить «вызов» внешней среды. На всех этапах развития строго
следующие друг за другом во времени процессы дифференцировки
ферментов сопровождают морфогенез специализированных клеток
и определяют в конечном счете их физиологическое значение. Та-
кие изменения в составе ферментов развиваются иногда на про-
2 ФЕРМЕНТЫ
99
Фосфатаза -
Рис. 2-18. Регуляция фермента путем химической модификации.
Фосфорилирование активирует фермент, а дефосфорилирование инактивирует.
тяжении недель и даже месяцев, однако некоторые сдвиги в содержа-
нии ферментов в клетке могут происходить значительно быстрее.
Приспособление к голоданию или к избыточному потреблению пищи,
связанное с изменениями количества ферментов, участвующих в
метаболизме углеводов и жиров, развивается часто на протяже-
нии нескольких часов. Тем не менее эти адаптивные сдвиги в соот-
ношениях ферментов в организме происходят относительно мед-
ленно— в противоположность осуществляемым по принципу об-
ратной связи воздействиям ингибиторов и активаторов на уже су-
ществующие молекулы ферментов.
В настоящее время твердо установлено, что синтез и распад
ферментов, как и других белков, происходит в организме непре-
рывно. У взрослого здорового человека в условиях динамического
равновесия процессы синтеза и распада имеют одинаковую ско-
рость, благодаря чему общее содержание фермента не изменяется
во времени. Для каждого фермента характерна своя скорость распа-
да. В большинстве случаев полное прекращение синтеза фермента
привело бы к исчезновению 50% молекул фермента за несколько
дней, но некоторые ферменты обновляются значительно быстрее.
Скорость синтеза фермента может варьировать от нуля до макси-
мума, тогда как скорость распада представляется постоянной.
Таким образом, любое вещество, влияющее на скорость синтеза фер-
мента, способно оказать существенное воздействие на регуляцию
обмена веществ путем изменения соотношения ферментов в орга-
низме. В основе многих гормональных воздействий на обмен ве-
ществ у человека лежат, как было установлено, именно такие кон-
тролирующие влияния на выработку каталитически активных
белков.
Вещество, которое избирательно препятствует синтезу опреде-
ленного фермента, называется репрессором. Явление репрессии
100 2- ФЕРМЕНТЫ
Рис. 2-19. Регуляция синтеза фермента.
Конечный продукт (Г) цепи метаболических реакций снижает концентрацию фермента, ката-
лизирующего этап В путем репрессии его синтеза. Субстрат (Б) индуцирует синтез того
фермента, который превращает егэ в В, препятствуя действию репрессора.
представляет собой дополнительный механизм, посредством кото-
рого конечные продукты реакций обмена веществ могут регулиро-
вать процесс их собственного образования по принципу обратной
связи. Было доказано, что в некоторых системах накопление ме-
таболитов, образующихся в итоге цепи последовательных реакций,
предотвращает синтез одного из ферментов, функционирующего в
начале этой цепи (рис. 2-19). Продукт реакции в таком случае дей-
ствует как специфический репрессор синтеза этого фермента предот-
вращая как ненужное потребление субстратов, вовлекаемых в ре-
акции данной метаболической цепи, так и бесполезный расход энер-
гии и аминокислот, необходимых для образования каталитически
активного белка.
Явление, противоположное репрессии, известно под названиями
индукция фермента или дерепрессия. В типичном случае субстрат
определенного фермента способен индуцировать синтез этого фер-
мента, что в свою очередь стимулирует потребление данного суб-
страта. Воздействуя на механизм синтеза фермента, индуктор, ве-
роятно, прямо или косвенно противодействует репрессору. Соотно-
шение между репрессором (конечным продуктом) и индуктором (суб-
стратом) определяет, таким образом, количество ключевых фермен-
тов и обеспечивает приспособление последовательности метаболи-
ческих реакций к количеству метаболитов, поступающих в клетки
организма с пищей.
Как и в случае регуляторных ферментов, лишь немногие ключе-
вые ферменты способны реагировать подобным образом на изменение
физиологических потребностей. Такие ферменты называют индуци-
дельными (или адаптивными); ферменты, содержание которых в та-
ких условиях не изменяется, называют конститутивными; они сос-
тавляют постоянное содержимое клетки. У человека на адаптивные
2. ФЕРМЕНТЫ
101
ферменты, вероятно, в большей мере влияют эндокринные факторы,
нежели промежуточные продукты реакций обмена веществ. Так, гор-
моны коры надпочечника стимулируют синтез ферментов, участвую-
щих в образовании сахара крови (глюкозы), тогда как инсулин про-
тиводействует этому. Адренокортикостероиды прямо или косвенно
играют роль индукторов ферментов, когда как инсулин усиливает
процесс репрессии. От определяемой противоположными воздейст-
виями индукции и репрессии уровня синтеза ферментов зависит
физиологическая регуляция содержания глюкозы в крови этими
противоборствующими эндокринными системами.
ГЕНЕТИЧЕСКОЕ ДЕТЕРМИНИРОВАНИЕ
ФЕРМЕНТОВ
Наследуемый набор генов определяет в конечном счете прису-
щий организму набор ферментов. У разных людей интенсивность
реакций обмена веществ варьирует подобно тому, как варьируют
анатомические и другие признаки у представителей человеческого
рода — размеры тела, цвет кожи и др. Метаболические различия
лежат в основе характерных биохимических особенностей каждого
индивидуума, обозначаемых термином биохимическая индивидуаль-
ность. Биохимические особенности индивидуума передаются от
одного поколения другому, подобно тому как наследуется цвет глаз
или волос, т. е. через доминантные или рецессивные гены, согласно
законам Менделя. Генетически обусловленные метаболические раз-
личия реализуются фенотипически на уровне синтеза ферментов.
В некоторых случаях такие отклонения не оказывают никакого вли-
яния или даже бывают благоприятными; в других — они ведут к
трагическим последствиям для организма.
Мы уже отметили в гл. 1, что один ген (молекула ДНК) специ-
фически определяет последовательность аминокислот в одном фер-
менте (молекуле белка). Специфичность образования пар азотис-
тых оснований нуклеиновых кислот, участвующих в транскрипции
и трансляции информации, исходящей от определенного гена,
обеспечивает, таким образом, создание пространственной конфор-
мации синтезируемого фермента, необходимой для проявления ак-
тивности. В основе явлений наследственности лежит функциониро-
вание генов, которые управляют образованием и действием фермен-
тов, имеющих решающее значение для процессов обмена веществ.
Следовательно, любое изменение гена в результате замены одного
из азотистых оснований входящих в его состав нуклеотидов вызыва-
ет соответствующее изменение одной из аминокислот в синтезируе-
мом ферменте, что может привести к глубокому нарушению катали-
тического действия фермента в организме.
Воздействие на генетический механизм управления биосинтезом
ферментов может привести к различным последствиям. Во-первых,
102 2. ФЕРМЕНТЫ
Мутация—
измененный нуклеотид
t
Измененная
аминокислота
Рис. 2-20. Генетическое детерминирование ферментов.
Мутация, изменяя один нуклеотид в триплетном кодоне гена, вызывает изменение одной ами-
нокислоты в ферменте, что может повлиять на каталитические функции последнего.
оно может изменить систему синтеза фермента таким образом, что
она потеряет чувствительность к действию репрессоров или ин-
дукторов. В этом случае синтезируется нормальный фермент, но
процесс его выработки не регулируется, так что фермент вместо
адаптивного становится конститутивным. Такая мутация влияет
на регуляцию метаболизма, а не на его ход. Во-вторых, систе-
ма синтеза фермента, взаимодействуя последовательно с различ-
ными нуклеотидными тройками, может ответить на появление трип-
лета с измененным азотистым основанием заменой аминокислоты,
занимающей обычно определенное положение в молекуле фермента,
на другую аминокислоту (рис. 2-20). Если в результате этой за-
мены изменения свойств фермента минимальны, благодаря тому что
либо свойства новой аминокислоты весьма сходны со свойствами
обычно занимавшей данное положение, либо замещение происходит
в такой части белковой молекулы, которая не имеет значения для
2. ФЕРМЕНТЫ ЮЗ
действия активного центра фермента, то метаболический эффект
такой мутации окажется незначительным. Если же замена амино-
кислотного остатка на совершенно иной произойдет в активном
центре либо в положении, имеющем важное значение для возникно-
вения трехмерной конфигурации каталитически активного белка,
то метаболические последствия могут быть резко выраженными.
Сходное явление возникает в том случае, если мутация приводит
к исключению (делеции) одного из нуклеотидов, находящихся в на-
чале генетического сообщения, в результате чего один из триплетов
гена теряет информационную значимость, а система, синтезирующая
фермент, воспринимает поступающую генетическую информацию
как лишенную смысла (нонсенс) и не вырабатывает активного фер-
мента.
При любой из двух последних ситуаций возникает патологиче-
ское состояние, известное как врожденное нарушение обмена.
Для превращения вещества А в конечный продукт Я в организме
требуется последовательная цепь метаболических реакций; каждую
из этих реакций катализирует особый специфический фермент, син-
тезируемый в соответствии с инструкциями, исходящими от опре-
деленного гена (рис. 2-21, А . Если в результате мутации эти ин-
струкции перепутаны в такой степени, что фермент либо не синте-
зируется вовсе, либо синтезируется в неактивной форме, нормаль-
ный ход реакций обмена блокируется. В результате такого нару-
шения одного из звеньев цепи накапливаются продукты всех ре-
акций, которые предшествуют месту блока, и уменьшается концен-
трация продуктов реакций, следующих в метаболической цепи за
этим местом (рис. 2-21, Б). В результате такого нарушения обмена
веществ серьезно нарушаются физиологические функции организма,
что может оказаться опасным для жизни индивидуума.
О характере таких нарушений дает представление группа забо-
леваний, в основе которых лежит нарушение метаболизма аромати-
ческой аминокислоты фенилаланина (рис. 2-22), что описано более
подробно в гл. 6. При альбинизме в организме отсутствует фермент,
необходимый для превращения фенилаланина в нормальный пиг-
мент меланин. В результате для такого индивидуума характерны бе-
лые волосы, розовые радужные оболочки глаз, бледная кожа. Если
не считать повышенной чувствительности к воздействию солнечных
лучей, особой патологии у таких людей не наблюдается, и они могут
вести нормальный образ жизни. При алкаптонурии нарушен этап
распада ароматического ядра; в результате происходит накопление
нормального продукта обмена гомогентизиновой кислоты. Это сое-
динение быстро удаляется из крови почками и поэтому почти не ока-
зывает токсического действия. О таком состоянии обмена фенилала-
нина обычно не знают до тех пор, пока не заметят потемнение мочи
при ее хранении или пока не получат ошибочный положительный
результат при анализе мочи на содержание сахара, что обусловлено
104 2. ФЕРМЕНТЫ
А
Ген 1 * Фермент 1 -> ф
Б
Ге7Г2 -> Фермент 2 •> 4
В
Ген 3 -» Фермент 3 -> 4
Г
и т.д. -> и т.о. -> ф
Ф
4
Конечный продукт Я
Ген 1 -> Фермент 1 -►
Ген 2 -> Фермент 2 ->
И
з
<5
ы
о
к
—Йи Бло$
АА
БББ
Ф
вввв
Аномальный Аномальный _
ген 3 фермент 3
Недостаток (Г
всех |
продуктов, 4,
образующихся < .
ниже *
места *
(блока V
Рис. 2-21. Последствия врожденного нарушения обмена.
Дефектный ген, детерминирующий синтез дефектного фермента, вызывает накопление мета-
болитов выше места блока и их недостаточность ниже блока
свойствами гомогентизиновой кислоты как восстановителя. С годами
накопление аномальных ароматических продуктов обмена вызывает
пигментацию и воспаление суставов.
Рис. 2-22. Врожденные нарушения метаболизма фенилаланина.
При фенилкетонурии отсутствует первое звено обмена фенил-
аланина в печени. Фенилаланин накапливается в тканях организ-
ма, вызывая существенные нарушения развития мозга у детей и в
конечном счете — если не ограничить поступления фенилаланина
с пищей — умственную отсталость. При эндемическом зобе, со-
провождающемся кретинизмом, в ткани щитовидной железы отсут-
ствует фермент, необходимый для превращения фенилаланина в ти-
2. ФЕРМЕНТЫ 105
роксин. Возникающая недостаточность гормона щитовидной железы
препятствует нормальному росту и развитию, приводя к умствен-
ной и физической отсталости, если не применяется заместительная
терапия тироксином. Таким образом, последствия врожденных на-
рушений обмена фенилаланина в организме могут быть доброка-
чественными (альбинизм), умеренными или медленно развиваю-
щимися (алкаптонурия) или тяжелыми, что обусловлено либо ток-
сичностью накапливающихся продуктов обмена (фенилкетонурия),
либо отсутствием необходимых продуктов биосинтеза (кретинизм).
Рекомендуемая
литература
Bender М. L., Brubacher L. J.t Catalysis and Enzyme Action, McGraw-Hill, New
York, 1973.
Gelehrter T. D.t Enzyme Induction, New Engl. J. Med., 294, 522—526, 589—595,
646—651 (1976).
Hess G. P., Rupley J. A., Structure and Function of Proteins, Ann. Rev. Biochem.$
40, 1013—1044 (1971).
Holzer H.t Duntze W7., Metabolic Regulation by Chemical Modification of Enzy-
mes, Ann. Rev. Biochem., 40, 345—374 (1971).
Kirsch J., Mechanism of Enzyme Action, Ann. Rev. Biochem., 42, 205—234 (1973).
KoshlandD. E., Jr., Protein Shape and Biological Control, Sci. Am., 229, (4), 52—
64 (1973).
Mildvan A. S.j Mechanism of Enzyme Action, Ann. Rev. Biochem., 43, 357—399
(1974).
Raivio K. 0., Seegmiller J. E.t Genetic Diseases of Metabolism, Ann. Rev. Biocem.,
41, 543—576 (1972).
Rosenberg L. E., Inborn Errors of Metabolism. In: Bondy P. K., Rosenberg L. E.
(eds.), Diseases of Metabolism, W. B. Saunders, Philadelphia, 31—58, 1974.
Schimke R. T., Control of Enzyme Levels in Mammalian Tissues, Adv. Enzymol.,
37, 135—187 (1973).
Segal H. L., Enzymatic Interconversion of Active and Inactive Forms of Enzymes,
Science, 180, 25—32 (1973).
Stroud R. M.t A Family of Protein-Cutting Proteins, Sci. Am., 231, (1), 74—88
(1974).
3 БИОЭНЕРГЕТИКА
МЕТАБОЛИЧЕСКИЕ ПУТИ —
ЗАПАСАНИЕ ЭНЕРГИИ
И ОБРАТИМОСТЬ РЕАКЦИЙ
Выше мы рассмотрели некоторые важные факторы, влияющие на
каталитическую активность отдельных ферментов. Процессы обмена
веществ представляют собой совокупность таких ферментативных
реакций в организме. Можно ожидать, что каждое из превращений,
осуществляемых ферментами метаболических путей, будет целесо-
образным и важным для процесса в целом. Однако студенту, еще
не знакомому с мудрой экономикой обмена веществ в организме,
очень часто кажется, что метаболические тропинки бессмысленно
вьются в болотах терминологии и дремучих зарослях химических
структур, путь через которые лишь изредка, как по волшебству,
озаряют вспышки кажущихся фантастическими «макроэргических»
соединений. Почему, например, для простого химического превра-
щения
Глюкоза —> Молочная кислота
С„Н12Ов —*2С3НвО3
необходимо последовательное действие 11 ферментов с пятью ко-
ферментами или кофакторами и почему в ходе этого превращения
требуется образование 10 промежуточных органических соедине-
ний, девять из которых соединены с одной или двумя молекула-
ми фосфата? Эта кажущаяся ненужной сложность представляется
иногда студенту либо плохой шуткой природы, либо своего рода
заговором садистов, дьявольским изобретением биохимиков. Хотя
преподавателей биохимии не следует признавать виновными по
этому последнему пункту обвинения, я подозреваю, что многие уче-
ные затратили массу труда (либо подтверждая реальность кажу-
щихся изгибов на путях обмена веществ множеством эксперимен-
тальных доводов, либо описывая отдельные достопримечательности,
встречающиеся на этих путях, с любовью, тщательностью и забот-
ливостью) для того, чтобы оправдать все кажущиеся отклонения,
объезды и ухабы на метаболических проспектах и переулках.
Понимание биологического значения метаболических реакций
должно быть основано на оценке энергетических превращений и
конечных продуктов этих реакций. Короче говоря, не следует
рассматривать обмен веществ лишь как одномерный процесс, как
бы протекающий в горизонтальной плоскости. Необходимо помнить,
Энергетический уровень
Рис. 3-1, Изменения энергии в цепи метаболических реакций,
108 3- БИОЭНЕРГЕТИКА
что этот процесс имеет еще и вертикальный параметр, поскольку
метаболические пути пересекают энергетические холмы и долины.
Таким образом, мы должны вообразить себя не картографами, ин-
тересующимися лишь вычерчиванием метаболических путей на плос-
кой поверхности карты, а скорее мореплавателями, шоферами, ко-
торым предстоит преодолеть эти пути, несмотря на ухабы и пре-
пятствия, создаваемые постоянно меняющимися энергетическими
условиями между точкой на старте и финишной лентой метаболиче-
ской гонки (рис. 3-1).
Если, продолжая рассмотрение нашего примера, допустить, что
А— это молекула глюкозы, а Я — две молекулы молочной кислоты,
то тогда для большинства тканей нашего тела основное значение
данного биохимического превращения заключается в запасании при-
годной для использования химической энергии, расходуемой на
осуществление других физиологических функций. В мозгу и нервах
эта энергия требуется для создания электрических зарядов, в
скелетных мышцах — для совершения механической работы, в
почках и эритроцитах — для выполнения осмотической работы и
т. д. В целом процесс превращения глюкозы в молочную кислоту,
называемый гликолизом, служит прежде всего для выработки энер-
гии; этот процесс удовлетворяет поэтому требованиям, сформулиро-
ванным выше в отношении отдельно взятых ферментативных реакций:
энергетический запас субстрата должен превосходить энергетиче-
ский запас продуктов реакции. Таким образом, с точки зрения
энергетики весь этот биохимический процесс может происходить
самопроизвольно в направлении сверху вниз. В количественом вы-
ражении эта цепь реакции сопровождается высвобождением
56 ккал энергии на каждый моль потребляемой глюкозы.
Если бы энергия высвобождалась в ходе одноэтапного прямо-
го химического превращения, лишь небольшая ее доля могла бы
быть запасена в форме, пригодной для последующего использова-
ния; наибольшая часть энергии выделялась бы в виде тепла, что
можно считать целесообразным, если только считать единственной
целью потребления нами пищи поддержание градиента температуры
тела относительно окружающей среды. Однако выработка тепла —
лишь одна из второстепенных задач, стоящих перед процессами ка-
таболизма. Ведь тепловая энергия не может быть использована
организмом ни в процессе роста или анаболизма для замещения жиз-
ненно важных компонентов тканей, ни при выполнении упомянутых
выше физиологических функций. Для сопряжения этих потребляю-
щих энергию процессов с вырабатывающими энергию процессами
катаболизма необходимо приспособление, обеспечивающее осво-
бождение пригодной для использования химической энергии от-
дельными порциями.
Каждая из этих порций, или квантов, химической энергии состав-
ляет примерно 7,5 ккал и соответствует образованию макроэрги-
3. БИОЭНЕРГЕТИКА Ю9
ческого фосфата — соединения, называемого аденозинтрифосфатом,
(АТФ). В свете представления об этих квантах энергии становится
более ясным значением многоэтапности процессов обмена веществ.
Необходимо подразделить этот «гликолитический водопад» (с энер-
гией 56 ккал) на небольшие энергетические «капли» для того, что-
бы предотвратить непроизводительные расходы энергии в виде теп-
ла и обеспечить запасание этих небольших порций энергии в виде
молекул АТФ, которые могут быть использованы как носители хи-
мической энергии в других потребляющих энергию реакциях. По-
следовательные реакции обмена глюкозы создают как бы каскад
или лестницу небольших отдельных изменений энергии вместо ла-
винообразного энергетического обвала.
Другое преимущество, связанное с созданием энергетической
лестницы, относится к проблеме «восхождения», или обратимости
процесса. В избранном нами примере распад, или катаболизм, глю-
козы до молочной кислоты, ведущий к выработке энергии, преобла-
дает в большинстве органов, однако в печени имеет более важное
физиологическое значение обратный, анаболический, процесс — об-
разование глюкозы из молочной кислоты. Другие ткани удаляют из
крови глюкозу, используя ее для энергетических нужд, и освобож-
дают конечные продукты обмена, в том числе и молочную кислоту,
обратно в кровоток. Резкое усиление функций этих периферических
тканей сопровождается накоплением избытка молочной кислоты (что
вызывает снижение pH, или метаболический ацидоз), а также к
уменьшению концентрации глюкозы в крови (гипогликемия). Пе-
чень устраняет этот дисбаланс, поглощая молочную кислоту из кро-
ви и ресинтезируя глюкозу, которая вновь может поступать в кро-
воток для использования в процессах катаболизма, протекающих в
перифических тканях. Этот процесс синтеза глюкозы из других, со-
держащих углерод молекул (таких, как молочная кислота), назы-
ваемый глюконеогенезом, осуществляется преимущественно в резуль-
тате реакций, обратных ферментативным реакциям гликолиза.
Реакции гликолиза не могли бы протекать в обратном направле-
нии, если бы они сопровождались одноэтапным рассеиванием боль-
шого количества энергии. Фермент может катализировать обратную
реакцию, превращая значительные количества продуктов реакции
обратно в субстрат, только в тех случаях, когда энергетические раз-
личия между субстратом и продуктами реакции не очень велики.
При точно сбалансированном равновесии между субстратом и про-
дуктами реакции направление реакции определяется преимущест-
венно скоростями удаления одного из реагентов. При быстром
удалении реагента реакция может протекать как бы «снизу вверх»,
против градиента энергии, если только энергетический барьер
совсем мал. Если же этот барьер велик, то для того, чтобы обойти
это препятствие, должна быть использована другая ферментатив-
ная реакция.
ПО з. БИОЭНЕРГЕТИКА
При глюконеогенезе используются механизмы обоих типов. В от-
ношении трех ферментативных этапов гликолиза энергетические
соотношения не благоприятствуют обратимости реакций, и для пре-
одоления этих энергетических препятствий оказывается необходимым
использовать совершенно иные ферменты. Остающиеся восемь фер-
ментов гликолиза, однако, катализируют реакции, достаточно точно
сбалансированные таким образом, что они могут быть использованы
в качестве обратных при синтезе глюкозы. Таким образом, ана-
логия с лестницей становится полной. Лестница не только обеспе-
чивает более безопасный и рациональный способ спуска с энерге-
тических высот, но и облегчает задачу обратного подъема, подразде-
ляя непреодолимо большую затрату энергии на этапы, с каждым из
которых в отдельности легко справиться.
Прежде чем переходить к более подробному рассмотрению обмена
веществ у человека, остановимся в заключение на одном общем воп-
росе. Он касается множественности промежуточных продуктов,
участвующих в цепях и циклах метаболических реакций. В большин-
стве случаев соединения, образуемые в ходе реакций между пункта-
ми А и Я, имеются в клетках организма в очень низких концентра-
циях. Обычно реакции обмена веществ очень легко и быстро удаля-
ют эти промежуточные продукты по мере их образования. Необхо-
димость такой эффективно работающей системы очевидна с точки
зрения экономичности: накопление в клетке значительных концен-
траций частично измененных молекул создает затруднения, подоб-
ные тем, которые возникли бы на заводе в случае накопления на
конвейере не совсем готовой продукции. Накопление в клетке про-
межуточных продуктов обмена может привести к значительному
повреждению метаболических механизмов (не говоря уже о непроиз-
водительном их использовании). В настоящее время установлено, что
во многих случаях наличие одного неработающего фермента в цепи
метаболических реакций может привести к крайне тяжелым или даже
трагическим последствиям. Таким образом, нормальные промежу-
точные продукты обмена, накапливаясь в организме в чрезмерных
количествах, могут вызвать тяжелые патологические состояния.
Рассматривая химические соединения, участвующие в той или иной
отдельной реакции в процессе обмена веществ, мы фактически мы-
сленно как бы останавливаем находящийся в постоянном движении
поток событий. Мы должны постоянно помнить, что эти процессы
происходят в клетке очень быстро и что образующиеся промежуточ-
ные вещества существуют лишь очень недолго.
МАКРОЭРГИЧЕСКИЕ СОЕДИНЕНИЯ
Представление о так называемых макроэргических соединениях
имеет большое значение для понимания процессов обмена веществ
у человека. Обычно придерживаются ошибочного мнения о наличии
3. БИОЭНЕРГЕТИКА Щ
Аденин
NH,
к°
Рибоза \_
Пирофосфатные связи
о 1 о I о
СН2О-Р-О-Р-О-Р-ОН + Н20
о- О”
0“
Высвобождение
энергии
Др = -7,5 ккал
на 1моль
Аденозинтрифосфат (АТФ)
о
+ H0-P-04'
6-
Меорганическии
фосфат (Фн)
Аденозиндифосфат (АДФ)
Рис. 3-2. Структура аденозинтрифосфата (АТФ) и продуктов его гидролиза,
в этих соединениях богатой энергией связи, разрыв которой высво-
бождает большое количество химической энергии. Следует подчерк-
нуть, что разрыв связи в любом химическом соединении приведет
к высвобождению огромного количества энергии. Та «макроэнергия»,
о которой шла речь выше, высвобождается именно при гидролити-
ческом расщеплении данного соединения, т. е. в результате присое-
динения элементов воды, так что макроэргические соединения весьма
лабильны в водных растворах. Второе соображение, которое следует
помнить, заключается в том, что именно свободная энергия, или вы-
свобождаемая при гидролизе энергия, пригодная для последующего
использования, придает этим макроэргическим соединениям столь
большое значение для процессов обмена веществ. Свободная энер-
гия представляет собой ту долю энергии, которая может быть исполь-
зована организмом для выполнения химической работы, и обычно
обозначается сокращенно буквой F; символ ДГ, встречающийся
более часто, обозначает изменение свободной энергии в ходе реак-
ции. Согласно третьему, наиболее важному из всех положению, фер-
менты обладают свойством катализировать перенос энергии между
парами реагентов. Именно таким образом достигается сопряжение
вырабатывающих энергию процессов катаболизма с потребляющими
энергию процессами анаболизма, мышечного сокращения, передачи
нервных импульсов и т, д.
112 3. БИОЭНЕРГЕТИКА
Наиболее важным из числа богатых энергией, или макроэрги-
ческих, соединений является АТФ, аденозинтрифосфат (рис. 3-2).
Он состоит из гетероциклического структурного элемента аденина,
пятиуглеродного сахара рибозы и трех фосфатных групп, соединен-
ных пирофосфатными связями так, что они составляют цепочку.
Именно последние придают АТФ способность легко подвергаться
гидролизу. Вода легко атакует пирофосфатную структуру, посколь-
ку электростатическое взаимное отталкивание отрицательно заря-
женных фосфатных групп создает тенденцию к их разобщению. Это
сильно выраженное стремление к отщеплению концевых фосфатных
групп АТФ представляет собой также движущую силу катализируе-
мых ферментами реакций переноса, которые приводят к фосфорилиро-
ванию других соединений в организме за счет АТФ. Такой перенос
энергетически осуществим потому, что он направлен от субстрата,
обладающего более высоким запасом энергии, к продуктам реакции,
занимающим менее высокий энергетический уровень.
Простым примером, иллюстрирующим эти правила, служит фос-
форилирование глюкозы за счет АТФ, происходящее в присутствии
фермента гексокиназы. Продуктами этой реакции являются аденозин-
дифосфат (АДФ, т. е. АТФ, концевая фосфатная группа которого
удалена) и глюкозо-6-фосфат — соединение, бедное энергией. Раз-
личие между богатыми и бедными энергией фосфатными соединения-
ми видно на примере уравнений реакций, описывающих гидролиз
этих соединений:
1. Аденозин — Ф~Ф~Ф + Н2О —> Аденозин —Ф~Ф + Н3РО4
(АТФ) (АДФ) Д/7 = —7,5 ккал
2. Глюкозо-6 —Ф + Н2ОГлюкоза+ Н3РО4
ДГ =—3,2 ккал.
В реакции (2), как это обычно имеет место при гидролизе любого
простого фосфатного эфира сахаров, образование свободной энер-
гии составляет лишь 2 или 3 ккал на 1 моль реагирующего вещества.
Гидролитическое расщепление одной из пирофосфатных связей АТФ
сопровождается, напротив, значительно большей потерей свободной
энергии; по определению, участвующее в реакции вещество считают
богатым энергией, если убыль свободной энергии составляет вели-
чину, превышающую 5 ккал на 1 моль реагента. Гексокиназа со-
прягает эти два процесса переноса энергии, используя как дви-
жущую силу высвобождение большого количества энергии в реакции
(1) для обеспечения протекания реакции (2') в обратном направле-
нии, т. е. «снизу вверх» в энергетическом смысле:
1. АТФ + Н2О->АДФ + Н3РО4 (ДГ = —7,5 ккал)
2': Глюкоза + Н3РО4—>Глюкозо-6-Ф + Н2О (ДГ = +3,2 ккал)
3. АТФ + Глюкоза —> АДФ + Глюкозо-6-Ф (Д/7 = —4,3 ккал)
3. БИОЭНЕРГЕТИКА ЦЗ
Уравнение реакции (3) получают суммированием реакции (1) и (2').
Изменение энергии в результате этой суммарной реакции равно сум-
ме изменений энергии в реакциях (1) и (2').
Рассматривая этот пример, следует обратить внимание на сле-
дующие положения. Во-первых, для того чтобы реакция (2) проте-
кала в обратном направлении, необходимо заменить на обратный
знак изменения свободной энергии, показывая тем самым, что сис-
тема нуждается в снабжении энергией для этерификации молекулы
глюкозы фосфатом (т. е.+3,2 ккал на 1 моль образующегося глю-
козо-6-фосфата). Во-вторых, в отсутствие соответствующей кина-
зы — фермента, сближающего реагирующие соединения и катали-
зирующего реакции переноса фосфата, весь процесс в целом, пред-
ставленный суммарным уравнением (3), был бы невозможен. В-треть-
их, в суммарном уравнении (3) показано, что участвующие в
процессе Н2О и Н3РО4 алгебраически исключаются. Фактически
фермент катализирует процесс, сближая АТФ и глюкозу, благодаря
тому что каждое из этих веществ связано в активном центре фермен-
та, чем обеспечивается возможность прямого переноса фосфатной
группы без образования Н3РО4. Наконец, суммирование энергети-
ческих показателей свидетельствует о том, что реакция (3) в том
виде, как она записана, приведет в конечном счете к высвобожде-
нию —4,3 ккал на 1 моль реагирующих веществ. Таким образом,
эта реакция будет иметь тенденцию протекать в направлении фос-
форилирования глюкозы. Реакция фосфорилирования теперь стано-
вится в энергетическом смысле идущей как бы «сверху вниз», что
обеспечивается ее сопряжением с дефосфорилированием АТФ. По-
скольку для обеспечения реакции (3) потребовался бы значительный
расход энергии (+4,2 ккал на 1 моль реагирующих веществ), фер-
мент гексокиназа не может в сколько-нибудь значительной мере
способствовать ходу процесса в обратном направлении (т. е. как бы
«снизу вверх»).
В природе встречается много различных макроэргических соеди-
нений (рис. 3-3), и они могут играть различную роль в процессах
обмена веществ в зависимости от специализации функций тканей и
организма в целом. В клетке обнаружены и некоторые другие нук-
леозидтрифосфаты, но АТФ, очевидно, играет ведущую роль как
донор фосфатных групп в системах с ферментами киназами. Другие
трифосфаты выполняют специальные функции в процессах обмена
веществ: уридинтрифосфат (УТФ) образует реакционноспособные
производные с фосфатами сахаров (такие, как УДФ-глюкоза) при
анаболических процессах обмена углеводов; цитидинтрифосфат
(ЦТФ) играет важную роль в образовании активированных проме-
жуточных продуктов (таких, как ЦДФ-холин) при синтезе фосфо-
липидов; гуанозинтрифосфату (ГТФ) присуща важная функция
избирательного ускорения образования пептидной связи при ана-
болизме белков. Более того, АТФ, УТФ, ЦТФ и ГТФ служат не-
о
I сн2о®-©-®
b
УриЪинтрифосфат (УТФ)
Цитпидинтрифоофат (ЦТФ)
NHj
о
I СН2О-© -Ф - OCH2CH2-N+ (СНэ)з
bo>j
ЦитиЪинЪифосфат-холин (ЦДФ-холин)
Гуанозингприфосфат (ГТФ)
Аминоацил-аЪенилатп (Аминоацил-АМФ)
СН2О-Ф
I
снон
С-О-®
II
о
Z3- 'Ьифосфоглицерат
(ДФГ)
сн2
и
с-о-Ф
I
соон
Фосфоенолпируватп
(ФЕП)
NH
C-N-®
I
НзС-N
СНа- СООН
Фосфокреатпин
о
И
сн3 -с-з-Кофермешп А
Ацетил-КоА
Рис. 3-3. Некоторые важные макроэргические соединения.
3. БИОЭНЕРГЕТИКА Ц5
посредственными предшественниками полинуклеотидной цепи ри-
бонуклеиновой кислоты (РНК); соответствующие нуклеотиды, в
состав которых входят сахара в дезоксиформе — дАТФ, дЦТФ,
дГТФ и дТТФ (дезокситимидинтрифосфат, заменяющий УТФ),—
играют такую же роль при биосинтезе дезоксирибонуклеиновой
кислоты (ДНК), как это было описано в гл. 1.
Другие фосфатные соединения также могут высвобождать при
гидролизе достаточно большое количество энергии, чтобы их можно
было отнести к числу макроэргических соединений. Эти вещества
можно подразделить на две общие группы: 1) соединения, образую-
щиеся в ходе процессов катаболизма и служащие для превращения
и запасания энергии, и 2) соединения, которые могут быть исполь-
зованы тканями в качестве «аварийного» источника энергии. В число
соединений первой группы включают производные углеводов:
1,3-дифосфоглицерат (ДФГ) и фосфоенолпируват (ФЕП). Эти два
соединения образуются как кратковременно существующие проме-
жуточные продукты анаэробных превращений энергии в ходе ре-
акций гликолиза. В молекуле ДФГ фосфат этерифицирован в по-
ложении 1 с образованием весьма лабильной ацил-фосфатной слож-
ноэфирной связи. В ФЕП фосфат присоединен так, что возникает
нестабильный енольный эфир. В обоих случаях выделение энергии
при гидролизе даже более значительно, чем при гидролизе АТФ
(ДГ=—12 и —14 ккал на 1 моль соответственно). Следовательно,
оба эти соединения могут отдавать фосфатную группу на АДФ при
синтезе АТФ в ходе реакций, обратных обычным реакциям киназ-
ного типа.
Вторая из названных групп соединений включает азотсодержа-
щие фосфагены, такие, как фосфокреатин, имеющийся в тканях поз-
воночных, и фосфоаргинин беспозвоночных. Фосфокреатина особенно
много в скелетных мышцах, где он может быт источником энергии
при кратковременных, но стремительных действиях, например при
состязаниях в беге на короткие дистанции. Количества энергии, вы-
свобождаемой при гидролизе N-фосфатной связи фосфагенов, сопос-
тавимы с теми количествами энергии, которые высвобождаются при
гидролизе АТФ, и, таким образом, общие потери энергии при пере-
носе фосфатной группы от фосфагена к АДФ с образованием АТФ
весьма малы. Благодаря этому реакция переноса фосфата между
АТФ и фосфокреатином, катализируемая креатинкиназой, легко
обратима. В покое, когда образуется больше АТФ, чем потребля-
ется, эта киназа работает в направлении синтеза фосфокреатина, ко-
торый служит легко мобилизуемым резервом химической энергии.
Во время работы, однако, потребление АТФ при сокращении мышц
и других процессах, протекающих с затратой энергии, сдвигает
равновесие киназной реакции в направлении распада фосфокреатина,
что позвляет поддерживать постоянную концентрацию АТФ, удов-
летворяя энергетические потребности тканей.
116 3. БИОЭНЕРГЕТИКА
Образование макроэргических соединений является общим меха-
низмом, при помощи которого клетка способна активировать моле-
кулы в ходе реакций переноса химических групп и других процес-
сов обмена веществ. Ацильные группы соединений с короткой це-
пью — (таких, как ацетат) или высших жирных кислот (таких, как
пальмитат) могут быть превращены в весьма реакционноспособные
в результате превращения в серусодержащие (тио) эфиры кофермен-
та А (КоА). Эти тиоэфиры, подобно ацилфосфатам, характеризуются
большими величинами отрицательной свободной энергии гидро-
лиза (—7 ккал/моль). Такие богатые энергией производные ацил-
КоА проявляют высокую реакционную способность в реакциях аци-
лирования, а также в весьма разнообразных промежуточных эта-
пах анаболизма и катаболизма липидов. Активация карбоксильной
группы может быть также осуществлена путем образования весьма
лабильных ацил-аденилатных соединений. Эта реакция имеет важ-
ное значение в механизме образования эфиров ацил-КоА, а также
при активации аминокислот в процессе образования пептидных свя-
зей. Во всех случаях карбоксильные группы образуют сложно-
эфирную связь с аденозинмонофосфатной частью молекулы АТФ.
Два концевых фосфата АТФ освобождаются в виде неорганического
пирофосфата (Ф—Фн), и, поскольку этот последний не может быть
вновь непосредственно использован для синтеза АТФ, в ходе ре-
акции фактически используются два макроэргических эквивалента.
На метаболических путях встречаются многочисленные другие
богатые энергией промежуточные продукты, которые активируют-
ся, ускоряя реакции переноса групп. Образование этих промежу-
точных продуктов во всех случаях прямо или косвенно зависит от
наличия энергии, поставляемой АТФ. Таким образом, в энергети-
ческой экономике клетки используется несколько видов «конвер-
тируемой валюты», причем каждый из этих видов предназначен для
нужд определенных процессов обмена веществ; однако единой ва-
лютой, объединяющей все взаимопревращения энергии, является
адениннуклеотидная система с АТФ в роли золота как универсаль-
ного эквивалента.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ
Процессы выработки энергии в тканях зависят в конечном счете
от катализируемых ферментами окислительных реакций. Отдель-
ные органы и типы клеток существенно различаются по окислитель-
ному потенциалу, но во всех случаях абсолютно необходим, в конце
концов, молекулярный кислород. Встречаясь с, казалось бы, бес-
конечным разнообразием типов цепей окислительных реакций,
студенты очень часто забывают этот простой, но чрезвычайно важ-
ный принцип. Среди огромного разнообразия дегидрогеназ и пере-
3. БИОЭНЕРГЕТИКА Ц7
$Н2
Восстановленный
субстрат
2Н
2е“
синтезы
а) Восстановительные
Окисленный Восстановительны^)) Окислительное
субстрат эквиваленты
фосфорилирование
Глюкоза
Жирные кислоты
Стерины
Аминокислоты и mb.
АТФ
Рис. 3-4. Использование энергии, высвобождаемой при биологических окисли-
тельных процессах.
НикотинамиЬаЬениндинуклеотиЬ (НАД)
НикотинамиЬаЬенинЬинуклеотиЬфосфатп (НАДФ)
S
Рис. 3-5. Структура н и коти на мидаден и нди нуклеотида (НАД) и его фосфата
(НАДФ).
носчиков электронов не следует терять из виду основной факт, ка-
сающийся биологических окислительных процессов, а именно то
обстоятельство, что их значение в первую очередь заключается в
выработке энергии для работы клетки либо непосредственно путем
предоставления подвижных водородных ионов для восстановитель-
ных синтезов глюкозы, жирных кислот, стероидов и т. д., либо
косвенно путем соединения этих водородных атомов с кислородом
в процессе образования воды, в ходе сопряженного образования АТФ
при окислительном фосфорилировании (рис. 3-4). Мы можем осоз-
нать биологическое значение и важность этих окислительных про-
цессов, происходящих в клетке, в свете энергетического обмена,
рассматривая либо энергию восстановления, либо энергию фосфори-
лирования.
Подобно тому как АТФ играет центральную роль в энергети-
ческом обмене клетки посредством реакций фосфорилирования,
так и коферменты НАД и НАДФ выполняют важнейшую, ключевую
функцию в окислительно-восстановительных реакциях. В молекуле
никотинамидадениндинуклеотида (НАД) содержится амид витамина
В, ниацин, или никотиновая кислота, который соединен через мо-
П8 3. БИОЭНЕРГЕТИКА
Восстановленный окисленный
субстрат НАД*
окисленный Восстановленный
субстрат НАД-Н
Рис, 3-6, Роль никотинамидных коферментов в дегидрогенировании.
лекулу рибозы с концевым фосфатом АДФ (рис. 3-5). Аденин-нук-
леотидная часть молекул этих коферментов, несомненно, участвует
главным образом в реакциях связывания, которые определяют спе-
цифичность их взаимодействия с определенными ферментными сис-
темами; это обстоятельство с очевидностью следует из того факта,
что никотинамидадениндинуклеотидфосфат (НАДФ), имеющий лишь
еще одну дополнительную фосфатную группу, присоединенную к
аденин-рибозной части молекулы, играет в процессах обмена ве-
ществ роль, достаточно четко отличающуюся от роли НАД. Однако
именно никотинамидная часть молекул обоих коферментов придает
им уникальное свойство, благодаря которому они занимают цен-
тральное положение в процессах окисления и восстановления.
В присутствии подходящих ферментов никотинамидное кольцо этих
коферментов обладает свойством извлекать водород из множества
разнообразных простых молекул, встречающихся в биологических
объектах; этот процесс логично назвать дегидрогенированием, а
катализирующий его фермент — дегидрогеназой (рис. 3-6). При
типичной реакции два атома водорода (с двумя относящимися к
ним электронами) отделяются от субстрата с образованием окислен-
ной формы субстрата: один водород с двумя электронами (Н:~,
или гидрид-ион) переносится на никотинамидное кольцо с образова-
нием восстановленного НАД или НАДФ (НАД-Н или НАДФ-Н),
а другой — освобождается в окружающую среду без электронов
(Н+, или протон). Основными особенностями такого переноса водо-
рода, благодаря которым этот процесс столь важен для экономики
клетки, являются:
1) обратимость многих дегидрогеназных реакций вследствие
того, что изменения энергии при этих реакциях как правило не-
велики;
2) способность коферментов — как в окисленном, так и в вос-
становленном состоянии — легко отделяться от дегидрогеназ путем
диссоциации;
3) возможность участия в таких реакциях множества субстра-
тов различных типов — углеводов, липидов, аминокислот и т. д.
3. БИОЭНЕРГЕТИКА J19
Благодаря этим общим свойствам никотинамиднуклеотидная
система (окислительно-восстановительная) характеризуется чрез-
вычайной маневренностью. Обратимость процессов позволяет ей
участвовать как в окислении субстрата, так и в восстановлении
продукта реакции в зависимости от потребностей клетки. Подвиж-
ность системы облегчает двусторонний обмен атомами водорода и
электронами между различными дегидрогеназными системами и
различными частями клетки. Благодаря возможности вовлечения
разнообразных субстратов эта система служит связующим звеном,
посредством которого восстанавливающие эквиваленты, необхо-
димые при восстановительном анаболизме биомолекул одной ка-
тегории, могут быть предоставлены в результате окислительного
катаболизма молекул другой категории.
Хорошим примером сопряженных с НАД переносов водорода в
тканях человека может служить реакция, катализируемая лактат-
дегидрогеназой. Как и в случае рассмотренной выше гексокиназной
реакции, полезно подразделить процесс на составляющие его этапы,
для того чтобы понять природу движущей силы, заставляющей эту
систему работать. Однако в отношении окислительно-восстанови-
тельных реакций эту движущую силу выражают обычно в терминах
восстановительных потенциалов (Е'й), а не изменений энергии, хотя,
по существу, эти термины равноценны. Этапы реакции характери-
зуют в терминах, выражающих тенденцию или стремление каждого
из реагирующих веществ действовать в качестве химического вос-
становителя, отдавая электроны молекулам акцепторов:
1. НАД-Н+Н+-^НАД++2Н + + 2е- (£; = —0,32 В)
2. Лактат —> Пируват 4- 2Н+ + 2е~ (Е^ = —0,19 В)
Чем более отрицательна величина EJ (в вольтах), тем более выра-
жено стремление участвующих в реакции веществ действовать в
качестве восстанавливающей системы, отдавая электроны другому
веществу. Так, в нашем примере пара НАД-Н=НАД+ в реакции (1)
имеет более отрицательный восстановительный потенциал и стре-
мится отдать электроны (и атомы водорода) для восстановления пары
лактат — пируват в реакции (2), которая поэтому будет идти в об-
ратном направлении:
2'. Пируват + 2Н + + 2е~—* Лактат.
Суммарная реакция (3), представленная как сумма реакий (1) и
(2'), после исключения общих реагентов имеет вид
3. НАД-Н -]-Н+ + Пируват—► НАД+ + Лактат.
Движущей силой этой реакции восстановления пирувата является
сильный восстановительный потенциал НАД-Н, величина E# ко-
торого настолько низка, что он может действовать в качестве хими-
120 3. БИОЭНЕРГЕТИКА
ческого восстановителя по отношению к множеству важных мета-
болитов в организме. Таким образом, как НАД-Н, так и НАДФ-Н
(который имеет такой же восстановительный потенциал) представ-
ляют собой особую форму химической восстановительной энергии
при биосинтезе глюкозы путем глюконеогенеза, при образовании
длинных алкильных цепей жирных кислот, при фиксации аммиака
с образованием глутаминовой кислоты и при многих других про-
цессах анаболизма. Подобно тому как пара АТФ-АДФ действует
в качестве центрального источника энергии при переносах хими-
ческих групп, так и пары НАД-Н=НАДи НАДФ-Н=НАДФ пред-
ставляют собой как бы общую энергетическую валюту при реак-
циях восстановления, в ходе которых происходит перенос водорода.
Второй формой обмена энергии при биологических окислитель-
но-восстановительных реакциях является использование восста-
новительной энергии не в ходе процессов анаболизма, а для вы-
работки АТФ, что представляет явление, общее для всех процессов
катаболизма при клеточном дыхании, и служит главным источником
АТФ, по существу, в каждой клетке организма. В общей форме эти
реакции можно записать так:
1. НАД-Н + Н+ -^НАД++2Н++2е~ (EJ = —0,32 В)
4. Н2О—1/2Оа + 2Н++2е~ (EJ = +0,82B)
Учитывая охарактеризованные выше критерии, можно заключить,
что реакция (4) при сопряжении процессов будет протекать в об-
ратном направлении, благодаря чему в сумме получим:
5. НАД • Н + Н+1/2 О2 —> НАД++ Н2О (Е; = 1,14В)
где ДЕ# представляет собой абсолютную величину различия вос-
становительных потенциалов двух этапов процесса. Благодаря
такой большой разности потенциалов между парами НАД-Н-НАД
и Н2О-О2 происходит высвобождение большого количества энер-
гии, ДГ=—53 ккал на 1 моль НАД-Н, окисленного кислородом
(Д£=—46 ДЕ0)- Как и в рассмотренном выше случае с глюкозой,
если такая реакция протекает одноэтапно (например, при сжигании
водорода в атмосфере кислорода, как это имеет место в ракетах),
то организм теряет энергию в виде тепла или кинетической энергии.
Для того чтобы регулировать высвобождение энергии, клетка ис-
пользует два принципа организации захвата и сохранения энергии
пригодной для выполнения химической работы.
Первый принцип полностью сходен с тем, который мы обсужда-
ли выше, рассматривая гликолитическую систему, а именно ис-
пользование лестницы небольших, капельных порций энергии вме-
сто единого разрушительного водопада. В случае окисления НАДИ
3. БИОЭНЕРГЕТИКА 121
Направление переноса электронов
АТФ
АТФ
2е
НАДН
SH,
ДГ « —10 ккал-
на 1 моль
Общее
количество
высвобождаемой
энергии <
53 ккал
на 1 моль
Пере-
пере-
носчик
Пере-
носчик
2
Пере-
носчик
высвобождаемой энергии
3
носчик
АТФ
Q
Рис, 3-7, Окисление НАД«Н кислородом при участии ряда переносчиков электро*
нов,
это достигается при помощи целого ряда переносчиков электронов
с постепенно нарастающими величинами Е[. Они обеспечивают
перенос восстанавливающих эквивалентов в конечном счете на кис-
лород, выполняющий роль окончательного акцептора электронов.
Такой ступенчатый каскад электронов облегчает подразделение изме-
нений энергии на несколько порций, или квантов, по —7,5 ккал,
нужных для синтеза 1 моль АТФ (рис. 3-7).
Второй принцип, отличающий эту систему от смеси растворимых
ферментов гликолиза в цитоплазме, основывается на простран-
ственной близости переносчиков электронов, связанных в строго
определенных соотношениях с мембранной структурой митохон-
дрий. Таким образом, последовательность реакций переноса элек-
тронов определяется как постепенным изменением величин восста-
новительных потенциалов, так и последовательностью расположе-
ния переносчиков в полужидкой среде. Физическое состояние этой
чрезвычайно упорядоченной системы имеет большое значение для
обеспечения скорости и высокой эффективности процесса, исклю-
чая необходимость в легко диффундирующих промежуточных про-
дуктах реакций и сводя к минимуму побочные реакции. Более того,
как будет подробно рассмотрено ниже, ориентация переносчиков
электронов относительно поверхностей мембраны имеет решающее
значение для энергетического сопряжения и процессов переноса ио-
нов.
122 3. БИОЭНЕРГЕТИКА
ДЫХАТЕЛЬНАЯ ЦЕПЬ
И ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
В систему переноса электронов в митохондриях включены че-
тыре класса переносчиков, каждый из которых способен претерпе-
вать обратимое окисление и восстановление в результате потери и
присоединения электронов. В некоторых случаях перенос электро-
нов может сопровождаться переносом водорода; в других — ионы
водорода могут возникать или потребляться, что создает градиенты
концентрации Н + .
К первой категории переносчиков относятся флавопротеиды,
содержащие в качестве простетической группы витамин В—рибо-
флавин, который играет роль, сходную с ролью никотинамида в
НАД. Гетероциклическая структура молекулы рибофлавина обла-
дает свойством присоединять атомы водорода и электроны (рис. 3-8).
Рибофлавин в нуклеотидной форме в виде флавинадениндинуклео-
тида (ФАД) или флавиномононуклеотида (ФМН, рибофлавинфосфат)
прочно связан с соответствующими дегидрогеназами и в противо-
положность НАД- Н не обладает свойством легко переносить восста-
новительные эквиваленты путем диффузии к другим дегидрогеназам.
Второе различие заключается в том, что реакции, катализируемые
флавин-зависимыми дегидрогеназами, не являются легко обрати-
мыми и, следовательно, флавиновые коферменты не участвуют в
переносе химических восстанавливающих эквивалентов при восста-
новительных синтезах, подобно тому как это делают никотинамидные
коферменты.
В соответствии с их относительно низкими восстановительными
потенциалами 0 вольт) флавопротеиды функционируют в не-
скольких пунктах, где электроны включаются в дыхательную
цепь. От восстановленного НАД два электрона и два водорода
переносятся на ФМН-кофермент:
1. НАД. Н + Н + + Ферм-ФМН — НАД+ + Ферм-ФМН - На.
Поскольку имеется существенное различие в восстановительных
потенциалах между парами НАД-НАД-Н и ФМН-ФМН-Н2 (A£„«
«0,3В), энергии высвобождается более чем достаточно для выра-
ботки 1 моль АТФ (ДГ«—46-0,3»—14 ккал). Эта реакция соот-
ветствует первому пункту сопряжения при окислительном фосфори-
лировании, где энергия, высвобождаемая в ходе окислительной
реакции, сопрягается с реакцией образования АТФ из АДФ и не-
органического фосфата (Фн). Флавопротеиды, содержащие ФАД,
также обеспечивают поступление электронов в дыхательную цепь
от сукцината, КоА-производных жирных кислот и «-глицерофосфа-
та. В этих случаях, однако, величины Е'о для субстратных пар очень
близки к соответствующим величинам для пары Ферм-ФАД — Ферм-
ФАДНа; поэтому разность AEi не достаточно велика для образова-
6 ......... ,
1 сЬ
Восстановленный ЧУ
флавиновый кофермент
(ФАД Нг или ФМН Нг)
Восстановленный Окисленный флавиновый Окисленный
субстрат кофермент (ФАД или ФМН) субстрат
Рис, 3-8, Роль рибофлавиновых коферментов в дегидрогенировании.
124 3. БИОЭНЕРГЕТИКА
Окисленный
кофермент Q
(KoQ)
Окисленный Восстановленный
флавопротеиЪ кофермент Q
(KoQ-Hz)
Восстановленный
флавопротеиЪ
Рис. 3-9. Кофермент Q.
ния АТФ. При использовании этих субстратов (в отличие от тех,
с которыми связано образование НАД-Н) процесс идет в обход
первого пункта сопряжения и, следовательно, ведет к образованию
меньшего (на 1 моль) количества АТФ в расчете на 1 моль окисляе-
мого субстрата.
Ко второй категории переносчиков электронов относится бен-
зохиноновое соединение — кофермент Q (рис. 3-9). При восстанов-
лении он, подобно флавопротеидам, присоединяет два электрона и
два водорода, образуя гидрохиноновое соединение KoQ-Ha. Пара
KoQ-H2=KoQ имеет величину £#, лишь немногим более положи-
тельную, чем у флавопротеидов, которые таким образом могут пере-
носить восстанавливающие эквиваленты на хиноны; происходящее
при этом изменение энергии не достаточно для образования 1 моль
АТФ. По-видимому, система KoQ представляет собой узловой пункт,
где различные флавопротеиды могут отдать свои электроны и атомы
водорода:
ФП1 - Н2 + KoQ — ФП1 + KoQ - Н2
ФП2-Н2 + КоР--*ФП2+ KoQ-H2 и т. д.
В соответствии с его разносторонней ролью сборщика восстанав-
ливающих эквивалентов от нескольких различных флавиновых
ферментов кофермент Q представлен в дыхательной цепи в более
высоких концентрациях, чем большинство других переносчиков
электронов. Кроме того, его относительно небольшой молекулярный
вес и хорошая растворимость в липидной фазе митохондриальной
мембраны идеально соответствуют функции KoQ как подвижного
переносчика, взаимодействующего с фиксированными электрон-
переносящими белками.
Третий тип компонентов дыхательной цепи составляет группа раз-
личных гемопротеидов, цитохромов. Отличаясь друг от друга пре-
имущественно структурой белковых компонентов, все цитохромы
содержат конъюгированное тетрапиррольное кольцо, координацион-
но связанное с атомом железа в качестве простетической группы
(рис. 3-10). В отличие от флавопротеидов, которые, как было отме-
/ \ / • \ / \ ’ О 1 ^ч 1 ' ' 8(н) + N—Fe3--N । । 1 \ < 1 , ... 1 J У * / \ ^N / Ферр и гем Восстановленный Окисленный субстрат цитохром Белок^^ч^ / \ / \ . 1 ' *ч^ { s 1 1 s+ 1 N—Fe1*—М |+(ид 1 X - 1 1 1 1 \/ ч \ 1 / / \ \ Г ’ Л / (t/в”) \ * / \ J \ / Феррогем Окисленный Восстановленный субстрат цитохром Рис, 3-10, Цитохромы,
126 3. БИОЭНЕРГЕТИКА
чено выше, функционируют параллельно, перенося восстанавливаю-
щие эквиваленты на общий акцептор KoQ, цитохромы действуют
последовательно в процессе переноса восстанавливающих эквива-
лентов от KoQ на конечный акцептор — кислород. Кроме того, в
отличие от всех рассмотренных до сих пор переносчиков цитохромы
переносят вдоль дыхательной цепи лишь один электрон. При этом
происходит обратимое окисление и восстановление атома железа
простатической группы, переходящего из Fe2+ в Fe3+. Таким обра-
зом осуществляется цепь реакций между гемами цитохромов с
переносом одного электрона в каждом звене цепи.
Первым звеном в этой цепи реакций является перенос электронов
от KoQ-На на цитохром Ь, имеющий наиболее низкую величину
Е*
KoQ-Ha + 2Fe3+-UHTOxpoM b —* KoQ + 2Fe2+-wiToxpoM & + 2Н+.
Следует отметить, что для такого переноса двух электронов от вос-
становленного KoQ требуется 2 моль одноэлектронного акцептора —
цитохрома Ь\ кроме того, атомы водорода, которые не могут быть
перенесены путем восстановления атома железа цитохромов, осво-
бождаются в виде протонов. Пары KoQ=KoQ-Ha и Fe2+=Fe3+-
цитохром b имеют близкие величины ЁЦ» и при этих реакциях про-
исходят лишь небольшие энергетические изменения. Восстановлен-
ная форма цитохрома b имеет низкую величину Е'й, что позволяет ей
действовать в качестве восстановителя гема следующих перенос-
чиков в дыхательной цепи, а именно цитохромов с. Прослеживая
далее судьбу восстанавливающих эквивалентов, удобно сохранять
постоянными стехиометрические соотношения электронных пар,
представляя реакции с участием цитохромов происходящими по-
парно:
2Реа+-цитохром &+2Ре3+-цитохром с—*2Ре3+-цитохром Ь+
+ 2Ре2+-цитохром с.
Именно эта реакция важна потому, что она представляет собой
второй пункт сопряжения фосфорилирования с окислением; вели-
чины Е'„ для цитохромов b и с равны +0,04 В и +0,25 В; поэтому
Д£^=0,21В, а ДР«—10 ккал на два электрона, что более чем
достаточно для образования АТФ. Дополнительный цитохром, обоз-
начаемый как си с величиной Е'й, очень близкой соответствующей
величине для цитохрома с, является промежуточным участником
этой реакции, фактически осуществляющим перенос электронов
между цитохромами b и с.
Завершающим этапом дыхания является реакция, катализируе-
мая ферментом цитохромоксидазой — сложным гемопротеидом, со-
держащим два химически различных гема, которые обозначают
а и а3. Первый из них реагирует с цитохромом с, принимая электроны
и перенося их на компонент а3, который уникален по сравнению с
3. БИОЭНЕРГЕТИКА 127
другими цитохромами в том отношении, что способен прямо взаимо-
действовать с кислородом как конечным акцептором электронов в
дыхательной цепи. Последовательный перенос электронов от цито-
хрома с к а и затем до а3 осуществляется путем реакций, аналогич-
ных тем, которые были подробно охарактеризованы выше при рас-
смотрении участка цепи между цитохромами b и с. С точки зрения
энергетики гемы а и а3 цитохромоксидазы находятся в равновесном
состоянии, поскольку они имеют одинаковую величину Е3 (+0.29В),
и, очевидно, при переносе электронов от цитохрома с происходит
высвобождение лишь небольшого количества энергии (Д£о«О,О4 В).
Выработка достаточно большого количества энергии может быть
обеспечена в ходе последующей реакции, составляющей третий,
и последний, пункт сопряжения:
2Ре4+-цитохром a,4-2H + -f-1/2О2 —► 2Ре3+-цитохром а3-рН2О.
Как было отмечено выше, пара Н2О-О2 имеет большую величину
Ео(+0>82 В), что соответствует нашим обычным представлениям о
кислороде как сильном окислителе. Свойство кислорода с жад-
ностью присоединять электроны, поставляемые цитохромоксидазной
реакцией, является главной движущей силой всей последователь-
ности переноса электронов вдоль дыхательной цепи. Способность
кислорода служить резервуаром для оттока электронов обеспечи-
вает поддержание каждого из переносчиков дыхательной цепи в
окисленном состоянии, благодаря чему такие переносчики могут
принимать восстанавливающие эквиваленты, поставляемые суб-
стратами тканевого дыхания (НАД-Н, сукцинат и т. д.). На уровне
третьего пункта сопряжения вырабатывается больше энергии
(ДЕо=О,53 В; AF=—24 ккал/2е_), чем при любой другой реакции
в дыхательной цепи. Эта энергия, казалось бы, достаточно велика для
того, чтобы обеспечить образование нескольких молей АТФ, но тем
не менее в третьем пункте сопряжения, как и в первых двух, выход
АТФ составляет 1 моль. Следует отметить также, что при цитохро-
моксидазной реакции используются те два происходящих от суб-
страта водородных иона, которые были освобождены в среду при
окислении KoQ-H2 цитохромом Ь\ эти атомы водорода в конечном
счете становятся источником метаболической воды в организме.
Рассмотрев довольно подробно реакции дыхательной цепи,
ознакомимся теперь с основными особенностями и принципами
действия этой чрезвычайно важной системы переноса энергии
(рис. 3-11). Первой и наиболее существенной особенностью является
общий выход пригодной для использования химической энергии,
преобразованной в молекулы АТФ. Об эффективности процесса окис-
лительного фосфорилирования обычно судят по величине отношения
этерифицированного фосфата к поглощенному кислороду (О), т. е.
по отношению Р : О. Вычислить это стехиометрическое соотноше-
ние можно, зная число звеньев дыхательной цепи, где происходит
(3)
I--------------1-------------1_____________I_____________I_____________1_____________I
—0,4 -0,2 0,0 +,0,2 +0,4 +0,6 +0,8
Рис. 3-11. Дыхательная цепь.
ФП1 — флавопротеид, Q — кофермент Q; b, ct, ct a, a3 — цитохромы. Восстановительные потенциалы (£q) указаны в соответствии е располо-
жением каждого из переносчиков. Высвобождение энергии при реакциях между переносчиками достаточно велико, чтобы обеспечить образование
АТФ на трех этапах сопряжения /, 2 и 3. Стрелки указывают направление переноса электрона от субстратов к кислороду. Точки приложения дей-
ствия ингибиторов дыхательной цепи обозначены заключенным в кружок минусом
з. биоэнергетика 129
фосфорилирование. Поскольку окисление НАД-Н сопряжено с пере-
носом электронов через каждый из трех этапов сопряжения, мы мо-
жем заключить, что окисление любого субстрата, поставляющего в
дыхательную цепь свои электроны при участии НАД-Н, приведет к
образованию 3 моль АТФ на пару электронов, перенесенных к кис-
лороду. Так как два электрона восстановят 1/2 моль (1/2 О2) или
один атом кислорода на заключительном цитохромоксидазном эта-
пе, мы можем выразить это соотношение, указав, что 3 моль фос-
фата образуют эфирную связь с АДФ при синтезе АТФ в расчете
на каждый атом кислорода (О), потребленный дыхательной цепью;
в сокращенной записи эта мысль выражается так: Р : 0=3. При
окислении других широко распространенных субстратов, которые
переносят свои электроны на дыхательную цепь при участии флаво-
протеидов (например, сукцинат, КоА-производные жирных кислот
или а-глицерофосфат), лишь два последних этапа сопряжения во-
влекаются в перенос электронов, и поэтому окисление таких суб-
стратов дает отношение Р : 0=2. Наконец, окисление такого веще-
ства, как аскорбиновая кислота (витамин С), которая может непо-
средственно восстанавливать цитохром с в обход двух первых
этапов сопряжения, дает величину Р : 0=1.
Оценивая эффективность процесса, отметим, что окисление
1 моль НАД-Н высвобождает 52,4 ккал, тогда как образование
3 моль АТФ соответствует запасанию 3x7,5=22,5 ккал пригодной
для использования химической энергии; эффективность процесса,
таким образом, составляет (22,5/52,4)X100, или примерно 40%.
Остающиеся 30 ккал высвобождаемой энергии представляют собой
движущую силу процесса, затрачиваемую на обеспечение практи-
чески необратимой работы дыхательной цепи в направлении:
SH2+O->S+H2O. Потеря энергии происходит главным образом в
виде тепла, которое не может быть использовано для осуществления
полезной химической или механической работы в гомойотермном ор-
ганизме человека, функционирующем при постоянной температуре.
Однако тепло, образующееся при процессах дыхания, является важ-
нейшим фактором в работе механизмов терморегуляции, которые
поддерживают температуру тела на постоянном уровне — выше
температуры окружающей среды.
Токсическое действие на клетки ряда ядовитых веществ сво-
дится к избирательной блокаде некоторых звеньев цепи переноса
электронов. Среди этих ингибиторов дыхания наиболее известен
цианистый водород, газообразное вещество, которое выделяется
при действии кислот на цианиды. Вдыхание HCN или попадание в
организм через желудочно-кишечный тракт нескольких миллиграм-
мов таких солей, как KCN или NaCN, приводит к быстрой смерти
в результате жадного связывания цианидным анионом CN~ атома
железа в цитохроме а3. Хотя ни один из цитохромов дыхательной
цепи не способен к образованию такого комплекса с цианидом, тем
130 3. БИОЭНЕРГЕТИКА
не менее работа дыхательной цепи в целом блокируется. Образуя
ингибирующее соединение с гемом компонента а3, цианид подавляет
активность цитохромоксидазы, блокируя перенос электронов на
кислород от других цитохромов, расположенных «ниже» цитохром-
оксидазы в дыхательной цепи. В результате такой блокады на пути
потока электронов в конце дыхательной цепи цитохромы и другие
переносчики электронов в этой цепи накапливаются в восстановлен-
ной форме, не подвергаясь окислению.
Противогрибковый антибиотик антимицин А оказывает токсичес-
кое действие на клетки млекопитающих, избирательно блокируя
перенос электронов между цитохромами b и с3. В результате такой
блокады дыхательной цепи все переносчики электронов, располо-
женные «ниже» цитохрома Ci в дыхательной цепи, останутся в вос-
становленном состоянии, тогда как цитохромы а и а3 окажутся
окисленными.
К третьему классу ингибиторов,— барбитурат барбамил (амо-
барбитал) и инсектицид ротенон, относятся вещества, которые бло-
кируют «низко» расположенные звенья цепи переноса электронов,
действуя на уровне флавопротеидов, переносящих электроны от
НАД-Н на KoQ. Так, барбамил и ротенон избирательно ингиби-
руют окисление тех субстратов, которые взаимодействуют с дыха-
тельной цепью через НАД-зависимые дегидрогеназы, тогда как на
окисление таких субстратов, как сукцинат, алифатический ацил-
КоА и а-глицерофосфат, которые отдают свои электроны непосред-
ственно флавопротеидам, эти ингибиторы не действуют.
Интересно, что каждый из названных выше ингибиторов дыха-
ния действует либо на тот или иной этап сопряжения с фосфо-
рилированием, либо в непосредственной близости от них. Следует,
однако, иметь в виду, что эти ингибиторы действуют в первую
очередь на окислительно-восстановительные реакции в дыхатель-
ной цепи, блокируя поток электронов. Кроме того, они препят-
ствуют образованию АТФ путем окислительного фосфорилирова-
ния, что и объясняет причину их токсичности.
Существуют также ингибиторы, которые действуют непосред-
ственно на процесс образования АТФ, нарушая механизмы сопря-
жения в окислительном фосфорилировании. Важная группа этих
веществ включает соединения, известные под общим названием
разобщающие агенты, примером которых служат нитрофенолы
(в частности, 2,4-динитрофенол, или ДНФ), галофенолы (например,
пентахлорфенол и тироксин), а также множество, казалось бы, не-
сходных органических соединений (салициланилиды ифенилгидра-
зоны карбонил цианидов). В отличие от ингибиторов дыхания раз-
общающие агенты (такие, как ДНФ) не влияют на движение по-
тока электронов по дыхательной цепи; обычно они оказывают про-
тивоположное действие, значительно повышая скорость процессов
клеточного дыхания. Однако такое ускоренное дыхание не приводит
3. БИОЭНЕРГЕТИКА 131
к образованию АТФ. Иными словами, процессы фосфорилирования
и окисления теперь уже не сопряжены друг с другом. Обычно в
равной мере нарушаются все три этапа сопряжения. Такое разоб-
щение окислительного фосфорилирования приводит к нерегулируе-
мому, бесплодному дыханию, при котором освобождающаяся энер-
гия целиком рассеивается в виде тепла. Ядовитые нитрофенолы типа
ДНФ, случайно попав в организм, стимулируют обмен веществ и
теплообразование, что приводит к повышению температуры тела.
Повышение интенсивности обмена веществ при гиперфункции щи-
товидной железы также связано с подобным разобщающим эффек-
том, который в данном случае обусловлен резким повышением кон-
центрации гормонов щитовидной железы — тироксина и трииодти-
ронина.
Агентом другого типа, действующим непосредственно на реак-
ции фосфорилирования, сопряженные с дыханием, является анти-
биотик олигомицин; он действует непосредственно на ферментную
систему превращения АДФ в АТФ. Рассмотренные агенты, таким
образом, предотвращают как фосфорилирование, так и движение
потока электронов, сопряженное с фосфорилированием. Если по-
ток электронов не сопряжен с образованием АТФ, олигомицин
не оказывает ингибирующего действия; поэтому в присутствии
такого разобщающего агента, как ДНФ, подавление дыхания оли-
гомицином полностью устраняется.
ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
Понять сущность и оценить значение этих, казалось бы, част-
ных наблюдений можно лучще всего в процессе рассмотрения фе-
номена, называемого дыхательным контролем. Этот феномен пред-
ставляет собой важный пример действия механизмов, регулирую-
щих скорость метаболических процессов в организме. В состоянии
покоя человек потребляет лишь небольшое количество кислорода;
если же он выполняет физическую работу, его органы дыхания
должны усилить свою функцию, поставляя необходимый дополни-
тельный кислород. Выражая эту идею в количественных соотно-
шениях, мы можем указать, что при активном сокращении скелет-
ная мышца использует в 100 раз больше кислорода, чем в условиях
покоя. Каким образом это осуществляется? Вероятно, наилучший
подход к этой проблеме состоит не столько в том, чтобы попытаться
понять причины максимальной активизации дыхательной системы,
сколько в том, чтобы раскрыть сдерживающие механизмы, благода-
ря которым скорость процессов дыхания в условиях покоя поддер-
живается на низком уровне. Максимальная дыхательная активность
соответствует наибольшему возможному потоку электронов вдоль
дыхательной цепи, когда она работает бесконтрольно и бесполезно.
Для того чтобы оценить особенности механизма «включения» ды-
132 3. БИОЭНЕРГЕТИКА
Потока
электронов
нет
А
Быстрый
поток
электронов
Б
Быстрый
лоток
электронов
В
Потока
электронов
нет
Г
Рис. 3-12. Дыхательный контроль.
Перенос энергии окислительного фосфолирирования представлен как результат сопряжения
системы переноса электронов (е~) и системы фосфолирирования (Ф) в виде взаимосвязанных
шестерен. А. В отсутствие АДФ Б. В присутствии АДФ. В. В присутствии 2, 4-динитрофе-
нола (ДНФ) с АДФ или без него Г В присутствии олигомицина с АДФ или без него.
хания, необходимо понять работу регулирующей системы, которая
«выключает» тканевое дыхание, когда это требуется.
Решающим фактором поддержания окислительных реакций в
условиях покоя на низком уровне является низкая потребность
в энергии. Как следствие этого, адениловые нуклеотиды клетки
представлены главным образом АТФ, тогда как концентрации АМФ
и АДФ очень низки. В качестве главного регулирующего соединения
функционирует АДФ, поскольку существует непосредственное со-
пряжение потока электронов и фосфорилирования АДФ в дыхатель-
ной цепи. В организме имеется система превращения энергии, ко-
торая сопрягает процессы энергоотдачи, сопровождающей поток
электронов и запасания энергии путем образования АТФ, так же
совершенно, как если бы на каждом этапе сопряжения имелась
система взаимодействующих шестерен (рис. 3-12). Таким образом,
несмотря на наличие избытка субстрата (НАД- Н, сукцинат и т. д.),
а также избытка кислорода для окислительных реакций благода-
ря тесному сопряжению с фосфорилированием, поток электронов
не будет проходить через пункты сопряжения, если отсутствуют
АДФ и неорганический фосфат, необходимые для удаления энергии,
которая накапливается в звеньях, обеспечивающих ее превращение.
В норме неорганический фосфат имеется в избытке, так что лими-
тирующим фактором становится концентрация АДФ (рис. 3-12, Л).
3. БИОЭНЕРГЕТИКА 133
Следует отметить, что, хотя поток электронов мог бы проходить
через те звенья дыхательной цепи, где фосфорилирования не про-
исходит, в отсутствие АДФ блокирование потока электронов в пунк-
тах сопряжения 1, 2 и 3 приводит к блокированию всего процесса
дыхания в целом с такой же неумолимостью, как это происходит
в присутствии барбамила, антимицина А или цианида.
Когда клетка переходит от состояния покоя к активному функ-
ционированию (например, механическое сокращение мышцы, воз-
никновение импульса в нерве, активный транспорт в почках, сти-
муляция биосинтеза), она начинает использовать запасы креатин-
фосфата и АТФ, опустошая резервы первого и превращая послед-
ний в неорганический фосфат и АДФ. Теперь электроны получают
возможность проходить через пункты сопряжения с максимальной
скоростью, поскольку наличие АДФ в распоряжении системы фос-
форилирования устраняет «обратное давление» энергии в системе
ее переноса, позволяя «шестерням» проворачиваться свободно
(рис. 3-12, Б). Столь интенсивное дыхание будет продолжаться
до тех пор, пока существует потребность в энергии для выполнения
работы; когда же потребность в энергии удовлетворена и АДФ вновь
полностью превращен в АТФ, опять устанавливается дыхательный
контроль, обеспечивающий состояние покоя. Таким образом, соот-
ношение АТФ и АДФ точно регулирует функционирование цепи пе-
реноса электронов в соответствии с энергетическими потребностями
клетки.
Механизм действия таких разобщающих агентов, как ДНФ,
состоит в нарушении связей между промежуточными процессами
преобразования энергии. Так, в присутствии ДНФ не происходит
образования АТФ и отсутствует «обратное давление» энергии на пере-
носчики электронов, поскольку накапливающаяся энергия рассеи-
вается в виде тепла. Короче говоря, точка приложения действия
разобщающих агентов лежит между процессом переноса электронов
и фосфорилированием; в результате воздействия этих агентов на-
рушается взаимное сцепление «шестерен», что позволяет процессу
дыхания происходить с максимальной, неконтролируемой скоростью
(рис. 3-12, В). С другой стороны, такие ингибиторы сопряжения, как
олигомицин, предотвращают взаимодействие между адениловыми
нуклеотидами и системой фосфорилирования, так что АДФ не имеет
более возможности способствовать рассеиванию энергии, накапли-
вающейся в системе преобразования энергии; поскольку эти две
системы все еще сопряжены, то «обратное давление» энергии сдер-
живает процесс переноса электронов даже в присутствии АДФ
(рис. 3-12, Г). Однако дыхание вновь достигает максимальной ве-
личины при добавлении ДНФ, благодаря тому что этот разобщаю-
щий агент действует, устраняя взаимосвязь между дыхательной
цепью и точкой приложения эффекта олигомицина на завершающий
этап процесса образования АТФ.
134 3. БИОЭНЕРГЕТИКА
ЦИКЛ ЛИМОННОЙ кислоты
Источники электронов, поступающих в систему окислительного
фосфорилирования, многочисленны и разнообразны. Мы видели,
например, что промежуточные продукты обмена углеводов сукци-
нат и а-глицерофосфат, а также жирные кислоты (путем окисления
их КоА-производных) могут, перенося электроны прямо на флаво-
протеиды дыхательной цепи, давать отношение Р : О, равное двум.
Другие продукты обмена углеводов (пируват, малат, изоцитрат или
а-кетоглутарат), жиров (окси-формы КоА-производных жирных
кислот или 0-оксибутират) и аминокислоты (глутамат или пролин),
перенося свои электроны в форме НАД- Н, дают отношение Р : О,
равное трем. Этот перечень отнюдь не полон: многие другие ком-
поненты пищевых продуктов или тканей служат топливом для ды-
хательной цепи в зависимости от сложившихся условий в отношении
наличия в системе веществ и потребности в них. Однако один источ-
ник, выполняющий особенно важную роль в загрузке метаболиче-
ской цепи окислительного фосфорилирования, требует специального
и более подробного рассмотрения. Речь идет о процессе, посредством
которого совершается, казалось бы, простое превращение двухугле-
родных соединений (например, ацетат) до 2 моль СО2. Как ив случае
казавшегося простым расщепления гексозы на два трехуглеродных
компонента, природа сделала этот процесс весьма сложным. В дан-
ном случае мы имеем дело с состоящей из множества ферментов
системой, работающей, как колесо, или цикл реакций. В соответ-
ствии с названием одного из наиболее важных реагирующих сое-
динений этот процесс обычно обозначают термином цикл лимонной
кислоты, либо — в более общей форме — цикл трикарбоновых ки-
слот, или (в честь открывшего его исследователя) — цикл Кребса.
Ацетат поступает в этот цикл в активированной форме, в виде
тиоэфира кофермента А, или ацетил-КоА. Значение цикла лимонной
кислоты в процессах обмена веществ основывается на том факте,
что ацетил-КоА играет чрезвычайно важную роль как конечный
продукт катаболизма, образующийся из углеводов в результате
декарбоксилирования пирувата, из липидов — путем последователь-
ного отделения двухуглеродных фрагментов от длинных алкильных
цепей при окислении жирных кислот, а также из таких аминокислот,
как лизин, фенилаланин, тирозин, лейцин и изолейцин — в ходе
процессов их катаболизма (рис. 3-13). Более того, в образование
промежуточных продуктов этого цикла вносят свой вклад и многие
другие аминокислоты, после того как они подвергаются дезамини-
рованию: глутамат, пролин, гистидин, аргинин (до а-кетоглутарата),
аспартат (до оксалоацетата), а также аланин, цистеин, серин и гли-
цин (до пирувата). Не будет преувеличением назвать цикл лимонной
кислоты общим завершающим этапом катаболизма углеродсодер-
жащих соединений в организме. Другая особенность, придающая
3. БИОЭНЕРГЕТИКА 135
этому циклу важное значение в выработке энергии, состоит в том,
что все катализирующие его реакции ферменты, коферменты и про-
межуточные продукты локализованы внутри митохондрий клетки.
Таким образом, НАД-Н и другие доноры электронов цикла лимон-
ной кислоты могут свободно отдавать свои электроны непосредст-
венно дыхательной цепи мембранной системы митохондрий.
Биологическое значение цикла лимонной кислоты определяется
тем, что он, подобно гликолизу, представляет собой ряд последо-
вательно протекающих реакций, посредством которых освобождае-
мые при окислении молекулы ацетата электроны и энергия подраз-
деляются на регулируемые порции. Однако в отличие от гликолиза
данный процесс протекает лишь в одном направлении; регенера-
136 3. БИОЭНЕРГЕТИКА
ция ацетата из двуокиси углерода путем обращения цикла в орга-
низме невозможна. Кроме того, также в отличие от гликолиза рас-
сматриваемая последовательность реакций носит не линейный, а
циклический характер, причем участвующие в этих реакциях сое-
динения автоматически претерпевают регенерацию при каждом «обо-
роте колеса». Таким образом, промежуточные продукты составляю-
щих этот цикл реакций действуют как истинные катализаторы:
они принимают участие в реакциях, но их концентрация при этом
не изменяется. Рассматривая баланс атомов углерода, можно за-
ключить, что этот процесс состоит, по существу, в сочетании двух-
углеродных (2С) фрагментов (ацетата) и 4С-фрагментов (оксало-
ацетата) с образованием бС-соединений (цитрата) (рис. 3-13). После
определенной перестройки в изомерную форму это бС-соединение
(изоцитрат) окисляется и декарбоксилируется до одноуглеродной
молекулы (СО2) и 5С-фрагмента (а-кето глутарат). Последний в свою
очередь окисляется и декарбоксилируется до 1С (СО2) и ^-фраг-
мента (сукцинат), который после окислений и перестроек вновь
превращается в исходное 4С-соединение (оксалоацетат), регенери-
руя, таким образом, исходное звено цикла. Ацетат является един-
ственной монокарбоновой кислотой, участвующей в реакциях цик-
ла; все бС-промежуточные продукты представляют собой трикарбо-
новые кислоты, а 5С- и 4С-фрагменты — дикарбоновые соединения.
Поскольку главная задача цикла лимонной кислоты состоит в
образовании СО2 и энергии, сосредоточим внимание на тех эта-
пах, которые имеют важное значение в реакциях декарбоксилиро-
вания и окисления. Следует подчеркнуть, что непосредственное
образование АТФ возможно лишь в ходе одной из реакций цикла;
в основном же выработка энергии происходит в процессе отделе-
ния атомов водорода и электронов от ацетата и переноса их на ды-
хательную цепь. Первую реакцию декарбоксилирования катализи-
рует изоцитратдегидрогеназа (а), которая, как указывает назва-
ние фермента, осуществляет также окисление: перенося пару элек-
тронов на НАД и образуя, таким образом, СО2 и НАД-Н (рис. 3-14).
Во второй реакции декарбоксилирования участвует продукт пре-
дыдущей реакции; на этом этапе а-кетоглутаратдегидрогеназа (б)
также образует СО2 и НАД-Н в качестве конечных продуктов, но
с использованием значительно более сложной процедуры, чем при
декарбоксилировании и окислении изоцитрата. Для декарбоксили-
рования а-кетоглутарата необходим один из витаминов группы
В — тиамин в его пирофосфатной коферментной форме; для этапа
окисления требуется связанный ФАД, обеспечивающий в конечном
счете перенос электронов на свободный НАД; наконец, цепь угле-
родных атомов, остающаяся после освобождения СО2 и электронов,
требует участия дисульфгидрильного кофермента — липоевой ки-
слоты — для переноса сукцината на Ко А в виде тиоэфира. В ре-
зультате этих реакций часть энергии, высвобождаемой при окис-
3. БИОЭНЕРГЕТИКА 137
НО-СН-СООН
сн2-соон
Малат
СН2-С00Н
Н-С-СООН
но-сн-соон
Изоцитрат
(а)/^НАД+
H2OZ 1
сн-соон
сн-соон
Сукцинил-Ко4
Рис. 3-14. Реакции цикла Кребса.
Объяснения см. в тексте.
со,
СНгСООН
I
сн2
KOASH о«С-СООН
(б)J а-кетпоглутарат
^НАД+
НАД-Н
СО2
лении а-кетоглутарата, оказывается заключенной в образовав-
шемся сукцинил-КоА, макроэргическая тиоэфирная связь которого
способна трансформироваться в макроэргическую фосфатную связь
гуанозинтрифосфата (ГТФ), который в свою очередь способен пре-
вращаться в митохондриях в АТФ. Таким представляется тот един-
ственный этап, в ходе которого возможно непосредственное образо-
вание АТФ в цикле лимонной кислоты. В других окислительных
реакциях этого цикла участвуют ФАД-зависимая сукцинатдегидро-
геназа (6), которая, как было отмечено выше, передает электроны
непосредственно на KoQ дыхательной цепи, и, наконец, малатде-
гидрогеназа (г), катализирующая образование НАД*Н и регене-
рацию оксалоацетата.
138 3. БИОЭНЕРГЕТИКА
Для того чтобы оценить выход энергии при функционировании
цикла, мы можем допустить, что каждая молекула НАД- Н и ФАД-
•Н2, образованная в ходе окислительных реакций, может быть
окислена непосредственно путем переноса электронов через пункты
сопряжения окисления с фосфорилированием. Таким образом, на
каждый моль ацетил-КоА, превращенного в цитрат, а затем в изо-
цитрат, при каждом обороте цикла будут получены следующие вы-
ходы:
а) Изоцитрат —► а-Кетоглутарат б) а-Кетоглутарат —► Сукцинил-КоА в) Сукцинил-КоА —► Сукцинат+ГТФ а) Сукцинат —* Фумарат+ФАД-Н2 д) Малат —► Оксалоацетат + НАД*Н + СО2 +НАД-Н + СО2+НАД-Н 3 АТФ 3 АТФ 1 АТФ 2 АТФ 3 АТФ
12 АТФ
Помимо того что цикл обеспечивает окисление ацетил-КоА,
он представляет собой также путь катаболизма многих аминокислот
через а-кетоглутарат и оксалоацетат. Более того, поскольку деза-
минирование глутамата и аспартата в организме человека обратимо,
две образующиеся кетокислоты как промежуточные продукты цикла
могут вносить свой вклад в процессы синтеза и распада аминокислот
(рис. 3-15). Таков лишь один пример биосинтетических функций
цикла Кребса, которые связывают его с обменом углеводов, липи-
дов и аминокислот. От тех реакций цикла Кребса, которые протекают
на участке между фумаратом и оксалоацетатом, зависит включение
одного из атомов азота в аргинин и, следовательно, в мочевину. Обра-
зующийся в митохондриях цитрат способен проходить через их
мембрану в цитоплазму и там подвергаться распаду до ацетил-
КоА; этот процесс обеспечивает поступление субстрата для синтеза
жирных кислот и стероидов. Биосинтез простетических групп ге-
мов в цитохромах и гемоглобине требует участия на первом этапе
этого процесса митохондриального фермента, который использует в
качестве одного из субстратов образуемый в цикле Кребса сукци-
нил-КоА.
В этих биосинтетических функциях цикла оксалоацетат, оче-
видно, занимает ключевую позицию. Он участвует в образовании
аспартата, который в свою очередь служит предшественником при
образовании пуринов и пиримидинов, а также мочевины и аргини-
на. Он играет ключевую роль в обеспечении атомов углерода для
глюконеогенеза за счет разнообразных аминокислот и других не-
углеводных источников. Более того, оксалоацетат играет централь-
ную роль при восполнении запасов тех биохимических компонентов
цикла, которые участвуют в различных биосинтетических процессах
ц которые будут рассмотрены ниже.
Рис. 3-15. Функции промежуточных продуктов цикла лимонной кислоты в процессах биосинтеза.
140 3 БИОЭНЕРГЕТИКА
РЕГУЛЯЦИЯ ЦИКЛА КРЕБСА
Регуляция цикла Кребса имеет фундаментальное значение в
приспособлении организма к изменению условий внешней среды и к
изменению состояния физиологических систем. Существует несколь-
ко регуляторных факторов, которые можно подразделить на две ос-
новные группы: регуляция углеродсодержащимп субстратами и
промежуточными продуктами реакций самого цикла и регуляция
адениловыми нуклеотидами, которые служат коферментами и ко-
нечными продуктами (рис. 3-16).
Прежде всего рассмотрим функции промежуточных продуктов
реакций цикла, главным образом регуляторную роль оксалоаце-
тата. Точно установлено, что истощение тканевых запасов Ъксало-
ацетата ведет к прекращению работы цикла. Последствия этого для
клетки ужасны не только по причине истощения одного из наиболее
важных источников энергии, но также потому, что в отсутствие до-
статочного количества оксалоацетата, необходимого для взаимо-
действия с ацетил-КоА, образующимся при процессах катаболизма
жиров и углеводов, накапливаются двухуглеродные фрагменты;
в результате конденсации последних в тканях появляется избыток
ацетоацетата и других «кетоновых тел», что ведет к возникновению
патологического состояния, известного под названием кетоз. Во
всех случаях, когда ацетил-КоА образуется в столь больших коли-
чествах, что имеющегося оксалоацетата не хватает для конденсации
с ацетил-КоА и последующего его окисления, в ходе реакций цикла
возникает кетоз. Короче говоря, к кетозу приводит относительная
недостаточность оксалоацетата (т. е. относительная по сравнению с
уровнем ацетил-КоА); обычно кетозом сопровождается дисбаланс
между окислением жиров и катаболизмом углеводов. Это обстоя-
тельство определяется свойством углеводов регенерировать оксало-
ацетат путем карбоксилирования пирувата. Эта АТФ-зависимая
реакция катализируется в митохондриях биотиновым ферментом
пируваткарбоксилазой и представляет собой главный механизм
фиксации двуокиси углерода с образованием углеводов в организме.
Образующийся при такой фиксации СО2 оксалоацетат используется
в цикле Кребса, а также для обеспечения процесса глюконеогенеза
углеродсодержащими фрагментами при осуществлении многообраз-
ных функций аспартата в процессах обмена веществ, для выполнения
биосинтетических функций цикла, которые требуют выработки ци-
трата, а-кетоглутарата, сукцинил-КоА. Реакции цикла, ведущие к
образованию оксалоацетата, регулируются по принципу обратной
связи благодаря тому, что оксалоацетат (структурный аналог сук-
цината) действует в качестве конкурентного ингибитора сукцинат-
дегидрогеназы. Этот фермент приобретает, таким образом, значение
регуляторного звена цикла, так как накопление оксалоацетата бло
кирует цикл на этапе окисления сукцината до тех пор, пока приток
Глюкоза
I
Рис. 3-16. Регуляция цикла ли-
монной кислоты.
Соединения, действующие как отри-
цательные модификаторы, обозначе-
ны стрелками с заключенными в
кружки знаками минус; положитель-
ные модификаторы обозначены зак-
люченными в кружки знаками плюс
ЗАТФ
142 3. БИОЭНЕРГЕТИКА
дополнительного ацетил-КоА не позволит удалить избыток оксало-
ацетата.
Ацетил-КоА играет также другую важную роль в ауторегуляции
цикла как мощный активатор пируваткарбоксилазы; поскольку
ацетил-КоА является облигатным аллостерическим модификато-
ром этого фермента, в отсутствие ацетил-КоА в тканях образуется
лишь ничтожно малое количество оксалоацетата. Эта система конт-
ролей и балансировок обеспечивает (в нормальных пределах по-
ступления и потребления промежуточных продуктов метаболиче-
ских реакций) регулирование биохимических превращений цикла
так, чтобы не было ни избытка, ни недостатка промежуточных про-
дуктов. Нарушения баланса обычно происходят в тех случаях, когда
в результате окисления жиров в тканях накапливается ацетил-КоА
(как это происходит при голодании) или когда катаболизм углево-
дов недостаточно интенсивен для поступления пирувата, необхо-
димого для образования оксалоацетата (что имеет место при сахар-
ном диабете).
Накопление цитрата предотвращается несколькими механизма-
ми, действующими по принципу обратной связи, а также «отвле-
кающими маневрами». К числу последних относится упомянутый
выше процесс диффузии избытка цитрата из митохондрий в цито-
плазму, где распад цитрата до ацетил-КоА приводит к отвлечению
этих двухуглеродных фрагментов на синтез липидов. Более того,
первый этап биосинтеза жирных кислот (карбоксилирование аце-
тил-КоА) катализируется аллостерическим биотиновым ферментом
ацетил-КоА-карбоксилазой, активаторами которой служат цитрат
и изоцитрат. Поэтому накопление любой из этих трикарбоновых
кислот еще более ускоряет отвлечение КоА от окисления в цикле
Кребса на синтез жиров. На способности цитрата действовать в
качестве отрицательного модификатора фосфофруктокиназы, бло-
кируя тем самым катаболизм углеводов на раннем этапе гликолиза,
основан дополнительный механизм обратной связи, позволяющий
цитрату уменьшить его собственное накопление.
Ко второй категории регуляторов активности цикла лимон-
ной кислоты относятся системы нуклеотидов АТФ-АДФ-АМФ
и НАД-Н-НАД*. Первым контролируемым этапом является про-
цесс включения в цикл ацетил-КоА; участвующий в этом про-
цессе фермент цитратсинтетаза находится под контролем осущест-
вляемого по принципу обратной связи ингибирования продуктами
реакций цикла — НАД-Н и АТФ. Таким образом, когда дальней-
шая выработка энергии фосфорилирования или восстановления
более не требуется, работа цикла прекращается в результате алло-
стерического торможения первой участвующей в нем ферментатив-
ной реакции. Другим важнейшим регулируемым этапом цикла яв-
ляется реакция, катализируемая изоцитратдегидрогеназой. Этот
фермент превращается в его каталитически активную форму лишь в
3. БИОЭНЕРГЕТИКА 143
присутствии АДФ, тогда как связывание НАД-Н или АТФ инакти-
вирует фермент, так что и на этом этапе осуществляется регуля-
ция цикла в соответствии с энергетическими потребностями клетки.
Как было отмечено выше, через АДФ, необходимый для окис-
лительного фосфорилирования, состояние энергетических запасов
клетки оказывает регулирующее воздействие на общую интенсив-
ность тканевого дыхания. Этот дыхательный контроль, осуществ-
ляемый низкими концентрациями АДФ, замедляет также работу
цикла лимонной кислоты, поскольку подавление способности дыха-
тельной цепи осуществлять окисление НАД-Н и ФАД-Н2, образу-
емых в ходе реакций цикла, тормозит активность дегидрогеназ в
результате возникновения недостаточности окисленных переносчи-
ков — НАД+ и ФАД.
К числу других косвенных воздействий нуклеотидов относятся
торможение в присутствии АДФ внемитохондриального фермента,
расщепляющего цитрат. При низком уровне запаса энергии в клет-
ке этот эффект АДФ обеспечивает использование цитрата в мито-
хондриях для выработки АТФ в реакциях цикла, исключая отвле-
чение цитрата на образование ацетил-КоА в цитоплазме. Таким обра-
зом, синтез жиров из углеводов происходит лишь при высоком уровне
АТФ. Высокий уровень АТФ в цитоплазме способствует также уско-
рению синтеза глюкозы из неуглеводных предшественников и подав-
лению гликолиза. С одной стороны, АТФ подавляет активность фос-
фофруктокиназы и пируватдегидрогеназы, препятствуя тем самым
использованию глюкозы, а с другой — служит аллостерическим ак-
тиватором фруктозодифосфатазы в печени, способствуя этим обра-
зованию глюкозы. АДФ и АМФ противодействуют указанным эф-
фектам АТФ; поэтому при низком уровне энергии в клетке (т. е.
много АДФ и АМФ, но мало АТФ) больше глюкозы подвергается
распаду до пирувата, чем обеспечивается получение больших ко-
личеств ацетил-КоА для работы цикла, тогда как при высоком уров-
не энергии в клетке (мало АДФ и АМФ, но много АТФ) инактивиру-
ется гликолиз и ускоряется обратный ему процесс глюконеогенеза
в таких тканях, как печень.
РОЛЬ МИТОХОНДРИЙ
В ЭНЕРГЕТИЧЕСКОМ ОБМЕНЕ
Во всех клетках нашего организма, кроме эритроцитов, за вы-
работку энергии в процессе метаболизма ответственны митохондрии.
В эритроцитах отсутствуют эти органеллы, присущие всем другим
клеткам человеческого тела; поэтому существование эритроцитов
полностью зависит от таких анаэробных процессов, как гликолиз.
Связанные с дыханием аэробные процессы, представляющие собой
значительно более мощные источники АТФ, протекают в митохонд-
риях, которые, помимо переносчиков электронов и сопряженных с
144 3. БИОЭНЕРГЕТИКА
ними механизмов переноса энергии окислительного фосфорилиро-
вания, содержат также ферменты, необходимые для работы цикла
Кребса, для окисления и карбоксилирования пирувата, для окисле-
ния жирных кислот и для ключевых реакций обмена аминокислот.
Поскольку митохондрии, в которых происходят все эти процессы,
отделены от остальной части цитоплазмы мембранным барьером,
они составляют как бы изолированную метаболическую область,
своего рода «клетку в клетке». Более того, мембраны митохондрий
осуществляют уникальную функцию благодаря тому, что в них
«встроены» многие ферментные системы окислительного метаболизма.
Как было указано в гл. 1, митохондрии имеют две различные
мембранные системы, окружающие внутреннее пространство, на-
зываемое матриксом; жидкое содержимое митохондрий богато фер-
ментами цикла лимонной кислоты и ферментами окисления жирных
кислот, а также необходимыми для их действия коферментами и про-
межуточными субстратами. Матрикс окружен внутренней мембраной
митохондрий; эта мембрана образует многочисленные выступы;
на ее внутренней, обращенной в сторону матрикса поверхности
«сидят» ровными рядами сферические частицы (рис. 3-17). Выступы
мембраны, называемые кристами, значительно увеличивают пло-
щадь ее поверхности. В структуру внутренней мембраны встроены
все компоненты дыхательной цепи; кроме того, эта мембрана служит
барьером, регулирующим циркуляцию веществ между цитоплаз-
мой и матриксом. Сопряжение потока электронов в мембране с
окислительным фосфорилированием обеспечивается сферическими
частицами внутренней мембраны, которые катализируют синтез
АТФ из АДФ и неорганического фосфата. Этот функциональный
аппарат митохондрий (внутренняя мембрана плюс матрикс) окружен
гладкой наружной мембраной. С последней связана активность лишь
немногих ферментов; она свободно проницаема для всех молекул,
кроме макромолекул, и выполняет главным образом защитную или
опорную функцию, ограничивая объем, в котором размещена много-
кратно изогнутая внутренняя мембрана.
Циркуляция субстратов между матриксом митохондрий и цито-
плазмой имеет первостепенное значение для энергетического об-
мена клетки. Нуклеотиды, например, не обладают способностью
свободно проникать через внутреннюю мембрану; тем не менее
АДФ должен проникать из цитоплазмы к частицам внутренней
мембраны для образования АТФ, а последний должен проходить
сквозь мембрану в обратном направлении для удовлетворения энер-
гетических потребностей клетки. Для поддержания баланса этих
процессов внутренняя мембрана содержит транслоказную систему.
которая обладает рецепторами с высоким сродством к АДФ на на-
ружной поверхности и рецепторами для АТФ на внутренней. Ис-
пользуя обратимое «переключение» («flip-flop») или переброску этих
двух рецепторов, транслоказа обеспечивает обмен вновь синтези-
3. БИОЭНЕРГЕТИКА 145
2Н
2Н*
АТФ АДФ
Цитрат Малат
Жиры
-Ацетил-КоА
Оксалоацетат
Цитоплазма
Рис. 3-17. Митохондрия.
Внизу увеличенное изображение внутренней мембраны с переносчиками электронов (соот-
ветственно рис. 3-11) и схемой движения метаболитов между цитоплазмой и матриксом
рованных молекул АТФ, движущихся в сторону цитоплазмы, на
эквивалентное число молекул АДФ, движущихся из цитоплазмы в
митохондрии. Таким путем общее содержание адениловых нуклео-
тидов в митохондриях всегда поддерживается постоянным; образо-
вание АТФ уравновешено с распадом АТФ до АДФ в окружающей
цитоплазме.
146 3. БИОЭНЕРГЕТИКА
Движение восстановительных эквивалентов между цитоплаз-
мой и внутримитохондр иальным пространством осуществляется с
использованием системы транслокации совершенно иного типа,
так называемого субстратного челнока. Поскольку никотинамид-
нуклеотиды НАД+ и НАД- Н, подобно адениннуклеотидам, не спо-
собны свободно диффундировать через внутреннюю митохондри-
альную мембрану, они переносят свои восстанавливающие эквива-
ленты на субстраты, которые проникают через мембраны, выполняя,
таким образом, функции челноков. Требуется лишь наличие соот-
ветствующих НАД-зависимых дегидрогеназ по обе стороны внутрен-
ней митохондриальной мембраны:
Е,
1. В цитоплазме: НАД-Н+ НАД* +SH2
е,
2. В митохондриях: SH2 4- НАД* S 4- НАД • Н 4- Н+.
Когда эти реакции протекают «слева направо» (прямые реакции)
восстанавливающие эквиваленты от НАД- Н, который образуется
в цитоплазме в ходе таких процессов, как гликолиз, могут проникать
в митохондрии, где они в форме SH3 подвергаются окислению при
участии реакций дыхательной цепи. Как результат осуществления
этих реакций в обратном направлении, энергия восстановления,
вырабатываемая в митохондриях при работе цикла Кребса или
при окислении жирных кислот, переносится из митохондрий в
цитоплазму в форме SH2; последний путем обращения реакции (I)
участвует в образовании НАД-Н, необходимого для восстанови-
тельных синтезов, таких, как обращение гликолиза при синтезе
глюкозы в цитоплазме.
Природа субстратов S и SH2, участвующих в челночном эффекте,
еще требует выяснения. В печени SHa, вероятно, представлен мала-
том — метаболитом, проникающим сквозь внутреннюю мембрану
с помощью системы переносчиков. Малатдегидрогеназа удовлетво-
ряет требованию обязательного присутствия как в митохондриях,
так и вне их; этот фермент может, таким образом, катализировать
реакции типа (1) и (2). Оксалоацетат (вещество S в малатной чел-
ночной системе) не способен достаточно быстро диффундировать и
потому сам по себе не обеспечивает полностью работу челночной
системы; но здесь возможна промежуточная реакция его превра-
щения, например в аспартат. К числу других пар S-SH2, возможно
выполняющих челночные функции, относятся диоксиацетонфосфат,
а-глицерофосфат и ацетоацетат-0-оксибутират, но универсальность
их функции для всех тканей не доказана.
Перемещения таких субстратов, как малат, из митохондрий
в цитоплазму и обратно могут быть облегчены важными системами
переноса, или транспортерами. Подобно системе переноса аденин-
нуклеотидов, переносчики органических кислот действуют путем
обмена на перемещающиеся в обратном направлении анионы по
3. БИОЭНЕРГЕТИКА 147
принципу «моль на моль». Так, малат, сукцинат и другие дикарбо-
ксилаты взаимодействуют со специфическим транспортером, который
в качестве противоиона перемещает в обратном направлении фосфат.
Цитрат, изоцитрат и другие трикарбоксилаты диффундируют путем
обмена на малат, который передвигается в обратном направлении,
используя другую специфическую систему переноса. О важности
переноса дикарбоксилатов упоминалось в связи с переносом вос-
станавливающих эквивалентов посредством малатного челночного
механизма. Перемещение цитрата и изоцитрата из митохондрий
в цитоплазму имеет решающее значение при биосинтезе жирных ки-
слот; при этом цитрат обеспечивает поступление ацетил-КоА в ци-
топлазму, а изоцитрат служит источником НАДФ-Н при участии
цитоплазматической НАДФ-зависимой изоцитратдегидрогеназы.
Для глутамата, аспартата и орнитина существуют также другие
транспортеры, обеспечивающие необходимую связь между процес-
сами обмена аминокислот в митохондриях и в цитоплазме.
Большинство монокарбоновых субстратов (например, ацетат),
по-видимому, обладает способностью свободно диффундировать
сквозь внутреннюю мембрану без участия специфических систем
переноса. Однако для облегчения перемещения высших жирных
кислот из цитоплазмы, где они образуются в ходе реакций липолиза,
в матрикс, где находятся ферменты окисления жирных кислот,
существует специальный механизм переноса. Перенос алифатиче-
ских ацильных групп сквозь митохондриальную внутреннюю мем-
брану сопровождается образованием диффундирующего эфира с
соединением, называемым карнитином. Эту реакцию катализирует
специальный фермент, встроенный во внутреннюю мембрану ми-
тохондрий и катализирующий процессы, протекающие в определен-
ных направлениях (изнутри наружу и наоборот). Процесс, направ-
ленный наружу, сводится к переносу ацильной группы (остатка
жирной кислоты), находящейся в виде активированного эфира КоА,
на карнитин, располагающийся на наружной, обращенной к цито-
плазме поверхности внутренней мембраны:
Ацил-КоА + Карнитин Z2 Ацилкарнитин + КоА.
Процесс, направленный внутрь, заключается в ферментативном
обращении предыдущего процесса, т. е. в превращении ацилкарни-
тина, обладающего свойством свободно проходить сквозь мембрану,
в ацил-КоА на той стороне внутренней мембраны митохондрий, ко-
торая обращена в сторону матрикса. Важно отметить, что этот ме-
ханизм переноса обеспечивает эффективный транспорт ацил-КоА,
который не способен проникать сквозь внутреннюю мембрану ми-
тохондрий, из цитоплазмы в матрикс без изменения содержания
кофермента А в этих двух отсеках клетки.
Перенос катионов в матрикс митохондрий непосредственно свя-
зан с передачей энергии внутренней мембраны митохондрий На
148 3. БИОЭНЕРГЕТИКА
основе представлений о возникновении электродвижущих сил, со-
провождающих движение ионов сквозь эту мембрану, вероятно,
можно будет понять в конечном счете механизм запасания энергии
при окислительном фосфорилировании. Прежде всего следует отме-
тить, что внутренняя мембрана митохондрий совершенно непрони-
цаема для большинства катионов вообще и для ионов водорода в
частности. Поэтому и возможно возникновение ионного градиента
между содержимым митохондрий и цитоплазмой. Если возникнове-
ние такого градиента обусловлено перемещением Н + в определенном
направлении, то создается протон-движущая сила, или трансмем-
бранный градиент pH. Более того, совершенно ясно, что перенос-
чики электронов дыхательной цепи ориентированы во внутренней
мембране митохондрий асимметрично, а именно так, что они доступны
для соответствующих субстратов либо с одной стороны мембраны,
либо с другой ее стороны. Например, НАД-Н может взаимодейство-
вать с дыхательной цепью только со стороны матрикса, или с
M-стороны, тогда как цитохром с функционирует с наружной, цито-
плазматической поверхности, или с Ц-стороны. Такое расположе-
ние переносчиков электронов во внутренней мембране определяет
движение электронов при окислительно-восстановительных ре
акциях дыхательной цепи в строго определенном направлении.
Следовательно, процесс переноса электронов может привести
к разделению зарядов и возникновению ионных градиентов между
митохондриями и цитоплазмой, подобно тому как контролируемое
сгорание водорода в топке приводит к выработке электрической
энергии в результате разделения заряженных Н+- и ОН"-ионов,
возникающих при окислительной реакции:
2Н2 + О2—>2Н + +2ОН-.
При тканевом дыхании протоны выталкиваются из митохондрий,
оставляя обращенную к матриксу поверхность внутренней мемб-
раны заряженной отрицательно, тогда как сам матрикс оказыва-
ется щелочным по сравнению с окружающей средой, т. е. цитоплаз-
мой Этот выброс Н+ свидетельствует о такой направленности рас-
положения переносчиков электронов, которая обеспечивает освобож-
жение Н+ в окружающую среду, тогда как захват Н+ происходит
при цитохромной реакции на обращенной к матриксу поверхности
мембраны:
2Fea+-цитохром а3 + 2Н+ +1/2 О2 —* 2 Fe3+-цитохром а3 + Н2О.
Таким образом, возникающий в результате окислительных реакций
в дыхательной цепи повышенный энергетический уровень мито-
хондрий можно выразить в терминах электрохимического градиента
Н4; в сущности, присущая данному субстрату энергия восстанови-
тельного потенциала превращается в электрохимический потенциал.
3. БИОЭНЕРГЕТИКА 149
Следствием электроотрицательности содержимого митохондрий,
энергетический уровень которых повышен, является то обстоя-
тельство, что такие катионы, как К+, Са2+ и другие, могут проникать
в матрикс даже против химического концентрационного градиента,
перемещаясь по направлению градиента электрического потенциала.
При этом такое движение катионов приводит к снижению энерге-
тического «уровня» митохондрий, повышенного в результате сопря-
женного с дыханием выброса протонов; иными словами, энергия,
которая в обычных условиях была бу запасена путем окислитель-
ного фосфорилирования, рассеивается в процессах активного пере-
носа ионов. В результате образование АТФ и перенос катионов ста-
новятся конкурирующими процессами, предъявляющими взаимо-
исключающие запросы к энергетическим ресурсам, создаваемым тка-
невым дыханием.
Ионы кальция представляют собой исключение из общего прави-
ла, касающегося непроницаемости внутренней мембраны для ка-
тионов. На мембране имеются специфические рецепторы, облегчаю-
щие перенос Са2+ через мембранный барьер. Значение такой сис-
темы переноса неясно; исключение в этом отношении представляют
лишь клетки слизистой оболочки кишечника: быстрое проникнове-
ние Са2+ в митохондрии и создание таким образом «стока» этих ионов
из содержимого кишечника в клетку ускоряет процесс всасывания
Са2+ в кишечнике.
Накопление в митохондриях таких ионов, как К+, происходит
очень медленно, если только катион не связан с комплексообразую-
щим агентом, подобным валиномицину, избирательно заключаю-
щим К+ в большую, неполярную, циклическую структуру, спо-
собную проникать сквозь гидрофобную часть мембраны. Хотя для
проникновения сквозь мембранный барьер и используются также
механизмы, подобные описанным, с участием таких жирораствори-
мых «ионофорных» агентов, как валиномицин, однако энергетиче-
ские основы процессов переноса всех катионов (Са2+, К+ или лю-
бых других) совершенно одинаковы, и при этих процессах действу-
ют одинаковые системы переноса энергии.
Компоненты механизма сопряжения, использующие состояние
повышенного энергетического потенциала митохондрий для выра-
ботки АТФ, можно описать, но трудно объяснить. Реакция АДФ+
+Фн->АТФ+Н2О протекает в сферических частицах внутренней
мембраны. Из этих частиц после их отделения от внутренней мемб-
раны удается получить белковый фактор, необходимый для окисли-
тельного фосфорилирования. Этот белок катализирует реакцию,
обратную синтезу АТФ, т. е. обладает активностью АТФазы, и,
поскольку он был первым идентифицированным фактором сопря-
жения, его называют РгАТФазой. Это тот этап окислительного
фосфорилирования, который чувствителен к ингибирующему дей-
ствию антибиотика олигомицина. Почему изолированный Fi ката-
150 3. БИОЭНЕРГЕТИКА
лизирует гидролиз АТФ, тогда как нативная частица осуществляет
синтез АТФ?
Ответ, вероятно, должен учитывать представление об асиммет-
ричности ориентации сферических частиц на внутренней мембране
и о важности реакций, протекающих в мембранах в строго опреде-
ленном направлении, что необходимо вновь подчеркнуть в связи с
сопряженностью процессов передачи энергии. Когда Fi изолирован,
он имеет свободный доступ к НаО —необходимому компоненту
гидролитической реакции, катализируемой АТФазой; таким обра-
зом, в водном растворе Fi действует в термодинамически благопри-
ятствуемом направлении, а именно в направлении распада АТФ.
В функциональном же состоянии Fi связан с гидрофобной частью
внутренней мембраны и, быть может, специально ориентирован
так, что доступен для АТФ и АДФ лишь с внутренней, обращенной к
матриксу стороны (М-стороны). Вероятно, находясь в гидрофоб-
ном окружении, этот фермент имеет довольно ограниченный доступ
к НаО; было выдвинуто предположение, что фактически с активным
центром Fj реагируют продукты ионизации воды, т. е. Н+ и ОН-.
Если фермент в разной мере доступен для Н+ и ОН- по обе стороны
мембраны, то истинная активность НаО в каталитическом центре
пропорциональна произведению концентраций ионов [Н+]м- 1ОН_]ц,
где подстрочные индексы указывают обращенную в сторону матрик-
са (М) и в сторону цитоплазмы (Ц) поверхности мембраны. Движе-
ние протонов от М-стороны к Ц-стороне, как это происходит при
тканевом дыхании, будет эффективно снижать [Н+]м и одновременно
уменьшать [ОН_]ц; такое перемещение приводит, следовательно, к
уменьшению величины произведения концентраций ионов и умень-
шению активности НаО в каталитическом центре Fi. Если эффек-
тивная концентрация НаО снижается в ходе реакции
АДФ 4-Фн - ♦ АТФ+Н2О,
то эта реакция будет происходить «слева направо». По существу,
происходящий в соответствии с этим механизмом синтез АТФ явля-
ется процессом дегидратации, в ходе которого необходимая для от-
нятия воды электрохимическая энергия обеспечивается односторон-
ним откачиванием протонов через мембрану во время сопряженного
с фосфорилированием дыхания.
На основе такого механизма легко объяснить феномен разоб-
щения. Такие липофильные разобщающие агенты, как 2,4-динитро-
фенол, способны проникать сквозь внутреннюю мембрану митохонд-
рий либо в виде фенолят-иона (PhO-), либо в виде сопряженного
фенола (PhOH). В этой последней форме они могут переносить в
митохондриальный матрикс протон и диссоциировать, освобождая
Н+ и фенолят-ион; фенолят диффундирует наружу и снова переносит
протон. В этом смысле разобщающие агенты являются ионофорами,
довольно сходными с валиномицином; они действуют, разрушая
3. БИОЭНЕРГЕТИКА 151
протонный градиент, который создается необходимым для образова-
ния АТФ переносом электронов в строго определенном направлении.
В результате запасание энергии оказывается нарушенным, ткане-
вое дыхание становится неконтролируемым, протекая с максималь-
ной, не зависящей от присутствия АДФ скоростью, как это было
рассмотрено выше.
Хотя многие из этих представлений о механизме образования
АТФ не рассмотрены полностью, из сказанного ясно, что процессы,
участвующие в образовании и использовании богатых энергией сое-
динений системы запасания энергии, образующейся при тканевом
дыхании, перекачивание ионизированных молекул сквозь мито-
хондриальные мембраны и многие связанные с этими процессами
системы, необходимые для химической, электрической и осмотиче-
ской работы клетки, связаны в единое целое благодаря определенной
направленности реакций обмена веществ и разделению зарядов.
ЭНЕРГОЗАВИСИМЫЕ СИСТЕМЫ ПЕРЕНОСА
Клеточная мембрана служит защитным барьером, предотвраща-
ющим проникновение вредных или бесполезных веществ из окру-
жающей среды и затрудняющим утечку важных компонентов из
содержимого цитоплазмы. Помимо этих довольно пассивных ог-
раничений, обусловленных непроницаемостью мембраны, в облег-
чении захвата необходимых пищевых веществ, выведении конеч-
ных продуктов обмена и т. д. участвует также целый ряд актив-
ных процессов, требующих затраты энергии. Поскольку наружная
мембрана клетки в отличие от митохондриальных мембран не имеет
собственной системы выработки энергии, она зависит от АТФ, обра-
зуемой при реакциях катаболизма в других частях цитоплазмы.
Системы активного переноса в клеточной мембране сопрягают энер-
гозависимые перемещения ионов и метаболитов с гидролизом АТФ,
и, таким образом, эти системы, подобно фактору Fi митохондрий,
обычно характеризуют и идентифицируют на основе их АТФазной
активности.
Наиболее широко распространенной системой активного пере-
носа этого типа является система Na\ К+-АТФазы, названная
так потому, что она требует для максимальной скорости гидролиза
АТФ как Na+ , так и К+. Активность этого фермента непосредствен-
но связана с процессом поддержания клетками постоянства их вну-
треннего ионного состава. Тогда как плазма крови и другие вне-
клеточные жидкости имеют высокую концентрацию Na+ и низкую
концентрацию К+, содержимое клеток, наоборот, характеризуется
высокой концентрацией К+ и низкой концентрацией Na+. Клетки
должны постоянно затрачивать энергию для того, чтобы поддержи-
вать эти соотношения ионов против градиентов концентраций.
Это достигается при помощи Na + , Л?-АТФазного комплекса, состоя-
152 3. БИОЭНЕРГЕТИКА
Внешняя
среда
Фермёнт-2К
Фермент — (?) — 3Na‘
Клеточная
мембрана
Рис. 3-18. Na + , К+-АТФазная система активного переноса катионов через кле-
точные мембраны.
щего из каталитически активного белка, связанного с фосфолипи-
дами и расположенного в мембране асимметрично.
Способность этого комплекса гидролизовать АТФ, а также
свойство клетки осуществлять перенос Na4 и К+ избирательно
блокируются сердечным гликозидом уабаином. Фермент АТФаза
действует строго направленно, связываясь с АТФ в присутст-
вии Na4 лишь на внутренней поверхности мембраны. В ходе этого
процесса фермент подвергается фосфорилированию и осуществляет
перемещение сквозь мембрану наружу трех ионов Na4 на каждую
использованную молекулу АТФ (рис. 3-18) Фосфорилированный
фермент подвергается гидролизу с освобождением неорганического
фосфата только при взаимодействии с К+ на наружной поверхности
мембраны. В ходе этого этапа дефосфорилирования на каждый моль
освобождаемого Фн сквозь мембрану клетки мигрируют внутрь два
иона К+. Уабаин блокирует именно эту К+-зависимую реакцию
Общим результатом работы такого «ионного насоса» является выб-
рос из клетки трех ионов Na+ и всасывание из внеклеточной жидко-
сти двух ионов К4 на каждую молекулу АТФ, гидролизованную до
АДФ и Фи. Эта уабаин-чувствительная Na4, К+-АТФаза имеется
в наружной мембране всех типов клеток — мышечных, клеток моз
га, эритроцитов и других,— где происходит транспорт Na+ и К4
Многие различные типы клеток и тканей дифференцировань
особым образом для осуществления функций всасывания или сек
реции. Так, париетальные клетки слизистой оболочки желудка
вырабатывают НС1 для подкисления содержимого желудка. Этоз
3. БИОЭНЕРГЕТИКА 153
процесс зависит от тканевого дыхания и, несомненно, коррелирует
с освобождением кислоты митохондриями, и в этом случае, по-ви-
димому, важнейшим энергозависимым этапом является выброс ионов
водорода Н+, тогда как ионы С1~, вероятно, следуют за ними пас-
сивно для поддержания электронейтральности. Далее по ходу же-
лудочно-кишечного тракта всасывание сахаров и аминокислот
происходит против градиентов концентраций в микроворсинках то-
щей кишки за счет энергии тканевого дыхания Перенос Na+ не-
изменно сопровождает перенос органических молекул, что ука-
зывает на взаимосвязь систем передачи энергии для ионных на-
сосов и для обеспечения миграции заряженных и нейтральных ме-
таболитов. Всасывание Са2+, главным образом в виде фосфата
кальция, представляет собой энергозависимую систему переноса в
кишечнике. В клетках эпителия подвздошной кишки специфический
белок-носитель, для синтеза которого требуется витамин D, осуще-
ствляет поглощение Са2+ из просвета кишечника. Для обеспечения
такого переноса Са2+ против градиента концентраций необходима
энергия тканевого дыхания: во-первых, на уровне клеточной мемб-
раны для синтеза АТФ, участвующего в работе Са2+, М§2+-АТФаз-
ной транспортной системы, аналогичной Na+, К+-АТФазной; во-
вторых, для облегчения «стока» в митохондриальный матрикс.
В почках природа и направление перемещений водораствори-
мых соединений определяются наряду с прочими факторами чисто
структурными условиями, различной проницаемостью разных мор-
фологических образований в сочетании с факторами гормональной
регуляции. Несмотря на сложность этих явлений, процессы актив-
ного переноса энергетически в общем сходны. Сохранение необхо-
димых компонентов путем обратного всасывания сквозь эпителиаль-
ные клетки проксимального отдела нефрона непосредственно свя-
зано с механизмом натриевого насоса, который работает при уча-
стии ориентированной наружу уабаин-чувствительной Na+, К+-
АТФазной системы, имеющейся и в других клетках. Первичной
движущей силой является активный перенос ионов Na+ (что при-
водит к их удержанию в организме) в сочетании с переносом анионов
(таких, как С1_) и нейтральных молекул (таких, как глюкоза), ко-
торые оказываются пассивными попутчиками, использующими энер-
гию, поставляемую перемещением Na+ Как и в других клетках,
ионы К+ перемещаются в направлении, обратном движению Na+,
и, таким образом, активно выводятся в мочу. Чужеродные соедине-
ния, которые активно секретируются (например, /г-аминогиппуро-
вая кислота), вероятно, используют ту же систему снабжения энер-
гией, как и активно всасываемые вещества, поскольку они кон-
курируют между собой, когда одновременно находятся в системе.
164 3. БИОЭНЕРГЕТИКА
ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
В НЕРВНОЙ ТКАНИ
Работа мозга требует большой затраты энергии (с этим охотно
согласится любой студент). По существу, почти одна четверть по-
требляемого организмом кислорода расходуется в процессах тка-
невого дыхания клеток мозга. Аноксия, или лишение О2, всего на
несколько секунд сопровождается потерей сознания, а длительная
аноксия приводит к необратимым нарушениям функций мозга.
Только аэробные процессы окислительного фосфорилирования мо-
гут эффективно удовлетворить высокие и непрерывные потребности
ткани мозга в энергии.
Как и во многих других тканях организма, значительная доля
потребляемой мозгом энергии приходится на активный перенос
веществ через клеточные мембраны. В нервной ткани эти процессы
сходны с наблюдаемыми в клетках других типов, но потребность
в энергии значительно выше. Например, у эритроцита способность
генерировать АТФ невелика, но и использует он на поддержание
постоянства своего внутреннего ионного состава примерно 30%
этого количества. С другой стороны, мозг, отличающийся (по от-
ношению к его размерам) чрезвычайно высокой активностью окис-
лительных процессов, расходует на поддержание ионных градиен-
тов между содержимым нервных клеток и окружающей их средой
почти 70% производимого им большого количества АТФ. Причина
такой высокой потребности нервной ткани в энергии заключается
в том, что при проведении нервных импульсов через мембрану нерв-
ной клетки проходит мощный поток ионов; при этом постоянно не-
обходимы метаболические реакции для возвращения к исходному
уровню электрического потенциала мембран после завершения
нервного импульса. Именно на этом этапе возвращения к исходному
состоянию, т. е. после завершения перемещений ионов, нервные
ткани требуют необычайно высокой затраты энергии.
Подобно другим клеткам, нейроны поддерживают высокий внут-
риклеточный уровень К+ при низких концентрациях Na+ и С1"
по сравнению с окружающей средой. В состоянии покоя клеточная
мембрана во много раз более проницаема для К+ и С1_, чем для Na+.
Следовательно, К+ имеет возможность выходить из клеток, а С1_
проникать в клетки путем диффузии по направлению градиентов
их концентраций. Однако Na+ проникает в клетки значительно бо-
лее медленно. В результате этого на наружной поверхности мемб-
раны возрастает положительный заряд, что выражается в разности
электрических потенциалов величиной примерно в 70 мВ между
наружной и внутренней поверхностями клеточной мембраны
(рис. 3-19,Л). Это так называемый потенциал покоя нейрона. Для
поддержания потенциала покоя на постоянном уровне клетка не-
прерывно затрачивает небольшое количество энергии на работу на-
3. БИОЭНЕРГЕТИКА 155
Рис. 3-19. Энергетические потребности нервной ткани в связи с переносом ионов.
Объяснения см. в тексте
триевого насоса, возвращающего в окружающую среду те неболь-
шие количества Na+, которые медленно поступают в клетку. Осо-
бенностью, характерной для нервных и мышечных клеток, является
их возбудимость, т. е. способность отвечать на раздражение изме-
нениями распределения ионов и, следовательно, появлением электри-
ческого заряда, или потенциала действия, который может переда-
ваться вдоль мембраны аксона.
Подробное рассмотрение особенностей раздражающих стимулов
и факторов, определяющих распространение потенциала действия
по нерву, выходит за рамки излагаемого предмета. С точки зрения
энергетики нервной проводимости достаточно рассмотреть на мо-
лекулярном уровне следующие процессы, которые сопровождают
изменения электрических зарядов на поверхности мембраны. Преж-
де всего первичным ответом на раздражение нерва независимо от
природы раздражителя и рецептора является резкое локальное
изменение мембраны нервной клетки, в результате которого про-
ницаемость этой мембраны для Na+ возрастает в несколько сотен
раз (рис. 3-19,Б). Поскольку концентрация Na+ в окружающей
среде значительно выше, чем в нервной клетке, и благодаря преоб-
ладанию положительных зарядов в окружающей среде Na+ быстро
устремляется в нейрон соответственно направлению концентраци-
онного и электрохимического градиентов. В результате этого по-
тенциал покоя исчезает, т. е. происходит деполяризация, и большой
приток Na+ изменяет знак разности потенциалов таким образом,
что она становится положительной на внутренней поверхности мем-
браны, достигая величины примерно 50 мВ. После прекращение
действия раздражителя клеточная мембрана вновь становится не-
проницаемой для Na+, а К+ диффундирует наружу по концентра-
ционному и электрохимическому градиентам до возвращения раз-
ности потенциалов к исходному состоянию.
Следует отметить, что эти перемещения ионов происходят в ре-
зультате пассивного движения по направлению существующих
градиентов и поэтому фактическое распределение электрического
заряда, сопровождающее распространение потенциала действия
вдоль нервного волокна, не является само по себе энергозависимым
156 3. БИОЭНЕРГЕТИКА
процессом. Однако после изменения (на обратный) знака обычных
градиентов К* и Na+ нейрон утрачивает способность отвечать воз-
буждением на последующий раздражающий стимул; требует за-
траты АТФ именно процесс возвращения к исходному уровню воз-
будимости нерва в результате переноса Na+ вновь в окружающую
среду, а К+ обратно в клетку.
Перемещения Na+ и К+ в период возвращения к исходному уров-
ню после возбуждения осуществляются посредством механизмов,
аналогичных тем, которые действуют и в других клетках. Нервная
ткань содержит весьма активную уабаин-чувствительную Na+,
К*-АТФазу, которая обладает свойствами, необходимыми для обе-
спечения работы натриевого насоса в направлении изнутри наружу
с одновременным движением К+ снаружи внутрь (рис. 3-19, В).
Потребности в энергии для возвращения содержания ионов к ис-
ходному уровню, свойственному состоянию покоя, удовлетворяются
рядом метаболических процессов, первым из которых является пря-
мое использование АТФ. При раздражении нерва происходит крат-
ковременное снижение уровня АТФ, что отражает его участие в
работе ионного насоса, однако содержание АТФ быстро возвраща-
ется к исходному уровню. Это явление связано с существованием
резерва энергии, запасенной в виде креатинфосфата, который обе-
спечивает поддержание постоянного уровня АТФ при участии креа-
тинфосфокиназы:
Креатин-Ф + АДФ Z2 Креатин + АТФ.
При длительном раздражении уровень АТФ в нервной ткани
не снижается, а остается постоянным за счет креатинфосфата, со-
держание которого в дальнейшем снижается, если потребность в
энергии превышает ее запасы.
В тот период, когда за счет резерва креатинфосфата поддержива-
ется уровень АТФ, дыхание митохондрий усиливается благодаря
кратковременному повышению концентрации АДФ. Это явление
можно наблюдать в опытах с изолированными кусочками ткани моз-
га, скорость дыхания которых в состоянии покоя очень низка,
но резко усиливается при раздражении электрическим током.
Поглощение кислорода тканью человеческого мозга in vivo про-
должается со скоростью, близкой к максимальной, даже в состоя-
нии «покоя», поскольку в нейронах живого мозга непрерывно воз-
никают импульсы и происходит возвращение их ионных градиентов
к исходному уровню. Усиленный обмен энергии и, следовательно,
повышенное поглощение кислорода мозгом можно обнаружить
in situ только в условиях усиленного внешнего раздражения, на-
пример при лечении электрошоком, когда интенсивность тканевого
дыхания возрастает вдвое. При обычных обстоятельствах потреб-
ление энергии в состоянии покоя удивительно мало отличается от
потребления энергии при интенсивной умственной деятельности в
3. БИОЭНЕРГЕТИКА 157
состоянии бодрствования, хотя это последнее состояние часто со-
провождается усталостью. С точки зрения затрат энергии то, что
происходит в мозгу в состоянии покоя, можно сравнить со случай-
ным шумом в комнате, переполненной музыкантами, которые на-
страивают свои инструменты независимо друг от друга; для согла-
сованных действий исполнителей, составляющих управляемый ди-
рижером оркестр, не требуется больших затрат энергии по срав-
нению с исходным уровнем активности, чем ее расходуется в период
их подготовки к исполнению Для обоих случаев можно признать,
что существует какая-то абсолютная потребность в энергии, но
организация затрат энергии для достижения определенной цели на-
ходится под контролем систем более высокого уровня.
ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
В МЫШЦАХ
Использование энергии метаболических реакций в мышцах
отличается рядом характерных особенностей Прежде всего оче-
видно следующее количественное соотношение: сокращения ске-
летных мышц, гладких мышц и сердечной мышцы в различной сте-
пени зависят от конкретных уровней активности, но тем не менее
они совершаются постоянно и, так же как в нервной системе, их
метаболические механизмы требуют постоянного притока топлива.
Природа этого топлива также может быть различной (как будет
изложено в последующих разделах), но независимо от того, будет
ли его источником окисление кетоновых тел в сердечной мышце,
или жирных кислот в скелетной мышце в условиях покоя, или
анаэробный катаболизм запасов гликогена в напряженно работаю-
щей скелетной мышце, в конечном счете движущей силой для совер-
шения механической работы во всех случаях является энергия,
высвобождающаяся при распаде АТФ.
Второй существенной особенностью является наличие во мно-
гих мышцах миоглобина. Этот гемопротеид, подобно гемоглобину
крови, обратимо связывается с О2 и служит, таким образом, вну-
триклеточным резервом кислорода, обеспечивающим аэробные про-
цессы образования энергии в тканях, когда запасы О2 в них исто-
щаются. В таких красных мышцах содержатся многочисленные ми-
тохондрии с плотно упакованными складчатыми мембранами (что
указывает на высокую мощность в них окислительных процессов);
эти митохондрии расположены в непосредственной близости к со-
кратительным миофибриллам, которые используют АТФ, образую-
щийся в митохондриях при окислительном фосфорилировании.
Для этого класса скелетных мышц характерны медленные сокраще-
ния и способность длительное время оставаться в состоянии сокра-
щения. В мышцах, функции которых требуют коротких, быстрых
залпов активности, мало миоглобина и митохондрий; поэтому их
к* к*
Рис. 3-20. Обмен энергии в сокращающейся мышце.
Объяснения см. в тексте.
3. БИОЭНЕРГЕТИКА jgg
иногда называют белыми мышцами. Они содержат большие запасы
гликогена в цитоплазме, и их функция зависит преимущественно
от анаэробного гликолиза как источника образования АТФ.
Наконец, сложный характер энергетических потребностей мышц
определяется тем, что мышечная клетка обладает возбудимостью
и сократительной способностью одновременно; в соответствии с
этим в ходе цикла сокращения и расслабления мышцы действуют
три самостоятельных АТФ-зависимых механизма: 1) натриевый на-
сос клеточной мембраны; 2) кальциевый насос внутри самой клетки;
3) механизм, который превращает химическую энергию гидролиза
АТФ в механическую энергию сокращения (рис. 3-20).
Как и в нервной ткани, работа натриевого насоса мышц опреде-
ляется функционированием Na+, К+-АТФазной системы клеточной
мембраны мышц, или сарколеммы. Перемещение К+ внутрь, а
Na+— наружу против градиентов их концентраций требует большой
затраты значительной доли энергии, образуемой мышцей в покое
(рис. 3-20, А). Подобно мембране нервной клетки, сарколемма об-
наруживает мембранный потенциал (примерно +50 мВ на наружной
поверхности), обусловленный возникновением этих ионных гра-
диентов. Стимуляция мышцы осуществляется посредством волны
деполяризации, которая движется вдоль мембраны мышечной клет-
ки, подобно тому как нервный импульс распространяется вдоль мем-
браны аксона, но с меньшей скоростью. В результате этого вся мышца
отвечает на сократительный стимул как единое целое. В периоде
возвращения к исходному состоянию после совершения мышечной
работы существенными АТФ-зависимыми процессами являются
возвращение к исходному состоянию ионных градиентов и реполя-
ризация сарколеммы, помимо затрат энергии на собственно механи-
ческие проявления мышечного сокращения (рис. 3-20, В).
Внутриклеточная мембранная система, известная как саркоплаз-
матический ретикулум, служит местом нахождения кальциевого
насоса. Ряд связанных между собой канальцев и цистерн изолирует
заключенное в них жидкое содержимое от цитоплазмы, окружающей
сократительные элементы мышцы. В состоянии покоя основная
масса Са2+ мышцы обособлена в содержимом саркоплазматического
ретикулума, тогда как в цитоплазме концентрация Са2+ очень низка
(<10-7 М). Стимуляция мышцы, приводящая к деполяризации
наружной плазматической мембраны сарколеммы, вызывает вторич-
ное освобождение Са2* через внутриклеточные мембраны, окружаю-
щие содержимое саркоплазматического ретикулума. Повышение
концентраций Са2+ (до ~10-e М) в цитоплазме, омывающей сокра-
тительные волокна, имеет важнейшее значение на пусковом этапе
мышечного сокращения; повышение концентрации Са2+ активирует
распад гликогена (рис. 3-20, Б). С прекращением стимуляций
мышцы Са2+ быстро исчезает из цитоплазмы. Некоторая его часть,
вероятно, поступает в митохондрии за счет создаваемого дыханием
160 3. БИОЭНЕРГЕТИКА
протонного градиента. Однако основная масса Са2+ за время вос-
становления исходного состояния после мышечного сокращения
возвращается в содержимое саркоплазматического ретикулума.
Поскольку концентрация Са2+ в цитоплазме очень быстро падает до
чрезвычайно низкого уровня, ясно, что процесс его возвращения в
саркоплазматический ретикулум, по-видимому, активируется ме-
таболическим насосом, который противодействует неблагоприятному
градиенту концентраций Са2+. Энергию для этого процесса обеспе-
чивает АТФ, и весь процесс осуществляется связанной с мембраной
саркоплазматического ретикулума ферментной системой, гидро-
лизующей АТФ только в присутствии Са2+, т. е. Са2+-АТФазной
системой. На каждый моль гидролизуемого АТФ в саркоплазмати-
ческий ретикулум переносятся два иона Са2+.
Молекулярной основой процесса сокращения является взаимо-
действие двух фибриллярных белков — актина и миозина, харак-
терных для мышечной ткани, где они образуют сложную структуру
актомиозин, свойства которого отличаются от свойств каждого
из составляющих его белков. Обе молекулы реагируют с аденин-
нуклеотидами: актин в его фибриллярной форме реагирует с АДФ,
миозин — с АТФ. Однако, когда эти белки соединяются между
собой с образованием актомиозина, то в присутствии АТФ этот
комплекс подвергается диссоциации на составляющие его белки.
Повторное соединение актина и миозина возможно только после
добавления Са2+; при этом АТФ подвергается гидролизу до АДФ
и неорганического фосфата. Представляется вероятным, что изу-
чение на молекулярном уровне этих процессов, а также подроб-
ное выяснение структуры молекул даст возможность объяснить
механизм мышечного сокращения. Молекулярная модель, которая
в настоящее время наиболее полно соответствует этим критериям,
предусматривает разрывы и восстановление связей между акти-
новыми и миозиновыми нитями. Такие связи разрываются и вос-
станавливаются таким образом, что молекулы скользят друг от-
носительно друга, благодаря нему в сократившейся мышце дости-
гается укорочение зоны расположения продольно ориентированных
нитей (рис. 3-20, Б). С точки зрения энергетики важнейшее значе-
ние имеет тот факт, что АТФ должен подвергаться гидролизу каж-
дый раз в момент разрыва и восстановления связи между этими
двумя белками. Для расщепления АТФ и, следовательно, для
осуществления пусковой фазы сократительного процесса необхо-
димо присутствие Са2+. Поскольку связи, или мостики, которые
обратимо возникают между этими двумя функционирующими
белками, многочисленны, количество АТФ, используемого для
обеспечения такой потребности в механической энергии при сокра-
щении, значительно превосходит то его количество, которое тре-
буется для возвращения к исходному уровню ионных градиентов
в активно функционирующих мышцах.
3. БИОЭНЕРГЕТИКА 161
Можно подсчитать, что при максимальной интенсивности ра-
боты мышцы общий запас АТФ в ней истощается менее чем за се-
кунду. Работа с максимальной интенсивностью может, однако,
продолжаться за счет двух резервных систем макроэргических
фосфатов. Первая из них включает креатинфосфокиназную фер-
ментную систему, которая катализирует реакцию
Креатин-Ф 4- АДФ Креатин + АТФ.
Как и в нервной ткани, эта система способна поддерживать содер-
жание АТФ на постоянном уровне, несмотря на непрерывно про-
должающийся, быстрый гидролиз этого нуклеотида. Содержание
креатинфосфата в мышце в условиях покоя обычно в 5 раз выше
содержания АТФ; поэтому за счет такого источника можно под-
держивать максимальную активность в течение еще нескольких
секунд. По мере того как резерв креатинфосфата истощается, всту-
пает в действие вторая система, катализируемая ферментом аде-
нилаткиназой:
2АДФ^АТФ + АМФ.
При этой реакции используется вторая реакционноспособная фос-
фатная группа для образования из АДФ дополнительных коли-
честв АТФ; эта реакция важна тем, что она служит для повышения
концентрации АМФ в мышечной ткани. Как было отмечено выше,
АМФ выполняет важнейшую функцию сигнализации об истоще-
нии клеточных энергетических ресурсов и действует как мощный
положительный стимул на некоторые ключевые ферменты катабо-
лизма углеводов, ведущего к образованию дополнительных коли-
честв АТФ.
Повышение концентрации АДФ при постоянном гидролизе
АТФ активирует механизм окислительного фосфорилирования,
а также регуляторные ферменты цикла лимонной кислоты и глико-
лиза (рис. 3-20, Б). Таким образом, в период возвращения к исход-
ному состоянию после мышечного сокращения окислительные
реакции и реакции гликолиза будут протекать ускоренно до тех
пор, пока содержание АДФ и АМФ в тканях повышенно. Хотя
мышца уже и закончила работу, процессы катаболизма должны
восполнить недостаток макроэргических соединений, возникший
в ходе предшествующего периода активности. Это состояние часто
называют метаболической задолженностью мышцы; оно отличается
от состояния покоя ускоренным потреблением кислорода, усилен-
ным образованием лактата или сочетанием того и другого. Время,
необходимое для погашения задолженности, может в несколько
раз превосходить длительность периода активной работы. Подобно
многим биологическим системам, сократительный аппарат мышц
отрегулирован и подготовлен к функционированию на пределе
152 3. БИОЭНЕРГЕТИКА
своих возможностей в течение таких периодов времени, которые
превосходят имеющиеся резервы, но в конечном счете образовав-
шаяся задолженность должна быть погашена.
Рекомендуемая
литература
Abood L. G., Excitation and Conduction in Neuron. In: Albers R. W., Siegel G. J,
Katzman R., Agranoff B. W. (eds.), Basic Neurochemistry, Little, Brown
and Company, Boston, 1972, pp. 41—65.
Christensen H. N., Biological Transport, CA, Benjamin, Menlo Park, 1974.
Cohen C., The Protein Switch of Muscle Contraction, Sci. Am., 233, (5), 36—45
(1975).
Dahl J. Hokin L. E., Sodium-Potassium Adenosinetriphosphatase, Ann. Rev.
Biochem., 43, 327—356 (1974).
Dawson A. P., Selwyn M. J.t Mitochondrial Oxidative Phosphorylation. In: Bull
A. T., Lagnado J. R., Thomas J. O., Tipton K. F. (eds.), Companion to Bio-
chemistry, Longman, London, 1974, pp. 553—586.
Estrada 0. S. (ed.), Ion Transport and Transformation of Energy in Mitochondria,
PAABS Rev., 4, 407—447 (1975).
Glynn I. M., Karlish S. J. D., The Sodium Pump, Ann. Rev. Physiol., 37, 13—55
(1975).
Lehninger A. L., Bioenergetics, CA, Benjamin, Menlo Park, 1972.
Lemberg R., Barrett J., Cytochromes, Academic Press, New York, 1973.
MacLennan D. H., Holland P. C., Calcium Transport in Sarcoplasmic Reticulum,
Ann. Rev. Biophys. Bioeng., 4, 377—404 (1975).
Margaria R., The Sources of Muscular Energy, Sci. Am., 226, (3), 84—91 (1972).
Martonosi A., Biochemical and Clinical Aspects of Sarcoplasmic Reticulum Fun-
ction, Curr. Top. Memb. Transp., 3, 84—197 (1972).
Morkin E., LaRaia P. J., Biochemical Studies on the Regulation of Myocardial
Contractility, New Engl. J. Med., 290, 445—451 (1974).
Munn E. A., The Structure of Mitochondria, Academic Press, London, 1974.
Murray J. M., Weber A., The Cooperative Action of Muscle Proteins, Sci. Am.,
230, (2), 59—69 (1974).
Rocker E.t Inner Mitochondrial Membranes: Basic and Applied Aspects, Hosp.
Pract., 9, (2), 87—93 (1974).
Sokoloff L., Circulation and Energy Metabolism of the Brain. In: Albers R. W.,
Siegel G. J., Katzman R., Agranoff B. W. (eds.), Basic Neurochemistry, Little,
Brown, Boston, 1972, pp. 299—325.
Squire J. M.t Muscle Filament Structure and Muscle Contraction, Ann. Rev. Bio-
phys. Bioeng., 4, 137—163 (1975).
Tandler B,t Hoppel C. L., Mitochondria, Academic Press, New York, 1972.
Taylor E. W., Chemistry of Muscle Contraction, Ann. Rev. Biochem., 41, 577—
616 (1972).
Wainio W. W.t The Mammalian Respiratory Chain, Academic Press, New York, 1970,
Wilson D. F.t Dutton P. L., Wagner M.t Energy-Transducing Components in Mi-
tochondrial Respiration, In: Sanadi D. R., Packer L. (eds.), Current Topics
in Bioenergetics, Academic Press, New York, vol. 6, 1973, pp. 234—265.
Wilson D. F., Erecinska M., Dutton P. L., Thermodynamic relationship in Mi-
tochondrial Oxidative Phosphorylation, Ann. Rev. Biophys. Bioeng., 3, 203—
230 (1974),
4 УГЛЕВОДЫ
К углеводам относятся сахара и их производные; их общая
химическая формула представляет собой сочетание углерода и
воды [С(Н2О)1П, что видно из самого названия. Из числа сахаров
в организме человека преобладает гексоза (п=6) глюкоза', важны,
однако, и другие гексозы (например, галактоза и фруктоза), а
также некоторые пентозы (п=5) — рибоза и дезоксири-
боза (рис. 4-1). Триозы (п=3), тетрозы (п=4) и гептозы (п=7)
количественно представляют собой минорные компоненты, но как
промежуточные продукты метаболических реакций они играют
ключевую роль.
Сахара, не соединенные с другими сахарами, называют моно-
сахаридами (рис. 4-1, Б). Когда два сахара связаны между собой,
как, например, в молочном сахаре лактозе, которая содержит глю-
козу, соединенную с галактозой, образующееся соединение назы-
вают дисахаридом (рис. 4-1, В). Из большого числа моносахаридов,
соединенных по принципу «голова к хвосту» с образованием цепи,
возникают полисахариды (рис. 4-1, Г). Последние в организме со-
ставляют важный резерв углеводов в виде гликогена, который пред-
ставляет собой высокомолекулярный полимер, образованный из
молекул глюкозы.
УГЛЕВОДЫ ПИЩИ
Углеводы, потребляемые с обычными природными пищевыми
продуктами, представлены главным образом крахмалом — резерв-
ным полисахаридом растений, который по своей структуре подобен
гликогену. Тростниковый сахар, или сахароза,— дисахарид, со-
стоящий из глюкозы и другой гексозы — фруктозы (рис. 4-1, В),—
преобладает в рационе «цивилизованного» общества; лактоза яв-
ляется важным компонентом молочных продуктов. Небольшие
количества свободных гексоз (глюкозы и фруктозы) содержатся
в меде и фруктах.
Организм человека не нуждается в определенных углеводах,
но в сбалансированной диете примерно 50% энергетических по-
требностей организма должны быть удовлетворены за счет углево-
дов. Единственным производным углеводов, которое должно быть
н н н он н н
I I I I I I
н-с-с-с-с-с-с
он он он н он о
(а) Прямая цепь
н н н он н н
I I I I I I
Н-С-С-С-С-С-С-ОН
1 I 1 1 1 I
ОН I ОН Н ОН I
(б) Пиранозное кольцо
®CHtOH
(в) Способ Ха у орта (г) Упрощенный способ
СН2ОН СН2ОН СН:ОН
a-Глюкоза р-Глюкоза
СН2ОН СН2ОН СН2ОН СН2ОН
a-Галактоза
Фруктоза
рибоза ^-Дезоксирибоза
Гексозы
Пентозы
в.
СН2ОН СН2ОН СН2ОН СН2ОН
(а-Глюкоза) (а-Глюкоза) (fi-Галактоза) (а-Глюкоза)
Мальтоза Лактоза
(а-Глюкоза) (р-Фруктоза)
Сахароза
Г.
СН2ОН СН2ОН СН2ОН
Р 1-4 -связи
Целлюлоза
а УА-СВЯЗи
Крахмал
или гликоген
Риг 4-1. Нркотопые важнейшие углеводы.
А. Глюкозу изображают четырьмя способами: а — в виде соединения с прямой цепью углеродных атомов, имеющего свободную альдегидную груп-
пу в положении 1; б — в виде пиранозной циклической структуры, образующейся при замыкании полуацетальной связи между-альдегидной груп-
пой в положении 1 и гидроксилом в положении 5; в — по способу Хауорта, который представляет пиранозное кольцо в виде плоского шестиуголь-
ника с замещающими группами, ориентированными по обе стороны от плоскости кольца; г — упрощенным способом, использованным в этой кни-
ге, при котором указывают лишь — ОН группы, присоединенные к кольцу (атомы Н не указывают). Б. Структуры важнейших моносахаридов
изображены упрощенным способом; гидроксильная группа в положении I может быть ориентирована от плоскости кольца вниз (а) или вверх
(0). В. Дисахариды изображены с а-или 0-связями в молекулах в зависимости от расположения заместителей у участвующего в образовании
связи углеродного атома в положении 1. Г. В полисахаридах могут быть а- или 0 -связи.
166 4- УГЛЕВОДЫ
представлено в диете обязательно, является аскорбиновая кислота,
или витамин С. Фактически все представители животного мира
способны синтезировать это шестиуглеродное соединение путем
трех ферментативных превращений глюкозы. Однако у человека,
а также у других приматов и у морской свинки в организме отсут-
ствует один из ферментов, участвующих в этой цепи реакций об-
мена. Это явление представляет собой особый тип врожденного
нарушения обмена веществ, которое возникло в результате мута-
ции в ходе эволюции приматов. Другие важные углеводы, такие,
как галактоза и пентозы, синтезируются в организме, и их поступ-
ление с пищей необязательно.
В общей популяции встречаются отдельные индивидуумы, орга-
низм которых не способен использовать фруктозу, содержащуюся
в пище. В таких случаях повышено содержание фруктозы в моче,
что приводит иногда к ошибочному диагнозу диабета; однако такая
фруктозурия не относится к серьезной патологии и важного кли-
нического значения не имеет. К более тяжелым последствиям ведет
непереносимость галактозы, встречающаяся у детей с врожденным
нарушением обмена, известным как галактоземия. Следствием та-
кого нарушения обмена являются умственная отсталость и разви-
тие катаракты, что удается предотвратить, исключив из диеты
молоко и другие источники галактозы. Помимо этих исключитель-
ных случаев, существует лишь небольшое число ограничений,
касающихся потребления углеводов с пищей.
ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ
В желудочно-кишечном тракте в значительной мере всасываются
только моносахариды. Такие дисахариды, как сахароза, расщеп-
ляются в тонком кишечнике специфическими гидролазами — фер-
ментами, которые катализируют присоединение элементов воды
к дисахаридным связям, расщепляя их с образованием моносаха-
ридов, входивших в состав дисахарида. Такие полисахариды, как
крахмал из растительных объектов и гликоген животных тканей,
расщепляются под влиянием гидролаз другой группы, называемых
амилазами, которые специфически разрывают связи в этих поли-
мерах с длинными цепями углеродных атомов в молеку-
лах (рис. 4-2). Амилазы образуются как в слюнных железах, так и
в поджелудочной железе, обеспечивая, таким образом, непрерыв-
ный и полный гидролиз полисахаридов во время прохождения пищи
по кишечнику. Структурный полисахарид растений целлю-
лоза (рис. 4-1, Г) имеет иную конфигурацию связей между моно-
мерами глюкозы и не расщепляется амилазами. Таким образом,
целлюлоза не может служить пищевым источником углеводов для
человека, но она играет роль полутвердого носителя, или напол-
нителя, в содержимом кишечника. Амилазы атакуют молекулы
4. УГЛЕВОДЫ 167
(2)Переваривание
в кишечнике
Лактоза
’-ц
о о '
Портальный
кровоток
Клетка эпителия -----
кишечника
Галактоза •
AfaLojoO Глюкоза О
°0°
о°
о »
Фруктоза Э
::°э
о о
Мальтоза
/
О О
О о
Фекалии
Рис. 4-2. Переваривание и всасывание углеводов.
/. Частичное переваривание полиеахаридов (крахмала или гликогена) происходит в полости
рта под влиянием амилазы слюны. 2 Этот процесс завершается в кишечнике под влиянием
амилазы поджелудочной железы 3 Гидролазы дисахаридов, секретируемые слизистой обо-
лочкой кишечника, расщепляют мальтозу, лактозу и сахарозу; образующиеся моносахариды
всасываются через эпителий слизистой в портальный кровоток
крахмала и гликогена в разных местах вдоль цепей, расщепляя их
на более короткие фрагменты, до тех пор пока не остается только
состоящий из двух остатков глюкозы дисахарид, называемый
мальтозой (рис. 4-1, В). Молекулы мальтозы расщепляются с об-
168 4 УГЛЕВОДЫ
разованием свободной глюкозы под влиянием специфической гид-
ролазы мальтозы. которая содержимся в кишечном соке, выделяе-
мом клетками эпителия кишечника.
Моносахариды галактоза, глюкоза, фруктоза и пентоза, попа-
дающие в организм с пищей или освобождаемые при переваривании
других сахаридов, всасываются микроворсинками эпителия тонкого
кишечника. Различия в скорости всасывания обусловлены раз-
личиями в механизмах переноса этих сахаров сквозь мембраны
клеток желудочно-кишечного тракта. Так, всасывание глюкозы и
галактозы возможно, даже если их концентрация в клетках эпи-
телия выше, чем в содержимом кишечника (т. е. против градиента
концентраций). Таково характерное свойство живых клеток —
способность к активному транспорту', для совершения соответст-
вующей осмотической работы требуется затрата энергии. Всасы-
вание небольших количеств дисахаридов сахарозы и лактозы —
возможно при наличии значительного их избытка в пищевых про-
дуктах. Однако эти дисахариды не могут быть использованы в ор-
ганизме и выводятся с мочой в неизменном виде.
ПЕЧЕНЬ
Паренхиматозные клетки печени служат главным местом био-
химических превращений углеводов пищи и оказывают на их об-
мен регуляторное воздействие (рис. 4-3). Всасываясь, сахара по-
падают из клеток эпителия кишечника в кровеносные капилляры,
впадающие в воротную вену; по ней моносахариды пищи поступают
непосредственно в печень. Здесь сахара быстро поглощаются па-
ренхиматозными клетками, где происходит превращение фруктозы
и галактозы в глюкозу. Таким образом, глюкоза представляет
«обой главное соединение углеводной природы, поступающее в об-
щий кровоток после прохождения сахаров через печень. Одной из
важнейших функций печени в процессах обмена веществ является
ее участие в поддержании постоянного уровня глюкозы в крови
(глюкостатическая функция): глюкоза, поступающая в избытке,
превращается здесь в резервную, пригодную для хранения форму,
с тем чтобы снова обратить эти запасы в глюкозу в период, когда
пища поступает в ограниченном количестве.
Энергетические потребности самой печени, как и других тканей
организма, удовлетворяются за счет внутриклеточного катабо-
лизма поступающей глюкозы. В катаболизме глюкозы участвуют
два различных процесса: 1) гликолитический путь превращения
1 моль глюкозы в 2 моль лактата с образованием 2 моль АТФ и
2) фосфоглюконатный путь превращения 1 моль глюкозы в 6 моль
СО2 с образованием 12 моль НАДФ-Н. Оба процесса протекают
в анаэробных условиях, обе ферментные системы содержатся в раст-
воримой части цитоплазмы, и оба пути требуют предварительного
4. УГЛЕВОДЫ 169
Рис. 4-3. Роль печени в обмене углеводов.
фосфорилирования глюкозы до глюкозо-6-фосфата при участии
АТФ-зависимого фермента глюкокиназы. Этим, однако, сходство
исчерпывается. Если гликолиз обеспечивает энергией клеточные
реакции фосфорилирования, синтез белка и другие процессы, тре-
бующие АТФ, то фосфоглюконатный путь служит главным источ-
ником энергии восстановления для биосантетических реакций,
таких, как этапы синтеза жирных кислот и стероидов, требующие
участия НАДФ-Н. В ходе превращений, протекающих по фосфо-
глюконатному пути, молекула глюкозы в анаэробных условиях
полностью распадается до СО2, но в ходе гликолиза происходит лишь
частичный катаболизм глюкозы до трехуглеродных фрагментов;
для полного окисления последних необходимо присутствие кисло-
рода и участие митохондрий. При эробных условиях благодаря
сочетанным действиям гликолиза в цитоплазме и цикла лимонной
кислоты с окислительным фосфорилированием в митохондриях
достигается максимальный выход 38 моль АТФ на 1 моль глюкозы.
Различны также промежуточные продукты, образующиеся при
реакциях этих двух путей превращения глюкозы. При превраще-
нии по фосфоглюконатному пути в качестве промежуточных про-
дуктов образуются пентозы, которые могут быть частично исполь-
зованы для удовлетворения потребностей клетки в рибозе при син-
170 4 УГЛЕВОДЫ
тезе нуклеотидов и нуклеиновых кислот. Промежуточные продукты
превращения по гликолитическому пути — фосфотриозы — могут
быть использованы путем их восстановления для образования
а-глицерофосфата при синтезе жиров. При гликолизе образуется
также пируват, который может быть использован для синтеза ала-
нина, аспартата и различных иных соединений (через образование
оксалоацетата), а также для синтеза множества других компонен-
тов клетки, образующихся из ацетил-КоА. Хотя реакции фосфо-
глюконатного пути у фотосинтезирующих организмов и могут быть
использованы для образования глюкозы, в тканях млекопитающих
этот процесс практически необратим и протекает лишь в направ-
лении распада глюкозы. В противоположность этому реакции гли-
колиза могут протекать и в обратном направлении, благодаря чему
происходит синтез глюкозы путем глюконеогенеза. В печени прибли-
зительно одна треть глюкозы окисляется по фосфоглюконатному
пути, а остальные две трети используются в ходе гликолитических
реакций.
гликолиз
В общих чертах (рис. 4-4) процесс гликолиза представляют как
цепь реакций, включавшую изомеризацию глюкозо-6-фосфата до
кетогексозы фруктозо-6-фосфата и фосфорилирование последнего
при участии специфической киназы — фосфофруктокиназы. Обра-
зующийся шестиуглеродный сахар с фосфатными группами, при-
соединенными эфирными связями к каждому из концов углеродной
цепи, называется фруктозо-1,6-дифосфатом. Эта молекула расщеп-
ляется на две симметричные половины, образуя 2 молекулы триозо-
фосфата, которые в результате обратимой изомеризации становятся
взаимозаменяемыми в реакциях обмена веществ. Катализируемая
триозофосфатдегидрогеназой окислительная реакция гликолиза
обеспечивает перенос восстановительных эквивалентов от молекулы
триозы на НАД+ с образованием НАД-Н. Освобождаемая при
этом окислительном процессе энергия резервируется в результате
перехода неорганического фосфата в весьма реакционноспособный
ацил-фосфат в молекуле продукта реакции 1,3-дифосфоглицерата.
Последнее соединение передает эту фосфатную группу на АДФ
с образованием АТФ и 3-фосфоглицерата. После переноса этой
фосфатной группы в положение 2 образующийся продукт реакции
дегидратируется под влиянием фермента енолазы с образованием
второго богатого энергией промежуточного продукта гликолиза —
фосфенолпирувата. Последний отдает свой фосфат на АДФ, об-
разуя АТФ и пируват. Таким образом, каждая из двух молекул
триозы, которые образуются при расщеплении одной молекулы
гексозы, обеспечивает образование двух молекул АТФ; при гликолизе
1 моль глюкозы образуется 4 моль АТФ. Поскольку 2 моль АТФ
Н Н ОН н н
I I I I I
но-сн2-с-с-с-с-с
I I I I II
он онноно
Глюкоза
адф
н н он н н
I I I I I
®-О-СН2-С-С-С-С-С
I I I I II
онон н он о
Гпюкозо-6-Ф
н н ОН
_ । । ।
®-о-сн2-с-с-с-с-сн2он Фруктозо-6-Ф
онон н о
АДФ
Н НОН
®-0-CH2-c-t-t-c-CH20 ® Фруктозо-1,б-диФ
ононн о
н н
л ", II
2-Триозо-Ф ®-о-сн2-с-с
I II
он о
ГлицералъЪегиЪ-З-Ф
НО-СН2-С-СН2О®
II
о
Диоксиацетон-Ф
р->2НАД"
н о ।
®-O-CH2-C-C-O® 1 &диФ-глицерап[
Н О
~ 1 11
®-О-СН2-С-С-ОН
I 1°н
з-Ф-Глицерат
|2 НАД-н!
2 НАД
т ТН О
I II
но-сн2-с-с-он
. р®
1 1 о
v ▼ II
СН2=С-С-ОН
о®
2-Ф-Глицерат
ф-енолпируват
2 АДФ
I и
ЛалтаотСНз-с-с-0Н
I
он
X , /и М2 atm
v т 11 ч_/
СН3-С-С-ОН Пируват
о
2<ь
Рис. 4-4. Гликолиз.
При расщеплении гексозы образуются 2 молекулы триозы; поэтому все этапы, протекающие
после образования триоз, удвоены (двойные стрелки). НАД*Н в анаэробных условиях пов-
торно используется для восстановления пирувата. Суммарная реакция выражена уравнением:
1. Глюкоза+2АДФ+2Ф -> 2 Лактат+2 АТФ.
178 4. УГЛЕВОДЫ
необходимы для превращения глюкозы в фруктозе-1,6-дифосфат,
общий энергетический выход гликолиза составляет 2 моль АТФ
на 1 моль потребленной глюкозы.
Ход этой происходящей при гликолизе окислительной реакции
зависит от превращения НАД+ в НАД Н, и поэтому требуется
участие механизма регенерирования НАД+ из образуемого таким
путем НАД-Н. В отсутствие кислорода этот процесс осуществляет
лактатдегидрогеназа, которая принимает атомы водорода от НАД- Н
и переносит их на пируват, образуемый в качестве конечного про-
дукта цепи реакций, протекающих после этапа образования три-
озофосфата. При этом образуются НАД+, который может быть
вновь использован при окислительной реакции, катализируемой
триозофосфатдегидрогеназой, и лактат, представляющий собой ко-
нечный продукт анаэробного гликолиза. Поскольку окислительно-
восстановительные реакции, катализируемые триозофосфатдегидро-
геназой и лактатдегидрогеназой, сопрягаются друг с другом, об-
разуя внутренне компенсированную систему, в паре НАД+—
НАД-Н в конечном счете изменений не происходит.
В некотором смысле процесс гликолиза по своей сути является
межмолекулярным окислением полигидроксильной молекулы гек-
созы, при котором один конечный продукт (лактат) становится
более окисленным (—СООН), а другой конечный продукт стано-
вится более восстановленным (—СН3). При аэробном гликолизе
образуется значительно меньше лактата; в присутствии О2 большая
часть пирувата превращается не в лактат, а в ацетил-КоА, а большая
часть НАД-Н окисляется цепью переноса электронов.
ГЛЮКОНЕОГЕНЕЗ
Процесс, обратный гликолизу, глюконеогенез, имеет особенно
важное значение в печени, которая представляет собой главный из
органов, участвующих в образовании глюкозы из углеводных и
неуглеводных исходных продуктов. Хотя энергетические сдвиги
при большинстве реакций гликолиза достаточно малы, так что
они могут протекать и в обратном направлении, имеются три ката-
лизируемых ферментами этапа, которые протекают в направлении
синтеза глюкозы в столь малой степени, что могут рассматриваться
как фактически необратимые процессы (рис. 4-5). Ферментами,
катализирующими эти реакции, являются: (а) глюкокиназа (глю-
коза -* глюкозо-6-фосфат); (б) фосфофруктокиназа (фруктозо-6-фос-
фат -> фруктозо-1,6-дифосфат) и (в) пируваткиназа (фосфоенолпи-
руват -* пируват).
Специальные ферменты глюконеогенеза обеспечивают обход
этих барьеров на пути, обратном гликолизу. Барьеры, создаваемые
двумя первыми киназами, преодолеваются просто благодаря на-
личию двух специфических фосфогидролаз: (а') глюкозо-6-фосфа-
4. УГЛЕВОДЫ 173
тазы, (глюкозо-6-фосфат -> глюкоза) и (Ь') фруктоза-1 ,6-дифосфа-
тазы (фруктозо-1,6-дифосфат-> фруктозо-6-фосфат). Важно отме-
тить, что эти фосфатазы не ускоряют реакций, обратных реакциям,
которые катализируют соответствующие киназы, что обозначало бы
осуществление термодинамически невероятного ресинтеза АТФ и
Гликолиз
глюконеогенез
Глюкоза
(а) ЛГФк I
(Глюкокиназа) *1 | (Глюкозо~6?Фаза)
Глюкозо-6-Ф
Фруктозо-6-Ф
<6) /1ТФх I Ф”
(Ф-Фруктокиназа) К (Фруктозе- 1fi-Ъи Фаза)
Фруктозо-1,6-()иФ
2-Триозо-Ф
Ди-Ф-Глицерат
fe") (Ф'Енолпируват-
карбоксикиназа)
Оксалоацетат
2ГТФ
Ф-Енолпируват
(Пируваткиназа) J I
2АТФ
Аланин
2АТФ
N4 I X V- (Tluput
Лактат [2НАД-Н\ кар&»
(в')
jeam-
юксилаза)
Рис. 4-5. Глюконеогенез.
Показаны три необратимые реакции гликолиза (а), (б) и (в), а также реакции глюконео!енеза
(af), (б'), (Г) и (в**), которые идут в обход необратимых этапов.
174 УГЛЕВОДЫ
АДФ. Фосфатазы катализируют гидролитические реакции, в кото-
рых присоединение HSO ведет к освобождению неорганического
фосфата, а энергия фосфоэфирной связи высвобождается в виде
тепловой энергии.
Преодоление барьера на пируваткиназном уровне требует более
напряженной работы процессов обмена веществ и осуществляется
при участии двух ферментов: (Ь') пируваткарбоксилазы (пируват 4-
+ СОа -> оксалоацетат) и (Ь") фосфоенолпируваткарбоксикиназы
(оксалоацетат -> фосфоенолпируват 4- СО2). Обе реакции тре-
буют затраты энергии; первая, как было отмечено выше, сопровож-
дается гидролизом АТФ до АДФ, тогда как вторая обеспечивается
дефосфорилированием ГТФ до ГДФ (последний может быть вновь
превращен в ГТФ за счет АТФ). Поскольку для обеспечения этапа
превращения 3-фосфоглицерата в 1,3-дифосфоглицерат (обратимый
процесс) необходим третий моль АТФ, общий расход энергии на
синтез глюкозы из 2 моль пирувата составит шесть эквивалентов
макроэргического фосфата. Кроме того, для обеспечения обрати-
мости триозофосфатдегидрогеназного этапа необходима восстано-
вительная энергия в виде НАД-Н.
Таким образом, стехиометрические соотношения при глюко-
неогенезе из пирувата (или из таких его предшественников, как
аланин) будут следующими:
2 Пируват4-2НАД-Н+6АТФ—► 1 Глюкоза4-2НАД+ 4-
4-6АДФ4-6Фн-
Суммарное уравнение реакции глюконеогенеза из оксалоаце-
тата (который может образоваться, например, при катаболизме
таких аминокислот, как аспартат, глутамат и других) будет таким:
2 Оксалоацетат 4- 2 НАД • Н 4- 4АТФ —► 1Глюкоза 4- 2СО2 4-
4- 2НАД+ 4- ЗАДФ 4- 4ФН.
Заметим, что в данном случае необходимы лишь 4 моль АТФ,
поскольку один из энергозависимых этапов в этом процессе не
участвует.
Другим чрезвычайно важным исходным материалом для про-
цесса глюконеогенеза в печени является лактат, который обра-
зуется в других тканях (таких, как мышцы), а затем током крови
переносится в печень В этом случае потребности в восстановитель-
ной энергии для обращения триозофосфатдегидрогеназной реакции
будут обеспечены сопряжением ее с реакцией, обратной лактатде-
гидрогеназной реакции; эти два фермента составляют внутренне
компенсированную систему как при анаэробном гликолизе:
2 Лактат4-6АТФ—♦ 1 Глюкоза4-6АДФ4-6Фн.
Возможное объяснение синдрома внезапной смерти, или так
называемой «смерти в колыбели» (довольно часто наблюдаемого
4. УГЛЕВОДЫ 175
в США), заключается в том, что в печени таких детей обнаружи-
вается, как было показано в самых последних предварительных
исследованиях, недостаточность фермента фосфоенолпируваткар-
боксикиназы. По-видимому, нарушение способности поддерживать
постоянным уровень сахара в крови за счет глюконеогенеза в пе-
чени в промежутках между кормлениями может лежать в основе
этих ранее не поддававшихся объяснению случаев внезапной
смерти внешне здоровых детей.
РЕГУЛЯЦИЯ ГЛИКОЛИЗА
И ГЛЮКОНЕОГЕНЕЗА
Соотношение между процессами катаболизма и анаболизма
глюкозы в клетках печени находится под контролем целого ряда
факторов регуляции, включая концентрацию метаболитов, нук-
леотидов, а также воздействие гормонов (рис. 4-6) Следует отме-
тить, что клетки печени, а также (хотя и в меньшей мере) клетки
почек и слизистой оболочки кишечника уникальны в том отноше-
нии, что они содержат полный набор ферментов, необходимых для
обращения процесса гликолиза. Другие ткани обладают регуля-
торными факторами, которые участвуют только в процессах «вклю-
чения» или «выключения» гликолиза, в соответствии с их собствен-
ными потребностями в энергии. Клетки печени, напротив, несут
большую ответственность за клетки других органов; они «чувст-
вуют» возникновение потребности в глюкозе и вне печени, включая
соответственно реакции глюконеогенеза. Более того, эта регулятор-
ная система должна также обеспечивать «выключение» катаболи-
ческих реакций гликолиза в то время, когда происходит процесс
глюконеогенеза во избежание возникновения в клетке бесполез-
ного рассеивающего энергию цикла:
Глюкоза —>• 2 Лактат + 2 АТФ.
2 Лактат + 6 АТФ —♦ Глюкоза.
Внутриклеточные регуляторы
Субстраты и промежуточные продукты метаболических реак-
ций играют важную роль в регуляции соотношения между глико-
лизом и глюконеогенезом. Как и при регуляции цикла лимонной
кислоты, концентрация оксалоацетата ограничивает скорость про-
цесса глюконеогенеза в целом. Чтобы создать эффективный источ-
ник субстрата для образования фосфоенолпирувата, концент-
рация оксалоацетата должна быть выше необходимой для цикла.
Источниками образования оксалоацетата, помимо карбоксилиро-
вания пирувата, являются главным образом процессы катабо-
лизма белков и дезаминирования свободных аминокислот с обра-
176 4. УГЛЕВОДЫ
Рис. 4-6. Регуляция гликолиза и глюконеогенеза в печени.
Отрицательные модификаторы представлены заключенными в кружок знаками минус; стрел-
кой указана реакция, которая ингибируется или репрессируется. Положительные модифи-
каторы обозначены заключенными в кружок знаками плюс; стрелка указывает реакцию, ко-
торая стимулируется или индуцируется.
зованием таких кетокислот, как оксалоацетат и а-кетоглутарат.
Следовательно, любые физиологические факторы, которые стиму-
лируют распад белков в тканях, предотвращают их биосинтез из
4. УГЛЕВОДЫ 177
аминокислот или усиливают активность аминотрансфераз и других
ферментов, катализирующих превращение аспартата и глутамата
в соответствующие кетокислоты, будут косвенно способствовать
глюконеогенезу, обеспечивая дополнительное количество субстрата.
Важную роль играет также аминокислота аланин, поскольку
при дезаминировании аланина образуется пируват; аланин яв-
ляется отрицательным аллостерическим модификатором пируват-
киназы, обеспечивая таким образом источник углерода для глюко-
неогенеза и предотвращая возникновение бесполезного цикла
Пируват + АТФ + ГТФ —► Фосфоенолпируват
Фосфоенолпируват—> Пируват + АТФ.
Как было отмечено выше, цитрат действует как функционирую-
щий по принципу отрицательной обратной связи модификатор,
ингибирующий фосфофруктокиназу и блокирующий гликолиз на
начальном этапе. Таким образом, если в печени в результате деза-
минирования аминокислот накапливаются в избытке промежуточ-
ные продукты реакций цикла Кребса, это ведет к подавлению гли-
колиза и стимуляции синтеза глюкозы.
Образование избытка ацетил-КоА также способствует глюко-
неогенезу, поскольку в действии пируваткиназы в качестве поло-
жительного модификатора участвует ацетил-КоА. Подобно ала-
нину, ацетил-КоА также подавляет активность пируваткиназы.
Интересно, что, хотя алкильные боковые цепи жиров не слу-
жат источником углерода для синтеза углеводов, высшие жирные
кислоты ускоряют глюконеогенез, действуя в качестве аллостери-
ческих модификаторов. Таким образом, физиологические факторы
и гормональные агенты, которые стимулируют распад жиров до
свободных жирных кислот или подавляют процессы потребления
жирных кислот тканями, служат одновременно стимуляторами
синтеза глюкозы в печени. Главной точкой приложения этого сти-
мулирующего воздействия является фермент глюконеогенеза —
фруктозодифосфатаза — активность которого возрастает во
много раз при связывании со свободными жирными кислотами.
Одновременно жирные кислоты подавляют активность пируватки-
назы и фосфофруктокиназы, благодаря чему достигается блокиро-
вание гликолиза на время осуществления глюконеогенеза.
Фруктозо-1,6-дифосфат оказывает регуляторное воздействие
уникального характера на фермент пируваткиназу. Этот фермент
при нормальных условиях находится в печени в маскированном
состоянии; для его действия требуется в качестве положитель-
ного аллостерического модификатора фруктозодифосфат. Этот факт
представляет собой пример того, как промежуточный продукт
одной из первых реакций в цепи гликолитического процесса дейст-
вует в качестве агента, функционирующего по принципу положи-
тельной прямой связи, не только предотвращающего избыточное
178 УГЛЕВОДЫ
накопление данного продукта, но также обеспечивающего ускоре-
ние его собственного катаболизма в дальнейшем
Другим примером тонкой регуляции посредством взаимодейст-
вия противоположно направленных факторов служит контроли-
рующий эффект, осуществляемый в клетке путем энергетических
сдвигов, находящих отражение в соотношениях адениловых нук-
леотидов. При низком энергетическом уровне в клетках печени,
т. е. при низких концентрациях АТФ и высоких концентрациях
АМФ и АДФ, процесс гликолиза «включен», а глюконеогенез «вы-
ключен». В противоположной ситуации обеспечен ход процесса
синтеза глюкозы при избытке энергии в клетке, на что указывают
высокая концентрация АТФ и низкие концентрации АМФ и АДФ.
Помимо того очевидного факта, что глюконеогенез требует энергии
в виде АТФ, следует учитывать и другие, более тонкие регулятор-
ные воздействия адениловых нуклеотидов, которые в сочетании
друг с другом действуют как аллостерические модификаторы. Глав-
ным заслоном на пути глюконеогенеза является фруктозодифосфа-
тазная реакция, которая при связывании ферментом АМФ, пред-
ставляющим собой в этой системе отрицательный аллостерический
модификатор, оказывается «выключенной». Таким образом, когда
запасы энергии в клетке находятся на низком уровне, весь фрукто-
зодифосфат, образуемый путем фосфофруктокиназной реакции,
направляется на выработку АТФ в процессе гликолиза; при этом
наличие АМФ предотвращает возникновение непроизводительно
расходующего энергию цикла
Фруктозо-6-фосфат+АТФ —► Фруктозодифосфат
Фруктозодифосфат —* Фруктозо-6-фосфат + Фн.
Кроме того, повышение концентрации АМФ и АДФ активируют
фосфофруктокиназу, тогда как повышение концентрации АТФ
подавляет активность как фосфофруктокиназы, так и пируватки-
назы. Таким образом, сниженный энергетический уровень «выклю-
чает» глюконеогенез, «включая» одновременно гликолиз за счет
воздействия АМФ и АДФ на уровне взаимопревращений в системе
фруктозо-6-фосфат — фруктозодифосфат; повышенный энергетиче-
ский заряд, с другой стороны, создает движущую силу, обеспечи-
вающую ход глюконеогенеза при одновременном «выключении»
киназных реакций, которые присущи гликолизу.
Внеклеточные регуляторы
На те внутриклеточные регуляторные факторы, которые имеют
отношение в первую очередь к возможностям и потребностям самой
печени, накладывается действие внеклеточных факторов, сигна-
лизирующих о нуждах организма как целого. К числу таких вне-
клеточных факторов относится наличие субстрата в кровотоке.
4. УГЛЕВОДЫ 179
Во время напряженной работы мышц, например когда лактат об-
разуется в таком избытке, что митохондрии мышц не справляются
с окислением пирувата и НАД-Н, анаэробный гликолиз преоб-
ладает над аэробным катаболизмом через цикл лимонной кислоты
и цепь переноса электронов. Накапливающийся в избытке лактат
диффундирует в кровоток и, достигая печени, служит источником
углерода при глюконеогенезе. Образуемая при этом глюкоза посту-
пает в кровоток, а затем вновь в работающие мышцы, осуществляя
тем самым так называемый цикл Kopw.
Мышцы: Глюкоза—► 2 Лактат (+2 АТФ),
Печень: 2 Лактат —> Глюкоза (—6 АТФ).
В этом случае кровь функционирует как переносчик метаболитов.
Иными словами, мышца может добыть два АТФ для механической
сократительной работы за счет шести АТФ печени. К числу иных,
но сходных способов получения субстратов для глюконеогенеза
относятся использование внепеченочных источников свободных
аминокислот, которые образуются при катаболизме белков мышц
и других тканей, и мобилизация запасов жиров из тканевых депо,
что может обеспечить повышение концентрации в печени свободных
жирных кислот, действующих как источник энергии для глюко-
неогенеза, а также в качестве модуляторов участвующих в этих
процессах ферментов.
Другим внепеченочным фактором, регулирующим соотношение
между образованием и потреблением глюкозы в печени, является
сама по себе концентрация глюкозы в крови. Во-первых, следует
отметить, что в отличие от большинства клеток нашего тела клетки
печени лишены какой-либо системы переноса, ускоряющей захват
глюкозы. Поэтому глюкоза поступает в клетки печени просто в ре-
зультате пассивной диффузии, и внутриклеточная концентрация
глюкозы в печени соответствует ее концентрации в крови. Очевидно,
что в «период изобилия», например после приема богатой углево-
дами пищи, повышение концентрации глюкозы в крови будет сти-
мулировать гликолиз в печени, обеспечивая повышенный уровень
внутриклеточного субстрата; наоборот, в период голодания низкая
внеклеточная концентрация глюкозы будет усиливать диффузию
в кровоток внутриклеточной глюкозы, синтезированной в процессе
глюконеогенеза. Второй особенностью, делающей печень особенно
чувствительной к изменению концентрации глюкозы в крови,
является наличие уникального фермента глюкокиназы. Хотя дру-
гие ткани обладают неспецифическими гексокиназами с очень
низкими величинами для глюкозы (10"6 до 10"5 М), фермент
печени весьма специфичен и имеет относительно высокую для
глюкозы ^м=2х10"2 Л4). Поскольку эта величина соответствует
концентрации 360 мг на 100 мл (тогда как в норме натощак содержа-
ние глюкозы в крови примерно равно 90 мг на 100 мл), мы можем
180 УГЛЕВОДЫ
легко подсчитать, используя уравнение Михаэлиса — Ментен, что
глюкокиназа печени здорового человека натощак «работает не на
полную мощность»:
.. hnaxtS]
Km+IS] •
Отсюда
°_____________________[$]_______90____90 __on oz
Утах “ Км+ [S] “ 360+ 90 “ 450 “ •
Когда концентрация глюкозы в крови удваивается, например
после приема богатой углеводами пищи, v/Vmax заметно возрастает,
достигая 33% предельной мощности, тогда как снижение нормаль-
ного уровня в 2 раза, например при гипогликемии, уменьшает
соответственно скорость фосфорилирования глюкозы до примерно
10% предельной мощности. Такое сочетание свойства глюкозы
свободно диффундировать сквозь клеточную мембрану с высокой
/См гексокиназы делает степень потребления глюкозы печенью
чрезвычайно чувствительной к концентрации глюкозы в крови.
Другую группу внепеченочных регуляторов глюконеогенеза и
гликолиза в печени составляют эндокринные факторы. Инсулин,
например, косвенно усиливает потребление глюкозы, вызывая
увеличение синтеза ключевого фермента глюкокиназы; увеличение
количества этого фермента приводит к удалению глюкозы из крово-
тока в результате превращения ее в клетках печени в недиффунди-
рующий глюкозо-6-фосфат. Гормоны коры надпочечника, имеющие
кислород при 11-м атоме углерода, оказывают выраженное воз-
действие на обмен углеводов, поэтому их и называют глюкокорти-
коидами. Такие глюкокортикоиды, как кортизол, воздействуют на
печень в направлении, обратном действию инсулина, усиливая
глюконеогенез. В основе механизма этого воздействия лежит индук-
ция синтеза нескольких ферментов, необходимых для осуществле-
ния процесса глюконеогенеза, в том числе некоторых трансаминаз,
пируваткарбоксилазы, фосфоенолпируваткарбоксикиназы и глю-
козо-6-фосфатазы. Этим эффектам глюкокортикоидов противодейст-
вует инсулин, и, таким образом, соотношение между этими дейст-
вующими в противоположных направлениях гормонами опреде-
ляет степень выраженности указанных эффектов. Хотя глюкокор-
тикоиды ускоряют биосинтез перечисленных выше каталитически
активных белков в печени, они одновременно ускоряют катабо-
лизм белка в других тканях, обеспечивая таким образом увеличе-
ние количества свободных аминокислот как субстратов для синтеза
глюкозы в клетках печени. Глюкагон, являющийся, подобно инсу-
лину, гормоном поджелудочной железы, стимулирует фермента-
тивные реакции превращения пирувата в фосфоенолпируват. Этот
гормон, кроме того, косвенно усиливает глюконеогенез в резуль-
тате активации печеночной липазы, которая в свою очередь вызы-
4 УГЛЕВОДЫ 181
вает повышение содержания жирных кислот в клетках. Как и в слу-
чае глюкокортикоидов, стимулирующему действию глюкагона на
глюконеогенез также противостоит инсулин.
Само собой понятно, что нельзя рассматривать действие эндо-
кринных факторов на эти процессы изолированно; представляется
вероятным, что решающее значение имеет соотношение одного гор-
мона с другим; воздействие избытка или недостатка данного агента
следует рассматривать в связи с концентрацией его антагонистов.
МЕТАБОЛИЗМ ПИРУВАТА
Полное окисление пирувата, возникающего в процессе глико-
лиза, осуществляется через общий конечный путь обмена углево-
дов, жиров и белков, а именно через цикл лимонной кислоты (гл. 3).
До включения в этот цикл пируват должен путем диффузии проник-
Глюкоза
НАДФН
НАДФ
NH2
СН3СНСООН
Аланин
НАД
НАД-Н
Глутамат
АТФ.
Аспартат^.
[Лце/лальЗегы?]
дегидроеенозная
система)
ОН
I
СНзСНСООН
Лактат
О
II
СН3С соон
Пируват
АТФ
► Жирные кислоты
Стерины
и /п.д.
CH3CSK0A
АцетиЛ'КоА
Оксалоацетат
Цитрат
Малат
ос-Кетоглутарат
Рис. 4-7. Обмен пирувата.
ТФФ — тиамин пирофосфат.
182 4- УГЛЕВОДЫ
нуть из цитоплазмы в митохондрии, где пируватдегидрогеназная
ферментная система действует согласно механизму, совершенно
аналогичному описанному выше для окислительного декарбокси-
лирования а-кетоглутарата в ходе реакций цикла (рис. 4-7). Таким
образом, эта сложная многоферментная система первоначально
декарбоксилирует пируват до ацетальдегида при участии тиамин-
пирофосфата; связанный с ферментом ацетальдегид окисляется до
остатка уксусной кислоты, который переносится на липоевую кис-
лоту, тогда как освобождаемые в ходе этого окислительного про-
цесса атомы водорода переносятся при участии ФАД и НАД+;
наконец, такая активированная ацетильная группа переносится
на свободную молекулу кофермента А, причем энергия тиоэфирной
связи оказывается резервированной. Суммарное уравнение этой
реакции следующее:
Пируват+ KoASH +НАД+ Ацетил ~ SKoA-j-НАД-Н Ц-СО2.
Печень, как и все ткани человеческого тела, не имеет механизма
превращения энергии этой тиоэфирной связи ацетил-КоА в АТФ,
соответствующего механизму, который действует в случае сукци-
нил-КоА; энергия тиоэфирной связи используется при таких реак-
циях конденсации, как цитратсинтетазная реакция или при пре-
вращении ацетильных групп в жирные кислоты, стероиды и другие
важные компоненты печени.
Действие пируватдегидрогеназы регулируют два важных регу-
лятора, функционирующих по принципу отрицательной обратной
связи. Первым из них является продукт прямой реакции ацетил-
КоА, который резко подавляет активность фермента, предотвращая
накопление избыточных количеств самого регулятора. Второй ре-
гулятор представляет собой конечный продукт митохондриальных
окислительных процессов АТФ, который фосфорилирует дегидро-
геназу, образуя неактивную форму этого фремента. В результате
этого цикл лимонной кислоты оказывается перекрытым на раннем
этапе, когда резервы энергии в клетке высоки.
Очевидно, пируват занимает ключевое положение в обмене угле-
водов: в отсутствие О2 он обеспечивает образование лактата, под-
держивая гликолиз; в присутствии О2 он полностью окисляется в
цикле Кребса, высвобождая огромные количества энергии; он может
подвергаться карбоксилированию, благодаря чему обеспечивается
дальнейшая работа цикла или достигается обращение гликолиза.
Помимо этих важных функций, относящихся в первую очередь к
обмену углеводов, существуют многочисленные пути взаимопре-
вращений с участием пирувата, воздействующих на другие метабо-
лические процессы. Пируват участвует в метаболизме аминокислот
и сам образуется в ходе этих процессов — либо путем прямого
трансаминирования до аланина, либо через другие кетокислоты
(в форме которых он служит предшественником аспартата, глута-
4 УГЛЕВОДЫ 183
мата и др.). В виде ацетил-КоА пируват вносит свой вклад в ана-
болизм разнообразных липидов и других важных соединений, на-
пример ацетилхолина. Более того, как мы отметим в гл. 5, пируват
участвует в действии малатдегидрогеназы:
Малат + Н АДФ + Пир у ват 4- СО2 + НАДФ • Н + Н+.
Эта реакция может служить важным источником восстанови-
тельной энергии для тех клеточных анаболических процессов (та-
ких, как биосинтез жирных кислот и стероидов), для которых
необходим восстановленный НАДФ. Таким образом, пируват пред-
ставляет собой как бы настоящий перекресток, где скрещиваются
многочисленные пути обмена углеводов, жиров и белков.
ФОСФОГЛЮКОНАТНЫЙ ПУТЬ
Фосфоглюконатный путь сопровождается рядом сложных пре-
вращений, которые мы здесь подробно рассматривать не будем.
Наиболее важные окислительные реакции катализируют две раз-
личные НАДФ-зависимые дегидрогеназы: 1) глюкозо-6-фосфат-де-
гидрогеназа, окисляющая альдегидную группу глюкозы до карбок-
сильной группы, образуя таким образом 6-фосфоглюконовую кис-
лоту и НАДФ-Н, и 2) 6-фосфоглюконатдегидрогеназа, действующая
на продукт реакции, катализируемой предыдущим ферментом, и
осуществляющая окислительное декарбоксилирование в соответст-
вии с механизмом, подобным механизму изоцитрадегидрогеназной
реакции; образование пятиуглеродного сахара рибулозо-5-фосфата
н
I
с«о
I
н-с-он
I НАДФ* /НАДФ-Н
но-с-н I © 4
। \ х 7
н-с-он XJLX ж
Н-£-он (Дегидрогеназа)
CH.O®
ОН
I
с=о
Н-С-ОН
I НАДФ
НО-С-Н
н-с-он
сн2он
НАДФ-Н |
с=о
н-с-он
I (Дегидрогеназа) I
Н-С-ОН Н-С-ОН
СО,
сн2о©
сн.о®
Пентозы для
нуклеиновых
кислот
Рибулозо-5-Ф
(5Х) (6Х)
Рис, 4-8, Фосфоглюконатный путь,
184 4- УГЛЕВОДЫ
и НАДФ-Н сопровождается освобождением СО2 из карбоксильной
группы (рис. 4-8). Этот путь обмена важен для клетки (помимо обес-
печения пентозами) главным образом как источник восстановитель-
ной энергии, необходимой для синтезов (в виде НАДФ-Н). Послед-
ний служит также главным фактором регуляции превращений, про-
текающих по этому пути, поскольку обе дегидрогеназы сильно
ингибируются восстановленной формой НАДФ. При беспрепятствен-
ном накоплении в клетке НАДФ-Н вызовет почти полный блок этих
дегидрогеназ, который будет снят только после использования
НАДФ-Н с превращением его в НАДФ+ в ходе того или иного вос-
становительного процесса. Таким образом, фосфоглюконатный путь
реагирует на возникающее, например, при синтезе жирных кислот
повышение потребности клетки в НАДФ-Н. Однако реакции об-
мена веществ в клетке будут протекать экономично, поскольку
снижение потребности в НАДФ-Н приведет к перекрыванию фос-
фоглюконатного пути на его начальных этапах, благодаря чему
глюкозо-6-фосфат сохранится для использования в других целях.
Полное окисление глюкозо-6-фосфата до СО2 в ходе реакций
фосфоглюконатного пути осуществляется благодаря превращениям
пентоз (образуемых в результате дегидрирования) в гексозы. На
первый взгляд это кажется невозможным без обратной фиксации
СО2, освобождаемой на начальных этапах процесса, но в действи-
тельности такие превращения происходят в результате метаболи-
ческого фокуса с «жонглированием» осколками молекулы пенто-
зы, которые присоединяются к другим пентозам и отнимаются от
них. Общие стехиометрические соотношения можно рассмотреть,
исходя из 6 моль глюкозо-6-фосфата:
1. 6 Глюкозо-б-фосфат-f-12 НАДФ+ —► 6-Рибулозо-5-фосфат-|-
+ 6СО2+ 12НАДФ-Н.
2. 6Рибулозо-5-фосфат 5 Глюкозо-6-фосфат4-Фн-
Суммируя уравнения реакций (1) и (2), получим
Глюкозо-6-фосфат 4-12 НАДФ —► 6СО2 4- 12 НАДФ • Н 4- Фн-
Составляющие суммарную реакцию отдельные превращения шести
пентоз можно охарактеризовать, рассматривая их арифметические
соотношения: в ходе реакции двухуглеродный фрагмент одной пен-
тозы переносится на вторую пентозу (5С4-5С 7С4-ЗС). Затем
этот семиуглеродный сахар переносит трехуглеродный фрагмент
на трехуглеродный сахар (7С4-ЗС -> 4С4-6С), образуя одну моле-
кулу гексозы. Остающийся четырехуглеродный сахар присоединяет
двухуглеродный фрагмент, донором которого является третья
пентоза (4С4-5С -> 6С4-ЗС); при этом образуется вторая молекула
гексозы плюс триоза. Можно видеть, что, удваивая каждый из упо-
мянутых выше процессов, мы таким образом объясним потребление
4. УГЛЕВОДЫ 185
шести молекул пентоз с образованием четырех молекул гексоз и
двух триоз; последние могут конденсироваться в результате обра-
щения гликолиза, образуя пятую молекулу гексозы. Таким обра-
зом, основными участками реакций этого пути превращений яв-
ляются лишь те соединения, названия которых набраны курсивом;
именно за счет этих соединений поддерживается общий баланс:
6 х 5С-сахара = 5 х бС-сахара.
Другие участники этих реакций, т. е. 7С-, 4С- и ЗС-сахара,— лишь
кратковременно существующие промежуточные продукты этого пу-
ти метаболических реакций (рис. 4-8).
ОБМЕН ГЛИКОГЕНА В ПЕЧЕНИ
Поскольку глюкоза как моносахарид свободно диффундирует
через мембрану печеночных клеток, она не может служить резер-
вуаром углеводов в печени. Так как фосфатные эфиры глюкозы и
фруктозы не стбль легко проникают через мембраны, фосфорилиро-
вание этих сахаров создает как бы ловушку для них, эффективно
изолируя реакции гликолиза и фосфоглюконатного пути в преде-
лах внутриклеточного отсека. Тем не менее фосфаты сахаров не мо-
гут накапливаться в больших количествах в печени, поскольку бла-
годаря осмосу увеличение запасов подобных растворимых соеди-
нений будет сопровождаться накоплением больших количеств воды.
Создание в печени большого запаса недиффундирующей глюкозы
без сопутствующего осмотического набухания органа возможно
лишь благодаря способности печени превращать избыток углево-
дов в большой нерастворимый полимер гликоген.
После приема пищи, богатой углеводами, эта резервная форма
глюкозы может составлять одну десятую всей массы печени. При
голодании запас гликогена почти полностью истощается. Учитывая
обычные, связанные с приемами пищи колебания, считают, что содер-
жание гликогена в печени составляет от 2 до 8% веса этого органа;
средняя «нормальная» величина — примерно 5%. Значение этого
сравнительно небольшого запаса энергии, который в норме у взрос-
лого эквивалентен 70—90 г глюкозы, заключается в том, что он
служит быстромобилизуемым источником сахара как для крови,
питающей другие ткани, так и для нужд самой печени. В течение
первых 12—24 ч после приема пищи потребности организма в угле-
водах в основном удовлетворяются за счет распада гликогена в пе-
чени. После более длительного' голодания замедленная реакция
этой ткани на действие эндокринных факторов приведет к усиленно-
му синтезу ферментов, участвующих в обмене аминокислот, образо-
вании фосфоенол пирувата и т. д., так что глюконеогенез будет
осуществляться с максимальной интенсивностью после того, как
запасы гликогена истощатся.
186 4. УГЛЕВОДЫ
Гликогенез
Синтез гликогена, или гликогенез, представляет собой анаболиче-
ский процесс, требующий затраты энергии в форме как АТФ, так
и уридинтрифосфата (УТФ). Последний обычно участвует в акти-
вации глюкозы, галактозы и других сахаров в ряде ферментативных
реакций; уридиннуклеотиды можно рассматривать как универсаль-
ные коферменты обмена сахаров. Исходным продуктом для процес-
са гликогенеза является глюкоза, которая прежде всего должна
быть превращена в глюкозо-6-фосфат при участии глюкокиназы за
счет АТФ. Таким образом, можно видеть, что глюкозо-6-фосфат за-
нимает ключевое положение как общий промежуточный продукт
ряда процессов углеводного обмена: он способен к обратимому
превращению в пируват путем гликолиза или глюконеогенеза, а
также к необратимому — в пентозы или СОа в ходе реакций фосфо-
глюконатного пути. Глюкозо-6-фосфат подвергается обратимому
превращению в гликоген (рис. 4-9).
Первым уникальным этапом синтеза гликогена является про-
стое катализируемое ферментом перемещение фосфатной группы
глюкозо-6-фосфата из положения 6 в положение 1. В осуществле-
нии следующего этапа, активации глюкозо-1-фосфата, участвуют
уридиннуклеотиды. В ходе этого процесса два концевых фосфат-
ных остатка УТФ освобождаются в виде неорганического пирофос-
фата, тогда как остаток УМФ соединяется при помощи пирофосфат-
ного мостика с глюкозо-1-фосфатом, образуя УДФ-глюкозу (рис.
4-10). Эта весьма реакционноспособная коферментная форма глю-
козы способна участвовать в многочисленных ферментативных
реакциях, приводящих либо к соединению молекул сахаров с дру-
гими веществами (например, с белками или липидами при образо-
вании гликопротеидов или гликолипидов), либо к взаимопревра-
щениям сахаров (например, глюкозы в галактозу).
Гликоген
/I ▼ (Гликогенолиз)
Глюкозо-1-Ф
АТФ
Глюкоза
ГЛЮКОЗО-Б-Ф'
I Пентозы,
ico2
%
(Гликолиз)
атф,надн+-~
Пируват
(Гпюконсогенез)
*----АТФ, НАД-Н
Рис, 4-9. Обмен гликогена и глюкозо-6-фосфата в печени.
Гликогенез
оооо<
J Гликогенолиз
J-6-связи
ветвления
Ветвление
сн,он
сн,он CHjOH
Q.<>.n
СН, ОН СН2
сн,он
Затравка
УДФ-глюкоза
сн,он
АДФ
Глюкозо-6-Ф
Глюкоза-1-Ф
| Линейные
связи
Разветвленный глиноген (а-Ьб-связь)
о
Линейный глиноген /а- 1-4-связи)
ум»
сн.он
сн,он
о
сн,он
сн,он
Фосфорилаза
> \ о-УДФ
Г <1
оооооо
ООООО
О-УДФ
н,о**
rj|
Глюкоза
Рис. 4-10. Гликогенез и гликогенолиз.
Действие синтетазы и ветвящих ферментов изображено схематически в центре; слева пред-
ставлены соответствующие структурные формулы; справа показано действие фосфорилаз,
освобождающих глюкозо-1-фосфат в результате фосфоролиза концевых 1—4-связей, а также
Гликоген = Q-глюканогидролазы ~ фермента, воздействующего н а 1*=6-связи о освобожде-
нием глюкозы.
188 УГЛЕВОДЫ
При реакции, катализируемой гликогенсинтетазой, входящий
в состав УДФ-глюкозы мономер глюкозы присоединяется к сво-
бодной гидроксильной группе в положении 4 концевого остатка
глюкозы уже существующей молекулы гликогена. Эта реакция
повторяется с участием следующих поступающих в систему моле-
кул УДФ-глюкозы, каждая из которых присоединяет по одному
остатку глюкозы в положении 1 и освобождает УДФ. За счет АТФ
этот УДФ может быть вновь превращен в УТФ. Образующийся по-
лимер содержит различное число (от нескольких тысяч до сотен
тысяч) мономеров глюкозы, соединенных 1—4-связями.
Такая молекула не существует в виде вытянутой в одну линию
цепи, поскольку имеется второй фермент, переносящий часть ра-
стущей цепи в обратном направлении с присоединением к свобод-
ной гидроксильной группе в положении 6 мономера глюкозы уже
существующей цепи. Сочетанное действие этого «ветвящего» фер-
мента и гликогенсинтетазы приводит к образованию линейных це-
пей мономеров глюкозы, соединенных 1—4-связями, и боковых вет-
вей с 1—6-связями в точках ветвления. В результате этого струк-
тура гликогена напоминает дерево с ветвями, присоединенными к
почти каждому десятому остатку глюкозы. Такая сильно развет-
вленная структура выполняет в клетке две главные функции: во-
первых, она обеспечивает множество концевых участков, пригод-
ных для быстрого присоединения или освобождения молекул глюко-
зы; во-вторых, она придает компактность и плотность резервируе-
мой в клетке частице.
Электронно-микроскопическое исследование показывает, что
эти частицы в цитоплазме печени соединены друг с другом в кла-
стеры, или розетки, диаметром примерно 20 нм. Эти частицы содер-
жат в виде структурированного многоферментного комплекса, по-
мимо запасов гликогена, ферменты синтеза гликогена (синтетаза и
ветвящий фермент), а также ферменты его распада.
Гликогенолиз
Распад гликогена в печени происходит в ответ на повышение
потребностей в глюкозе либо со стороны печеночной ткани, либо
в других частях тела. Фермент фосфорилаза, как указывает его на-
звание, ответствен за разрыв связей между глюкозными мономера-
ми гликогеновых цепей путем присоединения по этим связям не-
органического фосфата, но не воды, как это имеет место при гидро-
литическом действии амилазы на полисахариды. Фосфорилаза от-
личается от амилазы еще и тем, что последовательно отщепляет
остатки глюкозы один за другим от ко нчиков ветвей «гликогеново
го дерева», а не в результате беспорядочного действия на любые-
связи. Действие фосфорилазы направлено только на линейные
участки молекулы полимера, вплоть до точек ветвления; гидролиз
4. УГЛЕВОДЫ 189
1—6-связей с освобождением глюкозы катализирует специальный
фермент гликоген—6-глюканогидролаза (debranching enzyme), бла-
годаря действию которого оставшаяся часть «дерева» становится
пригодной для дальнейшей обработки при участии фосфорилазы.
Поскольку последний фермент катализирует присоединение фосфа-
та к линейным 1—4-связям, продукты действия фосфорилазы пред-
ставляют собой молекулы глюкозо-1-фосфата, число которых при-
мерно в 10 раз превосходит число молекул свободной глюкозы, обра-
зующихся при гидролизе 1—6-связей.
Молекулы глюкозо-1-фосфата могут под влиянием фосфоглюко-
мутазы вновь превращаться в глюкозо-6-фосфат, который служит
непосредственным источником энергии в печени в ходе реакций ли-
бо гликолитического, либо фосфоглюконатного пути. При исполь-
зовании такого способа получения внутриклеточной энергии удоб-
ства, связанные с наличием гликогена как тканевого резерва угле-
водов, обходятся клетке в один макроэргический эквивалент на
молекулу глюкозо-6-фосфата, проходящего через цикл:
Глюкозо-6-фосфат —► Глюкозо-1-фосфат
Глюкозо-1-фосфат + УТФ —► УД Ф-глюкоза + Пирофосфат
УДФ-глюкоза —► Гликоген + УДФ
УДФ + АТФ УТФ + АДФ
Гликоген + Фн —► Глюкозо-1-фосфат
Г люкозо-1 -фосфат —► Г люкозо-6-фосфат.
Для обеспечения энергией и других тканей глюкозо-6-фосфат
подвергается гидролизу до свободной глюкозы (способной диффун-
дировать в кровоток) с рассеиванием дополнительного макроэрги-
ческого эквивалента:
Г л юкоза 4; АТФ —► Г л юкозо-6-фосфат + АДФ
Глюкозо-6-фосфат —* Глюкоза + Фн •
Таким образом, цикл: глюкоза крови -> гликоген печени -> глюко-
за крови, обеспечивающий внепеченочные ткани энергией, пригод-
ной для создания запасов, требует два макроэргических эквивален-
та на 1 моль глюкозы.
Факторы регуляции гликогенеза
и гликогенолиза
Как и в случае системы гликолиз —глюконеогенез, синтез и рас-
пад гликогена в печени не протекают как независимые процессы.
Гликогенез и гликогенолиз также работают вместе как интегриро-
ванная, строго регулируемая система, на которую воздействуют как
внутри- так и внеклеточные соотношения между поступлением и
потреблением глюкозы (рис. 4-11). Однако в данном случае регуля-
190 4- УГЛЕВОДЫ
Рис. 4-11. Регуляция обмена гликогена в печени.
А. Состояние покоя. Преобладает синтез гликогена, так как форма синтетазы активна, а фос-
форилаза b имеет низкую активность. Б. Состояние возбуждения. Преобладает распад глико-
гена, так как форма D синтетазы имеет низкую активность, а фосфорилаза а — высокую.
ция не связана с медленной индукцией синтеза ферментов; алло-
стерические эффекты метаболитов наслаиваются на первичные кон-
формационные изменения, вызываемые циклическим АМФ. Эти
воздействия циклического АМФ обеспечивают быстрое изменение
обмена гликогена в печени в ответ на внеклеточные запросы, но
таким образом, чтобы синтез и распад гликогена не происходили
одновременно и чтобы не создавался бесцельно расходующий
энергию цикл:
Глюкоза 4- 2АТФ —► Гликоген
Гликоген —♦ Глюкоза.
В состоянии «покоя» нормальная печеночная клетка содержит
ничтожно малые количества циклического АМФ, а ферменты угле-
водного обмена существуют в их немодифицированных формах, на-
зываемых фосфорилазой b и гликогенсинтетазой 1 (рис. 4-11, А).
4. УГЛЕВОДЫ 191
Форма 1, или нечувствительная форма, этой синтетазы получила
такое название потому, что ее действие не подвержено аллостериче-
ской регуляции метаболитами. В состоянии покоя эта синтетаза
максимально активна, и при наличии достаточного количества
УДФ-глюкозы в качестве субстрата происходит «включение» син-
теза гликогена. Вместе с тем b-форма фосфорилазы не активна;
только в результате аллостерического взаимодействия с АМФ кон-
формация фосфорилазы b превращается в свойственную каталити-
чески активной форме фермента. Поскольку АТФ тормозит связы-
вание АМФ, фосфорилаза b становится активной только при таком
снижении энергетических резервов клетки, которое требует моби-
лизации гликогена. Когда разворачивающийся катаболизм глюко-
зы обеспечивает возвращение уровня АТФ к исходным величинам,
концентрация АМФ снижается и процесс гликогенолиза «выклю-
чается». Таким образом, в отсутствие внешних раздражителей ско-
рость распада гликогена в печени изменяется только в результате
изменений внутриклеточных запасов энергии. Даже при работе о
максимальной интенсивностью гликогенсинтетаза может обеспечить
производство гликогена со скоростью, которая составляет лишь
одну сотую от максимальной скорости гликогенолиза; не обяза-
тельно поэтому выключать синтетазу на те короткие интервалы вре-
мени, когда фосфорилаза активирована АМФ для устранения крат-
ковременных перебоев в снабжении энергией самой печени.
Ответ обмена гликогена в печени на запросы, исходящие от вне-
печеночных тканей, опосредованы действием аденилатциклазы —
фермента, который занимает важное положение на клеточной мем-
бране (рис. 4-11, Б). Его можно сравнить с двуликим Янусом. Об-
ращенное наружу «лицо» циклазы обладает специфическими ре-
цепторами для тех гормонов, которые, не проникая через мембрану
печеночной клетки, изменяют обмен веществ в ней путем либо по-
ложительной, либо отрицательной модификациии активности цик-
лазы благодаря связыванию с наружными рецепторными участ-
ками. Обращенное внутрь «лицо» аденилатциклазы представляет
собой внутренний каталитический участок, который катализирует
отщепление двух концевых фосфатов АТФ в виде неорганического
пирофосфата, используя энергию, высвобождаемую при таком от-
щеплении, для внутренней этерификации остающегося фосфата о
собственной рибозой, что ведет к образованию циклического эфира.
Как АТФ, служащий субстратом в этой реакции, так и циклический
АМФ, образующийся в ходе этой реакции, локализованы исключи-
тельно в пределах внутриклеточного пространства.
С наружными рецепторами аденилатциклазы могут взаимодейст-
вовать два различных класса эндокринных агентов: адреналин,
освобождаемый в кровоток при стрессе, активирует циклазу; глю-
кагон, выделяемый поджелудочной железой при снижении содер-
жания глюкозы в крови, также активирует циклазу; антагонистом
192 4. УГЛЕВОДЫ
этого эффекта служит инсулин. Таким образом, адреналин и глю-
кагон вызывают повышение уровня циклического АМФ в печени,
а инсулин понижает его. В присутствии циклического АМФ глико-
генсинтетаза и фосфорилаза фосфорилируются за счет АТФ при
участии протеинкиназ, которые в норме находятся в покоящейся
клетке в неактивном состоянии. Под влиянием очень небольших ко-
личеств циклического АМФ эти киназы достигают максимальной
активности; следует учитывать также, что число фосфорилирован-
ных молекул фермента исчезающе мало. Это ведет к следующему:
во-первых, количество АТФ, потребляемого при образовании цик-
лического АМФ и при действии протеинкиназ, будет пренебрежимо
мало в общем балансе энергии в клетке; во-вторых, результатом та-
кого каскада реакций будет чрезвычайно значительное усиление
эффекта присоединения молекулы гормона к клеточной мембране.
В этом смысле обмен гликогена в состоянии покоя представляется
как бы сбалансированным на грани взрыва; гормональные эффекты
служат лишь для приведения в действие чувствительного пускового
механизма аденилатциклазы.
Фосфорилирование фосфорилазы b превращает ее в обладающую
максимальной активностью фосфорилазу а. Последняя проявляет
максимальную активность в отсутствие АМФ и не ингибируется
под влиянием АТФ. В этом отношении она напоминает форму I
синтетазы, поскольку она не чувствительна к аллостерическим моди-
фикаторам и быстро расщепляет гликоген печени независимо от
запасов энергии в самой ткани. Под влиянием гормонов обмен гли-
когена в печени обслуживает организм как целое (например, если
требуется повысить концентрацию глюкозы в крови). После фос-
форилирования гликогенсинтетазы этот фермент будет функциони-
ровать каталитически только в присутствии высоких концентраций
глюкозо-6-фосфата. Учитывая зависимость действия фермента от
наличия указанного аллостерического модификатора, фосфорили-
рованную синтетазу называют зависимой (dependent) формой (D-
формой).
Значение такого типа регуляции заключается в том, что гормо-
нальный сигнал, указывающий на необходимость разрушения гли-
когена, свидетельствует об истощении запасов глюкозы и ее фосфор-
ных эфиров; низкие концентрации глюкозо-6-фосфата в сочетании
с высокими показателями содержания циклического АМФ обеспе-
чивают «выключение» синтеза гликогена при максимальной актива-
ции его распада. В подкрепление этого эффекта оба продукта глико-
генсинтетазной реакции (УДФ и гликоген) действуют как отрица-
тельные модификаторы, удерживающие синтетазу в заблокиро-
ванной, или D-форме. Без этого ответ на воздействие гормонов не
был бы плавным и ограниченным во времени; после прекращения
раздражения гидролитические ферменты клетки быстро превращают
циклический АМФ в обычный АМФ и дефосфорилируют ферменты
4. УГЛЕВОДЫ 193
обмена гликогена, вновь превращая фосфорилазу а в неактивную
форму b и гликогенсинтетазу D в активную форму I (т. е. в формы,
характерные для состояния покоя).
Печеночные гликогенозы
и галактоземия
Известны генетически обусловленные заболевания, при которых
нарушение нормальных ферментативных реакций в печени вызы-
вает избыточное отложение гликогена; эти заболевания обозначают
общим термином печеночные гликогенозы. У некоторых больных на-
копление избытка гликогена в печени приводит к такому значитель-
ному ее увеличению, что она легко прощупывается и даже вызывает
увеличение живота. Такая гепатомегалия характерна для подобных
заболеваний.
Первым описано наиболее распространенное среди заболеваний,
сопровождающихся нарушением депонирования гликогена,— гли-
когеноз типа I, или болезнь Гирке. По существу, нарушение обмена
гликогена при этом заболевании является вторичным, первичное
же нарушение — это наследуемая по рецессивному типу недостаточ-
ность фермента глюкозо-6-фосфатазы. В связи с этим для таких
больных характерны низкий уровень глюкозы в крови натощак.
В тяжелых случаях подобная гипогликемия приводит к судорогам и
замедлению роста в результате хронического подавления выработ-
ки инсулина. Накопление гликогена в печени и почках связано с
подавлением процесса удаления гликозо-6-фосфата, который не толь-
ко служит предшественником субстрата глюкогенсинтетазы, но так-
же активатором D-формы этого фермента.
Гликогеноз типа III, или болезнь Кори, характеризуется увели-
чением в печени и других тканях запасов гликогена, для молекулы
которого типичны очень короткие наружные ветви, что обусловле-
но отсутствием фермента, катализирующего гидролиз 1—6-связей
в молекуле гликогена. Наоборот, гликогеноз типа IV, или болезнь
Андерсена, обусловлена недостаточностью ветвящего фермента, что
приводит к накоплению гликогена с аномально длинными цепями в
молекуле. Хотя при гликогенозе типа III накапливается значитель-
но больше гликогена, чем при гликогенозе типа IV, гликогеноз
типа III отличается доброкачественным течением и не угрожает
жизни ребенка. Гликогеноз типа IV, вероятно, в результате реак-
ции организма на аномальный неразветвленный гликоген неизбеж-
но сопровождается циррозом печени и приводит к смерти.
Гликогеноз типа VI, или болезнь Херса, характеризуется от-
сутствием фосфорилазы, что приводит к накоплению в печени гли-
когена нормальной структуры. Симптомы этой болезни сходны с
симптомами гликогеноза типа I, но менее выражены. За исключе-
194 4. УГЛЕВОДЫ
Лактоза пищи
Глюкоза -4—Галактоза
АТФ
(Киназа)
Гликоген
Гэлактозо-1-Ф
(ТРансрераза)^УДф-г™К03а Ч
ч^Глюкозо-1-Ф '^УТФ
(Эпимераза)
СН,ОН
О
СН20Н
6 УриЪин
УДФ-глюкоза
УриЪин
УДФ-галактоза
Рис. 4-12. Обмен галактозы в печени.
При галактоземии нарушена функция трансферазы, образующей УДФ-галактозу.
нием гликогеноза типа I, заболевания, связанные с нарушением де-
понирования гликогена, по-видимому, встречаются очень редко.
Другим нарушением углеводного обмена в печени, которое на-
следуется по рецессивному типу, является галактоземия. при ко-
торой нарушение метаболизма поступающей в желудочно-кишеч-
ный тракт галактозы может вести к развитию катаракты и умствен-
ной отсталости. В норме превращение галактозы в глюкозу осу-
ществляется в печени через уридиновый промежуточный продукт
УДФ-галактозу (рис. 4-12). Недостаточность трансферазы, катали-
зирующей образование нуклеотидного производного этого сахара,
приводит к накоплению галактозо-1-фосфата, токсичного для моз-
га, и к появлению галактозы в моче. Такая галактозурия в сочета-
нии с увеличением печени и непереносимостью молока считается в
педиатрии важным диагностическим признаком. Раннее распознава-
ние болезни очень важно, поскольку простое исключение молока
из рациона обеспечивает нормальное развитие и прекрасный про-
гноз в отношении жизни. По мере роста развиваются вспомога-
тельные пути обмена галактозы, благодаря чему в дальнейшем по-
требление с пищей некоторого количества молока становится допу-
стимым.
МЫШЦЫ
В отличие от печени, которой приходится учитывать запросы
других органов и тканей, мышцы в отношении углеводного обмена
работают в строгом соответствии с принципом самообслуживания.
4. УГЛЕВОДЫ 195
В этом смысле цель мышечной клетки довольно однозначна и со-
стоит в том, чтобы наиболее эффективно использовать поступаю-
щую глюкозу для образования АТФ, необходимого при осуществле-
нии механической работы — сокращения. В состоянии покоя зна-
чительные количества глюкозы могу быть резервированы в виде
гликогена, который при мышечном сокращении будет подвергать-
ся распаду. Цитоплазма мышечных клеток содержит в высоких кон-
центрациях ферменты гликолиза, а изобилие митохондрий обеспе-
чивает эффективный распад продуктов гликолиза через цикл лимон-
ной кислоты и цепь переноса электронов. Лишь в условиях крайне-
го утомления эти аэробные процессы не справляются с накоплением
лактата.
За исключением гликогенеза, мышца осуществляет лишь немно-
гие синтетические функции; ключевые ферменты глюконеогенеза
в ней отсутствуют, и гликолиз, по существу, протекает необра-
тимо. Для восстановительных синтезов в мышце НАДФ-Н не тре-
буется, и фосфоглюконатный путь почти не функционирует. За иск-
лючением использования пирувата для образования аланина, ко-
нечные продукты обмена углеводов лишь в небольшой степени ис-
пользуются для биосинтетических реакций. Например, в небольшой
мере осуществляется превращение ацетил-КоА-> жирные кислоты.
Резюмируя, можно сказать, что обмен углеводов в мышцах
обеспечивает создание тканевых запасов гликогена в состоянии по-
коя и использование этих запасов, а также поступающей глюкозы
при напряженной работе; основные энергетические потребности всех
типов мышц удовлетворяются главным образом за счет окисления
продуктов обмена жиров. Фактически ни медленно сокращающаяся
гладкая мышечная ткань, ни сердечная мышца не потребляют глю-
козу в значительной мере. Во время напряженной работы сердце,
например, обеспечивает себя субстратом для деятельности его много-
численных митохондрий, окисляя лактат, доставляемый кровью,
от работающих скелетных мышц. Вопросы, которые будут рассмот-
рены ниже, имеют отношение именно к этой последней категории по-
перечнополосатых мышц, составляющих главную мышечную массу
конечностей и всего тела.
ЗАХВАТ ГЛЮКОЗЫ
И ФОСФОРИЛИРОВАНИЕ
Поступление глюкозы в клетки скелетной мышцы облегчается
системой переноса на поверхности мембраны; активность этой систе-
мы повышается либо в присутствии инсулина, либо при усиленной
работе мышц (рис. 4-13). Как только глюкоза проникла в клетку,
она эффективно удерживается в ней путем фосфорилирования до
глюкозо-6-фосфата. Катализирующая эту реакцию гексокиназа имеет
значительно более низкую величину Км для глюкозы, чем глюкоки-
196 4- УГЛЕВОДЫ
наза печени (10“5 М, против 10-а М). Другие различия между этими
двумя ферментами имеют отношение к их физиологической регуля-
ции: гексокиназа мышц сильно ингибируется по принципу отрица-
тельной обратной связи продуктом катализируемой ею реакции
глюкозо-6-фосфатом, тогда как на фермент печени это соединение не
оказывает действия; синтез глюкокиназы печени усиливается ин-
сулином, чего не наблюдается в отношении гексокиназы мышц. Та-
4. УГЛЕВОДЫ 197
ким образом, фермент мышц участвует лишь во внутриклеточной ре-
гуляции; этот фермент будет фосфорилировать глюкозу только до
тех пор, пока глюкозо-6-фосфат используется в мышечной ткани для
гликолиза или образования гликогена.
Другое важнейшее различие между тканью печени и мышцы со-
стоит в отсутствии фермента глюкозо-6-фосфатазы в мышцах. Это
относится также к большинству внепеченочных тканей, за исклю-
чением почек и тонкого кишечника, значение которых в образова-
нии глюкозы невелико. Для мышц и других тканей превращение
глюкозы в глюкозо-6-фосфат представляет собой процесс, проте-
кающий лишь в одном направлении и предопределяющий исполь-
зование углеводов исключительно для внутриклеточного метабо-
лизма.
ГЛИКОЛИЗ И ЕГО РЕГУЛЯЦИЯ
Реакции гликолиза в мышцах и печени сходны между собой, но
имеются различия в количествах и регуляторных свойствах от-
дельных ферментов, катализирующих эти реакции. В мышцах фос-
фофруктокиназная реакция более чем в 20 раз активнее, чем в пе-
чени, тогда как фруктозодифосфатазная активность в печени в 20
раз выше, чем в мышцах. Эти соотношения характерны для нор-
мальных физиологических условий, когда в мышцах преобладает
гликолиз как процесс катаболизма; в печени эти реакции сбаланси-
рованы таким образом, что преобладает синтез глюкозы. Фосфо-
фруктокиназа имеет важнейшее значение в регуляции гликолиза
как в мышцах, так и в печени. Для фермента мышц характерен та-
кой же тип аллостерической регуляции по принципу отрицательной
обратной связи при участии АТФ и цитрата (тогда как АМФ об-
ладает свойством устранять их тормозное действие), но высшие
жирные кислоты не влияют на активность этого фермента. Регуля-
ция очень низкой фруктозодифосфатазной активности, по-видимо-
му, большого значения в мышечной ткани не имеет.
Пируваткиназная активность в мышцах также в 20 раз выше,
чем соответствующая активность в печени, тогда как пируваткар-
боксилазу и фосфоенолпируваткарбоксикиназу, которые вместе
составляют эффективный шунт, позволяющий осуществить реакцию,
обратную пируваткиназной, в мышцах фактически не удается обна-
ружить. Пируваткиназная система мышц обладает более выражен-
ным отрицательным аллостерическим эффектом в присутствии АТФ,
чем фермент печени, но эффекты других метаболитов не выражены.
Таким образом, важнейшие факторы регуляции гликолиза в мыш-
цах имеют отношение к концентрации АТФ, что согласуется с пред-
ставлением о первостепенном значении обмена глюкозы для удов-
летворения энергетических потребностей внутриклеточных про-
цессов.
198 4. УГЛЕВОДЫ
ЛАКТАТДЕГИДРОГЕНАЗЫ
Между скелетной и сердечной мышцами существует фундамен-
тальное различие в отношении использования ими пирувата и
образования лактата. Сердце представляет собой орган, работающий,
в сущности, при аэробных условиях и снабженный столь большим
количеством митохондрий, что сердечная мышца окисляет не только
пируват, образующийся в результате протекающего в ней самой
гликолиза, но и лактат, который образуется в других тканях. Нао-
борот, в скелетной мышце потенциальная наибольшая активность
ферментов гликолиза при быстро наступающем утомлении может
превысить возможности системы доставки кислорода и способности
митохондриальных окислительных систем окислять НАД-Н; в такие
периоды напряженной деятельности скелетные мышцы работают в
анаэробных условиях, количественно превращая пируват в лактат.
Образующийся таким путем лактат диффундирует в печень, где он
используется для ресинтеза глюкозы, или в сердце и другие ткани,
где происходит его окисление.
Указанные метаболические различия соответствуют различиям
в субъединицах изоферментов лактатдегидрогеназы\ эти субъеди-
ницы обозначают буквами Н (от Heart — сердце) или М (Muscle —
мышца). Активный фермент содержит различные сочетания из четы-
рех таких субъединиц (Н4М4, НзМь Н2М2 или НХМ3). В сердце или
других тканях, функционирующих при аэробных условиях, пре-
обладают Н-формы (Н4, H3MX и т. д.), тогда как скелетная мышца
обладает только М4 (рис. 4-14). Изоферменты Н4 и такие сочетания
субъединиц, в которых Н-формы преобладают, функционируют зна-
чительно менее эффективно с пируватом в качестве субстрата, чем
с лактатом; кроме того, изоферменты Н4 ингибируются высокими
Рис. 4-14. Изоферменты лактатдегидрогеназы.
Форма М4 в скелетной мышце благоприятствует превращению пирувата в лактат, тогда как
форма Н4 в сердечной мышце благоприятствует окислению лактата до пирувата.
4. УГЛЕВОДЫ 199
концентрациями пирувата. Таким образом, сердечная мышца и дру-
гие ткани, в которых имеются Н4, будут преимущественно исполь-
зовать пируват в реакциях, отличающихся от реакции, катализи-
руемой лактатдегидрогеназой; последняя реакция в этих функ-
ционирующих при аэробных условиях тканях используется для
окисления лактата до пирувата. Активность изоферментов М4 не
тормозится пируватом; положение равновесия катализируемой эти-
ми изоферментами реакции смещено в сторону превращения пи-
рувата в лактат, когда другие пути использования НАД-Н и пи-
рувата не адэкватны, как это имеет место при быстром сокращении
скелетной мышцы.
МЕТАБОЛИЗМ ГЛИКОГЕНА
В МЫШЦЕ
Ферментные системы и регуляторные механизмы, участвующие
в обмене гликогена в мышце и в печени, сходны между собой. По-
скольку запас гликогена в мышце служит только для удовлетворе-
ния ее собственных потребностей, его концентрация в меньшей мере,
чем в печени, изменяется при голодании; после приемов пищи кон-
центрация гликогена в мышцах не достигает таких высоких зна-
чений, как в печени. Содержание гликогена в мышце, находящейся
в состоянии покоя и получающей достаточное количество питатель-
ных веществ, редко превышает 1 % от ее общего веса, что обуслов-
лено торможением активности гликогенсинтетазы гликогеном, когда
его концентрация превышает эту величину. Поскольку общая масса
мышц в организме человека велика, суммарные запасы гликогена
в мышцах примерно в 5 раз больше, чем в печени. Несмотря на на-
личие такого большого запаса вещества, способного превратиться
в глюкозу, гликоген мышц невозможно использовать для воспол-
нения уменьшенного уровня глюкозы в крови, так как в мышцах
нет глюкозо-6-фосфатазы. В соответствии с этим обмен гликогена
в мышцах представляет собой исключительно внутриклеточный
процесс, изменяющийся в зависимости от собственных внутренних
энергетических потребностей клетки. В мышцах осуществляется
цикл реакций гликогенеза — гликогенолиза:
Глюкозо-6-фосфат—►Гликоген
Гликоген —► Глюкозо-6-фосфат.
Для мышечной клетки затрата энергии в уплату за удобное
хранение составит поэтому всего один макроэргический эквивалент
на 1 моль глюкозы, как это было подсчитано выше в отношении ис-
пользования внутриклеточной энергии в печени.
200 4. УГЛЕВОДЫ
Регуляция гликогенолиза
и гликогенеза
В мышце, находящейся в покое, фосфорилаза Ь, как и в печени,
не активна: в физиологических условиях активность этого фермен-
та совершенно не изменяется при изменениях концентрации АТФ
и АМФ в клетке. Катализируемое киназой фосфорилирование фос-
форилазы с образованием фосфорилазы а представляет собой пер-
вичный этап активации, имеющий отношение к начальным стадиям
самого процесса сокращения (рис. 4-15) Киназа фосфорилазы мышц
сильно активируется Са2+, концентрация которого в мышце в усло-
виях покоя низка; раздражение соответствующего нерва вызывает
освобождение Са2+ из связанной формы в цитоплазме (гл. 3, рис.
3-20). Такое освобождение Са2+ служит пусковым механизмом сокра-
щения мышцы и одновременно стимулирует образование фосфори-
лазы а из фосфорилазы Ь, а также превращение гликогенсинтетазы
из формы I в форму D. Таким образом, сигнал, побуждающий мыш-
цу к началу работы, служит одновременно стимулом для распада
гликогена, обеспечивающего снабжение энергией. После прекраще-
ния стимула Са2+ удаляется из цитоплазмы, и благодаря действию
фосфатаз гликогенолиз оказывается «выключенным», тогда как син-
тетаза превращается в более активную форму I.
В дополнение к этой внутриклеточной регуляции посредством
изменений концентрации Са2+ на гликоген мышц воздействует так-
же внеклеточный агент — адреналин, причем это воздействие опос-
редовано через аденилатциклазную систему; в противоположность
печени мембрана мышечной клетки не имеет рецепторов для глюка-
гона и, следовательно, не реагирует на этот гормон.
Циклаза мышц по сравнению с аналогичным ферментом печени
более чувствительна к адреналину, который служит сигналом об-
щей тревоги, побуждающим к максимально напряженной мышечной
деятельности в период, когда требуются усилия чрезвычайно боль-
шой интенсивности. Повышение внутриклеточных концентраций
циклического АМФ в результате активации аденилатциклазы при-
водит к превращению киназы фосфорилазы в такую форму, которая
активна даже в присутствии очень низких концентраций Са2+.
Таким образом, фосфорилаза b может быть активирована с образо-
ванием фосфорилазы а независимо от процессов, сопровождающих
мышечное сокращение, чем обеспечивается постоянный, повышен-
ный уровень образования глюкозо-6-фосфата для выработки энер-
гии путем реакций гликолиза.
Гликоген представляет собой наиболее быстро используемый
источник энергии для мышечной деятельности после того, как за-
пасы богатых энергией АТФ и креатинфосфата в мышцах исчерпа-
ны (через 20—30 с после наиболее напряженной работы, например
при беге на короткие дистанции). Использование гликогена затем
4. УГЛЕВОДЫ 201
Гликоген
Т Синтетаза J
I
I
Фосфорилаза b J
t
Гексозо-Ф
а
а
f
СОг +АТФ
Гликоген
14
। Синтетаза D
I
I
Гексозо-Ф
СО2 +АТФ
Рис. 4-15. Обмен гликогена в мышцах и его регуляция.
Либо ионы кальция (освобождаемые в ответ на раздражение нервов), либо циклический АМФ
(освобождаемый в ответ на воздействие адреналина) способствуют превращению фосфорилазы
в ее активную з-форму и превращению синтетазы в ее неактивную D-форму А В покое.
Б. При раздражении
происходит с той максимальной скоростью, которую только допус-
кает гликолиз (в течение 2—3 мин) до тех пор, пока накопление
лактата не становится избыточным и самоограничивающим. Кроме
того (как это имеет место, например, при беге на длинные дистан-
202 4- УГЛЕВОДЫ
ции), работу мышцы ограничивают максимальные скорости реаги-
рования аэробных механизмов окисления НАД-Н и пирувата. Пер-
воначально в качестве топлива будет преимущественно потребляться
гликоген мышц, но затем его роль как окисляемого субстрата посте-
пенно возьмут на себя жирные кислоты. Таким образом, функцио-
нирование мышцы в условиях длительной работы приобретает черты
сходства с теми процессами, которые характерны для мышцы в по-
кое. Даже после нескольких часов относительно медленной деятель-
ности достаточно короткого (всего несколько минут) периода отды-
ха для того, чтобы восстановить энергетические ресурсы.
Гликогенозы мышц
Описано несколько нарушений метаболизма гликогена, пора-
жающих в различной мере и мышечную ткань. Так, например, гли-
коген с аномальной структурой, характерной для гликогенозов пе-
чени типов III и IV, был обнаружен также в мышцах. Гликогеноз
типа II, или болезнь Помпе, поражает до некоторой степени печень,
но наиболее тяжелые последствия этого нарушения тканевых ре-
зервов гликогена отмечаются при исследовании мышечной ткани;
эти последствия сводятся к развитию слабости скелетных мышц, рас-
ширению сердца и смерти в раннем детстве в результате сердечной
недостаточности. В указанных тканях отсутствует а-1,4-гликози-
даза, но не ясно, почему этот фермент требуется для предотвраще-
ния избыточного отложения гликогена.
Гликогеноз типа V, или болезнь Мак-Ардля, представляет со-
бой наиболее широко распространенный гликогеноз, поражающий
только скелетные мышцы, в которых полностью отсутствует фос-
форилаза. Активность фосфорилазы в печени соответствует норме,
и гипогликемия не обнаруживается. За исключением наступающих
при тяжелой физической нагрузке мышечных судорог, симптомы
этой болезни обычно выражены незначительно, что подчеркивает
важность жирных кислот и других внемышечных источников энер-
гии для сокращения мышц.
Редкие случаи гликогенеза типа VII связывали с наличием в
скелетных мышцах очень низкого уровня фосфофруктокиназы (1—
3% от нормального уровня). Как и при гликогенозе типа V, боль-
ные гликогенозом типа VII также переносят умеренные физические
нагрузки, что вновь подчеркивает упомянутое выше положение о
существовании наряду с углеводным обменом других источников
энергии для мышечной деятельности.
МОЗГ
По сравнению со всеми органами тела функции мозга в наиболь-
шей степени зависят от обмена углеводов (рис. 4-16). Если в крови,
поступающей к мозгу, концентрация глюкозы становится вдвое
4. УГЛЕВОДЫ 203
ниже нормальной, то в течение нескольких секунд наступает потеря
сознания, а через несколько минут — смерть. Для того чтобы обес-
печить освобождение достаточного количества энергии, катаболизм
глюкозы должен осуществляться в соответствии с аэробными меха-
низмами; об этом свидетельствует даже более высокая чувствитель-
ность мозга к гипоксии (низкое содержание кислорода в крови),
чем к гипогликемии (низкое содержание глюкозы в крови). В допол-
нение к образованию энергии для поддержания электрохимических
градиентов, участвующих в передаче нервных импульсов, мета-
болизм глюкозы может также обеспечивать синтез нейромедиато-
ров, аминокислот, липидов и компонентов нуклеиновых кислот,
предоставляя углеродсодержащие предшественники для процессов,
происходящих в клетках мозга. Фосфоглюконатный путь функцио-
нирует в небольшой мере, обеспечивая НАДФ-Н для некоторых из
этих синтезов, но в основном катаболизм глюкозы в ткани мозга
протекает по гликолитическому пути.
ИСПОЛЬЗОВАНИЕ ГЛЮКОЗЫ
В ТКАНЯХ МОЗГА
Свойства системы захвата глюкозы в тканях мозга и в скелетной
мышце сходны. Гексокиназа мозга также имеет высокое сродство к
глюкозе (Лм~10~вЛ1), что обеспечивает эффективную работу меха-
204 УГЛЕВОДЫ
низма удерживания глюкозы в клетках. Активность ферментов
гликолиза очень высока. Регуляция фосфофруктокиназной реакции
осуществляется при помощи АТФ и цитрата по принципу отрица-
тельной обратной связи; положительная прямая связь обеспечи-
вается за счет АМФ.
Высокая активность митохондриальных ферментов цикла ли-
монной кислоты предотвращает накопление лактата в тканях мозга;
большая часть пирувата подвергается окислению до ацетил-КоА.
Небольшая доля ацетил-КоА используется для жизненно важного
процесса образования нейромедиатора ацетилхолина; небольшие
количества ацетильных групп могут находиться в ткани мозга в
виде резервного соединения N-ацетиласпартата. Большая часть мо-
лекул ацетил-КоА, однако, подвергается окислению в процессах
выработки энергии в ходе цикла лимонной кислоты.
Промежуточные продукты реакций цикла лимонной кислоты иг-
рают важную вспомогательную роль в обмене веществ в ткани моз-
га, обеспечивая процессы синтеза аспартата и глутамата соответ-
ствующими предшественниками (кетокислотами); эти две аминокис-
лоты имеют особенно важное значение для функций нервной тка-
ни. Чрезмерно интенсивное использование промежуточных про-
дуктов цикла Кребса для осуществления этих реакций может
привести к нарушению обмена углеводов; токсическое действие
аммиака на мозг, например, может быть связано с истощением за-
пасов а-кетокислот, которые используются при фиксации NH3. В об-
ход цикла [путем декарбоксилирования глутамата до у-аминобути-
рата (ГАМК) и превращения последнего в сукцинат] увлекается
примерно 10% углеродных атомов катаболизируемой в тканях мозга
глюкозы.
ДРУГИЕ СУБСТРАТЫ
МЕТАБОЛИЗМА
В ТКАНИ МОЗГА
Как и можно было ожидать на основании сведений о жизненной
необходимости снабжения глюкозой, мозг обладает лишь неболь-
шими внутриклеточными запасами энергии. Несмотря на полную
зависимость от катаболизма углеводов, в условиях длительного го-
лодания мозг может приспособиться к использованию кетоновых
тел крови (таких, как p-оксибутират) для обеспечения цикла Кребса
субстратами. В крайних случаях обеспечение пригодными для окис-
ления а-кетокислотами достигается за счет катаболизма таких ами-
нокислот, как глутамат и аспартат. Стимуляция ткани мозга (на-
пример, электрическим током) вызывает быстрое использование за-
пасов АТФ и фосфокреатина. Мозг содержит мало гликогена (0,1%
от общего веса); этот запас расходуется очень быстро, если поступ-
ление глюкозы извне не соответствует потребностям мозговой ткани.
4. УГЛЕВОДЫ 205
Механизм регуляции фосфорилазной системы мозга неизвестен.
Хотя мозг содержит чрезвычайно активную аденилатциклазную си-
стему, которая активируется (вырабатывая циклический АМФ)
такими нейрогормонами, как норадреналин и серотонин, ее значе-
ние для обмена углеводов неясно, поскольку не происходит одно-
временной активации фосфорилазы, как это характерно для мышц.
ЭРИТРОЦИТЫ
Эритроциты человека обладают характерными для эукариотиче-
ских клеток органеллами лишь до определенной стадии дифференци-
ровки— до ретикулоцита. На более поздних этапах из этих клеток
исчезают ядра, митохондрии и другие органеллы; в результате в
зрелом эритроците не обнаруживаются реакции цикла лимонной
кислоты и дыхательной цепи. Парадоксальным представляется тот
факт, что эти клетки, важнейшая функция которых заключается
в переносе кислорода для нужд других тканей, сами используют для
выработки энергии только анаэробные механизмы.
ИСПОЛЬЗОВАНИЕ ГЛЮКОЗЫ
В ЭРИТРОЦИТЕ
Глюкоза проникает в эритроцит из окружающей плазмы при
помощи системы энергозависимого переноса, на которую не влияет
инсулин (рис. 4-17). При нормальных условиях более 90% исполь-
зуемой эритроцитами глюкозы подвергается гликолизу, который
обеспечивает АТФ, необходимый для энергозависимых процессов
Лактат
крови
Глюкоза
крови
Гемоглобин
2,3 -Ъифоароглицерат
Глюкоза
Лактат
Глюкозо-6-Ф.
Триозо-Ф НАДФ'
Пируват
Пентозо-Ф
НАДФ-Н
Окисленный
глутатион
Рис, 4-17. Обмен углеводов в эритроците.
206 4- УГЛЕВОДЫ
переноса через клеточную мембрану. Помимо обеспечения захвата
глюкозы, эти механизмы переноса, которые сопряжены с гидроли-
зом АТФ, облегчают движение Na+ наружу и К+ внутрь для под-
держания характерного состава содержимого клетки (высокая кон-
центрация К+, низкая — Na+) против концентрационных градиен-
тов плазмы крови (низкая концентрация К+, высокая — Na+). При
триозофосфатдегидрогеназной реакции гликолиза также образует-
ся НАД-Н, необходимый для восстановления избытка метгемогло-
бина (окисленной формы гемоглобина, не связывающей О2), кото-
рый может образоваться в эритроците под влиянием окисляющих
агентов.
Побочным продуктом реакций гликолиза, который обнаруживает-
ся в эритроцитах в необычайно высоких концентрациях, является
2,3-дифосфоглицерат. Последний выполняет несколько функций: во-
первых, он является главным фосфорсодержащим соединением в
данных клетках и служит важным анионом, уравновешивающим
внутриклеточные катионы и действующим также в качестве буфер-
ного агента; во-вторых, он может служить резервом энергии при
чрезвычайных обстоятельствах, когда клетка не имеет запасов кре-
атинфосфата и гликогена; и, в-третьих, он связывается с гемогло-
бином, уменьшая его сродство к Оа и, таким образом, облегчая ос-
вобождение кислорода в тканях. Фосфоглюконатный путь в норме
составляет лишь небольшую долю в общем катаболизме глюкозы,
но в условиях повышения потребности в НАДФ-Н активность этого
«шунта» может возрастать во много раз. Эритроцитам нужен НАДФ х
X Н главным образом для того, чтобы поддерживать важный внутри-
клеточный восстановитель, глутатион, в его восстановленной —
SH-форме; следовательно, воздействие агентов, ускоряющих окис-
ление глутатиона в —S—S-форму, активирует реакции фосфоглюко-
натного пути, которые обеспечивают поступление компенсирующих
восстановительных эквивалентов в форме НАДФ-Н.
ГЕМОЛИТИЧЕСКИЕ АНЕМИИ
Значение углеводного и энергетического обмена для функций
эритроцитов становится особенно отчетливым при рассмотрении
нескольких врожденных нарушений обмена веществ, ведущих к
гемолизу и анемии. Например, для гликогеноза типа VII, о котором
говорилось в разделе о мышцах, характерна частичная недостаточ-
ность фермента фосфофруктокиназы в эритроцитах, что снижает
эффективность образования АТФ и ведет к появлению слабо выра-
женных признаков гемолиза.
Более тяжелое расстройство связано с другим наследуемым по
рецессивному типу патологическим состоянием — недостаточностью
пируваткиназы, при котором активность этого фермента снижена
именно в эритроцитах. Поскольку гликолиз блокирован на этапе,
4. УГЛЕВОДЫ 207
находящемся до последней продуцирующей энергию стадии, ката-
болизм глюкозы не может сопровождаться выработкой АТФ. Кро-
ме того, пораженные клетки накапливают в избытке 2,3-дифосфо-
глицерат, но из-за недостаточности киназы они не могут исполь-
зовать его для образования АТФ. Недостаток энергетических ре-
сурсов в клетке приводит к нарушению постоянства ее внутреннего
состава и нарушению целостности мембраны. Деформация клетки
и другие изменения свойств поверхности приводят к тому, что се-
лезенка «оценивает» такие клетки как аномальные; они удаляются
из кровотока и разрушаются ретикуло-эндотелиальной системой.
Были описаны и другие, тоже тяжелые, виды гемолитической ане-
мии, связанные с врожденными дефектами эритроцитарных фермен-
тов, участвующих в реакциях гликолиза (триозофосфатизомераза,
глюкозофосфатизомераза, фосфоглицераткиназа и гексокиназа), но
эти заболевания, по-видимому, встречаются очень редко.
О роли фосфоглюконатного пути в способности эритроцита про-
тивостоять экзогенным стрессам свидетельствует существование
группы широко распространенных медикаментозных гемолитиче-
ских анемий, которые характеризуются недостаточностью глюкозо-
6-фосфатдегидрогеназы. Склонность к таким заболеваниям насле-
дуется как сцепленный с полом рецессивный признак; они встре-
чаются чаще у негров и у жителей стран, расположенных в бассей-
не Средиземного моря. Описаны случаи повышенной чувствительно-
сти к противомалярийному средству — примахину. Среди жителей
Средиземноморья наряду с повышенной чувствительностью к при-
махину встречаются случаи повышенной чувствительности к кон-
ским бобам (Vicia fava) — так называемый фавизм. У людей, о ко-
торых идет речь, не удается обнаружить никаких патологических
симптомов до тех пор, пока они встретятся с провоцирующим аген-
том, запускающим механизм развития тяжелой гемолитической
анемии, иногда со смертельным исходом. Эти агенты способствуют
окислению глутатиона в эритроцитах. В отсутствие глюкозо-6-фос-
фатдегидрогеназы клетки не обеспечивают повышения содержания
НАДФ-Н, необходимого для возвращения окисленного глутатиона
в его —SH-форму. Снижение концентрации восстановленного глута-
тиона сопровождается появлением отложений денатурированного
гемоглобина (тельца Хейнца), что приводит к деформации клеточ-
ной мембраны; такая деформация как бы отбирает дефектные эрит-
роциты для разрушения в синусоидах селезенки, что вызывает ост-
рый гемолитический криз.
САХАР КРОВИ
В результате сложного взаимодействия описанных выше про-
цессов создается тонко сбалансированное равновесие, обеспечиваю-
щее постоянный уровень глюкозы в циркулирующей крови (рис.
208 4. УГЛЕВОДЫ
Рис. 4-18. Регуляция уровня сахара в крови.
Противодействующие факторы служат для поддержания нормального уровня глюкозы в кро-
ви в пределах от 70 до 90 мг на 100 мл. Гипергликемия вызывает освобождение инсулина (И)
из поджелудочной железы, что приводит к снижению уровня сахара в крови Чрезмерное
повышение содержания глюкозы в крови сопровождается ее выведением с мочой (глюкозу-
рия). Гипогликемия способствует освобождению агентов, повышающих содержание сахара в
крови — глюкагона (Г) из поджелудочной железы, кортизола (К) из коры надпочечников и
адреналина (А) из мозговой части надпочечников
4-18). Если глюкоза не поступает с пищей, то у здорового человека
в крови поддерживается постоянная концентрация глюкозы от 70
до 90 мг/100 мл. После приема содержащей углеводы пищи концент-
рация глюкозы на короткое время возрастает примерно до 150 мг/
100 мл, но через 2 ч она обычно возвращается к норме. Печень дей-
ствует как первая буферная система; она удаляет поступающие по
воротной вене моносахариды, образующиеся при переваривании
пищи, и превращает их в глюкозу, а затем в гликоген. Поступление
избытка глюкозы приводит к повышению ее концентрации в об-
щем кровотоке, что в свою очередь стимулирует поглощение глю-
козы периферическими тканями (мышцы, жировая клетчатка и
4. УГЛЕВОДЫ 209
другие). Достигая поджелудочной железы, избыточная концентра-
ция глюкозы крови стимулирует выделение инсулина клетками
островков Лангерганса; инсулин вызывает дальнейшее усиление
поглощения глюкозы периферическими тканями.
Как было отмечено выше, инсулин также стимулирует исполь-
зование глюкозы для синтеза гликогена и подавляет образование
глюкозы в ходе реакций глюконеогенеза; инсулин представляет
собой главный действующий по принципу отрицательной обратной
связи агент, участвующий в снижении содержания глюкозы в кро-
ви до нормальных величин после гипергликемии. При сахарном
диабете нарушение образования инсулина приводит к недостаточ-
ному использованию и чрезмерному образованию глюкозы, что со-
провождается стойкой гипергликемией. Если такой больной при-
нимает богатую углеводами пищу, то концентрация глюкозы в крови
повышается настолько резко, что почки не справляются с ее об-
ратным всасыванием из гломерулярного фильтрата (примерно
220 мг/100 мл) и глюкоза начинает выводиться с мочой (глюко-
зурия).
Когда углеводы с пищей не поступают, нормальный уровень
глюкозы в крови поддерживается благодаря ее выделению в кро-
воток из печени. Во время длительного голодания клетки почек
также вносят значительный вклад в поддержание постоянного
уровня глюкозы в крови. Другие ткани участвуют лишь в удале-
нии глюкозы из внеклеточных жидкостей, поскольку в этих тканях
отсутствует глюкозо-6-фосфатаза, необходимая для превращения
других углеводных соединений в свободную глюкозу. Снижение
концентрации глюкозы в крови, достигающей поджелудочной же-
лезы, стимулирует выделение островковыми клетками глюкагона.
Этот гормон оказывает избирательное действие на печень, ускоряя
гликогенолиз и способствуя повышению уровня глюкозы в крови.
Таков кратковременный и быстро действующий ответ на лишение ор-
ганизма пищи, но он не обеспечит поддержания уровня глюкозы бо-
лее чем на 24 ч; по истечении этого времени запасы гликогена в пе-
чени оказываются истощенными. Вторую линию обороны держит
кора надпочечников, которая включается в эти процессы при дли-
тельном голодании, выделяя глюкокортикоиды. Эти гормоны стиму-
лируют более медленный синтез ферментов глюконеогенеза в пече-
ни и усиливают распад белков в других тканях, что обеспечивает
процесс глюконеогенеза углеродсодержащими субстратами. По-
скольку этим эффектам в норме противодействует инсулин, реаги-
рующий на гипергликемию, и поскольку при диабете этот инсулино-
вый ответ отсутствует, избыточный глюконеогенез при диабете мож-
но рассматривать как результат неконтролируемого действия глю-
кокортикоидов. Наоборот, гипергликемию можно обнаружить при
нормально функционирующей поджелудочной железе, когда гипер-
функция коры надпочечников (например, при синдроме Кушинга)
210 4. УГЛЕВОДЫ
приводит к повышению уровня глюкокортикоидов относительно
уровня инсулина. К числу других агентов, вызывающих усиленное
выделение глюкозы, т. е. к числу гипергликемизирующих агентов, от-
носится адреналин, усиливающий гликогенолиз как в печени, так
и в мышцах при стрессе, а также гормон роста, подавляющий исполь-
зование глюкозы и благоприятствующий сдвигу в сторону перехода
на катаболизм жиров в ответ на резко выраженную гипогликемию.
Очевидно, что именно сочетание и согласованность действия этих
взаимосвязанных факторов, определяющих совершенство регуля-
ции уровня глюкозы в крови, обеспечивает приспособление обмена
углеводов в целом организме к изменяющимся условиям питания,
роста, активности и другим физиологическим функциям.
Рекомендуемая
литература
Altszuler N., Finegold М. J., Glucose Metabolism. In: Becker F. F. (ed.), The
Liver: Normal and Abnormal Functions, M. Dekker, Part A. New York, 1974,
pp. 463—530.
Bachelard M.S., Control of Carbohydrate Metabolism. In: Lajtha A. (ed.), Hand-
book of Neurochemistry, Vol. IV, Control Mechanisms in the Nervous System,
Plenum Press, New York, 1970, pp. 1—12.
Balazs R., Carbohydrate Metabolism. In: Lajtha A. (ed.), Handbook of Neuroche-
mistry, Vol. Ill, Metabolic Reactions in the Nervous System, Plenum Press,
New York, 1970, pp. 1—36.
Beutler E., Glucose-6-phosphate Dehydrogenase Deficiency. In: Stanbury J. B.,
Wyngaarden J. B., Fredrickson D. S. (eds.), The Metabolic Basis of Inherited
Disease, McGraw-Hill, New York, 1972, pp. 1358—1388.
Bondy P. K., Felig P., Disorders of Carbohidrate Metabolism. In: Bondy P. К.»
Rosenberg L. E. (eds.), Diseases of Metabolism, W. B. Saunders, Philadelphia,
1974, pp. 201—340A.
Brewer G. J., General Red Cell Metabolism. In: Surgenor DMacN, (ed.), The Red
Blood Cell, Academic Press, New York, 1974, pp. 387—435.
Eaton J. W., Brewer G. J., Pentose Phosphate Metabolism. In: Surgenor DMacN,
(eds.), The Red Blood Cell, Academic Press, New York, 1974, pp. 436—473.
Everse J., Kaplan N. O., Lactate Dehydrogenases: Structure and Function, Adv.
Enzymol., 37, 61—134 (1973).
Fisher E. H., Pocker A., Saari J. C., The Structure, Function and Control of Gly-
cogen Phosphorylase, Essays Biochem., 6, 23—68 (1970).
Goldberg N.D., Cyclic Nucleotides and Cell Function, Hosp. Pract., 9, (5), 127—142
(1974).
Hers H. G., The Control of Glycogen Metabolism in the Liver, Ann. Rev. Biochem.,
45, 167—189 (1976).
Howell R. R., The Glycogen Storage Diseases. In: Stanbury J. B., Wyngaarden J. B.,
Fredrickson D. S. (eds.), The Metabolic Basis of Inherited Disease, McGraw-
Hill, New York, 1972, pp. 149—173.
Leung K., Munck A., Peripheral Actions of Glucocorticoids, Ann. Rev. Physiol.,
37, 245—272 (1975).
Maker H. S., Lehrer G. M., Carbohydrate Chemistry of Brain. In: Albers R. W.,
Siegel G. J., Katzman R., Agranoff B. W. (eds.), Basic Neurochemistry, Little,
Brown, Boston, 1972, pp. 169—190.
Mansour T. E., Phosphofructokinase, Curr Top. Cell Regul., 5, 2—46 (1972).
Moses S. IF., Gutman A., Inborn Errors of Glycogen Metabolism, Adv. Pediatr
19, 95—169 (1972).
4 УГЛЕВОДЫ 211
Newsholme Е. А.,Start С., Regulation in Metabolism, J. Wiley and Sons, New Ydrk,
1974. [Имеется перевод: Ньюсхолм Э., Старт К. Регуляция метаболизма.—
М.: Мир, 1977.]
Pastan /., Cyclic AMP, Sci. Am., 227, (2), 97—105 (1972).
Perkins J. P., Adenil Cyclase. In: Greengard P., Robinson G. A. (eds.), Advances
in Cyclic Nucleotide Research, Vol. 3, Raven Press, New York, 1973, pp. 1—64.
Posternak T.t Cyclic AMP and Cyclic GMP, Ann. Rev. Pharm., 14, 23—33 (1974).
Purich D. L.t Fromm H. J.t Rudolph F, B., The Hexokinases: Kinetic, Physical1
and Regulatory Properties, Adv. Enzymol., 39, 250—326 (1973).
Segal S., Disorders of Galactose Metabolism. In: Stanbury J. B., Wyngaarden J. B.,
Fredrickson D. S. (eds.), The Metabolic Basis of Inherited Disease, McGraw-
Hill, 1972, pp. 196—222.
Soderling T. R., Park C. R., Recent Advances in Glycogen Metabolism. In: Green-
gard P., Robinson G. A. (eds.), Advances in Cyclic Nucleotide Research, Vol.4,
Raven Press, New York, 1974, pp. 284—333.
Utter M. F.t Barden R. E., Taylor B. L., Pyruvate Carboxylase: an Evaluation of
the Relationships between Structure and Mechanism and between Structure and
Catalitic Activity, Adv. Enzymol., 42, 2—72 (1975).
Valentine W. N., Red Cell Enzyme Deficiencies as a Cause of Hemolytic Disorders,
Ann. Rev. Med., 23, 93—100 (1972).
Valentine W. N., Tanaka K. R., Pyruvate Kinase Deficiency and Other Enzyme-
Deficience Hereditary Hemolytic Anemias. In: Stanbury J. B., Wyngaar-
den J. B., Fredrickson D. S. (eds.), The Metabolic Basis of Inherited Disease,
McGraw-Hill, New York, 1972, pp. 1338—1357.
Villar-Palasi C., Larner J., Glycogen Metabolism and Glycolytic Enzymes, Ann,
Rev. Biochem., 39, 639—672 (1970),
5 липиды
К числу липидов относится группа довольно разнообразных со-
единений, не очень хорошо растворимых в воде; обычно эти соеди-
нения экстрагируют из тканей при помощи таких органических ра-
створителей, как хлороформ и метанол. Общей особенностью мно-
гих липидов является наличие в их молекулах остатков жирных
кислот, которые представляют собой соединения с длинной неразвет-
вленной цепью углеродных атомов, имеющей на одном из концов
карбоксильную группу и содержащей различное число двойных
связей. Число углеродных атомов в этих цепях обычно равно 16,
18 или 20, а число двойных связей варьирует от нуля до четырех
(рис. 5-1,Л). Пальмитиновая кислота (16 : 0) представляет собой
наиболее широко распространенную насыщенную кислоту; олеино-
вая кислота (18 : 1) является наиболее часто встречающейся нена-
сыщенной кислотой с одной двойной связью; линолевая кислота
(18:2), линоленовая кислота (18:3) и арахидоновая* кислота
(20: 4) — наиболее важные полиненасыщенные кислоты.
Эти жирные кислоты редко встречаются в свободном виде; обыч-
но они существуют в составе сложных эфиров, в которых карбок-
сильная группа кислоты связана с различными спиртами. Наиболее
важным из этих спиртов является глицерин (рис. 5-1,Б), в молеку-
ле которого имеются три гидроксильные группы. Одна, две или все
три из числа этих гидроксильных групп могут быть этерифицирова-
ны жирными кислотами с образованием моно-, ди- или триацил-
глицеринов соответственно. Когда две гидроксильные группы гли-
церина связаны с жирными кислотами, а третья с фосфатной груп-
пой, образуются липиды, называемые фосфоглицеридами
В основе структуры липидов другого обширного класса лежит
конденсированная ароматическая система фенантрена; к числу со-
единений этого класса относятся стероиды (рис. 5-1,В), представ-
ляющие собой производные холестерина. К категории липидов от-
носится также большая группа разнообразных жирорастворимых
соединений, включая жирорастворимые витамины A, D, Е и К.
CH} (CR; h 4COOH Пальмитиновая кислота (16-0)
СН3 (CH:) 16 COOH Стеариновая кислота (18 0)
CH, (CH. )7CH=CH(CH. )7COOH Олеиновая кислота ( 18 7)
CHj(CH214CH=CHCH2CH=CH(CH2)7COOH Линолевая кислота (18'2)
CHjCH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH Линоленовая кислота (18.3)
СНз (СН2 )4 СН=СНСН2 СН»СНСН2СН=СНСН2 СН»СН(СН2 )3СООН Арахидоновая
кислота (20:4)
СН2ОН
I
НО-СН
I
СН2ОН
II
О CHjOCRt
II I
r2co-ch о
I II
CH2OCRj
Глиц ерин Триацилглиц ерин
(8-остотки с длинной цепью
углеродных атомов)
0 CH.OCR,
и I
r2co-ch о
I II
СН.ОР-ОХ
I
он
Фосфоглицериды
(Холин, инозит итд.)
Холестерин
( стерин)
Эстрон
(стероидный гормон)
Арахидоновая кислота 20 4
(Незаменимая тарная кислота)
Л ГФ-2а ч
( Простагландин)
Рис. 5-1. Некоторые важные липиды.
А. Широко распространенные жирные кислоты Первая цифра в скобках обозначает длину це-
пи углеродных атомов; вторая—число двойных связей Пальмитиновая кислота (16 : 0) содер-
жит 16 углеродных атомов и не имеет двойных связей в молекуле; в молекуле арахидоновой
кислоты (20 : 4) имеется 20 углеродных атомов и 4 двойные связи Б Глицеринсодержащие
липиды. В. Липиды стероидной природы; связь между холестерином и стероидными гормо-
нами. Г. Незаменимая жирная кислота (арахидоновая кислота) и ее связь с простагланди-
нами.
214 5. ЛИПИДЫ
ЖИРЫ пищи
При нормальных условиях питания до 40% общего числа потреб-
ляемых организмом калорий обеспечивают липиды, среди которых
наиболее важным источником энергии служат триацилглицерины,
обычно называемые жирами. В жирах разного происхождения со-
став жирных кислот различен, животные жиры по сравнению с ра-
стительными обычно содержат больше насыщенных и меньше поли-
ненасыщенных остатков жирных кислот.
В организме человека возможен синтез необходимых ему насы-
щенных и мононенасыщенных жирных кислот; полиненасыщенные
жирные кислоты должны поступать в организм с пищей, поэтому
их называют незаменимыми жирными кислотами. Потребность тка-
ней в этих веществах, вероятно, связана с их участием в осуществ-
лении трех важных функций: 1) они служат предшественниками
важных гормоноподобных веществ простагландинов (рис. 5-1,Г),
2) они поддерживают жидкое состояние, присущее липидам кле-
точных мембран в норме, и 3) они предотвращают отложение хо-
лестерина и других липидов в стенках кровеносных сосудов, что
имеет первостепенное значение в патогенезе атеросклероза. Содер-
жание холестерина в пище, составляющее при нормальном режиме
питания лишь несколько сотен миллиграммов в день, может играть
второстепенную роль в развитии атеросклероза.
ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ
Поскольку 99% липидов, поступающих в организм с пищей,
фактически составляют жиры, важнейшая проблема, связанная
с проникновением липидов из желудочно-кишечного тракта, ка-
сается в конечном счете судьбы жирных кислот и глицерина, вхо-
дящих в состав триацилглицеринов. Для обеспечения нормальной
функции кишечника в отношении всасывания жиров определяющее
значение имеет взаимодействие четырех факторов: 1) секреция под-
желудочной железой гидролитических ферментов, разрывающих в
жирах сложноэфирные связи; 2) освобождение вместе с желчью де-
тергентов, эмульгирующих жиры и продукты их распада; 3) захват
продуктов переваривания клетками слизистой оболочки, покры-
вающими ворсинки тонкого кишечника, и 4) превращение этих про-
дуктов переваривания в частицы для транспорта от клеток слизи-
стой в лимфатические сосуды и, следовательно, в кровоток.
Нарушение любого из этих процессов приводит к расстройству
всасывания жиров и к серьезному поражению кишечника. Главным
симптомом таких поражений является выведение с экскрементами
большого количества жиров, что в клинике называют стеаторреей.
Обычно стеаторрея сопровождается тяжелой диарреей, при которой
организм теряет воду и электролиты; одновременно нарушается
5. липиды 215
всасывание других компонентов пищи (в частности, жирораствори-
мых витаминов); наконец, при длительном заболевании в результа-
те поступления в организм недостаточного количества калорий раз-
вивается кахексия. К нарушению всасывания жиров и стеаторрее
могут приводить заболевания поджелудочной железы, сопровож-
дающиеся дефицитом пищеварительных ферментов, закупорка желч-
ного протока, что ведет к недостатку поверхностно-активных ве-
ществ, содержащихся в желчи, нарушения всасывания на уровне
клеток кишечного эпителия и различные заболевания, связанные с
нарушением секреции и переноса липидов в лимфатические сосуды.
липолиз
Этим общим термином обозначают процессы гидролиза липидов
ферментами, известными под общим названием липазы. Такие про-
цессы важны не только для всасывания липидов из желудочно-ки-
шечного тракта, но также для использования тканями жиров, всо-
савшихся в кишечнике после приема пищи, а также для мобилиза-
ции жиров из тканевых депо в период голодания. В двенадцатиперст-
ной кишке небольшие количества жиров, попавших сюда с пищей,
смешиваются с панкреатическим соком, содержащим липазы и бу-
ферные системы, а также с желчью, которая содержит поверхност-
но-активные соли желчных кислот. На образующуюся щелочную
эмульсию триацилглицеринов воздействует липаза, быстро освобож-
дающая жирные кислоты с обоих концов молекулы жира (рис. 5-2).
Продукты липолиза представляют собой смесь диацилглицеринов,
2-моноацилглицеринов и свободных жирных кислот, которые превра-
щаются в натриевые мыла, способствуя дальнейшему усилению по-
верхностно-активных (детергентных) свойств содержимого кишеч-
ника. Поскольку 2-моноацилглицерины совершенно не подвергают-
ся воздействию липазы поджелудочной железы, при липолизе об-
разуются лишь небольшие количества свободного глицерина.
О R,COOH о
и 4 II
О CH2-O-C-R, / о CHj-0-C-Rj
11 1 (Липаза) / 11 I
С-О-СН о — " Vх» R2-C-O-CH
I II z" I
CHj-O-C-Rj Н2О Соли желчных СН2-ОН
кислот
R.COOH
/ О СН,ОН
(Липаза) / 11 1
---Х > R2 - с -О-СН
I
Н2 О Соли желчных Кислот СН2 ОН
Триацилглицерин
L2-Диацилглицерин 2-Моноацилглицерин
Рис. 5-2. Действие липазы поджелудочной железы при переваривании триацил-
глицерина,
216 5- липиды
СОЛИ ЖЕЛЧНЫХ кислот
И МИЦЕЛЛЫ
Детергентные эффекты желчи обусловлены солями желчных кис-
лот, которые представляют собой производные стероидов и обра-
зуются при окислении холестерина в печени. Если стероидная часть
молекул желчных кислот имеет характерные для липидов гидрофоб-
ные свойства, то их окисленные боковые цепи, к которым присоеди-
нены аминокислоты глицин или таурин, гидрофильны (рис. 5-3).
Такая двоякая растворимость, характерная для детергентов и мыл,
иногда обозначается термином амфипатичность: гидрофобный ко-
нец молекулы легко смешивается с другими липидами, например с
жирами, в содержимом кишечника; гидрофильный конец не сме-
шивается так легко с липидами, но облегчает контакт с преобла-
дающей в просвете кишечника водной фазой. Благодаря этому об-
разуется эмульсия липидов в воде, состоящая из мельчайших капелек
жира. Эту эмульсию стабилизируют торчащие гидрофильные концы
молекул солей желчных кислот, образующие как бы «кожу», или
интерфазу, при соприкосновении с окружающей водной средой.
Диспергирование жиров с образованием таких тонких эмульсий
облегчает их взаимодействие в качестве субстратов с липазами при
гидролитических реакциях; таким образом, соли желчных кислот
служат мощными активаторами процесса переваривания (рис. 5-4).
Другим типом ассоциации, определяемой амфипатической приро-
дой солей желчных кислот, является образование мицелл. Этот про-
цесс основан на том же принципе, что и образование эмульсии: гидро-
фильные части взаимодействуют с водной средой, выступая наружу;
гидрофобные части остаются взаимосвязанными во внутренней сфе-
ре мицеллы. Однако в мицелле нет обширной внутренней липидной
фазы, поскольку толщина всего агрегата соответствует размеру од-
ной мелекулы. Таким образом, мицеллы на несколько порядков мень-
ше, чем частицы в эмульсии. Если последние достаточно велики и
их можно обнаружить благодаря характерной молочной мутности,
которую они создают, то мицеллярные суспензии оптически про-
Гликохолат натрия (соль желчной кислоты)
Рис, 5-3, Принцип детергентного действия солей желчных кислот,
Пища
Большие
липидные
Тонкий
кишечник
О******* •' Остатки жирных кислот
гОН
но]
Lqh
Остатки
глицерина
капли
Липаза
но
НО
Na
Лимфатический
сосуд
П Соли желчных
Эмульгирова- кислот
оШ
Жир
Хиломикрон
АТФ КоА ацил-КоА
Смешанная мицелла
Триацил-
глицерин
Клетка слизистой
оболочки кишечника
Кровь
воротной
вены
печень
оОЪ
Тонкодисперсная эмульсия
Триацил -
глицерин
Гидролиз
гон м
|_ Ншприсвыв
NaO----- мыла
глицерин
Na Na q?
Na
Соли желчных
кислот
Белок
ОН
он г/
Кровоток
Рис. 5-4. Переваривание и всасывание жиров.
Эмульгирование солями желчных кислот предшествует гидролизу под влиянием липазы в ки-
шечнике. Образующиеся при переваривании продукты, взаимодействуя с солями желчных
кислот, дают изображенные здесь непропорционально большими мицеллы, которые в действи-
тельности значительно меньше, чем частицы жира в эмульсии Мицеллы без предваритель-
ного разрушения поступают в клетки слизистой оболочки кишечника; в этих клетках вновь
образуются жиры, которые секретируются в лимфу в виде хиломикронов, имеющих тонкую
белковую оболочку Соли желчных кислот возвращаются в печень через воротную вену, об*
разующую внутрипеченочную систему циркуляции крови.
218 S. ЛИПИДЫ
зрачны. Эмульгирование имеет важное значение потому, что спо-
собствует увеличению поверхности контакта при воздействии ли-
пазы на липиды, однако частицы эмульсии слишком велики для то-
го, чтобы они могли пройти через клеточную мембрану. Мицеллы
же легко всасываются клетками эпителия тонкого кишечника. По-
скольку моноглицериды и свободные жирные кислоты, образующие-
ся при липолизе, также имеют амфипатическую природу, они рас-
полагаются между молекулами солей желчных кислот, образуя
таким образом смешанные мицеллы. Между гидрофобными областя-
ми мицеллы иногда бывают заключены небольшие количества хо-
лестерина, создавая своего рода сэндвич. Очень сходные структуры
участвуют в образовании клеточных мембран из амфипатических
фосфолипидов. Негидролизованные триацилглицерины или диа-
цилглицерины не проникают сквозь клеточные мембраны и не вклю-
чаются легко в мицеллярный слой. Полагают, что мицеллярные
частицы служат важнейшими переносчиками в процессе всасывания
в кишечнике продуктов гидролиза липидов и в сохранении солей
желчных кислот в просвете кишечника.
Заключительные этапы процесса всасывания липидов осуществ-
ляются в клетках слизистой. За исключением небольших коли-
честв жирных кислот с относительно короткой углеродной цепью
(т. е. с цепью длиной в десять углеродных атомов или меньше, как
в жирных кислотах, встречающихся в липидах молока), которые
попадают непосредственно в кровь воротной вены и, следовательно,
в печень, высшие жирные кислоты и моноглицериды вступают
друг с другом в реакцию реэтерификации, образуя триацилглицери-
ны. Этот процесс является энергозависимым, поскольку жирные
кислоты первоначально должны быть подвергнуты активации с
образованием при участии АТФ их КоА-производных. Вместе с хо-
лестерином ресинтезированный триацилглицерин проходит сквозь
боковую поверхность клетки слизистой в виде довольно крупной
липидной капли, которая окружена тонким слоем белков и фосфоли-
пидов. Такая липидная капля, именуемая хиломикроном, прони-
кает в лимфатические сосуды, придавая хилусу, или лимфе, после
приема пищи характерный вид молока. Этот богатый жирами хилус
медленно продвигается по лимфатическим путям и по грудному про-
току попадает в кровь. После приема с пищей большого количества
жиров кровь в течение нескольких часов изобилует хиломикрона-
ми, придающими устойчивую мутность плазме.
ПЕЧЕНЬ
Как и при метаболизме углеводов, паренхиматозные клетки пе-
чени играют ведущую роль в обмене липидов. В одних случаях речь
идет о непосредственном участии этих клеток, например в биосин-
тезе холестерина и его превращении в соли желчных кислот или в
S. липиды 219
образовании фосфолипидов плазмы крови; процессы эти почти
исключительно локализованы в печени. В других случаях, напри-
мер при образовании жировых депо в организме, печень может иг-
рать модифицирующую или регуляторную роль. В норме резервы
триацилглицеринов в самой печеночной ткани весьма малы (в от-
личие от богатых запасов гликогена); они составляют менее 1%
от общей массы органа. Однако соотношение между потреблением
жиров, их синтезом в организме и, следовательно, процессами обра-
зования резервов в других тканях (например, при патологических
состояниях в кровеносных сосудах и в других органах) в значитель-
ной мере контролируется процессами обмена веществ в печени.
Некоторые липиды, всасываясь в кишечнике, попадают в пе-
чень непосредственно с кровью, поступающей через воротную вену.
К их числу относятся соли желчных кислот и жирные кислоты с ко-
роткой цепью. Последние не имеют большого значения в обмене
веществ; исключение в этом отношении составляют дети, в рационе
которых преобладают жиры молока. Жирные кислоты с короткой
цепью переносятся кровью в виде комплексов с альбумином плаз-
мы. Достигая печени, они подвергаются катаболизму в ходе реак-
ций окисления жирных кислот и, по-видимому, не используются в
сколько-нибудь значительной мере для повторного включения в
липиды печени. Соли желчных кислот, однако, захватываются пе-
ченью и поступают в общий фонд вместе с новосинтезированными
желчными кислотами. Таким образом, хотя организм и располагает
всего несколькими граммами солей желчных кислот, входящих в
этот внутриклеточный фонд, а также находящихся в желчных про-
токах печени и (в концентрированной форме) в запасном резервуаре,
т. е. в желчном пузыре, лишь немногие сотни миллиграммов секре-
тируемых желчных кислот избегают обратного всасывания в желу-
дочно-кишечном тракте и попадают в экскременты. Этот цикличе-
ский процесс переноса от печени по желчным путям в кишечник, а
затем по воротной вене обратно в печень называется внутрипече-
ночной циркуляцией (рис. 5-4). Такой замкнутый путь обеспечивает
сохранение большей части желчных кислот, выделяемых с желчью,
а также повторное использование некоторых жирорастворимых ко-
нечных продуктов обмена, таких, как желчные пигменты (гл. 6).
Большая часть последних, однако, избегает обратного всасывания
и выводится из организма с фекалиями.
Другие липиды поступают в печень через вторую важнейшую
кровеносную систему этого органа, а именно по печеночной артерии.
Например, жиры пищи достигают клеток печени через общий кро-
воток в виде хиломикронов. Последние присоединяются к мембране
печеночной клетки, вероятно, за счет белков их наружной оболочки;
содержащиеся в хиломикронах триглицериды поддаются действию
липолитического фермента, находящегося в клеточной мембране.
Этот фермент (липопротеидлипаза) гидролизует КоА-производные
220 s. липиды
жирных кислот, не проявляя избирательности в отношении к ка-
кому-либо из трех положений, и, следовательно, диглицериды и
моноглицериды не накапливаются в качестве промежуточных про-
дуктов, как это имеет место во время липолиза в кишечнике. Осво-
бождаемый глицерин поступает в клетки печени, где он либо вновь
используется для синтеза жиров, либо окисляется. Жирные кис-
лоты, поступающие в клетку печени, могут подвергаться превраще-
ниям, аналогичным тем, какие претерпевает остаток глицерина, т. е.
они могут участвовать в реакциях анаболизма или катаболизма —
в зависимости от соотношения между количествами поступающих
в клетку и потребляемых ею жирных кислот. Другим важнейшим
источником поступающих в печень липидов являются неэтерифици-
рованные, или свободные, жирные кислоты, которые освобождаются
из главных жировых депо в жировой ткани и переносятся кровью в
виде комплексов с альбумином плазмы. Это перемещение жирных
кислот из депо в ткани с интенсивным обменом представляет собой
главный механизм мобилизации энергии в организме.
Печень занимает ключевую позицию в процессах мобилизации,
переработки и биосинтеза жиров. Нарушения нормального баланса
этих противодействующих систем может приводить кочень серьезным
расстройствам обмена веществ, а также к отложению избытка жи-
ров в клетчатке (ожирение) или в клетках самой печени (жировое
перерождение печени).
Жировое перерождение печени может возникать по многим при-
чинам. Вообще говоря, инфильтрация печени избытком жиров озна-
чает, что ее клетки не справляются с метаболизмом жиров, посту-
пающих в печень с током крови. Такое нарушение бывает обуслов-
лено токсическим или дегенеративным поражением печени на фоне
нормального потребления жиров и их мобилизации из жировых де-
по или (реже) в связи с повышенным поступлением жиров в клетки
печени. Наиболее широко распространенными причинами жирово-
го перерождения печени являются: 1) потребление веществ, ток-
сичных для клеток печени (например, этанол, представляющий со-
бой подобный фактор в одной трети всех случаев, и такие галоидо-
производные углеводородов, как хлороформ или четыреххлористый
углерод); 2) пища, содержащая недостаточное количество белка
(например, синдром, называемый квашиоркором, представляет собой
одну из наиболее серьезных форм алиментарной недостаточности в
развивающихся странах мира), и 3) инфекционные болезни или зло-
качественные опухоли, поражающие клетки печени или желчные пу-
ти. Все перечисленные выше факторы, воздействуя на печень, на-
рушают ее метаболические функции. К числу причин, имеющих не-
посредственное отношение к доставке избытка жиров в печень, от-
носятся голодание и сахарный диабет, которые сопровождаются
усиленной мобилизацией жирных кислот из тканевых резервов.
S. ЛИПИДЫ 221
ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
Наиболее компактным «топливом», удовлетворяющим энергети-
ческие потребности организма, являются жирные кислоты, что
определяется особенностями их химической структуры. В расчете
на 1 моль полное окисление жирных кислот высвобождает в не-
сколько раз больше пригодной для использования химической энер-
гии, чем окисление углеводов; например, при окислении 1 моль
пальмитиновой кислоты образуется 130 моль АТФ, тогда как при
окислении 1 моль глюкозы образуется 38 моль АТФ. В расчете на
единицу веса выход энергии различается также более чем в два раза
(9 ккал на 1 г жиров против 4 ккал на 1 г углеводов или белков).
В основе этого высокого выхода энергии лежит та же причина, ко-
торая делает бензин, нефть и другие нефтяные продукты таким эф-
фективным топливом для выработки тепловой и механической энер-
гии, а именно высокая степень восстановленности углерода в длин-
ных алкильных цепях. Основная часть молекулы жирной кислоты
состоит из повторяющихся звеньев (СН2)П, т. е. структуры, макси-
мально обогащенной водородом.
Как мы видели из предыдущего изложения (гл. 3), энергия, за-
пасаемая в ходе биологических окислительных процессов, образует-
ся в основном в связи с контролируемым переносом электронов от
атомов водорода дыхательной цепи, сопряженным с фосфорилирова-
нием АДФ до АТФ. Поскольку жирные кислоты построены в основ-
ном из углерода и водорода и, таким образом, содержат в своем со-
ставе значительно меньше атомов кислорода, чем углеводы, окисле-
ние жирных кислот сопровождается поглощением пропорциональ-
но большего количества кислорода и, следовательно, образованием
большего количества АТФ при окислительном фосфорилировании
(рис. 5-5). Более половины основной (т. е. свойственной состоянию
покоя) энергетической потребности многих тканей (в том числе и
тканей печени, но не мозга) удовлетворяется за счет катаболизма
жиров, что особенно явно выражено в условиях голодания.
Процессы окисления жирных кислот осуществляются исключи-
тельно в митохондриях. Они непосредственно связаны с заключи-
тельными реакциями катаболизма в системе переноса электронов и
цикла лимонной кислоты, которые участвуют также в окислении
углеводов (гл. 4) и производных аминокислот (гл. 6). Для удобст-
ва процесс окисления жирных кислот можно считать состоящим из
Жиры: — (СН2)„ —+Зп(О)—*пСО24-пН2О
Углеводы: — (СНО)р —|- 2р (О) —* рСО2 + рН2О
Рис. 5-5. Схема, объясняющая относительно высокий выход богатых энергией сое-
динений при окислении жиров по сравнению с окислением углеводов.
В расчете на каждый атом углерода цепи жирной кислоты потребляется’/2 или на 50% боль-
ше кислорода, потребляемого в расчете на каждый атом углерода углеводов. Кроме того,
ДЛЯ жирных кислот характерна гораздо большая длина цепи, и, следовательно п>р (в сред-
нем в 3 разд).
222 5- липиды
трех этапов (рис. 5-6): 1) активация, жирных кислот путем энерго-
зависимой реакции образования тиоэфиров ацил-КоА (этот этап
предшествует также использованию жирных кислот для биосинтеза
жиров или фосфолипидов): 2) ^-окисление, т. е. образующий как бы
замкнутый цикл реакций последовательного отделения атомов
водорода от алкильной цепи и отщепления двухуглеродных
остатков в виде молекул ацетил-КоА (эти реакции характерны толь-
ко для окисления жирных кислот); и 3) окисление в цикле лимонной
кислоты образующихся молекул ацетил-КоА до СО2 и дополнитель-
ного количества водорода, используемого затем при окислительном
фосфорилировании (таков общий конечный путь окисления углево-
дов, жиров и белков).
В некоторых тканях проникновение жирных кислот в митохонд-
рии требует участия молекул карнитина в качестве переносчика.
Митохондрии печени, однако, обладают свойством использовать
жирные кислоты и без участия опосредованного карнитином меха-
низма переноса. Вот почему активация свободных жирных кислот
может происходить в интрамитохондриальном пространстве в ходе
реакции, которая использует свободную энергию гидролиза гуано-
зинтрифосфата (ГТФ) до гуанозиндифосфата (ГДФ). Эта реакция
аналогична процессу, обратному стадии превращения сукцинил-
КоА в сукцинат в цикле лимонной кислоты; в этом случае одна мо-
лекула жирной кислоты реагирует с коферментом А на каждую мо-
лекулу ГТФ, гидролизуемую до ГДФ и неорганического фосфата.
Таким образом, эта реакция сопряжена с обеспечивающей энергию
реакцией превращения сукцинил-КоА:
1. Сукцинил-КоА + ГДФ Ч~ФЯ —* Сукцинат + ГТФ + KoASH
2. Жирная кислота + KoASH-f-ГТФ—► КоА-производное жирной
кислоты + ГДФ + Фя.
Таким образом,
3. Сукцинил-КоА + Жирная кислота —> КоА-производное жирной
кислоты + Сукцинат.
О
II
R-C-OH
Жирная ,
кислота /АТФ АМФ +Ф -Фй
KoASH (ГТФ) (W +ФЯ)
(Активация)
О
и
R-C-SKoA
Алифатический
ацил-КоА
((^-Окисление)
трикарбоновых
Жиры
Фосфолипиды
[Н]4-----~
| (Окислительное
I фосфорилирование)
цикл
О
> CHj-C-SKoA
Ацетил-КоА
2СОг
кислот
АТФ
Рис, 5-6, Три этапа окисления жирной кислоты,
5. липиды 223
(Д) (а) О
II
R — СН2-СМ2 — СН2-СН2-С-SKoA
(1)
ГФАД
^ФАДН,
О
II
R—СН2—СН2—СН=СН—С—SKoA
(2)
ZH2°
он о
I II и
R-CH2-CH2-CH-CH2-C-SKoA
(3)
Г-НАД+
<*НАДН + Н +
R-CH2-CH2-C-CH2-C-SKoA
(4)
I II II
R—СН2—СН2 —С—SKoA + CHS—С—SKoA
(1)
z~ ФАД
<>ФАДН2
О
Ацетил-КоА
R —СН=СН —С—SKoA
Начальный требующий затраты энергии этап активации подго-
тавливает молекулу жирной кислоты для всех последующих ре-
акций, сопровождающихся высвобождением энергии, подобно тому
как фосфорилирование подготавливает молекулу глюкозы к про-
цессу катаболизма путем гликолиза.
Процесс ^-окисления получил такое название потому, что атомы
водорода и электроны КоА-производных жирных кислот удаля-
ются и перераспределяются в ходе окислительно-восстановитель-
ных реакций таким образом, что атом углерода в 0-положении этой
цепи становится окисленным в наибольшей мере. Это окисленное
соединение затем претерпевает расщепление, причем 0-углеродный
атом становится карбоксильным концом укороченной ацильной
Цепи после отделения двух концевых углеродных атомов в виде
ацетил-КоА. Имеется полная аналогия между этими окислительно-
восстановительными реакциями и теми реакциями цикла лимонной
224 б. липиды
кислоты, в ходе которых сукцинат превращается в оксалоацетат:
реакция (1), которая аналогична сукцинатдегидрогеназной ре-
акции, и реакция (3), которая аналогична реакции, катализиру-
емой малатдегидрогеназой, сопровождаются катализируемым спе-
цифическими дегидрогеназами переносом водорода на флавиновые
и никотинамидные коферменты соответственно. (Перенос двух
электронов от НАД-Н на дыхательную цепь приводит к образо-
ванию трех молекул АТФ, тогда как при переносе от ФАД-Н2
электроны поступают в цепь через другой флавопротеид, занима-
ющий тот же уровень, что и сукцинатдегидрогеназа, и выход АТФ,
таким образом, составляет две молекулы.) Реакция (2), этап гид-
ратации, аналогична фумаразной реакции. Реакция (4), аналогич-
ной которой в цикле лимонной кислоты нет, заключается в рас-
щеплении 0-кетоацил-производного кофермента А при участии
специфического фермента тиолазы с образованием ацетил-КоА
плюс КоА-производного, укороченного на два углеродных атома
и подготовленного к следующему циклу 0-окисления.
Таким образом, исходная алифатическая ацильная цепь катабо-
лизируется последовательно, при каждом цикле реакций присоеди-
няется 1 моль Н2О и 1 моль KoASH, удаляются четыре восстано-
вительных эквивалента в виде ФАД-Н2 и НАД-Н+Н+, образуется
1 моль СН3СО—SKoA. Выход энергии при 0-окислении составляет
5 моль АТФ на каждый цикл реакций. Следовательно, если при-
нять за исходную такую типичную алифатическую ацильную груп-
пу, как пальмитил-КоА (16 : 0), то процесс 0-окисления будет за-
вершен в результате семи циклов реакций
СН3(СН?)14СО—SKoA + 7Н2О + 7KoASH + 7ФАД + 7НАД+
8СН3СО—SKoA + 7Ф А Д • Н2 + 7Н А Д • Н + 7Н+.
Учитывая перенос восстановительных эквивалентов на дыхатель-
ную цепь и принимая во внимание расход одной молекулы АТФ
(которая эквивалентна ГТФ) на первоначальную активацию паль-
митиновой кислоты, мы можем выразить стехиометрию этой реакции
в энергетических терминах, допуская образование 34 моль Н2О
при синтезе АТФ:
СН3(СН2)14СООН + 8K0ASH + 7О2 + 34АДФ + 34ФН —
— 8СН3СО—SKoA + 34АТФ + 42Н2О.
Таким образом, хотя 0-окисление происходит в присутствии кисло-
рода, в энергетическом отношении этот процесс сходен с анаэроб-
ной последовательностью гликолитических реакций, поскольку
оба процесса ведут лишь к частичному окислению исходных сое-
динений, и выход энергии составляет лишь часть общего теорети-
чески возможного выхода.
Как и при катаболизме углеводов, завершение окисления жир-
ных кислот требует участия цикла лимонной кислоты. Это явствует
5. липиды 225
из стехиометрии окисления в цикле Кребса продуктов, возникаю-
щих при окислении пальмитиновой кислоты:
8 Ацетил-КоА +16О2 + 96АДФ + 96ФН — 16СО2 + 8К oASH -f-
+ 96АТФ + 104Н2О.
Таким образом, выход энергии при этом общем конечном пути
катаболизма примерно в 3 раза больше, чем при самом 0-окислении;
суммарный выход АТФ, как было отмечено выше, составляет
130 моль на каждый моль полностью окисленной пальмитиновой кис-
лоты. Поток электронов, направленный на участвующие в 0-окис-
лении дегидрогеназы, зависит, конечно, от условий регуляции этого
потока в участках сопряжения вдоль дыхательной цепи; цикл
лимонной кислоты также играет первостепенную роль в поддер-
жании нормального уровня функционирования процесса путем
удаления образующегося продукта — ацетил-КоА. Нарушение в
печени нормального течения цикла лимонной кислоты приводит,
как было кратко отмечено в гл. 3 (более подробное обсуждение
этого вопроса будет представлено ниже, в разделе, посвященном
регуляции обмена жирных кислот), к накоплению ацетильных
групп и отвлечению этих углеродсодержащих соединений от уча-
стия в окислительных процессах на образование кетоновых тел.
Хотя последние, поступая через печень в кровоток, могут подвер-
гаться метаболизму в качестве дающих энергию субстратов, избы-
точное накопление этих соединений ведет к серьезным патологи-
ческим изменениям.
СИНТЕЗ ЖИРНЫХ кислот
До сих пор мы рассматривали процессы обмена жирных кислот,
поступающих в печень в конечном счете из пищи. За исключением
полиненасыщенных незаменимых жирных кислот, все другие жир-
ные кислоты, необходимые либо как структурные липиды для
построения мембран, либо для создания тканевых депо, в организме
человека синтезируются. Этот суммарный синтез жирных кислот
de novo называется липогенезом; печень — это тот орган, который
занимает одно из первых мест по интенсивности данного процесса.
Хотя любое вещество, для которого конечным продуктом обмена
является ацетил-КоА, используется как предшественник при ли-
погенезе, наиболее важным материалом для последнего служат
углеводы. Рассмотрим, например, процессы, происходящие в ор-
ганизме человека после сытного обеда, когда в клетках печени
накапливается избыток глюкозы. После восполнения любого воз-
никшего ранее дефицита гликогена в печени дальнейший синтез
этого полисахарида ограничивается рассмотренной в гл. 4 системой
регуляции, функционирующей по принципу обратной связи. Те-
перь избыток глюкозы будет расщепляться до ацетил-КоА и СО2,
Митохондриальное
пространство
Цитозоль
Пируват
4
о
II
ch3cskoA
Ацетил-КоА
(Синтетаза)
Оксало'
* ацетат
Цитрат
*KoASH
Мембрана
О
п
CH3CSK0A
Ацетил-КоА
расщепляющий''
фермент)
Оксало-
ацетат
(Карбоксилаза)
соон
CHjCSKoA
- .-г* анлГ.а Малонил-КоА
С02 АТФ АДФ+ФН
Биотин
—АДФ+4^
— АТФ
Цитрат +КоЛ5Н
Пальмитил-КоА
Фосфоглицериды
(Синтетаза)
(7К)
18:0
18:1
Рис. 5-7. Три этапа биосинтеза
Фосфатидная
кислота
ТриацилелицериЬы
жирных кислот»
5. липиды 227
которые необходимы для образования жирных кислот. В общем
можно сказать, что во всех случаях, когда потребление углеводов
превышает энергетические потребности организма, этот избыток
превращается в жиры.
Липогенез — это не просто процесс, обратный 0-окислению.
Подобно тому как это имеет место при гликогенезе и гликогенолизе,
процессы анаболизма и катаболизма жирных кислот осуществля-
ются путем совершенно различных реакций. Одно различие заклю-
чается в том, что синтез протекает вне митохондрий, в цитозоле.
Другое различие состоит в том, что, хотя кофермент А имеет важное
значение для липогенеза, промежуточные продукты этого процесса
присоединяются к сульфгидрильной группе белка, известного
под названием ацилпереносящий белок (АПБ). В-третьих, липогенез
требует участия реакции карбоксилирования с вовлечением СО,,
АТФ и кофермента биотина, которые не нужны при 0-окислении.
Наконец, процессы, обратные этапам окисления, которые при
0-окислении требуют участия коферментов ФАД и НАД+, при
липогенезе проявляют абсолютно специфическую потребность в
НАДФ-Н для обеспечения восстановительных эквивалентов.
Для удобства рассмотрим биосинтез жирных кислот как процесс,
складывающийся из трех этапов (рис. 5-7): (1) обеспечение исход-
ного материала, ацетил-КоА, который образуется в митохондриях
и должен быть перенесен наружу, в цитозоль, 2) карбоксилиро-
вание ацетил-КоА с образованием истинного субстрата липогенеза
малонил-КоА и 3) конденсация этих двухуглеродных фрагментов
и их восстановление с образованием высших насыщенных жирных
кислот, главным образом пальмитиновой.
Хотя реакции липогенеза происходят в цитозоле, исходный
материал, ацетил-КоА, образуется в митохондриях. Поскольку
внутренняя митохондриальная мембрана непроницаема для кофер-
мента А и его производных, ацетил-КоА первоначально должен
быть превращен в соединение, способное проникнуть сквозь эту
мембрану. Такое превращение может быть осуществлено путем
взаимодействия ацетил-КоА и оксалоацетата с образованием цит-
рата; митохондриальная мембрана обладает специфическим центром
переноса, или транслоказной системой, для таких трикарбоновых
кислот, как цитрат и изоцитрат. Как только цитрат достигает ци-
тозоля, он превращается обратно в ацетил-КоА плюс оксалоацетат
при участии цитрат-расщепляющего фермента: эту реакцию
нельзя рассматривать как обратную той, которую катализирует
конденсирующий фермент; она представляет собой процесс, тре-
бующий доставки энергии в виде АТФ, а также кофермента А.
Оксалоацетат может быть перенесен обратно в интрамитохондри-
альное пространство при помощи специфической транслоказы для
этой дикарбоновой кислоты. Таким путем оксалоацетат играет
каталитическую роль рукоятки, которая переносит ацетильную
228 в. липиды
группу из интрамитохондриалыюго пространства в цитозоль;
клетка должна пожертвовать молекулу АТФ для того, чтобы об-
легчить работу этого цикла переноса.
Второй этап липогенеза — карбоксилирование ацетил-КоА —
осуществляется в цитозоле при участии фермента, называемого
ацетил-КоА — карбоксилазой; в активном центре этого фермента
содержится связанный витамин биотин. В присутствии АТФ мо-
лекула двуокиси углерода связывается с биотиновой простатиче-
ской группой фермента, образуя весьма реакционноспособный
карбоксибиотин:
1. СО, + Биотин — Фермент+АТФ —► Карбоксибиотин —
— Фермент + АДФ 4- Фн.
В такой активированной форме карбоксильная группа легко пе-
реносится на ацил-КоА, образуя содержащее свободный карбоксил
соединение малонил-КоА:
СООН
I
2. Карбоксибиотин—Фермент 4-СН3СО —SKoA —> СН2СО—
—SKoA + Биотин — Фермент.
Эта реакция формально идентична карбоксилированию пирувата
при участии пируваткарбоксилазы. И в этом случае клетка расхо-
дует молекулу АТФ при активации ацетил-КоА для его подго-
товки к участию в реакции конденсации в ходе липогенеза. Этап
карбоксилирования, как это будет показано ниже, представляет
собой первостепенной важности регулятор синтеза жирных кислот,
поскольку он контролирует включение в этот процесс двух угле-
родных фрагментов.
Во всех последующих этапах липогенеза участвуют либо мало-
нильная, либо ацетильная группа, хотя их активированные карбок-
силы переносятся от KoASH на АПБ-SH (рис. 5-8). Все углеродные
атомы синтезируемой жирной кислоты, за исключением тех двух
атомов, которые занимают концевое положение (СН3СН2—) и ведут
свое происхождение от ацетил-АПБ, получаются в конечном счете
из малонил-АПБ. Более того, хотя процесс карбоксилирования
представляет собой важный пусковой этап липогенеза, присоединя-
емая —СООН отделяется от малонил-КоА в виде СО2 в ходе реакций
конденсации. Поэтому фактически все углеродные атомы жирной
кислоты в конечном счете происходят из ацетил-КоА и ни одна из
молекул СО2, присоединяемых при карбоксилировании, не вклю-
чается в жирные кислоты. Как и в случае глюконеогенеза, мы имеем
дело с такой ситуацией, когда процесс биосинтеза, казалось бы,
сопровождается неэкономным расходованием запасов энергии в
клетке, используя сложный механизм активации, вместо того
чтобы просто осуществить реакцию, обратную катаболической. Как
5 ЛИПИДЫ 229
Ацетил- КоА
АПБЭН
KoASH
Л/алонил-КоА
СНЛ
I
БАПБ
Рис. 5-8. Роль ацил-переносящегобелка (АПБ) и НАДФ.Н в восстановительном
биосинтезе жирных кислот.
и при шунтировании от пирувата до фосфоенолпирувата в процессе
глюконеогенеза, биологическое значение образования малонил-КоА
за счет АТФ и последующего декарбоксилирования заключается
в обеспечении движущей силы для осуществления энергетически
неблагоприятствуемой реакции, т. е. для образования ацетоацетиль-
ной группы из двух ацетильных групп. В процессе 0-окисления
снижение энергии при тиолазной реакции, участвующей на этапе
расщепления при протекании процесса в прямом направлении,
столь велико, что осуществление обратной реакции конденсации
на основе такого механизма обычно сопровождается низкими вы-
ходами ацетил-КоА. Этот энергетический барьер преодолевается
путем использования весьма реакционноспособной малонильной
группы для осуществления первого, ключевого этапа конденсации,
который приводит к образованию ацетоацетил-Б-АПБ и СО2.
Последующие этапы синтеза жирных кислот в цитоплазме
сходны с реакциями, обратными реакциям митохондриального
0-окисления. Кетогруппа в 0-положении первоначально восстанав-
ливается при участии НАДФ-Н до гидроксильной группы; в ре-
зультате реакции дегидратации образуется двойная связь; с обра-
230 6. липиды
зующимся бутирил-Б-АПБ затем конденсируется вторая малониль-
ная группа, что ведет к образованию шестиуглеродного соединения
Р-кетоацил-Б-АПБ. Этот цикл восстановлений и дегидратаций по-
вторяется, таким образом, до тех пор, пока не образуется в конеч-
ном счете 16-углеродный пальмитил-Б-АПБ (рис. 5-8). Только
после достижения этого завершающего этапа процесса биосинтеза
алифатическая ацильная цепь освобождается от комплекса фер-
ментов, синтезирующих жирные кислоты, которые вытесняются
Ко ASH с освобождением пальмитил-КоА.
Осуществление этого процесса со всеми промежуточными про-
дуктами прочно связано с большим многоферментным комплексом
синтетазой жирных кислот. Можно вычислить суммарные стехио-
метрические соотношения в процессе, катализируемом синтетазой
жирных кислот:
Ацетил-КоА+ 7Малонил-КоА 4- 14НАДФ-Н-4- 14Н+ —<
—>-Пальмитил-КоА + 7КоА + 7С024- 14НАДФ+ 4-7Н2О.
Для того чтобы оценить общее поступление энергии, мы должны
допустить, что АТФ требуется: 1) для перемещения ацетил-КоА
в цитоплазму из митохондрий (этап расщепления цитрата) и 2) для
образования малонил-КоА из ацетил-КоА (ацетил-КоА-карбокси-
лазный этап):
8 Ацетил-КоА+ 15АТФ+14НАДФ • Н+14Н+—>- Пальмитил-КоА+
+ 15АДФ + 15Фн + 7КоА+ 14НАДФ+ +7Н2О.
Пальмитил-КоА способен к самым разнообразным метаболи-
ческим превращениям (рис. 5-7). Как в митохондриях, так и в эн-
доплазматическом ретикулуме он может быть удлинен на два атома
углерода за один этап. Пальмитат и образующаяся при его уд-
линении стеариновая кислота (18 : 0) могут подвергаться десату-
рации в эндоплазматическом ретикулуме с образованием мононе-
насыщенных жирных кислот: пальмитолеиновой (16 : 1) и олеи-
новой (18 : 1) соответственно. Пальмитил-КоА может подвергаться
этерификации при взаимодействии с гидроксильными группами
а-глицерофосфата, образуя фосфатидную кислоту, которая пред-
ставляет собой ключевой промежуточный продукт в процессах
биосинтеза как жиров, так и фосфолипидов. Пальмитил-КоА
может быть этерифицирован до диацилглицерина, который обра-
зуется при дефосфорилировании фосфатидной кислоты до триацил-
глицерина (в печени, как и в большинстве тканей, не происходит
ни образования моноацилглицеринов, ни их этерификации до
диацилглицеринов, как это имеет место в клетках слизистой же-
лудочно-кишечного тракта). Наконец, пальмитил-КоА может быть
перенесен обратно в митохондрии либо в виде свободной кислоты,
либо в виде карнитинового эфира для участия в 0-окислении,
если энергетические запасы в клетке окажутся на низком уровне.
s. липиды 231
РЕГУЛЯЦИЯ ОБМЕНА
ЖИРНЫХ КИСЛОТ
Поддержание определенного соотношения между катаболизмом
и анаболизмом жирных кислот в печени связано с воздействием
метаболитов внутри клетки, а также с влиянием на этом фоне внеш-
них сил, таких, как гормональные факторы и потребляемая пища.
Эти воздействия, очевидно, зависят от соотношений с метаболизмом
других соединений (углеводы и белки), от запаса энергии в клетке
печени и от перемещения липидов между печенью и другими тка-
нями нашего тела. По отношению к другим тканям печень играет
роль, подобную ее роли в поддержании постоянства уровня глю-
козы в крови, поскольку печень вносит существенный вклад в
обеспечение нормального содержания белков, фосфолипидов, хо-
лестерина и некоторых липопротеидов плазмы; печень является
важнейшим потребителем жира хиломикронов и фонда свободных
жирных кислот плазмы крови.
При регуляции 0-окисления первостепенное значение имеет
доступность субстрата (рис. 5-9). Поступление жирных кислот в
клетки печени обеспечивается: 1) захватом неэтерифицированных
жирных кислот, доставляемых в печень из жировой ткани (регу-
Рис. 5-9, Три источника жирных кислот в клетках печени.
232 5. ЛИПИДЫ
Рис. 5-10. Регуляция обмена жирных кислот в печени энергетическими уровнями.
Высокие концентрации АДФ ускоряют окисление жирных кислот, а также окисление обра-
зующихся водородов и ацетил-КоА. Высокие концентрации АТФ тормозят окисление этих
конечных продуктов катаболизма жирных кислот и способствуют биосинтезу жирных кислот
и продуктов их этерификации
ляция выхода жирных кислот из жировых клеток осуществляется
главным образом гормонами, как это будет изложено в следующем
разделе); 2) захватом жирных кислот, освобождаемых при воздей-
ствии внеклеточной липазы на хиломикроны (наиболее существен-
ные изменения в поступлении субстрата из этого источника обуслов-
лены содержанием жиров в пище) и 3) освобождением жирных
кислот под действием внутриклеточной липазы из триглицеридов
печени. Как и в случае липазы жировой ткани, которую мы будем
обсуждать в следующем разделе, действие липазы печени стиму-
лируется теми гормонами, которые способствуют повышению со-
держания циклического АМФ в результате активации аденилат-
циклазной системы; в печени, таким образом, действие глюкагона
вносит важный вклад в увеличение внутриклеточного образования
жирных кислот.
Вторым контролирующим фактором — как и при регуляции
всех окислительных реакций, которые сопряжены с функциониро-
ванием дыхательной цепи,— является уровень запаса энергии в
клетке (рис. 5-10). Цикл р-окисления в митохондриях зависит от
потока электронов через центры сопряжения с окислительным
фосфорилированием; таким образом, общая скорость потребления
жирных кислот путем их окисления зависит от соотношения кон-
центраций АДФ и АТФ. Когда содержание АДФ находится на вы-
соком уровне (клеточные резервы энергии малы), могут протекать
реакции сопряжения, что способствует синтезу АТФ и поддержанию
потока электронов от флавопротеид- и НАД-зависимых дегидро-
геназ, участвующих в р-окислении. С другой стороны, когда по-
вышено содержание АТФ, упомянутые выше реакции тормозятся
по механизму дыхательного контроля; накапливающиеся жирные
5 ЛИПИДЫ 233
Рис. 5-11. Образование кетоновых тел в печени и их использование в других тка-
нях.
Избыточное образование кетоновых тел (кетоз) возникает в условиях преобладания катабо-
лизма жирных кислот по сравнению о катаболизмом углеводов.
кислоты используются для биосинтеза жиров или фосфолипидов,
а суммарный синтез пальмитата и других высших жирных кислот
в печени повышается.
Способность цикла лимонной кислоты катаболизировать ацетил-
КоА, образующийся при Р-окислении, имеет исключительно важ-
ное значение в реализации общего энергетического потенциала
катаболизма жирных кислот, а также в предотвращении нежела-
тельного накопления кетоновых тел. К числу последних относятся
ацетоуксусная кислота и продукты ее восстановления или декар-
боксилирования, ^-оксибутират и ацетон соответственно. Эти
вещества могут образоваться в ходе реакции, обратной тиолазной,
которая в норме благоприятствует расщеплению образующегося
при р-окислении остатка ацетоацетила, но которая может быть
направлена в сторону обратного процесса конденсации двух моле-
кул ацетил-КоА, когда их концентрация повышена. Из ацетоацетил-
КоА могут образоваться либо стерины, либо свободная ацетоук-
сусная кислота, как это будет показано в следующем разделе,
посвященном обмену холестерина.
В норме в митохондриях печени образуется небольшое коли-
234 5. липиды
чество кетоновых тел, диффундирующих из печени в кровоток.
Скелетная и сердечная мышцы, мозг и другие внепеченочные ткани
способны превращать ацетоуксусную кислоту вновь в ацетил-КоА;
таким образом эти ткани могут обеспечить значительную долю их
энергетических потребностей в состоянии покоя за счет катаболизма
кетоновых тел. Печень же не способна использовать свободную
ацетоуксусную кислоту, отделившуюся от остатка КоА, и поэтому
в самой печени не может происходить окисление кетоновых тел.
Как уже обсуждалось в разделе, посвященном регуляции цикла
лимонной кислоты, образование кетоновых тел в печени опреде-
ляется в первую очередь соотношением между образованием ацетил-
КоА (главным образом путем р-окисления) и содержанием оксало-
ацетата, который образуется путем карбоксилирования пирувата
и, следовательно, зависит от адекватного использования углеводов
(рис. 5-11). Таким образом, ускоренный катаболизм жирных кис-
лот или сниженный уровень использования углеводов (как порознь,
так и в сочетании) могут приводить к образованию в печени такого
избытка кетоновых тел, что внепеченочные ткани не справляются
с их утилизацией. В тех случаях, когда накапливаются соединения,
обладающие свойствами кислот, снижается pH биологических
жидкостей и развивается метаболический ацидоз. При большом
избытке кетоновых тел они выводятся почками, т. е. возникает
кетонурия. В крайне тяжелых случаях ацетон выводится через
легкие и может быть обнаружен в выдыхаемом воздухе. Голодание
и диабет, ведущие к усиленному освобождению жирных кислот из
тканевых депо и к снижению метаболизма углеводов в печени,—
вот две наиболее обычные причины кетоза.
Регуляция синтеза жирных кислот de novo определяется также
доступностью субстрата и энергии (рис. 5-12). Как и в случае 13-
окисления, чрезвычайно важны взаимосвязи с обменом углеводов
вообще и с фосфоглюконатным путем и циклом лимонной кислоты
в частности. В значительной мере фосфоглюконатный путь обес-
печивает НАДФ-Н для восстановительных реакций при биосинтезе
жирных кислот. Глюкозо-6-фосфат — дегидрогеназная реакция бло-
кируется высшими жирными кислотами; следовательно, образова-
ние НАДФ-Н при этом процессе максимально только в тех случаях,
когда концентрации жирных кислот низки, что является сигналом
о необходимости ускорения синтеза.
Другой источник НАДФ-Н — реакция, катализируемая фер-
ментом малатдегидрогеназой,— также имеет важное значение для
синтеза жирных кислот в печени. К такому выводу приводит тот
факт, что содержание упомянутого фермента в печени нарастает
при изменениях условий питания, способствующих усиленному
синтезу жирных кислот в печени (например, при переходе на бо-
гатую углеводами или бедную жирами диету). Таков один из при-
меров общего приспособления процессов обмена веществ в печени
Глюкоза-6-Ф
Пентозо-Ф
Пируват
Малонил-КоА
Цитозоль
АТФ
Митохондрия
> Алифатический
ацил-КоА
Фосфо-
глицериды
Триацил-
глицериды
(Малатдегидро-
геназа)
Богатая углеводами
'X' пища vZ
Малат
Малат
Богатая углеводами
С02 (Карбоксилаза)
Ацетил-КоА
Расщепляющий
% фермент
Цитрат
Ацетил-КоА
Оксалоацетат
Цитрат
Изоцитрат
Изоцитрат
Рис. 5-12. Регуляторные факторы, воздействующие на биосинтез жирных кислот в печени.
Стимулирующие факторы обозначены заключенными в кружок знаками плюс и стрелкой, указывающей стимулируемую реакцию; негативные
модификаторы обозначены заключенными в кружок знаками минус и стрелкой, указывающей ингибируемую реакцию.
236 5. липиды
и в жировой клетчатке к изменяющимся в зависимости от пищевого
режима потребностям в синтезе жиров.
Регуляция цикла лимонной кислоты важна главным образом
в связи с обеспечением поступления цитрата, который служит не
только имеющим первостепенное значение источником ацетил-КоА,
но также важным аллостерическим регулятором синтеза жирных
кислот. Для накопления достаточных количеств цитрата и перехода
его в цитозоль в митохондриях должны быть созданы значительные
энергетические резервы. Повышение концентрации АТФ блокирует
изоцитратдегидрогеназную систему по механизму аллостериче-
ского ингибирования, что вызывает накопление в митохондриях
трикарбоновых кислот. После миграции во внемитохондриальное
пространство цитрат может быть расщеплен до ацетил-КоА и ок-
салоацетата; АТФ-зависимый фермент, расщепляющий цитрат,
также находится под контролирующим воздействием внешних
факторов, поскольку его активность снижается при голодании и
диабете, а его синтезу способствует переход на богатый углеводами
или бедный жирами рацион.
Соли трикарбоновых кислот цитрат и изоцитрат играют также
роль мощных модулирующих эффекторов ацетил-КоА—карбокси-
лазы — ключевого регулирующего фермента в процессе синтеза
жирных кислот. Повышение концентрации цитрата или изоцитрата
вызывает положительное аллостерическое модифицирование этого
фермента путем повышения максимальной скорости катализируемой
им реакции (Vmax).
Следовательно, образующийся в митохондриях цитрат способ-
ствует усиленному образованию малонил-КоА в цитоплазме двумя
путями: обеспечивая ацетил-КоА в качестве субстрата в оптималь-
ных количествах для карбоксилирования и стимулируя активность
упомянутой карбоксилазы. Процессы синтеза ацетил-КоА — кар-
боксилазы и синтетазы жирных кислот могут находиться под воз-
действием контролирующих факторов такого же типа, как и фер-
мент, расщепляющий цитрат, поскольку активность этих ферментов
липогенеза в печени возрастает при переходе на рацион, богатый
углеводами или бедный жирами. В конечном счете регуляция обес-
печивается снижением активности ацил-КоА — карбоксилазы и
ферментного комплекса синтетазы жирных кислот по принципу
торможения конечным продуктом реакции — за счет накопления
алифатических ацил-КоА. Таким образом, накопление продуктов
синтеза жирных кислот автоматически блокирует процесс их об-
разования; любой избыток КоА-производных высших жирных кис-
лот в печени при наличии достаточных запасов энергии будет
превращен в жиры и фосфолипиды для переноса в жировые депо
и другие внепеченочные ткани.
Б. липиды 237
ОБМЕН ХОЛЕСТЕРИНА
Стерины и их производные относятся к незаменимым компонен-
там нашего тела. В отличие от триацилглицеридов, которые служат
просто энергетическими резервами, холестерин и его сложные
эфиры с жирными кислотами являются важными компонентами
структуры клеточных мембран, а также предшественниками таких
выполняющих разнообразные и важные функции в организме
производных, как соли желчных кислот, стероидные гормоны и
витамин D. Регуляции обмена холестерина принадлежит ведущая
роль в поддержании нормального состояния сердечно-сосудистой
системы; нарушение обмена холестерина сопровождается развитием
симптомов атеросклероза, как это будет рассматриваться далее в
разделе, посвященном липидам крови. В значительной мере про-
цессы катаболизма и биосинтеза, которые определяют обновление
фонда холестерина в организме, осуществляются в печени, в желч-
ных путях, в слизистой кишечника и в системе внутрипеченочной
циркуляции. В соответствии с этим обмен холестерина наиболее
удобно рассматривать в этом общем контексте (рис. 5-13).
Как было отмечено в разделе, посвященном всасыванию липи-
дов, небольшие количества холестерина могут в кишечнике обра-
зовывать мицеллы с солями желчных кислот и благодаря этому
проникать в клетки слизистой кишечника и в составе хиломик-
ронов попадать в общий кровоток. В кишечнике человека коли-
чество всасывающегося холестерина строго ограничено (максимум
около 0,5 г в день); избыток холестерина, поступающий в кишечник
с пищей, выводится с фекалиями. Холестерин хиломикронов в
значительной мере задерживается в печени, где он может либо
подвергаться эстерификации, взаимодействуя с КоА-производными
жирных кислот и образуя сложные эфиры холестерина в мембранах
печеночных клеток, либо превращается в соли желчных кислот.
Этот последний путь превращения, очевидно, представляет собой
важнейшее направление катаболизма, если учитывать общее коли-
чество стеринов, участвующих в процессах обмена веществ в че-
ловеческом организме. Более того, образование солей желчных
кислот в печени тщательно регулируется по принципу отрицатель-
ной обратной связи. Соли желчных кислот, возвращаемые системой
внутрипеченочной циркуляции, действуют как ингибиторы тех
ферментов печени, которые участвуют в окислении холестерина до
желчных кислот. Следовательно, усиленная экскреция солей желч-
ных кислот с фекалиями, предотвращающая обычный процесс ин-
гибирования по принципу обратной связи, приводит к усилению
катаболизма холестерина путем окисления и, таким образом, к
уменьшению общего фонда холестерина в организме. Такое эк-
скретирование солей желчных кислот может быть осуществлено,
например, путем приема холестирамина — соединения, образую-
238 5. липиды
Рис. 5-13. Роль печени в обмене холестерина и солей желчных кислот.
щего с солями желчных кислот не поддающийся обратному вса-
сыванию комплекс. Этот комплекс выводится, снижая тем самым
концентрацию холестерина в сыворотке крови.
Как печень, так и клетки слизистой оболочки кишечника спо-
собны к синтезу холестерина de novo из ацетил-КоА (рис. 5-14).
Этот путь сложен, и его подробности здесь рассматриваться не
будут. Первые этапы биогенеза стеринов составляют наиболее
важные для этого процесса в целом реакции, выделяющие эту си-
стему среди других цепей биохимических превращений липидного
обмена и играющие центральную роль в функции регуляторных
механизмов. Как и в случае системы синтеза жирных кислот, пер-
вым этапом является образование ацетоацетильной группы, но
этот процесс, вероятно, осуществляется в результате реакции,
обратной тиолазной. На следующем этапе в процессе конденсации
5. ЛИПИДЫ 239
> Ацетоацетат
Ацетил-КоА
CHjC-SKoA KoASH
О (Тиолаза) О О (Сиитпетаза) ОН О (Лиаза)
СНдС-SKoA СН3—С—СН2-С—SKoA —- ^CH3-C-CH2-C-SKoA
О / СН2-СООН
CH3C-SK0A KoASH ОМГ-КоА
Рис. 5-14. Биосинтез холестерина»
Стрелками о заключенными в кружок знаками минус обозначены регуляторные механизмы,
которые функционируют на основе принципа отрицательной обратной связи.
участвует третья молекула ацетил-КоА, образуя важный шести-
углеродный промежуточный продукт р-окси-0-метилглутарил-КоА
(ОМГ-КоА). В печени эта последняя молекула представляет собой
общий предшественник либо свободной ацетоуксусной кислоты,
либо холестерина. Ключевой реакцией синтеза стеринов представ-
ляется следующая реакция, в результате которой ОМГ-КоА вос-
станавливается при участии двух молекул НАДФ-Н до мевалоно-
вой кислоты (3,5-диокси-3-метилвалериановая кислота). Эта ре-
акция, катализируемая специфическим ферментом ОМГ-КоА—ре-
дуктазой, необратима и является первым определяющим звеном
длинной цепи реакций, ведущей к построению циклической струк-
туры холестерина. Целый ряд энергозависимых этапов лежит на
пути, ведущем к конденсации 6 изопреноидных 5С-промежуточных
продуктов (которые образуются при декарбоксилировании мева-
лоновой кислоты) при построении ЗОС-соединения сквалена, которое
циклизуется в стериновое кольцо.
У некоторых животных (например, у крысы) активность пече-
ночной ОМГ-КоА—редуктазы находится под регуляторным воздей-
ствием стеринового конечного продукта, воздействием, осуществ-
ляемым по принципу отрицательной обратной связи. Если животное
получает богатую холестерином пищу, то биосинтез холестерина
тормозится в результате блокирования этой реакции, участвующей
в осуществлении начального этапа процесса. Этот механизм не
представляется важным в организме человека в первую очередь
потому, что всасывание холестерина из кишечника ограничено, а
240 5. ЛИПИДЫ
печеночный фермент, по-видимому, не реагирует на изменения
концентрации холестерина в крови. Значительная доля общего
количества холестерина в организме человека синтезируется, од-
нако, в клетках слизистой оболочки желудочно-кишечного тракта.
В этих клетках кишечника биосинтез холестерина регулируется по
принципу обратной связи через ключевой фермент ОМГ-КоА —
редуктазу желчными кислотами, но не холестерином. Таким об-
разом, синтез стеринов, образование желчных кислот и рецирку-
ляция солей желчных кислот составляют, как можно видеть, само-
регулирующуюся систему.
Образуемый в печени холестерин покидает этот орган двумя
путями: часть холестерина попадает в кровоток и подвергается эте-
рификации за счет фосфатидилхолина, а часть выводится с желчью
вместе с мицеллами солей желчных кислот. Важным следствием
существования этого последнего пути является патологическое
отложение избытка холестерина, накапливающегося в виде желч-
ных камней, способных вызвать закупорку желчного протока.
ОБМЕН ФОСФОЛИПИДОВ
Подобно стеринам, фосфолипиды представляют собой незамени-
мые компоненты клеточных мембран печени и других тканей.
Биологические мембраны в основе своей структуры имеют молекулы
фосфолипидов, расположенные таким образом, что они образуют
слои, подобные слоям солей желчных кислот в мицелле (гл. 1).
Такие структуры типа сэндвича, образующиеся в результате взаи-
модействия амфипатических фосфолипидов, пронизаны отдельными
молекулами стеринов и функционирующих в мембранах белков.
Последние располагаются или по одну сторону мембраны — либо
на внутренней, либо на наружной поверхности (как обсуждалось
в гл. 3 при рассмотрении вопроса об асимметрии митохондриальных
мембран), или пронизывают гидрофобную зону мембраны, как это
имеет место в случае транслоказных белков, которые участвуют в
перемещении гидрофильных молекул сквозь липидный двухслойный
барьер из одного водного отсека клетки в другой. Главная функция
фосфолипидов, таким образом, сводится к обеспечению фундамен-
тальной структуры мембран как барьеров проницаемости, как
своего рода двумерных строительных лесов для клеток и органелл,
а также как гидрофобной среды для ферментов, связанных с мем-
бранами, в частности тех ферментов, которые участвуют в переносе
электронов, превращениях энергии и поддержании химических
концентрационных градиентов.
Биосинтез фосфолипидов в печени необходим для выполнения
трех главных задач: 1) обеспечения обновления и приспособления
структурных фосфолипидов в мембранных образованиях самой
печени; 2) выработки фосфолипидов, переносимых к другим тканям
5 липиды 241
ОН
Триацилглицерин
Алифатический Л
ацил-КоА'
Цитидинхолин
HO-I
Loh
Глицерин
I ^АТФ
(Киназа) if
Г Алифатический
1 ацил-КоА
G\\.
а-Глицеро-Ф
(Ф) холин
1,2-Диглицерид Фосфатидизхолин
t>r<hi у. Цитидин -@-(£Х этанолами»
Фосфатидил -
этанолами»
(ЗХ)
S-
Аденозил-
метионин
(Дегидрогеназа)
НАДН
-он
Фосфатидная
кислота
I х^ЦТФ
о=
Диоксиацетон-Ф
Глюкоза
Лактат
L о{ф)-(ф)“ цитидин
ЦДФ-диглицерид
Инозит
Этаноламин
^ф)- серин
Фосфатидилсерин
C0z
а-Глицеро-Ф
Фосфатидилинозит
Рис. 5-15. Реакции биосинтеза фосфолипидов.
Фосфатидилглицерин
током крови с липопротеидами плазмы и 3) обеспечения диацил-
глицеридов для биосинтеза жиров в печени. Рассматривая эти
разнообразные функции, проще всего остановиться вначале на
обсуждении последнего из перечисленных пунктов.
Как уже было отмечено выше, печень не располагает источником
моноацилглицерина для синтеза жиров и не имеет ферментов,
ацилирующих этот сложный эфир, подобных тем ферментам, ко-
торые обнаружены в клетках слизистой оболочки кишечника.
Очевидно, диацилглицерин печени образуется из фосфатидной
кислоты. Источником образования последней как промежуточного
продукта, занимающего центральное положение в обмене и жиров,
и фосфолипидов, может быть либо процесс превращения глицерина,
либо гликолиз (рис. 5-15). Глицерин поступает в печень после
воздействия внеклеточной липазы на жиры хиломикронов. Для
242 5. липиды
повторного использования глицерин должен быть подвергнут
фосфорилированию при участии специфической киназы (за счет
АТФ) с образованием а-глицерофосфата. Реакции гликолиза также
могут вести к образованию а-глицерофосфата путем восстановления
триозофосфатного промежуточного продукта диоксиацетонфосфата
при участии специфической дегидрогеназы (за счет НАД-Н). Об-
разуемый в ходе реакций, катализируемых либо глицеролкиназой,
либо а-глицерофосфатдегидрогеназой, а-глицерофосфат подверга-
ется затем этерификации двумя молями алифатического ацил-КоА
с образованием фосфатидной кислоты, или диацилглицерофосфата.
Фосфатидная кислота, будучи сама по себе лишь минорным
компонентом клеток, служит общим предшественником всех других
фосфолипидов, а также предшественником жиров, подвергаясь
дефосфорилированию с образованием диацилглицеринов. При об-
разовании фосфатидилхолина, например, этот диацилглицериновый
остаток взаимодействует с активированной фосфохолиновой группой
нуклеотида цитидиндифосфатхолина (ЦДФ-холин). Эта реакция
аналогична активации глюкозы или галактозы путем взаимодей-
ствия с уридиндифосфатом (УДФ); подобно тому как уридин лежит
в основе построения нуклеотидных коферментов обмена углеводов,
так и цитидин участвует в качестве важного компонента в биосин-
тезе липидов. Путем идентичной реакции осуществляется перенос
фосфоэтаноламиновой группы от ЦДФ-этаноламина на диацил-
глицерин с образованием фосфатидилэтаноламина. Последний также
способен превращаться в фосфатидилхолин в печени путем переноса
трех активированных метильных групп, как это будет рассмотрено
далее в гл. 6. Компоненты, содержащие холин и этаноламин, со-
ставляют в сумме более трех четвертей всех фосфолипидов печени,
а также большинства других тканей.
К числу минорных относятся фосфолипиды, содержащие ино-
зит, глицерин или серин, присоединенные к фосфатидильной группе.
Как в фосфатидилинозите, так и в фосфатидилглицерине, фосфа-
тидильная группа активирована в результате реакции фосфатидной
кислоты с ЦТФ; продукт этой реакции ЦДФ-диглицерид затем
переносит фосфатидильную группу как таковую на молекулу ино-
зита или глицерина. Параллельные системы, обеспечивающие
участие любого из указанных выше активируемых цитидином про-
цессов в биосинтезе фосфатидилсерина, не были, однако, обнару-
жены у высших животных. В печени млекопитающих регенерация
серинового остатка фосфолипидов осуществляется преимущест-
венно путем обменного замещения при участии фосфатидилэта-
ноламина. Фосфатидилсерин подвержен также декарбоксилиро-
ванию до фосфатидилэтаноламина, чем завершается ряд превраще-
ний в печени:
Серин Этаноламин ЗСНа> Холин,
5. липиды 243
где все компоненты, участвующие в этих превращениях, связаны
с фосфатидильной группой (гл. 6).
ОБРАЗОВАНИЕ ЛИПОПРОТЕИДОВ
Фактически все фосфолипиды печени или других тканей входят
в состав мембран; лишь очень немногие из них находятся в раство-
рах или мицеллах. Если фосфолипиды все же встречаются в раство-
римой фазе клеток или в биологических жидкостях, то они непре-
менно связаны со специальными переносчиками белковой природы,
называемыми липопротеидами. Такие комплексы фосфолипидов
с белками-переносчиками представляют собой важную транспорт-
ную форму, используемую для переноса фосфолипидов из области
эндоплазматического ретикулума, где преимущественно осуществ-
ляется их биосинтез, к митохондриям, аппарату Гольджи, плазма-
тической мембране, другим мембранам и органеллам клетки. Ли-
попротеиды участвуют также во внеклеточных перемещениях фос-
фолипидов от печени к другим тканям организма. Как было отме-
чено выше, хиломикроны содержат холестерин и триацилглицерин,
помимо связанных с белками фосфолипидов. Альбумин плазмы
крови также входит в состав липопротеидов, образуя комплексы
со свободными жирными кислотами и другими жирорастворимыми
веществами в крови.
Образование липопротеидов относится к числу важнейших
синтетических функций печени; нарушение биосинтеза белкового
компонента липопротеидов приводит к тяжелым расстройствам
обмена липидов в организме. Нарушение способности крови пере-
носить нормальные количества фосфолипидов и холестерина на-
блюдается при болезни Танжье, которая обусловлена врожденной
недостаточностью образования этого транспортного белка в печени.
Недостаточность синтеза альбумина в печени, приводящая к аналь-
буминемии, обусловливает снижение способности плазмы крови
переносить жирные кислоты, освобождаемые из жировых депо.
Более того, поскольку наиболее важные системы переноса синте-
зируемых в печеночных клетках жиров из печени требуют связы-
вания жиров со специфическими белками для обеспечения переноса
с током крови, любое нарушение образования этих белков может
привести к накоплению избытка триацилглицеринов в клетках.
В этом, вероятно, заключается причина жирового перерождения
печени, наблюдаемого у больных с хронической белковой недоста-
точностью (как было отмечено выше) или у больных, получавших
большие дозы антибиотика тетрациклина, подавляющего синтез
белка.
244 5. ЛИПИДЫ
ЖИРОВАЯ ТКАНЬ
В норме жиры составляют примерно 15% массы тела взрос-
лого здорового человека; в зависимости от возраста, телосложения,
пола возможны вариации в широких пределах. В отличие от за-
пасов гликогена резервы липидов в различных типах клеток нашего
тела встречаются не так часто. Резервы липидов сосредоточены
в определенных анатомических образованиях: в таких частях брю-
шины, как сальник и брыжейка, в подкожной клетчатке, в кост-
ном мозгу. Эти специальные жировые депо составляют высокодиф-
ференцированную жировую ткань, которая содержит специализи-
рованные клетки ретикуло-эндотелиальной системы, называемые
адипоцитами или жировыми клетками. Не следует, однако, делать
на этом основании вывод о метаболической инертности жировых
клеток; правильным является противоположное заключение. Клетки
жировой ткани обладают способностью синтезировать жирные
кислоты, подобно тому как это делают клетки печени в периоды
изобилия, а также располагают активными механизмами катабо-
лизма, освобождающими жирные кислоты для нужд тканей в пе-
риоды лишений. Не следует также думать, что отложения жиров
в жировых тканях служат только энергетическими резервами.
Жировые отложения выполняют и другие важные функции: 1) изо-
лируют глубоко расположенные ткани от чрезмерного воздействия
холода и тепла; 2) предохраняют кости, ткани и внутренние органы
от толчков и ударов и 3) (последнее по порядку, но не по значи-
мости) «сглаживают острые углы» скелета, придавая формам тела
ту нежную округлость, которая представляется эстетичной и при-
влекательной.
Полностью загруженная жировая клетка состоит из тонкого
пояска цитоплазмы, окружающей большую липидную каплю. Ли-
пиды могут составлять до 90% массы жировой ткани; среди этих
липидов 99% приходятся на долю триацилглицерина. В жировых
депо жиры несколько более насыщенны, чем в печени, поскольку
жировая ткань лишена той системы десатурации, с которой свя-
зано образование мононенасыщенных жирных кислот. При липо-
генезе в жировой ткани образуется поэтому преимущественно
пальмитиновая кислота. Тем не менее резервные жиры человека,
получающего произвольную диету, характеризуются высокой сте-
пенью ненасыщенности; более половины жирных кислот прихо-
дится на долю олеиновой (18 : 1) или линолевой (18 : 2) кислот.
Это соотношение постепенно изменяется в сторону приближения к
составу липидов пищи, особенно в отношении содержания поли-
ненасыщенных жирных кислот. Содержание олеиновой кислоты
(18 : 1), которая синтезируется преимущественно в печени, под-
держивается в жировой ткани на уровне, достаточно высоком для
5. Липиды 245
того, чтобы резервные жиры оставались в жидком состоянии для
компенсации изменений условий питания или температуры внешней
среды.
ЛИПОГЕНЕЗ
В образовании жирных кислот de novo и их включении в жиры
жировой ткани участвуют ферменты и системы реакций, подобные
тем, которые обнаружены в печени. Жировая клетка, однако, не
так богато обеспечена цитоплазмой и митохондриями, как пече-
ночная, и, таким образом, процесс липогенеза в жировой ткани в
значительно большей мере зависит от обеспечения его предшест-
венниками, промежуточными продуктами и коферментами. В част-
ности, сочетанные реакции обмена углеводов, в результате которых
образуются ацетил-КоА, АТФ, НАДФ-Н и а-глицерофосфат, ог-
раничивают скорость синтеза жиров. Этот факт объясняет значение
того наблюдения, что количество липидов, которые накапливаются
в жировых депо, определяется в большей мере содержанием в обыч-
ном рационе углеводов, а не жиров.
Использование глюкозы в жировых клетках происходит ча-
стично при участии фосфоглюконатного пути, обеспечивающего
НАД-Н для восстановительных реакций липогенеза (рис. 5-16).
Однако основная доля глюкозы, претерпевающей метаболизм в
жировой ткани (более 80%), вступает в реакции гликолитического
пути и цикла лимонной кислоты, обеспечивая АТФ и митохондри-
альный цитрат, необходимые для образования ацетил-КоА в цито-
золе. По крайней мере половина необходимого НАДФ-Н образу-
ется при участии малатдегидрогеназы, отличающейся высокой
активностью в жировых клетках. Кроме того, реакции гликолиза
имеют особенно важное значение для синтеза жиров в жировой
ткани, поскольку последняя в отличие от печени не обладает спо-
собностью использовать глицерин. В жировых клетках отсутст-
вует фермент глицеролкиназа, и поэтому эти клетки должны полу-
чать весь а-глицерофосфат, необходимый для синтеза фосфатидной
кислоты, путем восстановления диоксиацетонфосфата (образую-
щегося при гликолизе) при участии а-глицерофосфатдегидрогеназы.
Помимо синтеза жиров из глюкозы крови, жировая ткань может
использовать циркулирующие жирные кислоты, которые дости-
гают жировых депо в виде триацилглицерина в составе либо хило-
микронов, либо липопротеидов, синтезируемых в печени. Вот
каким образом сочетанные воздействия условий питания и обмена
веществ в печени могут изменить состав жирных кислот в жировых
депо. Жировые клетки содержат внеклеточную липопротеидлипазу,
которая освобождает жирные кислоты из липопротеидов крови.
Жирные кислоты захватываются жировой тканью, но глицерин
не может быть использован и должен быть возвращен в печень
246 5- липиды
Рис. 5-16, Липогенез в жировой ткани и регуляция биосинтеза жирных кислот.
или другие ткани, где он вновь вовлекается в реакции обмена
веществ. Таким образом, жировая клетка (независимо от того,
использует ли она эндогенно генерируемые жирные кислоты или
жирные кислоты, поступающие с пищей и синтезируемые в пе-
чени) требует одновременного поступления глюкозы для синтеза
а-глицерофосфата, необходимого при синтезе жиров. Этот синтез
осуществляется путем дефосфорилирования фосфатидной кислоты
и ацилирования образующегося диацилглицерина, как это про-
исходит и в печени. Жировая клетка, однако, не способна к обра-
зованию липопротеидов и, следовательно, не может экспортировать
свои жиры в наружную среду и в кровоток; весь образуемый в
жировой ткани триацилглицерин вместо этого секретируется в
резервную каплю на внутренней поверхности этих глобулярных
клеток.
АДАПТАЦИЯ ФЕРМЕНТОВ
И ПИТАНИЕ
О связи между потреблением жиров и образованием жировых
депо уже упоминалось. Более того, как следует из предшествующего
изложения, потребление углеводов с пищей оказывает значитель-
5 ЛИПИДЫ 247
ное воздействие на синтез жиров в жировой ткани. Частично это
обусловлено просто стимуляцией синтеза жиров в печени, а также
обеспечением большого количества глюкозы в качестве субстрата,
поддерживающего липогенез в самих жировых клетках. Значение
последнего фактора иллюстрирует, например, один из эффектов
инсулина, а именно стимуляция захвата и использования глюкозы
жировыми клетками, что способствует тем самым резкому уско-
рению липогенеза в жировых депо. Высококалорийная и особенно
богатая углеводами пища поэтому способствует синтезу жиров по
закону действия масс (рис. 5-16).
Другой тип адаптации к условиям питания осуществляется
параллельно описанной выше адаптации процессов обмена веществ
в печени, а именно адаптивным изменением активности ферментов
в результате аллостерической модификации, а также изменением
содержания ферментов, обусловленным воздействиями на синтез
белка (рис. 5-16). К первой категории относится активация ацетил-
КоА — карбоксилазы, которая, как и в печени, стимулируется
повышением концентрации цитрата в жировых клетках, что, таким
образом, обеспечивает максимальный уровень синтеза жиров только
в тех случаях, когда в клетках имеется большое количество глю-
козы, подвергающейся метаболизму. Ко второй категории отно-
сится регуляция синтеза ключевых ферментов обмена глюкозы и
липогенеза. При голодании, например, активность липопротеид-
липазы в жировой ткани подавлена, что предотвращает использо-
вание триацилглицеринов циркулирующих липопротеидов для
образования резервных форм жиров и обеспечивает возможность
их использования вместо этого для удовлетворения повышенных
энергетических потребностей других тканей. При голодании до-
полнительные регуляторные механизмы участвуют в уменьшении
генерирования НАДФ-Н в ходе реакций фосфоглюконатного пути
и при реакции, катализируемой малатдегидрогеназой, в умень-
шении образования ацетил-КоА в результате убыли количества
фермента, расщепляющего цитрат, и в уменьшении использования
ацетил-КоА путем снижения активностей как ацетил-КоА — кар-
боксилазы, так и синтетазы жирных кислот в жировой ткани.
Такое избирательное блокирование синтеза ферментов в жировой
ткани сохраняет резервы глюкозы в организме для использования
в ходе процессов, требующих энергетического обеспечения, но после
возвращения к рациону с нормальным количеством калорий за
несколько дней происходит устранение описанных эффектов бло-
кирования. Богатый углеводами или бедный жирами рацион спо-
собствует дальнейшему усилению синтеза этих ферментов липо-
генеза, обеспечивая усиленное образование жиров в жировых
депо.
248 5. липиды
ЛИПОЛИТИЧЕСКИЕ СИСТЕМЫ
И ИХ ГОРМОНАЛЬНАЯ
РЕГУЛЯЦИЯ
Помимо внеклеточной липазы, жировая клетка содержит внут-
риклеточную липазную систему, действующую только на жировую
каплю, предназначенную для депонирования (рис. 5-17). В про-
цессе внутриклеточного липолиза действуют два фактора: 1) ли-
паза, которая медленно воздействует только на триацилглицерины
и стимулируется циклическим АМФ, и 2) фермент, который пол-
ностью гидролизует диацилглицерины до глицерина, как только
они образуются под влиянием первой липазы. Поскольку именно
первый фермент лимитирует скорость процесса липолиза триацил-
глицерина в целом и поскольку циклический АМФ образуется при
участии аденилциклазы в ответ на ее активацию некоторыми гор-
монами, весь процесс, ведущий к освобождению жирных кислот
из жировой ткани, часто считают обусловленным воздействием
липазы, чувствительной к гормонам. Эти жирные кислоты вновь
используются жировыми клетками и вновь включаются в состав
жиров; однако, как правило, гормональный сигнал, приводящий к
освобождению жирных кислот, ассоциируется с повышенной по-
требностью других клеток в метаболической энергии. В этих по-
следних случаях свободные жирные кислоты из тканевых депо по-
ступают в кровоток и разносятся к другим областям тела в виде
АТФ Циклический
Жирные кислоты
Глицерин крови
чувствительная пи
липаза)
Триацилглицерин 1,2-Диацилглицерин
ГОН
но-
(Диацилглицерин*
гидролаза)
Loh
Глицерин
Рис. 5-17. Внутриклеточный липолиз в жировой ткани и его гормональная регу-
ляция,
5 ЛИПИДЫ 24$
комплексов с альбумином плазмы. Образующийся глицерин не
может быть вновь использован жировыми клетками и количест-
венно освобождается в кровоток.
Мембрана жировой клетки обладает двумя типами рецепторов
гормонов: 1) рецепторы, взаимодействующие с такими гормонами,
как катехоламины (адреналин или норадреналин), которые уси-
ливают образование циклического. АМФ при участии аденилцик-
лазы и, следовательно, активируют липолиз, и 2) рецепторы инсу-
лина, которые противодействуют активации аденилциклазы этими
стимулирующими гормонами; стимуляция рецепторов инсулина,
таким образом, ведет к снижению концентрации циклического АМФ
и подавлению липолиза. Этот эффект инсулина иллюстрируется,
например, его воздействием на обмен веществ в жировой ткани
при сахарном диабете; отсутствие инсулина при этом заболевании
приводит к бесконтрольной стимуляции внутриклеточной липазы
липолитическими гормонами; наблюдается четко выраженная мо-
билизация свободных жирных кислот из жировых клеток. По-
добное явление может вносить определенный вклад в усиление ли-
полиза при голодании, поскольку снижение содержания глюкозы
в крови подавляет выработку и выделение инсулина поджелудочной
железой.
Воздействие охлаждения, эмоционального стресса и усиленной
физической нагрузки также приводит к мобилизации свободных
жирных кислот из депо либо в результате усиленной секреции
адреналина из мозгового вещества надпочечников в общий кровоток,
либо под влиянием освобождения норадреналина при стимуляции
симпатических нервов, которые иннервируют жировую ткань
непосредственно. Другие гормоны, такие, как глюкагон, адрено-
кортикотропный гормон (АКТГ) и гормон роста, тоже повышают
аденилциклазную активность и, следовательно, способствуют ос-
вобождению жирных кислот из жировой ткани. Во всех этих слу-
чаях мобилизация жиров, являясь ответом на стресс, увеличенную
мышечную нагрузку или повышенную потребность в энергии,
приводит к значительному повышению содержания жирных кислот,
необходимых для выработки энергии в других тканях нашего тела.
МЫШЦЫ
Широко распространенное мнение о том, что мышцы якобы
Удовлетворяют свои потребности в энергии только за счет катабо-
лизма углеводов, следует признать ошибочным. В какой-то мере
это представление оправдывается данными о содержании в скелет-
ных мышцах большого количества гликогена и о его быстром рас-
паде при работе, а также в ходе реакции гликолиза при функцио-
нировании мышц в анаэробных условиях. Такие процессы обмена
веществ обычно сопровождают интенсивную мышечную работу;
250 5- липиды
однако, как было отмечено выше (гл. 3), главным источником энер-
гии для мышцы в состоянии покоя служит окисление жирных кис-
лот. Сердечная мышца и гладкие мышцы стенок кровеносных со-
судов, вероятно, в большей степени используют жиры и продукты
их превращений, чем глюкозу, даже в периоды максимально ин-
тенсивного функционирования. Длительная, средняя по интен-
сивности работа скелетных мышц требует участия катаболизма
как углеводов, так и жиров, причем последний процесс становится
преобладающим по мере увеличения длительности физической
нагрузки. Это явление наблюдается при беге на длинные дистанции;
при таких условиях в мышцах ног поглощаются и окисляются
возрастающие количества жирных кислот по мере истощения в
мышцах запасов гликогена. Следует вспомнить, что выделение
катехоламинов, стимулирующее использование гликогена в мышцах,
ускоряет также липолиз в жировых депо и, следовательно, акти-
вирует 0-окисление в мышцах в результате последующего увели-
чения содержания жирных кислот в кровотоке.
Помимо использования жирных кислот как таковых, мышцы
располагают ферментами, необходимыми для катаболизма кетоновых
тел, которые возникают при неполном окислении жиров в печени
(рис. 5-18). Например, 0-оксибутират может быть окислен с обра-
зованием НАД-Н и ацетоацетата при участии специфической де-
гидрогеназы, которая весьма активна в митохондриях скелетных
и сердечной мышц. Этот ацетоацетат, а также поступающий в мышцы
с током крови активируются под влиянием митохондриального
фермента, который отсутствует в печени, но имеется в мышцах и
б. липиды 251
других внепеченочных тканях:
Ацетоацетат + Сукцинил-КоА —► Ацетоацетил-Ко А + Сукцинат.
Ацетоацетил-Ко А затем расщепляется тиолазой до ацетил-КоА,
который используется для выработки энергии путем окисления в
цикле лимонной кислоты. Сердечная мышца, в частности, извлекает
большое количество энергии путем катаболизма ацетоацетата
именно по этой схеме.
Все описанные выше реакции являются катаболическими. Это
характерно для обмена липидов в мышцах, которые, как и в случае
углеводного обмена, осуществляют лишь немногие анаболические
реакции липидного обмена. Хотя жировые депо формируются в
анатомических образованиях, прилежащих к мышечной ткани, сами
мышечные клетки не способны к синтезу жирных кислот или триа-
цилглицеринов.
РОЛЬ КАРНИТИНА
Хотя карнитин стимулирует окисление жирных кислот в боль-
шинстве тканей, для митохондрий мышц характерна гораздо более
выраженная зависимость от опосредованных карнитином реакций
переноса, чем для митохондрий других тканей, например печени.
В пользу этого положения свидетельствуют два факта: 1) концент-
рация карнитина в тканях мышц очень велика, что согласуется с
его физиологической ролью; 2) в мышцах не происходит (имеющего
место в печени) митохондриального ГТФ-зависимого активирования
жирных кислот, и образование их КоА-производных осуществляется
исключительно в цитозоле путем АТФ-зависимой реакции:
Жирная кислота-]-АТФ + KoASH —> КоА-производное жирной
кислоты + АМФ + Ф—Фн.
Поскольку КоА-производные жирных кислот образуются вне ми-
тохондрий, внутренние мембраны которых непроницаемы для ко-
фермента А или каких-либо его производных, использование жир-
ных кислот митохондриями мышц может происходить только в
присутствии карнитина. Как было отмечено выше (гл. 3), КоА-
производные жирных кислот обратимо реагируют с карнитином,
образуя легко проникающие сквозь мембраны ацил-карнитиновые
соединения, которые могут быть перенесены внутрь митохондрий,
где возможно их 0-окисление.
МОЗГ
Нервная ткань особенно богата липидами, которые могут со-
ставлять почти половину ее общей массы. Ткань мозга и нервов
содержит лишь небольшие количества триацилглицерина. Боль-
252 5. липиды
Рис. 5-19. Обмен липидов и их производных в мозгу,
шую часть липидов нервной ткани представляют сложные липиды:
фосфолипиды, липиды, содержащие аминоспирт с длинной цепью
углеродных атомов в молекуле — сфингозин (сфинголипиды), и
холестерин, который всегда обнаруживают в свободном, а не в
этерифицированном состоянии, характерном для большинства дру-
гих тканей. Все эти липиды могут быть синтезированы в мозгу из
глюкозы и других низкомолекулярных соединений, поступающих
с током крови, так что мозг обладает довольно высокой способно-
стью синтезировать жирные кислоты. Все синтезируемые жирные
кислоты используются для образования фосфолипидов или сфин-
голипидов, но не для резервных жиров (рис. 5-19). В мозгу обна-
ружен также интенсивный процесс биосинтеза холестерина из
ацетил-КоА.
Митохондрии мозга и нервной ткани практически инертны в
отношении Р-окисления жирных кислот, и весь ацетил-КоА, не-
обходимый для выработки энергии в реакциях цикла лимонной
кислоты для синтеза стероидов и других важных синтетических
реакций, таких, как синтез нейромедиатора ацетилхолина, должен
быть получен в результате превращений глюкозы. Мозг обладает
в определенной мере способностью извлекать энергию в результате
превращений кетоновых тел при участии реакций, рассмотренных
5. ЛИПИДЫ 253
выше в разделе, посвященном мышцам. В норме скорость исполь-
зования этих соединений в нервной ткани очень низка по срав-
нению с катаболизмом глюкозы, но при голодании окисление 0-
оксибутирата в мозгу резко усиливается и может представить
собой важный альтернативный источник энергии, когда концент-
рация глюкозы в крови становится слишком низкой.
ЛИПИДЫ И МИЕЛИНИЗАЦИЯ
Липиды нервной ткани можно подразделить на две большие
группы: 1) липиды серого вещества, которые входят в состав ней-
ронных мембран, и 2) липиды белого вещества, из которого состоит
многослойный миелиновый футляр. Если большинство компонен-
тов серого вещества сходно с компонентами клеточных мембран
многих других тканей, то миелиновые структуры характерны именно
для нервной ткани. К числу типичных липидов миелина относятся
холестерин, большинство сфиноголипидов и некоторые фосфоли-
пиды. В мозге эмбриона очень мало миелина; однако сразу после
рождения синтез липидов миелина резко усиливается и появляются
отчетливо различимые отложения миелина вокруг нервных волокон.
Образовавшаяся миелиновая оболочка остается стабильной на
протяжении всей жизни. Поэтому интенсивность синтеза липидов
в тканях мозга взрослого значительно ниже, чем у ребенка.
Структура миелиновой оболочки складывается из множества
слоев клеточной мембраны, расположенных один над другим.
Такая структура обусловлена механизмом образования этой обо-
лочки при участии опорных, или глиальных, клеток, обвивающих
аксон нервной клетки, образуя множество оборотов в виде свитка.
К уникальным липидам, имеющимся в составе миелиновой оболочки,
относятся характерные фосфолипиды, называемые этаноламино-
выми плазмалогенами (в которых алифатическая ацильная группа,
занимающая положение 1 в фосфатидилэтаноламине, заменена на
ненасыщенную образующую эфирную связь группировку с длинной
цепью углеродных атомов), и сфинголипид цереброзид (в котором
галактоза и жирная кислота связаны со сфингозином).
К числу других сфинголипидов, имеющихся в нервных тканях,
а также в других клетках нашего тела, относятся сфингомиелин
(который содержит фосфорилхолин и жирные кислоты) и ганглио-
зиды (содержащие остатки галактозы, глюкозы, жирных кислот
и углеводного производного сиаловой кислоты). Сфингомиелин
обнаруживают как в белом, так и в сером веществе мозга; он яв-
ляется компонентом всех клеточных мембран, и в частности миелина.
Ганглиозиды не входят в состав миелина, но, по-видимому, пред-
ставляют собой специфические компоненты клеточных мембран
нейронов серого вещества мозга.
254 5. липиды
ЛИПИДОЗЫ,
ПОРАЖАЮЩИЕ НЕРВНУЮ
СИСТЕМУ
При целом ряде генетически детерминированных заболеваний
происходит накопление избытка липидов в нервной системе. Обычно
такое патологическое отложение липидов, называемое липидозом,
приводит к дегенерации нервных клеток, умственной отсталости
и смерти в раннем детстве. Одним из наиболее тщательно изученных
из числа этих врожденных расстройств обмена липидов является
болезнь Тей-Сакса — наследуемый по рецессивному типу ганглио-
зидоз, встречающийся особенно часто у евреев. Для этой патологии
характерна недостаточность фермента, участвующего в катаболизме
некоторых ганглиозидов мозга, в результате чего эти липиды на-
капливаются в нейронах; при этом нарушаются функции мозга,
развивается слепота и ребенок погибает. Такие же нарушения
функций мозга обнаруживают у детей, страдающих болезнью Ни-
мана — Пика, или сфингомиелинозом, и болезнью Гоше, или глю-
коцереброз идозом. При этих расстройствах сфинголипиды накап-
ливаются в мозгу и других тканях в результате недостаточности
ферментов их катаболизма.
Все эти нарушения обмена веществ приводят к тяжелым и не-
обратимым поражениям нервной системы, для которых в настоящее
время не существует эффективных методов терапии или профилак-
тики. Тем не менее знание этих нарушений оказалось в высшей
степени важным, поскольку появилась возможность выявлять хи-
мическими или энзимологическими методами предполагаемых ге-
терозиготных носителей соответствующих рецессивных генов, так
что возможные родители гомозиготных больных могут получить
соответствующую генетическую консультацию в отношении плани-
рования семьи. Кроме того, химические и энзимологические ис-
следования вероятных гомозиготных носителей соответствующих
генов могут быть проведены с использованием амниоцентеза (т. е.
изучения эмбриональных клеток из амниотической жидкости)
у беременных женщин, в анамнезе которых есть указания на суще-
ствование этих врожденных расстройств в семье. В таких случаях
точная диагностика in utero такой разрушительной болезни дает
убедительное моральное и медицинское обоснование прерывания
беременности путем аборта.
ЛИПИДЫ КРОВИ
Как и в случае углеводов, постоянный уровень липидов в крови
поддерживается в результате конкурирующих процессов поглоще-
ния липидов тканями и поступления их либо с пищей, либо путем
мобилизации из печени и жировых депо. Однако сахар крови пред-
ставлен одним растворимым соединением — глюкозой, тогда как
5. липиды 255
липиды крови являются гетерогенными комплексами, обязательно
связанными с различными белковыми фракциями плазмы. Эти
комплексы содержат примерно равные количества триацилглице-
ринов, фосфолипидов и холестерина, а также меньшие количества
неэтерифицированных жирных кислот. Более того, в противополож-
ность уровню глюкозы в крови нормальный уровень общих липидов
крови натощак, равный примерно 500 мг/100 мл, может изменяться
в значительно более широких пределах (±200 мг/100 мл) и значи-
тельно более медленно возвращается к исходным величинам после
приема пищи.
Поскольку ткани, вероятно, не предъявляют таких строгих
требований в отношении липидов крови, как в отношении глюкозы,
последствия снижения содержания липидов в крови не столь серь-
езны, как в случае гипогликемии. Как будет отмечено в следующем
разделе, нарушения обмена липидов крови касаются главным
образом повышения их содержания (гиперлипемия).
КЛАССЫ ЛИПОПРОТЕИДОВ
И ИХ СОСТАВ
Различия между отдельными классами липопротеидов крови
основываются на их относительной плотности при центрифугиро-
вании, т. е. на уровне флотации в условиях центрифугирования
с использованием растворов, имеющих различные величины удель-
ного веса. Так, хиломикроны легче, чем все липопротеиды, и фло-
тируют на поверхности, если только среда, в которой происходит
центрифугирование, имеет удельный вес 1,006 или более; поэтому
такую фракцию обозначают символом 4<^1,006. Вторую фракцию
получают центрифугированием при условиях дальнейшего увели-
чения удельного веса среды до 1,019; эта фракция содержит липо-
протеиды очень низкой плотности, или ЛОНП (d= 1,006—1,019).
Дальнейшее увеличение удельного веса растворителя и повторное
центрифугирование приводят к получению липопротеидов низкой
плотности, или ЛНП (4=0,019—1,063), липопротеидов высокой
плотности, или ЛВП (4=1,063—1,21), и липопротеидов очень
высокой плотности, или ЛОВП (4>1,21). Эти фракции не пред-
ставляют собой чистые компоненты, но их исследования составляют
основу полезной рабочей классификации липидов крови.
Состав этих липопротеидов отражается на величинах их плот-
ности; так, наиболее легкие фракции содержат преимущественно
триацилглицерины, тогда как более тяжелые фракции отличаются
постепенно нарастающим отношением белков к липидам (рис. 5-20).
Хиломикроны состоят главным образом из жиров, а также из тон-
кой белковой «скорлупки». ЛОНП очень богаты жирами, но со-
держат преимущественно фосфолипиды. ЛНП наиболее богаты
холестерином, ЛПВ содержат особенно много фосфолипидов. ЛОВП
256 5. липиды
Остатки
аполипопротеинов
Рис. 5-20. Классы липопротеидов крови.
Различные типы липопротеидов изображены соответственно относительным размерам моле-
кул, содержанию белка (темное наружное кольцо) и природы входящих в их состав липидов
(Т — триацилглицерин. X — холестерин, Фл — фосфолипид, ЖК — жирные кислоты).
Плотность указана справа, электрофоретические обозначения по отношению к белкам сыво-
ротки крови приведены в скобках над символом каждой фракции. Остальные обозначения в
тексте.
отличаются очень низким относительным содержанием липидов и
содержат жирные кислоты, связанные с альбумином, и некоторые
другие липопротеиды, после того как они теряют большую часть
входивших в их состав связанных липидов. За исключением аль-
буминовых комплексов, все эти липопротеиды относятся к кате-
гории глобулинов.
При электрофорезе эти липопротеиды мигрируют с различной
скоростью по направлению к аноду, за исключением хиломикронов,
которые остаются неподвижными. Наиболее быстро перемещается
альбумин, за которым следуют а-глобулины (ЛВП) и 0-глобулины
(ЛНП). ЛОНП мигрируют между а- и 0-зонами, и поэтому их иногда
называют пре-бета-липопротеидами. ЛОВП, отличающиеся от
альбумина, не обнаруживаются при электрофорезе.
6. липиды 257
МЕХАНИЗМЫ ПЕРЕНОСА
Каждый из упомянутых выше классов липопротеидов выполня-
ет определенную функцию в переносе липидов с кровью. Как было
отмечено выше при рассмотрении всасывания липидов, хиломикроны
образуются в слизистой оболочке желудочно-кишечного тракта и
переносят поступающие с пищей жиры, которые всасываются в
кишечнике. Хотя эти липиды поступают из кишечника преимуще-
ственно в печень и жировую клетчатку, любая ткань может по-
треблять жирные кислоты липидов хиломикрона, если она распо-
лагает активной липопротеидлипазной ферментной системой. Дей-
ствительно, после приема жирной пищи, когда поступление хило-
микронов в кровоток приводит к возникновению молочной мутности
(липемия), активность липопротеидлипазы в крови одновременно
нарастает, что обеспечивает гидролиз жиров и, следовательно,
устранение мутности. Вот почему этот фермент называют иногда
фактором просветления. Природа этого фермента не выяснена,
но и его освобождение из тканей, и его активность стимулируются
антикоагулянтом гепарином. Липопротеидлипаза эндотелиальных
стенок сосудов, представляющих собой связанную (а не свободную,
как в крови) форму этого фермента, также активируется гепарином.
Функция ЛОНП, или пре-бета-фракции, также заключается в
переносе триацилглицеринов к тканям, но ЛОНП переносят ис-
ключительно те жиры, которые синтезируются эндогенно в печени.
Жирные кислоты этих триацилглицеринов образуются, следова-
тельно, как из пищевых жиров, перерабатываемых в печени, так
и в результате происходящего в печени синтеза жирных кислот,
удлинения цепи и образования двойных связей. Эти жиры потреб-
ляются главным образом жировой тканью. Поскольку, однако,
жиры ЛОНП также могут быть подвергнуты гидролизу под влия-
нием липопротеидлипазы, жирные кислоты ЛОНП становятся
доступными для использования другими тканями, которые обла-
дают этим ферментом, а также в тех случаях, когда активность
фактора просветления в кровотоке повышена.
Фракция ЛОВП содержит связанные с альбумином жирные
кислоты, которые представляют собой транспортную форму липидов,
мобилизованных из жировых депо при участии чувствительной к
действию гормонов липазы жировой ткани. Хотя общее содержание
жирных кислот в этой фракции мало (10—20 мг/100 мл) и состав-
ляет примерно 5% от общего количества имеющихся в плазме крови
жирных кислот, быстрое использование и освобождение связанных
с альбуминами жирных кислот обеспечивает чрезвычайно интен-
сивное обновление этого активного обменного фонда. При голода-
нии до 70% общих энергетических потребностей организма могут
быть удовлетворены за счет этой фракции жирных кислот, причем
общий фонд находящихся в системе кровообращения жирных кис-
лот полностью обновляется каждые несколько минут.
258 5. липиды
ЛНП, или 0-липопротеидные фракции, переносят основную
массу имеющегося в плазме холестерина, который представлен
главным образом его сложными эфирами. Этот липопротеидный
комплекс, образующийся в печени, содержит свободный холестерин,
который после выделения в кровоток этерифицируется при уча-
стии фермента плазмы крови холестерол-лецитин — ацилтрансфе-
разьц переносящего остаток ненасыщенной жирной кислоты из
положения 2 фосфатидилхолина (т. е. лецитина), входящего в со-
став фракции ЛВП:
Холестерин + Фосфатидилхолин—> Сложный эфир холестерина +
+ Л изофосфатидил холин.
В составе другого продукта реакции лизофосфатидилхолина,
или лизолецитина, имеется единственный остаток жирной кислоты,
образующий сложно-эфирную связь с атомом в положении 1. Фер-
менты эритроцитов и многих других тканей обладают способностью
вновь превращать лизолецитин в лецитин за счет КоА-производных
жирных кислот.
Как холестерин, так и фосфолипиды фракций ЛНП и ЛВП (а-
липопротеиды) обладают свойством вступать в обменные взаимодей-
ствия с соответствующими компонентами мембран клеток крови,
а также других клеточных мембран, с которыми возможен контакт
этих фракций. Белковые компоненты, однако, не вступают в обмен-
ные взаимодействия и (после удаления липидных составляющих)
поступают обратно в печень для повторного использования в со-
ставе фракции ЛОВП.
ОТЛОЖЕНИЕ ЛИПИДОВ
ПРИ АТЕРОСКЛЕРОЗЕ
Это заболевание и его главные осложнения — сердечная недо-
статочность, расстройства мозгового кровообращения и гиперто-
ния — представляют собой главные причины смерти в экономи-
чески развитых странах. Атеросклероз чаще поражает мужчин,
чем женщин. Развитие этого заболевания связано с действием мно-
гочисленных генетических факторов и таких факторов внешней
среды, как диабет, злоупотребление курением, отсутствие физи-
ческой нагрузки, ожирение и пища, богатая насыщенными жир-
ными кислотами. Два последних фактора, а также характер хими-
ческих изменений свидетельствуют о том, что атеросклероз пред-
ставляет собой результат нарушений липидного обмена; именно из
этого исходят при многочисленных исследованиях патогенеза
атеросклероза и при разработке методов терапии и профилактики
этого заболевания.
Патология сводится к отложению липидов (главным образом,
холестерина и его сложных эфиров) в виде бляшек, или атером,
б. липиды 259
в интиме артерий. У американцев мужского пола такие отложения
обнаруживаются даже в раннем детстве; с возрастом распространен-
ность и интенсивность образования таких бляшек постепенно на-
растают. В конечном счете просвет сосуда закрывается бляшкой
и ток крови по такому сосуду нарушается; это приводит к умень-
шению доставки кислорода к тканям; например к мозгу и другим
жизненно важным органам; атеросклеротические изменения в
стенках сосудов влекут за собой развитие гипертонии с вытекаю-
щими отсюда последствиями. Тромбоциты и обломки клеток нередко
накапливаются в местах повреждений, вызывая дополнительное
нарушение циркуляции крови в важнейших артериях, обеспечи-
вающих кровоснабжение сердца, почек и мозга; образующиеся
сгустки могут отрываться, образуя эмболы в отдаленных областях,
где просвет кровеносных сосудов сужен.
Ведущими факторами, которые играют главную роль в возник-
новении всех этих последствий, служат отложения липидов на
ранних этапах образования бляшек и одновременно повышение
концентрации липидов (особенно холестерина) в циркулирующей
крови тех людей, у которых атеросклероз встречается чаще, чем
в общей популяции. Противодействуя влиянию факторов риска,
которые могут способствовать повышению содержания холестерина
и функционально связанных с ним липидов в крови, целесообразно
уменьшить потребление с пищей продуктов животного происхож-
дения, в которых содержатся большие количества этого стероида,
хотя, как было отмечено выше, интенсивность всасывания холе-
стерина в желудочно-кишечном тракте человека весьма ограни-
чена. В пользу преимущественного потребления с пищей расти-
тельных (но не животных) жиров свидетельствуют также данные
о том, что стероид растений 0-ситостерин противодействует вса-
сыванию холестерина; в растениях имеются и другие вещества,
в частности растительные белки и клетчатка, которые, по-видимому,
способствуют снижению содержания холестерина в крови. К числу
особенно важных факторов относятся значительно более высокий
уровень содержания в растительных тканях полиненасыщенных
жирных кислот при изобилии в животных жирах насыщенных
жирных кислот. Положительная корреляция между гиперхолесте-
ринемией и величиной отношения количества насыщенных жирных
кислот к ненасыщенным в продуктах питания, а также высокая
частота сердечно-сосудистых заболеваний среди жителей развитых
стран, потребляющих много мяса, по сравнению с вегетарианцами,
служат обоснованием предлагаемых профилактических мер, каса-
ющихся потребления липидов с пищей.
Наряду с ограничением потребления липидов с пищей, не следует
забывать и о других мерах, к числу которых относятся введение
гормонов или их аналогов (как эстрогены, так и тироксин способ-
ствуют снижению уровня холестерина в крови), витаминов (нико-
260 5. ЛИПИДЫ
тиновая кислота и пиридоксин также оказывают некоторое благо-
творное действие), лекарственных препаратов, подавляющих вса-
сывание холестерина (Р-ситостерин), обратное всасывание солей
желчных кислот (холестирамин) или биосинтез холестерина в пе-
чени (клофибрат). Все эти агенты — как порознь, так и в сочета-
нии,— а также ряд еще не идентифицированных факторов расти-
тельной природы, изучаемых в настоящее время, были использо-
ваны в терапии атеросклероза с целью устранения нарушения об-
мена холестерина.
ГИПЕРЛИПЕМИЯ
Поскольку величины, характеризующие нормальный уровень
холестерина крови, варьируют в широких пределах, трудно точно
определить верхнюю границу, отделяющую норму от гиперлипемии
(повышения содержания липидов в крови). Были охарактеризо-
ваны определенные расстройства, при которых обнаруживают из-
быток отдельных липидов или липопротеидов; некоторые из этих
расстройств, сопровождающихся гиперлипемией как наиболее важ-
ным симптомом, относятся к группе врожденных нарушений об-
мена. Первое из таких расстройств, называемое гиперлипопротеи-
демией типа I, сопровождается врожденным отсутствием фактора
просветления, или липопротеидлипазы, в плазме крови. К числу
характерных проявлений этого заболевания относятся повышение
уровня хиломикронов, даже натощак, и чрезвычайно резкое повы-
шение концентрации триацилглицеринов в крови после приема
пищи. По этой причине данное заболевание часто называют гипер-
хиломикронемией. Уровень холестерина или фосфолипидов в крови
повышен незначительно, так что данное нарушение обмена не
связано с высоким риском в отношении атеросклероза. Для этого
нарушения характерна папулезная сыпь, обусловленная отложе-
нием жиров в коже (ксантомы), увеличение селезенки и печени;
при вовлечении поджелудочной железы возникают острые боли
в животе. Ограничение потребления жиров и калорийных продук-
тов питания обычно дает хороший терапевтический эффект.
Гиперлипопротеидемия типа 1I клинически характеризуется
обилием ксантом не только в коже, но и повсеместно в сухожилиях
и кровеносных сосудах. Такое поражение сосудов атеросклерозом
проявляется даже у молодых людей. Химически это состояние ха-
рактеризуется нормальным уровнем триацилглицерина в сыворотке
при резком повышении уровня холестерина, и особенно фракции
ЛНП (Р-липопротеиды). На этом основании данное заболевание
иногда называют гипербеталипопротеидемией. Лечение направлено
на снижение уровня холестерина при помощи особой диеты и ле-
карственных препаратов, упомянутых в предыдущем разделе.
Состояние, известное как гиперлипопротеидемия типа III,
5. ЛИПИДЫ 261
характеризуется выраженным в различной мере повышением содер-
жания холестерина и триацилглицеринов в сыворотке, а также
разнообразными симптомами, связанными с образованием ксантом
и развитием атеросклероза. По сравнению с синдромом типа II
это заболевание протекает мягче и встречается, как правило, у
взрослых.
Повышение уровня триацилглицеринов в крови больных с ги~
перлипопротеидемией типа IV связано с фракцией ЛОНП (пре-
бета-липопротеиды) и усиливается при потреблении с пищей боль-
шого количества углеводов. По-видимому, при этом заболевании
синтез жиров в печени из углеводов преобладает над их удалением
из кровотока; такое состояние иногда называют эндогенной или
вызываемой углеводами гиперлипемией. Это нарушение сопровож-
дается ожирением, поражением сосудов; в семейном анамнезе у
таких больных обычно отмечают диабет. Лечение сводится к на-
значению низкокалорийной и бедной углеводами диеты.
Кроме перечисленных выше врожденных нарушений обмена,
описан целый ряд вторичных гиперлипемий, вызываемых факто-
рами внешней среды. Само по себе потребление избытка калорийной
пищи может привести к экзогенному или эндогенному повышению
уровня триацилглицеринов крови в зависимости от потребления
богатой жирами или углеводами пищи. Злоупотребление алкого-
лем, который служит хорошим субстратом при синтезе жирных
кислот в печени, может вызвать эндогенное повышение содержания
триацилглицеринов в крови. Поскольку недостаточность инсулина
вызывает усиленную мобилизацию жиров из депо, у больных диа-
бетом нередко бывает повышение содержания в крови триацил-
глицеринов и фосфолипидов, которые образуются при условии
поступления в печень избытка свободных жирных кислот.
Рекомендуемая
литература
Albrink М. J.t Overnutrition and the Fat Cell. In: Bondy P. K., Rosenberg L. E
(eds.), Diseases of Metabolism, W. B. Saunders, Philadelphia, 1974, pp. 417—444.
Ansell G. B., Hawthorne J, N., Dawson R. M. C. (eds.), Form and Function of
Phospholipids, Elsevier, London, 1973.
Biorntorp P.t Ostman J., Human Adipose Tissue, Dynamics, and Regulation,
Adv. Met. Disord, 5, 277—327 (1971).
Bortz W. M., On the Control of Cholesterol Synthesis, Metabolism, 22, 1507—1524
• (1973).
Brady R. 0., Hereditary Fat-Metabolism Diseases, Sci. Am., 229, (2), 88—97 (1973).
Brady R. 0., Inborn Errors of Lipid Metabolism, Adv. Enzymol., 38, 293—
316 (1973).
Brown M. S., Goldstein J. L., Familial Hypercholesterolemia: Genetic Biochemical
and Pathophysiological Consideration, Adv. Intern., Med., 20, 273—296 (1975).
Burns T. W., Langley P. E., Robinson G. A. (eds.), Studies on the Role of Cyclic
AMP in Human Lipolysis. In: Greengard P., Robion G. A (eds.), Advances
in Cyclic Nucleotide Research, Vol. 1, Raven Press, New York, 1972, pp.
63-85.
262 S- липиды
Carroll К. K.t Hamilton R.M.G., Effects of Dietary Crotein and Parbohydrate
on Plasma Cholesterol Levels in Relation to Atherosclerosis, J. Food Sci., 40,
18—23 (1975).
Connor HZ. E., Connor S. L., The Key Role of Nutritional Factors in the Prevention
of Coronary Heart Disease, Prevent. Med., 1, 49—83 (1972).
Cotton D. W. K. (eds.), Lipid Metabolism and Atherosclerosis, Elsevier, New York*
1973.
Danielsson H. H.t Sjoval J., Bile Acid Metabolism, Ann. Rev. Biochem., 44, 233—
253 (1975).
Dempsey M. E., Regulation of Steroid Biosynthesis, Ann. Rev. Biochem., 43, 967—
990 (1974).
Dietschy J. M., Wilson J. D., Regulation of Cholesterol Metabolism, New Engl,
J. Med., 282, 1128—1138, 1179—1183, 1241—1249 (1970).
Fredrickson D. S., В reslow J. L.t Primary Hyperlipoproteinemia in Infants, Ann,
Rev. Med., 24 , 315—324 (1973).
Fredrickson D. S., Cotto A. M. Jr., Levy R. /., Familial Lipoprotein Deficiency
(Abeta-lipoproteinemia, Hypobetalipoproteinemia, and Tangier Disease).
In: Stanbury J. B., Wyngaarden J. B., Fredrickson D. S. (eds.), The Metabolic
Basis of Inherited Disease, McGraw-Hill, New York, 1972, pp. 493—530.
Fredrickson D. S., Levy R. I., Familial Hyperlipoproteinemia. In: Stanbury J. B.,
Wyngaarden J. B., Fredrickson D. S. (eds.), The Metabolic Basis of Inherited
Disease, McGraw-Hill, New York, 1972, pp. 545—614.
Jackson R. L., Cotto A. M., Phospholipids in Biology and Medicine, New Engl,
J. Med., 290, 24—29; 87—93 (1974).
Kannel W. B., The Disease of Living, Nutr. Today, 6, (3), 2—11 (1971).
Kolodny E. H., Lysosomal Storage Diseases, New Engl. J. Med., 294, 1217—1220
(1976).
Lane M. D., Moss J., Polakis S. E., Acetyl Coenzyme A Carboxylase, Curr. Top.
Cell Regul., 8, 139—195 (1974).
LeBaron F. V., Metabolism of Myelin Constituents. In: Lajtha A. (eds.), Handbook
of Neurochemistry, Vol. Ill, Metabolic Reactions in the Nervous System, Ple-
num Press, New York, 1970, pp. 561—573.
McMurray W. C., Magee W. L., Phospholipid Metabolism. Ann. Rev. Biochem.,
41, 129—160 (1972).
Morrisett J. D., Jackson R. L., Gotto A. M. Jr., Lipoproteins: Structure and Fun-
ction, Ann. Rev. Biochem., 44, 183—207 (1975).
Nadler H. L., Prenatal Diagnosis of Inborn Defects: a Status Report, Hosp. Pract.,
10, (6), 41—51 (1975).
Numa S., Yamashita S., Regulation of Lipogenesis in Animal Tissues, Curr. Top.
Cell Regul., 8, 197—246 (1974).
Rodwell V. W., McNamara D. J., Shapiro D. J., Regulation of Hepatic 3-Hydroxy-
3-Methylglutaryl-Coenzyme A Reductase, Adv. Enzymol., 38, 373—412 (1973).
Romsos D. R., Leveille G. A., Effect of Diet on Activity of Enzymes Involved in
Fatty Acid and Cholesterol Synthesis, Adv. Lipid Res., 12, 97—146 (1974).
Rosell S., Saltin B., Energy Need, Delivery, and Utilization in'Muscular Exercise.
In: Bourne G. H. (eds.), The Structure and Function of Muscle, Vol. Ill, Phy-
siology and Biochemistry, Academic Press, New York, 1972, pp. 186—221.
Scanu A. M., Wisdom C., Serum Lipoproteins: Structure and Function, Ann. Rev.
Biochem., 41, 703—730 (1972).
Scheig R., Diseases of Lipid Metabolism. In: Bondy P. K., Rosenberg L. E. (eds.),
Diseases of Metabolism, W. B. Saunders, Philadelphia, 1974, pp. 341—416.
Smith E. B., The Relationship between Plasma and Tissue Lipids in Human Athe-
rosclerosis, Adv. Lipid Res., 12, 1—49 (1974).
van de Bosch H., Phosphoglyceride Metabolism, Ann. Rev. Biochem., 43, 243—277
(1974).
Volpe J. J., Vagelos P. R., Saturated Fatty Acid biosynthesis and its Regulation,
Ann. Rev. Biochem., 42, 21—60 (1973).
6 АЗОТИСТЫЙ ОБМЕН
В организме встречаются многочисленные азотсодержащие со-
единения, различающиеся по своей структуре и функциям. Поли-
мерные азотистые соединения определяют основные свойства живых
систем, тогда как углеводы и липиды в первую очередь служат
метаболическим топливом для выработки энергии; вклад же их
в структуру клетки следует считать второстепенным. В основе важ-
нейших функциональных механизмов и регуляции всех процессов
обмена веществ лежат структурные белки, ферменты и другие
функционально активные белки (такие, как миозин, гемоглобин,
цитохромы), а также липопротеиды и нуклеиновые кислоты. Кроме
того, каждый из мономеров, составляющих эти макромолекулы,
ведет свою независимую «метаболическую жизнь». Наряду с нук-
леиновыми кислотами не менее важны входящие в их состав нуклео-
тиды — АТФ, УТФ, ЦТФ и ГТФ,— которые, как мы уже отмечали,
представляют собой ключевые промежуточные продукты в реакциях
обмена веществ. Каждая из аминокислот, входящих в состав белков,
также вносит свой вклад в синтез углеводов путем глюконеогенеза,
в липогенез или выработку энергии в результате катаболизма до
ацетил-КоА или (посредством особых реакций анаболизма) в об-
разование других важных азотистых соединений, таких, как ка-
техоламины, гормоны щитовидной железы, креатин, порфириновое
кольцо гема и азотистые основания нуклеотидов и фосфолипидов.
АЗОТ ПИЩИ
Основную массу азота пищи, используемого в организме, по-
ставляют белки. В связи с рассмотрением вопроса об азоте пищи
важно учитывать ряд положений: 1) общее количество поступаю-
щего в организм белка; 2) перевариваемость этого белка; 3) амино-
кислотный состав пищи; 4) общую калорийность поступающих в
организм продуктов питания. Потребности организма в белке су-
щественно меняются в зависимости от стадии развития индивидуума
и от состояния его здоровья (например, период выздоровления после
перенесенной болезни, беременность, лактация и т. д.). Для под-
держания нормального состояния здорового взрослого человека
требуется примерно 0,7 г белка в день в расчете на 1 кг веса тела;
264 6- АЗОТИСТЫЙ ОБМЕН
для новорожденного эта величина превышает 2,0 г, снижаясь к
5-летнему возрасту до 1,0 г. Для беременных и кормящих рекомен-
дуется добавочное количество пищевого белка, составляющее при-
мерно 20% нормы.
Биологическая ценность пищевых белков определяется как сте-
пенью их использования после переваривания, так и их аминокис-
лотным составом. Целый ряд факторов, включая предварительную
обработку, в том числе тепловую, изменяет перевариваемость бел-
ков, но некоторые животные белки (например, белки кожи и ке-
ратин волос) не используются в организме человека. Что касается
качества белка, определяемого его аминокислотным составом, то
здесь мы встречаемся с оценкой, противоположной высказанной
относительно липидов и входящих в их состав жирных кислот:
растительные белки по своему аминокислотному составу, как пра-
вило, менее ценны, чем белки животного происхождения. При
отсутствии в рационе достаточного количества углеводов и жиров
возрастают требования к катаболизму белков как источнику удов-
летворения энергетических потребностей. В условиях избытка
белков при достаточном количестве других компонентов пищи этот
избыток подвергается катаболизму, внося свой вклад в пополнение
резервов липидов в жировой ткани, и в конечном счете развивается
ожирение.
Следует отметить, что организм не нуждается в поступлении
с пищей нуклеиновых кислот. Пуриновые и пиримидиновые осно-
вания образуются в организме из аминокислот; избыток этих ос-
нований, поступающих с пищей, подвергается распаду и выводится.
В современном мире важнейшую проблему питания, по-види-
мому, составляет белковая недостаточность. Семьи, живущие на
грани нищеты, нередко получают с пищей мало белка даже при
достаточном количестве калорий. Как правило, богатая белком
пища дорого стоит; в связи с этим проблема белковой недостаточ-
ности приобретает социальный характер. В процессе многочис-
ленных обследований, проведенных в последнее время, получены
документальные доказательства снижения числа пре- и постнаталь-
ных аномалий развития в тех случаях, когда беременным и кормя-
щим женщинам из бедных слоев общества назначали белковые
добавки к пищевому рациону. Несомненно, в нашем обществе
предоставление достаточной материальной помощи нуждающимся
может решить многие проблемы охраны здоровья как в детском,
так и в старческом возрасте.
В других странах, в частности в тех районах тропической Аф-
рики, Латинской Америки и Азии, население которых занято тяже-
лым сельскохозяйственным трудом, проблема нехватки пищи осо-
бенно остра. В результате потребления недостаточно калорийной
и бедной белками пищи возникает синдром, который носит название
квашиоркора (рис. 6-1). Он поражает прежде всего младенцев в
6. АЗОТИСТЫЙ ОБМЕН 265
I Сывороточный
♦ альбумин - Отек
| ЛОНП -^Жировое перерождение
печени
| Гемоглобин -► Анемия
*ние
Синтез
клеточного
белка
Рис. 6-1. Порочный круг при квашиоркоре.
Поступление в организм недостаточного количества белка приводит к нарушению функций
кишечника и неэффективному использованию тех небольших количеств белка, которые по-
ступают с пищей (ЛОНП, липопротеиды очень низкой плотности).
| Ферменты поджелудочной
железы
период отнятия от груди, так как из-за преимущественно углеводной
пищи они не получают того количества белка, которое необходимо
им для нормального роста. Нарушение нормального синтеза белка
в печени вызывает снижение содержания сыворотного альбумина,
что приводит к отеку, а снижение содержания пре-бета-липопро-
теидов (ЛОНП) приводит к развитию жирового перерождения
печени. Снижен синтез гемоглобина, в результате чего развивается
анемия. Резко нарушается функция кишечника, поскольку из-за
недостатка аминокислот-предшественников страдает синтез фермен-
тов поджелудочной железы и обновление клеток слизистой кишеч-
ника. Смертность таких детей очень высока; они погибают от диар-
реи, острых инфекций и хронических заболеваний печени. Вклю-
чение в рацион полноценного животного белка (например, молочного
порошка) или сбалансированных смесей растительных белков со-
вершенно необходимо для предотвращения необратимых поражений
у таких детей.
НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ
В организме человека синтезируются некоторые аминокислоты,
другие — он синтезировать не способен, и они должны быть до-
ставлены с пищей (рис. 6.2). Последние аминокислоты называют
незаменимыми («необходимыми»), что, по существу, неверно, по-
скольку организму «необходимы» все аминокислоты. Так называ-
емые заменимые аминокислоты способны заменять одна другую
в рационе, поскольку в организме они превращаются друг в друга;
кроме того, заменимые аминокислоты образуются из промежуточ-
ных продуктов углеводного или липидного обмена при наличии
соответствующего источника общего азота. Для незаменимых ами-
нокислот такие пути обмена существуют только у растений и микро-
организмов. Следовательно, для обеспечения жизнедеятельности
266 в. АЗОТИСТЫЙ ОБМЕН
Незаменимые аминокислоты
nh2
сн2
I
сн2
1
CH-NHj
соон
Аргинин
СНз
СН,
4ch-ch-nh2
сн2 соон
✓
СН3
xchch2ch-nh2
СНз соон
Изолейцин Лейцин
NHX
I
СНХ
СН2
I
СН2
I
сн,
I
СН—NH2
I
соон
Лизин
сн,
I
S
I
сн2
I
сн2
ch-nh2
соон
Гистидин
ch-nh2
I
соон
СНз
I
СНОН
ch-nh2
I
соон
СНз
S
ch-ch-nh2
I
СНз СООН
Метионин Фенилаланин Треонин
Триптофан
Балин
Заменимые аминокислоты
сн,
СН—NH,
I
СООН
Аланин
соон
I
сн2
I
CH-NH,
I
соон
CONH2
I
сн2
I
CH-NH,
I
СООН
CHrSH
I
CH-NH,
I
СООН
Аспартат Аспарагин
соон
I
сн2
I
сн2
I
CH-NH.
I
соон
Глутамат
conh2
I
сн2
сн2
I
CH-NH3
соон
Глутамин
СН2ОН
I
ch-nh2
I
соон
Глицин Пролин Серин
Цистеин
Рис. 6-2. Классификация аминокислот.
Аргинин и гистидин медленно синтезируются в организме и необходимы для обеспечения его
нормального функционирования; цистеин синтезируется из метионина, а тирозин — из фе-
нилаланина.
человека необходимо бесперебойное ежедневное поступление в
организм сбалансированной смеси, содержащей все эти аминокис-
лоты. Дисбаланс (т. е. увеличение относительного содержания той
или иной из аминокислот) или их поступление в организм в различ-
6. АЗОТИСТЫЙ ОБМЕН
267
ное время (а не одновременно) также может привести к алимен-
тарной недостаточности.
Для нормального развития необходимо поступление в организм
достаточного количества аминокислот с разветвленной цепью угле-
родных атомов в молекуле — лейцина, изолейцина и валина', аро-
матических аминокислот — фенилаланина и триптофана; алифа-
тических аминокислот — треонина и лизина и серусодержащей
аминокислоты метионина. Поскольку фенилаланин превращается
в организме в заменимую аминокислоту тирозин, а метионин также
метаболизируется с образованием заменимой аминокислоты ци-
стеина, включение в рацион достаточного количества этих двух
«заменимых» компонентов приведет к значительной экономии или
сокращению потребности в соответствующих «незаменимых» пред-
шественниках. Основные аминокислоты аргинин и гистидин за-
нимают менее определенное место в белковом питании. Так, потреб-
ление пищи, бедной аргинином, хотя и не сказывается на нормаль-
ном росте, может вести к нарушению сперматогенеза; рацион, бед-
ный гистидином, приводит к развитию экземы, отставанию в росте
и нарушению синтеза гемоглобина.
Причиной неполноценности большинства растительных белков
является относительно низкое содержание в них некоторых неза-
менимых аминокислот по сравнению с их содержанием в других
источниках (например, в говяжьем мясе, молоке, яйцах). Яйцо
часто считают идеальным источником белка, хотя не следует забы-
вать о высоком содержании холестерина в яичном желтке. Необ-
ходимо подчеркнуть, что не во всех странах яйца доступны широким
слоям населения. Сказанное относится также к молочным и мясным
продуктам: районы с низкой продуктивностью сельского хозяй-
ства характеризуются, как правило, недостаточным уровнем их
производства; следует также учитывать, что усиленное потребление
этих продуктов в качестве источника белка сопровождается повы-
шенным поступлением в организм животных жиров, богатых на-
сыщенными жирными кислотами. Некоторые животные белки, в
особенности бедные жирами молочные продукты, все еще продол-
жают служить источниками питания, но до тех пор, пока богатые,
производящие эти продукты страны не разработают более рацио-
нальную систему хранения и распределения избытка яиц, молока
или мяса (вместо практикуемого в настоящее время умышленного
уничтожения), основная масса населения земного шара должна
будет потреблять, как и в наши дни, белки злаков и другие расти-
тельные белки.
Составить вегетарианскую диету, содержащую достаточное ко-
личество белка, не трудно; при этом какое-либо одно растение не
должно быть единственным или преобладающим продуктом питания.
Так, например, кукуруза очень бедна триптофаном и лизином,
тогда как бобовые бедны метионином; однако сбалансированная
268 6. АЗОТИСТЫЙ обмен
смесь кукурузы с соевой мукой или белками овощей при одновре-
менном поступлении в организм составит «полноценный» источник
белка, поскольку в такой смеси компоненты будут дополнять друг
друга и недостаточность отдельных аминокислот компенсируется.
Именно из этого исходят при производстве и распространении таких
растительных пищевых смесей, как «Инкапарина», состоящей из
кукурузы, сорго и хлопкового семени, которую использовали в
бедных районах Латинской Америки. Перспективно также прак-
тическое использование достижений генетики растений. Был со-
здан мутант кукурузы («opaque 2»), относительно богатый лизином,
а также гибрид ржи и пшеницы (тритикале), сочетающий устой-
чивость одного родителя с высокой урожайностью другого. Не-
которые линии тритикале отличаются более высоким содержанием
белка, а содержание лизина в них близко к величинам, характерным
для богатой лизином кукурузы.
АЗОТИСТЫЙ БАЛАНС
Этот параметр характеризует соотношение анаболизма и ката-
болизма белка в организме. Положительный азотистый баланс
свидетельствует о том, что поступление с пищей азота превышает
его выведение из организма. При этих условиях, которые имеют
место в детском возрасте, в период роста, при беременности, в пе-
риод реконвалесценции после болезни, происходит реальный синтез
белка в организме, т. е. наблюдается накопление азота. При не-
достаточном поступлении калорий с пищей, например при длитель-
ном голодании, белки тканей разрушаются, обеспечивая энергети-
ческие потребности и глюконеогенез и, следовательно, в организм
поступает меньше азота, чем выводится. Такое состояние называют
отрицательным азотистым балансом-, оно наблюдается также
при изнурительных заболеваниях или в тех случаях, когда белки
пищи неполноценны. Так, отсутствие в рационе хотя бы одной не-
заменимой аминокислоты приводит к тому, что азотистый баланс
становится отрицательным, поскольку для обеспечения биосинтеза
белка необходимо наличие всех природных аминокислот. Для
взрослого, потребляющего достаточное количество полноценного
белка, в норме характерно состояние азотистого равновесия, т. е.
количество потребляемого азота точно соответствует количеству
азота, выводимого из организма. В известной мере такое представ-
ление об азотистом равновесии согласуется с нашими повседнев-
ными наблюдениями над взрослыми людьми. Организм использует
лишь такое количество белкового азота пищи, какое необходимо
для восполнения ферментов и клеточных элементов желудочно-
кишечного тракта, а также для замены компонентов особых тканей
(кожа, эритроциты), которые изнашиваются в ходе нормальных
процессов жизнедеятельности. Доля заменяемых по этому прин-
6. АЗОТИСТЫЙ ОБМЕН 269
ципу компонентов белков нашего организма, как и следовало ожи-
дать, очень мала по сравнению с общей массой тела. В состоянии
азотистого равновесия основная масса потребляемого белка ката-
болизируется в процессах выработки энергии.
Почему же в таком случае организм испытывает столь настоя-
тельную потребность именно в белке и в незаменимых аминокисло-
тах? Почему эти потребности в энергии не могут быть удовлетво-
рены почти полностью в результате увеличения потребления угле-
водов и липидов? Для того чтобы ответить на эти вопросы, требу-
ется иное представление об обмене веществ, отличающееся от того,
которое подразумевается, когда мы используем термин «равно-
весие» или рассматриваем замену изношенных компонентов тела.
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ
БЕЛКОВ В ОРГАНИЗМЕ
Хотя на основании повседневных наблюдений создается впечат-
ление о постоянстве структуры тела взрослого человека, в дейст-
вительности это постоянство является кажущимся. Даже при со-
стоянии покоя в клетках и тканях совершается непрерывный обмен
веществ и энергии с окружающей их средой. Мы уже видели ранее,
что находящиеся в состоянии покоя нервные и мышечные клетки
потребляют энергию, необходимую для переноса метаболитов в
процессе жизнедеятельности. Значительная доля обмена веществ
с окружающей средой имеет отношение к этой фундаментальной
энергетической потребности. Кроме того, метаболические меха-
низмы (ферменты, структурные элементы клеток и тканей) участ-
вуют в обмене веществ с внешней средой. Из этих представлений
следует, что все элементы клеток нашего тела непрерывно нахо-
дятся в процессе обновления, при котором распад уравновешен
ресинтеэом, т. е. имеет место стационарное состояние, когда по-
стоянное поступление и удаление эквивалентных количеств молекул
в каждый данный (как бы остановленный) момент времени создает
впечатление, что процесс фиксирован в положении равновесия.
Важно провести грань между стационарным и равновесным состоя-
нием. Фактически нельзя говорить о равновесии в применении к
жизни. Живой организм приближается к статическому равновесию,
только когда умирает; на протяжении всей жизни организм по-
требляет вещества и осуществляет энергетические превращения,
для того чтобы избежать инертного положения равновесия.
О стационарном состоянии организма свидетельствует, напри-
мер, ежедневное обновление наших белков и составляющих их
аминокислот (рис. 6-3). Представление о динамическом состоянии
белков тела приложимо также к состоянию фосфолипидов мембран
и других кажущихся статичными структурных компонентов клеток,
и если в аминокислоту ввести метку — включить в ее молекулу
270 6. АЗОТИСТЫЙ ОБМЕН
Дзо/л
белков
пищи
Фонд свободных । Белки *
* аминокислот ^г~ тканей
С02
Энергия
Выводимый N
Рис. 6-3. Стационарное состояние обмана белков.
Хотя в норме у взрослого имеется соответствие между количеством азота, поступающего с
пищей и выводимого из организма, тем не менее между тканевыми белками и фондом свобод-
ных аминокислот в крови и других жидкостях тела осуществляется постоянный обмен амино-
кислотами и обновление.
атом тяжелого азота (N15), то легко проследить путь такой меченой
аминокислоты в тканях. Допустим, что в организм, находящийся
в состоянии азотистого равновесия, поступило некоторое коли-
чество меченой аминокислоты. Поскольку общее количество по-
ступающего в организм азота соответствует количеству выводимого,
можно предположить, что весь поступивший 15N будет выведен
в тот же день. На самом же деле проходит много дней — своего
рода «метаболическая одиссея».
Не удивительно, что некоторое количество метки быстро вклю-
чится в клеточные структуры и ферменты желудочно-кишечного
тракта, а также в другие структуры, которые расходуются в про-
цессе жизнедеятельности. В альбумин и липопротеиды плазмы,
синтезируемые в печени, меченая аминокислота также включится
достаточно быстро. Метку (15N) приобретет и фонд свободных ами-
нокислот циркулирующей крови; отсюда она проникнет во все
ткани. Вновь образующие эритроциты получат метку в составе
ЧМ-аминокислоты в гемоглобине и других белках; она сохранится
там в течение примерно 120 дней, т. е. на протяжении «жизни»
этой популяции клеток. Другие органы — печень, почки, мышцы,
мозг и соединительная ткань (перечислены в порядке убывания) —
постепенно захватят меченую аминокислоту. Этот процесс включе-
ния аминокислоты в различные белки происходит с различной
скоростью. Ферменты печени, например те, образование которых
индуцируется в ответ на изменение физиологических функций и
которые все время ресинтезируются и распадаются, быстро приоб-
ретут метку и также быстро ее утратят. Белок коллаген в соедини-
тельной ткани, миозин мышц, миелин зрелого мозга захватят лишь
небольшое количество этой аминокислоты, но, включившись, метка
сохранится здесь надолго.
Математически наиболее удобно и точно выражать эти различ-
ные скорости обновления в величинах времени, нужного для осу-
ществления обмена половины всех молекул; эта величина назы-
вается периодом полужизни или Ti/2; ее численное значение варь-
ирует от нескольких минут для индуцибельных ферментов до не-
6. АЗОТИСТЫЙ ОБМЕН 271
скольких месяцев для стабильных структурных белков. Средняя
величина периода полужизни для белков всего организма в целом
составляет примерно 3 нед; из этого следует, что статистически
в среднем каждые 3 нед половина белковых компонентов челове-
ческого тела полностью обновляются путем распада и ресинтеза.
Можно показать при помощи вычислений, что общая скорость
синтеза белков в организме в состоянии азотистого равновесия
достигает 500 г в день, т. е. почти в 5 раз превосходит среднее по-
требление с пищей. Естественно, для того чтобы достичь такого
результата, должно быть обеспечено эффективное повторное ис-
пользование аминокислотных предшественников и продуктов рас-
пада белков; оценивая это, мы получаем представление о поистине
грандиозном масштабе обмена компонентов нашего тела с окружа-
ющей средой.
ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ
При нормальном питании азот поступает в организм человека
главным образом в виде белков. За небольшим исключением, эти
белки не поступают из желудочно-кишечного тракта непосредст-
венно в кровоток. Небольшие количества белка, который всасы-
вается без изменений, вызывают в отдельных случаях аллергиче-
ские реакции, которые встречаются у отдельных людей по отноше-
нию к определенным пищевым продуктам. Всасывание антител из
молока матери является важным механизмом защиты новорожден-
ного от инфекционных заболеваний.
Однако, как правило, белки пищи подвергаются гидролизу
до составляющих их компонентов — аминокислот, и лишь послед-
ние всасываются в кровь. Переваривание белков представляет
собой сложный «ступенчатый» процесс, который совершается в три
этапа: 1) в желудке; 2) в тонком кишечнике и 3) в клетках слизи-
стой оболочки тонкого кишечника (рис. 6-4). Первые два этапа
включают расщепление длинных полипептидных цепей белка до
коротких олигопептидов. Последние всасываются в клетки слизи-
стой, где они расщепляются до свободных аминокислот, которые
затем поступают в кровь воротной вены.
ПРОТЕОЛИЗ
Такое расщепление белков заключается в гидролизе пептидных
связей специфическими протеазами, которые действуют на длинные
полипептидные цепи, или пептидазами, действующими на короткие
олигопептиды. На поступающие в желудочно-кишечный тракт белки
первым воздействует в желудке пепсин. Эта протеаза вырабаты-
вается клетками слизистой желудка в неактивной, зимогенной форме,
называемой пепсиногеном', в кислой среде содержимого желудка
Пища
H2N<XXXXX> СООН
Поджелудочная
Тонкий
Рис, 6-4, Переваривание и всасывание белков пищи,
6. АЗОТИСТЫЙ ОБМЕН 273
зимоген превращается в активную форму, причем этот процесс
требует отщепления части ферментного белка. Свободный пепсин
действует аутокаталитически, образуя сам себя в результате гид-
ролиза пепсиногена. Пепсин воздействует на белки избирательно,
атакуя только по местам расположения пептидных карбоксильных
групп тех аминокислотных остатков, в боковых цепях которых
имеются ароматические циклические структуры. Поэтому пепсин
может действовать на полипептидные цепи во многих точках.
Такие частично переваренные белки поступают затем в нейт-
рализованное содержимое тонкого кишечника, где на них воздей-
ствуют далее протеазы поджелудочной железы — трипсин и хи-
мотрипсин. Как и пепсин, эти протеолитические ферменты обра-
зуются в виде неактивных зимогенов, благодаря чему сами секре-
тирующие их клетки оказываются защищенными от гидролиза.
Трипсиноген активируется в результате воздействия на него обра-
зующейся в желудочно-кишечном тракте протеазы энтерокиназы}
возникающий трипсин аутокаталитически действует на трипсино-
ген, а также выполняет функцию пускового механизма (триггера)
в процессе активации других зимогенов — химотрипсиногена и
прокарбоксипептидаз. Трипсин и химотрипсин избирательно ка-
тализируют гидролиз по местам расположения пептидных карбо-
ксилов аминокислотных остатков с основными и ароматическими
боковыми цепями соответственно и, таким образом, действуют,
как бы дополняя друг друга. В результате совместного действия
протеаз содержимого кишечника образуются постепенно умень-
шающиеся остатки (олигопептиды). Воздействие карбоксипептидаз
приводит к освобождению аминокислот, начиная от некоторых
концевых аминокислотных остатков со свободными карбоксиль-
ными группами. Таким образом, в результате первых двух этапов
переваривания белков образуются небольшие пептиды, преимуще-
ственно три- и дипептиды, и свободные аминокислоты. Все эти
низкомолекулярные соединения легко проникают в клетки слизи-
стой оболочки кишечника при участии систем, обеспечивающих
быстрый перенос аминокислот через биологические мембраны.
Заключительный этап переваривания белков, происходящий в
клетках слизистой кишечника, состоит в том, что на всосавшиеся
олигопептиды воздействует целый ряд внутриклеточных пептидаз.
Благодаря этому система захвата аминокислот из кишечника дей-
ствует весьма эффективно, так как небольшие пептиды подверга-
ются гидролизу, как только они поступают в клетки, что препят-
ствует созданию в слизистой концентрационного градиента. Сво-
бодные аминокислоты, которые попали в клетки путем всасывания
при участии энергозависимой системы активного переноса или об-
разовались в результате действия клеточных пептидаз, диффун-
дируют затем в кровь воротной вены. Небольшая часть аминокис-
лот пищи подвергается в желудочно-кишечном тракте разрушению
274 6 АЗОТИСТЫЙ ОБМЕН
при участии бактерий с образованием токсичного продукта — ам-
миака. В норме аммиак всасывается и поступает с кровью воротной
вены в печень, где и происходит его обезвреживание.
ПЕЧЕНЬ
Как и в отношении многих других процессов обмена веществ,
в сложных превращениях белков и аминокислот печень играет
исключительно важную, можно сказать ключевую, роль (рис. 6-5).
Такое первостепенное значение печени в азотистом обмене обуслов-
лено многими причинами. Первая и наиболее очевидная связана
с анатомическим расположением этого органа. После потребления
белковой пищи клетки печени принимают на себя «первый удар»
потока аминокислот и других продуктов переваривания, посту-
пающих из кишечника по воротной вене. Таким образом, большая
масса азотистых соединений, которые могли бы оказать повреж-
дающее воздействие на другие органы, как бы «перехватывается»
печенью и претерпевает определенные изменения, прежде чем по-
ступить в общий кровоток. Другим анатомическим преимуществом
печени является ее органическая связь с желчевыводящими путями,
что позволяет выводить некоторые вредные конечные продукты
азотистого обмена (в частности, желчные пигменты) непосредст-
венно в желудочно-кишечный тракт.
От желудочно-кишечного
тракта
Общий
кровоток
Портальный
кровоток
К желудочно-кишечному
тракту
Гем
тела
Пиримидины
ппохоза
Аминокислоты
Желчные пути
Печень
К периферическим тканям
Заменимые
аминокислоты
Белки
плазмы
кетоно
тела
тканей
Конечные
продукты
обмена
Пурины
Конъюгаты
желчных
пигментов
Рис, 6-5. Роль печени в азотистом обмене.
Аминокислоты—Белки
лищи
Энергия + СО2
*4Мочевина
\Мочевая кислота
6. АЗОТИСТЫЙ ОБМЕН 275
Вторая причина, по которой печень занимает ключевое поло-
жение в азотистом обмене, заключается в том, что печеночные
клетки в отличие от других клеток нашего тела располагают полным
набором ферментов, участвующих в обмене аминокислот. Это
позволяет печени осуществлять в самых различных масштабах
расщепление, модификацию и синтез азотистых соединений. Веду-
щая роль печени в обмене свободных аминокислот связана с тремя
важными функциональными процессами: 1) распадом углеродного
скелета аминокислот для выработки энергии и обеспечения глю-
конеогенеза; 2) образованием заменимых аминокислот и азотистых
оснований нуклеиновых кислот из простых предшественников и
3) обезвреживанием аммиака и других конечных продуктов ката-
болизма, в том числе мочевины, мочевой кислоты, желчных пиг-
ментов и т. д. Во многих случаях такому многообразию метаболи-
ческих функций и свойству печени реагировать на изменения за-
просов организма способствует явление индукции ферментных
систем в ответ на воздействия пищевых или гормональных факторов.
Третья причина — очень быстрое обновление, обусловленное
быстротой синтеза и распада белков печени. Общий баланс между
катаболизмом и анаболизмом белка в печени следует считать осо-
бенно важным для организма как целого по следующим трем сооб-
ражениям: 1) печень синтезирует многие белки на экспорт, выделяя
их в плазму; 2) образование внутриклеточных ферментов в печени
влияет на обмен веществ во всем организме и 3) некоторые белки
печени способны быстро подвергаться распаду, обеспечивая ла-
бильный резерв аминокислот в периоды недостаточного питания.
Скорость обновления белков в печени выше, чем в любом другом
органе, кроме поджелудочной железы. Еще одной особенностью
синтеза белка в печени является тот факт, что скорость этого про-
цесса избирательно повышается под действием таких гормонов,
как глюкокортикоиды, которые в других тканях усиливают ката-
болизм белков. При голодании, например, белки мышц подвергаются
распаду, обеспечивая высвобождение энергии, тогда как в печени
значительно усиливается превращение аминокислот в белки, такие,
как ферменты глюконеогенеза (из углерода аминокислот) или мо-
чевинообразования (из азота аминокислот).
Таким образом, печень функционирует как аминостат, регули-
рующий поступление азотистых соединений и их освобождение на
периферию. Несмотря на суточные колебания в «спросе и предло-
жении», уровень белков и свободных аминокислот в плазме оста-
ется строго постоянным. Периферические ткани либо используют
эти имеющиеся в крови источники азота для реакций биосинтеза,
либо, наоборот, осуществляют расщепление входящих в их состав
белков с освобождением аминокислот в кровоток, как это имеет
место при условиях, способствующих катаболизму. Когда эти
вещества с током крови поступают в печень, последняя использует
276 6- АЗОТИСТЫЙ ОБМЕН
имеющийся в ее распоряжении уникальный набор ферментов для
удаления из крови избытка аминокислот и превращения их в глю-
козу, кетоновые тела, СО2 и мочевину.
АМИНОТРАНСФЕРАЗЫ
Катализируемые этими ферментами реакции имеют очень важ-
ное значение в азотистом обмене, поскольку они участвуют во взаи-
мопревращениях многих аминокислот и в сохранении органиче-
ского азота в виде аминогрупп. Аминотрансферазы представляют
собой семейство ферментов, обладающих различной субстратной
специфичностью по отношению к аминокислотам, по-разному рас-
пределенных в различных тканях организма, но имеющих один
и тот же кофермент и действующих в соответствии с одним и тем же
механизмом. Этим коферментом является витамин Вв в форме пири-
доксальфосфата. Механизм действия заключается в простом пере-
носе аминогруппы (—NHa) одной а-аминокислоты с образованием
второй а-аминокислоты, причем пиридоксалевая группа связана
с ферментом, который действует при этом переносе аминогруппы
как посредник:
д , __ Аминотрансфераза
а-Аминокислота. +а-Кетокислота,----------------► а-Кетокис-
Пиридоксальфосфат
лота, +а-Аминокислота2.
При таком переносе происходят лишь незначительные энергети-
ческие сдвиги, и реакция будет протекать в любом направлении
в зависимости от соотношения концентраций реагирующих компо-
нентов и потребности в них. Таким образом, если концентрация
аминокислоты2 относительно низка, тогда как аминокислота!,
а также кетокислота2 представлены в изобилии, то перенос амино-
групп будет (в присутствии фермента) идти слева направо, приводя
к синтезу аминокислоты2. Наоборот, этот фермент может осуществ-
лять катаболизм той же аминокислоты, если она имеется (либо в
результате поступления в организм с пищей, либо путем мобили-
зации из периферических органов) в ткани печени в избытке.
Фактически все аминокислоты, кроме лизина и треонина, под-
вергаются воздействию специфических аминотрансфераз. В печени,
обладающей особенно широким ассортиментом таких ферментов,
нет аминотрансфераз, которые действуют на аминокислоты с раз-
ветвленной цепью — лейцин, изолейцин и валин. Эти аминокислоты
вступают в реакции переноса аминогрупп только в таких перифе-
рических тканях, как почечная и мышечная.
Наиболее обычным участником катализируемых различными
аминотрансферазами реакций является глутамат. Названия 1 ами-
1 По современной номенклатуре в рабочем названии этих ферментов рекомен-
дуется использовать лишь аминокислоту-донор, например аланинаминотрансфе-
разу и т. д. — Прим, перев,
6. АЗОТИСТЫЙ ОБМЕН 277
Рис. 6-6. Важнейшие реакции переноса аминогрупп (трансаминирования) с учас-
тием а-кетоглутарата и глутамата.
Указаны взаимосвязи g циклом лимонной кислоты через а-кетокислоты, а также с глутамат-
дегидроген азной реакцией
нотрансфераз составляют в соответствии с теми парами амино-
кислот, с которыми идет реакция (рис. 6-6). Глутамат-аланинами-
нотрансфераза и глутамат-тирозинаминотрансфераза — наиболее
известные представители этого семейства ферментов в печеночных
клетках. В ответ на введение глюкокортикоидов активность этих
ферментов значительно возрастает, что обусловлено индукцией
синтеза ферментного белка под влиянием этих гормонов. Одновре-
менно индуцируется синтез целого ряда ферментов углеводного
обмена, которые также участвуют в глюконеогенезе с использова-
нием в качестве участников реакций тех аминокислот и кетокислот,
которые образуются при действии аминотрансфераз.
Повреждение печеночных клеток сопровождается выделением
аминотрансфераз в кровоток. Так, при остром гепатите активность
глутамат-аланинаминотрансферазы в сыворотке крови возрастает
более чем в 100 раз против нормы. При хроническом поражении
печени в сыворотке крови повышено также содержание глутамат-
аспартатаминотрансферазы\ при повреждении миокарда также
возрастает содержание этого фермента в крови. При диагностике
и лечении заболеваний печени исследования активности перечис-
ленных ферментов в крови дают ценную информацию для диагноза.
278 6. АЗОТИСТЫЙ ОБМЕН
ОБМЕН ГЛУТАМИНОВОЙ
КИСЛОТЫ
Хотя ни одна аминокислота не играет столь уникальной роли
в азотистом обмене, которая была бы сопоставима с ролью глюкозы
в обмене углеводов, глутаминовая кислота и ее амид глутамин,
конечно, занимают ключевые позиции. Как было указано выше,
глутамат и в ряде случаев глутамин служат важнейшими донорами
аминогрупп для аминотрансфераз. Вместе с тем соответствующая
глутамату кетокислота — а-кетоглутаровая — легко образуется в
ходе реакций цикла лимонной кислоты и, таким образом, может
быть акцептором NHa-rpynn многих других аминокислот в печени
при обратимых реакциях переноса. Глутамат выполняет также клю-
чевые функции в обмене различных аминокислот, принимая амино-
группы от тех из них, которые представлены в избытке, и отдавая
их другим, недостаточность которых могла бы возникнуть в случае
отсутствия этого процесса.
Помимо его ключевой функции в аминотрансферазных реакциях,
глутамат участвует также в реакциях иного типа, являющихся
краеугольным камнем азотистого обмена, а именно в реакциях
окислительного дезаминирования. Этим термином обозначают про-
цесс, при котором а-аминогруппа освобождается в виде аммиака
(NH3), тогда как углеродная цепь окисляется до а-кетоглутарата.
Эта реакция требует участия никотинамидного кофермента (НАД
или НАДФ) в окислении и катализируется специфическим фер-
ментом глутаматдегидрогеназой, которая не действует ни на одну
другую аминокислоту (рис. 6-6).
Некоторые особенности этой реакции окислительного дезами-
нирования имеют важное физиологическое значение. Первой осо-
бенностью является то, что аминотрансферазная реакция [напри-
мер, (1)] может протекать в сопряжении с глутаматдегидрогеназной
реакцией (2):
Аланин + а-Кетоглутарат —> Пируват-}-Глутамат (/)
Глутамат-}-НАД+ —► а-Кетоглутарат-|-НН3-}-НАД-Н-}-Н+. (2)
Таким образом,
Аланин-}-НАД+ (или НАДФ+) —* Пируват-}-NHs-}-НАД-Н
(или НАДФ-Н)+ Н+. (3)
Таким путем самые разнообразные аминокислоты, которые попа-
дают в печень либо путем всасывания из желудочно-кишечного
тракта, либо из периферических тканей, могут вступать в реакции
катаболизма с образованием а-кетокислот и восстановленных
никотинамидных коферментов (для выработки энергии или обра-
зования глюкозы) и NHS (для образования мочевины). Вторая
особенность, которая будет рассмотрена в следующем разделе,
6. АЗОТИСТЫЙ ОБМЕН 279
связана с тем фактом, что в присутствии добавленного восстанов-
ленного никотинамидного кофермента эта дегидрогеназа способна
катализировать обратную реакцию синтеза глутамата и других
аминокислот из NH3. Третьей особенностью является локализация
этой дегидрогеназы в митохондриях, где к ней имеют доступ кето-
кислоты и никотинамидные коферменты, участвующие в реакциях
цикла лимонной кислоты. Наконец, важную особенность состав-
ляет регуляторная природа этого фермента, который аллостери-
чески ингибируется под влиянием АТФ и ГТФ, но активируется
при воздействии АДФ и ГДФ, так что максимальная скорость
окислительного дезаминирования аминокислот в печени дости-
гается в тех случаях, когда энергетические резервы этой ткани
минимальны.
ЗАМЕНИМЫЕ АМИНОКИСЛОТЫ
За исключением тирозина (который образуется непосредственно
из незаменимой аминокислоты фенилаланина) и цистеина (который
образуется из метионина), заменимые аминокислоты образуются,
как правило, в печени из глутаминовой кислоты (рис. 6-7). Ис-
точником всех атомов углерода (а также азота аминогрупп) пролина,
орнитина и аргинина является процесс метаболизма молекулы
глутамата. Источником углерода аланина, серина и глицина служат
трехуглеродные промежуточные продукты гликолиза, а источником
азота их аминогрупп — глутамат; аспартат получает свой углерод
из четырехуглеродного промежуточного продукта цикла лимонной
Глюкоза
4
ЗФ-Глицерат • -> Серин Глицин
Рис, 6-7, Образование заменимых аминокислот.
280 6. АЗОТИСТЫЙ ОБМЕН
кислоты, оксалоацетата, и в этом случае источником азота (при
участии переноса аминогрупп) служит глутамат.
Действительно, сочетание реакции, обратной глутаматдегид-
рогеназной
а-Кетоглутарат +NH3 + НАД-Н (или НАДФ-Н)—<-
—»• Глутамат + НАД* (или НАДФ*), (2')
G реакцией, обратной соответствующей аминотрансферазной реакции
Глутамат 4-а-Кетокислота —- а-Кетоглутарат + Аминокислота, (/')
может обеспечить биосинтез любой аминокислоты при условии
снабжения организма запасом нужной а-кетокислоты и источни-
ком NH3:
а-Кетокислота 4- NH3 4- НАД • Н (или НАДФ • Н) —►
—> Аминокислота 4-НАД* (или НАДФ*). (3')
Поскольку этот процесс является обратным окислительному
дезаминированию и требует обеспечения источником восстанови-
тельной энергии в виде НАД-Н или НАДФ-Н, его называют вос-
становительным аминированием. Хотя большая часть азота амино-
групп для биогенеза заменимых аминокислот в норме обеспечи-
вается непосредственно переносом аминогрупп от других имею-
щихся в избытке аминокислот без превращения в NH3, печень и
другие ткани способны использовать восстановительное аминиро-
вание для сохранения и повторного использования аммиака, обра-
зующегося либо в процессах клеточного метаболизма, либо в ре-
зультате действия бактерий в желудочно-кишечном тракте.
ОБМЕН АММИАКА
Различают три общих разновидности процессов фиксации аммиа-
ка в печени с образованием органических азотистых соединений:
1) восстановительное аминирование, которое, как было показано
выше, обеспечивает биогенез глутамата и других аминокислот при
сохранении азота аммиака; 2) образование амидов, таких, как глу-
тамин, которые способны выполнять функции временного резерву-
ара и транспортной формы аммиака, и 3) образование карбамоил-
фосфата, который необходим при биосинтезе таких соединений,
как пиримидиновые азотистые основания нуклеиновых кислот,
или при синтезе мочевины — выводимого из организма конечного
продукта азотистого обмена. Для превращения неорганического
NH3 в органический N при осуществлении реакций всех этих трех
категорий клетка должна затратить энергию: при реакциях первой
категории — в форме восстановленных коферментов (никотин-
амидных); при реакциях двух последних категорий — в форме
G АЗОТИСТЫЙ ОБМЕН 281
АТФ. Все эти реакции исключительно важны для жизни организма,
поскольку свободный аммиак, если бы он накапливался в биологи-
ческих жидкостях, крайне токсичен.
Глутамин
Это соединение образуется из глутаминовой кислоты в резуль-
тате присоединения аммиака к ее терминальной карбоксильной
группе; следовательно, оно представляет собой не амин, как можно
по ошибке подумать, исходя из названия, а амид (рис. 6-8). Глу-
тамин образуется в результате катализируемой ферментом глута-
минсинтетазой энергозависимой реакции, ускоряемой за счет
гидролиза молекулы АТФ. Печень обладает также способностью
превращать глутамин обратно в глутамат и аммиак, но эту реакцию
не катализирует глутаминсинтетаза, поскольку действие этого
фермента не является обратимым. Расщепление осуществляет спе-
циальный фермент глутаминаза, катализируя гидролиз глутамина
до глутамата и аммиака; как и при других гидролитических реак-
циях, здесь имеет место значительная потеря энергии, так что и
этот фермент действует необратимо и освобождаемая энергия не
может быть сохранена для повторного использования в виде АТФ.
Очевидно, что действие глутаминсинтетазы и глутаминазы долж-
но быть согласовано системами регуляции, чтобы предотвратить
бесцельное рассеивание энергии в цикле такого типа, какой мы
рассматривали выше в связи с одновременным действием киназы
и фосфатазы. В норме глутаминсинтетаза активна в печени; фер-
мент поддерживает внутриклеточную концентрацию аммиака на
уровне, не достигающем границ токсичности. Накопление в клетках
образующегося глутамина не сопровождается токсическим эффек-
том; некоторые количества глутамина поступают в кровоток, где
он является преобладающим компонентом общего фонда свободных
Рис. 6-8. Реакции обмена глутамина,
282 б АЗОТИСТЫЙ ОБМЕН
Рис. 6-9. Роль печени в обмене глутамина.
Перенос образующихся при участии аммиака азотистых соединений к периферическим тка-
ням и от них.
аминокислот (рис. 6-9). При интенсивном глюконеогенезе катабо-
лизм белка и аминокислот в таких периферических тканях, как
мышечная, приводит к образованию аммиака, который для безо-
пасного переноса с током крови в печень может быть превращен
в периферических тканях в глутамин. В печени затем происходит
активация глутаминазы, в результате чего образуются глутамат
и свободный аммиак. Глутамат подвергается воздействию глута-
матдегидрогеназы, что обеспечивает восстановленные никотин-
амидные коферменты и источники углерода для синтеза глюкозы,
а также дополнительный аммиак; образовавшийся в результате
комбинированного действия глутаминазы и глутаматдегидрогеназы
аммиак затем устраняется от дальнейшего участия в реакциях
обмена веществ путем превращения в мочевину — конечный про-
дукт азотистого обмена.
Цикл мочевины
Мочевина (NH2CONH2) была исторически первым и, конечно,
одним из простейших органических соединений, синтезированных
химическим путем. Формально она представляет собой диамид
угольной кислоты, образуемый при взаимодействии NH3 с другим
конечным продуктом обмена веществ — СО2. Это кажущееся про-
стым химическое превращение в действительности по аналогии с
6 АЗОТИСТЫЙ ОБМЕН 283
О
II
h2n-c-nh2
Мочевина
H2N-C-NH2
II
NH2
I
Орнитин
H2N-C = O
i
NH
I
Цитруллин
I
Аргинин
NH3 От аспартата
Рис. 6-10. Краткая схема цикла мочевины.
Показано, что концевая NH2-rpynna орнитина участвует в переносе углерода и двух атомов
азота, которые в конечном счете входят в состав молекулы мочевины.
также представляющимся простым катаболизмом двухуглеродной
ацетильной группы до СО2 требует участия весьма сложно взаимо-
действующей системы ферментов и промежуточных продуктов.
На этой заключительной стадии азотистого обмена, как и на за-
ключительных этапах обмена углеродсодержащих соединений,
также осуществляются каталитические циклы реакций. Факти-
чески параллелизм между этими двумя циклами определяется
более тесной взаимосвязью, чем та, которая была бы основана лишь
на сходстве механизмов: во-первых, как реакции цикла лимонной
кислоты, так и ключевые пусковые реакции цикла мочевины со-
вершаются в митохондриях печени; во-вторых, поступление СО2
и АТФ, необходимых для образования мочевины, обеспечивается
работой цикла лимонной кислоты; в-третьих, эти два цикла, по
существу, сливаются друг с другом, поскольку в их функциони-
ровании участвуют одни и те же четырехуглеродные промежуточные
соединения. Таким образом, эти взаимосвязанные циклические
пути обмена мочевины и лимонной кислоты можно назвать в честь
биохимика, который выяснил значение обоих циклов «двухколес-
ным велосипедом» Кребса.
В цикле мочевины участвуют две аминокислоты, которые не
входят в состав пептидных цепей в белках нашего тела (орнитин
и цитруллин) и две аминокислоты, которые вступают в реакции
образования пептидных связей (аргинин и аспартат). Роль ор-
нитина аналогична роли оксалоацетата в цикле лимонной кислоты,
т. е орнитин действует как каталитический переносчик тех групп,
которые модифицируются в ходе реакций цикла, но сам по себе в
результате этого процесса не изменяется. Молекула орнитина
имеет терминальную NH2-rpynny, которая служит «рукояткой»,
принимающей молекулы СО2 и NH3 в процессе их превращений
в органические предшественники молекулы мочевины, что и пока-
зано на схеме (рис. 6-10).
284 6. АЗОТИСТЫЙ ОБМЕН
О
HjN-S-NHj
Мочевина
NH;
(Аргиназа)
Н2О
NH2
СООН
Орнитин
<СНа)э
I
CHNHj
C-NH
Аргининемия НеЪос
--------- ОКТ
NH;
аточность I
МН2(Кар6амоил-Ф- NH
| синтетаза) +
С-0
I
Карба&оил-Ф
(Орнитин-
карбамоил-
трансфераза)
Фи
С-0
NH
(СН2)
Ггнетические
аномалии
NH
CHNHj
Аргининосукцинат Цитруллинемия
ациЬурия \
СООН
Аргинин
Аргинино-
сукциназа
NH2 СООН
C-N-CH
I
NH
(СН2 )з СООН
CHNH;
2АТФ
Недостаточность
КФС
соон
h2nch
СН3
СООН
Аспартат
(СН2)з
CH-NH;
СН2
СООН
Цитруллин
(Синтетаза аргининоянтарной
кислоты )
АМф+ф-Фн
соон
Аргининоянтарная кислота
Ж| со;
Рис. 6-11. Подробная схема цикла мочевины (КФС— карбамоилфосфатсинтетаза;
ОКТ — орнитинкарбамоилтрансфераза).
Первая часть цикла мочевины включает активацию СО2 и одной
молекулы NH3 путем образования уже упоминавшегося выше
карбамоилфосфата. Эта реакция требует затраты энергии двух
молекул АТФ и участия специфического фермента карбамоилфосфат-
синтетазы (рис. 6-11). Этот фермент аллостерически активйруется
кофактором N-ацетилглутаматом и, вероятно, оказывает регули-
рующее влияние на весь цикл. Помимо его роли как предшествен-
ника мочевины, карбамоилфосфат также вносит свой вклад в био-
генез части пиримидинового кольца путем взаимодействия с моле-
кулой аспартата. В процессе образования мочевины карбамоильная
группа (NH2—СО) переносится как таковая на концевую NH2-
группу орнитина с использованием значительного количества
энергии, которая высвобождается при распаде активированного
фосфата, что необходимо для реакции. Фермент орнитин-карба-
моилтрансфераза, катализирующий этот процесс, уникален для
клеток печени; присутствие значительного количества этого фер-
6. АЗОТИСТЫЙ ОБМЕН 285
мента в плазме имеет большое диагностическое значение. Продукт
этой реакции цитруллин имеет в качестве терминальной химиче-
ской группировки уреидную группу NH2CONH. Дальнейшие пре-
вращения цитруллина возможны лишь после того, как он покинет
митохондрии, перейдя в цитоплазму печеночной клетки вместе с
аспартатом, где они взаимодействуют друг с другом при участии
соответствующей синтетазы и АТФ, образуя промежуточный про-
дукт, имеющий сложное название — аргининоянтарная кислота.
Последняя подвергается немедленному ферментативному расщеп-
лению таким образом, что NH2-rpynna, принадлежавшая аспартату,
теперь присоединена к группе NH2C(=NH)NH—, т. е. к гуаниди-
новой группировке аргинина, тогда как остаток молекулы аспартата
превращается в фумарат.
До сих пор мы рассматривали реакции превращения орнитина
в аргинин. Поскольку сам орнитин может быть синтезирован из
глутамата, легко понять, каким образом печень обеспечивает удов-
летворение основных потребностей организма в аргинине путем
этих реакций цикла мочевины. Часть этого аргинина потребуется
для синтеза белка здесь же и в других тканях, часть используется
для образования креатина (которым особенно богата мышечная
ткань); большая же часть направляется на осуществление заклю-
чительной реакции цикла мочевины, которую катализирует спе-
цифический фермент аргиназа. Этот фермент находят исключи-
тельно в цитоплазме печеночных клеток и только у тех биологи-
ческих видов, которые, подобно человеку и другим млекопитающим,
превращают азотистые шлаки в мочевину. У других животных
(например, у рыб или птиц), которые экскретируют вместо моче-
вины аммиак или мочевую кислоту, возможна цепь реакций, ве-
дущих к образованию аргинина, но у них печеночные клетки
лишены аргиназной активности. Этот фермент катализирует гидро-
литическое отщепление NH2C(=NH)— или гуанидиновой группи-
ровки от молекулы аргинина с освобождением мочевины и регене-
рацией свободного орнитина. Последний способен вновь поступать
в митохондрии для выполнения своей каталитической функции при
следующем «обороте» цикла.
Все это превращение в целом требует некоторого дополнитель-
ного регулирования, что связано с работой цикла лимонной кислоты,
который обеспечивает обновление запаса четырехуглеродных про-
межуточных продуктов (рис. 6-12). Вспомним, что при распаде
аргининоянтарной кислоты образуются аргинин и фумарат; по-
следний должен быть превращен вновь в аспартат, чтобы цикл
мочевины мог функционировать каталитически. Это превращение
обеспечивается переносом фумарата обратно в митохондрии и его
окислением до оксалоацетата (через малат) при участии ферментов,
катализирующих реакции этих звеньев цикла лимонной кислоты.
Одновременное окисление НАД-Н, образующегося при участии
286 6. АЗОТИСТЫЙ ОБМЕН
Рис. 6-12. «Двухколесный велосипед» Кребса. Взаимосвязи между циклом моче-
вины и циклом лимонной кислоты.
малатдегидрогеназы в дыхательной цепи, обеспечивает 3 моля АТФ,
что соответствует потребностям в энергии для реакций цикла мо-
чевины. Наконец, оксалоацетат может быть превращен в аспартат
путем переноса аминогруппы от глутамата при участии глутамат-
аспартатаминотрансферазы митохондрий. Конечно, для образова-
ния двуокиси углерода как источника входящего в состав моче-
вины углеродного атома необходимы дополнительные «обороты»
цикла лимонной кислоты.
НАРУШЕНИЯ ОБМЕНА АММИАКА
Реакции, которые мы рассматривали выше, осуществляются
преимущественно в клетках печени. В клетках других тканей встре-
чаются некоторые из числа катализирующих эти реакции ферментов
(например, ферменты, необходимые для синтеза карбамоилфос-
фата или аргинина в этих тканях), но, подобно печени рыб или
птиц, ни одна из внепеченочных тканей не содержит значительного
количества фермента аргиназы. Такие ткани, следовательно, ли-
шены способности синтезировать мочевину, и поэтому при нару-
шениях функции печени общая способность организма обезврежи-
вать токсичный аммиак путем образования нетоксичной мочевины
снижается.
Во многих случаях при заболеваниях печени поражение парен-
химы органа сопровождается разрастанием соединительной ткани
и нарушением кровотока, который в норме составляет одну чет-
верть всей оттекающей от сердца крови. В результате такой обту-
рации воротной системы развиваются коллатерали, впадающие в
обход печени непосредственно в полую вену, т. е. в общий кровоток.
По такому порто-кавальному шунту вещества, всасывающиеся в
6 АЗОТИСТЫЙ ОБМЕН 287
желудочно-кишечном тракте, попадают, минуя печень, непосред-
ственно в ткани организма, что резко усугубляет и без того серь-
езные последствия нарушения дезинтоксикации аммиака и других
токсичных соединений патологически измененными клетками пе-
чени.
Печеночная кома
Одним из симптомов тяжелого поражения печени является раз-
витие тяжелых приступов, сопровождающихся потерей сознания
(кома). Эти приступы учащаются в терминальных стадиях заболе-
вания. Такое коматозное состояние, называемое печеночной комой,
как полагают, связано с повышением содержания в крови аммиака,
а также других токсичных соединений, которые накапливаются в
результате нарушения обмена веществ в печени. Поскольку многие
из этих соединений образуются при действии кишечной флоры на
поступающие в желудочно-кишечный тракт белки и аминокислоты,
лечение коматозных больных обычно направлено на уменьшение
потребления белков с пищей и на подавление жизнедеятельности
микроорганизмов путем введения антибиотиков, не подвергающихся
всасыванию.
В особо тяжелых случаях можно предпринять попытки транс-
плантации печени, обменного переливания крови или гемодиализа.
Приступы комы удается облегчить, а сопровождающую их гипер-
аммониемию уменьшить, если при условии сохранения какого-то
количества функциональной паренхимы стимулировать частично
блокированный цикл мочевины. Так, сообщалось о благоприятном
эффекте введения аргинина либо в виде свободной аминокислоты,
либо, что оказалось более эффективным, в составе основных белков
(таких, как протамины), которые, вероятно, обеспечивают медлен-
ное, но длительное освобождение аргинина. Такое лечение обосно-
вывают необходимостью повысить концентрацию всех каталити-
ческих компонентов цикла и, таким образом, увеличить ток ам-
миака через аргинин для образования мочевины.
Другим аналогичным подходом к этой проблеме является введе-
ние N-карбамоилглутамина, который, подобно N-ацетилглутамату,
действует как кофактор при карбамоилфосфатсинтетазной реакции
в печени. Однако в отличие от N-ацетильного соединения, которое
после поступления в организм быстро расщепляется, N-карбамоиль-
ное не подвергается гидролизу и поэтому эффективно обеспечивает
усиление пускового этапа цикла, вовлекающего аммиак в процесс
образования мочевины. Такие методы лечения, естественно, дают
лишь временный эффект, не действуя на основную причину забо-
левания, и должны рассматриваться исключительно как паллиа-
тивные меры для выведения больного из коматозного состояния.
288 б АЗОТИСТЫЙ ОБМЕН
Наследственные болезни
Встречается врожденная недостаточность каждого из пяти
ферментов цикла мочевины (рис. 6-11). В каждом случае у ново-
рожденного наблюдаются симптомы острого отравления аммиаком:
эпизодическая рвота, судороги, летаргия или другие симптомы
нарушения функций нервной системы. В некоторых случаях по-
добные нарушения приводят к смерти в течение первых месяцев
жизни, но, если даже такой ребенок выживает, он резко отстает
в развитии.
При цитруллинемии и аргининосукцинатацидурии соответст-
вующие промежуточные продукты цикла мочевины накапливаются
в крови и других биологических жидкостях в результате недо-
статочности ферментов, необходимых для синтеза или распада ар-
гининоянтарной кислоты. Достигающие почек чрезмерно высокие
концентрации промежуточных продуктов цикла мочевины не под-
вергаются обратному всасыванию из клубочкового фильтрата, и с
мочой постоянно выводится по нескольку граммов цитруллина
или аргининоянтарной кислоты. Такую специфическую аминоаци-
дурию легко обнаружить при анализе мочи. Наблюдалась также
аргининемия (с выведением аргинина с мочой), обусловленная
недостаточностью аргиназы. При каждом из этих нарушений об-
мена мочевины имеет место, помимо накопления промежуточных
продуктов цикла мочевины, резкое увеличение содержания в крови
аммиака, особенно после поступления белков в желудочно-кишеч-
ный тракт.
Общим признаком двух других редких наследственных заболе-
ваний — недостаточности карбамоилфосфатсинтетазы и недо-
статочности орнитинтранскарбамилазы — является значительная
гипераммониемия без накопления промежуточных продуктов цикла
мочевины. Хотя при этих заболеваниях речь идет о полном отсут-
ствии соответствующих ферментов, очевидно, что даже частичное
нарушение той или иной из реакций цикла мочевины сказывается
на способности печени эффективно обезвреживать аммиак, особенно
в условиях усиленного катаболизма аминокислот после приема
пищи. Можно думать, что и острая интоксикация, и необратимое
поражение мозга в хронических случаях связаны с гипераммоние-
мией, а не с накоплением промежуточных продуктов цикла моче-
вины. Лечить эти заболевания мы пока не умеем, однако тщатель-
ный уход и ограничение потребления белка с пищей в раннем
детстве до минимума, необходимого для поддержания роста и раз-
вития, позволяет уменьшить степень острых неврологически^ рас-
стройств, а также снизить вероятность необратимого поражения
мозга.
6 АЗОТИСТЫЙ ОБМЕН 289
ОБМЕН АРОМАТИЧЕСКИХ
АМИНОКИСЛОТ
К числу аминокислот с ароматическими боковыми цепями от-
носятся фенилаланин, тирозин и триптофан. Первые две амино-
кислоты, в молекуле которых имеется простое бензольное кольцо,
близко родственны между собой, поскольку в процессе обмена
веществ тирозин образуется из фенилаланина. Триптофан, содержа-
щий конъюгированное индольное кольцо, метаболически превра-
щается в витамин В — ниацин. Эти обусловленные особенностями
метаболизма взаимосвязи определяют сложные соотношения ком-
понентов пищи. Так, например, хотя фенилаланин является неза-
менимой, а тирозин заменимой аминокислотой, изобилие тирозина
в рационе как бы «сберегает» фенилаланин — потребность в нем
снижается. В тех случаях, когда превращение фенилаланина на-
рушено, т. е. образуется меньше тирозина, последний, как мы уви-
дим, становится „незаменимой" аминокислотой.
Пеллагра — синдром витаминной недостаточности, связанный
со снижением содержания ниацина в пище,— возникает в тех слу-
чаях, когда организм лишен нормальной способности превращать
триптофан в ниацин. Отсутствие витамина С, необходимого для
метаболизма тирозина, или витамина Вв, который участвует в
метаболизме триптофана, также приводит к нарушениям в исполь-
зовании ароматических аминокислот.
Катаболические пути
Ароматические кольца образуются в природе при участии фер-
ментов растений и микроорганизмов. В организме высших живот-
ных и человека этих ферментов нет; способность же разрушать
ароматические кольца (в конечном счете до СО2) им присуща.
Многие ткани организма превращают бензольные и индольные
кольца ароматических аминокислот в такие биологически важные
производные, как пигменты и гормоны, однако главную роль в
подобных катаболических превращениях берет на себя печень,
обеспечивая как распад указанных соединений, так и сопровож-
дающую его выработку энергии.
Легко описать катаболизм фенилаланина: речь идет о простом
присоединении гидроксильной группы к бензольному кольцу с об-
разованием тирозина (рис. 6-13); эту реакцию катализирует фермент,
который соответственно называется фенилаланингидроксилазой\ он
имеется только в клетках печени. Для процесса гидроксилиро-
вания требуется молекулярный кислород, обеспечивающий атом О
для ОН-группы, и два кофермента — НАДФ-Н и птеридинсодер-
жащий кофактор, которые совместно обеспечивают доставку Н.
Важно отметить, что данная реакция необратима; тирозин может
290 6. АЗОТИСТЫЙ ОБМЕН
Птеридин
CHNHj
I
СООН
Фенилаланин
(Фенилаланин-
гидроксилаза)
НАДФ-Н НАДФ*
л •Оксифенил -
пируват
Тирозин
Оксидаза
Витамин С
Фумарат Ацетоацетат Фумарилацетоацетат Гомогентизиновая
| кислота
Глюкоза
Рис. 6-13. Катаболизм фенилаланина и тирозина.
несколько уменьшить потребность в фенилаланине, но он не может
быть использован для замены фенилаланина, поскольку процесса,
обратного гидроксилированию, не происходит.
Катаболизм тирозина также осуществляется в клетках печени.
Первый этап катаболизма тирозина, как и многих других амино-
кислот, связан с переносом аминогруппы при участии тирозинами-
нотрансферазы, о которой упоминалось выше. Образование глюко-
кортикоидных гормонов или потребление с пищей больших коли-
честв тирозина, стимулирующее синтез тирозинаминотрансферазы
в печени, ускоряя распад этой аминокислоты, приводит к образо-
ванию большого количества глюкозы. Образующаяся из тирозина
кетокислота при участии оксидазы, требующей Оа и аскорбиновой
кислоты, подвергается превращению в гомогентизиновую кислоту.
При недостаточности витамина С, особенно у новорожденных в
первые дни жизни, активность этой оксидазы снижена. В крови при
этом накапливаются соответствующие предшественники; тирозин,
а также образующаяся из него кетокислота п-оксифенилпируват
выводятся с мочой. Это состояние у детей называют тирозинемией
новорожденных1, оно встречается преимущественно у недоношенных,
в печени которых ферментные системы не достигли полной зрелости.
Это часто встречающееся отклонение от нормы отличается от тяжелой
наследственной тирозинемии (которую мы рассмотрим в следующем
6 АЗОТИСТЫЙ ОБМЕН 291
Триптофан
NH2
I
- СНуСН-СООН
(Оксигеназа)
Кинуренин
Кин у реновая
кислота
ОН
Ацетоацетат
Рис. 6-14. Катаболизм триптофана.
СООН
ОН
Ксантуреновая
кислота
разделе) своим преходящим характером: ограничение потребления
белка с пищей или назначение новорожденному витамина С устра-
няет такую тирозинемию.
Разрыв ароматического кольца гомогентизиновой кислоты дос-
тигается в присутствии О2 в результате воздействия оксидазы гомо-
гентизиновой кислоты; при этом образуется соединение с открытой
восьмиуглеродной цепью, которое затем расщепляется до ацето-
ацетата и фумарата — конечных продуктов катаболизма тирозина.
Ацетоацетат поступает из печени в кровоток и служит субстратом
энергодающих реакций для внепеченочных тканей, главным обра-
зом для мышечной. Фумарат же окисляется непосредственно в
печени либо в ходе реакций цикла Кребса, либо (после превращения
в оксалоацетат) в реакциях глюконеогенеза. Таким образом, поло-
вина атомов каждой окисленной молекулы тирозина может быть
источником образования глюкозы, тогда как остальные углеродные
атомы должны быть использованы вне печени в ходе описанного
выше метаболизма кетоновых тел.
Катаболизм триптофана также осуществляется преимуществен-
но в печени (рис. 6-14). Первая реакция этой довольно сложной мета-
болической цепи особенно интересна тем, что она, подобно тирозин-
аминотрансферазе, чувствительна к кортизолу. Активность ката-
лизирующего эту реакцию фермента — триптофаноксигеназы
во много раз повышается под влиянием либо самого триптофана,
либо глюкокортикоидных гормонов. Последние действуют как
истинные индукторы синтеза нового фермента; субстрат же, трип-
тофан, прямо взаимодействует с ферментом, который уже был син-
тезирован, удерживая его в стабилизированной, устойчивой к рас-
паду форме. Эти два воздействия (гормона и субстрата) обеспечи-
292 6. АЗОТИСТЫЙ ОБМЕН
вают эффективное использование избытка триптофана, предотвра-
щая его накопление в печени, а также способствуя удовлетворению
потребностей организма в энергии. Фермент раскрывает пиррольное
кольцо в индольной структуре с образованием замещенного бен-
зольного производного, которое называется кинуренином. Послед-
ний подвергается дальнейшему распаду в печени с отщеплением
трех углеродных атомов его боковой цепи в виде аланина, который
подвергается далее превращениям, ведущим к образованию глю-
козы; остальная часть молекулы, 3-оксиантранилат, способна
окисляться до СО2 и ацетоацетата (поступающего для использова-
ния во внепочечные ткани) или перестраивается в несколько стадий
с образованием пиридинового кольца НАД и НАДФ.
Подсчитано, что в норме более 95% триптофана вступает на
описанный выше путь окислительных превращений. Не удивитель-
но, что ниацин — витамин, обеспечивающий образование цикли-
ческих структур молекул никотинамидных коферментов, может быть
заменен в рационе триптофаном, причем для замены 1 мг ниацина
пищи в организм должно быть введено 60 мг триптофана. Установ-
лено, что приблизительно половина обычной потребности в ниацине
(20 мг/день) удовлетворяется за счет триптофана пищи.
Характерные для пеллагры, или недостаточности ниацина, симп-
томы дерматита, диарреи и деменции (печально известные «три
Д») могут наблюдаться либо при недостатке триптофана в пище,
либо при нарушении его использования. В качестве примера по-
следней ситуации можно указать на недостаточность витамина В,
(пиридоксина). Дело в том, что на этапе превращения производных
кинуренина в 3-оксиантранилат необходим пиридоксальфосфат.
В отсутствие пиридоксина цепь метаболизма триптофана прерывает-
ся и промежуточные продукты, производные кинуренина, направ-
ляются на образование других конечных продуктов — кинуреновой
и ксантуреновой кислот. Появление этих аномальных метаболитов
в моче под влиянием триптофановой нагрузки позволяет поставить
диагноз нарушения метаболизма триптофана, и в частности недо-
статочности пиридоксина. Обнаружение значительных количеств
ксантуреновой кислоты в моче новорожденных при судорогах поз-
волило, например, разработать способ успешного лечения этого
заболевания добавлением пиридоксина в питательные смеси для
новорожденных.
Биосинтез некоторых
особых метаболитов
Перечень многочисленных биологически активных соединений,
образующихся в организме из ароматических аминокислот, свиде-
тельствует об их особо важной роли наряду с их очевидным значе-
нием в процессах синтеза белка и выработки энергии (рис. 6-15).
6. АЗОТИСТЫЙ ОБМЕН 293
Фенилаланин
Фенилпируват
(Печень)
Тирозин
Кетоновые
тела
(Нервная система) „ ч
-------Норадреналин
(Щитовидная
железа)
। —> Тироксин
(Мозговой слои
наЪ почечника)
Адреналин
(Кожа, мозг)
। — Пигмент меланин
Фенцлацетрт
(Печень)
Глюкоза
(Печень)
Триптофан
(Печень)
(Нервная система)
Бактерии желудочно-
кишечного тракта)
Никотинамид
Серотонин
Индолы
Глюкоза
Кетоновые
тёла
Рис. 6-15. Биосинтез некоторых продуктов из ароматических аминокислот в раз-
личных тканях организма.
Фенилаланин через его метаболит тирозин служит источником
образования меланина — окрашенного в коричневый цвет компо-
нента пигментных клеток кожи, мозга и других тканей. Эти же
две аминокислоты наряду с участием в пигментообразовании спо-
собны превращаться в такие гуморальные факторы, как адреналин
и норадреналин (в надпочечниках и симпатической нервной системе
соответственно). Реагируя с иодом, тирозин в щитовидной железе
превращается в гормон тироксин. Триптофан способен превращаться
в нейрогуморальный фактор серотонин (в желудочно-кишечном
тракте, некоторых отделах нервной системы и в тучных клетках
соединительной ткани). Как показано ниже, нарушение любого из
этих метаболических превращений может привести к развитию тя-
желых заболеваний.
Наследственные болезни
Врожденные нарушения обмена ароматических аминокислот
весьма разнообразны — от совершенно безобидных до крайне тяже-
лых (гл. 2). К числу доброкачественных относятся два синдрома,
294 в. АЗОТИСТЫЙ ОБМЕН
которые первыми были охарактеризованы как генетически детерми-
нированные нарушения обмена веществ,— алкаптонурия и альби-
низм. Алкаптонурия, которая наследуется по рецессивному типу,
обусловлена отсутствием одного из ферментов главного пути ката-
болизма тирозина, а именно оксидазы гомогентизиновой кислоты.
Промежуточный продукт этого метаболического пути — гомогенти-
зиновая кислота — накапливается в печени и поступает в кровоток.
Почки, которые в норме не встречают в содержимом канальцев
этот метаболит, обращаются с ним как с чужеродным, активно
выводя его с мочой. В результате гомогентизиновая кислота быст-
рее удаляется из крови, не накапливаясь в организме, подобно
метаболитам тех звеньев, которые расположены «над» местом бло-
кады. При стоянии мочи на воздухе содержащаяся в ней гомогенти-
зиновая кислота чернеет. Эту патологию выявляют также при об-
наружении в моче восстанавливающих соединений в отсутствие
глюкозы и галактозы. Никаких других патологических проявле-
ний в раннем возрасте не наблюдается. Постепенное накопление
гомогентизиновой кислоты в тканях и, вероятно, ее окисление в
ходе процесса, аналогичного происходящему в моче, приводит с
возрастом к общей пигментации, или охронозу, соединительной
ткани. У пожилых людей это явление сопровождается характерны-
ми поражениями крупных сосудов и позвоночника.
При альбинизме выпадает та ветвь метаболизма тирозина, кото-
рая ведет к образованию меланина. Фермент тирозиназа, которым в
норме богаты пигментные клетки, или меланоциты, в таких случаях
отсутствует, в результате чего волосы, кожа и глаза лишены пиг-
мента. Если не считать повышенной чувствительности к солнечным
лучам и некоторого нарушения зрения, никаких серьезных симпто-
мов при альбинизме не отмечается.
К числу более серьезных врожденных нарушений обмена отно-
сятся аномалии метаболизма фенилаланина и тирозана: фенилкето-
нурия и врожденная тирозинемия соответственно. При последнем
заболевании биохимический дефект напоминает нарушение, харак-
терное для тирозинемии новорожденных, с нарастанием экскреции
тирозина и образующейся из него кетокислоты. Однако при этом
наследственном расстройстве с возрастом улучшения не наступает,
поскольку фермент (оксидаза п-оксифенилпирувата) не появляется.
Некоторые из таких больных погибают в раннем детстве; у тех же,
которые выживают, обнаруживаются хронические дегенеративные
изменения в печени и почках. Для таких больных вредны высо-
кие концентрации ароматических аминокислот в пище; их следует
избегать. Потребление с пищей тирозина и его предшественника
фенилаланина необходимо ограничивать до минимально необходи-
мого для поддержания роста. Для ребенка, у которого обнару-
жено подобное врожденное нарушение, такой режим питания дол*
жен быть установлен с самого раннего детства.
6. АЗОТИСТЫЙ ОБМЕН 293
Особенно хорошие результаты диетотерапии были получены при
фенилкетонурии. В таких случаях поступление в организме фенила-
ланина должно быть строго ограничено; тирозин же становится
незаменимым компонентом пищи. Необходимо обеспечить поступле-
ние в организм достаточного количества тирозина. Причиной этого
заболевания является отсутствие в печени фермента фенилаланин-
гидроксилазы, так что нормальное превращение фенилаланина
пищи в тирозин нарушено. Поэтому тот тирозин, который необходим
для удовлетворения потребностей организма, должен содержаться
в рационе. Фенилаланин же используется лишь при синтезе белка,
так что его избыток накапливается в клетках печени и попадает в
кровоток, где его концентрация может оказаться в 50 —100 раз выше
нормы. Почки не справляются с реабсорбцией такого количества
фенилаланина, в результате чего он выводится с мочой. Такая спе-
цифическая аминоацидурия, если она сопровождается повышением
уровня этой аминокислоты в крови, типична для данного нарушения
обмена, отличает его от почечной недостаточности и легко диагно-
стируется простым анализом мочи. Стойкое повышений уровня фе-
нилаланина индуцирует синтез аминотрансферазы, частично пре-
вращающей избыточный фенилаланин в-соответствующую кетокис-
лоту— фенилпировиноградную (рис. 6-15).
Именно наличие этого фенилкетона в моче дало основание обо-
значить соответствующее патологическое состояние применяемым в
настоящее время термином; в течение многих лет соответствующим
диагностическим тестом служит реакция между фенилпировино-
градной кислотой и хлорным железом, при которой появляется ти-
пичное зеленое окрашивание. Кроме того, образуются и выводятся
с мочой другие аномальные метаболиты, такие, как фенилмолочная
и фенилуксусная кислоты; последнее соединение «пахнет мышами»,
так что болезнь легко диагностировать «по запаху»; именно так она
и была впервые обнаружена.
Если ничего не предпринимать, фенилкетонурия приводит к
весьма тяжелым последствиям. Больные дети, хотя при рождении
и могут казаться нормальными, резко отстают в умственном раз-
витии. В дальнейшем величины IQ (ай-кю) у таких детей остаются
на низком уровне (<20). К счастью, этот трагический исход можно
предотвратить, если поставить правильный диагноз при рождении.
В наши дни это легко осуществимо в ходе массового обследования
новорожденных с целью выявления фенилкетонурии, а также це-
лого ряда других наследственных заболеваний, сопровождающихся
повышением уровня аминокислот в крови (аминоцидемией).
Если фенилкетонурия обнаружена в первые недели жизни и
быстро начата диетотерапия, то поражение мозга не разовьется.
Важно ограничить количество потребляемого фенилаланина таким
образом, чтобы обеспечить его поступление в организм в коли-
чествах, необходимых и достаточных для роста и развития, но
296 6. АЗОТИСТЫЙ ОБМЕН
предотвратить накопление его в жидкостях тела. По-видимому,
избыток фенилаланина или одного из его метаболитов оказывает
токсическое действие на развивающуюся нервную систему, по-
скольку при назначении бедной фенилаланином диеты в раннем дет-
стве умственное развитие ребенка протекает нормально. По дости-
жении 8—10 лет такие дети могут переходить на нормальное пита-
ние, и никаких признаков отравления фенилаланином у них не
наблюдается. Напротив, дети, у которых это заболевание не диаг-
ностируют сразу при рождении, а выявляют по умственной отста-
лости, не могут быть излечены; применение диетотерапии на таком
позднем этапе не вернет ребенку нормального интеллекта. Ясно,
что распознавать и начинать лечить фенилкетонурию следует как
можно раньше.
Использование триптофана нарушено при болезни Хартнупа,
названной так по фамилии членов семьи, в которой это наследствен-
ное заболевание было впервые обнаружено. Это расстройство в
отличие от упоминавшихся выше касается нарушения всасывания
аминокислоты, а не ее метаболизма. Нарушение всасывания трип-
тофана проявляется двояко. Первое и наиболее серьезное проявле-
ние обусловлено неполным всасыванием триптофана в желудочно-
кишечном тракте, что приводит к недостаточному образованию
ниацина в печени и, следовательно, к появлению симптомов пеллаг-
ры; задержка триптофана в просвете кишечника ведет к его превра-
щению при участии микрофлоры толстого кишечника в аномальные
продукты обмена — метаболиты индола. Второе проявление свя-
зано с тем, что почки не способны к реабсорбции триптофана и дру-
гих нейтральных аминокислот из клубочкового фильтрата, в ре-
зультате чего наблюдается общая аминоацидурия без увеличения
содержания аминокислот в крови. У таких больных наблюдаются:
поражения кожи, характерные для пеллагры, повышение чувстви-
тельности к солнечным лучам, а также двигательная атаксия,
характерная для дисфункции мозжечка. Для лечения болезни Харт-
нупа используют ниацин, добавляемый к пище. Больным рекомен-
дуется защита от солнечных лучей, а также периодическая стерили-
зация желудочно-кишечного тракта антибиотиками для того, чтобы
подавить образование (при участии микрофлоры) продуктов распада
триптофана, способных оказывать токсическое действие.
ОБМЕН СЕРУСОДЕРЖАЩИХ
АМИНОКИСЛОТ
Подобно ароматическим аминокислотам, значение в организме
серусодержащих аминокислот в равной мере определяется их
участием в образовании жизненно важных метаболитов, а также той
ролью, которую они играют в структуре и функции белков. В этой
последней связи следует отметить, что цистин (дисульфидное, или
6. АЗОТИСТЫЙ ОБМЕН 297
окисленное, производное) обеспечивает ковалентные поперечные
мостики для многих белков; цистеин (восстановленное, или сульф-
гидрильное, соединение) часто является участником каталитиче-
ского процесса в активном центре ферментов.
Другая серусодержащая аминокислота метионин интересна
тем, что ее связь с цистеином напоминает существующую между
фенилаланином и тирозином, о чем говорилось выше. Пищевую
потребность в незаменимой аминокислоте метионине можно снизить
путем обеспечения заменимой аминокислотой цистеином; последний
образуется преимущественно в печени в результате необратимого
распада метионина. В молекуле метионина, как указывает его
название, имеется присоединенная к атому серы метильная группа,
которая служит источником целого ряда ключевых метильных
соединений в различных органах и тканях.
Перенос активных
метильных групп
Для переноса на другие соединения метильная группа метионина
должна быть активирована в результате взаимодействия атома
серы с АТФ (рис. 6-16). Этот процесс активации уникален в том
отношении, что освобождаются три фосфатные группы АТФ; из
них две — в виде неорганического пирофосфата, а третья — в виде
неорганического фосфата. Очевидно, что при таком гидролити-
ческом процессе высвобождается большое количество энергии;
эта энергия расходуется на образование макроэргического кофер-
ментного производного S-аденозилметионина. Последнее соединение
содержит остаток аденозина молекулы АТФ, который присоединен
к атому серы через углерод рибозы в положении 5. Этот трехзаме-
щенный атом серы, или сульфоний, придает большую лабильность
присоединенной к нему метильной группе, в результате чего рас-
щепление связи S+—СНз высвобождает энергию в количестве, эк-
вивалентном высвобождаемому при гидролизе АТФ. Это обстоя-
тельство и объясняет возникновение той силы, которая обеспечи-
вает перенос метильной группы на весьма разнообразные акцептор-
ные соединения.
В ряде случаев реакция переноса метильных групп служит
для осуществления биосинтеза некоторых соединений (например,
холина, адреналина и креатина); в других случаях продукты этой
реакции (например, метанефрин и N-метилникотинамид) предназ-
начены для выведения из организма. Хотя в таком переносе могут
участвовать в качестве акцепторов различные атомы, перенос
метильной группы происходит, как правило, на атомы азота или
кислорода. В каждом случае реакцию такого переноса катализирует
особый фермент, специфичный по отношению к акцептору метиль-
ной группы. Такие ферменты называют метилтрансферазами.
СНз ни*
L W
CH2 АТФ
I
ch-nh2
соон
jemuoHUH
CH3
♦S-CH2 AieHUH
- I
CH2
I
CH2
I
CH-NH,
I
COOH
6-A Ьенозил метионин
Адреналин
Гликоциамин
X____ Креатин
— Этаноламин
Холин
Серин S-дЪенозилгомоцистеин
< Метанефрин
и т.д.
CH-NH,
СООН
но
CHj-S-CH,
СН2 CH-NHj
CH-NH, соон
соон
Цистатионин
Витамин В6
сн,
I
CHj
I
CH-NH:
соон
Гомосерин
HS
I
CH2
I
CH—NH,
СООН
Цистеин
Рис. 6-16. Обмен серусодержащих аминокислот — метионина и цистеина.
Роль в реакциях переноса метильных групп.
б. АЗОТИСТЫЙ ОБМЕН 299
Катализируемые ими реакции обычно необратимы. Поэтому требу-
ется бесперебойное поступление метионина с пищей.
Другой продукт реакции, катализируемой метилтрансфераза-
ми,— это S-аденозилгомоцистеин — деметилированная форма до-
нора активной метильной группы. При участии гидролитического
фермента освобождаются аденозин и гомоцистеин. Последний спо-
собен вновь превращаться в метионин за счет метильной группы
бетаина — продукта окисления холина — соединения, содержа-
щего метильные группы. Следовательно, поступление холина с
пищей снижает потребность в метионине, связанную с необходи-
мостью в метильных группах. Превращение гомоцистеина в метио-
нин возможно, кроме того, при участии других одноуглеродных
доноров, присоединенных к коферментам — производным фолие-
вой кислоты, что будет описано в следующем разделе; непременным
компонентом этого пути превращений, который, вероятно, обеспе-
чивает от х/10 до х/4 общего объема использования метильных
групп в организме, является витамин Bi2. В соответствии с этим на-
рушение всасывания или метаболизма витамина Bi2 мешает исполь-
зованию гомоцистеина путем его реметилирования.
Гомоцистеин, образующийся при деметилировании метионина,
в основном превращается в печени в цистеин. Следует отметить, что
приставка гомо указывает на гомологию в отношении цистеина,
т. е. в углеводородной цепи гомоцистеина имеется по сравнению
с цистеином еще одна СН2-группа, так что для превращения в
цистеин гомологичной аминокислоты формально должно произойти
удаление только одного углеродного атома. Фактически же ни
один из углеродных атомов гомоцистеина не переходит в молекулу
цистеина; переносится только атом серы, что осуществляется путем
процесса, состоящего из двух реакций и называемого транссульфи-
рованием. Сначала при участии фермента синтетазы сера присоеди-
няется к аминокислоте серину с образованием тиоэфира цистатио-
нина. В этом соединении атом серы служит мостиком между остат-
ками гомоцистеина и серина. Затем гидролитический фермент раз-
рывает этот мостик, катализируя расщепление связи по другую
сторону от атома серы, что обеспечивает перенос серы на остаток
серина с образованием цистеина и освобождением гомолога серина —
гомосерина. Поскольку оба указанных фермента действуют, по су-
ществу, необратимо, гомоцистеин в норме не накапливается в
жидкостях или клетках тела. Обе реакции протекают при участии
коферментной формы витамина Вв — пиридоксальфосфата, и по-
этому процесс транссульфирования в значительной степени зависит
от поступления достаточного количества этого витамина с пищей.
300 6. АЗОТИСТЫЙ ОБМЕН
Наследственные болезни
Врожденная недостаточность синтезирующего фермента, а также
фермента, катализирующего гидролитическое расщепление в про-
цессе транссульфирования, наследуется по рецессивному типу:
в первом случае накапливается гомоцистеин, который окисляется
до соответствующего дисульфидного производного гомоцистина;
во втором — происходит, накопление цистатионина. При обеих
ситуациях метаболиты, которые в норме не появляются в моче, бы-
стро выводятся из организма почками; принято называть такие
расстройства гомоцистинурией и цистатионинурией.
Гомоцистинурия — одно из наиболее распространенных врож-
денных нарушений обмена аминокислот; по частоте она уступает
только фенилкетонурии. Гомоцистинурия всегда сопровождается
смещением хрусталика (ectopia lentis), изменениями костей (остео-
пороз) и поражением сердечно-сосудистой системы (тромбоэмболия).
Больные нередко сильно отстают в умственном развитии. Харак-
терная аномалия глаз в сочетании с положительной реакцией на
присутствие дисульфидных (—S—S—) соединений в моче (цианидно-
нитропруссидная реакция) позволяют легко поставить диагноз.
Смерть иногда наступает рано от тромбоза крупных артерий. В неко-
торых случаях очень большие дозы витамина Вв устраняют биохи-
мические сдвиги, что указывает на образование в организме таких
больных апофермента синтетазы, который, однако, взаимодейст-
вует с коферментом аномально, обнаруживая в этой реакции высо-
кую величину Км.
Подобное наблюдение было сделано в нескольких случаях цис-
татионинурии, при которой функция гидролитического фермента,
вероятно, также в значительной мере зависит от пиридоксальфос-
фата. Эффективность длительного применения витамина Вв, огра-
ничения потребления метионина или дополнительного приема цис-
теина для лечения этих патологических состояний, по-видимому,
до сих пор не получила окончательной оценки. Это вдвойне трудно
при цистатионинурии, при которой нет ясных и определенных кли-
нических проявлений, хотя это заболевание было впервые обнару-
жено у лиц, находившихся на стационарном лечении в учреждениях
для умственно отсталых.
МЕТАБОЛИЗМ ПИРИМИДИНОВ
И ПУРИНОВ
Эти азотсодержащие циклические соединения представляют
собой важнейшие компоненты нуклеотидных коферментов многих
метаболических реакций, а также пол ину клее гидов клеточных РНК
и ДНК. Для удовлетворения потребностей человека в пиримидинах
или пуринах их поступление в организм с пищевыми продуктами
6. АЗОТИСТЫЙ ОБМЕН
301
играет, по-видимому, лишь второстепенную роль; исходными ма-
териалами для полного биосинтеза этих гетероциклических соеди-
нений служат обычно предшественники аминокислоты и углеводы.
Хотя фактически во всех тканях, особенно в таких интенсивно
пролиферирующих, как кроветворная, происходит обновление нук-
леиновых кислот и нуклеотидов, главным местом новообразования
этих циклических соединений в организме является печень. Фер-
менты катаболизма, используемые при выведении избытка пирими-
динов, обладают свойством разрушать эти циклические структуры
полностью. Однако в организме человека нет ферментов, необходи-
мых для разрыва пуриновых колец; поэтому избыток пуринов вы-
водится из организма человека неразрушенным, в виде мочевой
кислоты.
Существует сложная система регуляции синтеза, повторного
использования и распада пиримидинов и пуринов, обеспечивающая
необходимые соотношения этих процессов. Нарушения этих регу-
ляторных механизмов особенно резко сказываются на обмене пури-
нов: вмешательство в биосинтез пуринов вызывает значительное
ограничение роста и размножения клеток, тогда как усиленный
распад пуринов до мочевой кислоты сопровождается развитием
заболеваний суставов; эти заболевания обозначают общим термином
подагра.
Биосинтез циклических
структур
Пиримидиновое кольцо образуется путем конденсации двух
широко распространенных предшественников — аспарагиновой
кислоты и карбамоилфосфата. Последний участвует и в образовании
мочевины, но при синтезе пиримидинов это соединение, по-видимому,
образуется иным путем (рис. 6-17). Карбамоилфосфатсинтетаза
цикла мочевины использует NH3, она находится в митохондриях,
где осуществляется также следующая реакция цикла. Синтетаза,
участвующая в биосинтезе пиримидинов, однако, получает NHa
за счет амидного азота глутамина и находится вне митохондрий,
в цитозоле. Эти начальные реакции пути биосинтеза ингибируются
его конечными продуктами — пиримидиновыми нуклеотидами УТФ
и ЦТФ, что служит классическим примером регуляции по принци-
пу отрицательной обратной связи. Для фермента аспартаткарба-
моилтрансферазы, например, аллостерическим ингибитором служит
ЦТФ, так что избыток этого нуклеотида в клетке автоматически
выключает свой собственный биосинтез, действуя на раннее звено
в цепи биосинтетических реакций. Аналогичным образом цито-
зольная (но не митохондриальная) форма карбамоилфосфатсинтета-
зы ингибируется УТФ по принципу обратной связи. Хотя в печеноч-
ной клетке возможна конкуренция за общие предшественники
302 6. АЗОТИСТЫЙ ОБМЕН
Цитозоль
Митохондрия
Рис. 6-17. Краткая схема образование пиримидинового кольца.
Внутриклеточное распределение и регуляция карбамоилфосфатсинтетазы при этом иные,
чем при образовании мочевины.
(аспартат и карбамоилфосфат) процессов биосинтеза мочевины и
пиримидиновых производных, особенности внутриклеточного рас-
пределения ферментов и специфических регуляторных механизмов
позволяют этим двум процессам функционировать независимо и
параллельно друг другу в соответствии с общими потребностями
организма.
В результате осуществления ряда реакций молекула карбамоил-
аспартата подвергается циклизации с образованием замкнутой
структуры, окисляемой затем до оротовой кислоты. Последняя
превращается в нуклеотид при помощи активированного сахара
фосфорибозилпирофосфата (ФРФФ) (рис. 6-18). Это соединение,
образующееся из рибозо-5-фосфата за счет двух терминальных фос-
фатов АТФ, является макроэргическим и, таким образом, может
само по себе энергетически обеспечить возникновение связи между
углеродом, который находится в положении 1 рибозы, и азотом в
положении 1 пиримидина. Наконец, декарбоксилирование приводит
к образованию продукта цепи реакции уридиловой кислоты, или
УМФ.
Дальнейшая достройка пиримидинового кольца путем присоеди-
нения NH2 от глутамина приводит к образованию цитидин-нуклео-
тидов, тогда как присоединение СН3 — к образованию тиминнук-
леотидов. Источником СН3 производных тимина служит не S-аде-
нозилметионин, как это бывает обычно; эти метильные группы
образуются в результате восстановления и переноса одноуглерод-
6. АЗОТИСТЫЙ ОБМЕН
303
(ф)осн,
Ко
Тимидилат (ЪТМФ)
Ц umubunam (ЦМФ)
Рис. 6-18. Подробная схема биосинтеза пиримидиновых нуклеотидов.
ного фрагмента (формальдегида), связанного с коферментом —
фолиевой кислотой. Здесь мы встречаемся с тем же типом реакции
образования метильных групп, который обсуждался выше в связи с
ресинтезом метионина из гомоцистеина; в этом случае также тре-
буется участие витамина Bi2. Синдром, связанный с недостаточно-
стью этого витамина, пернициозная анемия, сопровождается также
нарушением поступления тимидиннуклеотидов в кроветворные тка-
ни; в результате нарушается синтез ДНК в дифференцирующихся
клетках крови, а это ведет к недостаточности эритроцитов в цирку-
лирующей крови.
Синтез пуриновой циклической структуры — значительно более
сложный процесс. По сложности и числу промежуточных соедине-
ний он сопоставим с важнейшими метаболическими процессами,
например с гликолизом. Некоторые узловые моменты синтеза пу-
ринов представляются интересными и важными: по сравнению с пи-
римидинами синтез пуринов протекает как бы в обратном направ-
лении в том смысле, что остаток рибозы присоединяется к синтези-
руемому веществу не на конечных этапах процесса, а на начальных.
В отличие от синтеза пиримидинов, осуществляющегося при уча-
стии двух простых предшественников, атомы пуринового кольца
происходят из нескольких источников: самый важный вклад при
этом вносит глицин, обеспечивающий один азот и два углерода;
304 6. АЗОТИСТЫЙ ОБМЕН
Рис. 6-19. Биосинтез пуриновых нуклеотидов.
Указан порядок (от 1 до 7) присоединения атомов, составляющих циклическую структуру.
два атома азота ведут свое происхождение от глутамина и один —
от аспартата; один атом углерода происходит из СО2, а два других
присоединяются отдельно в виде одноуглеродных фрагментов,
связанных с фолиевой кислотой (порядок присоединения показан
на рис. 6-19).
Исходным соединением при синтезе пуринов служит активиро-
ванная форма рибозы (ФРФФ), в которой макроэргический пиро-
фосфат вытесняется МН2-группой, отдаваемой глутамином. Далее
за счет АТФ присоединяется глицин, карбоксильная группа кото-
рого образует амидную связь с этой NH2-rpynnofl. Именно на
этом этапе, еще до замыкания меньшего имидазольного кольца,
к NH2-группе замещенного глицина присоединяется (при участии
кофермента фолиевой кислоты) одноуглеродный остаток. В ходе
образования большего кольца последовательно присоединяются
один углерод и два атома азота и в этом случае протекающий при
участии фолиевой кислоты перенос последнего атома углерода осу-
ществляется непосредственно перед замыканием цикла. Таким обра-
зом, в результате замыкания колец возникает завершенная струк-
тура пуринового нуклеотида инозиновой кислоты (ИМФ). Последняя
служит родоначальникохМ других пуриновых нуклеотидов: в ре-
в. азотистый обмен
305
зультате присоединения ЫН2-группы аспарагиновой кислоты
в положении 6 образуется адениловая кислота (АМФ); окисление
с последующим присоединением МН2-группы глутамина в положе-
нии 2 дает гуаниловую кислоту (ГМФ).
Потребность в переносе с участием фолиевой кислоты на двух
этапах, завершающих построение пуринового кольца, делает био-
синтез пуринов, а также биосинтез РНК и ДНК и, следовательно,
пролиферацию клеток в высокой степени зависимыми от нормаль-
ного уровня и метаболизма фолиевой кислоты. Фолиевая кислота
представляет собой витамин — необходимый компонент питания
человека; его отсутствие в пище вызывает один из наиболее часто
встречающихся в современном мире синдромов недостаточности.
Как было отмечено выше в связи с рассмотрением вопроса об огра-
ничении синтеза тимина, недостаточность фолиевой кислоты при-
водит к особенно тяжелым поражениям пролиферирующих клеток
костного мозга и других кроветворных тканей. В соответствии с
этим главным признаком такой недостаточности является харак-
терная анемия с появлением в крови крупных незрелых эритроци-
тов (мегалобластов). Имеется тесная связь между этими явлениями и
потребностью в фолиевой кислоте и витамине Bi2 (цианокобаламине)
как дополнительных пищевых факторах. Можно достичь кажуще-
гося излечения при пернициозной анемии путем введения в организм
избытка фолиевой кислоты; однако недостаточность витамина В)2
оказывает на нервную систему дополнительные разрушительные
воздействия, которые не устраняет фолиевая кислота. Поэтому смяг-
чение симптомов мегалобластической анемии под влиянием фолие-
вой кислоты может ориентировать ошибочно, что нередко бывает
опасным. Это имеет особенно важное значение при нарушениях
функций кишечника (воспаление подвздошной кишки, спру), когда
всасывание фолиевой кислоты и витамина Bi2 не обеспечивает
потребностей организма. Недостаточность фолиевой кислоты также
часто встречается при беременности и у маленьких детей.
Образование мочевой кислоты
Как было отмечено выше, пиримидиновые структуры в орга-
низме могут подвергаться полному катаболизму до СО2 и NH3;
освобождаемый при распаде пиримидинов азот выводится из орга-
низма в составе мочевины. Аналогичных механизмов распада пури-
новых структур не существует. Некоторые свободные пурины,
образующиеся либо при переваривании нуклеиновых кислот пи-
щи, либо в результате катаболизма тканевых нуклеиновых кислот
и нуклеотидов, могут быть вновь использованы в организме при
помощи так называемых механизмов повторного использования,
которые будут обсуждаться ниже. Эти реакции, однако, имеют
редущее значение в экономном повторном использовании уже син-
306 б. АЗОТИСТЫЙ ОБМЕН
Гипоксантин
Выведение
с мочой
Пробенецид
Рис. 6-20. Катаболизм пуринов с образованием мочевой кислоты.
Штриховыми линиями показаны реакции повторного использования пуринов (ФРФФ, фос-
форибозилпирофосфат).
тезированных пуринов во внепеченочных тканях. В печени свобод-
ные пуриновые основания как экзогенного, так и эндогенного про-
исхождения подвергаются в основном дезаминированию с образо-
ванием ксантина или гипоксантина. Окисление обоих этих метабо-
литов катализируется флавинсодержащим ферментом печени ксан-
тиноксидазой в присутствии О2 с образованием в качестве конеч-
ного продукта мочевой кислоты (рис. 6-20). Так как мочевая кисло-
6. АЗОТИСТЫЙ ОБМЕН
307
та не может быть ни использована повторно, ни подвергнута даль-
нейшему распаду, это соединение аналогично мочевине попадает в
мочу и выводится из организма в виде конечного продукта азоти-
стого обмена. Таким образом, выведение мочевой кислоты свиде-
тельствует о катаболизме нуклеиновых кислот в организме. Со-
держание мочевой кислоты в моче частично отражает количество
поступающих в организм экзогенных пуринов; если использовать
стандартизованную свободную от пуринов пищу, то по содержанию
мочевой кислоты в суточной моче можно судить об интенсивности
обновления эндогенных пуринов.
Подагра и родственные
ей заболевания
Подагра представляет собой синдром, который характеризуется
артритом и избытком мочевой кислоты в крови (гиперурикемия).
Причины, частота острых воспалительных приступов и сопровож-
дающие их воздействия на другие органы в разных случаях бывают
различными. Это заболевание чаще встречается у мужчин, причем с
возрастом тяжесть проявлений и частота приступов нарастают.
Установлено, что воспалительные изменения суставов, а также обыч-
но сопровождающие это заболевание поражения почек обусловлены
осаждением в тканях кристаллов мононатриевой соли мочевой кис-
лоты. Со временем эти отложения урата натрия превращаются в
большие видимые простым глазом узлы — тоффи, которые особенно
часто встречаются в области суставов конечностей; одновременно
появляются камни в мочевыводящих путях.
Даже в нормальных условиях концентрация солей мочевой кис-
лоты в жидкостях человеческого тела приближается к пределу
растворимости. В крови больных подагрой ураты содержатся в
количестве, превосходящем теоретический предел растворимости,
т. е. образуют перенасыщенный раствор Хотя белки сыворотки
стабилизируют такой перенасыщенный раствор на длительное время,
любое местное снижение pH (например, в мочевыводящих путях)
или возможный распад солюбилизирующих факторов (например,
в соединительной ткани суставов) может привести к появлению
очагов кристаллизации мочевой кислоты или ее солей.
Первичным фактором, определяющим развитие гиперурикемии,
как правило, является возникновение избытка мочевой кислоты
в ходе метаболических реакций; благоприятствующим фактором
может быть уменьшение экскреции, особенно как следствие заболе-
вания почек, злоупотребления алкоголем или отравления солями
тяжелых металлов. Метаболические нарушения при подагре, по-
добно типу наследования, являются мультифактор ными. В ряде
случаев усиленное образование мочевой кислоты бывает связано с
нарушением механизма повторного использования пуринов. Фер-
308 6- АЗОТИСТЫЙ ОБМЕН
мент фосфорибозилтрансфераза в норме участвует в повторном
использовании гипоксантина или гуанина, превращая их в соответ-
ствующие нуклеотиды; эта реакция, требующая энергетического
обеспечения за счет другого субстрата — ФРФФ,— полностью
аналогична процессу присоединения оротовой кислоты к рибозе на
главном пути биосинтеза пиримидиновых нуклеотидов (рис. 6-20).
У Некоторых страдающих подагрой взрослых врожденная частичная
недостаточность этой трансферазы приводит (по еще не объясненным
причинам) к общей активации биосинтеза пуринов. Когда этот
фермент отсутствует полностью (так называемый синдром Леша —
Нихана), развиваются сопутствующие гиперурикемии чрезвычайно
тяжелые поражения нервной системы. Для таких больных харак-
терны отставание в умственном развитии, начиная с раннего детст-
ва, стремление к самоистязанию (укусы). Такие лекарственные сред-
ства, как аллопуринол, который снижает образование мочевой кис-
лоты в результате торможения ксантиноксидазной активности, и
пробенецид, который усиливает выведение мочевой кислоты поч-
ками, были успешно использованы для устранения гиперурикемии
и для облегчения многих проявлений этих заболеваний.
МЕТАБОЛИЗМ ГЕМА
Гем представляет собой ярко-красный комплекс железа и азот-
содержащего порфиринового кольца. Гем является функциональной
группой таких переносящих кислород белков, как гемоглобин эри-
троцитов и миоглобин мышц, а также таких окислительных фермен-
тов, как оксигеназы и гидроксилазы печени или широко распрост-
раненные в тканях цитохромы митохондрий. Поддержание постоян-
ства и регуляция нормальной скорости образования и распада гема
имеют решающее значение не только в связи с жизненно важной
ролью гемопротеидов в организме, но также потому, что метаболиты
и побочные продукты, возникающие при нарушениях обмена гема,
оказывают тяжелые токсические воздействия. Хотя такие кровет-
ворные ткани, как костный мозг, селезенка и другие компоненты
ретикуло-эндотелиальной системы, играют весьма важную роль
в метаболизме гема, печень благодаря ее регуляторной функции в
биосинтезе порфиринов, а также в выведении желчных пигментов
как конечных продуктов обмена является ключевым органом, в
котором осуществляется метаболизм гема.
Синтез порфирина
и гема
Важнейшие особенности строения и синтеза порфиринового коль-
ца можно, не углубляясь в подробности, суммировать следующим
образом (рис. 6-21): во-первых, сукцинил-КоА (который поставляет
6. АЗОТИСТЫЙ ОБМЕН
309
Стероиды I
Барбитурат*
соон
I
сн,
Сукцинил-КоА I
I
COSCoA
+
сн, соон
Глицин |
nh2
соон
I
соон
соон сн,
I I
сна сн,
Порфобилиноген (ЛБГ)
Рис. 6-21. Биосинтез порфирина и гема.
Ме — метил, Ви — винил, Пр —= пропионовая кислота.
большую часть атомов углерода порфирина) и глицин (который
обеспечивает все атомы азота) соединяются друг с другом, образуя
Ь-аминолевулиновую кислоту (АЛК). Затем две молекулы АЛК
конденсируются и циклизуются в замещенное пятичленное кольцо
порфобилиногена (ПБГ). Четыре таких ПБГ затем соединяются как
бы мостиками, образуя большую порфириновую циклическую моле-
кулу, из которой после нескольких ферментативных перестроек
других заместителей возникает природный изомер протопорфирин
IX. Наконец, ион двухвалентного железа при участии феррохелата-
зы образует комплексное соединение с самым центром этого плоского
порфиринового кольца, соединяясь с каждым из четырех атомов
азота; это и есть гем. Как первая реакция, катализируемая фермен-
том АЛК-синтетазой, так и последняя реакция, которую катализи-
рует гем-синтетаза, осуществляются в митохондриях, но другие
промежуточные этапы протекают в цитозоле. Работу всей цепи ре-
акций синтеза гема контролирует именно первый фермент, катали-
зирующий начальную реакцию цепи. АЛК-синтетаза в норме об-
ладает активностью, составляющей лишь 1/1,0 активности, прису-
щей следующему этапу (реакция конденсации), и, следовательно,
310 6. АЗОТИСТЫЙ ОБМЕН
лимитирует скорость процесса в целом. Более того, как каталити-
ческая активность, так и синтез этого фермента подвержены инги-
бированию конечным продуктом гемом, действующим по принципу
обратной связи.
Такие стероидные гормоны, как эстрогены и глюкокортикоиды,
а также некоторые лекарственные средства (сульфамиды, барбиту-
раты) стимулируют биосинтез АЛК-синтетазы в печени, тогда
как высокие концентрации глюкозы, подобно гему, предотвращают
индукцию фермента. Концентрация доступного железа оказывает
влияние на образование гема при участии феррохелатазы; подобное
воздействие оказывает и парциальное давление кислорода (Рог)-
Последний фактор имеет особенно важное значение для регуляции
биосинтеза гема в костном мозгу; это согласуется с наблюдениями
об адаптивном ускорении эритропоэза низкими концентрациями
кислорода у жителей высокогорных районов.
Порфирии
Некоторые из этих состояний обусловлены наследственными
нарушениями обмена веществ в костном мозгу и поэтому называ-
ются эритропоэтическими порфириями\ другие, обусловленные
либо первичной врожденной аномалией печени, либо вторичной,
латентной чувствительностью синтеза гема в печени к некоторым
токсичным агентам, называются печеночными порфириями. Харак-
терной особенностью всех этих синдромов является накопление в
тканях различных производных порфирина, распределение которых
зависит от места их синтеза. Например, при эритропоэтических
порфириях накапливающиеся порфирины легко выявляются в эрит-
роцитах и в кроветворных клетках благодаря интенсивной флуо-
ресценции в ультрафиолете. При печеночных порфириях флуорес-
цируют клетки печени, а не костного мозга. Во многих случаях
производные порфирина попадают в мочу (уропорфирии); их темно-
красное окрашивание и способность флуоресцировать в ультрафио-
лете служат основой диагностических тестов.
При всех формах порфирии, за исключением одной, у больных
обнаруживаются поражения кожи, различающиеся по степени тяже-
сти, а также повышенная чувствительность к солнечным лучам.
Часто, но не всегда заболевание сопровождается симптомами со
стороны нервной системы. Последние, наблюдающиеся только при
печеночных порфириях, варьируют от интенсивных болей в животе
или в конечностях до параличей, судорог, галлюцинаций, психозов
и комы. Подобно гемофилии, печеночную порфирию называют «коро-
левской болезнью», так как она передавалась по наследству в коро-
левских домах Ганновера и Пруссии, а также в семье Стюартов;
помешательство короля Англии Георга III связывали с этим забо-
леванием.
в. АЗОТИСТЫЙ ОБМЕН
311
Факторами, провоцирующими возникновение острых приступов
порфирии, бывают либо воздействие солнечных лучей, либо по-
ступление в организм лекарственных препаратов или гормонов, ин-
дуцирующих синтез АЛК-синтетазы. При печеночных порфириях
активность этого фермента в печени повышается во много раз по
сравнению с нормой. По-видимому, эти синдромы принципиально
отличаются от других врожденных нарушений обмена, при которых
отмечается снижение ферментативной активности. Повышение ак-
тивности АЛК-синтетазы, вероятно, обусловлено наследственным
дефектом системы регуляции, так что происходит «сверхиндукция»
синтеза фермента без ограничивающего влияния репрессии.
Желчные пигменты
Подобно их предшественникам гемопротеидам, желчные пигмен-
ты представляют собой вещества, ярко окрашенные в различные
цвета: от зеленого (биливердин) до красновато-желтого (билирубин).
Как указывает само название, они придают окраску желчи. Поступ-
ление в желчь служит нормальным путем выведения желчных пиг-
ментов, которые являются конечными продуктами катаболизма
порфириновых компонентов гемопротеидов. В отличие от апопротеи-
на и железа, которые удерживаются в организме, порфирины не
используются повторно, а выводятся целиком в виде их „разомк-
нутых" тетрапиррольных производных.
Если желчные пигменты накапливаются в крови и других жид-
костях тела либо при избыточном их образовании, либо в резуль-
тате недостаточного выведения с желчью, они придают интенсивную
желтую окраску коже. Такое состояние, называемое желтухой,
может возникать при распаде большого количества эритроцитов
(гемолиз), что ведет к образованию избытка билирубина в ходе
катаболизма гемоглобина, но чаще желтуха возникает вследствие
нарушения нормальных механизмов, при помощи которых печень
справляется с потоком билирубина. У взрослых билирубин не ока-
зывает серьезного токсического воздействия, тогда как у новорож-
денных желтуха порой приводит к тяжелым и необратимым наруше-
ниям, особенно в ткани мозга.
Распад гема. В некоторых тканях происходит катаболизм гемопро-
теидов. Всем знакомо появление целой «радуги», образуемой желч-
ными пигментами после кровоизлияний и местного распада гемо-
глобина в коже и подкожной клетчатке, например при синяках или
поверхностных ссадинах. В основном продукты распада гема обра-
зуются из гемоглобина, освобождаемого при гемолизе тех эритро-
цитов, которые достигли своего предельного «возраста» (4 мес).
Непрерывное удаление этих стареющих клеток и последующее
превращение гемоглобина в желчные пигменты происходит преиму-
щественно в селезенке; ретикуло-эндотелиальные элементы печени и
312 6- АЗОТИСТЫЙ ОБМЕН
Рис. 6-22. Катаболизм гема и конъюгация желчных пигментов.
костного мозга играют при этом второстепенную роль. Все эти
ткани содержат весьма активную ферментную систему, гемоксигена-
зу, которая связана с эндоплазматическим ретикулумом (рис. 6-22).
Перед распадом остаток гема отделяется путем диссоциации
от белкового компонента гемоглобина или других гемопротеидов.
В присутствии О2 и НАДФ-Н связанный с мембранами цитохром,
обозначаемый символом Р450, окисляет один из углеродных атомов,
которые служат как бы мостиками, связывающими между собой
6 АЗОТИСТЫЙ ОБМЕН
313
пиррольные кольца, и освобождает его в виде окиси углерода. Та-
ким образом достигается раскрытие порфиринового кольца с обра-
зованием линейной тетрапиррольной цепи биливердина. Глобин
(или другие белковые компоненты) гидролизуются до свободных
аминокислот, которые частично превращаются затем во вновь син-
тезированные белки. Освобождаемое при распаде гема железо почти
количественно сохраняется в организме для повторного использо-
вания в составе новых гемопротеидов.
Биливердин редко накапливается или поступает в кровь из
клеток, в которых он синтезируется, поскольку по мере его образо-
вания на биливердин воздействует очень активный растворимый
фермент редуктаза, для функционирования которого также требуется
НАДФ-Н. Продуктом этой реакции является билирубин — наи-
более важный из встречающихся в организме желчных пигментов.
Сам билирубин мало растворим в воде и, вероятно, встречается в
содержимом клеток или во внеклеточных жидкостях только в виде
комплексов с белками. Однако благодаря растворимости свободного
билирубина в липидах он легко проникает сквозь гидрофобные
клеточные мембраны. Следовательно, билирубин, образующийся в
ретикуло-эндотелиальных тканях, диффундирует в кровоток, где
включается в процесс создания растворимого комплекса с альбуми-
ном плазмы. Такой комплекс представляет собой важнейшую нор-
мальную транспортную форму желчных пигментов.
Конъюгация билирубина. Достигая печеночных клеток, комплекс
альбумин-билирубин диссоциирует, и свободный билирубин прони-
кает сквозь клеточную мембрану. В цитозоле он затем связывается
с белком-переносчиком. Главной функцией печени является превра-
щение билирубина, который поступает из различных мест распада
гема в организме, в водорастворимую форму, пригодную для вы-
ведения с желчью (рис. 6-22). Это достигается путем присоединения
производных сахаров к двум из пиррольных колец в результате
процесса, называемого конъюгацией. Производное сахара глюку-
роновая кислота присоединяется в активированной форме, в виде
УДФ-глюкуроновой кислоты; последняя образуется в печени в ре-
зультате действия растворимой дегидрогеназы на УДФ-глюкозу с
использованием двух молей НАД. Специфический фермент эндо-
плазматического ретикулума глюкуронилтрансфераза катализирует
перенос молекулы активированной глюкуроновой кислоты на каж-
дую из двух карбоксильных групп пропионовой кислоты со слож-
ноэфирными связями. Образующаяся конъюгированная форма желч-
ного пигмента билирубин — диглюкуронид содержит гидрофильные
остатки сахаров, противодействующие гидрофобным свойствам
остальной части молекулы. Такой конъюгат не только хорошо
растворим в воде сам по себе, но также облегчает солюбилизацию
свободного билирубина, образуя с ним комплексное соединение.
Как конъюгированные, так и неконъюгированные молекулы били-
Клетки
ретикуло-
эндотелиальной
системы
Кровь
Печень
Желчь
Кишечник
Кал
Норма
Гемоглобин
4 .
Билирубин
4 ,
Билирубин-
альбумин
4 .
Билирубин-
диглюкуронид
I
Уробилин
Гемолитическая
Гемоглобин
Билирубин-
альбумин
ди глюкуронид
Уробилин
Нормальный цвет Темный
Паренхиматозная
Гемоглобин
Обтурационная
Гемоглобин
Билирубин
Билирубин-
Билирубия'
ЪиглюкурониЪ
Билирубин-
Ъиглюкуронид
Уробилин
Светлый Бесцветный
Рис. 6-23. Три вида желтух и нарушения обмена желчных пигментов в различных тканях.
Жирные стрелки указывают последовательность реакций обмена веществ Утолщи на этих стрелок соответствует интенсивности каждой реакции по
сравнению с нормой. Светлые стрелки указывают изменения (увеличение или уменьшение) содержания желчных пигментов в различных тканях
и жидкостях тела.
6. АЗОТИСТЫЙ ОБМЕН
315
рубина могут затем поступать из печеночных клеток в желчные про-
токи, по которым они будут перемещаться с током желчи к желчно-
му пузырю до того, как станет возможным их выброс в желудочно-
кишечный тракт.
Желтуха. В норме печень осуществляет эффективное удаление
желчных пигментов из циркулирующей крови; после ряда окисли-
тельно-восстановительных реакций, катализируемых микроорга-
низмами кишечника, продукты превращения желчных пигментов
уробилины выводятся с фекалиями. Нормальный ход этих событий
нередко нарушается под влиянием самых разнообразных факторов,
действующих порознь или в сочетании друг с другом (рис. 6-23).
Гемолитическая желтуха возникает в результате образования из-
бытка билирубина, превосходящего способность нормальных пече-
ночных клеток к конъюгации; при этом в крови накапливается
неконъюгированный билирубин, а фекалии становятся почти чер-
ными из-за повышенного содержания выводимых уробилинов. Гепа-
тоцеллюлярная (паренхиматозная) желтуха возникает как следст-
вие заболеваний, при которых нарушается либо захват, либо конъю-
гация свободного билирубина печенью, в результате чего неконъю-
гированный билирубин, освобождаемый при нормальном гемолизе,
также накапливается в крови, а содержание уробилинов в фека-
лиях снижается. Обтурационная желтуха — результат блокады
оттока желчи, что сопровождается накоплением конъюгированного
билирубина и его поступлением обратно в циркулирующую кровь.
Растворимый комплекс билирубин — диглюкуронид попадает в мо-
чу, хотя выведение уробилинов с фекалиями может быть настолько
ничтожным, что кал остается фактически бесцветным.
Таким образом, данные химического анализа о количестве
конъюгированного и неконъюгированного билирубина в крови, а
также результаты определения выведения желчных пигментов
имеют важное значение для выяснения этиологии желтухи. Однако
практически различия между описанными видами желтухи редко
бывают такими отчетливыми, т. е. лишь в редких случаях, за
исключением начальных этапов, удается обнаружить обтурацию
желчных протоков без поражения печеночных клеток, обусловлен-
ного обратным током желчи. В других случаях возможны различ-
ные сочетания нарушений осмотической резистентности эритроци-
тов, внутрипеченочных нарушений (либо метаболизма, либо тран-
спорта) и холестаза.
Желтуха, обусловленная недостаточной функцией печени, не-
редко встречается у новорожденных; это так называемая гипербили-
рубинемия новорожденных, В данном случае речь идет о биохими-
ческой незрелости печени при рождении. Эмбрион не располагает
ферментной системой конъюгации, и выведение билирубина из
организма эмбриона осуществляется через плаценту в циркулирую-
щую кровь материнского организма. После рождения ребенок
316 6. АЗОТИСТЫЙ ОБМЕН
оказывается изолированным от этой системы, а созревание его соб-
ственных механизмов конъюгации и экскреции билирубина еще не
завершилось. Естественно, любое дополнительное ускорение гемо-
лиза, как это наблюдается при несовместимости групп крови в от-
ношении Rh-фактора (эмбриональный эритробластоз), АВО или
других антигенов, резко осложняет ситуацию и усиливает гиперби-
лирубинемию. Более того, в противоположность транзиторной
«физиологической» желтухе доношенных детей (такая желтуха
обычно проходит самопроизвольно в течение 2 нед по мере развития
конъюгирующего фермента печени) у недоношенных замедленная
дифференцировка ферментов печени может привести к столь значи-
тельному повышению содержания неконъюгированного билирубина
в крови, что это становится опасным.
Билирубин опасен своим токсическим воздействием на разви-
вающийся мозг, что в свою очередь определяется способностью
неконъюгированного билирубина легко проникать через клеточные
мембраны. У взрослых нейротоксический эффект желтухи наблю-
дается редко — конъюгированный билирубин не проникает в клетки
мозга из кровотока. Отложение билирубина в мозгу происходит
при так называемой ядерной желтухе (Kernicterus). В острых слу-
чаях у детей развиваются судороги, и они погибают в раннем дет-
стве. В менее тяжелых случаях такие дети выживают, но тем не ме-
нее они могут страдать необратимыми расстройствами нервной си-
стемы, которые проявляются в атаксии и других нарушениях мото-
рики, а также в умственной отсталости.
Для лечения тяжелых случаев гипербилирубинемии у детей
часто необходимы героические меры: в некоторых случаях прихо-
дится производить полное обменное переливание крови; в других —
детям вводят барбитураты, поскольку эти лекарственные средства,
как известно, стимулируют индукцию в печени синтеза глюкуро-
нилтрансферазы, которая необходима для конъюгации билирубина.
В последнее время предложен новый метод лечения — так называе-
мая «фототерапия»: используется тот факт, что желчные пигменты
разрушаются при действии ультрафиолетового света. Облучение
больных солнечным светом или другими источниками ультрафиоле-
товых лучей способствует распаду избытка билирубина до водораст-
воримых продуктов, которые выводятся из организма с желчью.
Этот способ лечения применяют при врожденном нарушении обме-
на, связанном с отсутствием системы конъюгации билирубина (син-
дром Криглера — Наджара)\ у таких больных часто развивается
ядерная желтуха, а индукция синтеза фермента, необходимого для
конъюгации билирубина, у них невозможна.
Были описаны случаи хронической желтухи, при которых симп-
томы выражены вообще в меньшей степени, концентрация желчных
пигментов в крови повышается периодически и в меньшей степени
и заболевание протекает более длительно. Такие синдромы бывают
в. АЗОТИСТЫЙ ОБМЕН
317
обусловлены частичным снижением в печени активности глюкуро-
нилтрансферазы (болезнь Джилберта), когда наблюдается уме-
ренное и периодически наступающее повышение содержания не-
конъюгированного билирубина в крови. С другой стороны, нару-
шение переноса диглюкуронида билирубина из печеночных клеток в
желчь (синдром Дубина — Джонсона) приводит к выраженному в
различной мере накоплению конъюгированного билирубина в
крови. При том и другом нарушении больным назначали фенобар-
битал с целью индуцировать синтез соответствующего фермента и
таким образом добиться уменьшения гипербилирубинемии. Однако в
большинстве случаев симптомы заболевания выражены в столь
незначительной мере, что лечения не требуется.
ПОЧКИ
Роль почек в метаболизме азотистых соединений является жиз-
ненно важной не только потому, что они выполняют очевидную функ-
цию выведения конечных продуктов, но и в связи с тем, что они
служат дополнительным местом синтеза глюкозы из аминокислот,
а также обеспечивают регуляцию образования аммиака, компенси-
руя появление избытка ионов водорода в циркулирующей крови.
Экскреторные механизмы почечных клеток уникальны в смысле из-
бирательности и эффективности действия. Для того чтобы спра-
виться с сотнями различных метаболитов, поступающих с током
крови, эпителиальные клетки почек содержат в своих мембранах
целый ряд специфических систем переноса, способных узнавать и
отделять „друга" от „врага". «Дружественные» незаменимые мета-
болиты, циркулирующие в крови (например, аминокислоты и глю-
коза), должны быть удержаны в организме, а токсичные конечные
продукты обмена (например, аммиак и мочевина) — выведены с
мочой. Метаболические превращения и энергетические затраты по-
чек ориентированы преимущественно на процессы переноса, имею-
щие непосредственное отношение к экскреции. Глюконеогенез и
кислотно-щелочные соотношения в клетках почек координированы,
поскольку углерод для образования глюкозы и азот, экскретируе-
мый в виде аммиака, образуются в результате дезаминирования ами-
нокислот.
ОКИСЛЕНИЕ АМИНОКИСЛОТ
Клетки почек обладают способностью дезаминировать амино-
кислоты. В митохондриях этих клеток весьма активны аминотранс-
феразы, действующие на многие широко распространенные амино-
кислоты, а также глутаматдегидрогеназа. Эти ферменты обеспечи-
вают окислительное дезаминирование аминокислот, поступающих в
почки с током крови (рис. 6-24). Кровь представляет собой важ-
318 6. АЗОТИСТЫЙ ОБМЕН
Рис. 6-24. Роль почек в обмене аминокислот и аммиака.
нейший источник свободных аминокислот для метаболических ре-
акций в почках, поскольку клетки почек в норме осуществляют
протеолиз лишь в небольшой мере как в отношении свободных
тканевых белков, так и в отношении белков плазмы крови.
Из аминокислот, циркулирующих в крови, легче других подвер-
гаются биохимическим превращениям в почках глутамат, аспартат,
аланин и глицин. Первые три аминокислоты подвергаются комби-
нированному воздействию аминотрансфераз и глутаматдегидроге-
назы; глицин же требует действия специальной ферментной системы,
глициноксидазы, катализирующей прямое окислительное дезамини-
рование. Все эти механизмы функционируют в ткани почек, по су-
ществу, необратимо, поскольку биосинтеза аминокислот здесь почти
не происходит.
МЕТАБОЛИЗМ ИОНА АММОНИЯ
Одной из важнейших функций почек является поддержание pH
циркулирующей крови в узких пределах, соответствующих опти-
мальной работе ферментных систем организма. Механизмы регуля-
ции pH весьма сложны; для их функционирования имеют значение
такие факторы, как образование органических кислот или угольной
кислоты (СО2) в качестве тканевых метаболитов и выведение СОа
через легкие. Почки представляют собой идеальную систему выве-
дения ионов водорода с мочой. Работа этой системы сопровождается
образованием аммиака в результате ускоренного распада амино-
кислот. Электрически нейтральная молекула NH3 свободно диффун-
дирует из ткани почек сквозь клеточные мембраны в мочу, где он,
взаимодействуя с ионом водорода, образует катион аммония:
nh3+h+^:nh4+.
6. АЗОТИСТЫЙ ОБМЕН
319
Ион аммония не обладает свойством свободно проникать через
клеточную мембрану, благодаря чему он способствует выведению
иона водорода с мочой.
Такая система имеет ряд преимуществ: во первых, аммиак пред-
ставляет собой конечный продукт обмена, свободно и без значитель-
ных энергетических затрат поступающий в почки в результате
катаболизма аминокислот. Во-вторых, большие количества водо-
родных ионов могут быть выведены с мочой без резкого снижения
pH. В-третьих, выведение катиона аммония в сочетании с анионами
мочи (например, с фосфатами или такими анионами органических
кислот, как ацетат) позволяет экономить имеющиеся в организме
запасы натрия и других нужных катионов. Наконец, путем адаптив-
ных изменений процесса образования аммиака в организме почки
могут реагировать на колебания выработки кислот в различных
органах и тканях.
Глутаминазы
Почка располагает рядом ферментных систем, разрушающих
глутамин, но, подобно большинству реакций анаболизма амино-
кислот, синтез глутамина не осуществляется. Глутамин доставля-
ется к почкам током крови. Клетки почек жадно поглощают из
циркулирующей крови глутамин, который образуется в основном за
счет аммиака клеток печени. В почках же аммиак образуется преи-
мущественно из глутамина, так что последний можно рассматривать
как нетоксичную форму аммиака, который совершает челночные
движения между печенью и почками. Глутаминаза почек действует
подобно глутаминазе печени, освобождая глутамат и NHa путем
простой реакции гидролиза Однако фермент почек отличается тем,
что его активность значительно возрастает под влиянием неоргани-
ческого фосфата. Образующийся глутамат может, конечно, подвер-
гаться затем дезаминированию при участии глутаматдегидрогеназы,
так что из глутамина в конечном итоге образуются две молекулы
аммиака.
Роль почек
при ацидозе
В норме ионы аммония в моче составляют лишь небольшую фрак-
цию общего экскретируемого азота. Адаптивное увеличение выве-
дения аммиака почками может происходить при метаболическом
ацидозе, т. е когда в других тканях организма усиливается обра-
зование кислотных метаболитов до такой степени, что pH крови
снижается, или, хотя и в меньшей мере, при дыхательном ацидозе,
т. е. когда легкие не обеспечивают достаточно быстрого удаления
СО2. В случаях ацидоза у некоторых больных, например при не-
320 6. АЗОТИСТЫЙ ОБМЕН
леченом диабете, когда образуются и экскретируются большие
количества ацетоуксусной и 0-оксимасляной кислот, содержание
аммиака в моче возрастает в 10 раз или более, так что аммиак ста-
новится главным конечным продуктом азотистого обмена.
Этому адаптивному увеличению образования аммиака в ответ
на ацидоз способствуют различные факторы. Во-первых, стимули-
руется образование в печени и выделение в кровоток дополни-
тельного количества глутамина. Во-вторых, повышается скорость
захвата глутамина почками, так что содержание глутамина в цир-
кулирующей крови поддерживается почти на том же постоянном
уровне, как и при нормальном соотношении кислот и щелочей.
В-третьих, постепенно повышается содержание глутаминазы, ами-
нотрансфераз и глутаматдегидрогеназы в почках. Наконец, стиму-
ляция глюконеогенеза и окислительных реакций цикла лимонной
кислоты в митохондриях почек способствует ускоренному исполь-
зованию а-кетоглутарата и других кетокислот, образующихся
при распаде аминокислот. Таким образом, в условиях снижения
pH окружающей среды почки способны соответственно изменять
образование NH3 путем увеличения доступности субстрата, удале-
ния других продуктов реакции, а также путем повышения актив-
ности биокатализаторов.
ПЕРЕНОС АМИНОКИСЛОТ
Как было упомянуто выше, почки способны «очищать» кровоток
от чужеродных веществ. Эти вещества, по существу, могут быть нор-
мальными промежуточными продуктами внутриклеточных метабо-
лических процессов (например, гомоцистеин или гомогентизиновая
кислота), которые воспринимаются почками как чужеродные по-
тому, что в норме они в кровоток не попадают. Поэтому такие сое-
динения сразу же удаляются из крови; они могут активно секрети-
роваться почками в мочу. Такая ситуация, характерная для пато-
логических состояний, создала бы серьезные нарушения азотистого
обмена в организме, если бы почки поступали столь же расточи-
тельно по отношению ко всем аминокислотам, имеющимся в цирку-
лирующей крови. На самом деле важная функция определенных
клеток почек заключается в обратном захвате таких важных ве-
ществ, как глюкоза, аминокислоты и неорганические ионы, для того
чтобы предотвратить их утрату организмом вместе с конечными про-
дуктами обмена. Этот процесс избирательного удерживания назы-
вается обратным всасыванием.
Во время образования мочи жидкая часть и низкомолекулярные
компоненты плазмы крови поступают в результате фильтрации в
почечные канальцы, которые по всей длине выстланы эпителием,
обладающим различной способностью к всасыванию. У проксималь-
ного конца канальцев расположены клетки, функция которых за-
в. АЗОТИСТЫЙ ОБМЕН
321
ключается в обратном всасывании аминокислот из фильтрата, преж-
де чем он поступит в мочевыводящие пути. В норме почти 100%
аминокислот возвращаются в кровь именно таким образом: этим
объясняется тот факт, что в норме аминокислоты составляют лишь
минорный компонент мочи.
Захват аминокислот клетками почечных канальцев требует за-
траты энергии, поскольку молекулы аминокислот должны переме-
щаться против градиента концентрации. Специфичность этого про-
цесса, а также другие его особенности напоминают действие фер-
мента на соответствующий субстрат: например, скорость обратного
всасывания достигает предела при насыщении высокими концентра-
циями аминокислот, что аналогично Vmax ферментативных реак-
ций; кроме того, сходные по структуре аминокислоты способны кон-
курировать в процессе всасывания. Все эти свойства указывают,
что при обратном всасывании аминокислота образует комплекс с
переносчиком (подобный фермент-субстратному комплексу), кото-
рый представляет собой белковую молекулу, содержащую специфи-
ческий центр связывания и находящуюся на наружной поверхности
клеточной мембраны. Поступление энергии либо в виде АТФ, либо
в виде ионного градиента обеспечивает затем перемещение аминокис-
лоты сквозь мембрану с последующим ее освобождением в клетке.
Свободный переносчик затем возвращает центр связывания на на-
ружную поверхность и ожидает следующую аминокислоту, действуя,
таким образом, как бы каталитически, поскольку сам переносчик
в ходе этих процессов не изменяется. Сходная система переноса
функционирует в желудочно-кишечном тракте при всасывании ами-
нокислот пищи. Подобно каталитически активным белкам (фермен-
там), образование переносчиков определяется генами. В некоторых
случаях наследственная недостаточность системы переноса поража-
ет и всасывание в желудочно-кишечном тракте, и обратное всасы-
вание в почках определенной аминокислоты или группы родствен-
ных аминокислот (например, при обсуждавшейся выше болезни
Хартнупа). Родственные аминокислоты, взаимодействующие с
группоспецифичной системой переноса, могут конкурировать меж-
ду собой за один и тот же переносчик. Было охарактеризовано пять
таких аминокислотных групп: нейтральные аминокислоты (включая
такие ароматические аминокислоты, как триптофан), двухосновные
аминокислоты (включая цистин), дикарбоновые аминокислоты, ими-
нокислоты (плюс глицин) и р-аминокислоты.
Почечные аминоацидурии
Появление повышенных количеств аминокислот в моче обуслов-
лено одной из двух общих причин, лежащих в основе либо метабо-
лической аминоацидурии (примером которой может служить фенил-
кетонурия, характеризующаяся врожденным или приобретенным
322 6. азотистый обмен
дефектом ферментной системы, в результате чего нарушается ис-
пользование определенной аминокислоты, попадающей поэтому
в мочу), либо почечной аминоацидурии (типичным примером кото-
рой служит болезнь Хартнупа, при которой первичный дефект за-
ключается в нарушении обратного всасывания некоторых амино-
кислот в почечных канальцах). Как и в случае истинных врожден-
ных нарушений обмена, такая недостаточность почечных перенос-
чиков может быть наследственной, но она бывает также приобре-
тенной в результате воздействия ядов на эпителиальные клетки по-
чек. Поскольку одна система переноса участвует в транспорте не-
скольких аминокислот, поражение почечных канальцев сопровож-
дается множественной аминоацидурией, охватывающей компонен-
ты группоспецифичной системы, и они могут носить общий харак-
тер в случаях неспецифических поражений почек.
Цистинурия представляет собой наиболее изученный и часто
встречающийся пример наследственной почечной аминоацидурии.
Если не считать склонности к образованию в мочевыводящих пу-
тях камней, состоящих из слабо растворимого цистина, это расст-
ройство, по-видимому, не сопровождается серьезной патологией.
С целью предотвращения закупорки такими цистиновыми камня-
ми необходимо поддерживать на высоком уровне как объем мочи,
так и величину pH в ней. При этих условиях, которые могут быть
созданы путем введения в организм больших количеств жидкости и
щелочных агентов, концентрация экскретируемого цистина будет
поддерживаться на уровне, не достигающем насыщения, что дела-
ет возможным растворение мелких камней. Наряду с цистином мо-
ча в подобных случаях содержит варьирующие количества двухос-
новных аминокислот (аргинина, лизина и орнитина), которые в
самых общих чертах напоминают по структуре цистин и, по-види-
мому, в норме подвергаются обратному всасыванию при участии
одной и той же группоспецифичной системы переноса.
Другими примерами генетически детерминированной аминоаци-
дурии того же типа, что и цистинурия, может служить болезнь Харт-
нупа и иминоглицинурия. При этом последнем расстройстве в из-
бытке экскретируются только глицин и иминокислоты (пролин и
оксипролин), что еще раз подчеркивает значение группоспецифич-
ных систем для обратного всасывания в почечных канальцах.
При некоторых врожденных нарушениях обмена также возни-
кает генерализованная аминоацидурия. Эта аномалия иногда про-
является с возрастом; так это происходит, например, при галакто-
земии, когда накапливающийся галактозо-1-фосфат постепенно „от-
равляет" почечные канальцы, или при болезни Вильсона (гепатолен-
тикулярная дегенерация), когда задержка в организме и отложение
меди оказывает такое же действие. Подобная аминоацидурия, оче-
видно, является вторичным проявлением патологического процесса
в этих случаях; утрата аминокислот из общего фонда азотистых
6. АЗОТИСТЫЙ ОБМЕН
323
соединений редко представляет собой серьезный патогенетический
фактор при таких состояниях. При общем подавлении обратного
всасывания в почечных канальцах многие другие вещества (напри-
мер, глюкоза и фосфаты) также начинают экскретироваться в боль-
ших количествах. Так, одним из важнейших патологических из-
менений, возникающих при наследственной генерализованной ами-
ноацидурии, называемой синдромом Фанкони, является нарушение
минерализации костей, обусловленное избыточной потерей фосфата
с мочой, что приводит к патологическим переломам. Детям, страдаю-
щим этим расстройством, приходится вводить в организм большие
дозы витамина D с целью ограничить такую экскрецию фосфата и
обеспечить нормальный рост костей. Прием некоторых лекарствен-
ных средств (например, производных нитробензола) или попадание
в организм тяжелых металлов (например, ртути, свинца или кад-
мия), воздействующих на почки, нарушают всасывание многих сое-
динений в канальцах, что приводит к развитию приобретенной гене-
рализованной аминоацидурии, сопровождающейся также глюкозу-
рией и фосфатурией.
КОНЕЧНЫЕ ПРОДУКТЫ
АЗОТИСТОГО ОБМЕНА
Количественные аспекты выведения азотистых соединений были
рассмотрены выше в связи с поступлением азотистых соединений
в организм с пищей при обсуждении проблемы азотистого баланса.
Качественные особенности конечных продуктов азотистого обмена
в такой же мере важны в плане исследований процессов жизнедея-
тельности в норме и патологии. Допустим, что мы пытаемся получить
представление о состоянии домашнего хозяйства жителей дома на
основании изучения мусора; вес мусора может дать нам самое общее
представление об уровне активности обитателей, но для того, чтобы
сделать какие-либо конкретные выводы о состоянии дел в этом доме,
нам пришлось бы заняться подробным изучением контейнеров и эти-
кеток. Идентификация и анализ отдельных конечных продуктов об-
мена в моче предоставляет нам аналогичную возможность оценки
состояния азотистого обмена в организме (рис. 6-25).
Преобладающим компонентом среди экскретируемых с м^чой
азотистых соединений является мочевина. У взрослого здорового че-
ловека на ее долю приходится более трех четвертей всех экскрети-
руемых азотистых веществ. Существует прямая зависимость между
количеством поступающего с пищей белка и количеством выводимой
мочевины. Отклонения от нормы отражают функциональное состоя-
ние печени или почек. В крайне тяжелых случаях, например при
нарушении функции почек, содержание мочевины в крови резко
повышается (уремия). При полном нарушении функции печени пре-
кращается образование мочевины, которую могли бы экскретиро-
Нуклеиновые кислоты
5-20 г N/день
Варьирует-, Только следы;
нарастает при нарастает при
поступлении уменьшении
в организм массы мышц
белка
0,3-0,8 г N/день 0,08-0,15гN/день Ничтожные следы 0,4-1,0 г N/день
Постоянный Нарастают Нарастают Нарастает
уровень; при при тяжелых при ацидозах
нарастает при нарушениях заболеваниях
увеличении обмена почек
массы мышц веществ или
поражениях
почечных
канальцев
Рис. 6-25, Конечные продукты азотистого обмена в нормальной моче и при состояниях, ведущих к повышенной их экскреции.
6. АЗОТИСТЫЙ ОБМЕН
325
вать почки. Относительные концентрации мочевины в крови и моче
отражают соотношение между свойством печени синтезировать моче-
вину и свойством почек эффективно освобождать кровь от этого
конечного продукта азотистого обмена.
Креатин и креатинин — метаболиты, которые образуются пре-
имущественно в клетках мышц; выведение этих метаболитов с мо-
чой указывает на состояние мышечной системы в организме. Так,
креатинин непрерывно образуется в мышцах из креатинфосфата;
процесс этот протекает без участия ферментов. Поскольку креати-
нин не может быть превращен обратно в креатин, а также благодаря
тому что попадающий в кровоток креатинин активно секретируется
в мочу, он быстро и необратимо выводится сразу же по мере образо-
вания. Количество экскретируемого креатинина не зависит от коли-
чества поступающего в организм с пищей азота и остается постоян-
ным у одного и того же человека независимо от объема выделяемой
мочи. Это позволяет использовать креатинин как точку отсчета для
сопоставления с другими веществами, выводимыми с мочой. Коли-
чество выводимого креатинина непосредственно зависит от размера
тела и особенно от мышечной массы индивидуума. В отличие от
креатинина креатин может быть повторно использован для синтеза
креатинфосфата; как и в случае аминокислот, сохранение креатина
в организме обеспечивается его обратным всасыванием в почечных
канальцах. У маленьких детей и у беременных женщин в моче по-
являются небольшие количества креатина, но у взрослых в норме он
почти не экскретируется. Повышение экскреции креатина часто
указывает на поражение мышечной ткани, сопровождающееся
уменьшением ее массы, подобно тому как это происходит при голо-
дании и различных формах мышечной дистрофии.
Мочевая кислота как конечный продукт азотистого обмена была
рассмотрена в связи с метаболизмом пуринов и подагрой. Разуме-
ется, количество мочевой кислоты в моче здоровых людей связано с
содержанием нуклеиновых кислот в пище: оно особенно высоко в та-
ких наиболее богатых белками продуктах, как мясо. Экскреция
мочевой кислоты изменяется параллельно экскреции мочевины, хотя
и на более низком уровне. Такая богатая белком пища, как яйца
и молочные продукты, содержит очень мало пуринов; это следует
иметь в виду при необходимости уменьшить образование в организ-
ме и, следовательно, экскрецию мочевой кислоты. Почки весьма
эффективно удаляют мочевую кислоту из крови посредством про-
цесса активной секреции в почечных канальцах.
Аминокислоты в норме составляют небольшую часть выводимых
с мочой азотистых соединений. К аминокислотам, обратное всасы-
вание которых менее эффективно, относятся: глицин, гистидин,
глутамин, серин и аланин. Следовательно, в норме эти аминокислоты
обнаруживаются в моче особенно часто; в условиях генерализован-
ной аминоацидурии увеличение содержания именно этих аминокис-
326 6. АЗОТИСТЫИ ОБМЕН
лот бывает выражено наиболее значительно. Появление в моче дру-
гих групп аминокислот или отдельных аминокислот позволяет од-
нозначно диагностировать нарушения обмена веществ или пораже-
ние почечных канальцев.
Аммиак как конечный продукт азотистого обмена уже был рас-
смотрен подробно. Необходимо подчеркнуть, что аммиачный запах
большинства проб мочи при стоянии усиливается в результате раз-
ложения других продуктов азотистого обмена; следовательно, по-
лезные сведения можно получить лишь при определении аммиака
в свежей моче. Увеличение содержания аммиака в моче вызывается
ацидозом, а также сопровождает повышение уровня аммиака или
аминокислот в крови.
Белки в норме не попадают в мочу. Лишь те белки, молекулы
которых относительно малы, могут проникать из крови в клубочко-
вый фильтрат; большинство таких белков эффективно подвергается
обратному всасыванию. Любое увеличение содержания белков в мо-
че до уровня, превосходящего «следы», указывает на тяжелое пора-
жение почек. В таких случаях, например при нефротическом синд-
роме, наличие в моче большого количества альбумина при соответ-
ствующем снижении содержания альбумина в крови может быть
выражено особенно четко.
МОЗГ
Обмен аминокислот и их производных в тканях нервной систе-
мы важен для дифференцировки миелина, нервных клеток и их от-
ростков в растущем организме, а также для поддержания структу-
ры и функций зрелой нервной системы. В раннем детстве особенно
резко сказывается на развитии мозга недостаточность белков в пище
(например, при квашиоркоре). Хотя путем увеличения содержания
белка в пище удается устранить многие симптомы, тем не менее убе-
дительно доказано, что, если только такие добавки не были введены
в решающие первые месяцы жизни, когда мозг развивается наиболее
быстро, произойдут необратимые нарушения умственной деятель-
ности. Если учесть, что избыточные количества аминокислот (на-
пример, при фенилкетонурии) оказывают сходные необратимые воз-
действия вскоре после рождения ребенка, то станет очевидным жиз-
ненно важное значение для нормального развития умственной дея-
тельности правильного баланса, т. е. сохранения приблизительно
эквивалентных соотношений всех аминокислот.
На всех этапах онтогенеза для мозга характерен активный тран-
спорт незаменимых аминокислот, благодаря которому поддержива-
ются более высокие концентрации этих аминокислот в нервных
клетках по сравнению с их концентрацией в плазме крови, снабжаю-
щей нервную систему. Эти концентрационные механизмы особенно
важны для поглощения ароматических аминокислот, которые служат
6. АЗОТИСТЫЙ ОБМЕН
327
предшественниками соответствующих аминов. Такие амины, об-
разующиеся в нервных клетках, играют роль нейромедиаторов или
оказывают регулирующие воздействия на функцию нервной систе-
мы. Некоторые заменимые аминокислоты, например глутамат, аспар-
тат (или их производные), а также глицин, обнаруженные в тканях
мозга в высоких концентрациях, также способны изменять возбу-
димость нервной системы. Перечисленные заменимые аминокислоты
также синтезируются в нервных клетках, и изменение их концентра-
ций в плазме крови мало влияет на их содержание в тканях мозга.
ОБМЕН ГЛУТАМАТА
Из числа заменимых аминокислот, обнаруженных в тканях нерв-
ной системы, глутаминовая кислота наиболее важна как с точки
зрения концентрации, так и ее превращений в другие соединения. К
числу последних относятся такие важные вещества, как глутамин и
а-кето глутарат, которые обеспечивают соответственно взаимосвязь с
метаболизмом аммиака и углеводов, а также тормозный нейромедиа-
тор у-аминомасляная кислота (ГАМК). В совокупности эти родст-
венные глутамату вещества составляют более половины общего
количества аминокислот мозга. Они образуются в нервных клетках
за счет углерода глюкозы, доставляемой кровью, что составляет при-
мерно одну десятую часть общего количества потребляемых мозгом
углеводов (рис. 6-26).
В нервной ткани глутамат может образоваться либо путем пе-
реноса аминогруппы от любой из целого ряда аминокислот на а-ке-
тоглутарат, либо путем восстановительного аминирования этого
последнего промежуточного продукта цикла лимонной кислоты с
использованием аммиака и в присутствии глутаматдегидрогеназы.
Этот фермент, функционирующий в тканях мозга преимущественно
в направлении синтеза глутамата, весьма чувствителен к концентра-
ции аммиака. Однако в условиях избыточного образования аммиака
(как это происходит при расстройствах, сопровождающихся судо-
рогами) большая его часть используется для дальнейшего превра-
щения глутамата в глутамин при участии высокоактивной глутамин-
синтетазы, обнаруженной в нервной ткани. В отличие от глутамата,
который с трудом проникает сквозь клеточную мембрану, глутамин
диффундирует свободно и, таким образом, может переходить в кро-
воток или в спинномозговую жидкость, удаляя тем самым из мозга
две молекулы весьма токсичного аммиака. Определение содержа-
ния глутамина в спинномозговой жидкости при таких состояниях,
как печеночная кома, дает ценную информацию о количестве аммиа-
ка, достигающем мозга. Определение степени взаимопревращения
глутамина, глутамата, а-кетоглутарата и NH3 затрудняется теми
различиями, которые существуют между отдельными областями моз-
га и типами клеток. Однако в основном в нервной ткани глутамат и
328 6. АЗОТИСТЫЙ ОБМЕН
Рис. 6-26. Метаболизм аминокислот в тканях мозга.
родственные ему соединения функционируют сочетанно, обеспечи-
вая захват и удаление аммиака.
Хотя глутамат в тканях мозга не подвергается интенсивному
окислению и, таким образом, не вносит значительного вклада в энер-
гетическое обеспечение работы мозга, он частично используется в
процессе переноса аминогрупп для образования других заменимых
аминокислот. Из последних наиболее важное значение имеет аспар-
тат, образующийся в нервной ткани при участии высокоактивного
фермента аспартатаминотрансферазы. Реагируя с ацетил-КоА, ас-
партат образует N-ацетиласпартат—соединение, концентрация ко-
торого в нервной ткани (и только в нервной!) настолько велика, что
приближается к концентрации глутамата и родственных ему соеди-
нений. Функция этого уникального компонента нервной системы до
сих пор не выяснена. Он может служить в тканях мозга постоянным
источником ацетильных групп, которые используются для образо-
вания ацетилхолина или для синтеза жирных кислот. С другой сто-
роны, функция N-ацетиласпартата, возможно, сводится просто к
поддержанию устойчивого отрицательного заряда содержимого
нервных клеток. Известно также, что в мозгу встречаются более
сложные пептиды, содержащие N-ацетиласпартат или N-ацетилглу-
тамат, но их роль до сих пор загадочна.
Гамма-аминомасляная кислота
Это соединение, часто обозначаемое в медицинской литературе
сокращенным термином ГАМК, также представляет собой характер-
ный компонент мозга. ГАМК образуется в результате отщепления
6. АЗОТИСТЫЙ ОБМЕН
329
соон
I
сн2
I
СН2
I
chnh2
соон
(Глутамат-
декарбоксилаза)
Витамин В6
СООН
Глутамат (Перенос
трикарбоновых
СН2
I
сн2
I
nh2
кислот
ГАМК-шунт
у-Аминомасляная кислота
(ГАМК)
Рис. 6-27. Метаболизм у-аминомасляной кислоты (ГАМК) в тканях мозга.
от глутамата соседнего с аминогруппой карбоксила при участии
специфического фермента глутаматдекарбоксилазы, который рас-
пространен главным образом в тканях нервной системы (рис. 6-27).
Распределение ГАМК в тканях мозга соответствует распределению
тех клеток, которые оказывают тормозное воздействие на другие
клетки (например, клетки Пуркинье мозжечка). Считают вероят-
ным, что ГАМК играет роль нейромедиатора в синапсах, образуе-
мых при участии таких ингибиторных клеток в центральной нерв-
ной системе (глицин, по-видимому, выполняет подобную ингибитор-
ную функцию в спинном мозге). Эти специфические воздействия на
клетки связаны с освобождением ГАМК на их наружной поверх-
ности. Кроме того, осуществляемая ГАМК регуляторная функция
внутри самого нейрона частично определяет уровень общей возбу-
димости: низкое содержание ГАМК сопровождается развитием-су-
дорог, тогда как стойко повышенный уровень ГАМК противостоит
возникновению судорожных состояний. В общем дикарбоновые ами-
нокислоты глутамат и аспартат повышают возбудимость нервных
клеток, тогда как монокарбоновые — ГАМК и глицин — вызывают
противоположный эффект. Соотношение между этими возбуждающи-
ми и тормозными агентами имеет существенное значение для регу-
ляции физиологических функций нервной системы.
Превращение глутамата в ГАМК создает путь в обход цикла ли-
монной кислоты, так называемый ГАМК-шунт. Лишь примерно
330 6. АЗОТИСТЫЙ ОБМЕН
одна десятая часть всей используемой глюкозы проходит через этот
шунт: ГАМК превращается в сукцинат, минуя, таким образом, а-ке-
тоглутаратдегидрогеназную реакцию.
Пиридоксин и судороги
Как и для многих ферментов метаболизма аминокислот, в част-
ности для аминотрансфераз и декарбоксилаз, витамин Вв в виде
кофермента пиридоксальфосфата является незаменимым кофакто-
ром и при синтезе ГАМК в тканях мозга. Апофермент глутаматдекар-
боксилазы слабо связывает пиридоксальфосфат, так что активность
этого фермента и, следовательно, концентрация ГАМК в мозгу
резко снижаются в условиях недостаточности витамина Вв.
Было показано, что наблюдаемое у некоторых детей врожденное
нарушение, характеризующееся судорогами и приводящее иногда
к смерти в раннем детстве, поддается лечению большими дозами ви-
тамина Вв. Эта аномалия, называемая пиридоксинозависимостью,
у детей, не получавших лечения, связана с нарушением превраще-
ния глутамата в ГАМК, что свидетельствует о сниженном по срав-
нению с нормой сродстве глутаматдекарбоксилазы к ее коферменту.
Инъекции самой ГАМК как способ лечения не эффективны, посколь-
ку ГАМК с трудом проникает в мозг из циркулирующей крови. Та-
кие дети могут, однако, жить и нормально развиваться, если диаг-
ноз поставлен рано и проведено лечение большими дозами витамина.
БИОГЕННЫЕ АМИНЫ
Эти важные продукты метаболизма аминокислот участвуют в
процессах проведения импульсов от одной нервной клетки к дру-
гой (рис. 6-28). После раздражения первой нервной клетки она ос-
вобождает химический агент в заполненную жидкостью щель между
нею и соседней нервной клеткой. Повышение ионной проницаемости
мембраны второй клетки под влиянием этого агента в указанной
щели, или синапсе, приводит к быстрой диффузии ионов натрия во
вторую клетку. Результатом является деполяризация клеточной
мембраны, инициирующая волну электрических разрядов вдоль
второго нерва. Те химические агенты, которые образуются при та-
ком раздражении и обеспечивают передачу нервного импульса че-
рез синапс, обычно называют нейромедиаторами. Как было отме-
чено выше, к числу таких участвующих в проведении нервных им-
пульсов соединений относятся тормозные агенты — ГАМК и гли-
цин. Установлено, что существуют четыре типа возбуждающих
нейромедиаторов, распространение которых в нервной системе раз-
лично. К числу таких нейромедиаторов относятся ацетилхолин
(в холинэргических окончаниях), норадреналин (в адренэргических
6. АЗОТИСТЫЙ ОБМЕН
331
Рис. 6-28. Выделение и действие нейромедиаторов в синапсах.
окончаниях), серотонин (в серотонинэргических окончаниях) и
гистамин (который, как считают, участвует в функционировании
ряда сенсорных нервных механизмов).
Ацетилхолин
Рассматривая участие ацетилхолина в процессах нервного воз-
буждения, различают четыре фазы в судьбе этого важного соедине-
ния: биосинтез, депонирование, выделение и распад. Химически аце-
тилхолин представляет собой простой эфир, образованный ацетатом
и аминоспиртом холином. Последний образуется из аминокислоты се-
рина путем декарбоксилирования до этаноламина с последующим
присоединением трех метильных групп, источником которых слу-
жит S-аденозилметионин (рис. 6-29). Как было отмечено выше, этим
превращениям подвергаются азотистые соединения, образующие
комплексы с фосфолипидами. Холин, кроме того, представляет
собой важный компонент структуры мембран нервных клеток.
Биосинтез ацетилхолина, катализируемый специфическим фер-
ментом холин-ацетилтрансферазой, происходит только в нервных
волокнах, в частности в тех участках, где их окончания соприка-
саются с поверхностями других нервных или мышечных клеток.
В таких нервных окончаниях холин, который был доставлен либо
332 6- АЗОТИСТЫЙ ОБМЕН
СООН
hoch2-ch-nh2
Серин ^^С°2
hoch2-ch2-nh2
Этаноламин
Глюкоза
Пируват
О
II
СНз-C-SKoA.
Ацетил-КоА
Холин СНз
сн3
11 /
СНз-С-О-СН2- СН2- N - сн3
(Ацетилтрансфераза) X
Ацетилхолин СНз
Рис. 6-29. Обмен ацетилхолина в нервной ткани (SAM — S-аденозилметионин).
с током крови, либо синтезирован в самих нервах, реагирует с аце-
тил-КоА, образующимся преимущественно при окислении углево-
дов в нервной системе. Синтезированный таким образом ацетилхо-
лин быстро инкапсулируется, переходя в стойкую резервную форму
и хранится в мельчайших образованных мембраной пузырьках
(рис. 6-28). При раздражении нерва эти пузырьки сливаются с по-
верхностной мембраной клетки и выделяют свое содержимое, кото-
рое представляет собой конгломерат молекул ацетилхолина, в си-
наптическую щель. Затем нейромедиатор, мигрируя через щель, до-
стигает мембраны соседней нервной клетки и повышает ее проницае-
мость для натрия, как это было описано в гл. 3. После того как ра-
бота завершена, т. е. после индукции изменений электрического
потенциала во второй нервной клетке, избыток ацетилхолина дол-
жен быть разрушен и удален, т. е. его эффект должен быть кратко-
временным. Этот процесс осуществляется на поверхности мембраны
при участии специфического гидролитического фермента ацетилхо-
линэстеразы, который расщепляет ацетилхолин вновь до ацетата
и холина (рис. 6-29). Распределение ацетилхолина в нервной систе-
ме соответствует распределению ферментов ацетилхолинтрансфера-
зы и эстеразы, достигая наивысших концентраций на месте контак-
та моторных нервных окончаний со скелетной мышцей, а также в
области окончаний парасимпатических нервов, например блуждаю-
щего.
в. АЗОТИСТЫЙ ОБМЕН
333
Специфические ингибиторы ацетилхолинэстеразы позволяют аце-
тилхолину накапливаться, поскольку иных путей удаления этого
нейромедиатора, кроме медленной диффузии, не существует. Аген-
ты, оказывающие такие воздействия, называют антихолинэстера-
зами; к их числу относятся вещества, используемые в качестве ле-
карственных средств для контролируемого локального потенциро-
вания действия ацетилхолина, а также яды. К категории последних
относят инсектициды и нервные газы, воздействие которых сопро-
вождается накоплением в нервной системе больших количеств аце-
тилхолина, что приводит к гибели пораженного организма при раз-
витии судорог и остановке дыхания.
Катехоламины
К этому важному классу биогенных аминов относится адреналин
(эпинефрин) — вещество, синтезирующееся в мозговом слое над-
почечников и участвующее в общих системных эффектах возбужде-
ния симпатической нервной системы; норадреналин (норэпине-
фрин) — предшественник адреналина и химический передатчик нер-
вных импульсов в синапсах симпатической нервной системы, а так-
же в различных видах адренэргических нервных волокон — и
диоксифенилэтиламин, или дофамин, который служит предшествен-
ником двух других катехоламинов и, кроме того, играет особую
роль в некоторых двигательных областях мозга. Все эти аромати-
ческие амины содержат диоксибензольное кольцо (катехин) и обра-
зуются в процессе обмена веществ из тирозина или фенилаланина
(рис. 6-30).
Биосинтез катехоламинов в мозговом слое надпочечников или
в нервной системе начинается действием гидроксилирующего фер-
мента, сходного по природе участвующих кофакторов и механизму
катализируемой реакции с фенилаланингидроксилазой печени.
Рассматриваемая реакция заключается в присоединении второй
гидроксильной группы к кольцу тирозина с образованием диокси-
фенилаланина, который называется в медицинской литературе со-
кращенно ДОФА. Превращение ДОФА в дофамин катализирует
пиридоксин-зависимая декарбоксилаза, отщепляющая СО2.
Значение дофамина особенно велико при паркинсонизме. Это
патологическое состояние характеризуется утратой контроля над
двигательной системой и проявляется, в частности, тремором и ри-
гидностью. При паркинсонизме резко снижена концентрация до-
фамина в экстрапирамидных центрах мозга, участвующих в регу-
ляции двигательных функций. Введение самого дофамина не дает
большого эффекта, поскольку он, по-видимому, не проникает из
крови в мозг, т. е. не способен преодолеть гемато-энцефалический
барьер. Однако его предшественник ДОФА проникает в базальные
ганглии, где локализуется поражение; в результате действия внутри-
334 6- АЗОТИСТЫЙ ОБМЕН
сн2 °2
I
CHNHj
I
соон
ОН
(Гидро-
ксилаза)
/ НАДф+1
Птеридин сн2
CHNH,
I
соон
он
(декарбо-
ксилаза)
Витамин В®4
со2
Мозговой слой
ОН надпочечника он
сн2
I
NH
I
Тирозин
Моча
Диоксифенил-
аланин
(ДОФА)
снон снон
I I
соон сн
Ванилилминдальная
кислота
Рис. 6-30. Биосинтез и распад катехоламинов.
клеточной декарбоксилазы на ДОФА концентрация дофамина здесь
достигает нормального уровня, что приводит к преходящему, но
отчетливому смягчению симптомов паркинсонизма.
В других областях нервной системы дофамин выполняет функ-
ции промежуточного продукта в процессе синтеза норадреналина.
Превращение это катализирует гидроксилаза, но в данном случае
гидроксильная группа присоединяется к боковой цепи, а не к коль-
цу. Такая же реакция происходит и в мозговом слое надпочечника,
где в результате заключительного метилирования (при участии S-
аденозилметионина в качестве донора метильных групп) образуется
адреналин. Независимо от того, где происходят эти биосинтетические
процессы, катехоламины хранятся в тканях в форме гранул или
везикул до тех пор, пока не выделятся под влиянием нервного им-
пульса.
После воздействия на клеточные мембраны катехоламины пре-
терпевают инактивацию различными путями. Во-первых, они ак-
тивно поглощаются соседними клетками, благодаря чему удаляются
от мембран; этот процесс, вероятно, наиболее важен с точки зрения
быстроты удаления. После того как катехоламины проникают в
клетку, митохондриальный фермент моноаминоксидаза быстро от-
щепляет аминогруппу с образованием соответствующего альдеги-
да. Кроме того, катехоламины, поступающие в кровоток, попадают
6. АЗОТИСТЫЙ ОБМЕН
335
в печень, где подвергаются биологической инактивации в результа-
те присоединения метильной группы (источником которой служит
S-аденозилметионин) к одной из гидроксильных групп кольца. В ко-
нечном итоге в результате сочетания обоих процессов из организма
выводятся в качестве конечных продуктов обмена катехоламинов
такие дезаминированные, метилированные ароматические кислоты,
как, например, ванилилминдальная (рис. 6-30).
Целый ряд фармакологических агентов, оказывающих тормозное
воздействие на некоторые из перечисленных выше реакций в цент-
ральной нервной системе, могут резко изменять поведение и настрое-
ние. В общем, такие средства, как алкалоид раувольфии резерпин,
опустошают в тканях мозга запасы норадреналина, вызывая его
выделение из резервных гранул, что дает седативный, успокаиваю-
щий эффект. С другой стороны, ингибиторы моноаминоксидазы, ко-
торые препятствуют удалению норадреналина из мозга и тем самым
приводят к его накоплению, способствуют возбуждающему антиде-
прессивному эффекту. Однако введение таких ингибиторов может
способствовать опасному повышению концентрации катехолами-
нов в тканях мозга при одновременном поступлении этих веществ с
пищей. Например, некоторые сыры и вина содержат большие коли-
чества тирамина, так что обед с вином и сыром может иметь траги-
ческие последствия на фоне терапии ингибиторами моноаминоксида-
зы.
Серотонин
Это соединение, образующееся из триптофана, выполняет функ-
ции нейромедиатора в некоторых проводящих путях мозга. Серо-
тонинэргическую реакцию описывают как классическую защитную
реакцию страха, т. е. отступление или бегство, в противополож-
ность адренэргической реакции, которая сопровождается стремле-
нием к агрессии, борьбе. Серотонин встречается не только в тканях
мозга: он обнаружен в высокой концентрации в желудочно-кишеч-
ном тракте и в ткани легких.
Хотя первый этап процесса биосинтеза серотонина, а именно
гидроксилирование индольного кольца триптофана, может проте-
кать медленно при участии неспецифического для этой реакции
фермента фенилаланингидроксилазы, в тканях нервной системы су-
ществует иной специфический гидроксилирующий фермент, который
катализирует образование соответствующего продукта 5-окситрип-
тофана (рис. 6-31). В реакции, катализируемой ферментом триптофан-
гидро ксилазой, участвуют О2 и птеридиновый кофермент; фермент
встречается в тех областях мозга, которые содержат высокие кон-
центрации серотонина. Серотонин, или 5-окситриптамин, образу-
ется из 5-окситриптофана при участии фермента декарбоксилазы.
CH2CHCOOH
| пи
NH2
(Гидроксилаза)
Триптофан
02 НАДФ-Н
Птеридин
5-Окси триптофан
5-Окситриптамин
(Серотонин)
(Моноаминоксидаза)
Мойа
НО
СН2СООН
н
5-Оксииндолуксусная
кислота
Рис. 6-31. Метаболизм серотонина.
6. АЗОТИСТЫЙ ОБМЕН
337
Удаляется серотонин главным образом под действием моноами-
ноксидазы, так что ингибиторы этого фермента могут также вызы-
вать повышение концентрации серотонина в нервной системе. Ко-
нечный продукт обмена серотонина —5-оксииндолуксусная кисло-
та — выводится почками; следовательно, выведение этого метабо-
лита с мочой характеризует состояние процессов синтеза серотони-
на и его освобождения из депо.
Рекомендуемая
литература
Axelrod J.3 Neurotransmitters, Sci. Am., 230, (6), 59—71 (1974).
Balagura-Baruch S., Renal Metabolism and the Transfer of Ammonia. In: Rouil-
ler C., Muller A. F. (eds.), The Kidney: Morphology, Biochemistry, Physio-
logy, Academic Press, New York, 1971, pp. 254—328.
Baldessarini R. J.t Karobath M., Biochemical Physiology of Central Synapses,
Ann. Rev. Physiol., 35, 273—304. (1973).
Baxter C. F.t The Nature of y-Amino-Butyric Acid. In: Lajtha A. (eds.), Handbook
of Neurochemistry, Vol. Ill, Metabolic Reactions in Nervous System, Plenum
Press, New York, 1970, pp. 289—454.
Becker M. A., Seegmiller J. E., Genetic Aspects of Gout, Ann. Rev. Med., 25, 15—
28 (1974).
Berk P. D., Howe R. B., Berlin N. Disorders of Bilirubin Metabolism. In: Bon-
dy P. К.» Rosenberg L. E. (eds.) Diseases of Metabolism, W. B. Saunders,
Philadelphia, 1974, pp. 825—880.
Bigwood E. J. (eds.), Protein and Amino Acid Functions, Pergamon Press, Oxford,
1972.
Brown Ammonium Metabolism in Liver Disease: Studies with Lactulose. In:
Brown H., Hardwick D. F. (eds.), Intermediary Metabolism of the Liver, C.C.
Thomas, Springfield, Ill., 1973, pp. 115—146.
Cahill G. F.t Jr., Owen 0. E.t The Role of the Kidney in the Regulation of Protein
Metabolism. In: Munro H. N. (eds.), Mammalian Protein Metabolism, Vol.
IV, Academic Press, New York, 1970, pp. 559—585.
Chase T. N., Murphy D. L.t Serotonin and Central Nervous System Function, Ann.
Rev. Pharm., 13, 181—197 (1973).
Curtis D. R., Johnston G. A. R.t Amino Acid Transmitters. In: Lajtha A. (eds.),
Handbook of Neurochemistry, Vol. IV, Control Mechanisms in the Nervous
System, Plenum Press, New York, 1970, pp. 115—134.
Curzon G.t Brain Amine Metabolism in Some Neurological and Psychiatric Disor-
ders. In: Cumings J. N. (eds.), Biochemical Aspects of Nervous Diseases, Ple-
num Press, London, 1972, pp. 151—212.
Elwyn D. H., The Role of the Liver in Regulation of Amino Acid and Protein Me-
tabolism. In: Munro H. N. (ed.), Mammalian Protein Metabolism, Vol. IV,
Academic Press, New York, 1970, pp. 523—558.
Felig P., Amino Acid Metabolism in Man, Ann. Rev. Biochem., 44, 933—955 (1975).
Friedkin M.t Thymidylate Synthetase, Adv. EnzymoL, 38, 235—292 (1973).
Gerritsen T., Waisman H. A., Homocystinuria. In: Stanbury J. B., Wyngaarden
J. B., Fredrickson D. S. (eds.), The Metabolic Basis of Inherited Disease, McGraw-
Hill, New York, 1972, pp. 404—412.
Gidari A. S., Levere R. D., Kappas A., Porphyrin-Heme Synthesis and the Hepa-
tic Porphyrias. In: Becker F. F. (ed.), The Liver: Normal and Abnormal Fun-
ctions, Part A, M. Dekker, New York, 1974, pp. 401—461.
Henderson J. F.t Paterson A. R. P.t Nucleotide Metabolism: An Introduction, Aca-
demic Press, New York, 1973.
338 6- АЗОТИСТЫЙ ОБМЕН
Hoskin F. С. 6., Acetylcholine. In: Albers R. W., Siegel G. J., Katzman R., Agra-
noff B. W. (eds.), Basic Neurochemistry, Little, Brown, Boston, 1972, pp. 105—130.
Hsia Y, E., Inherited Hyperammonemic Syndromes, Gastroenterology, 67, 347—
Hulse J. H.t Spurgeon D., Triticale, Sci. Am., 231, (2), 72—80 (1974).
Israel J. B.t Arias I. M., Inheritable Disorders of Bilirubin Metabolism, Adv.
Intern. Med., 21, 77—96 (1976).
Iverson L. L., Metabolism of Catecholamines. In: Lajtha A (ed.), Handbook of Neu-
rochemistry, Vol. IV, Control Mechanisms in the Nervous System, Plenum
Press, New York, 1970, pp. 197—220.
Kelley W. N., Current Therapy of Gout and Hyperuricemia, Hosp. Pract., 11, (5),
69—76 (1976).
Kelley W. N., Arnold W. J.t Human Hypoxanthine-Guanine Phosphoribosyl trans-
ferase: Studies on the Normal and the Mutant Forms of the Enzyme, Fed.
Proc., 32 1656—1659 (1973).
Kelley W. N., Wyngaarden J, B.t The Lesch-Nyhan Syndrome. In: Stanbury J. B.,
Wyngaarden J. B., Fredrickson D. S. (eds.), The Metabolic Basis of Inherited
Disease, McGraw-Hill, New York, 1972, pp. 969—991.
Knox W. E., Phenylketonuria. In: Stanbury J. B., Wyngaarden J. B., Fredrick-
son D. S. (eds.), The Metabolic Basis of Inherited Disease, McGraw-Hill, New
York, 1972, pp. 266—295.
Marver H. S., Schmid R., The Porphyrias. In: Stanbury J. B., Wyngaarden J. B.,
Fredrickson D. S. (eds.), The Metabolic Basis of Inherited Disease, McGraw-
Hill, New York, 1972, pp. 1087—1140.
Meyer U. A., Schmid R.t Hereditary Hepatic Porphyrias, Fed. Proc., 32, 1649—
1655 (1973).
Molinoff P. B., Axelrod J., Biochemistry of the Catecholamines, Ann. Rev. Bio-
chem., 40, 465—500 (1971).
Munro H. N.t Protein Synthesis and Breakdown in the Liver. In: Brown H., Hard-
wick D. F. (eds.), Intermediary Metabolism of the Liver, С. C. Thomas, Springs
field, III, 1973, pp. 3—22.
Murray A. IF., The Biological Significance of Purine Salvage, Ann. Rev. Biochem, j
50, 811—826 (1971).
Newcombe D. S., Inherited Biochemical Disorders and Uric Acid Metabolism, Uni-
versity Park Press, Baltimore, 1975.
Nyhan W. L., The Lesch-Nyhan Syndrome, Ann. Rev. Med., 24, 41—60 (1973).
Nyhan IF. L. (ed.), Heritable Disorders of Amino Acid Metabolism: Patterns of
Clinical Expression and Genetic Variation, J. Wiley and Sons, New York, 1974.
Orloff J,t Burg M.t Kidney, Ann. Rev. Physiol., 33, 88—130 (1971).
Ostrcw J, D., Bilirubin and Jaundice. In: Becker F. F. (ed.), The Liver: Normal
and Abnormal Functions, Part A, M. Dekker, New York, 1974, pp. 303—370.
Page I. H., Carlsson A., Serotonin. In: Lajtha A. (ed.), Handbook of Neurochemi-
stry, Vol. IV, Control Mechanism in the Nervous System, Plenum Press, New
York, 1970, pp. 251—262.
Porter J. W. G.t Rolls B. A. (eds,), Protein in Human Nutrition, Academic Press,
New York, 1973.
Potter L. T., Acetylcholine, Choline Acetyltransferase, and Acetylcholinesterase.
In: Lajtha A. (ed.), Handbook of Neurochemistry, Vol. IV, Control Mechanisms
in the Nervous System, Plenum Press, New York, 1970, pp. 263—284.
Ratner S., Enzymes of Arginine and Urea Synthesis, Adv. Enzymol., 39, 1—90
(1973).
Schildkraut J. J., Biogenic Amines and Affective Disorders, Ann. Rev, Med., 25,
333—348 (1974).
Schmid R., Hyperbilirubinemia. In: Stanbury J. B., Wyngaarden J. B., Fredrick-
son D. S. (eds.), The Metabolic Basis of Inherited Disease. McGraw-Hill, New
York, 1972, pp. 1141—1179.
Scriver C. R., Inborn Errors of Metabolism: a new Frontier of Nutrition, Nutr,
Today, 9, (5), 4—15 (1974),
6. АЗОТИСТЫЙ ОБМЕН
339
Scriver С. R., Rosenberg L. Е., Amino Acid Metabolism and its Disorders, W. B. Sau-
nders, Philadelphia, 1973.
Seakins J. W. T., Saunders R. A., Toothill C. (eds.), Treatment of Inborn Errors
of Metabolism, Churchill Livingstone, Edinburgh, 1973.
Seegmiller J. E., Diseases of Purine and Pyrimidine Metabolism. In: Bondy P. К.»
Rosenberg L. E. (eds.), Diseases of Metabolism, W. B. Saunders, Philadel-
phia, 1974, pp. 655—774.
Segal S., Disorders of Renal Amino Acid Transport, N. Engl. J. Med., 294, 1044—
1051, 1976.
Shin V. E., Efron M. L.t Urea Cycle Disorders. In: Stanbury J. B., Wyngaarden J. B.,
Fredrickson D. S. (eds.), The Metabolic Basis of Inherited Disease, McGraw-
Hill, New York, 1972, pp. 370—392.
Snyder S. H.t Catecholamines and Serotonin. In: Albers R. W., Siegel G. J., Katz-
man R., Agranoff B. W. (eds.), Basic Neurochemistry, Little, Brown, Boston,
1972, pp. 89—104.
Tschudy D. P., Porphyrin Metabolism and the Porphyrias. In: Bondy P. К.» Ro-
senberg L. E. (eds.), Diseases of Metabolism, W. B., Saunders, Philadelphia,
1974, pp. 775—824A.
van den Berg C. J., Glutamate and Glutamine. In: Lajtha A. (ed.) Handbook of Neu-
rochemistry, Vol. Ill, Metabolic Reactions in the Nervous System, Plenum
Press, New York, 1970, pp. 355—380.
Watkins J. C., Metabolic Regulation in the Release and Action of Excitatory and
Inhibitory Amino Acids in the Central Nervous System, Biochem. Soc. Symp.,
36, 33—47, 1972.
Whittaker V. P,t Membranes in Synaptic Function, Hosp. Pract., 9, (4), 111—119,
1974.
Wyngaarden J. B., Kelley W. N.t Gout. In: Stanbury J. B., Wynngaarden J. B.,
Fredrickson D. S. (eds.), The Metabolic Basis of Inherited Disease, McGraw-
Hill, New York, 1972, pp. 889—968.
Zieve L., Nicoloff D, M.t Pathogenesis of Hepatic Coma, Ann. Rev. Med., 26, 143—
157, 1975.
7 ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
Если средний студент после первого знакомства с биохимией
выносит впечатление об обмене веществ как о ряде не связанных друг
с другом процессов, то это вполне простительно. Предварительное
ознакомление с предметом предполагает расчленение сложного
клубка химических процессов, совершающихся в организме, на
группы более или менее родственных между собой реакций и соеди-
нений, как это и было сделано при составлении глав и подразделов
этой книги. Однако наступает момент, когда необходимо попытаться
связать в единое целое эти кажущиеся изолированными реакции, с
тем чтобы понять, каким образом их совокупность составляет целе-
сообразно функционирующую живую систему.
ИНТЕГРИРУЮЩИЕ СИСТЕМЫ
Для каждого, кто вообще размышлял об этом предмете, пред-
ставляется вполне очевидным, что организм человека — это нечто
бесконечно более сложное, чем простой конгломерат, или совокуп-
ность различного типа клеток. Клетки, дифференцированные для
осуществления специфических биохимических и физиологических
функций, взаимодействуют друг с другом, образуя ткани, которые
в свою очередь структурно организованы в виде органов. Такая ор-
ганизация обеспечивает рациональное разделение функциональной
активности, но требует участия контролирующих инстанций, сог-
ласующих и координирующих работу различных органов и тканей,
с тем чтобы она гармонично соответствовала потребностям организ-
ма как целого (рис. 7-1).
Эту интегрирующую роль играют три важнейшие системы. Пре-
жде всего к их числу относится нервная система — центр обработ-
ки информации и принятия решений, воспринимающий импульсы,
которые отражают воздействия на организм изменяющихся условий
среды (недостаточность кислорода, голод, жажда, боль и другие
предостережения об опасности), а также передающий соответствую-
щие команды другим органам с целью приспособления их функцио-
нального состояния к этим изменениям условий среды. Второй из
числа указанных систем является эндокринная система — фабрика
и хранилище химических передатчиков (посредников), оказывающих
7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА 341
Внешняя среда
Желудочно-
кишечный
тракт
Переваривание
Всасывания
Мышечная
система
почки
Выведение
Система
размножения
печень
центр
химической
обработки
синтез
Регуляция
Дезинтоксикация
Структурная
Механичес-
кая работа
Жировая
ткань
Хранение и
выделение
.топлива
система
Образование медиаторов
Трофические
Сяимуларугоерп } Гормоны
Ннгибцрующие
нервная
система
Центр обработки
информации
Ощущения
Анализ
Передача
импульсов
система
Перенос-
02-С02
Пища
Гормоны
Конечные
продукты
обмена
Рис. 7-1.. Интегрирующие функции нервной, эндокринной и сосудистой систем в
метаболизме.
Органы
дыхания
Газообмен
Сосудистая
Эндокринная
разнообразные воздействия на рост, размножение и развитие, а
также на другие важные функции организма. Относительно быстрые
адаптивные реакции эндокринной системы способствуют поддержа-
нию постоянства концентрации в крови таких веществ, как глюко-
за, липиды, кальций, а также обеспечивают оптимальное соотноше-
ние между синтезом и распадом компонентов тканей в зависимости
от энергетических потребностей. Третьей является сосудистая си-
стема, которая служит для переноса всех химических соединений
в организме. К сосудистой системе относятся трубчатые структуры
и подвижные переносчики, необходимые для доставки кислорода,
органических питательных веществ и минеральных компонентов из
внешней среды к клеткам, расположенным в глубине органов и
тканей, для переноса строительных материалов, топлива и химиче-
342 7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
ских передатчиков между тканями, а также для выведения из ор-
ганизма проникших в него патогенных микробов, токсинов и конеч-
ных продуктов обмена веществ.
В норме эти три системы взаимодействуют бесперебойно, допол-
няя друг друга. Воздействия гормонов эндокринной системы осуще-
ствляются через ток крови, циркулирующей по сосудистой системе;
концентрация гормонов в циркулирующей крови, поступающей в
синтезирующие их железы, регулирует секрецию этих гормонов по
принципу отрицательной обратной связи. Регулирующим механиз-
мом более высокого уровня являются вещества, вызывающие выделе-
ние гормонов — так называемые «рилизинг-факторы» гипоталамуса.
Рилизинг-факторы оказывают воздействие на главную эндокринную
железу в организме человека — гипофиз. Адреналин, синтезируемый
в мозговом слое надпочечников, а также норадреналин нервной
системы усиливают ток крови и давление в сосудистой системе. Эти
и многие другие примеры физиологических регуляторных процессов
свидетельстьуют о тесной взаимозависимости названной выше «трой-
ки» интегрирующих систем при координации разнообразных пере-
мещений и перестроек молекул в организме.
ВЗАИМОСВЯЗИ
МЕЖДУ УГЛЕВОДАМИ,
ЖИРАМИ И БЕЛКАМИ
Между превращениями этих трех групп соединений в процессе
обмена веществ должны существовать целесообразные взаимосвя-
зи, подобно тому как должны функционировать в согласии друг с
другом три основные интегрирующие системы. Существует несколь-
ко различных путей взаимодействия этих классов метаболитов.
Так, они могут образоваться в результате процессов, имеющих
сходное энергетическое обеспечение, общие предшественники и
промежуточные продукты, общие конечные пути окисления углеро-
да и водорода при образовании подлежащих выведению из организ-
ма конечных продуктов обмена (рис. 7-2). Как будет указано в сле-
дующих разделах, важнейшую роль в установлении равновесия
процессов обмена играет соотношение между поступлением в орга-
низм каждого из соединений и активностью реакций его потребле-
ния. При рассмотрении в самой общей форме факторов обеспечения
и потребления следует учитывать роль интегрирующих систем,
осуществляющих тонкую регуляцию метаболизма в норме и патоло-
гии.
Липиды
Углеводы
Белки
Глюкоза
Гликоген
Триацил глицериды
НАДФ-Н ^-Глюкозо-б-фосфат
Триозофосфат
Жирные кислоты а-Глицеро- <
фосфат
Ацетил-КоА
Лактат Пируват
НАД-Н
Ацетил-КоА
Ацетоацетат
АТФ
Оксалоацетат
Цитрат
а-Кетоглутарат
С02
Глутамат
Стераны
Г НАД-Н I
| НАД-Н
Мочевина Орнитин
Аргинин
Полипептиды
Аланин
Серин
Глицин
АсЛЬртат
Аспартат
Цитруллин
Рис, 7-2. Взаимосвязь липидов, углеводов и белков в процессах обмена веществ.
344 7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
ОБЩЕЕ ЭНЕРГЕТИЧЕСКОЕ
ОБЕСПЕЧЕНИЕ
При биосинтезе самых разнообразных простых и сложных орга-
нических соединений или макромолекул используются в качестве
общих источников энергии либо АТФ, обеспечивающий энергию фос-
форилирования, либо НАД-Н или НАДФ-Н, поставляющие вос-
становительную энергию. Один из этих подвижных источников хи-
мической энергии совершенно необходим для обеспечения процессов
анаболизма. Следовательно, если в клетке преимущественно осу-
ществляется синтез определенного класса соединений, это должно
происходить за счет катаболизма другого вещества. Поэтому общий
энергетический фонд клетки можно рассматривать как определен-
ный запас движущей силы, за который должны конкурировать все
анаболические и другие эндергонические процессы.
Например, когда от печени требуется увеличение выработки
глюкозы за счет обращения процесса гликолиза, она не может од-
новременно синтезировать белки и жиры; напротив, возникнет
необходимость осуществить гидролиз части имеющихся белков и
жиров и частично окислить образующиеся аминокислоты или жир-
ные кислоты для обеспечения синтеза НАД- Н и АТФ для нужд глю-
конеогенеза. Как и при индукции глюкокортикоидами некото-
рых ферментов, необходимых для поддержания максимальной ско-
рости глюконеогенеза, возможно, что при усиленном синтезе опре-
деленного белка происходит одновременное усиление катаболизма
целого ряда других белков, для того чтобы удовлетворить возрос-
шую потребность в энергии. Подобно этому, в любой клетке, где
усилены процессы образования мембран, потребуется ускорить рас-
пад углеводов для обеспечения биосинтеза необходимых белков и
липидов. В клетках печени и жировой клетчатки процесс липогенеза
особенно зависит от утилизации глюкозы для генерации НАДФ-Н
и АТФ, необходимых при превращении ацетил-КоА в жирные кис-
лоты. Для реакций полимеризации при гликогенезе, дупликации
ДНК и РНК, удлинении полипептидной цепи во всех случаях тре-
буется поступление энергии, которую обеспечивает параллельно
протекающий распад других органических соединений.
ОБЩИЕ ПРЕДШЕСТВЕННИКИ
И ПРОМЕЖУТОЧНЫЕ
ПРОДУКТЫ ОБМЕНА
Существование общих предшественников и промежуточных про-
дуктов обмена веществ является предпосылкой возникновения еще
одного уровня взаимосвязей метаболических путей и возможного
осуществления конкурентных взаимодействий. Общий фонд угле-
рода, особенно в виде углеводов, влияет на процессы синтеза липи-
7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА 345
дов и белков. Например, предшественники трехуглеродных скеле-
тов глицерина при липогенезе, а также аланина или серина при син-
тезе белка ведут свое происхождение непосредственно от триоз, воз-
никающих при гликолитическом процессе обмена углеводов.
По-видимому, наиболее важным общим промежуточным продук-
том обмена веществ, участвующим во всех метаболических процес-
сах и потому представляющим решающее связующее звено, являет-
ся ацетил-КоА. Этот двухуглеродный фрагмент может образоваться
при катаболизме алкильных цепей и стероидов в ходе обмена липи-
дов из некоторых ароматических и алифатических аминокислот или
из глюкозы и других углеводов. Вспомним также жизненно важную
регуляторную роль ацетил-КоА как положительного эффектора пи-
руваткарбоксилазы, обеспечивающего поступление оксалоацетата
либо для глюконеогенеза, для образования аспартата, либо для
поддержания потока веществ через цикл лимонной кислоты.
Важно отметить однонаправленность потока веществ в сторону
липогенеза от углеводных или белковых источников через ацетил-
КоА. Поскольку в организме человека не существует механизма,
обеспечивающего превращение этого двухуглеродного фрагмента
в трехуглеродные соединения, необходимые для глюконеогенеза
или для образования таких заменимых аминокислот, как аланин,
обратный переход углерода жирных кислот в глюкозу или белки
невозможен. При катаболизме липидов происходит регенерация
небольших количеств трехуглеродных промежуточных продуктов
за счет остатков глицерина, но в сопоставлении с большими запаса-
ми углерода в боковых цепях триацилглицеридов, например, они
не имеют существенного значения.
ОБЩИЙ КОНЕЧНЫЙ ПУТЬ
Общим конечным путем для всех систем метаболизма являются,
безусловно, цикл лимонной кислоты и реакции дыхательной цепи.
Эти протекающие в митохондриях процессы используются для коор-
динации целого ряда метаболических реакций на различных уров-
нях. Цикл лимонной кислоты является в клетке главным источни-
ком двуокиси углерода для реакций карбоксилирования, с которых
начинается синтез жирных кислот и глюконеогенез; та же двуокись
углерода поставляет углерод для мочевины и некоторых звеньев пу-
риновых и пиримидиновых колец. Взаимосвязи между процессами
углеводного и азотистого обмена также достигаются посредством
промежуточных продуктов цикла лимонной кислоты (а-кетоглутарат
и глутамат, оксалоацетат и аспартат, сукцинат и гем). Участие ас-
партата в цепи метаболических реакций от цитруллина до аргинина
и в образовании фумарата обеспечивает непосредственную связь
между участком цикла Кребса от фумарата до оксалоацетата и цик-
лом мочевины.
346 1- ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
Существует несколько путей, по которым промежуточные про-
дукты цикла лимонной кислоты включаются в процесс липогенеза.
Расщепление цитрата приводит к образованию ацетил-КоА, играю-
щего роль предшественника при биосинтезе жирных кислот; цит-
рат является также положительным модификатором первичной
ацетил-КоА-карбоксилазной реакции. В присутствии НАДФ-зави-
симых декарбоксилирующих ферментов изоцитрат и малат обеспе-
чивают образование НАДФ-Н, который расходуется в последующих
восстановительных этапах синтеза жиров.
Продукты распада углеводов и жиров поступают в цикл в виде
ацетил-КоА; большая часть продуктов катаболизма аминокислот
поступает в цикл в виде а-кетокислот. В любом случае при полном
окислительном распаде этих соединений в митохондриях происходит
перенос водорода от указанных веществ на фиксированные в мембра-
нах флавопротеиды или на подвижные молекулы НАД. Образую-
щийся ФАДН2 должен быть вновь окислен in situ при участии систе-
мы цитохромов; НАД-Н либо переносит свои восстановительные
эквиваленты на дыхательную цепь, либо используется для обеспе-
чения восстановительных синтезов в других частях клетки после
его переноса из митохондрий посредством одного из челночных суб-
стратных переносчиков. Роль ключевого фактора, определяющего
пути превращения НАД-Н, играет состояние адениннуклеотидов.
Высокое содержание АДФ и низкое содержание АТФ свидетель-
ствуют о малом запасе энергии; при этом НАД- Н вовлекается в ре-
акции дыхательной цепи, усиливая сопряженные с запасанием энер-
гии процессы окислительного фосфорилирования. Обратное явле-
ние наблюдается при низком содержании АДФ и высоком содержа-
нии АТФ; ограничивая работу системы переноса электронов, они
способствуют использованию НАД-Н в других восстановительных
реакциях — таких, как синтез глутамата или глюконеогенез.
ВЗАИМОСВЯЗИ ТКАНЕЙ
И ОРГАНОВ
В первых главах этой книги я пытался показать, какие метаболи-
ческие функции выполняют различные ткани. В некоторых случаях
биохимические процессы в клетках узкоспециализированы и функ-
ции клеток весьма ограничены; таким примером могут служить
эритроциты, где происходит только анаэробный катаболизм глю-
козы. В других случаях клетки проявляют себя как мультипотен-
тные, т. е. обладают способностью осуществлять самые разнообраз-
ные ферментативные превращения. Так, гепатоциты участвуют в
процессах анаболизма, катаболизма, во взаимопревращениях углево-
дов, жиров и белков, а также выполняют другие метаболические
функции.
7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА 347
Процессы обмена веществ, происходящие
исключительно или преимущественно в печени
Углеводы
Азотистые
Липиды соединения
Галантоза\ „
Фруктоза
Глюкозо-6-Ф —► Глюкоза
Глюконеогенез
Холестерин -> Желчные кислоты
Жиры -► Кетоновые тела
Липоеенез
Синтез
холестерина
Образование мочевины
Синтез белков
сыворотки крови
Конъюгация желчных
пигментов
Синтез гема
Обмен ароматических
аминокислот
Обмен пуринов и
пиримидинов
Перенос метильных
групп
Рис. 7-3. Процессы обмена веществ, осуществляемые в первую очередь печенью.
Функции, осуществляемые в других органах или тканях: дефосфорилирование глюкозы и
глюконеогенез, которые в меньшей мере происходят в почках, липогенез — в жировой ткани,
синтез холестерина — в слизистой оболочке желудочно-кишечного тракта, синтез гема —
в ретикуло-эндотелиальной системе, обмен ароматических аминокислот — в нервной ткани,
а также обмен пуринов и пиримидинов или перенос метильных групп, которые происходят в
некоторых других тканях.
Все клетки одного организма обладают одинаковыми молекула-
ми ДНК; на определенном этапе жизни каждой клетки последняя
обеспечивает выражение этой ДНК путем репликации при делении
или путем транскрипции во время синтеза белков в период роста.
По мере дифференцировки клеток в направлении приобретения ими
окончательной специализированной формы в органах нашего тела
они утрачивают (в различной степени) способность обеспечивать
выражение гена, и ДНК постепенно становится как бы немой. В
крайнем случае возможно полное исчезновение ДНК — так про-
исходит, например, в эритроцитах; другой пример — утрата спо-
собности к репликации, что наблюдается в зрелых нейронах, ко-
торые у взрослого не делятся. В клетках многих типов лишь часть
общего количества ДНК подвергается транскрипции, т. е. обеспе-
чивает образование информационной РНК, которая соответствует
ферментам и другим белкам, характерным для данной клетки. В
клетках других типов считывание ДНК для образования опреде-
ленных информационных последовательностей невозможно, если
не удалено особое вещество — репрессор. Степень и время воздейст-
вия этих сложных регулирующих факторов определяют ход биохи-
мической специализации ткани и развития органов. Утрачивая час-
тично свои метаболические возможности в процессе специализации,
такие дифференцированные ткани становятся зависимыми от кле-
348 7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
ток других типов в смысле доставки необходимых метаболитов и уда-
ления конечных продуктов обмена.
В предыдущих главах я привел сведения о путях обмена веществ,
начиная с момента их поступления в организм, их переваривания и
всасывания в желудочно-кишечном тракте. За этими процессами,
естественно, следует поступление компонентов пищи через главные
«ворота» (получившие удачное название «воротная вена») в печень.
Подчеркнуть роль печени в обмене веществ уместно также в связи
с большой метаболической активностью этой первичной химической
фабрики (рис. 7-1). По многообразию и приспособляемости ни один
другой орган не может сравниться с печенью, в которой происходят
сложные взаимосвязанные процессы обмена веществ, воздействую-
щие на весь организм (рис. 7-3). Попытаемся подвести итоги рассмот-
рению этих процессов в связи с функциями других органов.
ПЕЧЕНЬ
Печень действует как железа, наделенная и экзокринными, и
эндокринными функциями. Продуктом внешней секреции (экзокрин-
ная функция) является желчь, выделяемая печенью в желудоч-
но-кишечный тракт,— это раствор, содержащий такие конечные
продукты обмена, как желчные пигменты, а также важные ускори-
тели переваривания жиров — соли желчных кислот. Последние
представляют собой главные продукты окисления стероидов; об-
ратное всасывание солей желчных кислот из желудочно-кишечного
тракта составляет важный механизм саморегуляции, действующий
по принципу обратной связи, поскольку окисление холестерина в
печеночных клетках подавляется солями желчных кислот, которые
возвращаются из кишечника. Большое значение имеет уровень био-
синтеза холестерина, происходящего в желудочно-кишечном трак-
те; этот процесс также находится под регуляторным влиянием ме-
ханизма, функционирующего по принципу обратной связи, посколь-
ку биосинтез холестерина в значительной мере блокируется солями
желчных кислот, которые захватываются клетками слизистой обо-
лочки.
Продуктами внутренней секреции печени (эндокринная функ-
ция) являются не гормоны, а метаболиты, которые разносятся то-
ком крови и используются другими клетками, изменяя их функции.
К числу таких метаболитов относятся: 1) глюкоза, секретируемая
преимущественно во время голодания, под влиянием стимуляции
глюкокортикоидами или глюкагоном, а также при усиленной мы-
шечной деятельности; этим обеспечиваются потребности гликолиза в
тканях мозга и мышц; 2) триацилглицериды, освобождаемые после
поступления в желудочно-кишечный тракт углеводов или стимуля-
ции инсулином и вносящие свой вклад главным образом в осуществ-
ление процессов липогенеза в жировой ткани, и 3) кетоновые тела.
1. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА 349
Желудочно-
кишечный
тракт
Глутамин
Желчные
пигменты
Жирные
кислоты
Лактат
Аланин
Лимфа
Липиды
Углеводы —
Аминокислоты. .
Желчные
пигменты
гЖелчевыводящие
пути
Соли
желчных
кислот
Общий
кровоток
Хиломикроны
Глюкоза
Глюкоза
ГАМК
кислом конзюгаты
желчных
пигментов
ЖирЫ'
к
Жирные
кислоты.
Печень
почки
Глюкоза
Глутамин
Амино-
кислоты
Белки
и
Амино-
кислоты
Мочевина \
Глюкоза \
Гликоген
11-
Гексозофосфат
*** Кетоновые
Жировая
ткань
Жиры
аГлицерофосфа1/Г[
Глюкоза
. *"**. Жирные
Г кислоты
Глюкоза
/Лило- 4
протеиды
МЫШЦЫ \ \ )
Лактат
Кетоновые
тела \ Жирные
4 Амино- Белки
кислоты
Стероиды к ..
\Мочевина
Мозг
/ Глюкоза
Ацетил- . .
холин +~Ачетил-КоА
X / NHj
Глутамат,
ч г
I Глутамин
Мочевыво-
дящие
пути
NH/
Рис, 7-4, Взаимосвязи между процессами обмена веществ в печени и в других тка-
нях.
образующиеся в избытке при голодании, а также при потреблении
пищи, богатой жирами или бедной углеводами; это соединения, при-
годные для использования в мышечной и нервной ткани в качестве
источников энергии. Разумеется, выше перечислены лишь немногие
общие пути воздействия образующихся в печени метаболитов на
550 7- ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
биохимические реакции в других тканях. Кроме того, печень от-
ветственна за синтез и секрецию альбумина, сывороточных липопро-
теидов и факторов свертывания крови, а также других важных про-
дуктов азотистого обмена, предназначенных для использования в
разных тканях.
Внепеченочные ткани характеризуются, однако, некоторой ме-
таболической автономией. Главные реакции, ведущие к выработке
энергии (гликолиз, реакции цикла лимонной кислоты, окислитель-
ное фосфорилирование, окисление жирных кислот), а также важ-
нейшие биосинтетические процессы (синтез белка, нуклеиновых
кислот, липогенез и глюкогенез) осуществляются в клетках других
типов, но уровень активности этих реакций может быть различным.
Тем не менее зависимость этих тканей от обмена веществ в печени
имеет часто наибольшее значение для обеспечения нормальных
функций и гомеостаза. Поэтому мы обсудим и резюмируем некоторые
принципиально важные примеры этих взаимоотношений между пе-
ченью и другими тканями (рис. 7-4).
ЖИРОВАЯ ТКАНЬ
И ПЕЧЕНЬ
Процессы обмена жиров в печени и жировой клетчатке нераз-
рывно связаны между собой. Образовавшиеся в печеночных клет-
ках триацилглицериды служат важным источником жиров, накап-
ливающихся в жировых депо. Другим источником таких жиров
являются новообразованные триацилглицериды самих адипоцитов.
Поскольку глюкоза обеспечивает атомы углерода для синтезируе-
мых в жировой ткани жирных кислот и остатков глицерина и по-
скольку печень играет ведущую роль в-регуляции содержания глю-
козы в крови, липогенез в жировых депо вдвойне зависит от про-
цессов обмена веществ в печени.
Характерный для периода обильного питания поток атомов угле-
рода от клеток печени к клеткам жировой клетчатки изменяет свое
направление на обратное, когда поступление в организм энергии
снижается; тогда активация гормон-чувствительной липазы в ади-
поцитах приводит к освобождению в кровоток глицерина и жирных
кислот. Эти продукты распада триацилглицеридов идут на удовлет-
ворение потребности печени в энергии при голодании, когда окис-
ление жирных кислот обеспечивает образование НАД-Н и АТФ, не-
обходимых для глюконеогенеза. С другой стороны, жирные кислоты
могут быть непосредственно использованы вместо глюкозы в таких
внепеченочных тканях, как мышечная.
7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА 351
МЫШЦЫ И ПЕЧЕНЬ
Существование непосредственной взаимосвязи между процесса-
ми обмена веществ в мышечной и печеночной тканях отмечено на
нескольких уровнях. При обильном питании обе ткани удаляют глю-
козу из циркулирующей крови, что сопровождается отложением в
них избытка гликогена. Усиленная физическая работа, которая пред-
ставляет собой важнейший стимул для гликогенолиза в мышцах,
способствует распаду гликогена до лактата, диффундирующего
в кровь. Снижение количества потребляемой пищи составляет важ-
нейший механизм активации распада гликогена в печени, но только
до глюкозы, которая поступает в кровь. Подобное различие между
этими двумя тканями отмечается также в соотношениях гликолиза
и глюконеогенеза. В мышечной ткани, где высока активность фос-
фофруктокиназы и пируваткиназы, но низка активность фруктозо-
дифосфатазы, пируваткарбоксилазы и фосфоенолпируваткарбокси-
киназы, баланс смещен в направлении гликолиза поступающей глю-
козы с образованием АТФ и лактата. В печеночной ткани с противо-
положным соотношением ферментативных активностей по сравне-
нию с мышечной тканью баланс смещен в направлении глюконео-
генеза; за счет других внутриклеточных источников АТФ (на-
пример, окисления жирных кислот) возможна регенерация глюко-
зы из поступающего лактата для удовлетворения потребностей мышц.
При длительном голодании, когда белки мышц подвергаются ка-
таболизму, скелетные мышцы путем переноса аминогрупп превра-
щают значительные количества пирувата в аланин, который затем
может служить вместо лактата источником углерода для глюконео-
генеза в печени. В этом лактат-глюкозном цикле участвуют печень
и скелетные мышцы; следует помнить, что сердечная мышца пред-
ставляет собой аэробную ткань, богатую митохондриями и обладаю-
щую лактатдегидрогеназной ферментной системой, склонной по-
треблять лактат, но не продуцировать его.
Как скелетные мышцы, так и сердечная функционируют за счет
печени, используя кетоновые тела — 0-оксибутират и ацетоацетат.
Поскольку печень лишена фермента, который активирует ацетоа-
цетат путем образования его КоА-производного, большое коли-
чество кетоновых тел поступает в кровоток в условиях потребления
низкокалорийной, бедной углеводами или богатой жирами пищи,
когда интенсивность окисления жирных кислот в печени превос-
ходит ее способность обеспечивать удаление ацетил-КоА. Мышцы,
а также почки и некоторые другие внепеченочные ткани активируют
ацетоацетат за счет сукцинил-КоА и извлекают энергию путем окис-
ления образовавшегося ацетил-КоА. Даже в состоянии покоя су-
ществует постоянный поток ацетоацетата и других кетоновых тел
от печени к периферическим тканям, где они используются для вы-
работки значительной доли энергии, в частности тепловой. Одна-
352 7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
ко сердечная и скелетные мышцы, хотя их работа и зависит от об-
разующихся в печени метаболитов, в значительной мере удовлетво-
ряют в норме свою потребность в АТФ за счет окисления жирных
кислот, поступающих в результате мобилизации из жировых депо.
ПОЧКИ И ПЕЧЕНЬ
Процесс глюконеогенеза осуществляется как в почках, так и в
печени, но в почках генерируется лишь небольшая доля всей глю-
козы (примерно одна десятая). Однако при нарушении функции пе-
чени или в условиях ацидоза с усиленным распадом аминокислот до
а-кетокислот, которые служат предшественниками глюкозы в поч-
ках, их вклад в глюконеогенез значительно повышается.
Почки зависят от поступления из печени глутамина, который слу-
жит источником аммиака, необходимого для нейтрализации экскре-
тируемых ионов водорода. С другой стороны, работа печени зави-
сит от экскреторной функции почек, обеспечивающей удаление мо-
чевины и других конечных продуктов обмена из циркулирующей
крови, при сохранении таких вырабатываемых печенью продуктов,
как глюкоза, аминокислоты и белки.
МОЗГ И ПЕЧЕНЬ
Наконец, тесно связаны между собой и процессы обмена в тка-
нях мозга и в печени; прежде всего дело в том, что нервная ткань
целиком зависит от бесперебойной доставки глюкозы, что обеспе-
чивает печень. В процессах катаболизма глюкозы вырабатываются:
1) энергия, необходимая клеткам мозга для активного переноса ио-
нов, участвующих в процессах возбуждения; 2) ацетил-КоА для
синтеза липидов, миелина и ацетилхолина; 3) материал для образо-
вания углеродных цепей глутамата, у-аминобутирата (ГАМК) и
других аминокислот.
Поскольку в тканях мозга происходит активный метаболизм
аминокислот, а вместе с тем мозг отличается особой чувствительно-
стью к токсическому воздействию аммиака, здесь выработались эф-
фективные защитные механизмы, обеспечивающие связывание NH3;
это происходит главным образом путем образования глутамата и
глутамина. В конечном счете печень удаляет NH3 из тканей мозга
и других периферических тканей путем образования мочевины. На-
рушение функции печени или метаболические сдвиги с нарушением
реакций цикла мочевины серьезно сказываются на развитии мозга
и, следовательно, на высшей нервной деятельности именно из-за
существования такой зависимости мозга от печени, которая долж-
на обеспечить удаление аммиака и других конечных продуктов об-
мена, токсичных для нервной ткани.
7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА 353
ПОДДЕРЖАНИЕ СТАЦИОНАРНОГО
СОСТОЯНИЯ
Взрослый здоровый организм находится в равновесии с окружаю-
щей его средой. Такое равновесие предусматривает своевременное
подавление процессов роста, что представляется не менее замеча-
тельным, чем способность клеток расти и делиться, и в такой же мере
жизненно необходимым. Нарушение нормальных тормозных меха-
низмов может привести к гигантизму, ожирению или к безудержной
анархии злокачественного роста. Вполне возможно, что понимание
механизмов малигнизации будет достигнуто нами в будущем не в ре-
зультате изучения особых причин быстрого роста и агрессивности
злокачественных клеток, а благодаря исследованию причин отсут-
ствия этих свойств у нормальных клеток.
В организме взрослого главным фактором, определяющим нор-
мальный баланс процессов обмена веществ, является соотношение
между поступлением пищи и расходом энергии. Недостаточное пи-
тание быстро приводит к обратимой мобилизации запасов энергии
в организме, однако длительная алиментарная недостаточность
или голодание вызывает необратимый распад тканей. Системати-
ческое переедание также чревато развитием патологического со-
стояния (ожирение) в результате переполнения тканевых депо.
Прежде чем обсудить эти два крайних проявления дисбаланса обмена
веществ, рассмотрим механизмы поддержания постоянства состава
органов и тканей, а также свойства регуляторов, воздействующих
на ферменты анаболизма и катаболизма.
АНАБОЛИЧЕСКИЕ ГОРМОНЫ
Эти агенты усиливают способствующее росту влияние избыточ-
ного питания. Гормон роста — полипептид, секретируемый перед-
ней долей гипофиза, стимулирует биосинтез РНК и белка практиче-
ски во всех клетках. Такое общее усиление накопления азотистых
соединений сопровождается усиленным поглощением аминокислот
из циркулирующей крови. Одним из факторов, способствующих
выделению гормона роста, является повышение уровня аминокислот
в крови, так что максимальное усиление анаболизма тканевых бел-
ков обеспечивается наличием большого количества предшест-
венников.
Инсулин секретируется поджелудочной железой в ответ на повы-
шение уровня глюкозы или аминокислот в крови; он стимулирует
поглощение глюкозы и аминокислот тканями. Кроме того, инсулин
способствует усиленному использованию глюкозы для синтеза гли-
когена, липогенеза и гликолиза, одновременно ограничивая глю-
конеогенез в печени и блокируя липолиз в жировых депо. Этот гор-
мон усиливает анаболизм тканевых белков, подавляя в то же самое
время катаболизм аминокислот.
354 7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
Тироксин, который секретируется щитовидной железой в ответ
на действие тироид-стимулирующего гормона (ТСГ) передней доли
гипофиза, стимулирует рост и дифференцировку тканей. Такое воз-
действие проявляется главным образом в усилении синтеза белка,
и особенно в усилении образования митохондриальных окислитель-
ных ферментов. Таким образом, гормон щитовидной железы ока-
зывает регуляторное влияние на поглощение кислорода и общую
интенсивность обмена веществ в тканях.
Специфические анаболические функции в большей мере присущи
стероидным гормонам — эстрогенам*, они образуются в женском ор-
ганизме (в яичниках) и стимулируют синтез РНК и белка в опреде-
ленных клетках-мишенях (матка); мужские стероидные гормоны —
андрогены — синтезируются в яичках и вызывают аналогичное ус-
корение анаболизма РНК и белка во многих тканях, в том числе
в скелетных мышцах.
КАТАБОЛИЧЕСКИЕ ГОРМОНЫ
Многие гормоны участвуют в регуляции процессов, обеспечиваю-
щих возмещение повышенных затрат энергии при состояниях стрес-
са или при алиментарной недостаточности. Глюкагон — полипеп-
тид, секретируемый поджелудочной железой в ответ на резкое
снижение содержания глюкозы в крови, т. е. противодействует ги-
погликемическому эффекту инсулина. Глюкагон специфически по-
вышает гликогенолиз в печени, в результате чего содержание глю-
козы в циркулирующей крови возрастает. Кроме того, глюкагон
стимулирует глюконеогенез и липолиз в печени. Жирные кислоты,
освобождаемые под влиянием липазы, служат другим источником
энергии и способствуют процессу глюконеогенеза.
Гормоны группы катехоламина — норадреналин, выделяемый
при раздражении окончаниями симпатических нервов, и адреналин,
секретируемый мозговым слоем надпочечника,— по своему действию
напоминают в известной мере глюкагон, но их влияние распростра-
няется и на другие ткани, кроме печени; они активируют гликоге-
нолиз в мышцах и печени, а также стимулируют липолиз в жировой
ткани, благодаря чему повышается содержание глюкозы и жир-
ных кислот в плазме.
Такие глюкокортикоидные стероидные гормоны, как кортизол,
секретируются корой надпочечников в ответ на воздействие АКТГ
(адренокортикотропного гормона) передней доли гипофиза. Корти-
зол противодействует многим эффектам инсулина, блокируя за-
хват клетками глюкозы и ее превращение в жиры, а также тормозя
синтез белка в периферических тканях. Одновременно стимулиру-
ется образование в печени ферментов, участвующих в катаболизме
аминокислот и в глюконеогенезе. В результате этого запасы белка
ро внепеченочных тканях истощаются, поскольку продолжается
1. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА 3§5
гидролиз белка при подавленном синтезе. Естественно, что поток
аминокислот устремляется от периферии к печени; при этом увели-
чивается как количество углерода, направляемого на образование
глюкозы, так и количество азота, используемого для образования
мочевины.
ГОЛОДАНИЕ
Войны, неурожайные годы, стихийные бедствия в разных час-
тях земного шара периодически привлекают внимание международ-
ной общественности к проблемам недоедания и голода. Время от
времени в газетах упоминаются в связи с этим Биафра, Бангладеш
или Эфиопия, но внимание общества быстро отвлекается на что-то
другое. Однако представление о том, что голодание наблюдается
якобы лишь периодически и лишь в ограниченных районах мира,
далеко от истины. В действительности голодание представляет со-
бой постоянно существующую, глобальную проблему, сопровож-
дающую бедность и другие типы социальной дисгармонии во всех
странах. По данным Всемирной продовольственной и сельскохо-
зяйственной организации при ООН одна пятая часть населения раз-
вивающихся стран страдает от недоедания; одна вторая часть наибо-
лее чувствительной к недоеданию категории населения, а именно дети
в возрасте до 6 лет, в странах «третьего мира» страдает от белково-
калориевой недостаточности. Обследования, проведенные в послед-
нее время в США и Канаде, выявили значительную алиментарную
недостаточность среди бедного населения. Эта ситуация является
угрожающей, поскольку она сама создает условия для собственно-
го усугубления: недоедание приводит к нарушению физического и
умственного развития ребенка, что в свою очередь ведет к невозмож-
ности повышения жизненного уровня и для следующего поколения.
Часто, классифицируя проявления алиментарной недостаточно-
сти, различают: квашиоркор, который был рассмотрен выше в связи
с азотистым обменом и который обусловлен главным образом потреб-
лением бедной белком пищи, и маразм — состояние, связанное с об-
щей белково-калориевой недостаточностью. В классических слу-
чаях квашиоркор проявляется у детей в возрасте от 1 года до 3 лет
и характеризуется отеками, задержкой жира (особенно в печени,
которая при этом резко увеличивается), дряблостью кожи, малым
количеством волос и отсутствием в них пигмента, апатией и раздра-
жительностью. При маразме задержка в росте резко выражена уже
в возрасте от 6 мес до 1 года; в противоположность детям с квашиор-
кором, которые из-за отеков часто выглядят одутловатыми и кругло-
лицыми, дети при маразме как бы «сморщиваются» — их мышцы
атрофируются, а жир в организме отсутствует. В типичных случаях
маразма поражения печени, кожи и волос не наблюдается: такой
ребенок неспокоен, реактивен, но не раздражителен. Между этими
356 7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
двумя крайними проявлениями имеется множество промежуточных
форм. Практически их трудно разграничить, но с точки зрения ле-
чения важно установить, чего не хватало в пище ребенка — белка,
калорий или того и другого.
В некоторых из предыдущих разделов были охарактеризованы
химические сдвиги и адаптация процессов обмена в организме при
голодании. Основной принцип, объединяющий все эти явления,
базируется на идее эквивалентности энергии различных классов
пищевых веществ и компонентов тканей Когда общее поступление
калорий с важнейшими видами «топлива» (углеводами и жирами)
становится меньше, чем расход энергии, в организме начинается
распад белков, как поступающих с пищей, так и собственных; это
ведет к общему истощению, касающемуся мышц и других органов,
что наблюдается при маразме. Таким образом, голодание можно
рассматривать как такое состояние, при котором организм „пожирает
самого себя“ для удовлетворения своих энергетических потребно-
стей. Прежде чем наступит это тяжелое, часто фатальное состояние,
происходит целый ряд изменений в процессах обмена, зависящих,
конечно, от условий питания в период, предшествующий голоданию.
Рассмотрим процессы, которые произойдут в организме здоро-
вого, упитанного взрослого, если его внезапно лишить пищи. При
этом сразу же снизится содержание глюкозы в крови, что приведет
к снижению секреции инсулина и повышению секреции глюкагона
поджелудочной железой и к стимуляции гликогенолиза в печени.
Если пища не поступает в течение 24 ч, запасы гликогена в печени
в основном истощаются; на 2-й день должны включиться иные меха-
низмы. Так, длительная секреция глюкагона вызывает активацию
гормон-чувствительной липазы, благодаря чему освобождается
больше жирных кислот, окисляемых в печени. Подобно этому, АКТГ,
катехоламины и другие гормоны, освобождаемые в ответ на посту-
пающие в центры регуляции стрессорные стимулы, способствуют
активации липазы жировой ткани; мобилизация образующихся
жирных кислот из жировых депо обеспечивает энергией перифери-
ческие ткани, печень и другие внутренние органы. В отличие от
кратковременного поступления энергии за счет запасов гликогена
в печени триацилглицериды жировой ткани могут обеспечивать ор-
ганизм достаточным количеством АТФ в течение нескольких недель.
По мере того как организм приспосабливается к длительному го-
лоданию (на протяжении первых недель), резко возрастает количест-
во кетоновых тел, образуемых печенью, поскольку преобладает окис-
ление жирных кислот, тогда как поступление пирувата и оксалоаце-
тата снижено, из-за чего не обеспечивается достаточный поток ме-
таболитов через цикл лимонной кислоты. Спустя несколько недель
такие ткани, как сердце и в конечном счете мозг приспосабливаются
к удовлетворению значительной доли своих энергетических потреб-
ностей за счет этих кетоновых тел. Однако, если образование ке-
7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА 357
тоновых тел превосходит их использование, возникает метаболиче-
ский ацидоз, который стремятся компенсировать как органы дыха-
ния (выделение СО2), так и почки (экскреция NHJ). Одновременно
по мере перехода к мобилизации и окислению жирных кислот, жи-
ровая ткань и печень постепенно расходуют такие участвующие в
биосинтезе жирных кислот ферменты, как ацетил-КоА — карбо-
ксилаза, синтетаза жирных кислот, фермент, расщепляющий цитрат.
Если голодание продолжается, происходит мобилизация ткане-
вых белков и их использование в качестве источников энергии. Как
это ни парадоксально, первыми мобилизуются лабильные белки
желудочно-кишечного тракта и пищеварительные ферменты подже-
лудочной железы, что нарушает использование тех небольших ко-
личеств пищи, которые поступают в желудочно-кишечный тракт.
В дальнейшем начинается распад белков внутренних органов (пе-
чени и селезенки), затем — функциональных белков мышц и нако-
нец белков нервной системы. Эта последовательность использования
соответствует скоростям обновления белков при описанном выше
стационарном состоянии. Катаболизм аминокислот, стимулируемый
усиленной секрецией глюкокортикоидов и сниженной секрецией
инсулина, служит непосредственным источником АТФ для перифе-
рических тканей и обеспечивает поступление углерода для образо-
вания глюкозы в печени и почках. В первые недели голодания, не-
смотря на общее повышение катаболизма белка, наблюдается зна-
чительное увеличение содержания в печени таких участвующих в
глюконеогенезе ферментов, как аминотрансферазы, фосфатазы,
ферменты, катализирующие превращение пирувата в фосфоенолпи-
руват. При длительном голодании, когда мозг удовлетворяет свои
энергетические потребности в большей мере за счет 0-оксибутирата,
чем за счет глюкозы, интенсивность глюконеогенеза постепенно сни-
жается. Одновременно с этим масса мышечной ткани, общая ак-
тивность организма и, следовательно, затраты энергии также убы-
вают. Наконец, когда все резервы жиров истощены, организм начи-
нает расходовать даже жизненно важные белки сердца, легких,
клеток крови и т. д.; затем наступает смерть от коллапса.
ОЖИРЕНИЕ
Одна из трагических ироний современной цивилизации состоит
в том, что если в развивающихся странах примерно одна треть на-
селения в той или иной мере страдает от недоедания, то для населе-
ния развитых стран наиболее серьезную проблему питания пред-
ставляет переедание. Оценить частоту случаев ожирения доволь-
но трудно, так как объективных критериев, позволяющих определить
жесткие границы нормы в смысле содержания жира в организме,
не существует. Однако, по данным последних обследований, про-
веденных в США и Канаде, у одной трети взрослых жителей этих
358 7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
стран вес тела более чем на 20% превышает идеальный. Для этой
группы людей с избыточным весом характерна значительно более
высокая смертность от болезней, относимых к группе наиболее час-
тых причин внезапной смерти. Если учесть, что важнейшими факто-
рами, предрасполагающими к ишемической болезни сердца являют-
ся курение сигарет, сидячий образ жизни, гипертония, гиперлипе-
мия и ожирение, причем четыре последних фактора часто сочетаются
друг с другом у людей с избыточным весом, то указанная опасность
станет очевидной. К этим серьезнейшим медицинским проблемам
присоединяются и другие удручающие спутники ожирения: одыш-
ка, боли в суставах и переломы, осуждение общества и потеря ува-
жения к самому себе.
Описаны два важнейших типа ожирения, различающихся по
причинам, лежащим в их основе, и по поражаемым возрастным груп-
пам: ожирение у детей, при котором перекармливание в раннем дет-
стве ведет к увеличению числа клеток в жировой ткани (адипоцитов),
и ожирение у взрослых, при котором либо недостаточное использо-
вание, либо избыточное потребление калорий с пищей ведет к уве-
личению размеров адипоцитов, но не изменяет их числа. Наиболее
коварен синдром ожирения, развивающийся в раннем детстве, не
только потому, что он предрасполагает к таким заболеваниям, как
респираторные инфекции в детском возрасте, но также потому, что
он обычно приводит к ожирению в дальнейшем и у взрослого, по-
скольку многочисленные жировые клетки сохраняются в организме
на протяжении всей жизни. Высказывалось предположение о зна-
чении генетического фактора в развитии ожирения у детей, посколь-
ку частота его особенно высока среди потомков тучных людей При
развивающемся у взрослых синдроме ожирения разобраться в со-
четании вызывающих его причин бывает нелегко.
Страдающим ожирением людям хорошо известен жестокий пара-
докс: суровый голод среди изобилия. По-видимому, «аппестат»,
т. е. гипоталамический центр регуляции аппетита, у этих людей
«установлен на слишком высокую отметку». В других случаях стра-
дающие ожирением люди потребляют не больше пищи, чем худоща-
вые, но они значительно менее активны. Хотя им приходится выпол-
нять большую дополнительную работу — «носить свой избыточный
вес», однако создается впечатление, что тучные значительно менее
активны физически и затрачивают меньше энергии на осуществле-
ние нормальных физиологических функций. К сожалению, механиз-
мы энергосопряжения при ожирении функционируют слишком эф-
фективно.
Реальный прирост жиров в депо происходит в тех случаях, ког-
да липогенез, обусловленный поступлением с пищей избытка угле-
водов и жиров, преобладает над мобилизацией жирных кислот и
их окислением для удовлетворения потребностей периферических
тканей в энергии. Липогенезу способствует избыточное питание и
7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА 359
усиленная секреция инсулина; усиленная физическая нагрузка
и повышенная секреция липолитических гормонов (катехоламины и
глюкагон) стимулируют использование жиров. Поскольку все про-
цессы в организме взаимосвязаны, было бы ошибкой концентри-
ровать все внимание в случаях ожирения на том, что происходит в
жировой ткани. Накопление жира в депо — это лишь последнее зве-
но в цепи метаболических нарушений.
Жиры, поступающие в организм с пищей, вносят непосредст-
венный вклад в создание запасов триацилглицеридов в жировой
ткани. Об этом свидетельствует тот факт, что состав непредельных
жирных кислот жировых депо постепенно приобретает черты сход-
ства с составом непредельных жирных кислот экзогенных жиров
пищи. Однако основным фактором липогенеза при ожирении явля-
ются углеводы. Глюкоза, поступающая в кровь (в результате вса-
сывания из кишечника) в количествах, превосходящих потребности
печени или возможности процесса депонирования гликогена, преж-
де всего используется для синтеза жирных кислот. Наиболее важ-
ным местом образования эндогенных, преимущественно насыщенных
жирных кислот являются клетки печени. Поступающий из печени
избыток глюкозы и триацилглицеридов захватывают клетки жиро-
вой клетчатки, в которой происходит синтез дополнительных коли-
честв жирных кислот. Этерификация жирных кислот, проникающих
в клетки жировой клетчатки, а также жирных кислот, синтезируе-
мых в самой жировой ткани, зависит от превращения поступающей
глюкозы в акцептор — а-глицерофосфат. В жировой клетчатке туч-
ных усиленное превращение глюкозы в а-глицерофосфат сочета-
ется с ингибированием его окисления дегидрогеназой митохондрий.
В результате повышается доля глюкозы, используемой для образо-
вания глицерина, и этерификация жирных кислот начинает преобла-
дать над выхождением свободных жирных кислот из клеток.
Эффекты инсулина как бы наслаиваются на тот дисбаланс, ко-
торый создает излишнее питание. У людей, страдающих ожирением,
отмечается значительное повышение содержания инсулина в цир-
кулирующей крови, а также чрезмерная реакция на поступление
глюкозы в желудочно-кишечный тракт Сочетание избыточного пи-
тания с гиперинсулинизмом не только способствует захвату глюко-
зы жировой клетчаткой, но и индуцирует синтез ряда ферментов
(фермента, расщепляющего цитрат, ацетил-КоА — карбоксилазы и
синтетазы жирных кислот) в клетках печени и жировой ткани, что
ведет к стимуляции липогенеза. Кроме того, повышение концентра-
ции инсулина ингибирует гормон-чувствительную липазу, что вы-
зывает дальнейшее смещение нарушенного баланса в сторону отло-
жения жиров.
Лечение ожирения — крайне трудная и неблагодарная задача,
особенно если учитывать отдаленные результаты. Затратив чрез-
вычайные волевые усилия, можно добиться на несколько месяцев
360 7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
значительного снижения веса, но затем некоторое изменение при-
вычек или эмоциональный срыв полностью изменяют ход процесса
на обратный, и вес быстро восстанавливается. Биохимический ме-
ханизм этого легко понять, если учесть тот факт, что адаптивное уве-
личение активности ферментов липогенеза происходит за несколько
часов после приема пищи, тогда как деадаптация требует многих
недель голодания. Ощущение безнадежности усиливают частые
жестокие насмешки окружающих, распространенное в обществе
мнение о том, что все тучные — обжоры.
Для резкого снижения веса прибегали к полному голоданию под
наблюдением врачей в условиях стационара, но данные, представ-
ленные в предыдущем разделе, подчеркивают опасности, связан-
ные с этими драконовыми мерами. Важнейшая проблема, конечно,
возникает вследствие того, что при полном голодании потеря веса
может происходить в большей мере не за счет жировых депо, а за
счет органов и тканей, не содержащих резервных жиров. Поскольку
при ожирении жир обычно накапливается в первую очередь в ущерб
мышечной ткани, такой «расход» тканей сказывается на общем со-
стоянии. Поэтому при лечении представляется более целесообраз-
ным сократить общее поступление калорий до уровня, который был
бы ниже минимально необходимого для поддержания активности
организма и обеспечения достаточного количества белка, обеспечи-
вающего синтез компонентов мышц и других, не содержащих жира
тканей, а также для предотвращения развития отрицательного азо-
тистого баланса вследствие усиленного глюконеогенеза. Уменьшение
поступления в организм углеводов, безусловно, предотвращает
склонность к липогенезу, который индуцируется повышением со-
держания глюкозы в крови и гиперинсулинизмом. Ограничение по-
ступления углеводов в организм достигается, в частности, заменой
в рационе сахарозы, которая содержится в больших количествах в
современных рафинированных продуктах питания, на хуже всасы-
вающиеся крахмалоподобные природные углеводы. Важнейшим фак-
тором адаптивного увеличения липогенеза является резкое повыше-
ние содержания глюкозы в крови после ежедневного обильного
однократного приема пищи, привычного для склонных к ожирению
людей. Следовательно, полезнее разделять ежедневный пищевой
рацион на несколько небольших порций.
Снижению веса тела способствует дозированная физическая на-
грузка; рекомендуется комплекс упражнений, трудность которых
нарастает постепенно. Во-первых, повышенный расход энергии в
большей мере способствует катаболизму, чем анаболизму жиров.
Во-вторых, стимуляция развития мышц обеспечивает расходование
тканевых депо, ускоряя одновременно компенсаторное наращи-
вание массы тканей, свободных от избытка жира. В-третьих, по мере
того как упражнения постепенно становятся все более трудными,
сопровождающее их освобождение катехоламинов усиливает липо-
7. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА 361
лиз, а также использование жирных кислот тканями мышц. В-чет-
вертых, склонность к развитию сердечно-сосудистых заболеваний
уменьшается по мере тренировок, повышающих силу и выносливость
сердца и органов дыхания. Наконец, повышение подвижности и ра-
ботоспособности позволяют человеку активно участвовать в самых
разнообразных формах деятельности, что способствует появлению
ощущения счастья и благополучия.
Рекомендуемая
литература
Buskirk Е. R., Obesity: a Brief Overview with Emphasis on Exercise, Fed. Proc.,
33, 1948—1951, 1974.
Coleman J. E., Metabolic Interrelationships Between Carbohydrates, Lipids and
Proteins, In: Bondy P. K., Rosenberg L. E. (eds.), Diseases of Metabolism,
W. B. Saunders, Philadelphia, 1974, pp. 107—220.
Craddok D., Obesity and its Management, Churchill Livingstone, Edinburgh, 1973.
Cravioto J., Hambraeus L.t Vahlquist B. (eds.), Early Malnutrition and Mental
Development, Almqvist and Wiksell, Stockholm, 1974.
Dobbing J., Smart J. L., Vulnerability of Developing Brain and Behaviour, Br.
Med. Bull., 30, 164—168, 1974.
Davidson C. S., Liver Pathophysiology: Its Relevance to Human Disease, Little,
Brown, Boston, 1970.
Felig P., Wahren J.t Protein Turnover and Amino Acid Metabolism in the Regu-
lation of Gluconeogenesis, Fed. Proc., 33, 1092—1097, 1974.
Leveille G. A., RomsosD. R., Meal Eating and Obesity, Nutr. Today, 9, (6), 4—9,
1974.
Neely J. R., Morgan H. E.t Relationship between Carbohydrate and Lipid Meta-
bolism and the Energy Balance of Heart Muscle, Ann. Rev. Physiol., 36, 413—
459, 1974.
Ruderman N. B., Muscle Amino Acid Metabolism and Gluconeogenesis, Ann. Rev.
Med., 26, 245—258, 1975.
Sabry Z. /., Campbell J. A., Campbell M. E,, Forbes A. L., Nutrition Canada, Nutr.
Today, 9, (1), 5—13, 1974.
Sokoloff L., Metabolism of Ketone Bodies by the Brain, Ann. Rev. Med., 24, 271—
280, 1973.
Tizard J.t Early Malnutrition, Growth, and Mental Development in Man, Brit.
Med. Bull., 30, 169—174, 1974.
Winick M.t Childhood Obesity, Nutr. Today, 9, (3), 6—12, 1974.
Young V. R., The Role of Skeletal and Cardiac Muscle in the Regulation of Protein
Metabolism. In: Munro H. N. (ed.), Mammalian Protein Metabolism, Vol. IV,
Academic Press, New York, 1970, pp. 586—674.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Аденин 44
N-Аденозилметионин 297
Аденилаткиназа 161
Адентилатциклаза 191, 200
Адреналин 191, 200, 210, 249, 293,
333, 354
Адренокортикотропный гормон
(АКТГ) 249
АДФ 132—133, 143, 178, 197, 232,
268, 322
Азотистое равновесие 268
Азотистый баланс 268—269, 274—317,
317—326, 326—327, 360
Активный перенос веществ 68, 151—
153
— транспорт аминокислот 321
---натрия 155, 159, 168, 206
Активный центр ферментов 78—79
Аланин 177
Алкаптонурия 103, 294
Аллопуринол 308
Аллостерические модификаторы 93—
96
Альбинизм 103, 294
Альбумин 257, 313
Амилазы 166
Аминоацидурия 322
Аминокислоты 39
— активация 50
— активный транспорт в почках 321
— ароматические 103, 275—300, 317—
323, 326—337
— в моче 320, 322, 325
— всасывание 273
— незаменимые 265—268
— оксилительное дезаминирование
278—279
— серусодержащие 296—300
6-Аминолевулиновая кислота 309
у-Аминомасляная кислота 204, 328—
330
Аминотрансфераза(ы) 276—278
Аммиак, выведение с мочой 318, 326
— обмен 204, 286—288, 318—320, 327
— образование 274
— токсичность 204
Амниоцентез 254
АМФ, регуляция гликогенолиза в пе-
чени 178, 191, 197, 204
— синтез 305
— циклический 190—193, 200, 248
Анаболизм 75
— регуляция 353
Анальбуминемия 243
А ндерсена болез н ь 193
Андрогены 354
Аноксия 154
Антикодоны 51—55
Антимицин А 130
Антихолинэстераза 333
Арахидоновая кислота 212
Аргиназа 285
Аргинин 285
Аргининосукцинатацидурия 288
Аскорбиновая кислота 166
---роль в обмене тирозина 290
Аспартаткарбамоилтрансфераза 301
Атеросклероз 258—260
АТФ 109, 112, 122—127, 143, 157—
161, 178, 182, 191, 197, 204, 232,
236, 344
— образование 170
— потребность 174, 228, 230
АТФаза 149, 150, 151, 153
Ацетил-КоА 134, 140, 177, 182, 345
Ацетил-КоА-карбоксилаза 228, 247,
357, 359
Ацетилхолин 331—333
Ацетилхолинэстераза 332
Ацидоз 318—320, 357
Ацилпереносящий белок (АПБ) 227
Барбамил 130
Белки 41
— в мембранах 66—67
---пище 263—268
— вторичная структура 60
— выведение с мочой 326
— денатурация 63, 87
— обмен 342—346
— первичная структура 58—60
— переваривание и всасывание 271—
274
— распад 357
— синтез 49—55
— третичная структура 60—63
— функции 55—57
— четвертичная структура 63—64
Белковый обмен 269
Биливердин 311, 313
Билирубин 311—317
Билирубин — диклюкуронид 313
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 363
Биогенные амины 330—337
Биотин 227
«Ветвящий фермент» 188, 193
Витамин Вб 299, 300, 303, 305. См.
также Пиридоксин
— С см. Аскорбиновая кислота
Вильсона болезнь 322
Восстановительное аминирование 280
Восстановительный потенциал 119—
120
Врожденные нарушения обмена ЮЗ-
105
Галактоза 163
Галактоземия 166, 194, 322
Ганглиозиды 253, 254
Гексокиназа 112—113, 195, 203
Гем 308—310, 311—313,
Гемоглобин 57, 59, 64 , 311
Гемоксигеназа 312
Гемолитическая анемия 206, 207
Гемопротеиды 308
Генетический код 51—55
Гены, регуляция ферментов 101—105
— репликация 41—46
— транскрипция 46—47
Гепарин 257
Гидролазы 166
Гиперлипемия 261
Гирке болезнь 193
Гистоны 59, 70
Гликоген 163, 185, 194, 199—202
Гликоген-6-глюканогидролаза 189, 193
Гликогенез 186, 193, 200
Гликогенозы 193, 202
Гликогенолиз 189—193, 200—202,
356—357
Гликогенсинтетаза 188, 190, 192, 199,
200
1,4-Гликозидаза 202
Гликолиз. 108—НО, 170—172, 175—
181, 197, 203—204
Гликолитический путь 168. См. так-
же Гликолиз
Гликолипиды 69
Гликопротеиды 69
Глицерин 249
Глицеролкиназа 242
а-Глицерофосфатдегидрогеназа 242,
245, 359
Глициноксидаза 318
Глутамат 278, 319, 327—328
Глутамат-аланинаминотрансфераза
277, 278
Глутаматдегидрогеназа 278—279
Глутаматдекарбоксилаза 329, 330
Глутамат-тирозинаминотрансфераза
277, 290
Глутамин 281—282, 319, 327—328
Глутаминаза 281, 319
Глутаминсинтетаза 281
Глутатион 206
Глюкагон 180, 191, 209, 232, 249, 354,
356
Глюкоза 112—113, 163, 179—180, 195,
203, 207—210
Глюкозо-6-фосфат 38, 186, 192, 196
Глюкозо-6-фосфатаза 172, 193
Гл юкозо-6-фосфатдегидрогеназа 183,
184, 207, 234
Глюкокиназа 179—180
Глюкокортикоиды 180—181, 209,
277, 290, 291, 310, 354, 357
Глюконеогенез 109—ПО, 172—181,
313, 356—357
Глюкуронилтрансфераза 313, 317
ГМФ 305
Голодание 209, 355—357
Годьджи аппарат 71
Гомоцистинурия 300
Гормоны анаболические 353—354
— катаболические 354
— полипептидной природы 56
— роста 210, 249, 353
— щитовидной железы 131
Гоше болезнь 254
ГТФ 113
Гуанин 44
Двойная спираль 43
Дегидрогеназы 118—119
Дезоксирибоза 163
Дерепрессия ферментов 100—101
Джилберта болезнь 317
Диацилглицерины 212, 215
2,4-Динитрофенол (ДНФ) 130, 133, 150
Диоксифениламин (дофамин) 333
1,3-Дифосфоглицераты 115, 170
2,3-Дифосфоглицераты 206
ДНК 41-55
— в дифференцирующихся клетках 347
--- митохондриях 71
— репликация 42—46
— транскрипция 46—47
ДНК-пол имераза 46
Дубина — Джонсона синдром 317
Дыхательная пепь 122—131, 345—346
Дыхательный контроль 131—133
Желтуха 315—317
Желчные кислоты 216—219, 237—240
— пигменты 311—317
Жирные кислоты 177, 212, 214, 218.
364 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
220, 221—225, 231—236, 245—
248, 250, 251, 252, 359
Жировая ткань 245—247, 350, 359
Жиры, синтез 247, 360. См. также
Жирные кислоты
Заменимые аминокислоты 279—280
Зимогены 97, 271—273
Зимогенные гранулы 72
Изоцитратдегидрогеназа 136, 142—
143
Иммуноглобулины 57
Игибирование конкурентное 91—93
— конечным продуктом 96
Ингибиторы дыхания 129—131
Инсулин 180, 192, 196, 209, 247, 249,
349, 353, 356
Ионные градиенты 154—156, 159
Ионный транспорт в митохондриях
147—150
Кальциевый насос 159
Кальция ионы 200
Карбамоилфосфатсинтетаза 284, 288,
301
Карбоксипептидаза 273
Карнитин 147, 251
Катаболизм 75, 354
Катехоламины 333—335, 356. См.
такжеi Адреналин, Норадреналин
Квашиоркор 264, 355
а-Кетоглутаратдегидрогеназа 136
Кетоз 140, 234
Кетоновые тела 204 , 233, 234, 250—
251, 320, 356
Киназы 98
Кодоны 51—55
Кома печеночная 287
Кори болезнь 193
Кофермент А 116, 221—223
Коферменты 90—91
Крахмал 163
Креатин 325
Креатинфосфат 115, 156, 161
Креатинфосфокиназа 156, 161
Криглера—Наджара синдром 316
Ксантиноксидаза 306, 308
Кушинга синдром 209
Лактат 174, 178
Лактатдегидрогеназа 119, 172, 198
Лактоза 163
Леша-Нихана синдром 308
Лизосомы 72
Лимонная кислота 236
Линолевая кислота 244
Линоленовая кислота 212
Липаза(ы) 215, 232, 248
Липидозы 254
Липиды 64—65, 212, 214—218, 240,
258—260
Липогенез 225—230, 245—246, 358—
361. См. также Жирные кислоты
Липоевая кислота 136, 182,
Липолиз 215, 248—249 , 356
Липопротеидлипаза 219, 245, 247,
257, 260
Липопротеиды 243, 255, 256, 258, 261
Мак-Ард ля болезнь 202
Макромолекулы 41
Макроэргические соединения 110—116
Малатдегидрогеназа 137, 146, 183,
234—245
Малонил-КоА 228, 230
Мальтаза 166
Мальтоза 166
Маразм 355
Меланин 293
Мембраны 64—72, 240
Метаболизм 75
— интеграция 340—355
— при голодании 355—357
----ожирении 357—361
Метгемоглобин 206
Метилтрансфераза 297
Метионин 297—300
Миелин 253
Микротрубочки 73
Микрофибриллы 73
Миоглобин 157
Митохондрии 70—71, 108, 143—151
Михаэлиса—Ментен уравнение 82—
84, 180
Моноаминооксидаза 334
Моноацилглицерин 212, 215
Моча 323—326
Мочевая кислота 282—286, 305—308
323—325
Мутации, 52 101—105
Мышцы, болезни 202
— обмен 157—162, 194—202, 249—
251, 351—352
— сокращение 159—162, 199—202
НАД 117—120
— синтез из триптофана 292
НАД-Н 136, 142, 146, 170, 172, 174,
344, 346
НАДФ 117—118
НАДФ-Н 168, 183, 227, 234, 245, 283,
306, 344, 346
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 365
Натриевый насос 154—155, 159, 206
Нейромедиаторы 330—337
Нефротический синдром 326
Ниацин 292
Нимана—Пика болезнь 254
Норадреналин 249, 293, 333, 354
Нуклеозидтрифосфаты 113
Нулеотиды 40
Обратное всасывание 320
Ожирение 320, 357—361
р-Окисление см. Жирные кислоты,
окисление
Окисление—восстановление 116—121
Окислительное дезаминирование 278—
279
—фосфорилирование 122—131, 148—
151
Оксалоацетат 138, 140, 175, 234
Оксидаза гомогентизиновой кислоты
290, 291, 294
Олеиновая кислота 212, 244
Олигомицин 131, 133, 149
Орнитин-карбамоилтрансфераза 284,
288
Пальмитиновая кислота 212, 225, 230,
244
Пеллагра 292
Пентозы 163, 184—185
Пепсин 271
Пептидазы 271
Пернициозная анемия 303
Печень, азотистый обмен 274—317,
348—350
— болезни 193—194
— жировое перерождение 220
— липидный обмен 218—244
— углеводный обмен 168—194
Паркинсонизм 333
Пиридоксальфосфат 276
Пиридоксин 292, 330. См. также
Пиридоксальфосфат
Пиримидин 300—307
Пируват 181—183
Пируватдегидрогеназа 182
Пируваткарбоксилаза 140, 174
Пируваткиназа 177, 178, 197, 206
Плазматическая мембрана 67—69
Подагра 307—308
Полинуклеотиды 41
Полипептиды 41
Полирибосомы 55
Полисахариды 41
Помпе болезнь 202
Порфирии 310—311
Порфирин 308—310
Почки, азотистый обмен 317—326,
352
Примахин 207
Простагландины 214
Протеазы 271
Протеинкиназа 192, 200
Протеолиз 271—274
Пурины 305—308
Разобщающие агенты 130—131, 133,
150
Репрессия ферментов 99—101
Рибоза 163
Рибосомы 49—55 71
РНК 41—55
РНК-полимераза 47, 48
Ротенон 130
Саркоплазматический ретикулум 159
Сахароза 163
Сахарный диабет 209, 249, 320
Свободная энергия 110—113
Серотонин 293, 335—337
Синаптические пузырьки 72
Синдром внезапной смерти 174
Синтетаза жирных кислот 230, 247,
357
а-Спираль 60, 63
Стеаторрея 214
Стероиды 212
Сукцинатдегидрогеназа 137
Сфинголипиды 252
Сфингомиелин 253
Танжье болезнь 243
Тей-Сакса болезнь 254
Тиамин 136, 182
Тимин, синтез 302
Тиолаза 224, 251
Тирозин 290
Тирозиназа 294
Тирозинемия 290, 294
Тироксин 293, 354
Трансляция 49—55
Транссульфирование 299
Триацилглицерин в жировой ткани
218, 244, 246, 256, 257, 260—261
Триацилглицерины 212, 214, 219
Триозофосфатдегидрогеназа 170
Трипсин 273
Триптофан 291—292, 296
Триптофангидроксилаза 335
Триптофаноксигеназа 291
Уабаин 152
Углеводы 163, 166—206, 342—346
УМФ 302
366 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Уридиндифосфатглюкоза (УДФ-глю-
коза) 113, 186—188
Уридиндифосфатглюкуроновая кис-
лота 313
УТФ 113, 186, 301
Фавизм 207
Фанкони синдром 323
Фенилаланин 289
Фенилаланингидроксилаза 289, 295
Фенилкетонурия 104 , 294—295
Фермент-субстратный комплекс 76—
80
Ферменты, адаптивный синтез 98—
101
— активация зимогенов 97
—аллостерические модификаторы 93—
96
— влияние ионов 89—90
-----pH 88—89
-----температуры 85—88
305
— генетическое детерминирование
101—105
— ингибирование 79, 91—93
— индукция 100—101
— кофакторы и коферменты 90—91
— механизм действия 76—80
— отрицательная обратная связь
96, 100
— простетические группы 78, 91
— регуляция 93—105
— репрессия и дерепрессия 99—101
— специфичность 78—80
— химическая модификация 98
Феррохелатаза 309, 310
Флавинадениндинуклеотид (ФАД)
Флавинмононуклеотид (ФМН)
Фолиевая кислота
Фосфатазы 98
Фосфатидил инозит
Фосфатидилсерин
Фосфатидил хол ин
Фосфатидилэта нолами н
Фосфатидная кислота 230, 242,
Фосфоглицериды 65, 212, 240
Фосфоглюконатный путь 168, 184, 206,
245, 283—285
Фосфоенолпируват в энергетическом
обмене 115, 170
Фосфоенолпируваткарбоксикиназа 174
Фосфокреатин см. Креатинфосфат
Фосфолипиды в мембранах 65, 240—
243
Ф осфор ибоз и л п ир офосфат
Фосфор ибозилтрансфераза
Фосфорилаза 188, 190, 192, 193, 200,
122
122
242
242
242
242
245
302, 304
308
202, 205
Фосфофруктокиназа 142, 177, 178,
202, 204
Фруктоза 163
Фруктозо-1,6-дифосфат 177
Фруктозо-1,6-дифосфатаза 173
Фруктозурия 166
Хартнупа болезнь 296, 321
Херса болезнь 193
Хиломикрон 218, 255
Химотрипсин 273
Холестерин 212, 237—240, 2
260
Холестерол-лецитин—ацилтраг
258
Холин 297—299
Холин-ацетилтрансфераза 33
Хромаффинные гранулы 72
ЦДФ-холин см. Цитидиндифс
лин
Целлюлоза 166
Цереброзиды 253
Цианиды 129
Цикл Кори 179
— лимонной кислоты 134—143,
224, 233, 345
— трикарбоновых кислот см.
лимонной кислоты
Цистатионурия 300
Цитидин 302
Цитидинтрифосфат (ЦТФ) 301
Цитидиндифосфатглицерид (ЦДФ
глицерид) 242
Цитидиндифосфатхолин (ЦДФ-холи
242
Цитидинтрифосфат 113
Цитохромы 124—126
Цитохромоксидаза 126
Цитрат 177, 197, 247
Цитрат-расщепляющий фермент 227,
236, 247, 357, 359
Цитруллинемия 288
Эндемический зоб 104
Эндоплазматический ретикулум 71 —
72
Энергия активации 86, 143—151, 154—
162, 342—346
Эритроциты 205—206
Эстрогены 354
Этаноламиновые плазмалогены 253
Ядро 69—70
Ядрышко 70
ОГЛАВЛЕНИЕ
одчика ........................................................ 5
ювие...................................................... 7
Зловарь терминов................................................ 9
Список сокращений............................................... 30
ведение........................................................ 32
Рекомендуемая литература.................................. 35
!ь как молекулярный процесс.................................. 36
Лростые молекулы.............................................. 38
Макромолекулы ................................................ 41
Мембраны и органеллы.......................................... 64
Рекомендуемая литература . ............................. 73
................................................................ 75
Природа ферментативного катализа , ........................... 76
Регуляция действия ферментов . ............................... 93
Рекомендуемая литература............................... 105
Биоэнергетика................................................... 106
Метаболические пути — запасание энергии и обратимость реакций 106
Макроэргические соединения.................................... НО
Окислительно-восстановительные реакции . ♦................... 116
Цикл лимонной кислоты........................................ 134
Роль митохондрий в энергетическом обмене..................... 143
Энергозависимые системы переноса............................. 151
Энергетический обмен в нервной ткани......................... 154
Энергетический обмен в мышцах................................ 157
Рекомендуемая литература............................... 162
4. Углеводы , .................................................... 163
Углеводы пищи ,.............................................. 163
Переваривание и всасывание................................... 166
Печень . , , ................................................ 168
Мышцы ....................................................... 194
Мозг......................................................... 202
Эритроциты . . .. ........................................... 205
Сахар крови.................................................. 207
Рекомендуемая литература............................... 210
5. Липиды......................................................... 212
Жиры пищи , , ............................................... 214
368 ОГЛАВЛЕНИЕ
Переваривание и всасывание................................. 214
Печень..................................................... 218
Жировая ткань.............................................. 244
Мышцы...................................................... 249
Мозг....................................................... 251
Липиды крови............................................... 254
Рекомендуемая литература............................. 261
6. Азотистый обмен.............................................. 263
Азот пищи . ............................................... 263
Переваривание и всасывание ................................ 271
Печень..................................................... 274
Почки...................................................... 317
Метаболизм иона аммония * , а.............................. 318
Мозг....................................................... 326
Биогенные амины............................................ 330
Рекомендуемая литература . .......................... 337
7. Интеграция метаболизма....................................... 340
Интегрирующие системы...................................... 340
Взаимосвязи между углеводами, жирами и белками............. 342
Взаимосвязи тканей и органов............................... 34G
Поддержание стационарного состояния........................ 353
Рекомендуемая литература............................. 361
Предметный указатель . .......................................... 362
У. Мак-Мюррей
ОБМЕН ВЕЩЕСТВ У ЧЕЛОВЕКА
Ст научный редактор Е. А. Яновская. Мл. научный редактор 3.
Художник Ф Н Буданов. Художественный редактор Б. Н. Юдкин.
Те:?ническ11й редактор И. м/КренделеваКорректор В. И. Постнова
ИБ № 1879
Сдано влабор 25.01.80. Подписано к печати 2®1^-80о^°₽маТ|
гкй,1 Ко 9 Гапнитупа латинская. Печать высокая. Объем 11,50 бум. ...
Уч.-изд.'Л'. 24Д4. Изд. № 4/0323. Тираж 20 000 экз. Заказ Ns 745. Цена 2 руб.
ИЗДАТЕЛЬСТВО «МИР» Москва, 1-й Рижский пер., 2
В. Соллертинская.
Бумага
л. Усл.
типограф-
печ. л. 23.
Отпечатано в Ленинградской типографии № 2 головном предприятии ордена Трудового
Красного Знамени Ленинградского объединения «Техническая книга» им Евгении Соко-
ловой Союзполиграфпрома при Государственном комитете СССР по делам издательств,
полиграфии и книжной торговли, 198052, г. Ленинград, Л-52, Измайловский проспект, 29,
с матриц ордена Октябрьской Революции н ордена Трудового Красного Знамени Первой
Образцовой типографии имени А. А. Жданова Союзполиграфпрома при Государственном
комитете СССР по делам издательств, полиграфии и книжной торговли. Москва, М-54,
Валовая, 28