Author: Гаевская А.В.
Tags: биология клетки и субклеточных частиц цитология articulata (членистые) болезни животных (кроме болезней домашних животных) патология животных экология и биогеография охрана живой природы паразиты человека паразиты нематоды пищевого происхождения
ISBN: 978-5-9909013-2-2
Year: 2016
А.В. ГАЕВСКАЯ
МИР
ПАРАЗИТОВ ЧЕЛОВЕКА
II. НЕМАТОДЫ И НЕМАТОДОЗЫ ПИЩЕВОГО ПРОИСХОЖДЕНИЯ
Российская академия наук Институт морских биологических исследований им. А. О. Ковалевского
А. В. Гаевская МИР ПАРАЗИТОВ ЧЕЛОВЕКА
II. НЕМАТОДЫ И НЕМАТОДОЗЫ ПИЩЕВОГО ПРОИСХОЖДЕНИЯ
Севастополь
2016
УДК 576.8:595.132:591.2
ББК 28.08
Г 12
Г 12 Гаевская А. В. Мир паразитов человека. II. Нематоды и нематодозы пищевого происхождения. - Севастополь, ЭКОСИ-Гидрофизика, 2016. - 442 с., илл.- 172.
ISBN 978-5-9909013-2-2
В монографии впервые в русскоязычной литературе обобщена вся доступная информация о 137 видах нематод, принадлежащих к 66 родам из 34 семейств, чьё попадание к человеку прямо или опосредованно связано с его питанием. Приведены самые необходимые сведения о систематическом положении, морфологии, биологии, жизненном цикле, круге хозяев - промежуточных, дополнительных, окончательных, географическом распространении видов - возбудителей нематодозов человека, информация о случаях заражения людей, патогенезе, эпидемиологии и профилактике вызываемых ими заболеваний.
Для паразитологов, биологов, работников медицинских учреждений, санитарноветеринарных служб, рыбной, пищевой и туристической отрасли, аспирантов и студентов профильных институтов, а также всех любителей блюд из термически необработанных про-
дуктов. УДК 576.8:595.132:591.2 ББК 28.08
печатается по рекомендации
Учёного совета ФГБУН «Институт морских биологических исследований им. А. О. Ковалевского РАН»
Рецензенты:
О. Г. Миронов, доктор биол. наук, проф.
М. В. Юрахно, доктор биол. наук, проф.
ISBN 978-5-9909013-2-2
© Гаевская Альбина Витольдовна, 2016
СОДЕРЖАНИЕ
Введение, или
ОПЯТЬ ПАРАЗИТЫ??!.................................................. 7
Глава 1
КАКИЕ ОНИ, НЕМАТОДЫ?................................................11
Глава 2
НЕМАТОДЫ - НЕЗНАКОМЫЕ ЗНАКОМЦЫ
Семейство Angiostrongylidae (B6hm et Gebauer, 1934)............. 15
Род Angiostrongylus Kamensky, 1905............................ 15
Семейство Anisakidae Railliet et Henry, 1912.....................35
Род Anisakis Dujardin, 1845....................................36
Род Contracaecum Railliet et Henry, 1912.......................56
Род Pseudoterranova Mozgovoy, 1950............................ 63
Семейство Ascarididae Baird, 1853................................74
Род Ascaris Linnaeus, 1758.....................................75
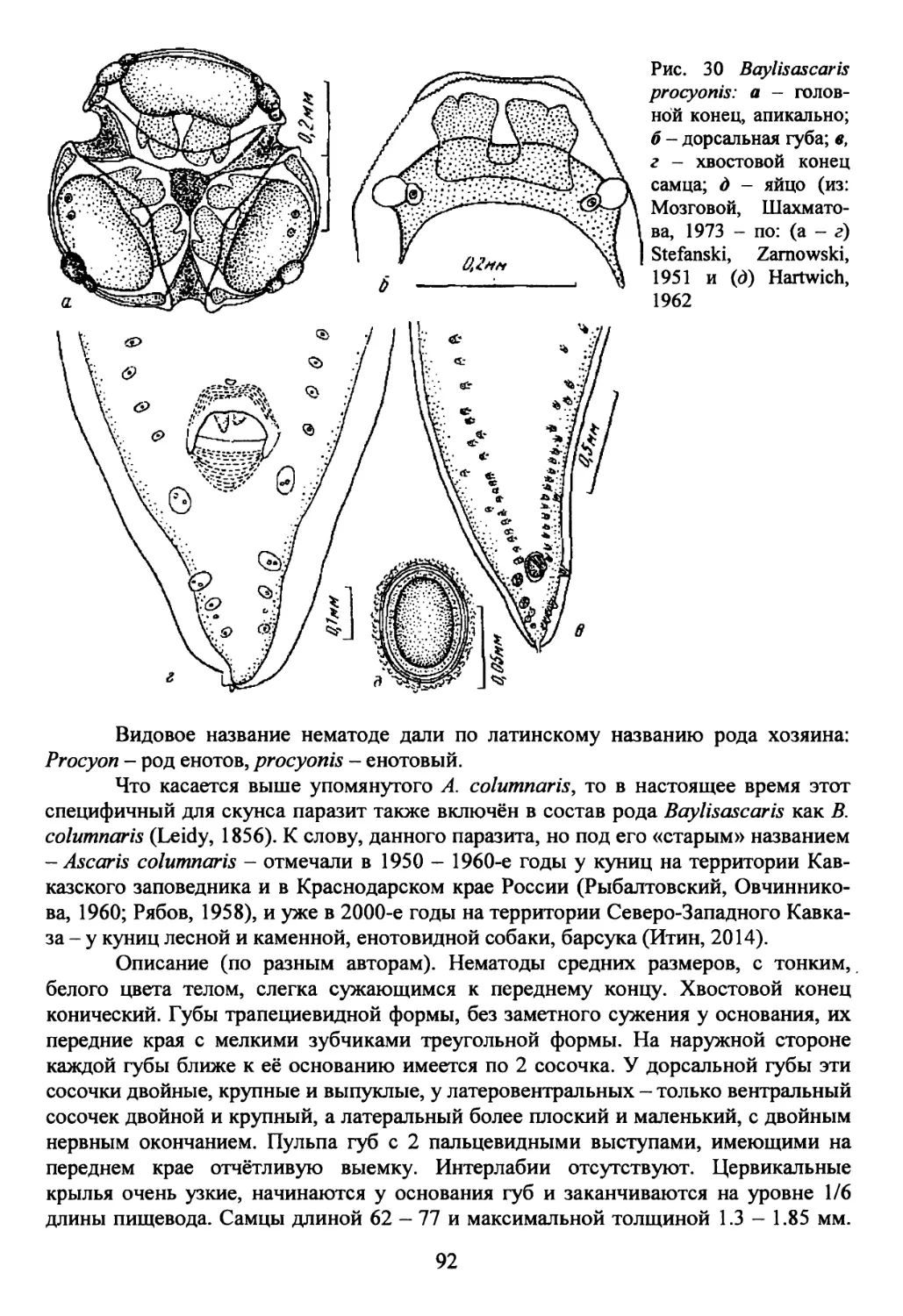
Род Baylisascaris Sprent, 1968.................................90
Род Lagochilascaris Leiper, 1909..............................103
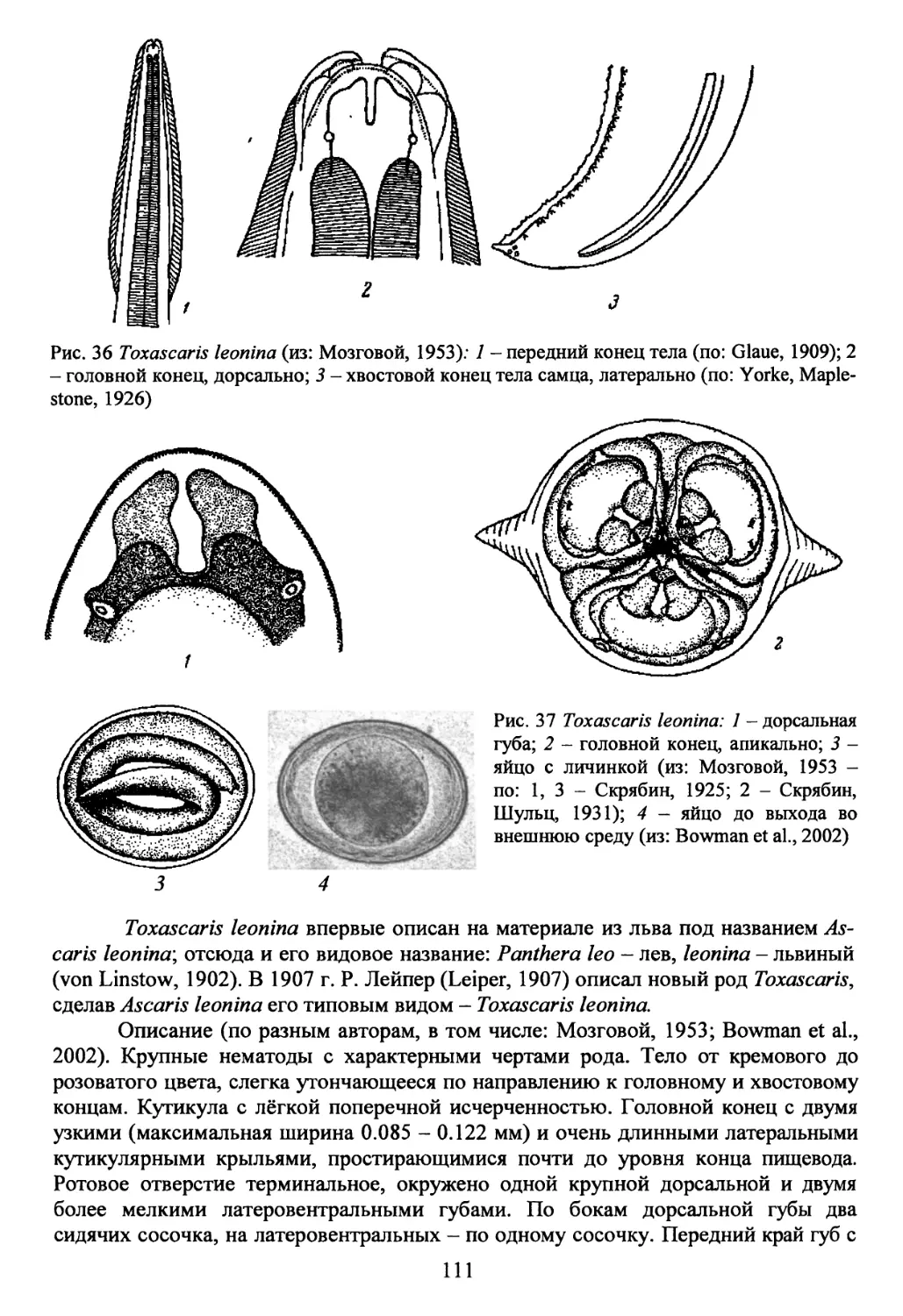
Род Toxascaris Leiper, 1907...................................110
Род Toxocara Stiles, 1905.....................................116
Семейство Capillariidae Railliet, 1915..........................136
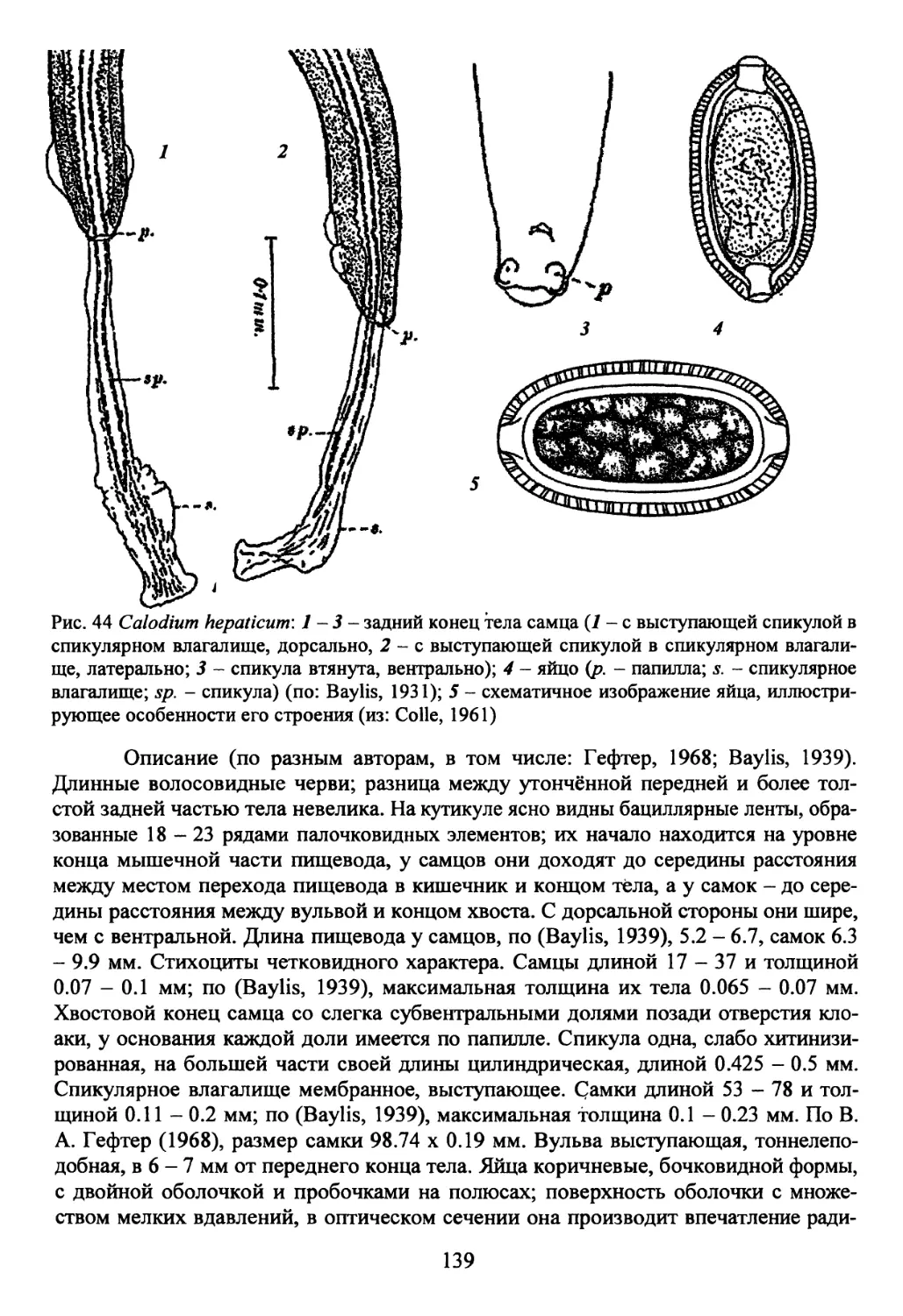
Род Calodium Dujardin, 1845...................................138
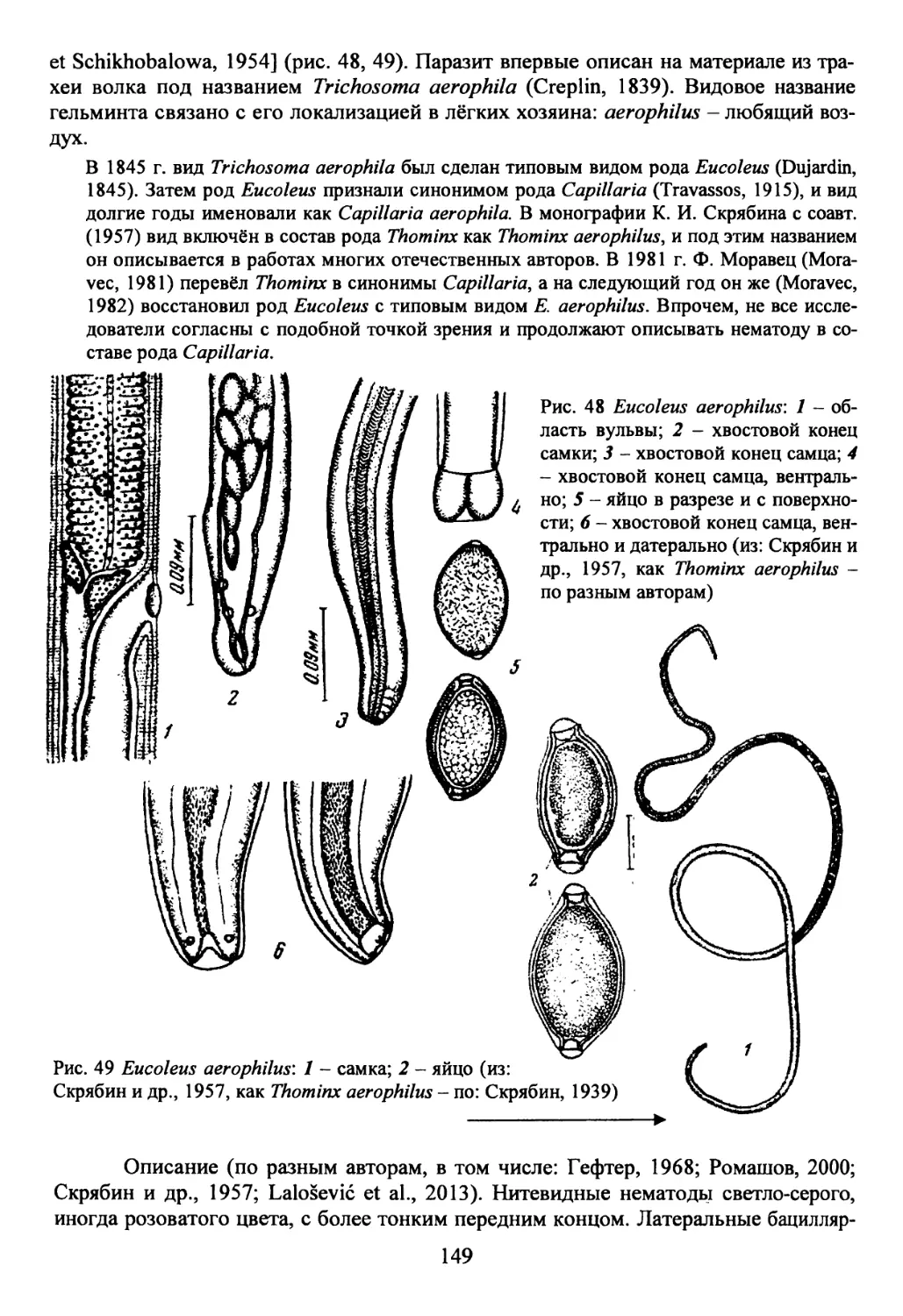
Род Eucoleus Dujardin, 1845...................................148
Род Paracapillaria Mendonca, 1963 ............................154
Семейство Dioctophymidae Railliet, 1915.........................165
Род Dioctophyme Collet-Meygret, 1802..........................166
Род Eustrongylides Jagerskiold, 1909..........................180
Семейство Dracunculidae Stiles, 1907............................189
Род Dracunculus Reichard, 1759................................189
Семейство Gnathostomatidae Railliet, 1895 ......................198
Род Gnathostoma Owen, 1836....................................199
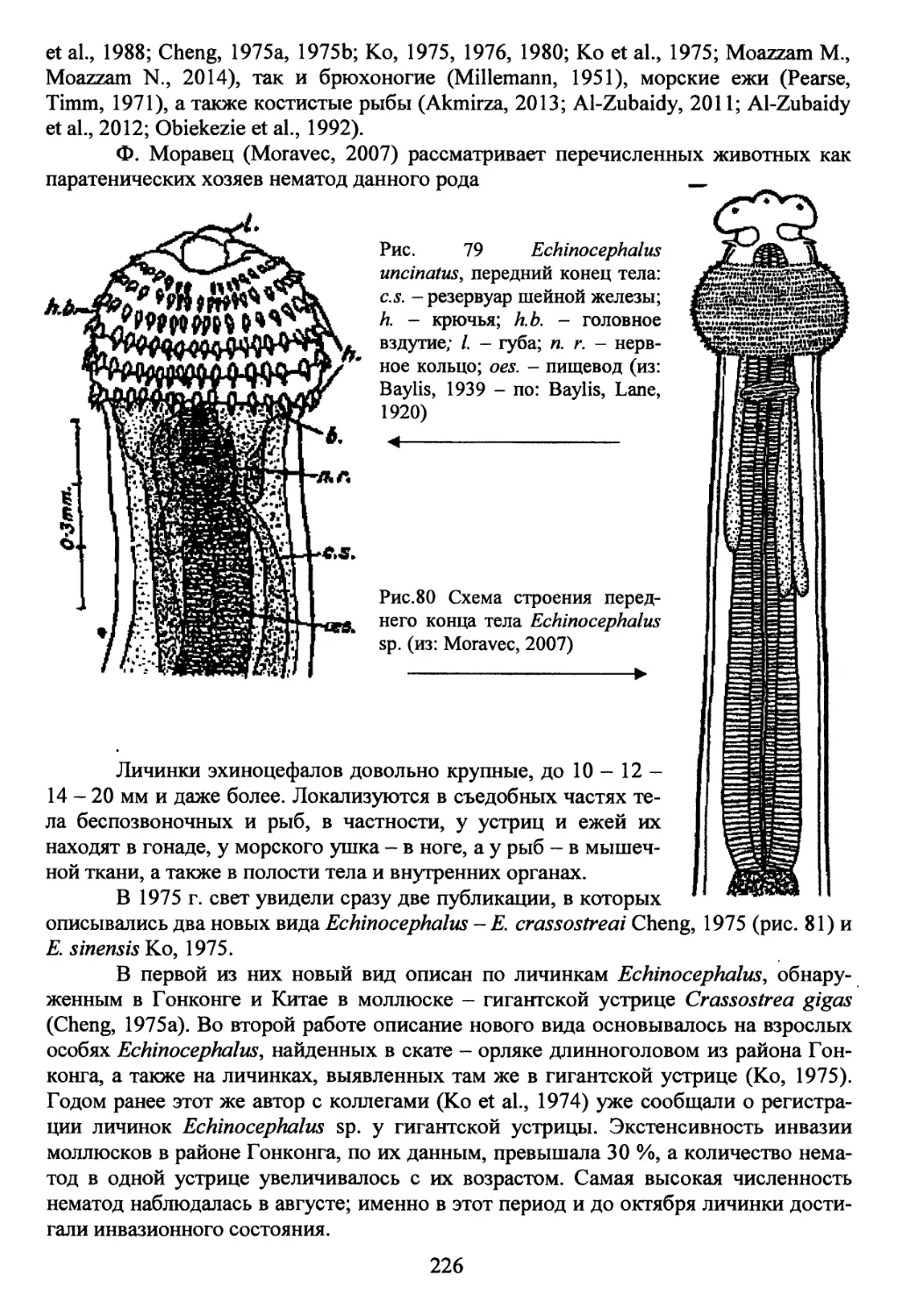
Род Echinocephalus Molin, 1858................................225
Семейство Gongylonematidae Sobolev, 1949........................229
Род Gongylonema Molin, 1857...................................229
Семейство Physalopteridae (Railliet, 1893)......................236
Род Physaloptera Rudolphi, 1819.............................. 236
Род Abbreviata Travassos, 1920................................239
3
Семейство Syngamidae Leiper, 1912.................................245
Род Mammomonogamus Ryzhikov, 1948 ...............................245
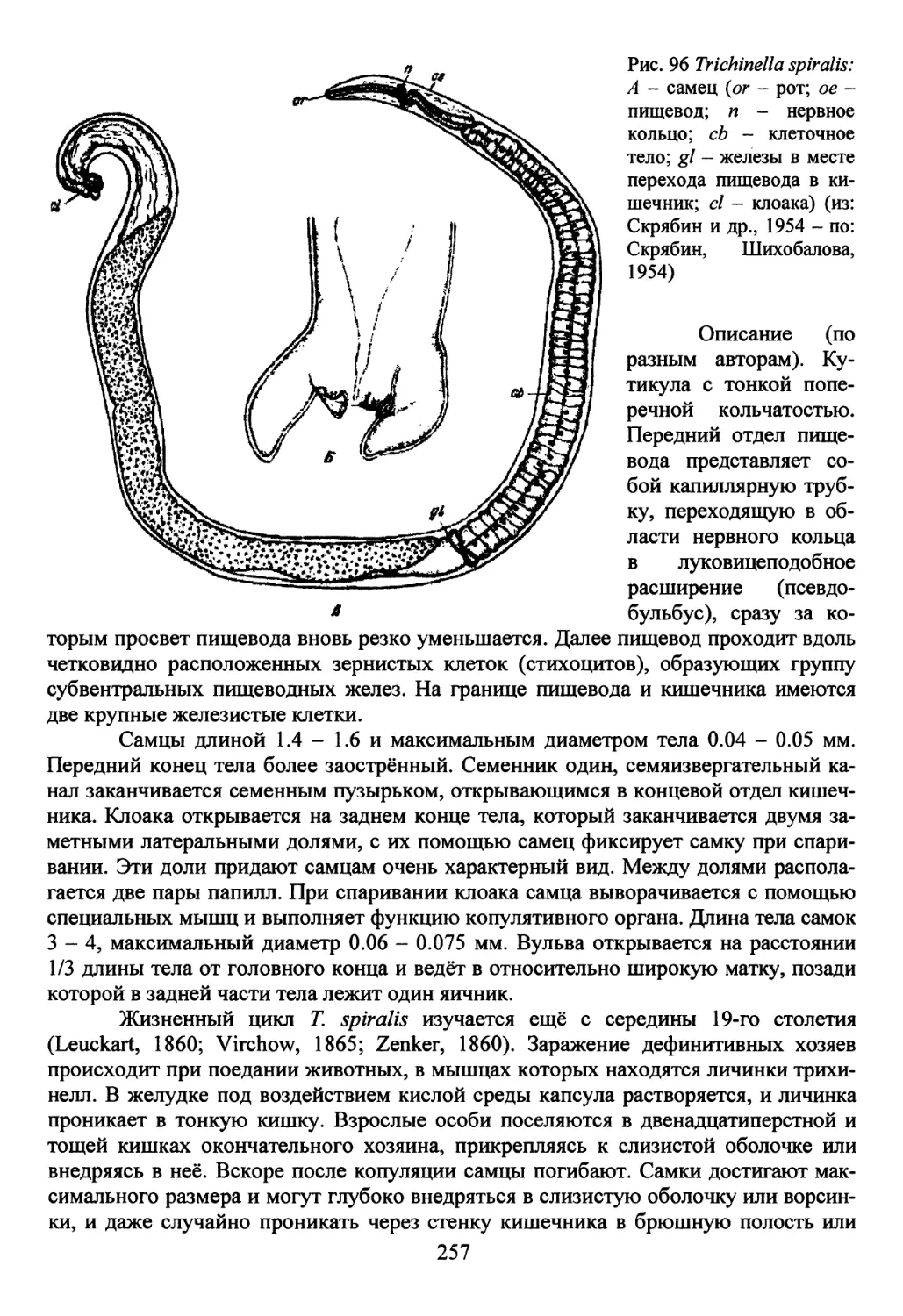
Семейство Trichinellidae Ward, 1907...............................254
Род Trichinella Railliet, 1895...................................254
Семейство Trichostrongylidae Leiper,1908..........................274
Род Trichostrongylus Looss, 1905 ................................275
Haemonchus Cobb, 1898........................................287
Род Marshallagia Orloff, 1933....................................291
Род Mecistocirrus Railliet et Henry, 1912........................292
Род Nematodirus Ransom, 1907.....................................294
Род Ostertagia Ransom, 1907......................................295
Род Teladorsagia Andreeva et Satubaldin, 1954....................296
Глава 3, или
HE С ХЛЕБОМ ЕДИНЫМ..................................................299
Семейство Acuariidae Railliet, Henry et Sissoff, 1912.............299
Семейство Alloionematidae Chitwood et McIntosh, 1934..............301
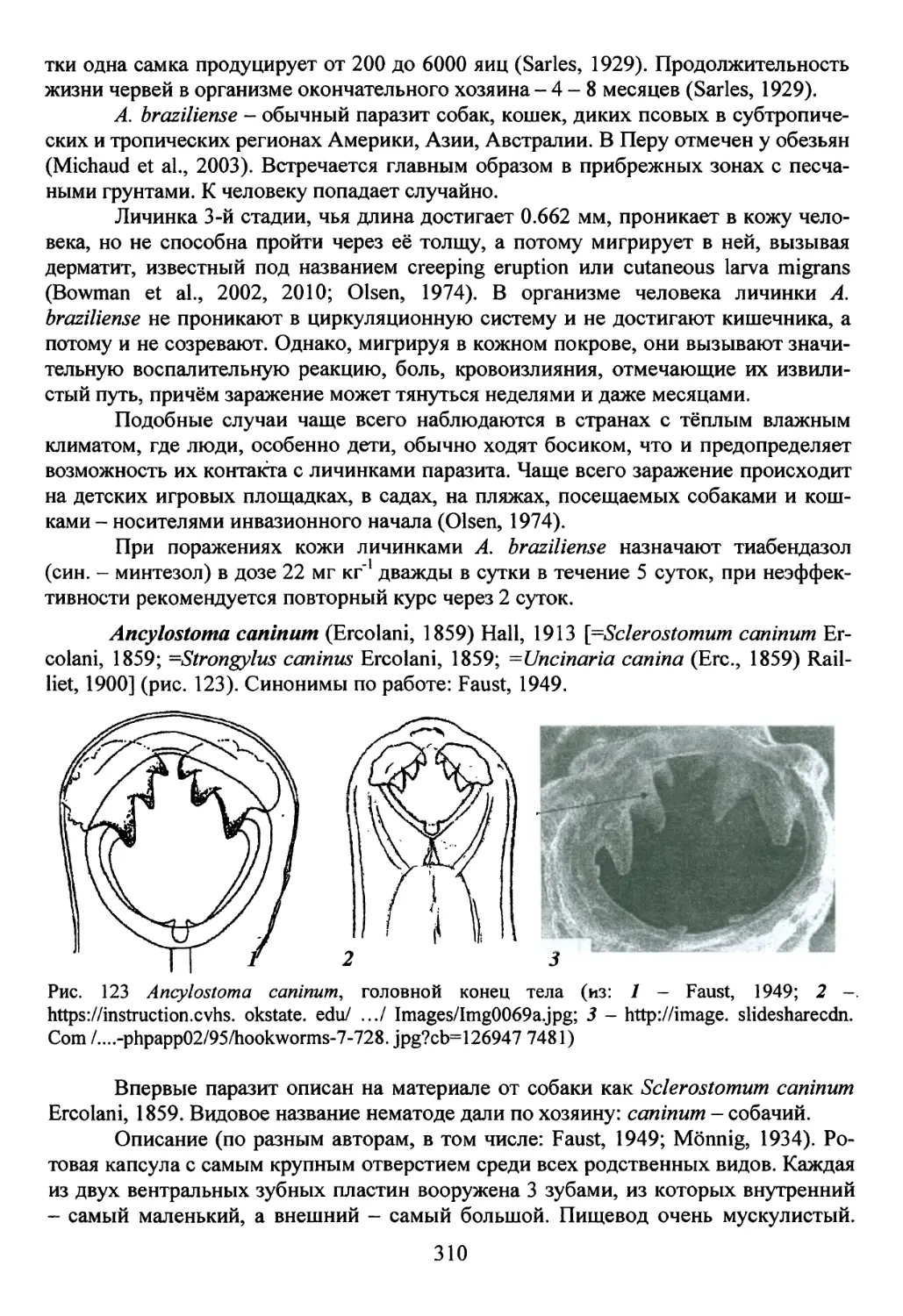
Семейство Ancylostomatidae (Looss, 1905)..........................302
Род Ancylostoma (Dubini, 1843) Creplin, 1845...................303
Род Necator Stiles, 1903 ......................................314
Род Uncinaria Froelich, 1789...................................316
Семейство Cephalobidae Filippjev, 1934............................321
Семейство Chabertiidae Popova, 1952...............................321
Род Cyclodontostomum Adams, 1933.................................322
Род Oesophagostomum Molin, 1861..................................323
Род Ternidens Railliet et Henry, 1909............................327
Семейство Diploscapteridae Micoletzky, 1922.......................331
Род Diploscapter Cobb, 1913......................................332
Семейство Meloidogynidae Skarbilovich, 1959.......................335
Семейство Mermithidae Braun, 1883.................................337
Семейство Metastrongylidae Leiper, 1912...........................341
Род Metastrongylus Molin, 1861...................................341
Семейство Onchocercidae Leiper, 1911..............................344
Род Onchocerca Diesing, 1841......;..............................345
Род Brugia Buckley, 1960.........................................349
Род Dirofilaria Railliet et Henry, 1911..........................351
Род Loa Stiles, 1905.............................................355
Род Mansonella Faust, 1929.......................................357
Род Meningonema Orihel et Esslinger, 1973........................360
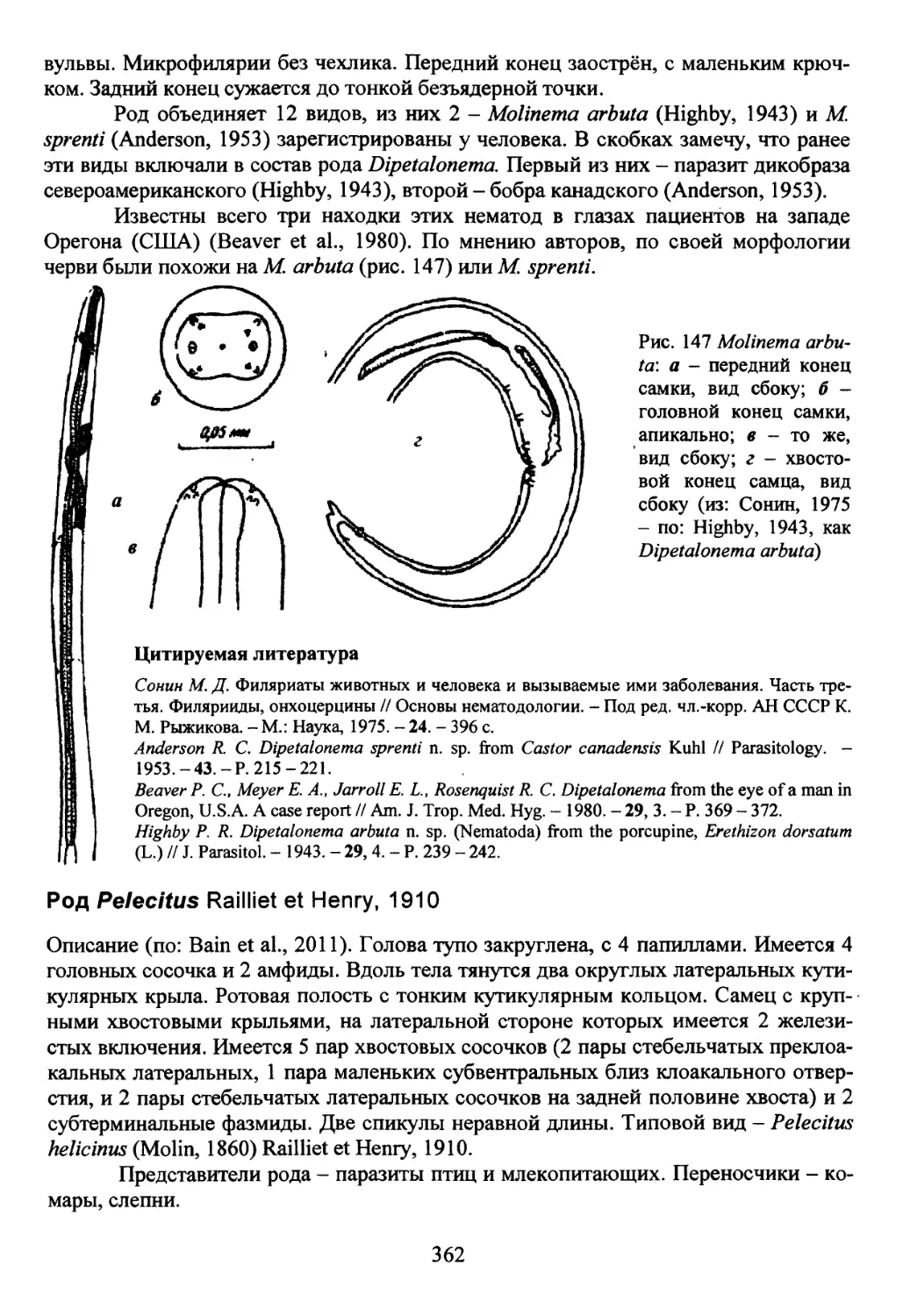
Род Molinema Freitas et Lent, 1939...............................361
4
Род Pelecitus Railliet et Henry, 1910..........................362
Род Wuchereria Da Silva Araujo, 1877...........................363
Семейство Oxyuridae Cobbold, 1864................................365
Род Enterobius Leach, 1853.....................................366
Семейство Panagrolaimidae Thome, 1937............................369
Род Halicephalobus Timm, 1956..................................370
Род Turbatrix Peters, 1927.....................................374
Семейство Peloderidae Andrassy, 1976.............................375
Род Pelodera Schneider, 1866...................................376
Семейство Philometridae Baylis et Daubney, 1926..................379
Семейство Rhabditidae Orley, 1880................................381
Род Rhabditis Dujardin, 1844...................................381
Род Caenorhabditis Osche, 1952.................................387
Семейство Rictulariidae Hall, 1915...............................389
Семейство Robertdollfusidae Chabaud et Campana, 1950.............391
Семейство Setariidae Yorke et Maplestone, 1926...................393
Род Setaria Viborg, 1795......................................393
Семейство Spirocercidae Chitwood et Wehr, 1932...................398
Род Spirocerca Railliet et Henry, 1917........................398
Семейство Strongyloididae Chitwood et McIntosh, 1934.............401
Род Strongyloides Grassi, 1879................................401
Семейство Syphaciidae Skrjabin et Schikhobalova, 1951 ...........409
Род Syphacia Seurat, 1916.....................................409
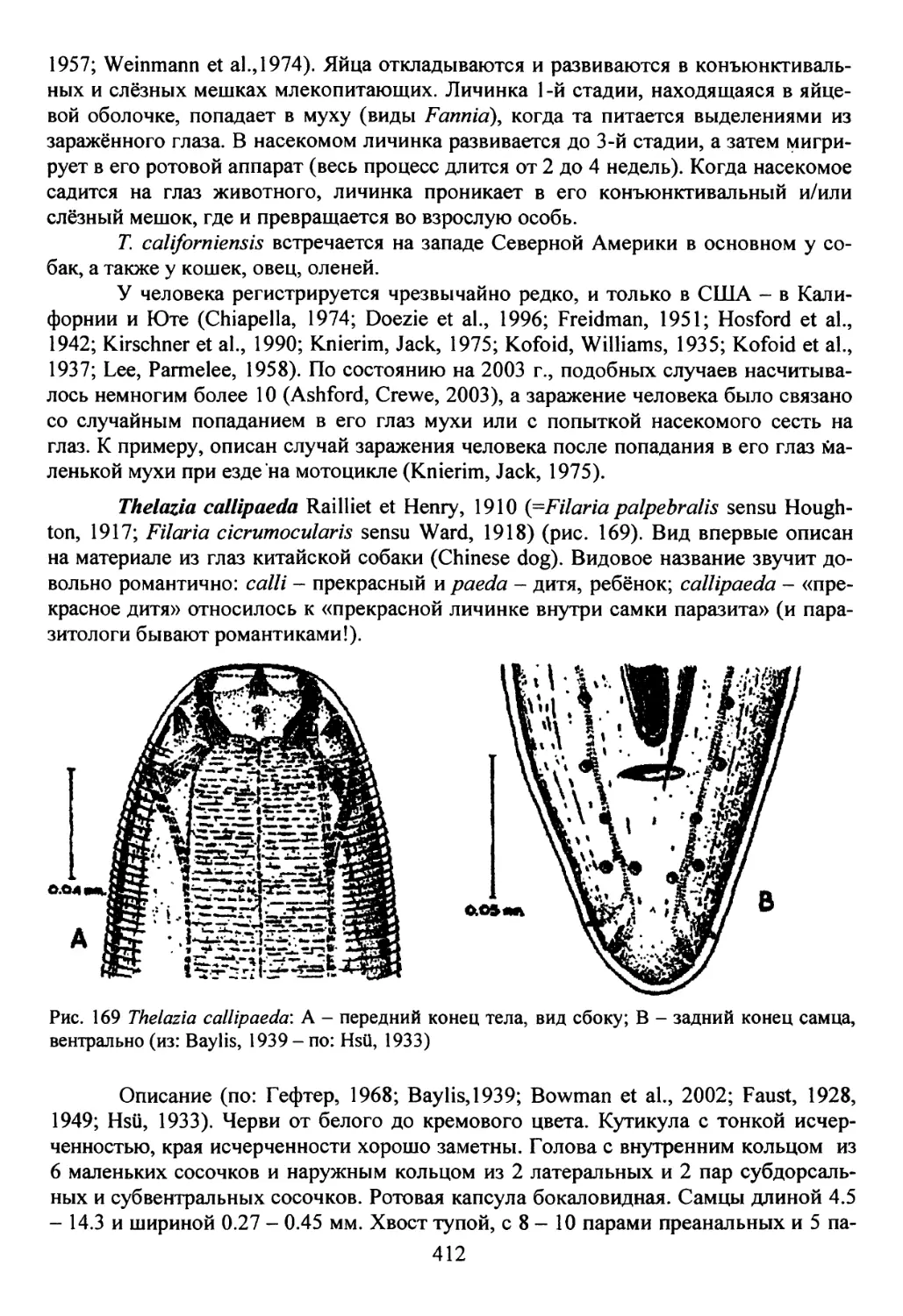
Семейство Thelaziidae Skrjabin, 1915 ............................411
Род Thelazia Bose, 1819.......................................411
Семейство Trichuridae Ransom, 1911...............................416
Род Trichuris Roederer, 1761...................................416
Глава 4, или НИЧЕГО, КРОМЕ СТАТИСТИКИ..........................................421
Приложение 1 СЛОВАРЬ НЕОБХОДИМЫХ ТЕРМИНОВ И ПОНЯТИЙ....................................425
Приложение 2 ПЕРЕЧЕНЬ ПАРАЗИТОВ И ВЫЗЫВАЕМЫХ ИМИ ЗАБОЛЕВАНИЙ........................................433
Научные (латинские) названия...................................433
Русские названия...............................................441
5
В, Шорохов
Сам по себе муравей - существо мудрое, но саду он - враг.
Фрэнсис Бэкон Francis Bacon (1561 - 1626). английский философ, историк, политик, основоположник эмпиризма
Всякая вещь в природе является либо причиной, направленной на нас, либо следствием, идущим от нас.
Марсилио Фичино
Marsilio Ficino (1433 - 1499) итальянский гуманист, философ и астролог, основатель и глава Флорентийской Платоновской академии
Введение, или
ОПЯТЬ ПАРАЗИТЫ??!
В 2015 г. вышел в свет первый том монографии «Мир паразитов человека», посвящённый одной из групп паразитических червей - трематодам, чьё попадание к человеку связано с пищей и чьё паразитирование вызывает у того заболевания различной степени тяжести (Гаевская, 2015). Таковых к настоящему времени в мире насчитывается 129 видов из 57 родов, относящихся к 25 семействам. Учитывая способ заражения человека подобными трематодами, вызываемые ими заболевания получили название трематодозов пищевого происхождения.
Однако список гельминтов, попадающих к человеку с пищей и могущих представлять - и представляющих - реальную угрозу его здоровью далеко не исчерпывается одними трематодами. Не менее распространёнными у Homo sapiens и не менее, а иногда и более опасными являются представители другой группы паразитических червей - нематоды, или круглые черви. Именно этим гельминтам и посвящён второй том названной монографии.
Мир нематод огромен и разнообразен. По мнению специалистов, к тем десяткам тысяч свободноживущих и паразитических видов, которые описаны к настоящему времени, своего открытия ожидают ещё сотни тысяч новых видов. Паразитические нематоды в половозрелом состоянии поселяются у самых разных позвоночных животных, включая человека, а на стадии личинки многие из них используют в качестве промежуточных или резервуарных хозяев многочисленные виды беспозвоночных и даже позвоночных животных, включая рыб, амфибий, рептилий и млекопитающих. Эта группа нематод, реализующих свой жизненный цикл через промежуточных и дополнительных/паратенических хозяев, и составляет основу нематодо-
7
зов пищевого происхождения: заражение ими человека происходит непосредственно через пищевые продукты. Помимо того, имеется обширная группа нематод -паразитов растений, чьих личинок также иногда находят у человека. Часть паразитических нематод развивается без участия промежуточных хозяев, а их яйца и/или личинки развиваются во внешней среде, попадая к человеку с немытой зеленью, овощами, загрязнённой питьевой водой, почвой или же через грязные руки. Строго говоря, в таких случаях нет пищевого пути заражения в обычном понимании: человек может не есть немытую зелень, не пить воду из подозрительного источника, но всё равно рискует заразиться опасными нематодами, поскольку «забывает» о необходимости соблюдения элементарных правил личной гигиены. В природе существуют также нематоды, чьи личинки попадают к человеку через кровососущих насекомых - их промежуточных хозяев. И, наконец, есть виды, чьи личинки, помимо пассивного попадания к человеку, способны активно нападать на него. В целом же разделить всех нематод, регистрируемых у человека, на тех, что попадают к нему только с едой, и тех, заражение которыми происходит с водой, немытой зеленью (ведь это - тоже еда!) или грязными руками, довольно трудно. К тому же, в одном и том же семействе могут быть виды, одни из которых попадают в организм человека с пищевыми продуктами, а другие - с почвой, грязными руками, контаминированной зеленью.
В процессе работы над данной монографией удалось собрать сведения о 137 вилах нематод из 66 родов, чьё попадание к человеку прямо или косвенно связано с особенностями его питания. Все эти виды подробно описаны в главах 2 и 3. И всё же установить точное количество видов нематод, потенциально патогенных для человека и полезных животных, довольно трудно. В мире регулярно описываются новые таксоны этих гельминтов, и нет никакой гарантии того, что среди них не окажутся потенциально патогенные виды.
Несмотря на довольно солидную цифру (почти 140 видов!), многие виды нематод встречаются у человека редко или же очень локально, некоторые относительно безвредны для его здоровья и не имеют серьёзной социально-экономической значимости. Только немногие из паразитирующих у людей нематод характеризуются обширным распространением по планете и могут вызывать патологические изменения в организме человека или серьёзные заболевания, и даже - в редких случаях -смерть. В тексте подробно описаны все виды - и редко встречающиеся, и обычные для людей, с характеристикой тех изменений, к которым приводит их поселение в организме человека.
Вместе с тем, отсутствие информации об обнаружении у человека того или иного вида нематод из числа потенциально патогенных для него вовсе не означает отсутствие инвазии им как таковой в природе. Именно по этой причине многие специалисты считают, что в ряде случаев потенциально опасными для человека могут быть все представители того или иного рода, несмотря на факт регистрации у человека только одного или нескольких из них.
Встречающиеся у человека нематоды в своём подавляющем большинстве являются паразитами важных в хозяйственном и промысловом отношении млекопитающих и птиц - их окончательных хозяев. По этой причине вызываемые нематодами болезни имеют и ветеринарное и экономическое значение, а заболевания домашних пи
8
томцев (кошек, собак) придаёт им ещё и социальную значимость. От животных к человеку может быть передано множество контактных болезней. В настоящее время известно около 300 болезней, общих для человека и животных, примерно третья часть из них попадает к человеку с пищей - растительной, животной или с водой. Близкая связь между людьми и животными приводит к серьёзному риску для здоровья человека.
Во всём мире вопросам диагностики, патогенности, профилактики, терапии и распространения нематодозов человека уделяется огромное внимание. Им посвящены десятки, если не сотни монографий, общие, региональные и таксономические обзоры, многочисленные диссертационные исследования, не говоря уже о тысячах статей, многие из которых относятся к числу редких, труднодоступных.
В то же время в русскоязычной литературе нет ни одной обобщающей работы, в которой были бы сведены воедино данные обо всех нематодах, чьё попадание к человеку прямо или опосредованно связано с его питанием. Наиболее весомый аргумент в пользу необходимости написания подобной сводки - это тот факт, что в современных условиях широкомасштабного миграционного перемещения населения, активных туристических и зарубежных деловых поездок, интенсивного обмена продуктами питания, быстрой доставки любого продукта из любого региона мира, при отсутствии соответствующей информации никто не может быть гарантирован от возможности заражения тем или иным видом нематод из числа потенциально патогенных для него. Человек просто обязан знать, где и кого он может встретить и как избежать риска заражения патогенными гельминтами.
Итак. Данная монография посвящена нематодам, чьё попадание к человеку прямо или косвенно связано с его питанием.
В первой главе дана краткая характеристика типа нематод: описаны морфология, анатомия, особенности жизненных циклов нематод, их распространение в природе, сделаны ссылки на соответствующие таксономические сводки, которые использованы в процессе работы над монографией.
Вторая и третья главы содержат описания всех нематод, попадающих к человеку с недостаточно обработанными или сырыми пищевыми продуктами, загрязнёнными овощами, ягодами, зеленью, с питьевой водой, и когда-либо обнаруженных у него. Первоначально приведена характеристика семейства, к которому принадлежат роды нематод, чьи представители зарегистрированы у человека, затем дана характеристика рода и входящих в него видов. Приведены самые необходимые сведения о систематическом положении, морфологии, биологии, жизненном цикле, круге хозяев - промежуточных, дополнительных, окончательных, географическом распространении видов - возбудителей нематодозов человека, информация о случаях заражения людей, патогенезе, эпидемиологии и профилактике вызываемых ими заболеваний. Текст сопровождается иллюстрациями, заимствованными из опубликованных источников, на которые сделаны обязательные ссылки в подписи к соответствующему рисунку. Всем авторам публикаций, чей иллюстративный материал сделал описание обнаруженных у человека нематод более наглядным и полноценным, выражаю искреннюю признательность. Характеристику каждого семейства, а в случае если тот представлен несколькими родами, то характеристику каждого рода завершает список использованной литературы. В отличие от первого то
9
ма, где невероятно объёмный список источников (более 1500) приведён в конце монографии, в данном томе выбран более рациональный способ её размещения, значительно облегчающий читателю работу с цитируемой литературой.
Для удобства изложения и восприятия материала семейства, роды внутри семейств, а также виды внутри родов расположены в тексте в алфавитном порядке. Исключение составляют типовые род или вид - если таковые имеются среди описываемых нами, - их описание предваряет остальные.
Четвёртая глава - своего рода заключение, в котором приведённые статистические данные наглядно демонстрируют и масштабы распространения на планете отдельных нематодозов человека, и опасность заражения людей нематодами, и причины и особенности распространения нематодозов в современном мире.
В конце книги помещены Словарь необходимых терминов и понятий (приложение 1) и Перечень названий паразитов и вызываемых ими заболеваний на латинском (757 наименований) и русском (161) языках (приложение 2).
При изложении материала использованы все доступные литературные источники по интересующей нас проблеме. При описании нематод учтены последние изменения в систематике того или иного таксона, о чём сделаны соответствующие ссылки. Однако в ряде случаев точки зрения разных авторов на систематическое положение того или иного вида (рода, семейства, отряда) не совпадают; по этой причине, дабы не навязывать собственного мнения, в тексте цитируются соответствующие публикации, отражающие мнение авторов по данному вопросу. Столкнувшись с тем, что в отдельных публикациях иногда встречаются разночтения в авторстве тех или иных таксонов нематод, когда у одного и того же вида (рода, семейства) указываются разные авторы или же разные годы, я сочла необходимым коротко остановиться и на этой проблеме.
Видовая принадлежность моллюсков, ракообразных, насекомых, рыб, птиц и животных, упоминаемых в тексте, приведена в соответствии с соответствующими современными справочными материалами, прежде всего, WoRMS (www.marine-species.org/aphia/php), FishBase.
В заключение считаю своим приятным долгом выразить самую сердечную признательность администрации ФГБУН «Институт морских биологических исследований им. А. О. Ковалевского РАН» (Севастополь) и лично директору института д. б. н. С. Б. Гулину за представленную возможность выполнить настоящую работу, зав. библиотекой института О. А. Андреевой, а также И. Д. Тромбицкому (Eco-TIRAS, Кишинёв, Молдова) за содействие в поисках некоторых труднодоступных публикаций.
10
Глава 1
КАКИЕ ОНИ, НЕМАТОДЫ?
Нематоды (Nematoda ) - огромный по количеству видов тип первичнополостных червей, живущих на дне морей, океанов и пресных водоёмов, приспособившихся к жизни в почве, участвующих практически во всех гнилостных процессах. В качестве паразитов нематоды поселяются во всех органах животных и растений. Тем не менее, несмотря на многообразие сред обитания, эти черви обладают единой организацией.
Тело нематод (рис. 1) цилиндрическое, удлинённое, нитевидное или веретеновидное, у некоторых форм мешковидное и даже шаровидное; у всех нематод на поперечном срезе тело всегда круглое (отсюда название - круглые черви). Тело нематод обычно лишено окраски, будучи прозрачным, или же с беловато-, коричневато-, желтовато-окрашенной кутикулой.
Рис. 1 Схема строения нематод: А -самка, Б - самец (из: Догель, 1981): 1 -ротовая полость; 2 - пищевод; 3 -ЪуиьЪусы пищевода; 4 - окологлоточное нервное кольцо; 5 - выделительная пора; 6 - средняя кишка; 7 - яичник; 8 - яйцевод; 9 - матка; 10 - яйцо в матке; 11 - женское половое отверстие; 12 -задняя кишка; 13 - анальное отверстие; 14 - семенник; 15 - семяпровод; 16 -семяизвергательный канал; 17- спикулы; 18 - бурсальные крылья; 19 - рёбра бурсы (органы осязания)
Длина тела от 0.8 мм до 20 - 40 см, у некоторых паразитических форм - до 1 и даже 8 м (паразит плаценты кашалота -Placentonema gigantissima). У большинства видов нематод вдоль тела проходят 4 продольные линии: 2 по бокам и 2 по середине спинной (дорсальной) и брюшной (вентральной) сторон. Брюшную сторону тела легко определить по положению на ней выделительного отверстия (недалеко позади рта или на уровне нервного кольца), ануса (возле заднего конца), а у самок ещё и полового отверстия (вульвы)
11
(обычно возле середины тела). Тело нематоды снаружи покрыто сложно устроенной, толстой (её толщина может достигать 20 % диаметра тела), эластичной, многослойной кутикулой - своеобразным наружным скелетом этих червей, создающим, совместно с полостным тургором, опору для соматической мускулатуры. Помимо того, кутикула выполняет защитную функцию, предохраняя червей от механических повреждений и ядовитых веществ.
Иногда кутикула гладкая, но обычно она имеет поперечную, иногда продольную, исчерченность, на ней могут располагаться шипы, крючья, кольца, валики, бугорки и другие образования.
Под кутикулой залегает гиподерма, - тонкий слой цилиндрического эпителия, а под ней - мускулатура, состоящая из одного слоя продольных волокон. Круговой мускулатуры нет, поэтому нематоды способны изгибаться только в спиннобрюшной плоскости. Под кожно-мускульным мешком находится довольно обширная полость тела. Особенности её развития, а также строения стенок указывают на то, что это - первичная полость тела, непосредственно граничащая с окружающими её органами. Полость заполнена перивисцеральной жидкостью и немногочисленными клетками мезенхимы - зародышевой соединительной ткани. Помимо отмеченной выше опорной функции, полость играет важную роль в обменных процессах: через неё от кишечника к мускулатуре и половой системе проходит транспорт усвоенных из пищи веществ.
Ротовое отверстие находится в центре на переднем конце тела и окружено особыми выступами, так называемыми губами (labia) (обычно их три - одна дорсальная и две латеральых), сосочками, чувствительными органами. Иногда губы могут отсутствовать. На губах и позади них по бокам головы расположены амфиды - органы химического чувства, образованные углублением покровов, к которым подходят нервы. Довольно часто губы несут зубчики, папиллы и т.п. У представителей некоторых родов между губами имеются конические выросты - интерлабии (interlabia), отходящие от основания губ и протянувшиеся между ними.
Пищеварительная система устроена довольно просто. Кишечник тянется через всё тело в виде прямой трубки. Его передний участок, так называемая глотка, делится на ротовую полость (стому) и собственно глотку, обычно называемую пищеводом. Иногда ротовая полость окружена ротовой капсулой с толстой кутикулой. У некоторых паразитических форм в ротовой полости могут располагаться кутикулярные выросты - зубчики. Пищевод с плотными мускулистыми стенками, в которых находятся пищеводные железы. Глотка переходит в среднюю кишку, а далее следует короткая задняя кишка (ректум), которая заканчивается анальным отверстием, расположенным вентрально возле задней оконечности или на ней. Паразитические нематоды питаются соками животного-хозяина, некоторые из них -кровью.
Центральная часть нервной системы образована окологлоточным кольцом, окружающим переднюю часть пищевода. От кольца вперёд и назад отходят продольные нервные стволы, связанные с гиподермой. Нервные окончания подходят к чувствительным сосочкам и папиллам.
Органы чувств у паразитических нематод развиты слабо. Обычно имеются органы осязания в виде папилл (осязательных бугорков), расположенных главным образом вокруг рта, а у самцов на заднем конце тела - ещё и половые (генитальные) папиллы.
12
Выделительная система нематод состоит из одноклеточных кожных (гипо-дермальных) желез. Обычно имеется одна шейная железа, связанная у большинства паразитических форм с двумя длинными симметричными экскреторными каналами, начинающимися в задней части тела и расположенными в боковых утолщениях гиподермы. Через боковые каналы удаляются вырабатываемые в теле жидкие продукты обмена. У переднего конца сосуды сливаются в экскреторный синус, открывающийся экскреторной порой. Положение экскреторной поры является важным признаком в систематике нематод.
Кровеносная и дыхательная системы у нематод отсутствуют. У свободно-живущих нематод и паразитов растений газообмен происходит через покровы тела. У паразитических нематод, живущих в кишечнике и некоторых других внутренних органах животных (например, в стенке желудка) в условиях постоянного дефицита кислорода, важную роль в их метаболизме играют процессы анаэробного расщепления гликогена - основного источника энергии для этих червей. Конечным продуктом обмена являются органические кислоты, в особенности масляная и валериановая, присутствие которых в полостной жидкости нематод обусловливает её едкость.
Нематоды, как правило, раздельнополы, и в большинстве своём обладают чётким половым диморфизмом. Самцы обычно мельче самок, у некоторых видов иногда в 10 - 15 раз. В целом половые органы имеют вид парных трубок, лежащих в полости тела и содержащих половые клетки на разных стадиях развития. У самок половые железы и протоки обычно парные, у самцов одна из трубок часто редуцирована. Передние тонкие части трубки у самки являются яичниками, в которых происходит овогенез. Яичник расширяется в яйцепроток, который открывается в матку. Обе маточные трубки сливаются в одинарную вагину, открывающуюся го-нопорой, или вульвой, на брюшной стороне тела. У самцов тонкая передняя часть трубки служит семенником, в котором происходит процесс сперматогенеза. Семенник переходит в семяпроток, мускулистая терминальная часть которого функционирует как семяизвергательный канал. В качестве вспомогательных органов у самцов имеются кутикулярные иглы, или спикулы, которые помещаются в особой совокупительной сумке, и рулёк. Спикул обычно две, разной формы; их форма и размеры имеют таксономическое значение.
Оплодотворение внутреннее, размножение исключительно половое. Большинство нематод яйцекладущие, но есть среди них и живородящие. Яйца разнообразной формы, одеты мощной оболочкой, у многих видов скульптурированной, и часто снабжены различного рода образованиями - волосками, пробочками, филаментами.
Эмбриональное развитие чаще всего проходит в матке, у некоторых форм -во внешней среде. Развитие личинок сопровождается линькой. Яйца или личинки выводятся наружу. Личинки внешне уже напоминают взрослую стадию, их рост и превращение сопровождается несколькими (четырьмя) линьками, при которых старая кутикула заменяется новой. Для дальнейшего развития личинки должны попасть в другую особь того же вида животного-хозяина. Однако имеется огромное число видов, у которых часть жизненного цикла проходит в организме промежуточного хозяина. Не попавшие в подходящего хозяина молодые стадии нематод погибают.
13
Большинство нематод попадает к своему хозяину алиментарным путём, т. е. с пищей и/или водой. Особенностью развития нематод является то, что многие виды в процессе развития совершают миграцию в организме хозяина и переходят из одного органа в другой.
До недавнего времени нематод рассматривали в ранге класса в составе типа нематгельминтов (Nemathelminthes) (Определитель, 1987; Moravec, 1994). В настоящее время все исследователи единодушны в признании за нематодами ранга типа Nematoda.
Автор одного из учебных пособий, С. П. Гапонов (2005), выделяет в типе нематод 3 класса: Adenophorea, Secementa (возможно, опечатка - Secementea), Ne-matomorpha. В таксономической сводке WoRMS1 тип Nematoda разделён на 4 класса (Adenophorea, Chromadorea, Enoplea, Secementea), к которым также причислена сборная группа Nematoda incertae sedis.
В одной из последних таксономических сводок тип Nematoda Cobb, 1932 разделён на 3 класса (Enoplea, Dorilaimea, Chromadorea), объединяющих суммарно 31 отряд, 267 семейств, 2829 родов и 74783 вида (Hodda, 2011). Из общего числа известных родов 7, каждый из которых представлен одним видом, найдены только в ископаемом состоянии. Несмотря на такую солидную цифру - 74783 вида, - некоторые исследователи считают, что на планете остались ещё не открытыми не менее полумиллиона видов этих червей.
Из общего числа паразитических видов нематод 50 являются паразитами человека (Puranik, Asha Bhate, 2007); в размещённой на сайте www.worms-info.ru информационной сводке «Медицинская гельминтология <...> у человека» таковых перечислено 145 видов. Паразитирующие у человека нематоды известны в разных отрядах. Одни нематоды попадают к человеку с пищей и/или водой, содержащей личинок этих гельминтов, другие - с загрязнёнными овощами, фруктами, немытыми руками, на которых случайно могли оказаться яйца или личинки паразитов, третьи (как, например, ришта) - только с водой, в которой находятся заражённые промежуточные хозяева паразита.
В монографии приведены описания всех видов нематод, зарегистрированных у человека, чьё попадание к. нему прямо или косвенно связано с пищей, а последствия заражения ими зачастую носят весьма пагубный характер.
Цитируемая литература
Гапонов С. П. Паразитические черви (введение в гельминтологию). - Воронеж: Воронежск. гос. унив-т, 2005. - 205 с.
Догель В. А. Зоология беспозвоночных: Учебник для ун-тов / Под ред. проф. Полянского Ю. И. - 7-е изд., перераб. и доп. - М.: Высш, школа, 1981.-606 с.
Определитель паразитов пресноводных рыб. Т. 3. Паразитические многоклеточные. - Л.: Наука, 1987. - 583 с. - (Определители по фауне СССР, изд. Зоол. ин-том АН СССР; Вып. 149).
Hodda М. Animal biodiversity И Zootaxa. - 2011. -No 3148. - Р. 63 - 95.
Moravec F. Parasitic nematodes of freshwater fishes of Europe. - Kluwer Acad. Publ., 1994. - 473 pp.
Puranik P., Asha Bhate. Animal forms and functions: Invertebrata. - New Dehli, India: Surup & Sons, 2007.
-P.217.
1 WoRMS - World Register of Marine Species: at http://www.marinespecies.org/aphia.php7p =taxdetails&id=799. on 2016-01-10.
14
Гл а в a 2
НЕМАТОДЫ - НЕЗНАКОМЫЕ ЗНАКОМЦЫ
Нематоды - одни из наиболее распространённых паразитов на планете, вызывающие у поражённых ими животных и растений заболевания - нематодозы. Ниже приведены описания тех нематод, которые могут попасть к человеку алиментарным путём. Для удобства восприятия материала все семейства нематод расположены в алфавитном порядке. И начнём с семейства ангиостронгилид - Angiostrongylidae.
Семейство Angiostrongylidae (Bohm et Gebauer, 1934)
Семейство включают в класс Chromadorea в составе отряда Rhabditida (Hodda, 2011) или Strongylida (Mendonca et al., 2008).
Нематоды с длинным узким нитевидным телом. Передний конец тела округлый. Кутикула с поперечной исчерченностью. Хвостовой конец самца заканчивается копулятивной бурсой с поддерживающими рёбрами, положение, количество и морфологические особенности которых являются важными таксономическими признаками в определении родов. Вульва на заднем конце тела. Паразиты млекопитающих. Типовой род - Angiostrongylus Kamensky, 19051.
Структура и состав семейства Angiostrongylidae, его место в системе нематод всё ещё окончательно не определены, хотя почти 40 лет назад Р. Андерсон (Anderson R., 1978) и выражал надежду, что со временем ситуация должна проясниться (Cowie, 2013). Более того, некоторые исследователи рассматривают эту группу в ранге подсемейства Angios-trongylinae в семействе Metastrongylidae. В равной степени отсутствует однозначная оценка количества родов и видов, объединяемых в Angiostrongylidae. По одним данным (Hodda, 2011), в нём 3 рода с 17 видами, по другим (Robles et ak, 2016; Spratt, 2015), один только род Angiostrongylus объединяет 21 вид. Вместе с тем, представители данного семейства, в частности рода Angiostrongylus, имеют медицинское и ветеринарное значение, вызывая серьёзные заболевания у человека и полезных животных.
Род Angiostrongylus Kamensky 1905
Синонимы (по: Spratt, 2015):
Haemostrongylus Railliet et Henry, 1907
Angiocaulus Schultz, 1951
Описание (по разным авторам). Нематоды с нитевидным телом, сужающимся к обоим концам. Головной конец закруглён. Кутикула гладкая, с поперечной исчерченностью. Ротовое отверстие простое. Губы и ротовая капсула отсутствуют. Экскреторная пора близ или на уровне соединения пищевода с кишечником. Примечательной особенностью самок данного рода является положение трубчатых маточных протоков, которые молочно-белыми нитями спирально оборачиваются вокруг
1 В некоторых источниках (ADW. Animaldiversity.org/accounts /Angiostrongylus_ cantonen-sis/classification/.) род Angiostrongylus включён в состав семейства Metastrongylidae, в работе Н. П. Шихобаловой (1968) - в семейство Filaroididae Schulz, 1951.
15
заполненного кровью кишечника, как усик вокруг столбика («barber’s pole»). Паразиты млекопитающих. Типовой вид - Angiostrongylus vasorum (Baillet, 1866) Kamensky, 1905.
В 1946 г. в синонимы рода Angiostrongylus были сведены Haemostrongylus Raillet et Henry, 1907, Parastrongylus Bayle, 1928, Rodentocaulus Shul’tz, Orlov et Kutas, 1933, Pulmonema Chen, 1935 и Cardionema Yamaguti, 1941 (Dougherty, 1946). В 1970 г. на основании морфологии латеральных рёбер бурсы виды рода Angiostrongylus разделили на два подрода - Angiostrongylus и Parastrongylus (Drozdz, 1970). В 1986 г. род Angiostrongylus разделили на пять родов (Ubelaker, 1986), а входящие в него виды были распределены по новым родам на основании морфологии рёбер копулятивной бурсы и приуроченности к определённой группе хозяев. В частности, род Angiostrongylus остался для видов, паразитирующих в хищниках, а виды из грызунов семейства Muridae оказались в роде Parastrongylus. Однако подобное действо не получило всеобщего признания, и подавляющее большинство авторов по-прежнему описывают виды из грызунов в составе рода Angiostrongylus.
В публикациях последних лет можно встретить разные данные о количестве видов, входящих в род Angiostrongylus'. 14 (Romero-Alegria et al., 2014), 15 (Eamsob-hana et al., 2010), 18 (Maldonado et al., 2012), около 20 (Cowie, 2013), 20 (Bhaibulaya, 1991; Cross, 2004), 21 (Robleset al., 2016; Spratt, 2015). Из 21 вида 15 паразитируют в грызунах, а 6 - в плотоядных животных. Судя по оригинальным описаниям, 13 видов имеют ограниченное распространение, а восемь, и в их числе A. cantonensis (Chen, 1935) и A. costaricensis Morera et Cespedes, 1971, обладают обширным ареалом, который, к тому же, расширяется (Kim et al., 2002; Spratt, 2015).
Среди грызунов, отмеченных в качестве хозяев Angiostrongylus, - многочисленные представители семейств Cricetidae, Echimyidae, Gliridae, Heteromyidae, Muridae, Sciuridae, а среди плотоядных - Canidae, Felinidae. У разных представителей рода от 1 до 19 видов хозяев. За исключением A. costaricensis и A. siamensis Ohbayashi, Kamiya et Bhaibulaya, 1979, поселяющихся в мезентериальных артериях кишечника, все остальные виды живут в лёгочных артериях и правом желудочке сердца своих хозяев.
У человека достоверно зарегистрировано паразитирование двух видов Angiostrongylus — A. cantonensis и A. costaricensis. Помимо того, к потенциально патогенным видам относят A. mackerrasae Bhaibulaya, 1968, A. malaysiensis Bhaibulay et Cross, 1971 и A. siamensis (Bhaibulaya, 1991), хотя факты, подтверждающие подобное предположение, пока отсутствуют (Spratt, 2015). В некоторых публикациях среди опасных для человека видов упоминают A. vasorum.
Angiostrongylus cantonensis (=Pulmonema cantonensis Chen, 1935; =Haemostrongylus ratti Yokogawa, 1937) (рис. 2, 3). Впервые вид описан на материале из лёгочных артерий и сердца домашних крыс из Кантона (Китай) под названием Pulmonema cantonensis (Chen Н., 1935). Видовое название нематоды связано с районом её первого обнаружения: Canton - Кантон (нынешний Гуанчжоу, крупнейший торгово-промышленный город и морской порт Южного Китая).
В 1937 г. появились две статьи с описанием Haemostrongylus ratti Yokogawa, 1937 из крыс на Тайване (Matsumoto,1937; Yokogawa, 1937). В настоящее время и Pulmonema cantonensis и H.ratti - синонимы A. cantonensis (Dougherty, 1946).
В русскоязычной литературе A. cantonensis называют крысиным лёгочным червем, в англоязычной - rat lungworm.
16
Рис. 3 Схематичное изображение Angiostrongylus cantonensis'. слева - самка, справа - самец (oesophagus - пищевод, ovaries - яичники, testis - семенники) (из: Capinera, Walden, 2013 - по: Mackerras, Sandars, 1955).
Рис. 2 Angiostrongylus cantonensis (слева -направо: передний конец самки, лате-рально; хвостовая бурса самца, вентрально; задний конец тела самки, лате-рально) (из: Maldonado et al., 2012)
esophagus
Описание (по: Bhaibulaya, 1991; с допдл-нениями других авторов, в том числе: Cowie, 2013; Maldonado et al., 2012; Thiengo et al., 2010). ®*’rte Нематоды с нитевидным, прозрачным при жизни телом, сужающимся к обоим концам. Головной конец закруглён. На дорсальной поверхности латерально близ уровня соединения пищевода с кишечником расположены цервикальные железы. Ротовое отверстие окружено 6 папиллами (2 дорсальными, 2 латеральными и 2
вентральными) и двумя латеральными амфидами. Рот открывается прямо в пищевод, имеющий длину 0.29 - 0.35 мм. Перед соединением с кишечником пищевод расширяется. Кишечник широкий, тонкостенный. Экскреторная пора несколько позади уровня соединения пищевода с кишечником. Нервное кольцо находится впереди середины длины пищевода. Длина тела самцов 12-27, толщина 0.2 - 0.42 мм. Бурса небольшая, хорошо развитая, почкообразная, слегка асимметричная, с характерными рёбрами. Вентральное ребро делится в точке примерно двух третей его длины на маленькое вентровентральное и крупное латеровентральное рёбра, не доходящие до края бурсы. Дорсальное ребро выглядит как короткий стержень, разделяющийся на три ветви, с пальцеобразными наружнодорсальными рёбрами, разделёнными у основания. Латеральные рёбра отходят от общего ствола. Антеролатеральное ребро толще остальных и выступает подобно большому пальцу. Медио- и постеролатеральные рёбра отходят от общего ствола; медиолатеральное ребро всегда крупнее постеролатерального. Между дорсальным и вентральным рёбрами возникает наружнодорсальное ребро. Спикулы длинные, узкие, с хорошо выраженной исчер-
ценностью, почти равные, длиной 1.0 - 1.46 мм. Губернакулюм заметный, загнутый. Самки длиной 15 - 34 и шириной 0.24 - 0.56 мм. Хвост округлый. Вагина длинная, тонкостенная, 1.50 - 3.25 мм. Вульва в виде поперечной щели, в 0.25 мм от заднего конца тела. Яйца удлинённо-овальные, с тонкой гиалиновой оболочкой. Размеры яиц 68 - 74 х 46 - 48 цт, при откладке не содержат эмбрион. Самка откладывает за сутки до 15 тыс. яиц.
A. cantonensis имеет сложный жизненный цикл и включает промежуточного и окончательного хозяев (Alicata, 1964; Bhaibulaya, 1991; Mackerras, Sandars, 1955;
Рис. 4 Схема жизненного цикла Angiostrongylus cantonensis
Взрослые особи живут в лёгочных артериях и правом желудочке сердца млекопитающих. После копуляции, происходящей в лёгочной артерии хозяина, самки откладывают яйца, в которых развиваются личинки 1-й стадии; их длина достигает 0.25 - 0.3, ширина 0.014 - 0.018 мм. Личинки проникают в альвеолы, откуда мигрируют в трахею, где заглатываются и попадают в пищеварительный тракт, а затем с фекалиями выносятся во внешнюю среду. Улитки, слизни, поедая фекалии, заглатывают и личинок, которые проникают в их мышечную ткань, где через 7-9 дней после заражения претерпевают первую линьку. Предполагают, что личинки могут активно проникать в ногу моллюска (Spratt, 2015). Вторая линька происходит через 12-16 дней после заражения или через 5-7 дней после первой линьки. Личинки 3-й стадии находятся в чехлике личинки 2-й стадии и располагаются в мышечной ткани промежуточного хозяина, свернувшись кольцом (Bhaibulaya, 1991). Личинки 3-й стадии с рабдитоидным пищеводом, достигают в длину 0.42 - 0.52 и
онности.
ширину 0.02 - 0.03 мм; хвост с характерным сжатием перед сужением к тупому концу, без поперечной исчерченности (рис. 5). Личинки могут оставаться в организме промежуточного хозяина довольно длительное время, не теряя своей инвази-
Рис. 5 Angiostrongylus cantonensis, инвазионная личинка 3-й стадии из слизня (из: http://www.cdc.gov/dpdx/angio stron-gyliasis/gallery.html#acantonLarva)
Попав в желудок дефинитивного хозяина, личинки быстро спускаются в кишечник, где через стенку тонкого кишечника проникают в кровь и через венозную систему достигают лёгких и почек, откуда распределяются по различным органам.
Большинство личинок мигрирует в мозг, некоторые из них оказываются в нём в течение 24 ч. Через 4-6 дней после попадания в организм животного личинка 4-й стадии, чья длина составляет 0.85 - 1.0 мм, покидает кутикулу личинки 3-й стадии и мигрирует в субарахноидальное пространство для дальнейшего развития. Четвёртая линька в субарахноидальном пространстве происходит через 7-9 дней после попадания в организм животного. Молодые особи покидают чехлик личинки 4-й стадии и мигрируют в лёгочные артерии через венозные синусы мозга. Большинство молодых червей достигает лёгочных артерий на 26 - 35-й день после заражения. Весь период развития до откладки яиц занимает от 42 до 45 дней.
Промежуточный хозяин A. cantonensis - многочисленные виды садовых слизней и наземных моллюсков. Например, в Новой Каледонии заражённость слизней семейства вероницеллид-Vaginulus plebeius и Laevicaulus alte - колебалась от 4 до 50 % (обычно в пределах 10 - 17 %) первого из них и от 19 до 100 % (обычно 27 - 37 %) - второго; чёрный слизень Deroceras laeve был заражён на 5 % (Ash, 1976). Впечатляет то количество личинок, которое можно было обнаружить у этих слизней: до 14600 экз. - у V. plebeius и 8600 экз. - у L. alte. Исследованный в этих же садах лёгочный моллюск Bradybaena similaris оказался заражён всего на 3.1 %.
На Филиппинах личинки данного вида нематод зарегистрированы у 100 % Achatinafulica и Veronicella sp., 50 % Pila luzonica (Velasquez, 1972).
К слову, Achatina fulica, или африканская гигантская наземная улитка, аха-тина гигантская, широко распространена в странах с тропическим климатом и может являться одной из основных причин расселения A. cantonensis по странам и континентам (Alicata, 1990; Duffy et al., 2004), поскольку является важным объектом экспорта-импорта. Этот моллюск во многих регионах мира считается деликатесом и его обычно едят в сыром виде. В Европе, в том числе и в России, где выживаемость ахатины в естественных условиях невозможна, её часто содержат в качестве домашних животных. Если учесть то количество личинок, которое может содержаться только в одной особи этого моллюска (а это тысячи личинок 3-й стадии), то нетрудно представить, как легко паразит попадает в новые регионы.
Дефинитивные хозяева A. cantonensis - наземные млекопитающие, принадлежащие к разным отрядам, всего 24 вида. Наиболее обычны среди них- крысы, 19
чаще всего рода Rattus, и, прежде всего, серая, чёрная, малая, полевая, а также Bandicota. Заражённость отдельных видов крыс на Филиппинах достигает 3 - 10 % (Cross, 1982; Eduardo, 1991, 2001), а в одном из районов на о. Лейте (Восточные Филиппины) Rattus rattus mindanensis оказался заражён этим гельминтом почти на 29 % (Eduardo, 2001).
В жизненный цикл A. cantonensis, помимо промежуточного и окончательного хозяев, вклиниваются паратенические, среди которых могут быть как беспозвоночные, так и позвоночные животные. И хотя личинки в них не развиваются, однако роль таких хозяев в жизненном цикле паразита велика, поскольку они способствуют его широкому расселению во времени и пространстве. Паратенические хозяева A. cantonensis - наземные планарии и крабы, пресноводные креветки, например, Macrobrachium spp., головастики, лягушки и ящерицы, в том числе варан. Так, в Новой Каледонии заражённость наземной планарии Kontikia forsterorum (=Geoplana forsterorum) личинками A. cantonensis достигала 30 - 60 % (Ash, 1976). Этих личинок отмечают даже у морских рыб (Wallace, Rosen, 1967), что вызывает у ряда исследователей определённые сомнения, учитывая чувствительность нематод к солёности (Janovy, Roberts, 2000; Prociv et al., 2000).
Вполне реально включение в круг паратенических хозяев и домашней птицы, например, цыплят, а также свиней и крупного рогатого скота, что подтвердили результаты их экспериментального заражения (Alicata, 1964). У подопытных животных через 2 недели после заражения личинки ангиостронгила локализовались в стенке желудка, печени, лёгких и селезёнке, однако мышечная ткань была свободна от них. Через 5 недель обнаруженные в свинье личинки оказались инкапсулированными и погибшими.
И, наконец, паразит может выживать в таких случайных хозяевах, как лошади, собаки, обезьяны и другие животные, а также человек. В частности, описаны случаи менингоэнцефалита у обезьян в зоопарке, вызванного личинками A. cantonensis, которые попали к приматам в результате их контакта с заражёнными улитками (Anderson et al., 1990).
В организме человека личинки могут развиваться до молодой взрослой стадии, но не до половозрелого состояния; известно всего несколько случаев, когда нематоды проникали в лёгкие и откладывали яйца (Cross, 1987; Punyagupta, 1979).
Первый клинический случай заражения человека датируется 1944-м годом (Nomura, Lin, 1945). Тогда в Тайваньском госпитале от эозинофильного менингоэнцефалита скончался 15-летний мальчик. При аутопсии в его спинномозговой жидкости обнаружились метастронгилоидные нематоды, которых авторы определили как Haemostrongylus ratti. Сообщение об этом случае было опубликовано в тайваньском медицинском журнале на японском языке. Но! шёл 1945 год, ещё не закончилась Вторая мировая война, и данная статья, естественно, осталась неизвестной широкой научной общественности. Ознакомиться с ней смогли только в 1964 г., когда она была переведена на английский язык, и Н ratti свели в синоним к A. cantonensis (Beaver, Rosen, 1964).
В 1961 г. крысиный лёгочный червь был выявлен на Гавайях при аутопсии филиппинца, скончавшегося от менингоэнцефалита (см.: Alicata, 1964). К слову, А. cantonensis - единственный вид рода, встречающийся на Филиппинах, и к 2001-му году здесь было зарегистрировано всего 10 случаев заражения им человека, и ни один из них не имел фатального исхода (Eduardo, 2001).
20
В том же, 1961-м, году появилось сообщение о вспышке ангиостронгилиа-зиса на Таити (Rosen et al., 1961).
К 1967 г. в Новой Каледонии зарегистрировали 243 случая заражения людей A. cantonensis (Rosen et al., 1967), а в Таиланде зафиксирован смертельный случай, связанный с инвазией личинками этой нематоды (Tangchai et al., 1967).
В 1971 г. заражение человека впервые выявлено в Австралии (Gutteridge, 1971), хотя, скорее всего, оно было известно в Брисбене ещё в 1959 г. (Heaton, Gutteridge, 1980).
В 1981 г. описана вспышка ангиостронгилиазиса на Новых Гебридах с двумя летальными исходами (Bowden, 1981), и в том же году A. cantonensis впервые обнаружили у человека, моллюсков и крыс на Кубе (Aguiar et al., 1981; Pascual et al., 1981). Это была первая находка данного вида в Западном полушарии.
В 1982 г. сообщается о наблюдавшемся в 1981 г. эозинофильном менингите, вызванном ангиостронгилом, у 21 из 24 корейских рыбаков, работавших на Самоа (Kliks et al., 1982). Источником заражения стал моллюск - упомянутая выше ахати-на гигантская.
В 1984 г. описано первое заражение человека в Китае (Не et al., 1984), и до 1994 г. в стране было зафиксировано всего 4 аналогичных случая. Однако между 1994 и 2006 гг. таковых было уже более 300 (Не et al., 2009). В 2003 и 2005 гг*? наблюдалась вспышка заболевания в Куньмине, центральном городе провинции Юнань (Zhou et al., 2009), в 2006-м - в Пекине (пострадал 141 человек) (Wang J. et al., 2008), в 2008 г. - на юго-западе Китая (33 случая). В 2011 г. появляются сразу два сообщения о вспышке ангиостронгилиазиса в разных регионах страны (Chen F. et al., 2011; Deng et al., 2011). Проблема заражения людей A. cantonensis в Китае приобретает общенациональный характер.
В 2001 г. сообщается о вспышках ангиостронгилиазиса на Тайване (сами случаи имели место в 1998 и 1999 гг.) (Tsai et al., 2001), в 2002 г. - на Ямайке (Lindo et al., 2002), в 2004-м - в Японии на о. Окинава (Asato et al., 2004), в 2010-м - в Эквадоре (Dorta-Contreras et al., 2010). Между 2001 и 2005 гг. на Гавайях зафиксировано 24 случая эозинофильного менингита (Hochberg et al., 2007).
Помимо сообщений о вспышках заболевания, в многочисленных публикациях описываются находки этой нематоды у людей в разных регионах мира, к примеру, в США в Новом Орлеане (New et al., 1995), в Египте (Brown et al., 1996), в Австралии в Сиднее (Senanayake et al., 2003), в Бразилии в штате Мунас Гераис (Thiengo et al., 2010) и т.д. В целом к настоящему времени документально подтверждены тысячи случаев заражения человека A. cantonensis (Wei, Wu, 2013). При этом 75 % всех случаев приходится на Китай и Таиланд (Ewers, Anisowicz, 2014).
Попавшие в организм человека личинки проникают в головной и спинной мозг, иногда в глаза. Большинство личинок, попавших в ЦНС, не способны вернуться в кровеносное русло и погибают. Тем не менее, их наличие, передвижение внутри ткани мозга или глаза и гибель, а также провоцируемый ими иммунный ответ вызывают у человека болезненное состояние. В зависимости от локализации личинок и клинических симптомов различают три основных проявления заражения: эозинофильный менингит, эозинофильный энцефалит и глазной ангиостронги-лиазис (Не et al., 2009), а само заболевание, вызываемое A. cantonensis, именуют angiostrongyliasis cantonensis (Chen F. et al., 2011), neuroangiostrongyliasis (Alicata, 1988), Angiostrongylus eosinophilic meningitis (AFM) (Murphy, Johnson, 2013), но
21
чаще всего - angiostrongyliasis (ангиостронгилиазис) или же angiostrongylosis (ан-гиостронгилозис).
Инкубационный период варьирует от 1 до 30 - 40 дней, и во многом зависит от количества паразитов, попавших в организм, и от состояния иммунной системы.
При проникновении в глаз червь чаще всего локализуется в его передней камере, где очень активно перемещается. У больных могут наблюдаться головная боль, покраснение глаза, слезотечение, помутнение и изъязвление роговицы, отёк ретины, гиперестезия (повышенная чувствительностью роговицы глаза), светобоязнь, расстройство зрения, паралич глазной мышцы и даже слепота (Cross, 1987; Diao et al., 2011; Feng et al., 2013; Ihalamulla et al., 2007; Malhotra et al., 2006; Mattis et al., 2009; Sinawat et al., 2008; Thu et al., 2002). Нематоды обычно легко удаляются хирургическим путём, после чего зрение, как правило, восстанавливается. Для обездвижения червя рекомендуется использовать лидокаин (Mehta et al., 2006). В цитируемых источниках их авторы приводят длину личинок, извлечённых из глаза, -от 10 до 20 мм.
Миграция личинок в ЦНС обычно сопровождается сильной или умеренной головной болью, миалгией (спонтанная или вызванная пальпацией боль в мышцах), лихорадкой (температура варьирует от нормальной до 40°С), тошнотой, рвотой, радикулитом, негнущейся шеей, утомляемостью, слабостью, сыпью на коже (Deng et al., 2011; Kliks, Palumbo, 1992; Murphy, Johnson, 2013; Slom et al., 2002). Радикулит или миелит могут спровоцировать парапарез или недержание мочи. В спинномозговой жидкости содержатся лейкоциты, главным образом эозинофилы, иногда в ней обнаруживаются молодые взрослые черви (Cross, 1987). Периферийная эозинофилия варьирует от 5 до 63 %, эозинофилия спинномозговой жидкости - от 26 до 75 % (Bhaibulaya, 1991; Punyagupta, 1979; Punyagupta et al., 1975). Чаще всего симптомы заболевания проявляются в течение 2 недель и могут растягиваться на недели и месяцы (Eamsobhana, Yong, 2009).
Поражение ЦНС может привести к эозинофильному менингиту или менингоэнцефалиту, параличу. Подобное состояние часто называют тропическим эозинофильным менингитом (tropical eosinophilic meningitis) (Eduardo, 2001). При сильном поражении возможен летальный исход (Bowden, 1981; Li et al., 2001; Lindo et al., 2004; Morton et al., 2013; Nomura, Lin, 1945; Sawanyavisuth et al., 2009; Tangchai et al., 1967 и др.). Подобные случаи очень редки, но всё же отмечаются в самых разных странах мира. Так, в Австралии скончался 11-месячный малыш, который был доставлен с Фиджи в связи с развитием у него вялого квадрипареза (неполное нарушение функций рук, туловища, ног, тазовых функций, возникшее в результате повреждения сегментов спинного мозга на шейном уровне). При вскрытии у ребёнка были выявлены личинки A. cantonensis (Cooke-Yarborough et al., 1999). На Ямайке описан случай гибели от заражения ангиостргонгилами 14-месячного мальчика; при аутопсии в его мозге и лёгких обнаружились многочисленные личинки нематоды (Lindo et al., 2004). По данным цитируемых авторов, данный смертельный случай, вызванный заражением A. cantonensis, был первым в Западном полушарии. В Сиднее из двух детишек, у которых был диагностирован геморрагический менингоэнцефалит, один скончался (Morton et al., 2013). Полагаю, что для иллюстрации возможной опасности заражения ангилостронгилами приведённых примеров вполне достаточно. И всё же статистика свидетельствует, что смертность не превышает 2 - 3 % (Eamsobhana, Yong, 2009).
22
Следует иметь в виду, что эозинофильный менингит могут вызывать личинки не только A. cantonensis, но и других нематод, проникших в ЦНС, в том числе Baylisascaris, Toxocara, Gnathostoma, - о них мы поговорим ниже, - а также некоторые виды трематод, цестод, вирусы, бактерии или же грибы. Похожие симптомы могут быть выражены также при рассеянном склерозе, злокачественных опухолях, например, острой лейкемии, глиобластоме, и даже при реакции организма на некоторые лекарственные препараты и вентрикулоперитонеальное шунтирование (Panackel et al., 2006). В результате из-за сходства симптоматики возможна постановка неверного диагноза.
Исследователи как-то проанализировали три летальных случая, вызванных, как потом выяснилось, A. cantonensis (Li et al., 2001). Все они были диагностированы ошибочно, а потому антигельминтозное лечение не предпринималось. Авторы считают, что при первых же симптомах недомогания для правильной постановки диагноза следует проводить исследование спинномозговой жидкости и смыва с бронхов, чтобы назначать эффективное антигельминтозное лечение и тем самым спасти пациента.
Что касается лекарственных препаратов, применяемых для лечения ангиостронгилиазиса, то здесь нет устоявшегося единодушия. Чаще всего используют комбинацию преднизолона и альбендазола. Сообщается также об эффективном применении мебендазола со стероидами (Leone et aL 2007), альбендазола с кортикостероидами (Chotmongkol et al., 2004). На Тайване при лечении детей с успехом применили мебендазол с альбендазолом (Hwang, Chen, 1991). Однако некоторые авторы считают эффективность действия альбендазола слабо доказанной (Murphy, Johnson, 2013), полагая, тем не менее, что двухнедельный курс кортикостероидных препаратов сокращает продолжительность и понижает тяжесть проявляемых симптомов.
Диагноз на заражение A. cantonensis ставят на основании клинической картины и лабораторных исследований. Для быстрой диагностики рекомендуют использовать диагностические наборы на основе дот-блот ИФА, которые показали свою простоту, эффективность и экономичность для применения в полевых условиях (Eamsobhana, Dechkum, 2000; Eamsobhana, Yong, 2009). В то же время некоторые исследователи отмечают, что хотя и существует несколько серологических тестов, но ни один из них до сих пор полностью не проверен (Murphy, Johnson, 2013).
Неоценимую помощь в постановке диагноза может оказать анамнез больного, в ходе которого становится понятным, могла ли пища стать источником его заражения.
Уже давно установлено, что личинки A. cantonensis попадают к человеку с пищей, прежде всего, с мясом улиток, пресноводных креветок, наземных крабов, лягушек, ящериц (Alicata, 1964, 1991; Bhaibulaya, 1991; Herwaldt, 2012; Panackel et al., 2006; Wang Q. et aL, 2008; Zhou et al., 2009). Так, встречаемость эозинофильного менингоэнцефалита на Таити обычно связывают с употреблением в пищу местных блюд, в том числе tai or о, которое готовят из сырых креветок. Для этого блюда к протёртому кокосовому ореху добавляют креветочный сок, приготовленный из размолотого желудка, и этой смесью обкладывают порции креветок в свежей воде. В Таиланде источником инвазии является моллюск Pila ampullacea, у которого в пищу идёт передняя часть ноги: её отрезают и затем или погружают в кипящую воду или хранят на льду, чтобы сохранить мясо свежим. Далее к нарезанным ма
23
леньким кусочкам добавляют свежий сок (в зависимости от сезона он может быть самым разным) и смешивают с овощами. Традиционное тайское блюдо Koi-Noi также готовят из сырого мяса моллюсков, которое смешивают со специями и соком цитрусовых (Eamsobhana et al., 2009).
На юге Тайваня основным источником заражения людей является так называемый яблочный моллюск Ротасеа canaliculata (=Ampullarium canaliculatus)2 (Wang J.-J. et al., 2011), Этот южноамериканский моллюск был завезён на Тайвань в 1979 г. как потенциальный пищевой ресурс, а в настоящее время широко распространился по острову (Tsai et al., 2001). Традиционное употребление в пищу сырых моллюсков и огромное количество этих улиток, продаваемых на рынке, создают идеальные предпосылки для заражения людей личинками нематоды. К примеру, в Куньмине (столице провинции Юнань, Китай) на рынках ежедневно продаётся около тонны Р. canaliculata (Zhou et al., 2009). В одном из городов провинции Юнань ежегодно в марте даже проводится так называемый «Улиточный фестиваль» (по-китайски - Luoshi Ле), во время которого люди собирают моллюсков и едят их сырыми или полусырыми, а также перевозят их в новые места (Deng et al., 2011).
Описаны также случаи заражения людей через сырое мясо и печень бенгальского варана (Bhaibulaya, 1991; Panackel et al., 2006), восточной золотой лягушки Pelophylax plancyi {=Rana plancyi) (Lai et al., 2007). В некоторых регионах источником инвазии служат наземные крабы, которых едят сырыми, а также плохо прожаренная печень и другие внутренние органы свиней или скота, к которым случайно попали личинки нематоды (Alicata, 1964, 1991).
В Новой Каледонии и на Гавайях, где практически отсутствует обычай употреблять в пищу сырых моллюсков, потенциальным источником заражения могут быть салатная зелень или сок из неё, на/в которых случайно оказались очень мелкие садовые слизни или наземные планарии (Cross, 1987; Ewers, Anisowicz, 2014; Slom et al., 2002; Wang Q. et al., 2008; Yeung et al., 2013). Подобный путь попадания к человеку личинок A. cantonensis вполне реален, учитывая их находки в слизи, например, малайского слизня Microparmarion malayanus (Heyneman, Lim, 1967), или же у наземной планарии Kontikia forsterorum (Ash, 1976). О возможности заражения человека нематодами через свежую зелень пишут и австралийские (Gut-teridge, Findlater, 1972), и американские медики (Ewers, Anisowicz, 2014; Slom et al., 2002).
Несомненного внимания заслуживает также информация об обнаружении личинок Angiostrongylus у мухи Musca domestica (Maipanich et al., 2012). И хотя выявленные в них личинки показали 16.85 % отличий на генетическом уровне от А. cantonensis, тем не менее, уже сам факт их регистрации в домашних насекомых свидетельствует о возможности попадания опасных личинок к человеку через загрязнённую ими пищу.
2Род Ampullarius (Lamarck 1799), равно как и Conchylium (Cuvier 1816), являются синонимами рода Ротасеа (Репу 1810) [См. по этому поводу: http://www.applesnail.net, а также Cazzaniga N. J. Old species and new concepts in the taxonomy of Ротасеа (Gastropoda: Ampul-lariidae) // Biocell. - 2002. - 26, 1. - P. 71 - 81]. В публикациях, связанных с паразитированием у моллюсков ангиостронгилид, разные авторы употребляют или то или другое название рода.
24
И, наконец, предполагают, что заражение ангиостронгилами может происходить также при питье воды, в которой по тем или иным причинам оказались личинки нематоды (Cheng, Alicata, 1964).
Каковы же те превентивные меры, которые могут предотвратить заражение человека A. cantonensis? Прежде всего, в эндемичных по ангиостронгилиазису регионах следует отказаться от употребления в пищу в сыром виде мяса улиток, креветок, крабов, лягушек, как бы соблазнительно и экзотично ни выглядели приготовленные из них блюда. Зелень следует очень тщательно промывать в проточной воде, чтобы на ней не осталось ни следов слизи, в которой могут оказаться личинки нематоды, ни тех мелких слизней или планарий, которые переносят этих личинок (Ewers, Anisowicz, 2014; Yeung et al., 2013).
Если улитки или слизни становятся весьма многочисленными в домашнем саду или других местах, где выращивают овощи, предназначенные для употребления в пищу в сыром виде, то овощи необходимо исследовать на наличие этих беспозвоночных и. в любом случае, тщательно промыть.
Как отмечено выше, A. cantonensis впервые обнаружен и описан в Китае (Chen Н., 1935). Вполне возможно, что вид имеет восточноазиатское происхождение, но утверждать это довольно трудно, учитывая современное обширное распространение паразита, связанное с деятельностью человека (Prociv et al., 2000). Пятьдесят лет назад Д. Аликата (Alicata, 1964) особое внимание обращал на отсутствие A. cantonensis на некоторых тихоокеанских островах, в частности Самоа, Фиджи и других, объясняя этим фактом и отсутствие случаев заражения данным паразитом местного населения. К настоящему времени A. cantonensis не только известен на упомянутых островах, но и стал причиной вспышек заболеваний человека на некоторых из них, о чём упоминалось выше. Расширению ареала вида способствуют, прежде всего, интенсификация транспортных связей как торгового, так и военно-морского флота, а также вселение и последующее расселение упомянутых выше моллюсков - ахатины гигантской и яблочного моллюска - в новые регионы. При попадании A. cantonensis в новые регионы отсутствие у данного вида узкой специфичности и к окончательным, и к промежуточным хозяевам способствует его успешной адаптации к новым условиям и новым хозяевам.
По состоянию на 2016 г., ареал A. cantonensis включал Австралию, Гавайи, Таити, Самоа, Фиджи, Новые Гебриды, Новую Каледонию, Папуа-Новую Гвинею, Японию, Китай, Тайвань, Филиппины, Индонезию, Мадагаскар, Египет, Индию, Шри-Ланка, Маврикий, Кот-д’Ивуар, Канарские о-ва, Южную Африку, Кубу, Ямайку, Гаити, острова Карибского бассейна, Пуэрто-Рико, Эквадор, Бразилию, юго-восток США. Практически во всех из них зарегистрировано и заражение людей этим гельминтом. Примечательно, что столь широкое распространение A. cantonensis привело к тому, что в различных географических регионах в экспериментально заражённых хозяевах наблюдаются определённые различия в степени инвазионное™, патогенности и тяжести заболеваний, вызываемых этим гельминтом (Cross, 1979). Более того, результаты недавних молекулярно-генетических исследований данного вида показали его высокое разнообразие на генетическом уровне (Eamsobhana et al., 2015).
В связи со столь широким распространением паразита не могут не насторожить ставшие в последние годы довольно регулярными сообщения о заражении им людей во время поездок в страны, эндемичные по A. cantonensis (Ewers, Anisowicz,
25
2014; Ramirez-Avila et al., 2009). Описан, к примеру, случай, когда симптомы эозинофильного менингита обнаружились у 12 из 23 молодых людей - жителей трёх штатов США, вернувшихся из поездки на Ямайку (среди Них, кстати, были и студенты-медики) (Slom et al., 2002). Аналогичный диагноз был поставлен одному из жителей Швейцарии после поездки на Кубу (Bartschi et al., 2004) и итальянцу, посетившему столицу Доминиканской Республики - Санто-Доминго (Leone et al., 2007). Эозинофильным менингитом, сопровождавшимся лёгкой головной болью, диареей, общим недомоганием и радикулитом, закончилось путешествие по Латинской Америке и островам Фиджи одной из жительниц Бельгии (Ali et al., 2008). К 2009 г. в Европе было зарегистрировано 11 случаев заражения людей A. cantonensis, причём первый из них датировался 1988-м годом и имел место во Франции. Среди стран, в которых зафиксированы подобные случаи, помимо Швейцарии, Франции, Бельгии и Италии, названных выше, оказались также Германия, Великобритания и Хорватия (Maretic et al., 2009).
Полагают, что уже само поведение туристов, считающих для себя просто обязательным попробовать экзотические, непривычные блюда, которые могут быть приготовлены из сырого или недостаточно обработанного сырья, провоцирует риск их заражения A. cantonensis (Diaz, 2010). К тому же, у туристов часто отсутствуют самые элементарные сведения о возможных очагах гельминтозных заболеваний в посещаемой ими стране.
Angiostrongylus costaricensis (рис. 6, 7). Паразит впервые описан на материале, который был собран в клиниках Коста-Рики от пациентов, главным образом, детей, с диагнозом эозинофильного гастроэнтерита (Morera, Cespedes, 1971). Нематоды локализовались в мелких артериях стенки кишечника больных, вызывая образование гранулём. Видовое название паразиту дали по месту его первоначального обнаружения.
Рис. 6 Angiostrongylus costaricensis: 1 - передний конец самки, латерально; 2 - хвостовая бурса самца, вентрально; 3 - задний конец тела самки, латерально (из: Maldonado et al., 2012)
26
Е
8
Рис. 7 Angiostrongylus costaricensis, задний конец тела взрослой особи самца: 1 - из человека (из: Могега, C£spe-des, 1971); 2 - из южноамериканского полевого хомячка Akodon montensis, Аргентина (из: Robles et al., 2016)
Описание (по: Могега, Cespedes, 1971; с дополнениями других авторов, в том числе: Maldonado et al., 2012). С характерными чертами рода. Экскреторная пора на уровне основания дубинкообразного пищевода. Самцы длиной 15 - 19.9 и шириной 0.08 - 0.093 мм. Хвостовой конец загнут вентрально. Позади клоакального отверстия расположены три папиллы. Спикулы узкие, с исчерченностью, длиной 0.27 - 0.31 мм, заканчиваются двумя образованиями в виде крючьев. Губернакулюм 0.045 мм длиной. Копулятивная бурса хорошо развита, слегка асимметричная. Вентральные рёбра с почкообразными окончаниями, сливаются по всей длине, за исключением дистальной одной пятой части, одна из них, латеральная, слегка длиннее. Латеральные рёбра отходят от общего ствола, одинакового размера, при этом постеро- и медиолатеральное рёбра сливаются в проксимальной половине, а наружное ребро отделяется от них после того, как отходит от общего ствола. Наружнодорсальное ребро длинное, узкое, начинается возле основания латеральных и отделено от дорсального. Дорсальное ребро толстое, короткое, заканчивается тремя верхушками: центральной - короткой, шишкообразной и боковыми -клювообразными. Самки длиной до 27 - 32.8 и шириной 0.32 - 0.35 мм. Хвостовой конец округло-закруглённый, слегка загнутый вентрально. Вульва в 0.175 мм и анус в 0.053 мм от верхушки хвоста (по другим данным, соответственно 0.24 - 0.29 и 0.06 - 0.07 мм). На верхушке хвоста имеется маленький выступ. Яйца тонкостенные, овальные.
Жизненный цикл A, costaricensis похож на таковой A. cantonensis, за исключением того, что в окончательном хозяине взрослые черви оседают в артериолах подвздошной кишки.
Промежуточный хозяин - прежде всего, слизни из семейства Veronicellidae, например, Sarasinula marginata, Vaginulus plebeius, Phyllocaulis variegatus, P. so-leiformis и другие, а также наземные моллюски Limax spp., Bradybaena similaris (Graeff-Teixeira et al., 1993; Mendonca et al., 2008; Spratt, 2015). В Коста-Рике V. plebeius инвазирован личинками A. costaricensis в среднем на 3.9 % (исследовано 8870 экз. моллюсков), при этом в одном из городов заражённость этого слизня достигала 27.4 % (Charpentier et al., 2015).
27
Дефинитивные хозяева - наземные млекопитающйе, принадлежащие к семействам Cricetidae, Heteromyidae, Muridae. В Центральной Америке основной дефинитивный хозяин паразита - котоновая крыса, Sigmodon gispidus (Pena et al., 1995).
A. costaricensis - зоонозный вид, вызывающий у человека абдоминальный ангиостронгилозис или, как его ещё называют, эозинофильный гастроэнтерит.
В организме человека A. costaricensis, в отличие от A. cantonensis, часто достигает половой зрелости. Однако и яйца, и личинки погибают, вызывая интенсивную воспалительную реакцию - гранулёматозные повреждения с эозинофильным инфильтратом в кишечнике и близлежащих лимфатических узлах. Внутри гранулём обычно содержатся яйца нематоды, или пустые, или с клетками или эмбрионами, или же с личинками. В мелких артериях стенки кишечника могут встречаться даже взрослые черви. В фекалиях пациентов яйца никогда не обнаруживаются.
На Коста-Рике, откуда паразит впервые описан, заболевание, как таковое, известно, по меньшей мере, с 1952 г. (Morera, Cespedes, 1971), но только в 1971 г. был выявлен его истинный виновник - нематода A. costaricensis. К тому времени в стране зарегистрировали более 70 случаев заражения людей данным гельминтом. За 10 последующих лет в Национальной детской клинике Коста-Рики зафиксировали 116 случаев заражения детей, причём 53 % из них составляли дети от 6 до 13 лет (Loria-Cortes, Lobo-Sanahuja, 1980). В 90 случаях врачам пришлось прибегнуть к подвздошно-толстокишечной резекции, или удалению аппендикса, или же гемиколэктомии. Из общего числа пациентов двое скончались, а остальные выздоровели.
В 1972 г. появляется первое сообщение о регистрации A. costaricensis у человека в Гондурасе (Sierra, Morera, 1972), в 1973-м - в Венесуэле (Zambrano, 1973), в 1974-м - в Мексике (Velazquez et al., 1974), в 1975-м - в Бразилии (Ziliotto et al., 1975), в 1986-м - в Аргентине (Demo, Pessat, 1986), в 1991-м - в Никарагуа (здесь описана серия из 12 случаев) (Duarte et al., 1991) и т.д.
Заражение проявляется, прежде всего, симптомом «острого живота» с болями в правой подвздошной области, болью при пальпации, рвотой, диареей, запором, прощупываемой при пальпации опухолевидной массой в правом нижнем квадранте, жёсткостью живота, анорексией, слабостью, лихорадкой (может носить умеренный характер), гепатомегалией. Поражения локализуются в слепой кишке, восходящей ободочной кишке, области подвздошной кишки, аппендиксе и кишечнике, где наблюдаются эозинофильный инфильтрат, кровоизлияния, отёк и уплотнение кишечной стенки, желтый грануляционный материал в субмукозе, содержащий яйца паразита. В большинстве случаев выражен лейкоцитоз с преобладанием эозинофилов. Эозинофилия колеблется от 11 до 81 %, но может быть и менее 10 % (Morera, Cespedes, 1971). Иногда наблюдается прободение стенки кишечника (Incani et al., 2007; Vuong et al., 2002).
Заболевание диагностируют на основании клинических признаков, однако окончательный диагноз может быть поставлен только при обнаружении червей в артериях после гистологического исследования материала, полученного при биопсии (Graeff-Teixeira et al., 1991). При лабораторных исследованиях используют несколько серологических тестов, включая ИФА, однако выбор антигена и специфичности тестов всё ещё нуждаются в усовершенствовании (Maldonado et al., 2012).
28
Для лечения абдоминального ангиостронгилиазиса применять антигельмин-тики не рекомендуется, поскольку те провоцируют беспорядочную миграцию червей и/или усиление повреждений, вызываемое воспалительной реакцией организма на погибших гельминтов в местах их локализации. Единственным способом избавления от неприятных симптомов, таким образом, является хирургическое удаление повреждённых участков кишечника (Maldonado et al., 2012).
К настоящему времени ареал A. costaricensis простирается от юго-востока США на севере до Аргентины на юге, причём на юго-востоке США паразит постепенно осваивает всё новые территории, продвигаясь от Флориды в северо-восточном направлении.
Помимо Коста-Рики, случаи заражения людей A. costaricensis зарегистрированы в США, Мексике, Гондурасе, Панаме, Доминиканской Республике, Мартинике, Гваделупе, Никарагуа, Венесуэле, Гватемале, Эквадоре, Колумбии, Бразилии, Аргентине, на островах Карибского бассейна, в Испании, Франции, Заире (Incani et al., 2007; Miller et al., 2006; Romero-Alegria et al., 2014). Подсчитано, что по состоянию на 2014 г. 89.6 % всех случаев заболевания людей абдоминальным ангиостро-нгилиазисом было выявлено на Коста-Рике, 2.7 % - в Бразилии, 1.8 % - в США (Romero-Alegria et al., 2014). До 1985 г. на Коста-Рике на 100 тыс. населения ежегодно приходилось 12 случаев заражения Л. costaricensis (Morera, 1985).
Случаи регистрации ангилостронгилиазиса людей в регионах, где A. costaricensis в природе пока не известен, связаны с посещением ими стран, эндемичных по данному заболеванию. К примеру, 73-летняя жительница Лос-Анджелеса (США) попала в клинику с острой брюшной болью через 4 недели после возвращения из Эль-Сальвадора, где проживала в течение 5 месяцев (Wu et al., 1997). При лапаротомии в подвздошной кишке пациентки обнаружилась перфорация, связанная с сегментально утолщённой стенкой кишечника. При микроскопическом обследовании у больной были выявлены эозинофильный илеит, взрослые особи A. costaricensis в просвете артерий, яйца нематоды в субмукозе, а также артериолит (воспаление артериол) с тромбозом.
В этом же ряду стоит история с 32-летним французом, жителем предместья Парижа, перенесшим резекцию участка подвздошной кишки в связи с перитонитом, вызванным поражением A. costaricensis (Vuong et al., 2002). За два месяца до поступления в клинику пациент посетил Французскую Гвиану.
И, наконец, в 1987 г. был описан случай обнаружения абдоминального ан-гиостронгилозиа у 2 5-летнего жителя Заира, у которого из стенки кишечника был удалён узелок с погибшей нематодой (Baird et al., 1998). Окружающие узелок ткани характеризовались гранулёматозным воспалением и многочисленными эозинофилами и содержали личинок и яйца нематоды, чьи морфологические особенности, по мнению авторов публикации, соответствовали таковым A. costaricensis. Это - первое и единственное сообщение о регистрации данного вида на африканском континенте. К сожалению, информация об этом случае заимствована из реферата статьи, сам же источник найти не удалось. Однако, учитывая особенности географического распространения A. costaricensis и трудности в определении яиц и личинок нематод данного рода, можно предположить ошибочное определение паразита.
Что касается мер профилактики, направленных на предупреждение заражения ангилостронгилом костарикским, то они в принципе не отличаются от таковых, описанных выше по отношению к A. cantonensis.
29
Цитируемая литература
Шихобалова Н.П. Глава 1. Введение в медицинскую гельминтологию / Протозойные болезни, гель-минтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 271 - 318. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Aguiar Р. Н, Morera Р., Pascual J. Е. First record of Angiostrongylus cantonensis in Cuba // Am. J. Trop. Med. Hyg - 1981. - 30, 5. - P. 963 - 965.
AH A. B., Van den Enden E., Van Gompel A., Van Esbroeck M. Eosinophilic meningitis due to Angiostrongylus cantonensis in a Belgian traveler // Travel Med. Infect. Dis. - 2008. - 6, 1-2. - P. 41 - 44.
Alicata J. E. Angiostrongylus cantonensis (eosinophilic meningitis): historical events in its recognition as a new parasitic disease of man // J. Wash. Acad. Sci. - 1988. - 78, 1. - P. 38 - 46.
Alicata J. E. Angiostrongylus cantonensis, the ’’mystery" parasite of man in the Pacific // Summary Research Report.-1990.-P. 1-13.
Alicata J. E. The discovery of Angiostrongylus cantonensis as a cause of human eosinophilic meningitis // Parasitol. Today. - 1991. - 7. - P. 151 - 153.
Anderson D., Fitzgerald L., Gardiner C, Gutter A., Harris R. Eosinophilic meningoencephalitis due to Angiostrongylus cantonensis as the cause of death in captive non-human primates // Am. J. Trop. Med. Hyg. -1990.-42, l.-P. 70-74.
Anderson R. C. Keys to the genera of the superfamily Metastrongyloidea / R. C. Anderson, A. G. Chabaud, S. Willmont (eds), C.I.H. Keys to the Nematode Parasites of Vertebrates, No. 5, Commonwealth Agricultural Bureaux, Farnham Royal, Bucks, 1978. - 40 pp.
Asato R., Taira K, Nakamura M., Kudaka J. et al. Changing epidemiology of Angiostrongylus cantonensis in Okinawa prefecture, Japan // Japan. J. Infect. Dis. - 2004. - 57. - P. 184 - 186.
Ash L R. Observations on the role of mollusks and planarians in the transmission of Angiostrongylus cantonensis infection to man in New Caledonia // Rev. Biol. Trop. - 1976. - 24, l.-P. 163 - 174.
Baird J. K, Neafie R. C, Lanoie L, Connor D. H. Abdominal angiostrongylosis in an African man: case study // Am. J. Trop. Med. Hyg. - 1987. - 37, 2. - P. 353 - 356.
Bartschi E, Bordmann G., Blum J., Rothen M. Eosinophilic meningitis due to Angiostrongylus cantonensis in Switzerland // Infection. - 2004. - 32, 2. - P. 116.
Beaver P. C, Rosen L Memorandum on the first report of Angiostrongylus in man by Nomura & Lin, 1945 // Am. J. Trop. Med. Hyg. - 1964. - 13. - P. 589.
Bhaibulaya M. Snail borne parasitic zoonoses: angiostrongyliasis // Southeast Asian J. Trop. Med. Publ. Health. -1991.-22, Suppl. -P. 189 - 193. (www.tm.mahidol.ac.th/seameo).
Bowden D. K. Eosinophilic meningitis in the New Hebrides: two outbreaks and two deaths // Am. J. Trop. Med. Hyg. - 1981. -30, 5. - P. 1141 - 1143.
Brown F. M., Mohareb E. W., Yousif F, Sultan N., Girgis N. I. Angiostrongylus eosinophilic meningitis in Egypt П Lancet. - 1996. - 348. - P. 964 - 965.
Capinera J., Walden H. S. Rat lungworm Angiostrongylus cantonensis (Nematoda: Strongylida: Metastrongy-lida) П IF AS Etensen. EENYS70. - 2013. - 4 pp. http://edis.ifas.ufl.edu.
Charpentier L. V., Salas G. Z, Mora R. A. Prevalencia de larvas de Angiostrongylus costaricensis (Nematoda: Angiostrongylidae) en babosas Vaginulus plebeius (Mollusca: Veronicellidae) de Costa Rica // Rev. Med. Univ. Costa Rica. - 2015. - 9, 2. - P. 53 - 62. DOI: http://dx.doi.org/10.15517/rmu.v9i2.22009.
Chen F., Chen S, Li K., Li T. et al. Investigation on outbreak of Angiostrongyliasis cantonensis due to consumption of snail food in Dali City // Chin. J. Schisto. Control. - 2011. - 23. - P. 687 - 690.
Chen H. T. Un nouveau nematode pulmonaire, Pulmonena cantonensis n.g. n.sp,des rats de Canton // Ann.. Parasitol. Hum. Comp. -1935. - 13.-P. 312-317.
Cheng T. C., Alicata J. E. Possible role of water in the transmission of Angiostrongylus cantonensis (Nematoda: Metastrongyloidae) 11 J. Parasit. - 1964. - 50, 2. - P. 4232 - 4236.
Chotmongkol V., Wongjitrat C, Sawadpanit K., Sawanyawisuth K. Treatment of eosinophilic meningitis with a combination of albendazole and corticosteroid // Southeast Asian J. Trop. Med. Publ. Health. - 2004. -35, l.-P. 172- 174.
Cooke-Yarborough С. M., Kornberg A. J., Hogg G. G., Spratt D. M., Forsyth J. R L. A fatal case of angiostrongyliasis in an 11-month-old infant // Med. J. Aust. - 1999. - 170. - P. 541 - 543.
Cowie R.H. Biology, systematics, life cycle, and distribution of Angiostrongylus cantonensis, the cause of rat lungworm disease // Hawaii J. Med. Public Health. - 2013. - 72, 6, Suppl. 2. - P. 6 - 9.
Cross J. H. Studies on angiostrongyliasis in Eastern Asia and Australia. -NAMRU-2 Special Publication 44, US Naval Medical Research Unit, Taiwan, 1979. - 164 pp.
30
Cross J. H. Angiostrongyliasis I Seminar on Parasitic Zoonoses in the Tropic. - Quezon City: Asian Institute of Tourism, 1982. -P. 33-41.
Cross J. H, Public health importance of Angiostrongylus cantonensis and its relatives // Parasitol. Today. -1987.-3.-P. 367-369.
Cross J. H. Angiostrongylus (Parastrongylus) cantonensis in the Western Hemisphere // Southeast Asian J. Trop. Med. Publ. Health. - 2004. - 35, Suppl. 1. - P. 107 -11.
Demo O. J., Pessat O. A. Angiostrongylosis abdominal. Primer caso observado en Argentina // Prensa. Med. Argent. - 1986. - 73. - P. 732 - 738.
Deng Z. H., Lv S., Lin J. Y, Lin R X et al. An outbreak of angiostrongyliasis in Guanging, People’s Republis of China: Migrants vulnerable to an emerging disease 11 Southeast Asian J. Trop. Med. Publ. Health. -2011. -42, 5.-P. 1047-1053.
Diao Z, Wang J., Qi H, Li X et al. Human ocular angiostrongyliasis: A literature review 11 Trop. Doct. -2011. -41.-P. 76-78.
Diaz J. H. Recently reemerging helminthic infections causing eosinophilic meningoencephalitis: neuroangi-ostrogyliasis, baylisascariasis, and gnathostomiasis // J. Neuroparasitol. - 2010. -1. - P. 1-14.
Dorta-Contreeras A. J. B., Padilla-Docal J. M., Moreira L, Martini Robles J. et al. Neuroimmunological findings from the first report of Angiostrongylus cantonensis outbreak in Ecuador I I Int. J. Infect. Dis. - 2010. -14.-P. 381.
Dougherty E. C. The genus Aelurostrongylus Cameron, 1927 (Nematoda: Metastrongylidae) and its relatives; with descriptions of Parafilaroides gen. nov., and Angiostrongylus gubernaculatus sp. nov. I I Proc. Helmin-thol. Soc. Wash. - 1946. -13. -P. 16-26.
Drozdz J. Revision de le systdmatique du genre Angiostrongylus Kamensky, 1905 (Nematoda: Metastrongy-loidea) I I Ann. Parasitol. (Paris). - 1970. - 45, 5. -P. 597-603.
Duarte Z, Могега P., Vuong P. H. Abdominal angiostrongyliasis in Nicaragua: a clinico-pathological study of a series of 12 cases reports // Ann. Parasitol. - 1991. - 66. - P. 269 - 262.
Duffy M. S.t Miller C. L., Kinsella J. M., de Lahunta A. Parastrongylus cantonensis in a nonhuman primate, Florida // Emerg. Infect. Dis. - 2004. -10. - P. 2207 - 2210.
Eamsobhana P., Dechkum N. Recognition of a 31-kDa diagnostic antigen from excretory/ secretory products of adult Parastrongylus cantonensis by infected human sera // Trop. Biomed. - 2000. -17. - P. 103-108.
Eamsobhana P., Lim P. E, Solano G., Zhang H, Gan X, Yong H. S. Molecular differentiation of Angiostrongylus taxa (Nematoda: Angiostrongylidae) by cytochrome c oxidase subunit I (COI) gene sequences // Acta Tropica. -2010. -116. -P. 152- 156. DOI: 10.1016/j.actatropica.2010.07.005.
Eamsobhana P., Lim P. E, Yong H S. Phylogenetics and systematics of Angiostrongylus lungworms and related taxa (Nematoda: Metastrongyloidea) inferred from the nuclear small subunit (SSU) ribosomal DNA sequences // J. Helminthol. -2015. -89, 3. -P. 317-325. doi: 10.1017/S0022149X14000108.
Eamsobhana P., Yong H. S. Immunological diagnosis of human angiostrongyliasis due to Angiostrongylus cantonensis (Nematoda: Angiostrongylidae) // Int. J. Infect. Dis. - 2009. -13, 4. - P. 425 -431.
Eamsobhana P., YoolekA., Punthuprapasa P., YongH. S. Thai koi-hoi snail dish and angiostrongyliasis due to Angiostrongylus cantonensis'. Effects of food flavoring and alcoholic drink on the third-stage larvae in infected snail meat 11 Foodbome Pathog. Dis. - 2009. - 6, 3. - P. 401 - 405.
Eduardo S. L. Food-borne parasitic zoonoses in the Philippines // Southeast Asian J. Trop. Med. Publ. Health. -1991.-22, Suppl. -P. 16-22 (www.tm.mahidol.ac.th/seameo/.../06-16-22/).
Eduardo S. L. Helminth zoonoses in the Philippines: public health problem associated with eating habit and practices 11 Trans. Natl. Acad. Sci. Tech., Philippines. - 2001. - 23. - P. 105-119.
Ewers E. C, Anisowicz S. K. The potential danger of eating wild lettuce: A brief review of human rat lungworm infection И Hawaii J. Med. Public Health. - 2014. - 73, 11, Suppl. 2. - P. 28 - 32.
Feng Y., Nawa Y., Sawanyavisuth K, Lv Z. et al. Comprehensive review of ocular angiostrongyliasis with special reference to optic neuritis // Korean J. Parasitol. -2013. - 51. -P. 613 - 619.
Graeff-Teixeira C, Camillo-Coura L., Lenzi H. L. Histopathological criteria for the diagnosis of abdominal angiostrongyliasis // Parasitol. Res. - 1991. - 77, 7. -P..606 - 611.
Graeff-Teixeira C, Thiengo S. C, Thom£ J. W., Medeiros A. B., Camillo-Coura L., Agostini A. A. On the diversity of mollusc intermediate hosts of Angiostrongylus costaricensis Morera & Cdspedes, 1971 in southern Brazil // Mem. Inst. Oswaldo Cruz. - 1993. - 88. - P. 487 - 489.
Gutteridge В. H. Angiostrongylosis (Correspondence)//Med. J. Aust. - 1971. -1. -P. 931 -932.
Gutteridge В. H, Findlater C. Human larval meningitis possibly following lettuce ingestion in Brisbane 11 Pathology. - 1972. - 4. - P. 63 - 64.
He H, Cheng M., Yang X, Meng J. et al. Preliminary molecular characterization of the human pathogen Angiostrongylus cantonensis // BMC Mol. Biol. -2009. -10. -P. 97. DOI 10.1186/1471-2199-10-97.
31
He J. Z., Zhu S. H, Yang S. Q., Yu B. W. et al. First discover and evidence ofAngiostrongylus cantonensis in the cerebrospinal fluid from the case of the population of the mainland of China // Acad. J. Guangzhou Med. Coll. - 1984. -12. -P. 56 - 61. (Article in Chinese).
Heaton D. C, Gutteridge В. H Angiostrongyliasis in Australia // Aust. N. Z. J. Med. - 1980. - 10. - P. 255 -256.
Herwaldt B. L Angiostrogyliasis (Angiostrongylus cantonensis infection, neurologic angiostrongyliasis). Centers for Disease Control and Prevention, Yellowbook, chapter 3. 2012.
Heyneman D., Lim B. Angiostrongylus cantonensis'. proof of direct transmission with its epidemiological implications II Science. - 1967. -158. -P. 1057 - 1058.
Hochberg N. S., ParkS. Y., Blackburn B. G. et al. Distribution of eosinophilic meningitis cases attributable to Angiostrongylus cantonensis, Hawaii // Emerg. Infect. Dis. -2007. -13, 11. -P. 1675 - 1680.
Hwang К. P., Chen E. R. Clinical studies on Angiostrongyliasis among children on Taiwan // Southeast Asian J. Trop. Med. Publ. Health. -1991.-22, Suppl. - P. 194 - 199.
Ihalamulla R L, Fernando S. D., Weerasena К. H, Cross J. H. et al. A further case of parastrongyliasis (angiostrongyliasis) from the eye of a patient in Sri Lanka 11 Ceylon J. Med. Sci. - 2007. - 50. - P. 15-17.
Incani R N., Caleiras E, Martin M., Gonzalez C. Human infection by Angiostrongylus costaricensis in Venezuela: first report of a confirmed case // Rev. Inst. Med. Trop. Sao Paulo. - 2007. - 49, 3. - P. 197 - 200.
Kim D. Y., Stewart T. B., Bauer R W., Mitchell M. Parastrongylus (^Angiostrongylus) cantonensis now endemic in Louisiana wildlife I I J. Parasitol. - 2002. - 88. - P. 1024 - 1026.
Kliks M. M., Kroenke K, Hardman J. M. Eosinophilic radiculomyeloencephalitis: an angiostrongyliasis outbreak in American Samoa related to ingestion of Achatina fulica snails // /Un. J. Trop. Med. Hyg. - 1982. -31, 6.-P. 1114-1122.
Kliks M. M., Palumbo N. E. Eosinophilic meningitis beyond the Pacific Basin. The global dispersal of a peridomestic zoonosic caused by Angiostrongylus cantonensis, the nematode lung-worm of rats 11 Soc. Sci. Med. -1992.-34, 2.-P. 199-212.
Lai С. H, Yen С. M., Chin C, Chung H. C. et al. Eosinophilic meningitis caused by Angiostrongylus cantonensis after ingestion of raw frogs // Am. J. Trop. Med. Hyg. - 2007. - 76, 2. - P. 399 - 402.
Leone S, De Marco M., Ghirga P., Nicastri E, Esposito M., Narciso P. Eosinophilic meningitis in a returned traveler from Santo Domingo: case report and review // J. Trav. Med. - 2007. -14, 6. - P. 407 - 410.
Li D.N., He A., Wang Y., Liang Y., Li Z.Y. et al. Three lethal cases of Angiostrongylus cantonensis infected children // Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. - 2001. - 19. - P. 310 - 311.
Lindo J. F, Escoffery С. T, Reid B., Codrington G. Cunningham-Myrie C, Eberhard M. L. Fatal autochthonous eosinophilic meningitis in a Jamaican child caused by Angiostrongylus cantonensis //Am. J. Trop. Med. Hyg. - 2004. - 70,4. - P. 425 - 428.
Lindo J., Waugh C, Hall J., Cunningham-Myrie C, Ashley D, Eberhard M. Enzootic Angiostrongylus cantonensis in rats and snails after outbreak of human eosinophilic meningitis in Jamaica // Emerg. Infect. Dis. -2002.-8.-P. 324-326.
Loria-Cortes R., Lobo-Sanahuja J F. Clinical abdominal angiostrongylosis. A study of 116 children with intestinal eosinophilic granuloma caused by Angiostrongylus costaricensis 11 Am. J. Trop. Med. Hyg. - 1980. - 29.-P. 538-544.
Mackerras M. J., Sandars D. F. The life history of the rat lung-worm, Angiostrongylus cantonensis (Chen) (Nematoda: Metastrongylidae) 11 Austr. J. Zool. - 1955. - 3, 1. - P. 1-25.
Mainpanich W., Yoonuan T„ Thaenkham U., Komalamisra C. et al. Houseflies: a possible transport host of Angiostrongylus sp. // J. Trop. Med. Parasitol. - 2012. - 35, 1. - P. 22 - 26. www.ptat.thaigov.net.
Maldonado A. Jr., Simdes R, Thiengo S. Angiostrongyliasis in the Americas, chapter 171 Zoonosis. - Lomezo-Morales J. (ed.). - Rijeka, Croatia. -2012. DOI 10.5772/38632.
Malhotra S, Mehta D. K, Arora R, Chauhan D. et al. Ocular angiostrongyliasis in a child — first case report from India // J. Trop. Pediatr. - 2006. - 52, 3. - P. 223 - 225.
Maretic T., Perovic M., Vince A., Lukas D. et al. Meningitis and radiculomyelitis caused by Angiostrongylus cantonensis // Emerg. Infect. Dis. — 2009. —15, 6. — P. 996 — 998. doi: 10.3201/eidl506.081263/
Matsumoto T. On a nematode found in the lung, especially with the pulmonary artery of the wild rat // J. Med. Assoc. Formosa. - 1937.-36. -P. 2620 - 2623.
Mattis A., Mowatt L., Lue A., Lindo J, Vaughan H. Ocular angiostrongyliasis - first case report from Jamaica // West Indian Med. J. - 2009. - 58, 4. - P. 383 - 385.
Mehta D. K., Arora R, Chauhan D., Shroff D., Narula R. Chemo-paralysis for the removal of a live intraocular worm in ocular angiostrongyliasis 11 Clin. Experiment. Ophthalmol. - 2006. - 34, 5. - P. 493 - 495.
Mendonqa C. L. G. F, Carvalho O. S, Mota E. M., Lenzi H. L. Development of Angiostrongylus costaricensis Moreraand Cespedes 1971 (Nematoda: Angiostrongylidae) in the intermediate host Sarasinula marginata
32
(Semper 1885)(Mollusca: Soleolifera)//Parasitol. Res. - 2008. -102. - P. 861 -865. DOI 10.1007/s00436-007-0834-y.
Miller C. L, Kinsella J. М.» Garner M. M., Evans S. et al. Endemic infections of Parastrongylus (=Angiostron-gylus) costaricensis in two species of nonhuman primates, raccoons, and an opossum from Miami, Florida // J. Parasitol. - 2006. - 92. - P. 406 - 408.
Morera P. Abdominal angiostrongyliasis: a problem of public health // // Parasitol. today. - 1985. - l.-P. 173 -175.
Morera P., Cespedes R Angiostrongylus costaricensis n. sp. (Nematoda: Metastrongyloidea), a new lungworm occurring in man in Costa Rica // Rev. Biol. Trop. - 1971. -18. - P. 173- 185.
Morton N. J., Britton P., Palasanthiran P., Bye A., Sugo E., Keeson A. Severe haemorrhagic meningoencephalitis due to Angiostrongylus cantonensis among young children in Sydney, Australia // Clin. Infect. Dis. -2013.-57, 8.-P. 1158-1161.
Murphy G. S., Johnson 5. Clinical aspects of eosinophilic meningitis and meningoencephalitis caused by Angiostrongylus cantonensis, the rat lungworm 11 Hawaii J. Med. Public Health. - 2013. - 72, (6 Suppl. 2). -P. 35-40.
Yew D., Little M. D., Cross J. Angiostrongylus cantonensis infection from eating raw snails // New England J. Med.-1995.-332, 16.-P. 1105-1106.
Nomura S., Lin P. H. First case report of human infection with Haemostrongylus ratti, Yokagawa I I Taiwan No. Ikai. - 1945. -3. -P. 589-592.
Panackel V., Vishad, Cherian G., Vijayakumar K, Sharma R N. Eosinophilic meningitis due to Angiostrongylus cantonensis // Indian J. Med. Microbiol. - 2006. - 24, 3. - P. 220 - 221.
Pascual J. E, Bouli R P., Aguiar H. Eosinophilic meningoencephalitis in Cuba, caused by Angiostrongylus cantonensis II Am. J. Trop. Med. Hyg. - 1981. -30, 5. -P. 960 - 962.
Pena G. P. M., Andrade Filho J. de S, Assis S. C. de. Angiostrongylus costaricensis'. first record of its occurrence in the state of Espirito Santo, Brazil, and a review of its geographic distribution // Rev. Inst. Med/ trop. Sao Paulo. - 1995. -37, 4. -P. 369 - 374.
Prociv P., Spratt D., Carlisle M. Neuro-angiostrongyliasis: unresolved issues // Intern. J. Parasitol. - 2000. -30, 12 - 13. -P. 1295- 1303.
Punyagupta S. Angiostrongyliasis: clinical features and human pathology / Cross J. H., editor. Studies on angiostrongyliasis in Eastern Asia and Australia. - NAMRU-2-SP-44. Taipei, Taiwan: US Army Medical Research Unit No. 2. - 1979. - P. 138 - 150. (цит. no: Eamsobhana, Yong, 2009).
Punyagupta S, Juttiyudata P., Bunnag T. Eosinophilic meningitis in Thailand. Clinical studies of 484 typical cases probably caused by Angiostrongylus cantonensis 11 Am. J. Trop. Med. Hyg. - 1975. - 24, 6, pt. l.-P. 921 -931.
Qvarnstrom Y., Sullivan J. J., Bishop H. S, Hollingsworth R., da Silva A. J. PCR-based detection of Angiostrongylus cantonensis in tissue and mucus secretions from molluscan hosts // Appl. Environ. Microbiol. -2007. - 73.-P. 1415-1419.
Ramirez-Avila L., Slome S, Schuster F. L., Gavali S. et al. Eosinophilic meningitis due to Angiostrongylus and Gnathostoma species // Clin. Infect. Dis. - 2009. - 48, 3. - P. 322 - 327. doi: 10.1086/595852.
Robles M. R, Kinsella J. M., Galliari C., Navone G. T. New host, geographic records, and histopathologic studies of Angiostrongylus spp. (Nematoda: Angiostrongylidae) in rodents from Argentina with updated summary of records from rodent hosts and host specificity assessment // Mem. Inst. Oswaldo Cruz, Rio de Janeiro. -2016. - 111, 3. http://dx.doi.org/10.1590/0074-02760150371.
Romero-Alegria A., Belhassen-Garcia M., Velasco-Tirado V., Garcia-Mingo A. et al. Angiostrongylus costaricensis'. Systematic review of case reports // Advances in Infectious Diseases. -2014.-4, 1. - P. 36 - 41. http://dx.doi.org/10.4236/aid.2014.41007
Rosen L., LaigretJ., Bories S. Observations on an outbreak of eosinophilic meningitis on Tahiti, French Polynesia // Am. J. Hyg. - 1961. - 74. - P. 26 - 42.
Rosen L., Loison G., Laigret J, Wallace G. D. Studies on eosinophilic meningitis. 111. Epidemiologic and clinical observations on Pacific islands and the possible etiologic role of Angiostrongylus cantonensis // Amer. J. Epidemiol. - 1967.-85, l.-P. 17-44.
Sawanyavisuth K, Takahashi K, Hoshuyama T„ Senthlong V. et al. Clinical factors predictive encephalitis caused by Angiostrongylus cantonensis 11 Am. J. Trop. Med. Hyg. - 2009. - 81. - P. 698 - 701.
Senanayake S. N., Pryor D. N., Walker J. et al. First report of human angiostrongyliasis acquired in Sydney // Med. J. Australia. - 2003. - 179. - P. 430 - 431.
Sierra E., Morera P. Angiostrongilosis abdominal. Primero caso humano encontrado en Honduras (hospital Evangelico de Siguatepeque) // Acta Med. Costar. - 1972. - 14, 1. - P. 95 - 99.
33
SinawatS., SanguansakT., AngkawinijwongT., Ratanapakorn T. etal. Ocularangiostrongyliasis: clinical study of three cases//Eye (Lond). - 2008. - 22, 11. - P. 1446-1448. doi: 10.1038/eye.2008.135.
Slom T J., Cortese M. M., Gerber S. L, Jones R. C., Holtz T. H. et al. An outbreak of eosinophilic meningitis caused by Angiostrongylus cantonensis in travelers returning from the Caribbean // New England J. Med. -2002.-346, 9.-P. 668-674.
Spratt D. Л/. Species of Angiostrongylus (Nematoda: Metastrongyloidea) in wildlife: A review // Intern. J. Parasitol.: Parasites and Wildlife. -2015. -4, 2. -P. 178 - 189.
Tangchai P., Nye S. W., Beaver P. C. Eosinophilic meningoencephalitis caused by angiostrongyliasis in Thailand. Autopsy report П Am. J. Trop. Med. Hyg. - 1967. - 16, 4. - P. 454 - 461.
Thiengo S. C, Maldonado A., Mota E. M., Torres E. J. L, Caldeira R. et al. The giant African snail Achatina fulica as natural intermediate host of Angiostrongylus cantonensis in Pernambuco, northeast Brazil // Acta Trop. -2010. - 115. -P. 194- 199.
Thu T P., Nguyen N. X, Lan le T, Kiichle M. [Ocular Angiostrongylus cantonensis in a female Vietnamese patient: case report] // Klin. Monbl. Augenheilkd. - 2002. - 219, 1. - P. 892 - 895. (Article in German).
Tsai H. C, Liu Y. C, Kunin С. M., Lee S. S. et al. Eosinophilic meningitis caused by Angiostrongylus cantonensis-. report of 17 cases // Am. J. Med. - 2001. - 111, 2. -P. 109 - 114.
Ubelaker J. E. Systematic of species referred to the genus Angiostrongylus I I J. Parasitol. - 1986. - 72, 2. - P. 237-244.
Velasquez C. Molluscs of parasitological significance in the Philippines. - U.P. Press, 1972. - 16 pp.
Velazquez Z. J, Baquedano R. W., Perez R. A., Bates Flores M. Angiostrongylus costaricensis. Primeros casos mexicanos // Rev. Inst. Mexicamos. - 1974. - 26. - P. 389 - 394.
VuongP. N, Brama P., Bonete R., Houissa-VuongS. et al. [Necrotic eosinophilic angiitis with ileal perforation and peritonitis secondary to abdominal angiostrongyliasis] // Presse Med. - 2002. - 31, 36. - P. 1700 - 1703. (Article in French).
Wallace G. D., Rosen L. Studies on eosinophilic meningitis. IV. Experimental infection of fresh-water and marine fish with Angiostrongylus cantonensis // Amer. J. Epidemiol. - 1967. - 85. - P. 395 - 402.
WangJ.-J, Chung L.-Y., Lin R.-J., Lee J.-D. et al. Eosinophilic meningitis risk associated with raw Ampullar-ium canaliculatus snails’ consumption // Kaohsiung J. Med. Sci. - 2011. - 27, 5. - P. 184 - 189.
Wang J., ZhengX. Y., Yin С. H, Guo Z. Z. et al. [Epidemiological analysis on 141 cases of angiostrongyliasis cantonensis in Beijing] // Z hongu a Liu Xing Bing Xue Za Zhi. - 2008. - 29. - P. 27 - 29. (Chinese text).
Wang Q.-P., Lai D.-H, Zhu X Q., Chen Z.-G., Lunn Z.-R. Human angiostrongyliasis 11 Lancet Infect. Dis. -2008. - 8.-P. 621 -630.
Wei J, WuZ. Angiostrongylus cantonensis in China / Treatment of Human Parasitosis in Traditional Chinese Medicine. -MehlhomH., WuZ., Ye B. (Eds.) - Parasitol. Res. Monogr. - 2013. - 6. - P. 215 - 237. DOI 10.1007/978-3-642-39824-7J 4.
Wu S. S., French S. W., Turner J. A. Eosinophilic ileitis with perforation caused by Angiostrongylus (Parastrongylus) costaricensis. A case study and review // Arch. Pathol. Lab. Med. - 1997. - 121, 9. - P. 989 -991.
Yokogawa S. A new species of nematode found in the lung of rats, Haemostrongylus rattv. sp. nov. // Trans. Nat. Hist. Soc. Formosa. - 1937. - 27. - P. 247 - 250.
Yeung N. W., Hayes K. A., Cowie R. H. Effects of washing produce contaminated with the snail and slug hosts of Angiostrongylus cantonensis with three common household solutions 11 Hawaii J. Med. Public Health. -2013. - 72.-P. 83-86.
Zambrano Z. Ileocolitis pseudotumoral eosinofilica de origen parasitario I I Rev. Latinoam. Patol. - 1973. -12, l.-P. 43-50.
Zanini G. M., Graeff-Teixeira C. Inactivation of infective larvae of Angiostrongylus costaricensis with short time incubations in 1.5 % bleach solution, vinegar or saturated cooking salt solution // Acta Tropica. - 2001. -78, l.-P. 17-21.
Zhou Z., Barennes H, Zhou N., Ding L., Zhu Y. H, Strobel M. [Two outbreaks of eosinophilic meningitis in Yunann (China) clinical, epidemiological and therapeutical issues] // Bull. Soc. Pathol. Exot. - 2009. -102, 2.-P. 75-80.
ZiliottoA., Kunzle J. E, Fernandes L. A., Prates-Campos J. C, Britto-Costa R. Angiostrongiliase: apresenta-caode unprovavel caso//Rev. Inst. Med. Trop. - 1975. -17. -P. 312-318.
34
Семейство Anisakidae Railliet et Henry, 1912
В таксономических сводках разных лет семейство Anisakidae включают в класс Chro-madorea в составе отряда Spirurida (Hodda, 2011) или же Rhabditida1, в класс Secementea в составе отряда Ascaridida (Moravec, 1994), или же в класс Phasmidea в составе отряда As-caridata (Despommier D. D., Karapelou J. W. Parasitic life cycles. - Springer - Verlag, 1987. -127 pp.). Подобные разночтения, с которыми мы не раз будем сталкиваться при обзоре того или иного семейства нематод, свидетельствуют об отсутствии у специалистов единого мнения о структуре данной группы гельминтов и филогенетических взаимоотношениях различных таксонов внутри неё.
Описание (из: Гаевская, 2005 - по разным авторам). Обычно крупные черви, с плотной, поперечно исчерченной кутикулой. У некоторых форм кутикула несёт ряды шипиков. Ротовое отверстие окружено тремя хорошо развитыми губами -одной дорсальной и двумя несколько меньшими вентролатеральными; у некоторых форм они могут быть вооружены зубчиками, зубовидными образованиями или зубчатыми гребнями. У представителей отдельных родов губы разделены тремя, более мелкими интерлабиями. Форма, расположение и вооружение губ, наличие или отсутствие интерлабий являются важными признаками в систематике анизакид. Ротовое отверстие ведёт в прямой, цилиндрический, иногда слегка расширенный во второй половине пищевод (oesophagus), который состоит из переднего (мышечного) и заднего (железистого; его называют желудочком - ventriculus) отделов. Иногда желудочек слабо выражен, почти редуцирован. Кишечник в виде прямой трубки, ограниченной однослойным столбчатым эпителием. Его терминальная часть - ректум открывается анальным отверстием на заднем конце тела. С ректумом связаны три крупных анальных железы. В месте перехода желудочка в кишечник у представителей разных родов имеются или желудочный (ventricular appendix), или кишечный (intestinal caecum) выросты (отростки), или одновременно тот и другой, иногда их может быть несколько, или же оба выроста отсутствуют. По мнению многих исследователей, особенности строения пищеварительной системы анизакид являются одними из основных признаков в их систематике. Вокруг пищевода располагается нервное кольцо. У самцов две спикулы, обычно равные и внешне одинаковые. Рулёк имеется, но чаще отсутствует. Хвостовые генитальные папиллы сидячие (их количество и расположение используют в систематике анизакид). Вульва в средней части тела. Яйца с гладкой оболочкой. Выделительная система асимметричная, представлена железистой клеткой, связанной каналом с экскреторной порой, открывающейся вентрально. У представителей одних родов она располагается между основанием субвентральных губ, у других - заметно выше нервного кольца, у третьих - на его уровне или чуть ниже. Положение экскреторной поры - один из основных признаков в систематике анизакид. Взрослые формы - паразиты пресмыкающихся, земноводных, птиц и млекопитающих. Типовой род - Anisakis Dujardin, 1845.
1 Vanaverbeke J., Shamsi S. (2015). Ascaridoidea Baird, 1853. Accessed through: World Register of Marine Species at http://www.marinespecies.org/aphia.php?p=taxdetails&id=22816 on 2016-04-08.
35
Взрослые формы анизакид - преимущественно паразиты пищеварительного тракта водных животных или животных, экологически связанных с водной средой, - пресмыкающихся, земноводных, птиц и млекопитающих. Личинок этих нематод регистрируют у представителей практически всех групп водных животных - от беспозвоночных до позвоночных. Для прохождения жизненного цикла паразиту необходима последовательная смена двух - трёх, а иногда и четырёх хозяев, связанных трофическими отношениями. Смена хозяев обычно сопровождается чередованием поколений паразита.
Многие исследователи считают, что полностью и, главное, достоверно расшифровать жизненный цикл любого представителя анизакид можно только при условии экспериментального заражения животных личинками соответствующих стадий или же выращиванием в искусственных средах личинок и яиц. Подобные эксперименты позволяют не только установить этапы развития паразита, но и выявить факторы, влияющие на продолжительность тех или иных стадий, что имеет немаловажное значение в изучении эпидемиологии анизакид и профилактике ани-закидозисов человека и полезных животных.
Представители семейства Anisakidae распространены по всему земному шару: их находят в арктических и антарктических водах, в умеренных широтах и тропическом поясе, в морских и континентальных водоёмах.
Семейство анизакид - в числе одних из самых крупных среди паразитических нематод; оно объединяет 18 родов с 224 видами (Hodda, 2011). Поскольку в сферу наших интересов входят только те из них, которые, в случае попадания к человеку, опасны для его здоровья, то таковых немного - это представители родов Anisakis, Contracaecum Railliet et Henry, 1912 и Pseudoterranova Mozgovoy, 19502.
Однако, прежде чем приступить к их описанию, отмечу, что с человеком, как с хозяином, анизакиды эволюционно не связаны, и по этой причине совершенно чужды его организму. Попадая в новую, фактически агрессивную для них среду, личинки активно ищут выход из неё, глубоко внедряясь в стенки желудочно-кишечного тракта и травмируя их. В организме человека они не способны развиваться и достигать половой зрелости, но могут выживать достаточно долго, и даже проходить линьку до 4-й стадии, вызывая определённые патологические изменения. В результате возникает бурная неспецифическая реакция аллергического типа, ведущая к формированию иммунного воспаления, характерного для инфекционной этиологии вообще и некоторых гельминтозных заболеваний человека, в частности.
2 В 2005 г. мною опубликована монография «Анизакидные нематоды и заболевания, вызываемые ими у животных и человека». В ней приведены сведения об особенностях морфологии, жизненных циклах, патогенности, распространении нематод семейства анизакид, представляющих потенциальную опасность для здоровья людей и полезных животных; изложена история возникновения проблемы анизакидозисов человека, приведена информация о патогенности анизакид для человека, распространении этого заболевания и путях заражения людей; описаны методика обследования рыб на наличие анизакид, определения жизнеспособности этих паразитов и их фиксации, а также методы обеззараживания рыбы и морепродуктов. Среди описанных в монографии анизакид были и роды Hysterothylacium Ward et Magath, 1917 и Raphidascaris Raillet et Henry, 1915, чьими окончательными хозяевами являются рыбы. Эти роды в настоящее время практически все исследователи рассматривают в составе семейства Raphidascarididae.
36
Род Anisakis Dujardin, 18453
Синонимы: Stomachus (Goeze inZeder, 1800)
Filocapsularia Deslongschamps, 1824
Peritracheilus Diesing, 1851 Conocephalus Diesing, 1860
Описание (из: Гаевская, 2005 - по разным авторам). Довольно крупные нематоды. Тело цилиндрическое, с округлым передним и коническим суженным задним концами. Рот окружён тремя хорошо развитыми губами, каждая губа с двудольчатым выступом, который несёт одинарное кольцо зубчиков. У основания дорсальной губы две сенсорных папиллы, на обеих вентролатеральных губах - по одной. Интер-лабии отсутствуют. Экскреторная пора открывается на головном конце между вентролатеральными губами. Пищевод состоит из мышечной передней части с крупными железистыми клетками, и железистой задней части - желудочка, имеющего иногда сигмоидальную форму. Желудочный и кишечный отростки отсутствуют. Спикулы короткие и равные или почти равные, или же относительно длинные и неравные; имеются 3 или 4 пары постанальных хвостовых папилл. Вульва располагается впереди. Яйца от округлой до овальной формы, оболочка гладкая, прозрачная. Паразиты желудка и кишечника морских млекопитающих, главным образом китов4. Типовой вид - Anisakis simplex (Rudolphi, 1809, det. Krabbe, 1878) Baylis, 1920.
Род Anisakis установлен 170 лет назад (Dujardin, 1845) для вида Ascaris simplex Rud., 1809 (первоначально в статусе подрода в составе рода Ascaris). Однако это родовое название вскоре было забыто, и в течение многих десятилетий нематод, которых следовало бы отнести к Anisakis, описывали под другими названиями, чаще всего, Ascaris. Особенно сильны были разночтения в определении этих паразитов применительно к их личиночным формам, которых находили в рыбах.
Родовое название Anisakis восстановили в 1912 г. Виды Anisakis морфологически очень похожи и трудно различимы. Возможно, по этой причине из 21 вида Anisakis, описанного к 1971 г., Д. Дэйви (Davey, 1971) оставил только три валидных: Anisakis simplex, A. typica (Diesing, 1860) (синоним: A. tursiops Crusz, 1946) и A. physeteris Baylis, 1923 (синонимы: A. skrjabini Mozgovoi, 1946; A. oceanica Johnston & Mawson, 1951; A. brevispiculata Dollfus, 1968). Все остальные или были сведены в синонимы A. simplex, или же рассматривались как нуждающиеся в дополнительном изучении.
С конца 1980 - начала 1990-х годов и по настоящее время при изучении анизакид широко применяется электрофоретический метод, который позволяет выявить наличие репродуктивной изоляции между популяциями бисексуальных организмов и установить, принадлежат ли они к разным видам или нет, а также дать количественную оценку их генетической дивергенции (Mattiucci Nascetti, 2006; Nascetti et al., 1986; Orec-chia et al., 1986). В результате выяснилось, что в роде Anisakis под одним и тем же видовым названием, чаще всего Anisakis simplex, во многих случаях в действительности скрывались разные виды, а синонимия ряда видов оказалась необоснованной.
3 А. Акмирза (Akmirza, 1998) рассматривает род Anisakis в семействе Heterocheilidae.
4 Известна находка Anisakis sp. у чёрной глупой крачки в Австралии (Johnston, Mawson, 1951).
37
Род Anisakis имеет всесветное распространение - его представителей
находят практически во всех океанах и морях, даже в таком внутриконти-нентальном море, как Каспийское, на всех широтах - от Арктики до Антарктики.
Жизненный цикл нематод включает свободноплавающие личиночные ста-
дии, паразитические личиночные стадии в промежуточных и резервуарных (транс-
портных) хозяевах, паразитические личиночные и взрослые стадии в окончательном хозяине - морских млекопитающих (рис. 8).
Рис. 8 Предполагаемая схема жизненного цикла Anisakis simplex в открытых водах (-) и возможная циркуляция в прибрежных / солоноватых водах (- -): а -яйца с личинками 1 -3-й стадий, LI-3; b -свободноплавающая L3 в чехлике; с - предполагаемый (транспортный) хозяин с личинками, покинувшими чех-лик; d - обязательный промежуточный хозяин (эуфаузииды с L3); е, i, j - транспортные хозяева с L3; f - окончательный хозяин; g - висцера транспортного хозяина с L3; h - свободноплавающие L3 из погибших обязательных промежуточных или транспортных хозяев (из: Koie, 2001).
Яйца нематоды с зародышем на
стадии протопласта попадают в воду вместе с фекалиями морских млекопитающих. Эмбриональное развитие и первые две линьки личинки проходят в плавающем в воде яйце (Koie, 2001; Koie et al., 1995). Время развития зависит от температуры; например, у А, simplex оно обратно пропорционально температуре и занимает от 3 до 21 дня (5 -21°С), но не зависит от солёности (Hojgaard, 1998). Вышедшие из яиц личинки 3-й стадии достигают в длину 0.25 - 0.28 мм и одеты в толстую эластичную кутикулу личинок 2-й стадии. Эта похожая на кокон, исчерченная, с двумя боковыми высту
пами кутикула увеличивает плавучесть личинок, которые всегда сосредотачиваются в толще воды.
Первый промежуточный хозяин паразита - главным образом эуфаузииды, хотя и известны случаи обнаружения этих личинок в креветках, амфиподах и крабах. Эуфаузииды заглатывают плавающих в воде личинок, в их организме те осво
38
бождаются от чехлика и мигрируют в гемоцель (кровеносную полость). Между плавающими в воде личинками и эуфаузиидами могут вклиниться так называемые транспортные хозяева - мелкие ракообразные, например, копеподы, которые проглотили личинок, а затем, став жертвой эуфаузиид или других ракообразных, а также рыб-планктофагов, передали им этих паразитов.
Рыбы и головоногие моллюски, питающиеся эуфаузиидами, получают с пищей и личинок 3-й стадии. От мелких рыб или кальмаров личинки могут попасть к крупным хищным рыбам или кальмарам, а также встречаться в свободном состоянии в планктоне, куда попадают после гибели их хозяев - рыб и беспозвоночных. К слову, личинки Anisakis simplex из сельди сохраняют жизнеспособность в солоноватой и морской воде, по меньшей мере, в течение 6 недель (Koie, 2001). Возможность подобной трансмиссии нематод от одного вида рыб к другому, от одного вида головоногих моллюсков к другому или же к рыбам и их последующего выживания в новом хозяине подтверждена экспериментально (Larsen et al., 2002; Smith, 1974; Rolbiecki et al., 2001).
Взрослые формы Anisakis паразитируют в пищеварительном тракте морских млекопитающих, прежде всего, китов; по этой причине они даже получили название «китового червя» («whale-worm»). В целом, среди их хозяев более 50 видов китов и ластоногих. Известны находки этих нематод и у других млекопитающих; например, на северо-западном побережье Канады личинки Anisakis sp. были выявлены в кишечнике речной выдры (Hoberg et al., 1997). Однако могут ли попавшие в иных млекопитающих личинки развиться в их организме во взрослую форму - пока не ясно. Окончательные хозяева заражаются нематодами, поедая эуфаузиид, рыб, кальмаров, заражённых личинками 3-й стадии. В их организме личинки последовательно проходят третью и четвёртую линьки, и превращаются сначала в 4-ю пред-взрослую стадию, а затем во взрослую форму.
К настоящему времени род включает 11 достоверных видов5. Наиболее известен среди всех видов Anisakis - A. simplex, возможно, по той причине, что это был первый представитель рода, обнаруженный у человека ещё в середине прошлого столетия, и оказавшийся, к тому же, широко распространённым и чрезвычайно патогенным для людей. Помимо того, к числу опасных для человека относят A. pegreffii Campana-Rouget et Biocca, 1955 и Л. physeteris Baylis, 1923. Можно предположить, что потенциально опасными для человека могут быть все представители рода Anisakis.
Anisakis simplex [=Ascaris simplex Rud., 1809; —Anisakis patagonica (von Lin-stow, 1880); =Anisakis kuekenthalii Cobb, 1889; =Anisakis rosmari Ъау\\з, 1916; =Anisakis catodontis Baylis, 1929; =Anisakis aZataHsu, 1933; =Anisakis kogi-ae Johnston et Mawson, 1939; —Anisakis tridentata Kreis, 1939; —Anisakis iva-nizkii Mozgovoi, 1949; =Anisakis kukenthhaliil>AozgoNo\, 1951; =Anisakis marina van Thiel, 1966]6 (рис. 9). Впервые паразит описан на материале из желудка тюленя под названием Ascaris simplex Rud., 1809. Видовое название от латинского simplex -простой.
5 WoRMS (2015). Anisakis Dujardin, 1845. Accessed through: World Register of Marine Species at http://www.marinespecies.org/aphia.php?p=taxdetails&id=22832 on 2016-04-08.
6 Синонимы no WoRMS (2015) (см. сноску 5).
39
Рис. 9 Anisakis simplex'. 1 - хвостовой конец тела самки, латерально; 2 - яйцо; 3 - хвостовой конец тела самца, вентрально (из: Мозговой, 1953)
Нематоды среднего размера. Кутикула поперечно исчерчена по всему телу с интервалами 3 - 5 цт в начале тела и 35 - 51 цт на его середине. Цервикальные сосочки очень крупные, выступающие. Нервное кольцо располагается выше уровня цервикальных сосочков. Пищевод прямой, незначительно расширяющийся кзади. Длина тела половозрелых самцов колеблется от 47 до 75 мм. Хвостовые сосочки многочисленные: преанальных 60 - 72 пары и один непарный, постанальных 6 пар и анальных 1-2 пары. Спикулы неравные, длиной 2.0 - 2.5 и 1.7 - 1.9 мм, слегка изогнуты вентрально. Длина тела половозрелых самок от 55 до 160 мм. Хвост прямой, притуплённый. Вульва открывается на середине тела. Яйца круглые или почти круглые, 47 - 53 цш в диаметре. Плодовитость червей очень высока; подсчитано, что у взрослых самок длиной около 130 мм в матке содержится до 1 млн. яиц (Aspholm, 1994b).
Предзврослые и взрослые особи A. simplex поселяются в основном в желудке своих хозяев - морских млекопитающих. К примеру, в исландских водах у тюленя обыкновенного в желудке локализовалось 79 % всех особей нематод данного вида, а у тюленя серого - 83 % (Olafsdottir, Hauksson, 1994).
В обширной литературе можно найти множество примеров, иллюстрирующих особенности распространения отдельных видов Anisakis среди разных видов хозяев и в различных регионах Мирового океана. Например, в числе хозяев A. simplex (sensu lato) известны ремнезуб атлантический, дельфины белобокий, беломордый, бурый, дельфин-францисканец, афалина, свиньи белокрылая морская и колючеплавниковая морская, белуха, бутылконос высоколобый, тюлени обыкновенный, серый и гренландский, сейвал, кашалот, касатка малая, полосатик остромордый и многие другие (см.: Гаевская, 2005).
Анализ литературных данных, посвящённых встречаемости анизакид, в том числе A. simplex, у морских млекопитающих, показывает, что среди паразитирующих у них нематод эти гельминты являются одними из наиболее многочисленных. Количество червей, обнаруживаемых в одном животном, может достигать огромных величин - многих десятков тысяч. И даже осреднённые данные об их числен
40
ности в одной особи хозяина наглядно свидетельствуют о том, сколь высокой может быть общая численность анизакисов в его популяции. Как-то подсчитали, что в желудке полосатика остромордого находится в среднем 40 000 экз. A. simplex (Aspholm, 1994b).
Паразитирование A. simplex в желудочно-кишечном тракте морских млекопитающих во многих случаях не проходит для них бесследно. Известно множество примеров патогенного воздействия этих гельминтов на их хозяев. Чаще всего оно проявляется образованием язв на стенках желудка, иногда им сопутствует гастрит (Motta et al., 2008). Приведу только один, но довольно типичный пример. В желудках семи из 10 морских свиней, попавших в тресковые сети у атлантического побережья Канады, были выявлены личинки и взрослые особи A. simplex (Smith, 1989). При этом взрослые черви располагались в просвете желудка, а личинки - в язвах в его стенке. У пяти дельфинов в стенке вентрального сектора переднего желудка выявлено по одному крупному кратероподобному изъязвлению, содержащему гроздь личинок 3 и 4-й стадий развития. У шестого животного в одной большой язве, помимо грозди личинок, наблюдалось скопление из шести очень мелких язв, три из которых содержали личинок. У последнего из заражённых дельфинов отмечена крупная множественная язва, с 5 кратерами, в каждом из которых находилась гроздь личинок.
У тюленя обыкновенного из исландских вод 70 % язв располагалось в вентральном и левом латеральном отрезке дна и в пилорическом отрезке желудка (Aspholm, 1994а).
Помимо морских млекопитающих - истинных хозяев анизакисов, случайными хозяевами этих гельминтов могут оказаться наземные млекопитающие, о чём свидетельствуют отдельные публикации. Например, у пса в Англии наблюдали рвоту после того, как тот съел свежую пикшу, содержащую анизакисных личинок (цит. по: Margolis, 1977).
Известно, что на звероводческих фермах пушных зверей часто кормят морской рыбой. С целью изучения возможного негативного влияния личинок A. simplex на здоровье выращиваемых норок, животным скормили по 15 или 30 личинок 3-й стадии, извлечённых из мерлузы и заложенных внутрь кормовых «шариков» (Margolis, Beverley-Burton, 1977). У большинства животных быстро наступила сильная реакция с повторяющейся рвотой и дефекацией, дрожью, и другими признаками недомогания, тогда как другие не проявили явных признаков дискомфорта. Во всех наблюдаемых случаях рвота и/или дефекация наступали в течение 3 ч после скармливания личинок, а в одном случае - соответственно через 30 и 45 мин. У норки, которая не испытывала ни дрожи, ни рвоты, ни дефекации, при вскрытии спустя час в желудке и двенадцатиперстной кишке было обнаружено 26 личинок. При вскрытии остальных подопытных животных спустя 4 ч после заражения признаков проникновения личинок не наблюдалось.
Один из авторов цитируемой работы привёл случай из своей давней практики, когда его попросили определить червей, обнаруженных в большом количестве в фекалиях разводимых норок. Животные находились в плохом состоянии и медленно росли. Черви были определены им как личинки Anisakis.
Итак. Заражение водных млекопитающих A. simplex происходит через рыбу, головоногих моллюсков и ракообразных, наземных млекопитающих - только через рыбу. Заражение человека связано с употреблением в пищу и рыб и головоногих
41
моллюсков. Во всех случаях в роли этиологического агента выступают личинки 3-й стадии.
Анизакисных личинок, регистрируемых у рыб, в прежние времена описывали под разными названиями: Ascaris marina, A. salaris, A. simplex, A. sphyranurae, Ascaris sp., Anisakis marina, Capsularia marina, Stomachus marina и даже Eustoma rotundatum. В 1970 - 1990-е годы их чаще всего именовали Anisakis simplex или же Anisakis sp., а также Anisakis larva (1) или же Anisakis sp. Type I (то же, что Anisakis simplex), Anisakis sp. larva (2) или же Anisakis sp. Type II (то же, что A. physeteris). Японские авторы различали 3 типа личинок: Anisakis sp. I, Anisakis sp. II и Anisakis sp. III. Первый из них соответствовал A. simplex из европейских вод, второй - Anisakis Type II, а третий тип был обнаружен только однажды (эта личинка имела короткий желудочек, как у Anisakis sp. II, и маленький мукрон на хвосте, как у Anisakis sp. I).
В рыбах личинки обычно локализуются в полости тела, особенно в её заднем отделе, где они инкапсулируются (иногда могут быть без капсулы) на брыжейке, печени, гонадах, пилорических придатках; встречаются они также в мускулатуре и в паренхиме гонад (рис. 10).
Рис. 10 Личинки Anisakis simplex на печени сайды (из: Гаевская, 2005)
В головоногих моллюсках личинки нематод обычно располагаются в цистах на наружной стенке желудка, на мантии, в полости яичника, семенника, иногда встречаются на яичнике, но могут также поражать мускулатуру головоногих (Гаевская и др., 1986; Nagasawa, 1993). Чаще всего нематод отмечают у кальмаров, иногда у каракатиц. В ряде случаев личинки в висцере рыб и головоногих моллюсков могут образовывать отдельные скопления из большого количества особей (Abollo et al, 2001; Berland, 1981).
Личинки свёрнуты в плоскую спираль, располагаются в прозрачных или полупрозрачных, бесцветных или слегка желтоватого цвета, тонких цистах. Иногда их можно найти в свободном состоянии: видимо, к моменту обнаружения они не успели образовать цисту. Передний конец личинки, свёрнутой в капсуле, направлен к наружной стороне спирали; большинство личинок не проявляют никаких признаков движения или активности. По внешнему облику личинки 3-й стадии очень похожи на взрослые формы, но имеют меньшие размеры, а степень развития губ и внутренних органов зависит от этапа онтогенеза (рис. 11, 12).
Диаметр цист 1.5-6 мм, длина личинок обычно 1.5- 4 см при максимальной ширине 0.14 - 0.57 мм. Тело слегка прозрачное, серое, удлинённое, цилиндрическое, заострённое к обоим концам. Кутикула хорошо развита, с тонкой поперечной исчерченностью. Ниже уровня нервного кольца имеются шейные сосочки. Губы незаметные. Вокруг треугольного ротового отверстия располагаются сосочки -два дорсолатеральных и два вентролатеральных. На голове имеется заметный личиночный (сверлильный) зуб. Экскреторная пора открывается на головном конце, 42
ниже вентрально ориентированного сверлильного зуба. У живых личинок в передней части тела сквозь его стенки ясно виден контур крупного желудочка в виде белого пятнышка. Задний край желудочка характерно скошен; треугольный просвет кишечника сильно сокращён. Ректум окружён тремя анальными железами и открывается анальным отверстием. Хвост короткий, конический, заканчивается острым кутикулярным выступом, так называемым мукроном (mucron) длиной (по разным данным) 11-25 или 19-32 щп. Личинка в рыбе не питается и находится в состоянии покоя.
Рис. 11 Anisakis simplex: схема строения личинки 3-й стадии (а и б - передний и задний концы тела; в - детали строения пищеварительной системы) (из: Гаевская, Ковалёва, 1990)
Рис. 12 Anisakis simplex (s. 1.): головной конец тела, апикально (из: Gibson, 1970)
Личинки Anisakis необычайно широко распространены у морских и
океанических рыб, их можно встретить даже у солоноватоводных и некоторых пресноводных хозяев (Гаевская, 2004, 2005). Перечислить все виды рыб и головоногих моллюсков, у которых они найдены, практически невозможно, т.к. это заняло бы не один десяток страниц, да и особой необходимости в этом нет. Наиболее заражены этими нематодами прибрежные рыбы, для эпипелагических и глубоководных рыб характерна более низкая заражённость. Подобные различия во многом обусловлены особенностями распределения окончательных и промежуточных хозяев этих паразитов в океане. В прибрежных водах обычно наблюдается наиболее высокая плотность популяций морских млекопитающих, ракообразных и рыб, чем в других комплексах (пелагическом, глубоководном и др.), в результате чего здесь создаются оптимальные условия для осуществления жизненного цикла паразита. Но даже один и тот же вид рыбы в разных частях своего ареала может быть по-разному заражён этими гельминтами, что зависит от множества абиотических и биотических факторов.
43
Учитывая те изменения, которые произошли в составе рода Anisakis, накопившуюся в литературе информацию о встречаемости этих личинок у рыб анализировать довольно трудно. В этой связи подчеркну ещё раз, что основной целью данной монографии является не ревизия таксономического статуса нематод, в том числе анизакид, а обобщение и анализ современного состояния изученности тех из них, которые, попадая к человеку алиментарным путём, представляют опасность для его здоровья.
Первый случай заражения человека анизакисными личинками официально зафиксирован в 1954 г. в Нидерландах. Именно тогда врач Страуб (Straub) сообщил о пациенте, страдавшем сильными брюшными болями и кишечным расстройством после употребления в пищу слегка подсоленной сельди (по: Van Thiel et al., 1960). Спустя сутки после появления указанных симптомов была проведена лапаротомия (вскрытие брюшной полости). В подвздошной кишке пациента обнаружили язву диаметром 1.5 см, из которой в просвет кишечника выступал червь длиной 1.3 см.
Первой научной публикацией, в которой содержалась информация о заражении людей анизакисами, является выше процитированная статья (Van Thiel et al., 1960). В ней сообщалось о том, что в Нидерландах с 1955 по 1959 гг. было отмечено 11 случаев проявления у людей острого желудочно-кишечного синдрома, включавшего сильные и внезапные брюшные колики, жар. При этом двое из пациентов скончались (предполагают, что от вторичной инфекции). Исследование желудочно-кишечного тракта больных выявило личинок нематод, внедрённых в слизистую и окружённых флегмонной инфильтрацией всех слоёв желудочной и/или кишечной стенки с эозинофилами.
В 1960 г. в Нидерландах была создана специальная комиссия по изучению данной проблемы, так называемый «Anisakis Committee» (Ruitenberg, 1970). Именно работа данной комиссии способствовала выработке законодательных мер, направленных на обеззараживание рыбы до её поступления к потребителю. Эти меры, как будет показано ниже, включали глубокую предварительную заморозку рыбы при соответствующем температурном режиме и в определённом временном интервале или же её термическую обработку при высоких температурах.
За период с 1955 г. и по настоящее время заражение людей анизакисными личинками зарегистрировано во многих странах мира, в том числе в США, Канаде, Бразилии, Чили, Франции, Германии, Норвегии, Великобритании, Бельгии, Испании, Японии, Южной Корее, Тайване, России. Наибольшее количество пострадавших людей отмечено в странах Юго-Восточной Азии, где традиционно используют в пищу блюда из сырой рыбы, головоногих моллюсков, креветок, крабов. Среди европейских стран более всего случаев заражения людей анизакисами регистрируется в Испании, Нидерландах, Германии (EFSA, 2010; Puente et al., 2008). В скобках замечу, что хотя патогенными для человека считают не только Anisakis simplex, но и другие виды анизакид, однако 97 % всех выявленных случаев заражения людей этими нематодами относится именно кА. simplex (Rosales et al., 1999).
В Японии первые, официально зарегистрированные случаи обнаружения у человека эозинофильной гранулёмы паразитарного происхождения относятся к 1965 г. (Yokogawa, Yoshimura, 1965). Выявленных в гранулёмах нематод авторы определили как «анизакисоподобных» личинок. Эти сообщения сразу же привлекли внимание паразитологов и хирургов и, по указанию правительства, в том же 1965 г. в Японии была создана научно-исследовательская группа по изучению паразитарной гранулёмы. В эту группу входили паразитологи, патологи, хирурги, морские биологи, которые в течение трёх лет проводили исследования анизакиози-44
са в общенациональном масштабе. Тем не менее, заражение людей личинками А. simplex по-прежнему отмечается в этой стране (Kagei, Isogaki, 1992; Kino et al., 1993; Tanabe et al., 1990). На о. Хоккайдо, например, с 1980 по 1996 гг. был зарегистрирован 26661 случай заражения людей A. simplex (Ishikura et al., 1996). Подсчитано, что из общего числа ежегодно выявляемых в мире случаев анизакиазиса свыше 90 % приходится на Японию (Pravettoni et al., 2012).
В Корее первые документально подтверждённые факты заражения человека анизакисами относятся к 1968 г. (Kim et al., 1971). В дальнейшем подобные случаи здесь заметно участились. Так, только в одной из паразитологических лабораторий за 3 года - с июня 1989 по июнь 1992 гг. - зафиксировано более 100 обращений местных жителей в связи с заражением анизакидами, при этом в большинстве своём выявленные личинки относились к A. simplex (Im et al., 1995). В 1998 г. Т. Сонг с соавт. (Song et al., 1998) описали 39 случаев острого анизакиазиса в г. Инчон.
В США первый случай регистрации у людей анизакиса датируется 1973-м годом (цит. по: Jackson, 1975). Жительница Бостона шведского происхождения в течение 5 дней жаловалась на высокую температуру и боль в нижней части живота. Рентгеновское обследование показало, что у неё воспалена терминальная часть подвздошной кишки, а стенки прямой кишки утолщены. Поражённые участки удалили хирургическим путём, а затем исследовали. Выяснилось, что воспалительный процесс затронул субмукозу, мышечную ткань и полостной жир, наблюдались некротизированная гранулёма, сильно выраженные эозинофильный и фибробластический инфильтраты, клапан подвздошной кишки был утолщён, стенки прямой и подвздошной кишки отёчные. «Виновником» выявленной патологии оказалась личинка Anisakis-typt- Анамнез показал, что пациентка употребляла в пищу слегка маринованную рыбу, приготовленную по старинным скандинавским рецептам.
В Испании заражение человека анизакисом впервые описано в 1991 г. (Аге-nal et al., 1991), к 1998 г. было отмечено уже 32 подобных случая (Torre et al., 2000), в 1999-м добавился ещё один (Rosales et al., 1999).
В Бразилии информация об обнаружении у человека анизакисной личинки впервые появилась в печати всего несколько лет назад (Cruz et al., 2010). Поступивший в клинику 73-летний мужчина пожаловался на сильные брюшные боли, ощущения переполненности желудка и преждевременной сытости, появившиеся у него 3 недели назад после того, как он поел сырые морепродукты. При эндоскопии в проксимальной части тела желудка и антральном отделе обнаружилось плоское повреждение с гиперемированной поверхностью. Некоторые повреждения характеризовались изъязвлениями и густой поверхностной консистенцией. В двенадцатиперстной кишке был выявлен воспалённый участок слизистой, а в нём обнаружен свернувшийся червь.
В бывшем Советском Союзе заражение человека анизакисами впервые официально зарегистрировано в 1987 г. во Владивостоке (Соловьёва, Красных, 1989). Второй случай отмечен в 1988 г. также на Дальнем Востоке (Сердюков, 1993). В 2000-м году Г. Ф. Соловьёва и Н. А. Таран описывают ещё два случая обнаружения личинок в желудке у человека. Все пострадавшие поступали в клиническую больницу практически с одними и теми же жалобами на сильную боль в эпигастральной области, не зависящую от приёма пищи, чувство горечи во рту, сухость слизистых оболочек, тошноту, рвоту, иногда отмечали озноб и ломоту в суставах.
45
В первом случае (Соловьёва, Красных, 1989) у 47-летней женщины при эндоскопии была выявлена гиперемированная и слабо гипертрофированная слизистая желудка, а в его антральном отделе обнаружен червь длиной 21 мм; как потом определили, личинка A. simplex 4-й стадии. На месте его прикрепления располагалось красного цвета локальное 2-миллиметровое возвышение. Незадолго до появления неприятных симптомов пострадавшая поела жареного терпуга свежего вылова.
А. М. Сердюков (1993) не приводит характеристики самого заболевания, но отмечает, что заражение пациентки было связано с употреблением в пищу слабосолёной кеты.
Третий и четвёртый случаи (Соловьёва, Таран, 2000) также связаны с едой -употреблением в пищу дальневосточных рыб. У одной из пострадавших - 46-летней женщины - в теле желудка и антральном отделе на большой кривизне наблюдались обширные поверхностные эрозии с гельминтами, внедрившимися одним концом в слизистую желудка; неполные эрозии были выражены на отёчной гиперемированной слизистой вокруг привратника; небольшие геморрагии отмечены на слизистой луковице. У второй пациентки - 21-летней женщины - в антральном отделе желудка на отёчной гиперемированной слизистой обнаружилось множество неполных эрозий, в центре одной из них на большой кривизне находился червь, одним концом внедрившийся в слизистую желудка.
Общепринято считать, что об инвазии людей личинками анизакис впервые стало известно только в 1960 г. (Van Thiel et al., 1960). Однако в (EFSA, 2010) я прочитала, что впервые заражение человека анизакидами описал Leuckart ещё в 1876 г. В этой связи хочу обратить внимание на следующую публикацию. В 1964 г. Т. Осима (Oshima, 1964 - цит. по Oshima, 1972) проанализировал опубликованные с 1940 г. в различных медицинских журналах Японии статьи, в которых шла речь о регистрации гастрокишечных эозинофильных гранулём. Оказалось, что в 10 случаях из 29, т.е. более 34 %, в центре гранулём обнаруживались маленькие личинки, похожие на Ascaris. В те же годы Б. Эшби с соавт. (Ashby et al., 1965) писали, что первые сообщения об эозинофильной гранулёме в желудочно-кишечном тракте человека появились лет 25 назад, но до последнего времени (имелся в виду, безусловно, 1965 г.) этиология этих поражений оставалась неясной. Таким образом, невольно напрашивается вывод, что, в действительности, анизакиозис не новая болезнь человека, а, скорее, ранее ошибочно диагностированная или просмотренная.
Попав в желудок и/или кишечник человека, личинки Anisakis не уничтожаются его пищеварительными соками и не перевариваются, но активно проникают в мукозу и субмукозу, в основном, кишечника или желудка, повреждая их. Личинки не созревают в организме человека, который является для них случайным хозяином, однако могут проходить в нём линьку до 4-й личиночной стадии. Тем не менее, спустя несколько недель личинки погибают и кальцифицируются (Grabda, 1991). Факт гибели личинок в организме несвойственного им хозяина подтверждается экспериментами на лабораторных млекопитающих (Gibson, 1970; Grabda, 1991; Myers, 1963; Van Thiel, 1962).
Линька личинки в организме человека наступает в том случае, когда она остаётся в нём в течение 3-5 дней (Fujino et al., 1984). Это подтвердили и опыты на крысах: если личинки Anisakis оставались в желудке крыс более 3-4 дней, то у них происходила линька до 4-й предвзрослой стадии (Gibson, 1970).
46
Обычно в организм человека попадает одна особь нематоды. Возможно, это связано с тем, что уже первая попавшая в организм человека личинка вызывает столь серьёзные патологические отклонения, что пострадавшие сразу же обращаются за врачебной помощью. Пациенты с множественной инвазией анизакисами составляют, во всяком случае, в Японии, 5 - 10 % от общего числа всех случаев (Kagei, Isogaki, 1992). Упомянутые выше Г. Ф. Соловьёва и Н. А. Таран (2000) сообщают об обнаружении в слизистой желудка пациентки 4 личинок A. simplex. В Корее у 68-летней жительницы Бусана в слизистой желудка выявили 5 внедрившихся личинок нематоды (Noh et al., 2003). И уж совсем невероятным представляется случай обнаружения в желудке одной пострадавшей 56 личинок Anisakis (Kagei, Isogaki, 1992).
Как правило, у человека личинки поражают желудок и кишечник, однако в клинической практике известны их находки в глотке, поджелудочной железе, сальнике, лимфатических узлах, брюшной и плевральной полостях, печени, яичнике и других органах. Например, у жительницы Токио спустя несколько часов после употребления ею в пищу «sashimi» из сырого кальмара обнаружились две прикрепившиеся к языку личинки Anisakis (Tanabe et al., 1990). Воспалительной реакции в месте прикрепления личинок не наблюдалось, однако были выражены лёгкая боль и отёк глотки. У 27-летней жительницы Кореи, поступившей в отделение отоларингологии с жалобой на трудности при глотании и ощущение постороннего тела в горле, в углублении на нижней поверхности левой нёбной миндалины выявили нематоду, которую после удаления определили как Anisakis sp. (Kim et al., 1971). Серовато-белый червь достигал в длину 3.6 см при ширине 0.6 мм.
Исходя из особенностей локализации личинок в организме человека различают анизакиозис - желудочный (gastric), кишечный (intestinal), внегастрокишеч-ный (extra gastrointestinal), орофарингеальный, т.е. слизистой оболочки полости рта (oropharyngeal) и скоротечный полостной (transient luminal) (Takei, Powell, 2007). Подмечено, что для Японии характерна главным образом желудочная форма заболевания (однако в этом случае этиологическим агентом чаще является Pseudoterranova decipiens), а в европейских странах более обычна кишечная (Hochberg, Hamer, 2010).
Помимо того, в желудочной и кишечной формах выделяют острое (Fujino et al., 1984) и хроническое (Cespedes et al., 2000) течение заболевания.
Заболевание, вызываемое личинками Anisakis, называют по-разному: болезнь «сельдяного червя» («herring-worm» disease) (впервые было установлено, что источником инвазии людей являются личинки нематод из сельди), анизакиазис, анизакиозис, анизакидозис, синдром мигрирующей («странствующей») личинки (syndrome «larva migrans»), «болезнь рыбаков» («fishermen disease»), эозинофильный флегмонный энтерит, эозинофильная флегмона кишечника и т. д.
Попадание в организм человека живых анизакисов приводит к общему сепсису. Болезнь развивается на фоне гиперсенсибилизации организма экскреторносекреторной субстанцией живых нематод и продуктами распада погибших личинок (Сердюков, 1993). В данном случае A. simplex выступает как этиологический агент аллергических реакций, непосредственно связанных с иммуноглобулином (Ig)E (Daschner et al., 2005; Fernandes et al., 1996; Ferre, 2001; Kimura et al., 1999). Эти реакции проявляются от быстрой вспышки и потенциально опасных анафилактических реакций до состояния хронической слабости. Установлено, что не только жи
47
вые, но и погибшие личинки A. simplex вызывают у человека аллергические реакции на присутствующие в них антигены (Audicana et al., 2002; Moreno-Ancillo et al., 1997; Vidacek et al., 2009).
При изучении in vitro влияния экскреторных и секреторных продуктов личинок A. simplex на свёртывание крови человека были выявлены их антикоагулянтные свойства (Perteguer et al., 1996). На этом основании было высказано предположение, что подобное антикоагулянтное действие может играть важную роль в процессе внедрения личинок в слизистую желудочно-кишечного тракта.
Заболевание обычно сопровождается высокой температурой, лихорадкой, острой желудочно-кишечной болью, горечью во рту, тошнотой, рвотой, коликами, диареей, запором, иногда плевральным выпотом, астмой и затруднённым дыханием. У многих больных резко снижается кислотность, у двух третей из числа заболевших желудочный сок содержит примесь крови, более чем у половины пациентов в крови наблюдается эозинофилия (при поражении желудка) или же выражен лейкоцитоз (при поражении кишечника). Вокруг внедрившейся личинки возникает гиперемия, а пролиферативные и гнойно-экссудативные изменения приводят к формированию эозинофильной флегмоны и абсцесса, возникновению феномена Артю-са. Гранулёмы могут проявляться в двух формах - рассеянной или локализованной. В ряде случаев наблюдается непроходимость кишечника или же прободение его стенки (Lopez-Serrano et al., 2000; Taniguchi et al., 2011). В хирургически удалённых участках кишечника обнаруживают опухоли, содержащие личинок Anisakis или их остатки.
В связи с общей аллергической (неспецифической) симптоматикой клиническая диагностика анизакиозиса затруднена, и его часто принимают за язвенную болезнь, непроходимость кишечника, гастрит, энтерит, колит, острый холецистит, острый аппендицит, камни в жёлчном пузыре, опухоли различной этиологии и т. д. Например, в одном из исследований было показано, что свыше 60 % случаев анизакиозиса было диагностировано как аппендицит, «острый живот», рак желудка или болезнь Крона (Crohn’s disease - хроническое воспалительное заболевание, поражающее весь желудочно-кишечный тракт от полости рта до анального отверстия) (Sakanari, McKerrow, 1989). Поскольку кишечный анизакиазис может иметь симптом «острого живота», то у пациентов с илеитом или колитом хирурги должны предполагать вероятность подобного диагноза, т.е. анизакиазиса, особенно на фоне употребления пострадавшими в пищу сырой или термически плохо обработанной рыбы (Ortega-Deballon et al., 2005).
Диагностика по аллергической реакции на личинок Anisakis затруднена в связи с их перекрёстной реактивностью с другими аллергенами, в том числе и личинок других родов анизакид (Iglesias et al., 1996; Valls et al., 2003). К тому же, известно, что у многих людей возникает аллергическая реакция в виде крапивницы при употреблении в пищу морской рыбы, в частности восточной скумбрии, сардин, тунцов, трески. Особенно трудно поставить правильный диагноз у детей, поскольку большинство положительных проб с накалыванием (prick test) на A. simplex совпадает с положительными пробами на другие аллергены, в результате чего может быть поставлен неверный диагноз. К сожалению, неправильная диагностика влечёт за собой применение ошибочных методов терапии. Самую лучшую специфичность показывает секреторно-экскреторный антиген, помогающий распознать действи
48
тельно заражённого пациента, поэтому его рекомендуют использовать в качестве индикатора заражения.
Постановке правильного диагноза на заражение анизакисными нематодами в немалой степени способствует применение эндоскопов с миниатюрной камерой и специальными щипцами, благодаря которым хирурги легко выявляют и удаляют личинок.
И, безусловно, нельзя недооценивать подробный анамнез, в результате которого выясняется, что фактически во всех зарегистрированных случаях заражения анизакисами пациенты употребляли блюда из свежевыловленной рыбы или кальмаров, как правило, или в сыром виде, или недостаточно термически обработанными (Couture et al., 2003). Симптомы заболевания обычно проявляются в течение 1 -5 ... 12 ч после приёма пищи.
После извлечения личинок с помощью эндоскопов или их удаления хирургическим путём, симптомы болезни через некоторое время исчезают. Полагают, что весьма эффективными могут оказаться применение антигельминтиков - альбендазола, ивермектина, меденбазола, а также медикаментозная обработка противовоспалительными средствами (Dziekonska-Rynko et al., 2002; Moore et al., 2002).
В большинстве случаев заражение людей нематодами происходит при употреблении пищи из морепродуктов, приготовленной в домашних условиях. К примеру, во Владивостоке источником заражения одной из пациенток, о которых шла речь выше, стало приготовленное ею по рецептам японской кухни блюдо «хе», в котором к нарезанной тонкими ломтиками свежей сельди добавляются специи и столовый уксус, а второй пациентки - недостаточно обжаренный свежевыловлен-ный терпуг (Соловьёва, Таран, 2000). Описан случай (Kagei, Isogaki, 1992), когда жительница одной из японских префектур почувствовала сильные боли в желудке после употребления в пищу национального блюда sashimi (ломтики сырой рыбы), приготовленного ею из полосатого тунца. У одной из жительниц Кореи причиной рвоты и эпигастральных болей стал сырой анчоус в соевом соусе с красным перцем (Noh et al., 2003). Во всех перечисленных случаях у пострадавших были выявлены личинки Anisakis simplex.
Случаи заражения людей анизакисами в ресторанах или барах, в частности в sus/к-барах, довольно редки, но всё же имеют место (Just et al., 2008; Oshima, 1987). О возможном наличии этих личинок в рыбе, идущей на приготовление блюд sushi и sashimi, свидетельствует следующий пример. Как-то в США в 32 ресторанах Сиэтла, где готовят sushi, в течение 19 месяцев проводили исследования рыбного сырья - морской рыбы, идущей на приготовление этого восточного блюда. Оказалось, что почти 10 % кусочков (порций) лосося содержало до трёх анизакис-ных личинок 3-й стадии развития (Adams et al., 1994). По одной личинке обнаружили в 5 % обследованных порций скумбрии, тогда как тунец и морской окунь были свободны от паразитов. И хотя все личинки погибли, т. к. рыба была предварительно заморожена, но среди погибших нематод встретились две погибающие особи, на основании чего был сделан вывод о недостаточно глубокой заморозке рыбы. Одновременно обследовались специализированные магазины, обеспечивающие рестораны и покупателей рыбой для sashimi, и в одной пробе морского окуня была обнаружена живая анизакидная личинка. Кстати, авторы замечают, что попытки найти анизакид в мясе рыбы, не нарушая его целостности, в целом, безуспешны.
49
Проверка sushi из лосося на наличие в нём нематод с помощью просвечивания или ультрафиолетового света оказалась не эффективна.
Судя по этой публикации, самым надёжным способом обеззараживания рыбы, содержащей личинок анизакисов, является её заморозка. Причём по одним рекомендациям (European Commission (ЕС) Regulation (ЕС) No. 853/2004; Huss, 2004), если рыбу предполагается употреблять в пищу в сыром или почти сыром виде, коптить при температуре ниже +60°С, мариновать или солить, то её следует промораживать при температуре -20°С по всей глубине продукта в течение не менее суток. По другим данным (Howgate, 2007), при -20°С рыбу следует выдерживать не менее 7 суток, но при -35°С достаточно 15 ч.
Что касается действия высоких температур на выживаемость нематод, то одни исследователи (Huss, 2004) пишут, что при +5 5 °C нематоды погибают в течение одной минуты, другие (Sakanari, McKerrow, 1989) считают, что в домашних условиях рыбу следует прожаривать при достижении температуры внутри рыбы +60°С и выше не менее 10 мин.
Ещё одно немаловажное наблюдение: в микроволновой печи при +65°С нематоды, находившиеся в рыбе - стрелозубой камбале, остались живыми, но при +74°С и выше погибли в течение 15 с (Adams et al., 1999).
Я. Граб да (Grabda, 1982, 1983), изучавшая жизнеспособность и инвазион-ность личинок анизакиса в балтийской сельди - свежей, солёной и пряного посола, установила, что после подобной технологической обработки в рыбе могут встретиться живые личинки. По этой причине критерий «неподвижности» нематод недостаточен для гарантии безопасности рыбы и продукции из неё. По польским стандартам, для сельди пряного посола полную гарантию безопасности, т.е. гибели всех личинок нематод, можно получить, выдержав рыбу в рассоле в течение 4 нед.
В 4 % уксусной кислоте с добавлением 6 % соли нематоды A. simplex, выделенные из сельди, выживают в течение 26 дней; даже 7 % уксусная кислота и 15 % соль не гарантируют гибели всех нематод (Davey, 1972). После 72-часовой выдержки свежего филе сельди в рассолах различной крепости и pH половина личинок всё ещё активно двигалась (Karl, 1987). На этом основании автор работы делает вывод, что только глубокая предварительная заморозка может служить надёжной гарантией того, что все нематоды в солёном/маринованном филе погибли.
Однако процесс гибели личинок можно ускорить добавлением свежей, не высохшей, горчицы в 5 % концентрации в воде или уксусе. Эффективное действие этой приправы сказывается спустя 30 мин после её добавления.
Губительное воздействие на нематод оказывает вымачивание в уксусе (синтетической уксусной кислоте) или винном уксусе, полученном из риса или в процессе пивоваренного производства (Lida et al., 1987). При этом наблюдается прямая зависимость между гибелью личинок и концентрацией уксусной кислоты: концентрация выше 20 % быстро убивает всех личинок, слабые растворы (0.5 %) действуют медленно (48 - 72 ч).
Учитывая особенности локализации личинок в рыбе, для предупреждения их миграции из висцеры в мышечную ткань некоторые исследователи рекомендуют потрошить рыбу сразу после вылова (Dias et al., 2010; Silva-Junior et al., 2011).
Весьма эффективным способом предупреждения заражения людей анизакисами может быть предпочтительное употребление в пищу рыб, выращенных в хозяйствах. При исследовании методом просвечивания 3700 экз. филе атлантического
50
лосося весом 2 - 3 и 3 - 4 кг, выращенного на норвежских и шотландских фермах, было установлено полное отсутствие в них анизакид (Angot, Brasseur, 1993). Сравнение заражённости личинками A. simplex тихоокеанских лососей в природных и искусственных условиях показало, что все исследованные особи нерки, выловленные во время её весенней миграции, содержали этих гельминтов, тогда как в хозяйствах и атлантический лосось, и кижуч, и чавыча были свободны от них (Deardorff, Kent, 1989). Авторы делают вывод, что употребление в пищу выращенных в хозяйствах лососей увеличивает границы безопасности для любителей сырых морепродуктов. Аналогичные результаты получили японские учёные при исследовании в 1992, 1998 и 1999 гг. мускулатуры лососёвых рыб - кижуча и пестряка (камчатского лосося), выращиваемых в хозяйствах Японии (Inoue et al., 2000). При исследовании содержимого пищеварительного тракта этих рыб в нём не нашли потенциальных промежуточных хозяев анизакисных нематод, что позволило сделать вывод об очень низкой вероятности заражения ими выращиваемых лососёвых.
Во всех инструктивных материалах и публикациях подчёркивается, что поступающая в торговую сеть и на предприятия общественного питания мороженая, солёная, маринованая и копчёная рыба должна быть свободна от живых нематод (Ghittino, 1987). Таковы санитарно-эпидемиологические требования к качеству и безопасности рыбного сырья, разработанные и применяемые во многих странах мира.
Вместе с тем, появившаяся в последние годы информация (Audicana et al., 2002; Moreno-Ancillo et al., 1997; Vidacek et al., 2009) о возможности проявления у людей аллергической реакции на рыбу, содержащую уже погибших личинок Anisakis simplex, заставляет по-новому взглянуть на эту проблему, требующую дополнительных исследований. Иными словами, хотя заморозка или варка/жарка рыбы ограничивают риск заражения человека анизакисными личинками, однако не предохраняют от возможного развития аллергических реакций на антигены в погибших паразитах.
Следовательно, перед исследователями встают задачи: выяснить, при каких температурных градиентах всё же возможно разрушение аллергенов нематод, какова продолжительность тех процедур, которые вызывают их разрушение, что происходит при этом с токсинами, какова реакция организма человека на антигены разных видов анизакисов и т.д.
Итак. Как уже отмечено, в настоящее время опасными для здоровья человека рассматривают три вида Anisakis - A. simplex, A. pegreffii (во взрослом состоянии -паразит тюленя белобокого и кашалота большеголового) и A. physeteris (паразит кашалотов и клюворыла кювьерова). Однако в подавляющем большинстве публикаций выявленные у людей анизакисные личинки фигурируют как A. simplex, или же Anisakis sp. Впрочем, это вполне объяснимо, если учесть, что те радикальные изменения, которые претерпела систематика видов данного рода, произошли не так уж и давно. Информация об обнаружении у людей других видов Anisakis носит единичных характер. В частности, известно о регистрации личинок A. physeteris у человека в Японии (Asato et al., 1991; Kagei et al., 1978 - паразит описан как Anisakis type-II larva) и Испании (Clavel et al., 1993), а личинок A. pegreffii - в Италии (Fumarola et aL, 2009; Mattiucci et al., 2011) и Хорватии (Mladineo et al., 2016).
В последние 30 лет наблюдается увеличение числа регистраций анизакио-зиса у человека (EFSA, 2010). Более того, реальный риск заражения людей в Европе
51
оценивается в 0.038 %, т.е. 20 случаев на страну в год (D’amico et al., 2014). Многие исследователи объясняют подобный факт несколькими причинами, и, прежде всего, ростом потребления населением свежей рыбы и изменением технологии её приготовления, а также улучшением диагностики этого заболевания, связанного с разработкой достаточно надёжных серологических, иммунологических, радиографических и некоторых других методов. Увеличение потребления в пищу рыбы, естественно, влечёт за собой и рост числа случаев заражения анизакисами (Petithory, 2007), однако японские исследователи считают, что факт увеличения количества пострадавших больше связан с достижениями в области диагностики заболевания, чем с организацией поточного производства sushi и/или sashimi (Oshima, 1987), весьма модных ныне во многих странах мира.
Цитируемая литература
Гаевская А. В. Паразиты и болезни морских и океанических рыб в природных и искусственных условиях. -Севастополь: ЭКОСИ-Гидрофизика, 2004. -237 с.
Гаевская А. В. Анизакидные нематоды и заболевания, вызываемые ими у животных и человека. - Севастополь: ЭКОСИ-Гидрофизика, 2005.-223 с.
Гаевская А. В., Ковалева А. А. Личинки анизакидных нематод - паразиты морских и океанических рыб // Экспресс-информация ЦНИИТЭИРХ (Сер. Обработка рыбы и морепродуктов). - М., 1990. - Вып. 9.-С. 17-36.
Гаевская А. В., Нигматуллин Ч. М., Шухгалтер О. А. Сравнительно-экологическая характеристика паразитофауны фоновых видов кальмаров сем. Ommastrephidae в юго-западной Атлантике / Тез. докл. 4 Всесоюз. конф, по промысловым беспозвоночным. - М., 1986. - Ч. 2. - С. 337 - 338.
Мозговой А. А. Аскаридаты животных и человека и вызываемые ими заболевания. Книга II // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1953. - 2. - 616 с.
Сердюков А. М. Проблема анизакидоза // Медицинская паразитология и паразитарные болезни. - 1993. -№2.-С. 50-54.
Соловьева Г. Ф., Красных А. М. Обнаружение личинки Anisakis simplex (Ascaridata, Anisakidae) в желудке у человека / Паразиты животных и растений: Сб. науч. тр. - Владивосток, 1989. - С. 131 - 133.
Соловьёва Г Ф., Таран Н. А. Два случая обнаружения личинок Anisakis simplex (Ascaridina, Anisakidae) в желудке у человека // Известия ТИНРО. - 2000. -127. - С. 590 - 592.
Abollo Е, Gestal С., Pascual S. Anisakis infestation in marine fish and cephalopods from Galician waters: an updated perspective I I Parasitol. Res. - 2001. - 87. - P. 492 - 499.
Adams A. M., Leja L. L., Jinneman K., Beeh J., Yuen G. A. Anisakid parasites, Staphylococcus aureus and Bacillus cereus in sushi and sashimi from Seattle area restaurants //J. Food Prot. - 1994. - 57 - P. 311-317.
Adams A., Miller K, Wekell M., Dong F. Survival of Anisakis simplex in microwave-processed arrowtooth flounder (Atheresthes stomias) I I J. Food Protection. - 1999. - 62, 4. - P. 403 - 409.
Akmirza A. [The parasite fauna of horse mackerel] / Dogu Anadolu BOlgesi III. Su Uriinleri Sempozyumu, 10 - 12 Haziran 1998, Erzurum. - P. 333 - 344 (text in Turkish; English summary).
Angot V., Brasseur P. European farmed Atlantic salmon (Salmo salar L.) are safe from anisakid larvae // Aquaculture. - 1993. - 118, 3 - 4. - P. 339 - 344.
Arenal J. J., Marcos J. L, Borrego M. H, Bowakin D. B. et al. Anisakiasis сото causa de apendicitis aguda у cuadro reumatoldgico: primer caso en la literatura mddica// Rev. Esp. Enf. Dig.- 1991. -79. - P. 355- 358.
Asato R., Wakuda M., Suiyoshi T. A case of human infection with Anisakis physeteris larvae in Okinawa, Japan//Japan. J. Parasitol. - 1991.-40. - P. 181-183.
Ashby B. S, Appleton P. J., Dawson J. Eosinophilic granuloma of gastro-intestinal tract caused by herring parasitic Eustoma rotundatum II Brit. Med. J. - 1965. - 1. - P. 1141 - 1145.
Aspholm P. E. The species composition of anisakid nematodes in the gastric ulcers in harbor seals (Phoca vitulina) from the outer Oslofjord 11 Bull. Scand. Soc. Parasitol. - 1994a. - 4, 2. - P. 9 - 10.
Aspholm P. E. Fecundity of Anisakis simplex from minke whales (Balaenoptera acutorostrata) И Bull. Scand. Soc. Parasitol. - 1994b. - 4, 2. - P. 11.
Audicana M. T, Ansotegui I. J., de Corres L. E, Kennedy M. W. Anisakis simplex: dangerous - dead and alive? // Trends Parasitol. - 2002. - 18. - P. 20 - 25.
Berland B. Massenbefall von Anisakis simplex-Larven am Magen des Kabeljaus (Gadus morhua L.) И IV Wissenschaf. Konf. Physiol., Biol., Parasit. Nutzfischen (3 -5.09.1980, Rostock). -1981. -P. 125 - 128.
52
Cespedes M., Saez A., Rodriguez L, Pinto J. M., Rodriguez R. Chronic anisakiasis presenting as a mesenteric mass II Abdom. Imaging. - 2000. - 25, 5. - P. 548 - 550.
Clavel A., Delgado B., Sanchez-Acedo C, Carbonell E. et aL A live Anisakis physeteris larva found in the abdominal cavity of a woman in Zaragoza, Spain I I Japan. J. Parasitol. - 1993. - 42. - P. 445 - 448.
Couture C, Gagnon J., Desbiens C. Human intestinal anisakiosis due to consumption of raw salmon 11 Am. J. Surg. Pathol. - 2003. - 27. - P. 1167 - 1672.
Cruz A. R, de Souto P. C. S, Ferrari С. К. B., Allegretti S. M., Arrais-Silva IF. W. Endoscopic imaging of the first clinical case of anisakidosis in Brazil И Sci. Parasitol. - 2010. - 11, 2. - P. 97 - 100.
D’amico P., Malandra R, Costanzo R, Castigliero L, Guidi A. et al. Evolution of the Anisakis risk management in the European and Italian context // Food Res. Int. - 2014. - 64. - P. 348 - 362.
Daschner A., Vega de la Osada F., Pascual C. Y. Allergy and parasites reevaluated: wide-scale induction of chronic urticaria by the ubiquitous fish-nematode Anisakis simplex in an endemic region // Allergol. Im-munopathol. (Madr). - 2005. - 33, 1. - P. 31 - 37.
Davey J. T. A revision of the genus Anisakis Dujardin, 1845 (Nematoda: Ascaridida) // J. Helminthol. - 1971. -45, l.-P. 51-72.
Davey J. T. The public health aspects of a larval roundworm from the herring 11 Community Health. - 1972. -4.-P. 104-106.
DeardorffT. L., Kent M. L. Prevalence of Anisakis simplex in pen-reared and wild-caught salmon (Salmon-idae) from Puget Sound, Washington // J. Wildl. Dis. - 1989. - 25, 3. - P. 416 - 419.
Dias F J. E, Sao Clemente S. C, Knoff M. Nematoides anisaquideos ё cestdides Trypanorhyncha de im-portancia em saude publica em Aluterus monoceros (Linnaeus, 1758) no Estado do Rio de Janeiro, Brasil H Rev. Bras. Parasitol. Vet. - 2010. - 19, 2. - P. 94 - 97. http://dx.doi.org/10.4322/rbpv.01902005.
Dujardin F. Histoire naterelle des Helminthes on vers intestinaux. - Paris, 1845. - 16. - 654 pp. (Anisakis: page 220).
Dziekonska-Rynko J., Rokicki J., Jablonowski Z Effects of ivermectin and albendazole against Anisakis simplex in vitro and in guinea pigs // J. Parasitol. - 2002. - 88. - P. 395 - 398.
EFSA. European Food Safety Authority. Scientific opinion on risk assessment of parasites in fishery products //EFSA J. -2010.-8.-P. 1543- 1634.
European Commission (EC) Regulation (EC) No. 853/2004 of the European Parliament and of the Council of 29 April 2004 laying down specific hygiene rules on the hygiene of foodstuffs II Off. J. Eur. Union. - 2004. -L139.-P. 55-95.
Fernandez de Corres L., Audicana M., Del Pozo M.D., Munoz D., Fernandez E. et al. Anisakis simplex induces not only anisakiasis: report on 28 cases of allergy caused by this nematode // J. invest. Allergol. clin. Immunol. - 1996.-6. -P. 315 -319.
Ferre I. Anisakiosis у otras zoonosis parasitarias transmitidas por consume de pescado // Aquatic. - 2001. -14.-P. 1 -21.
Fujino T., Ooiwa T., Ishii Y. Clinical, epidemiological and morphological studies on 150 cases of acute gastric anisakiasis in Fukuoka Prefecture // Japan. J. Parasitol. - 1984. - 33, 1. - P. 73 - 92. (In Japanese with English title and abstract).
Fumarola L., Monno R, lerardi E., Rizzo G., Giannelli G. et al. Anisakis pegreffii etiological agent of gastric infections in two Italian women // Foodbome Path. Dis. - 2009. - 6. - P. 1157- 1159.
Ghittino P. Come mi sembra che sia nato in Europa il “terremoto Anisakiasi” nei prodotti ittici // Il Pesce. -1987.-No. 4.-P. 57-69.
Gibson D. I. Aspects of the development of “Herringworm” (Anisakis sp. larva) in experimentally infected rats // Nytt. Mag. Zool. - 1970. - 18, no. 2. - P. 175 - 187.
Grabda J. Studies on the life cycle and morphogenesis of Anisakis simplex (Rud., 1809) (Nematoda, Anisakidae) cultured in vitro // Acta Ichthyol. Piscator. - 1976.-6, l.-P. 119-140.
Grabda J. Studies on survial and development in vitro of Anisakis simplex stage III larvae in time // Acta Ichthyol. Piscat. - 1982. - 12, 1. - P. 69 - 77.
Grabda J. Studies on viability and infectivity of Anisakis simplex stage III larvae in fresh salted and spiced Baltic herring // Acta Ichthyol. Piscat. - 1983. - 12, 2. - P. 117 - 129.
Grabda J. Marine fish parasitology. An outline. - Warszawa: PWN - Polish Sci. Publ., 1991. - 306 pp.
Hoberg E. P., Henny C. J., Hedstrom OR., Grove Ri A. Intestinal helminths of river otters (Lutra canadensis) from the Pacific Northwest // Jx Parasitol. - 1997. - 83, 1. - P. 105 - 110. DOI: 10.2307/3284324.
Hochberg N. S., Hamer D. H Anisakidosis: Perils of the Deep // Clin. Infect. Dis. - 2010. - 51. - P. 806 -812.
Hodda M. Animal biodiversity // Zootaxa. - 2011. - No 3148. - P. 63 - 95.
53
Hojgaard D. P. Impact of temperature, salinity and light on hatching of eggs of Anisakis simplex (Nematoda, Anisakidae), isolated by a new method, and some remarks on survival of larvae // Sarsia. - 1998. -83, 1. -P.21-28.
How gate P. Chapter 16: Parasites. Seafood Network Information Center - 2007. 4ttp://seafood.ucdavis.edu/ HACCP/Compendium/Chapt 16. htm.
Huss H.H. Assessment and management of seafood safety and quality // Parasites. - 2004. - 444. - P. 1 - 229.
Iglesias R, Leiro J., Ibeira F. M., Santamarina M. T et al. Antigenic cross-reactivity in mice between third-stage larvae of Anisakis simplex and other nematodes // Parasit. Res. - 1996. - 83. - P. 378 - 381.
Im К I, Shin H. J., Kim В. H, Moon S. I Gastric anisakiasis cases in Cheju-do, Korea // Korean J. Parasitol. - 1995. - 33, 3. - P. 179-186 (in Korean; English summary).
Inoue K, Oshima S. I, Hirata T, Kimura I. Possibility of anisakid larvae infection in farmed salmon // Fish. Sci. -2000. -66, 6. -P. 1049 - 1052.
Ishikura H, Takahashi S, Sato N., Matsuura A., Nitto H. et al. Epidemiology of anisakidiosis and related human diseases and studies on parasites infecting marine mammals, fishes and squids 11 Bull. Mar. Biomed. Inst., Sapporo Med. Univ. School of Medicine. - 1996.-3. - P. 23 - 37.
Jackson G. L. The “New disease” status of human anisakiasis and North American cases: a review // J. Milk Food Techn. - 1975. -31, 12. - P. 769 - 773.
Johnston T H, Maw son P. M. Report on some parasitic nematodes from the Australian Museum // Rec. Austral. Mus. - 1951. - 22. - P. 289 - 297.
Just P. A., Meatchi T, Elouaret Y., Badoual C, Couchon S. [Anisakidosis : An emmergent disease] // Gastro-enteroLClin. Biol. - 2008. - 32. - P. 782 - 784. (in French).
Kagei N., Isogaki H. A case of abdominal syndrome caused by the presence of a large number of Anisakis larvae // Intern. J. Parasit. - 1992. - 22, 2. - P. 251 - 253.
Kagei N., Sano M., Takahashi Y. et al. A case of acute abdominal syndrome caused by Anisakis type-II larva 11 Jap. J. Parasit. - 1978. -27, 5. - P. 427 - 431.
Karl H. Ueberlebensfaehigkeit von Nematodenlarven (Anisakis simplex) bei der Herstellung von Heringsfi-lets nach Matjesart unter Verwendung frischer Rohware // Inf. Fischwirtsch. - 1987.- 34, 3. - P. 137 - 138.
Kim С. H, Chung B. S, Moon Y, I., Chun S H. A case report on human infection with Anisakis sp. in Korea // Korean J. Parasitol. -1971.-9, 1. -P. 39 - 43 (in Korean; English summary).
Kimura S, Takagi Y., Gomi K. IgE response to Anisakis compared to seafood // Allergy. - 1999. - 54. - P. 1225-1226.
Kino H., Watanabe K, Matsumoto K, Ueda M., Sugiura M. et al. Occurrence of anisakiais in the western part of Shizuoka prefecture, with special reference to the prevalence of anisakid infections in sardine, Engraulis japonica H Jpn. J. Parasit. - 1993. - 42. - P. 308 - 312.
Koie M. Experimental infections of copepods and sticklebacks Gasterosteus aculeatus with small ensheathed and large third-stage of Anisakis simplex (Nematoda, Ascaridoidea, Anisakidae) I I Parasitol. Res. - 2001. -87, l.-P. 32-36.
Koie M., Berland B., Burt M. D. B. Development to third-stage larvae occurs in the eggs of Anisakis simplex and Pseudoterranova decipiens (Nematoda, Ascaridoides, Anisakidae) // Can. J. Fish. Aquat. Sci. - 1995. - 52 (Suppl. 1).-P. 134-139.
Larsen A. H, Bresciani J., Buchmann K. Interactions between ecto- and endoparasites in trout Salmo trutta H Vet. Parasitol. -2002. -103, 1. -P. 167 - 173.
Lida At., Oka Sh., Daikoku T, Oishi J. // Bull. Fac. Fish. Hokkaido Univ. - 1987. - 38, 3. - P. 301 - 310 (Engl, summary).
Lopez-Serrano M. C, Gomez A. A., Daschner A., Morenoangillo A., De Parga J. M. S. et al. Gastroallergic anisakis: Findings in 22 patients // J. Gastroenter. Hepatol. - 2000. - 15. - P. 503 - 506.
Margolis L. Public health aspects of “codworm” disease // J. Fish. Res. Bd. Can. - 1977. -34. - P. 887 - 898.
Margolis L., Beverley-Burton M. Response of mink (Mustela vison) to larval Anisakis simplex (Nematoda: Ascaridida) // Int. J. Parasitol. - 1977. - 7. - P. 269 - 273.
Mattiucci S, Nascetti G. Molecular systematic, phylogeny and ecology of anisakid nematodes of the genus Anisakis Dujardin, 1845: An update // Parasite. - 2006. -13. - P. 99 - 113.
Mattiucci S., Paoletti M., Borrini F., Palumbo M., Palmieri R. et al. First molecular identification of the zoonotic parasite Anisakis pegreffii (Nematoda: Anisakidae) in a paraffin-embedded granuloma taken from a case of human intestinal anisakiasis in Italy // BMC Infectious Diseases. - 2011; 11:82. http://www. biomedcentral, com/1471-233 4/1 1/82.
Mladineo I, Popovic M., Drmic-Hofman I, Poljak V. A case report of Anisakis pegreffii (Nematoda, Anisakidae) identified from archival paraffin sections of a Croatian patient // BMC Infectious Diseases. -2016. -16: 42. - DOI: 10.1186/s 12879-016-1401-x
54
Moore D. A., Girdwood R. W., Chiodini P.L. Treatment of anisakiasis with albendazole I I Lancet. - 2002. -360.-P. 54.
Moravec F. Parasitic nematodes of freshwater fishes of Europe. - Dordrecht / Boston / London: Kluwer Acad. Publ., 1994. -473 p.
Motta M. R A., Pinheiro D. C. S. N., Carvalho V. L, Viana D. de A. et al. Gastric lesions associated with the presence of Anisakis spp. Dujardin, 1845 (Nematoda: Anisakidae) in cetaceans stranded on the coast of Ceara, Brazil // Biota Neotrop. - 2008. - 8. - P. 91 - 95.
Myers B. J. The migration of J«wato-type larvae in experimental animals II Can. J. Zool. - 1963. - 41, 1. -P. 147-148.
Nagasawa K. Review of human pathogenic parasites in Japanese common squid (Todarodes pacificus) I Oku-rani T., О’Dor R. K., Kubodera T. (eds.) Recent Advances in Fisheries Biology. - Tokai Univ. Press, Tokyo. - 1993.-P. 293-312.
Nascetti G., Paggi L., Orecchia P., Smith J. W. et al. Electrophoretic studies on the Anisakis simplex complex (Ascaridida, Anisakidae) from the Mediterranean and North-East Atlantic 11 Int. J. Parasitol. - 1986. - 16, 6.-P. 633-640.
Noh J. H, Kim S. M., Ock M. S, Park M. L, Goo J. Y. A case of acute gastric anisakiasis provoking severe clinical problems by multiple infection // Korean J. Parasitol. - 2003. - 41, 2. - P. 97 - 100.
Olafsdottir O., Hauksson E. Distributions of anisakid nematodes in the digestive tract of common seal (Phoca vitulina L.) and grey seal (Halichoerus grypus (Fabr.)) I I Bull. Scand. Soc. Parasitol. - 1994. - 4, 2. - P. 10.
Orecchia P., Paggi L., Mattiucci S, Smith J. W., Nascetti G., Bullini L. Electrophoretic identificationof larvae and adults of Anisakis (Ascaridida: Anisakidae) // J. Helminthol. - 1986. -60. - P. 331 - 339.
Ortega-Deballon P., Carabias-Hernandez A., Martin-Bldzquez A., Garaulet P. etal. [Anisakiasis: an infestation to be known by surgeons] // Ann. Chir. - 2005. -130, 6-7. - P. 407 - 410. (Article in French).
Oshima T. Anisakis and anisakiasis in Japan and adjacent area / Progress in medical Parasitology in Japan. -4. - Meguro Parsitological Museum, Tokyo, Japan, 1972. - P. 301 - 393.
Oshima T. Anisakiasis - Is the sushi bar guilty? 11 Parasitol. Today. - 1987. - 3, no. 2. - P. 44 - 48.
Perteguer M. J., Raposo R., Cuellar C In vitro study on the effect of larval excretory/secretory products and crude extracts from Anisakis simplex on blood coagulation // Int. J. Parasitol. - 1996. - 26. - P. 105 - 108.
PetithoryJ. C. New data on anisakiasis // Bull. Acad. Natl. Med. -2007. -191, 1. -P. 53 - 65.
Pravettoni V., Primavesi L., Piantanida M. Anisakis simplex', current knowledge // Eur. Ann. Allergy Clin. Immunol.-2012.-44, 4.-P. 150-156.
Puente P, Anadon A. M., Rodero M., Romans F, Ubeira F. M., Cuellar C. Anisakis simplex', the high prevalence in Madrid (Spain) and its relation with fish consumption I I Exp. Parasitol. - 2008. -118. - P. 271 - 274.
Rolbiecki L., Jane A., Rokicki J. Stickleback as a potential paratenic host in the Anisakis simplex life cycle in the Baltic Sea: results of experimental infection // Wiad. Parazytol. - 2001. - 47, 3. - P. 257 - 262.
Rosales J., Mascaro C, Fernandez C, Luque F. et al. Acute intestinal anisakiasis in Spain: a fourthstage Anisakis simplex larva // Mem. Inst. Oswaldo Cruz, Rio de Janeiro. - 1999. - 94, 6. - P. 823 - 826.
Ruitenberg E. J. Anisakiasis. Pathogenesis, serodiagnosis and prevention: Published doctoral dissertation. -Rijksuniversiteit, Utrecht, 1970. - 138 p.
Sakanari J. A., McKerrow J. H. Anisakiasis // Clin.Microbiol. Rev. - 1989. - 2. - P. 278 - 284.
Silva-Junior A. C. S, Ramos J. S., Gama C. S. Parasitismo de larvas de Anisakidae em Acestronrhynchus lacustris da area de prote^ao ambiental do rio Curiau, Масара, Estado do Атарй // Rev. Bras. Engenh. Pesca.-2011.-6, 2.-P. 1-10.
Smith J. W. Experimental transfer of Anisakis sp. larvae (Nematoda: Ascaridata) from one fish host to another // J. Helminthol. - 1974. - 48, 3. - P. 229 - 177.
Smith J. ИС Ulcers associated with larval Anisakis simplex В (Nematoda: Ascaridoidea) in the forestomach of harbour porpoises Phocoena phocoena (L.) // Can. J. Zool. - 1989. - 67, 9. - P. 2270 - 2276.
Song T J, Cho S. W., Joo К H. Endoscopic findings of aucte gastric anisakiasis - Thirty-nine cases in Inchon City II Korean J. Gastrointest. Endosc. - 1999. - 19. -P. 878 - 884.
Takei H, Powell S. Z. Intestinal anisakidosis (anisakiosis) // Ann. Diagn. Pathol. - 2007. - 11. - P. 350 - 352.
Tanabe M., Miyahira Y., Okuzawa E, Segawa M. et al. A case report of ectopic anisakiasis // Jap. J. Parasitol. -1990.-39, 4.-P. 397-399.
Taniguchi G.t Nagahara A., Matsumoto K, Ritsuno H, Igusa Y. et al. Asymptomatic anisakiasis of the colon incidentally found by colonoscopy // J/ Clin/ Gastroenterol. - 2011. - 4. - P. 371 - 373.
Torre R. M., Perez J. A., Hernandez M. B. et al. Anisakiasis en peascados frescos comercializados en el Norte de Cordova // Rev. Esp. Salud Publica. - 2000. - 74, 5 - 6. - P. 517 - 526.
Valls A., Pascual C, Martin Esteban M. Anisakis and anisakiosis // AllergoL Immunopathol. (Madr.). -2003. -31, 6.-P. 348-355.
55
Van Thiel P. H. Anisakiasis 11 Parasitology. - 1962. - 32, Suppl. - P. 145 - 153.
Van Thiel P. H., Kuipers F. C., Roskam R. T. A nematode parasitic to herring, causing acute abdominal syndromes in man // Trop. Geogr. Med. - 1960. - 2. - P. 97 - 115.
Vidacek S, de las Herras C., Solas M.T., Mendiz6bal A., Rodrnguez-Mahillo A. I. et al. Anisakis simplex allergens remain active after conventional or microwave heating and pepsin treatments of chilled and frozen L3 larvae // J. Sci. Food Agric. - 2009. - 89. - P. 1997 - 2002.
Yokogawa M., Yoshimura H. Jwsate-like larvae causing eosinophile granulomata in the stomach of man // Amer. J. Trop. Med. Hyg. - 1965. - 14. - P. 770 - 773.
Род Contracaecum Railliet et Henry, 1912
Синонимы (no: Bruce et al., 1994):
Kathleena Leiper et Atkinson, 1914
Cerascaris Cobb, 1929
Описание (из: Гаевская, 2005 - по разным авторам). Губы округлённые. Ряды зубчиков у основания губ отсутствуют. Интерлабии хорошо развиты. Экскреторная пора на головном конце у основания вентролатеральных губ. Пищевод цилиндрический, желудочек маленький, редуцированный. Имеются желудочный и кишечный выросты разной длины; соотношение размеров этих выростов используют в систематике нематод данного рода. Спикулы почти одинаковой длины, с узкими крыльями. Имеются многочисленные генитальные папиллы. Вульва в передней части тела. Яйцекладущие. Взрослые формы - паразиты рыбоядных птиц, а также тюленей. Типовой вид - Contracaecum microcephalum (Rudolphi, 1809) (рис. 13).
Рис. 13 Contracaecum microcephalum'. 1 - передний конец пищеварительного канала; 2 - хвостовой конец самки, латерально; 3 - хвостовой конец самца, латерально; 4 - головной конец, апикально (из: Мозговой, 1953)
До 1981 г. под родовым названием Contracaecum описывались нематоды, чьими окончательными хозяевами были как рыбы и рептилии, так и птицы, и млекопитающие.
56
В 1981 г. часть видов, а, именно, тех, что заканчивают своё развитие в рыбах, была вынесена в род Hysterothylacium (Deardorff, Overstreet, 1981). В настоящее время Hys-terothylacium включён в состав семейства Raphidascarididae.
Род Contracaecum широко распространён по планете и объединяет десятки видов. Некоторые из них фактически являются космополитами. К примеру, С. mi-crocephalum найден у пеликанов, чаек, поганок, бакланов и многих других птиц в Европе, Азии, Африке, Северной и Южной Америке, а также в Новой Зеландии, С. variegatum (Rud., 1809) - на севере Германии, в Шотландии, Южной Африке и на Фолклендских о-вах, С. micropapillatum (Stossich, 1890) - в Европе, Азии, Северной Америке, Африке и Австралии. Численность взрослых форм контрацекумов в птицах может достигать очень высоких значений. Известно, что при сильной заражённости этими нематодами у птиц могут наблюдаться геморрагии и язвы в желудке, что ведёт к ослаблению их организма и даже гибели, особенно в условиях стресса или же при неблагоприятных факторах среды (Fagerholm et al., 1996; Ру-rovetsi, Papazaharidou, 1995).
Среди видов Contracaecum., заканчивающих развитие в птицах, достаточно полно изучены жизненные циклы у С. microcephalum, С. micropapillatum, С. ovale (Linstow, 1907), С. rudolphii Hartwich, 1964.
Общая схема жизненного цикла птичьих видов Contracaecum такова. Яйца нематод попадают в воду без признаков дробления. Через 3 суток при 25 - 29°С в них формируется личинка 1-й стадии, которая линяет к концу 4-х суток и выходит из яйца на 5 - 6-й день. Вышедшие в воду личинки прикрепляются группами к каким-либо подводным предметам и сохраняют жизнеспособность при 22 - 25°С в течение 15-18 дней; при понижении температуры продолжительность периода выживания личинок увеличивается. Промежуточные хозяева - циклопы и рачки диаптомусы заражаются при заглатывании личинок 2-й стадии. В их организме те проникают через стенку кишечника в гемоцель, где превращаются в личинок 3-й стадии (рис. 14).
Рис. 14 Схема строения личинки Contracaecum, находящейся на 3-й стадии развития (из: Гаевская, Ковалёва, 1990)
Если таких рачков заглатывают рыбы, то нематоды проникают через стенку кишечника в полость их тела и оседают в мезентерии, хозяева - птицы заражаются через второго промежуточного или же резервуарного, так называе-£ мого паратенического, хозяина. Экспериментально подтверждена возможность заражения одно- и двухдневных птенцов половозрелыми и молодыми гельминтами, которых взрослые птицы отрыгивают вместе с пищей при кормлении птенцов (Мозговой, 1953).
В роли паратенических хозяев в жизненных циклах Contracaecum выступают в основном рыбы и
57
ракообразные, а также личинки хирономид, стрекоз, головастики, лягушки. При этом часто одни и те же виды животных могут быть и промежуточными и резервуарными хозяевами.
Паразитирующие в рыбах личинки Contracaecum тонкие, желтоватого или коричневатого цвета, заключены в плоские капсулы; длина их тела колеблется от 0.4 до 24 мм. На головном конце имеются зачатки губ и хорошо развитый личиночный (сверлильный) зуб. Интерлабии, характерные для взрослых форм, ещё не выражены. Экскреторная пора открывается на уровне основания губ. Желудочек маленький. Имеются желудочный и кишечный выросты различной протяжённости. Ректум окружён анальными железами и открывается анальным отверстием. Хвостовой конец с мукроном.
У пресноводных рыб Европы и на территории бывшего Советского Союза, зарегистрированы около 10 видов личинок Contracaecum, - С. microcephalum, С. micropapillatum, С. ovale, С. rudolphii, С. osculatum (Rud., 1802) и другие (Гаевская, 2012, 2013; Определитель паразитов, 1987; Moravec, 1994).
Наиболее изученными и, возможно, одними из наиболее распространённых являются личинки С. osculatum (sensu lato). Кстати, личинки именно этого вида обнаружены у человека.
Contracaecum osculatum (s. s.) \=Ascaris osculata Rudolphi, 1802; =Katleena osculata (Rudolphi, 1802) Leiper et Atkinson, 1915)] впервые описан по материалам из тюленя под названием Ascaris osculata Rudolphi, 1802.
В обширной литературе, посвящённой паразитированию анизакид у морских млекопитающих, можно найти множество примеров, иллюстрирующих особенности встречаемости этих гельминтов у разных видов хозяев и в разных регионах. Однако развернувшиеся в последние десятилетия активные работы по переисследованию таксономического статуса многих видов анизакид, в том числе и представителей рода Contracaecum, с использованием новых методологических подходов заставляют пересмотреть и существующие взгляды на особенности их распределения в популяциях хозяев и по акваториям. К примеру, в настоящее время из вида Contracaecum osculatum выделены С. osculatum (s. s.), С. osculatum А, С. osculatum В, С. osculatum D, С. osculatum Е и С. osculatum (s. 1.) (Nascetti et al., 1993; Orecchia et al., 1994 и др.). Каждый из перечисленных видов приурочен к какому-либо хозяину (хозяевам), а его распространение, как правило, ограничено определённой акваторией. Например, среди хозяев С. osculatum (s. s.) - серый тюлень, а С. osculatum (s. 1.) - нерпы байкальская, кольчатая, ларга, тюлени белобрюхий, гренландский (лысун), обыкновенный, серый, хохлач, тюлень Уэдделла, тюлень-крабоед, морские львы калифорнийский и южный, морж, морской заяц, морской леопард, сивуч, южный морской слон.
Экстенсивность и интенсивность инвазии этим гельминтом морских млекопитающих достигают очень высоких значений. К примеру, у гренландского тюленя в зал. Святого Лаврентия (атлантическое побережье Канады) максимальное количество С. osculatum достигало 4677 экз. (Marcogliese et al., 1996).
Жизненный цикл С. osculatum изучен в экспериментальных условиях (Koie, Fagerholm, 1993, 1995) (рис. 15). Яйца получены из нематод, извлечённых из трёх серых тюленей, случайно попавших в сети. Большинство яиц было инкубировано в морской воде при 6°С, а для ускорения развития некоторых из них содержали при 15°С. Из яиц выходили личинки 3-й стадии длиной 0.30 - 0.32 мм (ранее существовало мнение, что из яиц выходят личинки 2-й стадии). Тонкая, гладкая кутикула личинок 1-й стадии оставалась в яйце, тогда как у личинки 2-й стадии кутикула
58
толстая, исчерченная и служит чехлом для только что вышедшей, находящейся внутри него личинки. Свободноплавающих личинок заглатывали различные ракообразные, но только в копеподах личинки проникали из кишечника в гемоцель (в отдельных рачках их насчитывалось более 10). К концу первой недели длина тела личинок увеличилась до 0.38 - 0.44 мм. Авторы рассматривают ракообразных в качестве паратенических хозяев в жизненном цикле С. osculatum.
Рис. 15 Жизненный цикл Contracaecum osculatum (справа - личинка 3-й стадии из морской камбалы). А: ракообразные - паратенический хозяин; В: первый промежуточный хозяин -рыба; С: хозяин - только рыба или рыба - второй (третий) промежуточный хозяин; D: окончательный хозяин; Е: свободноплавающие яйца с личинкой 1 - 3-й стадий (LI - L3) и свободные, только что вылупившиеся личинки (заключены в чехлик личинки 2-й стадии).
а - заражение паратенических хозяев [А] и прямое заражение [-] рыб через заглатывание
личинок (гипотетически) - L3 >0.3 мм; b - перенос L3 от одной рыбы к другой: bl - L3 >0.3 мм; Ь2 - L3, >1.0 мм (?); с - заражение окончательного хозяина - L3 >4 мм (из: Koie, Fagerholm, 1995).
Проанализировав результаты экспериментального заражения хозяев, а также многочисленные литературные данные о встречаемости личинок С. osculatum у
59
рыб, авторы (Koie, Fagerholm, 1993, 1995) пришли к выводу, что первые две линьки паразита проходят в яйце, а последние две - в окончательном хозяине, т. е. в тюленях. Ни в ракообразных, ни в рыбах линьки личинок не наблюдается.
Приведённая схема жизненного цикла С. osculatum, по сути, не отличается от выше изложенной касательно птичьих видов, но акценты относительно роли тех или иных групп беспозвоночных и позвоночных животных в ней несколько смещены. В данном случае авторы (Keie, Fagerholm, 1993, 1995) относят ракообразных, в организме которых развития личинок не происходит, к группе паратонических хозяев.
Личинок С. osculatum отмечают главным образом у морских рыб, а также у некоторых солоноватоводных и даже пресноводных хозяев. Они могут также встречаться у рыб, разводимых в пресноводных хозяйствах, в случае их кормления морской рыбой. Например, в Ботническом заливе Балтийского моря личинок С. osculatum обнаружили у 7 видов рыб (Fagerholm, 1982; Valtonen et al., 1988). По данным первого из цитируемых авторов, наиболее заражены ими треска (33.3 %; 1-102 нематоды в одной рыбе), сёмга (11.9 %; 1 - 2 экз.) и разводимая на фермах радужная форель, которую кормили балтийской сельдью (13.3 %; 1 - 2 экз.). По данным Т. Валтонен с соавт. (Valtonen et al., 1988), более всего инвазированы лосось, керчак, налим и треска (20, 20, 16 и 15 % соответственно), причём с возрастом заражённость рыб увеличивается.
В Северном море личинки С. osculatum найдены мною у норвежского паута (у 9 из 20 рыб, по 1 - 22 экз.) и шпрота (по 2-13 экз. в рыбе).
В рыбах личинки локализуются в плоских округлых капсулах в серозной плёнке внутренних органов, в мезентерии, иногда глубоко в паренхиме печени, или в мускулатуре. Какие-либо данные о возможной миграции личинок в теле рыб после их вылова отсутствуют.
Личинки (рис. 16, 17) довольно крупные, однако их длина колеблется в широких пределах - от 3.8 до 22.7 мм.
Рис. 16 Contracaecum osculatum, личинка 3-й стадии: а -головной конец тела; б - хвостовой конец тела (из: Определитель паразитов, 1987)
Субвентральные губы с одной заметной папиллой, дорсальная - с тремя (в «Определителе паразитов, 1987» отмечено наличие двух папилл на дорсальной гу-
60
бе), одна из которых антеромедианная. Кутикула с поперечной исчерченностью. Экскреторная пора расположена между основаниями двух субвентральных выступов губ, непосредственно позади личиночного зуба. Желудочный отросток примерно такой же длины как пищевод, но почти в 2 раза длиннее кишечного. Имеются три ректальные железы. Хвост конический, с тупой верхушкой.
В 1960-е годы, когда появились первые сообщения о случаях заражения людей личинками Anisakis, в том числе и в Японии, в этой стране попытались определить возможность паразитирования и других анизакидных нематод, в частности рода Contracaecum, у человека. Первый эксперимент закончился неудачей (Shiraki, 1969). Вскрытие кролика через 3 ч после того, как ему скормили выделенных из минтая 50 живых личинок С. osculatum (s. 1.), показало, что все личинки, находившиеся в его желудке и кишечнике, потеряли свою подвижность.
В 1967 г. была опубликована информация об обнаружении в желудке собаки на о. Хоккайдо паразитической гранулёмы, спровоцированной личинками Contracaecum sp. и Pseudoterranova (как Terranova) sp. (Kitayama et al., 1967). Авторы не определяли их видовой принадлежности, но поскольку в морских рыбах близ Хоккайдо наиболее обычны С. osculatum (s. 1.) и Р. decipiens (s. 1.), то, видимо, именно они и стали причиной образования гранулёмы (Shiraki, 1974).
Следующая публикация (Kikuchi et al., 1975) знакомит нас с результатами скармливания 230 живых личинок С. osculatum (s. 1.), извлечённых из тихоокеанской трески, девяти щенкам 3 - 4-месячного возраста. В итоге выяснилось, что через 5 - 8 ч личинки проникали в тонкий кишечник, а затем в толстый, где были наиболее обычны через 24 - 30 ч после попадания в организм животных. Из общего количества скормленных личинок 58 % внедрились в слизистую, 27 % находились свободными в просвете кишечника и 15 % выделились из животных. В слизистой в месте прикрепления личинок наблюдались патологические изменения. Исследователи высказали предположение как о возможности проникновения личинок С. osculatum в стенку пищеварительного тракта человека, так и об их способности вызывать в нём патологические повреждения.
Подобные эксперименты, но с другими животными - крысами и хомячками, были выполнены в Финляндии (Fagerholm, 1988). В опытах использовались личинки 3-й стадии С. osculatum из печени балтийской трески. Спустя 2-5 дней обнаруженные в желудке подопытных животных личинки находились уже на 4-й стадии и были идентичны личинкам этой же стадии из тюленей. Взрослые же формы были выращены из особей 3-й стадии на 42-й день после того, как тех хирургическим путём ввели в полость тела лабораторных крыс. Комментируя результаты опытов, автор замечает, что поскольку личинки контрацекума встречаются в основном во внутренних органах рыб, а не в мускулатуре, то они не так часто попадают к человеку, как, например, личинки Anisakis spp., и по этой причине исследователи уделяют им намного меньше внимания, чем следовало бы.
Что касается официально зарегистрированных случаев обнаружения представителей рода контрацекум у человека, то они носят, в полном смысле этого слова, единичный характер. Я. Грабда (Grabda, 1991) упоминает об одном случае заражения человека нематодами данного рода, имевшем место в Германии. Учитывая регион обнаружения гельминта, где у рыб одним из наиболее обычных паразитов являются личинки С. osculatum, можно предположить, что именно эти личинки были выявлены у пострадавшего. Японские исследователи сообщают о двух случаях
61
обнаружения С. osculatum (s. 1.) у людей на о. Хоккайдо (Ishikura et al., 1996). Авторы подсчитали, что от общего числа анизакидных личинок, выявленных за 16 лет в этом регионе у людей, доля личинок С. osculatum (s. 1.) составила всего 0.2 %.
Несмотря на столь скудную информацию о случаях заражения человека нематодами рода Contracaecum, многие авторы относят их к числу гельминтов, потенциально опасных для его здоровья (Nagasawa, 2012). В качестве аргументов в пользу подобной точки зрения приводятся результаты экспериментальных работ по заражению различных представителей млекопитающих личинками этого рода, извлечёнными из рыб. При этом окончательными хозяевами видов Contracaecum, с которыми работают экспериментаторы, являются не только морские млекопитающие, о чём свидетельствуют выше приведённые примеры, но и рыбоядные птицы. Так, успехом увенчался опыт по заражению двухмесячного котёнка личинками С. multi-papillatum (Drasche, 1882), в половозрелом состоянии паразитирующего у птиц (Vidal-Martinez et al., 1994). Нематод извлекли из цихлазомы - эвригалинной рыбы, обычной в пищевом рационе местного населения в Мексике. Попытки заразить ими цыплят, крыс и утят потерпели неудачу. Однако у котёнка, в основном в передней части кишечника, обнаружили 4 взрослых самцов (длиной 19.8 - 29.8 мм) и 5 самок (20.1 - 38.6 мм), среди которых были зрелая, незрелые и ювенильные особи. Три нематоды прикрепились к стенке кишечника, вызвав геморрагии, связанные с небольшими язвами. Авторы полагают, что, хотя личинки обычно локализуются в печени, почках й мезентерии рыб, они, тем не менее, могут встретиться в любом другом участке её тела или же остаться в непотрошённой рыбе. Если в пищу употребляют сырую рыбу, или плохо прожаренную или же копчёную без соблюдения соответствующего температурного режима, то черви могут попасть к человеку.
Столь же успешным был эксперимент по заражению личинками С. multi-papillatum кроликов (Barros et al., 2004). Нематоды прижились у 80 % подопытных животных. И хотя внешние проявления заражения у них не проявлялись, но при вскрытии были обнаружены разрушения слизистой желудка, лейкоцитарный инфильтрат и многофокусный некроз ткани.
Цитируемая литература
Гаевская А. В. Анизакидные нематоды и заболевания, вызываемые ими у животных и человека. - Севастополь: ЭКОСИ-Гидрофизика, 2005.-223 с.
Гаевская А. В. Паразиты и болезни рыб Чёрного и Азовского морей: I - морские, солоноватоводные и проходные рыбы. - Севастополь: ЭКОСИ-Гидрофизика, 2012. - 380 с.
Гаевская А. В. Паразиты и болезни рыб Чёрного и Азовского морей: II - полу проходные и пресноводные рыбы. - Севастополь: ЭКОСИ-Гидрофизика, 2013. - 354 с.
Гаевская А. В., Ковалева А. А. Личинки анизакидных нематод - паразиты морских и океанических рыб // Экспресс-информация ЦНИИТЭИРХ (Сер. Обработка рыбы и морепродуктов). - М., 1990. - Вып. 9.-С. 17-36.
Мозговой А. А. Аскарвдаты животных и человека и вызываемые ими заболевания. Книга II И Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1953. - 2. - 616 с.
Определитель паразитов пресноводных рыб. Т. 3. Паразитические многоклеточные. - Л.: Наука, 1987. - 583 с. - (Определители по фауне СССР, изд. Зоол. ин-том АН СССР; Вып. 149).
Barros L. A., Tortelly К, Pinto R. М., Gomes D. С. Effects of experimental infections with larvae of Eustron-gylides ignotus Jaegerskiold, 1909 and Contracaecum multipapillatum (Drasche, 1882) Baylis, 1920 in rabbits 11 Arq. Bras. Med. Vet. Zootec. - 2004. - 56, 3. - P. 325 - 332.
Bruce N. L, Adlard К D., Cannon L. R. G. Synoptic checklist of ascaridoid parasites (Nematoda) from fish hosts // Invertebr. Taxon. - 1994. - 8. - P. 583 - 674.
62
Deardorff T. L., Overstreet R M. Review of Hysterothylacium and Iheringascaris (both previously = Thynnascaris) (Nematoda: Anisakidae) from the northern Gulf of Mexico 11 Proc. Biol. Soc. Wash. - 1981. - 93 (1980).-P. 1035- 1079.
Fagerholm H.-P. Parasites of fish in Finland. VI. Nematodes. ~ Abo: Abo Akademi, 1982. - 128 p.
Fagerholm H-Р. Incubation in rats of a nematode larva from cod to establish its specific identity: Contracaecum osculatum (Rudolphi) // Parasit. Res. - 1988. -75, 1 -P. 57-63.
Fagerholm H. P., Overstreet R. M., Humphrey-Smith I. Contracaecum magnipapillatum (Nematoda, Asca-ridoidea) - resurrection and pathogenic effect of a common parasite from the proventriculus of Anous minu-tus from the Great Barrier Reef, with a note on C. variegatum //Helminthology. - 1996. - 33. - P. 195 -207.
Grabda J. Marine fish parasitology. An outline. - Warszawa: PWN - Polish Sci. Publ., 1991. - 306 pp.
Ishikura H, Takahashi S., Sato N., Matsuura A., Nitto H. et al. Epidemiology of anisakidiosis and related human diseases and studies on parasites infecting marine mammals, fishes and squids // Bull. Mar. Biomed. Inst., Sapporo Med. Univ. School of Medicine. - 1996. -3. -P. 23 - 37.
Kikuchi S., Hayashi M., Kosugi K, Aigase R. Experimental infection of dogs with Contracaecum sp. larvae (type-E) // Yokohama Med. J. - 1975. - 26. - P. 45 - 48 (In Japanese with English abstract).
Kitayama H, Ohbayashi M., Satoh H, Kitamura Y. Studies on parasitic granuloma in the dog I I Japan. J. Parasitol. - 1967. -16. - P. 28 - 35 (In Japanese with English abstract).
Kaie M., Fagerholm H-Р. Third-stage larvae emerge from eggs of Contracaecum osculatum sensu stricto (Nematoda, Anisakidae) I I J. Parasitol. - 1993. - 79, 5. - P. 777 - 780.
Koie M., Fagerholm H.-P. The life cycle of Contracaecum osculatum (Rudolphi, 1802) sensu stricto (Nematoda, Ascaridoidea, Anisakidae) in view of experimental infections I I Parasitol. Res. - 1995. - 81. - P. 481 -489.
Marcogliese D. J., Boily F., Hammill M. O. Distribution and abundance of stomach nematodes (Anisakidae) among grey seals (Halihoerus grypus) and harp seals (Phoca groenlandica) in the Gulf of St. Lawrence // Can. J. Fish. Aquat. Sci. - 1996. - 53, 12. -P. 2829-2836.
Moravec F. Parasitic nematodes of freshwater fishes of Europe. - Dordrecht / Boston / London: Kluwer Acad. Publ., 1994. -473 p.
Nagasawa K. The biology of Contracaecum osculatum sensu lato and C. osculatum A (Nematoda: Anisakidae) in Japanese waters: a review // Biosphere Sci. -2012. -51. - P. 61 —69.
Nascetti G., Cianchi R., Mattiucci S., D’Amelio S. et al. Three sibling species within Contracaecum osculatum (Nematoda, Ascaridida, Ascaridoidea) from the Atlantic Arctic-Boreal region: Reproductive isolation and host preferences 11 Int. J. Parasitol. - 1993. - 23, l.-P. 105 - 120.
Orecchia P., Mattiucci S., Amelia S, Paggi L. et al. Two new members in the Contracaecum osculatum complex (Nematoda, Ascaridoidea) from the Antarctic // Int. J. Parasitol. - 1994. - 24, 3. - P. 367 - 377.
Pyrovetsi M., Papazaharidou M. Mortality factors of Dalmatian pelicans (Pelecanus crispus) wintering in Macedonia, Greece 11 Environ. Conserv. - 1995. -22. -P. 345-351.
Shiraki T. [On the histological diagnosis of the diseases caused by migrating larval nematodes (mainly anisakiasis) in the gastro-intestinal tracts] 11 Saishin-Igaku. - 1969. - 24. - P. 378 - 389. (In Japanese with English abstract).
Shiraki T. Larval nematodes of family Anisakidae (Nematoda) in the northern Sea of Japan - as a causative agent of eosinophilic phlegmone or granuloma in the human gastro-intestinal tract //Acta Med. Biol. -1974.-22.-P. 57-98.
Valtonen E.T., Fagerholm H.-Р., Helle E. Contracaecum osculatum (Nematoda: Anisakidae) in fish and seals in Bothnian Bay (Northeastern Baltic Sea) // Intern. J. Parasitol. - 1988. -16, 3. - P. 365 - 370.
Vidal-Martinez V.M., Osorio-Sarabia D., Overstreet RM. Experimental infection of Contracaecum multi-papillatum (Nematoda: Anisakinae) from Mexico in the domestic cat I I J. Parasitol. - 1994. - 80, 4. - P. 576-579.
Род Pseudoterranova Mozgovoy, 1950
Синоним: Phocanema Myers, 1959
Описание (из: Гаевская, 2005 — по разным авторам). Нематоды с тремя крупными мускулистыми двудольчатыми губами. На внутренней поверхности каждой губы у её переднего края располагается ряд мелких зубчиков. Интерлабии отсутствуют. Пищевод прямой, слегка расширенный кзади. Желудочный отросток отсутствует.
63
Кишечный отросток, направленный вперёд, различной протяжённости. Спикулы равные или почти равные. Вульва в передней половине тела. Экскреторная пора у основания губ. Во взрослом состоянии - паразиты морских китообразных и ластоногих. Типовой вид - Pseudoterranova decipiens (Krabbe, 1878).
Род Pseudoterranova, основанный ещё в 1950 г. для вида Porrocaecum kogiae Johnston et Mawson, 1939 от карликового кашалота, в течение 30 с лишним лет имел в своём составе только данный вид. В то же время будущий типовой вид рода - Pseudoterranova decipiens - сначала входил в состав рода Porrocaecum, затем Terranova, и, наконец, Pho-сапета. Таким образом, первоначально описанный как Ascaris decipiens Krabbe, 1878, вид затем последовательно становился Porrocaecum decipiens, Terranova decipiens и Phocanema decipiens. В 1983 г. Д. Гибсон (Gibson, 1983) показал, что Phocanema (этот род установили специально для Porrocaecum decipiens) является синонимом Pseudoterranova, и вид паразита, соответственно, должен называться Pseudoterranova decipiens [данная комбинация впервые была использована в 1982 г. (Gibson, Colin, 1982)]. Однако и в зарубежной, и в русскоязычной литературе начала 1980-х гг. вид всё ещё продолжал фигурировать под названием Phocanema decipiens (см., напр., Grabda, 1991).
Довольно длительное время род Pseudoterranova рассматривали как монотипичный: в его составе числился только один вид - уже упомянутый Р. decipiens, а других представителей рода относили к его синонимам. В последнее время, как отмечено выше, в таксономических исследованиях анизакидных нематод стали широко использовать генетические методы. В результате установлено, что многие виды в действительности представлены комплексом из нескольких репродуктивно изолированных, родственных видов. Аналогичные исследования были выполнены и в отношении Pseudoterranova decipiens (s. 1.). В итоге данный вид оказался разделён на шесть (Paggi et al., 1991,2000).
Pseudoterranova decipiens \=Ascaris decipiens Krabbe, 1878; =Porrocaecum decipiens (Krabbe, 1878) Baylis, 1920; = Terranova decipiens (Krabbe, 1878) Baylis, 1916; =Phocanema decipiens (Krabbe, 1878) Myers, 1959] (рис. 18). Видовое название decipiens можно перевести как обманчивый, вводящий в заблуждение.
Р. decipiens - характерный паразит тюленей - обыкновенного, серого, хохлача. Из-за приуроченности к этим животным в англоязычной литературе нематоду часто называют «seal-worm», т.е. тюлений, или котиковый червь.
Нематоды средних размеров, относительно тонкие, тело сужено к обоим концам. Кутикула с поперечной исчерченностью. Передний край губ с вырезкой, которая делит их на две симметричные части. Самцы длиной до 40 - 52, самки 52 -64 мм. Хвост самок тупоконечный. Вульва в передней половине тела. Яйца круглые или почти круглые, диаметром 46 - 52 цш.
Взрослые черви поселяются в желудке своих хозяев. Интенсивность инвазии животных может быть очень высока. Так, в желудке морского льва как-то насчитали 4500 экз. Р. decipiens (Ishikura et al., 1995). При экспериментальном заражении тюленя обыкновенного личинками псевдотеррановы выяснилось, что те обычно проникали в слизистую и субмукозу желудка животных, а их передние концы были инкапсулированы в аморфной эозинофильной субстанции (Brattey et al., 1990). Желудок заражённых тюленей часто был гиперемированный и отёчный, наблюдались выступающие воспалённые зоны или язвенные повреждения.
64
Рис. 18 Pseudoterranova decipiens (s.l.): 1 -хвостовой конец самца, латерально; 2 - яйцо;
3 - губа с внутренней стороны; 4 - спикула;
5 - передний отдел пищеварительного канала; 6 - передний конец тела; 7 - головной конец, апикально; 8 - хвостовой конец самки, вентрально (из: Мозговой, 1953)
Все работы, связанные с изучением жизненного цикла нематод рода Pseudoterranova, выполнялись на Р. decipiens, но при этом следует учесть те изменения, которые претерпел данный вид, вследствие чего отдельные данные, относящиеся к Р. decipiens в действительно могут иметь отношение к другому виду. Тем не менее, в целом, схема жизненного цикла Pseudoterranova сходна с таковой Anisakis, за некоторыми исключениями (рис. 19).
Попавшие в воду яйца Р. decipiens, преж
де чем осесть на дно, переносятся течениями в 100-метровом слое воды в течение 12 дней примерно на 50 км. В метровом слое воды над дном оседание яиц происходит в течение 3 ч, а далее они могут разноситься ещё метров на 500. Размеры и плотность
яиц, а, следовательно, и скорость их оседания могут иметь адаптивное значение к переносу сильными океаническими течениями на большие расстояния (McConnell etai., 1997).
В яйце развивается личинка 2-й стадии, которая выходит заключённой в кутикулу личинки 1-й стадии, и обладает сверлильным зубом (Measures, Hong, 1995). На основании результатов электронно-микроскопического обследования яиц и личинок цитируемые авторы утверждают, что у Р. decipiens в яйце происходит только
65
одна линька, а покидающая яйцо личинка находится на 2-й стадии развития и заключена внутри кутикулы личинки 1-й стадии. Основным фактором, влияющим на развитие яиц, продолжительность жизни личинок во внешней среде, а, следовательно, и на их распределение в толще воды, заражение ими промежуточных хозяев и развитие в них, является температура.
Рис. 19 Схема жизненного цикла Pseudoterranova decipiens (s. 1.): А - яйца в воде; В - L2 (3?), покинувшая яйцо и прикрепившаяся к субстрату хвостом; С - ранняя L2 (3?) в гемоцеле донных копепод; D - L2 с возможной линькой до L3 в гемоцеле донных ракообразных и случайных полихет; Е - от ранней до поздней L3 в полости тела и мускулатуре бентосоядных рыб; F - поздняя L3 в полости тела и мускулатуре демерсальных хищных рыб; G - 3 и 4-я линьки и развитие до взрослой стадии в желудке тюленей (из: McClelland et al., 1990)
Личинки попадают в ракообразных, в основном, амфипод, в организме которых линяют и превращаются в личинку 3-й стадии. При экспериментальном скармливании заражённых амфипод рыбам 12 разных видов выяснилось, что приживались в них только черви крупнее 1.41 мм (длина тела личинок в амфиподах колебалась от 0.82 до 7.08 мм) (McClelland, 1995).
66
Попавшие в рыбу личинки 3-й стадии остаются в ней в таком состоянии до тех пор, пока не окажутся в организме дефинитивного хозяина, в котором они претерпевают две последующие линьки и превращаются первоначально в предвзрос-лую, а затем и взрослую форму.
От мелких рыб или кальмаров личинки могут также попадать к крупным хищным рыбам или же кальмарам. Подобная возможность попадания личинок Р. decipiens от одного вида рыб к другому и их последующего выживания в новом хозяине подтверждена экспериментально (Scott, 1954).
Однако, согласно другим исследованиям, у Р. decipiens (sensu lato), как и у Anisakis simplex (s. 1.), в яйце во время личиночного развития происходят не одна, а две линьки (Koie et al., 1995). Известно, что у личинки 2-й стадии отсутствуют рек-тум, ротовая полость, экскреторная система, боковые выступы. В то же время вышедшие из яиц личинки обладают хорошо развитым сверлильным зубом и пищеварительным трактом. Эти личинки, находящиеся на 3-й стадии, заключены в толстую, похожую на кокон, кутикулу личинки 2-й стадии, тогда как тонкая кутикула личинки 1-й стадии остаётся в яйце. Вышедшие в воду личинки активны и совершают резкие движения, поочерёдно сгибая и вытягивая тело, и не прикрепляются к субстрату. Таким образом, схема жизненного цикла Р. decipiens практически не изменилась, но акценты относительно роли в нём тех или иных групп животных и этапов развития нематоды несколько сместились.
Ранее существовало мнение, что основным дополнительным хозяином в жизненном цикле Р, decipiens является треска. Паразит даже получил соответствующее название - «тресковый червь» («codworm»). К настоящему времени установлено, что в разных регионах Мирового океана роль основного промежуточного хозяина у Р. decipiens выполняют разные виды рыб. Например, в устье Эльбы основным промежуточным хозяином Р. decipiens (s. 1.) служит европейская корюшка (Moller, Klatt, 1988). Подсчитано, что каждая особь обыкновенного тюленя, питаясь корюшкой, ежедневно получает 18 экз. нематод.
В водах Норвегии личинки Р. decipiens встречаются только у демерсальных и бентических рыб, причем самая высокая заражённость характерна для бычка керчака: в прибрежных водах южной и западной Норвегии средний индекс обилия этого паразита составил соответственно 36 и 23 червя на рыбу (Jensen et al., 1994).
Личинки локализуются в полости тела, на брыжейке, пилорических придатках, печени, стенке желудка, в желудке и кишечнике рыб (рис. 20). Обычно они имеют красновато-коричневую окраску и внешне похожи на кровеносные сосуды рыбы.
Рис. 20 Личинки Pseudoterranova decipiens на стенке желудка рыбы (из: Гаевская. 2003)
Как правило, личинки в рыбе располагаются свободно, но иногда могут быть заключены в капсулу. Изучение процесса образования капсулы показало, что первоначально большинство личинок инкапсулируется в
67
двухслойных капсулах: внутренний слой состоит из макрофагов и эпителиоидных клеток различной стадии дегенерации, а наружный - из соединительной ткани. У нематод более «старой» инвазии капсула состоит только из соединительной ткани с двумя отчётливыми зонами: внутренней, более тонкой, - плотная соединительная ткань и наружной - более толстой зоны рыхлой соединительной ткани (Ramakrishna, Burt, 1991).
псевдотеррановы не способны
Личинки Р. decipiens (s. 1.) (рис. 21) довольно крупные, длиной 10 - 50 и шириной 0.3 - 1.2 мм; тело плотное. Цвет личинок изменяется от красновато-коричневого до белого, что зависит от концентрации гемоглобина в их псев-доцеломической жидкости (Dixon et al., 1993). Кутикула с тонкой поперечной исчерченностью. Головной конец с ли-с чиночным зубом. Экскреторная пора открывается на головном конце тела. Желудочек удлинённый. Желудочный отросток отсутствует, но имеется направленный вперёд кишечный вырост. Хвост конический, с маленьким, но заметным мукроном.
Рис. 21 Схема строения Pseudoterranova decipiens (sensu lato) (слева - передний и задний концы тела; справа - детали строения пищеварительной системы) (из: Гаевская, Ковалёва, 1990)
Когда-то полагали, что личинки
выживать и, тем более, развиваться в организме
человека, а потому их не рассматривали гельминтами, представляющими опасность для его здоровья. Однако после первых же случаев регистрации у человека анизакисов, исследователи обратили внимание и на псевдотерранову, тем более, что оба вида личинок могут встречаться в одних и тех же рыбах одновременно. Иными словами, если в организм человека вместе с сырой рыбой попадает личинка Anisakis, то почему бы не предположить, что к нему может попасть и личинка Pseudoterranova?
К настоящему времени заражение людей личинками Р. decipiens, безусловно, намного реже регистрируемое, чем анизакисами, выявлено в Канаде, США, Перу, Чили, Гренландии, Исландии, Великобритании, Японии, Корее.
В Японии по состоянию на 1989 г. было известно 335 случаев заражения людей личинками Pseudoterranova (Ishikura, 1990), тогда как на о. Хоккайдо с 1980 по 1996 гг. таковых зарегистрировано 789 (Ishikura et al., 1996).
В Корее к 1994 г. из 158 официально зарегистрированных случаев анизакидо-зиса людей в семи из них виновниками заболевания оказались личинки Р. decipiens
68
(Sohn, Seol, 1994). К 2001 г. количество подобных регистраций увеличилось до 12 (Yu et al., 2001). Примечательно, что 13-й, по-своему уникальный случай был описан только в 2013 г. (Na et al., 2013). На этот раз нематоду, оказавшуюся личинкой Р. decipiens 3-й стадии развития, обнаружили во время стандартного общего обследования пациентки при эндоскопии желудка. Примечательно и тот факт, что никаких жалоб, обычных в таких случаях, от женщины не поступало. Выяснилось, что за 13 ч до обследования в её обеденном меню было блюдо из морского окуня.
В США к 1986 г. из 24 случаев заражения людей анизакидами на долю псевдотеррановы пришлось 16 (Desowitz, 1986). Следует учесть, что в 1970-е годы этих личинок, обнаруживаемых у человека, описывали под названием Phocanema (Chitwood, 1975; Juels et al., 1975; Kates et al., 1973; Lichtenfels, Brancato, 1976).
В Чили в 1997 - 1999 гг. зарегистрировано 7 случаев заражения людей Р. decipiens (Mercado et al., 2001), к 2007 г. - 15 (Torres et al., 2007), а в 2012 - 2014 гг. -4 (Weitzel et al., 2015).
У большинства пациентов нематоды располагались в ротовой полости и вызывали ощущение чего-то постороннего во рту и глотке, кашель, тошноту, рвоту.
Но - все ли обнаруженные в подобных случаях личинки действительно относятся к Р. decipiens? Вопрос не праздный. Дело в том, что сейчас уже считается доказанным, что под названием Р. decipiens на самом деле описывались другие виды, близкие к нему и практически не различимые морфологически, но генетически представляющие собой иные виды. Более того, каждый из тех видов, которых когда-то описывали как «Р. decipiens», фактически имеет свой определённый ареал. Например, Р. decipiens встречается в Северной Атлантике и Северо-Восточной Па-цифике, Р. decipiens Е - в антарктических и субантарктических водах, Р. azarasi (Yamaguti et Arima, 1942) - в Северной Пацифике, Р. bulbosa (Cobb, 1888) - в Северо-Восточной Атлантике и Северо-Западной Пацифике, Р. cattani George-Nascimento et Urrutia, 2000 - в Юго-Восточной Пацифике, Р. krabbei Paggi et al., 2000 - в Северо-Восточной Атлантике (Weitzel et al., 2015).
В связи с этим, сообщения о регистрации Р. decipiens у населения в Чили или Перу может на самом деле означать, что в действительности здесь был выявлен Pseudoterranova cattani, паразитирующий у южноамериканского морского льва в юго-восточной части Тихого океана. И если ещё в первое десятилетие 21-го столетия писали о встречаемости у людей в Чили Р. decipiens (Jofre et al., 2008; Mercado et al., 2001), то в настоящее время в публикациях уже указывается Р. cattani (Weitzel et al., 2015). Возможные промежуточные хозяева этого вида в водах Чили - морской лещ, тихоокеанская ставрида, мерлуза (Torres et al., 2007).
В Японии, как мы видели, во всех сообщениях, касающихся инвазии людей псевдотеррановой, фигурировал только Р. decipiens. Однако не так давно появилась первая информация о заражении человека в этой стране Р. azarasi (Arizono et al., 2011). Эта информация примечательна тем, что сам случай имел место в 2009 г. Тогда пациентка выкашляла нематоду, чья длина достигала 35 мм, которую определили как личинку 4-й стадии Р. decipiens (s. 1.). Однако последующие генетические исследования этого червя позволили цитируемым авторам отнести паразита к Р. azarasi. Предполагается, что личинки этого вида встречаются в водах Японии у тихоокеанской трески, минтая, корюшки.
Для заболевания, вызываемого у людей личинками Pseudoterranova, ранее предлагались разные названия - террановиазис или террановозис (terranoviasis, ter-
69
ranovosis), фоканемйазис (phocanemiasis), что, безусловно, зависело от того, какое родовое название паразита использовал исследователь. Иногда даже употребляли анизакидозис или же анизакиазис. Поскольку в настоящее время правильное родовое название паразита - Pseudoterranova (псевдотерранова), то заболевание, следуя правилам «Стандартизированной номенклатуры паразитарных болезней животных» (Standardized Nomenclature of Animal Parasitic Diseases (SNOAPAD). -1988), именуют pseudoterranovosis - псевдотеррановозис. Безусловно, можно использовать, и довольно часто используют, особенно в справочных материалах, и такое название как болезнь «трескового червя» (cod worm disease), но оно не может рассматриваться как научное.
Как и в случае с личинками Anisakis, в организме человека личинки Pseudoterranova не созревают, но могут проходить линьку, превращаясь в личинку 4-й стадии (Koh et al., 1999; Mercado et al., 1997, 2001; Sohn, Seol, 1994). Более того, обнаружив как-то у пациентки молодую взрослую самку Р. decipiens, находящуюся на стадии окончательного метаморфоза (Ishikura et al., 1995), авторы цитируемой статьи высказали предположение, что паразит со временем сможет адаптироваться к человеку как к окончательному хозяину (совсем неутешительное предположение!).
При попадании в организм человека личинки внедряются в основном в его гортань или же слизистую желудка. Однако, в отличие от личинок Anisakis, это внедрение обычно поверхностное: личинки Pseudoterranova внедряются только передним концом тела. Более чем в 80 % зарегистрированных случаев эти черви были найдены внедрившимися в слизистую желудка. Помимо того, их находили в глотке, куда они мигрировали из желудка, а также в фекалиях и рвоте. Известен случай, когда личинку обнаружили в области аневризмы правой подвздошной артерии после её удаления хирургическим путём. Поражения псевдотеррановой стенки кишечника, столь обычного для личинок анизакиса, никем пока не отмечено.
Случаи регистрации заражения людей личинками Pseudoterranova намного менее многочисленны, чем анизакисами, возможно, по причине сходства клинических признаков. Однако само заболевание всё-таки протекает легче. Основной клинический симптом заражения проявляется сильной эпигастральной болью, иногда сопровождаемой кашлем, тошнотой и рвотой. При гастроскопии стенки желудка отмечают её отёк, воспаление, утолщение слизистой и кровотечение в месте прикрепления червя, хотя в некоторых случаях заметного локального изменения в тканях почти нет.
Неспецифичность симптомов, проявляемых при попадании в организм человека личинок псевдотеррановы, иногда может привести к неверной диагностике. Известен пример, когда больному, обратившемуся к врачам с жалобой на периодическую эпигастральную боль и тошноту, возникшие через два дня после употребления им в пищу сырой морской рыбы, первоначально поставили диагноз гастроэнтерита. Однако при последующей гастрофиброскопии в его желудке обнаружили личинку нематоды, внедрившуюся в его слизистую (Yu et al., 2001). Извлечённый червь достигал в длину 34.5 при ширине 0.84 мм и был определён как Р. decipiens.
В 50 % проанализированных случаев попадания к человеку псевдотеррановы, боль, иногда спазматическая и повторяющаяся примерно через каждые 3-10
70
мин, возникала через 2 - 10 ч после употребления в пищу сырой рыбы или кальмаров и продолжалась до тех пор, пока пациенты не обращались за помощью к медикам, т. е. от 6 ч до 10 дней. Через несколько часов или же несколько дней после удаления червя болезненные ощущения исчезали, и пациент возвращался к нормальной жизни.
В редких случаях болезнь протекает без симптомов (Na et al., 2013). Имеются также данные о выходе личинок через рот, или же с рвотой и/или фекалиями (Cabrera et al., 2003). Вполне вероятно, что в подобных случаях попавший в просвет желудка червь не оказал - не успел оказать - заметного патологического воздействия на слизистую.
Замечу, что, по данным разных авторов, длина тела извлечённых из слизистой желудка пациентов личинок псевдотеррановы 3-й стадии колебалась от 22.0 до 42.6 при ширине 0.54 - 1.01 мм (Doi, 1973; Lee et al., 1998).
Поскольку симптомы заражения человека псевдотеррановой не специфичны, то одних только клинических признаков явно недостаточно для постановки правильного диагноза. Для этой цели прибегают к помощи рентгеноскопии или же гастроскопии. Даже если при этом невозможно установить, какие именно личинки попали к человеку - анизакисы или псевдотерранова, важно другое - наличие в желудочно-кишечном тракте пациента патогенных для него анизакид.
Как и в случае с анизакисами, во многих случаях поставить правильный диагноз помогает подробный анамнез, в результате которого выясняется, что симптомы заболевания появились у пострадавших вскоре после употребления ими в пищу свежих или недостаточно термически обработанных морепродуктов, прежде всего, рыб и кальмаров.
Практически все исследователи подчёркивают, что заражение людей псевдотеррановой связано с употреблением ими в пищу сырой или слегка маринованной морской рыбы, используемой при приготовлении таких национальных блюд как cebiche, sushi или sashimi (Cabrera et al., 2003; Jofre et al., 2008; Laffon-Leal et al., 2000; Mercado et al., 2001; Torres et al., 2007; Yu et al., 2001; Zvejnieks et al., 1999 и др.). Приведу только один пример, иллюстрирующий сказанное. 17-летняя жительница Лимы (Перу), будучи в г. Ика (центральная часть страны), заказала в ресторане cebiche. Это блюдо готовят здесь из мелко нарезанной сырой рыбы различных сортов, которую первоначально в течение 15 мин маринуют в соке лайма, а затем добавляют нарезанный кольцами красный лук и иногда рокото (острый перец из Перу). Родиной этого блюда считается Перу, но оно получило распространение во многих латиноамериканских странах, хотя рецепты его приготовления в разных регионах могут значительно варьировать. Через четыре часа после приёма пищи у молодой особы появилось ощущение тошноты, которое усиливалось в течение последующих пяти часов, после чего с рвотой у неё вышел червь. Паразита определили как личинку 3-й стадии Р. decipiens (Cabrera et al., 2003).
Методы обеззараживания рыбы и головоногих моллюсков, содержащих личинок псевдотеррановы, тривиальны и практически не отличаются от таковых, предлагаемых для рыбы и морепродуктов, содержащих личинок анизакиса. Прежде всего, речь идёт о необходимости предварительной заморозки рыбы и последующем её хранении при -20°С в течение 7 дней или же глубокой заморозке при -35 °C
71
в течение 15 ч (US Food and Drug Administration Parasites, 2001). Этого времени вполне достаточно для обеззараживания рыбного сырья.
Цитируемая литература
Гаевская А. В. Паразитология и патология рыб: Энциклопедический словарь-справочник. -М.: Изд-во ВНИРО, 2003.-231 с.
Гаевская А. В. Анизакидные нематоды и заболевания, вызываемые ими у животных и человека. - Севастополь: ЭКОСИ-Гидрофизика, 2005. - 223 с.
Гаевская А. В., Ковалева А. А. Личинки анизакидных нематод - паразиты морских и океанических рыб // Экспресс-информация ЦНИИТЭИРХ (Сер. Обработка рыбы и морепродуктов). - М., 1990. - Вып. 9.-С. 17-36.
Мозговой А. А. Аскаридаты животных и человека и вызываемые ими заболевания. Книга II И Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1953. - 2. - 616 с.
Arizona N., Miura Т, Yamada М., Tegoshi Г, Onishi К. Human infection with Pseudoterranova azarasi roundworm//Emerg. Infect. Dis. -2011. -7. -P. 555 -556. 10.3201/eidl703.101350
Brattey J., Bishop C. A., Myers R A. Geographic distribution and abundance of Pseudoterranova decipiens (Nematoda: Ascaridoidea) in the musculature of Atlantic cod, Gadus morhua, from Newfoundland and Labrador / Bowen W. D. [Ed.] Population biology of sealworm (Pseudoterranova decipiens) in relation to its intermediate and seal hosts. - Can. Bull. Fish. Aquat. Sci. - 1990. -222. - P. 67 - 82.
Cabrera R., Luna-Pineda M. A., Suarez-Ognio L. Nuevo caso de infeccion humana por una larva de Pseudoterranova decipiens (Nematoda: Anisakidae) en el Peru И Rev. gastroenterol. Peru. - 2003. - 23, 3. -P. 217-220.
Chitwood M. Phocanema-Type larval nematode coughed up a boy in California I I Am. J. Trop. Med. Hyg. -1975.-24.-P.710-711.
Desowitz R S. Human and experimental anisakiasis in the United States // Hokkaido J. Med. Sci. - 1986. -61.-P.358-371.
Dixon B„ Kimmins W., PohajdakB. Variation in color of Pseudoterranova decipiens (Nematoda: Anisakidae) larvae correlates with haemoglobin concentration in the pseudocoelomic fluid // Can. J. Fish Aquat. Sci. -1993.-50, 4.-P. 767-771.
Doi К Clinical aspects of acute heterocheilidiasis of the stomach (due to larvae of Anisakis and Terranova decipiens) - especially on its differential diagnosis by {-ray and endoscopy. // Stomach and intestine. -1973.-8. - P. 1513 - 1518. (In Japanese with English title and abstract).
George-Nascimento M., Urrutia X. Pseudoterranova cattani sp. nov. (Ascaridoidea: Anisakidae), a parasite of the South American sea lion Otaria byronia De Blainville from Chile // Rev. Chil. Hist. Nat. - 2000. -73, l.-P. 93-98. 10.4067/S0716-078X2000000100010.
Gibson D. I. The systematics of ascaridoid nematodes - a current assessment I Stone R. A., Platt H. M. and Khalil L. F. (eds.). Concepts in Nematode Systematics. - Acad. Press, London and New York. - 1983. - P. 321 -338.
Gibson D. I., Colin J. The Terranova enigma // Parasitology. - 1982. - 85, 2. - P. 36 - 37.
Ishikura H. Epidemiological aspects of intestinal anisakiasis and its pathogenesis I Ishikura N. and Kikuchi K. (eds.). Intestinal anisakiasis in Japan: Infected fish, sero-immunological diagnosis, and prevention. -Springer-Verlag, Tokyo. -1990.
Ishikura H., Kikuchi K, Akao N., Doutei M., Yagi K. et al. [Parasitologic significance of the alteration of the causative Anisakidae worm and of the Pseudoterranova decipiens female immature adult worm, casting off the cuticles, and excreted from human in Kanazawa City] // Hokkaido Igaku Zasshi. - 1995. - 70, 5. - P.. 667 - 685. (In Japanese with English title and abstract).
Ishikura H., Takahashi S., Sato N., Matsuura A., Nitto H. et al. Epidemiology of anisakidiosis and related human diseases and studies on parasites infecting marine mammals, fishes and squids // Bull. Mar. Biomed. Inst., Sapporo Med. Univ. School of Medicine. - 1996. - 3. - P. 23 - 37.
Jensen T, Andersen K, Des Clers S. Seal worm {Pseudoterranova decipiens) infections in demersal fish from two areas in Norway I I Can. J. Zool. - 1994. - 72, 4. - P. 598 - 608.
Jofre M. L, Neira О. P., Noemi H. L, Cerva C. J. L. [Pseudoterranovosis and sushi] // Rev. Chilena Infec-tol. -2008. -25, 3. -P. 200-205. doi: /S0716-10182008000300010. (Article in Spanish).
Juels C. W., Butler W., Bier J. W., Jackson G. J. 1975. Temporary human infection with a Phocanema sp. I I Am. J. Trop. Med. Hyg. - 1975. -24. -P. 942 - 944.
Kates S., Wright К A., Wright R. A case of human infection with the cod nematode Phocanema sp. И Am. J. Trop. Med. Hyg. - 1973. - 22. - P.606 - 608.
72
Koh M. S., Huh S., Sohn W.-M. A case of gastric pseudoterrano viasis in a 43-year-old man in Korea // Korean J. Parasitol. - 1999. - 37, 1. - P. 47 - 49.
Koie M., Berland B., Burt M. D. B. Development to third-stage larvae occurs in the eggs of Anisakis simplex and Pseudoterranova decipiens (Nematoda, Ascaridoides, Anisakidae) // Can. J. Fish. Aquat. Sci. - 1995. -52, Suppl. l.-P. 134- 139.
Laffon-Leal S. M., Vidal-Martinez V M., Arjona-Torres G. 'Cebiche'—a potential source of human anisakiasis in Mexico? // J. Helminthol. - 2000. - 74, 2. - P. 151 - 154.
Lee I. H, JamgS., Lee C. Y. et al. A case of human infection of the larvae from Pseudo-terranova decipiens I I Korean J. Gastrointest. Endoscopy. - 1998. - 18. - P. 732 - 736.
Lichtenfels L. S. Jr, Brancato P. F. Anisakid larva from throat of an Alaskan Eskimo H Am. J. Trop. Med. Hyg. - 1976. - 25. - P.691 - 693.
McClelland G. Experimental infection of fish with larval sealworm, Pseudoterranova decipiens (Nematoda, Anisakinae) // Can. J. Fish. Aquat. Sci. - 1995. - 52, suppl. l.-P. 140 - 156.
McClelland G., Misra R K, Martell D. J. Larval anisakine nematodes in various fish species from Sable Island Bank and vicinity I Bowen W. D. [Ed.] Population biology of sealworm {Pseudoterranova decipiens) in relation to its intermediate and seal hosts. - Can. Bull. Fish. Aquat. Sci. - 1990. - 222. - P. 83 - 118.
McConnell C J, Marcogliese D. J, Stacey M. IK Settling rate and dispersal of seal worm eggs (Nematoda) determined using a revised protocol for myxozoan spores // J. Parasitol. - 1997. - 83, 2. - P. 203 - 206.
Measures L. N, Hong H The number of moults in the egg of seal worm, Pseudoterranova decipiens (Nematoda, Ascaridoidea): an ultrastructural study // Can. J. Fish Aquat. Sci. - 1995. - 52, Suppl. l.-P. 156 -160.
Mercado R, Torres P., Mair a J. Human case of gastric infection by a fourth larval stage of Pseudoterranova decipiens (Nematoda, Anisakidae) // Rev. Saude Pub. - 1997.-31. - P. 131 -133.
Mercado R, Torres P., Munoz V., Apt W. Human infection by Pseudoterranova decipiens (Nematoda, Anisakidae) in Chile: Report of seven cases H Mem. Inst. Oswaldo Cruz. -2001. - 96, 5. - P. 653 - 655. http://dx.d0i.0rg/l 0.1590/S0074-02762001000500010.
Moller H, Klatt S. The role of smelt as transmitter of seal worm Pseudoterranova decipiens in the Elbe estuary//ICES CM 1988/: 13. - 14 p.
Na H K, Sej M., Chai J.-Y., Lee E. K, Jeon S. M. A case of anisakidosis caused by Pseudoterranova decipiens larva// Korean J. Parasitol. -2013. -51, 1. -P. 115 - 117.DOI:10.3347/kjp.2013.51.1.115.
Paggi L, Mattiucci S., Gibson D. I., Berland B. et al. Pseudoterranova decipiens species A and В (Nematoda, Ascaridoidea): nomenclatural designation, morphological diagnostic characters and genetic markers // Syst. Parasitol. - 2000. - 45, 3. - P. 185 - 197.
Paggi L., Nascetti G., Cianchi R, Orecchia P. et al. Genetic evidence for three species within Pseudoterranova decipiens (Nematoda, Ascaridida, Ascaridoidea) in the North Atlantic and Norwegian and Barents Seas H Int. J. Parasitol. - 1991. - 21, 2. - P. 195 - 212.
Ramakrishna N. R, Burt M. D. Tissue response of fish to invasion by larval Pseudoterranova decipiens (Nematoda; Ascarioidea) // Can. J. Fish. Aquat. Sci. - 1991. - 48, 9. - P. 1623 - 1628.
Scott D. M. Experimental infection of Atlantic cod with a larval marine nematode from smelt // J. Fish. Res. Bd. Canada. - 1954. - 11, 7. - P. 894 - 900.
Sohn W. M., Seol S. Y. A human case of gastric anisakiasis by Pseudoterranova decipiens larva // Korean J. Parasitol. - 1994. -32, 1. -P. 53 - 56.
Torres P, Jercic M. L, Weitz J. C., Dobrew E. K, Mercado R A. Human pseudoterranovosis, an emerging infection in Chile // J. Parasitol. - 2007. - 93, 2. - P. 440 - 443.
US Food and Drug Administration Parasites I Fish and fisheries products hazards and controls guidance, 3rd ed. Rockville (MD): The Administration; 2001. -P. 65 - 72.
Weitzel T, Sugiyama H, Yamasaki H, Ramirez C, Rosas R, Mercado R Human infections with Pseudoterranova cattani, Chile // Emerg. Infect. Dis. - 2015. - 21, 10. - P. 1874 - 1875. .http://dx.doi.org/10.3201/eid2110.141848.
Yu J. R, Seo M., Kim Y, W., Oh M. H, Sohn W. M. N human case of gastric infection by Pseudoterranova decipiens larva // Korean J. Parasitol. - 2001. - 39, 2. - P. 193 - 196.
Zvejnieks P., Lichtenstein К A., Koneman E. W. Diagnosis: Luminal anisakidosis due to Pseudoterranova decipiens //Clin. Infect. Dis. - 1998.-26, 5.-P. 1085, 1222- 1223. DOI: 10.1086.520292.
73
Семейство Ascarididae Baird, 1853
Семейство обычно включают в класс Chromadorea в составе отряда или Spirurida (Hodda, 2011), или Rhabditida1, или же Ascaridida (Bauer, 2013). В работе Д. Лелес с колл. (Leles et al., 2012), «Wikipedia»1 2 и «The Taxonomicon»3 оно отнесено к классу Secementea в составе отряда Ascaridida.
Описание (по: Мозговой, 1953; Мозговой, Шахматова, 1973; с дополнениями других авторов). Крупные нематоды - длиной до 50 см и более, с чётко выраженным половым диморфизмом: самки всегда крупнее самцов. Ротовое отверстие в вЦде трёхгранной щели, с тремя заметными губами, снабжёнными сосочками. Ротовая капсула отсутствует. Пищевод цилиндрический. Кишечник простой, трубкообразный. Задний конец самцов загнут на брюшную сторону, хвост заканчивается тупо; имеются две спикулы, равные или почти равные. Преанальная присоска у самцов отсутствует. Матка самок делится на две ветви. Яйцекладущие. Яйца очень многочисленные, при откл*адке несегментированные. Развитие прямое. Паразиты кишечника позвоночных животных всех классов. Типовой род - Ascaris Linnaeus, 1758.
В 1956 г. Д. Спрент (Sprent, 1956) проанализировал всю информацию о жизненных циклах, биологии и распространении аскаридид, накопившуюся с 1866 г., т. е. с того момента, когда Р. Лейкарт (R. Leuckart) впервые высказал мысль, что у этих червей первоначально были промежуточные хозяева. Д. Спрент развил своё видение процесса исчезновения промежуточного хозяина из жизненного цикла Ascarididae. По его мнению, аскаридиды изначально возникли как паразиты морских членистоногих, а осваивали морских животных, используя своего рода посредников - беспозвоночных и рыб. Яйца этих гельминтов, отложенные в фекалиях литоральных животных, могли попадать к питающимся на литорали наземным животным-копрофагам, в организме которых личинки покидали яйцевую оболочку и просто вынуждены были постепенно выработать механизм инцистирования в их тканях. От копрофагов эти личинки попадали к наземным плотоядным животным. Освоение неплотоядных наземных животных могло происходить через различные модификации миграционного поведения попадавших в их организм личинок, например, у Ascaris - это трахейный путь, у Тохосага - ограниченный абдоминальный и т.д. В конечном итоге необходимость в промежуточном хозяине у Ascarididae отпала.
Ascarididae - очень обширное семейство, объединяющее 34 рода с 402 видами (Hodda, 2011), по GBIF4, - 13 родов с 327 видами. Этих червей находят у самых разных водных и наземных позвоночных животных по всему земному шару. Более того, судя по палеопаразитологическим данным, аскаридиды существовали на планете уже десятки, если не сотни, миллионов лет назад (Poinar, Boucot, 2006). В Бельгии в копролитах игуанодона, жившего в раннем меле (100 - 140 млн. лет назад), выявили яйца двух видов аскаридид рода Ascarites Poinar et Boucot, 2006.
У человека известны представители родов Ascaris, Baylisascaris Sprent, 1968, Lagochilascaris Leiper, 1909, Toxascaris Leiper, 1907 и Тохосага Stiles, 1905. К
1 World Register of Marine Species: http://www.marinespecies.org/...=taxdetails&id=22816.
2 https://en.wikipedia.org/wiki/Baylisascaris_procyonis.
3 taxonomicon.taxonomy.nl/TaxonTree.aspx?id=l 17875.
4 Global Biodiversity Information Facility - www.gbif.ord/species/5979.
74
числу опасных для людей относят Parascaris equorum (Goeze, 1782), так называемую лошадиную аскариду (Bisseru, 1967). Однако документальные подтверждения регистрации личинок этого вида у человека отсутствуют.
Несмотря на то, что аскаридиды развиваются без промежуточного хозяина, заражение ими человека обычно происходит с едой - немытыми овощами, ягодами, фруктами, зеленью и другой загрязнённой пищей, а также с водой, контаминированной яйцами паразита. Известны случаи попадания к человеку личинок некоторых аскаридид с сырым или слабо обработанным мясом и печенью животных. Следовательно, провоцируемые ими заболевания, условно говоря, имеют пищевое происхождение. На этом основании, а также учитывая высокую социально-экономическую значимость вызываемых аскаридидными нематодами заболеваний, описание этих гельминтов включено в монографию. Эти же обстоятельства, т. е. патогенность и значимость, обуславливают повышенный интерес к аскаридидам медиков, ветеринаров и паразитологов во всём мире, вследствие чего данному семейству нематод посвящена огромная по своему объёму литература, включающая различного рода монографии, справочники, сводки, пособия, статьи.
Род Ascaris Linnaeus, 1758
Описание (по: Мозговой, 1953, с дополнениями других авторов). Нематоды с характерными чертами семейства. Кутикула поперечно исчерчена. Рот окружён тремя губами - одной дорсальной и двумя вентролатеральными. По внутреннему краю губ располагается ряд зубчиков. Интерлабии отсутствуют. Из органов чувств развиты только осязательные сосочки (папиллы)5 вокруг рта. Хвост самца конический, с многочисленными преанальными и немногими постанальными сосочками. Хвостовой бурсы нет. Спикулы равные, трубчатые, без крыльев. У самок два трубчатых яичника. От них отходят яйцеводы, переходящие в матки, которые сливаются в непарную вагину, открывающуюся на вентральной стороне тела, впереди его середины. Оплодотворение внутреннее. Оболочка яиц толстая, бугристая или гладкая, многослойная. Паразиты пищеварительного тракта млекопитающих, в том числе человека. Типовой вид Ascaris lumbricoides Linnaeus, 1758.
В 19-м столетии, особенно в его начале, очень многие виды аскаридид описывались под родовым названием Ascaris. С развитием таксономии и систематики нематод значительное число видов (15) этого рода перевели в другие роды и даже семейства. Ascaris adunca Rudolphi, 1802, например, стал Hysterothylacium aduncum (Rud., 1802) (семейство Raphidascarididae), Ascaris decipiens Krabbe, 1878 - Pseudoterranova decipiens (Krabbe, 1878), Ascaris osculata Rudolphi, 1802 - Contracoecum osculatum (Rud., 1802) (семейство Anisakidae) и т.д. Но ещё большее число видов - 51 - так и не нашли своего места в современной систематике и остаются в Ascaris как nomen nudum
5 Описание Ascaris lumbricoides, размещённое на сайтах «http://unienc.ni/w/ru/281445-chelovecheskaya-askarida.html» и «http://dic.academic.ru/dic.nsf/ ruwiki/1421227», содержит следующую информацию (дословно):
«Из органов чувств развиты только осязательные бугорки (папиллом) вокруг ротового отверстия».
Но! папиллома - это доброкачественная опухоль кожи или слизистой оболочки, выступающая под их поверхностью в виде сосочка. У нематод же имеются папиллы - органы чувств этих гельминтов.
75
(www.marinespecies. org/aphia.php?p=taxdetails &id=22864). В последние два десятилетия для изучения видов Ascaris и вызываемых ими заболеваний широко используют молекулярные маркёры, что позволило получить ценную информацию для понимания эволюции и филогении этой весьма специфичной группы нематод (Peng, Criscione, 2012).
В качестве паразитов человека известны Ascaris lumbricoides и A, suum.
Ascaris lumbricoides (рис. 22 - 25). Видовое название происходит от латинского lumbricus - глист, дождевой червь; lumbricoides - подобный глисту, дождевому червю, похожий на глиста, дождевого червя. Несмотря на то, что таксономический статус нематоды был определён только в 1758 г., и заслуга в этом, как известно, принадлежит Карлу Линнею, в действительности червь был хорошо известен врачам и натуралистам уже в Древнем мире, поскольку во многих регионах это был один из наиболее обычных паразитов человека.
В русскоязычной ли-
тературе червь получил название - аскарида человеческая, что явно указывает на приуроченность этого паразита к человеку.
Рис. 23 Ascaris lumbricoides, головной конец, апикально (из: Мозговой, 1953 - по: Скрябин, Шульц, 1931)
Рис. 24 Ascaris lumbricoides’. 1 - хвостовой конец самца, вентрально; 2 -хвостовой конец самки, латерально; 3 - то же, вентрально; 4 - область
Рис. 22 Ascaris lumbricoides (из: https://en.wikipedia.org/wiki/ As-carididae)
вульвы; 5 - яйцо (из: Мозговой, 1953 -
по: Скрябин, Шульц, 1931)
76
Рис. 25 Ascaris lumbricoides: A - головной конец тела, вентрально; В - головной конец тела, апикально; С - хвостовой конец самца, вентрально; D -яйцо(из: Faust, 1949)
Описание (по разным авторам). Тело удлинённое, цилиндрическое, заострённое к концам, бледно-розового, розовато-жёлтого или кремового цвета. Длина тела самцов до 15-30 см, диаметр 2-4 мм, самок соответственно 20 - 49 см и 2 -6 мм. Размеры тела варьируют в зависимости от возраста червя и от их количества в кишечнике хозяина. Ротовое отверстие окружено тремя губами. Дорсальная губа в виде широкого эллипса, крупнее латеро-вентральных губ, имеет с каждой стороны по одному двойному сосочку. Лагеро-вентральные губы с одним двойным сосочком, с обеих сторон которого располагается по два мелких сосочка. Пульпа губ спереди разделена на две лопасти, расширенные к свободному краю и с вырезкой посередине. У самцов хвост загнут на брюшную сторону; имеются около 70 пар преанальных папилл и 7 пар постанальных. Спикулы слегка загнутые. Хвост самок с конически закруглённым отростком и двумя крупными постанальными папиллами. Вульва открывается в 1/3 от переднего конца тела. Яйца овоидной формы, с наружной бугристой оболочкой, коричневатого цвета вследствие абсорбции пигмента из фекалий, размерами 45 - 75 х 35 - 50 pm. Самки могут откладывать яйца, лишённые белковой оболочки, и тогда они бесцветны, прозрачны, а их размеры составляют 50 - 100 х 40 - 60 pm.
Плодовитость самок A. lumbricoides необычайно высока. А. А. Мозговой (1953) цитирует работы ряда авторов, согласно которым одна зрелая особь откладывает в сутки до 245 тыс. яиц (Подъяпольская, Капустин, 1950), в год - около 64 млн. (Скрябин, 1925), а масса яиц, отложенных одной самкой в течение года, превышает её собственную массу в 1700 раз (Догель, 1947). Развития яиц в кишечнике человека не происходит из-за отсутствия в нём достаточного количества кислорода. Весь процесс эмбрионального развития паразита происходит после выделения яиц с фекалиями хозяина во внешнюю среду. При попадании в почву при благоприятной температуре (20 - 25°С) и достаточной влажности через 10-15 дней в яйце формируется личинка, при менее благоприятных условиях этот срок удлиняется, а при температуре окружающей среды ниже +12 и выше 38°С развития личинок не происходит. Подсчитано, что для развития личинки и достижения ею инвазионного состояния требуется 335 - 360 градусо-суток (www.medscop.ru).
77
М. К. Токарева (2007) установила, что в черноземной зоне России на сроки развития и выживаемости яиц A. lumbricoides влияют также соли тяжёлых металлов и пестициды, если их содержание в почве превышает предельно допустимые концентрации в 3 - 4 раза и более, и аномальные геомагнитные поля напряжённостью 0.9 - 2 эрстеды и выше. При названных параметрах сроки развития яиц сокращаются в 1.6- 2.2 раза, а выживаемости - в 1.3 - 1.5 раза.
Благодаря пятислойной белково-липидной оболочке, защищающей зародыш от механических и химических повреждений, яйца A. lumbricoides очень устойчивы к неблагоприятным факторам среды: к примеру, остаются жизнеспособными, перезимовав под снежным покровом на полях фильтрации (Мозговой, 1953). Во внешней среде яйца сохраняют инвазионность до 10 лет (Брудастов и др., 1975; Dora-Laskey et al., 2014). Известны случаи, когда яйца не теряли жизнеспособности после 4-5 лет хранения в формалине. Губительное воздействие на яйца оказывают вещества, растворяющие жир, в том числе спирт, эфир, бензин, а также прямые солнечные лучи и высокие температуры. А. А. Мозговой (1953) цитирует работу А. А. Филипченко и В. Н. Данскера (1935), авторы которой указывают температуру +50°С, как критическую для яиц аскариса, при которой те гибнут в течение нескольких секунд. Однако в публикациях можно найти и другие данные о пределах термоустойчивости яиц Л. lumbricoides. Э. Фауст (Faust, 1949), например, цитирует работу (Unat, 1942), в соответствии с данными которой при 30 - 40°С яйца погибают в течение 30 мин, при 55°С - 15 мин, при 60 - 65°С - 5 мин, и только при 100°С наступает их мгновенная гибель.
Попав per os в организм хозяина, личинка покидает яйцевую оболочку и через слизистую тонкой кишки проникает в кровоток воротной вены. Далее личинки, чьи размеры в этот момент не превышают 0.2 - 0.3 мм, проходят с током крови через печень и верхнюю полую вену в правую часть сердца и по лёгочной артерии попадают в лёгкие, где остаются на несколько дней. Отсюда они проникают в просвет альвеол, пробуравливаясь через стенку лёгочных капилляров. При передвижении личинки, чья длина достигает уже 1.5-2.1 мм, раздражают рецепторы дыхательных путей, тем самым вызывая безусловный кашлевой рефлекс. Кашель способствует тому, что личинки достаточно быстро поднимаются вверх по бронхам и трахее, попадают в гортань, носоглотку и оказываются в ротовой полости. Смешиваясь здесь со слюной, они заглатываются вместе с ней и оказываются в тонкой кишке, откуда начинался их путь по организму человека. Весь процесс миграции занимает 14-15 дней. Примерно через 10-11 недель после попадания яйца в организм человека оплодотворённая самка начинает откладывать яйца (Подъяполь-ская, 19686).
Половозрелые особи A. lumbricoides локализуются в тощей и подвздошной кишках, питаясь жидкой полупереваренной пищей хозяина. Практически во всех информационных источниках отмечено, что продолжительность жизни этого вида не превышает 10-12 мес. По некоторым данным, она колеблется от 6 до 24 (Dora-Laskey et al.. 2014) или от 12 до 18 месяцев (www/medicalj.ru).
Предпочтительным местом обитания A. lumbricoides является тонкая кишка, однако аберрантные личинки могут мигрировать в селезёнку, печень, поджелудочную железу, почки, лимфатические узлы и даже мозг, куда заносятся током крови.
В англоязычной литературе заболевания, вызываемые представителями рода Ascaris, в том числе A. lumbricoides, называют ascariasis - аскариазис (от латин
78
ского названия рода паразита Ascaris, к корню которого - Ascari - добавляется суффикс -asis). В русскоязычной научно-популярной и справочной литературе за этими заболеваниями прочно укрепилось название - аскаридоз, а самого паразита называют аскаридой, хотя правильнее было бы называть аскарисом. Кстати, в англоязычной литературе аскаридами (ascarids) иногда называют всех представителей данного семейства (см., напр., Kazacos, 1986).
Клинические признаки поражения человека проявляются по-разному при миграции личинок в его организме (ранняя, или миграционная фаза заболевания) и при паразитировании взрослых особей в кишечнике (поздняя, или кишечная фаза). Мигрирующие личинки механически повреждают стенку кишечника, печень и особенно лёгкие - капилляры, альвеолы. При слабых инвазиях симптомы поражения могут отсутствовать, клинические проявления мало выражены, заболевание протекает незаметно. Однако в клинически выраженных случаях у человека обычно наблюдаются общая слабость, головная боль, утомляемость, потливость, субфебрильная температура (редко поднимается выше 38°С), упорный сухой кашель, слюнотечение, зуд, отёчность век и лица. Больные жалуются на появление на коже на кистях и стопах зудящих высыпаний типа крапивницы. При интенсивных заражениях отчётливо проявляются признаки аллергии, симптомы острой аскаридозной пневмонии, бронхита, экссудативного плеврита, явления бронхиальной астмы. Аускультативно определяются хрипы, шум трения плевры. При тяжелых пневмониях аскаридозной этиологии, сопровождающейся аллергией, важную роль в развитии болезни играют обширные кровоизлияния, вызванные разрывом капилляров лёгких мигрирующими личинками с последующим развитием воспалительных явлений (http://www.eurolab.ua/encyclopedia/trip/1409/). Эти клинические проявления ранней фазы дополняются симптомами нарушения функции сердечнососудистой системы, печени. При рентгенологическом обследовании лёгких в одной доле или по всему лёгкому отмечается наличие инфильтратов, как одиночных, так и множественных. У некоторых больных эозинофилия достигает 60 - 80 %; как правило, она появляется одновременно с инфильтратами в лёгких, реже - позже и ещё реже - раньше их. В данном случае организм человека сенсибилизируется чужеродными белками, источником которых являются продукты обмена личинок, а также сами погибающие личинки.
Взрослые особи, локализующиеся в кишечнике, механически раздражают его стенки и, к тому же, потребляют питательные вещества, предназначенные для организма хозяина. При этом нематоды выделяют ингибиторы трипсина и химотрипсина, из-за чего у больного ухудшаются процессы всасывания пищевых веществ, нарушается толерантность к лактозе. Иногда кишечная фаза протекает субклинически, однако гораздо чаще сопровождается понижением аппетита, слюнотечением, болями в животе, тошнотой, рвотой, диареей и/или запором, повышенной утомляемостью, потерей веса. У детей преобладают диспепсические явления, сопровождающие боли в животе, часто схваткообразные и довольно сильные, возникающие самопроизвольно или при пальпации. Показательны результаты изучения клинико-лабораторных характеристик кишечной фазы аскаридоза у взрослых пациентов в инфекционной клинической больнице г. Уфы, полученные автором одной из диссертационных работ - Е. Р. Валинуровой (2008). Синдром общей интоксикации был отмечен у 90.6 % больных, болевой абдоминальный синдром - у 74.1 %, дисфункция желудочно-кишечного тракта - у 64.5 %, аллергический синдром - у
79
61.2 %, анемия 1-й степени - у 31.5 %, гипотиреоз (заболевание, обусловленное недостаточным содержанием в организме гормонов щитовидной железы) - у 25.2 % пациентов. До процедуры лечения сыворотка крови больных содержала повышенное, в сравнении с группой контроля, содержание интерлейкина-1 (медиатор воспаления и иммунитета), интерлейкина-6 (интерлейкин, который может действовать как провоспалительный и антивоспалительный цитокин), фактора некроза опухоли (р<0.05).
Скопления крупных многочисленных червей (до 100 особей), образующих клубки в просвете пищеварительного тракта, могут вызвать его непроходимость, зачастую сопровождаемую прободением стенки кишечника (рис. 26). В подобных случаях чаще всего страдают дети.
Рис. 26 Ascaris lumbricoides, взрослые черви в кишечнике человека (из: Мозговой, 1953)
Основными признаками аскаридозной непроходимости являются схваткообразные резкие боли в животе и тошнота, задержка стула и газов, вздутие живота, видимая перистальтика кишок, прощупывание опухоли в брюшной полости, чаще в подвздошной области (http://www.eurolab.Ua/encyclopedia/trip/l 409/). Непроходимость может возникать также при рефлекторном спазме кишечника, если какая-либо одна нематода располагается поперёк кишечника, упираясь передним и задним концами тела в его стенки. При тяжёлых кишечных инвазиях возможен летальный исход.
При аскаридозе описаны также дизентериеподобные, холероподобные и напоминающие брюшной тиф симптомы, но при этом всё же следует учитывать вероятность сочетания заражения нематодами с инфекционными заболеваниями.
Иногда взрослые черви, чьи размеры достигают нескольких десятков сантиметров, начинают активно перемещаться, что чаще всего наблюдается при их высокой численности или же у самок при отсутствии самцов, но может быть также связано с действием антигельминтных препаратов. Нематоды покидают организм хозяина чаще всего ночью, через анальное или ротовое отверстия, или же через нос. К слову, в Интернете размещены многочисленные фотографии и видеоролики, иллюстрирующие подобное, довольно нелицеприятное, зрелище. В некоторых случаях взрослые особи, поднимаясь по пищеварительному тракту, достигают глотки и уже оттуда заползают в дыхательные пути, что становится причиной смерти от асфиксии. Вне кишечника человека зрелые черви могут жить в течение нескольких суток.
Если нематоды проникли в печень, жёлчный пузырь или жёлчные протоки, то вызывают сверлящие боли в правом подреберье, закупорку протоков (механическая закупорка общего жёлчного протока может спровоцировать желтуху), гнойный холецистит, гепатомегалию, сепсис; проникновение в протоки поджелудочной
80
железы сопровождается острым панкреатитом, а поражение самой железы - её увеличением, абсцессами и жировым перерождением. Описан случай образования в поджелудочной железе узелков, вызванных скоплением яиц A. lumbricoides (Скрябин, Шульц, 1931).
При высокой заражённости человека у того могут проявляться определённые психические нарушения - повышенная раздражительность, головокружение, беспокойный сон, ночные страхи, головная боль, нервные тики и даже эпилептиформные судороги.
Показано, что паразитирование A. lumbricoides у детей приводит к недостатку в их организме витаминов А и С, а в тех случаях, когда у ребенка насчитывается 26 нематод, тот недополучает в сутки 1/10 общей ежедневной нормы белка (Muller, 2002).
Во всех ситуациях происходит отравление организма продуктами жизнедеятельности паразитов. Токсичность A. lumbricoides, как на личиночной, так и на взрослой стадиях очень высока. Позволю себе привести выдержку из текста монографии А. А. Мозгового (1953; стр. 60): «Нанесение на кожу человека свежей жидкости, полученной из тел Ascaris lumbricoides, или втирание порошка, приготовленного из высушенного и растёртого паразита, во всех случаях вызывали резкую местную реакцию, появляющуюся иногда уже через 5 минут. Местная реакция выражалась постепенно усиливавшимся покраснением и припухлостью кожи. Общая реакция выражалась в появлении эозинофилии (в одном случае дошедшей через 18 часов до 26 %)».
В «Международной классификации болезней 10-го пересмотра» (МКБ-10)* 6, принятой 43-й Всемирной Ассамблеей Здравоохранения, в «Классе I. Некоторые инфекционные и паразитарные болезни (А00-В99)» выделен блок «В65-В83 Гель-минтозы», который содержит раздел «В77 Аскаридоз» с тремя подразделами:
В77.0 Аскаридоз с кишечными осложнениями;
В77.8 Аскаридоз с другими осложнениями;
В77.9 Аскаридоз неуточнённый.
Инвазия нематодами отягощает течение различных болезней, в том числе острых детских инфекций - кори, коклюша, дифтерии, скарлатины, нарушает иммуногенез при инфекционных заболеваниях. В частности, заражение этими гельминтами очень осложняет течение многих глазных заболеваний, особенно трахомы, которая, если не удалить нематод, нередко не поддаётся лечению (Подъяполь-ская, 1968а). С аскаридозом часто сочетаются кровоизлияния в сетчатку, при нём тяжело протекают конъюнктивиты. Н. Д. Гогина (1964) отмечает, что миграция личинок может провоцировать отёк век невоспалительного характера, сопровождающийся инфильтрацией в их толще. Этот же автор наблюдала два случая токсико-аллергического иридоциклита на почве паразитирования аскарид (цит. по: Подъ-япольская, 1968а).
В целом, в 11 - 67 % случаев аскаридоз сопровождается осложнениями и провоцирует возникновение вторичных заболеваний (Dora-Laskey et al., 2014).
6 а) mkb.10.com.
б) Инструкция по использованию МКБ-10 утверждена Министерством здравоохранения РФ 23 мая 1998 г. № 2000/52-98.
81
При неосложнённом заболевании - прогноз благоприятный, при развитии осложнений - серьёзный.
И, наконец, недавно показана возможная связь между инвазией А. lumbricoides женщин детородного возраста и количеством рождённых ими детей (Blackwell et al., 2015а, 2015b). Исследования выполнялись в Боливии среди женщин племени Tsimane (Chimane), в результате чего выяснилось, что заражённые этими гельминтами туземки имели в среднем на два ребёнка больше, чем те, у кого данный паразит отсутствовал. (Сказанное отнюдь не означает, что для увеличения рождаемости следует усиленно глотать яйца аскаридид!).
Диагностика заражения личиночными и взрослыми формами A. lumbricoides принципиально отличается.
Лёгочная (миграционная) стадия представляет определённые трудности для диагностики из-за отсутствия яиц при копроовоскопии, поэтому её диагностируют по наличию эозинофилов и личинок в мокроте. Клиническими симптомами могут служить повышение температуры тела, непродуктивный кашель, одышка, эозинофилы в мокроте, летучие инфильтраты в лёгких, накопление эозинофилов в лёгочных альвеолах (т.е. выражены признаки эозинофильной пневмонии, или синдрома Лёффлера). Необходимо иметь в виду, что признаки синдрома Лёффлера бывают вызваны поражением некоторыми другими нематодами, в частности Trichinella spiralis, а также схистозоматидными трематодами (schistosomatid trematodes). Лёгочную стадию можно также диагностировать иммунологическими методами - реакциями преципитации (РП), непрямой гемагглютинации (РИГА), связывания комплемента (РСК).
Кишечную инвазию диагностируют на основании выявления в кале яиц и их идентификации, реже - по обнаружению в нём взрослых нематод, из данных анамнеза, а также при повышении титра антител в крови (данный метод можно использовать как дополнительный в комплексе с клиническими симптомами). Клиническими симптомами могут служить тошнота, рвота, брюшные боли, диарея и/или констипация (запор). И всё же главный метод диагностики аскаридоза - это анализ кала на яйца паразита. Копроовоскопию рекомендуется проводить с использованием методов обогащения калового материала, например, по методу Фюллеборна7, позволяющему обследовать большой объём материала (http://www.medkurs.ru/ clinical/excrement/section3247/2912l.html). Однако, совершенно очевидно, что если в кишечнике человека поселились только самцы нематоды, то даже при наличии у больного симптомов аскаридоза, яиц в фекалиях не будет. Следовательно, отрицательный результат копроовоскопического анализа ещё не означает отсутствия заражения как такового.
Лечение аскаридоза лучше всего проводить на кишечной стадии, поскольку гибель личинок в лёгких в период их миграции может усугубить поражение дыхательной системы. Доказана достаточно высокая чувствительность взрослых аска-рисов к альбендазолу (немозол), мебендазолу (вермокс) и пирантелу, в некоторых источниках называют также левамизол (декарис). Поскольку при применении того или иного препарата могут наблюдаться различного рода побочные эффекты, само
7 Метод получил название по фамилии немецкого паразитолога Фридриха Фюллеборна (F. Fullebom, 1866 - 1932 или 1933), известного своими работами в области гельминтологии и разработавшего, в том числе, ряд методов гельминтологических исследований.
82
лекарство и его дозировку назначают только медицинские работники, контролирующие курс лечения и вносящие в него по мере необходимости определённые коррективы. Считается, что альбендазол и мебендазол предпочтительнее назначать при кишечной непроходимости, а пирантел более приемлем при лечении беременных.
Народная медицина предлагает десятки рецептов избавления от гельминтов с помощью настоев из различных специй, трав и травяных сборов, лука, чеснока, семян. Многие из них проверены временем и заслуживают самого серьёзного внимания. Тем не менее, заниматься самолечением - довольно рискованное мероприятие, и во избежание возможных осложнений необходимы врачебная консультация, правильная диагностика заболевания и врачебный контроль.
Аскариазис, аскаридоз - типично антропонозное заболевание (Громашев-ский, 1965; Подъяпольская, 19686; Подъяпольская, Капустин, 1950, O’Lorcain, Holland, 2000). Основным источником поступления яиц нематоды в окружающую среду и их разносчиком является заражённый человек, т.е. паразитоноситель.
Основной механизм заражения человека - фекально-оральный (Громашев-ский, 1965), через немытые обсеменённые яйцами нематод овощи, зелень, ягоды, фрукты, а также с любой контаминированной пищей (через грязные руки) и водой. В Кении, например, в некоторых районах популярно поедание термитных домиков, что также способствует заражению местных жителей яйцами аскариса (Luoba et al., 2005). Обсеменению пищевых продуктов в немалой степени способствуют мухи, переносящие яйца паразита, реже - другие домашние насекомые, в том числе тараканы. Поскольку яйца аскариса обладают липучестью, то могут прилипать к обуви и легко заноситься в помещения, а их мельчайшие размеры способствуют переносу ветром вместе с пылью на большие расстояния.
В связи с тем, что яйца A. lumbricoides не развиваются в организме человека, - напомню, что их развитие происходит только в почве, - повторное заражение возможно лишь в результате контакта с инвазионными яйцами нематоды, находящимися в окружающей среде. Иными словами, заражение человека полностью зависит от личной гигиены и санитарных условий.
Личная гигиена проста и необременительна: обязательное мытьё рук перед приготовлением пищи и перед едой, после посещения туалета, особенно в общественных местах, а также после улицы; столь же обязательное мытьё в проточной воде ягод (прежде всего, клубники), овощей, зелени, фруктов, посуды. Не следует забывать и о защите помещения и пищи от мух - пассивных разносчиков яиц нематоды. Воспитательная работа среди детей и подростков призвана привить им осознание необходимости соблюдения всех перечисленных выше правил личной гигиены, что предотвратит их от заражения опасными гельминтами.
Один из путей общественной профилактики заключается в выявлении и лечении больных, основной категорией среди которых являются дети, причём в основном в возрасте от 2 до 10 лет. Дети, играя весь тёплый сезон во дворах, песочницах, садах, на детских площадках, в парках, скверах, почву которых они сами же нередко загрязняют фекалиями, имеют большую вероятность, чем взрослые, заразиться яйцами аскариса. К тому же детвора достаточно часто пренебрегает теми гигиеническими навыками, которые родители пытаются привить им. При единичных случаях гельминтоза лечат только тех пациентов, в кале которых обнаружены яйца аскариса. Нематод, выделенных после лечения от больного, уничтожают, фекальные массы заливают кипятком, извёсткой и выдерживают в закрытой ёмкости в
83
течение 40 мин. Как отмечено выше, высокая температура губительно действует на формирующуюся в яйце личинку. Контрольное обследование эффективности предпринятого лечения следует проводить через 2-3 недели в течение 3-х дней,*а затем ещё через 2 недели также в течение 3-х дней. Лица, переболевшие аскаридозом, обычно должны находиться под диспансерным наблюдением в течение 3-х лет (www/medicalj .ги).
Не меньшее значение в профилактике аскаридоза имеет санитарное благоустройство населённых мест, уход за детскими игровыми площадками и песочницами, в которых следует регулярно рыхлить песок (яйца аскарисов погибают под действием солнечных лучей).
Принимая во внимание основополагающую роль почвенного фактора в жизненном цикле A. lumbricoides, особое внимание необходимо уделять мероприятиям, направленным на предупреждение загрязнения почвы сточными водами, используемыми для орошения и удобрения полей. В равной степени абсолютно недопустимо удобрять почву огородов, приусадебных участков свежими фекалиями, которые следует использовать только после компостирования (в «компостной куче» температура доходит до 80°С, губительной для яиц нематоды).
Самые древние находки яиц A. lumbricoides у человека относят к 30 000 г. до н. э. (Bouchet et al., 1995). К началу нынешнего столетия заражение людей А. lumbricoides зарегистрировано более чем в 150 странах мира, особенно в тропических, субтропических и умеренных широтах. В полярных, приполярных и пустынных районах паразит редок. Наиболее высока заражённость людей в высоко урбанизированных регионах, и более всего - в столицах. К примеру, в одной из работ по гельминтам человека (Muller, 2002), приведены весьма любопытные цифры распространения аскаридоза по планете: к началу 21-го столетия в Китае было поражено 523 - 539 млн. человек, в Кении - 38 %. В Рио-де-Жанейро (Бразилия) заражённость жителей достигала 25 %, в Александрии (Египет) - 47 %, в Лагосе (Нигерия) - 68 %, в Куала-Лумпуре (Малайзия) - 64 %, в Хайдарабаде (Индия) - 35 %, в Маниле (Филиппины) - 80 % и т.д. В 2006 г. общее количество людей в мире, заражённых A. lumbricoides, оценивали в 807 - 1221 млн. (Benthony et al., 2006), а в 2014-м таковых насчитывалось уже около 1.4 млрд., в том числе почти 4 млн. человек в США (Dora-Laskey et al., 2014). В некоторых тропических странах заражённость населения может достигать 70 % и выше. Например, в отдельных регионах Индонезии аскариазис выявлен почти у 90 % местных жителей (Dora-Laskey et al., 2014). В России заболевание отмечается практически по всей территории. В среднем показатель заболеваемости варьирует от 60 до 85 на 100 тыс. населения. Большая часть больных выявляется среди городского населения (60 %), а среди возрастных групп доминируют дети (до 65 %). Географически максимальная заболеваемость регистрируется в Дальневосточном регионе (Сахалин и Приморье) (www/medicalj.ru). К примеру, в 1998 г. уровень заболеваемости в среднем по России составил 59.2 случаев на 100 тыс. населения (Калинина, 2005), но на Сахалине он был выше среднего по стране в 5.5, а по Приморскому краю - в 3.3 раза (Экологический вестник России, 2000). Повышенная заболеваемость отмечена также в Северокавказском и Западносибирском регионах, тогда как в Поволжском и Центрально-Чернозёмном районах она заметно ниже.
Средняя заболеваемость населения Земли может достигать 100 млн. случаев в год. Несмотря на то, что аскридоз редко заканчивается летальным исходом, еже-
84
годная смертность в мире от него колеблется от 8000 до 100 000 человек. Чаще всего погибают дети от непроходимости кишечника и перитонита.
Совершенно очевидно, что особенности распространения паразита регулируются факторами внешней среды, при которых может происходить формирование инвазионной личинки, а также социальными, санитарно-бытовыми, поведенческими и, как ни странно это звучит, генетическими факторами (есть люди, предрасположенные к заражению аскарисами). В целом, как облигатный паразит человека, паразит может быть обнаружен везде, где живёт его потенциальный хозяин, при наличии соответствующих условий окружающей среды. В зоне тёплого и влажного климата заражение происходит круглогодично, в зоне умеренного климата - с апреля по октябрь.
Ascaris suum Goeze, 1782 (^Ascaris suilla Dujardin, 1845) (рис. 27) - типичный паразит свиней, широко распространённый на свинофермах и в домашних хозяйствах по всему миру. Видовое название происходит от латинского названия рода хозяина: Sus - свинья, на материале от которой червь впервые был описан. В русскоязычной литературе нематоду называют свиной аскаридой.
Рис. 27 Ascaris suum: а - губы, апикально (из: Мозговой, Шахматова, 1973 - по: Мозговой и др., 1960);
1-2-хвостовой конец самца (из: Мозговой, 1953 — по: Озёрская, 1930)
В силу большого морфологического сходства A. suum с A. lumbricoides, дискуссия о его таксономической самостоятельности длится не один год и даже не одно десятилетие (Anderson et al., 1991; Leles et al., 2012; Loreille, Bouchet, 2003; Zhu et al., 1999). Яйца обоих видов, обнаруженные в фекалиях свиньи и человека, морфологически идентичны, однако взрослые формы имеют лёгкие различия в морфологии, которые обычно используют для их определения (Ansel, Thibaut, 1973). Несмотря на то, что названные виды рассматривают специфичными каждый к своему хозяину, яйцами A. lumbricoides успешно заражали свиней и наоборот, A. suum развивался в человеке, т. е. жизненные циклы и того, и другого вида завершались в обоих хозяевах (см.: Crompton, 2001). Д. Лёлес с соавт. (Leles et al., 2012), изучив паразитологические, палеонтологические, археологические и палеопаразитологические данные, а также результаты исследований по молекулярной биологии обоих видов, предложили их синонимизировать. В пользу воз-85
можной синонимичности сравниваемых видов свидетельствует и тот факт, что они образуют гибридные формы, встречающиеся как у человека, так и у свиней.
Описание (по разным авторам). Крупные нематоды с характерными чертами рода. В живом состоянии черви розовато- или серовато-жёлтого цвета. Самцы длиной 105 - 310 и толщиной 2-4 мм, имеют две равные спикулы, длиной 2 — 3.5 мм. Самки длиной 200 - 490 и толщиной 3-6 мм. Отверстие вульвы в передней трети тела; у места её расположения тело имеет отчётливо выраженную перетяжку. Яйца золотисто-коричневые, овальной формы, с фестончатой наружной оболочкой, придающей им сходство с тутовой ягодой, размером (по разным авторам) 56 - 87 х 46 -57, 45 - 75 х 35 - 50 или 50 - 75 х 40 - 50 цт. Самки могут откладывать неоплодо-творённые яйца, чьи размеры несколько превышают таковые оплодотворённых яиц, 88 - 94 х 44 цт. Одна взрослая особь откладывает в сутки от 100 до 200 тыс. яиц, а в её матках одновременно содержится до 27 млн. яиц (Roberts, Janovy, 2008).
Цикл развития A. suum типичен для представителей рода Ascaris (рис. 28).
Рис. 28 Схема биолого-эпизоотологического цикла Ascaris suum (из: Мозговой, 1953 - по: Скрябин, 1931)
Яйца с фекалиями хозяина попадают во внешнюю среду, где в них при благоприятных условиях в течение 10 дней развивается инвазионная личинка. За это время личинка в яйце дважды линяет и, попав в организм окончательного хозяина, покидает яйцо уже на 3-й стадии, покрытой чехликом личинки 2-й стадии (Fagerholm et al., 2000). Свиньи заражаются, заглатывая инвазионные яйца вместе с пищей или водой, загрязнёнными калом больных свиней. Личинка, покинувшая в кишечнике свиньи яйцевую оболочку, проделывает обычный, характерный для аска-рисов миграционный путь в крови и через 10 дней вновь попадает в кишечник, где на 14-й день линяет и превращается в личинку 4-й стадии, а на 25-й день - в личин
ку 5-й стадии. Через 6 недель после попадания в окончательного хозяина черви достигают половозрелого состояния.
Патогенное влияние свиной аскариды на организм её хозяина - свиньи аналогично таковому, наблюдаемому при заражении человека A. lumbricoides. Замечено, что негативное влияние нематод на организм животных выражено сильнее, если те получают недостаточный или неполноценный корм, в частности содержащий мало витаминов. Особенно сильно страдают поросята от трёх- до восьмимесячного возраста; у старых свиней заболевание наблюдается значительно реже.
Основным источником распространения паразита в природе служат инвази-рованные свиньи - паразитоносители. Заражение новых особей хозяина происходит через загрязнённую пищу и воду. Кроме того, как показали экспериментальные исследования, свиньи могут заражаться через поедание печени и лёгких цыплят, поражённых личинками свиной аскариды (Permin et al., 2000). Кстати, продемонстрировав своими опытами возможность заражения свиней подобным образом и учитывая факт паразитирования свиной аскариды у человека, авторы цитируемой работы высказали опасения по поводу возможной трансмиссии этого паразита к человеку через сырую печень цыплят.
В Бразилии A. suum, помимо свиней, нашли у пекари (Regolin et al., 2009).
Несмотря на то, что A. suum считают специфичным паразитом свиней, его отмечают и у людей. Прочитав в одной из публикаций о заражении яйцами свиной аскариды нескольких человек в Канаде (Anderson, 1995), я нашла первоисточник, в котором описывалась эта почти криминальная история.
27 февраля 1970 г. в «The Bulletin. Bend, Oregon» была опубликована заметка «Pig parasite almost kills four students» («Свиной паразит почти убивает четырёх студентов»), суть которой сводилась к следующему. Некий Эрик Кранц, снимавший в Квебеке жильё вместе с четырьмя другими аспирантами, поссорившись с коллегами на бытовой почве, подложил им в пищу яйца A. suum, которые выкрал из университетской лаборатории. Через 10-12 дней молодые люди почувствовали острое недомогание, клинические признаки которого свидетельствовали о поражении лёгких, на основании чего им был поставлен диагноз пневмонии. Поскольку состояние юношей резко ухудшалось, - антибиотики бесполезны при аскаридозах, - врачи начали искать истинную причину болезни и в результате выявили у них заражение свиной аскаридой, от которого юношей в конечном итоге вылечили. По подсчётам врачей, один из пострадавших мог получить огромное количество личинок - 400 тыс. Видимо, именно об этом молодом человеке шла речь, когда лечащий врач сообщил, что состояние одного из юношей было критическим, и он чуть было не погиб. Совершенно очевидно, что данная история, которую можно рассматривать как яркий пример биотерроризма, является наглядной иллюстрацией возможного применения на практике одного из видов биологического оружия - паразитов.
Кстати, именно этот инцидент стал отправной точкой в отсчёте и обсуждении случаев регистрации A. suum у человека (Anderson, 1995; Anderson, Jaenike, 1997; Crewe, Smith, 1971; Lord, Bullock, 1982; Phills et al., 1972).
В настоящее время A. suum отмечают у населения Японии и Китая (соответственно: Arizono et al., 2010; Zhou et al., 2012). В эндемичных зонах, где встречаются оба вида, A. suum является важным источником заражения человека. К тому же, при столь тесном совместном обитании оба вида образуют гибридные формы. В Китае, например, 95 % гибридных форм выявлено у человека.
87
Итальянские исследователи также сообщают о регистрации гибридной формы A. suum/lumbricoides у человека (Dutto, Petrosillo, 2013). Речь идёт об обнаружении у 42-летнего мужчины - хозяина свинофермы на северо-западе Италии -самки и самца нематоды, которые были определены как генотип, промежуточный между A. suum и A. lumbricoides. Последующие исследования свиней на этой ферме показали, что некоторые из них инвазированы A. suum, однако ни у одного из членов семьи фермера нематоды не были выявлены. Как выяснилось, заражение фермера произошло, скорее всего, из-за присущей ему привычки обкусывать ногти. Таким образом, у человека могут паразитировать не только специфичный для него вид A. lumbricoides, но и характерный для свиней A. suum. В. А. Гефтер (1968) приводит данные о регистрации у людей ещё двух видов Ascaris - A. texana Smith et Goeth, 1904 (в Техасе, США) и A. maritima Leuckart, 1876 (в Гренландии). Оба вида в настоящее время рассматривают синонимами A. lumbricoides (Faust, 1949). О. И. Калинина в учебном пособии «Биология гельминтов и профилактика гельминто-зов» (2005) на стр. 47 утверждает (дословно): «Человек не может заразиться ни лошадиной, ни свиной аскаридой - в его организме нет подходящих для них условий существования. Точно так же человеческая аскарида не паразитирует у животных. Источником заражения человека аскаридами может быть только человек». Увы! эта информация, как мы видим, явно не соответствует действительности. К слову, результаты молекулярных исследований показали, что в Северной Америке большинство случаев заражения людей аскарисами вызвано A. suum (Anderson, Jaenike, 1997). Помимо того, не исключена возможность регистрации у людей гибридной формы названных видов. Во всех случаях заражение сопровождается весьма неприятными явлениями и даже может иметь летальный исход. Основная превентивная мера - личная гигиена на фоне комплекса санитарно-ветеринарных мероприятий, направленных на уничтожение инвазионного начала.
Цитируемая литература
Брудастов А. Н., Краснонос Л. Н, Бабаева Р. И. К вопросу о максимальных сроках выживания яиц аскарид в почве / Основные паразитарные болезни, их предупреждение и лечение: Мат. рес-публ. науч.-практ. конф., Ташкент. - Ташкент, 1975. -ЧП.- С. 29 - 33.
Валинурова Е. Р. Клинико-лабораторная характеристика кишечной стадии аскаридоза у взрослых (разработка дополнительных критериев оценки эффективности лечения): автореф. дисс...канд. мед. наук: 14.00.10 - инфекционные болезни. - М., 2008. - 22 с.
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Громашевский Л. В. Общая эпидемиология: руководство для врачей и студентов санитарно-гигиенических факультетов. 4е изд., перераб. - М.: Медицина, 1965. - 290 с.
Догель В. А. Курс общей паразитологии. Изд. 2-е. - Л.: Учпедгиз, 1947. - 372 с.
Калинина О. И. Биология гельминтов и профилактика гельминтозов (учебное пособие). - Владивосток: Изд-во ТГЭУ, 2005. - 80 с.
Мозговой А. А. Аскаридаты животных и человека и вызываемые ими заболевания. Книга I // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1953. -2.-351 с.
Мозговой А. А., Шахматова В. И. Аскаридаты животных и человека и вызываемые ими заболевания. Книга IIIИ Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1973. - 23. - 218 с
Озёрская В. Н. Глистные болезни пищеварительного тракта свиней и их значение в экономике свиноводческого хозяйства. - М.: Сельхозгиз, 1930. - 128 с.
88
Подъяпольская В. П. Глава III. Патогенное действие гельминтов человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968а. - С. 328 - 334. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Подъяпольская В. П. Глава XXIV. Аскаридоз / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 19686. - С. 543 -561.
Подъяпольская В. П.9 Капустин В. Ф. Глистные заболевания человека. - М.: Медгиз, 1950.-608 с.
Скрябин К И. Аскариды и их значение в медицине и ветеринарии. Гельминтологический этюд. - М., 1925. - 140 с. (цит. по: Мозговой, 1953).
Скрябин К. И., Шульц Р.-Э. С. Гельминтозы человека. Ч. II. - М.-Л.: Госмедгиз, 1931. - 768 с.
Токарева М. К. Экологические особенности возбудителя аскаридоза в условиях воздействия техногенных и аномальных природных факторов: на примере Курской области: автореф. дисс... канд. биол. наук: 03.00.19 - паразитология. - М., 2007. - 22 с.
Филипченко А. А., Данскер В. Н. У эпидемиологии аскаридиоза // Тр. Ленингр. ин-та эпидемиол. и бактериол. им. Пастера. - 1935. - 2. - Работа паразитол. отдела (цит. по: Мозговой, 1953).
Anderson Т. J. Ascaris infections in humans from North America: molecular evidence for cross-infection // Parasitology. - 1995.-110, 2.-P. 215-219. 10.1017/S0031182000063988.
Anderson T J. C, Jaenike J. Host specificity, evolutionary relationships and macrogeographical differentiation among Ascaris populations from humans and pigs I I Parasitology. - 1997. -115, 3. - P. 325 - 342.
Anderson T J., Romero-Abai M. E, Jaenike J. Genetic structure and epidemiology of Ascaris populations: patterns of host affiliation in Guatemala // Parasitology. - 1991. - 107, 3. - P. 319 - 334.
Ansel M., Thibaut M. Value of the specific distinction between Ascaris lumbricoides Linnaeus 1758 and Ascaris suum Goeze 17827/ Int. J. Parasitol. - 1973.-3, 3. -P. 317-319. 10.1016/0020-7519(73)90109-4.
Arizono N., Yoshimura Y., Tohzaka N., Yamada M., Tegoshi T. et al. Ascariasis in Japan: is pig-derived Ascaris infecting humans? // Jpn. J. Infect. Dis. - 2010. - 63, 6. - P. 447 - 448.
Bauer C. Baylisascariosis - infections of animals and humans with 'unusual' roundworms // Vet. Parasitol. -2013. -193, 4. -P. 404-412. doi: 10.1016/j.vetpar.2012.12.036.
Benthony J, Brooker S., Albonico M., Geiger S. M., Loukas A. et al. Soil-transmitted helminth infections: ascariasis, trichuriasis, and hookworm // Lancet. - 2006. - 367. - P. 1521 - 1532.
Blackwell A. D., Tamayo M. A., Beheim B., Trumble В. C, Stieglitz J. et al. Helminth infection, fecundity, and age of first pregnancy in women I I Science. - 2015. - 350, 6263. - P. 970 - 972.
Blackwell A. D., Tamayo M. A., Kaplan H, Gurven M. Effects of parasitism on fecundity and life history in human females I 8th Ann. Meet. Amer. Ass. Phys. Anthropol. - 2015. - On-line: meeting.physanth.org.
Bouchet F, Baffler D., Girard M., Morel. P, Paicheler J. C, David F. Pal^oparasitologie en contexte pleistocene: premidres observations й la Grande Grotte d'Arcy-sur-Cure (Yonne), France I I C. R. Acad. Sci. Paris. -1996.-319.-P. 147-151.
Crewe W., Smith D. H. Human infection with pig Ascaris (A. suum) //Ann. Trop. Med. Parasitol. - 1971. -65, l.-P. 85.
Crompton D. Ж T: Ascaris and ascariasis 11 Adv. Parasitol. - 2001. - 48. - P: 286 - 375.
Dora-Laskey A., Weiss E. L., Ezenkwele U. A. Ascaris lumbricoides И (On-line). eMedicine-Medscope, 2014.
Dutto M., Petrosillo N. Hybrid Ascaris suum/lumbricoides (Ascarididae) infestation in a pig farmer: a rare case of zoonotic ascariasis И Cent. Eur. J. Public Health. - 2013. - 21, 4. - P. 224 - 226.
Fagerholm H.-Р., Nansen P., Roepstorff A., Frandsen F, Eriksen L. Differentiation of cuticular strutures during the growth of the third-stage larva of A suum after emerging from the egg И J. Parasitol. - 2000. -86, 3.-P. 421 -427.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Hodda M. Animal biodiversity // Zootaxa. - 2011. - No 3148. - P. 63 - 95.
Leles D., Gardner S. L, Reinhard K, Iniguez A., Araujo A. Are Ascaris lumbricoides and Ascaris suum a single species?//Parasites & Vectors.-2012.-5. -e42. DOI: 10.1186/1756-3305-5-42.
Lord W. D., Bullock W. L. Swine Ascaris in humans // N. Engl. J. Med. - 1982. - 306. - P. 113.
Loreille O., Bouchet F. Evolution of ascariasis in humans and pigs: a multi-disciplinary approach // Mem. Inst. Oswaldo Cruz. - 2003. - 98, Suppl. 1. - P. 39 - 46.
Luoba A. I, Wenzel Geissler P., Estambale B. et al. Earth-eating and reinfection with intestinal helminths among pregnant and lactating women in western Kenya // Trop. Med. Int. Health. - 2005. - 10, 3. - P. 220 -227.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
89
O’Lorcain P., Holland С. V. The public health importance of Ascaris lumbricoides 11 Parasitology. - 2000. -121, Suppl.-P. 51-71.
Peng W„ Criscione Ch. D. Ascariasis in people and pigs: New inferences from DNA analysis of worm populations // Infect., Genet., Evol. - 2012. -12, 2. - P. 227 - 235.
Permin A., Henningsen E, Murrell K. D., Roepstorff A., Nansen P. Pigs become infected after ingestion of livers and lungs from chickens infected with Ascaris of pig origin 11 Int. J. Parasitol. - 2000. - 30, 7. - P. 867-868.
Phills J. A., Harrold A. J., Whiteman G. V., Perlmutter L. Pulmonary infiltrates, asthma and eosinophilia due to Ascaris suum infestation in man 11N. Engl. J. Med. - 1972. - 286, 18. - P. 965 - 970.
Poinar G. Jr., Boucot A. J. Evidence of intestinal parasites of dinosaurs 11 Parasitology. - 2006. - 133. - P. 245-249. doi: 10.1017/S0031182006000138 P.
Regolin A. L, Oliveira С. H. S., Carvalho-Pinto C. J. Primeira ocorrencia de Ascaris suum em queixada (Tayassu pecari: Tayassuidae), Santa Catarina, Brasil [abstract] // Rev. Patol. Trop. - 2009. -38, Suppl. 2. -P. 1092.
Roberts L, JanovyJ., Jr. Foundations of Parasitology. - McGraw-Hill, 8th ed., 2008. - 728 pp.
Sprent J. F. A. The life cycles of nematodes in the family Ascarididae Blanchard 1896 // J. Parasitol. - 1954. -40, 5, Sect. l.-P. 608-617.
Zhou C, Li M., Yuan K., Deng S., Peng W. Pig Ascaris: an important source of human ascariasis in China // Infect., Genet., Evol. -2012. - 12, 6. -P. 1172 - 1177. doi: 10.1016/j.meegid.2012.04.016.
Zhu X., Chilton N. B., Jacobs D. E, Boes J, Gasser R. B. Characterization of Ascaris from human and pig hosts by nuclear ribosomal DNA sequences 11 Int. J. Parasitol. - 1999. - 29, 3. - P. 469 - 478.
Род Baylisascaris Sprent, 1968
Описание (по: Мозговой, Шахматова, 1973; Hartwich, 1962; Sprent, 1968; Stefanski, Zamowski, 1951; с дополнениями других авторов). Крупные нематоды с характерными чертами семейства. Взрослые самки достигают в длину 14-28, самцы - 7 -12 см. Зубчатые гребни на губах имеются или незаметные. Шейные (цервикальные) крылья выступают или уменьшены. Кутикулярные полосы доходят до поверхности крыльев. Дорсальные и субвентральные сосочки губ с двойным окончанием. Самцы характеризуются околоклоакальной бугристостью, наличием более 30 преа-нальных сосочков; постанальные сосочки расположены с обеих сторон хвоста, передняя пара сосочков двойная. Имеются ещё 2 пары субвентральных одинарных сосочков и фазмиды. Спикулы толстые, равномерной толщины. Положение вульвы варьирует - от передней четверти тела до преэкваториального. Оболочка яиц бугристая, бахромчатая или гладкая. Паразиты плотоядных и грызунов. Типовой вид -Baylisascaris transfuga (Rudolphi, 1819) Sprent, 1968.
Жизненный цикл Baylisascaris типичен для геогельминтов, т.е. в нём отсутствуют промежуточные хозяева (рис. 29).
Однако, как подчёркивают исследователи (Bauer, 2013; Sprent, 1953), все Baylisascaris имеют факультативный гетероксенный жизненный цикл; во всяком случае, именно такой результат получен в экспериментальных условиях. Яйца, содержащие зародыш, выходят во внешнюю среду с фекалиями. При благоприятных условиях внешней среды в яйце после двукратной линьки формируется подвижная личинка 3-й стадии, заключённая в чехлик личинки 2-й стадии. Этот процесс занимает 2-4 недели (Papini et al., 1994; Sakla et al., 1989). Яйца сохраняют жизнеспособность во внешней среде в течение нескольких лет, выдерживая и жару, и зимние морозы. Заражение животных происходит при заглатывании яиц или при поедании других животных, уже заражённых нематодами. Если личинки попали в соответствующего дефинитивного хозяина, то линяют в нём и развиваются в половозрелую стадию в течение нескольких недель. В тех случаях, когда личинки попадают
90
«не в того хозяина» и пытаются найти в нём «свою» локализацию, хозяин пытается избавиться от него, или изолируя или убивая его. Быстро двигаясь, чтобы избежать ответной реакции хозяина, личинки оказываются в печени, глазах, спинном или головном мозге. Иногда их находят в сердце, лёгких и других органах. Разрушая часть мозга, личинки могут изменять поведение хозяина до такой степени, что тот становится лёгкой добычей хищника, который вместе с пищей получает и паразита, приобретающего, таким образом, нового хозяина.
Рис. 29 Схема жизненного цикла Baylisascaris procyonis: 1 - яйцо попадает во внешнюю среду; 2 - развитие яйца во внешней среде; 3 - попадание яйца, содержащего инвазионную личинку, в дефинитивного хозяина; 4 -заражение мелких млекопитающих и птиц личинками нематоды; 5 - личинки инцистиру-ются в тканях; 6 -заражение дефинитивного хозяина; 7 -взрослые нематоды в кишечнике окончательного хозяина; 8 - заражение человека (i - инфекционная стадия; d - диагностическая стадия) (из: https://en. Wikipedia, org/wiki/ Baylisasca-ris_ procyonis)
Род объединяет 9 видов (Bauer, 2013). Принято считать, что все виды Baylisascaris потенциально опасны для здоровья человека (Bauer, 2013; Gavin et al., 2005), однако одним из наиболее известных и, к тому же, высоко патогенным для человека является В. procyonis.
Baylisascaris procyonis (Stefanski et Zamowski, 1951) Sprent, 1968 [^Ascaris procyonis Stefanski et Zamowski, 1951; Toxascaris procyonis (Stefanski et Zamowski, 1951) Sprent et Haakh, 1956] (рис. 30). Паразит впервые выделен от енотов в Нью-Йоркском зоопарке в 1931 г. и указан тогда под названием Ascaris columnaris Leidy, 1856 (McClure, 1933). Однако, несмотря на своё североамериканское происхождение, впервые данный вид описан на материале от енота-полоскуна из Лодзинского зоопарка (Польша) (Stefanski, Zamowski, 1951).
91
Рис. 30 Baylisascaris procyonis: a - головной конец, апикально; б - дорсальная губа; в, г - хвостовой конец самца; д - яйцо (из: Мозговой, Шахматова, 1973 - по: (а - г) Stefanski, Zamowski, 1951 и (д) Hartwich, 1962
Видовое название нематоде дали по латинскому названию рода хозяина: Ргосуоп - род енотов, procyonis - енотовый.
Что касается выше упомянутого A. columnaris, то в настоящее время этот специфичный для скунса паразит также включён в состав рода Baylisascaris как В. columnaris (Leidy, 1856). К слову, данного паразита, но под его «старым» названием -Ascaris columnaris - отмечали в 1950 - 1960-е годы у куниц на территории Кавказского заповедника и в Краснодарском крае России (Рыбалтовский, Овчинникова, 1960; Рябов, 1958), и уже в 2000-е годы на территории Северо-Западного Кавказа - у куниц лесной и каменной, енотовидной собаки, барсука (Итин, 2014).
Описание (по разным авторам). Нематоды средних размеров, с тонким, белого цвета телом, слегка сужающимся к переднему концу. Хвостовой конец конический. Губы трапециевидной формы, без заметного сужения у основания, их передние края с мелкими зубчиками треугольной формы. На наружной стороне каждой губы ближе к её основанию имеется по 2 сосочка. У дорсальной губы эти сосочки двойные, крупные и выпуклые, у латеровентральных — только вентральный сосочек двойной и крупный, а латеральный более плоский и маленький, с двойным нервным окончанием. Пульпа губ с 2 пальцевидными выступами, имеющими на переднем крае отчётливую выемку. Интерлабии отсутствуют. Цервикальные крылья очень узкие, начинаются у основания губ и заканчиваются на уровне 1/6 длины пищевода. Самцы длиной 62 - 77 и максимальной толщиной 1.3 - 1.85 мм.
92
Хвостовой конец самца с 40 - 44 преанальными и 5 парами постанальных сосочков (первые 2 пары двойные). Спикулы слегка изогнутые, почти одинаковой длины. Самки длиной 60 - 120 и толщиной 1.6 - 2.7 мм. Вульва на границе первой и второй четвертей длины тела. Вагина короткая. Яйца с крупной тёмной зиготой, почти полностью заполняющей полость яйца, эллипсоидальные, коричневого цвета, с толстой оболочкой с тонкозернистой поверхностью, 77 - 79 х 53 - 57 (Stef-anski, Zamowski, 1951), 73 - 79 х 53 - 65 (Hartwich, 1962) или 63 - 88 х 50 - 70 pm
(Kazacos, 2001; Pinero et al., 2012). Последние из цитируемых авторов отмечают, что чаще всего встречаются яйца размерами 68 - 76 х 55 - 61 pm.
Жизненный цикл В. procyonis очень похож на таковой представителей рода Ascaris - кишечных паразитов человека и животных (см. рис. 29).
Зрелая самка продуцирует в сутки более 115 - 179 тыс. яиц (Pinero et al., 2012). Подсчитано, что в 1 г фекалий енота обычно содержится до 20 — 26 тыс. яиц, причём более высокая численность яиц характерна для молодых особей, у которых она может достигать 250 тыс. (Pinero et al., 2012). Каждый заражённый зверёк выделяет за сутки в среднем более 1 млн. яиц нематоды. Изучая частоту откладки яиц в фекалиях енота, исследователи пришли к выводу, что, прежде чем судить о заражённости этих животных по результатам анализа фекалий, его следует выполнять в
течение как минимум трёх суток (Reed et al., 2012). В яйцах, находящихся во внешней среде, при благоприятных условиях (температура 22 — 25 °C, влажность 100 %) в течение 11-14 дней формируется личинка, инвазионная для дефинитивного хозяина (рис. 31). При менее благоприятных условиях сроки формирования личинки удлиняются.
Рис. 31 Личинка Baylisascaris procyonis, покидающая оболочку яйца (из: https://en.wikipedia.org/wiki/Baylisascaris_procyonis)
Еноты, как правило, молодые, заражаются при случайном заглатывании яиц. Если же те попадают к другим животным, обычно грызунам, а также к птицам, то в их кишечнике покинувшие яйца личинки проникают в печень, а затем в лёгкие. Попав в лёгочные вены, они мигрируют через левое предсердие, распространяясь по всему телу, особенно в область головы, шеи и туловища. В таких дополнительных (паратонических) хозяевах личинки инкапсулируются в маленьких эозинофильных гранулёмах. Подобные инвазированные животные чаще всего становятся добычей енотов старшего возраста, попав в которых личинки покидают цисту и проникают в тонкий кишечник, где в течение 32-38 дней достигают половозрелого состояния. В случае заражения енотов яйцами, содержащими личинок 2-й стадии, те развиваются до взрослого состояния за 50 - 76 дней (Pinero et al., 2012).
В. procyonis - специфичный паразит енота-полоскуна Procyon lotor, широко распространённый в Северной Америке. На территории США заражённость енота варьирует от 3.4 до почти 100 %8. К примеру, в Портленде (Орегон) паразита обнаружили у 58 % обследованных енотов (Yeitz et al., 2009), а близ Чикаго - у 39 % животных, добытых охотниками, ив 18 % проб фекалий (из 433) (Page et al., 2009). При этом молодые особи заражены сильнее взрослых: более 90 % против 37 - 55 %
8 www.michigan,gov.DNR-RaccoonRoundworm(Baylisascaris)html.
93
(Pinero et al., 2012). В Канаде в Виннипеге (провинция Манитоба) В. procyonis выявили у 37.1 % особей городской популяции енота (Sexsmith et al., 2009), а на юго-западе страны - у 61 % животных (Ching et al., 2000). Среднее количество червей, обнаруживаемых в одном хозяине, колеблется от 43 до 52, причём у молодых зверьков этот показатель выше (48 - 62; от 1 до 480), чем у взрослых особей (2 - 22; 1 -257) (Ermer, Fodge, 1986; Kazacos, 2001; Snyder, Fitzgerald, 1985). Известно, что енот обычно не страдает от инвазии, и лишь при высокой численности червей у него может наблюдаться непроходимость кишечника.
Сделаем небольшое отступление и вспомним, каким образом енот-полоскун, а вместе с ним и его паразит, оказались в Европе и ряде других регионов.
В 1927 г. в округе Франкенберг - Эдер (Германия) в лес было выпущено четыре американских енота (www.ohotnik.ru). По другой версии, еноты впервые появились в Германии в 1934 г., когда некий владелец птицефермы на севере Гессена (Германия) доставил лесничему две пары енотов с просьбой выпустить их в лес. В 1945 г., во время Второй мировой войны, при бомбёжке была повреждена ферма близ Берлина, из которой сбежали 25 енотов (в некоторых источниках пишут о побеге енотов из Берлинского зоопарка). В настоящее время в Германии обитает вторая по численности, после североамериканской, популяция енота-полоскуна, насчитывающая по состоянию на 2008 г. от 200 000 до 400 000 животных; в окрестностях города Кассель в Гессене их плотность достигла 100 голов на 1 км2. Из Германии еноты, легко приспосабливающиеся к новым условиям среды, проникли в соседние области Дании, Бельгии, Нидерландов, Польши, Чехии, Венгрия, Швейцарии, Франции.9 В 2001 г. еноты впервые появились в Испании, и также начали активно расселяться по территории страны.10
С 1936 по 1958 гг. неоднократные попытки акклиматизировать енота предпринимались и в Советском Союзе. В итоге к настоящему времени устойчивые популяции этих животных сформировались в Беларуси и Азербайджане. Более того, азербайджанские еноты уже распространились на территорию северокавказских республик РФ, проникли в Грузию, Армению, приграничные районы Турции.
И, наконец, совершенно невероятно выглядит история появления енота-полоскуна в Японии. После демонстрации на местных экранах популярного сериала о приключениях маленького очаровательного енота Раскала, многие дети захотели иметь подобного зверька дома, и вскоре в Японию из Северной Америки ежемесячно начали доставлять около 1500 молодых енотов в качестве домашних животных. Всего в середине 1970-х годов было завезено около 20 тыс. зверьков. Однако эти животные приручаются не столь хорошо, как хотелось бы, и поэтому подросших енотов обычно выпускали в лес. В итоге в 2000 г. дикие еноты были отмечены в 17 префектурах Японии, в 2004-м - уже в 42-х, а в 2008 г. - во всех 47. В наши дни в стране ежегодно отлавливают тысячи особей енота-полоскуна, кстати, славящегося ценным мехом, но тот продолжает успешно размножаться и процветать, хозяйничая на полях, вылавливая рыбу в прудах, активно посещая помойки, далеко разнося при этом мусор, проникая на придомовые территории и даже в дома. Ежегодный ущерб сельскому хозяйству Японии от енотов в 2006 г. оценили в 160 млн. иен (см. сноску 9).
Вместе с енотом в страны Европы и Японии проник и его специфичный паразит - В, procyonis. который, как и хозяин, постепенно осваивает всё новые регионы. На территории Германии наблюдаются определённые различия в заражённости енотов этим гельминтом: в одних районах им поражено 70 - 80 % животных
9 http://mmgp.ru.light-news.rU/21-03-2015/id49686.html.
10 http://noticia.ru/allnews/nauka/enotyi-aktivno-zaselyayut-ispaniyu.htm.
94
(Hohmann et al., 2002), в других - 39 % (Winter et al., 2005). На западе Польши яйца бэйлисаскариса выявили в 3.7 % проб фекалий енота, от 1 до 5 яиц в пробе (Bartoszewicz et al., 2008). В. procyonis обнаружен также в Чехии и Словакии (Тепо-ra et al., 1991); в Японии его отметили в среднем у 27 % животных (Miyashita, 1993).
Информация о находках В. procyonis у этого зверька в России, Азербайджана или Беларуси к настоящему времени отсутствует. А. А. Азизова (2010) нашла у енота в Азербайджане Baylisascaris lotorus, но среди известных видов Baylisascaris таковой не значится (Bauer, 2013). Вполне возможно, что в данном случае это мог быть В. procyonis. Учитывая зоонозное значение гельминта, желательно провести дополнительные паразитологические исследования енота в указанном регионе.
На американском континенте В. procyonis зарегистрирован ещё у двух представителей семейства енотовых - кинкажу (в переводе с языка индейцев Од-жибае - «медовый медведь») и олинго (Kazacos et al., 2011). В эксперименте взрослые черви выращены в опоссуме (Kazacos, 2001). И, наконец, домашние собаки, -но не кошки, - также оказались восприимчивы к заражению и могут высеивать яйца паразита (Bowman et al., 2005; Greve, O’Brien, 1989; Kazacos, 2001).
Как отмечено выше, яйца нематоды довольно часто попадают к другим животным и даже птицам, в организме которых вышедшие из яиц личинки не развиваются, а мигрируют по всему телу, оседая в различных органах и тканях. Среди подобных хозяев В. procyonis - более 100 видов млекопитающих и птиц, как в естественных условиях, так и в эксперименте (Kazacos, 2001; Murray, Kazacos, 2004; Okulewicz, Bunkowska, 2009). При попадании в организм паратенических хозяев небольшого количества личинок клинические признаки поражения могут отсутствовать, однако обычно инвазия проявляется и клинически, и патологически. Мигрирующие личинки вызывают разрушения в глазах, повреждают ткань печени и лёгких, головного и спинного мозга, вызывают депрессию, сонливость, нарушение координации движений, изменения в поведении.
Наиболее тяжёлые последствия для здоровья животного имеет поражение мозга. Фатальные или серьёзные повреждения ЦНС выявлены в природе и/или эксперименте у мышей белой и домашней, кроликов, хомяков, белок, сурков, нутрии, лисиц, собак, в том числе охотничьих, голубей, страуса-эму и т.д. (см. сноску 5; Kazacos, 2001). Так, в США у кролика флоридского и сурка американского лесного как-то наблюдалась вспышка цереброспинального нематодоза, вызванного личинками В. procyonis (Jacobson et al., 1976). При обследовании обитающих в тех же лесных угодьях 7 енотов, заражение В. procyonis выявили у пяти из них; причём у одного енота в 1 г фекалий насчитывалось почти 27500 яиц нематоды. При экспериментальном заражении яйцами нематоды кролика, выращенного в лаборатории, через 80 дней у того развились симптомы неврологического заболевания. Подобный результат получен и в эксперименте с песчанкой когтистой, у которой личинки встречались в основном в мозге, а также в глазах (Cho et al., 2007).
Гибелью животного от тяжёлого неврологического заболевания закончился эксперимент с саймири, или беличьей обезьяной, которой скормили 5000 инвазионных яиц В. procyonis (Kazacos et al., 1981). Случаи регистрации личинок бэйлисаскариса, сопровождавшиеся развитием энцефалопатии и обширными повреждениями мозга, описаны от домашних кроликов (Deeb, Di Giacomo, 1994).
В Японии в одном из небольших природных парков, где обитали еноты и домашние кролики, у первых обнаружилось заражение взрослыми особями В. рго-
95
су on is, а у вторых - симптомы неврологического заболевания, так называемого синдрома мигрирующей личинки (larva migrans) (Sato et al., 2003). Поражение этими личинками привело к гибели японской макаки в сафари-парке (Sato et al., 2005). Принимая во внимание зоонозное значение данного вида, а также трудности в очистке территории от яиц гельминта, авторы обеих публикаций считают, что результаты их исследований должны стать своего рода предостережением для владельцев домашних животных, ветеринаров, врачей, работников органов здравоохранения.
И, наконец, заслуживает внимания примечательный случай заражения морских свинок личинками В. procyonis через древесную стружку, используемую в качестве подстилки при содержании этих грызунов (Van Andel et al., 1995). У больных животных наблюдались признаки неврологической дисфункции, а в их мозге были выявлены личинки бэйлисаскариса. Выяснилось, что стружка была загрязнена фекалиями енота, часть из которых содержала яйца нематоды. После замены подстилки на другой материал исчез и источник заражения морских свинок.
О возможности заражения людей В. procyonis исследователи писали ещё в 1960-е годы (Beaver, 1969). Первый случай инвазии человека датируется 1973 г. -пострадавшей была 18-месячная девочка из Миссури (Anderson et al., 1975). Самой первой жертвой стал в 1980 г. 10-месячный малыш из Пенсильвании, у которого личинки спровоцировали развитие эозинофильного менингоэнцефалита (Huff et al., 1984). При аутопсии младенца в тканях различных органов, в том числе мозга и сердца, были выявлены многочисленные гранулы, содержащие личинок бэйлисаскариса. Семья погибшего ребёнка проживала в лесистой сельской местности, где водились еноты, обосновавшиеся и на придомовой территории. В 1984 г. от энцефалита и эозинофилии, вызванных заражением В. procyonis, скончался 18-месячный мальчик; при аутопсии в его мозге насчитали 3200 личинок нематоды (Fox et al., 1985). Аналогичные случаи имели место и в последующие годы - в 1989, 1995, 1997, 1999, 2000-м и т.д. (Boschetti, Kasznica, 1995; Gavin et al., 2002; Hajek et al., 2009; Hamann et al., 1989; Moertel et al., 2001; Sorvillo et al., 2002; Wise et al., 2005). Подобный перечень можно было бы продолжить - фактически такие случаи описываются каждые 1 - 2 года (Wise et al., 2005) -, однако суть всех их можно выразить несколькими словами: Baylisascaris procyonis относится к числу нематод, исключительно опасных и даже смертельных для человека.
По характеру локализации личинок различают неврологический, глазной и висцеральный бэйлисаскариозис.
Поражение мозга (синдром так называемой неврологической мигрирующей личинки - neural larva migrans) - заболевание, наиболее серьёзное и зачастую заканчивающееся фатально. Клинические признаки и симптомы могут развиваться в течение 2-4 недель после заражения и включают слабость, изменение психического состояния, расстройство координации движения (атаксию), раздражительность, оцепенение, эозинофилию в периферийной крови и спинномозговой жидкости, коматозное состояние. Поражение глубоких слоёв белого вещества приводит к развитию острого эозинофильного менингоэнцефалита (Hajek et al., 2009; Huff et al., 1984; Park et al., 2000; Rowley et al., 2000). Иногда менингоэнцефалит не приводит к летальному исходу, но у выздоровевшего остаются очень тяжёлые неврологические последствия (Cunningham et al., 1994; Rowley et al., 2000).
96
Глазная форма поражения (ocular larva migrans) довольно часто встречается одновременно с поражением мозга (Mets et al., 2003; Rowley et al., 2000), но бывает выражена и отдельно. В любом случае у пострадавшего отмечают так называемый синдром диффузного одностороннего подострого нейроретинита (Diffuse unilateral subacute neuroretinitis - DUSN), светобоязнь, ретинит, кровоизлияния в ретину, отёк, васкулит, ограничение зрения и/или слепоту (обычно одностороннюю) (Goldberg et al., 1993; Kazacos et al., 1985; Naumann, Knorr, 1994). Случаи, когда у человека выражена только глазная форма заболевания, как правило, не фатальны, но, тем не менее, их результатом является повреждение зрительного нерва и постепенное ухудшение зрения (Goldberg et al., 1993; Kiichle et al., 1993).
Висцеральная форма заболевания (visceral larva migrans) встречается очень редко и наблюдается в тех случаях, когда мигрирующие личинки оседают в органах брюшной и/или грудной полости и других тканях, но не в глазах и не в ЦНС. При этом заражение может проявляться неспецифичными симптомами, зачастую похожими на таковые при поражении мозга (Wise et al., 2005). В целом могут быть выражены боли в животе, пятнистая сыпь, эозинофилия, увеличенная печень (гепатомегалия), пневмония. Типичным примером подобной формы заболевания является закончившееся фатально заражение 10-летнего мальчика в Массачусетсе (Boschetti, Kasznica, 1995). При жизни у ребёнка наблюдались брюшные боли, периферийная эозинофилия. При аутопсии в его сердце обнаружилось шишковатое прикреплённое полипоидное образование, захватившее миокард левого желудочка и выступающее в его просвет. Эта масса содержала несколько крупных личинок нематод диаметром 0.06 - 0.07 мм. Тело личинок подверглось резорбции под воздействием воспалительного инфильтрата.
Патологические проявления, возникающие при заражении личинками В. procyonis, более серьёзные в сравнении с теми, что вызывают личинки других нематод, например, виды Тохосага или же Ancylostoma, также мигрирующие в тканях человека (Kazacos, 2001). Миграция этих личинок более агрессивна, во время миграции они растут, достигая длины 1.5 - 2.0 при ширине 0.06 - 0.08 мм, усугубляя механические повреждения тканей своими более крупными размерами. К тому же, выделяемые личинками экскреторно-секретируемые белки и продуцируемые хозяином нейротоксины эозинофильного происхождения вызывают выраженные воспалительные реакции.
В очень редких случаях заражение внешне никак не проявляется, как это имело место, например, в Германии, когда у клинически здорового человека серологическим методом установили инвазию бэйлисаскарисом (Conraths et al., 1996).
В целом, как показывает статистика, заражение В. procyonis более всего присуще детям от 9-месячного возраста до 6 - 10 лет, и они же чаще всего погибают от инвазии (Anderson et al., 1975; Cunningham et al., 1994; Fox et al., 1985; Hajek et al., 2009; Huff et al., 1984; Moertel et al., 2001; Perlman et al., 2010; Wise et al., 2005). Учитывая это, педиатры, работающие в эндемичных зонах, должны располагать подробной информацией о данном заболевании и уметь диагностировать его (Park et al., 2000).
Тем не менее, судя по публикациям, риску заражения В. procyonis подвластны представители всех возрастных групп. Так, в Канаде при аутопсии 72-летней женщины, страдающей болезнью Альцгеймера и скончавшейся от крупного лёгочного эмбола, в белом веществе левой фронтальной доли мозга обнаружили
97
несколько повреждений, в каждом из которых располагалась личинка нематоды, окружённая макрофагами, лимфоцитами, клетками плазмы и редкими эозинофилами (Hung et al., 2012).
Что касается лечения бэйлисаскариозиса, то в США для этой цели рекомендуется альбендазол из расчёта 25 - 50 мг кг1 в день per os в течение 10-20 дней. Лечение следует начинать как можно раньше, при первых же подозрениях на возможность попадания в организм яиц нематоды: оно тем успешнее, чем раньше начинается. В идеальном варианте: приём препарата следует начать не позже 3-х дней после заражения. Если альбендазол в течение этих дней по какой-либо причине недоступен, можно принимать мебендазол или иверментин (для более подробной информации см.: www.CDC-Baylisascaris-Resources for Health Professionals).
Проникшую в ретину глаза личинку рекомендуют уничтожать лазерной фотокоагуляцией, как это проверено на других видах личинок нематод, попадающих в глаза (Raymond et al., 1978).
Заражение людей происходит случайно, чаще всего с землёй, а также с грязными руками, немытыми зеленью, овощами, ягодами или же с водой, контаминированными яйцами паразита. Маленькие дети часто заражаются с пола (обычно именно этим объясняется поражение детей в столь младенческом возрасте - 9 - 18 месяцев), поскольку яйца бэйлисаскариса легко прилипают к подошве обуви и заносятся в дом. Отмечены случаи заражения детей яйцами нематоды, попавшими с экскрементами енотов на дрова, заготовленные для домашнего камина (Huff et al., 1984; Stephenson, 2002). Особенно велик риск заражения у людей, страдающих пищевым расстройством, которое выражается в тяге к несъедобным веществам, например, земле, мелу, штукатурке.
Обсуждается также возможность попадания к человеку яиц нематоды с питьевой водой. В тех случаях, когда в крупных городах функционируют стандартные очистные системы, чьи фильтры задерживают относительно крупные яйца В. procyonis. заражение людей с питьевой водой мало вероятно (Sorvillo et al., 2002). Однако заглатывание яиц с водой из природных источников, прудов, любых стоячих пресноводных водоёмов, куда яйца смываются дождевой водой, вполне допустимо.
Меры, направленные на предупреждение заражения человека и домашних животных бэйлисаскарисом, разнонаправлены. Прежде всего, заметим, что енотов часто продают как домашних животных, но они таковыми не являются, хотя и производят впечатление милых добродушных зверьков, чьи лапки так похожи на ладони человека. Лучше не держать их дома, но если всё-таки «очень хочется», то, во-первых, следует убедиться в отсутствии В, procyonis у приобретённого для дома енота (известно, что еноты заражаются этим паразитом в совсем юном возрасте), а во-вторых, ни в коем случае нельзя допускать контакта домашнего питомца с дикими сородичами.
В группе риска находятся также охотники, прикармливающие енотов. К тому же, прикармливание этих животных способствует фекальному загрязнению сельских территорий, тем самым повышая вероятность передачи инвазии людям.
Возможное посещение участков, где обитают еноты, следует минимизировать, не допуская на них детей и домашних животных. Территорию вокруг домов, детские игровые площадки, песочницы необходимо очищать от помёта енотов, ко
98
торый должен быть уничтожен. Известно, что многие собаки, особенно щенки, являются копрофагами, что влечёт за собой высокую вероятность попадания к ним яиц паразита. Тот факт, что В. procyonis может созревать в собаках (Bowman et al., 2005), свидетельствует об увеличении риска заражения человека, тесно контактирующего с этими животными. Еноты устраивают отхожие места - своего рода общественные туалеты - на пнях, выступающих корнях у ствола дерева, возле спиленных деревьев, у стен, заборов, во дворах, песочницах (Roussere et al., 2003). В цитируемой статье приведена фотография такого «туалета» в развилке дуба на высоте 3.5 м от земли. Установлено, что подобные места посещает от 1 до 7 животных, причём в течение 2 недель один и тот же енот может побывать в 6 «туалетах» (Hirsch et al., 2014). На этом основании авторы работы делают вывод, что в пробе фекалий от одного отдельно взятого животного яиц нематоды может быть намного меньше, чем в пробе из такого общего туалета.
Успешную очистку загрязнённой территории осложняет устойчивость яиц В. procyonis к дезинфекции и обеззараживанию, а также к низким температурам (яйца нематоды легко переносят понижение температуры до -15°С). Показано также, что при 4°С эмбриональные яйца остаются инвазионными в течение 9-12 лет, что подтвердил эксперимент по заражению мышей, у которых наблюдалось поражение ЦНС (Kazacos, 2001). При полном высушивании яйца сохраняли жизнеспособность при комнатной температуре в течение минимум 6 мес., а их гибель наблюдалась только после 7 мес. (Shafir et al., 2011).
Итак, чтобы обезопасить себя и своих родных от заражения столь опасным паразитом призыв «Мойте руки перед едой!» и по сей день не потерял своей актуальности, равно как и обязательное мытьё в проточной воде ягод, овощей, зелени с огорода, а также купленных на рынках. При выборе мест для пикника у водоёмов в местах обитания енотов необходимо обследовать территорию на предмет возможного наличия «общественных туалетов» этих животных и не использовать для питья воду из этих водоёмов.
Кратко резюмируем сказанное. К настоящему времени единственным представителем Baylisascaris. зарегистрированным у людей и вызывающим у них тяжёлое и, в ряде случаев, смертельное заболевание, является В. procyonis. Заражение им известно в США (подавляющее большинство случаев), Канаде, Германии. Однако потенциальный риск заражения человека в других регионах, где обитают еноты, также очень велик, поскольку эти животные широко распространились по территории многих стран, в том числе и на юге России. Подтверждает сказанное и тот факт, что в районе регистрации заболевания у человека данный паразит обычно встречается и у енотов (Goldberg et al., 1993; Park et al., 2000). Следовательно, изучение гельминтофауны енота-полоскуна на территории Европы, а также других регионов, где встречается этот вселенец, имеет большое значение для общественного здоровья (van der Giessen et al., 2004). В США, к примеру, исследования В. procyonis проводятся практически на всей территории страны, а их результаты находят отражение в многочисленных статьях и сводных работах (Bauer, 2013; Gavin et al., 2005; Kazacos, 2001; Pinero et al., 2012; Wise et al., 2005).
Помимо В. procyonis. к числу видов Baylisascaris. потенциально опасных для здоровья человека и животных, относят также В. columnaris (Leidy, 1856) - специфичного паразита скунса и В. metis (Gedoelst, 1920) - из барсука (Kazacos, 2001). По этой причине, даже если какой-либо представитель данного рода пока не найден
99
у людей, в любом случае следует соблюдать соответствующие меры предосторожности во избежание контакта с яйцами этих паразитов. Например, в Пермском государственном цирке в кале медведей гималайского, бурого и бурого белокоготного выявили большое количество яиц В. transfuga (Сивкова, Непримерова, 2012). Паразит широко распространён по странам и континентам, паразитируя практически у всех известных видов медведей (Moudgil et al., 2004). Следовательно, помимо необходимости антигельминтозного лечения медведей, работники цирка обязательно должны быть предупреждены о возможности случайного заражения других животных, содержащихся в цирке (да и о своём здоровье следует подумать).
Обоснованность этих опасений подтверждают результаты экспериментального заражения грызунов инвазионными яйцами В. transfuga. Так, у мышей на 7-й день после заражения мигрирующие личинки были обнаружены в задней камере глаза и внутри глазной перепонки, спровоцировав образование гранулём в сосудистой оболочке глаза и слоях ретины (Papini et al., 1996). Для песчанки когтистой заражение имело фатальный исход: животные погибли на 8 - 11 день эксперимента в состоянии сильной депрессии и исхудания (Sato et al., 2004). При вскрытии в их мозге были обнаружены живые подвижные личинки В. transfuga, вызвавшие его исключительно сильное размягчение. У мышей, также участвующих в данном эксперименте, нематод тоже выявили в мозге, но, как и в описанном выше опыте (Papini et al., 1996), они были изолированы внутри гранулём. Кстати, В. transfuga также относят к числу нематод, потенциально опасных для здоровья человека (Bis-seru, 1967).
Цитируемая литература
Азизова А. А. Эколого-фаунистический анализ паразитов енота-полоскуна (Procyon lotor) по различным зонам Азербайджана // Геоэкология. Юг России: экология, развитие. - 2010. - № 1. - С. 86 - 90.
Итин Г. С. Особенности гельминтофауны диких хищных млекопитающих в ландшафтно-географических зонах Северо-Западного Кавказа: Дисс... канд. биол. наук: 03.02.08 - экология. - Краснодар, 2014.-171 с.
Мозговой А. А., Шахматова В. И. Аскаридаты животных и человека и вызываемые ими заболевания. Книга III И Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1973. - 23. - 218 с Рыбалтовский О. В., Овчинникова С. Л. К изучению гельминтофауны Кавказского заповедника // Тр. Кавказского гос. заповедника. - Майкоп, 1960. - Вып. 6. - С. 209 -211.
Рябов Л. С. Кавказская лесная и каменная куницы в Краснодарском крае // Тр. Кавказского гос. заповедника. - Майкоп, 1958. - Вып. 4. - С. 62 - 189.
Сивкова Т. Н, Непримерова Т. А. Распространение паразитарных болезней хищных животных в условиях цирка// www.rusnauka.com/17_AVSN_2012/Veterinaria/l_l12593.doc.com.
Anderson D. С., Greenwood R., Fishman M.t Kagan I. G. Acute infantile hemiplegia with cerebrospinal fluid eosinophilic pleocytosis: an unusual case of visceral larva migrans // J. Pediatr. - 1975. - 86,2. ~ P. 247-249.
Bartoszewicz M., Okarma H, Zalewaki A., Szcz^sna J. Ecology of the raccoon (Procyon lotor) from western Poland // Ann. Zool. Fennica. - 2008. - 45. - P. 291 - 298.
Bauer C. Baylisascariosis - infections of animals and humans with 'unusual’ roundworms // Vet. ParasitoL -2013.-193, 4. -P. 404-412. doi: 10.1016/j.vetpar.2012.12.036.
Beaver P. C. The nature of visceral larva migrans // J. Parasitol. - 1969. - 55, 1. - P. 3 - 12.
Bisseru B. Diseases of man acquired from his pet. - London: William Heinemann Med. Books Ltd., 1967. -483 pp.
Boschetti A., Kasznica J. Visceral larva migrans induced eosinophilic cardiac pscudotumor: a cause of sudden death in a child // J. Forensic Sci. - 1995. - 40, 6. - P. 1097 - 1099.
Bowman D. D., Ulrich M. A., Gregory D. K, Neumann N. R. et al. Treatment of Baylisascaris procyonis infections in dogs with milbemycin oxime // Vet. Parasitol. - 2005. - 129. - P. 285 - 290.
Ching H. L, Leighton B. J., Stephen C. Intestinal parasites of raccoons (Procyon lotor) from southwest British Columbia // Can. J. Vet. Res. - 2000. - 64, 1. - P. 107 - 111.
100
Cho S„ Egami M., Ohnuki H, Saito K, Chinone S, Shichinohe K. et al. Migration behaviour and pathogenesis of five ascarid nematode species in the Mongolian gerbil Meriones unguiculatus // J. Helminthol. -2007.-81, l.-P. 43-47.
Conraths F. J., Bauer C., Cseke J., Laube H. Arbeitsplatzbedingte Infektionen des Menschen mit dem Waschbarspulwurm Baylisascaris procyonis // Arb. Sozialmed. Umweltmed. - 1996. -31. - P. 13-17.
Cunningham С. K, Kazacos К R, McMillan J. A., Lucas J. A., McAuley J. B. et al. Diagnosis and management of Baylisascaris procyonis infection in an infant with nonfatal meningoencephalitis // Clin. Infect. Dis. - 1994. - 18, 6. - P. 868 - 872.
Deeb B. J., Di Giacomo R F. Cerebral larva migrans caused by Baylisascaris sp. in pet rabbits 11 J. Am. Vet. Med. Assoc. - 1994. - 205, 12. - P. 1744 - 1747.
Ermer E. M., Fodge J. A. Occurrence of the raccoon round worm in raccoons in western New York // N. Y. Fish and Game J. - 1986. - 33, 1. - P. 58 - 61.
Fox A. S, Kazacos К R, Gould N. S., Heydemann P. T., Thomas C, Boyer К. M. Fatal eosinophilic meningoencephalitis and visceral larva migrans caused by the raccoon ascarid Baylisascaris procyonis // N. Engl. J. Med. - 1985.-312, 25. -P. 1619 - 1623.
Gavin P. J., Kazacos К R, Shulman S. T. Baylisascariasis // J. Clin. Microbiol. - 2005. - 18, 4. - P. 703 -718.
Gavin P. J., Kazacos К R, Tan T Q.t Brinkman W. B., Byrd S. E. et al. Neural larva migrans caused by the raccoon roundworm Baylisascaris procyonis II Pediatr. Infect. Dis. J. - 2001. - 21, 10. - P. 971 - 975.
Goldberg M. A., Kazacos К R, Boyce W. M., Ai E, Katz B. Diffuse unilateral subacute neuroretinitis. Morphometric, serologic, and epidemiologic support for Baylisascaris as a causative agent // Ophthalmology. -1993.-100, ll.-P. 1695- 1701.
Greve d H, О Brien S. E. Adult Baylisascaris procyonis infection in two dogs // Comp. Anim. Pract. - 1989. - 19.-P. 41-43.
Hajek J, Yau Y., Kertes P.t Soman T, Laughlin S., KananiR. A child with raccoon roundworm meningoencephalitis: a pathogen emerging in your own backyard? // Can. J. Infect. Dis. Med. Microbiol. - 2009. - 20, 4.-P. 177-180.
Hamann К J., Kephart G. M., Kazacos К R, Gleich G. J. Immunofluorescent localization of eosinophil granule major basic protein in fatal human cases of Baylisascaris procyonis infection // Am. J. Trop. Med. Hyg. - 1989. - 40, 3. - P. 291 - 297.
Hartwich G. Uber den Waschbarenspulwurm Ascaris procyonis Stefanski et Zamowski, 1951 und seine Stel-lung im System der Ascaroidea (Nematoda) // Ceskosl. Parasitol. - 1962. - 9. - P. 239 - 256.
Hirsch В. T, Prange S, Hauver S. A., Gehrt S. D. Patterns of latrine use by raccoons (Procyon lotor) and implication for Baylisascaris procyonis transmission // J. Wildl. Dis. - 2014. - 50, 2. - P. 243 - 249. doi: 10.7589/2013-09-251.
Hohmann U., Voight S, Andreas U. Raccoons take the offensive. A current assessment / Kowarik I., Starfinger U. (ed.). Biologische Invasionen, herausforderung zum Handelsn? - Neobiota. - 2002. - l.-P. 191-192.
Hujf D. S, Neafie R. C, Binder M. J., De Leon G. A., Brown L W., Kazacos К R. Case 4. The first fatal Baylisascaris infection in humans: an infant with eosinophilic meningoencephalitis // Pediatr. Pathol. -1984.-2, 3.-P. 345-352.
Hung T, Neafie R C, Mackenzie I. R A. Unusual Baylisascaris procyonis infection in elderly person, British Columbia, Canada // Emerg. Infect. Dis. - 2012. -18, 2. - P. 341 - 342.
Jacobson H A., Scanlon P. F., Nettles V. F., Davidson W. R. Epizootiology of an outbreak of cerebrospinal nematodiasis in cottontail rabbits and woodchucks // J. Wildl. Dis. - 1976. - 12, 3. - P. 357 - 360.
Kazacos К R. Raccoon ascarids as a case of larva migrans // Parasitol. Today. - 1986. - 2, 9. - P. 253 - 255.
Kazacos К R. 11. Baylisascaris procyonis and related species / W. M. Samuel, M. J. Pybus, A. A. Kocan (Eds.), Parasitic Diseases of Wild Animals (2nd ed.), Manson, London, 2001. -P. 301 -341.
Kazacos К R, Kilbane T. P., Zimmerman К D,, Chavez-Lindell T, Parman B. et al. Raccoon roundworms in pet kinkajous - three States, 1999 and 2010 // Morb. Mortal. Wkly. Rep. -2011. -60. -P. 302-305.
Kazacos K, Raymond L., Kazacos E, Vestre W. The raccoon ascarid: a probable cause of human ocular larva migrans // Ophthalmology. - 1985. -92, 12. -P. 1735 - 1744.
Kazacos KR, Wirtz W. L., Burger P. P., Christmas C. S. Raccoon ascarid larvae as a cause of fatal central nervous system disease in subhuman primates // J. Am. Vet. Med. Assoc. - 1981. -179. - P. 1089-1094.
Kiichle M., Knorr H. L., Medenblik-Frysch S, Weber A., Bauer C, Naumann G. O. Diffuse unilateral subacute neuroretinitis syndrome in a German most likely caused by the raccoon roundworm, Baylisascaris procyonis I I Graefes Arch. Clin. Exp. Ophthalmol. - 1993. - 231, 1. - P. 48 - 51.
McClure G. Nematode parasites of mammals. From specimens collected in the New York Zoological Park, 1931// Zoologica (New York). - 1933. -15. - P. 29 - 47.
101
Mets M. В., Noble A. G„ Basti S, Gavin P., Davis A. T, Shulman S. T., Kazacos К R. Eye findings of diffuse unilateral subacute neuroretinitis and multiple choroidal infiltrates associated with neural larva migrans due to Baylisascaris procyonis // Am. J. Ophthalmol. — 2003. - 135, 6. - P. 888 — 890.
Miyashita M. Prevalence of Baylisascaris procyonis in raccoons in Japan and experimental infections of the worm to laboratory animals // J. Urban. Living Health Assoc. - 1993. -37. - P. 137 - 151.
Moertel C. L., Kazacos K. R, Butterfield J. H., Kita H, Watterson J., Gleich G. J. Eosinophil-associated inflammation and elaboration of eosinophil-derived proteins in 2 children with raccoon roundworm {Baylisascaris procyonis) encephalitis // Pediatrics. —2001. —108, 5. - E93.
Moudgil A. D., Singla L. D., Singh M. P. First report on molecular identification and fenbendazole resistance against Baylisascaris transfuga infection in Melursus ursinus (sloth bear) // Helminthologia. - 2014. - 51. 4.-P. 262-268.
Murray W. J., Kazacos К R. Raccoon roundworm encephalitis // Clin. Infect. Dis. - 2004. - 39, 10. - P. 1484 -1492.
Naumann G. O., Knorr H. L. Diffuse unilateral subacute neuroretinitis. Morphometric, serologic, and epidemiologic support for Baylisascaris as a causative agent // Ophthalmology. - 1994. - 101, 6. -P. 971 - 972.
Okulewicz A., Bunkowska K. [Baylisascariasis - a new dangerous zoonosis] // Wiad. Parazytol. - 2009. - 55, 4. -P. 329 - 334. (Article in Polish).
Page L. K, Gehrt S. D., Cascione A., Kellner K. F. The relationship between Baylisascaris procyonis prevalence and raccoon population structure // J. Parasitol. - 2009.- 95. - P. 1314-1320. doi: 10.1645/GE-1998.1.
Papini R, Cavicchio P., Casarosa L. Effect ovicide in vivo mdbendazole sur les ceufs de Baylisascaris transfuga // Rev. Mdd. VSt. _ 1994. -145, 1. -P. 55 - 57.
Papini R, Renzoni G., Lo Piccolo S, Casarosa L. Ocular larva migrans and histopathological lesions in mice experimentally infected with Baylisascaris transjuga embryonated eggs // Vet. Parasitol. - 1996. - 61, 3-4. -P. 315-320.
Park S. Y., Glaser C, Murray W. J., Kazacos K. R, Rowley H. A. et al. Raccoon roundworm {Baylisascaris procyonis) encephalitis: case report and field investigation // Pediatrics. - 2000. -106, 4. - E56.
Perlman J. E, Kazacos К R, Imperato G. H, Desai R U., Schulman S. K, Edwards J. Baylisascaris procyonis neural larva migrans in an infant in New York city // J. Neuroparasitol. -2010.-1, l.-P. 1-5.
Pinero J., Lorenzo-Morales J., Martin-Navarro C., Lopez-Arenciba A., Reyes-Batlle M., Valladares B. 16. Zoonosis caused by Baylisascaris procyonis / Zoonosis. - Ed. J. Lorenzo-Morales. - 2012. - P. 285 - 302. Available: http://www.intechopen.com/books/zoonosis/zoonosis-caused-by-baylisascaris-procyonis.
Raymond L. A., Gutierrez Y„ Strong L. E., Wander A. H. et al. Living retinal nematode (filarial-like) destroyed with photocoagulation // Ophthalmology. - 1978. - 85. - P. 944 - 999.
Reed C., Henke S. C., Kresta A. E. Frequency of deposition and location of Baylisascaris procyonis in raccoon feces // J. Wildl. Dis. - 2012. - 48, 1. - P. 190 - 194.
Rowley H. A., Uht R M., Kazacos К R, Sakanari 1, Wheaton W. V. et al. Radiologic-pathologic finding in raccoon roundworm {Baylisascaris procyonis) encephalitis // Am. J. Neuroradiol. - 2000. - 21, 2. - P. 415 - 420.
Roussere G. P., Murray W. J., Raudenbush С. B.t Kutilek M. J., Levee D. J, Kazacos K. R. Raccoon roundworm eggs near homes and risk for larva migrans disease, California communities // Emerg. Infect. Dis. -2003.-9, 12.-P. 1516- 1522.
Sakla A. A., Donnelly J. J., Khatami M., Roc key J. H. Baylisascaris procyonis (Stefanski and Zamowski, 1951) Ascarididae: Nematoda. I. Embryonic development and morphogenesis of second stage larvae // As-siut Vet. Med. J. - 1989. - 21. - P. 68 - 75.
Sato H, Kamiya H, Furuoka H. Epidemiological aspects of the first outbreak of Baylisascaris procyonis larva migrans in rabbits in Japan // J. Vet. Med. Sci. - 2003. - 65, 4. - P. 453 - 457.
Sato H, Matsuo K, Osanai A., Kamiya H, Akao N. et al. Larva migrans by Baylisascaris transfuga: fatal ' neurological diseases in Mongolian jirds, but not in mice // J. Parasitol. - 2004. - 90, 4. - P. 774 - 781.
Sato H, Une Y, Kawakami S, Saito E, Kamiya H. et al. Fatal Baylisascaris larva migrans in a colony of Japanese macaques kept by a safari-style Zoo in Japan // J. Parasitol. - 2005. - 91, 3. - P. 716 - 719.
Sexsmith J. L., Whiting T. L., Gree C., Orvis S, Berezanski D. J., Thompson A. B. Prevalence and distribution of Baylisascaris procyonis in urban raccoons {Procyon lotor) in Winnipeg, Manitoba // Canad. Vet. J. -2009.-50, 8.-P. 846-850.
Shafir S. C., Sorvillo F. J., Sorvillo T, Eberhard M. L. Viability of Baylisascaris procyonis eggs // Emerg. Infect. Dis. - 2011. -17, 7. - P. 1293 - 1295.
Snyder D. E, Fitzgerald P. R. The relationship of Baylisascaris procyonis to Illinois raccoons {Procyon lotor) // J. Parasitol. - 1985. - 71, 5. - P. 596 - 598.
Sorvillo F. J., Ash L. R., Berlin O. G., Yatabe J.A., Degiorgio C., Morse S. A. Baylisascaris procyonis: An emerging helminthic zoonosis // Emerg. Infect. Dis. - 2022. - 8, 4. - P. 355 - 359.
102
Sprent J. F. A. On the migratory behavior of larvae of various ascarid species in white mice. II. // J. Infect. Dis.-1953.-92.-P. 114-117.
Sprent J. F. A. Notes on Ascaris and Toxascaris with a definition of Baylisascaris gen. nov. // Parasitology. -1968.-58, l.-P. 185- 198.
Stefanski W., Zarnowski E. Ascaris procyonis n. sp. provenant de Г intestin de Procyon lotor L. // Ann. Mus. zool. polon. - 1951. -14. - P. 199 - 202.
Stephenson J. Raccoon parasite an emerging health concern // J. Am. Med. Assoc. - 2002. - 288. - P. 2109 -2110.
Tenora F, Honigova M., Stanek M. Interesting findings of two species of Ascaridata (Nematoda) parasites of carnivore in Czech and Slovak Federative Republic // Helminthologia. - 1991. - 28. -P. 131-135.
Van Andel R. A., Franklin C. L., Besch-Williford C., Riley L. K., Hook R R Jr, Kazacos K. R Cerebrospinal larva migrans due to Baylisascarisprocyonis in a guinea pig colony //Lab. Anim. Sci. - 1995. -45, l.-P. 27-30.
Van der Giessen G. W. B., Isken L. D., Tiemersma E. IV. Zoonoses in Europe” a risk to public health // Bielthoven RIVM. - 1984. - Raport no. 330200002/2004. - P. 29 - 32.
Winter M.9 Stube M., Heidecke D. Zur Okologie des WaschbSren (Procyon lotor L., 1758) in Sachsen-Anhalt // Beitr. Jagd- und Wihlforsch. - 2005. - 30. - P. 303 - 322.
Wise M. E, Sorvillo F. J, Shaflr S. C., Ash L. R, Berlin O. G. Severe and fatal central nervous system disease in humans caused by Baylisascaris procyonis, the common roundworm of raccoons: a review of current literature // Microbes Infect. - 2005. - 7, 2. - P. 317 - 323.
Yeitz J. L, Gillin С. M., Bildfell R J, Debess E. E. Prevalence of Baylisascaris procyonis in raccoons (Procyon lotor) in Portland, Oregon, USA // J. Wildl. Dis. - 2009. - 45, l.-P. 14-18.
Род Lagochilascaris Leiper, 1909
Описание (по: Мозговой, 1953; Мозговой, Шахматова, 1973; с дополнениями других авторов). Мелкие нематоды с характерными чертами семейства. Кутикула с лёгкой поперечной исчерченностью. По всей длине тела проходят латеральные крылья. Губы толстые, с глубокой выемкой; от остальной части тела губы отделены выраженной бороздкой, позади которой располагается кутикулярное кольцо. От кольца начинаются интерлабии. Характерная особенность нематод - наличие маленькой медианной лопасти губ. Внутренняя поверхность каждой губы разделена вертикально, вследствие чего та имеет вид «заячьей губы». Пищевод простой. Хвостовой конец самца тупой, конический, без крыльев, с 24 - 40 парами преанальных и 5 парами постанальных состочков. Спикулы почти равные, без крыльев. Самки с двусторонней маткой. Вульва немного впереди середины тела. Яйца круглые, с толстой шероховатой оболочкой. Паразиты млекопитающих. Типовой вид -Lagochilascaris minor Leiper, 1909.
Род Lagochilascaris с типовым видом L. minor был обоснован для аскари-дидных нематод, выделенных из нарывов на шее двух местных жителей из Тринидада (Leiper, 1909). Род немногочислен и к настоящему времени насчитывает 5 видов, паразитирующих у хищных млекопитающих.
Lagochilascaris minor (рис. 32 - 34). Видовое название паразита связано с его некрупными размерами11.
11 В монографии А. А. Мозгового и В. И. Шахматовой (1973) на стр. 93 читаем: «Видовое (выделено мною - АГ) название гельминта автор дал по строению ротовых органов, которые имеют вид «заячьей губы»». В действительности эту особенность строения ротового аппарата нематоды автор подчеркнул в названии рода: Лауам; - заяц; - губа.
103
Рис. 32 Lagochilascaris minor. A - передний конец тела; В - хвостовой конец самца; С - яйцо (из: Faust, 1949 -по: Leiper, 1909)
0,05 *н
OJ/5hh
О,О5нн
О,О5нн
г
Рис. 33 Lagochilascaris minor а, б - дорзальная губа в различном положении; в - головной конец, апикально; г - головной конец, вентрально; д - участок губы с проксимальным выростом пульпы (из: Мозговой, Шахматова, 1973-по: Sprent, 1971)
Исключительно детальное описание L. minor на всех стадиях развития нематоды принадлежит Д. Спренту (Sprent, 1971). В его основу цитируемый автор положил результаты обработки препаратов Р. Лейпера, сборов, присланных ему другими исследователями, а также обширного материала, собранного им в ряде географических регионов, включая Тринидад, где паразит впервые был обнаружен.
Описание (по разным авторам, в том числе: Sprent, 1971). Некрупные нематоды кремового цвета. Основные три губы с утолщённой кутикулой и глубокой зазубриной на переднем крае. Передняя часть губы в форме клешни со сближенными кончиками. На дорсальной губе 2 двойных субдорсальных сосочка, на субвентральных - один двойной вентролатеральный и один латеральный сосочки, а также одна амфидиальная пора. Удлинения пульпы губ выдаются в их передние доли. Глубокая кольцевидная бороздка отделяет губы от остальной части тела. Позади губ имеется заметный воротничок, из которого выступают треугольные интерла-бии, с внутренней стороны переходящие в ножеподобные, разделяющие губы выросты. Боковые крылья, протянувшиеся от уровня нервного кольца до конца тела, поддерживаются кутикулярными складками. Самцы длиной до 17-20 мм. Хвост заострённый, с закруглённым терминальным кончиком, загнут вентрально, примерно с 40 (по некоторым данным, 24 - 25) парами преанальных и 5 парами поста-104
нальных сосочков. Спикулы длиной 0.35 - 0.412 мм. Самки длиной 18-21 мм. Вульва с 2 выступающими губами, преэкваториальная. Петли матки и яичника в средней трети тела. Яйца округлые или сферические, размерами 43 - 85 х 35 - 63 pm, с толстой трёхслойной оболочкой, имеющей неправильной формы углубления. Яйца развиваются до стадии подвижной личинки в течение 8-14 дней.
Рис. 35 Lagochilascaris minor: а - головной конец, дорсолатерально; б - то же, апикально; в - дорсальная губа; г - хвостовой конец самки; д - то же, самца, латерально; е - вагина (из: Мозговой, Шахматова, 1973 - по: Sprent, 1971)
Взрослые особи L. minor зарегистрированы в основном у человека (см.: Ваг-rera-P6rez et al., 2012), а также у дымчатого леопарда Neofelis nebulosa (=Felis nebu-losa) (Faust, 1949)13. Две зрелые самки нематоды встретились в Венесуэле у кустарниковой собаки (Volcan et al., 1991). L. minor пыюдуым также у собак (Ра?б et al., 1999) и кошек (Sudre et al., 2012), в том числе домашних (Barbosa et al., 2005). Вместе с тем, практически все исследователи придерживаются той точки зрения, что окончательный хозяин этой нематоды в природе всё ещё не известен.
12 В монографии А. А. Мозгового (1953) в описание вида на стр. 133 вкралась досадная опечатка: указана неверная длина спикул - 3.5 - 4.0 мм вместо 0.35 - 0.4 мм.
13 Э. Фауст (Faust, 1949) не отметил источник информации, а только написал «The normal habitat of this worm is the intestine of the cloudy leopard, Felis nebulosa» (стр. 481). Neofelis nebulosa - редкий вид леопарда, обитающий в Юго-Восточной Азии - Индии, Непале, Таиланде, Китае и т.д. В Северной Америке встречается в зоопарках.
105
В течение многих десятилетий, прошедших с того самого дня, когда Р. Лей-пер впервые обнаружил L. minor у двух жителей Тринидада, учёные пытались понять, кто же в действительности является истинным дефинитивных хозяином нематоды и как происходит заражение человека (Muller, 2002). Всё это время предпринимались попытки заразить яйцами L, minor самых разных животных, начиная от кошек и собак и заканчивая грызунами (Barbosa et al., 2005; Bruyning et al., 1957; Oostburg, Varma, 1968; Pa^o et al., 1991, 1999; Semerene et al., 2004; Volcan, Medrano, 1990; Volcan et al., 1992). На основании экспериментальных исследований, модельными объектами в которых были мыши домашняя и белоногая лесная, хомяки, морские свинки, агути, выступавшие в роли промежуточных хозяев, удалось установить, что у L. minor может быть гетероксенный жизненный цикл. В грызунах, которым скормили яйца нематоды, извлечённые из абсцессов у человека, развитие личинки останавливалось на 3-й стадии: такие личинки мигрировали через стенку кишечника и проникали в печень, лёгкие, скелетные мышцы и подкожную ткань, где вскоре инцистировались (Campos et al., 1992). В кошках, которым скармливали заражённых таким образом мышей, личинки покидали цисту и мигрировали в пищевод, глотку, трахею, прилегающие ткани и шейные лимфатические узлы, и на 9 -20-й день в любом из этих мест развивались зрелые черви (Barbosa et al., 2005; Campos et al., 1992; Pa?6 et al., 1999; Semerene et al., 2004; Volcan et al., 1992). В одном из экспериментов у одной из кошек на 43-й день после заражения в повреждении обнаружились одновременно взрослые особи нематоды, яйца с личинкой и личинки 3-й стадии, что свидетельствовало о возможности самозаражения этих животных (Campos et al., 1992). В то же время опыты по заражению кошек per os яйцами нематоды не дали положительного результата, что, по мнению исследователей, подтверждает факт наличия в жизненном цикле L. minor обязательного промежуточного (Campos et al., 1992; Volcan et al., 1992) или паратенического хозяина (Pa?6 et al., 1999). Примечательно, что отдельные личинки, локализующиеся в мышцах экспериментально заражённых мышей, развивались во взрослых червей внутри цист (Campos et al., 1992).
Основываясь на результатах подобных экспериментов, всё большее число исследователей склоняется к мысли, что человек может заражаться не только яйцами L. minor, но и через сырое и/или недожаренное мясо грызунов, контаминированное личинками 3-й стадии. В первом случае взрослые черви развиваются в повреждениях, аналогично тому, как они развивались в цистах в мышах, заражённых яйцами паразита. Во втором случае в человеке происходит развитие паразита подобно тому, как это имело место в кошках, которым скормили инвазированных личинками мышей. В пользу возможности заражения людей через мясо животных может говорить и то обстоятельство, что в тех регионах, где у людей отмечается самая высокая заражённость данной нематодой, население обычно употребляет грызунов в пищу (Ра?б et al., 1999).
Обычно клинические признаки заболевания проявляются через 1-2 недели после заражения. Наиболее заметный внешний признак поражения - появление нарыва, чаще всего на шее, под челюстью, за ухом, который постепенно увеличивается, принимая в конечном итоге вид крупного бугристого вздутия с подкожными абсцессами в области шеи и прилегающей ткани. Затем кожа лопается, в центре вздутия образуется свищ и из нарыва через определённые промежутки времени выделяются с гноем многочисленные взрослые черви, личинки и яйца. Яйца продол
106
жают развиваться в личинок, достигающих взрослого состояния в тканях у основания нарыва. Повреждения обнаруживаются также в мастоидах, челюстях, языке, среднем и внутреннем ухе, носовой полости, глотке, миндалинах, зубных альвеолах, слюнной железе, веках, лимфатических узлах, ткани лёгких и ЦНС.
В зависимости от локализации паразита и продолжительности заболевания симптомы заражения человека проявляются по-разному - от умеренных до серьёзных. Обычно больные жалуются на головную боль, болезненные ощущения в области лимфатических узлов, повышенную температуру, продуктивный кашель, боль при глотании, отсутствие аппетита, похудение, тошноту, рвоту. В случае поражения ткани лёгких и/или центральной нервной системы, сопровождаемого развитием энцефалопатии, менингита, возможен летальный исход (Moraes et al., 1985; Orihuela et al., 1987; Palheta-Neto et al., 2002; Rosemberg et al., 1986).
К тому же, заболевание может носить затяжной характер, о чём свидетельствуют случаи, имевшие место в разных странах. В Мексике, например, у 11-летней девочки из небольшого городка на берегу Тесехакана на шее ниже правого угла челюсти образовалась крупная дольчатая опухоль размером 5x3 см, с гнойной фистулой в центре, в которой находилось множество мелких червей. Лечение per os тиабендазолом (50 мг кг-1 двумя пятидневными курсами) и празиквантелом (400 мг в течение 3 дней) не дали положительного результата. Даже после хирургического вмешательства, после удаления опухоли, клиническое состояние девочки не улучшилось, и в гное продолжали появляться взрослые черви, яйца и личинки нематоды (Vargas-Ocampo, Alvarado-Aleman, 1997). Авторы публикации обращают внимание на тот факт, что семья девочки, состоящая из родителей и 12 братьев - все внешне здоровые, - жили в очень скромной хижине, а качество их питания и гигиены находилось на низком уровне.
Весьма примечательный - по продолжительности - случай заболевания человека описан в Колумбии (Moncada et al., 1998). 41-летняя индианка обратилась в клинику с жалобами на продолжающиеся в течение 10 лет периодические приступы тонзиллита, кашля, сопровождаемые выходом «белых червей». В последние четыре года женщина испытывала боль при глотании, у неё ухудшился аппетит, и она похудела на 10 кг без видимых на то причин. При обследовании в стенке ротоглотки и нёбных миндалинах у пациентки были выявлены беловатые черви длиной 15 -20 мм, по своим морфологическим особенностям соответствующие L. minor.
С 1909 г., когда у человека впервые обнаружили L. minor, его эпизодически, но с завидным постоянством находят у местных жителей в Мексике, Боливии, Коста-Рике, Эквадоре, Колумбии, Венесуэле, Суринаме, Бразилии (в основном в бассейне Амазонки), Тринидаде и Тобаго14 (Aguilar-Nascimento et al., 1993; Aquino et al., 2008; Barrera-Perez et al., 2012; Barrera-Perez et al., 2012; Botero, Little, 1986; Cal-vopifia et al., 1998; Correa et al., 1978; Draper, Buckley, 1963; Moncada et al., 1998; Mondragon et al., 1973; Moraes et al., 1985; Muller, 2002; ОПё-Goig et al., 1997; Oostburg, 1992; Oostburg, Varma, 1968; Orihuela et al., 1987; Pawan, 1926, 1927; Roman-Lopez et al., 2003; Santos, 1990; Vargas-Ocampo, Alvarado-Aleman, 1997; Vieira et al., 2000; Volcan et al., 1982 и др.). Поскольку заболевание обычно выявляют у жителей
14 В. А. Гефтер (1968; стр. 660) отмечает обнаружение Lagochilascaris minor у человека в Индии, ссылаясь на две работы зарубежных авторов (Draper, 1963; Draper, Buckley, 1963). В действительности в этих статьях речь идёт о находке данного паразита у человека в Тобаго (Тринидад и Тобаго - островное государство в Вест-Индии).
107
отдалённых сельских районов, окружённых тропическими лесами, многие авторы отмечают, что число действительных случаев заражения L. minor может быть намного большим, чем освещено в литературе. К слову, по состоянию на 2008 г. было описано 110 таких случаев (Aquino et al., 2008).
Что касается препаратов, применяемых для лечения данного заболевания, то информация по этому вопросу довольно противоречива (Barbosa, Campos, 2001; Barrera-Perez et al., 2012; Bento et al., 1993; Calvopina et al., 1998; Vargas-Ocampo, Alvarado-Aleman, 1997; Vieira et al., 1996, 222). Более того, многие считают, что идеального эффективного средства в настоящее время пока нет, а те лекарства, что применяют на практике, требуют длительного курса. Среди рекомендуемых препаратов перечисляют несколько - ивермектин, альбендазол, тиабендазол, празиквантел; первые два их них являются препаратами выбора. Так, лечение альбендазолом 18-летнего юноши, испытывавшего в течение 3 лет отсутствие аппетита, существенную потерю веса, жар и продуктивный кашель, вызванные, как оказалось, заражением L. minor, уже через неделю привело к улучшению его состояния, а через месяц наступило выздоровление (Barrera-Perez et al., 2012). В целом пациент в течение 30 дней ежедневно принимал 400 мг альбендазола.
Итак, к настоящему времени представители Lagochilascaris (напомню, что в роде пока описано 5 видов) вне Америки и Африки не известны. Среди них только один вид - L. minor паразитирует у человека. Однако, несмотря на более чем 100-летнюю историю регистрации этого вида у людей, мы вынуждены констатировать, что до сего времени отсутствует единая точка зрения по поводу особенностей жизненного цикла нематоды и того, какую роль в нём играет человек, даже при том, что паразит завершает в Homo sapiens свой жизненный цикл. К тому же, механизм миграции личинок в организме человека фактически не исследован. И, наконец, не ясно, почему черви локализуются столь избирательно, поражая органы и ткани только верхней части туловища.
L. minor у людей встречается редко (единичные случаи на сотни тысяч населения в местах регистрации заболевания), поэтому его не относят к числу обычных паразитов человека и рассматривают случайным для него, не имеющим эпидемиологического значения (Palheta-Neto et al., 2002).
Цитируемая литература
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Мозговой А. А. Аскаридаты животных и человека и вызываемые ими заболевания. Книга I // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1953. - 2. - 351 с.
Мозговой А. А., Шахматова В. И. Аскаридаты животных и человека и вызываемые ими заболевания. Книга III // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1973. - 23. -218 с
Aquino R. Т. R., Magliari М. Е. R., Filho J. К, Silva М. A. L. G. et al. Infec^So humana рог Lagochilascaris minor com envolvimento ocular, auditivo e das meninges // Rev. Inst. Med. trop. SSo Paulo. - 2008. - 50, 6. http://dx.doi.org/10.1590/S0036-46652008000600009
Aguilar-Nascimento J. E, Silva G. M., Tadano T., Valadares-Filho M., Akiyama A. M. P., Castelo A. Infection of the soft tissue of the neck due to Lagochilascaris minor // Trans. Roy. Soc. Trop. Med. Hyg. - 1993. -87.-P. 198.
Barbosa C. A. L., Barbosa A. P., Campos D. M. B. Gato dom£stico (Felis catus domesticus) сото possivel reservatdrio de Lagochilascaris minor Leiper, 1909 // Rev. Patol. Trop. - 2005.-34. -P. 205 - 211.
108
Barbosa C. A. L, Campos D. M. B. Avalia$3o da eficdcia terapeutica da ivermectina sobre larvas de quarto estAdio de Lagochilascaris minor em gatos infectados experimentalmente // Rev. Soc. bras. Med. trop. -2001.-34.-P. 373-376.
Barrera-Perez M., Manrique-Saide P., Reyes-Novelo E, Escobedo-Ortegon J., Sanchez-Moreno M. et al. Lagochilascaris minor Leiper, 1909 (Nematoda: Ascarididae) in Mexico: three clinical cases from the Peninsula of Yucatan // Rev. Inst. Med. trop. SSo Paulo. - 2012. - 54, 6. - http://dx.doi.org/10.1590/S0036-46652012000600005.
Bento R-F., Mazza C, Motti E. F., Chan Y. T. et al. . Human lagochilascariasis treated successfully with ivermectin: a case report И Rev. Inst. Med. trop. S3o Paulo. -1993. - 35. - P. 373 - 375.
Botero D., Little M. D. Two cases of human Lagochilascaris infection in Colombia // Am. J. Trop. Med. Hyg. - 1984.-33, 3.-P. 381 -386.
Bruyning C. F. A. Notes on Lagochilascaris minor Leiper, 1909 // Doeum. Med. Geogr. Et Trop. - 1957. -9. -P. 173- 175.
Calvopina M., Angel G., Herrera M., Serrano M., Guderian R. H. Treatment of human lagochilascarisis with ivermectin: First report from Ecuador // Trans. Roy. Soc. Trop. Med. Hyg. - 1998. - 92, 2. - P. 223 - 224. DOI: 10.1016/S0035-9203(98)90756-8.
Campos D. M., Freire- Filha L. G., Vieira M. А., Радд J. M., Maia M. A. Experimental life cycle of Lagochilascaris minor Leiper, 1909 // Rev. Inst. Med. Trop. S3o Paulo. - 1992. - 34, 4. - P. 277 - 287.
Correa M. O. A., Hyakutake S, Brandi A. J., Monteiro C. G. Novo caso de parasitismo humano por Lagochilascaris minor Leiper, 1909 // Rev. Inst. Adolfo Lutz. - 1978. - 38. - P. 59 - 65.
Draper J. ИС Infection with Lagochilascaris minor // Br. Med. J. — 1963. -1 (5335). - P. 931 - 932.
Draper J. W., Buckley J. J. C. Lagochilascaris minor (Leiper) from a patient in Tobago // Trans. R. S. Trop. Med. Hyg. - 1963. - 57, 1. - P. 7.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Leiper R T. A new nematode worm from Trinidad, Lagochilascaris minor // Proc. Zool. Soc. London. -1909.-4.-P. 742-743.
Moncada L. L, Alvarez C. A., Castellanos C. et al. Lagochilascaris minor in a patient from the Colombian Amazon: a case report // Rev. Inst. Med. trop. SSo Paul. - 1998. - 40. - P. 387 - 389.
Mondragon H, Cano M. R, Botero D. R. Primer caso de infecciion humana por Lagochilascaris minor en Colombia//Antioquia medica. - 1973.-23. -P. 463 -464.
Moraes M. A. P., Arnaud M. V. C, Macedo R. C, Anglada A. E. Infec^So pulmonar fatal por Lagochilascaris sp., provavelmente Lagochilascaris minor Leiper, 1909 // Rev. Inst. Med. Trop. SSo Paulo. - 1985. - 27. -P. 46-52.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Olle-Goig J. E., Recacoechea M., Feeley T. First case of Lagochilascaris minor infection in Bolivia // Trop. Med. Int. Health. - 1997. - 1, 6. - P. 851 - 853.
Oostburg B. F. J. The sixth case of lagochilascariasis minor in Surinam // Trop. Geogr. Med. - 1992. -44. -P. 154-159.
Oostburg B. F. J., Varma A. A. O. Lagochilascaris minor infection in Surinam, a report case // Am. J. Trop. Med. Hyg. - 1968. - 17, 4. -P. 548 - 550.
Orihuela R., Botto C, Delgado O., Ortiz A., Suarez J. A., Arguello C. Human Lagochilascarisis infection in Venezuela. Description of a fatal case// Inst. Med. Trop. Venezuela. - 1987.-20. -P. 217-221.
Pago J. M., Campos D. M. B., Maia M. A., Freire-Filha L. G., Vieira M. A. Lagochilascaris minor infec^o experimental em Dasyprocta agouti // Rev. Inst. Med. Trop. SSo Paulo. -1991.-33 (Suppl 8). -P. 40.
Pago J. M., Campos D. M. B., Oliveira J. A. Wild rodents as experimental intermediate hosts of Lagochilascaris minor Leiper, 1909 // Mem. Inst. Oswaldo Cruz. - 1999. - 94, 4. - P. 441 - 449.
Palheta-Neto F. X., de Ledo R. N. Q., Neto H. F, Tomita S, de Lima M. A. M., Pezzin-Palheta A. C. Con-tribu$ao ao estudo da Lagochilascariase humana // Rev. Bras. Otorinolaringol. - 2002. - 68. - P. 101 - 105
Pawan J. L. A case of infection with Lagochilascaris minor (Leiper) // Ann. Trop. Med. Parasitol. - 1926. -20.-P. 201 -202.
Pawan J. L. Another case of infection with Lagochilascaris minor (Leiper) // Ann. Trop. Med. Parasitol. -1926.-21.-P. 45-46.
Roman-Lopez E, Rosas-Carrasco O., Sanchez-Zuniga M. J., Alexanderson-Rosas E. G., Soto-Abraham V. et al. Lagochilascariosis en un paciente con diabetes tipo 2. Evolucidn aguda у mortal. Reporte del primer caso en la literature // Med. Intema. Mex. - 2003. -19. - P. 255 - 258.
Rosemberg S, Lopes M..B., Masuda Z., Campos R., Vieira В. M. C. Fatal encephalopathy due to Lagochilascaris minor infection // Am. J. Trop. Med. Hyg. - 1986. - 35. - P. 575 - 578.
109
Santos V. M. Relato de caso de infec^ao humana рог Lagochilascaris minor // An. Bras. Dermatol. - 1990. -65. -P. 189-192.
Semerene A. R., Lima R. de S. Jr, Oliveira J. A., Magalhaes A. V., Stefani M. N. et al. Experimental lagochi-lascariosis: histopathological study of inflammatory response to larval migration in the murine model // Mem. Inst. Oswaldo Cruz. - 2004. - 99. - P. 393 - 398.
Sprent J. F. A. Speciation and development in the genus Lagochilascaris // J. Parasitol. - 1971.-62, l.-P. 71-112.
Sudre A. P., Uchda F., Brener B. Lagochilascaris in a housecat and the potential risk for human disease H Brazil. J. Infect. Dis. - 2012. - 16, 1. - P. 111 - 112.
Vargas-Ocampo F., Alvarado-Aleman F. J. Infestation from Lagochilascaris minor in Mexico // Int. J. Dermatol. - 1997.-36, 1. -P. 56-58.
Vieira M. A., de Oliveira J. A., Barbosa C. A. L. Avalia^o da efic&cia do albendazol na lagochilascarfase murina experimental I I Rev. Patol. Trop. - 1996. - 25. - P. 253 - 262.
Vieira M. A., de Oliveira J. A., Ferreira L. S, de Oliveira, Barbosa A. [A case report of human lagochilasca-riasis coming from Para State, Brazil // Rev. Soc. Bras. Med. Trop. - 2000. - 33, 1. - P. 87 - 90.
Volcan G. S, Medrano С. E. Infecci6n inducida on el roedor selvatico Dasyprocta leporina (Rodentia: Da-syproctidae) con huevos larvados de Lagochilascaris minor ((Nematoda: Ascarididae) // Rev. Inst. Med. Trop. S£o Paolo. - 1990. - 32. - P. 395 - 402.
Volcan G. S., Medrano С. E., Payares G. Experimental heteroxenous cycle of Lagochilascaris minor Leiper, 1909 (Nematoda: Ascarididae) in white mice and in cats // Mem. Inst. Oswaldo Cruz. - 1992. - 87, 4. -http://dx.d0i.0rg/l 0.1590/S0074-02761992000400010.
Volcan G. S, Medrano С. E, Quinones D. Infeccion natural de Speothos venaticus (Carnivora: Canidae) por estadios adultos de Lagochilascaris sp. // Rev. Inst. Med. Trop. S£o Paolo. - 1991. -33. - P. 451 -458.
Volcan G. S., Ochoa F. R., Medrano С. E., Valera Y. Lagochilascaris minor infection in Venezuela. Report of a case // Am. J. Trop. Med. Hyg. - 1982. -31. - P. 1111-1113.
Род Toxascaris Leiper, 1907
В информационной сводке «smartsite.ucdavis.edu/» род Toxascaris вместе с близким родом Тохосага рассматривается в составе семейства Toxocaridae Hartwich, 1954. В настоящее время семейство Toxocaridae не имеет валидного статуса, однако в составе семейства Ascarididae, среди прочих, выделено подсемейство Toxocarinae Osche, 1958.
Описание (по: Мозговой, 1953). Крупные нематоды, телом сужено к концам. Кутикула с поперечной исчерченностью. Шейные крылья имеются. Передние дольки пульпы губ отчётливо отделены от лопастей глубокой бороздкой, расширены и разведены на концах. Интерлабии отсутствуют. Пищевод простой. Желудочек у основания пищевода отсутствует. Хвост самцов конический, с преанальными и постанальными сосочками, без пальцевидного придатка. Одна пара сосочков вблизи клоаки двойная. Хвостовые крылья отсутствуют. Спикулы почти равные, без крыльев. Рулёк отсутствует. Вульва самок в передней трети тела. Матка двуветвистая. Яйца почти круглые, с толстой гладкой оболочкой. Паразиты плотоядных млекопитающих. Типовой вид - Toxascaris leonina (von Linstow, 1902) Leiper, 1907.
Род немногочислен, но его представителей отмечают на всех континентах. Наиболее распространённый вид - Т. leonina^ и именно его находили у людей.
Toxascaris leonina [=Ascaris leonina von Linstow, 1902; =Ascaris canis Glaue, 1909; =Ascaris cati Schrank,71788, частично; =Ascaris leproptera Rudolphi, 1809, частично; ^Toxascaris limbata Railliet et Henry, 1911; =Ascaris microptera Rudolphi, 1819; ^Toxascaris microptera (Rudolphi, 1819) Railliet et Henry, 1911] (рис. 36, 37). Перечисленные синонимы приведены по работе: Мозговой, 1953.
110
Рис. 36 Toxascaris leonina (из: Мозговой, 1953): 1 - передний конец тела (по: Glaue, 1909); 2 - головной конец, дорсально; 3 - хвостовой конец тела самца, латерально (по: Yorke, Maplestone, 1926)
Рис. 37 Toxascaris leonina: 1 - дорсальная губа; 2 - головной конец, апикально; 3 -яйцо с личинкой (из: Мозговой, 1953 -по: 1, 3 - Скрябин, 1925; 2 - Скрябин, Шульц, 1931); 4 - яйцо до выхода во внешнюю среду (из: Bowman et al., 2002)
Toxascaris leonina впервые описан на материале из льва под названием Ascaris leonina., отсюда и его видовое название: Panthera leo - лев, leonina - львиный (von Linstow, 1902). В 1907 г. Р. Лейпер (Leiper, 1907) описал новый род Toxascaris, сделав Ascaris leonina его типовым видом - Toxascaris leonina.
Описание (по разным авторам, в том числе: Мозговой, 1953; Bowman et al., 2002). Крупные нематоды с характерными чертами рода. Тело от кремового до розоватого цвета, слегка утончающееся по направлению к головному и хвостовому концам. Кутикула с лёгкой поперечной исчерченностью. Головной конец с двумя узкими (максимальная ширина 0.085 - 0.122 мм) и очень длинными латеральными кутикулярными крыльями, простирающимися почти до уровня конца пищевода. Ротовое отверстие терминальное, окружено одной крупной дорсальной и двумя более мелкими латеровентральными губами. По бокам дорсальной губы два сидячих сосочка, на латеровентральных - по одному сосочку. Передний край губ с
111
зубчиками. Внутренняя полость губы с двумя латерально расположенными пальцевидными выступами гиподермы. Имеется также медианный выступ гиподермы, передний край которого, в свою очередь, расщеплён на две дольки, располагающиеся своими вершинами на латеральных выступах гиподермы, не прикрывая медианного седловидного углубления. Пищевод мощный, цилиндрический, слегка расширенный в задней части. Самцы длиной 40 - 60 и шириной 1.5-2 мм. Хвостовой конец равномерно утончён, имеется около 25 пар преанальных сосочков и пять пар постанальных. Две пары постанальных сосочков расположены латерально, две - субмедианно и одна - субмедианно, позади отверстия клоаки. Спикулы длиной до 0.9 - 1.5 мм, слегка заострённые на дистальных концах, с гладкой поверхностью. Самки длиной 50 - 150 и шириной 1.8 - 2.4 мм. Хвост конический. Вульва на расстоянии одной трети от переднего конца тела. Яйца эллипсоидной, почти круглой формы, с плотной гладкой скорлупой, 80 -90 х 75 pm.
Взрослые особи Т. leonina живут в тонком кишечнике плотоядных млекопитающих. Яйца попадают во внешнюю среду с фекалиями хозяина. Наблюдения над развитием яиц показали, что после 4 дней культивирования при температуре 25°С инвазионную личинку содержали 95 % яиц; при 17 - 22°С за 6 дней до инвазионной стадии развилось 99 % яиц, а при 37°С инвазионного состояния достигли 97 % яиц (Okoshi, Usui, 1967, 1968). При 40°С яйца оказались не способны завершить своего развития, и не развивались даже после понижения температуры до 25°С. Инвазионной у этих нематод является личинка 3-й стадии.
Заражение окончательных хозяев происходит двумя путями: прямым, т.е. непосредственно инвазионными яйцами, и/или через грызунов, чьи мышцы и другие органы содержат инвазионных личинок (Sprent, 1959) (рис. 38).
Рис. 38 Схема жизненного цикла Toxascaris leonina
В случае попадания яиц к окончательному хозяину, покинувшие яйцевую оболочку личинки проникают в стенку кишечника, где претерпевают линьку, а затем возвращаются в просвет кишечника, где происходит их созревание. При попадании яиц нематоды к грызунам, вышедшая из яйца личинка мигрирует, прежде всего, в скелетную мускулатуру, линяет, а затем инцистируется (рис. 39).
112
Рис. 39 Toxascaris leonina, личинка 3-й стадии в мышцах хомячка (общий вид) (из: Мозговой, Шахматова, 1973-по: Кудрявцев, 1971)
При изучении миграции личинок в организме белых мышей выяснилось, что на 4 -135-й день лёгкие были поражены у 96 % подопытных животных, половые органы - у 84 %, ' слизистая кишечника - у 81 %, и уже на 10-й
день после заражения личинки были найдены в скелетных мышцах 100 % грызунов (Prokopic, Figallova, 1982). К. Матов (Matoff, 1949) установил, что осевшие в мышцах грызунов личинки сохраняют жизнеспособность более 5-6 месяцев.
Среди окончательных хозяев Т. leonina - многочисленные представители плотоядных, прежде всего, псовые и кошачьи, в том числе собаки гиеновая, динго, енотовидная, а также домашние и служебные, шакал, лисицы, песец, волк, койот, оцелот, барс снежный, дикий кот, гепард, рысь, пума, леопард, ягуар, тигр, лев и другие (Есаулова и др., 2015; Итин, 2014; Мозговой, 1953; Bisseru, 1967; Seneviratna, 1955; Sprent, 1959 и др.). Например, в Кроноцком заповеднике на Камчатке яйца Т. leonina были выявлены в 14 % проб фекалий лисицы обыкновенной (Давыдов, Шемяков, 2015). Высокая заражённость этим гельминтом характерна для песца в Гренландии (58 %) (Kapel, Nansen, 1996), волка на севере Аляски (84 %) (Rausch, Williamson, 1959). На общем фоне хозяев-хищников весьма необычно выглядит находка этого паразита у антилопы-вилорога в Вайоминге в США (Bergstrom et al., 1985). Черви располагались в заднем отделе тонкого кишечника животного, при этом большинство самок не имело яиц, в связи с чем у авторов возник вопрос: а могут ли вообще они продуцировать жизнеспособные яйца в столь необычном хозяине? Длина самок нематоды достигала 4.5 - 6 см при ширине 0.8 - 1.2 мм, самцов соответственно 3.4 - 3.7 см и 0.7 - 0.9 мм.
Учитывая зоонозное значение Т. leonina, особую озабоченность вызывает факт широкого распространения этого вида среди собак, включая служебных и домашних. Так, в Нижнем Поволжье, в Волгограде и сельских пунктах, Т. leonina выявлен у 34.54 % собак городской и сельской популяций при интенсивности инвазии 1 - 23 экз. (Шинкаренко, 2005). Работавшая в том же регионе С. А. Акимова (2007) определила, что в 1 г фекалий собак насчитывалось в среднем 16.6 ± 2.46 экз. яиц Т. leonina. В Алтайском крае паразит отмечен у 39.95 ± 7.5 % особей обследованных собак и 37.8 ± 1.1 % кошек (Лунева, 2015), в Ставрополе - у 6.2 % собак и 9 % кошек (Деркачёв, 2014). В Тбилиси Т. leonina зарегистрировали у 23.7 % собак - бездомных, домашних, приютских и неизвестного происхождения, причём наиболее высокой заражённостью отличались собаки старше 2-х лет - 48.3 % (Гогоберишви-ли, Поцхверия, 2013). В Турции яйца Т. leonina обнаружились в фекалиях 21.8 % обследованных особей собак, состоящих на военной службе (Senlik et al., 2006). В одном из регионов Италии, в Апулии, яйца токсаскариса были выявлены в 8 из 54 проб фекалий собак, собранных в зелёных парковых зонах, на дорожках в парках, на игровых площадках, в зоне общественных зданий и у школы (Tarsitano et al., 2010). В Гданьске (Польша) при обследовании песка из песочниц на игровых площадках и фекалий собак яйца Т. leonina встретились в 11 % проб фекалий (Rokicki
113
et al., 2007), а в Турции, в Кириккале, - в 1.5 % проб песка на детских игровых площадках (Aydenizoz, 2006). Подобных примеров можно привести множество.
При высокой численности в окончательном хозяине Т leonina оказывает серьёзное патогенное воздействие на его организм. В частности, Г. А. Сивкова с со-авт. (2014), изучавшие микроморфологические изменения в тканях плаценты служебных собак породы немецкая овчарка, спонтанно заражённых токсаскарисами, выяснили, что нематоды вызывают в плаценте альтеративные изменения, приводящие в конечном итоге к гипотрофии и гипоксии плода.
Особенно серьёзное значение приобретает Т leonina в связи с его распространением среди разводимых пушных животных, и, прежде всего, песцов. Установлено, что высокая заражённость песцов токсаскарисом в условиях неволи приводит к исхуданию и ослаблению их организма, что отрицательно сказывается на размерах шкурок и их качестве, а, следовательно, и на рентабельности хозяйства (Аникиева и др., 2012).
Что касается возможности паразитирования Т. leonina у людей и последствий этого заражения, то авторы практически всех обзорных работ по гельминто-зам человека отмечают вероятность его инвазии личинками Т leonina, которые могут вызвать у него так называемый синдром висцеральной мигрирующей личинки (visceral larva migrans) (Research.vet.upenn.edu/Hosts/Toxascarisleonina/). В действительности же информация о регистрации у человека этой нематоды очень скудна и насчитывает буквально единичные источники.
Когда в 1907 г. Р. Лейпер описывал новый род Toxascaris, материал по которому он получил в 1906 г. в Египте в период работы в Каирской лаборатории под руководством известного гельминтолога проф. А. Лоосса, то среди хозяев этих нематод он упомянул и человека (Leiper, 1907; стр. 1297). А. И. Гринберг (1961) описал случай удаления самца и самки Т leonina из абсцесса в области правой голени у 39-летнего жителя Кишинёва (Молдова), в течение 15 лет страдавшего хроническим остеомиелитом. По словам пациента, который принёс с собой в клинику собранных им же 20 червей, ранее в течение 5 лет он удалил из опухоли около 50 нематод. Черви достигали в длину 6 - 7 см. Эту историю постоянно упоминают в многочисленных источниках, в которых идёт речь о нематодах - потенциально и реально патогенных для человека (Гефтер, 1968; Bisseru, 1967; Bowman et al., 2002). В. А. Гефтер (1968), ссылаясь на опубликованные данные, приводит информацию о случаях кишечного токсаскариоза человека в бывшем Советском Союзе (данные К. И. Скрябина с коллегами) и Египте (Leiper, 1907).
И, наконец, в Уганде (Восточная Африка) в глазу ребёнка была выявлена аскаридидная личинка, длина тела которой в два раза превышала размер личинок Toxascaris, встречающихся в тканях, но, тем не менее, авторы отнесли её к названному роду (Beaver, Bowman, 1984).
Цитируемая литература
Акимова С. А. Токсокароз и токсаскаридоз плотоядных в Нижнем Поволжье // Известия Нижне-волжск. агроуниверсит. комплекса. - 2007. - № 4 (8). - cyberleninka.ru/article/n/toxocaros..povolznie.
Аникиева Л. В., Тютюнник Н Н., Аниканова В. С. Влияние токсаскаридозной инвазии на хозяйственно-полезные признаки песцов клеточного содержания // Тр. Карельск. НЦ РАН. - 2012. - № 2. - С. 26-31.
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. (Многотомное руководство по 114
микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Гогоберишвили М. С., Поцхверия Ш. О. Некоторые вопросы эпизоотологии токсокароза и токсаскари-доза собак в Тбилиси // Теория и практика паразитарных болезней животных. - 2013. - Вып. № 14. -С. 118-121.
Гринберг А. И. Редкие случаи заражения человека Toxascaris leonina и Тохосага mystax // Медицинск. паразит, и паразит, болезни. - 1961. - 30, 5. - С. 626.
Давыдова О. Е, Шемяков Д. Н. Паразитофауна лисицы обыкновенной Кроноцкого заповедника / Новые знания о паразитах: Мат. V Межрегион, конф. «Паразитологические исследования в Сибири и на Дальнем Востоке», 14-16 сентября 2015. - Новосибирск, 2015. - С. 33 - 34.
Деркачев Д. Ю. Разработка новых технологических приёмов диагностики и мер борьбы при нематодо-зах плотоядных: Автореф. дис...канд. вет. наук: 03.02.11- паразитология. - Ставрополь, 2014. -22 с
Есаулова Н. В., Поярков А. Д, Карнаухов А. С., Куксин А. Н. и др. К вопросу о паразитофауне ирбиса (Panthera uncia) и других хищных млекопитающих в экосистемах Алтае-Хангае-Саянской горной страны / Новые знания о паразитах: Мат. V Межрегион, конф. «Паразитологические исследования в Сибири и на Дальнем Востоке», 14-16 сентября 2015. - Новосибирск, 2015. - С. 43-44.
Итин Г С. Особенности гельминтофауны диких хищных млекопитающих в ландшафтно-географических зонах Северо-Западного Кавказа: Дисс....канд. биол. наук: 03.02.08 - экология. - Краснодар, 2014.-171 с.
Кудрявцев А. А. Токсаскаридоз песцов (история вопроса, биология возбудителя, профилактика и терапия): Дисс. канд. наук. -М., 1971 (цит. по: Мозговой, Шахматова, 1973).
Лунева Н. А. Биологические особенности основных гельминтозов домашних плотоядных животных Алтайского края: Автореф. дисс...канд. биол. наук: 03.02.11-паразитология. - Барнаул, 2015. -23 с
Мозговой А. А. Аскаридаты животных и человека и вызываемые ими заболевания. Книга I // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1953. - 2. - 351 с.
Мозговой А. А., Шахматова В. И. Аскаридаты животных и человека и вызываемые ими заболевания. Книга IIIИ Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1973. - 23. -218 с
Сивкова Г. А., Патлусова Е. С., Сивкова Т. Н. Морфологические изменения в плаценте служебных собак при инвазии Toxascaris leonina // Российск. паразитол. журн. - 2014. - № 3. - С. 63 - 67.
Скрябин К. И. Аскариды и их значение в медицине и ветеринарии. Гельминтологический этюд. - М., 1925. - 140 с. (цит. по: Мозговой, 1953).
Скрябин К. И., Шульц Р.-Э. С. Гельминтозы человека. Ч. II. -М.-Л.: Госмедгиз, 1931. - 768 с.
Шинкаренко А. Н. Экология паразитов собак и меры борьбы с вызываемыми ими заболеваниями в Нижнем Поволжье: Автореф. дисс...докт. вет. наук: 03.02.19 - паразитология; 16.00.03 - ветеринарная микробиология, вирусология, микология с микотоксикологией, иммунология. - Иваново, 2005. -53 с.
Aydenizdz Ozkayhan М. Soil contamination with ascarid eggs in playgrounds in Kirikkale, Turkey // J. Hel-minthol. - 2006. - 80, 1. - P. 15 - 18.
Beaver P. C, Bowman D. D. Ascaradoid larva (Nematoda) in the eye of a child in Uganda // Am. J. Trop. Med. Hyg. - 1984. -33. -P. 1272 - 1274.
Bergstrom R C, Kingston N., Talbott J R. Toxascaris leonina (Nematoda: Ascarididae) from the pronghorn antelope, Antilocapra americana, in Wyoming // Proc. Helminth. Soc. Wash. - 1985.-52. -P. 142 - 143.
Bisseru B. Diseases of man acquired from his pet. - London: William Heinemann Med. Books Ltd., 1967. -483 pp.
Bowman D. D., Hendrix С. M., Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Ipwa State Press, 2002.-467 pp.
Kapel С. M. O., Nansen P. Gastrointestinal helminthes of arctic foxes (Alopex lagopus) from different bio-climatological regions in Greenland И J. Parasitol. - 1996. - 82, l.-P. 17-24.
Leiper R. T. Two new genera of nematodes occasionally parasitic in man // Br. Med. J. - 1907. - 1 (2422). -P. 296-298.
Matoff К. (Матов К.) Экспериментални изследовання въерху странствуването на Тохосага canis, Toxascaris leonina, Neoascaris vitulorum // Годишник на сельскостопанската Академия «Георги Димитров». Вет.-мед. фак. - 1949. - 25. - С. 593 - 659.
Okoshi S., Usui М. Experimental studies on Toxascaris leonina. I. Incidence of T. leonina among dogs and cats in Japan // Jap. J. Vet. Sci. - 1967. - 29. - P. 185 - 194.
Okoshi S., Usui M. Experimental studies on Toxascaris leonina. IV. Development of eggs of three ascarids, T. leonina, Тохосага canis and Тохосага cati, in dogs and cats // Jap. J. Vet. Sci. - 1968. - 30. - P. 29 - 38.
115
Prokopic J., Figallovd K. The migration of larvae of Toxascaris leonina (Linstow, 1909) in experimentally infected white mice I I Folia Parasitol. (Praha). - 1982. - 29, 3. - P. 233 - 238.
Rausch R L, Williamson F. S. L. Studies on the helminth fauna of Alaska. 34. The parasites of wolves, Canis lupus L. // J. Parasitol. - 1959. - 45. - P. 395 - 403.
Rokicki J., Kucharska A. P., Dzido J., Karczewska D. [Contamination of playgrounds in Gdansk city with parasite eggs] // Wiad. Parazytol. - 2007. - 53, 3. - P. 227 - 320.
Seneviratna P, A check list of helminths in the Department of Veterinary Pathology, University of Ceylon, Peradeniya // Cry. vet. J. - 1955. - 3. - P. 32 - 37.
Senlik B., Cirak И К, Karabacak A. Intestinal nematode infections in Turkish military dogs with special reference to Toxocara canis // J. Helminthol. - 2006. - 80, 3. - P. 99 - 303.
Sprent J. F. A. The life histoiy and development of Toxascaris leonina (von Linstow, 1902) in the dog and cat I I Parasitology. - 1959. - 49. - P. 330 - 371.
Tarsitano £, Greco G., Decaro N., Nicassio F., Lucente M. S. et al. Environmental monitoring and analysis of faecal contamination in an urban setting in the city of Bari (Apulia region, Italy): health and hygiene implications // Int. J. Environ. Res. Public Health. - 2010. - 7, 11. - P. 3972 - 3986. doi: 10.3390/ ijerph7113972.
von Linstow O. F. B. Beobachtungen an neuen und bekannten Nemathelminthen // Arch. Mikr. Anat. - 1902. -60.-P. 217-232.
Wright W. H. 1935. Observations on the life histoiy of Toxascaris leonina (Nematoda: Ascaridae) I I Proc. Helm. Soc. Wash. - 1935.-2, l.-P. 56.
Yorke W., Maplestone P. A. The Nematode parasites of Vertebrates. - London, 1926. - 526 pp.
Род Toxocara Stiles, 1905
Синоним: Neoascaris Travassos, 1927
Долгие годы род Toxocara относили к семейству Toxocaridae (Maizels et al., 2000; Warren, 1970). В современной систематике семейство Toxocaridae не имеет валидного статуса, а род Toxocara относится к семейству Ascarididae в составе подсемейства Toxocarinae Osche, 1958 (см.: Hartwich, 2009). Тем не менее, в некоторых информационных сводках род Toxocara по-прежнему включён в состав семейства Toxocaridae (The Taxonomicon - taxonom-icon.taxonomy.nl/...=117875; ITIS Report - www.itisgov/servlet/...63836; ZipcodeZoo - zip-codezoo.com/index.php/Toxocaridae/; Animal Diversity Web - ADB: animaldiversi-ty.org/accounts/ Toxocaridae).
Во многих отечественных работах (Акимова, 2007; Березина, 2006; Деркачёв, 2014; Калинина, 2005; Лунева, 2015; Лысенко и др., 1996; Пискун и др., 2009; Шинкаренко, 2005; Юхименко, Майданник, 2012; www.infectology.ru/parasitic/helmintoses/toxocarosis.aspx) их авторы рассматривают род Toxocara в составе семейства Anisakidae, куда он был включён А. А. Мозговым ещё в 1950 г. (Мозговой, 1953). За прошедшие десятилетия систематика аскаридат, в том числе и семейства Anisakidae, претерпела существенные изменения, и многие ранее входившие в него роды, например, Toxocara, Porrocaecum Railliet et Henry, 1912, Raphidascaris Railliet et Henry, 1915, в настоящее время являются членами других семейств.
Описание (по разным авторам). С характерными чертами семейства. Довольно крупные нематоды (самцы длиной 3-10, самки до 18 см), с зауженными передним и задним концами. Передний конец тела загнут вентрально. Развиты цервикальные (шейные) вздутия кутикулы - так называемые крылья. Ротовое отверстие окружено тремя губами. Задняя часть пищевода с мускулистой бульбой, что отличает данный род от близкого Toxascaris. Задний конец тела самцов загнут на брюшную сторону, снабжён пальцеобразным отростком и крыльями. Яйца с толстой оболочкой, имеющей характерную мелкую бугристость. Род - космополит. Типовой вид - Toxocara Stiles, 1905.
116
После того, как род Neoascaris стал синонимом Тохосага, число видов в последнем увеличилось до 23 (Gibbons et al., 2001); по другим данным (Borecka, 2010), род Тохосага объединяет 27 видов. Большинство видов описано из плотоядных, в основном семейств Canidae, Felidae, Viverridae, Procyonidae, Mustelidae, Her-pestidae.
Многие исследователи полагают, что для человека потенциально патогенными являются все представители Тохосага (Morgan, 2013), однако главным источником заражения людей принято считать Т. canis (Mizgajska, 2001). Вместе с тем, к настоящему времени накопилось достаточно информации, чтобы рассматривать и Т. cati возможной причиной случаев токсокариазиса человека, особенно глазного (Fisher, 2003; Taylor, Holland, 2001). Во всём мире изучению биологии и экологии Т. canis, географического распространения паразита, его патогенности для человека и животных, а также разработке методов диагностики вызываемых им заболеваний уделяют самое пристальное внимание, что, естественно, находит отражение в огромном массиве опубликованных данных. Своеобразная «популярность» темы токсокароза (токсокариазиса) подверждается также обилием источников, цитируемых в отдельных статьях, число которых может доходить до 60 - 90 и более (см., напр., Адаменко, Никулин, 2004; Maizels et al., 2000).
Тохосага canis (Werner, 1782) Johnston, 1916 [=Lumbricus canis Werner, 1782; -Ascaris canis (Werner, 1782) Gmelin, 1790; =Ascaris mystax canis (Werner, 1782) Blanchard, 1888; ^Toxascaris limbata Railliet et Henry, 1901; ^Toxascaris mar-ginata Leiper, 1907; =Toxascaris canis (Werner, 1782) Castellani et Chalmers, 1913; =Belascaris canis (Werner, 1782) Garin, 1913] (Синонимы no: Faust, 1949) (рис. 40). Видовое название нематоде дали по латинскому названию рода хозяина: Canis -собака. Обычно паразита называют токсокарой собачьей или аскаридой собачьей.
Рис. 40 Тохосага canis: А - передний конец тела, вентрально; В - поперечный срез через шейную область, иллюстрирующий строение крыла; С - задний конец самца, латерально; D - поперечный срез через спикулу; Е - яйцо (из: Faust, 1949)
Описание (по разным авторам, в том числе: Faust, 1949). Шейные крылья протянулись вдоль боковых краёв передней части тела, их длина больше ширины. Самцы длиной 4 - 10 см. Задний конец самцов с несколькими парами стебельчатых и тремя парами сидячих папилл. Спикулы длинные, слегка неравные, изогнутые, на срезе выпукло-вогнутые. Самки длиной 6 - 18 см. Вульва преэкваториальная. Общий маточный проток очень короткий. Яйца от почти шарообразной до овальной формы, с плотной толстой оболочкой, диаметром
117
75 - 85, или 90 х 75 pm.
Общая схема жизненного цикла Т. canis типична для аскаридид (рис. 41). Половозрелая самка откладывает, по данным разных авторов, 100 - 200 тыс. яиц в сутки, которые попадают во внешнюю среду с фекалиями хозяина. Формирующаяся в яйце личинка при благоприятных условиях достигает инвазионного состояния за 15 - 20 дней. Развитие яиц токсокары - фотозависимый процесс, в связи с чем они не могут успешно развиваться в отсутствии света; в то же время прямые солнечные лучи губительны для них. Для развития яиц оптимальны глинистые влагоёмкие почвы, температура 23 - 30°С, относительная влажность воздуха 85 %, почвы - выше 20 % (Методические указания МУ 3.2.1043-01). Нижний температурный порог развития яиц - 10 - 13°С, минимальная относительная влажность почвы - 5 -8 %. По мнению П. А. Солопова (2009), изучавшего развитие яиц Т. canis в условиях эксперимента, оптимальными для этого процесса являются температура 23 -25°С, относительная влажность воздуха 82 - 85 %. В эксперименте при этих параметрах формирование личинок завершалось через 25-30 дней. На 38-е сутки инвазионную личинку содержали 92 % яиц.
Рис. 41 Схема жизненного цикла Toxocara canis
Во внешней среде при неблагоприятных условиях жизнеспособность и ин-вазионность яиц Т. canis могут сохраняться в течение нескольких лет, что вообще характерно для аскаридид (Скрябин, Петров, 1964). Наблюдения в разных регионах
118
России показали, что яйца успешно перезимовывают в почве, особенно под снежным покровом, а с наступлением тёплой весенней погоды начинают развиваться (Лунева, 2015; Субботин, 2002). Известно, что инвазионные яйца остаются жизнеспособными и после воздействия на них различных негативных внешних факторов, в том числе химических. Так, они сохранили свою жизнеспособность даже после 8 - 9-месячного хранения в антифиризе и тосоле, ещё раз подтвердив устойчивость яйцевых оболочек аскаридидных нематод к воздействию агрессивной среды (Бу-лекбаева, Тарасовская, 2015).
Заражение дефинитивных хозяев - плотоядных животных - происходит яйцами из окружающей среды (прямой путь), а также личинками через плаценту (внутриутробный, или трансплацентарный) или с молоком матери (трансмаммарный путь заражения). При этом длина тела инвазионных личинок не превышает 0.4 мм, а максимальный диаметр равен 0.018 - 0.021 мм.
В случае заглатывания инвазионных яиц щенками моложе 3-месячного возраста, вышедшая из яйца личинка пронизывает слизистую кишечника и через печень и кровеносную систему достигает лёгких, при кашле попадает в глотку и заглатывается вместе со слюной, попадая в тонкий кишечник, где достигает половозрелого состояния. Средняя продолжительность жизни половозрелых токсокар - 4 месяца, максимальная - 6. Если же яйца заглатываются собаками старшего возраста, то покинувшие в их кишечнике яйцевую оболочку личинки проникают в печень, лёгкие, мышцы, соединительную ткань, почки и другие ткани и органы животного, где их развитие приостанавливается. Эти «спящие» личинки активизируются у беременных самок и мигрируют в развивающийся плод, накапливаясь в его лёгких. После рождения щенка личинки токсокары проникают в его кишечник, где и созревают. В итоге черви могут быть обнаружены у щенков уже через неделю после рождения. Для щенков подобный - трансплацентарный - способ заражения является наиболее обычным. В период лактации отдельные личинки мигрируют в молочные железы и с молоком попадают к щенкам.
В естественных условиях возможен ещё один альтернативный источник заражения хозяев-хищников - мелкие животные, обычно грызуны, а также свиньи, овцы, коровы, птицы или земляные черви, которые могут случайно заглатывать находящиеся во внешней среде инвазионные яйца Т. canis (Тумольская, 1998). В их организме покинувшие яйцевую оболочку личинки мигрируют в различные органы и ткани, где и оседают, но не развиваются. В результате хищник вместе с пищей получает и личинок токсокар. Возможность естественного заражения яйцами Т. canis иных животных, не псовых, получила документальное подтверждение в многочисленных экспериментальных исследованиях. Так, успешно закончился эксперимент по скармливанию инвазионных яиц Т. canis двум макакам-резус и шести белым крысам (Dhar et al., 1966). Подобный положительный результат получен и при заражении песчанки когтистой, у которой уже через 3 дня личинки были обнаружены в печени, а также в скелетных мышцах, мозге и глазах (Cho et al., 2007). У цыплят, заражённых per os зрелыми яйцами Т. canis, личинки были выявлены в печени (от 40 до 192 экз.), мышцах (8 - 166), сердце (0 - 4), селезёнке (0 - 2) и мозге (0 - 1) (Maruyama et al., 1994). Подобная картина наблюдалась и в распределении личинок в организме экспериментально заражённых японских перепелов: большинство личинок локализовалось в печени (1 - 288 экз.), в меньшей степени - в
119
мышцах туловища и ног и единично - в мозге, сердце и глазах (Nakamura et al., 1991).
И, наконец, нельзя не обратить внимания на результаты экспериментального заражения паратенического хозяина, в данном случае мышей, личинками токсо-кары, извлечёнными из печени другого искусственно заражённого паратенического хозяина - японского перепела (Pahari, Sasmal, 1990). В отличие от перепелов, в мышах личинки локализовались главным образом в мышцах туловища, конечностей и в мозге, и только единичные особи - в печени, лёгких и висцере. Полученные цитируемыми авторами данные не только свидетельствуют о возможности многократного пассажа личинок Т. canis от одного хозяина к другому, что значительно увеличивает шансы паразита на попадание к окончательному хозяину, но и указывают на возможность инвазии человека через пищевые продукты.
Среди окончательных хозяев Т. canis собаки, а также волк, енотовидная собака, шакал, лисица, песец и другие представители семейства псовых. В Кроноцком заповеднике на Камчатке яйца токсокары были выявлены в 6 % проб фекалий лисицы обыкновенной (Давыдов, Шемяков, 2015). На территории Северо-Западного Кавказа лисица поражена токсокарой повсеместно на 7.7 - 24.2 %, енотовидная собака и шакал - в предгорных и горных районах (первая соответственно на 6.7 и 6.6 %, второй - на 15 и 10 %), а волк - только в плавневой зоне (25 %) (Итин, 2014).
В Азербайджане Т. canis обнаружили у енота-полоскуна; в зависимости от региона заражённость животных колебалась от 5.5 до 12 %, интенсивность инвазии -от 2 до 7 экз. (Азизова, 2010). В центральном Лаосе эту нематоду зарегистрировали у 5 % домашних кошек при интенсивности инвазии 1-23 экз. (Scholz et al., 2003), а в Куала-Лумпуре (Малайзия) - у 10.9 % уличных кошек (Lee et al., 1993).
И всё же основным дефинитивным хозяином Т. canis являются собаки, скорее всего, в силу своего повсеместного распространения: эти животные - домашние, служебные, уличные, одичавшие - живут в сельских и урбанизированных районах, в горной и равнинной местности, на островах и континентах. В Алтайском крае России, например, токсокару зарегистрировали у 43.9 ± 8.6 % обследованных собак (Лунева, 2015), в Ставрополе - у 23.1 % (Деркачёв, 2014), в Рязани средняя заражённость этих животных за 2006 - 2009 гг. составила 17.3 ± 0.7 % (Солопов, 2009). В Тбилиси (Грузия) паразита выявили в среднем у 24.7 % собак, среди которых были как домашние животные, так и бездомные, приютские и неизвестного происхождения; при этом особи до 1.5-летнего возраста были заражены на 59.3 % (Гогоберишвили, Поцхверия, 2013). По данным В. А. Туйнова (2010), в Украине нвазированность собак токсокарами составляет в среднем 15 - 16 %.
В Дели (Индия) токсокару обнаружили у 34.7 % собак, а наибольшая степень заражения была присуща молодым особям в возрасте до одного года (Dhar et al., 1966). В окрестностях Тираны (Албания) Т. canis встретился у 75.7 % собак, причём более высокая заражённость также наблюдалась у молодых животных (Xhaxhiu et al., 2011). В Турции яйца Т. canis обнаружили в фекалиях 13.3 % обследованных особей собак, состоящих на военной службе, причём и здесь наиболее заражёнными оказались щенки до 6-месячного возраста (Senlik et al., 2006).
Можно привести десятки подобных примеров, наглядно иллюстрирующих практически повсеместную заражённость собак названным паразитом. Тем не менее, по данным Е. С. Березиной (2006), севернее 66° с.ш. токсокара у собак не встречается.
120
П. А. Солопов (2009) считает, что высокий уровень заражённости токсока-рой щенков является следствием отсутствия у молодых собак приобретённого специфического иммунитете. По его данным, собаки старше одного года преимущественно свободны от половозрелых особей токсокары.
В окончательных хозяевах взрослые черви локализуются в тонком кишечнике, не прикрепляясь к его стенкам и двигаясь против его перистальтики; питаются содержимым кишечника хозяина.
У взрослых собак заболевание, вызванное инвазией токсокарой, встречается довольно редко и протекает относительно мягко; чаще всего в подобных случаях наблюдаются расстройство пищеварения и потеря веса. Однако у щенков поражение нематодами может сопровождаться ярко выраженной патологией. Заражённые животные проявляют признаки беспокойства, угнетения, шерсть становится тусклой, взъерошенной, наблюдаются анемичность слизистых оболочек, частый сухой кашель, болезненная реакция при пальпации грудной клетки и брюшной стенки, могут быть выражены диарея, запор, асцит, пневмония и даже прободение кишечника (Солопов, 2009; Parsons, 1987). Больные щенки отстают в росте и развитии, в тяжёлых случаях возможен летальный исход.
А. Н. Шинкаренко (2005) приводит данные, согласно которым при токсока-розе в крови собак резко снижаются концентрации гемоглобина, эритроцитов, общего белка, альбуминов, увеличивается активность ферментов АлАТ, АсАТ, щелочной фосфатазы, альфа-амилазы, глобулиновых фракций белка, возникает дисбактериоз и снижается секреторная активность кишечника. В острой стадии токсока-роза у больных животных наблюдаются острый гепатит и бронхопневмония, а в хронической стадии - язвенный энтерит.
Т. canis относится к числу нематод, одних из наиболее распространённых у человека. Заражение людей происходит при заглатывании инвазионных яиц токсокары. В проксимальном отделе тонкой кишки из яиц выходят личинки, которые через слизистую кишечника проникают в кровь и заносятся в печень и правую половину сердца. Попав в лёгочную артерию, личинки продолжают миграцию, переходя в лёгочную вену, достигают левой половины сердца и разносятся кровью по разным органам и тканям. Достигнув той точки, где из-за малого диаметра сосуда они не могут продвигаться дальше (напомню, что их диаметр достигает 0.021 мм), личинки покидают кровяное русло и оседают в печени, лёгких, сердце, почках, поджелудочной железе, головном мозге, глазах, мезентериальных лимфатических узлах, щитовидной железе и других органах и тканях (Тумольская, 1998; Sprent, 1958). Здесь они сохраняют жизнеспособность в течение длительного времени (месяцы, годы) (Smith et al., 2009). Личинки, осевшие в тканях, не развиваются и пребывают в гранулёмах в состоянии покоя, но под влиянием определённых факторов периодически активизируются и возобновляют миграцию, обусловливая тем самым рецидивы заболевания. С течением времени часть личинок в тканях инкапсулируется и постепенно разрушается.
Повторное заглатывание человеком яиц Т. canis предполагает повторение цикла миграции личинок и, скорее всего, повторение клинических проявлений болезни.
В организме человека токсокары не достигают половой зрелости и остаются на личиночной стадии развития, а вызываемые ими заболевания -токсокароз (ток-сокарозис, токсокариазис - toxocarosis, toxocariasis) - относятся к группе гельмин-
121
тозов с так называемым синдромом мигрирующей личинки (larva migrans). Информация о том, что в кишечнике человека иногда находили взрослые формы Т. canis, скорее всего, не соответствует действительности вследствие возможного ошибочного определения нематод. Как выяснилось, в ряде случаев за Т. canis были приняты незрелые формы взрослых особей Ascaris (www.cfsph.iastate.edu).
В организме человека личинки токсокары могут выживать до 10 лет, поскольку выделяют особую субстанцию, которая предотвращает контакт эозинофилов и антител хозяина с эпикутикулой личинки (Юхименко, Майданник, 2012; www.infectology.ru/parasitic/helmintoses/ toxocarosis.aspx).
Токсокароз человека характеризуется длительным рецидивирующим течением, полиорганными поражениями иммунологической природы и многообразием клинических проявлений, обусловленных миграцией личинок по различным органам и тканям (Майданник и др., 2012; Туйнов, 2010; Тумольская, 1998). Формирование иммунного ответа - основной защитной реакции организма - является главным механизмом патогенеза токсокароза: иммунологические реакции, переходя границы адекватного иммунного ответа, становятся иммунопатологическими и являются причиной формирования патологического процесса (Лысенко и др., 1996).
Степень выраженности, характер и продолжительность клинического ответа на заражение токсокарой разнообразны, индивидуальны, малоспецифичны и зависят от многих факторов, в том числе от интенсивности инвазии, специфики распределения личинок в органах и тканях, частоты реинвазии, возраста человека, общего состояния его здоровья и иммунного статуса.
Мигрируя сквозь ткани и органы, личинки Т. canis механически повреждают кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения, одновременно отравляя организм человека продуктами своей жизнедеятельности и тканевого распада. При разрушении личинок в организм человека попадают их соматические антигены. Все патологические проявления при токсокаро-зе связаны в основном с аллергическими реакциями немедленного и замедленного типов. В частности, образование гранулём в печени, лёгких, поджелудочной железе, миокарде, мезентериальных лимфатических узлах, головном мозге человека происходит за счёт механизмов аллергической реакции замедленного типа.
Различают три формы токсокарозиса человека: висцеральную, глазную и скрытую. Некоторые исследователи выделяют также неврологическую форму поражения, другие же относят её к висцеральной. В отдельных публикациях иногда встречается упоминание о кожной форме.
Висцеральная форма (visceral larva migrans) проявляется рецидивирующей лихорадкой, лёгочным синдромом различной степени тяжести - от лёгких катаральных явлений до острого бронхита, пневмонии и приступов удушья (особенно тяжело протекает у детей раннего возраста), длительным субфебрилитетом, гепатомегалией, миокардитом, панкреатитом, абдоминальными болями, диспепсией, лимфоденопатией (более выражена у детей), лейкоцитозом, эозинофилией периферической крови (в ряде случаев до 70 - 80 % и более). На коже могут наблюдаться высыпания в виде крапивницы или полиморфной сыпи, иногда проявляются сильнейшие отёки кожи и слизистых оболочек (отёки типа Квинке). В случае локализации личинок в мышечной ткани могут развиваться болезненные инфильтраты по ходу мышц. Поражение щитовидной железы проявляется симптомами опухоли. Некоторые исследователи отмечают прямую связь между тяжестью клинических
122
проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, ги-пергаммаглобулинемия (Лысенко и др., 1996; Токсокароз, 2004; Тумольская, 1998).
Следует иметь в виду, что многие из перечисленных симптомов проявления висцеральной формы заболевания могут быть вызваны и другими гельминтами, причём не только нематодами, но и цестодами.
Глазная форма токсокароза (ocular larva migrans) примечательна тем, что патологический процесс может затрагивать практически все отделы глаза - сетчатку, хрусталик, стекловидное тело и т.д. Чаще всего поражается один глаз. У заболевших наблюдается снижение остроты зрения вплоть до его полной потери, могут развиться косоглазие, катаракта, витрит, симптомы опухолевого процесса, параор-битальные отёки, лейкокория, резкий экзофтальм, множественные повреждения ретины, неврит зрительного нерва, панофтальмит (тотальное гнойное воспаление и расплавление всех структур и оболочек глазного яблока) (Лысенко и др., 1996; Чередниченко, 1985; Arevalo et al., 2013; Ashton, 1960; Gillespie et al., 1993; Hunt, 1995; Otranto, Eberhard, 2011; Schneier, Durand, 2011; Stewart et al., 2005; Zugulska-Mach et al., 1993 и др.). Иногда может наблюдаться высокая эозинофилия - до 44 %, но в целом она менее выражена и не столь постоянна, как в случае висцеральной формы заболевания.
Судя по статистическим данным, глазная форма встречается намного чаще остальных. В США, например, по данным Центра по борьбе с болезнями, среди 700 - 1000 ежегодно регистрируемых случаев токсокароза на глазную форму приходится 330 - 600 случаев. Отдельные авторы высказывают мнение, что в действительности случаев глазного токсокариазиса на порядок больше, чем сообщается о них, даже в развитых странах («Hundreds of cases have been reported and described and untold thousands of cases have probably occurred, even in developed countries») (Otranto, Eberhard, 2011). Данная форма заболевания более характерна для детей старшего возраста и подростков, хотя её регистрируют и у взрослых.
Скрытый токсокароз (токсокариазис) (covert toxocariasis) нельзя отнести ни к висцеральной, ни к глазным формам (Taylor, Holland, 2001; www.cfsph.iastate.edu). При этой форме поражения антитела к Тохосага связываются с несколькими системными или локализованными симптомами, но не соответствуют ни висцеральному, ни глазному синдромам. Для скрытого токсокароза характерны абдоминальные боли (наиболее обычное проявление), головная боль, анорексия, тошнота, рвота, гепатомегалия, нарушение сна, слабость, кашель, астма. Заболевание не всегда сопровождается эозинофилией.
Неврологическая форма токсокароза (токсокариазиса) (neural larva migrans) впервые описана в середине прошлого столетия (Beautyman, Woolf, 1951). Цитируемые авторы предположили тогда, что обнаруженная ими в мозге ребёнка инкапсулированная аскаридидная личинка относится к Ascaris lumbricoides. Через 15 лет исследователи уточнили, что в действительности то была личинка Тохосага canis (Beautyman et al., 1966). При локализации личинок в центральной нервной системе заболевание проявляется упорными головными болями, бессоницей, слабостью, нарушением координации движений, эпилептиформными приступами; у больного могут развиться менингит, менингоэнцефалит, энцефаломиелит, менингоэнцефа-ломиелит, парез, паралич; при исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов (Glickman et al., 1979; Hill et al., 1985; Vidal et al.,
123
2003). К счастью, неврологическая форма заболевания встречается очень редко: так, с 1982 по 2002 гг., т.е. за 20 лет, было описано всего 20 подобных случаев (Vidal et al., 2003). Данная форма токсокароза чаще регистрируется у взрослых (Bouchard et al., 1998; Vidal et al., 2003). Инвазированные токсокарами дети существенно отличаются от здоровых лиц во многих нейропсихологических тестах, моторной и познавательной функциях.
Отметим, что эозинофильный менингит могут вызывать личинки не только Т. canis, но и других нематод, проникших в ЦНС, в том числе Baylisascaris, Angiostrongylus, о чём уже мы уже говорили выше, а также некоторые виды трематод, цестод, отдельные вирусы, бактерии или же грибы. Похожие симптомы могут быть выражены, например, при туберкулёзе, рассеянном склерозе, злокачественных опухолях и даже при реакции организма на некоторые лекарственные препараты.
У каждого отдельного больного симптомы поражения токсокарой могут проявляться в изолированном виде или в различных сочетаниях, а сама болезнь протекать с различной степенью тяжести. Клинические проявления заболевания у детей, как правило, выражены ярче, а инвазия протекает тяжелее, чем у взрослых.
По степени проявления клинических признаков токсокароз может быть бессимптомным (со слабоположительной реакцией ИФА) или минимально лёгким (например, в виде умеренной эозинофилии), среднетяжёлым и тяжёлым (в виде пневмонии, гепатита, энцефаломиелита, миокардита, лейкемоидной реакции и пр., в том числе крапивницы, дерматита, отёка Квинке, анафилактического шока). Тяжёлое течение болезни с диссеминацией возбудителя наблюдается при очень массивной инвазии, а также при нарушениях иммунной системы (Туйнов, 2010). Летальные случаи при токсокарозе редки и связаны с проникновением личинок в миокард и важные в функциональном отношении участки центральной нервной системы.
Течение болезни может быть также острым (например, одиночный непродолжительный эпизод крапивницы), хроническим и рецидивирующим. В хронической стадии болезни острые клинические и лабораторные признаки затухают, а наиболее стабильным лабораторным показателем остаётся гиперэозинофилия периферической крови.
Показано, что токсокароз осложняет течение многих острых инфекций, сопутствующих хронических заболеваний, к примеру, вирусного гепатита, гриппа, хронической обструктивной болезни лёгких. В отличие от других гельминтозов, токсокароз не только имеет выраженные иммунопатологические проявления, но и оказывает сильное иммуносупрессирующее действие. Так, у инвазированных детей после вакцинации и ревакцинации против дифтерии, столбняка и кори уровень специфических антител был ниже защитного (Лысенко и др., 1996; Юхименко, Майданник, 2012).
Одной из наиболее серьёзных проблем, возникающих при токсокарозе, является его связь с бронхиальной астмой (Тумольская, 1998). Дело в том, что у больных астмой нередко обнаруживаются антитела к антигенам Т. canis классов IgG и IgE, а в зависимости от остроты и длительности паразитарного процесса, и длительности клинических проявлений бронхиальной астмы преобладает тот или иной класс иммуноглобулинов. Установлено, что среди больных бронхиальной астмой с гиперэозинофилией периферической крови токсокарой поражены 22 % взрослых и 28 % детей (цит. по: Золотова, 2003). Клинические наблюдения свиде
124
тельствуют об улучшении течения бронхиальной астмы и даже выздоровлении после ликвидации токсокарозной инвазии.
Диагностика токсокароза затруднена ввиду полиморфизма и неопределённости клинических проявлений (Холодняк, 2009). По этой причине с этим заболеванием могут столкнуться врачи самых разных специальностей - педиатры, терапевты, окулисты, гематологи, гастроэнтерологи, онкологи, невропатологи и другие (Лысенко и др., 1996). В целом диагноз ставят на основании клинической картины, гематологических изменений (гиперэозинофильный лейкоцитоз), эпидемиологического анамнеза (контакт с собаками, игра в песочнице, геофагия) и иммунологического исследования проб сыворотки крови методом иммуноферментного анализа (ИФА). Для иммунологического анализа используется иммуноферментная тест-система «Тиаскар» производства «Вектор-Бест», пригодная также для проведения скрининговых массовых иммуноэпидемиологических исследований (Методические указания МУ 3.2.1043-01). Методика проведения ИФА изложена в соответствующей инструкции по применению диагностического набора как для массовых сероэпидемиологических исследований с использованием испытуемых сывороток в одном разведении, так и для подтверждения клинического диагноза путём раститров-ки испытуемой сыворотки (Методические указания МУ 3.2.1043-01).
Серологический метод (анализ на наличие в организме человека специфических антител на антигены, продуцируемые токсокарами) даёт наиболее надёжные результаты. Так, по данным сероэпидемиологических исследований, положительные иммунологические реакции на токсокар в очагах токсокароза выявляются у 2 -14 % практически здоровых лиц (Тумольская, 1998). Однако следует помнить, что иногда возможен ложноположительный результат анализа: речь идёт о лицах, заражённых эхинококками, описторхами (в острой фазе заболевания), с миграционной фазой аскаридоза (Пискун и др., 2009).
В случае глазного токсокароза также применяют серологические пробы (Park et al., 2000). Однако они не всегда дают положительный результат, поскольку эта форма заболевания обычно развивается при пониженной иммунной реакции организма на инвазию токсокарами.
Паразитологический анализ возможен крайне редко и только при исследовании биопсионного или секционного материала, когда в тканях удаётся обнаружить и верифицировать личинки Т. canis (Методические указания МУ 3.2.1043-01). Однако выявить личинок довольно трудно, а идентифицировать их по гистологическим срезам практически невозможно.
Трудности в диагностике токсокароза иногда приводят к ошибочному диагнозу, когда у больных определяют пневмонию, милиарный туберкулёз, бронхиальную астму, коклюш, лейкоз и различные другие заболевания, протекающие с эозинофильным синдромом.
При неосложнённом заболевании токсокарозом - прогноз для жизни благоприятный, при массивной инвазии и развитии осложнений, особенно у лиц с нарушениями иммунитета, — серьёзный, вплоть до летального исхода.
Практически все специалисты, и отечественные, и зарубежные, единодушно признают, что лечение токсокароза всё ещё недостаточно разработано и потому остаётся серьёзной проблемой. Во многом это обусловлено многообразием клинических проявлений заболевания и трудностями в его диагностике. В целом, успех лечения зависит не только от эффективности лекарственного препарата, но и от
125
клинической картины заболевания, стадии болезни, возраста больного и полноценности его иммунного ответа. Среди рекомендуемых препаратов называют альбендазол, тиабендазол (минтезол), мебендазол (вермокс), медамин. Рекомендации по их применению, разовой дозе и продолжительность курса лечения - в компетенции медицинских работников, поэтому не буду на них останавливаться.
Лечение глазного токсокароза проводят субконъюнктивальными инъекциями депомедрола, с использованием фото- и лазерокоагуляции для разрушения ток-сокарных гранулём. В ряде случаев приходится прибегать к хирургическому вмешательству (http://www.problemkozha.ru/toxocara).
Источником заражения людей являются, прежде всего, яйца Т. canis, которые могут находиться в почве, в песке на детских игровых площадках, на зелени, овощах и ягодах, растущих на приусадебных участках или же купленных на рынке, на предметах обихода, в пыли помещений, на шерсти животных. Широкому распространению яиц способствуют как высокий репродуктивный потенциал паразита, так и устойчивость яиц к воздействию неблагоприятных факторов, вследствие чего они длительное время остаются в почве жизнеспособными даже после полного разрушения экскрементов, с которыми попали во внешнюю среду.
Информация о загрязнённости яйцами токсокары почвы, песка в детских песочницах, территории общественных мест очень обширна. Всего несколько примеров. В Италии в Апулии при обследовании 54 проб фекалий собак, собранных в зелёных парковых зонах, на дорожках в парках, на игровых площадках, в зоне общественных зданий и у школы, в 8 из них были выявлены яйца Т. canis (Tarsitano et al., 2010). В Гданьске (Польша) яйца токсокар (авторы не определяли их виды) были выявлены в 11 % проб фекалий собак и кошек и 6.2 % проб песка из песочниц на детских игровых площадках (Rokicki et al., 2007). Аналогичные исследования в Ки-риккале (Турция) показали наличие яиц Тохосага spp. на 5 из 8 площадок в 15.6 % проб песка (от 1 до 11 яиц) и 7.7 % проб фекалий собак (Aydeniz6z, 2006). В некоторых странах Европы даже отказались от использования песочниц для игр детей в связи с риском заражения токсокарой (Юхименко, Майданник, 2012).
Другие животные семейства псовых (волки, лисы), также являющиеся облигатными хозяевами, имеют дополнительное эпидемиологическое значение.
Помимо псовых, диссеминаторами яиц токсокары, возможно, могут быть животные других семейств, о чём свидетельствует следующая информация. Обследуя фекалии ондатры в окрестностях г. Павлодар, исследователи обнаружили в них инвазионные содержащие сформированную подвижную личинку яйца Т. canis (Бу-лекбаева, Тарасовская, 2015). Материал собирался в пригородном припойменном биотопе, часто посещаемом местными жителями. Авторы публикации предположили, что яйца токсокары попали в кишечник ондатры вместе с пищей - растениями, на которых они могли случайно оказаться; в желудочно-кишечном тракте животного они продолжили развитие и затем вместе с его фекалиями невредимыми вышли во внешнюю среду.
Роль бытового контакта с почвой в заражении людей яйцами токсокары многократно доказана более высокой долей регистрируемых случаев заболевания среди детей, владельцев приусадебных и дачных участков, огородов, работников коммунальных служб, лиц, занятых работой на земле, а также взрослых и детей тех домов, где во дворах выгуливают собак.
126
Яйца Т. canis могут переноситься также на шерсти собак (Wolfe, Wright, 2003). Возможность попадания яиц токсокары на лапы и шерсть домашних животных вполне реальна во время их прогулок во дворах, куда могут забредать и безнадзорные собаки-паразитоносители. Яйца токсокары покрыты липучим веществом, вследствие чего прочно прилипают к любой поверхности, на которой оказались. Кстати, лабораторные исследования подтвердили возможность развития до инвазионного состояния яиц, прикрепившихся к шерсти собак (Keegan, 2011).
Определённую роль в распространении яиц Т. canis играют также бытовые насекомые, особенно тараканы. В условиях эксперимента продемонстрировано, что из общего количества яиц токсокары, поедаемых тараканами, четвёртая часть затем выделяется ими во внешнюю среду в жизнеспособном состоянии (www.infectology.ru/parasitic/helmintoses/toxocarosis.aspx).
Яйца Т. canis обнаруживаются также в смывах с овощей и столовой зелени с частотой до 3 % от числа исследованных проб, что подтверждает возможность их попадания к человеку с пищей (Методические указания МУ 3.2.1043-01). В научно-методическом пособии «Токсокароз» его авторы (Лысенко и др., 1996) сообщают, что ещё в 1984 г. в Ереване В. А. Давидянц обнаружил яйца токсокар в 9 % проб зелени из магазинов и в смывах рук детей (до 3.0 %).
Не может не насторожить и тот факт, что человек может заражаться не только яйцами, но и личинками токсокары через сырое или слабо термически обработанное мясо или печень животных - паратенических (резервуарных) хозяев нематоды (свиней, овец, коров, кроликов, домашней птицы) (Taira et al., 2004; Takakura, 1993). В частности, в Японии описаны случаи заражения людей Т. canis при употреблении в пищу мяса и/или печени цыплят, а также крупного рогатого скота, контаминированных личинками токсокары (Ito et al., 1986; Sakai et al., 1983).
И, наконец, авторы некоторых публикаций допускают возможность передачи инвазии у человека трансплацентарным и трансмаммарным путями (Пискун и ДР, 2009).
Заражение Т. canis регистрируют у людей разного возраста, но чаще всего страдают дети 3-5 лет в силу своего наибольшего контакта с почвой и собаками, а также присущего им подспудного нежелания следовать общепринятым правилам личной гигиены. Например, в результате серологического обследования 808 детей и 125 взрослых положительный титр антител к антигенам токсокар выявлен соответственно у 39.4 и 11.2 % из них (Захарчук, 2007).
Значительному риску поражения токсокарами подвержены кинологи, работники коммунального хозяйства, ветеринарных служб, цирков и зоопарков, автоводители и автослесари, продавцы овощной продукции, владельцы собак и члены их семей, содержащие животных в жилище, владельцы приусадебных участков и огородов, лица, занимающиеся охотой с собаками, а также люди со склонностью к геофагии и низким уровнем гигиенических навыков.
Заражение людей может происходить в течение всего года, поскольку яйца токсокары месяцами и годами сохраняют инвазионность. Однако наибольшее число заражений обычно приходится на летне-осенний период, когда и количество яиц в почве и вероятность контакта человека с почвой являются максимальными.
Профилактика токсокароза человека и полезных животных является комплексной медико-ветеринарной проблемой государственного уровня: токсокароз включён в систему отчётности; каждый случай его выявления немедленно фикси-
127
руется в территориальном центре Госсанэпиднадзора (Лысенко и др., 1996). В решении этой проблемы самое активное участие должны принимать органы исполнительной власти, жилищно-эксплуатационные организации, станции по борьбе с болезнями животных, органы здравоохранения при непосредственном участии и контроле учреждений санитарно-эпидемиологической службы (Методические указания МУ 3.2.1043-01).
Меры, направленные на предупреждение заражения человека и домашних животных токсокарами, разнонаправлены. Санитарно-ветеринарные мероприятия должны быть ориентированы на контроль численности популяции бродячих собак, выявление больных животных и их своевременную дегельминтизацию, санацию окружающей среды, в том числе почвы и водоёмов. Детские игровые площадки, скверы, парки, территории возле школ, дошкольных детских учреждений должны быть максимально защищены от возможности проникновения на них бродячих животных. Для выгула домашних собак следует выделять отдельные специально оборудованные для этой цели участки земли, на которых следует организовать уборку фекалий животных (в принципе это должны делать сами хозяева своих питомцев, используя для этой цели специальные ёмкости).
Личная гигиена мало чем отличается от общепринятых в отношении других аскаридид: прежде всего, это - обязательное мытьё рук после контакта с почвой и/или животными, после прогулок, игр на детских площадках и в песочницах, после работы в огороде и на приусадебных участках и т.д. Зелень и овощи, собранные с огорода или купленные на рынке, а также другие пищевые продукты, которые могут содержать частицы почвы, следует тщательно промывать проточной водой. Учитывая возможность заражения личинками токсокары через необработанное мясо домашней птицы и животных, мясную продукцию в очагах токсокароза следует обязательно подвергать горячей термической обработке или же заморозке.
Не меньшее значение в профилактике токсокароза принадлежит санитарнопросветительской работе, призванной помочь людям осознать тот вред, который может принести их организму заражение столь опасным гельминтом, и который не так уж и трудно предупредить.
Заболевание человека токсокарозом широко распространено по планете. Многочисленные случаи инвазии людей описаны в США, Мексике, Англии, Нидерландах, Франции, Польше, Болгарии, Чехии, Румынии, Югославии, Турции, Иране, Малайзии, Китае, Корее, на Филиппинах и в других странах, и даже на Гавайских островах (Alicata, 1964). В России, по данным сероэпидемиологического исследования, токсокарой инвазировано до полумиллиона человек (Токсокароз. 2004). Наибольшее число заболевших выявлено на административных территориях Центрального, Уральского, Западно-Сибирского и Дальневосточного районов. Высокий уровень заболеваемости населения отмечен в Еврейской автономной области (9.9), Республике Алтай (3.5), Удмуртской Республике (3.4), Тульской (2.7) и Новгородской (1.9) областях, Чувашской Республике (1.9), Кемеровской (1.9), Пермской (1.8) и Сахалинской (1.8) областях при среднефедеративном показателе 0.33 на 100 тыс. населения (Методические указания МУ 3.2.1043-01). В крупных городах, где постоянно увеличивается численность собак, особенно безнадзорных, во внешней среде накапливается большое количество инвазионного начала возбудителей различных гельминтозов, в том числе токсокароза, что создаёт реальную угрозу для здоровья человека.
128
Тохосага cati (Schrank, 1788) Brumpt, 192715 (рис. 42). Видовое название нематоды связано с её первым обнаружением именно у домашней кошки: cat -кошка, cati - кошачий.
Описание (по разным авторам, в том числе: Bowman et al., 2002; Faust, 1949; Gallas, da Silveira, 2013). Нематоды коричневато-жёлтого, кремового или розоватого цвета. Передний конец тела нематод с короткими и широкими латеральными крыльями, придающими ему вид наконечника стрелы. Дорсальная губа с двумя крупными боковыми папиллами, субвентральные губы с одной большой папиллой в середине губы и маленькой папиллой близ амфидиальной поры. По краям каждой губы располагаются зубчики. Нервное кольцо близ экскреторной поры. Длина пищевод составляет от 2 до 6 % от длины тела. Пищевод заканчивается железистым желудочком. Самцы длиной 3 - 6 см. Хвостовой конец тела самца с 20 - 25 парами преанальных и 12 постанальными папиллами. Длина почти равных спикул 1.7 - 1.9 мм. Самки длиной 4-12 см. Вульва самок в 25 - 40 % длины от переднего конца тела. Общий маточный проток длинный. Яйца почти шарообразные, с тонкой оболочкой, мелкой бугристостью, диаметром 65 - 75 (Faust, 1949), 55 - 74 х 37 - 74 pm (Gallas, da Silveira, 2013). Инвазионная личинка длиной 0.4 и максимальным диаметром 0.015 - 0.017 мм.
Рис. 42 Тохосага cati: А - передний конец тела, вентрально; В - поперечный срез через шейную область, иллюстрирующий строение крыла; С - задний конец самца, латерально; D - поперечный срез через спикулу; Е - яйцо (из: Faust, 1949)
15 Синонимы Тохосага cati, заимствованные из работы (Gallas, da Silveira, 2013): Ascaris alata Bellingham, 1839; Ascaris cati Schrank, 1788; Ascaris circumflexa Molin, 1858; Ascaris crenulata Bremser, 1824; Ascaris felis Gmelin, 1790; Ascaris globulus Linstow, 1899; Ascaris mystax (Zeder, 1800) Rudolphi, 1802; Ascaris teres Goeze, 1782; Belascaris cati (Schrank, 1788) Brumpt, 1922; Belascaris cati Railliet & Henry, 1911; Belascaris crenulata (Bremser, 1824) Railliet & Henry, 1911; Belascaris mystax (Zeder, 1800) Leiper, 1907; Fusaria mystax Zeder, 1800; Тохосага cati Baylis & Daubney, 1923; Тохосага crenulata (Bremser, 1824) Yorke & Maplestone, 1926; Тохосага felis (Goeze, 1782) Brumpt, 1936; Тохосага mystax (Zeder, 1800) Stiles & Brown, 1924.
129
Схема жизненного цикла Т. cati аналогична таковой Т. canis. Заражение же-финитивных хозяев происходит или яйцами, или через мелких животных - паратонических (промежуточных) хозяев, инвазированных личинками паразита, или трансмаммарным путём. Возможно, что именно мелкие млекопитающие являются основным источником заражения кошачьих (Dubinski et al., 1995). Так, в Великобритании из 510 крыс, обследованных на 11 сельских фермах, 15 % из них оказались заражены личинками Т. cati (Webster, MacDonald, 1995).
Среди оончательных хозяев Т. cati - практически все представители семейства кошачьих: рыси канадская, пиренейская, обыкновенная и рыжая, пума, леопард, ягуарунди, оцелот, онцилла, тигры, львы, коты камышовый, южноамериканский Жоффруа, кошки бенгальская, лесная, дикая европейская, ириомотейская, или японская дикая, домашняя.
В Приморском крае России дальневосточный лесной кот заражён этой нематодой на 80 % с интенсивностью инвазии 1-22 экз. (Коняев и др., 2015). В Алтайском крае паразит выявлен у 46.01 ± 5.2 % особей обследованных кошек (Лунева, 2015), в Ставрополе - у 18.1 % (Деркачёв, 2014). Г. С. Итон (2014) зарегистрировал паразита у лисицы и лесного кота на территории Северо-Западного Кавказа. К слову, перечисленные авторы описывают паразита под названием Т. mystax.
В Пермском государственном цирке яйца Т. cati обнаружились в кале 8 тигров, а также у леопарда и 86.36 % особей африканского льва (Сивкова, Непримерова, 2012). В Бразилии заражение этой нематодой выявлено у пумы (у 2 особей из 3 вскрытых), онциллы (у 2 из 3-х), ягуарунди (у 3 из 5-ти) и кота Жоффруа (у 4 из 6-ти) (Gallas, da Silveira, 2013), а в Эстонии - у 68 % рыси обыкновенной (Valdmann et al., 2003). В центральном Лаосе токсокара найдена у 11 % домашних кошек при интенсивности инвазии 1-18 экз. (Scholz et al., 2003), во Франции - у 31 % (Petithory et al., 1996), в Тайпее (Тайвань) - у 41 % уличных кошек (Fei, Мо, 1997). В Иране в проыинции Шираз уличные кошки заражены Т. cati на 42.6 % (Zibaei et al., 2007), а в Кашане - на 13.3 % (Mohsen, Hossein, 2009). Перечень всех случаев регистрации Т. cati у разных видов кошачьих по странам и континентам занял бы, наверное, не одну страницу. Вместе с тем, одно совершенно очевидно: Т. cati - широкораспространённый паразит кошек, как бродячик, так и домашних.
Что касается возможного заражения человека токсокарой кошачьей, то к настоящему времени известно всего несколько случаев регистрации взрослых особей и личинок этой нематоды, как правило, у детей. Э. Фауст (Faust, 1949) пишет о 10 случаях обнаружения Т. cati у человека в Европе и Северной Америке, ссылаясь при этом на работу 1941-го года (Swartzwelder, 1941).
Комментируя сообщение (von Reyn et al., 1978) о находке у человека взрослых кишечных стадий обоих видов токсоар - и Т. cati, и Т. canis, Д-р П. Бивер (Beaver et al., 1984) написал, что такие сообщения, как правило, ненадёжны. В тех немногих случаях, когда взрослый червь действительно вышел изо рта или ануса ребёнка, сопутствующие тому обстоятельства свидетельствовали, что нематода попала к ребёнку или в уже зрелом состоянии или же, что более вероятно, к нему попала незрелая взрослая особь из фекалий или рвотных масс заражённой собаки или кошки. Возможно, что таким же образом - случайным заглатыванием взрослых нематод - можно объяснить 4 случая обнаружения взрослых особей Т. cati у детишек в США (Eberhard, Alfano, 1998).
130
И уж совсем немногочисленны статьи с описаниями регистрации у людей личинок Т. cati. В Филадельфии мелкие личинки токсокары были обнаружены у 2-летнего мальчика при биопсии печени (Karpinski et al., 1956). Поскольку малыш играл с инвазированным котёнком и не имел никаких контактов с собаками - хозяевами Т. canis, авторы определили личинок как Т. cati. В Израиле у 5-летней девочки, поступившей в клинику в коматозном состоянии с высокой температурой и конвульсиями, при аутопсии в тканях мозга были выявлены многочисленные личинки, которых отнесли к Т. cati (Schoenfeld et al., 1964). В Бразилии при серологическом обследовании 54 детей с симптомами тропического эозинофильного синдрома, 21 из них были серопозитивны на антитела Тохосага, а после дальнейшего анализа только один из них, по мнению исследователей, был серопозитивен на Т. cati (Virginia et al., 1991).
И всё же, несмотря на столь редкую регистрацию Т. cati у человека, пренебрегать мерами предосторожности во избежание заражения этой нематодой никак не следует. Всё сказанное выше относительно мер, направленных на предупреждение заражения людей токсокарой собачьей, в равной степени применимо и к токсо-каре кошачьей.
Итак, к настоящему времени среди опасных для человека представителей рода Тохосага наиболее известным, широко распространённым и опасным является Т. canis. Проблеме паразитирования этого вида у людей посвящена столь обширная литература, что выбрать из всего массива опубликованных данных наиболее интересные, мало известные и в то же время наиболее информативные было невероятно трудно. Второй по значимости вид - это, безусловно, Т. cati. Вполне возможно, что в действительности данный вид чаще встречается у человека, чем описано в литературе, но, в силу определённой инерции мышления, обнаруженных у человека личинок во многих случаях «автоматически» относят к Т. canis как наиболее известному и широко распространённому. Оба вида на стадии личинки внешне морфологически не различимы, лишь диаметр тела у Т. cati слегка меньше такового у Т. canis: 0.015 -0.017 против 0.018 - 0.021 мм (Nichols, 1956).
Среди токсокар, найденных у человека, иногда называют Тохосага ptero-podis Baylis, 1926. Этот вид паразитирует у крылановых и зарегистрирован у них на тихоокеанских островах. Утверждают, что именно Т. pteropodis вызвал у людей вспышку болезни с гепатитоподобными симптомами, которая получила в Австралии название «загадочной болезни Пальмового острова» (Palm Island mystery disease) (Prociv, 1989 - цит. no: Muller, 2002). Однако некоторые исследователи полагают, что это могло быть просто пищевое отравление (Muller, 2002). Более никто эту нематоду у людей не встречал, хотя вероятность таких находок никак нельзя исключать.
И, наконгец, в качестве возможного паразита человека упоминают также Т. vitulorum (Goeze, 1782). Эти крупные нематоды (длиной до 15-30 см) живут в кишечнике крупного рогатого скота, буйволов, бизона, зебу и других представителей семейства полорогих, населяющих в основном тропические и субтропические регионы. Случаи заражения люжей данным паразитом документально не подтверждены, а упоминания о них могут в действительности относиться или к Т. canis или Т. cati.
Для всех видов токсокар человек является биологическим тупиком в их жизненном цикле, поскольку они не достигают в нём половой зрелости. И вполне
131
возможно, что столь агрессивное поведение личинок токсокар в организме человека вызвано именно тем обстоятельством, что они попадают «не в того хозяина» и пытаются покинуть его.
Цитируемая литература
Адаменко Г. П., Никулин Ю. Т. Токсокароз - актуальная проблема здравоохранения // Медицинские новости. - 2004. - № 2. - С. 31 - 36.
Азизова А. А. Эколого-фаунистический анализ паразитов енота-полоскуна (Procyon lotor) по различным зонам Азербайджана И Геоэкология. Юг России: экология, развитие. - 2010. - № 1. - С. 86 - 90.
Акимова С. А. Токсокароз и токсаскаридоз плотоядных в Нижнем Поволжье И Известия Нижне-волжск. агроуниверсит. комплекса. - 2007. - № 4 (8). - cyberleninka.ru/article/n/toxocaros..povolznie.
Березина Е. С. Особенности распространения токсокароза в популяциях собак и человека // Ветер, патология. - 2006. - № 3. - С. 45 - 55.
Булекбаева Л. Т., Тарасовская Н. Е. К паразитофауне ондатры в окрестностях г. Павлодара / Новые знания о паразитах: Мат. V Межрегион, конф. «Паразитологические исследования в Сибири и на Дальнем Востоке», 14-16 сентября 2015. - Новосибирск, 2015. - С. 19 - 20.
Гогоберишвили М. С., Поцхверия Ш. О. Некоторые вопросы эпизоотологии токсокароза и токсаскари-доза собак в Тбилиси И Теория и практика паразитарных болезней животных. - 2013. - Вып. № 14. -С. 118-121.
Гринберг А. И. Редкие случаи заражения человека Toxascaris leonina и Тохосага mystax // Медицинск. паразит, и паразит, болезни. - 1961. -30, 5. - С. 626.
Давыдова О. Е, Шемяков Д. Н. Паразитофауна лисицы обыкновенной Кроноцкого заповедника / Новые знания о паразитах: Мат. V Межрегион, конф. «Паразитологические исследования в Сибири и на Дальнем Востоке», 14-16 сентября 2015. - Новосибирск, 2015. - С. 33 - 34.
Деркачев Д. Ю. Разработка новых технологических приёмов диагностики и мер борьбы при нематодо-зах плотоядных: Автореф. дис...канд. вет. наук: 03.02.11- паразитология. - Ставрополь, 2014. - 22 с
Захарчук О. I. Стан захворюваност! на токсокароз на Буковиш И Буковин. мед. вкник. - 2007. - 11 (4). -С. 124-126.
Золотова И. А. Бронихиальная астма и токсокароз (клиническое, иммунологическое и функциональное исследование): Автореф. дисс...канд. мед. наук. - 14.03.36. -М., 2003 (medical-diss-com).
Итин Г С. Особенности гельминтофауны диких хищных млекопитающих в ландшафтно-географических зонах Северо-Западного Кавказа: Дисс....канд. биол. наук: 03.02.08 - экология. - Краснодар, 2014.-171 с.
Калинина О. И. Биология гельминтов и профилактика гельминтозов (учебное пособие). - Владивосток: Изд-во ТГЭУ, 2005. - 80 с.
Коняев С. В., Серёдкин И. В., Малкина А. В. Фауна гельминтов дальневосточного лесного кота (Prionailurus bengalensis euptilurus) в России / Новые знания о паразитах: Мат. V Межрегион, конф. «Паразитологические исследования в Сибири и на Дальнем Востоке», 14-16 сентября 2015. - Новосибирск, 2015. - С. 61 -62.
Лунева Н. А. Биологические особенности основных гельминтозов домашних плотоядных животных Алтайского края: Автореф. дисс...канд. биол. наук: 03.02.11-паразитология. - Барнаул, 2015.-23 с
Лысенко А. Я., Константинова Т И, Авдюхина Т. И. Токсокароз. - М., 1996. - 18 с.
Майданник В. Г, Хайтович Н. В., Юхименко Г. Г. Гельминтозы у детей. - К.: Дорадо-Друк, 2012. -604.
Методические указания. МУ 3.2.1043-01 (Утв. Главным государственным санитарным врачом РФ 28.05.2001) 3.2. Профилактика паразитарных болезней. Профилактика токсокароза. (По состоянию на ноябрь 2007 года. Дата введения: 1 октября 2001 года).
Мозговой А. А. Аскаридаты животных и человека и вызываемые ими заболевания. Книга I // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1953. -2.-351 с.
Пискун Т. А., Якимович Н. И., Мирутков Д. Д. Токсокароз у детей: учебно-методическое пособие. -Минск: БГМУ, 2009. - 27 с.
Сивкова Т Н, Непримерова Т. А. Распространение паразитарных болезней хищных животных в условиях цирка// www.rusnauka.com/17_AVSN_2012/Veterinaria/l_l12593.doc.com.
Скрябин К. И., Петров А. М. Основы ветеринарной нематодологии. -М.: Колос, 1964. - 527 с.
Солопов П. А. Иммуноферментный метод диагностики токсокароза собак, сероэпизоотологический мониторин и терапия: Автореф. дисс...канд. вет. наук: 03.00.19 - паразитология. - М., 2009. - 23 с.
132
Субботин А. М. Гельминтозы собак Беларуси и меры борьбы с ними: Автореф. дисс... канд. вет. наук. - Минск, 2002.
Токсокароз. Клиника, дагностика, лечение, профилактика. Информационно-методическое пособие. -Новосибирск, 2004.-48 с. (drive.google.com.9603.pdf).
Туйнов В. А. Синдром larva migrans (малоизвестное об известном) // Газета «Новости медицины и фармации» Инфекционные болезни (330) 2010 (Тематический номер), http://www.mif-ua.com/ archi ve/article/13 583.
Тумольская Н. И. Токсокароз: современный подход // Лечащий врач. - 1998. - № 3. -www.lvrach.ru/1998/03/4526724.
Холодняк Г. Е. Клинико-эпидемиологические особенности, диагностика и новые подходы к терапии токсокароза у детей: Автореф. дисс...канд. мед. наук: 14.00.10 - инфекционные болезни. - М., 2009.
Чередниченко В. М. Поражение глаз при токсокарозе // Офтальмол. журн. - 1985. - № 4. - С. 236 -239.
Шинкаренко А. Н. Экология паразитов собак и меры борьбы с вызываемыми ими заболеваниями в Нижнем Поволжье: Автореф. дисс...докт. вет. наук: 03.02.19 - паразитология; 16.00.03 - ветеринарная микробиология, вирусология, микология с микотоксикологией и иммунология. - Иваново, 2005. -53 с.
Юхименко Г Г., Майданник В. Г. Токсокароз у детей И Международн. журн. педиатрии, акушерства и гинекологии. - 2012. - 2, 1. - С. 124-134.
Akao N., Ohta N. Toxocariasis in Japan // Parasitol. Int. - 2007. - 56. - P. 87 - 93.
Alicata J. E. Parasitic infections of man and animals in Hawaii // Hawaii Agricult. Exper. Stat., Univ. Hawaii, 1964. -Techn. Bull. No. 61. - 138 pp.
Arevalo J. F., Espinoza J. V., Arevalo F. A. Ocular toxocariasis // J. Pediatr. Ophthalmol. Strabismus. - 2013.
-50, 2.-P. 76-86. doi: 10.3928/01913913-20120821-01.
Ashton N. Larva granulomatosis of retina due to Toxocara canis 11 Br. J. Ophthalmol. - 1960. - 44, 3. - P. 129-148.
Aydenizdz Ozkayhan M. Soil contamination with ascarid eggs in playgrounds in Kirikkale, Turkey // J. Helminthol. - 2006. - 80, 1. - P. 15 - 18.
Beautyman W., Beaver P. C., Buckley J. J., Woolf A. L. 1966. Review of a case previously reported as showing an ascarid larva in the brain // J. Pathol. Bacteriol. - 1966. - 91. - P. 271 - 273.
Beautyman W., Woolf A. L. An ascaris larva in the brain in association with acute anterior poliomyelitis // J. Pathol. Bacteriol. - 1951. - 63. - P. 635 - 647.
Beaver P. C„ Jung R. C., Cupp E. W. Clinical Parasitology. 9th edition. Philadelphia, Pa: Lea and Febiger, 1984.-825 pp.
Bisseru B. Diseases of man acquired from his pet. - London: William Heinemann Med. Books Ltd., 1967. -483 pp.
Borecka A. [The spread of nematodes from Toxocara genus in the world] // Wiad. Parazytol. - 2010. - 56, 2.
-P. 117-124.
Bouchard O., Bosseray A., Leclercq P., Micoud M. Meningo encephalite a Toxocara canis I I Ann. Med. Interne (Paris). - 1998. - 149. - P. 391 - 392.
Bowman D. D., Hendrix С. M., Lindsay D. S, Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-467 pp.
Cho S., Egami M., Ohnuki H, Saito K, Chinone S., Shichinohe K. et al. Migration behaviour and pathogenesis of five ascarid nematode species in the Mongolian gerbil Meriones unguiculatus // J. Helminthol. -2007.-81, l.-P. 43-47.
Dhar D. N., Pattanayak S, Basu P. C. Prevalence of Toxocara canis (Werner, 1782) Johnston, 1916 and other intestinal helminth infections in dogs in Delhi and experimental studies on T. canis infection in laboratory animals // Bull. Indian Soc. for Malaria & other Communicable Dis. - 1966. - 3, 4. - P. 303 - 311.
Dubinski P., Havasiova-Reiterova K., Petko B., Hovorka I. Role of small mammals in the epidemiology of toxocariasis // Parasitology. - 1995. - 110. - P. 187- 193.
Eberhard M. L., Alfano E. Adult Toxocara cati infections in U.S. children: report of four cases // Am. J. Trop. Med. Hyg. - 1998. - 59. - P. 404 - 406.
Fei C. Y.t Mo К. M. Survey for endoparasitic zoonoses in stray dogs and cats in Taipei City // J. Chin. Soc. Vet. Sci. - 1997. - 23. - P. 26 - 33.
Fisher M. Toxocara cati: an underestimated zoonotic agent // Trends in Parasitology. - 2003. - 19. - P.167-170.
133
Gallas M., da Silveira E. F. Тохосага cati (Schrank, 1788) (Nematoda, Ascarididae) in different wild feline species in Brazil: new host records // Biotemas. - 2013. - 26, 3. - P. 117 - 125. http://dx.doi.org/ 10.5007/2175-7925.2013v26n3p 117.
Gibbons L. M., Jacobs D. E., Sani R А. Тохосага malaysiensis n. sp. (Nematoda: Ascaridoidea) from the domestic cat (Felis catus Linnaeus, 1758) // J. Parasitol. - 2001. - 87, 3. - P. 660 - 665.
Gillespie S. Ht Dinning W. J, Voller A., Crower oft N. S. The spectrum of ocular toxocariasis 11 Eye. - 1993. -7.-P. 415-418.
Glickman L. T., Cypress R. N., Crumrine P. K., Gitlin D. А. Тохосага infection and epilepsy in children // J. Pediatr. - 1979. - 94. - 75 - 78.
Hartwich G, Ascaridida, Ascaridoidea / Anderson R. C., Chabaud A., Willmott S. (Ed.). Keys to the Nematode parasites of vertebrates. -Wallinford: CABI Publ., 2009. - P. 309 - 323.
Hill I. R., Denham D. A., Scholtz C. L. Тохосага canis larvae in the brain of a British child // Trans. R. Soc. Trop. Med. Hyg. - 1985. - 79. - P. 351 - 354.
Hunt L. Ocular toxocariasis // Insight. - 1995. - 20, 4. - P. 32 - 33.
Ito K, Sakai K., Okajima T, Ouchi K, Funakoshi A. et al. Three cases of visceral larva migrans due to ingestion of raw chicken or or cow liver // J. Jpn. Soc. Int. Med. - 1986. - 75. - P. 759 - 766. (in Japanese) (цит. no: Akao, Ohta, 2007).
Karpinski F E, Evcerts-Suarez E. A.t Sawitz W. G. Larval granulomatosis (visceral larva migrans) // AMAJ Dis. Child. - 1956. - 92. - P. 34 - 40.
Keegan J. D. The significance of Тохосага ova in the hair of well-cared for owned dogs: MSc thesis, Trinity College Dublin, Dublin, 2011 (цит. no: Morgan, 2013).
Kirchheimer R., Jacobs D. E. Тохосага species egg contamination of soil from children’s play areas in southern England 11 Vet. Rec. - 2008. - 163. - P. 394 - 395.
Lee С. C, Cheng N. Y., Bohari Y. Тохосага canis from domestic cats in Kuala Lumpur // Trop. Biomed. -1993. -10.-P. 79-80.
Maizels R, M.t Tetteh К. K. A., Loukas А, Тохосага canis: genes expressed by the arrested infective larval stage of a parasitic nematode // Int. J. Parasitol. - 2000. - 30. - P. 495 - 508.
Maruyama S, Nino T, Yamamoto K, Katsube Y. Parasitism of Тохосага canis larvae in chickens inoculated with the ascarid eggs // J. Vet. Med. Sci. - 1994. - 56, l.-P. 139 - 141.
Mircean V, Titilincu A.t Vasile C. Prevalence of endoparasites in household cat (Felis catus) populations from Transylvania (Romania) and association with risk factors // Vet. Parasitol. - 2010. - 171, 1. - P. 163 -166. doi: 10.1016/j.vetpar.2010.03.005.
Mizgajska H. Eggs of Тохосага spp. in the environment and their public health implications // J. Helminthol. - 2001.-75.-P. 147-151.
Mohsen A., Hossein H. Gastrointestinal parasites of stray cats in Kashan, Iran 11 Trop. Biomed. - 2009. - 26, l.-P. 16-22.
Morgan E. P. Dogs and nematode zoonoses / Dogs, Zoonoses and Public Health. - Eds. Macpherson C. N. L., Meslin F.-X., Wandeler A. I. - 2nd Edition. - CAB Intern., 2013. - P. 153 - 161.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Nakamura S, Sotoyama T, Hayasaka S., Kameyama Y. et al. Parasitism of Тохосага canis larvae in Japanese quails by inoculation of the ascarid eggs 11 J. Vet. Med. Sci. - 1991. - 53, 5. - P. 865 - 872.
Nichols R. L. The etiology of visceral larva migrans. I. Diagnostic morphology of infective second stage Тохосага larvae // J. Parasitol. - 1956. - 42. - P. 349 - 391.
Otranto D., Eberhard M. L Zoonotic helminths affecting the human eye // Parasites & Vectors. - 2011. - 4. -P. 41. doi: 10.1186/1756-3305-4-41.
Pahari T. K, Sasmal N. K. Experimental infection of mice with Тохосага canis larvae obtained from Japanese quails // Int. J. Parasitol. - 1990. - 20, 2. - P. 263 - 264.
Park S. P.t Park L, Park H. Y., Lee S. U.t Huh S., Magnaval J. F. Five cases of ocular toxocariasis confirmed by serology // Korean J. Parasitol. - 2000. - 38. - P. 267 - 273.
Parsons J. C Ascarid infections of cats and dogs П Vet. Clin. N. Am. - 1987. - 17. - P. 1307 - 1339.
Petithory J. C, Vandemeulebroucke E, Jousserand P., Bisognani A. C. Prevalence of Тохосага cati in cats in France // Bull. Soc. Fran. Parasitol. - 1996. -14, 1. - P. 79 - 84.
Rokicki J., Kucharska A. P., Dzido J., Karczewska D. [Contamination of playgrounds in Gdansk city with parasite eggs] // Wiad. Parazytol. - 2007. - 53, 3. - P. 227 - 320.
Sakai K, Okajima Y., Ohuchi K. A case of visceral larva migrans due to the ingestion of raw hen liver If Nai-ka. - 1983. - 51. - P. 963 - 967. [in Japanese with English abstract].
134
Schneier A. J., Durand M. L. Ocular toxocariasis: advances in diagnosis and treatment // Int. Ophthalmol. Clin.-2011.-51, 4.-P. 135- 144. doi: 10.1097/110.0b013e31822d6a5a.
Schoenfeld A. E., Ghitnic E., Rosen N. Granulomatous encephalitis due to Тохосага larvae (visceral larva migrans) // Harefuah. - 1964. - 66. - P. 337 - 339.
Scholz T, Uhlirovd M., Ditrich O. Helminth parasites of cats from the Vientiane Province, Laos, as indicators of the occurrence of causative agents of human parasitoses // Parasite. - 2003. -10. - P. 313 - 350.
Senlik B., Cirak V. Y, Karabacak A. Intestinal nematode infections in Turkish military dogs with special reference to Тохосага canis // J. Helminthol. - 2006. - 80, 3. - P. 99 - 303.
Smith H, Holland C.t Taylor M., Magnaval J.F., Schantz P., Maizels R. How common is human toxocariasis? Towards standardizing our knowledge // Trends in Parasitology. - 2009. - 25. - P. 182 - 188.
Sprent J. F. A. Observations on the development of Тохосага canis (Werner, 1782) in the dog // Parasitology. - 1958.-48.-P. 184-209.
Stewart J. M., Cubillan L. D., Cunningham E. T Jr. Prevalence, clinical features, and causes of vision loss among patients with ocular Toxocariasis // Retina. - 2005. - 25, 8. - P. 1005 - 1013.
Sw artzwelder J. C. Tozocara cati (cat ascarid) infection in man. Report of an additional case 11 J. Trop. Med. Hyg. - 1941. - May 15.-2 pp. (цит. no: Faust, 1949).
Taira K., Saeed L, Permin A., Kapel С. M. Zoonotic risk of Тохосага canis infection through consumption of pig or poultry viscera // Vet. Parasitol. - 2004. - 121. - P. 115-124.
Takakura Y. An epidemiological study of food-borne toxocariasis: fowl and cattle as paratenic hosts of Тохосага canis 11 J. Juzen. Med. - 1993. - 102. - P. 828 - 935. (in Japanese with English abstract).
Tarsitano E., Greco G., Decaro N., Nicassio F., Lucente M. S., Buonavoglia C., Tempesta M. Environmental monitoring and analysis of faecal contamination in an urban setting in the city of Bari (Apulia region, Italy): health and hygiene implications // Int. J. Environ. Res. Public Health. -2010.-7, 11. - P. 3972 - 3986. doi: 10.3390/ ijerph7113972. Epub 2010 Nov. 9.
Taylor M. R. H, Holland С. V. Toxocariasis / Principles and practice of clinical parasitology. - Eds. Gillespie S. H., Pearson R. D. - J. Wiley & Sons, Ltd, 2001. - P. 501 - 520.
Valdmann H, Moks E, Talvik H. Helminth fauna of Eurasian lynx (Lynx lynx) in Estonia // J. Wildl. Dis. -2004.-40, 2.-P. 356-360.
Vidal J. E., Sztajnbok J, Seguro A. C. Eosinophilic meningoencephalitis due to Тохосага canis: case report and review of the literature // Am. J. Trop. Med. Hyg. - 2003. - 69, 3. - P. 341 - 343.
Virginia P., Nagakura K., Ferreira O., Tateno S. Serologic evidence of toxocariasis in northeast Brazil // Jap. J. Med. Sci. Biol.-1991.-44, l.-P. 1-6.
von Reyn C. F., Roberts T M., Owen R., Beaver P. C. 1978. Infection of an infant with an adult Тохосага cati (Nematoda) 11 J. Pediatr. - 1978. - 93. - P. 247 - 249.
Warren E. G. Infections of Тохосага canis in dogs fed infected mouse tissues // Parasitology. - 1969. - 59. -P. 837-841..
Warren E. G. Studies on the morphology and taxonomy of the genera Тохосага Stiles, 1905 and Neoascaris Travassos, 1927 // Zool. Anz., Jena. - 1970. - 185, 5 - 6. - P. 393 - 442.
Webster J. P, MacDonald D. W. Parasites of wild brown rats (Rattus norvegicus) on UK farms 11 Parasitology. - 1995. - 111. - P. 247 - 266.
Wolfe A., Wright I. P. Human toxocariasis and direct contact with dogs П Vet. Rec. - 2003. - 152. - P. 419 -422.
Xhaxhiu D., Kusi I., Rapti D., Kondi E., Postoli R., Rinaldi L., Dimitrova Z. M., Viser M., Knaus M., Rehbein S. Principal intestinal parasites of dogs in Tirana, Albania // Parasitol. Res. - 2011. - 108, 2. - P. 341 - 353. doi: 10.1007/S00436-010-2067-8.
Zibaei M., Sadijadi S. M., Sarkari B. Prevalence of Тохосага cati and other intestinal helminthes in stray cats in Shiraz, Iran // Trop. Biomed. - 2007. - 24, 2. - P. 39 - 43.
Zugulska-Mach H, Krukar-Baster K., Zibrowski S. Ocular toxocariasis in children and youth // Doc. Ophthalmol. - 1993. - 84, 2. - P. 145 - 154.
135
Семейство Capillariidae Railliet, 19151
В таксономической сводке 2011-го года семейство Capillariidae включено в класс Dorilaimea в составе отряда Trichocephalida (Hodda, 2011 - см. источник на стр. 14). В более ранних публикациях его можно встретить в классе Aphasmida в составе отряда Trichurata (Despommier, Karaspelou, 1987) или же в классе/подклассе Adenophorea в отряде Enoplida (Bowman et al., 2002; Moravec, 1994).
Описание (по: Определитель, 1987; с дополнениями из работ других авторов). Тонкие нитевидные нематоды, передняя часть тела которых тоньше задней. Две латеральные, дорсальная и вентральная бациллярные ленты состоят из субкутикулярных клеток, погружённых в гиподермальные валики. От этих клеток к поверхности кутикулы отходят выводные протоки различной формы и величины. Рот простой, ротовая капсула со стилетом. Пищевод состоит из короткого мышечного и длинного железистого отделов. Последний представлен цепочкой околопищеводных железистых клеток (стихоцитов), расположенных в один или два ряда вокруг пищеводной трубки. Этот участок пищевода получил название стихосомы. Самцы с одной спикулой. Спикулярное влагалище с шипиками или без. Хвостовой конец самцов с папиллами или без них, у некоторых форм с латеральными крыльями. Вульва иногда выступающая или с выростом различной длины, открывается позади дистального конца стихосомы. Поверхность яиц или гладкая, или с бугорками и углублениями. Паразиты позвоночных животных. Типовой род - Capillaria Zeder, 1800.
Таксономия Capillariidae - предмет непрекращающейся дискуссии в продолжении уже многих десятилетий. Многие авторы, не признавая гетерогенности данной группы, относили - и даже в настоящее время относят - всех капилляриид к одному роду - Capillaria (s. 1.). Например, в таксономической сводке «bug.tamu.edu/research/collection/ .../Family/Capillariidae.txt» в синонимах данного рода перечислены Trichosoma Rudolphi, 1819; Trichosomum Creplin, 1829; Calodium Dujardin, 1845; Liniscus Dujardin, 1845; Thominx Dujardin, 1845; Callodium JSgerskjold, 1909; Hepaticola Hall, 1916; Skrjabinocapillaria Skarbilovich, 1946; Ritaklossia Freitas, 1959; Amphibiocapillaria Moravec, 1982; Pseudocapillaroides Moravec et Cosgrove, 1982. Некоторые исследователи признавали существование только двух родов - Capillaria и Thominx.
В 1982 г. Ф. Моравец (Moravec, 1982) предложил новую систему капилляриид, выделив в составе семейства 16 родов. В работе 1987 г. Ф. Моравец с соавт. (Moravec et al., 1987) отметили, что Capillariidae - одна из групп, наиболее трудных в изучении, главным образом из-за неадекватного описания большого количества видов и отсутствия данных по их биологии. При этом они подчеркнули, что предложенную в 1982 г. Ф. Моравицем новую систему капилляриид многие авторы не поддержали. В этой же работе (Moravec et al., 1987) её авторы признали в семействе Capillariidae валидными уже 22 рода. В таксономической сводке 2011-го года в семействе значатся 18 родов с 390 видами (Hodda, 2011). Тем не менее, в публикации 2014 г. Ф. Моравец и Ж. Жюстин (Moravec, Justine, 2014) по-прежнему придерживаются той точки зрения, что семейство Capillariidae насчитывает 22 рода, из числа которых представители 9 родов паразитируют в рыбах.
1 Практически во всех таксономических сводках автором семейства Capillariidae назван Railliet, 1915 (см.: Vanaverbeke, 2015). В работах К. И. Скрябина с соавтор. (1957), Н. П. Шихобаловой (1968), Ф. Моравеца с соавт. (Moravec et al., 1987), Б. В. Ромашова (2000), а также в «Определителе» (1987) авторство семейства отнесено к Neveu-Lemaire, 1936.
136
Несмотря на общепринятую точку зрения о валидности семейства Capillariidae, некоторые авторы включают Capillaria и близкие роды в состав семейства Trichinellidae или же Trichuridae (см., напр., Quadros et al., 2009).
Жизненные циклы капилляриид разнообразны и могут быть как прямые (гомоксенные), когда промежуточный хозяин отсутствует, так и гетероксенные, с участием облигатного промежуточного хозяина, роль которого выполняют олигохеты, редко рыбы (Moravec et al., 1987). В жизненном цикле Paracapillaria philip-pinensis (Chitwood, Velasquez et Salazar, 1968) - кишечного паразита человека, в зависимости от того, откладывают самки яйца или же личинок, промежуточный хозяин соответственно имеется или же отсутствует (в этом случае наблюдается аутоинвазия окончательного хозяина). У некоторых видов капилляриид с прямым развитием трансмиссия паразитов часто осуществляется через паратенических хозяев.
Семейство Capillariidae - космополит, а среди его дефинитивных хозяев -представители практически всех групп позвоночных животных. По Б. В. Ромашову (1998), среди хозяев-млекопитающих максимальное видовое разнообразие капилляриид наблюдается у рукокрылых, далее следуют грызуны, насекомоядные, хищники, парнокопытные, сумчатые, приматы, зайцеобразные, даманы. По данным цитируемого автора, семейство включает более 400 видов.
Отдельные виды капилляриид имеют серьёзное ветеринарное и медицинское значение, поскольку являются возбудителями гельминтозов не только полезных животных, но и человека. Среди опасных для людей капилляриид - представители родов Calodium, Eucoleus Dujardin, 1845 и Paracapillaria Mendonca, 1963.
Цитируемая литература
Определитель паразитов пресноводных рыб. T. 3. Паразитические многоклеточные. - Л.: Наука, 1987. - 583 с. - (Определители по фауне СССР, изд. Зоол. ин-том АН СССР; Вып. 149).
Ромашов Б. В. Нематоды семейства Capillariidae млекопитающих: Фауна, морфология, систематика, биология, экология, филогения: Автореф. дисс... докт. биол. наук. - 03.00.19 - паразитология, гельминтология. - Воронеж, 1998.
Ромашов Б. В. Три вида капилляриид (Nematoda: Capillariidae) от хищных млекопитающих (Carnivora) и обсуждение системы и эволюции нематод семейства Capillariidae. 1. Переописание Eucoleus аег-ophilus и Е. boehmi И Зоол. журн. - 2000. - 79, 12. - С. 1379 - 1391.
Скрябин К. И., Шихобалова Н. П., Орлов И. В. Трихоцефаллиды и капиллярииды животных и человека и вызываемые ими заболевания / Основы нематодологии. Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1957. - 6. - С. 263 - 568.
Шихобалова Н.П. Глава 1. Введение в медицинскую гельминтологию / Протозойные болезни, гель-минтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 271 - 318. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Bowman D.D., Hendrix С. М., Lindsay D. S., Barr S. С. Feline Clinical Parasitology. - Iowa State Press, 2002.-467 pp.
Despommier D. D., Karaspelou J. ИС Parasitic life cycles. - Springer-Verlag, 1987. - 127 pp.
Moravec F. Proposal of a new systematic arrangement of nematodes of the family Capillariidae If Folia Parasitol. - 1982.-29, 2.-P. 119- 132.
Moravec F. Parasitic nematodes of freshwater fishes of Europe. - Kluwer Acad. Publ., 1994.-473 pp.
Moravec F., Justine J-L. Capillaria plectropomi n. sp. (Nematoda: Capillariidae), a new intestinal parasite of the leopard coral grouper Plectropomus leopardus (Serranidae) off New Caledonia // Parasite. -2014. -21, 76.
Moravec F., Prokopic J, Shlikas A. V. The biology of nematodes of the family Capillariidae Neveu-Lemaire, 19361I Folia Parasitol. - 1987. - 34, 1. - P. 39 - 56.
Quadros R.M., Pilati C., Marques S. M. T., Mazzolli M., Bene det R. C. Capillaria hepatica in Puma concol-or: First report in Brazil // J. Zoo & Wildlife Med. - 2009. - 40, 3. - P. 586 - 587.
137
Vanaverbeke J. Capillariidae Railliet, 1915. Accessed through (2015): World Register of Marine Species at http://www. marinespecies.org/aphia. php?p=taxdetails&id=834681.
Род Calodium Dujardin, 1845
Упомянутые выше разногласия относительно валидности того или иного рода капилляриид находят отражение и в разночтениях по поводу синонимов рода Calodium, Многие авторы называют его синонимом Capillaria. Ф. Моравец в работе 1982-го года (Moravec, 1982) рассматривает синонимом Calodium род Hepaticola Hall, 1916.
Описание (по разным авторам, в том числе: Moravec, 1982). С характерными чертами семейства. Стихоциты расположены в один ряд. Хвост самца округлый, с хорошо развитыми хвостовыми латеральными крыльями и двумя маленькими дольчатыми латеральными папиллами. Дорсальная кутикулярная мембрана отсутствует. Спикула среднеразмерная, на поперечном срезе круглая, иногда слегка хитинизи-рованная. Спикулярное влагалище без шипиков. Вульва с отростком или без него. Поверхность яиц с мелкими бугорками или ячеистая. Яйцекладущие. Тканевые паразиты (селезёнка, печень) млекопитающих. Типовой вид - Calodium splenaecum (Dujardin, 1843) Dujardin, 1945.
Вследствие отсутствия общепринятой системы таксономического состава семейства Capillariidae описываемый ниже патогенный для человека вид Calodium hepaticum в разных статьях можно обнаружить или в Calodium, или в Capillaria (чаще всего в медицинской литературе), или же в Hepaticola. Основные отличия Calodium от Capillaria, помимо специфичного местообитания в организме хозяина, заключаются в наличии у самцов латеральных хвостовых крыльев и отсутствии у спикулярного влагалища шипиков, тогда как у Capillaria латеральные хвостовые крылья отсутствуют, а спикулярное влагалище с шипиками.
Calodium hepaticum (Bancroft, 1893) Moravec, 1982 [=Trichocephalus hepati-cus Bancroft, 1893; Capillaria hepatica (Bancroft, 1893) Travassos, 1915; Hepaticola hepatica (Bancroft, 1893) Hall, 1916] (рис. 43, 44). В работе Г. Бэйлиса (Baylis, 1939;
стр. 242) годом описания вида указан 1894-й -Bancroft, 1894, - а не 1893-й год. Впервые паразит описан на материале из печени крыс (Bancroft, 1893). Видовое название нематоде дали по месту её локализации: hepaticum - печёночный.
Рис. 43 Calodium hepaticum. оригинальные иллюстрации вида из статьи Томаса Бэнкрофта (Bancroft, 1893) как Trichocephalus hepaticus (по: https://en. Wikipedia. org/wiki/Capillaria_hep atica)
138
Рис. 44 Calodium hepaticunv. 1 - 3 - задний конец тела самца (7 - с выступающей спикулой в спикулярном влагалище, дорсально, 2 - с выступающей спикулой в спикулярном влагалище, латерально; 3 - спикула втянута, вентрально); 4 - яйцо (р. - папилла; - спикулярное влагалище; sp. - спикула) (по: Baylis, 1931); 5 - схематичное изображение яйца, иллюстрирующее особенности его строения (из: Colle, 1961)
Описание (по разным авторам, в том числе: Гефтер, 1968; Baylis, 1939). Длинные волосовидные черви; разница между утончённой передней и более толстой задней частью тела невелика. На кутикуле ясно видны бациллярные ленты, образованные 18-23 рядами палочковидных элементов; их начало находится на уровне конца мышечной части пищевода, у самцов они доходят до середины расстояния между местом перехода пищевода в кишечник и концом тела, а у самок - до середины расстояния между вульвой и концом хвоста. С дорсальной стороны они шире, чем с вентральной. Длина пищевода у самцов, по (Baylis, 1939), 5.2 - 6.7, самок 6.3 - 9.9 мм. Стихоциты четковидного характера. Самцы длиной 17 - 37 и толщиной 0.07 - 0.1 мм; по (Baylis, 1939), максимальная толщина их тела 0.065 - 0.07 мм. Хвостовой конец самца со слегка субвентральными долями позади отверстия клоаки, у основания каждой доли имеется по папилле. Спикула одна, слабо хитинизи-рованная, на большей части своей длины цилиндрическая, длиной 0.425 - 0.5 мм. Спикулярное влагалище мембранное, выступающее. Самки длиной 53 - 78 и толщиной 0.11 - 0.2 мм; по (Baylis, 1939), максимальная толщина 0.1 - 0.23 мм. По В. А. Гефтер (1968), размер самки 98.74 х 0.19 мм. Вульва выступающая, тоннелеподобная, в 6 - 7 мм от переднего конца тела. Яйца коричневые, бочковидной формы, с двойной оболочкой и пробочками на полюсах; поверхность оболочки с множеством мелких вдавлений, в оптическом сечении она производит впечатление ради
139
альной исчерченности. Размеры яиц, по данным разных авторов: 63 х 32 (Baylis, 1939; средние размеры), 51 - 67.5 х 30 - 35 (Faust, 1949), 49 - 54 х 28 - 32 (Гефтер, 1968), 48 - 66 х 28 - 38 (Muller, 2002), 58 - 63 х 31 - 36, в среднем 60 х 34 цт (Klisiowicz et ah, 2014). В целом, крайние пределы размеров яиц выглядят следующим образом: 40 - 78 х 26 - 45 цт.
Общая схема жизненного цикла С. hepaticum такова (рис. 45).
Рис. 45 Схема жизненного цикла Calodium hepaticum
Самки откладывают незрелые яйца небольшими гроздьями в паренхиму печени дефинитивного хозяина, где они и остаются в течение его жизни, не развиваясь, но оставаясь жизнеспособными. Во внешнюю среду яйца могут попасть только после разрушения тела хозяина, т.е. после его естественной гибели или если тот будет съеден другим животным, с фекалиями которого яйца выделяются во внешнюю среду. Находки незрелых яиц в фекалиях крыс связаны с каннибализмом по->следних (Momma, 1930). Поскольку попавшие в организм таких животных яйца находятся в незрелом состоянии, то те не заражаются ими, а лишь являются их пассивным разносчиком, играя, тем не менее, важную роль в распространении паразита. К числу основных разносчиков яиц нематоды К. Момма (Momma, 1930) относит также насекомых. При благоприятных условиях в попавших в почву яйцах в течение 4-6 недель формируется личинка, способная заражать нового хозяина. Животные, чаще всего грызуны, заглатывают инвазионные яйца с кормом или водой. В желудочно-кишечном тракте дефинитивного хозяина личинка покидает оболочку яйца (рис. 46) и сквозь стенку ки-шечника проникает в портальную систему.
Рис. 46 Calodium hepaticum', личинка, покидающая оболочку яйца (из: Faust, 1949-по: Fullebom, 1924)
Током крови личинки заносятся в печень (как исключение, в лёгкие или почки), где через 3-4 дня у них происходит линька, за ней 140
вторая (5-7 дней) и третья (на 9-16 день). У личинок 4-й стадии уже выражен половой диморфизм (у самцов - на 18-й, самок - 20-й день). Далее они проходят ещё одну линьку и превращаются в личинку 5-й стадии, достигающую половой зрелости на 18-21-е сутки. После завершения яйцекладки самки погибают и рассасываются; самцы погибают несколько раньше. Продолжительность жизни самок составляет 59 дней, самцов — 33 - 40 (Lee, 1964; Wright, 1961).
По мнению Б. В. Ромашова (1998), главной особенностью жизненного цикла С. hepaticum является временная синхронизация основных этапов развития паразита с особенностями биологии хозяев. Эволюционная адаптация вида шла по пути приспособления к хозяевам с высоким репродуктивным потенциалом и относительно коротким онтогенезом, к числу которых относятся, прежде всего, грызуны.
Среди хозяев С. hepaticum - свыше 90 видов грызунов (Fuehrer, 2014а), а также более 180 видов плотоядных (псовые, кошачьи), всеядных, насекомоядных, приматов, включая человека (Fuehrer, 2014b). В центральном Тайване нематоду обнаружили почти у половины (49.5 %) исследованных грызунов и землероек (Tung et al., 2009), на двух островах Азорского архипелага - соответственно у 4.1 и 19.6 % особей домашней мыши, отловленных в жилых домах (Resendes et al., 2009). На севере Новосибирской области в подтаёжных мелколиственных лесах Северной Барабы нематода (описана как Hepaticola hepatica) отмечена у нескольких видов полёвок, заражённость которых колебалась от 0.2 до 10.4 % (Чечулин и др., 2011). В Бразилии С. hepaticum зарегистрировали у кугуара (Quadros et al., 2009), в Англии - у дикого кролика (Morgan, 1931). В Кроноцком заповеднике (Камчатка), Юго-Западной Туве и в Италии яйца нематоды выявлены в фекалиях лисицы обыкновенной (соответственно: Давыдова, Шемяков, 2015; Есаулова и др., 2015; Macchioni et al., 2013). Судя по опубликованным данным, к заражению С. hepaticum восприимчивы также койот, скунс, собаки, кошки, свиньи, лошади, обезьяны. Кстати, у кошек паразит встречается очень редко, известно всего два подобных случая: в Словакии и Бразилии (Bowman et al., 2002).
Наиболее высокая встречаемость С. hepaticum наблюдается среди крыс -серой, александрийской, чёрной, хлопковой, жёлтогрудой, рисовой, малой рисовой, или полевой. К примеру, в Китае в г. Куньмин серая крыса заражена им на 66.7 %, жёлтогрудая — на 65.1 % (Zhou et al., 1998), а в г. Дали - они же на 77 и 77.5 % соответственно (Shen et al., 2003). В Балтиморе (США) взрослые особи серой крысы оказались заражены на 85.6 %, молодые - на 21.5 % (Luttermoser, 1936). В городской зоне Рио-де-Жанейро (Бразилия) паразит выявлен в среднем у 45 % обследованных особей серой крысы (Simoes et al., 2014). Подобных примеров, иллюстрирующих ту главенствующую роль, которую играют крысы в паразито-хозяинной системе С. hepaticum, в соответствующей литературе можно найти множество.
В дефинитивном хозяине С. hepaticum поселяется в его печени. К. Момма (Momma, 1930) пишет, что ни в одной из 29 вскрытых им крыс, чья печень была поражена нематодами, в кишечнике черви не встречались. Этот же автор цитирует работу одного из японских исследователей (Suda), показавшего в экспериментальных условиях, что отдельные яйца всё же могут заноситься из печени в жёлчные протоки и жёлчный пузырь, а уже оттуда попадать в кишечник хозяина.
Особенности миграции личинок С. hepaticum в теле хозяина, онтогенез и продолжительности жизни нематод, а также вызываемые ими патологические из
141
менения в организме животных изучены в экспериментально заражённых мышах, белых крысах и кроликах (Lee, 1964).
В печени животных яйца нематоды обнаруживаются в виде желтоватобеловатой массы. В паренхиме печени они окружаются макрофагами, многоядерными гигантскими клетками, плотным инфильтратом лейкоцитов, моноцитов, нейтрофилов и, особенно, эозинофилов, мелкими очагами некроза. При этом клетки печени атрофируются и замещаются элементами соединительной ткани; в итоге у животных развивается острый паренхиматозный гепатит (Gomes et al., 2006; Lee, 1964; Oliveira et al., 2004; Quadros et al., 2009). У слабо заражённых особей печень атрофируется только частично, и после гибели червей начинает восстанавливаться, однако локализованный цирроз всё же остаётся. При высокой заражённости - в печени одного грызуна как-то насчитали 938 тыс. яиц (Klenzak et al., 2005) - вполне возможен летальный исход. К слову, в Балтиморском зоопарке (США) с 1997 по 2001 гг. от заболевания, вызванного С. hepaticum, погибло 5 особей чернохвостой луговой собачки (Landolfi et al., 2003).
Практически все специалисты считают С. hepaticum редким паразитом человека. И хотя сообщения об обнаружении яиц этой нематоды в фекалиях людей довольно регулярно появляются в печати, но подобные случаи представляют собой пример так называемого «ложного паразитизма» (spurious infection) и явно связаны с поеданием заражённой печени животных. Попавшие вместе с пищей в организм человека яйца нематоды не являются инвазионными, поскольку их созревание, как известно, происходит во внешней среде. При этом какие-либо симптомы, свидетельствующие о наличии яиц нематоды в кишечном тракте человека, отсутствуют, а сам он даже не подозревает о той роли, которую играет в жизненном цикле гельминта. В данном случае Homo sapiens - пассивный разносчик яиц нематоды, косвенно способствующий расселению паразита во времени и пространстве.
Ещё в 1939 г. А. Фостер и К. Джонсон (Foster, Johnson, 1939) утверждали, что находки яиц «капиллярий» в фекалиях панамцев связаны с употреблением теми в пищу печени пекари и местных обезьян, поражённых данным паразитом. Об этом потом писал и Э. Фауст (Faust, 1949), ссылаясь на свои исследования в Панаме. Подобным же образом, но только на этот раз через печень тапира Tapirus terrestris, попали к одной из жительниц долины Рио Негро обнаруженные в её фекалиях яйца С. hepaticum (Carvalho-Costa et al., 2009). В Бразильской Амазонии случаи ложного паразитизма С. hepaticum выявлены в 7.5 % обследованных семей, причём в каждой отдельной семье, где было отмечено заражение, яйца нематод обнаруживались у 50 - 83.3 % домочадцев (Goncalves et al., 2012). Авторы цитируемой статьи подчёркивают, что у лиц, употребляющих в пищу печень диких животных, вероятность получить вместе с едой яйца нематоды возрастает десятикратно. В качестве доказательства они приводят результат обследования печени пекари, которая оказалась инвазирована этим паразитом (пекари, кстати, был благополучно съеден). В тех краях среди местного населения очень популярно блюдо farofa, которое готовят из муки маниоки, обжаренной в масле и смешанной с потрохами грызунов - агути, пекари, пака и других животных. В целом в Бразилии в регионе бассейна Амазонки зафиксировано 94 из 135 случаев ложного паразитизма С. hepaticum, зарегистрированных в мире (Klisiowicz et al., 2014). К этим 94-м авторы добавили ещё несколько, выявленных при обследовании жителей небольшого посёлка на юге Бразилии.
142
К числу других стран, где известны подобные случаи, относятся Панама, Французская Гвиана, Перу, Тайвань, Россия, США, Зимбабве (Скрябин и др., 1929; Cabada et al., 2013; Fuehrer et al., 2011).
В отличие от вышеописанного явления ложного паразитизма, когда к человеку попадают незрелые яйца нематоды, заражение инвазионными яйцами приводит к серьёзным негативным последствиям. До 1956 г. было известно всего четыре официально зарегистрированных случая поражения людей С. hepaticum, каждый из которых оказался фатальным для них. Самый первый из них касался британского солдата, в течение трёх лет служившего в Индии (Dive et al., 1924). При аутопсии в его печени обнаружились взрослые черви и яйца «капиллярий», последние локализовались по периферии выраженного в печени абсцесса. Второй и третий случаи зарегистрированы в США в Новом Орлеане (Faust, 1949) и Мэриленде (Otto et al., 1954), четвёртый - в Турции, где от подобного заболевания скончался 60-летний мужчина (Turhan et al., 1954).
В 1956 г. описан фатальный случай заражения С. hepaticum 15-месячной девочки на Гавайях (Ewing, Tilden, 1956). Диагноз поставили ещё при жизни ребёнка: при биопсии печени в ней обнаружилось множество нематод и их яйца (рис. 47). Выяснилось, что малышка могла заразиться с землёй, которую ела.
Рис. 47 Участок печени человека, на котором видны яйца Calodium hepaticum и поперечный срез через тело червя (из: Ewing, Tilden, 1956)
В 1957 г. сообщается о поражении печени у человека в Южной Африке (Cochrane et al., 1957), в 1962-м - в Мексике (Romero Garcia et al., 1962), в 1970-м -в Италии (Cislaghi, Radice, 1970), в 1972-м - в Чехословакии (Slais, Sterba, 1972), в 1981-м - в Бразилии (Pereira, Franca, 1981). В 1983 г. опубликована статья о заболевании 27-летней женщины в Нигерии (Attah et al., 1983), в 1993-м - 14-месячной девочки в Корее (Choe et al., 1993), в 1995-м - 32-летней женщины на Окинаве (Япония) (Kohatsu et al., 1995). В 1996 г. описан случай обнаружения в печени 6-летней девочки в Индии заметных гранулёматозных повреждений, окружающих яйца С. hepaticum (Govil, Desai, 1996). При этом авторы цитируемой статьи подчёркивают, что при поверхностном обследовании эти яйца можно принять за таковые опасной для человека трематоды - Schistosoma mansoni.
Заражение людей С. hepaticum продолжают регистрировать и в 21-м столетии. В 2005 г. описано заболевание 54-летнего мужчины в США (Klenzak et al., 2005), в 2007 г. - 14-месячного ребёнка в Индии (Nabi et al., 2007), и в том же году заболевание впервые выявлено в Таиланде (Tesana et al., 2007). В 2010 г. сообщается об очередном случае «истинного паразитизма» С. hepaticum у человека в Китае (Li et al., 2010). Подобный перечень можно было бы продолжить и далее, однако если учесть, что только к 2011 г. в мире было опубликовано около 90 сообщений о
143
заражении людей С. hepaticum, то столь объёмного материала с цитированием соответствующих источников хватило бы не на одну страницу.
Небольшая ремарка относительно давности заражения людей капилляри-идами. В 2014 г. появилась статья, авторы которой (Mowlavi et al., 2014), встретив в Амьене (север Франции) в захоронении подростка III - IV веков два овальной формы обызвествлённых объекта, похожих на цисты, с помощью петрографического метода тонких срезов обнаружили в стенке этих цист яйца нематод, которые предположительно отнесли к «Capillaria hepatica».
Картина проявления симптомов заболевания во многом зависит от интенсивности заражения человека и состояния его иммунной системы. Как правило, симптомы проявляются циклическими, но постоянными болями в животе в области печени, увеличением и болезненностью печени и селезёнки, снижением аппетита, лихорадкой и ознобом, диареей, исхуданием. Развиваются симптомы гепатита (воспаление печени), асцита (избыток жидкости в брюшной полости), гепатолитиа-за (камни в жёлчном пузыре и жёлчных протоках). Нематоды, постоянно передвигающиеся в междольковой соединительной ткани печени, разрушают всё новые и новые её участки, тем самым приводя к потере функции этого жизненно важного органа. Гибель взрослых червей в ткани печени и их разложение усиливают иммунный ответ хозяина, что приводит к хроническому воспалению и инкапсуляции мёртвых нематод коллагеновыми волокнами. В итоге аномальный рост фиброзной соединительной ткани, замещающей паренхиматозную ткань печени, может привести к циррозу - тяжёлому смертельному заболеванию печени. При этом яйца червей оказываются заключёнными в гранулёматозную ткань, которая замещает большие участки паренхимы печени, вызывая гепатомегалию. При гистологическом исследовании печени больных, скончавшихся от заражения С. hepaticum, в ней обнаруживались многочисленные мелкие гранулёмы, содержащие взрослых нематод, их фрагменты и яйца. Вокруг гранулём выражен реактивный воспалительный процесс с вовлечением эозинофилов, лимфоцитов, плазматических и гигантских клеток, макрофагов. Гранулёмы чаще всего располагаются около портальной системы или центральной вены, но не в жёлчных протоках.
При лабораторных исследованиях у больных выявляются эозинофилия (25 -87 %), лейкоцитоз (до 14 000 и даже 24900 в 1 мл), анемия, гипоальбуминемия (патологическое состояние, характеризующееся снижением уровня альбумина в сыворотке крови ниже 35 г * л1), гиперглобулинемия (увеличение глобулинов в крови) (Гефтер, 1968; Colle, 1961; Kohatsu et al., 1995; Nabi et al., 2007).
Прогноз зависит от продолжительности и тяжести протекающего заболевания и может быть очень серьёзным, особенно при наличии таких осложнений, как абсцессы, некроз, цирроз печени.
Диагностировать болезнь на основании только клинических признаков трудно, тем более что яйца нематод в фекалиях, моче или жёлчи больных не обнаруживаются. Большую помощь в этом вопросе оказывает биопсия печени, позволяющая выявить в ней, прежде всего, характерные «законсервированные» яйца гельминта (Sawamura et al., 1999). Среди серологических тестов предлагается также использовать метод непрямой иммунофлюоресценции (Juncker-Voss et al., 2000).
Относительно эффективности препаратов, назначаемых для лечения данного заболевания, мнения медиков несколько расходятся. В упомянутом случае бо
144
лезни 14-месячной девочки в Корее положительный результат получен в результате применения первоначально альбендазола (10 - 20 мг кг'1 в сутки в течение 20 дней), а затем тиабендазола (25 мг кг'1 в сутки в течение 27 дней) (Choe et al., 1993). Тем не менее, в течение последующих двух лет у ребёнка сохранялась гепатомегалия.
Для лечения троих детишек в Бразилии одному из них - двухлетнему мальчику - прописали тиабендазол (500 мг в день в течение 3 суток), другому - 18-месячной девочке - альбендазол (400 мг в день в течение 21 дня), третьему - 35-месячной девочке - альбендазол (400 мг в день в течение 100 дней) в комбинации с кортикоидным препаратом преднизоном (1 мг кг'1 в день в течение 1 месяца с постепенным уменьшением дозы) (Sawamura et al., 1999).
В Индии успех в лечении 14-месячного ребёнка был достигнут в результате двухнедельного приёма альбендазола (Nabi et al., 2007). По мнению цитируемых авторов, препаратом выбора является тиабендазол, альтернативным препаратом -альбендазол, возможно также применение ивермектина.
Для уменьшения воспаления печени рекомендуется назначать стероиды (Pannenbecker et al., 1990).
К сожалению, зачастую единственным радикальным средством избавления от паразитов является хирургическое удаление поражённых участков печени пациентов (Klenzak et al., 2005; Kohatsu et al., 1995).
Заражение людей происходит при проглатывании инвазионных яиц с загрязнёнными продуктами питания, водой, почвой. Неоднократно при анамнезе выяснялось, что пострадавшие имели контакты с землёй и даже ели её. Именно с поеданием земли связан тот факт, что яйца нематод чаще всего попадают к маленьким детям, в возрасте от 1 до 5 - 7 лет (Berger et al., 1990; Bustamente-Sarabia et al., 1996; Choe et al., 1993; Colle, 1961; Ewing, Tilden, 1956; Nabi et al., 2007; Otto et al., 1954; Sawamura et al., 1999; Terrier et al., 1999).
Во внешней среде яйца нематоды могут рассеиваться хищными и всеядными животными, птицами, жуками-трупоедами, мухами, а также человеком, проходя через пищеварительный тракт которых они остаются без изменения. В. А. Гефтер (1968), проанализировав опубликованные данные, отмечает устойчивость яиц С. hepaticum к воздействию неблагоприятных факторов среды, что позволяет им сохранять жизнеспособность в почве в течение полугода и более. В эксперименте в лабораторных условиях под 10-сантиметровым слоем воды они выживали в течение года, а при высушивании погибали только через 25 суток.
Учитывая сказанное выше, совершенно очевидно, что для предупреждения заражения, прежде всего, следует строго соблюдать личную гигиену и учить детей этому непреложному правилу, тщательно промывать в проточной воде зелень и овощи, собранные на огороде или же купленные на рынке, не пить воду из неизвестных источников и, безусловно, не есть землю. Немаловажную роль в профилактике заболевания играет просветительская работа среди населения.
Из приведённой выше информации видно, что С. hepaticum относится к числу достаточно редких паразитов человека. Тем не менее, география регистрации случаев вызываемого им заболевания весьма обширна: Канада, США, Мексика, Бразилия, Германия, Англия, Франция, Италия, Чехия, Турция, Индия, Таиланд, Китай, Япония, Гавайи, Нигерия, Южная Африка. В целом, к 2011 г. в мире опубликовано 72 сообщения о поражении печени, 13 серологически подтверждённых
145
случаях и 78 случаях ложного паразитизма (Fuehrer et al., 2011). По другим данным, число случаев ложного паразитизма достигает 135 (Klisiowicz et al., 2014).
Цитируемая литература
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. проф. П. Г. Сергиев).
Давыдова О. Е, Шемяков Д. Н. Паразитофауна лисицы обыкновенной Кроноцкого заповедника / Новые знания о паразитах: Мат. V Межрегион, конф. «Паразитологические исследования в Сибири и на Дальнем Востоке», 14-16 сентября 2015. - Новосибирск, 2015. - С. 33 - 34.
Есаулова Н. В., Поярков А. Д, Карнаухов А. С., Куксин А. Н и др. К вопросу о паразитофауне ирбиса {Panthera uncia) и других хищных млекопитающих в экосистемах Алтае-Хангае-Саянской горной страны / Новые знания о паразитах: Мат. V Межрегион, конф. «Паразитологические исследования в Сибири и на Дальнем Востоке», 14 - 16 сентября 2015. - Новосибирск, 2015. - С. 43 - 44.
Ромашов Б. В. Нематоды семейства Capillariidae млекопитающих: Фауна, морфология, систематика, биология, экология, филогения: Автореф. дисс... докт. биол. наук. - 03.00.19 - паразитология, гельминтология. - Воронеж, 1998.
Скрябин К И., Подъяпольская В. П, Шихобалова Н. П. Новые случаи гепатиколеза человека И Русск. журн. тропич. мед. и вет. паразитол. - 1929. - 7, 7. - С. 449 - 450.
Чечулин А. И., Карпенко С. В., Панов В. В. Экологические особенности заражения нематодой Hepaticola hepatica (Bancroft, 1893) Hall, 1916 (Nematoda, Capillariidae) грызунов юга Западной Сибири И Сибирск. экол. журн. - 2011. - № 4. - С. 563 - 569.
Attah Е. В., Nagarajan S, Obineche Е. N., Gera S. С. Hepatic capillariasis П Am. J. Clin. Pathol. - 1983. -79, l.-P. 127-130.
Bancroft T. L. On the whipworm of the rat’s liver // J. Proc. R. Soc. New S. Wales. - 1893. -27. - P. 89 - 90.
Baylis H. A. On the structure and relationships of the nematode Capillaria {Hepaticola) hepatica (Bancroft) // Parasitol. - 1931.7 23. - P. 533 - 543.
Baylis H. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Berger T., Degremont A., Gebbers J, О., Тот O. Hepatic capillariasis in a 1-year-old child I I Eur. J. Pediatr. -1990.-149, 5.-P. 333-336.
Bowman D. D., Hendrix C. M.t Lindsay D. S, Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-467 pp.
Bustamente-Sarabia J., Suswillo K, Contreras-Moreno E. Capillaria hepatica in a 19-month old boy, third case in Mexico 11 Bol. Med. Hosp. Infant. Mex. - 1996. - 53. - P. 395 - 400.
Cabada M. M., Lopez M., White A. C. Jr. Capillaria hepatica pseudoinfection // Am. J. Trop. Med-. Hyg. -2013.-89,4.-P. 609. <
Carvalho-Costa F. A., Silva A. G., de Souza A. H, Moreira C. J., de Souza D. L. et al. Pseudoparasitism by Calodium hepaticum (syn. Capillaria hepatica} Hepaticola hepatica) in the Negro River, Brazilian Amazon //Trans. R. Soc. Trop. Med. Hyg. -2009. -103, 10. -P. 1071 - 1073. doi: 10.1016/j.trstmh.2009.04.015.
Choe G., Lee Н-S., Seo J.-K., Chai J-Y. et al. Hepatic capillariasis: first case report in the Republic of Korea // Am. J. Trop. Med. Hyg. - 1993. - 48, 5. - P. 610 - 625.
Cislaghi F, Radice C. Infection by Capillaria hepatica. First case report in Italy // Helv. Paediatr. Acta. -1970.-25, 6.-P. 647-654.
Cochrane J. C, Sagorin L., Wilcocks M. G. Capillaria hepatica infection in man; a syndrome of extreme eosinophilia, hepatomegaly and hyperglobulinaemia// S. Aft. Med. J. - 1957. -31, 30. -P. 751 -755.
Colle S. Parasitism by Capillaria hepatica I I Pediatrics. - 1961. - 27, 4. - P. 648 - 655.
Dive G. H., LaFrenais H. M., MacArthur W. P. A case of deposition of the eggs of Hepaticola hepatica in the human liver. With a note on the identity of the eggs // J. Roy. Army Med. Corps. - 1924. - 43. - P. 1 - 4.
Ewing G. N., Tilden T. L. Capillaria hepatica'. A report of fourth case of true human infestation I I J. Pediatrics. - 1956. -48, 3. -P. 341 -348.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Foster A. O., Johnson С. M. An explanation for the occurrence of Capillaria hepatica ova in human faeces suggested by the finding of three new hosts used as food I I Trans. Roy. Soc. Trop. Med. Hyg. - 1939. - 32, 5.-P. 639 - 644.
146
Fuehrer H.-P. An overview of the host spectrum and distribution of Calodium hepaticum (syn. Capillaria hepatica)'. part 1 - Muroidea) // Parasitol. Res. - 2014a. - 113, 2. - P. 619 - 640. doi: 10.1007/s00436-013-3691-x.
Fuehrer H.-P. An overview of the host spectrum and distribution of Calodium hepaticum (syn. Capillaria hepatica)'. part 2 - Mammalia (excluding Muroidea) // Parasitol. Res. - 2014b. - 113, 2. - P. 641 - 651. . doi: 10.1007/s00436-013-3692-9.
Fuehrer H.-Р., Igel P., Auer H. Capillaria hepatica in man - an overview of hepatic capillariasis and spurious infections // Parasitol. Res. -2011.-109, 4. - P. 969 - 979.
Fiilleborn P. Uber den Infektionsweg bei Hepaticola hepatica //Arch. f. Schijfs- u. Tropenhyg. - 1924. -28. -P. 48-61.
Gomes A. T., Cunha L M., Bastos C. G., Medrado B. F. et al. Capillaria hepatica in rats: focal parasitic hepatic lesions and septal fibrosis run independent courses I I Mem. Inst. Oswaldo Cruz. - 2006. - 101. - P. 895-898.
Goncalves A. Q„ Ascaso C, Santos I., Serra P. T., Juliao G. R, Orlandi P. P. Calodium hepaticum'. household clustering transmission and the finding of a source of human spurious infection in a community of the Amazon region // PLoS Negl. Trop. Dis. -2012. -6, 12. -P. 1943. doi: 10.1371/joumal.pntd.0001943.
Govil H, Desai M. Capillaria hepatica parasitism // Indian J. Pediatr. - 1996. - 63, 5. - P. 698 - 700.
Juncker-Voss M., Prost H, Lussy H, Enzenberg U., Auer H, Novotny N. Serological detection of Capillaria hepatica by indirect immunofluorescence assay // J. Clin. Microbiol. -2000. -38. -P. 431 -433.
Klenzak J., Mattia A., Valenti A., Goldberg J. Hepatic capillariasis in Maine presenting as a hepatic mass // Am. J. Trop. Med. Hyg. - 2005. - 72, 5. - P. 651 - 653.
Klisiowicz D. R, Reifur L., Shimada M. K, Haidamak J., Cognialli R. C. R., Ferreira T. High occurrence of Calodium hepaticum (syn. Capillaria hepatica) spurious infection in a village in the Atlantic Forest of southern Brazil // Mem. Inst. Oswaldo Cruz. - 2014. - 109, 3. - P. 371 - 373. doi: 10.1590/0074-0276140315
Kohatsu H, Zaha O., Shimada K, Chibana T., Yara I. et al. A space-occupying lesion in the liver due to Capillaria infection // Am. J. Trop. Med. Hyg. - 1995. - 52, 5. - P. 414 - 418.
Landolfi J. A., Karim В. O., Poynton S. L., Mankowski J. L. Hepatic Calodium hepaticum (Nematoda) infection in a zoo colony of black-tailed prairie dogs (Cynomys ludovicianus) // J. Zoo Wildl. Med. - 2003. -34, 4.-P. 371 -374.
Lee С. IV. [The experimental studies on Capillaria hepatica] I I Kisaengchunghak Chapchi. - 1964. -2, 1. -P. 63-80. (Article in Korean).
Li C.-D., Yang H.-L., Wang Y. Capillaria hepatica in China I I World J. Gastroenterol. - 2010. - 16, 6. - P. 698-702.
Luttermoser G. W. A helminthological survey of Baltimore house rats (Rattus norvegicus) // Am. J. Hyg. -1936.-24.-P. 350.
Macchioni F., Chelucci L., Guardone L., Mignone W. et al. Calodium hepaticum (Nematoda: Capillaridae) in a red fox (Vulpes vulpes) in Italy with scanning electron microscopy of the eggs I I Folia Parasitol. (Praha). -2013. -60, 2. -P. 102 - 104.
Momma K. Notes on modes of rat infestation with Hepaticola hepatica 11 Am, Trop. Med. Parasitol. - 1930. -24.-P. 109-113.
Moravec F. Proposal of a new systematic arrangement of nematodes of the family Capillariidae // Folia Parasitol. - 1982. - 29, 2. - P. 119 - 132.
Morgan D. O. On the occurrence of Hepaticola hepatica as a natural infection of the wild rabbit in England I I J. Helminthol. - 1931. - 9, 1. - P. 39 - 40.
Mowlavi G., Kacki S, Dupouy-Camet J., Mobedi I. et al. Probable hepatic capillariosis and hydatidosis in an adolescent from the late Roman period buried in Amiens (France) - Parasite. - 2014. -21: 9. doi: 10.1051 /parasite/2014010.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Nabi F., Palaha H. K, Sekhsaria D., Chiatale A. Capillaria hepatica infestation // Indian Pediatrics. - 2007. -44, 10. -P. 781 -782.
Oliveira L., de Souza M. M., Andrade Z. A. Capillaria hepatica-mduczd. hepatic fibrosis in rats: paradoxical effect of repeated infections // Rev. Soc. Bras. Med. Trop. - 2004. - 37. - P. 123 - 127.
Otto G. F., Berthrong M., Appleby R. E, Rawlins J. C, Wilbur O. Eosinophilia and hepatomegaly due to Capillaria hepatica infection // Bull. Johns HopkinsHosp. - 1954. - 94, 6. - P. 319 - 336.
147
Pannenbecker J., Miller T. C, Miller J. Capillaria hepatica I I Monatsschr Kinderheillod. - 1990. - 138. - P. 767-777.
Pereira V. G., Franga L. C. [Human Capillaria hepatica infection. Report of a case treated successfully] H Rev. Hosp. Clin. Fac. Med. S&o Paulo. - 1981. - 36. - P. 31 - 34.
Quadras R. M., Pilati C, Marques S. M. T, Mazzolli M., Benedet R C. Capillaria hepatica in Puma concol-or: First report in Brazil 11 J. Zoo & Wildlife Med. - 2009. - 40, 3. - P. 586 - 587.
Resendes A. R, Amaral A. F., Rodrigues A., Almeria S. Prevalence of Calodium hepaticum (syn. Capillaria hepatica) in house mice (Mus musculus) in the Azores archipelago // Vet. Parasitol. - 2009. - 160, 3-4. - P. 340-343. doi: 10.1016/j.vetpar.2008.11.001.
Romero Garcia F., Mendiola J., Biaji F. [Elevated eosinophilia with visceral manifestations. IV. 1st case of Capillaria hepatica infection in Mexico] I I Bol. Med. Hosp. Infant. Mex. - 1962. - 19. -P. 473 -479. (Article in Spanish).
Sawamura R, Fernandes M._L, Peres L._C, Galvao L._C. et al. Hepatic capillariasis in children: report of 3 cases in Brazil // Am. J. Trop. Med. Hyg. - 1999. - 61, 4. -P. 642 - 647.
Shen L. J., Luo Z. Y., Li W., Li Z. H, Gao C. et al. Investigation on rats infected with Capillaria hepatica in Dali // Zhongguo Jishengchoubing Fangzhi Zazhi. - 2003. -16. - P. 296 - 298.
Simoes R CL, Luque J. L., Faro M. J, Motta E., Maldonado A. Prevalence of Calodium hepaticum (syn. Capillaria hepatica) in Rattus norvegicus in the urban area of Rio de Janeiro, Brazil // Rev. Inst. Med. Trop. S3o Paulo. - 2014. - 56, 5. - P. 455 - 457.
Slais J., Sterba J. Solitary liver granulomas in man caused by Capillaria hepatica (Bancroft, 1893) in Czechoslovakia // Folia Parasitol (Praha). - 1972. - 19, 4. - P. 373 - 374.
Terrier P., Hack L, Hatz C, Theintz G., Roulet M. Hepatic capillariasis in a 2-yr-old // J. Pediatr. Gastroenterol. Nut. - 1999. - 28, 3. - P. 338 - 340.
Tesana S., Puapairoj A., Saeseaw O. Granulomatous, hepatolithiasis and hepatomegaly caused by Capillaria hepatica infection: first case report of Thailand // Southeast Asian J. Trop. Med. Public Health. - 2007. -38.-P. 636-640.
Tung К. C, Hsiao F. C, Yang С. H, Chou С. C, Lee Ж M. et al. Surveillance of endoparasitic infections and the first report of Physaloptera sp. and Sarcocystis spp. in farm rodents and shrews in central Taiwan I I J. Vet. Med. Sci. - 2009. - 71. - P. 43 - 47.
Turhan B., Unat E. K., Yenermen M., Simmer C. Insan karacigerinde: Capillaria hepatica (Bancroft, 1893) Travassos, 1915 //Mikrobiol. Dergisi. - 1954.-7. -P. 149- 159.
Wright K. A. Observation on the life cycle of Capillaria hepatica (Bancroft, 1893) with a description of the adult// Can. J. Zool. - 1961. -39. -P. 167 - 182.
Zhou X M., Zhang G. E, Li C, Li F H. et al. Investigation on rats infected with Capillaria hepatica in Kunming // Zhongguo Renshou Gonghuanbing Zazhi. - 1998. - 14. - P. 33.
Род Eucoleus Dujardii^ 1845
Описание (по: Скрябин и др., 1957; Moravec, 1982). С характерными чертами семейства. Передняя (пищеводная) часть тела значительно короче задней. Хвостовые латеральные крылья отсутствуют. Задний конец тела самца зауженный, с рудиментарной псевдобурсой, сформированной двумя маленькими, округлыми, направленными назад боковыми долями, соединёнными между собой редуцированной дорсальной кутикулярной мембраной. Спикула узкая, умеренно склеротизированная, иногда почти незаметная. Спикулярное влагалище длинное, способное выворачиваться, плотно покрыто кутикулярными шипиками. Вульва не выступающая. Яйца с толстой оболочкой. Паразиты дыхательной системы и слизистого слоя ротовой полости, пищевода и желудка птиц и млекопитающих. Типовой вид - Eucoleus аег-ophilus (Creplin, 1839) Dujardin, 1845.
Упомянутый типовой вид - паразит многочисленных представителей плотоядных и всеядных животных - зарегистрирован и у человека.
Eucoleus aerophilus [-Trichosoma aerophila Creplin, 1839; = Capillaria aer-ophila (Creplin, 1939) Travassos, 1915; =Thominx aerophilum (Creplin, 1939) Skrjabin 148
et Schikhobalowa, 1954] (рис. 48, 49). Паразит впервые описан на материале из трахеи волка под названием Trichosoma aerophila (Creplin, 1839). Видовое название гельминта связано с его локализацией в лёгких хозяина: aerophilus - любящий воз
дух.
В 1845 г. вид Trichosoma aerophila был сделан типовым видом рода Eucoleus (Dujardin, 1845). Затем род Eucoleus признали синонимом рода Capillaria (Travassos, 1915), и вид долгие годы именовали как Capillaria aerophila. В монографии К. И. Скрябина с соавт. (1957) вид включён в состав рода Thominx как Thominx aerophilus, и под этим названием он описывается в работах многих отечественных авторов. В 1981 г. Ф. Моравец (Moravec, 1981) перевёл Thominx в синонимы Capillaria, а на следующий год он же (Moravec, 1982) восстановил род Eucoleus с типовым видом Е. aerophilus. Впрочем, не все исследователи согласны с подобной точкой зрения и продолжают описывать нематоду в составе рода Capillaria.
Рис. 48 Eucoleus aerophilus: 1 - область вульвы; 2 - хвостовой конец самки; 3 - хвостовой конец самца; 4 - хвостовой конец самца, вентрально; 5 - яйцо в разрезе и с поверхности; 6 - хвостовой конец самца, вентрально и датерально (из: Скрябин и др., 1957, как Thominx aerophilus -по разным авторам)
Рис. 49 Eucoleus aerophilus: 1 - самка; 2 - яйцо (из:
Скрябин и др., 1957, как Thominx aerophilus - по: Скрябин, 1939)
Описание (по разным авторам, в том числе: Гефтер, 1968; Ромашов, 2000; Скрябин и др., 1957; Lalosevic et al., 2013). Нитевидные нематоды светло-серого, иногда розоватого цвета, с более тонким передним концом. Латеральные бацилляр
149
ные ленты хорошо видны, но вентральные наблюдаются редко (Lalosevic et al., 2013). Терминальное ротовое отверстие, лишённое губ и сосочков, ведёт в длинный пищевод. Длина тела самцов (крайние размеры; по разным авторам) 10.4 - 25 при ширине на уровне конца пищевода 0.06 - 0.11 мм. Самки крупнее самцов, их длина достигает 16 - 41.8 при ширине 0.105 - 0.185 мм. Б. В. Ромашов (2000) приводит следующие размеры червей: самцы длиной 16.63 - 30.96 и шириной 0.085 - 0.139, самки соответственно 25.42 - 36.35 и 0.146 - 0.194 мм. Хвостовой конец самца с тремя парами папилл: одной - вентролатеральной и двумя - дорсолатеральными. Длина спикулы 0.88 - 1.36 мм (в среднем 1.14 ± 0.18). Вагина мускулистая. Вульва снаружи окружена кутикулярным валиком. Яйца бледно-серые, толстостенные, лимонообразной формы, с пробочками на обоих полюсах; оболочка покрыта сложным узорчатым рисунком. Размеры яиц 62 - 77 х 33 - 37 (Скрябин и др., 1957), 69 -74 х 39 - 42 (в среднем 72.11 ± 0.99 х 40.65 ± 0.81) (Ромашов, 2000), 59 - 83 х 26 -40 (Bowman et al., 2002), 61 - 95 х 30 - 47 (в среднем 73 х 35) Jim (Lalosevic et al., 2013).
Сведения о жизненном цикле Е. aerophilus неполны и довольно отрывочны, в частности не совсем понятен способ передачи инвазии к окончательным хозяевам (Lalosevic et al., 2013). Тем не менее, известно, что самки откладывают в лёгких дефинитивного хозяина незрелые яйца. Раздражая бронхи, те вызывают кашель, во время которого постепенно продвигаются в ротовую полость. Далее при заглатывании с мокротой яйца попадают в кишечный тракт и, наконец, выносятся во внешнюю среду. Возможно также выделение яиц с мокротой при откашливании. В почве при благоприятной температуре в течение 40 (35 - 45) дней происходит развитие яиц до инвазионного состояния, сохраняющееся у них во внешней среде в течение года. Эти яйца заглатываются различными животными, в организме которых из них выходят личинки. Яйца также могут заглатываться дождевыми червями, участие которых в жизненном цикле нематоды, по мнению ряда авторов, является обязательным. Судя по кругу дефинитивных хозяев паразита, среди которых много хищников (не могут же все они питаться дождевыми червями!), в жизненном цикле нематоды могут участвовать паратенические хозяева. Полагают, что в теле окончательного хозяина личинки совершают лимфогематогенную миграцию. Полное развитие личинки в организме дефинитивного хозяина до половозрелой стадии завершается за 28 - 29 дней (Боровкова, 1947; цит. по: Гефтер, 1968), по другим данным, - за 40. Срок жизни паразита - около одного года.
Е. aerophilus известен на всех континентах, а среди его окончательных хозяев - собаки, в том числе домашние, волки, койот, лисицы, песец, кошки, включая домашних, пума, рысь, леопард дальневосточный, опоссум, енотовидная собака, соболь, куницы, мангуст, барсук, норка, ёж обыкновенный и другие. К примеру, в Центральном Нечерноземье России паразит зарегистрирован у лисицы обыкновенной, волка, енотовидной собаки, бродячих и охотничьих собак (Андреянов и др., 2009), в Воронежском заповеднике и на сопредельной территории - у лисицы, волка, енотовидной собаки, куниц лесной и каменной (Ромашов, 2000), на территории Северо-Западного Кавказа - у лисицы обыкновенной, енотовидной собаки, барсука, куниц лесной и каменной, енота-полоскуна, кота лесного, шакала (Итин, 2014), в Трансильвании (Румыния) - у домашних кошек (Mircean et al., 2010), в Иране - у ежа обыкновенного (Naem et al., 2015).
150
Однако чаще всего и с наиболее высокими показателями Е. aerophilus отмечают у лисиц. В частности, в Нидерландах паразит обнаружен у 46.8 % особей лисицы обыкновенной (Borgsteede, 1984), в Венгрии - у 66 % (Sreter et al., 2003), в Норвегии - 88 % (Davidson et al., 2006), в Дании -74.1 % (Saeed et al., 2014), в регионе Северо-Западного Кавказа - у 8.8 - 30.3 % (Итин, 2014), в Воронежском заповеднике и на прилегающей территории (Россия) - 75 % (Ромашов, 2000). В Сербии обследованные особи лисицы оказались заражены на 84 % при интенсивности инвазии 1-71 экз.; примечательно, что при копроовоскопии яйца нематоды обнаружились только в 38 % проб (LaloSevic et al., 2013).
Взрослые черви поселяются в слизистой оболочке трахеи, бронхов и альвеол, глубоко погружаясь в неё передним концом тела. В большинстве случаев внешние симптомы инвазии выражены довольно умеренно, однако при высокой заражённости у животных наблюдаются тяжёлые поражения дыхательной системы. В таких случаях заболевание проявляется общим расстройством дыхания, булькающими звуками в бронхах, хрипами, чиханием, хроническим сухим продуктивным кашлем, слабостью, ухудшением аппетита, прогрессирующим истощением (Burgess et al., 2008; Christenson, 1938; Di Cesare et al., 2012; Nettles et al., 1975; Traversa et al., 2009). Заболевание нередко осложняется инфекционным процессом в лёгких, вследствие чего у больных животных развивается пневмония со всеми свойственными ей симптомами (Скрябин и др., 1957). Учитывая негативное влияние нематод на здоровье домашних животных, специалисты считают необходимым включать лёгочный эуколеозис (eucoleosis) при дифференциальной диагностике заболеваний органов дыхания у собак и кошек (Traversa et al., 2009).
У человека Е. aerophilus встречается очень редко. В 1936 г. акад. К. И. Скрябин был приглашён в одну из московских клиник для консультации по поводу обнаружения яиц нематод в мокроте одного из больных, страдавших тяжёлым трахеобронхитом. Константин Иванович определил их как яйца Thominx aerophilus и описал эту историю в статье 1939-го года (Скрябин, 1939). К 1952 г. было выявлено 4 подобных случая (заболевание описывали как томинксоз - см.: Скрябин и др., 1957). По состоянию на 2008 г., в мире было зарегистрировано всего 11 случаев поражения людей нематодами данного вида: в России, Украине, Марокко, Иране, Франции, Сербии (см.: Lalosevic et al., 2008).
Несмотря на редкую встречаемость у человека, Е. aerophilus никак нельзя исключать из числа зоонозных видов, поскольку он вызывает тяжёлое заболевание дыхательных путей. Клинические проявления заболевания: кашель, одышка, учащённое дыхание, повышенная температура, острый бронхит, иногда осложнённый бронхопневмонией. В первые дни у больного появляются боль в горле, тяжесть в грудной области, сильный сухой лающий кашель, температура повышается до 38 -39°С. В дальнейшем наблюдается выделение большого количества пенистой слизисто-гнойной мокроты с эозинофилами, изредка с прожилками крови. Приступы мучительного кашля повторяются несколько раз в сутки, чаще по ночам, иногда заканчиваются рвотой. Наблюдается раздражение слизистой трахеи, одышка, цианоз губ и пальцев, резкая слабость, исхудание. В крови отмечается эозинофилия (25 -30 % и выше), ускорение СОЭ до 38 - 45 мм ч’1. Заболевание может осложняться вторичной бактериальной инфекцией.
151
По наблюдениям Н. Е. Семеновой и Т. И. Барабашкиной (Скрябин и др., 1957), после гибели паразита выздоровление наступает крайне медленно, а у больных в течение многих лет продолжаются приступы астматического характера.
Диагностируют лёгочный эуколеозис на основании обнаружения яиц нематоды в мокроте и/или фекалиях. Вместе с тем, отсутствие специфических клинических признаков вполне может быть причиной ошибочной диагностики. В этом отношении примечателен случай, имевший место в Сербии, когда у пациентки с первоначальным клиническим диагнозом бронхиальной карциномы при бронхоскопии было выявлено заражение Е. aerophilus (Lalosevic et al., 2008). В пробах обнаружились хорошо сохранившиеся яйца нематод без эмбриона, оболочки яиц и незрелые яйца с несформированной оболочкой, по своим морфологическим особенностям, соответствующие таковым описываемого вида. Диагноз лёгочного эуколеозиса в данном случае был подтверждён иммунофлюоресцентным тестом IF АТ.
Ещё в 1952 г. Н. Е. Семёнова, чью работу цитируют в своей монографии К. И. Скрябин с соавт. (1957), не исключала возможности того, что заболевание, в силу схожести симптомов его проявления с таковыми других лёгочных заболеваний, может оставаться недиагностированным. В связи с этим, по её мнению, особое внимание следует обратить на больных астмой.
Учитывая исключительную редкость данного заболевания у людей, информация о методах его лечения чрезвычайно скудна. Тем не менее, известно, что в описанном выше случаев с жительницей Сербии её лечение начали с мебендазола (5 мг кг"1 в день в течение 6 дней) и продолжили альбендазолом (15 мг кг1 в день в течение 20 дней) (Lalosevic et aL, 2008).
Заражение людей происходит с водой, зеленью и овощами, контаминированными инвазионными яйцами нематоды, в случае поедания земли, но, прежде всего, с загрязнёнными руками, на которых могли оказаться яйца паразита при работе на садово-огородных участках, при случайном раздавливании земляных червей во время земляных работ, на рыбной ловле.
В качестве профилактических мер, как и в случае с Calodium hepaticum. рекомендуется соблюдать личную гигиену, тщательно промывать в проточной воде зелень и овощи, независимо от того, собраны ли они на огороде или же куплены на рынке, не пить воду из неизвестных источников и, безусловно, не есть землю.
В связи с широким распространением Е. aerophilus не только у диких животных, но и у содержащихся в домашних условиях и на придомовой территории кошек и собак, особое внимание следует обратить на роль этих животных как дис-семинаторов яиц гельминта, имеющего зоонозное значение. Большую помощь в этом вопросе могут оказать работники ветеринарных служб, проводя разъяснительную работу среди любителей домашних животных. Так, при опросе 196 владельцев домашних кошек в Трансильвании (Румыния) 66.3 % из них знали о потенциальной опасности для здоровья человека паразитирующих у кошек гельминтов, в том числе Е. aerophilus. при этом для 65.4 % из них источником подобной информации были ветеринары (Mircean et al., 2010).
Тема паразитозов человека, в том числе и вызываемых капилляриидными нематодами, в последнее время очень активно обсуждается на различных порталах в интернете. К большому сожалению, иногда приходится сталкиваться с информацией, мягко говоря, не соответствующей действительности. Например, 16 мая 2016 г. на «mydoctorhouse.ru» в статье «Симптомы лёгочного капилляриоза» читаю (дословно): «Аскариды вида 152
Capillaria aerophila находят в...» и здесь же далее «... не исключается вариант инфицирования от прикосновения к животному или при поцелуе с человеком-носителем паразитов» (выделено мною - АГ). Подобную «связь» заражения лёгочным эуколеозом «с поцелуями с больным человеком» отметили и на медицинском портале «http://www.medicinform.net/» (16 мая 2016 г.).
Начнём с того, что капиллярииды никогда не относились к аскаридам (см. стр. 76). Столь вольно обращаться с названиями групп организмов, принадлежащих к разным классам беспозвоночных, совершенно недопустимо. Это равнозначно тому, например, как если бы устриц из класса двустворчатых моллюсков отнесли бы к кальмарам из класса головоногих моллюсков только на том основании, что и те, и другие принадлежат к одному типу - моллюскам. Далее. Заразиться «от прикосновения к животному или при поцелуе с человеком-носителем паразитов» (надо же придумать такое!) практически невозможно, поскольку нематоды откладывают в лёгких дефинитивных хозяев незрелые яйца, не содержащие инвазионной личинки, а созревание яиц и формирование в них инвазионной личинки у Е. aerophilus происходит во внешней среде.
Цитируемая литература
Андреянов О. Н, Сафиуллин Р. Т., Горохов В. В., Абалихин Б. Г и др. Заражённость хищников семейства псовых в различных эколого-географических зонах Центрального Нечерноземья России И Теория и практика борьбы с паразитарными болезнями (посвящается 80-летию со дня рождения Андрея Стефановича Бессонова). - М., 2009. - Вып. 10. - С. 17-20.
Боровкова А. М. Цикл развития томинксоза серебристо-чёрных лисиц, эпизоотология и профилактика: Дисс. кавд. наук. -М., 1947. (цит. по: Гефтер, 1968).
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. проф. П. Г. Сергиев).
Итин Г. С. Особенности гельминтофауны диких хищных млекопитающих в ландшафтно-географических зонах Северо-Западного Кавказа: Дисс...канд. биол. наук: 03.02.08 - экология. - Краснодар, 2014.-171 с.
Ромашов Б. В. Три вида капилляриид (Nematoda: Capillariidae) от хищных млекопитающих (Carnivora) и обсуждение системы и эволюции нематод семейства Capillariidae. 1. Переописание Eucoleus aerophilus и Е. boehmi И Зоол. журн. - 2000. - 79, 12. - С. 1379 - 1391.
Семёнова Н Е. Новый случай томинксоза И Сов. Медиц. - 1952. - № 1 (цит. по: Скрябин и др., 1957). Скрябин К. И. Томинксоз легких - новый гельминтоз человека // Мед. паразит, и паразит, бол. - 1939.
-8, 4.-С. 167-170.
Скрябин К. И., Шихобалова Н П., Орлов И. В. Трихоцефаллиды и капиллярииды животных и человека и вызываемые ими заболевания / Основы нематодологии. Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1957. - 6. - С. 387 - 404.
Bowman D.D., Hendrix С. М., Lindsay D. Б, Barr Б. С. Feline Clinical Parasitology. - Iowa State Press, 2002.-467 pp.
Burgess H, Ruotsalo K., Peregrine A. Б, Hanselman B., Abrams-Ogg A. Eucoleus aerophilus respiratory infection in a dog with Addison’s disease // Can. Vet. J. - 2008. - 49. - P. 389 - 392.
Christenson R. O. Life history and epidemiological studies on the fox lungworm, Capillaria aerophila (Creplin, 1839) 11 Livro Jub. L. Travassos, 1938. -P. 119-136.
Creplin F. С. H Eingeweidewiirmer, finnenwtirmer, thierwtirmer //Allg. Encycl. Wissensch. u. Kunste. -Ersch & Gruber, Leipzig. -1839. - Istsect. - 32. - P. 277-302.
Davidson R. K., GJerde B., Vikoren T, Lillehaug A., Handeland K. Prevalence of Trichinella larvae and extra-intestinal nematodes in Norwegian red foxes (Vulpes vulpes) 11 Vet. Parasitol. - 2006. - 136, 3 - 4. - P. 307-316.doi:10.1016/j.vetpar.2005.11.015.
Di Cesare A., Castagna G., Meloni S., Otranto D., Traversa D. Mixed trichurid infestation in a dog from Italy // Parasites & Vectors. - 2012. - 5. - P. 128.
Dorgsteede F. H M. Helminth parasites of wild foxes (Vulpes vulpes L.) in the Netherlands H Z. f. Parasi-tenk. - 1984. - 70. - P. 281 - 285.
Dujardin F. Histoire naturelle des helminthes. - Lib. Encycl. Roret.: Paris, 1845. - 655 pp.
153
Lalosevic D., Lalosevic V, Klem I., Stanojev-Jovanovic D., Pozio E. Pulmonary capillariasis miming bronchial carcinoma //Am. J. Trop. Med. Hyg. - 2008. - 78, l.-P. 14-16. http://www.ajtmh.org/content/ 78/1/14.full.pdf.
Lalosevic V, Lalosevic D., Capo L, Simin V., Galfi A., Traversa D. High infection rate of zoonotic Eucoleus aerophilus in foxes from Serbia// Parasite. -2013.-20, 3. http://dx.doi.org/10/1051/parasite/2012003.
Mircean V., Titilincu A., Vasile C. Prevalence of endoparasites in household cat (Felis catus) populations from Transylvania (Romania) and association with risk factors // Vet. Parasitol. - 2010. - 171, l.-P. 163 -166. doi: 10.1016/j.vetpar.2010.03.005.
Moravec F. Invalidity of the genus Thominx Dujardin, 1845 (Nematoda: Capillariidae // Folia Parasitol. -1981.-28, 2.-P. 104.
Moravec F. Proposal of a new systematic arrangement of nematodes of the family Capillariidae // Folia Parasitol. - 1982. - 29, 2. - P. 119 - 132.
Naem S, Pourreza B., Gorgani-Firouzjaee T The European hedgehog (Erinaceus europaeus), as a reservoir for helminth parasites in Iran // Vet. Res. Forum. - 2015. - 6, 2. - P. 149-153.
Nettles V. F, Prestwood A., Davidson FK R. Severe parasitism in an opossum // J. Wildlife Dis. - 1975. - 11, 3. -P. 419 -420. doi: 10.7589/0090-3558-11.3.419.
Saeed L, Maddox-Hyttel C., Monrad J., Kapel CM, Helminths of red fox (Vulpes vulpes) in Denmark // Vet. Parasitol. -2006. - 139, 1 -3. -P. 168 - 179. doi: 10.1016/j.vetpar.2006.02.015.
Sreter T, Szell Z, Marucci G., Pozio E, Varga I. Extra-intestinal nematode infections of red foxes (Vulpes vulpes) in Hungary // Vet. Parasitol. - 2003. -115. - P. 329 - 334.
Travassos L. P. Contributes para о conhecimento da fauna helmintolojica brasileira. V. Sohre as especies brasileiras do genero Capillaria Zeder, 1800 // Mem. Inst. Oswaldo Cruz. - 1915. - 7. -P. 146-172.
Traversa D., Di Cesare A., Milillo P., loro R, Otranto D. Infection by Eucoleus aerophilus in dogs and cats: Is another extra-intestinal parasitic nematode of pets emerging in Italy? 11 Res. Vet. Sci. - 2009. - 87, 2. -P. 270-272.
Род Paracapillaria Mendonca, 1963
Описание (no: Moravec, 1982, 1994). С характерными чертами семейства. Стихоци-ты расположены в один ряд. Латеральные хвостовые крылья у самца отсутствуют. Имеется мембранная бурса, поддерживаемая двумя латеральными пальцеподобными выступами, идущими вдоль заднего края бурсы с дорсальной стороны. Дорсальный хвостовой вырост отсутствует. Имеется пара крупных сидячих адальных и постанальных папилл. Спикула без поверхностного поперечного желобка. Спикулярное влагалище без шипиков. Отросток вульвы у самок отсутствует. Типовой вид -Paracapillaria piscicola (Travassos, Artigas et Pereira, 1928) Mendonca, 1963.
Единственный вид Paracapillaria, паразитирующий у человека, это - Paracapillaria {Crossicapillaria) philippinensis (Chitwood, Velasquez et Salazar, 1968) Moravec, 2001.
Paracapillaria {Crossicapillaria) philippinensis {^Capillaria philippinensis Chitwood, Velasquez et Salazar 1968; =Aonchotheca philippinensis (Chitwood, Velasquez et Salazar 1968) Moravec, 1982; -Calodium philippinensis (Chitwood, Velasquez et Salazar 1968) Anderson, 1992) (рис. 50, 51). Вид впервые описан на материале, полученном в 1963 г. при аутопсии 29-летнего жителя Северного Лусона (Филиппины), скончавшегося от неподдающейся лечению диареи (Chitwood et al., 1968). Название виду дали по месту его первого обнаружения: Capillaria philippinensis - капиллярия филиппинская.
Со времени первого обнаружения Capillaria philippinensis в течение последующих 30 лет данный вид, оказавшийся, как выяснилось, высоко патогенным для человека паразитом, был объектом интенсивного изучения многих исследователей. При этом, как пишет Ф. Моравец (Moravec, 2001), практически все авторы ориентировались на перво-
154
описание вида (Chitwood et al., 1968), в котором некоторые таксономически важные черты, как, например, строение хвостового конца самца, описаны неадекватно или не описаны вовсе. Вследствие сказанного, истинное таксономическое положение «Capillaria philippinensisy> оставалось неясным. Существовавшая когда-то концепция (Baylis, 1928), согласно которой все капиллярииды относились к одному роду Capillaria (sensu lato), большинством гельминтологов более не поддерживается, но в медицинской литературе ещё сохраняется. Поскольку «Capillaria philippinensis» по своей морфологии не соответствовала диагнозу рода Capillaria (s. s.), в 1982 г. Ф. Моравец (Moravec, 1982) перевёл её в ро&. Aonchotheca L6pez-Neyra, 1947, отметив определённую условность этого действа. В 1992 г. вид перевели в род Calodium (Anderson, 1992), по мнению Ф. Моравеца (Moravec, 2001), без достаточных на то оснований.
В 2001 г. Ф. Моравец (Moravec, 2001) опубликовал статью, посвящённую переописа-нию и таксономическому положению «Capillaria philippinensis». Материалом для работы послужили сборы нематод от жителя Филиппин, т.е. из тех мест, где вид впервые был описан. В результате Ф. Моравец не только переописал вид, уточнив многие детали строения нематоды, но и обосновал необходимость его включения в род Paracapillaria в составе нового подрода Crossicapillaria, созданного им специально для данного вида.
Отличительной биологической чертой нового подрода являлся тот факт, что самки этого вида продуцируют в окончательном хозяине и яйца, и личинок. Взрослые особи живут в пищеварительном тракте птиц и млекопитающих, а жизненный цикл протекает с
участием промежуточных хозяев.
XMVVftKMt BN» AWVT $ЙО*14& ТЙГ
POtTKRIOft МЭ CF MAU
Рис. 50 Paracapillaria phil-ippinensis*. а - передний конец тела со стилетом; б - задний конец тела самца (отмечены втянутое спи-кулярное влагалище, спикула и хвостовые крылья); в - личинка (из: armymedical. tpub. com)
Рис. 51 Paracapillaria philippinensis: a - незрелые яйца в теле самки; б - зрелое яйцо (из: http://web. Stanford. edu/.../ParaSites2005/Capillariasis/ parasi-temorphlink.htm#)
155
Описание (по: Moravec, 2001; с дополнениями из работ других авторов). С характерными чертами рода. Очень мелкие тонкие нематоды. Кутикула почти гладкая. Вдоль тела тянутся две относительно узкие латеральные бациллярные ленты. Передний конец тела заужен, округлый. Ротовое отверстие терминальное, щелевидное, ориентировано дорсовентрально и окружено двумя выступающими латеральными губами, соединёнными в углах ротового отверстия. Наружный край губ округлый. Рот окружён 12 головными папиллами, расположенными в двух кругах по 6 папилл в каждом. Мышечный пищевод короткий, иногда расширен в задней половине. Нервное кольцо на уровне второй четверти длины мышечного пищевода. Стихоциты среднеразмерные, расположены в один ряд. Самцы длиной 1.5 - 3.9, максимальной шириной 0.023 - 0.036 мм. Задний конец тела округлый. Спикула гладкая, хорошо склеротизированная, длиной 0.411 - 0.468 мм (15 - 19 % длины тела). Спикулярное влагалище одинаковой ширины. Самки длиной 2.3 - 5.3, максимальной шириной 0.023 - 0.047 мм. Яйца размерами 36 - 47.5 х 18.75 - 22.5 цт, имеют форму земляного ореха, с плоскими биполярными пробочками. Яйца могут быть двух типов: одни из них имеют типичную форму земляного ореха, а другие -ту же форму, но вздутую. У яиц также различают две оболочки - толстую и тонкую. Толстая оболочка либо достаточно гладкая, либо с лучеподобной сетью, тонкая - прозрачная и позволяет видеть внутри спирально свёрнутую личинку. Наличие тонкой оболочки доказывает наличие аутоинвазии в жизненном цикле этого паразита (Sukontason et al., 2006).
Жизненный цикл Р. philippinensis изучался в экспериментальных условиях (Cross, 1992; Cross, Basaea-Sevilla 1991; Cross et al., 1972). Яйца нематоды из фекалий человека и обезьян поместили в воду при температуре 25 - 30°С и через 10 дней в них развились личинки. Через 14 дней инкубации яйца скормили рыбам, в пищеварительном тракте которых личинки покидали оболочку яйца и проникали в слизистую. Только что вылупившиеся личинки имели в длину 0.13 - 0.15 мм, а в течение последующих 18-21 дня выросли до 0.25 - 0.3 мм, достигнув инвазионного состояния. Через 3 месяца личинки в рыбах имели те же размеры, т.е. более не росли. Обычно они локализуются в пищеварительном тракте рыб, в редких случаях встречаются в их печени, в других органах их не находили. Установлено, что личинки в рыбах сохраняют инвазионность до 7 месяцев. При скармливании личинок из рыб 34 макакам заразилась 21 особь, причём успешно прижилась и 7-месячная личинка. При анализе экскрементов заражённых животных у двух из них через 10 и 17 дней уже обнаружились яйца нематоды, а у трёх обезьян яйца периодически выявлялись в течение более года. При вскрытии экспериментально заражённых обезьян в них были выявлены самки нематод, откладывающие яйца, самки, продуцирующие личинок, и другие черви. Все они локализовались в тонком кишечнике животных. У одной из макак, которой скормили 30 личинок, через 30 дней насчитали 926 экз. нематод, что явно свидетельствовало о наличии аутоинвазии животного.
Аналогичный опыт, но на этот раз с когтистой песчанкой в качестве подопытных животных, был выполнен в Таиланде (Bhaibulaya et al., 1979). Яйца Р. philippinensis из фекалий человека после 2-3 недель культивирования при температуре 28 - 32°С скормили рыбам, отловленным в водоёмах вокруг Бангкока, в том числе в рыбоводном хозяйстве. Из 9 видов рыб заразились 6 (среди них 4 вида рыб местные жители употребляют в пищу в сыром виде). Через 25 - 28 дней личинок,
156
чья длина достигла 0.3 - 0.325 мм, скормили 6 особям песчанки когтистой. В песчанках зрелые самки нематод, чьё развитие завершилось за 10 - 11 дней, через 13 -14 дней стали продуцировать личинок. Эти личинки через 22 - 24 дня дали следующую генерацию взрослых особей - самцов и самок, откладывающих толстостенные незрелые яйца. Через 4-5 недель после заражения при вскрытии у всех животных были обнаружены взрослые особи нематоды и личинки.
Таким образом, жизненный цикл Р. philippinensis протекает двояко: или без промежуточного хозяина, и в этом случае самки продуцируют личинок непосредственно в организме дефинитивного хозяина, или же с промежуточным хозяином, в роли которого выступают рыбы, а самки в этом случае продуцируют незрелые яйца (рис. 52).
Рис. 52 Схема жизненного цикла Paracapillaria philippinensis
Окончательный хозяин Р. philippinensis — рыбоядные птицы, в том числе цапля египетская, кваква обыкновенная, выпь малая китайская (Bair et al., 2004), что было подтверждено и в экспериментальных условиях (Cross, Basaea-Sevilla 1983). В природе, однако, заражение птиц встречается редко (во всяком случае, информация о находках этих гельминтов в природе необычайно скудна).
Паразит может быть патогенен для млекопитающих, что убедительно доказал выполненный на Филиппинах эксперимент со скармливанием трём особям когтистой песчанки рыб Hypseleotris cyprinoides {-Hypseleotris bipartita), отловленных в лагуне, а также купленных на рынке (Cross, Basaea-Sevilla 1991). Все подопытные животные погибли в результате сильного заражения.
Патогенные свойства паракапиллярии филиппинской проявляются и при её попадании в организм человека.
157
В 1963 г. зафиксирован первый случай заражения человека Р. philippinensis. 29-летний житель одной из деревень на побережье Северного Лусона (Филиппины) скончался от неподдающейся лечению диареи. При вскрытии в его кишечнике обнаружилось огромное количество нематод, которые были описаны в качестве нового для науки вида из рода Capillaria - С. philippinensis (Chitwood et al., 1968). В 1965 - 1967 гг. подобное заболевание вновь проявилось на Филиппинах, на этот раз в одной из деревень, расположенной в 150 км к югу от места регистрации первого инцидента: число заболевших здесь достигло 1000 человек, причём 77 из них скончались от этой болезни. В конце 1978 - начале 1979 гг. вторая небольшая вспышка - заболело около 50 человек - наблюдалась на северо-востоке о. Минданао (Cross et al., 1979). Подсчитано, что с 1967 по 1990 гг. здесь было выявлено 1884 случая заражения людей Р. philippinensis, из них для 110 человек заболевание оказалось фатальным (Cross, 1992; Cross, Bhaibuloya, 1983). В последнее время на Филиппинах паракапиллярию у людей регистрируют очень редко (Eduardo, 2001).
В 1973 г. описан первый случай заражения человека в Таиланде: в стуле 18-месячной девочки были выявлены яйца, личинки и взрослые особи Р. philippinensis (Pradatsundarasar et al.,’ 1973). Через год появилась информация о втором случае в этой стране, на этот раз заболел 46-летний мужчина, жаловавшийся на частый (до 4 - 5 раз в сутки) жидкий стул; в его фекалиях также обнаружились яйца нематоды и взрослые черви (Sanpakit, Bhaibulaya, 1974). В 1981 г. на северо-востоке страны зафиксировали первую, но небольшую по масштабам, вспышку кишечного парака-пилляриазиса - 20 заболевших, однако 9 человек из них скончались (Kuna-ratanapruk et al., 1981). Подобные случаи в Таиланде имели место и в последующие годы. Так, с 1994 по 2006 гг. в 25 провинциях страны описано 82 аккумулированных случая, из которых около половины были связаны с употреблением в пищу рыбы сырой или слабо обработанной термически (Saichea et al., 2008).
В 1983 г. заболевание впервые отмечено на Тайване (Hwang, 1998). За последующие 20 лет, по декабрь 2003 г., здесь документально подтверждена регистрация 30 случаев заболевания людей кишечным паракапилляриазисом (Lu et al., 2006). Судя по статье (Bair et al., 2004), до 2001 г. таковых было известно всего 14. Подмечено, что заболевание чаще наблюдается у мужчин и лиц старшего возраста. Все упомянутые случаи после соответствующего лечения закончились выздоровлением (Lu et al., 2006).
В том же, 1983-м, году появляется информация о первом заражении человека Р. philippinensis в Японии (Mukai et al., 1983). Второй аналогичный случай в этой стране был зафиксирован только через 5 лет (Nawa et al., 1988).
С 1989 г. регулярно публикуются данные о регистрации кишечного парака-пилляриазиса у местного населения в Египте. Первый случай касался 41-летней жительницы Каира (Youssef et al., 1989), второй - 38-летней жительницы Нижнего Египта (Mansour et al., 1990). В последующие годы заболевание регистрируют в различных регионах Египта, включая Каир и Менуф, а также Верхний и Нижний Египет (Ahmed et al., 1999; Amin et al., 2015; Anis et al., 1998; Attia et al., 2012: Austin et aL, 1999; El-Dib et al., 1992; El-Karaksy et al., 2004; Khalifa et al., 2000 и др.). К примеру, с мая 2007 по январь 2009 гг. в Верхнем Египте выявили 21 случай инвазии паракапиллярией людей в возрасте от 9 до 50 лет (Attia et al., 2012). Среди 160 больных с хронической диареей и другими гастрокишечными симптомами, нахо
158
дившихся с января 2010 по май 2011 гг. на лечении в университетской клинике Бе-ни-Суэфа, причиной недомогания 8 из них (5 %) стало заражение Р. philippinensis (Amin et al., 2015).
В 1992 г. опубликована статья о регистрации Р. philippinensis у человека в Италии, хотя само заражение, как полагают, произошло в Индонезии (Chichino et al., 1993). В 1993 г. похожая история описана в Испании (Dronda et al., 1993), но на этот раз пострадавшим оказался молодой человек - уроженец Колумбии.
В 1994 г. описан первый случай заражения человека паракапиллярией в Индии (Kang et al., 1994), в 2012 г. в этой стране зафиксирован третий аналогичный случай (Vasantha et al., 2012).
В 2010 г. болезнь впервые обнаружили в Китае у 33-летней женщины, проживающей на окраине г. Даньчжоу (северо-запад провинции Хайнан) (Fan et al., 2012). В течение 11 месяцев она страдала хронической диареей с абдоминальными болями, отёками, гипоальбуминемией и похудела за это время на 12.5 кг. По словам пациентки, с марта по апрель 2009 г. она ежедневно употребляла в пищу sashimi из сырой рыбы - вьюна амурского Misgumus anguillicaudatus, которого ей рекомендовали в качестве лечебного средства от хронической непроходимости кишечника, коей она страдала в течение 7 лет. Спустя месяц появилась диарея, сопровождаемая острыми болями. До болезни она не выезжала за пределы города, а все остальные члены семьи, не евшие рыбу, были здоровы. История болезни этой женщины примечательна тем, что и в клинике, и в одной из больниц города первоначально ей был поставлен неверный диагноз. Наконец, в паразитологической лаборатории при анализе стула больной в нём выявили яйца нематоды (43.7 х 14.6 щп) и одного взрослого самца размером 1.6 х 0.1 мм, определённого как «Capillaria philippinensis». К этому же виду отнесли и обнаруженные при анализе яйца. Пациентке прописали 30-дневный курс альбендазола (400 мг сут'), и на пятый день после начала курса лечения она покинула больницу.
В том же 2010-м году появилась статья с описанием заражения человека, впервые выявленного на Кубе (Nunez et al., 2010). 21-летний житель Гаваны обратился за медицинской помощью из-за сильной диареи, возникшей у него после того, как он поел блюдо из рыбы. Частота стула дошла уже до 15 раз в сутки, появились симптомы анорексии и астении. При копроовоскопии пациента обнаружились яйца Р. philippinensis.
К настоящему времени случаи кишечного заболевания людей, вызванного паракапиллярией филиппинской, зарегистрированы на Филиппинах, Тайване, в Таиланде, Индонезии, Японии, Корее, Лаосе, Китае, Иране, Индии, Египте, Объединённых Арабских Эмиратах, Италии, Испании, Великобритании, Колумбии, на Кубе. При этом более всего подобных случаев выявлено на Филиппинах и в Таиланде.
Первоначально заражение проявляется рецидивирующими сильными абдоминальными болями и интенсивным и непривычным урчанием в животе (borbo-rymus). Могут возникать болезненность и напряжение живота. Через 2-3 недели появляется обильный (до 5 - 10 и даже до 15 раз в сутки), желтоватый или зеленоватый, водянистый стул с неприятным запахом, наблюдаются субфебрильная температура, головные боли, снижение или полное отсутствие аппетита, тошнота и рвота, общая слабость, отёки, заметная утрата массы тела, снижение мышечной силы, неврологических рефлексов - коленного, ахиллового. При лабораторных ис-
159
следованиях у больных выявляется гипоальбуминемия (Chunlertrith et al., 1992; Tesanaet al., 1983).
Большое количество паразитов и их яиц в кишечнике может вызвать синдром хронической кишечной псевдообструкции, иными словами, серьёзно нарушить способность кишечника проталкивать пищу (Vilairatana, 1994). Симптомы заболевания напоминают таковые, вызываемые механической обструкцией тонкого кишечника. Сообщается также о возможности развития перитонита (Bair et al., 2004).
Половозрелые нематоды, в большом количестве проникающие в слизистую оболочку тонкого кишечника, повреждают её, вызывая синдром мальабсорбции, -патологического состояния тонкой кишки, при котором наблюдается нарушение процесса всасывания в ней питательных веществ. В результате развития этого синдрома формируется тяжёлая энтеропатия с гипокалиемией, гипонатриемией, гипокальциемией и гипопротеинемией (Ahmed et al., 1999). Кстати, поскольку названный синдром может быть вызван самыми разными причинами, то при его диагностировании рекомендуется учитывать возможность заражения Р. philippinensis (Paulino etal., 1973).
При отсутствии соответствующего лечения заболевание приводит к серьёзным потерям мышечной массы, кахексии, отёку и через 2-3 месяца может закончиться летальным исходом от потери электролита в результате сердечной недостаточности и/или от септицемии (Cross, 1992). При вскрытии людей, умерших от кишечного паракапилляриазиса, в их кишечнике обнаруживаются многие тысячи личинок и взрослых червей (Cross, Bhaibulaya, 1983). Замечено, что за пределы тонкого кишечника инвазия не распространяется.
Диагноз ставят на основании обнаружения в стуле пациентов характерных яиц, личинок и/или взрослых особей нематоды (Ahmed et al., 1999; Anis et al., 1998; Belizario et al., 2000; Pradatsundarasar et al., 1973; Vasantha et al., 2012). При наличии клинических симптомов паракапилляриазиса, но при отсутствии яиц и/или червей в пробах стула для диагностики заболевания используют эндоскопию (Bair et al., 2004; Wongsawasdi et al., 2002). Для серодиагностики разработана методика применения антигена паразитической нематоды Trichinella spiralis (Intapan et al., 2006).
В качестве лекарственных препаратов большинство медицинских работников рекомендуют применять альбендазол (Anis et al., 1998; Bair et al., 2004; Fan et al., 2012; Helmy et al., 2011; Vasantha et al., 2012) или мебендазол (Ahmed et al., 1999; Bair et al., 2004). Эффективность применения названных препаратов в значительной степени зависит от своевременности постановки диагноза и тяжести протекания болезнетворного процесса, что наглядно демонстрирует следующий пример. В Египте для лечения четырёх пациентов в возрасте от 12 до 45 лет, страдавших в течение 1 - 7 месяцев от тяжёлой диареи, сопровождавшейся рвотой и абдоминальными коликами, был назначен мебендазол для приёма в течение 28 дней по 400 мг в сутки в двух раздельных дозах. Одновременно больным были прописаны пища с высоким содержанием белка и курс коррекции дисбаланса электролита (Ahmed et al., 1999). На 2-е сутки лечения у пациентов прекратилась рвота, с 4-го дня улучшился аппетит, уменьшилась диарея. Однако один пациент через 2 дня после начала лечения скончался от ярко выраженной гипокалиемии, лечение которой явно запоздало.
160
Заражение человека личинками Р. philippinensis происходит через пищевые продукты, прежде всего, солоноватоводных и пресноводных рыб, употребляемых в еду в сыром или полусыром виде (Eduardo, 1991, 2001; Fan et al., 2012; Lu et al., 2006; Saichea et al., 2008). На Филиппинах, например, это - Hypseleotris cyprinoides (местное название bagsit} или же Ambassis miops (bagsan) (Cross, Basaea-Sevilla 1991). Этих некрупных рыбок, чья длина не превышает соответственно 8 и 10 см, филиппинцы вообще предпочитают употреблять в пищу в сыром виде с соответствующими приправами.
В Таиланде основной источник заражения людей - также блюда из сырой рыбы, в частности, Koi pla (измельчённая сырая рыба, смешанная с лимонным соком, мелко нарезанным красным луком и перцем чили) или же Taab КааЬ (готовится аналогично предыдущему блюду, с той лишь разницей, что тушка рыбы не рубится на кусочки, а растирается). Эти блюда являются любимыми у населения сельскохозяйственных районов, поскольку быстро и легко готовятся, а идущие на их приготовление пресноводные рыбы в изобилии водятся в этих регионах. К тому же, некоторые рыбки столь малы, что даже нет необходимости потрошить их.
Таким образом, чтобы предупредить заражение Р. philippinensis, опасной для здоровья человека нематодой, достаточно, во-первых, выпотрошить рыбу, т.е. удалить пищеварительный тракт, где обычно локализуются личинки нематоды, а во-вторых, обработать рыбу термически, чтобы обеззаразить её.
Подводя краткие итоги изложенного, не могу не остановиться на одной публикации, привлекшей моё внимание по той причине, что её авторы попытались проанализировать состояние изученности проблемы кишечного паракапилляриазиса, прежде всего, в стране их проживания - в Египте (Khalifa, Othman, 2014). По их мнению, несмотря на то, что с момента первого обнаружения Р. philippinensis на Филиппинах прошло уже более полувека, но по-прежнему нет ответа на многие вопросы, касающиеся систематики и морфологии паразита, его жизненного цикла, диагностики, патологии и клинических признаков вызываемого им заболевания, механизма передачи возбудителя среди хозяев и распространения в природе. Более того, определённую тревогу у них вызывает информация об участившихся случаях регистрации паразита вне эндемичного района, в частности в Египте: неизвестно и непонятно, каким образом данный вид попал в эту страну, и каким образом стал распространяться здесь, охватывая всё большее число египетских провинций, в частности средний Египет (Khalifa, Othman, 2014).
И хотя эти опасения касаются ситуации в Египте, по-моему, они применимы и к другим регионам, где выявляется Р. philippinensis. Например, в одной из публикаций описывается 7 случаев заболевания людей кишечным паракапилляриа-зисом на Тайване (Hwang, 1998). Эта же информация вошла в более позднюю статью других специалистов по данному региону (Bair et al., 2004). Авторы обеих цитируемых работ обращают особое внимание на то обстоятельство, что двое из числа заболевших явно заразились в Таиланде, поскольку почувствовали все признаки недомогания только после возвращения из поездки в эту страну. Иными словами, вероятность заражения паракапиллярией вне страны проживания, при посещении эпидемичного по данному заболеванию региона вполне реальна. Кстати, это подтверждается фактами обращения за помощью в медицинские учреждения людей в
161
неэндемичных по данному заболеванию регионах, о чём говорилось выше (Chichino et al., 1993; Dronda et al., 1993).
В целом, становится очевидным, что проблема заражения людей Р. philippinensis охватывает всё новые и новые страны и регионы, о чём свидетельствуют недавняя регистрация подобных случаев в таких странах, как Куба (Nunez et al., 2010) или же Китай (Fan et al., 2012). В Китае, кстати, событие имело место на всемирно известном курортном острове Хайнань.
Несколько слов по поводу заражения Р. philippinensis молодого мужчины на Кубе (Nunez et al., 2010). Дело в том, что молодой человек никогда не покидал пределы страны и, следовательно, не мог заразиться где-либо в ином месте, кроме как на Кубе. С его слов, недомогание у него появилось после того, как он поел одно из рыбных блюд - это так называемая breadcrumb-covered fish, или «рыба, обвалянная в хлебных крошках (сухарях)». Для этого блюда филе рыбы нарезают на кусочки толщиной примерно с палец, обваливают их в муке, затем в яйце и, наконец, в хлебных крошках (сухарях); обжаривают в масле при 180°С до золотистого цвета, причём продолжительность жарки не регламентируется, а основной показатель готовности блюда - золотистый цвет поджаренной рыбы. Не исключено, что в данном случае рыба недостаточно прожарилась внутри. Но была ли то местная рыба или импортированная из дальних стран, - неизвестно. Парадокс заключается в том, что паракапиллярия филиппинская на Кубе в естественных условиях не известна, её здесь никогда не отмечали ни у птиц, ни у рыб. Авторы, описавшие данный случай, даже подчёркивают в статье, что это - первый случай регистрации паразита у человека не только на Кубе, но и на американском континенте.
Всё сказанное свидетельствует о необходимости расширения паразитологических исследований на предмет выявления Р. philippinensis в разных странах, а также усиления внимания со стороны медицинских учреждений и правительственных органов к изучению данного паразита. В пользу сказанного, в частности, говорит и следующая информация (Belizario et al., 2000). Известно, что эндемичным районом по кишечному паракапилляриазису на Филиппинах является Северный Лусон. Однако здесь обозначился ещё один эндемичный район - провинция Долина Компостела на острове Минданао, где в одной из деревень от заболевания скончалось 12 человек, которым не был поставлен правильный диагноз, а в лучшем случае диагностировали гастроэнтерит. Заболевание даже получило название Mystery Disease. Выявить истинную причину удалось, благодаря поступившей в клинику Манилы 20-летней жительницы этой деревни, жаловавшейся на продолжительную диарею, отёки ног, анорексию, потерю массы. В её стуле были выявлены яйца, личинки и взрослые черви. После проведения соответствующего обследования жителей деревни 22.2 % из них оказались позитивны на Р. philippinensis. Известно, что в рационе местного населения обычны сырые крабы, креветки, улитки, рыба, которые могут быть заражены личинками не только капилляриидных нематод, но и других гельминтов, опасных для здоровья человека, каковые, кстати, также обнаруживаются у людей. Примечательна и система санитарно-ветеринарного контроля в этих местах, вернее, отсутствие таковой. Оказывается, фекальные массы здесь поступают в те же водоёмы, где жители ловят рыб и ракообразных, на поля, где собирают улиток, которых потом едят.
162
Столкнувшись с подобными проблемами и в Таиланде и комментируя распространение кишечного паракаппиляриазиса в этой стране, исследователи отмечают, что даже если количество случаев заражения людей уменьшится, то паразит, как причина заражения людей, всё равно останется (Saichea et al., 2008).
Цитируемая литература
Ahmed L, EL-Dib N. A., EL-Boraey Y., Ibrahim M. Capillaria philippinensis'. an emerging parasite causing severe diarrhea in Egypt // J. Egypt. Soc. Parasitol. - 1999. - 29, 2. - P. 483 - 493.
Amin F. А/. A., El-Dib N. A., Enas Y. A.-S. А/., Mona E. A. Clinical and laboratory investigations of cases infected with Capillaria philippinensis in Beni-Suef Governorate, Egypt I I Comp. Clin. Pathol. - 2015. -24,4.-P. 871 -878.
Anderson R C. Nematode parasites of vertebrates. Their development and transmission. - C.A.B. International, Wallingford, U.K., 1992.-578 pp.
Anis M. H, Shafeek H, Mansour N, S., Moody A. Intestinal capillariasis as a cause of chronic diarrhoea in Egypt//J. Egypt. Soc. Parasitol. - 1998-28, l.-P. 143-147.
Attia R. A. H. , Tolba M. E. M., Yones D. A., Bakir H. Y et al. Capillaria philippinensis in Upper Egypt: Has it become endemic? // Am. J. Trop. Med. Hyg. - 2012. - 86, 1. - P. 126 - 133. doi: 10.4269/ajtmh.2012.11-0321.
Austin D. N., Mikhail M. G., Chiodini P. L., Murray-Lyon L. M. Intestinal capillariasis acquired in Egypt // Eur. J. Gastroenterol. Hepatol. - 1999. - 11. -P. 935-936.
Bair M.-J., Hwang K.-P., Wang T.-E, Liou T.-C, Lin S.-C. et al. Clinical features of human intestinal capillariasis in Taiwan // Worls J. Gastroenterol. - 2004. - 10, 16. - P. 2391 - 2393.
Baylis H. A. Records of some parasitic worms from British vertebrates //Ann. Mag. Nat. Hist., Series 10. -1928.-l.-P. 329-343.
Belizario V. Y., de Leon W. U., Esparar D. G., GalangJ. M., Fantone J., Verdadero C. Compostela Valley: a new endemic focus for Capillariasis philippinensis // Southeast Asian J. Trop. Med. Public Health. - 2000. -31, 3.-P. 478-481.
Bhaibulaya M., Indra-Ngarm S, Ananthapruti M. Freshwater fishes of Thailand as experimental intermediate hosts for Capillaria philippinensis // Intern. J. Parasitol. - 1979. - 9. - P. 105 - 108.
Chichino G., Bernuzzi A. M., Bruno A. Intestinal capillariasis (Capillaria philippinensis) acquired in Indonesia: a case report // Am. J. Trop. Med. Hyg. - 1992. - 47. - P. 10-12.
Chitwood M. B., Velasquez C, Salazar N. G. Capillaria philippinensis sp. n. (Nematoda: Trichinellida), from the intestine of man in the Philippines // J. Parasitol. - 1968. - 54, 2. - P. 368 - 371.
Chunlertrith K., Mairiang P., Sukeepaisarnjaroen W. Intestinal capillariasis: a cause of chronic diarrhea and hypoalbuminemia // Southeast Asian J. Trop. Med. Public Health. - 1992. - 23. - P. 433 - 436.
Cross J. H. Intestinal capillariasis // Clin. Microbiol. Rev. - 1992.-5, 2. - P. 120 - 129.
Cross J. H, Banzon T., Clarke M. D., Basaca-Servilla V. et al. Studies on the experimental transmission on Capillaria philippinensis in monkeys // Trans. Roy. Soc. Trop. Med. Hyg. - 1972. - 66. - P. 819 - 827.
Cross J. H, Basaea-Sevilla V. Experimental transmission of Capillaria philippinensis to birds // Trans. Roy. Trop. Med. Hyg. - 1983. - 77. - P. 511 - 514.
Cross J. H, Basaea-Sevilla V. Capillariasis philippinensis: a fish-borne parasitic zoonoses // Southeast Asian J. Trop. Med. Publ. Health. -1991.-22, Suppl. - P. 153 -162.
Cross J. H, Bhaibulaya M. Intestinal capillariasis in the Philippines and Thailand I Croll N., Cross J., eds. Human Ecology and Infectious Diseases. -N. Y.: Acad. Press, 1983. -P. 103 - 136.
Cross J. H, Singson C. N., Battad S, Basaea-Sevilla V. Intestinal capillariasis: epidemiology, parasitology and treatment // Proc. R. Soc. Med. Int. Cong. Symp. Ser. - 1979. - 24. - P. 81 - 86.
Dronda F., Chaves F, Sanz A., Lopez-Velez R. Human intestinal capillariasis in an area of nonendemicity: case report and review // Clin. Infect. Dis. - 1993. -17, 5. -P. 909 - 912.
Eduardo S. L. Food-borne parasitic zoonoses in the Philippines // Southeast Asian J. Trop. Med. Publ. Health. - 1991. -22, Suppl. -P. 16-22 (www.tm.mahidol.ac.th/seameo/.../06-16-22/).
Eduardo S. L. Helminth zoonoses in the Philippines: public health problem associated with eating habit and practices//Trans. Natl. Acad. Sci. Tech., Philippines. -2001. -23. -P. 105 - 119.
El-Dib N. A., FarragA. J., Salama H. M., Salama Z. A., Mostafa S. M. A new case of intestinal capillariasis in Egypt // J. Trop. Med. Hyg. - 1992. - 2, 1. - P. 75 - 76.
El-Karaksy H, El-Shabrawi M., Mohsen N., Kotb M., El-Koofy N., El-Deeb N. Capillaria philippinensis a cause of fatal diarrhea in one of two infected Egyptian sisters // J. Trop. Pediatr. - 2004. - 50. - P. 57 - 60.
163
Fan Z, Huang Y, Qian S, Lv G., Chen Y. et al. Serious diarrhea with weight loss caused by Capillaria philippinensis acquired in China: a case report // BMC Res. Notes. - 2012. - 5. - P. 554. doi: 10.1186/1756-0500-5-554.
Helmy H, El-Dib N., Mogahed E, Yasin N., El-Karaksy H. A child with rotor syndrome and Capillaria philippinensis: case report and review of literature // J. Egypt. Soc. Parasitol. - 2011. -41, 2. - P. 417 - 422.
Hwang К- P. Human intestinal capillariasis (Capillaria philippinensis) in Taiwan // Acta Paed. Sin. - 1998. -39.-P. 82-85.
Intapan P. M., Maleewong W., Sukeepaisarnjaroen W., Morakote N. Potential use of Trichinella spiralis antigen for serodiagnosis of human capillariasis philippinensis by immunoblot analysis // Parasitol Res. -2006. - 98.-P. 227-231.
Kang G., Mathan M., Ramakrishna B. S., Mathai E, Sarada V. Human intestinal capillariasis: first report from India//Trans. R. Soc. Trop. Med. Hyg. - 1994. -88. -P. 204.
Khalifa R, Othman Л A. Some studies on Capillaria philippinensis and its mysterious trip from Philippines to Egypt (review article) // J. Egypt. Soc. Parasitol. -2014.-44, l.-P. 161-171.
Khalifa R M., Sakla A., Hassan A. A. Capillaria philippinensis - a human intestinal nematode newly introduced to Upper Egypt // Helminthologia. - 2000. - 37. - P. 23 - 27.
Kunaratanapruk S.t lam-Ong S, Chatsirimongkol C. Intestinal capillariasis: The first epidemic in Thailand // Ramathibodi Med. J. - 1981. -4. -P. 209 -213.
Lu L. H, Lin M.-R., Choi W.-M., Hwang К.-P., Hsu Y.-H. et al. Human intestinal capillariasis (Capillaria philippinensis) in Taiwan I J Am. J. Trop. Med. Hyg. - 2006. - 74, 5. - P. 810 - 813.
Mansour N. S., Anis M. H, Mikhail E. M. Human intestinal capillariasis in Egypt // Trans. R. Soc. Trop. Med. Hyg.-1990.-84.-P. 114.
Moravec F. Proposal of a new systematic arrangement of nematodes of the family Capillariidae // Folia Parasitol. - 1982. - 29, 2. - P. 119 - 132.
Moravec F. Parasitic nematodes of freshwater fishes of Europe. - Kluwer Acad. Publ., 1994. -473 pp.
Moravec F. Redescription and systematic status of Capillaria philippinensis, an intestinal parasite of human beings//J. Parasitol.-2001.-87, l.-P. 161-164.
Mukai T., Shimizu S, Yamamoto M. A case of intestinal capillariasis // Jpn. Arch. Int. Med. - 1983. - 3. - P. 163-169.
Nawa Y., Imai J. L, Abe T., Kisanuki H, Tsuda К A case report of intestinal capillariasis. The second case found in Japan // Jpn. J. Parasitol. - 1988. - 37. - P. 113-118.
Niihez F. A., Espinosa F, Rodriguez G. A., Medina A. I. C, Atencio I. V., Gago M. M. Primer hallazgo de infeccidn por Paracapillaria (Crossicapillaria) philippinensis (Chitwood, Velasquez у Salazar, 1968) en Cuba // Rev. Cubana Med. Trop. - 2010. - 62, 2. - P. 125 - 129.
Paulino G. B., Wittenberg J. Intestinal capillariasis: a new cause of a malabsorption pattern // Am. J. Roentgenol. Radiother. NucL Med. - 1973. - 117. -P. 340-345.
Pradatsundarasar A., Pecharanond K, Chintanawongs C, Ungthavorn P. The first case of intestinal capillariasis in Thailand // Southeast Asian J. Trop. Med. Public Health. - 1973.-4, l.-P. 131-134.
Saichua P., Nithikathkul C, Kaewpitoon N. Human intestinal capillariasis in Thailand // World J. Gastroenterol. -2008. - 14, 4. -P. 506 - 510. doi: 10.3748/wjg. 14.506.
SanpakitS. S. S, Bhaibulaya M. Intestinal capillariasis from Saraburi province, Thailand: report of the second case // J. Med. Assoc. Thai. - 1974. - 57. - P. 453 - 460.
Sukontason К L , Sukontason K, Piangjai S., Vogtsberger R C. Ultrastructure of eggs of Paracapillaria (Crossicapillaria) philippinensis and evidence related to its life cycle // Micron. - 2006. - 37, 1. - P. 87 -90.
Теs ana S., Bhuripanyo K, Sanpitak P., Sithithaworn P. Intestinal capillariasis from Udon Thani province, northeastern part of Thailand: report of an autopsy case //J. Med. Assoc. Thai. - 1983. - 66. - P. 128-131.
Vasantha P. L., Girish N., Leela K. S. Human intestinal capillariasis: a rare case report from non-endemic area (Andhra Pradesh, India) // Indian J. Med. Microbiol. - 2012. - 30, 2. - P. 236 - 239. doi: 10.4103/0255-0857.96708.
Vilairatana P. Capillariasis with chronic intestinal pseudo-obstruction // Southeast Asian J. Trop. Med. Public Health. - 1994. - 25. - P. 600 - 602.
Wongsawasdi L., Ukarapol N, Lertprasertsuk N. The endoscopic diagnosis of intestinal capillariasis in a child: A case report obstruction // Southeast Asian J. Trop. Med. Public Health. - 2002. - 33, 4. - P. 730 -732.
Youssef F. G., Mikhail E. M., Mansour N. S. Intestinal capillariasis in Egypt: a case report Egypt //Am . J. Trop. Med. Hyg. - 1989. - 40. - P. 195 - 196.
164
Семейство Dioctophymidae Railliet, 19151
Синонимы (по: Карманова, 1968):
EustrongylidaeLeiper, 1908 Eustrongylididae Leiper, 1912 Dioctophymatidae Chitwood et Chitwood, 1950
Выше отмечалось, что систематика нематод всё ещё далека от завершённости. Сказанное относится и к семейству Dioctophymidae. Уже в нынешнем 21-м столетии в одних источниках семейство отнесено к классу Enoplea, а в нём к отряду Dioctophymatida (Liu, 2013; WoRMS, 2016), в других - к классу Secementea и отряду Ascaridida* 2, или же - к классу Dori-laimea и отряду Dioctophymatida (Hodda, 2011). Иногда его можно обнаружить в классе Adenophorea в составе отряда Enoplida (Arthur, Ahmet, 2002) или же Dioctophymata (Гапонов, 2005). Невольно напрашивается вывод, что у нематодологов пока нет единой точки зрения относительно систематики не только диоктофимид, но и вообще всего типа нематод.
Описание (по: Карманова, 1968; Определитель, 1975). Крупные черви. Головной конец простой, без мощной мышечной присоски. Кутикула с поперечной исчер-ченностью. Передний конец тела гладкий или вооружён многочисленными шипами. Ротовое отверстие лишено губ и интерлабиев; вокруг рта имеется 12 или 18 папилл, расположенных более или менее симметрично. Ротовая полость слабо развита, без хитинового вооружения. На дне ротовой полости открывается отверстие пищевода треугольного сечения. Пищевод относительно длинный, без бульбуса и деления на мышечный и железистый отделы. В толще его стенки заключены сложные многоядерные эзофагеальные железы, протоки которых открываются в просвет начальной части пищевода. Кишечник простой, без дивертикулов. Нервное кольцо сдвинуто далеко вперёд и охватывает основание пищевода. Основные сенсорные органы представлены, как и у всех нематод, папиллами, щетинками, амфидами. Самцы с единственной игловидной спикулой, заключённой в толстостенный мышечный футляр. Хвостовая бурса чашевидная, с мощными мышечными стенками. Рулёк и другие дополнительные копулятивные органы отсутсгвуют. Хвост самок тупо закруглён. Вульва располагается либо на уровне пищевода, либо вблизи ануса, открывающегося терминально или субтерминально. Яйца со скулыпурированной поверхностью и крышечками на полюсах. Во взрослом состоянии - паразиты птиц и млекопитающих. Развитие со сменой хозяев. Типовой род - Dioctophyme Collet-Meygret, 1802.
В настоящее время семейство включает, по одним данным, 4 рода и 27 видов (Hodda, 2011; см. источник на стр. 14), по другим, - 3 рода и 18 видов (Koehle-retal., 2009).
У человека зарегистрированы представители родов Dioctophyme и Eustron-gylides Jagerskiold, 1909.
’а) В работе (Baylis, 1939) - указан 1916 год.
б) Во многих публикациях встречается Dioctophymatidae (напр., Hodda, 2011; Moravec, 1994).
2 https://en.wikipedia.org/.../Dioctophyme_renale; animaldiversity.org; Nature.british-towns.net/ .../06_genus_menu.asp; Taxonomicon.taxonomy.nl/TaxonName.aspx?id=l 178998scr; Global Biodiversity Information Facility: www.gbif.org/species/4554237/classification.
165
Цитируемая литература
Гапонов С. П. Паразитические черви (введение в гельминтологию). - Воронеж: Воронежск. гос. унив-т, 2005. - 205 с.
Карманова Е. М. Диоктофимидеи животных и человека и вызываемые ими заболевания // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1968. - 20. - 262 с.
Определитель паразитов позвоночных животных Чёрного и Азовского морей. - Киев: Наук, думка, 1975.-552 с.
Arthur J. R., Ahmet А. Т. A. Checklist of the parasites of fishes of Bangladesh // Rome, FAO, 2002. - FAO Fish. Techn. Paper. No. 369/1. - 77 pp.
Baylis H. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Di-octophymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Koehler A. V. A., Hoberg E. P., Torres-Perez F., Cook J. A. A molecular view of the superfamily Diocto-phymatoidea (Nematoda) // Comp. Parasitol. - 2009. - 76, 1. - P. 100 - 104.
Liu D. 50. Dioctophyme I Molecular detection of human parasitic pathogens. - Ed. Liu D. - CRC Press, Taylor & Francis Group, 2013. - P. 535 - 538.
Moravec F. Parasitic nematodes of freshwater fishes of Europe. - Kluwer Acad. Publ., 1994. - 473 pp
Род Dioctophyme Collet-Meygret, 1802
Синонимы (no: Moravec, 1994):
Eustrongylus Diesing, 1851 Mirandonema Kreis, 1945
Описание (по разным авторам, в том числе: Карманова, 1968; Baylis, 1939; Moravec, 1994). С характерными чертами семейства. Очень крупные черви. Головной конец округлый, хвостовой - тупой. Кутикула исчерчена. С каждой стороны тела одним сплошным рядом тянутся кутикулярные латеральные сосочки, которые доходят до его конца. Ротовое отверстие окружено округлыми папиллами, расположенными в два круга, по 6 папилл в каждом; папиллы наружного круга крупные, внутреннего -маленькие. Амфиды расположены латерально между кольцами папилл. Нервное кольцо окружает передний конец пищевода. Пищевод длинный, узкий, молочного цвета, заканчивается мощным клапаном. Кишечник ярко-красного цвета. Хвостовая бурса самца колоколообразная, без поддерживающих структур. Вульва открывается впереди заднего конца пищевода. Типовой и единственный вид - Dioctophyme renale (Goeze, 1782) Stiles, 1901.
После длительных дебатов, продолжавшихся почти два столетия, относительно правомочности использования названия Dioctophyme Collet-Meygret, 1802 или же Dioctophy-та Bose, 1803, Международная комиссия по зоологической номенклатуре - по запросу (Tollitt, 1987) - вынесла вердикт в пользу применения первого из них. Однако отдельные авторы и в настоящее время продолжают употреблять название Dioctophyma (см., напр., Dyer, 1998; Hemddez-Russo et al., 2014; Nakagawa et al., 2007 и др.).
Dioctophyme renale [=Ascaris renalis Goeze, 1782; =Ascaris canis et martis Schrank, 1788; =Ascaris visceralis Gmelin, 1790; =Strongylus gigas Rudolphi, 1802; ^Eustrongylus gigas (Rud., 1802); =Strongylus renalis Moquin-Tandon, 1860; =Eustrongylus visceralis Railliet, 1885; =Eustrongylus renalis Leiper, 1915]3. Столь обширный список синонимов данного вида - явное свидетельство сложной и довольно запутанной истбрии его описания. Впервые паразита обнаружили ещё в конце 16-го столетия, в 1583 г., но описан впервые он был только через 200 лет, в
3 Перечень синонимов приведён по работе Н. П. Шихобаловой (1968). В работе (Baylis, 1939) в числе синонимов D. renale перечислены 22 вида.
166
1782 г., по экземплярам, обнаруженным И. Геце (Y. Goeze) в почке собаки. К слову, за эти два столетия нематоду обнаруживали не единожды, но её или принимали за змею, или сближали с дождевыми червями4.
Видовое название связано с особенностями локализации червей: renale -почечный. В англоязычной литературе D. renale обычно называют giant kidney worm (гигантский почечный червь), а вызываемое им заболевание dioctophymatosis (диоктофиматозис), dioctophymiasis (диоктофимиазис), dioctophymosis (диоктофи-мозис), kidney worm infection (заражение почечным червем). В русскоязычной научно-популярной и справочной литературе D. renale, благодаря своим крупным размерам, получил название гигантского свайника, свайника-великана (рис. 53, 54).
Рис. 53 Внешний вид Dioctophymerenale (из: www.wikiwand.com)
Рис. 54 Гигантский свайник Dioctophyme renale в почке собаки (по Павловскому) (из: http://medbiol.ru/medbiol/dog/0011 fd2c.htm)
Поскольку вид D. renale является единственным в роде, то приведённая выше характеристика рода в равной степени применима и к данному виду. Дополним её некоторыми деталями, почерпнутыми из разных источников.
Черви очень крупные, ярко-розового, красноватого, коричневато-красного или кроваво-красного цвета, с мощным цилиндрическим телом, суженным к обоим концам. Самцы длиной до 20 - 45 см, диаметр тела 5-6 мм. Хвостовая бурса в форме колокола, из которой выступает единственная щетинковидная светло-коричневая спикула длиной от 6 до 14.5 мм, заметная даже невооружённым глазом. Самки длиной5 от 20 до 107 см при диаметре до 10 - 12 мм. Наиболее часто встре
4 История открытия и описания D. renale детально изложена в классической монографии Е. М. Кармановой (1968). Несмотря на то, что работа была опубликована почти 50 лет назад (для науки это - солидный срок!), она не потеряла своей значимости и по сей день. Её по-прежнему цитируют многие современные нематодологи, чьи публикации посвящены изучению диоктофимид.
5 Обычно в литературе указывают максимальную длину самца D. renale - 44 см, а самки -103 см. Самец длиной 44.3 см и самка длиной 107 см были выявлены Е. М. Кармановой (1960) у экспериментально заражённой собаки, которой скормили олигохет, содержащих личинок паразита; взрослые черви располагались соответственно в брюшной полости и правой почке животного. В монографии 1968 г. Е. М. Карманова подчёркивает, что «самые крупные зрелые экземпляры» самцов достигали 45 см и что ею «в эксперименте у собаки выращена самка длиной 105.0 см» (стр. 41).
167
чаются самки 55 - 65 см при ширине 7-12 мм. Вульва открывается недалеко от головного конца тела на уровне нижнего конца пищевода. Отверстие вульвы окружено складками в виде валиков; по краю отверстия располагаются мелкие папиллы. Яйца овальные, коричневато-жёлтого цвета, с толстой оболочкой, обладающей 60 -90 характерными полукруглыми вдавлениями, наподобие неглубоких карманов, по всей поверхности, за исключением полюсов (рис. 56).
публикациях, варьируют в пределах 60-
Рис. 56 Яйца Dioctophyme renale из концевого отдела матки червя (из: Карманова, 1968 - по: Скрябин, 1927)
Размеры яиц у червей из американской норки - 74.3 х 46.7 (Woodhead, 1950), из собаки - 62.01 - 75.15 х 36.35 - 53.03 (в среднем 67.23 ± 2.77 х 42.78 ± 2.85) pm (Pedrassani etal., 2009); в целом размеры яиц, приводимые в разных 84 х 38-52 pm (Baylis, 1939; Liu,
2013). Яйца откладываются до начала дробления или на стадии двух бластомеров.
Жизненный цикл D. renale включает промежуточного, паратонического и дефинитивного хозяев и протекает по следующей схеме (рис. 57).
Рис. 57 Схема жизненного цикла Dioctophyme renale
168
Яйца D.renale попадают во внешнюю среду с мочой хозяина. В воде в течение 15-100 дней происходит их созревание (йнвазионность зрелых яиц сохраняется во внешней среде в течение нескольких месяцев и даже лет). Эти яйца поедаются свободноживущими червями - водными олигохетами, в частности Lumbriculus va-riegatus (Карманова, 1960, 1968). В качестве промежуточного хозяина известны также мелкие бранхиобделлидные аннелиды Cambarincola spp., живущие в жаберной полости речных раков (Woodhead, 1950). Под действием пищеварительных соков хозяина крышечка на яйце растворяется (этот процесс занимает 5 мин), и личинка выходит в просвет кишечника. При помощи стилета (онхиостиля), в желобок которого стекает жидкость, секретируемая специальной маленькой железой, личинка пронизывает стенку кишечника олигохеты и проникает в полость её тела, а затем в брюшной кровеносный сосуд (Карманова, 1960; Woodhead, 1950). В организме промежуточного хозяина личинки дважды линяют и развиваются до инвазионной 3-й стадии (L3). Заражённых олигохет поедают пресноводные рыбы, в том числе осетровые, карповые, окунёвые, сомовые и многие другие, попав в которых личинки дальше не развиваются, а инкапсулируются в мышцах брюшной стенки тела, мезентерии, стенке пищеварительного тракта (Карманова, 1968; Measures, Anderson, 1985; Moravec, 1994). При этом, естественно, не исключается возможность заражения хищных рыб, к примеру, щуки, судака, от других рыб, ставших их жертвой.
Кроме рыб, личинок D. renale регистрируют у раков, крабов, лягушек, например, Chaunus ictericus (Pedrassani et al., 2010), и других амфибий. В 2014 г. появилось сообщение об обнаружении личинок- D. renale на юге Бразилии у 50 % обследованных особей пресноводной черепахи Trachemys dorbigni, у которой они локализовались в мышцах, целомической полости, мезентерии, серозе желудка, на поверхности лёгких, сердца, печени, поджелудочной железы, селезёнки и кишечника (Mascarenhas, Muller, 2014). Все выше перечисленные животные являются не промежуточными, а паратоническими (резервуарными) хозяевами в жизненном цикле данного паразита (Карманова, 1960, 1968).
Находящиеся на 3-й стадии развития личинки (рис. 58) жёлтого или рыжего цвета, нитевидные, со слегка заострённым передним и тупым задним концами, длиной 6 - 10 и диаметром 0.11 - 0.3 мм. Кутикула почти гладкая или исчерченная. Ротовые папиллы располагаются в двух кругах. В наружном круге четыре простые папиллы, а две латеральные - сложные. Ротовая полость короткая, пищевод длинный, цилиндрический, переходит в кишечник через клапаны. Кишечник тёмнокрасного цвета. Ректум бесцветный, открывается терминально. Личинки на этой стадии развития уже обладают половым диморфизмом.
Попав в окончательного хозяина, личинки через стенку желудка/кишечника проникают в его печень, где происходит их следующая линька. Примерно через 50 дней взрослые, но ещё не половозрелые черви мигрируют через перитонеальную полость к месту окончательной локализации - в почку, как правило, правую. При высокой заражённости черви могут заселять обе почки. Иногда паразит не достигает почки и заканчивает развитие в брюшной полости. Самцы после копуляции живут ещё некоторое время, а затем погибают; самки же откладывают яйца в почечную ткань, откуда те выносятся в мочевой пузырь и далее во внешнюю среду. В отсутствии самцов самки неоплодотворённые яйца не откладывают. Полный жизнен
169
ный цикл нематоды от яйца и до яйца занимает 2 года. Продолжительность жизни D. renale в организме окончательного хозяина достигает 3-5 лет.
Рис. 58 Dioctophyme renale^ личинка 3-й стадии; а - головной конец тела; б - область границы пищевода и кишечника; в - хвостовой конец тела самца; г - хвостовой конец тела самки; д - инкапсулированная личинка из щуки (из: Определи-
тель, 1987 - по: Карманова, 1968)
D. renale широко распространён в мире, особенно в странах умеренного климата, но в Африке и Океании данный вид редок. В странах Европы, Азии, Америки, Африки в числе хозяев гигантского свайника известны домашние и уличные собаки, шакал чепрачный, койот, лисицы серая, серебристо-чёрная и обыкновенная, голубой песец, росомаха, енотовидная собака, куньи, а также медведь, крыса серая, обезьяна-капуцин, енот, дикий кабан, нерпа обыкновенная (Андреянов и др., 2009; Карманова, 1968; Anderson, 2000; Cameiro et al., 1974; Hajialilo et aL, 2015; Hernandez-Camacho et al., 2011; Hoffman et aL, 2004; Nakagawa et aL, 2007; Pedrassani et aL, 2009; Tokiwa et aL, 2011; Whelen et aL, 2011 и др.). В США и Канаде основные дефинитивные хозяева D. renale- американская норка (Crichton, Urban, 1970; Dyer, 1998; Hallberg, 1953; Mace, 1976; Measures, 2001), американская куница (Seville, Addison, 1995), собаки (Dunne, 1940; Wislocki, 1919), в Южной Америке, и, прежде всего, в Бразилии - гризоны (семейство куньих) (Barros et aL, 1990), а также псовые, в том числе собака кустарниковая (Ргоеп^а, 1935), лисица саванновая, или майконг (Ribeiro et aL, 2009), волк гривистый, или гуара (Duarte et aL, 2013). В Бразилии паразита нашли также у носухи обыкновенной (Milanelo et aL, 2009) и ленивца южного двупалого (Rocha et aL, 1965). На Северо-Западном Кавказе на территории Краснодарского края D. renale выявлен у лисицы обыкновенной (Итин, 2014; Итин, Кравченко, 2010), а также у енотовидной собаки и шакала (Итин, 2014). Ре
170
гистрируют D. renale и у кошек, в том числе домашних, однако заражение этих животных носит достаточно случайный характер (Pedrassani et al., 2010, 2014; Stefans-ki et al., 1936; Verocai et al., 2009 и др.).
Некоторые исследователи подчёркивают, что домашние собаки являются нетипичным, временным или случайным, хозяином D. renale (Kommers et aL, 1999; Nakagawa et al., 2007). Однако если судить по регулярным находкам этих нематод именно у собак, как домашних, так и безнадзорных (Карманова, 1968; Bellini, Ferreira, 2001; Dunne, 1940; Ferreira et al., 2010; Gargili et al., 2002; Hall, 2005; Hemadez-Russo et al., 2014; Leite et al., 2005; Samuell et al., 1990; Wislocki, 1919 и др.), то этих животных, впрочем, как и всех псовых, следует отнести к обычным хозяевам гигантского свайника. На севере Ирана, к примеру, паразита выявили у 13 % обследованных особей уличных собак и 35 % шакала (Sadighian et al., 1967). В «Большой Медицинской Энциклопедии» 1929-го года выпуска утверждается, что на территории России этот паразит встречается у собак почти повсюду (БМЭ, 1929). Многочисленные примеры регистрации D. renale у собак на территории бывшего Советского Союза приводит в своей монографии Е. М. Карманова (1968) (рис. 59).
Рис. 59 Dioctophyme renale, личинка 3-й стадии в стенке желудка собаки (из: Карманова, 1968)
Более того, уже в настоящее время О. И. Калинина (2005, 2012) отмечает, что в последние годы в Приморском крае, по данным ветнадзора, случаи заражения собак гигантским свайником участились.
Ещё в середине прошлого сто-
летия один из исследователей (Dunne, 1940), описывая вызванную паразитированием D. renale патологию почки у 4-летней собаки в штате Айова, предположил, что реальная цифра заражения этих животных в Северной Америке в два раза выше официальной. К тому времени, по данным цитируемого автора, было известно 75 подобных случаев.
Предполагается, что у домашних животных - крупного рогатого скота, овец, коз, свиней, лошадей, а также домашней птицы D. renale не паразитирует, хо
тя возможность их заражения нематодами во время водопоя в случае заглатывания с водой инвазированных олигохет не исключается (Anderson, 2000; Measures, 2001; Woodhead, 1950). Действительно, в мире известны единичные находки этих гельминтов у лошадей и крупного рогатого скота, которые анализирует в своей монографии Е. М. Карманова (1968). Замечу, что картина поражения этих животных практически ничем не отличается от таковой, наблюдаемой у других хозяев.
Иными словами, D. renale демонстрирует удивительную приспособленность к жизни в организме самых разных представителей млекопитающих.
Обычно в одном животном встречается один червь, множественное заражение наблюдается редко (Barros et al., 1990; Miranda et al., 1992; Monteiro et al., 2002; Nakagawa et al., 2007). Известное максимальное количество нематод, обнаруженное в одном хозяине, составило 34 экз. (Monteiro et al., 2002). Именно столько червей
171
насчитали в Бразилии у собаки смешанной породы, причём 28 экз. из этого числа было найдено в абдоминальной полости животного, а 6 - в правой почке.
Половозрелые особи D. renale поселяются в почках (предпочтительная локализация) или абдоминальной полости, реже в мочевом пузыре и мочевыводящих каналах. Предпочтительная локализация в правой почке может быть связана с её более близким расположением к печени и двенадцатиперстной кишке, откуда паразит и проникает к почке. К примеру, у американской норки в 86 % случаев черви локализовались в правой почке, в 6 % - только в абдоминальной полости, а в 7 % -и в почках, и в полости (Fyvie, 1971). Однако у носухи обыкновенной - обитателя одного из национальных парков Бразилии, где гигантский свайник был выявлен у 75 % обследованных особей данного вида, - в 47 % случаев черви встретились в абдоминальной полости, в 17.8 % - только в правой почке, а в 19.6 % - и в правой почке, и в брюшной полости (Milanelo et al., 2009).
Иногда этих гельминтов находят в совершенно нетипичных местах: например, у собак их обнаруживали в молочной железе (Hall, 2005; Samuel! et al., 1990), желудке (Miranda et al., 1992), подкожном узле в паховой области (Mattos-Junior, Pinheiro, 1994), а у кошек - в грудной полости (Stefanski et al., 1936).
Поскольку нематоды питаются кровью и клетками тканей, которые растворяют пищеварительными энзимами, они наносят серьёзный вред здоровью животного-хозяина. Разрушенная паренхима почек замещается соединительной тканью, почечные канальцы атрофируются, и в результате от почки фактически остаётся только капсула, окружающая червя (см. рис. 44). Поскольку обычно у животного заражена одна почка, как правило, правая, то вторая берёт на себя всю нагрузку, и вследствие большей нагрузки оказывается намного крупнее, чем та же почка у здорового животного (Leite et al., 2005): у американской норки, например, на 60 % (Масе, 1976), а у собаки - почти в 2 раза (Dunne, 1940).
У заболевших животных могут наблюдаться нефрит (воспаление почки), гематурия (кровь в моче), пиурия (гной в моче), почечные колики (в случае миграции червей в мочеиспускательный канал). При локализации червей в мочевом пузыре у животных развивается воспаление мочевого пузыря. Вполне возможно, что яйца нематод могут провоцировать образование камней, о чём свидетельствует, например, их обнаружение в камне, извлечённом из мочевого пузыря 4-летней собаки на севере Онтарио (Канада) (Whelen et al., 2011). Если же черви остаются в абдоминальной полости, то они могут вызывать перитонит (воспаление брюшины), а также гепатит (воспаление печени) и асцит (скопление жидкости в брюшной полости) (Масе, 1976; Measures, 2001; Verocai et al., 2009 и др.). Заболевание сопровождается потерей веса, общей слабостью, истощением организма, конвульсиями, анемией. Почечная недостаточность, а в ряде случаев разрыв почки могут привести - и приводят - к фатальному исходу.
Диагноз на поражение гигантским свайником чаще всего ставится только при аутопсии животного или в ходе операции, проводимой по другим причинам. И хотя инвазию можно выявить по наличию яиц нематоды в моче животного, но следует учесть, что при поселении самки паразита в абдоминальной полости или в случае заражения только самцами, яйца в моче отсутствуют. Наиболее оптимальным способом выявления взрослых червей в почках и/или брюшной полости является ультразвуковое сканирование.
172
D. renale - самая крупная нематода из числа паразитирующих у человека, причём, как выяснилось этот червь встречался у людей ещё многие тысячелетия назад. В Швейцарии яйца D. renale были найдены в шести копролитах на стоянке людей времён неолита возле озера, обилие рыбы и лягушек в котором обеспечивало их пищей (LeBailly et al., 2003). Авторы находки предположили, что на ранней стадии развития человеческого общества люди были сильнее заражены этими нематодами, поскольку ещё отсутствовало понимание необходимости тщательной термической обработки рыбы.
И. Игнятович с колл. (Ignjatovic et al., 2003), сообщая о находке D. renale у 44-летнего мужчины, заразившегося во время пребывания в одной из стран региона Каспийского моря, подчёркивают, что к 1949 г. в литературе было известно всего 9 аутеничных случаев заражения людей данной нематодой. По другим сведениям, с 1657 по 1959 гг. был описан 21 случай, когда у людей или обнаруживали этих червей при аутопсии, или же нематоды самопроизвольно выходили при мочеиспускании (Begg, 1959). В частности, ещё в 1886 г. Р. Бланшар (Blanchard) писал о 87-сантиметровом черве, которого выявили при аутопсии в мочевом пузыре усопшего, и перечислил 9 случаев поражения гигантским червем жителей Европы.
В наше время D. renale редко регистрируют у людей; тем не менее, такие случаи известны в самых разных странах и фактически на всех континентах (кроме Антарктиды, разумеется). Примечательно, что сообщения о подобных случаях в последние годы стали появляться в печати значительно чаще, что наглядно иллюстрируют и ссылки на источники.
После 1959 г. появились публикации о регистрации D. renale у человека в Бразилии (Amato et al., 1976), США (Beaver, Theis, 1979; Gutierrez et al., 1989), Иране (Hanjani et al., 1968), Индии (Agrawal et al., 2014; Venkatrajaiah et al., 2014), Китае (Li et al., 2010), Японии (Urano et al., 2001), Индонезии (Sardjono et al., 2008), Корее (Park et al., 2013), Таиланде (Beaver, Khamboonruang, 1984), Австралии (Fernando, 1983) и ряде других стран (Гефтер, 1968; Плотников, 1977; Levine, 1968; Narvaez et al., 1994; Olsen, 1973; Sun et al., 1986).
На территории России у человека паразита впервые зарегистрировали в 1928 г. на Дальнем Востоке в низовьях Амура у местного жителя - гиляка (БМЭ, 1929; стр. 272). Е. М. Карманова (1968) упоминает о случае обнаружения паразита К. И. Скрябиным и В. П. Подъяпольской у женщины гольдки на Дальнем Востоке в 1929 г. Информация о двух находках D. renale в Казахстане и Воронежской области приведена в публикации В. П. Подъяпольской и В. Ф. Капустина (1950). В 2002 г. появилось сообщение об обнаружении гигантского свайника у девочки в Архангельске, у которой паразит вышел необычным путём - через плевральный дренаж (Лысенко и др., 2002). В 2008-м году выявлено заражение человека в Камчатском крае6. Помимо того, на одном из сайтов размещена информация - без необходимой в таких случаях ссылки на источник - о регистрации диоктофим у человека в Казахстане, в Воронежской области и на Дальнем Востоке7.
6 «О заболеваемости редкими гельминтозами и протозоонозами в Российской Федерации в 2008 году». - www.cgekuban.ru/gig/prof/lek/gelm.php.
7 Информация размещена на сайте: www.zooclub.ru/wiki.29.shtml. Скорее всего, эти данные заимствованы из монографии Е. М. Кармановой (1968; стр. 77).
173
У человека паразит обычно поселяется в почках, реже мочевом пузыре. Иногда - при множественной инвазии - черви могут поражать оба органа одновременно, что в частности иллюстрирует уникальный случай обнаружения нематод у 67-летнего жителя Явы, который в течение двух месяцев чувствовал определённый дискомфорт в левой части спины и у которого во время мочеиспускания самостоятельно выделился крупный червь (Sardjono et al., 2008). При цистоскопии в его мочевом пузыре обнаружили множество червей, а при последующем обследовании выявили расширение левой почки, а также многочисленных червей в коре почки и почечной лоханке. Длина тела нематод, которых определили как D. renale, достигала 35 - 40 см, а толщина 2-3 мм. Несмотря на медицинское вмешательство, включая удаление сильно повреждённой почки, состояние здоровья пациента продолжало ухудшаться, и через 8 дней после поступления в клинику он скончался.
Однако не менее удивительный случай самопроизвольного выделения червей из мочевого пузыря человека был описан ещё в 1898 г. в США (Morehouse, 1898). У 58-летнего жителя штата Огайо с 27 марта 1896 г. и в течение нескольких последующих дней выделилось 58 червей длиной от одного дюйма и до одного фута, т.е. от 2.5 до 30 см. К слову, паразит указан автором публикации под названием Eustrongylus gigas.
О самостоятельном выделении двух нематод из уретры 61-летней жительницы Болгарии пишет и В. А. Гефтер (1968), ссылаясь на статью К. Rangueloff-Simeonoff (1961), найти которую мне не удалось.
Помимо обычных мест локализации, нематоды могут встречаться и в других частях тела, например, в подкожных узлах (Beaver, Khamboonruang, 1984; Beaver, Theis, 1979; Gutierrez et al., 1989; Tokiwa et al., 2014; Urano et al., 2001). Так, у 23-летней жительницы штата Огайо (США) нематоду обнаружили в подкожной ткани брюшной стенки тела (Gutierrez et al., 1989), у проживающей в Японии 26-летней китаянки - с внутренней стороны левого бедра (Urano et al., 2001), а у 12-летнего мальчика на севере Таиланда и у мужчины в центральной Калифорнии (США) - на передней стенке грудной клетки (соответственно: Beaver, Khamboonruang, 1984; Beaver, Theis, 1979). В последнем из перечисленных случаев паразита отнесли к D. renale условно, не исключив его возможной принадлежности к другому представителю семейства диоктофимид -Eustrongylides sp. (Beaver, Theis, 1979).
В основе патогенеза D. renale лежат токсико-аллергические реакции и механическое воздействие гельминтов, а вызываемые ими в организме человека патологические изменения первоначально определяются миграцией личинок к почке -месту обычного обитания, а уже затем пребыванием взрослых червей в органе. Заражение людей, как правило, сопровождается гематурией и пиурией, тошнотой и рвотой (особенно в момент проникновения червя через стенку желудка или кишечника в брюшную полость), субфебрильной температурой, почечными коликами, диффузной кальцификацией, слабостью, исхуданием, анемией. Очень часто пациенты жалуются на боли в поясничной и паховой области, при этом боли могут распространяться по всему животу. В очень редких случаях наблюдается хроническая почечная недостаточность, которая может оказаться смертельной для человека (Li et al., 2010). Так, 7 февраля 2015 г. в новостном канале «NewsToday» сообщили о кончине 76-летней жительницы Чехии, у которой в почке и мочевом пузыре обнаружили по одному экземпляру D. renale (http://outbreaknewstoday.com/dog-kidney-worm-found-in-czech-republic-woman-22594/).
174
Иногда клинические признаки заражения нематодами напоминают таковые при злокачественных опухолях, а паразиты выявляются только при оперативном вмешательстве (Gu et al., 2012; Katafigiotis et al., 2013; Sun et al., 1986). В этом отношении показателен следующий пример. У 50-летнего китайца при ультразвуковой и компьютерной томографии в правом верхнем квадранте брюшной полости обнаружилась ретроперитонеальная масса. При операции пациенту удалили геморрагическую цисту, располагавшуюся в правом верхнем полюсе почки, прилегающем к надпочечнику. Стенка этой цисты состояла из гранулёматозной ткани, содержащей яйца и поперечные срезы паразита, которых определили как «Dioctophy-та renale». При этом яйца нематод в моче больного отсутствовали (Sun et al., 1986).
В то же время описан случай одновременного обнаружения у пациента и злокачественной фиброзной гистиоцитомы мочевого пузыря и атрофии почки, вызванной поселившимся в ней гигантским свайником (Park et al., 2013).
Диагноз на наличие инвазии D. renale ставится на основании обнаружения в моче больного яиц нематоды, изучения истории заболевания пациента, радиологического исследования увеличенной или кальцифицированной почки. Анализ мочи может также показать наличие в ней крови и гноя, выявить эозинофилию. Однако следует учесть, что у человека довольно часто паразитирует только одна самка с неоплодотворёнными яйцами, которые она не откладывает, либо единственный самец, вследствие чего в подобных случаях яйца нематоды в моче не встречаются.
И всё же инвазия людей D. renale регистрируется редко, поэтому стандартных методов лечения пока не разработано, хотя и сообщается о применении препарата ивермектина (Ivermectin) для лечения пациента (Ignjatovic et al., 2003).
Единственным способом избавления от паразита следует признать его хирургическое удаление с последующим лечением почечных расстройств; в исключительно редких случаях приходится удалять сильно поражённую почку.
И, наконец, несколько слов относительно высказываемых опасений по поводу возможности заражения человека яйцами D. renale от инвазированных домашних собак и/или кошек. Подобные опасения беспочвенны, поскольку люди заражаются не яйцами, а только личинками нематоды и только через рыб, лягушек или же раков.
Отдельные исследователи подчёркивают незначительную роль собак в эпидемиологии человека, связанной с D. renale (Morgan, 2Q13). Действительно, несмотря на то, что собаки выступают в роли паразитоносителя, их заражение в природе не носит столь масштабного характера, чтобы представлять прямую угрозу для людей. Однако с целью предупреждения распространения диоктофим в природе не следует кормить собак сырой рыбой, выловленной в сомнительных водоёмах, а чтобы исключить случайное заглатывание заражённых олигохет, нельзя позволять им пить воду из подобных источников. К сожалению, к бродячим собакам подобные меры применить практически невозможно. Но! - в нормальном обществе не должно быть бездомных животных!
Итак. Заражение человека гигантским свайником происходит через сырую или полусырую рыбу, не обработанное мясо амфибий или же раков, а единственной профилактической мерой является соблюдение рекомендуемого режима технологической обработки продуктов. Предполагается также, что заражение возможно при случайном заглатывании инвазированных олигохет, например, при купании в мелких стоячих или медленно текущих водоёмах или питье воды из таких водоёмов.
175
По этой причине воду из подобных водоёмов следует пить только после кипячения, или же профильтровав её через ткань (Плотников, 1977).
В этой связи хочу обратить внимание читателей на следующую информацию, размещённую на сайте «Plpnemweb.usdavis.edu/nematodex/Taxadata/Drenale.html»: «Humans may be infected by consumption of molluscs (выделено мною - АГ) that are infected with Dioctophyma renale». Иными словами, предполагается, что люди могут заражаться, употребляя в пищу моллюсков, инвазированных D. renale. Какие-либо примеры, иллюстрирующие сказанное, отсутствуют.
Напомню, что промежуточный хозяин D. renale - пресноводные олигохеты, которых могут поедать рыбы, амфибии, ракообразные, черепахи, получающие вместе с пищей и личинок паразита. Именно эти животные и выступают в роли своеобразного транспортного звена, передающего личинок нематод дальше по трофической цепочке к млекопитающим, в том числе человеку. Моллюски не питаются аннелидами, а потому получить от них (или с ними) этих личинок не могут, следовательно, и не могут быть источником заражения людей нематодами данного вида. В то же время хорошо известно, что многие моллюски являются источником заражения человека патогенными трематодами (Гаевская, 2015)8.
Цитируемая литература
Андреянов О.Н., Сафиуллин Р. Т., Горохов В. В., Абалихин Б. Г и др. Заражённость хищников семейства псовых в различных эколого-географических зонах Центрального Нечерноземья России // Теория и практика борьбы с паразитарными болезнями (посвящается 80-летию со дня рождения Андрея Стефановича Бессонова). - М., 2009. - Вып. 10. - С. 17-20.
БМЭ- Большая Медицинская Энциклопедия. - Гл. ред. Н. А. Семашко. - М.: АО «Советская Энциклопедия», 1929. - 9. - С. 274.
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Итин Г. С. Особенности гельминтофауны диких хищных млекопитающих в ландшафтно-географических зонах Северо-Западного Кавказа: Дисс...канд. биол. наук: 03.02.08 - экология. - Краснодар, 2014.-171 с.
Итин Г С., Кравченко В. Л/. Эколого-фаунистическая характеристика гельминтов лисицы обыкновенной на территории Краснодарского края, -http://www.kubanvet.ru/joumal_n3_20107.html.
Калинина О. И. Биология гельминтов и профилактика гельминтозов (учебное пособие). - Владивосток: Изд-во ТГЭУ, 2005. - 80 с.
Калинина О. И. Биологические основы санитарно-профилактических мероприятий в охотничьих хозяйствах юга Дальнего Востока: учебное пособие. - Владивосток: Дальнаука, 2012. - 84 с
Карманова Е. М. К расшифровке цикла развития нематоды Dioctophyme renale (Goez£9 1782) - паразита почек хищных млекопитающих и человека И Докл. АН СССР. - 1960. - 132, 5. - С. 1219 - 1220.
Карманова Е. М. Диоктофимидеи животных и человека и вызываемые ими заболевания И Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1968. - 20. - 262 с.
Лысенко А. Я., Авдюхина Т. И., Горбунова Ю. П., Константинова Т. Н., Романенко Л. Н., Владимова М. Г. Случай диоктофимоза {Dioctophyme renale) у девочки из Архангельска // Медицинская паразитология и паразитарные болезни. - 2002. - N 4. - С. 48 - 50.
Определитель паразитов пресноводных рыб. Т. 3. Паразитические многоклеточные. - Л.: Наука, 1987. - 583 с. - (Определители по фауне СССР, изд. Зоол. ин-том АН СССР; Вып. 149).
Плотников Н. Н. Диоктофимоз / Большая Медицинская Энциклопедия. - Гл. ред. акад. Б. В. Петровский. - М.: Изд-во «Советская Энциклопедия», 1977. - С. 333.
^Гаевская А. В. Мир паразитов человека. I. Трематоды и трематодозы пищевого происхождения. - Севастополь: НПЦ ЭКОСИ-Гидрофизика, 2015. - 410 с.
176
Подъяполъская В. П., Капустин В. Ф. Глистные заболевания человека. - М.: Медгиз, 1950. - С. 276 -514.
Скрябин К. И. К характеристике Dioctophyme renale (Goeze, 1782) - паразита почек млекопитающих И Тр. Гос. ин-та эксперимент, ветеринарии. - 1927.-4, 2. - С. 130 - 145.
Шихобалова Н. П. Глава 1. Введение в медицинскую гельминтологию / Протозойные болезни, гель-минтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 271 - 318. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Agrawal R, Kumar Р., Mishra Р. Р., Gupta R., Premi Н. К Dioctophyma renale: a chance finding on bladder catheterization on a pregnant female П Indian J. Med. Case Rep. -2014.-3, 1. - P. 70 - 72.
Amato J. F. R, Grisi L., Rosa И L. M. ReuniSo dos casos brasilieros de dioctofimose canina, com registro do caso de mais alta intensidade de infec^So por Dioctophyme renale (Goeze, 1782) П Rev. Bras. Biol. - 1976. -36.-P. 117-122.
Anderson R. C. Nematode parasites of vertebrates: Their development and transmission. 2nd ed. - Oxon: CABI Publ., 2000. -P. 595-597. http://dx.doi.org/10.1079/9780851994215.0000.
Barros D. M., Lorini M. L., Persson V. G. Dioctophymosis in the little grison (Galictis cuja) П J. Wildl. Dis. -1990. - 26, 4. -P. 538 - 539. doi: 10.7589/0090-3558-26.4.538.
Baylis H. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Beaver P. C, Khamboonruang C. Dioctophyma-hke nematode in a subcutaneous nodule from man in Northern Thailand П Am. J. Trop. Med. Hyg. - 1984.-33, 5. - P. 1032 -1034.
Beaver P. C., Theis J. H. Dioctophymatid larval nematode in a subcutaneous nodule from man in California // Am. J. Trop. Med. Hyg. - 1979. - 28, 2. - P. 206-212.
Begg R.C. Parasitic infections of the genitor-urinary tract. II. Metazoa. I. Hclminthes. A) Nematoda H Encyclopedia of Urology. - 1959. - 9, 2. - P. 236 -251.
Bellini E., Ferreira C. Dioctophyma renale en el perro. Primer hallazgo en Uruguya П Veterinaria. - 2001. -36, l.-P. 21-24.
Blanchard R. Nouvelle observations de strongyle geant chez 1’homme // Compt. Rend. Soc. Biol., Paris. -1886.-3.-P. 379.
Carneiro J. R., Pereira E., Puglia L. R. Nota sobre a ocorrencia de Dioctophyme renale (Goeze, 1782) em Goiania// Rev. Parasotol. Trop. - 1974.-3.-P. 215-216.
Crichton И J., Urban R. E. Dioctophyme renale (Goeze, 1782) in Manitoba mink 11 Can. J. Zool. - 1970. -48.-P. 591 -592.
Duarte J., Costa A. M. B., Katagiri S.t Martins J. A.t Oliveira M. E., Ribeiro С. M. Parasitism by Dioctophyme renale (Goeze, 1782) in maned wolf (Chrysocyon brachyurus), Brazil 11 Vet. Zootec. - 2013. - 20, l.-P. 52-56.
Dunne H. W. A case of Dioctophyme renale in a dog // Iowa State Univ. Vet. - 1940. - 2, 3, Article 5. - P. 115-116. Available at: http://lib.dr.iastate.edU/iowastate_veterinarian/vol2/iss3/5.
Dyer N. ИС Dioctophyma renale in ranch mink // J. Vet. Diagn. Invest. - 1998. - 10, 1. - P. 111 - 113.
Fernando S. S. The giant kidney worm (Dioctophyma renale) infection in man in Australia // Am. J. Surg. Pathol.- 1983.-7, 3.-P. 181-184.
Ferreira V. L.t Medeiros F. P.r July J. R., Raso T. F. Dioctophyma renale in a dog: clinical diagnosis and surgical treatment H Vet. Parasitol. - 2010. - 168. - P. 151-155.
Fyvie A. Dioctophyma renale I Davis J. W., Anderson R. C. (Eds.). Parasitic Diseases of Wild Mammals. -Iowa State Univ. Press, Ames, 1971. - P. 258 - 262.
Gargili A., Firat Toparlak M., Qetinkaya H. First case report of Dioctophyma renale (Goeze, 1782) in a dog in Istanbul, Turkey 11 Turk. J. Vet. Anim. Sci. - 2002. - 26. - P. 1189-1192.
Gu У., Li G., Zhang J., Zhang Y. Dioctophyma renale infection masquerading as a malignancy I I Kidney Intern. - 2012. - 82. - P. 1 342. Doi: 10.1038/ki.2012.315.
Gutierrez Y., Cohen M., Machicao C. N. Dictyophyme larva in subcutaneous tissues of a woman in Ohio I I Am. J. Surg. Pathol. - 1989. - 13. - P. 800 - 802.
Hajialilo E., Mobedi L, Masoud J., Hasanpour H.t Mowlavi G. Dioctophyme renale in Vulpes vulpes from the Caspian Sea littoral of Iran П Iran. J. Publ. Health. - 2015. - 44, 5. - P. 698 - 700.
Hall P., Corral F., Lattanzio L., Ontiveros L., Cardillo N. Reporte de un caso de Dioctophyma renale en teji-do mamario de un canino hembra П InVet. - 2005. - 7. - P. 188- 189.
Hallberg C. W. Dioctophyma renale (Goeze. 1782) a study of the migration routes to the kidneys of mammals and resultant pathology // Trans. Amer. Microsc. Soc. - 1953. -72, 4. - P. 351 - 363.
177
Hanjani A. A., Sadighian A., Nikakhtar B. The first report of human infection with Dioctophyma renale in Iran I I Trans. R. Soc. Trop. Med. Hyg. - 1968. - 62, 5. - P. 647 - 648.
Hernandez-Camacho N., Pineda-Lopez R., Lopez-Gonzalez C. A, Jones R. W, Nematodes parasites of the gray fox (Urocyon cinereo argenteus, Schreber, 1775) in the seasonally dry tropical highlands of central Mexico H Parasitol. Res. - 2011. - 108. - P. 1425 - 1429.
Hernandez-Russo Z.t Supparo-Rizzardini E, dos Santos-Nunez C, Nan-Monte F. N. Dioctophyma renale in caninos (Canis familiaris) de Uruguya // Neotrop. Helminthol. -2014.-8, l.-P. 123- 130.
Hodda M. Animal biodiversity П Zootaxa. - 2011. - No 3148. - P. 63 - 95.
Hoffman V., Nolan T. J., Schoelkopf R. First report of the giant kidney worm (Dioctophyme renale) in a harbor seal (Phoca vitulina) H J. Parasitol. - 2004. - 90,3. - P. 659 - 660. doi: http://dx.doi.org/10.1645/GE-198R.
Ignjatovic Stojkovic L, Kutlesic C., Tasic S. Infestation of the human kidney with Dioctophyme renale //Urologia Intern.-2003.-70, l.-P. 70-73. Doi: 10.1159/000067695.
Katafigiotis L, Fradkiadis E., Pournaras C, Nonni A.t Stavodimos K.G. A rare case of a 39year old man with a parasite called Dioctophyma renale mimicking renal cancer at the computed tomography of the right kidney. A case report I I Parasitol. Intern. - 2013. - 62, 5. Doi: 10.1016/j/parint.2013.06.007.
Kommers G. D., Ilha M. R. S, Barros C. S. L. Dioctofimose em cSes: 16 casos // Ciencia Rural, Santa Maria. -1999.-29, 3.-P. 517-522.
LeBailly M., Leuzinger U., Bouchet F. Dioctophymidae eggs in coprolites from neolithic site of Arbon-Bleiche 3 (Switzerland) П J. Parasitol. - 2003. - 89. - P. 1073 - 1076. doi: 10.1645/ge-3202m.
Leite L. C, Cirio S. M., Diniz J. M.F. et al. LesSes anatomopatol6gicas presentes na infec^o por Dioctophyma renale (Goeze, 1782) em cSes dom^sticos (Canis familiaris Linnaeus, 1758) // Arch. Vet. Sci. - 2005. -10, l.-P. 95-101.
Levine N. D. Nematode parasites of domestic animals and of man. - Bragess Publ. Comp., Minneapolis, Minnesota, 1968. - 600 pp.
Li G., Liu C, Li F, Zhou M., Liu X., Niu Y. Fatal bilateral dioctophymatosis // J. Parasitol. - 2010. - 96, 6. -P. 1152- 1154.
Liu D. 50. Dioctophyme I Molecular detection of human parasitic pathogens. - Ed. Liu D. - CRC Press, Taylor & Francis Group, 2013. - P. 535 - 538.
Mace T. F. Lesions in mink (Mustela vison) infected with giant kidney worm (Dioctophyma renale) // J. Wildlife Dis. - 1976. - 12, 1. -P. 88-92. Doi: 10.7589/0090-3558-12.1.88.
Mascarenhas C., Mtiller G. Third-stage larvae of the enoplid nematode Dioctophyme renale (Goezs, 1782) in the freshwater turtle Trachemys dorbigni from southern Brasil П J. Helminthol. - 2014. - 89, 5. - P. 1-6.
Mattos-Junior D. G., Pinheiro J. Dioctophyma renale (Goeze, 1782) in subcutaneous tissues of the inguinal region of a dog 11 Arq. Bras. Med. Vet. Zootec. - 1994. - 46. - P. 301 - 302.
Measures LN. Dioctophymatosis / Samuel W. M., Pybus M. J., Kocan A. A. Parasitic Diseases of Wild Mammals. 2nd ed. - Iowa State Univ. Press; 2001. - P. 357 - 364. http://dx.doi.org/10.1002/ 9780470377000.chl3.
Measures L. N, Anderson R. C. Centrarchid fish as paratenic hosts of the giant kidney worm, Dioctophyma renale (Goeze, 1782) H J. Wildlife Dis. - 1985. - 21. - P. 11 - 19.
Milanelo L., Moreira M. B., Fitorra L. S, Petri B. S. S, Alves M., dos Santos A. C. Occurrence of parasitism by Dioctophyma renale in ring-tailed coatis (Nasua nasua) of the Tiete Ecological Park, Sio Paulo, Brasil // Pesq. Vet. Bras. - 2009. - 29, 12. http://dx.doi.org/10/1590/S0100-736X2009001200001.
Miranda M. A., Benigno R. N. M., Calvao G. R., De Oliveira S. A. L. Dioctophyma renale (Goeze, 1782): ectopic localization and high intensity of infection in Canis familiaris from the State of Рагй П Arq. Bras. Med. Vet. Zool. - 1992. - 44, 2. - P. 151 - 153.
Monteiro S. G., Sallis E. S. V., Stainki D. R. Infec^o natural por trinta e quatro helmintos da espicie Dioctophyma renale (Goeze, 1782) em urn cio I I Rev. Fac. Zootec. Vet. Agro. Uruguaiana. - 2002. - 91. - P. 95 -99.
Moravec F. Parasitic nematodes of freshwater fishes of Europe. - Kluwer Acad. Publ., 1994. - 473 pp.
Morehouse G. ИС Eustrongylus gigas H J. Amer. Med. Assoc. - 1898. - 30, № 13. - P. 717-718. Doi: 10.1001 /jamal 898.72440650025001 html.
Morgan E. P. Dogs and nematode zoonoses I Dogs, Zoonoses and Public Health. - Eds. Macpherson C. N. L., Meslin F.-X., Wandeler A. I. - 2nd Edition. - CAB Intern., 2013. -P. 153 - 161.
Nakagawa T. L.t Bracarense A. P., dos Reis A. C., Yamamura M. H, Headley S. A. Giant kidney worm (Dioctophyma renale) infections in dogs from Northern Parani, Brazil // Vet. Parasitol. - 2007. - 145, 3 - 4. -P. 366-370.
Narvaez J. A., Turell L. P., Serra J., Hidalgo K. Hyperdense renal cystic lesions caused by Dioctophyme renale 11 Amer. J. Roentgenol. - 1994. - 163, 4. - P. 997 - 998.
178
Olsen О. ИС Animal parasites. Their life cycle and ecology. 3rd ed. - Univ. Park Preaa, Baltimore, Maryland, 1973.-562 pp.
ParkH.Y., Seo J. W., Lee В. H, Lee J. Y., Kim S. Y. et al. Simultaneous occurrence of malignant fibrous histiocytoma of the ureter and Dioctophyma renale infection: A case report 11 J. Korean Soc. Radiol. - 2013. -68, 5.-P. 411-415.
Pedrassani D., Hoppe E. G. L., Avancini N, Nascimento A. A. Morphology of eggs of Dioctophyme renale Goeze, 1782 (Nematoda: Dioctophymatidae) and influences of temperature on development of first-stage larvae in the eggs И Rev. Bras. Parasitol. Vet.- 2009. - 18, 1. - Online version. http://dx.doi.org/10.4322/rbpv.01801003.
Pedrassani D., Wendt H, Rennau E. A, Pereira S. T, Wendt S. B. Dioctophyme renale Goeze, 1782 in a cat with a supernumerary kidney 11 Rev. Bras. Parasitol. Vet. -2014.-23, l.-P. 109-111.
Pedrassani D., Wendt S. В. T, Pilati C., Machado R. Z., Nascimento A. A. Diagndstico ultrassonogr&fico de infec^ao intensa por Dioctophyme renale em rim esquerdo de сйо - relato de caso 11 Clin. Vet. - 2010. - 85, l.-P. 74-80.
Proenqa C. Sobre dois casos de Dioctophyme renale em cao no Rio de Janeiro П Bol. Vet. Exerc. - 1935.-2. -P. 50-51.
Ribeiro С. T, Verocai G. G., Tavares L. E. Dioctophyme renale (Nematoda, Dioctophymatidae) infection in the crab-eating fox {Cerdocyon thous) from Brazil 11 J. Wildlife Dis. - 2009. - 45, l.-P. 248 - 250.
Rocha U. F., Serra R. G., Grechi R. Parasitismo por Dioctophyma renale (Goeze, 1782) em “preguiQa” Cho-loepus didactyus, Linnaeus, 1758 П Rev. Farm. Bioquim. Univ. Sao Paulo. - 1965. - 3. - P. 325 - 334.
Sadighian A., Amini F. Dioctophyma renale (Goeze, 1782) Stiles, 1901 in stray dogs and jackals in Shahsavar region, Iran 11 J. Parasitol. - 1967. - 53, 5. - P. 961.
Samuell C. A., Fuse L. A., San Rome C. A. Un caso de Dioctophyme renale en glandula mam&ria de perra // Rev. Med. Vet. (Buenos-Aires). - 1990. - 71, 4. - P. 162-164.
Sardjono T. W„ Purnomo В. B., Iskandar A., Gunawan A. Dioctophymatosis renalis in humans. First case report from Indonesia I Parasites: a hidden threat to Global Health: Proc. 3rd ASEAN Cong. Trop. Med. Parasitol., Thailand, 2008. - 3. - P. 90 - 93.
Seville R. S, Addison E. M. Nongastrointestinal helminths in marten {Martes americana) from Ontario, Canada // J. Wildlife Dis. - 1995. - 31. - P. 529 - 533.
Stefanski W., Strankowski M., Nagorski F. Sur un cas du strangle geant {Dioctophyme renale) dans la cavite thoracique du chat И C. R. Soc. Sci. Lett. Varsovie. - 1936. - 29. - P. 65 - 66.
Sun T, Turnbull A., Lieberman P. H, Sternberg S. S. Giant kidney worm {Dioctophyma renale) infection mimicking retroperitoneal neoplasm // Am. J. Surg. Pathol. - 1986. - 10, 7. - P. 508 - 512.
Tokiwa T., Harunari T, Tanikawa T, Akao N., Ohta N. Dioctophyme renale (Nematoda: Dioctophymatoidea) in the abdominal cavity of Rattus norvegicus in Japan 11 Parasitol. Intern. - 2011. - 60, 3. - P. 324 - 326.
Tokiwa T, Ueda W., Takatsuka S, Okawa K, Onodera M., Ohta N., Akao N. The first genetically confirmed case of Dioctophyme renale (Nematoda: Dioctophymatida) in a patient with a subcutaneous nodule П Parasitol. Intern. - 2014. - 63. - P. 143 - 147.
Tollitt M. E. Dioctophyme Collet-Meygret, 1802 (Nematoda): proposed confirmation of spelling (CIOMS Case NO. 7) // Bull. Zool. Nomenci. - 1987. - 44. - P. 237 - 239.
Urano Z., Has eq aw a H, Katsumata T, Toriyama K. et al. Dioctophymatid nematode larva found from human skin with creeping eruption // J. Parasitol. - 2001. - 87, 2. - P. 462 - 465.
Venkatrajaiah N, Kalbande S. H, Rao G. И N, Reddy И C., Reddy S. H et al. Dioctophymatosis renalis in humans: First case report from India П J. Assoc. Physic. India. - 2014. -62. - P. 70 - 73.
Verocai G. G., Measures L. N, Azevedo F. D., Correia T. R., Fernandes J. L, Scott F. B. Dioctophyme renale (Goeze, 1782) in the abdominal cavity of a domestic cat from Brazil // Vet. Parasitol. - 2009. - 161, 3-4. -P. 342-344. http://dx.doi.Org/10.1016/j.vetpar.2009.01.032.
Whelen J. C, Houston D. M., White C, Favrin M. G. Ova of Dioctophyme renale in a caninestruvite urolith H Can. Vet. J.-2011.-52, 12.-P. 1353- 1355.
Wislocki G. B. Observations on Dioctophyme renale in dogs // J. Parasitol. - 1919. - 6, 2. - P. 94 - 97. DOI: 10.2307/3270900
Woodhead A. E. Life history cycle of the giant kidney worm, Dioctophyma renale (Nematoda), of man and many other mammals // Trans. Amer. Microsc. Soc. - 1950. - 69, 1. - P. 21 - 46.
179
Род Eustrongylides Jagerskiold, 1909
Описание (по: Карманова, 1968; Определитель, 1975, 1987; Moravec, 1994). С характерными чертами семейства. Черви средней величины. Тело без вздутия на головном конце, расширенное и изогнутое в средней части и сужено к концам. Кутикула толстая, многослойная, с поперечной исчерченностью, но без шипов. Гиподерма тонкая и незаметная. Ротовое отверстие окружено 12 или 18 папиллами, расположенными обычно в двух - трёх кругах, по 6 папилл в каждом, из которых 2 латеральных и 4 субмедианных. Два ряда папилл располагаются вдоль боков тела. Пищевод длинный, более широкий в задней части. Копулятивная бурса самца мышечная, толстостенная, без поддерживающих структур. Спикула длинная, игловидная. Задний конец самки тупой, вульва вблизи терминально расположенного ануса. Яйца довольно крупные9. Паразиты стенки железистого желудка птиц, связанных с водной средой. Типовой вид - Eustrongylides tubifex (Nitzsch, in Rudolphi, 1819) Jagerskiold, 1909 (рис. 60).
Рис. 60 Eustrongylides tubifex: 1 — передний конец самки; 2 - головной конец апикально; 3 - хвостовой конец самца; 4 - хвостовой конец самки; 5 - яйцо (из: Карманова, 1968-по: Jagerskiold, 1909)
Род Eustrongylides установили для видов Dioctophymatoidea, живущих в опухолях в стенке железистого желудка птиц, в основном рыбоядных (Jagerskiold, 1909). На момент основания род объединял 9 видов, к 1968 г. - 14 (Карманова, 1968), а к 1988 г. - 19 (Measures, 1988b). Однако после ревизии 1988-го года в нём остались только Е. excisus Jagerskiold, 1909, Е. ignotus Jagerskiold, 1909 и Е. tubifex-, 7 видов перевели в синонимы, а 9 оставили как species inquirendae (Measures, 1988b). Тем не менее, в настоящее время одни авторы (Koehler et al., 2009) пишут об 11 видах в составе рода Eustrongylides, другие (Мошу, 2014) - о 30. Замечу, что часть видов описана по личиночным формам, а
потому для подтверждения их статуса необходимо получить взрослую форму.
Жизненный цикл Eustrongylides протекает с поэтапной сменой хозяев. Яйца гельминта попадают в воду с фекалиями птицы, а также при отрыжке или гибели
9 Размеры яиц у Е. tubifex - 60 - 90 х 30 - 50, у Е. excisus - 57 - 80 х 33 - 40 (Определитель, 1975), Е. ignotus- 58 - 66 х 35 - 44 pm (Jftgerskidld, 1909).
180
хозяина. Известно, что в воде яйца нематод сохраняют жизнеспособность до 2.5 лет (Cole, 1999). В находящемся в воде яйце развивается личинка 1-й стадии, которая не покидает яйцевой оболочки; при температуре 26 - 33°С этот процесс завершается в среднем за 3 недели (Moravec, 1994). У Е. tubifex, например, развитие личинки 1 -й стадии при 25°С длится от 23 до 26 дней (Measures, 1988а), у Е. ignotus в зависимости от температуры - от 17 до 28 дней (Coyner et al., 2003а).
Первый промежуточный хозяин паразита - малощетинковые черви, в частности Lumbriculus variegatus, Tubifex tubifex, Limnodrilus hoffmeisteri, которые заражаются, поедая эти яйца. В пищеварительном тракте олигохеты личинка выходит из оболочки, проникает через стенку кишечника в полость тела и далее в брюшной кровеносный сосуд. Здесь личинка дважды линяет, растёт и достигает 3-й стадии развития примерно за 50 дней. Однако для достижения инвазионного состояния ей необходимо ещё 60 - 70 дней (Moravec, 1994). В частности, у Е. tubifex развитие личинки 2-й стадии при температуре 25°С происходит в течение 30 дней после заражения, а инвазионной 3-й стадии -70 - 109 дней (Measures, 1988а). В промежуточном хозяине личинки эустронгилид могут выживать более года (Cole, 1999).
Вторым промежуточным хозяином служат многочисленные виды рыб, в том числе осетровые, угрёвые, лососёвые, сельдёвые, окунёвые, карповые, колюш-ковые, сомовые, угрёвые, бычковые и другие (Гаевская, 2012, 2013; Карманова, 1968; Мошу, 2014; Определитель, 1975, 1987; Поспехов, 2013; Шедько и др., 2010; Abe, 2011; Cirkovic et al., 2013; Dezfuli et al., 2015; Ibiwoye et al., 2004; Mitchell et al., 2009; Moravec, 1994; Shukerova et al., 2010; Sloboda et al., 2010; Urde§, 2013; и многие другие).
В рыбах инкапсулированные личинки располагаются в брюшной полости, печени, семенниках, мезентерии, мускулатуре, просвете желудка и в его стенках, иногда их находят сво-боднолежащими в по-
В организме дополнительного хозяина происходит формирование личинок 4-й, инвазионной для окончательных хозяев, стадии. Хищные рыбы, такие как щуки, налим, судак, вместе с пищей - мирными рыбами получают и личинок нематод, выступая в жизненном цикле паразита в роли паратонических хозяев, которые могут быть заражены сильнее своих жертв, поскольку личинки нематод постоянно накапливаются в их организме. Возможность передачи личинок 4-й стадии от одной рыбе к другой доказана в экспериментальных условиях (Cooper et al., 1978; Coyner et al., 2003a). В целом, по состоянию на 2010 г., личинки Eustrongylides выявлены у рыб, принадлежащих к 17 отрядам (Sloboda et al., 2010).
181
Относительно недавно на примере Е. ignotus было показано, что рыбы способны заражаться личинками, находящимися на 1-й стадии развития (Coyner et al., 2003а). Подобный вывод был сделан на основании результатов экспериментального заражения гамбузии Gambusia holbrooki яйцами нематоды, содержащими личинок 1-й стадии. В гамбузии в течение 84 - 105 дней после заражения эти личинки развились до 4-й стадии. Далее заражённых таким образом гамбузий скормили 3 видам хищных рыб - большеротому окуню, чёрному краппи и солнечному окуню, в которых затем были выявлены личинки паразита. Иными словами, рыбы могут за-
ражаться не только через олигохет, содержащих инвазионных личинок 3-й стадии,
но и яйцами нематод, содержащими личинок 1-й стадии.
Паразитирующие в рыбах личинки Eustrongilides (рис. 62) довольно крупные, у разных видов длина их нитевидного тела достигает 3-12 см. А. Мошу (2014) приводит максимальную длину личинок в 13.5 см. Размеры личинок варьируют также в зависимости от стадии её развития, локализации и вида рыбы-хозяина. Вдоль тела по бокам от переднего до заднего конца протянулись 2 ряда сосочков. Округлое ротовое отверстие окружено 12 папиллами, расположенными в
2 круга по 6 папилл в каждом. Папиллы наружного круга меньше таковых внутреннего ряда или равны им. Нервное кольцо находится на некотором удалении от головного конца.
Рис. 62 Eustrongilides excisus, личинка 3-й стадии: 1 - общий вид; 2 - головной конец; 3 - хвостовой конец тела самки; 4 - хвостовой конец самца (из: Карманова, 1968)
Личинки разных видов эустрон-гилид внешне очень похожи, поэтому довольно часто их определяют только до родового уровня и отмечают как Eustrongylides sp. По мнению Ф. Моравеца (Moravec, 1998), единственный надёжный способ установить точную систематическую принадлежность личинок - это получить их взрослую форму. Надо полагать, что немалую роль в решении этой проблемы может сыграть применение молекулярногенетических методов исследования.
Заражённость рыб личинками Eustrongylides варьирует в довольно широких пределах. Например, в Сербии судак, выловленный в канале Дунай - Тиса - Дунай, оказался поражён ими на 11.5, а сом - на 14.26 % (Cirkovic et al., 2013). Количество личинок в одном судаке колебалось от единичных особей до 256 экз. В бассейне реки Тауй (Охотское море) эустронгилиды встретились у 50 % кунджи, 42.9 % хариуса, 12 % малоротой корюшки и 20 % девятииглой колюшки; максимальное количество червей в рыбе не
182
превышало 6 экз. (Поспехов, 2013). В Китае угорь рисовый (Monopterus albus), являющийся, к слову, одним из основных коммерческих объектов в стране, заражён Е. ignotus на 40 - 90 % (Wen et al., 2000). По данным А. Мошу (2014), в Молдове в водохранилищах Днестровско-Прутского междуречья окунь, щука, судак, солнечный окунь и бычки в отдельные годы поражены эустронгилидами на 94 - 100 %, а интенсивность инвазии доходит до 40 экз. на рыбу. С увеличением возраста у рыб наблюдается рост и экстенсивности, и интенсивности инвазии нематодами (Cooper et al., 1978).
При высокой численности эти гельминты оказывают негативное влияние на состояние здоровья рыб (Brugni, Viozzi, 1999; Dezfuli et al., 2015; Papema, 1976; Urde§, 2013) и даже могут вызывать их гибель, особенно в аквахозяйствах (Mitchell et al., 2009). Определённую озабоченность вызывает и тот факт, что эти крупные паразиты, в случае локализации в мышечной ткани, могут стать причиной выбраковки рыбной продукции (Bangham, 1972). Распространению эустронгилид и росту заражённости ими рыб в немалой степени способствуют загрязнение и эвтрофикация водоёмов (Coyner et al., 2003b; Hirshfield et al., 1983; Spalding et al., 1993; Urde§, 2013; Urde§ et al., 2008,2015).
Личинок эустронгилид, чаще всего как Eustrongylides sp., находили также у рыбоядных змей, в том числе у змеи подвязочной обыкновенной (Lichtenfels, Lavies, 1976), ужей обыкновенного и водяного (Kirin, 2002; Sloboda et al., 2010; Yil-dirimhan et aL, 2007), северного американского (Bursey, 1986). Примечательно, что заражение рептилий этими гельминтами в ряде случаев оказывается фатальным для них (Lichtenfels, Lavies, 1976). В Мексике личинок эустронгилид обнаружили в мышцах лапок и скелетных мышцах крупной съедобной лягушки Lithobates mega-poda (=Rana megapoda) (Ramirez, Osorio, 2002), в США - в тканях водных саламандр Amphiuma (Panesar, Beaver, 1979), в Турции - в полости тела и на желудке лягушки озёрной (Saglam, Arikan, 2006), в Парагвае - в желудке каймана парагвайского (Goldberg et aL, 1991), в Ботсване - в желудке крокодила нильского (Junker et aL, 2006). Известны случаи регистрации личинок и у млекопитающих, в частности, у выдры канадской на тихоокеанском побережье США (Hobery et aL, 1997) и в Мэриленде (Abram, Lichtenfels, 1974).
Дефинитивные хозяева Eustrongylides - птицы, в той или иной степени связанные с водной средой, - Anseriformes, Charadriiformes, Ciconiiformes, Gaviiformes, Passeriformes, Pelecaniformes, Podicipediformes (Measures, 1988b). В Азово-Черноморском бассейне эти нематоды найдены у бакланов, пеликанов, гусей, гагар, поганок, куликов, чаек, цапель, чернети, кряквы и др. (Определитель, 1975). Попав в желудок птицы, личинки в течение 3 - 5 ч достигают места окончательной локализации - серозной оболочки железистого желудка птиц. Здесь они инкапсулируются, проходят последнюю 4-ю линьку, вскоре после которой достигают половой зрелости. Зрелые черви свёрнуты кольцами внутри капсул, и только их концы выступают в просвет желудка. Через 9-10 дней половозрелые самки начинают продуцировать яйца (Cole, 2009; Moravec, 1994; Xiong et aL, 2009). Самцы погибают вскоре после копуляции: у Е. ignotus, например, они становятся половозрелыми на 4-й день, а погибают между 7 и 9 днями; самки «переживают» самцов на 7 - 10 дней и также дегенерируют и погибают (Xiong et aL, 2009).
На фоне всего вышесказанного несколько странно выглядит следующая информация (Ibiwoye et aL, 2004; стр. 41): «Eustrongylides species have complex, indirect life cycle <...> with fish as intermediate, paratenic (alternative) or final (definitive) hosts». И далее. «The final host (which contains the reproductive adult stage of the nematode may be a piscivorous (fish-eating) fish, mammal, amphibian, reptile or bird» (выделено мною -АГ). Ну
183
не могут быть рыбы, амфибии, рептилии окончательным хозяином гельминта, заканчивающего своё развитие в теплокровном животном!
Представители рода Eustrongylides. прежде всего, Е. ignotus, Е. tubifex и Е. excisus, относятся к числу нематод, высоко патогенных для их хозяев (Coyner et al., 2002; Roffe, 1988; Spalding, Forrester, 1993, 2008; Spalding et al., 1993). Проникая через стенку желудка к месту окончательной локализации, нематоды повреждают мышечную ткань и слизистую оболочку желудка. Половозрелые черви располагаются в капсулах, выступающих над серозной оболочкой желудка. У больных птиц наблюдаются атаксия (недостаточная координация движений), анорексия, отсутствие аппетита, истощение, угнетённое состояние. К тому же, повреждая пищеварительный тракт птиц, паразиты способствуют проникновению в полость их тела болезнетворных бактерий, провоцируя, таким образом, появление у тех вторичной инфекции, бактериального перитонита, воспаление брюшной стенки тела, бактериальную инфильтрацию в кровь, септицемию, воспаление воздушных мешков. Вызываемые нематодами заболевания - эустронгилидозисы - сопровождаются высокой смертностью среди птиц, в частности цапель (Roffe, 1988; Winterfield, Kazacos, 1977). Так, во Флориде в Национальном парке Everglade гибель птиц на гнездовье от эустронгилидозиса достигала 80 % (Spalding et al., 1993).
В 1982 г. в печати появилось первое сообщение о случайном заражении сразу нескольких человек личинками Eustrongylides sp. (Guerin et al., 1982). Чтобы понять механизм негативного воздействия этих паразитов на организм млекопитающих, исследователи провели экспериментальное заражение личинками эустронги-лид новозеландских белых кроликов (Shirazian et al., 1984). Выяснилось, что черви проникали через стенки пищевода и желудка в плевральную и перитонеальную полости животных в течение 24 ч после заражения. Вскрытие подопытных животных с разным временным интервалом после инокуляции показало, что мигрирующие личинки вызывали многофокусный перитонит и множественный гранулематоз в печени. В 2004 г. о результатах подобного опыта с заражением кроликов личинками Е. ignotus сообщили бразильские исследователи (Barros et al., 2004). У заражённых животных были отмечены гематомы на стенке желудка, вызванные мигрирующими червями, большей или меньшей степени гиперемия слизистой желудка, разрушение эпителия, образование различного размера язвенных повреждений с выступающими краями, сгустки крови на брюшине. Таким образом, результаты обоих экспериментов продемонстрировали явную опасность эустронгилид для здоровья млекопитающих.
По этой причине эустронгилид относят к числу гельминтов, потенциально опасных для здоровья человека, о чём, кстати, наглядно свидетельствуют даже те немногочисленные примеры, которые приведены ниже.
Прежде всего, отметим, что подавляющее большинство регистрируемых случаев заражения эустронгилидами человека, - а их, к счастью, немного, -относится к рыбакам-любителям и связано с привычкой есть свежевыловленную рыбу непосредственно после её поимки.
Именно о таком пути попадания нематод к трём рыбакам из Балтимора (Мэриленд, США) сообщалось в упомянутой выше публикации (Guerin et al., 1982).
Первый пациент, 23-летний мужчина, обратился в клинику из-за прогрессирующей резкой брюшной боли, первые признаки которой появились у него в течение 24 ч после того, как он съел на рыбалке двух свежих голавлей. В ходе операции
184
у больного были выявлены две нематоды: один червь располагался в брюшной полости, второй - в перфорации стенки кишечника. Поперечная ободочная кишка характеризовалась точечными кровоизлияниями и экссудатом.
Второй пациент, 25-летний мужчина, был доставлен в отделение неотложной помощи клиники с похожими симптомами, появившимися в течение 24 ч после трапезы с сырой рыбой. Выполненная через 2 дня лапаротомия выявила двух нематод возле перфорированного кишечника. Третьему рыбаку, который также ел голавля из того же водоёма и у которого появились те же симптомы, хирургическое вмешательство не потребовалось, т.к. через 4 дня болезненные ощущения у него исчезли. Опрос ещё 12 человек, которые также ели свежевыловленных рыб, показал, что в течение последующих 4 недель похожие симптомы у них отсутствовали. Исследование 67 голавлей, пойманных в том же водоёме, где рыбачили пострадавшие, показал, что почти 50 % рыб заражены такими же личинками, какие были выявлены у прооперированных пациентов. Длина червей достигала 80 - 120 мм, диаметр тела 1-2 мм. Все нематоды оказались личинками Eustrongylides sp., находящимися на 4-й стадии.
Очень похожий случай был описан в 1989 г. в Нью-Джерси (США), где у 17-летнего юноши, жаловавшегося на сильную боль в правом нижнем квадранте живота, в результате хирургической операции выявили в брюшной полости двух крупных живых нематод длиной 55 и 59 мм. Нематоды были определены как личинки Eustrongylides 4-й стадии (Eberhard et al., 1989). По словам пациента, во время рыбалки он ел свежевыловленную рыбу.
В том же, 1989-м, году появилось ещё одно сообщение о заражении человека эустронгилидой. На этот раз пострадавшим оказался поступивший в клинику с диагнозом острого аппендицита 24-летний житель Нью-Йорка, накануне вечером пообедавший в доме своего приятеля sushi, приготовленным из неизвестной рыбы (Wittneretal., 1989).
Следующая публикация знакомит нас с результатами операции по подозрению на аппендицит одного из жителей Нью-Джерси, в ходе которой в его перитонеальной полости обнаружили нематоду Е.ignotus (Narr et al., 1996). В процессе беседы с пострадавшим выяснилось, что на рыбалке он съел двух голавлей, выловленных в одном из ручьёв штата. Авторы публикации исследовали гольянов из указанного пациентом ручья и установили факт их заражённости личинками Е. ignotus.
Таким образом, единственный источник заражения людей эустронгилидами - сырая и/или недожаренная (недоваренная) рыба. При этом, однако, не следует забывать, что в группе риска находятся также любители сырого змеиного и/или лягушачьего мяса.
Попавшие в организм человека нематоды дальше не развиваются, оставаясь на 4-й личиночной стадии. Однако заражение ими приводит, как мы видим, к гастриту, воспалению желудка, прободению стенки кишечника, вследствие чего требуется немедленное хирургическое вмешательство. Внешние признаки заражения зачастую похожи на таковые при остром аппендиците, по этой причине обычно прибегают к срочной операции по его удалению (Arias, 1989; Cole, 1999).
До 2014 г. все известные случаи обнаружения личинок Eustrongylides у людей были связаны с их хирургическим удалением из брюшной полости пациентов, причём до операции никаких подозрений на возможное заражение нематодами не возникало. В 2014 г. появилась статья, в которой описывалось два случая самостоя
185
тельного выхода личинок эустронгилид через кожу у жительниц Южного Судана (Eberhard, Ruiz-Tiben, 2014).
Событие имело место в апреле 2013 г. У двух пациенток 23 и 24 лет, живущих в разных деревнях, из кожи ног выделились два (по одному у каждой пострадавшей) крупных живых червя красно-коричневого цвета, длиной 7 и 8.5 см и максимальным диаметром 0.8 мм. На фотографии, которую приводят авторы публикации, хорошо видна довольно крупная припухлость над поверхностью кожи и выходящая из неё нематода. Оба червя оказались самками паразита. На основании морфологических и анатомических особенностей нематоды были отнесены к роду Eustrongylides.
Почему черви покинули человека, а не инкапсулировались под кожей, как Dioctophyme renale (см выше), неизвестно, но авторы считают, что данный случай иллюстрирует возможность и такого необычного способа паразитирования зоонозного вида у человека. В связи с этим хочу напомнить упомянутый выше (стр. 174) случай обнаружения в США в подкожном узле у мужчины нематоды, которую условно отнесли к D. renale. не исключив её возможной принадлежности к Eustrongylides sp. (Beaver, Theis, 1979).
Что касается суданского случая, то остаётся только гадать, почему и каким образом черви мигрировали в нижние конечности из брюшной полости, куда они обычно проникают из пищеварительного тракта человека.
Таким образом, чрезвычайно редкие находки у людей личинок эустронгилид свидетельствуют об их явно случайном попадании к нему, предотвратить которые не составит труда, если быть внимательным при разделке рыб (лягушек, змей, черепах). При наличии в сырье подозрительных красных «жилок», те следует удалить, а рыбу (лягушек, змей, черепах) обработать термически.
Цитируемая литература
Гаевская А. В. Паразиты и болезни рыб Чёрного и Азовского морей: I - морские, солоновато водные и проходные рыбы. - Севастополь: ЭКОСИ-Гидрофизика, 2012.-380 с.
Гаевская А. В. Паразиты и болезни рыб Чёрного и Азовского морей: II - полупроходные и пресноводные рыбы. - Севастополь: ЭКОСИ-Гидрофизика, 2013. - 354 с.
Карманова Е. М. Диоктофимидеи животных и человека и вызываемые ими заболевания // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1968. - 20. - 262 с.
Мошу А. Гельминты рыб водоёмов Днестровско-Прутского междуречья, потенциально опасные для здоровья человека. - Ред. Илья Тромбицкий. - Кишинэу: Международная ассоциация хранителей реки Эсо-TIRAS, 2014. - 88 с.
Определитель паразитов позвоночных животных Чёрного и Азовского морей. - Киев: Наук, думка, 1975.-552 с.
Определитель паразитов пресноводных рыб. Т. 3. Паразитические многоклеточные. - Л.: Наука, 1987. - 583 с. - (Определители по фауне СССР, изд. Зоол. ин-том АН СССР; Вып. 149).
Поспехов В. В. Гельминты и паразитические ракообразные рыб озёрно-речной системы Чукча (бассейн р. Тауй, Охотское море) // Известия ТИНРО. - 2013. - 172. - С. 181 - 188.
Шедько М. Б., Соколов С. Г., Кошелев В. Н., Евтешина Т В. и др. Паразитофауна эндемичных осетровых рыб реки Амур в свете литературных и оригинальных данных / Теоретические и практические проблемы паразитологии: Мат. Междунар. научн. конф. (30 ноября - 3 декабря 2010 г. Москва). -М., 2010.-С. 427-431.
Abe N. Molecular and morphological identification of helminthes found in Japanese smelt, Hypomesus trans-pacificus nipponensis, with notes on new host records of Eustrongylides ignotus and Raphidascaris gigi // Acta Parasitol. - 2011. - 54, 2. - P. 227 -231.
Abram J. B.t Lichtenfels J. R. Larval Eustrongylides sp. (Nematoda: Dioctophymatoidea) from otter, Lutra canadensis, in Maryland // Proc. Helminthol. Soc. Wash. - 1974. - 41. - P. 253.
186
Arias V. E. A worm in the peritoneum. Risks of eating shellfish and raw fish И Rev. Esp. Enfermed. Aparate Digest.- 1989,-76.-P. 669.
Bangham R. К A resurvey of the fish parasites of western Lake Erie // Ohio Biol. Surv. Bull. - 1972. - 4. - P. 1-23.
Barros L. A., Tortelly R., Pinto R. M., Gomes D. C. Effects of experimental infections with larvae of Eustrongylides ignotus JSgerskiOld, 1909 and Contracaecum multipapillatum (Drasche, 1882) Baylis, 1920 in rabbits // Arq. Bras. Med. Vet. Zootec. - 2004. - 56, 3. - P. 325 - 332.
Beaver P. C, Theis J. H. Dioctophymatid larval nematode in a subcutaneous nodule from man in California// Am. J. Trop. Med. Hyg. - 1979. - 28, 2. - P. 206 - 212.
Brugni N. L„ Viozzi G. P. Presence of Eustrongylides sp. (Nematoda: Dioctophymatoidea) in Galaxias macu-latus (Jenyns, 1842) (Pisces: Galaxiidae) from Patagonia, Argentina // J. Helminthol. Soc. Wash. - 1999. -66, l.-P. 92-94.
Bursey C. R. Histological aspects of natural eustrongyloid infections of the northern water snake, Nerodia sipedon II J. Wildlife Dis. - 1986. - 22. - P. 527 - 532.
Cirkovic M., Novakov N., Petrovic J., Ljubojevic D., Apic J., Babic J., Teodorovic V. Finding of parasitic nematodes of fishes present in the market // Arch. Vet. Med. - 2013. - 6, 2. - P. 3 - 13.
Cole R.A. Chapter 29. Eustrongylidosis I Field Manual of Wildlife Diseases: General Field Procedures and Diseases of Birds. - Eds. M. Friend, J. C. Franson. - Biol. Res. Div., Washington, DC, 1999. - P. 223 -228.
Cooper C. L., Crites J. L, Sprinkle-Fastkie D. J. Population biology and behavior of larval Eustrongylides tubifex (Nematoda: Dioctophymatida) in poikilothermous hosts // J. Parasitol. - 1978. - 64, l.-P. 102 - 107.
Coyner D. F., Spalding M. G., Forrester D. J. Epizootiology of Eustronglyides ignotus in Florida: Distribution, density, and natural infections in intermediate hosts// J. Wildlife Dis. - 2002. - 38, 3. - P. 483 -499.doi:10.7589/0090-3558-38.3.483.
Coyner D. F., Spalding M. G., Forrester D. J. Epizootiology of Eustrongylides ignotus in Florida: transmission and development of larvae in intermediate hosts // J. Parasitol. - 2003a. - 89, 2. - P. 290 - 298.
Coyner D. F., Spalding M. G., Forrester D. J. Influence of treated sewage on infections of Eustrongylides ignotus (Nematoda: Dioctophymatoidea) in Eastern mosquitofish (Gambusia holbrooki) in an urban watershed // Comp. Parasitol. - 2003b. - 70, 2. - P. 205 - 210. doi: http://dx.doi.org/ 0.1654/4061.
Dezfuli B. S, Manera M., Lorenzoni M, Pironi F., Shinn A. P., Giari L. Histopathology and the inflammatory response of European perch, Perea fluviatilis muscle infected with Eustrongylides sp. (Nematoda) I I Parasites & Vectors. - 2015.-8. - P. 227. Doi: 10.1186/sl 3071-015-0838-x.
Eberhard M. L, Hurwitz H, Sun A. M., Coletta D. Intestinal perforation caused by larval Eustrongylides (Nematoda: Dioctophymatoidae) in New Jersey // Am. J. Trop. Med. Hyg. -1989. - 40, 6. - P. 648 - 650.
Eberhard M L., Ruiz-Tiben E. Cutaneous emergence of Eustrongylides in two persons from South Sudan H Am. J. Trop. Med. Hyg. - 2014.-90, 2.-P. 315-317. Doi: 10.4269/ajtmh. 13-0638.
Goldberg S. R., Bursey C. R., Aquino-Shuster A. L. Gastric nematodes of the Paraguayan caiman, Caiman yacare (Alligatoridae) H J. Parasitol. - 1991. - 77, 6. - P. 1009 -1111.
Guerin P. F., Marapudi S, McGrail L, Moravec C. L., Schiller E. et al. Intestinal perforation caused by larval Eustrongylides 11 Morb. Mort. Week. Rep. - 1982. - 31. - P. 383 - 389. См. также информацию на.-CDC.http://www.cdc.gov/mmwr/preview/mmwrhtml/00001134.htm.
Hirshfield M. F., Morin R. F., Hepner D. J. Increased prevalence of larval Eustrongylides (Nematoda) in the mummichog (Fundulus heteroclitis) from the discharge canal of a power plant in the Chesapeake Bay П J. Fish Biol.- 1983.-23.-P. 135-142.
Hobery E. P., Henny C J., Hedstrom O. R., Grove R. A. Intestinal helminths of river otters (Lutra canadensis) from the Pacific Northwest // J. Parasitol. - 1997. - 83, l.-P. 105-110. Doi: 10.2307/3284324.
Ibiwoye T. I. L, Balogun A. M., Ogunsusi R. A., Agbontale J. J. Determination of the infection densities of mudfish Eustrongylides in Clarias gariepinus and C. anguillaris from Bida floodplain of Nigeria // J. Appl. Sci. Environ. Mgt. - 2004. - 8, 2. - P. 39 - 44. Online at http:// www.bioline.org.br/ja.
Jagerskiold A . Zur Kenntnis der Nematoden Gattungen Eustrongyloides und Hystrichis II Nova Acta Regiae Soc. Sci. Ups. - 1909. - Series IV. - 2, 3. - P. 1 - 48.
Junker K., Wallace K, Leslie A. J., Boomker J. Gastric nematodes of Nile crocodiles, Crocodylus niloticus Laurenti, 1768, in the Okavango River, Botswana // OnderstepoortJ. Vet. Res. - 2006. - 73, 2. - P. 111-114.
Kirin D. New records of the helminth fauna from grass snake, Natrix natrix L., 1758 and dice snake, Natrix tessellata Laurenti, 1768 (Colubridae: Reptilia) in South Bulgaria //Acta Zool. Bulg. - 2002. - 54, l.-P. 49-53.
187
Koehler А. И A., Hoberg E. P., Torres-Perez F., Cook J. A. A molecular view of the superfamily Dioctophy-matoidea (Nematoda) // Comp. Parasitol. - 2009. - 76, l.-P. 100 - 104.
Lichtenfels J. R., Lavies B. Mortality in red-sided garter snakes, Thamnophis sirtalisparietalis, due to larval nematode, Eustrongylides sp. // Lab. Anim. Sci. - 1976. - 26. - P. 465 - 467.
Measures L, M. The development of Eustrongylides tubifex (Nematoda: Dioctophymatoidea) in oligochaetes И J. Parasitol. - 1988a. - 74, 2. - P. 294 - 304.
Measures L. M. Revision of the genus Eustrongylides JagerskiOld, 1909 (Nematoda: Dioctophymatoidea) of piscivorous birds // Canad. J. Zool. - 1988b. - 66, 4. - P. 885 - 895.
Mitchell A. J., Overstreet R. M., Goodwin A, E. Eustrongylides ignotus infecting commercial bass, Mor one chrysops female X Morone saxatilis male, and other fish in the southeastern USA // J. Fish Dis. - 2009. -32. - P. 795 - 799. Doi: 10.1111/j. 1365-2761.2009.01051.
Moravec F. Parasitic nematodes of freshwater fishes of Europe. - Kluwer Acad. Publ., 1994. - 473 pp.
Moravec F. Nematodes of Freshwater Fishes of the Neotropical Region. - Acad. Praha, 1998. - 464 pp.
Marr L. L, O'Donnell J. G., Libster B., Alessi P., Abraham D. Eustrongylidiasis - a parasitic infection acquired by eating live minnows // J. Amer. Osteopath. Assoc. - 1996. - 96, 7. - P. 400 - 402.
Panesar T. S, Beaver P. C. Morphology of the advanced-stage larva of Eustrongylides wenrichi Canavan 1929, occurring encapsulated in the tissues of Amphiuma in Louisiana // J. Parasitol. - 1979. - 65, 1. - P. 96 - 104.
Paperna I. Host distribution and pathology of infections with larvae of Eustrongylides (Dioctophymidae, Nematoda) in fishes from East African lakes // J. Fish Biol. - 1974. - 6, 1. - P. 67 - 76.
Ramirez L. J., Osorio S. D. Histological lesions in skeletal muscle, caused by Eustrongylides sp. (Nematoda: Dictiophymatoidae) larvae in edible frogs from Lake Cuitzeo, in the state of Michoacan, in Mexico // Vet. Mex. - 2002. - 33, 3. - P. 335 - 341.
Roffe T. J. Eustrongylides sp. epizootic in young common egrets (Casmerodius albus) // Avian Diseases. -1988.-32.-P. 143- 147.
Saglam M., Arikan H. Endohelminth fauna of the marsh frog Rana ridibunda from Lake Hazar, Turkey // Dis. Aquat. Org. - 2006. - 72, 3. - P. 253 - 260. Doi:10.2478/sl 1687-010-0016-9.
Shirazian D., Schiller E. L, Glaser C. A., Vonderfecht & L. Pathology of larval Eustrongylides in the rabbit // J. Parasitol. - 1984. - 70, 5. - P. 803 - 806.
Shukerova S., Kirin D., Hanzelova V. Endohelminth communities of the perch, Perea fluviatilis (Perciformes, Percidae) from Srebama Biosphere Reserve, Bulgaria // Helminthologia. - 2010. - 47, 2. - P. 99 - 104. Doi:10.2478/sl 1687-010-0016-9.
Sloboda M., Mihalca A. D., Falka I., Petrzelkovd К J., Carlsson M. et al. Are gobiid fish more susceptible to predation if parasitized by Eustrongylides ex cis us? An answer from robbed snakes // Ecol. Res. - 2010. -25.-P. 469-471. Doi:10.1007/sl 1284-009-067-6-4.
Spalding M. G., Bancroft G. T, Forrester D. J. The epizootology of eustrongylidosis in wading birds (Cico-niiformes) in Florida // J. Wildlife Dis. - 1993. - 29, 2. - P. 237 - 249.
Spalding M. G., Forrester D. J. Pathogenesis of Eustrongylides ignotus in Ciconiiformes // J. Wildlife Dis. -1993. -29. -P. 250-260. doi: 10.7589/0090-3558-29.2.250.
Spalding M. G., Forrester D. J. Eustrongylides / Parasitic diseases of wild birds. - Atkinson С. T., Thomas N. J., Hunter D. B. (Eds.) - Ames, Iowa: Wiley-Blackwell, 2008. - P. 289 - 316.
Urde§ L. Overview of the larval eustrongylidosis in freshwater fish captured from the Danubian Delta, Romania//Aquat. Vet.-2013.-7, l.-P. 14-19.
Urde§ L., Hangan M., Diaconescu C., lanitchi D., Serafim К Eustrongylidosis' occurrence in freshwater fish from the Danubian Delta area H Sci. Pap. Anim. Sci. Biotechn. - 2008. - 41, 2. - P. 182 -186.
Urde§ L. D., Marin M. P., Diaconescu C, Micolae C. G., Hangan M. First case report of Eustrongylidosis in eel (Anguilla anguilla) populations inhabiting Danube Delta lakes // Agricult. & Agricult. Sci. Proc. -2015.-6.-P. 277-280.
Wen A. X., Yang G. Y, Zhang T. F. Preliminary investigation of parasite in host Monopterus albus from Sichuan //Sichuan J. Zool. -2000.- 19, l.-P. 22-23.
Winterfield R. W., Kazacos K. R. Morbidity and mortality of great blue herons in Indiana caused by Eustrongylides ignotus 11 Avian Diseases. - 1977. - 21. - P. 448 -451.
Wittner M., Turner J. W., Jacquette G., Ash L. R., Salgo M. P., Tanowitz H B. Eustrongylidiasis - a parasitic infection acquired by eating sushi // N. Engl. J. Med. - 1989. - 320, 17. - P. 1124- 1126.
Xiong R, Wang G. T, Wu S. G., Mie P. Development of Eustrongylides ignotus (Nematoda: Dioctophymida) in domestic ducks (Anas platyrhynchos domestica (L.)) // J. Parasitol. - 2009. - 95, 5. - P. 1035 - 1039.
Yildirimhan H S, Bursey C R, Goldberg S. R. Helminth parasites of the grass snake, Matrix natrix, and the dice snake, Matrix tessellate (Serpentes: Colubridae), from Turkey// Comp. Parasitol. - 2007. - 74. - P. 343 -354.
188
Семейство Dracunculidae Stiles, 19071
Синоним (no: Faust, 1949):
Fuellebomiidae Faust, 1929
Описание (по: Ивашкин и др., 1971; Faust, 1949). Тело длинное и тонкое. Самки заметно крупнее самцов. Головной конец округлый, с кутикулярным щитком. Губы и псевдолабии отсутствуют. Ротовое отверстие окружено внутренним кольцом из 4 - 6 папилл и наружным кольцом из 4 двойных папилл. Амфиды позади латеральных папилл. Пищевод состоит из переднего мышечного и заднего железистого отделов или полностью мышечный. Губернакулюм имеется или отсутствует. Вульва в середине тела, перед наступлением половой зрелости вульва и анус зарастают или атрофируются. Матки дивергентные. Живородящие. Выход личинок во внешнюю среду происходит через разрывы стенок матки и тела возле рта самки червя. Паразитируют в соединительной ткани и полости тела позвоночных животных. Типовой род - Dracunculus Reichard, 17591 2.
Жизненный цикл дракункулид проходит с участием промежуточного хозяина - водных ракообразных (копепод, остракод, бранхиур) (Moravec, 2004). У некоторых видов в жизненном цикле могут участвовать паратенические хозяева (Eberhard, Brandt, 1995).
Семейство немногочисленно, объединяет 3 рода с 15 видами (Hodda, 2011).
Единственный представитель дракункулид, известный как паразит человека, это - один из видов рода Dracunculus. D. medinensis (L., 1758).
Род Dracunculus Reichard, 1759 emend. Brackett, 1938
Синонимы (по: Ивашкин и др., 1971):
Furia Linnaeus, 1758
Gordius Linnaeus, 1758 (partum)
Vena Gallandat, 1773
Filaria Muller, 1787
Vermiculus Dunglison, 1858 Fuellebornius Leiper, 1926
Описание (по: Ивашкин и др., 1971; Baylis, 1939; Brackett, 1938; Faust, 1949). Передний конец с круговым кутикулярным выпячиванием, или щитком. Рот небольшой. Внутреннее кольцо головных папилл состоит из 4 - 6, наружное - из 4 двойных папилл. Амфиды находятся позади латеральных папилл наружного кольца. Цервикальные сосочки расположены немного позади уровня нервного кольца. Пищевод состоит из переднего - очень короткого мышечного и заднего - длинного железистого отделов. В передний отдел открываются крупная дорсальная и две более мелкие субвентральные одноклеточные железы. Железистая часть разделена перетяжкой на короткий передний и больший задний участки. Кишечник рудиментарный. Нервное кольцо окружает пищевод в области его сжатия. Кишечник прямой. Плазмиды чёткие. Самцы с 10 - 13 парами преанальных и постанальных папилл. Спикулы обычно одинаковой или почти одинаковой длины. Губернакулюм
1 В ряде источников (Ивашкин и др., 1971; Кадыров, 1968; Faust, 1949) автором семейства указан Leiper, 1912.
2 В мире растений описан род с таким же названием: Dracunculus Mill., 1754 - род многолетних травянистых растений в семействе ароидных (Агасеае).
189
имеется. Хвост в виде тугой спирали. Вульва расположена в передней части тела, возле головного конца; у взрослых самок она атрофирована или закрыта. Вагина простирается вперёд на небольшое расстояние. Две ветви матки соединяются в тонкостенный проток перед вульвой и позади неё. У половозрелых самок матка занимает всю полость тела. Хвост самки заострён и загнут вентрально в виде маленького крючка, благодаря чему та прочно удерживается в тканях хозяина. Живородящие. Типовой вид - Dracunculus medinensis (Linnaeus, 1758) Gallandant, 1773.
Dracunculus medinensis (L., 1758)3 (рис. 63, 64). В 1758 г. К. Линней (Linnaeus, 1758) включил эту нематоду в свою «Systema Naturae» под назвавием Gordius medinensis. Такое название виду (medinensis - мединский) он дал, исходя из того, что вызываемая им болезнь, как писал в 11-м веке Авиценна и на что обратил внимание К. Линней, была широко распространена среди местного населения вокруг арабского города Медина.
В англоязычной литературе нематоду чаще всего называют Guinea worm (гвинейский червь), а также Medina worm, serpent worm, dragon worm, producing dracunculosis, провоцируемое же им заболевание - dracunculiasis, dracontiasis, Guinea worm disease - GWD. В русскоязычной литературе паразита обычно именуют риштой (от персидского - нить), реже - гвинейским червем, мединским червем, а вызываемое им заболевание - дракункулёзом.
На протяжении столетий Dracunculus medinensis, известного под разными названиями ещё со времён египетских фараонов, изучали тысячи специалистов. Подробное описание гельминта можно найти в многочисленных отечественных и зарубежных источниках, включая научную, справочную, научно-популярную и методическую литературу (Ивашкин и др., 1971; Кадыров, 1968; Калинина, 2005; Литвинов, 1977; Мяндина, Тарасенко, 2013; Baylis, 1939; Faust, 1949; Grove, 1990; Muller, 2002; Velschius, 16744 и многие другие). Довольно полная информация о нематоде размещена и на десятках сайтах в Глобальной сети. К примеру, на «web.stanford.edu» представлена тематическая подборка литературы от истории открытия червя и описания его морфологических и биологических особенностей до результатов его искоренения на планете.
Описание (по разным авторам, в том числе: Ивашкин и др., 1971; Кадыров, 1968; Baylis, 1939; Faust, 1949). С характерными чертами рода. Головной конец с кутикулярным щитком. Небольшой рот окружен внутренними и наружными сосочками. Кишечник тёмно-коричневого цвета. Самцы обнаруживаются очень редко. Их длина составляет 12-29 (до 40 см, по: Baylis, 1939), толщина 0.2 - 0.4 мм. Из-за малых размеров - в сравнении с самкой - самцы долгое время вообще оставались неизвестными, а их адекватное описание по экземплярам, полученным в экспериментально заражённых собаках, впервые появилось только в 1937 г. (Moorthy, 1937). Хвостовой конец самца с 4 парами преанальных и 6 парами постанальных
3 Э. Фауст (Faust, 1949) перечисляет следующие синонимы D. medinensis'. Gordius medinensis Linnaeus, 1758 (vel. 1785); (?) Vena medinensis (Linn., 1758) Gallandant, 1773; Dracunculus grcecorum Gruner, 1777; Filaria medinensis (Linn., 1758) Gmelin, 1790; Furia vena medinensis (Linn., 1758) Modeer, 1795; Filaria aethiopica Valenciennes, 1856; Dracunculus aethiopicus (Vai., 1856) Schneidemuehl, 1896; Vermiculus capsularis Dunglison, 1895; Fuellebornius medinensis (Linnaeus, 1758) Leiper, 1926. По (Muller, 2002), среди синонимов вида Gordius medinensis Linnaeus, 1758; Filaria medinensis (L.); Fuellebornius medinensis Leiper, 1926.
4 Georg Hieronymous Velschius (Welsch) опубликовал в 1674 г. монографию, все 456 страниц которой были посвящены только одному объекту - мединскому червю.
190
сосочков. I пара от хвостового конца - вентролатеральная, II и III - субвентральные, не разделённые, IV - вентральная, расположена у III пары, V и VI - на некотором расстоянии от IV пары. Четыре пары преанальных папилл образуют 2 ряда. Плазмиды латеральные, позади V пары папилл. Спикулы тёмно-коричневые, почти равные, длиной до 0.75 мм. Губернакулюм 0.2 мм. Самки молочного цвета, волосовидные, длиной 100 - 400 (Monnig, 1934), до 53 (Moorthy, 1937), 32 - 120 (Baylis, 1939), 70- 120 (Faust, 1949), 32- 129 (Кадыров, 1968), 32- 120 (Литвинов, 1977), 80 (Bowman et al., 2002), 50 - 80 см (Muller, 2002) при диаметре 0.5 - 1.7 мм. У оплодотворённой самки матка заполнена множеством личинок и занимает почти всё тело. Отверстие вульвы облитерировано; личинки выходят наружу через разрывы стенки матки в области головного конца самки. Общее количество личинок, продуцируемое одной зрелой особью, достигает 8-10 млн.
Рис. 63 Dracunculus medinensis, А - передний конец самки, вентрально; В - головной конец, апикально; С - задний конец самца; D - личинка 1-й стадии (из: Faust, 1949)
Рис. 64 Dracunculus medinensis, задний конец тела самца: А - вид сбоку; В - вид с брюшной стороны (из: Baylis, 1939 - по: Moorthy, 1937)
Окончательный хозяин паразита - человек; кроме того, разные авторы сообщали о находках этих нематод у собак, лошади, крупного рогатого скота, норок, енотов, леопарда, бабуинов (Mirza, 1957; Monnig, 1934). Не исключено, что в ряде случаев речь могла идти о других видах Dracunculus. Известны находки этого паразита и у кошек — в Казахстане и Китае (Bowman et al., 2002).
191
Цикл развития D. medinensis расшифровал А. П. Федченко (1870), открывший промежуточного хозяина гельминта - циклопов, благодаря чему были выяснены основы эпидемиологии заболевания и созданы предпосылки для разработки мер по его профилактике и искоренению. О значимости открытия А. П. Федченко свидетельствует сам факт перевода его статьи на английский язык и публикации в американском специализированном журнале в 1971 г., т.е. фактически через 100 лет после её первого появления в печати.
Развитие личинки D. medinensis в циклопах детально изучил проф. Л. М. Исаев (1934).
В целом схему жизненного цикла D. medinensis можно представить следу-
Рис. 65 Схема жизненного цикла Dracunculus medinensis
Личинки 1-й стадии попадают во внешнюю среду - воду - через разрывы в стенке матки и тела червя. Личинки обладают сформированным кишечником, хотя и не питаются, длинным заострённым хвостом, исчерченной кутикулой, их размеры составляют 0.490 - 0.737 (0.643) х 0.018 - 0.024 (0.023) мм. В воде личинки очень активны, их кружащиеся движения аналогичны таковым свободноживущих нематод. Личинки живут в воде 4-7 дней, но для дальнейшего развития им необходимо попасть к промежуточным хозяевам - мелким (1-2 мм) циклопидам родов Mesocyclops (М. aequatorialis, М. kieferi), Metacyclops (М. margarelae), Thermocy-clops (T crassus, T. incisus, T. inopinus, T. oblongatus), Cyclops (C. coronatus, C. hya-linus, C. oithonoides, C. quadricomis, C. vicinus,), а также Aentocyclops, Eucyclops, Macrocyclops, Orthonoides, Tropocyclops. Попав в кишечник ракообразных, личинки пронизывают его стенку и выходят в гемоцель, где после двух линек достигают инвазионного состояния. Их длина при этом достигает 0.45 при толщине 0.014 мм, они обладают коротким двулопастным хвостом. При 24°С этот процесс завершается за 14 дней. Когда человек заглатывает с водой заражённых циклопов, то попавшие в его пищеварительный тракт личинки внедряются в стенку двенадцатиперстной кишки, мигрируют через мезентерий брюшной полости, через живот и грудь в течение примерно 15 дней. Пути миграции личинок окончательно всё же не изучены. В ходе этой миграции личинки не увеличиваются в размерах, но после двух линек осевшие в подкожной ткани половозрелые черви созревают примерно в течение 100 дней. Продолжительность жизни самцов не превышает 6 месяцев. После
192
оплодотворения самцы инкапсулируются и в итоге погибают. Обычно они рассасываются, но иногда на рентгеновских снимках видны кальцифицированные экземпляры. Самки же постепенно двигаются вниз, достигая места окончательной локализации через 8-10 месяцев после заражения. Через 10 месяцев самки содержат полностью сформированных личинок, а через год после того, как в организм попала личинка 3-й стадии, зрелая самка выходит из тканей (Muller, 2002).
Клинические симптомы в ранней фазе заражения, пока самки свободно передвигаются через соединительные ткани, обычно отсутствуют. Подкожный ход червя не всегда удаётся наблюдать, поскольку паразит или, во всяком случае, большая его часть располагается в более глубоких слоях подкожной клетчатки и, к тому же, болевых ощущений в этот период человек, как правило, не испытывает. Однако, когда самка выходит к поверхности тела, ситуация резко меняется.
А. А. Кадыров (1968; стр. 641) приводит следующее описание клинических симптомов поздней стадии заражения: «Клинические проявления поздней фазы начинаются с кратковременных, иногда очень тяжёлых, продромальных явлений, которые характеризуются зудом и крапивницей на всём теле, гиперемией конъюнктивы глаз и других видимых слизистых оболочек, одутловатостью лица, приступами удушья; нередко возникают тошнота, рвота, понос; иногда присоединяются головокружения и обморочные состояния, а в других случаях резкое возбуждение и даже бред. К концу продромального периода, продолжающегося 2-3 дня, присоединяются местные симптомы в виде локализованного воспалительного инфильтрата вокруг головного конца паразита, покраснения кожи, ощущаются зуд в этой области и небольшая болезненность; воспалительный фокус приподнимается, достигая величины грецкого ореха; на его верхушке образуется пузырь 2 - 7 см в диаметре. Расплавление тканей происходит, по-видимому, под действием протеолитических ферментов паразитов. Через несколько дней пузырь лопается и обнажается беловатая некротическая масса. После её отторжения из хода, в котором располагается паразит, выдвигается его головной конец. При соприкосновении с водой кутикула на головном конце вблизи вульвы разрывается, и в образовавшееся отверстие выпячивается матка, тоже вскоре разрывающаяся. Из матки вытекает молочного цвета жидкость, содержащая множество личинок. После этого продромальные явления исчезают».
Симптоматика заболевания во многом зависит от локализации нематоды. Известно, что в 80 % случаев паразиты оседают в нижних конечностях человека -стопе, голени, остальные 20 % приходятся на долю червей, проникших в другие, самые разные части тела - руки, ладони, туловище, ягодицы, мошонку, угол челюсти, лобно-носовую пазуху, язык, веки (Thomas, Rambo, 1954). В целом патогенное действие нематоды связано с сенсибилизацией организма продуктами её обмена, механическим повреждением тканей и вторичной инфекцией.
Что касается возможных осложнений, то большинство из них возникает в результате присоединения вторичной бактериальной инфекции в месте расположения лопнувшего пузыря, которая провоцирует развитие абсцессов, флегмон, гангрены, трофических язв, маститов, эпидидимитов, артритов. При отсутствии своевременно начатого лечения может развиться сепсис. Другая группа осложнений связана с развитием аллергических проявлений, возникающих в результате обрыва гельминта и выхода большого количества микроскопических личинок в окружаю
193
щие ткани. При этом могут быть выражены аллергические отёки, синовиты, артриты.
Иногда самка паразита погибает ещё до прободения кожных покровов и затем рассасывается или же кальцифицируется. Такие обызвествлённые останки нематоды легко выявляются при рентгенологическом исследовании. Тем не менее, подобные черви могут провоцировать развитие артрита.
Диагностика заражения дракункулой на ранних стадиях практически невозможна. Диагностировать заболевание внешне можно лишь в тех случаях, когда виден подкожный ход червя, или сформировался кожный волдырь, или же из нарыва появился головной конец тела паразита.
Действенных лекарственных препаратов, излечивающих от дракункулёзиса, равно как и вакцин, предупреждающих заражение гвинейским червем, пока не существует, хотя и имеются публикации об эффективности применения, например, ивермектина (Bowman et al., 2002). Тем не менее, при развитии нарыва для уменьшения боли рекомендуется принимать болеутоляющие препараты, например, аспирин, для более успешного извлечения червей - метронидазол или тиабендазол (Grove, 1990), для предотвращения развития бактериальной инфекции — антибиотики, а при наличии аллергических явлений проводят терапию антигистаминными препаратами. Показано также, что мебендазол убивает нематод (Shafei, 1976), но гибель паразита, остающегося при этом в теле человека, может привести к развитию аллергических реакций с соответствующими негативными последствиями.
У лиц, инвазированных D. medinensis, иммунитет не вырабатывается, и человек может заражаться практически ежегодно при любом новом попадании личи
нок нематоды в его организм.
Единственным и самым радикальным средством избавления от нематоды является её удаление: в тот момент, когда из лопнувшего нарыва выдвигается головной конец гельминта, его аккуратно ухватывают и начинают постепенно наматывать нитевидное тело паразита на марлевый валик или палочку (рис. 66, 67). Иногда нарыв надрезают, чтобы ускорить этот процесс. При появлении ощущения сопротивления со стороны червя во избежание его обрыва, что, как мы видели, может привести к серьёзным последствиям, эту процедуру прекращают, а уже выделенную часть фиксируют повязкой. Эту манипуляцию повторяют в последующие
дни и проводят её до полного извлечения гельминта, при этом ногу или любую другую часть тела с нарывом погружают в воду для стимуляции выхода червя. Чаще всего за один приём удаётся вытянуть 5 -10 см тела нематоды, а сама процедура, в зависимости от длины тела самки, может растянуться на несколько дней и даже недель.
Рис. 66 Извлечение гельминта (Dracunculus medinensis) с тыльной стороны стопы постепенным вытягиванием и наматыванием на марлевый валик (из: Литвинов, 1977)
Судя по многочисленным описаниям, а также старинным и современным иллюстрациям, этот стандартный, скорее, традиционный метод избавления от гви
194
нейского червя известен с давних времён, надо полагать, во все времена существования проблемы заражения им людей. Показателен в этом отношении растиражированный во многих изданиях рисунок, на котором изображена процедура удаления мединского червя из ноги человека персидскими врачами в 9 веке (рис. 67).
Рис. 67 Заимствованная из монографии Г. И. Велыпа (G. Н. Velschius, 1674) иллю-страция, подписанная «Exercitationes de Vena medinensis et de Vermiculus capillari-bus infantium». На рисунке изображена сцена удаления Dracunculus medinensis из ноги пациентов в Персии в 9-м столетии.
Единственный путь попадания инвазионного начала - личинок нематоды к человеку - алиментарный, через питьевую воду, в которой могут находиться инвазированные циклопы. Вода практически неотделима от пищи, избежать её употребления невозможно, а, следовательно, существует и вероятность заражения личинками нематоды во время питья при несоблюдении определённых правил, о чём
пойдёт речь ниже.
Существование в природе очагов инвазии D. medinensis возможно только при определённых естественных и социально-бытовых условиях. Прежде всего, это - возможность контакта инвазированных людей с водоёмами, изобилующими циклопами, а также наличие благоприятных климатических условий для сохранения жизнеспособности вышедших в воду личинок паразита и их последующего развития в циклопах. Однако основополагающее значение для циркуляции паразита в эндемичных регионах имеет употребление населением для питья необеззараженной воды.
Учитывая тот факт, что мединский червь является паразитом человека, для избавления людей от этого гельминта необходимо разорвать ту цепочку, по которой осуществляется жизненный цикл паразита, позволяющий ему попадать к дефинитивному хозяину. Если разорвать эту цепочку, то паразит исчезнет естественным образом. Поскольку заражение человека происходит через воду, содержащую инвазированных циклопов, то первый и самый главный заслон на этом пути: обеззараживание используемой в питьевых целях воды, которое проводится разными способами, включая кипячение, фильтрование, обработку соответствующими дезинфицирующими препаратами. При этом большое значение должно придаваться санитарно-просветительской работе среди местного населения.
Сколь велика значимость подобной работы свидетельствует ликвидация в начале 1930-х годов очагов заболевания гвинейским червем среди местного насе-
195
ления в Средней Азии, очень распространённого здесь в некоторых районах до 1932 г. (Калинина, 2005; Литвинов, 1977). Весьма показательны в этом отношении и результаты деятельности Центра Картера, созданного в 1982 г. по инициативе экс-президента США Д. Картера. С середины 1980-х годов названный Центр проводил большую общеобразовательную и практическую работу среди местного населения многих африканских стран, направленную на ликвидацию дракункулиа-зиса. Сконцентрировала на этом направлении свои усилия и Всемирная организация здравоохранения (ВОЗ) (Hopkins, Ruiz-Tiben, 1991). Борьба с гвинейским червем фактически была объявлена межгосударственной проблемой. В Судане, к примеру, была даже выпущена серия почтовых марок, посвящённая ликвидации этого паразита (рис. 68).
Рис. 68 Одна из трёх почтовых марок, выпущенных в Судане в рамках кампании по ликвидации гвинейского червя (из: http://bio stamps.narod.ni/worldlist/sudan/sudan_2002_dr/s
udan_2002_dr.htm)
Итогом всех этих усилий стало не только резкое снижение количества регистрируемых в мире случаев заражения людей данным паразитом, но и исчезновение большинства эндемичных очагов, как, например, в Средней Азии, Индии, Южной Америке, ряде регионов Африки. Для примера приведу несколько цифр. В одной из публикаций 1947-го года количество больных дракункулиазисом в Африке оценивалось в 15 млн., в Азии - в 30 млн., в бывшем Советском Союзе - в 3.3 млн. (Stoll, 1947). В 1985 г. в мире официально было выявлено 3.5 млн. случаев заражения людей этим гельминтом, а к 2000 г. их количество уменьшилось на 98 %. В 2010 г. ВОЗ насчитала 1758 подобных случаев (из них 1690 пришлось на Южный Судан), а с января по сентябрь 2012 г. - всего 521 (в 2011 г. за тот же период таковых было выявлено 1006) (www.who.int/mediacentre/ news/releases/2013/ntds_ report_20130116/en/index.).
В январе 2015 г. ВОЗ зафиксировала всего 22 случая заболевания людей дракункулиазисом и одновременно сертифицировала 198 стран, территорий и зон, представляющих 186 стран-членов этой организации, свободных от данного заболевания. На начало 2015 г. оставалось только четыре африканские страны - Чад, Эфиопия, Мали и Южный Судан, где по-прежнему отмечают случаи заражения людей данным паразитом (Centers for Disease Control and Prevention).
Цитируемая литература
Ивашкин В. М„ Соболев А. А., Хромова Л. А. Камалланаты животных и человека и вызываемые ими заболевания И Основы нематодологии. - Ред. акад. К. И. Скрябин. - М.: Наука, 1971. -22. - 389 с.
Исаев Л. М. О способе проникновения личинок ришты (Dracunculus medinensis) в циклопов И Мед. паразитол. -1934. -3, 3. - С. 212.
Кадыров А. А. Глава XXXII. Дракункулёз / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. — С. 639 - 644.
196
- (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Калинина О. И. Биология гельминтов и профилактика гельминтозов (учебное пособие). - Владивосток: Изд-во ТГЭУ, 2005. - 80 с.
Литвинов С. К. Дракункулёз // Большая Медицинская Энциклопедия. - Гл. ред. акад. Б. В. Петровский. - М.: Изд-во «Советская Энциклопедия», 1977. - С. 473 - 475.
Мяндина Г. И., Тарасенко Е. В. Медицинская паразитология. Учебное пособие. - М.: Практическая медицина, 2013. - 256 с.
Федченко А. П. О строении и размножении ришты {Filaria medinensis L.). -М., 1870. - Fedchenko А. Р. Concerning the structure and reproduction of the Guinea worm, Filaria medinensis // Am. J. Trop. Med. Hyg. - 1971. - 20. - P. 511 - 523. Translation from the Russian.
Baylis H. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. -P. 1 -274.
Bowman D. D., Hendrix C. M, Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-467 pp.
Brackett S. Description and life history of the nematode Dracunculus ophidensis n. sp., with a redescription of the genus // J. Parasitol. -1938. - 24, 4. - P. 353 - 361. Doi: 19.2307/3272445.
Eberhard M. L., Brandt F. H. The role of tadpoles and frogs as paratenic hosts in the life cycle of Dracunculus insignis (Nematoda: Dracunculidae) // J. Parasitol. - 1995.-81. - P. 792 - 793.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Grove D. I. A History of Human Helminthology. - CABI, 1990. - 848 pp.
Hopkins D. R., Ruiz-Tiben E. Strategies for dracunculiasis eradication // Bull. World Health Organization. -1991.-69.-P. 533-540.
Linnaeus C. Systema naturae per regna triae naturae, secundum classes, ordines, genera, species, cum charac-teribus, differentiis, synonymis, locis. 10th edition. - L Salvii, Holmiae, 1758. -2 volumes. - 823 pp. (цит. no: Grove, 1990).
Mirza M. B. On Dracunculus Reichard, 1759, and its species // Z. f. Parasitenk. - 1957. -18, 1. - P. 44 - 47.
Monnig H O. Veterinary helminthology and entomology.’ The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934.-427 pp.
Moorthy V. N. A redescription of Dracunculus medinensis 11 J. Parasitol. - 1937. - 23. - P. 220 - 224.
Moravec F. Some aspects of the taxonomy and biology of dracunculoid nematodes parasitic in fishes: a review // Folia Parasitol. - 2004. - 51. - P. 1-13.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Shafei A. Z. Preliminary report on the therapeutic effect of mebendazole in Guinea worm infection // J. Trop. Med. Hyg. - 1976. - 79. -P. 197 - 200.
Stoll N. R. This wormy world II J. Parasitol. - 1947.-33, l.-P. 1-18.
Thomas A., Rambo V. Dracunculus medinensis (Guinea worm) in the orbit // Indian J. Ophthalmol. - 1954. -2, 2.-P. 51-52.
Velschius G. IL Exercitatio de Vena Medinensi, ad mentem Ebnisinae sive de dracunculi veterum. Specimens e xhibens novae versionis ex Arabico, cum commentarion uberiori, cui accedit altera de vermiculus capil-laribus infantium. -Theophili Goebelli, Augustae Vindelicorum, 1674. -456 pp. (цит. no: Grove, 1990).
197
Семейство Gnathostomatidae Railliet, 1895
Семейство включено в состав отряда Spirurida, которое одни исследователи рассматривают в классе Chromadorea (Hodda, 2011)1, а другие - в классе Secementea (Al-Zubaidy et al., 2012; Waikagul, Diaz Chamacho, 2007).
Описание (по: Ивашкин, Хромова, 1976; Определитель, 1975; Baylis, 1939). Ротовое отверстие удлинено в дорсовентральном направлении. Псевдолабии крупные, латеральные, трёхлопастные или куполообразные. Интерлабии отсутствуют. На внутренней стороне губ кутикула утолщена и обычно снабжена удлинёнными зубчатыми гребнями или пластинками. На головном конце тела кутикула образует характерную резкую перетяжку, отделяющую головное вздутие от остальной части тела; поверхность вздутия поперечно исчерчена или усажена рядами шипов, количество и расположение которых используется в систематике этих гельминтов. Имеется от 4 до 6 крупных одноклеточных лемнископодобных шейных желез. Стома сильно редуцирована. Пищевод хорошо развит, состоит из мышечного и железистого отделов. Кишечник в виде слегка изогнутой трубки тёмно-коричневого цвета. Самцы с хвостовыми крыльями, поддерживаемыми крупными стебельчатыми сосочками. Спикулы равные или неравные по длине. Вульва открывается в задней части тела, иногда в середине или в переднем отделе тела. Яйцекладущие. Яйца относительно крупные, с тонкой оболочкой, при откладке не содержат сформированной личинки. Паразиты холоднокровных и теплокровных позвоночных - рыб, амфибий, рептилий, млекопитающих. Типовой род - Gnathostoma Owen, 1836.
Жизненный цикл гнатостоматид включает смену промежуточного (беспозвоночные животные) и окончательного (позвоночные) хозяев, в который могут включаться резервуарные хозяева.
Семейство объединяет 5 родов, представленных 61 видом (Hodda, 2011). Некоторые авторы включают в состав семейства 3 рода с 12 видами (Al-Zubaidy, 2011). Нас интересуют только два рода - Gnathostoma и Echinocephalus Molin, 1858, чьи представители известны как паразиты человека.
Цитируемая литература
Ивашкин В. М., Хромова Л. А. Кукулланаты и гнатостомататы животных и человека и вызываемые ими заболевания // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1976. - 27. -С. 285-434.
Определитель паразитов позвоночных Чёрного и Азовского морей. - Киев: Наук, думка, 1975. - 552 с. Al-Zubaidy А. В. Larvae of Echinocephalus overstreeti Deardorff and Ko, 1983 (Nematoda: Gnathostomatidae) in the Red Sea fish, Abalistes stellatus (Balistidae), Yemen coastal water // Mar. Sci. - 2011. - 22, 1. -P. 31-43. DOI: 10.4197.
Al-Zubaidy A.B., Mhaisen F.T., Abker M.A.M. Occurrence of five nematode species from some Red Sea fishes, Yemen Mesopot // J. Mar. Sci. - 2012. - 27, 2. - P. 140 - 156.
Baylis H. A, The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Waikagul J., Diaz Chamacho S. P. 7. Gnathostomiasis / Darwin K. D. ed. Food-Borne Parasitic Zoonoses, Fish and Plant-Borne Parasites, World Class Parasites. - Springer, Berlin, 2007. - P. 235.
1 См. источник на стр. 14.
198
Род Gnathostoma Owen, 1836
Синонимы (no: Baylis, 1939):
Cheiracanthus Diesing, 1838
Cheiranthus v. Linstow, 1893
Cheiriacanthus Schneidemiihl, 1896
Gnathostomum Mitter, 1912
Описание (по: Ивашкин, Хромова, 1976; Baylis, 1939; с дополнениями). Кутикула по всей длине тела или до уровня границы пищевода и кишечника покрыта шипи-ками, направленными назад. Передние шипики чешуевидные, с несколькими зубчиками по свободному краю, далее расположены шипики с меньшим количеством зубчиков и, наконец, последние шипики только с одним остриём. Головное вздутие вооружено поперечными рядами изогнутых крючьев. На средней лопасти головных губ зуб отсутствует. Пищеводные железы в виде длинных чётко дифференцированных тяжей. Самцы обладают неравными спикулами и 6 - 9 парами хвостовых сосочков. Хвост самца заканчивается вздутием, вооружённым шипиками. Вульва находится позади середины тела; вагина длинная. Яйца овальные, с крышечкой на одном из полюсов. Паразиты млекопитающих. Типовой вид - Gnathostoma spinig-erum Owen, 1836.
В 1920-е годы в разных странах мира довольно регулярно стали появляться сообщения о регистрации нематод рода Gnathostoma у человека (Maplestone, 1929; Morishita, Faust, 1925; Tamura, 1921 и т.д.). Естественно, чтобы понять, как происходит заражение людей этими опасными нематодами, и каким образом его можно предупредить, необходимо было изучить биологию этих паразитов и, прежде всего, особенности их жизненного цикла. Первые же такие работы (Africa et al., 1936а, 1936b; Chandler, 1925a; Daengsvang, Tansubat, 1938; Prommas, Daengsvang, 1933, 1936) показали, что нематоды данной группы относятся к биогельминтам, т.е. их жизненный цикл реализуется со сменой хозяев (рис. 69).
Половозрелые самки откладывают незрелые яйца на стадии одного - двух шаров дробления. Во внешней среде в нём формируется личинка, которая линяет, и из яйца выходит личинка 2-й стадии, сохраняющая на себе полинявшую кутикулу личинки 1-й стадии в виде тонкого прозрачного чехлика. Этих личинок заглатывают циклопы родов Cyclops, Eucyclops, Mesocyclops, Thermocyclops, участвующие в жизненном цикле гнатостом в качестве первого промежуточного хозяина (Prommas, Daengsvang, 1933). В теле циклопа личинка освобождается от чехлика и проникает в полость его тела, где на 10 - 14-й день линяет во второй раз. Полинявшие личинки гнатостом уже обладают характерным головным вздутием, вооружённцм четырьмя поперечными рядами крючьев, количество которых в каждом ряду используется в их диагностике. Заражённые циклопы передают личинок по трофической цепочке дальше - или дефинитивным, или резервуарным хозяевам (в зарубежной литературе принято считать, что в жизненном цикле гнатостом участвует второй промежуточный хозяин). В роли резервуарного (паратонического) хозяина могут быть рыбы, лягушки, а также хищные рыбы, рептилии, питающиеся мирными рыбами и амфибиями и получающие с пищей личинок паразита. В организме дефинитивного хозяина - плотоядных и всеядных млекопитающих личинки проникают в стенку желудка, где достигают половой зрелости. Некоторые виды гнатостом поселяются в пищеводе, почках или мочевом пузыре (Bertoni-Ruiz et al., 2011). Работа
199
ми О. В. Головина (1954 - 1960) показано, что развитие гнатостом может протекать с участием только двух хозяев - первого промежуточного и дефинитивного (цит. по: Ивашкин, Хромова, 1976).
Рис. 69 Схема жизненного цикла нематод рода Gnathostoma
Род Gnathostoma объединяет 15 видов (Bertoni-Ruiz et al., 2011), по другим данным - 12 (Waikagul, Diaz Chamacho, 2007) или же 13 (Cole et al., 2004). В качестве паразитов человека известны 5 видов - G. spinigerum, G. hispidium, G. doloresi и G. nipponicum (в Австрало-Азиатском регионе), G. binucleatum (на американском континенте). Помимо того, имеется неподтверждённое сообщение о находке личинок G. malaysiae Miyazaki et Dunn, 1965 у двух японцев, заразившихся, по их словам, через съеденных сырых пресноводных креветок (Nomura et al., 2000). Во взрослом состоянии G. malaysiae паразитирует у крыс. Вместе с тем, существует вполне резонное предположение, что потенциально опасными для человека являются все виды Gnathostoma (Waikagul, Diaz Chamacho, 2007).
В зарубежной литературе можно встретить самые разные термины, связанные с обнаружением гнатостом у людей: Gnathostoma, Larva migrans profundus, Nodular migratory eosinophilic panniculitis, Creeping eruption, Choko-Fuschu Tua chid, Spiruroid larva migrans, Wandering swelling, Yangtze edema. Заболевания, вызываемые гнатостомами, обычно называют gnathostomiasis (гнатостомиазис) или gnathos-tomosis (гнатостомозис), в русскоязычной литературе - гнатостомоз.
Gnathostoma spinigerum Owen, 1836 (=Cheiracanthus robustus Diesing, 1836; =Filaria radula Schneider, 1866; =Cheiracanthus siamensis Levinson, 1889; =Gnatho-stoma paronai Porta, 1908; =Gnathostoma kyushuense Miyazaki, 1950) (рис. 70, 71). Синонимы приведены по работе: Ивашкин, Хромова, 1976.
200
Среди синонимов указан также вид Cheiracanthus socialis Leidy, 1859, впервые описанный от американской норки в США (Leidy, 1858). Однако в настоящее время самостоятельность данного вида, теперь известного под названием Gnathostoma socialis (Leidy, 1858), восстановлена (Bertoni-Ruiz et al., 2011).
Впервые этих гельминтов обнаружил в стенке желудка молодого тигра, погибшего от разрыва аорты в Лондонском зоологическом саду, сэр Ричард Оуэн (Owen, 1836). Видовое название нематоды указывает на наличие многочисленных шипов на поверхности её тела: spinigerum - колючий, покрытый колючками, шипами.
Рис. 70 Gnathostoma spinigerum, слева - передний конец тела, дорсально (h.b. - головное вздутие; /. - губа; 5. -
шипы на теле; s.mp. - субмедианная папилла); справа - задний конец самца, вентрально (на левой стороне рисунка большинство шипов не изображены) (из: Baylis, Lane, 1920)
Описание (по разным авторам). Тело прямое, слегка расширенное в передней половине и зауженное в задней. На головном вздутии 6-11 рядов концентрически расположенных крючьев длиной 15-25 pm. Поверхность тела примерно на две трети своей длины покрыта уплощёнными шипиками. Самые передние шипики с 3 - 4 зубчиками, на уровне пищевода у шипов три зубца, причём медианный обычно длиннее остальных; позади уровня пищевода шипики становятся дву-, а к середине тела - одновершинными. У ротового отверстия имеются две латерально расположенные трёхлопастные губы, резко отграниченные от головного вздутия. Медианная лопасть каждой губы слегка выдаётся вперёд; у основания латеральных лопастей с каждой стороны субмедианно располагается по одному сосочку. Имеются четыре шейные железы. Самцы длиной 10-31 мм и максимальной толщиной 1-1.9 мм. Хвостовой конец спиралевидно загнут, заканчивается кутикулярным расширением, поддерживаемым стебельчатыми половыми сосочками. Кроме того, на вентральной поверхности хвостового конца находятся ещё три пары маленьких сидячих сосочков. Длина спикул, приводимая в работах разных авторов, весьма разнится и укладывается в следующие пределы: длинная спикула 0.9 - 2.63, короткая 0.4 - 0.8 мм. Самки длиной 9 - 54, максимальной толщиной 1 - 2.5 мм. Хвост прямой, по форме похож на усечённый конус; кутикула хвостового конца расширена в виде двух лопастей. Вульва в 1/3 - 1/5 от заднего конца тела. Яйца овальные, с толстой коричневатой оболочкой и утолщением на одном из полюсов. Размеры яиц (по разным авторам) 60 - 73 х 35 - 42 цт.
201
Рис. 71 Gnathostoma spi-nigerum: a - форма и расположение шипов на теле самки; б - хвостовой конец самки; в - хвостовой конец самца; г - яйцо из матки; д - личинка 3-й стадии (из: Ивашкин, Хромова, 1976 -по: Miyazaki, 1960)
Самки G. spinig-егит откладывают яйца в просвет желудка животного-хозяина, откуда они попадают в кишечник и далее с фекалиями выносятся во внешнюю среду. Дальнейшее развитие яиц происходит только в пресной воде. При 27°С через 5 дней в яйце развивается личинка, которая вскоре линяет и покидает яйцевую оболочку. Плавающих в воде личинок 2-й стадии заглатывают циклопы.
Попав в рачков, личинки сразу же выходят из чехлика, пронизывают стенку желудка и проникают в полость их тела, где немедленно начинается процесс формирования личинки 3-й стадии, который в зависимости от температуры завершается за 5 -7-10 дней (Janwan et al., 2011).
Заражённых циклопов заглатывают различные рыбы (угорь, сом, судак, окунь, змееголовы, кефали, карповые), а также лягушки, в организме которых личинки сохраняются живыми, и хотя и растут, но не развиваются. В Юго-Восточной Азии наиболее обычный хозяин G. spinigerum - угорь рисовый, или, как его ещё называют, угорь болотный, флюта белая (Monopterus albus, или Fluta alba) (Le et al., 2000; Rojekittikhun et al., 1998; Setasuban et al., 1991; Waikagul, Diaz Amacho, 2007). У рыб личинки локализуются в фиброзных мембранах в печени, стенках кишечника, полости тела, мускулатуре. Помимо того, личинки нематоды могут встретиться в змеях, к которым они явно попадают с заражёнными рыбами или лягушками. В Индии, например, их обнаружили в питоне сетчатом, кобре, змее очковой (Chandler, 1925), в Японии - в уже тигровом, динодоне восточном и полозе мало
202
чешуйчатом лазающем (Miyazaki, 1960), на Филиппинах - у лягушки прибрежной тропической, ужа собакоголового обыкновенного (Eduardo, 2001).
Длина личинок до 4 мм (Moravec, 1994). Кутикула по всей длине тела покрыта поперечными рядами (более 200) простых заострённых шипиков. Головное вздутие вооружено 4 поперечными рядами крючьев; в каждом ряду обычно их более 40 (44 - 52), при этом по направлению к заднему концу тела среднее количество крючьев в ряду увеличивается. Что касается размеров личинок и количества крючьев на головном вздутии, то приведённая далее информация явно свидетельствует о том, что в разных регионах эти показатели разнятся от приведённых выше (Moravec, 1994).
Длина тела личинок из японских рыб достигала 4.6 - 5.5 мм; на теле насчитывалось 200 рядов шипиков; на головном вздутии количество крючьев в рядах от 1 до 4-го составляло 39 - 49 (в среднем 44), 42 - 54 (47), 45 - 56 (50) и 45 - 58 (52) (Miyazaki, 1954). Личинки из угря рисового, обследованного в Таиланде, имели в длину 2.1 - 6.2 при ширине 0.3 - 0.6 мм; количество крючьев на головном вздутии в рядах от 1 до 4-го: 36 -53, 38 - 57, 39 - 55 и 49 - 52 (Rojekittikhun et al., 1998). Личинки из угря, исследованного в Мьянме, достигали в длину 2.3 - 4.4 при ширине 0.25 - 0.425, головное вздутие в среднем 0.093 х 0.221 мм, в каждом из четырёх рядов крючьев - от 1 к 4-му - насчитывалось в среднем 41, 45, 48 и 51 крючок; мышечный отдел пищевода длиной 1.025, шейные мешки 0.574 мм (Chai et al., 2015). В скобках замечу, что личинки разных видов гнатостом внешне очень похожи, и потому многие исследователи используют для их дифференциации количество ядер в клетках кишечного эпителия, выявляемых на срезе, и количество эпителиальных клеток (Diaz-Camacho et al., 2002; Nomura et al., 2000).
В заражённости рыб личинками гнатостом наблюдаются значительные колебания. Так, купленная на рынке в Бангкоке печень от 1788 угрей оказалась на 26 % поражена личинками G. spinigerum, причём в июне - июле заражённость печени достигала 74 %, а в апреле - мае - всего 8 % (Sugaroon, Wiwanitkit, 2003). К слову, о сезонных колебаниях заражённости угрей личинками гнатостом в Таиланде и их связи с сезоном дождей в этой стране исследователи сообщали ещё в 1998 г. (Rojekittikhun et al., 1998). В Мьянме из 37 угрей, купленных на местном рынке в Янгоне, нематоды встретились у 89.2 % из них, при этом в одной рыбе насчитывалось от 1 до 96 личинок (Chai et al., 2015). Практически все нематоды располагались в мускулатуре рыб и только 4.5 % - в висцере. Иная картина заражённости угрей наблюдалась во Вьетнаме: здесь при обследовании 1081 угря личинки гнатостом были выявлены только у 0.11 % особей (Le, Rojekittikhun, 2000).
Дефинитивные хозяева заражаются, поедая рыб, лягушек, змей, контаминированных личинками гнатостом, или же заглатывая вместе с водой заражённых циклопов. Помимо того, экспериментально показано, что заражение животных возможно перкутально личинками 3-й стадии (Daengsvang et al., 1970). Подобный вывод сделан на основании результатов опыта, в ходе которого извлечённых из змееголова личинок гнатостомы поместили на кожу котят, а затем наблюдали, как в течение 5-60 мин те проникали через кожу в близлежащие ткани, откуда мигрировали в печень, диафрагму, брюшные мышцы и стенку грудной клетки. Через 2 -7.5 месяцев в фекалиях кошек были выявлены яйца нематод.
Попав к окончательному хозяину, личинки G. spinigerum поселяются в стенке его желудка, вызывая образование крупных опухолевидных разрастаний диаметром до 2.5 см, от которых к просвету кишечника идёт канал. От момента попадания к хозяину и до начала откладки паразитом яиц проходит от 100 до 225 дней (Prommas, Daengsvang, 1937; Miyazaki, 1960).
203
Среди хозяев G. spinigerum в основном кошачьи - тигр, леопард, лев азиатский, пума, кошки, как домашние, так и уличные. Так, в 1920-е годы в Индии гна-тостому выявили у 10 - 30 % кошек (Chandler, 1925). Кстати, у кошек паразит найден также в Лаосе, Малайзии, Японии, Таиланде, на Филиппинах, в Австралии и Египте (Bowman et al., 2002). Заражение может быть фатальным для этих животных, прежде всего, из-за прободения стенки желудка (Chandler, 1925b). Учитывая широкое распространение данного паразита у кошек, многие исследователи полагают, что те играют значительную роль как источник распространения гнатостоми-азиса - опасного для человека заболевания (напр., Sur, Biswas, 1988).
В США в штате Джорджия взрослые особи этого паразита были обнаружены в стенке желудка енота (Bisseru, 1967). Иногда G. spinigerum регистрируют у собак (Morgan, 2013). Подробную информацию о регистрации гнатостом у этих животных в Японии, на Филиппинах, в Китае приводят в своей монографии В. М. Ивашкин и Л. А. Хромова (1976). В Краснодарском крае России нематоду встретили у лисицы обыкновенной (Итин, 2014; Итин, Кравченко, 2010) и американской норки (Итин, 2014). Экспериментально показано, что окончательным хозяином G. spinigerum может быть лисица японская (Shirakawa, 1959 - цит. по: Ивашкин, Хромова, 1976). На Филиппинах паразит найден у пальмовой циветты и у лемура-шерстокрыла (Eduardo, 1991, 2001).
G. spinigerum, открытый ещё в 1836 г., у Homo sapiens впервые был найден только в 1889 г. в Таиланде (Levinson, 1889). В распоряжении исследователя оказался один экземпляр незрелой самки, которую д-р Deuntzer извлёк из грудной опухоли тайской женщины. Второй случай также имел место в Таиланде: на этот раз один экземпляр незрелого самца был выявлен в подкожном узле человека (Leiper, 1909). В 1921 г. появилось первое описание заражения человека гнатостомой в Японии (Tamura, 1921), в 1925-м - в Китае (Morishita, Faust, 1925), в 1929-м - в Индии (Maplestone, 1929) и т.д. В настоящее время вид стал наиболее важным представителем рода, вызывающим у человека заболевание, которое в ряде случаев бывает фатальным для него (Chitanondh, Rosen, 1967; Schmutzhard et al., 1988).
Поскольку симптомы и клиническая картина проявления гнатостомиазиса, вызываемого разными представителями данного рода, весьма схожи, то их общее описание приведено ниже. Здесь же и далее при характеристике других патогенных для человека видов гнатостом ограничусь информацией о тех или иных казусах, необычных проявлениях заражения людей этими гельминтами.
У человека обычно обнаруживаются личинки и/или молодые гнатостомы, но изредка могут встретиться и половозрелые особи, что наглядно иллюстрирует случай внутричерепного гнатостомиазиса, имевший место в Корее (Lee et al., 1988). У живущей в этой стране женщины тайского происхождения, страдающей от менингоэнцефалита, удалили червя длиной 12.3 и шириной 0.9 мм. Паразит оказался самцом G. spinigerum (авторы приводят его краткое описание и рисунок).
Ареал G. spinigerum охватывает регионы южной, юго-восточной и восточной Азии - Индию, Шри-Ланку, Китай, Японию, Филиппины, Таиланд, Лаос, Мьянму, Камбоджу, Вьетнам, Малайзию, а также Среднюю Азию, Австралию, Египет, Украину.
Gnathostoma binucleatum Almeyda-Artigas, 1991 (рис. 72). Гнатостом, паразитирующих у кошачьих в Мексике, первоначально относили к G. spinigerum. Видимо, этим объясняются встречающиеся в отдельных сводных работах (напр., 204
Ивашкин, Хромова, 1976; Moravec, 1994) указания на регистрацию данного вида в Центральной Америке. И только в 1991 г. мексиканский вид был описан как новый для науки (Almeyda-Artigas, 1991). В настоящее время считается доказанным отсутствие G. spinigerum в Америке, причём не только в Центральной, но и в Северной и Южной (Bertoni-Ruiz et al., 2011). Видовое название нематоды от латинского Ыпи-cleatum - двуядерный.
Рис. 72 Gnathostoma binucleatum: 1 - передний конец тела с головным вздутием, вид сбоку (стрелка указывает на шейную папиллу); 2 - крючья головного вздутия (из: Koga et al., 2003).
Черви средних размеров; самцы длиной 1-1.5, самки 2 - 2.5 см. Имеется пара трёхлопастных губ, у которых центральная лопасть меньше латеральных. Головное вздутие с 8 - 10 поперечными рядами изогнутых крючьев, характеризующихся коническим и толстым основанием (рис. 66, 2). Шейные папиллы располагаются в первой четверти тела на уровне 16-20 рядов кутикулярных шипов. Шипы на теле различаются по форме и размерам в зависимости от участка тела. Сразу позади головного вздутия и до уровня шейных папилл они короткие и широкие, с 1 -3 зубцами, при этом центральный зубец крупнее латеральных. На уровне середины пищевода зубцы становятся узкими и длинными, с 1 — 2 зубцами, а дальше - одновершинными. Спикулы неравные, 1.4 и 0.31 мм длины. Вульва открывается слегка постэкваториально. Яйца с гладкой поверхностью и утолщением на одном полюсе, размером 66 ± 2.92 х 40 ±.3.11 pm (Koga et al., 2003).
Описывая новый вид, автор (Almeyda-Artigas, 1991) предположил, что роль своеобразного вектора по передаче паразита к человеку могут играть пресноводные и олигогалинные рыбы, заражённые личинками данного вида нематод.
К настоящему времени установлено, что в Мексике в жизненном цикле G. binucleatum участвуют более 20 видов рыб (Diaz-Camacho et al., 2008; Kifime et al., 2004; Leon-Regagnon et al., 2008; Martinez-Salazar, Leon-Regagnon, 2005; Perez et al., 2008). В частности, личинки 3-й стадии встречены в скелетных мышцах Petenia splendida (15.5 %), Cichlasoma managuense (8.6 %) и Gobiomorus dormitory (22.2 %) (Kifime et al., 2004), у Pomadasys macracanthus (1.8 %) и Mugil curema (2.16 %) (Guerrero, Alba-Hurtado, 2007), у Dormitator latifrons и Ariopsis guatemalensis 205
(=Sciades guatemalensis) (Garcia-Marquez et al., 2009) и т.д. Немаловажную роль в жизненном цикле гельминта играют и черепахи, например, мексиканская илистая Kinostemum integrum и красноухая Trachemys scripta, заражённость которых составляет соответственно 79.1 и 52.5 % (Guerrero, Alba-Hurtado, 2007). Обнаружены эти личинки и у крокодила острорылого Crocodylus acutus (Garcia-Marquez et al., 2009). Комментируя эту находку, авторы подчёркивают, что поскольку эти рептилии стоят на вершине пищевой цепи, то обнаружение в их мышцах личинок гнато-стомы является тупиковым в жизненном цикле паразита. К тому же, люди не едят крокодильего мяса; следовательно, инвазированные крокодилы, в отличие от многих видов рыб в этой стране, не являются потенциальным источником заражения человека.
Длина личинок 2.6 - 5.9 мм; на теле 240 рядов шипиков; на головном вздутии в каждом из 4 рядов насчитывается 35 - 44 (39), 38 - 47 (42), 40 - 49 (45), 43 -52 (48) крючьев (Almeyda-Artigas, 1991).
Данные из работ других авторов. Длина личинок 3 - 5.2 (4.3) мм, на теле 261 ряд шипиков, количество крючьев на головном вздутии от 1 к 4-му ряду — 36 — 40 (38), 36 - 48 (44), 38-50 (44), 38 -’54 (45) (Leon-Regagnon et al., 2002). Средняя длина тела 3.13 (3.12 - 3.14), максимальная ширина 0.32 (0.31 — 0.32); размеры головного вздутия 0.12 (0.11 — 0.13) х 0.24 (0.23 - 0.25), губ 0.025 (0.024 - 0.026) х 0.083 (0.082 - 0.084); длина пищевода 1.22 (1.22 - 1.23), ширина 0.20 (0.19 - 0.21); размеры шейного мешка 0.7 (0.6 - 0.8) х 0.087 (0.085 - 0.088) мм; количество крючьев в головных рядах — от 1 к 4-му - 36 - 39 (в среднем 38), 40 - 41 (40), 44 - 46 (45), 44 - 46 (46); на теле 255 рядов шипиков (Garcia-Marquez et al., 2009). Средняя длина личинок 4.67 мм, на теле 227 - 275 рядов шипиков. Среднее количество крючьев на головном вздутии от 1 к 4-му ряду: 39.3,43.9, 46.6 и 49.8 (Koga et al., 2003).
Окончательные хозяева G. binucleatum - леопард, кошки, как домашние, так и уличные. В эксперименте половозрелые формы выращены в двух собаках, которым скормили личинок из рыб и пеликанов; яйца гнатостомы появились в фекалиях животных через 8 и 9 месяцев (Koga et al., 2003). При вскрытии в стенке желудка одной собаки выявили две опухоли с 1 и 3 червями, у другой - две опухоли с 6 и 3 нематодами. Столь же успешно закончился опыт по заражению кошки и собаки личинками из белой цапли; взрослые особи встретились в кошке через 17 дней после заражения, а в собаке - через 35 (Diaz-Camacho et al., 2002).
На территории Мексики распространены 3 вида Gnathostoma - G. binucleatum, G. lamothei Bertoni-Ruiz et al., 2005 и G. turgidum Stossich, 1902, в числе хозяев которых известно 80 видов животных (Garcia-Marquez et al., 2014; Perez et al., 2008). Однако к зоонозным видам пока относят только G. binucleatum (Leon-Regagnon et al., 2002).
История обнаружения этого гельминта у местных жителей в Мексике берёт начало с 1970 г. (Pelaez, Perez-Reyes, 1970), причём авторы публикации особо подчеркивали, что пациент не был ни путешественником, ни иммигрантом из стран Юго-Восточной Азии. С 1989 г. количество подобных случаев постоянно увеличивается (Diaz-Camacho et al., 2002). Например, между 1995 и 2005 гг. в этой стране было зафиксировано 6328 случаев заражения людей гнатостомой (Guerrero, Alba-Hurtado, 2007), а к 2006-му году - 8000 случаев кожного и 11 - глазного гнатосто-миазиса людей (Lamothe-Argumedo, 2003, 2006).
Известно также о находке этого гельминта у местных жителей в Эквадоре (Almeyda-Artigas et al., 2000; Ollague et al., 1984). Здесь диагноз поставили сразу 15 206
пациентам, при этом у двух из них при биопсии был найден червь. На основании выявленных у пациентов гистопатологических изменений и клинической картины для данного типа заболевания было предложено название «nodular migratory eosinphilic panniculitis» (Ollague et al., 1984).
Ареал G. binucleatum: Мексика, Эквадор, Гватемала и, возможно, Перу.
Несомненная социально-экономическая значимость G. binucleatum вызвала повышенный интерес со стороны специалистов к изучению этого гельминта и, следовательно, обусловила появление большого числа публикаций по различным аспектам его морфологии, биологии, экологии, распространения и патогенности.
Gnathostoma doloresi Tubangui, 1925 (рис. 73, 74). Паразит впервые описан на материале из стенки желудка домашней свиньи на Лусоне (Филиппины) (Tubangui, 1925). При этом были обнаружены только самки нематоды. Самцы, а также самки были описаны несколькими годами позже по экземплярам, полученным от свиней в Индии (Maplestone, 1930).
Рис. 73 Gnathostoma doloresi, внешний вид нематоды (из: Baylis, 1939 - по: Tubangui, 1925) _
в л
Gnathostoma
Wb
Рис. 74 doloresi\ а - головной конец тела, вентрально; б -передний конец тела, вентрально; в - форма крючьев на головном вздутии; г -форма чешуек на теле нематоды; д - хвостовой конец самки; е - яйцо (из: Ивашкин, Хромова, 1976 -по: Tubangui, 1925)
OfZ*M а
ill н*
Нематоды средних размеров. Задняя половина тела характерно утолщена; это расширение более заметно с дорсальной стороны. Тело покрыто кутикулярными чешуйками, зубчатость которых изменяется по направлению назад в следующей последовательности: наиболее передние шипики с 3 - 4 зубцами, на уровне середины шейных желез они становятся 6 - 7-зубчатыми, далее вновь 3-вершинными и, 207
наконец, у заднего конца тела - волосовидными. Головное вздутие с 10 рядами направленных назад крючьев. Самцы длиной (по разным авторам) 11 - 12, 20 - 21, 35 - 38, 19.7 - 38, максимальная толщина 0.9 - 1.2, 1.4 - 1.66 или же 1.1 - 2.6 мм. Длина массивных изогнутых притупленных на конце спикул 1.85 - 2.08 и 0.6 - 0.7 мм. Самки длиной 16 - 22, 27 - 31, 27 - 52 или же 43 - 52, толщина 1.46 - 4.9 мм. Вульва посередине тела. Яйца мелкие, снабжены крышечками на полюсах. Размеры яиц 52 - 67 х 31 - 37 цт.
Жизненный цикл G. doloresi протекает по типичной для гнатостом схеме. Первый промежуточный хозяин - циклопы. Личинки имеют почти такое же строение, как и личинки других видов гнатостом, но отличаются от них значительно меньшими размерами (в среднем 0.315 мм). Головное вздутие с четырьмя рядами крючьев, в каждом из которых их менее 40. Крючья первого ряда заметно мельче тех, что расположены в последнем ряду. Личинки 3-й стадии зарегистрированы в саламандрах (Miyazaki, Ishii, 1952), лягушках (Hasegawa et al., 1982) и змеях (Imai et al., 1989).
Взрослые черви поселяются в стенке желудка домашних свиней и диких кабанов одиночно или группами. П. Мэплстоун (Maplestone, 1930) как-то выявил этого гельминта у 24.5 % свиней, обследованных им в Калькутте (Колката с 2001 г.).
В неоднократно цитируемой мною классической работе В. М. Ивашкина и Л. П. Хромовой (1976) приведена информация о «заражённости G. doloresi поросят, являющихся дефинитивными хозяевами этой нематоды и о единичной находке её у человека - продавца мяса» (стр. 316). При этом авторы ссылаются на публикации одного из японских исследователей (Isobe, 1958, 1959).
В 1989 г. появилось сообщение о первом, что вытекало из названия самой статьи, документально зафиксированном случае извлечения G. doloresi из подкожного узла у жителя префектуры Миязаки в Японии (Nawa et al., 1989). Однако годом раньше, в 1988 г., была опубликована статья, в которой сообщалось о трёх подтверждённых и пяти предположительных случаях регистрации у человека этих нематод, причём всё в той же префектуре Миязаки (Ogata et al., 1988).
В середине 1990-х годов была описана находка личинки гнатостомы в подвздошно-ободочной кишке 57-летнего жителя упомянутой префектуры Миязаки (Seguchi et al., 1995). К слову, случаи висцерального гнатостомиазиса встречаются очень редко. Через неделю после того, как мужчина съел несколько кусочков мяса змеи - щитомордника обыкновенного, у него развились сильные брюшные боли. В восходящей толстой кишке возле печёночного изгиба обнаружилась опухоль, которую удалили хирургическим путём. При гистологическом обследовании опухоли в ней нашли паразита, окружённого массивным инфильтратом эозинофилов. Выявленный червь оказался личинкой 3-й стадии G. doloresi.
Ещё более примечателен случай заражения 46-летнего жителя юга Японии через сырое мясо симы Oncorhynchus masou, выращенной на ферме (Akahane et al., 1998). Первоначально мужчина почувствовал эпигастральную боль, продолжавшуюся в течение 3 дней, а затем на теле появилась сыпь, которая всё расширялась, и потому на 18-й день пациент обратился в клинику. Ни в одной из четырёх биопсий кожи личинки нематод не встретились. Однако на 20-й день пузыри появились в нижней части живота, и из одного из них была извлечена маленькая нематода. Через день после этого на нижней челюсти слева внезапно появилось вздутие, которое сохранялось в течение недели. Затем все кожные ненормальности стали постепенно
208
исчезать и через 30 дней исчезли полностью. Изолированная нематода на основании морфологии и количества крючьев на головном вздутии была определена как зрелая личинка 3-й стадии G. doloresi. Данный случай примечателен ещё и тем, что источником заражения человека стала рыба, выращенная на ферме.
В настоящее время G. doloresi зарегистрирована у свиней в Японии, Сингапуре, Новой Гвинее, на Филиппинах, Тайване, в Индии. В России паразит обнаружен у диких кабанов в Приморье.
Gnathostoma hispidum Fedtschenko, 1872 (рис. 75, 76). Паразит впервые описан А. П. Федченко (1872) по экземплярам, извлечённым из стенки желудка дикого кабана в Туркестане. Видовое название подчёркивает особенности вооружения нематоды: от латинского hispidum - щетинистый.
Рис. 75 Gnathostoma hispidum'. расположение Рис. 76 Gnathostoma hispidum'. а - головной и форма кутикулярных шипов на поверхно- конец, апикально; 6 - яйцо; в - хвостовой сти тела самки (из: Ивашкин, Хромова, 1976 конец самца (из: Ивашкин, Хромова, 1976 -- по: Miyazaki, I960) по: Ciurea, 1911)
Живые особи G. hispidum отличает своеобразная окраска тела: передняя часть розовато-красная, задняя - серовато-бурая с желтоватыми нитевидными полосками просвечивающих половых желез. Тело цилиндрическое. Головной конец отделён от остальной части тела глубокой перетяжкой. По обеим сторонам рта имеется по одной широкой губе. На каждой губе по два крупных сосочка, между которыми видны три небольших папилловидных возвышения. Головное вздутие с 9 - 12 рядами крючьев длиной до 29 pm; в каждом ряду до 100 - 130 крючьев. Кутикулярные шипики, как и у всех Gnathostoma, в зависимости от участка тела имеют 209
разные форму и размеры. Наиболее передние из них с 7 - 9 почти равными зубчиками, у более задних шипиков средний зубец становится длиннее остальных (рис.
77).
Рис. 77 Gnathostoma hispidum, шипики на теле червя на уровне пищевода (из: Baylis, 1939 - по: Ratz, 1900)
На уровне заднего края пищевода, т.е. в 3.4 - 5.5 мм от переднего конца тела, шипики
приобретают обычную заострённую форму без зубцов. Длина самцов 12-25, мак-
симальная толщина 1.2-2 мм. Хвост округлой формы, с 19 сосочками. Спикулы длиной 0.88 - 1.37 и 0.32 - 0.60 мм. Самки длиной 21-45 мм. Хвостовой конец са
мок в виде усечённого конуса. Вульва открывается несколько впереди середины тела. Яйца с тонкой оболочкой, усеянной маленькими вдавлениями, с крышечкой на одном полюсе; размеры яиц 68 - 74 х 39 - 42 pm.
Биология G. hispidum типична для всех гнатостом. Самка нематоды откладывает яйца в просвет желудка животного-хозяина, откуда те выносятся в кишечник и далее с фекалиями попадают во внешнюю среду. В воде при 22.5°С через 11 -12 дней из яйца выходит личинка, способная сохранять жизнеспособность до 30 суток. Циклопы заглатывают личинок, которые в их кишечнике освобождаются от чехлика и через стенку пищеварительного тракта мигрируют в полость тела. Здесь личинки линяют и достигают инвазионного состояния: при 27°С на 7 - 8-й день, а при 22 - 25 °C - на 10 - 12-й. Резервуарные (паратонические) хозяева - рыбы, амфибии, змеи, птицы, млекопитающие - заражаются, заглатывая инвазированных циклопов или уже заражённых резервуарных хозяев. В их организме личинки ми
грируют из кишечника в полость тела и достигают мускулатуры, где инкапсулируются. Весь процесс миграции личинки занимает 30 дней, после чего их рост прекращается. Возможна также реинвазия резервуарных хозяев.
В эксперименте исследователи получили зрелых личинок 3-й стадии в обезьяне, которой скормили 80 экз. личинок из вьюна, импортируемого в Японию из Юго-Восточной Азии (видимо, из Китая) (Koga et al., 1988). Через 466 дней в мышцах животного обнаружили капсулы, в которых локализовались зрелые личинки 3-й стадии; всего прижилась 51 личинка, т.е. почти 64 %. Столь же удачным был опыт по заражению личинками из рыбы мышей, при этом в мышах нематоды увеличились в размерах в среднем в 3.8 раза (Sohn, Lee, 1996).
Паразитирующие в рыбах личинки 3-й стадии мелкие, их размеры 1.3 - 2.3 х 0.18 - 0.40 (Определитель, 1987) или 0.693 х 0.101 мм (Sohn, Lee, 1996). Кутикула прозрачная, с мелкими шипиками в 190 рядах. Подвижное головное вздутие размером 0.12 х 0.16 мм, почти полностью погружено в передний конец тела. На переднем конце головного вздутия располагаются трёхлопастные губы, на каждой из которых имеются 3 сосочка, среди них центральный выражен слабее остальных. Головное вздутие вооружено шипами, среднее количество которых от 1 к 4-му ряду составляет: 36.7, 39.5, 41.6 и 44.3. Мышечная часть пищевода почти в 10 раз короче железистой. Протоки пищеварительных желез открываются в соответствующие резервуары на головном вздутии. Нервное кольцо располагается на границе между пищеводом и кишечником. Половые органы не развиты.
210
Обнаруженные в змее — динодоне краснопоясном - личинки G. hispidum достигали в длину 1.53 - 2.63 (в среднем 2.18) и ширину 0.22 - 0.35 (0.29) мм. На теле 220 рядов кутикулярных шипиков. Головное вздутие 0.05 - 0.08 х 0.14 - 0.19 (в среднем 0.07 х 0.17) мм. Количество крючьев на головном вздутии - от 1 к 4-му ряду: 36 - 42 (в среднем 38.6), 38 - 44 (40.5), 38 - 46 (41.5), 38 - 48 (43.7) (Cho et al., 2007).
Взрослые особи G. hispidum паразитируют у домашних и диких свиней, изредка встречаются у крупного рогатого скота. Заражение животных происходит или на водопое при случайном заглатывании с водой инвазированных циклопов, или при поедании паратенических хозяев. Второй путь является основным. У сильно инвазированных свиней в стенке желудка может насчитываться несколько десятков и даже более сотни взрослых нематод. Черви вызывают у свиней хроническое воспаление стенки желудка, гепатит печени.
Первое сообщение о находке G. hispidum у человека датируется 1924-м годом. Тогда нематоду выявили у жителя Токио, но при извлечении повредили червя (Morishita, 1924). Спустя 25 лет гнатостому щетинистую обнаружили в глазу китайца (Chen, 1949). Последующая информация о регистрации G. hispidum у людей касается в основном региона Японии, при этом авторы практически всех публикаций подчёркивают решающую роль импортируемых из Китая рыб (Chinese loaches) как источника инвазии (Akahane, Mako, 1984; Araki, 1986; Demitsu, Aizawa, 1985; Morita et al., 1984). Известно также о единичных случаях обнаружения этих нематод у людей в Индии.
В целом ареал G. hispidum включает Германию, Австрию, Венгрию, Румынию, Францию, Россию, Казахстан, Туркмению, Узбекистан, Киргизию, Азербайджан, Индию, Шри-Ланка, Китай, Филиппины, Малайзию, Японию, Вьетнам.
Gnathostoma nipponicum Yamaguti, 1941 (рис. 78). Данный вид нематод впервые был найден у японской норки в 1931 г. (Yoshida, 1931), но описан тогда под названием Gnathostoma spinigerum. Получив дополнительный материал от этого же хозяина и из того же региона С. Ямагути (Yamaguti, 1941) описал его уже как представителя нового вида - Gnathostoma nipponicum. Видовое название указывает на место находки гельминта: nipponicum - японский.
Описание (по разным авторам). Довольно крупные нематоды, тело которых до двух третей его длины покрыто зубчатыми чешуйками; форма и размеры которых изменяются по направлению к заднему концу тела. Передние чешуйки с 3 - 5 зубцами, у последующих их количество уменьшается до одного - двух. Головное вздутие с 7 - 11 рядами крючьев. У ротового отверстия латерально расположены две четырёхугольные губы, на внутренней стороне переднего края которых выступает небольшая зубчатая пластинка. Самцы длиной 10 - 28 и шириной 1-1.9 мм. Хвост заканчивается тупо; вентральная сторона хвоста, за исключением небольшого участка возле клоаки, покрыта мелкими поперечно расположенными шипиками. Спикулы длиной 1.1 - 2.63 и 0.4 - 0.8 мм. Имеются четыре пары крупных пальцевидных субвентральных сосочков и три пары маленьких чувствительных вентральных. Самки длиной 20 - 29 и шириной 1.0 - 1.6 мм. Вульва располагается ближе к задней части тела. Яйца с тонкой оболочкой и крышечкой на одном полюсе, размерами 63 - 78 х 38 - 48 цт.
211
Рис.78 Gnathostoma nipponicum', a - самка (показаны форма и расположение шипов на теле); б - хвостовой конец самца (без спикул); в - задний конец самца (из: Ивашкин, Хромова, 1976 - по: Yamaguti, 1941, 1961)
Жизненный цикл G. nipponicum типичен для всех гнатостом.
Первый промежуточный хозяин - циклопы нескольких видов, резервуарные -пресноводные рыбы. Обследование вьюна амурского, импортируемого в Японию из Китая, выявило его заражённость личинками гнатостом, по своим морфологическим особенностям соответствовавшим таковым G, nipponicum (Sohn et al., 1993). Авторы делают вывод о возможности заражения людей гнатостомами при употреблении в пищу популярных в Японии блюд из сырого вьюна, импортируемого из Китая.
Личинки гнатостомы японской мелкие, почти бесцветные, с коричневатым. кишечником. На теле насчитывается 229 поперечных рядов мелких шипиков; головное вздутие с 3 рядами крючьев: в первом ряду в среднем 34.5 крючьев, во втором - 36.7, в третьем - 39.7 (Sohn et al., 1993).
Половозрелые особи G, nipponicum - паразиты куньих (Ashizawa et al., 1979).
В Японии известно два случая заражения человека гнатостомой японской (Ando et al., 1988). Гораздо чаще в этой стране отмечают попадание к человеку другой гнатостомы - G. hispidum, В цитируемой работе её авторы подчёркивают, что пациенты заразились через вьюна амурского Misgurnus anguillicaudatus, которого они ели в сыром виде. Обследовав шесть особей колонка - естественного оконча
212
тельного хозяина нематоды - в той же местности, где было выявлено заражение людей, исследователи установили их заражённость зрелыми червями G. nipponicum. Удачными были у них опыты и по заражению вьюна.
Впервые гнатостому у человека описал в 1889 г. Г. М. Левинсон (Levinson, 1889), в распоряжении которого оказался один экземпляр незрелой самки нематоды, которую д-р Deuntzer извлёк из опухоли груди у тайской женщины. Паразит был описан под названием Cheiracanthus siamensis (цит. по: Faust, 1949; Houston, 1994). К настоящему времени проблеме паразитирования гнатостом у человека посвящены сотни публикаций: фактически каждый случай регистрации этих опасных гельминтов у людей находит отражение в соответствующих медицинских и/или паразитологических журналах. В Международной классификации болезней 10-го пересмотра (МКБ-10)2, принятой 43-й Всемирной Ассамблеей Здравоохранения, в «Классе I. Некоторые инфекционные и паразитарные болезни (А00-В99)», в блоке «В65-В83 Гельминтозы» даже выделен раздел «В83.1 Гнатостомоз (подвижная опухоль)». Изложить содержание всех статей - частных и обзорных - не представляется возможным по причине ограниченности объёма данной монографии, да и особой необходимости в этом нет. Посему ограничусь анализом наиболее интересных и значимых публикаций, наглядно иллюстрирующих медицинскую и социально-экономическую значимость проблемы заражения людей гнатостомами.
Прежде всего, подчеркнём, что, попадая в организм человека, личинки гнатостом не могут завершить в нём своего жизненного цикла. Например, гнатостома, выделенная из больного более чем через 12 месяцев после появления первых признаков заболевания, хотя и несколько увеличилась в размерах в сравнении с личинками из рыб, но по-прежнему оставалась на личиночной стадии. Для сравнения: в организме кошек черви достигают половозрелого состояния за 2 - 5 месяцев (Ивашкин, Хромова, 1976). Человек не принадлежит к числу дефинитивных хозяев этих гельминтов, и поэтому у личинок, попавших в организм несвойственного для них хозяина, по всей видимости, срабатывает механизм так называемого «эффекта бегства». Личинки мигрируют через органы брюшной полости и грудной клетки в кожу, подкожную клетчатку, глаза, желудок, печень, лёгкие, центральную нервную систему (ЦНС), приводя ^ возникновению локализованных участков воспаления и кровоизлияний и вызывая нарушения в их работе. Клинические проявления инвазии обычно связаны с миграцией единственной личинки, во время которой могут наблюдаться местные воспалительные реакции, боль, кашель, гематурия, сопровождающиеся лихорадкой и эозинофилией. Питаясь фактически за счёт хозяина, паразит вызывает у того дисбаланс микроэлементов, что приводит к нарушению обменных процессов в его организме. Симптомы поражения разнообразны, а их проявление зависит от степени повреждения того или иного органа, а также продолжительности заболевания.
В зависимости от локализации личинок нематод в организме человека различают внутрикожный (дермальный), висцеральный, глазной и неврологический гнатостомиазис.
Попавшие в желудок личинки немедленно начинают внедряться в его стенку. Буквально через несколько минут человек чувствует острую боль в горле и
2 mkb.10.com. Инструкция по использованию МКБ-10 утверждена Министерством здравоохранения РФ 23 мая 1998 г. № 2000/52-98.
213
грудной клетке, появляются кашель, тошнота и рвота. Дальнейшее продвижение червя сопровождается головной болью, жаром, расстройством желудка, болью в эпигастрии (Diaz-Camacho et al., 2003). Подобные симптомы могут быть ошибочно приняты за панкреатит и пневмонию.
При поселении гнатостом в лёгких, куда они, скорее всего, проникают вскоре после попадания в желудок, внезапно появляются боли за грудиной, кашель, связанные с миграцией личинок; на рентгенограмме видны множественные затемнения лёгочной ткани, иногда наблюдаются явления гидропневмоторакса (скопление жидкости и воздуха в плевральной полости) (Nagler et al., 1983). При кашле возможно выделение нематод с мокротой (Nitidandhaprabhas et al., 1978).
Проникая в подкожную клетчатку, личинки и молодые гнатостомы или локализуются здесь в узлах размером с горошину, или свободно блуждают в коже, подкожной клетчатке, под слизистыми оболочками, в результате чего образуются транзиторные ползучие припухлости, подкожные ходы и абсцессы на спине, животе, верхних и нижних конечностях, лице и коже головы. При этом в течение одного часа личинка может преодолеть путь длиною более 1 см (Feinstein, Rodriguez-Valdes, 1984). Клинически болезнь проявляется линейным дерматитом (высыпания из крупных напряжённых пузырей с прозрачным или геморрагическим содержимым) или интермиттирующими, т.е. характеризующимися периодическими подъёмами и спадами, болезненными и зудящими отёками с покраснением на лице, груди, животе, спине, конечностях, а также лихорадкой, эозинофильным лейкоцитозом (Cui et al., 2013; Rusnak, Lucey, 1993; Vanegas et al., 2014). Особенно часто поражаются дистальные участки конечностей и веки. Проявления обычно исчезают через неделю, однако нередки рецидивы на протяжении многих лет. Гнатостомы могут паразитировать в организме человека многие годы, более 10 лет.
Известен случай, когда 42-летняя жительница штата Синалоа в Мексике в течение 4 лет страдала от болезненных, зудящих, мигрирующих вздутий на лице (Baquera-Heredia et al., 2002). (Как она терпела это все годы?!). Когда эти опухоли появились возле глаза, то развился отёк век с покраснением слизистой оболочки глаза. При клиническом обследовании в передней камере глаза пациентки обнаружили подвижного червя, которого удалили хирургическим путём.
И ещё один пример рецидива клинических признаков кожного гнатостомиа-зиса. Женщина из Бангладеш, проживавшая в Германии уже более 2 лет, вынуждена была обратиться в клинику из-за беспокоившего её в течение 5 месяцев мигрирующего, болезненного вздутия на левой руке. После серии лабораторных исследований, выявивших её заражение гнатостомой, пациентке прописали курс лечения альбендазолом, что привело к внешней миграции личинки и полному исчезновению неприятных симптомов (Grobusch et al., 2000).
О глазном поражении человека G. spinigerum, приведшему к слепоте, впервые сообщили в 1937 г. в Таиланде (Rhithibaed, Daengsvang, 1937). К 2012 г. в 12 странах мира было выявлено 74 случая внутриглазного гнатостомиазиса, при этом в 4 странах отмечено более 10 случаев в каждой, а в Индии - 14 (Pillai et al., 2012). Учитывая, что иногда люди сами освобождаются от «инородного тела» в глазу, не исключено, что подобных случаев в действительности больше, чем это явствует из публикаций. Нематоды могут локализоваться в стекловидном теле, сосудистой оболочке глазного яблока, радужной оболочке, под веком, где активно и беспорядочно передвигаются, вызывая повышенную слезоточивость, сильную припухлость
214
века, острую боль, фотофобию, создавая помехи зрению (Barua et al., 2007; Kannan et al., 1999; Tiwari et al., 2009). Поражение глаза протекает с явлениями целлюлита в области глазницы, увеита (воспаление сосудистой оболочки глазного яблока), неврита (воспаление нерва), иридоциклита (воспаление радужной оболочки и цилиарного тела глазного яблока) с отслоением сетчатки; могут также наблюдаться отёк роговой оболочки глаза и помутнение радужной оболочки (Basak et al., 2004; Bhattacharjee et al., 2007; Bhende et al., 2005; Chuenkongkaew et al., 2007; Hem et al., 2015; Kannan et al., 1999; Le et al., 2002; Pillai et al., 2012). К тому же, нематоды повреждают радужную оболочку, буквально продырявливая её, могут вызывать плотное помутнение стекловидного тела с фиброзной пролиферацией через диск зрительного нерва, провоцировать образование глаукомы (Biswas et al., 1994). Для извлечения паразита из стекловидного тела хирурги вынуждены прибегать даже к первичной витрэктомии (pars plana vitrectomy), т.е. удалению стекловидного тела или его части (Basak et al., 2004). Иногда червь может самопроизвольно покинуть орбиту глаза (Chuenkongkaew et al., 2007).
И всё же наиболее тяжёлые последствия имеет поражение центральной нервной системы. Миграция личинки G. spinigerum по нервным стволам и внутри ЦНС приводит к смертельному эозинофильному менингиту с энцефаломиелитом (Lo Re, Gluckman, 2002; Ramirez-Avila et al., 2009; Schmutzhard et al., 1988). Заболевание характеризуется приступами мучительной корешковой боли, парестезией туловища и конечностей (расстройство чувствительности кожи, характеризующееся ощущениями онемения, покалывания), вслед за которыми может последовать параплегия (паралич обеих нижних или обеих верхних конечностей). В спинномозговой жидкости (СМЖ) отмечается эозинофильный лейкоцитоз. К тому же СМЖ часто бывает ксантохромной, т.е. окрашенной в жёлтый или жёлто-коричневый цвет продуктами распада гемоглобина. В головном и спинном мозге, в мозжечке и корешках нервов наблюдаются множественные геморрагии и некрозы, в желудочках - гематомы, а между твёрдой и паутинной мозговыми оболочками - субдуральное кровоизлияние (Sawanya-wisuth et al., 2009). Прогноз при поражении ЦНС серьёзный: заболевание нередко (8 - 25 %) заканчивается смертью в результате кровоизлияний в мозг или разрушения жизненно важных центров.
В последние годы в Таиланде всё чаще регистрируют заболевание - эозинофильный радикуломиелоэнцефалит, возбудителем которого считают G. spinigerum. Первоначально у заболевшего появляются боли в животе, слабость, бессонница, мигрирующие подкожные опухоли, характерны рецидивы. В дальнейшем увеличивается и становится болезненной печень, повышается температура. Наблюдаются нарушения со стороны ЦНС: снижение тактильной и болевой чувствительности во всём теле, онемение, параплегия, а затем горизонтальный нистагм (непроизвольные колебательные движения глаз высокой частоты), охриплость голоса, отсутствие глотательного рефлекса, паралич лицевого нерва, конечностей. В некоторых случаях наступает затруднение дыхания, расстройство кровообращения, общие тонические судороги и смерть. В крови выражен прогрессирующий высокий лейкоцитоз с эозинофилией до 96 %. СМЖ желтоватая, с повышенным содержанием клеточных элементов, в том числе эозинофилов и нейтрофильных гранулоцитов, иногда метамиелоцитов (cyclowiki.org/wiki/гнатостомоз).
Диагноз на поражение гнатостомами ставится на основании клиники болезни, внутрикожной аллергической реакции и более специфичной реакции преципи-
215
тации с сывороткой крови и мочой больных с антигеном из личинок, паразитирующих в рыбе. В ранней диагностике весьма полезна также картина крови пациента, поскольку при поражении гнатостомами резко возрастают в числе лейкоциты, особенно эозинофилы. Диагноз подтверждается выделением гнатостом.
Кстати, введение в диагностике гнатостомиазиса серологических методов (Caballero-Garcia et al., 2005; Wongkham et al., 2000) показало, что в действительности он распространён среди людей гораздо шире, чем предполагали. К примеру, во Вьетнаме по состоянию на 1998 г. было известно всего 3 случая поражения человека Gnathostoma. Однако, как только стали применять серологический метод, выявились сотни подобных случаев (Carrique-Mas, Bryant, 2013). При этом доля дермального типа поражения составляла 63.8 %, висцерального - 14.7 % (Le et al., 2004). В дельте Меконга у населения отмечено поражение глаз (Le et al., 2002).
Кожный гнатостомозиазис следует дифференцировать от очень похожего поражения кожи, вызываемого кожной мигрирующей личинкой, а поражение гнатостомами ЦНС от аналогичного поражения, вызываемого нематодой Angiostrongylus cantonensis. И, наконец, вместо гнатостомы человек в действительности может быть поражён личинками цестоды спарганума, локализующимися в подкожной соединительной ткани и поверхностных мышцах и вызывающими образование подкожных мигрирующих узелков (Akkarachinorate et al., 2013). Совершенно очевидно, что правильный диагноз предопределяет и соответствующее лечение
В клинических исследованиях для лечения гнатостомиазиса апробированы самые разные препараты, но к настоящему времени реальную эффективность показал только альбендазол, стимулирующий внешнюю миграцию личинок (Grobusch et al., 2000; Suntharasamai et al., 1992). Показано, что для лечения кожного гнатостомиазиса альбендазол (400 мг сут'1 в течение 21 дней) более эффективен, чем однократная пероральная доза ивермектина (200 мкг кг'1) (Kraivichian et al., 2004). По другим данным (Chappuis et al., 2001), ивермектин эффективнее альбендазола. Возможно, что эффективность того или иного препарата в определённой степени зависит от видовой принадлежности попавшего к человеку паразита, а, может быть, и от степени его развития, а также индивидуальных особенностей организма пациента. Во всяком случае, подавляющее большинство медицинских работников отдают предпочтение альбендазолу, который рекомендуется принимать в дозе 200/400 мг два раза в день в течение 21 дня (Clement-Rigolet et al., 2004; Del Giudice et al., 2005; de Vries et al., 2001; Grobusch et al., 2000; Hennies et al., 2006; Jelinek et al., 1994; Kraivichian et al., 2004; Muller-Stover et al., 2004; Vanegas et al., 2014 и др.). Более того, при кожном гнатостомиазисе рекомендуется начать приём альбендазола ещё до вскрытия нарыва (Sakamoto et al., 2004).
Хирургическое лечение основано на удалении паразитов из подкожного покрова или внутреннего органа.
Кратко резюмируем изложенное. Прежде всего, отметим, что из 12 - 13 видов, которых объединяет род Gnathostoma, у человека достоверно зарегистрированы 5, т.е. около или несколько более 40 %. Однако, как уже подчёркивалось, некоторые исследователи считают, что паразитировать у человека способны все представители данного рода. Далее. Невольно обращает на себя внимание широкая география случаев регистрации гнатостом у человека: Индонезия, Мьянма, Камбоджа, Лаос, Вьетнам, Малайзия, Япония, Филиппины, Австралия, Китай, Индия, Бангладеш, Шри-Ланка, Израиль, Мексика, Эквадор, Гватемала, Перу, Канада, Замбия, Ботсва-216
на. Из перечисленных районов наиболее крупными очагами заболевания являются Таиланд, Япония и Мексика.
С начала 1980-х годов количество регистрируемых случаев заражения человека значительно увеличилось, а их география расширилась (Clement-Rigolet et al., 2004; Herman, Chiodini, 2009; Ligon, 2005). Объяснение этому мы находим не только в совершенствовании методов диагностики данного заболевания, но и в растущих международных торговых перевозках, когда живность доставляется самолётами из любой точки в любой регион мира буквально в считанные часы, а также в интенсивных миграционных перемещениях населения, активных деловых поездках и весьма популярных в наше время туристических поездках в экзотические страны.
Проиллюстрируем сказанное несколькими примерами.
Выше уже упоминалась заражённость гнатостомами рыбы, импортируемой в Японию из Китая. Очень похожая картина выявлена при обследовании в ряде городов США угря-кучии (Monopterus cuchia), поставляемого в живом виде на местные этнические рынки в основном из Бангладеш (Cole et al., 2004). У 27.7 % угрей в печени, мышцах, желудочно-кишечном тракте и/или почках были выявлены личинки G. spinigerum, на основании чего авторы сделали вывод о потенциальной опасности для здоровья человека употребления этих рыб в пищу в необработанном виде.
В этой связи не могу не привести ещё один, довольно своеобразный пример. В Корее как-то конфисковали партию змей четырёх видов, в том числе динодона краснопоясного, которую пытались провезти контрабандой из Китая (Cho et al., 2007). Всю партию - 211 экз., в том числе 80 экз. динодона - отдали на паразитологическое обследование в лабораторию, где работали авторы цитируемой статьи. В результате у 22.5 % динодона были выявлены личинки G. hispidum, в среднем в одной заражённой змее насчитывалось 11.4 личинки. Ещё одна нематода была обнаружена в одной из 50 обследованных особей полоза лазающего. Естественно, ни о каком санитарно-ветеринарном контроле контрабандного товара речь не шла.
Одной из причин роста поражения людей гнатостомами стал возросший в последние десятилетия интерес к поездкам в тропические регионы Юго-Восточной Азии, Африки и Центральной Америки. Ежегодно из развитых стран их посещает 50 млн. человек (Herman, Chiodini, 2009). Оказавшись в экзотичной среде, резко отличающейся от привычной обстановки, каждый уважающий себя турист считает себя просто обязанным попробовать какое-нибудь необычное местное блюдо. В результате подобных дегустаций случаи выявления у людей гнатостом регистрируют в таких странах, где ранее их никогда не отмечали. Например, паразит был выявлен у 13-летнего жителя Германии после 4-недельного отдыха в Таиланде (Jelinek et al., 1994), у французского туриста - после посещения Мексики (Del Giu-dice et al., 2001) и у француженки, проживавшей во Вьетнаме (Del Giudice et al., 2005), у двух датчан, путешествовавших по Юго-Восточной Азии (de Vries et al., 2001). Пострадали и два испанских вояжёра после поездки в Мексику и Таиланд, причём у одного из них была выявлена подкожная форма заболевания, а у второго - более тяжёлая, медуллярная (Gorgolas et al., 2003).
47-летний житель Японии, находясь с деловым визитом во Вьетнаме, вместе со своим вьетнамским другом ел там жареную лягушку. (Sakamoto et al., 2004). Через 5 месяцев его приятелю был поставлен диагноз гнатостомиазиса, а через 7 месяцев и его японский коллега обнаружил у себя на правой ноге вздутие, которое
217
постепенно переместилось на правую руку, в связи с чем он вынужден был обратиться за медицинской помощью. Гематологический анализ показал наличие у него эозинофилии, а серологический тест был положителен на гнатостом. Пациенту прописали альбендазол в дозе 400 мг в сутки, и на 11 день лечения из поражения на правой ладони он ногтями вытащил нематоду, которую специалисты определили как G. spinigerum.
В этом же ряду стоит довольно необычный случай заражения гнатостомой 37-летней женщины родом из Лаоса, но живущей в Германии в течение 17 лет. Посетив после длительного перерыва свою родину, она по возвращении через какое-то время обратилась в клинику из-за появившегося на щеке характерного вздутия. На основании наличия специфических антигнатостомных антител, клинических признаков и истории поездки пациентки в Лаос ей был поставлен диагноз кожного гнатостомиазиса, для лечения которого был успешно применён альбендазол (Hennies et al., 2006). Очень похожая история когда-то имела место в Канаде (Houston, 1994). Гнатостомиазис, вызванный G. spinigerum, был выявлен в этой стране у 31-летней женщины тайского происхождения, супруги местного жителя, которая ежегодно почта 6 месяцев проводила на своей исторической родине, где, по её словам, обычным блюдом в её меню была местная рыба, зачастую полусырая, термически необработанная.
Описаны также случаи выявления гнатостом у людей после поездок в Перу (Chappuis et al., 2001), в бассейн Замбези в Замбии (Hale et al., 2003), в Ботсвану (Herman et al., 2009), Корею (Lo Re, Giuckman, 2002).
Болезнь характеризуется природной очаговостью, что во многом определяется предпочтительным употреблением местным населением в пищу сырого мяса рыб, лягушек, змей, а также птицы - цыплят, уток. Ассортимент таких блюд весьма разнообразен. В Мексике, например, большой популярностью пользуется блюдо ceviche, пришедшее в эту страну из Перу. Для его приготовления нарезанную кубиками рыбу и лук заправляют соком лайма или лимона, а также солью и перцем-чили и выдерживают в течение нескольких часов при комнатной температуре. В Таиланде в числе подобных блюд - Koi-pla (фарш или мелко нарезанная рыба с пряной салатной заправкой), во Вьетнаме - koi са song, в Японии — sushi, sashimi, в Южной Америке - callos и т.д. Суть всех блюд одна - сырое мясо рыбы, птицы, креветок, лягушек, змей, заправленное различными специями и соусами. В Индии практически все случаи внутриглазного гнатостомиазиса выявлены на востоке и северо-востоке страны, где среди местного населения весьма популярны копчёная и маринованная рыба, а также крабы - основной источник, по мнению авторов цитируемой публикации, заражения людей (Pillai et al., 2012).
О том, что приправы, в частности лимонный сок, никак не гарантируют обеззараживания рыбы, продемонстрировал случай с восемью жителями Мауны в Ботсване (Frean, 2010). Источником их инвазии стала маринованная в лимонном соке тиляпия, которую они ели во время поездки к дельте реки Окаванго, а заболевание проявилось кожными узелками и несколькими мигрирующими вздутиями. Последние образовали поверхностные кожные повреждения, из которых извлекли мелких червей, определённых как Gnathostoma sp. Столь же неприятные последствия, имела новогодняя вечеринка для девяти её участников в Таиланде (Migasena et al., 1991). Пятеро из них почувствовали тошноту, рвоту, спазмы в животе и диарею в течение первых 24 ч после того, как попробовали рыбное блюдо Hu-sae (увы!
218
не смогла найти ингредиентов этого блюда), остальные испытали те же симптомы на следующий день. Затем у пострадавших появились недомогание, дискомфорт в области грудной клетки, кашель, миалгия, слабость, зуд, мигрирующие отёки; у всех пациентов была выражена эозинофилия. После соответствующих лабораторно-диагностических анализов и тестов выяснилось, что причиной столь неприятных симптомов стала инвазия любителей сырых блюд личинками G. spinigerum.
Каковы же те превентивные меры, которые следует предпринять для предупреждения заражения гнатостомами? Прежде всего, как мы видим, огромное значение имеют ветеринарно-санитарный контроль и сертификация рыбы и прочей живности, поступающей из неблагополучных по гнатостомиазису регионов в торговую сеть, на предприятия общепита, а также на экспорт. Примеры, подтверждающие правоту сказанного, приведены выше.
В районах распространения гнатостом категорически противопоказано употреблять в пищу сырую или недостаточно обработанную рыбу, а также мясо лягушек, змей, уток, цыплят. Экспериментально показано, что заключённые в капсулы личинки гибнут в воде при температуре 70°С в течение 6 мин, в уксусе - в течение 6 ч, в соевом соусе -12 ч (Egashira, 1953). Живая личинка в мясе рыбы на глубине 1 см погибает в кипящей воде через 5 мин, а в 4 % уксусе - через 5.5 ч (Daengsvang, 1949). Рыбу и прочие пищевые продукты, могущие стать источником заражения гнатостомами, рекомендуют также выдерживать в морозильной камере при -20°С в течение 3-5 суток.
О необходимости тщательной термической обработки рыбного сырья свидетельствует пример с заражением гнатостомами супружеской пары в Австралии (Cameron et al., 2011). Супруги отдыхали в экзотическом месте на северо-западном побережье континента, где запекали на костре рыбу, причём цельной тушкой. Время обжарки рыбы не контролировалось, а степень её прожарки осталась неизвестной. По возвращении домой через 10-12 дней у обоих супругов появились неприятные симптомы кожной формы поражения гнатостомами. Диагноз был установлен на основании серологического теста. Лечение ивермектином оказалось успешным: мониторинг состояния супругов в течение последующих 6 лет показал отсутствие у них каких-либо признаков гнатостомиазиса.
Профилактика гнатостомозиса заключается также в проведении просветительской работы среди населения, осуществлении общих санитарно-ветеринарных мероприятий, направленных, прежде всего, на недопущение сброса в водоёмы нечистот со свиноферм. В звероводческих хозяйствах, на свинофермах, а также на птицефермах не следует кормить выращиваемых животных и птиц сырой рыбой, выловленной в неблагополучном водоёме. В равной степени в местности, где известны случаи заражения гнатостомами диких и домашних животных, а также рыб, змей, лягушек, нельзя допускать, чтобы свиньи пили воду из небольших озёр, прудов, луж; для этой цели лучше всего использовать колодезную воду.
И, наконец, любители путешествий обязательно должны располагать информацией о распространении тех или иных опасных для здоровья человека паразитов, в том числе гнатостом, в тех странах, куда они направляются, а также о мерах, могущих уберечь их от заражения ими. И эту информацию им обязаны предоставлять туристические фирмы, организующие поездки в соответствующие страны.
219
Цитируемая литература
Ивашкин В. М., Хромова Л. А. Кукулланаты и гнатостомататы животных и человека и вызываемые ими заболевания И Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1976. - 27. -С. 285-434.
Итин Г С., Особенности гельминтофауны диких хищных млекопитающих в ландшафтно-географических зонах Северо-Западного Кавказа: Дисс...канд. биол. наук: 03.02.08 - экология. - Краснодар, 2014.-171 с.
Итин Г. С., Кравченко В. М. Эколого-фаунистическая характеристика гельминтов лисицы обыкновенной на территории Краснодарского края, -http://www.kubanvet.ru/joumal_n3_20107.html.
Скрябин К. И. 4-я РГЭ в Донскую область (окр. г. Новочеркасска). - Пятая РГЭ в Туркестанский край. - Деятельность 28-й гельминтол. эксп. в СССР. - М., 1927. - С. 32 - 40 и 40 - 92.
Africa С. М., Refuerzo Р. G., Garcia Е. Y. Observations on the life cycle of Gnathostoma spinigerum H Philipp. J. Sci. - 1936a. -59. -P. 513-521.
Africa С. M., Refuerzo P. G., Garcia E. Y. Further observations on the life cycle of Gnathostoma spinigerum //Philipp. J. Sci. - 1936b. -61. -P. 221 -225.
Akahane H, Mako T. Infection patterns of Gnathostoma hispidum in loaches imported from mainland China I I Jpn. J. Parasitol. - 1984.-33. -P. 509 - 513. (in Japanese).
Akahane H, Shibue K, Shimizu A., Toshitani S. Human gnathostomiasis caused by Gnathostoma doloresi, with particular reference to the parasitological investigation of the causative agent // Ann. Trop. Med. Parasitol. - 1998. - 92, 6. - P. 721 - 726.
Akkarachinorate K., Pukvaran U, Kittipong C, Chalit K„ Paron D. et al. Subcutaneous larva migrans of a sparganum in a gnathostomiasis-endemic area 11 Clin. Med. - 2013. - 2. - P. 530 - 534.
Almeida-Artigas R J. Finding of Gnathostoma binucleatum n. sp. (Nematoda: Spirurida) in wild felids and the role of freshwater and oligohaline fishes as human gnathostomiasis vectors in the lower basin of Pa-paloapan river, Oaxaca-Veracruz, Mexico // An. Inst. Cienc. Mar. Limnol. Univ. Nal. Auton. Mexico. -1991.- 18.-P. 137-155.
Almeida-Artigas R J., Bargues D. M., Mas-Coma S. ITS-2 rDNA sequencing of Gnathostoma species (Nematoda) and elucidation of the species causing human Gnathostomiasis in the Americas // J. Parasitol. -2000. - 86.-P. 537-544.
Ando K, Tanaka H, Taniguchi Y., Shimuzu M., Kondo К Two human cases of gnathostomiasis and discovery of a second intermediate host of Gnathostoma nipponicum in Japan I I J. Parasitol. - 1988. - 74, 4. - P. 623-627.
Araki T. Gnathomiasis-parasitic diseases caused by eating raw loaches // Kansen Ensyou Meneki (Infection, Inflammation and Immunology). - 1986. - 16. - P. 110 - 111. (in Japanese).
Ashizawa H., Kugi G., Usui M., Nos aka D., Tatemaya S, Owada K. Gnathostoma nipponicum infection in weasels captured in Oita Prefecture, Japan. Result of a survey in the 1978 shooting seasons // Bull. Fac. Agricult., Miyasaki Univ. - 1979. -26. -P. 291 -297.
Baquera-Heredia J., Cruz-Reyes A., Flores-Gaxiola A., Lopez-Pulido G., Diaz-Simental E, Valderrama-Valenzuela L. Case report: Ocular gnathostomiasis in northwestern Mexico // Am. J. Trop. Med. Hyg. -2002.-66, 5.-P. 572-574.
Barua P., Hazarika N. K, Barua N, Barua С. К, Choudhury B. Gnathostomiasis of the anterior chamber // Indian J. Med. Microbiol. - 2007. - 25, 3. - P. 276 - 278.
BasakS. K, Sinha T K, Bhattacharya D., Hazra T. K, Parikh S. Intravitreal live Gnathostoma spinigerum I I Indian J. Ophthalmol. - 2004. - 52, 1. - P. 57 - 58.
Baylis H A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Baylis H. A., Lane C A. Revision of the nematode family Gnathostomidae // Proc.Zool. Soc. London. - 1920. -P. 245-310.
Bertoni-Ruiz F, Lamothe-Argumedo M. R, Garcia-Prieto L, Osorio-Sarabia D., Leon-Regagnon V. Systematics of the genus Gnathostoma (Nematoda: Gnathostomatidae) in the Americas //Rev. Mex. Biodivers. -2011.-82.-P. 453-464.
Bhattacharjee H, Das D., Medhi J. Intravitreal gnathostomiasis and review of literature // Retina. - 2007. -27, l.-P. 67-73
Bhende M„ Biswas J., Gopal L. Ultrasound biomicroscopy in the diagnosis and management of intraocular gnathostomiasis // Am. JA Ophthalmol. - 2005. - 140, l.-P. 140-142.
Bisseru B. Diseases of man acquired from his pet. - London: William Heinemann Med. Books Ltd., 1967. -483 pp.
220
Biswas J., Gopal L., Sharma T., Badrinath S. S. Intraocular Gnathostoma spinigerum, Clinicopathologic study of two cases with review of literature I I Retina. - 1994. -14, 5. - P. 438 - 444.
Bowman D. D., Hendrix С. M., Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-467 pp.
Caballero-Garcia M. L., Almeyda-Artigas R. J„ Mosqueda-Cabrera M. A., Jimenez-Cardoso E. Gnathostoma binucleatum: excretion-secretion antigen analysis obtained from advanced third-stage larvae in in vitro culture // Exp. Parasitol. -2005. - ПО. -P. 140 - 145.
Cameron J. J, Harangozo C. S.t Fuller A. J. Gnathostomiasis in remote northern Western Australia: the first confirmed cases acquired in Australia // Med. J. Aust. - 2011. -195, 1. -P. 42 - 44.
Carrique-Mas J. J., Bryant J. E. A review of food-borne bacterial and parasitic zoonoses in Vietnam И Eco-Health. -2013. - 10. -P. 465-489. Doi: 10.1007/sl0393-013-0884-9.
Chai J.-Y., Sohn W.-M., Na В, K, Park J.-B., Jeoung H G. et al. Larval Gnathostoma spinigerum detected in Asian swamp eels, Monopterus albus, purchased from a local market in Yangon, Myanmar I I Korean J. Parasitol. -2015. - 53, 5. - P. 610 - 625.
Chandler A. C. Contribution to the life-histoiy of a gnathostome // Parasitol. - 1925a. - 17. - P. 237 - 244.
Chandler A. C, The helminthic parasites of cats in Calcutta and the relationship of cats to human helminthic infections H Ind. J. Med. Res. - 1925. - 13. - P. 213 - 227.
Chappuis F, Farinelli T., Loutan L. Ivermectin treatment of a traveler who returned from Peru with cutaneous gnathostomiasis // Clin. Infect. Dis. - 2001. - 33, 4. - P. 17-19.
Chen H, T. A human ocular infection by Gnathostoma in China // J. Parasitol. - 1949. - 35, 4. - P. 431 - 433.
Chitanondh H, Rosen L, Fatal eosinophilic encephalomyelitis caused by the nematode Gnathostoma spinigerum // Am. J. Trop. Med. Hyg. - 1967. -16. - P. 638 - 645.
Cho S.-H, Kim Т.-S., Kong Y., Na B.-K, Sohn W.-M. Larval Gnathostoma hispidum detected in the red banded odd-tooth snake, Dinodon rufozonatum rufozonatum, from China // Korean J. Parasitol. - 2007. - 45, 3. -P. 191 - 198. DOI: http://dx.doi.Org/10.3347/kjp.2007.45.3.191.
Ciurea J. Uber Gnathostoma hispidum Fedtsh. П Zeitschr. f. Infektions-Krankh. d. Hausth., Berlin. -1911.-10.-P. 288-292.
Cui J, Wang Y.f Wang Z. Q. Cutaneous gnathostomiasis with recurrent migratory nodule and persistent eosinophilia: a case report from China // Korean J. Parasitol. - 2013. - 51, 4. - P. 467 - 470. doi: 10.3347/kjp.2013.51.4.467.
Chuenkongkaew W., Chirapapaisan N., Hongyok T., YoolekA. Isolated optic neuritis from an identified Gnathostoma spinigerum // Eun J. Ophthalmol. - 2007. - 17, l.-P. 130 - 132.
Clement-Rigolet M. C, Danis M., Caumes E. [Gnathostomosis, an exotic disease increasingly imported into Western countries] // Presse M6d. - 2004.-33, 21. -P. 1527 - 1532.
Cole R. A., Choudhury A., Nico L. G., Griffin К M. Gnathostoma spinigerum in live Asian swamp eels (Monopterus spp.) from food markets and wild populations, United States // Emerg. Infect. Dis. - 2004. -20, 4. -http://dx.doi.org/10.3201/eid2004.131566 [Internet].
Daengsvang S. Human gnathostomiasis in Siam with reference to the method of prevention //J. Parasitol. -1949.-35, 2.-P. 116-121.
Daengsvang S, Sermwatsri B., Youngyi P., Guname D. Penetration of the skin by Gnathostoma spinigerum larvae // Ann. Trop. Med. Parasitol. - 1970. - 64. - P. 399 - 402.
Daengsvang S., Tansubat P. A contribution to the knowledge of the second intermediate hosts of Gnathostoma spinigerum Owen, 18361I Ann. Trop. Med. Parasit. - 1938. - 32. - P. 137 - 140.
Del Giudice P., Cua E, Le Fichoux Y.f Marty P., Caumes E., Dellamonica P. [Gnathostomiasis: an emerging parasitic disease?] //Ann. Dermatol. Venereol. - 2005. -132, 12, Pt 1. - P. 983 - 985.
Del Giudice P., Dellamonica P., Durant J., Rahelinrina V., Grobusch M. P. et al. A case of gnathostomiasis in a European traveler returning from Mexico // Br. J. Dermatol. - 2001. -145, 3. - P. 487 -489.
Demitsu T„ Aizawa H Gnathostomiasis cutis // Rinshohifuka. - 1985. - 39. - P. 255 - 260. (in Japanese).
de Vries P. J, Ker st J. M., KortbeekL. M. [Migrating swellings from Asia: gnathostomiasis] //Ned. Tijdschr. Geneeskd. - 2001. -145, 7. - P. 322 - 325. (Dutch text; English summary).
Diaz-Camacho S. P., de la Cruz-Otero M. C, Zazueta-Ramos M. L., Bojorquez-Contreras A., Sicairos-Felix J. et al. Identification of estuarine fish Dormitator latifrons as an intermediate host and Eleotris picta as a paratenic host for Gnathostoma binucleatum in Sinaloa, Mexico // Parasitol. Res. - 2008. - 103, 6. - P. 1421 - 1425.
Diaz-Camacho S. P., Willms K, de la Cruz-Otero M. C, Zazueta-Ramos M. L. et al. Acute outbreak of gnathostomiasis in a fishing community in Sinaloa, Mexico // Parasitol. Int. - 2003. - 52, 2.-- P. 133 - 140.
221
Diaz-Camacho S. P., Willms K, Ramos M. Z.> de la Cruz-Otero M. C, Naw a Y. et al. Morphology of Gnathostoma spp. isolated from natural hosts in Sinaloa, Mexico 11 Parasitol. Res. - 2002. - 88, 7. - P. 639 -645.
Eduardo S. L. Food-borne parasitic zoonoses in the Philippines // Southeast Asian J. Trop. Med. Public Health. - 1991. -22, Suppl. -P. 16-22 (www.tm.mahidol.ac.th/seameo/.../06-16-22/).
Eduardo S. L. Helminth zoonoses in the Philippines: public health problem associated with eating habits and practices I I Trans. Natl. Acad. Sci. Tech., Philippines. -2001. -23. -P. 105 - 119.
Egashira M. Studies of Gnathostoma spinigerum III. Experimental studies on the therapy of gnathostomiasis //Acta Med.-1953.-23, l.-P. 123-129.
Feinstein R J., Rodriguez-Valdes J. Gnathostomiasis or larva migrans profundus // J. Am. Acad. Dermatol. -1984.-11, 4.-P. 738-740.
Frean J. Gnathostomiasis: an emerging parasitic disease in Southern Africa / ICOPA XII. - Melbourne, 2010. -P. 1133.
Garcia-Marquez L. J., Lamothe-Argumedo R, Osorio-Sarabia D., Garcia-Prieto L., Leon-Regagnon V. Morphological and molecular identification of Gnathostoma binucleatum (Nematoda: Gnathostomatidae) advanced third stage larvae (AdvLa) in the state of Colima, Mexico // Rev. Mexic. Biodiv. - 2009. - 80, 3. -P. 867-670.
Garcia-Marquez L. J, Ledn-Regagnon V., Lamothe-Argumedo R, Osorio-Sarabia D., Garcia-Prieto L. Inflammatory response caused by larvae and adults of Gnathostoma (Nematoda: Gnathostomatidae) in vertebrates of Mexico, including humans // Rev. Mexic. Biodiv. - 2014. - 85. - P. 429 - 435. DOI: 10.7550/rmb.35496
Gorgolas Md., Santos-O’Connor F, Unzu. A. L., Fernandez-Guerrero M. L. et al. Cutaneous and medullar gnathostomiasis in travelers to Mexico and Thailand // J. Travel Med. - 2003. -10, 6. - P. 358 - 361.
Grobusch M. P., Bergmann F, Teichmann D., Klein E. Cutaneous gnathostomiasis in a woman from Bangladesh I I Int. J. Infect. Dis. - 2000. - 4, 1. - P. 51 - 54.
Guerrero C. A., Alba-Hurtado F. Estuarine fish and turtles as intermediate and paratenic hosts of Gnathostoma binucleatum in Nayarit, Mexico I I Parasitol Res. - 2007. -102, l.-P. 117-122.
Hale D. C, Blumberg L, Frean J. Case report: gnathostomiasis in two travelers to Zambia // Am. J. Trop. Med. Hyg. - 2003. - 68, 6. - P. 707 - 709.
Hasegawa H, Otsuru M., Asato R. Helminth fauna of the Ryukyu Archipelago, Japan. 3. Gnathostoma doloresi larvae from Rana (Babina) suhaspera in Amami-oshima Island // Ryukyu Univ. J. Hlealth Sci. Med.-1982.-5.-P. 87-91.
Hem S., Tarantola A., Chheang R, Nop P., Kerleguer A. First reported case of intraocular Gnathostoma spinigerum in Cambodia // Bull. Soc. Pathol. Exot. - 2015. -108, 5. - P. 312 - 315.
Hennies F, Jappe U., Kapaun A., Enk A. Gnathostomiasis: import from Laos // J. Dtsch. Dermatol. Ges. -2006.-4, 5.-P. 414-416.
Herman J. S, Chiodini P. L. Gnathostomiasis, another emerging imported disease // Clin. Microbiol. Rev. -2009. - 22, 3. - P. 484 - 492. doi: 10.1128/CMR.00003-09.
Herman J. S, Wall E, Van Tulleken C, Godfrey-Faussett P., Bailey R L., Chiodini P. L. Emergence of gnathostomiasis in Botswana in British tourists // Emerg. Infect. Dis. - 2009. -15. - P. 594 - 597.
Hodda M. Animal biodiversity 11 Zootaxa. - 2011. - No 3148. - P. 63 - 95.
Houston S. Gnathostomiasis: Report of a case and brief review // Can. J. Infect. Dis. - 1994. - 5, 3. - P. 125 -129.
Imai J., Akahane H, Horiuchi S., Maruyama H, Naw a Y. Gnathostoma doloresi: development of the larvae found in snakes, Agkislrodon halys. to adult worms in a pig // Japan. J. Parasitol. - 1989. - 38. - P. 221 -225.
Janwan P., Intapan P. M., Sanpool O., Sadaow L et al. Growth and development of Gnathostoma spinigerum (Nematoda: Gnathostomatidae) larvae in Mesocyclops aspericornis (Cyclopoida: Cyclopidae) H Parasites & Vectors. - 2011. -4. -P. 93. http://www.parasitesandvectora.eom/content/4/l/93.
Jelinek T., Ziegler M., Loscher T. [Gnathostomiasis after a stay in Thailand] // Dtsch. Med. Wochenschr. -1994. -119, 47. -P. 1618 - 1622. (in German).
Kannan К A., Vasantha K, Venugopal M. Intraocular gnathostomiasis // Indian J. Ophthalmol. - 1999. - 47, 4.-P. 252-253.
222
Kijune T, Lamothe-Argumedo R, Garcia-Prieto L., Oceguera-Figueroa A., Leon-Regagnon V. Gnathostoma binucleatum (Spirurida: Gnathostomatidae) en peces dulceacufcolas de Tabasco, Mexico H Rev. biol. Trop. -2004.-52, 2.-P. 371 -376.
Koga M., Akahane H, Lamothe-Argumedo R., Osorio-Sarabia D., Garcia-Prieto L. et al. Surface ultrastructure of larvae and adults of Gnathostoma binucleatum obtained in Mexico // Bull. Centr. Res. Inst., Fukuoka Univ. Ser. E. Unterdiscipl. Sci.-2003. - l.-P. 1-8.
Koga M, Ishibashi J., Ishii Y. Experimental infection in a monkey with Gnathostoma hispidum larvae obtained from loaches 11 Ann. Trop. Med. Parasitol. - 1988. - 82, 4. - P. 383 - 388.
Kraivichian K, Nuchprayoon S, Sitichalernchai P., Chaicumpa W., Yentakam S. Treatment of cutaneous gnathostomiasis with ivermectin // Am. J. Trop. Med. Hyg. - 2004. - 71, 5. -P. 623 - 628.
Lamothe-Argumedo R. La gnatostomiasisen Mexico: un problema de salud publica // An. Inst. Biol., Univ. Nac. Autdn. Мёх, Ser. Zool. - 2003. - 74. - P. 99 - 103.
Lamothe-Argumedo R. Gnatostomiasis ocular humana. Casos registrado sentodo el mundo entre 1937 у 2005 I I Rev. Mexic. Oftalmol. - 2006. - 80. - P. 185 - 190.
Le T. X, Rojekittikhun W. A survey of infective larvae of Gnathostoma in eels sold in Ho Chi Minh City. Southeast Asian // J. Trop. Med. Publ. Health. - 2000. - 31. - P. 133 - 137.
Le T. X, Rojekittikhun W,, Punpoowong B., Le T. N., Hien T. V. Case report: intraocular gnathostomiasis in Vietnam // J. Trop. Med. Publ. Health. - 2002. -33, 3. - P. 485 - 489.
Le T. X, Hoa P. L.t Dekumyoy P., Hoan N. H, KhuongL. H. et al. Gnathosthoma infection in south Vietnam I I J. Trop. Med. Publ. Health. - 2004. - 35, Suppl. 1. - P. 97 - 99.
Lee S. H, Hong S. T., Chai J. Y. Description of a male Gnathostoma spinigerum recovered from a Thai woman with meningoencephalitis //Korean J. Parasitol. - 1988. - 26, 1. - P. 33 - 38. http://dx.doi.org/10.3347 /kjp. 1988.26.1.33.
Leidy J. Cheiracanthus socialis in the stomach of mink (Mustela visori) И Proc. Acad. Nat. Sci. Phil. - 1858. -2.-P. 4.
Leiper R T. The structure and relationships of Gnathostoma siamensis (Levinsen) // J. Parasitol. - 1909. - 2. -P. 72-77.
Leдn-Rёgagnon V., Osorio-Sarabia D., Garcia-Prieto L., Akahane H. et al. Study of the ethiological agent of gnathostomosis in Nayarit, Mexico // Parasitol. Intern. - 2002. - 51, 2. - P. 201 - 204.
Levinson G. С. M. Om en ny Rundom hos mennesket Cheiracanthus siamensis n. sp. I I Kjhobenhovn: Naturhistoriske Forening. - 1889. -P. 323-326.
Ligon B. L. Gnathostomiasis: a review of a previously localized zoonosis now crossing numerous geographical boundaries // Semin. Pediatr. Infect. Dis. - 2005. - 16, 2. -P. 137 - 142.
Lo Re V„ Gluckman S. J. Eosinophilic meningitis due to Gnathostoma spinigerum // J. Infect. - 2002. - 45, 2. -P. 117-120.
Maplestone P. A. A case of human infection with a gnathostome in India I I Ind. Med. Gaz. - 1929. - 64. -P. 273-285.
Maplestone P. A. Nematode parasites of pigs in Bengal // Rec. Ind. Mus. Calcutta. - 1930. -32, 1. -P. 83 -87.
Martinez-Salazar E. A., Leon-Regagnon V. Confirmation of Gnathostoma binucleatum Almeyda-Artigas, 1991, advanced third-stage larvae in Tres Palos Lagoon, Mexico, by morphological and molecular data// J. Parasitol. - 2005. - 91, 4. - P. 962 - 965.
Migasena S, Pitisuttithum P., Desakorn V. Gnathostoma larva migrans among guests of a New Year party // Southeast Asian J. Trop. Med. Public Health. - 1991. - 22, Suppl. - P. 225 - 227.
Miyazaki I. Studies on Gnathostoma occurring in Japan (Nematoda: Gnathostomatidae) II Life history of Gnathostoma and morphological comparison of its larval forms // Kyushu Mem. Med. Sc. - 1954. - 5. - P. 123-139.
Miyazaki I. On the genus Gnathostoma and human gnathostomiasis, with special reference to Japan H Exp. Parasitol. - 1960. - 9. - P. 338 - 370.
Miyazaki L, Ishii У. An experimental infection of a wild boar with a larval gnathostome encysted in the muscle of salamander, Hynobius I I Medicine & Biology (Japan). - 1952. - 24. - P. 235 - 237.
Morgan E. P. Dogs and nematode zoonoses I Dogs, Zoonoses and Public Health. - Eds. Macpherson C. N. L, Meslin F.-X., Wandeler A. I. - 2nd Edition. - CAB Intern., 2013. -P. 153 - 161.
Morishita K. A pig nematode Gnathostoma hispidum Fedtschenko as a human parasite I I Ann. Trop. Med. Parasitol. - 1924. - 18, 1. -P. 23 - 26.
Morishita K., Faust EC. Two new cases of human creeping disease (Gnathostomiasis) in China, with a note on the infection in reservoir hosts in the China Area // J. Parasitol., - 1925. -11. - P. 158-162.
223
Morita H., Segawa T, Nishiyama T. Gnathostoma cases caused by imported loaches I I J. Nara Med. Ass. -1984. -35. -P. 607-619. (in Japanese).
Muller-Stover L, Richter J., Hdussinger D. [Infection with Gnathostoma spinigerum as a cause of eosinophilic oesophagitis] // Dtsch. Med. Wochenschr. - 2004. -129, 38. - P. 1973 - 1975. (Article in German).
Nagler A., Pollack S., Hassoun G., Kerner H., Barzilai D, Lengy J. Human pleuropulmonary gnathostomiasis: a case report from Israel П Isr. J. Med. Sci. - 1983. - 19. -P. 834 - 837.
Nawa Y., Imai J., Ogata K, Otsuka К The first record of confirmed human case of Gnathostoma doloresi infection // J. Parasitol. - 1989.-75, l.-P. 166 - 169.
Nitidandhaprabhas P., Hanchasin S, Vongsloesvidhya Y. A case of penile gnathostomiasis in Thailand // Am. J. Trop. Med. Hyg. - 1978. - 27. - P. 1282 - 1283.
Nomura Y., Nagakura K, Kagei N., Tsutsumi Y., Araki K, Sugawara M. Gnathostomiasis possibly caused by Gnathostoma malaysiae 11 Tokai J. Exp. Clin. Med. - 2000. - 25, l.-P. 1-6.
Ogata K, Imai J., Naw a Y. Three confirmed and five suspected human cases of Gnathostoma doloresi infection found in Miyazaki Prefecture, Kyushu // Japan. J. Parasitol. - 1988. - 37. - P. 358 - 364.
Ollague W., Ollague J., Guevara de Veliz A., Penaherrera S. Human gnathostomiasis in Ecuador (nodular migratory eosinophilic panniculitis) first finding of the parasite in South America // Int. J. Dermatol. -1984.-23, 10.-P. 647-651.
Owen R. Anatomical descriptions of two species of Entozoa from the stomach of a tiger (Felis tigress Linn), one of which forms a new genus of Nematoidea, Gnathostoma I I Proc. Zool. Soc. London. - 1836. - 47. -P. 123-126.
Pelaez D., Perez-Reyes R. Gnathostomiasis humane in America // Rev. Lat.-Amer. Microbiol. - 1970. - 12, l.-P. 83-91.
Perez A. Y., Garcia-Prieto L., Osorio-Sarabia D., Lamothe-Argumedo R, Leon-Regagnon V. Present distribution of the genus Gnathostoma (Nematoda: Gnathostomatidae) in Mexico // Zootaxa. - 2008. - № 1930. -P. 39-55.
Pillai G. S., Kumar A., Radhakrishnan N., Maniyelil J., Shafi T. et al. Intraocular gnathostomiasis: Report of a case and review of literature // Am. J. Trop. Med. Hyg. - 2012. - 86, 4. - P. 620 - 623. doi: 10.4269/ ajtmh.2012.11-0719.
Prommas C., Daengsvang S. Preliminary report of a study on the life cycle of Gnathostoma spinigerum 11 J. Parasitol. - 1933. -19. -P. 287-292.
Prommas C., Daengsvang S. Further report of a study on the life cycle of Gnathostoma spinigerum И Indian Med. Gaz. - 1936. -22. -P. 180-186.
Prommas C., Daengsvang S. Feeding experiments on cats with Gnathostoma spinigerum larvae obtained from the second intermediate host I I J. Parasitol. - 1937. - 23, l.-P. 115-116.
Ramirez-Avila L„ Slome S, Schuster F. L., Gavali S. et al. Eosinophilic meningitis due to Angiostrongylus and Gnathostoma species // Clin. Infect. Dis. - 2009. - 48, 3. - P. 322 - 327. doi: 10.1086/595852.
Ratz S. von. Neue Nematoden in der ungarischen Fauna // Termesz. Fiiz., Budapest. - 1900. - 23. - P. 178 — 186.
Rhithibaed C„ Daengsvang S. A case of blindness caused by Gnathostoma spinigerum // J. Med. Assoc. Thai. - 1937. -19. - P. 840 - 845.
Rojekittikhun W., Pubampen S, Waikagul J. Seasonal variation in the intensity of Gnathostoma larvae in swamp eels (Fluta alba) sold in a local market in Bangkok // Southeast Asian J. Trop. Med. Public Health. -1998.-29, l.-P. 148-153.
Rusnak J. M., Lucey D. R. Clinical gnathostomiasis: case report and review of the English-language literature //Clin. Infect. Dis. - 1993. - 16, 1. -P. 33 -50.
Sakamoto M., Sato F., Mizuno Y., Komatsuzaki M., Yoshikawa К et al. [Gnathostomiasis caused by Gnathostoma spinigerum etiologically diagnosed upon extraction of the worm from the skin] // Kansenshogaku Zasshi. - 2004. - 78, 5. - P. 442 - 445 (in Japanese).
Sawanyawisuth K, Chlebicki M. P., Pratt E, Kanpittaya J„ Intapan P. M. Sequential imaging studies of cerebral gnathostomiasis with subdural hemorrhage as its complication // Trans. R. Soc. Trop. Med. Hyg. -2009.-103, l.-P. 102-104. doi: 10.1016/j.trstmh.2008.09.011.
Schmutzhard E, Boongird P., Vejjajiva A. Eosinophilic meningitis and radiculomyelitis in Thailand, caused by CNS invasion of Gnathostoma spinigerum and Angiostrongylus cantonensis // J. Neurosurg. Psychiatiy. -1988.-51, l.-P. 80-87.
Seguchi K, Matsuno M., Kataoka H., Kobayashi T. et al. A case report of colonic ileus due to eosinophilic nodular lesions caused by Gnathostoma doloresi infection // Am. J. Trop. Med. Hyg. - 1995. - 53, 3. - P. 263-266.
224
Setasuban P., Nuamtanong S., Rojanakittikoon V., Yaemput S., Dekumyoy P. et al. Gnathostomiasis in Thailand: a survey on intermediate hosts of Gnathostoma spp. with special reference to a new type of larvae found in Fluta alba I I Southeast Asian J. Trop. Med. Public Health. -1991.-22, Suppl. -P. 220 -224.
Sohn W.-M., Kho W.-G., Lee S.-FL Larval Gnathostoma nipponicum found in the imported Chinese loaches// Korean J. Parasitol. - 1993. - 31,4. - P. 347 - 352.
Sohn W.-M., Lee S.-H. Identification of larval Gnathostoma obtained from imported Chinese loaches//Korean J. Parasitol. - 1996.-34, 3. -P. 161 - 167. http://dx.doi.org/10.3347/kjp.1996.34.3J61.
Sugaroon S, Wiwanitkit V. Gnathostoma infective stage larvae in swamp eels (Fluta alba) at a metropolitan market in Bangkok, Thailand // Ann. Clin. Lab. Sci. - 2003. - 33, 1. - P. 94 - 96.
Suntharasamai P., Riganti M., Chittamas S, Desakorn V. Albendazol stimulates outward migration of Gnathostoma spinigerum to the dermis in man I I Southeast Asian J. Trop. Med. Public Health. - 1992. - 23. -P. 716-722.
Sur S. K., Biswas G. Cat - a source of human parasitic infection I I Ind. J. Publ. Health. - 1988. - 32. - P. 211. Tamura H. On creeping disease // Brit. J. Derm. Syphilis. - 1921. -33. -P. 81 - 102, 138 - 151.
Tiwari S, Chayani N., Rautaraya B. Intraocular Gnathostoma spinigerum'. a case report // Cases Journal. -2009.-2: 9370. doi: 10.1186/1757-1626-2-9370.
Tubangui M. A. Metazoan parasites of Philippine domestic animals // Philipp. J. Sci. - 1925. - 28. - P. 11-35.
Vanegas E. S, Cendejas R F, Mondragon A. A 41-year-old woman with migratory panniculitis // Am. J. Trop. Med. Hyg. -2014. -90, 5. -P. 786-787. doi: 10.4269/ajtmh. 13-0318.
Waikagul J., Diaz Chamacho S. P. 7. Gnathostomiasis I Darwin K. D. ed. Food-Borne Parasitic Zoonoses, Fish and Plant-Borne Parasites, World Class Parasites. - Springer, Berlin, 2007. -P. 235.
Wongkham C., Maleewong W., Leamviteevanich K., Intapan P. M., Morakote N. Antigenic components of Gnathostoma spinigerum recognized by infected human sera by two-dimensional polyaciylamide gel electrophoresis and immunoblotting // Asian Рас. J. Allergy Immunol. - 2000. -18, 1. - P. 47 - 52.
Yamaguti S. Studies on the helminth fauna of Japan. Pt. 35. Mammalian nematodes II // Japan. J. Zool. -1941.-9.-P. 409-438.
Yoshida S. On the Gnathostoma spinigerum Owen, 1836, causing the oesophageal tumor of Japanese weasels // Zool. Mag. - 1931. - 43. - P. 266 - 275.
Род Echinocephalus Molin, 1858 (?1859)3
Синоним (по: Ивашкин, Хромова, 1976):
Cheiracanthus von Linstow, 1904 (pro parte) nec Diesing, 1838
Описание (по: Ивашкин, Хромова, 1976; с дополнениями из работ других авторов). Средних размеров черви. Головное вздутие с поперечными рядами крючьев. Шипики на теле и кутикулярный воротник за головным вздутием отсутствуют. Имеются четыре резервуара шейных желез. Самец со слабо выраженными хвостовыми крыльями и 6 - 8 парами каудальных сосочков. Передние пары сосочков разделены более широкими интервалами, чем остальные. Спикулы равные или слегка неравные, трубчатые, длинные, тонкие, с поперечной исчерченностью. У самок вульва расположена у заднего конца тела. Вагина длинная, открывается в широкий маточный мешок с двумя передними петлями. Яйцекладущие формы. Яйца овальные, с тонкой, мелкозернистой оболочкой, при откладке не содержат сформированного зародыша. Во взрослом состоянии - паразиты хрящевых рыб. Типовой вид - Echinocephalus uncinatus Molin, 1858 (рис. 79).
Род Echinocephalus (рис. 79-81) объединяет 10 видов (Moazzam М., Мо-azzam N., 2014).
В жизненных циклах эхиноцефалов дополнительными хозяевами являются беспозвоночные и позвоночные животные: моллюски, как двустворчатые (Andrews
3 В разных источниках указывают или 1858 или же 1859-й год.
225
et al., 1988; Cheng, 1975a, 1975b; Ko, 1975, 1976, 1980; Ko et al., 1975; Moazzam M., Moazzam N., 2014), так и брюхоногие (Millemann, 1951), морские ежи (Pearse, Timm, 1971), а также костистые рыбы (Akmirza, 2013; Al-Zubaidy, 2011; Al-Zubaidy et al., 2012; Obiekezie et al., 1992).
Ф. Моравец (Moravec, 2007) рассматривает перечисленных животных как
паратенических хозяев нематод данного рода
Рис. 79 Echinocephalus uncinatus. передний конец тела: c.s. - резервуар шейной железы; Л. - крючья; h.b. - головное вздутие; I. - губа; п. г. - нервное кольцо; oes. - пищевод (из: Baylis, 1939 - по: Baylis, Lane, 1920)
◄-----------------------
Рис.80 Схема строения переднего конца тела Echinocephalus sp. (из: Moravec, 2007)
------------------------►
Личинки эхиноцефалов довольно крупные, до 10 - 12 -14-20 мм и даже более. Локализуются в съедобных частях тела беспозвоночных и рыб, в частности, у устриц и ежей их находят в гонаде, у морского ушка - в ноге, а у рыб - в мышечной ткани, а также в полости тела и внутренних органах.
В 1975 г. свет увидели сразу две публикации, в которых
описывались два новых вида Echinocephalus - Е. crassostreai Cheng, 1975 (рис. 81) и
Е. sinensis Ко, 1975.
В первой из них новый вид описан по личинкам Echinocephalus. обнаруженным в Гонконге и Китае в моллюске - гигантской устрице Crassostrea gigas (Cheng, 1975а). Во второй работе описание нового вида основывалось на взрослых особях Echinocephalus. найденных в скате - орляке длинноголовом из района Гон-
конга, а также на личинках, выявленных там же в гигантской устрице (Ко, 1975). Годом ранее этот же автор с коллегами (Ко et al., 1974) уже сообщали о регистрации личинок Echinocephalus sp. у гигантской устрицы. Экстенсивность инвазии моллюсков в районе Гонконга, по их данным, превышала 30 %, а количество нематод в одной устрице увеличивалось с их возрастом. Самая высокая численность нематод наблюдалась в августе; именно в этот период и до октября личинки дости
гали инвазионного состояния.
226
Рис. 81 Echinocephalus crassostreai, головной конец тела личинки 3-й стадии из устрицы, SEM (из: Cheng, 1978)
Нематоды рода Echinocephalus в половозрелом состоянии паразитируют у холоднокровных животных - морских и пресноводных скатов (Beveridge, 1987: Singh et al., 2010; Yamaguti, 1961). Следовательно, можно было бы предположить, что в случае попадания к человеку они не должны
представлять для него какой-либо опасности. Однако, учитывая тот факт, что род Echinocephalus принадлежит к семейству гнатостоматид, чьих представителей, относящихся к роду Gnathostoma. регистрируют у людей по всему земному шару, все исследователи единодушны в оценке потенциальной возможности заражения людей личинками Echinocephalus и в их возможной опасности для его здоровья (А1-Zubaidy, 2011; Ко, 1976; Moazzam М., Moazzam N., 2014). Эти опасения в определённой степени базируются также на том, что личинки нематод данного рода локализуются в съедобных частях тела рыб, моллюсков, морских ежей, которых, как известно, довольно часто едят в сыром или полусыром виде.
По этой причине изучение их патогенности по отношению к млекопитающим представляет значительный научный и практический интерес. Экспериментальное заражение личинками эхиноцефалов, например, котят закончилось тем, что через 16 - 30 ч после заражения трое из них погибли (Ко, 1976, 1977). При вскрытии погибших животных во многих органах у них были выявлены нематоды. У подопытной обезьяны через 14 дней после заражения в стенке желудка обнаружилась фиброзная капсула с дегенерирующими нематодами, а один червь был найден в лёгких.
Патогенность для теплокровных животных личинок эхиноцефалов вызвана, прежде всего, их миграцией в висцеральных органах. Вполне вероятно предположить, что при попадании личинок в неспецифичного хозяина, каковым для паразитов холоднокровных животных являются млекопитающие, в том числе человек, нематоды проявляют повышенную активность, пытаясь избежать неблагоприятного воздействия агрессивной для них среды пищеварительного тракта теплокровного животного. В ответ на это вторжение в организме человека возникают определённые аллергические реакции.
Информации о регистрации у людей личинок Echinocephalus мне не встретилось, однако это не означает, что подобные случаи не могли иметь места где-либо в приморских регионах при употреблении в пищу морепродуктов, не прошедших соответствующей технологической обработки.
227
Цитируемая литература
Akmirza A. [Parasitic nematodes of fish in the coastal waters of Gok^eada] // Turk. Parazitol. Demegi. -2013.-37, 3.-P. 199-202.
Al-Zubaidy A. B. Larvae of Echinocephalus overstreeti Deardorff and Ko, 1983 (Nematoda: Gnathostomatidae) in the Red Sea fish, Abalistes stellatus (Balistidae), Yemen coastal water I I Mar. Sci. - 2011. - 22, l.-P. 31-43. DOI: 10.4197.
Al-Zubaidy A. B., Mhaisen F.T., Abker M.A.M. Occurrence of five nematode species from some Red Sea fishes, Yemen Mesopot// J. Mar. Sci. -2012. -27, 2. -P. 140 - 156.
Andrews R. H., Beveridge L, Adams M., Baverstock P. R. Identification of life cycle stages of the nematode Echinocephalus overstreeti by allozyme electrophoresis // J. Helminthol. - 1988.-62. -P. 153 - 157.
Baylis H. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Baylis H. A., Lane C. A. Revision of the nematode family Gnathostomidae // Proc. Zool. Soc. London. -1920.-P. 245-310.
Beveridge I. Echinocephalus overstreeti Deardorff and Ko, 1983 (Nematoda: Gnathostomatoidea) from elasmobranchs and molluscs in South Australia// Trans. R. S. South Australia. - 1987. - 111. -P. 79 - 92.
Cheng Th. C. Echinocephalus crassostreai sp. nov., a larval nematode from oyster Crassostrea gigas in the orient I I J. Invert. Pathol. - 1975a. - 26, 1. - P. 81 - 90.
Cheng Th. C. A structural and histochemical study of the reaction complex in Crassostrea gigas (Mollusca) to Echinocephalus crassostreai (Nematoda) I I J. Invert. Pathol. - 1975b. - 26, l.-P. 113-119.
Cheng Th. C. Larval nematodes parasitic in shellfish // Mar. Fish. Rev. - 1978. - 40, 10. - Paper 1345. - P. 39-42.
Ko R. C. Echinocephalus sinensis n. sp. (Nematoda: Gnathostomatidae) from the ray (Aetabatus flagellum) in Hong Kong, Southern China I I Can. J. Zool. - 1975. - 53, 4. - P. 490 - 500.
Ko R. C. Experimental infection of mammals with larval Echinocephalus sinensis (Nematoda: Gnathostomatidae) from oysters (Crassostrea gigas) // Can. J. Zool. - 1976. - 54, 4. - P. 597 - 609.
Ko R. C. Effects of temperature acclimation on infection of Echinocephalus sinensis (Nematoda: Gnathostomatidae) from oysters to kittens // Can. J. Zool. - 1977. - 55, 7. - P. 1129-1132.
Ko R. C., Ling J., Adal M. N. Cephalic anatomy of a gnathostomatid nematode Echinocephalus sinensis, parasite of oysters and rays // J. Morphol. - 1980. -165, 3. - P. 301 - 317.
Ko R. C., Morton B., Wong P. S. Echinocephalus sp. Molin, 1858 (Spiruroidea: Gnathostomatidae), an unusual nematode from the oyster, Crassostrea gigas Thunberg, 1793 11 Proc. 3^ Intern. Congress of Parasitology, Munich, 1974. - 1974. -3. -P. 1731 - 1732.
Ko R. C., Morton B., Wong P. S. Prevalence and histopathology of Echinocephalus sinensis (Nematoda: Gnathostomatidae) in natural and experimental hosts // Can. J. Zool. - 1975. - 53, 5. - P. 550 - 559.
Millemann R E. Echinocephalus pseudouncinatus n. sp., a nematode parasite of the abalone //J. Parasitol. -1951.-37.-P. 435-439.
Moazzam M., Moazzam N. Some observations on the infestation of bivalve, Scapharca natalensis, by larval nematode, Echinocephalus (Nematoda: Gnathostomatidae) // Pakistan J. Zool. - 2014. - 46, 5. - P. 1455 -1458.
Moravec F. Some aspects of the taxonomy and biology of adult spirurine nematodes parasitic in fishes: a review // Folia Parasitol. - 2007. - 54. - P. 239 - 257.
Obiekezie A. I., Anders K, Lick R., Moller H., Palm H. External lesions and flesh parasites in commercial fishes of Nigerian inshore waters // Aquat. Living resour. - 1992. - 5. -P. 173 - 183.
Pearse J. S., Timm R. W. Juvenile nematodes (Echinocephalus pseudouncinatus) in the gonads of sea urchins (Centrostephanus coronatus) and their effect on host gametogenesis // Biol. Bull. - 1971. - 140, 1. - P. 95 -103.
Singh N., Chauhan D. K, Khare A. K. Diversity of fish nematode - Echinocephalus chengii n. sp. (Nematoda: Spirurida, Gnathostomatidae) from Meerut-Delhi region I I J. Exp. Zool. India. - 2010. - 13, 2. - P. 587-591.
Yamaguti S. Systema Helminthum. Vol. III. Nematodes of Vertebrates. Part 1 and 2. - Interscience Publ., New York.-1961.-1261 pp.
228
Семейство Gongylonematidae Sobolev, 1949
Семейство включают в класс Chromadorea в составе отряда Spirurida (Hodda, 2011).
Описание (по разным авторам). Тело удлинённое, узкое; его передняя часть с неправильными продольными рядами кутикулярных бугорков, по крайней мере, на левой стороне тела. Имеются парные цервикальные крылья, либо одно на левой стороне. Губы очень маленькие, образуют маленькое воронкоподобное кольцо, окружающее рот и способное втягиваться или выпячиваться. Фаринкс короткий, узкий, цилиндрический. Хвостовой конец самца слегка извитой вокруг своей оси, с асимметричными крыльями и варьирующим количеством пар стебельчатых пре-анальных и постанальных сосочков. Спикулы неравные по длине и отличающиеся по форме. Дополнительная пластинка имеется. Вульва вблизи заднего конца тела. Вагина длинная. Маточные ветви противоположные. Взрослые черви поселяются в ходах в слизистой оболочке пищевода, рта, желудка млекопитающих или птиц. Типовой и единственный род - Gongylonema Molin, 1857.
Гонгилонематиды широко распространены по всему земному шару, а их жизненный цикл протекает с участием промежуточных хозяев - многочисленных видов насекомых.
Род Gongylonema Molin, 18571
Синоним: Myzonimus Stiles, 1892
Поскольку род является единственным представителем данного семейства, то приведённая выше характеристика семейства в равной степени приемлема и для характеристики рода. Типовой вид - Gongylonema minimum Molin, 1857.
Род объединяет 36 видов (Hodda, 2011), но только один из них известен в качестве паразита человека - Gongylonemapulchrum Molin, 1857. Информационный сайт «http://ru.wikipedia.org.wiki/roHrnrioHeMaTO3» содержит информацию о регистрации у человека ещё 3 видов Gongylonema: G. hominis Stiles, 1921, G. labiale Pane, 1864 (в действительности вид был назван G. labialis) и G. subtile Alessandrini, 1914. Все перечисленные виды являются синонимами G. pulchrum.
Gongylonema pulchrum Molin, 18571 2 (рис. 82). Впервые о паразите стало известно в 1850 г. от д-ра Д. Лейди (J. Leidy), который описал червя, обнаруженного в ротовой полости ребёнка, под названием Filariae hominis oris, приняв его за гвинейского червя (Guinea worm) (сейчас это - Dracunculus medinensis', см. стр. 189 -197). Однако из-за уникальной локализации найденного гельминта и его значительно меньших размеров, в сравнении с гвинейским червем, данное предположение не нашло поддержки. В 1857 г. Р. Молин впервые описал паразита под его соб-
1 Э. Фауст (Faust, 1949) рассматривает род в составе семейства Spiruridae.
2 Синонимы вида из работы (Baylis, 1939): Gongylonema spirale Molin, 1857; Filaria labialis Pane, 1864; Spiroptera scutata esophagea bovis Mtlller, 1869; Filaria scutata Leuckart, 1873; Spiroptera scutata Korzil, 1878 [? 1877]; Filaria scutata esofagea bovis Perroncito, 1882; Gongylonema scutatum Railliet, 1892; Myzomimus scutatus Stiles, 1892; Gongylonema confusum Sonsi-no, 1896; Gongylonema subtile Alessandrini, 1914; Gongylonema hominis Stiles, 1921; Gongylonema ransomi Chapin, 1922; ^Spiroptera ursi Dujardin, 1845; Gongylonema filiforme Mo-lin,l 857; ? Gongylonema contortum Molin, 1860; IGongylonema ursi Neumann, 1894.
229
ственным названием - Gongylonema pulchrum.Bvm.oboe название нематоды происходит от латинского pulchrum - красивый(ая) (видимо, автор узрел в этом паразите определённую красоту).
Рис. 82 Gongylonema-pulchrum, слева - направо: передний конец тела, дорсально; то же, вид сбоку; задний конец тела самца, вентрально (из: Baylis, 1939); яйцо (из: Wilde et al., 2001)
Описание (по разным авторам, в том числе: Baylis, 1939; Faust, 1949). С характерными чертами рода. Длинные тонкие черви с 8 продольными рядами круглых или овальных кутикулярных бугорков на головном конце. Цервикальные крылья симметричные и относительно широкие. Имеются пара очень маленьких латеральных цервикальных папилл и две крупные латеральные амфиды. Ротовое отверстие маленькое и вытянуто в дорсовентральном направлении. Фаринкс узкий, трубчатый; передняя мышечная часть пищевода относительно короткая и узкая. Самцы длиной 12-62 и толщиной 0.15- 0.36 мм. Хвостовой конец самца с асимметричными крылообразными расширениями, с 10 парами папилл и двумя фазмид-ными отверстиями. Левая спикула длинная, узкая, с тупой верхушкой, её длина варьирует от 4 до 23 мм, и может достигать почти половины длины тела червя. Правая спикула очень короткая, крепкая, 0.084 - 0.18 мм. Самки длиной 14 - 74 и толщиной 0.275 мм3. Задний конец асимметричный, тупо конический. По бокам хвоста самки видны фазмидные отверстия. Вульва слегка выступающая. Вагина проходит от вульвы вперёд до середины тела. Яйца овальные, прозрачные, с толстой скорлупой, размерами 50 - 70 х 25 - 37 (Baylis, 1939), 50 -70 х 22 - 27 (Faust, 1949), 50 - 67 х 23 - 37 (Гефтер, 1968), 60 х 40 pm (Wilde et al., 2001), при откладке содержат сформированную личинку.
Яйца гонгилонем, содержащие личинку 1 -й стадии, выделяются с фекалиями животных во внешнюю среду. Личинки обладают головным крючком и рядом
3 В литературе можно найти сведения и о самках более крупных размеров: 145 (MOnnig, 1934), 150 мм (Wilde et al., 2001).
230
тонких шипиков вокруг тупого переднего конца. Во внешней среде они остаются в покоящемся состоянии до тех пор, пока не попадут в подходящего промежуточного хозяина, в организме которого происходит их дальнейшее развитие. В этой роли известно свыше 50 видов членистоногих из самых разных родов - Aphodius, Blatella, Blops, Geotrupes, Gymnopleurus, Onthophagus и многих других (Гефтер, 1968; Зубаирова и др., 2012; Чеботарёв, Полищук, 1961; Baylis, 1939; Muller, 2002 и др.). Так, в условиях Украины паразит был обнаружен у 28 видов жуков, причём экстенсивность инвазии ряда видов достигала 90 %, а количество личинок в одном жуке доходило до 193 экз. (Чеботарёв, Полищук, 1961). В Дагестане личинки выявлены у 36 видов жуков-копрофагов, заражённость некоторых из них в отдельных биотопах превышала 50 % (Зубаирова и др., 2012). Попав в кишечник насекомых, личинки покидают оболочку яйца и, используя вооружение переднего конца тела, проникают через стенку кишечника в окружающие органы и ткани, главным образом в жировое тело и мальпигиевые сосуды. После развития и двух последовательных линек (в течение 32 - 42 дней) личинки достигают 3-й, инвазионной, стадии и инкапсулируются. Длина тела личинок при этом достигает 2.9 -3.3 мм. В случае гибели насекомого личинки могут длительное время жить вне его тела во внешней среде (Зубаирова и др., 2012; Чеботарёв, Полищук, 1961). Показано, например, что, когда мёртвые насекомые попадают в воду, личинки покидают их тело и способны некоторое время выживать в воде (Baylis, 1939).
Животные заражаются при заглатывании жуков и тараканов, содержащих инвазионных личинок гонгилонем, с кормом и питьевой водой в стойлах, на пастбищах, водопое. Попав в пищеварительный тракт дефинитивных хозяев, личинки первоначально поселяются в ткани стенки пищевода, где и растут. Вокруг спиралевидно свёрнутого червя формируется соединительнотканная капсула, изолирующая его от окружающих тканей пищевода. Размеры капсулы по мере роста заключённого в неё гельминта постепенно увеличиваются и в конечном итоге могут достигнуть величины крупной горошины. Первоначально капсулы розоватого цвета, но затем становятся серовато-бледными или даже белыми. Достигнув половой зрелости, черви разрывают капсулу и мигрируют в толщу эпителиального слоя стенки желудка, двенадцатиперстной кишки, пищевода (рис. 83), где и обитают, свободно передвигаясь в различных направлениях, заползая даже в слизистую глотки, языка, ротовую полость, рубец. И всё же излюбленными местами обитания взрослых червей являются начальная и конечная части пищевода (Чеботарёв, Полищук, 1961).
Рис. 83 Половозрелые Gongylonema pulchrum, разорвав стенку пищевода, выходят в слизистую оболочку (из: Чеботарёв, Полищук, 1961)
Количество нематод в одном животном может доходить до 100 экз. и даже более. К примеру, у погибшего в Киевском зоопарке зебу насчитали 203 гонгило-немы (Чеботарёв, Полищук, 1961).
Gongylonema pulchrum - чрезвычайно эврибионтный паразит на всех этапах своего жизненного цикла, что обеспечивает ему не только широкий круг хозяев, 231
но и распространение по разным странам и континентам. Среди дефинитивных хозяев паразита - крупный рогатый скот, овцы, козы, домашние и дикие свиньи, лошади, верблюды, буйволы, буффало, олени, медведи, зайцы, кролики, белки, обезьяны и т.д. К примеру, в условиях Дагестана заражённость овец и крупного рогатого скота достигает 41 % при интенсивности инвазии 39 ± 4.32 экз. (Зубаирова и др., 2012).
У поражённых гонгилонемой животных наблюдаются гиперемия, отёчность и деформация пищевода, возможны его закупорка и болезненность, вследствие чего те даже могут отказываться от приёма пищи. Тяжёлое поражение приводит к гибели животного, а, следовательно, и к экономическим потерям в хозяйствах (Anderson, 1992).
В англоязычной научной и научно-справочной литературе G. pulchrum получила название gullet worm - пищеводный, глоточный червь (по особенностям локализации), а вызываемые им заболевания - gongylonematosis или gongylonemiasis, в русскоязычной - гонгилонематоз.
Случаи заражения людей G. pulchrum достаточно редки, однако именно благодаря этому обстоятельству, каждый из них детально описывается в соответствующей литературе (Allen, Esquela-Kerscher, 2013; Battistelli-Lux, 2013; Cappucci et al., 1982; Crusz, Sivatinagam, 1950; Dismuke, Routh, 1963; Eberhard, Busillo, 1999; Feng, Su, 1955; Illescas-Gomez et al., 1988; Jelinek, Loscher, 1994; Molavi et al., 2006; Pesson et al., 2013; Ransom, 1923; Stiles, Baker, 1928; Thomas, 1952; Ward, 1916; Wilde et al., 2001; Wilson et al., 2001; Young, Hayne, 1953 и др.). В итоге в разные годы заражение людей этим гельминтом отмечали в Испании, Италии, Франции, Германии, Болгарии, Венгрии, Украине, бывшем Советском Союзе, Марокко, США, на Ближнем Востоке, в Турции, Иране, Шри-Ланке, Китае, Японии, Австралии, Новой Зеландии. К 2013 г. количество официально зарегистрированных случаев гонгилонемиазиса людей достигло 60 (Pesson et al., 2013).
Идеальной средой для поселения паразита у человека является слизистая оболочка внутренней поверхности щёк, продолжающаяся слизистой оболочкой мягкого нёба, нижней части языка и дна полости рта. По этой причине у человека нематоды обычно локализуются на слизистой оболочке ротовой полости (на верхней и нижней губе, с внутренней стороны щёк, под языком и пр.), где образуют небольшие папулы. Паразит очень подвижен, и больные ощущают его движение, а также зуд, боль в зубах, горле, затруднение при движении языком и при глотании, причём эти симптомы могут то исчезать, то вновь появляться (Allen, Esquela-Kerscher, 2013; Battistelli-Lux, 2013; Jelinek, Loscher, 1994). При осмотре слизистой оболочки губ и полости рта обнаруживаются ссадины, окружённые зоной гиперемии, зигзагообразные ходы гельминта (Ayala, Yencha, 2012; Wilson et al., 2001). Инвазия сопровождается усиленным слюнотечением, изредка кровью в слюне, фарингитом и стоматитом. Помимо того, могут наблюдаться резкая головная боль, раздражительность и рвота (Alessandrini, 1914), эозинофилия (до 42 %) (Wilde et al., 2001). Все эти симптомы исчезают после извлечения паразитов.
Возможны и другие проявления заражения человека гонгилонемой. В Китае, например, у одной больной наблюдался дегтеобразный стул; при повторной эзофагоскопии у пациентки были выявлены гипертрофия и морщинистость стенки пищевода, кровоточащие эрозии и значительный дефект слизистой размером 1 см2 (Feng, Su, 1955).
232
Примечательно, что симптомы заражения могут проявляться у человека в течение года - двух и даже нескольких лет (Ayala, Yencha, 2012; Molavi et al., 2006).
Диагностировать заражённость G. pulchrum на основании жалоб пациента практически невозможно, во всяком случае, весьма затруднительно. Диагноз обычно ставится по результатам определения систематической принадлежности извлечённых гельминтов. Определённую помощь может оказать также опрос пациента, помогающий установить возможность его заражения гонгилонемой через воду или насекомых.
Наиболее радикальным средством избавления от гонгилонемы является извлечение паразита после поверхностного разреза слизистой оболочки на участке его локализации. Нередко больные сами извлекают паразита пальцами или же любыми подручными средствами ~ зубной щёткой, пинцетом, иглой (Allen, Esquela-Kerscher, 2013; Jelinek, Loscher, 1994; Urch et al., 2005). Так поступил, например, 48-летний сельский житель юга Эльзаса (Франция), который обратился в клинику по поводу беспокоившего его в течение нескольких недель зуда в различных частях слизистой оболочки рта. При первичном клиническом обследовании причина зуда не была установлена. Однако пациенту всё же удалось сфотографировать «нить», обнаруженную им в слизистой оболочке щеки, а затем извлечь и самого червя (Battistelli-Lux, 2013). Таким же образом избавился от нематоды и 36-летний Д. Аллен, сотрудник одного из колледжей в Виргинии, который в течение 3 месяцев ощущал языком папулы в гортани, вызванные гонгилонемой. Когда червь переместился из горла в ткани нижней губы, а затем щеки, он обратился к врачам за консультацией. Не получив вразумительного совета, Д. Аллен с помощью пинцета сам извлёк паразита из тканей щеки. Морфологический и генетический анализ червя показал его принадлежность к G. pulchrum (Allen, Esquela-Kerscher, 2013). Кстати, за всю историю наблюдений в США это был 13 случай заражения человека гонгилонемой.
Поскольку человек может быть поражён несколькими особями гонгилонемы, то даже после удаления червя, особенно силами самого пациента, рекомендуется тщательно обследовать ротовую полость на возможное наличие других особей паразита. Например, после того, как 27-летняя жительница Германии извлекла зубной щёткой из слизистой оболочки щеки нитевидное образование, оказавшееся самкой G. pulchrum. медики обнаружили у неё на другой стороне ротовой полости ещё одну нематоду (Urch et al., 2005).
Что касается медикаментозного лечения, то обычно оно не требуется, а после извлечения нематоды слизистая оболочка восстанавливается в течение нескольких дней. Тем не менее, при лечении, например, работавшего в Лаосе японца успешно применялся альбендазол в дозе 400 мг каждые 8 ч в течение 3 дней (Wilde et al., 2001). В то же время известен случай, когда пациентка, которой был назначен 3-дневный курс альбендазола для приёма дважды в день по 200 мг, после трёх доз отказалась от него из-за начавшейся тошноты (Wilson et al., 2001). С. В. Коняев с соавт. (2008) получили положительный результат при однократном скармливании лемуру Вари альбендазола в дозе 37.5 мг кг1.
Заражение людей носит случайный характер и происходит при проглатывании насекомых - промежуточных хозяев нематоды или при питье воды из водоёмов, куда могли попасть личинки вместе с насекомым (как уже отмечалось, личинки, попав в воду, могут некоторое время выживать в ней). Опросы пострадавших показывают, что некоторые больные пили воду из ручьёв и других открытых
233
водоёмов близ пастбищ, водопоя скота. Не исключена также возможность попадания к человеку личинок гельминта с едой - насекомыми. Известно, что в некоторых частях мира и в некоторых странах съедобные насекомые являются важным источником белка. Так, иногда люди едят тараканов (cockroaches), которые, по их мнению, обладают медовым вкусом (Weber, Mache, 1973). По этой причине, учитывая невероятно широкое распространение G. pulchrum, для тех, кто ест сырых насекомых, всегда существует реальный риск заражения этим гельминтом. Однако обжаренные или каким-либо иным способом приготовленные насекомые не представляют опасности для здоровья человека.
Заражение возможно не только в результате непосредственного употребления в пищу насекомых - носителей инвазионных личинок гонгилонем. Источником инвазии могут стать загрязнённые продукты и вообще любая пища, производство и приготовление которых происходят в антисанитарных условиях, для которых характерно обилие насекомых - тараканов, навозных жуков, контактирующих с продуктами. Личинки, покинувшие после гибели насекомого его тело, могут попасть на продукты питания, в питьевую воду. К слову, при опросе некоторых больных выяснялось, что в их окружении в изобилии водились насекомые.
В то же время, люди, сами того не ведая, практически регулярно едят насекомых и/или же части их тела. В США, например, даже разработаны нормативные документы, регламентирующие допустимое количество яиц насекомых, незрелых особей и имаго, а также частей насекомых, которые могут присутствовать в различных пищевых продуктах (Center for Food Safety and Applied Nutrition). Например, на 100 г арахисового масла допускается наличие до 30 фрагментов насекомых, в 50 г молотого перца - 475 фрагментов насекомых, в каждой чашке золотого изюма-35 яиц плодовой мушки и 10 целых или эквивалентных им фрагментов насекомых.
Исходя из изложенного, становится очевидным, что наиболее действенным способом избежать заражения G. pulchrum является соблюдение элементарных санитарно-гигиенических правил, отвечающих требованиям современного цивилизованного общества. Сюда входят и фильтрование питьевой воды, и термическая обработка блюд, приготовленных из съедобных насекомых, и уничтожение бытовых насекомых на предприятиях общественного питания и в условиях домашней кухни, и, безусловно, борьба с заражённостью гонгилонемами домашнего скота - своеобразного источника и разносчика паразита.
Цитируемая литература
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Зубаирова М. М., Атаев А. М., Газимагомедов М. Г. Хозяинная специфичность Gongylonema pulchrum Molin, 1857 // Теория и практика паразитарных болезней животных. - 2012. - Вып. 13. - С. 178 - 180. http://cyberleninka.ru/article/n/hozyainnaya-spetsifichnost-gongylonema-pulchrum-molin-1857#ixzz4CTyEsl5s.
Коняев С. В., Козлов Е. М., Верхоланцева С. И., Ленкина Я. Г. Гонгилонематоз // Мат. VIII Сибирской вег. конф. - Новосибирск, 2008. - С. 212-214. nsau.edu.ru/images/vetfac/images/ebooks/pages/2008/ canifelis/konjaev2.htm.
Чеботарёв Р. С., Полищук В. 77. Новое о возбудителе гонгилонематоза - Gongylonema pulchrum Molin, 1857 // Зоол. журн. - 1961. - 40, 7. - С. 976 - 982.
234
Alessandrini G. Nuovo caso di parassitismo nell* uomo da Gongylonema // Boll. R. Acad. Med. Roma. -1914. - 40.-P. 42-44.
Allen J, D., Esquela-Kerscher A. Gongylonema pulchrum infection in a resident of Williamsburg, Virginia, verified by genetic analysis // Am. J. Trop. Med. Hyg. - 2013. - 89, 4. - P. 755 - 757. doil0.4269/ajtmh. 13-035.5
Anderson R C. Nematode parasites of vertebrates; their development and transmission. - CABI, Oxon, 1992.
Ayala M. A., Yencha M. FK Gongylonema'. a parasitic nematode of the oral cavity // Arch. Otolaryngol. Head Neck Surg.-2012.-138, 11.-P. 1082-1084. doi: 10.1001/2013.jamaoto.386.
Battistelli-Lux C. [Buccal infection with Gongylonema pulchrum'. an indigenous case in France] 11 Ann. Dermatol. Venereol. -2013. - 140, 10. -P. 623-627. doi: 10.1016/j.annder.2013.07.007.
Baylis H. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Cappucci D. T Jr., Augsburg J. K., Klinck P. C. Gongylonemiasis / Steele J. H., editor. Handbook Series in Zoonoses, Section C: Parasitic Zoonoses, vol. II. Boca Raton, Florida: CRC Press, 1982. -P. 181-192.
Center for Food Safety and Applied Nutrition, US Food and Drug Administration, US Department of Health and Human Services. The food defect action level. 1995 May. Revised in March 1997 and in May 1998. Also available through the US Food and Drug Administration Web site (http://www.cfsan.fda.gov~dms /dalbook.html). Цит. no: Wilson et al., 2001.
Crusz H., Sivatinagam V. A note on the occurrence of Gongylonema pulchrum Molin, 1857 in man in Ceylon П J. Parasitol. - 1950. - 36, 1. - P. 25 - 26.
Dismuke J. C. Jr., Routh C. F. Human infection with Gongylonema in Georgia I I Am. J. Trop. Med. Hyg. -1963.-12, l.-P. 73-74.
Eberhard M. L., Busillo C. Human Gongylonema infection of a resident of New York City 11 Am. J. Trop. Med. Hyg. - 1999.-61, 1. -P. 51 - 52.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Feng L. C., Su S. C. Two Chinese cases of Gongylonema infection. A morphological study of the parasite and clinical study of the cases 11 Chin. Med. J. - 1955. - 73. - P. 149 - 162.
Illescas-Gomez M. P., Osorio M., Gomez Garcia V., Gomez Morales M. A. Human Gongylonema infection in Spain // Am. J. Trop. Med. Hyg. - 1988. - 38. - P. 363 - 365.
Jelinek T., Loscher T. Human infection with Gongylonema pulchrum'. a case report // Trop. Med. Parasitol. -1994.-45, 4.-P. 329-330.
Molavi G. H., Massoud J., Gutierrez Y. Human Gongylonema infection in Iran // J. Helminthol. - 2006. - 80, 4.-P. 425- 428.
Mbnnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Pesson B., Hersant C., Biehler J. F., Abou-Bacar A., Brunet J. et al. First case of human gongylonemosis in France // Parasite. - 2013. - 20. - 5. doi: 10.105 l/parasite/2013007.
Ransom В. H. A new case of Gongylonema from man // J. Parasitol. - 1923. - 9. - P. 224.
Stiles C. W., Baker С. E. A fifth case of Gongylonema hominis in man in the United States // J. Parasitol. -1928. -15.-P. 221 -222.
Thomas L. J. Gongylonema pulchrum, a spirurid nematode infecting man in Illinois, USA // Proc. Helminthol. Soc. Wash. - 1952. - 19. - P. 124 - 126.
Urch T, Albrecht В. C., Biittner D. IV., Tannich E. [Human infection with Gongylonema pulchrum} // Dtsch. Med. Wochenschr. - 2005. - 130, 45. - P. 2566 - 2568. (Article in German).
Ward H. B. Gongylonema in the role of a human parasite // J. Parasitol. - 1916. - 2. - P. 119-125.
Weber G., Mache K. Uber Hauterscheinungen bei Gongylonema pulchrum, seine Erstbeobachtung in Deutschland beim Menschen // Hautarzt. - 1973. - 24. - P. 286 - 288.
Wilde H., Suankratay C., Thongkam C., Chaiyabutr N. Human Gongylonema infection in Southeast Asia// J. Travel Med. - 2001. - 8. - P.204 - 206. http://jtm.oxfordjoumals.org.
Wilson M. E., Lorente C. A., Allen J. E., Eberhard M. L. Gongylonema infection of the mouth in a resident of Cambridge, Massachusetts // Clin. Infect. Dis. - 2001. - 32, 9. - P. 1378 - 1380. doi: 10.1086/319991.
YoungM. D„ Hayne I. Gongylonema in South Carolina// J. Am. Med. Ass. - 1953. -151. -P. 40.
235
Семейство Physalopteridae (Railliet, 1893)
Первоначально эта группа нематод была описана в ранге подсемейства Physalopterinae Railliet, 1893, а в 1908 г. ей присвоили ранг семейства (Leiper, 1908). К. И. Скрябин и А. А. Соболев (1964) рассматривали физалоптерид в составе отряда Spirurata. В настоящее время семейство относят к классу Chromadorea в составе отряда Rhabditida (De Ley, Blaxter, 2002) или Spirurida (Hodda, 2011).
Описание (по разным авторам, в том числе: Скрябин, Соболев, 1964; Faust, 1949). Рот с двумя мощно развитыми нелопастными губами (псевдолабиями), снабжёнными зубами на внутренней поверхности. Интерлабии отсутствуют. Сосочки наружного ряда, располагающиеся на псевдолабиях, сливаются полностью или частично. Кутикула свободно прилегает к телу и часто образует вокруг его переднего конца препуциевидный воротничок. Стома сильно редуцирована. Самцы с широкими крыльями, часто соединёнными на вентральной стороне тела (везикула) над клоакой, хвостовые сосочки на длинных стебельках и/или сидячие; крылья могут отсутствовать. Самки с двумя, четырьмя или большим количеством маток. Вульва впереди середины тела. Яйца прозрачные, толстостенные, при откладке содержат эмбрион. Паразиты птиц, млекопитающих, рептилий, значительно реже амфибий и рыб. Типовой род-Physaloptera Rudolphi, 1819.
Семейство объединяет 16 родов с 290 видами (Hodda, 2011 - см. источник на стр. 14). В качестве паразитов человека известны представители двух родов -уже упомянутого Physaloptera. а также Abbreviata Travassos, 1920.
Цитируемая литература
Скрябин К. И., Соболев А. А. Спирураты животных и человека и вызываемые ими заболевания. Часть 2. Физалоптероидеи // Основы нематодологии. Под ред. акад. К. И. Скрябина. - М.: Наука, 1964. -12.-334 с.
De Ley Р., Blaxter М. Systematic position and phylogeny / The biology of nematodes. - Ed. D. L. Lee. -London, N. Y.: Taylor & Francis, 2002. - P. 1 - 59.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Род Physaloptera Rudolphi, 1819
Синонимы (no: bug.tamu.edu/research/collection/hallan/.../Physalopteridae):
Physalopterus Blainville, 1820:231 (опечатка) Phyaloptera Linstow, 1878:180 (опечатка) Physoloptera Mudie in Blyth, 1840 (опечатка) Physolptera Westwood, 1851 (опечатка)
Описание (по разным авторам, в том числе: Скрябин, Соболев, 1964; Baylis, 1939; Faust, 1949). С характерными чертами семейства. Вытянутые в длину черви, постепенно суживающиеся в передней половине и в задней трети тела. Кутикула обычно поперечно исчерчена, позади псевдолабий образует характерный воротничок. Имеются 2 небольших шиповидных шейных сосочка, располагающихся латерально на коротком расстоянии от головного конца и образующих прямой угол с продольной осью тела. На очень коротком расстоянии от их уровня открывается экскреторная пора. Внутренние поверхности губ уплощены, наружные выпуклы, общая конфигурация губ обычно треугольная или полукруглая. На каждой губе по 2 наружных сосочка. Пищевод состоит из передней мускульной и задней железистой час
236
тей. Хвостовые крылья самцов соединены кпереди от ануса. Имеются, по крайней мере, 4 пары стебельчатых сосочков, поддерживающих хвостовые крылья и окружающих клоаку, и некоторое количество сидячих субвентральных сосочков, из которых три обычно преанальных и пять постанальных. Спикулы неравные, почти равные или равные. Вульва самки в передней половине тела; матка с 2, 4 или большим количеством ветвей. Яйца овальные, с толстой оболочкой, при откладке содержат личинку. Паразиты млекопитающих, птиц, рептилий и очень редко амфибий. Типовой вид - Physaloptera (Physaloptera) clausa Rudolphi, 1819.
По состоянию на 2012 г., род объединял 100 видов, включая валидные и in-quirendae, причём более всего видов - 67 - было описано от млекопитающих (Pereira et al., 2012).
В информационной сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru) в числе таковых отмечены два представителя Physaloptera - Р. caucasica von Linstow, 1902 и Physaloptera transfuga Marits et Grinberg, 1970. Первый из них является членом рода АЬ-breviata, чьё описание приведено ниже.
Следует отметить, что в ряде публикаций видовая принадлежность физа-лоптер, выявленных у человека, не указана. К примеру, в 1954 г. был описан случай регистрации самок Physaloptera sp. в подкожной клетчатке в области шеи у 16-летней жительницы Хайдарабада (Индия) (Singh, Rao, 1954). Заражение сопровождалось образованием многочисленных абсцессов с гнойным содержимым, в которых находились нематоды. Вследствие отсутствия среди извлечённых физалоптер самца, вид паразита не определялся.
Годом позже появилось сообщение об обнаружении яиц Physaloptera sp. в фекалиях 8-летнего мальчика, а также у взрослого мужчины в Колумбии (Lleras, Pan, 1955). Принадлежность выявленных яиц к определённому виду физалоптер авторы не устанавливали по причине отсутствия взрослых форм червей.
В опубликованной в 1977 г. статье описывался имевший место в Квинсленде (Австралия) случай гангрены дистальной части малого кишечника у 11-месячного малыша, вызванной поражением личинками нематод, возможно, - как пишут авторы - из рода Physaloptera. Гистологический срез кишечника показал наличие ишемического некроза, эозинофильного гранулёматоза и личиночных червей в просвете и стенке кровеносных сосудов. Воспалительный процесс затронул мезентерий, где у сосудов были выражены некроз, тромбоз и эндартериит (Nicolaides et al., 1977). Полагают, что ребёнок мог заразиться во время игры на траве, проглотив заражённых насекомых, которые находились на ней.
Physaloptera transfuga Marits et Grinberg, 1970 (рис. 84, 85). Вид описан по нематодам, извлечённым из абсцесса губы женщины в Молдавии (Мариц, Гринберг, 1970).
В 1964 г. 35-летняя особа обратилась за медицинской помощью в связи подозрением на рак нижней губы. В течение 2 лет она ощущала зуд, боли в грудной клетке, сопровождавшиеся сыпью по всему телу; затем нижняя губа стала опухать. В 1965 г. больную направили в паразитологический отдел Кишинёвской санитарно-эпидемиологической станции, где у неё из абсцесса нижней губы извлекли 63 экз. половозрелых нематод, описанных в качестве представителя нового вида Physaloptera. Видовое название transfuga - перебежчик, беглец - авторы дали паразиту на том основании, что, по их мнению, он перешёл к человеку от животных.
237
Рис. 84 Physaloptera transfuga: а, б- передний конец тела; в - зубной аппарат (апикальный зуб и интеролатеральный) (из: Мариц, Гринберг, 1970)
Рис. 85 Physaloptera transfuga: а — хвостовой конец самца, вентрально; б - кутикулярные бугорки; в - стебельчатые сосочки (из: Мариц, Гринбкрг. 1970)
Нематоды белого цвета. Кутикула с тонкой поперечной исчерченно-стью. Передний конец тела со своеобразным воротничком, в который может втягиваться головной конец. Псведола-бии несут по паре головных сосочков и амфиде и вооружены парой зубов, один из которых - наружный - короткий, конический, одновершинный, а второй - внутренний - крупный, высокий,
трёхраздельный. Имеются два латеральных шиповидных шейных сосочка. Самец длиной 12.0 и шириной 0.75 мм. Латеральные хвостовые крылья длиной 1.624 и максимальной шириной 1.680 мм, сходятся на уровне хвостового конца, образуя полукруглое очертание, спереди смыкаются на вентральной стороне. Крылья поддерживаются 4 парами длинностебельчатых сосочков - 2 парами пре- и 2 парами постанальных. Имеются также 13 вентральных сидячих сосочков, 3 из них расположены у переднего края клоаки, а 5 пар - постанальных. Спикулы неравные, левая длиной 0.683, правая 0.414 мм. Вентральная поверхность хвоста с мелкими кутикулярными бугорками, образующими продольные ряды. Самки длиной 14-21 и максимальной шириной 1.108-1.813 мм. Хвост заканчивается тупо, кутикула в его области складчатая. Вагина в передней половине тела. Матка двойная. Яйца овальные, с гладкой толстой оболочкой, размерами 45 - 50 х 33 - 36 щп.
Замечу, что в природе данный вид нематод пока не известен.
Цитируемая литература
Мариц Н. М., Гринберг А. И. Новый вид физалоптер - Physaloptera transfuga n. sp. (Nematoda: Physalopteridae) // Паразиты животных и растений. - Кишинбв, 1970. - № 5. - С. 67 - 72.
Скрябин К. И., Соболев А. А. Спирураты животных и человека и вызываемые ими заболевания. Часть 2. Физалоптероидеи // Основы нематодологии. Под ред. акад. К. И. Скрябина. - М.: Наука, 1964. -12.-С.11-134.
Baylis Н. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
238
Lleras A. S., Pan C. Two cases of Physaloptera infection in man from Colombia // J. Parasitol. - 1955. - 41, 6.-P. 635.
Nicolaides N. J., Musgrave J., McGuckin D., Moorhouse D. E. Nematode larvae (Spirurida: Physalopteridae) causing infarction of the bowel in an infant // Pathology. - 1977. - 9. - P. 129 - 135.
Pereira F. B., Alves P. V., Pocha В. M. et al. A new Physaloptera (Nematoda: Physalopteridae) parasite of Tupinambus merianae (Squamata: Teiidae) from southeastern Brazil // J. Parasitol. - 2012. - 98, 6. - P. 1227- 1235.
Singh S. N., Rao И R. On a species of Physaloptera causing a subcutaneous abscess in the neck of an Indian //J. Helminthol. - 1954.-28, 3-4. -P. 155 - 158. DOI: http://dx.doi.org/10.1017/S0022149X00032818.
Род Abbreviate Travassos, 1920
Синонимы (по: Скрябин, Соболев, 1964):
Strongylus Muller, 1780, part.
Physaloptera Rudolphi, 1819, part.
Spiroptera Rudolphi, 1819, part.
A breviata Travassos, 1919
В 1919 г. Л. Травассос (Travassos, 1919) предложил создать новый род «Abreviata» для видов Physaloptera с двумя очень разными по длине спикулами, двумя матками, 4 парами стебельчатых или сидячих папилл. В публикации следующего года он исправил название рода «Abreviata» на Abbreviata Travassos, 1920. Р. Шульц (1927) добавил к этим признакам следующие: наличие одного наружнодорсального зуба, одного внутреннего латерального и двух двойных субмедианных зубов на каждой псевдолабии. Помимо того, воротничок позади псевдолабий, имеющийся у Physaloptera, у видов Abbreviata отсутствует.
Описание (по разным авторам, в том числе: Скрябин, Соболев, 1964; Faust, 1949). На каждой из двух латеральных губ имеется по одному медианному наружному зубу и небольшому зубчику изнутри от него. На некотором расстоянии от медианного зуба по его сторонам имеется по одному двойному зубу - субвентральному и субдорсальному. Края губ могут быть с мелкими зубчиками. На поверхности каждой губы по одной паре сосочков. Хвостовой конец самца с кутикулярной везикулой, образующей пару латеральных крыльев. Вентральная поверхность везикулы с кутикулярными бугорками. Спикулы обычно очень разные. Матки с двумя, четырьмя или более петлями. Паразиты млекопитающих и рептилий. Типовой вид -Abbreviata abbreviata (Rudolphi, 1819).
Единственный вид Abbreviata, регистрируемый у людей, это - A. caucasica (von Linstow, 1902).
Abbreviata caucasica (v. Linstow, 1902) Schulz, 1927 (=Physaloptera caucasica v. Linstow, 1902; = Physaloptera mordens Leiper, 1907)1 (рис. 86 - 88). Видовое название нематоды связано с местом её первого обнаружения: caucasica - кавказская.
История открытия вида детально изложена в монографии К. И. Скрябина и А. А. Соболева (1964). Суть её вкратце такова. В конце 19 в. д-р Менетре (Menetrtes) обнаружил в тонком кишечнике жителя Кавказа нематод - 9 самок и 2 самцов -, которых отправил для определения в Зоологический музей Петербурга, откуда те были переправлены в Германию проф. О. фон Линстову. Тот описал нематод как Physaloptera caucasica v. Linstow, 1902 и вернул материалы в Академию наук России. В 1925 г. тогда ещё профессору К. И. Скрябину передали пробирку с типовыми экземплярами названного вида,
1 В некоторых источниках (см., напр., Ashford, Crewe, 2003; стр. 79) Abbreviata caucasica рассматривают синонимом Physaloptera caucasica.
239
которые обработал Р. Шульц, в результате значительно дополнивший описание Physaloptera caucasica и переведший данный вид в род Abbreviata (Шульц, 1926).
В 1907 г. Р. Лейпер (Leiper, 1907, 1908) обнаружил у ребёнка в Уганде нематоду, которую описал как новый вид - Physaloptera mordens Leiper, 1907. В последующем была показана идентичность Р. mordens и Р. caucasica (Ortlepp, 1926).
Кстати, существует мнение (Bowman et al., 2002), что «Physaloptera caucasica» может быть синонимом Abbreviata gemina (von Linstow, 1899).
Рис. 86 Abbreviata caucasica'. A - передний конец тела; В - вид сбоку на внутреннюю губу с зубными выростами; С - апикальный вид на внутренние губы; D -хвостовой конец самца с асимметричными крыльями, сидячими папиллами и спикулами; Е - яйцо (из: Faust, 1949 - по: А - Leiper, 1908; В - Ortlepp, 1926; С, Е- Schulz, 1926; D-n. Linstow, 1902)
Описание (по разным авторам, в том числе: Скрябин, Соболев, 1964; Faust, 1949). Кутикула с тонкой исчерченностью. Имеются две крупные латеральные губы, вооружённые зубами - одним апикальным, одним внутренним простым, боковыми двойными и краевыми мелкими зубами. Близ вершинного и боковых двойных зубов мелкие зубчики отсутствуют. На каждой губе по 2 сосочка. Пара шейных сосочков похожа на острые шипики, выступающие из кратерообразного углубления кутикулы. Самцы длиной 1.2 - 5 см и максимальной шириной 0.7 - 1мм. Хвостовой конец несколько загнут вентрально. Образованные расширением кутикулы хвостовые крылья неравной длины: левое несколько короче правого. Имеются 2 пары пре- и 2 пары постанальных стебельчатых папилл, пара пре- и 5 пар постанальных сидячих сосочков и непарный медианный преанальный сосочек. Вентральная поверхность хвоста с характерными кутикулярными щитками в виде широких листиков с острым, направленным латерально концом. Спикулы неравные: 3.2 - 5.5 и 0.47 - 0.62 мм. Самки длиной 2.4 - 10 см при максимальной ширине 1.4 - 2.8 мм; по (Fain, Vandepitte, 1964), длина самок 10.8 - 11.7 см, ширина 2-3 мм. Задний конец тела сужается до острой вершины. Вульва открывается позади уровня заднего конца пищевода, реже на его уровне или несколько впереди него. Маток четыре. Яйца эллиптические, с бесцветной гладкой толстой оболочкой; размеры яиц, приводимые большинством авторов, укладываются в пределы 44 - 65 х 32 -45, по (Poinar, Quentin, 1972), размеры яиц 35 - 40 х 25 - 35 цш. Яйца в матке содержат зрелую личинку.
240
Рис. 87 Abbre-viata caucasiccr.
1 - передний конец тела; 2 -головной конец апикально; 3 -хвостовой конец самки; 4 - хвостовой конец самца (из: Шульц, 1926)
Рис. 88 Abbreviata caucasiccr. 1 - 2 - передний конец самки, извлечённой из человека (1 -вентрально, 2 - латерально); 3 - головной конец апикально; 4 - маточные трубы самки; 5 -задний конец тела самки; 6 - задний конец тела самца вентрально; 7 - задний конец тела самца (из: Fain, Vandepitte, 1964)
241
Жизненный цикл A. caucasica детально не изучен. Тем не менее, установлено, что в нём в качестве промежуточного хозяина участвуют жуки и тараканы, возможно, и другие насекомые-копрофаги, а также кузнечики (Muller, 2002; Poinar, Quentin, 1972)2. Яйца, содержащие личинок 1-й стадии, выделяются с фекалиями дефинитивных хозяев во внешнюю среду. Попав в организм промежуточного хозяина - насекомого, личинка уже через 1.5 ч покидает оболочку яйца и проникает в стенку кишечника, где вскоре оказывается окружённой тканью хозяина, формирующего капсулу, прикреплённую к наружной стенке кишечника (Poinar, Quentin, 1972). Личинки, оставшиеся в просвете кишечника, не развиваются и вскоре погибают. В теле насекомого личинки развиваются до 3-й инвазионной стадии в течение 21-27 дней (рис. 89) (Гефтер, 1968). В Марокко в желудке жабы мавританской Amietophrynus mauritanicus (=Bufo mauritanicus) встретились личинки A. caucasica 3 и 4-й стадий (Chabaud, 1954), а в Австралии у 8 видов австралийских мелких варанов были выявлены как половозрелые формы нематод рода Abbreviata. так и цисты с личинками, локализующиеся в тканях ящериц (Jones, 2010). Развитие до половозрелой стадии в дефинитивном хозяине завершается в течение 70 - 93 дней.
Рис. 89 Abbreviata caucasica*. 1 - личинка 3-й стадии, передний конец тела апикально; 2 -общий вид; 3 - половой зачаток латерально; 4 - личинка 4-й стадии, передний конец тела апикально (из: Скрябин, Соболев, 1964 - по: Petter, 1960)
Окончательные хозяева A. caucasica - приматы, в организме которых черви поселяются в слизистой желудка, пищевода или кишечной стенки (Гефтер, 1968; Muller, 2002).
Заражение людей А. caucasica носит явно случайный характер. После первого обнаружения этого паразита у человека на Кавказе (von Linstow, 1902) и в Уганде (Leiper, 1908) подобные случаи в мире фиксируются чрезвычайно редко.
Так, в 1911 и 1913 гг. появились первые сообщения о заражении людей в тропической Африке (Leiper, 1913). В 1932 г. опубликована информация о выявлении данного гельминта у человека в Зимбабве (Blackie, 1932), в 1935-м - в Панаме (Faust, Martinez, 1935; исследователи сделали вывод, что это был случай так назы
2 На веб-сайтах «WetSpital.ru; zdorovieinfo.ru; slovar.cc; Laid.ru» относительно жизненного цикла Abbreviata caucasica размещена следующая информация (дословно): «промежуточные хозяева - различные позвоночные животные» (выделено мною - АГ).
242
ваемого ложного паразитизма), в 1964-м - в Конго (Vandepitte et al., 1964), в 1965-м - в Чили (Apt et al., 1965).
По состоянию на 1984 г., в мире было известно всего 12 случаев регистрации A. caucasica у человека (Beaver et al., 1984).
В целом, заражение людей этим паразитом зафиксировано в Конго, Намибии, Замбии, Зимбабве, Бразилии, Чили, Колумбии, Панаме, Израиле, Индии, Индонезии (Гефтер, 1968; Apt et al., 1965; Ashford, Crewe, 2003).
Попавшие в организм человека нематоды могут располагаться в слизистой на всём протяжении пищеварительного тракта от пищевода до тонкого кишечника, погружаясь в неё головным концом тела. Обычно заражение A. caucasica проявляется повторяющейся рвотой, эпигастральной болью, повышенной эозинофилией. В Индонезии как-то взрослые черви были выявлены у пациентки в жёлчном протоке, что стало причиной развития у больной жёлчной боли, желтухи и лихорадки (Muller, 2002).
Диагноз ставится на основании обнаружения яиц A.caucasica в фекалиях. При этом следует иметь в виду, что определение родовой принадлежности физа-лоптерид только на основании морфологии обнаруженных яиц может быть чревато серьёзными ошибками в силу их большого внешнего сходства. К примеру, яйца, выявленные в фекалиях пациентов в Колумбии, которых определили как Physaloptera, вполне могли принадлежать Abbreviata, поскольку они практически неразличимы (Lleras, Pan, 1955). Более того, яйца и личинок Physaloptera очень легко можно принять за таковые, принадлежащие Ascaris, о чём пишут многие авторы (Apt et al., 1965; Cleeland et al., 2013; Fain, Vandepitte, 1964; Faust, 1949; Hira, 1947; Vandepitte et al., 1964). И, наконец, известно, что у физалоптер яйца немногочисленны и, к тому же, относительно тяжелы, а потому могут быть не выявлены при использовании стандартного флотационного метода; по этой причине для обнаружения яиц физалоптерид ветеринарные паразитологи рекомендуют использовать метод Sugar Solution Flotation (David, Lindquist, 1982; Kazacos, 2010).
Каким образом эти паразиты попадают к человеку, до сих пор остаётся загадкой (Fain, 1997). Тем не менее, практически все исследователи единодушны во мнении, что человек может заразиться только при поедании насекомых или каких-либо иных животных, служащих паратоническими хозяевами в жизненном цикле данного вида, и съеденных в необработанном виде (Ashford, Crewe, 2003; Muller, 2002). Иными словами, источник заражения человека A. caucasica - пища.
Цитируемая литература
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Скрябин К. И., Соболев А. А. Спирураты животных и человека и вызываемые ими заболевания. Часть 2. Физалоптероидеи // Основы нематодологии. Под ред. акад. К. И. Скрябина. - М.: Наука, 1964. -12.-С. 135-209.
{Шульц Р.) Schulz R. Sur la morphologie du Physaloptera caucasica Linstow, 1902, de Fhomme // Ann. Parasitol. - 1926. - 4,1. - P. 74 - 84.
Шульц P. Семейство Physalopteridae (Nematodes) и принципы его классификации / Сборник работ по гельминтологии, посвящ. К. И. Скрябину. - М., 1927. - С. 287 - 312.
Apt W„ Sapunar J., Doren G., Rojo M. [Physaloptera caucasica. First human cases in Chile] // Bol. Chil. Parasitol. - 1965. - 20,4. -P. 111-113 (Article in Spanish).
243
Ashford R. W., Crewe IK The parasites of Homo sapines'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
Beaver P. C, Jung R. C, Cupp E. IK Clinical Parasitology. - 9th edition. - Lea & Febiger, Philadelphia, 1984.-825 pp.
Blackie IT. An helminthological survey of Southern Rhodesia // Mem. London School Hyg. Trop. - 1932. -5.-P. 84-85.
Bowman D. D., Hendrix С. M., Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-467 pp.
Chabaud A. Essai de revision des Physalopt£res parasites de reptiles 11 Ann. Parasitol. - 1954. - 30. - P. 29 -52.
Cleeland L. M., Reichard M. V., Tito R. Y., Reinhard K. J., Lewis C. A/., Jr. Clarifying prehistoric parasitism from a complementary morphological and molecular approach П J. Archaeol. Sci. - 2013. - 40, 7. - P. 3060-3066. doi: 10.1016/j.jas.2013.03.010
David E. D., Lindquist IK D. Determination of the specific gravity of certain helminth eggs using sucrose density gradient centrifugation 11 J. Parasitol. - 1982. - 68, 5. - P. 916 - 919.
Fain A. 8. Human helminthic infections. - 1997. - P. 485 - 499. - lib.itg.be/open/hica/1997/hica0485.
Fain A., Vandepitte J. Description des Physalopteres (Abbreviata caucasica Linstow, 1902) r6colt6s chez 1’homme au Congo // Bull. Acad. R. Med. Belg. - 1964. - 4. - P. 663 - 682. (Text in French).
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Faust E. C, Martinez IK H. Notes on helminths from Panama. II. Rare human nematode eggs in the feces of individuals from the Chagres River, Panama П J. Parasitol. - 1935. - 21. - P. 332 - 336.
Hira P. R. Some helminthozoonotic infections in Zambia 11 Afr. J. Med. Med. Sci. - 1978. - 7. - P. 1 - 7.
Jones H. I. Dwarf monitor lizards (Varanidae : Varanus, Odatria s. gen.) as definitive and paratenic hosts for physalopteran nematodes // Austral. J. Zool. - 2010. - 58, 2. - P. 69 - 75. http://dx.doi.org/10.1071 /ZO09122
Kazacos K. R. How do you detect Physaloptera species eggs? П Vet. Med. - 2010. - 105. - P. 472 - 473.
Leiper R. T. Physaloptera mordens, a new intestinal parasite of man 11 Trans. Soc. Trop. Med. Hyg. - 1907. -l.-P. 76-82.
Leiper R. T. Physaloptera mordens, a new intestinal parasite of man in Uganda // Lancet. - 1908. - 174. - P. 102.
Leiper R. T. On the frequent occurrence of Physaloptera mordens as an intestinal parasite of man in Tropical Africa П J. Trop. Med. Hyg. London. - 1911. - 14. - P. 209 -211.
Leiper R. T. Observations on certain helminths of man П Trans. Soc. Trop. Med. Hyg. London. - 1913. - 6. -P. 263-297.
Linstow O. von. Zwei neue Parasiten des Menschen // Centralbl. f. Bakt. Parasit., Jena - 1902.-31.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Ortlepp R. J. On the identity of Physaloptera caucasica v. Linstow, 1902, and Physaloptera mordens Leiper, 1908//J. Helminthol.- 1926.-4.-P. 199-202. DOI: 10.1017/S0022149X00029692.
Petter A. J. La blatte germanique (Blatella germanica L.) hote intermediaire probable d'Abbreviata caucasica (Linstow, 1902) nematode parasite des primates et de 1’homme // Compt. Rend. Soc. Biol. - 1960. - 154. -P. 87-90.
Poinar G. O., Jr, Quentin J.-C. The development of Abbreviata caucasica (von Linstow) (Spirurida: Physalopteridae) in an intermediate host // J. Parasitol. - 1972. - 58, 1. - P. 23 - 28.
Travassos L. Contributes para о conhecimento da fauna helmintholojica brazileira // Mem. Inst. Oswaldo Cruz.-1919.-11, 1.
Travassos L. Contributes para о conhecimento da fauna helmintholojica brazileira. X. Sobre as species do genero Turgida H Mem. Inst. Oswaldo Cruz. - 1920. - 12, 1. - P. 73 - 76.
Vandepitte J., MichauxJ. L., Fain A., Gatti L. Premieres observations congolaises de physalopt£rose humaine П Ann. Soc. Belg. M6d. Trop. - 1964. - 44, 6. - P. 1067 - 1076.
244
Семейство Syngamidae Leiper, 1912
Семейство включают в состав отряда Strongylata (Nosanchuk et al., 1995) или Rhabditida (Рыжиков, 1949).
Описание (по разным авторам, в том числе: Рыжиков, 1948, 1949; Barus et al., 1978; Faust, 1949). Нематоды с цервикальными сосочками или без них. Ротовая капсула хорошо развита, с толстыми краями в форме 6 фестонов. У основания ротовой капсулы имеются радиально расположенные зубы двух размеров. Самцы заметно меньше самок. У некоторых сингамид самец после копуляции остаётся постоянно прикреплённым копулятивной бурсой к вульве самки, в результате чего пара имеет своеобразную Y-образную форму. Столь характерное расположение спаренных червей и послужило в своё время основанием для названия рода - Syngamus (ouv -вместе и уацод - брак), впоследствии ставшего типовым в семействе. Хвостовой конец самца снабжён хорошо развитой бурсой с характерными для представителей данного отряда поддерживающими рёбрами. Вентральные рёбра сомкнуты, латеральные чётко отграничены и от дорсальных, и от вентральных. Дорсальное ребро с одним бифурцирующим стволом, каждая ветвь которого может иметь 2-3 вершины. Спикулы равные или почти равные, короткие или длинные, иногда отсутствуют. Губернакулюм имеется или отсутствует. Задний конец тела самки конический. Вульва в передней или средней трети тела. Матки параллельные. Яйцекладущие. Яйца с маленькими «пробочками» или без них. Поселяются в просвете дыхательных путей млекопитающих и птиц. Типовой род - Syngamus von Siebold, 1836
Сингамиды широко распространены по всей планете, многие из них, в частности представители рода Syngamus, имеют значение в ветеринарной медицине (Bejsovec, 1976; Gutierrez, 2000). По этому поводу процитирую К. М. Рыжикова, который ещё в 1949 г. писал: «Среди паразитических нематод сингамиды заслуживают особого внимания. Наличие у представителей этого семейства многих совершенно своеобразных биологических особенностей (перманентная спаренность самца и самки, явление резервуарного паразитизма, локализация в просвете дыхательных путей животных и т. д.) делает их чрезвычайно интересным объектом изучения с теоретической стороны. Несомненно и практическое значение сингамид. Инвазии, вызываемые этими паразитами, довольно часто встречаются у молодняка домашней птицы и причиняют большой экономический ущерб птицеводству» (Рыжиков, 1949; стр. 7). К этому постулату остаётся добавить только одно: некоторые представители данного семейства, в частности рода Mammomonogamus Ryzhikov, 1948, известны и как паразиты человека.
Род Mammomonogamus Ryzhikov, 1948
Описание (по: Рыжиков, 1948, 1949). Цервикальные сосочки имеются. Ротовая капсула без кутикулярного венчика. На внутренней поверхности капсулы имеются рёбра. Спикулы очень короткие, толстые, могут отсутствовать. Вульва во второй четверти тела самки. Яйца в форме широкого овала, без пробочек, иногда с поперечной штриховатостью по поверхности. Паразиты млекопитающих. Типовой вид-Mammomonogamus laryngeus (Railliet, 1899).
245
Виды Mammomonogamus поселяются в верхних дыхательных путях крупного рогатого скота, овец, коз, лошадей, оленей, слонов, гиппопотама. Их находили также у кошачьих - пумы, тигра, домашних кошек, и даже у орангутанга (Collet et al., 1986).
В качестве паразита человека обычно регистрируют М. laryngeus. Кроме того, у человека в Вест-Индии обнаружен Syngamus nasicola von Linstow, 1899, - паразит носовой полости жвачных, прежде всего, домашнего крупного рогатого скота, овец, коз. Однако в настоящее время этот вид относят к синонимам М. laryngeus (Рыжиков, 1949; Macko et al., 1981).
Mammomonogamus laryngeus (Railliet, 1899) Ryzhikov, 1948 (^Syngamus laryngeus Railliet, 1899; = Syngamus nasicola von Linstow, 1899; = Syngamus kingi Leiper, 1913) (рис. 90 - 92). Вид впервые описан на материале от крупного рогатого скота из Юго-Восточной Азии под названием Syngamus laryngeus Railliet, 1899. В 1948 г. К. М. Рыжиков перевёл виды Syngamus, паразитирующие у млекопитающих, в созданный им новый род Mammomonogamus, типовым видом которого и стал бывший Syngamus laryngeus, ставший Mammomonogamus laryngeus. Видовое название от места локализации червей: laryngeus - гортанный.
Рис. 91 Mammomonogamus laryngeus: А - передний конец тела самца; В - то же, самки; С -копулятивная бурса самца, прикреплённая к вульве самки (sp - мелкие спикулы); D - яйцо (из: Faust, 1949; Л, в-по: Leiper, 1913).
246
Рис. 92 Mammomonogamus laryngeus: 1 - головной конец самца, дорсально; 2 - головной конец самки, дорсально; 3 - хвостовой конец самки; 4 - 8 - рёбра бурсы самца (из: Рыжиков, 1949 - по: Vaz, 1935)
М. laryngeus примечателен тем, что самец, значительно уступающий по размерам самке, после копуляции перманентно остаётся в спаренном с самкой состоянии, прикрепившись копулятивной бурсой к её вульве. Такая пара червей имеет своеобразную Y-образную форму. Самец, прочно удерживающий бурсой тело самки, одновременно фиксируется ротовой капсулой к слизистой органа, и потому служит для самки, чьё более крупное тело подвержено большему риску отторжения,
дополнительным средством укрепления в организме хозяина (Рыжиков, 1948).
Взрослые особи красного или красновато-коричневого цвета, что обусловлено их питанием кровью хозяина. Ротовая капсула хорошо развитая, толстостенная, чаше- или шарообразная, в её глубине располагается от 8 до 10 примерно равных зубов. Внутренняя стенка капсулы в месте её соединения с пищеводом толстая, мускулистая. Вокруг этой стенки имеется толстое кутикулярное кольцо, по границе которого располагается пара широких лепесткоподобных губ - дорсальная и вентральная, и пара дорсолатеральных и вентролатеральных губ. В промежутке между каждыми двумя губами имеется маленький сосочек. Самцы значительно меньше самок, длиной до 3 - 6.3 при ширине 0.35 - 0.38 мм. Вентральных рёбер бурсы обычно два, но иногда они сливаются в одно толстое ребро. Латеральные рёбра отходят от общего основания и тесно прилегают друг к другу. Среднелатеральное ребро короче соседних. Наружнодорсальное ребро узкое и отходит от дорсального, расщеплённого более чем на половину своей длины. Спикулы толстые, короткие, не более 23 - 30 pm в длину. Самки более крупные, длиной 8.7 - 23.5 при ширине 0.5 - 0.57 мм. Задний конец самки заострённый. Вульва слегка впереди-середины тела. Яйца эллипсоидальные, без крышечки; размеры яиц, приводимые разными авторами, в целом укладываются в пределы 78 - 98 х 40 - 54 цт.
247
Жизненный цикл М. laryngeus изучен слабо. Известно, что после откладки яиц личинки 3-й стадии развиваются в течение 9-15 дней при 26 - 30°С. Предполагается, что яйца развиваются в почве, а также в организме дождевых червей, пресноводных моллюсков, насекомых и других беспозвоночных - резервуарных хозяев, в организме которых могут сохраняться продолжительное время (Гефтер, 1968). Участие резервуарных хозяев в биологическом цикле данного вида не является обязательным. Однако, по мнению ряда авторов, дождевых червей нельзя рассматривать только как случайных переносчиков личинок, поскольку в их организме личинки проникают сквозь стенку пищеварительного тракта в мышцы, где живут довольно длительное время. Более того, неудачные попытки заразить кошек личинками Mammomonogamus ierei (Buckley, 1934), вылупившимися из яиц, полученных от заражённой кошки, дали основание автору эксперимента сделать вывод о необходимости участия в жизненном цикле Mammomonogamus промежуточного хозяина (Buckley, 1933). Заражение окончательных хозяев, вероятно, происходит с зеленью, водой, животной пищей. Полагают, что в организме дефинитивного хозяина личинки могут попадать к месту окончательной локализации через кровеносную систему и лёгкие (Muller, 2002). В целом развитие от личинки до взрослой особи занимает около 3 недель (Weinstein, Molavi, 1971).
Как уже подчёркивалось, взрослые особи М. laryngeus поселяются в верхних дыхательных путях жвачных, особенно коров, зебу, овец, коз, буйволов, а также у копытных.
М. laryngeus заражает и человека, вызывая заболевание, получившее название mammomonogamiasis - маммомоногамиазис, mammomonogamosis - маммомо-ногамозис, syngamiasis - сингамиазис или syngamosis - сингамозис.
Впервые гельминт был выявлен у человека в январе 1913 г. д-ром Кингом (King), обнаружившим пару червей в мокроте страдающей кашлем ирландки, живущей в Сент-Люсии (Вест-Индия).
Сделаем небольшое отступление и обратимся к монографии К. М. Рыжикова (1949). На стр. 77 автор пишет (дословно): «Отметим случаи сингамоза у человека. Таких случаев зарегистрировано пять: 1) Лейпер (1913) - в Зап. Индии (штат Люция). Паразит описан новым видом -5. kingi». (Здесь и далее выделено мною - АГ).
В действительности, данный случай имел место в Вест-Индии (West Indies). Вест-Индия - традиционное историческое название островов в Карибском бассейне и прилегающих к ним островов в Мексиканском заливе и Атлантическом океане. Пациентка, у которой нашли нематод, жила на одном из них - о. Сент-Люсия (с 1979 г. это - маленькое островное государство). Кстати, в Индии нет штата под названием «Люция». Эту же ошибку в определении географического названия места находки М. laryngeus К. М. Рыжиков повторяет и на стр. 80 (дословно): «Бэкли приводит следующие данные о встречаемости паразитов у животных Зап. Индии (Трайнидад)».
Речь идёт о статьях J. Buckley, в 1930-е годы работавшего на Тринидаде - острове в южной части Карибского моря (всё та же Вест-Индия) - и находившего там сингамид у овец и кошек (Buckley, 1933, 1934).
Та же географическая неточность содержится в работе В. А. Гефтер (1968; стр. 650): «...у человека первый случай описал в Индии Leiper».
Резюмирую: в Индии М. laryngeus у людей не зарегистрирован.
Проф. Р. Лейпер (Leiper, 1913), которому медик отправил нематод для определения, описал их под названием Syngamus kingi Leiper, 1913. Очевидно, что ви
248
довое название нематоде было дано по фамилии автора находки этих червей. Впоследствии S. kingi был переведён в синоним Syngamus laryngeus.
Следующий случай зафиксировали в 1920 г. в Бразилии (Travassos, 1921 -цит. по: Freitas et al., 1995; Sossai et al., 2007; Weinstein, Molavi, 1971), причём тогда была подтверждена идентичность выявленных у человека червей с нематодами, паразитирующими в этом регионе у домашнего скота.
Случаи заражения людей М. laryngeus редки, но, тем не менее, публикации о них довольно регулярно появляются в соответствующей литературе. По данным медицинских работников, за все годы, начиная с 1913-го, во всём мире официально зафиксировано немногим более 100 подобных случаев (Castano et al., 2006; da Costa et al., 2005; Nosanchuk et al., 1995; Pulcherio et al., 2013). Однако не исключено, что в действительности их может быть больше, поскольку симптоматика заражения сингамидами, как мы увидим далее, не имеет ярко выраженных клинических признаков, свойственных только данным гельминтам.
Подавляющее большинство случаев заражения людей М. laryngeus зарегистрировано в островных государствах Карибского бассейна и в Южной Америке: на Ямайке, Мартинике, в Пуэрто-Рико, Сент-Люсии, Гваделупе, Доминиканской Республике, Тринидаде, Гайане, Бразилии, Колумбии (Buckley, 1934; Castano et al., 2006; de Lara et al., 1993; Dufat et al., 1971; Freitas et al., 1995; Nosanchuk et al., 1995; Pontes et al., 1992; Pulcherio et al., 2013; Rosen, 2006; Severo et al., 1988; Sossai et al., 2007). Единичные случаи известны в Китае, Корее, Таиланде, на Филиппинах (Eamsobhana et al., 2006; Kim et al., 1998; Li et al., 1997; Limawongpranee et al., 2004; Pipitogool et al., 1992; Qu, 1997).
Что касается факта заражения людей в таких странах, как Австралия, США, Канада, Франция, Швейцария, Англия, Италия, Португалия, то они связаны с поездками жителей этих стран в эндемичные по данному гельминтозу регионы (Angheben et al., 2009; Basden et al., 1974; Birrell et al., 1978; da Costa et al., 2005; Cunnac et al., 1988; Gardiner, Schantz, 1983; Leers et al., 1985; Nosanchuk et al., 1995; Ragaz, Sakman, 1998; Timmons et al., 1983; Turner et al., 2003). К примеру, описанное в Канаде в 1985 г. заражение человека М. laryngeus - кстати, первое в стране -было связано с путешествием пациента по Карибским островам (Leers et al., 1985). Заражение молодой особы из Итаки (штат Нью-Йорк, США) произошло во время её недельного вояжа по Ямайке (Nosanchuk et al., 1995). Через 8 дней после возвращения у молодой женщины появились сухой кашель, боль в горле, температура. Не буду пересказывать всю историю её болезни - первоначально пациентку лечили от вирусного бронхита, - но в конечном итоге через четыре с лишним месяца с задней стенки глотки пострадавшей извлекли красно-коричневое Y-образное червеподобное образование, оказавшееся парой спаренных червей - М. laryngeus, имевших размеры: самец 4.3 х 0.43, самка 14 х 0.55 мм, яйца 75 - 80 х 45 - 60 цт.
Подобный случай описан и в Италии: 43-летнего мужчину после поездки по Карибам безрезультатно лечили от астмы, бронхита, гастроэзофагеальной рефлюксной болезни, пока не провели бронхоскопию, в ходе которой и обнаружили инвазию М. laryngeus (Angheben et al., 2009).
59-летняя жительница Швейцарии, проживавшая большую часть года на островах Карибского бассейна, во время одного из приездов на родину пожаловалась медикам на мучивший её сухой кашель с пароксизмом (Ragaz, Sakman, 1998).
249
Лечение кортикостероидами и антибиотиками давало только временное облегчение. При бронхоскопии у пациентки выявили диффузное воспаление слизистой бронхов, а в левом нижнем бронхе обнаружили Y-образный организм, представляющий собой двух спаренных червей - М. laryngeus.
Болезнью закончилась поездка в Южную Америку и 65-летней португалки. В июле - сентябре 2004 г. она посетила Бразилию, где в её меню были обычны зелень, сырые овощи и фрукты, а питьевая вода, как она считала, была безопасна для здоровья. По возвращению в Португалию женщину стали беспокоить кашель и лихорадка (da Costa et al., 2005). Антимикробные препараты не дали положительного результата и через месяц, в середине октября, пациентка поступила в больницу с упорным кашлем и отхаркиванием. В конце ноября у неё развился уже хронический кашель с кровохарканьем. Ей были прописаны антимикробные препараты. В январе 2005 г. бронхофиброскопия показала утолщение двусторонних бронховаскулярных связок и дискретное диффузное воспаление слизистой оболочки бронхов. В вязкой, кровянистой слизи вокруг правого медиального бронха обнаружился подвижный Y-об разный червь, который при ближайшем рассмотрении оказался самцом и самкой в спаренном состоянии. Червей удалили пинцетом и определили как М. laryngeus. Для лечения пациентка принимала альбендазол по 200 мг трижды в день в течение 3 дней, а затем мебендазол по 100 мг в том же режиме. Кашель и гемоптизис постепенно исчезали, и к началу февраля наступило выздоровление.
У человека нематоды поселяются в гортани, трахеях, бронхах. Относительно недавно в Таиланде этих червей обнаружили в двенадцатиперстной кишке пациента; видимо, М. laryngeus может также быть и гастрокишечным паразитом (Еаш-sobhana et al., 2006). В этом последнем случае пациент жаловался на боль в грудной клетке, рвоту кровью, чёрный дегтеобразный стул, вздутие живота, но никаких симптомов, связанных с поражением дыхательной системы, не обнаруживалось. Вполне возможно, что в описываемом случае взрослые черви были выкашляны из гортани, проглочены заново и попали в двенадцатиперстную кишку.
Симптомы заболевания обычно не проявляются до тех пор, пока черви не достигнут взрослого состояния, т.е. на 6 - 11 день после заражения. При локализации в бронхах или трахее черви вызывают пароксизм кашля или чихания, во время которого, кстати, они могут быть выплюнуты с мокротой. Если паразиты располагаются в гортани, то у человека возникает раздражающее ощущение царапания в глотке, будто кто-то ползает, скребётся в ней. У разных людей симптомы выражены по-разному, что во многом зависит от места поселения нематод. Тем не менее, наиболее обычные клинические признаки: сухой кашель, пароксизм, часто по ночам (Ragaz, Sakman, 1998), причём приступы кашля иногда сопровождаются кровохарканьем, астматическим синдромом (БМЭ, 1984). Если изначально диагноз поставлен неверно, то эти симптомы, наряду с субфебрилитетом, могут длиться в течение нескольких месяцев. Кстати, подобные симптомы проявляются и у домашних жвачных и копытных животных в случае их заражения М. laryngeus.
Кроме того, у некоторых пациентов отмечают жар (da Costa et al., 2005), потерю веса (Birrell et al., 1978), боль в грудной клетке, плевральную боль (Eamsobha-na et al., 2006; Sossai et al., 2007; Weinstein, Molavi, 1971), рвоту (Eamsobhana et al., 2006), периферийную эозинофилию до 23 % (lunod et al., 1970). При бронхоскопии верхних дыхательных путей обнаруживается красная, слегка отёчная слизистая и
250
обычно пара червей, образующих характерную Y-образную фигуру. Однажды черви были найдены в цисте (Gardiner, Schantz, 1983).
Примечательно, что, несмотря на питание нематод кровью хозяина, случаев анемии среди пострадавших не наблюдалось.
Из-за нехарактерной симптоматики заражение маммомоногамой предварительно могут ошибочно диагностировать как трахеобронхит, астму, пневмонию, вирусный бронхит и даже, как мы видели, гастроэзофагеальную рефлюксную болезнь, с назначением соответствующего в таких случаях медикаментозного лечения, которое не даёт положительного эффекта. К тому же, симптомы проявления инвазии сингамидами весьма похожи на таковые, наблюдаемые при заражении ка-пилляриидной нематодой Eucoleus aerophilus (см. стр. 151).
Оптимальным способом диагностики следует признать бронхоскопию или эзофагогастродуоденоскопию. Что касается эозинофилии, то отмечено, что из-за наблюдаемой высокой вариабельности она не может использоваться в диагностике заболевания. Правильно поставить диагноз помогает также обнаружение в стуле и/или слюне пациентов характерных яиц М. laryngeus, напоминающих яйца анкилостом, но с более толстой, чем у тех, оболочкой. Диагностика основывается на определения систематической принадлежности удалённых червей.
Прогноз благоприятный. Прежде всего, следует отметить успешное ручное (при помощи пинцета или других эндоскопических инструментов) или бронхоскопическое удаление червей (da Costa et al., 2005), описан случай аспирации (Kim et al., 1998). Обычно у человека регистрируют одну пара червей, но в очень редких случаях встречается множественное заражение (Kim et al., 1998; Nosanchuk et al., 1995; Pipitogool et al., 1992). После удаления червей неприятные симптомы быстро - в течение 24 ч и даже менее - исчезают. Патологического повреждения тканей в последующем также не наблюдается.
Что касается медикаментозного лечения, то контролируемых исследований эффективности применения антигельминтных препаратов специально не проводилось, но большинству пациентов прописывали альбендазол, мебендазол или тиа-бендазол без каких-либо побочных эффектов.
Источник заражения людей маммомоногамой не известен, поскольку биологический цикл нематоды детально не изучен. Предполагают, что инвазионные яйца, личинки или даже взрослые черви могут попадать к человеку через растения, воду или животную пищу (Pontes et al., 1992). И хотя доказательства этому пока отсутствуют, подобное предположение выглядит более чем вероятным. В этом отношении весьма примечателен описанный в Корее случай выявления М. laryngeus у 61-летней женщины, которая никогда не выезжала в регионы, эндемичные по данному заболеванию, и не имела контактов с домашними животными (Kim et al., 1998). За 5 дней до появления недомогания и лихорадочного состояния она выпила свежую кровь черепахи (откуда привезённую?), традиционно употребляемую местным населением в качестве питательного продукта. Через неделю после появления первых неприятных симптомов больная обратилась в клинику за помощью. Первоначально её лечили от пневмонии, но выполненная через 10 дней бронхоскопия показала наличие множества спаренных червей, прикрепившихся к сегментальным и субсегментальным стенкам в обеих нижних долях бронхов и в правой средней доле бронха. Червей, безусловно, удалили.
251
Учитывая всё выше изложенные, приходится констатировать, что до тех пор, пока не будет установлен источник попадания нематод к человеку, профилактика заражения М. laryngeus может базироваться только на тщательном соблюдении правил личной гигиены, питье обеззараженной воды и употреблении в пищу термически обработанной животной пищи, мытых в проточной воде зелени, овощей и фруктов. Эти простые правила должны неукоснительно соблюдать все лица, посещающие эндемичные по данному заболеванию тропические регионы Южной Америки и Карибского бассейна.
Цитируемая литература
БМЭ - Большая медицинская энциклопедия. 3 издание / Главный редактор акад. В. Петровский. - М.: Изд-во «Советская Энциклопедия», 1984. - 23. - С. 771.
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. проф. П. Г. Сергиев).
Рыжиков К. М Филогенетические связи нематод сем. Syngamidae и опыт перестройки их систематики И Докл. АН СССР. - 1948. - 62, 5. - С. 733 - 736.
Рыжиков К. М Сингамиды домашних и диких животных / Основы нематодологии. Под ред. акад. К. И. Скрябина. - М.-Л.: Изд-во АН СССР, 1949. - 1. - 165 с.
Angheben A , Gobbo М., Gobbi F, Bravin A., Toneatti F. et al. Human syngamosis: an unusual cause of chronic cough in travelers П BMJ Case Rep. 2009; 2009. doi: 10.1136/bcr. 12.2008.1305.
Barus V„ Sergeeva T. P., Sonin M. D., Ryzhikov К. M. Helminths of fish-eating birds of the Palearctic. I. Nematoda. - RySavy B., Ryzhikov К. M., editors. - Springer-Science+Business Media, В. V., 1978.
Basden R. D. E., Jackson J. W., Jones E. I. Gapeworm infestation in man П Br. J. Dis. Chest. - 1974. - 68. -P. 207-209.
Bejsovec J. [Ecology of syngamosis in a large scale farming area] H Angew. Parasitol. - 1976. - 17, 4. - P. 196 - 207. (Article in German).
Birrell D. J., Moorhouse D. E., Gardnert M. A. H., May C. S. Chronic cough and haemoptysis due to a nematode, "Syngamus laryngeus" 11 Aust. N. Z. J. Med. - 1978. - 8, 2. P. 168 - 170.
Buckley J. J. C. Some observations on two West Indian parasites of man И Proc. R. S. Med. - 1933. - P. 134 - 135. www.ncbi.nlm.nih.gov/pmc/.../procrsmed00696-0030.pdf.
Buckley J. J. On Syngamus nasicola Linstow, 1899 from sheep and cattle in the West Indies H J. Helminthol. - 1934.-12, l.-P. 47-62.
Castano J. C, Nwiez F. A., Gonzalez M. M., Tellez G., Giraldo M. I. [First case report of Mammomonogamus {Syngamus) laryngeus human infection in Colombia] // Biomedica. - 2006. - 26, 3. - P. 337 - 341. 9Article in Spanish).
Collet J. Y., Galdikas В. M., Sugarjito J., Jojosudharmo S. A coprological study of parasitism in orangutans {Pongo pygmaeus) in Indonesia // J. Med. Primatol. - 1986. - 15. — P. 121 - 129.
da Costa J. C, Delgado M. L., Vieira P., Afonso A., Conde B., Cross J.H. Syngamoniasis in tourist И Emerg. Infect. Dis.-2005.-11, 12.-P. 1976- 1977. doi: 10.3201/eidl 112.050713.
Cunnac M., Magnaval J. F., Cayarci D., Leophonte P. [3 cases of human syngamiasis in Guadeloupe] H Rev. Pneumol. Clin. - 1988. - 44, 3. - P. 140 - 142. (Article in French).
Dufat R., Sang H. E, Herrenschmidt J. L., Vergez P., Andre J. [Apropos of a new case of human bronchial syngamosis coming from Martinique] // J. Fr. Med. Chir. Thorac. - 1971. - 25, 5. - P. 547 - 554. (Article in French).
Eamsobhana P., Mongkolporn T., Punthuprapasa P., YoolekA. Mammomonogamus roundworm (Nematoda: Syngamidae) recovered from the duodenum of a Thai patient: a first and unusual case originating in Thailand // Trans. R. Soc. Trop. Med. Hyg. - 2006. - 100. - P. 387 - 391.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Freitas A. L., De Carli G., Blankenhein M. H. Mammonomonogamus {Syngamus) laryngeus infection: a new Brazilian human case H Rev. Inst. Med. Trop. S. Paulo. - 1995. - 37, 2. - P. 177 - 179.
Gardiner С. H., Schantz P. M. Mammomonogamus infection in human: Report of a case И Am. J. Trop. Med. Hyg. - 1983. - 32, 5. - P. 995 - 997.
252
GutierrezY. Diagnostic Pathology of Parasitic Infections with Clinical Correlations. 2nd ed. - New York: Oxford University Press, 2000.
Junod C, Philbert M, Sang H. T. Une observation de syngamose humaine a localization bronchique. Premier cas tracte et queri par le thiabendazole 11 Bull. Soc. Pathol. Exot. - 1970. - 63, 4. - P. 483 - 488.
Kim H. ¥., Lee S. M., Joo J.-E., Na M. J, Ahn M. H., Min D. Y. Human syngamosis: the first case in Korea И Thorax. - 1998. - 53, 8. - P. 717 - 718. doi: 10.1136/thx.53.8.717.
de Lara T. de A., Barbosa Л/. A., de Oliveira M. R., de Godoy L, Queluz T.T. Human syngamosis: Two cases of chronic cough caused by Mammomonogamus laryngeus 11 Chest. - 1993. - 103, l.-P. 264 - 265.
Leers W. D., Sarin M. K., Arthurs K. Syngamosis, an unusual cause of asthma: the first reported case in Canada И Can. Med. Assoc. J. - 1985. - 132, 3. - P. 269 - 270.
Leiper R. T. Observations on certain helminths of man H Trans. Soc. Trop. Med. Hyg. - 1913. - 6. - P. 265 -297.
Li D., Li G., Zhan X. Three cases of human Mammomonogamus laryngeus infection П Chin. J. Parasitol. Parasit. Dis. - 1997. -15. - P. 281 - 284.
Limawongpranee S., Samanthai S., Yoolek A. Human Mammomonogamus laryngeus infection (syngamosis): the second case report in Thailand H Siriraj Hosp. Gaz. - 2004. - 56. - P. 82 - 86.
Linstow O. von. Nematoden aus der Berliner Zoologischen Sammlung П Mitt. Zool. Mus. Berlin. - 1899. - 1. -P. 18-19.
Macko J. K., Birova V., Flores R. Deliberations on the problems of Mammomonogamus species (Nematode, Syngamidae) in ruminants 11 Folia Parasitol. (Prague). - 1981. - 28. - P. 43 - 49.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Nosanchuk J. S, Wade S. E., Landolf M. Case report of and description of parasite in Mammomonogamus laryngeus (human syngamosis) infection 11 J. Clin. Microbiol. 1995. - 33, 4. - P. 998-1000.
Pipitogool IK, Chaisiri K., Visetsuspakarn P., Srigan V., Maleewong W. Mammomonogamus (Syngamus} laryngeus. First case report in Thailand H Southeast Asian J. Trop. Med. Public Health. - 1992. - 23. - P. 336-337.
Pontes P., Gadelha M. E., Gregorio L. C, Behlau M., Steffen N. Singamose larfngea: apresenta^o de dois casos П Braz. J. OtorhinolaryngoL - 1992. - 58. - P. 294 - 297.
Pulcherio J. О. B., Machado da Silva E. О. M., Rezende D. P., Barbeira P. В. B., Machado R. S, de Oliveira M. A. B. Human syngamosis as an uncommon cause of chronic cough // Int. Arch. OtorhinolaryngoL - 2013. - 17, 4. - P. 413 - 414. doi: 10.1055/s-0033-1351680.
Qu F.Y. First Mammomonogamus laryngeus infection case occurred in Shanghai //Chin. J. Parasitol. Parasit. Dis.- 1997.-15.-P. 198-200.
Ragaz A., Sakman P. An exotic cause of chronic cough // Respiration. - 1998. - 65, 2. - P. 159 - 160.
Railliet A. Syngame laryngien du boeuf // C. R. Soc. Biol. Paris. - 1899. - 6, 10. - P. 174 - 176.
Rosen M. J. Chronic cough due to tuberculosis and other infections: ACCP evidence-based clinical practice guidelines I I Chest. - 2006. - 129, 1 (Suppl). - P. 197 - 201.
Sever о L. C, Conci L. M. A., Camargo J. J. P., Andre-Alves M. R., Palombini В. C. Syngamosis: two new Brazilian cases and evidence of possible pulmonary cycle H Trans. R. Soc. Trop. Med. Hyg. - 1988. - 82. -P. 467-468.
Sossai В. B., Bussular R. L., Pe^anha P. M., Ferreira Junior C. U., Sessa P. A. [First description of human bronchial syngamosis in the State of Espirito Santo] // Rev. Soc. Bras. Med. Trop. - 2007. - 40, 3. - P.343 - 345. (Article in Portuguese).
Timmons R. F, Bowers R. E, Price D. L. Infection of the respiratory tract with Mammomanogamus (Syngamus) laryngeus'. a new case in Largo, Florida, and a summary of previously reported cases // Am. Rev. Respir. Dis. - 1983. - 128, 3. - P. 566 - 569.
Travassos L. Notas Helminthologicas. - Brasil-M£dico. - 1921. - 35. - P. 67.
Turner P., Turner C. G., Bowers К. M., Gibson D. I., Chiodini P. L. A case of human syngamosis //Travel. Med. Infect. Dis. - 2003. - 1, 4. - P. 231 - 233.
Vaz Z. Sobre a pretense validez de “Syngamus nasicola” presence do “Syngamus laryngeus” nas fossas na-saes de cameiros do Brasil П Arch. Inst. Biol. S. Paulo, Brasil. - 1935. - 6, art. 3. - P. 35 - 39.
Weinstein L., Molavi A. Syngamus laryngeus infection (Syngamosis) with chronic cough // Ann. Intern. Med. - 1971.-74, 4.-P. 577-580.
253
Семейство Trichinellidae Ward, 1907
Это немногочисленное семейство - всего 4 рода с 16 видами - включают в класс Dorilaimea в составе отряда Trichocephalida (Hodda, 2011).
Мелкие нематоды, хвостовой отдел которых у представителей обоих полов лишь немного толще головного конца тела. Рот простой. У самцов отсутствуют спикула и спикулярное влагалище. Самки с одинарным половым аппаратом; вульва в передней половине тела. Яйцеживородящие. Паразиты млекопитающих, при этом взрослые черви паразитируют в кишечнике своих хозяев, а личинки - в их мышечной ткани. Типовой род - Trichinella Railliet, 1895.
Род Trichinella Railliet, 1895
Синонимы (по: Baylis, 1939):
Trichina Owen, 1835, пес Meigen, 1830;
Trichine Bischoff, 1840;
Trichinia Bisehoff, 1840; Trichinus Bischoff, 1840.
Описание (по: Скрябин и др., 1954; Baylis, 1939). С характерными чертами семейства. Тело почти одинакового диаметра по всей длине, лишь слегка утолщается сзади. Кутикула с тонкой поперечной исчерченностью. Имеется небольшой хитиновый стилет, который может выдвигаться из ротового отверстия. Пищевод в передней половине узкий, слегка извилистый, в начале второй половины несколько расширяется. В месте перехода пищевода в кишечник находятся две крупные клетки, возможно, пищеварительные железы. Латеральные бациллярные ленты начинаются близ мышечной части пищевода и тянутся до заднего конца тела. Задний конец тела самцов с двумя коническими придатками, у основания которых располагается по два бугорковидных сосочка, между которыми может выпячиваться клоака. Вульва самок в области пищевода. Самки яйцеживородящие. Яйца без скорлупы, но окружены тонкой мембраной. Взрослые черви паразитируют в кишечнике млекопитающих и отрождают личинок, которые инкапсулируются в мышечной ткани того же хозяина. Паразиты млекопитающих, птиц и рептилий. Типовой вид - Trichinella spiralis (Owen, 1835) Railliet, 1895.
К настоящему времени род включает 12 таксонов: 8 видов и 4 генотипа (Ро-zio, 2007). Все они морфологически весьма схожи на всех стадиях развития, поэтому для их дифференциации используют как биологические, так и биохимические и генетические критерии (Andrews et al., 1995; Pozio, La Rosa, 2003). Генетически и биологически все Trichinella разделяются на два клада, основным критерием формирования которых является наличие или отсутствие внутримышечной коллагеновой капсулы вокруг личинки паразита (Zarlenga et al., 2006).
Трихинеллы широко распространены по планете, за исключением Антарктиды, а их основными хозяевами служат млекопитающие: более 150 видов из 12 отрядов (Marsupialia, Insectivora, Edentata, Chiroptera, Lagomorpha, Rodentia, Cetacea, Carnivora, Perissodactyla, Artiodactyla, Tylopoda, Primates) (Pozio, 2005). Помимо того, среди хозяев этих гельминтов 7 видов птиц и 3 вида рептилий (Pozio, 2005). Все Trichinella относятся к числу наиболее опасных паразитов человека, а 254
потому уже более 160 лет - с середины 19-го столетия - являются объектом пристального внимания паразитологов, медицинских и ветеринарных работников. Мировая литература, посвящённая данной группе нематод, обширна и насчитывает десятки монографий, многие сотни, если не тысячи, статей, обзорных публикаций, справочных пособий, методических рекомендаций. Суть их вкратце такова.
Жизненный цикл Trichinella своеобразен: любое животное, у которого может паразитировать тот или иной представитель данного рода, является для него последовательно дефинитивным (кишечные трихинеллы) и промежуточным (мышечные трихинеллы) хозяином (Бессонов, 1972). Ни одна из стадий паразита не выходит во внешнюю среду. Личинки нематод первой стадии развития паразитируют в поперечнополосатой мускулатуре животного (человека), три последующие личиночные стадии и взрослые особи - в просвете тонкого кишечника хозяина (рис. 93). Однако, для того, чтобы жизненный цикл паразита замкнулся, личинки, локализующиеся в мышечной ткани, должны попасть к другому хозяину. Иначе говоря, этот хозяин должен быть съеден другим, что и происходит в случае хищничества, каннибализма или поедания мясных отходов и падали - у животных, или при употреблении в пищу сырого (недожаренного/недоваренного, вяленого или слабо копчёного) мяса - у человека.
Рис. 93 Схема жизненного цикла Trichinella'. 1 -заражение через мясо, содержащее инвазионных личинок; 2 - выход личинок из капсул и последующий рост и развитие червей; 3 - самцы и самки нематод в тонком кишечнике; 4 - от-рождение самками личинок, мигрирующих в мышцы и инкапсулирующихся в них (5 - у ряда видов личинки не инкапсулируются).
Domestic Cycle - жизненный цикл нематод в грызунах и свиньях; Syl-vatic Cycle - жизненный цикл в диких животных.
I - инвазионная стадия; d -диагностическая стадия (из: www.cdc.gov.CDC-Trichinellosis-Biology).
Из общего числа известных видов наиболее изучен один - Т. spiralis, обязанный этим не только своему широкому распространению на планете, но и тому высоко патогенному воздействию, которое он оказывает на организм человека.
255
Trichinella spiralis (Owen, 1835) Railliet, 1895 {^Trichina spiralis Owen, 1835; =Trichina qffinis Diesing, 1851, pro parte (частично); =Trichina spiralis hominis Kraemer, 1853; =Pseudalius trichina Davaine, 1862) (рис. 94 - 96). Синонимы по работе: Faust, 1949.
Э. Фауст (Faust, 1949) пишет, что впервые этих нематод нашли при аутопсии в мышечной ткани пациентов в Лондоне (Peacock, 1828; Hilton, 1833). Однако практически во всех источниках описание открытия этих нематод начинается с истории, случившейся 2 февраля 1835 г. в лондонском госпитале. В тот день студент Джеймс Пэджет, препарируя на занятиях по нормальной анатомии мышцы 55-летнего итальянца, скончавшегося от туберкулёза лёгких, столкнулся с тем, что скальпели с трудом разрезают ткань (Paget, 1835). Присмотревшись, он обнаружил в мышцах мелкие обызвествлённые капсулы, в которые были заключены очень мелкие свернувшиеся черви. Кусочек ткани диафрагмы, содержащей многочисленные включения, передали в Британский музей зоологу Ричарду Оуэну (Owen R., 1835), обладавшему самым совершенным на тот период микроскопом, который и описал червей в качестве нового для науки вида - Trichina spiralis. Видовое название подчёркивало характерную форму тела личинки: spiralis -спиральный.
Вскоре после публикации статьи Р. Оуэна появились новые сообщения о заражении людей «трихинами» в Англии, Германии, Дании, Северной Америке, а в 1846 г. этих личинок нашли в мясе свиней в Филадельфии, США (Leidy). В 1860 г. в экспериментах с кошками было продемонстрировано, что скормленные им личинки нематод развиваются во взрослых червей в слизистой их кишечника (Leuckart, 1860).
Рис. 95 Trichinella spiralis: А - взрослый самец; В - взрослая самка; С - личинка; D - передний конец тела самки (cb - клетка тела; е - эмбрион в матке; ео - пищевод; es b - псевдобульба пищевода; i - кишечника; пг - нервное кольцо; v -вульва (из: Faust, 1949 - по разным авторам)
Рис. 94 Trichinella spiralis: А - взрослый самец; В - взрослая самка; С -личинки, инкапсулированные в мышцах (из: Baylis, 1939 - по: Fiebiger)
256
в
Рис. 96 Trichinella spiralis: A - самец (or - рот; oe -пищевод; n - нервное кольцо; cb - клеточное тело; gl - железы в месте перехода пищевода в кишечник; cl - клоака) (из: Скрябин и др., 1954 - по: Скрябин, Шихобалова, 1954)
Описание (по разным авторам). Кутикула с тонкой поперечной кольчатостью. Передний отдел пищевода представляет собой капиллярную трубку, переходящую в области нервного кольца в луковицеподобное расширение (псевдо-бульбус), сразу за ко
торым просвет пищевода вновь резко уменьшается. Далее пищевод проходит вдоль четковидно расположенных зернистых клеток (стихоцитов), образующих группу субвентральных пищеводных желез. На границе пищевода и кишечника имеются две крупные железистые клетки.
Самцы длиной 1.4 - 1.6 и максимальным диаметром тела 0.04 - 0.05 мм. Передний конец тела более заострённый. Семенник один, семяизвергательный канал заканчивается семенным пузырьком, открывающимся в концевой отдел кишечника. Клоака открывается на заднем конце тела, который заканчивается двумя заметными латеральными долями, с их помощью самец фиксирует самку при спаривании. Эти доли придают самцам очень характерный вид. Между долями располагается две пары папилл. При спаривании клоака самца выворачивается с помощью специальных мышц и выполняет функцию копулятивного органа. Длина тела самок 3-4, максимальный диаметр 0.06 - 0.075 мм. Вульва открывается на расстоянии 1/3 длины тела от головного конца и ведёт в относительно широкую матку, позади которой в задней части тела лежит один яичник.
Жизненный цикл Т. spiralis изучается ещё с середины 19-го столетия (Leuckart, 1860; Virchow, 1865; Zenker, 1860). Заражение дефинитивных хозяев происходит при поедании животных, в мышцах которых находятся личинки трихинелл. В желудке под воздействием кислой среды капсула растворяется, и личинка проникает в тонкую кишку. Взрослые особи поселяются в двенадцатиперстной и тощей кишках окончательного хозяина, прикрепляясь к слизистой оболочке или внедряясь в неё. Вскоре после копуляции самцы погибают. Самки достигают максимального размера и могут глубоко внедряться в слизистую оболочку или ворсинки, и даже случайно проникать через стенку кишечника в брюшную полость или
257
лимфатические узлы мезентерия. От момента заражения до начала откладки зрелой самкой личинок проходит от 1 до 6 дней, а процесс откладки личинок продолжается, по одним данным, в течение 4-16 недель (Bowman et al., 2002), по другим - 10 - 30 дней (Меркушев, Озерецковская, 1968) или до 5 - 6 недель (Калинина, 2005). Каждая зрелая самка отрождает до 1500 личинок (Leuckart, 1860), чьи размеры первоначально не превышают 90 -100 х 6 цт, что позволяет им легко проникать через печёночные и лёгочные фильтры. Попав в лимфатическую, а затем кровеносную системы, личинки током крови разносятся в ткани различных органов, но за исключением поперечнополосатой мускулатуры, везде погибают (лишь немногие из них проникают непосредственно в кровеносные капилляры кишечной стенки). Достигнув поперечнополосатой мускулатуры, личинки пробуравливают сарколемму волокна, используя для этой цели стилет и выделяемые ими литические энзимы. Чаще всего они поражают мускулатуру органов, обильно снабжаемых кровью: ножки диафрагмы, межрёберные и брюшные мышцы, язык, мышцы гортани, жевательные мышцы, а также мышцы ног. При сильной инвазии поражённое мышечное волокно дегенерирует, превращаясь в мелкозернистую массу. Гибель личинок в сердечной мышце обусловлена особенностями структуры поперечнополосатых
мышечных волокон миокарда.
Через 17-18 дней после попадания в тот или иной орган личинка достигает 0.8 мм в длину и начинается процесс закручивания её тела (рис. 97), а через 4 недели вокруг неё отмечаются первые следы образования капсулы.
Рис. 97 Trichinella spiralis, общий вид личинки (из: ru.wikipedia.org.Трихинеллы)
Первичная оболочка капсулы образуется за счёт сарколеммы мышечного волокна. Капсула представляет собой неправильно овальное образование; её стенка состоит из тонкого соединительнотканного слоя и прозрачного гиалинового слоя; последний со временем заметно увеличивается (рис. 98, 99).
Рис. 98 Trichinella spiralis, капсулы с личинками в мышцах свиньи (из: Лернер, Леме-лев, 1989)
Рис. 99 Trichinella spiralis, гистологический срез через мышцу экспериментально заражённой кошки с капсулой личинки (из: Bowman et al., 2002)
258
Формирование гиалинового слоя связывают с образованием преципитатов вокруг живых личинок. Капсулы очень мелкие, их величина и форма у разных хозяев неодинаковы: у человека, например, её средний размер составляет 0.4 - 0.6 х 0.25 - 0.26 мм. Обычно в капсуле содержится одна личинка, спирально свёрнутая в 2.5 оборота, однако при высокой заражённости в ней могут быть заключены два и даже три паразита. Капсула выполняет защитную функцию, её стенка пронизана кровеносными сосудами, через которые личинка получает питательные вещества и кислород и отдаёт продукты метаболизма. Инкапсулированные личинки не питаются, не двигаются и обладают очень высокой устойчивостью к неблагоприятным факторам среды, сохраняя жизнеспособность до 24 лет (Monnig, 1934). Они могут сохраняться даже после гибели хозяина после 4-месячного гниения мышечной ткани, способны переносить температуру -12°С в течение почти двух месяцев, а температуру до +60 ... 70°С, по некоторым данным (Калинина, 2005), - нескольких суток. И, наконец, они прекрасно выживают в 6 % растворе поваренной соли (Калинина, 2005).
Спустя 14-18 месяцев после заражения начинается процесс обызвествления капсулы, обычно с её полюсов. Полностью этот процесс завершается в течение двух лет, но в некоторых случаях затягивается на более длительный срок. Личинки при этом не всегда погибают и могут оставаться жизнеспособными.
При исследовании мышц животного (человека) с давним заражением можно обнаружить капсулы на всех стадиях кальцификации - от ещё лишённых кальция до полностью обызвествлённых, внутри которых содержатся как живые, так и погибшие личинки трихинеллы.
Круг хозяев Т. spiralis необычайно широк и варьирует, равно как и их заражённость, в зависимости как от вида хозяина, так и от географического региона. К примеру, на территории Кировской области РФ паразита нашли у 66.7 % волка, 35.7 % рыси, а также у ласки, лесной куницы (Масленникова, 2005). На Северо-Западном Кавказе гельминта обнаружили у лисицы, енотовидной собаки, барсука, куниц лесной и каменной, шакала, волка, енота-полоскуна, лесного кота (Итин, 2014). При этом заражённость, например, барсука колебалась от 16.7 до 20 %, а среднее количество личинок в 1 г ткани - от 31 до 34 экз., шакала - соответственно 13.3 - 30 % и 14 - 20.5 экз., лисицы - 9.1 - 15.4 % и 4.7 - 8.0 экз. В Якутии гельминт зарегистрирован почти у всех промысловых плотоядных - волка, песца, росомахи, рыси, соболя и других, а из домашних животных - у собаки (Коколова и др., 2013).
А. А. Шевцов (1970) сообщает, что из 146 кошек, обследованных в Одессе, доля особей, заражённых трихинеллами, составила 71.23 %, тогда как среди крыс -6.45 %, а среди свиней - только 0.35 %. В Полесье и Закарпатье (Украина) нематоду обнаружили у 4.35 % особей дикого кабана (Дщик, 2006а), 14.8 % красной лисицы, 18.2 % волка, 16.7 % лесной куницы и у единственного обследованного медведя (Дидык, 20066). При этом в Закарпатской области у добытой в тех краях куницы в 10 г мышечной ткани насчитывалось 380 личинок, а у лисицы - в среднем 120. Подобных примеров можно привести великое множество.
В целом хозяевами трихинелл служат преимущественно хищные и всеядные млекопитающие - волки, шакал, собаки, рысь, лисицы, песец, барсук, медведи, тигры, колонок, куницы, норки, выдра, опоссумы, кошки, енотовидная собака и
259
многие другие, а также домашние свиньи, дикий кабан, лошади, грызуны, а среди них, прежде всего, крысы, некоторые насекомоядные, морские ластоногие. Поскольку в распространении трихинелл могут участвовать насекомые-некрофаги, поедающие трупы заражённых личинками нематод животных, то травоядные животные вполне могут проглотить таких насекомых с кормовыми растениями и заразиться подобным путём. Именно этим объясняют обнаружение личинок трихинелл в мясе овец, лошадей, северных оленей, птиц (Чистенко и др., 2014). Возможность распространения трихинелл насекомыми доказана экспериментально (Асатрян и др., 2002). В их организме эти личинки не развиваются, однако покидают капсулу и сохраняются в кишечнике до нескольких суток. Доказана также возможность передачи инвазии среди животных через экскременты, содержащие живых кишечных трихинелл и инвазионные кишечные личинки трихинелл, которые выделяются заражёнными животными в первые дни после инвазии (Чистенко и др., 2014).
Трихинеллёзис является природно-очаговым заболеванием. Различают природные, первичные по своему происхождению, и синантропные очаги инвазии. Вторые возникают и поддерживаются среди домашних животных и синантропных грызунов. В синантропных очагах распространение Т. spiralis у крыс и свиней тесно связано, поскольку свиньи охотно поедают трупы грызунов, а последние заражаются, поедая заражённое трихинеллами свиное мясо, а также пищевые отходы (см. рис. 93). Между природными и синантропными очагами существует прямая и обратная связь. В синантропные очаги инвазия заносится из природных или человеком, добывающим на охоте диких животных и скармливающим их остатки домашним животным, или же дикими синантропными животными (крысами, мышами), которые мигрируют весной в природные очаги, а осенью возвращаются назад. В результате формируются смешанные природно-синантропные очаги (www.eurolab.ua). Природные очаги встречаются практически на всех континентах. В равной степени везде регистрируются, или могут быть зарегистрированы случаи заболевания людей, вызванные употреблением в пищу заражённого мяса диких животных, а также домашней свинины и продукции из неё.
Судя по палеонаходкам, трихинеллы поражали людей задолго до их официального открытия: обызвествлённых личинок этих нематод находили во многих мумиях древнего Египта. Предполагают также, что Т. spiralis была распространена ещё в доколумбовом Новом Свете (Kliks, 1990).
Случаи заражения людей трихинеллами регистрируют повсеместно. К примеру, на Гавайях паразита впервые обнаружили в 1936 г., а к 1964 г. здесь было выявлено 112 случаев заражения людей. При этом большинство пострадавших ели термически слабо обработанное мясо дикого кабанчика или продукцию из него (Alicata, 1964). Автор цитируемой публикации, работая в Гонолулу, исследовал при аутопсии 135 диафрагм и в 7.4 % из них обнаружил личинок трихинелл. Кстати, на Гавайях этот гельминт найден у мангуста, крыс и свиней. Следует подчеркнуть, что Гавайские острова - единственные среди многочисленных небольших тихоокеанских островов, где встречается трихинелла.
В Таиланде с 1962 по 1991 гг. было отмечено 118 отдельных вспышек заболевания, охвативших 5400 пациентов, из числа которых 95 человек скончались (Khamboonruang, 1991). Однако предполагается (Pozio et al., 2007), что возбудителем заболевания людей в данном случае мог быть другой представитель рода -
260
трихинелла папуасская, Т. рариае Pozio et al., 1999, ещё неизвестная научному миру во время регистрации упомянутых вспышек.
В Аргентине с 1971 по 1981 гг. зафиксировали 908 случаев заражения людей, а с 1990 по 2002 гг. - 6919 (Ribicich et al., 2005). При этом заражённость трихинеллами свиней в 1914 г. составила 0.46 %, а в 1990 - 2004 гг. - 0.01 - 0.03 %.
И всё же более или менее значительные вспышки заболевания чаще наблюдаются в странах северного полушария. В частности резкий рост заражённости людей трихинеллами отмечается в последние годы в Румынии: с 1980 по 2004 гг. в стране было выявлено 28293 подобных случая (Blaga et al., 2007). Анализируя причины участившихся в конце 1990 - начале 2000-х годов случаев заражения людей трихинеллами в странах юго-восточной Европы, исследователи (Cuperlovic et al., 2005) приходят к выводу, что основополагающую роль в этом явлении сыграли политические и социальные изменения в регионе, а также война на Балканах и связанные с этим экономические последствия. Авторы отмечают значительное распространение трихинеллы в Болгарии, Сербии, Черногории, Румынии и Хорватии, умеренное - в Боснии и Герцеговине. В Греции и Македонии этот гельминт у человека и животных не найден, но в Турции и Словении фиксируют спорадические случаи заражения людей. В Венгрии длительное время паразита не находили, но в 2003 - 2004 гг. были отмечены единичные случаи. К слову, случаи заражения трихинеллой, квалифицируемые как спорадические, в действительности могут быть вспышками, поскольку с трудом верится, чтобы мясо инвазированного животного (домашней свиньи, дикого кабана, медведя) употреблялось в пищу только одним заболевшим человеком.
Что касается распространения трихинеллёзиса в Северной Америке, то ещё в 1960 - 1970-е годы в зарубежной и отечественной литературе можно было встретить упоминания о высокой заражённости трихинеллами людей, в частности, в США (Меркушев, Озерецковская, 1968). Действительно, в Докладе Национального института здоровья, опубликованном в 1943 г., отмечалось, что 16.2 % населения страны поражены трихинеллами, т.е. заражённым оказывался один человек из шести. В 1950-е годы в стране ежегодно регистрировали 450 - 500 случаев заражения людей, но в 1997 - 2001 г. их количество уменьшилось до 12 в год (Edelstein et al., 2009). И, наконец, благодаря комплексу мер, направленных на оздоровление населения, риск заражения человека через свинину, купленную в супермаркетах, мясных лавках или подаваемую в ресторанах, в период 2002 - 2007 гг. оценивался всего в 1 на 285 миллионов (Gamble, Hill, 2013). Тем не менее, и в настоящее время в ряде источников ещё можно встретить, например, такую фразу: «Наибольшая поражённость людей наблюдается в США, Германии и Польше, где имеются стойкие стационарные очаги» (www.eurolab.ua) (выделено мною - АГ).
Заболеваемость людей в России регистрируется практически повсеместно, причём преобладает заражение человека в синантропных очагах, и возникает оно преимущественно вспышками, чаще всего - семейными, иногда охватывающими большое число людей. Основными регионами, неблагополучными по трихинеллёзу, рассматривают Краснодарский, Ставропольский, Хабаровский и Красноярский края, Северный Кавказ, Магаданскую область, Якутию, Чукотку. В частности, в 1999 г. на Дальний Восток приходилось 32.8% всех случаев заболевания по стране (Экологический вестник России, 2001 - цит. по: Калинина, 2005). В 2002 г. случай
261
массового заражения трихинеллой людей (53 чел.) после употребления мяса бурого медведя отмечен в Красноармейском районе Приморского края (Калинина и др., 2002), а в 2003 г. 2 случая заболевания зарегистрированы в Тернейском районе (Калинина, 2005). Уместно заметить, что в настоящее время трихинелл, паразитирующих у медведей Дальнего Востока России, относят к виду Trichinella nativa Britov et Boev, 1972 (Серёдкин, 2015).
По данным Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, в 2011 г. в РФ зафиксировано 84 случая заражения трихинеллами, причём их наибольшее количество (44) выявлено у лиц в возрасте 20-30 лет. Фактором, способствовавшим заражению людей, явилось мясо диких (57 %) и домашних животных (32%), не прошедшее ветеринарно-санитарную экспертизу. По данным этого же государственного органа, в 2012 г. заболевание трихинеллёзом выявлено уже в 118 случаях в 23 регионах России, причем в 15 из них заболеваемость была выше среднероссийских показателей.
В странах ближнего зарубежья стационарные синантропные очаги зарегистрированы в Беларуси, Литве, Молдове, правобережных областях Украины, Уральской области Казахстана. К примеру, в Закарпатской, Черниговской и Тернопольской областях Украины с 1946 по 1996 гг. было выявлено 128 больных трихинеллёзом, четверо из которых скончались (см. Дщик, 2006а). При этом если первоначально источником инвазии людей была заражённая личинками трихинеллы домашняя свинина, то в 1991 и 1996 гг. им стало мясо дикого кабана.
Предполагается, что в мире трихинеллами поражено 11 млн. человек (Du-pouy-Camet, 2000).
Заболевание, вызываемое у человека нематодами рода Trichinella, в англоязычной научно-справочной и научно-популярной литературе называют trichinosis, trichinellosis, trichinelliasis (трихинозис, трихинеллёзис, трихинеллиазис), в русскоязычной - трихиноз или трихинеллёз.
Клиника трихинеллёза характеризуется яркими аллергическими проявлениями, а тяжесть болезни зависит от интенсивности инвазии и состояния иммунной системы человека, причём фаза кишечного трихинеллёза, как правило, проходит клинически незаметно. Приведённое далее описание клинической картины поражения трихинеллами составлено по многочисленным источникам, как отечественных, так и зарубежных авторов (Калинина 2005; Коколова и др., 2013; Меркушев, Озе-рецковская, 1968; Озерецковская, 1968; Руководство..., 2000; Чистенко и др., 2014; Despommier et al., 2005; Faust, 1949; Muller, 2002 и многие другие).
При заражении человека трихинеллами инкубационный период обычно длится от 10 до 25 дней; короткий (5-8 дней) и длительный (28 - 30) периоды наблюдаются редко. Как правило, длительный инкубационный период характерен для лёгкого течения заболевания и наоборот.
Уже с первых дней болезни у пациентов отмечаются плохое самочувствие, головная боль, повышение температуры, иногда до 39 - 40°С, отёки век и лица, эозинофилия крови. У большинства больных наблюдается лихорадка ремиттирующе-го (послабляющего) типа, при котором разница между утренней и вечерней температурами превышает 1°С. При лёгких заболеваниях и средней тяжести она нарастает обычно в течение 1 - 4 дней, у тяжелобольных - 13 - 20-ти. У некоторых боль
262
ных в течение нескольких месяцев может держаться субфебрильная температура. Иногда наступают рецидивы с подъёмом температуры.
Очень характерны для данного заболевания отёки век и всего лица - своеобразное лунообразное лицо, благодаря чему в народе болезнь получила название «одутловатка», «большая голова», «лягушачье лицо» (Коколова и др., 2013). Реже отёк может охватывать шею, туловище, конечности. При лёгком и среднетяжёлом течении болезни отёки возникают быстро и держатся 1-2, реже 3 недели. При осложнённом трихинеллёзе отёки, как и лихорадка, развиваются медленнее и достигают максимума в более поздние сроки. При тяжёлом течении болезни отёки могут принимать генерализованный характер, в значительной степени обусловленный ускоренным катаболизмом белка и гипопротеинемией (Чистенко и др., 2014).
Часто появляются полиморфная сыпь, конъюнктивит, кровоизлияния в конъюнктиву. Отёки век и лица в сочетании с конъюнктивитом - одни из постоянных признаков трихинеллёза.
Спустя 1 - 3 и больше дней от начала заболевания у подавляющего числа больных возникают мышечные боли: сначала в мышцах нижних конечностей, затем в других группах мышц - ягодичных, спины, живота, рук, шеи, жевательных, языка, глотки, глазных. Этот период связан с оседанием личинок в мышцах. При тяжёлом течении болезни могут появляться тяжелейшие миалгии с контрактурами и полной обездвиженностью больного. Лёгкие заболевания (в этих случаях количество личинок в 1 г мышечной ткани не превышает 10 экз.) часто протекают без выраженных миалгий, подъёма температуры и трудны для диагностики. Мышечные боли и отёки могут периодически возобновляться.
Примерно через 10 дней после заражения чётко проявляется эозинофилия, которая достигает максимальных значений на 3 - 4-й неделе. Между числом эозинофилов и степенью других клинических проявлений выявлена прямая зависимость. Клинически выраженное течение болезни сопровождается повышением эозинофилов в крови до 50 - 60 %, максимально до 80 - 90 % на фоне лейкоцитоза до 10000 - 30000 в 1 мм3. Крайне тяжёлые формы заболевания, напротив, протекают с гипоэозинофилией, а в терминальном периоде - с анэозинофилией.
Абдоминальный синдром встречается не более чем у четверти больных и возникает на 3 - 4-й неделях болезни обычно при интенсивном заражении, сопровождаясь кожными высыпаниями и приступообразными сильными болями. Этот синдром не связан с паразитированием трихинелл в кишечнике, а зависит от сосудистых поражений. Могут также наблюдаться диспептические расстройства, но диарея отмечается редко. Из-за сильных болей в животе и расстройства пищеварения заболевание иногда ошибочно принимают за брюшной тиф и другие инфекции.
В остром периоде больные могут страдать от бессонницы, головных болей, галлюцинаций и даже депрессии. В осложнённых случаях развиваются более стойкие неврологические и психотические синдромы.
В начале болезни некоторые из отмеченных признаков могут отсутствовать. Полная клиническая картина обычно становится ясной в течение 2-4 дней, а клинические проявления достигают максимума к концу первой недели болезни и держатся в течение 1 - 3 недель. И, наконец, часто наблюдается полиморфное клиническое течение трихинеллёза.
263
Следует подчеркнуть, что при интенсивной инвазии возможны осложнения, вызванные органными и системными поражениями, - миокардит, пневмония, реже менингит, менингоэнцефалит, а также флебит (воспаление стенок вен), тромбоз крупных сосудов, нефрит, гепатит. Осложнения обычно развиваются на 3 - 4-й, реже 5-й неделях заболевания. При трихинеллёзном миокардите может возникнуть острая сердечнососудистая недостаточность, но обычно она нарастает постепенно. Для пневмонии характерны диффузное усиление сосудистого рисунка и поражение плевры. Параличи и парезы при трихинеллёзе также связаны с неспецифическими васкулитами (воспалением и разрушением стенок кровеносных сосудов) и диффузноочаговым гранулёматозом в головном и спинном мозге, реже с тромбозами крупных сосудов.
В очень тяжелых случаях возможен смертельный исход от истощения, пневмонии или сердечной недостаточности, скорее всего, между 4 и 8 неделями.
Трихинеллёз, особенно в тех регионах, где он редок, не всегда распознаётся сразу, и его часто приходится дифференцировать с острыми кишечными инфекциями, брюшным или сыпным тифом, гриппом и ОРЗ, отёком Квинке, пневмонией, токсической дифтерией зева, лептоспирозом, геморрагической лихорадкой с почечным синдромом и др.
Для постановки правильного диагноза необходимо учитывать эпидемиологические, клинические и лабораторные данные. Наиболее достоверный метод лабораторной диагностики: исследование - при доступности продукта - на наличие личинок трихинелл мяса, которое могло послужить причиной заражения. Обнаружить мигрирующих личинок в венозной крови больного практически невозможно вследствие кратковременности их пребывания в сосудистом русле. При необходимости проводят микроскопическое исследование биоптата икроножной или дельтовидной мышцы пациента в стационарных условиях.
Для серологической верификации трихинеллёза используют следующие иммунологические реакции: реакция связывания комплемента, реакция кольцепре-ципитации и реакция преципитации, которые проводятся, как правило, с парными сыворотками крови больного. Специфические антитела проявляются через 14-15 дней после заражения и достигают максимума на 4 - 12 неделе. Диагностический титр в ИФА - 1 : 200 (Чистенко и др., 2014). Серологические реакции становятся положительными лишь на 3 - 4-й неделе инвазии, что делает их полезными, в основном, для ретроспективной диагностики заболевания.
При биохимическом исследовании крови определяются проявления диспро-теинемии (гипоальбуминемия и гипергаммаглобулинемия на фоне общей гипопротеинемии). Уровень аланиновой трансаминазы нередко повышен.
Заражённый трихинеллами человек эпидемиологической опасности не представляет, тем не менее, в связи с необходимостью своевременного и рационального лечения, все больные с тяжёлым и среднетяжёлым течением трихинеллёза госпитализируются в инфекционные или терапевтические лечебные учреждения. Для специфической терапии применяются в основном мебендазол (вермокс), реже - тиабендазол, в некоторых публикациях упоминается альбендазол. Дозы препаратов и продолжительность курса лечения - в компетенции медицинских работников. При выраженной интоксикации проводится специальная терапия.
264
Совершенно очевидно, что во всех случаях заражение людей трихинеллами происходит только алиментарным путём: человек заглатывает личинок при употреблении в пищу недостаточно проваренного или прожаренного, копчёного, вяленого или солёного мяса, строганины, при дегустации мясного фарша. Так, заболевание людей на территории РФ чаще всего связано с убоем свиней и заготовкой мясных продуктов, в том числе из охотничьих трофеев - кабана, барсука, медведя. В Якутии, например, заражение человека происходит при употреблении в пищу без достаточной термической обработки мяса промысловых животных, прежде всего, копчёного мяса бурого медведя, а также сала или мяса собаки и волка, употребляемых в лечебных целях (Коколова и др., 2013). В районах Арктики важными источниками инвазии местного населения являются медвежатина и мясо морских млекопитающих. Основной источник заражения человека на Дальнем Востоке - мясо домашних свиней, диких кабанов, медвежатина (Калинина, 2005). В описанных в литературе случаях заражения людей в Узбекистане источником их инвазии стало мясо дикого кабана (Лернер, Лемелев, 1989). В Польше в 2000 -2005 гг. 88 % всех случаев заражения людей трихинеллами было связано с употреблением в пищу мяса дикого кабана (Golab, Sadkowska-Todys, 2006). В Испании из 49 вспышек, имевших место в 1990 - 2001 гг., в 75.5 % из них заражение произошло с мясом дикого кабана, 14.3 % - через домашнюю свинину, а в 10.3 % случаев установить источник не удалось (Rodriguez et al., 2004). При этом оказалось, что Т. spiralis была «виновником» заболевания людей только в 38.5 % случаев, а в 61.5 %- Т. britovi.
В Японии в Йокогаме с декабря 198 Г по январь 1982 гг. было зафиксировано 172 случая заражения людей трихинеллой, вызванного употреблением в пищу sashimi, основу которого составляло замороженное мясо гималайского медведя (см.: city.yokogama.lg.jp. About Trichinella spiralis infectious disease).
В Таиланде заражение людей Т. spiralis регистрируют в основном в сельской местности. Как правило, все случаи связаны с употребление в пищу традиционного местного блюда «lahb», обычно подаваемого на различного рода фестивалях, например, northern Thai New Year (северный Тайский Новый Год), свадьбах и т.д. Это популярное блюдо состоит из сырого, мелко нарезанного мяса, смешанного со специями и чили, и подаётся почти в сыром виде (Khamboonruang, 1991).
Очень похожая история произошла в 1982 г. на юге Ливана в 4 деревнях, где наблюдалась одна из самых обширных вспышек трихинеллёза (более 1000 клинических случаев), связанная с употреблением в пищу сырой свинины (raw pork meat) - основы национального деревенского блюда kebbeh nayyeh (Olaison, Ljungstrom, 1992). Возможно, в 1982 г. для этого блюда действительно использовали свинину, но, судя по опубликованным рецептам, в настоящее время kebbeh nayyeh готовят из сырой нежирной рубленой баранины или козлятины, предварительно промороженной в течение двух недель, с добавлением мелкой дроблёной пшеницы, трав (мяты, майорана), перца, соли, белого лука, оливкового масла (www/mamaslebanesekitchen.com).
Тем не менее, в 1995 г. и вновь на юге Ливана в одной из деревень с населением 800 - 1000 жителей заболело сразу 200 человек, отведавших на праздновании Рождества и Нового года местное блюдо kube niye (дословно «сырое мясо»), основу которого составляла сырая свинина (Haim et al., 1997). Мясо, приобретённое в ме
265
стной мясной лавке, как показали последующие исследования, оказалось поражено личинками Т. spiralis.
Восприимчивость людей к трихинеллёзу высокая, что явствует из высокого удельного веса заболевших от общего количества лиц, употреблявших заражённое трихинеллами мясо. В результате перенесённой болезни у человека вырабатывается гуморальный и клеточный иммунитет высокого уровня, предупреждающий возможность повторного развития заболевания (Бритов, Нивин, 2006).
Борьба с трихинеллёзом осуществляется по двум основным направлениям: хорошо налаженный ветеринарно-санитарный контроль и активная санитарнопросветительная работа. В отношении природных очагов трихинеллёза важной превентивной мерой является закапывание охотниками тушек хищных животных после снятия шкурок, тщательная термическая обработка мяса медведя и кабана перед употреблением в пищу, недопустимость скармливания домашним животным отходов переработки мяса диких млекопитающих. И всё же наличие очагов заболевания в дикой природе затрудняет его профилактику среди населения.
В комплексе превентивных мер первостепенное значение имеют те, что направлены на предупреждение заражения трихинеллами домашних свиней. Содержание свиней должно исключать возможность поедания ими трупов грызунов, павших животных, а также отходов боен и тушек диких животных, добытых на охоте. На свиноводческих комплексах, бойнях, утильзаводах, складах мясных продуктов и кожевенного сырья следует систематически проводить дератизацию.
В основе общественной профилактики трихинеллёза лежит микроскопическое исследование свинины, которое в обязательном порядке должно проводиться на мясокомбинатах, скотобойных пунктах, мясомолочных и пищевых контрольных станциях, расположенных на продовольственных рынках. Обязательной экспертизе на наличие трихинелл следует подвергать мясо всех животных - охотничьих трофеев и свиней из индивидуальных хозяйств, поступающее на продажу. При обнаружении в 24 мышечных срезах диафрагмы (или других мышц) личинок трихинелл мясо уничтожают или направляют на техническую утилизацию. Свинину и другие мясные продукты, не имеющие клейма или свидетельства о проведении санитарноветеринарной экспертизы, покупать в несанкционированных местах торговли (спонтанных рынках, местах продажи с лотков на открытом воздухе, вблизи дорог и мест проживания), очень рискованно. Опасность заражения через мясопродукты домашнего приготовления обычно намного выше, чем через продукцию производственной выработки.
Учитывая результаты экспериментального изучения влияния различных способов технологической обработки свиного мяса на выживаемость личинок трихинелл, в США, в соответствии с нормативными документами 9CRR318.10, рекомендуется обрабатывать свинину при 52.2°С в течение 2 ч, при 55.6°С - 15 мин и при 60°С - 1 мин. В то же время в соответствии с регламентом Департамента сельского хозяйства США (U. S. Department of Agriculture), свежее мясо свиньи подлежит обработке в течение 3 мин при 63.8°С (Gamble, Hill, 2013). По информации цитируемых авторов, тот же Департамент сельского хозяйства рекомендует следующие сроки выдерживания мяса при низких температурах: -17.8°С - 106 ч, -20.6°С -82 ч, -23.3°С - 63 ч, -26.1 °C - 48 ч, -34.5°С - 8 ч и -37.2°С - 0.5 ч.
266
Необходимо подчеркнуть, что все упомянутые временные интервалы обработки мяса при той или иной температуре подразумевают под собой отсчёт времени от момента достижения соответствующей температуры по всей глубине обрабатываемого куска мяса.
В РФ разработан целый пакет нормативных документов, направленных на безопасность пищевого сырья и продуктов, целью которых в конечном итоге является охрана здоровья населения: СанПиН 2.3.2.1078 - 01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов»; СанПиН 3.2.1333-03 «Профилактика паразитарных болезней на территории Российской Федерации»; МУК 4.2.735-99 «Паразитологические методы лабораторной диагностики гельмин-тозов и протозоозов»; МУК 3.2.988 - 00 « Методы санитарно-паразитологической экспертизы рыбы, моллюсков, ракообразных, земноводных, пресмыкающихся и продуктов их переработки» и т.д. Ознакомиться со всеми документами можно на соответствующих электронных ресурсах.
Trichinella britovi Pozio, La Rosa, Murrell et Lichtenfels, 1992 (трихинелла Бритова)1. Паразит лесных обитателей умеренных зон Европы и Азии. Есть информация о его распространении на севере Африки в Алжире; здесь заражение Т. britovi было выявлено у местного жителя, отведавшего мясо инвазированного шакала (Nezri et al., 2006). Родственные Т britovi генотипы: Trichinella T9 (обнаружен в Японии) и Trichinella Т8 (выявлен в Южной Африке и Намибии) (Pozio, 2001, 2007а, 2007b).
В Польше, где заражение людей трихинеллами связано с употреблением в пищу мяса дикого кабана и домашней свиньи, первый из них заражён, наряду с Т. britovi, также Т spiralis. Тем не менее, молекулярное исследование мясной продукции, поражённой трихинеллами, вызвавшими в 2005 г. три вспышки заболевания в этой стране, показало, что во всех случаях возбудителем была Т. spiralis (Golab, Sadkowska-Todys, 2006).
Подобная совместная встречаемость обоих названных видов трихинелл в диких кабанах наблюдается, например, в Испании (Rodriguez et al., 2008), однако Т britovi в этой стране регистрируют у людей в 1.6 раза чаще, чем Т. spiralis (Rodriguez et al., 2004).
T britovi известна также как возбудитель трихинеллёзиса людей на юге и в центральной Италии (Piergili-Fioretti et al., 2005; Pozio et al.,1993).
1 Вид назван зарубежными исследователями в честь Василия Александровича Бритова (1928 г. рожд.), члена Международной комиссии по трихинеллёзу, известного своими многочисленными трудами, посвящёнными проблеме трихинеллёза (см., напр., Бритов, 1982). Широкой общественности В. А. Бритов более известен как разработчик так называемой вакцины Бритова, способной укрепить иммунную систему и защитить от рака, в основе которой лежит вакцинация больного специально выведенным для этой цели штаммом трихинеллы (медицинской трихинеллой). В августе 2001 г. автор получил патент № 2172182 на ’’Способ профилактики и лечения заболеваний иммунной системы и средство для его осуществления", зарегистрированный в Госреестре изобретений РФ.
Очень спорная тема, вызывающая самые противоречивые мнения. Активно дискутировалась в прессе в начале 2000-х годов и продолжает быть предметом обсуждения и в настоящее время (в этом легко убедиться: достаточно войти в Интернет, введя соответствующий тег, и через 0.47 с на мониторе возникает 14100 упоминаний о вакцине Бритова).
267
Несмотря на серьёзность заболевания, вызываемого Т. britovi у человека, вид менее патогенен, чем Т. spiralis (Piergili-Fioretti et al., 2005; Pozio et al., 1993).
Trichinella murrelli Pozio et La Rosa, 2000 (= генотип Trichinella T5) (трихинелла Мэрелла)2. Распространена среди млекопитающих - обитателей леса в умеренных зонах США, южной Канады и, возможно, Мексики (Pozio, 2001; Pozio, Zar-lenga, 2013). Среди хозяев паразита - медведи, лисицы, енот, койот, кугуар, рысь, а также домашние собаки, лошади.
Как показала практика, заражение человека трихинеллой Мэрелла возможно через конину и медвежатину. В 1985 г. во Франции наблюдалась вспышка три-хинеллёзиса - тогда заболел 431 человек, - вызванная употреблением в пищу заражённой конины, завезённой из Коннектикута (США) (Ancelle et al., 1988). В октябре 2008 г. в северной Калифорнии (США) на одном из общественных мероприятий, где подавали блюда из мяса чёрного медведя, 30 человек из 38 присутствующих заразились трихинеллой (Hall et al., 2012).
Trichinella nativa Britov et Boev, 1972. Распространена среди млекопитающих арктической и субарктической лесных зон Голарктики. Этот вид особенно характерен для бореальных и арктических районов России (Спиридонов и др., 2016). Его родственный генотип - Trichinella Тб выявлен в ряде штатов США, в том числе на Аляске, в Айдахо, Монтане и ряде других (Pozio, 2001, 2007а, 2007b). Международной комиссией по трихинеллезу Т. nativa в 1980 г. была признана вариететом Trichinella spiralis. Однако авторы публикаций последних лет перечисляют Т. nativa среди валидных представителей данного рода (см., напр., Букина, 2011; Се-рёдкин, 2015; Спиридонов и др., 2016), подчёркивая реальную возможность заражения человека её личинками через мясо медведя и морских млекопитающих.
Скорее всего, заболевания, вызываемые Т. nativa у человека, ранее относили к Т. spiralis.
Trichinella nelsoni Britov et Boev, 1972 (трихинелла Нельсона)3. Распространена в экваториальной Африке к югу от Сахары, прежде всего, в Кении и Южной Африке, в основном среди гиен (семейство) Hyaenidae и крупных кошачьих (Felidae). В 1980 г. Международная комиссия по трихинеллёзу признала Trichinella nelsoni вариететом Trichinella spiralis. Впрочем, судя по многочисленным публикациям последних лет, с этим практически никто не согласился, а видовая самостоятельность данного паразита была подтверждена молекулярно-генетическими исследованиями.
Заражение человека Т. nelsoni происходит с мясом африканского бородавочника и свиней. Описаны закончившиеся фатально случаи необычайно высокой заражённости этими нематодами нескольких местных жителей в Африке, когда при аутопсии одного молодого человека («young boy») в 1 г мышечной ткани языка насчитывалось более 5000 цист, а у другого - 6530 (Muller, 2002).
2 Вид назван в честь известного нематодолога К. D. Murrell за его вклад в изучение иммунологии и эпидемиологии Trichinella.
3 Вид назван в честь известного медицинского паразитолога профессора Г. С. Нельсона (George S. Nelson), активно работавшего в 1950 - 1980-е годы в области изучения паразитов и болезней человека и животных, в частности в африканских странах, в том числе в Кении.
268
Trichinella papuae Pozio, Owen, La Rosa, Sacchi, Rossi et Corona, 1999 (трихинелла папуасская). Паразит солоноватоводных крокодилов, а также домашних и диких свиней - обитателей лесов на Папуа-Новой Гвинее (Owen 1., 2005; Owen I. et al., 2005; Pozio, 2005, 2007a, 2007b; Pozio et al., 1999). Вид примечателен тем, что его личинки не инкапсулируются в мышечной ткани животных, а длина их тела почти на одну треть больше длины личинок родственного, также не инкапсулирующегося в мышцах вида - Т. pseudospiralis. К тому же, в отличие от сравниваемого вида, личинки Т. рариае не способны заражать птиц. Паразит развивается в ином диапазоне температур - от 26 до 40°С, благодаря чему он освоил как холоднокровных, так и теплокровных животных (Pozio et al., 2004).
Уже в нынешнем столетии на Папуа-Новой Гвинее был зарегистрирован очаг заражения людей данной трихинеллой: поражение выявили у 28.9 % местных жителей (Owen I., 2005; Pozio, 2001).
Trichinella pseudospiralis Garkavi, 1972 (трихинелла ложноспиральная). Паразит птиц (13 видов) и млекопитающих (14 видов) по всему миру. Освоение столь широкого круга хозяев связано со способностью паразита развиваться при температуре 37 - 42.5°С. Т. pseudospiralis принадлежит к группе видов трихинелл, у которых личинки не вызывают образования так называемых Nurse клеток. Эти клетки морфологически отличаются от всех типов клеток млекопитающих. Более того, ни одно патологическое состояние не вызывает у этих животных формирования подобных клеток.
Т. pseudospiralis образует три различимые популяции в Палеарктике, Неарк-тике и Австралийском регионе (La Rosaet al., 2001). Иногда вид встречается совместно с Т. spiralis. Например, при обследовании языков 112 добытых на охоте особей флоридской пумы (кстати, самый редкий подвид пумы) и полученных при некроп-сии, у 16 из них была выявлена Т. pseudospiralis, у одной - Т. spiralis и у двух особей - оба вида одновременно (Reichard et al., 2015). Основным источником заражения пумы, по мнению авторов публикации, являются дикие свиньи, заражённые во Флориде обоими видами нематод. О подобной совместной встречаемости обоих названных видов трихинелл в диких свиньях на северо-востоке Германии не так давно писали и немецкие коллеги (Nockler et al., 2006).
Примечательно, что на Тасмании, где Т. pseudospiralis обнаружили у 30 % особей сумчатого, или тасманийского дьявола (у 46 животных из 153) (Obendorf et al., 1990), свиньи не обитают; следовательно, жизненный цикл паразита в тех краях протекает по иному пути, чем в Северной Америке.
Первая вспышка заболевания, вызванного трихинеллой ложноспиральной, наблюдалась в 1994 - 1995 гг. в Таиланде: тогда один человек из 59 заразившихся скончался (Jongwutiwes et al., 1998). Источником заражения людей стало мясо диких свиней, которое продавал жителям деревни местный охотник. Успех в лечении пациентов обеспечило применение альбендазола.
Вторая вспышка имела место в России на Камчатке: здесь заболевание было выявлено примерно у 50 человек (Britov, 1997).
В 1999 г. была отмечена третья вспышка трихинеллёзиса, на этот раз в Европе, на юго-востоке Франции (Ranque et al., 2000).
269
Trichinella zitnbabwensis Pozio, Foggin, Marucci, La Rosa, Sacchi, Corona, Rossi et Mukaratirwa, 2002 (трихинелла зимбабвенская). Впервые была обнаружена у нильского крокодила, разводимого на фермах в Зимбабве. Заражённость животных составила 39.5 % (Pozio et al., 2002). Паразит известен в Зимбабве, Мозамбике, Эфиопии, Южной Африке. Это - третий вид Trichinella, у которых личинки не инкапсулируются в мышечной ткани хозяев. Как и Т. рариае, личинки Т. zimbabwensis не способны заражать птиц, но, как и Т. рариае, данный вид также может завершать свой жизненный цикл в млекопитающих и рептилиях (Pozio, 2005, 2007а, 2007b; Pozio, Zarlenga, 2005; Pozio et al., 2004, 2007). Паразит способен заражать приматов (Owen I. et al., 2005; Pozio, Zarlenga, 2005). У человека пока не найден.
Кратко подытожим изложенную выше информацию.
Прежде всего, отметим, что абсолютно все известные к настоящему времени представители Trichinella, независимо от их видовой принадлежности, представляют опасность для здоровья людей. При этом не исключено, что отдельные описанные в литературе случаи заболевания людей, возбудителем которых была названа Т. spiralis, в действительности могли быть вызваны другими представителями рода. Особенно убедительно выглядит это предположение на фоне внешнего морфологического сходства нематод данного рода на всех стадиях жизненного цикла, перекрывания ареалов многих из них, например, Т. spiralis и Т. britovi, и даже совместной встречаемости разных видов в одном и том же хозяине.
Совершенно очевидно, что проблема заражения людей трихинеллами не является сугубо региональной, а носит межгосударственный характер. В 1958 г. по решению Международного съезда паразитологов в Будапеште была создана Международная комиссия по трихинеллёзу, первая конференция которой состоялась в 1960 г. В 1988 г. в Италии на базе Национального института здоровья в Риме (Istitu-to Superiore de Sanita, Roma) был основан Международный центр хранения и идентификации изолятов трихинелл (Trichinella Reference Center, TRC).
Детальный анализ мировой фауны Trichinella и распространения известных видов среди животных и человека по странам и континентам выполнен Э. Поцио (Pozio, 2007а). По данным цитируемого автора, к 2007-му году заражение людей этими нематодами документально зафиксировано в 55 странах мира. В некоторых из них подобные случаи встречаются только в отдельных этнических меньшинствах, а также среди туристов, поскольку местные жители не употребляют в пищу сырое мясо или вообще не едят мясо некоторых животных. С учётом того факта, что треть населения планеты - это иудеи и мусульмане, не употребляющие свинину по религиозным соображениям, эту группу людей не включают в группу риска. Тем не менее, как мы видели на примере заболевшего жителя Алжира (Nezri et al., 2006), представители этих конфессий также могут случайно заразиться, даже не употребляя свинину. Более того, расширение круга хозяев трихинелл за счёт включения в него рептилий и птиц также предполагает возможность заражения людей, уже независимо от их вероисповедания, разными видами этих нематод.
Случаи заражения домашних (главным образом, свиней) и диких животных зарегистрированы соответственно в 43 (21.9%) и 66 (33.3%) странах (Pozio, 2007а). В целом из 198 стран мира, около 40 (20 %) - это небольшие островные государства вблизи крупных континентов, или города-государства, где трихинеллы не могут циркулировать среди животных из-за отсутствия местной фауны (как домашней, 270
так и дикой). И, наконец, всё ещё отсутствует информация о распространении трихинеллы среди животных на территории 92 стран.
И последнее. Работая над настоящим разделом, анализируя доступную информацию по трихинеллам и трихинеллёзу (трихинеллёзису) - а она поистине неисчерпаема, - всё время ловила себя на мысли: сколь интересна эта тема, сколько в ней ещё неизведанного и неоткрытого, и как много можно было бы написать по данному вопросу.
Цитируемая литература
Асатрян А. М., Мовсесян С. О., Геворкян А. Ш. Экспериментальное заражение насекомых личинками Trichinella spiralis Owen, 1835 и Т. pseudospiralis Garkavi, 1972 // Теоретические и прикладные проблемы паразитологии. - М.: Наука, 2002. - С. 16 - 19. - (Труды Ин-та паразитологии. T. 43).
Бессонов А. С. Эпизоотология (эпидемиология) и профилактика трихинеллёза. - Вильнюс: Минтис, 1972.-Ч. 1.-304 с.
Бритов В. А. Возбудители трихинеллеза. - М.: Наука, 1982. - 271 с.
Бритов В. А., Нивин Е. А. Реабилитация трихинелл и перспективы их использования / Мат. X Между-нар. научн. конф. 27.04 - 9.05.2006, г. Бангкок, Таиланд. - Пермь: Изд-во ПОНИЦАА, 2006. - доступно: rak.flyboard.ru.
Букина Л. А. Распространение трихинеллеза на морских побережьях Чукотки И Вестник Ульяновской с.-х. акад. - 2011. - № 4(16). - С. 80 - 84.
Д1дик Ю. М. Копитш дикоТ фауни як резерват трихшельозу на територп Полюся та захщноТ частини УкраТни // Vestnik zoologii. - 2006а. - 40, 3. - С. 271 - 274.
Дидык Ю. М. Гельминты рода Trichinella (Nematoda, Trichinellidae) у хищных млекопитающих Полесья и Карпат // Vestnik zoologii. - 20066. - 40, 5. - С. 457 - 461.
Итин Г. С. Особенности гельминтофауны диких хищных млекопитающих в ландшафтно-географических зонах Северо-Западного Кавказа: Дисс... канд. биол. наук: 03.02.08 - экология. - Краснодар, 2014.-171 с.
Калинина О. И. Биология гельминтов и профилактика гельминтозов (учебное пособие). - Владивосток: Изд-во ТГЭУ, 2005. - 80 с.
Калинина О. И., Сарычева А. Ю., Харитонов А. М. Экологические ограничения в развитии туризма в регионе (на примере Приханкайско-Раздольненской группы районов Приморского края) / География и региональные исследования. - Чебоксары, 2002. - С. 228 -231.
Коколова Л. М., Платонов Т А., Верховцева Л. А., Григорьева Л. А., Кочнева Л. Г Роль паразитарных болезней в патологии человека И Рос. паразитол. журн. - 2013. - № 2. - С. 43 - 47.
Лернер П. М., Лемелев В. Р. Важнейшие гельминтозы человека в Узбекистане. - Ташкент: Медицина УзССР, 1989. - 125 с.
Масленникова О. В, Гельминтофауна промысловых животных в природных биоценозах Кировской области: Автореф. дисс...канд. биол. наук. - 03.00.19 - паразитология. - М., 2005. - 20 с.
Меркушев А. В., Озерецковская Н. Н. Глава XXX. Трихинеллёз / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 601 - 615. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Озерецковская Н. Н. Клинико-эпидемиологические особенности трихинеллёза из различных географических районов СССР // Мед. параз. и параз. бол. - 1968. - № 4. - С. 387-397.
Руководство по инфекционным болезням. - Под ред. Ю. В. Лобзина. - Санкт-Петербург, 2000. - Часть 1.-С. 117-121.
Серёдкин И. В. Трихинеллёз бурого и гималайского медведей на Дальнем Востоке России // Вестник КрасГАУ. - 2015. - № 12. - С. 167-173 (Мат. III Междунар. научно-практич. конф.).
Скрябин К И., Шихобалова Н. П., Соболев А. А., Парамонов А. А., Судариков В. Е. Камалланаты, раб-дитаты, тиленхаты, трихоцефаляты, диктиофиматы и распределение паразитических нематод по хозяевам // Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954.-4.-927 с.
Спиридонов С. Э., Букина Л. А., Одоевская Н. М., Серёдкин Н. В. .Анализ нуклеотидных митохондриальных последовательностей CoxI изолятов Trichinella nativa от морских и сухопутных млекопитающих Дальнего Востока России / Современные проблемы теоретической и морской паразитоло
271
гии: сборник научных статей / ред. К. В. Галактионов, А. В. Гаевская. - Севастополь: Изд-ль Бондаренко Н. Ю., 2016. - С. 161 - 163.
Чистенко Г. Н., Гузовская Т. С., Раевская И. А. Трихинеллёз И Мир медицины. - 2014. - № 12. -www.bsmu.by/files/7e74130.
Шевцов А. А. Ветеринарная паразитология. 2-е изд., перераб. и доп. -М.: Колос, 1970.-463 с.
Ancelle Т, Dupouy-Camet J., Bougnoux М., Fourestie V., Petit Н. et al. Two outbreaks of trichinosis caused by horse-meat in France in 1985 H Am. J. Epidemiol. - 1988. - 127. - P. 1302 - 1311.
Andrews J. R., Bandi C, Pozio E., Gomez Morales M. A., Ainsworth R., Abernethy D. Identification of Trichinella pseudospiralis from a human case using random amplified polymorphic DNAI I Am. J. Trop. Med. Hyg. - 1995. - 53. - P. 185 - 188.
Blaga R, Durand B., Antoniu S., Gherman C. et al. A dramatic increase in the incidence of human trichinel-losis in Romania over the past 25 years: impact of political changes and regional food habits // Am. J. Trop. Med. Hyg. - 2007. - 76, 5. - P. 983 - 986.
Bowman D. D., Hendrix С. M., Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Ipwa State Press, 2002.-467 pp.
Britov V. A. Trichinosis in Kamchatka // Wiad. Parazytol. - 1997. - 43. - P. 287 - 288.
Cuperlovic K, Djordjevic M., Pavlovic S. Re-emergence of trichinellosis in southeastern Europe due to political and economic changes // Vet. Parasitol. - 2005. - 132 1-2. - P. 159 - 166.
Despommier D. D., Gwadz R. W.t Hofer P. J., Knirsch C. A. 21. Trichinella spiralis (Railliet, 1896). - P. 135 - 142. In: Parasitic Diseases, fifth Edition. - Apple Tree Prod. L.L.C.NY, 2005. - 363 pp.
Dupouy-Camet J. Trichinellosis: a worldwide zoonosis // Vet. Parasitol. - 2000. - 93. - P. 191 - 200.
Dupouy-Camet J., Paugam A., De Pinieux G., Lavarde V., Viellefond A. Trichinella murrelli'. pathological features in human muscles at different delays after infection // Parasite. - 2001. - 8. - P . 176- 179.
Edelstein S., Gerard B., Bushell T C, Gundersen C. Food and nutrition at risk in America: Food insecurity, biotechnology, food safety, and bioterrorism. - Jones and Bartlett Publ., LLC, 2009. - 321 pp.
Gamble H. R., Hill D. Trichinella // National Pork Board/800-456-7675/pork/org. - 2013. - 5 pp.
Golab E., Sadkowska-Todys M. [Epidemiology of human trichinellosis in Poland - currently and in the past] П Wiad. Parazytol. - 2006. - 52, 3. - P. 181 - 187. (Article in Polish).
Haim M., Efrat M., Wilson M., Schanyz P. M. et al. An outbreak of Trichinella spiralis infection in southern Lebanon // Epidemiology & Infection. - 1997. - 119, 3. - P. 357 - 362.
Hall R. L., Lindsay A., Hammond C, Montgomery S. P., Wilkins P. P. et al. Outbreak of human trichinellosis in Northern California caused by Trichinella murrelli И Am. J. Trop. Med. Hyg. - 2012. - 87, 2. - P. 297 -302. doi: 10.4269/ajtmh.2012.12-0075.
Jongwutiwes S., Chantachum N., Kraivichian P, Siriyasatien P., Putaporntip C et al. First outbreak of human trichinellosis caused by Trichinella pseudospiralis И Clin. Infect. Dis. - 1998. -26, l.-P. 111-115.
Khamboonruang C. The present status of trichinellosis in Thailand // Southeast Asian J. Trop. Med. Public Health. - 1991. - 22, Suppl. - P. 312 - 315.
Kliks M. M. Helminths as heirlooms and souvenirs: a review of new world paleoparasitology // Parasitol. Today. - 1990. - 6, 4. - P. 93 - 100.
La Rosa G., Marucci G., Zarlenga D. S., Pozio E. Trichinella pseudospiralis populations of the Palearctic region and their relationship with populations of the Nearctic and Australian regions // Int. J. Parasitol. -2001.-31, 3.-P. 297-305.
Leidy J. On the existence of an Entozoon (Trichina spiralis) in the superficial part of the extensor muscles of the thigh of a hog // Proc. Acad. Nat. Sci., Philadelphia. - 1846. - 3. - P. 107 - 108.
Leuckart R. Untersuchungen ueber Trichina spiralis. - Leipzig u. Hejdelberg, 1860. - 120 pp.
Monnig H O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Nezri M., Ruer J., De Bruyne A., Cohen-Valensi R., Pozio E, Dupouy-Camat J. Premiere observation d’un cas de humain de trichinellose a Trichinella britovi en Algerie apre’s consummation de viande de chacal (Canis aureus) // Bull. Soc. Pathol. Exotique. - 2006. - 99. - P. 94 - 95.
Nockler K., Reckinger S., Pozio E. Trichinella spiralis and Trichinella pseudospiralis mixed infection in a wild boar (Sus scrofa) of Germany // Vet. Parasitol. - 2006. - 137, 3-4. - P. 364 -368.
Obendorf D. L., Handlinger J. H, Mason R. W., Clarke К. P., Forman A. J. et al. Trichinella pseudospiralis infection in Tasmanian wildlife // Aust. Vet. J. - 1990. - 67, 3. - P. 108-110.
272
Olaison L., Ljungstrom L An outbreak of trichinosis in Lebanon // Trans. R. Soc. Trop. Med. Hyg. - 1992. -86, 6.-P. 658-660.
Owen I. L. Parasitic zoonoses in Papua New Guinea // J. Helminthol. - 2005. - 79, 1. - P. 1-1 4.
Owen I. L., Gomez Morales M. A., Pezzotti P., Pozio E. Trichinella infection in a hunting population of Papua New Guinea suggests an ancient relationship between Trichinella and human beings // Trans. R. Soc. Trop. Med. Hyg. - 2005. - 99, 8. - P. 618 - 624.
Owen R. Description of a microscopic Entozoon infesting the muscles of the human body // Trans. Zool. Soc. London. - 1835. - 1. -P. 315 - 324.
Piergili-Fioretti D., Castagna B., Frongillo R. F, Bruschi F. Re-evaluation of patients involved in a trichinel-losis outbreak caused by Trichinella britovi 15 years after infection П Vet. Parasitol. - 2005. - 132, 1-2. - P. 119-123.
Pozio E. Taxonomy of Trichinella and the epidemiology of infection in the Southeast Asia and Australian regions // Southeast Asian J. Trop. Med. Public Health. - 2001. - 32, Suppl 2. - P. 129 - 132.
Pozio E. The broad spectrum of Trichinella hosts: from cold- to warm-blooded animals // Vet. Parasitol. -2005.-132, 1-2.-P. 3-11.
Pozio E. World distribution of Trichinella spp. infections in animals and humans // Vet. Parasitol. - 2007a. -149.-P. 3-21.
Pozio E. Taxonomy, biology and epidemiology of Trichinella parasites I Dupouy-Camet J., Murrell K. D. (Eds.), FAO/WHO/OIE guidelines for the surveillance, management, prevention and control of trichinello-sis. - World Organization for Animal Health Press, Paris, 2007b. - P. 1-35.
Pozio E., Foggin С. M., Gelanew T, Marucci G., Hailu A. et al. Trichinella zimbabwensis in wild reptiles of Zimbabwe and Mozambique and farmed reptiles of Ethiopia // Vet. Parasitol. - 2007. -143. - P. 305 -310.
Pozio E., Foggin С. M., Marucci G., La Rosa G., Sacchi L. et al. Trichinella zimbabwensis n. sp. (Nematoda), a new non-encapsulated species from crocodiles (Crocodylus niloticus) in Zimbabwe also infecting mammals // Int. J. Parasitol. - 2002. - 32, 14. - P. 1787 - 1799.
Pozio E., La Rosa G. PCR-derived methods for the identification of Trichinella parasites from animal and human samples // Methods in Molecular Biology. - 2003. - 216. - P. 299 - 309.
Pozio E., Marucci G., Casulli A., Sacchi L., Mukaratirwa S. et al. Trichinella рариае and Trichinella zimbabwensis induce infection in experimentally infected varans, caimans, pythons and turtles // Parasitology. - 2004. - 128.-P. 333-342.
Pozio E., Owen I. L., La Rosa G., Sacchi L., Rossi P., Corona S. Trichinella рариае n.sp. (Nematoda), a new non-encapsulated species from domestic and sylvatic swine of Papua New Guinea 11 Int. J. Parasitol. -1999.-29, 1 l.-P. 1825- 1839.
Pozio E., Varese P., Morales M., Croppo G., Pelliccia D., Bruschi F. Comparison of human trichinellosis caused by Trichinella spiralis and by Trichinella britovi // Am. J. Trop. Med. Hyg. - 1993. - 48,4. - P. 568 - 575.
Pozio E., Zarlenga D. S. Recent advances on the taxonomy, systematics and epidemiology of Trichinella // Int. J. Parasitol. - 2005. - 35, 11-12. - P. 1191 - 1204.
Pozio E, Zarlenga D. S, New pieces of the Trichinella puzzle // Int. J. Parasitol. - 2013. - 43, 12-13. - P. 983 -997. doi: 10.1016/j.ijpara.2013.05.010.
Ranque S, Faugere B., Pozio E, La Rosa G., Tamburrini A. et al. Trichinella pseudospiralis outbreak in France // Emerg. Infect. Dis. - 2000. - 6, 5. - P. 543 - 547.
Reichard M. V., Criffield M., Thomas J. E, Paritte J. M., Cunningham M. et al. High prevalence Qi Trichinella pseudospiralis in Florida panthers (Puma concolor coryi) // Parasites & Vectors. - 2015. -8: 67 DOI: 10.1186/s 13071-015-0674-z.
Ribicich M., Gamble H. R., Rosa A., Bolpe J., Franco Я. Trichinellosis in Argentina: an historical review // Vet. Parasitol. - 2005. - 132, 1-2. - P. 137 - 142.
Rodriguez E., Olmedo J., Ubeira F. M., Blanco C., Gdrate T Mixed infection, Trichinella spiralis and Trichinella britovi, in a wild boar hunted in the Province of Caceres (Spain) // Exp. Parasitol. - 2008. -119, 3. -P. 430-432. doi: 10.1016/j.exppara.2008.03.017.
Rodriguez de las Parras E., Rodriguez-Ferrer M., Nieto-Martinez J., Ubeira F. M., Gdrate-Ormaechea T. [Trichinellosis outbreaks in Spain (1990-2001)] П Enferm. Infecc. Microbiol. Clin. - 2004. - 22, 2. - P. 70 - 76. (Article in Spanish).
Virchow R. Zur Trichinen-Lehre // Arch. path. Anat. - 1865. - 32. - P. 332 - 371.
Zarlenga D. S, Rosenthal B,, La Rosa G., Pozio E, Hoberg E. P. An old genus learns new tricks: late Tertiary colonization and speciation of Trichinella nematodes among Eutheria // Proc. Nat. Acad. Sci. USA. -2006. - 103. - P. 7354-7359.
Zenker F. A. Uber die Trichinenkrankheit des Menschen 11 Arch. path. Anat. - 1860. - 18. - P. 561 - 572.
273
Семейство Trichostrongylidae Leiper, 1908
Семейство, объединяющее в настоящее время 224 рода с 1321 видом, включают в класс Chromadorea в составе отряда Rhabditida (Hodda, 2011).
Описание (по: Скрябин и др., 1952, 1954; Faust, 1949). Мелкие нитевидные черви красного цвета. Ротовое отверстие терминальное, реже несколько смещено дорсально. Ротовая капсула и зубы отсутствуют. У самцов имеется крупная половая бурса с хорошо развитыми рёбрами. Спикул две. Рулёк может отсутствовать. Хво-
стовой конец самок конический, иногда с шипом или шиповидными выростами на верхушке. Половой аппарат самок парный. Вульва обычно в задней половине тела. Паразиты амфибий, рептилий, птиц и млекопитающих. Космополиты. Типовой род - Trichostrongylus Looss, 1905. к
Жизненный цикл трихостронгилид прямой, т.е. не требует участия проме-
жуточного хозяина (рис. 100).
A-infective Stage А± Dkagnoefc Stage
Рис. 100 Схема жизненного цикла трихостронгилид (1 - яйца во внешней среде; 2 -рабдитовидная личинка, вылупившаяся из яйца; 3 - филяриевидная личинка, развившаяся во внешней среде из рабдитовидной личинки; 4 - заражение окончательного хозяина; 5 -взрослые черви в тонком кишечнике (из: cdc.gov. CDC-
DPDx-Trichostrongy-losis-index)
(i - инвазионная и d -диагностическая стадии)
Откладываемые самками яйца содержат от 8 до 30 шаров дробления (бластомеров) и попадают во внешнюю среду с фекалиями дефинитивного хозяина. Яйца трихостронгилид имеют тонкую, прозрачную и бесцветную оболочку. При благоприятных условиях в яйце в течение 1-3 суток развивается личинка 1-й стадии, так называемая рабдитовидная личинка, которая покидает его оболочку. Н. Е. Семёнова (1968) цитирует работу А. X. Алтаева (Тр. Гельминтол. лаб. АН СССР. -М., 1961, т. 11, стр. 10), показавшего, что при 23 - 25°С личинки Т. skrjabini Kalan-tarjan, 1928 вылупляются через 24 - 42 ч. Продолжительность развития яиц во внешней среде, а также выживаемость вылупившихся личинок зависят от температуры, влажности, доступа кислорода, причём разные виды трихостронгилид демонстрируют разную устойчивость к одному и тому же показателю (Beveridge et al., 1989). В целом яйца хорошо развиваются в воде, но быстро гибнут при высыхании.
274
В бескислородной среде их развитие прекращается, но при возобновлении доступа кислорода восстанавливается. Личинки чувствительны к высыханию, воздействию чрезмерно высоких или низких температур, интенсивной инсоляции. Рабдитовидная личинка дважды линяет и превращается в филяриевидную личинку 3-й стадии, мигрирующую на растительность. Заражение животных происходит при поедании ими трав с личинками, а также с водой (Скрябин и др., 1954). Такая личинка, проглоченная хозяином, попадает в его кишечник, где и остаётся. Претерпев ещё две линьки, примерно через 2-4 недели после заражения личинка развивается в половозрелую особь.
У человека зарегистрированы трихостронгилиды 7 родов.
Цитируемая литература
Семёнова Н. Е. XXXI. Трихостронгилидозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 596 -600. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Скрябин К. И., Шихобалова Н. П., Шульц Р. С. Трихостронгилиды животных и человека И Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954. - 3. - 683 с.
Скрябин К. И., Шихобалова Н. П., Шульц Р. С., Попова Т. И., Боев С. К., Делямуре С. Л. Стронгиляты // Определитель паразитических нематод / Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1952.-3.-С. 310-504.
Beveridge Pullman A.L., Martin R. R., Barelds A. Effects of temperature and relative humidity on development and survival of the free-living stages of Trichostrongylus colubriformis, T. rugatus and T. vitrinus // Vet. Parasitol. - 1989. - 33, 2. - P. 143 - 153.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp. Hodda M. Animal biodiversity // Zootaxa. - 2011. - No 3148. - P. 63 - 95.
Род Trichostrongylus Looss, 1905
Синонимы (no: IRMNG, (2012)1:
Tricostrongylus Travassos, 1914
Trychostrongylus Kitamura, 1916 Cobboldostrongylus Sarver, 1956 Buckley a Sarwar, 1956 Gilesia Sarwar, 1956 Probostrongylus Sarwar, 1956
Описание (по: Скрябин и др., 1952). Головной конец тонкий. Рот окружён тремя небольшими губами. Ротовая полость выражена слабо. Шейные сосочки отсутствуют. Бурса самцов с крупными латеральными лопастями, срединная из которых выражена слабо. Вентральные рёбра широко разделены, вентровентральное ребро значительно меньше и тоньше латеровентральных. Латеральные рёбра изолированы друг от друга. Наружнодорсальные рёбра отходят от общего с дорсальным ребром основания. Дорсальное ребро раздвоено на конце, каждая ветвь, в свою очередь, также раздваивается. Имеются мелкие сосочки. Спикулы короткие, несколько скрученные, проксимальный конец с вздутым или дисковидным отростком, дистальный - часто с выростами. Рулёк имеется. Отверстие вульвы с хитинизирован-
1 IRMNG (2012). Trichostrongylus Looss, 1905. Accessed through: The Interim Register of Marine and Nonmarine Genera at http://www.irmng.org/aphia.php?p=taxdetails&id= 1036886.
275
ними губами. Яйцекладущие. Паразиты млекопитающих, реже птиц. Типовой вид -Trichostrongylus retortaeformis (Zeder, 1800)Looss, 1905.
В англоязычной литературе паразитирующих у домашнего скота трихос-тронгилов обычно называют wireworms - проволочники (Muller, 2002), hair-worms - волосатики (www.merial.ph.equine_vleg_hair.pdf).
Среди паразитирующих у людей представителей Trichostrongylus называют 11 видов, спорадически отмечаемых у них во многих странах практически на всех континентах: в Австралии и Тасмании, Египте, Марокко, Эфиопии, Тунисе, Иране, Ираке, Индии, Израиле, Японии, Корее, Индонезии, Лаосе, Таиланде, Армении, Франции, Румынии, Германии, Италии, России, США, Чили и т.д. (Bradbury, 2006; Lattes et al., 2011; Muller, 2002; Watthanakulpanich et al., 2013 и др.).
Трихостронгилы обычно локализуются в тонком кишечнике, а поскольку ротовая капсула у них отсутствуют, то они глубоко погружаются головным концом в слизистую оболочку пищеварительного тракта. В США описан случай обнаружения Т. colubriformis (Giles, 1892) в аппендиксе пациента (Schenken, Moss, 1938).
Во многих случаях симптомы заражения выражены слабо, что связано со слабой интенсивностью инвазии человека, являющегося для этих нематод факультативным хозяином. Тем не менее, больные могут жаловаться на пониженный аппетит, тошноту, отрыжку, метеоризм, схваткообразные боли в животе, нарушение стула, боли в правом подреберье, головные боли, общую слабость и раздражительность, иногда наблюдаются признаки жёлчной колики (Семёнова, 1968; Becquet et al., 1982; Boreham et al., 1995). Отдельные авторы отмечают у пациентов эозинофилию от умеренной до сильно выраженной (Becquet et al., 1982; Boreham et al., 1995; Thibert et al., 2006), лейкоцитоз, гипохромную анемию co снижением гемоглобина и цветного показателя, а также резкую эозинофильную реакцию в костном мозгу (см.: Семёнова, 1968).
Диагноз основан на обнаружении яиц нематод в фекалиях (методы Фюлле-борна, Като) или в дуоденальном содержимом, причём пробы рекомендуется выдержать в тепле в течение 1 - 3 суток (Семёнова, 1968). Авторы многих публикаций подчёркивают трудности в определении яиц трихостронгилов, в частности их дифференциацию от яиц Necator и Ancylostoma (Boreham et al., 1995; Kitamura, Oishi, 1913; Koino, 1927; Thibert et al., 2006; Yong et al., 2007). При этом всё же следует иметь в виду, что яйца Trichostrongylus крупнее, уже и удлинённые в сравнении с таковыми анкилостоматид. В настоящее время для дифференциации яиц названных нематод широко используют молекулярно-генетические методы (Yong et al., 2007).
Заражение практически всегда происходит через пищу - свежую зелень, овощи (Boreham et al., 1995; Watthanakulpanich et al., 2013), выращенные на земельных участках, где для удобрения используют фекальные массы, а также через питьевую воду, в которой могут оказаться личинки нематоды. (Именно по этой причине трихостронгилиды включены мною в группу видов, вызывающих нематодозы пищевого происхождения). Опасности заражения подвергаются также взрослые и особенно дети, имеющие привычку брать в рот сорванные на пастбищах растения, грызть травинку. И, наконец, личинки могут попасть в рот с загрязнённых рук (если их не вымыть, конечно) после земляных работ или ухода за животными.
276
Заражение личинками через кожу маловероятно: в экспериментальных условиях попытки введении личинок Т. orientalis через неповреждённую кожу закончились безрезультатно (Otsuru, Ito, 1972).
Trichostrongylus affinis Graybill, 1924 (affinis - родственный, соседний) (рис. 101). Впервые описан на материале от двух диких кроликов, добытых в Нью-Джерси, США (Graybill, 1924).
Зрелые самцы длиной 5 - 7.5 и шириной 0.123 мм. Дистальный конец передневентрального и наружнодорсального рёбер загибаются соответственно вентрально и дорсально. Остальные рёбра лежат плотно друг к другу. Спикулы и рулёк коричневого цвета. Спикулы короткие, массивные, почти равные, расщеплены на 2 основные ветви, оканчивающиеся крючкообразным остриём. Длина спикул 0.131 - 0.156 мм. Самки 8.7 - 9.3 х 0.106 -0.177 мм. Яйца 57 - 66 х 33 - 40 щп. Личинки во внешней среде достигают инвазионного состояния в течение 10 дней.
Рис. 101 Trichostrongylus affinis, бурса самца (из: Graybill, 1924)
Ареал вида охватывает североамериканский конти
нент, где его отмечают у американских зайцев, в том числе беляка, диких кроликов, изредка - у домашних кроликов. Паразит известен также у песчанки когтистой, хомяков - хлопкового и болотного рисового (Dixon, 1965). Заражение животных происходит с травой, на которую заползают личинки нематоды. При сильной инвазии гельминты вызывают истощение организма (Dixon, 1965).
Данный вид обнаружен у человека в США (Muller, 2002).
Trichostrongylus axel (Cobbold, 1879) Railliet et Henry, 1909 (рис. 102). Вид
первоначально описан под названием Strongylu-rus Axel Cobbold, 1879 и назван в честь Mr. Axe (Эйкс), нашедшего маленького червя в слизистой желудка ишака.
Самцы длиной 3.4 - 4.5 и шириной 0.05 -0.07, самки соответственно 4.6 - 5.5 и 0.075 мм. Спикулы жёлто-коричневые, неравные, 0.085 -0.104 и 0.110 - 0.128 мм. Дистальные концы спикул с особыми отростками, располагающимися в 0.065 мм от их переднего конца. Яйца 70 - 92 х 35 - 42 щп. От попадания личинок в организм дефинитивного хозяина до откладки половозрелой самкой яиц проходит 20 - 25 дней.
Рис. 102 Trichostrongylus axei: 1 - спикулы и рулёк; 2 -бурса самца; 3 - хвостовой конец самки; 4 - область вульвы (из: Скрябин и др., 1954 - по: Калантарян, 1928)
277
Обычные хозяева Т. axei - жвачные животные. У крупного рогатого скота, коз, овец, муфлонов, баранов, мулов, бизона, антилоп черви обычно поселяются в сычуге, у лошади и свиньи - в желудке. Молодняк более восприимчив к заражению. При сильной инвазии в желудке животных отмечены отёки и гиперплазия, животные слабо прибавляют в весе и плохо растут.
Ареал вида распространяется на все континенты - Америку, Евразию, Африку, Австралию (Скрябин и др., 1954; Monnig, 1934).
К 1970 г. спорадические случаи заражения человека Т. axei с невысокой интенсивностью инвазии были известны в Японии, Пакистане, Армении, России, на Яве, Маврикии (Otsuru, Ito, 1972). Так, в Японии в 1955 - 1962 гг. при обследовании 503 пациентов, прошедших соответствующее лечение, и вскрытии 24 усопших выявили 1 самца и 5 самок Т. axei (Otsuru, Ito, 1972). В 1967 - 1974 гг. на территории Ирана заражённость местного населения этой нематодой наблюдали в 6 регионах из 11 обследованных (Ghadirian, Arfaa, 1975).
В 1982 г. появилось первое сообщение о регистрации Т. axei у человека в Италии (Cancrini et al., 1982), в 1985 г. - в Карибском регионе (Bundy et al., 1985), в 2013 г. - в Таиланде (Phosuk et al., 2013).
Trichostrongylus brevis Otsuru, 1962 (рис. 103). В 1961 г. M. Оцуру проводил массовое лечение пациентов, заражённых Trichostrongylus, препаратом Bephenium hydroxynaphthoate и неожиданно обнаружил самцов неизвестной нематоды - по одной подобной особи выделилось от 20-летней женщины, 42-
I | летнего мужчины и 14-летнего подростка. Нематоды отлича-
|| / лись от описанных к тому времени видов Trichostrongylus ис-
X | ' ключительно короткими спикулами, что, в основном, и по-
/ i I служило основанием для описания червей в качестве нового
/ \У/ I , . у / вида (Otsuru, 1962). На подобную отличительную особенность
k ji / / >Д/ описываемого паразита указывает и его видовое название: хГ / / J'Ак brevis - короткий.
^50*^ Рис. 103 Trichostrongylus brevis, бурса (из: Otsuru, Ito, 1972)
Самцы длиной 4.1 мм, тело постепенно расширяется к заднему концу; максимальная ширина (выше бурсы) около 0.08 мм. Бурса двучастичная, загибается вентрально. Спикулы сильно хитинизированные, коричневато-жёлтого цвета, равные или почти равные, внешне похожие, длиной 0.090 - 0.096 и шириной около 0.024 мм. На конце каждой спикулы имеется маленький крючок, а на передневентральных концах - по дископодобному выступу. Самки не известны.
В упомянутой выше работе (Otsuru, Ito, 1972) её авторы пишут об обнаружении ими всего 6 самцов Т. brevis за 3-летний период наблюдений.
В одной из статей, опубликованной в 1998 г., сообщалось о находке Т. brevis у коз в районе Стамбула, Турция (Akkaya, 1998).
Trichostrongylus calcaralus Ransom, 1911 (рис. 104).
Самцы длиной 4.7 - 6.6 и шириной выше бурсы 0.10-0.13 мм. Дорсальное ребро начинается от основания правого антеродорсального ребра и располагается асимметрично, окончания его двух ветвей простые. Спикулы 0.175 - 0.190 мм, тёмно-бурого цвета, слегка изогнуты вентрально и тупо усечены на дистальном конце.
278
Самки длиной 6 - 8 и шириной 0.09 - 0.12 мм в области вульвы. Яйца размерами 60 - 70 х 30 - 36 цт, откладываются с 8 - 32 шарами дробления.
Рис. 104 Trichostrongylus calcaratus: 1 - область вульвы; 2 - хвостовой конец самки; 3 - бурса самца, вид сбоку; 4 - дорсальные рёбра бурсы; 5 - спикулы и рулёк (из: Скрябин и др., 1954 -по: Travassos, 1921)
Паразит зайцев и кроликов в Северной Америке. При высокой заражённости может быть патогенным для своих хозяев (Sarles, 1937). Недавно эту нематоду обнаружили у дикого, или как его ещё называют, европейского кролика в Италии (Tizza-ni et al., 2014). Инвазированными оказались все 100 % обследованных животных, а средняя интенсивность инвазии составила 221.4 экз.
Во многих обзорных работах вид включён в список трихостронгилов, регистрируемых у человека (Muller, 2002).
Trichostrongylus capricola Ransom, 1907. Видовое название нематоды происходит от родового названия хозяина: латинское Capra - коза, козёл (трихострон-гил козлиный).
Самцы длиной 4.3 - 4.9 и толщиной 0.08 - 0.1 мм. Спикулы в проксимальной половине более толстые, чем в дистальной. Самки длиной 5.8 - 6.8 и толщиной 0.075 - 0.08 мм. Яйца 75 - 95 х 35 - 45 pm.
Т. capricola поселяется в тонком кишечнике коз и овец, известен также у лося и американского вилорога, буйволов и крупного рогатого скота. Распространён в Евразии и Северной Америке.
Самые известные случаи заражения людей Т. capricola зафиксированы в Иране (Ghadirian, Arfaa, 1975; Ghadirian et al., 1974). Здесь в провинции Исфаган нематоду выявили у 13.3 % сельских жителей (всего было обследовано 30 человек) и 22.5 % кочевников (из 40); заражёнными также оказались все 10 овец и 10 коз, исследованных в той же местности.
В 1982 г. появилось первое сообщение о регистрации Т. capricola у человека в Италии (Cancrini et al., 1982).
Trichostrongylus colubriformis (Giles, 1892) Ransom, 1911 [=Strongylus colu-briformis Giles, 1892; =Strongylus instabilis Railliet, 1893; =Strongylus subtilis Looss, 1895; ^Trichostrongylus instabilis (Railliet, 1893) Looss, 1905; =Trichostrongylus subtilis (Looss, 1895) Looss, 1905] (рис. 105, 106). Видовое название можно перевести как «змееобразный».
В 1895 г. известный немецкий гельминтолог А. Лоосс (Looss, 1895), работавший в те годы в Египте, обнаружил при аутопсии местного жителя в нижней части тонкого кишечника нематод, которых описал как новый вид Strongylus subtilis. В 1905 г. тот же ис
279
следователь создал новый род Trichostrongylus, куда перевёл Strongylus subtilis, а также Strongylus instabilis Railliet, 1893. В настоящее время оба вида - синонимы Т. colubriformis.
Рис. 105 Trichostrongylus colubriformis: 1 - спикулы и рулёк; 2 - бурса самца; 3 - хвостовой конец самки; 4 - область вульвы (из: Скрябин и др., 1954-по: Калантарян, 1928)
55 W
Рис. 106 Trichostrongylus colubriformis, бурса (из: Ghasemikhah et al., 2011)
При жизни черви красноватого или кремового цвета. Самцы длиной 4 - 6 и максимальной шириной (впереди бурсы) 0.078 - 0.095 мм. Спикулы слегка неравные, длиной 0.118 - 0.145 мм, имеют вид изогнутой лодочки с толстым корневым отростком на проксимальном конце и треугольным отростком у дистального конца,
резко выступающим при боковом положении спикул. Рулёк яркого желтовато-коричневого цвета, длиной 0.070 мм, при взгляде сбоку имеет вид волнообразно изогнутой кривой с двумя волнами. Самки длиной 5 - 6 и максимальной шириной 0.08 - 0.10 мм. Яйца 73 - 76 х 40 - 43 цт. По (Sato et al., 2011), размеры яиц 83.3 х 49.6 pm.
Самки откладывают яйца в фазе 8-16 бластомеров, а в тот момент, когда с фекалиями дефинитивного хозяина те попадают во внешнюю среду, в них содержатся уже 24 - 32 бластомера. Через 18 - 20 ч личинка 1-й стадии, имеющая в длину 0.33 - 0.35 мм, покидает яйцо. К моменту первой линьки личинки вырастают до 0.5 - 0.6 мм. При благоприятных условиях они достигают инвазионного состояния
в течение трёх суток. Низкие температуры (4-10°С) тормозят вылупление личинок из яиц и их развитие до инвазионного состояния (Beveridge et al., 1989).
Основные дефинитивные хозяева Т. colubriformis - жвачные и зайцеобразные, у которых черви локализуются в тонком кишечнике, а также в сычуге (у жвачных). К примеру, из 53 овец, обследованных на скотобойнях в Исфагане (Иран), у 21.43 % животных эти нематоды располагались в кишечнике, ау7.14%-в сычуге, тогда как у коз, заражённость которых составила 15.09 % (из 53 животных), - только в кишечнике (Pestechian et al., 2014).
280
Из-за своего патогенного воздействия на организм животных в англоязычной литературе Т. colubriformis получил название Black scour worm - чёрный поносный червь.
Среди всех трихостронгилов Т. colubriformis чаще всего регистрируют у людей. В Иране, например, в 1970-е годы у людей были известны 7 видов Trichostrongylus, но по встречаемости среди них доминировали Т. colubriformis и Т. orien-talis (Ghadirian, Arfaa, 1975).
Как отмечено выше, впервые этого гельминта нашли в кишечнике египтянина в 1895 г. (Looss, 1895). Первый случай в Европе был описан В. П. Подъяполь-ской (1923), обнаружившей нематод при аутопсии ребёнка в его кишечнике. До 1970-х годов паразита спорадически отмечали у людей в Японии, России, Индонезии, Индии, Пакистане, Иране, Ираке, Армении, Турции, Египте, Кении, Австралии, США, Чили (см.: Ghadirian, Arfaa, 1975; Otsuru, Ito, 1972). Как правило, поражённость людей была невысока. Например, в трёх префектурах Японии в 1955 -1962 гг. при обследовании 503 пациентов, прошедших лечение, и в результате 24 аутопсий встретилось всего 2 самца и 3 самки Т. colubriformis (Otsuru, Ito, 1972).
В последующие годы список стран, где отмечалось заражение людей Т. colubriformis, расширился: подобные случаи были зафиксированы в Бразилии (Fleury et al., 1970), Франции (Becquet et al., 1982; Lattes et al., 2011), Лаосе (Sato et al., 2011; Watthanakulpanich et al., 2013; Yong et al., 2007), Таиланде (Phosuk et al., 2013). Надо полагать, что в определённой степени это связано с совершенствованием методологических подходов к определению яиц этих гельминтов, внешне, как уже упоминалось, очень похожих на яйца анкилостоматид. В этом отношении примечательна публикация, авторы которой (Sato et al., 2011) провели копроовоскопическое обследование жителей одного из сельских регионов Лаоса. Из 46 пациентов, чьи пробы предварительно показали наличие яиц анкилостоматид (hookworm), только у одного из них был выявлен Necator americanus, у 2-х - Ancylostoma duodenale, а у 43 (93.5 %) - Т. colubriformis.
И ещё один пример из Лаоса. При обследовании 272 жителей одной из деревень почти 60 % из них оказались поражены гельминтами, из которых 36.9 % приходилось на долю Т. colubriformis (Watthanakulpanich et al., 2013).
Напомню, что продолжительность жизни Т. colubriformis в организме человека составляет, по меньшей мере, 7 лет (Sandground, 193 6). И в этой связи нельзя не обратить внимания на статью, в которой описываются результаты карантинного обследования на севере Франции мигрантов из Юго-Восточной Азии (1139 человек) и Африки (3750) (Becquet et al., 1982). За 10 лет здесь зафиксировали 71 случай заражения Т. colubriformis (у одного пациента было выявлено 27 самцов нематоды), причём, только 11 случаев пришлось на долю выходцев из Юго-Восточной Азии, остальные - на долю африканских переселенцев. Поражает география паразитоно-сителей, прибывших из Африки: Алжир, Судан, Кения, Танзания, Зимбабве, Руанда, Замбия, Тунис, Центральноафриканская республика и т.д.
Trichostrongylus longispicularis Gordon, 1933 (=Trichostrongylus lerouxi Bi-occa, Chabaud et Ghadirian, 1974). Вид впервые описан по единственному самцу, который был обнаружен у овцы в Новом Южном Уэльсе (Австралия) (Gordon, 1933). Основанием для описания нового вида послужили длина и форма спикул (рис. 107), а также асимметричное дорсальное ребро, отличавшие червя от извест
281
ных к тому времени видов Trichostrongylus. Видовое название нематоды подчёркивает присущую ей особенность - длинные спикулы: longispicularis - длинноспику-лярный.
В 1974 г. появилось описание нового вида Trichostrongylus, основанном на материале от дикого быка в Иране (Biocca et al., 1974). Вид был назван в честь Р. L. Le Roux, известного своими работами по трихостронгилидам - Т. lerouxi.
И. Янсен (Jansen, 1984) изучил все литературные данные по Т. longispicularis и Т. lerouxi и пришёл к выводу, что второй из них является синонимом первого. Кстати, к тому времени, как цитируемый автор выполнил свою работу, Т. longispicularis был обнаружен у крупного рогатого скота, а также в овцах, ламе, бизоне, свиньях в Великобритании, Италии, Дании, Бразилии, США и т.д.
Рис. 107 Trichostrongylus longispicularis, спикулы и рулёк (из: http://www.wzsfz.com/search 1 .php?cid=2147&page=2)
Описание (по: Gordon, 1933; Jansen, 1984). Длина червей 4.7 - 6.5 мм, максимальная ширина впереди бурсы 0,073 - 0.126 мм. Спикулы часто тёмно-коричневого цвета, узкие, заканчиваются тонкими серповидными образованиями; спикулы 0.165 - 0.208 и 0.160 - 0.196 мм.
В настоящее время паразит зарегистрирован по всему миру, за исключением Африки (Jansen, 1984). Заражённость животных часто достигает высоких показателей. М. Миллер (Miller, 1963), например, сообщает, что количество нематод, обнаруженных в Калифорнии в сычуге у четырёх коров, колебалось от 27500 до 96400, а в тонком кишечнике - от 5270 до 54600 экз.
Единственное сообщение о встречаемости Т. longispicularis у людей, какое удалось найти в литературе, содержится в опубликованной в 1977 г. статье, в которой этот вид описывался под названием Т. lerouxi. Паразит был выявлен в Иране у местных жителей, обследованных после антигельминтозного лечения: на севере Ирана - у 22 % пациентов, в центральном Иране - у 14% и на юго-западе страны -у 8 % (Ghadirian, 1977).
Trichostrongylus orientalis Jimbo, 1914 (рис. 108, 109). Заражение людей трихостронгилами впервые было отмечено ещё в 1889 г. (Ogata, 1889), однако тот материал и все последующие находки трихостронгилов у людей в Японии до 1914-го года относили к Т. instabilis (=Т. colubriformis) (Otsuru, Ito, 1972). Новый вид был описан также на материале от человека (Jimbo, 1914). Видовое название паразита подчёркивало его приуроченность к восточному региону: orientalis - восточный.
Полупрозрачные серого цвета нематоды. Самцы длиной 3.8 - 4.8 и шириной выше бурсы 0.072 - 0.079 мм. Спикулы желтовато-коричневого цвета, толстые в проксимальной части и тонкие, как бы обрубленные - в дистальной. На дистальном конце спикулы прямые, их кончик заострённо-закруглённый с небольшим шерохо-вато-коркообразным бородавчатым наростом. Длина спикул 0.133 - 0.140 при ширине 0.017 - 0.021 мм. По (Otsuru, Ito, 1972), длина спикул 0.119 - 0.133 мм. Самки длиной 4.7 - 6.7 и шириной на уровне вульвы 0.075 - 0.083 мм. Хвост конический. В матке насчитывается 10-20 несегментированных яиц. Яйца размерами 75 - 92 х
282
38 - 47 pm, при откладке содержат 16-32 бластомера, которые выглядят как гроздь виноградин.
Рис. 108 Trichostrongylus orientalis: 1 - спикулы и рулёк; 2 - дистальные концы спикул; 3 - область вульвы; 4 - бурса (из: Скрябин и др., 1954 - по: Калантарян, 1928)
Рис. 109 Trichostrongylus orientalis'. бурса, спикулы и рулёк (из: Otsuru, Ito, 1972).
Т. orientalis паразитирует в тонком кишечнике человека. Очень редко и в небольших количествах его отмечают у других животных, в частности кроликов, овец (Otsuru, Ito, 1972).
В Японии заражение людей встречается повсеместно и при очень высоких показателях. К примеру, в 1955 - 1962 гг. при обследовании 503 пациентов, прошедших лечение, и в результате 24 аутопсий были выявлены 21671 экз. самцов и 42764 экз. самок данного вида нематод (Otsuru, Ito, 1972).
Помимо Японии, Т. orientalis известен у Homo sapiens в южном и центральном Китае, на Тайване, в Корее, Дальнем Востоке России, Иране, Армении (Скрябин и др., 1954; Ghadirian, Arfaa, 1975; Otsuru, Ito, 1972; Rei, 1914).
Trichostrongylus probulurus (Railliet, 1898) Looss, 1905 (рис. 110). Длина тела самцов 4.3 - 5.5 при максимальной ширине (выше бурсы) 0.078 - 0.087 мм. Спикулы тёмно-коричневого цвета, относительно толстые, с двумя треугольными выступами на вентральной стороне, сильно перекрученные, 0.125 - 0.134 мм. Самки длиной 4.5 - 6.5 при ширине 0.078 - 0.090 мм. Яйца 76 - 92 х 37 - 46 цт.
Ареал Т. probulurus охватывает Северную Америку, Евразию, Африку. Среди его окончательных хозяев - овцы, козы, муфлон, суслики, зайцы, верблюды, крысы. Очень интересные результаты дало изучение фауны гельминтов четырёхполосной травяной мыши, или как ещё называют, крысы, в ЮАР (Froeschke, Matthee, 2014). Выяснилось, что её заражённость Т. probulurus зависела от условий среды обитания: у городских крыс она составила 6.7 %, у живущих среди домашнего скота - 9.9 %, у грызунов в обычных естественных условиях - 31 %, а у грызунов в собранном урожае - 40 %.
283
Случаи заражения человека известны в Египте (Looss, 1905), Армении (Калантарян, 1927), России (Скрябин, Шульц, 1928), Иране (Ghadirian, Arfaa, 1975).
Рис. ПО Trichostrongylus probulurus-. 1 - спикулы и рулёк; 2 - 3 - область вульвы; 4 - хвостовой конец самки (из: Скрябин и др., 1954 - по: Калантарян, 1928)
Trichostrongylus skrjabini Kalantarjan, 1928. Вид впервые описан из Армении; назван в честь выдающегося отечественного гельминтолога, в те годы ещё профессора, К. И. Скрябина.
Самцы длиной 4.8 - 5.3 и максимальной шириной 0.072 - 0.080 мм. Спикулы ярко-жёлтого цвета, длиной 0.111 - 0.114 и 0.122 - 0.125 мм. Самки длиной 5.5 -6.0 и максимальной шириной на уровне вульвы 0.070 - 0.080 мм. Яйца 88 - 94 х 38 - 44 цт.
Окончательные хозяева - овцы, козы, косули, муфлон, буйвол, крупный рогатый скот. Паразит известен у человека.
Trichostrongylus vitrinus Looss, 1905. Вид впервые описан на материале от человека в Египте (Looss, 1905).
Мелкие нитевидные розоватые нематоды. Самцы длиной 4.8 - 6.25 и максимальной шириной 0.080 - 0.112 мм. Спикулы маленькие, 0.160 - 0.178 мм, прямые, заострённые к дистальному концу. Самки длиной 5.2 - 7.и шириной 0.095 мм. Яйца 82 - 90 х 46 - 50 цш.
Вид - космополит. Ареал Т. vitrinus охватывает страны Африки, Америки, Евразии, Новую Зеландию.
Среди дефинитивных хозяев Т. vitrinus - овцы, козы, муфлон, альпака, лось, серна, буйволы, крупный рогатый скот. К примеру, в Терско-Сулакской низменности Дагестана Т. vitrinus выявили у 42.2 % обследованных коз (по 21 - 219 экз. в одном животном), 15 % крупного рогатого скота (9 - 246 экз.), 13.3 % овец (7 - 29) и 7.5 % буйволов (7 - 53 экз.) (Кочкарёв и др., 2010). У овец, обследованных на скотобойнях Исфагана (Иран), нематоды встретились в кишечнике (у 26.79 % животных) и сычуге (3.57 %), у коз - только в кишечнике (у 18.87 %) (Pestechian et al., 2014). Иногда этих гельминтов отмечают у свиньи, кроликов, верблюда.
Случаи заражения человека Т. vitrinus немногочисленны и описаны в Египте (Looss, 1905), Иране (Ghadirian, Arfaa, 1975), Италии (Cancrini et al., 1982), Марокко (Poirriez et al., 1984).
284
И ещё несколько слов по поводу регистрации у человека трихостронгилов. В последние годы довольно часто можно встретить сообщения об обнаружении в той или иной стране у человека не определённых до вида Trichostrongylus. Чаще всего это наблюдается в тех случаях, когда в распоряжении исследователей оказываются только результаты копроовоскопического анализа, т.е. яйца нематод. Таковы, например, находки Trichostrongylus sp./spp. у пациентов в Южной Африке (Adams et al., 2005), Египте (el-Shazly et al., 2006), Бразилии (Souza et al., 2013), Австралии (Bradbaiy et al., 2010) и т.д.
Цитируемая литература2
Калантарян Е. В. Трихостронгилёзы человека в Армении / Сб. работ по гельминтологии, поев. проф. К. И. Скрябину. - 1927. - С. 84 - 96.
Калантарян Е. В. К фауне трихостронгилид овец Армении И Тр. Гос. ин-та экспер. вет. - 1928. - 5, 2. -С. 40-57.
Кочкарёв А. Б., Атаев А. М., Зубаирова Л/. Л/., Корсаков Н. Т. Гельминты домашних жвачных в экосистемах Терско-Сулакской низменности Дагестана // Рос. паразит, журн. - 2010. - № 1. - С. 10 - 14.
Орлов И. В. Краткие сведения о гельминтофауне животных б. Тамбовской губ. // Вестник соврем, ветеринарии. - 1930. -№ 10. - С. 275 - 276 (цит. по: Скрябин и др., 1954).
Подъяпольская В. П. Обнаружение Trichostrongylus instabilis в кишечнике ребёнка И Русск. журнал тропич. мед. - 1923. - № 2. - С. 64-65.
Семёнова Н. Е. XXXI. Трихостронгилидозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: «Медицина», 1968. - С. 596 - 600. -(Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Скрябин К. И., Шихобалова Н. П., Шульц Р. С. Трихостронгилиды животных и человека // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М:: Изд-во АН СССР, 1954. - 3. - С. 41 - 90.
Скрябин К. И., Шихобалова Н. П., Шульц Р. С., Попова Т. И., Боев С. К, Делямуре С. Л. Стронгиляты И Определитель паразитических нематод / Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1952.-3.-С. 326-331.
Adams И J., Markus М. В., Adams J. F., Jordaan Е. et al. Paradoxical helminthiasis and giardiasis in Cape Town, South Africa: Epidemiology and control // Afr. Health. Sci. - 2005. - 5, 3. - P. 276 - 280.
Akkaya H. The investigations on the trichostrongylid nematodes of the hair-goats slaughtered in Istanbul in Turkey 11 Turkiye Parazitol. Derg. - 1998. - 22. - P. 77 - 87.
Becquet R., Poirriez J., De-Cas E., Dutoit E. et al. (7 authors). Contribution а Г etude de la trichostrongylose humaine (a propos de 71 observatios) // Ann. Soc. beige Med. Trop. - 1982. - 62. - P. 139 - 155.
Beveridge Pullman A.L., Martin R. R., Barelds A. Effects of temperature and relative humidity on development and survival of the free-living stages of Trichostrongylus colubriformis, T. rugatus and T. vitrinus И Vet. Parasitol. - 1989.-33, 2. - P. 143 - 153.
Biocca E, Chabaud A., Ghadirian E. Trichostrongylus lerouxi n. sp. parasite de Bos taurus II Parassitologia. - 1974.-162, 3.-P. 199-207.
Boreham R. E., McCowan M. J., Ryan A. E., Allworth A. M., Robson J. M. Human trichostrongyliasis in Queensland 11 Pathology. - 1995. - 27, 2. - P. 182 - 185.
Bradbury R. S. An imported case of trichostrongylid infection in Tasmania & a review of human trichostron-gylidiosis 11 Ann. Australas. Coll. Trop. Med. - 2006. - 7, 2. - P. 25 - 28.
Bradbury R. S., Males C. R., GoldsmidJ. M. An unusual helminth infection in a South East Asian refugee // Ann. Australian Coll. Trop. Med. - 2010. - 11, 1. -P. 16-18.
Bundy D. A., Terry S. L, Murphy С. P., Harris E. A. First record of Trichostrongylus axei infection of man in the Caribbean region П Trans. R. Soc. Trop. Med. Hyg. - 1985. - 79, 4. - P. 562 - 563.
Cancrini G., Boemi G., lori A., Corselli A. [Human infestations by Trichostrongylus axei, T capricola and T vitrinus. 1st report in Italy] П Parassitologia. - 1982. - 24, 2-3. - P. 145 - 149. (Article in Italian).
2 Примечание. Процитирована только малая часть литературных источников, в которых содержится информация о трихостронгилах, в том числе паразитирующих у человека.
285
Dixon С. E. Infection of domestic rabbits and gerbils with Trichostrongylus affinis Graybill, 19241I J. Parasitol. - 1965. - 51, 2.-P. 299.
el-ShazlyA. M, el-Nahas H. A., Soliman M., Sultan D. M., Abedl Tawab A. H., Morsy T. A. The reflection of control programs of parasitic diseases upon gastrointestinal helminthiasis in Dakahlia Governorate, Egypt // J. Egypt. Soc. Parasitol. - 2006. - 36. - P. 467 - 480.
Fleury G, C, Correa M. O., Amato-Neto A. Identification of Trichostrongylus colubriformis as a human parasite // Rev. Inst. Med. Trop. Sao Paulo. - 1970. - 12. - P. 288 - 292.
Froeschke G., Matthee S. Landscape characteristics influence helminth infestations in a peri-domestic rodent - implications for possible zoonotic disease // Parasites & Vectors. - 2014. - 7: 393. DOI: 10.1186/1756-3305-7-393.
Ghadirian E. Human infection with Trichostrongylus lerouxi (Biocca, Chabaud, and Ghadirian, 1974) in Iran // Am. J. Trop. Med. Hyg. - 1977. - 26, 6 (1). - P. 1212 - 1213.
Ghadirian E, Arfaa E Present status of trichostrongyliasis in Iran П Am. J. Trop. Med. Hyg. - 1975. - 24, 6. -P. 935-941.
Ghadirian E, Arfaa F., Sadighian A. Human infection with Trichostrongylus capricola in Iran // Am. J. Trop. Med. Hyg. - 1974. - 23, 5. - P. 1002 - 1003.
Ghasemikhah R., Mirhendi H, Kia E. B., Mowlavi Gh., Sarmadian H. et al. Morphological and morphometrical description of Trichostrongylus species isolated from domestic ruminants in Khuzestan Province, Southwest Iran H Iran. J. Parasitol. - 2011. - 6, 3. - P. 82 - 88.
Gordon H, McL. Some ovine trichostrongylids reported from Australia for the first time, with a description of Trichostrongylus longispicularis sp. nov. from a sheep // Aust. Vet. J. - 1933. - 9. - P. 34 - 37.
Graybill H. W. A new species of round worm of the genus Trichostrongylus from the rabbit // Proc. U. S. Nat. Mus. No. 2548. - 1924. - 66, 11. - P. 1 - 3.
Hunter G. W., Ritchie L. S., Kaufman E. H, Pan C, Yokogawa M. et al. (12 authors). Parasitological studies in the Far East. IV. An epidemiologic survey in Yamanashi Prefecture, Honshu, Japan //Japan. J. Med. -1951.-4.-P. 113-124.
Jansen J. Justice to Trichostrongylus longispicularis Gordon, 1933 (Nematoda: Trichostrongylidae) // Syst. Parasitol. - 1982. - 4, 2. - P. 141 - 146.
Jimbo K. Uber eine neue Art von Trichostrongylus aus dem Darme des Menschen in Japan. (Trichostrongylus orientalis n. sp.) // Annot. Zool. Japan. - 1914. - 8. - P. 459 - 465.
Kitamura M, Oishi T On eggs of Strongylus subtilis liable to be mistaken for those of hookworm, with reference to eggs of Fasciolopsis buski found in Japanese people П Tokyo Iji Shinshi. - 1913. - 1803. - P. 523 - 531 (in Japanese).
Lattes S, Ferte H, Delaunay P., Depaquit J., Vassallo M. et al. Trichostrongylus colubriformis nematode infections in humans, France // Emerg. Infect. Dis. - 2011. - 17, 7. - P. 1301 - 1302.doi: 10.3201/ eidl 707.101519.
Looss A. Strongylus subtilis n. sp., eine bisher unbekannter Parasit des Menschen in Aegypten // Zbl. Bakt. Parasitol., Orig. - 1895. - 18, 6. - P. 161 - 169.
Looss A. Notizen zur Helminthologie Aegyptien. VI. Das Genus Trichostrongylus n. g., mit zwei neuen gele-gentlichen Parasiten des Menschen 11 Zbl. Bakt. Parasitol., Orig. - 1905. - 39, 4. - P. 409 - 422.
Miller M. Г. Trichostrongylus longispicularis in cattle in California // Proc. Helm. Soc. Wash. - 1963. - 30, l.-P. 117-118.
Monnig H, O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Ogata M. A parasite // Tokyo Iji Shinshi. - 1889. - 579. - P. 855 - 856 (In Japanese) (цит. no: Otsuru, Ito, 1972).
Otsuru M. Trichostrongylus brevis sp. nov. from man (Nematoda: Trichostrongylidae) П Acta Med. Biol. (Niigata). - 1962. - 9. - P. 273 - 278.
Otsuru M., Ito J. Genus Trichostrongylus in Japan // Progress of medical Parasitology in Japan. - Eds K. Morishita, Y. Komiya, H. Matsubayashi. - 1972. - 4. - P. 421 - 463. www.kiseicu.org.E4-8-463.pdf.
Panasoponkul C., Radomy os P., Singhasivanon V. Trichostrongylus infection in a Thai boy //Southeast Asian J. Trop. Med. Public Health. - 1985. - 16. - P. 513 - 514.
Pestechian N., Kalani H, Faridnia R., Yousefi H.-A. Zoonotic gastrointestinal nematodes (Trichostrongylidae) from sheep and goat in Isfahan, Iran // Acta Sci. Vet. - 2014. - 42. - 1243. - 6 pp.
286
Phosuk I., Intapan P. M., Sanpool O., Janwan P., Thanchomnang T. et al. (8 authors). Molecular evidence of Trichostrongylus colubriformis and Trichostrongylus axei infections in humans from Thailand and Lao PDR П Am. J. Trop. Med. Hyg. - 2013. - 89, 2. - P. 376 - 379. doi: 10.4269/ajtmh. 13-0113.
Poirriez J., Dei-Cas E, Guevart E. et al. Human infestation by Trichostrongylus vitrinus in Morocco П Ann. Parasitol. Hum. Comp. - 1984. - 59. - P. 636 - 638.
Rei S. On incidence of Trichostrongylus orientalis in Korea 11 Chugai Iji Shimpo. - 1914. - 820. - P. 666 -673 (In Japanese), (цит. no: Otsuru, Ito, 1972).
Sandground J. H. On the potential longevity of various helminthes with a record of a species of Trichostrongylus in man // J. Parasitol. - 1936. - 22. - P. 464 - 470.
Sarles M. P. Production of fatal infestations in rabbits with Trichostrongylus calcaratus (Nematoda) П Am. J. Epidemiol. - 1937. - 19, 1. - P. 86 - 102.
Sato M., Yoonuan T., Sanguankiat S, Nuamtanong S, Pongvongsa T. et al. (10 authors). Short report: Human Trichostrongylus colubriformis infection in a rural village in Laos 11 Am. J. Trop. Med. Hyg. - 2011. - 84, 1. - P. 52 - 54. doi: 10.4269/ajtmh.2011.10-0385.
Schenken J. R., Moss E. S. Trichostrongylus colubriformis in the human appendix. Report of a case in Luoi-siana 11 J. Lab. Clin. Med. - 1938. - 24. - P. 15 - 17.
Souza R. P., Souza J. N., Menezes J. F., Alcantara L. M., Soares N. M., Teixeira M. C. A. Human infection by Trichostrongylus spp. in residents of urban areas of Salvador city, Bahia, Brazil 11 Biom&iica. - 2013. -33, 3. doi: http://dx.doi.org/10.7705/biomedica.v33i3.770
Thibert J. B., Guiguen C., Gangneux J. P. [Human trichostrongyloidosis: case report and microscopic difficulties to identify ankylostomidae eggs] H Ann. Biol. Clin. (Paris). - 2006. - 64, 3. - P. 281 - 285. (Article in French).
Tizzani P., Ferreira A. D., Silvestri E., Ghirardi M. et al. (9 authors). Description of the helminth parasitofau-na in an isolated population of wild rabbit (Oryctolagus cuniculus) in Alessandria, Italy // Atti XVIII Cong. Soc. Ital. Parassit., Roma, 24 - 27 Giugno 2014. - 2014. - P. 274.
Travassos L. Contribute para о conhecimento da fauna helmintologica brasileira. XIII. Ensalo monographi-co da familia Trichostrongylidae Leiper, 1912 // Mem. Inst. Oswaldo Cruz. - 1921. - 13. - P. 5 - 135.
Watthanakulpanich D., Pongvongsa T, Sanguankiat S, Nuamtanong S. et al. Prevalence and clinical aspects of human Trichostrongylus colubriformis in Lao PDR 11 Acta Tropica. - 2013. - 126, 1. - P. 37 - 42.
Yong T S, Lee J. H., Sim S., Lee J., Min D. Y. et al. Differential diagnosis of Trichostrongylus and hookworm eggs via PCR using ITS-1 sequence П Korean J. Parasitol. - 2007. - 45, 1. - P. 69 - 74.
Род Haemonchus Cobb, 1898
Описание (по: Скрябин и др., 1952, 1954; Ransom, 1911). Головной конец сравнительно широкий и тупой. Ротовая полость небольшая, с маленьким, но чётко выраженным зубом, отходящим от дорсальной стенки. Шейные сосочки крупные. Кутикула с поперечной исчерченностью и продольными линиями. Бурса с двумя крупными латеральными лопастями и маленькой асимметрично расположенной дорсальной лопастью. Вентральные рёбра слиты в проксимальной части и разделены в дистальной. Латеральные рёбра начинаются общим стволом. Наружнодорсальное ребро длинное, тонкое, отходит отдельно от дорсального. Дорсальное ребро расположено резко асимметрично, близко к левой лопасти, разделяется на две ветви, каждая из которых также разделена. Спикулы сравнительно короткие и массивные. Губернакулюм имеется. Вульва самок в задней трети тела, иногда прикрыта клапанами. Матки расходящиеся. Хвостовом конец тела самок без шипа. Паразиты жвачных, факультативно грызунов и человека. Типовой вид - Haemonchus contortus (Rudolphi, 1803) Cobb, 1898.
В составе рода более 10 видов, один из которых несколько раз был выявлен у людей. Это уже упомянутый типовой вид рода - Н. contortus.
Haemonchus contortus (Rudolphi, 1803) Cobb, 1898 (^Strongylus contortus Rudolphi, 1803; = Strongylus filicollis Rud., 1803 sensu Molin, 1861; = Strongylus placet
287
Place, 1893; = Haemonchus fuhrmanni Kamensky, 1929; = Haemonchus atectus Lebe-dew, 1929; = Haemonchuspseudocontortus Lebedew, 1929) (рис. Ill, 112). Синонимы по работам: Скрябин и др., 1952; Faust, 1949.
Рис. 111 Haemonchus contortus (из: www.farmanimalhealth.co.uk/sheep-worms)
Описание (по: Скрябин и др., 1954; Faust, 1949). С характерными чертами рода. Самцы длиной 18 - 22 и максимальной шириной вблизи основания бурсы 0.35 - 0.42 мм. Боковые лопасти бурсы кзади глубоко прорезаны, длинные, средней длиной 1.125 и шириной 0.535 мм. Асимметричная задняя лопасть имеет общее основание с левой латеральной лопастью. Вентральные рёбра кпереди несколько изогнуты и достигают края бурсы. Самые толстые из всех рёбер - постеровентральное и антеролатеральное, а их концы широко отставлены друг от друга. Спикулы коричневого цвета, длиной 0.488 - 0.544 и наибольшей шириной вблизи проксимального конца 0.04 - 0.05 мм; заканчиваются характерным вздутием. Рулёк светло-коричневый, челнокообразный, 0.250 - 0.312 мм. Самки длиной 25 — 34 и максимальной шириной 0.59 - 0.74 мм. Яичники парные, спирально извитые (отсюда видовое название нематоды: contortus - скрученный, закрученный). Вульва может быть снабжена мощным клапаном. Яйца с тонкой оболочкой, размерами 80 - 85 х 40 - 45 pm.
Рис. 112 Haemonchus contortus-. 1 - спикулы и рулёк; 2 - передний конец тела, вид сбоку; 3 - область вульвы; 4 - хвостовой конец самки (из: Скрябин и др., 1952 - по: Скрябин, Шульц, 1931)
Жизненный цикл Н contortus типичен для трихостронгилидных нематод (Скрябин и др., 1954; Monnig, 1934; Ransom, 1911). Яйца, отложенные самкой в просвет желудка животного-хозяина (от 5000 до 15000 ежесуточно), попадают с его фекалиями во внешнюю среду. В момент откладки яйца содержат 4 бластомера, но при выходе из организма хозяина - уже 12 - 16. Во внешней среде в яйцах, нахо-288
дящихся в фекальных массах, при благоприятной температуре через 10 ч формируется личинка, имеющая в длину около 0.28 мм. Через 14 - 17 ч личинка покидает яйцо, а её длина при этом увеличивается до 0.34 - 0.35 мм. Сроки созревания яиц зависят от температуры и могут растягиваться на дни и даже недели (Ransom, 1911). Высушивание и замораживание губительно действуют и на яйца, и на только что вылупившихся личинок. Пребывая во внешней среде, личинки проходят ещё две линьки и примерно через 3-4 суток превращаются в инвазионную филяриевидную личинку 3-й стадии, чья длина достигает 0.57 - 0.82 мм. Эти личинки обладают уникальной способностью активно передвигаться по влажной почве, забираться вертикально на растительность, и тем самым обеспечивать себе попадание в окончательного хозяина, который вместе с кормом заглатывает и паразитов. Инвазионные личинки очень устойчивы к высушиванию и холоду. В организме дефинитивного хозяина полное созревание паразита происходит в течение 16-18 дней, а на 17 - 21-й день в фекалиях инвазированного животного появляются первые яйца нематоды.
Н. contortus - обычный паразит овец, коз, домашнего крупного рогатого скота, зубробизона, различных видов оленей, у которых поселяется в сычуге (четвёртом желудке). У лошадей, свиней и кроликов данный вид не встречается (Ransom, 1911). Эту нематоду рассматривают одним из наиболее важных паразитов мелких жвачных (овец и коз) (Peter, Chandrawathani, 2005), наносящих животноводству серьёзный урон (Jennings, 1976). Прикрепляясь головным концом к слизистой оболочке сычуга, личинки 4 стадии и взрослые особи рассекают выступающим в их ротовую полость ланцетовидным зубом кровеносные сосуды и высасывают кровь хозяина. Подобный способ питания червей вызывает у животного анемию, отёки, обезвоживание, сонливость, потерю веса, а выделяемые паразитами гемолитические энзимы приводят к кишечным расстройствам, причиняя существенный вред здоровью животного (Ransom, 1911). При сильной инвазии возможен летальный исход, особенно у молодых животных (Tembely et al., 1997). В англоязычной справочной литературе иногда нематоду называют: twisted stomach worms - скрученные желудочные черви.
Н. contortus - космополит. Его находят практически повсеместно: паразит хорошо адаптировался к условиям и тропического климата и холодных горных регионов (Domy et al., 1996; Peter, Chandrawathani, 2005).
Известно всего несколько случаев заражения человека этим гельминтом. Эрнст Фауст (Faust, 1949) в монографии «Гельминтология человека» приводит информацию (не указывая её источник) о некоем De Magelhaes, который нашёл Н. contortus у человека в Бразилии, и о работавшем в Австралии W. S. Sweet, обнаружившим там яйца нематоды в фекалиях трёх аборигенов.
Упомянутый De Magelhaes опубликовал в 1908 г. сообщение о находке взрослых особей Н. contortus у местного жителя с самого юга Бразилии (см.: Hildreth, Harmon, 2013). Материал был передан ему Dr. Von Basseviz, который выявил нематод у пациента с симптомами заражения анкилостоматидами (hookworm), проходившего лечение тимолом. Кстати, после лечения все симптомы инвазии у пациента исчезли.
Второй автор, о котором пишет Э. Фауст, W. S. Sweet, обнаружил яйца Н. contortus в фекалиях аборигенов в западной Австралии. Пробы фекалий были взяты
289
с земли, где, к слову, вполне могли оказаться и фекалии коз, обычных в хозяйствах австралийских аборигенов. По этой причине достоверность данной информации у некоторых исследователей вызывает сомнение (см.: Hildreth, Harmon, 2013).
Тем не менее, возможность встречаемости Н. contortus у местных жителей в Австралии подтверждают результаты эксперимента по успешному заражению козлёнка личинками 3-й стадии, выращенными из яиц, собранных от одной семьи на севере страны. От подопытного животного были получены взрослые особи Н. contortus (Heydon, Green, 1931).
В 1973 г. появилось сообщение о регистрации Н. contortus у 60-летней женщины, живущей в сельской местности в районе Исфагана в Иране (Ghaderian, Arfaa, 1973). В фекальных массах пациентки после её лечения Bephenium hydroxynaphthoate обнаружились один самец и две самки Н. contortus.
Эти же данные приведены в аннотированном списке паразитов Homo sapiens. опубликованном в 2003 г. (Ashford, Crewe, 2003), и в других более поздних обзорных работах (Hildreth, Нагтоп, 2013).
Информация о возможном патогенном воздействии Н. contortus на организм человека отсутствует. Тем не менее, известно, что паразит использует несколько механизмов, направленных против нормальной кровоостанавливающей функции тромбоцитов, и подавляет агрегацию и адгезию тромбоцитов человека (Crab et al., 2002).
Заражение человека Н. contortus происходит при заглатывании инвазионных личинок 3-й стадии развития (Gillani et al., 2012), которые оказались на свежей зелени и овощах, выращенных на полях, удобряемых необеззараженными нечистотами, или же с питьевой водой, в которую могли попасть эти личинки.
Цитируемая литература
Скрябин К. И., Шихобалова Н. П., Шульц Р. С. Трихостронгилиды животных и человека // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954. - 3. - С. 400-421.
Скрябин К. И., Шихобалова Н. П., Шульц Р. С., Попова Т. И., Боев С. К., Деляму ре С. Л. Стронги ляты И Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1952.-3.-С. 431 -438.
Ashford R. W., Crewe И< The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
Crab A., Noppe W., Pelicaen C, Van Hoorelbeke K., Deckmyn H. The parasitic hematophagous worm Haemonchus contortus inhibits human platelet aggregation and adhesion: partial purification of a platelet inhibitor // Thromb. Haemost. - 2002. - 87, 5. - P. 899 - 904.
Dorny P., Batubara A., Iskander M., Pandey V. Helminth infections of sheep in North Sumatra, Indonesia 11 Vet Parasitol. - 1996. - 61. - P. 353 - 358.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Ghaderian E, Arfaa F. First report of human infection with Haemonchus contortus, Ostertagia ostertagi, and Marshallagia marshalli (family Trichostrongylidae) in Iran H J. Parasitol. - 1973. - 59, 6. - P. 1144 - 1145.
Gillani S. IV., Sari Y. O., Baig A. A., Baig M. Helminthiais; Clinical insights. - Syed Wasif Gillani, 2012. -111 pp. (https://books.google.com/books?isbn=l 105494594).
Heydon G. M., Green A. K. Some worm infestation of man in Australia // Med. J. Austr. - 1931. - 1. - P. 619 -623.
Hildreth M. B., Harmon A. Chapter 55. Haemonchus / Molecular detection of human parasitic pathogens. -Ed. D. Liu. - CRC Press, 2013. - C. 571 - 582.
Jennings F. IV. The anaemas of parasitic infections / Pathophysiology of parasitic infections. - E. J. L. Souls-by, ed. - New York: Acad. Press, 1976. - P. 41 - 67.
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
290
Peter J. W., Chandrawathani P. Haemonchus contortus'. parasite problem No. 1 from tropics - Polar Circle. Problems and prospects for control based on epidemiology // Trop. Biomed. - 2005. - 22, 2. - P. 131 - 137.
Ransom В. H. The nematodes parasitic in the alimentary tract of cattle, sheep, and other ruminants 11 U. S. Bus. Anim. Industry. - 1911. - Bull. 127. - 132 pp.
Tembely S., Lahlou-Kassi A., Rege J. E., Sovani S., Diedhiou M. L., Baker R. L. The epidemiology of nematode infections in sheep in a cool tropical environment П Vet. Parasitol. - 1997. - 70. - P. 129-141.
Род Marshallagia Orloff, 1933
Описание (по: Скрябин и др., 1954). Кутикула с поперечной исчерченностью и продольными гребнями. Шейные сосочки сильно развитые, направлены назад. Ротовая капсула маленькая. Бурса самцов широкая, дополнительная дорсальная мембрана снабжена двумя тонкими рёбрами. Сосочки перед бурсой имеются. Вентральные рёбра различной толщины, слегка расходятся и достигают края бурсы. Антеродорсальное ребро тонкое, длинное; начинается у основания дорсального и почти достигает края бурсы. Дорсальное ребро очень длинное и тонкое, в дистальной части разделяется на две ветви с тройными кончиками. Спикулы мощные, с 3 отростками на дистальном конце. Рулёк отсутствует. Хвост самок конический, острый, без шипа. Вульва в задней половине тела, прикрыта маленьким клапаном. Амфидельные. Яйца относительно очень крупные. Паразиты пищеварительного тракта жвачных. Типовой вид - Marshallagia marshalli (Ransom, 1907) Orloff, 1933.
Единственный вид Marshallagia, когда-либо выявленный у человека, это -уже упомянутый типовой вид рода.
Marshallagia marshalli (Ransom, 1907) Orloff, 1933 (рис. 119). Впервые паразит описан под названием Ostertagia marshalli Ransom, 1907.
Рис. 119 Marshallagia marshalli'. 1,2-область вульвы; 3, 4 - спикулы; 5 -бурса; 6 - хвостовой конец самки (из: Скрябин и др., 1954 - по разным авторам)
Кутикула продольно исчерчена 30 - 35 линиями, поперечная исчерченность отсутствует. Самцы длиной 10-13 мм. Бурса как бы гофрирована: от её каждой стороны отходят парные рукава: наружный, ярко-жёлтого цвета, с 5 рёбрами, и внутренний - бесцветный, с одним наружнодорсальным ребром. Наружный рукав разделяется на три ветви, каждая из которых имеет соответствующие рёбра. Спикулы 0.24 -0.28 мм. Самки длиной 12-20 мм. Яйца 160 - 200 х 75 - 100 pm.
М. marshalli паразитирует у широкого круга хозяев: от овец -
291
в Египте, Саудовской Аравии и Калмыцкой степи до сайгака - в Казахстане и коз -в Дагестане, от толсторога - в США до северного оленя - в Арктике и пятнистого оленя в Мордовии. Среди хозяев паразита также косуля, муфлон, олень-карибу, мазам и другие жвачные, и даже верблюд.
Единственный случай обнаружения М. marshalli у человека описан в Иране (Ghaderian, Arfaa, 1973). Нематода локализовалась в слизистой кишечника.
Цитируемая литература
Скрябин К. И., Шихобалова Н. П., Шульц Р. С. Трихостронгилиды животных и человека // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954. - 3. - С. 184 - 194.
Ghaderian Е., Arfaa F. First report of human infection with Haemonchus contortus, Ostertagia ostertagi, and Marshallagia marshalli (family Trichostrongylidae) in Iran 11 J. Parasitol. - 1973. - 59, 6. - P. 1144 — 1145.
Род Mecistocirrus Railliet et Henry, 1912
Описание (по: Скрябин и др., 1954; Monnig, 1934). Тело утончающееся к переднему концу. Кутикула с тонкой поперечной исчерченностью и 30 продольными линиями. На голове 6 маленьких сосочков. Шейные сосочки имеются. Рот открывается слегка дорсально. Ротовая капсула с крупным зубом, подобным таковому у Haemonchus. Бурса самцов состоит из двух крупных латеральных и маленькой дорсальной лопастей. Антеро- и постеровентральные рёбра разделены, первое из них меньше и тоньше второго. Медио- и постеролатеральные рёбра маленькие, сложены вместе. Дорсальное ребро короткое, раздваивается на ветви, каждая из которых заканчивается 3 веточками; от него отходит очень тонкое наружнодорсальное ребро. Спикулы очень длинные, тонкие, достигают трети длины паразита. Губернакулюм отсутствует. Пребурсальные сосочки имеются. Вульва самок близ ануса. Хвостовой конец самок конический. Паразиты жвачных. Типовой вид - Mecistocirrus digitatus (von Linstow, 1906) Railliet et Henry, 1912.
M. digitatus упоминается практически во всех публикациях, в той или иной степени затрагивающих проблему заражения людей нематодами.
Mecistocirrus digitatus (von Linstow, 1906) Railliet et Henry, 1912 (рис. 113). Попробуем перевести на русский язык латинское название вида: digitatus - пальцевый, пальцевидный, величиной с палец. Скорее всего, это определение можно отнести к рёбрам бурсы, имеющим очень характерное расположение и форму (см. рис. 113, 4 и 114).
Для описания вида см. характеристику рода. Самцы длиной до 31 и шириной 0.50 - 0.55 мм. Спикулы соединены вместе почти на всём протяжении, длиной 3.8 - 7 (Monnig, 1934) или 3.1 - 4.46 мм (Скрябин и др., 1954). Самки длиной 37 -45 и шириной 0.7 - 1.0 мм. Яйца 95 - 120 х 56 - 60 (M6nnig, 1934), 108 - 129 х 51 -63 (Скрябин и др., 1954) или 112 - 134 х 56 - 67 щп (Демшин и др., 1970).
М. digitatus обычно поражает коров, быков, буйволов, овец, зебу, буффало, у которых локализуется в сычуге. Встречается и у свиньи, но у неё паразит поселяется в желудке (M6nnig, 1934). Будучи гематофагами, нематоды травмируют слизистую оболочку сычуга, рассекая ланцетом кровеносные сосуды, и вызывают воспалительные процессы, которые в итоге приводят к истощению и задержке роста животных, а при высокой заражённости - даже к их гибели.
292
Рис. 114 Mecistocirrus digitatus: хвостовой конец самца, дорсально (из: MOnnig, 1934) ------------------►
Рис. 113 Mecistocirrus digitatus'. 1 - головной конец; 2, 3 - спикулы, вентрально и латерально; 4 - хвостовой конец самца; 5 - хвостовой конец самки (из: Скрябин и др., 1954 -по: Тощев, 1929)
Г. Мённиг (Monnig, 1934) в монографии, посвящённой ветеринарной гельминтологии и энтомологии, на стр. 219 пишет: «М. digitatus <...> occurs <...> rarely man in eastern countries and in Central America», т.е. встречается редко у человека в восточных странах и Центральной Америке (источник этой информации в тексте отсутствует). Однако авторы обзорной работы по паразитам человека (Ashford, Crewe, 2003), включая данный вид в перечень регистрируемых у Homo sapiens, подчёркивают, что источник, утверждающий, что вид («гаге [in humans]») редко встречается у человека в восточных странах и Центральной Америке, неясен. Ещё раньше, в 1949 г., Э. Фауст (Faust, 1949) писал, что сообщение об обнаружении яиц этой нематоды в фекалиях человека в Гонконге выглядит сомнительным, т.к., вероятнее всего, этот материал был не от человека (« there is considerable probability that the material in question was not human in origin») (стр. 452). Кстати, в монографии Э. Фауста также не приводится ссылка на источник этих сведений.
Тем не менее, К. И. Скрябин с соавт. (1954) указывали М. digitatus как факультативного паразита человека. В информационной сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru) данный вид также включён в перечень нематод, зарегистрированных у человека.
Авторы ещё одной обзорной работы считают заражение человека этим гельминтом очень необычным (Gillani et al., 2012).
Таким образом, так и осталось неясным: кто же в действительности впервые обнаружил заражение человека М digitatus и действительно ли то был М digitatus.
293
Цитируемая литература
Демшин Н. И., Пиголкин А. У., Теплое Н. В. К биологии нематоды Mecistocirrus digitatus (Linstow, 1906) - паразита сычуга крупного рогатого скота И Паразитология. - 1970. -4, 1. - С. 48 - 52.
Скрябин К. И., Шихобалова Н. П., Шульц Р. С. Трихостронгилиды животных и человека // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954. - 3. - С. 535 - 540.
Тощее А. П. К познанию гельминтофауны крупного рогатого скота Дальнего Востока И Тр. Дальневост. ин-та экспер. вет. - 1930. - Вып. 6. - С. 122 - 128. (цит. по: Скрябин и др., 1954).
Ashford R. W., Crewe ИС The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Gillani S. W., Sari Y. O., Baig A. A., Baig M. Helminthiais; Clinical insights. - Syed Wasif Gillani, 2012. -111 pp. (https://books.google.com/books?isbn=l 105494594).
Mdnnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - P. 219.
Род Nematodirus Ransom, 1907
Описание (по: Скрябин и др., 1954). Нитевидные нематоды. Вдоль тела тянутся продольные гребневидные линии. Рот окружён 6 сосочками. Дорсальная стенка ротовой полости с ланцетовидным зубом. Бурса самцов состоит из двух крупных латеральных и маленькой дорсальной лопастей. Дорсальные рёбра двойные, заканчиваются двумя - тремя пальцевидными ветвями. Спикулы длинные, нитевидные. Губернакулюм отсутствует. Пребурсальные сосочки обычно отсутствуют. Вульва самок в задней трети или четверти тела. Хвостовой конец самок конический, с тонким шипом. Яйцекладущие. Типовой вид - Nematodirus filicollis (Rudolphi, 1802) Ransom, 1907.
Паразиты диких и домашних жвачных. Гематофаги. Широко распространены по планете.
В монографической работе (Muller, 2002) и информационной сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru), а также в некоторых других аналогичных источниках среди регистрируемых у человека трихостронгилид упоминается один вид рода Nematodirus - N abnormalis May, 1920. Однако найти хотя бы одну публикацию, в которой описывался бы подобный случай, не удалось.
В связи с этим позволю себе привести цитату из обзорной работы (Ashford, Crewe, 2003) по паразитам Homo sapiens, в которой относительно данного вида написано следующее (дословно):
«Status. The original record of this species as a human parasite was recording to informed sources, unreliably identified».
Учитывая ненадёжность определения N. abnormalis в качестве паразита человека, его описание мною не приводится.
Цитируемая литература
Скрябин К. И., Шихобалова Н. П., Шульц Р. С. Трихостронгилиды животных и человека И Основы нематодологии. - Под ред. акад. К. И. Скрябина. -М.: Изд-во АН СССР, 1954.-3. - С. 474 - 514.
Ashford R. W„ Crewe И< The parasites of Homo sapiens: An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 139.
294
Род Ostertagia Ransom, 1907
Описание (по: Скрябин и др., 1954; Faust, 1949). Тело с продольными рядами кутикулярных гребней. Ротовая полость небольшая. Шейные сосочки имеются. Бурса самцов состоит из двух латеральных и небольшой дорсальной лопастей. Вершины вентральных рёбер обычно сближены. Дорсальное ребро бифурцирует на дистальном конце, каждая ветвь обычно также расздвоена. Наружнодорсальные рёбра отходят от основания дорсального. Внутри бурсы обычно имеется бурсальная мембрана со свободным дистальным краем, поддерживаемая двумя тонкими рёбрами. Вентрально от клоаки имеется преанальная мембрана. Спикулы короткие, равные, заканчиваются 1 - 3 верхушками. Рулёк имеется. Пребурсальные сосочки хорошо развиты. Вульва в задней части тела. Типовой вид - Ostertagia ostertagi (Stiles, 1892) Ransom, 1907.
В настоящее время род включает около 15 видов, однако таксономическая самостоятельность некоторых из них вызывает определённые сомнения.
Впервые о заражении человека Ostertagia стало известно в далёкие 1940-е годы. В Азербайджане при аутопсии человека был обнаружен один самец О. ostertagi, а в другом случае - О. circumcincta (в настоящее время этот вид входит в состав рода Teladorsagia) (Касимов, 1941, 1943, 1945). Комментируя находки, автор публикаций подчёркивал, что эти случаи, скорее всего, были эпизодическими и случайными, связанными, видимо, с употреблением в пищу недостаточно приготовленного сычуга коровы, овцы или козы, содержащего узелки с паразитами.
В 1973-м году была опубликована работа, в которой описано заражение человека в Иране тремя видами трихостронгилид, в том числе Ostertagia ostertagi (Ghadirian, Arfaa, 1973).
Ostertagia ostertagi (Stiles, 1892) Ransom, 1907 (рис. 115). Род и вид названы в честь Robert Ostertag.
Рис. 115 Ostertagia ostertagi: 1 -спикула; 2 - хвостовой конец самца; 3 - область вульвы (из: Скрябин и др., 1954 - по: 1 - Ransom, 1911; 2,3 - Travassos, 1921)
Самцы длиной 5.4 - 7.5 при максимальной ширине выше бурсы 0.115 - 0.130 мм. Бурса маленькая. Спикулы длиной 0.22 - 0.23 мм; в задней половине каждой спикулы с её внутренней стороны имеется по 2 тонких зубчатых отростка. Самки длиной 8.3 - 9.2 и шириной 0.12 - 0.16 мм. Вульва прикрыта клапаном. Яйца размерами 65 -80 х 30 - 40 pm. Зрелая самка откладывает в сутки 100 - 200
295
яиц. Только что выделенные яйца содержат 6-8 бластомеров.
О. ostertagi - широко распространённый паразит крупного рогатого скота, а также овец, коз и других домашних и диких жвачных. При высокой заражённости молодых животных может стать причиной их гибели. Обычно встречается вместе с другими представителями трихостронгилид.
В англоязычной литературе можно встретить разные названия этой нематоды: Osties или Osters - сокращённо от Ostertagia, или же medium stomach worm, brown stomach worm - средний или коричневый желудочный червь.
Цитируемая литература
Касимов Г. Б. Первый случай обнаружения остертагиоза человека // Мед паразитология и параз. болезни. - 1941. - 10. - С. 121 - 123.
Касимов Г Б, Первый случай обнаружения в человеке в Азербайджане Ostertagia ostertagi (Stiles, 1892) И Мед паразитология и параз. болезни. - 1943. - 12, 5. - С. 81.
Касимов Г. Б. К материалам остертагиоза у человека в Азербайджане И Докл. АН Азерб. ССР. - 1945. -1,2.-С. 87-90.
Скрябин К. И., Шихобалова Н. П., Шульц Р. С. Трихостронгилиды животных и человека И Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954. - 3. - С. 115 -180.
Faust Е. С. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 449.
Ghaderian E., Arfaa F. First report of human infection with Haemonchus contortus, Ostertagia ostertagi, and Marshallagia marshalli (family Trichostrongylidae) in Iran // J. Parasitol. - 1973. - 59, 6. - P. 1144 — 1145.
Ransom В. H. The nematodes parasitic in the alimentary tract of cattle, sheep, and other ruminants H U. S. Bus. Anim. Industry. - 1911. - Bull. 127. - 132 pp.
Travassos L. Contribute para о conhecimento da fauna helmintologica brasileira. Xiii. Ensalo monographi-co da familia Trichostrongylidae Leiper, 1912 // Mem. Inst. Oswaldo Cruz. - 1921. - 13. - P. 5 - 135.
Род Teladorsagia Andreeva et Satubaldin, 1954
Описание (по: Скрябин и др., 1954). Бурса из трёх лопастей. Дорсальное ребро относительно короткое, бифурцирует в дорсальной трети. Половой конус в вентральной части обладает довольно мощным опорным аппаратом. Типичная дорсальная мембрана полового конуса с поддерживающими её дорсальными рёбрышками отсутствует, а вместо них имеются сидячие сосочки. Спикулы с двумя короткими отростками, поддерживающими их крылья. Рулёк имеется.
Обосновывая новый род, его авторы в качестве типового вида указали Teladorsagia davtiani Andreeva et Satubaldin, 19543. Однако в настоящее время этот вид рассматривают синонимом Teladorsagia trifurcata (Ransom, 1907) Drozdz, 1965 (Drozdz, 1965). В этот же род была переведена Ostertagia circumcincta (Stadelmann, 1894) Ransom, 1907, которую, как отмечено выше, обнаружили вместе с Ostertagia ostertagi у человека в Азербайджане (Касимов, 1941,1943, 1945 - см. Ostertagia).
Teladorsagia circumcincta (Stadelmann, 1894) Drozdz, 1965 [^Strongylus cir-cumcinctus Stadelmann, 1894; =Strongylus vicarius Stadelmann, 1893; =Strongylus cervi-cornis McFadyean, 1897; ^Strongylus instabilis Julien, 1897; Ostertagia circumcincta (Stadelmann, 1894) Ransom, 1907; = Ostertagia turkestanica Petrov et Shakhovtseva, 1926; = Stadelmann circumcincta (Stadelmann, 1894) Sarwar, 1956; = Ostertagiella cir-
3 В статье А. П. Аксёнова с соавт. (2011) читаем: Teladorsagia davtiani Grigorian, 1954. В действительности под таким видовым названием был описан представитель другого рода -Ostertagia davtiani Grigorian, 1951.
296
cumcincta (Stadelmann, 1894) Andreeva, 1957] (рис. 116). Синонимы приведены по
работе: Lichtenfels et al., 1988.
Некрупные черви. Кутикула нематод с 16 - 18 продольными бороздами. Самцы в длину 9.8 - 11 (Скрябин и др., 1954) или 5.4 - 11.4 (8.13) мм (Lichtenfels, Pillit, 1991). Спикулы 0.40 -0.42 (Скрябин и др., 1954) или 0.242 - 0.408 (0.317) мм (Lichtenfels, Pillit, 1991). По данным цитируемых авторов, длина самок 12.5-13.5 и 9.1-12.4 (10.7) мм, размеры яиц 89 - 93 х 46 - 50 и 84- 101 x40-56 (91 x49) цт.
Рис. 116 Teladorsagia circumcinctcr. /, 2 - бурса самца; 3 - половой конус; 4 - область вульвы; 5 - спикулы; 6 - рулёк (из: Скрябин и др., 1954 - по: Скрябин, Шульц, 1937, как Ostertagia circumcincta')
Т circumcincta - широко
распространённый паразит домашних и диких жвачных животных, прежде всего, овец и коз. Обычно нематоды локализуются в сычуге, иногда в тонкой кишке. Интенсивность инвазии может достигать нескольких тысяч экземпляров (Асадов, 1960). Инвазированные животные плохо едят, у них наблюдаются сонливость, сильная продолжительная диарея, исхудание. Высокая заражённость молодых животных может оказаться фатальной для них.
Цитируемая литература
Аксёнов А. П., Кузнецов Д. Н., Решетников А. Д. О видовом составе нематод сычуга и тонкого кишечника северных оленей И Рос. паразитол. журн. - 2011. - № 1. - С. 6 - 10.
Асадов С. Л/. Гельминтофауна жвачных животных СССР и её эколого-географический анализ. - Баку: Изд-во АН АзССР, 1960. - 511 с.
Скрябин К. И., Шихобалова Н. П., Шульц Р. С. Трихостронгилиды животных и человека // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954. - 3. - С. 241 -246.
Скрябин К. И,, Шульц Р. С. Гельминтозы крупного рогатого скота и его молодняка. - М.: Сельхозгиз, 1937.-723 с.
Drdzdz J. Studies on helminths and helminthiases in Cervidae. I. Revision of the subfamily Ostertagiinae Sarwas, 1956 and an attempt to explain the phylogenesis of its representatives // Acta Parasitol. Polonica. -1965.-13, 44.-P. 445-481.
Lichtenfels J. R.t Pillit P. A. A rcdcscription of Ostertagia bisonis (Nematoda: Trichostrongyloidea) and key to species of Ostertagiinae with a tapering lateral synlophe from domestic ruminants in North America // Proc. Hclminthol. Soc. Wash. - 1991. -58, 2. - P. 231 -244.
Lichtenfels J. R., Pillit P. A., Lancaster M. B. Cuticular ridge patterns of seven species of Ostertagiinae (Nematoda) parasitic in domestic ruminants // Proc. Helminthol. Soc. Wash. - 1988. - 55, 1. - P. 77 - 86.
297
Итак, несколько заключительных слов по данному разделу.
К настоящему времени у человека достоверно зарегистрировано паразитирование 17 видов из 7 родов семейства Trichostrongylidae. И из них относятся к роду Trichostrongylus, все остальные роды представлены одним видом каждый.
Какой-либо закономерности в заражении людей трихостронгилидами не наблюдается: как правило, оно носит спорадический, случайный характер и связано с попаданием инвазионных личинок нематод к человеку с растительной пищей или питьевой водой, или же с грязными руками, на которых могли оказаться эти личинки. Известно, что личинки трихостронгилид отличаются высокой мобильностью и способны передвигаться по влажной почве, заползая на растительность, где и «дожидаются» того момента, когда эти растения будут съедены дефинитивным хозяином. Употребление в пищу немытой сырой зелени, овощей, ягод, выращенных на полях или огородах, где для удобрения используют неочищенные фекальные массы, открывает прямой путь для попадания личинок к человеку. Аналогичную опасность таит в себе и питьё неочищенной сырой воды из водоёмов близ пастбищ, поскольку личинки трихостронгилид могут выживать в воде до 3 месяцев.
Следовательно,’ наиболее радикальным средством борьбы с заражением, а точнее, его предупреждения, является соблюдение элементарных санитарно-гигиенических правил, которые совсем нетрудно усвоить. Прежде всего, необходимо тщательно промывать проточной водой овощи, ягоды и зелень, выращенные на полях и огородах, удобряемых нечистотами. Воду из источников, расположенных близ водопоя животных, перед употреблением следует профильтровать (прокипятить). Лучше отказаться от пагубной привычки брать в рот, покусывать травинки, сорванные на пастбищах. И, наконец, всеобщее правило «обязательно мыть руки после работы на земле и ухода за животными» ещё никто не отменял.
Учитывая, что основным источником инвазии трихостронгилидами являются, помимо диких, домашние жвачные, и, принимая во внимание патогенность многих из этих нематод для разводимых животных, самое серьёзное внимание следует уделять выявлению данных паразитов, лечению животных и профилактике их возможного заражения. В равной степени следует обеззараживать нечистоты для предупреждения возможного распространения яиц и личинок нематод.
И последнее. Несмотря на столь редкую встречаемость трихостронгилид у человека, подобные случаи нельзя оставлять без внимания. И не только по причине вообще нежелательного присутствия паразитов у человека, но и потому, что, как установлено, и Ostertagia, и Haemonchus, и Trichostrongylus, а возможно, и другие представители данного семейства, являются переносчиками патогенных микобактерий (Pavlik, Falkinham, 2009). Известно, что отдельные представители этих бактерий патогенны для млекопитающих, вызывая серьёзные болезни, в том числе и у человека.
Цитируемая литература
Pavlik L, Falkinham J. О. Ill (Eds). The occurrence of pathogenic and potentially pathogenic Mycobacteria in animals and the role of the environment in the spread of infection. - P. 199 - 282. / Ed. Kazda J., Pavlik I., Falkinham J. O. Ill, Hruska K. The ecology of Mycobacteria: [Impact on animal’s and human’s health. -- Springer Sci+ Dus. Media В. V., 2009. - 520 pp.
298
Глава 3
НЕ С ХЛЕБОМ ЕДИНЫМ...
Предыдущая глава содержит описание нематод, чьё попадание к человеку связано с его питанием и сопровождается развитием болезнетворного процесса той или иной степени тяжести, а сами заболевания получили название нематодозов пищевого происхождения. При этом некоторые из подобных видов, как мы видели, попадают к человеку не только с обычной пищей, но и с питьевой водой, а отдельные виды -ещё и через грязные руки, контаминированные яйцами (личинками) паразита.
К сожалению, перечисленными выше видами далеко не исчерпывается перечень тех нематод, которые могут быть обнаружены у людей. Среди них есть виды, чьи личинки попадают к человеку только через питьевую воду, в которой случайно могут оказаться промежуточные хозяева паразита - мелкие рачки циклопы. Имеется целая группа нематод, чьи личинки активно проникают в человека через кожу открытых участков его тела или же через кровососущих насекомых. Отдельную группу составляют нематоды, заражение которыми является следствием несоблюдения элементарных правил личной гигиены. И, наконец, иногда у человека отмечают нематод, чьё попадание к нему представляет собой самую настоящую загадку для учёных.
Справедливости ради следует сказать, что во многих случаях информация о заражении людей подобными видами носит.в полном смысле этого слова единичный характер. Тем не менее, среди нематод, чьё попадание к человеку никак не связано с пищей, имеются отдельные виды, являющиеся его обычными паразитами, а заражение ими зачастую несёт серьёзную угрозу его здоровью.
Коротко охарактеризуем данную группу нематод, для удобства восприятия расположив семейства в алфавитном порядке.
Семейство Acuariidae Railliet, Henry et Sissoff, 1912
Описание (по разным авторам). Небольшие нематоды, обладающие двумя отчётливыми латеральными губами. Передняя часть тела с типичными кутикулярными канатиками, начинающимися по бокам губ. На головном конце тела позади губ имеется своеобразное хитиновое кольцо. Ротовое отверстие ведет в фаринкс, как правило, с поперечно-исчерченными стенками, за которым следует пищевод, состоящий из мышечной и железистой частей. Самцы снабжены хвостовыми крыльями, поддерживаемыми 4 парами преанальных и различным количеством постанальных сосочков. Спикулы различаются по длине и форме. Взрослые формы - паразиты птиц, в основном связанных с водной средой, редко млекопитающих. Типовой род - Acuaria Bremser, 1811.
К. И. Скрябин с соавт. (1965) объединили в составе семейства 16 родов с 179 видами. В настоящее время Acuariidae относят к отряду Spirurida и включают в него 39 родов с 299 видами (Hodda, 2011 - см. источник на стр. 14).
Жизненный цикл акуариид включает смену промежуточного (ракообразные, насекомые) и окончательного хозяев; у видов, заканчивающих развитие в око-
299
ловодных птицах, в жизненном цикле могут участвовать паратенические хозяева (рыбы, лягушки) (Anderson, 2000).
Единственное сообщение о находке акуариид у человека датируется 1936-м годом (Africa, Garcia, 1936). Речь идёт о нематоде, обнаруженной на Филиппинах у фермера, страдавшего от хронического катарального конъюнктивита и кератита. По словам пациента, за 7 месяцев до обращения к врачу он однажды проснулся ночью от умеренной боли и зуда в области края века правого глаза. Ему удалось удалить из глаза какое-то тёмное вещество, но в течение недели тот оставался опухшим и болезненным, а затем стал как будто нормальным, хотя иногда и возникало ощущение зуда в нижнем веке. Спустя 4.5 месяца веко неожиданно начало опухать, а в правом нижнем конъюнктивальном мешке появилось ощущение зуда и жгучей боли, которые сопровождались слезотечением, светобоязнью и ухудшением зрения.
В клинике, куда пострадавший обратился за медицинской помощью, в опухоли на нижней глазной конъюнктиве, примерно в 1 см от внешнего угла глазной щели правого глаза, обнаружились два беловатых, нитевидных фрагмента тела нематоды, каждый из которых имел в длину около 5 мм и толщину около 0.2 мм. Один из фрагментов оказался головным концом, а другой - частью середины тела. На головном конце располагались две треугольной формы губы, каждая с парой сосочков. Кутикула с широкой поперечной исчерченностью. От основания губ отходили дорзальная и вентральная пары двойных кутикулярных волнистых канатиков. На гистологических препаратах повсюду встречались яйца нематоды, смешанные с некротическими массами. Яйца размерами 28x18 щи, имели плотную оболочку, некоторые из них содержали эмбрион. Авторы отнесли нематоду к роду Cheilospirura Diesing, 1861 (рис. 117).
Рис. 117 Фрагмент нематоды, извлечённой из глаза жителя Филип-пин (из: Africa, Garcia, 1936)
К' Скрябин с соавт. (1965) перевели род V Wlft «к Cheilospirura в синоним рода Acuaria, однако не все согласи-
I лись с подобной точкой зрения (Chabaud, 1975) и, судя по по-
1 следним публикациям (напр., Brener et al., 2006; Rouhani et al.,
P э/Як vk 2014), признают данный род валидным. Замечу, что отдельные
й Ж представители Cheilospirura могут быть патогенными для их
& ш хозяев. В частности, С. hamulosa (Diesing, 1851) является
£ Ж 1 ИВ Im опасным паразитом домашней птицы - цесарок, кур, фазанов,
£ g 1 |Д 111 индеек (Brener et al., 2006). Повреждая слизистую мышечного
£ fR If) желУДка> черви вызывают образование гранулём, воспаление
г еВе 0/ эпителиальных клеток и их перерождение, у больных птиц
f Тв/ наблюдается расстройство пищеварения, истощение. При ин-
£ |||т-IS /в/ тенсивной инвазии возможна гибель птицы.
/ Sr М/ И хотя спос°б заражения человека нематодой в опи-
iff Я/ санном выше случае не ясен, тем не менее, он иллюстрирует вероятность такой инвазии.
Цитируемая литература
Скрябин К. И., Соболев А.А., Ивашкин В. М. Спирураты животных и человека и вызываемые ими заболевания // Основы нематодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1965. -14. - С. 31 - 132.
300
Africa С. M., Garcia Е. Y. A new nematode parasite (Cheilospirura sp.) of the eye of man in the Philippines I I J. Philipp. Isl. Med. Assoc. - 1936. - 16. - P. 603 - 607.
Anderson R. C. Nematode parasites of vertebrates: their development and transmission. 2nd Edition. - CABI Publ., 2000.-651 c.
Brener B., Tortelly R., Muniz-Pereira L. C, Pinto R. M. Cheilospirura hamulosa (Diesing, 1851) (Nematoda, Acuaroidea) in turkeys in Brazil: occurrence and pathology // Arq. Bras. Med. Vet. Zootec. - 2006. - 58, 2. -P. 287-290.
ChabaudA. G. Keys to the genera of the order Spirurida. Part 2. Spiruroidea, Habronematoidea and Acuaroidea / CIH keys to the nematode parasites of vertebrates. No. 3. - R. C. Anderson, A. G. Chabaud, S. Will-mott (eds.). - CAB, Farnham Royal, U. K., 1975. - P. 29 - 58.
Rouhani S., Ebrahimi M„ Rostami A., Fallahi S. S. Effective, appropriate and simple culture, egg hatching and cryoreserving of the nematode Cheilospirura hamulosa H Brit. Poultry Sci. - 2014. - 55. - P. 846 - 849.
Семейство Alloionematidae Chitwood et McIntosh, 1934
В информационной сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru) в числе представителей семейства Rhabditidae указан вид Cheilobus quadrilabiatus Cobb, 1924.
В монографии К. И. Скрябина с соавт. (1954) род Cheilobus Cobb, 1924 также рассматривается в семействе Rhabditidae (в составе подсемейства Alloionematinae), причём к синонимам Cheilobus названные авторы отнесли род Rhabditophanes Fuchs, 1930.
В настоящее время Alloionematinae присвоен ранг семейства Alloionematidae (Andrassy, 1983; Baker, 1962; Fauna Europaea1; Hodda, 2011), род Cheilobus Cobb, 19241 2 относят к синонимам Rhabditophanes Fuchs, 1930, а упомянутый выше вид Cheilobus quadrilabiatus Cobb, 1924 рассматривают синонимом Rhabditophanes schneideri (Biltschli, 1873) Goodey, 1953 (Andrassy, 1983; Baker, 1962; Fauna Europaea).
Аллойонематиды - очень мелкие нематоды, менее 2 мм длиной. Головной конец с ротовыми и головными папиллами. Амфиды поровидные, располагаются на уровне головных папилл. Стома короткая, не призматическая, состоит из отдельных раб-дионов. Пищевод цилиндрический, заканчивается бульбусом с клапанами; медианный бульбус без створок. Хвост конический. У самцов две отдельные спикулы и рулёк. Бурса отсутствует. Имеются парные генитальные папиллы, а также непарная анальная папилла. Половая система самок дидельфная. Типовой род - Alloionema A. Schneider, 1859.
Аллойонематиды объединяют 4 рода с 6 видами (Hodda, 2011); относятся к группе наземных нематод, питающихся микроорганизмами. Некоторые виды на личиночной стадии известны как симбионты беспозвоночных: например, Alloionema связана с брюхоногими моллюсками, a Rhabditophanes - с насекомыми.
Вид «Cheilobus quadrilabiatus» (рис. 118), обычно живущий в гниющей растительности и отмеченный как-то в фекалиях детей в Словакии (Muller, 2002), относят к псевдопаразитам человека, причём под знаком вопроса (?) (Ashford, Crewe, 2003; Gillani et al, 2012).
Некоторые исследователи даже комментируют его как вид с сомнительной историей («doubtful tale») (см.: Ashford, Crewe, 2003).
1 www.faunaeur.org/ftill_results.php?id=224405.
2 Но не Cheilobus Rafinescu, 1817 - название рода рыб.
301
За исключением упомянутой монографии (Muller, 2002), других публикаций, в которых Cheilobus quadrilabiatus упоминался бы как паразит человека, найти не удалось. К сожалению, в цитируемой работе отсутствует ссылка на источник, из которого была почерпнута данная информация.
Рис. 118 «Cheilobus quadrilabiatus»'. А - передний конец тела; Б - хвост самца; В - личинка, прикрепившаяся к скелету хозяина-насекомого (из: Скрябин и др., 1954 - по: Filip-jev, Schuurmans-Stekhoven, 1941)
Цитируемая литература
Скрябин К. И., Шихобалова Н. П., Соболев А. А., Парамонов А. А., Судариков В. Е. Камалланаты, рабдитаты, тиленхаты, трихоцефаляты, диктиофи-
маты и распределение паразитических нематод по хозяевам И Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954. - 4. - С. 205 - 206.
Andrdssy L A taxonomic review of the suborder Rhabditina (Nematoda: Secementea). - ORSTOM, Paris, 1983.-241 pp.
Ashford R W., Crewe FT. The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
Baker A. D. Check lists of the nematode superfamilies: Dorylaimoidea, Rhabditoidea, Tylenchoidea, and Aphelenchoidea. - Leiden, E. J. Brill, 1962. - 260 pp.
Filipjev I., Schuurmans-Stekhoven J. R. A manual of agricultural helminthology. - Leiden, 1941. - 878 pp. (цит. по: Скрябин и др., 1954).
Gillani S. W., Sari Y. O., Baig A. A., Baig M. Helminthiais; Clinical insights. - Syed Wasif Gillani, 2012. -111 pp. (https://books.google.com/books?isbn=l 105494594).
Hodda M. Animal biodiversity H Zootaxa. - 2011. - No 3148. - P. 63 - 95.
Семейство Ancylostomatidae (Looss, 1905)
Описание (по: Скрябин и др., 1952). Некрупные нематоды с мощно развитой хитиновой ротовой капсулой; рот круглой или овальной формы, ротовое отверстие располагается наискось, снабжено вентральными режущими органами - зубами или пластинками, радиальные короны отсутствуют. Пищевод расширен в своей задней части. Хвостовая бурса самца широкая, латеральные лопасти хорошо развиты, вентральные рёбра смежные. Половой аппарат самки двойной, вульва открывается впереди или позади середины тела. Паразиты пищеварительного тракта млекопитающих. Типовой род -Ancylostoma (Dubini, 1843) Creplin, 1845.
Семейство объединяет 20 родов с 144 видами (Hodda, 2011). Анкилостомати-ды - геогельминты, развиваются без промежуточных хозяев; питаются кровью своих хозяев.
У человека отмечают представителей 3 родов анкилостоматид: Ancylostoma с 4 видами - A. duodenale (Dubini, 1843), A. caninum (Ercolani, 1859), A. braziliense de Faria, 1910, A. ceylanicum Looss, 1911; Necator Stiles, 1903 с видом N. americanus (Stiles, 1902); Uncinaria Frolich, 1789 с видом U. stenocephala (Railliet, 1884).
302
Наибольшую известность получили A. duodenale и N. americanus - широко распространённые паразиты человека. Исследователи подчёркивают внешнее сходство и взрослых форм, и яиц обоих видов, а также практически одинаковый способ заражения ими человека. Во многих публикациях оба вида зачастую описываются вместе, в одной рубрике.
Цитируемая литература
Скрябин К. И., Шихобалова Н. П., Шульц Р. С., Попова Т. И., Боев С. К., Делямуре С. Л. Стронгиляты И Определитель паразитических нематод / Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1952.-3.-С. 118-158.
Род Ancylostoma (Dubini, 1843) Creplin, 1845
Синонимы (по: Скрябин и др., 1952):
Agchylostoma Dubini, 1843
Anchylostomum Diesing, 1845
Dochmius Dujardin, 1845
Diplodon Molin, 1861
Ankylostomum Bumion, 1881
Ankylostoma Luntz, 1885
Описание (по разным авторам, в том числе: Скрябин и др., 1952). Некрупные черви беловатого цвета с красноватым оттенком. Головной конец изогнут дорсально. На уровне нервного кольца имеется два шейных сосочка. Ротовое отверстие овальное, обращено наискось в дорсальную сторону. Хорошо развитая удлинённая ротовая капсула несёт на вентральной стороне переднего края парные, симметрично расположенные крупные зубцы, крючковидно загнутые внутрь. Со дна капсулы поднимается кутикулярная выстилка пищевода, образующая своеобразную орнаментацию, состоящую из одного дорсального и двух вентральных выростов. Дорсальный вырост непарный, медианный, доходит до края ротового отверстия, прилегая к стенке ротовой капсулы. Два вентральных выроста в виде листовидных пластинок с тупо срезанным передним краем расположены симметрично латеровентрально в виде двух образований на дне ротовой капсулы. Бурса состоит из маленькой медианной и двух крупных латеральных лопастей. Вентральные рёбра слегка расщеплены на своей вершине. Латеральные рёбра отходят от общего ствола и разделены друг от друга. Наружнолатеральное ребро отходит от общего ствола с дорсальным. Дорсальное ребро в своей дистальной части раздваивается, каждая ветвь заканчивается тремя вершинами. Спикулы равные. Рулёк отсутствует. Хвостовой конец самок конически заострён, с небольшим шипиком. Вульва позади середины тела. Яйца овальной формы. Виды рода сгруппированы по 4 подродам.
Ancylostoma duodenale (Dubini, 1843) Creplin, 1843 [^Agchylostoma duodenale Dubini, 1843; Anchylostomum duodenale (Dub., 1843) Diesing, 1845; Anchylostoma duodenale (Dub., 1843) Chiaje, 1846; Strongylus quadridentatus v. Siebold, 1851; Dochmius ankylostomum Molin, 1860; Sclerostoma duodenale (Dub., 1843) Cobbold, 1864; Strongylus duodenalis (Dub., 1843) Schneider, 1866; Dochmius duodenalis (Dub., 1843) Leuckart, 1867; Ankylostomum duodenale (Dubini, 1843) Bugnion, 1880; Uncina-ria duodenalis (Dub., 1843) Railliet, 1885] (рис. 119 - 121). Синонимы по работе: Faust, 1949.
303
Впервые материал по данному виду получен в 1838 г. при аутопсии одной из жительниц Милана (Италия), однако само описание паразита появилось в печати только спустя несколько лет, в 1843 г. (Dubini, 1843). Видовое название нематоде дали по месту её локализации в хозяине: duodenale - двенадцатиперстная
Рис. 120 Ancylostoma duodenale'. А - передний конец тела; Б - хвостовой конец самца со спикулами (spicules) и бурсальными рёбрами (bursal rays) (из: image.slideshare cdn.com/.......phpapp02/95/ho
okworms -6-728.jpg?cb =
1269477 481)
Рис. 119 Ancylostoma duodenale'. А - передний конец тела с ротовой капсулой и зубами; Б -хвостовой конец самца со спикулой и бурсальными рёбрами (из: Faust, 1949)
Рис. 121 Ancylostoma duodenale'. слева - головной конец, дорсально, справа - то же, латерально (из: Скрябин и др., 1952 - по: Скрябин, Шульц, 1931)
Описание (по разным авторам, в том числе: Faust, 1949; Muller, 2002). Головной конец тела согнут вентрально, и потому ротовое отверстие несколько сдвинуто на брюшную сторону, вследствие чего в русскоязычной научно-справочной литературе паразита часто называют кривоголовкой, или кривоголовкой двенадцатиперстной (напр., Калинина, 2005; Маруашвили, 1968; Мяндина, Тарасенко, 2013).
304
Ротовая капсула с 4 вентральными и 2 маленькими дорсальными острыми крючками. Длина пищевода достигает 1/6 длины тела; в стенке пищевода имеется 3 эзофа-геальных железы - одна дорсальная и две субвентральные. Самцы длиной 8-11 при толщине тела 0.4 - 0.5 мм. Хвостовой конец с колоколообразной формы бурсой, ширина которой больше длины, вследствие чего хвост производит впечатление расширенного. Бурса поддерживается рёбрами, чьё расположение очень характерно для данного вида. Спикулы длинные, 1.9-2 мм, щетинкоподобные, отходят друг от друга в разные стороны и заканчиваются остриём, лежат в трубчатой полости вентролатерально к семяизвергательному протоку. Самки длиной 10 - 13 и шириной 0.4 - 0.6 мм. Вульва открывается в начале задней трети тела. Яйца овальные, с тупо закруглёнными полюсами, тонкой оболочкой, размерами 55 - 60 х 30 - 40 pm; между развивающимся эмбрионом и оболочкой имеется свободное пространство.
Как отмечено выше, жизненный цикл анкилостоматид прямой, без участия промежуточных хозяев. Не является исключением и анкилостома двенадцатиперстная (Looss, 1901). Половозрелые самки продуцируют яйца, которые с фекалиями человека выделяются во внешнюю среду. За сутки одна самка откладывает 20 - 30 тыс. яиц (Muller, 2002), причём их максимальное количество приходится на первые 12-18 месяцев жизни червя (Kendrick, 1934). Замечено, что плодовитость самок A.duodenale в 2 - 2.5 раза превышает таковую N. americanus (Faust, 1949). Распространение яиц на большие расстояния происходит в результате размывания фекалий, содержащих яйца, дождевыми и паводковыми водами. Этому же способствует механический перенос фекальных масс животными, в том числе домашними, а также птицами и насекомыми. Тот факт, что яйца анкилостоматид, проходя через желудочно-кишечный тракт животных и птиц, не теряют способности к дальнейшему развитию, приобретает эпидемиологическое значение (Маруашвили, 1968; Faust, 1949). Отложенные яйца находятся на ранней (2-8 бластомеров) стадии сегментации, в редких случаях могут встречаться несегментированные яйца. Из попавших на почву яиц при температуре 28 - 30°С, при соответствующей относительной влажности воздуха и при наличии кислорода через двое суток выходят рабдитовидные личинки, которые ведут свободный образ жизни, питаясь бактериями и разлагающимися органическими остатками. К слову, рабдитовидные личинки могут обнаруживаться уже в фекалиях инвазированных людей, страдающих запорами. Покинувшие оболочку яйца личинки достигают в длину 0.3 - 0.5 мм при максимальном диаметре в передней трети тела 0.017 мм. Затем они прекращают питаться, дважды линяют и переходят в филяриевидную личинку 3-й стадии (L3); длина их тела 0.66 мм, а чехлика, в который они заключены, 0.72 мм (Muller, 2002). Личинки могут оставаться в почве, на её поверхности или же подниматься до 30 см по влажным стеблям растений, а продолжительность их жизни во внешней среде составляет от нескольких недель (Sheorey et al., 2007) до 12 месяцев (Anderson, 2000), что зависит от условий окружающей среды. Губительное воздействие на них оказывают прямой солнечный свет, высушивание, а также температура ниже 0°С. Личинки обладают терморецепторами, и, улавливая тепло кожи человека, активно внедряются в незащищённую кожу, обычно рук или ног (Haas et al., 2005). При этом они секретируют энзимы, разрушающие клетки ткани и облегчающие им путь в дерме, и в течение 24 ч или даже раньше достигают кровеносного сосуда. Возможно также пассивное попадание личинок в организм человека с растительно
305
стью, на которой они оказались. По венозным сосудам личинки мигрируют в сердце, оттуда в лёгкие (это «путешествие» занимает около 10 дней), а затем по дыхательным путям поднимаются в глотку и вместе со слюной или мокротой попадают в желудок и, наконец, кишечник. В тонком кишечнике они прикрепляются к слизистой, активно питаются и достигают половой зрелости. При пероральном заражении, которое наблюдается реже, чем перкутальное, через лёгкие мигрируют немногие личинки, в основном же после кратковременного пребывания в желудке они переходят в кишечник. От момента попадания в организм человека до начала размножения паразита обычно проходит 5-8 недель.
Продолжительность жизни червей - 1 - 3 года (Hoagland, Schad, 1978), но может достигать 6-7 (Anderson, 2000) и даже 11-12 лет (Brooker et al., 2004; Sheo-rey et al., 2007). Г. M. Маруашвили (1968), ссылаясь на литературные данные, сообщает, что иногда черви могут жить в кишечнике человека до 15 лет. Столь продолжительный срок жизни паразита, скорее всего, может быть связан с его способностью задерживать (arrested) своё развитие в организме хозяина (Koshy et al., 1978; Schad et al., 1984; Wang et al., 1984).
Резервуаром и источником инвазии является заражённый анкилостомами человек, выделяющий при дефекации яйца нематоды и загрязняющий ими почву. Э. Фауст (Faust, 1949) перечисляет несколько публикаций, в которых сообщается о находках буквально единичных особей данного вида у льва, тигра, виверры, свиньи и собаки, а также у экспериментально заражённых обезьян и кошки. Д. Боумэн с соавт. (Bowman et al., 2002) пишут, что, несмотря на успешное заражение кошек и собак, заражённость A. duodenale в естественных условиях для них не характерна.
В англоязычной литературе можно встретить разные названия и A. duodenale, и вызываемого им заболевания: Old World hookworm, hookworm, intestinal nematode, ground itch, pruritic erythematous rash, Ankylostomiasis, anchylostomiasis, ancylostomiasis, helminthiasis, miners' anemia, tunnel disease, brickmaker's anemia. Часть из них отражает специфику проявления симптомов заболевания человека и особенности локализации паразитов в его организме. Некоторые же имеют исторические корни и в наше время труднообъяснимы, если не знать причины их появления. К примеру: почему «tunnel disease» - тоннельная болезнь?
История появления этого названия такова. В начале 1880-х годов большое количество итальянских рабочих, занятых на строительстве Сен-Готардского железнодорожного тоннеля в Швейцарских Альпах, вынуждены были вернуться домой из-за серьёзной анемии, приведшей к полной утрате ими работоспособности (Peduzzi, Piffaretti, 1983). Дома их состояние не улучшилось, а несколько человек скончалось. В феврале 1880 г. при вскрытии одного из итальянцев, умершего от губительной анемии, проф. Е. Perroncito обнаружил в его двенадцатиперстной кишке и тонком кишечнике не менее 1500 экз. анкилостомы. Выяснилось, что от похожих симптомов страдали сотни рабочих, занятых на строительстве этого тоннеля. Профессор Е. Perroncito изучил особенности биологии анкилостомы, пути заражения ею человека и разработал соответствующие превентивные меры, благодаря которым с 1898 г. и до окончания строительства тоннеля в 1906 г. более ни одного случая «тоннельной болезни» среди работающих там людей не было выявлено.
Каковы же симптомы заражения человека A. duodenale!
306
В развитии этого заболевания выделяют две фазы: раннюю - кожная и лёгочная формы заболевания, и хроническую - кишечная форма.
Кожная форма заболевания проявляется при проникновении личинок нематоды в кожу человека. Вскоре после проникновения возникает зуд и на коже появляется эритема с мелкими красными папулами, которые исчезают примерно через 10 дней. Если же заражение повторяется, то в этом случае моментально возникает крапивница, сменяющаяся через несколько часов красными папулами диаметром 1 - 2 мм, разделёнными участками чистой кожи. При последующих заражениях того же человека поражения становятся более тяжёлыми и сопровождаются локальными отёками и образованием пузырьков на коже. Следствием расчёса зудящих кожных папул может стать вторичное бактериальное инфицирование.
При лёгочной форме заболевания - в это время личинки, мигрируя по венозным сосудам, проникают в лёгкие, продвигаются по дыхательным путям, попадают в горло, - у больных могут наблюдаться приступы кашля, трахеиты и ларингиты с охриплостью голоса и даже афонией. Известны случаи обнаружения эозинофильных инфильтратов в лёгких, проявления сосудистых пневмоний, сопровождаемых лихорадкой и высокой (30 - 60 %) эозинофилией крови. Отдельные симптомы проявления лёгочной формы заболевания, вызываемые личинками A. duodenale, зачастую весьма похожи на таковые при заражении аскаридой человеческой (см. стр. 82).
Когда же анкилостомы поселяются в кишечнике человека - двенадцатиперстной кишке и верхнем отделе тонких кишок, заболевание переходит в хроническую фазу. Через 8-30 дней после заражения у пострадавших появляются боли в животе, напоминающие боли при язвенной болезни двенадцатиперстной кишки (в начале заболевания они носят острый характер, но со временем становятся менее выраженными), тошнота, рвота, диарея (стул может быть с примесью крови), отмечается общее недомогание. Возможна прерывистая лихорадка с повышением температуры до 38 - 39°С.
Однако наиболее характерной особенностью заражения является анемия (в просторечье - малокровие), имеющая гипохромный железодефицитный характер и протекающая иногда в очень тяжёлой форме (Faust, 1949). Анемию вызывают как мигрирующие по кровеносному руслу личинки, так и живущие в кишечнике черви, поскольку и те, и другие питаются кровью хозяина. Взрослые особи для этой цели повреждают слизистую оболочку кишечника и секретируют протеолитические энзимы, разрушающие и растворяющие края проделываемых ими ранок, а также препятствующие свёртыванию крови (Hotez et al., 1985). В среднем один червь потребляет от 0.14 до 0.25 мл крови в сутки (Muller, 2002). К тому же, анкилостомы, постоянно меняющие место прикрепления к стенке кишечника, оставляют после себя длительно кровоточащие ранки, что при большом количестве нематод также способствует развитию анемии.
Больные жалуются на общую слабость, апатию, одышку, шум в ушах, головокружение, потемнение в глазах, потерю веса, понижение или, реже, повышение аппетита. Объективно у больных выражены бледность кожных покровов, иногда периферические отёки, гипотония (снижение артериального давления), тахикардия (учащение пульса), систолический шум при выслушивании сердечных тонов, расширение границ сердца (www.medicalj.ru/diseases/infectious/1120-ankilostomidozy).
307
При гематологическом анализе выявляется типичная для анемии картина - анизо-пойкилоцитоз, микроцитоз, гипохромия и полихромазия эритроцитов, несколько пониженное содержание лейкоцитов, повышенное количество ретикулоцитов.
У многих пациентов наблюдается извращённый вкус: больные едят глину, известь, золу, уголь, кирпич, бумагу. У некоторых могут быть выражены нервно-психические расстройства.
При небольшом количестве червей заболевание асимптоматично.
Весьма любопытные данные об особенностях проявления симптомов заражения людей анкилостомой приводятся в одной из работ, датируемой 1923-м годом (Leach et aL, 1923). По сообщению цитируемых авторов, в период работы на Филиппинах они обнаружили, что отдельные пациенты, у которых насчитывалось свыше 1000 анкилостом, не испытывали серьёзных проблем со здоровьем. В то же время другие пациенты с единичным числом нематод болели очень тяжело. Вполне возможно, что подобное проявление тяжести заболевания зависело от общего состояния здоровья людей, а также от состояния их иммунной систем.
Прогноз при поражении анкилостомой благоприятный: при своевременной диагностике и лечении наступает выздоровление. Тем не менее, в редких запущенных случаях болезнь протекает очень тяжело и даже возможен смертельный исход.
В «Международной классификации болезней 10-го пересмотра» (МКБ-10) (см. сноску на стр. 81) в «Классе I. Некоторые инфекционные и паразитарные болезни (А00-В99)» в блоке «В65-В83 Гельминтозы» выделен раздел «В76 Анкило-стомидоз» с подразделом «В76.0 Анкилостомоз. Инвазия, вызванная видами Ancylostoma».
Диагноз на заражение A. duodenale ставят на основании результатов копро-овоскопического анализа. Неоценимую помощь может оказать также эпидемиологический анамнез, в ходе которого выясняется возможность контакта пациента с почвой, несоблюдение им элементарных правил личной гигиены. При этом следует иметь в виду вероятность ошибок при диагностике кишечной формы заболевания из-за общности его клинической симптоматики с острыми кишечными инфекциями и многими соматическими заболеваниями органов пищеварения (Бронштейн, Малышев, 2009). В этом случае положительный эффект может дать применение методов серологического тестирования (Mahmoud et al., 2005).
При лечении препарат выбора - альбендазол (Бронштейн, Малышев, 2003; Bennett, Guyatt, 2000). Для лечения детей от двух лет и старше назначают однократный приём альбендазола в дозе 400 мг или же мебендазола по 100 мг 2 раза в сутки в течение 3 дней. Разовая доза левамизола для детей - 2.5 мг на кг массы, для взрослых - 3 мг кг"1 (Muller, 2002); при интенсивной инвазии приём препарата повторяют через неделю. Пирантел назначают в дозе 10 мг на 1 кг массы пациента однократно в один приём; при интенсивной инвазии его рекомендуют принимать в течение 3-5 дней. При развитии анемии обязательно назначают препараты железа (Бронштейн, Малышев, 2003; Muller, 2002). Помимо лекарственных средств, больным рекомендуется калорийная, богатая белками пища (Bennett, Guyatt, 2000).
Как уже отмечено, заражение человека происходит активно внедряющимися в его кожные покровы личинками нематоды - при ходьбе босиком, на земляных работах, во время отдыха на травке и т.п. Вполне реально также попадание личинок с немытыми овощами, собранными с огорода, где для удобрения используют необ
308
работанные фекальные массы, или же с грязными руками, на которых могут оказаться очень мелкие личинки нематоды. Возможно также заражение личинками от матери через плаценту к плоду или же с материнским молоком к грудному ребёнку (Hotez, 1989; Yu et al., 1995). В этой связи не может не насторожить, например, факт регистрации A. duodenale в одном из сельских регионов Непала (Sarhahi District) у 78.8 % беременных женщин (обследовались особи в возрасте от 15 до 40 лет) (Navitsky et al., 1998).
К настоящему времени случаи заражения людей A. duodenale известны практически по всему миру, особенно в странах с мягким влажным климатом, расположенных в тропических и субтропических широтах. В северном полушарии выше 52° с. ш. паразит не обитает, поскольку для развития свободноживущей стадии нематоды необходима температура 22°С (Brooker et al., 2004; Faust, 1949; Miller, 1976). Однако заболевание может встречаться и в умеренном, и даже в холодном климате, обычно среди людей, занятых работой на шахтах, где царят относительно высокие температура и влажность, столь необходимые для быстрого развития личинок анкилостомы. К тому же, прослеживается явная приуроченность заболеваемости людей к регионам с низким социально-экономическим статусом населения, невысоким уровнем санитарно-гигиенической культуры. В мире число людей, заражённых анкилостомой, оценивается в десятки миллионов.
Ancylostoma braziliense de Faria, 1910. Впервые паразит описан на материале от кошек и собак на юге Бразилии (de Faria, 1910). Видовое название нематоде дали по месту её первого обнаружения: braziliense - бразильская.
Описание (по разным авторам, в том числе: Bowman et al., 2002; Faust, 1949; Monnig, 1934). Ротовая полость с меньшим отверстием, чем у A. duodenale. Ротовая капсула с пластинками, каждая из которых имеет маленький загнутый внутренний зуб и крупный наружный (рис. 122).
А Б В
Рис. Ancylostoma braziliense, ротовая капсула (из: А - M6nnig, 1934; Б - Faust, 1949; В -http://image.slidesharecdn.com/hookworms-100325002907-phpapp02/95/hookworms-16-728.Jpg ?сЬ=1269477481)
Самцы длиной 7.75 - 8.5 при толщине 0.35 мм. Бурса меньшего размера, чем у A. duodenale, а её ширина почти равна длине; рёбра бурсы короткие, как обрубленные. Длина тела самок 9 - 10.5, толщина 0.375 мм. Яйца внешне и по размерам (55 х 34 jim) не отличимы от таковых A. duodenale (Bowman et al., 2002). За су
309
тки одна самка продуцирует от 200 до 6000 яиц (Sarles, 1929). Продолжительность жизни червей в организме окончательного хозяина - 4 - 8 месяцев (Sarles, 1929).
A. braziliense - обычный паразит собак, кошек, диких псовых в субтропических и тропических регионах Америки, Азии, Австралии. В Перу отмечен у обезьян (Michaud et al., 2003). Встречается главным образом в прибрежных зонах с песчаными грунтами. К человеку попадает случайно.
Личинка 3-й стадии, чья длина достигает 0.662 мм, проникает в кожу человека, но не способна пройти через её толщу, а потому мигрирует в ней, вызывая дерматит, известный под названием creeping eruption или cutaneous larva migrans (Bowman et al., 2002, 2010; Olsen, 1974). В организме человека личинки А. braziliense не проникают в циркуляционную систему и не достигают кишечника, а потому и не созревают. Однако, мигрируя в кожном покрове, они вызывают значительную воспалительную реакцию, боль, кровоизлияния, отмечающие их извилистый путь, причём заражение может тянуться неделями и даже месяцами.
Подобные случаи чаще всего наблюдаются в странах с тёплым влажным климатом, где люди, особенно дети, обычно ходят босиком, что и предопределяет возможность их контакта с личинками паразита. Чаще всего заражение происходит на детских игровых площадках, в садах, на пляжах, посещаемых собаками и кошками - носителями инвазионного начала (Olsen, 1974).
При поражениях кожи личинками A. braziliense назначают тиабендазол (син. - минтезол) в дозе 22 мг кг1 дважды в сутки в течение 5 суток, при неэффективности рекомендуется повторный курс через 2 суток.
Ancylostoma caninum (Ercolani, 1859) Hall, 1913 \=Sclerostomum caninum Er-colani, 1859; -Strongylus caninus Ercolani, 1859; =Uncinaria canina (Ere., 1859) Railliet, 1900] (рис. 123). Синонимы по работе: Faust, 1949.
Рис. 123 Ancylostoma caninum, головной конец тела (из: 1 — Faust, 1949; 2 https://instruction.cvhs. okstate. edu/ .../ Images/Img0069a.jpg; 3 - http://image. slideshareedn.
Com /....-phpapp02/95/hookworms-7-728. jpg?cb=126947 7481)
Впервые паразит описан на материале от собаки как Sclerostomum caninum Ercolani, 1859. Видовое название нематоде дали по хозяину: caninum - собачий.
Описание (по разным авторам, в том числе: Faust, 1949; Monnig, 1934). Ротовая капсула с самым крупным отверстием среди всех родственных видов. Каждая из двух вентральных зубных пластин вооружена 3 зубами, из которых внутренний - самый маленький, а внешний - самый большой. Пищевод очень мускулистый.
310
Самцы длиной 10-12 при ширине 0.33 - 0.47 мм. Бурса крупная, рёбра длинные и узкие. Спикулы крепкие, 0.9 мм. Самки длиной 14-20 и шириной 0.5 - 0.6 мм. Вульва открывается на границе второй и последней трети длины тела. Яйца при откладке содержат 8 бластомеров. Размеры яиц 83.8 х 38 - 43 pm. По (Monnig, 1934), их размеры 56 - 65 х 37 - 43, по (Faust, 1949) - 63.8 х 40.4 pm.
A. caninum - паразит собак, лисиц, волков, песца, шакала, койота и других представителей семейства псовых на всех континентах. Иногда нематоду отмечают у кошек, причём собачьи и кошачьи паразиты представляют собой два физиологических штамма данного вида (Foster, Daengsvang, 1932). Подсчитано, что один червь за сутки высасывает 0.1 мг крови. 100 червей, таким образом, поглощают 10 мл крови, оставляя на стенке кишечника около 600 кровоточащих повреждений.
Заражение человека происходит через кожу личинками, которые, однако, не могут проникнуть в циркуляционную систему и кишечник, а потому мигрируют в коже, вызывая так называемый синдром мигрирующей в коже личинки - dermal larval migrans (Saeed S.; ADW), cutaneous larva migrans (Bowman et al., 2002, 2010). Личинки, длина тела которых достигает 0.63 мм, проникают в кожу, располагаясь в зернистом слое эпидермы или более глубоких слоях, откуда вновь мигрируют в эпидермис.
При проникновении личинок в кожу человека появляется ощущение жжения, зуда или покалывания в месте её внедрения. В коже развивается местная аллергическая реакция, сопровождаемая полиморфоядерной инфильтрацией, отёком, расширением капилляров и нередко разрушением клеток под действием протеаз паразита, и распространяющаяся в соответствии со скоростью продвижения личинки (1 - 5 см в сутки). Миграционный путь личинки часто виден на поверхности кожи в виде изломанной красной линии. Процесс может продолжаться до 4 - 6 месяцев, в очень редких случаях - дольше, но после гибели личинки обычно наступает полное выздоровление.
Если же личинки A. caninum каким-то образом случайно проглатываются человеком, то, попав в его кишечник, они вызывают эозинофильный энтерит со всеми характерными для него симптомами: отёком, асцитом, эозинофильным инфильтратом в стенке кишечника, лимфоденопатией. Кроме того, в местах прикрепления червей наблюдаются изъязвления слизистой, а также гранулёмы в субмукозе и лимфатических узлах (Croese et al., 1994; Prociv, Croese, 1990; Walker et al., 1995). Примечательный факт: ни один из выявленных в подобных случаях червей не был половозрелым (Croese et al., 1994).
Ancylostoma ceylanicum Looss, 1911. Паразит впервые описан на материале от циветты из Цейлона (Looss, 1911), с чем и связано его видовое название. Долгие годы вид рассматривали синонимом A. braziliense или его вариететом (Monnig, 1934; Wijers, Smit, 1966). Тем не менее, в 1951 г. было доказано, что это - два разных вида (Biocca, 1951).
Во взрослом состоянии A. ceylanicum паразитирует главным образом у диких хищников, может встречаться также у кошек и собак. Известен в Азии, Южной Америке, Африке, Новой Гвинее, Австралии.
Личинки 3-й стадии, чья длина достигает 0.712 мм, могут проникать к человеку через его кожу, вызывая образование папул в месте проникновения. В случае
311
попадания личинок в пищеварительный тракт человека, в течение 18-26 дней они достигают половой зрелости (Yoshida et al., 1972).
До недавнего времени A. ceylanicum не рассматривали как серьёзного патогена человека (Hotez, 1995; Hotez et al., 2004), поскольку он не вызывал столь сильной потери крови, как A. duodenale (Carroll, Grove, 1986). Однако к настоящему времени установлено, что анкилостома цейлонская провоцирует у человека диарею, абдоминальный дискомфорт (Hsu, Lin, 2012; Tu et al., 2008), а также когнитивное расстройство (Wijers, Smit, 1966). На этом основании её также следует отнести к числу гельминтов, имеющих важное зоонозное значение (Mahdy et al., 2012; Ngui et al., 2012; Thompson, Conlan, 2011).
Цитируемая литература
Бронштейн A. M., Малышев Н. А. Современные вопросы патофизиологии, диагностики и лечения паразитарных заболеваний органов пищеварения И Рос. журн. гастроэнтерологии, гепатологии, ко-лопроктологии. - 2003. - 14 (приложение № 20). - С. 60-66.
Бронштейн А. М., Малышев Н. А. Диарея путешественников, обусловленная анкилостомидозом, у туристки из России, посетившей Таиланд И Эпидемиология и инфекционные болезни. - 2009. - № 3.-С.35-36.
Маруашвили Г. М. Глава XXV. Анкилостомидозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 562 - 573. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Скрябин К. И., Шихобалова Н. П., Шульц Р. С., Попова Т. И., Боев С. К., Делямуре С. Л. Стронгиляты // Определитель паразитических нематод / Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1952.-3.-С.118-123.
Anderson R. С. Nematode parasites of vertebrates: their development and transmission. 2nd Edition. - CABI Publ., 2000.-651 c.
Bennett A., Guyatt H. Reducing intestinal nematode infection: efficacy of albendazole and mebendazole 11 Parasitol. Today. - 2000. - 16, 2. - P. 71 - 77.
Biocca E. On Ancylostoma braziliense (de Faria, 1910) and its morphological differentiation from A ceylanicum (Looss, 1911)//J. Helminthol.- 1951.-25, 1-2.-P. 1-10.
Bowman D. D., Hendrix С. M., Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002. - 467 pp.
Bowman D. D., Montgomery S. P., Zajac A. M., Kazacos K. R. Hookworms of dogs and cats as agents of cutaneous larva migrans 11 Trends in Parasitology. - 2010. - 26. - P. 162 - 167.
Brooker S., BethonyJ., Hotez P. J. Human hookworm infection in the 21st century 11 Advances in Parasitol. -2004.-58.-P. 197-288. doi: 10.1016/S0065-308X(04)58004-l.
Carroll S. M., Grove D. Experimental infection of humans with Ancylostoma ceylanicum’. clinical, parasitological, hematological and immunological findings // Trop. Geogr. Med.. - 1986. - 38, 1. - P. 38 - 45.
Croese J., Loukas A., Opdebeeck J., Prociv P. Occult enteric infection by Ancylostoma caninum’. a previously unrecognized zoonosis // Gastroenterology. - 1994. - 106, 1. - P. 3 - 12.
De Faria G. Contribuiveto para a systematic helmitolojioca braziliera 3. Ancylostoma braziliense n. sp. parazi-to dos gatos e cSis П Mem. Inst. Oswaldo Cruz. - 1910. - 2. - P. 286 - 293.
Dubini A. Nuovo verme intestinale umano (Agchylostoma duodenale), constitutente un sesto genere dei ne-matoidei proprii dell’ uomo // Ann. univ. di med., Milano (316). - 1843. - 106. - P. 5 - 13.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 411 - 443.
Foster A. O., Daengsvang S. Viability and rate of development of the eggs and larvae of the two physiological strains of the dog hookworm, Ancylostoma caninum 11 J. Parasitol. - 1932. -18. - P. 245 -251.
Haas W., Haberl B., Syafruddin Idris, I., Kallert D. et al. Behavioural strategies used by the hookworms Ne-cator americanus and Ancylostoma duodenale to find, recognize and invade the human host // Parasitol. Res. - 2005. - 95, 1. - P. 30 - 39. doi: 10.1007/s00436-004-1257-7.
Hoagland К. E, Schad G. A. Necator americanus and Ancylostoma duodenale'. Life history parameters and epidemiological implications of two sympatric hookworms of humans // Exp. Parasitol. - 1978. - 44, 1. -P. 36-49.
312
Hotez P. J. Hookworm infection in children // Pediatric Infect. Dis. J. - 1989.-8. - P. 516 - 520.
Hotez P. J. Human hookworm infection I Farthing M. J. G, Keusch G. T.5 Wakelin D., eds. Enteric Infection: Mechanisms, Manifestations, and Management. II. - London: Chapman & Hall, 1995. -P. 129- 150.
Hotez P. J., Brooker S, Bethony J. M., Bottazzi M. E., Loukas A., Xiao S. Hookworm infection // N. Engl. J. Med. - 2004. - 351. - P. 799 - 807.
Hotez P. J., Le Tang N., Me Ker row J. H, Cerami A. Isolation and characterization of a proteolytic enzyme from adult hookworm Ancylostoma caninum // J. Biol. Chem. - 1985. - 260, 12. - P. 7343 - 7346.
Hsu Y. C., Lin J. T. Intestinal infestation with Ancylostoma ceylanicum // N. Engl. J. Med. - 2012. - 366. - P. e20.
Kendrick J. R. The length of life and the rate of loss of the hookworm, Ancylostoma duodenale and Necator americanus 11 Am. J. Trop. Med. Hyg. - 1934. - 14. - P. 363 - 379.
Koshy A., Raina K, Sharma M. P., Mithal S., Tandon B. N. An unusual outbreak of hookworm disease in north India 11 Am. J. Trop. Med. Hyg. - 1978. - 27, 1. - P. 42 - 45.
Leach C. N., Schwartz B., Leach F. D., Haughwout F. G. Hookworm disease: A clinical entity in the Philippine Islands//Philipp. J. Sci. - 1923.-23.-P. 105-121.
Looss A. On the penetration of Ancylostoma larvae into the human skin П Centralbl. Backteriol. Parasitenk. -1901. - 29.-P. 733 -739.
Looss A. The anatomy and life histoiy of Ancylostoma duodenale Dub. A monograph. Part 2. The development in the free state H Rec. School Med., Ministry Educ., Egypt, Cairo. - 1911. -4. -P. 159 - 613.
Mahdy M. A. K., Lim Y. A. L., Ngui R., Fatimah M. R. S, Choy S H. et al. Prevalence and zoonotic potential of canine hookworms in Malaysia 11 Parasites Vectors. - 2012. - 5, l.-P. 88.
Mahmoud M. S., Abou Gamra M. M., Elkhayat M. M. Ancylostoma duodenale infection: a study of serum immunoglobulin G4 response to the excretory secretory antigen of adult worm // J. Egypt. Soc. Parasitol. -2005.-35, l.-P. 1 - 17.
Michaud C, Tantalean M., Ique C, Montoya E, Gozalo A. A survey for helminth parasites in feral New World non-human primate populations and its comparison with parasitiological data from man in the region // J. Med. Primatol. - 2003. - 32. - P. 341 - 345.
Miller T. A. Hookworm infection in man П Adv. Parasitol. - 1979. - 17. - P. 315 - 384.
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 134 - 137.
Navitsky R. C, Dreyfuss M. L., Shrestha J. et al. Ancylostoma duodenale is responsible for hookworm infections among pregnant women in the rural plains of Nepal //J. Parasitol. - 1998. - 84, 3. - P. 647 - 651.
Ngui R., Lim Y. A. L., Traub R., Mahmud R., Mistam M. S. Epidemiological and genetic data supporting the transmission of Ancylostoma ceylanicum among human and domestic animals // PLoS Negl. Trop. Dis. -2012.-6, 2.-P. el522.
Olsen О. IV. Animal parasites. Their life cycles and ecology. - Dover Publ., Inc., New York, 1974. - 565 pp.
Peduzzi R., Piffaretti J. C.Ancylostoma duodenale and the Saint Gothard anaemia // Br. Med. J. (Clin. Res. Ed.).- 1983.-287, 6409.-P. 1942- 1945.
Prociv P., Croese J. Human eosinophilic enteritis caused by dog hookworm Ancylostoma caninum H Lancet. - 1990. - 335 (8701). - P. 1299 - 1302. doi: 10.1016/0140-6736(90)91186-E.
Saeed S. Ancylostoma caninum. - ADW. Animaldiversity.org/accounts/ Ancylostoma_ caninum.
Sarles M. P. Quantitative studies on dog and cat hookworms, Ancylostoma braziliense, with special emphasis on age resistance 11 Am. J. Hyg. - 1929. -10. - P. 453 - 475.
Schad G. A., Murrell K. D., Fayer R., El Naggar H. M. S. et al. Paratenesis in Ancylostoma duodenale suggests possible meat-borne human infection // Trans. R. S. Trop. Med. Hyg. - 1984. - 78, 2. - P. 203 - 204.
Sheorey H, Biggs B. A., Traynor P. Nematodes I P. R. Murray, E. J. Baron, J. H. Jorgensen, M. L. Landry, M. A. Pfaller (Eds.), Manual of Clinical Microbiology (9th ed.). - Washington, D.C.: ASM Press, 2007. -P. 2144-2155.
Thompson R, Conlan J. Emerging issues and parasite zoonoses in the SE Asian and Australasian region H Vet. Parasitol. - 2011. - 181, 1. - P. 69 - 73.
Tu С. H, Liao W. C, Chiang T. H, Wang H. P. Pet parasites infesting the human colon // Gastrointest. En-dosc.-2008.-67, l.-P. 159- 160.
Walker N., Croese J., Clouston A. D., Parry M., Loukas A., Prociv P. Eosinophilic enteritis in northeastern Australia. Pathology, association with Ancylostoma caninum, and implications И Am. J. Surg. Pathol. -1995. - 19, 3. -P. 328 - 337. doi: 10.1016/S0166-6851(99)00011-0.
313
Wang М.-P., Hu Y.-F., FengJ.-M., Wu D.-L., Yao S.-Y. Persistent migration of Ancylostoma duodenale larvae in human infection П Chinese Med. J. - 1984. - 97, 2. - P. 147 - 149.
Yoshida Y., Okamoto K., Chiu J. K. Experimental infection of man with Ancylostoma ceylanicum // Chin. J. Microbiol. - 1972. - 4. - P. 157 - 167.
Yu S. H, Jian Z. X., Xu L. Q. Infantile hookworm disease in China. A review И Acta Trop. - 1995. - 59. - P. 265-270.
Род Necator Stiles, 1903
Описание (по: Скрябин и др., 1952; Faust, 1949; Muller, 2002). Головной конец изогнут в виде крючка и загнут дорсально. Ротовое отверстие чаще овальное, обращено наискось в дорсальную сторону. Ротовая капсула с 2 крупными, полулунной формы режущими пластинами, 3 парами зубцов на дорсальной стороне капсулы и 3 зубцами, выходящими из пищеводной воронки. Кутикула с лёгкой поперечной ис-черченностью. Цервикальные папиллы ниже уровня нервного кольца. Имеются 2 головных железы и одна дорсальная, пищеводная, открывающаяся на вершине особого конического выступа, который отходит от дорсальной стенки ротовой капсулы, свободно вдаваясь в её просвет. Хвостовой конец самцов загнут дорсально. Бурса узкая. Вентральные рёбра расщеплены. Латеральные ребра отходят от общего ствола, медио- и постеролатеральное срослись базальными частями на большом протяжении, наружнолатеральное обособлено от остальных латеральных. Наружнодорсальное ребро направлено вбок и вперёд, имеет общий ствол с дорсальным, которое бифурцирует сразу после отхождения наружнодорсального ребра. Каждая ветвь на дистальном конце раздвоена. Спикулы равные, их верхушки обычно соединены вместе и загнуты. Вульва впереди середины тела. Единственный вид, паразитирующий у человека, -N. americanus (Stiles, 1902).
Necator americanus (Stiles, 1902) Stiles, 1903 [=Uncinaria americana Stiles, 1902; =Ankilostomum americanum (Stiles, 1902) v. Linstow, 1903; Ancylostoma ameri-canum (Stiles, 1902) Siccardi, 1905; -Necator africanus Harris, 1910; Necator argentine Parodi, 1920] (рис. 124). Синонимы no: Faust, 1949.
Впервые вид описан под названием Uncinaria americana (Stiles, 1902), но затем для него был создан новый род - Necator. Несмотря на то, что описание вида появилось только в 1902 г., вызываемое им заболевание было известно среди населения юга и юго-востока США, а также на островах Карибского бассейна ещё с середины 18-го столетия (Faust, 1949; Stiles, 1901). Видовое название паразита указывает на район его первоначального обнаружения: americanus - американский.
Черви серовато-желтоватые, или бледно-розового цвета. Длина тела самцов 5-9, ширина 0.3 мм. Спикулы лежат плотно друг к другу, заканчиваются крючком. Длина самок 9-12, ширина 0.4 мм. Хвостовой конец самки без шипика. Вульва в передней трети тела. Яйца овальные, размером 64 - 72 х 35 - 40 р.т, при откладке содержат 2-4 бластомера. Самка откладывает в сутки около 15 тыс. яиц.
Из попавших во внешнюю среду яиц при оптимальных условиях через 1-2 суток выходят рабдитовидные личинки. Оптимальная температура для свободно-живущих личинок N. americanus находится в диапазоне 25 - 28°С (Miller, 1979). Через 7-10 дней после двух линек они превращаются в филяриевидную личинку, длина тела которой не превышает 0.59 мм, а размер чехлика, в котором она находится, 0.66 мм (Muller, 2002) (рис. 125).
314
Рис. 124 Necator americanus'. А, Д, E - ротовая капсула; Б, В, Г - задний конец тела самца (из: А, Б - image.slideshare cdn.com/hookworms...=1269477481; В - Monnig, 1934; Г -msu.edu/.../ hookscope.htm; Д - Скрябин и др., 1952; Е - quizlet.. ./parasitology-flash-cards/)
Рис. 125 Филяриевидная личинка Necator americanus (из: http://www.gastroscan.ru/handbook/390/8336)
Эти личинки уже способны заражать человека. В почве они сохраняют инвазионность в течение 7-8 недель.
Механизм заражения человека некатором -перкутанный (Matthews, 1982). При контакте с кожей личинки активно внедряются в неё и проникают
в кровеносные сосуды. Током крови они заносятся в лёгкие, затем в альвеолы, бронхи, трахею, глотку и ротовую полость, где проглатываются и в результате через 3-5 дней оказываются в кишечник. При случайном попадании личинок непо
средственно в ротовую полость человека, они проникают в его организм через эпителий (Nagahana et al., 1963). Продолжительность жизни червей - от 3 до 10 лет (Hoagland, Schad, 1978), средняя - 4 года, максимальная - 18 лет (Beaver, 1988).
Взрослые гельминты поселяются в двенадцатиперстной кишке и в верхнем отделе тощей кишки, используя для фиксации и последующего разрыва капилляров ротовую капсулу. Подсчитано, что одна особь некатора потребляет в сутки от 0.03 до 0.05 мл крови (Muller, 2002).
315
В англоязычной литературе можно встретить разные названия и N. americanus. и вызываемого им заболевания: American hookworm, New World hookworm, American murderer, producing tropical hookworm infection. Самое примечательное среди них - American murderer (американский убийца).
Источник заражения - инвазированный некатором человек, выделяющий с фекалиями яйца нематоды и загрязняющий ими почву, а единственным путём попадания личинок паразита в человека является перкутанный. Вместе с тем, возможен ещё один путь заражения людей, - с молоком матери к грудным младенцам. Подтверждает вероятность подобного механизма инвазии обнаружение личинки некатора в молоке кормящей тайской женщины (Setasuban et al., 1980).
Заражение людей некатором зарегистрировано во многих странах мира: Португалии, Турции, Иране, Индии, Шри-Ланке, Малайзии, Китае, Японии, Таиланде, Индонезии, Австралии, на юге США, островах Карибского бассейна, в Бразилии, Колумбии, Венесуэле, в Африке к югу от Сахары. Недавно вид обнаружили у обезьян, в частности, у лысого уакари в Перу (Michaud et al., 2003).
Цитируемая литература.
Скрябин К. И., Шихобалова Н. П., Шульц Р. С., Попова Т. И., Боев С. К., Деляму ре С. Л. Стронгиляты // Определитель паразитических нематод / Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1952.-3.-С. 146-148.
Beaver Р. С. Light, long-lasting Necator infection in a volunteer 11 Am. J. Trop. Med. Hyg. - 1988. - 39. - P. 369-372.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 423 - 443.
Hoagland К. E, Schad G. A. Necator americanus and Ancylostoma duodenale'. Life history parameters and epidemiological implications of two sympatric hookworms of humans // Exp. Parasitol. - 1978. - 44, 1. -P. 36-49.
Matthews В. E. Skin penetration by Necator americanus larvae // Z. Parasitenk. - 1982. - 68. - P. 81 - 86.
Michaud C., Tantalean M., Ique C., Montoya E., Gozalo A. A survey for helminth parasites in feral New World non-human primate populations and its comparison with parasitiological data from man in the region // J. Med. Primatol. - 2003. - 32. - P. 341 - 345.
Miller T. A. Hookworm infection in man П Adv. Parasitol. - 1979. - 17. - P. 315 - 384.
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 126 - 134.
Nagahana M., Tanabe K., Yoshida Y., Kondo K, Ishikawa M. et al. Experimental studies on the oral infection of Necator americanus. III. Experimental infection of three cases of human beings with Necator americanus larvae through the mucous membrane of the mouth // Japan. J. Parasitol. - 1963. - 12. - P. 162-167.
Setasuban P., Punari W., Meunnod C. Transmammary transmission of Necator americanus larva in the human host // Southeast Asian J. Trop. Med. Publ. Health. - 1980. - 11, 4. - P. 535 - 538.
Stiles С. IV. Uncinariasis (Ancylostomiasis) in man and animals in the United States // Tex. Med. News. -1901. -10.-P. 523 -532.
Stiles С. IV. A new species of hookworm (Uncinaria americana) parasitic in man И Am. Med. - 1902. - 3. -P. 777-778.
Род Uncinaria Froelich, 1789
Синонимы (по: Скрябин и др., 1952):
Dockmius Dujardin, 1845
Dachmoides Cameron, 1924
Описание (по разным авторам, в том числе: Скрябин и др., 1952; Faust, 1949; Monnig, 1934; Ransom, 1924). Черви похожи на Ancylostoma, но у вентрального края
316
воронковидной ротовой капсулы вместо зубов располагается пара режущих пластин, без разделения ротовой капсулы сочленёнными пластинками; в глубине капсулы два субвентральных ланцета; дорсальный конус отсутствует. Дорсальная сторона ротовой капсулы укорочена, ротовое отверстие располагается дорсально. Бурса хорошо развита, с двумя большими латеральными лопастями и малой дорсальной лопастью. Вентральные рёбра расщеплены. Переднелатеральное и латеральные рёбра отходят от общего ствола; медио- и заднелатеральное рёбра разделены. Наружнодорсальное ребро отходит от общего ствола с дорсальным; дорсальное ребро раздвоено в своей дистальной части, при этом каждая ветвь дважды или трижды расщеплена. Спикулы равные. Вульва на границе средней и задней трети длины тела. Паразиты наземных и морских млекопитающих. Типовой вид - Uncinaria cri-niformis (Goeze, 1782).
К середине 20-го столетия род насчитывал 9 видов. У человека очень редко отмечают только один вид - U. stenocephala.
Uncinaria stenocephala (Railliet, 1884) - впервые описан на материале из собаки (рис. 126). Видовое название нематоды отражает особенности строения её головного конца: stenocephala-узкоголовая.
Описание (по: Monnig, 1934; Ransom, 1924). Некрупные черви. Самцы длиной 5.6 - 11 мм. Медиолатеральное ребро примерно такой же ширины, как постеро-и наружнолатеральное. Дорсальное ребро бифурцирует дистально на трёхлучевые ветви. Спикулы длиной 0.64 - 0.76 мм, с заострённой верхушкой. Самки длиной 7.7 - 16 мм. Вульва в задней трети тела. Яйца прозрачные, овальной формы, размерами 64-90 х 36 - 50 цт.
Рис. 126 Uncinaria stenocephala: а - передний конец тела латерально (из: Monnig, 1934); б -бурса самца с левой стороны (е.1. - наружнолатеральное ребро; т.1. - медиолатеральное ребро; р.1. - постеролатеральное ребро) (из: Ransom, 1924); в - головной конец (из: Скрябин и др., 1952)
Половозрелые самки откладывают ежесуточно до 5 тыс. яиц, из которых через 12 - 20 ч выходят личинки 1-й стадии. Развитие яиц и личинок может происходить лишь в условиях оптимальной температуры - 20 - 30°С.
Заражение окончательных хозяев происходит двумя путями. При перку-таннном заражении инвазионные личинки, чья длина не превышает 0.50 - 0.58 мм, активно внедряются в открытые участки кожи животного, чаще всего между паль-317
цами лап (Smith, Eliot, 1969), а затем лимфогематогенным путём по малому кругу кровообращения через правую половину сердца достигают лёгких. Здесь они прорывают стенку кровеносных капилляров и мигрируют через альвеолы, бронхиолы и бронхи в трахеи. При откашливании личинки проглатываются и попадают в кишечник, где через 12-23 дня становятся половозрелыми. При пероральном заражении животные заглатывают личинок, обкусывая лапы или же облизывая шерсть, на которые те могли попасть, а также с кормом или водой со случайно оказавшимися в них личинками. В этом случае личинки обычно внедряются в стенку кишечника, где в течение нескольких дней дважды линяют, затем выходят в просвет кишечника и достигают половозрелого состояния.
Зрелые черви поселяются в тонком отделе кишечника собак, включая домашних, служебных, охотничьих, а также волков, лисиц, барсука, енотовидной собаки, енота-полоскуна, куниц и т. д. (Гогоберишвили, Поцхверия, 2013; Morgan, 2013; Senlik et al., 2006 и др.). Например, лисица обыкновенная в центральной Италии заражена U. stenocephala на 39.1 % (Magi et al., 2009), собаки в окрестностях Тираны (Албания) - на 64.9 % (Xhaxhiu et al., 2011), лесной кот в предгорной зоне Северо-Западного Кавказа - на 42.9 % (интенсивность инвазии 4-11 экз.), а барсук в этом же регионе - на 40 - 50 % (3 - 141 экз.) (Итин, 2014).
Взрослые унцинарии у человека не обнаружены. Однако личинки могут проникать в кожу, вызывая синдром мигрирующей личинки. Ещё в первой четверти 20-го столетия Ф. Фюллеборн (Fullebom, 1927) на собственном примере изучил возможность их проникновения в кожу человека.
Цитируемая литература
Гогоберишвили М. С., Поцхверия Ш. О. Некоторые вопросы эпизоотологии токсокароза и токсаскари-доза собак в Тбилиси И Теория и практика паразитарных болезней животных. - 2013. - Вып. № 14. -С. 118-121.
Итин Г С. Особенности гельминтофауны диких хищных млекопитающих в ландшафтно-географических зонах Северо-Западного Кавказа: Дисс...канд. биол. наук: 03.02.08 - экология. - Краснодар, 2014.-171 с.
Скрябин К. И., Шихобалова Н. П., Шульц Р. С., Попова Т. И., Боев С. К., Делямуре С. Л. Стронгиляты И Определитель паразитических нематод / Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1952.-3.-С.150- 154.
Fullebom F. Durch Hakenwurmlarven des Hundes (Uncinaria stenocephala) beim Menschen erzeugte “Creeping Eruption” 11 Abhaundl. Gebiet Auslandsk., Hamburg Univ. - 1927. - 26 (2). - P. 121 - 133.
Magi M., Macchioni F., Dell’Omodarme M., Prati M. C., Calderini P. et al. Endoparasites of red fox (Vulpes vulpes) in central Italy // J. Wildl. Dis. - 2009. - 45, 3. - P. 881 - 885.
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
Morgan E. P. Dogs and nematode zoonoses I Dogs, Zoonoses and Public Health. 2nd Edition. - Eds. Macpherson C. N. L., Meslin F.-X., Wandeler A. I. - CAB Intern., 2013. - P. 153-161.
Ransom В. H. Hookworms of the genus Uncinaria of the dog, fox, and badger // Proc. U. S. Nat. Mus. -1924.-65, art 20.-P. 1-5.
Senlik B., Cirak V Y., Karabacak A. Intestinal nematode infections in Turkish military dogs with special reference to Toxocara canis 11 J. Helminthol. - 2006. - 80, 3. - P. 99 - 303.
Smith B. L, Eliot D. C. Canine pedal dermatitis due to percutaneous Uncinaria stenocephala infection // N. Z. Vet. J. - 1969. -17. - P. 235 - 239.
Xhaxhiu D., Kusi L, Rapti D., Kondi E, Postoli R. et aL Principal intestinal parasites of dogs in Tirana, Albania// Parasitol. Res. - 2011. - 108, 2. - P. 341 - 353. doi: 10.1007/s00436-010-2067-8.
Вместо заключения. Изложенная выше информация свидетельствует о том, что анкилостоматиды относятся к числу нематод, наиболее распространённых среди
318
людей. По данным ВОЗ - Всемирной организации здравоохранения (WHO, 1998), в 1997 г. ими было заражено от 800 млн. до 1.25 млрд, человек, включая 44 млн. беременных женщин. При этом, по крайней мере, 1.6 млн. человек страдали от серьёзной анемии. Столь же удручающе выглядит ситуация и в 21 -м столетии. Полагают, что численность людей, заражённых анкилостоматидами, превышает 600 млн., причём почти треть из них - 156 млн. - составляют дети (Bethony et al., 2006; de Silva et al., 2003). Ежегодная смертность от заболеваний, вызываемых этими гельминтами, колеблется от 3000 до 65 000 человек (Brooker, 2010; Hotez, 2011). В подавляющем большинстве случаев в роли патогенов выступают A. duodenale и N. americanus, и только небольшая доля от числа заболевших вызвана заражением А. ceylanicum (Miller, 1979). В эндемичных очагах заболеваемость людей, провоцируемая A. duodenale и N. americanus, очень высока. Например, к югу от Сахары названными видами заражено 30 % местного населения (de Silva et al., 2003), на северо-востоке Ганы - 50 % (Yelifari et al., 2005). В Бразилии в штате Мату-Гросу анки-лостоматиды выявлены у 19.24 % индейцев этнической группы Tapirape, при этом среди детей заражённость составила 61.44 %, а среди взрослых - 2.57 % (Malheiros etal., 2014).
Можно ли избежать заражения личинками анкилостоматид?
Известно, что заболевание легче предупредить, чем потом вылечить. Эту азбучную истину иллюстрирует случай с отдыхавшей в Таиланде москвичкой, у которой после поездки развились острая диарея и высокая эозинофилия, вызванные заражением анкилостоматидами (Бронштейн, Малышев, 2009). Пострадал от этих нематод и 29-летний молодой человек после отдыха на Ямайке: через неделю на левой ноге обнаружилась папула, от которой пошла извилистая с кровоизлияниями вздувшаяся полоска, ежедневно увеличивающаяся на 1 см - с такой скоростью продвигалась в коже проникшая в неё личинка анкилостомы (Hilgarth et al., 1997).
Итак, при посещении эндемичных районов следует избегать контакта с почвой, не ходить босиком и не лежать на земле, строго соблюдать правила личной гигиены и тщательно мыть овощи проточной водой. Для удобрения почвы на огородах, приусадебных участках, полях не следует использовать фекалии, не прошедшие обеззараживания. В числе предупредительных мер также дегельминтизация отхожих мест и санитарная очистка мест общественного пользования в населенных пунктах, выделение специальных площадок для выгула домашних животных и проведение их регулярной санитарной обработки. Одной из основных превентивных мер, призванных предупредить заражение людей анкилостоматидами, следует считать санитарно-просветительскую работу, направленную на повышение уровня санитарной культуры населения. Как здесь не вспомнить предложенную ещё 30 лет назад стратегию контроля заражения анкилостоматидами в развивающихся странах и оказания первичной медико-санитарной помощи (Gilles, 1985).
Помимо перечисленных выше видов анкилостоматид, чьё паразитирование у человека зафиксировано документально, в литературе можно найти ссылки ещё на несколько видов, или явно случайно попавших к человеку, или видовой статус которых более чем сомнителен.
Так, Э. Фауст (Faust, 1949; стр. 422) упоминает публикацию (Yorke, Maplestone, 1926), в которой сообщено о находке у человека Ancylostoma malayanum (Ales-sandrini, 1905) Lane, 1916. Никакой дополнительной информации по данному факту
319
Э. Фауст не приводит. A. malayanum - типичный паразит многих видов медведей, регистрируется у них практически повсеместно (Asakawa et al., 2006)3. Другими сведениями о регистрации данного вида нематод у человека я не располагаю.
В информационной сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru) названы также Ancylostoma japonica Fukuda et Katsurada, 1925 и A. tubaeforme (Zeder, 1800). Однако, по мнению практически всех специалистов, оба вида являются сомнительными (doubtful species) (Ashford, Crewe, 2005; Gillani et al., 2012).
В этой же сводке (www.worms-info.ru) упоминаются Necator argentinus Ра-rodi, 1920 и N. suillus Ackert et Payne, 1922. Первый из них - синоним Necator americanus (Ashford, Crewe, 2005; Faust, 1949). Второй вид - типичный паразит свиней; впервые описан на материале от домашних свиней на Тринидаде, где эти животные поражены им почти на 90 % (Ackert, Payne, 1923). Предположение о возможности его паразитирования у людей сделано на основании результатов эксперимента (Ashford, Crewe, 2005). Информацию о естественных случаях заражения человека найти не удалось. В монографии (Muller, 2002) на стр. 136 написано: «N. suillus Ackert and Payne, 1922, once or twice in humans and widespread in pigs», при этом отсутствуют ссылки на источники, из которых можно было бы узнать, когда и где этот вид нашли «у человека один раз или дважды».
И ещё один вид анкилостоматид называют во многих обзорных работах (Ashford, Crewe, 2005; Faust, 1949; Gillani et al., 2012; Muller, 2002) как возможного паразита человека, ссылаясь при этом на единственную работу - Mayhew, 1947. Речь идёт о Bunostomum phlebotomum (Railliet, 1900) - паразите жвачных животных. Проводя опыты по заражению телят личинками этого и ещё одного вида - Oeso-phagostomum radiatum (Rud., 1803), экспериментатор (Mayhew, 1947) обратил внимание на появившиеся на его пальцах маленькие воспалённые точки, которые быстро увеличивались в размерах и достигли в диаметре около % дюйма. Через 2 или 3 дня на их месте развились узкие линейные извилистые повреждения, а сама зона повреждения вздулась и сильно чесалась, особенно по утрам. Подобные симптомы были выражены и у телят. Тем не менее, воспаление было не столь продолжительным, как при проникновении в кожу человека личинок Ancylostoma braziliense.
Цитируемая литература
Бронштейн А. М., Малышев Н. А. Диарея путешественников, обусловленная анкилостомидозом, у туристки из России, посетившей Таиланд И Эпидемиология и инфекционные болезни. - 2009. - № З.-С. 35-36.
Ackert J. Е., Payne F. К. Investigations on the control of hookworm disease. XII. Studies on the occurrence, distribution and morphology of Necator suillus, including descriptions of the other species of Necator H Am. J. Hyg. - 1923.-3, 1. - P. 1 - 25.
Ashford R. W., Crewe W. The parasites of Homo sapiens’. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. Second edition. - Taylor & Francis Inc., 2003. - 184 pp.
Bethony J., Brooker S., Albonico M., GeigerS. M., Loukas A. et al. Soil-transmitted helminth infections: asca-riasis, trichuriasis, and hookworm 11 Lancet. - 2006. - 367. - P. 1521 - 1532.
Brooker S, Estimating the global distribution and disease burden of intestinal nematode infections: Adding up the numbers - A review // Int. J. Parasitol. -2010.-40, 10. - P. 1137 - 1144. doi: 10.1016/j.ijpara. 2010.04.004.
3 Asakawa M., Mano T., Gardner S. L. First record of Ancylostoma malayanum (Alessandrino, 1905) from brown bears (IJrsus arctos L.) П Comp. Parasitol. - 2006. - 73, 2. - P. 282 - 284.
320
de Silva N. R., Brooker S, Hotez P. J., Montresor A., Engels D., Savioli L. Soil-transmitted helminth infections: updating the global picture H Trends Parasitol. - 2003. - 19. - P. 547 - 551.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Gillani S. W., Sari Y. O., Baig A. A., Baig M. Helminthiais; Clinical insights. - 2012. - 111 pp. (https://books.google.com/books?isbn=1105494594).
Gilles H. M. Selective primary health care: Strategies for control of disease in the developing world. XVII. Hookworm infection and anaemia 11 Rev. Infect. Dis. - 1985. - 7,1. - P. 111 - 118.
Hilgarth K. A., Fife К. H, Cushing H E. Cutaneous larva migrans H Clin. Infect. Dis. - 1997. - 25, 2. - P. 187, 301.
Hoagland К. E, Schad G. A. Necator americanus and Ancylostoma duodenale: Life histoiy parameters and epidemiological implications of two sympatric hookworms of humans 11 Exp. Parasitol. - 1978. - 44, 1. -P. 36-49.
Hotez P. J, The development impact of the neglected tropical diseases (NTDs). - U. N. Department of Economic and Social Affairs Population Division. - Expert Paper No. 2011/1. - 2011. - P. 1-40 (цит. no: Walanaet al., 2014).
Malheiros A. F, Delgado P. M., Lemos L.S., Shaw J. J. Infection by hookworms in indigenous of a remote region from the legal Amazon, Brazil // Neotrop. Helminthol. - 2014. - 8, 2. - P. 403 - 410.
Mayhew R. L. Creeping eruption caused by the larvae of the cattle hookworm Bunostomum phlebotomum 11 Proc. Soc. Exp. Biol. Med. - 1947. - 66, l.-P. 12-14.
Miller T. A. Hookworm infection in man П Adv. Parasitol. - 1979. - 17. - P. 315 - 384.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Walana W.t Aidoo E. N. K„ Vicar E. K., Toy S. С. K. Prevalence of hookworm infection: A retrospective study in Kumasi, Ghana // Sci. J. Publ. Health. - 2014. - 2, 3. - P. 196 - 199. doi: 10.11648/j.sjph. 20140203.19.
WHO-1998. The World Health Report 1998. Life in the 21th century. A vision for all. - World Health Organization, Geneva^ 1998. - 232 pp.
Yelifari L., Bloch P., Magnussen P., van Lieshout L., Dery G. et al. Distribution of human Oesophagostomum bifurcum, hookworm and Strongyloides stercoralis infections in northern Ghana П Trans. R. Soc. Trop. Med. Hyg. - 2005. - 99. - P. 32 - 38.
Yorke W., Maplestone Л A. The nematode parasites of vertebrates. - J. & A. Churchill, London, 1926. - 536 pp.
Семейство Cephalobidae Filippjev, 1934
В информационной сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru) в числе паразитирующих у людей нематод указаны 2 вида из семейства Cephalobidae - Micronema deletrix Anderson et Bemrick, 1965 [в современной систематике вид отнесён к синонимам Halicephalobus gingivalis (Stefanski, 1954)] и Turbatrix aceti (О. F. Muller, 1783).
Оба рода - и Halicephalobus Timm, 1956, и Turbatrix Peters, 1927 - входят в состав семейства Panagrolaimidae, чьё описание приведено ниже.
Семейство Chabertiidae Popova, 1952
Семейство рассматривают в составе отряда Strongylida (Schindler et al., 2005).
Описание (по разным авторам). Головной конец слегка изогнут дорсально или вентрально. Ротовая капсула хорошо развита. Зубы на дне ротовой капсулы чаще отсутствуют. Имеются наружная и внутренняя радиальные короны. Дорсальное ребро обычно с двумя ветвями на каждой стороне. Рулёк может отсутствовать. Половозрелые черви живут в толстой и слепой кишках приматов, жвачных, грызунов, свиней. Типовой род - Chabertia Railliet et Нету, 1909.
Развитие прямое, без участия промежуточных хозяев.
321
У человека зарегистрированы представители трёх родов - Cyclodontostomum Adams, 1933, Oesophagostomum Molin, 18614, Ternidens Railliet et Henry, 1909.
Род Cyclodontostomum Adams, 1933
Синоним: Ancistronema Smales, 1992
Описание (по: Скрябин и др., 1952; Adams, 1933; Gibbons, 2010). Мелкие нитевидные нематоды с неглубокой ротовой капсулой. Имеется по одной паре дорсальных, вентральных и латеральных головных сосочков. Ротовое отверстие круглое, терминальное. Наружная корона с 16 узкими треугольными, внутренняя - с 16 крючковидными образованиями. Пищеводная воронка с 3 зубами. Имеется неглубокий дорсальный пищеводный желоб. Пищевод в проксимальной части вздутый, в дистальной - расширенный. Экскреторная пора на уровне нервного кольца. Бурса симметричная, с большой дорсальной лопастью. Вентральные рёбра с общим стволом, параллельные, сближенные. Латеральные рёбра с общим стволом, переднелатеральные отделены от остальных латеральных. Наружнодорсальное ребро длинное и начинается от общего ствола с дорсальным. В дистальной трети дорсальное ребро раздваивается, каждая ветвь делится, образуя общую наружную ветвь. Половой конус с одной вентральной папиллой и 2 дорсальными округлыми лучиками. Спикулы почти равные. Вульва возле ануса. Матки параллельные, направлены вперёд. Хвост самок заострён. Яйца овальные, с тонкой оболочкой. Характерный паразит грызунов, в основном Murinae. Типовой вид - Cyclodontostomum purvisi Adams, 1933 (=Ancistronema coronatum Smales, 1992) (рис. 127).
Единственная работа, в которой сообщается о регистрации С. purvisi у человека, опубликована ещё в 1975 г. (Bhaibulaya, Indrangarm, 1975). Её авторы описывают находку двух взрослых особей данного вида в фекалиях 47-летнего жителя Таиланда, страдавшего от заражения капилляриидными нематодами. Какие-либо симптомы, указывающие на инвазию С. purvisi, у больного отсутствовали.
В той же местности, где жил пациент, данный вид нематод выявили в кишечнике бандикут бирманской и индийской. Полагают, что в данном случае заражение человека, скорее всего, произошло через непромытую зелень, на которой случайно могли оказаться личинки нематоды.
Другой информации о находках Cyclodontostomum у человека в доступной литературе обнаружить не удалось.
4 а) В учебно-методическом пособии А. А. Водянова с соавт. (2009) и в информационной справке «Имагинальные стронгилятозы желудочно-кишечного тракта и других сельскохозяйственных животных» (так работа названа у авторов - АВ) (studiopedia.org/10-22658.html) род Oesophagostomum включён в семейство Trichonematidae.
б) В Википедии (https://en.wikipedia.org/wiki/Oesophagostomum) данный род рассматривается в «семействе Strongyloidae» («family Strongyloidae»).
в) В монографии (Monnig, 1934) Oesophagostomum отнесён к семейству Strongylidae.
322
Рис. 127 Cyclodontostomum purvisi'. 1 - головной конец, дор-сально; 2 - головной конец, вид сбоку; 3 - передний конец тела; 4 - хвостовой конец самки; 5 -дорсальное ребро; 6 - бурса самца, вид сбоку (из: Скрябин и др., 1952-по: Adams, 1933)
Род Oesophagostomum Molin, 1861
Синонимы (по: Скрябин и др., 1952):
Hypostomum Stewart, 1898
Oesophagostomoides Schwartz, 1928 (в цастоящее время - валидный род)
Bosicola Sandground, 1929
Описание (по: разным авторам, в том числе: Скрябин и др., 1952; Anderson, 2000; Lichtenfels, 1980). Белые черви длиной до 15-25 мм. Рот направлен вперёд, либо слегка дорсально или вентрально. Передний конец тела с характерным цервикальным желобком, как бы отделяющим переднюю часть тела от остальной. Чёткая вздутая кутикула заканчивается округлым шейным воротником (пузырьком). На уровне пищевода от наружных слоёв кутикулы отходят хорошо развитые цервикальные сосочки, расположенные симметрично или слегка асимметрично. Иногда имеются латеральные крылья, слабо или мощно развитые. Ротовая капсула с тонкой стенкой и внутренними выступами, с наружной и внутренней радиальной короной с различным количеством щетинок. Пищеводная воронка с 3 слабо вооружёнными выгнутыми створками. Колокообразная бурса самцов со слабо развитой медианной лопастью. Вентральные рёбра параллельные и сомкнутые, доходят до края бурсы. Переднелатеральное ребро изолированное, до края бурсы не доходит. Медио- и постеролатеральные рёбра параллельные, соединённые, достигают края бурсы. Наружнодорсальное ребро отходит от дорсального. Дорсальное ребро раздвоено приблизительно на половину своей длины, от каждой ветви отделяется дополнительная рудиментарная ветвь, короткая и изогнутая. Спикулы равные, длинные, с крыльями, обычно скрученные в дистальной части. Рулёк имеется. Матки параллельные, направлены вперёд и оканчиваются позади середины тела. Вульва впереди ануса. Яйца овальные или эллипсовидные, тонкостенные, по форме похожи на таковые анкилостоматид; при откладке обычно содержат 16-32 клетки. Типовой вид - Oesophagostomum dentatum (Rudolphi, 1803) Molin, 1861.
323
Зрелая самка продуцирует до 5000 яиц в сутки, из которых выходят рабдитовидные личинки, ведущие свободный образ жизни и питающиеся бактериями. Эти личинки последовательно дважды линяют, в результате формируется филяриевидная личинка 3-й стадии, имеющая в длину 0.72 - 0.95 мм (Muller, 2002) и уже инвазионная для дефинитивного хозяина. Весь процесс занимает 6-7 дней (Dash, 1973). Окончательные хозяева заражаются, заглатывая личинок. Перкутанный способ заражения не известен. Попав в пищеварительный тракт животного, личинки внедряются в стенку тонкого кишечника, где примерно через 48 ч вокруг них формируется гранулёматозная ткань, вызывающая образование своеобразных узелков размером до 1.5 см и более, из-за чего эти нематоды даже получили название узелковых червей (nodule worms). Внутри узелков личинки линяют и переходят в 4-ю стадию, затем мигрируют в просвет кишечника, где проходят последнюю линьку и превращаются во взрослую стадию. Некоторые личинки достигают половозрелого состояния внутри узелков. Примерно через месяц после заражения в фекалиях животного появляются яйца паразита. Весь жизненный цикл паразита обычно завершается менее чем за 60 дней (рис. 128).
Рис. 128 Схема жизненного цикла нематод рода Oesophagostomum
Род Oesophagostomum - космополит и богат видами, более всего обычными в тропических и субтропических широтах. Взрослые черви питаются содержимым кишечника окончательного хозяина, каковыми для разных видов являются приматы - бабуины, макаки, шимпанзе, горилла, а также овцы, козы, крупный рогатый скот, дикие жвачные, свиньи. Нематоды могут вызывать диарею, при высокой интенсивности инвазии животные плохо едят, худеют; возможны очень серьёзные последствия, вплоть до летального исхода. Заражение домашнего скота эзофагостомами приводит к определённым экономическим потерям (Stewart, Gasbarre, 1989).
Полагают, что человек для Oesophagostomum - случайный хозяин (Palmer, Reeder, 1981). Первая информация о находке эзофагостомы у человека датируется 1905 годом: тогда были описаны паразиты, выделенные в 1902 г. Brumpt’ом из опухолей кишечника у 30-летнего мужчины из Южной Эфиопии (Railliet, Henry, 1905b). Второй аналогичный случай имел место в Бразилии: здесь во время амазонской экспедиции 1905 - 1909 гг. у скончавшегося от сильной дизентерии мужчины выявили О. stephanostomum (Thomas, 1910). В последующие годы спорадические находки нематод данного рода у людей регистрировались в Бразилии, Канаде, Индонезии, Малайзии, Китае, Брунее, на Филиппинах, но более всего в Африке, в том числе в Гане, Того, Нигерии, Зимбабве (Brack, 1987; Chabaud, Lariviere, 1958; Haaf, van Soest, 1964; Leiper, 1911; Wolferstan, 1910 и др.).
Ещё в 1970-е годы полагали, что заражение людей нематодами рода Oesophagostomum является очень редким заболеванием, а сам гельминт в организме человека не может завершить свой жизненный цикл (Barrowclough, Crome, 1978; Cha-
324
baud, Lariviere, 1958; Elmes, McAdam, 1954). В настоящее время все эти постулаты не получили подтверждения.
Заболевание, вызываемое Oesophagostomum, называют oesophagostomiasis или oesophagostomosis (эзофагостомиазис или эзофагостомозис), в ветеринарной практике - nodular worm (узелковый червь) (Muller, 2002; Stewart, Gasbarre, 1989).
Внедрившиеся в стенку кишечника, в основном толстого, личинки провоцируют воспалительную реакцию, приводящую к образованию узелков, внутри каждого из которых находится личинка, окружённая гнойным или некротическим материалом (Storey et al., 2000). При этом чёткой стенки вокруг этих узелков нет, а имеется слой макрофагов, эпителиальных клеток и фибробластов, зачастую с клетками плазмы и эозинофилами. Иногда внутри стенки кишечника образуются крупные узелки диаметром до 2 - 3 см, состоящие из многих мелких, размером с горошину. Эти узелки провоцируют образование в стенке кишечника абсцессов, фистул, опухолей (Baylet, Paillet, 1959). При локализации узелков под серозной оболочкой при пальпации по ходу толстой кишки у исхудавших больных можно определить плотные опухолевидные образования. Иногда узелки кальцифируются. Некоторые черви проникают через стенку кишечника в брюшную полость, вызывая серьёзные патологические изменения. На севере Ганы и Того, а также, возможно, на юге Буркина Фасо у пациентов часто обнаруживают эпигастральные или околопупочные вздутия, известные как «tumeur de Dapaong». Они могут сопровождаться сильной болью, закупоркой, а наличие абсцессов может потребовать хирургического вмешательства. Описан случай ректального кровотечения, вызванного паразитированием O»brumpti (=О. bifurcum) (Leoutsakds et al., 1977).
Наиболее частыми осложнениями при поражении человека эзофагостомами являются непроходимость кишечника или же инвагинация толстой кишки на уровне локализации паразитарных кист.
Симптомы заболевания варьируют от абдоминальной боли и диареи до кишечной непроходимости, связанной с образованием многочисленных узлов в стенке кишечника. Больные жалуются на отсутствие аппетита, потерю веса. Умеренная инвазия проходит без выраженных клинических признаков. В большинстве случаев заражение постепенно проходит само, без лечебного вмешательства (Muller, 2002).
Тем не менее, для лечения рекомендуют альбендазол в дозе 400 мг, или предпочтительнее, 10 мг кг1 массы тела ежедневно в течение 5 дней или же пиран-тела памоат (pyrantel pamoate) - две дозы по 10 мг кг1 массы тела (Muller, 2002; Ziem et al., 2006).
Диагностика во многом зависит от стадии заражения и связанной с этим патологией. Более того, заболевание может быть ошибочно диагностировано как амебома, карцинома толстой кишки, аппендицит или же туберкулёз подвздошной кишки (Muller, 2002).
Полагают, что единственный способ заражения человека, как и животных, орально-фекальный. Это утверждение основано, главным образом, на отсутствии данных о попадании личинок к окончательным хозяевам через кожу. Неизвестно также, могут ли эти личинки передаваться через воду и/или пищу. Поскольку биологический механизм передачи паразита всё ещё неясен, то предположение об орально-фекальной трансмиссии пока никак не объясняет, почему основной очаг заражения людей Oesophagostomum располагается в основном на севере Ганы и То
325
го. Возникает также много вопросов в связи с появившейся информацией о возможной передаче паразита от одного человека к другому.
Из всех видов Oesophagostomum, которых когда-либо находили у людей, с уверенностью можно говорить о трёх - О. aculeatum (von Linstow, 1879), О. bifurcum (Creplin, 1849) - основной вид, имеющий медицинское значение, и О. stepha-nostomum (Stossich, 1904). Кроме того, описан случай регистрации не определённого вида Oesophagostomum (sp.) в Малайзии у 8-летнего мальчика, страдавшего абдоминальными болями и исхуданием (Karim, Yang, 1992).
Oesophagostomum bifurcum (Creplin, 1849) \=Oesophagostomum apiostomum (Willach, 1891) Railliet et Henry, 1905 pro parte; =Oesophagostomum brumpti Railliet et Henry, 1905] (рис. 129). Видовое название: bifurcum - раздвоенный (скорее всего, подобное название было дано в связи с сильно раздвоенным дорсальным ребром).
Рис. 129 Oesophagostomum bifurcum, слева - головной конец тела самки, обнаруженной в фекалиях человека; справа - бурса самца (из: Polderman et al., 1991)
Самцы длиной 8.2 - 13.1 (в среднем 10.4), самки 11.0 - 16.8 (13.0) мм (Polderman et al., 1991). В наружной короне 10 - 12, внутренней - 20 - 24 щетинки. Вид отличается полиморфизмом в количестве щетинок в короне. Бурса симметричная, спикулы равные, 0.842 -1.113 мм. Размеры яиц 51 - 72 х 29 - 40 щи.
О. bifurcum - паразит обезьян и человека. Тем не менее, нематоды из человека и разных видов обезьян морфологически различаются, прежде всего, длиной и шириной тела, а также длиной пищевода и спикул (de Gruijter et al., 2006).
Во всём мире О. bifurcum у людей отмечается редко, но на северо-востоке Ганы и севере Того, а, возможно, и в Уганде - это обычный паразит местных жителей (Ghai et al., 2014; Polderman et al., 1991, 1999). Напомню, что первый случай заражения людей на севере Ганы был описан не так давно, - в 1964 г. (Haaf, van Soest, 1964). В настоящее время в отдельных регионах Африки заражённость местного населения О. bifurcum превышает 20 %. В частности, на севере Ганы и Того паразит поражает около 250 тыс. человек и более одного миллиона людей находятся в зоне риска (Yelifari et al., 2005; Ziem et al., 2006). В ряде деревень этого региона заражённость местных жителей варьирует от 48 до 90 % (Polderman et al., 1991, 1999; Pit et al., 1999; Yelifari et al., 2005).
Эзофагостомы довольно часто встречаются совместно с анкилостоматида-ми, однако дифференцировать этих нематод по выявленным в фекалиях яйцам
326
практически невозможно из-за их внешнего сходства. По этой причине обнаруженные при копроовоскопии яйца рекомендуется культивировать до получения личинок 3-й стадии (Polderman et al., 1991).
Oesophagostomum aculeatum (von Linstow, 1879) [^Oesophagostomum apios-tomum (Willach, 1891) Railliet et Henry, 1905 pro parte]. Видовое название: aculeatum - колючий, указывает на вооружение ротовой капсулы крепкими щетинками.
Ротовая капсула цилиндрическая. Наружная корона состоит из 10 заострённых щетинок, перемежающихся с 10 парами мелких шипов. Самцы длиной 8 -10 при ширине 0.3 - 0.35 мм. Бурса симметричная. Спикулы равные, длиной 1.15 мм. Самки длиной 11.5 - 19 и шириной 0.38 - 0.54 мм. Яйца 60 - 80 х 27 - 42 цт.
О. aculeatum паразитирует у обезьян, вызывая у тех так называемую узелковую болезнь. Первый случай заражения человека этой нематодой описан в Индонезии (Lie, 1949; Tan, Lie, 1953), второй - в Брунее (Ross et al., 1989). Второй случай примечателен тем, что червь был извлечён из безболезненной, трёхсантиметровой, содержащей коричневый гной опухоли на спине пациента. Как в данном случае паразит попал к человеку - неизвестно, но исследователи предположили, что это вполне могло быть перкутанное заражение.
Oesophagostomum stephanostomum (Stossich, 1904) (эзофагостом колючеротый). Описан на материале из толстого кишечника гориллы. Длина тела самцов 8 -24 при ширине 0.68 - 0.74 мм. Самки размером 18 - 30 х 0.74 - 0.9 мм.
Единственное сообщение о находке О. stephanostomum у человека - это упомянутый выше случай заражения скончавшегося в Бразилии мужчины (Thomas, 1910). При аутопсии в стенке подвздошной, толстой и двенадцатиперстной кишки усопшего насчитали 187 узелков, в каждом из которых находилось по одной незрелой нематоде - самке или самцу. Предполагается, что этот же паразит был обнаружен у человека в Суринаме (Muller, 2002; стр. 140).
Род Ternidens Railliet and Henry, 1909
Описание (по: Скрябин и др., 1952; Faust, 1949; Goldsmid, Lyons, 1973). Кутикула с поперечными кольцами. Передняя поверхность с 4 кнопкоподобными субмедианными папиллами и 2 латеральными амфидами. Ротовое отверстие направлено слегка дорсально, окружено двойной радиальной короной из 22 - 24 щетинок. Ротовая капсула терминальная, почти шаровидная. На дне капсулы имеются 3 сложных зуба, отходящих от 3 долек пищеводной воронки и состоящих из двух пластинок каждый. Головная везикула слабо развита. Имеется поперечный вентральный цервикальный желобок. Бурса чашеподобная. Вентральные рёбра сомкнуты. Антеро-латеральнос ребро изолированное, медио- и постеролатеральные рёбра соединённые. Наружнодорсальное ребро отходит от дорсального. Последнее раздвоено почти па половину своей длины, причём каждая ветвь заканчивается двумя вершинами. Спикулы длинные, равные. Губернакулюм в передней части узкий и толстый, сзади широкий и тонкий. Задний конец самок заужен. Вульва близ ануса. Яйца прозрачные, овальные. Паразиты приматов. Типовой и пока единственный вид - Ternidens deminutus (Railliet et Henry, 1905) Railliet et Henry, 1909.
327
Ternidens deminutus (^Triodontophorus deminutus Railliet et Henty, 1905; =Globocephalus macaci Smith, Fox et White, 1908) (рис. 130). Видовое название от: deminutus - малый, маленький.
Впервые нематод, известных в настоящее время как Ternidens deminutus, обнаружил в 1867 г. французский хирург Monestier при аутопсии жителя Мозамбика, скончавшегося в военном госпитале на Коморских о-вах (Amberson, Schwarz, 1952). Материал был отправлен в Национальный музей естественной истории в Париж, где он и оставался не определённым до 1905 г., когда его, наконец, описали под названием Triodontophorus deminutus (Railliet, Henry, 1905a). P. Лейпер отнёс к этому же виду нематоду, обнаруженную у молодой гориллы, скончавшейся в Лондонском зоологическом саду (Leiper, 1906; цит. по: Amberson, Schwarz, 1952). В 1909 г. для Triodontophorus deminutus был обоснован новый род - Ternidens, с типовым видом Т deminutus, который и по сей день остаётся единственным, известным в данном роде.
Рис. 131 Ternidens deminutus: А -передний конец тела; В - задний конец тела самца (из: Faust, 1949 -по: Railliet, Henry, 1905а)
Э. Фауст (Faust, 1949) приводит следующие размеры нематод: самцы 9.5 х 0.56, длина спикул 0.9, губернакулюм 0.107 х 0.053, самки 12 -16 х 0.73 мм, яйца 84 х 51 щи. Яйца при откладке содержат 8 клеток.
По (Muller, 2002): самцы 9.5 х 0.55, самки 12 - 16 х
0.65 - 0.75, длина спикул 0.9 мм, яйца 70 - 94 х 47 - 55 (в среднем 81 х 52) щп.
При сравнении особей нематод из павиана медвежьего и человека заметных морфологических различий между ними не обнаружилось, хотя средние размеры червей из обезьяны были несколько меньше в сравнении с особями из человека: самцы 7.96 ± 0.21 и самки 8.60 ± 0.19 против 9.67 ± 0.66 и 11.56 ± 0.81 мм соответственно (Goldsmid, Lyons, 1973).
Развитие яиц Т. deminutus, как и у всех Chabertiidae, происходит во внешней среде при оптимальной температуре 29°С. Через 30 ч из них выходят рабдитовидные личинки, ведущие свободный образ жизни и питающиеся бактериями. Эти личинки дважды линяют - соответственно на 6-й и 8 - 10-й день, в результате формируются личинки 3-й стадии, которые остаются внутри чехлика личинки 2-й стадии. Длина тела этих личинок 0.63 - 0.73, в среднем 0.68 мм (Muller, 2002).
Способ заражения окончательных хозяев достоверно не установлен. Попытки заразить обезьян личинками Т. deminutus перорально или же перкутанно потерпели неудачу. На этом основании было высказано предположение о возможном
участии в жизненном цикле нематод промежуточного хозяина, которым могут быть, например, термиты (Goldsmid, 1991). Вполне вероятно, что заражение приматов происходит с пищей, контаминированной личинками гельминта.
328
У человека эту нематоду отмечают в основном в центральных, восточных, юго-восточных и юго-западных странах африканского континента - Конго, Намибии, Танзании, Малави, Зимбабве, Маврикии (Goldsmid, 1968, 1974; Kilala, 1971; Kyronseppa, Goldsmid, 1978; Leiper, 1908; Sandground 1929; Van den Berghe, 1934 и др.). В Зимбабве в отдельных регионах местное население заражено на 60 - 87 % (Goldsmid, 1974). В 2005 г. появилось первое сообщение об обнаружении Т. deminutus у человека в Азии, а именно - в Таиланде (Hemsrichart, 2005). Пострадавшей оказалась 33-летняя женщина, поступившая в клинику из-за абдоминальной боли и непонятного образования в правом нижнем квадранте. При диагностической лапаротомии была выявлена сальниковая масса, присоединённая к концевому отделу подвздошной кишки. После операции по удалению этого образования вместе с частью подвздошной кишки и правосторонней толстой кишкой выяснилось, что образование представляло собой абсцесс с заключённым внутри незрелым самцом Т, deminutus.
По аналогии с процессом развития болезнетворного процесса у макак, заражённых Т. deminutus, предполагается, что попавшие в кишечник человека личинки внедряются в толщу его слизистой оболочки, образуя паразитарные узелки (Muller, 2002). Спустя 6-8 дней они вновь выходят в просвет кишки, прикрепляются к её стенке и постепенно превращаются в половозрелых особей, питающихся кровью хозяина. При этом черви вызывают не только изъязвления и узелки в кишечнике, как эзофагостомы, но и потерю крови, как анкилостоматиды. Заболевание сопровождается сонливостью, слабостью, тошнотой, отсутствием аппетита, потерей веса, у сильно поражённых лиц развивается анемия. Однако при слабой интенсивности инвазии возможно бессимптомное течение.
Диагноз ставится по результатам копроовоскопического анализа. Однако в силу внешнего сходства яиц Т. deminutus с таковыми анкилостоматид зачастую инвазию диагностируют как вызываемую вторыми, вследствие чего Т. deminutus даже получил название false hookworm (ложный, фальшивый).
Для лечения рекомендуют альбендазол в тех же дозах, что и при заражении анкил остомати дам и.
Таким образом, среди 6 видов нематод семейства Chabertiidae, которых до настоящего времени находили у человека, практически только один из них - Oesophagostomum bifurcum имеет столь широкое распространение в ряде африканских стран, что приобретает серьёзное медицинское и социально-экономическое значение. Однако отсутствие чёткой доказательной базы о путях попадания этих гельминтов к человеку в определённой степени тормозит и разработку соответствующих мер, направленных на предупреждение заражения ими людей.
Цитируемая литература
Водянов А. А., Луцук С. Н., Толоконников В. Н. Морфология, биология и лабораторная диагностика возбудителей инвазионных болезней животных. В 3 ч. Часть 1. Ветеринарная гельминтология: учебно-методическое пособие. - Ставрополь: АГРУ С, 2009. - 84 с.
Скрябин К. И., Шихобалова Н. П., Шульц Р. С, Попова Т. И., Боев С. К., Делямуре С. Л. Стронгиляты И Определитель паразитических нематод / Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1952. - 3. - С. 124, 248 - 264, 270.
Adams A. R. D. Report on a collection of Nematodes from the Federated Malay States // Ann. Trop. Med. Parasitol. - 1933.-27, l.-P. 1 - 13.
329
Amberson J. M., Schwarz E. Ternidens deminutus Railliet and Henry, a nematode parasite of man and primates П Ann. Trop. Med. Parasitol. - 1952. - 46, 3. - P. 227 - 237. doi: 10.1080/00034983.1952.11685527.
Ashford R. W., Crewe Ж The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. Second edition. - Taylor & Francis Inc., 2003. - 184 pp.
Baylet R. J., Paillet R. J. [Musculus abscess caused by Oesophagostomum] 11 Bull. Soc. Pathol. Exot. Filiales.
- 1959. - 52, 1. - P. 32 - 34. (Text in French).
Bhaibulaya M., Indrangarm S. Man, as an accidental host of Cyclodontostomum purvisi (Adams, 1933), and the occurrence in rats in Thailand 11 Southeast Asian J. Trop. Med. Publ. Health. - 1975. - 6, 3. - P. 191-194.
Brack M. Agents transmissible from Simians to man. - Springer-Verlag, 1987. - 453 pp.
ChabaudA. G., Lariviere M. Sur les Oesophagostomum parasites d’homme // Bull. Soc. Path. Exot. - 1958. -51,3.-P. 384-393.
Dash К. M The life cycle of Oesophagostomum columbianum (Curtice, 1890) in sheep // Int. J. Parasitol. -1973.-3, 6.-P. 843-851.
de GruijterJ. M., Blotkamp J„ Gasser R. B., Amponsah S.f Polderman A. M. Morphological variability within Oesophagostomum bifurcum among different primate species from Ghana // J. Helminthol. - 2006. - 80, 4. -P. 357-361.
Elmes B. G. T, McAdam I. Ж J. Helminthic abscess, a surgical complication of Oesophagostomes and hookworms 11 Ann. Trop. Med. Parasitol. - 1954. - 48, 1. - P. 1 - 7.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Ghai R. R., Chapman C. A., Omeja P. A., Davies T. J., Goldberg T L. Nodule worm infection in humans and wild primates in Uganda: Cryptic species in a newly identified region of human transmission H PLoS Negl. Trop. Dis.-2014.-8, l.-e2641. doi:10.1371/joumal.pntd.0002641.
Gibbons L. M. Keys to nematode parasites of vertebrates. Supplementary volume. - CABI, 2010. - 415 pp.
Goldsmid J. M. Studies on intestinal helminths in African patients at Harari Central Hospital, Rhodesia // Trans. R. Soc. Trop. Med. Hyg. - 1968.-62, 5. -P. 619-629. doi: 10.1016/0035-9203(68)90111-9.
Goldsmid J. M. The intestinal helminth zoonoses of primates in Rhodesia // Ann. Soc. beige M6d. Trop. -1974.-54, 2.-P. 87-101.
Goldsmid J. M. The African ‘hookworm’ problem: an overview / Macpherson C. N. L. and Craig P.S. (eds) Parasitic Helminths and Zoonoses in Africa. - Unwin Hyman, London, UK, 1991. - P. 101-137.
Goldsmid J. M., Lyons N. F. Studies on Ternidens deminutus Railliet & Henry, 1909 (Nematoda). 1. External morphology 11 J. Helminthol. - 1973. - 47, 2. - P. 119 - 126.
HaafE., van Soest A. H. Oesophagostomiasis in man in North Ghana // Trop. Geogr. Med. - 1964. - 16, 1. -P. 49-53.
Hemsrichart V. Ternidens deminutus infection: first pathological report of a human case in Asia // J. Med. Assoc. Thai. - 2005. - 88, 8. - P. 1140 - 1143.
Karim N:, Yang С. O. Oesophagostomiasis in man: report of the first Malaysian case with emphasis on its pathology // Malays. J. Pathol. - 1992. - 14, l.-P. 19-24.
Kilala С. P. Ternidens deminutus infecting man in Tanzania И E. Afr. Med. J. - 1971. - 48. - P. 636 - 645.
Kyronseppa H. J. P., Goldsmid J. M. Studies on the intestinal parasites in African patients in Owamboland, South West Africa И Trans. R. Soc. Trop. Med. Hyg. - 1978. - 72, 1. - P. 16 - 21 .doi: 10.1016/0035-9203(78)90291-2.
Leiper R. T The occurrence of a rare sclerostome of man in Nyasaland // J. Trop. Med. Hyg. - 1908. - 11. -P. 181-184.
Leiper R. T. The occurrence of Oesophagostomum apiostomum as an intestinal parasite of man in Nigeria // Trop. Med. Hyg. - 1911. - 14. - P. 116 - 118.
Leoutsakos B., Agnadi N., Kolisiatis S. Rectal bleeding due to Oesophagostomum brumpti'. report of a case H ’ Dis. Colon. Rectum. - 1977. - 20, 7. - P. 632 - 634.
Lichtenfels J. R. Keys to genera of the superfamily Strongyloidea I R. C. Anderson, A. G. Chabaud, S. Will-mott, eds. CIH Keys to the Nematode Parasites of Vertebrates. - Vol. 7. - CABI, Farnham Royal, Stough, U. K„ 1980.-41 pp.
Lie K. J. Helminthiasis of the intestinal wall caused by Oesophagostomum apiostomum (Willach, 1891) Railliet et Henry, 1905 // Neeri. Imdones. Morbis. Trop. - 1949. - 1, 1. - P. 75 - 80.
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
330
Palmer P. E. S, Reeder M. M. The imaging of tropical diseases, with epidemiological, pathological and clinical correlation. Vol.l, vol. 2. - Springer, 1981. - 1675 pp.
Pit D. S, Rijcken R E., Raspoort E. C., Baeta S. M., Poldeman A. M. Geographic distribution and epidemiology of Oesophagostomum bifurcum and hookworm infections in human in Togo // Am. J. Trop. Med. Hyg. - 1999.-61.-P. 951 -955.
Poldeman A. M.,Krepel H. P., Baeta S. M., BlotkampJ., Gigase P. Oesophagostomiasis, a common infection of man in northern Togo and Ghana // Am. J. Trop. Med. Hyg. - 1991. - 44, 3. - P. 334 - 344.
Poldeman A. M., Anemana S. D., Asigri И Human oesophagostomiasis: a regional health problem in Africa// Parasitol. Today. - 1999. - 15. - P. 129 - 130.
Railliet A., Henry A. Un nouveau sclerostomien (Triodontophorus deminutus nov. sp.) parasite de 1’homme H C. R. Sean. Soc. Biol. - 1905a. - 53. - P. 569 - 571.
Railliet A., Henry A. Encore un nouveau sclerostomien (Oesophagostomum brumpti nov. sp.) parasite de 1’homme 11 C. R. Sean. Soc. Biol. - 1905b. - 58. - P. 643 - 645.
Ross R. A., Gibson D. I., Harris E. A. Cutaneous oesophagostomiasis in man // Trans. R. Soc. Trop. Med. Hyg. - 1989. - 83, 3. - P. 394 - 395.
Sandground J. H. Ternidens deminutus (Railliet & Henry) as a parasite of man in Southern Rhodesia; together with observations and experimental infection studies on an unidentified nematode parasite of man from this region П Ann. Trop. Med. Parasitol. - 1929. - 23, 1. - P. 23 - 31. doi: 10.1080/00034983.1929.11684591.
Schindler A. R., de Gruijter J. M., Polderman A. M., Gasser R. B. Definition of genetic markers in nuclear ribosomal DNA for a neglected parasite of primates, Ternidens deminutus (Nematoda: Strongyiida) - diagnostic and epidemiological implications П Parasitol. - 2005. - 131, 4. - P. 539 - 546.
Stewart T., Gasbarre L. C. The veterinary importance of nodular worms (Oesophagostomum spp.) // Parasitol. Today. - 1989. - 5. - P. 209 - 213.
Storey P. A., Faile G., Hewitt E., Yelifari L. et al. Clinical epidemiology and classification of human oesophagostomiasis П Trans. R. Soc. Trop. Med. Hyg. - 2000. - 94, 2. - P. 177 - 182.
Tan K. S, Lie K. J. Redescription of Oesophagostomum apiostomum (Willach, 1891) Railliet and Henry, 1905 from man and monkeys in Indonesia 11 Trop. geogr. Med. - 1953. - 5, 2. - P. 123 - 127.
Thomas H. IV. The pathological report of a case of oesophagostomiasis in man // Ann. Trop. Med. Parasitol. -1910. - 4.-P. 57-88.
Van den Berghe L. L’existance de Ternidens deminutus au Katanga // Ann. Soc. Beige Med. Trop. - 1934. -14.-P. 189.
Wolferstan T. H. The pathological report of a case of Oesophagostomum brumpti in man H Ann. Trop. Med. Parasitol. - 1910.-4.-P. 57-88.
Yelifari L., Bloch P., Magnussen P., van Lieshout L., Dery G. et al. Distribution of human Oesophagostomum bifurcum, hookworm and Strongyloides stercoralis infections in northern Ghana П Trans. R. Soc. Trop. Med. Hyg. - 2005. - 99. - P. 32 - 38.
Ziem J. B., Magnussen P., Olsen A., Horton J., Asigri von L. L., Polderman A. M. Impact of repeated mass treatment on human Oesophagostomum and hookworm infections in northern Ghana П Trop. Med. Int. Health. - 2006. - 11, 11. - P. 1764 - 1772. doi: 10.1111 /j. 1365-3156.2006.01729.
Семейство Diploscapteridae Micoletzky, 1922
В информационной сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru) в числе представителей семейства Rhabditidae указан вид «Diploscapter coronata». Однако в подавляющем большинстве публикуемых в последние годы источников род Diploscapter Cobb, 1913 включают в состав семейства Diploscapteridae (Andrassy, 1983; Bohra, Sultana, 2012; Hodda, 2011; Vanaverbeke, 2015; Zhao et al., 2013), типовым родом которого он является.
Диплоскаптериды отличаются необычной для рабдитидных нематод билатерально симметричной головой; парные дорсальные и вентральные губы у них трансформированы в крючкоподобные образования (Andrassy, 1983; Bohra, Sultana, 2012). Амфиды маленькие, располагаются на латеральных губах. Стома рабдитоидная, длинная, трубчатая. Хейлостома не кутикулизирована, промезостома с параллельными стенками, метастома маленькая, невооружённая. Пищевод цилиндрический 331
или слегка вздутый. Хвост у обоих полов конический. Спикулы раздельные. Бурса узкая. Половых папилл 9 пар или меньше. Половые органы самки парные. Вульва медианная или субмедианная.
Семейство немногочисленное - всего 2 рода с 9 видами (Hodda, 2011), но его представители широко распространены по всему земному шару, что во многом обусловлено их образом жизни. Диплоскаптериды - наземные свободноживущие нематоды-бактериофаги, обитающие в почве, мху, соре, растительных остатках, возле разрушенных корней, в компосте, бытовых отходах, канализационных стоках. Тем не менее, один вид диплоскаптерид - Diploscapter coronatus (Cobb, 1893) -упоминается в нескольких публикациях в связи с его находкой у человека.
Род Diploscapter Cobb, 1913
Описание (по: Andrassy, 1983). С характерными чертами семейства. Очень мелкие нематоды, от 0.3 до 1.1 мм. Кутикула гладкая или с тонкой кольчатостью, иногда с тонкими продольными бороздками. На билатерально симметричной голове вентрально и дорсально располагаются парные крючкоподобные образования, латеральные губы также преобразованы, но в мембраноподобные структуры. Амфиды с маленькими отверстиями, находятся на латеральных губах. Стома трубчатая, в 3 - 4 раза длиннее диаметра головы. Эзофагеальный воротник имеется. Бурса открытая, умеренно развитая, с 6 - 9 папиллами. Яичники парные, вульва медианная или постмедианная. Типовой вид - Diploscapter coronatus (Cobb, 1893).
Diploscapter coronatus (Cobb, 1893) Cobb, 1913 (рис. 131, 132). Впервые описан под названием Rhabditis coronata по единственной самке, обнаруженной у корней на банановой плантации на Фиджи (Cobb, 1893). В 1913 г. тот же автор (Cobb, 1913) создал для этого вида новый род - Diploscapter с типовым видом Diploscapter coronata (Cobb, 1893). Видовое название нематоды можно перевести как украшенный венком, увенчанный, опоясанный.
Кутикула поперечно исчерчена (Eyualem et al., 1998; Hechler, 1968; Shan, Vaid, 2015). Головные папиллы отсутствуют. Две латеральные бороздки протянулись между основанием стомы и анусом. Амфиды непосредственно позади лопастей. Сосочки в центре лопастей легко различимы, а располагающиеся на субмедианных губах видны только при определённом ракурсе. Экскреторная пора противоположна медианному бульбусу. Участок тела между анусом и серединой хвоста с очень заметной кольчатостью. Фазмиды примерно в 15 pin позади ануса, маленькие и неприметные. Длина самцов 0.28 - 0.32 мм (Shan, Vaid, 2015). Хвост короткий, конический. Семенник один, вентрально загнут. Спикулы раздельные, 0.020 -0.023 мм, с маленьким дорсальным велюмом. Губернакулюм почти прямой, слегка загнут у проксимального конца, длиной 9-10 щп. Имеются 2 пары пре- и 5 пар постклоакальных папилл. Самки длиной 0.46 - 0.54 мм. Хвост удлинённоконический. Половая система амфидельфная, передняя ветвь - на правой, а задняя - на левой стороне кишечника. Каждая доля длиной 105 -170 цт. Сперматека не дифференцирована. Матка с длинной трубчатой и короткой мышечной частями. Вульва в виде поперечной щели. Для D. coronatus характерно партеногенетическое размножение (Lahl et al., 2006). Самцы встречаются необычайно редко. В одном из
332
исследований среди нескольких сотен тысяч самок обнаружили только 3 самцов (Hechler, 1968).
Рис. 131 Diploscapter coronatus: А - передний конец тела; В - область пищевода; С - задний конец самки (из: Andrassy, 1983)
Рис. 132 Diploscapter coronatus, самец (из: Shan, Vaid, 2015)
D. coronatus относится к группе геогельминтов. Разви
тие личинки до 1-й стадии происходит в яйце, а последующие четыре линьки - по-
сле того, как яйцо окажется во внешней среде. Примечательно, что в процессе сво
его развития все стадии личинок активно питаются, однако при отсутствии питания развитие приостанавливается (Hechler, 1968). Детально изучен морфогенез нематоды в процессе онтогенеза (Hechler, 1967, 1968). Личинки 1-й стадии имеют длину 0.18 - 0.19, 2-й- 0.20 - 0.23, 3-й - 0.24 - 0.32 и 4-й стадии - 0.32 - 0.36 мм.
D. coronatus ведёт свободноживущий образ жизни. Однако тот факт, что эти питающиеся бактериями нематоды поселяются в гниющих растительных остатках и прочей разлагающейся органике, предопределяет факт их возможного проникновения в живой организм при сопутствующих для этого обстоятельствах. Скорее
всего, именно так эти черви оказались в нарывах на теле содержащихся в неволе змей, у которых в некротическом содержимом узелков среди клещей и стадий их развития обнаружилось множество особей D. coronata (Sabu et al., 2002).
333
Однако каким путём эти нематоды могли попасть в желудок или мочевой пузырь человека - а именно там они обнаруживались, - можно только гадать.
Первое сообщение по этому поводу появилось в 1936 г. Тогда была описана находка D. coronatus в осадке мочи пожилой женщины, больной острым пиелонефритом (Yokogawa, 1936). Автор статьи подчёркивал, что нематоды были временными обитателями урогенитальной области.
Почти в то же время А. Чандлер (Chandler, 1938) сообщил об обнаружении большого количества особей D. coronatus на разных стадиях развития в рвотных массах 9 пациентов с недостаточностью или отсутствием соляной кислоты в желудочном соке. Возможно, что они попали в желудок с сырой растительной пищей.
Следующие два случая зафиксированы почти через 70 лет, уже в нынешнем столетии. Первый из них имел место в Центральном Таиланде. Здесь у 73-летней тайской женщины обнаружились многочисленные черви, похожие на анкилостом, но после фекальной культуры определённые как «JDiploscapter coronata» (Watthans-kulpanich et al., 2005). Какие-либо существенные клинические признаки поражения желудочно-кишечного тракта или мочеполовой системы у пациентки отсутствовали, и в целом она не ощущала себя больной в результате столь необычной инвазии.
Второй случай описан в Японии (Morimoto et al., 2006). На этот раз не характерные для человека паразитические нематоды и их яйца обнаружились в испражнениях 8-летней девочки, страдающей от геморрагического васкулита (пурпура Шёнлейна-Геноха). Взрослые самки достигали в длину 325.6 - 441.2 и в ширину 18.3 - 26.5 цт. Выявленных червей на основе характерной морфологии отнесли к «Z>. coronata». При культивировании фекалий больной через 7 дней обнаружились самцы и самки нематоды. Время выживания червей и процесс вылупления яиц исследовались в лабораторных условиях после очистки с искусственной желудочной или кишечной жидкостью. Оказалось, что взрослые черви в таких условиях выживали менее одной минуты, но яйца вылуплялись после обработки искусственным желудочным соком. По мнению авторов публикации, подобный факт говорит о том, что яйца D. coronatus^ случайно проглоченные или продуцируемые взрослыми особями, могут развиваться в кишечнике человека.
Скорее всего, перечисленные случаи демонстрируют возможность выживания D. coronatus при случайном попадании в организм человека и только при определённых условиях. По этой причине данную нематоду рассматривают псевдопаразитом человека (Gillani et al., 2012).
Тем не менее, медицинские работники должны быть предупреждены о потенциально серьезных последствиях, которые могут иметь место там, где люди контактируют со средой, загрязненной заражёнными фекалиями, или точнее, инвазионными яйцами D. coronatus (Watthanakulpanich et al., 2005).
Цитируемая литература
Andrassy I. A taxonomic review of the suborder Rhabditina (Nematoda: Secementia). - Orstom - Paris, 1983.-242 pp.
Bohra P., Sultana R. Nematodes of Thair Desert, Rajasthan П Rec. Zool. Surv. India. - 2012. - Occ. Paper No. 334.-P. 1-95.
Chandler A. C. Diplogaster coronata as a facultative parasite of man, with a general review of vertebrate parasitism by rhabditoid worms 11 Parasitol. - 1938. - 30, 1. - P. 40 - 45. DOI: http://dx.doi.org/! 0.1017/S0031182000010817.
334
Cobb N. A. Nematodes, mostly Australian and Fijian 11 Macleay Mem. Vol. Linn. Soc. N. S. W. - 1893. - P. 252-308.
Cobb N. A. New nematode genera found inhabiting fresh water and non-brackish soil // J. Wash. Acad. Sci. -1913.-3.-P. 432-444.
Eyualem A., Karegar A., Nabil H, De Ley P. A redescription and ultrastructural study of Diploscapter coronatus (Cobb, 1893) Cobb, 1913 from Ethiopia and Iran // Russ. J. Nematology. - 1998. - 6, l.-P. 17-22.
Gillani S. W., Sari Y. O., Baig A. A., Baig M. Helminthiasis; Clinical insights. - Said Wasif Gillani, 2012. -111 pp.
Hechler H. C. Morphological changes during the molt of Diploscapter coronata (Nematoda: Rhabditidae) П Proc. Helm. Soc. Wash. - 1967. - 34.-P. 151 - 155.
Hechler H. C. Postembryonic development and reproduction in Diploscapter coronata (Nematoda: Rhabditidae) 11 Proc. Helm. Soc. Wash. - 1968. - 35, 1. - P. 24 - 30.
Lahl V, Sadler B., Schierenberg E. Egg development in parthenogenetic nematodes: variations in meiosis and axis formation 11 Int. J. Dev. Biol. - 2006. - 50. - P. 393 - 398. doi: 10.1387/ijdb.052030vl.
Morimoto N, Korenaga M., Yagyu K., Kagei N., Fujieda M. et al. Morphological observations and the effects of artificial digestive fluids on the survival of Diploscapter coronata from a Japanese patient // J. Helminthol. - 2006. - 80, 4. - P. 341 - 348.
Sabu L., Devada K„ Subramanian H., Cheeran J. V. Diploscapter coronata (COBB, 1893) infestation in captive snakes // Zoos. Print J. - 2002. - 17. - P. 954 - 956. DOI: 10.11609/JoTT.ZPJ. 17.12.954-6.
Shah A. A., Vaid S. Description of Sclerorhabditis miniata n. sp. and first description of male of Diploscapter coronatus Cobb, 1913 (Nematoda: Rhabditidae) // J. Nematology. - 2015. - 47, 2. - P. 153 - 158.
Vanaverbeke J. Diploscapteridae Micoletzky, 1922. Accessed through: World Register of Marine Species (2015). at http://www.marinespecies.org/aphia.php?p=taxdetails&id=834867 on 2016-08-07.
Watthanskulpanich D., Anantaphruti M. T., Maikpanich IV. Diploscapter coronata infection in Thailand: report of the first case П Southeast Asian J. Trop. Med. Public Health. - 2005. - 36, Suppl. 4. - P. 99 - 101.
Yokogawa S. A human case of accidental parasitism of Diploscapter coronata (Cobb, 1893) Cobb, 1913 H Zool. Mag. Tokyo. - 1936. - 48, 8/10. - P. 507 - 511. (In Japanese; English summary p. 507).
Zhao Z. Q., Davies K. A., B^renton-Rule E. C, Grangier J, Gruber M. A. M. et al. Diploscapter formicidae sp. n. (Rhabditida: Diploscapteridae), from the ant Prolasius advenus (Hymenoptera: Formicidae) in New Zealand // Nematology. - 2013. - 15. - P. 109 - 123. Doi 10.1163/156854112X649828.
Семейство Meloidogynidae Skarbilovich, 1959
В ряде публикаций можно встретить информацию о находках в фекалиях человека яиц нематод рода Meloidogyne Goldi, 1887 из семейства Meloidogynidae.
Семейство объединяет 3 рода облигатных эндопаразитов растений, так называемых галлообразующих, или галловых, нематод, поселяющихся на корнях диких и культурных растений - овощных, зерно-бобовых, ягодных, цветочнодекоративных и т.д. При этом мелойдогиниды не только истощают растения, но и способствуют развитию вирусных, бактериальных и грибковых заболеваний, и потому имеют важное экономическое значение в зонах своего распространения. В англоязычной литературе этих нематод называют root-knot nematodes.
Для мелойдогинид характерен резко выраженный половой диморфизм. Самки неподвижны и примечательны своей раздутой, удлинённо-овальной, лимо-но-, бутылко-, груше- или шаровидной формой. Самцы подвижные, червеобразной формы. Самцы могут вообще отсутствовать, и тогда размножение происходит партеногенетическим путём.
Жизненный цикл мелойдогинид прямой, без промежуточного хозяина. Самка откладывает яйца в особый желатиноподобный яйцевой мешок, выделяемый специальными ректальными железами. Репродуктивный период у самок длится 2 -3 месяца, за это время она откладывает до 2500 яиц. После линьки личинка 2-й стадии покидает яйцо и проникает в корень растения. Её дальнейшее развитие с 335
соответствующими последовательными линьками до формирования половозрелой особи протекает в течение примерно 3 недель и зависит от температуры. Личинки 2-й стадии отличаются высокой жизнестойкостью и способны в течение 8-12 месяцев сохранять жизнеспособность даже при отсутствии растения-хозяина.
В составе упомянутого выше рода Meloidogyne к настоящему времени описано около 100 видов (Казаченко, Мухина, 2013). Более всего мелойдогины распространены в странах с влажным тропическим и субтропическим климатом, однако отдельные виды встречаются и в умеренной зоне, особенно в условиях тепличных хозяйств.
Довольно продолжительное время этих нематод относили к роду Heterodera Schmidt, 1871, и именно под таким родовым названием можно встретить описание яиц мелойдогин, обнаруженных у человека (см., напр., Blackie, 1932; Keller, 1935 -как Heterodera radicicola', Buckley, 1946, - как Heterodera marioni) (см. рис. 133).
Рис. 133 Meloidogyne marioni: 1 - 4 - стадии созревания яйца (из: Sandground, 1923); 5 - передний конец тела (из: Faust, 1949 - по: Cobb; как Heterodera marioni)
Яйца мелойдогинид впервые были выявлены в фекалиях американских военнослужащих в Первую мировую войну (Kofoid, White, 1919). При скрининге проб от 140 тыс. солдат яйца обнаружились у 429 (0.3 %). Авторы описали их как Oxyuris incognita. Через несколько лет Д. Сэндграунд (Sandground, 1923) в результате экспериментальных исследований доказал, что в действительности то были яйца растительных нематод, которых в те годы относили к семейству Heteroderidae. В течение последующих 40 лет сообщения о находках яиц Meloidogyne в фекалиях людей появлялись всё реже, и чаще всего были приурочены к африканским странам (Blackie, 1932; Buckley, 1946; Elsdon-Dew, 1952; Elsdon-Dew, Freedman, 1952; Goldsmid, 1968, 1970; Keller, 1935). После 1970 г. подобных случаев больше не фиксировали. Одна из возможных причин этого кроется во всё меньшем употреблении населением, особенно в урбанизированных районах, свежей растительной пищи. Тем не менее, замечу, что ещё в 1935 г. А. Келлер (Keller, 1935) подчёркивал возможность ошибочного определения яиц мелойдогинид, выявленных в фекалиях человека, которые легко можно принять за яйца аскарисов или анкилостомов.
В 2015 г. после длительного перерыва медицинские паразитологи напомнили мировому сообществу, что Meloidogyne. как транзитный паразит человека, хотя и позабыт, но не исчез (Bradbury, Speare, 2015). Яйца этих нематод были выявлены в фекалиях 3 из 586 человек, обследованных в двух деревнях на одном из Соломоновых островов.
336
И всё же, мелойгониды не относятся к числу нематод, могущих паразитировать у человека, а их обнаружение при копроовоскопическом анализе является наглядной иллюстрацией так называемого ложного паразитизма. И ещё немаловажная деталь: наличие яиц мелойгонид в фекалиях человека не может служить «сигналом» для назначения антигельминтозного лечения (Keller, 1935).
Цитируемая литература
Казаченко И. П., Мухина Т. И. Корневые галловые нематоды рода Meloidogyne Goeldi (Tylenchida: Meloidogynidae) мировой фауны. - Владивосток: Дальнаука, 2013. - 306 с.
Blackei ИС К. A helminthological survey of Southern Rhodesia 11 Mem. Ser. No. 5 London Sch. Hyg. Trop. Med. - London, England, 1932.
Bradbury R. S., Speare R. Passage of Meloidogyne eggs in human stool: forgotten, but not gone // J. Clin. Microbiol.-2015.-53, 4.-P. 1458- 1459. Doi: 10.1128/JCM/03384-14.
Buckley J. J. C. A helminthological survey of Northern Rhodesia // J. Helminthol. - 1946. - 21, 4. - P. 111-174. doi: 10.1017/S0022149X00032041.
Els don-Dew R. Heterodera in man 11 S. Afr. Med. J. - 1953. - 27, 7. - P. 140-141.
Elsdon-Dew R., Freedman L. Intestinal parasites in the Natal Bantu 11 S. Afr. J. Clin. Sci. - 1952. - 3, 2. - P. 59-65.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Goldsmid J. M. Spurious parasites recovered from stools and urines in Rhodesia H Centr. Afr. J. Med. - 1970. -16, 8.-P. 173- 178.
Keller A. E. The occurrence of eggs of Heterodera radicicola in human feces 11 J. Lab. Clin. Med. - 1935. -20, 4. - P. 390 - 392.
Kofoid C. A., White A. W. A new nematode infection of man 11 J. Am. Med. Ass. - 1919. - 72. - P. 567 - 579. http://dx.doi.org/10.1001 /jama. 1919.02610080033010.
Sandground J. H. «Oxyuris incognita» or «Heterodera radicicola»fl 11 J. Parasitol. - 1923. - 10. - P. 92 - 94.
Семейство Mermithidae Braun, 1883
Семейство включают в класс Dorilaimea в составе отряда Mermithida (Харченко, 2014; Capi-nera, 2011; Hodda, 2011) или в класс Enoplea в подклассе Dorilaimia (De Ley, Blaxter, 2002)..
Описание (по разным авторам). Тонкие нитевидные черви, длиной до 10 - 20 см и более и диаметром 0.2 - 0.5 мм, с округлённой головой, несущей сосочковидные рецепторы, и заострённым коническим или тупо округлённым хвостом. Поверхность кутикулы гладкая, тонко исчерченная, под кутикулой вдоль тела проходят перекрещивающиеся боковые, спинные и брюшные волокна. Кишечная полость отсутствует. Пищевод представляет собой сильно вытянутую в длину кутикулярную трубку со склеротизированными стенками, окружённую рядами клеток с крупными ядрами. Кишечный канал окружён развитым жировым телом, придающим нематоде белый цвет. Кишечник у ряда видов отсутствует. Поступление пищи из гемолимфы насекомого-хозяина происходит непосредственно через поверхность тела, а затем через стенки пищевода. Взрослые черви не питаются. Анальное отверстие ясно различимо лишь у самцов, через него наружу выходит сперма, и выдвигаются спикулы. Хвостовой конец самца с многочисленными сосочками. Клоака самок в виде небольшого углубления в кутикуле. Вульва в средней части тела. Яичники длинные, их вершины светлые, в остальной части тёмные вследствие накопления в половых клетках - будущих яйцах - значительного количества желтка. Типовой род - Mermis Dujardin, 1842.
337
Жизненный цикл мермитид изучен достаточно полно (Харченко, 2013; Baker, Capinera, 1997; Capinera, 1987, 2011; Christie, 1937; Baylis, 1944; Poinar, 1983 и др.). Взрослые особи - наземные свободноживущие черви, тогда как личинки ведут паразитический образ жизни, поселяясь в полости тела насекомых, а также некоторых других беспозвоночных - ракообразных, паукообразных, многоножек, моллюсков, дождевых червей, пиявок.
У большинства родов мермитид самки обычно откладывают яйца в воду, у некоторых - на почву, а вышедшие из них личинки активно проникают в беспозвоночных. Исключение составляют виды Mermis, чьи самки покидают почву и откладывают яйца на листву, травинки во время дождя или сразу после него (рис. 134, 135). Яйца остаются жизнеспособными в течение всего лета. Насекомые, поедая листья, траву, заглатывают вместе с едой и яйца паразита. Яйца Mermis покрыты оболочкой с полярными утолщениями, которые продолжаются двумя пучками тонких, ветвящихся филаментов. Пока яйца находятся в матке червя, филаменты прилегают к оболочке, но после откладки распрямляются и служат своеобразным приспособлением для прикрепления яйца к субстрату.
Рис. 134 Mermis nigrescens*. вверху - яйца нематоды на листе (из: Capinera, 2011; фото: John Capinera); внизу - яйцо с расправленными филаментами (из: Capinera, 2011 -по: Nickle, 1971)
Рис. 135 Mermis nigrescens*. а - самка, заползающая на травинку для откладки яиц; b - яйцо с полярными утолщениями оболочки и отходящими от них разветвлёнными филаментами (из: Goodye, 1951)
У некоторых видов, поражающих пауков, в жизненный цикл могут включаться паратонические хозяева, поедая которых пауки приобретают и личинок нематод (Lewbart, 2012). В теле беспозвоночного животного личинки линяют, растут, а достигнув взрослого, но ещё не половозрелого состояния, покидают хозяина, 338
пробуравливая отверстие в стенках его тела, что обычно оказывается фатальным для него. В связи с этим, мермитиды приобретают значение в качестве биологического метода борьбы с вредными насекомыми, а также с насекомыми - переносчиками заболеваний человека (Achinelly, Camino, 2005; Petersen, 1973; Petersen, Willis, 1972). Иногда личинки выходят через анальное или ротовое отверстие. Живущие во влажной почве нематоды не питаются, ещё раз линяют и собираются в своеобразные клубки, состоящие из самки и нескольких самцов. Взрослые особи достигают половозрелости в течение нескольких месяцев, иногда этот период длится до 2 лет (Gans, Burr, 1994). Самцы после спаривания погибают.
Полагают, что мермитиды принадлежат к одним из наиболее древних массовых паразитов беспозвоночных на Земле (Харченко, 2013, 2014). Об этом, в частности, свидетельствуют их находки в пауке из доминиканского янтаря, а также в палочнике, пауке, ручейнике, чешуекрылых из балтийского янтаря, возраст которого насчитывает 40 - 50 млн. лет (Poinar, 2000, 2011), или же в ископаемом жуке из каменноугольных отложений эоцена (Харченко, 2014).
Состав семейства изучен слабо, что связано с трудностями определения мермитид, особенно на стадии личинки, а также продолжительным циклом развития, затрудняющим их экспериментальное выращивание. К тому же, значительное число видов описано энтомологами при обнаружении червей в поражённых насекомых, т.е. по личиночным формам, а их названия зачастую не сопровождались соответствующим квалифицированным описанием (Харченко, 2014). По этой причине количество родов и видов, приводимое разными авторами, сильно варьирует. Согласно, например, сводке (Hodda, 2011), в состав семейства входят 102 рода с 599 видами. По данным Н. А. Харченко (2014), семейство объединяет 45 валидных родов с 615 видами. Примечательно, что виды, описанные по личиночным формам, принято относить к условному роду Agamomermis Stiles, 1903. Н. А. Харченко (2014) отнёс к этому роду также и 19 родов, обоснованных только по личинкам.
Сообщения об обнаружении мермитид у людей чрезвычайно редки. С середины 19 в. и по настоящее время таковых во всём мире насчитывается менее 10.
В 1926 г. был опубликован «Определитель-каталог червей, обнаруженных у человека» (Stiles, Hassall, 1926), в котором, среди прочих нематод, упоминаются два вида мермитид5. Первый из них описан в 1850-м, а второй - в 1880 гг. (Leidy, 1880). В первом случае речь шла о личинке Agamomermis hominis oris длиной около 14 см, найденной во рту ребёнка, во втором - о личинке A. restiformis длиной 65 см и диаметром 1.5 мм, пытавшейся выйти из мочеиспускательного канала мужчины6. Третий случай описан в 1927 г.: червь был выявлен у женщины, больной раком матки (Baylis, 1927). Далее сообщается об обнаружении Agamomermis у 5-летней девочки из Эквадора, страдавшей диареей и абдоминальными болями (Leon, 1946).
Находку зрелой самки Mermis nigrescens Dujardin, 1842 во рту месячного ребёнка в Орегоне (США) связывают с возможностью заноса паразита в дом на шерсти собаки или кошки с последующим проникновением нематоды, привлечённой влажностью, в ротовую полость ребёнка (Poinar, Hoberg, 1988).
5 Информация о регистрации мермитид у человека до 1949 г. из монографии (Faust, 1949).
6 Саму работу (Leidy, 1880), в которой сообщалось об этом паразите, найти не удалось, а информация о ней содержится в монографии Э. Фауста. Кстати, паразита первоначально описали как Filaria restiformis, а к роду Agamomermis его отнесли позже (Stiles, 1908).
339
Кстати, Mermis nigrescens (рис. 136) - типовой вид рода - впервые найден во Франции на листве после дождя (Dujardin, 1842). Описывая новый вид (род) автор предположил, что личинки нематод, определяемые ранее как Gordius L., 1766 в действительности могут относиться к Mermis. С 1842 г. было описано свыше 100 видов Mermis, но к настоящему времени в нём достоверными рассматривают только 11 видов (Presswell et al., 2015).
Рис. 136 Mermis nigrescens (из: https://en.wikipedia. org/wiki/Mermis_nigrescens)
Находки у людей перечисленных видов, а также Mermis sp., выявленного в моче местного жителя на о. Сикоко (Япония), исследователи рассматривают случайными для человека, представляющими примеры так называемого ложного паразитизма (Hasegawa et al., 1996). Однако одну находку, по мнению некоторых авторов (Muller, 2002), предположительно можно отнести к случаю реального паразитизма мермитид у человека. В Нигерии у местного жителя обнаружили самца мер-митиды в скоплении серозной жидкости между листками серозной оболочки яичка (Hunt et al., 1984). Неизвестно, как в данном случае произошло заражение человека.
Цитируемая литература
Харченко Н. А. Мермитиды - полостные паразиты беспозвоночных животных. - Воронеж: Воронежская гос. лесотехнич. академия, 2010. -475 с.
Харченко Н. А. Особенности биологии и экологии мермитид (Mermithida, Nematoda) - полостных паразитов беспозвоночных животных И Лесотехнич. журн. - 2013. - № 2 (10). - С. 155 - 167.
Харченко Н. А. География мермитид (Mermithida, Nematoda) - полостных паразитов беспозвоночных животных // Лесотехнич. журн. - 2014. - № 2. - С. 78 - 93.
Achinelly М. F., Camino N. В. Evaluation of the mosquitoes Aedes aegypti and Culex pip/ens(Diptera: Culi-cidae) as alternative hosts for laboratory mass-rearing of Strelkovimermis spiculatus (Nematoda: Mermithi-dae) // Nematology. - 2005. - 2005. - 7, 2. - P. 281 - 284.
Baker G. L, Capinera J. L. Nematodes and nematomorphs as control agents of grasshoppers and locusts H Mem. EntomoL Soc. Canada. - 1997. - 171. - P. 157-211.
Baylis H. A. Notes on two gordiids and a mermithid said to have been parasitic in man // Trans. Roy. Soc. Trop. Med. Hyg. - 1927. - 21. - P. 203 - 206.
Baylis H. A. Observations on the nematode Mermis nigrescens and related species И Parasitol. - 1944. - 36. -P. 122- 132.
Capinera J. L. Observationa on natural and experimental parasitism of insects by Mermis nigrescens Dujardin (Nematoda: Mermithidae) H J. Kanzas Entomol. Soc. - 1987. - 60, l.-P. 159 - 162.
Capinera J. Grasshopper nematode, Mermis nigrescens H EENY-500. University of Florida, 1FAS. 2011. Christie J. Mermis subnigrescens, a nematode parasite of grasshoppers // J. Agricult. Res. - 1937. - 55. - P. 353-364.
De Ley P., Blaxter M. Systematic position and phylogeny I The biology of nematodes. - Ed. D. L. Lee. -London, N. Y.: Taylor & Francis, 2002. - P. 1 - 59.
Dujardin F. Mdmoire sur la structure anatomique des Gordius et d’un autre helminthe, le Mermis, qu’on a confondu avec eux // Annis Sci. nat. Ser. II. - 1842. -18. - P. 129-151.
Gans C., Burr A. H. Unique locomotory mechanism of Mermis nigrescens, a large nematode that crawls over soil and climbs through vegetation 11 J. Morphol. - 1994. - 222. - P. 133 - 148.
Goodey T. Soil and freshwater nematodes. A monograph. - London, New York, 1951. - 390 pp.
Hasegawa H, Korenaga M., Kumazawa H, Imamawa K. Mermis sp. found from human urine in Kochi Prefecture, Japan (Nematoda: Mermithidae) // Japan. J. Parasitol. - 1996. - 45, 1. - P. 43 - 46.
340
Hunt D. J., Muller R., Hellyar A. G., Payne S. R. Mermithid in man // Trans. R. S. Trop. Med. Hyg. - 1984. -78. - P. 698 - 700.
Leidy J. On a filarial reported to have come from a man 11 Proc. Acad. Nat. Soc. Philadelphia. - 1880. - 32. -P. 130.
Ledn L. A. Cuarto caso de infeccion humana por Agamomermis И Rev. Med. Trop., Haban. - 1946. -12. - P. 25.
Lewbart G. A. Invertebrate Medicine. 2th Edition. - Wiley-Blackwell, 2012. - 507 pp.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Nickle Ж R. A contribution to our knowledge of the Mermithidae (Nematoda) // J. Nematol. - 1971. - 4. - P. 113-146.
Petersen J. J. Role of mermithid nematodes in biological control of mosquitoes // Exp. Parasitol. - 1973. -33.-P. 239-247.
Petersen J. J, Willis O. R. Procedures for the mass rearing of a mermithid parasite of mosquitoes // Mosq. News. - 1972. - 32. - P. 226 - 230.
Poinar G., Jr. Heydenius araneus n.sp. (Nematoda: Mermithidae), a parasite of a fossil spider, with an examination of helminths from extant spiders (Arachnida: Araneae) И Invert. Biol. - 2000. -119,4. - P. 388 - 393.
Poinar G. O., Jr. New fossil nematodes in Dominican and Baltic amber. - 2011. - https://core.ac.uk/ down-load/fdes/197/10197662.pdf.
Poinar G. O., Jr., Hoberg E. P. Mermis nigrescens (Mermithidae: Nematoda) recovered from the mouth of a child // Am. J. Trop. Med. Hyg. - 1988. - 39, 5. - P. 478 - 479.
Presswell B., Evans S., Poulin R., Jorge F. Morphological and molecular characterization of Mermis nigrescens Dujardin, 1842 (Nematoda: Mermithidae) parasitizing the introduced European earwig (Dermaptera: Forficulidae) in New Zealand // J. Helminthol. - 2015. - 89. - P. 267 - 276.
Stiles C. W. A reexamination of the type specimen of Filaria restiformis Leidy, 1880, Agamomermis restiformis // Bull. U. S. Hyg. Lab. - 1908. - No. 40. - P. 19.
Stiles C. W., Hassall A. Key-catalogue of the worms reported for man П Bull. U. S. Hyg. Lab. - 1926. - No. 142.-P. 113-162.
Семейство Metastrongylidae Leiper, 1912
В. Л. Контримавичус с соавт. (1976) отнесли семейство к отряду Strongylata. В более поздних публикациях семейство можно встретить в классе Chromadorea в составе отряда Rhabdi-tida (Hodda, 2011) или же в классе Secementea в составе отряда Strongylida (Fauna Europea. Taxon Tree - www/faunaeur.org).
Нематоды с гладкой кутикулой. Головной конец с 2 мощными трёхлопастными или 6 мелкими губами. Бурса самца хорошо развитая, но с атипичными рёбрами, или же редуцирована. Спикул две. Губернакулюм имеется или отсутствует. Вульва на заднем конце тела. Паразиты сумчатых, насекомоядных и парнокопытных. Типовой род - Metastrongylus Molin, 1861.
К Metastrongylidae относят 65 родов с 289 видами, распределёнными между 8 подсемействами (Hodda, 2011). Случаи регистрации метастронгилид у человека чрезвычайно редки, все они относятся к роду Metastrongylus.
Род Metastrongylus Molin, 1861
Описание (по: Контримавичус и др., 1976). Кутикула гладкая, с продолговатой (у некоторых форм с поперечной) исчерченностью. Головной конец с двумя латеральными трёхлопастными губами. Бурса хорошо развитая, но несколько атипичная, с укороченными рёбрами. Вентральные рёбра отходят общим стволом. Латеральные рёбра с общим основанием, переднелатеральное ребро - самое крупное. Дорсальное ребро небольшое, глубоко расщеплённое, наружнодорсальное ребро
341
короткое, тонкое, лежит отдельно от остальных. Вульва в задней части тела близ ануса. Яйца с толстой оболочкой, содержат личинку. Личинка 1-й стадии с рабди-тоидным пищеводом. Развитие с участием промежуточных хозяев. Типовой вид -Metastrongylus elongatus (Dujardin, 1846) Railliet et Henry, 1911.
Названный вид до недавнего времени являлся единственным, регистрируемым у людей. В 2016 г. появилось сообщение о находке другого представителя рода -М. salmi Gedoelst, 1923 у человека в Эквадоре (Calvopina et al., 2016).
Metastrongylus elongatus (Dujardin, 1846) Railliet et Henry, 1911 (рис. 137, 138). Этого паразита находили в лёгких свиней ещё в 18-м столетии, но описывали тогда под названиями Gordius pulmonaris apri Ebel, 1778, Ascaris filiformis Schrank, 1788, Ascaris apri Gmelin, 1790. Э. Фауст (Faust, 1949) перечисляет в синонимах M. elongatus 9 видов, В. Л. Контримавичус с соавт. (1976) - 14. Видовое название -elongatus переводится как «отдалённый».
Длинные нитевидные черви кремового или коричневого цвета (Контри- ма-вичус и др., 1976; Faust, 1949). Кутикула с продольной исчерченностью. Средняя лопасть губ - самая крупная. У основания каждой губы имеется по сосочку. Ротовая капсула практически отсутствует. На латеральных сторонах тела на уровне экскреторного отверстия расположены шейные сосочки. Пищевод удлинённый, в задней части слегка булавовидный. Самец длиной 11 - 25, шириной 0.12 - 0.22 мм. Переднелатеральное ребро грибообразной формы, оканчивается широкой шляпкой. Спикулы очень длинные, 3.7 - 5.53 мм, нитевидные, с крыловидным придатком и одинарным крючком на конце. Рулёк отсутствует. Самки длиной 28 - 50 и шириной до 0.45 мм. Задний конец самки сильно изогнут. Хвост сравнительно тонкий, ост-
рый. Вульва прикрыта мощным шаровид ным клапаном. Яйца округло- овальные, со слегка бугристой оболочкой, серого цвета, 45-60 х 30 - 41 pm. Э. Фауст (Faust, 1949) отмечает большую вариабельность размеров яиц и приводит следующие цифры: 57 - 100 х 39 - 72 pm.
Рис. 137 Metastrongylus elongatus: А - задний конец тела самца с бурсой и спикулами; В - окончание спикулы; С- задний конец тела самки (из: Faust, 1949)
Эмбриональное развитие яиц М. elongatus происходит в матке и завершается формированием личинки 1-й стадии. Яйца, содержащие личинок, откладываются в просвет дыхательных путей животного-хозяина, откуда при кашле они попадают в ротовую полость, а затем заглатываются. Продвигаясь по пищеварительному тракту, яйца в конечном итоге вместе с фекальными массами попадают во внешнюю среду. Во влажной почве личинки покидают яйцо, но для дальнейшего развития им необходимо попасть в промежуточного хозяина, каковым для данного вида являются дождевые черви (Schwartz, Alicata, 1929).
342
Рис. 138 Metastrongylus elongatus'. I - хвостовой конец самца со спикулами, дорсовентраль-но; 2 - бурса самца, дорсовентрально; 3 - участок спикулы; 4 - дистальный конец спикулы; 5 - головной конец, апикально; 6 - передний конец тела, вид сбоку; 7 - хвостовой конец самки, вид сбоку; 8 - яйцо (с личинкой) (из: Контримавичус и др., 1976 - по: Шульц, Каминский, 1937 - 7, 2, 4, 5, 6; Шульц, из архива К. И. Скрябина - 3; Hollo, 1965 - как Metastrongylus apri - 7)
Попав в пищеварительный тракт дождевого червя, личинки через стенку пищевода или желудка проникают в его кровеносные сосуды, где через 2-3 дня становятся неподвижными и свёртываются дугообразно. Проделав две линьки, личинки достигают инвазионного состояния в течение 10-25 дней. Свиньи и другие животные заражаются, поедая дождевых червей. Освободившиеся после переваривания червей личинки проникают через стенку кишечника в брыжеечные лимфатические узлы, а затем гематогенным путем заносятся в дыхательные пути.
Развитие до половозрелой стадии в организме дефинитивного хозяина занимает 25 -35 дней. Срок жизни М. elongatus у свиней - 6 - 12 мес. (Гефтер, 1968).
Дефинитивные хозяева М. elongatus домашние и дикие свиньи, а также крупный рогатый скот, овцы, козы, косуля, собака, у которых черви поселяются в трахее и задних долях лёгких. Вид включают в число опасных для свиней паразитов, который, к тому же, участвует в передаче вирусных болезней этих животных.
343
По состоянию на 1949 г. в мире было известно 3 случая обнаружения М. elongatus у человека, о которых упоминает Э. Фауст (Faust, 1949). Первый из них описан в 1845 г., тогда паразита нашли у 6-летнего мальчика (Diesing, 1845). Через 10 лет появилась информация о втором случае обнаружения нематоды у человека (Rainey, 1855). И, наконец, в третьем сообщении шла речь о находке этого гельминта в пищеварительном тракте продавца свинины (Chatin, 1888).
Эту же информацию приводит в обзорной статье В. А. Гефтер (1968), добавляя к ним ещё один случай, имевший место в Болгарии, где Б. Милошев (1963) описал множественную инвазию метастронгилёзом, энтеробиозом и тениаринхозом ребенка шести с половиной лет. В. Л. Контримавичус с соавт. (1976; стр. 10) при описании М. elongatus пишут коротко: «Хозяева:.., казуистически -<...> человек».
В одной из публикаций 2016-го года её авторы (Calvopina et al., 2016) подчёркивают, что до их работы в мире было известно всего четыре случая заражения людей Metastrongylus, причём все они имели место в Европе. Иными словами, явно речь идёт о четырёх, упомянутых выше фактах.
Кстати, в этой публикации сообщается об обнаружении у жителя Эквадора родственного вида Metastrongylus - М. salmi, обычными дефинитивными хозяевами которого также являются домашние и дикие свиньи.
Заражение человека, скорее всего, происходит через грязные руки при случайном раздавливании земляных червей.
Цитируемая литература
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. проф. П. Г. Сергиев).
Контримавичус В. Л., Делямуре С. Л., Боев С. И. Метастронгилоидеи домашних и диких животных // Основы нематодологии. - Под ред. К. М. Рыжикова. - М.: Наука, 1976. - 26. - 239 с.
Шульц Р. С, Каминский Ф. С. Метастронгилиды свиней, их морфология и систематика / Сборник работ по гельминтологии. - М.: Изд-во ВАСХНИЛ, 1937. - С. 615 - 624.
Calvopina М., Caballero Н., Morita Т., Korenaga М. Human pulmonary infection by the zoonotic Metastrongylus salmi nematode. The first reported case in the Americas H Am. J. Trop. Med. Hyg. -2016.-95, 4. - P. 871 - 873. doi: 10.4269/ajtmh. 16-0247.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Hollo F. Investigation on metastrongylosis in swine. II. Some remarks on the morphology of M. salmi Ge-doelst, 1923, with special references to its differentiation from M. apri // Acta veterinaria. - 1965. - 15. -P. 259-269.
Schwartz B., Alicata J. E. The development of Metastrongylus elongatus and M. pudendotectus in their intermediate hosts // J. Parasitol. - 1929. - 16. - P. 105.
Семейство Onchocercidae Leiper, 1911
Синонимы (no: GBIF Global Biodiversity Information Facility - www.gbif.org.Onchocercidae) Dipetalonematidae Wehr, 1935 Oncocercidae Yamaguti, 1961
Семейство входит в состав отряда Spirurida; в разных источниках этот отряд можно найти в классе Chromadorea (Hodda, 2011), или Secementea (GBIF Global Biodiversity Information Facility), и даже Rhabditea (https://msu.edu/course/zol/316/ovoltax.htm). По одним данным, семейство объединяет 87 родов с 668 видами (Hodda, 2011), по другим - 84 рода с 500 видами (Global Biodiversity Information Facility- www.gbif.org.Onchocercidae.Checklist View).
344
Описание (по разным авторам, в том числе: Сонин, 1975). Нематоды с удлинённым нитевидным телом, утончающимся к концам. Головной конец с расположенными по кругу хитинизированными шипиками или выступами, или без них. Ротовое отверстие окружено 3 небольшими губами. Ротовая капсула длинная, трубчатая или нет, с толстыми стенками или без них. Пищевод разделён на передний (более короткий, мышечный) и задний (удлинённый, железистый) отделы. Спикулы обычно резко различаются по длине и форме, реже - субэквальные. Вульва на уровне пищевода, но может быть ниже или выше него. Паразиты амфибий, рептилий, птиц, млекопитающих. Типовой род - Onchocerca Diesing, 1841.
Жизненный цикл Onchocercidae протекает с участием промежуточного хозяина - кровососущих комаров, мух, слепней, мошкары. Эти насекомые, нападая на заражённых животных, вместе с кровью заглатывают и личинок паразита, так называемых микрофилярий (Лейкина, Шипицина, 1968). Попав в пищеварительный тракт промежуточного хозяина, личинки перфорируют стенку кишечника и проникают в полость его тела, откуда мигрируют в грудные мышцы или мальпигиевы сосуды, где растут, претерпевая соответствующие две линьки. Через 2-3 недели личинки возвращаются в полость тела насекомого, затем проникают в его ротовые органы и скапливаются в колющем аппарате - хоботке. При нападении насекомого на нового хозяина в тот момент, когда его хоботок соприкасается с кожными покровами животного (человека), личинки начинают энергично двигаться и через разрыв кутикулы на вершине хоботка попадают на кожу. Внедряясь в толщу кожи, они проникают в кровеносные сосуды и током крови заносятся в соответствующие внутренние органы, где растут, развиваются' и через 3-18 месяцев превращаются во взрослых особей. Отрождаемые ими микрофилярии совершают суточные миграции в мелких (периферических) и крупных сосудах.
Различают периодичный тип микрофилярий, когда те появляются в периферической крови либо ночью, либо днём в зависимости от активности переносчика паразита, субпериодичный тип, при котором число микрофилярий может возрастать в определённое время суток, и непериодичный тип, при котором паразит постоянно находится в крови, не проявляя цикличности (Мяндина, Тарасенко, 2013).
Семейство Onchocercidae примечательно тем, что некоторые его представители паразитируют у человека, вызывая у того серьёзные заболевания, для которых обычно используется общий термин - filariasis (филяриазис). О социально-экономической значимости подобного рода заболеваний свидетельствует даже тот факт, что Всемирная организация здравоохранения (ВОЗ-WHO) включила эту группу зоонозных болезней в число пяти важнейших заболеваний человека в тропических регионах (Martin, Genchi, 2000).
Заражение микрофиляриями нематод семейства Onchocercidae происходит только через укусы насекомых и ни в коей мере не связано с пищей, питьевой водой и даже санитарно-гигиеническими условиями, т.е. фактически выходит за рамки основной тематики нашей монографии, посвящённой нематодозам пищевого происхождения. Тем не менее, учитывая широкое распространение заболеваний, вызываемых этими нематодами, и те серьёзные последствия, к которым они приводят, приведу краткое описание представителей 9 родов Onchocercidae, регистрируемых у человека.
345
Цитируемая литература
Лейкина Е. С, Шипицина Н. К. XXXI. Филяриозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 616 - 638. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. проф. П. Г. Сергиев).
Мяндина Г. И., Тарасенко Е. В. Медицинская паразитология. Учебное пособие. - М.: Практическая медицина, 2013. - С. 32 - 392.
Сонин М. Д. Филяриаты животных и человека и вызываемые ими заболевания. Часть третья. Филя-рииды, онхоцерцины // Основы нематодологии. - Под ред. чл.-корр. АН СССР К. М. Рыжикова. -М.: Наука, 1975. - 24. - С. 32 - 392.
Martin F. Genchi С. Dirofilariasis and other zoonotic filariases: an emerging public problem in developed countries // Res. Rev. Parasitol. - 2000. - 60, 1-2. - P. 1-16.
Род Onchocerca Diesing, 1841
Описание (по: Сонин, 1975). Самки значительно крупнее самцов. Кутикула с кольчатыми возвышающимися выступами, прерывающимися на уровне латеральных полей, и с поперечной исчерченностью. На головном конце четыре пары субмедианных сосочков в двух кругах, и пара амфид. Рот без губ. Хвостовые сосочки довольно многочисленные. Губернакулюм отсутствует. Матки описто-дельфные. Микрофилярии без чехлика. Паразиты млекопитающих, в том числе и человека. Типовой вид - Onchocerca reticulata Diesing, 1841.
Род объединяет 27 видов (Bosch et al., 2016). Наиболее известен среди них О. volvulus, окончательным хозяином которого является человек.
Onchocerca volvulus (Leuckart, 1893) Railliet et Henry, 1910 (^Filaria volvulus Leuckart, 1893; =Microfilaria nuda Rodenwaldt, 1914; -Onchocerca caecutiens Brumpt, 1919) (рис. 139). Вид впервые описан как Filaria volvulus Leuckart, 1893 по нематодам, извлечённым из подкожных узлов двух жителей Ганы. Видовое название volvulus можно перевести как «свернувшийся в клубок».
Молочно-белые черви. Длина тела самцов 19-42, толщина 0.13 - 0.21 мм. У самцов кутикула тонкая и менее орнаментированная, чем у самок. Хвостовой конец загнут вентрально. Спикулы 0.077 - 0.082 и 0.172 - 0.211 мм. Имеется 3-4 пары преанальных сидячих сосочков и несколько пар мелких сосочков у верхушки хвоста. Самки длиной 33 - 507 и толщиной 0.27 - 0.40 мм.
Промежуточный хозяин О. volvulus - мошки рода Simulium. Мельчайшие личинки нематоды, попавшие с кровью в организм самок насекомых в момент укуса теми инвазированного человека, развиваются в них и достигают инвазионной стадии за 6 - 7 дней. Таким же путём, при укусе инвазированным насекомым нового хозяина, личинки попадают к человеку.
7 В монографии Э. Фауста (Faust, 1949: стр. 527) в цифры, характеризующие длину самок Onchocerca volvulus, вкралась опечатка (дословно): «The females have a length measurement of 33.5 to 50 cm.». (Выделено мною - АГ). Эта же ошибка повторилась в статье «Онхоцеркоз» (ru.wikipedia.org): «...длина около 350 - 500 мм у самок...». Тем не менее, среди Onchocerca действительно есть виды, чья длина достигает нескольких десятков сантиметров, напр., Onchocerca gutturosa Neumann, 1910 (60 см и более) или же Onchocerca gibsoni Cleland et Johnston, 1910 (50 см) (MOnnig, 1934).
346
Рис. 139 Onchocerca volvulus’. A - головной конец апикально; В - хвостовой конец самца; С - микрофилярия из тканей вокруг зрелой самки (из: Faust, 1949)
Взрослые особи располагаются в подкожных узлах (онхоцеркомах) величиной от горошины до голубиного яйца, где самки производят множество личинок, до 1 млн. в год (Чебышев, 2012). Онхоцеркомы покрыты соединительнотканной капсулой и содержат живых и погибших червей. Чаще всего узлы располагаются в области таза, суставов конечностей и на голове, а также в подмышечной впадине, на уровне ребер, вблизи позвоночника. В каждом узле содержится несколько самок и самцов, переплетённых в клубок (видимо, отсюда и видовое название нематоды). Первые микрофилярии появляются через 10-18 мес. после заражения хозяина. Продолжительность их жизни достигает 6-30 месяцев. Личинки могут активно проникать в поверхностные слои кожи, лимфатические узлы, глаза, откуда попадают в организм мошек при нападении тех на человека, продол
жая, таким образом, цикл развития паразита.
Клинические симптомы заболевания проявляются после инкубационного периода, который длится около года. Помимо соединительнотканных капсул, на коже нередко появляются мелкие папулёзные высыпания, на которых возникают пузырьки или пустулы. После их отторжения остаются язвы, заживающие очень медленно, с образованием рубцов. Кожные поражения сопровождаются сильным зудом, общим недомоганием, лихорадкой, головными болями. Часть микрофилярий попадает в глаза человека, вызывая воспаление радужной и сосудистой оболочек, кровотечения, образование узелков на конъюнктиве, атрофию пигмента радужной оболочки, кератит и другие осложнения, ведущие к частичной и даже полной потере зрения. Большое значение в патогенезе инвазии имеет сенсибилизация организма продуктами обмена и распада как микрофилярий, так и взрослых особей.
Паразиты могут жить в организме человека до 15 лет (Duke, 1972).
Заболевание, вызываемое О. volvulus, часто называют речной слепотой (River blindness), поскольку переносчики нематод - мошкара в изобилии обитают по берегам рек и ручьев, где и происходит заражение человека (Basanez et al., 2006). Заболевание людей, вызываемое О. volvulus, характерно для стран Центральной и Южной Америки (Гватемала, Венесуэла, Мексика), Западной и Экваториальной Африки. Подсчитано, что в мире этим гельминтом поражено 37 млн. человек (Basanez et al., 2006). Иногда паразита встречают у обезьян, что, скорее всего, носит случайный характер.
347
Помимо О. volvulus, у человека отмечено ещё 6 видов Onchocerca: О. cervi-calis Railliet et Henry, 1910 (паразит лошадей, мулов), О. dewittei japonica Uni et al., 2001 (паразит дикого кабана), О. gutturosa Neumann, 1910 (паразит крупного рогатого скота), О. jakutensis (Gubanov, 1964) (паразит оленей), О. lupi Rodonaja, 1967 (паразит псовых), О. reticulata Diesing, 1830 (паразит лошадей) (Hashimoto et al., 1990; Kohsler et al., 2007; Otranto et al., 2011; Pampiglione et al., 2001; Sreter et al., 2002; Takaoka et al., 2001 и др.). В отличие от О. volvulus, перечисленные виды у людей встречаются чрезвычайно редко - во всём мире насчитали не более 25 подобных случаев (Uni et al., 2015).
В одной из обзорных работ по филяриазису человека, опубликованной в конце 20-го столетия, её авторы (Orihel, Eberhard, 1998), комментируя описания видов Onchocerca, найденных у человека в США, Канаде, Швейцарии, России и Японии (Ali-Khan, 1977; Beaver et al., 1974, 1989; Siegenthaler, Gubler, 1965; Takaoka et al., 1996), подчёркивают, что те очень схожи и могут относиться к одному и тому же виду - О. gutturosa. паразиту крупного рогатого скота (Шевцов, 1965).
Цитируемая литература
Сонин М. Д. Филяриаты животных и человека и вызываемые ими заболевания. Часть третья. Филя-рииды, онхоцерцины // Основы нематодологии. - Под ред. чл.-корр. АН СССР К. М. Рыжикова. -М.: Наука, 1975.-24.-396 с.
Чебышев Н. В. Медицинская паразитология. Учебное пособие. - М.: Медицина, 2012. - 304 с. Шевцов А. А. Ветеринарная паразитология. -М.: Изд-во «Колос», 1965.-415 с.
Ali-Khan Z. Tissue pathology and comparative microanatomy of Onchocerca from a resident of Ontario and other enzootic Onchocerca species from Canada and the USA // Ann. Trop. Med. Parasitol. - 1977. - 71. -P. 469-482.
Basdnez M. G., PionS. D., Churcher T.S., Breitling L. P., Little M. P.t Boussinesq M. River blindness: a success story under threat? // PLoS Med. - 2006. - 3. - e371.
Beaver P. C., Horner G. S., Bilos J. Z. Zoonotic onchocercosis in a resident of Illinois and observations on the identification of Onchocerca species 11 Am. J. Trop. Med. Hyg. - 1974. - 23. - P. 595 - 607.
Beaver P. C., Yoshimura H, Takayasu S, Hashimoto H, Little M. D. Zoonotic Onchocerca in a Japanese child // Am. J. Trop. Med. Hyg. - 1989. - 40. - P. 298 - 300.
Bosch F., Manzanell R, Mathis A. First description of Onchocerca jakutensis (Nematoda: Filarioidea) in red deer (Cervus elaphus) in Switzerland 11 Int. J. Parasitol.: Parasites & Wildlife. - 2016.-5, 2. - P. 192 - 197.
Duke В. O. L. Onchocerciasis // Brit. Med. Bull. - 1972. - 28. - P. 66 - 71.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Hashimoto H, Murakami L, Fujiwara S., Takayasu S, Takaoka H. et al. A human case of zoonotic onchocerciasis in Japan 11 J. Dermatol. - 1990. - 17. - P. 52 - 55.
Kohsler M., Soleiman A., Aspbck H. et al. Onchocerca jakutensis filariasis in humans H Emerg. Infect. Dis. -2007. - 13.-P. 1749- 1752.
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
Orihel T C., Eberhard M. L. Zoonotic filariasis // Clin. Microbiol. Rev. - 1998. - 11, 2. - P. 366 - 381.
Otranto D., Sakru N., Testini G., Gurlii V. P., Yakar K. et al. Case report: First evidence of human zoonotic infection by Onchocerca lupi (Spirurida, Onchocercidae) 11 Am. J. Trop. Med. Hyg. - 2011. - 84, 1. - P. 55 - 58. doi: 10.4269/ajtmh.2011.10-0465.
Pampiglione S., VakalisN., Lyssimachou A., Kouppari G., Orihel T. C. Subconjunctival zoonotic Onchocerca in an Albanian man //Ann. Trop. Med. Parasitol. - 2001. - 95. - P. 827 - 832.
Siegenthaler R., Gubler R. Paraarticulares Nematodengranulom (einheimische Onchocerca) // Schweiz. Med. Wochenschr. - 1965. - 95. - P. 1102 - 1104.
Sreter T, Szell Z., Egyed Z., Varga /. Subconjunctival zoonotic onchocerciasis in man: aberrant infection with Onchocerca lupYl //Ann. Trop. Med. Parasitol. - 2002. - 96, 5. - P. 497 — 502.
Takaoka H., Bain O., Tajimi S., Kashima K, Nakayama I. et al. Second case of zoonotic Onchocerca infection in a resident of Oita in Japan // Parasite. - 1996. - 3. - P. 179 - 182.
348
Такаока Н, Bain О., Uni S., Korenaga M., Tada К. et al. Human infection with Onchocerca dewittei japoni-ca, a parasite from wild boar in Oita, Japan H Parasite. - 2001. - 8. - P. 261 - 263.
Uni S.t Fukuda M., Otsuka Y., Hiramatsu N., Yokobayashi K. et al. New zoonotic cases of Onchocerca dewit-tei japonica (Nematoda: Onchocercidae) in Honshu, Japan // Parasit. Vectors. - 2015. - 8. - P. 59.
Род Brugia Buckley, 1960
Описание (по разным авторам, в том числе: Сонин, 1975). Кутикула в основном гладкая, лишь на вентральной поверхности самцов имеется поперечная исчерчен-ность, а на заднем конце самок - узелковидные утолщения. Головной конец буль-бусовидно расширен, с 4 парами субмедианных сосочков и парой латеральных ам-фид. Левая спикула состоит из трубчатой проксимальной и дистальной бичевидной частей, правая - из трубчатой проксимальной и сложно устроенной дистальной (по ней скользит спикула) частей. Матки параллельные, опистодельфные. Типовой вид -Brugia malayi (Brug, 1927).
Среди паразитирующих у человека представителей рода Brugia наиболее известен и распространён один - В. malayi (Brug, 1927).
Brugia malayi (Brug, 1927) Buckley, 1960 [=Filaria malayi Brug, 1927; ^Microfilaria malayi (Brug, 1927) Faust, 1929; =Filaria bancrofti Cobbold, 1877; =Wuchereria malayi (Brug, 1927) Rao et Maplestone, 1940]. Впервые паразит описан по микрофиляриям, выявленным в крови жителей Малайского архипелага, с чем и связано его видовое название: malayi - малайский.
Рис. 140 Brugia malayi, хвостовой конец самца (из: Faust, 1949 — как Wuchereria malayi)
Очень тонкие нитевидные беловатые нематоды. Голова слегка вздута, с хорошо развитыми папиллами, расположенными в двух кругах. Длина тела самцов 22 - 25, диаметр 0.09 мм. Хвостовой конец спирально закручен в три оборота (рис. 140). Одна пара длинных папилл находится непосредственно впереди клоаки и одна пара - сразу же позади неё; рядом две пары более мелких сосочков. Спикулы неравные, 0.34 - 0.36 и 0.11 - 0.12 мм. Рулёк маленький, лодочковидный. Самки длиной до 50 - 80 и диамет-
ром 0.16 - 0.3 мм (Сонин, 1975; Amaya, 2003; Faust, 1949). Хвост тупо закруглён Вульва медиовентральная.
Микрофилярии (рис. 141) длиной 0.16 - 0.26 и шириной 0.005 - 0.007 мм; чехлик далеко выступает за пределы тела; передний конец с двойным стилетом, задний слегка сужен. Имеются 4 крупные половые клетки с хорошо заметными ядрами. Одна из клеток значительно крупнее остальных (Лейкина, Шипицина, 1968). Личинки остаются в чехлике до тех пор, пока не попадут в кишечник москита.
Рис. 141 Личинка Brugia malayi в мазке крови (из: en.wikipedia.org.Brugia malayi)
349
Основной хозяин В. malayi - человек, но иногда его находят у кошек и обезьян, реже у собак (Meyrowitsch et al., 1998). Промежуточные хозяева, и, следовательно, переносчики - комары родов Mansonia, Anopheles, Aedes. Созревание личинок в теле комара происходит за 8 - 10 суток (Мяндина, Тарасенко, 2013). Инвазионные личинки имеют в длину 1.304 при ширине 0.020 мм. Личинки очень подвижны и мигрируют в голову, пальпы, антенны и брюшко комаров (Сонин, 1975).
Известны два штамма паразита: с ночной периодичностью и ночной субпериодичностью. Источником инвазии первым из них является только человек (антропоноз), вторым - обезьяны, дикие кошки, собаки (антропозооноз), а переносчиками служат комары только рода Mansonia.
Взрослые особи В. malayi паразитируют в лимфатических сосудах, микрофилярии - в кровеносных. Инкубационный период длится 2-3 месяца.
Первоначально заболевание проявляется общей сенсибилизацией и местными аллергическими реакциями: лихорадкой, крапивницей, кожным зудом, невралгией, воспалением лимфатических узлов. В последующем могут развиться отёки кожи и подкожной клетчатки, лимфатические узлы резко увеличиваются, появляются боли в животе, паховой области. На последней стадии болезни возможно развитие элефантизма ног, когда ноги ниже колена приобретают вид бесформенных обезображенных глыб огромных размеров.
Примечательно, что при заражении В. malayi гранулёматозный лимфангит и лимфаденит развиваются как на нижних, так и на верхних конечностях.
Болезнь распространена в основном в тропических странах Южной и Юго-Восточной Азии: Индии, Шри-Ланке, прибрежном Китае, на юге Кореи, во Вьетнаме, на Филиппинах, в Малайзии, Таиланде, Индонезии, Японии.
Brugia tirnori Partono, Pumomo, Dennis, Atmosoedjono, Oemijati et Cross 1977 - ещё один представитель рода, известный у человека. Видовое название паразита tirnori - тиморский от названия острова, на котором его впервые выявили у людей. Заражение обнаружено на островах Индонезии - Тимор, Флорес, Алор (Partono et al., 1977; Pumomo et al., 1977). Например, в небольшой деревне на о. Флорес микрофилярии нематоды были выявлены у 25 % жителей (Partono et al., 1977).
В числе регистрируемых у человека называют также Brugia beaveri Ash et Little, 1964 (впервые описан от енота, встречается также у кошек), В. guyanensis Orihel, 1964 (впервые описан от носухи из семейства енотовых), В. pahangi (Buck-ley et Edeson, 1956) (паразит кошек, собак, обезьян), а также Brugia sp. (Baird, Neafie, 1988; Baird et al., 1986; Kozeket al., 1984; Menendez, Bouza, 1988; Orihel, Beaver, 1989; Orihel, Eberhard, 1998; Rosenblatt et al., 1962). Подавляющее большинство случаев выявлено в США, единичные - в Колумбии, Перу>Бразилии, Эфиопии.
Цитируемая литература
Лейкина Е. С., Шипицина Н. К. XXXI. Филяриозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 616 - 638. (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. проф. П. Г. Сергиев).
Мяндина Г. И., Тарасенко Е. В. Медицинская паразитология. Учебное пособие. - М.: Практическая медицина, 2013. - 256 с.
350
Сонин М.Д. Филяриаты животных и человека и вызываемые ими заболевания. Часть третья. // Основы нематодологии. - Под ред. чл.-корр. АН СССР К. М. Рыжикова. - М.: Наука, 1975. - 24. - 396 с.
Amaya К. 2003. "Brugia malayi" (On-line), Animal Diversity Web. Accessed August 12, 2016 at http://animaldiversity.org/accounts/Brugia_malayi/.
Baird J. K., Alpert L. Friedman R., Schraft IV. C, Connor D. H. North American brugian filariasis: report of nine infections of humans // Am. J. Trop. Med. Hyg. -1986.-35, 6. - P. 1205 - 1209.
Baird J. K., Neafie R. C South American brugian filariasis: report of a human infection acquired in Peru // Am. J. Trop. Med. Hyg. -1988.-39, 2. - P. 185 - 188.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Kozek Ж J., Reyes M. A., Ehrman J., Garrido F, Nieto M. Enzootic Brugia infection in a two-year-old Colombian girl // Am. J. Trop. Med. Hyg. -1984. - 33, 1. - P. 65 - 69.
Menendez M. C, Bouza M. Brugia species in a man from western Ethiopia // Am. J. Trop. Med. Hyg. -1988.
-39, 2.-P. 189 - 190<
Meyrowitsch D. W., Toan N.D., Hao H.T., Toan N.D., Hao H.T. et al. A review of the present status of lymphatic filariasis in Vietnam // Acta Tropica. - 1998. - 70. - P. 335 - 347.
Orihel T. C, Beaver P. C. Zoonotic Brugia infections in North and South America // Am. J. Trop. Med. Hyg. - 1989. - 40.-P. 638-647.
Orihel T. C, Eberhard M. L. Zoonotic filariasis // Clin. Microbiol. Rev. - 1998. - 11, 2. - P. 366 - 381.
Partono F., Purnomo, Dennis D. T, Atmosoedjono S., Oemijati S., Cross J. H. Brugia timori sp.n. (Nematoda: Filarioidea) from Flores Island, Indonesia // J. Parasitol. - 1977. - 63, 3. - P. 540 - 546.
Purnomo, Dennis D. T, Partono F. The microfilaria of Brugia timori (Partono et al. 1977 = Timor Microfilaria, David and Edeson, 1964): morphologic description with comparison to Brugia malayi of Indonesia// J. Parasitol. - 1977. - 63, 6. - P. 1001 - 1006.
Rosenblatt P., Beaver P. C, Orihel T. C. A filarial infection apparently acquired in New York City 11 Am. J. Trop. Med. Hyg. - 1962. - 11. - P. 641 - 645.
Род Dirofilaria Railliet et Henry, 1911
Описание (по разным авторам, в том числе: Сонин, 1975). Кутикула с тонкой поперечной исчерченностью. Рот без губ, с 4 парами субтерминальных сосочков и парой латеральных амфид. Пищевод относительно короткий. Спирально скрученный хвостовой конец самца с тупоконическим окончанием, снабжён хвостовыми крыльями, крупными стебельчатыми пре- и маленькими постанальными папиллами. Вульва самок несколько ниже уровня пищевода. Личинки покидают материнскую особь без чехлика. Типовой вил - Dirofilaria immitis (Leidy, 1856).
В разных источниках последних лет в составе рода называют 26 - 27 видов. М. Редди (Reddy, 2013) пишет о 40 видах. Несмотря на широкое распространение дирофилярий у диких и домашних животных, у человека их регистрируют крайне редко (Faust, 1949), за исключением D. immitis и D. repens. Подробное описание истории изучения этих видов, этиологии, эпидемиологии, патоморфогенеза, диагностики, лечения и профилактики вызываемых ими заболеваний можно найти на: www://wikipedia.org/wiki/Диpoфиляpиoз. Заражение происходит трансмиссивным путём через укусы кровососущих комаров - носителей личинок нематоды. Однако сам человек является для дирофилярий факультативным хозяином, в котором их жизненный цикл неполон (Василевич, Пьянова, 2005).
В сводке «Медицинская паразитология...» (www.worms-info.ru) перечислено 6 видов Dirofilaria - D. immitis. D. repens, D. spectans, D. striata, D. tenuis, D. ursi. E. С. Лейкина и P. К. Шипицина (1968) упоминают также D. louisitanensis Faust, Thomas et Jones, 1941 и D. magalhaesi (R. Blanchard, 1896). Первый из них - синоним D. immitis.
351
Dirofilaria immitis (Leidy, 1856) Railliet et Henry, 1911 (рис. 142). Впервые вид описан на материале из сердца собак. Видовое название immitis — враждебный, жестокий, безжалостный, скорее всего, связано с высокопатогенными свойствами паразита по отношению к его окончательным хорзяевам. В монографии М. Д. Сонина (1975) перечислено 15 синонимов вида.
Самцы длиной около 10-18, самки 25 - 33 см (Сонин, 1975; Monnig, 1934).
Рис. 142 Dirofilaria immitis: А - передний конец самки, вид сбоку; В - задний конец самца вентролате-рально(из: Monnig, 1934)
Паразит зарегистрирован у собак, волка, динго, лисиц, домашних кошек, ягуара, ондатры, морских львов, котиков. Поселяется в правой половине сердца, из-за чего получил название кардионематоды. При высокой численности черви локализуются также в кровеносных сосудах, лёгочной артерии.
D. immitis приурочен к странам с более тёплым климатом. Однако в последние годы наблюдается расширение его ареала в северном направлении (Кравченко, 2014), что, по мнению многих авторов (Genchi et al., 2008), может
быть связано с общим потеплением климата на планете и широким распространением собак.
D. immitis - не столь частый паразит человека, однако, исследователи также обращают внимание на рост числа случаев заражения им людей. К примеру, в Японии первый случай был зафиксирован в 1964 г., а к первой половине 1995 г. таковых насчитывалось уже 120 (Makiya, 1997). Недавно подсчитали, что по состоянию на 2012 г. в мире было зафиксировано 372 случая заражения людей лёгочным ди-рофиляриазисом (Simon et al., 2012).
Полагают, что попавшие в организм человека личинки могут мигрировать в лёгкие, иногда в подкожные ткани, но не достигают половой зрелости (Morgan, 2013). Незрелые черви погибают в ответвлениях лёгочной артерии человека, где формируются круглые узелки диаметром до 2 - 3 см, которые иногда случайно обнаруживаются при рентгеноскопии грудной клетки.
Dirofilaria repens Railliet et Henry, 1911. Паразит впервые описан на материале из подкожной клетчатки собак Италии. Видовое название repens - новый, неожиданный - использовано авторами для отличия нового вида от уже известного D. immitis. Самцы достигают длины 14-15, самки - 15 - 17 см. Среди хозяев паразита - собаки, в том числе домашние, волк, лисицы, енот, кошки, енотовидная собака. Вид очень широко распространён в Европе, Азии, Африке.
D. repens - среди всех дирофилярий наиболее обычный паразит человека (Аракельян, 2007; Артамонова, Нагорный, 1996; Борисова и др., 1986; Возлюбленный и др., 2016; Лучшее и др., 2003; Поляков и др., 2003; Скрябин и др., 1930; Супряга и др., 2003; Ушаков и др., 2002; Babal et al., 2008; Khurana et al., 2010; Makiya,
352
1997; Nozais, Huerre, 1995; Pampiglione et al., 1996; Sabu et al., 2005; Soussi et al., 2004; Vakalis, Himonas, 1997 и др. - приведена только малая толика той обширной литературы, которая посвящена данной проблеме). К 1995 г. официально было зафиксировано около 400 случаев заражения людей D. repens, из них чуть меньше половины - в Италии (Pampiglione et al., 1995).
Судя по публикациям, в последние десятилетия наблюдается рост заражённости людей D. repens (или совершенствуется их диагностика?). Подобная картина наблюдается во многих странах. Так, в Польше в 2007 - 2012 гг. выявили 12 человек, заражённых D. repens (Demiaszkiewicz et al., 2014). Во Вьетнаме в Ханое с 2006 по 2010 гг. инвазию обнаружили у 10 человек: в 9 случаях нематоды располагались в конъюнктиве, в одном - в подкожной ткани (De et al., 2012). В России с 1915 по 1955 гг. было известно 15 случаев заражения людей D. repens (Возлюбленный и др., 2016), а с 1997 по 2002 гг. - около 100 (Супряга и др., 2003), при этом только в Москве и Московской области за 2000 - 2002 гг. - 11 (Лучшее и др., 2003). К началу 2014 г. на территории $2 субъектов РФ зарегистрировано 850 человек, инвазиро-ванных D. repens (Возлюбленный и др., 2016). Авторы одной из последних обзорных работ (Simon et al., 2012) пишут о 1410 случаях поражения людей подкожной и глазной формами дирофиляриазиса.
D. repens находят в подкожных узлах на голове, грудной стенке и верхних конечностях, в разных отделах глаза, иногда в более глубоких тканях. Очень редко гельминт может встретиться в лёгких, печени, под слизистой оболочкой ротовой полости и глотки, в половых органах (Лейкина, Шипицина, 1968).
Случаи заражения людей D. repens известны в Венгрии, Греции, Италии, Словакии, Франции, Германии, Нидерландах, Великобритании, Сербии, Хорватии, Польше, Австрии, Норвегии, России, Украине, Грузии, Армении, Литве, Беларуси, Турции, Тунисе, Индии, Шри-Ланке, Японии, Вьетнаме (De et al., 2012; Demiaszkiewicz et al., 2014; Simon et al., 2012).
Помимо описанных двух видов Dirofilaria, у человека отмечают ещё 6 представителей данного рода.
D. magalhaesi (R. Blanchard, 1896) Railliet et Henry, 1911 обнаружена у ребёнка в Бразилии (Lent, Texeira de Freitas, 1937). Из левого желудочка сердца были извлечены один самец (длиной 83 мм) и одна самка (155 мм) нематоды, описанной первоначально под названием Filaria bancrofii de MagalhSes, 1892. Возможно, вид является синонимом D. immitis (Сонин, 1975; Faust, 1949).
D. spectans Freitas et Lent, 1949 - паразит выдр бразильской и длиннохвостой. Зарегистрирован у человека в Рио-де-Жанейро (Vicente et al., 1997).
D. striata (Molin, 1858) Railliet et Henry, 1911. Паразит пумы, оцелота, пантеры, рыси, кошки длиннохвостой; поселяется в подкожной ткани (Bowman et al., 2013). У человека выявлен в США (Orihel, Eberhard, 1998; Orihel, Isbey, 1990).
D. tenuis Chandler, 1942 [^Dirofilaria conjunctivae (Addario, 1885)]. Паразит енотов Северной Америки; более всего характерен для региона южной Флориды. Отмечен у человека во Флориде (Isaza, Courtney, 1988; Lee, 2009). Всего известно около 50 подобных случаев (Ashford, Crewe, 2003; Muller, 2002). Черви локализуются под кожей в узелках, могут быть обнаружены близ глаза.
353
D. ursi Yamaguti, 1941 - паразит медведей в Северной Америке и Евразии. В Канаде и на севере США зафиксировано 10 случаев заражения людей D. ursi (Ashford, Crewe, 2003; Haldane et al., 1996) и дирофиляриями, похожими, как подчёркивают авторы публикации, на D. ursi (Beaver et al., 1987).
Цитируемая литература
Аракельян Р. С. Случай дирофиляриоза человека в Астраханской области // Мед. паразитол. и паразитарные болезни. - 2007. - № 3. - С. 55.
Артамонова А. А., Нагорный С. А. Случай Dirofilaria repens у человека // Мед. паразитол. и паразитарные болезни - 1996. - № 1. - С. 44.
Борисова М. А., Сиротюк Н. П., Цыганкова О. Д., Жулаева Т. Е. О проявлениях инвазии Dirofilaria repens (Railliet et Henry, 1911) у человека П Мед. паразитол. и параз. болезни - 1986. - № 5. - С. 86.
Василевич Ф. И., Пъянова А. М. Дирофиляриоз собак // Ветеринария. - 2005. - № 2. - С. 30 - 32. Возлюбленный Д. Е., Возлюбленный Е. И., Нечасов Н. Ю. Диагностика и лечение дирофиляриоза мягких тканей нижних конечностей // Хирургия. - 2016. - № 4. - С. 81 - 85.
Кравченко В. М. Дирофиляриоз плотоядных в северо-западном регионе Кавказа (эпизоотическая ситуация, патогенез, патоморфологическая характеристика): Дисс... докт. вет. наук: 03.02.11 - паразитология. - Краснодар, 2014. - 334 с.
Лейкина Е. С., Шипицина Н. К XXXI. Филяриозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 616-638.
Лучшее В. И., Супряга Р. Г, Дарченкова Н. Н, Бронштейн А. М., Жукова Л. А. и др. Дирофиляриоз человека в Московском регионе // Мед. паразитол. и паразит, болезни - 2003. - № 3. - С. 51 - 56.
Поляков В. Е., Лысенко А. Я., Авдюхина Т. И., Константинова Т. Н. Дирофиляриоз у детей и подростков // Медицинская помощь. - 2003. - № 2. - С. 37 - 39.
Скрябин К. И., Алыпгаузен А. Я., Шульман Е. С. Первый случай обнаружения Dirofilaria repens у человека // Тропическая медицина и ветеринария. - 1930. - 8, 2. - С. 9 - 11.
Сонин М. Д. Филяриаты животных и человека и вызываемые ими заболевания. Часть третья. И Основы нематодологии. - Под ред. чл.-корр. АН СССР К. М. Рыжикова. - М.: Наука, 1975. - 24. - 396 с.
Супряга Р. Г., Бронштейн А. М., Шмыров О. С., Авраменко Ю. В. Дирофиляриоз под маской ущемлённой паховой грыжи // Детская хирургия. - 2003. - № 4. - С. 50 - 51.
Ушаков А. В., Степанова Т Ф., Струкова А. С. Случай дирофиляриоза человека в городе Тюмени // Мед. паразитол. и паразитарные болезни - 2002. - № 4. - С. 52-53.
Ashford R. W., Crewe W. The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
Bdbal P., Kobzovd D., Novak L, Dubinsky P., Jalili N. First case of cutaneous human dirofilariosis in Slovak Republic I I Bratisl. Med. J. - 2008. - 109. - P. 486 - 488.
Beaver P. C, Wolfson J. S., Waldron M. A., Swartz M. N, Evans G. W., Adler J. Dirofilaria wrsi-like parasites acquired by humans in the northern United States and Canada: report of two cases and brief review // Am. J. Trop. Med. Hyg. - 1987. - 37,2. - P. 357 - 362.
Bowman D. D., Hendrix С. M., Lindsay D. S, Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-467 pp.
De N. V.t Le T. H, Chai J.-Y. Dirofilaria repens in Vietnam: Detection of 10 eye and subcutaneous tissue infection cases identified by morphology and molecular methods // Korean J. Parasitol. - 2012. - 50, 2. - P. 137-141. http://dx.doi.Org/10.3347/kjp.2012.50.2.137.
Demiaszkiewicz A. W., Polanczyk G.t Osinska B., Pyziel A. M. et al. The prevalence and distribution of Dirofilaria repens in dogs in the Mazovian Province of Central-Eastern Poland // Ann. Agricult. Environ. Med. - 2014.-21, 4.-P. 701 -704.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Genchi C, Rinaldi L., Mortarino M. Climate and Dirofilaria infection in Europe 11 Vet. Parasitol. - 2008. -163.-P. 286-292.
Haldane D. J., Johnston B. L., Walsh N. M. Subcutaneous dirofilariasis in Nova Scotia // Can. J. Infect. Dis. 0 1996.-7, l.-P. 67-69.
Isaza R, Courtney C. Possible association between Dirofilaria tenuis infections in humans and its prevalence in raccoons in Florida// J. Parasitol. - 1988. - 74. - P. 189 - 190.
354
Khurana S., Singh G.t Bhatti H. S., Malla N. Human subcutaneous dirofilariasis in India: a report of three cases with brief review of literature // Indian J. Med. Microbiol. - 2010. - 28, 4. - P. 394 - 396.
Lee Ж Ophthalmic case study: Dirofilaria tenuis nematode infection - www.ophthalmologyweb.com. Posted: February 2, 2009.
Lent H., Texeira de Freitas J. F. Contribui^o ao estudo do genero Dirofilaria Railliet & Henry, 1911 // Mem. Inst. Oswaldo Cruz. - 1937. - 32, 1. - P. 37 - 54 + 7 plates.
Makiya K. Recent increase of human infections with dog heart worm Dirofilaria immitis in Japan //Parassitologia. - 1997. - 39, 4. - P. 387 - 388.
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934.-427 pp.
Morgan E. P. Dogs and nematode zoonoses / Dogs, Zoonoses and Public Health. - Eds. Macpherson C. N. L., Meslin F.-X., Wandeler A. I. - 2nd Edition. - CAB Intern., 2013. - P. 153 - 161.
Nozais J. P, Huerre M. [A case of dirofilariasis of the scrotum of probable origin in Languedoc] // Bull. Soc. Pathol. Exot. - 1995. - 88, 3. - P. 101-102. (Article in French).
Orihel T, C, Eberhard M. L. Zoonotic filariasis H Clin. Microbiol. Rev. - 1998. - 11, 2. - P. 366 - 381.
Orihel T. C., Isbey E. K. Dirofilaria striata infection in a North Carolina child // Am. J. Trop. Med. Hyg. -1990. - 42.-P. 124-126.
Pampiglione S, Canestri T. G., Rivasi F Human dirofilariasis due to Dirofilaria (Nochtiella) repens: a review of world literature // Parassitologia. - 1995. - 37. - P. 149 - 193.
Pampiglione S, Canestri T G., Rivasi F, Vakalis N. Human dirofilariasis in Greece: a review of reported cases and a description of a new, subcutaneous case // Ann. Trop. Med. Parasjtol. - 1996. - 90. - P. 319 - 328.
Reddy M. V. Human dirofilariasis: An emerging zoonosis 11 Trop^Parasitol. - 2013. - 3, 1. - P. 2 - 3.
Sabu L., Devada K., Subramanian H. Dirofilariosis in dogs and humans in Kerala // Indian J. Med. Res. -2005.-121, 5.-P. 691 -693.
Simon F, Siles-Lucas M., Morchon R., Gonzalez-Miguel J. et al. Human and animal dirofilariasis: the emergence of a zoonotic mosaic H Clin. Microbiol. Rev. - 2012. - 25, 3. - P. 507 - 544.
Soussi A., Farah Klibi F, Zermani R, Rammeh S. et al. [Subcutaneous dirofilariasis due to Dirofilaria repens in Tunisia: a case involving the scrotum] 11 Med. Trop. (Mars). - 2004. - 64, 4. - P. 375 - 378.
Vakalis N. C, Himonas C. A. Human and canine dirofilariasis in Greece // Parassitologia. - 1997. - 39, 4. -P. 389-391.
Vicente J. J., Rodrigues H. O., Gomes D. C, Pinto R. M. Nematdides do Brasil. Parte V: Nematdides de mamiferos // Revta. bras. Zool. - 1997. - 14, SupL l.-P. 1 - 452.
Род Loa Stiles, 1905
Род обоснован в 1905 г. для нематод, обнаруженных в подкожной клетчатке жителей Африки, и затем неоднократно переописывался под разными названиями.
Род включает единственный вид - Loa loa (Cobbold. 1864) Castelloni et Chalmers, 19138 (=Filaria medinensis Gmelin, 1788 pro parte; =Filaria oculi humani Dujardin, 1845; =Filaria lacrymalis Dubini, 1850 nee Gurlt, 1833; =Filaria oculi Gervais et van Beneden, 1859; =Dracunculus oculi Diesing, 1860; =Filaria subconjunctivalis Guyon, 1864 sensu Braun, 1902; =Dracunculus loa Cobbold, 1864; =Filaria loa Guyot, sensu Leuckart et al.; Microfilaria diurna Manson, 1891) (рис. 143) (no: Faust, 1949).
Тело полупрозрачное, цилиндрическое, заострённое к переднему концу. Кутикула плотная, гладкая. Маленький терминальный рот без папилл. Имеются 2 латеральные и 4 маленькие субмедианные головные папиллы. Самцы длиной 30 - 40, шириной 0.35 - 0.43 мм. Хвостовой конец спирально закручен, с каудальными крыльями. Спикулы 0.123 - 0.176 и 0.088 - 0.113 мм. Имеются 4 пары преанальных (3 пары крупных и одна пара мелких) и 2 пары мелких постанальных сосочков. Длина тела самок 50 - 70, ширина 0.5 мм. Хвостовой конец тупо закруглён, с одной
8 В монографии М. Д. Сонина (1975) - Loa loa (Guyot, 1778) Stiles, 1905.
355
парой терминальных сосочков. Матка заполнена яйцами на всех стадиях развития и личинками, заключёнными в яйцевую оболочку. Продолжительность жизни червей -от 4 до 17 лет.
Рис. 143 Loa loa: А - передний конец тела с латеральными и субмедианными папиллами; В -задний конец тела самца, вентрально; С - то же, вид сбоку; D - хвостовой конец самки; Е -передний конец самки (из: Faust, 1949)
Микрофилярии обитают в кровеносных сосудах, имеют слабо прокрашивающийся и потому мало замет
ный чехлик. Длина тела 0.25 - 0.30, ширина 0.006 - 0.008 мм; головной конец широкий и плоский, хвостовой - короткий и толстый. Имеются 4 крупные половые клетки.
Окончательный хозяин - человек (нематоду находят и у обезьян), промежуточный -слепни рода Chrysops. Взрослые паразиты поселяются в подкожной клетчатке и в серозных полостях тела, активно передвигаясь под кожей и проникая под конъюнктиву глаза (рис. 144). Рис. 144 Миграционный путь взрослой особи Loa loa в конъюнктиве глаза (из: Faust, 1949)
После инкубационного периода, который длится от 1 до 3 лет, у больных сначала появляются лихорадка, боли в конечностях, крапивница. В последующем при передвижении взрослых червей под кожей отмечаются зуд и жжение в тканях, а при проникновении в глаз - конъюнктивит с опуханием век и резкими болями. Нередко внезапно возникают отёки, так называемая калабарская опухоль. Кожа на этих участках бледнеет или, напротив, краснеет, становится горячей, болезненной., При надавливании ямок не остаётся. Отёк рассасывается очень медленно. Иногда у мужчин возникает гидроцеле. Могут быть выражены абсцессы в мышцах, подмышечных и паховых лимфатических узлах (Лейкина, Шипицина, 1968).
Инвазия людей L. loa характерна для Центральной и Западной Африки. Однако активные миграционные перемещения жителей африканского континента сопровождаются регистрацией заражённых лоа людей и в неэндемичных регионах. Так, с 1986 по 2011 гг. в странах Западной Европы был зафиксирован 61 подобный случай, а в США - 31 (Antinori et al., 2012). Известны случаи находок этого гельминта в Индии (напр., Barua et al., 2005), Бразилии (Passos et al., 2012).
356
Из-за особенностей локализации в организме человека и приуроченности к африканскому континенту паразита называют African eye worm - африканский глазной червь.
Цитируемая литература
Лейкина Е. С., Шипицина Н. К. XXXI. Филяриозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 616-638.-(см. стр. 346).
Сонин М. Д. Филяриаты животных и человека и вызываемые ими заболевания. Часть 3 // Основы нематодологии. - Под ред. чл.-корр. АН СССР К. М. Рыжикова. - М.: Наука, 1975. - 24. - С. 335 - 339.
Antinori S, Schifanella L., Million M, Galimberti L., Ferraris L. et al. Imported Loa loa filariasis: three cases and a review of cases reported in non-endemic countries in the past 25 years H Int. J. Infect. Dis. - 2012. -16, 9.-P. 649-662. doi: 10.1016/j.ijid.2012.05.1023.
Barua P., Barua N., Hazarika N. K., Das S. Loa loa in the anterior chamber of the eye: A case report // In dian J. Med. Microbiol. - 2005. - 23, 1. - P. 59 - 60.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Passos R. M., Barbosa С. P., Almeida J, S., Ogawa G. M., Camargo L. M. A. Subconjunctival Loa loa worm: First case report in Brazil // Arq. Bras. Oftalmol. -2012.-75, 1. - P. 67 - 70.
Род Mansonella Faust, 1929
В настоящее время в роде Mansonella выделяют 7 подродов (Bain et al., 2015), объединяющих 31 вид. Среди паразитирующих у человека, прежде всего, называют Mansonella ozzardi, а также М. perstans и М. streptocerca (Crewe, 2001) (в старых публикациях их можно встретить vAcanthocheilonema или Dipetalonema).
Mansonella ozzardi (Manson, 1897) Faust, 1929 [=Filaria ozzardi Manson, 1897; =Filaria dernarquay Manson, 1897; =Filaria juncea Railliet, 1918; =Filaria tucu-mana Biglieri et Azaoz, 1917; =Dipetalonema ozzardi (Manson, 1897) Chabaud et Cho-quet, 1953]. Синонимы приведены по работе: Bain et al., 2015.
Кутикула без выраженной пеперечной исчерченности. Ротовая капсула отсутствует. Небольшой рот ведёт в нитевидный пищевод. Длина самцов 24 - 28.4, толщина 0.7 - 0.8 мм (размеры нематод из мартышки-гусара на Гаити - Orihel, Eberhard, 1982). Длина пищевода 0.77 - 1.02 мм. Хвост сильно изогнут, постепенно сужается к заднему концу, где резко закругляется в небольшую бульбу. Спикулы 0.38 - 0.42 и 0.14 - 0.16 мм. Длина самок 32 - 61.5, толщина 0.13-0.16 мм. Головной конец на уровне нервного кольца слегка вздут. Длина пищевода 0.77 - 1.05 мм. Хвостовой конец с 2 боковыми мышечными выступами. Анальное отверстие на небольшой папилле. Вульва впереди уровня соединения пищевода с кишечником.
Полностью развитые личинки покидают яйцевую оболочку и выходят в кровь без чехлика (рис. 145). Длина микрофилярий 0.185 - 0.232 мм, диаметр 3 -5 цт.
Хвостовой конец утончён. Ядро на верхушке хвоста отсутствует. В свежих мазках крови личинки отличаются высокой подвижностью, постоянно сворачиваются кольцом.
Рис. 145 Микрофилярия Mansonella ozzardi в мазке крови (препарат окрашен Гимза раствором) (из: en.wikipedia.org/../Mansonella_ozzardi/media/)
357
Переносчики микрофилярий - мокрецы Culicoides furens и другие виды семейства Heleidae. Личинки в теле переносчика достигают инвазионной стадии за 5 - 7 дней. Очень мелкие самки комаров с относительно длинным хоботком питаются кровью человека и животных, присаживаясь на свою жертву незаметно, зачастую ночью и в помещении. Их уколы весьма болезненны и вызывают зуд. Взрослые особи паразитируют у человека в брыжейке и под серозным покровом брюшной полости, микрофилярии - в крови, лишены периодичности (Лейкина, Шипицина, 1968).
Заражение М. ozzardi сопровождается артралгией, головными болями, лихорадкой, лёгочными симптомами, лимфаденитом, увеличением печени и зудом.
Заболевание людей приурочено к 17 странам Латинской Америки - от Мексики на севере до Аргентины на юге, а также в Карибском бассейне (Beaver et al., 1976; Faust, 1949; Kozek et al., 1983; Medeiros et al., 2009, 2014; Orihel, 1967).
Mansonella perstans (Manson, 1891) Orihel et Eberhard, 1982 [= Filaria perstans Manson, 1891; =Filaria sanguinis hominis minor (Manson, 1891); =Filaria ozzardi var. truncata Manson, .1897; =Acanthocheilonema perstans (Manson, 1891) Railliet, Henry et Langeron, 1912; =Dipetalonema perstans (Manson, 1891) Yorke et Maplestone, 1926; =Tetrapetalonema perstans (Manson, 1891) Yeh, 1957]. Синонимы приведены по работе: Bain et al., 2015.
Правая спикула с мембранной ложкообразной дистальной частью. Самки длиной до 50 мм. Вульва на уровне задней половины пищевода. Вагина очень длинная. Микрофилярии длиной 0.162 - 0.205 мм, с ядром на верхушке хвоста.
Паразит человека; встречается также у гориллы, шимпанзе. Впервые был обнаружен у женщины в Конго Е. ВгитрСом, но изучен А. Шабо в 1952 г. (Chabaud, 1952). Поселяется в лимфатических узлах, в мезентерии, почках, печени, поджелудочной железе, ректуме. Заражение часто протекает бессимптомно, но, тем не менее, могут наблюдаться отёк Квинке, кожный зуд, лихорадка, головные боли, боль в суставах, а также неврологические проявления. Во многих случаях отмечается эозинофилия (Bregajii et al., 2007).
Заражённость людей Л/, perstans регистрируют в странах Центральной и Южной Америки и в Африке к югу от Сахары (Beaver et al., 1976; Bregani et al., 2007; Kozek et al., 1983; Orihel, 1967; Simonsen et al., 2011). К примеру, на юге Конго паразит выявлен у 80 % пигмеев (Noireaux et al., 1990).
Mansonella streptocerca (Macfie et Corson, 1922) Orihel et Eberhard, 1982 [=Agamofilaria streptocerca Macfie et Corson, 1922; =Dipetalonema streptocerca (Macfie et Corson, 1922) Peel et Chardome, 1946; =Acanthocheilonema streptocerca (Macfie et Corson, 1922) Faust, 1949; =Moennigofilaria streptocerca (Macfie et Corson, 1922) Liang-Sheng, 1957; =Tetrapetalonema (Esslingeria) streptocerca (Macfie et Corson, 1922) Chabaud et Bain, 1976]. Синонимы из работы: Bain et al., 2015.
Впервые описан на материале от человека. Встречается также у шимпанзе, гориллы.
Длина самцов 17.5 - 18.1 при толщине 0.47, самок соответственно 27.4 -27.6 и 0.81 мм. Микрофилярии длиной 0.19 - 0.208 мм.
Нематоды локализуются в подкожной ткани примерно на 1 мм ниже эпидермиса и продуцируют микрофилярий, которые остаются в коже. Заражение мо-
358
жег проявляться кожным зудом, папулёзными высыпаниями, изменением пигментации, а также эозинофилией.
М. streptocerca впервые обнаружена у человека в Центрально-Африканской Республике L. О. Lanoie (материал обработан авторами статьи - Bain et al., 1995). Заражение людей регистрируют в Гане, Уганде, Центрально-Африканской Республике, Конго (Bain et al., 1995; Fischer et al., 1997a, 1997b; Neafie et al., 1975). Поражённость местного населения может достигать высоких показателей. К примеру, в Уганде в 12 деревнях паразита выявили у 5 - 89 % лиц старше 15 лет (Fischer et al., 1997а). Полагают, что в Африке им поражено 114 млн. человек.
Кроме того, в ряде источников (напр., itg.author-e.eu. Illustrated Lecture Notes on Tropical Medicine) можно встретить информацию о случайной регистрации у человека Mansonella rodhaini (Peel et Chardome, 1946)’ (однажды найдена у 14 из 440 человек в одной из деревень в Габоне - Richard-Lenoble al., 1982) и Mansonella semiclarum Fain, 1974 (в Конго). Оба вида продуцируют микрофилярий в организме человека. Переносчиком М. rodhaini является Culicoides sp., для М. semiclarum таковой не известен. К слову, М. semiclarum описана только по микрофиляриям (Сонин, 1975).
Среди паразитирующих у человека филяриат М. Д. Сонин (1975) называет Dipetalonema berghei (Peel et Chardome, 1951) Chabaud, 1952, найденную в стенке мочевого пузыря у местного жителя в Конго. В настоящее время данный вид относят к синонимам М. perstans, обычной у жителей этой страны (Bain et al., 1995). >
И, наконец, в 2015 г. появилась публикация, авторы которой (Mourembou et al., 2015) обнаружили у детей в Габоне, наряду с М. perstans, Mansonella, являющуюся, по их мнению, новым видом, условно названным Mansonella sp. «DEUX». Новый вид был выявлен только у фебрильных детей.
Цитируемая литература
Сонин М. Д. Филяриаты животных и человека и вызываемые ими заболевания. Часть третья. // Основы нематодологии. - Под ред. чл.-корр. АН СССР К. М. Рыжикова. - М.: Наука, 1975. - 24. - 396 с.
Bain О., Moisson Р., Huerre М„ Landsoud-Soukate J., Tulin С. Filariae from a wild gorilla in Gabon with description of a new speies of Mansoniella // Parasite. - 1995. - 2. - P. 315 - 322.
Bain O., Mutafchiev Y., Junker K., Guerrero R., Martin C, Lefoulon E., Uni S. Review of the genus Mansonella Faust, 1929 sensu lato (Nematoda: Onchocercidae), with descriptions of a new subgenus and a new subspecies//Zootaxa.-2015.-3918, 2.-P. 151 - 193. doi: 10.11646/zootaxa.3918.2.1.
Beaver P. C, Neel J. V., Orihel T. C. Dipetalonema perstans and Mansonella ozzardi in Indians of southern Venezuela // Am. J. Trop. Med. Hyg. - 1976. - 25. - P. 263 - 265.
Bregani E. R„ Tantardini F„ Rovellini A. [Mansonella perstans filariasis] // Parassitologia. - 2007. - 49, 1-2. - P. 23 - 26. (Article in Italian).
Chabaud A. G. Le genre Dipetalonema Diesing, 1861; essai de ckassification // Ann. Paras. Hum. Comp. -1952. - 27.-P. 250-285.
Chardone M., Peel E. Une nouvelle Filaire chez 1’homme au Congo Beige: Tetrapetalonema berghei n. sp. // Ann. Soc. Beige M6d. Trop. -1951. - 31. - P. 571 - 580.
Crewe W. Mansonneliasis. - Encyclopedia of Arthropod-transmitted infections of man and domesticated animals. - CABI Publ, 2001. - P. 327 - 329.
Fischer P„ Bamuhiiga J., Bilttner D. W. Treatment of human Mansonella streptocerca infection with ivermectin // Trop. Med. Intern. Health. - 1997a. - 2,2. - P. 191 - 199.
Fischer P., Bamuhiiga J., Biittner D. W. Occurrence and diagnosis of Mansonella streptocerca in Uganda // Acta Trop. - 1997b. - 63. - P. 43 - 55.
’ Ha www.worms-info.ru вид указан как Microfilaria rodhani.
359
Kozek IV. J., Palma G., Henao A., Garcia H., Hoyos M. Filariasis in Colombia: prevalence and distribution of Mansonella ozzardi and Mansonella (= Dipetalonema) perstans infections in the Comisaria del Guainia // Am. J. Trop. Med. Hyg. - 1983.-32. - P. 379 - 384.
Medeiros J. R, Costa C. A., Lima A. M., Pessoa F. A. Mansonella ozzardi (Nematoda: Onchocercidae) in the riverine population of the Tef£ River, state of Amazonia, Brazil // Rev. Soc. Bras. Med. Trop. - 2014. - 47. -P. 113-115.
Medeiros J. F., Ру-Daniel V., Barbosa U. C, Izzo T. J. Mansonella ozzardi in Brazil: prevalence of infection in riverine communities in the Purus region, in the state of Amazonas // Mem. Inst. Oswaldo Cruz. - 2009. -104, l.-P. 74-80.
Mourembou G., Fenollar F, Lekana-Douki J. B., Ndjoyi Mbiguino A., Maghendji Nzondo S. et al. Mansonella, including a potential new species, as common parasites in children in Gabon / /PLoS Negl. Trop. Dis. -2015.-9, 10: e0004155. doi: 10.1371/joumal.pntd.0004155.
Neafie R. C.t Connor D. H, Meyers W. M. Dipetalonema streptocerca (Macfie and Corson, 1922): description of the adult female // Am. J. Trop. Med. Hyg. - 1975. - 24. - P. 264 - 267.
Noireaux F., Itoua A., Carme B. Epidemiology of Mansonella perstans filariasis in the forest region of south Congo // Ann. Trop. Med. Parasitol. - 1990. - 84. - P. 251 - 254.
Orihel T. C, (1967) Infections with Dipetalonema perstans and Mansonella ozzardi in the aboriginal Indians of Guyana // Am. J. Trop. Med. Hyg. - 1967. - 16. - P. 628 - 635.
Orihel T. C, Eberhard M. L. Mansonella ozzardi'. a redescription with comments on its taxonomic relationships // Am. J. Trop. Med. Hyg. - 1982. - 31. - P. 1142 - 1147.
Richard-Lenoble D., Kombila M., Bain O. Foyer de filariose humaine au Gabon a microfilaire dermique in-diffSrenciable de Microfilaria rodhaini // Ann. Parasitol. Hum. Comp. - 1982. -57. - P. 506.
Simonsen P. E., Опара A. W., Asio S. M. Mansonella perstans filariasis in Africa // Acta Trop. -2011.- 120, Suppl. l.-P. 109-120. doi: 10.1016/j.actatropica.2010.01.014.
Род Meningonema Orihel et Esslinger, 1973
Нематод впервые нашли в мозге мартышки крошечной в Уганде в 1928 г. (Peruzzi, 1928), но не описали их. Первое подробное описание паразита, оказавшегося представителем нового рода - Meningonema, появилось значительно позже, в 1973 г., и было основано на материале от мартышки Cercopithecus talapoin из Экваториаль-ноцТвинеи (Orihel, Esslinger, 1973).
Meningonema peruzzi Orihel et Esslinger, 1973 (рис. 146). Вид назван в честь первооткрывателя этих червей М. Peruzzi - менингонема Перуцци.
Нематоды средних размеров. Стенка тела очень тонкая, прозрачная. Кутикула без поперечной исчерченности. Передний конец тела овальной формы, без кутикулярной орнаментации, большего диаметра, чем остальная часть тела. Рот простой. Ротовая капсула отсутствует. Пищевод короткий, без чёткого разделения на мышечную и железистую части. Хвост длинный, узкий, округлый. Самцы длиной 33 - 50 мм. Хвост без латеральных крыльев, с 5 - 4 парами пре- и 3 парами постанальных сосочков. Левая спикула лезвиеподобная, длиной 0.160 - 0.192 мм, правая - ладьевидная, 0.099 - 0.116. Рулёк отсутствует. Самки длиной 86 - 122 мм, тетрадельфные (4 матки), опистодельфные. Вульва в углублении в области пищевода. Вагина короткая.
Микрофилярии длиной 0.160-0.181 и диаметром 3 -5 pm. Тело цилиндрическое, слегка расширенное на переднем конце и постепенно сужающееся к заднему. Личинки остаются в чехлике, паразитируя в периферической крови. В окончательном хозяине взрослые черви поселяются в субарахноидальном пространстве на уровне продолговатого мозга.
360
Рис. 146 Meningonema peruzzi'. 1 - передний конец самки, латерально; 2 - задний конец самки; 3 - передний конец самца; 4 -задний конец самца; 5 - спикулы; 6 - микрофилярия
(из: Orihel, Esslinger, 1973)
Описывая новый вид, его авторы (Orihel, Esslinger, 1973) предположили, что к нему может относиться похожая на perstans микрофилярия (perstans-\iks microfilariae), обнаруженная ранее в мозговой жидкости у служившего в Родезии европейского солдата, у которого развился энцефаломиелит (Duke et al, 1968).
Возможность попадания М. peruzzii к человеку подтвердила находка личинки этого вида в спинномозговой жидкости жителя Камеруна, одновременно поражённого также Loa loa (Bous-sinesq et al, 1995).
Цитируемая литература
Boussinesq M., Bain O.f Chabaud A. G., Gardon-Wendel N., KamgnoJ., Chippaux J. P. A new zoonosis of the cerebrospinal fluid of man probably caused by Meningonema peruzzii, a filaria of the central nervous system of Cercopithecidae // Parasite. - 1995. - 2. - P. 173 - 176.
Duke D. C, Geklfand M., Gado K. G., Clarke V., Goldsmid M. Cerebral filariasis caused by Acanthocheilo-nema perstans // Centr. Afr. J. Med. - 1968. - 14, 1. - P. 21 - 27.
Orihel T. C, Esslinger J. H. Meningonema peruzzii gen. et sp. n. (Nematoda: Filarioidea) from the central nervous system of African monkeys I I J. Parasitol. - 1973. - 59, 3. - P. 437 - 441.
Peruzzi M. Cerebral filariasis in five monkeys infected with trypanosomal meningoencephalitis // League of Nations Health Organization, Final Report of the International Commission on human trypanosomiasis. -1928.-P. 309-313.
Род Molinema Freitas et Lent, 1939
Представители рода примечательны латерально удлинённой головой, плоской или вогнутой, и особенностями строения спикул. Левая спикула состоит из двух частей: проксимальной продольной складчатой и дистальной узкой (в виде филамента), которые могут быть равны по длине; правая спикула в форме конусовидного образования. У самок часто заметны железистые клетки, прикрепившиеся к вагине близ
361
вульвы. Микрофилярии без чехлика. Передний конец заострён, с маленьким крючком. Задний конец сужается до тонкой безъядерной точки.
Род объединяет 12 видов, из них 2 - Molinema arbuta (Highby, 1943) и М. sprenti (Anderson, 1953) зарегистрированы у человека. В скобках замечу, что ранее эти виды включали в состав рода Dipetalonema. Первый из них - паразит дикобраза североамериканского (Highby, 1943), второй - бобра канадского (Anderson, 1953).
Известны всего три находки этих нематод в глазах пациентов на западе Орегона (США) (Beaver et al., 1980). По мнению авторов, по своей морфологии черви были похожи на М. arbuta (рис. 147) или М. sprenti.
Рис. 147 Molinema arbuta'. а - передний конец самки, вид сбоку; б -головной конец самки, апикально; в - то же, вид сбоку; г - хвостовой конец самца, вид сбоку (из: Сонин, 1975 - по: Highby, 1943, как Dipetalonema arbuta)
Сонин М. Д. Филяриаты животных и человека и вызываемые ими заболевания. Часть третья. Филярииды, онхоцерцины И Основы нематодологии. - Под ред. чл.-корр. АН СССР К. М. Рыжикова. - М.: Наука, 1975. - 24. - 396 с.
Anderson R С. Dipetalonema sprenti n. sp. from Castor canadensis Kuhl H Parasitology. -1953.-43.-P. 215 -221.
Beaver P. C., Meyer E. A., Jarroll E. L., Rosenquist R. C. Dipetalonema from the eye of a man in Oregon, U.S.A. A case report 11 Am. J. Trop. Med. Hyg. - 1980. - 29, 3. - P. 369 - 372.
Highby P. R. Dipetalonema arbuta n. sp. (Nematoda) from the porcupine, Erethizon dorsatum (L.) // J. Parasitol. - 1943. - 29, 4. - P. 239 - 242.
Род Pelecitus Railliet et Henry, 1910
Описание (no: Bain et al., 2011). Голова тупо закруглена, с 4 папиллами. Имеется 4 головных сосочка и 2 амфиды. Вдоль тела тянутся два округлых латеральных кутикулярных крыла. Ротовая полость с тонким кутикулярным кольцом. Самец с крупными хвостовыми крыльями, на латеральной стороне которых имеется 2 железистых включения. Имеется 5 пар хвостовых сосочков (2 пары стебельчатых преклоа-кальных латеральных, 1 пара маленьких субвентральных близ клоакального отверстия, и 2 пары стебельчатых латеральных сосочков на задней половине хвоста) и 2 субтерминальные фазмиды. Две спикулы неравной длины. Типовой вид - Pelecitus helicinus (Molin, 1860) Railliet et Henry, 1910.
Представители рода - паразиты птиц и млекопитающих. Переносчики - комары, слепни.
362
Известно всего две находки нематод данного рода у человека. Первая - на северо-западе Колумбии. Здесь у человека в передней камере левого глаза обнаружили червя длиной 4.5 мм, оказавшегося самцом нематоды, которую первоначально отнесли к роду Loaina Eberhard et Orihel, 1984 (Botero et al., 1984), а затем перевели в род Peleci-tus (Bartlett, Greiner, 1986). Род Loaina был обоснован для двух видов Dirofilaria, паразитирующих у кроликов в Северной Америке, - D. scapiceps (Leidy, 1886) (рис. 148) и D. uniformis Price, 1957 (Eberhard, Orihel, 1984). Впоследствии D. scapiceps был отнесён к роду Pelecitus.
Рис. 148 Pelecitus scapiceps'. а - хвостовой конец самца, вентрально; б - хвостовой конец самки, вентрально; в -спикулы; г - передний конец тела самки (из: Сонин, 1975)
Следующий случай имел место в Бразилии (Bain et al., 2011). В передней камере левого глаза у 29-летнего мужчины, работавшего в лесопарковой зоне, был выявлен червь длиной в 4 мм. Нематоду удалили аспирационным путём.
Цитируемая литература
Сонин М. Д. Филяриаты животных и человека и вызываемые ими заболевания. Часть третья. Филя-ривды, онхоцерцины // Основы нематодологии. - Под ред. чл.-корр. АН СССР К. М. Рыжикова. -М.: Наука, 1975. - 24. - С. 278 - 279.
Bain О., Otranto D., Diniz D. G., Nascimento dos Santos J., Pinto de Oliveira N. et al. Human intraocular filariasis caused by Pelecitus sp. nematode, Brazil // Emerg. Infect. Dis. - 2011. - 17, 5. - P. 867 -879. http://dx.doi.org/10.3201/eidl705.101309.
Bartlett С. M., Greiner E. C. A revision of Pelecitus Railliet & Henry, 1910 (Filarioidea, Dirofilariinae) and evidence for the “capture” by mammals of filarioids from birds // Bull. Mus. Nat. d’Hist. Nat. (Paris). -1986.-8, l.-P. 47-99.
Botero D., Aguledo L. M., Uribe F. J., Esslinger J. H., Beaver P. C. Intraocular filaria, a Loaina species, from man in Colombia// Am. J. Trop. Med. Hyg. - 1984. -33,4. -P. 578 - 582.
Eberhard M. L., Orihel T. C. Loaina gen. n. (Filarioidea: Onchocercidae) for the filariae parasitic in rabbits in North America // Proc. Helminthol. Soc. Wash. - 1984. - 51,1. - P. 49 - 53.
Род Wuchereria Da Silva Araujo, 1877
He будет преувеличением сказать, что среди нематод семейства Onchocercidae одним из наиболее известных видов, в силу оказываемого им негативного влияния на здоровье человека, является Wuchereria bancrofti (Cobbold, 1877).
Ещё один вид Wuchereria из человека - W. lewisi Schacher, 1969 был найден в Бразилии и описан только по микрофиляриям (Schacher, 1969).
363
Wuchereria bancrofti (Cobbold, 1877) Seurat, 1921 (рис. 149) (=Filaria sanguinis hominis sensu Bush, 1872; =Filaria sanguinis hominis egyptiaca Sonsino, 1874; =Filaria bancrofti Cobbold, 1877; =Wuchereria filaria da Silva Araujo, 1877; =Filaria wuchereri da Silva Araujo, 1878; =Filaria sanguinis van Beneden, 1878; =Filaria noc-turna Manson, 1891; =Filaria philippinensis Ashburn et Craig, 1906). Синонимы no: Faust, 1949.
В русскоязычной научно-справочной литературе паразит получил название нитчатка Банкрофта, Банкрофтов струнец. Вв
Рис. 149 Wuchereria bancrofti: А - передний конец тела, вентрально; В - задний конец самца с папиллами; С -спикулы и губернакулюм; D - передний конец самки; Е - задний конец самки, вид сбоку (из: Faust, 1949 - по разным авторам)
Средних размеров нитевидные нематоды с закруглёнными концами тела (Лейкина, Шипицина, 1968; Сонин, 1975; Bain et al., 1985; Muller, 2002). Кутикула гладкая, за исключением задней части тела, где у самцов имеется поперечная ис-черченность, а у самок - многочисленные мелкие кутикулярные бляшки. Головной конец слегка расширен и несёт 8 сидячих сосочков, расположенных в двух рядах, и пару амфид. Самцы длиной до 30 - 40 при ширине 0.1 мм. Хвостовой конец загнут вентрально и снабжен 2 спикулами неравной величины, 8 парами пре- и 4 парами постанальных сосочков. Самки длиной 80 - 100 и шириной 0.24 - 0.3 мм. Вульва возле уровня середины пищевода. Одна самка в сутки продуцирует до 50 тыс. микрофилярий, длина тела которых достигает 0.25 - 0.3 при ширине 0.008 мм.
Микрофилярии, циркулирующие в периферической крови, заключены в чехлик и достигают в длину 0.127 - 0.320, в ширину 0.007 - 0.010 мм. Головной конец тела закруглён, со стилетом; хвостовой конец утончён. Центральная часть заполнена множеством мелких ядер. Имеются 4 крупные половые клетки.
Развитие паразита от момента попадания в организм человека до взрослого состояния происходит в течение 6-12 мес. Продолжительность жизни взрослых особей в организме человека может достигать 17 лет, микрофилярий - 70 дней.
Окончательный хозяин нематоды - человек, он же - источник инвазии; промежуточный хозяин и переносчик паразита - комары родов Anopheles, Culex,
364
Aedes. Болезнь от человека к человеку не передаётся. Взрослые особи паразитируют в лимфатических узлах и сосудах различных участков тела, микрофилярии - в кровеносной системе, где мигрируют между глубокими и периферическими сосудами. В зависимости от типа миграции микрофилярий у W. bancrofti различают два штамма: периодичный и субпериодичный. Представители первого в дневное время встречаются в сосудах лёгких, ночью - в периферической крови, второго - находятся в периферической крови круглосуточно, но днём их число заметно растёт.
Патогенное воздействие оказывают как взрослые черви, так и личинки. Поскольку большинство микрофилярий, мигрирующих в крови человека, не попадает к насекомым, то они в конечном итоге погибают. При их разложении выделяются токсины, что вызывает развитие аллергических реакций. Взрослые особи, скапливаясь клубками в лимфатических сосудах, закупоривают их просвет, тем самым замедляя лимфоток, что влечёт за собой варикозное расширение лимфатических сосудов и увеличение лимфатических узлов. В результате длительных лимфангитов и лимфаденитов может развиться слоновость (элефантизм) различных частей тела.
Заболевание распространено среди местного населения в большинстве экваториальных стран тропической Африки между 20° с.ш. и 20° ю.ш., а также на Мадагаскаре, в Бангладеш, Пакистане, Шри-Ланке, Индии, Китае, Индонезии, Корее, Японии, Мьянме, Таиланде, на Филиппинах, на севере Южной Америки, в Кариб-ском бассейне, на островах Тихого океана - Новой Гвинее, Меланезии, Полинезии, включая Фиджи, Самоа, Таити, на Гавайях (Muller, 2002). Помимо того, известны случаи регистрации W. bancrofti в неэндемичных районах у выходцев из тихоокеанского региона (Alicata, 1964). В мире этим гельминтом поражено, по меньшей мере, 107 млн. человек (Muller, 2002).
Цитируемая литература
Лейкина Е. С, Шипицина Я. К. XXXI. Филяриозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 616 - 638. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. проф. П. Г. Сергиев).
Сонин М.Д. Филяриаты животных и человека и вызываемые ими заболевания. Часть третья. // Основы нематодологии. - Под ред. чл.-корр. АН СССР К. М. Рыжикова. - М.: Наука, 1975. - 24. - 396 с.
Alicata J. Е. Parasitic infections of man and animals in Hawaii // Trop. Bull. - Hawaii, Honolulu, 1964. - No. 61.-138 pp.
Bain O., Dissanaike A. S., Cross J. H., Harinasuta C., Sucharit S. Morphologie de Wuchereria bancrofti adulte et sub-adulte // Ann. Parasitol. Hum. Comp. - 1985. - 60. - P. 613 - 630.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Schacher J. F. Intraspecific variation in microfilariae, with description of Wuchereria lew is i sp. nov. (Nematoda, Filarioidea) from man in Brazil //Ann. Trop. Med. Parasitol. - 1969. -63, 3. -P. 341 -351.
Семейство Oxyuridae Cobbold, 1864
Семейство, объединяющее 54 рода с 257 видами, включают в класс Chromadorea в составе отряда Rhabditida (De Ley, Blaxter, 2002) или Spirurida (Hodda, 2011).
Описание (по: Скрябин и др., 1951). Мелкого или среднего размера нематоды. Ротовые органы разнообразного строения. Пищевод снабжён бульбусом с клапанным аппаратом или двумя бульбусами, иногда средняя часть пищевода веретенообразно
365
вздута; у некоторых форм имеется мощно развитый фаринкс. Самцы с одной спикулой. Губернакулюм отсутствует. Вульва самок открывается в передней или задней половине тела. Яйцекладущие. Паразиты млекопитающих, рептилий, амфибий, редко рыб и птиц. Типовой род - Oxyuris Rudolphi, 1803.
Среди всех оксиурид нас интересуют только представители рода Enterobius Leach, 1853, поскольку именно их регистрируют у человека.
Род Enterobius Leach, 1853
Синонимы (по: Скрябин и др., 1951):
Oxyurias Stiles, 1905;
Fusarella Seurat. 1916;
Lumbriculus Aldrowande-Blanchard. 1889.
Описание (по разным авторам, в том числе: Скрябин и др., 1951; Faust, 1949). Ротовое отверстие окружено 3 губами. Кутикула с головной везикулой и боковыми крыльями, тянущимися от нервного кольца до анальной области. Фаринкс отсутствует. Бульбус пищевода с жевательным аппаратом, перетяжкой отделён от переднего отдела пищевода. Экскреторное отверстие позади уровня бульбуса. Хвост самца резко срезан на небольшом расстоянии от клоаки. Имеются стебельчатые пре- и постанальные сосочки и 2 пары сидячих постанальных сосочков. У самок хвост конический, сравнительно короткий. Вульва в передней части тела, за пределы кутикулярного покрова не выступает. Вагина очень короткая. Матки параллельные. Паразиты приматов и человека. Типовой вид - Enterobius vermicularis (Linnaeus, 1758) Leach, 1853.
Наиболее распространённым паразитом человека является Е. vermicularis. В некоторых регионах вместе с ним обычно встречается Е. gregorii Hugot, 1983.
Enterobius vermicularis (Linnaeus, 1758) Leach, 1853 [=Ascaris vermicularis Linnaeus, 1758; =Fusaria vermicularis (L., 1758) Zeder, 1803; =Oxyuris vermicularis (L., 1758) Lamarck, 1816; ^Oxyuris vermicularis (L., 1758) Bremser, 1819; -Oxyurias vermicularis (L., 1758) Stiles, 1905; =Fusarella vermicularis (L., 1758) Seurat, 1916] (рис. 150). Синонимы по: Скрябин и др., 1951; Faust, 1949.
В англоязычной литературе Е. vermicularis называют pinworm, threadworm, seatworm, в русскоязычной - острицы. Эти черви известны с древнейших времён. Их яйца были обнаружены в пещерах в Чили и США в копролитах, возраст которых составлял, по меньшей мере, 10 тыс. лет (Hugot et al., 1999; Muller, 2002).
Мелкие нематоды белого цвета, цилиндрической формы, с заострёнными концами тела. Самцы длиной 2-5, толщиной 0.2 мм. Задний конец тела загнут вентрально. Длина спикулы не более 0.1 - 0.14 мм. Длина самок 8 - 13, толщина 0.3 - 0.5 мм, хвост длинный, заострённый, по длине достигает примерно 1/3 длины тела. Матки заполнены огромным количеством яиц. Подсчитано, что зрелая самка может содержать 20 тыс. яиц (Leuckart, 1868 - цит. по: Faust, 1949). Когда самки начинают наполняться яйцами, их матка настолько растягивается, что заполняет всю полость тела. Яйца удлинённо-овальные, с одной стороны уплощённые, размерами 50 - 60 х 20 - 30 pm. Развитие без смены хозяев. Самцы после копуляции погибают. Взрослые самки живут 5-13 недель, самцы - 7 (Muller, 2002).
366
Рис. Enterobius vermicularis'. A - передний конец червя, вентрально; В -задний конец самца, вентрально; С -задний конец самца, вид сбоку (из: Faust, 1949 - по: Yorke, Maplestone, 1926)
Рис. Enterobius vermicularis'. 1 - самка; 2, 3 - хвостовой конец самца; 4 - самец; 5 -головной конец апикально (из: Скрябин и др., 1951 - по: 1 - 4 - Скрябин, Шульц, 1929: 5-Cameron. 1929)
В организме человека нематоды локализуются в заднем отделе тонкого кишечника, верхнем отделе толстой кишки и червеобразном отростке, прикрепляясь к слизистой оболочке при помощи головной везикулы и удерживаясь присасывательными движениями бульбуса пищевода (Семёнова, 1968). В редких случаях они мигрируют в желудок, пищевод и даже в ротовую полость; могут встретиться в носу и носоглотке. Для откладки яиц самки выползают из анального отверстия, вызывая при этом сильный зуд. Нередко черви заползают на промежность, половые органы, бёдра, откладывая яйца по пути следования. Половозрелая самка откладывает от 4 до 17 тыс. яиц. Обычно это происходит вечером или ночью. Яйца, отложенные непосредственно на теле человека, где имеются все необходимые условия для их развития (достаточное количество влаги, кислорода, благоприятная, около 36°С, температура), дозревают в течение 4 - 6 ч и в них формируется рабдитовидная личинка. Такие яйца уже инвазионны и, будучи занесены в рот человека, вызывают его заражение (Семёнова, 1968).
Для заболевания, вызываемого острицами, зарубежной научно-справочной литературе используют названия enterobiasis, enterobiosis, oxyuriasis - энтеробиазис, энтеробиозис, оксиуриазис, в русскоязычной литературе - энтеробиоз.
367
В большинстве случаев, при невысокой инвазии, Е. vermicularis не наносит заметного вреда организму человеку, но, тем не менее, вполне возможна и серьезная патология. Как и другие гельминты, острицы выделяют токсины, отравляя организм хозяина, что приводит к быстрой утомляемости, тошноте, рвоте, иногда возникают нервные расстройства, малокровие. Внедряясь в слизистую оболочку кишечника, черви вызывают её воспаление. Возможно также развитие абсцессов, флегмон, некрозов. Доказана роль остриц в возникновении аппендицита.
Е. vermicularis - один из наиболее обычных паразитов человека, особенно в регионах, расположенных в умеренном климате. Вызываемое им заболевание ВОЗ (WOH) классифицирует как наиболее широко распространённое в глобальном аспекте (Totkova et al., 2003). По оценкам специалистов, в мире этой нематодой поражён 1 млрд, человек (Cook, 1994). В тропических и слабо развитых странах, в целом, заражение-менее распространено, возможно, по причине того, что население в тех краях носит меньше одежды (Muller, 2002).
Особенно часто инвазия встречается у детей. В одном из районов Словакии (Turiec) заболевание выявили у 25.6 % детей (Straka et al., 2001), а в Братиславе - у 11.38 % от числа обследованных детей дошкольного возраста и 19.12 % - школьников (Totkova, 1999). По РФ энтеробиоз отмечен в среднем у 3 из каждых 100 детей в возрасте до 14 лет, при этом на Дальнем Востоке в Еврейской АО данный показатель в 2 раза выше (Калинина, 2005). Непроизвольно расчёсывая ночью зудящие места, ребёнок заносит под ногти мельчайшие яйца нематоды, вследствие чего происходит самозаражение и, как следствие, резко возрастает интенсивность инвазии. «Забывая» вымыть руки, касаясь продуктов питания, посуды, такой ребёнок служит источником инвазии для остальных членов семьи, других детей в дошкольном учреждении или же школе.
Профилактика энтеробиоза сводится в основном к соблюдению стандартных санитарно-гигиенических правил. Прежде всего, это - мытьё рук, содержание в чистоте жилых помещений и пищеблоков, борьба с мухами и тараканами, чистота нательного и постельного белья. Очень важно исключить возможность самозара-жения тех, кто страдает энтеробиозом, т.к. именно при высокой заражённости возрастает риск развития тяжёлых патологий. Большое значение придаётся санитарно-просветительской работе среди детей, их родителей, работников дошкольных учреждений, школ, интернатов (Калинина, 2005).
Enterobius gregorii Hugot, 1983. Самцы этого вида отличаются простой, более короткой спикулой (0.06 - 0.08 мм) и кутикулярной орнаментацией вокруг клоакального отверстия (Hugot, 1983; Hugot, Tourte-Schaefer, 1985).
Как отмечено выше, данный вид встречается обычно вместе с Е. vermicula-. ris. К примеру, в Японии у 64-летнего мужчины было выявлено 754 экз. Е. gregorii и 87 особей Е. vermicularis (Hasegawa et al., 1998). Несколько иная картина наблюдалась при обследовании школьников в одном из городов Кореи: здесь Е. gregorii отметили в 23.2 % случаев, E.vermicularis - в 76.8 % (Ahn et al., 1992).
Заражение людей известно во Франции, Англии, Японии, Южной Корее, Новой Гвинее (Ahn et al., 1992; Hasegawa et al., 1998; Hugot, Tourte-Schaefer, 1985; Chittenden, Ashford, 1987 и др.). Учитывая, что отличить друг от друга оба вида можно лишь при их тщательном морфологическом изучении, надо полагать, что в действительности ареал Е. gregorii может быть шире, чем это принято считать.
368
Цитируемая литература10
Калинина О, И. Биология гельминтов и профилактика гельминтозов (учебное пособие). - Владивосток: Изд-во ТГЭУ, 2005. - 80 с.
Семёнова Н. Е. Глава XXVII. Энтеробиоз и сифачиоз / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 581 - 587. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Скрябин К. И., Шихобалова Н. П., Мозговой А. А. Оксиураты и аскаридаты И Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1951. - 2. - С. 41 - 45.
Скрябин К. И., Шульц Р. С. Гельминтозы человека. Основы медицинской гельминтологии. - М.: Мед. изд., 1929.-4.1.-376 с.
Ahn Y.K., Chung Р. R., Soh С. Т. [Enterobius gregorii Hugot, 1983 recovered from school children in Kang-won-Do, Korea] // Korean J. Parasitol. - 1992.-30, 3. - P. 163 - 167. (Korean text, English summary).
Cameron T. W. M. The species of Enterobius Leach in primates // J. Helminthol. - 1929. - 7, 3. - P. 161 -182.
Chittenden A. M., Ashford R. IT. Enterobius gregorii Hugot, 1983: first report in the UK // Ann. Trop. Med. Parasitol. - 1987.-81,2.-P. 195- 198.
Cook G. C. Enterobius vermicularis infection // Gut. - 1994.-35. - P. 1159- 1162.
De Ley P., Blaxter M. Systematic position and phylogeny / The biology of nematodes. - Ed. D. L. Lee. -London, N. Y.: Taylor & Francis, 2002. - P. 1 - 59.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Hasegawa H, Takao Y., Nakao M., Fukuma T. et al. Is Enterobius gregorii Hugot, 1983 (Nematoda: Oxyuri-dae) a district species? // J. Parasitol. - 1998. - 84, l.-P. 131-134.
Hugot J.-P. Enterobius gregorii (Oxyuridae, Nematoda), a new human parasite П Ann. Parasitol. Hum. Comp. - 1983. - 58, 4. - P. 403 - 404.
Hugot J.-P.,Reinhard K. J., Gardner S. L., MorandS. Human enterobiasis in evolution: origin, specificity and transmission // Parasite. - 1999. - 6. - P. 201 - 208. On-line: http://www.parasite-houmal.org.
Hugot J.-P., Tourte-Schaefer C. Etude morphologique des deux Oxyures parasites de Phomme: Enterobius vermicularis et E. gregorii // Ann. Parasitol. Hum. Comp. - 1985. - 60, l.-P. 57 - 64.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Straka Baska T., Mad’ar R., Hudeckova H. Crevne parazity u deti regionu Turiec v dlholobom priereze. Ako d’alej s preventivnymi parazitologickymi vySetreniami? // Epidem. Microbiol. Imunol. - 2001. - 1. -P. 22 - 25.
Totkova A. Vyskyt drevnych parazitov u deti vo vel’komestskej aglomeracii. - Bratislava, Parazitol. ustav LFUK, 1999. - 148. - цит. no: Totkova et al., 2003.
Totkova A., Klobusicky M., Holkova P., Valent M. Enterobius gregorii - reality or fiction? // Bratisl. Lek. Listy. - 2003. - 104, 3. - P. 130 - 133.
Yorke W., Maplestone P. A. The nematodes parasites of vertebrates. - London, 1926. - 536 pp.
Семейство Panagrolaimidae Thorne, 1937
Данная группа нематод первоначально была описана в ранге подсемейства Panagrolaiminae Thome, 1937 в составе семейства Cephalobidae Chitwood et Chitwood, 1934. В настоящее время семейство Panagrolaimidae включают в класс Chromadorea в составе отрядов Panagro-laimida (Hodda, 2011), Tylenchida (Papadi et aL, 2013) или Rhabditida (ITIS Report), или же в класс Secementea в составе отряда Rhabditida (Bert et al., 2003; Myers aL, 2016).
Описание (по разным авторам, в том числе: Thome, 1937). Тело заострённое. Ис-черченность кутикулы очень тонкая, менее 2 цт. Передняя часть стомы в виде ши
10 Процитирована самая малая толика огромного массива литературных данных, посвящённых проблеме заражения людей оксиуридами.
369
рокой открытой камеры. Метастома обычно с зубом или зубами на дорсальном сегменте, иногда с зубчиками на субвентральных сегментах. Имеется от 3 до 6 губ, расположенных более или менее раздельно. Область губ без зубчиков и ресничек. Пищевод рабдитоидный. Терминальный эзофагеальный бульбус со створками. Нервное кольцо окружает истмус в его средней части. Самцы без бурсы, с одной непарной папиллой и 7 парами генитальных папилл. Спикулы часто с широким ве-люмом. Губернакулюм часто расширен сзади. Хвост самок конический, с заострённой верхушкой. Яичник без двойного изгиба позади вульвы. В переднем изгибе яичника сперматека отсутствует. Матка функционирует как семяприемник. Типовой род - Panagrolaimus Fuchs, 1930.
По одним данным, семейство объединяет 12 родов (Bert et al., 2003), по другим - 16 родов с 54 видами (Hodda, 2011).
Представители двух родов - Halicephalobus Timm, 1956 и Turbatrix Peters, 1927 известны как регистрируемые у человека.
Цитируемая литература
Bert W., Tandingan De Ley I.,' Van Driessche R., Segers H, De Ley P. Baujardia mirabilis gen. n., sp. n. from pitcher plants and its phylogenetic position within Panagrolaimidae (Nematoda: Rhabditida) // Nematology. - 2003. - 5, 3. - P. 405 - 420.
ITIS Report. - ITIS Standard Report Page - Panagrolaimidae. www.itis.gov.
Myers P., Espinosa R., Parr C. S, Jones T, Hammond G. S, Dewey T A. 2016. The Animal Diversity Web (online). Accessed at http://animaldiversity.org.
Papadi B., Boudreaux C., Tucker J. A., Mathison B., Bishop H, Eberhard M. E. Halicephalobus gingivalis: a rare cause of fatal meningoencephalomyelitis in humans // Am. J. Trop. Med. Hyg. - 2013. - 88, 6. - P. 1062-1064. doi: 10.4269/ajtmh. 12-0730.
Thorne G. A revision of the nematode family Cephalobidae Chitwood and Chitwood, 1934 // Proc. Helminthol. Soc. Wash. - 1937.-4, 1. - P. 1 - 16.
Род Halicephalobus Timm, 1956
Описание (по разным авторам, в том числе: Timm, 1956). Короткая цилиндрическая стома с коротким стегостомом (фарингеальный воротник). Пищевод рабдитоидный, с хорошо очерченным медианным бульбусом и терминальным бульбусом со створками. Истмус короче корпуса. Спикулы с короткой терминальной бифуркацией. Яичник продельфный, дважды заворачивающийся. Типовой вид - Halicephalobus limuli Timm, 1956.
По состоянию на 2014 г. род объединял 8 видов, но только один из них -Halicephalobus gingivalis (Stefansky, 1954) был зарегистрирован у человека.
Halicephalobus gingivalis (Stefansky, 1954) Andrassy, 1984 [=Rhabditis gingivalis Stefansky, 1954; =Tricephalobus gingivalis (Stefansky, 1954) Dougherty, 1955; =Micronema deletrix Anderson et Bemrick, 1965; =Trilabiatus gingivalis (Stefansky, 1954) Sudhaus, 1976; ^Halicephalobus deletrix (Anderson et Bemrick, 1965) Andrassy, 1984] (рис. 151). Синонимы no: Anderson et al., 1998.
Паразит впервые найден в Польше у лошади в опухоли на десне и описан под названием Rhabditis gingivalis (Stefansky, 1954).
Видовое название нематоды связано с местом её обнаружения в организме хозяина: gingivalis - десневой.
370
После своего открытия вид Rhabditis gingivalis последовательно побывал в роде Tricephalobus (Dougherty, 1955), затем - в Trilabiatus (Sudhaus, 1976) и, наконец, в 1984 г. его перевели в род Halicephalobus (Andrdssy, 1984), где он и находится в настоящее время.
Вид Micronema deletrix, перечисленный выше среди синонимов Halicephalobus gingivalis, был описан по экземплярам, извлечённым из опухоли в носовой полости лошади из Миннесоты (США) (Anderson, Bemrick, 1965). Однако название рода Micronema Кбтег, 1954 оказалось преоккупированным, т.е. уже использованным для другого организма, и в 1984 г. виды данного рода перевели в Halicephalobus (Andrdssy, 1984). Впоследствии была доказана синонимичность Hdeletrix (=Micronema deletrix) и Н gingivalis (Anderson et al., 1998).
Рис. 151 Halicephalobus gingivalis', 1 - 3 -развитие яйца от 2-клеточной стадии до личинки; 4 - головной конец; 5 - половой зачаток у личинки 3-й стадии; 6 -половая система у личинки 4-й стадии; 7 - хвостовой конец партеногенетической особи с анусом и фазмидами; 8 - зрелая партеногенетическая особь (вид сбоку) с полностью развитым, но не сегментированным яйцом в модифицированном переднем роге половой трубки и коротким свёрнутым яичником в заднем отроге; в стенке кишечника видны жировые капельки (из: Anderson et al., 1998)
Описание (по: Anderson et al., 1998; Stefansky, 1954). Очень мелкие нематоды. Длина тела 0.235 - 0.460 при максимальной ширине 0.014 -0.020 мм. Имеется 6 заметных, прозрачных, округлых губ. Конический асимметричный хвост короче на вентральной стороне, фазмиды позади ануса. Длина, хвоста 0.04 - 0.06 (Stefansky, 1954) или 0.059 - 0.077 (0.066) мм (Anderson R. С. et al., 1998). Ротовая полость удлинённая, разделена на два отдела. Вульва в виде широкой боковой щели на небольшом возвышении. Половая система у личинки 4-й стадии отчётливо дидельфная и амфидельфная. У пол-
ностью развитого взрослого червя задний участок половой трубки редуцируется до яичника с 9 - 12 ооцитами, увеличивающимися в размерах от заднего конца до переднего края. Терминальный конец яичника изогнут вентрально. У полностью зрелой нематоды передний отрог половой трубки превращается в комбинированный яйцевод с маткой, где находится од
371
но крупное, удлинённое яйцо с тонкой податливой оболочкой. Терминальный участок переднего отрога пальцеподобный, нефункционирующий, загибается дорсаль-но и назад. Размеры яиц 40 х 20 (Stefansky, 1954), 32 - 46 х 9 - 11 (Anderson R. V., Bemrick, 1965), 48-51 х 16 - 21pm (Anderson R. C. et al., 1998). В момент откладки яйцо сдавливается по бокам.
При 28°С формирование личинки в яйце от 2-клеточной стадии завершается за 17 - 18 ч, при 24 - 25°С - за 24 ч. Через 24 ч они покидают яйцевую оболочку. Только что вылупившиеся личинки достигают в длину 0.136 - 0.199 и в ширину 0.009 - 0.010 мм. При отсутствии соответствующих условий личинки не развиваются и остаются на 3-й стадии, достигнув размеров 0.180 - 0.240 х 0.009 - 0.010 мм (Anderson R. С. et al., 1998).
Н. gingivalis - нематода, ведущая свободный образ жизни, живущая в среде, богатой органикой, и питающаяся бактериями. Тем не менее, она известна как факультативный паразит лошадей (Anderson R. С. et al., 1998; Anderson R. V., Bemrick, 1965; Blunden et al., 1987; Johnson et al., 2001; Nadler et al., 2003 и др.), вызывающая, к тому же, гибель заражённых животных.
Об эпидемиологии H.gingivalis известно мало. Предполагают, что заражение лошадей может происходить через открытые раны (Eydal et al., 2012), с травой (Blunden et al., 1987), через носовую полость и даже передаваться с молоком кобылы к жеребёнку (Wilkins et al., 2001). Нематоды могут разноситься по организму через кровеносную или лимфатическую системы, оседая затем в различных органах (Kinde et al., 2000). В организме животного количество червей стремительно растёт благодаря их способности к партеногенетическому размножению. Большинство случаев инвазии лошадей распознаётся посмертно после тщательного вскрытия, в ходе которого обнаруживаются исключительно мелкие нематоды. Клиническая симптоматика очень вариабельна в зависимости от того, какие органы поражены, а методы диагностики фактически не разработаны. Больные животные выживают в очень редких случаях.
В равной степени все известные случаи заражения людей H.gingivalis заканчивались для тех фатально: 4 случая в США (Gardiner et al., 1981; Ondrejka et al., 2010; Papadi et al., 2013; Shadduck et al., 1979) и по одному в Канаде (Hoogstraten, Young, 1975) и Австралии (Lim et al., 2015). Среди скончавшихся как женщины, так и мужчины в возрасте от 5 до 74 лет. Во всех перечисленных случаях диагноз ставился только при аутопсии.
Помимо того, в Великобритании трагически погибли двое мужчин 42 и 67 лет, каждому из которых от одного и того же донора было пересажено по почке, как позже выяснилось, заражённой Н. gingivalis. По этому поводу 14 ноября 2014 г. ВВС News Online сообщила «Worm-infected kidneys' given to south Wales men, say solicitors» («Адвокаты говорят: мужчинам в Южном Уэльсе пересажены заражённые червями почки»), а 18 ноября «The Guardian newspaper» опубликовала заметку «Rare parasitic worm killed two kidney donor patients» («Редкий паразитический червь убил двух пациентов донорской почки»). Кстати, оказалось, что и сам донор скончался от заражения.
Инвазия провоцирует увеличение количества эозинофилов в спинномозговой жидкости (Papadi et al., 2013) и вызывает воспаление центральной нервной системы, ведущее к дисфункции мозга и менингоэнцефаломиелиту. У больных наблю
372
даются изменение психического состояния, а также продромальные зудящие сыпи, гранулёматозный васкулит (Ondrejka et al., 2010). При вскрытии усопших в каждом участке мозга - в обоих полушариях, мозжечке, стволе мозга, гипофизе, паутинной и мягкой мозговой оболочках, преимущественно в периваскулярных участках, включая зоны внутри паренхимы мозга (Gardiner et al., 1981; Lim et al., 2015; Ondrejka et al., 2010), а также в печени, сердце (Gardiner et al., 1981) находили взрослых самок, личинок и яйца нематоды.
Жизненный цикл паразита, способ заражения человека и факторы риска плохо известны (Papadi et al., 2013), хотя и предполагают, что оно может происходить через открытые раны, в частности, через пролежни (Gardiner et al., 1981).
В свободноживущем состоянии Н. gingivalis является бактериофагом, но как нематода питается, ведя паразитический образ жизни, точно не известно. Поскольку в организме человека и лошадей гельминт размножается и проникает в ткани самых разных органов (см.: Muller et al., 2008), то вполне возможно, что источниками пищи в данном случае могут быть кровь и/или ткани хозяина.
Цитируемая литература
Anderson R. С., Linder К. Е., Peregrine A. S. Halicephalobus gingivalis (Stefanski, 1954) from a fatal infection in a horse in Ontario, Canada with comments on the validity of H. deletrix and a review of the genus // Parasite. - 1998. - 5, 3. - P. 255 - 261.
Anderson R. V., Bemrick J. Micronema deletrix, n. sp., a saprophagous nematode inhabiting a nasal tumor of a horse 11 Proc. Helminthol. Soc. Wash. - 1965. - 32, 1. - P. 74 - 75
Andrassy I. Klass Nematoden. - G. Fischer Verlag, Stuttgard, 1984. - 509 pp.
Blunden A. S, Khalil L. F., Webbon P.M. Halicephalobus deletrix infection in a horse //Equine Vet J.-1987. - 19.-P. 255-260.
Dougherty E. C. The genera and species of the subfamily Rhabditinae Micoletzky, 1922 (Nematoda): a nomenclatorial analysis - including an addendum on the composition of the family Rhabditidae Orley, 188011 J. Helminthol. - 1955.-29.-P. 105- 152.
Eydal M., Bambir S. H, Sigurdarson S., Gunnarsson E. et al. Fatal infection in two Icelandic stallions caused by Halicephalobus gingivalis (Nematoda: Rhabditida) // Vet. Parasitol. - 2012. - 186. - P. 523 - 527.
Gardiner С. H, Koh D. S., Koh D. S, Cardella T. A. Micronema in man: third fatal infection // Am. J. Trop. Med. Hyg. - 1981 - 30, 3. - P. 586 - 589.
Hoogstraten J., Young W. G. Meningo-encephalomyelitis due to the saprophagous nematode, Micronema deletrix // Can. J. Neurol. Sci. - 1975. - 2, 2. - P. 121-126.
Johnson J., Hibler C., Tillotson K. et al. Radiculomeningomyelitis due to Halicephalobus gingivalis in a horse H Vet. Pathol. - 2001. - 38. - P. 559 - 561.
Kinde H, Mathews M., Ash L., Leger St. Halicephalobus gingivalis (H deletrix) infection in two horses in southern California // J. Vet. Diagn. Invest. - 2000. - 12. - P. 162 - 165.
Lim С. K, Crawford A., Moore C.V., Gasser R.B., Nelson R. et al. First human case of fatal Halicephalobus gingivalis meningoencephalitis in Australia // J. Clin. Microbiol. - 2015. - 53, 5. - P. 1768 - 1774. doi: 10.1128/JCM.00032-15.
Muller S., Grzybowski M., Sager H, Bornand K, Brehm W. A nodular granulomatous posthitis caused by Halicephalobus sp. in a horse H Vet. Dermatol. - 2008. - 19, 1. - P. 44 - 48.
Nadler S. A., Carreno R. A., Adams B. J. et al. Molecular phylogenetics and diagnosis of soil and clinical isolates of Halicephalobus gingivalis (Nematoda: Cephalobina: Panagrolaimoidea), an opportunistic pathogen of horses H Int. J. Parasitol. -2003.-33. - P. 1115-1125.
Ondrejka S. £., Procop G. W., Lai К. K, Prayson R. A. Fatal parasitic meningoencephalomyelitis caused by Halicephalobus deletrix : a case report and review of the literature // Arch. Pathol. Lab. Med. - 2010. -134, 4. - P. 625 - 629. doi: 10.1043/1543-2165-134.4.625.
Papadi B., Boudreaux C, Tucker J. A., Mathison B. et al. Halicephalobus gingivalis'. a rare cause of fatal meningoencephalomyelitis in humans H Am. J. Trop. Med. Hyg. - 2013. - 88, 6. - P. 1062 - 1064. doi: 10.4269/ajtmh. 12-0730.
373
Shadduck J. A., UbelakerJ., Telford V. Q. Micronema deletrix meningoencephalitis in an adult man // Am. J. Clin. Pathol. - 1979. - 72, 4. - P. 640 - 643.
Sudhaus JF. Vergkichende Untersuchungen zur Phylogenie, Systematik, Okologie, Biologie und Ethologie der Rhabditinae (Nematoda) // Zoologica. - 1976. - 115. - P. 1 - 229.
Stefansky FK Rhabditis gingivalis sp. n. parasite trouv6 dans un granulome de la gencive chez un cheval // Acta Parasitol. Polon. - 1954. - l.-P. 329 - 334.
Timm R. W. Marine nematodes from the Bay of Bengal. I. Phasmydea I I J. Bombay Nat. Hist. Soc. - 1956. -54, l.-P. 87-90.
Wilkins P. A., Wacholder S., Nolan T J., Bolin D. C. et al. Evidence for transmission of Halicephalobus deletrix (H. gingivalis) from dam to foal // J. Vet. Intern. Med. - 2001. - 15. - P. 412 - 417.
Род Turbatrix Peters, 1927
С характерными чертами семейства. Мелкие нематоды с узким цилиндрическим телом и гладкой кутикулой. Ротовая полость небольшая. Задний бульбус пищевода часто с жевательным аппаратом. Истмус намного короче корпуса. Бурса и крылья у самцов отсутствуют. Спикулы тонкие, изогнутые. Рулёк имеется. Хвостовой конец с папиллами. Типовой вид - Turbatrix aceti (О. F. Muller, 1783) Peters, 1927.
Turbatrix aceti (О. F. Muller, 1783) Peters, 1927 \j=Vibrio aceti Muller, 1783; =Vibrio anguillula var. aceti Muller, 1783; = Gordius aceti (Muller, 1783) Oken, 1815; = Anguillula aceti (Muller, 1783) Ehrenberg, 1838; Rhabditis aceti (Muller, 1783) Dujardin, 1845; Leptodera aceti (Muller, 1783) A. Schneider, 1866; = Leptodera oxophila A. Schneider, 1866; = Turbatrix aceti var. aceti (Muller, 1783) Peters, 1927 (рис. 152). Синонимы no: Baker, 1962.
Очень мелкие черви, живущие в уксуснокислой среде, упоминались в литературе задолго до того, как в 1783 г. О. Мюллер (Muller, 1783) дал им название Vibrio aceti: от латинского acetum - кислое вино, уксус. В 1927 г. Б. Петерс (Peters, 1927) создал новый род Turbatrix, переведя в него в качестве типового вида Vibrio aceti. В англоязычной литературе паразит получил название vinegar worm, vinegar eelworm, в русскоязычной - уксусная угрица.
Рис. 152 Turbatrix aceti (из: www.biolib.cz. 259719.jpg)
Описание (по разным авторам, в том числе: Faust, 1949). Нематоды с узким цилиндрическим телом, сужающимся к обоим концам. Передний конец закруглён, задний заострён. Кутикула гладкая. Ротовая полость незначительных размеров. Длина пищевода у самки равна примерно 1/9 длины всего её тела, у самца - 1/7. Длина самцов 1-2, толщина 0.024 - 0.040 мм. Спикулы длинные, тонкие, изогнутые, равные, 0.038 мм; стержень спи-
кул более или менее полностью закрыт в трубке. Губернакулюм килевидный. Имеются 2 пары преанальных, 1 пара аданальных и 1 пара постанальных сосочков (все вентральные), а также 1 пара постанальных дорсальных сосочков. Самки длиной 2.4 и диаметром 0.040 - 0.072 мм. Вульва позади середины тела. Личинки при рож-
дении имеют в длину 0.222 и толщину 0.012 мм.
374
T. aceti - свободноживущие нематоды, питающиеся микробиальной культурой; могут быть найдены в непастеризованном и непрофильтрованном уксусе, а также в различных жидкостях с уксуснокислым брожением. Развитие нематод прямое. Жизненный цикл проходит полностью в уксуснокислой среде. Черви достигают половозрелого состояния всего за 5 недель, а продолжительность их жизни не превышает 10 мес.
Кстати, помимо того, что Т. aceti имеет самое непосредственное отношение к процессу образования уксусной кислоты, этот червь является одним из наиболее популярных кормов для мальков аквариумных рыб, и его активно разводят аквариумисты.
Что касается возможной регистрации этих нематод у человека, то единственная информация по данному вопросу, которую удалось найти, содержится в монографии Э. Фауста (Faust, 1949). Автор пишет о находке Т. aceti в моче и влагалищных выделениях женщин и полагает, что уксусные угрицы в этих случаях были занесены извне при спринцевании с уксусом. В случае же обнаружения нематод в пробах мочи человека, по его мнению, также не исключается возможность внешнего заражения. Описывая эти случаи, Э. Фауст ссылается на одну работу (Billings, Miller, 1902), в которой, по его словам, сообщается о регистрации уксусной угрицы в сданной на анализ моче мужчины. В списке цитируемой литературы этот источник отсутствует. Одновременно Э. Фауст приводит другую публикацию (Stiles, Frankland, 1902), авторы которой (удалось найти аннотацию данной работы) описывают экстраординарный случай обнаружения «vinegar eelworm» в мочевом пузыре молодой женщины, страдающей от болезни Брайта. Паразиты были обычны в течение 34 дней, и присутствовали в моче в течение пары месяцев. Вполне вероятно, что заражение произошло через уретру в результате вагинальных спринцеваний с уксусом.
Совершенно очевидно, что применительно к Т. aceti речь может идти только о его мнимом, или ложном, паразитизме у человека (Скрябин и др., 1954).
Цитируемая литература
Скрябин К. И., Шихобалова Н. П., Соболев А. А., Парамонов А. А., Судариков В. Е. Камалланаты, аб-дитаты, тиленхаты, трихоцефаляты, диктиофиматы и распределение паразитических нематод по хозяевам И Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954.-4.-С. 195.
Baker A. D. Check lists of the nematode superfamilies Dorylaimoidea, Rhabditoidea, Tylenchoidea, and Aphelenchoidea. - Leiden, E, J, Brill, 1962. - 260 pp.
Faust E. C Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Muller O.F. Anmerkungen beim Durchlesen einiger AufsStze in den 10 ersten Stiiken der Naturforschers // Naturforscher. - 1783. - 19. - P. 150 - 176.
Peters B. G. On the nomenclature of the vinegar eel worm // J. Helminthol. - 1927. - 5. - P. 133 - 142.
Stiles C. W., Frankland W. A. A case of vinegar eel infection in the human bladder И Bur. Animal Industry Bull., Washington, 1902. - No. 35. - P. 35 - 40.
Семейство Peloderidae Andrassy, 1976
В информационной сводке «Медицинская паразитология...» (www.worms-info.ru) в числе представителей семейства Rhabditidae, зарегистрированных у людей, указаны Pelodera teres и «Peloderes» strongyloides. В настоящее время Pelodera является типовым родом семейства
375
Peloderidae, входящего, в свою очередь, в отряд Rhabditida в классе Chromadorea (De Ley, Blaxter, 2002; Vanaverbeke, 2015) или Secementea (Taxonomicon.taxonomy.nt).
Семейство объединяет 4 рода с 32 видами (Hodda, 2011). Пелодериды - свободно-живущие почвенные нематоды, имеющие прямой цикл развития и питающиеся бактериями. Тем не менее, два вида Pelodera известны у человека.
Род Pelodera Schneider, 1866
Описание (по разным авторам, в том числе: Goodey, 1963) (рис. 153). Большинство видов крупные, относительно толстые. Кутикула обычно с тонкой поперечной ис-черченностью. Губы обычно отчётливые, формируют открытую чашу. Метараб-дионы с 3 равными щетинкоподобными зубами. Стома хорошо развита, в 2 раза длиннее ширины головы. Эзофагеальный воротник и медианная бульба обычно имеются. Хвост самок тупо конический или куполообразный, с или без острого шипа. Вульва чаще медианная. Яичники обычно парные, на противо- положных сторонах. Хвост самцов с бурсой, часто закрытой, с 10 парами рёбрышек. Спикулы дистально сливаются. Имеется 2 или 3 пары преанальных папилл. Типовой вид -Pelodera strongyloides (Schneider, 1860).
Рис. 153 Pelodera'. А - передний конец тела; В - самка; С - задний конец тела самки; D - задний конец тела самца, вентрально (из: Nguyen, 200611 - по: Goodey, 1963)
Pelodera strongyloides (Schneider, 1860) (пелодера стронгилоподоб-ная).
Описание (по разным авторам, в том числе: Saari, Nikander, 2006). Ротовое отверстие окружено 6 хорошо очерченными губами с отчётливыми сосочками. Пищевод раб-дитоидного типа с корпусом, истму-сом и бульбусом. Медианная фарингеальная бульба с двойной полостью. Буккальное пространство равно примерно 1/5 длины пищевода, с 3 мета-стомальными зубами в месте соединения с пищеводом. Самцы длиной
около 1 мм. Спикулы коричневатого цвета, слиты в задних 2/3 своей длины. Имеется 10 пар удлинённых папилл: 2 пары пре- и 8 пар постклоакальных. Постклоакальные папиллы в двух билатеральных группах: более передняя группа из 5 сосочков, более задняя - из 3. Самки длиной 1.3 - 1.5 мм. Задний конец самки ту
11 Nguyen К .В. 2006. Nematology website in the University of Florida, http://kbn.ifas.ufl.edu/ rhabdi/rhabjey.HTM
376
пой, но заканчивается узким шипом длиной 20 цт. Вульва слегка позади середины тела. Матка содержит яйца размерами 55 - 65 х 34 - 39 цт.
Эти нематоды живут во влажной почве, влажном разлагающемся органическом субстрате - сене, соломе, листьях, отходах обработки зерновых культур.
Очень мелкие личинки Р. strongyloides могут проникать в открытые участки кожи, царапины, ранки, контактирующие с заражённой почвой или органиче-
ским материалом, причём проникнуть в здоровую кожу они не способны, этому процессу благоприятствуют различного рода повреждения кожного покрова. Обычно они локализуются в волосяных мешочках (фолликулах) (рис. 154) и поверхностной дерме, а длина личинок при этом достигает 0.6 при диаметре 0.038 мм.
Рис. 154 Гистологический срез через волосяной мешочек собаки с личинкой Pelodera strongyloides (из: Bowman et al., 2002 - как Rhabditis strongyloides)
Заражение вызывает воспаление кожи, зуд, образование папул, пустул, корочек. Обычно от этих личинок страдают коровы, лошади, овцы в случае их размещения в грязных стойлах, особенно в тех случаях, когда животные больны и с трудом могут подняться (Bowman et al., 2002). Известны они также и у собак, как бездомных, так и домашних (Saari, Nikander, 2006), у морской свинки (Rothig et al., 2016) и даже у тихоокеанского обыкновенного тюленя (McHuron et al., 2013). Для всех животных Р. strongyloides - факультативный паразит.
Однако и человеку не удаётся избежать нападения этих личинок, не проникающих глубоко в кожу, но вызывающих поверхностные зудящие папулы, эритемы, которые, если не предпринять лечения, могут сохраняться в течение нескольких недель. Описан случай, когда 11-летняя девочка довольно длительное время страдала от зудящей сыпи. Когда же сделали соскоб с кожи в месте папул, то выяснилось, что сыпь вызвана поражением рабдитовидными личинками Р. strongyloides, которых одновременно с этим выявили также и у домашней собаки (Pasyk,1978). Гистологическое исследование показало, что поверхностные пустулы были заполнены полиморфоядерными клетками, некротическими остатками и кератиноцитами и проникали через дерму в подкожные ткани. Некоторые гранулёмы содержали мёртвых личинок, в других личинки были живыми.
У 6-месячной девочки, которая явно отставала в развитии, на нижней части животика и бёдер были выражены гиперпигментированные узелковые папулы. Результаты биопсии кожи показали наличие в дерме так называемых дауэровских личинок Р. strongyloides (Ginsburg et al., 1984).
Ещё в одной из статей упоминалось заражение этими нематодами 20-летнего садовника из Хьюстона (Техас, США), но никакого описания паразита авторы не привели (Jones С. et al., 1991)
И, наконец, у 18-летнего молодого человека зудящие фолликулярные папулы и пустулы развились на ягодицах, а затем на правом боку. Соскоб кожи показал наличие множества живых рабдитовидных личинок, которые в культуре развились до взрослого состояния и дали потомство. Червей определили как Р. strongyloides.
377
Повреждения кожи были успешно вылечены 1% гамма-гексахлорциклогексановой мазью (Tanaka et al., 2004). К слову, личинки Р. strongyloides хорошо культивируются на пластинах кровяного агара при 25°С (The Merck Veterinary Manuel)12.
Pelodera teres Schneider, 1866 - второй вид пелодер, встреченный у человека. Самцы в среднем 2.01 х 0.56, самки 2.6 х 0.79 мм (Lukes et al., 1982).
Р. teres - сапрофит. Известно, в частности, что этот гельминт весьма обычен в клубнях овощей, в том числе картофеля. Например, в Черниговской области Украины, в 20 г клубня насчитали 208 экз. нематод, а частота их встречаемости составила 9.5 % (Жилина, 2004).
В Египте в окрестностях Каира Р. teres обнаружили в жуках - копрофагах, трупниках Euoniticellus pallens (=Onticellus pallens), Onitis alexis, Saprinus semipunctatus (Ali et al., 1973). Самцы нематод имели в длину 1.15 - 1.43, самки 1.05 -1.58 мм. Спикулы длиной 0.050 - 0.052 мм. В матке насчитывалось примерно 18 яиц, средним размером 96 х 38 pm.
Единственное упоминание о находке Р. teres у человека содержится в монографии (Muller, 2002). К сожалению, автор не указывает источник, из которого по
черпнуты эти данные.
Однако если учесть, что к синонимам Р. teres отнесён входящий в состав семейства Rhabditidae вид Rhabditis donbass Skijabin, Schulz et Serbinoff, 192613 (рис. 154), чьи личинки выявлены в фекалиях человека в Донбассе (Скрябин и др., 1954),
то можно с уверенностью утверждать, что, по крайней мере, один источник, подтверждающий находку Р. teres (^Rhabditis donbass) в фекалиях человека, мы знаем.
Кстати, видовое название -рабдита донбасская - связано с местом обнаружения паразита на территории Донбасса, где работала 25-я Ссоюзная гельминтологическая экспедиция (Скрябин и др., 1926)
Рис. 154 «.Rhabditis donbass»: А - передний конец тела; Б - хвостовой конец самки; В - хвостовой конец самца; Г- спикулы (из: Скрябин и др., 1954 -по: Скрябин и др., 1926)
Цитируемая литература
Жилина Т. Н. Фауна нематод (Nematoda) клубней картофеля, пораженных диги-ленхозом И Вести, зоол. - 2004. - 38, 5. -С. 75-78.
12 www.merckvetmanuel.com/mvni/mterumentary_systems.
13 Источник синонимии: Hallan, J. (2000-current). Biology Catalog. Web compilation accessible at http://bug.tamu.edu/research/collection/hallan: IRMNG (2012). Rhabditis donbass Skijabin, Shults & Serbinov, 1926. Accessed through: The Interim Register of Marine and Nonmarine Genera at http://www.irmng.org/aphia.php?p=taxdetails&id=l 1554717.
378
Скрябин К. И., Шихобалова Н. И, Соболев А. А., Парамонов А. А., Судариков В. Е. Камалланаты, раб-дитаты, тиленхаты, трихоцефаляты, диктиофиматы и распределение паразитических нематод по хозяевам // Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954. - 4. - С. 144 - 152.
Скрябин К. И., Шульц Р. С., Сербинов П. И. Новый вид Rhabditis человека - Rhabditis donbass n. sp. И Работа 25-й Союзной гельминтол. экспедиции в Артёмовск, округе Донбасса. - Изд. Артём, окр. отдела здравоохранения, 1926.
AU М., Wahab A., El-Kifel А. Н. Nematodes associated with Coleoptera species in Egypt. II // Parasitol. Hung.- 1973.-6.-P. 169- 183.
Bowman D. D., Hendrix С. M., Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002. - 467 pp.
De Ley P., Blaxter M. L. A new system for Nematoda: combining morphological characters with molecular trees, and translating clades into ranks and taxa //Nematology Monographs & Perspectives. - 2004. - 2. -P. 633-653.
Ginsburg B., Beaver P. C., Wilson E. R., Whitley R. J. Dermatitis due to larvae of a soil nematode, Pelodera strongyloides H Pediatr. Dermatol. - 1984. - 2, 1. - P. 33 - 37.
Goodey T. Soil and freshwater nematodes, 2nd ed. (rev. J. B. Goodey). - London & New York, Methuen & Co., 1963.-544 pp.
Jones С C., Rosen T, Greenberg C. Cutaneous larva migrans due to Pelodera strongyloides I I Cutis. - 1991.
-48.-P. 123- 126.
Lukes S., Prokopic J., Hulinskd D. Morphological study of Pelodera teres Schneider, 1866 by scanning electron microscopy // Folia Parasitol. - 1982. - 29, 1. - P. 33 - 36.
McHuron E. A., Miller M. A., Gardiner С. H, Batac F. L, Harvey J. T. Pelodera strongyloides infection in Pacific harbor seals (Phoca vitulina richardii) from California I I J. Zoo Wildl. Med. - 2013. - 44, 3. -P.799-802.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Pasyk K. Dermatitis rhabditidosa in an 11-year-old girl: a new cutaneous parasitic disease of man // Br. J. Dermatol.- 1978.-98, l.-P. 107-112.
Rothig A., Hermosilla C. R.t Taubert A., Thom N. Pelodera strongyloides as a cause of severe erythematous dermatitis in 2 guinea pigs (Cavia porcellus) 11 J. Exo. Pet. Med. - 2016. - 25, 3. - P. 208 - 212.
Saari S. A., Nikander S. E, Pelodera (syn. Rhabditis) strongyloides as a cause of dermatitis—a report of 11 dogs from Finland//Acta Vet. Scand. - 2006. - 48, l.-P. 18. doi: 10.1186/1751-0147-48-18.
Tanaka A., Kinoshita M., Tanaka T, Iwanaga Y., Kagei N., Hide M. Pelodera strongyloides infestation presenting as pruritic dermatitis I I J. Am. Acad. Dermatol. - 2004. - 51, 5 Suppl. - P. 181 - 184.
Vanaverbeke J. (2015). Peloderidae Andrassy, 1976. Accessed through: World Register of Marine Species at http://www.marinespecies.org/aphia.php?p=taxdetails&id=834866 on 2016-08-30.
Семейство Philometridae Baylis et Daubney, 1926
В информационной сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru) в числе зарегистрированных у людей нематод указан вид Philometra sp. из семейства Philometridae.
Прежде всего, необходимо подчеркнуть, что филометриды во взрослом состоянии паразитируют исключительно у рыб, - морских, солоноватоводных и пресноводных, у которых поселяются в полости тела, гонадах, серозных покровах, соединительной ткани, глазах, мышечной ткани (Ивашкин и др., 1971; Moravec, 2004, 2006; Moravec, de Buron, 2013). Эти нематоды необычайно широко распространены в морских и пресноводных водоёмах по всей планете, а круг их хозяев очень широк - от хрящевых до костистых рыб. Известно, что некоторые из представителей фи-лометрид относятся к числу патогенных для их хозяев - рыб, особенно в условиях искусственного выращивания последних.
379
Принадлежащие к этому семейству нематоды примечательны тем, что являются живородящими формами: у зрелых самок матка занимает почти всю полость тела и забита личинками, которые покидают материнскую особь через разрывы в стенке её тела. Развитие филометрид протекает с участием промежуточных хозяев - ракообразных.
Самцы намного мельче самок, их длина не превышает 2-4 мм, тогда как женские особи могут достигать в длину нескольких десятков сантиметров и даже более. К примеру, в полости тела гигантского морского окуня - полиприона американского обнаружена не определённая до вида Philometra sp., чья длина превышала один метр (Moravec, de Buron, 2013).
В 1971 г. семейство Philometridae объединяло 9 родов с 50 видами (Ивашкин и др., 1971), в 2004-м таковых числилось соответственно 12 и 115 (Moravec, 2004), в 2006-м - 11 и 105 (Moravec, 2006), в 2011-м - 11 и 117 (Hodda, 2011 - см. источник на стр. 14). За 2007 - 2012 гг. было описано 43 новых вида, в 2013-м - 7 (Moravec, de Buron, 2013), а в 2014 г. - ещё 2 (Moravec, АН, 2014).
Единственное сообщение, в котором упоминается филометридная нематода в связи с её регистрацией у человека, опубликовано 30 лет назад (Deardorff et al., 1986). Авторы описывают имевший место на Гавайских островах случай внедрения взрослой самки Philometra sp. в колотую рану на руке работника, который разделывал на филе крупную океаническую рыбу - каранкса синепёрого (рис. 155). Для
извлечения нематоды из ранки пришлось прибегнуть к помощи хирурга.
Рис. 155 Нематода Philometra sp., внедрившаяся в ранку на руке рыбака (из: Deardorff et al., 1986)
Цитируемая литература
Ивашкин В. М., Соболев А. А., Хромова Л. А. Камалланаты животных и человека и вызываемые ими заболевания // Основы нематодологии. - Ред. акад. К. И. Скрябин. - М.: Наука, 1971. - 22. - 389 с.
Deardorff Т. L., Overstreet R. М., Okihiro М., Tam R. Piscine adult nematode invading an open lesion in a human hand H Am. J. Trop. Med. Hyg. - 1986. - 35, 4. - P. 827 - 830.
Moravec F. Some aspects of the taxonomy and biology of dracunculoid nematodes parasitic in fishes: a review I I Folia Parasitologica. - 2004. - 51, l.-P. 1-13.
Moravec F. Dracunculoid and anguillicoloid nematodes parasitic in vertebrates. - Academia, Prague, 2006. -634 pp.
Moravec F,, AH A. H. Additional observations on Philometra spp. (Nemaroda: Philometridae) in marine fishes off Iraq, with the descriptions of two new species // Syst. Parasitol. - 2014. - 87. - P. 259 - 271.
Moravec F., de Buron I. A synthesis of our current knowledge of philometrid nematodes, a group of increasingly important fish parasites // Folia Parasitologica. - 2013. - 60, 2. - P. 81 - 101.
380
Семейство Rhabditidae Orley, 1880
Типовое семейство отряда Rhabditida в классе Chromadorea. Объединяет 38 родов с 229 видами (Hodda, 2011). Свободноживущие сапробионты, но некоторые паразитируют у беспозвоночных, в частности у насекомых и моллюсков, а также у позвоночных животных. Отдельные представители рабдитид, и, прежде всего, из рода Rhabditis. известны также как регистрируемые у человека. В большинстве случаев они обнаруживаются в моче и в фекалиях, куда заносятся извне мухами и другими насекомыми и где быстро развиваются; их рассматривают псевдопаразитами человека. Тем не менее, иногда у пациентов, у которых обнаруживались рабдитиды, наблюдались поносы с примесью крови, тошнота и усиленное слюнотечение (цит. по: Гефтер, 1968). Иногда рабдитиды временно поселяются в различных органах и тканях, например, в папулах кожи.
Род Rhabditis Dujardin, 1844
Практически во всех публикациях указывают 1845-й год описания рода и его типового вида, тогда как описание рода Rhabditis и его типового вида Rhabditis terricola было опубликовано F. Dujardin’oM в ноябре 1844 г. в Histoire naturelie des Helminthes на страницах 239 -243.
В 1985 г. Международная комиссия по зоологической номенклатуре опубликовала извещение14: - to complete entry no. 483 in the Official List of Generic Names in Zoology as follows: Rhabditis Dujardin, [Nov. 1844] (gender: feminine), type species, by subsequent designation by Stiles & Hassal, 1905, Rhabditis terricola Dujardin, [Nov. 1844].
В 2001 г. эта же Комиссия опубликовала Официальный список названий и работ в зоологии15, в котором на стр. 70 написано следующее (дословно):
Rhabditis Dujardin, [1844], Histoire naturelle des Helminthes, p. 239 (gender: feminine) (type species, by subsequent designation by Stiles & Hassal, 1905, Bulletin of the Bureau of Animal Industry, 79: 134: Rhabditis terricola Dujardin, [1844] (Nematoda). Direction 120.
Обращаю внимание на женский род названия Rhabditis.
Описание (по разным авторам, в том числе: Скрябин и др., 1954; Goodey, 1963). Очень мелкие нематоды, чаще всего длина их тела около I мм. Тело сужается к обоим концам. Кутикула с поперечной исчерченностью. На голове обычно имеются осязательные сосочки (папиллы), но не щетинки. Амфиды всегда расположены на передней плоскости головы, т. е. на губах. Губы сомкнутые. Стома хорошо развита, длинная, узкая, цилиндрическая или треугольная в поперечном сечении, обычно без зубов. Пищевод мускулистый, рабдитоидного типа, имеет два вздутия, причём терминальное - округлой формы с простым клапановидным дробильным аппаратом. Спикулы умеренной длины, парные, раздельные, слегка изогнутые. Дополнительная пластинка одна, задняя, медианная. Хвостовые крылья латеральные, мембранные, поддерживаются рёбрами. Хвостовой конец самки обычно клиновидной формы, но может быть зауженным и заострённым. Вульва чаще возле середины
14 Rhabditis Dujardin, [Nov. 1844] (Nematoda): proposed completion of official list entry. Z. N. (S.) 937 // Bull. zool. Norn. - 1985. - 42, 2. - P. 197 - 198.
15 Official lists and indexes of names and works in zoology. Supplement 1986 - 2000. - Ed. J. D. D. Smith. - ICZN, 2001.-136 pp.
381
тела, но может быть позади неё. Дидельфные, с симметричными сегментами. Форма хвоста самцов, форма и размеры спикул, количество и расположение бурсальных рёбер, а также форма хвоста самок и положение вульвы используются в таксономии видов Rhabditis. Типовой вид - Rhabditis terricola Dujardin, 1844.
Сапробионты, живущие в гниющих тканях растений и животных, причём личинки и взрослые особи обычно обитают совместно. Развитие прямое.
Род Rhabditis издавна привлекает внимание исследователей. Нас же эти нематоды интересуют, прежде всего, по той причине, что, несмотря на свободножи-вущий образ жизни, некоторых из них время от времени регистрируют у людей. Однако многие из подобных случаев, упоминаемых в литературе, могут в действительности относиться к явлениям псевдопаразитизма (Скрябин и др., 1954; Ashford, Crewe, 2003). Ряд видов был выявлен только в фекалиях человека при копрологическом анализе. «Здесь, несомненно, могло иметь место занесение этих нематод в фекалии извне, в частности, при посредстве насекомых» (Скрябин и др., 1954; стр. 145). И всё же в некоторых случаях виды данного рода являются паразитами, скорее всего, временными.
В 1954 г. К. И. Скрябин с соавт. (1954; стр. 487) в перечне паразитирующих у человека нематод отметили 6 видов Rhabditis'. R. donbass Skrjabin, Schulz et Serbi-noff, 192616, R. hominis Kobayashi, 1914, R. niellyi (R. Blanchard, 1885), R. pellio (Schneider, 1866), R. schachtiella Skrjabin et Schulz, 192617, Rhabditis sp. Frese, 1907. В самом тексте монографии (стр. 146) среди зарегистрированных у человека рабдит указана также R. clavopapillata Kreis et Faust, 193318.
В 2002 г. список обнаруженных у человека видов Rhabditis выглядел следующим образом: Rhabditis axei (Cobbold, 1884), R. elongata (A. Schneider, 1866), R. hominis, R. inermis (A. Schneider, 1866), R. niellyi, R. pellio, R. taurica Mireckij et Skrjabin, 1965, R. terricola, Rhabditis sp. (Muller, 2002). Как видно, в данном списке отсутствовали указанные выше R. donbass и R. schachtiella, но добавились R. axei, R. elongata, R. inermis, R. taurica и R. terricola (все виды обнаружены в фекалиях). Замечу, что зачастую авторы не устанавливают видовую принадлежность выявляемых у людей Rhabditis. В свете отсутствия у исследователей единой точки зрения по поводу состава семейства рабдитид, когда один и тот же вид указывается в разных родах, систематизировать информацию о встреченных у человека видах Rhabditis довольно трудно. Но - попытаемся.
Rhabditis terricola Dujardin, 1844 (рабдита, обитающая в земле) (рис. 156). Самцы длиной 1.02 - 1.1, самки 1.04 - 1.54 мм. Голова с отчётливо округлыми коническими губами, на каждой из которых имеется по 3 маленькие папиллы.
16 Вид отнесён к синонимам Pelodera teres Schneider, 1866 (семейство Peloderidae). Источник синонимии: Hallan J. (2000-current). Biology Catalog. Web compilation accessible at http://bug.tamu.edu/research/collection/hallan. - IRMNG (2012). Rhabditis Dujardin, 1845. Accessed through: The Interim Register of Marine and Nonmarine Genera at http://www.irmng.org/aphia.php?p=taxdetails&id= 1345614 on 2016-09-30.
17 В цитируемом выше источнике - IRMNG (2012), вид Rhabditis schachtiella Skrjabin et Schulz, 1926 рассматривается в числе не признанных (unaccepted).
18 Вид отнесён к роду Caenorhabditis Osche, 1952 [см.: IRMNG (2012). Caenorhabditis Osche, 1952. Accessed through: The Interim Register of Marine and Nonmarine Genera at http://www.irmng.org/aphia.php?p=taxdetails&id=1063291 on 2016-09-30].
382
Рис. 156 Rhabditis terricola: A - головной конец; Б -головной конец, апикально; В - хвостовой конец самки; Г - бурса и хвост самца (из: Скрябин и др., 1954 - по: Chitwood, 1933)
R. terricola - обычный сапробионт (Скрябин и др., 1954).
Б. Читвуд (Chitwood, 1933) обнаружил большое количество этих нематод в лёгких погибшей саламандры (явно вторичное поселение червей в разлагающейся ткани животного).
Сообщается о регистрации личинок R. terricola в фекалиях детей в Словакии (см.: Muller, 2002).
Rhabditis axei (Cobbold, 1884) Dougherty, 1955. Самцы длиной 0.9 - 1.55 и диаметром 0.06, самки соответственно 1.4 - 1.8 и 0.1 мм. У представителей обоих полов хвост очень длинный. Ротовая капсула маленькая и
узкая, без зубов.
Сапробионт; тем не менее, яйца, личинок и/или взрослых особей данного вида эпизодически регистрируют у беспозвоночных и позвоночных животных. К
примеру, на юго-западе Нигерии яйца и личинки R axei выявлены в фекалиях африканских гигантских улиток Archachatina и Achatina, а взрослые черви - в их рек-туме (Odaibo et al., 2000).
Египетские исследователи обнаружили R axei в фекалиях цыплят и попытались определить возможность их паразитирования в птицах. В результате инокуляции червей трём цыплятам выяснилось, что после прохождения через их кишечник нематоды оказались нежизнеспособны (El-Azazy et al., 1988). И, наконец, в Иране в фекалиях 3-летнего самца азиатского кистехвостого дикобраза, живущего в зоопарке, насчитали 14 самок и двух самцов R. axei (Rakhshanpour et al., 2012).
Время от времени появляются сообщения о находках R axei и у человека. Так, в Китае эти черви были выявлены у местных жителей в моче (Feng, Li, 1950) и кишечнике (Ye et al., 2002), в Зимбабве - в пробах мочи (Goldsmid, 1967, 1970). По мнению Д. Голдсмида (Goldsmid, 1970), в данном случае этих нематод можно рассматривать временными паразитами человека. В Иране яйца и личинки R axei обнаружились в мазках стула ВИЧ-инфицированных пациентов (Meamar et al., 2007). Видовую принадлежность нематод установили по взрослым формам, выращенным
в культуре.
Следует подчеркнуть, что среди синонимов R axei называют два вида, также регистрируемых у человека: Rhabditis elongata (A. Schneider, 1866) Butschli, 1873 (см.: Feng, Li, 1950) и Rhabditella gracilis Shingareva, Demidova et Kudriavzev, 1928 (cm.: Baker, 1962). Первый из них дважды был обнаружен у молодых женщин в Южной Корее (см.: Muller, 2002), второй выявлен в фекалиях человека и домашних кроликов на территории бывшего Советского Союза (Гефтер, 1968).
383
Rhabditis hominis (^Rhabditis faecalis Watanabe, 1920) (рабдита человеческая) (рис. 157). Данный вид, равно как и причисляемый к его синонимам Rhabditis faecalis (рабдита фекальная), в настоящее время рассматривают синонимом R. /иег-mis (Schneider, 1866)1’.
Впервые Л hominis описан по экземплярам, выявленным в пробах фекальных масс школьников в Японии (Kobayashi, 1914). X. Ватанаба (Watanabe, 1920), обнаружив рабдитидные яйца в стуле пациента, вырастил в культуре взрослых червей, которых описал под названием Rhabditis faecalis Watanabe, 1920. Затем этот же вид - Л hominis - был найден на юге США (Sandground, 1925). Э. Фауст (Faust,
1949) предположил, что, скорее всего, этого же червя нашли в содержимом желудка человека в 1907 г. (Frese, 1907).
Нематоды субцилиндрической формы с заострённым передним и задним концами (Faust, 1949). Ротовое отверстие с 4 губами. Самцы длиной 0.9 - 1.2, диаметром 0.030 - 0.050 мм. Хвостовые крылья в виде узких лент окружают отверстие клоаки, каждая из них поддерживается 6 короткими рёбрами. Спикулы равные, имеют кнопкообразную головку и заострённое окончание. Губернакулюм малень-
кий. Самки длиной 1.5 - 2.0 и диаметром 0.12 мм. Задний конец заострён. Вульва в середине тела. У молодых самок в матке содержится 10-50 эллипсоидальных яиц размерами 44 х 28 рш, но у более старших особей она заполнена рабдитовидными, готовыми к вымету личинками.
с
Рис. 157 Rhabditis hominis'. А — зрелая самка; В - передний конец взрослого червя (Ьс -ротовая капсула); С - задний конец самца (s - спикулы; g -губернакулюм; Ьр - бурса с бурсальными рёбрами); D -рабдитовидная личинка (из: Faust, 1949 - по: Sandground, 1925)
Rhabditis inermis (A. Schneider, 1866) Dougherty, 1955 (рабдита беззубая). В больших количествах встречается в свежих компостных кучах гниющей растительности, в незначительных количествах - в коровьем навозе (Gunhold, 1952).
Личинки выявлены в пробах фекалий школьников в Японии (Muller, 2002).
19 IRMNG (2012). Rhabditis Dujardin, 1845. Accessed through: The Interim Register of Marine and Nonmarine Genera at http://www.irmng.org/aphia.php?p=taxdetails&id=1345614.
384
Rhabditis niellyi (R. Blanchard, 1885) Blanchard, 1890 (рабдита Nielly). Описание этого червя основано на рабдитовидных личинках, обнаруженных в папулах на коже у 14-летнего подростка в Бресте (Франция) (Nielly, 1882). В течение 6 недель пациент страдал от точечных папул, напоминающих кожные поражения «craw-craw» у местного населения в Западной Африке, возбудителем которых являются нематоды семейства Onchocercidae. В данном случае в каждой папуле находилось от одной и более личинок длиной 0.33 и диаметром 0.013 мм, с заострённым передним и задним концами тела. Личинок описали под названием Anguillula lepto-dera Nielly, 1882. В 1885 г. вид перевели в род Leptodera, назвав его в честь первооткрывателя L. niellyi R. Blanchard, 1885, а затем - в род Rhabditis.
Происхождение личинок и пути их попадания к человеку остались неизвестными.
Иная информация по данному виду отсутствует. Более того, некоторые исследователи считают Rhabditis niellyi старым, сомнительным видом («old doubtful») (см.: Ashford, Crewe, 2003).
Rhabditis pellio (Schneider, 1866) Biitschli, 1873 (рис. 158). Личинки нематоды паразитируют в половых сегментах жуков-некрофагов и в нефридиях олигохет,
и созревают после гибели хозяев. Взрослые особи в норме живут в разлагающейся органике. Самцы длиной 0.99 - 1.81, самки 1.06 - 1.91 мм (Faust, 1949). Спикулы
короткие и равные по длине. Отверстие вульвы с двумя сосочками. Матки парные.
Э. Фауст (Faust, 1949) перечисляет несколько случаев обнаружения R. pellio у человека. Первый из них имел место ещё в 1880 г. Тогда нематоды были выявлены в моче женщины, страдающей от пиелонефрита, пневмонии и острого кишечного катара. Моча пациентки была кислая и содержала кровь, гной и альбумин. Взрослые черви локализовались в вагине, а личинки выходили с мочой. Следующие случаи датированы 1887 и 1888 гг. Возможно, вид является активно внедряющимся псевдопаразитом (см.: Ashford, Crewe, 2003).
Рис. 158 Rhabditis pellio'. А - передний конец тела червя (на рисунке показаны ротовая капсула и пищевод); В -задний конец самца с бурсой, бурсальными рёбрами и
В спикулами (из: Faust, 1949 по: Orley, 1886)
Rhabditis schachtiella Skrjabin et Schulz, 1926 (рабдита шахтная).
Вид описан по экземплярам нематод, обнаруженным в фекалиях человека в Артёмовском округе на территории Донбасса во время работы 25-й Союзной гельминтологической экспедиции. Как отмечено выше (IRMNG, 2012. Rhabditis Dujardin, 1845. Accessed through: IRMNG at http: //www.irmng.org/aphia.php7p =taxdetails&id= 1345614), вид R. schachtiella отнесён к числу Rhabditis, чья видовая самостоятельность не признана (unaccepted).
Rhabditis taurica Mireckij et Skrjabin, 1965 (рабдита таврическая). Найдена в фекалиях ребёнка в России. Псевдопаразит (?) (см.: Ashford, Crewe, 2003).
385
Rhabditis sp. Во многих публикациях встреченные у человека рабдитиды определены только до уровня рода (напр., Eldridge, 1993; Hara et al., 1974). Под таким названием описаны, к примеру, личинки рабдит, выявленные при анализе стула учащихся ряда сельских школ в Южной Корее (Ahn et al., 1985). Из 925 учеников нематод обнаружили у 5-х, причём в 0.1 г фекалий у них насчитывалось соответственно 110, 35, 130, 86 и 62 личинки. Через 3 недели после первого обследования ни у одного ребёнка нематоды не встретились. На этом основании авторы сделали вывод, что заражение детей было факультативным.
Д. Кампос с соавт. (Campos et al., 2002) сообщают об инвазии 5-месячного малыша личинками и взрослыми самками Rhabditis sp. в Бразилии. У ребёнка была выражена диарея с жидким, зелёного цвета стулом, в которых затем появилась кровь. Лечение тиабендазолом дало положительный результат.
Недавно описана ещё одна примечательная находка Rhabditis sp. у человека (Teschner et al., 2014). На этот раз живые нематоды обнаружились в наружном слуховом проходе у 37-летнего мужчины, в течение 8 недель страдавшего гнойным отитом обоих ушей. Пациент жаловался на постепенное ухудшение слуха, начавшееся одновременно с появлением симптомов отита. После удаления червей состояние больного стало улучшаться. Каким образом, нематоды попали в слуховой проход пострадавшего, осталось неизвестным.
Цитируемая литература
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Скрябин К. И., Шихобалова Н. П., Соболев А. А., Парамонов А. А., Судариков В. Е. Камалланаты, раб-дитаты, тиленхаты, трихоцефаляты, диктиофиматы и распределение паразитических нематод по хозяевам И Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954. - 4. - С. 144 - 152, 487.
Скрябин К. И., Шульц Р. С. Новый вид Rhabditis schachtiella n. sp. И Работа 25-й Союзной гельминтол. экспедиции в Артёмовск, округе Донбасса. - Изд. Арт. окр. отдела здравоохранения, 1926. - С. 69 - 72.
Скрябин К. И., Шульц Р. С., Сербинов П. И. Новый вид Rhabditis человека - Rhabditis donbass n. sp. И Работа 25-й Союзной гельминтол. экспедиции в Артёмовск, округе Донбасса. - Изд. Арт. окр. отдела здравоохранения, 1926.
Ahn К К., Chung Р. R., Lee К. Т. [Rhabditis sp. infected cases in rural school children] // Kisaengchunghak Chapchi. - 1985. - 23, l.-P. 1-6. (Article in Korean; English summary).
Ashford R. W., Crewe W. The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
Baker A. D. Check lists of the nematode superfamilies: Dorylaimoidea, Rhabditoidea, Tylenchoidea, and Aphelenchoidea. - Leiden, E. J. Brill, 1962. - 260 pp.
Campos D. M., Araujo J. L., Vieira M. C, Damasceno F., Barbosa A. P.[A case of parasitism by Rhabditis sp. in a child from Goiania, Goias, Brazil] H Rev. Soc. Bras. Med. Trop. - 2002. - 35, 5. - P. 519 - 522. (Article in Portuguese; English summary).
Chitwood В. C. On some nematodes of the superfamily Rhabditoidea and their status as parasites of reptiles and amphibians // J. Wash. Acad. Sci. - 1933. - 23, 11. - P. 508 - 520.
El-Azazy О. M. E.t El-Gawady H. M., Nada M. S. The occurrence of Rhabditis (Rhabditella) axei in the faeces of a chicken in Egypt // J. Helminthol. - 1988. - 62, 3. - P. 219 - 220. DOI: .http://dx.doi.org/10.1017/ S0022149X0001155X
Eldridge B. Human urinary tract infection caused by Rhabditis sp. П PHLS. Microbiol. Digest. - 1993. - 10, 4.-P. 202-203.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
386
Feng L. C., Li F. Two human cases of urinary infection with Rhabditella axei (Cobbold, 1844) Chitwood, 1933 //Peking nat. Hist. Bull. - 1950. - 18, 3. - P. 195-202.
GoldsmidJ. M. Rhabditis (Rhabditella) axei in the urine of an African in Rhodesia // J. Helminthol. - 1967. -41, 4. - P. 305 - 308. 10.1017/S0022149X00021842
GoldsmidJ. M. Spurious parasites recovered from stools and urines in Rhodesia // Centr. Afr. J. Med. - 1970. -16, 8.-P. 173 - 178.
Goodey T. Soil and freshwater nematodes, 2nd ed. (rev. J. B. Goodey). - London & New York, Methuen & Co., 1963. -544 pp.
Gunhold P. Uber die in Kompost lebenden Nematoden П Bonn Zool. Bull. - 1952. - 3, 1-2. - P. 151 - 166.
Hara M., Nakazato H., Araki T., Iwata S. A case of urinary tract infection by a nematode larva (Rhabditis sp.) П Kisechugaku Zasshi. - 1974. - 23. - P. 48.
Meamar A. R., Kia E. B., Zahabiun E, Jafari-Mehr A., Moghadam A., Sadjjadi S. M. The occurrence of severe infections with Rhabditis axei in AIDS patients in Iran // J. Helminthol. - 2007. - 81, 4. -P. 351- 352.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Nielly Y. M. Un cas de dermatose parasitaire non encore observee en France (Anguillula leptodera) // Bull. Acad. M6d. Paris. - 1882. - 46. - P. 395.
Odaibo A. B., Dehinbo A. J., Olofintoye L. K., Falode O. A. Occurrence and distribution of Rhabditis axei (Rhabditida; Rhabditidae) in African giant snails in southwestern Nigeria // Helminthologia. - 2000. - 37, 4.-P. 233-235.
Orley L. Die Rhabditiden und ihre medizinische Bedeutung. - Berlin, 1886. - 84 pp.
Rakhshanpour A., Youssefi M. R., Marhaba Z., Aryaiepour M., Mobedi 1. et al. The morphological and morphometric study of Rhabditis axei from Atherurus macrourus (Asiatic brush-tailed porcupine) // Global Ve-terinaria. - 2012. - 8, 3. - P. 305 - 307.
Sandground J. H. Observations on Rhabditis hominis in the United States H J. Parasitol. - 1925. - 11. - P. 140-148.
Teschner M., Wilrfel W., Sedlacek L., Suerbaum S, Тарре D., Hornef M. W. Outer ear canal infection with Rhabditis sp. nematodes in a human H J. Clin. Microbiol. - 2014. - 52, 5. - P. 1793 - 1795. doi: 10.1128/JCM.00115-14.
Watanabe H. On a species of Rhabditis occurring in the culture of eggs found in stool of a patients П Dobut-sugaku Zasshi. - 1920. - 32. - P. 389 - 395.
Ye L. P., Zhu C. G., Zhang J. N. Two cases of Rhabditis axei infections in human digestive system // Zhong-guoXue Xi Chong Bing Fang ZhiZaZhi. - 2002. - 14. - P. 187 (In Chinese).
Род Caenorhabditis (Osche, 1952) Dougherty, 1953
Род Caenorhabditis первоначально был обоснован в качестве одного из подродов Rhabditis (Osche, 1952), однако буквально через год подрод Caenorhabditis Osche, 1952 получил статус самостоятельного рода (Dougherty, 1953).
Описание (по разным авторам, в том числе: Goodey, 1963). Губы низкие, закрытые. Стома с щетинкоподобными зубчиками. Эзофагеальный воротник имеется. Бурса пелодерного типа, обычно закрытая, присоскообразная. Спикулы две, раздельные. У самцов обычно имеется 3 пары преанальных папилл. Самки с парными гонадами, вульва располагается в середине тела. Хвост самок конический, длинный. В составе рода имеются виды, представленные самцами и гермафродитными особями, являющимися, по сути, самками, приобретшими способность к сперматогенезу. Типовой вид - Caenorhabditis elegans (Maupas, 1900) Dougherty, 1953.
Род объединяет 18 видов, из числа которых 6 относят к числу сомнительных, поскольку их описание очень отрывочное, а сами виды найдены только один раз (Kiontke, Sudhaus, 2006). Кстати, С. elegans широко используется как модельный организм в исследованиях по генетике, нейрофизиологии, биологии развития, вычислительной биологии.
387
Представители Caenorhabditis живут в богатой микроорганизмами среде -компосте, разлагающихся трупах животных, гниющих фруктах. В культуре все виды хорошо питаются кишечной палочкой Escherichia coli, но чем они питаются в естественных условиях, достоверно неизвестно (Kiontke, Sudhaus, 2006). Некоторые виды паразитируют у наземных брюхоногих моллюсков.
К. И. Скрябин с соавт. (1954; стр. 146) в числе рабдит человека называют Rhabditis clavopapillata Kreis et Faust, 1933. Источник, откуда почерпнута эта информация, авторы не приводят. Найти его по соответствущим ключевым словам не удалось. В обзорных монографиях по паразитам человека (Faust, 1949; Muller, 2002) данный вид среди рабдитид не упоминается.
Как отмечено выше, в 1955 г. Rhabditis clavopapillata перевели в род Caenorhabditis как С. clavopapillata (Kreis et Faust, 1933) (Dougherty, 1955). В настоящее время данный вид относят к категории сомнительных, поскольку он был отмечен только однажды, и какая-либо иная информация о нём на протяжении многих десятилетий вообще отсутствует (Kiontke, Sudhaus, 2006).
Цитируемая литература
Скрябин К. И., Шихобалова Н. П., Соболев А. А., Парамонов А. А., Судариков В. Е. Камалланаты, раб-дитаты, тиленхаты, трихоцефаляты, диктиофиматы и распределение паразитических нематод по хозяевам // Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954.-4.-С. 146.
Dougherty Е. С. The genera of the subfamily Rhabditinae Micoletzky, 1922 (Nematoda) / In: Thapar Commemoration Volume, 1953. - P. 69 - 76.
Dougherty E. C. The genera and species of the subfamily Rhabditinae Micoletzky, 1922 (Nematoda): A nomenclatorial analysis, including an addendum on the composition of the family Rhabditidae Orley, 1880 // J. Helminthol. - 1955.-29, 3. - P. 105 - 152.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - 744 pp.
Goodey T. Soil and freshwater nematodes, 2nd ed. (rev. J. B. Goodey). - London & New York, Methuen & Co., 1963.-544 pp.
Kiontke K, Sudhaus W. Ecology of Caenorhabditis species 11 The online review of C. elegans biology (Ed.) Wormbook. 2006. doi/10.1895/wormbook. 1.37.1, http://www.wormbook.org/chapters/ecol/ Caenorhabditis. html.
Kreis H. A., Faust E. C. Two new species of Rhabditis (Rhabditis macrocerca and R. clavopapillata) associated with dogs and monkeys in experimental Strongyloides studies I I Trans. Am. Mier. Soc. - 1933.-52. -P. 162-172.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Osche G. Systematik und Phylogenie der Gattung Rhabditis // Zool. Jahrb. Syst. - 1952. - 81,3. - P. 190 - 280.
Таким образом, из 12 видов и 4 родов Rhabditidae, перечисленных в сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru), осталось 10 видов из 2 родов (Rhabditis и Caenorhabditis}. При этом, учитывая признанную и непризнанную синонимию некоторых из них, а также описание ряда не определённых до вида Rhabditis sp., точное число выявленных у человека видов рабдитид установить пока практически невозможно.
Следующие виды и роды из названного выше списка удалены:
• Cheilobus quadrilabiatus рассматривается синонимом Rhabditophanes schnei-deri в семействе Alloionematidae.
• Diploscapter coronata - вид в составе семейства Diploscapteridae.
• Pelodera strongyloides и Pelodera teres входят в состав семейства Peloderidae.
388
Семейство Rictulariidae Hall, 1915
Семейство включают в класс Chromadorea в составе отряда Spirurida (Hodda, 2011).
Описание (по разным авторам, в том числе: Baylis, 1939). Губы отсутствуют. Рот субтерминальный, открывается дорсально поперечным удлинённым отверстием, окружённым маленькими зубчиками. Ротовая капсула небольшая, хитинизиро-ванная; у её основания имеются зубчики или шипы. Кутикула вооружена двумя продольными субвентральными рядами крупных уплощённых гребнеподобных шипов, которые по направлению к заднему концу тела становятся меньше и располагаются реже. Количество и расположение шипов и зубчиков используют в систематике нематод данного семейства. Пищевод простой, булавовидный. Хвостовой конец самца конический, с бурсоподобными расширениями или без них. Имеется несколько пар пре- и постанальных папилл. Спикулы короткие, равные или почти равные. Вульва возле заднего конца пищевода; её положение также используют в систематике нематод. Ветви матки параллельные, проходят назад. Яйца при откладке содержат эмбрион. Паразиты тонкого кишечника млекопитающих - хищников, летучих мышей, грызунов. Промежуточный хозяин - насекомые; в жизненном цикле могут участвовать паратенические хозяева - рептилии, амфибии. Типовой род - Rictularia Frolich, 1802.
Семейство немногочисленное, объединяет всего 5 родов с 91 видом (Hodda, 2011).
Единственный официально зарегистрированный случай обнаружения нематоды этого семейства у человека имел место в Нью-Йорке (США) (Kenney et al., 1975). Зрелая самка Rictularia sp. была выявлена на гистопатологических срезах аппендикса при аутопсии 90-летнего мужчины. Естественно, выяснить, как этот гельминт попал к человеку, не представлялось возможным.
Тем не менее, данная находка Rictularia sp. упоминается практически во всех обзорных работах, посвящённых паразитам человека.
В связи с определением обнаруженной у усопшего нематоды как принадлежащей к роду Rictularia и отмеченной как Rictularia sp., следует напомнить, что в настоящее время многие виды данного рода переведены в другие роды. В этом отношении очень характерен следующий пример.
В составе рода Pterygodermatites Wedl, 1861 с 1996-го года числится нематода Р. cahirensis (Jagerskiold, 1909) Barus, Petavy, Deblock et Tenora, 1996, известная ранее как Rictularia cahirensis Jagerskiold, 1909. Этот гельминт широко распространён у кошачьих Северной Африки, Ближнего Востока и Индии, в том числе у домашних и уличных кошек (рис. 159).
Р. cahirensis - некрупные черви белого цвета. Склеротизированная ротовая капсула при взгляде сбоку имеет очень характерную форму, присущую только данному виду. Самцы достигают в длину 3.7 - 4.8, самки - 8.8 - 19.6 мм (Jagerskiold, 1909; Johnson, 1969). У самца насчитывается 96 вентролатеральных шипов, у самки - 126 - 135. Яйца овальные, толстостенные, размерами 39 - 43 х 24 - 34 цт, содержат личинку.
Первый промежуточный хозяин Р. cahirensis не известен. Однако по аналогии с родственным видом - Pterygodermatites affinis, промежуточным хозяином ко-
389
торого являются членистоногие, можно предположить, что и у Р. cahirensis, это, скорее всего, также членистоногие (Quentin et aL, 1976). Инцистированные личинки данного вида обнаружены в стенке кишечника и мезентерии ящериц (Gupta, Pande, 1970; Witenberg, 1928). В результате экспериментального скармливания личинок из заражённой тигровой лягушки Hoplobatrachus tigerinus щенкам через 25 - 40 дней в тех были получены половозрелые нематоды Р. affinis (Gupta, Pande, 1974). Иными словами, подтверждалась возможность участия в жизненном цикле риктуляриид паратен и ческих хозяев, а, следовательно, и возможность попадания через них этих
нематод к человеку.
а б в г
Рис. 159 Pterygodermatites cahirensis, самка: а - передний конец тела; б - задний конец тела; в - область вульвы; г - яйца (из: Johnson, 1969, как Rictularia cahirensis)
Цитируемая литература
Barus V., Petavy A. F, Deblock S., Tenor a F. On Pterygodermatities (Multipectines) affinis and other species of Multipectines (Nematoda, Rictulariidae) // Helminthologia. - 1996. - 33. - P. 93 - 100.
Baylis H. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Gupta V. P., Pande В. P. Hemidactylus flaviviridis, a paratenic host of Rictularia cahirensis 11 Current Science. - 1970. - 23. - P. 535 - 536.
Gupta V. P., Pande В. P. Development of re-encapsulated larva of Rictularia cahirensis in experimental pups И Ind. J. Parasitol. - 1977. - 1. - P. 177 - 180.
Hodda M. Animal biodiversity 11 Zootaxa. - 2011. - No 3148. - P. 63 - 95.
Jagerskiold L. Nematoden aus Aegypten und dem Sudan (eigesammelt von der schwedischen zoologischen Expedition) // Results Swedish Zoological Expedition Egypt and White Nile 1901 (Jagerskiold). - 1909. -Pt. 3. - 66 pp.
Johnson S. On some nematodes belonging to the genus Rictularia (Nematoda: Spiruroidea) // Rev. Biol. Trop. - 1969. - 15. 2. - P. 289 - 297.
Kenney M„ Eveland L. K, Yermakov V., Kassouny D. Y. A case of Rictularia infection of man in New York I I Am. J. Trop. Med. Hyg. - 1975. - 24, 4. - P. 596 - 599.
Quentin J. C., Seureau C., Fernet R. Cycle biologique du nematode rictulaire Pterygodermatites (Multipectines) affinis (Jagerskiold, 1904) // Ann. Parasitol. Hum. Compar. - 1976. - 51. - P. 51 - 64.
Witenberg G. G. Reptilien als Zchwischenwirte parasitischer Wurmer von Katze und Hund H Tierarztl. Rundschau. - 1928. - 34. - P. 603.
390
Семейство Robertdollfusidae Chabaud et Campana, 1950
Семейство, представленное 4 родами с 6 видами, включают в класс Dorilaimea в составе отряда Muspiceida (Hodda, 2011).
Описание (по: Anderson, Bain, 2009). Узкие черви длиной до 5 - 6 мм. Кутикула гладкая. Голова с кутикулярным вздутием, папиллами и амфидами или без них. Мускулатура может быть атрофирована. Пищеварительный тракт слабо выражен или атрофирован. Самцы с длинным заострённым хвостом и одной спикулой. Полость тела самки заполнена маточным мешком, занимающим большую часть тела. Вульва возле середины тела. Живородящие. Личинки развиваются в маточном мешке. Паразиты птиц, сумчатых и человека. Типовой род - Robertdollfusa Chabaud et Сатрапа, 1950.
В 1998 г. была опубликована статья, авторы которой (Dennett et al., 1998) сообщали о заболевании двух тасманийских жителей полимиозитом, вызванным, по их мнению, представителем нового рода нематод, паразитирующим в мышечной ткани людей. Описание нового рода Наусоскпета Spratt, Beveridge, Andrew et Dennett, 1999 с типовым видом H. perplexum Spratt, Beveridge, Andrew et Dennett, 1999, включённого авторами в семейство Robertdollfusidae, было опубликовано на следующий год (Spratt et al., 1999).
Нематоды характеризуются: исключительно мелкими размерами (0.3 - 0.5 х 0.025 - 0.045 мм); наличием на теле латеральных бациллярных лент, состоящих из одного ряда поровых клеток, расположенных нерегулярно и протянувшихся назад до области вульвы у неполовозрелых самок; маленькой, слабо склеротизированной почти трубчатой спикулой; наличием пары ампулообразных желез позади и крупной аморфной «клетки», поддерживающей заполненный гранулами, фляго- или тыквообразный резервуар в ректальной области взрослых и половозрелых самок, часто содержащей один или более крупных, светопреломляющих, в толстой оправе “глобул” на внешней поверхности резервуара; небольшим количеством яиц/ личинок (8 - 12), развивающихся в каждой матке.
Нематоды поселяются внутри мышечных волокон. Личинки развиваются в яйцах в маточных мешках и по достижении 3-й стадии развития прорывают голову самки, тем самым убивая её, и выходят в мышечную ткань, инвазируя новые мышечные волокна. Таким образом происходит самозаражение человека, а паразит завершает свой жизненный цикл, не покидая хозяина.
Первые случаи заражения человека, как уже отмечено, были зафиксированы на Тасмании в 1994 (у 33-летней женщины) и 1996 гг. (у 48-летнего мужчины) (Dennett et al., 1998). Оба заболевших страдали от прогрессирующего полимиозита: в течение 5 лет - пациентка и 1.5 лет - пациент. Любопытная деталь: первоначально женщине - это была англичанка, ботаник, много путешествующая по разным странам и континентам, - поставили диагноз трихинеллёзиса и лечили её от заражения этими нематодаи (Andrews et al., 1994). Через 10 лет после цитируемой публикации появилось сообщение об обнаружении Н. perplexum у нескольких жителей побережья на севере Австралии в Квинсленде (Basuroy et al., 2008). В статье описывались три случая, имевших место в разные годы: в 2004 и 2006 гг. - у 61-летних мужчин и в 2005-м - у 23-летней женщины. У всех пострадавших в течение 2-3
391
лет отмечалась прогрессирующая миопатия с эозинофилией и повышенной кретин-киназой, причиной которой, как выяснилось при обследовании пациентов, стало их заражение Н, perplexum. В 2013 г. был описан 6-й случай заражения человека названной нематодой, зафиксированный в 2011 году. На этот раз заболевание обнаружилось у 50-летнего мужчины на Тасмании, у которого в течение двух лет наблюдалась прогрессирующая слабость, исхудание (за 2 года больной похудел на 10 кг) и дисфагия (расстройство глотания) (McKelvie et al., 2013).
В целом заражение Н perplexum вызывает генерализованное поражение мышц и может протекать как в острой, так и в хронической форме. Чаще всего поражаются мышцы плечевого и тазового пояса, которые начинают слабеть, атрофируются и становятся болезненными при прикосновении к ним, возникают чувство слабости, усталости, трудности с глотанием пищи, наблюдается значительная потеря веса. Поражение дыхательных мышц может представлять серьёзную угрозу жизни человека.
К настоящему времени источники заражения человека этими нематодами -вода, почва, растения, животные - не ясны, равно как неизвестны и возможные хозяева Н perplexum среди диких или домашних животных.
Трудно очертить и регион, который можно было бы определить, как эндемичный по данному заболеванию. Из 5 случаев, зарегистрированных к 2008-му году, четверо пострадавших, включая жителей Тасмании, вели очень активный образ жизни, посещая, в том числе, северную Австралию, а один из пациентов за 20 лет никогда не покидал пределы этого региона. В то же время 6-й пациент, живущий на Тасмании, ни разу не был в северном Квинсленде.
В целом пока можно сделать вывод, что Н. perplexum является эндемичным для Австралии и Тасмании внутримышечным паразитом человека.
Исследователи возлагают большие надежды на геномные исследования Н, perplexum, которые могут пролить свет на взаимоотношения этой нематоды с другими паразитами человека и животных, выявить её природные источники и расшифровать жизненный цикл (Melville et al., 2016).
Цитируемая литература
Anderson R. С., Bain О, No. 9. Keys to genera of the supefamilies Rhabditoidea, Dioctophymatoidea, Trichi-nelloidea and Muspiceoidea. 2. Enoplida. Muspiceoidea. - P. 1 - 29. / Keys to Nematode parasites of vertebrates: Archival volume. - Eds. R. C. Anderson, A. G. Chabaud. S. Willmoth. - CAB Intern., Famham Royal, Bucks, England, 2009. - 463 pp.
Andrews J. R. H, Ainsworth R, Abernethy D.Trichinella pseudospiralis in humans: description of a case and its treatment // Trans. Roy. Soc. Trop. Med. Hyg. - 1994. - 88. - P. 200 - 203.
Basuroy R, Pennisi R, Robertson T., Norton R, Stokes J. et al. Parasitic myositis in tropical Australia // Med. J. Austr. - 2008. - 188, 4. - P. 254 - 256.
Dennett X., Siejka S. J., Andrews J. R. H, Spratt D. M. Polymyositis caused by a new genus of nematode // Med. J. Austr. - 1998. -168, 5. - P. 226 - 227.
McKelvie P., Reardon K., Bond K, Spratt D. M„ Gangell A. et al. A further patient with parasitic myositis due to Haycocknema perplexum, a rare entity // J. Clin. Neurosci. - 2013. - 20, 7. - P. 1019 - 1022. doi: 10.1016/j.jocn.2012.08.009.
Melville L., Farid R, McCarthy J. Isolation of Haycocknema perplexum genomic DNA via laser capture microdissection of individual nematodes // Pathology. - 2015. - 48, l.-P. 77.
Sprat D.t Beveridge I., Andrews J., Dennett X. Haycocknema perplexum n. g., n. sp. (Nematoda: Robertdoll-fusidae): an intramyofibre parasitic in man // Syst. Parasitol. - 1999. - 43, 2. - P. 123 - 131. Doi: 10.1023/A: 1006158218854.
392
Семейство Setariidae Yorke et Maplestone, 1926
Семейство включают в класс Secementea в составе отряда Spirurida (см.: GBIF Global Biodiversity Information Facility: www.gbif.org.Setaria Viborg, 1795 - Checklist View; Taxonomicon, 2006). В монографии К. И. Скрябина с соавт. (1949) авторы семейства Setariidae - Skrjabin et Schikhobalowa, 1945, в монографии М. Д. Сонина (1977) эта группа нематод имеет ранг подсемейства Setariinae Yorke et Maplestone, 1926.
Описание (по: Сонин, 1977; Monnig, 1934). Крупные нематоды длиной до 15 и более сантиметров, молочно-белого цвета. Кутикула гладкая или с тонкой исчерчен-ностью. Самки почти в 2 раза крупнее самцов. Тело заострённое, особенно к заднему концу. Имеются головные и шейные папиллы. Рот окружён кутикулярным кольцом, несущим характерные дорсальные и вентральные, а иногда и латеральные выступы. Пищевод разделён на отделы. Хвост самца спирально закручен, имеется по 4 пары пре- и постанальных папилл. Спикулы различаются по длине и форме. На хвосте самки могут быть шипы или несколько крупных конических выростов, бугорков. У обоих полов хвост имеет пару маленьких отростков возле верхушки. Вульва в передней части тела. Яйца овальные, с тонкой прозрачной оболочкой, содержат личинку. Типовой род - Setaria Viborg, 179520.
Род Setaria Viborg, 1795
Описание (по: Скрябин и др., 1949). С характерными чертами семейства. Околоро-товое хитиновое кольцо продолжается в виде 4 губ. Головной конец с 4 выступающими, иногда шиповидными головными сосочками. Цервикальные сосочки маленькие. Передняя часть пищевода короткая и узкая, задняя - длинная и толстая. Самка опистодельфная. Яйца с тонкой прозрачной оболочкой. Типовой вид - Setaria equina (Abildgaard, 1789) Viborg, 1795.
Жизненный цикл сетарий включает промежуточного хозяина - кровососущих насекомых - Aedes, Anopheles, Culex, которые при питании кровью животного заглатывают яйцЗЭЗа, содержащие личинок 1-й стадии. В их организме за 16-20 дней личинки достигают инвазионного состояния. Заражение дефинитивных хозяев также происходит во время нападения на них кровососущих насекомых для питания. Установлена также возможность перинатального заражения окончательных хозяев (Fujii et al., 1995; Wee et al., 1996). Описан, например, случай выделения с молоком кормящей самки буффало нескольких особей Setaria labiatopapillosa (Alessandrini, 1848) длиной до 10.5 см (Singh et al., 1996). В организме животного-хозяина развитие личинок сетарий до половозрелого состояния завершается в течение примерно 6 месяцев.
Сетарии характеризуются практически всесветным распространением и адаптацией к паразитированию у широкого круга млекопитающих - различных ви
20 В монографии М. Д. Сонина (1977), информационной сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru), а также в базе данных NEIHPID - North-East India Helminth Parasite Information Database (ne-piac.nehu.ac.in) данный род включён в состав семейства Onchocercidae.
393
дов непарно- и парнокопытных, а также мозоленогих (Азимов и др., 2015; Сонин, 1977). Взрослые черви поселяются в брюшной и грудной полости, печени, селезёнке, почках, лёгких, перикардии животных, и могут провоцировать умеренный фиброзный перитонит, а также воспалительные процессы в органах, в которых они поселились. Неполовозрелые сетарии, чья длина тела достигает 1 см, в случае проникновения в органы зрения животного вызывают слезотечение, отёк век, помутнение роговицы. Поражение личинками центральной нервной системы приводит к серьёзным и часто фатальным нейропатологическим нарушениям, известным как цереброспинальный сетариозис или поясничный паралич (Soulsby, 1982).
Видовое разнообразие, патогенность сетарий, особенности их экологии, биологии и локализации в организме хозяев изучены слабо, а точки зрения разных авторов по многим вопросам довольно противоречивы.
В монографии, посвящённой филяриатам животных и человека, М. Д. Сонин (1977), перечисляя известных хозяев Setaria equina, упоминает среди них и человека. При этом он ссылается на работу О. фон Линстова (von Linstow, 1902), в которой тот описывает находку сетарии у человека в Польше. Комментируя эту информацию, М. Д. Сонин подчёркивает, что данный случай требует подтверждения. Других сведений о регистрации S. equina у человека найти не удалось (возможно, что их просто нет). В то же время имеется сообщение о заражении нескольких человек в Румынии другим видом Setaria - S. labiatopapillosa (Panaitescu et al., 1999). Ещё в одной публикации, в которой описана 5. digitata (von Linstow, 1906) Railliet et Henry, 1911, вызывающая у овец, коз и лошадей фатальный церебральный сетариозис, исследователи предполагают возможность её паразитирования и у человека (Innes, Shoho, 1953). Тем не менее, это - только предположение, хотя оно даже нашло отражение в названии статьи цитируемых авторов (см. ссылку). И, наконец, в одной из недавно опубликованных статей её авторы (Perumal et al., 2016) предлагают использовать упомянутую 5. digitata как модельный объект для изучения одного из возбудителей тяжёлого заболевания человека - Wuchereria bancrofti из семейства Onchocercidae (см. стр. 364 - 365). Высказывая подобную мысль, авторы руководствовались близким сходством названных видов. Напомню, что ранее род Setaria также входит в это семейство в составе подсемейства Setariinae.
Setaria equina (Abildgaard, 1789) Viborg, 1795 (=Gordius equinus Abildgaard, 1789) (рис. 160, 161). Впервые описана на материале от лошади, с чем связано и видовое название нематоды: Equus - латинское название рода (сетария лошадиная). С момента его открытия в 1789 г. гельминт описывался под разными родовыми и видовыми названиями (Сонин, 1977). Цитируемый автор в числе синонимов 5. equina перечисляет 16 видов.
Довольно крупные тонкие нематоды. Перибуккальная корона выступающая, с дорсальным и вентральным перибуккальными возвышениями и двумя латеральными губами серповидной формы. Длина самцов (Monnig, 1934) 50 - 80, самок 90 -150, левая спикула 0.63 - 0.66, правая 0.14 - 0.23 мм. По (Сонин, 1977), самцы длиной 51 - 66 и шириной 0.47 - 0.56, самки соответственно 110 - 190 и 1.0 - 1.2 мм. Д. А. Азимов с соавт. (2015) приводят следующие морфометрические показатели нематод: самцы длиной 58 - 73 и шириной 0.48 - 0.58, самки соответственно 110 — 190 и 1.0 - 1.4, левая спикула длиной 0.62 - 0.66, правая 0.28 - 0.30 мм.
394
Рис. 161 Setaria equina (из: Скрябин и др., 1949 - по: Раевская, 1928)
Рис. 160 Setaria equina: a - передний конец тела, вид сбоку; б - задний конец тела самца, вентрально (из: MOnnig, 1934)
да
Микрофилярии длиной 0.22 - 0.26, с закруглённым головным и заострённым задним концами. Инвазионные личинки достигают длины 1.46 - 1.86 мм.
Взрослые черви поселяются в полости брюшины, а также в грудной, перикардиальной и плевральной полостях, лёгких, печени, селезёнке, кишечнике,
желудке и глазах животных, микрофилярии паразитируют в их крови. Установлено, что сетарии оказывают патогенное действие на организм лошадей, вызывая изменения в гематологических и биохимических показателях животных, развитие гнойно-некротических процессов в лёгких и печени.
Заболевание широко распространено во многих странах Европы, в том числе в России, Украине, Беларуси, прибалтийских государствах, в Азии, Северной Америке. К примеру, в Пензенской области РФ паразит обнаружен у 44 % обследованных лошадей, в Рязанской - у 23 %, а в Московской - у 17.4 % (Гришин, 2009).
Setaria labiatopapillosa (Alessandrini, 1848) Railliet et Heniy, 1911 (рис.161). История открытия этого вида довольно запутана, что нашло отражение в разночтениях относительно авторства и года описания гельминта (подробно об этом писал М. Д. Сонин в 1977 г.). В настоящее время общепринято считать, что авторство ви
395
да принадлежит А. Алессандрини (Alessandrini, 1848), который впервые упомянул об этом паразите в 1848 г., назвав его Filaria labiatapapillosa Alessandrini, 1848.
Рис. 162 Setaria labiatopapillosa: a - головной конец самца, вентрально; б - головной конец самца, вид сбоку; в - головной конец самки; г - головной конец самки, вид сбоку; д - головной конец самки, апикально; е - правая спикула; ж - левая спикула; з - хвостовой конец самца, вентрально; и - хвостовой конец самки, вентрально (из: Сонин, 1977 - по: Becklund, Walker, 1969)
Перибуккальная корона выступающая, с латеральными губами: треугольными - у самцов и прямоугольными - у самок. По (Сонин, 1977), самцы достигают в длину 40 - 51, ширину 0.38 - 0.45 мм, по (Sundar, D’Souza, 2015), размеры самцов составляют в среднем 80 х 0.4 мм. Хвостовой конец самцов сильно закручен. Левая спикула, более широкая в средней части, длиной 0.25 - 0.28 мм, правая, менее заметная, 0.12-0.16 мм. Самки длиной 60 - 94, шириной 0.6 - 0.9 мм (Сонин,. 1977) или 150 х 0.6 мм (Sundar, D’Souza, 2015). Хвостовой конец самок гладкий, с заострёнными боковыми выростами.
Микрофилярии длиной 0.24 - 0.31 мм. Промежуточные хозяева - комары, мухи-жигалки. Личинки достигают инвазионного состояния при 19 - 26°С и влажности 66 - 95 % через 16-24 дня. Их длина при этом составляет 2.2 - 2.6, а ширина 0,4 - 0.42 мм.
5. labiatopapillosa - широко распространённый паразит крупного рогатого скота по всему миру. Как правило, черви поселяются в брюшной полости жвачных, вызывая хронические воспалительные процессы, но их также обнаруживают на
396
сердце, в капсуле почки, в кишечнике, передней камере глаза, головном мозге (Сонин, 1977). Развитие червей до половозрелого состояния в организме дефинитивного хозяина - крупного рогатого скота длится до 6 месяцев.
Как уже отмечено выше, заражение людей S', labiatopapillosa имело место в Румынии близ озера Пантелимон, славящегося обилием в тех местах кровососущих насекомых (Panaitescu et al., 1999). Пострадавшими оказались четыре женщины в возрасте 35...68 лет, у которых в результате инвазии наблюдались светобоязнь, отёк глаза, слезотечение, ощущение инородного тела в глазу, низкая эозинофилия (6-8 %). Нематод удалили хирургическим путём.
Итак, судя по имеющейся информации, совершенно очевидно, что для человека заражение сетариями нетипично, носит исключительно случайный характер и может произойти только через кровососущих насекомых.
Цитируемая литература
Азимов Д. А., Сапаров К. А., Акрамова Ф. Д., Кучбоев А. Э., Гаипова М.Э. и др. Нематоды рода Setaria Viborg, 1795 (Filariina: Setaridae) - паразитов животных Узбекистана: морфологические и молекулярные подходы к их дифференциации // Рос. паразитол. журн. - 2015. - Вып. 4 . - DOI: 10.12737/17302.
Гришин Д В. Сетариоз лошадей в Центральной зоне России и меры борьбы с ним: Автореф. дисс...канд. вет. наук. - 03.00.19 - паразитология. - М., 2009. - 22 с.
Раевская 3. А. Сетарии и их патогенное значение И Труды Гос. ин-та эксп. вет. - 1928. -5, 1. - С. 53 -108 (цит. по: Скрябин и др., 1949).
Скрябин К. И., Шихобалова Н. IL, Соболев А. А. Спирураты и филяриаты И Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М. - JL: Изд-во АН СССР, 1949. - С. 418 - 455.
Сонин М. Д. Филяриаты животных и человека и вызываемые ими заболевания // Основы нематодологии. - Отв. ред. чл.-корр. АН СССР К. М. Рыжиков. - М.: Наука, 1977. - 24. - С. 29 - 126.
Alessandrini A. Agglunta del Professore Antonio Alessandrini all’articolo Vermi del dizionario di Medicina, Chirurgia ed Iglene di Hurtrel veterinaria d’Arboval tradotto dal Dottor Tommaso Tamberlicchi. - 1845. -5. (цит. по: Сонин, 1977).
Becklund W. W„ Walker M. L. Taxonomy, hosts and geographic distribution of the Setaria (Nematoda: Fila-roidea) in the United States and Canada 11 J. Parasitol. - 1969. - 55, 2. - P. 359 - 368.
Fujii T., Hayashi T, Ishimoto A., Takahashi S, Asano H., Koto T. Prenatal infection with Setaria marshalli (Boulenger, 1921) in cattle П Vet. Parasitol. - 1995. - 56. - P. 303 - 309.
Innes J. R. M., Shoho C. Cerebrospinal nematodiasis. Focal encephalomyelomalacia of animals caused by nematodes {Setaria digitata)', A disease which may occur in man П Arch. Neur. Psych. - 1953. - 70, 3. - P. 325-349. doi: 10.1001/archneurpsyc. 1953.02320330050006.
Linstow O. von. Beobachtungen an neuen und bekannten Nemathelminten П Arch. Mikr. Anat. - 1902. - 60. -P. 222.
Monnig H. O. Veterinaiy helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
Panaitescu D., Preda A., Bain O., Vasile-Bugarin A. C. Four cases of human filariosis due to Setaria labiatopapillosa found in Bucharest, Romania // Roum. Arch. Microbiol. Immun. - 1999. - 58, 2. - P. 203 - 207.
Perumal A. N. I., Gu naw ar dene Y. L N. S, Dassanayake R .S. Setaria digitata in advancing our knowledge of human lymphatic filariasis // J. Helminthol. - 2016. - 90, 2. - P. 129 - 138. DOI: http://dx.doi.org/ 10.1017/S0022149X15000309.
Singh J., Gil J. S, Singh H. Setaria labiatopapillosa excreted in milk of a buffalo (Bubalus bubalis) I I Buffalo Bull. (Thailand). - 1996. - 15, 2. - P. 31 - 32.
Soulsby E. J. L Helminths, Arthropods and Protozoa of Domesticated Animals. 7th ed. - Bailliere Tindall, London, 1982.-P. 316-319.
Sundar S. T. B., D "Souza P. E. Morphological characterization of Setaria worms collected from cattle // J. Parasit. Dis. -2015. -39, 3. -P. 572-576. doi: 10.1007/sl2639-013-0399-x.
Wee S. H., Jang H, Joo H. D„ Kang Y. B., Lee C. G. Setaria marshalli infection in neonatal calves И Korean J. Parasit. - 1996. - 34. - P. 207 - 210.
397
Семейство Spirocercidae Chitwood et Wehr, 1932
Одни авторы помещают семейство Spirocercidae в класс Chromadorea в составе отряда Rhabditida (De Ley, Blaxter, 2002; Vanaverbeke, 2015), другие - в класс Secementea в составе отряда Spirurida21.
У одних спироцеркид губы развиты слабо и не выступают над ротовым отверстием, у других развиты хорошо и разделяются над ротовым отверстием на 6 долей с зубами. Ротовое отверстие гексагональное. Фаринкс иногда со складчатостью или кольцевыми утолщениями. Ротовая полость без медианных долей, обычно с 6 зубами. Типовой род - Spirocerca Railliet et Henry, 1917.
Род Spirocerca Railliet et Henry, 1917
Описание (no: Baylis, 1939). Губы трёхдольчатые, редуцированные. Внутри гексагонального по своей форме ротового отверстия имеется 6 маленьких папилл. Фаринкс короткий, толстостенный, иногда вытянут вперёд, но его передний край завёрнут внутрь. Хвостовой конец самца спирально закручен и снабжён узкими крыльями. Имеются 4 пары пре- и 2 пары постанальных стебельчатых папилл. Спикулы неравные. Имеется маленькая дополнительная пластинка. Вульва впереди середины тела, возле заднего конца пищевода. Взрослые черви живут в опухолях в пищеводе или желудке хищных млекопитающих. Типовой вид - Spirocerca lupi (Rudolphi, 1809) Chitwood, 1933.
Для человека паразитирование спироцерк не характерно. Тем не менее, удалось найти информацию о случае заражения ребёнка Spirocerca lupi.
Spirocerca lupi (Rudolphi, 1809) Chitwood, 1933 {-Strongylus lupi Rudolphi, 1809; =Spiroptera sanguinolenta Rudolphi, 1819; =Filaria sanguinolenta Schneider, 1866; =Spirocerca sanguinolenta Railliet et Henry, 1911; Spirura sanguinolenta Seurat, 1912) (рис. 163). Синонимы no: Baylis, 1939. Впервые паразит описан на материале от волка, с чем связано и его видовое название - lupi'. от латинского lupus - волк.
Описание (по: Baylis, 1939; Monnig, 1939). Тело при жизни кроваво-красного цвета. Самцы длиной 30 - 54 и толщиной 1 мм. Левая спикула узкая и заострённая, 2.45 - 2.8 мм, правая более короткая и тупая, 0.475 - 0.750 мм. Дополнительная пластинка маленькая и тонкая, в вентральном аспекте подковообразная. Самки длиной 54 - 80 и толщиной 1-5 мм. Хвост самок тупой, с парой терминальных папилл, обычно направлен дорсально. Ветви матки параллельные. Яйца удлинённые, с гладкой оболочкой, их размеры, приводимые разными авторами, укладываются в пределы 30 - 40 х 11 - 15 цт. Однако по данным (Szcz^sna, Popiolek, 2007), размеры яиц 39 - 50 х 17-22 цт. При откладке яйца содержат полностью сформированную личинку 1-й стадии.
Яйца 5. lupi попадают во внешнюю среду с фекалиями или при рвоте животного-хозяина, чаще всего, это - собаки.
21 SIB|Taxonomia Spirocercidae - www.sib.gov.ar; NATURDATA|Biodivercidade omline - na-turdata.com.
398
1
2
Рис. 163 Spirocerca lupi: 1 - передний конец тела самки, дорсально; 2 - то же, латерально; 3 - передний конец тела самца, апикально (l.p. - латеральная папилла; s.l.p. - субдорсальная папилла); 4 - задний конец самца, латерально; 5 - терминальный участок хвоста самца, вентрально (из: Baylis, 1939)
Биологический цикл паразита проходит с участием промежуточных хозяев - жуков-копрофагов (Scarabaeus, Geotrupes, Gymnopleurus и другие), в организме которых личинки, достигнув 3-й, инвазионной, стадии, инкапсулируются (Bailey, 1965; Chhabra, Singh, 1972а, 1973; Faust, 1928). В одной цисте одновременно могут находиться две и более личинки, а однажды в эксперименте встретилась циста с 25 личинками (Bailey, 1965). С заражёнными жуками личинки могут попадать к паратоническим хозяевам - амфибиям, рептилиям, птицам, например, цыплятам, или мелким млекопитающим, в организме которых они вновь инкапсулируются (Chhabra, Singh, 1972b). Подобных хозяев поедают собаки или иные плотоядные животные. В их желудке личинки покидают цисту и проникают в портальные или лёгочные капилляры (Faust, 1927), или же непосредственно через желудочную и полостную артерии - в артериальную систему (Hu, НоеррИ, 1936). В торакальной аорте нематоды остаются в течение 2-3 месяцев. Из аорты черви проникают в стенку пищевода, где формируются характерные опухоли с отверстием, через которое откладываемые самкой яйца попадают в просвет пищевода. Опухоли достигают величины грецкого ореха или даже крупнее, и могут локализоваться также в стенках желудка, а иногда в лимфатических железах, бронхах, грудной и брюшной полостях и даже в стенке аорты. Помимо того, эти нематоды, отличающиеся необычайно высокой активностью, могут встретиться в стенке мочевого пузыря, почках, подкожных абсцессах, трахее, лёгких, спинном мозге (Du Plessis et al., 2007). От момента попадания в организм хозяина и до начала откладки яиц зрелой самкой обычно проходит 5-6 месяцев.
5. lupi отмечают в странах с тёплым и умеренным климатом, прежде всего, у псовых - собак, в том числе домашних, охотничьих, шакала, лисиц, а также у ко
399
шачьих, куньих, виверровых. Заражение собак обычно происходит во дворах, парковых зонах, на улицах при поедании травы, мусора, фекальных масс животных или кусков пищи, в которых могут оказаться заражённые жуки-копрофаги. По этой причине S. lupi даже получила название Park worm - парковый червь.
Что касается возможного паразитирования S. lupi у человека, то во многих источниках можно прочитать, что «it is important to note that the disease cannot be spread to humans» (http://www.vets.co.il/park-worm-spirocerca-lupi), т.е. болезнь не может передаваться от животного к человеку.
Тем примечательнее информация, опубликованная более полувека назад, об обнаружении S. lupi у новорожденного ребёнка (Biocca, 1959). Автор описывает изученный Moretti & Pezzani случай выявления нематод у родившегося восьмимесячным ребёнка. У его матери на шестом месяце беременности было выявлено многоводие, одной из причин которого могло быть любое инфекционное заболевание. Среди прочих болезненных симптомов у родившегося младенца было отмечено отсутствие мекония и перитонит плода. Младенец скончался на 12-й день. При аутопсии в терминальной части подвздошной кишки, часть которой была полностью заращена, обнаружилось пять взрослых самцов и самок S. lupi.
Какой-либо иной информации о находке S. lupi у человека мне не встретилось, несмотря на интенсивные поиски в соответствующей литературе.
Цитируемая литература
Bailey W. S. Parasites and cancer: sarcoma associated with Spirocerca lupi H Ann. N.Y. Acad. Sci. - 1965. -108.-P. 890-923.
Baylis H. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Biocca E. Infestazione umana prenatale da Spirocerca lupi (Rud, 1809) 11 Parassitologia. - 1959. - 1, 2. - P. 137-142.
Cameron J. 2003. "Spirocerca lupi" (On-line), Animal Diversity Web. Accessed August 06, 2016 at http://animaldiversity.org/accounts/Spirocerca_lupi.
Chhabra R. C, Singh K. S. Spirocerci lupi preinfactive stages in the intermediate host // J. Helminthol. -1972a.-46, 2.-P. 125- 137.
Chhabra R. C, Singh K. S. On Spirocerci lupi infection in some paratenic hosts infected experimentally 11 Indian J. Anim. Sci. - 1972b. - 42. - P. 297 - 304.
Chhabra R. C, Singh K. S. A study of the life-history of Spirocerci lupi; intermediate hosts and their biology H Indian J. Anim. Sci. - 1973. - 43. - P. 49 - 54.
De Ley P„ Blaxter M. Systematic position and phylogeny I The biology of nematodes. - Ed. D. L. Lee. -London, N. Y.: Taylor & Francis, 2002. - P. 1 - 59.
Du Plessis C. J., Keller N„ Millward I. R. Aberrant extradural spinal migration of Spirocerca lupi: four dogs 11 J. Small Anim. Pract. - 2007. - 48, 5. - P. 275 - 278.
Faust E. C. Migration route of Spirocerca sanguinolenta in its definitive host 11 Proc. Soc. Exp. Biol. Med., New York. - 1927. - 25. - P. 192 - 195.
Faust E. C. The life cycle of Spirocerca sanguinolenta - a natural nematode parasite of the dog 11 Science. -1928. - 68.-P. 407-409.
Ни С. H., Hoeppli R. J. C. The migration route of Spirocerca sanguinolenta in experimentally infected dogs 11 Chinese Med. J. - 1936. - Suppl. I. - P. 293 - 311.
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - 427 pp.
Szcz$sna J., Popiolek M. The first record of Spirocerca lupi (Rudolphi, 1809) (Spirocercidae, Nematoda) from Poland based on faecal analysis of wolf (Canis lupus L.) I I Helminthologia. - 2007. - 44,4. - P. 230 - 232.
Vanaverbeke J. Spirocercidae Chitwood & Wehr, 1932. Accessed through: World Register of Marine Species (2015). at http.7/www.marinespecies.org/aphia.php?p=taxdetails&id=834798.
400
Семейство Strongyloididae Chitwood et McIntosh, 1934
Относительно немногочисленное семейство (3 рода с 70 видами) включают в класс Chroma-dorea в составе отряда Panagrolaimida (Hodda, 2011) или Rhabditida (De Ley, Blaxter, 2002).
Стронгилоидиды примечательны наличием в их биологическом цикле двух генераций: свободноживущей и паразитической. Особи первой из них характеризуются наличием двух латеральных губ, редуцированной стомой, окружённой пищеводной тканью. Пищевод состоит из прекорпуса, метакорпуса, истмуса и бульбуса с клапанным аппаратом. Бурса у самцов отсутствует. Половая система самок дидельф-ная. Особи паразитической генерации обладают сильно удлинённым пищеводом. Типовой род-Strongyloides Grassi, 1879.
Стронгилоидиды относятся к группе так называемых геогельминтов, т.е. их биологический цикл не связан с промежуточными хозяевами, а заражение окончательных хозяев происходит яйцами/личинками во внешней среде.
Род Strongyloides Grassi, 1879
Синонимы (по: Скрябин и др., 1954):
Trichosomum Creplin, 1829
Anguillula Diesing, 1861 (in part)
Leptodera Schneider, 1866 (in part)
Rhabdonema Leuckart, 1879
Pseudorhabditis Perroncito, 1889nec Sttitz, 1912 Stercoralis Tanaka, 1910
Описание (по: Скрябин и др., 1954). Паразитическое поколение. Ротовое отверстие с двумя трёхлопастными губами и 8 сосочками в двух кругах. Самцы со слабо выраженной ротовой капсулой, пищевод снабжён бульбусом (у самок отсутствует). Иногда имеются рулёк и спикулы. Вульва самок позади середины тела. Амфи-дельфные. Размножаются яйцами, в которых могут находиться сформированные личинки. Паразиты млекопитающих, птиц, рептилий, амфибий.
Свободноживущее поколение. Ротовое отверстие с двумя трёхлопастными губами и сосочками в двух кругах. За ротовым отверстием следует небольшой вес-тибулюм. Пищевод с вздутиями в передней и задней частях. Самцы с изогнутым .хвостом, двумя спикулами, рульком и пре- и постанальными сосочками. Самки с прямым хвостом. Половой аппарат парный. Яйцекладущие или живородящие. Типовой вид - Strongyloides stercoralis (Bavay, 1876) Stiles et Hassall, 1902.
Несколько видов данного рода известны как паразитирующие у человека.
Strongyloides stercoralis (Bavay, 1876) Stiles et Hassall, 1902 (=Anguillula stercoralis Bavay, 1876 (личинки из фекалий); = Anguillula intestinalis Bavay, 1877 (взрослые самки из кишечника); =Pseudorhabditis stercoralis Perroncito, 1881 (сво-бодноживущие взрослые особи) (рис. 164, 165). Синонимы по: Muller, 2002. К. И. Скрябин с соавт (1954) приводят список из 11 синонимов данного вида.
История обнаружения этого вида (очень кратко). В июле 1876 г. врач из военного госпиталя в Тулоне Луи Норман (Louis Normand) обнаружил очень мелкого червя длиной 0.25 мм при копрологическом анализе французского солдата, проходившего службу в Кохинхине (юго-восточная часть Индокитайского п-ова) и отправленного во Францию 401
в связи с сильной диареей, получившей тогда название «кохинхинской диареи». В этом названии отразились и характерные признаки заболевания - диарея, и географическое место её происхождения - Кохинхина. Так в исторической географии принято называть юго-восточную часть п-ова Индокитай (вьетнамское название этой территории -Намбо). Червь был описан коллегой врача под названием Anguillula stercoralis Bavay, 1876. Видовое название: от латинского stercus - навоз, кал. Несколько месяцев спустя при аутопсии другого солдата, скончавшегося от кохинхинской диареи, в его фекалиях был обнаружен другой червь, длиной около 2 мм, описанный как Anguillula intestinalis Bavay, 1877. Тогда же при посевах кала были получены личинки, которых отнесли к А. intestinalis. В действительности в распоряжении исследователей были рабдитовидные и филяриевидные личинки, а также взрослые формы одного и того же вида, которого в 1879 г. сделали типовым в новом роде Strongyloides Grassi, 1879 - 5. intestinalis (Bavay, 1877). В 1902 г. была продемонстрирована идентичность Strongyloides intestinalis (=Anguillula intestinalis) и Anguillula stercoralis Bavay, 1876 и по праву приоритета типовым видом рода Strongyloides стал S. stercoralis (Bavay, 1876) Stiles et Hassall, 1902.
Рис. 164 Strongyloides stercoralis'. 4 - инвазионная личинка; Б -свободноживущая самка; В -свободноживущий самец; Г -паразитическая форма (из: Скрябин и др., 1954 - по: Yorke, Maplestone, 1926)
Очень мелкие черви с характерными чертами рода. Паразитические самцы длиной 0.7 и шириной 0.04 - 0.05 мм. Заострённый задний конец тела загнут на вентральную сторону, несёт две изогнутые
Рис. 165 Strongyloides stercoralis: А - передний конец самца; Б -область клоаки самца; В - хвост самца; Г - голова личинки (из: Скрябин и др., 1954 - по: Schuurmans-Stekhoven, 1928)
402
спикулы. Паразитические самки имеют узкое почти прозрачное тело, длиной 2.1 -2.7 и шириной 0.03 - 0.04 мм, на переднем конце тело слегка округлено, по направлению кзади равномерно суживается. Цилиндрический пищевод занимает около 1/3 длины тела. Вульва в задней половине тела. Парная матка содержит немногочисленные сегментированные яйца размерами 50 - 58 х 30 - 34 цгп.
Свободноживущие самцы похожи на самцов паразитического поколения, имеют размеры 0.8 - 1.0 х 0.04 - 0.05 мм. Свободноживущие самки меньше паразитических форм (0.9 - 1.7 х 0.05 - 0.085 мм) и напоминают свободноживущих нематод рода Rhabditis. Кутикула с тонкой исчерченностью. Вульва на середине тела. Размеры яиц 70 х 40 щп.
Паразитические самки откладывают ежедневно до 50 зрелых яиц. Яйца выделяются в подмукозный слой или же в просвет кишки, где личинки 1-й стадии, имеющие в длину 0.18 - 0.24 мм, покидают их и попадают во внешнюю среду с экскрементами хозяина (рис. 166).
Рис. 166 Схема жизненного цикла Strongyloides stercoralis (А - аутоинвазия)
Здесь они развиваются до стадии филяриевидной личинки, имеющей в длину 0.49 - 0.63 мм. Эти личинки или приостанавливают развитие до попадания в подходящего окончательного хозяина (гомогения), или же развиваются в самцов и самок свободноживущего поколения (гетерогония). Свободноживущее поколение обитает во влажной почве подобно сапрофитным нематодам и при благоприятных условиях может существовать там неопределённое время. Оплодотворённые самки свободноживущей генерации откладывают яйца с личинками 1-й стадии, которые 403
могут развиваться до следующего подобного поколения или же приостанавливать развитие на филяриоидной стадии. Известно, что филяриевидные личинки не питаются и сохраняют жизнеспособность в почве в течение нескольких недель.
Находящиеся во внешней среде инвазионные личинки проникают в хозяина через кожу (перкутанно) (McKerrow et al., 1990). В очень редких случаях личинки могут проглатываться с загрязнённой водой (пероральный путь заражения). Способность личинок проникать в кожу человека проверил на себе А. Лоосс в 1904 г. (цит. по: Grove, 1996). Проникшие через кожные покровы личинки, подобно личинкам аскарид и анкилостоматид, мигрируют с током крови в лёгкие, выходят в альвеолы, поднимаются по трахее до глотки и проглатываются со слюной, достигая таким путём кишечника - места окончательной локализации. Здесь личинки линяют и развиваются во взрослых червей паразитического поколения. В организме человека половозрелые самки локализуются в толще слизистой оболочки, главным образом в либеркюновых железах двенадцатиперстной кишки, а при интенсивной инвазии проникают в слизистую оболочку пилорической части желудка, всех отделов тонких кишок, слепой и ободочной кишки, панкреатические и жёлчные ходы (Ишмухаметов, Шабловская, 1968). Первые личинки в фекалиях человека появляются через 4 недели после попадания паразита в его организм. Если же личинки заглатываются с водой, то они обычно не совершают миграции. В этом случае первые личинки появляются в фекалиях через 17 дней после заражения.
Однако часть личинок 1-й стадии, вышедших в просвет кишечника из отложенных самкой яиц, при замедленной эвакуации каловых масс, попадая в толстую кишку, уже здесь развивается до 3-й стадии. Эти филяриевидные личинки мигрируют в воротную систему, - лимфатические сосуды или проникают в брюшную полость. При выходе из кишечника личинки могут внедряться также в кожу промежности и околоанальной области. В результате, не выходя во внешнюю среду, личинки развиваются в организме дефинитивного хозяина до половозрелого состояния, формируя самцов и самок, откладывающих яйца с рабдитовидными личинками. В итоге происходит процесс аутоинвазии (самозаражения) окончательного хозяина. Способность к размножению в дефинитивном хозяине приводит к необычайно высокой продолжительности заражения человека. В одной из публикаций сообщается об уникальной 65-летней хронической заражённости S. stercoralis 74-летней женщины (Leighton, MacSween, 1990).
5. stercoralis паразитирует в человеке, приматах; спонтанная заражённость зарегистрирована у кошек и собак. В эксперименте при нанесении филяриевидных личинок на кожу или введении per os успешнее заражались собаки, особенно щенки, чем кошки. Инвазия у собак длится от 1 до 7 месяцев, у кошек — от 2 до 7 недель, после чего наступает спонтанное выздоровление (Ишмухаметов, Шабловская, 1968).
Как сказано выше, впервые мир узнал о заражении человека S', stercoralis (пусть и под другим родовым названием) ещё в 19-м столетии. К слову, похожая история повторилась через 130 лет, но на этот раз пострадавшими оказались британские военнослужащие, а местом действия была одна из африканских стран -Сьерра-Леоне (Bailey et al., 2006). Здесь в трёхдневной спецоперации по освобождению заложников участвовали 153 военнослужащих и 86 человек персонала Королевских ВВС Великобритании, которые подвергались в этот период риску раз
404
личного рода заражениям. Спустя 6 недель после этой спецоперации у многих солдат проявились признаки желудочно-кишечного недомогания. После соответствующего обследования, среди прочих выявленных паразитов, у 9 % солдат обнаружилось заражение S. stercoralis.
Инвазия человека стронгилоидидами вызывает заболевание, «в ранней стадии которого наблюдаются диспепсический, болевой, астенический, кожный и лёгочный синдромы, в поздней стадии преобладают признаки поражения органов пищеварительной системы» (Ишмухаметов, Шабловская, 1968; стр. 587). Клинические проявления заболевания во многом зависят от места локализации нематод в организме человека. Известно, что у 15 - 30 % людей заболевание может быть асимптоматичным (Wehner, Kirsch, 1997).
В ранней стадии (до 10 суток), во время которой личинки мигрируют в организме хозяина, травмируя кожные покровы, кровеносные сосуды и лёгкие, инвазия проявляется лихорадкой, кожным зудом, крапивницей или папулёзными высыпаниями, местными отёками (Ly et al., 2003; Purvis et al., 1992; Smith et al., 1976; von Kuster, Genta, 1988). В лёгких появляются эозинофильные инфильтраты, развиваются кровоизлияния и пневмонические очаги (Wehner, Kirsch, 1997; Williams et al., 1988).
На следующей фазе инвазии, когда черви достигают половозрелого состояния, они разрушают слизистую оболочку кишечника, вызывают образование язв, питаются кровью. При лёгком течейии заболевания отмечаются тошнота, тупые эпигастральные боли; при этом стул, как правило, не изменён, но иногда наблюдаются запоры, которые могут чередоваться с лёгкими поносами. При выраженных проявлениях тошнота нередко сопровождается рвотой, возникают острые боли в эпигастрии или по всему животу. Диарея приобретает периодический характер - до 5-7 раз в сутки. У некоторых больных поражается печень (Gulbas et al., 2004). В периферической крови у большинства больных выявляется эозинофилия - до 70 -80 % (Мяндина, Тарасенко, 2013; Gulbas et al., 2004).
При тяжёлых формах заболевания диарея становится постоянной, стул приобретает гнилостный запах и содержит остатки непереваренной пищи. Наступает обезвоживание организма, тяжёлая вторичная анемия, кахексия. У больных отмечаются головная боль, головокружение, повышенная умственная утомляемость, неврастенические и психастенические синдромы. Наблюдаются симптомы дуоденита, энтероколита, реже ангиохолита. При отсутствии лечения заболевание приобретает длительное хроническое течение. Иногда могут наблюдаться тяжёлые, заканчивающиеся летально клинические проявления, особенно у иммунодепрессивных людей (German et al., 1992; Kosmadakis et al., 2010; Reddy, Swamalata, 2005; von Kuster, Genta, 1988).
В целом, следует подчеркнуть, что заболевание протекает длительно, с периодами обострений и ремиссий.
В Международной классификации болезней 10-го пересмотра (МКБ-10) (версия 2016 г.) в «Классе I. Некоторые инфекционные и паразитарные болезни (А00-В99)», в блоке «В65-В83 Гельминтозы» выделен раздел «В78 Стронгилоидоз» с соответствующими рубриками: В78.0 Кишечный стронгилоидоз; В78.1 Кожный стронгилоидоз; В78.7 Диссеминированный стронгилоидоз; В78.9 Стронгилоидоз неуточнённый (www.gastroscan.ru).
405
Диагноз ставят на основании обнаружения личинок (реже яиц) в дуоденальном содержимом и в фекалиях, обработанных по методу Бермана; в миграционной стадии иногда удаётся выявить в мокроте личинок и взрослых червей (Мяндина, Тарасенко, 2013; Wehner, Kirsch, 1997). Исследованию на инвазию стронгилоиди-дами подлежат также все больные с высокой эозинофилией крови.
Лечение проводят ивермектином, левамизолом, тиабендазолом (Руководство по инфекционным болезням. - 2000). Лекарством выбора является ивермектин (Ardis, 2009). Его принимают по 200 мг кг'1 массы тела сут1 в течение 2 дней. Альтернативными лекарствами считаются альбендазол и тиабендазол. Последний показан при мигрирующих формах стронгилоидозиса. Назначают в дозе 25 мг кг'1 массы тела каждые 12 ч в течение 2 дней после приёма пищи (при массе тела более 54 кг разовая доза составляет 1.5 г). Максимальная суточная доза не более 3 г. Второй курс лечения может быть назначен по показаниям через неделю. Тиабендазол ввели в практику лечения с 1962 г., но, по мнению медицинских работников, его никак нельзя считать панацеей от этого заболевания (Grove, 1996). Левамизол (декарис, аскаридол, тенизол) назначают на ночь в одной дозе 120 - 150 мг взрослому человеку, детям по 2.5 мг кг'1 массы тела. Повторный курс лечения проводят через неделю.
При своевременном лечении прогноз обычно благоприятный.
Несколько лет назад группа авторов провела скрининг 821 работы, опубликованных на английском, французском, итальянском и испанском языках с января 1991 по апрель 2011 гг., в которых описывались случаи заражения людей стронги-лоидесами (Buonfrate et al., 2013). Уже сама цифра - 821 - свидетельствует как о широком распространении заболевания, так и о том внимании, которые уделяется данному паразиту. Помимо всех прочих целей, которые поставили перед собой авторы, они попытались выяснить регионы, чьё население наиболее подвержено риску заражения этими гельминтами. Оказалось, что более всего случаев за эти 20 лет, более двух третей, пришлось на Индию, Аргентину и Бразилию. И если раньше полагали, что заражение встречается в основном в странах тропических и субтропических широт (Grove, 1996; Wehner, Kirsch, 1997), то теперь к ним добавились и страны умеренного климата - Бельгия, Франция, Германия, Нидерланды, Швейцария, Румыния, Канада и многие другие. Справедливости ради следует отметить, что во многих случаях заражение в столь нетипичных странах отмечается обычно у иммигрантов или беженцев из эндемичных по данному заболеванию регионов (La-gace-Wiens, Harding, 2007; Sampson, Grove, 1987).
По разным оценкам, в мире стронгилоидидами поражено от 30 до 100 млн. человек (Ardis, 2009; Grove, 1996).
Strongyloides fiilleborni (von Linstow, 1905). Нематода названа в честь Ф. Фюллеборна, известного своими работами в области медицинской и ветеринарной паразитологии. Вид отличается от S. stercoralis, прежде всего, тем, что во внешнюю среду попадают не личинки, а яйца, содержащие личинок, и у паразита отсутствует способность к аутоинвазии.
Встречается у шимпанзе, жёлтого бабуина и ряда других нечеловекообразных приматов в Африке и Азии. Отмечен у человека в Африке к югу от Сахары и в Папуа-Новой Гвинее. В 2000-м году появилось сообщение об обнаружении этого вида в Перу (Iwashita et al., 2000).
406
Что касается встречаемости Strongyloides fullebomi у местных жителей в Папуа-Новой Гвинее, то здесь распространён его подвид -S.f. kellyi Viney, Ashford et Bamish, 1991, от заражения которы\ь-более всего страдают дети, причём в возрасте до пяти лет (Viney et al., 1991). Заболевание проявлялось вздутием живота, расстройством дыхания, генерализованным отёком, нарушениями функций желудочно-кишечного тракта (Vince et al., 1979). В 1980 - 1990-е годы в стране наблюдалась смертность двухмесячных малышей, вызванная инвазией этим гельминтом (Ashford et al., 1992). При специальном обследовании детишек в возврате до одного года в 1 мл стула у них обнаруживалось от 100 до 98300 яиц нематоды (King, Mascie-Taylor, 2004).
К концу 20-го столетия род Strongyloides насчитывал более 50 валидных видов (Grove, 1996). Достоверно паразитирующими у человека называют два описанных выше вида - S. stercoralis и S. fullebomi с подвидом 5. f kellyi. В эксперименте была показана также возможность встречаемости у людей S. procyonis Little, 1965 (Little, 1965) и S. ransomi Schwartz et Alicata, 1930 (Kotlan, Vajda, 1934). Первый из них паразитирует у енота, второй - у свиней, в том числе домашних, и у кроликов. К слову, попытки других исследователей повторить опыты по заражению человека S. ransomi не увенчались успехом (Grove, 1996). Столь же безуспешными были попытки вырастить в организме человека половозрелых червей других видов Strongyloides - S. canis Brumpt, 1922 (паразит собак), S. cebus Darling, 1911 (паразит обезьян, в том числе капуцина), S. felis (Chandler, 1925) (известен у кошек, включая домашних), S. myopotami Artigas et Pacheco, 1933 (описан от грызунов и хищников, Бразилия), S. planiceps Rogers, 1943 (отмечен в кошках, включая домашних, собаках, мышах) и S. simiae Hung et Hoeppli, 1923 (паразит приматов) (Speare, 1989).
Тем не менее, в монографии (Muller, 2002) подчёркивается, что, помимо S. stercoralis и 5. fullebomi, у человека могут встретиться личинки 11 видов Strongyloides, включая перечисленных выше: Strongyloides cebus, S. canis, S. felis, S. myopotami, S papillosus (Wedl, 1956) (часто отмечается у домашних овец; известен у коз, крупного рогатого скота, кроликов, диких жвачных), S. planiceps, S. procyonis, S. ransomi, S. ratti Sandground, 1925 (обычен у грызунов, в том числе у серой крысы), 5. simiae и S. westeri Ihle, 1917 (паразит лошади, зебры, свиньи).
Цитируемая литература
Ишмухаметов А. И., Шабловская Е. А. XXXIII. Стронгилоидозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 587 - 595. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. проф. П. Г. Сергиев).
Мяндина Г. И., Тарасенко Е. В. Медицинская паразитология. Учебное пособие. - М.: Практическая медицина, 2013. - 256 с.
Руководство по инфекционным болезням. - Под ред. Ю. В. Лобзина. - Санкт-Петербург, 2000. — Часть 1.-С. 121-122.
Скрябин К. И, Шихобалова Н. П., Соболев А. А., Парамонов А. А., Судариков В. Е. Камалланаты, раб-дитаты, тиленхаты, трихоцефаляты, диктиофиматы и распределение паразитических нематод по хозяевам // Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1954.-4.-С. 172-191.
Ardif N. [An overview of Strongyloides stercoralis and its infections] // Mikrobiol. Bui. - 2009. - 43, l.-P. 169 - 177. (Article in Turkish).
Ashford R. W., Barnish G., Viney M. E. Strongyloides fuelleborni kellyi: infection and disease in Papua New Guinea//Parasitol. Today. - 1992. -8, 9.-P. 314-318.
407
Bailey M. S., Thomas R, Green A. D., Bailey J. W., Beeching N. J. Helminth infections in British troops following an operation in Sierra Leone 11 Trans. R. Soc. Trop. Med. Hyg. - 2006. - 100, 9. - P. 842 - 846.
Buonfrate D„ Requena-Mendez A., Angheben A., Munoz J., Gobbi F. et al. Severe strongyloidiasis: a systematic review of case reports//BMC Infect. Dis.-2013. - 13:78. DOI: 10.1186/1471-2334-13-78.
De Ley P., Blaxter M. Systematic position and phylogeny I The biology of nematodes. - Ed. D. L. Lee. -London, N. Y.: Taylor & Francis, 2002. - P. 1 - 59.
GermanJ. C, Flores J. H, Chiesura G., Ruiz E. M., Flores S. S., Laudanna A. A. [Fatal strongyloidiasis in an immunodepressed patient following renal transplantation] I I Revista do Hospital das Clinicas. - 1992. - 47, 1.-P.31 -33.
Grove D. I. Human strongyloidiasis 11 Adv. Parasitol. - 1996. - 38. - P. 252 - 309.
Gulbas Z, Kebapci M., Pasaoglu O., Vardareli E. Successful ivermectin treatment of hepatic strongyloidiasis presenting with severe eosinophilia // South Med. J. - 2004. - 97, 9. - P. 907 - 910. 10.1097/0l.SMJ. 0000139936.20116. A7.
Iwashita A. T, Ramos M. C., Casanova R. T, Mas-Coma S. et 4 authors. Strongyloides fuelleborni: reporte del primer caso clinic en Peru // Diagnostico. - 2000. - 39, 4. - P. 199 - 203.
King S. E, Mascie-Taylor C. G. Strongyloides fuelleborni kellyi and other intestinal helminths in children from Papua New Guinea: associations with nutritional status and socioeconomic factors //PNG Med. J. -2004.-47, 3-4.-P. 181-191.
Kosmadakis G., Georgoulias C.t Filiopoulos V., Stefanou I., Smirloglou D., Michail S. Lethal Strongyloides stercoralis superinfection in an immunocompromised patient // Ren. Fail. - 2010. - 32, 6. - P. 750 - 752. 10.3109/0886022X.2010.486490.
Kotlan S, Vajda T. Strongyloides-tanulmanyok. Allatorvosi // Lapok. - 1934. - 57. - P. 198 - 205
Lagace-Wiens P. R., Harding G.K. A Canadian immigrant with coinfection of Strongyloides stercoralis and human T-lymphotropic virus 1 // Can. Med. Assoc. J. - 2007. - 177, 5. - P. 451 - 453.
Leighton P. M., MacSween H. M. Strongyloides stercoralis: the cause of an urticarial-like eruption of 65 years’ duration 11 Arch. Int. Med. - 1990. - 150, 8. - P. 1747 - 1748.
Little M. D. Dermatitis in a human volunteer infected with Strongyloides of nutria and raccoon 11 Am. J. Trop. Med. Hyg. - 1965. -14. - P. 1007 - 1009.
LyM. N, Bethel S. L., Usmani A. S, Lambert D. R. Cutaneous Strongyloides stercoralis infection: an unusual presentation 11 J. Am. Acad. Dermatol. - 2003.-49 (2 Suppl. Case Reports). - P. 157 - 160.
McKerrow J.H., Brindley P., Brown M., Gam A.A. et al. Strongyloides stercoralis: identification of a protease that facilitates penetration of skin by the infective larvae H Exp. Parasitol. - 1990. - 70. - P. 134 - 143.
Purvis R. S., Beightler E. L.t Diven D. G., Sanches R. L., Tyring S. K. Strongyloides hyperinfection presenting with petechiae and purpura // Int. J. Dermatol. - 1992. - 31. - P. 169-171.
Reddy I. S, Swarnalata G. Fatal disseminated strongyloidiasis in patients on immunosuppressive therapy: report of two cases // Indian J. Dermatol. Venereol. LeproL - 2005. - 71, 1. - P. 38 - 40. 10.4103/0378-6323.13785.
Sampson L. A., Grove D. 1. Strongyloidiasis is endemic in another Australian population group: Indochinese immigrants 11 Med. J. Austral. - 1987. - 146. - P. 580 - 582.
Shuurmans-Stekhoven J. H.jun. Researches on Nemas and their larvae. III. Strongyloides stercoralis Bavay // Ztschr. f. Parasitenk. - 1928. - 1, 2. - P. 231 - 261.
Smith J. D., Goette D. K, Odom R. B. Larva currens. Cutaneous strongyloidiasis // Arch. Dermatol. - 1976. -112, 8.-P. 1161-1163.
Speare R. Identification of species of Strongyloides / Strongyloidiasis: a major roundworm infection of man. - D. I. Grove, ed. - London, Taylor & Francis, 1989. - P. 11-83.
Vince J. D., Ashford R. W., Gratten M. J., Bana-Koiri J. Strongyloides species infestation in young infants of papu, New Guinea: association with generalized oedema //P N G Med. J. - 1979. - 22, 2. - P. 120 - 127.
Viney M. E., Ashford R. W., Barnish G. A taxonomic study of Strongyloides Grassi, 1879 (Nematoda) with special reference to Strongyloides fuelleborni^on linstow, 1905 in man in Papua New Guinea and the description of a new subspecies H Syst. Parasitol. - 1991. - 18, 2. - P. 95-104. doi: 10.1007/BF00017661.
von Kuster L. C., Genta R. M. Cutaneous manifestations of strongyloidiasis И Arch. Dermatol. - 1988. - 124, 12.-P. 1826- 1830.
Wehner J. H„ Kirsch С. M. Pulmonary manifestations of strongyloidiasis 11 Semin. Respir. Infect. - 1997. -12,2.-P. 122- 129.
Williams J., Nunley D., Dralle W., Berk S. L., Verghese A. Diagnosis of pulmonary strongyloidiasis by bronchoalveolar lavage // Chest. - 1988. - 94. - P. 643 - 644.
Yorke W., Maplestone P. A. The nematodes parasites of vertebrates. - London, 1926. - 536 pp.
408
Семейство Syphaciidae Skrjabin et Schikhobalova, 1951
Описание (по: Скрябин и др., 1951). Ротовое отверстие окружено губами, иногда пластинками. Головная везикула, латеральные и хвостовые крылья имеются или отсутствуют. Передний конец самки у некоторых видов со своеобразной кутикулярной оборочкой. Хвостовой конец самцов заострённый или конический, иногда с остриём. На нём могут быть медиовентральные гребни, выпуклости с плоской вершиной, серия бляшек. Спикула одна. Губернакулюм имеется. Типовой род-Syphacia Seurat, 1916*.
Сифацииды - геогельминты, т.е. их жизненный цикл не связан с промежуточными хозяевами (Семёнова, 1968).
Один из представителей типового рода, а именно Syphacia obvelata (Rudolphi, 1802), являющийся, в свою очередь, типовым в названном роде, был обнаружен у детей на Филиппинах (Muller, 2002).
Род Syphacia Seurat, 1916
Описание (по: Скрябин и др., 1951). Ротовое отверстие окружено тремя губами. Имеются маленькие шейные крылья. Фаринкс отсутствует. Пищевод булавовидный, в задней части с бульбусом, отделённым от остальной части пищевода сужением и снабжённым клапановидным аппаратом. Вентральная поверхность тела самца с 2 - 3 кутикулярными медиовентральными гребнями. Задний конец позади клоаки срезан и заканчивается длинным заострённым хвостом. Вдоль передней части хвоста тянутся узкие крылья. Имеются две пары пре- и одна пара постанальных сосочков. Спикула относительно длинная. Губернакулюм расположен поперечно. Хвост самок длинный, заострённый. Вульва в передней части тела. Вагина короткая. Матка одна, очень длинная. Яичников два. Яйцекладущие. Паразиты грызунов. Типовой вид - Syphacia obvelata (Rudolphi, 1802) Seurat, 1916.
Syphacia obvelata (Rudolphi, 1802) Seurat, 1916 (=Fusaria obvelata Rudolphi, 1802; Ascaris obvelata Rudolphi, 1802; Oxyuris obvelata Bremser, 1819) (рис. 167). Синонимы приведены по работе: Скрябин и др., 1951. Вид - космополит.
Головной конец тела овальной формы, папиллы расположены в одном круге. Самцы длиной 1-1.6, самки 4-6 мм. Яйца веретеновидной формы и с одной совершенно плоской стороной; размеры яиц 115 - 140 х 35 цт. Ко времени яйцекладки яйца уже содержат рабдитовидную личинку (Семёнова, 1968).
Паразит слепой кишки мышей и крыс, как в естественных, так и в экспериментальных условиях. К примеру, в Самарской области, на территории Самарской Луки, паразита обнаружили у мышей - домовой, полевой, лесной, жёлтогорлой, а также у серой крысы, заражённость которых колебалась от 16 до 60 %, а индекс обилия - от 0.6 до 11.3 (Кириллова, Кириллов, 2011). О заражении этим гельминтом мышей малой лесной, домовой и жёлтогрудой в Воронежском заповеднике пишут А. Э. Долгих с колл. (2014). В агроценозе Красноперекопского района Республики Крым серая крыса поражена им на 17.1 % (Коваленко, Стрюков, 2013).
1 В информационной сводке «Медицинская паразитология. ...» (www.worms-info.ru) данный род включён в состав семейства Oxyuridae.
409
Рис. 167 Syphacia obvelata'. A - самец, вид сбоку; В - хвостовой конец самца, вентрально; С - задний конец самки, вид сбоку; D - передний конец самки; Е - яйцо с развивающейся личинкой (из: Faust, 1949 - по: Yorke, Maplestone, 1926)
Известно всего три случая обнаружения S. obvelata у детей на Филиппинах (Muller, 2002). Инвазия человека, скорее всего, может происходить в результате случайного контакта с тушкой заражённого грызуна, погибшего по той или иной причине (Faust, 1949).
Несмотря на широкое распространение S. obvelata среди диких и синатроп-ных грызунов, клинические аспекты заражения им не изучены даже применительно к обычным дефинитивных хозяевам этого паразита.
Цитируемая литература
Долгих А. Э., Коротких В. В., Ромашов Б. В. Фауна сифаций (Nematoda, Syphaciidae) и заражённость грызунов этими нематодами / Молодёжный вектор развития аграрной науки: Мат. 65-й научн. сту-денч. конф. - Воронеж, 2014. - С. 238 - 243.
Кириллова Н. Ю., Кириллов А. А. Нематоды (Nematoda) мелких млекопитающих Самарской Луки // Известия Самарского НЦ РАН. - 2011. - 13,1. - С. 114-122.
Коваленко И. С., Стрюков А. А. Видовой состав гельминтов серой крысы {Rattus norvegicus) в Крыму И Экосистемы, их оптимизация и охрана. -2013.-9 (28). - С. 177 - 184.
Семёнова Н. Е. Глава XXVII. Энтеробиоз и сифачиоз / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 581 - 587. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Скрябин К И., Шихобалова Н. П., Мозговой А. А. Оксиураты и аскаридаты // Определитель паразитических нематод. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1951.-2.-631 с.
Faust Е. С. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 465 - 466.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - 300 pp.
Yorke W., Maplestone P. A. The nematodes parasites of vertebrates. - London, 1926. - 536 pp.
410
Семейство Thelaziidae Skrjabin, 1915
Описание (no: Faust, 1949). Губы отсутствуют. Ротовая капсула имеется. Хвостовой конец самца заметно изогнут, с крыльями или без них, обычно с пре- и постанальными папиллами. Яйца при откладке полностью сформированы. Взрослые особи живут в глазной, носовой или ротовой полостях млекопитающих и птиц, в воздушных мешках птиц, в кишечнике рыб. Типовой pojx-Thelazia Bose, 1819.
Семейство объединяет 7 родов с 82 видами и входит в состав отряда Spiruri-da (Hodda, 2011). В некоторых источниках (напр., De Ley, Blaxter, 2002) семейство включено в состав отряда Rhabditida.
У человека известно паразитирование двух видов из рода Thelazia.
Род Thelazia Bose, 1819
Синоним: Thelazius Bose, 1819
Описание (по: Baylis. 1939). Кутикула с относительно грубой поперечной исчер-ченностью или кольчатостью, выступающие задние края которых придают телу в профиль зазубренный вид. Ротовая капсула, как правило, более или менее бокаловидная, передний край вырезан в виде шести фестонов. Хвост самца короткий и тупой, без крыльев. Преанальные сосочки многочисленные, часто имеется непарная преклоакальная папилла. Постанальных сосочков от 2 до 4 пар. Спикулы неравные. Дополнительная пластинка отсутствует. Хвост самки тупо закруглён. Вульва в передней части тела. Ветви матки параллельные, идущие кзади. Живородящие. Взрослые черви паразитируют в слёзных протоках или под веками глаз млекопитающих (иногда в водянистой влаге глаза), или под мигательными перепонками птиц. Типовой вид - Thelazia rhodesii (Desmarets, 1828).
Как уже упомянуто, у человека известны два вида Thelazia - Т. califomiensis Price, 1930 и Т. callipaeda Railliet et Henry, 1910. Оба паразита получили название eyeworms - глазные черви.
Thelazia califomiensis Price, 1930. Ф. Аллертон (Allerton, 1929) обнаружил в глазу собаки из района Лос-Анджелеса (Калифорния, США) нематод, которых Dr. Ackert определил как Thelazia callipaeda (по: Bowman et al., 2002). Однако Э. Прайс (Price, 1930) распознал в этом материале представителя нового вида и описал его под названием Т. califomiensis. Видовое название связано с регионом первого обна-
ружения паразита: califomiensis - калифорнийский.
Описание (по: Bowman et al., 2002) (рис. 168). Черви от белого до кремового цвета. Самцы длиной 12 -13 мм. Спикулы 1.5 - 1.7 и 0.15 - 0.19 мм. Самки длиной 15-17 мм. Вульва позади уровня соединения пищевода с кишечником, в 0.8 - 1.0 мм от переднего конца тела. Яйца в матке размером 52 х 29 pm.
Рис. 168 Передний конец тела Thelazia (из: Bowman et al., 2002)
Жизненный цикл Т. califomiensis изучен и в эксперименте, и в естественных условиях (Burnett et al., 411
1957; Weinmann et al., 1974). Яйца откладываются и развиваются в конъюнктивальных и слёзных мешках млекопитающих. Личинка 1 -й стадии, находящаяся в яйцевой оболочке, попадает в муху (виды Fannia), когда та питается выделениями из заражённого глаза. В насекомом личинка развивается до 3-й стадии, а затем мигрирует в его ротовой аппарат (весь процесс длится от 2 до 4 недель). Когда насекомое садится на глаз животного, личинка проникает в его конъюнктивальный и/или слёзный мешок, где и превращается во взрослую особь.
Т. californiensis встречается на западе Северной Америки в основном у собак, а также у кошек, овец, оленей.
У человека регистрируется чрезвычайно редко, и только в США - в Калифорнии и Юте (Chiapella, 1974; Doezie et al., 1996; Freidman, 1951; Hosford et al., 1942; Kirschner et al., 1990; Knierim, Jack, 1975; Kofoid, Williams, 1935; Kofoid et al., 1937; Lee, Parmelee, 1958). По состоянию на 2003 г., подобных случаев насчитывалось немногим более 10 (Ashford, Crewe, 2003), а заражение человека было связано со случайным попаданием в его глаз мухи или с попыткой насекомого сесть на глаз. К примеру, описан случай заражения человека после попадания в его глаз Маленькой мухи при езде на мотоцикле (Knierim, Jack, 1975).
Thelazia callipaeda Railliet et Henry, 1910 (=Filaria palpebralis sensu Houghton, 1917; Filaria cicrumocularis sensu Ward, 1918) (рис. 169). Вид впервые описан на материале из глаз китайской собаки (Chinese dog). Видовое название звучит довольно романтично: calli - прекрасный и paeda - дитя, ребёнок; callipaeda - «прекрасное дитя» относилось к «прекрасной личинке внутри самки паразита» (и паразитологи бывают романтиками!).
Рис. 169 Thelazia callipaeda: А - передний конец тела, вид сбоку; В - задний конец самца, вентрально (из: Baylis, 1939-по: Hsil, 1933)
Описание (по: Гефтер, 1968; Baylis, 1939; Bowman et al., 2002; Faust, 1928, 1949; Hsil, 1933). Черви от белого до кремового цвета. Кутикула с тонкой исчер-ченностью, края исчерченности хорошо заметны. Голова с внутренним кольцом из 6 маленьких сосочков и наружным кольцом из 2 латеральных и 2 пар субдорсальных и субвентральных сосочков. Ротовая капсула бокаловидная. Самцы длиной 4.5 - 14.3 и шириной 0.27 - 0.45 мм. Хвост тупой, с 8 - 10 парами преанальных и 5 па-412
рами постанальных папилл. Левая спикула длиной 1.3 - 2.42 мм, с заострённой верхушкой, правая - 0.12 - 0.16 мм, с тупой верхушкой. Самки размерами 6.25 -18.3 х 0.3 - 0.8 мм. Хвост тупоконечный. Вульва впереди уровня соединения пищевода с кишечником. Яйца размером 46 - 62 х 31 - 46.5 pm.
Жизненный цикл Т callipaeda изучен детально (Козлов, 1962, 1965; Otranto et al., 2005; Wang Z., Yang, 1993; Wang Z. et al., 1990). Яйца co сформированными личинками откладываются самками в слёзную жидкость дефинитивных хозяев. Личинка 1 -й стадии попадает к мухам из семейства Drosophilidae во время их питания на глазу животного. Ползая у внутреннего угла глаза животного, муха заглатывает яйца вместе со слёзной жидкостью. В насекомом в течение 3 недель личинка развивается до 3-й, инвазионной стадии. При этом у личинок половая система - и семенники, и обе ветви матки - намного более развиты, чем это обычно имеет место у личинок аналогичной стадии других нематод. Инвазионные личинки попадают к дефинитивному хозяину в момент, когда поверхность сосательной лопасти хоботка мухи соприкасается с увлажнённой поверхностью глаза. Минимальная продолжительность жизни паразита в дефинитивном хозяине - 9 месяцев (Козлов, 1965).
Т. callipaeda поселяется в конъюнктивальном мешке и под третьим веком глаза животных, чаще всего собак и лисиц; среди хозяев паразита также волки, песцы, енот, енотовидная собака, куница каменная, кошки, дикий европейский кролик, обезьяны. Паразит широко распространён в Евразии, а заражённость животных в некоторых регионах достигает высоких показателей. Так, в Испании из 456 обследованных собак паразита выявили у 39.9 % особей (Fuentes et al., 2012).
Заражение человека Т. callipaeda регистрируется намного чаще, чем Т. cali-forniensis. Впервые паразита нашли у человека в 1917 г. в Пекине: нематоду извлекли из глаза кули. С тех пор подобные случаи были зафиксированы во многих странах Европы и Азии: в Сербии (Tasic-Otasevic et al., 2016), Хорватии (Paradzik et al., 2016), Испании (Fuentes et al., 2012), Италии и Франции (Otranto, Dutto, 2008), Бангладеш (Akhanda et al., 2013; Hossain et al., 2011), Индии (Handique et al., 2014; Mahanta et al., 1996; Nath et al., 2008), Китае (Hsti, 1933; Lu, 1996; Shi et al., 1988; Wang S. et al., 2014), Корее (Choi et al., 1977; Hong et al., 1988; Ryu et al., 1987; Sohn et al., 2011), Вьетнаме (Nguyen et al., 2012), Таиланде (Bhaibulaya et al., 1970; Viriyavejakul et al., 2012), Индонезии (Kosin et al., 1989), Японии (Arizono et al., 1976), на Тайване (Yang et al., 2006), в России (Козлов, 1960, 1963). В скобках замечу: .процитирована только небольшая часть опубликованных источников по данному вопросу. Случаи заражения людей приурочены в основном к зонам высокой заражённости животных, в частности собак, включая домашних (Fuentes et al., 2012).
По состоянию на 2000 г., в мире было известно более 250 случаев заражения людей телязиями, причём их большая часть - в Китае (Koyama et al., 2000). В другой публикации можно найти сведения о том, что в Китае с 1980 по 2006 гг. зарегистрировали 700 аналогичных случаев (Shen et al., 2006). В 21-м столетии, судя по публикациям, география находок Т. callipaeda у человека значительно расширилась.
Клинически инвазия проявляется ощущением инородного тела в глазу, покраснением, обильным слёзотечением, отёчностью, светобоязнью; в течение нескольких дней развиваются конъюнктивит, кератит, блефарит с гноетечением и об
413
разованием корок, нередко наблюдается слипание век. Запущенные случаи могут привести к частичной или полной потере зрения.
Паразитов удаляют тонким пинцетом под местной анестезией, с последующей обработкой поражённого места 2 - 3 % раствором борной кислоты. Удаляют нематод также промыванием глаза 2 % раствором новокаина. Зачастую пациенты сами извлекают червей, обнаружив их в слёзной жидкости или под веком (см., напр., Viriyavejakul et al., 2012).
Итак, единственный путь попадания телязий к человеку - через насекомых, зачастую в изобилии вьющихся вокруг лица в жаркий летний день.
Цитируемая литература
Гефтер В. А. Глава XXXIV. Прочие нематодозы и казуистические находки нематод у человека / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 648 - 665.
Козлов Д. П. Случай обнаружение Thelazia callipaeda Railliet and Henry, 1910 у человека в СССР И Тезисы докл. научн, коиф. ВОГ. - М., 1960. - С. 56.
Козлов Д. П. Расшифровка цикла развития нематоды Thelazia callipaeda - паразита глаз человека и плотоядных млекопитающих // Докл. АН СССР. - 1962. - 142, 3. - С. 732 - 733.
Козлов Д. П. Первый случай обнаружения Thelazia callipaeda Railliet et Henry, 1910 у человека на территории СССР И Тр, Гельм, лаб. АН СССР. - 1963. - 13. - С. 75 - 77.
Козлов Д. 77. Эколого-фаунистическое изучение гельминтов канид (Canidae) Дальнего Востока и расшифровка жизненного цикла нематоды : Автореф. дисс...канд. биол. наук. - М., 1965. - 18 с.
Akhanda А. И., Akonjee A. R., Hossain М. М., Rahman М. A., Mishu F. A. et al. Thelazia callipaeda infestation in Bangladesh: a case report // Mymensingh Med. J. - 2013. - 22, 3. - P. 581 - 594.
Allerton F. R. Worm parasites on conjunctiva in dog // North. Am. Vet. - 1929. - 10. - P. 56.
Arizona N., Yopshida Y., Kondo K, Kuimoto H. et al. Thelazia callipaeda from man and dogs in Kyoto and its scanning electron microscopy // Jap. J. Parasitol. - 1976. - 25. - P. 402 - 408. (in Japanese).
Ashford R. W.t Crewe W. The parasites of Homo sapiens: An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
Baylis H. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Bhaibulaya M., Prasetsilpa S, Vajrasthira S. Thelazia callipaeda Railliet and Henry, 1910, in a man and dog in Thailand //Am. J. Trop. Med. Hyg. - 1970. - 19. - P. 476 - 479.
Bowman D. D.t Hendrix С. M., Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-467 pp.
Burnett H. S., Parmelee W. E., Lee R. D., Wagner E. D. Observations on the life cycle of Thelazia californiensis Price, 1930 // J. Parasitol. - 1957. - 43. - P. 433.
Chiapella К J. Verminous ophthalmia// West. J. Med. - 1974. - 120, 6. - P. 500.
Choi W. Y., Lee W. K, Lee O. R., Shin H. H, Shin N. Y. A case of human thelaziasis in Seoul П Korean J. Parasitol. - 1977. - 15, 2. - P. 127 - 132.
De Ley P.t Blaxter M. Systematic position and phylogeny I The biology of nematodes. - Ed. D. L. Lee. -London, N. Y.: Taylor & Francis, 2002. - P. 1 - 59.
Doezie A. M., Kudus R. W., Aldeen W., Hale D., Sith D.R., Mamalis N. Thelazia californiensis conjunctival infestation // Ophthal. Surg. Lasers. - 1996. - 27, 8. - P. 716 - 719.
Faust E. C. Studies on Thelazia callipaeda Railliet & Henry, 1910 // J. Parasitol. - 1928. - 15. - P. 75 - 86. Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 492 - 496. Freidman M. Thelaziasis der Conjunctiva, ein Nachtrat // Ophthalmologies - 1951.- 122. - P. 252 - 254. Fuentes I, Montes Saugar J. M., Latrofa S, Garate T, Otranto D. Thelaziosis in humans, a zoonotic infection, Spain, 2011 // Emerg. Infect. Dis. - 2012. - 18, 12. - P. 2073 - 2075. doi: 10.3201/eid 1812.120472.
Handique A. K, Tamuli A., Khan A. M. Ocular thelaziasis in a 7-month-old infant // Indian J. Med. Microbiol.-2014.-32, l.-P. 84-86. doi: 10.4103/0255-0857.124333.
Hong S. T, Lee S. H, Kim S. I. A human case of Thelazia callipaeda infection with reference to its internal structures // Korean J. Parasitol. - 1988. - 26, 2. - P. 137 - 140.
Hosford G. N., Stewart M. A., Sugarman E. I. Eye worm (Thelazia californiensis) infection in man // Arch. Ophthalmol. - 1942. - 27. - P. 1165 - 1170.
414
Hossain M. /., Hossain M. A., Nahar L., Hossain M. M., Mondal A. S. et al. Human thelaziasis in Bangladesh // Mymensingh Med. J. - 2011. - 20, 1. - P. 128 - 130.
Hsu H. F. On Thelazia callipaeda Railliet & Henry, 1910, infection in man and dog 11 Arch. Schijfs- u. Tro-penhyg. - 1933. - 37. - P. 363 - 369.
Kirschner В. I., Dunn J. P., Ostler H B. Conjunctivitis caused by Thelazia californiensis 11 Am. J. Ophthalmol. - 1990. - 110. - P. 573 - 574.
Knierim R., Jack M. K. Conjunctivitis due to Thelazia californiensis 11 Arch. Ophthalmol. - 1975. - 93. - P. 522-523.
Kofoid C A,, Williams O. L. The nematode Thelazia californiensis as a parasite of the eye of man in California// Arch. Ophthalmol. - 1935. - 13. - P. 176- 180.
Kofoid C. A., Williams O. L, Veale N. C. Thelazia californiensis, a nematode eye worm of dog and man, with a review of the Thelazias of domestic animals 11 Univ. Calif. Publ. Zool. - 1937. - 41. - P. 225 - 234.
Kosin E., Kosman M. L., Depary A. A. First case of human thelaziasis in Indonesia // Southeast Asian J. Trop. Med. Publ. Health. - 1989. - 20. - P. 233 - 236.
Koyama Y., Ohira A., Kono T, Yoneyama T, Shiwaku K. Five cases of thelaziasis// Brit. J. Ophthalmol. -2000.-84, 4. - P. 441. doi: 10.1136/bjo.84.4.439.
Lee R. D., Parmlee W. E. Thelaziasis in man // Am. J. Trop. Med. Hyg. - 1958. - 7. - P. 427 - 428.
Lu Y. F. An infant with Thelazia callipaeda infection H Chin. J. Parasitol. Parasit. Dis. - 1996. - 14. -P. 138.
Mahanta J., Alger J., Bordoloi P. Eye infestation with Thelazia species // Indian J. Ophthalmol. - 1996. - 44, 2.-P. 99-101.
Nath R, Narain K, Saikia L.t Pujari B. S., Thakuria B., Mahanta J. Ocular thelaziasis in Assam: a report of two cases//Indian J. Pathol. Microbiol.-2008.-51, l.-P. 146- 148.
Nguyen И D., Thanh H. L., Chai J.Y. The first human case of Thelazia callipaeda infection in Vietnam И Korean J. Parasitol. - 2012. - 50. 3. -P. 221 -223. doi: 10.3347/kjp.2012.50.3.221.
Otranto D., Dutto M. Human thelaziasis, Europe // Emerg. Infect. Dis. - 2008. - 14, 4. - P. 647 - 649.
Otranto D., Lia R. P., Cantacessi C., Testini G., Troccoli A. et al. Nematode biology and larval development of Thelazia callipaeda (Spirurida, Thelaziidae) in the drosophilid intermediate host in Europe and China // Parasitology. - 2005. - 131, 6. - P. 847 - 855.
Paradzik M. T, Samardzic K, Zivicnjak T et al. Thelazia callipaeda'. first human case of thelaziosis in Croatia//Wien. Klin. Wochenschr. - 2016.- 128. -P. 221 - 223. doi.org/10.1007s00508-015-0889-19.
Price E. W. A new nematode parasitic in the eyes of dogs in the United States // J. Parasitol. - 1930. - 17. -P. 112-113.
Railliet A., Henry A. C. L. Nouvelles observations sur les thdlazies ndmatodes parasites de 1’oiel П Compt. rend. Soc. BioL, Paris. - 1910. -68. -P. 213 -216.
Ryu J. S, Im K. /., Byun Y. J., Kim S. C. A case of human thelaziasis in Korea// Korean J. Parasitol. - 1987. -25, l.-P. 83-84.
Shen J. L., Gasser R. B., Chu D. Y., Wang Z. X. et al. Human thelaziosis - a neglected parasitic disease of the eye // J. Parasitol. - 2006. - 92, 4. - P. 872 - 875. doi: 10.1645/GE-823R.1.
Shi Y. E., Han J. J., Yang W. Y., Wei D. X. Thelazia callipaeda (Nematoda: Spirurida): transmission by flies from dogs to children in Hubei, China // Trans. Roy. Soc. Trop. Med. Hyg. - 1988. - 82. - P. 627.
Sohn W. M., Na В. K, Yoo J. M. Two cases of human thelaziasis and brief review of Korean cases // Korean J. Parasitol. -2011. -49, 3. -P. 265 -271. doi: 10.3347/kjp,2011.49.3.265.
Tasic-Otasevic S, Gabrielli S., Trenkic-Bozinovic M., Petrovic A., Gajic B. et al. Eyeworm infections in dogs and in a human patient in Serbia: a One Health approach is needed П Comp. Immunol. Microbiol. Infect. Dis.-2016.-45.-P. 20-22. http://dx.doi.Org/10.1016/j.cimid.2016.01.003 8.
Viriyavejakul P., Krudsood S, Monkhonmu S, Punsawad C. et al. Thelazia callipaeda'. a human case report // Southeast Asian J. Trop. Med. Public Health. - 2012. - 43, 4. - P. 851 - 856.
Wang S, Yu S. J., Wang X. L., Zhao M. Y. et al. A pediatric case report and literature review of thelaziosis in China // Int. J. Infect. Dis. - 2014. - 29. - P. 249 - 250. doi: 10.1016/j.ijid.2014.10.016.
Wang Z. X, Yang Z. X. 1993. Studies on the development of Thelazia callipaeda larva in the intermediate host Amiota variegata in China // Chin. J. Zool. - 1993. - 28. - P. 4 - 8.
Wang Z. X, Yang Z. X, Du J. S. The discovery of Amiota variegata as an intermediate host of Thelazia callipaeda in China // Chin. J. Zool. - 1990. - 25. - P. 55.
Weinmann C. J., Anderson J. R., RubtzoffP., Connolly G., Longhurst W. M. Eyeworms and face flies in California H Cal. Agric. - 1974. - 28. - P. 4 - 5.
Yang Y. J., Liag T. H., Lin S. H, Chen H. C, Lai S. C. Human thelaziasis occurrence in Taiwan // Clin. Exp. Optom. - 2006. - 89, 1. - P. 40 - 44.
415
Семейство Trichuridae Ransom, 1911
Трихуриды отличаются очень характерной формой тела (передняя часть тела у них значительно тоньше задней), наличием простого рта. У самцов одна спикула, окружённая спикулярным влагалищем, которое может выворачиваться вместе со спикулой. Вульва самок на границе перехода тонкой передней части тела в более толстую заднюю часть. Яйцекладущие. Яйца бочонковидные, с толстой оболочкой и пробочками на обоих полюсах. Паразиты млекопитающих. Типовой род - Trichuris Roederer, 1761.
Семейство объединяет 6 родов с 107 видами.
Трихуриды относятся к геогельминтам, их жизненный цикл проходит без участия промежуточного хозяина, а заражение дефинитивных хозяев происходит при заглатывании теми находящихся во внешней среде инвазионных яиц.
Род Trichuris Roederer, 1761
Описание (по: Скрябин и др., 1957). С характерными чертами семейства. Кутикула с тонкой поперечной исчерченностью. На вентральной поверхности переднего участка тела имеется широкая бациллярная полоса, вдоль краёв которой могут располагаться кутикулярные выступы. Пищевод длинный и тонкий. Половой аппарат самцов и самок одинарный. Задний конец самца обычно спиралевидно загнут дор-сально. Спикула с заострённым кончиком. Наружная поверхность спикулярного влагалища с шипами (у некоторых форм шипы отсутствуют). Задний конец самки дугообразно изогнут. Типовой вид - Trichuris trichiura (Linnaeus, 1771) Stiles, 1901.
В качестве паразитов человека называют 3 вида Trichuris: Т. trichiura, Т. suis (Schrank, 1788) и Т vulpis (Frolich, 1789).
Trichuris trichiura (Linnaeus, 1771) Stiles, 1901 (рис. 170, 171). Паразит человека. Впервые этих нематод наблюдал некто Morganini ещё в конце 17-го столетия. Однако это открытие было забыто, пока их вновь не открыл в 1761 г. проф. Рёдерер из Гёггингена, изучавший нематод, обнаруженных одним из его студентов в слепой кишке при анатомическом препарировании человека. Он описал нематод как представителей нового рода, который назвал Trichuris, т.е. волосохвост, поскольку принял нитевидную переднюю часть тела червя за его хвостовой конец (Roederer, 1761).
Нематоды с характерными чертами рода, белого или слегка красноватого цвета. Самцы длиной 30 - 52 мм. Спикула 2.7 - 3.9 мм. Самки длиной 35 - 55 мм. Яйца золотисто-жёлтого или желтовато-коричневого цвета, бочонко- или лимоновидной формы, с толстой оболочкой, состоящей из нескольких слоёв (рис. 172). Размеры яиц 50 - 54 х 22 - 23 (Faust, 1949), 50 - 65 х 20 - 30 (Скрябин и др., 1957), 47 - 54 х 22 - 23 (Шульман, 1968), 50 - 54 х 22 - 24 pm (Kenney, Eveland, 1978). Внутри яйца находится свернувшаяся личинка.
Самка откладывает яйца, в которых ещё не завершился процесс слияния ядер, заканчивающийся уже во внешней среде через сутки после выделения яиц. Согласно данным разных авторов, которые приводит в своей монографии Э. Фауст (Faust, 1949), одна самка откладывает в сутки 1000, 3333, 1349 - 4808 (в среднем 2035), т.е. от 1000 до 5000 яиц. В одном из источников утверждается, что самка
416
способна откладывать в сутки от 3000 до 20000 яиц (Bundy, Cooper, 1989). При оптимальной температуре 28 - 30°С и высокой относительной влажности в яйцах через 14-18 дней развивается подвижная личинка. Спустя 8-12 дней на головном конце личинки образуется стилет, после чего она становится инвазионной. После заглатывания инвазионное яйцо попадает в кишечник, где из него вылупляется личинка, проникающая в ворсинку слизистой кишки, которую она покидает через 3 -10 суток и фиксируется окончательно на стенке кишечника. Самка начинает откладывать яйца через 1 — 1.5 месяца после заражения человека.
Рис. 170 Trichuris trichiurcr. А - самец; В - Рис. 171 Trichuris trichiurcr. А - самец; В -самка (из: Faust, 1949, как Trichocephalus самка (из: Baylis, 1939) trichiurus)
Рис. 172 Trichuris trichiura, яйцо (из: Colle, 1961)
В англоязычной литературе паразит получил название whipworm, в русскоязычной - власоглав, хлыстовик. Подобным названием нематода обязана форме своего тела: её передний конец настолько тонок, что напоминает волос.
Попавшие в пищеварительный тракт человека нематоды активно внедряются в слизистую слепой или толстой кишки, червеобразного отростка, а при интенсивной инвазии распространяются по всему протяжению толстого кишечника, изредка - в нижнем отделе тонкой кишки. При этом они прокладывают с
417
толще слизистой своеобразные ходы, но в мышечный слой не проникают (Скрябин и др., 1957). Способность червей «прошивать» стенку кишечника связана с наличием у них пищеводных желез, выделяющих лизирующие ферменты.
Вокруг внедрившегося паразита на стенке кишечника обычно развивается воспалительная реакция, слизистая местами с кровоизлияниями, язвами, на отдельных участках некротизирована (Шевцов, 1965). Возможно также образование инфильтратов и отёчности, которую врачи иногда принимают за злокачественные опухоли (Калинина, 2005). Постоянно травмируя слизистую, паразит провоцирует излишние деления клеток, что приводит к развитию полипов кишечника. Известны случаи развития аппендицита, перитонита, вызванные власоглавом (Гапонов, 2005; Скрябин и др., 1957).
Трихуриозис (трихуриазис, трихуроз) - хроническое заболевание с довольно длительным течением (до 3-5 лет), характеризующееся нарушениями со стороны желудочно-кишечного тракта и нервной системы. Иногда протекает субклинически (Шульман, 1968).
Симптомы заболевания связаны с интенсивностью инвазии. Наличие менее 100 червей в организме человека обычно переносится бессимптомно (Гапонов, 2004). Более высокая интенсивность заражения приводит к обширному поражению кишечника, появлению лихорадки, поноса, слабости, припадков, напоминающих эпилептические. В ряде случаев могут быть выражены рвота, аллергические реакции (чаще в виде крапивницы). Иногда наблюдается чередование поносов с запорами. Живот при пальпации может быть болезненным, особенно в области слепой и ободочной кишок. В тяжёлых случаях возможны выпадение прямой кишки, кровотечения (Гапонов, 2004).
В монографической сводке К. И. Скрябин с соавт. (1957; стр. 166 - 167) цитируют многочисленные опубликованные к тому времени работы, авторов которых описывали у инвазированных трихурами больных бессонницу, истерические судорожные приступы, истерическую гемихорею, резкие головные боли, мигрень с явлениями тошноты и рвоты и даже парезы и параличи.
Поскольку симптоматика заражения трихурами не отличается свойствами, характерными только для данного заболевания, то на основании одной лишь клинической картины поставить диагноз практически невозможно. Точный диагноз ставится только по результатам копроовоскопического анализа.
В случае выявления инвазии больному назначают соответствующее лечение, а членов его семьи обследуют на наличие власоглава, причём мониторинг лиц, имеющих близкий контакт с инвазированным, следует вести в течение двух лет. Для лечения детей старше двух лет назначают альбендазол в дозе 400 мг однократно. При интенсивной инвазии приём повторяют в следующие два дня. Препарат выбора - мебендазол: по 100 мг дважды в сутки в течение 3 дней (www.gastroscan. гц.Власоглав (Trichuris trichiura). Трихоцефалёз).
В принципе прогноз благоприятный, за исключением запущенных случаев при очень высокой заражённости.
Полагают, что в мире носителями Т. trichiura являются около 1 млрд, человек (animaldiversity.org.ADW.TncAttm /rzc/zzMra.INROMATION). Особенно часто поражаются дети, что вполне объяснимо, учитывая пути попадания яиц нематоды в организм человека. К примеру, в странах Латинской Америки и Карибского бас
418
сейна из общего числа заражённых 66 % приходилось на долю детей до 15 лет. Как правило, заражение происходит через грязные руки после контакта с почвой, где могут оказаться яйца нематоды («забывают» детишки мыть руки после прогулок, игр в песочницах, на детских площадках, берут пальчики в рот!). В некоторых случаях загрязнение рук при контакте с почвой, например, на детских площадках, может играть важную роль в заражении трихурами (Шульман, 1968). Помимо того, вполне реально заражение с овощами и ягодами, выращенными на огородах, удобряемых необеззараженными нечистотами, при работе на подобных земельных участках, или же с водой, в которую попали яйца паразита.
Trichuris suis (Schrank, 1788). Характерный паразит свиней и кабана, так называемый свиной хлыстовик, свиной власоглав. Передняя часть тела очень длинная и тонкая, в 1.5 раза длиннее задней. Самцы достигают в длину 23 - 54, самки - 39 -53 мм. Жёлто-коричневые яйца размерами 52 - 61 х 27 - 30 pm.
Созревание нематоды в организме дефинитивного хозяина происходит в течение 6-8 недель, а продолжительность жизни червя составляет 4-5 месяцев (Beer, 1973).
Паразит распространён у свиней по всему миру, но наиболее обычен в регионах с тёплым влажным климатом.
Заражение человека происходит через грязные руки, почву или воду. Возможность паразитирования свиного власоглава у человека подтверждена экспериментально (Beer, 1971).
В последнее десятилетие в научном сообществе активно дискутируется вопрос о возможности применения специально подготовленных яиц свиного власоглава для лечения больных с воспалительными заболеваниями кишечника (язвенным колитом, болезнью Крона), не поддающимися стандартному лечению (Кга-din et al., 2006; Scholmerich et al., 2016; Summers et al., 2003, 2005 и др.). Предполагается, что улучшение состояния подобных пациентов связано с изменением баланса интерлейкинов, которые синтезируются Т-клетками слизистой оболочки кишечника.
Trichuris vulpis (Frolich, 1789). Обычный паразит псовых по всему миру. Поселяется в толстом кишечнике животных. Самцы достигают в длину 45 - 60, самки - 62 - 75 мм. Жёлто-коричневые яйца отличаются очень крупными размерами: 83 - 93 х 37 - 40 (Скрябин и др., 1957), 86 - 99 х 38 - 47 (90 х 44) pm (Marquez-N’avarro et al., 2012). Яйца имеют очень толстую оболочку, защищающую их от негативного воздействия факторов внешней среды, и, как утверждается, способны сохранять жизнеспособность в течение 7 лет. Во внешней среде развитие яиц до инвазионного состояния завершается в течение 2-4 недель, а попавшие в окончательного хозяина личинки достигают половозрелого состояния в течение 3 месяцев.
Первое сообщение о регистрации Т. vulpis у человека появилось в 1956 г. (Hall, Sonnenberg. 1956). Тогда у 4-летнего ребёнка была выявлена смешанная инвазия этого вида и Enterobius vermicularis. За последующие 60 лет случаи заражения людей названным гельминтом спорадически отмечались в самых разных странах: Италии (De Cameri et al., 1971), США (Dunn et al., 2002; Kenney, Eveland, 1978), Японии (здесь яйца паразита обнаружились сразу у 19 пациентов) (Kagei et al., 1986), Польше (Lineburg, Jastrzebski, 1987), Индии (заражении выявили у пересе
419
ленцев с Малого Андаманского острова) (Singh et al., 1993), Мексике (здесь у 9-летней девочки первоначально диагностировали ринит) (Mdrquez-Navarro et al., 2012) ит.д.
Симптоматика заражения людей Т. vulpis практически ничем не отличается от таковой, наблюдаемой при инвазии Т. trichiura.
Цитируемая литература
Гапонов С. П. Паразитические нематоды: Учебное пособие. - Воронеж: ВГУ, 2004. - 75 с.
Калинина О. И. Биология гельминтов и профилактика гельминтозов (учебное пособие). - Владивосток: Изд-во ТГЭУ, 2005. - 80 с.
Скрябин К. И., Шихобалова Н. П., Орлов И. В. Трихоцефаллццы и капиллярииды животных и человека и вызываемые ими заболевания / Основы нематодологии. Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1957. - 6. - С. 35 - 259.
Шевцов А. А. Ветеринарная паразитология. - М.: Колос, 1965.-415 с.
Шульман Е. С. Глава XXVI. Трихоцефалёз / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 574 -580. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Baylis Н. A. The fauna of British India, including Ceylon and Burma. Nematoda. Vol. II (Filarioidea, Diocto-phymoidea and Trichinelloidea). - London: Taylor and Francis, Ltd., 1939. - P. 1 - 274.
Beer R. J. Experimental infection of man with pig whipworm И Br. Med. J. - 1971. - 2. - P. 44.
Beer R. J. Studies on the biology of the life-cyclc of Trichuris suis Schrank, 1788 // Parasitology. - 1973. -67.-P. 253-262.
Bundy D. A., Cooper E. S. Trichuris and trichuriasis in humans 11 Adv. Parasitol. - 1989. - 28. - P. 107 - 173.
Colle S. Parasitism by Capillaria hepatica П Pediatrics. - 1961. - 27, 4. - P. 648 - 655.
De Carneri I., Gazzola E, Biagi F. Repeated infestations, presumable, of Trichuris vulpis in a child living in an endemic region of trichocephalosis // Riv. Parassitol. - 1971.-32, 2. - P. 135 - 136.
Dunn J. J., Columbus S. T, Aldeen W. E., Davis M., Carroll К. C. Trichuris vulpis recovered from a patient with chronic diarrhea and five dogs П J. Clin. Microbiol. - 2002. - 40, 7. - P. 2703 - 2704.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 373 - 379.
Hall J. E., Sonnenberg B. An apparent case of human infection with the whipworm of dogs, Trichuris vulpis (Froelich, 1789) П J. Parasitol. - 1956. - 42, 2. - P. 197 - 199.
Kagei N., Hayashi S, Kato K. Human cases of infection with canine whipworms, Trichuris vulpis (Froelich, 1789), in Japan H Jpn. J. Med. Sci. Biol. - 1986. - 39, 4. - P. 177 - 184.
Kenney M., Eveland L. K. Infection of man with Trichuris vulpis, the whipworm of dogs И Am. J. Clin. Pathol. - 1978. - 69, 2.-P. 199.
Kradin R. L., Badizadegan K., Auluck P., Korzenik J., Lauwers G. Y. Iatrogenic Trichuris suis infection in a patient with Crohn disease // Arch. Pathol. Lab. Med. - 2006. - 130, 5. - P. 718 - 720.
Lineburg A., Jastrzebski M. A case of infestation with Trichuris (Trichocephalus) vulpis Froelich, 1789 (Nematoda, Enoplida) in Poland // Wiad. ParazytoL - 1987. - 33, 2. - P. 181 - 184.
Marquez-Navarro A., Garcia-Bracamontes G., Alvarez-Ferndmdez В. E, Avila-Caballero L.P. et al. Trichuris vulpis (Froelich, 1789) infection in a child: A case report // Korean J. Parasitol. -2012.-50, 1. - P. 69 -71.
Roederer J. G. Noch nicht heschriebene Art Warmer im menschlichen Кбгрег I I GOtting. Anz. Von gelchrten Sachea. - 1761. - l.-P. 243. (цит. по: Скрябин и др., 1957).
Scholmerich J., Fellermann K, Seibold F. W., Rogler G., Langhorst J. et al. (18 authors). A randomised, double-blind, placebo-controlled trial crfTrichuris suis ova (TSO) in active Crohn’s disease // J. Crohn’s and Colitis. - 2016. - doi:org/10.1093/ecco-jcc/jjwl84.
Singh S, Samantaray J. C., Singh N., Das G. B., Verma I. C. Trichuris vulpis infection in an Indian tribal population H J. Parasitol. - 1993. - 79, 3. - P. 457 - 458.
Summers R. W., Elliott D. E., Orban J. F. Jr., Thompson R A., Weinstock J. V. Trichuris suis seems to be safe and possibly effective in the treatment of inflammatory bowel disease // Am. J. Gastroenterol. - 2003. - 98, 9.-P. 2034-2041.
Summers R W., Elliott D. E., Urban J. F. Jr., Thompson R A., Weinstock J. V. Trichuris suis therapy for active ulcerative colitis: A randomized controlled trial // Gastroenterology. - 2005. - 128, 4. - P. 825 - 832. DOI: http://dx.doi.Org/10.1053/j.gastro.2005.01.005.
420
Глава 4, или
НИЧЕГО, КРОМЕ СТАТИСТИКИ
К началу 21-го столетия на планете было описано около 25 тыс. видов нематод, как свободноживущих, так и паразитических (Hodda, 2011 - см. ссылку на стр. 14). Однако специалисты полагают, что в действительности эта группа организмов намного богаче и с учётом возможности описания новых видов реальное разнообразие нематод может достичь миллиона видов (Lambshead, 1993)1.
Группа нематод, чьё попадание к человеку прямо или косвенно связано с его питанием, к настоящему времени насчитывает 137 видов из 66 родов, принадлежащих к 34 семействам. На сайте www.gastroscan.ru/handbook/390/8349, в основу которого положена информация из «Международной классификации болезней 10-го пересмотра (МБК-10)», принятой 43-й Всемирной Ассамблеей Здравоохранения, в рубрике «Круглые черви (лат. Nematodes) и Нематодозы» перечислены около 50 видов нематод, вызывающих заболевания у человека. В принципе это - явно заниженная цифра, поскольку ещё в 1954 г. К. И. Скрябин с соавт. привели список из 61 вида нематод, зарегистрированных у человека на тот период. В информационной сводке «Медицинская паразитология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru) перечислено 146 видов нематод. К слову, это - одна из немногих современных сводок,, дающих общее впечатление о видовом составе гельминтов всех таксономических групп, встреченных у человека. Однако некоторые из приведённых в этом списке видов не являются валидными, так как сведены в синонимы или отнесены к категории сомнительных, а часть видов в естественных условиях у человека не зарегистрирована, но включена в данный перечень на основании результатов экспериментальных исследований. Тем не менее, совершенно очевидно, что с 1954 г., т.е. за 60 лет, список видов нематод, когда-либо зарегистрированных у человека, расширился более чем в 2 раза.
Наибольшее количество родов в семействах Onchocercidae (9), Trichostron-gylidae (7), Ascarididae (5), Ancylostomatidae (4), Anisakidae, Capillariidae и Chaber-tiidae (по 3), остальные семейства представлены 1 - 2 родами. Наибольшее количество видов - в семействах Onchocercidae (33), Trichostrorigylidae (17), Rhabditidae (10), Ancylostomatidae (7, или 9), Ascarididae (7 или 15), Chabertiidae (6), Anisakidae (5, или 13), Gnathostomatidae (5), в остальных семействах по 1 - 3 вида. Таким образом, наиболее представительными по числу видов, регистрируемых у человека, являются онхоцеркиды, трихостронгилиды, рабдитиды, анкилостоматиды, аскаридиды.
Среди родов нематод наибольшее количество видов, чья встречаемость у человека зафиксирована документально, - в Trichostrongylus (11), Rhabditis (9), Onchocerca, Dirofilaria, Trichinella (no 7), Gnathostoma (5).
Здесь следует сделать небольшую оговорку. Дело в том, что многие авторы полагают, что в некоторых родах количество видов, которые представляют потен
1 Lambshead Р. J. D. Recent developments to marine benthic bioviversity research // Oceanis. -1993.-19, 6.-P. 5-24, 1993.
421
циальную опасность для здоровья человека, намного больше числа тех, что зарегистрированы у него к настоящему времени. С этим утверждением трудно не согласиться: если, к примеру, у человека зарегистрированы 3 вида рода Anisakis, заражение каждым из которых сопровождается определёнными патологическими проявлениями, то почему не могут быть потенциально опасными для него и остальные 8 видов данного рода в случае попадания их представителей в его организм? Предполагается, например, что среди аскаридид опасны для человека все виды рода Toxocara (Morgan, 2013)2 (сейчас зарегистрированы только 2 вида) и все 9 видов Baylisascaris (Bauer, 2013; Gavin et al., 2005)3 (пока известен только один), среди гнато-стоматид - все виды Gnathostoma (Waikagul, Diaz Chamacho, 2007)4 и т.д. В целом речь идёт почти о 50 видах из разных семейств.
Вполне возможно, что в будущем может возрасти и число новых, неизвестных науке видов нематод, регистрируемых у человека, прежде всего, за счёт интенсификации паразитологических исследований в отдельных регионах Южной Америки, Африки, в островных государствах. Убедительным примером, подтверждающим сказанное, является недавнее описание нового австрало-тасманийского рода и вида нематод Haycocknema perplexum из семейства Robertdollfusidae (Sprat et al., 1999)5. Эти нематоды поражают мышечные ткани человека и высоко патогенны для него. В природе данный паразит пока не найден, его жизненный цикл полностью не изучен, равно как неизвестны и пути заражения им человека.
И, наконец, можно также предположить расширение списка видов нематод, регистрируемых у человека, за счёт пересмотра таксономического статуса отдельных видов (подобные примеры многократно приводились в тексте), а также совершенствования методов идентификации выявляемых нематод и их яиц.
Таким образом, упомянутые 137 видов - отнюдь не предел того разнообразия нематод, которые могут быть обнаружены у Homo sapiens и которые способны паразитировать у него.
Многие из зарегистрированных у человека нематод встречаются у него крайне редко, действительно случайно попадая к нему (вспомним единичные случаи обнаружения контрацекума, спироцерки, турбатрикса, мермитид, сингамид, акуариид и т.д.). В то же время отдельные опасные нематодозы распространены по многим странам и континентам, охватывая десятки и сотни миллионов людей. По подсчётам специалистов, только трихурами в мире заражено 750 млн. человек, ан-килостоматидами - 450 - 900 млн. (Nematodos. Caracteristicas generals. -osw.usal.es/ciencias), трихостронгилидами - 5.5 млн. Микрофиляриями Wuchereria bancrofti поражено не менее 120 млн. человек, главным образом в странах Цен
2 Morgan Е. Р. Dogs and nematode zoonoses / Dogs, Zoonoses and Public Health. - Eds. Macpherson C. N. L., Meslin F.-X., Wandeler A. I. - 2nd Edition. - CABI, 2013. - P. 153 - 161.
3 Bauer C. Baylisascariosis - infections of animals and humans with 'unusual' roundworms // Vet. Parasitol.-2013. - 193,4. -P. 404 - 412. doi: 10.1016/j.vetpar.2012.12.036.
4 Waikagul J., Diaz Chamacho S. P. 7. Gnathostomiasis / Darwin K. D. ed. Food-Borne Parasitic Zoonoses, Fish and Plant-Borne Parasites, World Class Parasites. - Springer, Berlin, 2007. - P. 235.
s Sprat D„ Beveridge I., Andrews J., Dennett X. Haycocknema perplexum n. g., n. sp. (Nematoda: Robertdollfusidae): an intramyofibre parasitic in man // Syst. Parasitol. - 1999. - 43, 2. - P. 123 -131. Doi: 10.1023/A: 1006158218854
422
тральной Африки, в дельте Нила, Центральной и Южной Америке (Melrose, 2002)6. Трихинеллёзная инвазия человека в первом десятилетии 21-го столетия была зафиксирована в 55 странах мира (из 198 официально признанных на планете), а случаи заражения этими паразитами домашних (главным образом, свиней) и диких животных - соответственно в 43 и 66 странах (Pozio, 2007)7. Подчёркивается, что средняя заболеваемость населения Земли аскаридозом может достигать 100 млн. случаев в год. И т.д.
Известно, что расселение паразитов, в том числе и зоонозных видов, по странам и континентам во многом происходит благодаря человеку, о чём пишут многие авторы. Немалую роль в этом процессе играют иммигранты, беженцы, а также иностранные наёмные рабочие. В этом плане очень характерен следующий пример. В Австралии в фекалиях 3-летнего ребёнка, прибывшего два месяца назад из Таиланда, где он и его родители, уехавшие из Мьянмы, жили в лагере для беженцев (ребёнок, кстати, родился в этом лагере), были выявлены яйца Trichostrongylus sp. (Bradbary et al., 2010)8 *.
К группе пассивных переносчиков зоонозных видов нематод в наше время можно также отнести туристов и деловых людей, посещавших эндемичные очаги и попробовавших экзотичные блюда в местах пребывания (подобные примеры неоднократно приводились в тексте). Названный фактор - туризм, и деловые поездки -в последние годы приобретает всё большее значение. Подтверждает сказанное очень характерный пример обнаружения высоко патогенной Gnathostoma spinigerum у 63-летнего жителя Южной Африки, много путешествовавшего по Азии (Muller-Stover et al., 2004)’. Смысл этого примера в том, что в Африке данный гельминт не встречается.
И, наконец, большую роль в распространении и поддержании очагов заражения человека многими нематодами играют животные, не только дикие, но, прежде всего, домашние, в частности кошки и собаки, на что уже давно обращают внимание исследователи (Duscher et al., 2014; Mackenstedt et al., 2015)10. В немалой степени этому способствует наблюдающийся в последние десятилетия рост их численности, а также расширение круга животных, входящих в список домашних питомцев (вспомним историю с одомашниванием енота, привнесшего с собой в дом
6 Melrose W. D. Lymphatic filariasis: New insights into an old disease // Int. J. Parasitol. - 2002. -32, 8. - P. 947 - 960. doi:10.1016/S0020-7519(02)00062-0.
7 Pozio E. World distribution of Trichinella spp. infections in animals and humans И Vet. Parasitol. - 2007. - 149. - P. 3 - 21.
8 Bradbury R. S., Males C. R., Goldsmid J. M. An unusual helminth infection in a South East Asian refugee // Ann. Australian Coll. Trop. Med. - 2010. -11, l.-P. 16 - 18.
’ Milller-Stdver L, Richter J., Haussinger D. [Infection with Gnathostoma spinigerum as a cause of eosinophilic oesophagitis] // Dtsch. Med. Wochenschr. - 2004. - 129, 38. - P. 1973 - 1975.
10 Duscher G. G„ Leschnik M., Fuehren H. P., Joachim A. Wildlife reservoirs for vector-borne canine, feline and zoonotic infection in Austria // Int. J. Parasitol. Parasites Wildl. -2014.-4, 1. -P. 88-96.
Mackenstedt U., Jenkins D., RomigT. The role of wildlife in the transmission of parasitic zoonoses in peri-urban and urban areas // Int. J. Parasitol. Parasites Wildl. - 2015. - 4, 1. - P. 71 -79. doi: 10.1016/j.ijppaw.2015.01.006.
423
человека и опасного для того паразита - нематоду Baylisascaris procyonis^ см. стр. 91 - 103).
Как мы видели, переносчиками нематод, потенциально опасных для здоровья человека, могут оказаться контаминированные инвазионными личинками рыбы и моллюски, насекомые и ракообразные, лягушки и змеи, а также заражённое мясо или печень крупного и мелкого рогатого скота и некоторых диких животных. Источником заражения могут стать также питьевая вода и водные растения, в которой или на которых по тем или иным причинам оказались яйца/личинки нематод или же промежуточные хозяева этих гельминтов, содержащие инвазионных личинок. Столь же обычно заражение человека через свежую зелень, овощи, ягоды, выращенные на участках, для удобрения которых используют необеззараженные нечистоты, а также через землю и грязные руки.
В прошлом риск заражения людей опасными для них гельминтами, в том числе нематодами, через пищевые объекты рассматривали ограниченным определёнными географическими регионами. В нынешнее время эти барьеры постепенно исчезают. И способствуют этому, как мы видим, не только активные перемещения населения, растущий туризм, деловые поездки, желание людей попробовать экзотические блюда, но и быстрая доставка свежих продуктов, в том числе из неблагополучных по нематодозам регионов, в любую точку мира, при которой паразиты не теряют своей инвазионности и остаются опасными для человека, поскольку продукты идут на приготовление блюд без соответствующей термической обработки .
Уничтожить паразитов в природе практически нереально, но знать особенности их распространения и приуроченности к определённым хозяевам и регионам, степень патогенности и меры предупреждения заражения ими человек просто обязан. Большая роль в этом отводится системе санитарно-ветеринарного контроля, которая должна стать своеобразным заслоном на пути попадания опасных паразитов к человеку, а также санитарно-просветительской деятельности соответствующих медицинских учреждений.
Заражение людей нематодами через пищу всё ещё остаётся важной социально-экономической проблемой для современного общества. Обычно подобные заболевания встречаются локально, но в некоторых частях мира могут носить эпидемический характер, при этом более всего они распространены среди детей, в том числе школьников, а также истощённых, ослабленных людей, лиц с ослабленной иммунной системой.
424
Приложение 1
СЛОВАРЬ
НЕОБХОДИМЫХ ТЕРМИНОВ И ПОНЯТИЙ
Абиотические факторы - совокупность условий неорганической среды, влияющих на организмы.
Аллергены — антигены, вызывающие у чувствительных к ним людей аллергические реакции. Гельминтные аллергены - антигены анизакид, аскарид, оксиурид, трихурид и других гельминтов.
Аллергия - форма иммунологического ответа организма, проявляющаяся в его повышенной чувствительности к разнообразным антигенам. Аллергию рассматривают как патологическое нарушение иммунитета.
Амплитуда интенсивности инвазии - величины минимальной и максимальной интенсивности инвазии конкретным видом паразита, встреченным в обследованной выборке (например, от I до 114 экз.; обычно записывается: 1-114).
Анамнез (от греческого avafivrpic; - воспоминание) - совокупность сведений, получаемых при медицинском обследовании путём расспроса самого обследуемого и/или знающих его лиц; играет основополагающую роль в постановке диагноза на гельминтозное заражение.
Анемия (синоним: малокровие, олигемия) - патологическое состояние, характеризующееся уменьшением количества эритроцитов и снижением содержания гемоглобина в единице объёма крови.
Антигельминтики - вещества, применяемые для борьбы с гельминтами.
Антигены - чужеродные для организма органические вещества, вызывающие образование антител и изменяющие его иммунологическую активность.
Антитела - глобулярные белки, обладающие способностью специфически связываться с антигенами.
Антропозоонозы - болезни человека, вызываемые специфическими патогена-ми-животных и переносимые животными.
Антропонозы - болезни, свойственные только человеку, возбудители которых приспособились в процессе эволюции к паразитированию только в организме человека и передаются от человека к человеку, другие животные в распространении не участвуют. К антропонозам в частности относятся гелъминтозы без промежуточного хозяина.
Антропургический очаг заболевания - природный очаг, возникший в результате хозяйственной деятельности человека при освоении им ранее не обжитых территорий; источником возбудителя заболеваний являются синантропные дикие и домашние животные.
Ареал - часть территории или акватории, в пределах которой распространён и проходит полный цикл развития данный таксон (вид, род, семейство и т. д.).
Биомониторинг - постоянное наблюдение за состоянием экосистемы с использованием биологических методов.
425
Биотические факторы - совокупность факторов, относящихся к органическому миру и определяющих условия существования организмов в том или ином месте. Действие этих факторов может быть не только непосредственным, но и выражаться в изменении условий среды. Взаимодействие биотических и абиотических факторов обусловливает возникновение и характер течения различных болезней животных и в конечном итоге предопределяет исход болезни.
Болезнь - ненормальное состояние организма или его части, которое нарушает их нормальное физиологическое функционирование.
Вентральный - брюшной, относящийся к брюшной стороне тела животного организма.
Ветеринария (от латинского veterinarius), ветеринарная медицина - отрасль науки, занимающаяся профилактикой, диагностикой и лечением болезней животных, а также их расстройствами и травмами.
Встречаемость паразита - характеристика естественного распределения какого-либо паразита в популяциях того или иного хозяина; встречаемость выражается цифровыми показателями экстенсивности и интенсивности инвазии, а также пространственным (или географическим) распределением.
Второй промежуточный хозяин - животное, в организме которого находится второе (бесполое) поколение паразита.
Выборка объекта для паразитологического обследования - часть от всего количества данного объекта, взятая для исследования с целью получения общей характеристики его заражённости.
Гельминтозные заболевания, гельминтозы - болезни человека, животных и растений, вызываемые паразитическими червями - гельминтами.
Гельминтология - раздел паразитологии, изучающий паразитических червей -гельминтов и заболевания, вызываемые ими у человека, животных и растений.
Гельминты, или паразитические черви - паразитические турбеллярии, моно-генеи, цестоды (ленточные черви), гирокотилиды, трематоды, нематоды (круглые черви), скребни (колючеголовые черви) и пиявки.
Гематокритное число - объёмное соотношение форменных элементов крови и плазмы. Является одним из показателей степени выраженности патологического процесса.
Геогельминты - группа паразитических червей (гельминтов) животных и человека, развивающихся без участия промежуточного и дополнительного хозяев. Яйца и личинки геогельминтов развиваются до инвазионного состояния во внешней среде (в грунте, перегное и в других субстратах).
Гистолиз - разрушение тканей животного организма путём растворения их элементов (клеток и межклеточного вещества) при участии особых клеток (фагоцитов) и ферментов.
Гистопатология - раздел патологической анатомии, изучающий микроскопические процессы, протекающие в тканях при различных заболеваниях.
Девастация - комплекс мероприятий, направленных на уничтожение возбудителя болезни на всех фазах его жизненного цикла всеми доступными средствами -механическими, физическими, химическими, биологическими.
Дегельминтизация- комплекс лечебно-профилактических мероприятий, направленных на оздоровление окружающей среды от инвазионного материала и оз
426
доровление животных и населения от гельминтов; является частью более широкого комплекса мероприятий - девастации. Термин впервые предложил К. И. Скрябин в 1925 г.
Дезинсекция (фр. des - уничтожение, удаление и лат. insectum - насекомое) -уничтожение специальными средствами паразитических насекомых, а также насекомых-вредителей хозяйства.
Декстральный (dextral) - расположенный справа.
Дератизация (фр. deratisation - «уничтожение крыс») - комплексные меры, направленные на уничтожение грызунов (крыс, мышей, полёвок и др.).
Дефинитивный хозяин - то же, что и окончательный хозяин.
Дистальный (от лат. disto - отстою) - участок органа, расположенный дальше от места его отхождения, прикрепления. Противоположный термин - проксимальный.
Дополнительный хозяин - то же, что и второй промежуточный хозяин.
Дорсальный - спинной, относящийся к спинной стороне тела, находящийся на спине животного организма.
Жизненный цикл паразита - совокупность всех фаз развития, пройдя которые организм достигает зрелости и способен дать начало следующему поколению. Длительность отдельных фаз у разных паразитов различная, общая длительность всего жизненного цикла (от яйца до яйца следующего поколения) значительно варьирует.
Жизнестойкость - устойчивость организма к воздействию неблагоприятных факторов среды.
Заражённость — наличие в организме животного каких-либо патогенных микроорганизмов или паразитов; характеризуется экстенсивностью и интенсивностью инвазии.
Зоонозы (от греческого zoon - животные) - болезни беспозвоночных и позвоночных (кроме человека), которые могут быть переданы человеку. Болезни, передаваемые от человека к животным, иногда называют реверсными (обратными) зоонозами или антропонозами (от греческого anthropos - человек и nosos - болезнь).
Иммунитет (лат. immunitas - освобождение, избавление от чего-либо) - способность иммунной системы организма избавляться от генетически чужеродных объектов; обеспечивает гомеостаз организма на клеточном и молекулярном уровнях организации. Реализуется иммунной системой.
Инвазионные болезни - болезни, вызываемые паразитическими простейшими, гельминтами, паразитическими ракообразными и другими паразитами животного происхождения. Болезни, вызываемые простейшими, нередко относят к инфекционным.
Инвазия (от латинского invasio - нашествие, нападение) - многозначный медицинский и биологический термин. В эпидемиологии и паразитологии инвазией называют проникновение паразитов в организм хозяина или - в более узком смысле - проникновение паразитов через эпителиальные барьеры хозяина.
Индекс обилия - среднее число паразитов конкретного вида, приходящееся на одну особь исследуемого вида; определяется путем деления общего числа выявленных паразитов данного вида на количество всех обследованных особей определённого вида.
427
Инкапсуляция - возникновение соединительно-тканной капсулы вокруг паразита или другого инородного включения в тканях животного-хозяина.
Интенсивность инвазии (заражённости) - количество паразитов данного вида в одной особи исследуемого вида хозяина; по результатам исследования нескольких особей интенсивность инвазии обычно указывается двумя цифрами - минимальной и максимальной.
Инфекция - внедрение и размножение в организме болезнетворных микроорганизмов, сопровождающееся комплексом реактивных процессов; завершается инфекционным заболеванием, бактерионосительством или гибелью микроорганизмов.
Инцистирование - процесс формирования цисты.
Капсула - обычно толстостенное соединительно-тканное уплотнение, образуемое тканями хозяина вокруг паразита или другого инородного включения.
Клиническая картина (синоним: клиника) - условное обозначение совокупности проявлений болезни и особенностей её течения как основы диагноза, прогноза и лечения.
Копрологическое исследование - обследование кала на наличие кишечных паразитов - яиц, личинок и/или взрослых особей червей, а также их фрагментов.
Копроовоскопия - исследование кала на наличие яиц гельминтов.
Латеральный - боковой; термин, указывающий на расположение какой-либо части тела организма в стороне от его срединной плоскости.
Лизис - разрушение клеток под влиянием различных агентов, например, ферментов.
Личиночная стадия паразита - постэмбриональная стадия индивидуального развития паразитов, у которых запасы питательных веществ в яйце недостаточны для завершения морфогенеза. Превращение личинки во взрослую особь заключается в перестройке организации, тем более глубокой, чем больше личинка отличается от закончившего своё развитие организма.
Локализация - отнесение чего-либо к определённому месту, ограничение распространения какого-либо явления, процесса возможно более тесными границами, территориальными пределами.
Локализация паразитов - местонахождение паразита в теле хозяина. Каждый паразит имеет более или менее определённое место поселения в организме хозяина, к которому он приспособлен наилучшим образом. В некоторых случаях паразит попадает в несвойственное ему место, что обычно заканчивается его гибелью.
Максимальная интенсивность инвазии - наибольшее число паразитов данного вида, зарегистрированное в одной особи обследуемого вида хозяина из общего числа исследованных особей.
Максимальная экстенсивность инвазии - наибольший процент обследуемого вида хозяина, заражённых конкретным видом паразита в какой-либо из обследуемых выборок; определяется при обследовании нескольких выборок.
Микроскопия - применение микроскопа и способы приготовления микроскопических препаратов.
Минимальная интенсивность инвазии - наименьшее число паразитов данного вида, найденное в одной особи обследуемого вида хозяина из общего числа исследованных особей.
428
Минимальная экстенсивность инвазии - наименьший процент обследуемого вида хозяина, заражённых конкретным видом паразита в какой-либо из обследуемых выборок; определяется при обследовании нескольких выборок.
Мониторинг - непрерывный процесс наблюдения и регистрации параметров какого-либо конкретного объекта в сравнении с заданными критериями.
Облигатный - обязательный, постоянно встречающийся.
Облигатный паразит - определённый вид паразита, который абсолютно не способен жить и размножаться без своего хозяина.
Облигатный хозяин - животное, обязательное в жизненном цикле определённого вида паразита, без которого тот абсолютно не способен жить и размножаться.
Объекты водного промысла - отдельные виды рыб, моллюсков, ракообразных, морских млекопитающих, водная растительность и др., образующие скопления, обеспечивающие их рентабельную добычу и переработку.
Окончательный хозяин - животное, в организме которого развивается и живёт половозрелая стадия паразита.
Онтогенез - индивидуальное развитие любого организма с момента зарождения до смерти; совокупность последовательных морфологических, физиологических и биохимических преобразований, которые проходит организм от зарождения до смерти.
Опасные для здоровья человека паразиты - паразиты, чьё попадание в организм человека представляет угрозу его здоровью.
Паразит - организм, постоянно или временно живущий на поверхности или внутри тела другого, более крупного животного и питающийся за его счёт.
Паразитарные болезни - болезни, вызываемые паразитами.
Паразитизм - исторически сформированная ассоциация генетически разнородных организмов, основанная на трофических связях и взаимоотношениях, когда один (паразит) использует другого (хозяина) как среду жизни и источник пищи, причём оба партнера находятся в антагонистических отношениях разной степени остроты. Паразитизм - преимущественно экологическое понятие, аналогичное понятиям планктонного, бентосного образа жизни организмов. Характерная особенность паразитизма определяется своеобразием среды жизни, каковой для паразита является живой организм (хозяин), активно реагирующий на присутствие паразита. Среда существования паразита, как показали Е. Н. Павловский и В. А. Догель, имеет двойственный характер: среда 1-го порядка - органы и ткани хозяина, окружающие паразита; среда 2-го порядка - среда, окружающая хозяина. Большая часть паразитов практически полностью утратила связь с внешним миром, и все стадии их развития происходят в организме хозяев. В зависимости от продолжительности паразитирования различают временный и стационарный паразитизм, последний включает паразитизм периодический и постоянный.
Паразитология - комплексная биологическая наука, изучающая явление паразитизма, т.е. взаимоотношения между паразитом и хозяином, их зависимость от факторов внешней среды, а также вызываемые паразитами заболевания и методы борьбы с ними.
Паразитоносителъ - животное, в теле которого паразит присутствует, но не приводит к заболеванию хозяина; сам хозяин при этом становится источником распространения паразита.
429
Паразитостойкость - мера стойкости организма к заражению определённым видом паразита.
Паразитофауна - совокупность видов паразитов, обитающих на определённой территории (акватории), в определённом хозяине (группе хозяев).
Паратонический хозяин - потенциальный промежуточный хозяин, не являющимся необходимым для онтогенетического развития гельминта, т.к. в нём не происходит его развития.
Патогенез - совокупность последовательных процессов, определяющих механизмы возникновения и течения болезни; включает в себя взаимосвязанные процессы, происходящие в больном организме (физиологические, биохимические, морфологические, иммунологические и т. д.), развивающиеся в нём после воздействия этиологического фактора.
Патогенный - болезнетворный, способный вызвать нарушения в организме хозяина.
Патология - 1) комплексная наука, изучающая закономерности возникновения, течения и исхода заболеваний, а также отдельных патологических процессов в организме животных; 2) патологические отклонения от нормы.
Первичный очаг заболевания - издревле существующий природный очаг.
Первый промежуточный хозяин - животное, в организме которого обитает поколение паразита, развивающееся из яйца.
Перкутанный (через кожу) - активное проникновение личинок паразита через неповреждённую кожу.
Персистенция - длительное существование патогена в конкретных условиях или на конкретной территории.
Проксимальный (новолат. proximalis, от лат. proximus — ближний) - участок органа, расположенный ближе к месту его отхождения, прикрепления. Противоположный термин - дистальный.
Резервуарный хозяин - животное, в организме которого личинки паразита (гельминта) могут переживать длительное время, но не развиваются и соответственно не достигают половой зрелости. Резервуарному хозяину принадлежит значительная роль в сохранении, аккумуляции и распространению данного вида гельминта.
Резистентность (дословно - сопротивление, противодействие) - устойчивость организма к воздействию различных физических, химических или биологических повреждающих факторов. В отношении человека и животных чаще используется термин иммунитет.
Синдром - совокупность симптомов, объединённых единым патогенезом (механизмом возникновения) и характеризующих определённое патологическое состояние организма. В некоторых случаях синдром характеризует всю картину заболевания, а остальные симптомы только детализируют её.
Синистральный (sinistral) - расположенный слева.
Систематика (от греч. стиотг|цапк6<; - упорядоченный, относящийся к системе) - раздел науки (в частности, зоологии), относящийся к классификации изучаемых объектов.
Специфичный хозяин - хозяин, к которому данный паразит адаптирован наилучшим образом. В результате взаимной и всесторонней приспособленности пара
430
зита и специфичного хозяина отношения между ними принимают закономерный, и даже облигатный, характер.
Средняя интенсивность инвазии - общее количество особей паразитов данного вида, выявленное при исследовании выборки определенного вида животных, деленное на число заражённых особей хозяев (т. е. среднее число паразитов данного вида, приходящееся на одну заражённую особь хозяина в исследованной выборке).
Средняя экстенсивность инвазии - средний процент заражённости нескольких исследованных выборок данного вида хозяина конкретным видом паразита.
Токсичность - способность ряда веществ биологической природы и/или химических соединений оказывать вредное действие на организм человека и животных.
Фиксатор, фиксирующая жидкость - специальная жидкость для фиксации паразитов (или других животных), частей их тела или кусочков поражённых ими тканей, чтобы сохранить их морфологическое строение и химический состав для последующих морфологических, анатомических, гистологических или цитологических исследований. Для каждой систематической группы паразитов существуют свои фиксаторы.
Фронтальный - лобный, относящийся ко лбу, параллельный его поверхности.
Хозяин - животное, на котором или в котором обитает паразит.
Циста - плотная оболочка, выделяемая паразитом и окружающая его.
Эксплантация - культивирование клеток, зачатков тканей и органов вне организма; то же, что культура тканей.
Экстенсивность инвазии - выраженное в процентах отношение количества особей определённого вида хозяев, заражённых конкретным видом паразита, к числу исследованных особей данного вида (т. е. процент заражённости).
Эндемики - виды, роды, семейства или другие таксоны животных и растений, распространённые только в определённой, чаще сравнительно ограниченной местности.
Эндемия - постоянное наличие и периодическое распространение некоторых болезней в определённой местности, обусловленное её природными особенностями и своеобразием условий жизни населения. Эндемия некоторых инфекционных и инвазионных заболеваний связана с наличием их природных очагов. Понятие эндемии относят и к болезням, которые распространены повсеместно, но степень их распространённости определяется условиями жизни населения на данной территории: например, распространение описторхозиса связано, прежде всего, с неудовлетворительным санитарным состоянием территории и водоёма, а также низким уровнем санитарно-просветительской работы.
Эндопаразиты - живут во внутренних полостях, тканях и клетках хозяина. Некоторые авторы разделяют эндопаразитов на полостных, тканевых, внутриклеточных и т.д.
Эозинофилы - одна из форм зернистых лейкоцитов (гранулоцитов) крови позвоночных. Цитоплазма эозинофилов содержит гранулы, окрашивающиеся кислыми красителями, в том числе эозином, в красный цвет. Количество эозинофилов возрастает при аллергических реакциях, инвазии гельминтами, болезнях кожи.
431
Эпидемиология (от древнегреческого ётлдтщш - имеющая всенародное распространение и Хоуод - учение) - общемедицинская наука, изучающая закономерности возникновения и распространения заболеваний различной этиологии с целью разработки профилактических мероприятий. Предметом изучения эпидемиологии является заболеваемость - совокупность случаев болезни на определённой территории в определённое время среди определённой группы населения.
Эпизоотии - характеризуются тем, что болезнь охватывает массовые количества животных на определённой площади. При этом патоген заносится из других регионов или происходит одновременное заражение животных от общего источника инфекции, не характерного ранее для данного района.
Эпизоотический очаг - понятие, характеризующее место пребывания источника (или источников) возбудителя инфекции или инвазии (больное животное, микробоноситель), где при данной ситуации возможна передача возбудителя восприимчивым животным.
Эпизоотология - ветеринарная наука о закономерностях возникновения, развития и угасания массовых болезней животных. Для профилактики и лечения болезней необходимо знать условия, которые приводят к проникновению возбудителя в организм животного.
Этиология - изучает причины и условия возникновения болезней; неразрывно связана с патологией.
In part - частично.
In situ - в месте нахождения.
In vitro - в пробирке.
In vivo - на живом организме; в естественных условиях; в действительности. Sensu lato - в широком значении, в широком понимании (какого-либо слова). Sensu stricto - в узком значении, в узком понимании (какого-либо слова).
Species inquirenda - вид, систематическое положение которого неясно и нуждается в дальнейшем изучении.
432
П риложение2
ПЕРЕЧЕНЬ
ПАРАЗИТОВ И
ВЫЗЫВАЕМЫХ ИМИ ЗАБОЛЕВАНИЙ
Научные (латинские) названия
Abbreviata 236, 237, 239 - 243
Abbreviata abbreviata 239
Abbreviata caucasica 239, 240 - 2421, 243
Abreviata 239
Acanthocheilonema 357
Acanthocheilonemaperstans 358
Acanthocheilonema streptocerca 358
Acuaria 299, 300
Acuariidae 299, 300, 301
Adenophorea 14, 136, 165
Agamofilaria streptocerca 358
Agamomermis 339
Agamomermis hominis oris 339
Agamomermis restiformis 339
Agchylostoma 303
Agchylostoma duodenale 303
Alloionema 301
Alloionematidae 301, 388
Alloionematinae 301
Amphibiocapillaria 136
Ancistronema 322
Ancistronema coronatum 322
Ancylostoma 97, 276, 302 -314, 316
Ancylostoma americanum 314
Ancylostoma braziliense 302, 309, 311, 320
Ancylostoma caninum 302, 310
Ancylostoma duodenale 281, 302, 303, 304
-309,312,319
Ancylostoma ceylanicum 302, 311, 312, 319
Ancylostoma japonica 320
Ancylostoma malayanum 319
Ancylostoma tubaeforme 320
Ancylostomatidae 302 - 321, 421
Anchylostomum 303
Anchylostomum duodenale 303
Angiocaulus 15
Angiostrongylidae 15-34
Angiostrongylinae 15
1 Здесь и далее жирным шрифтом указан номер страницы с рисунком данного вида
Angiostrongylus 15-34, 124
Angiostrongylus cantonensis 16,17 - 19, 20
-29
Angiostrongylus costaricensis 16, 26, 27-29
Angiostrongylus mackerrasae 16
Angiostrongylus malaysiensis 16
Angiostrongylus siamensis 16
Angiostrongylus vasorum 16
Anguillula 401
Anguillula aceti 374
Anguillula intestinalis 401, 402
Anguillula leptodera 385
Anguillula stercoralis 401,402
Anisakidae 35 - 73, 75, 116, 421
Anisakis 35 - 56, 61, 65, 68, 70, 422
Anisakis al at a 38
Anisakis brevispiculata 37
Anisakis catodontis 39
Anisakis kuekenthalii 39
Anisakis ivanizkii 39
Anisakis kogiae 39
Anisakis marina 39, 42
Anisakis oceanica 37
Anisakis patagonica 39
Anisakis pegreffii 39, 51
Anisakisphyseteris 37, 39, 42, 51
Anisakis rosmari 39
Anisakis simplex 37 - 39, 40,41, 42, 43 -56, 67
Anisakis skrjabini 37
Anisakis trident at a 38
Anisakis tursiops 37
Anisakis typica 37
Anisakis sp. 37, 42, 47, 51
Anisakis sp. 142
Anisakis sp. II 42
Anisakis sp. Ill 42
Anisakis sp. larva (1) 42
Anisakis sp. larva (2) 42
Anisakis sp. Type 142
Anisakis sp. Type II 42, 51
An isakis-type 45
Ankilostomum americanum 314
433
Ankylostoma 303
Ankylostomum 303
Ankylostomum duodenale 303
Aonchotheca 155
Aonchotheca philippinensis 154
Aphasmida 136
Ascaridata 35
Ascaridida 35, 74, 165
Ascarididae 74 - 135, 421
Ascaris 37, 46, 74 - 90, 93, 122, 243
Ascaris adunca 75
Ascaris alata 129
Ascaris apri 342
Ascaris canis 110, 117
Ascaris canis et martis 166
Ascaris cati 110, 129
Ascaris circumflexa 129
Ascaris columnaris 91, 92
Ascaris crenulata 129
Ascaris felis 129
Ascaris globulus 129
Ascaris lumbricoides 75, 76, 77, 78, 79, 80 -
85,88
Ascaris decipiens 64, 75
Ascaris filiformis 342
Ascaris leonina 110, 111
Ascaris leproptera 110
Ascaris marina 42
Ascaris maritima 88
Ascaris microptera 110
Ascaris mystax 129
Ascaris mystax canis 117
Ascaris obvelata 409
Ascaris osculata 58, 75
Ascaris procyonis 91
Ascaris renalis 166
Ascaris salaris 42
Ascaris sphyranurae 42
Ascaris suilla 85
Ascaris suum 76, 85, 86
Ascaris teres 129
Ascaris texana 88
Ascaris vermicularis 366
Ascaris visceralis 166
Ascaris sp. 42
Ascarites 74
Baylisascaris 23, 74, 90 - 103, 124, 422
Baylisascaris columnaris 92, 99
Baylisascaris lotorus 95
Baylisascaris melis 99
Baylisascaris procyonis 91-93-103
Baylisascaris transfuga 90, 100
Belascaris canis 117
Belascaris cati 129
Belascaris crenulata 129
Belascaris mystax 129
Bosicola 323
Brugia 349-351
Brugia beaveri 350
Brugia guyanensis 359
Brugia malayi 349, 350
Brugia pahangi 350
Brugia timori 350
Brugia sp. 350
Buckleya 275
Bunostomum phlebotomum 320
Caenorhabditis 382, 387-388
Caenorhabditis elegans 387
Callodium 136
Calodium 136- 148, 155
Calodium hepaticum 138- 140, 141, 142, 143-148
Calodium philippinensis 154
Calodium splenaecum 138
Capillaria 136 - 138, 149
Capillaria aerophila 148, 149
Capillaria hepatica 138, 144
Capillaria philippinensis 154, 155, 158, 159
Capillaria (s. 1.) 136, 155
Capillaria (s.s.) 155
Capillariidae 136- 164, 421
Capsularia marina 42
Cardionema 16
Cephalobidae 321, 369
C er as car is 56
Chabertia 321
Chabertiidae 321 -331,421
Cheilobus 301
Cheilobus quadrilabiatus 301,302, 388
Cheilospirura 300
Cheilospirura hamulosa 300
Cheiracanthus 199, 225
Cheiracanthus robustus 200
Cheiracanthus siamensis 200,213
Cheiracanthus socialis 201
Cheiranthus 199
Cheiriacanthus 199
Chromadorea 14, 35, 74, 198,229, 236,274,
341, 344, 365, 369, 376, 381, 389, 398, 408
Cobboldostrongylus 275
434
Conocephalus 37
Contracaecum 36, 56, 57 - 63
Contracaecum microcephalum 56-58
Contracaecum micropapillatum 57, 58
Contracaecum multipapillatum 62
Contracaecum osculatum 58, 59, 60-63, 75
Contracaecum osculatum (s. 1.) 58, 61, 62
Contracaecum osculatum (s. s.) 58
Contracaecum osculatum A 58
Contracaecum osculatum В 58
Contracaecum osculatum D 58
Contracaecum osculatum E 58
Contracaecum ovale 57, 58
Contracaecum rudolphii 57, 58
Contracaecum variegatum 57
Crossicapillaria 155
Cyclodontostomum 322
Cyclodontostomum purvisi 322, 323
Dachmoides 316
Dioctophyma 166
Dioctophymata 165
Dioctophymatida 165
Dioctophymatidae 165
Dioctophymatoidea 180
Dioctophyme 165-179
Dioctophyme renale 166,167,168, 169, 170,171- 179, 186
Dioctophymidae 165-188
Dipetalonema 357, 362
Dipetalonema arbuta 362
Dipetalonema berghei 359
Dipetalonema ozzardi 357
Dipetalonemaperstans 358
Dipetalonema streptocerca 358
Dipetalonematidae 344
Diplodon 303
Diploscapter 331 - 334
Diploscapter coronata 331, 332, 334
Diploscapter coronatus 332, 333, 334, 388
Diploscapteridae 331 -335, 388
D/rq/?7arfa 351 - 355,421
Dirofilaria conjunctivae 353
Dirofilaria immitis 351, 352
Dirofilaria louisitanensis 351
Dirofilaria magalhdesi 351, 353
Dirofilaria repens 351 - 353
Dirofilaria scapiceps 363
Dirofilaria spectans 351, 353
Dirofilaria striata 351, 353
Dirofilaria tenuis 351, 353
Dirofilaria uniformis 363
Dirofilaria ursi 351, 354
Dochmius 303
Dochmius ankylostomum 303
DoChmius duodenalis 303
Dockmius 316
Dorilaimea 14, 136, 165,254, 337, 391
Dorilaimia 337
Dracunculidae 189-197
Dracunculus 189-197
Dracunculus aethiopicus 190
Dracunculus grcecorum 190
Dracunculus medinensis 189, 190,191, 192,
193,194-196, 197, 229
Dracunculus loa 355
Dracunculus oculi 355
Echinocephalus 198, 225 - 228
Echinocephalus crassostreai 226, 227
Echinocephalus sinensis 226
Echinocephalus uncinatus 225, 226
Echinocephalus sp. 226
Enoplea 14, 165, 337
Enoplida 136, 165
Enterobius 366-369
Enterobius gregorii 366, 368
Enterobius vermicularis 366,367, 368,419
Escherichia coli 388
Eucoleus 137, 148,149- 154
Eucoleus aerophilus 148,149, 150- 154, 251
Eustoma rotundatum 42
Eustrongylidae 165
Eustrongylides 165
Eustrongylididae 165
Eustrongylus 166
Eustrongylus gigas 166, 174
Eustrongylus renalis 166
Eustrongylus visceralis 166
Eustrongylides 180-188
Eustrongylides excisus 180,182, 184
Eustrongylides ignotus 180 - 182, 184, 185
Eustrongylides tubifex 180, 181, 184
Eustrongylides sp. 174,181 - 186
Filaria 189
Filaria aethiopica 190
Filaria bancrofti 349, 353, 364
Filaria cicrumocularis 412
Filaria dernarquay 357
Filaria juncea 357
435
Filaria labialis 229
Filaria labiata papillosa 396
Filaria lacrymalis 355
Filaria loa 355
Filaria malayi 349
Filaria medinensis 190, 355
Filaria nocturna 364
Filaria oculi 355
Filaria oculi humani 355
Filaria ozzardi 357
Filaria ozzardi var. truncata 358
Filaria palpebralis 412
Filariaphilippinensis 364
Filaria radula 200
Filariaperstans 358
Filaria restiformis 339
Filaria sanguinis 364
Filaria sanguinis hominis' 364
Filaria sanguinis hominis egyptiaca 364
Filaria sanguinis hominis minor 358
Filaria sanguinolenta 398
Filaria scutata 229
Filaria scutata esofagea bovis 229
Filaria subconjunctivalis 355
Filaria tucumana 357
Filaria volvulus 345
Filaria voucher er i 364
Filariae hominis oris 229
Filaroididae 15
Filocapsularia 37
Fuellebomiidae 189
Fuellebornius 189
Fuellebornius medinensis 190
Furia 189
Furia vena medinensis 190
Fusarella 366
Fusarella vermicularis 366
Fusaria mystax 129
Fusaria obvelata 409
Fusaria vermicularis 366
Gilesia 275
Globocephalus macaci 328
Gnathostoma 23, 198 - 225, 227, 421, 422
Gnathostoma binucleatum 200, 204, 205 -207
Gnathostoma doloresi 200, 207 - 209
Gnathostoma hispidium 200, 209, 210 -
212,217
Gnathostoma kyushuense 200
Gnathostoma lamothei 206
Gnathostoma malaysiae 200
Gnathostoma nipponicum 200, 211, 212, 213
Gnathostoma paronai 200
Gnathostoma socialis 201
Gnathostoma spinigerum 199, 200, 201, 202, 203, 204, 211, 215, 217, 218, 423
Gnathostoma turgidum 206
Gnathostomatidael98 -228,421
Gnathostomum 199
Gongylonema 229 - 234
Gongylonema confusum 229
Gongylonema contortum 229
Gongylonema filiforme 229
Gongylonema hominis 229
Gongylonema labiale 229
Gongylonema labialis 229
Gongylonema minimum 229
Gongylonemapulchrum 229, 230, 231 - 234
Gongylonema ransomi 229
Gongylonema scutatum 229
Gongylonema spirale 229
Gongylonema subtile 229
Gongylonema ursi 229
Gongylonematidae 229 - 235
Gordius 189, 340
Gordius aceti 374
Gordius equinus 394
Gordius medinensis 190
Gordius pulmonaris apri 342
Haemonchus 287 - 291, 298
Haemonchus atectus 288
Haemonchus contortus 287, 288 - 291
Haemonchus fuhrmanni 288
Haemonchuspseudocontortus 288
Haemostrongylus 15, 16
Haemostrongylus ratti 16, 20
Haycocknema 391
Haycocknemaperplexum 391, 392,422
Halicephalobus 321, 370 - 374
Halicephalobus deletrix 370
Halicephalobus gingivalis 321, 370,371 -373
Halicephalobus limuli 370
Hepaticola 136, 138
Hepaticola hepatica 138, 141
Heterocheilidae 37
Heterodera 336
Heterodera marioni 336
Heterodera radicicola 336
436
Heteroderidae 336
Hypostomum 323
Hysterothylacium 36, 57
Hysterothylacium aduncum 75
Kathleena 56
Kathleena osculata 58
Lagochilascaris 74, 103 - 110
Lagochilascaris minor 103,104,105 - 110
Leptodera 385, 401
Leptodera niellyi 385
Leptodera aceti 374
Leptodera oxophila 374
Liniscus 136
Loa 355 - 357
Loa loa 355, 356, 361
Loaina 363
Lumbriculus 366
Lumbricus canis 117
Mammomonogamus 245 - 252
Mammomonogamus ierei 248
Mammomonogamus laryngeus 245, 246, 247
-252
Mansonella 357-360
Mansonella ozzardi 357, 358
Mansonellaperstans 357, 358
Mansonella rodhaini 359
Mansonella semiclarum 359
Mansonella streptocerca 357, 358
Mansonella sp. «DEUX» 359
Marshallagia 291, 292
Marshallagia marshalli 291, 292
Mecistocirrus 292 - 294
Mecistocirrus digitatus 292, 293, 294
Meloidogyne 335 - 337
Meloidogyne marioni 336
Meloidogynidae 335 - 337
Meningonema 360 - 361
Meningonema peruzzi 360, 361
Mermis 337,338-340
Mermis nigrescens 338, 339, 340
Mermis sp. 340
Mermithida 337
Mermithidae 337 - 341
Metastrongylidae 15, 341 -344
Metastrongylus 341 - 344
Metastrongylus elongatus 342, 343, 344
Metastrongylus salmi 342, 344
Microfilaria diurna 355
Microfilaria malayi 349
Microfilaria nuda 345
Microfilaria rodhani 359
Micronema 371
Micronema deletrix 321, 370, 371
Mirandonema 166
Moennigofilaria streptocerca 358
Molinema 361 - 362
Molinema arbuta 362
Molinema sprenti 362
Muspiceida 391
Myzonimus 229
Myzomimus scutatus 229
Necator 216, 302,314-316
Necat or africanus 314
Necator americanus 281, 302, 303, 305, 314, 315,316,319
Necator argentinus 314, 320
Necator suillus 320
Nemathelminthes 14
Nematodirus 294
Nematodirus abnormalis 294
Nematodirus filicollis 294
Nematomorpha 14
Neoascaris 116, 117
Oesophagostomoides 323
Oesophagostomum 322 - 327
Oesophagostomum aculeatum 326, 327
Oesophagostomum apiostomum 326, 327
Oesophagostomum bifurcum 325, 326, 329
Oesophagostomum brumpti 325, 326
Oesophagostomum dentatum 323
Oesophagostomum radiatum 320
Oesophagostomum stephanostomum 324, 326, 327
Oesophagostomum (sp.) 326
Onchocerca 345 - 349, 421
Onchocerca caecutiens 345
Onchocerca cervicalis 348
Onchocerca dewittei japonica 348
Onchocerca gibsoni 345
Onchocerca gutturosa 345, 348
Onchocerca jakutensis 348
Onchocerca lupi 348
Onchocerca reticulata 345, 348
Onchocerca volvulus 345, 346, 347, 348
Onchocercidae 344 - 365, 385, 393, 421
Oncocercidae 344
Ostertagia 295 - 296, 298
437
Ostertagia circumcincta 295, 296, 297
Ostertagia davtiani 296
Ostertagia marshalli 291
Ostertagia ostertagi 295 - 297
Ostertagia turkestanica 296
Ostertagiella circumcincta 296
Oxyuridae 365 - 369,409
Oxyurias 366
Oxyurias vermicularis 366
Oxyuris 366
Oxyuris obvelata 409
Oxyuris vermicularis 366
Panagrolaimida 369, 408
Panagrolaimidae 321, 369 - 375
Panagrolaiminae 369
Panagrolaimus 370
Paracapillaria 137, 154- 164
Paracapillaria philippinensis 137
Paracapillaria piscicola 154
Paracapillaria (Crossicapillaria)
philippinensis 154,155- 164
Par as car is equorum 75
Parastrongylus 16
Pelecitus 362-363
Pelecitus helicinus 362
Pelecitus scapiceps 363
Pelodera 375, 376, 377 - 378
Pelodera strongyloides 376, 377, 378, 388
Pelodera teres 375, 378, 382, 388
«Peloderes» strongyloides 375
Peloderidae 375 - 379, 382, 388
Peritracheilus 37
Phasmidea 35
Philometra sp. 379, 380
Philometridae 379, 380
Phocanema 63, 64
Phocanema decipiens 64
Physaloptera 236 - 239, 243
Physaloptera caucasica 237, 239
Physaloptera mordens 239
Physaloptera transfuga 237, 238
Physaloptera sp. 237
Physaloptera (Physaloptera) clausa 237
Physalopteridae 236
Physalopterinae 236
Placentonema gigantissima 11
Porrocaecum 64, 116
Porrocaecum azarasi 69
Porrocaecum bulbosa 69
Porrocaecum cattani 69
Porrocaecum decipiens 64
Porrocaecum kogiae 64
Porrocaecum krabbei 69
Probostrongylus 275
Pseudalius trichina 256
Pseudocapillaroides 136
Pseudorhabditis 401
Pseudorhabditis stercoralis 401
Pseudoterranova 36, 61, 63 - 73
Pseudoterranova decipiens 47, 64 65 - 67, 68 - 73, 75
Pseudoterranova decipiens E 69
Pseudoterranova sp. 61
Pterygodermatites 389
Pterygodermatites affinis 389, 390
Pterygodermatites cahirensis 389,390
Pulmonema 16
Pulmonema cantonensis 16
Raphidascarididae 36, 57, 75
Raphidascaris 36, 116
Rhabditea 344
Rhabditida 15, 35, 74, 236, 245, 274, 341, 365,369,376, 398,408,411
Rhabditidae 301, 378, 381 - 388, 421
Rhabditis 381 - 387, 403, 421
Rhabditis aceti 374
Rhabditis axei 382, 383
Rhabditis clavopapillata 382, 388
Rhabditis coronata 332
Rhabditis donbass 378, 382
Rhabditis elongata 382, 383
Rhabditis faecalis 384
Rhabditis gingivalis 370, 371
Rhabditella gracilis 383
Rhabditis hominis 382, 384
Rhabditis inermis 382, 384
Rhabditis niellyi 382, 385
Rhabditis pellio 382, 385
Rhabditis schachtiella 382, 385
Rhabditis strongyloides 377
Rhabditis taurica 382, 385
Rhabditis terricola 381, 382, 383
Rhabditis sp. 382, 386
Rhabditophanes 301
Rhabditophanes schneideri 301, 388
Rhabdonema
Rictularia 389
Rictularia cahirensis 389, 390
Rictularia sp. 389
Rictulariidae 389-390
438
Ritaklossia 136
Robertdollfusa 391
Robertdollfusidae 391, 392, 422
Rodentocaulus 16
Schistosoma mansoni 143
Sclerostoma duodenale 303
Sclerostomum caninum 310
Secementea 14, 35, 74, 165, 198, 341, 344, 369, 376, 393, 398
Setaria 393 - 397
Setaria digit ata 394
Setaria equina 393, 394, 395
Setaria labiatopapillosa 393 - 395, 396, 397
Setariidae 393-397
Setariinae 393, 394
Skrjabinocapillaria 136
Spirocerca 398 - 400
Spirocerca lupi 398, 399, 400
Spirocerca sanguinolenta 398
Spirocercidae 398 - 400
Spiroptera 239
Spiroptera sanguinolenta 398
Spiroptera scutata 229
Spiroptera scutata ossophagea bovis 229
Spiroptera ursi 229
Spirura sanguinolenta 398
Spirurata 236
Spirurida 35, 74, 198, 229,236, 344, 365, 389, 393,398,411
Stadelmann circumcincta 296
Stercoralis 401
Stomachus 37
Stomachus marina 42
Strongylata 245, 341
Strongylida 15, 321, 341
Strongylidae 322
Strongyloides 401 - 408
Strongyloides canis 407
Strongyloides cebus 407
Strongyloides felis 407
Strongyloides intestinalis 402
Strongyloides fullebomi 406, 407
Strongyloides fullebomi kellyi 407
Strongyloides myopotami 407
Strongyloides planiceps 407
Strongyloides papillosus 407
Strongyloides procyonis 407
Strongyloides ransomi 407
Strongyloides ratti 407
Strongyloides simiae 407
Strongyloides stercoralis 401, 402 - 407
Strongyloides westeri ЦУ1
Strongyloididae 401 - 408
Strongylus 239
Strongylus caninus 310
Strongylus cervicornis 296
Strongylus circumcinctus 296
Strongylus colubriformis 279
Strongylus contortus 287
Strongylus duodenalis 303
Strongylus filicollis 287
Strongylus gigas 166
Strongylus instabilis 279, 280, 296
Strongylus lupi 398
Strongylus placei 287
Strongylus quadridentatus 303
Strongylus renalis 166
Strongylus subtilis 279, 280
Strongylus vicarius 296
Syngamidae 245 - 253
Syngamus 245
Syngamus kingi 248
Syngamus laryngeus 246
Syngamus nasicola 246
Syphaciidae 409 - 410
Syphacia 409 - 410
Syphacia obvelata 409, 410
Teladorsagia 295
Teladorsagia circumcincta 296
Teladorsagia davtiani 296
Teladorsagia trifurcata 296
Ternidens 322, 327 - 329
Ternidens deminutus 327, 328
Terranova 64
Terranova decipiens 64
Terranova sp. 81
Tetrapetalonemaperstans 358
Tetrapetalonema (Esslingeria) streptocerca
358
Thelazia 411 -415
Thelazia callipaeda 411, 412,413
Thelazia califomiensis 411,413
Thelazia rhodesii 411
Thelaziidae 411-415
Thelazius 411
Thominx 136, 149
Thominx aerophilus 148,149, 151
Toxascaris 74, 110-116
Toxascaris canis 117
439
Toxascaris leonina 110, 111 - 113, 114 — 116
Toxascaris limbata 110, 117
Toxascaris marginata 117
Toxascaris microptera 110
Toxascaris procyonis 91
Тохосага 23, 74, 97, 110, 116 - 135, 422
Тохосага canis 117,118- 128, 130, 131
Тохосага cati 117,129 - 131
Тохосага crenulata 129
Тохосага felis 129
Тохосага mystax 129
Тохосага pteropodis 130
Тохосага vitulorum 130
Toxocaridae 110, 116
Toxocarinae 110, 116
Tricephalobus 371
Tricephalobus gingivalis 370
Trichina 254
Trichina affinis 256
Trichina spiralis 256
Trichina spiralis hominis 256
Trichine 254
254-271,421
Trichinella britovi 265, 267, 268, 270
Trichinella murrelli 268
Trichinella nativa 262, 268
Trichinella nelsoni 268
Trichinella рариае 261, 269, 270
Trichinella pseudospiralis 269
Trichinella spiralis 82, 160, 254, 255, 256-
259-268, 270
Trichinella zimbabwensis 270
Trichinella T5 268
Trichinella T6 268
Trichinella T8 267
Trichinella T9 267
Trichinellidae 137, 254 - 273
Trichinia 254
Trichinus 254
Trichocephalida 136, 254
Trichocephalus hepaticus 138
Trichonematidae 322
Trichosoma 136
Trichosoma aerophila 148, 149
Trichosomum 136, 401
Trichostrongylidae 274 - 298, 421
Trichostrongylus 274 - 287, 298, 421
Trichostrongylus affinis 277
Trichostrongylus axei 277, 278
Trichostrongylus brevis 278
Trichostrongylus calcaratus 278, 279
Trichostrongylus capricola 279
Trichostrongylus colubriformis 276, 279, 280,281,282
Trichostrongylus instabilis 279, 282
Trichostrongylus lerouxi 281,282
Trichostrongylus longispicularis 281, 282
Trichostrongylus orientalis 277, 281, 282, 283
Trichostrongylus probulurus 283, 284
Trichostrongylus retortaeformis 276
Trichostrongylus skrjabini 274, 284
Trichostrongylus subtilis 279
Trichostrongylus vitrinus 284
Trichostrongylus sp. 285, 423
Tricostrongylus 275
Trichurata 136
Trichuridae 137,416-420
Trichuris 416 - 420
Trichuris suis 416, 419
Trichuris trichiura 416, 417
Trichuris vulpis 416, 419, 420
Trilabiatus 371
Trilabiatus gingivalis 370
Triodontophorus deminutus 328
Trychostrongylus 275
Turbatrix 321, 370, 374 - 375
Turbatrix aceti 321, 374, 375
Turbatrix aceti var. aceti 374
Tylenchida 369
Uncinaria 302, 316 - 318
Uncinaria americana 314
Uncinaria canina 310
Uncinaria criniformis 317
Uncinaria duodenalis 303
Uncinaria stenocephala 302, 317, 318
Vena 189
Vena medinensis 190
Vermiculus 189
Vermiculus capsular is 190
Vibrio aceti 374
Vibrio anguillula var. aceti 374
Wuchereria 363-365
Wuchereria bancrofti 363,364, 365, 394, 422
Wuchereria filaria 364
Wuchereria lewisi 363
Wuchereria malayi 349
440
Русские названия
Акуарииды 422
Аллойонематиды 301
Ангиостронгил 21, 22, 25
Ангиостронгилиазис 21 - 25, 28
Ангиостронгилозис 22, 28
Анизакиазис 45, 47, 48, 70
Анизакиды, анизакидные нематоды 36, 40, 44-46, 49,61,69,71
Анизакидозис 36, 47, 68, 70
Анизакиозис 44, 46 - 48, 51
- желудочный (gastric) 47
- кишечный (intestinal) 47
- внегастрокишечный (extra gastrointestinal) 47
- орофарингеальный (oropharyngeal) 47
- скоротечный полостной (transient luminal) 47
Анизакисы, анизакисные нематоды 41, 44-50, 68,71
Анкилостомы 306 - 308
Анкилостома двенадцатиперстная 305
Анкилостоматиды 281, 289, 302, 305, 319,
320, 404, 422
Аскариазис 78, 83, 84
Аскарида свиная 87
Аскарида человеческая 76
Аскаридаты 116
Аскаридиды 75, 118, 119
Аскаридоз 79, 81 - 84
Аскариды 79, 152, 153, 404
Аскарис 78, 79, 83, 84, 88
Африканский глазной червь 357
Банкрофтов струнец 364
«Болезнь рыбаков» («fishermen disease») 47
Болезнь «сельдяного червя» («herringworm» disease) 47
Болезнь «трескового червя» (cod worm
disease) 70
Бэйлисаскариозис 96 - 98
- неврологический 96
- глазной 96
- висцеральный 96
Бэйлисаскарисы 95, 96, 98
Власоглав 417, 418
Волосатики 276
Гвинейский червь 190, 194, 195
Гигантский почечный червь 167
Гигантский свайник 167, 171, 175
Глазные черви 411
Гнатостома японская 212
Гнатостоматиды 227
Гнатостомиазис 200, 206,214-218
Гнатостомоз, гнатостомозис 200,219
Г натостомы 199-219
Гонгилонематоз 232
Гонгилонемиазис 232
Гонгилонемы 230 - 234
Диоктофиматозис 167
Диоктофимиазис 167
Диоктофимозис 167
Диоктофимы 173
Диплоскаптериды 332
Дирофилярии 351, 352
Дракункулёз, дракункулёзис 190, 194
Дракункулиазис 196
. Капиллярии 142, 143
Капиллярииды, капилляриидные нематоды 136-162
Капиллярия филиппинская 154
Контрацекум 422
Крысиный лёгочный червь 16, 20
Лёгочный дирофиляриазис 352
Лошадиная аскарида 75
Маммомоногамиазис, маммомоногамозис 248
Маммомоногамы 251
Мединский червь 190, 195
Мелойдогиниды 335-337
Мелойдогины 336
Менингонема Перуцци 360
Мермитиды 338 - 340, 422
Метастронгилёз 344
Метастронгилиды 341
Метастронгилоидные нематоды 20
Некатор 315, 316
Нитчатка Банкрофта 364
Оксиуриазис 367
Оксиуриды 366
441
Острицы 366
Паракапилляриазис 158, 160- 162
Паракапиллярия филиппинская 157 - 159, 161
Парковый червь 400
Пелодера стронгилоподобная 376
Пелодеры 278
Пищеводный, глоточный червь 232
Проволочники 276
Псевдотерранова 68-71
Псевдотеррановозис 70
Рабдита беззубая 384
Рабдита донбасская 378
Рабдита Nielly 385
Рабдита таврическая 385
Рабдита фекальная 384.
Рабдита человеческая 384
Рабдита шахтная 385
Рабдитиды 386
Ришта 190
Свайник-великан 167
Свиной хлыстовик, свиной власоглав 419
Сетарии 394, 395
Сетариозис 394
Сетария лошадиная 394
Сингамиазис, сингамозис 248
Сингамиды 245, 251, 422
Синдром мигрирующей («странствующей») личинки (syndrome «larva migrans») 47, 96, 122, 311 Скрученные желудочные черви 289
Спироцерка 422
Средний или коричневый желудочный червь 296
Стронгилоидиды 401, 405, 406
Схистозоматидные трематоды 82
Телязии413, 414
Тениаринхоз 344
Террановиазис 69
Террановозис 69
Токсаскарис 113
Токсокара 118 - 122, 126 - 128
Токсокариазис 121 - 124
Токсокароз 121-128
Токсокарозис 121-124
Томинксоз 151
Тоннельная болезнь 306
«Тресковый червь» («codworm») 67
Трихинелла зимбабвенская 270
Трихинелла ложноспиральная 269
Трихинелла Нельсона 268
Трихинелла папуасская 261, 269 Трихинеллёз, трихинеллёзис 260 - 271, 423
Трихинеллиазис 262
Трихинеллы 259 - 271
Трихиноз, трихинозис 262
Трихостронгилиды 274, 276,282,295
Трихостронгилы 276, 279, 285, 422
Трихуриды 416
Трихуриозис, трихуриазис, трихуроз 418
Трихуры 417 - 419, 422
Турбатрикс 422
Унцинарии 318
Физалоптериды 236, 243
Физалоптеры 243
Филометриды 379, 380
Филяриазис 345, 348
Филяриаты 394
Фоканемиазис 70
Хлыстовик 417
Церебральный сетариозис 394
Чёрный поносный червь 281
Эзофагостом колючеротый 327
Эзофагостомиазис, эзофагостомозис 325
Эзофагостомы 326
Энтеробиоз 344, 367
Энтеробиазис, энтеробиозис 367
Эуколеозис 151-153
Эустронгилиды 181-186
Эустронгилидозисы 184
Эхиноцефалы 225 - 227
442
Научное издание
Гаевская Альбина Витольдовна
Мир паразитов человека.
II. Нематоды и нематодозы пищевого происхождения
Отпечатано с готового оригинал-макета
Подписано в печать 25.10.2016
Тираж 400 экз. Заказ № 63
ООО «НПЦ «ЭКОСИ-Гидрофизика» ОГРН 1159204018940 от 07.05.2015 299011, г. Севастополь, ул. Ленина, 28 Тел (8692) 54-31-46
Гаевская Альбина Витольдовна-
доктор биологических наук, профессор, главный научный сотрудник Института морских биологических исследований им. А. О. Ковалевского Российской академии наук, заслуженный деятель науки и техники АР Крым, академик и член Президиума Крымской академии наук, лауреат премии им. И. И. Шмальгаузена за достижения в области зоологии, лауреат Государственной премии Украины в области науки и техники, лауреат Общегородского форума «Общественное признание» (Севастополь), почётный член Украинского паразитологического общества, Председатель Крымского отделений Паразитологического общества РАН; награждена медалью «Ветеран труда», памятными медалями академика К. И. Скрябина и академика Е. Н. Павловского, почётными грамотами Государственной Думы РФ, Президиума НАН Украины, Верховной Рады, Совета министров РК, губернатора г. Севастополя. Главный редактор «Морского биологического журнала». Научный редактор многих коллективных монографий. Автор и соавтор 380 работ, включая 5 патентов и более 30 монографий, в числе которых «Мир паразитов человека. 1. Трематоды и трематодозы пищевого происхождения» (2015), «Паразиты и болезни рыб Черного и Азовского морей» в двух томах (2012, 2013), «Паразиты и болезни гигантской устрицы (Crassostrea gigas) в условиях культивирования» (2010), «Паразиты, болезни и вредители мидий (Mytilus, Mytilidae). I -X» (10 выпусков: 2006 - 2014), «Паразитология и патология рыб: Энциклопедический словарь-справочник (2003, 2006), «Анизакидные нематоды и заболевания, вызываемые ими у животных и человека» (2005), «Паразиты и болезни морских и океанических рыб в природных и искусственных условиях» (2004), «Паразитолопя та патолопя риб: енциклопедичний словник-дов!дник» (2004) и др. Научный руководитель 13 кандидатских диссертаций.